Область техники, к которой относится изобретение
Настоящее изобретение относится к области инъекционных композиций гиалуроновой кислоты и к применению таких композиций в косметических и/или медицинских приложениях.
Уровень техники
Гиалуроновая кислота представляет собой один из наиболее широко применяемых биосовместимых полимеров для медицинского применения. Это встречающийся в природе полисахарид, принадлежащий к группе гликозаминогликанов (GAG). Гиалуроновая кислота и другие GAG содержат отрицательно заряженные гетерополисахаридные цепи, которые обладают способностью абсорбировать большие количества воды. Гиалуроновая кислота и производные продукты, полученные из гиалуроновой кислоты, широко применяют в биомедицинской и косметической областях, например, в процессе вискохирургии и в качестве кожного наполнителя.
Абсорбирующие воду гели или гидрогели широко применяют в биомедицинской области. Их получают, как правило, путем химического сшивания полимеров в бесконечные сетки. Хотя природная гиалуроновая кислота и определенным образом сшитые производные гиалуроновой кислоты абсорбируют воду до тех пор, пока они не оказываются полностью растворенными, сшитые гели гиалуроновой кислоты, как правило, абсорбируют определенное количество воды до тех пор, пока они не оказываются насыщенными, т.е. они обладают конечной способностью удерживания жидкости или степенью набухания.
Поскольку в большинстве живых организмов присутствует гиалуроновая кислота, имеющая одинаковую химическую структуру, за исключением своей молекулярной массы, она вступает в минимальное число реакций, и является пригодной для перспективного применения в медицине. Сшивание и/или другие модификации молекул гиалуроновой кислоты являются необходимыми для увеличения продолжительности ее существования в условиях организма. Кроме того, такие модификации влияют на способность удерживания жидкости молекулами гиалуроновой кислоты. Вследствие этого были предприняты многочисленные попытки модификации гиалуроновой кислоты.
Инъекционные производные гиалуроновой кислоты часто сочетают с подходящим анестетиком, например, лидокаином, чтобы уменьшать боль или неудобства, которые испытывает пациент, вследствие инъекционной процедуры.
Описание изобретения
Задача настоящего изобретения заключается в том, чтобы предложить улучшенную инъекционную композицию гиалуроновой кислоты для медицинских и/или немедицинских приложений.
Композиции гиалуроновой кислоты, применяемые для инъекций, требуется стерилизовать перед применением. Стерилизацию осуществляют, как правило, посредством термической обработки, такой как обработка в автоклаве. Термическая обработка, как правило, приводит к уменьшению жесткости или вязкости композиции гиалуроновой кислоты. Как упомянуто выше, инъекционные производные гиалуроновой кислоты часто сочетают с подходящим анестетиком, например, лидокаином, чтобы уменьшать боль или неудобства, которые испытывает пациент, вследствие инъекционной процедуры. Согласно наблюдениям, добавление некоторых обычно применяемых анестетиков, например, лидокаина, противодействует влиянию термической обработки на реологические свойства композиции гиалуроновой кислоты таким образом, что полученная в результате композиция становится более жесткой или вязкой, чем гель без лидокаина. Это изменение реологических свойств может оказаться неблагоприятным в некоторых приложениях, например, в приложениях, где требуемой или желательной является неглубокая инъекция геля, и/или где требуемой или желательной является кожа очень малой толщины. Примеры таких приложений включают восстановление кожи и увеличение мягких тканей, например, заполнение морщин или улучшение контура лица или тела, посредством инъекций геля гиалуроновой кислоты.
В настоящее время было обнаружено, что добавление в относительно небольшом количестве производного аскорбиновой кислоты в композицию гиалуроновой кислоты, включающую местный анестетик, выбранный из группы, состоящей из местных анестетиков амидного и сложноэфирного типов, способных эффективно подавлять «увеличение вязкости» композиции гиалуроновой кислоты, вызываемое местным анестетиком при стерилизации композиции в автоклаве. Таким образом, добавление в относительно небольшом количестве производного аскорбиновой кислоты в композицию гиалуроновой кислоты, включающую местный анестетик, может способствовать применению меньшей толщины кожи для инъекций без увеличения усилия, которое требуется для введения композиции, и без внесения изменений в компонент гиалуроновой кислоты. Кроме того, уменьшение вязкости и/или модуля упругости G' раствора является благоприятным в приложениях, где композицию впрыскивают неглубоко от поверхности кожи, например, для восстановления кожи или пластики мягких тканей, например, заполнения морщин или улучшения контура лица или тела, посредством инъекций геля гиалуроновой кислоты.
Воздействие производного аскорбиновой кислоты на вязкость и/или модуль упругости G' композиции продемонстрировано для немодифицированной гиалуроновой кислоты и модифицированной, например, сшитой, гиалуроновой кислоты, и это доказывает, что данное воздействие является общим для всех композиций, включающих гиалуроновую кислоту.
Помимо благоприятного воздействия на вязкость и/или модуль упругости G' композиции, добавление производного аскорбиновой кислоты в композицию может также обеспечивать и дополнительные преимущества. Аскорбиновая кислота (также известная как витамин C) и ее производные могут выступать как восстановители и поглотители агрессивных окислителей и радикалов. Поскольку аскорбиновая кислота и ее производные способны улучшать образование коллагена, они могут улучшать морфологию кожи. Они способны также улучшать образование эпидермального барьера, сокращать трансэпидермальные потери воды, ускорять заживление ран и, таким образом, играть важную роль в предотвращении старения кожи и связанных с этим состояний сухости кожи. Аскорбиновая кислота и ее производные известны своими противовоспалительными и светозащитными свойствами, а также своим воздействием на восстановление кожи от повреждений, связанных с ультрафиолетовым излучением. Кроме того, было показано, что аскорбиновая кислота и ее производные способны клинически улучшать дерматологические состояния, которые включают воспаление в качестве компонента процесса заболевания, такие как псориаз и астеатотическая экзема. Поскольку аскорбиновая кислота и ее производные способны подавлять образование меланина, они могут также производить эффект отбеливания кожи, и клинически доказано, что они улучшают состояние при меланозе кожи и ограниченном предраковом меланозе. Они могут также способствовать росту волос. Кроме того, предположено, что аскорбиновая кислота и ее производные обладают противораковыми свойствами.
Добавление производного аскорбиновой кислоты в композицию гиалуроновой кислоты, как правило, не производит никакого воздействия или производит незначительное воздействие на устойчивость композиции. А именно, было отмечено, что добавление производного аскорбиновой кислоты не повышает устойчивость композиции гиалуроновой кислоты. Исследования авторов настоящего изобретения показали, что добавление производного аскорбиновой кислоты может иногда приводить к небольшому уменьшению устойчивости композиции гиалуроновой кислоты. Однако авторы настоящего изобретения обнаружили, что преимущества, связанные с добавлением производного аскорбиновой кислоты перевешивают уменьшение устойчивости, вызванное ее добавлением в некоторых случаях. Чтобы избежать нежелательного уменьшения устойчивости композиции гиалуроновой кислоты концентрацию производного аскорбиновой кислоты следует поддерживать ниже максимальных концентраций, как описано ниже.
Согласно аспектам, проиллюстрированным в настоящем документе, предложена инъекционная композиция гиалуроновой кислоты, включающая:
гиалуроновую кислоту,
местный анестетик, выбранный из группы, состоящей из местного анестетика амидного и сложноэфирного типов или их сочетания, и
производное аскорбиновой кислоты в количестве, которое предотвращает или уменьшает воздействие на вязкость и/или модуль упругости G' композиции, вызванное местным анестетиком при термической стерилизации.
Термин «инъекционная» означает, что композиция гиалуроновой кислоты получена в форме, которая является подходящей для парентеральной инъекции, например, в мягкую ткань, такую как кожа, пациента или другого лица. Инъекционная композиция должна быть стерильной и свободной от компонентов, которые способны вызывать неблагоприятные реакции при введении в мягкую ткань, такую как кожа, пациента или другого лица. Это подразумевает отсутствие или лишь весьма низкую степень иммунной реакции, которая возникает у человека в результате лечения. Таким образом, у человека в результате лечения возникают лишь весьма слабые нежелательные местные или системные эффекты, или эти эффекты полностью отсутствуют.
Вязкость и/или модуль упругости G' композиции гиалуроновой кислоты можно измерять, применяя разнообразные способы, которые хорошо известны специалисту в данной области техники. Вязкость можно измерять, например, как вязкость при нулевом сдвиге (η0) методом ротационной вискозиметрии, применяя реометр Bohling VOR (измерительная система C14 или PP 30, промежуток 1,00 мм). Могут также оказаться применимыми и другие способы измерения вязкости. Модуль упругости G' можно измерять, например, применяя реометр Bohling VOR (измерительная система PP 30, промежуток 1,00 мм) и осуществляя изменение деформации, для определения области линейной вязкоупругости (LVR), а затем измерение вязкоупругих свойств в пределах LVR. Могут также оказаться применимыми и другие способы измерения модуля упругости G'.
Инъекционная композиция гиалуроновой кислоты предпочтительно является водной, и гиалуроновая кислота, местный анестетик и производное аскорбиновой кислоты предпочтительно набухают, растворяются или диспергируются в водной фазе.
Инъекционная композиция гиалуроновой кислоты включает гиалуроновую кислоту. Гиалуроновая кислота может представлять собой модифицированную, например, разветвленную или сшитую гиалуроновую кислоту. Согласно определенным вариантам осуществления, гиалуроновая кислота представляет собой сшитую гиалуроновую кислоту. Согласно специфическим вариантам осуществления, гиалуроновая кислота представляет собой гель гиалуроновой кислоты.
Если не определены другие условия, термин «гиалуроновая кислота» заключает в себе все варианты и сочетания вариантов гиалуроновой кислоты, гиалуроната или гиалуронана, имеющих разнообразные длины цепей и состояния заряда, а также разнообразные химические модификации, включая сшивание. Таким образом, данный термин также заключает в себе разнообразные гиалуронатные соли гиалуроновой кислоты с разнообразными противоионами, такой как гиалуронат натрия. Данный термин также заключает в себе разнообразные модификации гиалуроновой кислоты, такие как окисление, например, окисление групп -CH2OH в группы -CHO и/или -COOH; окисление перйодатом вицинальных гидроксильных групп, после чего необязательно следует восстановление, например, восстановление групп -CHO в группы -CH2OH или сочетание с аминами и образование иминов, за которым следует восстановление до вторичных аминов; сульфатирование; деамидирование, необязательно с последующим деаминированием или образованием амидов с новыми кислотами; этерификация; сшивание; замещения разнообразными соединениями, например, с применением сшивающего реагента или сочетание под действием карбодиимида; в том числе сочетание различных молекул, таких как белки, пептиды и активные компоненты лекарственных средств, с гиалуроновой кислотой; и деацетилирование. Другие примеры модификаций представляют собой реакции сочетания изомочевины, гидразида, бромциана, моноэпоксида и моносульфона.
Гиалуроновую кислоту можно получать из разнообразных источников животного и неживотного происхождения. Источники неживотного происхождения включают дрожжи и предпочтительно бактерии. Молекулярная масса одной молекулы гиалуроновой кислоты, как правило, находится в интервале от 0,1 до 10 МДа, но возможны и другие молекулярные массы.
В определенных вариантах осуществления концентрация указанной гиалуроновой кислоты находится в интервале от 1 до 100 мг/мл. В некоторых вариантах осуществления концентрация указанной гиалуроновой кислоты находится в интервале от 2 до 50 мг/мл. В специфических вариантах осуществления концентрация указанной гиалуроновой кислоты находится в интервале от 5 до 30 мг/мл или в интервале от 10 до 30 мг/мл. В определенных вариантах осуществления гиалуроновая кислота является сшитой. Сшитая гиалуроновая кислота включает сшивки между цепями гиалуроновой кислоты, что создает непрерывную сетку из молекул гиалуроновой кислоты, которые соединяются друг с другом посредством ковалентных сшивок, физического переплетения цепей гиалуроновой кислоты и разнообразных взаимодействий, таких как электростатические взаимодействия, водородные связи и силы Ван-дер-Ваальса (van der Waals).
Сшивание гиалуроновой кислоты можно осуществлять посредством модификации, сшивающим химическим реагентом. Сшивающий химический реагент можно, например, выбирать из группы, состоящей из дивинилсульфона, полиэпоксиды и диэпоксиды. Согласно вариантам осуществления, сшивающий химический реагент выбирают из группы, состоящей из 1,4-бутандиолдиглицидилового эфира (BDDE), 1,2-этандиолдиглицидилового эфира (EDDE) и диэпоксиоктана. Согласно предпочтительному варианту осуществления, сшивающий химический реагент представляет собой 1,4-бутандиолдиглицидиловый эфир (BDDE).
Сшитое производное гиалуроновой кислоты предпочтительно является биосовместимым. Это подразумевает, что у получающего лечение пациента возникает лишь весьма слабая иммунная реакция, или никакая иммунная реакция не возникает. Таким образом, у получающего лечение пациента возникают лишь весьма слабые нежелательные местные или системные эффекты, или данные эффекты не возникают.
Сшитое производное гиалуроновой кислоты согласно настоящему изобретению может представлять собой гель или гидрогель. Таким образом, его можно рассматривать как нерастворимую в воде, но в существенной степени разбавленную сшитую систему молекул гиалуроновой кислоты, когда воздействует жидкость, как правило, водная жидкость.
Гель содержит, главным образом, жидкость, которая может составлять, например, от 90 до 99,9 мас.% воды, но ведет себя подобно твердому веществу, вследствие трехмерной сетки сшитой гиалуроновой кислоты. Вследствие значительного содержания в нем жидкости, гель является структурно гибким и похожим на естественную ткань, что делает его весьма полезным в качестве клеточного каркаса для технологии культивирования ткани и для пластики ткани.
Как упомянуто выше, сшивание гиалуроновой кислоты для образования сшитого геля гиалуроновой кислоты можно осуществлять, например, посредством модификации сшивающим химическим реагентом, применяя, например, 1,4-бутандиолдиглицидиловый эфир (BDDE). Концентрация гиалуроновой кислоты и степень сшивания влияют на механические свойства, например, модуль упругости G', а также на свойства устойчивости геля. Сшитые гели гиалуроновой кислоты часто характеризуют термином «степень модификации». Степень модификации гелей гиалуроновой кислоты, как правило, находится в интервале между 0,1 и 15 мол.%. Было обнаружено, что воздействие производного аскорбиновой кислоты на вязкость и/или модуль упругости G' композиции согласно настоящему изобретению является особенно выраженным в сшитых гелях гиалуроновой кислоты с низкой степенью модификации. Наиболее выраженное воздействие возникает в гелях гиалуроновой кислоты, у которых степень модификации составляет 2 мол.% или менее, в том числе 1,5 мол.% или менее, в том числе 1,25 мол.% или менее, например, в интервале от 0,1 до 2 мол.%, в том числе в интервале от 0,2 до 1,5 мол.%, в том числе в интервале от 0,3 до 1,25 мол.%, по сравнению с более сшитыми гелями гиалуроновой кислоты. Степень модификации (мол.%) представляет собой количество сшивающего реагента (реагентов), которое связано с HA, т.е. молярное количество связанного сшивающего реагента (реагентов) по отношению к суммарному молярному количеству повторяющихся дисахаридных звеньев HA. Степень модификации отражает степень, в которой гиалуроновая кислота является химически модифицированной сшивающим реагентом. Все условия для реакции сшивания и подходящие аналитические методики для определения степени модификации хорошо известны специалисту в данной области техники, который способен легко регулировать эти и другие факторы, имеющие отношение к делу, и тем самым, обеспечивать подходящие условия, чтобы получать степень модификации в интервале от 0,1 до 2% и подтверждать характеристики полученного в результате продукта по отношению к степени модификации. Например, сшитый 1,4-бутандиолдиглицидиловым эфиром (BDDE) гель гиалуроновой кислоты можно получать согласно способу, который описан в примерах 1 и 2 опубликованной международной патентной заявки WO 9704012.
В предпочтительном варианте осуществления гиалуроновая кислота в составе композиции присутствует в форме сшитого геля гиалуроновой кислоты, который сшит сшивающим химическим реагентом, причем концентрация указанной гиалуроновой кислоты находится в интервале от 10 до 30 мг/мл, и степень модификации указанным сшивающим химическим реагентом находится в интервале от 0,1 до 2 мол.%.
Гели гиалуроновой кислоты могут также включать часть гиалуроновой кислоты, которая не является сшитой, т.е. не соединена с трехмерной сеткой сшитой гиалуроновой кислоты. Однако оказывается предпочтительным, чтобы, по меньшей мере, 50 мас.%, предпочтительно, по меньшей мере, 60 мас.%, предпочтительнее, по меньшей мере, 70 мас.% и наиболее предпочтительно, по меньшей мере, 80 мас.% гиалуроновой кислоты в гелевой композиции составляло часть сетки сшитой гиалуроновой кислоты.
Инъекционная композиция гиалуроновой кислоты дополнительно включает местный анестетик, выбранный из группы, состоящей из местных анестетиков амидного и сложноэфирного типов или их сочетания. Местный анестетик представляет собой лекарственное средство, которое вызывает обратимую местную анестезию и потерю болевого возбуждения нервных волокон. Когда анестетик применяют по отношению к специфическим нервным путям (нервная блокада), можно производить такие эффекты, как аналгезия (потеря болевого ощущения) и паралич (потеря мышечной силы). Местный анестетик можно вводить в композицию гиалуроновой кислоты, чтобы уменьшить боль или неудобства, которые испытывает пациент, вследствие инъекционной процедуры. В технике хорошо известны, и признаны группы местных анестетиков амидного типа (также обыкновенно называются термином «аминоамид») и местных анестетиков сложноэфирного типа (также обыкновенно называются термином «аминоэфир»).
Молекулы местных анестетиков амидного и сложноэфирного типов имеют простую химическую структуру, которую образуют ароматическая часть, присоединенная амидной или сложноэфирной связью к боковой цепи основания. Единственное исключение представляет собой бензокаин, в котором отсутствуют основные группы. Все остальные анестетики представляют собой слабые основания, у которых значения pKa находятся, главным образом, в интервале от 8 до 9, таким образом, что они являются в значительной степени, но не полностью ионизированными при физиологических значениях pH. Вследствие их аналогичной структуры можно предполагать, что они производят аналогичные химические и физические воздействия на композицию гиалуроновой кислоты.
Согласно определенным вариантам осуществления, местный анестетик выбирают из группы, состоящей из местных анестетиков амидного и сложноэфирного типов, например, бупивакаина, бутаниликаина, картикаина, цинхокаина (дибукаин), клибукаина, этилпарапиперидиноацетиламинобензоата, этидокаина, лигнокаина (лидокаин), мепивакаина, оксетазаина, прилокаина, ропивакаина, толикаина, тримекаина, вадокаина, артикаина, левобупивакаина, амилокаина, кокаина, пропанокаина, хлормекаина, циклометикаина, проксиметакаина, аметокаина (тетракаин), бензокаина, бутакаина, бутоксикаина, бутиламинобензоата, хлорпрокаина, диметокаина (ларокаин), оксибупрокаина, пиперокаина, паретоксикаина, прокаина (новокаин), пропоксикаина, трикаина или их сочетания.
Согласно определенным вариантам осуществления, местный анестетик выбирают из группы, состоящей из местных анестетиков амидного типа, например, бупивакаина, бутаниликаина, картикаина, цинхокаина (дибукаин), клибукаина, этилпарапиперидиноацетиламинобензоата, этидокаина, лигнокаина (лидокаин), мепивакаина, оксетазаина, прилокаина, ропивакаина, толикаина, тримекаина, вадокаина, артикаина, левобупивакаина или их сочетания. Согласно некоторым вариантам осуществления, местный анестетик выбирают из группы, состоящей из бупивакаина, лидокаина, и ропивакаина, или их сочетания.
Согласно специфическим вариантам осуществления, местный анестетик представляет собой лидокаин. Лидокаин представляет собой хорошо известное вещество, которое широко применяют в качестве местного анестетика в инъекционных композициях, таких как композиции гиалуроновой кислоты.
Концентрацию амидного или сложноэфирного местного анестетика может выбирать специалист в данной области техники в пределах терапевтически соответствующих интервалов концентраций каждого конкретного местного анестетика или их сочетаний.
В определенных вариантах осуществления концентрация указанного местного анестетика находится в интервале от 0,1 до 30 мг/мл. В некоторых вариантах осуществления концентрация указанного местного анестетика находится в интервале от 0,5 до 10 мг/мл.
Когда лидокаин применяют в качестве местного анестетика, лидокаин может присутствовать в концентрации, которая находится предпочтительно в интервале от 1 до 5 мг/мл, предпочтительнее в интервале от 2 до 4 мг/мл, в том числе эта концентрация может составлять приблизительно 3 мг/мл.
Инъекционная композиция гиалуроновой кислоты дополнительно включает производное аскорбиновой кислоты. Термин «производное аскорбиновой кислоты» при применении в настоящем документе означает аскорбиновую кислоту или производные аскорбиновой кислоты, включающие общую химическую структуру аскорбиновой кислоты. Таким образом, производное аскорбиновой кислоты может представлять собой соединение, имеющее химическую структуру:
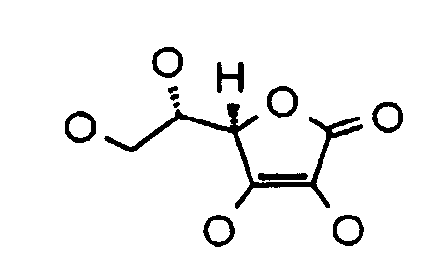
Производное аскорбиновой кислоты композиции может представлять собой аскорбиновую кислоту или соединение, структурно родственное аскорбиновой кислоте и/или полученное на ее основе.
Сама аскорбиновая кислота может оказаться полезной в некоторых приложениях, но вследствие своей низкой устойчивости она может находить лишь ограниченное применение в некоторых практических приложениях.
Производное аскорбиновой кислоты может растворяться в воде. Растворимость производного аскорбиновой кислоты в воде в атмосферных условиях может предпочтительно оказаться достаточной, чтобы обеспечивать растворение в желательной концентрации производного аскорбиновой кислоты в композиции. Растворимость растворимого в воде производного аскорбиновой кислоты в воде в атмосферных условиях может предпочтительно оказаться достаточной, чтобы обеспечивать концентрацию, составляющую 0,001 мг/мл или более и предпочтительнее 0,01 мг/мл или более, в композиции гиалуроновой кислоты.
Производное аскорбиновой кислоты может оказаться способным к образованию аскорбиновой кислоты или аскорбата в условиях организма (in vivo), например, посредством ферментативного разложения, которое осуществляют фосфатазы, гликозидазы и другие ферменты. Таким образом, согласно варианту осуществления, производное аскорбиновой кислоты может образовывать аскорбиновую кислоту или аскорбат при помещении в условия живого организма (in vivo).
В некоторых вариантах осуществления, производное аскорбиновой кислоты выбирают из группы, состоящей из фосфатного сложного эфира аскорбиновой кислоты, карбоксилатного сложного эфира аскорбиновой кислоты, сульфата аскорбиновой кислоты, сульфонатного сложного эфира аскорбиновой кислоты, карбоната аскорбиновой кислоты, а также замещенной ацеталем или кеталем аскорбиновой кислоты, или их сочетания.
Производное аскорбиновой кислоты может представлять собой, например, соединение, имеющее общую формулу:
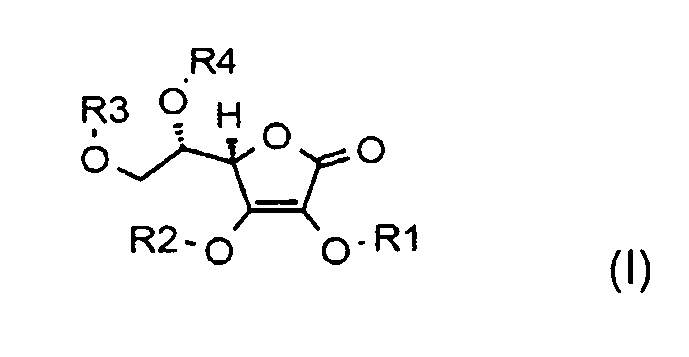
где R1, R2, R3, R4, независимо друг от друга, представляют собой атомы H или органические заместители. Соединение I может представлять собой, например, фосфатный сложный эфир аскорбиновой кислоты, где, по меньшей мере, один из R1, R2, R3 и R4 представляет собой
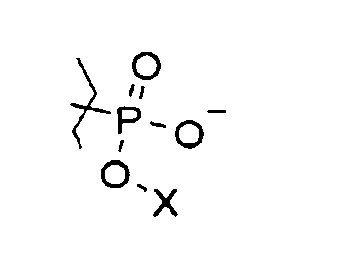
где X представляет собой H, алкил, алкенил, алкинил, арил, амин, спирт, гликозид или
где n может составлять от 0 до 500.
Противоионы могут представлять собой, но не ограничиваются этим, Na+, K+, Ca2+, Al3+, Li+, Zn2+ или Mg2+.
Соединение I может представлять собой, например, карбоксилатный сложный эфир аскорбиновой кислоты, где, по меньшей мере, один из R1, R2, R3 и R4 представляет собой
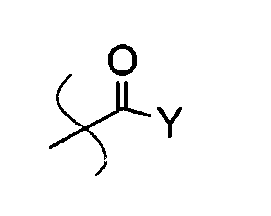
где Y представляет собой H, алкил, алкенил, алкинил, арил, амин, спирт, гликозид, сложный эфир аминокислоты или
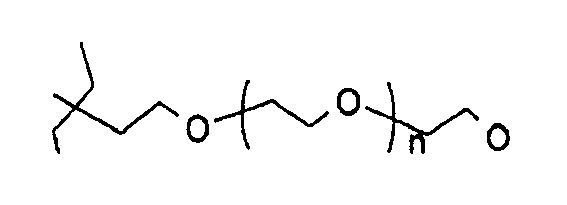
где n может составлять от 0 до 500.
Соединение I может представлять собой, например, сульфат аскорбиновой кислоты, где, по меньшей мере, один из R1, R2, R3 и R4 представляет собой
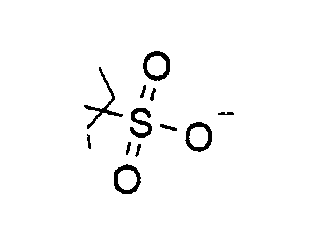
Противоионы могут представлять собой, но не ограничиваются этим, Na+, K+, Ca2+, Al3+, Li+, Zn2+ или Mg2+.
Соединение I может представлять собой, например, сульфонатный сложный эфир аскорбиновой кислоты, где, по меньшей мере, один из R1, R2, R3 и R4 представляет собой
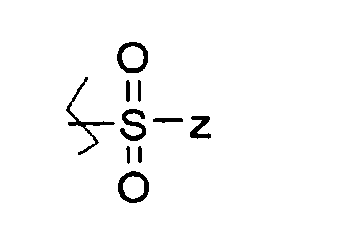
где Z представляет собой H, алкил, алкенил, алкинил, арил, амин, спирт, гликозид или

где n может составлять от 0 до 500.
Соединение I может представлять собой, например, карбонат аскорбиновой кислоты, где, по меньшей мере, один из R1, R2, R3 и R4 представляет собой
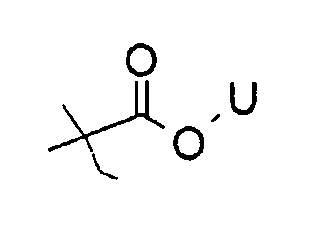
где U представляет собой H, алкил, алкенил, алкинил, арил, амин, спирт, гликозид или
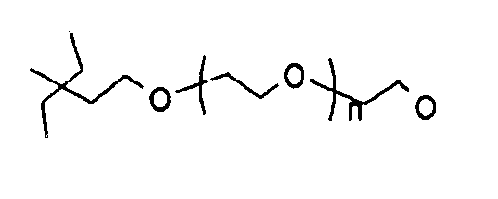
где n может составлять от 0 до 500.
Соединение I может представлять собой, например, замещенную ацеталем или кеталем аскорбиновую кислоту, где, по меньшей мере, один из R1, R2, R3 и R4 представляет собой
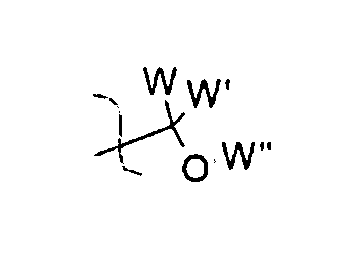
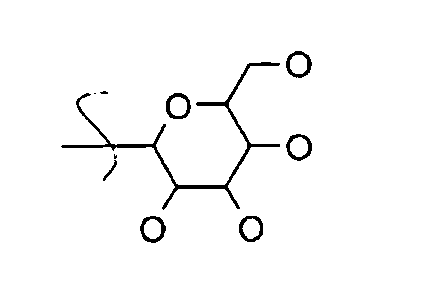
где W, W′ и W″ представляют собой H, алкил, алкенил, алкинил, арил, амин, спирт, или углеводный остаток, например:
Соединение I может представлять собой, например, замещенную ацеталем или кеталем аскорбиновую кислоту, имеющую общую формулу:
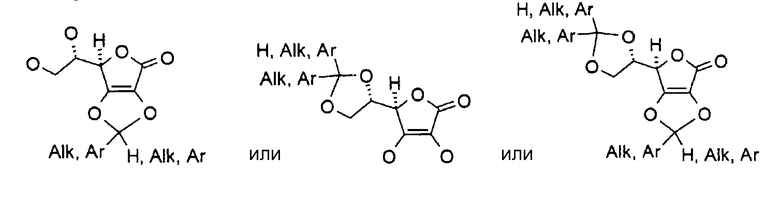
где H представляет собой атом водорода, Alk представляет собой алкил, и Ar представляет собой арил.
В некоторых вариантах осуществления производное аскорбиновой кислоты выбирают из группы, состоящей из аскорбилфосфата, аскорбилсульфата, и аскорбилгликозида, или их сочетания.
В определенных вариантах осуществления производное аскорбиновой кислоты выбирают из группы, состоящей из аскорбилфосфата и аскорбилгликозида, или их сочетания.
В некоторых вариантах осуществления аскорбилфосфат выбирают из группы, состоящей из аскорбилфосфата натрия (SAP) и аскорбилфосфата магния (MAP), или их сочетания. Аскорбилфосфаты превращаются в витамин C в условиях организма (in vivo) посредством ферментативного гидролиза, осуществляемого фосфатазами.
В некоторых вариантах осуществления производное аскорбиновой кислоты представляет собой аминоалкил аскорбилфосфат. В определенных вариантах осуществления производное аскорбиновой кислоты представляет собой аминопропиласкорбилфосфат.
В некоторых вариантах осуществления производное аскорбиновой кислоты представляет собой аскорбилглюкозид. Аскорбилглюкозид превращается в витамин C в условиях организма (in vivo) посредством ферментативного гидролиза, который осуществляют глюкозидазы.
В некоторых вариантах осуществления производное аскорбиновой кислоты представляет собой метилсиланоласкорбат.
В некоторых вариантах осуществления производное аскорбиновой кислоты представляет собой ацетонид L-аскорбиновой кислоты.
Производные аскорбиновой кислоты, описанные в настоящем документе, могут присутствовать в непротонированной или полностью или частично протонированной форме, или в форме фармацевтически приемлемой соли. В частности, термины «аскорбилфосфат», «аскорбилсульфат», «аминоалкиласкорбилфосфат», «аминопропиласкорбилфосфат», «аскорбилгликозид» и «аскорбилглюкозид» при применении в настоящем документе предназначены для описания соединений в непротонированной или полностью или частично протонированной форме, или в форме фармацевтически приемлемой соли. Примеры подходящих противоионов включают, но не ограничиваются этим, ионы алюминия, кальция, лития, магния, калия, натрия и цинка.
Концентрацию производного аскорбиновой кислоты может выбирать специалист в данной области техники в зависимости от конкретного применяемого производного аскорбиновой кислоты.
В определенных вариантах осуществления концентрация указанного производного аскорбиновой кислоты находится в интервале от 0,001 до 15 мг/мл. В определенных вариантах осуществления концентрация указанного производного аскорбиновой кислоты находится в интервале от 0,001 до 10 мг/мл. В некоторых вариантах осуществления концентрация указанного производного аскорбиновой кислоты находится в интервале от 0,01 до 5 мг/мл. Концентрация указанного производного аскорбиновой кислоты, превышающая 0,01 мг/мл, является предпочтительной, поскольку она обеспечивает более значительное уменьшение вязкости и/или модуля упругости G' композиции гиалуроновой кислоты. Концентрация указанного производного аскорбиновой кислоты ниже 5 мг/мл является предпочтительной, поскольку более высокие концентрации могут приводить к нежелательному уменьшению устойчивости композиции гиалуроновой кислоты без дополнительных преимуществ.
Требуемая концентрация производного аскорбиновой кислоты может изменяться в пределах определенных выше интервалов в зависимости от конкретного применяемого производного аскорбиновой кислоты. В качестве примера, подходящая концентрация аскорбилфосфата натрия (SAP) или аскорбилфосфата магния (MAP) может находиться в интервале от 0,01 до 1 мг/мл, в то время как подходящая концентрация аскорбилглюкозида может находиться в интервале от 0,1 до 5 мг/мл.
Таким образом, согласно варианту осуществления, производное аскорбиновой кислоты представляет собой аскорбилфосфат натрия (SAP) или аскорбилфосфат магния (MAP), концентрация которого находится в интервале от 0,01 до 1 мг/мл и предпочтительно в интервале от 0,01 до 0,5 мг/мл.
Согласно еще одному варианту осуществления, производное аскорбиновой кислоты представляет собой аскорбилглюкозид, концентрация которого находится в интервале от 0,01 до 1 мг/мл, предпочтительно в интервале от 0,01 до 0,8 мг/мл, и предпочтительнее в интервале от 0,05 до 0,4 мг/мл.
Как упомянуто выше, согласно наблюдениям, добавление производного аскорбиновой кислоты не приводит к повышению устойчивости композиции гиалуроновой кислоты. Другими словами, инъекционная композиция гиалуроновой кислоты согласно настоящему изобретению не проявляет повышенной устойчивости по сравнению с такой же композицией без производного аскорбиновой кислоты.
Термин «устойчивость» при применении в настоящем документе предназначен для описания способности композиции гиалуроновой кислоты к сопротивлению разложению в процессе хранения и погрузки перед применением. Известно, что введение дополнительных компонентов в гиалуроновую кислоту или гель гиалуроновой кислоты может воздействовать на устойчивость указанной гиалуроновой кислоты или геля гиалуроновой кислоты. Устойчивость содержащей гиалуроновой кислоты или гель гиалуроновой кислоты композиции можно определять, применяя ряд различных способов. Способы определения устойчивость включают, но не ограничиваются этим, исследование однородности, цвета, прозрачности, pH, содержания геля и реологических свойств композиции. Устойчивость композиции гиалуроновой кислоты часто определяют путем наблюдения или измерения одного или более из указанных параметров с течением времени. Устойчивость можно определять, например, посредством измерения вязкости и/или модуля упругости G' композиции гиалуроновой кислоты с течением времени. Вязкость можно измерять, например, как вязкость при нулевом сдвиге (η0) методом ротационной вискозиметрии, применяя реометр Bohling VOR (измерительная система C14 или PP 30, промежуток 1,00 мм). Могут также оказаться применимыми и другие способы измерения вязкости. Модуль упругости G' можно измерять, например, применяя реометр Bohling VOR (измерительная система PP 30, промежуток 1,00 мм) и осуществляя изменение деформации, для определения области линейной вязкоупругости (LVR), а затем измерение вязкоупругих свойств в пределах LVR. Могут также оказаться применимыми и другие способы измерения модуля упругости G'.
В более конкретном варианте осуществления предложена инъекционная композиция гиалуроновой кислоты, включающая водный гель гиалуроновой кислоты, содержащий от 2 до 50 мг/мл гиалуроновой кислоты; от 0,5 до 10 мг/мл лидокаина; и от 0,01 до 5 мг/мл производного аскорбиновой кислоты выбранный из группы, состоящей из аскорбилфосфата и аскорбилгликозида, или их сочетания.
В более конкретном варианте осуществления предложена инъекционная композиция гиалуроновой кислоты, включающая водный гель гиалуроновой кислоты, содержащий от 2 до 50 мг/мл гиалуроновой кислоты; от 0,5 до 10 мг/мл лидокаина; и от 0,01 до 5 мг/мл аскорбилфосфата, например, аскорбилфосфата натрия или магния.
В еще одном более конкретном варианте осуществления предложена инъекционная композиция гиалуроновой кислоты, включающая водный гель гиалуроновой кислоты, содержащий от 2 до 50 мг/мл гиалуроновой кислоты; от 0,5 до 10 мг/мл лидокаина; и от 0,01 до 5 мг/мл аскорбилгликозида, например, аскорбилглюкозида.
В некоторых вариантах осуществления, композицию подвергают стерилизации. В определенных вариантах осуществления композиция является стерилизованной, т.е. композицию подвергают термической и/или паровой обработке, чтобы стерилизовать композицию. В некоторых вариантах осуществления композицию подвергают стерилизации путем обработки в автоклаве или аналогичной термической или паровой стерилизации. Стерилизацию, например, обработку в автоклаве, можно осуществлять при значении F0 ≥ 4.
Значение F0 процесса стерилизации насыщенным паром представляет собой смертность, выраженную как эквивалентное время в минутах при температуре 121ºC и обеспечиваемую путем обработки продукта в его конечном контейнере, по отношению к микроорганизмам, у которых значение Z составляет 10.
Когда композиции гиалуроновой кислоты подвергают стерилизации посредством термической или паровой обработки, вязкость и/или модуль упругости G', как правило, снижается. Когда местный анестетик амидного или сложноэфирного типа добавляют в композицию гиалуроновой кислоты, это снижение вязкости и/или модуля упругости G' подавляется, и в результате этого получается более твердый или более вязкий конечный продукт.
Добавление производного аскорбиновой кислоты подавляет это воздействие местного анестетика, и в результате этого получается конечный продукт, который по своей вязкости и/или модулю упругости G' в большей степени напоминает композицию гиалуроновой кислоты без местного анестетика, без внесения изменений в компонент гиалуроновой кислоты.
Сшитое производное гиалуроновой кислоты согласно настоящему изобретению, или его водную композицию можно получать в виде предварительно наполненного шприца, т.е. шприца, который предварительно наполнен сшитой композицией гиалуроновой кислоты и подвергнут обработке в автоклаве.
Инъекционные композиции гиалуроновой кислоты, описанные в настоящем документе можно применять в медицинских, а также немедицинских, например, чисто косметических процедурах посредством инъекции этих композиций в мягкие ткани пациента или другого субъекта. Данные композиции оказались полезными, например, для увеличения мягких тканей, например, заполнения морщин посредством инъекций геля гиалуроновой кислоты. Обнаружено, что данные композиции являются особенно полезными в косметической процедуре, называемой в настоящем документе термином «восстановление кожи», причем в данной процедуре небольшие количества композиции гиалуроновой кислоты инъецируют в кожу, применяя множество инъекционных точек, распределенных по всей площади кожи, которая подлежит обработке, и это приводит к улучшению тонуса кожи и упругости кожи. Восстановление кожи представляет собой простую процедуру, и риски для здоровья, связанные с данной процедурой, являются очень низкими.
Согласно другим аспектам, проиллюстрированным в настоящем документе, предложена инъекционная композиция гиалуроновой кислоты, которая описана выше, для применения в качестве лекарственного средства. Данная композиция является полезной, например, в лечении разнообразных дерматологических состояний. В частности, предложена инъекционная композиция гиалуроновой кислоты, которая описана выше, для применения в дерматологическом лечении, выбранном из группы, состоящей из заживления ран, лечения состояния сухости кожи или поврежденной солнечным излучением кожи, лечения гиперпигментационных расстройств, лечения и предотвращение потери волос, а также лечения состояний, которые включают воспаление в качестве компонента процесса заболевания, таких как псориаз и астеатотическая экзема. Другими словами, предложена инъекционная композиция гиалуроновой кислоты, которая описана выше, для применения в получении лекарственного средства для применения в дерматологическом лечении, выбранном из группы, состоящей из заживления ран, лечения состояния сухости кожи или поврежденной солнечным излучением кожи, лечения гиперпигментационных расстройств, лечения и предотвращения потери волос, и лечения состояний, которые включают воспаление в качестве компонента процесса заболевания, такие как псориаз и астеатотическая экзема.
Согласно еще одному варианту осуществления, предложена инъекционная композиция гиалуроновой кислоты, которая описана выше, для применения в лечении суставных расстройств посредством внутрисуставной инъекции.
Согласно другим аспектам, проиллюстрированным в настоящем документе, предложено применение инъекционной композиции гиалуроновой кислоты, которая описана выше, для косметического немедицинского воздействия на пациента посредством инъекции композиции в кожу пациента. Цели данной косметической немедицинской процедуры могут представлять собой улучшение внешнего вида кожи, предотвращение и/или лечение потери волос, заполнение морщин или улучшение контура лица или тела пациента. Данное косметическое немедицинское применение не включает лечение какой-либо формы заболевания или медицинского состояния. Примеры улучшения внешнего вида кожи включают, но не ограничиваются этим, обработку поврежденной солнечным излучением кожи или состарившейся кожи, восстановление кожи, отбеливание кожи и лечение гиперпигментационных расстройств, таких как ограниченный предраковый меланоз, меланодермия и эфелиды (веснушки).
Согласно определенным вариантам осуществления, предложено применение инъекционной композиции гиалуроновой кислоты, которая описана выше, для улучшения внешнего вида кожи, предотвращения и/или лечения потери волос, заполнения морщин или улучшения контура лица или тела пациента. Данное применение предпочтительно включает инъецирование композиции в кожу и/или подкожный слой человека. Применение инъекционной композиции гиалуроновой кислоты для улучшения внешнего вида кожи, предотвращения и/или лечения потери волос, заполнения морщин или улучшения контура лица или тела пациента, может быть преимущественно или полностью немедицинским, например, чисто косметическим.
Согласно определенным вариантам осуществления, предложено применение инъекционной композиции гиалуроновой кислоты, которая описана выше для улучшения внешнего вида кожи. Согласно предпочтительному варианту осуществления, предложено применение инъекционной композиции гиалуроновой кислоты, которая описана выше, для восстановления кожи.
Согласно определенным вариантам осуществления, предложено применение инъекционной композиции гиалуроновой кислоты, которая описана выше, для предотвращения и/или лечения потери волос.
Согласно определенным вариантам осуществления, предложено применение инъекционной композиции гиалуроновой кислоты, которая описана выше, для заполнения морщин или улучшения контура лица или тела пациента.
Согласно другим аспектам, проиллюстрированным в настоящем документе, предложен способ улучшения внешнего вида кожи, предотвращения и/или лечения потери волос, заполнения морщин или улучшения контура лица или тела пациента, включающий:
a) получение инъекционной композиции гиалуроновой кислоты, которая описана выше, и
b) инъецирование указанной инъекционной композиции гиалуроновой кислоты в кожу пациента.
В определенных вариантах осуществления инъекционную композицию гиалуроновой кислоты инъецируют в кожу и/или подкожный слой.
Согласно определенным вариантам осуществления, способ включает улучшение внешнего вида кожи. Согласно предпочтительному варианту осуществления, способ включает восстановление кожи.
Согласно определенным вариантам осуществления, способ включает предотвращение и/или лечение потери волос.
Согласно определенным вариантам осуществления, способ включает заполнение морщин или улучшение контура лица или тела пациента.
Согласно другим аспектам, проиллюстрированным в настоящем документе, предложен способ получения композиции гиалуроновой кислоты, включающий:
a) смешивание гиалуроновой кислоты, местного анестетика, выбранного из группы, состоящей из местных анестетиков амидного и сложноэфирного типов или их сочетания, и производного аскорбиновой кислоты в количестве, которое предотвращает или уменьшает воздействие на вязкость и/или модуль упругости G' композиции, вызванное местным анестетиком при термической стерилизации, и
b) воздействие на смесь термической стерилизации.
В способе получения композиции указанное производное аскорбиновой кислоты предназначено для предотвращения или уменьшения воздействия местного анестетика на вязкость и/или модуль упругости G' композиции, вследствие термической стерилизации.
Компоненты композиции, т.е. гиалуроновая кислота, местный анестетик и производное аскорбиновой кислоты, можно дополнительно определить, как описано выше, для инъекционной композиции гиалуроновой кислоты.
Полученная композиция гиалуроновой кислоты не проявляет повышенной устойчивости по сравнению с такой же композицией без производного аскорбиновой кислоты.
В некоторых вариантах осуществления стерилизация на стадии b) включает воздействие на смесь термической обработки. В определенных вариантах осуществления стерилизация на стадии b) включает обработку в автоклаве смеси при значении F0 ≥ 4. Стерилизацию можно дополнительно охарактеризовать, как описано выше для композиции.
Согласно другим аспектам, которые проиллюстрированы в настоящем документе, предложено применение производного аскорбиновой кислоты в инъекционной композиции гиалуроновой кислоты, дополнительно включающей гиалуроновую кислоту и местный анестетик, выбранный из группы, состоящей из местных анестетиков амидного и сложноэфирного типов или их сочетания, для предотвращения или уменьшения воздействия местного анестетика на вязкость и/или модуль упругости G' композиции, вследствие термической стерилизации.
Компоненты композиции можно дополнительно определить, как описано выше для инъекционной композиции гиалуроновой кислоты. Стерилизацию можно дополнительно охарактеризовать, как описано выше.
Инъекционная композиция гиалуроновой кислоты, полученная посредством применения производного аскорбиновой кислоты, не проявляет повышенной устойчивости по сравнению с такой же композицией без производного аскорбиновой кислоты.
Краткое описание чертежей
Фиг. 1 представляет собой график, иллюстрирующий воздействие MAP (аскорбилфосфата магния) на гель гиалуроновой кислоты с лидокаином.
Фиг. 2 представляет собой график, иллюстрирующий воздействие MAP на гель гиалуроновой кислоты с лидокаином.
Фиг. 3 представляет собой график, иллюстрирующий воздействие MAP на несшитую гиалуроновую кислоту с лидокаином.
Фиг. 4 представляет собой график, иллюстрирующий воздействие MAP на несшитую гиалуроновую кислоту с лидокаином.
Фиг. 5 представляет собой график, иллюстрирующий воздействие MAP на гель гиалуроновой кислоты с лидокаином обработанный в автоклаве при различных значениях F0.
Фиг. 6 представляет собой график, иллюстрирующий воздействие MAP на гель гиалуроновой кислоты с бупивакаином.
Фиг. 7 представляет собой график, иллюстрирующий воздействие MAP на гель гиалуроновой кислоты с тетракаином.
Фиг. 8 представляет собой график, иллюстрирующий воздействие SAP (аскорбилфосфата натрия) на гель гиалуроновой кислоты с лидокаином.
Фиг. 9 представляет собой график, иллюстрирующий воздействие метилсиланоласкорбата на гель гиалуроновой кислоты с лидокаином.
Фиг. 10 представляет собой график, иллюстрирующий воздействие аскорбилглюкозида на несшитую гиалуроновую кислоту с бупивакаином.
Фиг. 11 представляет собой график, иллюстрирующий воздействие различных концентраций SAP на гель гиалуроновой кислоты с лидокаином.
Фиг. 12 представляет собой график, иллюстрирующий воздействие ацетонида L-аскорбиновой кислоты на гель гиалуроновой кислоты с тетракаином.
Фиг. 13 представляет собой график, иллюстрирующий воздействие SAP на гель гиалуроновой кислоты с лидокаином.
Фиг. 14 представляет собой график, иллюстрирующий воздействие аминопропиласкорбилфосфата на несшитую гиалуроновую кислоту с лидокаином.
Фиг. 15 представляет собой график, иллюстрирующий воздействие аскорбилглюкозида на гель гиалуроновой кислоты с лидокаином.
Фиг. 16 представляет собой график, иллюстрирующий воздействие аскорбилглюкозида на гель гиалуроновой кислоты с лидокаином.
Фиг. 17 представляет собой график, иллюстрирующий воздействие аскорбилглюкозида на гель гиалуроновой кислоты с лидокаином.
Фиг. 18 представляет собой график, иллюстрирующий воздействие MAP на гели гиалуроновой кислоты с лидокаином.
Фиг. 19 представляет собой график, иллюстрирующий воздействие SAP на гель гиалуроновой кислоты с лидокаином в исследовании устойчивости.
Фиг. 20 представляет собой график, иллюстрирующий воздействие аскорбилглюкозида на гель гиалуроновой кислоты с лидокаином в исследовании устойчивости.
Фиг. 21 представляет собой график, иллюстрирующий воздействие MAP или аскорбилглюкозида на гель гиалуроновой кислоты с лидокаином в исследовании устойчивости.
Фиг. 22 представляет собой график, иллюстрирующий воздействие аскорбилглюкозида на гель гиалуроновой кислоты с лидокаином в исследовании устойчивости.
Подробный список вариантов осуществления
1. Инъекционная композиция гиалуроновой кислоты, включающая
- гиалуроновую кислоту,
- местный анестетик, выбранный из группы, состоящей из местных анестетиков амидного и сложноэфирного типов или их сочетания, и
- производное аскорбиновой кислоты в количестве, которое предотвращает или уменьшает воздействие на вязкость и/или модуль упругости G' композиции, вызванное местным анестетиком при термической стерилизации.
2. Инъекционная композиция гиалуроновой кислоты по п. 1, причем указанная композиция не проявляет повышенной устойчивости по сравнению с такой же композицией без производного аскорбиновой кислоты.
3. Инъекционная композиция гиалуроновой кислоты по любому из предшествующих пунктов, в которой указанная гиалуроновая кислота представляет собой модифицированную гиалуроновую кислоту.
4. Инъекционная композиция гиалуроновой кислоты по п. 3, в которой указанная гиалуроновая кислота представляет собой гель гиалуроновой кислоты.
5. Инъекционная композиция гиалуроновой кислоты по п. 4, в которой гель гиалуроновой кислоты сшит посредством модификации сшивающим химическим реагентом.
6. Инъекционная композиция гиалуроновой кислоты по п. 5, в которой сшивающий химический реагент выбирают из группы, состоящей из дивинилсульфона, полиэпоксидов и диэпоксидов.
7. Инъекционная композиция гиалуроновой кислоты по п. 6, в которой сшивающий химический реагент выбирают из группы, состоящей из 1,4-бутандиолдиглицидилового эфира (BDDE), 1,2-этандиолдиглицидилового эфира (EDDE) и диэпоксиоктана.
8. Инъекционная композиция гиалуроновой кислоты по п. 7, в которой сшивающий химический реагент представляет собой 1,4-бутандиолдиглицидиловый эфир (BDDE).
9. Инъекционная композиция гиалуроновой кислоты по любому из пп. 5-8, в которой гель гиалуроновой кислоты имеет степень модификации, составляющую 2 мол.% или менее, в том числе 1,5 мол.% или менее, в том числе 1,25 мол.% или менее.
10. Инъекционная композиция гиалуроновой кислоты по любому из пп. 5-8, в которой гель гиалуроновой кислоты имеет степень модификации в интервале от 0,1 до 2 мол.%, в том числе в интервале от 0,2 до 1,5 мол.%, в том числе в интервале от 0,3 до 1,25 мол.%.
11. Инъекционная композиция гиалуроновой кислоты по любому из предшествующих пунктов, в которой концентрация указанной гиалуроновой кислоты находится в интервале от 1 до 100 мг/мл.
12. Инъекционная композиция гиалуроновой кислоты по п. 11, в которой концентрация указанной гиалуроновой кислоты находится в интервале от 2 до 50 мг/мл.
13. Инъекционная композиция гиалуроновой кислоты по п. 12, в которой концентрация указанной гиалуроновой кислоты находится в интервале от 10 до 30 мг/мл.
14. Инъекционная композиция гиалуроновой кислоты по любому из предшествующих пунктов, в которой указанный местный анестетик выбирают из группы, состоящей из лигнокаина (лидокаин), бупивакаина, бутаниликаина, картикаина, цинхокаина (дибукаин), клибукаина, этилпарапиперидиноацетиламинобензоата, этидокаина, мепивакаина, оксетазаина, прилокаина, ропивакаина, толикаина, тримекаина, вадокаина, артикаина, левобупивакаина, амилокаина, кокаина, пропанокаина, хлормекаина, циклометикаина, проксиметакаина, аметокаина (тетракаин), бензокаина, бутакаина, бутоксикаина, бутиламинобензоата, хлорпрокаина, диметокаина (ларокаин), оксибупрокаина, пиперокаина, паретоксикаина, прокаина (новокаин), пропоксикаина, трикаина, или их сочетания.
15. Инъекционная композиция гиалуроновой кислоты по любому из предшествующих пунктов, в которой указанный местный анестетик выбирают из группы, состоящей из местных анестетиков амидного типа, или их сочетания.
16. Инъекционная композиция гиалуроновой кислоты по п. 15, в которой указанный местный анестетик выбирают из группы, состоящей из лигнокаина (лидокаин), бупивакаина, бутаниликаина, картикаина, цинхокаина (дибукаин), клибукаина, этилпарапиперидиноацетиламинобензоата, этидокаина, мепивакаина, оксетазаина, прилокаина, ропивакаина, толикаина, тримекаина, вадокаина, артикаина, левобупивакаина или их сочетания.
17. Инъекционная композиция гиалуроновой кислоты по п. 16, в которой указанный местный анестетик выбирают из группы, состоящей из лидокаина, бупивакаина, и ропивакаина, или их сочетания.
18. Инъекционная композиция гиалуроновой кислоты по п. 17, в которой указанный местный анестетик представляет собой лидокаин.
19. Инъекционная композиция гиалуроновой кислоты по любому из предшествующих пунктов, в которой концентрация указанного местного анестетика находится в интервале от 0,1 до 30 мг/мл.
20. Инъекционная композиция гиалуроновой кислоты по п. 19, в которой концентрация указанного местного анестетика находится в интервале от 0,5 до 10 мг/мл.
21. Инъекционная композиция гиалуроновой кислоты по п. 20, в которой концентрация указанного лидокаина находится в интервале от 1 до 5 мг/мл.
22. Инъекционная композиция гиалуроновой кислоты по п. 21, в которой концентрация указанного лидокаина находится в интервале от 2 до 4 мг/мл.
23. Инъекционная композиция гиалуроновой кислоты по п. 22, в которой концентрация указанного лидокаина составляет приблизительно 3 мг/мл.
24. Инъекционная композиция гиалуроновой кислоты по любому из предшествующих пунктов, в которой указанное производное аскорбиновой кислоты представляет собой соединение, имеющее химическую структуру:
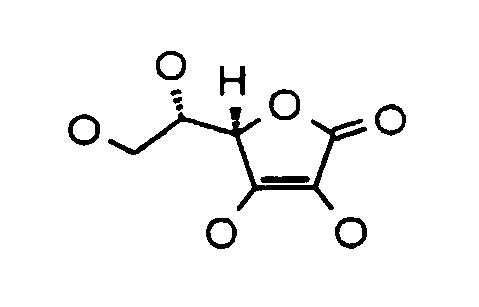
25. Инъекционная композиция гиалуроновой кислоты по любому из предшествующих пунктов, в которой указанное производное аскорбиновой кислоты растворяется в воде при атмосферных условиях.
26. Инъекционная композиция гиалуроновой кислоты по любому из предшествующих пунктов, в которой указанное производное аскорбиновой кислоты способно образовывать аскорбиновую кислоту или аскорбат при помещении в условия живого организма (in vivo).
27. Инъекционная композиция гиалуроновой кислоты по любому из предшествующих пунктов, в которой указанное производное аскорбиновой кислоты выбирают из группы, состоящей из аскорбилфосфатов, аскорбилсульфатов, аскорбилгликозидов или их сочетания.
28. Инъекционная композиция гиалуроновой кислоты по любому из предшествующих пунктов, в которой указанное производное аскорбиновой кислоты выбирают из группы, состоящей из аскорбилфосфатов и аскорбилгликозидов или их сочетания.
29. Инъекционная композиция гиалуроновой кислоты по любому из предшествующих пунктов, в которой указанное производное аскорбиновой кислоты представляет собой аскорбилфосфат.
30. Инъекционная композиция гиалуроновой кислоты по п. 29, в которой указанный аскорбилфосфат выбирают из группы, состоящей из аскорбилфосфата натрия (SAP) и аскорбилфосфата магния (MAP).
31. Инъекционная композиция гиалуроновой кислоты по любому из пп. 1-28, в которой указанное производное аскорбиновой кислоты представляет собой аскорбилгликозид.
32. Инъекционная композиция гиалуроновой кислоты по п. 31, в которой указанное производное аскорбиновой кислоты представляет собой аскорбилглюкозид.
33. Инъекционная композиция гиалуроновой кислоты по любому из предшествующих пунктов, в которой концентрация указанного производного аскорбиновой кислоты находится в интервале от 0,001 до 15 мг/мл.
34. Инъекционная композиция гиалуроновой кислоты по п. 33, в которой концентрация указанного производного аскорбиновой кислоты находится в интервале от 0,001 до 10 мг/мл.
35. Инъекционная композиция гиалуроновой кислоты по п. 34, в которой концентрация указанного производного аскорбиновой кислоты находится в интервале от 0,01 до 5 мг/мл.
36. Инъекционная композиция гиалуроновой кислоты по п. 35, в которой концентрация указанного производного аскорбиновой кислоты находится в интервале от 0,01 до 0,5 мг/мл.
37. Инъекционная композиция гиалуроновой кислоты по п. 30, в которой концентрация указанного аскорбилфосфата натрия (SAP) или аскорбилфосфата магния (MAP) находится в интервале от 0,01 до 1 мг/мл.
38. Инъекционная композиция гиалуроновой кислоты по п. 37, в которой концентрация указанного аскорбилфосфата натрия (SAP) или аскорбилфосфата магния (MAP) находится в интервале от 0,01 до 0,5 мг/мл.
39. Инъекционная композиция гиалуроновой кислоты по п. 31, в которой концентрация указанного аскорбилглюкозида находится в интервале от 0,01 до 0,8 мг/мл.
40. Инъекционная композиция гиалуроновой кислоты по п. 39, в которой концентрация указанного аскорбилглюкозида находится в интервале от 0,05 до 0,4 мг/мл.
41. Инъекционная композиция гиалуроновой кислоты по п. 1, включающая:
- водный гель гиалуроновой кислоты, содержащий от 2 до 50 мг/мл гиалуроновой кислоты,
- 0,5 до 10 мг/мл лидокаина, и
- 0,01 до 5 мг/мл производного аскорбиновой кислоты, выбранного из группы, состоящей из аскорбилфосфатов и аскорбилгликозидов, или их сочетания.
42. Стерилизованная инъекционная композиция гиалуроновой кислоты по любому из предшествующих пунктов.
43. Стерилизованная композиция гиалуроновой кислоты по п. 42, в которой композицию подвергают стерилизации путем обработки в автоклаве или аналогичной термической стерилизации.
44. Инъекционная композиция гиалуроновой кислоты по любому из пп. 1-43 для применения в качестве лекарственного средства.
45. Инъекционная композиция гиалуроновой кислоты по любому из пп. 1-43 для применения в дерматологическом лечении, выбранном из группы, состоящей из заживления ран, лечения состояния сухости кожи и пораженной солнечными ожогами кожи, лечения гиперпигментационных расстройств, лечения и предотвращения потери волос, и лечения состояний, которые включают воспаление в качестве компонента процесса заболевания, такие как псориаз и астеатотическая экзема.
46. Инъекционная композиция гиалуроновой кислоты по любому из пп. 1-43 для применения в лечении суставных расстройств посредством внутрисуставной инъекции.
47. Косметическое немедицинское применение инъекционной композиции гиалуроновой кислоты по любому из пп. 1-43 для улучшения внешнего вида кожи, предотвращения и/или лечения потери волос, заполнения морщин или улучшения контура лица или тела пациента.
48. Косметическое немедицинское применение по п. 47 для улучшения внешнего вида кожи пациента.
49. Косметическое немедицинское применение по п. 47 для заполнения морщин пациента.
50. Косметический немедицинский способ улучшения внешнего вида кожи, предотвращения и/или лечения потери волос, заполнения морщин или улучшения контура лица или тела пациента, включающий:
a) получение инъекционной композиции гиалуроновой кислоты по любому из пп. 1-43, и
b) инъецирование указанной инъекционной композиции гиалуроновой кислоты в кожу пациента.
51. Способ по п. 50, в котором указанную инъекционную композицию гиалуроновой кислоты инъецируют в кожу и/или подкожный слой.
52. Способ получения композиции гиалуроновой кислоты, включающий:
a) смешивание гиалуроновой кислоты, местного анестетика, выбранного из группы, состоящей из местных анестетиков амидного и сложноэфирного типов или их сочетания, и производного аскорбиновой кислоты в количестве, которое предотвращает или уменьшает воздействие на вязкость и/или модуль упругости G' композиции, вызванное местным анестетиком при термической стерилизации, и
b) воздействие на смесь термической стерилизации.
53. Способ по п. 52, в котором полученная композиция гиалуроновой кислоты не проявляет повышенной устойчивости по сравнению с такой же композицией без производного аскорбиновой кислоты.
54. Способ по любому из пп. 52 и 53, в котором стадия b) включает воздействие на смесь значения F0 ≥ 4.
55. Применение производного аскорбиновой кислоты в инъекционной композиции гиалуроновой кислоты, дополнительно включающей:
- гиалуроновую кислоту и
- местный анестетик, выбранный из группы, состоящей из местных анестетиков амидного и сложноэфирного типов или их сочетания,
для предотвращения или уменьшения воздействия местного анестетика на вязкость и/или модуль упругости G' композиции, вследствие термической стерилизации.
56. Применение по п. 55, в котором композиция гиалуроновой кислоты не проявляет повышенной устойчивости по сравнению с такой же композицией без производного аскорбиновой кислоты.
Примеры
Без намерения ограничиваться этим, настоящее изобретение далее будет проиллюстрировано посредством примеров. Поскольку полимер гиалуроновой кислоты и гель гиалуроновой кислоты могут всегда подвергаться некоторым изменениям при переходе от одной партии к другой, каждый пример был осуществлен с применением полимера гиалуроновой кислоты или геля гиалуроновой кислоты из одной партии, чтобы получать сопоставимые результаты. Незначительные изменения, например, реологических свойств или вязкости при сравнении аналогичных композиций в различных примерах могут быть обусловлены указанными изменениями при переходе от одной партии к другой.
Пример 1. Гель гиалуроновой кислоты с лидокаином и MAP
В данном эксперименте реологические свойства после обработки в автоклаве гелей гиалуроновой кислоты без добавок сравнивали с гелями гиалуроновой кислоты, содержащими добавки лидокаина, и гелями гиалуроновой кислоты, содержащими добавки лидокаина и MAP, соответственно.
Композиции, содержащие различные концентрации лидокаина и MAP, которые представлены в таблице 1, получали, как описано ниже.
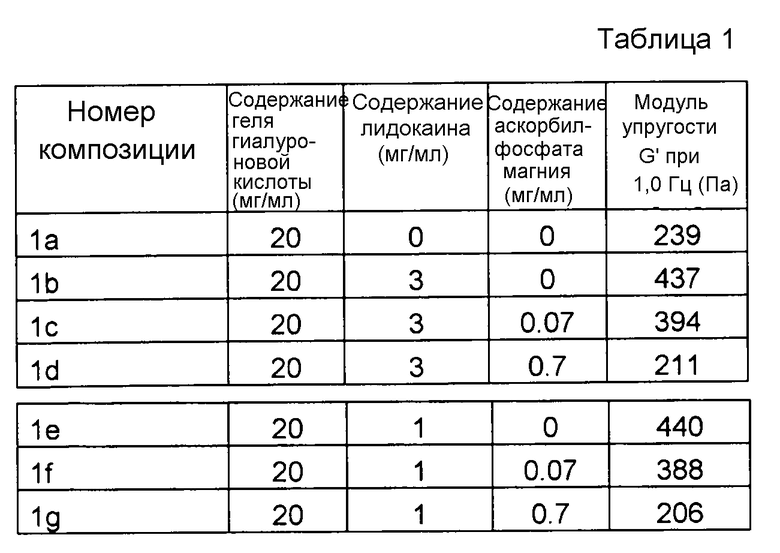
Во всех композициях применяли сшитый 1,4-бутандиолдиглицидиловым эфиром (BDDE) гель гиалуроновой кислоты, имеющий степень модификации 1 мол.% и содержание гиалуроновой кислоты 20 мг/мл. Степень модификации (мол.%) означает количество сшивающего реагента (реагентов), которое присоединяется к гиалуроновой кислоте, т.е. молярное количество присоединенного сшивающего реагента (реагентов) по отношению к суммарному молярному количеству повторяющихся дисахаридных звеньев HA. Степень модификации представляет собой степень, в которой гиалуроновая кислота химически модифицирована сшивающим реагентом.
Сшитый 1,4-бутандиолдиглицидиловым эфиром (BDDE) гель гиалуроновой кислоты можно получать, например, применяя способ, описанный в примерах 1 и 2 опубликованной международной патентной заявки WO 9704012.
Исходный раствор моногидрата гидрохлорида лидокаина (номер Реферативной службы по химии (CAS) 6108-05-0) от фирмы Sigma Aldrich (Сент-Луис, США) получали, растворяя моногидрат гидрохлорида лидокаина в воде для инъекций (WFI), и исходный раствор аскорбилфосфата магния (MAP, номер CAS 114040-31-2) от фирмы Nikko Chemicals Co. (Япония) получали, растворяя MAP в содержащем фосфатный буфер физиологическом растворе (8 мМ, 0,9% NaCl).
Композиция 1a:
Гель гиалуроновой кислоты разбавляли до такой же степени, как в композициях 1b-1g, добавляя содержащий фосфатный буфер физиологический раствор (8 мМ, 0,9% NaCl).
Композиция 1b:
Исходный раствор лидокаина добавляли в гель гиалуроновой кислоты до конечной концентрации 3 мг/мл геля.
Композиция 1c:
Исходный раствор лидокаина и исходный раствор MAP добавляли в гель гиалуроновой кислоты до конечных концентраций 3 мг лидокаина/мл и 0,07 мг MAP/мл геля.
Композиции 1d-1g получали таким же способом, изменяя количества исходного раствора лидокаина и исходного раствора MAP. Во все композиции добавляли содержащий фосфатный буфер физиологический раствор (8 мМ, 0,9% NaCl), чтобы обеспечивать разбавление до одинаковой степени.
Значения pH композиций устанавливали на уровне 7,5±0,2, и композиции набирали в стеклянные шприцы объемом 1 мл (BD Hypak SCF) и подвергали термической обработке в автоклаве Getinge GEV 6610 ERC-1 (F0~30).
Реологические свойства композиций анализировали, применяя реометр Bohling VOR (измерительная система PP 30, промежуток 1,00 мм). Сначала осуществляли изменение деформации, для определения области линейной вязкоупругости (LVR), а затем вязкоупругие свойства измеряли в пределах LVR.
Результаты представлены на фиг. 1. MAP подавляет воздействие на модуль упругости G' композиции, вызванное местным анестетиком при термической стерилизации. Чем выше концентрация MAP, тем больше снижение модуля упругости G'. Повышенная концентрация лидокаина не влияет на увеличение модуля упругости G'.
Пример 2. Гель гиалуроновой кислоты с повышенной степенью модификации лидокаином и MAP
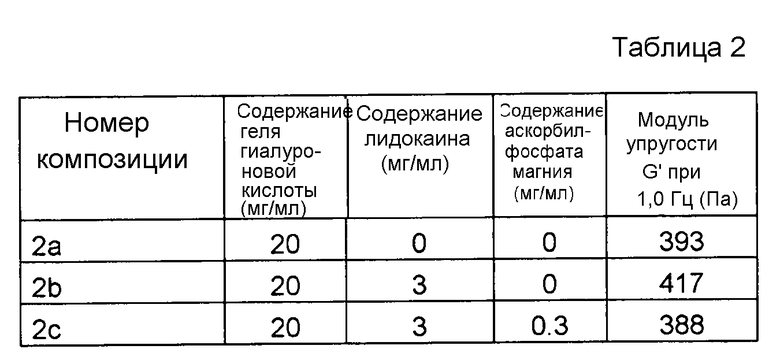
Композиции, которые представлены в таблице 2, получали, в основном, согласно способу, описанному в примере 1, за исключением того, что применяли гель гиалуроновой кислоты с повышенной степенью модификации (приблизительно 7%). Гель гиалуроновой кислоты можно получать, например, согласно способу, описанному в примерах патента США № 6921819 B2.
Значения pH композиций устанавливали на уровне 7,5±0,2, и композиции набирали в стеклянные шприцы объемом 1 мл (BD Hypak SCF) и подвергали термической обработке в автоклаве Getinge GEV 6610 ERC-1 (F0~29).
Реологические свойства композиций анализировали, применяя реометр Bohling VOR (измерительная система PP 30, промежуток 1,00 мм). Сначала осуществляли изменение деформации, для определения области линейной вязкоупругости (LVR), а затем вязкоупругие свойства измеряли в пределах LVR.
Результаты представлены на фиг. 2. MAP подавляет воздействие на модуль упругости G' композиции, вызванное местным анестетиком при термической стерилизации.
Пример 3. Несшитая гиалуроновая кислота с лидокаином и MAP
Композиции, которые представлены в таблице 3, получали, в основном, согласно способу, описанному в примере 1, за исключением того, что применяли несшитую гиалуроновую кислоту, у которой средняя молекулярная масса составляла 1×106 МДа.
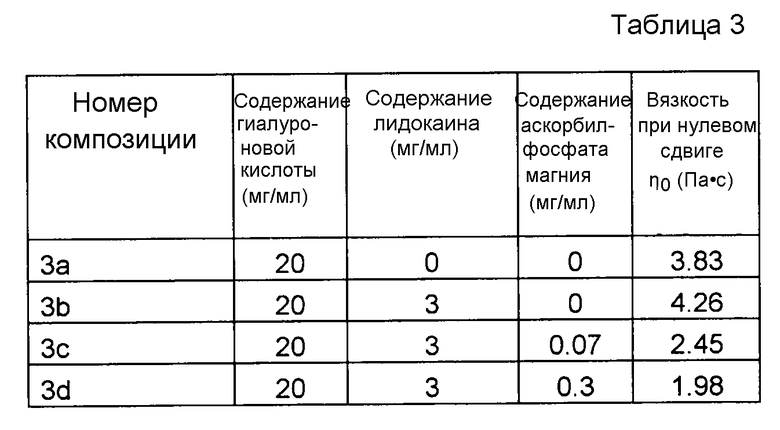
Значения pH композиций устанавливали на уровне 7,5±0,2, и композиции набирали в стеклянные шприцы объемом 1 мл (BD Hypak SCF) и подвергали термической обработке в автоклаве Getinge GEV 6610 ERC-1 (F0~22).
Вязкость композиций исследовали методом ротационной вискозиметрии, применяя реометр Bohling VOR (измерительная система PP 30, промежуток 1,00 мм). Результаты представлены на фиг. 3. MAP подавляет воздействие на вязкость композиции, вызванное местным анестетиком при термической стерилизации.
Пример 4. Несшитая гиалуроновая кислота с лидокаином и MAP при пониженных концентрациях
Композиции, которые представлены в таблице 4, получали, в основном, согласно способу, описанному в примере 3, за исключением того, что применяли пониженные концентрации MAP.
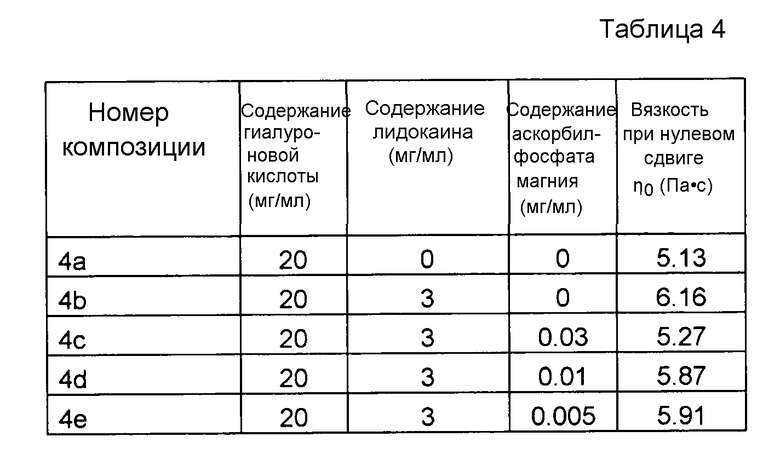
Значения pH композиций устанавливали на уровне 7,5±0,2, и композиции набирали в стеклянные шприцы объемом 1 мл (BD Hypak SCF) и подвергали термической обработке в автоклаве Getinge GEV 6610 ERC-1 (F0~22).
Вязкость композиций исследовали методом ротационной вискозиметрии, применяя реометр Bohling VOR (измерительная система PP 30, промежуток 1,00 мм).
Результаты представлены на фиг. 4. MAP подавляет воздействие на вязкость композиции, вызванное местным анестетиком при термической стерилизации.
Пример 5. Гель гиалуроновой кислоты с лидокаином и MAP обработанный в автоклаве при различных значениях F0
Композиции, которые представлены в таблице 5, получали, в основном, согласно способу, описанному в примере 1, за исключением того, что применяли различные концентрации MAP.
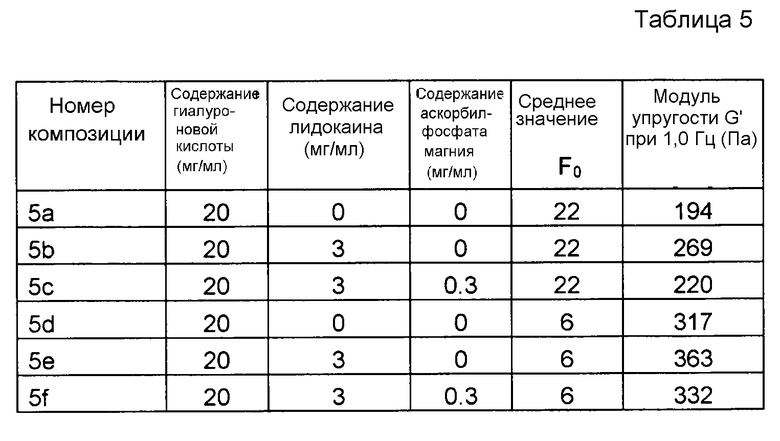
Значения pH композиций устанавливали на уровне 7,5±0,2, и композиции набирали в стеклянные шприцы объемом 1 мл (BD Hypak SCF) и подвергали термической обработке в автоклаве Getinge GEV 6610 ERC-1 при различных значениях F0, описанных в таблице 5.
Реологические свойства композиций анализировали, применяя реометр Bohling VOR (измерительная система PP 30, промежуток 1,00 мм). Сначала осуществляли изменение деформации, для определения области линейной вязкоупругости (LVR), а затем вязкоупругие свойства измеряли в пределах LVR.
Результаты представлены на фиг. 5. Воздействие на модуль упругости G' композиции, вызванное местным анестетиком при термической стерилизации, слегка увеличивается при повышении значения F0. MAP подавляет воздействие на модуль упругости G' композиции, вызванное местным анестетиком при термической стерилизации.
Пример 6. Гель гиалуроновой кислоты с бупивакаином и MAP
Композиции, которые представлены в таблице 6, получали, в основном, согласно способу, описанному в примере 1, за исключением того, что вместо лидокаина применяли бупивакаин (номер CAS 2180-92-9) от фирмы Cambrex (Карискога, Швеция), и что применяли гель гиалуроновой кислоты, у которого степень модификации составляла менее чем 1%, и содержание гиалуроновой кислоты составляло 12 мг/мл.
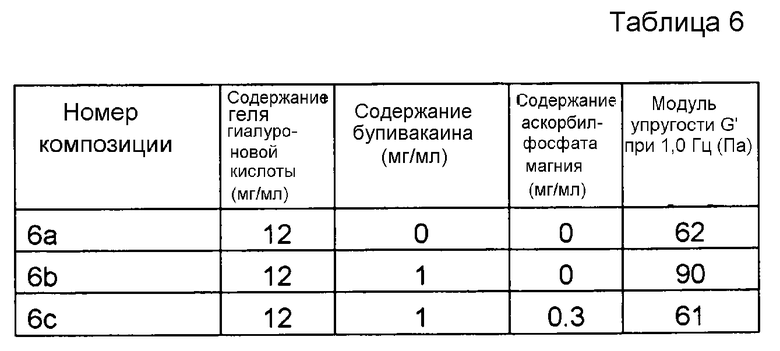
Значения pH композиций устанавливали на уровне 7,5±0,2, и композиции набирали в стеклянные шприцы объемом 1 мл (BD Hypak SCF) и подвергали термической обработке в автоклаве Getinge GEV 6610 ERC-1 (F0~22).
Реологические свойства композиций анализировали, применяя реометр Bohling VOR (измерительная система PP 30, промежуток 1,00 мм). Сначала осуществляли изменение деформации, для определения области линейной вязкоупругости (LVR), а затем вязкоупругие свойства измеряли в пределах LVR.
Результаты представлены на фиг. 6. Бупивакаин производит аналогичное воздействие на модуль упругости G' композиции, как лидокаин. MAP подавляет воздействие на модуль упругости G' композиции, вызванное местным анестетиком при термической стерилизации.
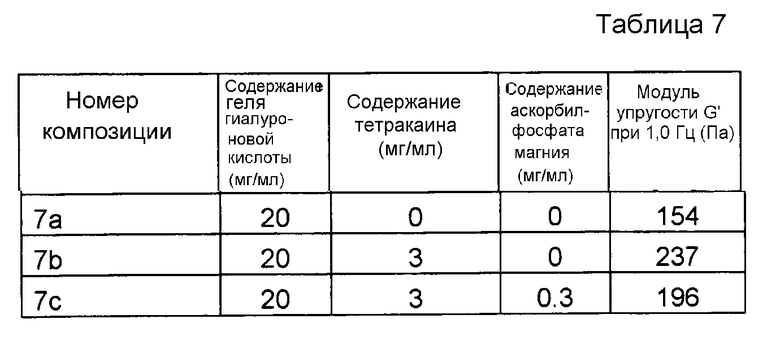
Пример 7. Гель гиалуроновой кислоты с тетракаином и MAP
Композиции, которые представлены в таблице 7, получали, в основном, согласно способу, описанному в примере 1 за исключением того, что вместо лидокаина применяли тетракаин (номер CAS 136-47-0 от фирмы Sigma Aldrich (Сент-Луис, США), и концентрация MAP составляла 0,3 мг/мл.
Значения pH композиций устанавливали на уровне 7,5±0,2, и композиции набирали в стеклянные шприцы объемом 1 мл (BD Hypak SCF) и подвергали термической обработке в автоклаве Getinge GEV 6610 ERC-1 (F0~22).
Реологические свойства композиций анализировали, применяя реометр Bohling VOR (измерительная система PP 30, промежуток 1,00 мм). Сначала осуществляли изменение деформации, для определения области линейной вязкоупругости (LVR), а затем вязкоупругие свойства измеряли в пределах LVR.
Результаты представлены на фиг. 7. Тетракаин производит аналогичное воздействие на модуль упругости G' композиции, как лидокаин. MAP подавляет воздействие на модуль упругости G' композиции, вызванное местным анестетиком при термической стерилизации.
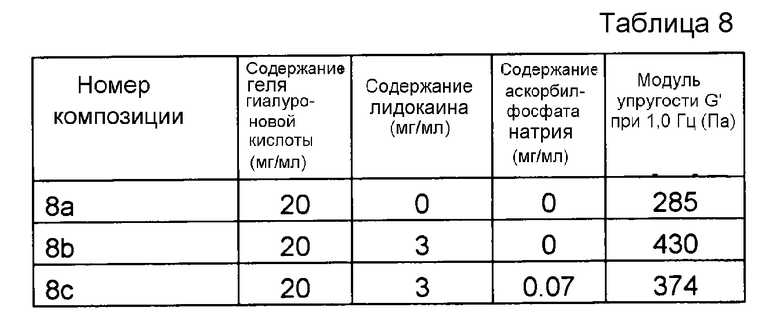
Пример 8. Гель гиалуроновой кислоты с лидокаином и SAP
Композиции, которые представлены в таблице 10, получали, в основном, согласно способу, описанному в примере 1, за исключением того, что вместо аскорбилфосфата магния (MAP) применяли аскорбилфосфат натрия (SAP).
Исходный раствор SAP (номер CAS 66170-10-3) от фирмы Sigma Aldrich (Сент-Луис, США) получали, растворяя SAP в содержащем фосфатный буфер физиологическом растворе (8 мМ, 0,9% NaCl).
Значения pH композиций устанавливали на уровне 7,5±0,2, и композиции набирали в стеклянные шприцы объемом 1 мл (BD Hypak SCF) и подвергали термической обработке в автоклаве Getinge GEV 6610 ERC-1 (F0~29).
Реологические свойства композиций анализировали, применяя реометр Bohling VOR (измерительная система PP 30, промежуток 1,00 мм). Сначала осуществляли изменение деформации, для определения области линейной вязкоупругости (LVR), а затем вязкоупругие свойства измеряли в пределах LVR.
Результаты представлены на фиг. 8. SAP подавляет воздействие на модуль упругости G' композиции, вызванное местным анестетиком при термической стерилизации.
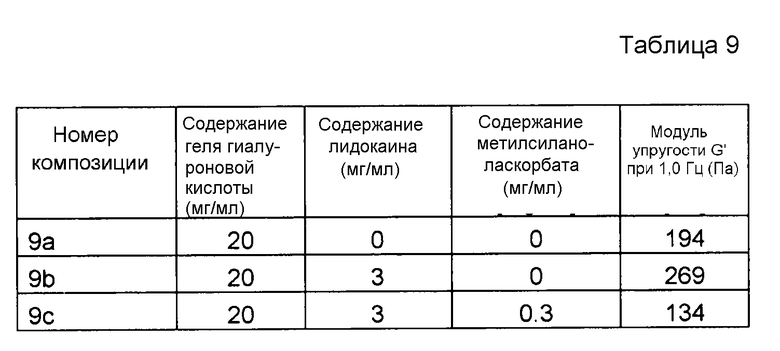
Пример 9. Гель гиалуроновой кислоты с лидокаином и метилсиланоласкорбатом
Композиции, которые представлены в таблице 11, получали, в основном, согласно способу, описанному в примере 1, за исключением того, что вместо аскорбилфосфата магния (MAP) применяли Ascorbosilane C (продукт номер 078) от фирмы Exsymol (Монако), который содержит метилсиланоласкорбат (номер CAS 187991-39-5).
Значения pH композиций устанавливали на уровне 7,5±0,2, и композиции набирали в стеклянные шприцы объемом 1 мл (BD Hypak SCF) и подвергали термической обработке в автоклаве Getinge GEV 6610 ERC-1 (F0~22).
Реологические свойства композиций анализировали, применяя реометр Bohling VOR (измерительная система PP 30, промежуток 1,00 мм). Сначала осуществляли изменение деформации, для определения области линейной вязкоупругости (LVR), а затем вязкоупругие свойства измеряли в пределах LVR.
Результаты представлены на фиг. 9. Метилсиланоласкорбат эффективно подавляет воздействие на модуль упругости G' композиции, вызванное местным анестетиком при термической стерилизации.
Пример 10. Несшитая гиалуроновая кислота с бупивакаином и аскорбилглюкозидом
Композиции, которые представлены в таблице 10, получали, в основном, согласно способу, описанному в примере 3, за исключением того, что вместо лидокаина применяли бупивакаин, и вместо MAP применяли аскорбилглюкозид (номер CAS 129499-78-1) от фирмы CarboMer, Inc. (Сан-Диего, США).

Значения pH композиций устанавливали на уровне 7,5±0,2, и композиции набирали в стеклянные шприцы объемом 1 мл (BD Hypak SCF) и подвергали термической обработке в автоклаве Getinge GEV 6610 ERC-1 (F0~22).
Вязкость композиций исследовали методом ротационной вискозиметрии, применяя реометр Bohling VOR (измерительная система C14).
Результаты представлены на фиг. 10. Аскорбилглюкозид подавляет воздействие на вязкость композиции, вызванное местным анестетиком при термической стерилизации.
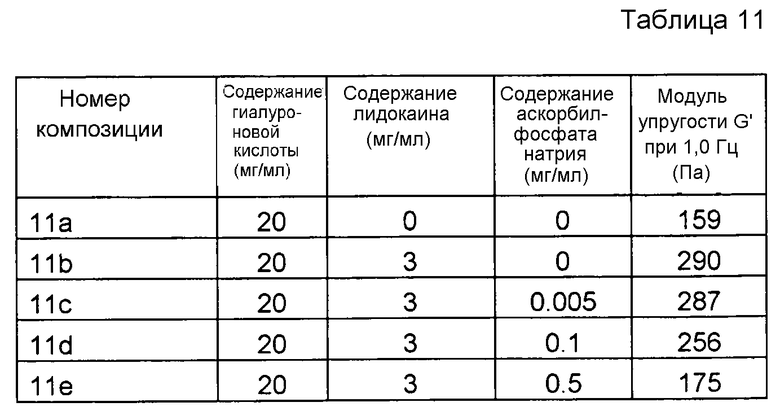
Пример 11. Гель гиалуроновой кислоты с лидокаином и различными концентрациями SAP
Композиции, которые представлены в таблице 11, получали, в основном, согласно способу, описанному в примере 8, за исключением того, что применяли различные концентрации аскорбилфосфата натрия (SAP).
Значения pH композиций устанавливали на уровне 7,5±0,2, и композиции набирали в стеклянные шприцы объемом 1 мл (BD Hypak SCF) и подвергали термической обработке в автоклаве Getinge GEV 6610 ERC-1 (F0~22).
Реологические свойства композиций анализировали, применяя реометр Bohling VOR (измерительная система PP 30, промежуток 1,00 мм). Сначала осуществляли изменение деформации, для определения области линейной вязкоупругости (LVR), а затем вязкоупругие свойства измеряли в пределах LVR. Результаты представлены на фиг. 11. SAP подавляет воздействие на модуль упругости G' композиции, вызванное местным анестетиком при термической стерилизации. Чем выше концентрация SAP, тем сильнее воздействие.
Пример 12. Гель гиалуроновой кислоты с тетракаином и ацетонидом L-аскорбиновой кислоты
Композиции, которые представлены в таблице 12, получали, в основном, согласно способу, описанному в примере 7, за исключением того, что вместо MAP применяли ацетонид L-аскорбиновой кислоты (номер CAS 15042-01-0) от фирмы Carbosynth (Беркшир, Великобритания), а также применяли повышенную концентрацию производного.

Значения pH композиций устанавливали на уровне 7,5±0,2, и композиции набирали в стеклянные шприцы объемом 1 мл (BD Hypak SCF) и подвергали термической обработке в автоклаве Getinge GEV 6610 ERC-1 (F0~5).
Реологические свойства композиций анализировали, применяя реометр Bohling VOR (измерительная система PP 30, промежуток 1,00 мм). Сначала осуществляли изменение деформации, для определения области линейной вязкоупругости (LVR), а затем вязкоупругие свойства измеряли в пределах LVR.
Результаты представлены на фиг. 12. Ацетонид L-Аскорбиновой кислоты эффективно подавляет воздействие на модуль упругости G' композиции, вызванное местным анестетиком при термической стерилизации.
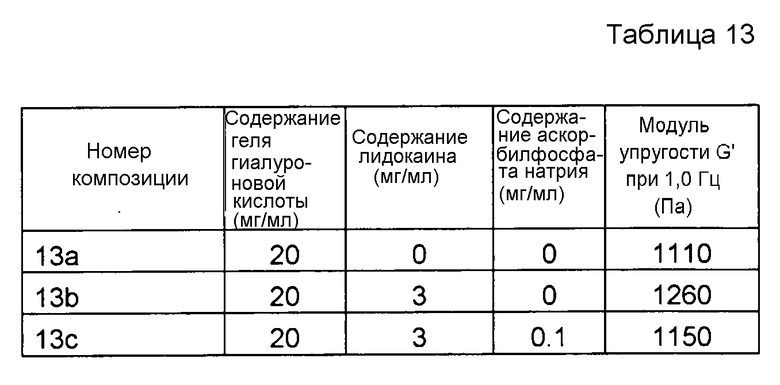
Пример 13. Гель гиалуроновой кислоты с повышенной степенью модификации лидокаином и SAP
Композиции, которые представлены в таблице 13, получали, в основном, согласно способу, описанному в примере 1, за исключением того, что применяли гель гиалуроновой кислоты с повышенной степенью модификации (приблизительно 7%), что вместо аскорбилфосфата магния (MAP) применяли аскорбилфосфат натрия (SAP, номер CAS 66170-10-3) от фирмы Sigma Aldrich (Сент-Луис, США), и что применяли другую концентрацию производного.
Значения pH композиций устанавливали на уровне 7,5±0,2, и композиции набирали в стеклянные шприцы объемом 1 мл (BD Hypak SCF) и подвергали термической обработке в автоклаве Getinge GEV 6610 ERC-1 (F0~32).
Реологические свойства композиций анализировали, применяя реометр Bohling VOR (измерительная система PP 30, промежуток 1,00 мм). Сначала осуществляли изменение деформации, для определения области линейной вязкоупругости (LVR), а затем вязкоупругие свойства измеряли в пределах LVR.
Результаты представлены на фиг. 13. SAP подавляет воздействие на модуль упругости G' композиции, вызванное местным анестетиком при термической стерилизации.
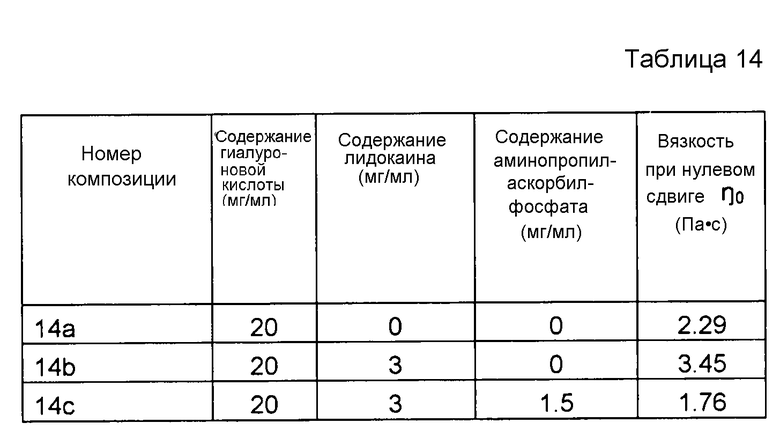
Пример 14. Несшитая гиалуроновая кислота с лидокаином и аминопропиласкорбилфосфатом
Композиции, которые представлены в таблице 14, получали, в основном, согласно способу, описанному в примере 3, за исключением того, что вместо аскорбилфосфата магния (MAP) применяли аминопропиласкорбилфосфат от фирмы Macro Care (Южная Корея), и что применяли повышенную концентрацию производного.
Значения pH композиций устанавливали на уровне 7,5±0,2, и композиции набирали в стеклянные шприцы объемом 1 мл (BD Hypak SCF) и подвергали термической обработке в автоклаве Getinge GEV 6610 ERC-1 (F0~22).
вязкость композиций исследовали методом ротационной вискозиметрии, применяя реометр Bohling VOR (измерительная система PP 30, промежуток 1,00 мм).
Результаты представлены на фиг. 14. Аминопропиласкорбилфосфат эффективно подавляет воздействие на вязкость композиции, вызванное местным анестетиком при термической стерилизации.
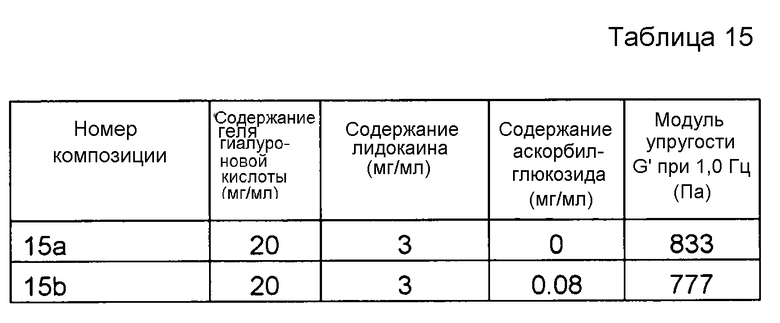
Пример 15. Гель гиалуроновой кислоты с лидокаином и аскорбилглюкозидом
Композиции, которые представлены в таблице 15, получали, в основном, согласно способу, описанному в примере 1 за исключением того, что вместо аскорбилфосфата магния (MAP) применяли аскорбилглюкозид от фирмы CarboMer, Inc. (Сан-Диего, США), и применяли другую концентрацию производного.
Значения pH композиций устанавливали на уровне 7,5±0,2, и композиции набирали в стеклянные шприцы объемом 1 мл (BD Hypak SCF) и подвергали термической обработке в автоклаве Getinge GEV 6610 ERC-1 (F0~23).
Реологические свойства композиций анализировали, применяя реометр Bohling VOR (измерительная система PP 30, промежуток 1,00 мм). Сначала осуществляли изменение деформации, для определения области линейной вязкоупругости (LVR), а затем вязкоупругие свойства измеряли в пределах LVR.
Результаты представлены на фиг. 15. Аскорбилглюкозид подавляет воздействие на модуль упругости G' композиции, вызванное местным анестетиком при термической стерилизации.
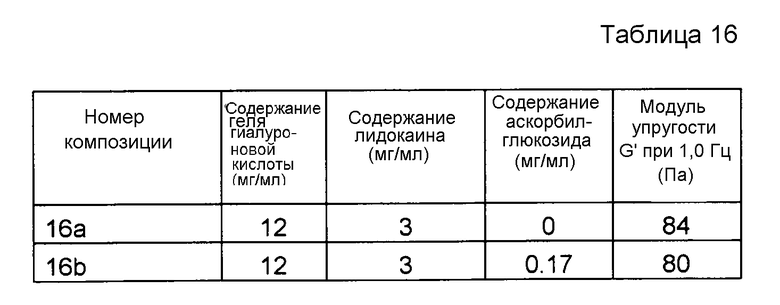
Пример 16. Гель гиалуроновой кислоты с лидокаином и аскорбилглюкозидом
Композиции, которые представлены в таблице 16, получали, в основном, согласно способу, описанному в примере 15 за исключением того, что применяли гель гиалуроновой кислоты, у которого степень модификации составляла менее чем 1%, и содержание гиалуроновой кислоты составляло 12 мг/мл, и что применяли повышенную концентрацию производного.
Значения pH композиций устанавливали на уровне 7,5±0,2, и композиции набирали в стеклянные шприцы объемом 1 мл (BD Hypak SCF) и подвергали термической обработке в автоклаве Getinge GEV 6610 ERC-1 (F0~23).
Реологические свойства композиций анализировали, применяя реометр Bohling VOR (измерительная система PP 30, промежуток 1,00 мм). Сначала осуществляли изменение деформации, для определения области линейной вязкоупругости (LVR), а затем вязкоупругие свойства измеряли в пределах LVR.
Результаты представлены на фиг. 16. Аскорбилглюкозид подавляет воздействие на модуль упругости G' композиции, вызванное местным анестетиком при термической стерилизации.
Пример 17. Гель гиалуроновой кислоты с лидокаином и аскорбилглюкозидом
Композиции, которые представлены в таблице 17, получали, в основном, согласно способу, описанному в примере 15 за исключением того, что применяли аскорбилглюкозид от другого производителя, а именно от фирмы Hayashibara Biochemical Laboratories, Inc. (Окаяма, Япония), и что применяли повышенные концентрации производного. В данном примере применяли гель гиалуроновой кислоты, в котором содержание гиалуроновой кислоты составляло 16 мг/мл.
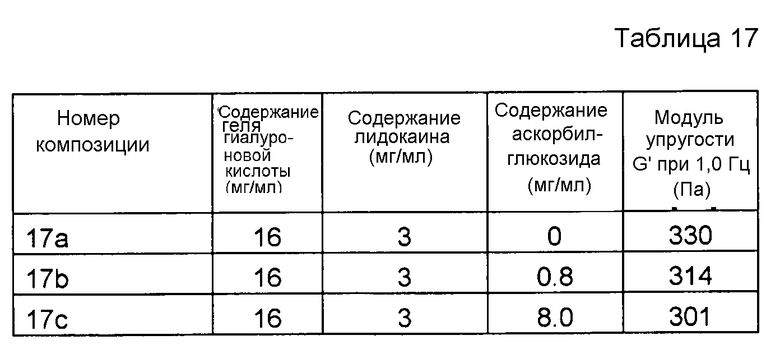
Значения pH композиций устанавливали на уровне 7,5±0,2, и композиции набирали в стеклянные шприцы объемом 1 мл (BD Hypak SCF) и подвергали термической обработке в автоклаве Getinge GEV 6610 ERC-1 (F0~23).
Реологические свойства композиций анализировали, применяя реометр Bohling VOR (измерительная система PP 30, промежуток 1,00 мм). Сначала осуществляли изменение деформации, для определения области линейной вязкоупругости (LVR), а затем вязкоупругие свойства измеряли в пределах LVR.
Результаты представлены на фиг. 17. Аскорбилглюкозид подавляет воздействие на модуль упругости G' композиции, вызванное местным анестетиком при термической стерилизации.
Пример 18. Гели гиалуроновой кислоты с различными степенями модификации лидокаином и MAP
Композиции, которые представлены в таблице 18, получали, в основном, согласно способу, описанному в примере 1 за исключением того, что применяли другую концентрацию MAP. В данном примере применяли гели гиалуроновой кислоты с различными степенями модификации.
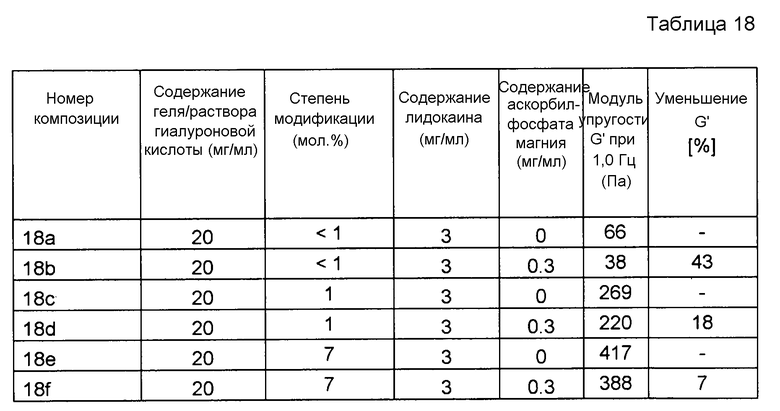
Значения pH композиций устанавливали на уровне 7,5±0,2, и композиции набирали в стеклянные шприцы объемом 1 мл (BD Hypak SCF) и подвергали термической обработке в автоклаве Getinge GEV 6610 ERC-1 (F0~22).
Реологические свойства композиций анализировали, применяя реометр Bohling VOR (измерительная система PP 30, промежуток 1,00 мм). Сначала осуществляли изменение деформации, для определения области линейной вязкоупругости (LVR), а затем вязкоупругие свойства измеряли в пределах LVR.
Результаты представлены на фиг. 18. MAP подавляет воздействие на модуль упругости G' композиции, вызванное местным анестетиком при термической стерилизации. Данный эффект является более выраженным в композициях с меньшей степенью модификации.
Пример 19. Исследование устойчивости в течение 14 суток при 60ºC для геля гиалуроновой кислоты с повышенной степенью модификации лидокаином и SAP
Композиции, которые представлены в таблице 19, получали, в основном, согласно способу, описанному в примере 2, за исключением того, что вместо аскорбилфосфата магния (MAP) применяли аскорбилфосфат натрия (SAP), и что применяли пониженную концентрацию производного.
Значения pH композиций устанавливали на уровне 7,5±0,2, и композиции набирали в стеклянные шприцы объемом 1 мл (BD Hypak SCF) и подвергали термической обработке в автоклаве Getinge GEV 6610 ERC-1 (F0~32).
Исследование устойчивости при 60ºC в течение 14 суток осуществляли с отбором образцов на 0, 3, 7, 11 и 14 сутки.
Реологические свойства композиций анализировали, применяя реометр Bohling VOR (измерительная система PP 30, промежуток 1,00 мм). Сначала осуществляли изменение деформации, для определения области линейной вязкоупругости (LVR), а затем вязкоупругие свойства измеряли в пределах LVR.
Результаты представлены на фиг. 19. Устойчивость композиции не увеличивалась под воздействием SAP. Скорость разложения композиции с SAP соответствует скорости разложения композиции без SAP.
Пример 20. Исследование устойчивости в течение 14 суток при 60ºC для геля гиалуроновой кислоты с лидокаином и аскорбилглюкозидом
Композиции, которые представлены в таблице 20, получали, в основном, согласно способу, описанному в примере 1, за исключением того, что вместо аскорбилфосфата магния (MAP) применяли аскорбилглюкозид от фирмы CarboMer, Inc. (Сан-Диего, США), и применяли другую концентрацию производного.
Значения pH композиций устанавливали на уровне 7,5±0,2, и композиции набирали в стеклянные шприцы объемом 1 мл (BD Hypak SCF) и подвергали термической обработке в автоклаве Getinge GEV 6610 ERC-1 (F0~22).
Исследование устойчивости при 60ºC в течение 14 суток осуществляли с отбором образцов на 0, 7 и 14 сутки.
Содержание геля определяли, добавляя избыток физиологического раствора к известному количеству композиции и тщательно диспергируя гель, чтобы получить разбавленную суспензию. Эту разбавленную суспензию геля фильтровали, применяя фильтр с отверстиями 0,22 мм, и концентрацию HA в фильтрате (экстрагируемой части) определяли карбазольным методом. Содержание геля вычисляли как долю HA в наполнителе, который не может проходить через фильтр с отверстиями 0,22 мм при фильтровании разбавленной суспензии продукта.
Результаты представлены на фиг. 20. Отсутствует изменение устойчивости для композиции, содержащей аскорбилглюкозид, по сравнению с композицией без аскорбилглюкозида.
Пример 21. Исследование устойчивости в течение 14 суток при 60ºC для геля гиалуроновой кислоты с лидокаином, MAP или аскорбилглюкозидом
Композиции, которые представлены в таблице 21, получали, в основном, согласно способу, описанному в примере 1, за исключением того, что применяли MAP или аскорбилглюкозид от фирмы CarboMer, Inc. (Сан-Диего, США), и что применяли гель гиалуроновой кислоты, у которого степень модификации составляла менее чем 1%, и содержание гиалуроновой кислоты составляло 12 мг/мл.
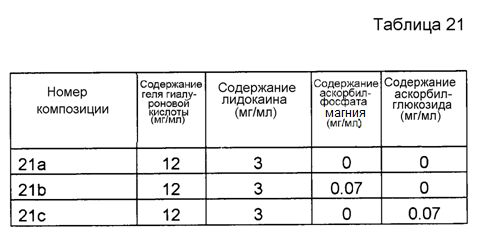
Значения pH композиций устанавливали на уровне 7,5±0,2, и композиции набирали в стеклянные шприцы объемом 1 мл (BD Hypak SCF) и подвергали термической обработке в автоклаве Getinge GEV 6610 ERC-1 (F0~26).
Исследование устойчивости при 60ºC в течение 14 суток осуществляли с отбором образцов на 0, 3, 7, 11 и 14 сутки.
Реологические свойства композиций анализировали, применяя реометр Bohling VOR (измерительная система PP 30, промежуток 1,00 мм). Сначала осуществляли изменение деформации, для определения области линейной вязкоупругости (LVR), а затем вязкоупругие свойства измеряли в пределах LVR.
Результаты представлены на фиг. 21. На устойчивость композиции не влияет аскорбилглюкозид. В композиции, содержащей MAP, наблюдается незначительное уменьшение устойчивости. Однако авторы настоящего изобретения обнаружили, что устойчивость композиций все же является приемлемой, и что преимущества, связанные с добавлением производного аскорбиновой кислоты, перевешивают незначительное уменьшение устойчивости, вызванное этим добавлением.
Пример 22. Исследование устойчивости в течение 16 часов при 90ºC для геля гиалуроновой кислоты с лидокаином и аскорбилглюкозидом
Композиции, которые представлены в таблице 22, получали, в основном, согласно способу, описанному в примере 1, за исключением того, что вместо аскорбилфосфата магния (MAP) применяли аскорбилглюкозид от фирмы Hayashibara Biochemical Laboratories, Inc. (Окаяма, Япония), и что применяли другие концентрации производного. В данном примере применяли гель гиалуроновой кислоты с содержанием гиалуроновой кислоты 16 мг/мл.
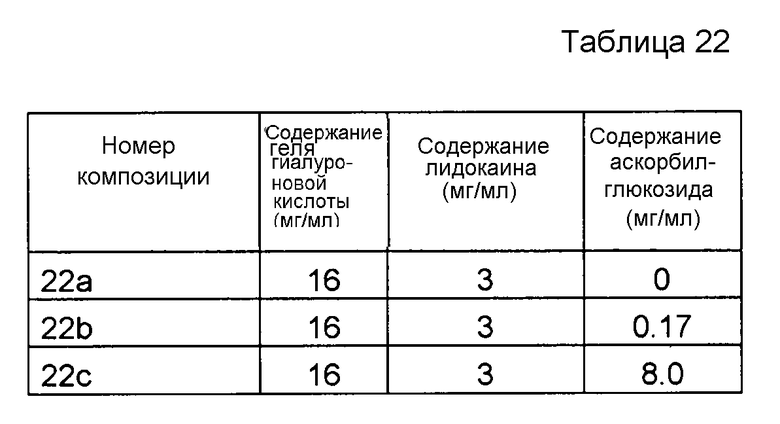
Значения pH композиций устанавливали на уровне 7,5±0,2, и композиции набирали в стеклянные шприцы объемом 1 мл (BD Hypak SCF) и подвергали термической обработке в автоклаве Getinge GEV 6610 ERC-1 (F0~26).
Исследование устойчивости при 90ºC в течение 16 часов осуществляли с отбором через 0, 8 и 16 часов.
Реологические свойства композиций анализировали, применяя реометр Bohling VOR (измерительная система PP 30, промежуток 1,00 мм). Сначала осуществляли изменение деформации, для определения области линейной вязкоупругости (LVR), а затем вязкоупругие свойства измеряли в пределах LVR.
Результаты представлены на фиг. 22. Аскорбилглюкозид в меньшей концентрации не влияет на устойчивость композиции. Повышенная концентрация аскорбилглюкозида уменьшает устойчивость композиции. На основании данных результатов был сделан вывод, что концентрация аскорбилглюкозида ниже 5 мг/мл является предпочтительной, поскольку более высокие концентрации могут приводить к нежелательному уменьшению устойчивости композиции гиалуроновой кислоты.
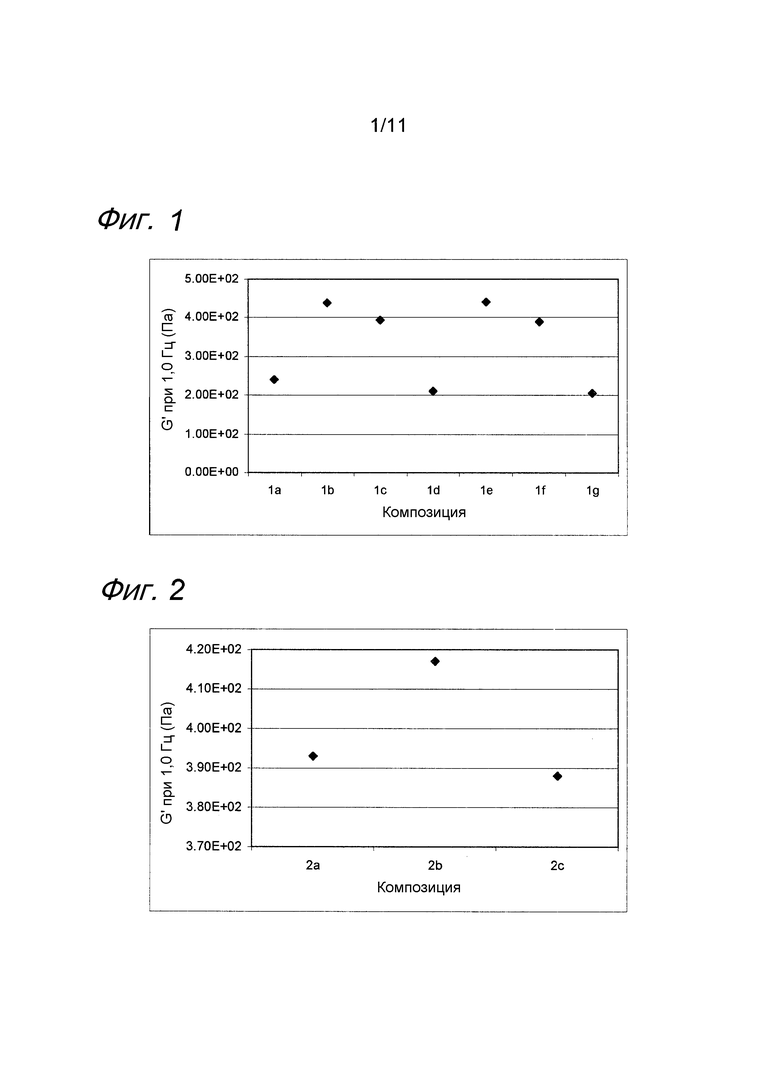
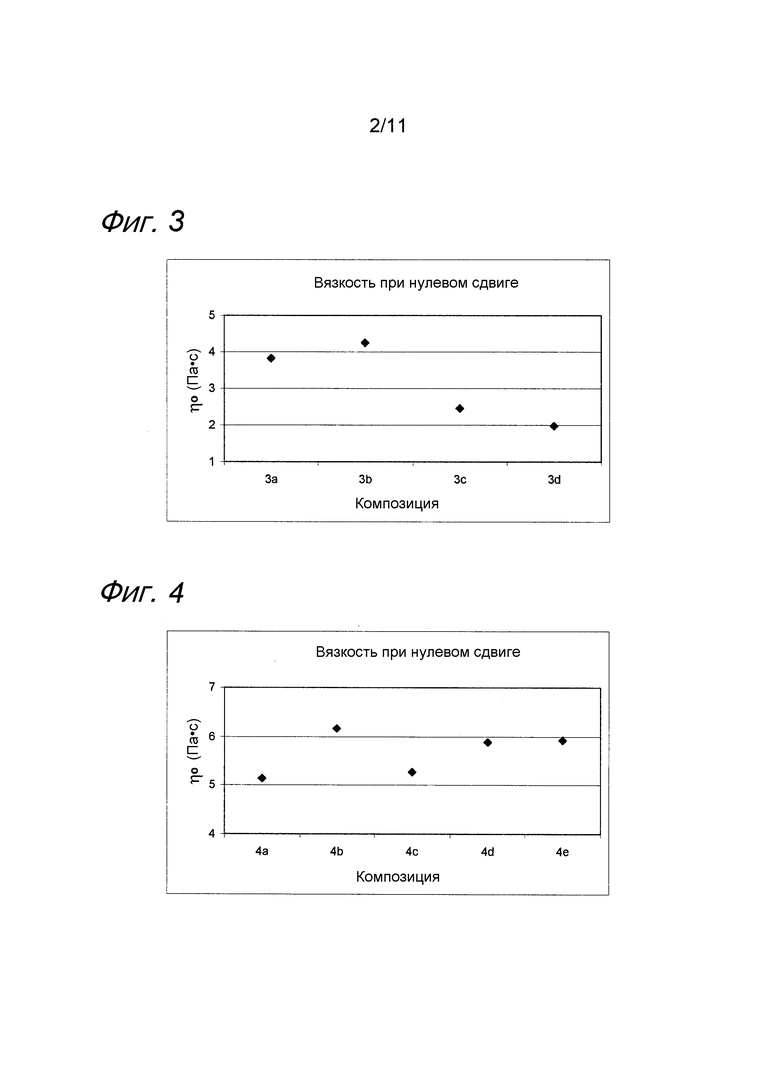
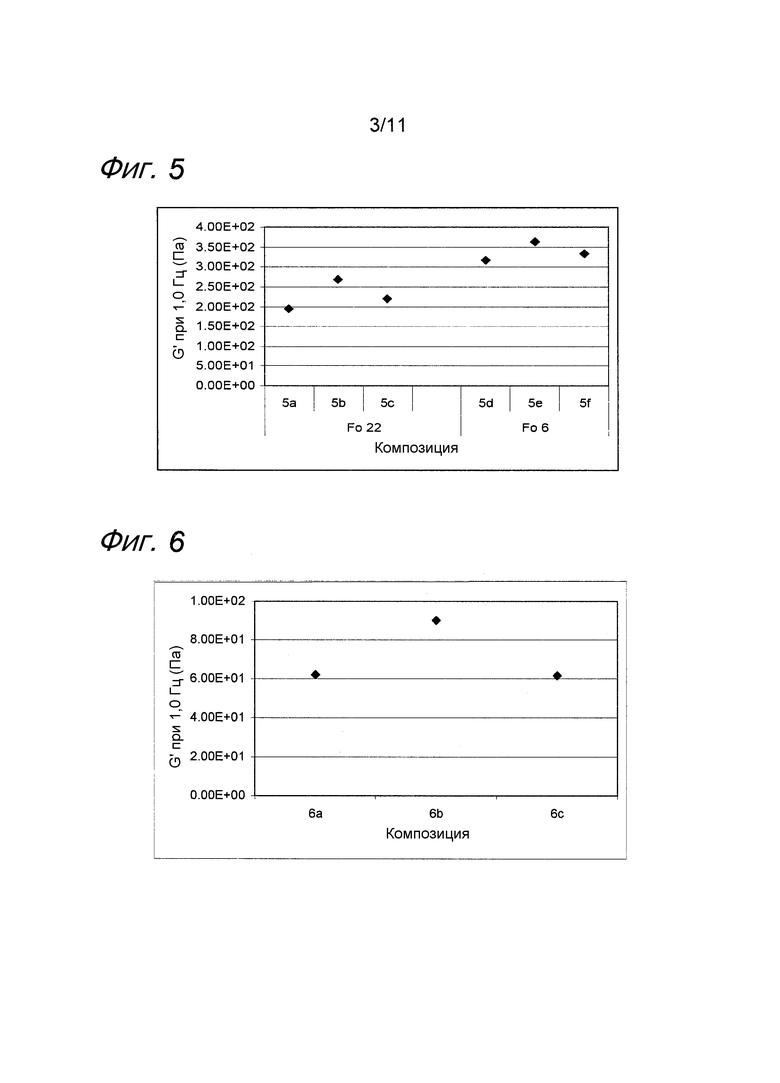
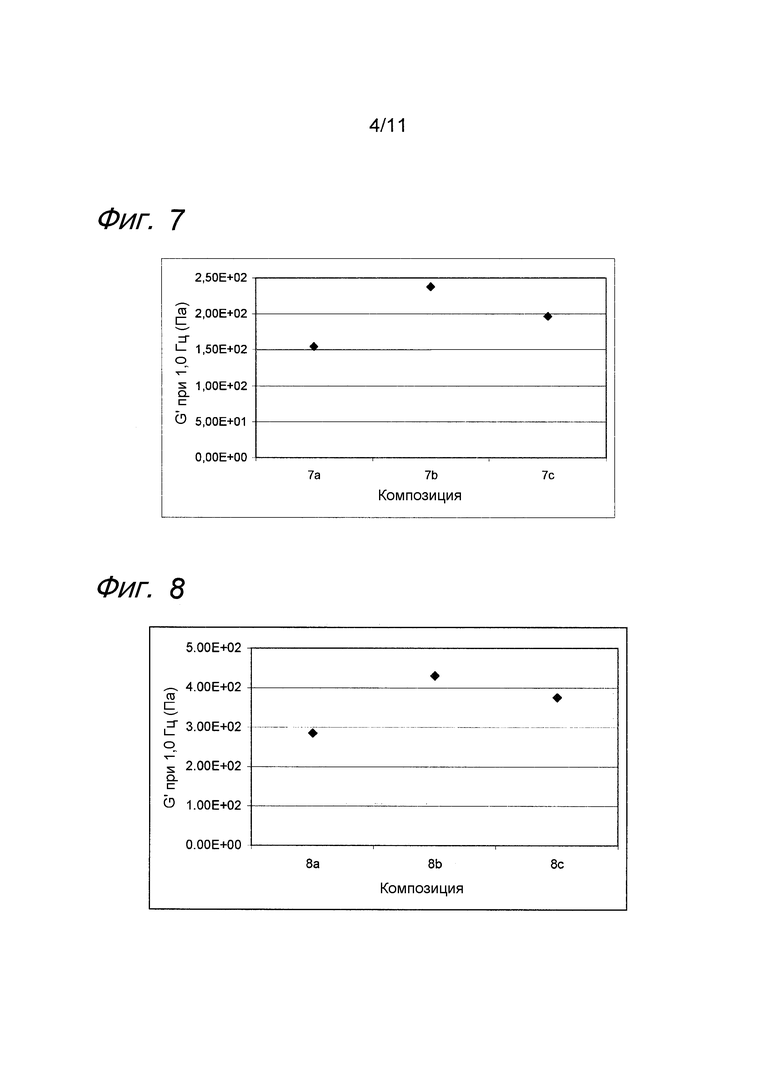
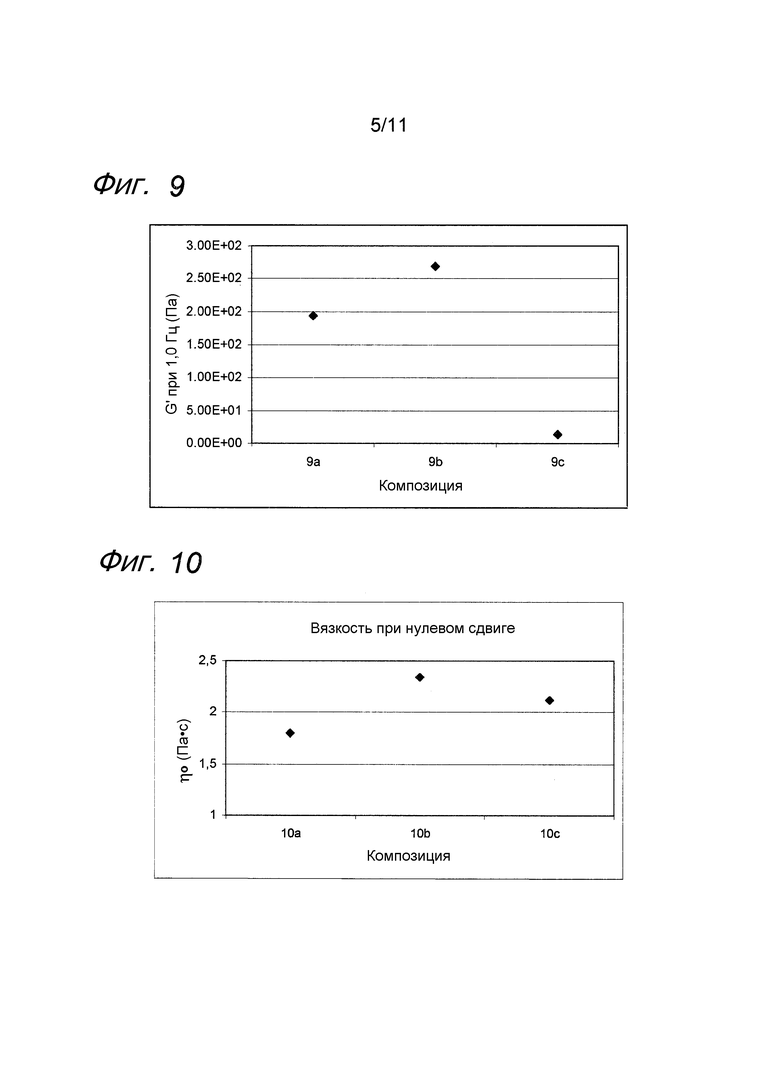
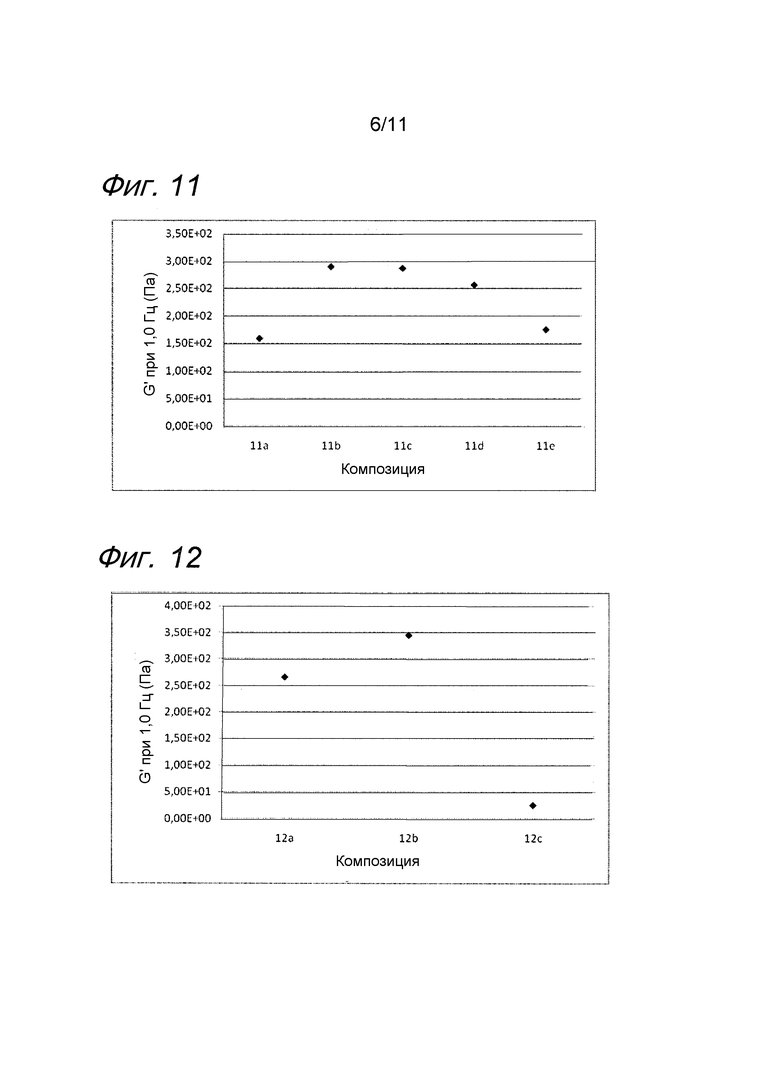
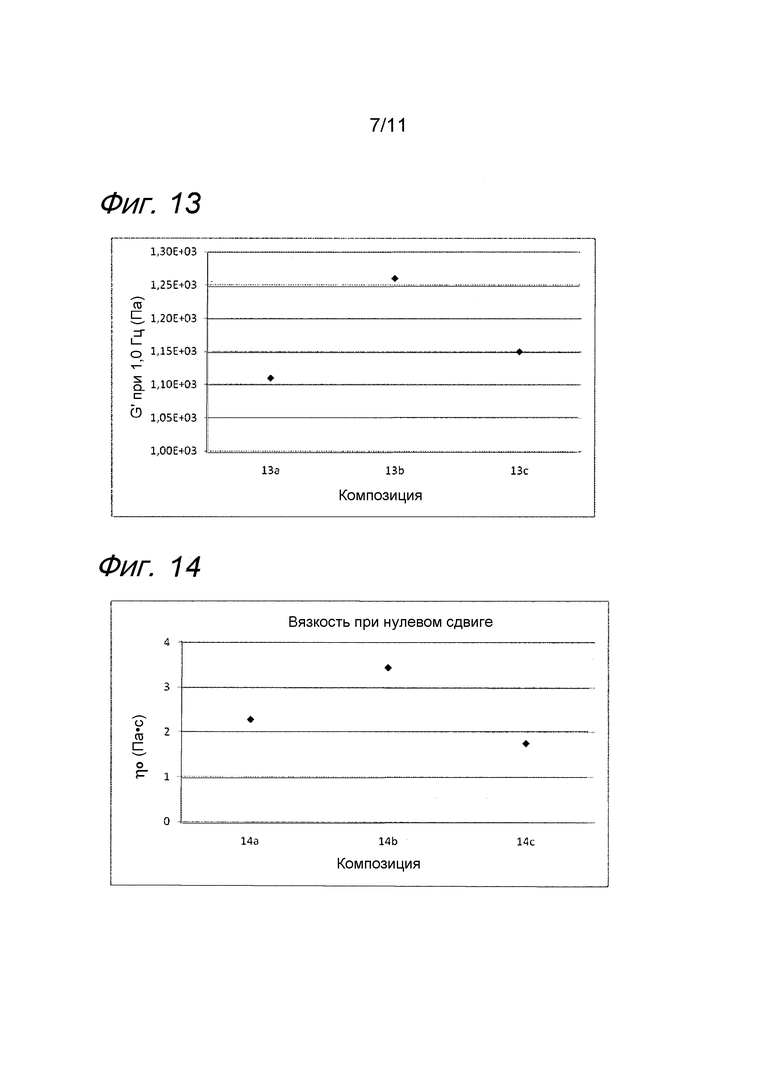

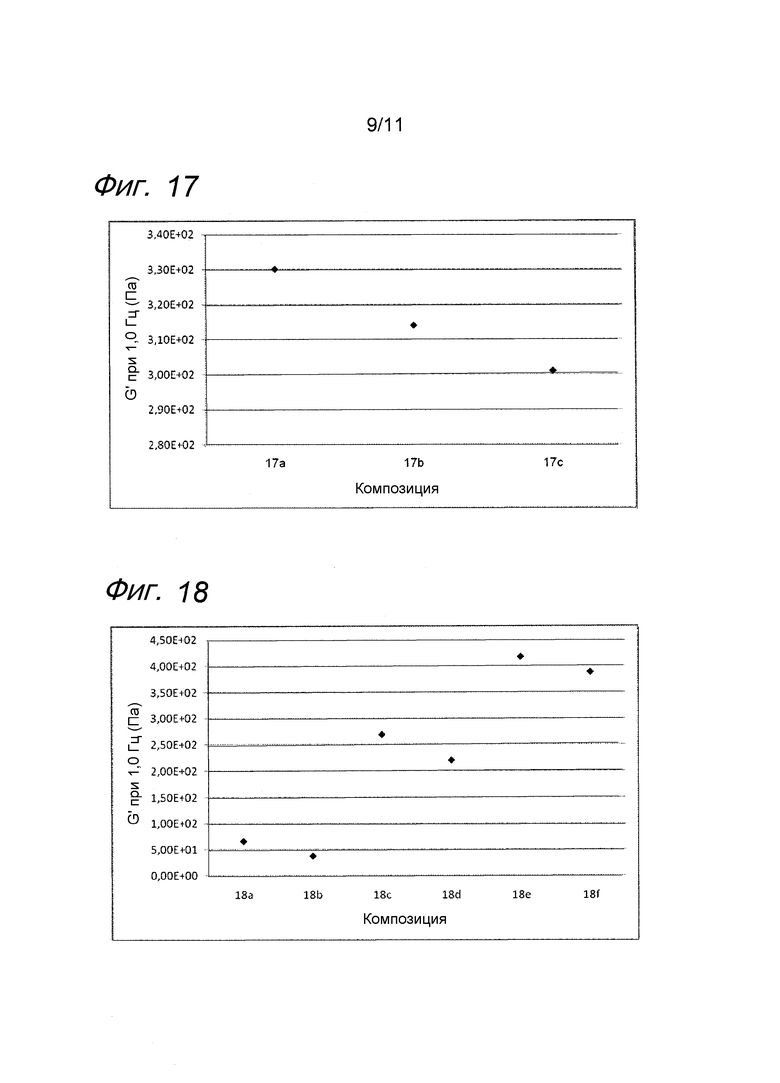

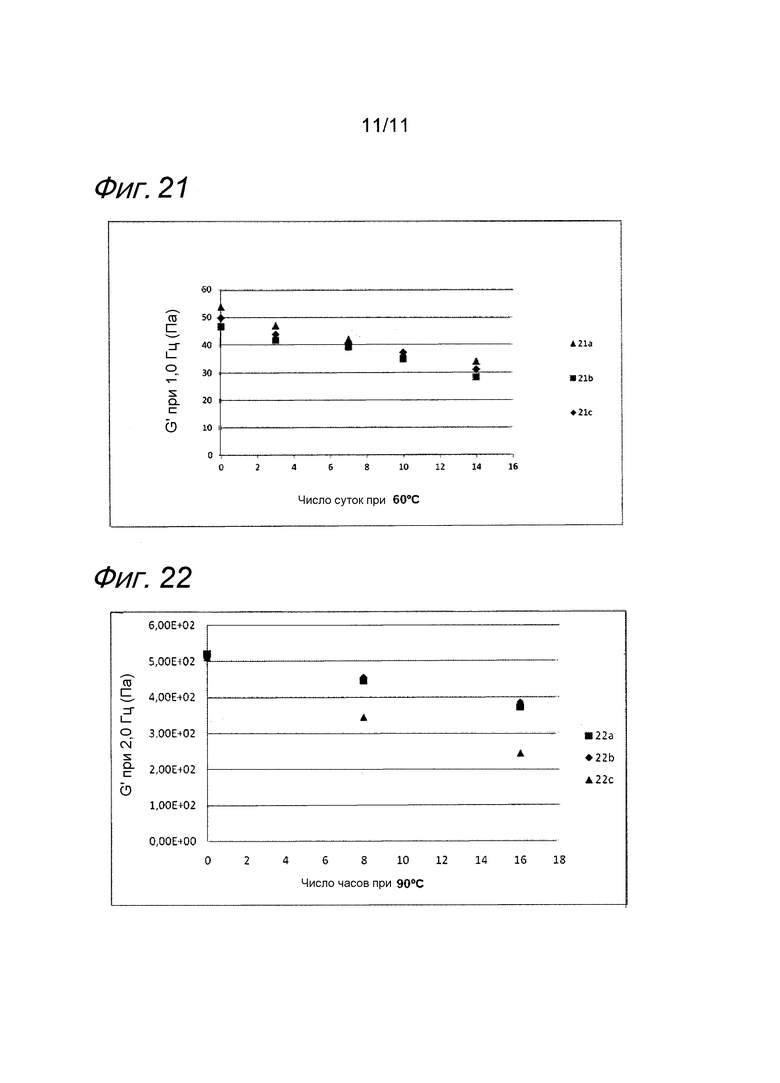
Группа изобретений относится к медицине, конкретно к инъекционной композиции гиалуроновой кислоты, включающей: гиалуроновую кислоту; местный анестетик, выбранный из группы, состоящей из местных анестетиков амидного и сложноэфирного типов или их сочетания; и производного аскорбиновой кислоты в количестве, которое предотвращает или уменьшает воздействие на вязкость и/или модуль упругости G' композиции, вызванное местным анестетиком при термической стерилизации. Описано применение производного аскорбиновой кислоты, а также описан способ получения композиции. Инъекции геля производного гиалуроновой кислоты восстанавливают кожу и увеличивают мягкие ткани, а также улучшают контур лица или тела. 7 н. и 19 з.п. ф-лы, 22 ил., 22 табл., 22 пр.
1. Применение производного аскорбиновой кислоты, выбранного из группы, состоящей из аскорбилфосфатов, аскорбилсульфатов и аскорбилгликозидов, в инъекционной композиции гиалуроновой кислоты, дополнительно включающей:
- гиалуроновую кислоту и
- терапевтически соответствующую концентрацию местного анестетика, выбранного из группы, состоящей из местных анестетиков амидного и сложноэфирного типов или их сочетания, для предотвращения или уменьшения воздействия местного анестетика на вязкость и/или модуль упругости G' композиции вследствие термической стерилизации, где концентрация указанного производного аскорбиновой кислоты в композиции находится в интервале от 0,01 до 5 мг/мл.
2. Применение по п. 1, в котором композиция гиалуроновой кислоты не проявляет повышенной устойчивости по сравнению с такой же композицией без производного аскорбиновой кислоты.
3. Применение по любому из предшествующих пунктов, в котором указанный местный анестетик представляет собой лидокаин и его концентрация предпочтительно находится в интервале от 1 до 5 мг/мл.
4. Применение по п. 1, в котором указанное производное аскорбиновой кислоты выбирают из группы, состоящей из аскорбилфосфатов и аскорбилгликозидов или их сочетания, предпочтительно аскорбилгликозид, предпочтительнее аскорбилглюкозид.
5. Применение по п. 1, в котором концентрация указанного производного аскорбиновой кислоты находится в интервале от 0,01 до 0,5 мг/мл.
6. Применение по п. 4, в котором указанное производное аскорбиновой кислоты выбирают из группы, состоящей из аскорбилфосфата натрия (SAP) или аскорбилфосфата магния (MAP), и концентрация указанного аскорбилфосфата натрия (SAP) или аскорбилфосфата магния (MAP) находится в интервале от 0,01 до 1 мг/мл, предпочтительно в интервале от 0,01 до 0,5 мг/мл.
7. Применение по п. 4, в котором указанное производное аскорбиновой кислоты представляет собой аскорбилглюкозид, и концентрация указанного аскорбилглюкозида находится в интервале от 0,01 до 1 мг/мл, предпочтительно в интервале от 0,01 до 0,8 мг/мл и предпочтительнее в интервале от 0,05 до 0,4 мг/мл.
8. Стерилизованная инъекционная композиция гиалуроновой кислоты, включающая:
- гель гиалуроновой кислоты и
- терапевтически соответствующую концентрацию местного анестетика, выбранного из группы, состоящей из местных анестетиков амидного и сложноэфирного типов или их сочетания, и
- производное аскорбиновой кислоты, выбранное из группы, состоящей из аскорбилфосфатов, аскорбилсульфатов и аскорбилгликозидов, в количестве, которое предотвращает или уменьшает воздействие на вязкость и/или модуль упругости G' композиции, вследствие термической стерилизации, где концентрация указанного производного аскорбиновой кислоты в композиции находится в интервале от 0,01 до 5 мг/мл, и композицию подвергают стерилизации посредством обработки в автоклаве при значении F0 ≥ 4.
9. Стерилизованная инъекционная композиция гиалуроновой кислоты по п. 8, причем указанная композиция не проявляет повышенной устойчивости по сравнению с такой же композицией без производного аскорбиновой кислоты.
10. Стерилизованная инъекционная композиция гиалуроновой кислоты по любому из пп. 8 или 9, в которой указанный местный анестетик представляет собой лидокаин, и его концентрация предпочтительно находится в интервале от 1 до 5 мг/мл.
11. Стерилизованная инъекционная композиция гиалуроновой кислоты по п. 8, в которой указанное производное аскорбиновой кислоты выбирают из группы, состоящей из аскорбилфосфатов и аскорбилгликозидов или их сочетания, предпочтительно аскорбилгликозид, предпочтительнее аскорбилглюкозид.
12. Стерилизованная инъекционная композиция гиалуроновой кислоты по п. 8, в которой концентрация указанного производного аскорбиновой кислоты находится в интервале от 0,01 до 0,5 мг/мл.
13. Стерилизованная инъекционная композиция гиалуроновой кислоты по п. 11, в которой указанное производное аскорбиновой кислоты, выбирают из группы, состоящей из аскорбилфосфата натрия (SAP) или аскорбилфосфата магния (MAP), и концентрация указанного аскорбилфосфата натрия (SAP) или аскорбилфосфата магния (MAP) находится в интервале от 0,01 до 1 мг/мл, предпочтительно в интервале от 0,01 до 0,5 мг/мл.
14. Стерилизованная инъекционная композиция гиалуроновой кислоты по п. 11, в которой указанное производное аскорбиновой кислоты представляет собой аскорбилглюкозид, и концентрация указанного аскорбилглюкозида находится в интервале от 0,01 до 1 мг/мл, предпочтительно в интервале от 0,01 до 0,8 мг/мл и предпочтительнее в интервале от 0,05 до 0,4 мг/мл.
15. Стерилизованная инъекционная композиция гиалуроновой кислоты по п. 8 для применения в качестве лекарственного средства.
16. Стерилизованная инъекционная композиция гиалуроновой кислоты по п. 8 для применения в дерматологическом лечении, выбранном из группы, состоящей из заживления ран, лечения состояния сухости кожи и пораженной солнечными ожогами кожи, лечения гиперпигментационных расстройств, лечения и предотвращения потери волос, и лечения состояний, которые включают воспаление в качестве компонента процесса заболевания, такие как псориаз и астеатотическая экзема.
17. Стерилизованная инъекционная композиция гиалуроновой кислоты по п. 8 для применения в лечении суставного расстройства посредством внутрисуставной инъекции.
18. Способ лечения дерматологического состояния, выбранного из группы, состоящей из заживления ран, лечения состояния сухости кожи и пораженной солнечными ожогами кожи, лечения гиперпигментационных расстройств, лечения и предотвращения потери волос и лечения состояний, которые включают воспаление в качестве компонента процесса заболевания, такие как псориаз и астеатотическая экзема, причем указанный способ включает применение стерилизованной инъекционной композиции гиалуроновой кислоты по любому из пп. 8-14.
19. Способ лечения суставного расстройства, причем указанный способ включает внутрисуставное инъецирование стерилизованной инъекционной композиции гиалуроновой кислоты по любому из пп. 8-14.
20. Применение стерилизованной инъекционной композиции гиалуроновой кислоты по любому из пп. 8-14 для улучшения внешнего вида кожи, предотвращения и/или лечения потери волос, заполнения морщин или улучшения контура лица или тела пациента.
21. Применение по п. 20 для улучшения внешнего вида кожи пациента.
22. Применение по п. 20 для заполнения морщин пациента.
23. Способ улучшения внешнего вида кожи, предотвращения и/или лечения потери волос, заполнения морщин или улучшения контура лица или тела пациента, включающий:
a) предоставление стерилизованной инъекционной композиции гиалуроновой кислоты по любому из пп. 8-14,
b) инъецирование указанной стерилизованной инъекционной композиции гиалуроновой кислоты в кожу пациента.
24. Способ по п. 23, в котором указанную стерилизованную инъекционную композицию гиалуроновой кислоты инъецируют в кожу и и/или подкожный слой.
25. Способ получения стерилизованной композиции гиалуроновой кислоты, включающий:
a) смешивание гиалуроновой кислоты, терапевтически соответствующей концентрации местного анестетика, выбранного из группы, состоящей из местных анестетиков амидного и сложноэфирного типов или их сочетания, и производного аскорбиновой кислоты, выбранного из группы, состоящей из аскорбилфосфатов, аскорбилсульфатов и аскорбилгликозидов, в количестве, которое предотвращает или уменьшает воздействие на вязкость и/или модуль упругости G' композиции, вызванное местным анестетиком при термической стерилизации, причем концентрация указанного производного аскорбиновой кислоты в композиции находится в интервале от 0,01 до 0,5 мг/мл, и
b) воздействие на смесь стерилизации с помощью автоклавирования при значении F0 ≥ 4.
26. Способ по п. 25, в котором полученная композиция гиалуроновой кислоты, не проявляет повышенной устойчивости по сравнению с такой же композицией без производного аскорбиновой кислоты.
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Приспособление в пере для письма с целью увеличения на нем запаса чернил и уменьшения скорости их высыхания | 1917 |
|
SU96A1 |
| EP 1884231 A1, 06.02.2008. | |||
Авторы
Даты
2016-12-20—Публикация
2012-02-03—Подача