ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к мультивалентной иммуногенной композиции, содержащей 15 различных конъюгатов полисахарид-белок, полученных путем конъюгирования капсульного полисахарида, полученного из Streptococcus pneumoniae серотипов 1, 2, 3, 4, 5, 6А, 6В, 7F, 9N, 9V, 14, 18С, 19А, 19F и 23F, с белком-носителем, таким как CRM197. Настоящее изобретение в целом относится к области медицины, а более конкретно - к микробиологии, иммунологии, вакцинам и предупреждению пневмококкового заболевания у младенцев, детей и взрослых с помощью иммунизации.
УРОВЕНЬ ТЕХНИКИ
Streptococcus pneumoniae является основным возбудителем пневмонии. Согласно ′′Тенденциям изменения смертности в зависимости от причин′′ 2010 г., опубликованным Национальным статистическим агентством, пневмония является одной из 10 наиболее частых причин смерти, вызывая 14,9 случаев смерти на 100000 человек, что составляет на 82,9% больше, чем в 2000 г. По оценке Всемирной организации здравоохранения (WHO) в 2012 г. в мировом масштабе 476000 ВИЧ-отрицательных детей в возрасте младше 5 лет умерли от инфекции, вызванной Streptococcus pneumoniae, что составляет 5% в смертности от всех причин у детей для детей младше пяти лет.
В 1977 г. доктор Роберт Остриэн (Robert Austrian) разработал 14-валентную пневмококковую полисахаридную вакцину для предупреждения пневмококкового заболевания, а затем вакцина была доработана до 23-валентной полисахаридной вакцины. Было доказано, что мультивалентные пневмококковые полисахаридные вакцины важны для предупреждения пневмококкового заболевания у взрослых людей преклонного возраста и пациентов высокого риска. Однако у младенцев и детей младшего возраста наблюдается слабый ответ на большинство пневмококковых полисахаридов, что обусловлено клеточным Т-независимым иммунным ответом. 7-валентная пневмококковая конъюгированная вакцина (7vPnC, Prevnar®) содержит капсульные полисахариды семи наиболее распространенных серотипов: 4, 6В, 9V, 14, 18С, 19F и 23F. После того, как Prevnar была одобрена в США в 2000 г., было показано, что она является высоко иммуногенной и эффективной против инвазивного заболевания и отита среднего уха у младенцев и детей младшего возраста. Данная вакцина на настоящий момент одобрена в примерно 80 странах по всему миру. Prevnar позволяет охватить приблизительно 80-90%, 60-80% и 40-80% инвазивных пневмококковых заболеваний (IPD) в США, Европе и других регионах мира, соответственно. Как и ожидалось, данные наблюдений, которые собирали на протяжении нескольких лет после введения в использование Prevnar, явно показали уменьшение количества инвазивных пневмококковых заболеваний, вызванных серотипами, которые охватывает Prevnar, в США. Однако, полнота охвата серотипов была ограничена в некоторых регионах, и количество инвазивных пневмококковых заболеваний, вызванных серотипами, которые не охватывает Prevnar, в частности 19А, увеличилось.
Консультативный комитет по практике иммунизации (ACIP) в феврале 2010 г. объявил о рекомендации недавно одобренной 13-валентной пневмококковой конъюгированной вакцины (PCV-13) для вакцинации. PCV-13 представляет собой пневмококковую конъюгированную вакцину, содержащую шесть дополнительных серотипов (1, 3, 5, 6А, 7F, 19А), помимо семи серотипов (4, 6В, 9V, 14, 18С, 19F, 23F), содержащихся в Prevnar. Согласно Активному эпидемиологическому надзору за ключевыми бактериальными патогенами США (ABCs) в общей сложности 64% случаев IPD, которые, как известно, вызваны патогенными серотипами, среди детей в возрасте младше 5 лет охвачены PCV-13. В 2007 г. только 70 случаев среди 4600 IPD у детей в возрасте младше 5 были охвачены PCV7, тогда как 2900 случаев были охвачены PCV-13, что составляло большую часть. В настоящее время в разработке находится 15-валентная пневмококковая конъюгированная вакцина, которая охватывает дополнительные серотипы, частота встречаемости которых увеличивается по мере смены серотипов.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Таким образом, настоящее изобретение обеспечивает мультивалентную иммуногенную композицию для предупреждения пневмококкового заболевания у младенцев, детей и взрослых, содержащую капсульные полисахариды, полученные из пневмококков 15 серотипов, в том числе серотипов 2 и 9N. Более конкретно, настоящее изобретение обеспечивает 15-валентную пневмококковую конъюгированную (PCV-15) композицию, содержащую серотипы 1, 2, 3, 4, 5, 6А, 6В, 7F, 9N, 9V, 14, 18С, 19А, 19F и 23F.
ТЕХНИЧЕСКОЕ РЕШЕНИЕ
Согласно одному аспекту настоящего изобретения, обеспечивается мультивалентная иммуногенная композиция, содержащая 15 различных конъюгатов полисахарид-белок, а также физиологически приемлемую основу, где каждый из конъюгатов содержит капсульный полисахарид, полученный из разных серотипов Streptococcus pneumoniae, конъюгированный с белком-носителем, причем капсульные полисахариды получены из серотипов 1, 2, 3, 4, 5, 6А, 6В, 7F, 9N, 9V, 14, 18С, 19А, 19F и 23F.
В мультивалентной иммуногенной композиции в соответствии с настоящим изобретением белком-носителем может быть CRM197. Мультивалентная иммуногенная композиция в соответствии с настоящим изобретением может дополнительно содержать адъювант, например, адъювант, включающий адъювант на основе алюминия. Адъювант может быть выбран из группы, состоящей из фосфата алюминия, сульфата алюминия и гидроксида алюминия и предпочтительно фосфата алюминия.
Согласно дополнительному аспекту настоящего изобретения обеспечивается фармацевтическая композиция для индуцирования иммунного ответа на конъюгат капсульного полисахарида Streptococcus pneumoniae, содержащая иммунологически эффективное количество указанной иммуногенной композиции.
В одном варианте осуществления фармацевтическая композиция может быть составлена в виде иммуногенной композиции, содержащей по 2 мкг каждого сахарида, кроме 6В в количестве 4 мкг; приблизительно 34 мкг белка-носителя CRM197; адъювант на основе 0,125 мг элементарного алюминия (0,5 мг фосфата алюминия) и буфер на основе хлорида натрия и янтарнокислого натрия в качестве наполнителей.
ТЕХНИЧЕСКИЙ РЕЗУЛЬТАТ
Мультивалентная иммуногенная композиция содержит капсульные полисахариды, полученные из 15 различных серотипов пневмококков, в том числе серотипов 2 и 9N, что, таким образом, приводит к повышению сывороточного титра IgG и функциональной активности антител. Соответственно, мультивалентную иммуногенную композицию можно преимущественно применять для предупреждения пневмококкового заболевания у младенцев, детей и взрослых.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
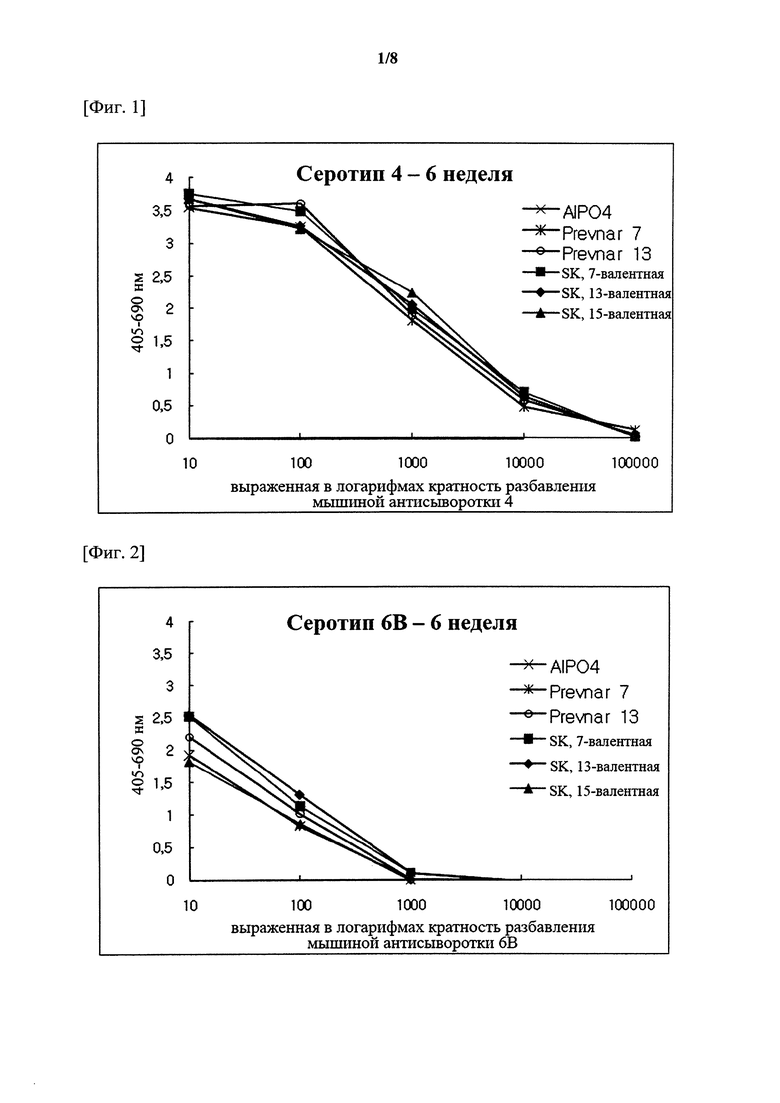
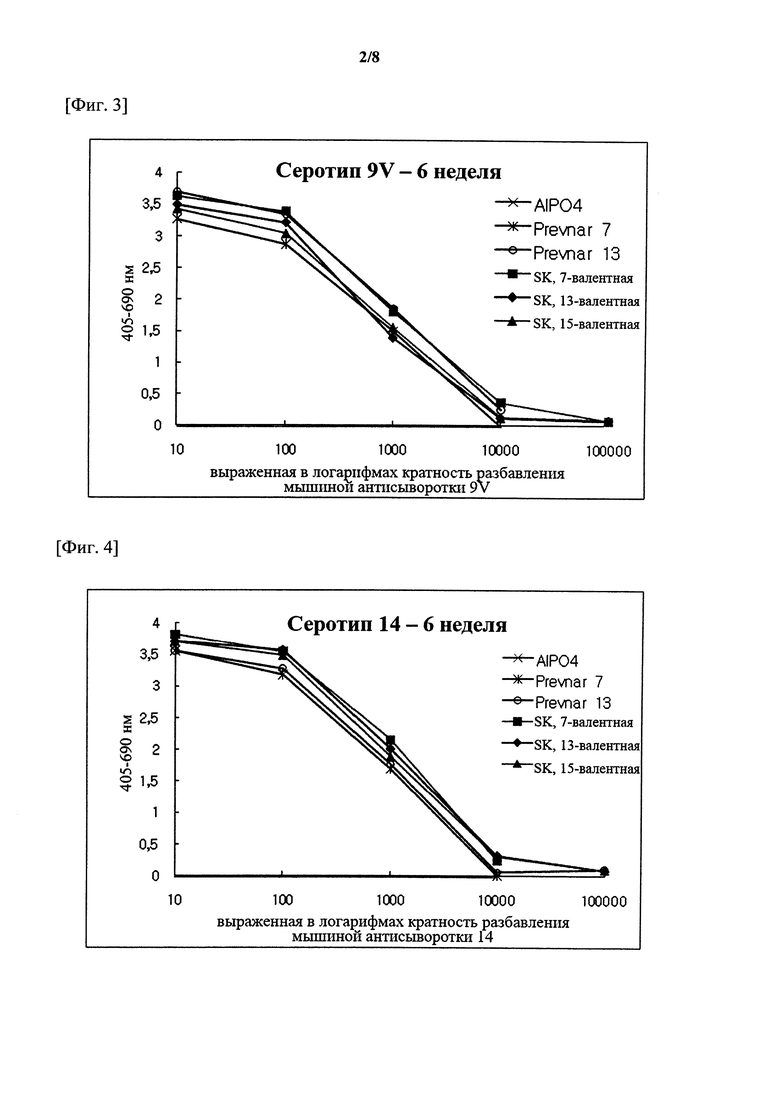
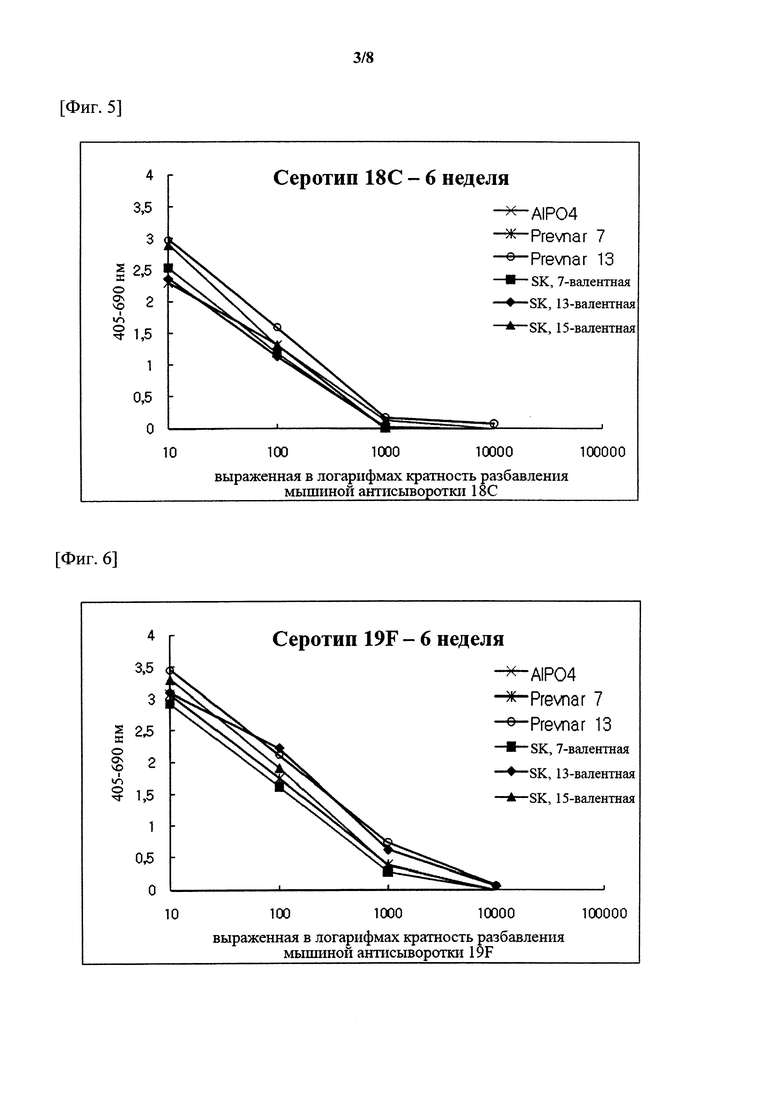
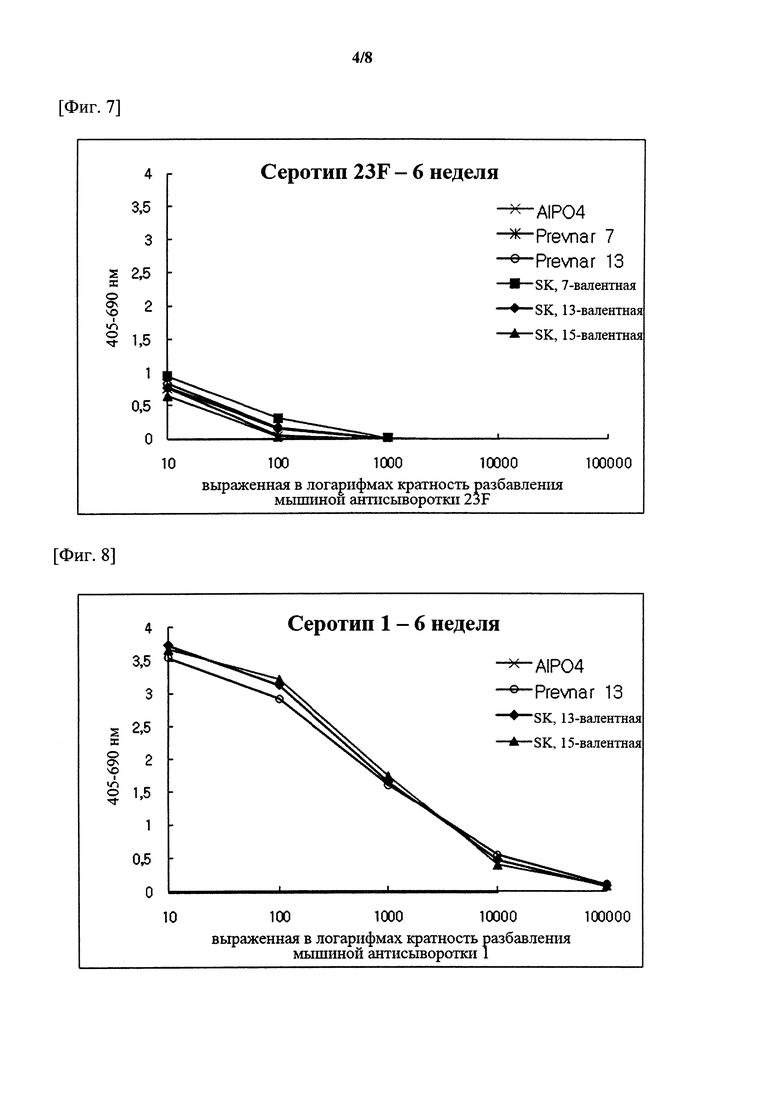
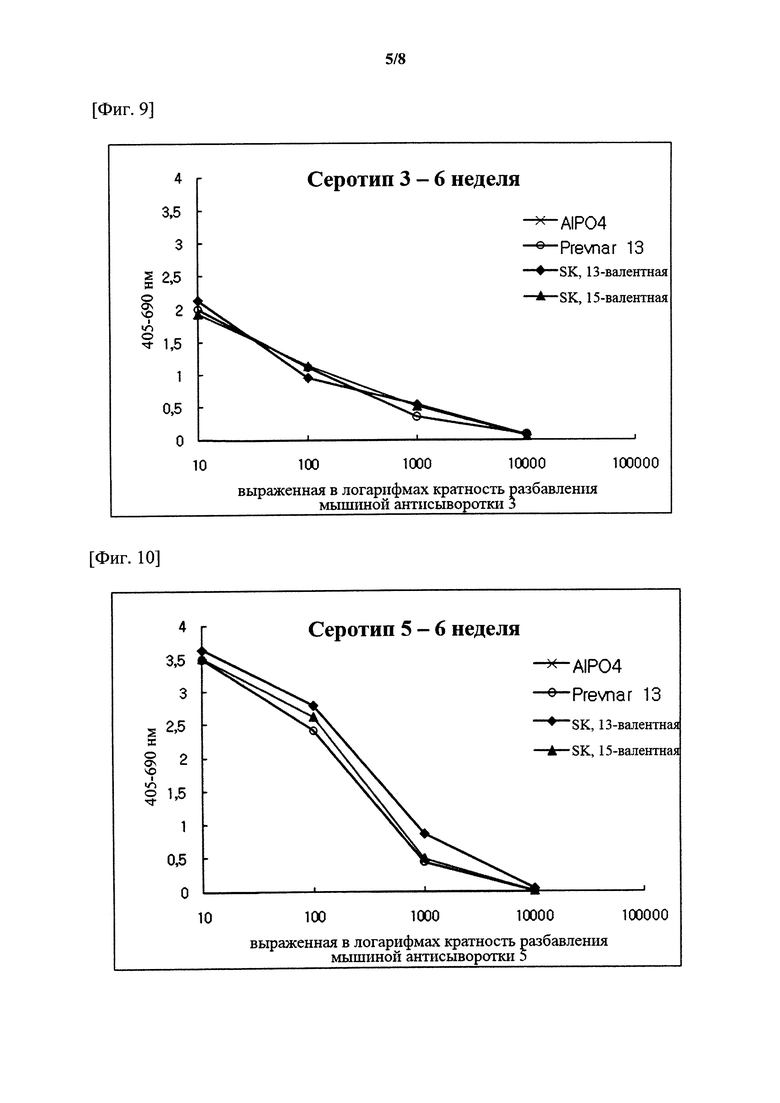
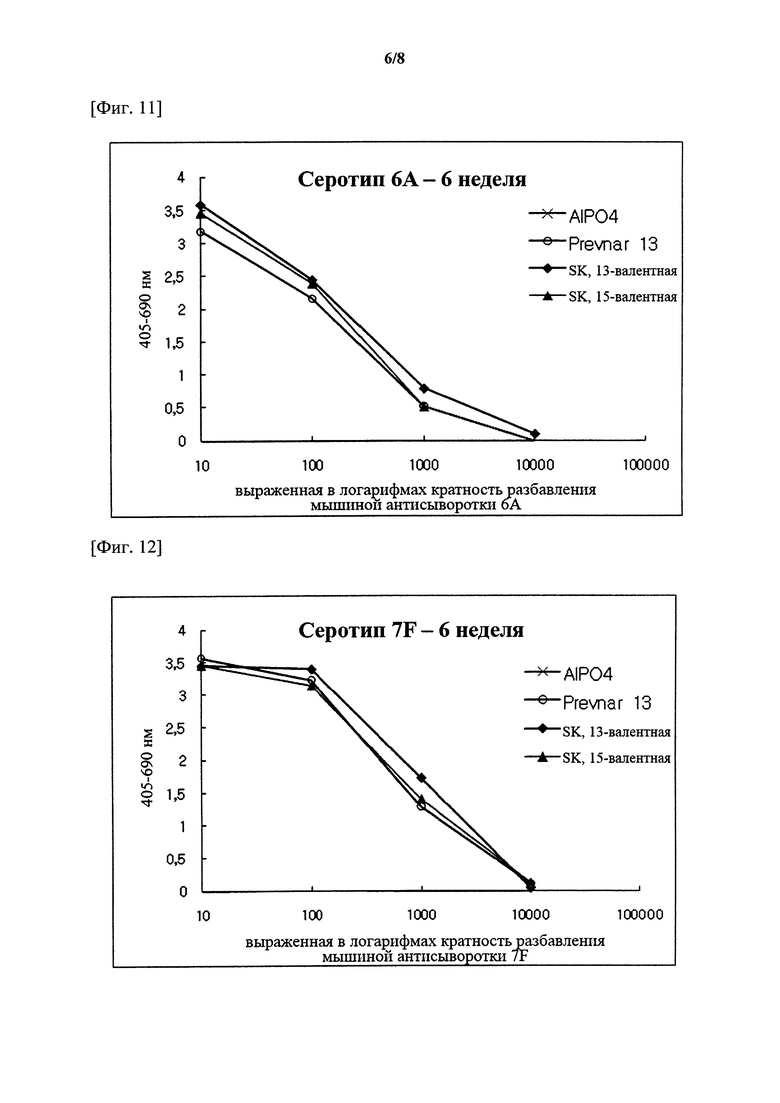
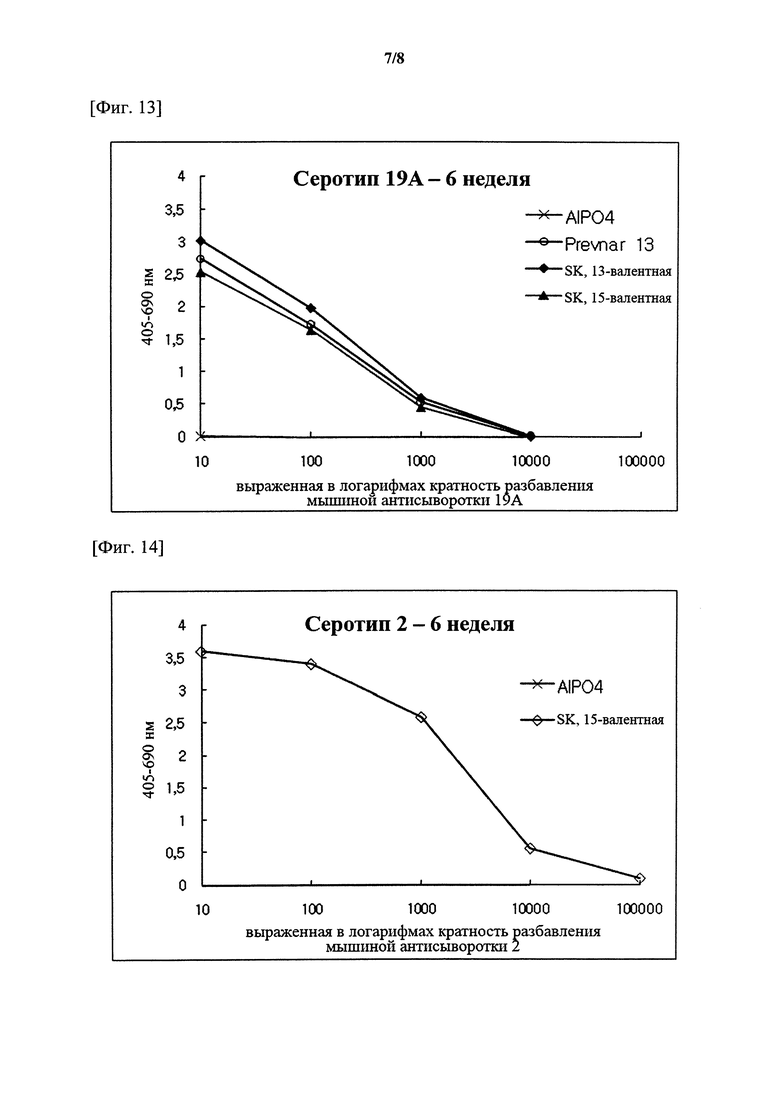
На фигурах 1-15 показан уровень серотипоспецифичных IgG, измеренный через 3 недели после второй инъекции (т.е. в общей сложности 6 недель) композиции вакцины по настоящему изобретению, и сравнительный пример (Prevnar 7 и Prevnar 13).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Произошла смена серотипов на некоторые серотипы с устойчивостью к антибиотикам и множественной лекарственной устойчивостью. Региональные различия в распространении серотипов привели к различиям в широте охвата Prevnar по регионам. (Harboe ZB, Benfield TL, Valentiner-Branth P, et al. Temporal Trends in Invasive Pneumococcal Disease and Pneumococcal Serotypes over 7 Decades. Clin Infect Dis 2010; 50:329-37). Таким образом, нет причин удалять какой-либо из серотипов в существующих пневмококковых конъюгированных вакцинах. Напротив, существует необходимость в дополнительном увеличении широты охвата путем добавления серотипов.
В 2008 Глобальный проект серотипирования пневмококка (GSP) опубликовал отчет, основанный на данных по IPD, которые отбирали с 1980 г. по 2007 г., в котором показано, что после серотипа 18С серотип 2 был 11-м по частоте встречаемости серотипом среди 20 наиболее частых имеющих всемирное значение серотипов. Кроме того, Samir К. Saha и соавт. сообщали, что серотип 2 может представлять угрозу, поскольку имеется высокая вероятность того, что серотип 2 будет вызывать пневмококковый менингит в Бангладеше, но не включен ни в одну пневмококковую конъюгированную вакцину (Saha SK, А1 Emran НМ, Hossain В, Darmstadt GL, Saha S, et al. (2012) Streptococcus pneumoniae Serotype-2 Childhood Meningitis in Bangladesh: A Newly Recognized Pneumococcal Infection Threat. PLoS ONE 2012; 7(3): e32134). Таким образом, если серотип 2 будет включен, возможно уменьшение числа пневмококковых инфекций и возможна дополнительная подготовка к смене серотипов, которая может произойти при вакцинации с помощью PCV-13.
Серотипы пневмококков характеризуются различными типами распределения по возрастам. В частности, серотип 9N, как было обнаружено, является относительно важным у младенцев в возрасте от 0 до 23 месяцев, по сравнению с детьми в возрасте от 24 до 59 месяцев. Серотип 9N был 14-м наиболее распространенным серотипом после 13 серотипов, включенных в PCV-13. Это указывает на то, что включение серотипа 9N будет способствовать уменьшению количества пневмококковых инфекций, в частности у младенцев.
Настоящее изобретение обеспечивает мультивалентную иммуногенную композицию, содержащую капсульные полисахариды, полученные из 15 серотипов пневмококков, в том числе серотипов 2 и 9N. Более конкретно, настоящее изобретение обеспечивает мультивалентную иммуногенную композицию, содержащую 15 различных конъюгатов полисахарид-белок, а также физиологически приемлемую основу, где каждый из конъюгатов содержит капсульный полисахарид, полученный из разных серотипов Streptococcus pneumoniae, конъюгированный с белком-носителем, причем капсульные полисахариды получены из серотипов 1, 2, 3, 4, 5, 6А, 6В, 7F, 9N, 9V, 14, 18С, 19А, 19F и 23F.
Капсульные полисахариды могут быть получены с помощью стандартных методик, известных специалистам в данной области. Капсульные полисахариды могут быть уменьшены в размере для уменьшения вязкости или увеличения растворимости активированных капсульных полисахаридов. В настоящем изобретении капсульные полисахариды получены из серотипов 1, 2, 3, 4, 5, 6А, 6В, 7F, 9N, 9V, 14, 18С, 19А, 19F и 23F Streptococcus pneumoniae. Данные пневмококковые конъюгаты получены посредством отдельных процессов и составлены с получением состава однократной дозы. Например, пневмококки для полисахаридов каждого серотипа выращивают в соевой среде, а затем очищают путем центрифугирования, осаждения и ультрафильтрации.
Белками-носителями предпочтительно являются белки, которые являются нетоксичными и нереактогенными, и которые можно получить в достаточном количестве и с достаточной чистотой. Белки-носители должны поддаваться стандартным процедурам конъюгации. В мультивалентной иммуногенной композиции по настоящему изобретению белком-носителем может быть CRM197. CRM197 является нетоксичным вариантом (т.е. анатоксином) дифтерийного токсина, выделенным из культур штамма С7 (β197) Corynebacterium diphteria, выращенных на среде на основе казаминовых кислот и дрожжевого экстракта. CRM197 очищают путем ультрафильтрации, осаждения с помощью сульфата аммония и ионообменной хроматографии. Альтернативно, CRM197 получают рекомбинантным способом в соответствии с патентом США №5614382.
Другие дифтерийные анатоксины также являются пригодными для применения в качестве белков-носителей. Другие пригодные белки-носителя включают инактивированные бактериальные токсины, такие как столбнячный анатоксин, коклюшевый анатоксин; холерный анатоксин (WO 2004/083251) Е. coli LT, Е. coli ST и экзотоксин A Pseudomonas aeruginosa. Бактериальные белки наружной мембраны, такие как комплекс с наружной мембраны (ОМРС), порины, белки, связывающиеся с трансферрином, пневмолизин, пневмококковый поверхностный белок A (PspA), пневмококковый белок адгезии (PsaA), С5а-пептидаза стрептококков группы А или группы В или белок D Haermophilus influenzae, также могут быть использованы. Другие белки, такие как овальбумин, гемоцианин лимфы улитки (KLH), альбумин бычьей сыворотки (BSA) или очищенное белковое производное туберкулина (PPD), также могут быть использованы в качестве белков-носителей. Варианты дифтерийного токсина, такие как CRM173, CRM228 и CRM45, могут быть использованы в качестве белка-носителя.
Для получения полисахаридов для реакции с белком-носителем очищенные полисахариды химически активируют. После активации каждый капсульный полисахарид отдельно конъюгируют с белком-носителем с образованием гликоконъюгата. В одном варианте осуществления каждый капсульный полисахарид конъюгирован с одним и тем же белком-носителем. Химической активации полисахаридов и последующей конъюгации с белком-носителем достигают посредством традиционных способов (например, патенты США №№4673574 и 4902506). Гидроксильные группы в полисахаридах окисляют до альдегидных групп с помощью окислителей, таких как периодаты (в том числе периодат натрия, периодат калия, периодат кальция или йодная кислота). Химическая активация приводит к неравномерному окислительному разложению соседних гидроксильных групп. Конъюгации достигают путем восстановительного аминирования. Например, осуществляют реакцию активированных капсульных полисахаридов и белка-носителя с восстановителем, таким как цианоборогидрид натрия. Непрореагировавшие альдегидные группы могут быть удалены путем добавления сильного окислителя.
После конъюгации капсульного полисахарида с белком-носителем конъюгаты полисахарид-белок очищают (обогащают в отношении количества конъюгата полисахарид-белок) с помощью множества методик. Данные методики включают концентрирование/диафильтрацию, колоночную хроматографию и глубинное фильтрование. Очищенные конъюгаты полисахарид-белок смешивают для составления иммуногенной композиции по настоящему изобретению, которую можно применять в качестве вакцины. Составление иммуногенной композиции по настоящему изобретению можно осуществлять с помощью способов, известных в уровне техники. Например, 15 отдельных пневмококковых конъюгатов можно составлять с физиологически приемлемой основой для получения композиции. Примеры таких основ включают без ограничений воду, забуференный физиологический раствор, многоатомные спирты (например, глицерин, пропиленгликоль, жидкий полиэтиленгликоль) и растворы декстрозы.
В одном варианте осуществления иммуногенная композиция по настоящему изобретению может содержать один или несколько адъювантов. Как определено в данном документе, ′′адъювант′′ представляет собой вещество, которое предназначено для повышения иммуногенности иммуногенной композиции по настоящему изобретению. Таким образом, адъюванты часто вводят для усиления иммунного ответа и хорошо известны специалистам в данной области. Пригодные адъюванты для повышения эффективности композиции включают без ограничений
(1) соли алюминия (квасцы), такие как гидроксид алюминия, фосфат алюминия, сульфат алюминия и т.д.;
(2) составы эмульсий ′′масло в воде′′ (при наличии или при отсутствии других специфичных иммуностимулирующих средств, таких как мурамилпептиды (определены ниже) или компоненты стенок бактериальных клеток), такие как, например, (a) MF59 (WO 90/14837), содержащий 5% сквалена, 0,5% Tween 80 и 0,5% Span 85 (необязательно содержащий различные количества МТР-РЕ (см. ниже), хотя это не требуется), составленный в виде субмикронных частиц с использованием микрофлюидайзера, такого как микрофлюидайзер Model 110Y (Microfluidics, Ньютон, Массачусетс), (b) SAF, содержащий 10% сквалена, 0,4% Tween 80, 5% блок-сополимера плюроника L121 и thr-MDP (см. ниже), или обработанный с помощью микрофлюидайзера с получением субмикронной эмульсии, или перемешанный на вортексе с получением эмульсии более крупных частиц, и (с) адъювантная система Ribi™ (RAS), (Corixa, Гамильтон, Монтана) содержащая 2% сквалена, 0,2% Tween 80 и один или несколько компонентов стенок бактериальных клеток из группы, состоящей из 3-О-деаилированного монофосфоролипида A (MPL™), описанного в патенте США №4912094 (Corixa), димиколата трегалозы (TDM) и скелета клеточных стенок (CWS), предпочтительно MPL+CWS (Detox™);
(3) адъюванты сапонины, такие как Quil А или STIMULON™ QS-21 (Antigenics, Фрамингем, Массачусетс) (патент США №5057540), или частицы, полученные на их основе, такие как ISCOM (иммуностимулирующие комплексы);
(4) бактериальные липополисахариды, синтетические аналоги липида А, такие как соединения аминоалкилглюкозамина фосфата (AGP), или их производные или аналоги, которые доступны от Corixa и которые описаны в патенте США №6113918; один из таких AGP представляет собой 2-[(R)-3-тетрадеканоилокситетрадеканоиламино]этил-2-дезокси-4-0-фосфоно-3-0-[(R)-3-тетрадеканоилокситетрадеканоил]-2-[(R)-3-тетрадеканоилокситетрадеканоиламино]-b-D-глюкопиранозид, который также известен как 529 (ранее известный как RC529), который составляют в водной форме или в виде стабильной эмульсии,
(5) синтетические полинуклеотиды, такие как олигонуклеотиды, содержащие мотив(ы) CpG (патент США №6207646);
(6) цитокины, такие как интерлейкины (например, IL-1, IL-2, IL-4, IL-5, IL-6, IL-7, IL-12, IL-15, IL-18 и т.д.), интерфероны (например, гамма-интерферон), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), макрофагальный колониестимулирующий фактор (M-CSF), фактор некроза опухоли (TNF), ко-стимулирующие молекулы В7-1 и В7-2 и т.д.;
(7) детоксифицированный мутантный бактериальный АДФ-рибозилированный токсин, такой как холерный токсин (СТ), либо дикого типа, либо мутантная форма, например, в котором глутаминовая кислота в положении аминокислоты 29 замещена на другую аминокислоту, предпочтительно гистидин, в соответствии с WO 00/18434 (см. также WO 02/098368 и WO 02/098369), коклюшевый токсин (РТ) или термолабильный токсин Е. coli (LT), в частности LT-K63, LT-R72, CT-S109, PT-K9/G129 (см., например, WO 93/13302 и WO 92/19265); и
(8) компоненты комплемента, такие как тример компонента комплемента C3d.
Мурамилпептиды включают без ограничений N-ацетил-мурамил-L-треонил-D-изоглутамин (thr-MDP), N-ацетил-нормурамил-L-аланин-2-(1′-2′дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)-этиламин (МТР-РЕ) и т.д.
В конкретном варианте осуществления в качестве адъюванта применяют соль алюминия. Адъювант на основе соли алюминия может входить в осажденную квасцами вакцину или адсорбированную на квасцах вакцину. Соли алюминия включают без ограничений гидратированную окись алюминия, тригидрат алюминия (АТН), гидрат алюминия, гидроокись алюминия, Alhydrogel, Superfos, Amphojel, гидроксид алюминия (III), гидроксифосфат-сульфат алюминия (адъювант фосфат алюминия (АРА)) и аморфный глинозем. АРА представляет собой суспензию гидроксифосфата алюминия. При смешивании хлорида алюминия и фосфата натрия в соотношении 1:1 осаждается гидроксифосфат-сульфат алюминия. Обеспечивают размер осажденных частиц 2-8 мкм с помощью мешалки с большими сдвиговыми усилиями и осуществления диализа с использованием физиологического раствора с последующей стерилизацией. В одном варианте осуществления коммерчески доступный Al(ОН)3 (например, Alhydrogel или Superfos) применяют для адсорбции белков. 50-200 г белка может быть адсорбировано 1 мг гидроксида алюминия, и данное соотношение зависит от изоэлектрической точки (pI) белков и рН растворителей. Белки с низким значением pI более прочно адсорбируются по сравнению с белками с высоким значением pI. Соли алюминия образуют депо антигенов, которое медленно высвобождает антигены в течение 2-3 недель, неспецифично активируя фагоциты, комплемент и врожденные иммунные механизмы.
Настоящее изобретение обеспечивает фармацевтическую композицию (например, состав вакцины) для индуцирования иммунного ответа на конъюгат капсульного полисахарида Streptococcus pneumoniae, содержащая иммунологически эффективное количество иммуногенной композиции.
Составы вакцины по настоящему изобретению можно применять для защиты или лечения человека, восприимчивого к пневмококковой инфекции, путем введения вакцины посредством системного пути или пути через слизистые. Как определено в данном документе, выражение ′′эффективная доза′′ относится к количеству, необходимому для индукции выработки антител до уровня, достаточного для значительного уменьшения вероятности инфицирования Streptococcus pneumonia или ее тяжести. Данные виды введения могут включать инъекцию посредством внутримышечного, внутрибрюшинного, внутрикожного или подкожного путей или введение через слизистые в ротовой полости/ пищеварительном тракте, дыхательных путях или урогенитальном тракте.
В одном варианте осуществления интраназальное введение применяют для лечения пневмонии или отита среднего уха в связи с тем, что носительство пневмококков в носоглотоке может быть предупреждено более эффективно, ослабляя таким образом инфекцию на ранней ее стадии. Количество конъюгатов в каждой дозе вакцины выбирают как количество, которое индуцирует иммунопротективный ответ без значительного отрицательного действия. Такое количество будет изменяться в зависимости от серотипа пневмококков. Как правило, каждая доза будет содержать от 0,1 до 100 мкг полисахаридов, более конкретно от 0,1 до 10 мкг и еще более конкретно от 1 до 5 мкг. Оптимальные количества компонентов для конкретной вакцины могут быть определены с помощью стандартных исследований, включающих наблюдение соответствующих иммунных ответов у субъектов. Например, количество для вакцинации субъекта-человека может быть определено путем экстраполяции результатов тестирования на животных. Кроме того, дозировка может быть определена эмпирически.
В конкретном варианте осуществления настоящего изобретения композиция вакцины представляет собой стерильный жидкий состав капсульных полисахаридов пневмококков серотипов 1, 3, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19А, 19F и 23F, по отдельности конъюгированных с CRM197. Каждая 0,5 мл доза составлена таким образом, что она содержит по 2 мкг каждого сахарида, кроме 6В в количестве 4 мкг; приблизительно 34 мкг белка-носителя CRM197; адъювант на основе 0,125 мг элементарного алюминия (0,5 мг фосфата алюминия) и буфер на основе хлорида натрия и янтарнокислого натрия в качестве наполнителей. Заполняют шприцы для однократной дозы жидкостью без консервантов. После встряхивания вакцина представляет собой гомогенную белую суспензию, готовую для внутримышечного введения.
В дополнительном варианте осуществления композицию по настоящему изобретению можно вводить в виде однократной инъекции. Например, композицию вакцины по настоящему изобретению можно вводить 2, 3, 4 или более раз с соответствующим образом определенными интервалами, например, с интервалами 1, 2, 3, 4, 5 или 6 месяцев или их комбинацией. Можно следовать схеме иммунизации, предусмотренной для вакцины Prevnar. Например, обычная схема для младенцев и детей преддошкольного возраста против инвазивного заболевания, вызванного S. pneumoniae, обусловленного серотипами, включенными в вакцину Prevnar, включает возраст 2, 4, 6 и 12-15 месяцев. Таким образом, в данном аспекте композицию вводят 4 раза, т.е. в возрасте 2, 4, 6 и 12-15 месяцев.
Композиции по настоящему изобретению могут также включать один или несколько белков Streptococcus pneumoniae. Примеры белков Streptococcus pneumoniae, пригодных для включения, включают белки, указанные в международной заявке на патент WO 02/083855, а также белки, описанные в международной заявке на патент WO 02/053761.
Композицию по настоящему изобретению можно вводить субъекту посредством одного или нескольких путей введение, известных специалисту в данной области, таких как парентеральный, чрескожный или чресслизистый, интраназальный, внутримышечный, внутрибрюшинный, внутрикожный, внутривенный или подкожный путь, и они могут быть составлены соответствующим образом. В одном варианте осуществления композицию по настоящему изобретению можно вводить в виде жидкого состава посредством внутримышечной, внутрибрюшинной, подкожной, внутривенной, интраартериальной или чрескожной инъекции или введения в слизистую дыхательных путей. Жидкий состав для инъекции включает раствор или подобное.
Композиция по настоящему изобретению может быть составлена в форме однократной дозы в ампуле, многократной дозы в ампуле или в предварительно заполненном шприце. Фармацевтически приемлемый носитель для жидкого состава включает водный или неводный растворитель, суспензию, эмульсию или масло. Примеры неводного растворителя включают пропиленгликоль, полиэтиленгликоль и этилолеат. Водные носителя включают воду, спиртовой/водный растворитель, эмульсию или суспензию, физиологический раствор, буферный раствор. Примеры масла включают масло растительного или животного происхождения, арахисовое масло, соевое масло, оливковое масло, подсолнечное масло, печеночный жир, синтетическое масло, такое как рыбий жир, и липиды, полученные из молока или яиц. Фармацевтическая композиция может быть изотонической, гипертонической или гипотонической. Однако желательно, чтобы фармацевтическая композиция для инфузии или инъекции была, по сути, изотонической. Таким образом, изотоничность или гипертоничность могут быть предпочтительными для хранения композиции. Если фармацевтическая композиция является гипертонической, композиция может быть разбавлена до изотонической перед введением. Веществом, регулирующим тоничность, может являться ионное вещество, регулирующее тоничность, такое как соль, или неионное вещество, регулирующее тоничность, такое как карбогидрат. Ионное вещество, регулирующее тоничность, включает хлорид натрия, хлорид кальция, хлорид калия и хлорид магния, но не ограничивается ими. Неионное вещество, регулирующее тоничность, включает сорбит и глицерин, но не ограничивается ими. Предпочтительно включен по меньшей мере один фармацевтически приемлемый буфер. Например, если фармацевтическая композиция является инфузионной или инъекционной, она предпочтительно составлена в буфере с буферная емкостью при рН от 4 до 10, например, рН 5-9 или 6-8. Буфер может быть выбран из группы, состоящей из TRIS, ацетатного, глутаматного, лактатного, малеатного, тартратного, фосфатного, цитратного, карбонатного, глицинатного, гистидинового, глицинового, сукцинатного и триэтаноламинного буферного раствора.
В частности, если фармацевтическая композиция предназначена для парентерального введения, буфер может быть выбран из буферов, пригодных с точки зрения Фармакопеи США (USP). Например, буфер может быть выбран из группы, состоящей из одноосновной кислоты, такой как уксусная кислота, бензойная кислота, глюконовая кислота, глицериновая кислота и молочная кислота; многоосновной кислоты, такой как аконитовая кислота, адипиновая кислота, аскорбиновая кислота, угольная кислота, глютаминовая кислота, яблочная кислота, янтарная кислота и винная кислота; и основания, такого как аммиак, диэтаноламин, глицин, триэтаноламин и TRIS. Для парентерального введения основы (для подкожной, внутривенной, внутрисуставной и внутримышечной инъекции) включают раствор хлорида натрия, раствор декстрозы в растворе Рингера, декстрозу и хлорид натрия, раствор лактата Рингера и нелетучие масла. Основы для внутривенного введения включают раствор декстрозы в растворе Рингера или аналогичный инфузионный раствор на основе декстрозы, питательные добавки и электролитные добавки. Пример включает стерильную жидкость, такую как вода и масло с поверхностно-активным веществом и фармацевтически приемлемым адъювантом или без таковых. Как правило, вода, физиологический раствор, раствор декстрозы, соответствующий раствор сахара и гликоли, такие как пропиленгликоль или полиэтиленгликоль, в частности полисорбат 80, являются пригодными для инъекции. Примеры масла включают масло животного и растительного происхождения, арахисовое масло, соевое масло, оливковое масло, подсолнечное масло, печеночный жир, синтетическое масло, такое как рыбий жир и липиды молока или яиц.
Состав по настоящему изобретению может содержать поверхностно-активные вещества. Предпочтительно сложный эфир полиоксиэтилена и сорбитана (обычно называемый Tween), в частности, полисорбат 20 и полисорбат 80; сополимеры (такие как DOWFAXTM) на основе этиленоксида (ЕО), пропиленоксида (РО), бутиленоксида (ВО); окстоцинолы с различными повторами группы этокси(окси-1,2-этандиила), в частности, октоксинол-9(Triton-100); этилфеноксиполиэтоксиэтанол (IGEPAL CA-630/NP-40); фосфолипид, такой как лецитин; нонилфенолэтоксилат, такой как TergitolTM серии NP; полиоксиэтиленовый жирный эфир, полученный на основе лаурилового, цетилового, стеарилового, олеилового спирта (сурфактант Brij), в частности, монолауриловый эфир триэтиленгликоля (Brij 30); сорбитановый эфир, известный как SPAN, в частности, сорбитана триолеат (Span 85) и сорбитана монолаурат, но без ограничения ими. Tween 80 предпочтительно содержится в эмульсии.
Могут быть использованы смеси поверхностно-активных веществ, такие как Tween 80/Span 85. Комбинация сложного эфира полиоксиэтилена и сорбитана, такого как Tween 80, и октоцинола, такого как Triton Х-100, также является пригодной. Комбинация Laureth 9 и Tween и/или октоцинола также является предпочтительной. Предпочтительно количество включенного сложного эфира полиоксиэтилена и сорбитана (такого как Tween 80) составляет от 0,01% до 1% (вес/объем), более конкретно 0,1%; количество включенного октилфеноксиполиоксиэтанола или нонилфеноксиполиоксиэтанола (такого как Triton Х-100) составляет от 0,001% до 0,1% (вес/объем), более конкретно от 0,005% до 0,02%; и количество включенного полиоксиэтиленового эфира (такого как Laureth 9) составляет от 0,1% до 20% (вес/объем), возможно от 0,1% до 10%, более конкретно от 0,1% до 1% или приблизительно 0,5%. В одном варианте осуществления фармацевтическую композицию доставляют с помощью системы контролируемого высвобождения. Например, для введения можно применять внутривенную инфузию, трансдермальный пластырь, липосому или другие пути. В одном аспекте могут быть использованы макромолекулы, такие как микросфера или имплантат.
Вышеприведенное раскрытие в целом описывает настоящее изобретение. Более полное понимание можно получить, обратившись к следующим конкретным примерам. Данные примеры описаны исключительно с иллюстративной целью и не предназначены для ограничения объема настоящего изобретения.
ПРИМЕРЫ
Пример 1. Получение капсульного полисахарида S. pneumoniae
Культивирование S. pnemoniae и очищение капсульных полисахаридов осуществляли способом, известным специалисту в данной области. Серотипы S. pneumoniae получали из Американской коллекции типовых культур (АТСС). S. pneumoniae характеризовались капсулами и неподвижностью, имели вид грамположительных ланцетовидных диплококков и характеризовались альфа-гемолизом в среде на основе кровяного агара. Серотипы идентифицировали с помощью теста Quelling с использованием специфичных антисывороток (патент США №5847112).
Получение клеточных банков
Получали несколько поколений посевного материала для размножения штамма и удаления компонентов животного происхождения (поколения F1, F2 и F3). Получали два дополнительных поколения посевного материала. Первое дополнительное поколение получали из емкости F3, а последующее поколение получали из емкости с первым дополнительным поколением. Емкости с посевным материалом хранили замороженными (≤-70°C) с синтетическим глицерином в качестве криоконсерванта. Для получения клеточного банка все культуры выращивали в соевой среде. Перед замораживанием клетки концентрировали путем центрифугирования, использованную среду удаляли, и клеточную массу повторно суспендировали в свежей среде, содержавшей криоконсервант (такой как синтетический глицерин).
Инокуляция
Культуры из рабочего клеточного банка использовали для инокуляции содержимого колб с посевным материалом, содержавших соевую среду. Колбу с посевным материалом использовали для инокуляции содержимого биореактора для выращивания посевного материала, содержавшего соевую среду.
Культивирование посевного материала
Культивирование посевного материала осуществляли в биореакторе для выращивания посевного материала при контролируемых температуре и рН. После достижения целевой оптической плотности биореактор для выращивания посевного материала использовали для инокуляции содержимого промышленного биореактора, содержавшего соевую среду.
Промышленное культивирование
Промышленное культивирование является последней стадией культивирования. Контролировали температуру, рН и скорость перемешивания.
Инактивация
Культивирование останавливали после прекращения роста путем добавления инактиватора. После инактивации содержимое биореактора охлаждали и регулировали рН культуральной жидкости лизированной культуры.
Очищение
Жидкость из биореактора центрифугировали и фильтровали для того, чтобы удалить бактериальный клеточный дебрис. Несколько операций концентрирования/диафильтрации, осаждения/элюцирования и стадий глубинной фильтрации использовали для удаления загрязняющий примесей и очищения капсульных полисахаридов.
Пример 2. Получение конъюгата капсульный полисахарид S. pneumoniae-CRM197
Полисахариды различных серотипов активировали различными путями, а затем конъюгировали с CRM197. Процесс активации включал уменьшение размера капсульных полисахаридов до целевых значений молекулярного веса, химическую активацию и замену буфера посредством ультрафильтрации. Очищенный CRM197 конъюгировали с активированными капсульными полисахаридами и конъюгаты очищали посредством ультрафильтрации и в конце фильтровали через фильтр с размером пор 0,22 мкм. Параметры процесса, такие как рН, температура, концентрация и время, были следующими.
(1) Активация
Стадия 1
Полисахарид каждого серотипа разбавляли водой для инъекций, ацетатом натрия и фосфатом натрия до конечной концентрации в диапазоне от 1,0 до 2,0 мг/мл. Для серотипа 1 добавляли гидроксид натрия (конечная концентрация основания 0,05 М) и раствор выдерживали при 50°C±2°C. Далее раствор охлаждали до 21-25°C и гидролиз останавливали путем добавления 1М HCl до достижения целевого рН 6,0±0,1. Для серотипа 3 добавляли HCl (конечная концентрация кислоты 0,01 М) и раствор выдерживали при 50°C±2°C. Далее раствор охлаждали до 21-25°C и гидролиз останавливали путем добавления 1 М фосфата натрия до достижения целевого рН 6,0±0,1. Для серотипа 4 добавляли HCl (конечная концентрация кислоты 0,1 М) и раствор выдерживали при 45°C±2°C. Далее раствор охлаждали до 21-25°C и гидролиз останавливали путем добавления 1 М фосфата натрия до достижения целевого рН 6,0±0,1. Для серотипа 6А добавляли ледяную уксусную кислоту (конечная концентрация кислоты 0,2 М) и раствор выдерживали при 60°C±2°C. Далее раствор охлаждали до 21-25°C и гидролиз останавливали путем добавления 1 М гидроксида натрия до достижения целевого рН 6,0±0,1. Для серотипа 14 и 18С добавляли ледяную уксусную кислоту (конечная концентрация кислоты 0,2 М) и раствор выдерживали при 94°C±2°C. Далее раствор охлаждали до 21-25°C и гидролиз останавливали путем добавления 1 М фосфата натрия до достижения целевого рН 6,0±0,1.
Стадия 2. Реакция с периодатом
Необходимые молярные эквиваленты периодата натрия для активации пневмококкового сахарида определяли на основании общего содержания сахарида. При тщательном перемешивании обеспечивали возможность осуществления реакции окисления в течение от 16 до 20 часов при 21-25°C для всех серотипов, кроме 1, 7F и 19F, для которых температура составляла ≤10°C.
Стадия 3. Ультрафильтрация
Окисленный сахарид концентрировали и подвергали диафильтрации водой для инъекций (WFI) на ультрафильтре с отсечением MWCO 100 кДа (ультрафильтре с отсечением 30 кДа для серотипа 1 и ультрафильтре с отсечением 5 кДа для серотипа 18С). Диафильтрацию осуществляли с использованием 0,9% раствора хлорида натрия для серотипа 1, 0,01 М буфера на основе ацетата натрия (рН 4,5) для серотипа 7F и 0,01 М буфера на основе фосфата натрия (рН 6,0) для серотипа 19F. Фильтрат отбирали, а ультраконцентрат фильтровали через фильтр с размером пор 0,22 мкм.
Стадия 4. Лиофилизация
Для серотипов 3, 4, 5, 9N, 9V и 14 концентрированный сахарид смешивали с белком-носителем CRM197, помещали в стеклянные колбы, лиофилизировали, а затем хранили при -25°±5°C.
Для серотипов 2, 6А, 6В, 7F, 19A, 19F и 23F добавляли определенное количество сахарозы, которое рассчитывали таким образом, чтобы достичь концентрации сахарозы 5%±3% в конъюгационной реакционной смеси. Для серотипов 1 и 18С не требовалось добавление сахарозы. Концентрированный сахарид далее помещали в стеклянные колбы, лиофилизировали, а затем хранили при -25°±5°C.
(2) Процесс конъюгации
Водную конъюгацию проводили для серотипов 1, 3, 4, 5, 9N, 9V, 14 и 18С, и DMSO конъюгацию проводили для серотипов 2, 6А, 6В, 7F, 19A, 19F и 23F.
Стадия 1. Растворение
Водная конъюгация
Для серотипов 3, 4, 5, 9N, 9V и 14 лиофилизированную смесь активированного сахарида-CRM197 размораживали и приводили к комнатной температуре. Лиофилизированный активированный сахарид-CRM197 затем восстанавливали в 0,1 М буфере на основе фосфата натрия при типичном соотношении в зависимости от серотипа. Для серотипов 1 и 18С лиофилизированный сахарид восстанавливали в растворе CRM197 в 1 М двухосновном фосфате натрия при типичном соотношении 0,11 л фосфата натрия на 1 л раствора CRM197.
Диметилсульфоксидная (DMSO) конъюгация
Лиофилизированный активированный сахарид серотипов 2, 6А, 6В, 7F, 19А, 19F, 23F и лиофилизированный белок-носитель CRM197 приводили к комнатной температуре и восстанавливали в DMSO.
Стадия 2. Реакция конъюгации
Водная конъюгация
Для серотипов 1, 3, 4, 5, 9N, 9V, 14 и 18С реакцию конъюгации инициировали путем добавления раствора цианоборогидрида натрия (100 мг/мл) для получения 1,0-1,2 моля цианоборогидрида натрия на моль сахарида. Реакционную смесь выдерживали в течение 44-96 часов при 23°C-37°C. Температуру и время реакции регулировали в зависимости от серотипа. Температуру затем снижали до 23°±2°C и добавляли 0,9% хлорид натрия в реактор. Раствор борогидрида натрия (100 мг/мл) добавляли для получения 1,8-2,2 молярного эквивалента борогидрида натрия на моль сахарида. Смесь выдерживали в течение 3-6 часов при 23°±2°C. С помощью данной процедуры восстанавливали любые непрореагировавшие альдегиды, присутствовавшие в сахариде. Смесь разбавляли 0,9% хлоридом натрия и разбавленную конъюгационную смесь фильтровали с помощью фильтра предварительной очистки с размером пор 1,2 мкм в камеру выдержки.
DMSO конъюгация
Для серотипов 2, 6А, 6В, 7F, 19А, 19F и 23F активированный сахарид и белок-носитель CRM197 смешивали в соотношении с диапазоном 0,8 г-1,25 г сахарида/г CRM197. Реакцию конъюгации инициировали путем добавления раствора цианоборогидрида натрия (100 мг/мл) в соотношении 0,8-1,2 молярного эквивалента цианоборогидрида натрия к одному молю активированного сахарида. WFI добавляли к реакционной смеси для достижения целевого 1% (объем/объем) и смесь выдерживали в течение 11-27 часов при 23°±2°C. Раствор борогидрида натрия, 100 мг/мл (типично 1,8-2,2 молярного эквивалента борогидрида натрия на моль активированного сахарида), и WFI (целевые 5%, объем/объем) добавляли к реакционной смеси и смесь выдерживали в течение 3-6 часов при 23°±2°C. С помощью данной процедуру восстанавливали любые непрореагировавшие альдегиды, присутствовавшие в сахариде. Далее реакционную смесь разбавляли 0,9% хлоридом натрия, и разбавленную конъюгационную смесь фильтровали с помощью фильтра предварительной очистки с размером пор 1,2 мкм в камеру выдержки.
Стадия 3. Ультрафильтрация
Разбавленную конъюгационную смесь концентрировали и подвергали диафильтрации на ультрафильтрационном фильтре с отсечением MWCO 100 кДа при минимум 20 объемах 0,9% хлорида натрия или буфера. Фильтрат отбирали.
Стадия 4. Стерилизующее фильтрование
Ультраконцентрат после диафильтрации с отсечением MWCO 100 кДа фильтровали через фильтр с размером пор 0,22 мкм. Технологический контроль (содержание сахарида, несвязанный белок, несвязанный сахарид, остаточный DMSO и остаточный цианид; для DMSO конъюгации, в дополнение к перечисленному, остаточный DMSO) осуществляли в отношении отфильтрованного продукта. Технологический контроль в отношении отфильтрованного ультраконцентрата осуществляли для того, чтобы определить, необходимы ли дополнительная концентрация, диафильтрация и/или разбавление. В случае необходимости отфильтрованный конъюгат разбавляли 0,9% хлоридом натрия с достижением конечной концентрации менее 0,55 г/л. На данной стадии осуществляли испытания при выпуске продукции в отношении содержания сахарида, содержания белка и соотношения сахарид: белок. Наконец конъюгат фильтровали (0,22 мкм) и осуществляли испытание при выпуске продукции (органолептические свойства, несвязанный белок, несвязанный сахарид, эндотоксин, определение размера молекул, остаточный цианид, остаточный DMSO, идентичность сахарида и идентичность CRM 197). Конечный нерасфасованный концентрированный раствор хранили при 2-8°C.
Пример 3. Составление мультивалентной пневмококковой конъюгированной вакцины
Необходимые объемы основной массы конечных концентратов рассчитывали, исходя из объема партии и объемных концентраций сахарида. После добавления необходимых количеств 0,85% хлорида натрия (физиологического раствора), полисорбата 80 и сукцинатного буфера в предварительно маркированный контейнер для состава добавляли основную массу концентратов. Препарат затем тщательно перемешивали и осуществляли стерилизацию фильтрацией через мембрану с размером пор 0,22 мкм. Составленную нерасфасованную массу аккуратно перемешивали во время и после добавления основной массы фосфата алюминия. Поверяли рН и регулировали при необходимости. Нерасфасованный продукт хранили при 2-8°C. Продукт, в объеме 0,5 мл, содержал по 2 мкг каждого сахарида, кроме 6В в количестве 4 мкг; приблизительно 34 мкг белка-носителя CRM197; адъювант на основе 0,125 мг элементарного алюминия (0,5 мг фосфата алюминия); 4,25 мг хлорида натрия; 295 мкг буфера на основе янтарнокислого натрия и 100 мкг полисорбата 80.
Пример 4. Иммуногенность мультивалентной пневмококковой конъюгированной вакцины
Мультивалентную пневмококковую вакцину, т.е. композицию вакцины (SK-15), полученную в примере 3, тестировали в отношении ее способности индуцировать иммуногенный ответ у кроликов. Характеристики данных иммуногенных эффектов получали с помощью антиген-специфичного ELISA в отношении сывороточных концентраций IgG и с помощью анализа опсонофагоцитирующей активности (ОРА) в отношении функции антител. Белых новозеландских кроликов иммунизировали внутримышечно в неделю 0 и неделю 3 при помощи планируемой клинической дозы для человека каждого полисахарида (2 мкг каждого PS, кроме 6В в количестве 4 мкг). Собирали образцы сыворотки крови каждые 3 недели после иммунизации.
Измерение концентрации серотипоспецифичных IgG
Капсульные полисахариды (PnPs) для каждого серотипа наносили на 96-луночный планшет при 500 нг/лунка. Собирали эквивалентное количество образцов сыворотки от каждого субъекта и объединяли по группам. Сборную сыворотку серийно разбавляли в 10 раз с помощью буфера для разведения антисыворотки, содержавшего Tween 20, 4 мкг/мл C-PS и 4 мкг/мл капсульного полисахарида серотипа 22F (PnPs 22F), а затем осуществляли реакцию при комнатной температуре в течение 30 минут. Планшет промывали 5 раз отмывочным буфером и затем на луночный планшет наносили 50 мкл предварительно адсорбированной и разбавленной сыворотки и инкубировали при комнатной температуре в течение 18 часов. Луночный планшет промывали таким же образом и затем добавляли конъюгаты антитело козы к IgG кролика-щелочная фосфатаза (1:50000) в каждую лунку с последующим инкубированием при комнатной температуре в течение 2 часов. Планшеты промывали, как описано выше, и добавляли 1 мг/мл п-нитрофениламинного буфера в качестве субстрата в каждую лунку, а затем осуществляли реакцию при комнатной температуре в течение 2 часов. Реакцию гасили путем добавления 50 мкл 3 М NaOH и измеряли коэффициент поглощения при 405 нм и 690 нм. В качестве сравнительных примеров 7-валентную вакцину (Prevnar 7, Pfizer) и 13-валентную вакцину (Prevnar 13, Pfizer) подвергали такой же процедуре. Результаты показаны на фигурах 1-15.
Функциональный тест иммуногенности (ОРА)
Функцию антител оценивали путем тестирования сыворотки в ОРА-анализе. Собирали эквивалентное количество образцов сыворотки от каждого субъекта, объединяли по группам и разбавляли в 10 раз. S. pneumonia культивировали в среде THY в зависимости от серотипа и разбавляли до 1000 КОЕ/10 мкл. Смешивали 200 мкл буфера для опсонизации, 10 мкл разбавленной сыворотки и 10 мкл разбавленных S. pneumonia и осуществляли реакцию при комнатной температуре в течение 1 часа. Смесь предварительно отдифференцированных клеток HL-60 и комплемента добавляли и осуществляли реакцию в термостате с CO2(37°C) в течение одного часа. Температуру снижали для того, чтобы остановить фагоцитоз и наносили мазок 5 мкл реакционной смеси на чашку с агаровой средой, которую предварительно сушили в течение 30-60 минут. Планшет инкубировали в термостате с CO2(37°C) в течение 12-18 часов, а затем подсчитывали колонии. ОРА-титр выражали как степень разбавления, при которой наблюдалось 50% гибель. В качестве сравнительного примера 13-валентную вакцину (Prevnar 13, Pfizer) подвергали такой же процедуре. Результаты показаны в таблицах 1-3.
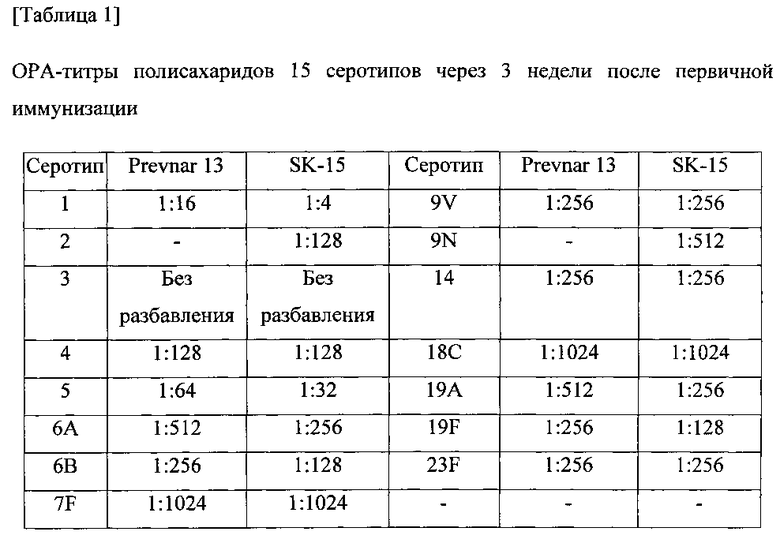
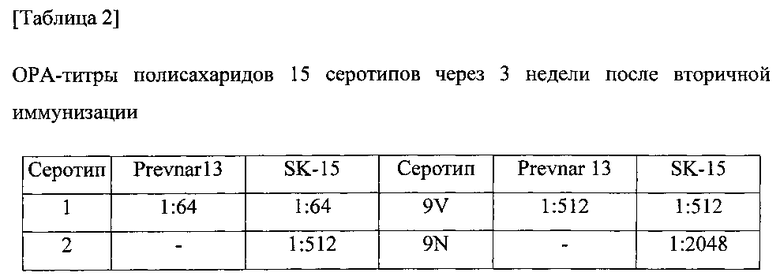

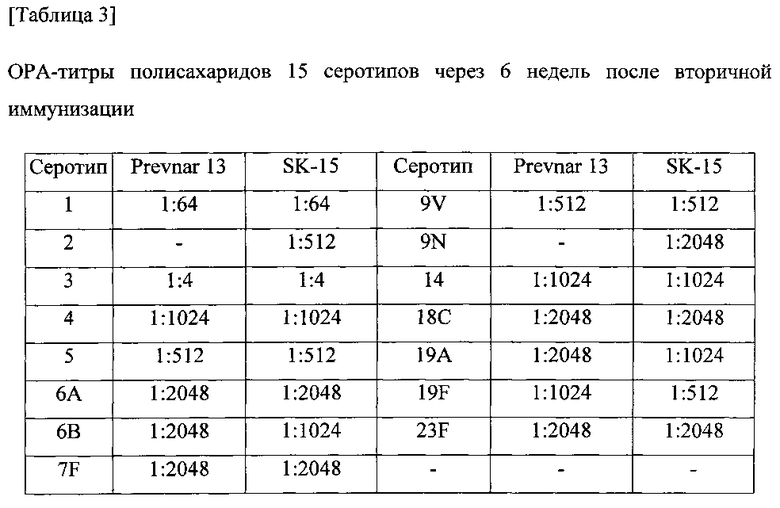
Серотипоспецифичный иммунный ответ, вызванный составом вакцины по настоящему изобретению, и таковой сравнительного примера оценивали с помощью IgG ELISA и комплемент-опосредованного ОРА в отношении функционального антитела. На фигурах 1-15 показаны результаты IgG ELISA, а в таблицах 1-3 показаны результаты измерений функциональной иммуногенности, полученных с помощью ОРА, со сравнением иммунных ответов среди групп обработки. Данные результаты указывают на то, что 15-валентная пневмококковая вакцина на основе полисахаридных конъюгатов индуцирует титр IgG и функциональную активность антител, эквивалентные или превосходящие Prevnar-13.
| название | год | авторы | номер документа |
|---|---|---|---|
| Мультивалентная композиция на основе конъюгатов пневмококковый полисахарид-белок | 2013 |
|
RU2606152C1 |
| Мультивалентная композиция на основе конъюгатов пневмококковый полисахарид-белок | 2013 |
|
RU2613148C2 |
| МУЛЬТИВАЛЕНТНАЯ КОМПОЗИЦИЯ НА ОСНОВЕ КОНЪЮГАТА ПНЕВМОККОВЫЙ ПОЛИСАХАРИД-БЕЛОК | 2007 |
|
RU2493870C2 |
| МУЛЬТИВАЛЕНТНАЯ КОМПОЗИЦИЯ НА ОСНОВЕ КОНЪЮГАТА ПНЕВМОККОВЫЙ ПОЛИСАХАРИД-БЕЛОК | 2007 |
|
RU2484846C2 |
| ИММУНОГЕННЫЕ КОМПОЗИЦИИ ДЛЯ ПРИМЕНЕНИЯ В ПНЕВМОКОККОВЫХ ВАКЦИНАХ | 2016 |
|
RU2712622C2 |
| ИММУНОГЕННЫЕ КОМПОЗИЦИИ ДЛЯ ПРИМЕНЕНИЯ В ПНЕВМОКОККОВЫХ ВАКЦИНАХ | 2021 |
|
RU2827429C1 |
| ПНЕВМОКОККОВАЯ ВАКЦИНА И ЕЕ ПРИМЕНЕНИЯ | 2010 |
|
RU2536248C2 |
| ИММУНОГЕННЫЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ КОНЪЮГИРОВАННЫЕ КАПСУЛЬНЫЕ САХАРИДНЫЕ АНТИГЕНЫ, И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2778704C2 |
| ИММУНОГЕННЫЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ КОНЪЮГИРОВАННЫЕ КАПСУЛЬНЫЕ САХАРИДНЫЕ АНТИГЕНЫ, И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2687460C2 |
| СОСТАВ ПНЕВМОКОККОВОЙ КОНЪЮГАТНОЙ ВАКЦИНЫ | 2018 |
|
RU2789546C2 |

Группа изобретений относится к медицине, а именно к иммунологии, и может быть использована для получения иммуногенной композиции. Мультивалентная иммуногенная композиция содержит 15 различных конъюгатов полисахарид-белок, а также физиологически приемлемую основу. Каждый из конъюгатов полисахарид-белок содержит капсульный полисахарид, полученный из разных серотипов Streptococcus pneumoniae, конъюгированный с белком-носителем CRM197, причем капсульные полисахариды получены из серотипов 1, 2, 3, 4, 5, 6А, 6В, 7F, 9N, 9V, 14, 18С, 19А, 19F и 23F. Группа изобретений относится также к фармацевтической композиции, составленной в виде однократной 0,5 мл дозы, содержащей: по 2 мкг каждого сахарида, кроме 6В в количестве 4 мкг; приблизительно 34 мкг белка-носителя CRM197; адъювант на основе 0,125 мг элементарного алюминия (0,5 мг фосфата алюминия) и буфер на основе хлорида натрия и янтарнокислого натрия в качестве наполнителей. Иммуногенная композиция, составленная в виде вакцины, содержащая адъювант на основе алюминия, позволяет увеличить диапазон применения в отношении пневмококковых заболеваний. Использование одного типа белка-носителя, конъюгированного с капсульными полисахаридами в мальтивалентной вакцине, позволяет избежать возможной иммунной интерференции. 2 н. и 5 з.п. ф-лы, 4 пр., 15 ил., 3 табл.
1. Мультивалентная иммуногенная композиция, содержащая 15 различных конъюгатов полисахарид-белок, а также физиологически приемлемую основу, отличающаяся тем, что каждый из конъюгатов полисахарид-белок содержит капсульный полисахарид, полученный из разных серотипов Streptococcus pneumoniae, конъюгированный с белком-носителем CRM197, причем капсульные полисахариды получены из серотипов 1, 2, 3, 4, 5, 6А, 6В, 7F, 9N, 9V, 14, 18С, 19А, 19F и 23F.
2. Мультивалентная иммуногенная композиция по п. 1, дополнительно содержащая адъювант.
3. Мультивалентная иммуногенная композиция по п. 2, отличающаяся тем, что адъювантом является адъювант на основе алюминия.
4. Мультивалентная иммуногенная композиция по п. 3, отличающаяся тем, что адъювант выбран из группы, состоящей из фосфата алюминия, сульфата алюминия и гидроксида алюминия.
5. Мультивалентная иммуногенная композиция по п. 4, отличающаяся тем, что адъювантом является фосфат алюминия.
6. Фармацевтическая композиция для индуцирования иммунного ответа на конъюгат капсульного полисахарида Streptococcus pneumoniae, содержащая иммунологически эффективное количество мультивалентной иммуногенной композиции по любому из пп. 1-5.
7. Фармацевтическая композиция по п. 6, отличающаяся тем, что мультивалентная иммуногенная композиция составлена в виде однократной 0,5 мл дозы, содержащей:
по 2 мкг каждого сахарида, кроме 6В в количестве 4 мкг;
приблизительно 34 мкг белка-носителя CRM197;
адъювант на основе 0,125 мг элементарного алюминия (0,5 мг фосфата алюминия) и буфер на основе хлорида натрия и янтарнокислого натрия в качестве наполнителей.
| WO2006110381 A1, 19.10.2006 | |||
| WO 2009000826 A1, 31.12.2008 | |||
| WO2006082530 A2, 10.08.2006. |
Авторы
Даты
2016-12-27—Публикация
2013-06-19—Подача