Область техники
Настоящее изобретение относится, например, к способу получения полипептидного гетеромультимера и полипептидного гетеромультимера, который имеет измененную аминокислоту в Fc участке так, что это способствует полипептидной гетеромультимеризации.
Уровень техники
Антитела привлекают внимание в качестве лекарственных средств по причине того, что они имеют высокую стабильность в крови и незначительное количество побочных реакций (непатентные литературные источники 1 и 2). Среди этих антител существуют биспецифические антитела, каждое из которых может распознавать два вида антигенов или эпитопов одновременно. Эти биспецифические антитела предполагаются как такие, которые имеют высокую целевую специфичность и функцию ингибирования множества путей одновременно (непатентный литературный источник 3). Например, уже запущенный в производство катумаксомаб представляет собой биспецифическое антитело, которое связывается с фактором адгезии эндотелиальных клеток ЕрСАМ и CD3, который экспрессируется на Т-клетках, и используется в качестве терапевтического лекарственного средства при злокачественных асцитах.
Некоторые отчеты, которые касаются получения биспецифических антител IgG-типа, содержат выводы о низкой эффективности получения биспецифического антитела, которое представляет интерес, или эффективного производства, несмотря на высокую степень сложности по причине сложной очистки (непатентный литературный источник 3). В случае трансфекции, например, в общей сложности 4 типов генов, то есть генов Н цепей и L-цепей, образующих IgG, имеющий два типа вариабельных участков, в клетки и секреции этих цепей путем коэкспрессии, ковалентная связь между этими двумя типами Н цепей или нековалентная связь между Н и L-цепями образуется случайным образом. Таким образом, процент биспецифических антител, которые представляют интерес, является чрезвычайно низким со значительно сниженной эффективностью производства. Изложенный подход к решению этой проблемы включает в себя применение аминокислотной замены в СН3 участках Н-цепей IgG, с помощью чего IgG, имеющие различные типы Н цепей в комбинации, могут преимущественно секретироваться (патентный документ 1 и непатентные литературные источники 4 и 5). Этот подход представляет собой способ, который включает в себя замену аминокислотной боковой цепи, присутствующей в СН3 участке одной из Н цепей, большей боковой цепью (выступ), и замещение ее партнерской аминокислотной боковой цепью, которая присутствует в СН3 участке другой Н цепи, меньшей боковой цепью (впадина), таким образом, что выступ входит во впадину, чтобы способствовать гетеродимеризации Н цепей и ингибировать гомодимеризацию Н цепей. Кроме того, сообщалось о способе введения различных зарядов в соответствующие СН3 участки Н-цепей IgG (патентный документ 2). В частности, этот способ включает замену аминокислоты, присутствующей в СН3 участке одной Н-цепи, аминокислотой, которая имеет положительный заряд, и замену ее партнерской аминокислоты, присутствующей в СН3 участке другой Н-цепи, аминокислотой, имеющей отрицательный заряд с целью содействия гетеродимеризации Н цепей и ингибирования гомодимеризации Н-цепей. В то же время также была описана методика контроля спаривания Н- и L-цепей (непатентный литературный источник 6). Этот подход использует антитела, полученные путем замены константного участка L-цепи (CL) и СН1 участка Н-цепи в одном Fab для эффективной индукции спаривания Н- и L-цепей, которое представляет интерес. Кроме того, также существует подход с использованием общих L-цепей в обоих Fab. В этом случае использование общих L-цепей позволяет ввести в клетки только один тип гена L-цепи и получать биспецифические антитела без необходимости принятия во внимание спаривания Н- и L-цепей. В настоящее время биспецифические антитела могут быть получены с высокой эффективностью путем сочетания методики гетеродимеризации и методики контроля спаривания Н- и L-цепей. Тем не менее, является сложным полностью контролировать спаривание Н- и L-цепей, и при этом является необходимой сложная молекулярная модель. Еще одна проблема представляет собой высокую степень трудности в поддержании высокой аффинности общих L-цепей для двух типов антигенов.
В то же время сообщалось о подходе, который называется обменом плечами Fab, в качестве способа получения биспецифических антител при использовании моноклональных антител, отдельно приготовленных заранее. Этот способ был разработан на основе открытия того факта, что in vivo замена половины молекулы IgG4 половиной молекулы эндогенного IgG4 приводит к получению биспецифического антитела (BiAb) (непатентный литературный источник 7). В соответствии с этими сообщениями два типа существующих в природе человеческих IgG4 антител смешивают in vitro с получением биспецифических антител (патентный документ 3), и эта реакция протекает более эффективно при восстанавливающих условиях (непатентный литературный источник 8). Два сайта, которые являются характерными для IgG4, то есть аминокислотные остатки в положении 228 в шарнирной области и в положении 409 СН3, были идентифицированы в качестве аминокислотных остатков, важных для данной реакции. Было обнаружено, что даже в IgG1 замена этих двух сайтов аминокислотами IgG4-типа вызывает реакцию с эффективностью, которая является эквивалентной таковой для IgG4 (патентный документ 4). Обмен плечами Fab обеспечивает получение биспецифического антитела, которое представляет интерес, путем простого смешивания in vitro моноклональных антител, полученных с помощью общего способа, и, таким образом, является в высокой степени универсальным. Однако при этом реакция обмена полумолекул происходит случайным образом. Таким образом, биспецифическое антитело, полученное путем смешивания двух типов антител, теоретически составляет 50% от общего количества антител, присутствующих в системе. Следовательно, был изучен способ улучшения показателя образования биспецифического антитела. Как сообщается, эффективность реакции может быть улучшена путем введения асимметричного изменения аминокислоты двух типов антител, т.е. K409R изменения, внесенного в Н-цепи одного антитела и F405L изменения в Н-цепи другого антитела, но при этом по-прежнему остается на уровне приблизительно 95% (патентный документ 5 и непатентный литературный источник 9). Эффективное и стабильное получение биспецифических антител неизбежно требует удобной очистки и минимизированной вариабельности в зависимости от партии. Таким образом, существует потребность в развитии отличного подхода, который позволяет получить более высокую эффективность реакции.
Список литературы
Патентная литература
Патентный документ 1: WO 1996/027011
Патентный документ 2: WO 2006/106905
Патентный документ 3: WO 2005/062916
Патентный документ 4: WO 2008/119353
Патентный документ 5: WO 2011/131746
Непатентная литература
Непатентный литературный источник 1: Nat Biotechnol., 23, 1073-1078, 2005
Непатентный литературный источник 2: Eur J Pharm Biopharm, 59 (3), 389-396, 2005
Непатентный литературный источник 3: mAbs, 4, 653-663, 2012 Непатентный литературный источник 4: Protein Engineering, 9, 617-621, 1996
Непатентный литературный источник 5: Nature Biotechnol., 16, 677-681, 1998
Непатентный литературный источник 6: Proc. Natl. Acad. Sci., 108, 11187-11192,2011
Непатентный литературный источник 7: Immunology, 97, 693-698, 1999
Непатентный литературный источник 8: Science, 317, 1554-1557, 2007
Непатентный литературный источник 9: Proc. Natl. Acad. Sci., 110, 5145-5150, 2013
Краткое изложение сущности изобретения
Техническая проблема
Настоящее изобретение было сделано в свете этих обстоятельств, задача настоящего изобретения заключается в том, чтобы обеспечить отличный подход для эффективного и стабильного получения гетеромультимера с высокой эффективностью реакции, посредством чего желаемый гетеромультимер получают путем улучшения полипептидной гетеромультимеризации при восстанавливающих условиях.
Решение проблемы
Авторы настоящего изобретения осуществили добросовестное исследование в отношении способа для контроля диссоциации и ассоциации Fc участков путем отбора полипептидов, которые содержат Fc участки, в качестве полипептидов, которые включаются в состав гетеромультимера. В результате этого авторы настоящего изобретения обнаружили, что: способствование диссоциации Fc участков и контроль их ассоциации при восстанавливающих условиях могут быть достигнуты путем замещения определенной аминокислоты, которая присутствует в СН3 участке тяжелой цепи; и желаемая гетеромерная молекула образуется эффективно по сравнению с традиционными методиками.
Настоящее изобретение основывается на этих открытиях и специфически обеспечивает следующее от [1] до [25].
[1] Способ получения гетеромультимера, включающий этапы:
a) обеспечения гомоварианта первых полипептидов, каждый из которых имеет первую антигенсвязывающую активность и включает Fc участок;
b) обеспечения гомоварианта вторых полипептидов, каждый из которых имеет вторую антигенсвязывающую активность, которая отличается от первой антигенсвязывающей активности, и включает Fc участок;
c) инкубации гомоварианта первых полипептидов и гомоварианта вторых полипептидов вместе при восстанавливающих условиях, которые позволяют цистеинам в шарнирных участках вызывать изомеризацию дисульфидной связи; и
d) получения гетеромультимера, включающего первый и второй полипептиды, где
1-3 наборы аминокислотных остатков, выбранные из следующих наборов аминокислотных остатков:
(1) аминокислотные остатки в положениях в соответствии с нумерацией EU 356 и 439,
(2) аминокислотные остатки в положениях в соответствии с нумерацией EU 357 и 370, и
(3) аминокислотные остатки в положениях в соответствии с нумерацией EU 399 и 409,
в СН3 участке, который находится в Fc участке первого и/или второго полипептида, имеют тот же тип заряда,
когда аминокислотные остатки в том же наборе из наборов аминокислотных остатков от (1) до (3) имеют тот же тип заряда, что и каждый другой как в СН3 участке первого полипептида, так и в СН3 участке второго полипептида, аминокислотные остатки в этом наборе в СН3 участке второго полипептида имеют заряд, противоположный таковому аминокислотных остатков в этом наборе в СН3 участке первого полипептида.
[2] Способ в соответствии с [1], где этап а) в [1] включает этап обеспечения третьего полипептида, который формирует мультимер с первым полипептидом, и этап b) включает этап обеспечения четвертого полипептида, который формирует мультимер со вторым полипептидом.
[3] Способ в соответствии с [1] или [2], где аминокислотные остатки, которые имеют тот же тип заряда, являются выбранными из одного или более аминокислотных остатков, включенных в любую из следующих групп (А) и (В):
(A) глутаминовая кислота (Е) и аспарагиновая кислота (D); и
(B) лизин (К), аргинин (R) и гистидин (Н).
[4] Способ в соответствии с любым из [1]-[3], где набор(ы) аминокислотных остатков, который(е) имеет(имеют) тот же тип заряда, что и каждый другой в каждом из первого и второго полипептидов, является(ются) любым из наборов аминокислотных остатков (1)-(4):
(1) аминокислотные остатки в положениях 356 и 439 в соответствии с нумерацией EU,
(2) аминокислотные остатки в положениях 357 и 370 в соответствии с нумерацией EU,
(3) аминокислотные остатки в положениях 399 и 409 в соответствии с нумерацией EU, и
(4) (i) аминокислотные остатки в положениях 399 и 409 в соответствии с нумерацией EU и
(ii) аминокислотные остатки в положениях 356 и 439 в соответствии с нумерацией EU.
[5] Способ в соответствии с любым из [1]-[4], где набор(ы) аминокислотных остатков, который(е) имеет(имеют) тот же тип заряда, что и каждый другой в каждом из первого и второго полипептидов, является(ются) любым из наборов аминокислотных остатков:
(i) аминокислотные остатки в положениях 399 и 409 в соответствии с нумерацией EU и
(ii) аминокислотные остатки в положениях 356 и 439в соответствии с нумерацией EU.
[6] Способ в соответствии с любым из [1]-[5], где в первом и/или втором полипептиде аминокислота изменяется таким образом, чтобы дестабилизировать стабильность СН3 участка первого и/или второго полипептида.
[7] Способ в соответствии с любым из [1]-[6], где в первом и/или втором полипепти, аминокислота в положении 397 и/или 392 в соответствии с нумерацией EU является измененной.
[8] Способ в соответствии с любым из [1]-[7], где участок Fc первого и/или второго полипептида является таковым IgG1, IgG2, IgG3 или IgG4 типа.
[9] Способ в соответствии с любым из [1]-[7], где участок Fc первого и/или второго полипептида представляет собой участок Fc, имеющий происхождение от мыши.
[10] Способ получения гетеромультимера в соответствии с [9], где
1-3 наборы аминокислотных остатков, выбранные из следующих наборов аминокислотных остатков:
(1) аминокислотные остатки в положениях 356 и 439 в соответствии с нумерацией EU,
(2) аминокислотные остатки в положениях 360 и 371 в соответствии с нумерацией EU, и
(3) аминокислотные остатки в положениях 399 и 409в соответствии с нумерацией EU
в СН3 участке, который содержится в Fc участке первого и/или второго полипептида, имеют тот же тип заряда, и
когда аминокислотные остатки в том же наборе среди наборов аминокислотных остатков (1)-(3) имеют тот же тип заряда, что и каждый другой как в СН3 участке первого полипептида, так и в СН3 участке второго полипептида, аминокислотные остатки в этом наборе в СН3 участке второго полипептида имеют заряд, противоположный таковому аминокислотных остатков в этом наборе в СН3 участке первого полипептида.
[11] Способ получения гетеромультимера, включающий этапы:
a) обеспечения гомоварианта первых полипептидов, каждый из которых имеет первую антигенсвязывающую активность и включает участок Fc;
b) обеспечения гомоварианта вторых полипептидов, каждый из которых имеет вторую антигенсвязывающую активность, которая отличается от первой антигенсвязывающей активности, и включает участок Fc;
c) инкубации гомоварианта первых полипептидов и гомоварианта вторых полипептидов вместе при восстанавливающих условиях, которые позволяют цистеинам в шарнирных участках вызывать изомеризацию дисульфидной связи; и
d) получения гетеромультимера, включающего первый и второй полипептиды, где
аминокислота в положении 397 и/или 392 в соответствии с нумерацией EU в СН3 участке, содержащемся в Fc участке первого и/или второго полипептида, является измененной.
[12] Способ в соответствии с любым из [1]-[11], где в первом и/или втором полипептиде
аминокислота в положении 397 в соответствии с нумерацией EU является измененной на Met (М), Phe (F) или Tyr (Y), и/или
аминокислота в положении 392 в соответствии с нумерацией EU является измененной на Asp (D), Glu (Е), Thr (Т), Val (V) или Ile (I).
[13] Способ в соответствии с любым из [1]-[12], где в первом и/или втором полипептиде аминокислота в положении 397 в соответствии с нумерацией EU является измененной на Phe (F) или Tyr (Y).
[14] Способ в соответствии с любым из [1]-[13], где в первом полипептиде аминокислота в положении 356 в соответствии с нумерацией EU является измененной на Lys (К), и аминокислота в положении 397 в соответствии с нумерацией EU является измененной на Phe (F) или Tyr (Y); и во втором полипептиде аминокислота в положении 397 в соответствии с нумерацией EU является измененной на Phe (F) или Tyr (Y), и аминокислота в положении 439 в соответствии с нумерацией EU является измененной на Glu (Е).
[15] Способ в соответствии с любым из [1]-[14], где этапы а) и Ь) осуществляются путем смешивания клеточной линии, которая продуцирует гомовариант первых полипептидов, с клеточной линией, которая продуцирует гомовариант вторых полипептидов, и этап с) осуществляют в супернатанте культуры.
[16] Способ в соответствии с любым из [1]-[15], где гетеромультимер представляет собой мультиспецифическое антитело или гетеро-Fc слитый белок.
[17] Способ в соответствии с любым из [1]-[16], где гетеромультимер представляет собой биспецифическое антитело.
[18] Способ в соответствии с любым из [1]-[17], где этап с), описанный в [1] или [11], предусматривает контакт с восстанавливающим агентом.
[19] Способ в соответствии с [18], где этап с) предусматривает прибавление активного вещества, выбранного из группы, которая состоит из глутатиона, L-цистеина, дитиотреитола, β-меркаптоэтанола, ТСЕР и 2-МЕА.
[20] Способ в соответствии с [19], где этап с) предусматривает прибавление активного вещества, выбранного из глутатиона и 2-МЕА.
[21] Гетеромультимер, который получают с помощью способа в соответствии с любым из [1]-[20].
[22] Гетеромультимер в соответствии с [21], где гетеромультимер представляет собой биспецифическое антитело.
[23] Композиция, включающая гетеромультимер в соответствии с [21] или [22] и фармацевтически приемлемый носитель.
[24] Гетеромультимер, включающий первый полипептид, имеющий первую антигенсвязывающую активность и включающий первый участок Fc, и второй полипептид, имеющий вторую антигенсвязывающую активность, которая отличается от первой антигенсвязывающей активности, и включающий первый участок Fc,
гетеромультимер получают путем инкубации гомоварианта первых полипептидов и гомоварианта вторых полипептидов вместе при восстанавливающих условиях, которые позволяют цистеинам в шарнирных участках вызывать изомеризацию дисульфидной связи, где
1-3 наборы аминокислотных остатков, выбранные из следующих наборов аминокислотных остатков:
(1) аминокислотные остатки в положениях 356 и 439 в соответствии с нумерацией EU,
(2) аминокислотные остатки в положениях 357 и 370 в соответствии с нумерацией EU, и
(3) аминокислотные остатки в положениях 399 и 409 в соответствии с нумерацией EU
в СН3 участке, содержащемся в Fc участке первого и/или второго полипептида, имеют тот же тип заряда,
когда аминокислотные остатки в том же наборе среди наборов аминокислотных остатков (1)-(3) имеют тот же тип заряда, что и каждый другой как в СН3 участке первого полипептида, так и в СН3 участке второго полипептида, аминокислотные остатки в этом наборе в СН3 участке второго полипептида имеют заряд, противоположный таковому аминокислотных остатков в этом наборе в СН3 участке первого полипептида, и
в первом и/или втором полипептиде аминокислота изменяется таким образом, чтобы дестабилизировать стабильность СН3 участка первого и/или второго полипептида.
[25] Гетеромультимер, который получают с помощью способа, включающего этапы:
a) обеспечения гомоварианта первых полипептидов, каждый из которых имеет первую антигенсвязывающую активность и включает участок Fc;
b) обеспечения гомоварианта вторых полипептидов, каждый из которых имеет вторую антигенсвязывающую активность, которая отличается от первой антигенсвязывающей активности, и включает участок Fc;
c) инкубации гомоварианта первых полипептидов и гомоварианта вторых полипептидов вместе при восстанавливающих условиях, которые позволяют цистеинам в шарнирных участках вызывать изомеризацию дисульфидной связи; и
d) получения гетеромультимера, включающего первый и второй полипептиды, где
наборы аминокислотных остатков 1-3, выбранные из следующих наборов аминокислотных остатков:
(1) аминокислотные остатки в положениях 356 и 439 в соответствии с нумерацией EU,
(2) аминокислотные остатки в положениях 357 и 370 в соответствии с нумерацией EU, и
(3) аминокислотные остатки в положениях 399 и 409 в соответствии с нумерацией EU
в СН3 участке, содержащемся в Fc участке первого и/или второго полипептида, имеют тот же тип заряда,
когда аминокислотные остатки в том же наборе из наборов аминокислотных остатков (1)-(3) имеют тот же тип заряда, что и каждый другой как в СН3 участке первого полипептида, так и в СН3 участке второго полипептида, аминокислотные остатки в этом наборе в СН3 участке второго полипептида имеют заряд, противоположный таковому аминокислотных остатков в этом наборе в СН3 участке первого полипептида, и
в первом и/или втором полипептиде аминокислота изменяется таким образом, чтобы дестабилизировать стабильность СН3 участка первого и/или второго полипептида.
Предпочтительные эффекты изобретения
В соответствии с настоящим изобретением улучшение диссоциации Fc участков и контроль их связывания при восстанавливающих условиях могут быть достигнуты с помощью замещения определенной аминокислоты, присутствующей в СН3 участке тяжелой цепи. Может обеспечиваться способ получения для эффективного образования желаемой гетеромерной молекулы по сравнению с традиционными методиками.
Путем применения способа в соответствии с настоящим изобретением может улучшаться удобство очистки биспецифического антитела, а также может быть минимизирована вариация в зависимости от партии по сравнению с традиционными методиками.
Характеристика способа получения гетеромультимера в соответствии с настоящим изобретением представляет собой изменение аминокислотного остатка в СН3 участке тяжелой цепи. Диссоциация и ассоциация между полипептидами улучшается путем введения изменения аминокислотного остатка в соответствии с настоящим изобретением в этот участок. В результате этого может быть эффективно получен гетеромультимер по сравнению с традиционными методиками.
Краткое описание фигур
[Фигура 1] Фигура 1 представляет собой диаграмму, показывающую результаты анализа продукта реакции замены Fab плеча с помощью ионообменной хроматографии. В этой диаграмме "BiAb" обозначает очищенное биспецифическое антитело; "Н54 гомо" обозначает моноклональное антитело, которое имеет вариабельные участки H54/L28; a "MRA гомо" обозначает моноклональное антитело, которое имеет вариабельные участки MRAH/MRAL. Числовые значения, указанные в процентах на диаграмме, представляют собой показатель образования биспецифического антитела, который был подсчитан путем деления площади пика, соответствующего биспецифическому антителу, на площадь всех антител, представленных в системе, после чего полученный результат умножали на 100.
[Фигура 2] Фигура 2 представляет собой диаграмму, показывающую результаты анализа продукта реакции замены Fab плеча с помощью ионообменной хроматографии. Эта диаграмма показывает результаты реакции при 3 типах восстанавливающих условий с применением MRAH-G1drP1/MRAL-k0 и H54-G1drN1/L28-k0 в качестве гомовариантов. Числовые значения, указанные в процентах на диаграмме, представляют собой показатель образования биспецифического антитела, который был подсчитан путем деления площади пика, соответствующего биспецифическому антителу, на площадь всех антител, представленных в системе, после чего полученный результат умножали на 100.
[Фигура 3] Фигура 3 представляет собой диаграмму, показывающую корреляцию между показателем образования биспецифического антитела при замене Fab плеча с использованием 5 мМ GSH в качестве восстанавливающего агента и стабильностью СН3 используемого гомоварианта. На диаграмме фраза "Значение большего термального развертывания СН3 в двух типах гомомеров" означает Tm для СН3 в гомоварианте, который имеет более высокое значение Tm для СН3, то есть имеет более стабильный СН3, между двумя гомовариантами, используемыми в реакции.
[Фигура 4] Фигура 4 представляет собой диаграмму, которая показывает конформацию человеческого IgG1 (PDB код: 3DO3) в V397 и около него.
[Фигура 5] Фигура 5 представляет собой диаграмму, которая показывает корреляцию между скоростью образования биспецифического антитела при замене Fab плеча с использованием 25 мМ 2МЕА в качестве восстанавливающего агента и стабильностью СН3 используемого гомоварианта. На диаграмме фраза "Значение более высокого Tm для СН3 в двух типах гомовариантов" означает Tm для СН3 в гомоварианте, который имеет более высокое значение Tm для СН3, то есть, имеет более стабильный СН3, между двумя гомовариантами, используемыми в реакции.
[Фигура 6] Фигура 6 представляет собой диаграмму, показывающую результаты анализа продукта реакции замены Fab плеча с помощью ионообменной хроматографии. Эта диаграмма показывает результаты осуществления реакции для различного времени реакции при использовании MRAH-G1dP17/MRAL-k0 и H54-G1dN17/L28-k0 в качестве гомовариантов. Числовые значения, указанные в процентах на диаграмме, представляют собой показатель образования биспецифического антитела, который был подсчитан путем деления площади пика, соответствующего биспецифическому антителу, на площадь всех антител, представленных в системе, после чего полученный результат умножали на 100.
[Фигура 7] Фигура 7 представляет собой диаграмму, показывающую результаты анализа продукта реакции замены Fab плеча с помощью ионообменной хроматографии. Эта диаграмма показывает результаты осуществления реакции для различного времени реакции при использовании MRAH-G1mrP1/MRAL-k0 и H54-G1mrN1/L28-k0 в качестве гомовариантов. Числовые значения, указанные в процентах на диаграмме, представляют собой показатель образования биспецифического антитела, который был подсчитан путем деления площади пика, соответствующего биспецифическому антителу, на площадь всех антител, представленных в системе, после чего полученный результат умножали на 100.
[Фигура 8] Фигура 8 представляет собой диаграмму, которая показывает конформацию мышиного IgG1 (PDB код: 1IGY) на границе взаимодействия между доменами СН3 и возле нее.
[Фигура 9] Фигура 9 представляет собой диаграмму, показывающую результаты анализа продукта реакции обмена мышиного Fab плеча IgG-типа с помощью CE-IEF. Числовые значения, указанные в процентах на диаграмме, представляют собой показатель образования биспецифического антитела, который был подсчитан путем деления площади пика, соответствующего биспецифическому антителу, на площадь всех антител, представленных в системе, после чего полученный результат умножали на 100.
[Фигура 10] Фигура 10 представляет собой диаграмму, показывающую сравнение цитотоксической активности биспецифического антитела против человеческого глипикана 3/ человеческого CD3. Биспецифическое антитело, полученное при использовании замены плеча человеческого Fab IgG-типа (Фигура 10-1) или замены плеча мышиного Fab IgG-типа (Фигура 10-2), сравнивали с биспецифическим антителом, полученным с помощью методики CrossMab.
[Фигура 11] Фигура 11 представляет собой диаграмму, показывающую изменение концентрации в крови биспецифического антитела против человеческого глипикана 3/ человеческого CD3, полученного при использовании замены плеча человеческого Fab IgG-типа, и биспецифического антитела, полученного с помощью методики выступ-во-впадину, у нормальных мышей.
[Фигура 12] Фигура 12 представляет собой диаграмму, показывающую изменение концентрации в крови антитела против человеческого рецептора IL-6, полученного с помощью замены плеча мышиного Fab IgG-типа и антитела против человеческого рецептора IL-6, которое имеет последовательность существующего в природе мышиного IgG1.
Описание воплощений
Настоящее изобретение относится к способу получения желаемого гетеромультимера путем изменения аминокислотного остатка в СН3 участке тяжелой цепи для того, чтобы улучшить диссоциацию при восстанавливающих условиях соответствующих гомовариантов полипептидов, каждый из которых имеет первую антигенсвязывающую активность, и полипептидов, каждый из которых имеет вторую антигенсвязывающую активность, которая отличается от первой антигенсвязывающей активности, и для контроля их гетероассоциации при восстанавливающих условиях. Настоящее изобретение также относится к способу для отбора желаемого гетеромультимера.
Определения терминов
В настоящем изобретении термин "полипептид" относится к полипептиду (полипептиду, содержащему Fc участок) или белку (белку, содержащему Fc участок), который включает участок Fc тяжелой цепи в аминокислотной последовательности. Полипептид обычно представляет собой полипептид, который имеет происхождение от организма, несмотря на то, что полипептид в соответствии с настоящим изобретением не является ограниченным таковым. Полипептид может представлять собой, например, полипептид, который состоит из искусственно сконструированной последовательности. Альтернативно, могут использоваться природный полипептид, синтетический полипептид, рекомбинантный полипептид или подобные им. Кроме того, фрагменты этих полипептидов также включаются в понятие полипептида в соответствии с настоящим изобретением.
В настоящем описании термин "антитело" относится к природному иммуноглобулину или иммуноглобулину, который получен при использовании частичного или полного синтеза. Антитело может быть изолировано из природного источника (например, плазмы или сыворотки крови, которая содержит существующие в природе антитела) или культурального супернатанта продуцирующих антитело гибридомных клеток, или может быть частично или полностью синтезировано при использовании подхода такого, как генетическая рекомбинация. Предпочтительные примеры антитела включают изотипы иммуноглобулинов и подклассы этих изотипов. Являются известными девять типов классов (изотипов), то есть, IgG1, IgG2, IgG3, IgG4, IgA1, IgA2, IgD, IgE и IgM, в качестве человеческих иммуноглобулинов. Являются известными четыре типа классов, то есть, IgG1, IgG2a, IgG2b и IgG3, в качестве мышиных иммуноглобулинов. Из этих изотипов человеческие иммуноглобулины IgG1, IgG2, IgG3 и IgG4, а также мышиные иммуноглобулины IgG1, IgG2a, IgG2b и IgG3 могут быть включены в антитело в соответствии с настоящим изобретением. IgG1 является предпочтительным в качестве мышиного иммуноглобулина. Множество аллотипов последовательности на основе генного полиморфизма описываются в качестве константных участков человеческого IgG1, человеческого IgG2, человеческого IgG3 и человеческого IgG4 в последовательностях белков, которые представляют иммунологический интерес, NIH публикация №91-3242. Любая из этих последовательностей может использоваться в настоящем изобретении. В частности, аминокислотная последовательность от положения 356 до 358 в соответствии с нумерацией EU в последовательности человеческого IgG1 может представлять собой DEL или может представлять собой ЕЕМ. Множество аллотипов последовательности на основе генного полиморфизма описываются в качестве константного участка человеческого Igκ (каппа) и константного участка человеческого Igλ. (лямбда) в последовательностях белков, которые представляют иммунологический интерес, NIH публикация №91-3242. Любая из этих последовательностей может использоваться в настоящем изобретении.
Термин "участок Fc" используется для определения С-терминального участка тяжелой цепи иммуноглобулина и включает природную последовательность участка Fc и вариант участка Fc. Несмотря на то, что границы участка Fc тяжелой цепи иммуноглобулина могут варьировать, участок Fc относится к участку, который включает шарнирные участки или их часть, а также СН2 и СН3 домены в молекуле антитела. Участок Fc тяжелой цепи человеческого IgG обычно определяется как удлинение от аминокислотного остатка Cys226 до карбокситерминального конца участка Fc, несмотря на то, что участок Fc в соответствии с настоящим изобретением не является ограниченным таковым. Участок Fc иммуноглобулина содержит два константных участка, то есть, СН2 и СН3. "СН2" домен участка Fc человеческого IgG обычно располагается от аминокислоты 231 до аминокислоты 340. "СН3" домен располагается от карбокситерминального конца участка Fc до участка СН2, то есть, располагается от аминокислоты 341 до приблизительно аминокислоты 447 IgG.
Участок Fc может быть предпочтительно получен путем частичного переваривания IgG моноклонального антитела или других при использовании протеолитического фермента, такого, как пепсин, после чего осуществляют повторное элюирование фракции, адсорбированной на колонке с белком А или белком G. Такой протеолитический фермент не является ограниченным до тех пор, пока фермент является способным к перевариванию целого антитела так, чтобы ограничительно образовывать Fab или F(ab')2 при приемлемом наборе условий реакции (например, рН) фермента. Примеры таких протеолитических ферментов могут включать пепсин и папаин.
Положение каждого сайта изменения представляют при использовании системы нумерации EU (Kabat ЕА и др., 1991. Sequences of Proteins of Immunological Interest. NIH).
В настоящем изобретении термин "ассоциация" полипептидов может относиться, например, к состоянию, когда два или более участков полипептида взаимодействуют друг с другом.
В настоящем изобретении фраза "контроль ассоциации" относится к контролю с целью достижения желаемого ассоциированного состояния и более специфически относится к контролю с целью предотвращения нежелательной ассоциацию между полипептидами (предпочтительно, ассоциацию между полипептидами, которые имеют идентичные аминокислотные последовательности).
В настоящем изобретении термин "поверхность контакта" обычно относится к расположению ассоциации, при котором полипептиды ассоциируют (взаимодействуют) друг с другом. Аминокислотные остатки, которые образуют поверхность контакта, обычно представляют собой один или более аминокислотных остатков, содержащихся в полипептидных участках, которые подвергаются такой ассоциации, и более предпочтительно, аминокислотные остатки, которые размещаются рядом в процессе участия во взаимодействии. Взаимодействие специфически включает, например, случай, когда аминокислотные остатки, которые размещаются рядом, в процессе ассоциации образуют водородную связь, электростатическое взаимодействие или солевой мостик между ними.
В настоящем изобретении "гомовариант" полипептидов относится к ассоциированной форме полипептидов, которые имеют идентичные аминокислотные последовательности.
В настоящем изобретении "гетеромер" полипептидов относится к ассоциированной форме первого полипептида и второго полипептида, который отличается аминокислотной последовательностью, по крайней мере, одним аминокислотным остатком от первого полипептида.
В настоящем изобретении "диссоциация" между полипептидами относится к состоянию, когда ассоциированная форма двух или более полипептидов в полипептидном гомоварианте разделяется на единичные полипептиды.
В настоящем изобретении "гетеромультимер" относится к белковому мультимеру, который состоит из многих типов полипептидов, способных к ассоциации друг с другом. В частности, "гетеромультимер" содержит, по крайней мере, первый полипептид и второй полипептид. В этом контексте второй полипептид представляет собой молекулу, которая отличается аминокислотной последовательностью, по крайней мере, одним аминокислотным остатком от первого полипептида. Гетеромультимер предпочтительно имеет антигенсвязывающие активности по отношению, по крайней мере, к двум различным типам лигандов, антигенов, рецепторов или субстратов, и т.д., несмотря на то, что гетеромультимер в соответствии с настоящим изобретением не является ограниченным таковым. Гетеромультимер может содержать дополнительный тип полипептида дополнительно к "гетеродимеру", образованному первым и вторым полипептидами. В частности, "гетеромультимер" в соответствии с настоящим изобретением не является ограниченным гетеродимером и также включает, например, гетеротример и гетеротетрамер.
В полипептиде мультимер в соответствии с настоящим изобретением, который включает первый полипептид, второй полипептид и один или два третьих полипептида, первый полипептид и второй полипептид могут соответственно образовывать мультимеры (димеры) с третьими полипептидами. Кроме того, сформированные димеры могут образовывать мультимер (тетрамер) друг с другом. Два третьих полипептида могут иметь полностью идентичные аминокислотные последовательности (которые могут иметь связывающую активность в отношении того же антигена). Альтернативно, два третьих полипептида могут иметь идентичные аминокислотные последовательности, но имеют две или более активности (они могут иметь, например, связывающие активности в отношении двух или более различных антигенов). В случае одного третьего полипептида такой третий полипептид может образовывать димер с любым из первого полипептида и второго полипептида с образованием полипептидного мультимера.
В полипептидном мультимере в соответствии с настоящим изобретением первый полипептид и второй полипептид предпочтительно имеют связывающие активности против различных антигенов. С другой стороны, третий полипептид может представлять собой полипептид, который имеет связывающую активность против того же антигена, что и любой из первого полипептида или второго полипептида, или оба. Альтернативно, третий полипептид может представлять собой полипептид, который имеет связывающую активность против антигена, отличного от такового первого полипептида и второго полипептида.
Альтернативно, полипептидный мультимер в соответствии с настоящим изобретением может представлять собой полипептидный мультимер, который включает первый полипептид, второй полипептид, третий полипептид и четвертый полипептид. В таком полипептидном мультимере первый полипептид и второй полипептид могут образовывать мультимеры (димеры) с третьим полипептидом и четвертым полипептидом, соответственно. Например, дисульфидная связь может образовываться между первым полипептидом и третьим полипептидом и между вторым полипептидом и четвертым полипептидом с образованием димеров.
В полипептидном мультимере в соответствии с настоящим изобретением первый полипептид и второй полипептид предпочтительно имеют связывающие активности против различных антигенов. С другой стороны, третий полипептид может представлять собой полипептид, который имеет связывающую активность против того же антигена, что и любой из первого полипептида или второго полипептида, или оба. Альтернативно, третий полипептид может представлять собой полипептид, который имеет связывающую активность против антигена, отличного от такового первого полипептида и второго полипептида. Четвертый полипептид может представлять собой полипептид, который имеет связывающую активность против того же антигена, что и любой из первого полипептида или второго полипептида, или оба. Альтернативно, четвертый полипептид может представлять собой полипептид, который имеет связывающую активность против антигена, отличного от такового первого полипептида и второго полипептида.
Когда "гетеромультимер" в соответствии с настоящим изобретением представляет собой биспецифическое антитело, то первый полипептид и второй полипептид могут представлять собой, например, полипептид, который включает аминокислотную последовательность тяжелой цепи антитела против антигена А, и полипептид, который включает аминокислотную последовательность тяжелой цепи антитела против антигена В, соответственно. В этом случае третий полипептид может представлять собой полипептид, который включает аминокислотную последовательность легкой цепи антитела против антигена А, в то время как четвертый полипептид может представлять собой полипептид, который включает аминокислотную последовательность легкой цепи антитела против антигена В.
В настоящем изобретении "полипептид, который обладает антигенсвязывающей активностью" относится к пептиду или белку, состоящему из 5 или более аминокислот, который имеет домен (или участок), способный к связыванию с белком или пептидом таким, как антиген или лиганд, и включает, например, вариабельный участок тяжелой цепи или легкой цепи антитела, рецептор, слитый пептид рецептора и участка Fc, каркаса и их фрагментов. В частности, полипептид, который обладает антигенсвязывающей активностью, может включать аминокислотную последовательность вариабельного участка антитела, рецептора, слитого пептида рецептора и участка Fc, каркаса или любого из их фрагментов.
Любой полипептид может использоваться в качестве каркаса до тех пор, пока полипептид является конформационно стабильным и может связываться, по крайней мере, с одним антигеном. Примеры такого полипептида включают, но не ограничены такими, как фрагменты вариабельного участка антитела, фибронектин, домены белка A, LDL домены рецептора А, липокалин, а также молекулы, описанные у Nygren и др. (Current Opinion in Structural Biology, 7: 463-469 (1997); и Journal of Immunol Methods, 290: 3-28 (2004)), Binz и др. (Nature Biotech 23: 1257-1266 (2005)), Hosse и др. (Protein Science 15: 14-27 (2006)).
Способы для получения вариабельного участка антитела, рецептора, слитого пептида рецептора и участка Fc, каркаса и их фрагментов являются хорошо известными квалифицированному специалисту в данной области техники. Полипептид, который включает аминокислотную последовательность такого участка и аминокислотную последовательность константного участка легкой цепи антитела, также может использоваться.
В настоящем изобретении термин "восстанавливающие условия" относится к условиям или окружающей среде, где остатки цистеина, формирующие внутреннюю дисульфидную связь тяжелой цепи в шарнирных участках тяжелой цепи, предпочтительнее восстанавливаются, чем окисляются. Восстанавливающие условия предпочтительно относятся к условиям или окружающей среде, которые позволяют цистеинам в шарнирных участках тяжелой цепи вызывать изомеризацию дисульфидной связи между тяжелыми цепями, и особенно предпочтительно относится к условиям или окружающей среде, которые позволяют цистеинам в шарнирных участках тяжелой цепи вызывать изомеризацию дисульфидной связи при отсутствии значительной изомеризации дисульфидной связи цистеинов за пределами шарнирных участков (то есть, при сохранении дисульфидной связи между тяжелой цепью и легкой цепью). В настоящем изобретении, например, время инкубации вместе гомовариантов первых полипептидов каждый из которых включает участок Fc, и вторых полипептидов, каждый из которых включает участок Fc, при восстанавливающих условиях может быть приемлемым образом установлено квалифицированным специалистом в данной области техники.
В настоящем изобретении термин "восстанавливающий агент" относится к соединению, которое восстанавливает молекулу в окружающей среде, то есть, соединению, которое сдвигает молекулу в состояние, когда молекула стала более восстановленной или становится более восстановленной в окружающей среде. Восстанавливающий агент действует в качестве донора электронов так, что восстанавливающий агент сам по себе приобретает окисленное состояние после восстановления субстрата. Таким образом, восстанавливающий агент представляет собой активное вещество, которое является донором электронов. Примеры восстанавливающих агентов включают дитиотреитол (DTT), меркаптоэтанол, цистеин, тиогликолевую кислоту, цистеамин (2-меркаптометиламин: 2-МЕА), глутатион (GSH), ТСЕР (трис(2-карбоксиэтил)фосфин) и борогидрид натрия.
В настоящем изобретении термин "изомеризация дисульфидной связи внутри тяжелой цепи" относится к замене дисульфидной связи, то есть, к реорганизации дисульфидной связи между цистеинами, которые находятся в различных тяжелых цепях.
Термин "образование дисульфидной связи" относится к процессу формирования ковалентной связи между двумя цистеинами, присутствующими в одном или более полипептидах. Эта связь схематически обозначается как "-S--S-
Термин "восстановление дисульфидной связи" относится к процессу расщепления дисульфидной связи в двух группах тиола (-SH группах).
В настоящем изобретении термин "FcγR" или "FcgR" относится к рецептору Fcγ, которые представляет собой рецептор, способный к связыванию с участком Fc IgG1, IgG2, IgG3 или IgG4 моноклонального антитела, и означает любого члена семейства белков, который существенно кодируется генами рецептора Fcγ. У человека это семейство, например, включает: FcγRI (CD64), включая изоформы FcγRIa, FcγRIb и FcγRIc; FcγRII (CD32), включая изоформы FcγRIIa (включая аллотипы H131 (Н тип) и R131 (R тип)), FcγRIIb (включая FcγRIIb-1 и FcγRIIb-2), и FcγRIIc; а также FcγRIII (CD 16), включая изоформы FcγRIIIa (включая аллотипы V158 и F158) и FcγRIIIb (включая аллотипы FcγRIIIb-NA1 и FcγRIIIb-NA2); и любую из еще не обнаруженных изоформ или аллотипов FcγR или FcγR человека. FcγR включает те, которые имеют происхождение от человека, мыши, крысы, кролика и обезьяны. FcγR не является ограниченным этими молекулами и может иметь происхождение от любого организма. Мышиные FcγR включают, например, FcγRI (CD64), FcγRII (CD32), FcγRIII (CD 16), а также FcγRIII-2 (CD 16-2) и FcγRIV, а также любую из еще не обнаруженных изоформ или аллотипов FcγR или FcγR мыши.
Способ получения гетеромультимера путем внесения изменений при использовании отталкивания зарядов аминокислотных остатков
В предпочтительном воплощении способ в соответствии с настоящим изобретением представляет собой способ получения гетеромера желаемых полипептидов путем изменения аминокислотных остатков, которые формируют поверхность контакта между полипептидами, для того, чтобы способствовать диссоциации гомовариантов первого и второго полипептидов с целью получения гетеромультимера, способного к образованию двух или более типов мультимеров, и для контроля ассоциации между полипептидами, которые составляют один или более типов мультимеров.
Полипептид, который имеет первую антигенсвязывающую активность, и полипептид, который имеет вторую антигенсвязывающую активность в соответствии с настоящим изобретением, могут каждый включать аминокислотную последовательность константного участка тяжелой цепи антитела или аминокислотную последовательность участка Fc антитела. Примеры аминокислотной последовательности участка Fc антитела или константного участка тяжелой цепи антитела включают, но не ограничены такими, как аминокислотные последовательности человеческих константных участков IgG-типа или участков Fc. Константные участки IgG-типа или участки Fc могут представлять собой любые из существующих в природ еизотипов IgG1, IgG2, IgG3 и IgG4. Альтернативно, могут использоваться их измененные формы. Лизин в положении 447 при нумерации в соответствии с EU и глицин в положении 446 при нумерации в соответствии с EU в участке Fc могут быть удалены при использовании методики генной рекомбинации нуклеиновых кислот, которые кодируют эти аминокислоты.
Полипептид, который имеет третью антигенсвязывающую активность, и полипептид, который имеет четвертую антигенсвязывающую активность в соответствии с настоящим изобретением, каждый может включать аминокислотную последовательность константного участка легкой цепи антитела. Примеры аминокислотной последовательности константного участка легкой цепи антитела включают, но не ограничены такими, как аминокислотные последовательности человеческого константного участка каппа- и лямбда-типа. Альтернативно, могут использоваться их измененные формы
Полипептид, который обладает антигенсвязывающей активностью в соответствии с настоящим изобретением, может включать аминокислотную последовательность вариабельного участка антитела (например, аминокислотные последовательности CDR1, CDR2, CDR3, FR1, FR2, FR3 и FR4).
В предпочтительном воплощении способа контроля диссоциации и/или ассоциации между полипептидами в соответствии с настоящим изобретением примеры способа включают способ, который предполагает введение отталкивания зарядов на поверхности контакта между константными участками тяжелых цепей для подавления ассоциации между тяжелыми цепями. Примеры аминокислотных остатков, которые приходят в контакт друг с другом на поверхности контакта между константными участками тяжелой цепи, могут включать пары в положениях 356 и 439, в положениях 357 и 370 и в положениях 399 и 409 в СН3 участках. Сайты в константных участках тяжелой цепи являются представленными в системе нумерации в соответствии с EU.
Как представлено в разделе Примеры, приведенном ниже, способ в соответствии с настоящим изобретением осуществляют путем изменения этих аминокислотных остатков для контроля диссоциации и/или ассоциации между полипептидами тяжелой цепи. В результате этого может быть получен желаемый гетеромультимер. В предпочтительном аспекте настоящее изобретение обеспечивает полипептид, который представляет собой антитело или белок, содержащий участок Fc (например, антитело IgG-типа, минитело (Alt М и др., FEBS Letters 199, 9; 454: 90-94), иммуноадгезин (непатентный литературный источник 2)), который включает два или более типов участков Fc тяжелой цепи, где наборы аминокислотных остатков 1-3, которые являются выбранными из наборов аминокислотных остатков (1)-(3):
(1) аминокислотные остатки в положениях 356 и 439 в соответствии с нумерацией EU,
(2) аминокислотные остатки в положениях 357 и 370 в соответствии с нумерацией EU, и
(3) аминокислотные остатки в положениях 399 и 409 в соответствии с нумерацией EU
в первом участке Fc тяжелой цепи имеют тот же тип заряда.
Настоящее изобретение также обеспечивает полипептид, в котором 1-3 наборы аминокислотных остатков, выбранные из наборов аминокислотных остатков (1)-(3) во втором участке Fc тяжелой цепи и отличающиеся от первого участка Fc тяжелой цепи, имеют заряд, противоположный таковому партнерских аминокислотных остатков, которые имеют тот же тип заряда, что и каждый другой в соответствующем(их) наборе(ах) среди наборов аминокислотных остатков (1)-(3) в первой участке Fc тяжелой цепи.
В полипептиде "аминокислотные остатки, которые имеют заряд" являются предпочтительно выбранными, например, из аминокислотных остатков, включенных в любую из следующих групп (а) и (b):
(a) глутаминовая кислота (Е) и аспарагиновая кислота (D); и
(b) лизин (К), аргинин (R) и гистидин (Н).
В отношении полипептида фраза "те, которые имеют тот же тип заряда" означает, например, что все два или более аминокислотных остатков представляют собой аминокислотные остатки, которые включены в любую из групп (а) и (b). Фраза "который имеет противоположный заряд" означает, например, что тогда, когда, по крайней мере, один аминокислотный остаток среди двух или более аминокислотных остатков представляет собой аминокислотный остаток, который включен в любую их групп (а) и (b), оставшийся(еся) аминокислотный(ые) остаток(остатки) представляет(ют) собой такой, который включен в другую группу.
В предпочтительном воплощении полипептид может иметь перекрестную связь между первым СН3 участком тяжелой цепи и вторым СН3 участком тяжелой цепи посредством дисульфидной связи.
В настоящем изобретении примеры "контролирующего ассоциацию поверхности контакта изменения" включают следующие изменения:
(1) изменение Asp (D) в положении 356 при нумерации в соответствии с EU в первом участке Fc тяжелой цепи на Lys (К), Arg (R) или His (Н), и изменение Lys (К) в положении 439 при нумерации в соответствии с EU во втором участке Fc тяжелой цепи на Glu (Е) или Asp (D);
(2) изменение Glu (Е) в положении 357 при нумерации в соответствии с EU в первом участке Fc тяжелой цепи на Lys (К), Arg (R) или His (Н), и изменение Lys (К) в положении 370 при нумерации в соответствии с EU во втором участке Fc тяжелой цепи на Glu (Е) или Asp (D); и
(3) изменение Asp (D) в положении 399 при нумерации в соответствии с EU в первом участке Fc тяжелой цепи на Lys (К), Arg (R) или His (Н), и изменение Lys (К) в положении 409 при нумерации в соответствии с EU во втором участке Fc тяжелой цепи на Glu (Е) или Asp (D).
В одном неограничивающем воплощении способ контроля диссоциации и/или ассоциации полипептидов в соответствии с настоящим изобретением ассоциируется со способом получения мышиного гетеромультимера. В предпочтительном воплощении этого способа примеры способа включают способ, который вовлекает введение отталкивания зарядов в поверхность контакта между константными участками тяжелых цепей для подавления ассоциации между тяжелыми цепями. В этом способе примеры аминокислотных остатков, которые входят в контакт друг с другом на поверхности контакта между константными участками тяжелой цепи, могут включать пары в положениях 356 и 439, в положениях 360 и 371 и в положениях 399 и 409 в СН3 участках. Эти сайты в константных участках тяжелой цепи являются представленными в системе нумерации в соответствии с EU.
Как показано в разделе Примеры, приведенном ниже, способ в соответствии с настоящим изобретением осуществляют путем изменения этих аминокислотных остатков в участках СН3, которые имеют происхождение от мыши для контроля диссоциации и/или ассоциации между полипептидами тяжелой цепи. В результате этого может быть получен желаемый гетеромультимер. В предпочтительном аспекте настоящее изобретение обеспечивает полипептид, который представляет собой антитело или белок, содержащий участок Fc (например, антитело IgG-типа, минитело (Alt М и др., FEBS Letters 199, 9; 454: 90-94), иммуноадгезин (непатентный литературный источник 2)), который включает два или более типов участков Fc тяжелой цепи, где наборы аминокислотных остатков 1-3, которые являются выбранными из наборов аминокислотных остатков (1)-(3):
(1) аминокислотные остатки в положениях 356 и 439 в соответствии с нумерацией EU,
(2) аминокислотные остатки в положениях 360 и 371 в соответствии с нумерацией EU, и
(3) аминокислотные остатки в положениях 399 и 409 в соответствии с нумерацией EU
в первом участке Fc тяжелой цепи имеют тот же тип заряда.
Настоящее изобретение также обеспечивает полипептид, в котором 1-3 наборы аминокислотных остатков, выбранные из наборов аминокислотных остатков (1)-(3), во втором участке Fc тяжелой цепи, которые являются отличными от первого участка Fc тяжелой цепи, имеют заряд, противоположный таковому партнерских аминокислотных остатков, которые имеют тот же тип заряда, что и каждый другой в соответствующем(их) наборе(ах) среди наборов аминокислотных остатков (1)-(3) в первом участке Fc тяжелой цепи.
В полипептиде "аминокислотные остатки, которые имеют заряд" являются предпочтительно выбранными, например, из аминокислотных остатков, включенных в любую из следующих групп (а) и (b):
(a) глутаминовая кислота (Е) и аспарагиновая кислота (D); и
(b) лизин (К), аргинин (R) и гистидин (Н).
В отношении полипептида фраза "которые имеют тот же тип заряда" означает, например, что все два или более аминокислотных остатков представляют собой аминокислотные остатки, которые включены в любую из групп (а) и (b). Фраза "который имеет противоположный заряд" означает, например, что тогда, когда, по крайней мере, один аминокислотный остаток из двух или более аминокислотных остатков представляет собой аминокислотный остаток, который входит в любую из групп (а) и (b), оставшийся(еся) аминокислотный(ые) остаток(остатки) представляет(ют) собой аминокислотный остаток, который входит в состав другой группы.
В предпочтительном воплощении полипептид может иметь перекрестную связь между первым СН3 участком тяжелой цепи и вторым СН3 участком тяжелой цепи посредством дисульфидной связи.
В настоящем изобретении примеры "изменения, контролирующего ассоциацию поверхности контакта" включают следующие изменения:
(1) изменение Asp (D) в положении 356 при нумерации в соответствии с EU в первом участке Fc тяжелой цепи на Lys (К), Arg (R) или His (Н), и изменение Lys (К) в положении 439 при нумерации в соответствии с EU во втором участке Fc тяжелой цепи на Glu (Е) или Asp (D);
(2) изменение Glu (Е) в положении 360 при нумерации в соответствии с EU в первом участке Fc тяжелой цепи на Lys (К), Arg (R) или His (Н), и изменение Lys (К) в положении 371 при нумерации в соответствии с EU во втором участке Fc тяжелой цепи на Glu (Е) или Asp (D); и
(3) изменение Asp (D) в положении 399 при нумерации в соответствии с EU в первом участке Fc тяжелой цепи на Lys (К), Arg (R) или His (Н), и изменение Lys (К) в положении 409 при нумерации в соответствии с EU во втором участке Fc тяжелой цепи на Glu (Е) или Asp (D).
Аминокислотные остатки, которые "подвергаются изменению" в соответствии с настоящим изобретением, не являются ограниченными аминокислотными остатками константных участков в полипептиде. Квалифицированный специалист в данной области техники может отыскать аминокислотные остатки, которые образуют поверхность контакта в полипептидном варианте или гетеромультимере, с помощью гомологичного моделирования или подобных способов при использовании коммерчески доступного программного обеспечения, и может изменять аминокислотные остатки в этих сайтах так, чтобы контролировать ассоциацию.
Термин "изменение" аминокислотных остатков в способе в соответствии с настоящим изобретением, в частности, относится, например, к замене исходных аминокислотных остатков другими аминокислотными остатками, удаление исходных аминокислотных остатков или прибавление нового аминокислотного остатка, и предпочтительно относится к замене исходных аминокислотных остатков другими аминокислотными остатками.
Способ получения гетеромультимера путем изменения аминокислоты в положении 397 и/или 392
В более предпочтительной воплощении способа контроля диссоциации и/или ассоциации между полипептидами в соответствии с настоящим изобретением способ представляет собой такой, который включает введение мутации аминокислотного остатка в участок Fc тяжелой цепи так, чтобы дестабилизировать стабильность СН3 участка тяжелой цепи. Этот способ может дополнительно включать необязательный этап упомянутого выше изменения аминокислоты, который относится к контролю поверхности контакта при использовании заряда отталкивания, и подобные ему.
В настоящем изобретении "дестабилизация стабильности СН3 участка" означает, что гомовариант полипептида, которые имеет, по крайней мере, один или более измененных аминокислотных остатков в участке Fc, становится более чувствительным к разделению на единичные полипептиды, чем неизмененный гомовариант полипептида.
В настоящем изобретении "дестабилизация стабильности участка СН3" предпочтительно означает, что промежуточная температура термической денатурации (Tm) СН3 участка тяжелой цепи, имеющего измененные аминокислотные остатки, при рН 7,4 составляет 72,5°С или ниже, 72,0°С или ниже, 71,5°С или ниже, 71,0°С или ниже, или 70,5°С или ниже, более предпочтительно 70,4°С или ниже, 70,3°С или ниже, 70,2°С или ниже, 70,1°С или ниже, 70,0°С или ниже, 69,9°С или ниже, 69,8°С или ниже, 69,7°С или ниже, 69,6°С или ниже, 69,5°С или ниже, 69,0°С или ниже, 68,5°С или ниже, 68,0°С или ниже, или 67,5°С или ниже.
Tm для СН3 участка тяжелой цепи может быть измерена, например, с помощью способа, описанного в Ссылочном Примере 3 настоящего описания. Раствор буфера или подобные ему для применения в этом измерении могут быть выбраны приемлемым образом.
В дополнительном предпочтительном воплощении способа для контроля диссоциации и/или ассоциации между полипептидами в соответствии с настоящим изобретением способ представляет собой такой, который включает введение мутации в аминокислотный остаток в положении 397 и/или 392 при нумерации в соответствии с EU в СН3 участке тяжелой цепи. Этот способ может дополнительно включать необязательный этап введения указанного изменения аминокислоты, связанной с контролем поверхности контакта, при использовании заряда отталкивания, или подобных.
В неограничивающем воплощении в соответствии с настоящим изобретением мутация может быть также введена в аминокислотный остаток в положении 397 и/или 392 при нумерации в соответствии с EU в СН3 участок тяжелой цепи в способе для контроля диссоциации и/или ассоциации между полипептидами, которые имеют происхождение от мыши. Этот способ может дополнительно включать необязательный этап введения указанного изменения аминокислоты, связанной с контролем поверхности контакта, при использовании заряда отталкивания или подобных.
Аминокислотный остаток для введения мутации в положении 397 предпочтительно заменяют на аминокислотный остаток, который имеет большую боковую цепочку, или на аминокислоту, которая имеет разветвленную боковую цепочку.
Аминокислотный остаток для введения мутации в положении 392 предпочтительно заменяют на аминокислотный остаток, который имеет негативный заряд, аминокислоту, которая имеет большую боковую цепочку, или на аминокислоту, которая имеет разветвленную боковую цепочку.
В настоящем изобретении примеры "аминокислоты, которая имеет большую боковую цепочку" включают Met (М), Phe (F), Tyr (Y), Val (V), Leu (L), Ile (I), Trp (W), Arg (R), His (H), Glu (E), Lys (K), Gln (Q), Asp (D), Asn (N), Cys (С) и Thr (T), и предпочтительно включают Met (M), Phe (F), Thr (T) и Tyr (Y).
В настоящем изобретении примеры "аминокислоты, которая имеет разветвленную боковую цепочку" включают Val (V), Ile (I) и Leu (L), и предпочтительно включают Val (V) и Ile (I).
В настоящем изобретении примеры "аминокислоты, которая имеет негативный заряд" включают Asp (D) и Glu (Е).
В настоящем изобретении предпочтительные примеры "гетеромультимера" могут включать мультиспецифические антитела и гетерологические слитые белки.
В неограничивающем аспекте настоящее изобретение обеспечивает аминокислотное изменение гетеромультимера для того, чтобы способствовать связыванию с FcγR. Предпочтительные примеры сайта изменения аминокислоты включают, но не ограничены такими, как аминокислота в положении 397 в соответствии с нумерацией EU. Аминокислотный остаток для введения мутации в положении 397 предпочтительно заменяют на аминокислоту, которая имеет большую боковую цепочку, или на аминокислоту, которая имеет разветвленную боковую цепочку.
В настоящем изобретении более предпочтительные примеры мультиспецифического антитела включают таковые IgG типа, scFv-IgG, тандем scFv-Fc, DVD-Ig, диатело-Fc, одноцепочечное диатело-Fc, IgG-scFv, sVD-IgG, Тандемаб, С-терминальное слияние scFv легкой цепи, триспецифическое С-терминальное слияние, триспецифическое N-терминальное слияние и IgG-Fab (Bispecific Antibodies, Roland E. Kontermann, 2011, WO 2010034441 и WO 2010145792).
В настоящем изобретении термин "антитело" используется в самом широком смысле и включает моноклональные антитела, поликлональные антитела и варианты антитела (химерные антитела, гуманизированные антитела, низкомолекулярные антитела (также включают фрагменты антитела), мультиспецифические антитела и т.д.) до тех пор, пока антитело демонстрирует желаемую биологическую активность. В настоящем изобретении "антитело" может представлять собой полипептид или может быть гетеромультимером. Антитело предпочтительно представляет собой моноклональное антитело, химерное антитело, гуманизированное антитело или низкомолекулярное антитело такое, как фрагмент антитела. В настоящем изобретении способ для контроля диссоциация и/или ассоциации в соответствии с настоящим изобретением может предпочтительно использоваться для получения (приготовления) этих антител.
Предпочтительные примеры полипептида или гетеромультимера, который подвергается способу в соответствии с настоящим изобретением, могут включать полипептид или гетеромультимер, который имеет вариабельный участок тяжелой цепи антитела и вариабельный участок легкой цепи антитела. В более предпочтительном аспекте настоящее изобретение обеспечивает способ для контроля диссоциация и/или ассоциации полипептида или гетеромультимера в соответствии с настоящим изобретением, который включает два или более типов тяжелой цепи и два или более типов вариабельных участков легкой цепи.
Полипептид, который обладает антигенсвязывающей активностью в соответствии с настоящим изобретением, может включать аминокислотную последовательность тяжелой цепи антитела или аминокислотную последовательность легкой цепи антитела. В частности, полипептид, который имеет первую антигенсвязывающую активность, и полипептид, который имеет вторую антигенсвязывающую активность, каждый могут включать аминокислотную последовательность тяжелой цепи антитела. Полипептид, который имеет третью антигенсвязывающую активность, и полипептид, который имеет четвертую антигенсвязывающую активность, каждый может включать аминокислотную последовательность легкой цепи антитела.
Когда полипептидный мультимер, который представляет интерес, представляет собой тетрамер, который является мультимером, сформированным из димера, образованного между первым полипептидом и третьим полипептидом, и димера, образованного между вторым полипептидом и четвертым полипептидом, например, полипептидный мультимер, в котором полипептиды, имеющие первую и вторую антигенсвязывающие активности, представляют собой полипептиды, каждый из которых включает аминокислотную последовательность тяжелой цепи антитела, в то время как полипептиды, имеющие третью и четвертую антигенсвязывающие активности, представляют собой полипептиды, каждый из которых включает аминокислотную последовательность легкой цепи антитела, также могут использоваться в качестве полипептидного мультимера в соответствии с настоящим изобретением.
Дополнительные предпочтительные примеры мультиспецифического антитела в соответствии с настоящим изобретением могут включать биспецифические антитела.
В предпочтительном аспекте настоящее изобретение относится, например, к способу для контроля диссоциация и/или ассоциации в отношении биспецифического антитела, которое включает два типа тяжелых цепей (первый полипептид и второй полипептид в полипептидном мультимере в соответствии с настоящим изобретением) и два типа легких цепей (третий полипептид и четвертый полипептид в полипептидном мультимере в соответствии с настоящим изобретением).
"Биспецифическое антитело" в соответствии с предпочтительным аспектом настоящего изобретения будет более подробно описано далее. "Первый полипептид и второй полипептид" относится к одной из (первой Н-цепи) двух тяжелых цепей (Н-цепей), которая входит в состав антитела, и другой Н-цепи (второй Н-цепи), отличной от первой Н-цепи. Вкратце, любая из двух Н-цепей может быть произвольным образом выбрана в качестве первой Н -цепи, а другая Н-цепь может быть принята как вторая Н -цепь. Кроме того, "третий полипептид и четвертый полипептид" относятся к одной (первой L-цепи) из двух легких цепей (L-цепей), которая входит в состав антитела, и другой L-цепи (второй L-цепи), отличной от первой L-цепи. Любая из двух L-цепей может быть произвольным образом выбрана в качестве первой L-цепи, а другая L-цепь может быть принята как вторая L-цепь. Обычно, первая L-цепь и первая Н-цепь имеют происхождение от одного и того же антитела, которое узнает определенный антиген (или эпитоп). Вторая L-цепь и вторая Н-цепь также имеют происхождение от одного и того же антитела, которое узнает определенный антиген (или эпитоп). В этом контексте L-H пара цепей, которая образуется первой Н-цепью и L-цепью, обозначается как первая пара (или первая HL молекула). L-H пара цепей, которая образуется второй Н-цепью и L-цепью, обозначается как вторая пара (или вторая HL молекула). Первая пара и вторая пара могут узнавать тот же антиген и предпочтительно узнают различные эпитопы. В этом случае Н-цепи или L-цепи в первой паре и второй паре предпочтительно имеют аминокислотные последовательности, отличные друг от друга. Когда первая пара и вторая пара узнают различные эпитопы, то первая пара может узнавать антиген, полностью отличный от второй пары, или первая пара и вторая пара могут узнавать различные сайты (различные эпитопы) на одном и том же антигене (например, тогда, когда антиген представляет собой гетеромерный рецептор, мультиспецифическое антитело, которое узнает различные домены, составляющие гетеромерный рецептор; или тогда, когда антиген представляет собой мономер, то мультиспецифическое антитело узнает множество сайтов в мономерном антигене). Такая молекула обычно связывается с двумя антигенами, но может иметь специфичности для двух или более (например, 3 типов) антигенов. Альтернативно, одна из пар может узнавать антиген такой, как белок, пептид, ген или сахар, а другая пара может узнавать, например, цитотоксическое вещество такое, как радиоактивное вещество, химиотерапевтический агент или токсин, который выделяется клетками. В случае получения желаемого антитела, которое имеет пары, сформированные определенными Н-цепями и L-цепями в комбинации, определенные Н-цепи и L-цепи могут быть произвольным образом определены как первая пара и вторая пара.
В настоящем изобретении "слитый белок" относится к белку, в котором две или более идентичные или существенно аналогичные белковые молекулы являются соединенными посредством аминокислотной последовательности линкера шарнирного участка Ig. Префикс "гетеро-" используется для описания слитого белка, который содержит более чем один тип белков. "Гетерослитый белок" содержит, например, два или более белка, которые представляют собой один или более остаточных белков и один или более различных белков, соединенных вместе.
"Антитело" в соответствии с настоящим изобретением включает такие, которые получены путем дополнительного изменения аминокислотной последовательности упомянутого выше антитела путем аминокислотной замены, делеции, добавления и/или инсерции или химеризации, гуманизации и т.д. Изменение аминокислотной последовательности путем аминокислотной замены, делеции, добавления и/или инсерции, а также химеризации, гуманизации и т.д. может осуществляться с помощью способа, который является хорошо известным для квалифицированного специалиста в данной области техники. Кроме того, аминокислотные последовательности вариабельных участков и константных участков антитела для применения в получении антитела в соответствии с настоящим изобретением в качестве рекомбинантного антитела могут быть изменены путем аминокислотной замены, делеции, добавления и/или инсерции, а также химеризации, гуманизации и т.д.
Антитело в соответствии с настоящим изобретением может представлять собой антитело, которое имеет происхождение от любого животного, в частности, может представлять собой мышиное антитело, человеческое антитело, крысиное антитело, кроличье антитело, козье антитело или верблюжье антитело. Антитело в соответствии с настоящим изобретением может представлять собой измененное антитело, полученное с помощью замены аминокислотной последовательности, например, химерное антитело, в частности, гуманизированное антитело. Альтернативно, может использоваться любое антитело такое, как модифицированное антитело, конъюгированное с различными молекулами, фрагмент антитела или низкомолекулярное антитело.
"Химерное антитело" представляет собой антитело, полученное путем комбинации последовательностей, которые имеют происхождение от различных животных. Примеры таких антител могут включать антитело, которое состоит из вариабельных (V) участков тяжелой цепи и легкой цепи мышиного антитела и константных (С) участков тяжелой цепи и легкой цепи человеческого антитела. Получение химерного антитела является известным в области техники. Химерное антитело может быть получено, например, путем: лигирования ДНК, кодирующей V участки антитела с ДНК, кодирующей С участки человеческого антитела; встраивания полученных продуктов лигирования в экспрессионные векторы; и переноса векторов в хозяйские организмы для продукции антитела.
"Гуманизированное антитело", которое также называется видоизмененным человеческим антителом, получают путем прививания участков антитела, определяющих комплементарность (CDR), которые имеют происхождение от животного, отличного от человека, например, происходят от мышиного антитела, на CDR человеческого антитела. Способ для идентификации CDR является известным в области техники (Kabat и др., Sequence of Proteins of Immunological Interest (1987), National Institute of Health, Bethesda, Md.; и Chothia и др., Nature (1989) 342: 877). Так, общий подход генетической рекомбинации также является известным в области техники (смотри публикацию европейской патентной заявки № ЕР 125023 и WO 96/02576). В соответствии с этим, например, CDR мышиного антитела определяются с помощью способа, известного в данной области техники. Получают ДНК, кодирующую антитело, имеющее эти CDR, связанные с каркасными участками (FR) человеческого антитела. Гуманизированное антитело может быть получено в системе при использовании обычных экспрессионных векторов. Такая ДНК может быть синтезирована с помощью ПЦР при использовании нескольких олигонуклеотидных праймеров, полученных таким образом, что они содержат часть, которая перекрывается с терминальными участками как CDR, так и FR (смотри способ, описанный в WO 98/13388). FR человеческого антитела, связанные с помощью CDR, выбирают таким образом, что CDR формируют предпочтительный антигенсвязывающий сайт. При необходимости, аминокислоты в FR вариабельных участков антитела могут быть изменены так, что CDR полученного видоизмененного человеческого антитела формирует приемлемый сайт связывания антигена (Sato и др., Cancer Res. (1993) 53: 851-6). Аминокислотные остатки в FR, которые были видоизменены, включают остатки, которые непосредственно связываются с антигеном при помощи нековалентной связи (Amit и др., Science (1986) 233: 747-53), остатки, которые влияют или воздействуют на структуры CDR (Chothia и др., J. Mol. Biol. (1987) 196: 901-17), и остатки, которые имеют отношение к взаимодействию VH-VL (ЕР 239400).
Когда антитело в соответствии с настоящим изобретением представляет собой химерное антитело или гуманизированное антитело, константные участки, имеющие происхождение от человеческого антитела, предпочтительно используются в качестве С участков антитела. Например, Cγ1, Сγ2, Сγ3 или Сγ4 могут использоваться для Н-цепи, а Сκ или Сλ могут использоваться для L-цепи. Кроме того, С участки человеческого антитела могут быть модифицированы, в случае необходимости, для того, чтобы улучшить антитело или стабильность его продукции. Химерное антитело в соответствии с настоящим изобретением предпочтительно включает вариабельные участки антитела, которые имеют происхождение от млекопитающего, отличного от человека, и константные участки, которые имеют происхождение от человеческого антитела. С одной стороны, гуманизированное антитело предпочтительно включает CDR, имеющие происхождение от антитела млекопитающего, отличного от человека, а также FR и С участки, которые имеют происхождение от человеческого антитела. Константные участки, которые имеют происхождение от человеческого антитела, имеют аминокислотные последовательности, специфические для каждого изотипа, такого, как IgG (IgG1, IgG2, IgG3 или IgG4), IgM, IgA, IgD или IgE. Константные участки, используемые в гуманизированном антителе в соответствии с настоящим изобретением, могут представлять собой константные участки антитела, которое принадлежит к любому изотипу. Предпочтительно, когда используются константные участки человеческого IgG, несмотря на то, что константные участки в соответствии с настоящим изобретением не ограничиваются таковыми. FR, которые имеют происхождение от человеческого антитела, используемые в гуманизированном антителе, не являются особо ограниченными и могут иметь происхождение от антитела, которое принадлежит к любому изотипу.
Вариабельные участки и константные участки химерного антитела или гуманизированного антитела в соответствии с настоящим изобретением могут быть изменены путем делеции, замены, инсерции и/или прибавления, и др., до тех пор, пока полученное антитело демонстрирует связывающую специфичность исходного антитела.
Химерное антитело или гуманизированное антитело, которое содержит последовательность, которая имеет происхождение от человека, демонстрирует сниженную антигенность в человеческом организме и, таким образом, считается полезным для введения человеку с терапевтической целью или т.п.
Комбинация с методикой изменения изоэлектрической точки и т.п.
В дополнительном предпочтительном воплощении в соответствии с настоящим изобретением аминокислотная мутация, которая изменяет изоэлектрическую точку (значение pI) полипептида, может быть введена в полипептид в соответствии с настоящим изобретением для того, чтобы очистить или получить полипептидный мультимер, содержащий первый - четвертый полипептиды, который представляет интерес, с более высокой степенью чистоты и с более высокой эффективностью (WO 2007114325 и US 20130171095). Например, способ для ассоциации гетерологических полипептидов, которые включают два типа константных участков тяжелой цепи, путем изменения СН3 доменов константных участков тяжелой цепи (который является описанным, например, в Protein Eng. 1996 Jul; 9 (7): 617-21; Protein Eng Des Sel. 2010 Apr; 23 (4): 195-202; J Biol Chem. 2010 Jun 18; 285 (25): 19637-46; WO 2009080254; и US 20130195849), и способ для способствования ассоциации тяжелой цепи и легкой цепи в конкретной комбинации (который является описанным, например, в WO 2009080251, WO 2009080252 и WO 2009080253), могут быть использованы для аминокислотной мутации, которую вводят для того, чтобы способствовать ассоциации между полипептидами.
Комбинация с методикой, которая относится к нацеливанию молекулы, связывающей специфический для ткани антиген
В неограничивающем воплощении в соответствии с настоящим изобретением способ в соответствии с данным изобретением может сочетаться с основанной на антителах методикой для диссоциации или связывания с антигеном зависимым от дозы образом присутствующей молекулы, в частности, для целевой ткани (WO 2013/180200).
Комбинация с другими методиками изменения константного участка и/или вариабельного участка
В неограничивающем воплощении в соответствии с настоящим изобретением способ в соответствии с настоящим изобретением может сочетаться с методикой изменения константных участков с целью улучшения связывания с FcγR (WO 2013047752).
В альтернативном воплощении примеры комбинации способа в соответствии с настоящим изобретением с другими методиками изменения константного участка включают его комбинацию с методикой контроля связывания с комплементом. Любой компонент комплемента может использоваться в качестве комплемента до тех пор, пока комплемент представляет собой полипептид, который формирует каскад комплемента. Предпочтительные примеры комплемента включают компоненты комплемента C1q, C1r и C1s, вовлеченные в связывание опсонина. Участок Fc, который имеет более высокую связывающую активность против комплемента, чем таковая существующего в природе участка Fc против комплемента, может быть получен путем аминокислотного изменения существующего в природе участка Fc. В этом контексте существующий в природе участок Fc относится к участку Fc на основе человеческого IgG1, IgG2, IgG3 или IgG4. Имеет ли или нет участок Fc более высокую связывающую активность против комплемента, чем существующий в природе участок Fc против комплемента, может быть приемлемым образом подтверждено путем использования иммунологического способа, известного в области техники, такого, как FACS или ELISA. Термин "изменение аминокислоты(аминокислот) или "аминокислотное изменение" участка Fc включает изменение аминокислотной последовательности исходного участка Fc на другую аминокислотную последовательность. Любой участок Fc может использоваться в качестве исходного домена до тех пор, пока полученная модифицированная или измененная форма исходного участка Fc может связываться с комплементом в нейтральном диапазоне рН. Участок Fc, полученный путем дополнительного изменения уже измененного участка Fc в качестве исходного участка Fc, может также предпочтительно использоваться в качестве участка Fc в соответствии с настоящим изобретением. Исходный участок Fc может означать полипептид сам по себе, композицию, содержащую исходный участок Fc, или аминокислотную последовательность, кодирующую исходный участок Fc. Исходный участок Fc может включать IgG участок Fc антитела, известный в области техники, который получают с помощью рекомбинации, как подытожено в разделе, касающемся антитела. Происхождение исходного участка Fc не является ограниченным, и исходный участок Fc может быть получен из произвольным образом выбранного организма млекопитающего, отличного от человека, или человека. Предпочтительные примеры произвольным образом выбранных организмов включают организмы, выбранные из мышей, крыс, морских свинок, хомяков, песчанки, кошек, кроликов, собак, коз, овец, крупного рогатого скота, лошадей, верблюдов и приматов, отличных от человека. В другом воплощении исходный участок Fc может быть получен из обезьян циномолгус, мармозетки, макаки-резус, шимпанзе или человека. Предпочтительно, когда исходный участок Fc может быть получен из IgG1 человека, но не ограничивается определенным классом IgG. Это означает, что участок Fc на основе IgG1, IgG2, IgG3 или IgG4 человека может приемлемым образом использоваться в качестве исходного участка Fc. Это также означает то, что участок Fc любого класса или подкласса IgG из произвольным образом выбранного организма может предпочтительно использоваться в качестве исходного участка Fc в соответствии с настоящим описанием. Примеры вариантов или сконструированных моделей существующего в природе IgG являются описанными в общедоступных литературных источниках (Curr. Opin. Biotechnol. (2009) 20 (6), 685-91; Curr. Opin. Immunol. (2008) 20 (4), 460-470; Protein Eng. Des. Sel. (2010) 23 (4), 195-202; и WO 2009086320, WO 2008092117, WO 2007041635 и WO 2006105338), несмотря на то, что участок Fc в соответствии с настоящим изобретением не является ограниченным таковыми.
Аминокислота в любом положении может быть изменена до тех пор, пока изменение аминокислоты может обеспечивать связывающую активность против комплемента или может способствовать связывающей активности для связывания с комплементом. Связывающая антиген молекула, которая включает участок Fc человеческого IgG1 в качестве человеческого участка Fc, предпочтительно содержит изменение для того, чтобы приводить к эффекту улучшения его связывающей активности с комплементом по сравнению со связывающей активностью исходного участка Fc человеческого IgG1. Примеры аминокислот для изменения связывающей активности против комплемента включают аминокислоты в участке Fc с измененной связывающей активностью против C1q, описанные, например, Duncan и др. (Nature (1988) 332, 738-740), Тао и др. (J. Exp. Med. (1993) 178, 661-667), Brekke и др. (Eur. J. Immunol. (1994) 24, 2542-2547), Xu и др. (Immunol. (1993) 150, 152А), WO 1994029351, WO 2000042072, и WO 2011091078.
Примеры таких аминокислот, которые позволяют осуществить изменение для улучшения связывающей активности против Clq, включают, по крайней мере, одну или более аминокислот, выбранных из положений от 231 до 238 и положений от 318 до 337 в соответствии с нумерацией EU. Один неограничивающий пример аминокислоты включает, по крайней мере, одну или более аминокислот, выбранных из группы, которая состоит из положений 235, 237, 267, 268, 276, 318, 320, 322, 324, 327, 331 и 333. Изменение этих аминокислот улучшает связывание участка Fc иммуноглобулина IgG-типа с комплементом.
Особенно предпочтительные примеры изменения включают изменение
аминокислоты в положении в 267 соответствии с нумерацией EU на Glu,
аминокислоты в положении 268 в соответствии с нумерацией EU на любую из Phe и Tyr,
аминокислоты в положении 276 в соответствии с нумерацией EU на Arg,
аминокислоты в положении 324 в соответствии с нумерацией EU на Thr,
аминокислоты в положении 327 в соответствии с нумерацией EU на Gly,
аминокислоты в положении 331 в соответствии с нумерацией EU на Pro, или
аминокислоты в положении 333 в соответствии с нумерацией EU на любую из Ala, Asp, Gly, Ser и Val
в участке Fc.
Количество аминокислот, которые подвергаются изменению, не является ограниченным. Может изменяться аминокислота только в одном сайте или аминокислоты в двух или более сайтах в произвольной комбинации, выбранные из тех, которые описаны выше как такие, которые могут быть изменены.
В альтернативном воплощении примеры комбинации способа в соответствии с настоящим изобретением с другими методиками изменениями константного участка включают его комбинацию с методиками изменения антитела, такими, как методика изменения Fc для улучшения связывания с FcRn при кислотных значениях рН (WO 2002060919, WO 2004035752, и WO 2000042072), методика изменения Fc для улучшения связывания с FcRn при нейтральном значении рН (WO 2011122011 и WO 2012133782), методика улучшения селективного связывания для ингибирования Fcγ рецепторов (WO 2012115241 и WO 2013125667), методика улучшения селективного связывания для активации Fcγ рецепторов (методика улучшения активности ADCC) (WO 2013002362) и методика снижения связывающей активности против ревматоидных факторов (WO 2013046704).
В неограничивающем воплощении примеры комбинации способа в соответствии с настоящим изобретением с методикой изменения вариабельного участка включают его комбинацию с такими методиками изменения, как рН-зависимое антитело (WO 2009125825) и кальций-зависимое антитело (WO 2012073992).
Библиотека антител, иммунизация и получение гибридомы
Известная последовательность может быть использована в качестве гена, кодирующего Н-цепь или L-цепь антитела перед введением мутации (в настоящем описании также просто называется "антитело в соответствии с настоящим изобретением") в способе в соответствии с настоящим изобретением. Альтернативно, ген может быть получен с помощью способа, хорошо известного квалифицированному специалисту в данной области техники. Например, ген может быть получен из библиотеки антител или может быть получен путем клонирования гена, который кодирует антитело, из гибридомы, которая продуцирует моноклональное антитело.
Множество библиотек антител уже являются известными в области техники в качестве библиотеки антитела. Кроме того, способы для получения библиотеки антител являются известными в области техники. Таким образом, квалифицированный специалист в данной области техники может приемлемым образом получить библиотеку антитела. Для фаговой библиотеки антитела смотри, например, такую литературу, как Clackson и др., Nature 1991, 352: 624-8, Marks и др., J. Mol. Biol. 1991, 222: 581-97, Waterhouses и др., Nucleic Acids Res. 1993, 21: 2265-6, Griffiths и др., EMBO J. 1994, 13: 3245-60, Vaughan и др., Nature Biotechnology 1996, 14: 309-14, и национальная публикация международной патентной заявки №2008-504970. Кроме того, может использоваться способ, известный в области техники такой, как способ для получения библиотеки при использовании эукариотических клеток (WO 95/15393) или способ рибосомального дисплея. Кроме того, методика получения человеческого антитело путем пэннинга при использовании библиотеки человеческих антител также является известной. Например, вариабельные участки человеческого антитела экспрессируют в качестве одноцепочечного антитела (scFv) на поверхности фагов с помощью способа фагового дисплея. Может быть отобран фаг, экспрессирующий scFv, который связывается с антигеном. Ген отобранного фага может подвергаться анализу для определения последовательностей ДНК, кодирующих вариабельные участки человеческого антитела, которое связывается с антигеном. Если последовательность ДНК scFv, которое связывается с антигеном может быть определена, то могут быть получены приемлемые экспрессионные векторы на основе этой последовательности, и они могут использоваться для получения человеческого антитела. Эти способы уже являются хорошо известными. Смотри WO 92/01047, WO 92/20791, WO 93/06213, WO 93/11236, WO 93/19172, WO 95/01438 и WO 95/15388.
В основном, любая методика, известная в области техники, используется в способе для получения гена, кодирующего антитело, из гибридомы. Желательный антиген или клетки, экспрессирующие желаемый антиген, используются в качестве сенсибилизирующего антигена. Животных подвергают иммунизации с помощью этого сенсибилизирующего антигена в соответствии с обычным способом иммунизации. Иммуноциты, полученные таким образом, сливают с первичными клетками, известными в области техники, при использовании обычного способа слияния клеток. Клетки, продуцирующие моноклональное антитело (гибридомы), подвергают скринингу с помощью обычного способа скрининга. Из мРНК, полученных из гибридом, может быть синтезирована кДНК вариабельных участков антитела (V участки) при использовании обратной транскриптазы, после этого указанную кДНК лигируют с ДНК, кодирующей желаемые константные участки антитела (С участки) для получения гена, который кодирует антитело.
В частности, несмотря на то, что настоящее изобретение не является ограниченным примерами, приведенными ниже, сенсибилизирующий антиген для получения генов, кодирующих Н-цепь и L-цепь антитела, включает как полный антиген, который обладает иммуногенностью, так и неполный антиген (включая гаптен и т.п.), который не демонстрирует иммуногенности. Например, может использоваться полноразмерный белок или частичный пептид белка, который представляет интерес. Кроме того, вещество, которое состоит из полисахарида, нуклеиновой кислоты, липида, или подобных им, как известно, может служить в качестве антигена. Антиген для антитела в соответствии с настоящим изобретением не является, в частности, ограниченным. Антиген может быть получен с помощью способа, который является хорошо известным квалифицированному специалисту в данной области техники и может быть получен в соответствии, например, со способом при использовании бакуловирусов (например, WO 98/46777). Гибридома может быть получена, например, в соответствии со способом Milstein и др. (G. Kohler и С.Milstein, Methods Enzymol. 1981, 73: 3-46). Когда антиген имеет низкую иммуногенность, то этот антиген может связываться с иммуногенной макромолекулой такой, как альбумин, для иммунизации. В случае необходимости, антиген может быть связан с другой молекулой для образования растворимого антигена. В случае использования трансмембранной молекулы такой, как рецептор, в качестве антигена, часть экстрацеллюлярного участка рецептора может использоваться в качестве фрагмента, или клетки, экспрессирующие трансмембранную молекулу на своей поверхности, могут использоваться в качестве иммуногена.
Клетки, продуцирующие антитело, могут быть получены путем иммунизации животных с помощью любого из приемлемых сенсибилизирующих антигенов, упомянутых выше. Альтернативно, лимфоциты, которые являются способными продуцировать антитела, могут быть иммунизированы in vitro и использоваться в качестве клеток, продуцирующих антитело. Различные млекопитающие могут использоваться в качестве животных, которых подвергают иммунизации. В общем случае используется животное из отряда Rodentia, Lagomorpha или Primates. Примеры таковых могут включать: животных из отряда грызунов (Rodentia) таких, как мыши, крысы и хомяки; животных из отряда зайцеобразных (Lagomorpha) таких, как кролики; и животных из отряда приматов (Primate) таких, как обезьяны, в том числе макаки, макаки-резус, плащеносных бабуинов и шимпанзе. Кроме того, также являются известными трансгенные животные, имеющие набор генов человеческого антитела, и такие животные также могут использоваться для получения человеческого антитела (смотри WO 96/34096; и Mendez и др., Nat. Genet. 1997, 15: 146-56). Вместо использования таких трансгенных животных, например, человеческие лимфоциты сенсибилизируют in vitro при использовании желаемого антигена или клеток, экспрессирующих желаемый антиген, и сенсибилизированные лимфоциты могут сливаться с клетками человеческой миеломы, например, U266, для получения желаемого человеческого антитела, которое обладает связывающей активностью против антигена (смотри патентную публикацию Японии №1-59878). Кроме того, трансгенные животные, которые имеют весь набор генов человеческого антитела, могут подвергаться иммунизации с помощью желаемого антигена для получения желаемого человеческого антитела (смотри WO 93/12227, WO 92/03918, WO 94/02602, WO 96/34096 и WO 96/33735).
Для иммунизации этих животных, например, сенсибилизирующий антиген приемлемым образом разводят или суспендируют в фосфатно-солевом растворе (PBS), физиологическом растворе или подобных им, смешивают с адъювантом, в случае необходимости, и эмульгируют. Потом полученный сенсибилизирующий антиген интраперитонеально или подкожно инъецируют животным. После этого сенсибилизирующий антиген, предпочтительно, смешивают с неполным адъювантом Фрейнда, вводят животным несколько раз с интервалами от 4 дней до 21 дня. Продукция антитела может быть подтверждена путем измерения титра антитела, которое представляет интерес, в сыворотке с помощью способа, который обычно используется для этого.
Гибридома может быть получена путем слияния клеток, продуцирующих антитело, полученных от животных, или лимфоцитов, иммунизированных с помощью желаемого антигена, с миеломными клетками при использовании агента слияния (например, полиэтиленгликоля), который обычно используется с этой целью (Goding, Monoclonal Antibodies: Principles и Practice, Academic Press, 1986, 59-103). В случае необходимости гибридомные клетки культивируют для роста, и связывающую специфичность антитела, которое продуцируется гибридомой, измеряют с помощью метода анализа, известного в данной области техники такого, как иммунопреципитация, радиоиммуноанализ (RIA) или твердофазный иммуноферментный анализ (ELISA). Потом гибридому, которая продуцирует антитело, подтверждают путем исследования на такие параметры, как специфичность, аффинность или активность, которые представляют интерес, гибридома также, в случае необходимости, может быть клонирована с помощью подхода, например, такого, как метод серийных разведений.
В дальнейшем ген, кодирующий выбранное антитело, может быть клонирован из гибридомы или клетки, продуцирующей антитело (сенсибилизированные лимфоциты, и др.), при использовании зонда (например, олигонуклеотида, комплементарного к последовательности, кодирующей константный участок антитела), способного, в частности, к связыванию с геном антитела. Этот ген может быть также клонирован из мРНК с помощью RT-ПЦР. Иммуноглобулины классифицируют в пять различных классов: IgA, IgD, IgE, IgG и IgM. Эти классы далее подразделяются на несколько подклассов (изотипов) (например, IgG-1, IgG-2, IgG-3 и IgG-4; а также IgA-1 и IgA-2). В настоящем изобретении Н-цепь и L-цепь, которые используются в получении антитела, могут иметь происхождение от антитела, которое принадлежит к любому из этих классов и подклассов. Такое антитело не является особым образом ограниченным и особенно предпочтительно представляет собой IgG.
В этом контексте гены, кодирующие Н-цепь и L-цепь могут быть изменены с помощью подхода генетической инженерии. Например, полученное рекомбинантно антитело, например, химерное антитело или гуманизированное антитело, может быть приемлемым образом получено с помощью искусственно измененного антитела, такого, как мышиное антитело, крысиное антитело, кроличье антитело, антитело хомяка, антитело овцы или верблюжье антитело с целью, например, снижения гетероантигенности у человека. Химерное антитело представляет собой антитело, которое состоит из вариабельных участков Н-цепи и L-цепи антитела млекопитающего, отличного от человека, например, мышиного антитела, и константных участков Н-цепи и L-цепи человеческого антитела. Химерное антитело может быть получено путем: лигирования ДНК, кодирующих вариабельные участки мышиного антитела, с ДНК, кодирующими константный участок человеческого антитела; встраивания полученных продуктов лигирования в экспрессионные векторы; и переноса векторов в хозяйские организмы для продукции антитела. Гуманизированное антитело также называется модифицированным человеческим антителом. Последовательности ДНК, сконструированные для соединения последовательностей участков, определяющих комплементарность (CDR) антитела млекопитающего, отличного от человека, например, мышиного антитела, синтезируются с помощью ПЦР из нескольких приготовленных олигонуклеотидов, которые имеют перекрывающиеся терминальные части. Полученные ДНК подвергают лигированию с ДНК, кодирующей константный участок человеческого антитела, и полученные продукты лигирования в дальнейшем встраивают в экспрессионные векторы, которые переносят в хозяйские организмы для продукции антитела (смотри ЕР 239400; и WO 96/02576). FR человеческого антитела, соединенные с помощью CDR, отбирают так, что участки, определяющие комплементарность, формируют благоприятный сайт связывания антигена. В случае необходимости, аминокислоты каркасных участков вариабельных участков антитела могут быть заменены так, что участки, определяющие комплементарность, полученного видоизмененного человеческого антитела формируют приемлемый сайт связывания антигена (К. Sato и др., Cancer Res. 1993, 53: 851-856).
В дополнение к упомянутой выше гуманизации, например, изменение является также возможным для улучшения биологических свойств антитела таких, как связывающая активность против антигена. Такое изменение может осуществляться с помощью способа такого, как сайт-направленный мутагенез (смотри, например, Kunkel (1985) Proc. Natl. Acad. Sci. USA 82: 488), ПЦР мутагенез или кассетный мутагенез. В общем случае, такой вариант антитела, который обладает улучшенными биологическими свойствами, имеет 70% или выше, более предпочтительно 80% или выше, также предпочтительно 90% или выше (например, 95% или выше, 97%, 98% или 99%) гомологии и/или подобности аминокислотной последовательности аминокислотным последовательностям вариабельного участка исходного антитела. В настоящем описании гомология и/или подобие последовательности определяется как процент аминокислотных остатков, которые являются гомологичными (идентичными аминокислотными остатками) или подобными (аминокислотные остатки, которые классифицируются в ту же группу на основе свойств боковой цепи общих аминокислот) с остатками исходного антитела после выравнивания последовательности и введения пробелов, в случае необходимости, как это требуется для достижения самого высокого значения гомологии последовательности. Типично, природные аминокислотные остатки классифицируются на основе свойств их боковой цепи в (1) гидрофобную группу: аланин, изолейцин, норлейцин, валин, метионин и лейцин; (2) нейтральную гидрофильную группу: аспарагин, глутамин, цистеин, треонин и серии; (3) кислотную группу: аспарагиновая кислота и глутаминовая кислота; (4) основную группу: аргинин, гистидин и лизин; (5) группу остатков, влияющих на ориентацию цепи: глицин и пролин; и (6) ароматическую группу: тирозин, триптофан и фенилаланин.
В общей сложности шесть участков, определяющих комплементарность, (гипервариабельные домены; CDR), которые присутствуют в Н-цепи и L-цепи вариабельных участков, обычно взаимодействуют друг с другом с образованием сайта связывания антигена в антителе. Даже один из этих вариабельных участков, как известно, обладает способностью распознавать и связываться с антигеном, хотя и с более низкой аффинностью, чем у молекулы, содержащей весь сайт связывания. Таким образом, гены, кодирующие Н-цепь и L-цепь антитела, в соответствии с настоящим изобретением могут кодировать фрагменты или остатки, содержащие соответствующие сайты связывания антигена Н-цепи и L-цепи до тех пор, пока полипептиды, которые кодируются генами, будут поддерживать связывающую активность против желаемого антигена.
Активность полипептида и примеры антигена
Например, антитело или полипептид, обладающий активностью, могут быть эффективно получены путем использования способа контроля диссоциации и/или ассоциации в соответствии с настоящим изобретением. Примеры активности могут включать в себя связывающую активность, нейтрализующую активность, цитотоксическую активность, агонистическую активность, антагонистическую активность и ферментативную активность. Агонистическая активность представляет собой активность внутриклеточных сигналов трансдукции, например, посредством связывания антитела с антигеном таким, как рецептор, чтобы индуцировать изменение в определенной физиологической активности. Примеры физиологической активности могут включать в себя, но без ограничения такими, как пролиферативная активность, активность выживания, активность дифференциации, транскрипционная активность, активность мембранного транспорта, связывающая активность, протеолитическая активность, активность фосфорилирования/дефосфорилирования, окислительно-восстановительная активность, передача активности, нуклеолитическая активность, дегидратационная активность, активность, индуцирующая гибель клеток, и активность индукции апоптоза.
Кроме того, антитело или полипептид, которые узнают желательный антиген или связываются с желательным рецептором, могут быть эффективно получены с помощью способа в соответствии с настоящим изобретением.
В настоящем описании антиген не является особым образом ограниченным, и может использоваться любой антиген. Предпочтительные примеры антигена включают лиганды (цитокины, хемокины и т.д.), рецепторы, раковые антигены, МНС антигены, антигены дифференциации, иммуноглобулины и иммунные комплексы, частично содержащие иммуноглобулин.
Примеры цитокинов могут включать интерлейкины с 1 по 18, колониестимулирующие факторы (G-CSF, M-CSF, GM-CSF и т.д.), интерфероны (IFN-α, IFN-β, IFN-γ и т.д.), ростовые факторы (EGF, FGF, IGF, NGF, PDGF, TGF, HGF и т.д.), факторы некроза опухоли (TNF-α и TNF-β), лимфотоксин, эритропоэтин, лептин, SCF, ТРО, MCAF и BMP.
Примеры хемокинов могут включать СС хемокины такие, как CCL1 - CCL28, СХС хемокины такие, как CXCL1 - CXCL17, С хемокины такие, как XCL1 - XCL2 и СХЗС хемокины такие, как CX3CL1.
Примеры рецепторов могут включать рецепторы, которые принадлежат к семейству рецепторов такому, как семейство рецептора гематопоетического фактора, семейство рецептора цитокина, семейство рецептора тирозинкиназы, семейство рецептора серин/треонин/киназы, семейство рецептора TNF, семейство рецептора, слитого с G белком, семейство GPI-связанного рецептора, семейство рецептора тирозинфосфатазы, семейство фактора адгезии и семейство рецептора гормона. Рецепторы, которые принадлежат к этим семействам рецепторов, и их характеристики являются описанными во многих литературных источниках, например, Cooke ВА., King RJB., van der Molen HJ. ред. New Comprehensive Biochemistry Vol. 18B "Hormones and their Actions Part II" pp. 1-46 (1988) Elsevier Science Publishers BV., Patthy (Cell (1990) 61 (1), 13-14), Ullrich и др. (Cell (1990) 61 (2), 203-212), Massague (e carries an acute accent) (Cell (1992) 69 (6), 1067-1070), Miyajima и др. (Annu. Rev. Immunol. (1992) 10, 295-331), Taga и др. (FASEB J. (1992) 6, 3387-3396), Fantl и др. (Annu. Rev. Biochem. (1993), 62, 453-481), Smith и др. (Cell (1994) 76 (6) 959-962), и Flower DR. (Biochim. Biophys. Acta (1999) 1422 (3) 207-234).
Предпочтительные примеры специфических рецепторов, которые принадлежат к семействам рецепторов, включают рецептор человеческого или мышиного эритропоэтина (ЕРО) (Blood (1990) 76 (1), 31-35; и Cell (1989) 57 (2), 277-285), рецептор человеческого или мышиного фактора стимуляции колоний гранулоцитов (G-CSF) (Proc. Natl. Acad. Sci. USA. (1990) 87 (22), 8702-8706; mG-CSFR; и Cell (1990) 61 (2), 341-350), рецептор человеческого или мышиного тромбопоэтина (ТРО) (Proc Natl Acad Sci USA. (1992) 89 (12), 5640-5644; и EMBO J. (1993) 12 (7), 2645-53), рецептор человеческого или мышиного инсулина (Nature (1985) 313 (6005), 756-761), рецептор человеческого или мышиного Flt-3 лиганда (Proc. Natl. Acad. Sci. USA. (1994) 91 (2), 459-463), рецептор человеческого или мышиного фактора роста тромбоцитов (PDGF) (Proc. Natl. Acad. Sci. USA. (1988) 85 (10) 3435-3439), рецептор человеческого или мышиного интерферона (IFN)-α/β (Cell (1990) 60 (2), 225-234; и Cell (1994) 77 (3), 391-400), рецептор человеческого или мышиного лептина, рецептор человеческого или мышиного гормона роста (GH), рецептор человеческого или мышиного интерлейкина (IL)-10, рецептор человеческого или мышиного инсулиноподобного ростового фактора (IGF)-I, рецептор человеческого или мышиного фактора, ингибирующего лейкемию (LIF), и рецептор человеческого или мышиного цилиарного нейротрофического фактора (CNTF).
Раковые антигены представляют собой антигены, которые экспрессируются при злокачественной трансформации клеток, и также называются специфическими для опухоли антигенами. Аномальные цепи Сахаров, которые возникают на поверхности клетки, или белковые молекулы, которые образуются тогда, когда клетки превращаются в раковые, являются включенными в понятие раковых антигенов и также называются раковыми углеводными антигенами. Предпочтительные примеры раковых антигенов включают GPC3, который принадлежит к семейству GPI-закрепленного рецептора как и упомянутые выше рецепторы, но экспрессируется при некоторых видах рака, включая рак печени (Int J Cancer. (2003) 103 (4), 455-65), ЕрСАМ, который экспрессируется при множестве типов рака легких (Proc Natl Acad Sci USA. (1989) 86 (1), 27-31), CA19-9, CA15-3 и сиалил SSEA-1 (SLX).
МНС антигены преимущественно классифицируются в МНС класс I антигенов и МНС класс II антигенов. МНС класс I антигенов включает HLA-A, -В, -С, -Е, -F, -G и -Н. МНС класс II антигенов включает HLA-DR, -DQ и -DP.
Антигены дифференциации могут включать CD1, CD2, CD4, CD5, CD6, CD7, CD8, CD10, CD11a, CD11b, CD11c, CD13, CD14, CD15s, CD16, CD18, CD19, CD20, CD21, CD23, CD25, CD28, CD29, CD30, CD32, CD33, CD34, CD35, CD38, CD40, CD41a, CD41b, CD42a, CD42b, CD43, CD44, CD45, CD45RO, CD48, CD49a, CD49b, CD49c, CD49d, CD49e, CD49f, CD51, CD54, CD55, CD56, CD57, CD58, CD61, CD62E, CD62L, CD62P, CD64, CD69, CD71, CD73, CD95, CD102, CD106, CD122, CD126 и CDw130.
Иммуноглобулины включают IgA, IgM, IgD, IgG и IgE. Иммунокомплексы содержат, по крайней мере, любой компонент иммуноглобулинов.
Другие примеры антигенов могут включать следующие молекулы: 17-IA, 4-1ВВ, 4Dc, 6-keto-PGF1a, 8-iso-PGF2a, 8-oxo-dG, A1 аденозиновый рецептор, АЗЗ, АСЕ, АСЕ-2, активин, активин А, активин АВ, активин В, активин С, активин RIA, активин RIA ALK-2, активин RIB ALK-4, активин RIIA, активин RIIB, ADAM, ADAM 10, ADAM 12, ADAM 15, ADAM17/TACE, ADAM8, ADAM9, ADAMTS, ADAMTS4, ADAMTS5, аддрессин, aFGF, ALCAM, ALK, ALK-1, ALK-7, альфа-1-антитрипсин, антагонист альфа-V/бета-1, ANG, Ang, APAF-1, APE, APJ, APP, APRIL, AR, ARC, ART, артемин, анти-Id, ASPARTIC, атриальный натрийуретический пептид, av/b3 интегрин, Axl, b2M, В7-1, В7-2, В7-Н, В-фактор стимуляции лимфоцитов (BlyS), ВАСЕ, ВАСЕ-1, Bad, BAFF, BAFF-R, Bag-1, ВАК, Bax, ВСА-1, BCAM, Bcl, ВСМА, BDNF, b-ECGF, bFGF, BID, Bik, BIM, BLC, BL-CAM, BLK, BMP, BMP-2 BMP-2a, BMP-3 (остеогенин), BMP-4 BMP-2b, BMP-5, BMP-6 Vgr-1, BMP-7 (OP-1), BMP-8 (BMP-8a, OP-2), BMPR, BMPR-IA (ALK-3), BMPR-IB (ALK-6), BRK-2, RPK-1, BMPR-II (BRK-3), BMP, b-NGF, BOK, бомбезин, нейротрофический фактор, который имеет происхождение от костного мозга, BPDE, BPDE-DNA, ВТС, фактор комлемента 3 (С3), С3а, С4, С10, СА125, CAD-8, кальцитонин, сАМР, канцероэмбриональный антиген (СЕА), ассоциированный с раком антиген, катепсин А, катепсин В, катепсин C/DPPI, катепсин D, катепсин Е, катепсин Н, катепсин L, катепсин О, катепсин S, катепсин V, катепсин X/Z/P, CBL, CCI, ССК2, CCL, CCL1, CCL11, CCL12, CCL13, CCL14, CCL15, CCL16, CCL17, CCL18, CCL19, CCL2, CCL20, CCL21, CCL22, CCL23, CCL24, CCL25, CCL26, CCL27, CCL28, CCL3, CCL4, CCL5, CCL6, CCL7, CCL8, CCL9/10, CCR, CCR1, CCR10, CCR10, CCR2, CCR3, CCR4, CCR5, CCR6, CCR7, CCR8, CCR9, CD1, CD2, CD3, CD3E, CD4, CD5, CD6, CD7, CD8, CD10, CD11a, CD11b, CD11c, CD13, CD14, CD15, CD16, CD18, CD19, CD20, CD21, CD22, CD23, CD25, CD27L, CD28, CD29, CD30, CD30L, CD32, CD33 (р67 белок), CD34, CD38, CD40, CD40L, CD44, CD45, CD46, CD49a, CD52, CD54, CD55, CD56, CD61, CD64, CD66e, CD74, CD80 (В7-1), CD89, CD95, CD123, CD137, CD138, CD140a, CD146, CD147, CD 148, CD 152, CD 164, CEACAM5, CFTR, cGMP, CINC, токсин Clostridium botulinum, токсин Clostridium perfringens, CKb8-1, CLC, CMV, CMV UL, CNTF, CNTN-1, COX, C-Ret, CRG-2, CT-1, CTACK, CTGF, CTLA-4, CX3CL1, CX3CR1, CXCL, CXCL1, CXCL2, CXCL3, CXCL4, CXCL5, CXCL6, CXCL7, CXCL8, CXCL9, CXCL10, CXCL11, CXCL12, CXCL13, CXCL14, CXCL15, CXCL16, CXCR, CXCR1, CXCR2, CXCR3, CXCR4, CXCR5, CXCR6, цитокератиновый ассоциированный с опухолью антиген, DAN, DCC, DcR3, DC-SIGN, комплементзависимый стимулятор гемолиза, des(1-3)-IGF-I (IGF-1 мозга), Dhh, дигоксин, DNAM-1, ДНКаза, Dpp, DPPIV/CD26, Dtk, EC AD, EDA, EDA-A1, EDA-A2, EDAR, EGF, EGFR (ErbB-1), EMA, EMMPRIN, ENA, рецептор эндотелина, энкефалиназа, eNOS, Eot, эотаксин 1, EpCAM, эфрин B2/EphB4, EPO, ERCC, Е-селектин, ET-1, фактор Па, фактор VII, фактор VIIIc, фактор IX, белок активации фибробластов (FAP), Fas, FcR1, FEN-1, ферритин, FGF, FGF-19, FGF-2, FGF3, FGF-8, FGFR, FGFR-3, фибрин, FL, FLIP, Flt-3, Flt-4, фолликулостимулирующий гормон, фракталкин, FZD1, FZD2, FZD3, FZD4, FZD5, FZD6, FZD7, FZD8, FZD9, FZD10, G250, Gas6, GCP-2, GCSF, GD2, GD3, GDF, GDF-1, GDF-3 (Vgr-2), GDF-5 (BMP-14, CDMP-1), GDF-6 (BMP-13, CDMP-2), GDF-7 (BMP-12, CDMP-3), GDF-8 (миостатин), GDF-9, GDF-15 (MIC-1), GDNF, GDNF, GFAP, GFRa-1, GFR-альфа 1, GFR-альфа 2, GFR-альфа 3, GITR, глюкагон, Glut4, гликопротеин IIb/IIIa (GPIIb/IIIa), GM-CSF, gp130, gp72, GRO, релизинг-фактор для гормона роста, гаптен (NP-cap или NIP-cap), HB-EGF, НСС, gB гликопротеин оболочки HCMV (цитомегаловируса), gH гликопротеин оболочки HCMV, UL HCMV, гематопоэтический фактор роста (HGF), Hep В gp120, гепараназа, Her2, Her2/neu (ErbB-2), Her3 (ErbB-3), Her4 (ErbB-4), gB гликопротеин вируса простого герпеса (HSV), gD гликопротеин HSV, HGFA, ассоциированный с меланомой антиген с высоким молекулярным весом (HMW-MAA), HIV gp120, HIV IIIB gp 120 V3 петля, HLA, HLA-DR, HM1.24, HMFG РЕМ, HRG, Hrk, сердечный миозин человека, цитомегаловирус человека (HCMV), человеческий гормон роста (HGH), HVEM, 1-309, IAP, ICAM, ICAM-1, ICAM-3, ICE, ICOS, IFNg, рецептор Ig, IgA, IgE, IGF, IGF-связывающий белок, IGF-1R, IGFBP, IGF-I, IGF-II, IL, IL-1, IL-1R, IL-2, IL-2R, IL-4, IL-4R, IL-5, IL-5R, IL-6, IL-6R, IL-8, IL-9, IL-10, IL-12, IL-13, IL-15, IL-18, IL-18R, IL-23, интерферон (INF)-альфа, INF-бета, INF-гамма, ингибин, iNOS, цепь А инсулина, цепь В инсулина, инсулиноподобный фактор роста 1, интегрин альфа 2, интегрин альфа 3, интегрин альфа 4, интегрин альфа 4/бета 1, интегрин альфа 4/бета 7, интегрин альфа 5 (альфа V), интегрин альфа 5/бета 1, интегрин альфа 5/бета 3, интегрин альфа 6, интегрин бета 1, интегрин бета 2, интерферон гамма, IP-10, I-TAC, JE, калликреин 2, калликреин 5, калликреин 6, калликреин 11, калликреин 12, калликреин 14, калликреин 15, калликреин L1, калликреин L2, калликреин L3, калликреин L4, КС, KDR, фактор роста кератиноцитов (KGF), ламинин 5, LAMP, LAP, LAP (TGF-1), латентный TGF-1, латентный TGF-1 bp1, LBP, LDGF, LECT2, lefty, Ley антиген, антиген, родственный с Ley антигеном, LFA-1, LFA-3, Lfo, LIF, LIGHT, липопротеин, LIX, LKN, Lptn, L-селектин, LT-a, LT-b, LTB4, LTBP-1, легочный сурфактант, лютеинизирующий гормон, бета-рецептор лимфотоксина, Мас-1, MAdCAM, MAG, МАР2, MARC, МСАМ, МСАМ, МСК-2, МСР, M-CSF, MDC, Мег, металлопротеаза, MGDF рецептор, MGMT, МНС (HLA-DR), MIF, MIG, MIP, MIP-1-альфа, МК, ММАС1, ММР, ММР-1, ММР-10, ММР-11, ММР-12, ММР-13, ММР-14, ММР-15, ММР-2, ММР-24, ММР-3, ММР-7, ММР-8, ММР-9, MPIF, Мро, MSK, MSP, муцин (Muc1), MUC18, мюллеров ингибирующий фактор, Mug, MuSK, NAIP, NAP, NCAD, N-кадгерин, NCA 90, NCAM, NCAM, неприлизин, нейротрофин-3, -4 или -6, нейротурин, нервный ростовой фактор (NGF), NGFR, NGF-бета, nNOS, NO, NOS, Npn, NRG-3, NT, NTN, OB, OGG1, OPG, OPN, OSM, OX40L, OX40R, pi50, p95, PADPr, паратиреоидный гормон, PARC, PARP, PBR, PBSF, PCAD, Р-кадгерин, PCNA, PDGF, PDGF, PDK-1, PEC AM, РЕМ, PF4, PGE, PGF, PGI2, PGJ2, PIN, PLA2, плацентарная щелочная фосфатаза (PLAP), P1GF, PLP, PP14, проинсулин, прорелаксин, белок С, PS, PSA, PSCA, специфический для предстательной железы мембранный антиген (PSMA), PTEN, PTHrp, Ptk, PTN, R51, RANK, RANKL, RANTES, RANTES, А цепь релаксина, В цепь релаксина, ренин, респираторно-синциатиальный вирус (RSV) F, RSV Fgp, Ret, ревматоидный фактор, RLIP76, RPA2, RSK, S100, SCF/KL, SDF-1, SERINE, сывороточный альбумин, sFRP-3, Shh, SIGIRR, SK-1, SLAM, SLPI, SMAC, SMDF, SMOH, SOD, SPARC, Stat, STEAP, STEAP-II, TACE, TACI, TAG-72 (ассоциированный с опухолью гликопротеин-72), TARC, ТСА-3, рецептор Т-клеток (например, рецептор Т-клеток альфа/бета), TdT, ТЕСК, ТЕМ1, ТЕМ5, ТЕМ7, ТЕМ8, ТЕКТ,тестикулярная PLAP-подобная щелочная фосфатаза, TfR, TGF, TGF-альфа, TGF-бета, TGF-бета панспецифический, TGF-бета RI (ALK-5), TGF-бета RII, TGF-бета RIIb, TGF-бета RIII, TGF-бета 1, TGF-бета 2, TGF-бета 3, TGF-бета 4, TGF-бета 5, тромбин, тимусный Ck-1, тиреотропный гормон, Tie, TIMP, TIQ, тканевой фактор, TMEFF2, Tmpo, TMPRSS2, TNF, TNF-альфа, TNF-альфа/бета, TNF-бета 2, TNFc, TNF-RI, TNF-RII, TNFRSF10A (TRAIL R1 Apo-2, DR4), TNFRSF10B (TRAIL R2 DR5, KILLER, TRICK-2A, TRICK-B), TNFRSF10C (TRAIL R3 DcR1, LIT, TRID), TNFRSF10D (TRAIL R4 DcR2, TRUNDD), TNFRSF11A (RANK ODF R, TRANCE R), TNFRSF11B (OPG OCIF, TR1), TNFRSF 12 (TWEAK R FN 14), TNFRSF13B (TACI), TNFRSF13C (BAFF R), TNFRSF14 (HVEM ATAR, HveA, LIGHT R, TR2), TNFRSF16 (NGFR p75NTR), TNFRSF17 (BCMA), TNFRSF18 (GITR AITR), TNFRSF19 (TROY TAJ, TRADE), TNFRSF19L (RELT), TNFRSF1A (TNF RI CD120a, p55-60), TNFRSF1B (TNF RII CD120b, p75-80), TNFRSF26 (TNFRH3), TNFRSF3 (LTbR TNF RIII, TNFC R), TNFRSF4 (OX40 ACT35, TXGP1 R), TNFRSF5 (CD40 p50), TNFRSF6 (Fas Apo-1, APT1, CD95), TNFRSF6B (DcR3 M68, TR6), TNFRSF7 (CD27), TNFRSF8 (CD30), TNFRSF9 (4-1BB CD137, ILA), TNFRSF21 (DR6), TNFRSF22 (DcTRAIL R2 TNFRH2), TNFRST23 (DcTRAIL R1 TNFRH1), TNFRSF25 (DR3 Apo-3, LARD, TR-3, TRAMP, WSL-1), TNFSF10 (TRAIL Аро-2 лиганд, TL2), TNFSF11 (TRANCE/RANK лиганд ODF, OPG лиганд), TNFSF12 (TWEAK Apo-3 лиганд, DR3 лиганд), TNFSF13 (APRIL TALL2), TNFSF13B (BAFF BLYS, TALL1, THANK, TNFSF20), TNFSF14 (LIGHT HVEM лиганд, LTg), TNFSF15 (TL1A/VEGI), TNFSF18 (GITR лиганд, AITR лиганд, TL6), TNFSF1A (TNF-a конектин, DIF, TNFSF2), TNFSF1B (TNF-b LTa, TNFSF1), TNFSF3 (LTb TNFC, p33), TNFSF4 (OX40 лиганд gp34, TXGP1), TNFSF5 (CD40 лиганд CD154, gp39, HIGM1, IMD3, TRAP), TNFSF6 (Fas лиганд, Apo-1 лиганд, APT1 лиганд), TNFSF7 (CD27 лиганд CD70), TNFSF8 (CD30 лиганд CD 153), TNFSF9 (4-IBB лиганд, CD137 лиганд), TP-1, t-PA, Тро, TRAIL, TRAIL R, TRAIL-R1, TRAIL-R2, TRANCE, рецептор трансферрина, TRF, Trk, TROP-2, TSG, TSLP, ассоциированный с опухолью антиген СА125, ассоциированный с опухолью антиген, демонстрирующий родственный с антигеном Ley углевод, TWEAK, ТХВ2, Ung, uPAR, uPAR-1, урокиназа, VCAM, VCAM-1, VECAD, VE-кадгерин, УЕ-кадгерин-2, VEFGR-1 (flt-1), VEGF, VEGFR, VEGFR-3 (flt-4), VEGI, VIM, вирусный антиген, VLA, VLA-1, VLA-4, VNR интегрин, фактор фон Виллебранда, WIF-1, WNT1, WNT2, WNT2B/13, WNT3, WNT3A, WNT4, WNT5A, WNT5B, WNT6, WNT7A, WNT7B, WNT8A, WNT8B, WNT9A, WNT9A, WNT9B, WNT10A, WNTIOB, WNT11, WNT16, XCL1, XCL2, XCR1, XCR1, XEDAR, XIAP, XPD, HMGB1, IgA, Aβ, CD81, CD97, CD98, DDR1, DKK1, EREG, Hsp90, IL-17/IL-17R, IL-20/IL-20R, окисленный LDL, PCSK9, прекалликреин, RON, TMEM16F, SOD1, хромогранин А, хромогранин В, тау, VAP1, кининоген с высоким молекулярным весом, IL-31, IL-31R, Nav1.1, Nav1.2, Nav1.3, Nav1.4, Nav1.5, Nav1.6, Nav1.7, Nav1.8, Nav1.9, EPCR, C1, C1q, C1r, C1s, C2, C2a, C2b, С3, С3а, C3b, C4, C4a, C4b, C5, C5a, C5b, C6, C7, C8, C9, фактор В, фактор D, фактор H, пропердин, склеростин, фибриноген, фибрин, протромбин, тромбин, тканевой фактор, фактор V, фактор Va, фактор VII, фактор VIIa, фактор VIII, фактор VIIIa, фактор IX, фактор IXa, фактор X, фактор Ха, фактор XI, фактор XIa, фактор XII, фактор XIIa, фактор XIII, фактор XIIIa, TFPI, антитромбин III, ЕПЦР, тромбомодулин, TAPI, tPA, плазминоген, плазмин, PAI-1, PAI-2, GPC3, синдекан-1, синдекан-2, синдекан-3, синдекан-4, LPA, S1P и рецепторы гормонов и факторов роста.
В неограничивающем воплощении в соответствии с настоящим изобретением одна специфичность биспецифического антитела может быть нацелена на раковый антиген, а другая специфичность может быть нацелена на антиген, который экспрессируется на CTL (цитотоксический Т-лимфоцит), например, CD3 или TNFRSF (суперсемейство рецептора фактора некроза опухоли), несмотря на то, что эти специфичности не являются ограниченными такой комбинацией. Примеры TNFRSF включают TNFRSF9 (CD 137), TNFRSF5 (CD40) и TNFRSF4 (ОХ40).
Изменение нуклеиновой кислоты
В другом аспекте получения в соответствии с настоящим изобретением настоящее изобретение обеспечивает способ получения гетеромультимера, имеющего мутацию в аминокислотных остатках, которые формируют поверхность контакта между полипептидами (например, аминокислотные остатки в положениях 356 и 439 в соответствии с нумерацией EU, положениях 357 и 370 и положениях 399 и 409), и/или аминокислотном остатке в положении 397 и/или 392 при нумерации в соответствии с EU, для того, чтобы контролировать диссоциацию и/или ассоциацию между полипептидами, способ получения, который включает этапы: (а) изменения нуклеиновых кислот, кодирующих аминокислотные остатки, которые формируют поверхность контакта между полипептидами, и т.д., по сравнению с исходными нуклеиновыми кислотами, для того, чтобы контролировать диссоциацию и ассоциацию между полипептидами; (b) культивирования клетки-хозяина, которая содержит нуклеиновые кислоты для экспрессии полипептидов; (с) извлечения полипептидов из культур клетки-хозяина и (d) инкубации этих полипептидов при восстанавливающих условиях для получения гетеромера желаемых полипептидов.
В предпочтительном варианте воплощения способ получения в соответствии с настоящим изобретением также представляет собой способ, который включает этап изменения нуклеиновых кислот, кодирующих аминокислотные остатки, которые формируют поверхность контакта между полипептидами, по сравнению с исходными нуклеиновыми кислотами, путем применения указанного выше способа для контроля диссоциация и/или ассоциации в соответствии с настоящим изобретением, для того, чтобы ингибировать ассоциацию между полипептидами.
В способе в соответствии с настоящим изобретением фраза "изменение нуклеиновых кислот" означает изменение нуклеиновых кислот для того, чтобы соответствовать аминокислотным остаткам, которые вводятся путем "изменения" в соответствии с настоящим изобретением. В частности, фраза "изменение нуклеиновых кислот" означает изменение нуклеиновых кислот, кодирующих исходные аминокислотные остатки (аминокислотные остатки перед осуществлением изменения) на нуклеиновые кислоты, кодирующие аминокислотные остатки, которые вводятся путем изменения. Обычно эта фраза означает осуществление манипуляции над генами или мутационную обработку для осуществления инсерции, делеции или замены, по крайней мере, одного основания в исходных нуклеиновых кислотах для того, чтобы получить кодоны, кодирующие аминокислотные остатки, которые представляют интерес. В частности, кодоны, которые кодируют исходные аминокислотные остатки, заменяют кодонами, которые кодируют аминокислотные остатки, которые являются введенными путем изменения. Такое изменение нуклеиновой кислоты может быть приемлемым образом осуществлено при использовании методики, которая является хорошо известной квалифицированному специалисту в данной области техники, например, сайт-направленного мутагенеза или ПЦР мутагенеза.
Нуклеиновые кислоты в соответствии с настоящим изобретением обычно встраивают в приемлемые векторы и трансфицируют в хозяйские клетки. Векторы особым образом не являются ограниченными до тех пор, пока векторы могут стабильно удерживать встроенные нуклеиновые кислоты. Например, когда Е. coli используется в качестве хозяйского организма, векторы pBluescript (которые производятся Stratagene Corp.) или подобные им представляют предпочтительные векторы для клонирования. Могут использоваться различные коммерчески доступные векторы. В случае использования векторов для получения полипептида в соответствии с настоящим изобретением экспрессионные векторы являются особенно полезными. Экспрессионные векторы не являются особенно ограниченными до тех пор, пока эти векторы позволяют осуществлять экспрессию полипептида in vitro, в Е. coli, в культивируемых клетках или в организме индивидуумов. Экспрессионные векторы предпочтительно представляют собой, например, pBEST векторы (которые производятся Promega К.К.) для in vitro экспрессии, рЕТ векторы (которые производятся Invitrogen Corp.) для Е. coli, pME18S-FL3 векторы (номер доступа GenBank АВ009864) для культивируемых клеток и pME18S векторы (Mol Cell Biol. 8: 466-472 (1988)) для индивидуальных организмов. Инсерция ДНК в соответствии с настоящим изобретением в векторы может осуществляться с помощью традиционного способа, например, реакции лигирования при использовании рестрикционных сайтов (Current protocols in Molecular Biology под ред. Ausubel и др. (1987) Publish. John Wiley & Sons. Раздел 11.4-11.11).
Клетки-хозяева не являются особым образом ограниченными, и различные клетки-хозяева используются в соответствии с этой целью. Примеры клеток для экспрессии полипептида могут включать бактериальные клетки (например, Streptococcus, Staphylococcus, Е. coli, Streptomyces и Bacillus subtilis), клетки грибов (например, дрожжей и Aspergillus), клетки насекомых (например, Drosophila S2 и Spodoptera SF9), животные клетки (например, СНО, COS, HeLa, С127, 3Т3, ВНК, НЕК293 и клетки меланомы Боуэса), а также растительные клетки. Перенос векторов в клетки-хозяева может осуществляться с помощью способа, известного в области техники, например, способа преципитации при использовании фосфата кальция, способа электропорации (Current protocols in Molecular Biology ред. Ausubel и др., (1987) Publish. John Wiley & Sons. Section 9.1-9.9), способа на основе липофектамина (производится GIBCO-BRL/Life Technologies, Inc.) или способа микроинъекции.
Приемлемый секреторный сигнал может быть введен в полипептид, который представляет интерес, для того, чтобы секретировать полипептид, который экспрессируется в клетке-хозяине, с полость эндоплазматического ретикулума, периплазматическое пространство или внутриклеточное пространство. Сигнал может быть эндогенным по отношению к полипептиду, который представляет интерес, или может быть чужеродным сигналом.
Когда полипептид в соответствии с настоящим изобретением секретируется в среду, извлечение полипептида в способе получения осуществляют путем извлечения культуральной среды. Когда полипептид в соответствии с настоящим изобретением находится в клетках, то клетки сначала подвергают лизису, а потом извлекают полипептид.
Способ, известный в области техники, в том числе преципитация при использовании сульфата аммония или этанола, экстракция кислотой или анионо- или катионообменная хроматография, хроматография на основе фосфоцеллюлозы, гидрофобная хроматография, аффинная хроматография, хроматография на основе гидроксиапатита и хроматографии при использовании лектина, может использоваться для извлечения и очистки полипептида в соответствии с настоящим изобретением из рекомбинантных культур клеток.
В неограничивающем воплощении в соответствии с настоящим изобретением примеры способа получения включают: способ, который предусматривает раздельное культивирование клеточных линий, соответственно, тех, которые продуцируют гомоварианты первого и второго полипептидов, и очистку культуральных супернатантов, после чего осуществляют FAE (замена Fab плеча) реакцию с использованием очищенного антитела; способ, который предусматривает раздельное культивирование клеточных линий, соответственно, тех, которые продуцируют гомоварианты первого и второго полипептидов, смешивание культуральных супернатантов без очистки и осуществление FAE реакции в смешанном культуральном супернатанте, после чего осуществляют очистку; способ, который предусматривает смешивание клеточной линии, продуцирующей гомовариант первого полипептида с клеточной линией, которая продуцирует гамовариант второго полипептида, культивирование смеси, и очистку культурального супернатанта, после чего осуществляют FAE реакцию при использовании очищенного антитела; и способ, который предусматривает смешивание клеточной линии, которая продуцирует гомовариант первого полипептида, с клеточной линией, которая продуцирует гамовариант второго полипептида, культивирование смеси и осуществление FAE реакции в культуральном супернатанте, после чего осуществляют очистку.
В неограничивающем воплощении настоящее изобретение обеспечивает способ получения гетеромультимера, который включает следующие этапы а)-с):
а) смешивание клеточной линии, которая продуцирует гомовариант первого полипептида, с клеточной линией, которая продуцирует гомовариант второго полипептида;
b) инкубация гомоварианта первого полипептида и гомоварианта второго полипептида вместе так, чтобы позволить цистеинам в шарнирных участках вызвать изомеризацию дисульфидной связи в культуральном супернатанте; и
c) получение гетеромультимера, включающего первый и второй полипептиды.
В неограничивающем воплощении настоящее изобретение обеспечивает способ получения гетеромультимера, который включает следующие этапы а)-с):
a) раздельное культивирование клеточных линий, которые, соответственно, продуцируют гомоварианты первого и второго полипептидов;
b) смешивание соответствующих культуральных супернатантов клеточных линий и инкубация гомоварианта первого полипептида и гомоварианта второго полипептида вместе так, чтобы позволить цистеинам в шарнирных участках вызвать изомеризацию дисульфидной связи; и
c) получение гетеромультимера, включающего первый и второй полипептиды.
Способ для селекции желаемого гетеромультимера
Настоящее изобретение также обеспечивает способ селекции желаемого гетеромультимера. В предпочтительном воплощении способ представляет собой способ для селекции гетеромультимера, обладающего желаемыми свойствами, который включает следующие этапы:
a) обеспечение набора первых полипептидов и набора вторых полипептидов, где каждый полипептид, который входит в состав первого набора имеет целевую специфичность, отличную от такой для каждого полипептида, который входит в состав второго набора, и каждый полипептид, который входит в состав первого и второго наборов, содержит изменение аминокислоты, связанное с контролем поверхности контакта при использовании силы отталкивая зарядов, и/или изменение аминокислоты для дестабилизации стабильности участка СН3;
b) инкубация каждого полипептида, который входит в состав первого набора, вместе с каждым полипептидом, который входит в состав второго набора, при восстанавливающих условиях, обеспечивая, таким образом, получение смеси гетеромультимеров различных типов;
c) анализ полученной смеси гетеромультимеров различных типов для предварительного определения желаемых свойств; и
d) отбор гетеромультимера, который обладает желаемыми свойствами.
Фармацевтическая композиция
Настоящее изобретение также относится к композиции (лекарственному средству), которая включает гетеромультимер в соответствии с настоящим изобретением и фармацевтически приемлемый носитель.
В настоящем изобретении фармацевтическая композиция обычно относится к лекарственному средству для лечения или предотвращения заболевания или для анализа или диагностики.
Фармацевтическая композиция в соответствии с настоящим изобретением может быть рецептирована с помощью способа, который является известным квалифицированному специалисту в данной области техники. Например, фармацевтическая композиция может использоваться в форме для парентеральной инъекции асептического раствора или суспензии с водой или любого другого фармацевтически приемлемого раствора. Например, фармацевтическая композиция может быть рецептирована с гетеромультимером, смешанной в форме единичной дозы, которая является необходимой или общепринятой в фармацевтической практике, в приемлемой комбинации с фармакологически приемлемыми носителями или средами, в частности, стерилизованной водой, физиологическим раствором, растительным маслом, эмульгатором, суспендирующим агентом, поверхностно-активным веществом, стабилизатором, вкусовым агентом, наполнителем, носителем, консервантом, связующим агентом, и т.д. Количество активного агента в таких препаратах устанавливают так, чтобы получить приемлемый объем в предписанном интервале.
Асептическая композиция для инъекции может быть рецептирована в соответствии с традиционной фармацевтической практикой при использовании носителя, такого, как инъецируемая дистиллированная вода.
Примеры водных растворов для инъекции включают физиологический раствор и изотонические растворы, содержащие глюкозу и другие вспомогательные вещества (например, D-сорбитол, D-маннозу, D-маннитол и хлорид натрия). Эти растворы могут использоваться в комбинации с приемлемым солюбилизирующим агентом, например, спиртом (этанол и т.д.) или полиспиртом (пропиленгликоль, полиэтиленгликоль, и т.д.), или неионным поверхностно-активным веществом (полисорбат 80(ТМ), НСО-50, и т.д.).
Примеры масляных растворов включают кунжутное масло и соевое масло. Эти растворы могут использоваться в комбинации с бензилбензоатом и/или бензиловым спиртом в качестве солюбилизирующего агента. Эти растворы могут дополнительно смешиваться с буфером (например, фосфатно-буферным раствором и буферным раствором на основе ацетата натрия), успокоительным агентом (например, гидрохлоридом прокаина), стабилизатором (например, бензиловым спиртом и фенолом) и антиоксидантом. Растворы для инъекций, приготовленных таким образом, обычно помещают в приемлемые ампулы.
Фармацевтическая композиция в соответствии с настоящим изобретением предпочтительно вводится парентерально. Композиция может быть в виде дозированной формы, например, инъекции, агента для назального введения, агента чрезлегочного введения или агента для чрезкожного введения. Фармацевтическая композиция может вводиться системно или местно, например, путем внутривенной инъекции, внутримышечной инъекции, интраперитонеальной инъекции или подкожной инъекции.
Способ введения может быть приемлемым образом выбран в зависимости от возраста и симптомов пациента. Доза фармацевтической композиции, содержащей антитело или полинуклеотид, кодирующий антитело, может быть установлена в пределах интервала, например, от 0,0001 до 1000 мг/кг веса тела на дозу. Альтернативно, доза может составлять, например, от 0,001 до 100000 мг на пациента, несмотря на то, что настоящее изобретение не является с необходимостью ограниченным числовыми значениями. Несмотря на то, что доза и способ введения варьируют в зависимости от веса, возраста, симптомов, и т.д., пациента, квалифицированный специалист в данной области техники может приемлемым образом выбрать приемлемую дозу и способ введения, принимая во внимание все обстоятельства.
В настоящем изобретении гетеромультимер в соответствии с настоящим изобретением является полезным в качестве активного ингредиента для терапевтического или профилактического агента для лечения рака. Примеры рака включают, но не ограничены такими, как: рак легких (включая мелкоклеточный рак легких, немелкоклеточный рак легких, легочную аденокарциному и плоскоклеточный рак легких), рак толстого кишечника, рак прямой кишки, колоректальный рак, рак молочной железы, рак печени, рак желудка, рак поджелудочной железы, рак почки, рак предстательной железы, рак яичников, рак щитовидной железы, рак желчных протоков, перитонеальный рак, мезотелиома, плоскоклеточный рак, рак шейки матки, рак тела матки, рак мочевого пузыря, рак пищевода, рак шеи и* головы, рак носоглотки, опухоль слюнных желез, тимома, рак кожи, рак базальных клеток, злокачественная меланома, рак анального отверстия, рак полового члена, рак яичка, опухоль Вильмса, острый миелоидный лейкоз (включая острый миелоидный лейкоз, острый миелобластный лейкоз, острый промиелоцитарный лейкоз, острый миеломоноцитарный лейкоз и острый моноцитарный лейкоз), хронический миелоидный лейкоз, острый лимфолейкоз, хронический лимфолейкоз, лимфома Ходжкина, неходжкинская лимфома (лимфома Беркитта, хронический лимфолейкоз, грибовидный микоз, мантийноклеточная лимфома, фолликулярная лимфома, диффузно крупноклеточная лимфома, лимфома маргинальной зоны, лейкоз ворсистых клеток, плазмоцитома, периферическая Т-клеточная лимфома и Т-клеточный лейкоз/лимфома взрослых), гистиоцитоз клеток Лангерганса, множественная миелома, миелодиспластический синдром, опухоль мозга (в том числе глиома, астроглиома, глиобластома, менингиома и эпендимома), нейробластома, ретинобластома, остеосаркома, саркома Капоши, саркома Юинга, ангиосаркома и гемангиоперицитома.
В случае необходимости, полипептид или гетеромультимер в соответствии с настоящим изобретением может быть получен в виде препаратов в комбинации с другими фармацевтическими ингредиентами.
Настоящее изобретение также обеспечивает набор для применения в способе лечения или способе предотвращения в соответствии с настоящим изобретением, который включает, по крайней мере, гетеромультимер, полученный с помощью способа получения в соответствии с настоящим изобретением, или фармацевтическую композицию в соответствии с настоящим изобретением. В этом набора, например, могут также дополнительно содержаться фармацевтически приемлемый наполнитель, носитель или инструкция, которая описывает его применение. Настоящее изобретение также относится к применению полипептида в соответствии с настоящим изобретением или полипептида, полученного с помощью способа получения в соответствии с настоящим изобретением, для получения терапевтического или профилактического агента для иммунологических и воспалительных заболеваний. Настоящее изобретение дополнительно относится к полипептиду в соответствии с настоящим изобретением или полипептиду, полученному с помощью способа получения в соответствии с настоящим изобретением, для применения в способе лечения или способе предотвращения в соответствии с настоящим изобретением.
Трехбуквенные коды аминокислот, которые используются в данной заявке, и их соответствующие однобуквенные коды являются следующими:
Алании: Ala: А
Аргинин: Arg: R
Аспарагин: Asn: N
Аспарагиновая кислота: Asp: D
Цистеин: Cys: С
Глутамин: Gln: Q
Глутаминовая кислота: Glu: Е
Глицин: Gly: G
Гистидин: His: Н
Изолейцин: Ile: I
Лейцин: Leu: L
Лизин: Lys: К
Метионин: Met: М
Фенилаланин: Phe: F
Пролин: Pro: Р
Серии: Ser: S
Треонин: Thr: Т
Триптофан: Trp: W
Тирозин: Tyr: Y
Валин: Val: V
Все литературные источники области техники, приведенные в данном описании, являются введенными в качестве ссылки.
Примеры
[Пример 1] Исследование по улучшению эффективности замены плеча Fab путем введения изменения, контролирующего ассоциацию поверхности контакта с антителом.
При замене плеча Fab смешивают два типа гомомерных антитела в присутствии восстанавливающего агента, и полученные четыре пары H-L-цепей молекул антитела (называются полу-молекулами или HL молекулами, каждая из которых представляет собой молекулу, которая состоит из одной тяжелой цепи и одной легкой цепи) подвергают повторной ассоциации путем обмена с получением биспецифического антитела. Поскольку повторная ассоциация HL молекул происходит случайным образом, то биспецифическое антитело, которое представляет интерес, теоретически получают только с выходом 50% от общего количества антител, присутствующих в системе. При условии, что различные заряды вводят заранее к двум типам мономерных антител, то предполагается, что гетеродимеризация может происходить преимущественно по отношению к гомодимеризации во время реассоциации полученных молекул HL с получением биспецифического антитела с высокой эффективностью. В соответствии с этим, изменения для контроля ассоциации на границе соприкосновения между участками СН3 антитела (изменение для того, чтобы способствовать гетероассоциации двух типов Н-цепей за счет использования взаимодействия зарядов и отталкивания между их СН3 участками), как сообщалось в WO 2006/106905, было использовано для исследования, могут ли они улучшить эффективность реакции замены плеча Fab (скорость образования биспецифического антитела).
Используемые вариабельные участки Н-цепи антитела, которые представляли собой вариабельные участки Н-цепи ДТ(Н) (SEQ ID NO: 1; в данной заявке далее упоминается как MRAH) и Н54 (SEQ ID NO: 2) антитела против рецептора человеческого интерлейкина 6, раскрыты в WO 2009/125825. MRAH-G1d (SEQ ID NO: 3) и H54-G1d (SEQ ID NO: 4), которые содержат константный участок G1d Н-цепи антитела, получали из константного участка Н-цепи человеческого IgG1 антитела путем удаления С-терминальных Gly и Lys, a MRAH-дтG4d (SEQ ID NO: 5) и H54-дтG4d (SEQ ID NO: 6), которые содержат константный участок дтG4d Н-цепи антитела, полученного из константного участка Н-цепи человеческого IgG4 антитела путем удаления С-терминальных Gly и Lys, получали при использовании вариабельных участков Н-цепи. После этого P228S и K409R изменения вводили в MRAH-G1d и H54-G1d для получения MRAH-G1dsr (SEQ ID NO: 7) и H54-G1dsr (SEQ ID NO: 8), которые имеют шарнирную последовательность IgG4-типа и последовательность СН3 домена. D356K дополнительно вводили как изменение, контролирующее ассоциацию поверхности контакта, в MRAH-G1dsr для получения MRAH-G1dsrP1 (SEQ ID NO: 9). K439E также дополнительно вводили как изменение, контролирующее ассоциацию поверхности контакта, в H54-G1dsr для получения H54-G1dsrN1 (SEQ ID NO: 10). E356K дополнительно вводили как изменение, контролирующее ассоциацию поверхности контакта, в MRAH-дтG4d для получения MRAH-дтG4dP1 (SEQ ID NO: 11). K439E дополнительно вводили как изменение, контролирующее ассоциацию поверхности контакта, в H54-дтG4d для получения H54-дтG4dN1 (SEQ ID NO: 12). L-цепи антитела MRAL-k0 (SEQ ID NO: 13) и L28-k0 (SEQ ID NO: 14) использовали для вариабельных участков Н-цепи MRAH и Н54, соответственно. MRAH-G1dsr/MRAL-k0, H54-G1dsr/L28-k0, MRAH-G1dsrP1/MRAL-k0, H54-G1dsrN1/L28-k0, MRAH-дтG4d/MRAL-k0, H54-дтG4d/L28-k0, MRAH-дтG4dP1/MRAL-k0, и H54-дтG4dN1/L28-k0 экспрессировали и очищали в соответствии со способом справочного Примера 1.
После этого два типа гомовариантов, полученные таким образом, смешивали в комбинациях, приведенных ниже, и продукты реакции подвергали оценке в соответствии с способами справочного Примера 2.
(1) MRAH-дтG4d/MRAL-k0 и H54-дтG4d/L28-k0
(2) MRAH-дтG4dP1/MRAL-k0 и H54-дтG4dN1/L28-k0
(3) MRAH-G1dsr/MRAL-k0 и H54-G1dsr/L28-k0
(4) MRAH-G1dsrP1/MRAL-k0 и H54-G1dsrN1/L28-k0
Условия реакции: в PBS (Sigma-Aldrich Corp., pH 7,4), [каждое моноклональное антитело] = 0,2 мг/мл, [GSH (Sigma-Aldrich Corp.)] = 0,5 мМ, 0,05% Твин 20 (Junsei Chemical Co., Ltd.), 37°C, 24 часа.
Два типа вариабельных участков антитела MRAH/MRAL и H54/L28, которые использовали в этом исследовании, отличались в основном по pI. Таким образом, пики, которые соответствуют их соответствующим гомовариантам, и соответствующие биспецифические антитела могут быть легко разделены с помощью ионообменной хроматографии, и при этом может быть оценена эффективность реакции. Фигура 1 показывает результаты оценки продуктов реакции с помощью ионообменной хроматографии. Продукт реакции дтG4d, полученный из MRAH-дтG4d/MRAL-k0 и H54-дтG4d/L28-k0, и продукт реакции G1dsr, полученный из MRAH-G1dsr/MRAL-k0 и H54-G1dsr/L28-k0, которые не несут изменений, контролирующих ассоциацию поверхности контакта, имели показатели 50,5% и 52,7%, соответственно, для образования биспецифического антитела. В противовес этом, продукт реакции дтG4dP1/N1, полученный из MRAH-дтG4dP1/MRAL-k0 и H54-дтG4dN1/L28-k0, который несет изменения, контролирующие ассоциацию поверхности контакта, имел показатель 99,0% образования биспецифического антитела, и продукт реакции G1dsrP1/N1, полученный из MRAH-G1dsrP1/MRAL-k0 и H54-G1dsrN1/L28-k0, который несет изменения, контролирующие ассоциацию поверхности контакта, имел показатель 98,5% образования биспецифического антитела. Таким образом, было обнаружено, что биспецифические антитела образуются с чрезвычайно высокой эффективностью. Эти результаты продемонстрировали тот факт, что биспецифическое антитело может быть получено с чрезвычайно высокой эффективностью путем смешивания двух типов гомовариантов, которые несут изменения, контролирующие ассоциацию поверхности контакта, как изложено в WO 2006/106905, в присутствии восстанавливающего агента.
[Пример 2] замена плеча Fab в гомоварианте, который имеет шарнирную последовательность существующего в природе IgG1 человека
В Примере 1 Замену плеча Fab осуществляли путем введения P228S изменения в IgG1 для того, чтобы получить шарнирный участок, который имеет последовательность существующего в природе человеческого IgG4. Однако существующий в природе IgG4, который вводится в живой организм, согласно имеющимся сведениям, вызывает замену половины молекулы эндогенным IgG4. Это происходит благодаря наличию Ser в положении 228 при нумерации в соответствии с EU в шарнирном участке. Замена этой аминокислоты на Pro IgG1-типа, как было показано, улучшает стабильность и предотвращает in vivo замену (Labrijn AF и др., Nat. Biotechnol. 2009, 27, 767-771). Таким образом, принимая во внимание введение в живой организм, последовательность шарнирного участка полученного биспецифического антитела желательно представляет собой 226С-227Р-228Р-229С. В соответствии с этим данное исследование осуществляли для анализа, является ли возможным вызывать замену плеча Fab путем введения изменения, контролирующего ассоциацию поверхности контакта, даже при использовании последовательности шарнирного участка существующего в природе человеческого IgG1.
Сначала K409R и D356K вводили в MRAH-G1d для получения MRAH-G1drPl (SEQ ID NO: 15), и K409R и К439Е вводили в H54-G1d для получения H54-G1drN1 (SEQ ID NO: 16). L-цепи MRAL-k0 и L28-k0 антитела использовали для вариабельных участков MRAH и Н54 Н-цепи, соответственно. MRAH-G1drP1/MRAL-k0 и H54-G1drN1/L28-k0 экспрессировали и очищали в соответствии со способом справочного Примера 1. После этого два типа гомовариантов, полученных таким образом, смешивали при условиях реакции, приведенных ниже, и продукты реакции подвергали оценке в соответствии со способом справочного Примера 2.
Условия реакции: в TBS (Takara Bio Inc., рН 7.6), [каждое моноклональное антитело] = 0,2 мг/мл, 0,05% Твин 20 (Junsei Chemical Co., Ltd.), 37°C, 24 часа. Исследование осуществляли при трех условиях содержания восстанавливающего агента [GSH (Sigma-Aldrich Corp.)] = 0,5 мМ или 5 мМ или [2-МЕА (Sigma-Aldrich Corp.)] = 25 мМ.
Фигура 2 показывает результаты анализа продуктов реакции в соответствии со способом справочного Примера 2. Показатель образования биспецифического антитела при тех же условиях, что и в Примере 1 (GSH = 0.5 мМ), составлял 21,8%, что было значительно ниже по сравнению с эффективностью в случае, когда аминокислотный остаток в положении 228 при нумерации в соответствии с EU представлял собой Ser. В противовес этому, показатель образования биспецифического антитела при восстанавливающих условиях 2-МЕА (25 мМ) или GSH (5 мМ) составлял 99% или более. Эти результаты демонстрируют, что биспецифическое антитело может быть получено с высокой эффективностью путем введения изменения, контролирующего ассоциацию поверхности контакта при использовании приемлемых восстанавливающих условий, даже если последовательность шарнирного участка представляет собой последовательность существующего в природе человеческого IgG1.
[Пример 3] Замена плеча Fab при использовании СН3 существующего в природе человеческого IgG1
Предыдущие исследования показали, что биспецифическое антитело, которое представляет интерес, получают со значительно более высокой эффективностью путем замены плеча Fab с помощью введения K409R изменения (что обеспечивает получение СН3 IgG4-Tnna) в человеческий IgG1 и изменения, контролирующего ассоциацию поверхности контакта (D356K и К439Е).
В то же время является известным, что если остаток аминокислоты в положении 409 представляет собой Arg, то стабильность антитела снижается при кислотных условиях (WO/2009/041613). Получение лекарственных средств на основе антител неизбежно требует этапа инактивации вирусов путем воздействия на антитело кислотных условий. В этой связи стабильность антитела при кислотных условиях является желательным образом высокой для поддержания качества антитела. В соответствии с этим является желательным, чтобы аминокислотный остаток в положении 409 не являлся Arg. С одной стороны, изменение K409R использовали в качестве изменения, которое, как сообщалось, является способным вызывать реакцию замены плеча Fab. В этом случае аминокислотный остаток в положении 409 представляет собой Arg, что, вероятно, приводит к проблеме стабильности при кислотных условиях. В соответствии с этим данное исследование осуществляли для анализа, является ли возможным или нет индуцировать замену плеча Fab путем введения только изменения, контролирующего ассоциацию поверхности контакта, как изложено в WO 2006/106905, в существующее в природе полностью IgG1 антитело человека без введения K409R изменения.
Исследованные комбинации изменений, контролирующих ассоциацию поверхности контакта, являются представленными в Таблице 1.
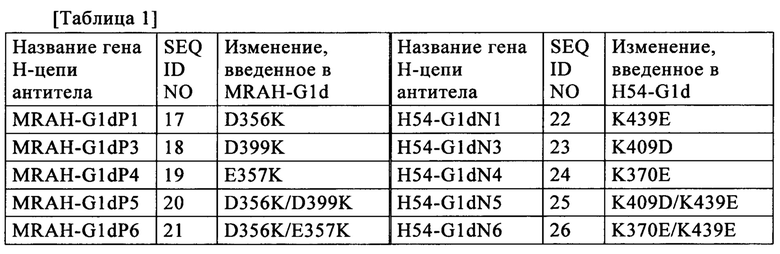
L-цепи MRAL-k0 и L28-k0 антитела использовали для вариабельных участков MRAH и Н54 Н-цепи, соответственно. MRAH-G1dP1/MRAL-k0, Н54-G1dN1/L28-k0, MRAH-G1dP3/MRAL-k0, H54-G1dN3/L28-k0, MRAH-G1dP4/MRAL-k0, H54-G1dN4/L28-k0, MRAH-G1dP5/MRAL-k0, H54-G1dN5/L28-k0, MRAH-G1dP6/MRAL-k0 и H54-G1dN6/L28-k0 экспрессировали и очищали в соответствии со способом справочного Примера 1.
После этого два типа гомовариантов, полученные таким образом, смешивали в комбинациях, приведенных ниже, и продукты реакции подвергали оценке в соответствии с способом справочного Примера 2.
(1) MRAH-G1dP1/MRAL-k0 и H54-G1dN1/L28-k0
(2) MRAH-G1dP3/MRAL-k0 и H54-G1dN3/L28-k0
(3) MRAH-G1dP4/MRAL-k0 и H54-G1dN4/L28-k0
(4) MRAH-G1dP5/MRAL-k0 и H54-G1dN5/L28-k0
(5) MRAH-G1dP6/MRAL-k0 и H54-G1dN6/L28-k0
Условия реакции: в TBS (Takara Bio Inc., pH 7,6), [каждое моноклональное антитело] = 0,2 мг/мл, 0,05% Твин 20 (Junsei Chemical Co., Ltd.), [GSH (Sigma-Aldrich Corp.)] = 5 мМ, 37°C, 24 часа.
Полученные результаты являются представленными в Таблице 2.
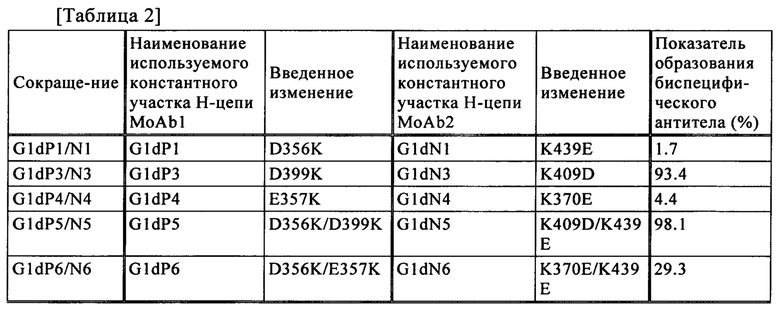
В этой таблице "Сокращение" обозначает аббревиатуру комбинации гомовариантов, используемых в реакции. Например, сокращение G1dP1/N1 означает, что MRAH-G1dP1/MRAL-k0 и H54-G1dN1/L28-k0 подвергают реакции. "Наименование используемого константного участка Н-цепи MoAb1 " обозначает наименование константного участка антитела, которое имеет вариабельный участок MRAH. "Наименование используемого константного участка Н-цепи MoAb2" обозначает наименование константного участка антитела, которое имеет вариабельный участок Н54. "Введенное изменение" обозначает изменение, введенное с помощью MRAH-G1d или H54-G1d.
G1dP1/N1 с изменением D356K, введенным в один гомовариант, и К439Е, введенным в другой гомовариант, имеет показатель образования биспецифического антитела 1,7%. На Фигуре 2 G1drP1/N1, который имеет изменение K409R и изменение, контролирующее ассоциацию поверхности контакта (D356K и К439Е), имеет показатель образования биспецифического антитела 99,3% при тех же условиях реакции (5 мМ GSH), что свидетельствует о том, что эффективность реакции значительно снижается в случае G1dP1/N1 вместо содержащегося Lys в качестве аминокислотного остатка в положении 409 при нумерации в соответствии с EU. В противовес этому, G1dP3/N3 с изменением D399K, контролирующим ассоциацию поверхности контакта, введенным в один гомовариант, и K409D, введенный в другой гомовариант, а также G1dP5/N5 с D356K/D399K, введенным в один гомовариант, и K409D/K439E, введенным в другой гомовариант, демонстрировали очень высокий показатель образования биспецифического антитела - на уровне 93,4% и 98,1%, соответственно. Эти результаты продемонстрировали, что замена плеча Fab может быть индуцирована с высокой эффективностью путем введения только изменения, контролирующего ассоциацию поверхности контакта, без использования K409R изменения, которое обеспечивает СН3 домен IgG4-типа.
После этого эффективность реакции сравнивали при 3 типах восстанавливающих условий в отношении G1dP3/N3 и G1dP5/N5, которые имеют высокую реакционную эффективность. При этом сравнении G1drP1/N1, используемый в Примере 2, и измененная форма, которая имеет комбинацию K409R, введенную в одно антитело, и F405L, введенная в другой гомовариант, как сообщалось Labrijn и др., в качестве изменений для эффективного получения биспецифического антитела путем замены плеча Fab, также подвергали исследованию в качестве контролей (Labrijn AF и др., Proc. Natl., Acad. Sci., 2013. 110. 5145-5150).
K409R вводили в MRAH-G1d для получения MRAH-G1dr (SEQ ID NO: 27), и F405L вводили в H54-G1d для получения H54-G1dl (SEQ ID NO: 28). L-цепи MRAL-k0 и L28-k0 антитела использовали для вариабельных участков MRAH и Н54 Н-цепи, соответственно. MRAH-G1drP1/MRAL-k0, H54-G1drN1/L28-k0, MRAH-G1dP3/MRAL-k0, H54-G1dN3/L28-k0, MRAH-G1dP5/MRAL-k0, H54-G1dN5/L28-k0, MRAH-G1dr/MRAL-k0 и H54-G1dl/L28-k0 экспрессировали и очищали в соответствии с способом справочного Примера 1.
После этого два типа гомовариантов, полученные таким образом, смешивали в комбинациях, приведенных ниже, и продукты реакции подвергали оценке в соответствии со способом справочного Примера 2.
(1) MRAH-G1drP1/MRAL-k0 и H54-G1drN1/L28-k0
(2) MRAH-G1dP3/MRAL-k0 и H54-G1dN3/L28-k0
(3) MRAH-G1dP5/MRAL-k0 и H54-G1dN5/L28-k0
(4) MRAH-G1dr/MRAL-k0 и H54-G1d1/L28-k0
Условия реакции: в TBS (Takara Bio Inc., pH 7,6), [каждое моноклональное антитело] = 0,2 мг/мл, 0,05% Твин 20 (Junsei Chemical Co., Ltd.), 37°C, 24 часа. Исследование осуществляли при трех условиях, касающихся восстанавливающего агента [GSH (Sigma-Aldrich Corp.)] = 0,5 мМ или 5 мМ или [2-МЕА (Sigma-Aldrich Corp.)] = 25 мМ.
Полученные результаты являются представленными в Таблице 3.

В этой таблице "Сокращение" обозначает аббревиатуру комбинации гомовариантов, используемых в реакции. Например, сокращение G1dP1/N1 означает, что MRAH-G1dP1/MRAL-k0 и H54-G1dN1/L28-k0 подвергают реакции. "Наименование используемого константного участка Н-цепи MoAb1" обозначает наименование константного участка антитела, которое имеет вариабельный участок MRAH". «Наименование используемого константного участка Н-цепи MoAb2" обозначает наименование константного участка антитела, которое имеет вариабельный участок Н54. "Введенное изменение" обозначает изменение, введенное с помощью MRAH-G1d или H54-G1d.
G1dr/1, несущий существующее изменение для повышения эффективности замены плеча Fab, как сообщается Labrijn и др., имел показатель образования биспецифического антитела 87,3% при восстанавливающих условиях 5 мМ GSH. При этих условиях G1dP3/N3 с D399K, введенным в один гомовариант, и K409D, введенным в другой гомовариант, имел показатель образования биспецифического антитела 85,2%, a G1dP5/N5 с D356K/D399K, введенным в один гомовариант, и K409D/K439E, введенным в другой гомовариант, имел показатель образования биспецифического антитела 99,1%. Кроме того, G1drP1/N1, имеющий D356K в одном гомоварианте и К439Е в другом гомоварианте в дополнение к K409R изменению IgG4-типа имел показатель образования биспецифического антитела 99,3%.
G1dr/1, несущий существующее изменение для повышения эффективности замены плеча Fab, как сообщается Labrijn и др., имел показатель образования биспецифического антитела 95,6% при восстанавливающих условиях 25 мМ 2МЕА. При этих условиях G1dP3/N3 с D399K, введенным в один гомовариант, и K409D, введенным в другой гомовариант, имел показатель образования биспецифического антитела 92,8%, и G1dP5/N5 с D356K/D399K, введенным в один гомовариант, и K409D/K439E, введенным в другой гомовариант, имел показатель образования биспечифического антитела 100%. Кроме того, G1drP1/N1, имеющий D356K в одном гомоварианте и К439Е в другом гомоварианте в дополнение к K409R изменению IgG4-типа, имел показатель образования биспецифических антител 99,7%.
G1dr/1, несущий существующее изменение для повышения эффективности замены плеча Fab, имел показатель образования биспецифического антитела 9,5% при восстанавливающих условиях 0,5 мМ GSH. При этих условиях G1dP3/N3 с D399K, введенным в один гомовариант, и K409D, введенным в другой гомовариант, имел показатель образования биспецифического антитела 4,8%, G1dP5/N5 с D356K/D399K, введенным в один гомовариант, и K409D/K439E, введенным в другой гомовариант, имел показатель образования биспецифического антитела 75,4%. Кроме того, G1drP1/N1, имеющий D356K в одном гомоварианте и К439Е в другом гомоварианте в дополнение к K409R изменению IgG4-типа, имел показатель образования биспецифических антител 21,8%. Такие восстанавливающие условия значительно снижали показатель образования биспецифического антитела во всех трех образцах по сравнению с другими восстанавливающими условиями.
Эти результаты демонстрируют, что G1dP5/N5 с D356K/D399K, введенным в один вариант, и K409D/K439E, введенным в другой вариант, демонстрируют более высокий показатель образования биспецифического антитела при всех условиях реакции по сравнению с существующим изменением для улучшения эффективности замены плеча Fab, как изложено Labrijn и др. Высокий показатель образования биспецифического антитела является очень важным для фактического получения биспецифических антител в качестве лекарственных средств. Таким образом, это изменение считается весьма полезным по сравнению с существующим изменением.
[Пример 4] Разработка высокоэффективной замены плеча Fab при использовании изменения для дестабилизации СН3 домена
Предыдущие примеры показали, что при условии введения различных зарядов в два типа гомовариантов путем изменения, контролирующего ассоциацию поверхности контакта, половина молекулы, которая образована из одного гомоварианта, в присутствии восстанавливающего агента предпочтительно ассоциируется с половиной молекулы, которая имеет происхождение от другого гомоварианта, с образованием биспецифического антитела с высокой эффективностью. Тем не менее, в процессе формирования биспецифического антитела путем замены Fab плеча диссоциация СН3 доменов, которые образуют полумолекулы (HL молекулы) после расщепления двух типов гомовариантов с восстанавливающим агентом, по имеющимся данным, становится этапом, который определяет показатель образования (Rispens Т и др., J. Am. Chem. Soc, 2011. 133. 10302-10311). Вкратце, если диссоциация СН3 доменов может быть улучшена путем умеренной дестабилизации СН3 доменов каждого гомоварианта, замена плеча Fab может предполагаться как такая, которая индуцируется более эффективно. В соответствии с этим, взаимосвязь между показателем образования биспецифического антитела и стабильностью СН3 доменов каждого гомоварианта сначала подвергали оценке в присутствии 5 мМ GSH, как показано в Таблицах 2 и 3. Стабильность СН3 доменов определяли с помощью Tm (промежуточная температура термической денатурации), которую измеряли в соответствии со способом справочного Примера 3 в качестве показателя.
Фигура 3 показывает взаимосвязь между показателем образования биспецифического антитела и более высокого значения Tm для СН3 в двух типах используемых гомовариантов. G1dP1/N1 или G1dP4/N4, которые имеют низкий показатель образования биспецифического антитела, имели значение Tm СН3 на уровне 76°С или выше, в то время как G1dP5/N5, G1dP3/N3 и G1drP1/N1, которые имели высокую эффективность реакции, имели Tm СН3 гомоварианта на уровне 65,1°С, 69,6°С и 69,5°С, соответственно. Эти результаты выявили тот факт, что показатель образования биспецифического антитела явным образом коррелирует со стабильностью СН3 каждого гомоварианта при обмене плеча Fab. Для достижения высокой эффективности реакции было также показано предпочтительным дестабилизировать стабильность СН3 участков гомоварианта, имеющего более стабильный СН3 между двумя типами используемых гомовариантов, так чтобы значение Tm этого СН3 опускалось ниже 70°С, и т.д. В этом контексте значение Tm СН3 участков (которые имеют последовательность существующего в природе человеческого IgG1) MRAH-G1d/MRAL-k0, измеренное при тех же условиях, которые указаны выше, составляло 83,6°С, демонстрируя, что для достижения высокой эффективности реакции в замене плеча Fab, является необходимым дестабилизировать стабильность СН3 участков так, чтобы снизить значение Tm СН3 участков, например, на 13°С или более по сравнению с таковым для существующего в природе человеческого IgG1.
Таким образом, это исследование осуществляли для анализа, будет ли или нет улучшаться показатель образования биспецифического антитела путем снижения значения Tm СН3 доменов используемых гомовариантов. Изменение IgG2-типа V397M использовали в качестве изменения для снижения стабильности СН3. IgG2 содержит Met в качестве аминокислотного остатка в положении 397 при нумерации в соответствии с EU. Введение изменения для замещения этой аминокислоты на Val IgG1-типа, как сообщалось, улучшает стабильность (Ть) СН3 участков (WO 2009/041613). Предполагалась, что введение изменения V397M в СН3 домены IgG1-типа могло бы дестабилизировать СН3 домены и способствовать их диссоциации.
Таким образом, V397M изменение вводили в оба гомоварианта G1dP1/N1, G1dP4/N4 или G1dP6/N6, которые имеют низкий показатель образования биспецифического антитела в Таблице 2, и изучали полученные G1dP8/N8, G1dP9/N9 и G1dP10/N10. В частности, V397M вводили в MRAH-G1dP1, MRAH-G1dP4, MRAH-G1dP6, H54-G1dN1, H54-G1dN4 и H54-G1dN6 для получения MRAH-G1dP8 (SEQ ID NO: 29), MRAH-G1dP9 (SEQ ID NO: 30), MRAH-G1dP 10 (SEQ ID NO: 31), H54-G1dN8 (SEQ ID NO: 32), H54-G1dN9 (SEQ ID NO: 33) и H54-G1dN10 (SEQ ID NO: 34). L-цепи антитела MRAL-k0 и L28-k0 использовали для вариабельных участков Н-цепи MRAH и Н54. MRAH-G1dP8/MRAL-k0, Н54-G1dN8/L28-k0, MRAH-G1dP9/MRAL-k0, H54-G1dN9/L28-k0, MRAH-G1dP10/MRAL-k0 и H54-G1dN10/L28-k0, экспрессировали и очищали в соответствии со способом справочного Примера 1. Значение Tm полученного антитела измеряли в соответствии со способом справочного Примера 3.
После этого два типа гомовариантов, полученных таким образом, смешивали в комбинациях, как приведено ниже, и продукты реакции подвергали оценке в соответствии со способом справочного Примера 2.
(1) MRAH-G1dP8/MRAL-k0 и H54-G1dN8/L28-k0
(2) MRAH-G1dP9/MRAL-k0 и H54-G1dN9/L28-k0
(3) MRAH-G1dP10/MRAL-k0 и H54-G1dN10/L28-k0
(4) MRAH-G1dr/MRAL-k0 и H54-G1dl/L28-k0
Условия реакции: в TBS (Takara Bio Inc., pH 7.6), [каждое моноклональное антитело] = 0,2 мг/мл, 0,05% Твин 20 (Junsei Chemical Co., Ltd.), [GSH (Sigma-Aldrich Corp.)] = 5 мМ, 37°C, 24 часа.
Полученные результаты показаны в Таблице 4.
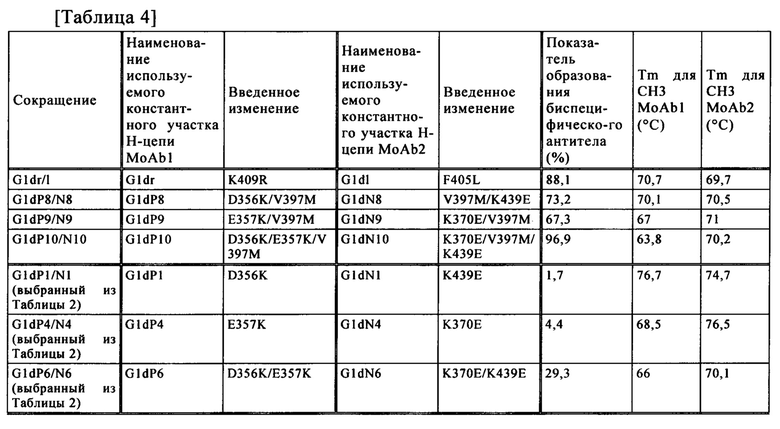
В таблице "Tm для CH3MoAb1" обозначает значение Tm для СН3 гомоварианта, который имеет вариабельный участок MRAH. "Tm для СН3 MoAb2" обозначает значение Tm для СН3 гомоварианта, который имеет вариабельный участок Н54.
В G1dP8/N8 с V397M изменением, введенным в оба гомоварианта G1dP1/N1, значение Tm СН3 снижалось на 6,6°С до 70,1°С для MoAb1 и снижалось на 4,2°С до 70,5°С для MoAb2, а показатель образования биспецифического антитела повышался от 1,7% до 73,2%. В G1dP9/N9 с V397M изменением, введенным в оба гомоварианта G1dP4/N4, значение Tm СН3 снижалось на 1,5°С до 67°С для MoAb1 и снижалось на 5,5°С до 71°С для MoAb2, а показатель образования биспецифического антитела повышался от 4,4% до 67,3%. В G1dP10/N10 с V397M изменением, введенным в оба гомоварианта G1dP6/N6, значение Tm СН3 снижалось на 2,2°С до 63,8°С для MoAb1, несмотря на отсутствие каких-либо изменений Tm для СН3 MoAb2, а показатель образования биспецифического антитела повышался от 29,3% до 96,9%. Эти результаты продемонстрировали, что эффективность образования биспецифического антитела при замене плеча Fab повышается при снижении значения Tm гомоварианта СН3 с помощью изменения V397M. В этом исследовании G1dr/l, который включал существующие изменения для улучшения эффективности замены плеча Fab, имел значение показателя образования биспецифического антитела 88,1%. Таким образом, было установлено, что G1dP10/N10 превосходил его по показателю образования биспецифического антитела.
Таким образом, это исследование проводили для анализа, будет ли или нет повышаться показатель образования биспецифического антитела путем введения изменения, которое предполагается как такое, которое вызывает больший эффект дестабилизации СН3 поблизости с эффективным положением 397 в соответствии с нумерацией EU. Фигура 4 показывает положение 397 в соответствии с нумерацией EU для СН3 домена и поблизости от него при использовании описанных данных о структуре, полученных с использованием рентгеновской кристаллографии (PDB: 3DO3) на IgG1.
Сначала D399 в А цепи рассматривалась для электростатического взаимодействия с К392 в В цепи. Таким образом, является возможным, что замена К392 на Asp или Glu дополнительно к V397M изменению может вызвать электростатическое отталкивание между этими цепями для дополнительной дестабилизации взаимодействия между цепями. Также предполагается, что замена К392 на аминокислоту, которая имеет разветвленную боковую цепочку, может дополнительно дестабилизировать ассоциацию между этими цепями с помощью стерического несоответствия с М397. Кроме того, также предполагалась возможность, что замена аминокислотного остатка в положении 397 при нумерации в соответствии с EU на более массивную аминокислоту может супрессировать ассоциацию СН3-СН3 больше, чем V397M изменение. С учетом этих точек зрения были заново получены 7 типов генов Н-цепи антитела, показанные в Таблице 5, на основе MRAH-G1dP1 и H54-G1dN1.

L-цепи MRAL-k0 и L28-k0 антитела использовали для вариабельных участков MRAH и Н54 Н-цепи, соответственно. MRAH-G1dP14/MRAL-k0, Н54-G1dN14/L28-k0, MRAH-G1dP15/MRAL-k0, H54-G1dN15/L28-k0, MRAH-G1dP16/MRAL-k0, H54-G1dN16/L28-k0, MRAH-G1dP17/MRAL-k0, H54-G1dN17/L28-k0, MRAH-G1dP18/MRAL-k0, H54-G1dN18/L28-k0, MRAH-G1dP19/MRAL-k0, H54-G1dN19/L28-k0, MRAH-G1dP20/MRAL-k0 и H54-G1dN20/L28-k0 экспрессировали и очищали в соответствии со способом справочного Примера 1. Значение Tm полученного антитела измеряли в соответствии со способом справочного Примера 3.
После этого два типа гомовариантов, полученных таким образом, смешивали в комбинациях, как приведено ниже, и продукты реакции подвергали оценке в соответствии со способом справочного Примера 2.
(1) MRAH-G1dP14/MRAL-k0 и H54-G1dN14/L28-k0
(2) MRAH-G1dP15/MRAL-k0 и H54-G1dN15/L28-k0
(3) MRAH-G1dP16/MRAL-k0 и H54-G1dN16/L28-k0
(4) MRAH-G1dP17/MRAL-k0 и H54-G1dN17/L28-k0
(5) MRAH-G1dP18/MRAL-k0 и H54-G1dN18/L28-k0
(6) MRAH-G1dP19/MRAL-k0 и H54-G1dN19/L28-k0
(7) MRAH-G1dP20/MRAL-k0 и H54-G1dN20/L28-k0
(8) MRAH-G1dr/MRAL-k0 и H54-G1d1/L28-k0
(9) MRAH-G1dP1/MRAL-k0 и H54-G1dN1/L28-k0
(10) MRAH-G1dP8/MRAL-k0 и H54-G1dN8/L28-k0
Условия реакции: в TBS (Takara Bio Inc., pH 7,6), [каждое моноклональное антитело] = 0,2 мг/мл, 0,05% Твин 20 (Junsei Chemical Co., Ltd.), [2-MEA (Sigma-Aldrich Corp.)] = 25 мМ, 37°C, 24 часа.
Полученные результаты показаны в Таблице 6.
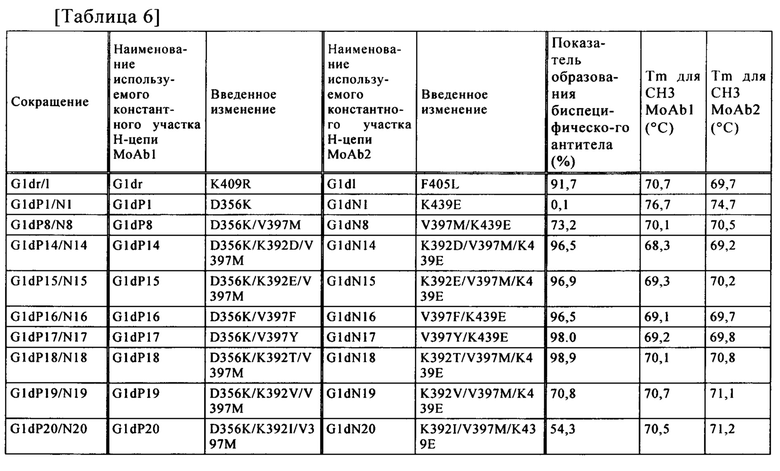
G1dP8/N8 с V397M изменением, введенным в оба гомоварианта G1dP1/N1, имел показатель образования биспецифического антитела на уровне 73,2%. В противовес этому, показатель образования биспецифического антитела был значительно повышен до 96,5% для G1dP14/N14 с K392D изменением, введенным в обе его цепи, до 96,9% для G1dP15/N15 с введенным изменением К392Е, и до 98,9% для G1dP18/N18 с введенным изменением К392Т. Кроме того, показатель образования биспецифического антитела был повышен до 96,5% для G1dP16/N16 с изменением V397F, введенным вместо V397M в G1dP1/N1, и до 98% для G1dP17/N17 с введенным изменением V397Y, по сравнению с V397M. Это, вероятно происходит потому, что, как это видно из того факта, что в то время как СН3 домены MoAb1 и MoAb2 в G1dP8/N8, содержащие V397M, имели значение Tm 70,1°С и 70,5°С, соответственно, значение Tm СН3 доменов для MoAb1 и MoAb2 составляло 69,1°С и 69,7°С для G1dP16/N16 и 69,2°С и 69,8°С для G1dP17/N17, эти изменения по сравнению с V397M изменением ослабляли взаимодействие между СН3 доменами каждого гомоварианта и способствовали их диссоциации, как это и предполагалось. В этом исследовании G1dr/1, который нес существующее изменение улучшения эффективности замены плеча Fab, имел значение показателя образования биспецифического антитела 91,7%. Таким образом, было установлено, что G1dP14/N14, G1dP15/N15, G1dP16/N16, G1dP17/N17 и G1dP18/N18 превосходили его по показателю образования биспецифического антитела.
Из соображений применимости к производству лекарственных средств G1dP16/N16 (D356K/V397F и V397F/K439E) и G1dP17/N17 (D356K/V397Y и V397Y/K439E) являются весьма полезными, благодаря своим показателям образования биспецифического антитела и меньшим количествам гетерогенных компонентов по сравнению с существующим изменением для улучшения эффективности замены плеча Fab.
Фигура 5 показывает взаимосвязь между стабильностью СН3 измененных изученных форм Таблиц 3 и 6 и показателем образования биспецифического антитела при использовании 25 мМ 2МЕА в качестве восстанавливающего агента. Как показано на Фигуре 5, стабильность СН3 каждого используемого гомоварианта очевидным образом коррелирует с эффективностью замены плеча Fab. Высокий показатель образования биспецифического антитела достигается путем дестабилизации стабильности СН3 участков гомоварианта, который имеет более стабильный СН3 между двумя типами используемых гомовариантов так, что Tm этого СН3 имеет значение, ниже 70°С, и т.д.
[Пример 5] Исследование времени реакции
Взаимоотношение между временем реакции и эффективностью реакции изучали при использовании G1dP17/N17, раскрытого в Примере 4.
Условия реакции: в TBS (Takara Bio Inc., рН 7,6), [каждое моноклональное антитело] = 1,0 мг/мл, [2-МЕА (Sigma-Aldrich Corp.)] = 25 мМ, 37°С, общее количество = 50 мкл.
Через 90 минут, 3 часа или 24 часа 450 мкл 25 мМ MES буферного раствора (рН 5,0), охлажденного до 4°С, прибавляли к реакционному раствору, который в дальнейшем хранили при 4°С до завершения реакции. После этого эффективность реакции оценивали в соответствии со способом справочного Примера 2 (Фигура 6).
Как показано на Фигуре 6, показатель образования биспецифического антитела для G1dP17/N17 составлял 94,6% за 90 минут, 95,2% за 3 часа и 97,4% за 24 часа в присутствии 25 мМ 2-МЕА. Таким образом, время реакции 90 минут предполагало показатель на уровне приблизительно 95%. Эти результаты показывают, что такая измененная форма демонстрирует достаточно более высокую эффективность реакции, чем показатель образования биспецифического антитела (Таблица 6) для G1dr/1 с K409R изменением, введенным в одну цепь, и F405L изменением, введенным в другую цепь.
[Пример 6] Оценка связывания измененной формы, демонстрирующей высокоэффективную замену плеча Fab, с человеческим FcgR и человеческим FcRn
Измененную форму G1dP17/N17, которая демонстрирует высокоэффективный FAE в Примере 4, подвергали оценке на ее связывание с человеческим FcgR и человеческим FcRn. Сначала MRAH-G1d/MRAL-k0, которое имеет последовательность существующего в природе IgG1, и измененную форму MRAH-G1dP17/MRAL-k0//H54-G1dN17/L28-k0 после замены плеча Fab подвергали анализу на их связывание с человеческим FcRn в соответствии со способом справочного Примера 5. Результаты анализа связывания с человеческим FcRn являются представленными в Таблице 7.

Результаты, представленные в Таблице 7, продемонстрировали, что измененная форма MRAH-G1dP17/MRAL-k0//H54-G1dN17/L28-k0, полученная путем замены плеча Fab, имеет активность связывания человеческого FcRn, эквивалентную таковой для существующего в природе IgG1.
После этого связывающую активность против человеческого FcgR подвергали оценке в соответствии со способом справочного Примера 4. В этом контексте MRAH-G1d/MRAL-k0, которая имеет последовательность существующего в природе IgG1, измененную форму MRAH-G1dP17/MRAL-k0//H54-G1dN17/L28-k0 после замены плеча Fab, два типа гомовариантов до реакции замены плеча Fab (MRAH-G1dP17/MRAL-k0 и H54-G1dN17/L28-k0) и два типа гомовариантов, в которых отсутствует изменение V397Y для стабилизации СН3 доменов (MRAH-G1dP1/MRAL-k0 и H54-G1dN1/L28-k0) оценивали вместе. В Таблице 8 KD для hFcgRIa, KD для hFcgRIIaR, KD для hFcgRIIaH, KD для hFcgRIIb и KD для hFcgRIIIaV представляют собой значения, которые отображают относительную связывающую активность каждой измененной формы тогда, когда KD G1d для каждого FcgR определяется как 1.
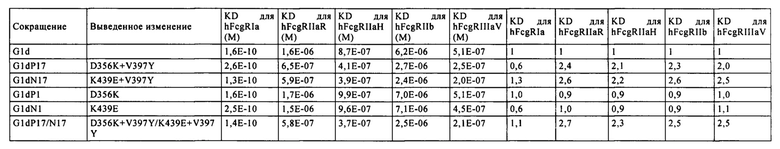
Связывание измененной формы G1dP17/N17 после замены плеча Fab, которое сравнивали с существующим в природе антителом, было усиленным в 1,1 раза для hFcgRIa, в 2,7 раза для hFcgRIIaR, в 2,3 раза для hFcgRIIaH, в 2,5 раза для hFcgRIIb и в 2,5 раза для hFcgRIIIaV. В этом контексте гомоварианты G1dP1 и G1dN1 перед введением V397Y, дестабилизирующего СН3 домен, связывались с каждым FcgR с активностью, эквивалентной таковой существующего в природе антитела. Кроме того, гомоварианты, которые были из них получены путем введения V397Y (G1dP17 и G1dN17), продемонстрировали улучшенное связывание с каждым из FcgR. Таким образом, V397Y изменение было определено как такое, которое улучшает связывание с каждым из hFcgR.
Эти результаты продемонстрировали, что G1dP17/N17, который достигает высокой эффективности замены плеча Fab, не повреждает связывание с человеческим FcRn и человеческим FcgR по сравнению с существующим в природе антителом.
[Пример 7] Исследование замены плеча Fab в культуральном супернатанте
Для получения биспецифического антитела путем замены Fab плеча предполагалось, что два типа гомовариантов отдельно культивируют и подвергают очистке, после чего осуществляют замену плеча Fab. Если реакция осуществляется в культуральном супернатанте, то этап очистки гомовариантов мог быть опущен. Таким образом, этот подход является в высокой степени предпочтительным. В соответствии с этим данное исследование осуществляли для анализа, можно ли или нет осуществлять замену плеча Fab с высокой эффективностью путем смешивания двух типов гомовариантов с восстанавливающим агентом в культуральном супернатанте.
Сначала аминокислотный остаток в положении 356 в MRAH-G1d и Н54-G1d заменяли на Е, а аминокислотный остаток в положении 358 заменяли на М для получения MRAH-G1m (SEQ ID NO: 49), H54-G1m (SEQ ID NO: 50), соответственно. После этого E356K и K409R вводили в MRAH-G1m для получения MRAH-G1mrP1 (SEQ ID NO: 51). K439E и K409R вводили в H54-G1m для получения H54-G1mrN1 (SEQ ID NO: 52). L-цепи MRAL-k0 и L28-k0 антитела использовали для вариабельных участков Н-цепи MRAH и Н54, соответственно. MRAH-G1mrP1/MRAL-k0 и H54-G1mrN1/L28-k0 экспрессировали и очищали в соответствии со способом справочного Примера 1.
FreeStyle 293 клетки (Invitrogen Corp.) культивировали в FreeStyle 293 среде для экспрессии и потом центрифугировали для получения супернатанта, который потом фильтровали через фильтр 0,22 мкм и использовали в качестве Mock СМ при замене плеча Fab.
Условия реакции: в Mock СМ (рН 7,6), [каждое моноклональное антитело] = 1,0 мг/мл, [2-МЕА (Sigma-Aldrich Corp.)] = 25 мМ, 37°С, 90 минут.
После проведения реакции аффинную среду rProtein A Sepharose Fast Flow (GE Healthcare Japan Corp.) прибавляли к реакционному раствору для очистки. После этого оценивали эффективность реакции в соответствии со способом справочного Примера 2 (Фигура 7).
Как показано на Фигуре 7, биспецифическое антитело было продемонстрировано как такое, которое образуется с эффективностью реакции 98% или выше при условиях реакции 37°С в течение 90 минут в присутствии 25 мМ 2-МЕА даже в культуральном супернатанте.
[Пример 8] Разработка замены плеча Fab в мышином IgG1
Предыдущие примеры показали, что замена плеча Fab эффективно индуцируется в человеческом IgG1 или человеческом IgG4. Это исследование осуществляли для анализа, можно ли или нет подобным образом формировать биспецифическое антитело путем замены плеча Fab в мышином IgG1.
В соответствии с описанной в литературе кристаллографической структурой (Harris LJ и др., J. Mol. Biol., 1998. 275. 861-872), D в положении при 399 нумерации в соответствии с EU и К в положении 409 при нумерации в соответствии с EU предполагались как такие, которые вносят свой вклад во взаимодействие между цепями СН3 доменов (Фигура 8). В соответствии с этим, исследование проводили для анализа, можно ли или нет индуцировать замену плеча Fab путем введения зарядов для того, чтобы способствовать гетеродимеризации с этими сайтами, как и в человеческом IgG1.
Используемые вариабельные участки Н-цепи антитела представляли собой вариабельные участки Н цепи дт(Н) (SEQ ID NO: 1; в данной заявке далее упоминается как MRAH) и Н54 (SEQ ID NO: 2) антитела против рецептора человеческого интерлейкина 6, раскрытого в WO 2009/125825. MRAH-mIgG1 (SEQ ID NO: 53) и H54-mIgG1 (SEQ ID NO: 54), которое имеет мышиный IgG1 константный участок Н-цепи в качестве константного участка Н цепи антитела, получали при использовании вариабельных участков Н цепи. Кроме того, D399K вводили в качестве изменения, контролирующего ассоциацию поверхности контакта, в MRAH-mIgG1 для получения MRAH-mIgG1mP3 (SEQ ID NO: 55). D399R вводили в качестве изменения, контролирующего ассоциацию поверхности контакта, в MRAH-mIgG1 для получения MRAH-mIgG1mP4 (SEQ ID NO: 56). K409D вводили в качестве изменения, контролирующего ассоциацию поверхности контакта, в H54-mIgG1 для получения H54-mIgG1mN3 (SEQ ID NO: 57). K409E вводили в качестве изменения, контролирующего ассоциацию поверхности контакта, в H54-mIgG1 для получения H54-mIgG1mN4 (SEQ ID NO: 58). MRAL-mk1 (SEQ ID NO: 59) и L28-mk1 (SEQ ID NO: 60), который имеет последовательность мышиного константного участка к цепи получали в качестве L-цепей. MRAL-mk1 и L28-mk1 L-цепи антитела использовали для вариабельных участков Н цепи MRAH и Н54, соответственно. MRAH-mIgG1mP3/MRAL-mk1, MRAH-mIgG1mP4/MRAL-mk1, H54-mIgG1mN3/L28-mk1 и H54-mIgG1mN4/L28-mk1 экспрессировали и очищали в соответствии со способом справочного Примера 1.
После этого осуществляли замену плеча Fab при использовании следующих комбинаций:
(1) MRAH-mIgG1mP3/MRAL-mk1 и H54-mIgG1mN3/L28-mk1
(2) MRAH-mIgG1mP4/MRAL-mk1 и H54-mIgG1mN4/L28-mk1
Условия реакции: в TBS (Takara Bio Inc., рН 7,6), [каждое моноклональное антитело] = 2 мг/мл, [2-МЕА (Sigma-Aldrich Corp.)] = 25 мМ, 37°С, 19 часов.
После осуществления реакции эффективность реакции определяли с помощью CE-IEF в соответствии со способом справочного Примера 5 (Фигура 9).
В результате исследования было подтверждено, что биспецифическое антитело образуется с эффективностью на уровне 89,2% путем реакции MRAH-mIgG1mP3/MRAL-mk1 и H54-mIgG1mN3/L28-mk1 и на уровне 89,9% путем реакции MRAH-mIgG1mP4/MRAL-mk1 и H54-mIgG1mN4/L28-mk1. Эта эффективность реакции была несколько ниже, чем таковая при замене плеча Fab при использовании человеческого IgG1 или человеческого IgG4. Это, главным образом, происходит по причине того, что мышиный IgG1 имеет 3 дисульфидные связи в шарнирных участках, что приводит к более сильному связыванию между двумя тяжелыми цепями, чем таковое в шарнирных участках человеческого IgG1 или человеческого IgG4 (Harris LJ и др., J. Mol. Biol., 1998. 275. 861-872).
[Пример 9] Оценка связывающей активности биспецифического антитела, полученного путем замены плеча Fab мышиного IgG1, против мышиного FcgR и мышиного FcRn
Два типа биспецифических антител (MRAH-mIgG1mP3/MRAL-mk1//H54-mIgG1mN3/L28-mk1 и MRAH-mIgG1mP4/MRAL-mk1//H54-mIgG1mN4/L28-mk1), полученных путем замены плеча Fab мышиного IgG-типа, подвергали анализу на их связывание с мышиным FcgR и мышиным FcRn в соответствии со ссылочными Примерами 4-3. Кроме того, MRAH-mIgG1/MRAL-mk1 получали в соответствии со ссылочным Примером 1 и подвергали анализу в качестве контроля. Результаты анализа являются представленными в Таблице 9.
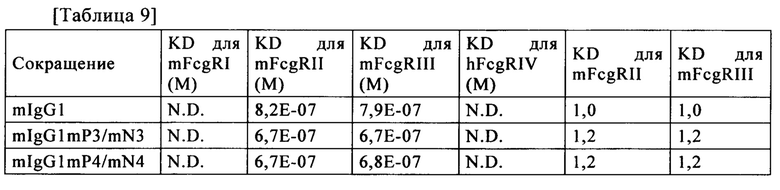
Оба из двух типов полученных биспецифических антител демонстрировали профиль связывания, подобный таковому для существующего в природе mIgG1. В частности, эти биспецифические антитела демонстрировали связывающую активность, которая была в 1,2 раза выше от таковой для существующего в природе mIgG1 против mFcgRII и mFcgRIII, при отсутствии связывания с mFcgRI и mFcgRIV.
После этого связывание с mFcRn подвергали оценке в соответствии со ссылочными Примерами 4-4. Результаты являются представленными в Таблице 10.

Оба из двух типов полученных биспецифических антител были выявлены как такие, которые поддерживают связывание mFcRn а уровне, эквивалентном таковому для существующего в природе mIg1l.
[Пример 10] Измерение цитотоксической активности
Будет ли каждое из человеческих IgG-типа биспецифических антител и мышиных IgG-типа биспецифических антител, полученных путем замены плеча Fab, поддерживать функции, эквивалентные таковым биспецифического антитела, полученного путем существующего подхода, подвергали оценке путем измерения цитотоксической активности биспецифического антитела против человеческого глипикана 3 и против человеческого CD3. Сначала биспецифические антитела против человеческого GPC3/ человеческое CD3, имеющие константные участки человеческого IgG4, получали в качестве контроля с помощью CrossMab технологии, как описано Schaefer и др. (Proc Natl Acad Sci, 2011, 108, 11187-11192). Эта молекула, полученная с помощью CrossMab технологии, представляла собой молекулу, в которой VH домен и VL домен были заменены в пределах Fab против человеческого GPC3, как описано в WO 2012/073985. Методику выступ-во-впадину использовали в константном участке Н цепи антитела для того, чтобы способствовать ассоциации. Методика выступ-во-впадину представляет собой методику, которая вовлекает замену аминокислотной боковой цепи, присутствующей в СН3 участке одной Н-цепи с большим размером боковой цепи (выступ), и замещение ее партнерской аминокислотной боковой цепью, присутствующей в СН3 участке другой Н-цепи с меньшей боковой цепью (впадина) так, что выступ входит во впадину для того, чтобы способствовать гетеродимизации Н-цепей, посредством чего может быть получено гетеродимеризированное антитело, которое представляет интерес (Nature, 1994, 372, 379-383). Изменение, описанное в WO 2011/108714, использовали в качестве изменения для аттенуирования связывания с FcgR. В частности, это изменение вводили для замены аминокислотных остатков в положениях 234, 235 и 297 в соответствии с нумерацией EU на Ala. Gly в положении 446 при нумерации в соответствии с EU и Lys в положении 447 при нумерации в соответствии с EU удаляли из С-терминального конца Н-цепей антитела. Для того чтобы способствовать очистке после экспрессии антитела, гистидиновую метку дополнительно прибавляли к С-терминальному концу Н-цепи анти-человеческого GPC3, и FLAG метку дополнительно прибавляли к С-терминальному концу Н-цепи анти-человеческого CD3. GC33(2)H-G4dKnHS (SEQ ID NO: 61) получали в качестве измененной Н-цепи анти-человеческого GPC3. Кроме того, rCE115H-G4dHlFS (SEQ ID NO: 62) получали как Н-цепь анти-человеческого CD3. L-цепь GC33(2)L-k0 (SEQ ID NO: 63) антитела и rCE115L-k0 (SEQ ID NO: 64) использовали со стороны анти-человеческого GPC3 и со стороны анти-человеческого CD3, соответственно. Полученное антитело экспрессировали путем транзиентной экспрессии в FreeStyle 293 клетках в соответствии со справочным Примером 1. Полученный культуральный супернатант прибавляли к колонке MabSelect SuRe (GE Healthcare Japan Corp.) и промывали колонку, после чего элюировали при использовании 50 мМ уксусной кислоты. Фракцию, содержащую антитело, прибавляли к колонке HisTrap HP (GE Healthcare Japan Corp.) или к колонке Ni Sepharose FF (GE Healthcare Japan Corp.), и промывали колонку, после чего элюировали при использовании имидазола. Фракцию, содержащую антитело, подвергали концентрации с помощью ультрафильтрационной мембраны. После этого концентрат прибавляли к колонке Superdex 200 (GE Healthcare Japan Corp.). Только мономерное антитело извлекали из элюата для того, чтобы получить очищенное антитело GPC3 ERY22-rCE115.
Далее каждое биспецифическое антитело, имеющее константные участки IgG1-типа человека, IgG4-типа человека или IgG1-типа мыши и вариабельные участки анти-человеческого GPC3/анти-человеческого CD3 получали путем замены Fab плеча. Для константных участков Н-цепи IgG1-типа человека и IgG4-типа человека изменение для замены аминокислотного остатка в положении 235 при нумерации в соответствии с EU на Arg и аминокислотного остатка в положении 239 при нумерации в соответствии с EU на Lys вводили в качестве изменения, снижающего связывание с FcgR, в G1dP17, G1dN17, G1drP1, G1drN1, G4dP1 и G4dN1, содержащих изменение для замены плеча Fab с целью получения F760P17, F760N17, F760G1drP1, F760G1drN1, F760G4dP1 и F760G4dN1, соответственно. Для константного участка Н-цепи IgG1-типа мыши изменение для замены аминокислотных остатков в положениях 235 и 239 в соответствии с нумерацией EU на Lys вводили в качестве изменения, снижающего связывание с FcgR, в mIgG1mP4 и mIgG1mN4, которые использовали в Примере 8, для получения mF18mP4 и mF18mN4, соответственно. Последовательность антитела к человеческому GPC3, описанную в WO 2012/073985, использовали в качестве вариабельного участка для получения H0000-F760N17 (SEQ ID NO: 65), H0000-F760G1drN1 (SEQ ID NO: 66), H0000-F760G4dN1 (SEQ ID NO: 67) и H0000-mF18mN4 (SEQ ID NO: 68). Кроме того, rCE115H-F760P17 (SEQ ID NO: 69), rCE115H-F760G1drP1 (SEQ ID NO: 70), rCE115H-F760G4dP1 (SEQ ID NO: 71) и rCE115H-mF18mP4 (SEQ ID NO: 72) получали в качестве Н-цепей со стороны человеческого CD3. GL4-k0 (SEQ ID NO: 79) со стороны анти-человеческого GPC3 и rCE115L-k0 (SEQ ID NO: 64) со стороны анти-человеческого CD3 широко используется в качестве L-цепей IgG1-типа и IgG4-THna человеческого антитела. GL4-mk1 (SEQ ID NO: 80) со стороны анти-человеческого GPC3 и rCE115L-mk1 (SEQ ID NO: 81) со стороны античеловеческого CD3 использовали в качестве L-цепей мышиного антитела IgG1-типа. Эти гомоварианты экспрессировали и очищали в соответствии со способом справочного Примера 1 для получения rCE115H-F760P17/rCE115L-k0, Н0000-F760N17/GL4-k0, rCE115H-F760G1drP1/rCE115L-k0, H0000-F760G1drN1/GL4-k0, rCE115H-F760G4dP1/rCE115L-k0, H0000-F760G4dN1/GL4-k0, rCE115H-mF18mP4/rCE115L-mk1 и H0000-mF18mP4/GL4-mk1.
После этого два типа гомовариантов, полученных таким образом, смешивали в комбинациях, как приведено ниже, для осуществления FAE реакции.
(1) rCE115H-F760P17/rCE115L-k0 и H0000-F760N17/GL4-k0
(2) rCE115H-F760G1drP1/rCE115L-k0 и H0000-F760G1drN1/GL4-k0
(3) rCE115H-F760G4dP1/rCE115L-k0 и H0000-F760G4dN1/GL4-k0
(4) rCE115H-mF18mP4/rCE115L-mk1 и H0000-mF18mP4/GL4-mk1
Условия реакции: в TBS (Takara Bio Inc., pH 7,6), [каждое моноклональное антитело] = 0,36 мг/мл, [2-МЕА (Sigma-Aldrich Corp.)] = 25 мМ, 37°С, 18 часов.
После осуществления реакции продукты подвергали диализу против PBS и использовали для оценки цитотоксической активности.
Оценку цитотоксической активности осуществляли с помощью способа, описанного в справочном Примере 6. Результаты представлены на Фигурах 10-1 и 10-2.
Как показано на Фигуре 10-1, все биспецифические антитела, полученные путем замены плеча Fab IgG1-типа человека и IgG4-Tnna человека, продемонстрировали цитотоксическую активность, эквивалентную такой для контрольного антитела (GPC3 ERY22-rCE115), полученного при использовании существующей методики получения биспецифического антитела. Как показано на Фигуре 10-2, биспецифическое антитело, полученное путем замены плеча Fab IgG-типа мыши, также продемонстрировало цитотоксическую активность, эквивалентную такой для контрольного антитела (GPC3 ERY22-rCE115), полученного при использовании существующей методики получения биспецифического антитела.
[Пример 11] Анализ фармакокинетики при использовании нормальных мышей
(11-1) Анализ in vivo при использовании нормальных мышей
Анализ in vivo при использовании нормальных мышей осуществляли для оценки того, будет ли антитело, полученное с помощью замены плеча Fab IgG-типа человека и IgG-типа мыши демонстрировать изменение концентрации в крови на том же уровне, что и антитело, полученное при использовании существующего подхода.
Три типа биспецифических антител против человеческого глипикана 3/ человеческого CD3 TR-G1drP1/N1, TR-G1dP17/N17 и TR-G4dP1/N1 получали в качестве человеческого антитела IgG-типа путем замены плеча Fab IgG-типа человека. Кроме того, биспецифические антитела TR-G1dKiH и TR-G4dKiH, содержащие те же вариабельные участки анти-человеческий глипикан 3/анти-человеческий CD3, что и указанные выше, получали при использовании константных участков, полученных путем введения изменения выступ-во-впадину (Nature, 1994, 372, 379-383) в константный участок G1d, начиная от Ala в положении 118 при нумерации в соответствии с EU в MRAH-G1d (SEQ ID NO: 3), или в константный участок G4d (константный участок G4dnT, начиная от Ala в положении 118 при нумерации в соответствии с EU в MRAH-дтG4d (SEQ ID NO: 5) и дополнительно содержащий шарнирный участок IgG1-типа, что приводило к замене аминокислотного остатка Ser в положении 228 на Pro), и использовали в качестве контрольного антитела. В этом контексте наименования константных участков G1dKiH и G4dKiH каждый означает константный участок, который экспрессируется как цепь выступа и цепь впадины в комбинации при использовании цепи выступа, в которой такое изменение (изменение для замены аминокислотного остатка в положении 349 на Cys и аминокислотного остатка в положении 366 на Trp) вводили в константный участок G1d или G4d, и цепи впадины, в которой такое изменение (изменение для замены аминокислотного остатка в положении 356 на Cys, аминокислотного остатка в положении 366 на Ser, аминокислотного остатка в положении 368 на Ala, и аминокислотного остатка в положении 407 на Val) вводили в константный участок G1d или G4d.
С одной стороны, H237-mIgG1mP3 (SEQ ID NO: 74), H237-mIgG1mN3 (SEQ ID NO: 75), H237-mIgG1mP4 (SEQ ID NO: 76) и H237-mIgG1mN4 (SEQ ID NO: 77) получали в качестве мышиных антител IgG-типа путем введения изменения для замены плеча Fab в H237-mIgG1 (SEQ ID NO: 73), который имеет последовательность вариабельного участка Н237 Н-цепи антитела против человеческого рецептора IL-6, описанного в WO 2009/125825, и последовательность существующего в природе mIgG1 константного участка. L104-mk1 (SEQ ID NO: 78), который состоит из последовательности вариабельного участка L104 L-цепи против человеческого рецептора IL-6, и константного участка mk1 κ цепи мыши использовали в качестве L-цепи антитела. Эти гомоварианты экспрессировали в соответствии со способом справочного Примера 1 для получения H237-mIgG1mP3/L104-mk1, Н237-mIgG1mN3/L104-mk1, H237-mIgG1mP4/L104-mk1 и H237-mIgG1mN4/L104-mk1. Замену плеча Fab осуществляли при использовании полученных гомовариантов для получение SA-mIgG1mP3/mN3 (H237-mIgG1mP3/L104-mk1 и Н237-mIgG1mN3/L104-mk1 в комбинации) и SA-mIgG1mP4/mN4 (Н237-mIgG1mP4/L104-mk1 и H237-mIgG1mN4/L104-mk1 в комбинации). SA-mIgG1 экспрессировали при использовании H237-mIgG1, и L104-mk1 использовали в качестве контрольного антитела.
Замену плеча Fab проводили при условиях реакции, приведенных ниже, во всех случаях. После осуществления реакции продукты подвергали диализу против PBS и использовали в анализе in vivo.
Условия реакции: в TBS (Takara Bio Inc., рН 7,6), [каждое моноклональное антитело] = 0,225 мг/мл, [2-МЕА (Sigma-Aldrich Corp.)] = 25 мМ, 37°С, 17 часов.
Каждое биспецифическое антитело человеческого IgG-типа против человеческого глипикана 3/человеческого CD3 (TR-G1dKiH, TR-G1drP1/N1, TR-G1dP17/N17, TR-G4dKiH и TR-G4dP1/N1) или каждое мышиные антитело против человеческого рецептора IL-6 (SA-mIgG1, SA-mIgG1mP3/mN3 и SA-mIgG1mP4/mN4) вводили нормальным мышам (C57BL/6J мыши, Charles River Laboratories Japan, Inc.). Потом каждое антитело подвергали оценке его in vivo кинетики. Антитело доводили до концентрации 0,1 мг/мл и вводили при дозе 10 мл/кг в хвостовую вену. По прошествии 5 минут, 2 часов, 1 дня, 2 дней, 3 дней, 7 дней, 14 дней, 21 дня и 28 дней после введения антитела брали кровь у мышей. Собранную кровь сразу же центрифугировали при 15,000 об./мин. при 4°С в течение 15 минут для получения плазмы. Отделенную плазму хранили в холодильной камере при температуре -20°С или ниже до начала анализа.
(11-2) Измерение концентрации биспецифического антитела в плазме крови с помощью ECLIA
Концентрацию биспецифического антитела в плазме крови мышей измеряли с помощью ECLIA. Сначала растворимый человеческий глипикан 3 распределяли по ячейкам планшета MULTI-ARRAY на 96 ячеек (Meso Scale Discovery) и оставляли стоять в течение ночи при 4°С для получения планшета с иммобилизированным растворимым человеческим глипиканом 3. Получали образцы для калибровки, содержащие каждое биспецифическое антитело при концентрации 200, 100, 50, 25, 12,5, 6,25 или 3,125 нг/мл в качестве концентрации в плазме крови, и аналитические образцы мышиной плазмы, разведенные 100-кратно или более. Образцы для калибровки и образцы плазмы крови для анализа распределяли в планшеты с иммобилизированным растворимым человеческим глипиканом 3 в количестве 100 мкл/ячейка и перемешивали при комнатной температуры в течение 2 часов. После этого кроличье идиотипическое антитело против антитела к человеческому CD3 перемешивали в планшете при комнатной температуре в течение 1 часа. Потом осуществляли его реакцию с антителом к кроличьему IgG-Sulfotag (Meso Scale Discovery) при комнатной температуре в течение 1 часа. После прибавления буфера Т для считывания (Meso Scale Discovery) измеряли световое излучение при использовании устройства для формирования изображений SECTOR Imager 2400 (Meso Scale Discovery). Концентрацию антитела в мышиной плазме крови подсчитывали исходя из сигналов излучения калибровочной кривой при использовании аналитического программного обеспечения SOFTmax PRO (Molecular Devices). Результаты представлены на Фигуре 11. Параметры фармакокинетики показаны в Таблице 11. Эти результаты, представленные на Фигуре 11 и в Таблице 11, показали, что все биспецифические антитела, полученные путем замены плеча Fab IgG-типа человека, демонстрировали изменение концентрации в крови на том же уровне, что и контрольное антитело, полученное при использовании методики выступ-во-впадину в качестве существующей методики получения биспецифического антитела.
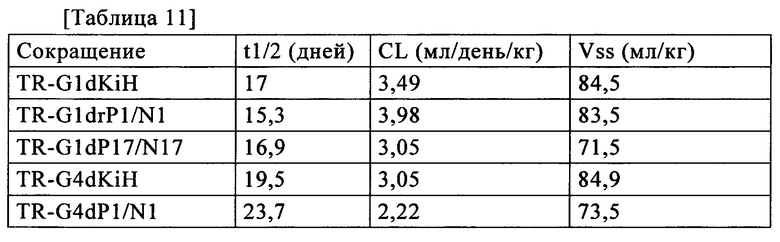
(11-3) Измерение концентрации мышиного антитела против человеческого рецептора IL-6 в плазме крови путем ELISA
Концентрацию мышиного антитела против человеческого рецептора IL-6 в плазме крови мышей измеряли с помощью ELISA. Сначала растворимый рецептор человеческого IL-6 распределяли по ячейкам планшета Nunc-Immuno, MaxiSoup (Nalge Nunc International Corp.) и оставляли стоять в течение ночи при 4°С для получения планшета с иммобилизированным растворимым рецептором человеческого IL-6. Готовили образцы для калибровки, каждый из которых содержал мышиное антитело против рецептора человеческого IL-6 при концентрации в плазме крови 2,50, 1,25, 0,625, 0,313, 0,156, 0,078 или 0,039 мкг/мл, и мышиные образцы плазмы крови для анализа, разведенные в 100 раз или более. Эти калибровочные образцы и образцы плазмы крови распределяли в количестве 100 мкл/ячейка в планшете с иммобилизированным растворимым рецептором человеческого IL-6 и перемешивали при комнатной температуры в течение 2 часов. Потом антитело против мышиного IgG-пероксидаза (Sigma-Aldrich Corp.) подвергали реакции с содержимым ячеек при комнатной температуре в течение 2 часов, и осуществляли цветную реакцию реакционного раствора при использовании ТМВ One Component HRP Microwell Substrate (BioFX Laboratories, Inc.) в качестве субстрата. Реакцию останавливали путем прибавления 1 N серной кислоты (Showa Chemical Industry Co., Ltd.). Поглощение реакционного раствора в каждой ячейке измеряли при 450 нм при использовании считывающего устройства для микропланшета. Концентрацию антитела в плазме мышей рассчитывали из поглощения в соответствии с калибровочной кривой при использовании программного обеспечения для анализа SOFTmax PRO (Molecular Devices). Результаты представлены на Фигуре 12. Параметры антитела приведены в Таблице 12. Результаты, представленные на Фигуре 12 и в Таблице 12, демонстрируют, что антитела, полученные путем замены плеча Fab IgG-типа мыши, демонстрируют изменение концентрации в крови на том же уровне, что и контрольное антитело, которое имеет последовательность существующего в природе mIgG1.
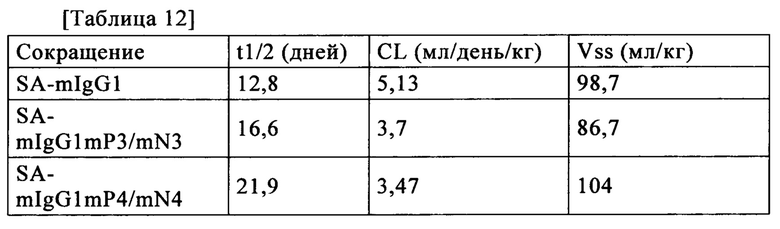
[Справочный Пример 1] Получение вектора для экспрессии антитела, экспрессия и очистка антитела
Полноразмерыне гены, имеющие нуклеотидные последовательности, кодирующие Н-цепь и L-цепь каждого антитела, были синтезированы при использовании набора для ПЦР или др. и получены с помощью способа, хорошо известного квалифицированному специалисту в данной области техники. Аминокислотную замену с помощью вводили с помощью способа, хорошо известного квалифицированному специалисту в данной области техники, при использовании ПЦР или подобных способов. Полученные плазмидные фрагменты встраивали в экспрессионные векторы для животных клеток с целью получения экспрессионных векторов Н-цепи и экспрессионных векторов L-цепи. Нуклеотидные последовательности полученных экспрессионных векторов определяли с помощью способа, хорошо известного квалифицированному специалисту в данной области техники. Полученные плазмиды транзиентно трансфицировали в линию НЕК293Н, имеющую происхождение от раковых клеток эмбриональной почки человека (Invitrogen Corp.) или FreeStyle 293 клетлк (Invitrogen Corp.), для экспрессии антитела. Полученный культуральный супернатант извлекали и после этого пропускали через фильтр 0,22 мкм MILLEX(R)-GV (Millipore Corp.) или фильтр 0,45 мкм MILLEX(R)-GV (Millipore Corp.) для получения культурального супернатанта. Антитело очищали от полученного культурального супернатанта с помощью способа, хорошо известного квалифицированному специалисту в данной области техники при использовании rProteinA Sepharose Fast Flow (GE Healthcare Japan Corp.) или Protein G Sepharose 4 Fast Flow (GE Healthcare Japan Corp.). Как и для концентрации очищенного антитела, поглощение измеряли при длине волны 280 нм при использовании спектрофотометра, и концентрацию антитела вычисляли с применением коэффициента экстинкции, который рассчитывали из полученного значения с помощью способа, такого, как РАСЕ (Protein Science 1995; 4: 2411-2423).
[Справочный Пример 2] Оценка показателя образования биспецифического антитела с помощью ионообменной хроматографии
Разделение каждого образца оценивали с помощью метода очистки на основе ионообменной хроматографии при использовании Prominence UFLC (Shimadzu Corp.). Биспецифические антитела разделяли при использовании способа градиента двух смешанных растворов с помощью 25 мМ MES буферного раствора (рН 5,0) и 25 мМ MES буферного раствора (рН 5,0), содержащего 500 мМ хлорида натрия в качестве мобильных фаз и ProPac WCX-10 (Thermo Fisher Scientific К.К.) в качестве колонки. Данные получали при длине волны 215 нм. Результаты элюирования оценивали при использовании Empower 2 (Waters Corp.).
Значение определяли путем деления значения площади биспецифического антитела на значение площади всех антител, присутствующих в системе, после чего умножали на 100 и использовали в качестве показателя образования биспецифического антитела (%). Если один из гомовариантов имел низкий показатель восстановления, то значение площади другого гомоварианта удваивали и суммировали со значением площади биспецифического антитела, и полученное значение использовали в качестве значения площади всех антител для расчета.
[Справочный Пример 3] Измерение Tm
Tm СН3 доменов измеряли с помощью способа, хорошо известного квалифицированному специалисту в данной области техники, при использовании Rotor-gene Q (Qiagen N.V.). Образец, содержащий смесь каждого антитела при концентрации 0,1 мг/мл и SYPRO оранжевый при концентрации 10 X концентрат нагревали от температуры 30°С до 99°С. Интенсивность флуоресценции (длина волны возбуждения: 470 нм, длина волны флуоресценции: 555 нм) измеряли на основе 0,4°С. Это измерение осуществляли в PBS (Sigma-Aldrich Corp., рН 7,4). Анализ проводили при использовании программного обеспечения Rotor-gene Q series. Точку перегиба, которую определяли с помощью первого вывода интенсивности флуоресценции, обозначали как Tm. Tm СН3 доменов подсчитывали при использовании значения Tm для MRAH СН2 около 70°С, Tm для MRAH Fab около 95°С, Tm для Н54 СН2 около 70°С и Tm для Н54 Fab приблизительно 90°С.
[Справочный Пример 4] Анализ взаимодействия с помощью SPR
(4-1) Способ получения FcγR и способ анализа взаимодействия между измененным антителом и FcγR
Внеклеточный домен каждого FcγR получали с помощью следующего способа: сначала ген внеклеточного домена FcγR синтезировали с помощью способа, хорошо известного квалифицированному специалисту в данной области техники. Для этого синтеза последовательность каждого FcγR получали на основе информации, зарегистрированной в NCBI. В частности, FcγRI получали на основе последовательности, которая имела номер доступа NCBI NM_000566,3; FcγRIIa получали на основе последовательности, которая имела номер доступа NCBI NM_001136219,1; FcγRIIb получали на основе последовательности, которая имела номер доступа NCBI NM_004001,3; FcγRIIIa получали на основе последовательности, которая имела номер доступа NCBI NM 001127593,1; и FcγRIIIb получали на основе последовательности, которая имела номер доступа NCBI NM_000570,3. Эти последовательности были меченными на С-концах с помощью последовательности гистидиновой метки. Полиморфизм является известным в отношении FcγRIIa, FcγRIIIa и FcγRIIIb. Полиморфные сайты получали со ссылкой на J. Exp. Med., 1990, 172: 19-25 для FcγRIIa, J. Clin. Invest., 1997, 100 (5): 1059-1070 для FcγRIIIa, и J. Clin. Invest., 1989, 84, 1688-1691 для FcγRIIIb.
Каждый полученный фрагмент гена встраивали в экспрессионные векторы для животных клеток для получения экспрессионных векторов. Полученные экспрессионные векторы транзиентно транфицировали в клетки, имеющие происхождение от раковых клеток эмбриональной почки человека FreeStyle 293 (Invitrogen Corp.) для экспрессии белка, который представляет интерес.После культивирования полученный культуральный супернатант извлекали и затем пропускали через фильтр 0,22 мкм, чтобы получить супернатант культуры. Полученный культуральный супернатант очищали, как правило, при использовании следующих 4 этапов: катионообменной хроматографии на колонке (SP Sepharose FF) в качестве этапа 1, аффинной колоночной хроматографии для His метки (HisTrap HP) в качестве этапа 2, гель-фильтрационной колоночной хроматографии (Superdex 200) в качестве этапа 3, и стерильного фильтрования в качестве этапа 4. Однако для FcγRI анионообменную хроматографию осуществляли на этапе 1 при использовании Q Sepharose FF. Оптическую плотность измеряли для каждого очищенного белка при 280 нм при использовании спектрофотометра, а концентрацию очищенного белка рассчитывали при использовании коэффициента экстинкции, рассчитанного из значения, полученного с помощью такого способа, как РАСЕ (Protein Science 1995; 4: 2411-2423).
Каждое измененное антитело подвергали анализу на его взаимодействие с каждым Fcγ рецептором, полученным при использовании Biacore Т100 (GE Healthcare Japan Corp.), Biacore T200 (GE Healthcare Japan Corp.), Biacore A100 или Biacore 4000. Электродный буфер представлял собой HBS-EP+ (GE Healthcare Japan Corp.). Температуру проведения анализа устанавливали на уровне 25°С.Используемые сенсорные микрочипы представляли собой микрочипы, полученные путем иммобилизации антигенного пептида, белка А (Thermo Fisher Scientific К.К.), белка A/G (Thermo Fisher Scientific K.K.) или белка L (ACTIGEN или BioVision) на микрочипа Series S Sensor Chip CM5 (GE Healthcare Japan Corp.) или микрочипе Series S Sensor Chip CM4 (GE Healthcare Japan Corp.) с помощью метода конденсации с амином или путем иммобилизации предварительно биотинилированного антигенного пептида на микрочипе Series S Sensor Chip SA (сертифицированный) (GE Healthcare Japan Corp.) посредством осуществления взаимодействия.
Антитело, которое представляет интерес, захватывали на эти сенсорные микрочипы и позволяли взаимодействовать с рецептором Fcγ, разведенным с помощью рабочего буфера. Количество, связывающееся с антителом, измеряли и сравнивали между антителами. Поскольку связывающееся количество рецептора Fcγ зависит от количества захваченного антитела, откорректированное значение, которое определяли путем деления связывающего количества рецептора Fcγ на количество каждого захваченного антитела, использовали для сравнения. Антитело, захваченное на сенсорный микрочип, смывали с помощью реакции 10 мМ глицин-HCl (рН 1,5), чтобы регенерировать сенсорный микрочип, который использовали повторно.
Для того, что подсчитать значение KD каждого измененного антитела для FcγR, осуществляли кинетический анализ в соответствии со следующим способом: сначала антитело, которое представляет интерес, захватывали на эти микрочипы и оставляли для взаимодействия с Fcγ рецептором, разведенным с помощью подвижного буфера. Для полученной сенсограммы результаты анализа глобально подганяли под в 1:1 модель связывания Ленгмюра при использовании программного обеспечения Biacore Evaluation для подсчета константы ka скорости ассоциации (л/моль/с) и константы kd скорости диссоциации (1/с). Из этих значений рассчитывали константу диссоциации KD (моль/л).
(4-2) Способ для получения FcRn и способ для анализа взаимодействия между измененным антителом и FcRn
FcRn представляет собой комплекс FcRn и β2-микроглобулина. Олиго ДНК праймеры получали на основе опубликованной последовательности гена человеческого FcRn (J Exp Med. 1994 Dec 1; 180 (6): 2377-81). Фрагмент ДНК, который содержал цельный ген, кодирующий FcRn, получали с помощью ПЦР при использовании полученных праймеров и человеческой кДНК (Human Placenta Marathon-Ready cDNA, Clontech Laboratories, Inc) в качестве матрицы. Фрагмент ДНК, кодирующий внеклеточный домен, который содержит сигнальный участок (Metl на Leu290), амплифицировали с помощью ПЦР при использовании полученного фрагмента ДНК в качестве матрицы и встраивали в экспрессионные векторы для клеток млекопитающих. Кроме того, олиго ДНК праймеры получали на основе опубликованной последовательности гена человеческого β2-микроглобулина (Proc. Natl. Acad. Sci. U.S.A. 99 (26): 16899-16903 (2002)). Фрагмент ДНК, который содержал цельный ген, кодирующий Р2-микроглобулин, получали с помощью ПЦР при использовании полученных праймеров и человеческой кДНК (Human Placenta Marathon-Ready cDNA, Clontech Laboratories, Inc) в качестве матрицы. Фрагмент ДНК, кодирующий цельный белок, содержащий сигнальный участок (Met1 на Met119), амплифицировали с помощью ПЦР при использовании полученного фрагмента ДНК в качестве матрицы и встраивали в экспрессионные векторы для клеток млекопитающих.
Растворимый человеческий FcRn экспрессировали с помощью следующих процедур: плазмиды, сконструированные для экспрессии человеческого FcRn (SEQ ID NO: 30) и β2-микроглобулина (SEQ ID NO: 31), трансфицировали в клетки НЕК293Н, имеющие происхождение от раковых клеток эмбриональной почки человека (Invitrogen Corp.) путем липофекции при использовании PEI (Polysciences, Inc.). Извлекали полученный культуральный супернатант и очищали при использовании IgG Sepharose 6 Fast Flow (Amersham Biosciences Corp.). После этого FcRn дополнительно очищали при использовании HiTrap Q HP (GE Healthcare Japan Corp.) (J Immunol. 2002 Nov 1; 169 (9): 5171-80).
Система, которая использует антитело, иммобилизированное на сенсорном микрочипе, описанная в J Immunol. 2009; 182 (12): 7663-71, и человеческий FcRn в качестве анализируемого вещества, была описана как система для оценки взаимодействия между антителом и FcRn при использовании Biacore. С этой целью человеческий FcRn получали так, как описано в справочном Примере 4. Эту систему использовали для оценки связывающей активности (константа диссоциации KD) Fv4-IgG1, Fv4-IgG1-v1 и Fv4-IgG1-v2 против человеческого FcRn при рН 6,0 и рН 7,4. Каждое антитело в качестве исследуемого вещества непосредственно иммобилизировали на микрочипе Series S Sensor Chip СМ5 и подвергали анализу. Иммобилизацию антитела на сенсорном микрочипе осуществляли при использовании 50 ммол/л фосфата натрия, 150 ммол/л NaCl и 0,05% (об./об.%) сурфактанта Р20 (рН 6,0) в качестве подвижного буфера и набора для конденсации амина в соответствии с инструкциями производителя для того, чтобы достичь значения 500 RU в качестве целевого количества иммобилизированного антитела.
Анализ проводили с помощью полученного сенсорного микрочипа при использовании 50 ммол/л фосфата натрия / 150 ммол/л NaCl и 0,05% сурфактанта Р20 (рН 6,0) или 50 ммол/л фосфата натрия, 150 ммол/л NaCl и 0,05% сурфактанта Р20 (рН 7,4) в качестве подвижного буфера. Анализ проводили при температуре 25°С для всех образцов. Вводили разведенный раствор человеческого FcRn или подвижный буфер (в качестве контрольного раствора) при скорости истечения 5 мкл/мин. в течение 10 минут так, чтобы позволить человеческому FcRn взаимодействовать с антителом на сенсорном микрочипе. После этого прибавляли подвижный буфер при скорости истечения 5 мкл/мин. в течение 1 минуты. После наблюдения диссоциации FcRn вводили 20 ммол/л Трис-HCl /150 ммол/л NaCl (рН 8,1) при скорости истечения 30 мкл/мин. в течение 15 секунд, и эту операцию повторяли дважды для регенерации сенсорного микрочипа.
Для того чтобы подсчитать значение KD каждого измененного антитела для FcRn, проводили кинетический анализ в соответствии со следующим способом: сначала антитело, которое представляет интерес, захватывали на эти микрочипы и оставляли для взаимодействия с FcRn, разведенным при использовании подвижного буфера. Для полученной сенсограммы результаты анализа глобально подганяли под в 1:1 модель связывания Ленгмюра при использовании программного обеспечения Biacore Evaluation для подсчета константы ка скорости ассоциации (л/моль/с) и константы kd скорости диссоциации (1/с). Из этих значений рассчитывали константу диссоциации KD (моль/л).
(4-3) Способ получения mFcγR и способ анализа взаимодействия между измененным антителом и mFcγR
Внеклеточный домен каждого из мышиных FcγR получали при использовании следующего способу: сначала ген внеклеточного домена FcγR синтезировали с помощью способа, хорошо известного квалифицированному специалисту в данной области техники. Для этого синтеза последовательность каждого FcγR получали на основе информации, зарегистрированной в NCBI. В частности, mFcγRI получали на основе последовательности NCBI со ссылочным номером последовательности: NP_034316,1; mFcγRII получали на основе последовательности NCBI со ссылочным номером последовательности: NP_034317,1; mFcγRIII получали на основе последовательности NCBI со ссылочным номером последовательности: NP_034318,2; и mFcγRIV получали на основе последовательности NCBI со ссылочным номером последовательности: NP 653142,2. Эти последовательности были меченными на С-терминальных концах с помощью последовательности гистидиновой метки.
Каждый полученный фрагмент гена встраивали в экспрессионные векторы для клеток животных для получения векторов экспрессии. Полученные векторы экспрессии были транзиентно трансфицированы в клетки, имеющие происхождение от раковых клеток эмбриональной почки человека FreeStyle 293 (Invitrogen Corp.), чтобы экспрессировать белок, который представляет интерес. Полученный культуральный супернатант извлекали и затем пропускали через фильтр 0,22 мкм, чтобы получить культуральный супернатант. Полученный культуральный супернатант очищали, как правило, при использовании следующих 4 этапов: ионообменной хроматографии на колонке в качестве стадии 1, аффинной хроматографии на колонке для гистидиновой метки (HisTrap HP) в качестве этапа 2, гель-фильтрационной колоночной хроматографии (Superdex 200) в качестве этапа 3 и стерильной фильтрации в качестве этапа 4. Ионообменную хроматографию на колонке этапа 1 проводили с использованием Q-Sepharose HP для mFcγRI, SP Sepharose FF для mFcγRII и mFcγRIV и SP Sepharose HP для mFcγRIII. D-PBS (-) использовали в качестве растворителя на стадии 3 или позднее, в то время как D-PBS (-), содержащий 0,1 М аргинина, использовали для mFcγRIII. Оптическую плотность измеряли для каждого очищенного белка при 280 нм при использовании спектрофотометра, а концентрацию очищенного белка рассчитывали с помощью коэффициента экстинкции, рассчитанного из полученного значения при использовании такого метода, как РАСЕ (Protein Science 1995; 4: 2411- 2423).
Каждое измененное антитело подвергали анализу на его взаимодействие с каждым Fcγ рецептором, полученным таким образом, при использовании Biacore Т100 (GE Healthcare Japan Corp.), Biacore T200 (GE Healthcare Japan Corp.), Biacore A100 или Biacore 4000. Используемый подвижный буфер представлял собой HBS-EP+ (GE Healthcare Japan Corp.). Температуру анализа устанавливали на уровне 25°С. Используемые сенсорные микрочипы представляли собой микрочипы, полученные путем иммобилизации антигенного пептида, белкаА (Thermo Fisher Scientific К.К.), белка A/G (Thermo Fisher Scientific К.К.) или белка L (ACTIGEN или BioVision) на сенсорном микрочипе Series S Sensor Chip СМ5 (GE Healthcare Japan Corp.) или микрочипечипе Series S Sensor Chip CM4 (GE Healthcare Japan Corp.) с помощью способа конденсации амина или путем иммобилизации предварительно биотинилированного антигенного пептида на микрочипе н Series S Sensor Chip SA (сертифицированный) (GE Healthcare Japan Corp.) путем взаимодействия.
Антитело, которое представляет интерес, захватывали на сенсорные микрочипы и оставляли для взаимодействия с mFcγR, разведенным при использовании подвижного буфера. Количество mFcγR, которое связывается с антителом, измеряли и сравнивали между антителами. Поскольку связывающее количество mFcγR зависит от количества захваченного антитела, откорректированное значение, которое определяли путем разделения связывающего количества mFcγR на количество каждого захваченного антитела, использовали для сравнения. Антитело, захваченное на каждом сенсорном микрочипе, вымывали при использовании реакции 10 мМ глицин-HCl (рН 1,5) для регенерации сенсорного микрочипа, который использовали повторно.
Для того чтобы рассчитать показатель KD каждого измененного антитела для FcγR, осуществляли кинетический анализ в соответствии со следующим способом: сначала антитело, которое представляет интерес, захватывали на эти микрочипы и оставляли для взаимодействия с mFcγR, разведенным при использовании подвижного буфера. Для получения сенсограммы результаты анализа подвергали глобальной подгонке в 1:1 модели связывания Ленгмюра при использовании программного обеспечения Biacore Evaluation для подсчета константы ka скорости ассоциации л/моль/с) и константы kd скорости диссоциации (1/s). Из этих значений рассчитывали константу диссоциации KD (моль/л).
(4-4) Способ получения mFcRn и способ анализа взаимодействия измененного антитела и mFcRn
Кинетический анализ осуществляли на мышином FcRn и каждом антителе при использовании Biacore Т100, Biacore Т200, Biacore А100 и Biacore 4000 (GE Healthcare Japan Corp.). Приемлемое количество белка L (ACTIGEN) иммобилизовали на сенсорном микрочипе СМ4 (GE Healthcare Japan Corp.) с помощью способа конденсации амина. Антитело, которое представляет интерес, захватывали на микрочипе. После этого туда же прибавляли разведенный раствор FcRn или подвижный буфер (в качестве контрольного раствора) так, чтобы мышиный FcRn мог взаимодействовать с антителом, захваченным на сенсорном микрочипе. Используемый подвижный буфер представлял собой 50 ммол/л фосфата натрия, 150 ммол/л NaCl и 0,05% (вес./об.) Твин 20 (рН 6,0), и каждый буфер также использовали для разведения FcRn. 10 ммол/л глицин-HCl (рН 1,5) использовали для регенерации микрочипа. Анализ осуществляли при 25°С для всех образцов. Из сенсограммы, полученной по результатам анализа, константу ka скорости ассоциации (1/мс) и константу kd скорости диссоциации (1/с) рассчитывали в качестве кинетических параметров. KD (М) каждого антитела для мышиного FcRn подсчитывали на основе этих параметров. Biacore Evaluation Software (GE Healthcare Japan Corp.) использовали для подсчета каждого параметра.
[Справочный Пример 5] CE-IEF
CE-IEF измерение осуществляли с помощью способа, хорошо известного квалифицированному специалисту в данной области техники, при использовании РА800 Plus (Beckman Coulter Inc.). Pharmalyte, который имеет широкий диапазон от 5 до 8, и Pharmalyte, который имеет широкий диапазон от 8 до 10,5, смешивали в равных количествах и подвергали анализу в интервале pI от 5 до 10,5. Анализ проводили при использовании раствора антитела с концентрацией 4 мг/мл, и результаты анализировали при использовании программного обеспечения 32 karat (Beckman Coulter Inc.). Показатель, который определяли путем деления значения площади биспецифического антитела на значение площади для всех антител, присутствующих в системе, и последующего умножения на 100, использовали в качестве показателя образования биспецифического антитела (%).
[Справочный Пример 6] Измерение цитотоксической активности
(6-1) Получение раствора мононуклеарных клеток периферической крови человека (РВМС) человека
50 мл периферической крови брали у каждого здорового волонтера (взрослого) при использовании шприца, предварительно наполненного 100 мкл 1000 единиц/мл раствора гепарина (Novo-Heparin 5000 единиц для инъекции, Novo Nordisk A/S). Периферическую кровь разводили в два раза с помощью PBS(-) и потом разделяли на четыре равные части, которые потом прибавляли к Leucosep пробиркам для разделения лейкоцитов (кат. номер 227290, Greiner Bio-One GmbH), с предварительно внесенными 15 мл Ficoll-Paque PLUS и предварительно центрифугировали. После центрифугирования (2150 об./мин., 10 минут, комнатная температура) пробирок для разделения отделяли слой фракции мононуклеарных клеток. Клетки фракции мононуклеарных клеток один раз промывали с помощью среды Игла, модифицированной по способу Дюльбекко, содержащей 10% FBS (Sigma-Aldrich Corp.; в данной заявке далее упоминается как 10% FBS/D-MEM). Потом концентрацию клеток доводили до 4 х 106 клеток/мл при использовании 10% FBS/D-MEM. Приготовленный таким образом раствор клеток использовали в качестве раствора РВМС человека в последующем анализе.
(6-2) Измерение цитотоксической активности
Цитотоксическую активность подвергали оценке на основе показателя ингибирования роста клеток при использовании xCELLigence анализатора клеток в режиме реального времени (Roche Diagnostics). Целевые используемые клетки представляли собой клеточную линию SK-pca13a, созданную путем стимуляции клеточной линии SK-HEP-1 для экспрессии человеческого GPC3. SK-pca13a отделяли от чашки и инокулировали в количестве 100 мкл/ячейка (1×104 клеток/ячейка) в планшет E-Plate 96 (Roche Diagnostics) для начала анализа живых клеток при использовании xCELLigence анализатора клеток в режиме реального времени. На следующий день планшет извлекали из xCELLigence анализатора клеток в режиме реального времени, и 50 мкл каждого антитела, доведенного до каждой из указанных концентраций (0,004, 0,04, 0,4 и 4 мкг/мл), прибавляли к планшету. После осуществления реакции при комнатной температуре в течение 15 минут, прибавляли 50 мкл (2×104 клеток/ячейка) раствора человеческих РВМС, приготовленного так, как указано в предыдущем разделе (6-1). Этот планшет повторно переносили в xCELLigence анализатор клеток в режиме реального времени для начала анализа живых клеток. Реакцию осуществляли при условиях 5% СО2 и 37°С. в течение 72 часов после прибавления РВМС человека. Показатель ингибирования роста клеток (%) определяли из значения клеточного индекса в соответствии с выражением, представленным ниже. Числовое значение после нормализации по отношению к значению клеточного индекса непосредственно перед добавлением антитела, определенное как 1, использовали в качестве значения клеточного индекса в этом вычислении.
Показатель ингибирования роста клеток (%) = (А-В) × 100 / (А-1), где А представляет собой среднее значение клеточного индекса ячеек, не содержащих антитела (только целевые клетки и РВМС человека), а В представляет собой среднее значение клеточного индекса ячеек, содержащих каждое антитело.
Промышленная применимость
Биспецифическое антитело может быть получено при восстанавливающих условиях путем применения способа в соответствии с настоящим изобретением с более высокой эффективностью, чем таковая при использовании традиционных методик.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ЧУГАИ СЕИЯКУ КАБУШИКИ КАИША
<120> СПОСОБ ПОЛУЧЕНИЯ ПОЛИПЕПТИДНОГО ГЕТЕРОМУЛЬТИМЕРА
<130> C1-A1307P
<150> JP 2013-200845
<151> 2013-09-27
<160> 81
<170> PatentIn version 3.5
<210> 1
<211> 119
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 1
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Arg Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Arg Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Thr Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Met Leu Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Arg Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Ser Leu Val Thr Val Ser Ser
115
<210> 2
<211> 119
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 2
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly Tyr Ser Ile Ser Asp Asp
20 25 30
Gln Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Gly Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Ala Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 3
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 3
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Arg Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Arg Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Thr Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Met Leu Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Arg Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Ser Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 4
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 4
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly Tyr Ser Ile Ser Asp Asp
20 25 30
Gln Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Gly Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Ala Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 5
<211> 444
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 5
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Arg Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Arg Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Thr Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Met Leu Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Arg Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Ser Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro
210 215 220
Cys Pro Ser Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val
260 265 270
Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu
435 440
<210> 6
<211> 444
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 6
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly Tyr Ser Ile Ser Asp Asp
20 25 30
Gln Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Gly Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Ala Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro
210 215 220
Cys Pro Ser Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val
260 265 270
Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu
435 440
<210> 7
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 7
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Arg Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Arg Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Thr Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Met Leu Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Arg Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Ser Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Ser Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 8
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 8
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly Tyr Ser Ile Ser Asp Asp
20 25 30
Gln Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Gly Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Ala Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Ser Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 9
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 9
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Arg Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Arg Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Thr Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Met Leu Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Arg Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Ser Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Ser Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Lys Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 10
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 10
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly Tyr Ser Ile Ser Asp Asp
20 25 30
Gln Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Gly Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Ala Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Ser Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Glu Ser Leu Ser Leu Ser Pro
435 440 445
<210> 11
<211> 444
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 11
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Arg Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Arg Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Thr Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Met Leu Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Arg Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Ser Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro
210 215 220
Cys Pro Ser Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val
260 265 270
Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Gln Lys Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu
435 440
<210> 12
<211> 444
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 12
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly Tyr Ser Ile Ser Asp Asp
20 25 30
Gln Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Gly Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Ala Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro
210 215 220
Cys Pro Ser Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val
260 265 270
Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Glu Ser Leu Ser Leu Ser Leu
435 440
<210> 13
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 13
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Gly Asn Thr Leu Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 14
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 14
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Ser Val Thr Ile Thr Cys Gln Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Glu Leu Leu Ile
35 40 45
Tyr Tyr Gly Ser Glu Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Glu Ala
65 70 75 80
Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Gly Asn Ser Leu Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Glu Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 15
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 15
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Arg Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Arg Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Thr Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Met Leu Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Arg Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Ser Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Lys Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 16
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 16
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly Tyr Ser Ile Ser Asp Asp
20 25 30
Gln Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Gly Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Ala Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Glu Ser Leu Ser Leu Ser Pro
435 440 445
<210> 17
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 17
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Arg Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Arg Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Thr Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Met Leu Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Arg Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Ser Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Lys Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 18
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 18
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Arg Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Arg Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Thr Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Met Leu Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Arg Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Ser Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Lys Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 19
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 19
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Arg Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Arg Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Thr Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Met Leu Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Arg Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Ser Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Lys Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 20
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 20
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Arg Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Arg Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Thr Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Met Leu Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Arg Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Ser Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Lys Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Lys Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 21
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 21
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Arg Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Arg Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Thr Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Met Leu Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Arg Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Ser Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Lys Lys Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 22
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 22
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly Tyr Ser Ile Ser Asp Asp
20 25 30
Gln Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Gly Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Ala Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Glu Ser Leu Ser Leu Ser Pro
435 440 445
<210> 23
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 23
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly Tyr Ser Ile Ser Asp Asp
20 25 30
Gln Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Gly Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Ala Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Asp Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 24
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 24
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly Tyr Ser Ile Ser Asp Asp
20 25 30
Gln Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Gly Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Ala Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Glu Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 25
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 25
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly Tyr Ser Ile Ser Asp Asp
20 25 30
Gln Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Gly Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Ala Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Asp Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Glu Ser Leu Ser Leu Ser Pro
435 440 445
<210> 26
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 26
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly Tyr Ser Ile Ser Asp Asp
20 25 30
Gln Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Gly Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Ala Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Glu Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Glu Ser Leu Ser Leu Ser Pro
435 440 445
<210> 27
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 27
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Arg Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Arg Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Thr Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Met Leu Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Arg Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Ser Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 28
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 28
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly Tyr Ser Ile Ser Asp Asp
20 25 30
Gln Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Gly Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Ala Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Leu Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 29
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 29
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Arg Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Arg Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Thr Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Met Leu Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Arg Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Ser Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Lys Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 30
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 30
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Arg Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Arg Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Thr Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Met Leu Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Arg Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Ser Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Lys Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 31
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 31
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Arg Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Arg Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Thr Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Met Leu Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Arg Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Ser Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Lys Lys Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 32
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 32
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly Tyr Ser Ile Ser Asp Asp
20 25 30
Gln Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Gly Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Ala Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Glu Ser Leu Ser Leu Ser Pro
435 440 445
<210> 33
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 33
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly Tyr Ser Ile Ser Asp Asp
20 25 30
Gln Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Gly Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Ala Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Glu Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 34
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 34
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly Tyr Ser Ile Ser Asp Asp
20 25 30
Gln Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Gly Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Ala Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Glu Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Glu Ser Leu Ser Leu Ser Pro
435 440 445
<210> 35
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 35
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Arg Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Arg Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Thr Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Met Leu Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Arg Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Ser Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Lys Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Asp Thr Thr Pro Pro Met Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 36
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 36
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Arg Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Arg Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Thr Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Met Leu Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Arg Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Ser Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Lys Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Glu Thr Thr Pro Pro Met Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 37
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 37
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Arg Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Arg Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Thr Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Met Leu Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Arg Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Ser Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Lys Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Phe Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 38
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 38
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Arg Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Arg Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Thr Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Met Leu Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Arg Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Ser Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Lys Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Tyr Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 39
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 39
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Arg Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Arg Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Thr Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Met Leu Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Arg Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Ser Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Lys Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Thr Thr Thr Pro Pro Met Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 40
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 40
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Arg Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Arg Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Thr Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Met Leu Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Arg Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Ser Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Lys Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Val Thr Thr Pro Pro Met Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 41
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 41
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Arg Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Arg Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Thr Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Met Leu Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Arg Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Ser Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Lys Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Ile Thr Thr Pro Pro Met Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 42
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 42
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly Tyr Ser Ile Ser Asp Asp
20 25 30
Gln Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Gly Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Ala Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Asp Thr Thr Pro Pro Met Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Glu Ser Leu Ser Leu Ser Pro
435 440 445
<210> 43
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 43
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly Tyr Ser Ile Ser Asp Asp
20 25 30
Gln Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Gly Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Ala Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Glu Thr Thr Pro Pro Met Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Glu Ser Leu Ser Leu Ser Pro
435 440 445
<210> 44
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 44
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly Tyr Ser Ile Ser Asp Asp
20 25 30
Gln Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Gly Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Ala Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Phe Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Glu Ser Leu Ser Leu Ser Pro
435 440 445
<210> 45
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 45
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly Tyr Ser Ile Ser Asp Asp
20 25 30
Gln Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Gly Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Ala Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Tyr Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Glu Ser Leu Ser Leu Ser Pro
435 440 445
<210> 46
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 46
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly Tyr Ser Ile Ser Asp Asp
20 25 30
Gln Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Gly Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Ala Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Thr Thr Thr Pro Pro Met Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Glu Ser Leu Ser Leu Ser Pro
435 440 445
<210> 47
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 47
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly Tyr Ser Ile Ser Asp Asp
20 25 30
Gln Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Gly Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Ala Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Val Thr Thr Pro Pro Met Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Glu Ser Leu Ser Leu Ser Pro
435 440 445
<210> 48
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 48
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly Tyr Ser Ile Ser Asp Asp
20 25 30
Gln Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Gly Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Ala Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Ile Thr Thr Pro Pro Met Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Glu Ser Leu Ser Leu Ser Pro
435 440 445
<210> 49
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 49
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Arg Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Arg Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Thr Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Met Leu Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Arg Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Ser Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 50
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 50
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly Tyr Ser Ile Ser Asp Asp
20 25 30
Gln Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Gly Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Ala Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 51
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 51
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Arg Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Arg Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Thr Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Met Leu Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Arg Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Ser Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Lys Glu Met Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 52
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 52
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly Tyr Ser Ile Ser Asp Asp
20 25 30
Gln Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Gly Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Ala Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Glu Ser Leu Ser Leu Ser Pro
435 440 445
<210> 53
<211> 443
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 53
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Arg Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Arg Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Thr Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Met Leu Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Arg Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Ser Leu Val Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr
115 120 125
Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr Leu
130 135 140
Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr Trp
145 150 155 160
Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser Ser
180 185 190
Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala Ser
195 200 205
Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Cys Lys
210 215 220
Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val Thr
245 250 255
Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val Gln Phe Ser
260 265 270
Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr Gln Pro Arg
275 280 285
Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro Ile
290 295 300
Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val Asn
305 310 315 320
Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys
325 330 335
Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu
340 345 350
Gln Met Ala Lys Asp Lys Val Ser Leu Thr Cys Met Ile Thr Asp Phe
355 360 365
Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln Pro Ala
370 375 380
Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp Gly Ser Tyr
385 390 395 400
Phe Val Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp Glu Ala Gly
405 410 415
Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His His
420 425 430
Thr Glu Lys Ser Leu Ser His Ser Pro Gly Lys
435 440
<210> 54
<211> 443
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 54
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly Tyr Ser Ile Ser Asp Asp
20 25 30
Gln Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Gly Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Ala Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr
115 120 125
Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr Leu
130 135 140
Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr Trp
145 150 155 160
Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser Ser
180 185 190
Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala Ser
195 200 205
Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Cys Lys
210 215 220
Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val Thr
245 250 255
Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val Gln Phe Ser
260 265 270
Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr Gln Pro Arg
275 280 285
Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro Ile
290 295 300
Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val Asn
305 310 315 320
Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys
325 330 335
Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu
340 345 350
Gln Met Ala Lys Asp Lys Val Ser Leu Thr Cys Met Ile Thr Asp Phe
355 360 365
Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln Pro Ala
370 375 380
Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp Gly Ser Tyr
385 390 395 400
Phe Val Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp Glu Ala Gly
405 410 415
Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His His
420 425 430
Thr Glu Lys Ser Leu Ser His Ser Pro Gly Lys
435 440
<210> 55
<211> 443
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 55
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Arg Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Arg Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Thr Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Met Leu Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Arg Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Ser Leu Val Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr
115 120 125
Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr Leu
130 135 140
Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr Trp
145 150 155 160
Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser Ser
180 185 190
Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala Ser
195 200 205
Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Cys Lys
210 215 220
Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val Thr
245 250 255
Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val Gln Phe Ser
260 265 270
Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr Gln Pro Arg
275 280 285
Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro Ile
290 295 300
Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val Asn
305 310 315 320
Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys
325 330 335
Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu
340 345 350
Gln Met Ala Lys Asp Lys Val Ser Leu Thr Cys Met Ile Thr Asp Phe
355 360 365
Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln Pro Ala
370 375 380
Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Lys Thr Asp Gly Ser Tyr
385 390 395 400
Phe Val Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp Glu Ala Gly
405 410 415
Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His His
420 425 430
Thr Glu Lys Ser Leu Ser His Ser Pro Gly Lys
435 440
<210> 56
<211> 443
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 56
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Arg Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Arg Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Thr Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Met Leu Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Arg Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Ser Leu Val Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr
115 120 125
Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr Leu
130 135 140
Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr Trp
145 150 155 160
Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser Ser
180 185 190
Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala Ser
195 200 205
Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Cys Lys
210 215 220
Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val Thr
245 250 255
Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val Gln Phe Ser
260 265 270
Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr Gln Pro Arg
275 280 285
Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro Ile
290 295 300
Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val Asn
305 310 315 320
Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys
325 330 335
Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu
340 345 350
Gln Met Ala Lys Asp Lys Val Ser Leu Thr Cys Met Ile Thr Asp Phe
355 360 365
Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln Pro Ala
370 375 380
Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Arg Thr Asp Gly Ser Tyr
385 390 395 400
Phe Val Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp Glu Ala Gly
405 410 415
Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His His
420 425 430
Thr Glu Lys Ser Leu Ser His Ser Pro Gly Lys
435 440
<210> 57
<211> 443
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 57
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly Tyr Ser Ile Ser Asp Asp
20 25 30
Gln Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Gly Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Ala Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr
115 120 125
Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr Leu
130 135 140
Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr Trp
145 150 155 160
Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser Ser
180 185 190
Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala Ser
195 200 205
Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Cys Lys
210 215 220
Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val Thr
245 250 255
Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val Gln Phe Ser
260 265 270
Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr Gln Pro Arg
275 280 285
Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro Ile
290 295 300
Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val Asn
305 310 315 320
Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys
325 330 335
Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu
340 345 350
Gln Met Ala Lys Asp Lys Val Ser Leu Thr Cys Met Ile Thr Asp Phe
355 360 365
Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln Pro Ala
370 375 380
Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp Gly Ser Tyr
385 390 395 400
Phe Val Tyr Ser Asp Leu Asn Val Gln Lys Ser Asn Trp Glu Ala Gly
405 410 415
Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His His
420 425 430
Thr Glu Lys Ser Leu Ser His Ser Pro Gly Lys
435 440
<210> 58
<211> 443
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 58
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly Tyr Ser Ile Ser Asp Asp
20 25 30
Gln Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Gly Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Ala Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr
115 120 125
Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr Leu
130 135 140
Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr Trp
145 150 155 160
Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser Ser
180 185 190
Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala Ser
195 200 205
Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Cys Lys
210 215 220
Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val Thr
245 250 255
Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val Gln Phe Ser
260 265 270
Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr Gln Pro Arg
275 280 285
Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro Ile
290 295 300
Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val Asn
305 310 315 320
Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys
325 330 335
Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu
340 345 350
Gln Met Ala Lys Asp Lys Val Ser Leu Thr Cys Met Ile Thr Asp Phe
355 360 365
Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln Pro Ala
370 375 380
Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp Gly Ser Tyr
385 390 395 400
Phe Val Tyr Ser Glu Leu Asn Val Gln Lys Ser Asn Trp Glu Ala Gly
405 410 415
Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His His
420 425 430
Thr Glu Lys Ser Leu Ser His Ser Pro Gly Lys
435 440
<210> 59
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 59
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Gly Asn Thr Leu Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Ala Asp Ala Ala
100 105 110
Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu Gln Leu Thr Ser Gly
115 120 125
Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe Tyr Pro Lys Asp Ile
130 135 140
Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg Gln Asn Gly Val Leu
145 150 155 160
Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser Thr Tyr Ser Met Ser
165 170 175
Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu Arg His Asn Ser Tyr
180 185 190
Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser Pro Ile Val Lys Ser
195 200 205
Phe Asn Arg Asn Glu Cys
210
<210> 60
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 60
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Ser Val Thr Ile Thr Cys Gln Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Glu Leu Leu Ile
35 40 45
Tyr Tyr Gly Ser Glu Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Glu Ala
65 70 75 80
Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Gly Asn Ser Leu Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Glu Arg Ala Asp Ala Ala
100 105 110
Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu Gln Leu Thr Ser Gly
115 120 125
Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe Tyr Pro Lys Asp Ile
130 135 140
Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg Gln Asn Gly Val Leu
145 150 155 160
Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser Thr Tyr Ser Met Ser
165 170 175
Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu Arg His Asn Ser Tyr
180 185 190
Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser Pro Ile Val Lys Ser
195 200 205
Phe Asn Arg Asn Glu Cys
210
<210> 61
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 61
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Asn Arg Asn Thr Tyr Leu His Trp Tyr Gln Gln Lys Pro Gly Gln Ala
35 40 45
Pro Arg Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ser Gln Asn
85 90 95
Thr His Val Pro Pro Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys
115 120 125
Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys
130 135 140
Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu
145 150 155 160
Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu
165 170 175
Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr
180 185 190
Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val
195 200 205
Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro
210 215 220
Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
225 230 235 240
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
245 250 255
Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr
260 265 270
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
275 280 285
Gln Phe Ala Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
290 295 300
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
305 310 315 320
Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
325 330 335
Pro Arg Glu Pro Gln Val Cys Thr Leu Pro Pro Ser Gln Glu Glu Met
340 345 350
Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro
355 360 365
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
370 375 380
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
385 390 395 400
Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val
405 410 415
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
420 425 430
Lys Ser Leu Ser Leu Ser Leu His His His His His His His His
435 440 445
<210> 62
<211> 455
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 62
Glu Val Gln Leu Val Glu Thr Gly Gly Ser Leu Val Gln Pro Gly Lys
1 5 10 15
Ser Leu Lys Leu Thr Cys Ala Thr Ser Gly Phe Thr Phe Ser Asn Ala
20 25 30
Trp Met His Trp Val Arg Gln Ser Pro Glu Lys Gln Leu Glu Trp Val
35 40 45
Ala Gln Ile Lys Ala Lys Ser Asn Asn Tyr Ala Thr Tyr Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Asn
65 70 75 80
Ile Tyr Leu Gln Met Asn Ser Leu Lys Glu Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Arg Tyr Val His Tyr Gly Ala Tyr Tyr Gly Val Asp Ala Trp
100 105 110
Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr
210 215 220
Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp
260 265 270
Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Ala Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Gln Cys Glu Met Thr Lys Asn Gln Val Ser Leu Ser
355 360 365
Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Arg Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Asp
435 440 445
Tyr Lys Asp Asp Asp Asp Lys
450 455
<210> 63
<211> 222
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 63
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Glu Met His Trp Ile Arg Gln Pro Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ala Ile Asp Pro Lys Thr Gly Asp Thr Ala Tyr Ser Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Leu Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Phe Tyr Ser Tyr Thr Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro
115 120 125
Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu
130 135 140
Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn
145 150 155 160
Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser
165 170 175
Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala
180 185 190
Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly
195 200 205
Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215 220
<210> 64
<211> 219
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 64
Asp Val Val Met Thr Gln Thr Pro Val Ser Met Ser Val Ser Leu Gly
1 5 10 15
Gly Gln Val Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Asn
20 25 30
Asn Gly Asn Thr Tyr Val Ser Trp Tyr Ile Gln Lys Pro Ser Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Ile Ser
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Pro Asp Asp Leu Gly Val Tyr Tyr Cys Gly Gln Gly
85 90 95
Thr Gln Asp Pro Tyr Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 65
<211> 443
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 65
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Glu Met His Trp Ile Arg Gln Pro Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ala Ile Asp Pro Lys Thr Gly Asp Thr Ala Tyr Ser Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Leu Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Phe Tyr Ser Tyr Thr Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
115 120 125
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
130 135 140
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
145 150 155 160
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
165 170 175
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
180 185 190
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
195 200 205
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
210 215 220
Pro Pro Cys Pro Ala Pro Glu Leu Arg Gly Gly Pro Lys Val Phe Leu
225 230 235 240
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
245 250 255
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
260 265 270
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
275 280 285
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
290 295 300
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
305 310 315 320
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
325 330 335
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
340 345 350
Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
355 360 365
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
370 375 380
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Tyr Leu Asp Ser Asp Gly
385 390 395 400
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
405 410 415
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
420 425 430
His Tyr Thr Gln Glu Ser Leu Ser Leu Ser Pro
435 440
<210> 66
<211> 443
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 66
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Glu Met His Trp Ile Arg Gln Pro Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ala Ile Asp Pro Lys Thr Gly Asp Thr Ala Tyr Ser Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Leu Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Phe Tyr Ser Tyr Thr Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
115 120 125
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
130 135 140
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
145 150 155 160
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
165 170 175
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
180 185 190
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
195 200 205
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
210 215 220
Pro Pro Cys Pro Ala Pro Glu Leu Arg Gly Gly Pro Lys Val Phe Leu
225 230 235 240
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
245 250 255
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
260 265 270
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
275 280 285
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
290 295 300
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
305 310 315 320
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
325 330 335
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
340 345 350
Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
355 360 365
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
370 375 380
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
385 390 395 400
Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln
405 410 415
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
420 425 430
His Tyr Thr Gln Glu Ser Leu Ser Leu Ser Pro
435 440
<210> 67
<211> 440
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 67
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Glu Met His Trp Ile Arg Gln Pro Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ala Ile Asp Pro Lys Thr Gly Asp Thr Ala Tyr Ser Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Leu Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Phe Tyr Ser Tyr Thr Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
115 120 125
Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val
130 135 140
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
145 150 155 160
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
165 170 175
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
180 185 190
Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys
195 200 205
Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys
210 215 220
Pro Ala Pro Glu Phe Arg Gly Gly Pro Lys Val Phe Leu Phe Pro Pro
225 230 235 240
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
245 250 255
Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp
260 265 270
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
275 280 285
Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
290 295 300
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
305 310 315 320
Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
325 330 335
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu
340 345 350
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
355 360 365
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
370 375 380
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
385 390 395 400
Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn
405 410 415
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
420 425 430
Gln Glu Ser Leu Ser Leu Ser Leu
435 440
<210> 68
<211> 439
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 68
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Glu Met His Trp Ile Arg Gln Pro Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ala Ile Asp Pro Lys Thr Gly Asp Thr Ala Tyr Ser Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Leu Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Phe Tyr Ser Tyr Thr Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro
115 120 125
Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val
130 135 140
Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser
145 150 155 160
Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu
165 170 175
Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser
180 185 190
Glu Thr Val Thr Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val
195 200 205
Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Cys Lys Pro Cys Ile Cys
210 215 220
Thr Val Lys Glu Val Ser Lys Val Phe Ile Phe Pro Pro Lys Pro Lys
225 230 235 240
Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val Thr Cys Val Val Val
245 250 255
Asp Ile Ser Lys Asp Asp Pro Glu Val Gln Phe Ser Trp Phe Val Asp
260 265 270
Asp Val Glu Val His Thr Ala Gln Thr Gln Pro Arg Glu Glu Gln Phe
275 280 285
Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro Ile Met His Gln Asp
290 295 300
Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val Asn Ser Ala Ala Phe
305 310 315 320
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg Pro Lys
325 330 335
Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met Ala Lys
340 345 350
Asp Lys Val Ser Leu Thr Cys Met Ile Thr Asp Phe Phe Pro Glu Asp
355 360 365
Ile Thr Val Glu Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn Tyr Lys
370 375 380
Asn Thr Gln Pro Ile Met Asp Thr Asp Gly Ser Tyr Phe Val Tyr Ser
385 390 395 400
Glu Leu Asn Val Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr Phe Thr
405 410 415
Cys Ser Val Leu His Glu Gly Leu His Asn His His Thr Glu Lys Ser
420 425 430
Leu Ser His Ser Pro Gly Lys
435
<210> 69
<211> 450
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 69
Glu Val Gln Leu Val Glu Thr Gly Gly Ser Leu Val Gln Pro Gly Lys
1 5 10 15
Ser Leu Lys Leu Thr Cys Ala Thr Ser Gly Phe Thr Phe Ser Asn Ala
20 25 30
Trp Met His Trp Val Arg Gln Ser Pro Glu Lys Gln Leu Glu Trp Val
35 40 45
Ala Gln Ile Lys Ala Lys Ser Asn Asn Tyr Ala Thr Tyr Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Asn
65 70 75 80
Ile Tyr Leu Gln Met Asn Ser Leu Lys Glu Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Arg Tyr Val His Tyr Gly Ala Tyr Tyr Gly Val Asp Ala Trp
100 105 110
Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser
210 215 220
Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Arg
225 230 235 240
Gly Gly Pro Lys Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
245 250 255
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
260 265 270
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu
275 280 285
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr
290 295 300
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
305 310 315 320
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro
325 330 335
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
340 345 350
Val Tyr Thr Leu Pro Pro Ser Arg Lys Glu Leu Thr Lys Asn Gln Val
355 360 365
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
370 375 380
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
385 390 395 400
Pro Tyr Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr
405 410 415
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
420 425 430
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
435 440 445
Ser Pro
450
<210> 70
<211> 450
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 70
Glu Val Gln Leu Val Glu Thr Gly Gly Ser Leu Val Gln Pro Gly Lys
1 5 10 15
Ser Leu Lys Leu Thr Cys Ala Thr Ser Gly Phe Thr Phe Ser Asn Ala
20 25 30
Trp Met His Trp Val Arg Gln Ser Pro Glu Lys Gln Leu Glu Trp Val
35 40 45
Ala Gln Ile Lys Ala Lys Ser Asn Asn Tyr Ala Thr Tyr Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Asn
65 70 75 80
Ile Tyr Leu Gln Met Asn Ser Leu Lys Glu Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Arg Tyr Val His Tyr Gly Ala Tyr Tyr Gly Val Asp Ala Trp
100 105 110
Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser
210 215 220
Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Arg
225 230 235 240
Gly Gly Pro Lys Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
245 250 255
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
260 265 270
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu
275 280 285
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr
290 295 300
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
305 310 315 320
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro
325 330 335
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
340 345 350
Val Tyr Thr Leu Pro Pro Ser Arg Lys Glu Leu Thr Lys Asn Gln Val
355 360 365
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
370 375 380
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
385 390 395 400
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr
405 410 415
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
420 425 430
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
435 440 445
Ser Pro
450
<210> 71
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 71
Glu Val Gln Leu Val Glu Thr Gly Gly Ser Leu Val Gln Pro Gly Lys
1 5 10 15
Ser Leu Lys Leu Thr Cys Ala Thr Ser Gly Phe Thr Phe Ser Asn Ala
20 25 30
Trp Met His Trp Val Arg Gln Ser Pro Glu Lys Gln Leu Glu Trp Val
35 40 45
Ala Gln Ile Lys Ala Lys Ser Asn Asn Tyr Ala Thr Tyr Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Asn
65 70 75 80
Ile Tyr Leu Gln Met Asn Ser Leu Lys Glu Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Arg Tyr Val His Tyr Gly Ala Tyr Tyr Gly Val Asp Ala Trp
100 105 110
Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr
210 215 220
Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Arg Gly Gly Pro
225 230 235 240
Lys Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp
260 265 270
Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Gln Lys Glu Met Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu
435 440 445
<210> 72
<211> 446
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 72
Glu Val Gln Leu Val Glu Thr Gly Gly Ser Leu Val Gln Pro Gly Lys
1 5 10 15
Ser Leu Lys Leu Thr Cys Ala Thr Ser Gly Phe Thr Phe Ser Asn Ala
20 25 30
Trp Met His Trp Val Arg Gln Ser Pro Glu Lys Gln Leu Glu Trp Val
35 40 45
Ala Gln Ile Lys Ala Lys Ser Asn Asn Tyr Ala Thr Tyr Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Asn
65 70 75 80
Ile Tyr Leu Gln Met Asn Ser Leu Lys Glu Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Arg Tyr Val His Tyr Gly Ala Tyr Tyr Gly Val Asp Ala Trp
100 105 110
Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala Lys Thr Thr Pro Pro
115 120 125
Ser Val Tyr Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met
130 135 140
Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val
180 185 190
Pro Ser Ser Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His
195 200 205
Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys
210 215 220
Gly Cys Lys Pro Cys Ile Cys Thr Val Lys Glu Val Ser Lys Val Phe
225 230 235 240
Ile Phe Pro Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro
245 250 255
Lys Val Thr Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val
260 265 270
Gln Phe Ser Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr
275 280 285
Gln Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu
290 295 300
Leu Pro Ile Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys
305 310 315 320
Arg Val Asn Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser
325 330 335
Lys Thr Lys Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro
340 345 350
Pro Lys Glu Gln Met Ala Lys Asp Lys Val Ser Leu Thr Cys Met Ile
355 360 365
Thr Asp Phe Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly
370 375 380
Gln Pro Ala Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Arg Thr Asp
385 390 395 400
Gly Ser Tyr Phe Val Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp
405 410 415
Glu Ala Gly Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His
420 425 430
Asn His His Thr Glu Lys Ser Leu Ser His Ser Pro Gly Lys
435 440 445
<210> 73
<211> 443
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 73
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly His Ser Ile Ser His Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Phe Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Gln Gly Arg Val Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr
115 120 125
Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr Leu
130 135 140
Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr Trp
145 150 155 160
Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser Ser
180 185 190
Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala Ser
195 200 205
Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Cys Lys
210 215 220
Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val Thr
245 250 255
Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val Gln Phe Ser
260 265 270
Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr Gln Pro Arg
275 280 285
Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro Ile
290 295 300
Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val Asn
305 310 315 320
Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys
325 330 335
Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu
340 345 350
Gln Met Ala Lys Asp Lys Val Ser Leu Thr Cys Met Ile Thr Asp Phe
355 360 365
Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln Pro Ala
370 375 380
Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp Gly Ser Tyr
385 390 395 400
Phe Val Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp Glu Ala Gly
405 410 415
Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His His
420 425 430
Thr Glu Lys Ser Leu Ser His Ser Pro Gly Lys
435 440
<210> 74
<211> 443
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 74
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly His Ser Ile Ser His Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Phe Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Gln Gly Arg Val Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr
115 120 125
Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr Leu
130 135 140
Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr Trp
145 150 155 160
Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser Ser
180 185 190
Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala Ser
195 200 205
Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Cys Lys
210 215 220
Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val Thr
245 250 255
Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val Gln Phe Ser
260 265 270
Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr Gln Pro Arg
275 280 285
Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro Ile
290 295 300
Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val Asn
305 310 315 320
Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys
325 330 335
Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu
340 345 350
Gln Met Ala Lys Asp Lys Val Ser Leu Thr Cys Met Ile Thr Asp Phe
355 360 365
Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln Pro Ala
370 375 380
Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Lys Thr Asp Gly Ser Tyr
385 390 395 400
Phe Val Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp Glu Ala Gly
405 410 415
Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His His
420 425 430
Thr Glu Lys Ser Leu Ser His Ser Pro Gly Lys
435 440
<210> 75
<211> 443
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 75
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly His Ser Ile Ser His Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Phe Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Gln Gly Arg Val Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr
115 120 125
Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr Leu
130 135 140
Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr Trp
145 150 155 160
Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser Ser
180 185 190
Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala Ser
195 200 205
Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Cys Lys
210 215 220
Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val Thr
245 250 255
Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val Gln Phe Ser
260 265 270
Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr Gln Pro Arg
275 280 285
Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro Ile
290 295 300
Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val Asn
305 310 315 320
Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys
325 330 335
Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu
340 345 350
Gln Met Ala Lys Asp Lys Val Ser Leu Thr Cys Met Ile Thr Asp Phe
355 360 365
Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln Pro Ala
370 375 380
Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp Gly Ser Tyr
385 390 395 400
Phe Val Tyr Ser Asp Leu Asn Val Gln Lys Ser Asn Trp Glu Ala Gly
405 410 415
Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His His
420 425 430
Thr Glu Lys Ser Leu Ser His Ser Pro Gly Lys
435 440
<210> 76
<211> 443
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 76
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly His Ser Ile Ser His Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Phe Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Gln Gly Arg Val Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr
115 120 125
Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr Leu
130 135 140
Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr Trp
145 150 155 160
Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser Ser
180 185 190
Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala Ser
195 200 205
Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Cys Lys
210 215 220
Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val Thr
245 250 255
Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val Gln Phe Ser
260 265 270
Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr Gln Pro Arg
275 280 285
Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro Ile
290 295 300
Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val Asn
305 310 315 320
Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys
325 330 335
Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu
340 345 350
Gln Met Ala Lys Asp Lys Val Ser Leu Thr Cys Met Ile Thr Asp Phe
355 360 365
Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln Pro Ala
370 375 380
Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Arg Thr Asp Gly Ser Tyr
385 390 395 400
Phe Val Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp Glu Ala Gly
405 410 415
Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His His
420 425 430
Thr Glu Lys Ser Leu Ser His Ser Pro Gly Lys
435 440
<210> 77
<211> 443
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 77
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly His Ser Ile Ser His Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Glu Gly Leu Glu Trp
35 40 45
Ile Gly Phe Ile Ser Tyr Ser Gly Ile Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Gln Gly Arg Val Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr
115 120 125
Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr Leu
130 135 140
Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr Trp
145 150 155 160
Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser Ser
180 185 190
Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala Ser
195 200 205
Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Cys Lys
210 215 220
Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val Thr
245 250 255
Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val Gln Phe Ser
260 265 270
Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr Gln Pro Arg
275 280 285
Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro Ile
290 295 300
Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val Asn
305 310 315 320
Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys
325 330 335
Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu
340 345 350
Gln Met Ala Lys Asp Lys Val Ser Leu Thr Cys Met Ile Thr Asp Phe
355 360 365
Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln Pro Ala
370 375 380
Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp Gly Ser Tyr
385 390 395 400
Phe Val Tyr Ser Glu Leu Asn Val Gln Lys Ser Asn Trp Glu Ala Gly
405 410 415
Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His His
420 425 430
Thr Glu Lys Ser Leu Ser His Ser Pro Gly Lys
435 440
<210> 78
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 78
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Ser Val Thr Ile Thr Cys Gln Ala Ser Thr Asp Ile Ser Ser His
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Glu Leu Leu Ile
35 40 45
Tyr Tyr Gly Ser His Leu Leu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Glu Ala
65 70 75 80
Glu Asp Ala Ala Thr Tyr Tyr Cys Gly Gln Gly Asn Arg Leu Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Glu Arg Ala Asp Ala Ala
100 105 110
Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu Gln Leu Thr Ser Gly
115 120 125
Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe Tyr Pro Lys Asp Ile
130 135 140
Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg Gln Asn Gly Val Leu
145 150 155 160
Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser Thr Tyr Ser Met Ser
165 170 175
Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu Arg His Asn Ser Tyr
180 185 190
Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser Pro Ile Val Lys Ser
195 200 205
Phe Asn Arg Asn Glu Cys
210
<210> 79
<211> 219
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 79
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Asn Arg Asn Thr Tyr Leu His Trp Tyr Gln Gln Lys Pro Gly Gln Ala
35 40 45
Pro Arg Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ser Gln Asn
85 90 95
Thr His Val Pro Pro Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 80
<211> 219
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 80
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Asn Arg Asn Thr Tyr Leu His Trp Tyr Gln Gln Lys Pro Gly Gln Ala
35 40 45
Pro Arg Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ser Gln Asn
85 90 95
Thr His Val Pro Pro Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu
115 120 125
Gln Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe
130 135 140
Tyr Pro Lys Asp Ile Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg
145 150 155 160
Gln Asn Gly Val Leu Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Met Ser Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu
180 185 190
Arg His Asn Ser Tyr Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser
195 200 205
Pro Ile Val Lys Ser Phe Asn Arg Asn Glu Cys
210 215
<210> 81
<211> 219
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 81
Asp Val Val Met Thr Gln Thr Pro Val Ser Met Ser Val Ser Leu Gly
1 5 10 15
Gly Gln Val Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Asn
20 25 30
Asn Gly Asn Thr Tyr Val Ser Trp Tyr Ile Gln Lys Pro Ser Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Ile Ser
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Pro Asp Asp Leu Gly Val Tyr Tyr Cys Gly Gln Gly
85 90 95
Thr Gln Asp Pro Tyr Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105 110
Arg Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu
115 120 125
Gln Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe
130 135 140
Tyr Pro Lys Asp Ile Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg
145 150 155 160
Gln Asn Gly Val Leu Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Met Ser Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu
180 185 190
Arg His Asn Ser Tyr Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser
195 200 205
Pro Ile Val Lys Ser Phe Asn Arg Asn Glu Cys
210 215
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИПЕПТИДНОГО ГЕТЕРОМУЛЬТИМЕРА | 2014 |
|
RU2758952C1 |
| АНТИ-CD137 АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2829536C2 |
| СПОСОБ ПОЛУЧЕНИЯ ВАРИАНТОВ FcyRIIB-СПЕЦИФИЧЕСКОЙ Fc-ОБЛАСТИ | 2013 |
|
RU2820161C1 |
| ВАРИАНТЫ FcγRIIB-СПЕЦИФИЧЕСКОЙ Fc-ОБЛАСТИ | 2013 |
|
RU2729831C2 |
| КОНСТРУКЦИИ СЛИТОГО БЕЛКА ДЛЯ ЗАБОЛЕВАНИЯ, СВЯЗАННОГО С КОМПЛЕМЕНТОМ | 2019 |
|
RU2824402C2 |
| ИНДУЦИРУЮЩИЙ ЦИТОТОКСИЧНОСТЬ ТЕРАПЕВТИЧЕСКИЙ АГЕНТ | 2022 |
|
RU2824285C2 |
| АНТИТЕЛА К РЕЦЕПТОРУ IL4 ДЛЯ ПРИМЕНЕНИЯ В ВЕТЕРИНАРИИ | 2019 |
|
RU2837141C2 |
| ПОЛИПЕПТИД, СОДЕРЖАЩИЙ АНТИГЕНСВЯЗЫВАЮЩИЙ ДОМЕН И ТРАНСПОРТИРУЮЩИЙ СЕГМЕНТ | 2017 |
|
RU2827545C2 |
| ВАРИАНТЫ FC-ОБЛАСТИ С МОДИФИЦИРОВАННЫМИ СПОСОБНОСТЯМИ СВЯЗЫВАТЬСЯ С FCRN | 2015 |
|
RU2730592C2 |
| ВАРИАНТЫ FC-ОБЛАСТИ С МОДИФИЦИРОВАННОЙ СПОСОБНОСТЬЮ СВЯЗЫВАТЬСЯ С FCRN И С СОХРАНЕННОЙ СПОСОБНОСТЬЮ СВЯЗЫВАТЬСЯ С БЕЛКОМ А | 2015 |
|
RU2727639C2 |
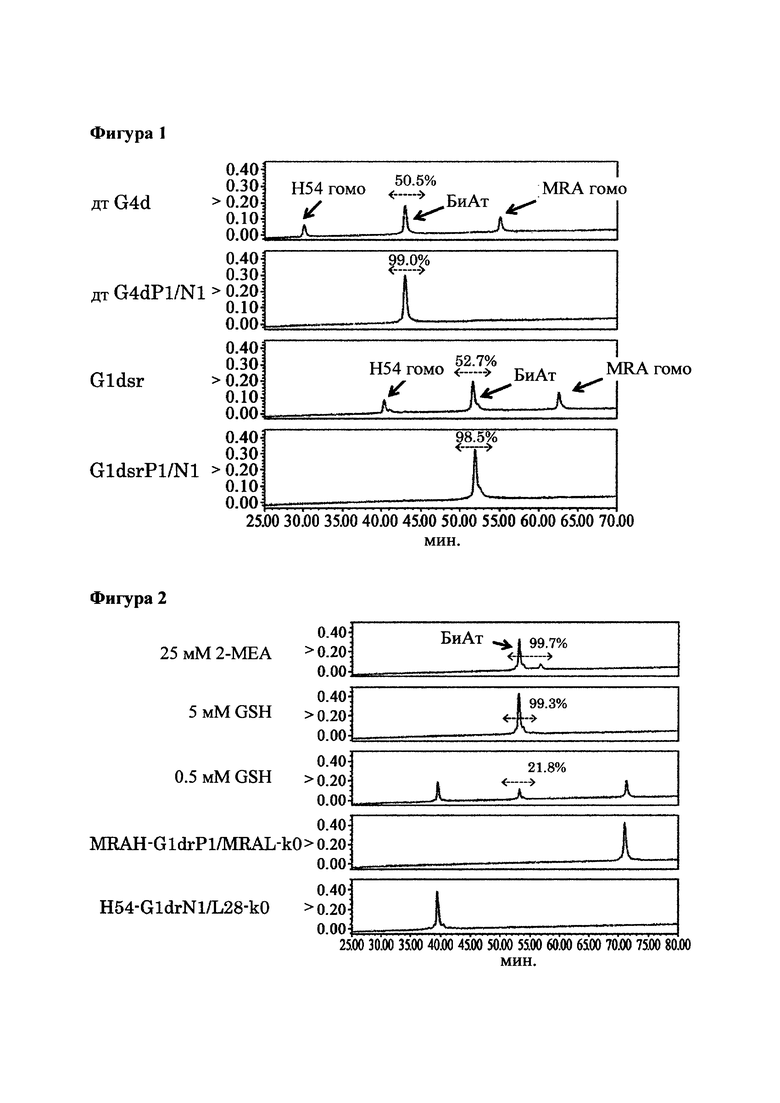
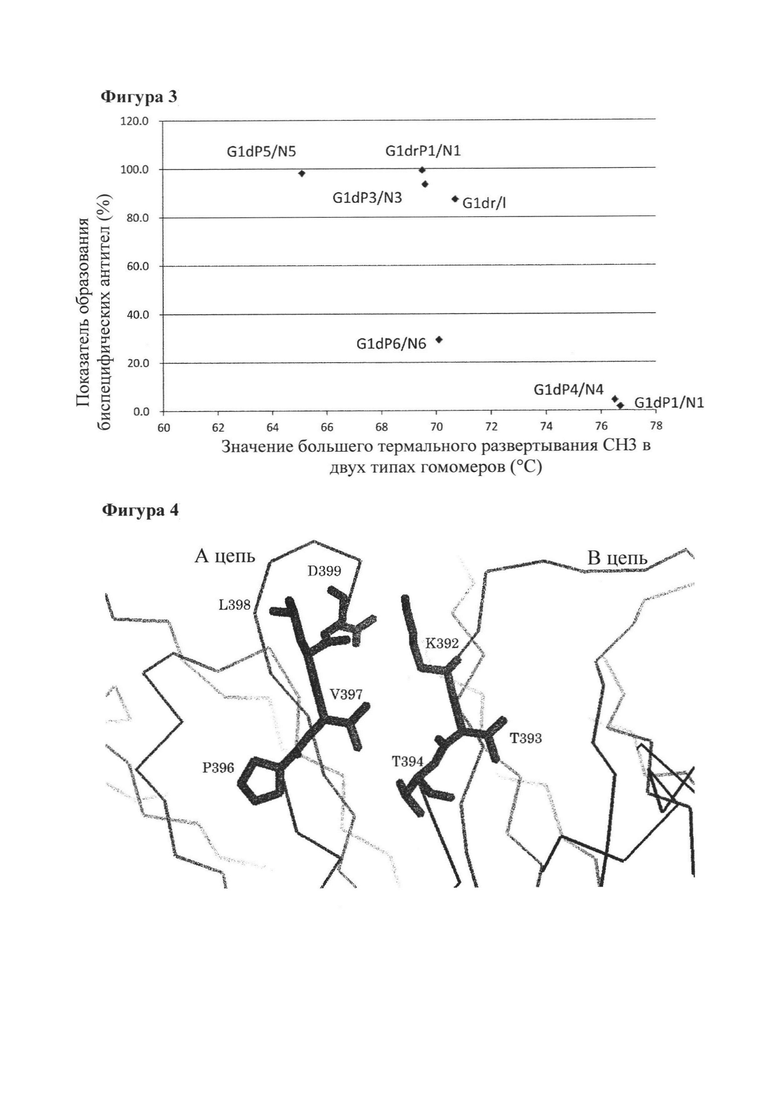
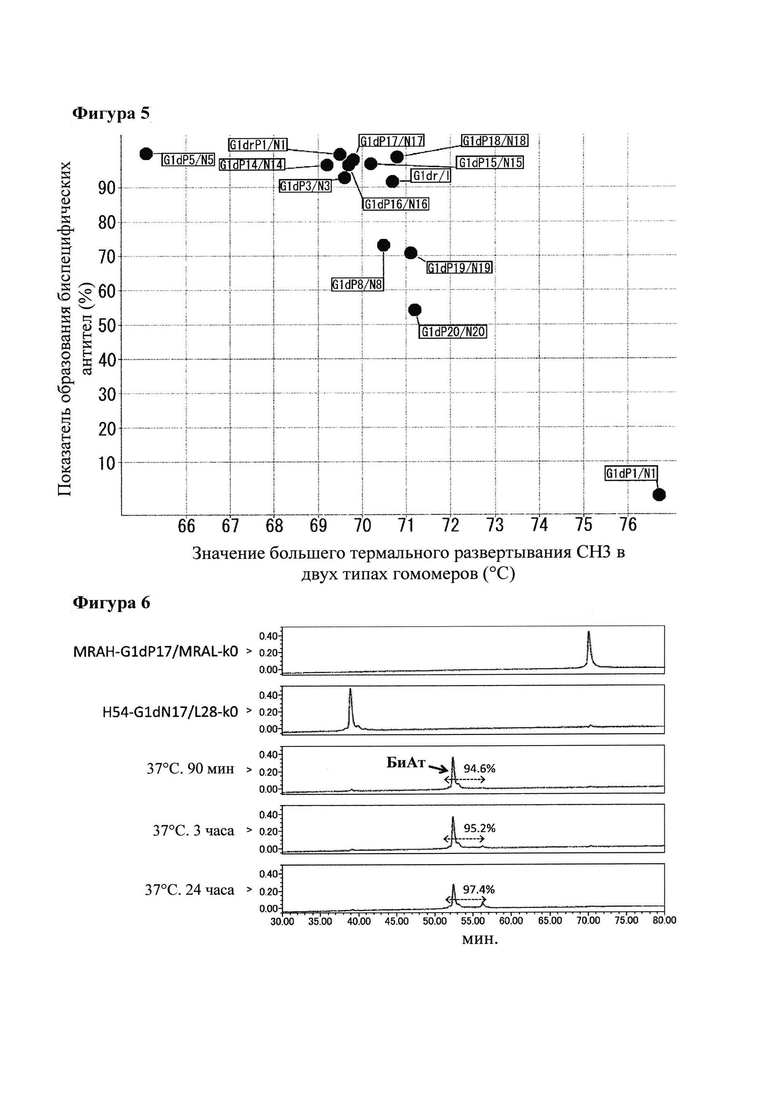
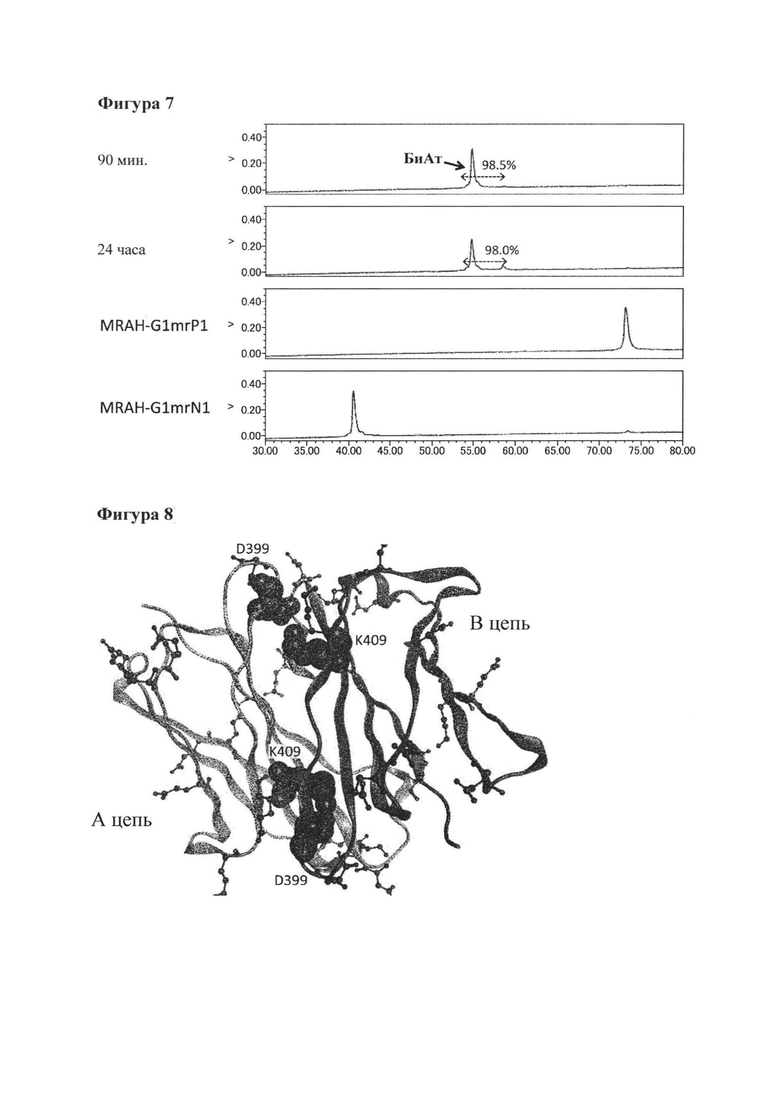

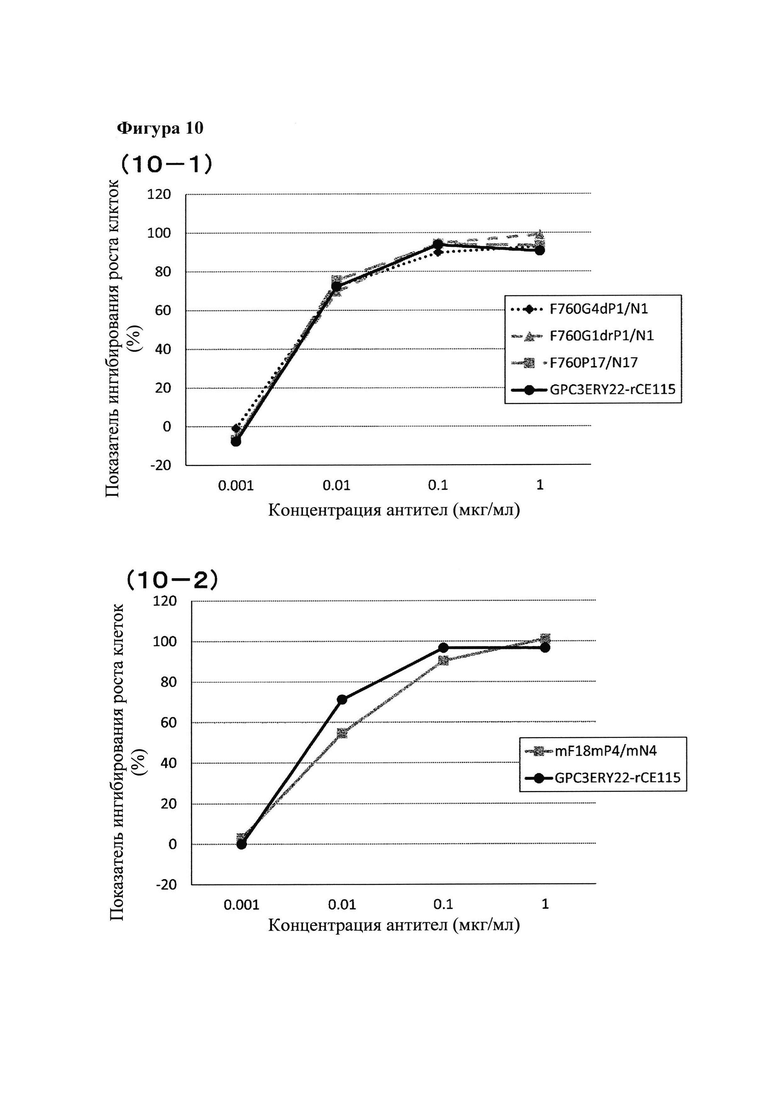
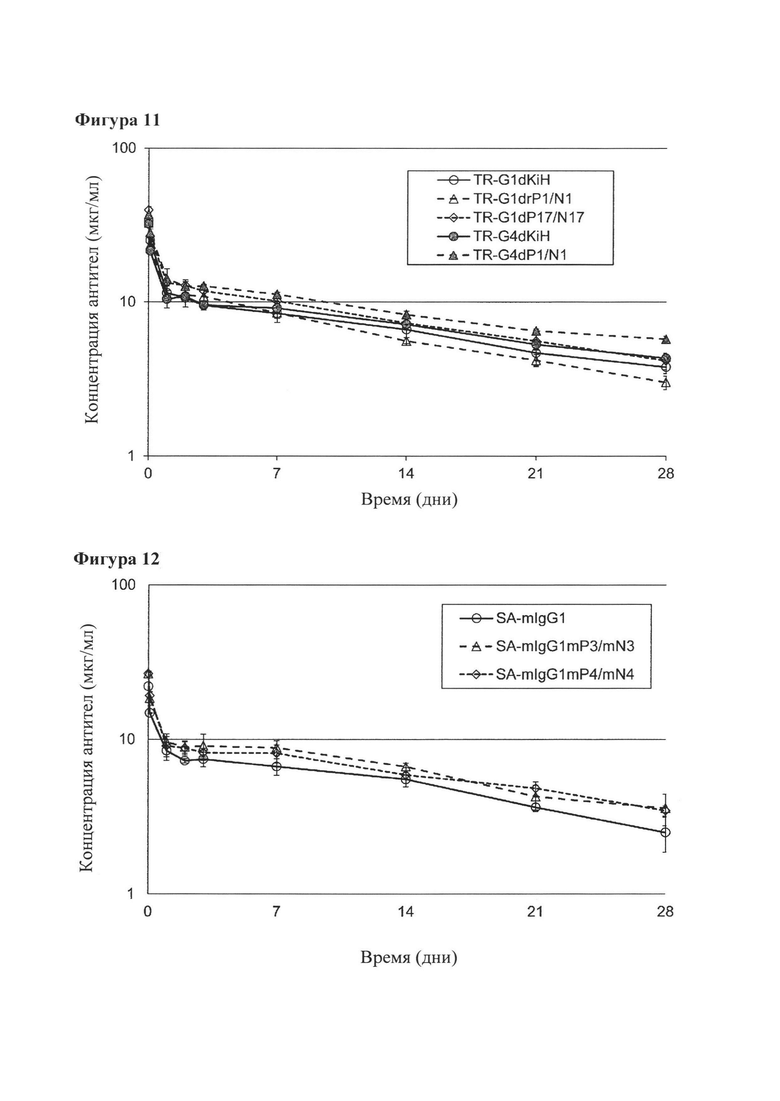
Настоящее изобретение относится к иммунологии. Предложен способ получения мультиспецифичного IgG1 антитела, согласно которому аминокислотные остатки в положениях 356 и 439 в соответствии с нумерацией EU в СН3 участках имеют такой заряд, чтобы достичь улучшенной диссоциации участков Fc и/или контроля их ассоциации посредством использования отталкивания зарядов. Данное изобретение может найти применение в получении терапевтических и профилактических агентов, в том числе для лечения рака. 12 з.п. ф-лы, 12 ил., 12 табл., 11 пр.
1. Способ получения мультиспецифичного IgG1 антитела, включающий следующие этапы:
a) получение ассоциированной формы идентичных первого полипептида и третьего полипептида, каждый из которых имеет первую антигенсвязывающую активность и включает участок Fc;
b) получение ассоциированной формы идентичных второго полипептида и четвертого полипептида, каждый из которых имеет вторую антигенсвязывающую активность, которая отличается от первой антигенсвязывающей активности, и включает участок Fc;
c) инкубация ассоциированной формы первых полипептидов и ассоциированной формы вторых полипептидов вместе при восстанавливающих условиях, которые позволяют цистеинам в шарнирных участках вызывать изомеризацию дисульфидной связи; и
d) получение мультиспецифичного IgG1 антитела, включающего первый и второй полипептиды, где аминокислотные остатки в положениях 356 и 439 в соответствии с нумерацией EU в СН3 участке, входящем в состав Fc участка первого полипептида, имеют одинаковый тип заряда, и аминокислотные остатки в положениях 356 и 439 в соответствии с нумерацией EU в СН3 участке, входящем в состав Fc участка второго полипептида, имеют одинаковый тип заряда, а аминокислотные остатки в положениях 356 и 439 в соответствии с нумерацией EU в СН3 участке второго полипептида, имеют заряд, противоположный таковому в аминокислотных остатках в положениях 356 и 439 в соответствии с нумерацией EU в СН3 участке первого полипептида,
где в первом и/или во втором полипептиде аминокислота в положении 397 согласно EU нумерации изменена на Met (M), Phe (F) или Туr (Y), и третий полипептид формирует мультимер с первым полипептидом, а четвертый полипептид формирует мультимер со вторым полипептидом.
2. Способ по п. 1, где аминокислотные остатки, которые имеют одинаковый тип заряда, выбирают из одного или более аминокислотных остатков, включенных в любую из следующих групп (А) и (В):
(А) глутаминовая кислота (Е) и аспарагиновая кислота (D); и
(В) лизин (K), аргинин (R) и гистидин (Н).
3. Способ по любому из пп. 1, 2, где в первом и/или втором полипептиде аминокислота изменяется таким образом, чтобы дестабилизировать стабильность СН3 участка первого и/или второго полипептида.
4. Способ по п. 3, где дополнительно в первом и/или втором полипептиде аминокислота в положении 392 в соответствии с нумерацией EU изменена.
5. Способ по п. 1, где Fc участок первого и/или второго полипептида представляет собой Fc участок, имеющий происхождение от мыши.
6. Способ по п. 1, где в первом и/или втором полипептиде аминокислота в положении 397 в соответствии с нумерацией EU изменена на Phe (F) или Туr (Y).
7. Способ по п. 4, где в первом и/или втором полипептиде аминокислота в положении 392 в соответствии с нумерацией EU изменена на Asp (D), Glu (Е), Thr (Т), Val (V) или Ilе (I).
8. Способ по любому из пп. 1, 2, где в первом полипептиде аминокислота в положении 356 в соответствии с нумерацией EU изменена на Lys (K), а аминокислота в положении 397 в соответствии с нумерацией EU изменена на Phe (F) или Туr (Y) и во втором полипептиде аминокислота в положении 397 в соответствии с нумерацией EU изменена на Phe (F) или Туr (Y), а аминокислота в положении 439 в соответствии с нумерацией EU изменена на Glu (Е).
9. Способ по п. 1, где этапы а) и b) осуществляют путем смешивания клеточной линии, которая продуцирует ассоциированную форму первых полипептидов, с клеточной линией, которая продуцирует ассоциированную форму вторых полипептидов, и этап с) осуществляют в культуральном супернатанте.
10. Способ по любому из пп. 1, 2 и 4-7, где мультиспецифичное IgG1 антитело представляет собой биспецифическое IgG1 антитело.
11. Способ по п. 1 или 9, где этап с) предусматривает контакт с восстанавливающим агентом.
12. Способ по п. 11, где этап с) предусматривает добавление активного вещества, выбранного из группы, которая состоит из глутатиона, L-цистеина, дитиотреитола, β-меркаптоэтанола, ТСЕР и 2-МЕА.
13. Способ по п. 12, где этап с) предусматривает добавление активного вещества, выбранного из глутатиона и 2-МЕА.
| EP 1870459 A1, 26.12.2007 | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| GUNASEKARAN, KANNAN, et al | |||
| "Enhancing antibody Fc heterodimer formation through electrostatic steering effects: applications to bispecific molecules and monovalent IgG." Journal of Biological Chemistry, 2010, 285(25):19637-19646 | |||
| SPIESS C | |||
| et al | |||
Авторы
Даты
2020-08-24—Публикация
2014-09-26—Подача