Протеинкиназы представляют собой большое семейство белков, которые играют центральную роль в регуляции широкого круга клеточных процессов и осуществляют контроль над клеточными функциями. Аномальная активность протеинкиназы связана с несколькими заболеваниями, в том числе псориазом и раковыми заболеваниями.
Известны ингибиторы киназы анапластической лимфомы (ALK), представляющие собой производные фосфора, запатентованные ARIAD Pharmaceuticals [США 2014/0066406 A1, WO 2009/143389]. В этой серии соединений самым известным является АР26113, также известный как Бригатиниб (Brigatinib), оральный ингибитор рецепторов тирозинкиназ, таких как киназы анапластической лимфомы (ALK) и рецептора эпидермального фактора роста (EGFR), предназначенный для лечения рака. Двойной ALK/EGFR ингибитор АР26113 связывает и ингибирует ALK и гибридные ALK белки, а также EGFR и его мутантные формы.
Следует отметить, что в публикациях имеет место путаница в химической структуре АР26113. Под этим номером опубликованы две структуры: CAS # 197958-12-5 и CAS #197953-54-0) [http://www.medkoo.com/Anticancer-trials/AP26113.htm]. Поэтому ниже эти ингибиторы будут обозначаться как АР26113(1) и АР26113(2).
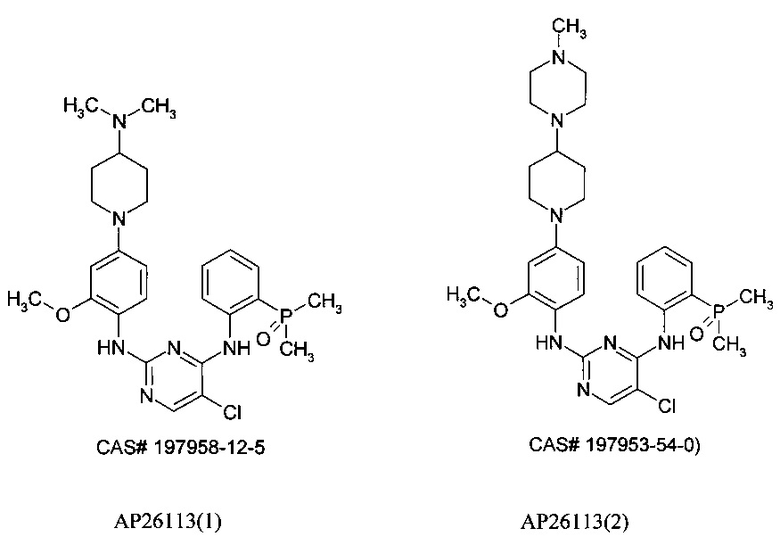
В настоящее время Бригатиниб (АР26113) демонстрирует в фазе 2 клинических испытаний эффективную внутричерепную противоопухолевую активность по отношению к ALK-положительному немелкоклеточному раку легких (NSCLC) у больных с метастазами в головном мозге, последовавшими после лечения Кризатинибом [http://www.esmo.org/Conferences/Past-Conferences/ELCC-2015-Lung-Cancer/News-Press-Releases/Brigatinib-AP26113-Shows-Intracranial-Anti-tumour-Activity-in-ALK-positive-NSCLC-patients-with-Brain-Metastasis-Following-Crizotinib].
В связи с большим количеством протеинкиназ и множеством связанных с ними заболеваний, создание новых классов селективных ингибиторов протеинкиназ для лечения заболеваний, обусловленных повышенной активностью протеинкиназ, остается актуальной задачей.
Ниже приведены определения терминов, которые использованы в описании этого изобретения.
«Активный компонент» (лекарственное вещество, лекарственная субстанция, drug-substance) означает физиологически активное вещество синтетического или иного (биотехнологического, растительного, животного, микробного и прочего) происхождения, обладающее фармакологической активностью и являющееся активным началом фармацевтической композиции, используемой для производства и изготовления лекарственного препарата (средства).
«Лекарственное средство (препарат)» - вещество (или смесь веществ в виде фармацевтической композиции) в виде таблеток, капсул, инъекций, мазей и других готовых форм, предназначенное для восстановления, исправления или изменения физиологических функций у человека и животных, а также для лечения и профилактики болезней, диагностики, анестезии, контрацепции, косметологии и прочего.
«Фармацевтическая композиция» обозначает композицию, включающую в себя активный компонент и, по крайней мере, один из компонентов, выбранных из группы, состоящей из фармацевтически приемлемых и фармакологически совместимых наполнителей, растворителей, разбавителей, носителей, вспомогательных, распределяющих и воспринимающих средств, средств доставки, таких как консерванты, стабилизаторы, наполнители, измельчители, увлажнители, эмульгаторы, суспендирующие агенты, загустители, подсластители, отдушки, ароматизаторы, антибактериальные агенты, фунгициды, лубриканты, регуляторы пролонгированной доставки, выбор и соотношение которых зависит от природы и способа назначения и дозировки. Примерами суспендирующих агентов являются этоксилированный изостеариловый спирт, полиоксиэтилен, сорбитол и сорбитовый эфир, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант, а также смеси этих веществ. Защита от действия микроорганизмов может быть обеспечена с помощью разнообразных антибактериальных и противогрибковых агентов, например, таких как парабены, хлорбутанол, сорбиновая кислота и подобные им соединения. Композиция может включать также изотонические агенты, например сахара, хлористый натрий и им подобные. Пролонгированное действие композиции может быть обеспечено с помощью агентов, замедляющих абсорбцию активного начала, например моностеарат алюминия и желатин. Примерами подходящих носителей, растворителей, разбавителей и средств доставки являются вода, этанол, полиспирты, а также их смеси, растительные масла (такие, как оливковое масло) и инъекционные органические сложные эфиры (такие как этилолеат). Примерами наполнителей являются лактоза, молочный сахар, цитрат натрия, карбонат кальция, фосфат кальция и им подобные. Примерами измельчителей и распределяющих средств являются крахмал, альгиновая кислота и ее соли, силикаты. Примерами лубрикантов являются стеарат магния, лаурилсульфат натрия, тальк, а также полиэтиленгликоль с высоким молекулярным весом. Фармацевтическая композиция для перорального, сублингвального, трансдермального, внутримышечного, внутривенного, подкожного, местного или ректального введения активного начала, одного или в комбинации с другим активным началом, может быть введена животным и людям в стандартной форме введения в виде смеси с традиционными фармацевтическими носителями. Пригодные стандартные формы введения включают пероральные формы, такие как таблетки, желатиновые капсулы, пилюли, порошки, гранулы, жевательные резинки и пероральные растворы или суспензии, сублингвальные и трансбуккальные формы введения, аэрозоли, имплантаты, местные, трансдермальные, такие как мази и кремы, подкожные, внутримышечные, внутривенные, интраназальные или внутриглазные формы введения и ректальные формы введения.
Цель настоящего изобретения заключается в создании новых модуляторов ALK и EGFR для лечения рака и других заболеваний.
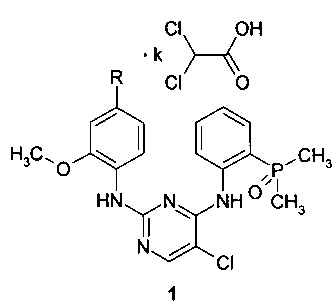
Поставленная цель достигается дихлорацетатами замещенных N4-[2-(диметилфосфорил)фенил]-N2-(2-метокси-4-пиперидин-1-илфенил)-5-хлорпиримидин-2,4-диаминов общей формулы 1.
Предметом настоящего изобретения являются неизвестные ранее дихлорацетаты замещенных N4-[2-(диметилфосфорил)фенил]-N2-(2-метокси-4-пиперидин-1-илфенил)-5-хлорпиримидин-2,4-диаминов общей формулы 1, их таутомеры и сольваты, которые представляют интерес в качестве модуляторов ALK и EGFR, предназначенных для лечения рака:
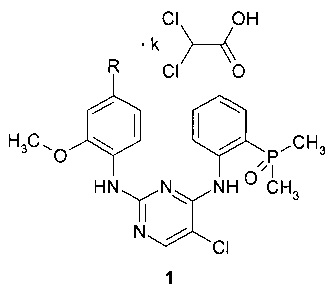
где R представляет собой диметиламиногруппу (соединение 1.1) или 4-метилпиперазин-1-ильный заместитель (соединение 1.2), а k представляет собой число 1, или 2, или 3.
Предметом настоящего изобретения являются ингибиторы киназ, в том числе и ALK и EGFR, которые представляют собой соединения общей формулы 1, их таутомеры и сольваты.
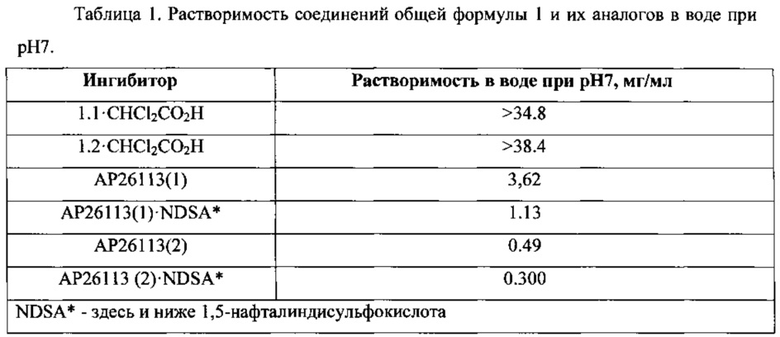
Основным преимуществом новых ингибиторов формулы 1 является более высокая их растворимость в водных средах, чем растворимость известных ингибиторов АР26113(1) и АР26113(2) и их 1,5-нафталиндисульфонатов АР26113(1)⋅NDSA и АР26113(2)⋅NDSA (Таблица 1). Так, например, в сопоставимых условиях растворимость нового ингибитора 1.2⋅CHCl2CO2H в водной среде при рН 7 (38,4 мг/мл) превышает примерно в 100 раз растворимость его аналога АР26113(2) и 1,5-нафталиндисульфоната (АР26113(2)⋅NDSA), растворимость которых составляет 0,49 мг/мл и 0,30 мг/мл соответственно. Аналогичная зависимость наблюдается и для нового ингибитора 1.1⋅CHCl2CO2H, растворимость которого радикально выше растворимости его аналога АР26113(1) и 1,5-нафталиндисульфоната (АР26113(1)⋅NDSA).
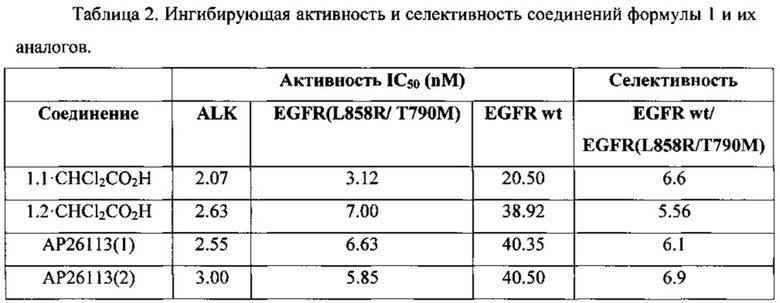
В сопоставимых условиях активность новых ингибиторов общей формулы 1 по отношению к ALK и EGFR[L858R/ Т790М] и селективность EGFR wt/EGFR(L858R/ Т790М несколько выше или сравнима с активностью известных ингибиторов АР26113 (Таблица 2).
Предметом настоящего изобретения являются также соединения формулы 1, пригодные для лечения у пациента рака и других заболеваний, в том числе при лечении у пациентов немелкоклеточного рака легких (NSCLC), в том числе с метастазами в головном мозге.
Предметом изобретения является фармацевтическая композиция, содержащая, по меньшей мере, одно соединение общей формулы 1 или его таутомер, стереоизомер, фармацевтически приемлемую соль или его сольват, и, по меньшей мере, один фармацевтически приемлемый наполнитель или добавку. Такая композиция может быть введена субъекту в случае необходимости подавлять рост, развитие рака и/или метастазов рака, в том числе твердых опухолей (например, рака предстательной железы, рака толстой кишки, поджелудочной железы и яичников, рака молочной железы, немелкоклеточного рака легкого (NSCLS), нейронных опухолей, таких как глиобластомы и нейробластомы; карциномы, рака мягких тканей); различных форм лимфомы, различных форм лейкемии и в том числе раковых заболеваний, устойчивых к другой обработке, в том числе тех, которые устойчивы к обработке другими ингибиторами киназ, и, как правило, для лечения и профилактики заболеваний или нежелательных состояний, обусловленных одной или более киназой, которые ингибируются соединениями по настоящему изобретению.
В соответствии с данным изобретением фармацевтическая композиции может быть в форме, подходящей для перорального применения (например, в виде таблеток, пастилок, твердых или мягких капсул, водных или масляных суспензий, эмульсий, диспергируемых порошков или гранул, сиропов или эликсиров), для местного применения (например, в виде кремов, мазей, гелей или водных или масляных растворов или суспензий), для введения путем ингаляции (например, в виде тонкоизмельченного порошка или жидкого аэрозоля), для введения путем инсуффляции (например, в виде тонкоизмельченного порошка) или для парентерального введения (например, в виде стерильного водного или масляного раствора для внутривенного, подкожного, внутримышечного введения дозы или в виде суппозиториев для ректального введения дозы).
Композиция по изобретению может быть получена обычными способами с использованием обычных фармацевтических наполнителей, хорошо известных в данной области. Таким образом, композиции, предназначенные для перорального применения, могут содержать, например, один или несколько окрашивающих, подслащивающих, вкусовых компонентов и/или консервант.
Соединения формулы 1 обычно вводят в теплокровного животного в единичной дозе в диапазоне 5-5000 мг/м2 площади тела животного, то есть примерно 0,1-100 мг/кг, и это обычно обеспечивает терапевтически эффективную дозу. Форма единичной дозы, такой как таблетка или капсула, обычно содержит, например, 1-250 мг активного ингредиента. Суточная доза обязательно будет варьироваться в зависимости от пациента, конкретного пути введения и тяжести заболевания, которое лечат. Соответственно, врач, который лечит конкретного пациента, может определить оптимальную дозу, учитывая ингибирующую активность против ALK и EGFR соединений общей формулы 1 и их таутомеров, стереоизомеров, сольватов, предназначенных для лечения заболеваний или медицинских состояний, обусловленных активностью ALK и EGFR, например рака.
Типы рака, которые могут быть восприимчивы к лечению с использованием соединений формулы 1 и их таутомеров, стереоизомеров, сольватов включают, но не ограничиваются лечением пациентов с немелкоклеточным раком легких (NSCLC), в том числе с метастазами в головном мозге.
Согласно другому аспекту настоящего изобретения, соединения формулы 1, как определено выше, или их таутомеры, стереоизомеры, сольваты предназначены для использования в качестве лекарственного средства.
В соответствии с настоящим изобретением предлагаются соединения формулы 1 и их таутомеры, стереоизомеры, сольваты для лечения заболевания, обусловленного активностью ALK и EGFR, в том числе для лечения ракового заболевания, обусловленного активностью ALK и EGFR.
Предметом настоящего изобретения является также производство лекарственного средства для лечения заболевания, обусловленного ALK и EGFR, предусматривающее использование соединения формулы 1 и его таутомера, стереоизомера, сольвата.
Предметом настоящего изобретения является также производство лекарственного средства для лечения рака, обусловленного ALK и EGFR, предусматривающее использование соединения формулы 1 и его таутомера, стереоизомера, фармацевтически приемлемой соли и сольвата.
Предметом настоящего изобретения является также лечение рака, обусловленного ALK и EGFR, предусматривающее использование соединения формулы 1 и его таутомера, стереоизомера, сольвата.
Предметом настоящего изобретения является также способ получения противоракового эффекта у пациента, нуждающегося в таком лечении, который включает введение указанному пациенту эффективного количества соединения формулы 1 или его таутомера, стереоизомера, сольвата.
В соответствии с настоящим изобретением предложен способ лечения человека, страдающего от заболевания, при котором выгодно ингибирование ALK и EGFR, в том числе рака, путем введения нуждающемуся в этом человеку терапевтически эффективного количества соединения формулы 1 или его таутомера, стереоизомера, сольвата.
В любом из аспектов или вариантов упомянутый в данном описании рак, указанный в общем смысле, может быть выбран из твердых опухолей (например, рака предстательной железы, рака толстой кишки, поджелудочной железы и рака яичников, рака молочной железы, немелкоклеточного рака легкого (NSCLS), нейронных опухолей, таких как глиобластомы и нейробластомы; карциномы, рака мягких тканей); различных форм лимфомы, таких как неходжкинская лимфома (NHL), известная как анапластическая крупноклеточная (ALCL), различные формы лейкемии; и в том числе рака, который устойчив к другим лекарствам, в том числе тех, которые устойчивы к ингибированию других киназ, и, как правило, для лечения и профилактики заболеваний или нежелательных состояний, обусловленных одной или более киназами, которые ингибируются соединениями по настоящему изобретению.
Изобретение относится также к способу лечения рака. Способ включает введение (в виде монотерапии или в комбинации с одним или несколькими другими противораковыми агентами, одним или несколькими агентами для облегчения побочных эффектов, излучение и т.д.) терапевтически эффективного количества соединения по настоящему изобретению нуждающемуся в этом человеку или животному, чтобы ингибировать, замедлить или уменьшить рост, развитие или распространение рака у реципиента, в том числе твердых опухолей или других форм рака, таких как лейкозы. Такое введение представляет собой способ лечения или профилактики заболеваний, обусловленных одной или несколькими киназами, путем их ингибирования одним из соединений формулы 1 или его фармацевтически приемлемым производным. "Администрация" включает доставку соединения формулы 1, или его пролекарства, или другого его фармацевтически приемлемого производного с использованием любого подходящего состава или способа введения. Обычно соединение вводят один или несколько раз в месяц, часто один или более раз в неделю, например ежедневно, через день, 5 дней/неделя и т.д. Наиболее предпочтительными являются оральный и внутривенный способы введения.
Противораковое лечение, описанное выше, может быть применено в качестве единственной терапии или может включать в дополнение использование соединения по настоящему изобретению к обычной хирургии или лучевой терапии или химиотерапии или иммунотерапии. Такая химиотерапия может вводиться одновременно, одновременно-последовательно или раздельно с лечением соединением по изобретению и может включать одну или более из следующих категорий противоопухолевых агентов: антипролиферативные/противоопухолевые препараты и их комбинации, используемые в медицинской онкологии; цитостатические агенты; агенты антивторжение; ингибиторы функции фактора роста; антиангиогенные агенты; сосудистые средства; антагонисты эндотелиновых рецепторов; антисмысловые терапии; подходы генной терапии и подходы иммунотерапии.
Таким образом, предметом настоящего изобретения является также фармацевтический продукт для комбинированного лечения рака, включающий соединение формулы 1 или его таутомер, стереоизомер, сольват и дополнительно противоопухолевое вещество, как определено выше.
Здесь, где термин "совместное лечение" используют по отношению к комбинированной терапии, следует понимать, что это может относиться к одновременному, раздельному или последовательному введению. В одном аспекте изобретения "комбинированное лечение" относится к одновременному введению. В другом аспекте настоящего изобретения "комбинированное лечение" относится к раздельному введению. В третьем аспекте настоящего изобретения "комбинированное лечение" относится к последовательному введению. Если введение последовательное или раздельное, задержка во введении второго компонента не должна быть такой, чтобы сохранить эффективность эффекта, возникающего в результате использования комбинации.
Таким образом, одним из вариантов изобретения является применение соединения формулы 1 или его таутомера, стереоизомера, сольвата и дополнительно противоопухолевого вещества для совместной терапии рака.
Предметом настоящего изобретения является также способ получения противоракового эффекта у нуждающегося в таком лечении теплокровного животного и человека, который включает введение указанным млекопитающим соединения формулы 1 или его таутомера, стереоизомера, сольвата и одновременное, раздельное или последовательное введение дополнительного противоопухолевого вещества указанному млекопитающему, в количествах, совместно обеспечивающих получение противоракового эффекта.
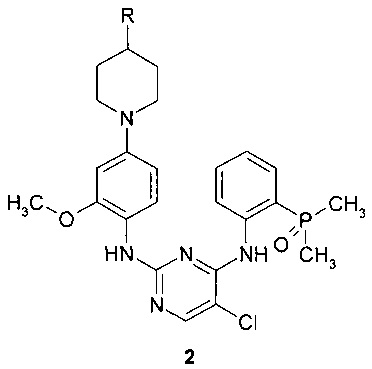
Предметом данного изобретения является также способ получения соединения формулы 1 путем взаимодействия соединения общей формулы 2 с 2,2-дихлоруксусной кислотой.
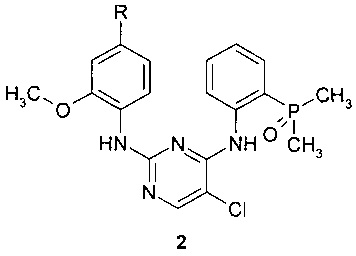
где R представляет собой диметиламиногруппу или 4-метилпиперазин-1-ильный заместитель.
Ниже изобретение описано более подробно с помощью конкретных примеров. Следующие примеры представлены с целью иллюстрации и не предназначены для ограничения изобретения каким-либо образом. Специалисты в данной области техники легко поймут различие некритических параметров, которые могут быть изменены или модифицированы, чтобы получить те же результаты.
Пример 1. Общий способ получения дихлорацетатов N4-[2-(диметил-фосфорил)-фенил]-N2-(2-метокси-4-пиперидин-1-ил-фенил)-5-хлор-пиримидин-2,4-диаминов (1.1⋅kCHCl2CO2H-1.17⋅kCHCl2CO2H). К раствору 0,17 ммоль N4-[2-(диметил-фосфорил)-фенил]-N2-(2-метокси-4-пиперидин-1-ил-фенил)-5-хлор-пиримидин-2,4-диамина (1.1-1.17) в смеси из 4 мл ацетона и 4 мл этанола добавляют при 25°С 1, 2 или 3 эквивалента (соответственно 22 мг, 44 мг или 66 мг) дихлоруксусной кислоты в виде раствора в 2 мл ацетона. Полученную смесь перемешивают в течение 20 ч, осадок отфильтровывают и сушат на воздухе или в вакууме. Если в результате реакции осадок не образуется, то реакционную массу упаривают в вакууме, к остатку добавляют 3 мл диэтилового эфира и перемешивают ультразвуком. Образующийся осадок отфильтровывают, промывают эфиром, сушат на воздухе или в вакууме. Получают ингибитор (1.1⋅kCHCl2CO2H-1.17⋅kCHCl2CO2H) с выходом 79-95%. N2-[4-(4-диметиламино-пиперидин-1-ил)-2-метоксифенил]-N4-[2-(диметилфосфорил)-фенил]-5-хлор-пиримидин-2,4-диамина дихлорацетат (1.1⋅CHCl2CO2H): LC-MS (ESI) 530 (М+Н)+; 1Н NMR (DMSO-d6, 400 MHz) δ 11.17 (s, 1Н), 8.49 (br, 1H), 8.08 (s, 1H) 8.07 (s, 1H), 7.53 (m, 1H), 7.42 (d, J=8.4 Hz, 1H), 7.36 (t, J=8 Hz, 1H), 7.10 (t, J=7.6 Hz, 1H), 6.65 (m, 1H), 6.51 (m, 1H), 6.11 (s, 1H), 3.85 (d, J=12.8 Hz, 2H), 3.77 (s, 3H), 3.28 (m. 1H), 2.77 (s, 6H), 2.69 (t, 11.6 Hz, 2H) 2.08 (m, 2H), 1.78 (s, 3H), 1.74 (s, 3H), 1.73 (m, 2H).
N4-[2-(диметилфосфорил)-фенил]-5-хлор-пиримидин-2,4-диамина бис-дихлорацетат (1.1⋅2CHCl2CO2H): LC-MS (ESI) 530 (M+H)+.
N4-[2-(диметилфосфорил)-фенил]-N2-{4-[4-(4-метилпиперазин-1-ил)-пиперидин-1-ил]-2-метоксифенил}-5-хлор-пиримидин-2,4-диамина дихлорацетат (1.9⋅CHCl2CO2H): LC-MS (ESI) 585 (M+H)+; 1H-NMR (DMSO-d6, 400 MHz): 11.16 (s, 1H), 8.5 (br.s, 1H), 8.06 (s, 2H), 7.60-7.45 (m 1H), 7.45-7.28 (m, 2H), 7.15-7.05 (m, 1H), 6.63 (br.s, 1H), 6.52-6.44 (m, 1H), 5.96 (br.s, 1H), 3.90-2.56 (m, 19H), 1.95-1.85 (m, 2H), 1.77 (s, 3H), 1.74 (s, 3H), 1.65-1.50 (m, 2H). N4-[2-(диметилфосфорил)-фенил]-N2-{4-[4-(4-метилпиперазин-1-ил)-пиперидин-1-ил]-2-метоксифенил}-5-хлор-пиримидин-2,4-диамина трис-дихлорацетат (1.9⋅3CHCl2CO2H): LC-MS (ESI) 585 (M+H)+.
Пример 2. Способ получения ингибиторов-прототипов АР26113(1), АР26113(2).
Ингибиторы АР26113(1) и АР26113(2) получены по аналогии с протоколом, описанным в патентной заявке США [США 2014/0066406 А1]. N2-[4-(4-диметиламино-пиперидин-1-ил)-2-метоксифенил]-N4-[2-(диметилфосфорил)-фенил]-5-хлор-пиримидин-2,4-диамин (АР26113(1)): LC-MS (ESI) 530 (М+Н)+; 1Н NMR (DMSO-d6, 400 MHz) δ 11.17 (s, 1Н), 8.48 (br, 1H), 8.06 (s, 1H) 8.04 (s, 1H), 7.52 (m, 1H), 7.39 (d, J=10.4 Hz, 1H), 7.34 (t, J=8 Hz, 1H), 7.09 (t, J=6.8 Hz, 1H), 6.63 (m, 1H), 6.47 (m, 1H), 3.76 (s, 3H), 3.71 (br. d, J=12.4 Hz, 2H), 2.67 (t, 11.2 Hz, 2H) 2.22 (br, 7H) 1.85 (d, J=12.8 Hz, 2H), 1.78 (s, 3H), 1.74 (s, 3H), 1.50 (m, 2H). N4-[2-(диметилфосфорил)-фенил]-N2-{4-[4-(4-метилпиперазин-1-ил)-пиперидин-1-ил]-2-метоксифенил}-5-хлор-пиримидин-2,4-диамин (AP26113(2)): LC-MS (ESI) 585 (M+H)+; 1H-NMR, (CDCl3, 400 MHz): 10.81 (br.s, 1H), 8.68-8.60 (m, 1H), 8.13-8.06 (m, 2H), 7.55-7.45 (m, 1H), 7.35-7.23 (m, 2H), 7.16-7.08 (m, 1H), 6.56 (d, J=2.3Hz, 1H), 6.50 (dd, J1=8.9Hz, J2=8.9Hz, 1H), 3.87 (s, 3H), 3.67 (d, J=12.2Hz, 2H), 2.80-2.36 (m, 11H), 2.34 (s, 3H), 2.04-1.95 (m, 2H), 1.85 (s, 3H), 1.82 (s, 3H), 1.80-1.66 (m, 2H).
Пример 3. Способ получения N2-[4-(4-диметиламино-пиперидин-1-ил)-2-метоксифенил]-N4-[2-(диметилфосфорил)-фенил]-5-хлор-пиримидин-2,4-диамин нафталин-1,5-дисульфоната (АР26113(1) NDSA). К раствору (,05 г (0,1 ммоль) N2-[4-(4-диметиламино-пиперидин-1-ил)-2-метоксифенил]-N4-[2-(диметилфосфорил)-фенил]-5-хлор-пиримидин-2,4-диамина (АР26113(1)) в 4 мл ацетона при 25°С добавляли раствор 0.034 г (0,1 ммоль) нафталин-1,5-дисульфокислоты в 1 мл ацетона или раствор 0.036 г (0,2 ммоль) 4-метилбензолсульфокислоты в мл ацетона. Полученную смесь перемешивали в течение 20 ч. Осадок отфильтровывали и сушили на воздухе до постоянного веса. Получали ингибитор АР26113(1)⋅NDSA: 1H-NMR (DMSO-d6, 400 MHz): 1.60-1.76 (m, 2H),1.78 (s,3H), 1.81 (s, 3H), 2.02-2.12 (m, 2H), 2.70-2.77 (m, 2H),2.77 (s, 3H), 2.78 (s, 3H), 3.26-3.39 (m, 1H), 3.79 (s, 3H), 3.89 (d, J=12.8Hz, 2H), 6.59 (d, J=8.2, 1H), 6.74 (s, 1H), 7.19-7.27 (m, 1H) 7.33 (d, J=8.1Hz, 1H), 7.41 (dd, J1=7.2, J2=8.6Hz, 3H), 7.58-7.68(m, 1H), 7.94 (d, J=7.2Hz, 2H), 8.21 (s, 1H), 8.43 (br.s, 1H), 8.87 (d, J=8.6Hz, 2H), 9.45 (br.s, 1H), 12.03 (br.s, 1H).
Пример 4. Способ получения N4-[2-(диметилфосфорил)-фенил]-N2-{4-[4-(4-метилпиперазин-1-ил)-пиперидин-1-ил]-2-метоксифенил}-5-хлор-пиримидин-2,4-диамин нафталин-1,5-дисульфоната (АР26113(2)⋅NDSA). К раствору 0,1 г (0,17 ммоль) N4-[2-(диметилфосфорил)-фенил]-N2-{4-[4-(4-метилпиперазин-1-ил)-пиперидин-1-ил]-2-метоксифенил}-5-хлор-пиримидин-2,4-диамина (АР26113(2)) в смеси 4 мл ацетона и 4 мл этанола при 25°С добавляли раствор 0.062 г (0,17 ммоль) 1,5-нафталин-дисульфокислоты в 1 мл ацетона. Полученную смесь перемешивали в течение 20 ч, осадок отфильтровывали и сушили на воздухе до постоянного веса. Получали ингибитор АР26113(2)⋅NDSA: 1H-NMR (DMSO-d6, 400 MHz): 11.52 (br.s, 1H), 8.9 (d, J=8.4Hz, 2H), 8.80-8.30 (m, 2H), 8.14 (br.s, 1H), 7.98 (d, J=7.1Hz, 2H), 7.64-7.54 (m, 1H), 7.52-7.36 (m, 4H), 7.16 (t, J=7.2Hz, 1H), 6.90-6.50 (m, 2H), 4.00-2.70 (m, 19H), 2.05-1.90 (m, 2H), 1.79 (s, 3H), 1.76 (s, 3H), 1.70-1.55 (m, 2H).
Пример 5. Определение термодинамической растворимости соединения формулы 1 и прототипов. Смешивали 5 мг исследуемого соединения с 1 мл универсального буфера (pION) с рН 7,0 в течение 15 мин при 25°С. Дополнительные количества веществ добавляли до тех пор, пока раствор не становился мутным. Виалы с раствором инкубировали при перемешивании в течение 24 ч при 25°С для достижения равновесия между раствором и осадком при насыщении. После уравновешивания 200 мкл раствора (в 2-х повторах) фильтровали через 96-луночный фильтровальный планшет (Millipore) для отделения осадка. Концентрацию соединений в фильтрате определяли спектрофотометрически с помощью стандартной калибровочной кривой. Проводили измерение спектра оптического поглощения вещества и построение калибровочной кривой при выбранной длине волны (обычно соответствующей максимуму поглощения вещества λmax). Концентрацию вещества в фильтрате (т.е. растворимость) рассчитывали по нижеприведенной формуле:
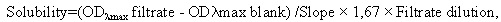
где ODλmax filtrate - оптическая плотность фильтрата,
ODλmax blank - оптическая плотность холостого раствора без вещества,
Slope - наклон калибровочной кривой,
1,67 - фактор разведения фильтрата ацетонитрилом,
Filtrate dilution - фактор разведения фильтрата буфером.
Полученные результаты представлены в Таблице 1.
Пример 6. Активность соединений по отношению к ALK. Соединения формулы 1 и прототипы тестировали по влиянию на активность ALK с помощью скрининговой платформы Z'-LYTE (Life Technologies). Концентрация ДМСО в реакционной смеси составляла 1%. 100 нл 100-кратных стоков исследуемых веществ в 100% ДМСО были разбавлены в 2.4 мкл киназного буфера (50 мМ HEPES pH 7.5, 0.01% BRIJ-35, 10 мМ MgCl2, 1 мМ EGTA) и добавлены к 5 мкл 2-кратной смеси Субстрат/Киназа (ALK/Tyr01, финальные концентрации - 4.24-96 нг ALK и 2 мкМ Tyr01) в 384-луночном планшете (черные, малого объема, производство Corning, кат. #3676). Вещества преинкубировали с киназами в течение 10 мин при комнатной температуре. После этого для начала реакции добавляли 2.5 мкл 4-кратного раствора АТФ (конечная концентрация АТФ в реакционной смеси 25 мкМ). После 30 с инкубации на шейкере реакцию инкубировали в течение 60 мин при комнатной температуре. После этого добавляли 5 мкл Реагента В (разбавленного 1:256) и инкубировали еще 60 мин при комнатной температуре. Измеряли флуоресценцию при возбуждении длиной волны 400 нм и эмиссии при 445 и 520 нм. Степень фосфорилирования пептидного субстрата рассчитывали по формуле ниже (если отношение эмиссии низкое - пептид фосфорилирован, т.е. нет ингибирования активности киназы, если отношение высокое - пептид не фосфорилирован, т.е. киназа ингибирована).
% фосфорилирования рассчитывается по формуле, указанной на странице 6 в стандартном протоколе скрининга Z'-LYTE (Life Technologies).
Полученные результаты представлены в Таблице 2.
Пример 7.
Активность соединений по отношению к EGFR. Соединения формулы 1 и прототипы тестировали по влиянию на активность двойного мутанта EGFR(L858R/T790M) и дикого EGFR wt (все ферменты предоставлены Invitrogen Corp., каталожные номера PV3872, PV4128 and PV4803, соответственно) с помощью скрининговой платформы Z'-LYTE (производство Life Technologies). Концентрация ДМСО в реакционной смеси составляла 1%. 5 мкл 2-кратной смеси Субстрат/Киназа (Tyr4/EGFRwt или EGFR-L858R или EGFR-Т790М, конечные концентрации - 0.5 мкМ для субстрата Tyr 4 и 1000, 250, 1000 нг/мл для EGFRwt или EGFR-L858R или EGFR-T790M соответственно) были добавлены в 384-луночные планшеты (черные, малого объема, производство Corning, кат. #3676). 1.5 мкл 100-кратных стоков исследуемых веществ в 100% ДМСО были разбавлены в 10 раз в 13.5 мкл киназного буфера (50 мМ HEPES pH 6.5, 0.01% BRIJ-35, 10 мМ MgCl2, 1 мМ EGTA, 0.02% NaN3) и затем 1 мкл разбавленных веществ добавляли к смеси Субстрат/Киназа. Вещества преинкубировали с киназами в течение 10 мин при комнатной температуре. После этого для начала реакции добавляли 4 мкл 2.5-кратного раствора АТФ (конечная концентрация АТФ в реакционной смеси была 180 или 100 или 40 мкМ для EGFRwt, EGFR-L858R и EGFR-T790M соответственно). После 30 с инкубации на шейкере реакцию инкубировали в течение 60 мин при комнатной температуре. После этого добавляли 5 мкл Реагента В (разбавленного 1:500) и инкубировали еще 60 мин при комнатной температуре. Измеряли флуоресценцию при возбуждении длиной волны 400 нм и эмиссии при 445 и 520 нм. Степень фосфорилирования пептидного субстрата рассчитывали по формуле ниже (если отношение эмиссии низкое - пептид фосфорилирован, т.е. нет ингибирования активности киназы, если отношение высокое - пептид не фосфорилирован, т.е. киназа ингибирована).
% фосфорилирования рассчитывается по формуле, указанной на странице 6 в стандартном протоколе скрининга Z'-LYTE (Life Technologies).
Концентрационная кривая зависимости активности киназы от концентрации тестируемых веществ строилась с использованием сигмоидной модели.
Полученные результаты представлены в Таблице 2.
Пример 8. Приготовление лекарства в виде таблеток. Смешивали, а затем спрессовывали в брусок 1600 мг крахмала, 1600 мг измельченной лактозой, 400 мг талька и 1000 мг ингибитора 1.1⋅CHCl2CO2H. Полученный брусок измельчали в гранулы и просеивают через сита, собирая гранулы размером 14-16 меш. Полученные гранулы таблетировали в таблетки, пригодных форм весом 500 мг каждая.
Пример 9. Приготовление лекарства в виде капсул. Ингибитор 1.1⋅CHCl2CO2H тщательно смешивали с порошком лактозы в соотношении 2:1. Полученную порошкообразную смесь упаковывали по 600 мг в желатиновые капсулы подходящего размера.
Пример 10. Приготовление лекарства в виде композиций для внутримышечных, внутрибрюшинных или подкожных инъекций. Смешивали 500 мг ингибитора 1.1⋅CHCl2CO2H, 300 мг хлорбутанола, 2 мл пропиленгликоля и 100 мл воды для инъекций. Раствор фильтровали и помещали в 1 мл в ампулы, которые укупоривали.
Специалисты в данной области техники легко поймут различие некритических параметров, которые могут быть изменены или модифицированы, чтобы достичь тех же результатов, представленных в изобретении. Различные модификации изобретения, в дополнение к описанным здесь, станут очевидными специалистам в данной области техники из приведенного выше описания.
Изобретение относится к новым соединениям - дихлорацетатам замещенных N4-[2-(диметилфосфорил)фенил]-N2-(2-метокси-4-пиперидин-1-илфенил)-5-хлорпиримидин-2,4-диаминов общей формулы 1, которые являются модуляторами ALK и EGFR и могут быть использованы для профилактики и/или лечения рака, в частности для лечения немелкоклеточного рака клеток легких (NSCLC), в том числе с метастазами в головном мозге. В формуле 1
R представляет собой диметиламиногруппу или 4-метилпиперазин-1-ильный фрагмент, а k представляет собой число 1, 2 или 3. Изобретение также относится к фармацевтической композиции, содержащей указанное соединение в качестве активного компонента в терапевтически эффективном количестве в сочетании с фармацевтически приемлемым разбавителем и/или носителем. Причем композиция может быть выполнена в форме таблеток, капсул или инъекций, помещенных в фармацевтически приемлемую упаковку. Изобретение также относится к способу получения соединения формулы 1 взаимодействием соединения общей формулы 2, где R представляет собой диметиламиногруппу или 4-метилпиперазин-1-ильный фрагмент, с 1, 2 или 3 эквивалентами 2,2-дихлоруксусной кислоты. 7 н. и 4 з.п. ф-лы, 2 табл., 10 пр.
1. Дихлорацетаты замещенных N4-[2-(диметилфосфорил)фенил]-N2-(2-метокси-4-пиперидин-1-илфенил)-5-хлор-пиримидин-2,4-диаминов общей формулы 1
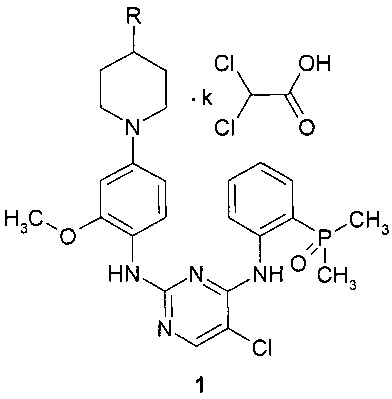
где R представляет собой диметиламиногруппу или 4-метилпиперазин-1-ильный фрагмент, а k представляет собой число 1, 2 или 3.
2. Активный компонент, обладающий противораковым действием, представляющий собой соединение общей формулы 1 по п. 1 для получения лекарственного средства.
3. Соединения по п. 1 для получения лекарственного средства для профилактики и/или лечения рака.
4. Противораковая фармацевтическая композиция, содержащая активный компонент по п. 2 в терапевтически эффективном количестве в сочетании с фармацевтически приемлемым разбавителем и/или носителем.
5. Противораковая фармацевтическая композиция по п. 4 в форме таблеток, капсул или инъекций, помещенных в фармацевтически приемлемую упаковку.
6. Способ профилактики и/или лечения рака, включающий введение эффективного количества соединения общей формулы 1 по п. 1.
7. Способ профилактики и/или лечения рака, включающий введение эффективного количества фармацевтической композиции по п. 4 или 5.
8. Способ по п. 6, для профилактики и/или лечения немелкоклеточного рака легких (NSCLC), в том числе с метастазами в головном мозге.
9. Способ изготовления фармацевтической композиции путем смешения соединения общей формулы 1 по п. 1 с фармацевтически приемлемыми разбавителем и/или носителем.
10. Способ изготовления фармацевтической композиции по п. 9 в форме, пригодной для лечения немелкоклеточного рака клеток легких (NSCLC), в том числе с метастазами в головном мозге.
11. Способ получения соединения формулы 1 взаимодействием соединения общей формулы 2 с 1, 2 или 3 эквивалентами 2,2-дихлоруксусной кислоты
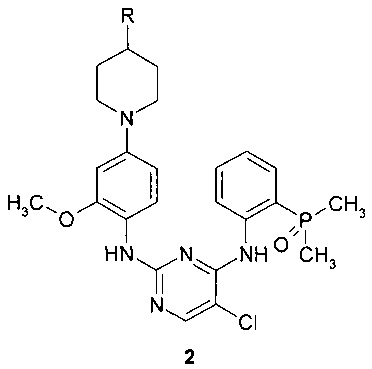
где R представляет собой диметиламиногруппу или 4-метилпиперазин-1-ильный фрагмент.
| US 20140066046 A1, 06.03.2014 | |||
| АЛКИЛ 2-{ [(2R,3S,5R)-5-(4-АМИНО-2-ОКСО-2Н-ПИРИМИДИН-1-ИЛ)- -ГИДРОКСИ-ТЕТРАГИДРО-ФУРАН-2-ИЛМЕТОКСИ]-ФЕНОКСИ-ФОСФОРИЛАМИНО} -ПРОПИОНАТЫ, НУКЛЕОЗИДНЫЕ ИНГИБИТОРЫ РНК-ПОЛИМЕРАЗЫ HCV NS5B, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2013 |
|
RU2534613C2 |
Авторы
Даты
2017-01-10—Публикация
2015-11-19—Подача