Изобретение относится к дихлорацетату N1,N2-дизамещенного N4-[4-(1-метил-1Н-индол-3-ил)-пиримидин-2-ил]-5-метоксибензол-1,2,4-триамина, который может быть пригодным для лечения или профилактики заболевания или медицинского состояния, обусловленного определенными мутантными формами рецептора эпидермального фактора роста (EGFR), например мутанты L858R, Exon 19 и Т790М. Это соединение может быть использовано при лечении или профилактике ряда различных видов рака. Изобретение также относится к фармацевтическим композициям, содержащим указанное соединение и его полиморфные формы, к способам их получения и к способам лечения заболеваний, обусловленных различными формами EGFR, с помощью указанного соединения.
Известен ряд необратимых ингибиторов второго поколения, содержащих аминохиназолиновый фрагмент Гефитиниба. Эти ингибиторы содержат акриламидный заместитель, который ковалентно связывается с Cys-797, который расположен в канале растворителя киназы. К этому типу ингибиторов относятся Афатиниб, Канертиниб, Докомитиниб и WZ-4002. Ковалентный механизм связывания, как полагают, способствует преодолению АТФ сродства двойного мутанта, в результате чего эти соединения в клеточных моделях демонстрируют высокую активность. Тем не менее, мутант Cys-797 присутствует во всех соответствующих формах EGFR. Эти соединения второго поколения обладают не только повышенной активностью по отношению к устойчивым мутантам, но и по отношению к EGFR дикого типа. Ингибирование дикого типа EGFR не вносит свой вклад в их клиническую эффективность, но, как полагают, снижает побочные эффекты (кожная сыпь и диарея). Поскольку эти побочные эффекты, как правило, ограничивают дозу у пациентов, то активность этих ингибиторов против дикого типа EGFR ограничит их активность у пациентов против мутации Т790М.
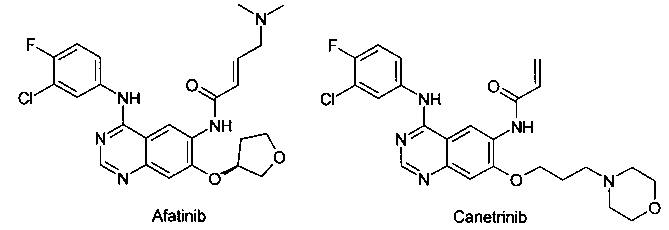
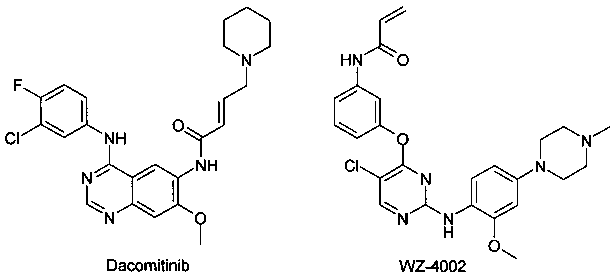
Компания АстраЗенека недавно запатентовала 2-(2,4,5-замещенные анилино)пиримидины в качестве модуляторов EGFR, полезных для лечения рака, включая модулятор AZD-9291 [Butterworrth, S.; Раймонд, М.; Финлей В. и др. 2-(2,4,5-Замещенные анилино)пиримидины как модуляторы EGFR, полезные для лечения рака. WO 2013014448]. Модулятор AZD-9291 наиболее продвинут и в 2015 г. по результатам нескольких Фаз III клинических испытаний [AstraZeneca, NCT02151981; AstraZeneca, NCT02296125] был одобрен FDA (США) в качестве препарата для лечения больных с мутацией рецептора эпидермального фактора роста EGFRm немелкоклеточного рака легкого (NSCLC), которые также имеют резистентную мутацию Т790М [https://www.astrazeneca.com/our-company/media-centre/press-releases/2015/astrazeneca-non-small-cell-lung-cancer-medicine-data-european-lung-cancer-congress-17042015.html].
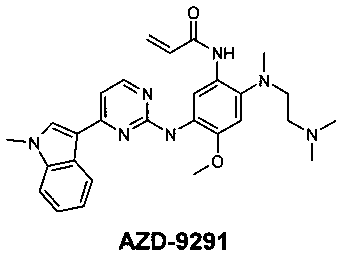
Однако до сих пор остается потребность в соединениях, которые наряду с благоприятным профилем активности против EGFR имеют более высокую растворимость в водных средах. Такие соединения, как ожидается, могут больше подходить в качестве терапевтических агентов.
Заявители неожиданно обнаружили, что дихлорацетат N1,N2-дизамещенного N4-[4-(1-метил-1Н-индол-3-ил)-пиримидин-2-ил]-5-метоксибензол-1,2,4-триамина общей формулы 1 наряду с высокой эффективностью против EGFR обладает более высокой растворимостью в водных средах, чем известный препарат AZD-9291.
Соединение общей формулы 1 по изобретению может также проявлять и другие выгодные физико-химические и биологические свойства (например, высокую проницаемость и/или низкое связывание белков плазмы) и/или благоприятные характеристики токсичности (например, уменьшилось блокирования HERG) и/или благоприятные метаболические профили по сравнению с другими известными ингибиторами EGFR. Таким образом, например, соединение общей формулы 1 может быть особенно полезным в лечении болезненных состояний, в которых вовлечены EGFR, например в лечении рака.
Ниже приведены определения терминов, которые использованы в описании этого изобретения.
«Активный компонент» (лекарственное вещество, лекарственная субстанция, drug-substance) означает физиологически активное вещество синтетического или иного (биотехнологического, растительного, животного, микробного и прочего) происхождения, обладающее фармакологической активностью и являющееся активным началом фармацевтической композиции, используемой для производства и изготовления лекарственного препарата (средства).
«Лекарственное средство (препарат)» - вещество (или смесь веществ в виде фармацевтической композиции) в виде таблеток, капсул, инъекций, мазей и других готовых форм, предназначенное для восстановления, исправления или изменения физиологических функций у человека и животных, а также для лечения и профилактики болезней, диагностики, анестезии, контрацепции, косметологии и прочего.
«Фармацевтическая композиция» обозначает композицию, включающую в себя активный компонент и, по крайней мере, один из компонентов, выбранных из группы, состоящей из фармацевтически приемлемых и фармакологически совместимых наполнителей, растворителей, разбавителей, носителей, вспомогательных, распределяющих и воспринимающих средств, средств доставки, таких как консерванты, стабилизаторы, наполнители, измельчители, увлажнители, эмульгаторы, суспендирующие агенты, загустители, подсластители, отдушки, ароматизаторы, антибактериальные агенты, фунгициды, лубриканты, регуляторы пролонгированной доставки, выбор и соотношение которых зависит от природы и способа назначения и дозировки. Примерами суспендирующих агентов являются этоксилированный изостеариловый спирт, полиоксиэтилен, сорбитол и сорбитовый эфир, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант, а также смеси этих веществ. Защита от действия микроорганизмов может быть обеспечена с помощью разнообразных антибактериальных и противогрибковых агентов, например, таких как парабены, хлорбутанол, сорбиновая кислота и подобные им соединения. Композиция может включать также изотонические агенты, например сахара, хлористый натрий и им подобные. Пролонгированное действие композиции может быть обеспечено с помощью агентов, замедляющих абсорбцию активного начала, например моностеарат алюминия и желатин. Примерами подходящих носителей, растворителей, разбавителей и средств доставки являются вода, этанол, полиспирты, а также их смеси, растительные масла (такие как оливковое масло) и инъекционные органические сложные эфиры (такие как этилолеат). Примерами наполнителей являются лактоза, молочный сахар, цитрат натрия, карбонат кальция, фосфат кальция и им подобные. Примерами измельчителей и распределяющих средств являются крахмал, альгиновая кислота и ее соли, силикаты. Примерами лубрикантов являются стеарат магния, лаурилсульфат натрия, тальк, а также полиэтиленгликоль с высоким молекулярным весом. Фармацевтическая композиция для перорального, сублингвального, трансдермального, внутримышечного, внутривенного, подкожного, местного или ректального введения активного начала, одного или в комбинации с другим активным началом, может быть введена животным и людям в стандартной форме введения в виде смеси с традиционными фармацевтическими носителями. Пригодные стандартные формы введения включают пероральные формы, такие как таблетки, желатиновые капсулы, пилюли, порошки, гранулы, жевательные резинки и пероральные растворы или суспензии, сублингвальные и трансбуккальные формы введения, аэрозоли, имплантаты, местные, трансдермальные, такие как мази и кремы, подкожные, внутримышечные, внутривенные, интраназальные или внутриглазные формы введения и ректальные формы введения.
Цель изобретения заключается в создании новых ингибиторов EGFR для лечения рака.
Поставленная цель достигается дихлорацетатом N-{2-[(2-диметиламиноэтил)-метил-амино]-5-[4-(1-метил-1Н-индол-3-ил)-пиримидин-2-иламино]-4-метоксифенил}-акриламида общей формулы 1
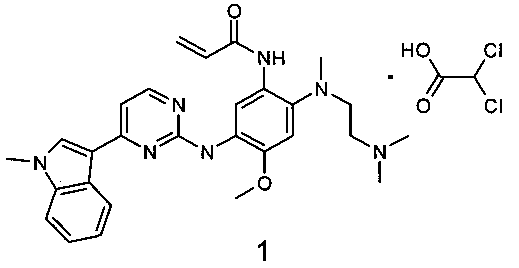
Предметом изобретения является также ингибитор EGFR, представляющий собой дихлорацетат N-{2-[(2-диметиламиноэтил)-метил-амино]-5-[4-(1-метил-1Н-индол-3-ил)-пиримидин-2-иламино]-4-метоксифенил}-акриламида общей формулы 1 или его сольват.
Соединение общей формулы 1 может существовать в сольватированных и несольватированных формах. Например, в виде гидрата. Изобретение охватывает все такие сольватированные и несольватированные формы.
Основным преимуществом нового ингибитора EGFR общей формулы 1 является его значительно более высокая растворимость в водных средах, чем растворимость AZD-9291. Так растворимость соединения общей формулы 1 в воде при рН7 составляет 1.43 мг/мл и более чем в 238 раз превышает растворимость AZD-9291 (<0.006 мг/мл). Растворимость ингибитора общей формулы 1 в воде и при рН 2 примерно в два раза выше растворимости AZD-9291 (таблица 1). Более того, растворимость ингибитора общей формулы 1 в водных средах значительно выше растворимости других солей AZD-9291 (нафталин-1,5-дисульфоната (AZD-9291 NDSA) и паратолуолсульфоната (AZD-9291 PTSA)), специально полученных для сравнительных исследований.

Активность ингибитора общей формулы 1 против двойной мутантной формы EGFR(L858R/T790M) в условиях протокола скрининга Life Technologies сравнима с активностью известного ингибитора AZD-9291 (таблица 2).
Изобретение относится к соединению общей формулы 1, которое ингибирует EGFR мутации, например L858R мутант, Exon 19 удаленнный EGFR мутант и резистентный Т790М мутант. Предпочтительно это соединение может быть использовано для лечения рака, устойчивого к существующей терапии.
Согласно изобретению соединение общей формулы 1 показывает более высокую растворимость в водных средах и, как ожидается, будет больше подходить в качестве терапевтического агента, особенно для лечения рака.
Предметом изобретения является способ получения соединения общей формулы 1 взаимодействием N-{2-[(2-диметиламинозтил)-метил-амино]-5-[4-(1-метил-1Н-индол-3-ил)-пиримидин-2-иламино]-4-метоксифенил}-акриламида с дихлоруксусной кислотой.
Предметом изобретения является активный компонент, обладающий противораковой активностью, для приготовления фармацевтической композиции и лекарственных форм, представляющий собой дихлорацетат N-{2-[(2-диметиламиноэтил)-метил-амино]-5-[4-(1-метил-1Н-индол-3-ил)-пиримидин-2-иламино]-4-метоксифенил}-акриламида или его сольват.
Предметом изобретения является фармацевтическая композиция, которая включает соединение общей формулы 1 или его сольват в сочетании с фармацевтически приемлемым разбавителем или носителем.
Фармацевтические композиции по изобретению могут быть в форме, подходящей для перорального применения (например, в виде таблеток, пластинок, твердых или мягких капсул, водных или масляных суспензий, эмульсий, диспергируемых порошков или гранул, сиропов или эликсиров), для местного применения (например, в виде кремов, мазей, гелей или водных или масляных растворов или суспензий), для введения путем ингаляции (например, в виде тонкоизмельченного порошка или жидкого аэрозоля), для введения путем инсуффляции (например, в виде тонкоизмельченного порошка) или для парентерального введения (например, в виде стерильного водного или масляного раствора для внутривенного, подкожного, внутримышечного введения дозы или в виде суппозиториев для ректального введения дозы).
Предметом изобретения является способ получения фармацевтической композиции смешением с инертным наполнителем и/или растворителем соединения общей формулы 1 или его сольвата в терапевтически приемлемом количестве.
Фармацевтические композиции по изобретению могут быть получены обычными способами с использованием обычных фармацевтических наполнителей, хорошо известных в данной области. Таким образом, фармацевтические композиции, предназначенные для перорального применения, могут содержать, например, один или несколько окрашивающих, подслащивающих, вкусовых агентов и/или консервантов.
Соединение общей формулы 1 или его сольват обычно вводят пациенту в единичной дозе в диапазоне 5-5000 мг/м2 площади тела, то есть примерно 0,1-100 мг/кг, и это обычно обеспечивает терапевтически эффективную дозу. Форма единичной дозы, такой как таблетка или капсула, обычно содержит, например, 1-250 мг активного ингредиента. Суточная доза обязательно будет варьироваться в зависимости от пациента, конкретного пути введения и тяжести заболевания, которое лечат. Соответственно, доктор, который лечит конкретного пациента, может определить оптимальную дозу.
Ингибирующая активность соединения общей формулы 1 или его сольвата по отношению к мутантам L858R EGFR, Т790М EGFR и Exon 19 EGFR может применяться при лечении заболеваний или медицинских состояний, обусловленных полностью или частично активностью EGFR мутанта, например рака. Типы рака, которые могут быть восприимчивы к лечению с использованием соединения общей формулы (1) или его сольвата, включают, но не ограничиваются ими, рак яичников, рак шейки матки, колоректальный рак, рак молочной железы, рак поджелудочной железы, глиому, глиобластомы, меланомы, рак простаты, лейкоз, лимфому не-Ходжкина, лимфомы, рак легких, гепатоцеллюлярный рак, рак желудка, желудочно-кишечных стромальных опухолей (GIST), рак щитовидной железы, рак желчного протока, рак эндометрия, рак почки, анапластическую крупноклеточную лимфому, острый миелоидный лейкоз (ОМЛ), множественные миеломы, меланомы и мезотелиомы.
Способ лечения указанных здесь типов рака заключается во введении соединения общей формулы 1 или его сольвата в фармацевтически приемлемом количестве млекопитающему, более предпочтительно человеку.
Аналогично использование соединения общей формулы 1 или его сольвата для лечения указанных типов рака: рак яичников, рак шейки матки, колоректальный рак, рак молочной железы, рак поджелудочной железы, глиома, глиобластомы, меланомы, рака простаты, лейкоз, лимфому не-Ходжкина, лимфомы, рак желудка, рак легких, гепатоцеллюлярный рак, рак желудка, желудочно-кишечных стромальных опухолей (GIST), рак щитовидной железы, рак желчного протока, рак эндометрия, рак почки, анапластическая крупноклеточная клеточная лимфома, острый миелоидный лейкоз (ОМЛ), множественные миеломы, меланомы и мезотелиомы, предполагает введение соединения общей формулы 1 или его сольвата млекопитающему, более предпочтительно человеку, в фармацевтически приемлемом количестве.
Предметом изобретения является лекарственное средство, представляющее собой соединение общей формулы 1 или его сольват, или активный компонент или фармацевтическую композицию в терапевтически эффективном количестве, предназначенное для лечения рака.
Предметом изобретения является лекарственное средство, представляющее собой соединение общей формулы 1 или его сольват, или активный компонент, или фармацевтическую композицию в терапевтически эффективном количестве, предназначенное для лечения видов рака, которые могут быть восприимчивы к лечению с использованием соединения общей формулы 1 или его сольвата и включают, но не ограничиваются ими: рак яичников, рак шейки матки, колоректальный рак, рак молочной железы, рак поджелудочной железы, глиома, глиобластомы, меланомы, рака простаты, лейкоз, лимфому не-Ходжкина лимфомы, рак желудка, рак легких, гепатоцеллюлярный рак, желудочно-кишечных стромальных опухолей (GIST), рак щитовидной железы, рак желчного протока, рак эндометрия, рак почки, анапластическая крупноклеточная клеточная лимфома, острый миелоидный лейкоз (ОМЛ), множественные миеломы, меланомы и мезотелиомы.
Предметом изобретения является также применение соединения общей формулы 1 или его сольвата для лечения заболевания, обусловленного мутантом L858R EGFR, и/или мутантом Т790М EGFR, и/или мутантом Exon19, например для лечения рака.
Предметом изобретения является также применение соединения общей формулы 1 или его сольвата для изготовления лекарственного средства для лечения заболевания, обусловленного мутантом L858R EGFR и/или мутантом Т790М EGFR и/или мутантом Exon19, например, для лечения рака.
Предметом изобретения является также применение соединения общей формулы 1 или его сольвата для лечения рака.
Предметом изобретения является также способ получения противоракового эффекта в млекопитающем, таком как человек, нуждающемся в таком лечении, который включает введение ему эффективного количества соединения общей формулы 1 или его сольвата.
В любом из аспектов или вариантов, упомянутых здесь, указанный рак может быть выбран из рака яичников, рака шейки матки, колоректального рака, рака молочной железы, рака поджелудочной железы, глиомы, глиобластомы, меланомы, рака простаты, лейкемии, лимфомы не-Ходжкина, лимфомы, рака желудка, рака легких, гепатоцеллюлярного рака, желудочно-кишечных стромальных опухолей (GIST), рака щитовидной железы, рака желчного протока, рака эндометрия, рака почки, анапластической крупноклеточной лимфомы, острого миелоидного лейкоза (ОМЛ), множественных миелом, меланомы и мезотелиомы.
Описанное выше лечение рака может быть как единственная терапия или может включать в дополнение соединение общей формулы 1 или его сольват по изобретению к обычной хирургии или лучевой терапии или химиотерапии или иммунотерапии. Химиотерапия может использоваться одновременно, последовательно или раздельно с лечением соединением общей формулы 1 или его сольватом и может включать один или более противоопухолевых агентов, в том числе: антипролиферативные противоопухолевые препараты и их комбинации, используемые в медицинской онкологии, такие как алкилирующие агенты, антиметаболиты, противоопухолевые антибиотики, антимитотические агенты и ингибиторы топоизомеразы; цитостатические агенты, такие как антиэстрогены, антиандрогены, антагонисты или агонисты LHRH, ингибиторы ароматазы и ингибиторы 5а-редуктазы; ингибиторы функции фактора роста и др. препараты.
Предметом изобретения является фармацевтическая композиция, включающая соединение общей формулы 1 или его сольват и дополнительное противоопухолевое вещество для совместного лечения рака.
Здесь, где термин "совместное лечение" используют по отношению к комбинированной терапии, следует понимать, что это может относиться к одновременному, раздельному или последовательному введения препаратов.
Таким образом, в одном из вариантов осуществления изобретения предлагается использование соединения общей формулы 1 или его сольвата и дополнительно противоопухолевого вещества для совместного лечения рака.
Предметом изобретения является способ получения противоракового эффекта в млекопитающем, в том числе у человека, который нуждается в таком лечении, который включает введение указанному млекопитающему соединения общей формулы 1 или его сольвата и одновременное, раздельное или последовательное введение дополнительного противоопухолевого вещества указанному млекопитающему.
Ниже изобретение иллюстрируется с помощью конкретных примеров. Следующие примеры представлены с целью иллюстрации и не предназначены для ограничения изобретения каким-либо образом. Специалисты в данной области техники легко поймут различие некритических параметров, которые могут быть изменены или модифицированы, чтобы получить те же результаты.
Пример 1. Дихлорацетат N-{2-[(2-диметиламиноэтил)-метил-амино]-5-[4-(1-метил-1Н-индол-3-ил)-пиримидин-2-иламино]-4-метоксифенил}-акриламида общей формулы 1.
К перемешиваемому раствору N-{2-[(2-диметиламиноэтил)-метил-амино]-5-[4-(1-метил-1Н-индол-3-ил)-пиримидин-2-иламино]-4-метоксифенил}-акриламида (375 мг, 0,75 ммоль) в ацетоне (4 мл) при 25°С добавляют дихлоруксусную кислоту (97 мг, 0,75 ммоль) в виде раствора в ацетоне (1 мл). Полученную смесь перемешивают в течение 15 ч. Полученное твердое вещество собирали фильтрованием и сушили на воздухе в течение ночи, получая указанное в заголовке соли (69 мг) в виде светло-желтых кристаллов. 1H-NMR (DMSO-d6, 400 MHz): 2.61 (s, 3Н), 2.74 (s, 6Н), 3.12-3.20 (m, 2Н), 3.20-3.28 (m, 2Н), 3.89 (s, 3Н), 3.90 (s, 3Н), 5.77 (d, J=10.3 Hz, 1H), 6.03 (s, 6H), 6.30 (d, J=16.8 Hz, 1H), 6.83 (dd, J1=10.0 Hz, h=16.8 Hz 1H), 7.02 (s, 1H), 7.16 (t, J=7.6 Hz, 1H), 7.21-7.27 (m, 2H), 7.52 (d, J=8.1 Hz, 1H), 7.92 (s, 1H), 8.28 (d, J=8.1 Hz, 1H), 8.33 (d, J=5.5 Hz, 1H), 8.58 (s, 1H), 8.97 (s, 1H), 9.60 (s, 1H).
Пример 2. Определение термодинамической растворимости соединения формулы 1, прототипа AZD-9291 и его солей. Смешивали 5 мг исследуемого соединения с 1 мл универсального буфера (pION) с рН 2,0, 4,0 или 7,0 в течение 15 мин при 25°С. Дополнительные количества веществ добавляли до тех пор, пока раствор не становился мутным. Виалы с раствором инкубировали при перемешивании в течение 24 ч при 25°С для достижения равновесия между раствором и осадком при насыщении. После уравновешивания 200 мкл раствора (в 2-х повторах) фильтровали через 96-луночный фильтровальный планшет (Millipore) для отделения осадка. Концентрацию соединений в фильтрате определяли спектрофотометрически с помощью стандартной калибровочной кривой. Проводили измерение спектра оптического поглощения вещества и построение калибровочной кривой при выбранной длине волны (обычно, соответствующей максимуму поглощения вещества λmax). Концентрацию вещества в фильтрате (т.е. растворимость) рассчитывали по нижеприведенной формуле:
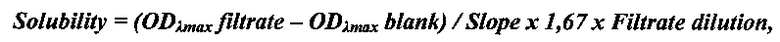
где
ODλmax filtrate - оптическая плотность фильтрата,
ODλmax blank - оптическая плотность холостого раствора без вещества,
Slope - наклон калибровочной кривой,
1,67 - фактор разведения фильтрата ацетонитрилом,
Filtrate dilution - фактор разведения фильтрата буфером.
Полученные результаты представлены в таблице 1.
Пример 3. Анализ активности. Соединение общей формулы 1 тестировали по влиянию на активность киназ EGFR wt, EGFR-L858R и EGFR-T790M (все ферменты предоставлены Invitrogen Corp., каталожные номера PV3872, PV4128 и PV4803 соответственно) с помощью скрининговой платформы Z′-LYTE (производство Life Technologies). Концентрация ДМСО в реакционной смеси составляла 1%. 5 мкл 2-кратной смеси Субстрат/Киназа (Tyr4/EGFRwt или EGFR-L858R или EGFR-T790M, конечные концентрации - 0.5 мкМ для субстрата Tyr 4 и 1000, 250, 1000 нг/мл для EGFRwt или EGFR-L858R или EGFR-T790M соответственно) были добавлены в 384-луночные планшеты (черные, малого объема, производство Corning, кат. #3676). 1.5 мкл 100-кратных стоков исследуемых веществ в 100% ДМСО были разбавлены в 10 раз в 13.5 мкл киназного буфера (50 мМ HEPES pH 6.5, 0.01% BRIJ-35, 10 мМ MgCl2, 1 мМ EGTA, 0.02% NaN3) и затем 1 мкл разбавленных веществ добавляли к смеси Субстрат/Киназа. Вещества преинкубировали с киназами в течение 10 мин при комнатной температуре. После этого для начала реакции добавляли 4 мкл 2.5-кратного раствора АТФ (конечная концентрация АТФ в реакционной смеси была 180 или 100 или 40 мкМ для EGFRwt, EGFR-L858R и EGFR-T790M соответственно). После 30 с инкубации на шейкере реакцию инкубировали в течение 60 мин при комнатной температуре. После этого добавляли 5 мкл Реагента В (разбавленного 1:500) и инкубировали еще 60 мин при комнатной температуре. Измеряли флуоресценцию при возбуждении длиной волны 400 нм и эмиссии при 445 и 520 нм. Степень фосфорилирования пептидного субстрата рассчитывали по формуле ниже (если отношение эмиссии низкое - пептид фосфорилирован, т.е. нет ингибирования активности киназы, если отношение высокое - пептид не фосфорилирован, т.е. киназа ингибирована).
% фосфорилирования рассчитывается как по формуле, указанной на с. 6 в стандартном протоколе скрининга Z′-LYTE (Life Technologies).
Концентрационная кривая зависимости активности киназы от концентрации тестируемых веществ строилась с использованием сигмоидной модели. Результаты сравнительного анализа активности соединения общей формулы 1, прототипа AZD-9291 представлены в таблице 2.
Пример 4. Получение лекарственного средства в виде таблеток. Спресовывали смесь 1600 мг крахмала, 1600 мг измельченной лактозы, 400 мг талька и 1000 мг ингибитора 1. Полученный брусок измельчали в гранулы и просеивали через сито, собирая гранулы размером 14-16 меш. Полученные гранулы таблетировали в таблетки пригодных форм весом 500 мг каждая.
Пример 5. Получение лекарственного средства в форме капсул. Ингибитор 1 тщательно смешивали с порошком лактозы в соотношении 2:1. Полученную порошкообразную смесь упаковывали по 600 мг в желатиновые капсулы подходящего размера.
Пример 6. Получение лекарственного средства в виде композиций для внутримышечных, внутрибрюшинных или подкожных инъекций. Смешали 500 мг ингибитора 1, 300 мг хлорбутанола, 2 мл пропиленгликоля и 100 мл инъекционной воды. Раствор фильтровали и помещали в 1 мл в ампулы и укупоривали.
Специалистам в данной области техники легко поймут различие некритических параметров, которые могут быть изменены или модифицированы, чтобы получить те же результаты. Различные модификации изобретения в дополнение к описанным здесь станут очевидными специалистам в данной области техники из приведенного выше описания.
Изобретение относится к новой соли - дихлорацетату N-{2-[(2-диметиламиноэтил)метил-амино]-5-[4-(1-метил-1Н-индол-3-ил)пиримидин-2-иламино]-4-метоксифенил}акриламида, которая обладает свойствами ингибиторов EGFR и может быть использована для лечения видов рака, опосредованного активностью EGFR и его мутантов, выбранных из L858R, 1790М и Exon19. Соединение предназначено для применения для лечения рака яичников, рака шейки матки, колоректального рака, рака молочной железы, рака поджелудочной железы, глиомы, глиобластомы, меланомы, рака простаты, лейкоза, лимфомы не-Ходжкина, рака желудка, рака легких, гепатоцеллюлярного рака, желудочно-кишечных стромальных опухолей (GIST), рака щитовидной железы, рака желчного протока, рака эндометрия, рака почки, анапластической крупноклеточной лимфомы, острого миелоидного лейкоза, множественной миеломы, меланомы и мезотелиомы. Предпочтительно соединение может быть использовано для профилактики и/или лечения мутаций рецептора эпидермального фактора роста EGFRm немелкоклеточного рака легкого (NSCLC), которые также имеют резистентную мутацию Т790М. Дихлорацетат N-{2-[(2-диметиламиноэтил)метил-амино]-5-[4-(1-метил-1Н-индол-3-ил)пиримидин-2-иламино]-4-метоксифенил}акриламида соответствует общей формуле 1
8 н. и 4 з.п. ф-лы, 2 табл., 6 пр.
1. Дихлорацетат N-{2-[(2-диметиламиноэтил)метил-амино]-5-[4-(1-метил-1Н-индол-3-ил)пиримидин-2-иламино]-4-метоксифенил}акриламида общей формулы 1
2. Активный компонент, обладающий противораковой активностью, представляющий собой дихлорацетат N[-{2-[(2-диметиламиноэтил)метил-амино]-5-[4-(1-метил-1Н-индол-3-ил)пиримидин-2-иламино]-4-метоксифенил}акриламида общей формулы 1.
3. Фармацевтическая композиция, обладающая противораковой активностью, в форме таблеток, капсул или инъекций, помещенных в фармацевтически приемлемую упаковку, включающая дихлорацетат N-{2-[(2-диметиламиноэтил)метил-амино]-5-[4-(1-метил-1Н-индол-3-ил)пиримидин-2-иламино]-4-метоксифенил}акриламида общей формулы 1 по п. 1 в качестве активного компонента в терапевтически эффективном количестве в сочетании с фармацевтически приемлемым разбавителем и/или носителем.
4. Способ получения фармацевтической композиции смешением с инертным наполнителем и/или растворителем дихлорацетата N-[-{2-[(2-диметиламиноэтил)-метил-амино]-5-[4-(1-метил-1Н-индол-3-ил)-пиримидин-2-иламино]-4-метоксифенил}акриламида общей формулы 1 в фармацевтически эффективном количестве.
5. Лекарственное средство, представляющее собой соединение по п. 1 в качестве активного компонента, обладающего противораковой активностью, или фармацевтическую композицию по п. 3, которое в терапевтически эффективном количестве, предназначено для лечения рака, опосредованного активностью EGFR.
6. Лекарственное средство по п. 5, представляющее собой дихлорацетат N-{2-[(2-диметиламиноэтил)метил-амино]-5-[4-(1-метил-1Н-индол-3-ил)-пиримидин-2-иламино]-4-метоксифенил}акриламида общей формулы 1 в качестве активного противоракового компонента, или фармацевтическую композицию по п. 3, которое в терапевтически эффективном количестве предназначено для лечения видов рака, опосредованных действием мутантов EGFR, выбранных из L858R, 1790М и Exon19.
7. Лекарственное средство по п. 6, предназначенное для лечения рака яичников, рака шейки матки, колоректального рака, рака молочной железы, рака поджелудочной железы, глиомы, глиобластомы, меланомы, рака простаты, лейкоза, лимфомы не-Ходжкина, рака желудка, рака легких, гепатоцеллюлярного рака, желудочно-кишечных стромальных опухолей (GIST), рака щитовидной железы, рака желчного протока, рака эндометрия, рака почки, анапластической крупноклеточной лимфомы, острого миелоидного лейкоза, множественной миеломы, меланомы и мезотелиомы.
8. Лекарственное средство по п. 6 или 7, представляющее собой дихлорацетат N-{2-[(2-диметиламиноэтил)метил-амино]-5-[4-(1-метил-1Н-индол-3-ил)пиримидин-2-иламино]-4-метоксифенил}акриламида общей формулы 1 в качестве активного противоракового компонента или фармацевтическую композицию по п. 3, которое в терапевтически эффективном количестве предназначено для лечения рака с мутацией рецептора эпидермального фактора роста EGFRm, которые также имеют резистентную мутацию Т790М.
9. Способ профилактики и/или лечения рака, опосредованного активностью EGFR, включающий введение в эффективном количестве дихлорацетата N-{2-[(2-диметиламиноэтил)метил-амино]-5-[4-(1-метил-1Н-индол-3-ил)пиримидин-2-иламино]-4-метоксифенил}акриламида общей формулы 1 в качестве активного противоракового компонента, или фармацевтической композиции по п. 3.
10. Способ по п. 9 для профилактики и/или лечения мутации рецептора эпидермального фактора роста EGFRm немелкоклеточного рака легкого (NSCLC), которые также имеют резистентную мутацию Т790М.
11. Применение дихлорацетата N-{2-[(2-диметиламиноэтил)метил-амино]-5-[4-(1-метил-1Н-индол-3-ил)пиримидин-2-иламино]-4-метоксифенил}акриламида общей формулы 1 для изготовления лекарственного средства для лечения рака, опосредованного активностью EGFR.
12. Применение дихлорацетата N-{2-[(2-диметиламиноэтил)метил-амино]-5-[4-(1-метил-1Н-индол-3-ил)пиримидин-2-иламино]-4-метоксифенил}акриламида общей формулы 1 по п. 1 для изготовления лекарственного средства по пп. 6-8 для лечения рака с мутацией рецептора эпидермального фактора роста EGFRm, которые также имеют резистентную мутацию Т790М.
| WO 2013014448 A8, 31.01.2013 & EA201391491 А1 | |||
| CN 104961731 A, 07.10 | |||
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| EA 201690328 A, приоритет 27.07.2011. | |||
Авторы
Даты
2016-12-10—Публикация
2015-11-19—Подача