Область техники, к которой относится изобретение
Настоящее изобретение относится к обогащенному дейтерием 4-гидрокси-5-метокси-N,1-диметил-2-оксо-N-[(4-трифтор-метил)фенил]-1,2-дигидрохинолин-3-карбоксамиду, к его фармацевтически приемлемым солям и к их использованию в терапии.
Уровень техники
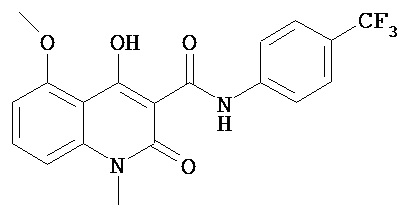
Соединение 4-гидрокси-5-метокси-Н,1-диметил-2-оксо-N-[(4-трифторметил)-фенил]-1,2-дигидрохинолин-3-карбоксамид (CAS# 254964-60-8, в настоящем документе также упоминается ниже как ABR-215050) имеет показанную эффективность в экспериментах на животных по отношению к раку (1). Показано также, что ABR-215050 способен ингибировать рост опухоли простаты посредством механизма, включающего антиангиогенную реакцию (2); четкая противоопухолевая реакция достигнута на ряде моделей опухолей in vivo с использованием линий клеток рака простаты человека (3). Это вдохновляет на дальнейшие опыты относительно соединения, и эффективность при лечении рака у людей показана в клиническом исследовании фазы 2 (4).
В последнем рандомизированном двойном слепом клиническом исследовании фазы II с контролем в виде плацебо ABR-215050 у пациентов с асимптоматическим метастатическим кастрационно-резистентным раком простаты показано различие на ряде пациентов при развитии заболевания на шести месяцах. В самом деле, результаты показывают, что доля пациентов с развитием заболевания в течение шестимесячного периода составляет 31% для пациентов, леченых ABR-215050, по сравнению с 66% для пациентов, леченых плацебо (р<0,0001). Медианная выживаемость без развития заболевания составляет 7,6 месяца для группы, леченой ABR-215050, по сравнению с 3,2 месяца для группы, леченой плацебо (р=0,0009). Лечение ABR-215050 также оказывает воздействие на биомаркеры, релевантные для развития рака простаты, и, как правило, хорошо переносится.
Кроме того, эксперименты на животных in vivo показали, что ABR-215050 также имеет эффективность при лечении аутоиммунных заболеваний. Таким образом, экспериментальное исследование на животных in vivo показало эффективность соединения при лечении ревматоидного артрита (5), а другое исследование показало его эффективность при лечении рассеянного склероза (6).
Дейтерий (2H или D) представляет собой стабильный и нерадиоактивный изотоп водорода, который имеет приблизительно удвоенную массу протия (1Н или Н), в настоящее время наиболее распространенного изотопа водорода. Дейтерирование фармацевтических препаратов для улучшения профилей фармакокинетики (РК), фармакодинамики (PD) и токсичности описано ранее для некоторых классов лекарственных средств. Например, описано (7), что различные структуры дейтерирования можно использовать (а) для уменьшения количества или устранения нежелательных метаболитов, (b) для увеличения половинного времени жизни исходного лекарственного средства, (с) для уменьшения количества доз, необходимых для достижения желаемого воздействия, (d) для уменьшения величины дозы, необходимой для достижения желаемого воздействия, (е) для увеличения образования активных метаболитов, если они образуются, (f) для уменьшения образования вредных метаболитов в конкретных тканях и/или для (g) создания более эффективного лекарственного средства и/или более безопасного лекарственного средства для полифармации, где полифармация может быть преднамеренной или нет. По этой причине в (7) описывается дейтерирование лахинимода и утверждается, что подход с использованием дейтерирования обладает большим потенциалом для замедления метаболизма лахинимода.
Раскрытие изобретения
В соответствии с первым аспектом, предлагается соединение, которое представляет собой обогащенный дейтерием 4-гидрокси-5-метокси-N,1-диметил-2-оксо-N-[(4-трифторметил)фенил]-1,2-дигидрохинолин-3-карбоксамид, имеющий обогащение дейтерием в амид-N-метильной группе, по меньшей мере, 70%; или его фармацевтически приемлемая соль.
Также предлагается способ получения обогащенного дейтерием 4-гидрокси-5-метокси-N,1-диметил-2-оксо-N-[(4-трифторметил)-фенил]-1,2-дигидрохинолин-3-карбоксамида, имеющего обогащение дейтерием в амид-N-метильной группе, по меньшей мере, 70%; или его фармацевтически приемлемой соли, посредством взаимодействия сложного С1-С4 алкилового эфира 4-гидрокси-5-метокси-1-метил-2-оксо-1,2-дигидрохинолин-3-карбоновой кислоты с дейтерированным N-метил-п-трифторметиланилином, имеющим обогащение дейтерием в N-метильной группе, по меньшей мере, 70%; в подходящем растворителе и необязательного взаимодействия полученного соединения с подходящим фармацевтически приемлемым основанием.
В одном из вариантов осуществления, соединение по настоящему изобретению имеет формулу (I)

где R1 выбирают из Н и фармацевтически приемлемых органических или неорганических катионов;
R2, R3 и R4 независимо выбирают из Н и D; и
CR2R3R4 имеет общее обогащение дейтерием, по меньшей мере, 70%.
Также предлагается способ получения соединения в соответствии с формулой (I)
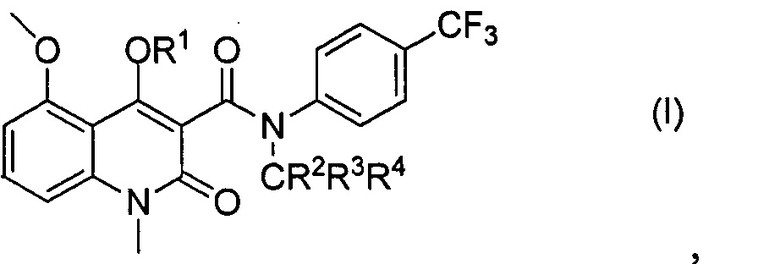
где R1, R2, R3 и R4 являются такими, как определено выше в настоящем документе;
включающий взаимодействие соединения формулы (II)

где R5 представляет собой С1-С4 алкильную группу;
с соединением формулы (III)

в подходящем растворителе; с получением соединения формулы (I), где R1 представляет собой Н;
и необязательное взаимодействие соединения формулы (I), где R1 представляет собой Н, с подходящим фармацевтически приемлемым основанием.
Соединение по настоящему изобретению является пригодным для применения в качестве лекарственного средства, например для применения при лечении злокачественного гиперпролиферативного заболевания или аутоиммунного заболевания.
Соединение по настоящему изобретению также является пригодным для применения в качестве лекарственного средства например для применения при лечении расстройства, облегчаемого посредством модулирования иммунной функции.
Вследствие этого предлагается также фармацевтическая композиция, содержащая терапевтически эффективное количество соединения в соответствии с настоящим изобретением.
Соединение по настоящему изобретению также является пригодным для применения в профилактике или лечении расстройства, выбранного из злокачественных гиперпролиферативных заболеваний и аутоиммунных заболеваний.
Также предлагается способ лечения млекопитающего, страдающего злокачественным гиперпролиферативным заболеванием. Кроме того, предлагается способ лечения млекопитающего, страдающего аутоиммунным заболеванием, а также способ лечения расстройства, которое облегчается посредством модулирования иммунной функции.
Краткое описание чертежей
Фигура 1 представляет собой график, представляющий кратность индуцирования экспрессирования люциферазы как функцию добавляемых количеств ABR-215050 и его метаболита после амидного деметилирования ABR-215691, соответственно, в линии клеток гепатомы человека, с использованием анализа in vitro с помощью репортерного гена люциферазы для измерения медиируемой Ah-индукции CYP1A1.
Фигура 2 представляет собой график, представляющий кратность индуцирования экспрессирования люциферазы как функцию добавляемых количеств бензо(а)пирена в линии клеток гепатомы человека с использованием анализа in vitro с помощью репортерного гена люциферазы для измерения медиируемой Ah-индукции CYP1A1.
Фигура 3 представляет собой структурную формулу ABR-215050, показывающую жирным шрифтом три метальных группы, которые присутствуют в соединении и которые упоминаются в настоящем документе как амид-N-метил, хинолин-N-метил и хинолин-O-метил, соответственно.
Фигура 4 представляет собой масс-спектр ABR-215050, имеющего дейтерированную амид-N-метильную группу, в положительном режиме с электрораспылительной ионизацией (ESI+). Обогащение дейтерием оставляет примерно 97%. Доля обогащенного дейтерием соединения представлена в масс-спектрометрическом пике (протонированная молекула, [М+Н]+) при m/z=410, и доля не обогащенного дейтерием соединения представлена как масс-спектрометрический пик при m/z=407 (3% по отношению к m/z=410). Масс-спектрометрический пик при m/z=432 представляет собой молекулярный ионный аддукт, образующийся из-за ионизации натрия [М+Na]+. масс-спектрометрические пики при m/z= 411, 412, 413 и 433 отражают естественное присутствие изотопов 13С, 15N, 17O и 18О.
Фигура 5 представляет собой столбиковую диаграмму, показывающую уровень (в нМ) амид-N-деметилированного метаболита ABR-215050 и обогащенного дейтерием ABR-215050 в плазме, где амид-N-метил является дейтерированным, в настоящем документе упоминается ниже также как ABR-215050-dx, соответственно, после введения крысам ABR-215050 и ABR-215050-dx в смеси (1:1).
Фигура 6 представляет собой столбиковую диаграмму, показывающую среднюю кратность индицирования CYP1A1 и CYP1A2 у крыс после перорального введения ABR-215050 и ABR-215050-dx, при пероральном введении обычной питьевой воды в качестве контроля.
Фигура 7 представляет собой график, показывающий воздействие введенного перорально ABR-215050-dx (10 мг/кг/день) на опухоль LNCaP у голых мышей Balb/c.
Осуществление изобретения
Как отмечено выше в настоящем документе, ABR-215050 показывает обещающие результаты в качестве терапевтически активного соединения, которое может быть пригодным для использования при лечении различных серьезных заболеваний.
ABR-215050 исследуют относительно его способности индуцировать CYP1A in vitro в анализе с TV-клетками. Этот анализ представляет собой анализ с помощью репортерного гена люциферазы, разработанный для измерения медиируемой AhR (арилуглеводородным рецептором) индукции CYP1A. Промоторы CYP1A человека и 5'-фланкирующие последовательности клонируют в векторах экспрессии люциферазы светлячков и стабильно встраивают в линию клеток гепатомы человека HepG2 (9). Выделенную линию клеток переименовывают в TV101L. Это исследование показывает, что ABR-215050 не индуцирует CYP1A, например, смотри ниже в настоящем документе как "Анализ in vitro способности ABR-215050 к индуцированию CYP1A".
У крыс обнаруживают три метаболита деметилирования ABR-215050, то есть хинолин-N-деметилированный метаболит, упоминаемый ниже в настоящем документе как ABR-219694, хинолин-O-деметилированный метаболит ABR-222097, упоминаемый ниже в настоящем документе как ABR-222097, и амид-N-деметилированный метаболит, упоминаемый ниже в настоящем документе как ABR-215691, смотри таблицу 1.



Эти метаболиты также исследуют с помощью анализа с TV-клетками. Подобно ABR-215050, ABR-219694 и ABR-222097, как обнаружено, не индуцируют CYP1A (данные не показаны). Неожиданно было обнаружено, что, в противоположность исходному соединению и двум другим метаболитам после деметилирования, ABR-215691 имеет существенную способность индуцирования CYP1A, в несколько раз большую, чем у двух других деметилированных метаболитов и у самого исходного соединения ABR-215050, смотри ниже в настоящем документе, как "Анализ in vitro способности индуцирования CYP1A1 для ABR-215691". Можно ожидать, что даже при очень низкой концентрации ABR-215691 может вносить существенный вклад в индуцирование CYP1A благодаря его очень высокой способности к индуцированию.
Водорастворимость ABR-215050 и его метаболитов также исследуют. Хорошо известно, что метаболизм, как правило, имеет целью преобразование соединений в более водорастворимые объекты (10), что в основном уменьшает токсичность, но также и облегчает выведение с помощью почек. Как ABR-219694, так и ABR-222097 являются в высшей степени водорастворимыми. Однако ABR-215691, как неожиданно обнаружено, имеет чрезвычайно низкую водорастворимость по сравнению с другими метаболитами, а также с исходным соединением, смотри таблицу 2.
Ввиду этой низкой водорастворимости ABR-215691, можно ожидать, что почечная экскреция ABR-215691 является низкой по сравнению с двумя другими метаболитами после деметилирования. Однако приведенные выше данные показывают, что индуцирование CYP1A с помощью ABR-215691 могли бы вызвать проблему взаимодействия различных лекарственных средств у человека in vivo, что даже если и не является непреодолимым, тем не менее должно серьезно учитываться при лечении.
По этой причине, фармакокинетические характеристики амид-N-метил-дейтерированного ABR-215050 (ниже в настоящем документе упоминается как ABR-215050-dx), где амид-N-метильный остаток является тридейтерированным, по сравнению с недейтерированным исходным соединением изучают на крысах. Уменьшение метаболического амид-N-деметилирования, когда амид-N-метил является меченым дейтерием, является очень выраженным; образование деметилированного метаболита уменьшается в целых четыре раза по сравнению с немеченым дейтерием ABR-215050. Другими словами, по отношению к ABR-215050, когда используют ABR-215050-dx, образование ABR-215691 in vivo уменьшается всего лишь до 25%. Отмечено также, что уменьшение амид-N-деметилирования не влияет на молярное отношение 1:1 исходных лекарственных средств in vivo в плазме, это означает, что положительные воздействия на облегчение заболевания сохраняются, но нежелательное побочное воздействие, состоящее в индуцировании CYP1A, подавляется. Смотри ниже в настоящем документе как "Исследование in vivo фармакокинетических характеристик ABR-215050 и ABR-215050-dx на крысах".
Кроме того, исследования in vivo на крысах показывают, что индуцирование CYP1A значительно уменьшается при введении ABR-215050-dx вместо ABR-215050 (смотри ниже в настоящем документе как "Исследование in vivo активности CYP1A 1/2 на крысах после введения ABR-215050 и ABR-215050-dx").
Исследования in vivo на мышах также показывают, что ABR-215050-dx сохраняет высокую терапевтическую активность (смотри ниже в настоящем документе как "Исследование in vivo противоопухолевого воздействия ABR-215050-dx на мышах").
Таким образом, в соответствии с настоящим изобретением, предлагается дейтерированный ABR-215050, который при введении дает существенно пониженное индуцирование CYP1A, в то же время обеспечивая высокую терапевтическую активность.
Для цели настоящего изобретения, термин "обогащение дейтерием" соединения в конкретном положении относится к проценту включения дейтерия в этом положении вместо водорода. Например, под "соединением, имеющим обогащение дейтерием 90% в данном положении" предполагается, что 90% молекул в образце содержит дейтерий в указанном положении. Природное содержание дейтерия составляет примерно 0,0156%, это означает, что природное обогащение дейтерием в каждом конкретном положении соединения составляет 0,0156%. Обогащение дейтерием может быть определено с использованием, например, масс-спектрометрии и спектроскопии ядерного магнитного резонанса.
Когда упоминается остаток, такой как метильная группа, содержащий несколько положений, которые могут дейтерироваться, термин "обогащение дейтерием" относится к среднему значению, вычисленному на основе индивидуальных значений для положений в остатке. В качестве иллюстративного примера, для остатка, имеющего обогащение дейтерием 90% и содержащего три конкретных положения дейтерирования, обогащение дейтерием в каждом индивидуальном положении может составлять, например, 85%, 92% и 93% (или любые другие процентные значения), для которых среднее значение составляет 90%.
Для целей настоящего изобретения, расстройства, облегчаемые посредством модулирования иммунной функции, включают, например, злокачественные гиперпролиферативные заболевания, такие как рак, аутоиммунные заболевания, воспаление и воспалительные заболевания, и расстройства гиперчувствительности иммунной системы.
Под "модулированием иммунной функции" подразумевается, например, ослабление или предотвращение иммунной реакции, которая вызывает нежелательные воздействия.
Как используется в настоящем документе, термины "злокачественное гиперпролиферативное заболевание", "рак" и "раковый" относятся к физиологическому состоянию у млекопитающих, которое, как правило, характеризуется неконтролируемым ростом клеток или описывает его. Для целей настоящего изобретения, примеры такого состояния включают, но не ограничиваясь этим, меланому, карциному, лимфому, бластому, саркому и лейкемию или лимфолейкозы. Более конкретные примеры такого состояния включают плоскоклеточный рак (например, плоскоклеточный рак эпителия), рак легких, включая мелкоклеточный рак легких, немелкоклеточный рак легких, аденокарциному легких и сквамозную карциному легких, рак брюшной полости, гепатоклеточный рак, рак кишечника или желудка, включая гастроинтестинальный рак, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичников, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак толстой кишки, рак прямой кишки, рак ободочной и прямой кишки, рак эндометрия или карциному матки, карциному слюнных желез, рак почек или почечный рак, рак простаты, рак вульвы, рак щитовидной железы, гепатокарциному, анальную карциному, пенильную карциному, а также рак головы и шеи.
Термин "аутоиммунное заболевание", как используется в настоящем документе, относится к любому расстройству, которое происходит, когда ткани живого организма подвергаются отрицательному воздействию его собственной иммунной системы. Для целей настоящего изобретения, примеры аутоиммунных заболеваний представляют собой: острый рассеянный энцефаломиелит (ADEM), острый некротизирующий геморрагический лейкоэнцефалит, болезнь Аддисона, агаммаглобулинемию, аллергическую астму, аллергический ринит, очаговую алопецию, амилоидоз, анкилозирующий спондилит, анти-GBM/анти-ТВМ нефрит, антифосфолипидный синдром (APS), аутоиммунную апластическую анемию, аутоиммунную вегетативную дистонию, аутоиммунный гепатит, аутоиммунную гиперлипидемию, аутоиммунный иммунодефицит, аутоиммунное заболевание внутреннего уха (AIED), аутоиммунный миокардит, аутоиммунный панкреатит, аутоиммуную ретинопатию, аутоиммунную тромбоцитопеническую пурпуру (АТР), аутоиммунное заболевание щитовидной железы, аксонные и нейронные нейропатии, болезнь Бало, болезнь Бехчета, буллезный пемфигоид, кардиомиопатию, болезнь Кастлемана, глютенчувствительную целиакию, болезнь Чагаса, синдром хронического переутомления, хроническую воспалительную демиелинизирующую полинейропатию (CIDP), хронический рецидивирующий многофокальный остеомиелит (CRMO), синдром Чарга-Стросса, рубцовый пемфигоид/злокачественный пемфигоид слизистой, болезнь Крона, синдром Когана, синдром холодовой агглютинации, врожденную блокаду сердца, миокардит Коксаки, CREST-синдром, эссенциальную смешанную криоглобулинемию, демиелинизирующие нейропатии, герпетиформный дерматит, дерматомиозит, болезнь Девика (оптиконевромиелит), дискоидную волчанку, синдром Дресслера, эндометриоз, атонический фасциит, нодозную эритему, экспериментальный аллергический энцефаломиелит, синдром Эванса, фибромиалгию, фиброзирующий альвеолит, гигантоклеточный артериит (темпоральный артериит), гломерулонефрит, синдром Гудпасчера, болезнь Грейвса, синдром Гийена-Барре, энцефалит Хасимото, тиреоидит Хасимото, гемолитическую анемию, болезнь Шенлейна-Геноха, герпес беременных, агаммаглобулинемию, идиопатическую тромбоцитопеническую пурпуру (ITP), IgA нефрапатию, IgG4-зависимое склеротическое заболевание, иммуннорегуляторные липопротеины, миозит с включенными тельцами, сахарный инсулинозависимый диабет (тип 1), интерстициальный цистит, хронический полиартрит у детей, ювенильный диабет, синдром Кавасаки, синдром Итона-Ламберта, лейкоцитокластический васкулит, красный плоский лишай, склерозирующий лишай, деревянистый конъюктивит, IgA-зависимый линейный дерматоз (LAD), системную красную волчанку (SLE), хроническую болезнь Лайма, болезнь Меньера, микроскопическую ангиопатию, диффузную болезнь соединительной ткани (MCTD), разъедающую язву роговицы, болезнь Мухи-Габерманна, множественный склероз, миастению гравис, миозит, нарколепсию, нейромиелит (болезнь Девика), нейтропению, глазной рубцующийся пемфигоид, неврит зрительного нерва, мигрирующий артрит, PANDAS (педиатрические аутоиммунные психоневрологические расстройства, связанные со стрептококком), паранеопластическую мозжечковую дегенерацию, ночную пароксизмальную гемоглобинурию (PNH), синдром Парри-Ромберга, синдром Персонейджа-Тернера, промежуточный увеит (периферический увеит), пузырчатку, периферическую нейропатию, перивенозный энцефаломиелит, злокачественное малокровие, POEMS-синдром, нодозный полиартериит, аутоиммунные полигландулярные синдромы тип I, II и III, ревматическую полимиалгию, полимиозит, постинфарктный синдром, постперикардиотомический синдром, прогестероновый дерматит, первичный биллиарный цирроз, первичный склерозирующий холангит, псориаз, псориатический артрит, идиопатический пульмонарный фиброз, гангренозную приодермию, истинную эритроцитарную аплазию, феномен Рейно, симпатическую рефлекторную дистрофию, синдром Рейтера, рецидивирующий полихондрит, синдром усталых ног, ретроперитонеальный фиброз, ревматический полиартрит, ревматоидный артрит, саркоидоз, синдром Шмидта, склерит, склеродермию, синдром Шегрена, иммунную реакцию, вызываемую нарушением гематотестикулярного барьера, синдром мышечной скованности, подострый септический эндокардит (SBE), синдром Сузака, метастатическую офтальмию, синдром Такаясу, височный артериит/гигантоклеточный артериит, тромбоцитопеническую пурпуру (ТТР), синдром Толоса-Ханта, поперечный миелит, язвенный колит, заболевание недифференцированной соединительной ткани (UCTD), увеит, васкулит, везикулобуллезный дерматоз, витилиго и гранулематоз Вегенера (11).
Термин "расстройство гиперчувствительности", как используется в настоящем документе, относится к такому расстройству, как аллергия. Примеры аллергии представляют собой атопический дерматит, аллергическую крапивницу, аллергию на пыльцу, аллергическую астму, анафилаксию, пищевую аллергию (на молоко, яйца, арахис, лесной орех, морепродукты, сою, пшеницу), аллергию на пенициллин и тому подобное.
Термин "млекопитающее", как используется в настоящем документе, включает человека, а также млекопитающее иное, чем человек, например лощадь, домашнее животное, такое как кошка или собака, сельскохозяйственное животное, такое как корова или овца, или лабораторное животное, такое как крыса или обезьяна. Предпочтительно, млекопитающее представляет собой человека.
Термин "лечение", как используется в настоящем документе, включает профилактику, а также облегчение симптомов заболевания. Таким образом, термин охватывает не только лечение пациента с целью освобождения пациента от признаков и симптомов заболевания или состояния, или для облегчения состояния пациента, страдающего от заболевания или расстройства, но также для профилактического лечения асимптоматического пациента для предотвращения возникновения или развития заболевания или состояния.
Термин "эффективное количество" относится к количеству соединения, которое оказывает терапевтическое воздействие на пациента, которого лечат. Воздействие может быть объективным (то есть измеримым с помощью некоторого исследования или маркера) или субъективным (то есть субъект сам сообщает о воздействии или чувствует воздействие).
Как отмечено выше в настоящем документе, в соответствии с первым аспектом, предлагается соединение, которое представляет собой обогащенный дейтерием 4-гидрокси-5-метокси-N,1-диметил-2-оксо-N-[(4-трифторметил)фенил]-1,2-дигидрохинолин-3-карбоксамид, имеющий обогащение дейтерием в амид-N-метильной группе, по меньшей мере, 70%, или его фармацевтически приемлемую соль.
В некоторых вариантах осуществления, обогащение дейтерием в амид-N-метильной группе составляет, по меньшей мере, 75%, или, по меньшей мере, 80%, или, по меньшей мере, 85%, например по меньшей мере, 90%, или, по меньшей мере, 95%, или, по меньшей мере, 97%.
В некоторых вариантах осуществления, соединение по настоящему изобретению дейтерируется также в одном или нескольких других положениях, то есть оно содержит D вместо Н в конкретном положении, которое не является амид-N-метильным остатком, при обогащении дейтерием, превышающим 0,0156%.
Также предлагается способ получения соединения, как определено выше в настоящем документе, посредством взаимодействия сложного С1-С4 алкилового эфира 4-гидрокси-5-метокси-1-метил-2-оксо-1,2-дигидрохинолин-3-карбоновой кислоты с дейтерированным N-метил-р-трифторметиланилином, имеющим обогащение дейтерием в амид N-метильной группе, по меньшей мере, 70%; в подходящем растворителе; и необязательного взаимодействия соединения с подходящим фармацевтически приемлемым основанием.
В некоторых вариантах осуществления, обогащение дейтерием в N-метильной группе N-метил-п-трифторметиланилина составляет, по меньшей мере, 75% или, по меньшей мере, 80%, или, по меньшей мере, 85%, например, по меньшей мере, 90%, или, по меньшей мере, 95%, или, по меньшей мере, 97%.
В некоторых вариантах осуществления, либо сложный С1-С4 алкиловый эфир 4-гидрокси-5-метокси-1-метил-2-оксо-1,2-дигидрохинолин-3-карбоновой кислоты, либо N-метил-п-трифторметиланилин, либо они оба являются дейтерированными в одном или нескольких других положениях.
"N Амид" 4-гидрокси-5-метокси-N,1-диметил-2-оксо-N-[(4-трифторметил)фенил]-1,2-дигидрохинолин-3-карбоксамида также может упоминаться как "N карбоксамид", то есть он представляет собой атом азота 3-карбоксамидного остатка, соединяющего фенильный кольцевой остаток соединения с хинолиновым кольцевым остатком. "Амид-N-метил" может также упоминаться как "карбоксамид-N-метил" и представляет собой метильную группу, соединенную с азотом (карбокс)амида.
Фармацевтически приемлемая соль соединения по настоящему изобретению может представлять собой, например, соль присоединения основания, полученную из гидроксида натрия, гидроксида калия, гидроксида кальция, моноэтаноламина, диэтаноламина, диметиламиноэтанола или морфолина.
В одном из вариантов осуществления, соединение по настоящему изобретению имеет формулу (I)

где R1 выбирают из Н и фармацевтически приемлемых органических или неорганических катионов; и
R2, R3 и R4 независимо выбирают из Н и D; и
CR2R3R4 имеет общее обогащение дейтерием, по меньшей мере, 70%.
В некоторых вариантах осуществления, R1 представляет собой Н. В других вариантах осуществления, R1 выбирают из фармацевтически приемлемых органических или неорганических катионов, например из катионов, полученных из натрия, калия, кальция, моноэтаноламина, диэтаноламина, диметиламиноэтанола и морфолина.
В формуле (I), R2, R3 и R4 независимо выбирают из Н и D, каждый из R2, R3 и R4 имеет такое обогащение дейтерием, что CR2R3R4 имеет общее обогащение дейтерием, по меньшей мере, примерно 70%. В некоторых вариантах осуществления, обогащение дейтерием CR2R3R4 составляет, по меньшей мере, примерно 75% или, по меньшей мере, примерно 80%, или, по меньшей мере, примерно 85%, например, по меньшей мере, примерно 90%, или, по меньшей мере, примерно 95%, или, по меньшей мере, примерно 97%.
Например, для общего обогащения дейтерием, по меньшей мере, примерно 70%, обогащение дейтерием каждого из R2, R3 и R4 должно составлять, по меньшей мере, примерно 89%; а для обогащения дейтерием, по меньшей мере, 97%, обогащение дейтерием каждого из R2, R3 и R4 должно составлять, по меньшей мере, примерно 99%.
Предпочтительно все R2, R3 и R4 являются идентичными (R2=R3=R4), то есть соединение по настоящему изобретению может быть представлено формулой (I'):

где R2 выбирают из Н и D, и 
Нужно понять, что любой из других атомов водорода в соединении в соответствии с формулой (I) также может быть заменен дейтерием. То есть, в дополнение к R2, R3 и R4, соединение формулы (I) может содержать до 13 (когда R1 не представляет собой Н) или 14 (когда R1 представляет собой Н) дополнительных атомов дейтерия, заменяющих атомы водорода в соединении формулы (I). В самом деле, благодаря природному распределению дейтерия, малая доля молекул в любом данном образце соединения формулы (I) будет содержать один или несколько атомов дейтерия. Однако присутствие таких дополнительных атомов дейтерия, либо природное, либо нет, не является критичным для настоящего изобретения. Тем не менее, в некоторых вариантах осуществления, соединение формулы (I) содержит, по меньшей мере, один дополнительный атом дейтерия в каком-либо конкретном положении ином, чем в амид-N-метильной группе, при обогащении дейтерием, превышающем то, которое встречается в природе, то есть при обогащении, превышающем 0,0156%, например обогащение дейтерием, по меньшей мере, 1%, или, по меньшей мере, 5%, например, по меньшей мере, 10%. Этот дополнительный атом дейтерия может заменить атом водорода в любом положении соединения формулы (I). Например, один или несколько атомов водорода, присоединенный к любой группе из хинолин-N-метильной группы или хинолин-O-метильной группы соединения формулы (I), может быть заменен дейтерием, и/или любые ароматические атомы водорода соединения формулы (I) могут быть заменены дейтерием.
Также предлагается способ получения соединения в соответствии с формулой (I), как определено выше в настоящем документе; посредством взаимодействия соединения формулы (II)
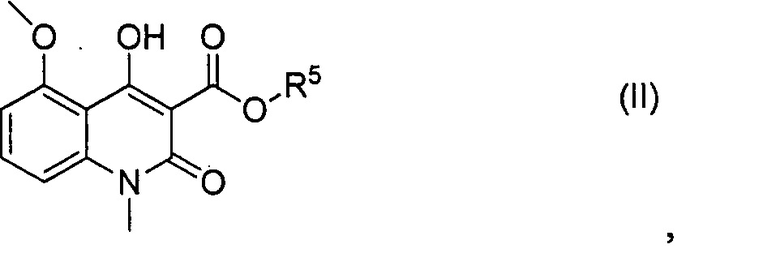
где R5 представляет собой С1-С4 алкильную группу;
с соединением формулы (III)
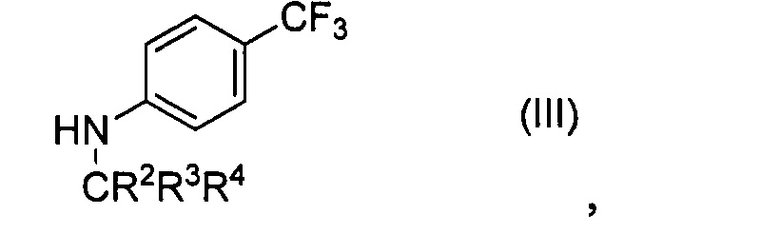
где R2, R3 и R4 являются такими, как определено выше в настоящем документе,
в подходящем растворителе, и необязательного взаимодействия соединения формулы (I), где R1 представляет собой Н, с подходящим фармацевтически приемлемым основанием, например NaOH, KOH, Са(ОН)2, моноэтаноламином, диэтаноламином, диметиламиноэтанолом или морфолином.
В соединении формулы (II), R5 может представлять собой С1-С4 алкильную группу, например С1-С3 алкильную группу, такую как метил или этил, в частности метил.
Соединение формулы (II) может содержать дейтерий в одном или нескольких положениях при обогащении дейтерием, превышающем то, которое обычно встречается в природе. Подобным же образом, в соединении формулы (III) любой из ароматических атомов водорода может быть заменен атомом дейтерия при обогащении дейтерием, превышающем то, которое обычно встречается в природе.
Реакцию между соединениями формулы (II) и (III) осуществляют в подходящей среде растворителя. Среда реакционного растворителя может представлять собой, например, углеводород, такой как С7-С10 алкан с прямой или разветвленной цепью, или циклоалкан, или их смесь, например гептан, октан или декагидронафталин.
Соединение по настоящему изобретению является пригодным для применения в терапии. Таким образом, в некоторых вариантах осуществления, настоящее изобретение предлагает соединение для применения при лечении злокачественных гиперпролиферативных состояний, например, выбранных из меланомы, карциномы, лимфомы, бластомы, саркомы и лейкемии или лимфолейкоза. В некоторых конкретных вариантах осуществления, настоящее изобретение предлагает соединение для применения при лечении злокачественных гиперпролиферативных состояний, выбранных из плоскоклеточного рака (например, плоскоклеточного рака эпителия), рака легких, включая мелкоклеточный рак легких, немелкоклеточный рак легких, аденокарциному легких и сквамозную карциному легких, рака брюшной полости, гепатоклеточного рака, рака кишечника или желудка, включая гастроинтестинальный рак, рака поджелудочной железы, глиобластомы, рака шейки матки, рака яичников, рака печени, рака мочевого пузыря, гепатомы, рака молочной железы, рака толстой кишки, рака прямой кишки, рака ободочной и прямой кишки, рака эндометрия или карциномы матки, карциномы слюнных желез, рака почек или почечного рака, рака простаты, рака вульвы, рака щитовидной железы, гепатокарциномы, анальной карциномы, пенильной карциномы, а также рака головы и шеи.
В некоторых вариантах осуществления, злокачественное гиперпролиферативное заболевание выбирают из твердой опухоли, злокачественной меланомы или гематологической опухоли.
В некоторых вариантах осуществления, твердую опухоль выбирают из аденокарциномы, например рака простаты, молочной железы, легких и прямой и ободочной кишки.
В некоторых вариантах осуществления, настоящее изобретение предлагает соединение для применения при лечении аутоиммунного заболевания, например аутоиммунного заболевания, как определено выше в настоящем документе.
В некоторых конкретных вариантах осуществления, аутоиммунное заболевание выбирают из болезни Крона, рассеянного склероза, ревматоидного артрита, язвенного колита и системной красной волчанки.
Эксперимент
Анализ т vitro способности ABR-215050 к индуцировать CYP1A1
Механизм транскрипции CYP1A1 включает связывание индуктора с Ah-рецептором с последующей транслокацией комплекса лиганд-Ah-рецептор в ядро, где он связывается со специфичными энхансерными последовательностями в 5'-фланкирующй области гена CYP1A1. Эти последовательности упоминаются как ксенобиотик-респонсивные элементы (XRE).
Анализ с помощью репортерного гена люциферазы используют для измерения медиируемой AhR индукции CYP1A1. Промоторы CYP1A1 и 5'-фланкирующие последовательности человека клонируют в векторы экспрессии люциферазы светлячков и стабильно встраивают в линию клеток гепатомы человек HepG2 (8). Выделенную линию клеток переименовывают в TV101L.
Клетки высевают в 96-луночные планшеты для культивирования ткани за 24-48 часов перед обработкой исследуемым соединением. После добавления ABR-215050 при концентрации 1, 10 и 100 мкМ, клетки дополнительно инкубируют в течение 12-24 часов. Клетки собирают посредством добавления лизирующего буфера с последующим циклом заморозки/оттаивания. Для определения активности люциферазы используют ферментативный анализ. Результаты, выраженные как кратность индуцирования экспрессии люциферазы, показаны в таблице 3 и на фиг.1.
В качестве сравнения, такой же анализ осуществляют с использованием бенз(а)пирена, хорошо известного умеренно сильного индуктора CYP1A1. Результаты показаны на фиг.2. Результаты анализа in vitro показывают степень взаимодействия исследуемых соединений с Ah-рецептором, который медиирует индуцирование как CYP1A1, так и CYP1A2.
Анализ in vitro способности ABR-215691 к индуцированию CYP1A
Используют такой же анализ, как используют для ABR-215050. Концентрации ABR-215691, которые используют и полученные результаты, выраженные как кратность индуцирования экспрессии люциферазы, показаны в таблице 4 и на фиг.1.
Исследования in vivo фармакокинетических характеристик ABR-215050 и ABR-215050-dx на крысах
Синтезируют дейтерированный (также упоминаемый как обогащенный дейтерием) ABR-215050, где амид-N-метильный остаток является тридейтерированным (ABR-215050-dx). Это дейтерированное соединение разбавляют недейтерированным ABR-215050 при молярном отношении 1:1. Эквивалентную молярную смесь 1:1 вводят крысам в эксперименте in vivo. Благодаря дополнительному мечению углеродом-13 в хинолиновом каркасе образовавшиеся амид-N деметилированные метаболиты могут селективно измеряться посредством ВЭЖХ-МС (высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием). В таблице 5 показаны уровни ABR-215050-dx и ABR-215050 в плазме (в нМ), измеренные у 4 различных крыс, а также отношение этих двух соединений.
Из таблицы 5 видно, что отношение дейтерированных и недейтерированных исходных соединений 1:1 у животных остается по существу неизменным в течение, по меньшей мере, до 4 часов при пероральной дозе 2,5 мг/кг.
Уровни в плазме ABR-215691, полученного из ABR-215050-dx и ABR-215050, также определяют с использованием ЖХ-МС/МС, и результаты показаны в таблице 6, которая также показывает вычисленное отношение уровней в плазме ABR-215 691, полученного из ABR-215050-dx и из ABR-215050, соответственно, а также вычисленное уменьшение образования амид-N-деметилированного метаболита.
Из таблицы 6 видно, что образование ABR-215691 существенно уменьшается посредством дейтерирования амид-N-метильной группы. Уменьшение амид-N-деметилирования, полученного с помощью указанного дейтерирования, находится в пределах от 70,5 до 75,8% в течение 4 часов после перорального дозирования. Результаты иллюстрируются на фиг.5.
Исследования in vivo активности CYP1A1/2 на крысах после введения ABR-215050 и ABR-215050-dx
Изучают на крысах in vivo индуцирование CYP1A1 и CYP1A2 после многократного введения ABR-215050 и ABR-215050-dx, соответственно.
Исследуемые препараты
Исследуемые препараты В и С и контрольный препарат А готовят следующим образом: для приготовления В, ABR-215050 растворяют в NaOH и стерильной воде при концентрации 0,5 мг/мл. рН раствора доводят до рН 7,4-8,5. Препарат С готовят таким же образом, используя ABR-215050-dx. Препарат А представляет собой контроль, содержащий только воду. Препараты хранят в холодильнике в течение максимум одной недели перед использованием. Данные для препаратов сведены в таблице 7.
Исследуемые животные
По прибытии в лабораторию исследуемые животные представляют собой самцов крысы Sprague Dawley в возрасте 9 недель, имеющих массу тела 250 г. Их разделяют на 3 группы и позволяют акклиматизироваться в течение, по меньшей мере, 7 дней перед исследованиями. В течение всего периода акклиматизации и исследований животные получают воду и корм (Labfor R70, от Kimstad, Sweden) ad libitum и выдерживаются при цикле 12 часов темноты/12 часов освещения при температуре 20±2°С и относительной влажности 50±15%.
Осуществление исследования
Перед введением любого исследуемого препарата измеряют массу тела каждого животного и определяют индивидуальную дозу для введения животному на основании массы животного. Введение осуществляют перорально в течение 4 дней, смотри таблицу 8.
Животных наблюдают дважды в день и взвешивают один раз в день. При любом признаке ухудшения общего состояния или при потере массы больше 15% крысу подвергают эвтаназии.
Отбор образцов
Незадолго перед введением конечной дозы отбирают образец крови из подкожной вены крысы №5. В конце периода введения (на 4-й день), образцы крови отбирают в гепаринизированные пробирки для анализа уровней вводимых соединений и амид-N-деметилированного метаболита в плазме. Образцы извлекают из подкожной вены (приблизительно 250 мкл крови) и из полой вены (максимальный возможный объем) в соответствии с графиком, показанным в таблице 9.
Образцы охлаждают в воде со льдом и центрифугируют при 1300g, +4°C в течение 10 минут настолько быстро, насколько это возможно, после извлечения (в пределах 30 минут). Плазму собирают, замораживают и хранят при -70°С до анализа.
Эвтаназия
Через 24 часа после введения конечной дозы животных взвешивают и от каждого животного отбирают конечный образец крови для фармакокинетического анализа. Затем животных подвергают эвтаназии и из каждого извлекают печень, ее взвешивают и непосредственно замораживают на измельченном сухом льду. Затем печени хранят при - 70°С до приготовления микросом.
Приготовление микросом
Микросомы приготавливают в соответствии со способом М-0287 "Preparation of subcellular fractions from animal tissues", а затем выдерживают при -70°С до анализа.
Определение концентрации белка
Общую концентрацию белка в микросомальной фракции определяют в соответствии со способом М-0289 "Determination of Protein according to Hartree".
Определение активности фермента CYP1A1/2
Активность фермента CYP1A1/2 определяют посредством инкубирования микросомальной фракции с метоксирезоруфином (MROD) и этоксирезоруфином (EROD), в качестве субстратов для CYP, в соответствии со способом М-0272А, при этом EROD показывает более высокую специфичность к CYP1A1, в то время как MROD показывает более высокую специфичность к CYP1A2.
Результаты показаны в таблице 10.
В соответствии с данными, представленными в таблице 10, наблюдаемая средняя кратность индуцирования CYP1A1 с помощью ABR-215050 составляет 42, в то время как ABR-215050-dx дает среднюю кратность индуцирования 11,5, что соответствует 73% уменьшению кратности индукции ((42-11,5)/42×100%) CYP1A1. Таблица 11 также показывает, что ABR-215050 дает среднюю кратность индуцирования CYP1A2 17, в то время как при введении ABR-215050-dx получается 5,5, то есть уменьшение кратности индукции CYP1A2, равное 68% ((17-5,5)/17×100%). Результаты иллюстрируются на фиг.6.
Исследования in vivo противоопухолевого воздействия ABR-215050-dx на мышах
Противоопухолевое воздействие дейтерированного ABR-215050 исследуют на мышах.
Линии клеток и условия культивирования
Кастрационно-резистентная сублиния LNCaP-19 заранее устанавливается из клеток LNCaP (12). Клетки поддерживают, как описано ранее (13). Клетки LNCaP-19 находятся между пассажем 10 и 23, когда их используют для экспериментов. Пассаж 1 определяется как первый пассаж в лаборатории авторов. Клетки исследуют и находят, что они не содержат микоплазмы.
Подкожное имплантирование клеток
Самцов атимических голых мышей BALB/c (в возрасте 8 недель) покупают у Taconic (Lille Skensved, Denmark). Для подкожной имплантации, один миллион опухолевых клеток, суспендированных в 200 мкл Matrigel (BD Bioscience, Bedford, MA), инокулируют в бок мыши. Размер опухоли измеряют с помощью штангенциркуля раз в неделю в течение эксперимента, и охват опухоли составляет 75% от нелеченой контрольной группы (n=12). В эксперименте с ростом опухоли ABR-215050-dx (10 мг/кг/день) вводят с помощью питьевой воды начиная со дня 7-го. Для получения обеспечения соответствующей дозы без значительных отклонений, потребление воды отслеживают для каждой клетки животного в течение всего эксперимента. Ранее было показано, что половинное время жизни в плазме тасквинимода составляет 3,4 часа и что введение 1-10 мг/кг/день с помощью питьевой воды дает стационарные уровни в плазме (0,4-1 мкМ) (14). Животных умерщвляют, когда средний размер опухоли для контрольной группы достигает объема 900±100 мм3 или когда объем опухоли для индивидуального животного достигает 1200 мм3. Результаты иллюстрируются на фиг.7.
Настоящее изобретение дополнительно иллюстрируется в следующем далее неограничивающем примере.
Пример
4-Гидрокси-5-метокси-N-дейтериометил-1-метил-2-оксо-N-[(4-трифторметил)фенил]-1,2-дигидрохинолин-3-карбоксамид
Сложный метиловый эфир 4-гидрокси-5-метокси-1-метил-2-оксо-1,2-дигидрохинолин-3-карбоновой кислоты (1,0 г, 3,79 ммоль), N-дейтериометил-р-трифторметиланилин (1,0 г), трибутиламин (100 микролитр) и н-октан (70 мл) нагревают с обратным холодильником, и летучие вещества медленно отгоняют в течение 6 часов. В конце реакции отгоняют приблизительно 60 мл растворителей и смесь охлаждают до комнатной температуры. Добавляют смесь н-гептана (25 мл) и толуола (6 мл), и суспензию кристаллов перемешивают в течение 20 мин, и кристаллы собирают посредством фильтрования, промывают н-гептаном и сушат с получением сырого указанного в заголовке соединения (1,52 г). Его растворяют в смеси метанола (11,2 мл), воды (6,8 мл) и гидроксида натрия (5 М, 0,83 мл, 4,15 ммоль). Добавляют хлористоводородную кислоту (5 М) для доведения рН приблизительно до 8-9 и смесь фильтруют для удаления любого нерастворимого материала. К фильтрату добавляют 5 М HCl, пока рН не станет равным приблизительно 2. Суспензию перемешивают в течение 1 часа и кристаллы собирают посредством фильтрования, промывают 33% водным раствором МеОН, а затем водой и, наконец, сушат в вакууме с получением указанного в заголовке соединения (1,25 г, 80%). Н-ЯМР (CDCl3); 9,95 (s, 1Н), 7,50 (m, 5H), 6,93 (d, 1H), 6,70 (d, 1H), 4,04 (s, 3H), 3.55 (s, 3Н). Анал. вычисл. для C20H14N2D3O4F3: С 58,68, Н 4,22, N 6,84. Найдено: С 58,8, Н 4,25, N 6,94. Масс-спектрометрия с ионизацией распылением (ESI) при атмосферном давлении: (М+Н) вычисл. 410, найдено 410, смотри фиг.3.
Сложный метиловый эфир 4-гидрокси-5-метокси-1-метил-2-оксо-1,2-дигидрохинолин-3-карбоновой кислоты приготавливают с помощью способа, как описано в (15).
N-дейтериометил-п-трифторметиланилин приготавливают следующим образом. 4-аминобензотрифторид (12,6 мл, 100 ммоль) растворяют в ТГФ (100 мл) и добавляют порциями трифторуксусный ангидрид (21,2 мл, 150 ммоль) при охлаждении на ледяной бане. После завершения добавления смесь выпаривают с получением трифторацетамидного производного в виде белого твердого продукта (26,1 г). Этот твердый продукт растворяют в ТГФ (100 мл) и охлаждают на ледяной бане. Порциями добавляют трет-бутоксид калия (180 ммоль, 20,2 г), а затем дейтериометилйодид (25 г, 173 ммоль) с последующим перемешиванием при комнатной температуре в течение 18 часов. Смесь выпаривают и распределяют между простым диэтиловым эфиром и водой. Органический экстракт промывают водой, а затем насыщенным раствором соли и сушат над сульфатом натрия. Выпаривание летучих продуктов дает 2,2,2-трифтор-N-дейтериометил-N-(4-трифторметил-фенил)ацетамид в виде желтоватого масла (27,3 г). Это масло растворяют в смеси метанола (125 мл) и гидроксида аммония (28% водный раствор, 50 мл). После перемешивания при комнатной температуре в течение 6 часов смесь концентрируют и распределяют между простым диэтиловым эфиром и водой. Органический экстракт промывают два раза водой, затем промывают насыщенным раствором соли и сушат над сульфатом натрия. Концентрированно дает желтое масло, которое очищают на оксиде кремния (гептан/этилацетат, 10:1-5:1) с получением указанного в заголовке соединения в виде желтого масла (16,2 г, 91%). Н-ЯМР (CDCl3); 7,40 (d, 2H), 6,60 (d, 2H), 4,10 (s, 1 Н).
Таким образом, посредством получения обогащенного дейтерием ABR-215050, имеющего дейтерированную амид-N-метильную группу, автор настоящего изобретения предлагает способ (а) уменьшения содержания указанного нежелательного метаболита с хорошо определенным нежелательным свойством, (b) без влияния на половинное время жизни исходного лекарственного средства и (с) без образования метаболитов с неизвестными свойствами по сравнению с недейтерированным соединением.
Поскольку дейтерированный ABR-215050 в соответствии с настоящим изобретением имеет существенно уменьшенное воздействие индуцирования CYP1A, настоящее изобретение, в частности, делает возможной сочетанную терапию с помощью лекарственных средств, которые склонны к метаболизации под действием CYP1A.
В случае когда соединения по настоящему изобретению используют в сочетании с другим лекарственным средством, два компонента могут находиться в одном и том же средстве или в отдельных средствах для одновременного или последовательного введения. Соединения по настоящему изобретению могут также использоваться или вводиться в сочетании с другим лечением, таким как облучение, для лечения рака.
Предполагается также, что уменьшение индуцирования цитохрома Р450 CYP1A даст возможность повышения дозы ABR-215050 (в амид-N-метил-дейтерированной форме), если это будет желательным, даже в присутствии лекарственных средств, которые метаболизируются с помощью CYP1A.
В соответствии с одним из аспектов настоящего изобретения предлагается способ лечения млекопитающего, страдающего расстройством, облегчаемым посредством модулирования иммунной функции, который включает введение млекопитающему эффективного количества соединения в соответствии с настоящим изобретением или его фармацевтически приемлемой соли.
В некоторых вариантах осуществления, лечение включает профилактику, а также облечение симптомов заболевания или расстройства.
В некоторых вариантах осуществления, лечение предназначено для облегчения симптомов заболевания, то есть для облегчения состояния пациента, страдающего от заболевания или расстройства.
Кроме того, предлагается способ лечения злокачественного гиперпролиферативного расстройства, например злокачественного гиперпролиферативного расстройства, как рассмотрено выше в настоящем документе, или аутоиммунного заболевания, например аутоиммунного заболевания, как описано выше в настоящем документе, у млекопитающего посредством введения млекопитающему эффективного количества соединения в соответствии с настоящим изобретением или его фармацевтически приемлемой соли.
Эффективные количества соединений формулы (I) предпочтительно вводятся пациенту, нуждающемуся в таком лечении, в соответствии с обычными способами введения и приготавливаются в виде обычных фармацевтических композиций, содержащих эффективное количество активного ингредиента и соответствующий фармацевтически приемлемый носитель. Такие композиции могут принимать разнообразные формы, например, растворов, суспензий, эмульсий, таблеток, капсул и порошков, приготовленных для перорального введения, аэрозолей для ингаляций, стерильных растворов для парентерального введения и суппозиториев для ректального введения или соответствующих препаратов для местного введения. Обычные процедуры для выбора и приготовления соответствующих фармацевтических препаратов описаны, например, в "Aulton’s Pharmaceutics: The Design and Manufacture of Medicines”, M.E. Aulton, Churchill Livingstone, 2007.
Соответствующая ежедневная доза для использования при лечении рака или аутоиммунного заболевания, как предполагается, изменяется в пределах между 0,0001 мг/кг и примерно 0,5 мг/кг массы тела, в частности между 0,001 мг/кг и 0,005 мг/кг массы тела, в зависимости от конкретного состояния, которое должно лечиться, возраста и массы тела конкретного пациента и реакции конкретного пациента на медицинский препарат. Точная индивидуальная доза, а также ежедневная доза, будет определяться в соответствии со стандартными медицинскими принципами под руководством врача.
Предполагаются разнообразные добавки для улучшения стабильности или простоты введения лекарственного средства. Фармацевтическая композиция может также содержать дополнительные терапевтически полезные вещества, иные чем соединения формулы (I).
Источники информации
(1) Заявка РСТ WO 01/30758 A1.
(2) Isaacs J, Pili R, Qian D, Dalrymple S, Garrison J, Kyprianou N, Bjork A, Olsson A, Leandersson T. Identification of ABR-215050 as lead second generation quinoline-3-carboxamide anti-angiogenic agent for the treatment of prostate cancer. Prostate. 2006 Dec 1;66(16):1768-78.
(3) Dalrymple S, Becker E, Isaacs J. The quinoline-3-carboxamide anti-angiogenic agent, tasquinimod, enhanced the anti-prostate cancer efficacy of androgen ablation and Taxotere without affecting serum PSA directly in human xenograft models. Prostate. 2007 67:790-797.
(4) Clinical Phase-II study "EudraCTNo: 2007-003470-26".
(5) Trentham D.E. 1982. Collagen arthritis as a relevant model for rheumatoid arthritis. Evidence pro and con. Arthr. Rheum. 25, 911-916.
(6) Международная заявка на патент № WO 00/03991.
(7) Заявка на патент США №2010/0055072 A1.
(8) London, 13 December 2007 Doc. Ref. EMEA/CHMP/EWP/490784/2007 http://www.ema.europa.eu/docs/en GB/document librarv/Qther/2009/11/WC500015483.pdf.
(9) Postlind, H., Vu, T.P., Tukey, R.H., and Quattrochi, L.C. (1993). Response of Human CYPl-Luciferase Plasmids to 2,3,7,8-Tetrachlorodibenzo-p-dioxin and Polycyclic Aromatic Hydrocarbons. Toxicol. Appl. Pharmco. 118, 255-262.
(10) Edward Kerns and Li Di. Drug-like Properties: Concepts, Structure Design and Methods: from ADME to Toxicity Optimization. Academic Press, 2008, ISBN 978-0-12-369520-8, p.139.
(11) The American Autoimmune Related Diseases Association, Inc. (AARDA) 22100 Gratiot Ave, East Detroit, MI 48021, USA http://www.aarda.org/research_displav.php?ID=47.
(12) Gustavsson H, Welen K, Damber JE. Transition of an androgen-dependent human prostate cancer cell line into an androgen-independent subline is associated with increased angiogenesis. Prostate. 2005;62:364-73.
(13) Jennbacken K, Gustavsson H, Welen K, Vallbo C, Damber JE. Prostate cancer development into androgen independency is associated with alterations in cell adhesion and invasivity. Prostate. 2006; 66:1631-40.
(14) Isaacs JT, Pili R, Qian DZ, Dalrymple SL, Garrison JB, Kyprianou N, Bjork A, Olsson A, Leanderson T. Identification of ABR-215050 as lead second generation quinoline-3-carboxamide anti-angiogenic agent for the treatment of prostate cancer. Prostate. 2006; 66:1768-78.
(15) Joensson et al, J. Med. Chem., 2004, 47, 2075-2088.
| название | год | авторы | номер документа |
|---|---|---|---|
| N-(2-ТИАЗОЛИЛ)АМИДНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ GSK-3 | 2007 |
|
RU2450000C2 |
| N-(2-ТИАЗОЛИЛ)АМИДНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ GSK-3 | 2007 |
|
RU2429237C2 |
| ТЕТРАГИДРОПИРАНИЛ АМИНО-ПИРРОЛОПИРИМИДИНОН И СПОСОБЫ ЕГО ПРИМЕНЕНИЯ | 2020 |
|
RU2747991C1 |
| ТЕТРАГИДРОПИРАНИЛ АМИНО-ПИРРОЛОПИРИМИДИНОН И СПОСОБЫ ЕГО ПРИМЕНЕНИЯ | 2015 |
|
RU2715421C2 |
| N1-(4-(5-(ЦИКЛОПРОПИЛМЕТИЛ)-1-МЕТИЛ-1H-ПИРАЗОЛ-4-ИЛ)ПИРИДИН-2-ИЛ)ЦИКЛОГЕКСАН-1,4-ДИАМИНОВЫЕ ПРОИЗВОДНЫЕ И РОДСТВЕННЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ СK1 И/ИЛИ IRAK1 ДЛЯ ЛЕЧЕНИЯ РАКА | 2018 |
|
RU2761457C2 |
| ПРОИЗВОДНЫЕ РАПАМИЦИНА, СОДЕРЖАЩИЕ ИЗОТИАЗОЛИДИН-1,1-ДИОКСИД И 1,4-БУТАНСУЛЬТОН, И ПУТИ ИХ ПРИМЕНЕНИЯ | 2020 |
|
RU2836680C2 |
| ИНГИБИТОРЫ GSK-3 | 2006 |
|
RU2449998C2 |
| 2-КАРБОКСАМИД ЦИКЛОАМИНО ПРОИЗВОДНЫЕ МОЧЕВИНЫ В КОМБИНАЦИИ С ИНГИБИТОРАМИ Hsp90 ДЛЯ ЛЕЧЕНИЯ ПРОЛИФЕРАТИВНЫХ ЗАБОЛЕВАНИЙ | 2012 |
|
RU2624493C2 |
| КОМПОЗИЦИИ И СПОСОБЫ, КОТОРЫЕ МОЖНО ИСПОЛЬЗОВАТЬ ДЛЯ ЛЕЧЕНИЯ ПРОЛИФЕРАТИВНЫХ ЗАБОЛЕВАНИЙ | 2015 |
|
RU2711500C2 |
| КОМБИНАЦИЯ ДЛЯ ЛЕЧЕНИЯ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ | 2017 |
|
RU2733950C1 |







Изобретение относится к области органической химии, а именно к обогащенному дейтерием 4-гидрокси-5-метокси-N,1-диметил-2-оксо-N-[(4-трифторметил)-фенил]-1,2-дигидрохинолин-3-карбоксамиду. Также изобретение относится к фармацевтической композиции на основе обогащенного дейтерием карбоксамида, способу его получения и способу лечения злокачественного гиперпролиферативного расстройства или аутоиммунного заболевания, основанному на использовании обогащенного дейтерием карбоксамида. Технический результат: получен обогащенный дейтерием 4-гидрокси-5-метокси-N,1-диметил-2-оксо-N-[(4-трифторметил)-фенил]-1,2-дигидрохинолин-3-карбоксамид, обладающий полезными биологическими свойствами. 4 н. и 21 з.п. ф-лы, 7 ил., 10 табл., 1 пр.
1. Соединение, которое представляет собой обогащенный дейтерием 4-гидрокси-5-метокси-N,1-диметил-2-оксо-N-[(4-трифторметил)фенил]-1,2-дигидрохинолин-3-карбоксамид, имеющий обогащение дейтерием в амид-N-метильной группе по меньшей мере 70%; или его соль с фармацевтически приемлемым органическим или неорганическим катионом.
2. Соединение по п.1, где указанное обогащение дейтерием составляет по меньшей мере 90%.
3. Соединение по п.1, имеющее формулу (I)

где R1 представляет собой Н или фармацевтически приемлемый органический или неорганический катион; и
R2, R3 и R4 независимо выбирают из Н и D; и
CR2R3R4 имеет общее обогащение дейтерием по меньшей мере 70%.
4. Соединение по п.3, где каждый из R2, R3 и R4 имеет обогащение дейтерием по меньшей мере 90%.
5. Соединение по п.1, где фармацевтически приемлемый катион выбирают из натрия, калия, кальция, моноэтаноламина, диэтаноламина, диметиламиноэтанола или морфолина.
6. Соединение по п.2, где фармацевтически приемлемый катион выбирают из натрия, калия, кальция, моноэтаноламина, диэтаноламина, диметиламиноэтанола или морфолина.
7. Соединение по п.3, где фармацевтически приемлемый катион выбирают из натрия, калия, кальция, моноэтаноламина, диэтаноламина, диметиламиноэтанола или морфолина.
8. Соединение по п.4, где фармацевтически приемлемый катион выбирают из натрия, калия, кальция, моноэтаноламина, диэтаноламина, диметиламиноэтанола или морфолина.
9. Фармацевтическая композиция для применения при лечении расстройства, выбранного из злокачественного гиперпролиферативного расстройства или аутоиммунного заболевания, содержащая терапевтически эффективное количество соединения по любому из пп.1-8.
10. Соединение по любому из пп.1-8 для применения в профилактике или лечении расстройства, облегчаемого посредством модулирования иммунной функции.
11. Соединение по любому из пп.1-8 для применения при лечении расстройства, выбранного из злокачественного гиперпролиферативного расстройства и аутоиммунного заболевания.
12. Соединение по п.11, где расстройство представляет собой злокачественное гиперпролиферативное расстройство.
13. Соединение по п.11, где злокачественное гиперпролиферативное расстройство представляет собой твердую опухоль, злокачественную меланому или гематологическую опухоль.
14. Соединение по п.11, где расстройство представляет собой аутоиммунное заболевание.
15. Соединение по п.11, где аутоиммунное заболевание выбирают из болезни Крона, рассеянного склероза, ревматоидного артрита, язвенного колита и системной красной волчанки.
16. Способ получения соединения, которое представляет собой обогащенный дейтерием 4-гидрокси-5-метокси-N,1-диметил-2-оксо-N-[(4-трифторметил)фенил]-1,2-дигидрохинолин-3-карбоксамид или его фармацевтически приемлемую соль, посредством взаимодействия в углеводородном растворителе сложного С1-С4 алкилового эфира 4-гидрокси-5-метокси-1-метил-2-оксо-1,2-дигидрохинолин-3-карбоновой кислоты с обогащенным дейтерием N-метил-р-трифторметиланилином, где N-метильная группа имеет обогащение дейтерием по меньшей мере 70%, и необязательного взаимодействия обогащенного дейтерием 4-гидрокси-5-метокси-N,1-диметил-2-оксо-N-[(4-трифторметил)фенил]-1,2-дигидрохинолин-3-карбоксамида с фармацевтически приемлемым органическим или неорганическим основанием.
17. Способ по п.16, в котором соединение формулы (II)

где R5 представляет собой С1-С4 алкильную группу,
взаимодействует с соединением формулы (III)

где R2, R3 и R4 независимо выбирают из Н и D; и
CR2R3R4 имеет общее обогащение дейтерием по меньшей мере 70%,
для получения соединения формулы (I)

и с необязательным взаимодействием соединения формулы (I) с фармацевтически приемлемым органическим или неорганическим основанием.
18. Способ по п.16 или 17, в котором обогащение дейтерием составляет по меньшей мере 90%.
19. Способ лечения злокачественного гиперпролиферативного расстройства или аутоиммунного заболевания у млекопитающего, который включает введение млекопитающему эффективного количества соединения, которое представляет собой обогащенный дейтерием 4-гидрокси-5-метокси-N,1-диметил-2-оксо-N-[(4-трифторметил)фенил]-1,2-дигидрохинолин-3-карбоксамид, имеющий обогащение дейтерием в амид-N-метильной группе по меньшей мере 70%; или его соль с фармацевтически приемлемым органическим или неорганическим катионом.
20. Способ по п.19, где указанное обогащение дейтерием составляет по меньшей мере 90%.
21. Способ по п.19, где соединение имеет формулу (I)

где R1 представляет собой Н или фармацевтически приемлемый органический или неорганический катион; и
R2, R3 и R4 независимо выбирают из Н и D; и
CR2R3R4 имеет общее обогащение дейтерием по меньшей мере 70%.
22. Способ по п.21, где указанное обогащение дейтерием составляет по меньшей мере 90%.
23. Способ по любому из пп.19-22 для лечения злокачественного гиперпролиферативного расстройства.
24. Способ по любому из пп.19-22, где злокачественное гиперпролиферативное расстройство представляет собой твердую опухоль, злокачественную меланому или гематологическую опухоль.
25. Способ по любому из пп.19-22, где аутоиммунное заболевание выбирают из болезни Крона, рассеянного склероза, ревматоидного артрита, язвенного колита и системной красной волчанки.
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Bratt O | |||
| et al: "Open-label, clinical phase I studies of tasquinimod in patients with castration-resistant prostate cancer", British journal of cancer, 2009, 101(8), стр.1233-1240 | |||
| Способ получения производных 3-хинолинкарбоновой кислоты или их солей | 1977 |
|
SU867299A3 |
Авторы
Даты
2017-01-17—Публикация
2012-06-20—Подача