Область техники, к которой относится заявка
[0001] Настоящая заявка направлена на ингибиторы тирозинкиназы Брутона (BTK), включая мутантную BTK, полезные в лечении заболеваний или расстройств, связанных с BTK киназой, включая иммунные расстройства, рак, сердечно-сосудистые заболевания, вирусные инфекции, воспаление, нарушения обмена веществ/функции эндокринной системы и неврологические расстройства. Конкретно, настоящая заявка рассматривает соединения и их композиции, которые ингибируют BTK, способы лечения заболеваний или расстройств, связанных с BTK, и способы синтеза этих соединений.
Уровень техники
[0002] BTK является членом семейства Тес тирозинкиназ, и играет важную роль в регуляции раннего развития В-клеток и активации и выживания зрелых В-клеток. (Hunter, Cell, 1987 50, 823-829). Функционируя на пути ниже от множества рецепторов, таких как, факторы роста, В-клеточный антиген, хемокин и врожденные иммунные рецепторы, BTK инициирует ряд клеточных процессов, включая клеточную пролиферацию, выживание, дифференцировку, подвижность, ангиогенез, продукцию цитокинов и презентацию антигена.
[0003] Модели мышей с дефицитом BTK продемонстрировали какую роль играет BTK в аллергических заболеваниях и/или аутоиммунном заболевании и/или воспалительном заболевании. Например, в стандартных предклинических мышиных моделях системной красной волчанки (SLE) мыши с дефицитом BTK показывают заметное улучшение развития заболевания. Кроме того, мыши с дефицитом BTK могут быть резистентными к коллаген-индуцируемому артриту и менее восприимчивы к Staphylococcus-индуцируемому артриту. Благодаря роли BTK в активации B-клеток, ингибиторы BTK также могут быть полезны в качестве ингибиторов патогенной активности, опосредованной B-клетками (такой как продуцирование аутоантител). Было показано, что экспрессия BTK в остеокластах, тучных клетках и моноцитах играет важную роль для функции этих клеток. Например, нарушение IgE-опосредованной активации тучных клеток и снижение продуцирования TNF-альфа активированными моноцитами связано с дефицитом BTK у мышей и людей. Таким образом, ингибирование BTK может быть полезным для лечения аллергических расстройств и/или аутоиммунных и/или воспалительных заболеваний, таких как: SLE, ревматоидный артрит, множественные васкулиты, идиопатическая тромбоцитопеническая пурпура (ITP), тяжелая миастения, аллергический ринит и астма (DiPaolo et. al., Nature Chem. Biol. 2011, 7(1):41-50; Liu et. al., Jour. Pharmacol. и Exp. Ther. 2011, 338(1):154-163).
[0004] Более того, роль BTK в апоптозе демонстрирует полезность ингибирования BTK активности для лечения раковых заболеваний, В-клеточной лимфомы, лейкоза и других гематологических злокачественных новообразований. Кроме того, учитывая роль BTK в функции остеокластов, ингибирование BTK активности может быть полезным для лечения костных расстройств, таких как остеопороз.
[0005] Таким образом, ингибирование BTK низкомолекулярными ингибиторами имеет потенциал для лечения иммунных расстройств, рака, сердечно-сосудистых заболеваний, вирусных инфекций, воспалений, нарушения обмена веществ/функции эндокринной системы и неврологических расстройств. Таким образом, остается значительная потребность в сильных низкомолекулярных ингибиторах BTK.
Сущность изобретения
[0006] Первый аспект настоящей заявки относится к соединению формулы (I):
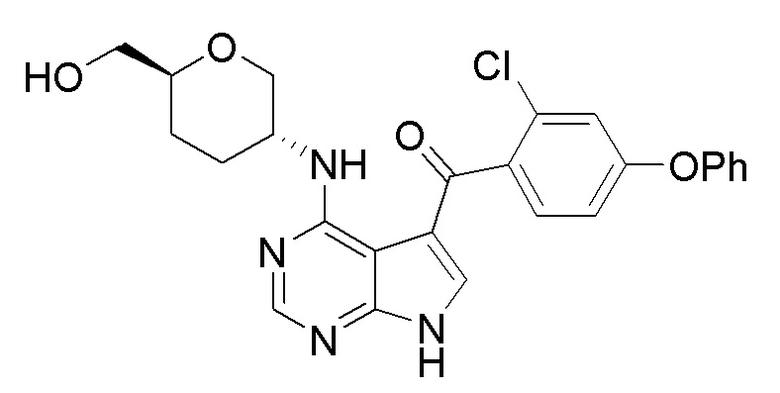 (I),
(I),
или его фармацевтически приемлемым солям, таутомерам, пролекарствам, сольватам, метаболитам, полиморфам, аналогам или производным. В контексте настоящей заявки, выражения ʺсоединение формулы (I)ʺ и ʺСоединение (I)ʺ относятся к одному и тому же соединению и могут использоваться взаимозаменяемо.
[0007] Другой аспект настоящей заявки относится к фармацевтической композиции, включающей соединение формулы (I) или его фармацевтически приемлемую соль, таутомер, пролекарство, сольват, метаболит, полиморф, аналог или производное и фармацевтически приемлемый разбавитель, эксципиент или носитель.
[0008] Другой аспект настоящей заявки относится к способу лечения BTK-опосредованного расстройства. Способ включает введение пациенту, нуждающемуся в лечении заболеваний или расстройств, связанных с модуляциям BTK киназы, терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, таутомера, пролекарства, сольвата, метаболита, полиморфа, аналога или производного.
[0009] Другой аспект настоящей заявки относится к способу лечения BTK-опосредованного расстройства. Способ включает введение пациенту, нуждающемуся в лечении заболеваний или расстройств, связанных с модуляциям BTK киназы, терапевтически эффективного количества фармацевтической композиции, включающей соединение формулы (I) или его фармацевтически приемлемую соль, таутомер, пролекарство, сольват, метаболит, полиморф, аналог или производное и фармацевтически приемлемый разбавитель, эксципиент или носитель.
[0010] Другой аспект настоящей заявки относится к способу лечения клеточно-пролиферативного расстройства. Способ включает введение нуждающемуся в этом пациенту терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, таутомера, пролекарства, сольвата, метаболита, полиморфа, аналога или производного.
[0011] Другой аспект настоящей заявки относится к способу лечения клеточно-пролиферативного расстройства. Способ включает введение нуждающемуся в этом пациенту терапевтически эффективного количества фармацевтической композиции, включающей соединение формулы (I) или его фармацевтически приемлемую соль, таутомер, пролекарство, сольват, метаболит, полиморф, аналог или производное и фармацевтически приемлемый разбавитель, эксципиент или носитель.
[0012] Другой аспект настоящей заявки относится к способу лечения рака. Способ включает введение нуждающемуся в этом пациенту терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, таутомера, пролекарства, сольвата, метаболита, полиморфа, аналога или производного.
[0013] Другой аспект настоящей заявки относится к способу лечения рака. Способ включает введение нуждающемуся в этом пациенту терапевтически эффективного количества фармацевтической композиции, включающей соединение формулы (I) или его фармацевтически приемлемую соль, таутомер, пролекарство, сольват, метаболит, полиморф, аналог или производное и фармацевтически приемлемый разбавитель, эксципиент или носитель.
[0014] Другой аспект настоящей заявки относится к способу модуляции (например, ингибирования) BTK. Способ включает введение нуждающемуся в этом пациенту терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, таутомера, пролекарства, сольвата, метаболита, полиморфа, аналога или производного.
[0015] Другой аспект настоящей заявки относится к способу модуляции (например, ингибирования) BTK. Способ включает введение нуждающемуся в этом пациенту терапевтически эффективного количества фармацевтической композиции, включающей соединение формулы (I) или его фармацевтически приемлемую соль, таутомер, пролекарство, сольват, метаболит, полиморф, аналог или производное и фармацевтически приемлемый разбавитель, эксципиент или носитель.
[0016] Другой аспект настоящей заявки относится к соединению формулы (I) или его фармацевтически приемлемой соли, таутомеру, пролекарству, сольвату, метаболиту, полиморфу, аналогу или производному, для применения в способе лечения BTK-опосредованного расстройства, клеточно-пролиферативного расстройства или рака или модуляции (например, ингибирования) BTK. Соединение формулы (I) или его фармацевтически приемлемую соль, таутомер, пролекарство, сольват, метаболит, полиморф, аналог или производное вводят в терапевтически эффективном количестве нуждающемуся в этом пациенту.
[0017] Другой аспект настоящей заявки относится к фармацевтической композиции, включающей соединение формулы (I) или его фармацевтически приемлемую соль, таутомер, пролекарство, сольват, метаболит, полиморф, аналог или производное и фармацевтически приемлемый разбавитель, эксципиент или носитель для применения в способе лечения BTK-опосредованного расстройства, клеточно-пролиферативного расстройства или рака или модуляции (например, ингибирования) BTK. Композицию вводят в терапевтически эффективном количестве нуждающемуся в этом пациенту.
[0018] Другой аспект настоящей заявки относится к применению соединения формулы (I) или его фармацевтически приемлемой соли, таутомера, пролекарства, сольвата, метаболита, полиморфа, аналога или производного для получения лекарственного средства для лечения BTK-опосредованного расстройства, клеточно-пролиферативного расстройства или рака или для модуляции (например, ингибирования) BTK. Соединение формулы (I) или его фармацевтически приемлемую соль, таутомер, пролекарство, сольват, метаболит, полиморф, аналог или производное вводят в терапевтически эффективном количестве нуждающемуся в этом пациенту.
[0019] Другой аспект настоящей заявки относится к применению фармацевтической композиции, включающей соединение формулы (I) или его фармацевтически приемлемую соль, таутомер, пролекарство, сольват, метаболит, полиморф, аналог или производное и фармацевтически приемлемый разбавитель, эксципиент или носитель для получения лекарственного средства для лечения BTK-опосредованного расстройства, клеточно-пролиферативного расстройства или рака или для модуляции (например, ингибирования) BTK. Композицию вводят в терапевтически эффективном количестве нуждающемуся в этом пациенту.
[0020] Настоящая заявка также обеспечивает способы лечения заболевания или расстройства, связанного с модуляцией BTK киназы, включая, но не ограничиваясь этим, иммунные расстройств, рак, сердечно-сосудистые заболевания, вирусные инфекции, воспаление, нарушения обмена веществ/функции эндокринной системы и неврологические расстройства, включающие введение пациенту, страдающему по меньшей мере одним из указанных заболеваний или расстройств, соединения формулы (I) или его фармацевтически приемлемой соли, таутомера, пролекарства, сольвата, метаболита, полиморфа, аналога или производного.
[0021] Настоящая заявка обеспечивает ингибиторы BTK, которые представляют собой терапевтические средства, для лечения заболеваний, таких как иммунные расстройств, рак, сердечно-сосудистые заболевания, вирусные инфекции, воспаление, нарушения обмена веществ/функции эндокринной системы, неврологические расстройства, и других заболеваний, связанных с модуляциям BTK киназы.
[0022] Настоящая заявка также обеспечивает соединения и композиции с улучшенным профилем безопасности и эффективности относительно известных ингибиторов BTK. Настоящая заявка также обеспечивает средства с новыми механизмами действия по отношению к BTK киназе в лечении различных типов заболеваний, включая иммунные расстройства, рак, сердечно-сосудистые заболевания, вирусные инфекции, воспаление, нарушения обмена веществ/функции эндокринной системы и неврологические расстройства. В конечном итоге, настоящая заявка предоставляет медицинскому сообществу новую фармакологическую стратегию лечения заболеваний и расстройств, связанных с BTK киназой.
Подробное описание изобретения
[0023] Настоящая заявка относится к соединению и композициям, которые способны модулировать активность тирозинкиназы Брутона (BTK). Настоящая заявка демонстрирует способы лечения, профилактики или ослабления заболевания или расстройства, в котором BTK играет роль, путем введения нуждающемуся в этом пациенту терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, таутомера, пролекарства, сольвата, метаболита, полиморфа, аналога или производного. Способы настоящей заявки можно использовать в лечении ряда BTK-опосредованных заболеваний и расстройств путем ингибирования активности BTK киназы. Ингибирование BTK обеспечивает лечение, профилактику или ослабление заболеваний, включая, но не ограничиваясь этим, иммунные расстройства, рак, сердечно-сосудистые заболевания, вирусные инфекции, воспаление, нарушения обмена веществ/функции эндокринной системы и неврологические расстройства.
[0024] В первом аспекте настоящей заявки описано соединение формулы (I):
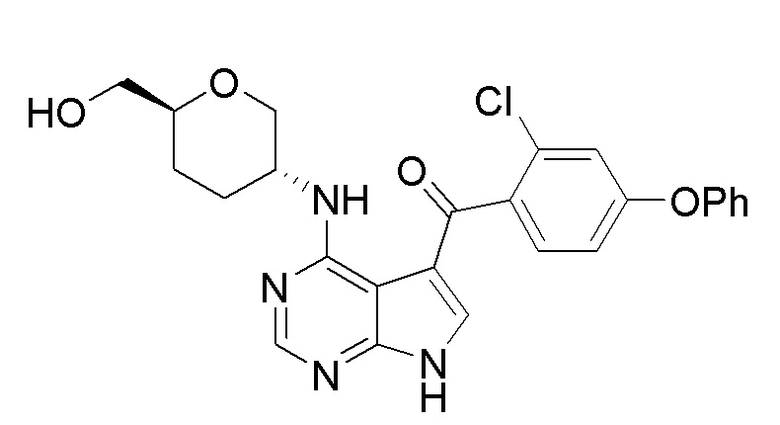 (I),
(I),
и его фармацевтически приемлемые соли, таутомеры, пролекарства, сольваты, метаболиты, полиморфы, аналоги или производные.
[0025] В одном варианте осуществления соединение формулы (I) представляет собой фармацевтически приемлемую соль. В другом варианте осуществления соединение формулы (I) представляет собой гидрат. В еще одном варианте осуществления соединение формулы (I) представляет собой сольват.
[0026] Детали настоящей заявки изложены в сопроводительном описании ниже. Хотя способы и материалы, аналогичные или эквивалентные описанным в настоящей заявке, могут быть использованы в практике или испытаниях настоящей заявки, здесь описаны иллюстративные способы и материалы. Другие признаки, объекты и преимущества настоящей заявки будут очевидны из описания и из формулы изобретения. В описании и прилагаемой формуле изобретения формы единственного числа также включают множественное число, если контекст явно не диктует иное. Если не определено иначе, все технические и научные термины, используемые в настоящей заявке, имеют то же значение, которое обычно понятно обычному специалисту в области, к которой относится эта заявка. Все патенты и публикации, цитируемые в описании, включены в настоящую заявку посредством ссылки во всей их полноте.
Определения
[0027] Артикли "a" и "an" используют в настоящей заявке для обозначения одного или нескольких (то есть, по меньшей мере, одного) грамматического объекта. В качестве примера "элемент" означает один элемент или более чем один элемент.
[0028] Термин "и/или" используют в настоящей заявке для обозначения либо "и", либо "или", если не указано иное.
[0029] Настоящая заявка также включает фармацевтические композиции, содержащие эффективное количество соединения формулы (I) и фармацевтически приемлемый носитель.
[0030] Термин "носитель", в контексте настоящей заявки, охватывает носители, эксципиенты и разбавители, и означает вещество, композицию или носитель, такой как жидкий или твердый наполнитель, разбавитель, эксципиент, растворитель или инкапсулирующее вещество, участвующее в переносе или транспортировке фармацевтического средства из одного органа или части тела в другой орган или часть тела субъекта.
[0031] Соединение формулы (I) могут образовывать соли, которые также входят в объем настоящей заявки. Подразумевается, что ссылка на соединение Формулы, представленной в настоящей заявке, и включает ссылку на его соли, если не указано иное.
[0032] Типичные "фармацевтически приемлемые соли" включают, например, водорастворимые и нерастворимые в воде соли, такие как ацетат, амсонат (4,4-диаминостильбен-2,2-дисульфонат), бензолсульфонат, бензонат, бикарбонат, бисульфат, битартрат, борат, бромид, бутират, кальций, эдетат кальция, камзилат, карбонат, хлорид, цитрат, клавуланат, дигидрохлорид, эдетат, эдизилат, эстролат, эзилат, фумарат, фунарат, глуцептат, глюконат, глутамат, гликолиларсанилат, гексафторфосфат, гексилрезорцинат, гидрабамин, гидробромид, гидрохлорид, гидроксинафтоат, йодид, изотионат, лактат, лактобионат, лаурат, магний, малат, малеат, манделат, мезилат, метилбромид, метилнитрат, метилсульфат, муцинат, напсилат, нитрат, соль N-метилглюкаминаммония, 3-гидрокси-2-нафтоат, олеат, оксалат, пальмитат, памоат (1,1-метен-бис-2-гидрокси-3-нафтоат, эйнбонат), пантотенат, фосфат/дифосфат, пикрат, полигалактуронат, пропионат, пара-толуолсульфонат, салицилат, стеарат, субацетат, сукцинат, сульфат, сульфосалицилат, сурамат, таннат, тартрат, теоклат, тозилат, триэтиодид и валерат.
[0033] Соединения настоящей заявки, например, включая фармацевтически приемлемые соли, таутомеры, пролекарства и полиморфы соединений, могут существовать в сольватированной форме с другими молекулами растворителя или в несольватированной форме.
[0034] ʺСольватʺ означает формы присоединения растворителя, которые содержат либо стехиометрические, либо не стехиометрические количества растворителя. Некоторые соединения или соли имеют тенденцию захватывать фиксированное молярное соотношение молекул растворителя в кристаллическом твердом состоянии, образуя таким образом сольват. Если растворителем является вода, образовавшийся сольват представляет собой гидрат; и если растворителем является спирт, образовавшийся сольват представляет собой алкоголят. Гидраты образованы комбинацией одной или нескольких молекул воды с одной молекулой вещества, в которой вода сохраняет свое молекулярное состояние как H2O.
[0035] Все стереоизомеры (например, геометрические изомеры, оптические изомеры и подобные) соединений по настоящему изобретению (включая соли, сольваты, сложные эфиры и пролекарства соединений, а также соли, сольваты и сложные эфиры пролекарств), такие как те, которые могут существовать благодаря асимметричным атомам углерода на различных заместителях, включая энантиомерные формы (которые могут существовать даже в отсутствие асимметричных атомов углерода), ротамерные формы, атропизомеры и диастереомерные формы, предусматриваются в объеме настоящей заявки, как и позиционные изомеры (такие как, например, 4-пиридил и 3-пиридил). Например, если соединение формулы (I) включает двойную связь или конденсированное кольцо, то как цис-, так и транс-формы, а также смеси, включены в объем настоящей заявки. Отдельные стереоизомеры соединения настоящей заявки, например, могут быть по существу свободными от других изомеров или могут быть смешаны, например, в виде рацематов или со всеми другими или другими выбранными стереоизомерами. Хиральные центры в настоящей заявке могут иметь конфигурацию S или R, определенную в Рекомендациях IUPAC 1974. Применение терминов ʺсольʺ, ʺсольватʺ, ʺсложный эфирʺ, ʺпролекарствоʺ и подобные, предназначено в равной степени для применения к соли, сольвату, сложному эфиру и пролекарству энантиомеров, стереоизомеров, ротамеров, таутомеров, позиционных изомеров, рацематов или пролекарств соединений по настоящему изобретению.
[0036] Термин "изомер" относится к соединениям, которые имеют одинаковую композицию и молекулярную массу, но отличаются физическими и/или химическими свойствами. Структурное различие может быть в строении (геометрические изомеры) или в способности вращать плоскость поляризованного света (стереоизомеры). Что касается стереоизомеров, соединения формулы (I) могут иметь один или несколько асимметричных атомов углерода и могут встречаться в виде рацематов, рацемических смесей или в виде отдельных энантиомеров или диастереомеров.
[0037] В настоящем описании структурная формула соединений представляет собой определенный изомер для удобства в некоторых случаях, но настоящая заявка включает все изомеры, такие как геометрические изомеры, оптические изомеры на основе асимметричного углерода, стереоизомеры, таутомеры и подобные.
[0038] ʺИзомерияʺ означает соединения, которые имеют идентичные молекулярные формулы, но отличаются последовательностью связывания их атомов или расположением их атомов в пространстве. Изомеры, которые отличаются расположением их атомов в пространстве, называются ʺстереоизомерамиʺ. Стереоизомеры, которые не являются зеркальными отображениями друг друга, называются ʺдиастереоизомерамиʺ, а стереоизомеры, которые являются неналагаемыми друг на друга зеркальными отображениями, называются ʺэнантиомерамиʺ или иногда оптическими изомерами. Смесь, содержащая равные количества отдельных энантиомерных форм противоположной хиральности, называется ʺрацемической смесьюʺ.
[0039] Соединения настоящей заявки могут содержать асимметричные или хиральные центры и, следовательно, существовать в разных стереоизомерных формах. Предполагается, что все стереоизомерные формы соединений настоящей заявки, а также их смеси, включая рацемические смеси, образуют часть настоящей заявки. Кроме того, настоящая заявка охватывает все геометрические и позиционные изомеры. Например, если соединение настоящей заявки включает двойную связь или конденсированное кольцо, то и цис- и транс-формы, а также их смеси, включены в объем настоящей заявки. Каждое соединение, раскрытое в настоящей заявке, включает все энантиомеры, которые соответствуют общей структуре соединения. Соединение может находиться в рацемической или энантиомерно чистой форме или любой другой форме с точки зрения стереохимии. Результаты анализа могут отражать данные, собранные для рацемической формы, энантиомерно чистой формы или любой другой формы с точки зрения стереохимии.
[0040] Атом углерода, связанный с четырьмя неидентичными заместителями, называют ʺхиральным центромʺ.
[0041] ʺХиральный изомерʺ означает соединение с по меньшей мере одним хиральным центром. Соединения с более чем одним хиральным центром могут существовать либо как отдельный диастереомер, либо как смесь диастереомеров, называемая «диастереомерной смесью». Когда присутствует один хиральный центр, стереоизомер можно охарактеризовать абсолютной конфигурацией (R или S) этого хирального центра. Абсолютная конфигурация относится к расположению в пространстве заместителей, присоединеных к хиральному центру. Заместители, присоединенные к рассматриваемому хиральному центру, оцениваются в соответствии с Правилом последовательности Кана, Ингольда и Прелога. (Cahn et al., Angew. Chem. Inter. Edit. 1966, 5, 385; errata 511; Cahn et al., Angew. Chem. 1966, 78, 413; Cahn and Ingold, J. Chem. Soc. 1951 (London), 612; Cahn et al., Experientia 1956, 12, 81; Cahn, J. Chem. Educ. 1964, 41, 116).
[0042] «Геометрический изомер» означает диастереомеры, которые обязаны своим существованием затрудненному вращению вокруг двойных связей. Эти конфигурации дифференцированы в своих названиях префиксами цис- и транс- или Z и E, которые указывают, что группы находятся на одной или на противоположной стороне двойной связи в молекуле в соответствии с правилами Кана-Ингольда-Прелога.
[0043] В другом варианте осуществления настоящей заявки, соединение формулы (I) представляет собой энантиомер. В некоторых вариантах осуществления соединение представляет собой (S)-энантиомер. В других вариантах осуществления соединение представляет собой (R)-энантиомер. Еще в других вариантах осуществления соединения формулы (I) может представлять собой (+) или (-) энантиомеры. Соединение может содержать более чем один стереоцентр.
[0044] В другом варианте осуществления настоящей заявки соединения формулы (I) представляют собой диастереомеры. В некоторых вариантах осуществления соединения представляют собой син-диастереомер. В других вариантах осуществления соединения представляют собой анти-диастереомер.
[0045] Диастереомерные смеси могут быть разделены на их отдельные диастереомеры на основе их физико-химических различий способами, хорошо известными специалистам в данной области, такими как, например, хроматография и/или фракционная кристаллизация. Энантиомеры могут быть разделены путем преобразования энантиомерной смеси в диастереомерную смесь посредством реакции с соответствующим оптически активным соединением (например, хиральным вспомогательным соединением, таким как хиральный спирт или хлорангидрид кислоты Мошера), разделяющей диастереомеры и преобразующей (например, гидролиз) отдельные диастереомеры в соответствующие чистые энантиомеры. Энантиомеры также можно разделить путем использования хиральной колоночной ВЭЖХ.
[0046] Также соединения настоящей заявки могут существовать в разных таутомерных формах, и все такие формы включены в объем настоящей заявки. Кроме того, например, все кето-енольные и имин-енаминовые формы соединений включены в настоящую заявку.
[0047] «Таутомер» является одним из двух или более структурных изомеров, которые существуют в равновесии и легко преобразуются из одной изомерной формы в другую. Это преобразование приводит к формальной миграции атома водорода, сопровождаемой переходом смежных сопряженных двойных связей. Таутомеры существуют в виде смеси ряда таутомероа в растворе. В твердой форме обычно преобладает один таутомер. В растворах, где возможна таутомеризация, будет достигнуто химическое равновесие таутомеров. Точное соотношение таутомеров зависит от нескольких факторов, включая температуру, растворитель и уровень pH. Понятие таутомеров, которые являются взаимопревращаемыми при помощи таутомеризации, называется таутомерией.
[0048] Из различных типов таутомерии, которые возможны, обычно наблюдают два. В кето-енольной таутомерии происходит одновременный сдвиг электронов и атома водорода. Таутомерия в кольцевой цепи возникает в результате альдегидной группы (-CHO) в молекуле сахарной цепи, взаимодействующей с одной из гидроксигрупп (-ОН) в той же молекуле, с получением ее циклической (кольцеобразной) формы, как показано глюкозой.
[0049] Обычные таутомерные пары представляют собой: кетон-енол, амид-нитрил, лактам-лактим, таутомерия амид-имидокислота в гетероциклических кольцах (например, в нуклеиновых основаниях, таких как гуанин, тимин и цитозин), амин-енамин и енамин-имин. Таутомерные пары (пирролопиримидинил)метанон-(пирролопиримидинил)метанол включены в настоящую заявку:

[0050] Настоящая заявка относится к соединению формулы (I) или его фармацевтически приемлемым солям, таутомерам, пролекарствам, сольватам, метаболитам, полиморфам, аналогам или производным, способным к ингибированию BTK, которые полезны для лечения заболеваний и расстройств, связанных с модуляцией BTK киназы. Настоящая заявка также относится к соединению формулы (I) или его фармацевтически приемлемым солям, таутомерам, пролекарствам, сольватам, метаболитам, полиморфам, аналогам или производным, которые полезны для ингибирования BTK. В некоторых вариантах осуществления, BTK представляет собой ВТК дикого типа. В других вариантах осуществления, ВТК представляет собой мутантную BTK.
[0051] Другой аспект настоящей заявки относится к соединению формулы (I), где соединение ингибирует киназную активность мутантной BTK, такую как резистентную к лекарственным средствам мутантную BTK, содержащую мутацию, резистентную к лекарственным средствам (например, мутацию C481S). В некоторых вариантах осуществления пациент или субъект не реагирует на ингибиторы BTK или испытывает рецидив после лечения ингибиторами BTK из-за мутации BTK киназы (например, мутации C481S), которая препятствует ингибированию мишени. В одном варианте осуществления ВТК мутация представляет собой C481S мутацию.
[0052] В некоторых вариантах осуществления настоящая заявка обеспечивает соединение формулы (I), где соединение является более сильным, чем один или несколько известных ингибиторов BTK, включая, но не ограничиваясь этим, Ибрутиниб, GDC-0834, RN486, CGI-560, CGI-1746, HM-71224, CC-292, ONO-4059, CNX-774 и LFM-A13, при ингибировании активности BTK. Например, соединение может быть по меньшей мере примерно в 2 раза, 3 раза, 5 раз, 10 раз, 25 раз, 50 раз или примерно в 100 раз более эффективным (например, как измерено при помощи IC50), чем Ибрутиниб, GDC-0834, RN486, CGI-560, CGI-1746, HM-71224, CC-292, ONO-4059, CNX-774 и/или LFM-A13 при ингибировании активности BTK.
[0053] В некоторых вариантах осуществления настоящая заявка обеспечивает соединение формулы (I), где соединение является более сильным, чем один или несколько известных ингибиторов BTK, включая, но не ограничиваясь этим, Ибрутиниб, GDC-0834, RN486, CGI-560, CGI-1746, HM-71224, CC-292, ONO-4059, CNX-774 и LFM-A13, при ингибировании активности BTK, содержащей одну или несколько мутаций, как описано в настоящей заявке, например, C481S. Например, соединение может быть по меньшей мере примерно в 2 раза, 3 раза, 5 раз, 10 раз, 25 раз, 50 раз или примерно в 100 раз более эффективным (например, как измерено при помощи IC50), чем Ибрутиниб, GDC-0834, RN486, CGI-560, CGI-1746, HM-71224, CC-292, ONO-4059, CNX-774, и/или LFM-A13 при ингибировании активности BTK, содержащей одну или несколько мутаций, как описано в настоящей заявке. Резистентный к лекарственным средствам BTK мутант может иметь, без ограничения, резистентную к лекарственным средствам мутацию, включающую мутацию C481S.
[0054] Эффективность ингибитора можно определить по значению IC50. Соединение с более низким значением IC50, как определено в практически аналогичных условиях, является более сильным ингибитором по сравнению с соединением с более высоким значением IC50.
[0055] Соединения настоящей заявки можно преобразовать в N-оксиды путем обработки окислителем (например, 3-хлорпероксибензойной кислотой (m-CPBA) и/или пероксидами водорода) с получением других соединений настоящей заявки. Таким образом, рассмотрены все показанные и заявленные азот-содержащие соединения, когда это допускает валентность и структура, для включения как соединения как оно показано, так и его N-оксидного производного (которое можно обозначить как N→O или N+-O-). Кроме того, в других случаях, атомы азота в соединениях настоящей заявки можно преобразовать в N-гидрокси или N-алкокси соединения. Например, N-гидрокси соединения можно получить путем окисления исходного амина окислителем, таким как mCPBA. Также рассмотрены все показанные и заявленные азот-содержащие соединения, когда это допускает валентность и структура, для охвата как соединений как они показаны, так и их N-гидрокси (т.е., N-OH) и N-алкокси (т.е., N-OR, где R представляет собой замещенный или незамещенный C1-C6 алкил, C1-C6 алкенил, C1-C6 алкинил, 3-14-членный карбоцикл или 3-14-членный гетероцикл) производных.
[0056] Термин "пролекарство", в контексте настоящей заявки, означает соединение, которое преобразуется in vivo метаболическим путем (например, путем гидролиза) в соединение по настоящему раскрытию.
[0057] Поскольку известно, что пролекарства усиливают множество желательных качеств фармацевтических препаратов (например, растворимость, биодоступность, обрабатываемость и т.д.), соединения формулы (I) или их фармацевтически приемлемые соли, таутомеры, сольваты, метаболиты, полиморфы, аналоги или производные доставляться в форме пролекарства. Таким образом, настоящая заявка предназначена для охвата пролекарства соединения формулы (I) или его фармацевтически приемлемой соли, таутомера, сольвата, метаболита, полиморфа, аналога или производного, способов доставки таких пролекарств и содержащих их композиций. "Пролекарства" предназначены для включения любых ковалентно связанных носителей, которые высвобождают активное исходное лекарственное вещество настоящей заявки in vivo, когда такое пролекарство вводят субъекту-млекопитающему. Пролекарства получают путем модификации функциональных групп, присутствующих в соединении, таким образом, чтобы модификации расщеплялись либо при рутинной манипуляции, либо in vivo, до исходного соединения. Пролекарства включают соединения настоящей заявки, где гидроксильная или амино группа связана с любой группой, которая, когда пролекарство настоящей заявки вводят субъекту-млекопитающему, отщепляется с образованием свободной гидроксильной или свободной амино группы, соответственно. Примеры пролекарств включают, но не ограничиваются этим, ацетатные, формиатные и бензоатные производные спиртовых и аминных функциональных групп в соединениях каждой из формул, описанных в настоящей заявке, или в их фармацевтически приемлемой соли, таутомере, пролекарстве, сольвате, метаболите, полиморфе, аналоге или производном.
[0058] Термин «кристаллические полиморфы», «полиморфы» или «кристаллические формы» означает кристаллические структуры, в которых соединение (или его соль или сольват) может кристаллизоваться в разных кристаллических упаковках, все из которых имеют одинаковый элементный состав. Различные кристаллические формы обычно имеют разные рентгеновские дифрактограммы, инфракрасные спектры, точки плавления, плотность, кристаллическую форму, оптические и электрические свойства, стабильность и растворимость. Растворитель перекристаллизации, скорость кристаллизации, температура хранения и другие факторы могут привести к доминированию одной кристаллической формы. Кристаллические полиморфы соединений можно получить путем кристаллизации в разных условиях.
[0059] В контексте настоящей заявки, термин ʺаналогʺ относится к соединению, которое структурно подобно другому соединению, но немного отличается составом (как при замене одного атома атомом другого элемента, или присутствием определенной функциональной группы, либо заменой одной функциональной группы другой функциональной группой). Таким образом, аналог представляет собой соединение, которое аналогично или сопоставимо по функции и внешнему виду, но не по структуре или по происхождению указанного соединения.
[0060] Настоящая заявка также включает изотопно-меченые соединения, которые идентичны тем, которые перечислены в каждой из формул, описанных в настоящей заявке, за исключением того, что один или несколько атомов заменены атомом, имеющим атомную массу или массовое число, отличное от атомной массы или массового числа, наиболее часто встречающегося в природе. Примеры изотопов, которые могут быть включены в соединения настоящей заявки, включают изотопы водорода, углерода, азота, фтора, такие как 3H, 11C, 14C, 2H и 18F.
[0061] Соединение формулы (I) или его фармацевтически приемлемые соли, таутомеры, пролекарства, сольваты, метаболиты, полиморфы, аналоги или производные, которые содержат вышеуказанные изотопы и/или другие изотопы других атомов, входят в объем настоящей заявки. Изотопно-меченые соединения по настоящему изобретению, например те, в которые включены радиоактивные изотопы, такие как 3H, 14C, полезны в анализах распределения лекарственного средства и/или субстрата. Меченые тритием, т.е., 3H и углеродом-14, т.е., 14C, изотопы полезны из-за легкости их получения и возможности детекции. Изотопы 11C и 18F полезны в PET (позитронно-эмиссионная томография). PET полезна в томографии головного мозга. Кроме того, замещение более тяжелыми изотопами, такими как дейтерий, то есть 2H, может давать определенные терапевтические преимущества, связанные с большей метаболической стабильностью, например, увеличенный период полувыведения in vivo или снижение дозировки и, следовательно, в некоторых случаях может быть предпочтительным. Изотопно-меченные соединения формулы (I) или их фармацевтически приемлемые соли, таутомеры, пролекарства, сольваты, метаболиты, полиморфы, аналоги или производные обычно могут быть получены путем осуществления процедур, описанных в схемах и/или в Примерах, описанных в настоящей заявке, путем замены не меченого изотопом реагента легко доступным изотопно-меченным реагентом. В одном варианте осуществления соединение формулы (I) или его фармацевтически приемлемые соли, таутомеры, пролекарства, сольваты, метаболиты, полиморфы, аналоги или производные, не являются изотопно-меченными.
[0062] Настоящая заявка относится к соединению, которое представляет собой модулятор BTK. В одном варианте осуществления соединение настоящей заявки представляет собой ингибитор BTK.
[0063] Термин "вводить", "применять" или "введение" в контексте настоящей заявки относится либо к прямому введению раскрываемого соединения или фармацевтически приемлемой соли раскрываемого соединения или композиции субъекту, либо к введению пролекарства, производного или аналога соединения или фармацевтически приемлемой соли соединения или композиции субъекту, которое может образовывать эквивалентное количество активного соединения в организме субъекта.
[0064] "Пациент" или ʺсубъектʺ относится к млекопитающему, например, человеку, мыши, крысе, морской свинке, собаке, кошке, лошади, корове, свинье или приматам, не относящимся к человеку, таким как обезьяна, шимпанзе, бабуин или макак-резус.
[0065] "Эффективное количество" или ʺтерапевтически эффективное количествоʺ, при использовании в связи с соединением или фармацевтической композицией, представляет собой количество, эффективное для лечения или профилактики заболевания у субъекта, как описано в настоящей заявке.
[0066] Термин "лечение", в отношении субъекта, относится к улучшению по меньшей мере одного симптома расстройства субъекта. Лечение включает исцеление, улучшение или по меньшей мере частичное ослабление расстройства.
[0067] Соединения настоящей заявки или их фармацевтически приемлемую соль, таутомер, пролекарство, сольват, метаболит, полиморф, аналог или производное, также можно использовать для профилактики заболевания, состояния или расстройства. В настоящей заявке, ʺпрофилактикаʺ или ʺпредотвращениеʺ описывает уменьшение или устранение возникновения симптомов или осложнений заболевания, состояния или расстройства.
[0068] Термин "расстройство" используют в настоящей заявке как означающий, и используется взаимозаменяемо с терминами, заболевание, состояние или болезнь, если не указано иное.
[0069] В настоящей заявке, термин "BTK-опосредованные" заболевания или расстройства означает любое заболевание или другое болезненное состояние, в котором BTK или ее мутант, как известно, играет роль. Соответственно, другой вариант осуществления настоящей заявки относится к лечению или уменьшению тяжести одного или нескольких заболеваний, в которых, как известно, играет роль BTK или ее мутант. В частности, настоящая заявка относится к способу лечения или уменьшения тяжести заболевания или состояния, выбранного из пролиферативного расстройства или аутоиммунного расстройства, где указанный способ включает введение нуждающемуся в этом пациенту соединения формулы (I) или его фармацевтически приемлемых солей, таутомеров, пролекарств, сольватов, метаболитов, полиморфов, аналогов или производных или композиции в соответствии с настоящей заявкой.
[0070] В контексте настоящей заявки, термин ʺклеточно-пролиферативное расстройствоʺ относится к состояниям, при которых нерегулируемый или аномальный рост, или и то и другое, клеток может приводить к развитию нежелательного состояния или заболевания, которое может быть или не быть злокачественным. Иллюстративные клеточные пролиферативные расстройства, в соответствии с настоящей заявкой, охватывают ряд состояний, в которых деление клеток является дерегулированным. Иллюстративные клеточные пролиферативные расстройства включают, но не ограничиваются этим, новообразования, доброкачественные опухоли, злокачественные опухоли, предраковые состояния, опухоли in situ, инкапсулированные опухоли, метастатические опухоли, жидкие опухоли, солидные опухоли, иммунологические опухоли, гематологические опухоли, рак, карциномы, лейкозы, лимфомы, саркомы и быстро делящиеся клетки. Термин ʺбыстро делящиеся клеткиʺ, в контексте настоящей заявки, определяется как любая клетка, которая делится со скоростью, превышающей или больше ожидаемой или наблюдаемой среди соседних или расположенных рядом клеток внутри одной и той же ткани. Клеточное пролиферативное расстройство включает предрак или предраковое состояние. Клеточное пролиферативное расстройство включает рак. Предпочтительно, способы, представленные в настоящей заявке, используют для лечения или облегчения симптомов рака. Термин ʺракʺ включает солидные опухоли, а также гематологические опухоли и/или злокачественные опухоли. ʺПредраковая клеткаʺ или ʺпредканцерогенная клеткаʺ представляет собой клетку, проявляющую клеточное пролиферативное расстройство, являющееся предраком или предраковым состоянием. ʺРаковая клеткаʺ или ʺканцерогенная клеткаʺ представляет собой клетку, проявляющую клеточное пролиферативное расстройство, которое представляет собой рак. Любые воспроизводимые средства измерения можно использовать для идентификации раковых клеток или предраковых клеток. Раковые клетки или предраковые клетки можно идентифицировать гистологическим типированием или путем гистологической оценки образца ткани (например, образца биопсии). Раковые клетки или предраковые клетки можно идентифицировать посредством применения подходящих молекулярных маркеров.
[0071] Типичные нераковые состояния или расстройства включают, но не ограничиваются этим, ревматоидный артрит; воспаление; аутоиммунное заболевание; лимфопролиферативные состояния; акромегалию; ревматоидный спондилит; остеоартрит; подагру, другие артритные состояния; сепсис; септический шок; эндотоксический шок; грамотрицательный сепсис; синдром токсического шока; астму; респираторный дистресс-синдром взрослых; хроническое обструктивное заболевание легких; хроническое воспаление легких; воспалительное заболевание кишечника; болезнь Крона; псориаз; экзему; язвенный колит; фиброз поджелудочной железы; острую и хроническую почечную болезнь; синдром раздраженной толстой кишки; изжогу; рестеноз; церебральную малярию; инсульт и ишемическую травму; нейронную травму; болезнь Альцгеймера; болезнь Гентингтона; болезнь Паркинсона; острую и хроническую боль; аллергический ринит; аллергический конъюнктивит; хроническую сердечную недостаточность; острый коронарный синдром; кахексию; малярию; проказу; лейшманиоз; болезнь Лайма; синдром Рейтера; острый синовиит; мышечную дегенерацию, бурсит; тендинит; тендовагинит; грыжу межпозвоночного диска, разрывы или пролапсированный синдром межпозвонкового диска; остеопетроз; тромбоз; рестеноз; силикоз; легочный саркоз; заболевания резорбции кости, такие как остеопороз; реакцию трансплантат-против-хозяина; рассеянный склероз; волчанку; фибромиалгии; СПИД и другие вирусные заболевания, такие как опоясывающий герпес, простой герпес I или II типа, вирус гриппа и цитомегаловирус; и сахарный диабет.
[0072] Типичные раковые заболевания включают, но не ограничиваются этим, адренокортикальный рак, связанные со СПИДом раковые заболевания, ассоциированную со СПИДом лимфому, анальный рак, аноректальный рак, рак анального канала, рак аппендикса, астроцитому детского мозжечка, астроцитому детского мозга, базально-клеточную карциному, рак кожи (немеланомный), рак желчных протоков, внепеченочный рак желчных протоков, внутрипеченочный рак желчных протоков, рак мочевого пузыря, рак мочевыводящих путей пузыря, рак костей и суставов, остеосаркому и злокачественную фиброзную гистиоцитому, рак головного мозга, опухоль головного мозга, глиому мозга, астроцитому мозжечка, церебральную астроцитому/злокачественную глиому, эпендимому, медуллобластому, супратенториальные примитивные нейроэктодермальные опухоли, глиому зрительного пути и гипоталамической области, рак молочной железы, бронхиальные аденомы/карциноиды, карциноидную опухоль, рак желудочно-кишечного тракта, рак нервной системы, лимфому нервной системы, рак центральной нервной системы, лимфому центральной нервной системы, рак шейки матки, детский рак, хронический лимфоцитарный лейкоз, хронический миелоидный лейкоз, хронические миелопролиферативные расстройства, рак толстой кишки, колоректальный рак, кожную Т-клеточную лимфому, лимфоидное новообразование, грибковые микозы, синдром Сезари, рак эндометрия, рак пищевода, эктракраниальную опухоль зародышевых клеток, эктрагонадальную опухоль зародышевых клеток, внепеченочный рак желчных протоков, глазной рак, внутриглазную меланому, ретинобластому, рак желчного пузыря, гастральный рак (рак желудка), желудочно-кишечную карциноидную опухоль, желудочно-кишечную стромальную опухоль (GIST), опухоль зародышевых клеток, опухоль яичников, гестационную трофобластическую опухоль, рак головы и шеи, гепатоцеллюлярный рак (рак печени), лимфому Ходжкина, гипофарингеальный рак, внутриглазную меланому, окулярный рак, опухоль островков поджелудочной железы (эндокринной части поджелудочной железы), саркому Капоши, рак почки, почечный рак, рак гортани, острый лимфобластный лейкоз, острый миелоидный лейкоз, хронический лимфоцитарный лейкоз, хронический миелолейкоз, волосистоклеточный лейкоз, рак губы и ротовой полости, рак печени, рак легких, немелкоклеточный рак легкого, мелкоклеточный рак легкого, связанную со СПИДом лимфому, неходжкинскую лимфому, первичную лимфому центральной нервной системы, макроглобулинемию Вальденстрема, медуллобластому, меланому, внутриглазную (глазную) меланому, карциному из клеток Меркеля, злокачественную мезотелиому, мезотелиому, метастатический плоскоклеточный рак шеи, рак полости рта, рак языка, синдром множественной эндокринной неоплазии, грибовидные микозы, миелодиспластические синдромы, миелодиспластические/миелопролиферативные заболевания, хронический миелолейкоз, острый миелоидный лейкоз, множественную миелому, хронические миелопролиферативные расстройства, рак носоглотки, нейробластому, рак полости рта, рак ротовой полости, рак ротоглотки, рак яичников, рак эпителия яичников, опухоль яичников с низким злокачественным потенциалом, рак поджелудочной железы, рак островковых клеток поджелудочной железы, рак параназального синуса и носовой полости, рак паращитовидной железы, рак полового члена, фарингеальный рак, феохромоцитому, пинеобластому и супратенториальные примитивные нейроэктодермальные опухоли, опухоль гипофиза, плазмоклеточную опухоль/множественную миелому, плевролегочную бластому, рак предстательной железы, рак прямой кишки, рак почечной лоханки и мочеточника, переходно-клеточный рак, ретинобластому, рабдомиосаркому, рак слюнных желез, семейство опухолей саркомы Юинга, саркому Капоши, саркому мягких тканей, рак матки, саркому матки, рак кожи (немеланомный), рак кожи (меланома), карциному кожи из клеток Меркеля, рак тонкой кишки, саркому мягких тканей, плоскоклеточную карциному, рак желудка (гастральный рак), супратенториальные примитивные нейроэктодермальные опухоли, тестикулярный рак, рак горла, тимому, тимому и рак вилочковой железы, рак щитовидной железы, переходно-клеточный рак почечной лоханки и мочеточника и других органов мочевой системы, гестационную трофобластическую опухоль, рак уретры, рак маточного эндометрия, саркому матки, рак тела матки, рак влагалища, рак вульвы и опухоль Вильма.
Способ получения соединений
[0073] Соединения настоящей заявки могут быть получены различными способами, включая стандартную химию. Подходящий путь синтеза показан на приведенных ниже схемах.
[0074] Соединение формулы (I) можно получить способами, известными в области органического синтеза, как это частично показано следующими схемами синтеза. На схеме, описанной ниже, ясно видно, что защитные группы для чувствительных или реакционноспособных групп используются там, где это необходимо, в соответствии с общими принципами или химией. Защитные группы обрабатывают в соответствии со стандартными способами органического синтеза (T. W. Greene and P. G. M. Wuts, "Protective Groups in Organic Synthesis", Third edition, Wiley, New York 1999). Эти группы удаляют на удобной стадии синтеза соединения с использованием способов, которые очевидны специалистам в данной области. Процессы выбора, а также условия реакции и порядок их выполнения должны соответствовать получению соединений настоящей заявки.
[0075] Специалист в данной области сможет распознать, существует ли стереоцентр в соединении формулы (I). Соответственно, настоящая заявка включает как возможные стереоизомеры (если не указано в синтезе), и включает не только рацемическое соединение, но и отдельные энантиомеры и/или диастереомеры. Когда соединение желательно в виде одного энантиомера или диастереомера, его можно получить стереоспецифическим синтезом или путем разделения конечного продукта или любого удобного промежуточного соединения. Разделение конечного продукта, промежуточного соединения или исходного вещества можно осуществить любым подходящим способом, известным в данной области техники. См., например, "Stereochemistry of Organic Compounds" by E. L. Eliel, S. H. Wilen and L. N. Mander (Wiley-lnterscience, 1994).
[0076] Соединения, описанные в настоящей заявке, можно получить из коммерчески доступных исходных веществ или синтезировать с использованием известных органических, неорганических и/или ферментативных процессов.
[0077] Соединения настоящей заявки можно получить несколькими способами, хорошо известными специалистам в области органического синтеза. В качестве примера, соединения настоящей заявки можно синтезировать с использованием способов, описанных ниже, вместе со способами синтеза, известными в области химии органического синтеза или их вариантами, как это признано специалистами в данной области. Предпочтительные способы включают, но не ограничиваются этим, описанные ниже способы. Соединения настоящей заявки (т.е. соединение формулы (I)) можно синтезировать, следуя стадиям, описанным в общей схеме 1, которая включает последовательность взаимодействий промежуточных соединений 2-a - 2-h. Исходные вещества являются либо коммерчески доступными, либо получены известными способами, опубликованными в литературе, или как проиллюстрировано.
Общая Схема 1
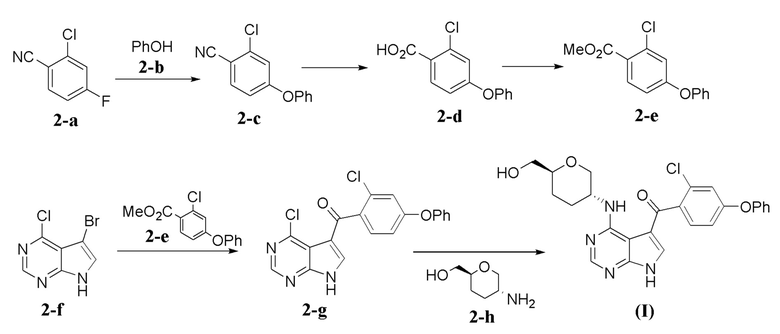
[0078] Общий способ получения соединения формулы (I) с использованием промежуточных соединений 2-a, 2-b, 2-c, 2-d, 2-e, 2-f, 2-g и 2-h показан в Общей Схеме 1. Нуклеофильное присоединение фенола 2-b к 2-хлор-4-фторбензонитрилу 2-a с использованием сильного основания, например, гидрида натрия (NaH), в растворителе, например, N,N-диметилформамиде (DMF), приводит к получению соединения 2-c. Гидролиз 2-c с использованием основания, например, гидроксида калия (KOH), в растворителе, например, этаноле, при повышенной температуре приводит к получению карбоновой кислоты 2-d. Этерификация соединения 2-d метилйодидом с использованием основания, например, карбоната калия (K2CO3) или карбоната цезия (Cs2CO3), в растворителе, например, N,N-диметилформамиде (DMF), обеспечивает соединение 2-e. Ацилирование промежуточного соединения 2-f соединением 2-e с использованием сильного основания, например, н-бутиллития (n-BuLi), в растворителе, например, тетрагидрофуране (THF), обеспечивает соединение 2-g. Нуклеофильное присоединение амина 2-h к арилхлориду 2-g с использованием основания, например, N,N-диизопропилэтиламина (DIPEA), и необязательно в растворителе, например, N,N-диметилформамиде (DMF), обеспечивает соединение формулы (I).
[0079] Смесь энантиомеров, диастереомеров, цис/транс- изомеров, полученную в результате описанного выше процесса, можно разделить на отдельные компоненты с использованием хиральной соли, хроматографией с использованием нормальной фазы, обращенной фазы или хиральной колонки, в зависимости от природы разделения.
Биологические анализы
Анализ киназной активности BTK
[0080] Испытываемый ингибитор и контрольные образцы получали в растворителе (т.е. DMSO) и добавляли в каждую лунку реакционного планшета. Полноразмерную активную BTK разбавляли в аналитическом буфере и добавляли в каждую лунку. После предварительной инкубации киназную реакцию инициировали путем добавления активирующей смеси, разбавленной в аналитическом буфере, содержащем биотинилированный пептид PLCγ2 и АТФ. Планшеты инкубировали и реакции затем останавливали в темноте путем добавления смеси для остановки/детекции, полученной в аналитическом буфере. Аналитические планшеты инкубировали в темноте и планшеты считывали на планшет-ридере.
Анализ киназной активности BTK C481S
[0081] Испытываемый ингибитор и контрольные образцы получали в растворителе (т.е. DMSO) при желаемой конечной концентрации и добавляли в каждую лунку реакционного планшета. Полноразмерную BTKC481S разбавляли в аналитическом буфере и добавляли в каждую лунку в объеме. После предварительной инкубации киназную реакцию инициировали путем добавления активирующей смеси, разбавленной в аналитическом буфере, содержащем биотинилированный пептид PLCγ2 и АТФ. Планшеты инкубировали и реакции затем останавливали в темноте путем добавления смеси для остановки/детекции, полученной в аналитическом буфере. Аналитические планшеты инкубировали в темноте и планшеты считывали на планшет-ридере.
Анализ анти-пролиферации
[0082] Клеточное выживание определяли при помощи анализа MTS. Вкратце, клетки (т.е. клетки TMD-8 или клетки Rec-1) высевали в 96-луночный планшет, культивировали в готовой питательной среде и затем обрабатывали различными лекарственными средствами и комбинациями лекарственных средств. Добавляли MTS/PMS и инкубировали, с последующей оценкой жизнеспособности клеток с использованием микропланшет-ридера. Данные нормализовали к необработанным контролям и анализировали при помощи Microsoft Excel.
Способы применения соединений
[0083] Другой аспект настоящей заявки относится к способу лечения, профилактики, ингибирования или устранения заболевания или расстройства, связанного с модуляцией BTK (например, ингибированием BTK). Способ включает введение пациенту, нуждающемуся в лечении заболеваний или расстройств, связанных с модуляцией BTK, эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, таутомера, пролекарства, сольвата, метаболита, полиморфа, аналога или производного или фармацевтической композиции соединения формулы (I). В одном варианте осуществления ВТК-опосредованное расстройство выбрано из иммунного расстройства, рака, сердечно-сосудистых заболеваний, вирусных инфекций, воспаления, нарушения обмена веществ/функции эндокринной системы и неврологических расстройств. В некоторых вариантах осуществления способ также включает введение дополнительного терапевтического средства, выбранного из противовоспалительного средства, иммуномодулирующего средства, химиотерапевтического средства, нейротропного фактора, средства для лечения сердечно-сосудистого заболевания, средства для лечения заболевания печени, антивирусного средства, средства для лечения заболеваний крови, средства для лечения диабета и средства для лечения иммунодефицитных состояний. В некоторых вариантах осуществления ВТК представляет собой ВТК дикого типа. В других вариантах осуществления ВТК представляет собой мутантную BTK (например, мутантную BTK C481S).
[0084] Другой аспект настоящей заявки относится к способу лечения, профилактики, ингибирования или устранения клеточно-пролиферативного расстройства, при этом способ включает введение нуждающемуся в этом пациенту терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, таутомера, пролекарства, сольвата, метаболита, полиморфа, аналога или производного или фармацевтической композиции соединения формулы (I). В одном варианте осуществления клеточно-пролиферативное расстройство представляет собой рак. В некоторых вариантах осуществления, способ также включает введение дополнительного терапевтического средства, выбранного из противовоспалительного средства, иммуномодулирующего средства, химиотерапевтического средства, нейротропного фактора, средства для лечения сердечно-сосудистого заболевания, средства для лечения заболевания печени, антивирусного средства, средства для лечения заболеваний крови, средства для лечения диабета и средства для лечения иммунодефицитных состояний.
[0085] Другой аспект настоящей заявки относится к способу модуляции BTK, при этом способ включает введение нуждающемуся в этом пациенту терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, таутомера, пролекарства, сольвата, метаболита, полиморфа, аналога или производного или фармацевтической композиции соединения формулы (I). В одном варианте осуществления модуляция BTK представляет собой ингибирование BTK. В некоторых вариантах осуществления ВТК представляет собой ВТК дикого типа. В других вариантах осуществления ВТК представляет собой мутантную BTK (например, мутантную BTK C481S).
[0086] Другой аспект настоящей заявки относится к соединению формулы (I) или его фармацевтически приемлемой соли, таутомеру, пролекарству, сольвату, метаболиту, полиморфу, аналогу или производному, для применения в способе лечения BTK-опосредованного расстройства. В одном варианте осуществления заболевание или расстройство выбрано из иммунного расстройства, рака, сердечно-сосудистых заболеваний, вирусных инфекций, воспаления, нарушения обмена веществ/функции эндокринной системы и неврологических расстройств. В некоторых вариантах осуществления способ также включает введение дополнительного терапевтического средства, выбранного из противовоспалительного средства, иммуномодулирующего средства, химиотерапевтического средства, нейротропного фактора, средства для лечения сердечно-сосудистого заболевания, средства для лечения заболевания печени, антивирусного средства, средства для лечения заболеваний крови, средства для лечения диабета и средства для лечения иммунодефицитных состояний. В некоторых вариантах осуществления ВТК представляет собой ВТК дикого типа. В других вариантах осуществления ВТК представляет собой мутантную BTK (например, мутантную BTK C481S).
[0087] В другом аспекте настоящая заявка относится к фармацевтической композиции соединения формулы (I) или его фармацевтически приемлемой соли, таутомера, пролекарства, сольвата, метаболита, полиморфа, аналога или производного для применения в способе лечения BTK-опосредованного расстройства. В одном варианте осуществления заболевание или расстройство выбрано из иммунного расстройства, рака, сердечно-сосудистых заболеваний, вирусных инфекций, воспаления, нарушения обмена веществ/функции эндокринной системы и неврологических расстройств. В некоторых вариантах осуществления способ также включает введение дополнительного терапевтического средства, выбранного из противовоспалительного средства, иммуномодулирующего средства, химиотерапевтического средства, нейротропного фактора, средства для лечения сердечно-сосудистого заболевания, средства для лечения заболевания печени, антивирусного средства, средства для лечения заболеваний крови, средства для лечения диабета и средства для лечения иммунодефицитных состояний. В некоторых вариантах осуществления ВТК представляет собой ВТК дикого типа. В других вариантах осуществления ВТК представляет собой мутантную BTK (например, мутантную BTK C481S).
[0088] Другой аспект настоящей заявки относится к соединению формулы (I) или его фармацевтически приемлемой соли, таутомеру, пролекарству, сольвату, метаболиту, полиморфу, аналогу или производному для применения в способе лечения, профилактики, ингибирования или устранения клеточно-пролиферативного расстройства. В одном варианте осуществления клеточно-пролиферативное расстройство представляет собой рак.
[0089] В другом аспекте настоящая заявка относится к фармацевтической композиции соединения формулы (I) или его фармацевтически приемлемой соли, таутомера, пролекарства, сольвата, метаболита, полиморфа, аналога или производного, для применения в способе лечения, профилактики, ингибирования или устранения клеточно-пролиферативного расстройства. В одном варианте осуществления клеточно-пролиферативное расстройство представляет собой рак.
[0090] Другой аспект настоящей заявки относится к соединению формулы (I) или его фармацевтически приемлемой соли, таутомеру, пролекарству, сольвату, метаболиту, полиморфу, аналогу или производному для применения в модуляции BTK. В одном варианте осуществления модуляция BTK представляет собой ингибирование BTK. В некоторых вариантах осуществления ВТК представляет собой ВТК дикого типа. В других вариантах осуществления ВТК представляет собой мутантную BTK (например, мутантную BTK C481S).
[0091] В другом аспекте настоящая заявка относится к фармацевтической композиции соединения формулы (I) или его фармацевтически приемлемой соли, таутомера, пролекарства, сольвата, метаболита, полиморфа, аналога или производного для применения в модуляции BTK. В одном варианте осуществления модуляция BTK представляет собой ингибирование BTK. В некоторых вариантах осуществления ВТК представляет собой ВТК дикого типа. В других вариантах осуществления ВТК представляет собой мутантную BTK (например, мутантную BTK C481S).
[0092] Другой аспект настоящей заявки относится к применению соединения формулы (I) или его фармацевтически приемлемой соли, таутомера, пролекарства, сольвата, метаболита, полиморфа, аналога или производного для получения лекарственного средства для лечения BTK-опосредованного заболевания или расстройства. В одном варианте осуществления заболевание или расстройство выбрано из иммунного расстройства, рака, сердечно-сосудистых заболеваний, вирусных инфекций, воспаления, нарушения обмена веществ/функции эндокринной системы и неврологических расстройств. В некоторых вариантах осуществления лечение дополнительно включает введение дополнительного терапевтического средства, выбранного из противовоспалительного средства, иммуномодулирующего средства, химиотерапевтического средства, нейротропного фактора, средства для лечения сердечно-сосудистого заболевания, средства для лечения заболевания печени, антивирусного средства, средства для лечения заболеваний крови, средства для лечения диабета и средства для лечения иммунодефицитных состояний. В некоторых вариантах осуществления ВТК представляет собой ВТК дикого типа. В других вариантах осуществления ВТК представляет собой мутантную BTK (например, мутантную BTK C481S).
[0093] В другом аспекте настоящая заявка относится к применению фармацевтической композиции соединения формулы (I) или его фармацевтически приемлемой соли, таутомера, пролекарства, сольвата, метаболита, полиморфа, аналога или производного для получения лекарственного средства для лечения BTK-опосредованного заболевания или расстройства. В одном варианте осуществления заболевание или расстройство выбрано из иммунного расстройства, рака, сердечно-сосудистых заболеваний, вирусных инфекций, воспаления, нарушения обмена веществ/функции эндокринной системы и неврологических расстройств. В некоторых вариантах осуществления лечение дополнительно включает введение дополнительного терапевтического средства, выбранного из противовоспалительного средства, иммуномодулирующего средства, химиотерапевтического средства, нейротропного фактора, средства для лечения сердечно-сосудистого заболевания, средства для лечения заболевания печени, антивирусного средства, средства для лечения заболеваний крови, средства для лечения диабета и средства для лечения иммунодефицитных состояний. В некоторых вариантах осуществления ВТК представляет собой ВТК дикого типа. В других вариантах осуществления ВТК представляет собой мутантную BTK (например, мутантную BTK C481S).
[0094] Другой аспект настоящей заявки относится к применению соединения формулы (I) или его фармацевтически приемлемой соли, таутомера, пролекарства, сольвата, метаболита, полиморфа, аналога или производного для получения лекарственного средства для лечения, профилактики, ингибирования или устранения клеточно-пролиферативного расстройства. В одном варианте осуществления клеточно-пролиферативное расстройство представляет собой рак.
[0095] В другом аспекте настоящая заявка относится к применению фармацевтической композиции соединения формулы (I) или его фармацевтически приемлемой соли, таутомера, пролекарства, сольвата, метаболита, полиморфа, аналога или производного для получения лекарственного средства для лечения, профилактики, ингибирования или устранения клеточно-пролиферативного расстройства. В одном варианте осуществления клеточно-пролиферативное расстройство представляет собой рак.
[0096] Другой аспект настоящей заявки относится к применению соединения формулы (I) или его фармацевтически приемлемой соли, таутомера, пролекарства, сольвата, метаболита, полиморфа, аналога или производного для получения лекарственного средства для модуляции BTK. В одном варианте осуществления модуляция BTK представляет собой ингибирование BTK. В некоторых вариантах осуществления ВТК представляет собой ВТК дикого типа. В других вариантах осуществления ВТК представляет собой мутантную BTK (например, мутантную BTK C481S).
[0097] В другом аспекте настоящая заявка относится к применению фармацевтической композиции соединения формулы (I) или его фармацевтически приемлемой соли, таутомера, пролекарства, сольвата, метаболита, полиморфа, аналога или производного для получения лекарственного средства для модуляции BTK. В одном варианте осуществления модуляция BTK представляет собой ингибирование BTK. В некоторых вариантах осуществления ВТК представляет собой ВТК дикого типа. В других вариантах осуществления ВТК представляет собой мутантную BTK (например, мутантную BTK C481S).
[0098] В некоторых вариантах осуществления способов и применений, описанных в настоящей заявке, рак выбран из рака молочной железы, яичника, шейки матки, предстательной железы, яичка, мочеполового тракта, пищевода, гортани, глиобластомы, нейробластомы, желудка, кожи, кератоакантомы, легкого, эпидермоидной карциномы, крупноклеточной карциномы, немелкоклеточной карциномы легких (NSCLC), мелкоклеточной карциномы, аденокарциномы легких, рака кости, ободочной кишки, аденомы, поджелудочной железы, аденокарциномы, щитовидной железы, фолликулярной карциномы, недифференцированной карциномы, папиллярной карциномы, семиномы, меланомы, саркомы, карциномы мочевого пузыря, карциномы печени и желчных путей, карциномы почек, поджелудочной железы, миелоидных расстройств, лимфомы, волосистоклеточного рака, рака буккальной полости, носоглотки, глотки, губы, языка, рта, тонкого кишечника, ободочной и прямой кишки, толстого кишечника, прямой кишки, головного мозга и центральной нервной системы, лейкемии Ходжкина, бронха, щитовидной железы, печени и внутрипеченочного желчного протока, гепатоцеллюлярного рака, гастрального рака, глиомы/глиобластомы, рака эндометрия, меланомы, почек и почечной лоханки, мочевого пузыря, тела матки, шейки матки, множественной миеломы, острого миелогенного лейкоза, хронического миелогенного лейкоза, лимфоцитарного лейкоза, хронического лимфоидного лейкоза (CLL), миелоидного лейкоза, рака полости рта и глотки, неходжкинской лимфомы, меланомы и ворсинчатой аденомы толстой кишки.
[0099] В любом из вариантов осуществления настоящей заявки рак может быть любым раком в любом органе, например, рак выбран из группы, состоящей из глиомы, карциномы щитовидной железы, карциномы молочной железы, мелкоклеточной карциномы легкого, немелкоклеточной карциномы, карциномы желудка, рака толстой кишки, карциномы желудочно-кишечного тракта, карциномы поджелудочной железы, карциномы желчных протоков, карциномы ЦНС, карциномы яичников, карциномы эндометрия, карциномы предстательной железы, карциномы почек, анапластической крупноклеточной лимфомы, лейкоза, множественной миеломы, мезотелиомы и меланомы и их комбинации.
[00100] В некоторых вариантах осуществления способов и применений, описанных в настоящей заявке, заболевание или расстройство представляет собой иммунное расстройство. В одном варианте осуществления иммунное расстройство представляет собой ревматоидный артрит.
[00101] В некоторых вариантах осуществления способов и применений, описанных в настоящей заявке, заболевание или расстройство представляет собой системное и местное воспаление, артрит; воспаление, связанное с подавлением иммунитета; отторжение органа при трансплантации, аллергии, язвенный колит, болезнь Крона, дерматит, астму, системную красную волчанку, синдром Шегрена, рассеянный склероз, склеродермию/системный склероз, идиопатическую тромбоцитопеническую пурпуру (ITP), васкулит антинейтрофильных цитоплазматических антител (ANCA), хроническое обструктивное заболевание легких (COPD), псориаз.
[00102] В одном варианте осуществления, способы лечения заболевания или расстройства, связанного с модуляцией BTK, включая иммунные расстройства, рак, сердечно-сосудистые заболевания, вирусные инфекции, воспаление, нарушения обмена веществ/функции эндокринной системы и неврологические расстройства, включают введение пациенту, страдающему, по меньшей мере, одним из указанных заболеваний или расстройств, соединения формулы (I).
[00103] Раскрытое соединение настоящей заявки можно вводить в эффективных количествах для лечения или предотвращения расстройства и/или предотвращения его развития у субъектов.
[00104] Соединение настоящей заявки можно вводить в терапевтически эффективных количествах в комбинированной терапии с одним или несколькими терапевтическими средствами (фармацевтические комбинации) или способами, например, без лекарственной терапии. Например, синергические эффекты могут возникать с другими анти-пролиферативными, противораковыми, иммуномодулирующими или противовоспалительными веществами. В некоторых вариантах осуществления соединение формулы (I) вводят в комбинации с дополнительным терапевтическим средством, выбранным из противовоспалительного средства, иммуномодулирующего средства, химиотерапевтического средства, нейротропного фактора, средства для лечения сердечно-сосудистого заболевания, средства для лечения заболевания печени, антивирусного средства, средства для лечения заболеваний крови, средства для лечения диабета и средства для лечения иммунодефицитных состояний. Когда соединение настоящей заявки вводят в комбинации с другими видами терапии, дозы совместно вводимых соединений будут, разумеется, варьироваться в зависимости от типа используемого совместно лекарственного средства, от конкретного используемого лекарственного средства, от состояния, подвергаемого лечению, и так далее.
[00105] Комбинированная терапия включает введение субъекту соединения в следующем сочетании с другими биологически активными ингредиентами (такими как, но не ограничиваясь этим, противовоспалительное средство, иммуномодулирующее средство, химиотерапевтическое средство, нейротропный фактор, средство для лечения сердечно-сосудистых заболеваний, средство для лечения заболеваний печени, противовирусное средство, средства для лечения заболеваний крови, средства для лечения диабета и средства для лечения иммунодефицитных состояний) и нелекарственными терапиями (такими как, но не ограничиваясь этим, хирургия или лучевая терапия). Например, соединение настоящей заявки можно использовать в комбинации с другими фармацевтически активными соединениями, предпочтительно соединениями, которые способны усиливать эффект соединения настоящей заявки. Соединение настоящей заявки можно вводить одновременно (как один препарат или отдельный препарат) или последовательно к другой лекарственной терапией или методом лечения. Как правило, комбинированная терапия предусматривает введение двух или более лекарственных средств в течение одного цикла или курса терапии.
Фармацевтические Композиции
[00106] Настоящая заявка также обеспечивает фармацевтические композиции, включающие соединение формулы (I) или его фармацевтически приемлемую соль, таутомер, пролекарства, сольват, метаболит, полиморф, аналог или производное, в комбинации с по меньшей мере одним фармацевтически приемлемым эксципиентом или носителем.
[00107] ʺФармацевтическая композицияʺ представляет собой состав, содержащий соединение настоящей заявки в форме, подходящей для введения субъекту. В одном варианте осуществления фармацевтическая композиция представлена в нерасфасованном виде или в единичной лекарственной форме. Единичная лекарственная форма представляет собой любую из множества форм, включая, например, капсулу, пакет для внутривенного вливания, таблетку, один насос на аэрозольном ингаляторе или флаконе. Количество активного ингредиента (например, композиции раскрытого соединения или его фармацевтически приемлемой соли, таутомера, пролекарства, сольвата, метаболита, полиморфа, аналога или производного) в единичной дозе композиции представляет собой эффективное количество и варьируется в соответствии с конкретным включенным лечением. Специалист в данной области поймет, что иногда необходимы рутинные вариации дозировки в зависимости от возраста и состояния пациента. Доза также будет зависеть от пути введения. Рассматриваются различные пути, включая пероральный, легочный, ректальный, парентеральный, трансдермальный, подкожный, внутривенный, внутримышечный, внутрибрюшинный, ингаляционный, буккальный, подъязычный, интраплевральный, интратекальный, интраназальный и подобные. Лекарственные формы для местного или трансдермального введения соединения настоящей заявки включают порошки, спреи, мази, пасты, кремы, лосьоны, гели, растворы, пластыри и ингалянты. В одном варианте осуществления активное соединение смешивают в стерильных условиях с фармацевтически приемлемым носителем и с любыми консервантами, буферами или пропеллентами, которые необходимы.
[00108] В контексте настоящей заявки, фраза ʺфармацевтически приемлемыйʺ относится к тем соединениям, веществам, композициям, носителям и/или лекарственным формам, которые с медицинской точки зрения подходят для использования в контакте с тканями людей и животных без чрезмерной токсичности, раздражения, аллергической реакции или других проблем или осложнений, соизмеримо с разумным соотношением польза/риск.
[00109] ʺФармацевтически приемлемый эксципиентʺ означает эксципиент, который полезен для получения фармацевтической композиции, который, как правило, безопасен, нетоксичен и ни биологически, ни иначе нежелателен, и включает эксципиент, который является приемлемым для ветеринарного применения, а также для фармацевтического назначения человеку. ʺФармацевтически приемлемый эксципиентʺ, в контексте описания и формулы изобретения, включает как один, так и более чем один такой эксципиент.
[00110] Фармацевтические композиции настоящей заявки формулируют таким образом, чтобы они были совместимы с предполагаемым путем введения. Примеры путей введения включают парентеральное, например, внутривенное, внутрикожное, подкожное, пероральное (например, ингаляция), трансдермальное (местное) и трансмукозальное введение. Растворы или суспензии, используемые для парентерального, внутрикожного или подкожного применения, могут включать следующие компоненты: стерильный разбавитель, такой как вода для инъекций, физиологический раствор, нелетучие масла, полиэтиленгликоли, глицерин, пропиленгликоль или другие синтетические растворители; антибактериальные средства, такие как бензиловый спирт или метилпарабен; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатирующие агенты, такие как этилендиаминтетрауксусная кислота; буферы, такие как ацетаты, цитраты или фосфаты, и агенты для регулирования тоничности, такие как хлорид натрия или декстроза. Уровень рН можно регулировать кислотами или основаниями, такими как хлористоводородная кислота или гидроксид натрия. Парентеральный лекарственный препарат может быть заключен в ампулы, одноразовые шприцы или многоразовые флаконы из стекла или пластика.
[00111] Соединение или фармацевтическую композицию настоящей заявки можно вводить субъекту множеством хорошо известных способов, используемых в настоящее время для химиотерапевтического лечения. Например, для лечения раковых заболеваний соединение настоящей заявки можно вводить непосредственно в опухоли, вводить в кровоток или полости тела или принимать внутрь или применять через кожу при помощи пластырей. Выбранная доза должна быть достаточной для эффективного лечения, но не настолько высокой, чтобы вызвать неприемлемые побочные эффекты. Состояние заболевания (например, рак, предрак и подобное) и здоровье пациента предпочтительно следует тщательно контролировать во время лечения и в течение разумного периода времени после лечения.
[00112] Термин ʺтерапевтически эффективное количествоʺ, в контексте настоящей заявки, относится к количеству фармацевтического средства для лечения, улучшения или профилактики идентифицированного заболевания или состояния или для обеспечения обнаруживаемого терапевтического или ингибирующего эффекта. Эффект может быть обнаружен любым методом анализа, известным в данной области. Точное эффективное количество для субъекта будет зависеть от массы тела субъекта, его размера и состояния здоровья; характера и степени тяжести состояния; и терапевтического средства или комбинации терапевтических средств, выбранных для введения. Терапевтически эффективные количества для данной ситуации можно определить рутинным экспериментами, и это находится в рамках квалификации и суждения клинициста. В одном варианте осуществления заболевание или расстройство выбрано из иммунного расстройства, рака, сердечно-сосудистых заболеваний, вирусных инфекций, воспаления, нарушения обмена веществ/функции эндокринной системы и неврологических расстройств. В другом варианте осуществления заболевание или состояние, требующее лечения, представляет собой рак. В другом варианте осуществления заболевание или состояние, требующее лечения, представляет собой клеточно-пролиферативное расстройство.
[00113] Для любого соединения терапевтически эффективное количество может быть оценено первоначально либо в анализах клеточной культуры, например, опухолевых клеток, либо на животных моделях, обычно крыс, мышей, кроликов, собак или свиней. Модель животного также можно использовать для определения соответствующего диапазона концентрации и пути введения. Такая информация затем может быть использована для определения полезных доз и путей введения человеку. Терапевтическую/профилактическую эффективность и токсичность можно определить с использованием стандартных фармацевтических процедур в клеточных культурах или на экспериментальных животных, например, ED50 (доза, терапевтически эффективная у 50% популяции) и LD50 (доза летальная для 50% популяции). Соотношение доз между токсическими и терапевтическими эффектами является терапевтическим индексом и может быть выражено как отношение LD50/ED50. Фармацевтические композиции, которые демонстрируют большие терапевтические индексы, являются предпочтительными. Доза может варьироваться в пределах этого диапазона в зависимости от используемой лекарственной формы, чувствительности пациента и пути введения.
[00114] Дозировку и введение корректируют для обеспечения достаточного уровня активного вещества(веществ) или для поддержания желаемого эффекта. Факторы, которые могут быть приняты во внимание, включают тяжесть болезненного состояния, общее состояние здоровья, возраст, массу и пол субъекта, режим питания, время и частоту введения, комбинацию(комбинации) лекарственных средств, аллергические реакции и переносимость/реакцию на терапию. Фармацевтические композиции длительного действия можно вводить каждые 3-4 дня, каждую неделю или раз в две недели, в зависимости от периода полувыведения и скорости клиренса конкретной лекарственной композиции.
[00115] Фармацевтические композиции, содержащие активное соединение (то есть соединение формулы (I)) настоящей заявки, можно получить способом, который обычно известен, например, посредством обычного смешивания, растворения, гранулирования, дражирования, растирания в порошок, эмульгирования, инкапсулирования, захвата или лиофилизации. Фармацевтические композиции могут быть сформулированы обычным способом с использованием одного или нескольких фармацевтически приемлемых носителей, содержащих эксципиенты и/или вспомогательные вещества, которые облегчают переработку активного соединения в препараты, которые могут быть использованы фармацевтически. Разумеется, соответствующая композиция зависит от выбранного пути введения.
[00116] Фармацевтические композиции, подходящие для инъекционного применения, включают стерильные водные растворы (если они водорастворимы) или дисперсии и стерильные порошки для приготовления стерильных растворов или дисперсий для инъекций непосредственно пере применением. Для внутривенного введения подходящие носители включают физиологический раствор, бактериостатическую воду, Cremophor EL™ (BASF, Parsippany, N.J.) или фосфатно-солевой буферный раствор (PBS). Во всех случаях композиция должна быть стерильной и должна быть текучей в той степени, в которой существует возможность введения через шприц. Она должна быть стабильной в условиях изготовления и хранения и должна быть защищена против инфицирующего действия микроорганизмов, таких как бактерии и грибы. Носитель может быть представлять собой растворитель или дисперсионную среду, содержащую, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и подобные), и их подходящие смеси. Соответствующую текучесть можно поддерживать, например, путем использования покрытия, такого как лецитин, путем поддержания требуемого размера частиц в случае дисперсии и с использованием поверхностно-активных веществ. Предотвращение действия микроорганизмов может быть достигнуто различными антибактериальными и противогрибковыми средствами, например, парабенами, хлорбутанолом, фенолом, аскорбиновой кислотой, тимеросалем и т.п. Во многих случаях в композицию предпочтительно включать изотонические агенты, например сахара, полиспирты, такие как маннит, сорбит, хлорид натрия. Длительную абсорбцию инъекционных композиций можно обеспечить путем включения в состав агента, который задерживает абсорбцию, например, моностеарата алюминия и желатина.
[00117] Стерильные растворы для инъекций могут быть получены путем включения активного соединения в требуемом количестве в подходящем растворителе с одним или с комбинацией ингредиентов, перечисленных выше, по мере необходимости, с последующей стерилизацией фильтрованием. Как правило, дисперсии получают путем включения активного соединения в стерильный носитель, который содержит основную дисперсионную среду и требуемые другие ингредиенты из перечисленных выше. В случае стерильных порошков для приготовления стерильных растворов для инъекций, способы получения представляют собой вакуумную сушку и сушку вымораживанием, что дает порошок активного ингредиента плюс любой дополнительный желаемый ингредиент из его ранее стерильного фильтрованного раствора.
[00118] Пероральные композиции обычно включают инертный разбавитель или пищевой фармацевтически приемлемый носитель. Они могут быть заключены в желатиновые капсулы или спрессованы в таблетки. Для целей перорального терапевтического введения активное соединение можно вводить с эксципиентами и использовать в форме таблеток, пастилок или капсул. Пероральные композиции также можно получить с использованием жидкого носителя для применения в качестве полоскания для рта, где соединение в жидком носителе применяют перорально для полоскания рта и выплевывают или проглатывают. Фармацевтически совместимые связывающие агенты и/или адъюванты могут быть включены как часть композиции. Таблетки, пилюли, капсулы, пастилки и тому подобное могут содержать любой из следующих ингредиентов или соединений аналогичного характера: связующее, такое как микрокристаллическая целлюлоза, трагакантовая камедь или желатин; эксципиент, такой как крахмал или лактоза, разрыхлитель, такой как альгиновая кислота, примогель или кукурузный крахмал; смазывающее вещество, такое как стеарат магния или стеротес; глидант, такой как коллоидный диоксид кремния; подсластитель, такой как сахароза или сахарин; или ароматизатор, такой как перечная мята, метилсалицилат или апельсиновая отдушка.
[00119] Для введения путем ингаляции соединение доставляют в форме аэрозольного спрея из находящегося под давлением контейнера или дозатора, который содержит подходящий пропеллент, например, газ, такой как диоксид углерода, или распылителя.
[00120] Системное введение можно также осуществлять при помощи трансмукозальных или чрескожных средств. Для трансмукозального или чрескожного введения в состав композиции вводят пенетранты, подходящие для проникновения через барьер. Такие пенетранты обычно известны в данной области и включают, например, для трансмукозального введения, детергенты, соли желчных кислот и производные фузидовой кислоты. Трансмукозальное введение можно осуществить путем применения назальных спреев или суппозиториев. Для трансдермального введения, активное соединение формулируют в виде мазей, бальзамов, гелей или кремов, как хорошо известно в данной области.
[00121] Активное соединение можно получить с фармацевтически приемлемым носителем, который защитит соединение от быстрого выведения из организма, например, в виде композиции с контролируемым высвобождением, включая имплантаты и микрокапсулированные системы доставки. Можно использовать биоразлагаемые биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, полиортоэфиры и полимолочная кислота. Специалистам в данной области техники будут очевидны способы получения таких композиций. Вещества также могут быть получены коммерчески от Alza Corporation и Nova Pharmaceuticals, Inc. Липосомальные суспензии (включая липосомы, нацеленные на инфицированные клетки, с моноклональными антителами к вирусным антигенам) также могут быть использованы в качестве фармацевтически приемлемых носителей. Их можно получить в соответствии со способами, известными специалистам в данной области, например, как описано в патенте США № 4522811.
[00122] Особенно предпочтительно, когда пероральные или парентеральные композиции сформулированы в единичную дозированную форму для удобства введения и единообразия дозировки. Единичная дозированная форма в настоящей заявке относится к физически дискретным единицам, подходящим в качестве единичных доз для требующего лечения субъекта; каждая единица содержит предопределенное количество активного соединения, рассчитанное для получения желаемого терапевтического эффекта, в сочетании с необходимым фармацевтическим носителем. Требования к единичным дозированным формам настоящей заявки диктуются, и напрямую зависят от них, уникальными характеристиками активного соединения и конкретным терапевтическим эффектом, который должен быть достигнут.
[00123] Для терапевтических применений дозы фармацевтических композиций, используемых в соответствии с заявкой, варьируются в зависимости от средства, возраста, массы и клинического состояния пациента-реципиента, а также квалификации и суждений лечащего врача или практикующего врача, осуществляющего лечение, среди других факторов, влияющих на выбранную дозу. Как правило, доза должна быть достаточной, чтобы приводить к замедлению и, предпочтительно, регрессу, роста опухолей, а также предпочтительно вызывать полную регрессию рака. Дозы могут варьироваться от примерно 0,01 мг/кг в день до примерно 5000 мг/кг в день. Эффективным количеством фармацевтического средства является такое количество, которое обеспечивает объективно идентифицируемое улучшение, как отмечает клиницист или другой квалифицированный наблюдатель. Например, регрессия опухоли у пациента может быть измерена с учетом диаметра опухоли. Уменьшение диаметра опухоли указывает на регрессию. Регрессия также проявляется в том, что опухоль не восстанавливается после прекращения лечения. В контексте настоящей заявки, термин ʺэффективная дозаʺ относится к количеству активного соединения для получения желаемого биологического эффекта у субъекта или в клетке.
[00124] Фармацевтические композиции могут быть включены в контейнер, упаковку или дозатор вместе с инструкциями для введения.
[00125] В контексте настоящей заявки, термин «фармацевтически приемлемые соли» относится к производным соединения по настоящему изобретению, где исходное соединение модифицировано путем получения его кислот или их оснований. Примеры фармацевтически приемлемых солей включают, но не ограничиваются этим, соли минеральных или органических кислот основных остатков, таких как амины, щелочные или органические соли кислотных остатков, таких как карбоновые кислоты, и т.п. Фармацевтически приемлемые соли включают обычные нетоксичные соли или соли четвертичного аммония исходного соединения, образованные, например, из нетоксичных неорганических или органических кислот. Например, такие обычные нетоксичные соли включают, но не ограничиваются этим, соли, образованные из неорганических и органических кислот, выбранных из 2-ацетоксибензойной, 2-гидроксиэтансульфоновой, уксусной, аскорбиновой, бензолсульфоновой, бензойной, бикарбоновой, карбоновой, лимонной, эдетиновой, этандисульфоновой, 1,2-этансульфоновой, фумаровой, глюкогептоновой, глюконовой, глутаминовой, гликолевой, гликолеарсаниловой, гексилрезорциновой, гидрабиновой, бромистоводородной, хлористоводородной, иодистоводородной, гидроксималеиновой, гидроксинафтойной, изетионовой, молочной, лактобионовой, лаурилсульфоновой, малеиновой, яблочной, миндальной, метансульфоновой, напсиловой, азотной, щавелевой, памовой, пантотеновой, фенилуксусной, фосфорной, полигалактуроновой, пропионовой, салициловой, стеариновой, субациновой, сукциновой, сульфаминовой, сульфаниловой, серной, дубильной, винной, толуолсульфоновой и широко распространенных аминокислот, таких как глицин, аланин, фенилаланин, аргинин и т.д.
[00126] Другие примеры фармацевтически приемлемых солей включают гексановую кислоту, циклопентанпропионовую кислоту, пировиноградную кислоту, малоновую кислоту, 3-(4-гидроксибензоил)бензойную кислоту, коричную кислоту, 4-хлорбензолсульфоновую кислоту, 2-нафталинсульфоновую кислоту, 4-толуолсульфоновую кислоту, камфорсульфоновую кислоту, 4-метилбицикло[2.2.2]-окт-2-ен-1-карбоновую кислоту, 3-фенилпропионовую кислоту, триметилуксусную кислоту, третичную бутилуксусную кислоту, муконовую кислоту и т.п. Настоящая заявка также охватывает соли, образованные, когда кислотный протон, присутствующий в исходном соединении, замещается либо ионом металла, например, ионом щелочного металла, ионом щелочно-земельного металла, либо ионом алюминия; или координационные соединения с органическим основанием, таким как этаноламин, диэтаноламин, триэтаноламин, трометамин, N-метилглюкамин, и т.п.
[00127] Следует понимать, что все ссылки на фармацевтически приемлемые соли включают формы присоединения растворителя (сольваты) или кристаллические формы (полиморфы), определенные выше, той же соли.
[00128] Соединение настоящей заявки также может быть получено в виде сложных эфиров, например, фармацевтически приемлемых сложных эфиров. Например, карбоновокислотная функциональная группа в соединении может быть преобразована в соответствующий сложный эфир, например, метиловый, этиловый или другой сложный эфир. Кроме того, спиртовая группа в соединении может быть преобразована в соответствующий сложный эфир, например ацетат, пропионат или другой сложный эфир.
[00129] Соединение настоящей заявки также может быть получено в виде пролекарств, например фармацевтически приемлемых пролекарств. Термины «про-лекарство» и «пролекарство» используются взаимозаменяемо и относятся к любому соединению, которое высвобождает активное исходное лекарственное средство in vivo. Поскольку известно, что пролекарства усиливают различные желательные качества фармацевтических препаратов (например, растворимость, биодоступность, обрабатываемость и т.д.), соединение настоящей заявки доставляться в форме пролекарства. Таким образом, настоящая заявка предназначена для охвата пролекарств заявленного соединения, способов его доставки и содержащих его композиций. «Пролекарства» предусматривают включение любых ковалентно связанных носителей, которые высвобождают активное исходное лекарственное средство настоящей заявки in vivo, когда такое пролекарство вводят субъекту. Пролекарства, раскрытые в настоящей заявке, получают путем модификации функциональных групп, присутствующих в соединении, таким образом, чтобы модификации расщеплялись либо при рутинной манипуляции, либо in vivo, до исходного соединения. Пролекарства включают соединение по настоящему изобретению, где гидроксильная, амино, сульфгидрильная, карбоксильная или карбонильная группа связаны с любой группой, которая может быть расщеплена in vivo с образованием свободной гидроксильной, свободной аминогруппы, свободной сульфгидрильной, свободной карбоксильной или свободной карбонильной группы, соответственно.
[00130] Примеры пролекарств включают, но не ограничиваются этим, сложные эфиры (например, ацетат, диалкиламиноацетаты, формиаты, фосфаты, сульфаты и производные бензоата) и карбаматы (например, N,N-диметиламинокарбонил) функциональных гидрокси групп, сложные эфиры (например, этиловые эфиры, сложные эфиры морфолиноэтанола) карбоксильных функциональных групп, N-ацильные производные (например, N-ацетил) N-основания Манниха, основания Шиффа и енаминоны функциональных аминогрупп, оксимы, ацетали, кетали и енольные эфиры кетоновых и альдегидных функциональных групп в соединении настоящей заявки и т.п., см. Bundegaard, H., Design of Prodrugs, p1-92, Elsevier, New York-Oxford (1985).
[00131] Соединение или фармацевтически приемлемые соли, таутомеры, пролекарства, сольваты, метаболиты, полиморфы, аналоги или их производные вводят перорально, назально, трансдермально, внутрилегочно, ингаляционно, буккально, сублингвально, внутрибрюшинно, подкожно, внутримышечно, внутривенно, ректально, интраплеврально, интратекально и парентерально. В одном варианте осуществления соединение или его фармацевтически приемлемую соль, таутомер, пролекарство, сольват, метаболит, полиморф, аналог или производное вводят перорально. Специалист в данной области поймет преимущества некоторых путей введения.
[00132] Режим дозирования с использованием соединения выбирают в соответствии с различными факторами, включая тип, вид, возраст, массу тела, пол и состояние пациента; тяжесть состояния, подлежащего лечению; путь введения; почечную и печеночную функцию пациента; и конкретное соединение или его фармацевтически приемлемую соль, таутомер, пролекарство, сольват, метаболит, полиморф, его аналог или производное. Обычно квалифицированный врач или ветеринар может легко определить и назначить эффективное количество лекарственного средства, необходимое для предотвращения, противодействия или остановки развития заболевания.
[00133] Способы формулирования и введения раскрытого соединения можно найти в Remington: Science and Practice of Pharmacy, 19th edition, Mack Publishing Co., Easton, PA (1995). В одном варианте осуществления описанное соединение и его фармацевтически приемлемые соли, таутомеры, пролекарства, сольваты, метаболиты, полиморфы, аналоги или их производные используют в фармацевтических препаратах в комбинации с фармацевтически приемлемым носителем или разбавителем. Подходящие фармацевтически приемлемые носители включают инертные твердые наполнители или разбавители и стерильные водные или органические растворы. Соединение или фармацевтически приемлемые соли, пролекарства, сольваты, метаболиты, полиморфы, аналоги или их производные будут присутствовать в таких фармацевтических композициях в количествах, достаточных для обеспечения желаемой дозы в диапазоне, описанном в настоящей заявке.
[00134] Все проценты и отношения, используемые в настоящем изобретении, если не указано иное, являются массовыми. Другие особенности и преимущества настоящего изобретения очевидны из различных примеров. Приведенные примеры иллюстрируют различные компоненты и методологию, полезные для практического применения настоящей заявки. Примеры не ограничивают заявленное изобретение. На основании настоящей заявки квалифицированный специалист может идентифицировать и использовать другие компоненты и методологию, полезные для практического применения настоящего изобретения.
Примеры
[00135] Далее изобретение иллюстрируется следующими примерами и схемами синтеза, которые не должны рассматриваться как ограничивающие объем или суть настоящего изобретения конкретными описанными процедурами. Следует понимать, что примеры приведены для иллюстрации некоторых вариантов осуществления, и что они не предназначены для какого-либо ограничения объема изобретения. Следует также понимать, что можно использовать другие различные варианты осуществления, модификации и их эквиваленты, которые могут быть очевидны для специалистов в данной области техники, не отступая от сущности настоящей заявки и/или объема прилагаемой формулы изобретения
Аналитические методы, материалы и оборудование
[00136] Если не указано иное, реагенты и растворители использовали в том виде, как они были получены от коммерческих поставщиков. Спектры протонного ядерного магнитного резонанса (ЯМР) были получены на спектрометрах Bruker или Varian на частоте 400 МГц. Спектры приведены в м.д. (δ), а константы взаимодействия, J, приведены в Герцах. В качестве внутреннего стандарта использовали тетраметилсилан (TMS). Масс-спектры получали с использованием одноцифрового масс-спектрометра Waters ZQ (ионная ловушка ESI). Данные чистоты и масс-спектры низкого разрешения получали использованием системы ультраэффективной жидкостной хроматографии (UPLC) Waters Acquity i-класса с фотодиодным детектором Acquity Photo Diode Array Detector, детектором рассеяния света Acquity Evaporative Light Scattering Detector (ELSD) и масс-спектрометром Waters ZQ. Данные получали с использованием программы Waters MassLynx 4.1 и чистоты, характеризуемой УФ длиной волны 220 нм, ELSD и ESI. Колонка: Acquity UPLC BEH C18 1,7 мкм 2,1 × 50 мм; Скорость потока 0,6 мл/мин; Растворитель A (95/5/0,1 10 мМ формиата аммония/ацетонитрил/муравьиная кислота), растворитель B (95/5/0,09 ацетонитрила/вода/муравьиная кислота); градиент: 5-100% В от 0 до 2 мин, выдерживание 100% В до 2,2 мин, затем 5% В к 2,21 мин.
Сокращения, используемые в следующих примерах и в других разделах настоящей заявки, означают следующее:
Пример 1: 2-хлор-4-феноксибензоат (Промежуточное соединение 2-D) 
Стадия 1: 2-хлор-4-феноксибензонитрил (Промежуточное соединение 2-B)
[00137] Фенол (3,66 г, 39 ммоль), растворенный в DMF (30 мл), обрабатывали при помощи 60% дисперсии NaH в масле (1,56 г, 39 ммоль) небольшими порциями до прекращения выделения газа. Реакционную смесь перемешивали при комнатной температуре в течение 10 минут, затем добавляли 2-хлор-4-фторбензонитрил (2-A, 5,0 г, 32,5 ммоль). Смесь перемешивали при комнатной температуре в течение 3 часов до завершения реакции (ЖХМС). Летучие вещества удаляли в вакууме и неочищенный продукт распределяли в DCM/воду. Органическую фазу отделяли и промывали насыщенным солевым раствором, сушили над Na2SO4. Концентрирование давало 7,5 г не совсем белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6) δ 7,96 (д, J=8,7 Гц, 1H), 7,51 (т, J=7,9 Гц, 2H), 7,33 (д, J=7,4 Гц, 1H), 7,30 (д, J=2,3 Гц, 1H), 7,20 (д, J=7,9 Гц, 2H), 7,04 (дд, J=8,7, 2,3 Гц, 1H); МС m/z 230 [M+H]+.
Стадия 2: 2-хлор-4-феноксибензойная кислота (Промежуточное соединение 2-C)
[00138] 2-хлор-4-феноксибензонитрил (2-B, 7,0 г, 30,6 ммоль), 5M раствор гидроксида калия (100 мл) и EtOH (20 мл) перемешивали при кипячении с обратным холодильником в течение 6 часов (пока исходное вещество не расходовалось). Смеси давали охладиться до комнатной температуры и смесь медленно подкисляли концентрированной HCl. Осадок отфильтровывали и сушили, с получением бежевого твердого вещества (2-C, 7,15 г, 94%). ЯМР (400 МГц, DMSO-d6) δ 13,22 (с, 1H), 7,88 (д, J=8,7 Гц, 1H), 7,48 (т, J=7,8 Гц, 2H), 7,27 (т, J=7,4 Гц, 1H), 7,16 (д, J=8,0 Гц, 2H), 7,08 (д, J=2,2 Гц, 1H), 6,97 (дд, J=8,7, 2,3 Гц, 1H); МС m/z 249 [M+H]+.
Стадия 3: метил 2-хлор-4-феноксибензоат (Промежуточное соединение 2-D)
[00139] 2-хлор-4-феноксибензойную кислоту (2-C, 5,0 г, 20,2 ммоль) растворяли в DMF (50 мл) и добавляли твердый K2CO3 (4,15 г, 30,1 ммоль). Реакционную смесь охлаждали до 0°C и по каплям добавляли метилйодид (1,4 мл, 22,2 ммоль). Смесь оставляли нагреваться до комнатной температуры в течение одного часа. Исходные вещество было полностью израсходовано в течение этого периода. Смесь разбавляли водой и экстрагировали при помощи Et2O. Сушка и концентрирование в вакууме давали желтое масло (2-D, 4,15 г, 79%), которое использовали без дополнительной очистки. ЯМР (400 МГц, DMSO-d6) δ 7,89 (д, J=8,7 Гц, 1H), 7,49 (т, J=7,9 Гц, 2H), 7,29 (т, J=7,4 Гц, 1H), 7,17 (д, J=7,9 Гц, 2H), 7,12 (д, J=2,4 Гц, 1H), 6,99 (дд, J=8,7, 2,4 Гц, 1H), 3,84 (с, 3H); МС m/z 263 [M+H]+.
Пример 2: (2-хлор-4-феноксифенил)(4-(((3R,6S)-6-(гидроксиметил)тетрагидро-2H-пиран-3-ил)амино)-7H-пирроло[2,3-d]пиримидин-5-ил)метанон (Соединение (I))
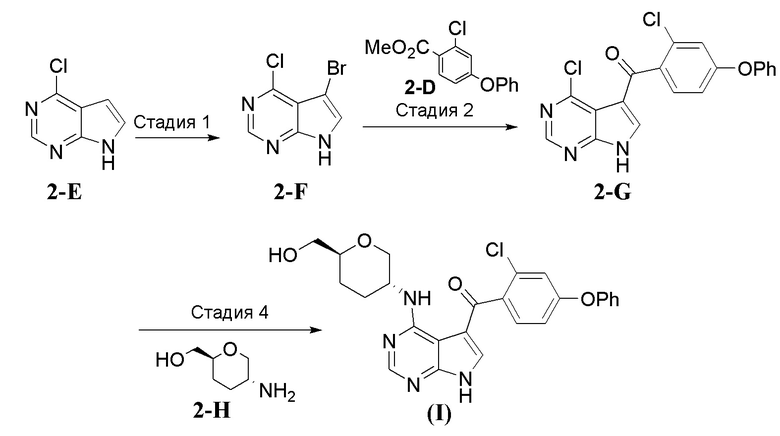
Стадия 1: 5-бром-4-хлор-7H-пирроло[2,3-d]пиримидин (Промежуточное соединение 2-F)
[00140] 4-хлор-7H-пирроло[2,3-d]пиримидин (2-E, 20,0 г, 130,7 ммоль), растворенный в DCM (800 мл), обрабатывали по частям N-бромсукцинимидом (26,7 г, 149,8 ммоль), поддерживая температуру около 25-30°C. Реакционную смесь перемешивали при комнатной температуре в течение ночи. Добавляли воду (500 мл) и фазы разделяли. Органическую фазу сушили над Na2SO4, фильтровали и концентрировали в вакууме. Неочищенный продукт растирали в Et2O, с получением после фильтрации 5-бром-4-хлор-7H-пирроло[2,3-d]пиримидина в виде белого твердого вещества (2-F, 22,43 г, 74%). Т.пл.: 242-244°C; 1H ЯМР (400 МГц, DMSO-d6) δ 12,96 (с, 1H), 8,61 (с, 1H), 7,94 (с, 1H); МС m/z 232 [M(35Cl, 79Br)+H]+, 234 [M(35Cl, 81Br)+H]+, 234 [M(37Cl, 79Br)+H]+, 236 [M(37Cl, 81Br)+H]+.
Стадия 2: (2-хлор-4-феноксифенил)(4-хлор-7H-пирроло[2,3-d]пиримидин-5-ил)метанон (Промежуточное соединение 2-G)
[00141] К перемешиваемому раствору 5-бром-4-хлор-7H-пирроло[2,3-d]пиримидина (2-F, 6,90 г, 29,7 ммоль) в THF (200 мл) добавляли по каплям n-BuLi (2,69 M в гексане, 23,2 мл, 62,3 ммоль) при -78°C в атмосфере инертного газа. Реакционную смесь хранили при -78°C в течение часа и затем добавляли предварительно охлажденный (до -78°C) раствор метил 2-хлор-4-феноксибензоата (2-D, 8,19 г, 31,2 ммоль) в THF (80 мл). Реакционную смесь перемешивали при -78°C в течение часа, затем гасили добавлением 1N раствора HCl (65 мл). Смесь оставляли нагреваться до комнатной температуры и затем экстрагировали при помощи EtOAc (3 × 100 мл). Объединенные экстракты промывали насыщенным солевым раствором, сушили над Na2SO4 и концентрировали в вакууме. Неочищенный продукт очищали при помощи колоночной хроматографии (SiO2, гексан/EtOAc) с получением (2-хлор-4-феноксифенил)(4-хлор-7H-пирроло[2,3-d]пиримидин-5-ил)метанона в виде белого твердого вещества (2-G, 4,73 г, 41%). 1H ЯМР (400 МГц, DMSO-d6) δ 13,426 (с, 1H), 8,75 (с, 1H), 8,14 (с, 1H), 7,60 (д, J=8,5 Гц, 1H), 7,49 (т, J=7,9 Гц, 2H), 7,26 (т, J=7,4 Гц, 1H), 7,23-7,12 (м, 3H), 7,01 (дд, J=8,5, 2,3 Гц, 1H); МС m/z 384 [M(35Cl, 35Cl)+H]+, 386 [M(35Cl, 37Cl)+H]+, 388 [M(37Cl, 37Cl)+H]+.
Стадия 3: (2-хлор-4-феноксифенил)(4-(((3R,6S)-6-(гидроксиметил)тетрагидро-2H-пиран-3-ил)амино)-7H-пирроло[2,3-d]пиримидин-5-ил)метанон (I)
[00142] Смесь (2-хлор-4-феноксифенил)(4-хлор-7H-пирроло[2,3-d]пиримидин-5-ил)метанона (2-G, 200 мг, 0,52 ммоль), ((2S,5R)-5-аминотетрагидро-2H-пиран-2-ил)метанола (72 мг, 0,54 ммоль) и DIPEA (272 мкл, 1,56 ммоль) перемешивали при 160°C в течение часа в условиях микроволнового облучения. Летучие вещества удаляли в вакууме и остаток очищали при помощи колоночной хроматографии (NH2-SiO2, DCM/MeOH) с получением (2-хлор-4-феноксифенил)(4-(((3R,6S)-6-(гидроксиметил)тетрагидро-2H-пиран-3-ил)амино)-7H-пирроло[2,3-d]пиримидин-5-ил)метанона в виде не совсем белого твердого вещества ((I), 175 мг, 70%). 1H ЯМР (400 МГц, DMSO-d6) δ 12,76 (с, 1H), 8,60 (д, J=7,1 Гц, 1H), 8,25 (с, 1H), 7,64 (с, 1H), 7,58 (д, J=8,4 Гц, 1H), 7,48 (т, J=7,6 Гц, 2H), 7,26 (т, J=7,2 Гц, 1H), 7,18-7,20 (м, 3H), 7,02 (д, J=8,3 Гц, 1H), 4,67 (с, 1H), 4,16 (д, J=7,7 Гц, 2H), 3,49-3,27 (м, 3H), 3,12 (т, J=11,2 Гц, 1H), 2,19 (д, J=11,4 Гц, 1H), 1,78 (д, J=12,9 Гц, 1H), 1,67-1,49 (м, 1H), 1,39 (д, J=12,3 Гц, 1H); МС m/z 479 [M(35Cl)+H]+, 481 [M(37Cl)+H]+.
Пример 3: Анализ киназной активности BTK
[00143] Испытываемый ингибитор и контрольные образцы (CGI-1746, GDC-0834, PCI-32765, Dasatinib и R-406) получали в 10% растворе DMSO при 10-кратной требуемой конечной концентрации и добавляли в каждую лунку реакционного планшета (Corning 96-луночный планшет с половинным объемом лунок и твердой белой несвязывающейся поверхностью) в объеме 2,5 мкл. Полноразмерную активную BTK разбавляли в аналитическом буфере (50 мM Tris, pH 8,0, 0,02 мг/мл BSA, 10 мМ MgCl2, 1 мМ EGTA, 10% глицерина, 0,2 мМ Na3VO4, 1 мМ DTT, 0,1 мМ β-глицерофосфата и 0,2 мМ NaF) и добавляли в каждую лунку в объеме 17,5 мкл для конечной концентрации в 25 мкл реакционной смеси 0,08 нМ. После 30-минутной предварительной инкубации при комнатной температуре киназную реакцию инициировали путем добавления 5 мкл активирующей смеси, разбавленной в аналитическом буфере, содержащем биотинилированный пептид PLCγ2 и АТФ, для конечных концентраций 150 нМ биотинилированного PLCγ2 и 180 мкM АТФ. Планшеты инкубировали в течение 60 минут при комнатной температуре. Реакции останавливали в темноте путем добавления 10 мкл смеси для остановки/детекции, полученной в аналитическом буфере, содержащем EDTA и AlphaScreen™ стрептавидиновые донорные и анти-pTYR100 акцепторные шарики. Конечные концентрации составляли 10 мМ EDTA и 500 нг/лунка донорных AlphaScreen™ и акцепторных шариков. Аналитические планшеты инкубировали в течение 60 минут при комнатной температуре в темноте и планшеты считывали на планшет-ридере Perkin Elmer Envision Multilabel (длина волны возбуждения: 640 нм, длина волны эмиссии: 570 нм). Результаты показаны в Таблице 1.
Пример 4: Анализ киназной активности BTK C481S
[00144] Испытываемый ингибитор и контрольные образцы (Staurosporine) получали в 10% DMSO при 10-кратной требуемой конечной концентрации и добавляли в каждую лунку реакционного планшета (Corning 96-луночный планшет с половинным объемом лунок и твердой белой несвязывающейся поверхностью) в объеме 2,5 мкл. Полноразмерную BTKC481S разбавляли в аналитическом буфере (50 мМ Tris, pH 8,0, 0,02 мг/мл BSA, 10 мМ MgCl2, 1 мМ EGTA, 10% глицерина, 1 мМ DTT, 1 мМ β-глицерофосфаат и 1 мМ NaF) и добавляли в каждую лунку в объеме 17,5 мкл для конечной концентрации в 25 мкл реакционной смеси 10 нМ. После 30-минутной предварительной инкубации при комнатной температуре киназную реакцию инициировали путем добавления 5 мкл активирующей смеси, разбавленной в аналитическом буфере, содержащем биотинилированный пептид PLCγ2 и АТФ, для конечных концентраций 125 нМ биотинилированного PLCγ2 и 60 мкM АТФ. Планшеты инкубировали в течение 60 минут при комнатной температуре. Реакции останавливали в темноте путем добавления 10 мкл смеси для остановки/детекции, полученной в аналитическом буфере, содержащем EDTA и AlphaScreen™ стрептавидиновые донорные и анти-pTYR100 акцепторные шарики. Конечные концентрации составляли 15 мМ EDTA, 1 мкM Стауроспорина и 500 нг/лунка AlphaScreen™ (гомогенный анализ усиления люминисценции при сближении) технологических донорных и акцепторных шариков. Аналитические планшеты инкубировали в течение 60 минут при комнатной температуре в темноте и планшеты считывали на планшет-ридере Perkin Elmer Envision Multilabel (длина волны возбуждения: 640 нм, длина волны эмиссии: 570 нм). Результаты показаны в Таблице 1.
Пример 5: Анализ анти-пролиферации
[00145] Выживаемость клеток определяют при помощи анализа MTS. Вкратце, клетки (т.е. клетки TMD-8 или клетки Rec-1) высевают в 96-луночный планшет в концентрации 2000-10000 клеток на лунку, культивируют в течение 24 часов в готовой питательной среде и затем обрабатывают различными лекарственными средствами и комбинациями лекарственных средств в течение 72 часов. Добавляют MTS/PMS и инкубируют в течение 4 часов, с последующей оценкой жизнеспособности клетки с использованием микропланшет-ридера (поглощение при 490 нм). Данные нормализуют к необработанным контролям и анализируют при помощи Microsoft Excel. Результаты показаны в Таблице 1.
Биологическая активность соединения (I)
Эквиваленты
[00146] Специалистам в данной области техники должны быть понятны, или они смогут установить, используя не более чем обычные эксперименты, многочисленные эквиваленты конкретных вариантов осуществления, описанных в настоящей заявке. Такие эквиваленты предусматриваются как охватываемые объемом следующей формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТЕТРАГИДРОПИРАНИЛ АМИНО-ПИРРОЛОПИРИМИДИНОН И СПОСОБЫ ЕГО ПРИМЕНЕНИЯ | 2020 |
|
RU2747991C1 |
| Ингибиторы BTK | 2020 |
|
RU2830171C1 |
| КОМПОЗИЦИИ И СПОСОБЫ, КОТОРЫЕ МОЖНО ИСПОЛЬЗОВАТЬ ДЛЯ ЛЕЧЕНИЯ ПРОЛИФЕРАТИВНЫХ ЗАБОЛЕВАНИЙ | 2015 |
|
RU2711500C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ | 2016 |
|
RU2744897C2 |
| ПРОИЗВОДНЫЕ 3-(1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОНА И ВАРИАНТЫ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2795850C2 |
| ПРОИЗВОДНОЕ ХИНАЗОЛИНОНА, СПОСОБ ЕГО ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЯ | 2017 |
|
RU2730500C2 |
| СОЕДИНЕНИЕ НА ОСНОВЕ ПИРРОЛАМИДОПИРИДОНА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2809596C2 |
| ОЧИЩЕННЫЕ ПИРРОЛОХИНОЛИНИЛ-ПИРРОЛИДИН-2,5-ДИОНОВЫЕ КОМПОЗИЦИИ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2010 |
|
RU2556205C2 |
| ПОЛИМОРФЫ ИНГИБИТОРА КИНАЗЫ | 2012 |
|
RU2636588C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ ДЛЯ ЛЕЧЕНИЯ РАКА | 2013 |
|
RU2699546C2 |
Изобретение относится к соединению формулы (I) или к его фармацевтически приемлемой соли. Также раскрывается фармацевтическая композиция для лечения ВТК-опосредованного расстройства на основе указанноего соединения или его соли. Технический результат – получено новое соединение и фармацевтическая композиция на его основе, которые могут найти применение в медицине для лечения BTK-опосредованного расстройства, выбранного из иммунного расстройства, рака, сердечно-сосудистых заболеваний, вирусных инфекций, воспаления, нарушения обмена веществ/функции эндокринной системы и неврологических расстройств. 5 н. и 40 з.п. ф-лы, 1 табл., 5 пр.
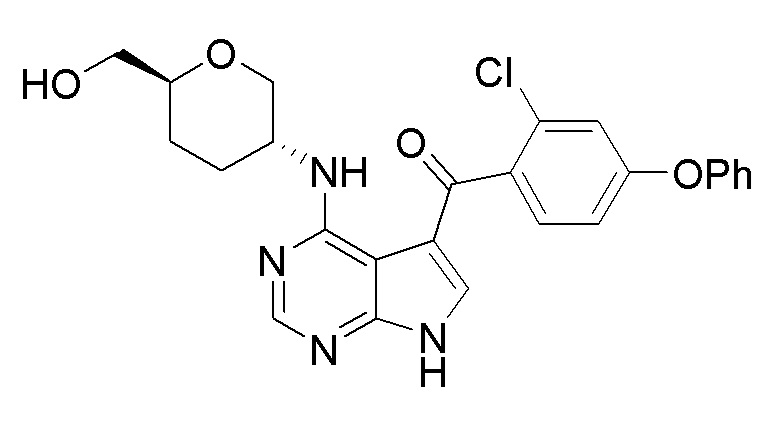 (I)
(I)
1. Соединение формулы (I):
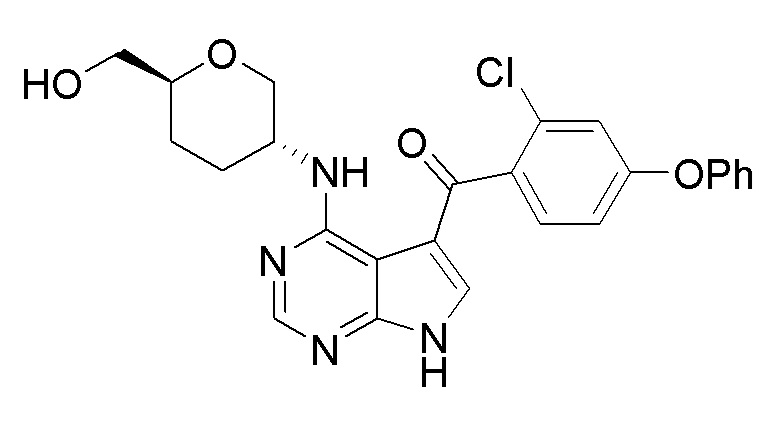 (I)
(I)
или его фармацевтически приемлемая соль.
2. Соединение по п.1 формулы (I):
 (I).
(I).
3. Фармацевтическая композиция для лечения ВТК-опосредованного расстройства, включающая эффективное количество соединения по п. 1 или его фармацевтически приемлемую соль или соединения по п. 2 и фармацевтически приемлемый разбавитель, эксципиент или носитель.
4. Способ лечения BTK-опосредованного расстройства, включающий введение нуждающемуся в этом пациенту терапевтически эффективного количества соединения по п. 1 или его фармацевтически приемлемой соли, или соединения по п. 2, или фармацевтической композиции по п. 3.
5. Способ по п. 4, где ВТК-опосредованное расстройство выбрано из иммунного расстройства, рака, сердечно-сосудистых заболеваний, вирусных инфекций, воспаления, нарушения обмена веществ/функции эндокринной системы и неврологических расстройств.
6. Способ по п. 5, где рак выбран из рака молочной железы, яичника, шейки матки, предстательной железы, яичка, мочеполового тракта, пищевода, гортани, желудка, кожи, легкого, кости, толстой кишки, поджелудочной железы, щитовидной железы, рака ворсистых клеток, буккальной полости, носоглотки, глотки, губы, языка, рта, тонкого кишечника, толстой и прямой кишки, толстого кишечника, прямой кишки, головного мозга и центральной нервной системы, бронха, печени, внутрипеченочного желчного протока, эндометрия, почек, почечной лоханки, мочевого пузыря, тела матки, шейки матки или полости рта, нейробластомы, кератоакантомы, эпидермоидной карциномы, крупноклеточной карциномы, немелкоклеточной карциномы легких (NSCLC), мелкоклеточной карциномы, аденокарциномы легких, аденомы, аденокарциномы, фолликулярной карциномы, недифференцированной карциномы, папиллярной карциномы, семиномы, меланомы, саркомы, карциномы мочевого пузыря, карциномы печени, карциномы почек, миелоидных расстройств, лимфомы, лейкоза Ходжкина, гепатоцеллюлярного рака, глиомы/глиобластомы, множественной миеломы, острого миелогенного лейкоза, хронического миелогенного лейкоза, лимфоцитарного лейкоза, хронического лимфоидного лейкоза (CLL), миелоидного лейкоза, неходжкинской лимфомы и ворсинчатой аденомы толстой кишки.
7. Способ по п. 5, где расстройство представляет собой ревматоидный артрит, системное и местное воспаление, артрит, воспаление, связанное с подавлением иммунитета, отторжение органа при трансплантации, аллергии, язвенный колит, болезнь Крона, дерматит, астму, системную красную волчанку, синдром Шегрена, рассеянный склероз, склеродермию/системный склероз, идиопатическую тромбоцитопеническую пурпуру (ITP), васкулит антинейтрофильных цитоплазматических антител (ANCA), хроническое обструктивное заболевание легких (COPD) или псориаз.
8. Способ по п. 5, в котором рак представляет собой хронический лимфоидный лейкоз.
9. Способ по п. 5, в котором рак представляет собой лимфому.
10. Способ по п. 9, в котором лимфома представляет собой неходжкинскую лимфому.
11. Способ по п. 9, в котором лимфома представляет собой В-клеточную лимфому.
12. Способ по п. 11, в котором В-клеточная лимфома представляет собой В-клеточную неходжкинскую лимфому.
13. Способ по п. 9, в котором лимфома представляет собой анапластическую крупноклеточную лимфому.
14. Способ по п. 9, в котором лимфома представляет собой лимфому центральной нервной системы (ЦНС).
15. Способ по п. 14, в котором лимфома ЦНС представляет собой первичную лимфому ЦНС.
16. Способ по п. 9, в котором лимфома представляет собой макроглобулинемию Вальденстрема.
17. Способ по п. 5, в котором рак представляет собой миелоидные расстройства.
18. Способ по п. 5, в котором рак представляет собой миелоидный лейкоз.
19. Способ по п. 5, в котором рак представляет собой острый миелогенный лейкоз.
20. Способ по п. 5, в котором рак представляет собой множественную миелому.
21. Способ по п. 5, в котором рак представляет собой лимфоцитарный лейкоз.
22. Способ по п. 5, в котором рак представляет собой саркому.
23. Способ по п. 5, в котором рак представляет собой опухоль головного мозга.
24. Способ модуляции BTK, включающий введение нуждающемуся в этом пациенту эффективного количества соединения по п. 1, или его фармацевтически приемлемой соли, или соединения по п. 2, или фармацевтической композиции по п. 3.
25. Соединение по п. 1, или его фармацевтически приемлемая соль, или соединение по п. 2, или фармацевтическая композиция по п. 3 для применения в способе лечения BTK-опосредованного расстройства или модуляции BTK.
26. Применение соединения по п. 1 или его фармацевтически приемлемой соли или соединения по п. 2 или фармацевтической композиции по п. 3 для получения лекарственного средства для лечения BTK-опосредованного расстройства или для модуляции BTK.
27. Соединение для применения по п. 25 или применение по п. 26, где ВТК-опосредованное заболевание или расстройство выбрано из иммунного расстройства, рака, сердечно-сосудистых заболеваний, вирусных инфекций, воспаления, нарушения обмена веществ/функции эндокринной системы и неврологических расстройств.
28. Соединение для применения или применение по п. 27, где рак выбран из рака молочной железы, яичника, шейки матки, предстательной железы, яичка, мочеполового тракта, пищевода, гортани, желудка, кожи, легкого, кости, толстой кишки, поджелудочной железы, щитовидной железы, рака ворсистых клеток, буккальной полости, носоглотки, глотки, губы, языка, рта, тонкого кишечника, толстой и прямой кишки, толстого кишечника, прямой кишки, головного мозга и центральной нервной системы, бронха, печени, внутрипеченочного желчного протока, эндометрия, почек, почечной лоханки, мочевого пузыря, тела матки, шейки матки или полости рта, нейробластомы, кератоакантомы, эпидермоидной карциномы, крупноклеточной карциномы, немелкоклеточной карциномы легких (NSCLC), мелкоклеточной карциномы, аденокарциномы легких, аденомы, аденокарциномы, фолликулярной карциномы, недифференцированной карциномы, папиллярной карциномы, семиномы, меланомы, саркомы, карциномы мочевого пузыря, карциномы печени, карциномы почек, миелоидных расстройств, лимфомы, лейкоза Ходжкина, гепатоцеллюлярного рака, глиомы/глиобластомы, множественной миеломы, острого миелогенного лейкоза, хронического миелогенного лейкоза, лимфоцитарного лейкоза, хронического лимфоидного лейкоза (CLL), миелоидного лейкоза, неходжкинской лимфомы и ворсинчатой аденомы толстой кишки.
29. Соединение для применения или применение по п. 27, где расстройство представляет собой ревматоидный артрит, системное и местное воспаление, артрит, воспаление, связанное с подавлением иммунитета, отторжение органа при трансплантации, аллергии, язвенный колит, болезнь Крона, дерматит, астму, системную красную волчанку, синдром Шегрена, рассеянный склероз, склеродермию/системный склероз, идиопатическую тромбоцитопеническую пурпуру (ITP), васкулит антинейтрофильных цитоплазматических антител (ANCA), хроническое обструктивное заболевание легких (COPD) или псориаз.
30. Соединение для применения или применение по п. 27, где рак представляет собой хронический лимфоидный лейкоз.
31. Соединение для применения или применение по п. 27, где рак представляет собой лимфому.
32. Соединение для применения или применение по п. 31, где лимфома представляет собой неходжкинскую лимфому.
33. Соединение для применения или применение по п. 31, где лимфома представляет собой В-клеточную лимфому.
34. Соединение для применения или применение по п. 33, где В-клеточная лимфома представляет собой В-клеточную неходжкинскую лимфому.
35. Соединение для применения или применение по п. 31, где лимфома представляет собой анапластическую крупноклеточную лимфому.
36. Соединение для применения или применение по п. 31, где лимфома представляет собой лимфому центральной нервной системы (ЦНС).
37. Соединение для применения или применение по п. 36, где лимфома ЦНС представляет собой первичную лимфому ЦНС.
38. Соединение для применения или применение по п. 31, где лимфома представляет собой макроглобулинемию Вальденстрема.
39. Соединение для применения или применение по п. 27, где рак представляет собой миелоидные расстройства.
40. Соединение для применения или применение по п. 27, где рак представляет собой миелоидный лейкоз.
41. Соединение для применения или применение по п. 27, где рак представляет собой острый миелогенный лейкоз.
42. Соединение для применения или применение по п. 27, где рак представляет собой множественную миелому.
43. Соединение для применения или применение по п. 27, где рак представляет собой лимфоцитарный лейкоз.
44. Соединение для применения или применение по п. 27, где рак представляет собой саркому.
45. Соединение для применения или применение по п. 27, где рак представляет собой опухоль головного мозга.
| RU 2012125070 A, 27.12.2013 | |||
| US 8940893 B2, 27.01.2015 | |||
| WO 2014188173 A1, 27.11.2014 | |||
| WO 2015189620 A1, 17.12.2015. |
Авторы
Даты
2020-02-28—Публикация
2015-12-23—Подача