Изобретение относится к медицине, а точнее - к медицинской диагностике, и применяется для обнаружения генов, ответственных за синтез следующих разрушающих антибиотики β-лактамаз, имеющих важное клиническое значение: SHV, СТХ-М, VIM, IMP, NDM, ОХА, KPC, GES, GIM, SPM у актуальных для медицины грамотрицательных микроорганизмов, в том числе у Acinetobacter baumannii, Pseudomonas aeruginosa, Klebsiella pneumoniae, Burkholderia spp., Enterobacter spp., Stenotrophomonas maltophilia, Elizabethkingia meningoseptica, Serratia marcescens.
Известно, что для обнаружения генов, ответственных за синтез клинически значимых семейств β-лактамаз у грамотрицательных микроорганизмов, существует ряд способов.
Известен способ определения нуклеотидных последовательностей генов β-лактамаз грамотрицательных бактерий, который выполняется методом секвенирования по Сэнгеру (Lee СС, Lui G, Ip М, Ling TK, Lee N. Frequent detection of plasmid-mediated quinolone resistance (qnr) genes in multidrug-resistant Enterobacteriaceae blood isolates, Hong Kong. Eur J Clin Microbiol Infect Dis. 2012 Nov; 31(11):3183-3189). В процессе секвенирования одна из цепочек анализируемой ДНК выступает в качестве матрицы для синтеза комплементарной цепочки ферментом ДНК-полимеразой. В полимеразную цепную реакцию добавляются дидезоксинуклеотиды с флуоресцентными метками с разными длинами волн испускания. У дидезоксирибонуклеотидов отсутствует 3'-гидроксильная группа, поэтому после их включения в цепь дальнейший синтез обрывается. В результате образуется набор фрагментов ДНК разной длины, которые заканчиваются тем или иным нуклеотидом. Реакционную смесь разделяют капиллярным электрофорезом в растворе, фрагменты ДНК, выходящие из капиллярной колонки, регистрируются детектором флуоресценции. Результаты анализируют с помощью компьютера и представляют в виде последовательности разноцветных пиков, соответствующих четырем нуклеотидам. Главный недостаток секвенирования генов β-лактамаз заключается в длительности его выполнения, - он реализуется в течение нескольких суток, что бывает недопустимым в тяжелых случаях заболеваний, когда требуется срочная диагностика по жизненным показаниям. Кроме этого способ секвенирование генов требует использования специализированного дорогостоящего оборудования.
Известен способ выявления генов β-лактамаз при помощи специализированных олигонуклеотидных микрочипов (Т. Naas, G. Cuzon, P. Bogaerts, Y. Glupczynski and P. Nordmann. Evaluation of a DNA Microarray (Check-MDR CT102) for Rapid Detection of ТЕМ, SHV, and CTX-M Extended-Spectrum β-Lactamases and of KPC, OXA-48, VIM, IMP, and NDM-1 Carbapenemases. J Clin Microbiol. 2011 Apr; 49(4):1608-1613). Олигонуклеотидные микрочипы представляют собой набор микроскопических ячеек, прикрепленных к твердой подложке. Каждая ячейка содержит несколько пикомоль одноцепочной ДНК со специфической последовательностью (ДНК-зонд), иммобилизованной в ячейке. Способ основан на гибридизации между двумя цепями ДНК - ДНК-зондом на чипе и ДНК-мишенью в растворе, чем выше их комплиментарность, тем стабильнее образующийся ДНК-дуплекс. Флуоресцентно меченая ДНК-мишень, связавшись с ДНК-зондом, производит флуоресцентный сигнал, зависящий от условий гибридизации. Сравнение уровней сигналов от различных ячеек позволяет сделать вывод о наличии специфических нуклеотидных последовательностей в исследуемом образце. Главный недостаток способа выявления генов β-лактамаз при помощи специализированных олигонуклеотидных микрочипов заключается в длительности его выполнения, - он реализуется не менее чем за двое суток. Кроме этого, указанный способ требует использования специализированного дорогостоящего оборудования для считывания сигналов с микрочипов и анализа полученной информации.
Наиболее близким к предлагаемому способу идентификации генов клинически значимых семейств β-лактамаз у грамотрицательных микроорганизмов является способ полимеразной цепной реакции (ПЦР) в реальном времени, который используется для выявления генов β-лактамаз класса ОХА (Hemarajata Р, Yang S, Hindler JA, Humphries RM. Development of a Novel Real-Time PCR Assay with High-Resolution Melt Analysis To Detect and Differentiate OXA-48-Like β-Lactamases in Carbapenem-Resistant Enterobacteriaceae. Antimicrob Agents Chemother. 2015 Sep; 59(9):5574-5580). Указанный способ использует общие принципы ПЦР и выполняется в несколько этапов. На первом этапе проводится подготовка материала для исследования. Для этого из биологического материал (кровь, гной, моча, ликвор, экссудат, аспират и т.д.), полученного от пациента, производится экстракция ДНК при помощи коммерческих наборов для лизиса клеток и экстракции ДНК». На втором этапе производится ПЦР-амплификация фрагментов целевых генов β-лактамаз при помощи ПЦР в реальном времени. Предварительно подготовленный лизат смешивается с другими компонентами реакции - праймерами, ДНК-полимеразов, азотистыми основаниями, специальными буферными растворами - и загружается в амплификатор для проведения ПЦР в реальном времени. В способе используются следующие нуклеотидные последовательности праймеров для выявления генов ОХА-β-лактамаз -  и
и  . Режим проведения ПЦР - по варианту «горячего старта» в реальном времени. Оценка реакции производится по нарастанию уровня флуоресценции в последовательных циклах ПЦР, что свидетельствует о наличии у исследуемых штаммов генов ОХА-β-лактамаз. Позитивный результат, отражающий наличие конкретных генов β-лактамаз в исследуемом образце, подтверждается на основе опережения амплификации в пробах с праймерами, соответствующими данному гену. Отрицательные результаты, отражающие отсутствие генов β-лактамаз в исследуемом образце, подтверждаются на основе отсутствии разницы в скорости амплификации в пробах с праймерами, соответствующими данным генам. Главным недостатком способа ПЦР в реальном времени является то, что он позволяет выявлять одновременно только очень ограниченное число генов клинически значимых семейств β-лактамаз, принадлежащих лишь к семейству ОХА, тогда как другие клинически значимые гены β-лактамаз (SHV, СТХ-М, VIM, IMP, NDM, KPC, GES, GIM, SPM) при помощи этого способа не могут быть обнаружены.
. Режим проведения ПЦР - по варианту «горячего старта» в реальном времени. Оценка реакции производится по нарастанию уровня флуоресценции в последовательных циклах ПЦР, что свидетельствует о наличии у исследуемых штаммов генов ОХА-β-лактамаз. Позитивный результат, отражающий наличие конкретных генов β-лактамаз в исследуемом образце, подтверждается на основе опережения амплификации в пробах с праймерами, соответствующими данному гену. Отрицательные результаты, отражающие отсутствие генов β-лактамаз в исследуемом образце, подтверждаются на основе отсутствии разницы в скорости амплификации в пробах с праймерами, соответствующими данным генам. Главным недостатком способа ПЦР в реальном времени является то, что он позволяет выявлять одновременно только очень ограниченное число генов клинически значимых семейств β-лактамаз, принадлежащих лишь к семейству ОХА, тогда как другие клинически значимые гены β-лактамаз (SHV, СТХ-М, VIM, IMP, NDM, KPC, GES, GIM, SPM) при помощи этого способа не могут быть обнаружены.
Таким образом, в настоящее время существует необходимость в создании нового способа одновременного обнаружения многих генов, ответственных за синтез клинически значимых семейств β-лактамаз, не требующего предварительной культивации патогенных микроорганизмов, дорогостоящих расходных материалов и оборудования, а также отличающегося простотой и быстротой проведения анализа, высокой специфичностью и чувствительностью.
Задачей настоящего изобретения является создание способа одновременного обнаружения клинически значимых семейств β-лактамаз у грамотрицательных микроорганизмов, включая β-лактамазы SHV, СТХ-М, VIM, IMP, NDM, ОХА, KPC, GES, GIM, SPM.
Техническим решением поставленной задачи является быстрое и одновременное получение информации о наличии у исследуемых грамотрицательных бактерий генов β-лактамаз SHV, СТХ-М, VIM, IMP, NDM, ОХА, KPC, GES, GIM, SPM.
Поставленная задача решается путем амплификации фрагментов генов с помощью полимеразной цепной реакции с набором специфических олигонуклеотидных праймеров и последующим разделением продуктов реакции путем электрофореза в агарозном геле. Набор специфичных олигонуклеотидных праймеров представлен: тремя парами олигонуклеотидных праймеров для амлификации генов семейства СТХ-М с нуклеотидными последовательностями 
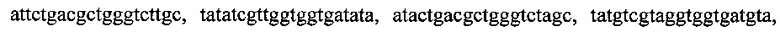 тремя парами олигонуклеотидных праймеров для амлификации генов семейства GES с нуклеотидными последовательностями
тремя парами олигонуклеотидных праймеров для амлификации генов семейства GES с нуклеотидными последовательностями 
 , тремя парами олигонуклеотидных праймеров для амлификации генов семейства GIM с нуклеотидными последовательностями
, тремя парами олигонуклеотидных праймеров для амлификации генов семейства GIM с нуклеотидными последовательностями 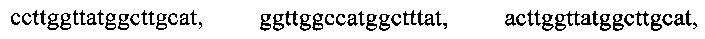
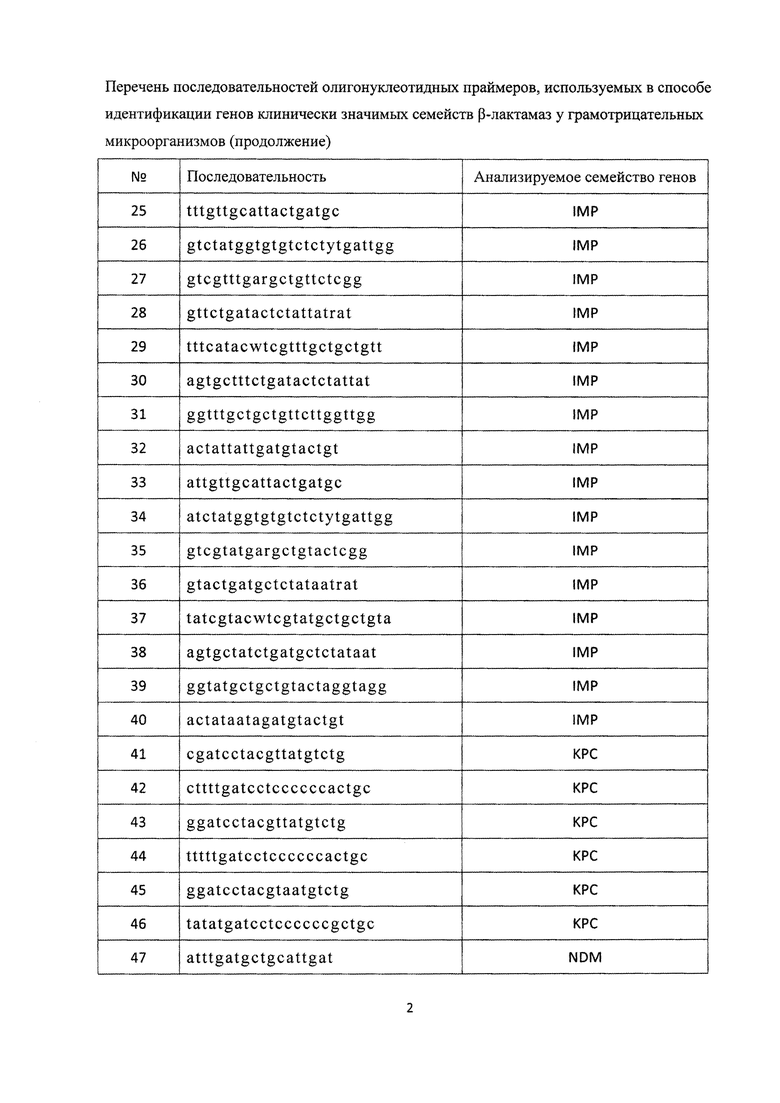
 , одиннадцатью парами олигонуклеотидных праймеров для амлификации генов семейства IMP с нуклеотидными последовательностями
, одиннадцатью парами олигонуклеотидных праймеров для амлификации генов семейства IMP с нуклеотидными последовательностями 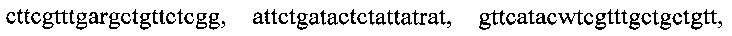
 тремя парами олигонуклеотидных праймеров для амлификации генов семейства KPC с нуклеотидными последовательностями
тремя парами олигонуклеотидных праймеров для амлификации генов семейства KPC с нуклеотидными последовательностями 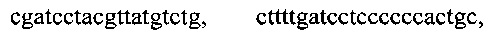
 , тремя парами олигонуклеотидных праймеров для амлификации генов семейства NDM с нуклеотидными последовательностями
, тремя парами олигонуклеотидных праймеров для амлификации генов семейства NDM с нуклеотидными последовательностями 
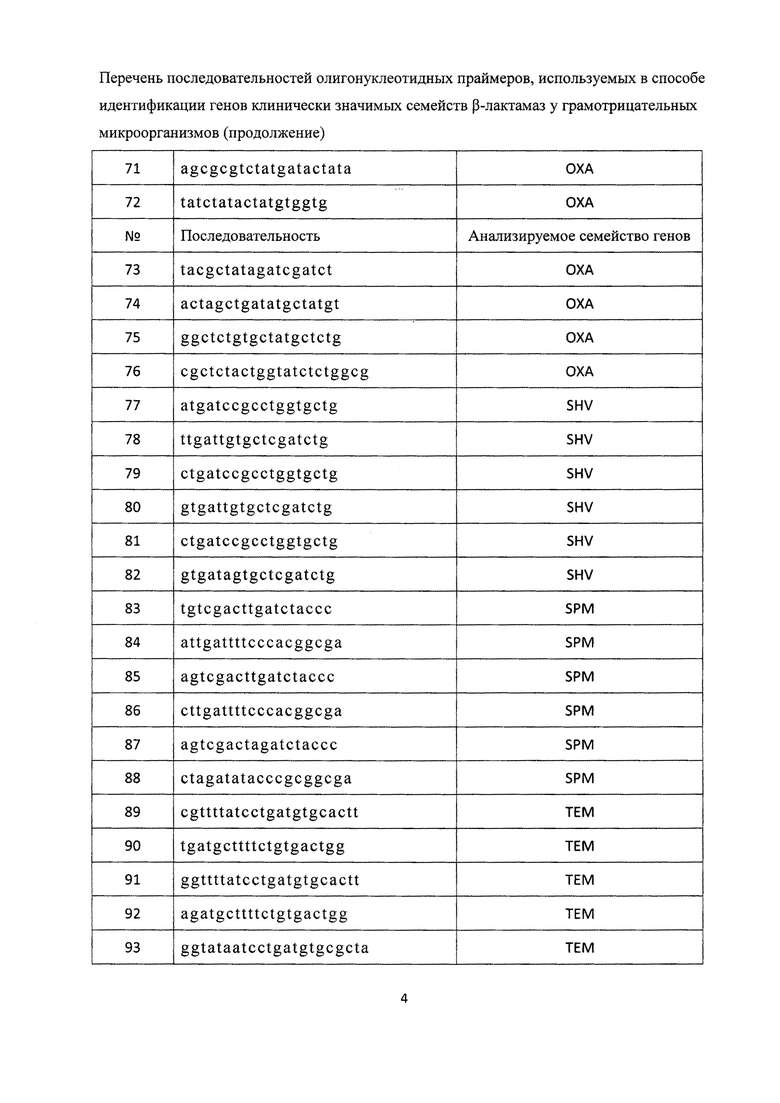
 , двенадцатью парами олигонуклеотидных праймеров для амлификации генов семейства ОХА с нуклеотидными последовательностями
, двенадцатью парами олигонуклеотидных праймеров для амлификации генов семейства ОХА с нуклеотидными последовательностями 

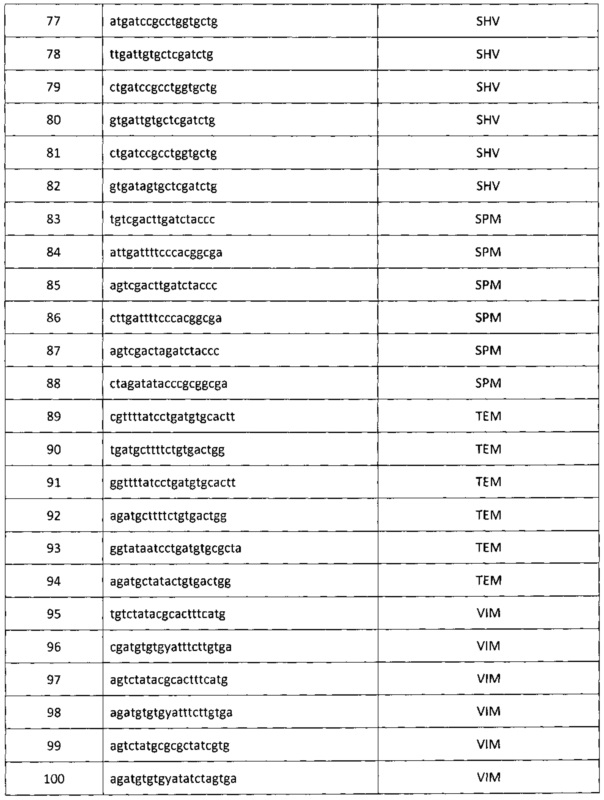
 , тремя парами олигонуклеотидных праймеров для амлификации генов семейства SHV с нуклеотидными последовательностями
, тремя парами олигонуклеотидных праймеров для амлификации генов семейства SHV с нуклеотидными последовательностями 
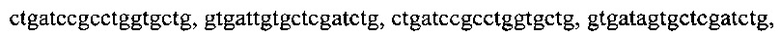 тремя парами олигонуклеотидных праймеров для амлификации генов семейства SPM с нуклеотидными последовательностями
тремя парами олигонуклеотидных праймеров для амлификации генов семейства SPM с нуклеотидными последовательностями 
 , тремя парами олигонуклеотидных праймеров для амлификации генов семейства ТЕМ с нуклеотидными последовательностями
, тремя парами олигонуклеотидных праймеров для амлификации генов семейства ТЕМ с нуклеотидными последовательностями 
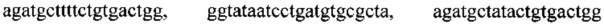 , тремя парами олигонуклеотидных праймеров для амлификации генов семейства VIM с нуклеотидными последовательностями
, тремя парами олигонуклеотидных праймеров для амлификации генов семейства VIM с нуклеотидными последовательностями 
 .
.
Способ выполняется в несколько этапов.
ЭТАП 1. Подготовка материала для исследования
На 1-м этапе из биологического материал (кровь, гной, моча, ликвор, экссудат, аспират и т.д.), полученного от пациента, производится экстракция ДНК. Для этого биологический материал в количестве от 1 до 10 мл центрифугируется при 10000 оборотах в минуту в течение 2 минут, надосадочная жидкость удаляется, к осадку добавляется 0,35 мл ТЕ-буфера из коммерческого «Набора для лизиса ДНК» (производство AmliSens). Осадок в ТЕ-буфере обрабатывается на вортексе 30 секунд.
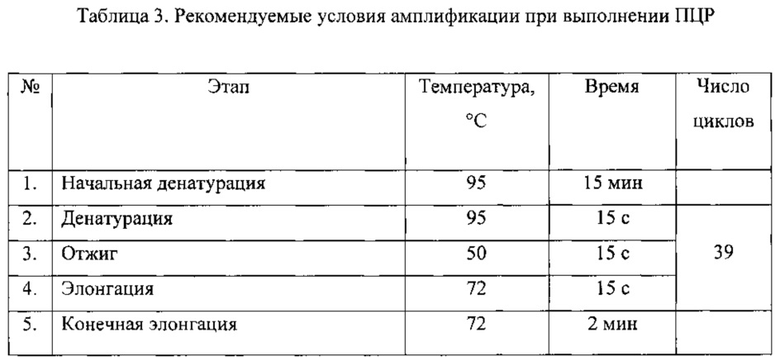
ЭТАП 2. ПЦР-амплификация фрагментов целевых генов
На 2-м этапе производится амплификация в исследуемом образце генов β-лактамаз (SHV, ОХА, СТХ-М, VIM, IMP, NDM, KPC, GES, GIM, SPM) при помощи на ДНК-амплификаторе. Предварительно подготовленный лизат (см. выше - «Этап 1») в количестве 3 мкл смешивается с другими компонентами реакции в количествах и порядке, указанном в Таблице 1. Конечный объем реакционной смеси составляет 25 мкл с учетом добавления матричной ДНК. Нуклеотидные последовательности праймеров для выявления генов β-лактамаз, указаны в Таблице 2 и Перечне нуклеотидных последовательностей праймеров, прилагаемом к настоящей заявке. Праймеры для проведения полимеразной цепной реакции были синтезированы на автоматическом синтезаторе 394 DNA/RNA synthesizer (Applied Biosystems, США). Режим проведения ПЦР отражен в Таблице 3. В качестве положительного контроля используют синтетические цепочки ДНК, идентичные естественным генам β-лактамаз.
ЭТАП 3. Оценка результатов
Продукты амплификации, полученные с помощью полимеразной цепной реакции с использованием данного набора праймеров, подвергают разделению путем проведения электрофореза в агарозном геле в камере для электрофореза. Извлекают гель из электрофорезной камеры и просматривают в УФ-свете на транс иллюминаторе. Результаты документируют путем фотографирования геля и сохранения полученных изображений. Далее, проводится анализ полученных изображений электрофореграмм. По расположению специфических полос для продуктов амплификации проводится интерпретация электрофореграммы, вывод о наличии у анализируемых образцов идентифицируемых генов β-лактамаз делается не основе сравнения изображений исследуемых образцов и положительных контролей (см. Этап 2).
Эффективность предлагаемого способа продемонстрирована на следующих примерах.
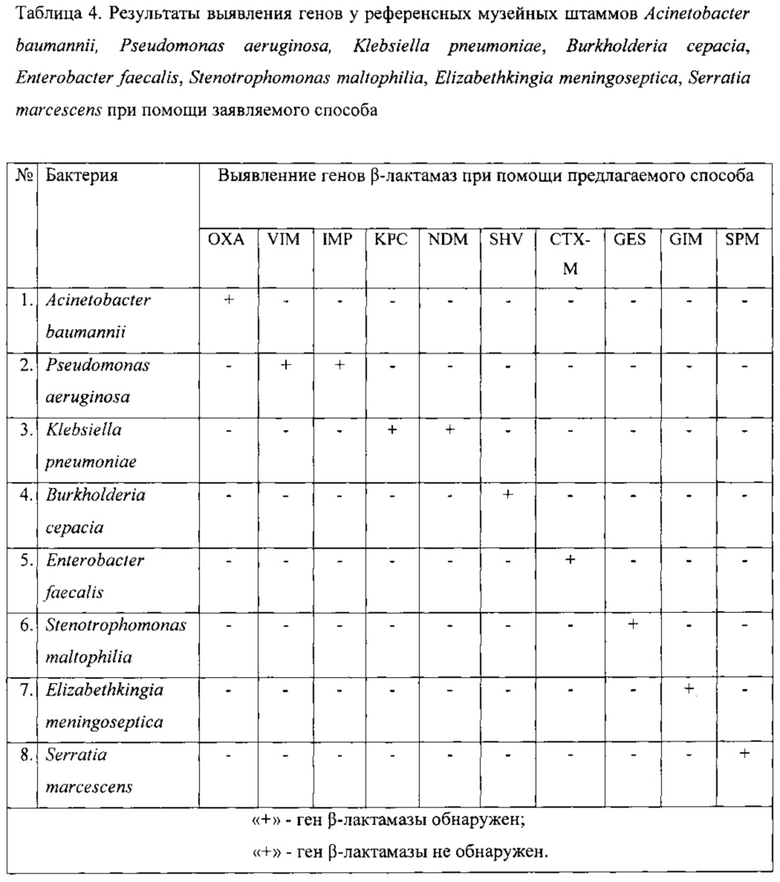
Пример 1
В качестве объекта исследования использовали референсные музейные штаммы бактерий, несущих заведомо известные гены β-лактамаз: Acinetobacter baumannii, несущий ген β-лактамазы ОХА, Pseudomonas aeruginosa, несущая гены β-лактамаз VIM и IMP, Klebsiella pneumoniae, несущая гены β-лактамаз KPC и NDM, Burkholderia cepacia, несущая ген β-лактамазы SHV, Enterobacter faecalis, несущий ген β-лактамазы СТХ-М, Stenotrophomonas maltophilia, несущая ген β-лактамазы GES, Elizabethkingia meningoseptica, несущая ген β-лактамазы GIM, Serratia marcescens, несущая ген β-лактамазы SPM. Из суточных бульонных (бульон Мюллера-Хинтона) культур перечисленных выше бактерий было отобрано по 1 мл жидкости. Отобранный материал в количестве от 1 мл центрифугировался при 10000 оборотах в минуту в течение 2 минут, надосадочная жидкость была удалена, к осадку был добавлен ТЕ-буфера (0,35) мл из коммерческого «Набора для лизиса ДНК» (производство AmliSens). Осадок в ТЕ-буфере был обработан на вортексе 30 секунд. Затем в исследуемом образце была произведена амплификация генов β-лактамаз (SHV, ОХА, СТХ-М, VIM, IMP, NDM, KPC, GES, GIM, SPM) на ДНК-амплификаторе «BioRad ThermoCycler С1000» со смесью праймеров, указанных в Таблице 2 в условиях, описанных выше. В качестве положительного контроля использовали синтетические цепочки ДНК, идентичные естественным генам β-лактамаз. Продукты амплификации, полученные с помощью полимеразной цепной реакции с использованием данного набора праймеров, были подвергнуты разделению путем проведения электрофореза в агарозном геле в камере для электрофореза. Результаты документированы путем фотографирования геля в трансиллюминаторе и сохранения полученных изображений. Далее, было проведено сравнение специфических полос положительного контроля и полос анализируемых образцов. Была выявлена идентичность полос в образцах с синтетическими цепочками ДНК, соответствующими генам SHV, ОХА, СТХ-М, VIM, IMP, NDM, KPC, GES, GIM, SPM, и полос в анализируемых образцах. Результаты отражены в таблице 4. Данный пример показывает возможность быстрого и правильного выявления генов β-лактамаз SHV, ОХА, СТХ-М, VIM, IMP, NDM, KPC, GES, GIM, SPM у возбудителей музейных штаммов.
Пример 2
В качестве объекта исследования использовали клинический материал - отделяемое из гнойной раны от больного из хирургического отделения. Предварительно путем классического микробиологического исследования в материале были обнаружены бактерии, относящиеся к виду Pseudomonas aeruginosa. Полученный материал в количестве от 1 мл центрифугировался при 10000 оборотах в минуту в течение 2 минут, надосадочная жидкость была удалена, к осадку был добавлен ТЕ-буфера (0,35) мл из коммерческого «Набора для лизиса ДНК» (производство AmliSens). Осадок в ТЕ-буфере был обработан на вортексе 30 секунд. Затем в исследуемом образце была произведена амплификация генов β-лактамаз (SHV, ОХА, СТХ-М, VIM, IMP, NDM, KPC, GES, GIM, SPM) на ДНК-амплификаторе «BioRad ThermoCycler C1000» со смесью праймеров, указанных в Таблице 2, в условиях, описанных выше. В качестве положительного контроля использовали синтетические цепочки ДНК, идентичные естественным генам β-лактамаз. Продукты амплификации, полученные с помощью полимеразной цепной реакции с использованием данного набора праймеров, были подвергнуты разделению путем проведения электрофореза в агарозном геле в камере для электрофореза. Результаты документированы путем фотографирования геля в трансиллюминаторе и сохранения полученных изображений. Далее, было проведено сравнение специфических полос положительного контроля и полос анализируемых образцов. Была выявлена идентичность полос в образцах с синтетическими цепочками ДНК, соответствующими генам ОХА, СТХ-М, VIM, IMP, и полос в анализируемом образце. Это позволило сделать вывод о наличии генов β-лактамаз ОХА, СТХ-М, VIM, IMP у синегнойной палочки (Pseudomonas aeruginosa), изолированной из гнойной раны. Данный пример показывает возможность быстрого одновременного выявления генов β-лактамаз ОХА, СТХ-М, VIM, IMP у возбудителя из клинического образца.



| название | год | авторы | номер документа |
|---|---|---|---|
| Синтетические олигонуклеотидные праймеры для идентификации штаммов и изолятов бактерии Acinetobacter и определения устойчивости к бета-лактамным антибиотикам и способ их применения | 2016 |
|
RU2646107C1 |
| Способ выявления возбудителей нозокомиальных оппортунистических инфекций и маркеров их резистентности к бета-лактамным антибиотикам и гликопептидам у женщин репродуктивного возраста и новорожденных детей для оптимизации антибактериальной терапии | 2016 |
|
RU2629322C1 |
| СПОСОБ ИДЕНТИФИКАЦИИ ГЕНОВ БЕТА-ЛАКТАМАЗ РАСШИРЕННОГО СПЕКТРА ДЕЙСТВИЯ КЛАССА А | 2009 |
|
RU2415932C1 |
| ОЛИГОНУКЛЕОТИДНЫЕ ПРАЙМЕРЫ ДЛЯ ДЕТЕКЦИИ И ТИПИРОВАНИЯ ГЕНОВ β-ЛАКТАМАЗ ПАТОГЕННЫХ БУРКХОЛЬДЕРИЙ | 2011 |
|
RU2474614C1 |
| ДНК-МИКРОЧИП ДЛЯ ИДЕНТИФИКАЦИИ ГЕНОВ БЕТА-ЛАКТАМАЗ РАСШИРЕННОГО СПЕКТРА ДЕЙСТВИЯ КЛАССА А | 2009 |
|
RU2415937C1 |
| БЕТА-ЛАКТАМАЗА, СПОСОБ ЕЕ МОДИФИКАЦИИ, ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2011 |
|
RU2570551C2 |
| СПОСОБ АНАЛИЗА ГЕНЕТИЧЕСКОГО ПОЛИМОРФИЗМА ДЛЯ ПРОВЕДЕНИЯ ПОСТНАТАЛЬНОЙ ДНК-ДИАГНОСТИКИ МУКОВИСЦИДОЗА | 2008 |
|
RU2412247C2 |
| Штамм бактерий Klebsiella pneumoniae, используемый в качестве тест-культуры при детекции гена NDM методом полимеразной цепной реакции для точной диагностики и назначения антибактериальной терапии клебсиелёзных инфекций | 2022 |
|
RU2797025C1 |
| Способ получения препарата рибонуклеопротеинового комплекса CRISPR-Cas и препарат для выявления гена антибиотикоустойчивости bla-OXA-1 в ультранизких концентрациях | 2024 |
|
RU2839763C1 |
| Набор CRISPR-Cas12 для выявления гена антибиотикоустойчивости bla-OXA-1 в ультранизких концентрациях (варианты) | 2024 |
|
RU2839486C1 |



Изобретение относится к биохимии, в частности к способу идентификации генов клинически значимых семейств β-лактамаз у грамотрицательных микроорганизмов, например, у различных штаммов Acinetobacter baumannii, Pseudomonas aeruginosa, Klebsiella pneumoniae, Burkholderia spp., Enterobacter spp., Stenotrophomonas maltophilia, Elizabethkingia meningoseptica, Serratia marcescens. Способ осуществляют путём амплификации фрагментов генов с помощью полимеразной цепной реакции с набором специфических олигонуклеотидных праймеров и последующим разделением продуктов реакции путём электрофореза в агарозном геле. С помощью указанного способа идентифицируют гены следующих семейств β-лактамаз SHV, СТХ-М, VIM, IMP, NDM, ОХА, KPC, GES, GIM и SPM. Настоящее изобретение позволяет увеличить арсенал средств для идентификации генов семейств β-лактамаз SHV, СТХ-М, VIM, IMP, NDM, ОХА, KPC, GES, GIM и SPM. 4 табл., 2 пр.
Способ идентификации генов клинически значимых семейств β-лактамаз SHV, СТХ-М, VIM, IMP, NDM, ОХА, KPC, GES, GIM, SPM у грамотрицательных микроорганизмов путем амплификации фрагментов генов с помощью полимеразной цепной реакции с набором специфических олигонуклеотидных праймеров и последующим разделением продуктов реакции путем электрофореза в агарозном геле и отличающися тем, что набор специфичных олигонуклеотидных праймеров представлен: тремя парами олигонуклеотидных праймеров для амлификации генов семейства СТХ-М с нуклеотидными последовательностями cttctgacgctgggtcttgc, gatatcgttggtggtgatata, attctgacgctgggtcttgc, tatatcgttggtggtgatata, atactgacgctgggtctagc, tatgtcgtaggtggtgatgta, тремя парами олигонуклеотидных праймеров для амлификации генов семейства GES с нуклеотидными последовательностями tatatccggtgtgatcgt, atgatgcttgcccctgct, catatccggtgtgatcgt, ttgatgcttgcccctgct, catgtccggtgtgatcgt, tagatgctagcccctgct, тремя парами олигонуклеотидных праймеров для амлификации генов семейства GIM с нуклеотидными последовательностями ccttggttatggcttgcat, ggttggccatggctttat, acttggttatggcttgcat, cgttggccatggctttat, actaggtaatggctagcgt, cgtaggccgtggctatat, одиннадцатью парами олигонуклеотидных праймеров для амлификации генов семейства IMP с нуклеотидными последовательностями cttcgtttgargctgttctcgg, attctgatactctattatrat, gttcatacwtcgtttgctgctgtt, tgtgctttctgatactctattat, cgtttgctgctgttcttggttgg, tctattattgatgtactgt, tttgttgcattactgatgc, gtctatggtgtgtctctytgattgg, gtcgtttgargctgttctcgg, gttctgatactctattatrat, tttcatacwtcgtttgctgctgtt, agtgctttctgatactctattat, ggtttgctgctgttcttggttgg, actattattgatgtactgt, attgttgcattactgatgc, atctatggtgtgtctctytgattgg, gtcgtatgargctgtactcgg, gtactgatgctctataatrat, tatcgtacwtcgtatgctgctgta, agtgctatctgatgctctataat, ggtatgctgctgtactaggtagg, actataatagatgtactgt, тремя парами олигонуклеотидных праймеров для амлификации генов семейства KPC с нуклеотидными последовательностями cgatcctacgttatgtctg, cttttgatcctccccccactgc, ggatcctacgttatgtctg, tttttgatcctccccccactgc, ggatcctacgtaatgtctg, tatatgatcctccccccgctgc, тремя парами олигонуклеотидных праймеров для амлификации генов семейства NDM с нуклеотидными последовательностями atttgatgctgcattgat, atggcatgtcgtgattgg, gtttgatgctgcattgat, gtggcatgtcgtgattgg, gtatgatgctgcgtagat, gtggcgtgtcgtgatagg, двенадцатью парами олигонуклеотидных праймеров для амлификации генов семейства ОХА с нуклеотидными последовательностями ccggacatcctctggtgattcat, cgatctgggcattctctat, tgcacatctatgattctttt, cttctattctttgtggtg, ctcgcttttgatcgatct, cttgctgatttgctatgt, tgctctgtgctttgctctg, tgctcttctggtttctctggca, acggacatcctctggtgattcat, tgatctgggcattctctat, agcacatctatgattctttt, tttctattctttgtggtg, ttcgcttttgatcgatct, acttgctgatttgctatgt, ggctctgtgctttgctctg, cgctcttctggtttctctggca, acggacgtcctctggtgatacgt, tgatctgggcgtactctat, agcgcgtctatgatactata, tatctatactatgtggtg, tacgctatagatcgatct, actagctgatatgctatgt, ggctctgtgctatgctctg, cgctctactggtatctctggcg, тремя парами олигонуклеотидных праймеров для амлификации генов семейства SHV с нуклеотидными последовательностями atgatccgcctggtgctg, ttgattgtgctcgatctg, ctgatccgcctggtgctg, gtgattgtgctcgatctg, ctgatccgcctggtgctg, gtgatagtgctcgatctg, тремя парами олигонуклеотидных праймеров для амлификации генов семейства SPM с нуклеотидными последовательностями tgtcgacttgatctaccc, attgattttcccacggcga, agtcgacttgatctaccc, cttgattttcccacggcga, agtcgactagatctaccc, ctagatatacccgcggcga, тремя парами олигонуклеотидных праймеров для амлификации генов семейства ТЕМ с нуклеотидными последовательностями cgttttatcctgatgtgcactt, tgatgcttttctgtgactgg, ggttttatcctgatgtgcactt, agatgcttttctgtgactgg, ggtataatcctgatgtgcgcta, agatgctatactgtgactgg, тремя парами олигонуклеотидных праймеров для амлификации генов семейства VIM с нуклеотидными последовательностями tgtctatacgcactttcatg, cgatgtgtgyatttcttgtga, agtctatacgcactttcatg, agatgtgtgyatttcttgtga, agtctatgcgcgctatcgtg, agatgtgtgyatatctagtga.
| СПОСОБ ИДЕНТИФИКАЦИИ ГЕНОВ БЕТА-ЛАКТАМАЗ РАСШИРЕННОГО СПЕКТРА ДЕЙСТВИЯ КЛАССА А | 2009 |
|
RU2415932C1 |
| РУБЦОВА М.Ю., и др., Мультипараметрическое определение генов и точечных мутаций в них для идентификации бета-лактамаз, Успехи биологической химии, 2010, т.50, с.303-348 | |||
| ШЕВЧЕНКО О.В., и др., Металло-β-лактамазы: значение и методы выявления у грамотрицательных неферментирующих бактерий, Клин | |||
| микробиол | |||
| антимикроб | |||
| химиотер., 2007, том 9, No.3, с.211-218 | |||
| WO 2011138402 А1, 10.11.2011. | |||
Авторы
Даты
2017-01-23—Публикация
2015-12-21—Подача