Изобретение относится к области молекулярной биологии, химической энзимологии и аналитической биотехнологии и может быть использовано в клинических микробиологических лабораториях и службах эпидемиологического контроля для выявления устойчивости возбудителей инфекционных заболеваний семейства Enterobacteriaceae к антибиотикам группы пенициллинов и цефалоспоринов по наличию генов бета-лактамаз и мутаций в них. Изобретение представляет собой способ проведения гибридизационного анализа на ДНК-микрочипе с иммобилизованными специфическими олигонуклеотидами для одновременного выявления трех типов генов бета-лактамаз класса А (ТЕМ, SHV и СТХ-М) и точечных мутаций в них, приводящих к изменению субстратной специфичности данных ферментов.
Более половины всех используемых в настоящее время антибиотиков составляют бета-лактамные антибиотики, среди которых наиболее широко используются антибиотики группы пенициллинов и цефалоспоринов, особенно при лечении широкого круга тяжелых инфекций, вызываемых грамотрицательными микроорганизмами семейства Enterobacteriaceae. Основным фактором, ограничивающим их клиническую эффективность, является способность микроорганизмов вырабатывать устойчивость к их действию - антибиотикорезистентность. Известно несколько механизмов резистентности микроорганизмов к пенициллинам и цефалоспоринам, однако основным из них является ферментативный гидролиз ферментами бета-лактамазами, образующимися в клеточной стенке [Paterson D.L. et al. Extended-spectrum beta-lactamases: a clinical update. Clin Microbiol Rev., 2005, 18, стр.657-686]. Бета-лактамазы представляют обширную группу генетически и функционально различных ферментов, отличающихся способностью разрушать бета-лактамное кольцо, в результате чего антибиотик теряет свою антимикробную активность. Из всего разнообразия бета-лактамаз наибольшую угрозу представляют бета-лактамазы расширенного спектра (БЛРС), вызывающие резистентность у изначально чувствительных микроорганизмов семейства Enterobacteriaceae [Perez F. et al. The continuing challenge of ESBLs. Curr Opin Pharmacol. 2000, 7, 459-469]. Благодаря плазмидной локализации генов распространение этих ферментов среди возбудителей инфекционных болезней человека, прежде всего инфекций, увеличивается с каждым годом. В отдельных лечебных учреждениях РФ частота продукции БЛРС среди некоторых микроорганизмов превышает 90%. Наиболее известными и распространенными типами БЛРС являются ТЕМ, SHV и СТХ-М.
Все описанные ферменты ТЕМ типа являются вариантами бета-лактамазы ТЕМ-1 и отличаются от исходного фермента единичными аминокислотными заменами (от одной до семи). Ключевыми для расширения спектра субстратной специфичности являются мутации в положениях 104, 164, 238 и 240.
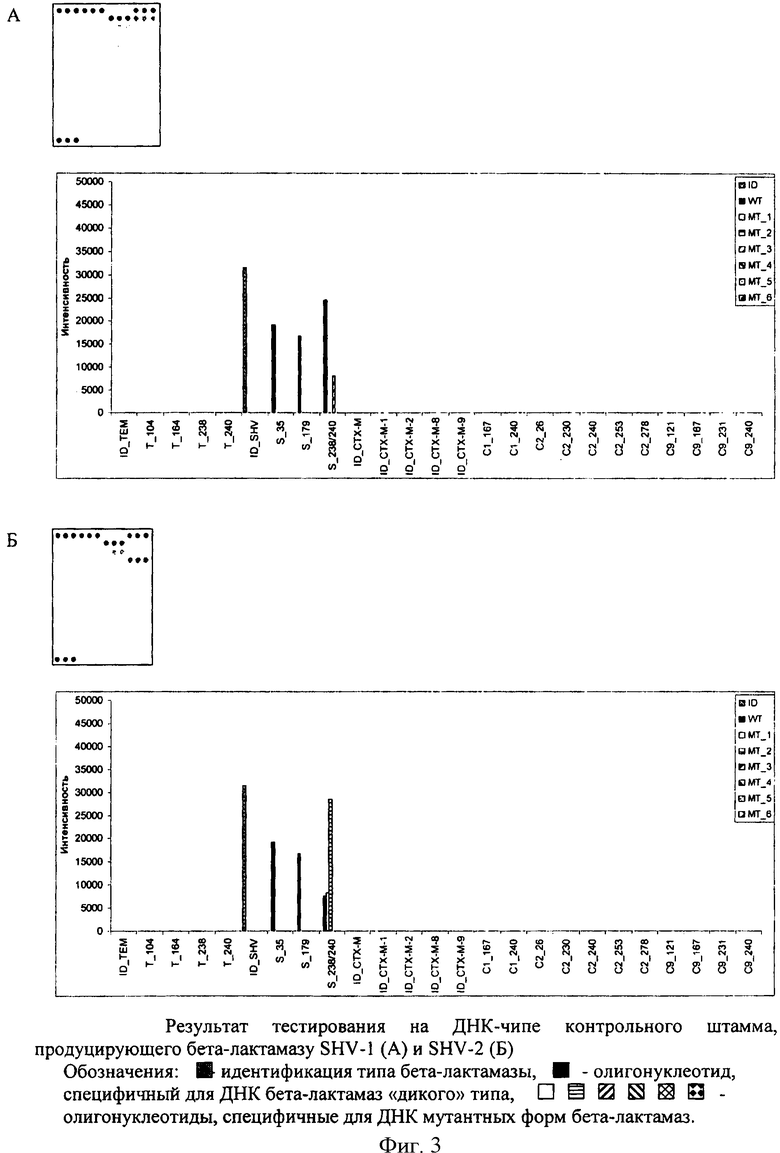
Ферменты SHV типа являются производными бета-лактамазы SHV-1 и отличаются от него наличием точечных мутаций. Ключевыми для изменения профиля субстратной специфичности являются мутации в положениях 35, 238 и 240.
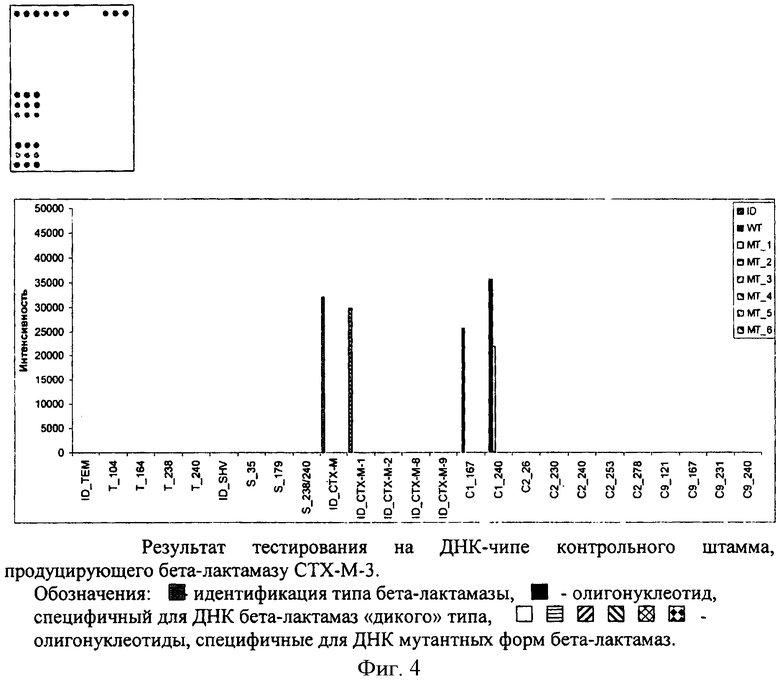
В последнее время во многих странах мира, в том числе и в РФ, отмечается стремительное распространение БЛРС СТХ-М типа [Edelstein M., Pimkin M., Palagin I., Edelstein I., Stratchounski L. Prevalence and molecular epidemiology of СТХ-М extended-spectrum beta-lactamase-producing Escherichia coli and Klebsiella pneumoniae in Russian hospitals. Antimicrob. Agents Chemother. 2003, 47, 3724-3732]. На основании гомологии аминокислотных последовательностей эти ферменты разделяются на 4 филогенетические группы (субкластеры). Расширение спектра их субстратной специфичности также связано с возникновением единичных мутаций. Ключевыми мутациями, определяющими спектр субстратной специфичности в отношении цефалоспоринов, являются мутации в положениях 167 и 240. Мутации в положениях 26, 230, 253, 278 для субкластера СТХ-М-2, в положениях 121, 231 для субкластера СТХ-М-9 важны для распознавания ферментов СТХ-М типа, распространенных в различных странах, в том числе и в России.
Стандартные клинические методы определения природы патогенов, вызывающих инфекционные заболевания, и определения устойчивости к антибиотикам основаны на фенотипической характеристике микроорганизмов-возбудителей. Эти методы достаточно длительны по времени, трактовка данных чувствительности штаммов к антибиотикам может быть неоднозначной. Традиционные микробиологические методы детекции БЛРС в лучшем случае позволяют оценить факт наличия фермента, однако они не могут дать информации о том, какой именно из ферментов присутствует, при этом ни один из традиционных микробиологических методов не обеспечивает детекцию БЛРС у 100% штаммов. Критерии чувствительности грамотрицательных микроорганизмов к цефалоспоринам III поколения Национальный комитет по клиническим лабораторным стандартам США (National Committee for Clinical Laboratory Standards, NCCLS) установил только для Е. coli и Klebsiella spp. В то же время продукция БЛРС описана практически у всех представителей семейства Enterobacteriaceae и ряда других грамотрицательных микроорганизмов.
Молекулярно-генетические методы позволяют более точно и полно определить и охарактеризовать гены, отвечающие за развитие резистентности. Быстрым и экономичным методом детекции БЛРС является амплификация генов-мишеней в ПЦР. Описан метод мультипраймерной ПЦР для идентификации генов бета-лактамаз SHV, ТЕМ и СТХ-М типов [Monstein H.J. et al. Multiplex PCR amplification assay for the detection of blaSHV, blaTEM and blаСТХ-М genes in Enterobacteriaceae. APMIS, 2007, 115, 1400-1408]. В результате мультипраймерной ПЦР амплифицируются фрагменты генов бета-лактамаз SHV, ТЕМ и СТХ-М типов, на основании размеров которых производится идентификация типа гена. Дифференцировать гены внутри указанных групп данным методом не представляется возможным, и необходимо дальнейшее исследование генов с целью выявления возможных мутаций, определяющих расширенный спектр активности.
Перспективным методом идентификации генов являются методы генотипирования на микрочипах. Технологии, развиваемые с использованием биологических микрочипов, в настоящее время активно развиваются в мире для выявления и идентификации биологического материала [Heller M.J. DNA microarray technology: devices, systems, and applications. Annu Rev Biomed Eng. 2002, 4, 129-53]. ДНК-микрочипы представляют собой подложку из стекла, кремния, пористых мембранных материалов, полимерных носителей, на которую нанесены в виде матрицы фрагменты ДНК, синтетические олигонуклеотиды, белки или иные молекулы-зонды, которые могут проявлять биологическую активность. ДНК-микрочипы для идентификации генов и мутаций в них основаны на гибридизации исследуемой нуклеотидной последовательности с расположенными в определенном порядке известными олигонуклеотидами или ДНК-последовательностями, иммобилизованными на поверхности микрочипа. Технология ДНК-чипов позволяет осуществлять многопараметрический анализ и проводить идентификацию патогена и его устойчивости к антибиотикам на молекулярном уровне. Данная технология является более информативной и имеет значительные преимущества перед традиционными молекулярно-биологическими методами, т.к. позволяет миниатюризировать исследуемый образец и анализатор, что значительно снижает стоимость анализа и время его проведения, а также одновременно определять различные параметры исследуемого образца.
Описан ДНК-макрочип на основе мембранного носителя для идентификации генов бета-лактамаз СТХ-М типа и отдельных мутаций в них методом гибридизационного анализа [Ensor V.M. et al. A novel reverse-line hybridization assay for identifying genotypes of CTX-M-type extended-spectrum β-lactamases. J. Antimicrob. Chemotherapy, 2007, 59, 387-395]. Недостатком данного подхода является «макро»формат чипа, в процессе полимеразной цепной реакции амплифицируются фрагменты генов бета-лактамаз СТХ-М типа, в результате возможно определить только ограниченное число мутаций. Условия определения мутаций в генах, относящихся к разным субкластерам бета-лактамаз СТХ-М типа, различаются, поэтому определение проводится на разных типах чипов, что затрудняет использование метода в эпидемиологических исследованиях.
Наиболее близким к заявляемому является способ гибридизационного анализа на ДНК-микрочипах с флуоресцентной детекцией для идентификации гена бета-лактамаз ТЕМ типа и мутаций в них [European Patent 1580281 A2, date of publication 28.09.2005, Bulletin 2005/39]. В данном способе проводили выбор последовательностей олигонуклеотидов, идентичных структуре гена бета-лактамазы ТЕМ типа, и иммобилизовали их на поверхности микрочипов из стекла. Метод гибридизационного анализа включал следующие стадии: выделение ДНК из образца, амплификацию специфического гена бета-лактамазы ТЕМ типа с одновременным введением флуоресцентной метки Су5, фрагментацию ДНК с помощью ДНКазы, гибридизацию меченой ДНК с иммобилизованными олигонуклеотидами, детекцию результатов гибридизации по активности флуоресцентной метки.
Задачей данного изобретения является разработка способа одновременного высокоспецифичного определения основных типов генов бета-лактамаз класса А (ТЕМ, SHV и СТХ-М) и точечных мутаций в них, вызывающих устойчивость микроорганизмов-возбудителей инфекционных заболеваний к пенициллинам и цефалоспоринам. Для этого предлагается использовать ДНК-микрочип с иммобилизованными специфическими олигонуклеотидами и реакцию мультипраймерной полимеразной цепной реакции для одновременной амплификации генов бета-лактамаз указанных типов. В процессе ПЦР в гены бета-лактамаз вводится метка - биотин. Биотин выявляется на поверхности микрочипа с помощью высокоспецифического взаимодействия биотина со стрептавидином в составе ковалентного конъюгата с пероксидазой хрена, которую затем выявляют колориметрически по накоплению нерастворимого окрашенного продукта ферментативной реакции, адсорбирующегося на поверхности микрочипа. Для количественной детекции результата гибридизации на чипе возможно применение оптических сканеров высокого разрешения.
Специфические олигонуклеотиды и контрольные олигонуклеотиды иммобилизуются одновременно в виде матрицы на поверхности микрочипа из нерастворимого носителя, в качестве которого может быть использовано стекло, пористые мембранные носители и другие материалы. Общий вид ДНК-чипа и расположение специфических олигонуклеотидов на нем изображены на фиг.1. Каждый олигонуклеотид наносят в виде трех пятен, расположенных по горизонтальной линии. Размер пятен определяется параметрами используемого оборудования и принципа нанесения. Контроли иммобилизации и гибридизации наносят на линии, ограничивающие микрочип сверху и снизу либо справа и слева. Олигонуклеотиды для выявления одной точечной мутации располагают в виде двух линий, каждая из трех точек, друг под другом. Число линий для определения одной мутации увеличивается, если имеется несколько вариантов полиморфизма гена в исследуемом участке. В качестве специфических олигонуклеотидов для идентификации генов бета-лактамаз СТХ-М типа и выявления положений мутации 238/240 в генах бета-лактамаз SHV типа используют смесь двух олигонуклеотидов в соотношении 1:1 (смесь олигонуклеотидов 30 и 31 для идентификации генов бета-лактамаз СТХ-М типа, смесь олигонуклеотидов 20 и 21 для положения, соответствующего ферменту «дикого» типа SHV-1, смесь олигонуклеотидов 22 и 23 и смесь олигонуклеотидов 28 и 29 для мутантов S_238/240_MT_1 и S_238/240_MT_6 соответственно).
Способ проведения гибридизационного анализа включает следующие стадии:
а) стадию выделения ДНК из клинического образца;
б) стадию одновременной амплификации генов бета-лактамаз ТЕМ, SHV и СТХ-М типов методом мультиплексной полимеразной цепной реакции с введением метки - биотина;
в) стадию фрагментации меченой ДНК с помощью ДНКазы;
г) стадию гибридизации меченой ДНК с иммобилизованными на ДНК-микрочипе олигонуклеотидами;
д) стадию детекции метки биотина, состоящую из инкубации микрочипа с конъюгатом стрептавидин-ПХ с последующей колориметрической детекцией ПХ.
В результате проведения гибридизационного анализа образцов ДНК, выделенных из клинических образцов возбудителей, на микрочипе с иммобилизованным набором олигонуклеотидов достигается следующий технический результат:
1) специфическая амплификация полноразмерных генов бета-лактамаз различных типов в одной мультиплексной ПЦР с одновременным введением биотина в качестве метки,
2) высокоспецифичное одновременное определение генов бета-лактамаз ТЕМ, SHV и СТХ-М типов и ключевых мутаций в них. Использование биотина в качестве метки позволяет обеспечить более высокую специфичность определения точечных мутаций вследствие небольшого размера молекулы и меньшего влияния на конформацию полинуклеотидной цепи по сравнению с флуоресцентными метками.
Принцип проведения габридизационного анализа на ДНК-микрочипе позволяет расширять состав олигонуклеотидов и добавлять специфические нуклеотиды для идентификации других мутаций в генах бета-лактамаз ТЕМ, SHV и СТХ-М типов либо для идентификации бета-лактамаз других типов при сохранении способа проведения анализа.
Предлагаемый способ является простым и надежным, в нем не используются дорогостоящие реагенты и оборудование.
Перечень сокращений:
БЛРС - бета-лактамазы расширенного спектра
ПХ - пероксидаза хрена
ПЦР - полимеразная цепная реакция
Примеры, подтверждающие возможность осуществления изобретения
Приведенные далее примеры предназначены лишь для подтверждения возможности осуществления изобретения и не ограничивают объем защиты изобретения.
Пример 1
Идентификация гена бета-лактамаз ТЕМ типа и определение точечных мутаций методом гибридизационного анализа на ДНК-микрочипе с колориметрической детекцией
На поверхности микрочипа из нитроцеллюлозы ковалентно иммобилизовали олигонуклеотиды по схеме, представленной на фиг.1, из растворов с концентрацией 20 мкМ в солевом буфере (160 мМ Na2SO4, 130 мМ Na2HPO4) нанесением на микрочип зон в виде пятен с диаметром от 50 до 350 мкм с помощью миниплоттера «Xact Arrayer» (LabNEXT Inc, США), затем инкубировали в течение 30 мин при 60°С. Микрочип отмывали 5 мин в 0,1% TritonX-100, 4 мин в 0,05% растворе НCl, 10 мин в 100 мМ KCl при постоянном встряхивании на горизонтальном шейкере при комнатной температуре. После этого микрочип отмывали 5 мин в в буфере ФБС (0,01 М KH2PO4, 0,15 М NaCl, pH 7.0) и инкубировали в 1% растворе БСА в том же буфере при 37°С в течение 30 мин для блокирования свободных центров связывания белков на поверхности микрочипа.
Для выделения ДНК исследуемые образцы энтеробактерий рассевались до отдельных колоний на чашки с агаром. Чашки инкубировали в термостате при 37°С в течение 12-15 часов. Затем 2-3 одинаковые колонии (1/2 петли) переносили с помощью стерильной 1-мкл петли в 0,5-мл центрифужную пробирку с 400 мкл стерильной деионизированной воды, суспендировали и микробные клетки осаждали центрифугированием в течение 2 мин при 7000 g. Затем удаляли надосадочную жидкость и ресуспендировали осадок в 100 мкл ТЕ буфера (10 mM Трис-HCl, 1 mM ЭДТА, рН 7.5). Инкубировали пробирки на водяной бане при 99°С в течение 20 мин. Встряхивали и центрифугировали пробирку при 7000 g в течение 3 мин, далее для ПЦР использовали супернатант.
Амплификацию методом ПЦР проводили в пробирках на 0,5 мл в объеме 25 мкл. В состав реакционной смеси входили: 1×Taq ДНК полимеразный буфер (2,5 мМ ацетата магния, 50 мМ KCl, 10 мМ Трис-HCl, рН 8.3), 2,5 ед. Taq ДНК-полимераза, 100 мкМ dATP, dGTP, dCTP, 60 мкМ dTTP, 40 мкМ dUTP-биотин, по 0,4 мкМ смеси прямых праймеров (5'-ATGAGTATTCAACATTTCCGTGTCG-3', 5'-TTATATTCGCCTGTGTATTATCTC-3', 5'-ATGGTTAAAAAATCACTGCGCCAG-3', 5'-ATGATGACTCAGAGCATTCGCC-3', 5'-GGTGACAAAGAGAGTGCAACGG-3') и обратных праймеров (5'-CTTAATCAGTGAGGCACCTATCTC-3', 5'-GTTAGCGTTGCCAGTGCTCG-3', 5'-CCGTCGGTGACGATTTTAGCCG-3', 5'-CCGTGGGTTACGATTTTCGCCG-3', 5'-CCCTTCGGCGATGATTCTCGC-3') и 5 мкл раствора образца ДНК. Амплификацию проводили в амплификаторе Mastercycler gradient (Eppendorf, Германия) по следующему протоколу: денатурация в течение 2 мин при 94°С, затем 30 циклов амплификации (20 сек денатурация при 94°С, 30 сек отжиг праймеров при 65°С, 45 сек элонгации при 72°С), затем 8 мин финальная элонгация при 72°С.
Для фрагментации амплифицированный ген бета-лактамазы растворяли в концентрации 30 нг/мкл в реакционном буфере (40 мМ Трис-НCl, 10 мМ MgSO4, 1 мМ CaCl2, рН 8.0) и добавляли ДНКазу в концентрации 0,2 мU/нг ДНК. Фрагментацию проводили при комнатной температуре в течение 5 мин. Реакцию останавливали, добавляя 3 мМ ЭДТА и инкубируя 10 мин в термостате при 65°С.
Для гибридизации 500 нг фрагментированной меченой ДНК растворяли в 400 мкл гибридизационном буфере (2×SSPE (0,8 М NaCl, 50 мМ NaH2PO4, 5 мМ ЭДТА), рН 7.7, содержащем 0,2% додецилсульфата натрия). Гибридизационную смесь наносили на ДНК-микрочип и инкубировали в течение 2 часов при температуре 45°С. После гибридизации проводили отмывку микрочипа в три стадии: 1) 2×SSC (0,3 М NaCl, 0,03 М цитрат натрия, содержащем 0,1% SDS, 2) 2×SSC и 3) 0,2×SSC, каждая стадия по 10 мин при комнатной температуре. Затем микрочипы инкубировали в растворе конъюгата стрептавидин-пероксидаза (разведение 1/1000) в ФБСТ (0,01 М KH2PO4, 0,15 М NaCl, 0,05% Tween20 pH 7.0), содержащем 1% БСА, в течение 1 часа при комнатной температуре при встряхивании на горизонтальном шейкере. После инкубации микрочипы отмывали (2 раза по 5 мин в ФБСТ, 1 раз - 5 мин в ФБС (0,01 М KH2PO4, 0,15 М NaCl, pH 7.0)) и помещали в субстратный раствор, содержащий 9,5 мл 0,1 М ацетатного буфера pH 5.5, 0,75 мл раствора 3,3',5,5'-тетраметилбензидина (6,3 мг/мл диметилсульфоксида), 1,5 мл 5% декстран сульфата натрия и 0,075 мл 0,2 М пероксида водорода, на 10 мин при комнатной температуре. После окрашивания микрочипы промывали дистиллированной водой и сушили на воздухе. Далее микрочипы сканировали на оптическом сканере Perfection V750 Pro (Epson) при разрешении 4800 dpi. Полученное изображение (в tiff формате) обрабатывали количественно с использованием программы Scan Array Express (PerkinElmer, version 3.0). Результаты представлены на фиг.2.
Пример 2
Идентификация гена бета-лактамаз SHV типа и определение точечных мутаций методом гибридизационного анализа на ДНК-микрочипе с колориметрической детекцией
Микрочип готовили, как описано в примере 1. Выделение ДНК из образца, амплификацию гена методом ПЦР, фрагментирование гена, гибридизацию на ДНК-микрочипе и детекцию проводили, как описано в примере 1.
Результаты представлены на фиг.3.
Пример 3
Идентификация гена бета-лактамаз СТХ-М типа и определение точечных мутаций методом гибридизационного анализа на ДНК-микрочипе с колориметрической детекцией
Микрочип готовили, как описано в примере 1. Выделение ДНК из образца, амплификацию гена методом ПЦР, фрагментирование гена, гибридизацию на ДНК-микрочипе и детекцию проводили, как описано в примере 1.
Результаты представлены на фиг.4.
Пример 4
Идентификация смеси трех генов бета-лактамаз ТЕМ, SHV и СТХ-М типов и определение точечных мутаций в них методом гибридизационного анализа на ДНК-микрочипе с колориметрической детекцией
Микрочип готовили, как описано в примере 1. Выделение ДНК из образца, амплификацию гена методом ПЦР, фрагментирование гена, гибридизацию на ДНК-микрочипе и детекцию проводили, как описано в примере 1.
Результаты представлены на фиг.5.
В табл. 1 и 2 представлены олигонуклеотиды и типы праймеров.





Изобретение относится к области молекулярной биологии, химической энзимологии и аналитической биотехнологии. Определение гена и точечных мутаций в них определяется по результату гибридизации ДНК, меченной биотином в процессе мультипраймерной полимеразной цепной реакции, с иммобилизованными на микрочипе специфическими олигонуклеотидами. Биотин в дуплексах ДНК на микрочипе выявляется конъюгатом стрептавидин-пероксидаза хрена с последующей колориметрической детекцией пероксидазы. Изобретение может быть использовано в клинических микробиологических лабораториях и службах эпидемиологического контроля для выявления устойчивости возбудителей инфекционных заболеваний семейства Enterobacteriaceae к антибиотикам группы пенициллинов и цефалоспоринов по наличию мутаций в кодирующих генах. 5 ил., 2 табл.
Способ идентификации генов бета-лактамаз расширенного спектра действия класса А, предусматривающий выбор последовательностей олигонуклеотидов, идентичных структуре определяемого гена, одновременную иммобилизацию их на поверхности микрочипов, выделение ДНК из образца, амплификацию ДНК с одновременным введением метки, фрагментацию ДНК с помощью ДНКазы, гибридизацию меченой ДНК с иммобилизованными олигонуклеотидами с последующей детекцией метки, отличающийся тем, что в качестве специфических олигонуклеотидов для идентификации генов бета-лактамаз ТЕМ, SHV и СТХ-М типов и выявления точечных мутаций в них используются следующие олигонуклеотиды:
амплификацию ДНК проводят методом мультипраймерной ПЦР, при этом в качестве праймеров используют следующие: прямые 5'-ATGAGTATTCAACATTTCCGTGTCG-3', 5'-TTATATTCGCCTGTGTATTATCTC-3', 5'-ATGGTTAAAAAATCACTGCGCCAG-3', 5'-ATGATGACTCAGAGCATTCGCC-3', 5'-GGTGACAAAGAGAGTGCAACGG-3', обратные 5'-CTTAATCAGTGAGGCACCTATCTC-3', 5'-GTTAGCGTTGCCAGTGCTCG-3', 5'-CCGTCGGTGACGATTTTAGCCG-3', 5'-CCGTGGGTTACGATTTTCGCCG-3,5'-CCCTTCGGCGATGATTCTCGC-3'; в качестве метки ДНК используют биотин, детекцию которого проводят колориметрически с использованием конъюгата стрептавидин-пероксидаза хрена.
| Измеритель разности фаз | 1988 |
|
SU1580281A1 |
| Уляшова М.М., Рубцова М.Ю., Егоров A.M | |||
| Метод гибридизационного анализа на ДНК-микрочипах с колориметрической детекцией для определения точечных мутаций в генах, выставка инновационных проектов, МГУ им | |||
| М.В.Ломоносова, химический факультет, сборник тезисов | |||
| - М., 2008, с.34 | |||
| Ling-Xiang Zhu et al | |||
| Multiplex Asymmetric | |||
Авторы
Даты
2011-04-10—Публикация
2009-10-23—Подача