Изобретение относится к области медицины, в частности, к диагностическим системам на основе определения профиля экспрессии генов для оценки прогноза рецидива первичного рака молочной железы.
Уровень техники
В настоящее время разработано несколько диагностических систем на основе определения профиля экспрессии генов. Следует отметить, что только для двух из них (OncotypeDX и MammaPrint) доступны данные как по исследованиям прогностической точности и воспроизводимости методик, так и по эффективности клинического использования.
Первая относится к системе определения профиля экспрессии генов на основе ОТ-ПЦР (OncotypeDX), вторая (MammaPrint) - к системе определения профиля экспрессии генов на основе технологии микрочипов.
OncotypeDX™ была разработана Genomic Health, Inc., USA. Следует отметить, что на сегодняшний день это единственная тест-система, клиническое использование которой одобрено экспертами FDA США и StGallen. По данным исследования National Surgical Adjuvant Breast and Bowel Project (NSABP) В14 риск отдаленного метастазирования в течение 10 лет, оцениваемый по OncotypeDX™, составляет 6,8% (4-10%), 14.3% (8-20%) и 30.5% (24-37%) для групп низкого, умеренного и высокого риска, соответственно (р<0.001). В исследовании NSABP В20 продемонстрировано, что пациенты из группы высокого риска демонстрируют большую эффективность адъювантной химиотерапии CAF, чем больные группы низкого риска. 10-летняя выживаемость без отдаленных метастазов у больных высокого риска увеличилась с 60 до 88%, тогда как эффективность XT в группе низкого риска осталась недоказанной.
Основной технической задачей данной тест-системы является определение профиля экспрессии 21 гена методом ОТ-ПЦР в ткани опухоли у больных раком молочной железы с целью определения риска появления отдаленных метастазов в течение 10 лет у больных всех возрастных категорий, с впервые диагностированным РМЖ I, II стадии, ЕР+, N0, получающих гормонотерапию Тамоксифеном. Методика ОТ ПЦР признана наиболее точной при работе с низкими концентрациями исследуемого материала. Большим преимуществом метода является возможность использования, как свежезамороженной ткани, так и парафиновых блоков в качестве источника РНК.
Основой для создания профиля экспрессии послужили 3 исследования с участием 447 пациентов и выборкой 250 генов. Окончательный отбор 16 генов был произведен на основании статистической силы вклада каждого из них во всех трех исследованиях. Коэффициент рецидива, обозначенный в пределах 0-100, был разбит на 3 интервала в границах 0-18 (низкий риск), 19-30 (умеренный риск), больше 31 (высокий риск). Данные границы были выбраны на основании результатов исследования NSABPB-20. Ниже представлены основные характеристики платформы OncotypeDX™.


Определение профиля экспрессии (22 гена) для прогнозирования 10-летней безрецидивной выживаемости (речь идет исключительно об отдаленных метастазах) проводилось с помощью анализа регрессии Кокса. Гены были разделены на несколько кластеров в зависимости от функции, коэкспрессии или обоих критериев [199]. Экспрессия кластера генов «рецепторов эстрогена» ассоциировалась с благоприятным прогнозом, а кластеров «пролиферации» и EGF - с отрицательным, при этом корреляция экспрессии HER2 и GRB7 составляла 0,82. Отдельно был выделен «макрофаговый кластер» (GSTM1, CD68, BAG1) как фактор отрицательного прогноза. Это было сделано в связи с появлением информации о том, что злокачественные клетки стимулируют синтез различных факторов роста, ангиогенеза и матриксных протеаз макрофагами, что способствует злокачественной прогрессии.
Расчет коэффициента рецидивирования, предложенный разработчиками, проводится по определенному алгоритму. Экспрессия каждого гена нормализуется относительно пяти референтных генов. Далее производится подсчет индивидуальных значений экспрессии кластеров генов:

Немасштабированный коэффициент рецидива (unsealed recurrence score - RSU) рассчитывают с использованием коэффициентов, полученных в исследованиях:


И наконец, полученные значения масштабируются по шкале риска рецидива от 0 до 100:

Оценка прогностической точности и воспроизводимости методики OncotypeDX.
В настоящее время проведено достаточно большое количество исследований клинической валидности OncotypeDX™, доказательства которой были получены в двух исследованиях Croninetal, 2004, и Croninetal. 2007, и нескольких клинических наблюдениях. Данные по эффективности были опубликованы в 9 исследованиях (Chang, 2007, Cobliegh, 2005, Esteva, 2005, Gianni, 2005, Habel, 2006, Mina, 2006, Oratz, Paik, 2004, и Paik, 2006). Коэффициент эффективности варьировал от 78,9 до 98,9.
Данные по валидации и воспроизводимости теста были опубликованы в трех исследованиях. В них оценивалась вариабельность результатов при повторных исследованиях одного или разных парафиновых образцов, через одинаковые интервалы времени, с использованием одного или нескольких наборов инструментов, одним или разными операторами. Результаты исследований подтвердили высокую воспроизводимость как самого профиля экспрессии, так алгоритма расчетов коэффициента рецидивирования. В целом стандартное отклонение колебалось в пределах 3 единиц RS, хотя авторы не обсуждают его влияния на стратификацию риска.
И наконец, 8 исследований были посвящены сравнению профиля экспрессии отдельных генов (ER, PR, HER2) со значениями, полученными при иммуногистохимическом исследовании. Корреляция RE по данным ИГХ и RT-ПЦР была высокой (0.8-1.0), в одном исследовании [96] корреляция была низкой (0,49), однако в нем сравнение ОТ-ПЦР проводилось с документальными данными ИГХ исследований.
На основании результатов вышеописанных исследований можно заключить, что существует достаточно доказательств хорошей воспроизводимости отдельных операционных процедур, чего нельзя сказать о диагностической системе в целом. Воспроизводимость различных срезов одного образца и разных образцов достаточно высокая. Отсутствуют сведения о влиянии качества подготовки образца на результаты исследования.
Клиническая эффективность. В 4 исследованиях были опубликованы предварительные результаты клинической эффективности OncotypeDX™. PaikS, (2006), используя образцы ткани и данные исследования NSABP-20, оценивал роль RS при прогнозировании эффективности адъювантной ПХТ у больных РМЖ ER+, N0. В группу была включена 651 женщина (227 после рандомизации получали Тамоксифен, 424 - Тамоксифен+ХТ). Пациенты с высоким риском рецидивирования (RS≥31) отличались высокой эффективностью XT (относительный риск, 0.26; 95% CI, 0.13-0.53; абсолютное повышение общей 10-летней выживаемости 27.6%; СКО, 8.0%). Пациенты с низким риском рецидивирования (RS≤18) отличались низкой эффективностью XT или отсутствием таковой (относительный риск, 1.31; 95% CI, 0.46-3.78; абсолютное повышение общей 10-летней выживаемости: -1.1%; СКО, 2.2%). У пациентов с умеренным риском рецидивирования не наблюдалось высокой эффективности XT, однако погрешности в оценке не позволяют исключить клиническую эффективность XT. В заключении авторы пришли к выводу, что RS способна не только квалифицировать риск появления отдаленных метастазов у больных ER+, N0, но и определить вероятный эффект XT.
Giannietal (2005) исследовали корреляцию RS с эффективностью химиотерапии. Авторы представили доказательства эффективности RS в отношении прогноза полного патологического ответа при проведении предоперационной XT по схеме паклитаксел + доксарубицин (р=0.005).
Mina et al., (2007), обнаружили клиническую неэффективность OncotypeDX™RS при прогнозировании полного патологического ответа на XT у больных с распространенным РМЖ. Goldsteinetal[170] применили 21-генную методику оценки OncotypeDX у 465 больных в клиническом испытании ECOG-2197, в котором проводилось сравнение эффективности двух режимов химиотерапии - АС (доксорубицин + циклофосфамид) и AT (доксорубицин + таксотер). При опухолях с одиночными регионарными метастазами (не более, чем в 3 лимфоузлах) и низким значением по шкале риска (менее 18) OncotypeDX в течение 5 лет наблюдения достоверно реже (менее чем у 10% больных) возникали местные рецидивы и отдаленные метастазы, чем у больных с аналогичной распространенность заболевания, но при более высоком значении по шкале риска рецидива. Эти результаты подтверждаются в клиническом испытании SWOG-8814, в которое было включено 367 пациенток с РЭ+ РМЖ, добавление химиотерапии по схеме FAC к гормонотерапии Тамоксифеном улучшало отдаленные результаты (показатели безрецидивной и общей выживаемости) только при высоком значении шкалы риска рецидива (более 30 по OncotypeDX), но не было выявлено преимуществ применения химиотерапии при промежуточном или низком значении риска. При сравнении эффективности аналогичной терапии в двух группах больных - с одиночными регионарными метастазами (1-3 лимфоузла) и множественными метастазами (4 и более метастатических лимфоузла) не было выявлено каких-либо преимуществ от применения химиотерапии в обеих группах при значениях по шкале рецидивов ниже 30 (т.е. при промежуточном и низком риске рецидивов).
Недавно было опубликовано исследование, в котором была проведена сравнительная оценка прогностической эффективности OncotypeDX и Adjuvant!on-line при проведении адъювантной XT и ГТ у пациентов с ER+, N0 РМЖ. В работу были включены 668 пациенток из исследования NSABPB-14, получавших Тамоксифен, 227 пациенток из исследования NSABPB-20, получавших Тамоксифен, и 424 пациентки из исследования NSABPB-20, получавших как XT, так и Тамоксифен адъювантно. Данные Adjuvant!on-line были доступны по 1952 больным из исследования NSABPB-20. По результатам исследования RS (р<0.001) и Adjuvant! (р=0.002) независимо продемонстрировали высокую прогностическую точность. Комбинированный прогностический результат на основе результатов RS и клинико-патологических факторов обладал большей прогностической точностью, чем сочетание RS и Adjuvant!. В заключении авторы пришли к выводу, что комбинация RS с клинико-патологическими характеристиками РМЖ позволяет максимально оптимизировать прогноз.
В настоящее время проводится единственное рандомизированное исследование TAILORx (Trial Assigning Individualized Optionsfor Treatment (Rx). Поставлена задача определить группу больных, для которых монотерапия Тамоксифеном эффективна, а
также показания для назначения адъювантной XT. Результаты исследования позволят ответить на вопрос о преимуществах назначения химиотерапии в группе больных промежуточного риска по данным RS, значения для которых по группам были снижены.
MammaPrint®. Данный профиль экспрессии был создан для прогноза рецидива у больных без метастазов в регионарные лимфоузлы. Платформа представляет собой набор 70 генов, оценка экспрессии которых проводилась при выделении мРНК из свежего материала опухоли со следующим фенотипом: T1-2, N-0, ER+, ER-. В двух исследованиях была подтверждена прогностическая точность данного профиля: 96% вероятность безметастатической пяти- и 94% 10-летней выживаемости для группы благоприятного прогноза; 74% и 65% для группы неблагоприятного прогноза.
Сообщение о создании профиля экспрессии 70 прогностических генов было опубликовано LauraJ. van'tVeer в Nature в 2002 году. MammaPrint®, разработанный на основе этого исследования, внедрен в коммерческое производство Agendia, на базе которой выполняется коммерческое тестирование. Тест основан на определении профиля экспрессии 70 генов, описанного van'tVeer в 2002 году [193], и используется для определения прогноза рецидива РМЖ у больных ≤61 года с первично выявленным инвазивным РМЖ ЕР+, ЕР-, N0. Следует отметить, что материальной основой данной платформы является технология создания микрочипов, отличающаяся от используемой в OncotypeDX ОТ-ПЦР. Хотя последняя признана более точной в отношении определения экспрессии генов, технология микрочипов дает информацию по экспрессии значительно большего количества генов. Ниже представлены основные характеристики платформы MammaPrint®.
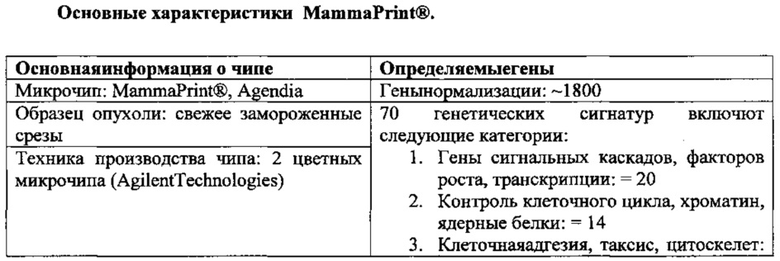

В данном профиле отражены все основные характеристики опухолевого процесса, такие как ингибирование апоптоза, отсутствие необходимости факторов роста, нечувствительности к сигналам ингибиторов роста, бесконечный репликативный потенциал, индукция ангиогенеза, инвазия и метастазирование.
Оценка прогностической точности и воспроизводимости методики.
Аналитическая валидность MammaPrint® изучалась в двух исследованиях. В исследовании Glasetal авторы проводили сравнительное исследование результатов, полученных в процессе создания коммерческого продукта MammaPrint® с результатами оригинального исследования vandeVijver, в которых методика продемонстрировала высокую воспроизводимость (коэффициент корреляции Пирсона=0.92, Р<0.0001). В исследовании Buyseetal автор представил доказательства общей аналитической валидности метода. Свежезамороженные блоки, собранные в пяти медицинских институтах, были направлены в лабораторию Agendia. Точность метода составила 80.9%. Achetal представили результаты исследования межлабораторной прецизионности. Выделение мРНК из материала четырех пациентов проводилось в 3 различных лабораториях, с целью определения вариабельности, возникающей вследствие ошибок на различных этапах методического процесса: амплификация и создание метки, гибридизация и отмывка, сканирование. Выделение и создание метки мРНК осуществлялось в двух различных лабораториях в Калифорнии и Амстердаме, далее лаборатории обменивались подложками для гибридизации и сканирования слайдов. Коэффициент корреляции Пирсона составил >0.995.
С целью определения клинической валидности были проведены следующие исследования: первым было опубликовано van'tVeeretal., в 2002 году, именно результаты
этого исследования легли в основу профиля MammaPrint®. Для выделения генов, экспрессия которых ассоциирована с безрецидивной 5-летней выживаемостью, был использован микрочип из 25000 позиций. В результате анализа было отобрано 70 генов-мишеней. В исследовании принимали участие 78 больных, из них у 34 появились отдаленные метастазы в течение пяти лет, а у 44 нет. С помощью созданной платформы больные были корректно распределены в группу высокого и низкого риска. 13 больных были классифицированы неверно. Согласно однофакторному анализу MammaPrint® обладал большей прогностической точностью по сравнению с классическими факторами прогноза и обладал независимой прогностической ценность относительно риска отдаленного метастазирования в течение пяти лет при мультифакторном анализе OR=18 (95% CI, 3.3-94).
Исследование vanderVijveretal в 2002 году [212] было первым масштабным валидационным исследованием данного профиля. В него были включены 252 больных с различным статусом поражения регионарных лимфоузлов, статусом рецепторов эстрогена, получавших различную адъювантную терапию (химиотерапию, Тамоксифен). Для оценки эффективности методики авторы опирались на данные безрецидивной и общей выживаемости. Важно отметить, что в исследуемую группу вошел 61 пациент из исследования van'tVeeretal 2002 года. Пациенты в группе были молодыми (моложе 52 лет), размер опухоли был небольшим (до 5 см). Результаты анализа профиля экспрессии коррелировали с размером опухоли, степенью злокачественности, положительным статусом ER, при этом следует отметить, что все ER+ пациенты попали в группу благоприятного прогноза. Пяти- и 10-летняя безрецидивная выживаемость (95% против 61%; 85% против 51%, соответственно) и общая 10-летняя выживаемость (95% против 55%) в этой группе была значительно выше, чем при неблагоприятном прогнозе по данным MammaPrint®. При мультифакторном анализе прогностический индекс, размер опухоли и химиотерапия были наиболее мощными прогностическими факторами в отношении развития отдаленных метастазов. При исключении из анализа ранее исследованных больных (61 пациент из исследования van'tVeeretal 2002) были получены аналогичные результаты. Авторы также продемонстрировали, что наибольшая прогностическая ценность достигается при совместном использовании классических критериев прогноза St. Gallen и профиля экспрессии 70 генов.
Клиническая эффективность. В исследовании Buyseetal., 2006 проведена сравнительная оценка прогностической эффективности Adjuvant Online, Nottingham Prognostic Index и St. Gallen моделей с профилем MammaPrint®. В исследовании принимали участие 402 пациентки моложе 60 лет, не получавших адъювантной XT, проходившие лечение в период 1980-1998. Результаты профиля экспрессии были получены для 302 больных из этой группы. В целом длительность наблюдения составила 13.6 лет, а отдаленное метастазирование наблюдалось в 25% случаев. Критериями для оценки эффективности прогноза были время до появления отдаленных метастазов, безрецидивная и общая выживаемость. Соотношения рисков в группах благоприятного неблагоприятного прогноза по критерию времени до появления отдаленных метастазов и общей выживаемости по данным MammaPrint® было статистически значимым при сравнении с прогностическими системами «группы контроля», AdjuvantOnline, NPI и St. Gallen, однако, была значительно ниже (в 1.5-2 раза) по сравнению с результатами других исследований. Вероятно это связано с большей медианой наблюдения по сравнению с группой vandeVijver.
Специфичность и чувствительность MammaPrint® была сравнима с Adjuvant Online в отношении пятилетней безрецидивной и десятилетней общей выживаемости. По данным ROC-анализа площади под кривой для MammaPrint® и AdjuvantOnline были сравнимы (0.68 против 0.66 для пятилетней выживаемости без отдаленных метастазов). Результаты исследования свидетельствуют о влиянии длительности наблюдения на прогностическую точность определения профиля экспрессии. Однако, поскольку в группу были включены больные моложе 60 лет, не получавшие адъювантной терапии, экстраполировать результаты на другие категории пациентов нельзя.
Исследование Glasetal, 2006 проводилось с целью дополнительной проверки результатов ранее проведенных исследований (van'tVeer и vandeVijver]). Для пересмотра были доступны 78 больных из группы van'tVeer и 148 больных без метастатического поражения регионарных лимфоузлов из группы vandeVijver. В исследовании были использованы различные референтные гены. В целом 15 больных были ошибочно распределены в группы риска, что стало доказательством достаточной воспроизводимости методики.
В настоящее время проводится одно мультицентовое, проспективное, рандомизированное исследование III фазы MINDACT (MicroarrayforNode-Negative Disease may Avoid Chemo therapy), целью которого является сравнение MammaPrint® с «классическими» прогностическими критериями и Adjuvant Online в отношении отбора пациентов, не нуждающихся в адъювантной ПХТ. Больные из группы неблагоприятного прогноза, по данным MammaPrint® и классических критериев, получают адъювантную ПХТ, из группы благоприятного прогноза по обоим критериям - нет, в группе неблагоприятного прогноза по какому-либо одному прогностическому критерию производится рандомизация больных. Результатов исследования в настоящее время еще нет.
Согласно результатам исследований для Mammaprint продемонстрирована высокая воспроизводимость результатов. Однако эффективность клинического применения и прогностическая точность были ниже по сравнению с OncotypeDX, но сравнимы с результатами других прогностических моделей. Отдельно следует отметить высокую эффективность Mammaprint при определении крайне положительного и крайне отрицательного прогноза, чего не было продемонстрировано для группы умеренного риска. Возможно, это объясняется меньшей строгостью критериев Mammaprint при отборе пациентов. В подтверждение этого использование данной прогностической системы не рекомендовано экспертами Панели St Gallen для использования в рутинной клинической практике.
В течение последних лет достигнут определенный прогресс в области понимания биологических механизмов канцерогенеза при раке молочной железы. Описание биологических «внутренних» подтипов рака молочной железы, пришедших на смену «классическим» факторам прогноза при I, II стадии заболевания, позволило по-новому оценить вклад различных параметров фенотипа опухоли в общую картину прогноза, что еще на один шаг приближает клиницистов к возможности индивидуализации схемы терапии. Однако новые представления о "внутренней" природе рака молочной железы все равно не позволяют ответить на все вопросы, связанные с прогнозом заболевания и соответствующим выбором схемы терапии.
На сегодняшний день ни одна прогностическая модель не позволяет диверсифицировать показания к определению схемы адъювантной терапии настолько, чтобы можно было говорить об индивидуализации программы лечения.
Раскрытие изобретения
Задачей настоящего изобретения является улучшение прогностической точности и воспроизводимости методики определения рецидивирования рака молочной железы.
Задача решается за счет определения профиля экспрессии 5 генов методом ОТ-ПЦР в ткани опухоли у больных раком молочной железы и на его основе расчета показателя рецидивирования с целью определения риска появления отдаленных метастазов у больных всех возрастных категорий с впервые диагностируемым раком молочной железы I, II стадии (T1-2N0-1M0). Данный способ включает в себя следующие этапы.
Результатом изобретения явилась разработка способа, относящегося к определению вероятности рецидивирования рака молочной железы у субъекта – млекопитающего.
Способ определения вероятности рецидивирования рака молочной железы у субъекта - млекопитающего, включающий:
(a) измерение уровня экспрессии РНК-транскриптов KI67, CCND1, PTEN, NDRG1, TERT в биологическом образце, содержащем опухолевые клетки, полученном от указанного субъекта, относительно референсного значения;
(b) определение показателя рецидивирования для указанного субъекта с учетом измеренных уровней экспрессии генов как точки на графике с двумя координатами Х и Y;
(c) использование указанного показателя рецидивирования для определения вероятности рецидивирования рака молочной железы, где для вычисления значения координаты X каждое значение экспрессии гена умножают на соответствующий коэффициент, далее из суммы полученных значений вычитают 3,17:
X=KI67*2,33+CCND1*(-1,26)+PTEN*0,91+NDRG1*(-1,33)+TERT*(-0,45)-3,17, и
где для вычисления значения координаты Y каждое значение экспрессии гена умножают на соответствующий коэффициент, далее из суммы полученных значений вычитают 1,33:
Y=KI67*0,54+CCND1*0,99+PTEN*(-1,08)+NDRG1*(-0,33)+TERT*0,008-1,33
при значении показателя рецидивирования, находящемся в пределах X<0,9; Y<-0,2, определяют максимальный риск рецидива через 0-30 месяцев; при значении показателя рецидивирования, находящемся в пределах X<0,3; Y>-0,1, определяют максимальный риск рецидива через 30-60 месяцев, при значении показателя рецидивирования, находящемся в пределах X>1; Y - любое, определяют минимальный риск рецидива.
Способ, где в качестве референсного значения определялся уровень экспрессии генов GUSB, В2М, HPRT.
Способ, где указанный субъект представляет собой человека.
Способ, где указанный биологический образец выбран из группы, состоящей из свежей опухолевой ткани, тонкоигольных аспиратов, перитониальной жидкости, протокового лаважа и плевральной жидкости.
Способ, где указанный биологический образец представляет собой образец опухоли.
Способ, где указанный образец опухоли получен из фиксированной заключенной в парафин опухолевой ткани.
Способ, где указанная ткань была получена биопсией.
Способ, где уровни экспрессии указанных РНК-транскриптов определены посредством RT-PCR.
Способ, где указанная РНК фрагментирована;
или
(a) измерение относительного уровня экспрессии РНК-транскриптов KI67, CCND1, PTEN, NDRG1, TERT в биологическом образце, содержащем опухолевые клетки, полученном от указанного субъекта;
(b) определение показателя рецидивирования для указанного субъекта с учетом измеренных уровней экспрессии генов;
(c) использование указанного показателя рецидивирования для определения вероятности рецидивирования рака молочной железы; и
(d) составление отчета, в котором приведен результат указанного определения.
В предпочтительном варианте:
- в качестве референсного значения определялся уровень экспрессии генов GUSB, В2М, HPRT;
- указанный субъект представляет собой человека;
- индивидуальный вклад каждого гена оценивают отдельно;
- определяют показатель рецидивирования как точку на графике с двумя координатами X и Y;
- вычисляют значения координаты X, как каждое значение экспрессии гена умножают на соответствующий коэффициент, далее из суммы полученных значений вычитают 3,17:
X=KI67*2,33+CCND1*(-1,26)+PTEN*0,91+NDRG1*(-1,33)+TERT*(-0,45)-3,17;
- вычисляют значение координаты Y, как каждое значение экспрессии гена умножают на соответствующий коэффициент, далее из суммы полученных значений вычитают 1,33:
Y=KI67*0,54+CCND1*0,99+PTEN*(-1,08)+NDRG1*(-0,33)+TERT*0,008-1,33;
- значение показателя рецидивирования, находящееся в пределах X<0,9; Y<-0,2, связано с максимальным риском рецидива через 0-30 месяцев;
- значение показателя рецидивирования, находящееся в пределах X<0,3; Y>-0,1, связано с риском рецидива через 30-60 месяцев;
- значение показателя рецидивирования, находящееся в пределах X>-0,3; Y>-0,2 или X>1; Y - любое, связано с минимальным риском рецидива;
- указанный биологический образец выбран из группы, состоящей из свежей опухолевой ткани, тонкоигольных аспиратов, перитониальной жидкости, протокового лаважа и плевральной жидкости;
- указанный биологический образец представляет собой образец опухоли;
- указанный образец опухоли получен из фиксированной заключенной в парафин опухолевой ткани;
- указанная ткань была получена биопсией;
- уровни экспрессии указанных РНК-транскриптов определены посредством RT-PCR;
- указанная РНК фрагментирована.
Этап выделения РНК
Выделение РНК из парафинизированной ткани производится по стандартной методике на колонках (например, RNeasy FFPE kit® Qiagen USA). Депарафинизация и обработка исследуемого материала проводится в соответствии с протоколом. Объем конечного раствора составлял 60 мкл со средней концентрацией РНК в нем 35-40 мкг/мл.
После получения РНК немедленно проводится этап обратной транскрипции. Реакцию ставится с использованием наборов специфических праймеров у НПО «ДНК Технология» согласно инструкции.
Реакция проводится при температуре 40°С в течение 30 минут, с последующей инактивацией обратной транскриптазы при 95°С в течение 5 минут. Полученный раствор кДНК либо немедленно использовался для ОТ-ПЦР, либо хранился при -20°С.
Для постановки ПЦР используются реактивы - наборы специфических праймеров и зондов фирмы «ЗАО НПФ ДНК-Технология». Контроль отсутствия реакции на геномной ДНК ставится с образцами, не прошедшими реакцию обратной транскрипции. ДНК-зонды, используемые для детекции продуктов амплификации исследуемых и нормировочных генов, помечены FAM. Реакционную смесь готовили согласно инструкции производителя. Реакции амплификации генов ставятся в разных пробирках в двух повторах. Амплификация осуществляется в режиме "реального времени" в объеме 12 мкл по следующей программе: 15 циклов - 80°С 1 сек, 94°С 1 сек; 1 цикл - 94°С; 50 циклов - 94°С 10 сек, 64°С 20 сек. Измерение уровня флуоресценции проводится на каждом цикле при температуре 64°С.
Уровень экспрессии мРНК измеряется в относительных единицах, определяемых методом сравнения индикаторных циклов (Ср), используя несколько формул:
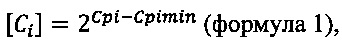
где Ci - уровень экспрессии гена без учета количества материала,
Cpi - значение индикаторного цикла в исследуемом образце,
Cpimin - значение индикаторного цикла в образце с максимальным уровнем экспрессии,
2 - эффективность амплификации.
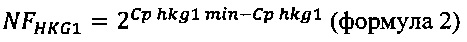
NFHKG1- нормировочный фактор для одного нормировочного гена/HouseKeepingGene,
Cphkg1 - значение индикаторного цикла в нормировочном образце 1,
Cphkg1min - значение индикаторного цикла в образце с максимальным уровнем экспрессии нормировочного гена 1,
2 - эффективность амплификации.

NF - нормировочный фактор с учетом всех нормировочных генов, рассчитывается как среднее геометрическое,
NFHKG1 - нормировочный фактор для одного нормировочного гена,
n - число нормировочных генов, в нашем случае n=5.

где CNF - уровень экспрессии гена с учетом нормировочного фактора, где
Ci - уровень экспрессии гена без учета количества материала,
NF - нормировочный фактор с учетом всех нормировочных генов.

где CNF - уровень экспрессии гена с учетом нормировочного фактора,
CNFmin - значение в образце с минимальным уровнем экспрессии.
Фактически уровень экспрессии приравнивается к 1 в образце с минимальным уровнем экспрессии. В остальных образцах данный показатель (уровень экспрессии) отражает, во сколько раз экспрессия гена выше по отношению к данному образцу.
В качестве референсного значения определялся уровень экспрессии генов GUSB, В2М, HPRT.
В таблице 1 представлен список функциональных генов, включенных в алгоритм: 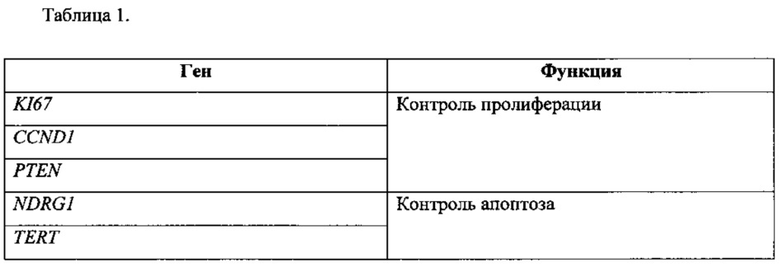
Формула алгоритма расчета
Решением алгоритма является показатель рецидивирования, определяемый как точка на графике с двумя координатами (X; Y). Для вычисления значения координаты X
необходимо каждое значение экспрессии гена умножить на соответствующий коэффициент, далее из суммы полученных значений вычесть 3,17:
X=KI67*2,33+CCND1*(-1,26)+PTEN*0,91+NDRG1*(-1,33)+TERT*(-0,45)-3,17
Для вычисления значения координаты Y необходимо каждое значение экспрессии гена умножить на соответствующий коэффициент, далее из суммы полученных значений вычесть 1,33:
Y=KI67*0,54+CCND1*0,99+PTEN*(-1,08)+NDRG1*(-0,33)+TERT*0,008-1,33
Таким образом, подставив значения уровней экспрессии генов в уравнения, решением будет являться две координаты (X; Y) на графике (фиг. 1).
Фиг. 1. Распределение групп пациентов с различным прогнозом безрецидивной выживаемости (максимальный риск рецидива через 0-30 месяцев после операции; 30-60 месяцев после операции; и группа с минимальным риском прогрессирования)
Границами между группами будут являться координаты показателя рецидивирования, представленные в таблице 2.


Эффективность классификации, проведенной на основе разработанной технологии, представлена в таблице 3.

Осуществление изобретения
Примеры расчета риска рецидива для трех различных пациентов:
1. Пациент, для которого наиболее высокий риск прогрессирования через 0-30 месяцев после лечения: Уровень экспрессии исследуемых генов:

Подставив эти значения в алгоритм для расчета координат, получим
Х=-0,33
Y=-1,25
Данные результаты удовлетворяют только значениям, для группы «0-30 месяцев до прогрессирования», соответственно, риск прогрессирования для данного пациента считается максимальным в период до 30 месяцев после начала лечения.
2. Пациент, для которого наиболее высокий риск прогрессирования через 30-60 месяцев после лечения:
Уровень экспрессии исследуемых генов:

Подставив эти значения в алгоритм для расчета координат, получим
Х=-6,24
Y=1,04
Данные результаты удовлетворяют только значениям, для группы «30-60 месяцев до прогрессирования», соответственно, риск прогрессирования для данного пациента считается максимальным в период от 30 до 60 месяцев после начала лечения.
3. Пациент, для которого риск прогрессирования заболевания минимален: Уровень экспрессии исследуемых генов:

Подставив эти значения в алгоритм для расчета координат, получим
Х=7,14
Y=1,35
Данные результаты удовлетворяют только значениям, для группы «без прогрессирования», соответственно, риск прогрессирования для данного пациента считается минимальным.
На фиг. 2 представлены положения точек для каждого пациента.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ прогнозирования развития метастазов у больных раком молочной железы | 2018 |
|
RU2675236C1 |
| Способ прогнозирования безметастатической выживаемости у больных раком молочной железы на основе экспрессии генов сомато-стволового перехода в резидуальной опухоли после предоперационной терапии | 2018 |
|
RU2682879C1 |
| МЕДИЦИНСКИЙ ПРОГНОЗ И ПРЕДСКАЗАНИЕ РЕЗУЛЬТАТОВ ЛЕЧЕНИЯ, ИСПОЛЬЗУЯ АКТИВНОСТИ МНОЖЕСТВА КЛЕТОЧНЫХ СИГНАЛЬНЫХ ПУТЕЙ | 2014 |
|
RU2718647C2 |
| Способ прогнозирования развития метастазов у больных нерезектабельным трижды негативным раком молочной железы | 2023 |
|
RU2802141C1 |
| Способ прогнозирования риска рецидивирования у ВПЧ16-позитивных больных с плоскоклеточным интраэпителиальным поражением тяжелой степени на основе определения физического статуса вируса | 2019 |
|
RU2719581C1 |
| Способ прогнозирования развития рецидива после проведенного комбинированного лечения рака полости рта | 2023 |
|
RU2825290C1 |
| Способ прогнозирования течения патологического процесса при первично-операбельном люминальном без гиперэкспрессии Her2neu раке молочной железы у женщин в постменопаузе | 2018 |
|
RU2694843C1 |
| Способ дооперационного прогнозирования риска рецидива у больных раком эндометрия Т1 стадии | 2021 |
|
RU2762493C1 |
| Способ определения тактики лечения больных с метастатическими формами и рецидивами трижды негативного рака молочной железы | 2023 |
|
RU2818730C1 |
| МЕТОД ПРОГНОЗА ЭФФЕКТИВНОСТИ ИММУНОТЕРАПИИ НА ОСНОВАНИИ ОЦЕНКИ УРОВНЯ ЭКСПРЕССИИ МРНК ЦИТОКИНОВ В ТКАНИ РАКА ПОЧКИ | 2009 |
|
RU2517082C2 |


Изобретение относится к области медицины. Предложен способ определения вероятности рецидивирования рака молочной железы у субъекта - млекопитающего, включающий измерение уровня экспрессии РНК-транскриптов KI67, CCND1, PTEN, NDRG1, TERT в биологическом образце, содержащем опухолевые клетки и определение показателя рецидивирования для указанного субъекта с учетом измеренных уровней экспрессии генов как точки на графике с двумя координатами X и Y. При значении показателя рецидивирования, находящемся в пределах X<0,9; Y<-0,2 определяют максимальный риск рецидива через 0-30 месяцев. При значении показателя рецидивирования, находящемся в пределах X<0,3; Y>-0,1 определяют максимальный риск рецидива через 30-60 месяцев. При значении показателя рецидивирования, находящемся в пределах X>1; Y - любое определяют минимальный риск рецидива. Изобретение позволяет увеличить точность и воспроизводимость методики определения рецидивирования рака молочной железы. 8 з.п. ф-лы, 2 ил., 11 табл., 3 пр.
1. Способ определения вероятности рецидивирования рака молочной железы у субъекта - млекопитающего, включающий:
(a) измерение уровня экспрессии РНК-транскриптов KI67, CCND1, PTEN, NDRG1, TERT в биологическом образце, содержащем опухолевые клетки, полученном от указанного субъекта, относительно референсного значения;
(b) определение показателя рецидивирования для указанного субъекта с учетом измеренных уровней экспрессии генов как точки на графике с двумя координатами X и Y;
(c) использование указанного показателя рецидивирования для определения вероятности рецидивирования рака молочной железы, где для вычисления значения координаты X каждое значение экспрессии гена умножают на соответствующий коэффициент, далее из суммы полученных значений вычитают 3,17:
X = KI67 * 2,33 + CCND1 * (-1,26) + PTEN * 0,91 + NDRG1 * (-1,33) + TERT * (-0,45) - 3,17, и
где для вычисления значения координаты Y каждое значение экспрессии гена умножают на соответствующий коэффициент, далее из суммы полученных значений вычитают 1,33:
Y = KI67 * 0,54 + CCND1 * 0,99 + PTEN * (-1,08) + NDRG1 * (-0,33) + TERT * 0,008 - 1,33
при значении показателя рецидивирования, находящемся в пределах X<0,9; Y<-0,2, определяют максимальный риск рецидива через 0-30 месяцев; при значении показателя рецидивирования, находящемся в пределах X<0,3; Y>-0,1, определяют максимальный риск рецидива через 30-60 месяцев, при значении показателя рецидивирования, находящемся в пределах X>1; Y - любое, определяют минимальный риск рецидива.
2. Способ по п. 1, где в качестве референсного значения определялся уровень экспрессии генов GUSB, В2М, HPRT.
3. Способ по п. 1, где указанный субъект представляет собой человека.
4. Способ по п. 1, где указанный биологический образец выбран из группы, состоящей из свежей опухолевой ткани, тонкоигольных аспиратов, перитониальной жидкости, протокового лаважа и плевральной жидкости.
5. Способ по п. 1, где указанный биологический образец представляет собой образец опухоли.
6. Способ по п. 5, где указанный образец опухоли получен из фиксированной заключенной в парафин опухолевой ткани.
7. Способ по п. 6, где указанная ткань была получена биопсией.
8. Способ по п. 1, где уровни экспрессии указанных РНК-транскриптов определены посредством RT-PCR.
9. Способ по п. 1, где указанная РНК фрагментирована.
| WO 2013023132 A1, 14.02.2013ТРОЦЕНКО И.Д | |||
| Анализ экспрессии генов при пролиферативных заболеваниях молочной железы | |||
| Автореф | |||
| дисс | |||
| канд | |||
| мед | |||
| наук | |||
| Москва, 2012, 27 c | |||
| Прибор для получения стереоскопических впечатлений от двух изображений различного масштаба | 1917 |
|
SU26A1 |
| Медицинские Диссертации | |||
| Найдено из Интернет: URL: http://medical-diss.com/medicina/analiz-ekspressii-genov-pri-proliferativnyh-zabolevaniyah-molochnoy-zhelezyKENNY F.S | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Clin Cancer Res | |||
| Металлический водоудерживающий щит висячей системы | 1922 |
|
SU1999A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| et al | |||
| Is the Oncotype DX assay necessary in strongly estrogen receptor-positive breast cancers? Am Surg | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
Авторы
Даты
2017-01-30—Публикация
2014-07-11—Подача