Изобретение относится к области медицины, конкретно к онкологии, и может быть использован для прогнозирования безметастатической выживаемости при раке молочной железы на основе экспрессии генов сомато-стволового перехода в резидуальной опухоли после предоперационной химиотерапии.
Одним из актуальных вопросов современной онкологии является проблема прогнозирования течения злокачественных новообразований с целью предсказания развития разных форм прогрессии заболевания и проведения коррекции противоопухолевой терапии. Важным направлением в исследованиях является поиск новых более информативных маркеров, а также выявление новых комбинаций уже установленных показателей, позволяющих существенно повысить точность предсказания.
Развитие метастатической болезни даже после, казалось бы, радикально проведенного комбинированного лечения, является основной причиной смерти онкологических больных в различные сроки после удаления первичной опухоли. В зависимости от локализации опухоли и стадии, процент больных, у которых развиваются метастазы, колеблется от 15 до 90%. Для рака молочной железы (РМЖ) вероятность гематогенного метастазирования связана со многими факторами. Одним из наиболее значимых прогностических признаков является молекулярный подтип опухоли. У больных люминальным А РМЖ даже без относительного разделения на стадии заболевания, в первые 8 лет наблюдения после комбинированного лечения развитие отдаленных метастазов наблюдается в 22% случаев, при люминальном Б подтипе - у 32% больных в течение 5-ти летнего периода наблюдбения. Самая высокая частота развития метастазов отмечена у больных с HER2/neu-позитивным РМЖ - до 50% больных метастазируют уже в первый год после лечения, а среди пациентов с трижды негативным раком у 34% больных выявляется диссеминация процесса в течение первых двух лет наблюдения [1]. Частота метастазирования определяется также и распространенностью опухолевого процесса: 5-летняя безрецидивная выживаемость у пациенток, получавших комплексное лечение по поводу трижды негативного РМЖ при I стадии составила - 85% больных, при IIA - 81%, при IIB - 82%, при IIIB - 43,5% больных [2]. Имеются данные о том, что смертность от РМЖ у пациенток в возрасте до 50 лет составляет 32%, а у женщин 60-69 лет - 8% [3, 4]. Лимфогенное метастазирование связано с высоким риском развития отдаленных метастазов. Примерно у двух третей женщин с лимфогенными метастазами в течение 10 лет после лечения развиваются гематогенные метастазы, и у 30% женщин без лимфогенных метастазов опухоль не дает гематогенных метастазов в течение 10-летнего периода [5].
В настоящее время определено большое количество факторов, позволяющих прогнозировать возможный исход заболевания. Это такие «классические» параметры, как молекулярные подтип опухоли, ее размер (Т), лимфогенное метастазирование (N), степень злокачественности, лекарственный патоморфоз после предоперационной химиотерапии. Неплохие результаты прогнозирования показывает microarray технология MammoprintTM, которая на основе оценки экспрессии 70 генов в опухоли прогнозирует исход заболевания и тактику адъювантного лечения [6], а также OncotypeDX. Для оценки риска метастазирования и назначения адъювантной химиотерапии у больных ранним раком молочной железы допускается применение следующих систем: OncotypeDX, РАМ50, Breast Cancer Index, урокиназного активатора плазминогена и ингибитора активатора плазминогена I типа [7].
Тем не менее, все без исключения известные прогностические факторы получены в результате ассоциативных исследований и не объясняют механизмы метастазирования, а с другой стороны, ни один прогностический фактор не является абсолютным, т.е. не прогнозирует метастазирование в 100% случаев при наличии признака и в 100% выживание при его отсутствии. Считается, что только у 30% пациентов известные прогностические факторы могут с высокой долей вероятности прогнозировать развитие метастазов или благоприятный исход, у подавляющего же большинства пациентов (70%) прогноз исхода заболевания остается неопределенным [8]. Таким образом, разработка новых прогностических факторов для РМЖ является актуальной задачей
Известен способ прогнозирование исхода больных раком молочной железы путем мониторинга экспрессии двух генов (Prognosis of breast cancer patients by monitoring the expression of two genes, Patent US 20150322533 A1, опубликован 12 ноября 2015 года). Данный способ прогнозирования исхода больных с дианозом рак молочной железы основан на определении уровня экспрессии генов CyclinG2 и Sharp1 в опухолевой ткани методом ПЦР-анализа, и позволяет прогнозировать безметастатическую выживаемость больных РМЖ. Согласно указанному способу, определяют уровень экспрессии генов CyclinG2 и Sharp 1 по технологии TaqMan с помощью специфичных праймеров и пробы (табл. 1), далее проводят ПЦР-анализ экспрессии данных генов, оценивают относительную экспрессию генов CyclinG2 и Sharp1 с помощью метода Pfaff1 относительно гена рефери GAPDH, причем в качестве калибраторов используют образцы от пациентов, у которых не было рецидива рака молочной железы. Данный способ оценки риска рецидива рака молочной железы, включающий измерение уровня экспрессии генов CyclinG2 и Sharp1 в образцах рака молочной железы путем обратной транскрипции мРНК из образца пациента в кДНК включает сравнение уровней экспрессии генов CyclinG2 и Sharp 1 в образце пациента со средним уровнем экспрессии гена CyclinG2 и Sharp1 во множестве контрольных образцов рака молочной железы от пациентов с рецидивом рака молочной железы и/или пациентов, у которых не было рецидива. По предлагаемому отношению, идентификация пациента предполагается как имеющего высокий риск рецидива, если уровни экспрессии генов CyclinG2 и Sharp1 в образце пациента не выше среднего уровня экспрессии генов CyclinG2 и Sharp1 в контрольных образцах и/или ниже уровня экспрессии генов CyclinG2 и Sharp1 в контрольных образцах.
Недостатком способа является полуколичественный характер измерения экспрессии генов CyclinG2 и Sharp1, основанный на «классической» ПЦР, а также необходимость подбора большого количества контрольных образцов с рецидивами заболевания и без рецидивов для осуществления способа. Кроме того, не указывается диагностическая точность прогноза метастазирования.
Известен способ прогнозирования безметастатической выживаемости при раке молочной железы на основе экспрессии гена белка YKL-39 (патент RU 2623869 С1, опубликован 29 июня 2017 года), включающий определение уровня экспрессии гена белка YKL-39 в опухолевой ткани методом ПЦР-анализа в режиме реального времени, значение экспрессии в нормальной ткане, взятой за калибратор, принимают за 1 условную единицу (1УЕ). Так, согласно указанному методу, определяют уровень экспрессии YKL-39 по технологии TaqMan с помощью специфичных праймеров и проб. При уровне экспрессии YKL-39 более 1 УЕ прогнозируют высокую, а при уровне экспрессии гена белка YKL-39 менее 1 УЕ - низкую вероятность длительного периода безметастатической выживаемости. Основной недостаток способа связан с низкой точностью прогноза исхода заболевания. В реферате указывается только на высокую и низкую вероятность благоприятного и неблагоприятного исхода. В способе не указывается чувствительность и специфичность прогнозирования. Однако, при апробации способа в таблице 1 указано что, при значении экспрессии YKL-39 >1 у 1 из 29 (3%) пациентов возникли метастазы - иначе говоря специфичность 97%. При значении экспрессии YKL-39 менее 1 у 20/62 (32%) больных возникли метастазы. Иначе говоря, чувствительность способа составляет 32%. Диагностическая точность 65%. Это немногим выше событий с 50% вероятностью. По-сути, можно говорить только о хорошей выживаемости у больных с экспрессией YKL-39 больше 1, точно прогнозировать исход при экспрессии YKL-39 меньше 1 нельзя. Кроме того, способ не учитывает ответ опухоли на неоадъювантную химиотерапию (и само наличие химиотерапии), поскольку на исследование берется биопсийный материал до лечения.
Новый технический результат - увеличение точности определения исхода рака молочной железы, у больных, получавших неоадъювантную химиотерапию (НХТ) за счет использования новых маркеров - оценки экспрессии трех генов сомато-стволового перехода ОСТ3, LAT и LMNB2 в остаточной резидуальной опухоли после НХТ.
Для достижения нового технического результата в способ прогнозирования безметастатической выживаемости у больных раком молочной железы на основе экспрессии генов сомато-стволового перехода в резидуальной опухоли после предоперационной химиотерапии, включающий исследование препаратов ткани опухоли молочной железы, которую берут у пациенток во время операции после проведения неоадъювантной химиотерапии с последующим выделением РНК, характеризующийся тем, что проводят количественную ПЦР в режиме реального времени определяют уровень экспрессии генов ОСТ3, LAT и LMNB2 по технологии TaqMan с помощью специфических праймеров проб ОСТ3 (F 5'-ggattacagtcccaggacatc -3'; R 5'- gctgaataccttcccaaataga -3'; Probe 5'-tgccaagctcctgaagcagaa -3'), LAT (F 5'- catccgagacagtgccttc -3'; R 5'-tcctgggacacattcacatact -3'; Probe 5'- cgcagaagcgtctctggatg -3'), LMNB2 (F 5'-acaactcggacaaggatcagt -3'; R 5'- gatgtacttgggcgtgaactt -3'; Probe 5'-ctggagaatcaagaggcaggtctt -3'), далее оценивают экспрессию генов ОСТ3, LAT и LMNB2 с помощью метода Pfaff1 относительно гена рефери GAPDH, причем в качестве калибратора используют РНК из нормальной перифокальной ткани молочной железы, взятой во время операции и при уровне экспрессии ОСТ3 ниже 1,3УЕ, LAT и LMNB2 ниже 1УЕ определяют их гипоэкспрессию, при уровне значений выше указанных показателей определяют гиперэкспрессию, при одновременной гиперэкспрессии генов ОСТ3, LAT, LMNB2 в остаточной резидуальной опухоли прогнозируют неблагоприятный исход с вероятностью 69%, при гипоэкспрессии хотя бы одного из генов прогнозируют благоприятный исход с вероятностью 94%.
Способ осуществляют следующим образом.
Для молекулярно-генетических исследований используют образцы остаточной резидуальной опухолевой ткани (образец опухоли отбирается из центра опухолевого узла в объеме ~60-70 мм3), которые берут у пациенток во время операции после проведения неоадъювантной химиотерапии. Образцы ткани опухоли помещают в раствор RNALater(Ambion, USA) и сохраняют при температуре -80°С (после 24х-часовой инкубации при температуре +4°С) для дальнейшего выделения РНК и ДНК.
РНК из взятых биопсийных образцов опухолевой ткани выделяют с помощью набора RNeasy Plus mini Kit, содержащего ДНК-азу I (Qiagen, Germany, # 74134). На спектрофотометре NanoDrop-2000 (Thermo Scientific, USA) оценивают концентрацию и чистоту выделения РНК. Целостность РНК оценивают при помощи капиллярного электрофореза на приборе TapeStation (Agilent Technologies, USA) и набора R6K ScreenTape (Agilent Technologies, USA # 5067-5367). С полученной РНК осуществляют синтез ДНК.
Уровень экспрессии генов сомато-стволового перехода ОСТ3, LAT и LMNB2 оценивают при помощи количественной обратно-транскриптазной полимеразной цепной реакции (ПЦР) в режиме реального времени (RT-qPCR) по технологии TaqMan на амплификаторе RotorGene-6000 (Corbett Research, Australia). С полученной ДНК проводят ПЦР-анализ экспрессии генов ОСТ3, LAT и LMNB2. Относительную экспрессию генов ОСТЗ, LAT и LMNB2 оценивают с помощью метода Pfaffl относительно гена рефери GAPDH. В качестве калибратора используют РНК из нормальной перифокальной ткани молочной железы, взятой во время операции или стандартизованный калибратор - РНК, полученную путем пулирования РНК не менее 10 образцов нормальной ткани молочной железы разных пациентов. Относительная экспрессия генов сомато-стволового перехода оценивается с помощью метода Pfaffl и следующая формула используется для того, чтобы определить отношение экспрессии между образцом и калибратором:
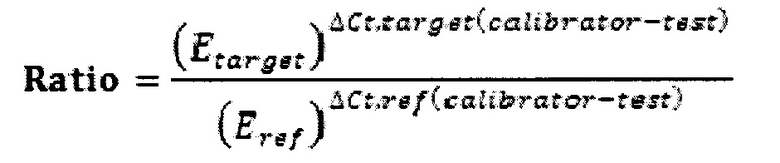
где Е - эффективность реакции, Ct пороговый цикл генов мишеней (target) и гена-реферри(ref). ΔCt, target(calibrator - test) = Ct гена мишени в калибраторе минус Ct гена мишени в опытном образце; ΔCt, ref(calibrator - test) = Ct генов-рефери в калибраторе минус Ct генов-рефери в опытном образце [9]. Таким образом, в качестве результата используется уровень экспрессии генов ОСТ3, LAT и LMNB2 относительно генов-рефери и нормальной ткани.
Уровень экспрессии генов ОСТ3, LAT и LMNB2 в опухолевой ткани молочной железы после проведения НХТ выше 1,3 УЕ для ОСТ3 и ниже 1УЕ для LAT и LMNB2 рассматривают как гиперэкспрессию и прогнозируют риск гематогенного метастазирования на уровне 69%, уровень экспрессии генов ОСТ3, LAT и LMNB2 ниже 1,3 УЕ для ОСТ3 и ниже 1УЕ для LAT и LMNB2 рассматривают как гипоэкспрессию, и, если гипоэкспрессирован хотя бы один из изученных генов, то с 94% вероятностью прогнозируется благоприятный исход.
Предлагаемый способ основан на анализе данных молекулярно-генетического методов исследования операционного материала, анализе амбулаторных карт и медицинских карт больных РМЖ.
Изучался операционный материал от 60 больных РМЖ с морфологически верифицированным диагнозом, клинической стадией IIA - IIIB (T1-4N0-3M0) и в возрасте 28-68 лет (средний возраст 48,32±0,67 лет), получавших в 2006-2010 годах комбинированное лечение в клиниках НИИ онкологии Томского НИМЦ. Исследование проведено в соответствии с Хельсинкской Декларацией 1964 г. (исправленной в 1975 и 1983 гг.), получено разрешение локального этического комитета НИИ онкологии Томского НИМЦ и информированное согласие пациентов. Более 85% больных имели инвазивный протоковый рак, у 74% больных размер опухоли составил 2-5 см (Т2) и 62% больных были с лимфогенными метастазами. Иммуногистохимическое исследование включало оценку экспрессии рецепторов эстрогена, прогестерона и HER2.
Все больные, в соответствии с «Consensus Conference on Neoadjuvant Chemotherapy (NAC) in Carcinoma of the Breast, April 26-28, 2003, Philadelphia, Pennsylvania)) » [10] (т.е. только IIA - IIIB стадиями) в неоадъювантном режиме получали 2-4 курса химиотерапии по схемам FAC, САХ или монотерапию таксотером. Через 3-5 недель после НХТ проводилась операция в объеме радикальной мастэктомии, радикальной резекции или секторальной резекции с аксиллярной лимфаденэктомией, затем больным 4 курса адъювантной химиотерапии по схеме FAC, лучевая терапия и/или гормональное лечение по показаниям. Эффективность предоперационной химиотерапии оценивали по критериям ВОЗ с помощью УЗИ и маммографии, которые проводили до лечения, после 2 курсов НХТ и перед операцией. Эффективность предоперационной химиотерапии оценивали по критериям международного противоракового союза Union Against Cancer [11] с помощью УЗИ и маммографии. Регистрировали полную регрессию (100% уменьшение опухоли), частичную регрессию (уменьшение объема опухоли более чем на 50%), стабилизацию (снижение объема менее чем на 50% или увеличение не более, чем на 25%) и прогрессирование (увеличение объема опухоли более чем на 25%).
Полная регрессию отмечена у 8 больных, частичная регрессия у 33, стабилизация у 13 и прогрессирование у 6 пациентов. Степень патоморфоза 1-2 наблюдалась у 43 из 60 пациенток (72%), степень патоморфоза 3-4 - у 17 из 60 больных (28%).
Уровень экспрессии генов сомато-стволового перехода ОСТ3, LAT и LMNB2 оценивали при помощи количественной обратно-транскриптазной полимеразной цепной реакции (ПЦР) в режиме реального времени (RT-qPCR) по технологии TaqMan на амплификаторе RotorGene-6000 (Corbett Research, Australia). С полученной ДНК проводили ПЦР-анализ экспрессии генов сомато-стволового перехода ОСТ3, LAT и LMNB2. В качестве гена-рефери используется ген «домашнего хозяйства» фермента GAPDH (glyceraldehydes-3-phosphatedehydrogenase), уровень экспрессии каждого целевого гена нормализуется по отношению к экспрессии гена-рефери.
Статистическая обработка данных проводилась с использованием пакета прикладных программ «STATISTICA 8.0» (StatSoft Inc., USA). Для анализа безметастатической выживаемости использовались кривые выживаемости, построенные по методу Каплана-Майера [12]. Оценка значимости различий между группами производилась с помощью log-rank теста.
Таким образом, при исследовании показателей прогноза у пациенток больных раком молочной железы в зависимости от уровня экспрессии генов ОСТ3, LAT и LMNB2 в опухолевой ткани были получены следующие результаты.
Из 60 обследованных пациентов отдаленные метастазы развились у 13 (22%) больных в сроки 3-48 месяцев с даты постановки диагноза. Определение экспрессии было проведено у 52 больных, для 8 больных, у которых в процессе НХТ была достигнута полная морфологическая регрессия, не было необходимости оценивать уровень экспрессии генов сомато-стволового перехода в опухоли после проведения НХТ, поскольку у них прогнозируется благоприятный исход по наличию полной морфологической регрессии после НХТ.
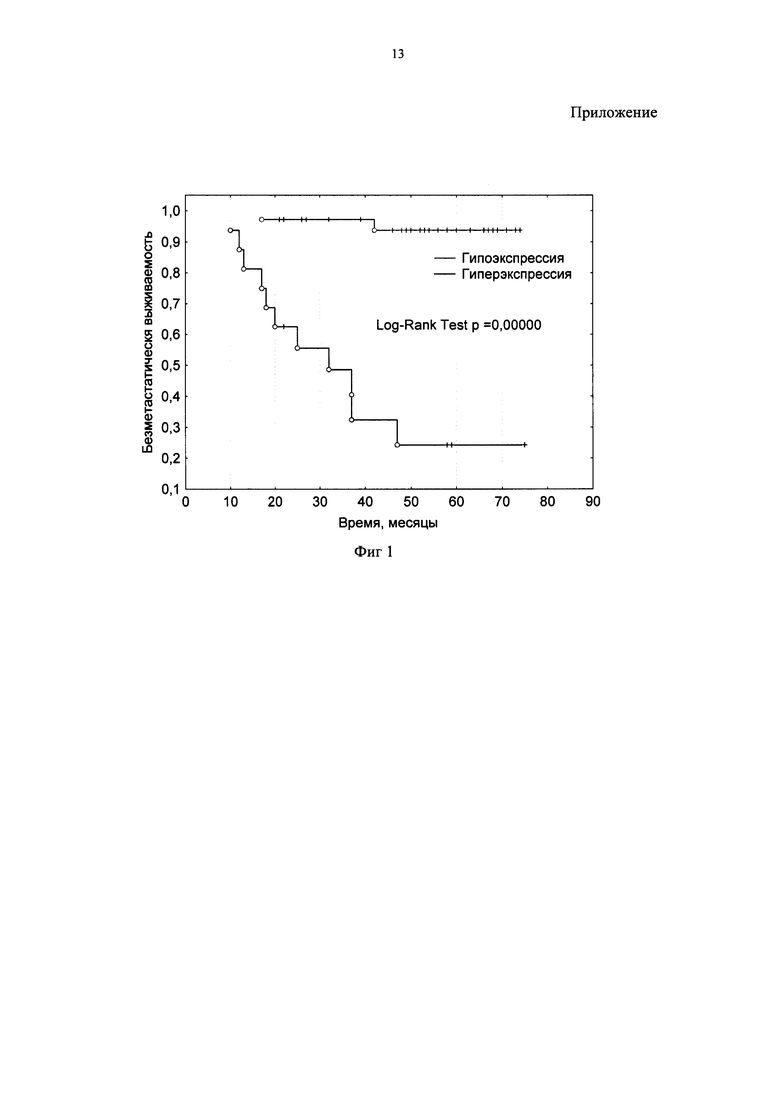
Из 52 обследованных гиперэкспрессия всех трех генов сомато-стволового перехода (ОСТ3, LAT и LMNB2) в остаточной резидуальной опухоли после НХТ отмечалась у 16 больных (31%) у 11 из них развились гематогенные метастазы, безметастатическая выживаемость в 5-ти летнем периоде наблюдения таких больных составила 31% (На Фиг. 1 представлены данные безметастатической выживаемости больных РМЖ в зависимости от экспрессии генов сомато-стволового перехода в остаточной резидуальной опухоли).
Риск гематогенного метастазирования на уровне 69% (чувствительность). У 36 больных наблюдалась гипоэкспрессия хотя бы одного из исследованных генов, 5-ти безметастатическая выживаемость этих больных составили 94% (34/36). (специфичность). Диагностическая точность прогнозирования исхода - 82%. По критерию Фишера при гиперэкспрессии трех генов OR(CI 95%) = 37,4(6,3-220,7), р=0,000004, относительный риск метастазирования RR(CI 95%) = 3,0(1,5-6,3), р = 0,000004.
В результате исследования был установлен новый прогностический фактор, который позволяет точно прогнозировать возникновение гематогенных метастазов или благоприятный исход у 82% (или у 100% больных с 82% точностью) больных РМЖ, получавшим НХТ и не достигшим полной морфологической регрессии. Клинические примеры:
Пример 1. Больная Ф 48 лет в ноябре 2007 поступила на лечение в клиники НИИ онкологии Томского НИМЦ с диагнозом РМЖ слева T2N1M0. По результатам морфологического исследования установлен молекулярный подтип опухоли - люминальный В, инфильтрирующий-дольковый рак, мультицентричная форма роста. В предоперационном периоде получила 2 курса монотерапии таксотером с плохим эффектом - 17% уменьшение опухоли (стабилизация) и патоморфозом 1 степени, по стандартным клинико-морфологическим параметрам прогноз неблагоприятный. В послеоперационном периоде получила 4 курса химиотерапии по схеме FAC, адъювантную лучевую терапию и гормональную терапию. Проведено исследование согласно предлагаемому способу, а именно определение экспрессия генов ОСТ3, LAT и LMNB2. Показано, что в остаточной резидуальной опухоли наблюдалась следующая экспрессия генов: ОСТ3 = 0, LAT = 2,95 и LMNB2 = 4,26, т.е. установлена гипоэкспрессия гена ОСТ3. По результатам анализа экспрессии генов сомато-стволового перехода у больной прогнозировали благоприятный исход с вероятностью 94%. В реальной ситуации у больной 71 месяц безметастатическая выживаемость, несмотря на неблагоприятные стандартные клинико-морфологические факторы прогноза, такие как, лимфогенное метастазирование, инфильтративно-дольковый рак, мультицентричный рост опухоли, плохой ответ на НХТ и 1 степень патоморфоза
Пример 2 Больная Н 47 лет в мае 2008 поступила на лечение в клиники НИИ онкологии Томского НИМЦ с диагнозом РМЖ слева T2N0M0. По результатам морфологического исследования установлен молекулярный подтип опухоли -люминальный В, инфильтрирующий-протоковый рак, уницентричная форма роста. В предоперационном периоде получила 4 курса монотерапии таксотером с хорошим эффектом - 84% уменьшение опухоли (частичная регрессия) и патоморфозом 3 степени, по стандартным клинико-морфологическим параметрам прогноз благоприятный. В послеоперационном периоде получила 4 курса химиотерапии по схеме FAC, адъювантную лучевую терапию и гормональную терапию. Проведено исследование согласно предлагаемому способу, а именно определение экспрессия генов ОСТ3, LAT и LMNB2. Показано, что в остаточной резидуальной опухоли наблюдалась гиперэкспрессия всех 3 генов ОСТ3 = 4,13, LAT = 1,31 и LMNB2 = 2,24. По результатам анализа экспрессии генов сомато-стволового перехода у больной прогнозировался неблагоприятный исход и гематогенное метастазирование с вероятностью 69%. В реальной ситуации у больной через 37 месяцев после операции возникли множественные метастазы в легких, костях и печени. Таким образом, несмотря на благоприятные стандартные клинико-морфологические факторы прогноза, такие как, отсутствие лимфогенного метастазирования, инфильтративно-протоковый рак, уницентричный рост опухоли, хороший ответ на НХТ и 3 степень патоморфоза у больной в соответствии с прогнозом возникли гематогенные метастазы.
Таким образом, предлагаемый способ с высокой долей информативности позволяет прогнозировать возникновение гематогенных метастазов у 82% больных РМЖ, получавшим НХТ и не достигшим полной морфологической регрессии за счет возможности учета ответа опухоли на НХТ, что позволяет проводить наиболее адекватную коррекцию противоопухолевой терапии.
Источники информации, принятые во внимание при составлении описания:
1. Генс Т.П., Моисеева Н.И., Овсий О.Г., Коробкова Л.И., Бяхов М.Ю., Рыбалкина Е.Ю., Ставровская А.А. Проблемы индивидуализации лекарственного лечения у больных раком молочной железы// Вестник Российского научного центра рентгенорадиологии Минздрава России. 2014. N 1.
2. Секундова М., Борисов В., Сдвижков А. Результаты комплексного лечения трижды негативного рака молочной железы// Опухоли женской репродуктивной системы. 2014. N 1.
3. Borg M.F. Breast-conserving therapy in young women with invasive carcinoma of the breast// Australasian Radiology. 2004. V. 48, N 3. P. 1440-1673.
4. Yankaskas B.C. Epidemiology of breast cancer in young women// Breast Disease. 2006. V. 23. N 1. P. 3-8.
5. Weigelt В., Baehner F.L., Reis-Filho J.S. The contribution of gene expression profiling to breast cancer classification, prognostication and prediction: a retrospective of the last decade// The Journal of pathology. 2009. V. 220, N 2. P. 263-280.
6. Tian S., Roepman P.,  Veer L.J., Bernards R., De Snoo F., Glas A.M. Biological functions of the genes in the mammaprint breast cancer profile reflect the hallmarks of cancer// Biomarker insights. 2010. V. 5. P. 129.
Veer L.J., Bernards R., De Snoo F., Glas A.M. Biological functions of the genes in the mammaprint breast cancer profile reflect the hallmarks of cancer// Biomarker insights. 2010. V. 5. P. 129.
7. Harris L.N., Ismaila N., McShane L.M., Andre F., Collyar D.E., Gonzalez-Angulo A.M., Hammond E.H., Kuderer N.M., Liu M.C., Mennel R.G. Use of biomarkers to guide decisions on adjuvant systemic therapy for women with early-stage invasive breast cancer: American Society of Clinical Oncology clinical practice guideline// Journal of Clinical Oncology. 2016. P. JCO652289.
8. Weigelt В., Geyer F.C., Reis-Filho J.S. Histological types of breast cancer: how special are they?// Molecular oncology. 2010. V. 4, N3. P. 192-208.
9. Pfaffl M.W. A new mathematical model for relative quantification in real-time RT-PCR// Nucleic acids research. 2001. V. 29, N 9. P. e45-e45.
10. Schwartz G.F., Hortobagyi G.N. Proceedings of the Consensus Conference on Neoadjuvant Chemotherapy in Carcinoma of the Breast, April 26-28, 2003, Philadelphia, Pennsylvania// The Breast Journal. 2004. V. 10, N 4. P. 273-294.
11. Hayward J.L., Carbone P.P., Heuson J.C., Kumaoka S., Segaloff A., Rubens R.D. Assessment of response to therapy in advanced breast cancer: a project of the Programme on Clinical Oncology of the International Union Against Cancer, Geneva, Switzerland// Cancer. 1977. V. 39, N3. P. 1289-94.
12. Kaplan E.L., Meier P. Nonparametric estimation from incomplete observations// Journal of the American statistical association. 1958. V. 53, N 282. P. 457-481.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ прогнозирования длительности безметастатического периода у больных инвазивной карциномой молочной железы неспецифического типа | 2024 |
|
RU2838685C1 |
| Способ прогнозирования пятилетней безметастатической выживаемости у больных раком молочной железы на основе экспрессии генов белков YKL-39 и CCL18 | 2017 |
|
RU2659676C1 |
| Способ прогнозирования безрецидивной выживаемости у больных раком молочной железы | 2016 |
|
RU2623869C1 |
| Способ прогнозирования риска лимфогенного метастазирования при раке молочной железы на основе экспрессии гена белка YKL-39 | 2016 |
|
RU2632115C1 |
| Способ прогнозирования риска развития отдаленных метастазов у больных операбельными формами рака молочной железы с метастазами в регионарные лимфоузлы | 2020 |
|
RU2733697C1 |
| Способ прогнозирования риска опухолевой прогрессии у больных раком молочной железы | 2024 |
|
RU2838618C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ИСХОДА ЗАБОЛЕВАНИЯ У БОЛЬНЫХ ЛЮМИНАЛЬНЫМ В И ТРИЖДЫ НЕГАТИВНЫМ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ У ПАЦИЕНТОК, НЕ ПОЛУЧАВШИХ В НЕОАДЪЮВАНТНОМ РЕЖИМЕ ХИМИО- ИЛИ ГОРМОНОТЕРАПИЮ | 2017 |
|
RU2648523C1 |
| Способ ингибирования метастазирования опухолей путем подавления дедифференцировки опухолевых клеток | 2023 |
|
RU2840966C1 |
| Способ прогнозирования развития метастазов у больных раком молочной железы | 2018 |
|
RU2675236C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ИСХОДОВ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2008 |
|
RU2361222C1 |
Изобретение относится к области медицины, в частности к онкологии, и предназначено для прогнозирования безметастатической выживаемости у больных раком молочной железы. У пациенток во время операции после проведения неоадъювантной химиотерапии (НХТ) берут ткань опухоли с последующим выделением РНК. Проводят количественную ПЦР в режиме реального времени, определяют уровень экспрессии генов ОСТ3, LAT и LMNB2 по технологии TaqMan с помощью специфических праймеров и проб. Оценивают экспрессию генов ОСТ3, LAT и LMNB2 с помощью метода Pfaff1 относительно гена рефери GAPDH. При уровне экспрессии ОСТ3 ниже 1,3 УЕ, LAT и LMNB2 ниже 1 УЕ определяют их гипоэкспрессию. При уровне значений выше указанных показателей определяют гиперэкспрессию. При одновременной гиперэкспрессии генов ОСТ3, LAT, LMNB2 в остаточной резидуальной опухоли прогнозируют неблагоприятный исход с вероятностью 69%. При гипоэкспрессии хотя бы одного из генов прогнозируют благоприятный исход с вероятностью 94%. Изобретение обеспечивает увеличение точности определения исхода рака молочной железы у больных, получавших НХТ, за счет использования новых маркеров - оценки экспрессии трех генов сомато-стволового перехода ОСТ3, LAT и LMNB2 в остаточной резидуальной опухоли после НХТ. 1 ил., 2 пр.
Способ прогнозирования безметастатической выживаемости у больных раком молочной железы на основе экспрессии генов сомато-стволового перехода в резидуальной опухоли после предоперационной химиотерапии, включающий исследование препаратов ткани опухоли молочной железы, которую берут у пациенток во время операции после проведения неоадъювантной химиотерапии с последующим выделением РНК, характеризующийся тем, что проводят количественную ПЦР в режиме реального времени, определяют уровень экспрессии генов ОСТ3, LAT и LMNB2 по технологии TaqMan с помощью специфических праймеров и проб ОСТ3 (F 5'-ggattacagtcccaggacatc-3'; R 5'-gctgaataccttcccaaataga-3'; Probe 5'-tgccaagctcctgaagcagaa-3'), LAT (F 5'-catccgagacagtgccttc-3'; R 5'-tcctgggacacattcacatact-3'; Probe 5'-cgcagaagcgtctctggatg-3'), LMNB2 (F 5'-acaactcggacaaggatcagt-3'; R 5'-gatgtacttgggcgtgaactt-3'; Probe 5'-ctggagaatcaagaggcaggtctt-3'), далее оценивают экспрессию генов ОСТ3, LAT и LMNB2 с помощью метода Pfaff1 относительно гена рефери GAPDH, причем в качестве калибратора используют РНК из нормальной перифокальной ткани молочной железы, взятой во время операции, и при уровне экспрессии ОСТ3 ниже 1,3 УЕ, LAT и LMNB2 ниже 1 УЕ определяют их гипоэкспрессию, при уровне значений выше указанных показателей определяют гиперэкспрессию, при одновременной гиперэкспрессии генов ОСТ3, LAT, LMNB2 в остаточной резидуальной опухоли прогнозируют неблагоприятный исход с вероятностью 69%, при гипоэкспрессии хотя бы одного из генов прогнозируют благоприятный исход с вероятностью 94%.
| Способ прогнозирования безрецидивной выживаемости у больных раком молочной железы | 2016 |
|
RU2623869C1 |
| GALLAGHER C.M | |||
| et al | |||
| Survival in patients with non-metastatic breast cancer treated with adjuvant trastuzumab in clinical practice | |||
| Springerplus | |||
| Токарный резец | 1924 |
|
SU2016A1 |
| Токарный резец | 1924 |
|
SU2016A1 |
| Найдено из Интернет: URL: https://www.ncbi.nlm.nih.gov/pubmed/27047721 | |||
| US 2011020317 A1, 27.01.2011. | |||
Авторы
Даты
2019-03-22—Публикация
2018-03-19—Подача