Описание
Релевантные заявки
Данная заявка заявляет преимущество предварительной заявки на патент США № 60/684853, поданной 26 мая 2005; раскрытие которой в полном объеме включено здесь для сведения.
Уровень техники
Данное изобретение в основном относится к гуманизированным анти-CD40-антителам для диагностического и терапевтического применения. Конкретнее, раскрываются гуманизированные анти-CD40-антитела и способы применения для лечения различных заболеваний или нарушений, для которых характерны клетки, экспрессирующие CD40. Также раскрываются фармацевтические композиции и предметы производства, такие как наборы, содержащие гуманизированное анти-CD40-антитело.
CD40 представляет интегральный мембранный гликопротеин типа I, и он относится к надсемейству рецептора фактора некроза опухолей (TNF). CD40 экспрессируется на различных типах клеток, включая нормальные и злокачественные В-клетки, разобщающие клетки, базальные эпителиальные клетки и клетки карцином. Он также находится на моноцитах, макрофагах, некоторых эндотелиальных клетках и фолликулярных дендритных клетках. CD40 экспрессируется на ранней стадии онтогенеза В-клеток, появляясь на предшественниках В-клеток после появления CD10 и CD19, но перед экспрессией CD21, CD23, CD24 и появлением поверхностного иммуноглобулина М (sIgM) (Uckun et al., 1990, Blood 15: 2449). Несмотря на то, что в ранних работах указывалось, что CD40 исчезает во время конечной дифференцировки В-клеток в плазматические клетки, CD40 детектировали на клетках миндалин и плазматических клетках костного мозга (Pellat-Decounynck et al., 1994, Blood 84: 2597).
Взаимодействие CD40 с его лигандом и противорецептором, CD40L (также обозначаемого как к CD154, gp39 и TRAP), приводит к индукции гуморального и опосредованного клетками иммунного ответа. CD40L представляет собой трансмембранный белок, преимущественно экспрессируемый на активированных лимфоцитах, CD4+ Т-клетках. Подобно другим белкам в семействе TNF структура CD40L является таковой для нековалентного тримера. Оказалось, что опосредуемый CD40 путь передачи сигнала необходим для пролиферации В-клеток, определения изотипа иммуноглобулинов (Ig), формирования зародышевого центра и коммитирования В-клеток памяти в ответ на зависимый от Т-клеток антиген. Связывание CD40 с CD40L приводит к мультимеризации CD40, генерации сигналов активации для антигенпрезентирующих клеток, таких как дендритные клетки, моноциты и В-клетки, и генерации сигналов роста и дифференцировки для активируемых цитокинами фибробластов и эпителиальных клеток. Несмотря на то, что сигнальные пути, посредством которых функционируют молекулы CD40 в клеточной дифференцировке, полностью не выяснены, сигналы CD40 передаются от мультимеризованного рецептора через рекрутмент ряда ассоциированных с рецепторами TNF факторов («TRAF») (Kehry, 1996, J. Immunolog. 156: 2345-2348). Подгруппы TRAF по-разному взаимодействуют с членами семейства рецепторов TNF, включая CD40, обеспечивая стимул для широкого ряда последующих сигнальных путей. TRAF1 и TRAF2 принимают участие в модуляции апоптоза (Speiser et al., 1997, J. Exp. Med. 185: 1777-1783; Yeh et al., 1997, Immunity 7: 715-725). TRAF 2, 5 и 6 участвуют в пролиферации и активации. В нормальных В-клетках связывание CD40 с CD40L приводит к рекрутменту TRAF2 и TRAF3 к рецепторному комплексу и вызывает отрицательную регуляцию других TRAF (Kuhne et al., 1997, J. Exp. Med. 186: 337-342).
Апоптоз и опосредуемая CD40 передача сигналов тесно связаны в период развития и дифференцировки В-клеток. Основной функцией апоптоза В-клеток является делеция клонов незрелых В-клеток, которая, как полагают, приводит к интенсивному перекрестному сшиванию поверхностных Ig в незрелых В-клетках. Судьба зрелых В-клеток также модулируется под действием комбинации передачи сигналов через поверхностные Ig и сигналы, происходящие от активированных Т-клеток, преимущественно опосредуемые молекулами CD40. Комбинация сигналов от поверхностных Ig и CD40 может подавить апоптозный путь и поддержать выживаемость В-клеток в зародышевых центрах. Данный риск проявления апоптоза в зародышевых центрах является критическим для развития аффинности антитело-продуцирующих В-клеток памяти.
При Т- и В-клеточных новообразованиях противоопухолевые эффекты (задержка роста с и без апоптоза) часто проявляются, когда злокачественные клетки подвергаются воздействию индуктора, который приводит к активации нормальных лимфоцитов. Данную индуцированную активацией задержку роста наблюдали с сигналами от рецепторов антигена или костимуляторных рецепторов (Ashwell et al., 1987, Science 237: 61; Bridges et al., 1987, J. Immunol. 139: 4242; Page and Defranco, 1988, J. Immunol. 140: 3717; и Beckwith et al., J. Natl. Cancer. Inst. 82: 501). Стимуляция CD40 анти- CD40-антителом или растворимым CD40L непосредственно подавляет рост В-клеточной лимфомы (Funakoshi et al., 1994, Blood 83: 2787-2784).
Описано несколько мышиных моноклональных антител (mAb) против CD40 (Katira et al., 1995, «CD40 Workshop Panel Report» в: Leukocyte Typing V, Schlossman et al., (eds) 1995, 1: 547-550). Например, было показано, что два mAb, CD40.7 (М2) и CD40.8 (М3) ингибируют связывание CD40 с CD40L (Fanslow et al., 1995, в: Leukocyte Typing V, Schlossman et al., (eds) 1995, 1: 555-556). Стимуляция CD40 под воздействием М2 и М3 подавляла рост нескольких В-клеточных лимфом человека и индуцировала регрессию развившихся опухолей в условиях in vivo (Funakoshi et al., 1994, Blood 83: 2787-2794; Funakoshi et al., 1996, J. Immunol. 19: 93-101). В патенте США № 5182368 раскрываются мышиные mAb против CD40, G28-5, которые могут усиливать пролиферацию В-клеток. Одноцепочечный иммунотоксин на основе одноцепочечной Fv-области G28-5 избирательно приводит к гибели человеческих гематологических линий злокачественных клеток, экспрессирующих CD40, в условиях in vitro (Francisco et al., 1997, J. Biol. Chem. 39: 24165-24169). Однако G28-5 не усиливают активацию В-клеток в присутствии CD40L и не потенцируют связывание CD40 и CD40L. В патенте США № 6838261 (и связанных патентах США № 6946129 и 6843989) описывается группа вариантных форм мышиных mAb против CD40, S2C6, и их применение при лечении различных нарушений, включая злокачественные, иммунологические и воспалительные заболевания. Было показано, что в дополнении к усилению опосредуемой CD40L стимуляции описанное в патенте США № 6838261 анти-CD40-антитело усиливает взаимодействие между CD40 и CD40L и в условиях in vivo проявляет противоопухолевую активность. Несмотря на то, что S2C6 само по себе будет стимулировать клеточную пролиферацию аналогично G28-5, S2C6 отличается от G28-5 по его способности усиливать связывание CD40L и повышать последующую величину опосредуемого CD40 сигнала активации.
Другие мышиные mAb против CD40, например, описанные в международной публикации заявки WO 95/17202, связываются с CD40 и проявляют эффективность при лечении и профилактике заболевания, для которого характерны экспрессирующие CD40 злокачественные клетки. Несмотря на то, что мышиные анти-CD40-антитела имеют потенциальную применимость в качестве терапевтических средств при лечении ассоциированных с CD40 заболеваний у людей, их иммуногенность представляет возможность нейтрализации ответа антител, например, ответа человеческого антимышиного антитела (НАМА), что снижает их значение.
Таким образом, существует потребность в гуманизированных анти-CD40-антителах, которые специфически связываются с определенными эпитопами CD40 и которые проявляют специфичность в отношении связывания с антигеном, аффинность и другие желаемые функциональные характеристики аналогичного, отличного от человеческого анти-CD40-антитела.
Сущность изобретения
Настоящее изобретение относится к гуманизированным анти-CD40-антителам и их антигенсвязывающим фрагментам, а также способам применения таких гуманизированных анти-CD40-антител и фрагментов для лечения заболеваний и нарушений, для которых характерны клетки, экспрессирующие поверхностный антиген CD40. Также оно относится к наборам и изделиям производства, включающим гуманизированное анти-CD40-антитело.
В некоторых вариантах осуществления обеспечивается выделенное антитело или антигенсвязывающий фрагмент, которые специфически связываются с человеческим CD40. Антитело или антигенсвязывающий фрагмент включают вариабельную область тяжелой цепи и/или вариабельную область легкой цепи. Вариабельная область тяжелой цепи может включать каркасную область, имеющую аминокислотную последовательность, по меньшей мере, на 90% идентичную аминокислотной последовательности человеческой вариабельной области тяжелой цепи подгруппы III с консенсусной аминокислотной последовательностью SEQ ID NO:2 и, по меньшей мере, один CDR, имеющий аминокислотную последовательность, по меньшей мере, на 90% идентичную соответствующему CDR тяжелой цепи с последовательностью SEQ ID NO:3. Вариабельная область легкой цепи может включать каркасную область, имеющую аминокислотную последовательность, по меньшей мере, на 90% идентичную человеческой вариабельной области легкой цепи подгруппы каппа I с консенсусной аминокислотной последовательностью SEQ ID NO:13 и, по меньшей мере, один CDR, имеющий аминокислотную последовательность, по меньшей мере, на 90% идентичную соответствующему CDR легкой цепи с последовательностью SEQ ID NO:14.
В некоторых вариантах осуществления каждый CDR тяжелой цепи, по меньшей мере, на 90% идентичен соответствующему CDR тяжелой цепи с последовательностью SEQ ID NO:3. В некоторых вариантах осуществления CDR тяжелой цепи включают аминокислотные последовательности CDR1, CDR2 и CDR3 тяжелой цепи с последовательностью SEQ ID NO:3. В некоторых вариантах осуществления каждый CDR легкой цепи, по меньшей мере, на 90% идентичен соответствующему CDR легкой цепи с последовательностью SEQ ID NO:14. В некоторых вариантах осуществления CDR легкой цепи включают аминокислотные последовательности CDR1, CDR2 и CDR3 с последовательностью SEQ ID NO:14.
В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент включают вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10 или SEQ ID NO:11. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент включают вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO:14, SEQ ID NO:15 или SEQ ID NO:16. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент имеют аминокислотную последовательность вариабельной области тяжелой цепи SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10 или SEQ ID NO:11 и аминокислотную последовательность вариабельной области легкой цепи SEQ ID NO:14, SEQ ID NO:15 или SEQ ID NO:16.
В некоторых вариантах осуществления вариабельная область тяжелой цепи и вариабельная область легкой цепи включают аминокислотные последовательности соответственно SEQ ID NO:3 и SEQ ID NO:14; соответственно SEQ ID NO:4 и SEQ ID NO:14; соответственно SEQ ID NO:5 и SEQ ID NO:14; соответственно SEQ ID NO:6 и SEQ ID NO:14; соответственно SEQ ID NO:7 и SEQ ID NO:14; соответственно SEQ ID NO:8 и SEQ ID NO:14; соответственно SEQ ID NO:9 и SEQ ID NO:14; соответственно SEQ ID NO:6 и SEQ ID NO:15; соответственно SEQ ID NO:6 и SEQ ID NO:16; соответственно SEQ ID NO:7 и SEQ ID NO:16; соответственно SEQ ID NO:10 и SEQ ID NO:14; соответственно SEQ ID NO:11 и SEQ ID NO:14; соответственно SEQ ID NO:10 и SEQ ID NO:16; или соответственно SEQ ID NO:11 и SEQ ID NO:16.
Антитело или антигенсвязывающий фрагмент могут включать константную область человеческого IgG, например, такую как константная область IgG изотипа IgG1, IgG2, IgG3 или IgG4. Антитело или антигенсвязывающий фрагмент могут включать константную область легкой цепи, например, такую как константная область легкой цепи каппа.
В некоторых вариантах осуществления антитело представляет hu sgn-0, hu sgn-1, hu sgn-4, hu sgn-14, hu sgn-15, hu sgn-16, hu sgn-17, hu sgn-18, hu sgn-19, hu sgn-22, hu sgn-23, hu sgn-26 или hu sgn-27. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент конкурируют за связывание с моноклональным антителом S2C6, которое секретируется гибридомой, имеющей номер для доступа РТА-110 в АТСС.
Антитело может также представлять антигенсвязывающий фрагмент, такой как Fab, Fab', F(ab')2, Fv-фрагмент, диантитело, одноцепочечное антитело, scFv-фрагмент или scFv-Fc. В антитело или антигенсвязывающий фрагмент можно ввести метку или конъюгировать с химиотерапевтическим препаратом, таким как ауристатин (например, ММАЕ или ММАF).
Также обеспечивается набор, содержащий анти-CD40-антитело или антигенсвязывающий фрагмент в контейнере. Набор может необязательно включать дополнительный компонент(ы), такие как инструкции по применению антитела для детектирования белка CD40 в биологической пробе.
Также обеспечиваются фармацевтические композиции, содержащие анти-CD40-антитело или его антигенсвязывающий фрагмент и фармацевтически приемлемый наполнитель(и).
В некоторых вариантах осуществления обеспечиваются выделенные полинуклеотиды, кодирующие гуманизированную вариабельную область тяжелой цепи и/или гуманизированную вариабельную область легкой цепи. Полинуклеотид может, например, кодировать аминокислотную последовательность вариабельной области тяжелой цепи SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10 или SEQ ID NO:11. Полинуклеотид также может, например, кодировать аминокислотную последовательность вариабельной области легкой цепи SEQ ID NO:14, SEQ ID NO:15 или SEQ ID NO:16.
В некоторых вариантах осуществления выделенный полинуклеотид кодирует аминокислотную последовательность вариабельной области тяжелой цепи и аминокислотную последовательность вариабельной области легкой цепи соответственно SEQ ID NO:3 и SEQ ID NO:14; соответственно SEQ ID NO:4 и SEQ ID NO:14; соответственно SEQ ID NO:5 и SEQ ID NO:14; соответственно SEQ ID NO:6 и SEQ ID NO:14; соответственно SEQ ID NO:7 и SEQ ID NO:14; соответственно SEQ ID NO:8 и SEQ ID NO:14; соответственно SEQ ID NO:9 и SEQ ID NO:14; соответственно SEQ ID NO:6 и SEQ ID NO:15; соответственно SEQ ID NO:6 и SEQ ID NO:16; соответственно SEQ ID NO:7 и SEQ ID NO:16; соответственно SEQ ID NO:10 и SEQ ID NO:14; соответственно SEQ ID NO:11 и SEQ ID NO:14; соответственно SEQ ID NO:10 и SEQ ID NO:16; или соответственно SEQ ID NO:11 и SEQ ID NO:16.
В некоторых вариантах осуществления обеспечиваются способы подавления роста клеток, экспрессирующих человеческий антиген CD40. Способы включают введение анти-CD40-антитела или антигенсвязывающего фрагмента в клетки, где данные анти-CD40-антитело или антигенсвязывающий фрагмент связываются с человеческим клеточным поверхностным антигеном CD40. Связывание антитела или антигенсвязывающего фрагмента с антигеном CD40 подавляет рост или дифференцировку клеток.
В некоторых вариантах осуществления обеспечиваются способы лечения субъекта, имеющего ассоциированное с CD40 нарушение. Способы включают введение субъекту анти-CD40-антитела или антигенсвязывающего фрагмента, где данные анти-CD40-антитело или антигенсвязывающий фрагмент связываются с человеческим CD40. Связывание антитела или антигенсвязывающего фрагмента с CD40 подавляет рост или дифференцировку клеток ассоциированного с CD40 нарушения. Ассоциированное с CD40 нарушение может представлять, например, хроническую лимфоцитарную лейкемию, лимфому Беркитта, множественную миелому, Т-клеточную лимфому, не-ходжкинскую лимфому, болезнь Ходжкина, макроглобулинемию Вальденстрема или саркому Капоши.
В некоторых вариантах осуществления обеспечиваются способы индукции истощения периферических В-клеток. Способы включают введение анти-CD40-антитела или антигенсвязывающего фрагмента в клетки, где данные анти-CD40-антитело или антигенсвязывающий фрагмент связываются с человеческим клеточным поверхностным антигеном CD40. Связывание антитела или антигенсвязывающего фрагмента с антигеном CD40 индуцирует истощение клеток. Периферические В-клетки могут, например, проявлять аутоиммунную реактивность у субъекта.
Изобретение наилучшим образом понимается при обращении к последующему подробному описанию, включающему предпочтительные варианты осуществления, в совокупности с сопровождающими фигурами и перечнем последовательностей. Приведенное ниже обсуждение является описательным, иллюстративным и примерным и не предназначается для ограничения объема изобретения, определенного формулой изобретения.
Краткое описание фигур
На фигуре 1А и 1В представлен полипептид (SEQ ID NO:18) и кодирующая (SEQ ID NO:17) и комплементарная последовательности ДНК тяжелой цепи гуманизированного анти-CD40-антитела. Полинуклеотидная последовательность снабжена примечаниями с указанием положения лидерной последовательности, вариабельной области и константной области человеческого IgG1. На фигуре 1С представлен полипептид (SEQ ID NO:21) и кодирующая (SEQ ID NO:20) и комплементарная последовательности ДНК легкой цепи гуманизированного анти-CD40-антитела. Полинуклеотидная последовательность снабжена примечаниями с указанием положения лидерной последовательности, вариабельной области и константной области человеческой легкой цепи каппа.
На фигуре 2 показано влияние обработки контрольным антителом, мышиным анти-CD40-антителом и гуманизированным анти-CD40-антителом на объем опухолей, определенной в течение двухнедельного периода, при обработке, начиная с 13 суток после трансплантации опухолей.
На фигуре 3 показано влияние обработки контрольным антителом, мышиным анти-CD40-антителом и гуманизированным анти-CD40-антителом на выживаемость мышей с опухолями.
Подробное описание изобретения
Для ясности раскрытия и не в качестве ограничения подробное описание изобретения разделяется на подразделы, которые следуют ниже.
Когда здесь используются торговые названия, то торговое название относится к торговому названию композиции продукта, названию лекарственного препарата «дженерика» и активному фармацевтическому ингредиенту(ам) продукта с торговым названием, если не указано иначе в контексте.
Если не указано иначе, то все использованные технические и научные термины имеют то же значение, которое обычно понимается специалистами в данной области по отношению к описанным способам и композициям.
Определения
Термины «CD40» и «поверхностный антиген CD40» относятся к гликопротеину массой 50 кДа, экспрессированному на поверхности нормальных и злокачественных В-клеток, который функционирует в качестве рецептора для сигналов, принимающих участие в пролиферации и дифференцировке и в некоторых случаях относится к Вр50 (Ledbetter et al., 1987, J. Immunol. 138: 788-785). Молекула кДНК, кодирующая CD40, была выделена из библиотеки, полученной из клеточной линии Raji лимфомы Беркитта (Stamenkovich et al., 1989, EMBO J., 8: 1403). Клетка, которая экспрессирует CD40, представляет собой любую клетку, для которой характерна экспрессия CD40 на поверхности, включая, но не ограничиваясь этим, нормальные и злокачественные В-клетки, разобщающие клетки, базальные эпителиальные клетки, клетки карциномы, макрофаги, эндотелиальные клетки, фолликулярные дендритные клетки, клетки миндалин и плазматические клетки, производные костного мозга. В некоторых вариантах осуществления молекула CD40 представляет молекулу человеческого CD40.
Термины «антигенный эпитоп CD40» и «эпитоп CD40», в том смысле, в котором они здесь используются, относятся к молекуле (например, пептиду) или фрагменту молекулы, способным вступать в иммунные реакции с анти-CD40-антителом и, например, они включают антигенную детерминанту CD40, распознаваемую моноклональным антителом S2C6. Антигенные эпитопы CD40 могут быть включены в белки, фрагменты белков, пептиды и тому подобное. Наиболее часто эпитопы представляют белки, короткие олигопептиды, имитаторы олигопептидов (т.е. органические соединения, которые имитируют способность связывания антитела с антигеном CD40) или их комбинации.
В том смысле, в котором они здесь используются, термины «специфическое связывание» и «специфически связываться» относятся к связыванию антитела с предопределенным антигеном. Как правило, антитело связывается с аффинностью, составляющей, по меньшей мере, примерно 1×107 М-1, и связывается с предопределенным антигеном с аффинностью, которая, по меньшей мере, в два раза выше по сравнению с аффинностью, характерной для связывания с неспецифическим антигеном (например, BSA, казеином), иным чем предопределенный антиген или очень близкий антиген.
«Нативные антитела» и «нативные иммуноглобулины» определяются здесь, как гетеротетрамерные гликопротеины, как правило, с молекулярной массой 150000 дальтон, состоящие из двух идентичных легких цепей (L) и двух идентичных тяжелых цепей (Н). Каждая легкая цепь ковалентно связана с тяжелой цепью дисульфидной связью с образованием гетеродимера. Гетеродимер образуется при ковалентном связывании дисульфидной связью двух идентичных тяжелых цепей таких гетеродимеров. Несмотря на то, что легкие и тяжелые цепи связаны вместе одной дисульфидной связью, количество дисульфидных связей между двумя тяжелыми цепями варьирует в зависимости от изотипа иммуноглобулина. Также каждая тяжелая и легкая цепь содержит регулярно расположенные внутри цепей дисульфидные мостики. Каждая тяжелая цепь имеет на аминоконце вариабельную область (VH), за которой следуют три или четыре константных области (СН1, СН2, СН3 и СН4), а также шарнирную область между СН1 и СН2. Каждая легкая цепь имеет две области, аминоконцевую вариабельную область (VL) и карбоксиконцевую константную область (СL). Область VL нековалентно связана с областью VH, в то время как область СL обычно ковалентно связана с областью СН1 посредством дисульфидной связи. Полагают, что определенные аминокислотные остатки образуют область раздела между вариабельными областями легкой и тяжелой цепей (Chothia et al., 1985, J. Mol. Biol. 186: 651-663).
Термин «гипервариабельный» относится к тому факту, что некоторые последовательности в вариабельных областях сильно различаются по последовательности среди антител и содержат остатки, которые непосредственно участвуют в связывании и определении специфичности каждого конкретного антитела в отношении его специфической антигенной детерминанты. Гипервариабельность в вариабельных областях обеих легкой и тяжелой цепи сосредоточена в трех сегментах, известных как гипервариабельные участки (CDR) или гипервариабельные петли (HVL). CDR определяются при сравнении последовательностей у Kabat et al., 1991, в «Sequences of proteins of immunological interest», 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD), в то время как HVL в структурном отношении определяются по трехмерной структуре вариабельной области, как описано Clothia and Lesk, 1987, J. Mol. Biol. 196: 901-917. Несмотря на то, что два этих метода приводят к несколько различающимся определениям CDR структурное определение является предпочтительным. По определению Kabat CDR-L1 находится примерно в остатках 24-34, CDR-L2 примерно в остатках 50-56 и CDR-L3 примерно в остатках 89-97 вариабельной области легкой цепи; CDR-Н1 находится примерно в остатках 31-35, CDR-Н2 примерно в остатках 50-65 и CDR-L3 примерно в остатках 95-102 вариабельной области тяжелой цепи.
Три CDR в каждой из тяжелой и легкой цепей разделены каркасными областями (FR), которые содержат последовательности с тенденцией к меньшей вариабельности. От аминоконца к карбоксиконцу вариабельных областей тяжелой и легкой цепей FR и CDR расположены в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4. В основном конфигурация β-складки FR располагает каждую из цепей в максимальной близости друг к другу, а также к CDR из другой цепи. Полученная конформация вносит свой вклад в антигенсвязывающий сайт (смотри Kabat et al., 1991, NIH Publ. № 91-3242, Vol. I, pages 647-669), хотя не все остатки CDR обязательно принимают непосредственное участие в связывании антигена.
Остатки FR и константные области Ig не принимают прямого участия в связывании антигена, но вносят свой вклад в связывание антигена и/или опосредуют эффекторную функцию антитела. Некоторые остатки FR могут оказывать существенное влияние на связывание антигена, по меньшей мере, тремя путями: нековалентным связыванием непосредственно с эпитопом, взаимодействием с одним или более остатками CDR и влиянием на поверхность раздела между тяжелой и легкой цепями. Константные области непосредственно не участвуют в связывании антигена, но опосредуют различные эффекторные функции Ig, такие как участие антитела в антителозависимой клеточной цитотоксичности (ADCC), комплементзависимой цитотоксичности (СDC) и антителозависимом клеточном фагоцитозе (ADCР).
Легкие цепи иммуноглобулинов позвоночных относятся к одному из двух четко различающихся типов, каппа (κ) и лямбда (λ), на основе аминокислотной последовательности константной области. Для сравнения тяжелые цепи иммуноглобулинов млекопитающих относятся к одному из пяти основных классов согласно последовательности константных областей: IgА, IgD, IgE, IgG и IgМ. IgG и IgА дополнительно подразделяются на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgА1 и IgА2. Константные области тяжелой цепи, которые соответствуют различным классам иммуноглобулинов, называются α, δ, ε, γ и μ. Хорошо известны структуры субъединиц и трехмерные конфигурации классов нативных иммуноглобулинов.
Термины «антитело», «анти-CD40-антитело», «гуманизированное анти-CD40-антитело» и «вариант гуманизированного анти-CD40-антитела» используются здесь в широком смысле и конкретно включают моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела) и фрагменты антител, такие как вариабельные области и другие участки антител, которые проявляют желаемую биологическую активность, например, связывание с CD40.
Термин «моноклональное антитело» (mAb) относится к антителу, полученному из популяции в основном гомогенных антител; т.е. отдельные антитела, составляющие популяцию, являются идентичными, за исключением образующихся в результате природных мутаций, которые могут находиться в минорных количествах. Моноклональные антитела являются высоко специфичными, непосредственно направленными против одной антигенной детерминанты, также называемой эпитопом. Определение «моноклональные» указывает на в основном гомогенную популяцию антител против идентичного эпитопа, и это не следует истолковывать, что требуется получение антител каким-либо определенным методом. Моноклональные антитела можно получить с использованием любого метода или методологии, известных в данной области; например, гибридомным методом, впервые описанным Köhler et al., 1975, Nature 256: 495 или методами на основе рекомбинантной ДНК, известными в данной области (смотри, например, патент США № 4816567). В другом примере моноклональные антитела также можно выделить из фаговой библиотеки антител с использованием методов, описанных Clackson et al., 1991, Nature 352: 624-628 и Marks et al., 1991, J. Mol. Biol. 222: 581-597.
В противоположность антитела при получении поликлональных антител, как правило, представляют гетерогенную популяцию изотипов и/или классов иммуноглобулинов или они также проявляют различную специфичность эпитопа.
Термин «химерное» антитело, в том смысле, в котором он здесь используется, представляет тип моноклонального антитела, у которого часть или полная аминокислотная последовательность одной или более областей или доменов тяжелой и/или легкой цепи идентична, гомологична или представляет вариант соответствующей последовательности в моноклональном антителе и от другого вида или относится к другому классу или изотипу иммуноглобулинов или происходит из другой консенсусной последовательности. Химерные антитела включают фрагменты таких антител, при условии, что фрагмент антитела проявляет желаемую биологическую активность исходного для него антитела, например, в отношении связывания с тем же эпитопом (смотри, например, патент США № 4816567; и Morrison et al., 1984, Proc. Natl. Acad. Sci. USA 81: 6851-6855).
Термины «фрагмент антитела», «фрагмент анти-CD40-антитела», «фрагмент гуманизированного анти-CD40-антитела» и «фрагмент варианта гуманизированного анти-CD40-антитела» относятся к участку полноразмерного анти-CD40-антитела, у которого сохраняется вариабельная область или функциональная способность, например, к специфическому связыванию с эпитопом CD40. Примеры фрагментов антитела включают, но не ограничиваются этим, фрагменты Fab, Fab', F(ab')2, Fd, Fv, scFv и scFv-Fc, диантитело, линейное антитело, одноцепочечное антитело, мини-антитело, диантитело, полученное из фрагментов антител, и мультиспецифические антитела, полученные из фрагментов антител.
Некоторые типы фрагментов антител можно получить ферментативной обработкой полноразмерного антитела. В результате расщепления антител папаином образуются два идентичных антигенсвязывающих фрагмента, называемых фрагментами «Fab», каждый с одним антигенсвязывающим сайтом, и остаточный фрагмент «Fс», названный так за счет его способности легко кристаллизоваться. Fab-фрагмент также содержит константную область легкой цепи и область СН1 тяжелой цепи. Обработка трипсином дает фрагмент F(ab')2, который имеет два антигенсвязывающих сайта и по-прежнему способен к перекрестному связыванию с антигеном.
Fab'-фрагменты отличаются от Fab-фрагментов по наличию нескольких дополнительных остатков в С-конце область СН1, включая один или более цистеинов из шарнирной области антитела. Fab-SH является здесь обозначением Fab', в котором остаток(и) цистеина константных областей имеет тиольную группу. Фрагменты F(ab')2 антитела представляют пары F(ab')2-фрагментов, связанные остатками цистеина в шарнирной области. Также известны другие химические сочетания фрагментов антител.
«Fv» представляет собой минимальный фрагмент антитела, который обладает полным антигенраспознающим и связывающим сайтом, состоящий из димера вариабельной области одной тяжелой и одной легкой цепи в тесной, нековалентной связи. В данной конфигурации три CDR каждой вариабельной области взаимодействуют с образованием антигенсвязывающего сайта на поверхности димера VH-VL. В совокупности шесть CDR придают антителу антигенсвязывающую специфичность.
«Одноцепочечный Fv» или «scFv»-фрагмент антитела представляет одноцепочечный вариант Fv, содержащий области антитела VH и VL, в котором домены расположены в одной полипептидной цепи и который способен распознавать и связываться с антигеном. Полипептид scFv необязательно содержит полипептидный линкер, расположенный между областями VH и VL, который способствует образованию трехмерной структуры scFv для связывания антигена (смотри, например, Pluckthun, 1994, in The Pharmacology of Monoclonal Antibodies, Vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, p. 269-315).
Термин «диантитела» относится к небольшим фрагментам антител, содержащим два антигенсвязывающих сайта. Каждый фрагмент содержит вариабельную область тяжелой цепи (VH), соединенную с вариабельной областью легкой цепи (VL). При использовании линкера, который является слишком коротким для соединения двух доменов в одной цепи, связанные области VH-VL вынуждены соединяться с комплементарными доменами другой цепи с образованием двух антигенсвязывающих сайтов. Более полно диантитела описаны, например, в Европейском патенте 404097; WO 93/11161 и Hollinger et al., 1993, Proc. Natl. Acad. Sci. USA 90: 644-6448.
Термин «линейные антитела» относится к антителам, которые включают пару тандемных Fd-сегментов (VH-СН1-VH-СН1), которые образуют пару антигенсвязывающих областей. Линейные антитела могут быть биспецифическими или моноспецифическими, как описано, например, Zapata et al., 1995, Protein Eng. 8(10): 1057-1062.
Гуманизированное антитело или фрагмент гуманизированного антитела включает вариант аминокислотной последовательности иммуноглобулина или ее фрагмент, которые способны связываться с предопределенным антигеном и которые включают одну или более FR, имеющую в основном аминокислотную последовательность человеческого иммуноглобулина, и один или более CDR, имеющие в основном аминокислотную последовательность, отличную от человеческого иммуноглобулина. Данная последовательность отличного от человеческого иммуноглобулина называется здесь «импортной» последовательностью, которая, как правило, взята из области «импортного» антитела, в частности вариабельной области. В основном гуманизированное антитело включает, по меньшей мере, CDR или HVL отличного от человеческого антитела, вставленные между FR вариабельной области человеческой тяжелой или легкой цепей. В некоторых аспектах гуманизированное анти-CD40-антитело содержит остатки или последовательности CDR и/или HVL, полученные из мышиного моноклонального антитела S2C6, вставленные между FR вариабельных областей человеческой консенсусной последовательности тяжелой и легкой цепи.
В другом аспекте гуманизированное анти-CD40-антитело содержит в основном все из, по меньшей мере, одной, и, как правило, две вариабельные области (такие, например, как в фрагментах Fab, Fab', F(ab')2, Fавс и Fv), в которых все или в основном все CDR соответствуют таковым отличного от человеческого иммуноглобулина, и все или в основном все FR представляют таковые консенсусной последовательности человеческого иммуноглобулина. В другом аспекте гуманизированное анти-CD40-антитело также включает, по меньшей мере, участок Fc-области иммуноглобулина, как правило, человеческого иммуноглобулина. Обычно антитело будет включать легкую цепь, а также, по меньшей мере, вариабельную область тяжелой цепи. Антитело также может включать одно или более из следующего: СН1, шарнирной области, СН2, СН3 и/или СН4 областей тяжелой цепи, где что подходит.
Гуманизированное анти-CD40-антитело может быть выбрано из любого класса иммуноглобулинов, включая IgМ, IgG, IgD, IgА и IgE, и представлять любой изотип, включая IgG1, IgG2, IgG3, IgG4, IgА1 и IgА2. Например, константная область может представлять связывающую комплемент константную область, когда желательно, чтобы гуманизированное антитело проявляло цитотоксическую активность, и изотип, как правило, представляет IgG1. В тех случаях, когда цитотоксическая активность не является желательной, то константная область может быть другого изотипа, например, IgG2. Альтернативное гуманизированное анти-CD40-антитело может содержать последовательности из более чем одного класса или изотипа иммуноглобулинов, и специалисты в данной области могут осуществить выбор конкретных константных областей для оптимизации желаемых эффекторных функций.
Не требуется, чтобы FR и CDR или HVL гуманизированного анти-CD40-антитела точно соответствовали исходным последовательностям. Например, один или более остатков в «импортном» CDR или HVL или консенсусной последовательности FR можно изменить (например, подвергнуть мутагенезу) заменой, вставкой или делецией, так что полученный аминокислотный остаток более не будет идентичен исходному остатку в соответствующем положении в любой исходной последовательности. Такие изменения, однако, как правило, не должны быть значительными. Как правило, по меньшей мере, 75% остатков гуманизированного антитела будет соответствовать таковым в исходных консенсусных FR и «импортных» CDR последовательностях, чаще, по меньшей мере, 90% и чаще всего более чем 95%, или более чем 98%, или более чем 99%.
Остатки иммуноглобулина, которые оказывают влияние на поверхность раздела между вариабельными областями тяжелой и легкой цепей («поверхность раздела VH-VL»), представляют таковые, которые оказывают влияние на близость или ориентацию двух цепей по отношению друг к другу. Некоторые остатки, которые могут участвовать во взаимодействиях между цепями, включают остатки VL 34, 36, 38, 44, 46, 87, 89, 91, 96 и 98, и остатки VH 35, 37, 39, 45, 47, 91, 93, 95, 100 и 103 (используется система нумерации, представленная Kabat et al. «Sequences of proteins of immunological interest» (National Institutes of Health, Bethesda, MD, 1987). Дополнительные остатки включают VL 43 и 85, и остатки VH 43 и 60, как раскрыто в патенте США № 6407213, который включен здесь в полном объеме для сведения. Несмотря на то, что данные остатки указаны только для человеческого IgG, они применимы для других видов. Остатки «импортных» антител, которые как разумно предполагают, принимают участие во взаимодействиях цепей, выбирают для замены в консенсусной последовательности.
Термины «консенсусная последовательность» и «консенсусное антитело», в том смысле, в котором они здесь используются, относятся к аминокислотной последовательности, которая содержит наиболее часто встречаемый аминокислотный остаток в каждом положении во всех иммуноглобулинах любого конкретного класса, изотипа или структуры субъединиц, например, в вариабельной области человеческого иммуноглобулина. Основой консенсусной последовательности могут быть иммуноглобулины определенного вида или многих видов. Понимается, что «консенсусная» последовательность, структура или антитело включают консенсусную человеческую последовательность, описанную в некоторых вариантах осуществления, и относятся к аминокислотной последовательности, которая содержит наиболее часто встречающиеся аминокислотные остатки в каждом положении во всех человеческих иммуноглобулинах любого конкретного класса, изотипа или структуры субъединиц. Обеспечиваются консенсусные человеческие структуры и консенсусные структуры, которые предусматривают другие виды в дополнении к человеку. Таким образом, консенсусная последовательность включает аминокислотную последовательность, имеющую, по меньшей мере, в каждом положении аминокислоту, которая находится в одном или более известном иммуноглобулине, но которая может не точно соответствовать полной аминокислотной последовательности любого одного иммуноглобулина. Консенсусную последовательность вариабельной области не получают из любого естественно продуцированного антитела или иммуноглобулина. Пригодные консенсусные последовательности включают консенсусную последовательность человеческой вариабельной области легкой цепи каппа I (SEQ ID NO:13) и консенсусную последовательность человеческой вариабельной области тяжелой цепи подгруппы III (SEQ ID NO:2), полученные по данным Kabat et al., 1991, в «Sequences of proteins of immunological interest», 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD и их варианты. FR консенсусных последовательностей тяжелой и легкой цепи и их варианты обеспечивают пригодные последовательности для получения гуманизированных анти-CD40-антител. Смотри, например, патенты США № 6037454 и 6054297. В некоторых вариантах осуществления FR, использованные для получения гуманизированных антител, были получены из консенсусных последовательностей для консенсусной последовательности человеческой вариабельной области легкой цепи каппа I и консенсусной последовательности человеческой вариабельной области тяжелой цепи подгруппы III.
В том смысле, в котором они здесь используются, термины «вариант», «вариант анти-CD40-антитела», «вариант гуманизированного анти-CD40-антитела» или «вариантное гуманизированное анти-CD40-антитело» каждый относится к гуманизированному анти-CD40-антителу, имеющему, по меньшей мере, последовательность CDR или HVL вариабельной области тяжелой цепи, полученную из мышиного моноклонального антитела S2C6, и последовательности FR, полученные из человеческих консенсусных последовательностей. Варианты включают таковые, имеющие одну или более замен аминокислот в вариабельных областях одной или обеих легкой или тяжелой цепей, при условии, что изменение аминокислоты не оказывает существенного влияния на связывание антитела с CD40. Как правило, варианты гуманизированных анти-CD40-антител включают замены аминокислот, которые повышают функциональную способность антитела посредством усовершенствованной укладки молекулы антитела.
«Выделенное» антитело представляет таковое, которое было идентифицировано и выделено и/или отделено от компонента его природной среды. Загрязняющие компоненты природной среды антитела представляют такие вещества, которые могут мешать диагностическому или терапевтическому применениям антитела, и они могут представлять собой ферменты, гормоны или другие белковые или небелковые растворенные вещества. В одном аспекте антитело будет очищено:
(а) до более чем 95% чистоты по массе антитела по данным метода Лоури, и в другом аспекте до более чем 99% по массе
или
(b) до степени чистоты, достаточной для получения, по меньшей мере, 15 остатков N-концевой или внутренней аминокислотной последовательности при использовании спинингового чашечного секвенатора, или
(с) до гомогенности при постановке SDS-PAGE в редуцирующих или нередуцирующих условиях с проявлением Кумасси синим или предпочтительно окрашиванием серебром.
Выделенное антитело включает антитело in situ в рекомбинантных клетках, если, по меньшей мере, будет отсутствовать один компонент из природной среды антитела. Как правило, однако, выделенное антитело будет получено при постановке, по меньшей мере, одной стадией очистки.
Термин «функциональная способность антитела» относится к факторам, которые вносят свой вклад в распознавание антителом антигена или эффективность антитела в условиях in vivo. Изменения аминокислотной последовательности антитела могут оказать влияние на свойства антитела, такие как укладка, и могут повлиять на физические факторы, такие как первоначальная скорость связывания антитела с антигеном (ν0), константу диссоциации антитела от антигена (Kd), константу аффинности антитела для антигена, конформацию антитела, стабильность белка и период полураспада антитела.
Термин «меченый эпитоп», при использовании в данном случае, относится к анти-CD40-антителу, гибридизованному с «эпитопом-меткой». «Эпитоп-метка» представляет полипептид, содержащий достаточное количество аминокислот для обеспечения эпитопа для продукции антитела, сконструированный таким образом, что он не оказывает отрицательного влияния на желаемую активность гуманизированного анти-CD40-антитела. Как правило, эпитоп-метка является в достаточной мере уникальным, так что антитело, продуцированное к эпитопу-метке, в основном не будет реагировать перекрестно с другими эпитопами. Подходящие полипептиды для метки обычно содержат, по меньшей мере, 6 аминокислотных остатков и, как правило, 8-50 аминокислотных остатков или примерно 9-30 остатков. Примеры эпитопов-меток и антитела, которые связываются с эпитопом, включают флуоресцентный полипептид-метку НА и его антитело 12СА5 (Field et al., 1988, Mol. Cell Biol. 8: 2159-2165; с-myc метку и антитела к ней 8F9, 3C7, 6E10, G4, B7 и 9Е10 (Evan et al., Mol. Cell Biol. 5(12): 3610-3616; и гликопротеин D вируса герпеса простого (gD) и его антитело (Paborsky et al., 1990, Protein Engineering 3(6): 547-553). В некоторых вариантах осуществления эпитоп-метка представляет «спасающий эпитоп рецептора связывания». В том смысле, в котором он здесь используется, «спасающий эпитоп рецептора связывания» относится к эпитопу Fc-области молекулы IgG (такого как IgG1, IgG2, IgG3 и IgG4), который ответственен за увеличение периода полураспада молекулы IgG в условиях in vivo.
Термин «цитотоксическое средство» относится к соединению, которое ингибирует или подавляет функцию клеток и/или вызывает разрушение клеток. Термин предназначается для включения радиоактивных изотопов (таких как I131, I125, Y90 и Re186), химиотерапевтические препараты и токсины, такие как ферментативно активные токсины бактериального, грибкового, растительного или животного происхождения и их фрагменты. Такие цитотоксические средства можно связать с антителом, например, гуманизированным анти-CD40-антителом, с использованием известных, стандартных методов и применять, например, для лечения пациента, которому показано лечение антителом.
«Химиотерапевтический препарат» представляет химическое соединение, пригодное для лечения злокачественного заболевания. Примеры химиотерапевтических препаратов включают алкилирующие агенты, такие как тиотепа и циклофосфамид (CYTOXANTM); алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включая алтретамин, триэтиленмеламин, тритиленфосфорамид, триэтилентиофосфорамид и триметилоломеламин; ацетогенины (особенно буллатацин и буллатацинон); камптотецин (включая синтетические аналоги топотекана); бриостатин; каллистатин; СС-1065 (включая его синтетические аналоги адозелезин, карзелезин и бизелезин); криптофицины (в частности, криптофицин 1 и криптофицин 8); доластатин, ауристатины (включая аналоги монометил-ауристатин Е и монометил-ауристатин F); дуокармицин (включая синтетические аналоги KW-2189 и CBI-TMI); элейтеробин; панкратистатин; саркодиктиин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, холофосфамид, эстрамустин, ифосфамид, меклоретамин, меклоретамин оксид гидрохлорид, мелфалан, новембихин, фенестерин, преднимустин; трофосфамид, урациловый иприт; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин, ранимустин; антиобитики, такие как антибиотики на основе энедиинов (например, калихеамицин, в частности, калихемицин гамма 1I и калихемицин phiI1, смотри, например, Agnew, Chem. Intl. Ed. Engl. 33: 183-186; динемицин, включая динемицин А; бифосфонаты, такие как клодронат; эсперамицин, а также неокарзиностатин хромофор и близкие хромопротеиновые антибиотики энедиины хромомофоры), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карзинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин (AdriamycinTM) (включая морфолино-доксорубицин, цианоморфолино-доксорубицин, 2-пирролинодоксорубицин и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марселломицин, митомицины, такие как митомицин С, микофенольная кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пуринов, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидинов, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, дромостанолон пропионат, эпитиостанол, мепитиостан, тестолактон; антиадреналовые препараты, такие как аминоглутетимид, митотан, трилостан; восполнители фолиевой кислоты, такие как фролиновая кислота; ацеглатон; альдофосфамид гликозид; аминолевулиновая кислота; энилурацил; амсакрин; бестрабуцил; бизантрен; эдатраксат; дефофамин; демоколцин; диазиквон; элфорнитин; эллиптиний ацетат; эпотилон; этоглюцид; нитрат галлия; гидроксимочевина; лентинан; лонидамин; маитанзиноиды, такие как маитанзин и анзамитоцины; митогуазон; митоксантрон; мопидамол; нитакрин; пентостатин; фенамет; пирарубицин; лозоксантрон; подофиллиновая кислота; 2-этилгидразид; прокарбазин; PSK®; разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновая кислота; триазиквон; 2,2',2”-трихлортриэтиламин; трихотецены (в частности, токсин Т-2, верракурин А, роридин А и ангуидин); уретан; виндезин; дакарбазин; манномустин; митабронитол; митолактол; пипоброман; гацитозин; арабинозид («Ara-C»); циклофосфамид; тиотепа; таксоиды, например, паклитаксел (TAXOL®, Bristol-Myers Squibb Oncology, Princeton, NY) и доксетаксел (TAXOTERETM, Rhone-Poulenс Rorer, Antony, Франция); хлорамбуцил; гемцитабин (GemzarTM); 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин; платина; этопозид (VP-16); ифосфамид; митоксантрон; винкристин; винорелбин (NavelbineTM); новантрон; тенипозид; эдатрексат; дауномицин; аминоптерин; кселода; ибандронат; СРТ-11; ингибитор топоизомеразы RFS 2000; дифтометилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота; капецитабин; и фармацевтически приемлемые соли, кислоты или производные любого из перечисленных препаратов. Также в данное определение входят антигормональные препараты, которые функционируют для регуляции или подавления действия гормонов на опухоли, такие как антиэстрогены и избирательные модуляторы рецепторов эстрогенов (SERM), включая, например, тамоксифен (в том числе NolvadexTM), ралоксифен, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торимифен (FarestonTM); ингибиторы ароматазы, которые ингибируют фермент ароматазу, которая регулирует продукцию эстрогенов в надпочечниках, такие, например, как 4(5)-имидазолы, аминоглутетимид, мегестрол ацетат (MegaceTM), эксеместан, форместан, фадрозол, ворозол (RivisorTM), летрозол (FemaraTM) и анастрозол (ArimidexTM) и антиандрогены, такие как флутамид, нилутамид, бикалутамид, лейпролид и госерелин; и фармацевтически приемлемые соли, кислоты или производные любого из перечисленных препаратов.
Термин «пролекарство», в том смысле, в котором он здесь используется, относится к предшественнику или производному фармацевтически активного соединения, которое является менее цитотоксичным для опухолевых клеток по сравнению с исходным препаратом и способным активироваться или превращаться ферментативным путем в более активную форму. Смотри, например, Wilman, 1986, «Prodrugs in Cancer Chemotherapy», в Biochemical Society Transactions, 14, p. 375-382, 615th Meeting Belfast и Stella et al., 1985, «Prodrugs: a chemical approach to targeted drug delivery», в «Directed Drug Delivery», Borchardt et al., (ed.), p. 247-267, Humana Press. Пригодные пролекарства включают, но не ограничиваются этим, фосфатсодержащие пролекарства, тиофосфатсодержащие пролекарства, сульфатсодержащие пролекарства, пептидсодержащие пролекарства, модифицированные D-аминокислотой пролекарства, гликозилированные пролекарства, β-лактасодержащие пролекарства, необязательно замещенные феноксиацетамидсодержащие пролекарства и необязательно замещенные фенилацетамидсодержащие пролекарства, пролекарства на основе 5-фторцитозина и другие пролекарства на основе 5-фторуридина, которые могут превращаться в более активный цитотоксический свободный препарат. Примеры цитотоксических препаратов, которые можно дериватизировать в пролекарства, включают, но не ограничиваются этим, химиотерапевтические препараты, описанные выше.
Термин «метка» относится к детектируемому соединению или композиции, которую конъюгируют прямо или опосредованно с антителом. Метка может быть детектируемой сама по себе (например, радиоизотопные метки или флуоресцентные метки) или в случае ферментатной метки могут катализировать химическое изменение субстрата или композиции, что делает их детектируемыми. Меченое гуманизированное анти-CD40-антитело можно получить и использовать в различных применениях, включая диагностику в условиях in vitro и in vivo.
«Липосома» представляет небольшую везикулу, состоящую из различных типов липидов, фосфолипидов и/или поверхностно-активного вещества. Липосомы являются пригодными для доставки млекопитающему соединения или композиции, такой как гуманизированное анти-CD40-антитело, раскрытое здесь, необязательно соединенное или в комбинации с одним или более фармацевтически активным препаратом. Компоненты липосомы обычно располагаются в бислойном порядке аналогично расположению липидов в биологических мембранах.
Молекула «выделенной» нуклеиновой кислоты представляет молекулу нуклеиновой кислоты, которая идентифицирована и отделена, по меньшей мере, от одной загрязняющей молекулы нуклеиновой кислоты, с которой она обычно связана в природном источнике нуклеиновой кислоты антитела. Молекула выделенной нуклеиновой кислоты находится в иной форме или состоянии, в которых она найдена в природе. Следовательно, молекулы выделенных нуклеиновых кислот отличаются от молекулы нуклеиновой кислоты, находящейся в нативных клетках. Однако молекула выделенной нуклеиновой кислоты включает нуклеиновокислотную молекулу, находящуюся в клетках, которая обычно экспрессирует антитело, например, нуклеиновокислотная молекула находится в положении хромосомы, отличном от такового в интактных клетках.
Термин «регуляторные последовательности» относится к полинуклеотидным последовательностям, необходимым для экспрессии операбельно связанной кодирующей последовательности в определенном организме-хозяине. Регуляторные последовательности, подходящие для применения в прокариотических клетках, например, включают последовательности промотора, оператора и сайта связывания с рибосомой. Эукариотические регуляторные последовательности включают, но не ограничиваются этим, промоторы, сигналы полиаденилирования и энхансеры. Данные регуляторные последовательности можно использовать для экспрессии и продукции гуманизированного анти-CD40-антитела в прокариотических и эукариотических клетках-хозяевах.
Нуклеиновокислотная последовательность «операбельно связана», когда ее помещают в функциональную связь с другой нуклеиновокислотной последовательностью. Например, препоследовательность нуклеиновой кислоты или секреторный лидер операбельно связан с нуклеиновой кислотой, кодирующей полипептид, если он экспрессируется в виде пробелка, который принимает участие в секреции полипептида; промотор или энхансер операбельно связан с кодирующей последовательностью, если он оказывает влияние на транскрипцию последовательности; или связывающий с рибосомой сайт операбельно связан с кодирующей последовательностью, если он расположен таким образом, что он облегчает трансляцию. Как правило, «операбельно связанный» означает, что связанные последовательности ДНК являются непрерывными и, в случае секреторного лидера, непрерывными и находятся в рамке считывания. Однако энхансеры необязательно являются непрерывными. Соединение можно осуществить лигированием в соответствующих сайтах рестрикции. Если такие сайты отсутствуют, то можно использовать синтетические олигонуклеотидные адапторы или линкеры.
В том смысле, в котором они здесь используются, выражения «клетка», «клеточная линия» и «клеточная культура» применяются взаимозаменяемо и все эти определения включают их потомство. Так, «трансформанты» и «трансформированные клетки» включают первичную данную клетку и культуры, полученные от нее, без учета числа пассажей. Также, очевидно, понятно, что все потомство по составу ДНК может точно не быть идентичным, за счет намеренных или природных мутаций. Также сюда включается мутантное потомство, которое обладает той же функцией или биологической активностью при скрининге, что и первоначально трансформированные клетки. В тех случаях, когда предполагается использование других определений, то это будет понятным по контексту.
Термин «млекопитающее» для целей лечения относится к любому животному, определенному как млекопитающее, включая людей, домашних и сельскохозяйственных животных, и также зоопарковых, спортивных или комнатных животных, таких как собаки, лошади, кошки, коровы и тому подобное. Предпочтительно млекопитающим является человек.
«Нарушение», в том смысле, в котором здесь используется данный термин, представляет собой любое состояние, которое подвергается лечению гуманизированным анти-CD40-антителом, описанным здесь. Оно включает хронические и острые нарушения или заболевания, в том числе патологические состояния, которые предрасполагают млекопитающее к данному нарушению. Не ограничивающие примеры или нарушения, которые поддаются лечению, включают злокачественные заболевания, злокачественные заболевания крови, доброкачественные и злокачественные опухоли, лейкемии и лимфоидные злокачественные образования и воспалительные, ангиогенные и иммунологические заболевания.
Термины «злокачественное заболевание» и «злокачественный» относятся или описывают физиологическое состояние у млекопитающего, которое, как правило, характеризуется неконтролируемым ростом клеток. Примеры злокачественного заболевания включают, но не ограничиваются этим, карциному, лимфому, бластому, саркому и лейкемию.
В том смысле, в котором он здесь используется, термин «ассоциированное с CD40 нарушение» или «ассоциированное с CD40 заболевание» относится к состоянию, при котором показана модификация или элиминация клеток, экспрессирующих CD40. Они включают клетки, экспрессирующие CD40 с аномальной пролиферацией, или клетки, экспрессирующие CD40, которые ассоциированы с раковым или злокачественным ростом. В более конкретные примеры злокачественных заболеваний входят таковые с аномальной экспрессией антигена CD40, включающие В-лимфобластоидные клетки, лимфому Беркитта, множественную миелому, Т-клеточные лимфомы, саркому Капоши, остеосаркому, эпидермальные и эндотелиальные опухоли, злокачественные опухоли поджелудочной железы, легких, молочной железы, яичников, ободочной кишки, простаты, головы и шеи, кожи (меланому), мочевого пузыря и почек. Такие нарушения включают, но не ограничиваются этим, лейкемии, лимфомы, включая В-клеточную лимфому и не-ходжкинскую лимфому, множественную миелому, макроглобулинемию Вальденстрема; солидные опухоли, включая саркомы, такие как остеосаркома, саркома Эвинга, злокачественную меланому, аденокарциному, включая аденокарциному яичников, саркому Капоши/опухоль Капоши и плоскоклеточную карциному.
Ассоциированное с CD40 нарушение также включает заболевания и нарушения иммунной системы, такие как аутоиммунные нарушения и воспалительные заболевания. Такие состояния включают, но не ограничиваются этим, ревматоидный артрит (RA), системную красную волчанку (SLE), склеродерму, синдром Шегрена, рассеянный склероз, воспалительное заболевание кишечника (например, язвенный колит или заболевание Крона), воспаление легких, астму и идиопатическую тромбоцитопеническую пурпуру (ITP).
Используемое выражение «останавливает рост» или «ингибирующее рост» относится к подавлению роста или пролиферации клетки, особенно злокачественной клетки, экспрессирующей антиген CD40. Так, подавление роста, например, приводит к существенному снижению процента злокачественных клеток в S-фазе.
Термин «внутривенная инфузия» относится к введению препарата в вену животного или человека-пациента в течение периода времени более чем примерно 15 мин, как правило, в течение примерно от 30 до 90 мин.
Термин «внутривенный болюс» или «внутривенное импульсивное введение» относится к введению лекарственного препарата в вену животного или человека, таким образом, что в организм препарат поступает в течение примерно 15 мин или менее, как правило, в течение 5 мин или менее.
Термин «подкожное введение» относится к введению препарата под кожу животного или человека-пациента, предпочтительно в «карман» между кожей и низлежащей тканью, посредством медленной, непрерывной доставки из резервуара препарата. Сдавливание или оттягивание кожи вверх и в сторону от низлежащей ткани может создать «карман».
Термин «подкожная инфузия» относится к введению препарата под кожу животного или человека-пациента, предпочтительно в «карман» между кожей и низлежащей тканью, посредством медленной, непрерывной доставки из резервуара препарата в течение периода времени, включая, но не ограничиваясь этим, 30 мин или менее, или 90 мин или менее. Необязательно инфузию можно проводить подкожной имплантацией насоса для доставки лекарственного препарата, имплантированного под кожу животного или человека-пациента, где насос доставляет заранее определенное количество лекарственного препарата в течение заранее определенного периода времени, например, в течение 30 мин, 90 мин или периода времени, составляющего продолжительность схемы лечения.
Термин «подкожный болюс» относится к введению лекарственного препарата под кожу животного или человека-пациента, где доставка болюса лекарственного препарата составляет менее чем примерно 15 мин; в другом аспекте менее чем примерно 5 мин и в еще одном аспекте менее чем примерно 60 сек. В еще одном аспекте введение проводят в «карман» между кожей и низлежащей тканью, где «карман» создают сдавливанием или оттягиванием кожи вверх и в сторону от низлежащей ткани.
Термин «терапевтически эффективное количество» используется по отношению к количеству активного препарата, обладающего полезным действием для пациента, например, способностью подавлять рост или вызывать делецию клеток. В одном аспекте терапевтически эффективное количество обеспечивает апоптозную активность или способность индуцировать гибель клеток. В другом аспекте терапевтически эффективное количество относится к мишеневой концентрации в сыворотке крови, которая, как было установлено, является эффективной, например, для замедления прогрессирования заболевания. Эффективность можно оценить различными путями в зависимости от состояния, которое подвергается лечению. Например, при злокачественных заболеваниях или нарушениях, характеризующихся клетками, экспрессирующими CD40, эффективность можно оценить периодом времени для прогрессирования заболевания (ТТР) или по определению скорости проявления ответной реакции (RR).
Термины «лечение» и «терапия» и тому подобное, в том смысле, в котором они здесь используются, включают терапевтические, а также профилактические, или подавляющие мероприятия в отношении заболевания или нарушения, приводящие к любому клинически желаемому или лечебному эффекту, включая, но не ограничиваясь этим, ослабление или облегчение одного или более симптомов, регрессию, замедление или остановку прогрессирования заболевания или нарушения. Так, например, термин «лечение» включает введение препарата до или после начала развития симптома заболевания или нарушения, тем самым предупреждая или приводя к исчезновению одного или более признаков заболевания или нарушения. В качестве другого примера термин включает введение препарата после клинического проявления заболевания для элиминации симптомов заболевания. Кроме того, введение препарата после начала развития и после появления клинических симптомов, когда введение оказывает влияние на клинические признаки заболевания или нарушения, такие как степень повреждения ткани или уровень или степень метастазирования, независимо от того приводит лечение к ослаблению заболевания или нет, входит в термины «лечение» и «терапия», в том смысле, в котором они здесь используются.
Термин «вкладыш в упаковке» используется здесь по отношению к инструкциям, обычно включаемым в промышленно доступные упаковки терапевтических продуктов, которые содержат информацию о показаниях, применении, введении, противопоказаниях и/или предостережениях, касающихся использования таких терапевтических продуктов.
Сокращенное обозначение «AFP» относится к диметилвалин-валин-долаизолейнин-долапроин-фенилаланин-п-фенилендиамину.
Сокращенное обозначение «ММАЕ» относится к монометилауристатину Е.
Сокращенное обозначение «АЕВ» относится к эфиру, полученному взаимодействием ауристатина Е с параацетилбензойной кислотой.
Сокращенное обозначение «АЕVВ» относится к эфиру, полученному взаимодействием ауристатина Е с бензоилвалериановой кислотой.
Сокращенное обозначение «ММАF» относится к довалин-валин-долаизолейнин-долапроин-фенилаланину.
Антитела
Описанное и раскрытое здесь представляет гуманизированные анти-CD40-антитела и композиции и предметы производства, содержащие гуманизированное анти-CD40-антитело. Также описываются связывающие средства, которые включают антигенсвязывающий фрагмент гуманизированного анти-CD40-антитела. Гуманизированные анти-CD40-антитела и связывающие средства могут остановить рост клеток, вызвать делецию клеток, экспрессирующих CD40, или индуцировать или вызывать иначе цитотоксический или цитостатический эффект на клетки-мишени. Гуманизированные анти-CD40-антитела и связывающие средства можно использовать при лечении различных заболеваний или нарушений, характеризующихся пролиферацией клеток, экспрессирующих поверхностный антиген CD40.
Гуманизированное анти-CD-антитело и связывающее CD40 средство каждое включает, по меньшей мере, участок, который специфически распознает эпитоп CD40 (т.е. антигенсвязывающий фрагмент). В некоторых вариантах осуществления гуманизированное анти-CD-антитело и связывающее CD40 средство включает антигенсвязывающий фрагмент, который конкурирует за связывание с антителом S2C6.
В некоторых вариантах осуществления антигенсвязывающий фрагмент может, например, блокировать пролиферацию или останавливать иначе рост клеток или вызывать их делецию, гибель или иначе их истощение, например, посредством подавления связывания поверхностного антигена CD40. Например, при Т- и В-клеточных новообразованиях противоопухолевые эффекты (например, остановка роста с или без делеции или апоптоза) часто проявляются, когда злокачественные клетки подвергаются воздействию стимула, который приводит к активации нормальных лимфоцитов. Данную индуцированную активацией остановку роста наблюдали с сигналами, передаваемыми через рецепторы антигена или костимуляторные рецепторы (смотри, например, Ashwell et al., 1987, Science 237: 61; Bridges et al., 1987, J. Immunol. 139: 4242; Page and Defranco, 1988, J. Immunol. 140: 3717; и Beckwith et al., 1990, J. Natl. Cancer Inst. 82: 501). Стимуляция CD40, в результате специфического связывания с антителом или растворимым лигандом, подавляет рост В-клеточной лимфомы (смотри, например, Funakoshi et al., 1994, Blood 83: 2787-2794). Препараты, которые подавляют рост злокачественных клеток таким образом и которые направлены против поверхностного антигена CD40, являются примерами подходящих препаратов.
Специфические в отношении CD40 средства включают антигенсвязывающий фрагмент гуманизированного анти-CD40-антитела, который связывается с CD40 (например, человеческим CD40 или его вариантом). Специфические в отношении CD40 средства и антитела можно необязательно конъюгировать или соединить с цитотоксическим или химиотерапевтическим препаратом. В аспектах, в которых гуманизированное антитело связывается с поверхностным антигеном CD40 и вызывает истощение типов клеток, экспрессирующих CD40, связывание в основном характеризуется хомингом с поверхностным антигеном CD40 клеток в условиях in vivo. Подходящие связывающие средства связываются с антигеном CD40 с достаточной аффинностью и/или авидностью так, что специфический к CD40 агент является пригодным в качестве терапевтического препарата за счет специфического направленного действия на клетки, экспрессирующие антиген.
В одном аспекте средство представляет гуманизированное антитело, содержащее CDR мышиного моноклонального антитела S2C6. (Антитело S2C6 описано, например, Paulie et al., 1984, Cancer Immunol. Immunother. 17: 165-179). Было показано, что антитело S2C6 проявляет агонистическую активность по отношению к человеческим периферическим В-клеткам, что было показано по способности антитела стимулировать пролиферацию первичных В-клеток в зависимости от дозы (смотри, например, Paulie et al., 1989, J. Immunol. 142: 590-595), а также по противоопухолевой активности в условиях in vivo (смотри, например, патент США № 6838261).
В некоторых аспектах гуманизированное антитело повышает связывание лиганда CD40 с CD40, по меньшей мере, на 45%, по меньшей мере, на 50%, по меньшей мере, на 60% или, по меньшей мере, на 75%. Способ определения повышения связывания лиганда CD40 с CD40 раскрыт в патенте США № 6838261 (раскрытие которого включено здесь для сведения).
В некоторых вариантах осуществления гуманизированные анти-CD40-антитела, включающие их антигенсвязывающие фрагменты, такие как вариабельные области тяжелой и легкой цепи, содержат аминокислотную последовательность остатков, полученных из CDR или HLV мышиного антитела S2C6 (смотри, например, патент США № 6838261), и аминокислотные остатки, полученные из каркасных областей человеческого иммуноглобулина. В одном аспекте аминокислоты человеческой каркасной области получены из человеческих консенсусных последовательностей вариабельной области тяжелой цепи подгруппы III и вариабельной области легкой цепи каппа, как описано в патенте США № 6037454. Гуманизированные анти-CD40-антитела необязательно включают специфические замены аминокислот в консенсусных каркасных областях.
Специфическая замена аминокислотных остатков в данных положениях каркасной области может привести к улучшению различных аспектов функциональной способности антитела, включая аффинность и/или стабильность связывания по сравнению с гуманизированными антителами, полученными «прямым обменом» CDR или HLV в человеческие консенсусные каркасные области, как показано в примерах приведенных ниже.
В некоторых вариантах осуществления гуманизированные анти-CD40-антитела, раскрытые здесь, содержат, по меньшей мере, вариабельную область тяжелой или легкой цепи, включающую CDR или HLV мышиного моноклонального антитела S2C6, и FR человеческих вариабельных областей консенсусной тяжелой и легкой цепи, имеющие специфические замены, представленные в таблице 5. Сопоставление аминокислотных последовательностей вариабельной области тяжелой цепи, содержащих замены, и аминокислотных последовательностей вариабельной области легкой цепи, содержащих замены, приведены соответственно в таблицах 3 и 4. Последовательности включают вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO:3 и вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO:14.
В некоторых вариантах осуществления гуманизированное анти-CD40-антитело представляет фрагмент антитела. Были разработаны различные способы получения фрагментов антител. Фрагменты можно получить посредством протеолитического расщепления интактных антител (смотри, например, Morimoto et al., 1992, Journal of Biochemical and Biophysical Methods 24: 107-117 и Brennan et al., 1985, Science 229: 81). Альтернативно фрагменты можно получить непосредственно в рекомбинантных клетках-хозяевах. Например, Fab'-SH-фрагменты можно непосредственно выделить из E. coli и химически сочетать с F(ab')2-фрагментами (смотри, например, Carter et al., 1992, Bio/Technology 10: 163-167). При другом подходе F(ab')2-фрагменты можно выделить непосредственно из культуры рекомбинантных клеток-хозяев. Специалистам в данной области известны другие методы получения фрагментов антител.
Некоторые варианты осуществления включают F(ab')2-фрагмент гуманизированного анти-CD40-антитела, содержащий аминокислотную последовательность вариабельной области тяжелой цепи и аминокислотную последовательность вариабельной области легкой цепи соответственно SEQ ID NO:3 и SEQ ID NO:14; соответственно SEQ ID NO:4 и SEQ ID NO:14; соответственно SEQ ID NO:5 и SEQ ID NO:14; соответственно SEQ ID NO:6 и SEQ ID NO:14; соответственно SEQ ID NO:7 и SEQ ID NO:14; соответственно SEQ ID NO:8 и SEQ ID NO:14; соответственно SEQ ID NO:9 и SEQ ID NO:14; соответственно SEQ ID NO:6 и SEQ ID NO:15; соответственно SEQ ID NO:6 и SEQ ID NO:16; соответственно SEQ ID NO:7 и SEQ ID NO:16; соответственно SEQ ID NO:10 и SEQ ID NO:14; соответственно SEQ ID NO:11 и SEQ ID NO:14; соответственно SEQ ID NO:10 и SEQ ID NO:16; или соответственно SEQ ID NO:11 и SEQ ID NO:16. Такие варианты осуществления могут включать интактное антитело, содержащее такой фрагмент F(ab')2.
Другие варианты осуществления включают F(ab')2-фрагмент гуманизированного анти-CD40-антитела, содержащий аминокислотную последовательность вариабельной области тяжелой цепи и аминокислотную последовательность вариабельной области легкой цепи соответственно SEQ ID NO:7 и SEQ ID NO:14; соответственно SEQ ID NO:6 и SEQ ID NO:16; соответственно SEQ ID NO:7 и SEQ ID NO:16; соответственно SEQ ID NO:10 и SEQ ID NO:14; соответственно SEQ ID NO:11 и SEQ ID NO:14; соответственно SEQ ID NO:10 и SEQ ID NO:16; и соответственно SEQ ID NO:11 и SEQ ID NO:16.
Еще одни варианты осуществления включают F(ab')2-фрагмент гуманизированного анти-CD40-антитела, содержащий аминокислотную последовательность вариабельной области тяжелой цепи и аминокислотную последовательность вариабельной области легкой цепи соответственно SEQ ID NO:7 и SEQ ID NO:14; соответственно SEQ ID NO:6 и SEQ ID NO:16; соответственно SEQ ID NO:10 и SEQ ID NO:16; соответственно SEQ ID NO:11 и SEQ ID NO:16.
Некоторые варианты осуществления включают F(ab')2-фрагмент, гуманизированного анти-CD40-антитела, который содержит вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO:10 и вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO:16.
В некоторых вариантах осуществления антитело или фрагмент антитела включает константную область, которая опосредует эффекторную функцию. Константная область может обеспечить антителозависимую клеточную цитотоксичность (ADCC), антителозависимый клеточный фагоцитоз (ADCР) и комплементзависимую цитотоксичность (СDC) против клетки-мишени, экспрессирующей CD40. Эффекторный домен(ы) может представлять, например, Fc-область молекулы Ig. Как правило, связывающее CD40 средство вызывает рекрутмент и/или активирует цитотоксические лейкоциты (например, природные клетки-киллеры (NK), фагоцитирующие клетки (например, макрофаги) и/или комплементные компоненты сыворотки).
Эффекторная область антитела может происходить от любого подходящего вида позвоночных и представлять любой изотип. Изотипы различных видов животных различаются по их способности опосредовать эффекторные функции. Например, способность человеческого иммуноглобулина опосредовать CDC и ADCC/ADCP обычно соответственно находится в следующем порядке IgM≈IgG1≈IgG3>IgG2>IgG4 и IgG1≈IgG3>IgG2/IgM>IgG4. Мышиные иммуноглобулины опосредуют CDC и ADCC/ADCP в основном соответственно в следующем порядке IgM≈IgG3>IgG2b>IgG2а>>IgG1 и IgG2b≈IgG2a>IgG1>>IgG3. В одном примере мышиный IgG2a опосредует ADCC, в то время как оба мышиных IgG2a и IgM опосредуют CDC.
Модификации антител
Гуманизированные анти-CD40-антитела и средства могут включать модификации гуманизированного анти-CD40-антитела или его антигенсвязывающего фрагмента. Например, может быть желательным модифицировать антитело в отношении проявления эффекторной функции, например, для повышения эффективности антитела при лечении злокачественного заболевания. Одной такой модификацией является введение остатка(в) цистеина в Fc-область, посредством чего имеет место образование дисульфидных связей между цепями в данной области. Полученное таким образом гомодимерное антитело может обладать повышенной способностью к интернализации и/или повышенной комплемент-опосредуемой способностью приводить к гибели клеток и/или антителозависимой клеточной цитотоксичностью (ADCC). Смотри, например, Caron et al., 1992, J. Exp. Med. 176: 1191-1195 и Shopes, 1992, J. Immunol. 148: 2918-2922. Гомодимерные антитела, обладающие повышенной противоопухолевой активностью, также можно получить с использованием гетеробифункциональных перекрестных линкеров, описанных Wolff et al., 1993, Cancer Research 53: 2560-2565. Альтернативно можно сконструировать антитело с включением двойных Fc-областей, тем самым, повысив способность антитела к лизису комплемента и ADCC. Смотри Stevenson et al., 1989, Anti-Cancer Drug Design 3: 219-230.
Были получены антитела с повышенной способностью поддерживать ADCC посредством модификации характера гликозилирования их Fc-области. Это является возможным, поскольку гликозилирование антитела по остатку аспарагина, N297, в домене СН2, участвует во взаимодействии между IgG и рецепторами Fcγ, необходимом в качестве предварительного условия для протекания ADCC. Были созданы линии клеток-хозяев для экспрессии антител с измененным гликозилированием, так, например, с повышенным расщеплением N-ацетилглюкозамина или пониженным содержанием фукозы. Снижение фукозы обеспечивает существенное усиление активности ADCC по сравнению с повышением расщепления N-ацетилглюкозамина. Более того, усиление ADCC под действием антител с низким уровнем фукозы не зависит от полиморфизма FcγRIIIa V/F.
Модификация аминокислотной последовательности Fc-области антител является альтернативой для конструирования гликозилирования с целью повышения ADCC. Исследовали сайт связывания в человеческом IgG1 для рецепторов Fcγ с помощью широкого мутационного анализа. Это привело к получению гуманизированных IgG1-антител с мутациями Fc, которые повысили аффинность связывания FcγRIIIa и усилили ADCC в условиях in vitro. Дополнительно были получены варианты Fc со многими различными пермутациями в отношении связывающих свойств, например, с повышенным связыванием со специфическими рецепторами FcγR при неизменном или пониженном связывании с рецепторами FcγR.
В некоторых вариантах осуществления Fc-область можно модифицировать, как описано в публикациях заявок на патент США № 2006-0003412 и 2006-0008883, раскрытие которых включено здесь для сведения.
Другой аспект включает иммуноконъюгаты, содержащие гуманизированное антитело или его фрагменты, конъюгированные с цитотоксическим агентом, таким как химиотерапевтический препарат, токсин (например, ферментативно активный токсин бактериального, грибкового, растительного или животного происхождения или его фрагмент), или радиоактивным изотопом (т.е. радиоактивный конъюгат).
Химиотерапевтические препараты, пригодные для получения таких иммуноконъюгатов, были описаны выше. Ферментативно активные токсины и их фрагменты, которые можно использовать для получения пригодных иммуноконъюгатов, включают цепь А токсина возбудителя дифтерии, не связывающие активные фрагменты токсина возбудителя дифтерии, цепь А экзотоксина (из Pseudomonas aeruginosa), цепь А рицина, цепь А абрина, цепь А модеццина, альфа-сарцин, белки Aleurites fordii, белки диантинов, белки Phytolaca Americana (PAPI, PAPII и PAP-S), ингибитор Momordica charantia, курцин, кротин, ингибитор Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин, трикотецены и тому подобное. Являются промышленно доступными различные радионуклиды для получения радиоконъюгированных гуманизированных анти-CD40-антител. Примеры включают 212Bi, 131I, 131In, 90Y и 186Re.
Конъюгаты гуманизированного анти-CD40-антитела и цитотоксического или химиотерапевтического препарата можно получить известными способами с использованием различных бифункциональных агентов для сочетания белков, таких как N-сукцинимидил-3-(2-пиридилдитиол)пропионат (SPDP), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат HCl), активные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидопроизводные (такие как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис(n-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол 2,6-диизоцианат) и бис-активные фторсодержащие соединения (такие как 1,5-дифтор-2,4-динитробензол). Например, иммунотоксин рицин можно получить, как описано Vitetta et al., 1987, Science 238: 1098. Меченная 14С 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксусная кислота (МХ-DTPA) представляет пример комплексообразующего агента для конъюгации радионуклида с антителом. Смотри, например, международную публикацию заявки WO 94/11026. Также можно получить конъюгаты с отщепляемым линкером, такие как описаны в опубликованной заявке на Европейский патент 0624377, раскрытие которой включено здесь для сведения.
В другом варианте осуществления антитело можно конъюгировать с «рецептором» (таким как стрептавидин) для придания направленности к опухоли. В данном способе конъюгат антитело-рецептор вводят пациенту с последующим удалением несвязанного конъюгата из кровообращения с использованием комплексообразующего агента и затем введением «лиганда», который избирательно связывается с рецептором (например, авидином), где лиганд конъюгирован с цитотоксическим препаратом (например, радионуклидом).
Гуманизированные анти-CD40-антитела, раскрытые здесь, можно формулировать в виде иммунолипосом. Липосомы, содержащие антитело, получают методами, известными в данной области, такими как описаны Epstein et al., 1985, Proc. Natl. Acad. Sci. USA 82: 3688; Hwang et al., 1980, Proc. Natl. Acad. Sci. USA 77: 4030; и в патентах США № 4485045 и 4544545. Раскрыты липосомы с повышенным временем нахождения в кровотоке, например, в патенте США № 5013556.
Особенно пригодные липосомы можно получить методом обратнофазового выпаривания с липидным составом из фосфатидилхолина, холестерина и ПЭГ-дериватизованного фосфатидилэтаноламина (ПЭГ-РЕ). Липосомы экструдируют через фильтры с определенным размером пор для получения липосом желаемого диаметра. Fab'-фрагменты антитела, раскрытого здесь, можно конъюгировать с липосомами, как описано Martin et al., 1982, J. Biol. Chem. 257: 286-288 посредством реакции обмена дисульфидов. В липосоме необязательно находится химиотерапевтический препарат (такой как доксорубицин). Смотри, например, Gabizon et al., 1989, J. National Cancer. Inst. 81(19): 1484.
Антитела, описанные и раскрытые здесь, также можно использовать в способах ADEPT (направленной антителами ферментативной терапии пролекарствами) посредством конъюгации антитела с активирующим пролекарство ферментом, который превращает пролекарство (например, пептидиловый химиотерапевтический препарат) в активный противоопухолевый препарат. Смотри, например, WO 81/01145, WO 88/07378 и патент США № 4975278. Ферментный компонент иммуноконъюгата, пригодный для ADEPT, представляет собой фермент, способный активироваться на молекуле пролекарства таким образом, что он превращает его в более активную, цитотоксическую форму. Специфические ферменты, которые являются пригодными для ADEPT, включают, но не ограничиваются этим, щелочную фосфатазу для превращения фосфатсодержащих пролекарств в свободные препараты; арилсульфатазу для превращения сульфатсодержащих пролекарств в свободные препараты; цитозиндезаминазу для превращения нетоксичного 5-фторцитозина в противоопухолевый препарат, 5-фторурацил; протеазы, такие как протеаза серратиа, термолизин, субтилизин, карбоксипептидазы и катепсины (такие как катепсины В и L) для превращения пептидсодержащих пролекарств в свободные препараты; D-аланилкарбоксипептидазы для превращения пролекарств, содержащих D-аминокислоты в качестве заместителей; расщепляющие углеводы ферменты, такие как β-галактозидаза и нейраминидаза, для превращения гликозилированных пролекарств в свободные препараты; β-лактамазу для превращения лекарственных препаратов, дериватизованных β-лактамами, в свободные препараты; и пенициллинамидазы, такие как пенициллинамидаза V или пенициллинамидаза G для превращения лекарственных препаратов, дериватизованных по атомам азота их аминогрупп соответственно феноксиацетильной или фенилацетильной группами, в свободные препараты. Альтернативно можно использовать антитела с ферментативной активностью («абзимы») для превращения пролекарств в свободные активные препараты (смотри, например, Massey, 1987, Nature 328: 457-458). Конъюгаты антитело-абзим можно получить известными методами для доставки абзима к популяции опухолевых клеток, например, ковалентным связыванием фермента с гуманизированным анти-CD40-антителом/гетеробифункциональными «сшивающими» реагентами, обсужденными выше. Альтернативно можно сконструировать гибридные белки, содержащие, по меньшей мере, одну антигенсвязывающую область антитела, раскрытого здесь, связанную, по меньшей мере, с функционально активным участком фермента, описанного выше, с использованием методов рекомбинантной ДНК (смотри, например, Neuberger et al., 1984, Nature 312: 604-608).
В некоторых вариантах осуществления может быть желательным использовать фрагмент гуманизированного анти-CD40-антитела, в большей степени, чем интактное антитело, например, для повышения проникновения в опухоль. Может быть желательным модифицировать фрагмент антитела в целях повышения периода полураспада в сыворотке крови. Этого можно достичь, например, включением «спасательного эпитопа рецептора связывания» во фрагмент антитела. В одном методе можно изменить соответствующую область фрагмента антитела (например, подвергнуть мутации) или эпитоп можно включить в пептид-метку, который затем гибридизовать с фрагментом антитела в одном конце или в середине, например, синтезом ДНК или пептида. Смотри, например, WO 96/32478.
В других вариантах осуществления также включаются ковалентные модификации гуманизированного анти-CD40-антитела. Их можно осуществить химическим синтезом или ферментативным или химическим расщеплением антитела, что как в данном случае применимо. В молекулу можно ввести другие типы ковалентных модификаций антитела взаимодействием аминокислотных остатков-мишеней антитела с органическим реагентом для дериватизации, который способен взаимодействовать с выбранными боковыми цепями или амино- или карбоксиконцевыми остатками.
Ковалентные модификации включают модификацию остатков цистеина, остатков гистидина, лизина и аминоконцевых остатков, остатков аргинина, остатков тирозина, карбоксильных боковых цепей (аспарагина или глутамина), остатков глутамина и аспарагина или серина, или треонина. Другой тип ковалентной модификации включает химическое или ферментативное сочетание гликозидов с антителом.
Удаление любых углеводных групп, присутствующих в антителе, можно осуществить химическим или ферментативным путем. Химическое дегликозилирование описано Hakimuddin et al., 1987, Arch. Biochem. Biophys. 259: 52 и Edge et al., 1981, Anal. Biochem. 118: 131. Можно провести ферментативное расщепление углеводных групп в антителах с использованием различных эндо- и экзогликозидаз, как описано Thotakura et al., 1987, Meth. Enzymol. 138: 350.
Другой тип пригодной ковалентной модификации включает связывание антитела с одним из различных небелковых полимеров, например, полиэтиленгликолем, пропиленгликолем или полиоксиалкиленами, способами, описанными в одном или более из следующего: патенте США № 4640835, патенте США № 4496689, патенте США № 4301144, патенте США № 4670417, патенте США № 4791192 и патенте США № 4179337.
Гуманизирование и варианты аминокислотных последовательностей
В примере 1 ниже описаны способы получения гуманизированного анти-CD40-антитела, в то время как в примере 2 приведены варианты. В некоторых вариантах осуществления может быть желательным получить варианты аминокислотных последовательностей данных гуманизированных антител, в частности, таковые с улучшенной аффинностью связывания или другими биологическими свойствами гуманизированного антитела.
Варианты аминокислотных последовательностей анти-CD40-антитела можно получить введением соответствующих замен нуклеотидов в ДНК анти-CD40-антитела или пептидным синтезом. Такие варианты включают, например, делеции и/или вставки, и/или замены остатков в аминокислотных последовательностях анти-CD40-антител, приведенных здесь в качестве примеров. Проводят любую комбинацию делеций, вставок и замен для получения в конечной конструкции, при условии, что конечная конструкция обладает желаемыми характеристиками. Аминокислотные замены могут также изменить посттрансляционный процессинг гуманизированного анти-CD40-антитела или его варианта, например, изменение числа или положения сайтов гликозилирования.
Подходящий метод идентификации определенных остатков или областей анти-CD40-антитела, которые являются предпочтительными положения для мутагенеза, называется «аланин сканирующим мутагенезом», описанный Cunningham and Wells (Science, 244: 1081-1085 (1989)). В данном случае идентифицируют остаток или группу остатков-мишеней (например, заряженные остатки, такие как arg, asp, his, lys и glu) и замещают на нейтральную или отрицательно заряженную аминокислоту (как правило, аланин) для оказания влияния на взаимодействие аминокислот с антигеном CD40. Данные аминокислотные положения, проявляющие функциональную чувствительность к заменам, затем удаляют введением дополнительных или других вариантов в или на сайты замещения. Таким образом, несмотря на то, что сайт введения вариации аминокислотной последовательности определен заранее, природа мутации сама по себе не определяется заранее. Например, для анализа проведения мутации в данном сайте проводят аланин сканирующий или произвольный мутагенез в мишеневом кодоне или области и экспрессированные варианты анти-CD40-антитела подвергают скринингу на желаемую активность.
Вставки в аминокислотную последовательность включают амино- и/или карбоксиконцевые гибридные конструкции размером в пределах от одного остатка до полипептидов, содержащих сто или более остатков, а также вставки внутри последовательности из одного или многих аминокислотных остатков. Примеры концевых вставок включают анти-CD40-антитело, гибридизованное с эпитоп-меткой. Другие инсерционные варианты молекулы анти-CD40-антитела включают гибридизацию с N- и С-концом анти-CD40-антитела с ферментом или полипептидом, который повышает период полураспада антитела.
Другим типом варианта является вариант замены аминокислоты. Данные варианты имеют, по меньшей мере, один аминокислотный остаток в молекуле анти-CD40-антитела, который удален и на его место вставлен другой остаток. Сайты, которые представляют наибольший интерес для заместительного мутагенеза, включают гипервариабельные участки, но также предусматриваются изменения FR. Консервативные замены представлены в таблице 1 под заголовком «предпочтительные замены». Если такие замены приводят к изменению биологической активности, то можно ввести более существенные замены, обозначенные «примерные замены», или как дополнительно будет представлено ниже при обращении к группам аминокислот, и продукты подвергнуть скринингу.
Таблица 1


Существенные модификации в биологических свойствах антитела осуществляют выбором замен, которые значительно различаются по их влиянию на поддержание (а) структуры остова полипептида в области замены, например, в виде складчатой или спиральной конформации, (b) заряда или гидрофобности молекулы в месте-мишени или (с) размера боковой цепи. Природные остатки подразделяются на группы на основе общих свойств боковой цепи:
(1) гидрофобные: норлейцин, met, ala, val, leu, ile;
(2) нейтральные гидрофильные: cys, ser, thr;
(3) кислые: asp, glu;
(4) основные: asn, gin, lys, arg;
(5) остатки, которые влияют на ориентацию цепи: gly, pro; и
(6) ароматические: trp, tyr, phe.
Неконсервативные замены будут включать замену члена одной группы на другую группу.
Любой остаток цистеина, не участвующий в поддержании правильной конформации гуманизированного или вариантного анти-CD40-антитела, также может быть замещен, как правило, на серин, для повышения стабильности молекулы к окислению, предотвращения аберрантного перекрестного «сшивания» или обеспечения установленных точек конъюгации с цитоксическим или цитостатическим соединением. В противоположность цистеиновую связь(и) можно добавить в антитело для повышения его стабильности (в частности, в тех случаях, когда антитело представляет фрагмент антитела, такой как Fv-фрагмент).
Тип заместительного варианта включает замещение одного или более остатков гипервариабельного участка исходного антитела (например, гуманизированного или человеческого антитела). Как правило, полученный вариант(ы), выбранные для последующей разработки, будут обладать улучшенными биологическими свойствами по сравнению с исходным антителом, из которого они получены. Удобным способом получения таких заместительных вариантов является созревание аффинности с использованием фагового дисплея. Вкратце, несколько сайтов гипервариабельного участка (например, 6-7 сайтов) подвергают мутации для получения всех возможных замен аминокислот в каждом сайте. Полученные таким образом варианты антител экспонируют моновалентным образом на частицах нитчатого фага в виде гибридных конструкций с продуктом гена III М13, упакованного в каждой частице. Затем расположенные на фаге варианты подвергают скринингу на их биологическую активность (например, аффинность связывания). Для идентификации кандидатов, сайтов гипервариабельного участка, для модификации можно провести аланин-сканирующий мутагенез для установления остатков гипервариабельного участка, вносящих существенный вклад в связывание антигена. Альтернативно или дополнительно к этому может быть полезным проанализировать кристаллическую структуру комплекса антиген-антитело для идентификации точек контакта между антителом и человеческим CD40. Такие остатки для контакта и соседние остатки являются кандидатами для замещения согласно разработанным здесь способам. После получения таких вариантов панель вариантов подвергают скринингу, как здесь описано, и антитела с наилучшими свойствами, проявленными в одном или более соответствующих тестах, можно отобрать для дальнейшей разработки.
Другой тип аминокислотного варианта антитела изменяет первоначальный характер гликозилирования антитела. Под «изменением» понимается делеция одной или более углеводных групп, обнаруженных в антителе, и/или добавление одного или более сайтов гликозилирования, которые отсутствуют в антителе.
Гликозилирование антител, как правило, является N-связанным или О-связанным. N-связанное относится к присоединению углеводородной группы к боковой цепи остатка аспарагина. Трипептидные последовательности аспарагин-Х-серин и аспарагин-Х-треонин, где Х представляет любую аминокислоту, за исключением пролина, являются последовательностями распознавания для ферментативного присоединения углеводной группы к боковой цепи остатка аспарагина. Таким образом, присутствие любой из данных трипептидных последовательностей в полипептиде создает потенциальный сайт гликозилирования. О-связанное гликозилирование относится к присоединению одного из сахаров, N-галактозамина, галактозы или ксилозы, с оксиаминокслотой, чаще всего серином или треонином, хотя, также можно использовать 5-оксипролин или 5-оксилизин.
Добавление сайтов гликозилирования в антитело соответственно проводят изменением аминокислотной последовательности, так чтобы она содержала одну или более представленных выше трипептидных последовательностей (для сайтов N-связанного гликозилирования). Можно также сделать изменение добавлением или заменой одного или более остатков серина или треонина в последовательности исходного антитела (для сайтов О-связанного гликозилирования).
Молекулы нуклеиновых кислот, кодирующие варианты аминокислотных последовательностей анти-CD40-антитела, получают различными методами, известными в данной области. Данные методы включают, но не ограничиваются этим, олигонуклеотид-опосредованный (или сайт-направленный) мутагенез, ПЦР-мутагенез или кассетный мутагенез ранее полученного варианта или невариантной версии анти-CD40-антитела.
Человеческие антитела
В качестве альтернативы гуманизации можно получить человеческие антитела. Например, можно использовать трансгенных животных (например, мышей), которые способны при иммунизации продуцировать полный спектр человеческих антител при отсутствии продукции эндогенного иммуноглобулина. Например, было описано, что гомозиготная делеция гена соединяющей области (JH) тяжелой цепи антитела у химерных и мутантных мышей зародышевой линии приводит к полному подавлению продукции эндогенных антител. Перенос совокупности генов иммуноглобулинов человеческой зародышевой линии таким мутантным мышам будет приводить к продукции человеческих антител при стимуляции антигеном. Смотри, например, Jakobovits et al., 1993, Proc. Natl. Acad. Sci. USA 90: 2551; Jakobovits et al., 1993, Nature 362: 255-258; Bruggermann et al., 1993, Year in Immunol. 7: 33 и патенты США № 5591669; 5589369; 5545807; 6075181; 6150584; 6657103 и 6713610.
Альтернативно можно использовать технологию фагового дисплея (смотри, например, McCafferty et al., 1990, Nature 348: 552-553) для получения человеческих антител и фрагментов антител в условиях in vitro из спектра генов вариабельной области (V) иммуноглобулинов от иммунизированных доноров. По данной методике гены V-области антитела клонируют в рамке считывания с одним из генов основного или минорного белков оболочки нитчатого бактериофага, такого М13 или fd, и экспонируют в виде функциональных фрагментов антитела на поверхности фаговой частицы. За счет того, что нитчатая частица содержит копию одноцепочечной ДНК генома фага, отбор, основанный на функциональных свойствах антитела, также приводит к отбору гена, кодирующего антитело, проявляющего данные свойства. Таким образом, фаг имитирует некоторые свойства В-клетки. Фаговый дисплей можно осуществить в различных форматах; например, смотри обзор Johson and Chiswell, 1993, Current Opinion in Structural Biology 3: 564-571. Можно использовать несколько источников сегментов V-генов для фагового дисплея. Clackson et al., 1991, Nature 352: 624-628 выделили различную совокупность антител против оксазолона из небольшой произвольной комбинаторной библиотеки V-генов, полученных из селезенки иммунизированных мышей. Можно сконструировать группу V-генов от иммунизированных людей-доноров и можно выделить различную совокупность антигенов (включая аутоантигены) в основном следуя методам, описанным Marks et al., 1991, J. Mol. Biol. 222: 581-597 или Griffith et al., EMBO J. 12: 725-734. Смотри, например, патенты США № 5565332 и 5573905. Как уже обсуждалось выше, можно также получить человеческие антитела с помощью активированных В-клеток в условиях in vitro (смотри патенты США №№ 5567610 и 5229275).
Полинуклеотиды, векторы, клетки-хозяева и способы рекомбинации
Другие варианты осуществления включают выделенные полинуклеотиды, которые содержат последовательность, кодирующую анти-CD40-антитело, векторы и клетки-хозяева, содержащие полинуклеотиды, и способы рекомбинации для получения гуманизированного антитела. Выделенные полинуклеотиды могут кодировать любую желаемую форму анти-CD40-антитела, включая, например, полноразмерные моноклональные антитела, фрагменты Fab, Fab', F(ab')2 и Fv, диантитела, линейные антитела, молекулы одноцепочечных антител и мультиспецифические антитела, полученные из фрагментов антител.
Некоторые варианты осуществления включают выделенные полинуклеотиды, содержащие последовательности, которые кодируют антитело или фрагмент антитела, имеющие аминокислотную последовательность вариабельной области тяжелой цепи SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10 или SEQ ID NO:11. Некоторые варианты осуществления включают выделенные полинуклеотиды, содержащие последовательности, которые кодируют антитело или фрагмент антитела, имеющие аминокислотную последовательность вариабельной области легкой цепи SEQ ID NO:14, SEQ ID NO:15 или SEQ ID NO:16.
В одном аспекте выделенная полинуклеотидная последовательность(и) кодирует антитело или фрагмент антитела, содержащие вариабельную область тяжелой цепи и вариабельную область легкой цепи, имеющие аминокислотные последовательности соответственно SEQ ID NO:3 и SEQ ID NO:14; соответственно SEQ ID NO:4 и SEQ ID NO:14; соответственно SEQ ID NO:5 и SEQ ID NO:14; соответственно SEQ ID NO:6 и SEQ ID NO:14; соответственно SEQ ID NO:7 и SEQ ID NO:14; соответственно SEQ ID NO:8 и SEQ ID NO:14; соответственно SEQ ID NO:9 и SEQ ID NO:14; соответственно SEQ ID NO:6 и SEQ ID NO:15; соответственно SEQ ID NO:6 и SEQ ID NO:16; соответственно SEQ ID NO:7 и SEQ ID NO:16; соответственно SEQ ID NO:10 и SEQ ID NO:14; соответственно SEQ ID NO:11 и SEQ ID NO:14; соответственно SEQ ID NO:10 и SEQ ID NO:16; или соответственно SEQ ID NO:11 и SEQ ID NO:16.
В другом аспекте выделенная полинуклеотидная последовательность(и) кодирует антитело или фрагмент антитела, содержащие вариабельную область тяжелой цепи и вариабельную область легкой цепи, имеющие аминокислотные последовательности соответственно SEQ ID NO:7 и SEQ ID NO:14; соответственно SEQ ID NO:6 и SEQ ID NO:16; соответственно SEQ ID NO:7 и SEQ ID NO:16; соответственно SEQ ID NO:10 и SEQ ID NO:14; соответственно SEQ ID NO:11 и SEQ ID NO:14; соответственно SEQ ID NO:10 и SEQ ID NO:16; и соответственно SEQ ID NO:11 и SEQ ID NO:16.
В еще одном аспекте выделенная полинуклеотидная последовательность(и) кодирует антитело или фрагмент антитела, содержащие вариабельную область тяжелой цепи и вариабельную область легкой цепи, имеющие аминокислотные последовательности соответственно SEQ ID NO:7 и SEQ ID NO:14; соответственно SEQ ID NO:6 и SEQ ID NO:16; соответственно SEQ ID NO:10 и SEQ ID NO:16; и соответственно SEQ ID NO:11 и SEQ ID NO:16.
В еще одном аспекте выделенная полинуклеотидная последовательность(и) кодирует антитело или фрагмент антитела, содержащие вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO:10, и вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO:16.
Полинуклеотид(ы), который содержит последовательность, кодирующую гуманизированное анти-CD40-антитело или его фрагмент или цепь, можно гибридизовать с одной или более регуляторной или контрольной последовательностью, известной в данной области, и можно поместить в подходящие экспрессирующие векторы или клетки-хозяева, известные в данной области. Каждую из полинуклеотидных молекул, кодирующих вариабельные области тяжелой или легкой цепей, можно независимо гибридизовать с полинуклеотидной последовательностью, кодирующей константную область, такую как человеческая константная область, что обеспечивает продукцию интактных антител. Альтернативно полинуклеотиды или их участки можно гибридизовать вместе с обеспечением матрицы для получения одноцепочечного антитела.
Для рекомбинантного получения полинуклеотид, кодирующий антитело, вставляют в реплицирующий вектор для последующего клонирования (амплификации ДНК) или для экспрессии. Доступны многие подходящие векторы для экспрессии рекомбинантного антитела. Компоненты векторов, как правило, включают, но не ограничиваются этим, одно или более из следующего: сигнальную последовательность, точку начала репликации, один или более генов-маркеров, энхансер, промотор и последовательность терминации транскрипции.
Гуманизированные анти-CD40-антитела можно также получить в виде гибридных полипептидов, в которых антитело гибридизовано с гетерологичным полипептидом, таким как сигнальная последовательность, или другим полипептидом, обладающим специфическим сайтом расщепления на аминоконце зрелого белка или полипептида. Выбранная гетерологичная сигнальная последовательность, как правило, представляет таковую, которая распознается и процессируется (т.е. расщепляется сигнальной пептидазой) клеткой-хозяином. Для прокариотических клеток-хозяев, которые не распознают и не процессируют сигнальную последовательность гуманизированного анти-CD40-антитела, сигнальную последовательность можно заменить на прокариотическую сигнальную последовательность. Сигнальная последовательность может представлять, например, щелочную фосфатазу, пенициллиназу, липопротеин, лидеры устойчивого к нагреванию энтеротоксина II и тому подобное. Для секреции у дрожжей природную сигнальную последовательность можно заменить, например, на лидерную последовательность, полученную из дрожжевого α-фактора инвертазы (включая лидеры α-фактора Saccharomyces и Kluyveromyces), лидеры кислой фосфатазы, глюкоамилазы C. albicans, или сигнальную последовательность, описанную в WO 090/13646. В клетках млекопитающих можно использовать сигнальные последовательности млекопитающих, а также вирусные секреторные лидеры, например, сигнал gD простого вируса герпеса. ДНК области такого предшественника лигируют в рамку считывания ДНК, кодирующей гуманизированное анти-CD40-антитело.
Экспрессирующий и клонирующий векторы содержат нуклеиновокислотную последовательность, которая обеспечивает репликацию вектора в одной или более клетках-хозяевах. Как правило, в клонирующих векторах данная последовательность представляет таковую, которая способствует вектору реплицироваться независимо от хромосомной ДНК хозяина, и включает точки начала репликации или автономно реплицирующиеся последовательности. Такие последовательности хорошо известны для различных бактерий, дрожжей и вирусов. Точка начала репликации из плазмиды pBR322 является подходящей для большинства грамотрицательных бактерий, точка начала репликации плазмиды 2 мк пригодна для дрожжей, и различные вирусные точки начала репликации (SV40, полиомы, аденовируса, VSV или BPV) пригодны для клонирующих векторов в клетках млекопитающих. Обычно компонент точка начала репликации не является необходимым для экспрессирующих векторов млекопитающих (как правило, можно использовать точку начала репликации SV40 только потому, что она включает ранний промотор).
Экспрессирующий и клонирующий векторы могут содержать селектирующий ген, также называемый селектируемым маркером. Обычные селектирующие гены кодируют белки, которые а) придают резистентность к антибиотикам или другим токсинам, например, ампициллину, неомицину, метотрексату или тетрациклину, b) дополняют ауксотрофную недостаточность или с) поставляют важные питательные вещества, отсутствующие в сложных средах, например, ген, кодирующий рацемазу D-аланина для Bacilli.
В одном примере схемы отбора используется препарат для остановки роста клетки-хозяина. Данные клетки, которые с успехом трансформируются гетерологичным геном, продуцируют белок, придающий резистентность к препарату и, таким образом, выживают в схеме отбора. В примерах такой доминантной селекции используются препараты неомицин, микофенольная кислота и гигромицин.
Другим примером подходящих селектируемых маркеров для клеток млекопитающих являются таковые, с помощью которых возможно идентифицировать клетки, компетентные для «приема» нуклеиновой кислоты, кодирующей гуманизированное анти-CD40-антитело, такие как DHFR (дигидрофолатредуктаза), тимидинкиназа, металлотионеин-I и -II (такие как гены металлотионеина приматов), аденозиндезаминаза, орнитиндекарбоксилаза и т.д.
Например, клетки, трансформированные селектируемым геном DHFR, вначале идентифицируют при культивировании всех трансформантов в культуральной среде, содержащей метотрексат (Mtx), конкурентный антагонист DHFR. Подходящей клеткой-хозяином, в случае когда применяется DHFR дикого типа, является линия клеток яичника китайского хомяка (СНО) с дефицитом активности DHFR (например, DG44).
Альтернативно можно отобрать клетки-хозяева (в частности, хозяева дикого типа, которые содержат эндогенную DHFR), трансформированные или котрансформированные ДНК-последовательностями, кодирующими гуманизированное анти-CD40-антитело, белком DHFR дикого типа и другим селектируемым маркером, таким как аминогликозид-3'-фосфотрансфераза (АРН), при культивировании клеток в среде, содержащей селектирующий агент для селектируемого маркера, такой как антибиотик аминогликозидного ряда, например, канамицин, неомицин или G418. Смотри, например, патент США № 4965199.
Подходящим селектирующим геном для применения в дрожжах является ген TRP1, присутствующий в дрожжевой плазмиде YRp7 (Stinchcomb et al., Nature, 282: 39 (1979)). Ген TRP1 обеспечивает селектирующий маркер для мутантного штамма дрожжей с отсутствием способности расти в среде при наличии триптофана, например, АТСС № 44076 или РЕР4-1 (Jones, 1977, Genetics, 1977, 85: 12). Присутствие участка TRP1 в геноме дрожжевой клетки-хозяина затем обеспечивает эффективную среду для детектирования трансформации при культивировании в отсутствии триптофана. Аналогично штаммы дрожжей c дефицитом Leu2, такие как АТСС 20622 или 38626, дополняются известными плазмидами, имеющими ген LEU2.
Кроме того, векторы, полученные из 1,6 мкм круговой плазмиды pKD1, можно использовать для трансформации дрожжей Kluyveromyces. Альтернативно имелись сообщения об экспрессирующей системе для крупномасштабного получения рекомбинантного бычьего химозина на основе K. lactis (Van den Berg, 1990, Bio/Technology, 8: 135. Также раскрыты стабильные мультикопийные экспрессирующие векторы для секреции зрелого человеческого сывороточного альбумина промышленными штаммами Kluyveromyces (Fleer et al., 1991, Bio/Technology, 9: 968-975).
Экспрессирующие и клонирующие векторы, как правило, содержат промотор, который распознается организмом-хозяином, и он операбельно связан с молекулой нуклеиновой кислоты, кодирующей анти-CD40-антитело или его полипептид. Подходящие промоторы для применения с прокариотическими хозяевами включают промотор phoA, промоторные системы β-лактамазы и лактозы, щелочной фосфатазы, триптофановую (trp) промоторную систему и гибридные промоторы, такие как tac-промотор. Другие известные бактериальные промоторы также являются подходящими. Промоторы для применения в бактериальных системах будут содержать последовательность Шайна-Дальгарно (S.D.), операбельно связанную с ДНК, кодирующую анти-CD40-антитело.
Известны многие промоторные последовательности эукариотов. Фактически все гены эукариотов содержат богатую АТ область, расположенную примерно на 25-30 оснований слева от сайта, где начинается транскрипция. Другой последовательностью, обнаруженной на 70-90 оснований слева от начала транскрипции многих генов, является область CNCAAT, где N может быть любым нуклеотидом. В 3'-конце большинства генов эукариотов находится последовательность AATAAA, которая может быть сигнальной для добавления поли-А-хвоста к 3'-концу кодирующей последовательности. Все данные последовательности соответственно вставляют в эукариотические экспрессирующие векторы.
Примеры подходящих промоторных последовательностей для применения с хозяевами-дрожжами включают промоторы для 3-фосфоглицераткиназы или других гликолитических ферментов, таких как энолаза, глицеральдегид-3-фосфатдегидрогеназа, гексокиназа, пируватдекарбоксилаза, фосфофруктокиназа, глюкозо-6-фосфатизомераза, 3-фосфоглицератмутаза, пируваткиназа, триозофосфатизомераза, фосфоглюкозоизомераза и глюкокиназа.
Индуцируемые промоторы обладают дополнительным преимуществом транскрипции, контролируемой условиями роста. Они включают промоторные области алкогольдегидрогеназы 2, изоцитохрома С, кислой фосфатазы, ферментов, связанных с метаболизмом азота, металлотионеина, глицеральдегид-3-фосфатдегидрогеназы и ферментов, ответственных за утилизацию мальтозы и галактозы. Подходящие векторы и промоторы для применения при экспрессии у дрожжей дополнительно описаны в EP 73657. Дрожжевые энхансеры также преимущественно используются с дрожжевыми промоторами.
Транскрипция гуманизированного анти-CD40-антитела из векторов в клетках-хозяевах млекопитающих регулируется, например, промоторами, полученными из геномов вирусов, таких как вирус полиомы, вирус птичьей оспы, аденовирус (такой как аденовирус 2), вирус папилломы крупного рогатого скота, вирус птичьей саркомы, цитомегаловирус, ретровирус, вирус гепатита-В и наиболее предпочтительно обезьяний вирус 40 (SV40), гетерологичными промоторами млекопитающих, например, промотором актина или промотором иммуноглобулина, и промоторами белков теплового шока, при условии, что такие промоторы совместимы с системами клеток-хозяинов.
Ранние и поздние промоторы вируса SV40 соответственно получают в виде фрагмента рестрикции SV40, который также содержит точку начала репликации вируса SV40. Немедленный ранний промотор человеческого цитомегаловируса соответственно получают из фрагмента рестрикции HindIII E. Система для экспрессии ДНК в хозяевах-млекопитающих с использованием вируса папилломы крупного рогатого скота в качестве вектора раскрывается в патенте США № 4419446. Модификация данной системы раскрыта в патенте США № 4601978. Смотри также Reyes et al., 1982, Nature, 297: 598-601, которые описывают экспрессию кДНК человеческого β-интерферона в мышиных клетках под контролем промотора тимидинкиназы из вируса герпеса простого. Альтернативно длинный концевой повтор вируса саркомы Рауса можно использовать в качестве промотора.
Транскрипцию ДНК, кодирующую гуманизированное анти-CD40-антитело, раскрытое здесь, у высших эукариотов часто усиливают вставкой энхансерной последовательности в вектор. В настоящее время известно много энхансерных последовательностей из генов млекопитающих (глобина, эластазы, альбумина, α-фетопротеина и инсулина). Как правило, однако, используют энхансер из вируса эукариотических клеток. Примеры включают энхансер SV40 в поздней стороне точки начала репликации (100-270 п.н.), энхансер раннего промотора цитомегаловируса, энхансер полиомы на поздней стороне точки начала репликации и энхансеры аденовируса. Смотри также Yaniv, 1982, Nature 297: 17-18, где приведено описание энхансерных элементов для активации промоторов эукариотов. Энхансер может быть сплайсирован в вектор в положении 5' или 3' по отношению к кодирующей последовательности гуманизированного анти-CD40-антитела, но предпочтительно он располагается в 5'-сайте от промотора.
Экспрессирующие векторы, используемые в эукариотических клетках-хозяевах (дрожжей, грибов, насекомых, растений, животных, человека или ядерных клетках от других многоклеточных организмов), также могут содержать последовательности, необходимые для терминации транскрипции и для стабилизации мРНК. Обычно такие последовательности находятся от 5'-конца, в некоторых случаях 3'-конца, нетранслируемых областей эукариотических или вирусных ДНК или кДНК. Данные области содержат нуклеотидные сегменты, транскрибируемые в виде полиаденилированных фрагментов в нетранслируемом участке мРНК, кодирующей анти-CD40-антитело. Одним пригодным компонентом терминации трансляции является область полиаденилирования бычьего гормона роста. Смотри WO 94/11026 и экспрессирующий вектор, раскрытый там. В некоторых вариантах осуществления гуманизированные анти-CD40-антитела можно экспрессировать с использованием системы CHEF. (Смотри, например, патент США № 5888809, раскрытие которого включено здесь для сведения).
Подходящими клетками-хозяевами для клонирования или экспрессии ДНК в векторах, описанных здесь, являются прокариотические, дрожжевые или высшие эукариотические клетки, описанные выше. Подходящие прокариоты для данной цели включают эубактерии, такие как грамотрицательные или грамположительные микроорганизмы, например, Enterobacteriaceae, такие как Escherichia, например, E. coli, Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella, например, Salmonella typhimurium, Serratia, например, Serratia marcescans и Shigella, а также Bacilli, такие как B. subtilis и B. licheniformis (например, B. licheniformis 41Р, раскрытые в DD 266710, опубликованном 12 апреля 1989 г.), Pseudomonas, такие как P. aeruginosa, и Streptomyces. Одним предпочтительным хозяином из E. coli для клонирования является E. coli 294 (ATCC 31 446), хотя, подходящими являются другие штаммы, такие как E. coli B, E. coli X1776 (ATCC 31537) и E. coli W3110 (ATCC 27325). Данные примеры в большей степени являются иллюстративными, чем ограничивающими.
В дополнении к прокариотам эукариотические микроорганизмы, такие как нитчатые грибы или дрожжи, являются подходящими в качестве хозяев для клонирования или экспрессии кодирующих гуманизированное анти-CD40-антитело векторов. Saсcharomyces cerevisiae или обычные пекарские дрожжи представляют наиболее часто используемые среди низших эукариотических микроорганизмов-хозяев. Однако имеется и является пригодным ряд других родов, видов и штаммов, таких как Schizosaccharomyces pombe; хозяева Kluyveromyces, например, такие как K. lactis, K. fragilis (ATCC 12424), K. bulgaricus (ATCC 16045), K. wickeramii (ATCC 24178), K. waltii (ATCC 56500), K. drosophilarum (ATCC 36906), K. thermotolerans и K. marxianus; yarrowia (EP 402226); Pichia pastoris (EP 183070); Candida; Trichoderma reesia (EP 244234); Neurospora crassa; Schwanniomyces, такие как Schwanniomyces occidentalis, и нитчатые грибы, такие как, например, Neurospora, Penicillium, Tolypocladium и Aspergillus, такие как A. nidulans и A. niger.
Подходящие клетки-хозяева для экспрессии гликозилированного гуманизированного анти-CD40-антитела получают из многоклеточных организмов. Примеры клеток беспозвоночных включают клетки растений и насекомых, в том числе, например многочисленные штаммы бакуловирусов и соответствующие возможные клетки-хозяева из насекомых, таких хозяев, как Spodoptera frugiperda (гусеница), Aedes aegypti (комары), Aedes melanogaster (комары), Drosophila melanogaster (дрозофила) и Bombyx mori (шелковая нематода). Широко известны различные вирусные штаммы для трансфекции, например, вариант L-1 Autographa californica NPV и штамм Bm-5 Bombyx mori NPV, и такие вирусы можно использовать здесь в качестве вируса по настоящему изобретению, особенно для трансфекции клеток Spodoptera frugiperda.
Также можно использовать культуры растительных клеток хлопчатника, кукурузы, картофеля, сои, петуньи, томатов и табака в качестве хозяев.
В другом аспекте экспрессию гуманизированного анти-CD40-антитела проводят в клетках позвоночных. Размножение клеток позвоночных в культуре (культуре ткани) стало обычной процедурой и широко доступны соответствующие методы. Примерами пригодных линий клеток-хозяев млекопитающих являются линия клеток почек обезьяны, трансформированная SV40 (COS-7, ATCC CRL 1651); линия человеческих эмбриональных почечных клеток (293 или клетки 293, субклонированные для культивирования в суспензионной культуре, Graham et al., 1977, J. Gen. Virol., 36: 59); клетки почек молодых хомячков (ВНК, АТСС CCL 10); клетки яичников китайских хомяков/DHFR- (CHO, Urlaub et al., 1980, Proc. Natl. Acad. Sci. USA, 77: 4216, например, DG44) мышиные клетки Сертоли (TM4, Mather, 1980, Biol Reprod., 23: 243-251); клетки почек обезьяны (CV1 ATCC CCL 70); клетки почек африканской зеленой мартышки (VERO-76, ATCC CRL-1587); человеческие клетки карциномы шейки матки (HELA, AТCC CCL2); клетки почек собаки MDCK, ATCC CCL 34); клетки печени крысы (BRL 3A, ATCC CRL 1442); клетки легких человека (W138, ATCC CCL 75); клетки печени человека (Hep G2, HB 8065); клетки опухоли молочной железы мышей (ММТ 060562, ATCC CCL51); клетки TRI (Mather et al., 1982, Annals N.Y. Acad. Sci., 383: 44-68); клетки MRC 5; клетки FS4 и линия клеток человеческой гепатомы (Нер G2).
Клетки-хозяева трансформируют с использованием вышеописанных экспрессирующих или клонирующих векторов для получения гуманизированного анти-CD40-антитела и культивируют в обычных питательных средах, модифицированных соответствующим образом для индукции промоторов, отбора трансформантов или амплификации генов, кодирующих желаемые последовательности.
Клетки-хозяева, используемые для продукции гуманизированного анти-CD40-антитела, описанного здесь, можно культивировать в различных средах. Подходящими для культивирования клеток-хозяев являются различные промышленно доступные среды, такие как среда Ham's F10 (Sigma-Aldrich Co., St. Louis, MO), минимальная эссенциальная среда (МЕМ) (Sigma-Aldrich Co.), RPMI-1640 (Sigma-Aldrich Co.) и среда Игла, модифицированная по способу Дульбекко (DMEM) (Sigma-Aldrich Co.). Кроме того, можно использовать любую среду, описанную, например, Ham et al., 1979, Meth. Enz. 58: 44; Barnes et al., 1980, Anal. Biohem., 102: 255; в патентах США № 4767704; 4657866; 4927762; 4560655; 5122469; WO 90/103430 и WO 87/00195, в качестве культуральной среды для клеток-хозяев. В любую из данных сред можно добавить, если это необходимо, гормоны и/или другие факторы роста (такие как инсулин, трансферрин или эпидермальный фактор роста), соли (такие как хлорид натрия, кальций, магний и фосфат), буферы (такие как HEPES), нуклеотиды (такие как аденозин или тимидин), антибиотики (такие как гентамицин), микроэлементы (обычно определяемые как неорганические соединения, присутствующие в конечных концентрациях на микромолярном уровне) и глюкозу или равноценный источник энергии. Можно также включить другие добавки в подходящих концентрациях, которые известны специалистам в данной области. Условия культивирования, такие как температура, рН и тому подобное, представляют таковые, которые ранее использовались для клеток-хозяев, выбранных для экспрессии, и они будут очевидными специалистам в данной области.
При использовании рекомбинантных методик антитело можно получить внутриклеточно, в периплазматическом пространстве или непосредственно секретировать в среду. Если антитело продуцируется внутри клетки, то в качестве первой стадии клетки можно разрушить для высвобождения белка. Дебриз из частичек, либо клетки-хозяева, либо лизированные фрагменты, удаляют, например, центрифугированием или ультрафильтрованием. Carter et al., 1992, Bio/Technology, 10: 163-167 описывают методику выделения антител, которые секретируются в периплазматическое пространство E. coli. Вкратце, клеточную массу размораживают в присутствии ацетата натрия (рН 3,5), ЭДТА и фенилметилсульфонилфторида (PMSF) в течение примерно 30 мин. Клеточный дебриз можно удалить центрифугированием. Когда антитело секретируется в среду, то супернатанты из таких экспрессирующих систем обычно вначале концентрируют с использованием промышленно доступного фильтра для концентрирования белка, например, блок для ультрафильтрования Amicon или Millipore Pellicon. Можно внести ингибитор протеазы, такой как PMSF, на любой из описанных выше стадий для ингибирования протеолиза и можно добавить антибиотики для предупреждения роста случайных загрязнителей. Можно использовать различные методы для выделения антитела из клетки-хозяина.
Композицию антитела, полученную из клеток, можно очистить с использованием, например, хроматографии на гидроксилапатите, гель-электрофореза, диализа и аффинной хроматографии, притом, что аффинная хроматография является типичным методом очистки. Применимость протеина-А в качестве аффинного лиганда зависит от вида и изотипа Fc-домена любого иммуноглобулина, который присутствует в антителе. Протеин-А можно использовать для очистки антител на основе человеческих тяжелых цепей гамма 1, гамма 2 или гамма 4 (смотри, например, Lindmark et al., 1983, J. Immunol. Meth., 62: 1-13). Протеин-G рекомендуется использовать для всех мышиных изотипов и для человеческого гамма 3 (смотри, например, Guss et al., 1986, EMBO J., 5: 1567-1575). Матрикс, с которым связан аффинный лиганд, наиболее часто представляет собой агарозу, но имеются другие матриксы. Можно использовать механически стабильные матриксы, такие как стекло с контролируемыми порами или поли(стиролдивинил)бензол для обеспечения более быстрой скорости потока и уменьшения времени обработки по сравнению с теми же показателями при использовании агарозы. В тех случаях, когда антитело содержит домен СН3, то пригодной для очистки является смола Bakerbond ABXTM (J.T. Baker, Phillisburg, NY). Также имеются другие методики для очистки белка, такие как фракционирование на колонке с ионно-обменной смолой, осаждение этанолом, обратнофазовая ВЭЖХ, хроматография на силикагеле, хроматография на гепарин-SEPHAROSETM, хроматография на анион- или катионобменной смоле (такая как на колонке с полиаспарагиновой кислотой), хроматофокусирование, SDS-PAGE и осаждение сульфатом аммония в зависимости от антитела, которое выделяют.
После проведения любой предварительной стадии(й) очистки смесь, содержащую интересующее антитело и примеси, можно подвергнуть гидрофобной хроматографии в условиях с низким рН с использованием буфера для элюирования при значении рН в пределах примерно 2,5-4,5, как правило, проводимой при низких концентрациях солей (например, примерно 0-0,25 М соли).
Условия гибридизации
Также включаются нуклеиновые кислоты, которые гибридизуются в условиях низкой, средней и высокой жесткости, определенные здесь, с целой или участком (например, участком, кодирующим вариабельную область) нуклеотидной последовательности, представленной SEQ ID NO:17, или комплементарной к ней последовательности, или SEQ ID NO:20 или комплементарной к ней последовательности. Гибридизующийся участок гибридизующейся нуклеиновой кислоты, как правило, имеет длину, по меньшей мере, из 15 (например, 20, 25, 30 или 50) нуклеотидов. Гибридизующийся участок гибридизующейся нуклеиновой кислоты, по меньшей мере, на 80%, например, по меньшей мере, на 90%, по меньшей мере, на 95% или, по меньшей мере, на 98% идентичен последовательности участка или всей нуклеиновой кислоте, кодирующей полипептид анти-CD40-антитело (например, вариабельную область тяжелой цепи или легкой цепи) или ее комплементарной последовательности. Гибридизующиеся нуклеиновые кислоты описанного здесь типа можно использовать, например, в виде зонда для клонирования, праймера, например, праймера для ПЦР, или диагностического зонда.
В качестве примера и не для ограничения используемые условия низкой жесткости представляют собой следующее (смотри также Shilo and Weinberg, 1981, Proc. Natl. Acad. Sci. USA 78: 6789-6792). В одном варианте осуществления фильтры, содержащие ДНК, предварительно обрабатывают в течение 6 ч при 40°С раствором, содержащим 35% формамида, 5Х SSC, 50 мМ Трис-HCl (рН 7,5), 5 мМ ЭДТА, 0,1% PVP, 0,1% Фиколл, 1% BSA и 500 мкг/мл денатурированной ДНК спермы лосося. Гибридизацию проводят в том же растворе при следующих модификациях: 0,02% PVP, 0,02% Фиколла, 0,2% BSA и 100 мкг/мл ДНК спермы лосося, 10% (мас./об.) декстрана сульфата, и используют 5-20×106 имп/мин 32Р-меченного зонда. Фильтры инкубируют в смеси для гибридизации в течение 18-20 ч при 40°С и затем промывают в течение 1,5 ч при 55°С в растворе, содержащем 2Х SSC, 25 мМ Трис-HCl (рН 7,4), 5 мМ ЭДТА, 0,1% SDS. Раствор для промывания заменяют на свежую порцию раствора и инкубируют еще в течение 1,5 ч при 60°С. Фильтры подвергают блоттингу и проводят авторадиографию. Если необходимо, то фильтры промывают в третий раз при температуре 65-68°С и повторно накладывают пленку. В другом варианте осуществления пример условий низкой жесткости включает гибридизацию в буфере, содержащем 35% формамида, 5Х SSC, 50 мМ Трис-HCl (рН 7,5), 5 мМ ЭДТА, 0,02% PVP, 0,02% Фиколла, 0,2% BSA и 100 мкг/мл денатурированной ДНК спермы лосося и 10% (мас./об.) декстрана сульфата в течение 18-20 ч при 40°С, промывание в буфере, состоящем из 2Х SSC, 25 мМ Трис-HCl (рН 7,4), 5 мМ ЭДТА и 0,1% SDS в течение 1,5 ч при 55°С и промывание в буфере, состоящем из 2Х SSC, 25 мМ Трис-HCl (рН 7,4), 5 мМ ЭДТА и 0,1% SDS в течение 1,5 ч при 60°С. Другие условия низкой жесткости, которые можно использовать, являются хорошо известными в данной области (например, которые применяют для межвидовых гибридизаций).
В качестве примера и без ограничения используемые условия высокой жесткости представляют собой следующее. Предварительную гибридизацию фильтров, содержащих ДНК, проводят в течение периода времени от 8 ч до ночи при 65°С в буфере, содержащем 6Х SSC, 50 мМ Трис-HCl (рН 7,5), 1 мМ ЭДТА, 0,02% PVP, 0,02% Фиколла, 0,02% BSA и 500 мкг/мл денатурированной ДНК спермы лосося. Фильтры гибридизуют в течение 48 ч при 65°С в смеси для предварительной гибридизации, содержащей 100 мкг/мл денатурированной ДНК спермы лосося и 5-20×106 имп/мин 32Р-меченного зонда. Фильтры промывают при 37°С в течение 1 ч в растворе, содержащем 2Х SSC, 0,01% PVP, 0,01% Фиколла и 0,01% BSA. Затем следует промывание в 0,1Х SSC при 50°С в течение 45 мин перед авторадиографией. Можно использовать другие условия высокой жесткости, известные в данной области.
В качестве примера и без ограничения используемые условия средней жесткости представляют собой следующее. Фильтры, содержащие ДНК, предварительно обрабатывают в течение 6 ч при 55°С раствором, содержащим 6Х SSC, 5Х раствора Денхардта, 0,5% SDS и 100 мкг/мл денатурированной ДНК спермы лосося. Гибридизацию проводят в том же растворе с 5-20×106 имп/мин 32Р-меченного зонда. Фильтры инкубируют в смеси для гибридизации в течение 18-20 ч при 55°С и затем дважды промывают в течение 30 мин при 60°С в растворе, содержащем 1Х SSC и 0,1% SDS. Фильтры подвергают блоттингу и проводят авторадиографию. Промывание фильтров проводят при 37°С в течение 1 ч в растворе, содержащем 2Х SSC, 0,1% SDS. Можно использовать другие условия средней жесткости, известные в данной области (смотри, например, Sambrook et al., 1989, Molecular Cloning, A Laboratory Manual, 2d Ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New-York; Sambrook et al., 2001; Molecular Cloning, A Laboratory Manual, 3rd Ed., Cold Spring Harbor Publish., Cold Spring Harbor, N.Y.; также смотри Ausubel et al., eds., in Current Protocols in Molecular Biology, серия руководств по лабораторным методам, 1987-1999, Current Protocols, 1994-1999 John Wiley and Sons, Inc.).
Некоторые варианты осуществления включают выделенные полинуклеотиды, содержащие последовательности, которые кодируют антитело или фрагмент антитела, имеющие аминокислотную последовательность вариабельной области тяжелой цепи, которая, по меньшей мере, на 80%, по меньшей мере, на 90%, по меньшей мере, на 95%, по меньшей мере, на 98% или, по меньшей мере, на 99% идентична аминокислотной последовательности SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10 или SEQ ID NO:11. Некоторые варианты осуществления включают выделенные полинуклеотиды, содержащие последовательности, которые кодируют антитело или фрагмент антитела, имеющие аминокислотную последовательность вариабельной области легкой цепи, которая, по меньшей мере, на 80%, по меньшей мере, на 90%, по меньшей мере, на 95%, по меньшей мере, на 98% или, по меньшей мере, на 99% идентична аминокислотной последовательности SEQ ID NO:14, SEQ ID NO:15 или SEQ ID NO:16.
В одном аспекте осуществления выделенная полинуклеотидная последовательность(и) кодирует антитело или фрагмент антитела, содержащие вариабельную область тяжелой цепи и вариабельную область легкой цепи, где каждая имеет аминокислотную последовательность, которая по меньшей мере, на 80%, по меньшей мере, на 90%, по меньшей мере, на 95%, по меньшей мере, на 98% или по меньшей мере, на 99% идентична аминокислотной последовательности соответственно SEQ ID NO:3 и SEQ ID NO:14; соответственно SEQ ID NO:4 и SEQ ID NO:14; соответственно SEQ ID NO:5 и SEQ ID NO:14; соответственно SEQ ID NO:6 и SEQ ID NO:14; соответственно SEQ ID NO:7 и SEQ ID NO:14; соответственно SEQ ID NO:8 и SEQ ID NO:14; соответственно SEQ ID NO:9 и SEQ ID NO:14; соответственно SEQ ID NO:6 и SEQ ID NO:15; соответственно SEQ ID NO:6 и SEQ ID NO:16; соответственно SEQ ID NO:7 и SEQ ID NO:16; соответственно SEQ ID NO:10 и SEQ ID NO:14; соответственно SEQ ID NO:11 и SEQ ID NO:14; соответственно SEQ ID NO:10 и SEQ ID NO:16; или соответственно SEQ ID NO:11 и SEQ ID NO:16.
В еще одном аспекте осуществления выделенная полинуклеотидная последовательность(и) кодирует антитело или фрагмент антитела, содержащие вариабельную область тяжелой цепи и вариабельную область легкой цепи, где каждая имеет аминокислотную последовательность, которая по меньшей мере, на 80%, по меньшей мере, на 90%, по меньшей мере, на 95%, по меньшей мере, на 98% или по меньшей мере, на 99% идентична аминокислотной последовательности соответственно SEQ ID NO:7 и SEQ ID NO:14; соответственно SEQ ID NO:6 и SEQ ID NO:16; соответственно SEQ ID NO:7 и SEQ ID NO:16; соответственно SEQ ID NO:10 и SEQ ID NO:14; соответственно SEQ ID NO:11 и SEQ ID NO:14; соответственно SEQ ID NO:10 и SEQ ID NO:16; и соответственно SEQ ID NO:11 и SEQ ID NO:16.
В еще одном аспекте осуществления выделенная полинуклеотидная последовательность(и) кодирует антитело или фрагмент антитела, содержащие вариабельную область тяжелой цепи и вариабельную область легкой цепи, где каждая имеет аминокислотную последовательность, которая по меньшей мере, на 80%, по меньшей мере, на 90%, по меньшей мере, на 95%, по меньшей мере, на 98% или по меньшей мере, на 99% идентична аминокислотной последовательности соответственно SEQ ID NO:7 и SEQ ID NO:14; соответственно SEQ ID NO:6 и SEQ ID NO:16; соответственно SEQ ID NO:10 и SEQ ID NO:16; соответственно SEQ ID NO:11 и SEQ ID NO:16.
В еще одном аспекте осуществления выделенная полинуклеотидная последовательность(и) кодирует антитело или фрагмент антитела, содержащие вариабельную область тяжелой цепи и вариабельную область легкой цепи, где каждая имеет аминокислотную последовательность, которая по меньшей мере, на 80%, по меньшей мере, на 90%, по меньшей мере, на 95%, по меньшей мере, на 98% или по меньшей мере, на 99% идентична аминокислотной последовательности соответственно SEQ ID NO:10.
В том смысле, в котором они здесь используются, термины «идентичные» или «процент идентичности» в отношении двух или более нуклеиновых кислот или полипептидных последовательностей, относится к двум или более последовательностям или субпоследовательностям, которые являются одинаковыми или имеют определенный процент нуклеотидов или аминокислотных остатков, которые являются одинаковыми, при сравнении и сопоставлении на максимальное соответствие. Для определения процента идентичности последовательности сопоставляют в целях оптимального сравнения (например, можно вводить гэпы в последовательности первой аминокислотной или нуклеиновокислотной последовательности для оптимального сопоставления со второй аминокислотной или нуклеиновокислотной последовательностью). Затем сравнивают аминокислотные остатки или нуклеотиды в соответствующих аминокислотных положениях или нуклеотидных положениях. В том случае, если положение в первой последовательности занято тем же аминокислотным остатком или нуклеотидом, что и соответствующее положение во второй последовательности, то молекулы являются идентичными по данному положению. Процент идентичности между двумя последовательностями представляет функцию количества идентичных положений у двух последовательностей (т.е. % идентичности = # идентичных положений/общее # количество положений (например, перекрывающихся положений) × 100). В некоторых вариантах осуществления две последовательности, между которыми проводят сравнение, имеют одинаковую длину после введения гэпов в последовательности, там, где это является подходящим (например, исключая дополнительную последовательность, выходящую за пределы последовательностей, которые сравниваются). Например, когда сравнивают последовательности вариабельных областей, то не учитывают последовательности лидера и/или константных областей. Для сравнений последовательностей между двумя последовательностями «соответствующий» CDR относится к CDR в том же положении в обеих последовательностях (например, CDR-Н1 в каждой последовательности).
Определение процента идентичности или процента гомологии между двумя последовательностями можно проводить с использованием математического алгоритма. Предпочтительным, не ограничивающим примером математического алгоритма, применяемого для сравнения двух последовательностей, является алгоритм Karlin и Altschul, 1990, Proc. Natl. Acad. Sci. USA 87: 2264-2268 в модификации Karlin и Altschul, 1993, Proc. Natl. Acad. Sci. USA 90: 5873-5877. Такой алгоритм включают в программы NBLAST и ХBLAST Altschul et al., 1990, J. Mol. Biol. 215: 403-410. Поиск нуклеотидов BLAST можно осуществить с использованием программы NBLAST, баллы = 100, длина слов = 12 с получением нуклеотидных последовательностей, гомологичных нуклеиновой кислоте, кодирующей интересующий белок. Поиск белков BLAST можно осуществить с использованием программы ХBLAST, баллы = 50, длина слов = 3 с получением аминокислотных последовательностей, гомологичных интересующему белку. Для получения сопоставлений с гэпами в целях сравнения можно использовать программу Gapped BLAST, описанную Altschul et al., 1997, Nucleic Acids Res. 25: 3389-3402. Альтернативно можно использовать PSI-BLAST для осуществления повторного поиска, с помощью которого можно детектировать дальние связи между молекулами (тот же источник). При использовании программ BLAST, Gapped BLAST и PSI-BLAST можно применить параметры дефолта соответствующих программ (например, ХBLAST и NBLAST). Другим предпочтительным, не ограничивающим примером математического алгоритма, используемого для сравнения последовательностей, является алгоритм Myers и Miller, CABIOS (1989). Такой алгоритм включают в программу ALIGN (версия 2.0), которая является частью программного обеспечения по сопоставлению последовательностей GCG. При использовании программы ALIGN для сравнения аминокислотных последовательностей можно использовать таблицу массы остатков РАМ120, длину пенальти гэпа 12 и пенальти гэпа 4. В данной области известны дополнительные алгоритмы для анализа последовательностей, и они включают ADVANCE и ADAM, описанные Torellis and Robotti, 1994, Comput. Appl. Biosci. 10: 3-5; и FASTA, описанную Pearson and Lipman, Proc. Natl. Acad. Sci. USA 85: 2444-8. В программе FASTA кtup является контрольной опцией, которая устанавливает чувствительность и скорость поиска. Если кtup=2, то аналогичные области в двух последовательностях, которые сравниваются, устанавливают поиском пар сопоставленных остатков; если кtup=1, то исследуются единичные сопоставляемые аминокислоты. Значение кtup можно установить на 2 или 1 для белковых последовательностей, или от 1 до 6 для последовательностей ДНК. Дефолт, если значение кtup не определено, составляет 2 для белков и 6 для ДНК. Альтернативно сопоставление белковых последовательностей можно осуществить с использованием алгоритма CLUSTAL W, как описано Higgins et al., 1996, Methods Enzymol. 266: 383-402.
Нетерапевтические применения
Антитела, описанные здесь, являются пригодными в качестве агентов для аффинной очистки. В данном способе антитела иммобилизуют на твердой фазе, такой как смола Sephadex или фильтровальная бумага, с использованием методов, хорошо известных в данной области. Иммобилизованное антитело подвергают взаимодействию с пробой, содержащей белок СD40 (или его фрагмент) для очистки, и затем подложку промывают подходящим растворителем, который будет удалять в основном все вещества в пробе, за исключением белка СD40, который связан с иммобилизованным антителом. Наконец, подложку промывают другим растворителем, таким как глициновый буфер, рН 5,0, который будет отделять белок СD40 от антитела.
Гуманизированные анти-СD40-антитела также могут быть пригодными при постановке диагностических тестов для детектирования и/или количественного определения белка СD40, например, при оценке его экспрессии в определенных клетках, тканях или сыворотке крови.
Для диагностических применений антитело, как правило, будет помечено с помощью детектируемой группы. Имеются многочисленные метки, которые в целом можно объединить в следующие группы:
а) радиоизотопы, такие как 35S, 14C, 125I, 3H и 131I. Антитело можно пометить радиоизотопом с использованием методов, описанных, например, в Current Protocols in Immunology, Volumes 1 and 2, 1991, Coligen et al., Wiley-Interscience, New York, Pubs. Радиоактивность можно определить с использованием сцинтилляционного счетчика;
b) имеются флуоресцентные метки, такие как хелаты редких щелочно-земельных металлов (хелаты европия) или флуоресцеин и его производные, родамин и его производные, дансил, лиссамин, фикоэритрин и техасский красный. Флуоресцентные метки можно конъюгировать с антителом с использованием известных методов, например, раскрытых в Current Protocols in Immunology, выше. Флуоресценцию можно определить с использованием флуориметра;
с) имеются различные метки на основе энзим-субстрата (смотри, например, патент США № 4275149, где приводится обзор по некоторым из них). Фермент, как правило, катализирует химическое изменение хромогенного субстрата, которое можно определить с использованием различных методик. Например, фермент может катализировать изменение цвета субстрата, которое можно определить спектрофотометрически. Альтернативно фермент может изменить флуоресценцию или хемилюминесценцию субстрата. Методики для количественного определения изменения флуоресценции описаны выше. Хемилюминесцентный субстрат становится электронно-возбужденным в результате химической реакции и затем может испускать свет, который можно определить, например, с использованием хемилюминометра, или передавать энергию акцептору флуоресценции. Примеры энзимных меток включают люциферазы, такие как люцифераза светлячков и бактериальная люцифераза (патент США № 4737456), люциферин, 2,3-дигидрофталазиндионы, малатдегидрогеназу, уреазу, пероксидазу, такую как пероксидаза из хрена (HRPO), щелочную фосфатазу, β-галактозидазу, глюкоамилазу, лизоцим, сахаридоксидазы (такие как глюкозооксидаза, галактозооксидаза и глюкоза-6-фосфатдегидрогеназа), оксидазы гетероциклических соединений (такие как уриказа и ксантиноксидаза), лактопероксидазу, микропероксидазу и тому подобное. Методы конъюгирования энзимов с антителами описаны O'Sullivan et al., 1981, Methods for Preparation of Enzyme-Antibody Conjugates for use in Enzyme Immunoassay, in Methods in Enzym. (J. Langone & H. Van Vunakis, eds.), Academic Press, N. Y., 73: 147-166.
Примеры комбинаций энзим-субстрат, например, включают:
i) пероксидазу из хрена (HRPO) с перекисью водорода в качестве субстрата, где пероксидаза кислот окисляет предшественник краски, такой как ортофенилендиамин (OPD) или 3,3',5,5'-тетраметилбензидин гидрохлорид (ТМВ);
ii) щелочную фосфатазу (АР) с пара-нитрофенилфосфатом в качестве хромогенного субстрата; и
iii) β-D-галактозидазу (β-D-Gal) с хромогенным субстратом, таким как п-нитрофенил-β-D-галактозидаза, или флурогенным субстратом 4-метиллюмбеллиферил-β-D-галактозидазой.
Специалистам в данной области известны многочисленные другие комбинации энзим-субстрат. Общий обзор по ним смотри в патентах США № 4275149 и 4318980.
В некоторых случаях метку конъюгируют с антителом опосредованно с использованием различных методов. Например, антитело можно конъюгировать с биотином, и любую из меток, относящихся к трем большим группам, представленным выше, можно конъюгировать с авидином или тому подобное. Биотин избирательно связывается с авидином и, таким образом, метку можно конъюгировать с антителом данным опосредованным образом. Альтернативно для достижения опосредованного конъюгирования метки с антителом, антитело можно конъюгировать с небольшим гаптеном (таким как дигоксин) и одну из различных типов меток, указанных выше, конъюгируют с анти-гаптен-антителом (например, анти-дигоксин-антителом). Таким образом, можно провести опосредованное конъюгирование метки с антителом.
В другом варианте осуществления изобретения гуманизированное анти-CD40-антитело используют без метки и его присутствие детектируют с использованием меченого антитела, которое связывается с гуманизированным анти-CD40-антителом.
Антитела по настоящему изобретению можно использовать в любом известном тесте, таком как тесты конкурентного связывания, прямом и непрямом сэндвич-тестах и тестах иммунопреципитации. Смотри, например, Zola, Monoclonal Antibodies: A Manual of Techniques, pp. 147-158 (CRC Press, Inc. 1987).
Диагностические наборы
Гуманизированное анти-CD40-антитело можно использовать в диагностическом наборе, т.е. упакованной комбинации реагентов, находящихся в заранее определенных количествах, с инструкциями по постановке диагностического теста. В тех случаях, когда антитело метят ферментом, то набор может включать субстраты и кофакторы, необходимые для фермента, такие как предшественник субстрата, который обеспечивает детектируемый хромофор или флуорофор. Кроме того, можно включить добавки, такие как стабилизаторы, буферы (например, блокирующий буфер или буфер для лизиса) и тому подобное. Относительные количества различных реагентов могут варьировать в широких пределах для обеспечения концентраций реагентов в растворе, что существенно оптимизирует чувствительность теста. Реагенты могут находиться в виде сухих порошков, обычно в виде лиофилизованных, включая наполнители, которые при растворении будут обеспечивать раствор реагента с соответствующей концентрацией.
Терапевтические применения
В другом варианте осуществления гуманизированное анти-CD-антитело, раскрытое здесь, является пригодным для лечения различных нарушений, ассоциированных с экспрессией CD40, описанного здесь.
Гуманизированное анти-CD40-антитело или средство можно вводить любыми подходящими путями, включая парентеральный, подкожный, внутрибрюшинный, ингаляционный и интраназальный, и, если желательно, для местного применения иммуносупрессора, введение в область поражения (в том числе перфузию или контактирование иначе трансплантата с антителом перед трансплантацией). Гуманизированное анти-CD40-антитело или средство можно вводить, например, в виде инфузии или болюса. Парентеральные инфузии включают внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение. Кроме того, гуманизированное анти-CD40-антитело соответственно подходит для пульсирующей инфузии, в частности, со снижением доз антитела. В одном аспекте введение проводят с помощью инъекций, наиболее предпочтительно внутривенной или подкожной инъекций, в зависимости отчасти от того, является ли введение кратковременным или длительным.
Для профилактики или лечения заболевания соответствующая дозировка антитела будет зависеть от различных факторов, таких как тип заболевания, которое подвергается лечению, определенного выше, тяжести и течения заболевания, вводят антитело для профилактических или терапевтических целей, предшествующего лечения, анамнеза у пациента и ответной реакции на антитело, и с учетом мнения лечащего врача. Антитело соответственно вводят пациенту однократно или несколько раз.
В зависимости от типа и тяжести заболевания доза в пределах примерно от 1 мкг/кг до 20 мкг/кг (например, 0,1-15 мг/кг) антитела представляет начальную возможную дозу для введения пациенту, например, в виде одного или более отдельных введений, или продолжительной инфузии. Типичная суточная доза может находиться в пределах примерно от 1 мкг/кг до 100 мг/кг в зависимости от факторов, указанных выше. При повторных введениях в течение нескольких дней или более, в зависимости от состояния, лечение продолжают до желаемого подавления симптомов заболевания. Однако могут быть пригодными другие схемы введения. Результативность данного лечения легко проследить с использованием обычных методов и тестов. Примерная схема введения является таковой, раскрытой в WO 94/04188.
Композицию антитела формулируют, дозируют и вводят таким образом, который согласуется с доброкачественной медицинской практикой. Учитываемые факторы в данном контексте включают конкретное нарушение, которое подвергается лечению, конкретного млекопитающего, которое подвергается лечению, клиническое состояние отдельного пациента, течение заболевания, место доставки средства, способа введения, схемы введения и других факторов, известных медикам. При определении «терапевтически эффективного количества» антитела, предназначенного для введения, следует руководствоваться такими факторами, и оно представляет минимальное количество, необходимое для профилактики, ослабления или лечения нарушения, связанного с экспрессией CD40.
Не требуется, но это не обязательно, формулировать антитело с одним или более препаратами, используемыми в настоящее время для профилактики или лечения данного заболевания. Эффективное количество таких других препаратов зависит от количества гуманизированного анти-CD40-антитела, присутствующего в композиции, типа нарушения или лечения, и других факторов, упомянутых выше. Как правило, их применяют в тех же дозах и при путях введения, которые использовались ранее, или в дозах, составляющих примерно от 1 до 99% от ранее используемых.
Ассоциированные с CD40 заболевания
Анти-CD40-антитела или средства являются пригодными для лечения или профилактики злокачественной опухоли, экспрессирующей CD40, или иммунологического заболевания, для которого характерна экспрессия CD40, например, неадекватная активация иммунных клеток (например, лимфоцитов или дендритных клеток). Такая экспрессия CD40 может возникнуть за счет, например, повышенных концентраций белка CD40 на поверхности клеток и/или измененной антигенности экспрессированного CD40. Лечение или профилактика иммунологического нарушения, согласно способам, описанным здесь, достигается введением субъекту, нуждающемуся в таком лечении или профилактике, эффективного количества анти-CD40-антитела или средства, в результате чего антитело (i) связывается с активированными иммунными клетками, которые экспрессируют CD40 и которые ассоциированы с болезненным состоянием и (ii) проявляет цитотоксическое, цитостатическое или иммуносупрессорное действие в отношении активированных иммунных клеток.
Иммунологические заболевания, которые характеризуются неадекватной активацией иммунных клеток и которые можно лечить или профилактировать способами, описанными здесь, можно классифицировать, например, по типу(ам) реакции(ям) гиперчувствительности, которые лежат в основе заболевания. Как правило, данные реакции подразделяют на четыре типа: анафилактические реакции, цитотоксические (цитолитические) реакции, реакции иммунного комплекса и/или опосредуемые клетками иммунные (CMI) реакции (также относящиеся к реакциям гиперчувствительности замедленного типа (DTH)). (Смотри, например, Fundamental Immunology (William E. Paul ed., Raven Press, N.Y., 3 rd ed. 1993)).
Конкретные примеры таких иммунологических заболеваний включают следующее: ревматоидный артрит, аутоиммунные заболевания с демиелинизацией (например, рассеянный склероз, аллергический энцефаломиелит), эндокринную офтальмопатию, увеоретинит, системную красную волчанку, миастению в тяжелой форме, болезнь Граве, гломерулонефрит, аутоиммунное гепатологическое нарушение, воспалительное заболевание кишечника (например, болезнь Крона или язвенный колит), анафилаксию, аллергическую реакцию, синдром Шегрена, сахарный диабет типа I, первичный цирроз желчных протоков, гранулематоз Вегенера, фибромиалгию, полимиозит, дерматомиозит, воспалительный миозит, множественную эндокринную недостаточность, синдром Шмидта, аутоиммунный увеит, болезнь Аддисона, адреналит, тиреоидит, тиреоидит Хашимото, аутоиммунное заболевание щитовидной железы, пернициозную анемию, атрофию желудка, хронический гепатит, волчаночный гепатит, атеросклероз, подострую кожную красную волчанку, гипопаратиреоз, синдром Дресслера, аутоиммунную тромбоцитопению, идиопатическую тромбоцитарную пурпуру, гемолитическую анемию, пузырчатку вульгарную, пузырчатку, дерматит герпетиформный, алопецию, пемфигоид, склеродерму, прогрессирующий системный склероз, синдром CREST (кальциноз, феномен Рейно, нарушение подвижности пищевода, склеродактилия и телеангиэктазия), аутоиммунное бесплодие у мужчин и женщин, анкилозирующий спондолит, язвенный колит, смешанное заболевание соединительной ткани, полиартериит нодозный, системный некротизирующий васкулит, атопический дерматит, атопический ринит, синдром Гудпасчера, болезнь Чага, саркоидоз, ревматическую лихорадку, астму, повторяющиеся выкидыши, антифосфолипидный синдром, легкое «фермера», эритему многоформную, посткардиотомический синдром, синдром Кушинга, аутоиммунный хронический активный гепатит, легкое «птицевода», токсический эпидермальный некролиз, синдром Альпорта, альвеолит, аллергический альвеолит, фиброзный альвеолит, интерстициальное заболевание легких, узелковую эритему, пиодермию гангренозную, реакцию после трансфузии, артериит Такаши, ревматическую полимиалгию, височный артериит, шистосомоз, гигантоклеточный артериит, аскаридоз, аспергиллез, синдром Самптера, экзему, лимфоматоидный грануломатоз, болезнь Бехчета, синдром Каплана, болезнь Кавасаки, денге, энцефаломиелит, эндокардит, эндомиокардиальный фиброз, эндофтальмит, эритему, псориаз, эритробластоз плода, эозинофильный фасциит, синдром Шульмана, синдром Фелти, филяриоз, циклит, хронический циклит, гетерохронический циклит, циклит Фучи, IgA-нефропатия, пурпура Геноха-Шенлейна, синдром трансплантат против хозяина, отторжение трансплантата, кардиомиопатию, синдром Итона-Ламберта, хроническое воспаление хрящей, криоглобулинемию, макроглобулинемию Вальденстрема, синдром Эвана, острый респираторный дистресс-синдром, воспаление легких, остеопороз, гиперчувствительность замедленного типа и аутоиммунную недостаточность половых желез.
Следовательно, способы, описанные здесь, включают лечение нарушений В-лимфоцитов (например, системной красной волчанки, синдрома Гудпасчера, ревматоидного артрита и диабета типа I), Th1-лимфоцитов (например, ревматоидного артрита, рассеянного склероза, псориаза, синдрома Шегрена, тиреоидита Хашимото, болезни Граве, первичного цирроза желчных протоков, грануломатоза Вегенера, туберкулеза или синдрома трансплантат против хозяина) или Th2-лимфоцитов (например, атопического дерматита, системной красной волчанки, атопической астмы, риноконъюнктивита, аллергического ринита, синдрома Оменна, системного склероза или хронического заболевания трансплантат против хозяина). Как правило, нарушения, ассоциированные с дендритными клетками, включают нарушения Th1-лимфоцитов или Th2-лимфоцитов.
В некоторых вариантах осуществления иммунологическое нарушение представляет опосредованное Т-клетками иммунологическое нарушение, такое как Т-клеточное нарушение, при котором активированные Т-клетки ассоциированы с нарушением экспрессии CD40. Анти-CD40-антитела или средства можно вводить для истощения таких экспрессирующих CD40 активированных Т-клеток. В конкретном варианте осуществления введение анти-CD40-антител или средств может приводить к истощению экспрессирующих CD40 активированных Т-клеток, в то время как покоящиеся Т-клетки в основном не подвергаются истощению под действием анти-CD40-антитела или средства. В данном контексте «в основном не подвергаются истощению» означает, что менее чем примерно 60%, или менее чем примерно 70% или менее чем примерно 80% покоящихся Т-клеток не подвергается истощению.
Анти-CD40-антитела или средства, описанные здесь, также являются пригодными для лечения или профилактики экспрессирующей CD40 злокачественной опухоли. Лечение или профилактика экспрессирующей CD40 злокачественной опухоли способами, описанными здесь, достигается введением субъекту, нуждающемуся в таком лечении или профилактике, эффективного количества анти-CD40-антитела или средства, посредством чего антитело или средство (i) связывается с экспрессирующими CD40 злокачественными клетками и (ii) проявляет цитотоксический или цитостатический эффект с истощением или подавлением пролиферации экспрессирующих CD40 злокачественных клеток.
Экспрессирующие CD40 злокачественные опухоли, которые можно лечить или профилактировать способами, описанными здесь, включают, например, лейкемию, такую как острая лейкемия, острая лимфоцитарная лейкемия, острая миелоидная лейкемия (например, миелобластная, промиелоидная, миеломоноцитарная, моноцитарная или эритроидная), хроническая лейкемия, хроническая миелоидная (гранулоцитарная) лейкемия или хроническая лимфоцитарная лейкемия; полицетамию истинную; лимфому (например, болезнь Ходжкина или не-ходжкинскую лимфому); множественную миелому, макроглобулинемию Вальденстрема; заболевание тяжелой цепи; солидные опухоли, такие как саркомы и карциномы (например, фибросаркома, миксосаркома, липосаркома, хондросаркома, остеогенная саркома, остеосаркома, хордома, ангиосаркома, эндотелиосаркома, лимфангиосаркома, лимфангиоэндотелиосаркома, синовиома, мезотелиома, опухоль Эвинга, лейомиосаркома, рабдомиосаркома, карцинома ободочной кишки, карцинома ободочной и прямой кишки, злокачественная опухоль поджелудочной железы, злокачественная опухоль молочной железы, злокачественная опухоль яичников, злокачественная опухоль простаты, плоскоклеточная карцинома, базально-клеточная карцинома, аденокарцинома, карцинома потовых желез, карцинома сальных желез, папиллярная карцинома, папиллярная аденокарцинома, цистаденокарцинома, медуллярная карцинома, бронхогенная карцинома, карцинома почек, гепатома, карцинома желчных протоков, хориокарцинома, семинома, эмбриональная карцинома, опухоль Вильмса, рак шейки матки, злокачественная опухоль матки, опухоль яичника, карцинома легких, мелкоклеточная карцинома легких, крупноклеточная карцинома легких, карцинома мочевого пузыря, эпителиальная карцинома, глиома, астроцитома, медуллобластома, краниофарингиома, эпендимома, пинеалома, гемангиобластома, акустическая неврома, олигодендроглиома, менангиома, меланома, нейробластома, ретинобластома, карцинома носоглотки или карцинома пищевода).
Фармацевтические композиции и их введение
Композицию, содержащую связывающее CD40 средство (например, анти-CD40-антитело), можно вводить субъекту, имеющему или с риском развития иммунологического нарушения или экспрессирующей CD40 злокачественной опухоли. Изобретение дополнительно относится к применению связывающего CD40 средства (например, анти-CD40-антитела) в производстве лекарственного препарата для профилактики или лечения экспрессирующей CD40 злокачественной опухоли или иммунологического нарушения. Термин «субъект», в том смысле, в котором он здесь используется, означает любого пациента-млекопитающего, которому можно вводить связывающее CD40 средство, включая, например, людей и млекопитающих, отличных от человека, таких как приматы, грызуны и собаки. Субъекты, которые в частности, предназначены для лечения с использованием способов, описанных здесь, включают людей. Антитела или средства можно вводить одни или в комбинации с другими композициями для профилактики или лечения иммунологического нарушения или экспрессирующей CD40 злокачественной опухоли.
Известны различные системы доставки и их можно использовать для введения связывающего CD40 средства. Способы введения включают, но не ограничиваются этим, внутрикожный, внутримышечный, внутрибрюшинный, внутривенный, подкожный, интраназальный, эпидуральный и пероральный пути. Связывающее CD40 средство можно вводить, например, инфузией, в виде болюса или инъекции, и можно вводить вместе с другими биологически активными препаратами, такими как химиотерапевтические препараты. Введение может быть системным или местным.
В конкретных вариантах осуществления композицию связывающего CD40 средства вводят с помощью инъекции, с помощью катетера, с помощью суппозитория или с помощью имплантата, где имплантат является пористым, непористым или гелеобразным материалом, включая мембрану, такую как сиаластичная мембрана или волокно. Как правило, при введении композиции используют вещества, которые не абсорбируют анти-CD40-антитело или средство.
В других вариантах осуществления анти-CD40-антитело или средство вводят с помощью системы с контролируемым высвобождением. В одном варианте осуществления можно использовать насос (смотри, например, Langer, 1990, Science 249: 1527-1533; Sefton, 1989, CRC Crit. Ref. Biomed. Eng. 14: 201; Buchwald et al., 1980, Surgery 88: 507; Saudek et al., 1989, N. Engl. J. Med., 321: 574). В другом варианте осуществления можно использовать полимерные материалы. (Смотри, например, Medical Applications of Controlled Release (Langer and Wise eds., CRC Press, Boca Raton, Florida, 1974); Controlled Drug Bioavailability, Drug Product Design and Performance (Smolen and Ball eds., Wiley, New York, 1984); Ranger and Peppas, 1983, Macromol. Sci. Rev. Macromol. Chem. 23: 61. Смотри также Levy et al., 1985, Science 228: 190; During et al., 1989, Ann. Neurol. 25: 351; Howard et al., 1989, J. Neurosurg. 81: 105). У Langer, выше, обсуждаются другие контролируемые системы высвобождения.
Связывающее CD40 средство (например, анти-CD40-антитело) можно вводить в виде фармацевтических композиций, содержащих терапевтически эффективное количество связывающего средства и один или более фармацевтически совместимых ингредиентов. Например, фармацевтическая композиция, как правило, включает один или более фармацевтических носителей (например, стерильные жидкости, такие как вода и масла, включая продукты переработки нефти, животного, растительного или синтетического происхождения, такие как кокосовое масло, соевое масло, минеральное масло, кунжутное масло и тому подобное). Вода представляет наиболее типичный носитель, когда фармацевтическую композицию вводят внутривенно. Также можно использовать солевые растворы и водные растворы декстрозы и глицерина в качестве жидких носителей, в частности, для инъекционных растворов. Подходящие фармацевтические эксципиенты включают, например, крахмал, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, мел, силикагель, стеарат натрия, глицерин моностеарат, тальк, хлорид натрия, сухое обезжиренное молоко, глицерин, пропиленгликоль, воду, этанол и тому подобное. Другие подходящие фармацевтические эксципиенты включают аминокислоты (например, аргинин, гистидин, глицин), поверхностно-активные вещества (например, полисорбаты) и сахара и спирты сахаров (например, сахарозу или сорбит и другие полиолы (например, трегалозу)). Композиция, если желательно, может также содержать минорные количества смачивающих веществ или эмульгаторов, или забуферивающих рН веществ. Данные композиции могут иметь форму растворов, суспензий, эмульсии, таблеток, пилюль, капсул, порошков, композиций с замедленным высвобождением и тому подобное. Композицию можно формулировать в виде суппозитория с традиционными связующими веществами и носителями, такими как триглицериды. Композиции для приема внутрь включают стандартные носители, такие как фармацевтической чистоты маннит, лактоза, крахмал, стеарат магния, сахарин натрия, целлюлоза, карбонат магния и т.п. Примеры подходящих фармацевтических носителей приведены в «Remington's Pharmaceutical Sciences», E.W. Martin. Такие композиции будут содержать терапевтически эффективное количество нуклеиновой кислоты или белка, как правило, в очищенной форме, вместе с подходящим количеством носителя для обеспечения формы для правильного введения пациенту. Композиции соответствуют способу введения.
В типичных вариантах осуществления фармацевтическую композицию составляют согласно обычным способам в виде фармацевтической композиции, адаптированной для внутривенного введения людям. Как правило, композиции для внутривенного введения представляют растворы в стерильном изотоническом водном буфере. Там, где это необходимо, фармацевтический препарат может также включать солюбилизирующее вещество и местный анестетик, такой как лидокаин, для снятия боли в месте инъекции. Как правило, ингредиенты поставляются или по отдельности, или смешанные вместе в разовой лекарственной форме, например, в виде сухого лиофилизованного порошка или не содержащего воду концентрата в герметично закрытом контейнере, таком как ампула или саше, с указанием количества активного вещества. В тех случаях, когда фармацевтический препарат предназначен для введения инфузией, то его можно разлить по бутылям для инфузий, содержащим стерильную воду или физиологический раствор фармацевтической чистоты. В тех случаях, когда фармацевтический препарат вводят с помощью инъекции, то можно обеспечить ампулу со стерильной водой для инъекций или физиологическим раствором таким образом, чтобы ингредиенты смешивались перед введением.
Кроме того, фармацевтическую композицию можно обеспечить в виде фармацевтического набора, включающего (а) контейнер, содержащий связывающее CD40 средство (например, анти-CD40-антитело) в лиофилизованной форме и (b) второй контейнер, содержащий фармацевтически приемлемый растворитель (например, стерильную воду) для инъекций. Фармацевтически приемлемый растворитель можно использовать для восстановления или разведения лиофилизованного анти-CD40-антитела или средства. Необязательно связанная с таким контейнером(и) может иметь место записка в форме, утвержденной официальным агентством, разрешающим производство, применение или продажу фармацевтических препаратов или биологических продуктов, где в записке отражается разрешение агентства на производство, применение или продажу для введения людям.
Количество связывающего CD40 средства (например, анти-CD40-антитела), которое является эффективным для лечения или профилактики иммунологического нарушения или экспрессирующей CD40 злокачественной опухоли, можно определить обычными клиническими методами. Кроме того, необязательно можно использовать тесты в условиях in vitro, результаты которых могут помочь для установления пределов оптимальных доз. Точная дозировка для применения в композиции также будет зависеть от пути введения и стадии развития иммунологического нарушения или экспрессирующей CD40 злокачественной опухоли, и она будет приниматься с учетом мнения лечащего врача и обстоятельств, свойственных для каждого пациента. Эффективные дозы можно экстраполировать из кривых зависимости доза-ответная реакция, полученных по результатам опытов в условиях in vitro или на модельных тест-системах на животных.
Например, токсичность и терапевтическую эффективность анти-CD40-антитела или средства можно определить в клеточных культурах или на экспериментальных животных стандартными фармацевтическими методами, используемыми для определения LD50 (дозы, вызывающей гибель 50% популяции) и ЕD50 (дозы, терапевтически эффективной в 50% популяции). Соотношение между токсической и терапевтической дозами представляет собой терапевтический индекс и его можно выразить в виде соотношения LD50/ЕD50. Предпочтительным является связывающее CD40 средство (например, анти-CD40-антитело), которое имеет высокий терапевтический индекс. В тех случаях, когда связывающее CD40 средство проявляет токсические побочные эффекты, то можно использовать систему доставки, которая направляет связывающее CD40 средство в место пораженной ткани, в целях сведения до минимума потенциального повреждения клеток, которые не экспрессируют CD40, и тем самым снижения побочных эффектов.
Данные, полученные по результатам тестов в клеточных культурах и исследований на животных, можно использовать при составлении предела доз для применения у людей. Как правило, доза связывающего CD40 средства находится в пределах концентраций в крови, которые включают ЕD50 с малой токсичностью или без ее проявления. Дозировка может варьировать в данном пределе в зависимости от используемой лекарственной формы и применяемого пути введения. Для любого связывающего CD40 средства, используемого в способе, терапевтически эффективную дозу можно первоначально установить по результатам тестов в клеточных культурах. Дозу можно определить, исходя из данных, полученных на моделях на животных, для достижения пределов концентраций в плазме крови, которые включают IC50 (т.е. концентрацию испытуемого соединения, при которой достигается половинное подавление симптомов) по данным, полученным в культуре клеток. Такую информацию можно использовать для более точного определения пригодных доз для людей. Можно определить концентрации в плазме крови, например, высокоэффективной хроматографией высокого давления.
Как правило, доза анти-CD40-антитела или связывающего CD40 средства, вводимая пациенту с иммунологическим нарушением или экспрессирующей CD40 злокачественной опухолью, как правило, составляет примерно от 0,1 мг/кг до примерно 100 мг/кг массы тела субъекта. Доза, вводимая субъекту, равняется примерно от 0,1 мг/кг до примерно 50 мг/кг, примерно от 1 мг/кг до примерно 30 мг/кг, примерно от 1 мг/кг до примерно 20 мг/кг, примерно от 1 мг/кг до примерно 15 мг/кг или примерно от 1 мг/кг до примерно 10 мг/кг массы тела субъекта.
Примерные дозы включают, но не ограничиваются этим, от 1 нг/кг до 100 мг/кг. В некоторых вариантах осуществления доза составляет примерно 0,5 мг/кг, примерно 1 мг/кг, примерно 2 мг/кг, примерно 3 мг/кг, примерно 4 мг/кг, примерно 5 мг/кг, примерно 6 мг/кг, примерно 7 мг/кг, примерно 8 мг/кг, примерно 9 мг/кг, примерно 10 мг/кг, примерно 11 мг/кг, примерно 12 мг/кг, примерно 13 мг/кг, примерно 14 мг/кг, примерно 15 мг/кг или примерно 16 мг/кг. Дозу можно вводить, например, каждый день, раз в неделю (каждую неделю), два раза в неделю, три раза в неделю, четыре раза в неделю, пять раз в неделю, шесть раз в неделю, раз в две недели или месяц. В конкретных вариантах осуществления доза составляет примерно 0,5 мг/кг/неделю, примерно 1 мг/кг/неделю, примерно 2 мг/кг/неделю, примерно 3 мг/кг/неделю, примерно 4 мг/кг/неделю, примерно 5 мг/кг/неделю, примерно 6 мг/кг/неделю, примерно 7 мг/кг/неделю, примерно 8 мг/кг/неделю, примерно 9 мг/кг/неделю, примерно 10 мг/кг/неделю, примерно 11 мг/кг/неделю, примерно 12 мг/кг/неделю, примерно 13 мг/кг/неделю, примерно 14 мг/кг/неделю, примерно 15 мг/кг/неделю или примерно 16 мг/кг/неделю. В некоторых вариантах осуществления пределы доз находятся примерно от 1 мг/кг/неделю до примерно 15 мг/кг/неделю.
В некоторых вариантах осуществления фармацевтические композиции, содержащие связывающее CD40 средство, могут дополнительно включать терапевтическое средство, конъюгированное или неконъюгированное со связывающим средством. Анти-CD40-антитело или связывающее CD40 средство можно вводить совместно с одним или более терапевтическими препаратами, применяемыми для лечения или профилактики иммунологических нарушений или экспрессирующей CD40 злокачественной опухоли. Например, комбинированная терапия может включать цитостатический, цитотоксический препарат или иммуносупрессор. Также комбинированная терапия может включать, например, введение средства, которое направлено на рецептор или рецепторный комплекс иной, чем CD40 на поверхности активированных лимфоцитов, дендритных клеток или экспрессирующих CD40 злокачественных клеток. Пример такого средства включает второе антитело, направленное не на CD40, которое связывается с молекулой на поверхности активированного лимфоцита, дендритной клетки или экспрессирующей CD40 злокачественной клетки. Другой пример включает лиганд, который направлен на такой рецептор или рецепторный комплекс. Как правило, такое антитело или лиганд связываются с рецептором клеточной поверхности на активированном лимфоците, дендритной клетке или экспрессирующей CD40 злокачественной клетке и повышает цитотоксический или цитостатический эффект анти-CD40-антитела посредством доставки цитотоксического или цитостатического сигнала к активированному лимфоциту, дендритной клетке или экспрессирующей CD40 злокачественной клетке.
Такое комбинированное введение может иметь аддитивный или синергитический эффект в отношении признаков заболевания (например, тяжести проявления симптома, количества симптомов или частоты рецидивов).
В отношении схем лечения при комбинированном введении, в конкретном варианте осуществления, анти-CD40-антитело или связывающее CD40 средство вводят совместно с терапевтическим препаратом. В другом конкретном варианте осуществления терапевтический препарат вводят до или после введения анти-CD40-антитела или связывающего CD40 средства, по меньшей мере, в течение от 1 ч до нескольких месяцев, например, по меньшей мере, в течение 1 ч, 5 ч, 12 ч, суток, недели, месяца или трех месяцев до или после введения анти-CD40-антитела или связывающего CD40 средства.
Пригодные группы цитотоксических препаратов или иммуносупрессоров включают, например, препараты, оказывающие отрицательное влияние на тубулин, ауристатины (например, ММАЕ или ММАF), вещества, связывающиеся с малой бороздкой ДНК, ингибиторы репликации ДНК, алкилирующие агенты (например, комплексы платины, такие как цис-платин, моно(платина), бис(платина) и тринуклеарные комплексы платины и карбоплатин), антрациклины, антибиотики, антифолаты, антиметаболиты, препараты, повышающие чувствительность к химиотерапии, дуокармицины, этопозиды, фторированные пиримидины, ионофоры, лекситропсины, нитрозомочевины, платинолы, преформирующие соединения, антиметаболиты пуринов, пуромицины, препараты, повышающие чувствительность к лучевой терапии, стероиды, таксаны, ингибиторы топоизомеразы, алкалоиды барвинка или тому подобное.
Отдельные цитотоксические препараты или иммуносупрессоры включают, например, андроген, антрамицин (АМС), аспарагиназу, 5-азацитидин, азатиоприн, блеомицин, бусульфан, бутионин сульфоксимин, камтотецин, карбоплатин, кармустин (BSNU), СС-1065, хлорамбуцил, цисплатин, колхицин, циклофосфамид, цитарабин, цитидин арабинозид, цитохалазин В, дакарбазин, дактиномицин (формерли-актиномицин), даунорубицин, декарбазин, доцетаксель, доксорубицин, эстроген, 5-фтордезоксиуридин, 5-фторурацил, грамицидин D, гидроксимочевину, идарубицин, ифосфамид, иринотекан, ломустин (CCNU), меклоретамин, мелфалан, 6-меркаптопурин, метотрексат, митрамицин, митомицин С, митоксантрон, нитроимидазол, паклитаксел, пликамицин, прокарбизин, стрептозотоцин, тенопозид, 6-тиогуанин, тиоТЕРА, топотекан, винбластин, винкристин, винорелбин, VP-16 и VМ-16.
В некоторых типичных вариантах осуществления терапевтическое средство представляет цитотоксический препарат. Подходящие цитотоксические препараты включают, но не ограничиваются этим, доластатины (например, ауристатин Е, AFP, MMAF, MMAE, AEB или AEVB), вещества, связывающиеся с малой бороздкой ДНК (например, энедиины и лекситропсины), дуокармицины, таксаны (например, паклитаксел и доксетаксел), пуримицины, алкалоиды растений барвинок, СС-1065, SN-38, топотекан, морфолинодоксорубицин, ризоксин, цианоморфолинодоксорубицин, эхиномицин, комбретастатин, нетропсин, эпотилон А и В, эстрамуцин, криптофизины, цемадотин, маитанзиноиды, дискодермолид, элейтеробин или митоксантрон.
В некоторых вариантах осуществления цитотоксический препарат представляет обычный химиотерапевтический препарат, например, такой как доксорубицин, паклитаксел, мелфалан, алкалоиды растений барвинок, метотрексат, митоцин С или этопозид. Кроме того, эффективные препараты, такие как аналоги СС-1065, калихеамицин, маитанзин, аналоги доластатина 10, ризоксин и палитоксин, можно связать с анти-CD40-антителами или средствами на их основе.
В конкретных вариантах осуществления цитотоксический или цитостатический препарат представляет собой ауристатин Е (также известный в данной области как доластатин-10) или его производное. Как правило, производное ауристатина В представляет, например, эфир, образованный ауристатином В и кетокислотой. Например, ауристатин Е можно подвергнуть взаимодействию с параацетилбензойной кислотой или бензоилвалериановой кислотой с получением соответственно АЕВ и AEVB. Другие типичные производные ауристатина Е включают AFP, MMAF и ММАЕ. Синтез и структура ауристатина Е и его производных описаны, например, в публикации заявки на патент США № 2004-0157782 А1 и 2005-0238649; международной заявке № РСТ/US03/24209, международной заявке № РСТ/US02/13435 и патентах США № 6884869; 6323315; 6239104; 6034065; 5780588; 5665860; 5663149; 5635483; 5599902; 5554725; 5530097; 5521284; 5504191; 5410024; 5138036; 5076973; 4986988; 4978744; 4879278; 4816444 и 4486414; раскрытие которых включено здесь для сведения.
В конкретных вариантах осуществления цитотоксический препарат представляет вещество, связывающееся с малой бороздкой ДНК. (Смотри, например, патент США № 6130237). Например, в некоторых вариантах осуществления связывающее с малой бороздкой вещество представляет соединение CBI. В других вариантах осуществления связывающимся с малой бороздкой веществом является энедиин (например, калихеамицин).
Примеры веществ, оказывающих отрицательное влияние на тубулин, включают, но не ограничиваются этим, таксаны (например, таксол®(паклитаксел), таксотере® (доксетаксел)), Т67 (туларик), алкалоиды растений барвинок (например, винкристин, винбластин, виндезин и винорелбин) и доластатины (например, ауристатин Е, AFP, MMAF, MMAE, AEB, AEVB). Другие вещества, оказывающие отрицательное влияние на тубулин, включают, производные баккатина, аналоги таксана (например, эпотилон А и В), нокодазол, колхицин и колцимид, эстрамустин, криптофизины, цемадотин, маитанзиноиды, комбретастатины, дискодермолид и элейтеробин.
В некоторых вариантах осуществления цитотоксический препарат представляет маитанзиноид, представитель другой группы веществ с действием против тубулина. Например, в конкретном варианте осуществления маитанзиноидом является маитанзин или DM-1 (ImmunoGen, Inc.; смотри также Chauri et al., 1992, Cancer Res. 52: 127-131).
В некоторых вариантах осуществления терапевтическое средство не является радиоактивным изотопом.
В некоторых вариантах осуществления цитотоксический препарат или иммуносупрессор является антиметаболитом. Антиметаболит может, например, представлять антагонист пуринов (например, азотиоприн или микофенолят мофетил), ингибитор дигидрофолатредуктазы (например, метотрексат), ацикловир, гангцикловир, зидовудин, видарабин, рибаварин, азидотимидин, цитидин арабинозид, амантадин, дидезоксиуридин, йододезоксиуридин, поскарнет или трифлуридин.
В других вариантах осуществления цитотоксический препарат или иммуносупрессор представляет такролимус, циклоспорин или рапамицин. В дополнительных вариантах осуществления цитотоксический препарат представляет альдеслейкин, алемтузумаб, алитретиноин, аллопуринол, алтретамин, амифостин, анастрозол, триоксид мышьяка, бексаротен, калустерон, капецитабин, целекоксиб, кладрибин, дарбепоэтин альфа, денилейкин дифритокс, декстразоксан, дромостанолон пропионат, эпирубицин, эпоэтин альфа, эстрамустин, эксеместан, филграстим, флоксуридин, флударабин, фулвестрант, гемицитабин, гемтузумаб, озогамицин, гозерелин, идарубицин, ифосфамид, иматиниб мезилат, интерферон альфа-2а, иринотекан, летрозол, лейковорин, левамизол, меклоретамин или азотистый иприт, мегестрол, месна, метотрексат, метоксален, митомицин С, митотан, нандролон фенпропионат, опрелвекин, оксалиплатин, памидронат, пегадемазу, пегаспаргазу, пегфилграстим, пентостатин, пипоброман, пликамицин, натриевую соль порфимера, прокарбазин, хинакрин, расбуриказу, ревлимид, сарграмостим, стрептозоцин, тамоксифен, темозоломид, тенипозид, тестолактон, тиогуанин, торемифен, тозитумомаб, трастузумаб, третиноин, урациловый иприт, валрубицин, винбластин, винкристин, винорелбин и золедронат.
В дополнительных вариантах осуществления лекарственный препарат представляет гуманизированное моноклональное анти-HER2-антитело; ритуксан (ритуксимаб; Genetech, Inc., South San Fracisco, CA); химерное моноклональное анти-CD-антитело); оварекс (AltaRex Corporation, MA); панорекс (Glaxo Wellcome, NC; мышиное IgG2a-антитело); цетуксимаб эрбитукс (Imclone Systems Inc., NY; химерное анти-EGFR-антитело); витаксин (MedImmune, Inc., MD); кампат I/H (Leukosite, MA; гуманизированное IgG1-антитело); смарт МI95 (Protein Design Labs., Inc., CA; гуманизированное IgG анти-CD33-антитело); лимфоцид (Immunomedics, Inc., NY; гуманизированное IgG анти-CD22-антитело); смарт ID10 (Protein Design Labs., Inc., CA; гуманизированное анти-HLA-DR-антитело); онколим (Techniclone, Inc., CA; меченное радиоактивной меткой мышиное анти-HLA-DR10-антитело); алломун (BioTrаnsplant, CA; гуманизированное анти-CD2-антитело mAb); авастин (Genentech, Inc., CA; гуманизированное анти-VEGF-антитело); эпратузамаб (Immunomedics, Inc., NY и Amgen, CA; анти-CD22-антитело) и СЕАцид (Immunomedics, Inc.; гуманизированное анти-СЕА-антитело).
Другие подходящие антитела включают, но не ограничиваются этим, антитела против следующих антигенов: СА125, СА15-3, СА19-9, L6, Lewis Y, Lewis X, альфа-фетопротеина, СА 242, плацентарной щелочной фосфатазы, специфического антигена простаты, кислой фосфатазы простаты, эпидермального фактора роста, MAGE-1, MAGE-3, MAGE-4, рецептора трансферрина, р97, MUC1-KLH, CEA, gp100, MART1, специфического антигена простаты, рецептора IL-2, СD20, СD52, СD33, СD22, человеческого хорионического гонадропина, СD38, муцина, Р21, MPG и продукта онкогена Neu.
В некоторых вариантах осуществления терапевтическое средство является иммуносупрессором. Иммуносупрессор может представлять, например, ганцикловир, этанерцепт, такролимус, циклоспорин, рапамицин, циклофосфамид, азатиоприн, микофенолят мофетил или метотрексат. Альтернативно иммуносупрессор может представлять, например, глюкокортикоид (например, кортизол или альдостерон) или аналог глюкокортикоида (например, преднизон или дексаметазон).
Подходящие ингибиторы циклооксигеназы включают меклофенамовую кислоту, мефенамовую кислоту, капруфен, диклофенак, дифлунизал, фенбуфен, фенопруфен, ибупруфен, индометацин, кетопруфен, набуметон, напроксен, сулиндак, теноксикам, толметин и ацетилсалициловую кислоту.
Подходящие ингибиторы липоксигеназы включают ингибиторы окисления-восстановления (например, производные катехолбутана, нордигидрогваретиковую кислоту (NDGA), мазопрокол, фенидон, инопален, ианополен, индазолиноны, нафзатром, бензофуранол, алкилгидроксиамин) и ингибиторы, не связанные с окислением-восстановлением (например, гидрокситиазолы, метоксиалкилтиазолы, бензопираны и их производные, метокситетрагидропиран, босвелликовую кислоту и ацетилированные производные босвелликовой кислоты и хинолинметоксифенилуксусную кислоту, замещенную циклоалкилом) и предшественники ингибиторов окисления-восстановления.
Другие подходящие ингибиторы липоксигеназы включают антиоксиданты (например, фенолы, пропилгаллат, флавоноиды и/или природные субстраты, содержащие флавоноиды, гидроксилированные производные флавонов, флавонол, дигидроквецертин, лютеолин, галангин, оробол, производные калкона, 4,2',4'-тригидроксикалкон, ортоаминофенолы, N-гидроксимочевины, бензофуранолы, эбселен и вещества, которые повышают активность восстановительных селеноферментов), соединения, образующие комплекс с ионом железа (например, гидроксамовые кислоты и их производные, N-гидроксимочевины, 2-бензил-1-нафтол, катехолы, гидроксиламины, карнозол, тролокс С, катехол, нафтол, сульфасалазин, зилейтон, 5-гидроксиантраниловую кислоту и 4-(омега-арилалкил)фенилалкановые кислоты), содержащие имидазол соединения (например, кетоконазол и интраконазол), фенотиазины и производные бензопирана.
Еще одни подходящие ингибиторы липоксигеназы включают ингибиторы эйкозаноидов (например, октадекатетраеновую, эйкозатетраеновую, докозатетраеновую, эйкозагексаеновую и докозагексаеновую кислоты и их эфиры, PGE1 (простагландин Е1), PGА2 (простагландин А2), випростол, 15-моногидроксиэйкозатетреновую, 15-моногидроксиэйкозатриеновую и 15-моногидроксиэйкозапентаеновую кислоты и лейкотриены В5, С5 и D5), соединения, оказывающие влияние на кальциевые потоки, фенотиазины, дифенилбутиламины, верапамил, фускозид, куркумин, хлорогеновую кислоту, кофеиновую кислоту, 5,8,11,14-эйкозатетраеновую кислоту (ETYA), гидроксифенилретинамид, ионапален, эскулин, диэтилкарбамазин, фенантролин, баикалеин, проксикромил, тиоэфиры, диаллилсульфид и ди(1-пропенил)сульфид.
Антагонисты рецептора лейкотриенов включают кальцитриол, онтазоласт, Bayer Bay-x-1005, Ciba-Geigy CGS-25019C, эбселен, Leo Denmark ETH-615, Lilly LY-293111, Ono ONO-4057, Terumo TMK-688, Boehringer Ingleheim BI-RM-270, Lilly LY 213024, Lilly LY 264086, Lilly LY 292728, Ono ONO-LB457, Pfizer 105696, Perdue Frederick PF 10042, Rhone-Poulenc Rorer RP 66153, SmithKline Beecham SB-201146, SmithKline Beecham SB-201993, SmithKline Beecham SB-209247, Searle SC-53228, Sumitamo SM 15178, American Home Products WAY 121006, Bayer Bay-o-8276, Warner-Lambert CI-987, Warner-Lambert CI-987BPC-15LY 223982, Lilly LY 233569, Lilly LY- 255283, MacroNex MNX-160, Merck and Co., MK-591, Merck and Co., MK-886, Ono ONO-LB-448, Perdue Frederick PF-5901, Rhone-Poulenc Rorer RP 14893, Rhone-Poulenc Rorer RP 66364, Rhone-Poulenc Rorer RP 69698, Shionoogi S-2474, Searle SC-41930, Searle SC-50505, Searle SC-51146, Searle SC-52798, SmithKline Beecham SKandF-104493, Leo Denmark SR-2566, Tanabe T-757 и Teijin TEI-1338.
Изделия производства
В другом аспекте обеспечивается изделие производства, содержащее вещества, пригодные для лечения нарушений, описанных выше. Изделие производства включает контейнер и этикетку. Подходящие контейнеры включают, например, бутыли, флаконы, шприцы и пробирки. Контейнеры могут быть изготовлены из различных материалов, таких как стекло или пластик. Контейнер содержит композицию, которая является эффективной для лечения состояния и может иметь стерильное отверстие для доступа. Например, контейнер может представлять собой мешок или флакон для внутривенного введения, имеющие запирающее устройство с инъекционной иглой для подкожного введения. Активное вещество в композиции представляет гуманизированное анти-CD40-антитело. На этикетке на контейнере или связанной с ним указывается, что композиция используется для лечения состояния выбора. Изделие производства может дополнительно включать второй контейнер, содержащий фармацевтически приемлемый буфер, такой как забуференный фосфатом физиологический раствор, раствор Рингера и раствор дектрозы. Он может дополнительно включать другие вещества, присутствие которых желательно с коммерческой и потребительской точки зрения, включая другие буферы, разбавители, фильтры, иглы, шприцы и вкладыши в упаковку с инструкциями по применению.
Депонирование в АТСС
Депонирование в АТСС моноклонального антитела S2C6 было произведено 25 мая 1999 г. согласно будапештскому соглашению по международному признанию депонирования микроорганизмов в целях патентования. АТСС находится по адресу 10801 University Boulevard, Manassas, Virgina 20110-2209, США. Данный депозит АТСС находится под номером для доступа РТА-110. АТСС расположена по адресу 10801 University Boulevard, Manassas, Virgina 20110-2209, США. Любой депозит доступен для специалистов в данной области и для поиска к депозиту не требуется 35 U.S.C. раздел 112. Описанное здесь не ограничивается объемом депонированного антитела, поскольку депонированный вариант осуществления предназначается в качестве единичной иллюстрации некоторых аспектов изобретения, и любое антитело, которое является функционально эквивалентным, находится в объеме данного изобретения. Депозит материала, который не составляет допущение, что имеющееся написанное описание является не адекватным для облегчения практического применения любого аспекта изобретения, включая его наилучший вариант осуществления, и не рассматривается в качестве ограничения объема формулы изобретения к конкретным представленным иллюстрациям. Действительно, специалистам в данной области станут очевидными различные модификации изобретения в дополнение к представленным и описанным здесь из приведенного выше описания, и они попадают в объем прилагаемой формулы изобретения.
Изобретение дополнительно описывается в последующих примерах, которые не предназначены для ограничения объема изобретения. Клеточные линии, описанные в последующих примерах, поддерживали в культуре в условиях, указанных Американской коллекцией типовых культур (АТСС) или Немецкой коллекцией микроорганизмов и клеточных культур GmbH, Braunschweig, Германия (DMSZ). Реагенты для клеточных культур получали от Invitrogen Corp. (Carlsbad, CA).
ПРИМЕРЫ
Пример 1: получение гуманизированного анти-CD40-антитела
Гуманизированное анти-CD40-антитело в основном конструировали «импортированием» CDR мышиного донорного анти-CD40-антитела в человеческое антитело-реципиент. Донорное антитело представляло мышиное моноклональное антитело S2C6, описанное в патенте США № 6838261, и было показано, что оно обеспечивает сильные, стимулирующие рост сигналы для В-лимфоцитов. Смотри, например, Paulie et al., 2000, J. Immunol. 142: 590. Получали консенсусные последовательности для человеческой вариабельной области тяжелой цепи подгруппы III (SEQ ID NO:2) и для человеческой вариабельной области легкой цепи каппа подгруппы I (SEQ ID NO:13), в основном как описано Carter et al., Proc. Natl. Acad. Sci. USA 89: 4285; в патенте США № 6037454 и патенте США № 6054297 для применения в качестве реципиентных человеческих доменов тяжелой и легкой цепей.
Фагемид рЕМХ1, описанный Cunningham et al., 1989, Science 243: 1330-1336), включает фрагмент ДНК, кодирующий человеческую консенсусную вариабельную область легкой цепи каппа подгруппы I и человеческую консенсусную вариабельную область тяжелой цепи подгруппы III, и представляет подходящий вектор для мутагенеза, а также экспрессии F(ab)s в E. coli. ДНК, кодирующая консенсусные вариабельные области, операбельно связана с промотором щелочной фосфатазы и последовательностью Шин-Дальгарно, полученные из плазмиды pUC119, рАК2, как описано Carter et al., Proc. Natl. Acad. Sci. USA 89: 4285. Конструировали уникальный сайт рестрикции SpeI между полинуклеотидами, кодирующими вариабельные области F(ab) легкой и тяжелой цепи. Конструировали рЕМХ1 и использовали для получения гуманизированных антител, описанных здесь.
Первое гуманизированное mAb S2C6 F(ab), обозначенное здесь как sgn-0, конструировали «импортированием» CDR мышиного антитела в каркасные области человеческой консенсусной последовательности сайт-направленным мутагенезом. Мутагенез в основном проводили с использованием методов, описанных Kunkel, 1985, Proc. Natl. Acad. Sci. USA 82: 488. Полученные аминокислотные последовательности вариабельных областей тяжелой и легкой цепи гуманизированной молекулы F(ab) представлены в таблице 2 (соответственно SEQ ID NO:3 и SEQ ID NO:14) и проводили сравнение с таковыми для донорного антитела, мышиного моноклонального антитела S2C6 (mMAb S2C6, также обозначенное здесь как SGN-14; соответственно SEQ ID NO:1 и SEQ ID NO:12) и с таковыми консенсусной последовательности человеческих антител-реципиентов, HuVH III и HuVLĸ I (соответственно SEQ ID NO:2 и SEQ ID NO:13).
Плазмиды трансформировали в штамм XL-1 синий E. coli (Strataene, San Diego, CA) для получения двух- и одноцепочечной ДНК. Каждую из вариабельных областей легкой и тяжелой цепи полностью секвенировали с использованием дидезоксинуклеотидного метода (Sequenase, US Biochemical Corp.). Плазмиды трансформировали в штамм 16С9 E. coli, производное ММ294, высевали на чашки с LB, содержащие 5 мкг/мл карбенициллина, и отбирали единичные колонии для экспрессии белка. 5 мл культуры добавляли к 500 мл карбенициллина АР5-100 мкг/мл и культивировали в течение 16 ч в колбах для встряхивания емкостью 4 л при 37°С. Затем среду АРS, состоящую из 1,5 г глюкозы, 11,0 г хиказы SF, 0,6 г дрожжевого экстракта (сертифицированного), 0,19 г MgSO4 (безводного), 1,07 г NH4Cl, 3,73 г KCl, 12 г NaCl, 120 мл 1М триэтаноламина, рН 7,4, доводили до 1 л водой и затем стерилизовали пропусканием через фильтр Sealkeen с размером пор 0,1 мкм.
Клетки собирали центрифугированием в центрифужной пробирке емкостью 1 л (Nalgene) при 3000 g и супернатант удаляли. После замораживания в течение 1 ч осадок после центрифугирования ресуспендировали в 25 мл холодного 10 мМ MES, 10 мМ ЭДТА, рН 5,0 (буфер А). 250 мкл 0,1 М PMSF (Sigma) добавляли для ингибирования протеолиза и вносили 3,5 мл маточного раствора яичного белка лизоцима (Sigma) для лизиса оболочки клеток бактерий. После мягкого встряхивания на льду в течение 1 ч пробу центрифугировали при 40000 g в течение 15 мин. Супернатант доводили до объема 50 мл буфером А и 2 мл наносили на колонку DEAE, уравновешенную буфером А. Затем элюат наносили на колонку с протеин А-сефарозой CL-4B (Pharmacia) (объем 0,5 мл), уравновешенную буфером А. Колонку промывали 10 мл буфера А и элюировали 3 мл 0,3 М глицина, рН 3,0, в 1,25 мл 1 М Трис, рН 8,0. Затем F(ab) обменивали на буфер в PBS с использованием фильтра Centricon-30 (Amicon) и концентрировали до конечного объема 0,5 мл. Проводили электрофорез F(ab) в SDS-PAGE для оценки чистоты и молекулярную массу подтверждали электрораспылительной масс-спектрометрией.
Было показано, что гуманизированное антитело sgn-0 обладает достоверно пониженной аффинностью связывания с CD40, иммобилизованным на титрационных микропланшетах, по сравнению с исходным мышиным антителом.
Таблица 2

Пример 2: получением вариантов гуманизированного анти-CD40-антитела
Проводили ряд мутаций с матрицей гуманизированным антителом, sgn-0, полученного как описано в примере 1. Конкретные мутации проводили с ДНК, кодирующей вариабельные области легкой и тяжелой цепи sgn-0 сайт-направленным мутагенезом, и последовательности вариантов, полученные из молекулы-матрицы, представлены ниже в таблицах 3 и 4.
Антитела, сконструированные с использованием данных вариантов вариабельных областей легкой и тяжелой цепи, анализировали в отношении связывающей активности. Каждое антитело разбавляли до равных концентраций и затем готовили серийные разведения. Разбавленные антитела анализировали на связывание с CD40, иммобилизованным на титрационных микропланшетах. Данные по аффинности связывания для вариантных антител приведены ниже в таблице 5. Антителами, проявившими активность связывания, приближающуюся к таковой у исходного мышиного антитела, были sgn-14, sgn-18, sgn-19, sgn-22, sgn-23, sgn-26 и sgn-27, при том, что варианты sgn-14, sgn-18, sgn-26 и sgn-27 наиболее близко приближались к исходному мышиному антителу SGN-14, и вариант sgn-26 показывал наилучшую функциональную активность в данных тестах.
Таблица 3


Таблица 4


Таблица 5

Пример 3: цитотоксическая активность гуманизированного анти-CD40-антитела в условиях in vitro
CD40+ и CD138+++ клеточные линии человеческой множественной миеломы, MM.1S, которая является чувствительной к дексаметазону, и MM.1R, которая является резистентной к дексаметазону, а также только что выделенные опухолевые клетки (CD40+ и CD138+++) от двух пациентов с множественной миеломой, обрабатывали гуманизированным антителом S2C6 в возрастающих концентрациях (0-100 мкг/мл) в течение 48 ч. Синтез ДНК оценивали по включению 3[Н]тимидина. Результаты указывали, что гуманизированное антитело S2C6 не стимулировало пролиферацию MM.1S, MM.1R или опухолевых клеток от двух пациентов (р>0,1).
Для дополнительной оценки цитотоксического действия гуманизированного антитела S2C6 в отношении данных клеток культуры MM.1S и MM.1R обрабатывали в течение 6 ч гуманизированным антителом S2C6 (10 мкг/мл) и затем культивировали совместно с ингибитором синтеза белка de novo циклогексимидом (0,2 мкг/мл) еще в течение 48 ч. Жизнеспособность клеток оценивали с использованием восстановления 3-(4,5-диметилтиозол-2-ил)-2,5-дифенилтетразолия бромида (МТТ) в качестве индикатора. Обработка гуманизированным антителом S2C6 и циклогексимидом «запускала» 50-60% гибель клеток обеих линий, в то время как обработка одним контрольным изотипом Ig, с или без циклогексимида, не индуцировала проявления цитотоксичности. Гуманизированное антитело S2C6 приводило к цитотоксичности, составляющей 20-30 % клеток, в культурах опухолевых клеток от двух пациентов, которая достоверно усиливалась в присутствии циклогексимида, использованного в нетоксичной дозе (0,2 мкг/мл).
Пример 4: противоопухолевая активность гуманизированного анти-CD40-антитела
Противоопухолевую активность гуманизированного анти-CD40-антитела оценивали на модели ксенотрансплантата лимфомы на мышах SСID. 5 млн опухолевых клеток Рамоса вводили подкожно мышам SСID (10 мышей/группе) за 13 суток до начала обработки препаратом. Мышиное анти-CD40-антитело или гуманизированное анти-CD40-антитело S2C6 вводили внутрибрюшинно 3 раза в неделю (4 мг/кг/дозу) при 8 или 5 дозах. Мышей обследовали на рост опухолей и каждую неделю определяли объем опухолей в течение 14-суточного опытного периода. Данные, приведенные на фигуре 2, показывают примерно 9-кратное повышение роста опухолей у контрольных мышей, в то время как за тот же опытный период рост опухолей у мышей, обработанных мышиным анти-CD40-антителом или гуманизированным антителом S2C6, был очень незначительным. Данные показывают, что гуманизированное антитело было таким же эффективным, как и мышиное анти-CD40-антитело, в подавлении роста опухолей на данной модели ксенотрансплантата В-лимфомы.
Пример 5: пролонгированная выживаемость под действием гуманизированного анти-CD40-антитела
Оценивали эффективность гуманизированного анти-CD40-антитела на выживаемость мышей с опухолями на модели ксенотрансплантата лимфомы на мышах SСID. Мышам SСID (10 мышей/группе) вводили внутривенно 1 млн опухолевых клеток Рамоса за 3 суток перед обработкой антителом. Мышей обрабатывали мышиным или гуманизированным анти-CD40-антителом, или контрольным Ig, вводя препараты внутрибрюшинно 2 раза в неделю (4 мг/кг/дозу) в целом в 5 дозах. Ежедневно мышиные клетки осматривали на наличие павших животных. Результаты, приведенные на фигуре 3, показывают, что ни одна мышь, обработанная контрольным антителом, не выживала позднее 34 суток после инокуляции опухолевых клеток, в то время как 8 из 10 мышей, обработанных мышиным анти-CD40-антителом, и все 10 мышей, обработанных гуманизированным анти-CD40-антителом, оставались живыми даже через 90 суток после прививки опухолевого имплантата. Данные свидетельствуют, что гуманизированное антитело было также эффективным, что и мышиное анти-CD40-антитело, в увеличении выживаемости мышей SСID на данной модели ксенотрансплантата В-лимфомы.
Здесь цитируются различные источники, включая заявки на патенты, патенты и научные публикации, раскрытие которых включено здесь в полном объеме для сведения. Цитирование или идентификация любого представленного здесь источника не следует рассматривать в качестве допущения, что такой источник был доступен как предшествующий уровень настоящего изобретения.
Применение сведений, раскрытых здесь, не сводится к объему конкретных вариантов осуществления, раскрытых здесь. Действительно специалистам в данной области очевидны различные модификации в свете наставлений, раскрытых здесь, и сопровождающих примерах. Предполагается, что такие модификации находятся в объеме прилагаемой формулы изобретения.
Показатели, относящиеся к депонированному микроорганизму или другому биологическому материалу
(РСТ Правило 13бис)
на странице _________________, строчка _______________________.
Американская коллекция типовых культур
10801 University Blvd.
Manassas, VA 20110
25 мая 1999 г.
РТА-110
(оставить место, если не применимо)
на дополнительном листе □
получающего офиса
☑ Этот лист был получен с между-
народной заявкой
Международного бюро
□ Этот лист был получен Международ-
ным бюро:
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИ-CD40-АНТИТЕЛА И СПОСОБЫ ПРИМЕНЕНИЯ | 2012 |
|
RU2609647C2 |
| АНТИКЛАСТЕРИНОВЫЕ АНТИТЕЛА И АНТИГЕНСВЯЗЫВАЮЩИЕ ФРАГМЕНТЫ И ИХ ИСПОЛЬЗОВАНИЕ ДЛЯ УМЕНЬШЕНИЯ ОБЪЕМА НОВООБРАЗОВАНИЙ | 2010 |
|
RU2627163C2 |
| АНТИТЕЛА ПРОТИВ CD40 И ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2796413C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИ-ТФР-БЕТА-АНТИТЕЛА | 2005 |
|
RU2386638C2 |
| АНТИТЕЛА К БЕЛКУ ПРОГРАММИРУЕМОЙ КЛЕТОЧНОЙ СМЕРТИ 1 | 2018 |
|
RU2812915C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИ-SIRPα АНТИТЕЛА | 2019 |
|
RU2812199C2 |
| АНТИ-CD40-АНТИТЕЛА, ПРИМЕНЕНИЕ И МЕТОДЫ | 2012 |
|
RU2649055C2 |
| ЛЕЧЕНИЕ РАКА С ПОМОЩЬЮ АНТИТЕЛА К СЕМАФОРИНУ 4D В КОМБИНАЦИИ С ЭПИГЕНЕТИЧЕСКИМ МОДУЛИРУЮЩИМ АГЕНТОМ | 2018 |
|
RU2783535C2 |
| ЛЕЧЕНИЕ РАКА С ПОМОЩЬЮ ГУМАНИЗИРОВАННОГО АНТИ-CD19 ХИМЕРНОГО АНТИГЕННОГО РЕЦЕПТОРА | 2014 |
|
RU2711975C2 |
| ПРИМЕНЕНИЕ АНТИ-CD40-АНТИТЕЛ | 2006 |
|
RU2442606C2 |






















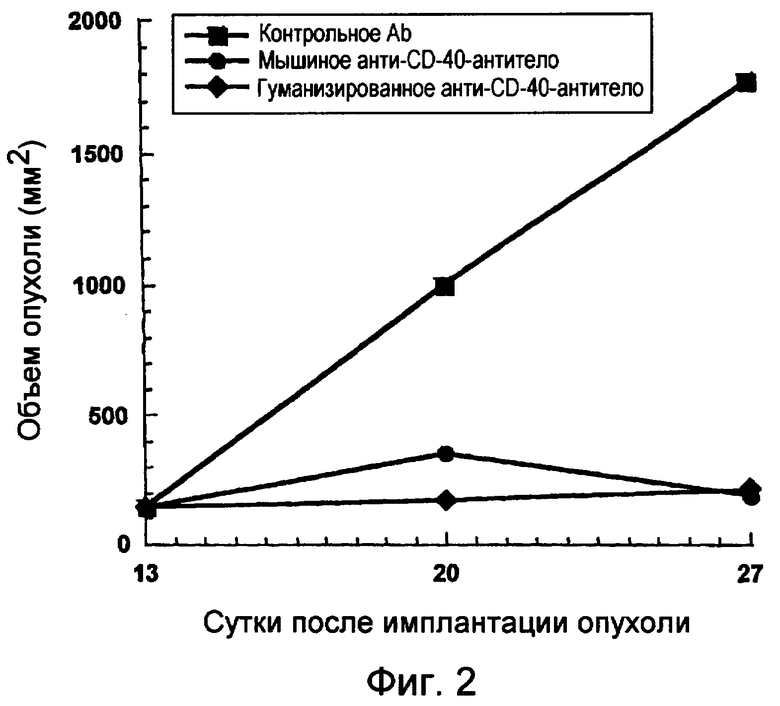

Изобретение относится к биотехнологии и представляет собой гуманизированные анти-СD40-антитела и их антигенсвязывающие фрагменты, а также полинуклеотиды, кодирующие вариабельные области антител по изобретению. Также представлены фармацевтическая композиция и набор на основе указанных антител. Антитела по изобретению можно эффективно использовать для лечения заболевания, для которого характерна экспрессия антигена CD40. 5 н. и 20 з.п. ф-лы, 3 ил., 5 табл.
1. Выделенное антитело или антигенсвязывающий фрагмент, которое специфически связывается с человеческим CD40, содержащее аминокислотную последовательность вариабельной области тяжелой цепи SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10 или SEQ ID NO:11 и аминокислотную последовательность вариабельной области легкой цепи SEQ ID NO:14, SEQ ID NO:15 или SEQ ID NO:16.
2. Антитело или антигенсвязывающий фрагмент по п.1, содержащее аминокислотную последовательность вариабельной области тяжелой цепи SEQ ID NO:10 и аминокислотную последовательность вариабельной области легкой цепи SEQ ID NO:16.
3. Антитело по п.1 или 2, содержащее константную область человеческого IgG.
4. Антитело по п.3, где изотип константной области IgG представляет собой IgG1, IgG2, IgG3 или IgG4.
5. Антитело по п.4, где изотип константной области IgG представляет собой IgG1.
6. Антитело по п.3, содержащее константную область легкой цепи, которая представляет собой константную область каппа.
7. Антитело или антигенсвязывающий фрагмент по п.1 или 2, который представляет собой антигенсвязывающий фрагмент антитела.
8. Антигенсвязывающий фрагмент по п.7, где фрагмент антитела представляет собой фрагменты Fab, Fab', F(ab')2, Fv, диантитело, одноцепочечное антитело, scFv-фрагмент или scFv-Fc.
9. Антитело или антигенсвязывающий фрагмент по п.1 или 2, дополнительно содержащее детектируемую метку.
10. Антитело или антигенсвязывающий фрагмент по п.1 или 2, где антитело конъюгировано с химиотерапевтическим препаратом.
11. Антитело или антигенсвязывающий фрагмент по п.10, в котором химиотерапевтический препарат представляет ауристатин.
12. Антитело или антигенсвязывающий фрагмент по п.11, в котором ауристатин представляет собой ММАЕ или MMAF.
13. Антитело или антигенсвязывающий фрагмент по п.1 или 2 для применения в качестве лекарственного средства для лечения злокачественной опухоли, экспрессирующей CD40, или иммунологического заболевания, ассоциированного с экспрессией CD40.
14. Антитело или антигенсвязывающий фрагмент по п.13, где лекарственное средство предназначено для подавления роста клеток, экспрессирующих антиген CD40 человека.
15. Антитело или антигенсвязывающий фрагмент по п.13, где лекарственное средство предназначено для лечения субъекта, имеющего ассоциированное с CD40 нарушение, где связывание антитела или антигенсвязывающего фрагмента с CD40 приводит к подавлению роста или дифференцировке клеток ассоциированного с CD40 нарушения.
16. Антитело или антигенсвязывающий фрагмент по п.15, где клетки ассоциированного с CD40 нарушения представляют собой В-лимфобластоидные клетки, клетки злокачественной опухоли поджелудочной железы, клетки злокачественной опухоли легких, клетки злокачественной опухоли молочной железы, клетки злокачественной опухоли яичников, клетки злокачественной опухоли ободочной кишки, клетки злокачественной опухоли простаты, злокачественные клетки кожи, клетки злокачественной опухоли головы и шеи, клетки злокачественной опухоли мочевого пузыря, клетки злокачественной опухоли костей или клетки злокачественной опухоли почек.
17. Антитело или антигенсвязывающий фрагмент по п.15, где ассоциированное с CD40 нарушение представляет собой хроническую лимфоцитарную лейкемию, лимфому Беркитта, множественную миелому, Т-клеточную лимфому, не-ходжкинскую лимфому, болезнь Ходжкина, макроглобулинемию Вальденстрема или саркому Капоши.
18. Антитело или антигенсвязывающий фрагмент по п.17, где вариабельная область тяжелой цепи и вариабельная область легкой цепи включают аминокислотные последовательности соответственно SEQ ID NO:10 и SEQ ID NO:16.
19. Антитело или антигенсвязывающий фрагмент по п.13, где лекарственное средство предназначено для индукции истощения периферических В-клеток.
20. Антитело или антигенсвязывающий фрагмент по п.19, где лекарственное средство предназначено для введения субъекту с иммунным нарушением.
21. Антитело или антигенсвязывающий фрагмент по п.20, где иммунное нарушение представляет собой ревматоидный артрит или системную красную волчанку.
22. Фармацевтическая композиция для лечения злокачественной опухоли, экспрессирующей CD40, или иммунологического заболевания, ассоциированного с экспрессией CD40, содержащая:
(i) антитело или антигенсвязывающий фрагмент по п.1 или 2, и
(ii) фармацевтически приемлемый носитель.
23. Выделенный полинуклеотид, кодирующий гуманизированную вариабельную область тяжелой цепи антитела или антигенсвязывающего фрагмента по п.1 или 2.
24. Выделенный полинуклеотид, кодирующий гуманизированную вариабельную область легкой цепи антитела или антигенсвязывающего фрагмента по п.1 или 2.
25. Набор для детектирования белка CD40 в биологической пробе, содержащий в контейнере антитело или антигенсвязывающий фрагмент по п.1 или 2, и необязательно инструкции по применению антитела для детектирования белка CD40 в биологической пробе.
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| WO 1997031025, 28.08.1997 | |||
| HAYASHI Т., ЕТ AL | |||
| Приспособление с иглой для прочистки кухонь типа "Примус" | 1923 |
|
SU40A1 |
| British Journal of Haematology, 2003, 121(4): 592-596 | |||
| РОЙТ А | |||
| и др | |||
| Иммунология | |||
| - М.: Мир, 2000, с.27, 37, 201, 212-214, 230. | |||
Авторы
Даты
2010-12-27—Публикация
2006-05-26—Подача