Предлагаемое изобретение относится к соединениям серебра и непосредственно касается коллоидного раствора наносеребра и способа получения коллоидного раствора наносеребра в этиленгликоле, который после его введения в гидрофобную полимерную матрицу может быть применен в медицине в качестве антимикробного и антивирусного средства.
Известны различные способы получения наночастиц серебра, которые условно подразделяются на два основных типа получения наночастиц металлического серебра (Materials Science and Engineering A. vol. 379, p. 378-383, 2004):
I) метод, осуществляемый при помощи физических воздействий: лазерное испарение, термическое испарение, дуговой разряд, плазма;
II) метод синтеза в жидкой среде, включающий восстановление ионов серебра в растворах в присутствии различных добавок (ПАВ, стабилизаторов), регулирующих размер получаемого наносеребра.
Метод (I), осуществляемый при помощи физических воздействий, довольно энергоемок и требует сложного аппаратурного оформления.
Наиболее применимым для получения наносеребра является метод синтеза наносеребра в жидкой среде, а именно в водной среде. Как известно, данный метод проводится восстановлением серебра в водных растворах его солей с помощью различных восстановителей. В качестве исходных соединений серебра используются его неорганические соли, такие как нитрат серебра (RU 2430169, C22B 11/00, 2011) галогениды серебра (RU 2458159), сульфат серебра (RU 2430169, C22B 11/00, 2011), сульфид серебра, карбонаты серебра, а также серебряные соли жирных карбоновых кислот (WO 2014189, B22F 1/00, 2014). В качестве исходных соединений применяются и предварительно полученные прекурсоры, каковыми являются, например, аминные комплексы серебра, которые затем в определенных условиях подвергаются обработке до получения конечного серебра в виде наночастиц (WO 2014189025, B22F 1/00, 2014), либо аммонийные комплексы, полученные из азотнокислого серебра и аммиака (TW 201422341, C22B 11/00, 2014), либо аминокарбонатные комплексы серебра, полученные из солей серебра и аминокарбоновых кислот (KR 20140113935, B22F 1/02, 2014; PL 404955, B22B 3/00, 2014). К таким исходным соединениям серебра можно отнести и комплексы (TW 201422342), получаемые при контактировании солей серебра или окиси серебра с алифатическими аминами (октиламин, гексиламин, олеиноамин), из которых затем восстановлением при температуре 10-50°C с применением гидразина или боргидрида натрия (NaBH4) получают серебро в виде наночастиц размером 10-200 нм. Боргидрид натрия в качестве восстановителя предлагается также использовать в другом известном способе получения наночастиц серебра из водного раствора солей серебра (AgNO3) в присутствии аминокислоты-L-цистеина (RU 2526390, B22B 3/00, 2013). В качестве восстановителя при получении наносеребра применяется также аскорбиновая кислота. Процесс восстановления с помощью аскорбиновой кислоты чаще всего проводится в присутствии стабилизирующих добавок: цитрата натрия [Yagiong Qin, Xiaohui Ji // Size control over spherical silver nanoparticles by ascorbic acid redaction // Colloid and Surfaces A: Physicochemical and Engineering Aspects, V. 372, (1-3), 2010, p. 172-176]; хитозана, используемого в виде раствора в уксусной кислоте [Zain, N.М., Stapley, A.G.F., and Shama, G., Green Synthesis of Silver and Copper Nanoparticles using Ascorbic acidand Chitosan for Antimicrobial Applications, Carbohydrate Polymers (2014), http://dx.doi.org/10.1016/j.carbpol.2014.05.081]; крахмала [Mayur Valodkar, Shefaly Modi, // Synthesis and anti-bacterial activity of Cu, Ag and Cu-Ag alloy nanjparticles: A green approach // Materials Reseach Bulletin 46 (2011) 384-389]. Однако отсутствует информация о получении наносеребра с использованием аскорбиновой кислоты в качестве восстановителя органических солей серебра в неводных средах.
Известен коллоидный раствор наносеребра в деионизированной воде, характеризующийся тем, что имеет концентрацию серебра от 5 до 100 мг/л, при этом доля наночастиц металлического серебра в нем составляет от 5 до 90% от общей концентрации серебра в растворе, доля наночастиц размером от 2 до 15 нм составляет от 65 до 85% от общей концентрации наночастиц металлического серебра в растворе, доля наночастиц размером от 15 до 35 нм составляет, соответственно, от 15 до 35% (RU 2456356, C22B 11/00, 2012). Данный коллоидный раствор получают электрохимическим методом, включающим электрохимическое растворение в деионизированной воде серебра, используемого в виде мелкодисперсного порошка с химической чистотой 99,999% и с размерами частиц до 100 нм. Процесс проводят в электролизере, внутри которого расположены электроды в виде емкостей из химически нейтрального материала, в которые помещают мелкодисперсный порошок серебра. Электролиз, согласно данному способу, проводят при постоянном напряжении (30-45 В) в условиях циклического изменения полярности общего раствора наночастиц в растворе. Однако несмотря на высокую устойчивость получаемого коллоидного раствора наносеребра в деионизированной воде (сохранение без агрегирования в течение порядка двух лет) он из-за гидрофильности среды не может быть диспергирован в гидрофобную полимерную матрицу. Кроме того, и сам электрохимический способ получения такого коллоидного раствора наносеребра, как и все электрохимические процессы, энергоемок, требует громоздкого аппаратурного оформления, кроме того, он многостадиен и не экономичен, поскольку включает дополнительную стадию получения мелкодисперсного порошка и деионизированной воды.
Для получения наносеребра в коллоидном состоянии применяется также жидкофазный процесс, основанный на реакции восстановления серебра в жидких средах. В известных способах, относящихся к данному направлению, процесс проводят в водной среде. Например, описан способ получения коллоидного раствора наночастиц серебра восстановлением серебра в водных растворах неорганических солей серебра (на примере нитрата серебра) при использовании в качестве восстановителя глюкозы или аскорбиновой кислоты [Е.А. Вишнякова, С.В. Сайкова, С.М. Жарков // Определение условий образования наночастиц серебра при восстановлении глюкозой в водных растворах // J. of Siberian Federal University. Chemistry 1 (2009 2) 48-55]. Процесс, согласно данной публикации, проводят следующим образом: к водному раствору нитрата серебра определенной концентрации (0,0001 М-0,005 М) добавляют такой же объем раствора восстановителя, доводят pH до заданного значения (оптимально 8,34) аммиаком, в качестве восстановителей применяют аскорбиновую кислоту или глюкозу и обрабатывают полученные растворы в микроволновой печи в течение 10 минут при мощности 700 Вт. Однако, как сказано в данной работе, в случае применения в качестве восстановителя аскорбиновой кислоты получаемый продукт (коллоидное наносеребро) не обладает агрегативной устойчивостью и быстро переходит в металлическое серебро (по данным РФА).
Так как одним из направлений применения наносеребра является получение из него материалов на основе органических высокомолекулярных соединений, важно то, в какой среде находятся наночастицы, поскольку это влияет на способность наносеребра диспергироваться, в частности в органических полимерах, таких как полиэтилены высокой и низкой плотности, различные смолы. Как известно, в случае применения для указанных целей коллоидных водных растворов наносеребра не достигается высокая степень их диспергирования в органических полимерах ввиду гидрофобности полимерной матрицы.
Для устранения указанных недостатков коллоидных водных растворов наносеребра предлагается коллоидный раствор наносеребра в многоатомном спирте и способ его получения.
Предлагаемый коллоидный раствор наносеребра в этиленгликоле содержит этиленгликоль, наночастицы серебра и имеет концентрацию наночастиц серебра от 1 до 100 мг/л, при этом доля наночастиц серебра размером от 5 до 8 нм составляет от 3 до 5%, от 30 до 50 нм - от 28 до 30%, от 50 до 75 нм - от 38 до 40%, от 75 до 100 нм - от 23 до 25%.
Предлагаемый способ получения коллоидного раствора наносеребра в этиленгликоле осуществляют реакцией восстановления этиленгликольного раствора трифторацетата серебра либо монохлорацетата серебра, концентрацией 10-3-10-5 моль/л, с использованием в качестве восстановителя эквимолярного количества аскорбиновой кислоты, проводимой при перемешивании в среде этиленгликоля при температуре 20-25°C.
Предлагаемый коллоидный раствор наносеребра в этиленгликоле можно рассматривать как новый прекурсор, в дальнейшем применяемый при изготовлении новых полимерных материалов, включающих наночастицы серебра. В отличие от уже известного коллоидного раствора наносеребра в деионизированной воде, предлагаемый продукт представляет собой коллоидный раствор наносеребра в этиленгликоле, что определяет его свойства, а именно способность наносеребра диспергироваться в органических полимерах, таких как полиэтилены высокой и низкой плотности, различные смолы. Использование именно органического растворителя в составе нового продукта способствует введению в дальнейшем наночастиц серебра в полимерную матрицу. Получаемый продукт характеризуется содержанием наночастиц серебра определенного размера: доля наночастиц серебра размером от 5 до 8 нм составляет от 3 до 5%, от 30 до 50 нм - от 28 до 30%, от 50 до 75 нм - от 38 до 40%, от 75 до 100 нм - от 23 до 25% и имеет концентрацию наночастиц серебра от 1 до 100 мг/л.
Коллоидный раствор наносеребра в этиленгликоле обладает определенным составом, характеризующимся конкретной долей наночастиц серебра, определенного указанного выше размера, и который отличается от состава известного коллоидного раствора наносеребра в деионизированной воде. Данный указанный состав получается определенным способом, который заключается в восстановлении аскорбиновой кислотой галогенпроизводных ацетатов серебра, а именно трифторацетата серебра и монохлорацетата серебра в безводной среде многоатомного спирта - этиленгликоля. Преимуществом данного способа является применение в качестве восстановителя аскорбиновой кислоты, являющейся экологически безопасным, биологически совместимым и доступным продуктом.
Существенными признаками способа являются также: концентрация используемого галогенпроизводного ацетата серебра (10-3-10-5 моль/л в этиленгликоле) и технологические условия проведения процесса, а именно перемешивание реакционной массы при температуре 20-25°C.
Предлагаемый способ технологичен и экономичен, что обуславливает возможности его промышленного осуществления. К достоинствам предлагаемого способа можно отнести:
- простоту аппаратурного оформления (по сравнению с использованием в аналогах сложного аппаратурного оборудования, например микроволновой печи либо электролитического оборудования);
- технологичность процесса благодаря проведению его при комнатных температурах, за короткий промежуток времени и без введения в процесс трудоемкой стадии по получению мелкодисперсного порошка;
- экономичность процесса благодаря использованию доступных реагентов без применения дополнительных стабилизаторов.
Коллоидный раствор наносеребра стабилен более полугода, хранится в стеклянных пузырьках в темноте и может быть применен в медицине при изготовлении антимикробных и антивирусных средств, полученных на основе гидрофобной полимерной матрицы, в которую введены наночастицы серебра в виде этого коллоидного раствора в этиленгликоле.
Ниже изобретение иллюстрируется рисунками (фиг. 1-4):
- фиг. 1 - спектр оптического поглощения коллоидного раствора наночастиц серебра, полученного из трифторацетата серебра;
- фиг. 2 - спектр оптического поглощения коллоидного раствора наночастиц серебра, полученных из монохлорацетата серебра;
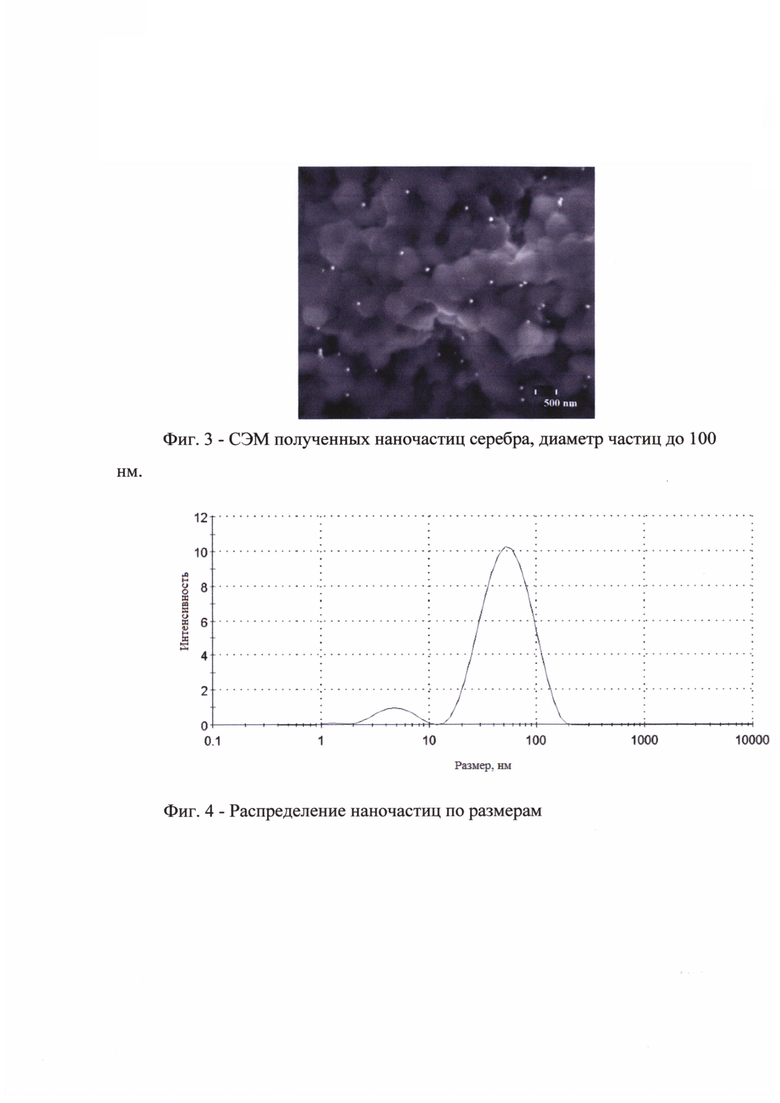
- фиг. 3 - СЭМ полученных наночастиц серебра;
- фиг. 4 - распределение наночастиц по размерам.
Присутствие в коллоидном растворе наночастиц серебра подтверждается наличием пика плазмонного резонанса при λ=417 нм в случае трифторацетата серебра (фиг. 1) и 435 нм в случае монохлорацетата серебра (фиг. 2), сканирующей электронной микроскопией (СЭМ), данные которой приведены на фиг. 3. Размеры наночастиц определялись на приборе Zetasizer nano series HT Malvern, кривые распределения по размерам приведены на фиг. 4.
Из спектров поглощения в УФ- и видимой области (фиг. 1 и 2) видно, что уже при смешении растворов прекурсора и восстановителя наблюдается появление плазмонного пика (λ=417 нм и 435 нм на фиг. 1 и 2 соответственно) от образовавшихся наночастиц серебра. Увеличение интенсивности поглощения при длине волны максимума плазмонной полосы свидетельствует об увеличении концентрации наночастиц в растворе при продолжении перемешивания.
Ниже изобретение иллюстрируется примерами и фиг. 1-4.
Пример 1
К 20 мл 10-3 М раствора трифторацетата серебра в этиленгликоле приливают 20 мл 10-3 М раствора аскорбиновой кислоты в этиленгликоле и перемешивают на магнитной мешалке при температуре 20°C. Раствор практически моментально приобретает ярко-желтую окраску. Получение наночастиц подтверждают наличием пика плазмонного резонанса при λ=417 нм и сканирующей электронной микроскопией. Получаемый продукт характеризуется содержанием наночастиц серебра определенного размера: доля наночастиц серебра размером от 5 до 8 нм составляет от 3 до 5%, от 30 до 50 нм - от 28 до 30%, от 50 до 75 нм - от 38 до 40%, от 75 до 100 нм - от 23 до 25% и имеет концентрацию наночастиц серебра 1±0,05 мг/л.
Пример 2
К 20 мл 10-3 М раствора монохлорацетата серебра в этиленгликоле приливают 20 мл 10-3 М раствора аскорбиновой кислоты в этиленгликоле и перемешивают при 25°C на магнитной мешалке. Раствор практически моментально приобретает ярко-желтую окраску. Получение наночастиц подтверждают наличием пика плазмонного резонанса при λ=435 нм и сканирующей электронной микроскопией. Получаемый продукт характеризуется содержанием наночастиц серебра определенного размера: доля наночастиц серебра размером от 5 до 8 нм составляет от 3 до 5%, от 30 до 50 нм - от 28 до 30%, от 50 до 75 нм - от 38 до 40%, от 75 до 100 нм - от 23 до 25% и имеет концентрацию наночастиц серебра от 20±0,4 мг/л.
Пример 3
К 20 мл 10-5 М раствора трифторацетата серебра в этиленгликоле приливают 20 мл 10-5 М раствора аскорбиновой кислоты в этиленгликоле и перемешивают при 20-25°C на магнитной мешалке. Раствор практически моментально приобретает ярко-желтую окраску. Получение наночастиц подтверждают наличием пика плазмонного резонанса при λ=417 нм и сканирующей электронной микроскопией. Получаемый продукт характеризуется содержанием наночастиц серебра определенного размера: доля наночастиц серебра размером от 5 до 8 нм составляет от 3 до 5%, от 30 до 50 нм - от 28 до 30%, от 50 до 75 нм - от 38 до 40%, от 75 до 100 нм - от 23 до 25% и имеет концентрацию наночастиц серебра от 65±3,25 мг/л.
Пример 4
К 20 мл 10-5 М раствора монохлорацетата серебра в этиленгликоле приливают 20 мл 10-5 М раствора аскорбиновой кислоты в этиленгликоле и перемешивают на магнитной мешалке. Раствор практически моментально приобретает ярко-желтую окраску. Получение наночастиц подтверждают наличием пика плазмонного резонанса при λ=435 нм и сканирующей электронной микроскопией. Получаемый продукт характеризуется содержанием наночастиц серебра определенного размера: доля наночастиц серебра размером от 5 до 8 нм составляет от 3 до 5%, от 30 до 50 нм - от 28 до 30%, от 50 до 75 нм - от 38 до 40%, от 75 до 100 нм - от 23 до 25% и имеет концентрацию наночастиц серебра от 95±5 мг/л.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОЛЛОИДНЫЙ РАСТВОР НАНОСЕРЕБРА В МЕТИЛЦЕЛЛОЗОЛЬВЕ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2016 |
|
RU2618303C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОРОШКА СВЕРХВЫСОКОМОЛЕКУЛЯРНОГО ПОЛИЭТИЛЕНА, МОДИФИЦИРОВАННОГО НАНОЧАСТИЦАМИ СЕРЕБРА | 2016 |
|
RU2631567C1 |
| Способ получения алюмооксидного керамического материала, модифицированного наночастицами серебра | 2020 |
|
RU2749340C1 |
| СПОСОБ ПОЛУЧЕНИЯ СВЕРХВЫСОКОМОЛЕКУЛЯРНОГО ПОЛИЭТИЛЕНА (СВМПЭ), ИМПРЕГНИРОВАННОГО НАНОЧАСТИЦАМИ СЕРЕБРА | 2016 |
|
RU2644907C1 |
| Способ получения стабильного раствора коллоидного серебра | 2022 |
|
RU2792646C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОНЦЕНТРАТОВ НАНОДИСПЕРСИЙ НУЛЬВАЛЕНТНЫХ МЕТАЛЛОВ С АНТИСЕПТИЧЕСКИМИ СВОЙСТВАМИ | 2010 |
|
RU2445951C1 |
| Способ получения наноразмерных частиц серебра | 2022 |
|
RU2802603C1 |
| КОЛЛОИДНЫЙ РАСТВОР НАНОСЕРЕБРА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2011 |
|
RU2456356C1 |
| Способ получения раствора коллоидного серебра | 2023 |
|
RU2806006C1 |
| ФОТОХИМИЧЕСКИЙ СПОСОБ ПОЛУЧЕНИЯ СТАБИЛИЗИРОВАННЫХ НАНОЧАСТИЦ СЕРЕБРА | 2014 |
|
RU2569546C1 |

Предлагаемое изобретение относится к получению коллоидного раствора наносеребра в этиленгликоле. Коллоидный раствор содержит этиленгликоль и наночастицы серебра в концентрации от 1 до 100 мг/л. Доля наночастиц серебра размером от 5 до 8 нм составляет от 3 до 5%, от 30 до 50 нм - от 28 до 30%, от 50 до 75 нм - от 38 до 40%, от 75 до 100 нм - от 23 до 25%. Коллоидный раствор получают восстановлением этиленгликольного раствора трифторацетата серебра либо монохлорацетата серебра с концентрацией 10-3-10-5 моль/л эквимолярным количеством аскорбиновой кислоты. Восстановление ведут при перемешивании в среде этиленгликоля при температуре 20-25°C. Полученный коллоидный раствор наносеребра стабилен более полугода, хранится в стеклянных пузырьках в темноте. 2 н.п. ф-лы, 4 ил., 4 пр.
1. Коллоидный раствор наносеребра в этиленгликоле, характеризующийся тем, что он содержит этиленгликоль, наночастицы серебра и имеет концентрацию наночастиц серебра от 1 до 100 мг/л, при этом доля наночастиц серебра размером от 5 до 8 нм составляет от 3 до 5%, от 30 до 50 нм - от 28 до 30%, от 50 до 75 нм - от 38 до 40%, от 75 до 100 нм - от 23 до 25%.
2. Способ получения коллоидного раствора наносеребра в этиленгликоле, отличающийся тем, что получают коллоидный раствор наносеребра в этиленгликоле по п.1, при этом ведут восстановление этиленгликольного раствора трифторацетата серебра либо монохлорацетата серебра с концентрацией 10-3-10-5 моль/л эквимолярным количеством аскорбиновой кислоты при перемешивании в среде этиленгликоля при температуре 20-25°C.
| ВИШНЯКОВА Е.А | |||
| и др | |||
| Определение условий образования наночастиц серебра при восстановлении глюкозой в водных растворах, Journal of Siberian Federal University | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| КОЛЛОИДНЫЙ РАСТВОР НАНОЧАСТИЦ СЕРЕБРА, МЕТАЛЛ-ПОЛИМЕРНЫЙ НАНОКОМПОЗИТНЫЙ ПЛЕНОЧНЫЙ МАТЕРИАЛ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, БАКТЕРИЦИДНЫЙ СОСТАВ НА ОСНОВЕ КОЛЛОИДНОГО РАСТВОРА И БАКТЕРИЦИДНАЯ ПЛЕНКА ИЗ МЕТАЛЛ-ПОЛИМЕРНОГО МАТЕРИАЛА | 2011 |
|
RU2474471C2 |
| КОЛЛОИДНЫЙ РАСТВОР НАНОСЕРЕБРА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2011 |
|
RU2456356C1 |
| US 7749299 B2, 06.07.2010 | |||
| US 7348365 B2, 25.03.2008 | |||
| СПОСОБ ПРОИЗВОДСТВА ЖЕЛЕЙНОГО МАРМЕЛАДА | 2003 |
|
RU2274123C2 |
Авторы
Даты
2017-02-08—Публикация
2015-07-29—Подача