Изобретение относится к синтезу коллоидных растворов благородных металлов и касается способов получения коллоидных растворов серебра с использованием стабилизаторов. Значительное количество методов синтеза коллоидного раствора серебра базируется на окислительно-восстановительных реакциях [1].
Известен способ получения коллоидного серебра путем восстановления Ag(I), в соответствии с которым к раствору лигносульфонатов (ЛСТ) с концентрацией до 30% при перемешивании в течение 10 мин добавляют навеску нитрата серебра до 10% от массы раствора. Затем в реакционную смесь добавляют восстановитель (борогидрид натрия, этиловый спирт и аскорбиновую кислоту) до 20% от массы раствора и реакционную смесь перемешивают на магнитной мешалке в течение 1 ч. При этом образуется стабильный в течение 6 месяцев золь сферических наночастиц серебра, с размером частиц около 20 нм. Вместо борогидрида натрия в качестве восстановителя используют этиленгликоль (20 мл на 0,1 г нитрата серебра), а реакцию восстановления проводят при 80°С в течение одного часа. Вместо борогидрида натрия используют аскорбиновую кислоту (700% от массы AgNO3), которую порционно в течение 30 минут добавляют в реакционную смесь, после чего ее перемешивают один час [12]. Недостатком указанного способа является большая продолжительность проведения реакции восстановления и использование борогидрида натрия, который является токсичным соединением.
Известен способ получения коллоидного серебра путем проведения реакции восстановления катионов серебра(I) с помощью восстановителя. Для этого первоначально проводят окисление лигносульфоната натрия при высокой температуре в щелочной среде, после чего реакционную смесь подкисляют серной кислотой и сульфируют с помощью сульфита натрия. После сульфирования при перемешивании добавляют хлорид натрия и крахмал для получения суспензии, к которой добавляют раствор AgNO3 и проводят восстановление катионов серебра(I) борогидридом натрия. После синтеза нано-частиц серебра проводят ферментативную деструкцию лигнина, и нано-серебро извлекается с получением пасты с однородной дисперсией наносеребра [13]. Недостатком является многостадийность получения коллоидного серебра.
Известен способ получения коллоидного серебра путем проведения реакции восстановления катионов серебра(I). Для этого к 1 мл раствора ЛСТ с концентрацией 12,5 г/л на магнитной мешалке добавляют 2,5 мл соли серебра с концентрацией 1 г/л. Полученный раствор перемешивают в течение 24 ч и для завершения реакции выдерживают в течение 7 сут [14]. Недостатком указанного способа является большая продолжительность проведения реакции восстановления.
Известен способ получения коллоидного серебра путем проведения реакции восстановления катионов серебра(I) с помощью восстановителя. Для этого с помощью ультразвука готовили водный раствор ЛСТ с концентрацией 20 мг/мл (раствор А). Отдельно готовили водный раствор аммиачного комплекса серебра с концентрацией 5 мг/мл ионов Ag(I) из AgNO3 с концентрацией ионов Ag(I) 10 мг/мл и добавляли к нему 5 М водный раствор аммиака. Затем раствор разбавляли до удвоения исходного объема. Одинаковые объемы приготовленных растворов смешивали, и реакцию проводили при комнатной температуре без перемешивания в течение требуемого времени (от 2 ч до 10 сут) при этом образуются стабильные коллоиды наночастиц серебра со средним размером частиц 41 нм [15]. Недостатком указанного способа является большая продолжительность проведения реакции восстановления.
Известен способ получения коллоидного серебра путем проведения реакции восстановления катионов серебра(I) с помощью восстановителя. На первом этапе синтеза получают гидрогель модифицированных лигносульфонатов натрия (МСЛС) для этого к 200 мл раствора лигносульфонатов натрия (40 мг/мл) добавляют 2 г гидроксида натрия и 6 мл 30% водного раствора перекиси. Полученную смесь перемешивают на магнитной мешалке в течение 30 мин, а затем добавляют 4 мл серной кислоты и 3 г сульфита натрия. Раствор перемешивают при 90°C еще 90 мин и охлаждают до комнатной температуры. После охлаждения при перемешивании добавляют 70 г хлорида натрия. Через 40 минут смесь фильтруют под вакуумом, полученное твердое вещество переносят на часовое стекло и нагревают при 135°C в печи в течение 90 мин, а затем охлаждают до комнатной температуры. К полученному твердому веществу добавляют 50 мл водного раствора гидроксида натрия (0,5 М) и перемешивают при комнатной температуре в течение 40 минут, а затем мелкодисперсное твердое вещество из суспензии отделяют центрифугированием и промывают деионизированной водой до нейтральной реакции, при этом получают частицы модифицированного ЛСТ гидрогеля. В пробирку к 8 г невысушенных частиц модифицированного ЛСТ гидрогеля при перемешивании добавляют 150 мл деионизированной воды и диспергируют полученную суспензию ультразвуком в течение 150 мин, а затем добавляют 0,5 мл раствора нитрата серебра (0,5 М). Полученную смесь подвергают сверхзвуковому диспергированию в течение 5 минут, затем добавляют 2 мл боргидрида натрия (1М) и перемешивают на магнитной мешалке при 25°C в течение 30 мин, после чего образовавшийся коллоидный раствор микрогидрогеля, содержащий наночастицы серебра сушат при 40°C под вакуумом до постоянной массы. При этом получают наночастицы серебра сферической формы с диаметром около 10 нм [16]. Недостатком указанного способа является большая продолжительность проведения реакции восстановления.
Известен способ получения коллоидного серебра путем проведения реакции восстановления катионов серебра(I) с помощью восстановителя. Для этого к 0,2 г диоксида кремния добавляли 1,5 мл органического растворителя (1,4-диоксан, ацетон или N,N-диметилформамид), 1 мл лигносульфоната натрия (12,5 г/л) и 2,5 мл аммиачного раствора нитрата серебра с концентрацией 1 г/л. После перемешивания в течение 10 мин смеси давали осаждаться и удаляли супернатант. Твердое вещество промывали водно-органическим раствором в соотношении 2:3 и высушивали [17]. Недостатком указанного способа является использование органических растворителей.
Известен способ получения коллоидного серебра путем проведения реакции восстановления катионов серебра(I) с помощью восстановителя. Для этого водный раствор нитрата серебра добавляют по каплям к водному раствору восстановителя - альгиновой кислоты из натриевой соли бурых водорослей. Также для синтеза используют смесь, состоящую из 50% альгиновой кислоты из натриевой соли бурых водорослей и 50% ЛСТ. Синтез проводят при перемешивании в течение 5 дней при комнатной температуре. Для каждой композиции получают две концентрации ионов серебра, а именно 1 мас.% (1Ag) и 5 мас.% (5Ag). Установлено, что оптимальной является продолжительность синтеза в течение 72 часов. Таким способом получают наночастицы серебра сферической формы со средним диаметром 10 нм [18]. Недостатком указанного способа является большая продолжительность проведения реакции восстановления.
Известен способ получения коллоидного раствора серебра путем смешивания растворов нитрата серебра, глюкозы и ЛСТ в качестве стабилизатора с последующим подщелачиванием аммиачной водой с последующим нагревом полученной смеси. При этом расход ЛСТ составляет 0,4…9,3 г на 1 г серебра(I), расход глюкозы для проведения реакции составляет 1,7…25,0 г на 1 г серебра, а расход аммиачной воды для подщелачивания реакционной смеси составляет 6,1…45,8 г на 1 г серебра(I). Нагрев осуществляют на кипящей водяной бане в течение 2…5 мин или в СВЧ-печи в течение 45…90 с [19]. Недостатками способа является большой расход аммиачной воды и выделение резко пахнущего аммиака при проведении реакции в условиях нагревания (прототип).
Задача изобретения заключается в расширении ассортимента стабилизаторов коллоидного раствора серебра и исключение выделения резко пахнущего аммиака при проведении реакции синтеза раствора коллоидного серебра в условиях нагревания.
Это достигается тем, что восстановление катионов серебра(I) проводят при нагревании по заданному температурно-временному графику в СВЧ-печи или на кипящей водяной бане (КВБ) с помощью восстановителя, в качестве которого используют: глюкозу, ксилозу или фруктозу в присутствии силиката натрия, являющегося стабилизатором коллоидного раствора серебра. При выполнении синтезов использовали растворы, характеристика которых представлена в таблице 1.
Предлагаемый способ осуществляется следующим образом. Первоначально готовят раствор, содержащий нитрат серебра AgNO3, стабилизатор, восстановитель. Коллоидный раствор серебра образуется в результате нагревания реакционной смеси по заданному температурно-временному графику на кипящей водяной бане (КВБ) или в СВЧ-печи. В качестве стабилизатора используют 0,5-1 мл раствора силиката натрия, концентрацией 23 мг/мл, что соответствует 106-426% от Ag(I), в качестве восстановителя используется раствор глюкозы, ксилозы или фруктозы, расходы растворов моносахаридов для приготовления реакционной смеси составляют 0,5-1,5 мл, что соответствует 28-169% от Ag(I). Реакция проводится на кипящей водяной бане в течение 5-30 мин или в СВЧ-печи в течение 2 мин.
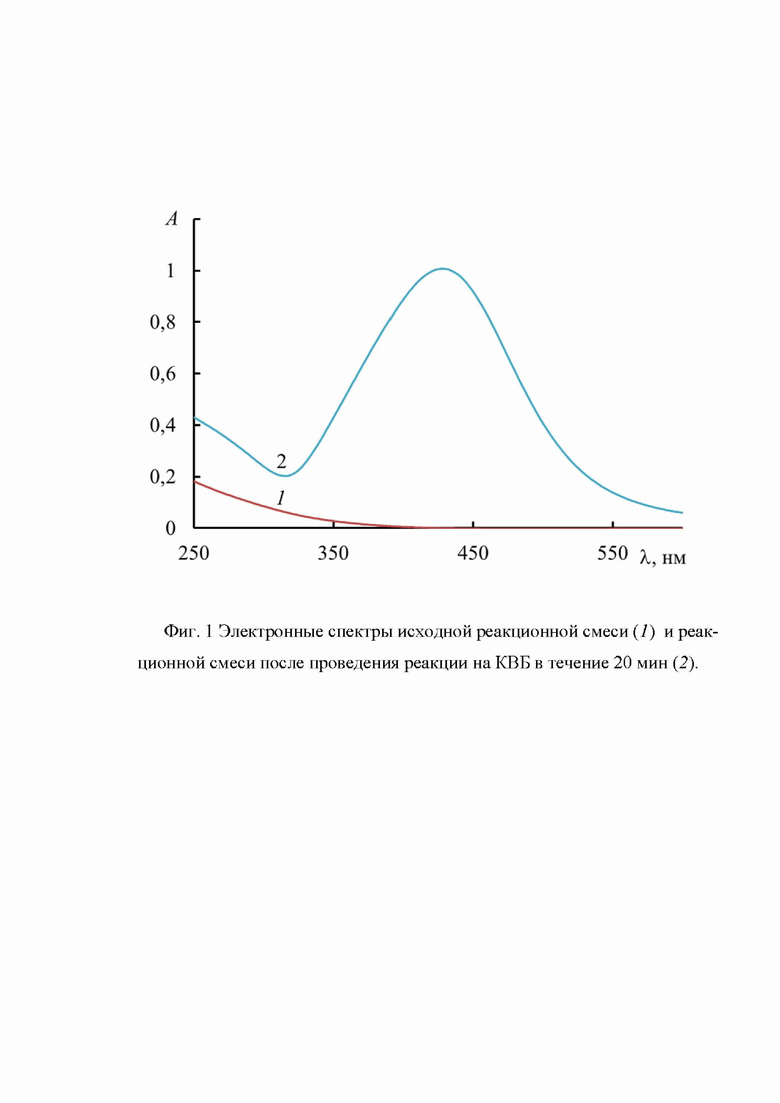
Для контроля над образованием коллоидного серебра использовали фотометрическое определение оптической плотности раствора при длине волны 430 нм. Выбор длины волны был сделан на основе изучения электронных спектров. Как видно из приведенных на фиг. 1 электронных спектров, в ходе реакции появляется новая полоса поглощения с максимумом при 430 нм. Эти результаты согласуются с данными, опубликованными в работе [20].
Кроме того были записаны электронные спектры растворов нитрата серебра:
Пример 1. В мерной пробирке на 25 мл смешивали 0,5 мл раствора глюкозы с концентрацией 6,1 мг/мл, что соответствует 28% от массы Ag, 0,5 мл раствора силиката натрия с концентрацией 23 мг/мл, что соответствует 106% от массы Ag, и 1 мл раствора нитрата серебра с концентрацией 10,8 мг Ag(I)/мл, нагревали на КВБ в течение 5 мин. После чего реакционную смесь охлаждали, объем раствора доводили до 25 мл дистиллированной водой. В результате получили прозрачный окрашенный раствор и измеряли его оптическую плотность при 430 нм на фотометре «Эксперт-003» в кювете с длиной рабочего слоя 10 мм. Измеренная величина оптической плотности при 430 нм составила 0,449.
Пример 2. Получение коллоидного раствора серебра в условиях примера 1, отличающееся тем, что продолжительность реакции составила 10 мин. В результате получили прозрачный окрашенный раствор. Измеренная величина оптической плотности при 430 нм составила 1,057.
Пример 3. Получение коллоидного раствора серебра в условиях примера 1, отличающееся тем, что продолжительность реакции составила 15 мин. В результате получили прозрачный окрашенный раствор. Измеренная величина оптической плотности при 430 нм составила 1,189.
Пример 4. Получение коллоидного раствора серебра в условиях примера 1, отличающееся тем, что продолжительность реакции составила 20 мин. В результате получили прозрачный окрашенный раствор. Измеренная величина оптической плотности при 430 нм составила 1,310.
Пример 5. Получение коллоидного раствора серебра в условиях примера 1, отличающееся тем, что продолжительность реакции составила 30 мин. В результате получили прозрачный окрашенный раствор. Измеренная величина оптической плотности при 430 нм составила 1,434.
Пример 6. Получение коллоидного раствора серебра в условиях примера 1, отличающееся тем, что приготовленную реакционную смесь не выдерживали на кипящей водяной бане (КВБ), а сразу измеряли оптическую плотность. Измеренная величина оптической плотности при 430 нм составила 0,006.
Пример 7. Получение коллоидного раствора серебра в условиях примера 6, отличающееся тем, что реакционную смесь готовили без использования раствора глюкозы, приготовленную реакционную смесь выдерживали на КВБ. Продолжительность нагревания составила 30 мин. Измеренная величина оптической плотности при 430 нм составила 0,001.
Пример 8. В мерной пробирке на 25 мл смешивали 0,5 мл раствора ксилозы с концентрацией 6,1 мг/мл, что соответствует 56% от массы Ag, 1 мл раствора силиката натрия с концентрацией 23 мг/мл, что соответствует 426% от массы Ag и 0,5 мл раствора нитрата серебра с концентрацией 10,8 мг Ag(I)/мл, нагревали на КВБ в течение 1,5 мин. После чего реакционную смесь охлаждали, объем раствора доводили до 25 мл дистиллированной водой. В результате получили прозрачный окрашенный раствор и измеряли его оптическую плотность при 430 нм на фотометре «Эксперт-003» в кювете с длиной рабочего слоя 10 мм. Измеренная величина оптической плотности при 430 нм составила 0,776.
Пример 9. В мерной пробирке на 25 мл смешивали 0,5 мл раствора фруктозы с концентрацией 6,0 мг/мл, что соответствует 56% от массы Ag, 1 мл раствора силиката натрия с концентрацией 23 мг/мл, что соответствует 426% от массы Ag и 0,5 мл раствора нитрата серебра с концентрацией 10,8 мг Ag(I)/мл, нагревали на КВБ в течение 1,5 мин. После чего реакционную смесь охлаждали, объем раствора доводили до 25 мл дистиллированной водой. В результате получили прозрачный окрашенный раствор и измеряли его оптическую плотность при 430 нм на фотометре «Эксперт-003» в кювете с длиной рабочего слоя 10 мм. Измеренная величина оптической плотности при 430 нм составила 0,711.
Пример 10. В мерной пробирке на 25 мл смешивали 0,5 мл раствора глюкозы с концентрацией 6,1 мг/мл, что соответствует 56% от массы Ag, 1 мл раствора силиката натрия с концентрацией 23 мг/мл, что соответствует 426% от массы Ag, и 0,5 мл раствора нитрата серебра с концентрацией 10,8 мг Ag(I)/мл, нагревали на СВЧ (мощность 800 Вт) в течение 2 мин. После чего объем раствора доводили до 25 мл дистиллированной водой весовым методом. В результате получили прозрачный окрашенный раствор и измеряли его оптическую плотность при 430 нм на фотометре «Эксперт-003» в кювете с длиной рабочего слоя 1 мм. Измеренная величина оптической плотности при 430 нм составила 0,755.
Пример 11. Получение коллоидного раствора серебра в условиях примера 1, отличающееся тем, что реакцию проводили без использования раствора силиката натрия, а продолжительность реакции составила 20 мин. В результате на стенках мерной пробирки выделилось серебряное зеркало
Пример 12. Получение коллоидного раствора серебра в условиях примера 1, отличающееся тем, что расход раствора силиката натрия составил 0,1 мл с концентрацией 23 мг/мл, что соответствует 21% от массы Ag, а продолжительность реакции составила 20 мин. В результате на стенках мерной пробирки образовалось серебряное зеркало и выделился осадок.
Пример 13. Получение коллоидного раствора серебра в условиях примера 12, отличающееся тем, что расход раствора силиката натрия составил 0,2 мл с концентрацией 23 мг/мл, что соответствует 43% от массы Ag. В результате реакционная смесь приобрела бурую окраску, и наблюдалось выделение крупнодисперсных частиц.
Пример 14. Получение коллоидного раствора серебра в условиях примера 12, отличающееся тем, что расход раствора силиката натрия составил 0,3 мл с концентрацией 23 мг/мл, что соответствует 64% от массы Ag. В результате реакционная смесь приобрела бурую окраску, и наблюдалось выделение крупнодисперсных частиц.
Пример 15. Получение коллоидного раствора серебра в условиях примера 12, отличающееся тем, что расход раствора силиката натрия составил 0,4 мл с концентрацией 23 мг/мл, что соответствует 85% от массы Ag. В результате реакционная смесь приобрела бурую окраску, и наблюдалось выделение крупнодисперсных частиц.
Пример 16. Получение коллоидного раствора серебра в условиях примера 10, отличающееся тем, что расход раствора глюкозы составил 1 мл с концентрацией 6,1 мг/мл, что соответствует 56% от массы Ag. В результате получили прозрачный окрашенный раствор, а величина оптической плотности при 430 нм составила 0,212.
Пример 17. Получение коллоидного раствора серебра в условиях примера 16, отличающееся тем, что расход раствора глюкозы составил 1,5 мл с концентрацией 6,1 мг/мл, что соответствует 85% от массы Ag. В результате получили прозрачный окрашенный раствор, а величина оптической плотности при 430 нм составила 0,297.
Пример 18. Получение коллоидного раствора серебра в условиях примера 16, отличающееся тем, что в качестве восстановителя использована фруктоза с концентрацией 6,0 мг/мл, что соответствует 56% от массы Ag. В результате получили прозрачный окрашенный раствор, а величина оптической плотности при 430 нм составила 0,839.
Пример 19. Получение коллоидного раствора серебра в условиях примера 18, отличающееся тем, что в качестве восстановителя использована ксилоза с концентрацией 6,1 мг/мл, что соответствует 113% от массы Ag. В результате получили прозрачный окрашенный раствор, а величина оптической плотности при 430 нм составила 0,898.
Пример 20. Получение коллоидного раствора серебра в условиях примера 18, отличающееся тем, что расход раствора фруктозы составил 1,5 мл с концентрацией 6,0 мг/мл, что соответствует 83% от массы Ag. В результате получили прозрачный окрашенный раствор, а величина оптической плотности при 430 нм составила 1,212.
Пример 21. Получение коллоидного раствора серебра в условиях примера 19, отличающееся тем, что расход раствора ксилозы составил 1,5 мл с концентрацией 6,1 мг/мл, что соответствует 169% от массы Ag. В результате получили прозрачный окрашенный раствор, а величина оптической плотности при 430 нм составила 1,344.
Полученные результаты сведены в табл. 1.
Таким образом, изобретение позволяет исключить выделение резко пахнущего аммиака при проведении реакции в условиях нагревания и получить устойчивый раствор коллоидного серебра, стабилизированный с помощью силиката натрия, расход которого составляет не менее 106% от массы Ag.
Примечания: * - выделилось серебряное зеркало; ** - образовалась окрашенная суспензия с седиментирующими крупнодисперсными частицами.
СПИСОК ИСТОЧНИКОВ
[1] Villaverde-Cantizano G., Laurenti M., Rubio-Retama J., Contreras-Cáceres R. Reducing Agents in Colloidal Nanoparticle Synthesis - an Introduction. Chapter 1 // Nanoscience & Nanotechnology Series. - 2021. - No.50. - 27 р.
[2] Yu C., Tang J., Liu F., Chen Y. Green synthesized nanosilver-biochar pho-tocatalyst for persulfate activation under visible-light illumination // Chemo-sphere. - 2021. - Vol. 284. - Art. Num. 131237. DOI: 10.1016/j.chemosphere.2021.131237
[3] Grigoreva A., Kolobova E., Pakrieva E., Mäki-Arvela P., Carabineiro S.A., Gorbunova A., Pestryakov A Supported silver nanoparticles as catalysts for liquid-phase betulin oxidation // Nanomaterials. - 2021. - Vol. 11, N 2. - Art. Num. 469., DOI: 10.3390/nano11020469
[4] Hojjati M., Soleimani E. Highly dispersible Fe3O4-Ag@OPO(OH)2 nano-composites as a novel eco-friendly magnetic retrievable catalyst for the reduction of p-nitrophenol //, Journal of the Chinese Chemical Society. - 2021. - Vol. 68, N 2. - P. 322-332. DOI: 10.1002/jccs.202000093
[5] Liang C., Lu Z.A., Wu J., Chen M.X., Zhang Y., Zhang B., Xu P. Recent advances in plasmon-promoted organic transformations using silver-based catalysts // ACS Applied Materials & Interfaces. - 2020. - Vol. 12, N 49. - P. 54266-54284., DOI: 10.1021/acsami.0c15192
[6] Bahcelioglu E., Unalan H.E., Erguder T.H. Silver-based nanomaterials: A critical review on factors affecting water disinfection performance and silver release // Critical Reviews in Environmental Science and Technology. - 2021. - Vol. 51, N 20. - P. 2389-, 2423. DOI: 10.1080/10643389.2020.1784666
[7] Morganti P., Del Ciotto P., Stoller M., Chianese A. Antibacterial and anti-inflammatory green nanocomposites // Chemical Engineering Transactions. - 2016. - Vol. 47. - P. 61-66. DOI: 10.3303/CET1647011
[8] Пат. 2622020 РФ. Комплексная косметическая композиция для ухода за кожей / М.Л. Тютиков // Бюл. - 2017. - № 16
[9] Pat. CN106116917 (A). Int. Cl: C05G3/00; C05G3/60. Organic water-soluble fertilizer / W.U. HONGBO. - Publ.: 2016.11.16
[10] альтернативой кормовым антибиотикам может выступать использование в рационе коллоидного серебра
[11] Meng Y., Su F., Chen Y. Supercritical fluid synthesis and tribological applications of silver nanoparticle-decorated graphene in engine oil nanofluid // Scientific reports. - 2016. - Vol. 6, N 1. - P. 1-12. DOI: 10.1038/srep31246
[12] Pat. 102489716 CN. B22F 9/24 (2006.01). Preparation method for lignosulfonate nano-silver colloid / Lijuan Chen; Yujun Xiang. - Publ. 2012-06-13
[13] Pat. 108620604 CN. B22F1/00; B22F 9/24; B82Y30/00; B82Y40/00. Preparation method of high-purity nanometer silver paste / Jiang Mengcheng; Liu Juhua; Zhu Caidi. - Publ. 2018-10-09
[14] Modrzejewska-Sikorska A., Konował E., Cichy A., Nowicki M., Jesionowski T., Milczarek G. The effect of silver salts and lignosulfonates in the synthesis of lignosulfonate-stabilized silver nanoparticles // J. Mol. Liq. - 2017. - Vol. 240. - P. 80-86. DOI:, 10.1016/j.molliq.2017.05.065
[15] Milczarek G., Rebis T., Fabianska J. One-step synthesis of lignosulfonate-stabilized silver nanoparticles // Colloids and Surfaces B: Biointerfaces. - 2013. - Vol. 105. - P. 335-341. DOI: 10.1016/j.colsurfb.2013.01.010
[16] Xiang Y., Xu W., Zhan Y., Xia X., Xiong Y., Xiong Y., Chen L. Preparation of modified sodium lignosulfonate hydrogel-silver nanocomposites // Polymer Composites. - 2013, ". - Vol. 34, N 6. - P. 860-866. DOI: 10.1002/pc.22490"
[17] Milczarek G., Motylenko M., Modrzejewska-Sikorska A., Klapiszewski Ł., Wysokowski M., Bazhenov V.V., Jesionowski T. Deposition of silver nanoparticles on organically-modified silica in the presence of lignosulfonate // RSC Advances. - 2014. - Vol. 4, N 94, . - P. 52476-52484. DOI: 10.1039/C4RA08418G
[18] Dumitriu R.P., Nita L.E., Sacarescu L., Vasilescu D.S. Preparation of silver nanoparticle dispersion by a green synthesis method // University politehnica of bucharest scientific bulletin series b-chemistry and materials science. - 2015., - Vol. 77. - N. 2. - P. 81-90
[19] Пат. 2756266 РФ. МПК C22B 11/00 (2006.01); C01G 5/00 (2006.01); B22F 9/24 (2006.01); B01J 13/00 (2006.01). Способ получения раствора колло-идного серебра / В.А. Плахин, Ю.Г. Хабаров, В.А. Вешняков // БИ. - 2021. - № 28
[20] Xue Y., Qiu X., Liu Z., Li Y. Facile and Efficient Synthesis of Silver Nano-particles Based on Biorefinery Wood Lignin and Its Application as the Optical Sensor // ACS Sustainable Chemistry & Engineering. - 2018. - Vol. 6, N 6. - P. 7695-7703. DOI:10.1021, /acssuschemeng.8b00578
[21] Chen, Z., Zhang, W., Lu, M., Li, M., Zhang, S. Preparation of naphthylamine by catalytic hydrogenation over palladium/mesoporous carbon // Shiyou Huagong/Petrochemical Technology. - 2016. - Vol. 45, N 12. - P. 1449-1454
[22] Пат. 2079482 РФ. МПК C07C 205/06. Способ нитрования нафталина / О.В. Бахвалов, К.Г. Ионе // Опубл. 25.06.1993
[23] al J.P.J., Priyadarshini S., Lakshmi Kantam M., Maheswaran H. Copper catalyzed ipso-nitration of iodoarenes, bromoarenes and heterocyclic haloarenes under ligand-free conditions // Tetrahedron Letters. - 2012. - Vol. 53, N 12. - P. 1511 - 1513., " . DOI: 10.1016/j.tetlet.2012.01.056"
[24] Wu X.-F., Schranck J., Neumann H., Beller M. Convenient and mild synthesis of nitroarenes by metal-free nitration of arylboronic acidsw // Chemical Communications. - 2011. - Vol. 47, N 46. - P. 12462+12463. DOI: 10.1039/c1cc15484b
[25] Hajipour A.R., Ruoho A.E. A fast and mild method for nitration of aromatic rings // Phosphorus, Sulfur and Silicon and the Related Elements. - 2004. - Vol. 179, N 2. - P. 221-226. DOI: 10.1080/10426500490274655
[26] Dleersnyder K., Schaltin S., Fransaer J., Binnemans K., Parac-Vogt T.N. Ceric ammonium nitrate (CAN) as oxidizing or nitrating reagent for organic reactions in ionic liquids // Tetrahedron Letters. - 2009. - Vol. 50, N 32. - P. 4582-4586, ". DOI: 10.1016/j.tetlet.2009.05.093".
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения стабильного раствора коллоидного серебра | 2022 |
|
RU2792646C1 |
| Способ получения раствора коллоидного серебра | 2020 |
|
RU2756226C1 |
| ЦВЕТОРЕАГЕНТ ДЛЯ ФОТОМЕТРИЧЕСКОГО ОПРЕДЕЛЕНИЯ КАТИОНОВ СЕРЕБРА В ВОДНОМ РАСТВОРЕ | 2023 |
|
RU2820125C1 |
| СПОСОБ ФОТОМЕТРИЧЕСКОГО ОПРЕДЕЛЕНИЯ КАТИОНОВ СЕРЕБРА В ВОДНОМ РАСТВОРЕ | 2024 |
|
RU2835291C1 |
| СТАБИЛИЗАТОР РАСТВОРА КОЛЛОИДНОГО СЕРЕБРА | 2024 |
|
RU2837787C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СУЛЬФИД-ИОНОВ В ВОДНЫХ РАСТВОРАХ | 2024 |
|
RU2835293C1 |
| Способ определения концентрации глюкозы | 2022 |
|
RU2791905C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВОДНОГО КОЛЛОИДНОГО РАСТВОРА СУЛЬФИДА СЕРЕБРА | 2024 |
|
RU2835680C1 |
| Стабилизатор коллоидного раствора серебра | 2022 |
|
RU2794897C1 |
| КОЛЛОИДНЫЙ РАСТВОР НАНОСЕРЕБРА В ЭТИЛЕНГЛИКОЛЕ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2015 |
|
RU2610197C2 |
Изобретение относится к синтезу коллоидных растворов благородных металлов. Раскрыт способ получения раствора коллоидного серебра путем приготовления реакционной смеси, содержащей нитрат серебра, стабилизатор, восстановитель, последующей выдержки реакционной смеси по заданному температурно-временному графику, при этом в качестве стабилизатора используют 0,5-1 мл раствора силиката натрия концентрацией 23 мг/мл, что соответствует 106-426% от Ag(I), в качестве восстановителя используется раствор глюкозы, ксилозы или фруктозы, расходы растворов моносахаридов для приготовления реакционной смеси составляют 0,5-1,5 мл, что соответствует 28-169% от Ag(I), а реакция проводится на кипящей водяной бане в течение 5-30 мин или в СВЧ-печи в течение 2 мин. Изобретение обеспечивает расширение ассортимента стабилизаторов коллоидного раствора серебра и исключение выделения резко пахнущего аммиака при проведении реакции синтеза раствора коллоидного серебра в условиях нагревания. 1 ил., 2 табл., 21 пр.
Способ получения раствора коллоидного серебра путем приготовления реакционной смеси, содержащей нитрат серебра, стабилизатор, восстановитель, последующей выдержки реакционной смеси по заданному температурно-временному графику, отличающийся тем, что в качестве стабилизатора используют 0,5-1 мл раствора силиката натрия концентрацией 23 мг/мл, что соответствует 106-426% от Ag(I), в качестве восстановителя используется раствор глюкозы, ксилозы или фруктозы, расходы растворов моносахаридов для приготовления реакционной смеси составляют 0,5-1,5 мл, что соответствует 28-169% от Ag(I), а реакция проводится на кипящей водяной бане в течение 5-30 мин или в СВЧ-печи в течение 2 мин.
| Способ получения раствора коллоидного серебра | 2020 |
|
RU2756226C1 |
| СПОСОБ ПОЛУЧЕНИЯ СТАБИЛЬНЫХ СУСПЕНЗИЙ МЕТАЛЛИЧЕСКИХ НАНОЧАСТИЦ И СТАБИЛЬНЫЕ КОЛЛОИДНЫЕ СУСПЕНЗИИ, ПОЛУЧЕННЫЕ ТАКИМ СПОСОБОМ | 2010 |
|
RU2536144C2 |
| US 20170259341 A1, 14.09.2017 | |||
| NOMURA K | |||
| et al | |||
| Solution Conductivity as a Key Factor for Thin Silica Coating on Colloidal Silver // Japanese Journal of Applied Physics, 2009, V.48, pp.1-4. | |||
Авторы
Даты
2023-10-25—Публикация
2023-04-05—Подача