Область техники
[0001] Область техники изобретения в целом относится к антителам, их антиген-связывающим фрагментам, полипептидам, иммуноконъюгатам, соединяющимся с CD37, а также к способам использования таких CD37-связывающих молекул для терапии заболеваний, например В-клеточных злокачественных новообразований.
Уровень техники
[0002] Лейкоцитарный антиген CD37 («CD37»), также известный как GP52-40, тетраспанин-26 или TSPAN26, является трансмембранным белком суперсемейства тетраспанинов (Maecker et al., 1997, FASEB J. 11:428-442). Он представляет собой в значительной степени гликозилированный белок с четырьмя трансмембранными доменами, который экспрессируется В-клетками на этапах от пре-В-клеток до периферических зрелых В-клеток, но отсутствует при терминальной дифференциации в плазматические клетки (Link et al., 1987, J Pathol. 152:12-21). Антиген CD37 слабо экспрессируется Т-клетками, миелоидными клетками и гранулоцитами (Schwartz-Albiez et al. 1988, J. Immunol., 140(3)905-914). Однако CD37 также экспрессируется злокачественными В-клетками, например, клетками неходжкинской лимфомы (НХЛ) и хронического лимфоидного лейкоза (ХЛЛ) (Moore et al. 1986, J Immunol. 137(9):3013-8). Исходя из данного профиля экспрессии, CD37 представляет интересную мишень для терапии В-клеточных злокачественных новообразований.
[0003] Хотя точная физиологическая роль CD37 не установлена, в исследованиях предполагается его роль в пролиферации Т-клеток (van Spriel et al. 2004, J Immunol., 172(5):2953-61). Поскольку он является представителем семейства тетраспанинов клеточной поверхности гликопротеинов, CD37 также может образовывать комплексы с другими поверхностными белками (Angelisova 1994, Immunogenetics., 39(4):249-56). У мышей, дефицитных по CD37, развитие проистекало нормально, отклонений в развитии и клеточном составе лимфоидных органов не наблюдалось. Отмечались пониженные уровни IgG1 и изменения в ответах к антигенам, зависимым от Т-клеток (Knobeloch et al. 2000, Mol Cell Biol., 20(15):5363-9).
[0004] Антитела были предложены в качестве многообещающего способа для терапии подобных онкологических заболеваний. В частности, желательны антитела, которые способны индуцировать апоптоз у клеток-мишеней. Помимо этого, желательны антитела, проявляющие комплемент-зависимую цитотоксическую активность (КЗЦ) и антитело-зависимую цитотоксичность (АЗКЦ).
[0005] В настоящее время для терапии В-клеточных злокачественных новообразований используется антитело против CD20, называемое ритуксимабом (Leget et al., 1998, Curr. Opin. Oncol., 10:548-551). Тем не менее, не все пациенты откликаются на терапию ритуксимабом, а у респондентов, отзывающихся на лечение ритуксимабом, впоследствии может развиться рецидив и резистентность к терапии ритуксимабом. Помимо этого, CD37-связывающие агенты также испытывались в качестве возможных средств для терапии В-клеточных злокачественных новообразований. В Trubion Pharmaceuticals были разработаны CD37-связывающие агенты SMIP-016 и TRU-016 (Zhao et al., 2007, Blood, 110:2569-2577). SMIP-016 - одноцепочечный полипептид, который содержит вариабельные области из гибридомы и сконструированные человеческие константные области. TRU-016 - гуманизированная версия белка SMIP против CD37. См., например, публикацию U.S. №2007/0009519. TRU-016 проходит клинические проверки с целью терапии хронического лимфолейкоза (ХЛЛ). Компания Boehringer Ingelheim также представила CD37-связывающий агент в международной патентной заявке №WO 2009/019312. Однако КЗЦ-активность не была отмечена ни у одного из этих связывающих агентов и ни одной про-апоптозной активности in vitro не была отмечена в присутствии перекрестно-сшивающих агентов.
[0006] Радиоиммунологическая терапия (РИТ) с использованием радиомеченого антитела против CD37 МВ-1 применялась в двух раздельных исследованиях. Терапевтические дозы 1311-МВ-1 вводились шести пациентам с рецидивами НХЛ (Press et al. 1989 J Clin Oncol. 7(8):1027-38, Press at el. 1993, N Engl J Med. 329(17): 1219-24). У всех шести пациентов была достигнута полная ремиссия (ПР) с продолжительностью от четырех до тридцати одного месяца. В другом исследовании 131I-МВ-1 вводился десяти пациентам с рецидивами НХЛ (Kaminski et al. 1992 J Clin Oncol. 10(11): 1696-711). У всех четверых пациентов наблюдался ответ, варьировавшийся по продолжительности от двух до шести месяцев, была отмечена лишь одна ПР. Тем не менее, не все пациенты могут проходить лечение вследствие неблагоприятного биораспределения радиометки, что приводит к радиоактивному облучению жизненно важных органов, которые не являются мишенями. Более того, РИТ-связанная токсичность, наблюдавшаяся в этих исследованиях, включала тяжелую миелосуппрессию и токсичность по отношению к сердцу и легким. Хотя эти клинические данные позволяют предположить, что радиоиммуноконъюгаты против CD37 могут быть эффективными, данные виды терапии трудоемки, а при рецидиве у пациентов, прошедших РИТ, повторять этот вид терапии невозможно из-за рисков, связанных с высокими дозами облучения.
[0007] Чтобы преодолеть ограничения РИТ, были разработаны конъюгаты антитело-цитотоксический агент (АСС), также называемые конъюгатами антитело-препарат (ADC). К ним относятся иммуноконъюгаты, содержащие цитотоксический агент, ковалентно связанный с антителом через химический линкер, который позволяет осуществить специфическую доставку цитотоксических лекарственных препаратов в клетки, экспрессирующие белок, распознаваемый антителом. Однако белки, которые плохо интернализируются, не считаются подходящими мишенями для подобных терапевтических средств. CD37 структурно схож с CD20, поскольку оба антигена обладают четырьмя трансмембранными доменами, хотя CD20 не является представителем семейства тетраспанинов (Tedder et al. 1989, J. Immun. 142: 2560-2568). Была изучена способность антител против некоторых антигенов В-клеток, включая CD37 и CD20, к эндоцитозу и распаду (Press et al. 1989, Cancer Res. 49(17):4906-12 и Press et al. 1994, Blood. 83(5): 1390-7). Антитело против CD37 MB-1 удерживалось на клеточной поверхности и медленно захватывалось клетками лимфомы Daudi in vitro. Антитело МВ-1 также обладало низкой скоростью эндоцитоза и внутриклеточного метаболизма клетками пациентов с НХЛ in vitro. Аналогичные результаты были получены для антитела против CD20 1F5, которое также в основном удерживалось на поверхности клеток лимфомы и захватывалось в слабой степени. Конъюгаты ADC CD20-антител были ранее изучены, однако они не проявляли выраженной активности, особенно при использовании недисульфидных или кислотно-стабильных линкеров (см., к примеру, Poison et al., 2009, Cancer Res., 69(6):2358-2364). В свете этих наблюдений CD37 не расценивался как предпочтительная цель для конъюгатов антитело-препарат.
[0008] Таким образом, существует потребность в CD37-связывающих агентах, включая антитела, их антиген-связывающие фрагменты и конъюгаты антитело-препарат (иммуноконъюгаты) для лечения В-клеточных злокачественных новообразований. Настоящее изобретение адресовано этой необходимости.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0009] В настоящем документе описаны новые антитела, связывающиеся с человеческим CD37, иммуноконъюгаты, содержащие эти антитела, а также способы их применения. Также предлагаются новые полипептиды, например антитела, связывающиеся с человеческим CD37, фрагменты таких антител и иные полипептиды, связанные с такими антителами. Также предлагаются полинуклеотиды, содержащие нуклеотидные последовательности, кодирующие полипептиды, и векторы, содержащие полинуклеотиды. Помимо этого, предлагаются клетки, содержащие полипептиды и/или полинуклеотиды по изобретению. Также предлагаются композиции (например, фармацевтические композиции), содержащие новые антитела против CD37. Помимо этого, предлагаются способы получения и применения новых CD37-антител или иммуноконъюгатов, например способы, в которых новые CD37-антитела или иммуноконъюгаты используются для ингибирования роста опухоли и/или для лечения рака.
[0010] Предлагаются антитела или их антигенсвязывающие фрагменты, специфически связывающиеся с CD37, которые способны индуцировать комплемент-зависимую цитотоксичность (КЗЦ). В некоторых вариантах воплощения антитело или его антигенсвязывающий фрагмент также способны индуцировать апоптоз и/или антитело-зависимую клеточно-опосредованную цитотоксичность (АЗКЦ).
[0011] Антитело или его антигенсвязывающий фрагмент могут быть такими, чтобы связываться с таким же CD37-эпитопом, что и антитело, выбранное из группы, состоящей из: (а) антитела, содержащего полипептид SEQ ID NO:55 и полипептид SEQ ID NO: 72; (б) антитела, содержащего полипептид SEQ ID NO:59 и полипептид SEQ ID NO:75; (в) антитела, содержащего полипептид SEQ ID NO: 61 и полипептид SEQ ID NO:77; (г) антитела, содержащего полипептид SEQ ID NO:64 и полипептид SEQ ID NO:80; (д) антитела, содержащего полипептид SEQ ID NO: 66 и полипептид SEQ ID NO:82; (е) антитела, содержащего полипептид SEQ ID NO: 68 и полипептид SEQ ID NO:84 (ж) антитела, содержащего полипептид SEQ ID NO:70 и полипептид SEQ ID NO:86.
[0012] В некоторых вариантах воплощения антитело или его антигенсвязывающий фрагмент специфически связываются с CD37 и специфически связываются с полипептидом SEQ ID NO:180. В определенном варианте воплощения антитело или его антигенсвязывающий фрагмент не связываются с полипептидом SEQ ID NO:184.
[0013] В некоторых вариантах воплощения антитело или его антигенсвязывающий фрагмент специфически связываются с CD37 и антитело или его антиген-связывающий фрагмент выбраны из группы, состоящей из: (а) антитела, содержащего полипептид SEQ ID NO:55 и полипептид SEQ ID NO: 72; (б) антитела, содержащего полипептид SEQ ID NO:59 и полипептид SEQ ID NO:75; (в) антитела, содержащего полипептид SEQ ID NO: 61 и полипептид SEQ ID NO:77; (г) антитела, содержащего полипептид SEQ ID NO: 64 и полипептид SEQ ID NO: 80; (д) антитела, содержащего полипептид SEQ ID NO:66 и полипептид SEQ ID NO:82; (е) антитела, содержащего полипептид SEQ ID NO:68 и полипептид SEQ ID NO:84 (ж) антитела, содержащего полипептид SEQ ID NO:70 и полипептид SEQ ID NO:86.
[0014] В определенных вариантах воплощения антитело или его антигенсвязывающий фрагмент продуцируются гибридомой, выбранной из группы, состоящей из: депонента АТСС номер РТА-10664, депонированного АТСС 18 февраля 2010; депонента АТСС номер РТА-10665, депонированного АТСС 18 февраля 2010; депонента АТСС номер РТА-10666, депонированного АТСС 18 февраля 2010; депонента АТСС номер РТА-10667, депонированного АТСС 18 февраля 2010; депонента АТСС номер РТА-10668, депонированного АТСС 18 февраля 2010; депонента АТСС номер РТА-10669, депонированного АТСС 18 февраля 2010; и депонента АТСС номер РТА-10670, депонированного АТСС 18 февраля 2010.
[0015] В некоторых вариантах воплощения антитело или его антигенсвязывающий фрагмент специфически связываются с CD37, и антитело содержит полипептидные последовательности, выбранные из группы, состоящей из: (a) SEQ ID NOs:4, 5 и 6 и SEQ ID NOs:28, 29 и 30; (б) SEQ ID NOs:7, 8 и 9 и SEQ ID NOs:31, 32 и 33; (в) SEQ ID NOs:10, 11 и 12 и SEQ ID NOs:34, 35 и 36; (г) SEQ ID NOs:13, 14 и 15 и SEQ ID NOs: 37, 38 и 39; (д) SEQ ID NOs:13, 14 и 15 и SEQ ID NOs:37, 40 и 39; (е) SEQ ID NOs:16, 17 и 18 и SEQ ID NOs:41, 42 и 43; (ж) SEQ ID NOs:19, 20 и 21 и SEQ ID NOs:44, 45 и 46; (з) SEQ ID NOs:19, 20 и 21 и SEQ ID NOs:44, 47 и 46; (и) SEQ ID NOs:22, 23 и 24 и SEQ ID NOs:48, 49 и 50; (к) SEQ ID NOs:22, 23 и 24 и SEQ ID NOs:48, 51 и 50; (л) SEQ ID NOs:25, 26 и 27 и SEQ ID NOs:52, 53 и 54; и (м) вариантов (а)-(л), содержащих 1, 2, 3 или 4 консервативных аминокислотных замены.
[0016] В еще одних вариантах воплощения антитело или его антигенсвязывающий фрагмент содержат полипептидные последовательности, которые по меньшей мере на 90% идентичны, по меньшей мере на 95% идентичны, по меньшей мере на 99% идентичны или идентичны полипептидным последовательностям, выбранным из группы, состоящей из: (a) SEQ ID NO:55 и SEQ ID NO:72; (б) SEQ ID NO:56 и SEQ ID NO:73; (в) SEQ ID NO:57 и SEQ ID NO:74; (г) SEQ ID NO:58 и SEQ ID NO:74; (д) SEQ ID NO:59 и SEQ ID NO:75; (e) SEQ ID NO:60 и SEQ ID NO:76; (ж) SEQ ID NO:61 и SEQ ID NO:77; (з) SEQ ID NO:62 и SEQ ID NO:78; (и) SEQ ID NO:63 и SEQ ID NO:79; (к) SEQ ID NO:64 и SEQ ID NO:80; (л) SEQ ID NO:65 и SEQ ID NO:81; (м) SEQ ID NO:66 и SEQ ID NO:82; (н) SEQ ID NO:67 и SEQ ID NO:83; (o) SEQ ID NO:68 и SEQ ID NO:84; (п) SEQ ID NO:69 и SEQ ID NO:85; (p) SEQ ID NO:70 и SEQ ID NO:86; и (с) SEQ ID NO:71 и SEQ ID NO:87.
[0017] В некоторых вариантах воплощения антитело или его антигенсвязывающий фрагмент являются мышиными, нечеловеческими, гуманизированными, химерными, перестроенными или человеческими.
[0018] В некоторых вариантах воплощения антитело или фрагмент антитела способны индуцировать in vitro апоптоз клеток, экспрессирующих CD37, в отсутствие перекрестносшивающих агентов. В некоторых вариантах воплощения антитело или антигенсвязывающий фрагмент способны индуцировать комплемент-зависимую цитотоксичность (КЗЦ). В еще одних вариантах воплощения антитело или антигенсвязывающий фрагмент способны индуцировать антитело-зависимую клеточно-опосредованную цитотоксичность (АЗКЦ).
[0019] В других вариантах воплощения антитело или его антигенсвязывающий фрагмент являются человеческими или гуманизированными, специфически связывающимися с CD37 и способны индуцировать in vitro апоптоз клеток, экспрессирующих CD37, в отсутствие перекрестносшивающих агентов. В еще одних вариантах воплощения человеческое или гуманизированное антитело или его антигенсвязывающий фрагмент способны индуцировать комплемент-зависимую цитотоксичность (КЗЦ) и/или способны индуцировать антитело-зависимую клеточно-опосредованную цитотоксичность (АЗКЦ).
[0020] В иных вариантах воплощения антитело или его антигенсвязывающий фрагмент связываются с человеческим CD37 и CD37 макаки.
[0021] В некоторых вариантах воплощения антитело или его антигенсвязывающий фрагмент являются полноразмерными антителом или антигенсвязывающий фрагментом. Антитело или его антигенсвязывающий фрагмент могут содержать Fab, Fab', F(ab')2, Fd, одноцепочечный Fv или scFv, дисульфидно-связанный Fv, домен V-NAR, IgNar, интратело, IgGACFO, минитело, F(ab')3, тетратело, триатело, диатело, однодоменное антитело, DVD-Ig, Fcab, mAb2, (scFv)2 либо scFv-Fc.
[0022] В других вариантах воплощения CD37-связывающий агент является полипептидом, который специфически связывается с CD37, и полипептид содержит полипептидные последовательности, выбранные из группы, состоящей из: (a) SEQ ID NOs:4, 5 и 6 и SEQ ID NOs:28, 29 и 30; (б) SEQ ID NOs:7, 8 и 9 и SEQ ID NOs:31, 32 и 33; (в) SEQ ID NOs:10, 11 и 12 и SEQ ID NOs:34, 35 и 36; (г) SEQ ID NOs:13, 14 и 15 и SEQ ID NOs:37, 38 и 39; (д) SEQ ID NOs:13, 14 и 15 и SEQ ID NOs:37, 40 и 39; (е) SEQ ID NOs:16, 17 и 18 и SEQ ID NOs:41, 42 и 43; (ж) SEQ ID NOs:19, 20 и 21 и SEQ ID NOs:44, 45 и 46; (з) SEQ ID NOs:19, 20 и 21 и SEQ ID NOs:44, 47 и 46; (и) SEQ ID NOs:22, 23 и 24 и SEQ ID NOs:48, 49 и 50; (к) SEQ ID NOs:22, 23 и 24 и SEQ ID NOs:48, 51 и 50; (л) SEQ ID NOs:25, 26 и 27 и SEQ ID NOs:52, 53 и 54; и (м) вариантов (а)-(л), содержащих 1, 2, 3 или 4 консервативных аминокислотных замены.
[0023] В других вариантах воплощения CD37-связывающий агент является полипептидом, который специфически связывается с CD37, и полипептид содержит последовательности, которые по меньшей мере на 90% идентичны, по меньшей мере на 95% идентичны, по меньшей мере на 99% идентичны или идентичны полипептидным последовательностям, выбранным из группы, состоящей из: (a) SEQ ID NO:55 и SEQ ID NO:72; (б) SEQ ID NO:56 и SEQ ID NO:73; (в) SEQ ID NO:57 и SEQ ID NO:74; (г) SEQ ID NO:58 и SEQ ID NO:74; (д) SEQ ID NO:59 и SEQ ID NO:75; (e) SEQ ID NO:60 и SEQ ID NO:76; (ж) SEQ ID NO:61 и SEQ ID NO:77; (з) SEQ ID NO:62 и SEQ ID NO:78; (и) SEQ ID NO:63 и SEQ ID NO:79; (к) SEQ ID NO:64 и SEQ ID NO:80; (л) SEQ ID NO:65 и SEQ ID NO:81; (м) SEQ ID NO:66 и SEQ ID NO: 2; (н) SEQ ID NO:67 и SEQ ID NO:83; (o) SEQ ID NO:68 и SEQ ID NO:84; (п) SEQ ID NO:69 и SEQ ID NO:85; (p) SEQ ID NO:70 и SEQ ID NO:86; и (с) SEQ ID NO:71 и SEQ ID NO:87.
[0024] Клетки, продуцирующие антитело или его антигенсвязывающий фрагмент, или полипептид могут изготавливаться и использоваться согласно способам, описанным здесь. Предлагаются способы получения антитела или его антигенсвязывающего фрагмента, или полипептида, заключающиеся в (a) культивировании клеток, продуцирующих такой CD37-связывающий агент; и (b) выделении антитела, его антигенсвязывающего фрагмента либо полипептида из культивированных клеток.
[0025] В некоторых вариантах воплощения CD37-связывающий агент является иммуноконъюгатом с формулой (A)-(L)-(C), где: (А) - CD37-связывающий агент, (L) - линкер, и (С) - цитотоксический агент, причем линкер (L) соединяет (А) с (С).
[0026] В некоторых вариантах воплощения CD37-связывающий агент является иммуноконъюгатом с формулой (A)-(L)-(C), где: (А) - антитело или антигенсвязывающий фрагмент, которые специфически связываются с CD37, (L) - нерасщепляемый линкер, и (С) - цитотоксический агент, причем линкер (L) соединяет (А) с (С).
[0027] В некоторых вариантах воплощения CD37-связывающий агент является иммуноконъюгатом с формулой (A)-(L)-(C), где: (А) - антитело или антигенсвязывающий фрагмент, которые специфически связываются с CD37, (L) - линкер, и (С) - майтансиноид, причем линкер (L) соединяет (А) с (С).
[0028] Иммуноконъюгатный линкер может быть нерасщепляемым линкером. Линкер может быть выбран из группы, состоящей из расщепляемого линкера, нерасщепляемого линкера, гидрофильного линкера и линкера, основывающегося на двухосновной карбоновой кислоте. Линкер может быть выбран из группы, состоящей из: N-сукцинимидил 4-(2-пиридилдитио)пентаноата (SPP), N-сукцинимидил 4-(2-пиридилдитио)бутаноата (SPDB) или N-сукцинимидил 4-(2-пиридилдитио)-2-сульфобутаноата (sulfo-SPDB), N-сукцинимидил 4-(малеимидометил) циклогексанкарбоксилата (SMCC), N-сульфосукцинимидил 4-(малеимидометил) циклогексанкарбоксилата (sulfoSMCC), N-сукцинимидил-4-(иодацетил)-аминобензоата (SIAB) и N-сукцинимидил-[(N-малеимидопропионамидо)-тетраэтиленгликолевого] эфира (NHS-PEG4-малеимида). Линкер может быть N-сукцинимидил-[(N-малеимидопропионамидо)-тетраэтиленгликолевым] эфиром (NHS-PEG4-малеимидом).
[0029] Цитотоксический агент может быть выбран из группы, состоящей из майтансиноида, аналога майтансиноида, доксорубицина, модифицированного доксорубицина, бензодиазепина, таксоида, СС-1065, аналога СС-1065, дуокармицина, аналога дуокармицина, калихеамицина, доластатина, аналога доластатина, аристатина, производного томаимицина и производного лептомицина либо пролекарственной формы агента. Цитотоксический агент может быть майтансиноидом. Цитотоксический агент может быть N(2')-деацетил-N((2')-(3-меркапто-1-оксопропил)-майтансином (DM1) или (N-2')-деацетил-N2-(4-меркапто-4-метил-1-оксопентил)-майтансином (DM4).
[0030] Также в настоящем изобретении предлагается фармацевтическая композиция, содержащая CD37-связывающий агент и фармацевтически приемлемый носитель.
Фармацевтическая композиция может содержать второй противоопухолевый агент.
[0031] Также здесь предлагается диагностический реактив, содержащий помеченный CD37-связывающий агент. Метка может быть выбрана из группы, состоящей из радиометки, флуорофора, хромофора, визуализирующего средства и иона металла.
[0032] Также здесь предлагается набор, содержащий CD37-связывающий агент.
[0033] Способы, описанные здесь, включают способы ингибирования роста клеток, экспрессирующих CD37, включающие контактирование клетки с CD37-связывающим агентом либо с содержащей его фармацевтической композицией.
[0034] Также предлагаются способы лечения пациента с онкологическим заболеванием, включающие введение пациенту терапевтически эффективного количества CD37-связывающего агента или содержащей его фармацевтической композиции субъекту.
[0035] Способы могут содержать введение второго противоопухолевого препарата субъекту. Второй противоопухолевый агент может быть химиотерапевтическим агентом.
[0036] Онкологическое заболевание может быть онкологическим заболеванием, выбранным из группы, включающей В-клеточные лимфомы, НХЛ, прекурсорные В-клеточные лимфобластные лейкемию/лимфому и неоплазмы зрелых В-клеток, В-клеточную хроническую лимфоцитную лейкемию (ХЛЛ)/мелкоклеточную лимфоцитарную лимфому (МЛЛ), В-клеточную пролимфоцитную лейкемию, лимфоплазмацитную лимфому, лимфому клеток мантийной зоны (ЛКМЗ), фолликулярную лимфому (ФЛ), включая высокодифференцированную, среднедифференцированную и низкодифференцированную ФЛ, кожную центрально-фолликулярную лимфому, В-клеточную лимфому маргинальной зоны, В-клеточную лимфому маргинальной зоны MALT-типа, В-клеточную лимфому маргинальной зоны узлового типа, В-клеточную лимфому маргинальной зоны селезеночного типа, волосатоклеточный лейкоз (ВКЛ), диффузную В-крупноклеточную лимфому, лимфому Беркитта, плазмацитому, плазмаклеточную миелому, посттрансплантационное лимфопролиферативное расстройство, макроглобулинемию Вальденстрема, а также анапластическую крупноклеточную лимфому (АККЛ).
[0037] Изолированные полинуклеотиды, содержащие последовательность, кодирующую полипептид, по меньшей мере на 90% идентичный, по меньшей мере на 95% идентичный, по меньшей мере на 99% идентичный либо идентичный последовательности, выбранной из группы, состоящей из SEQ ID NOs: 55-87, также предлагаются здесь. Полинуклеотид может содержать последовательность, по меньшей мере на 90%, по меньшей мере на 95% идентичную, по меньшей мере на 99% идентичную либо идентичную SEQ ID NOs: 121-151.
[0038] Также здесь предлагаются векторы и клетки-хозяева, содержащие такие полинуклеотиды и векторы.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ/ФИГУР
[0039] На Фигуре 1 представлены гистограммы связывания антитела с нетрансфицированными контрольными клетками 300-19 (слева) и CD37-экспрессирующими клетками 300-19 (справа). Показаны гистограммы окрашивания 10 нМ muCD37-3, muCD37-12, muCD37-38 и отсутствие первичного антитела.
[0040] На Фигуре 2 представлены гистограммы связывания антитела с нетрансфицированными контрольными клетками 300-19 (слева) и CD37-экспрессирующими клетками 300-19 (справа). Показаны гистограммы окрашивания 10 нМ muCD37-50, muCD37-51, muCD37-56 и muCD37-57.
[0041] На Фигуре 3 представлено связывание (A) muCD37-3 и muCD37-12 и (В) muCD37-8, muCD37-10 и muCD37-14 с клетками WSU-DLCL-2 по данным проточной цитометрии. Для каждой использовавшейся концентрации антител показана средняя интенсивность флуоресценции (СИФ). Кривые связывания использовались для определения величины ЕС50 связывания антител, которая соответствует кажущейся Kd каждого антитела.
[0042] На Фигуре 4 представлены результаты анализа с Аннексином-V по измерению индукции апоптоза клеток лимфомы Ramos, инкубированных с (А) ритуксимабом, muCD37-3, muCD37-8, muCD37-10, muCD37-12 или muCD37-14 и (В) ритуксимабом, huCD37-3, muCD37-38, muCD37-50, muCD37-51, muCD37-56 или muCD37-57 в концентрации 10 нМ. Для сравнения использовались контрольные образцы необработанных клеток в отсутствие антител (no Ab).
[0043] На Фигуре 5 представлены результаты исследований пролиферации WST-8 на клетках лимфомы SU-DHL-4, инкубированных с различными концентрациями антител muCD37-3, muCD37-38, muCD37-50, muCD37-51 и muCD37-16 в течение 5 дней.
[0044] На Фигуре 6 представлен перечень поверхностных остатков CD37-3 и замещений в перестроенных версиях для (A) CD37-3 VL и (В) CD37-3 VH.
[0045] На Фигуре 7 представлен перечень поверхностных остатков CD37-50 и замещений в перестроенных версиях для (A) CD37-50 VL и (В) CD37-50 VH.
[0046] На Фигуре 8 показано выравнивание перестроенных последовательностей вариабельных областей CD37-3 и CD37-50 с их мышиными эквивалентами: А) вариабельный домен легкой цепи CD37-3, В) вариабельный домен тяжелой цепи CD37-3, С) вариабельный домен легкой цепи CD37-50, D) вариабельный домен тяжелой цепи CD37-50. Черточками «-» показаны идентичные с мышиной последовательностью остатки.
[0047] На Фигуре 9 представлены (А) анализы прямого связывания muCD37-3, chCD37-3, muCD37-12 и chCD37-12 с клетками Ramos по данным проточной цитометрии и (В) анализы конкурентного связывания muCD37-3, chCD37-3, huCD37-3v1.0 и huCD37-3vl.01 с клетками BJAB в присутствии конъюгатов muCD37-3-PE в концентрации 2 нМ.
[0048] На Фигуре 10 представлены данные проточной цитометрии о связывании антител против CD37 с клетками 300-19, экспрессирующими антиген CD37 макаки: (А) связывание muCD37-3, muCD37-12, muCD37-38, muCD37-50, muCD37-51, muCD37-56, muCD37-57, WR17 и TRU-016 и (В) связывание huCD37-3, huCD37-38, huCD37-50, huCD37-51, huCD37-56 и huCD37-57. Кривые связывания использовались для определения величины ЕС50 связывания антител, которая соответствует кажущейся Kd каждого антитела.
[0049] На Фигуре 11 представлены результаты анализа с Аннексином-V по измерению индукции апоптоза клеток лимфомы Ramos, инкубированных с различными концентрациями (А) huCD37-3, huCD37-38, huCD37-50 и (В) huCD37-51, huCD37-56, huCD36-57 и ритуксимаба. Для сравнения применялись контрольные образцы клеток, обработанных контрольным человеческим антителом изотипа IgG1 (huIgG-контроль).
[0050] На Фигуре 12 представлены результаты исследований пролиферации WST-8 на клетках лимфомы (A) SU-DHL-4 и (В) DOHH-2, инкубированных с различными концентрациями антител muCD37-3, chCD37-3, huCD37-3v1.0 и huCD37-3v1.01 в течение 5 дней.
[0051] На Фигуре 13 представлены результаты исследований пролиферации WST-8 на клетках лимфомы (A) Granta-519 и (В) SU-DHL-4, инкубированных с различными концентрациями антител huCD37-3, TRU-016 или ритуксимаба в течение 5 дней.
[0052] На Фигуре 14 представлены результаты КЗЦ-анализов клеток лимфомы Ramos, инкубированных с (A) huCD37-3, huCD37-38, chCD37-12 или контрольным антителом huIgG1-изотипа и (В) huCD37-38, huCD37-50, huCD37-51, huCD37-56, huCD37-57, chCD37-12 или контрольным антителом huIgG1-изотипа в присутствии 5% человеческой сыворотки в качестве источника комплемента.
[0053] На Фигуре 15 представлены результаты АЗКЦ-анализа клеток лимфомы Daudi, инкубированных с (A) huCD37-3, huCD37-38, huCD37-50, TRU-016 и (В) huCD37-51, huCD37-56, huCD37-57, TRU-016 или контрольным человеческим антителом IgG1-изотипа в присутствии очищенных человеческих НК-клеток в качестве эффекторных клеток.
[0054] На Фигуре 16 представлено выравнивание полноразмерных аминокислотных последовательностей CD37 мыши, человека и макаки. Черточками «-» показаны идентичные с мышиной последовательностью остатки. Малые и большие внеклеточные домены помечены подчеркиваниями.
[0055] На Фигуре 17 представлено выравнивание большого внеклеточного домена последовательностей CD37 человека, рекомбинантной мышиной и мышиной дикого типа, макаки, а также химерных последовательностей. Черточками «-» показаны идентичные с человеческой последовательностью остатки. Показаны позиции конструированных сайтов рестрикции, подчеркнуты затронутые остатки.
[0056] На Фигуре 18 представлено связывание панели CD37-антител с клетками, трансфицированными (А) человеческим CD37 дикого типа и (В) вариантом hCD37-M3, по данным проточной цитометрии с использованием 1,5 мкг/мл каждого антитела.
[0057] На Фигуре 19 представлено связывание панели CD37-антител с клетками, трансфицированными (А) вариантом hCD37-Ml и (В) вариантом hCD37-M45, по данным проточной цитометрии с использованием 1,5 мкг/мл каждого антитела.
[0058] На Фигуре 20 представлено связывание с клетками BJAB (A) huCD37-3 в сравнении с huCD37-3-SMCC-DM1, huCD37-3-SPP-DM1 и huCD37-3-sulfo-mal-DM4 и (В) huCD37-38 в сравнении с huCD37-38-SMCC-DM1 по данным проточной цитометрии. Кривые связывания использовались для определения величины ЕС50 связывания антител или конъюгатов, которая соответствует кажущейся Kd.
[0059] На Фигуре 21 представлены результаты (А) анализа с Аннексином-V по измерению индукции апоптоза и (В) результаты КЗЦ-анализа. Анализы проводились на клетках лимфомы Ramos с различными концентрациями huCD37-3, huCD37-3-SMCC-DM1, контрольного антитела hulgG1, контрольного конъюгата hulgG1-SMCC-DM1 или ритуксимаба. КЗЦ-анализы проводились в присутствии 5% человеческой сыворотки в качестве источника комплемента.
[0060] На Фигуре 22 представлены результаты АЗКЦ-анализа (А) клеток лимфомы Daudi, инкубированных с huCD37-3, huCD37-3-SMCC-DM1, huCD37-3-PEG4-mal-DM1, TRU-016 или контрольным антителом hulgG1-изотипа, и (В) клеток лимфомы Ramos, инкубированных с huCD37-3, huCD37-3-SMCC-DM1, huCD37-3-PEG4-mal-DM1 или контрольным человеческим антителом hulgG1-изотипа, в присутствии очищенных человеческих НК-клеток в качестве эффекторных клеток.
[0061] На Фигуре 23 представлены результаты анализа клеточного цикла с использованием окрашивания пропидия иодидом (А) клеток BJAB и (В) клеток RL, инкубированных с huCD37-3, huCD37-3-SMCC-DM1 или несвязывающимся контрольным конъюгатом hulgGI-SMCC-DM1 при концентрации 10 нМ в течение 20 часов.
[0062] На Фигуре 24 представлены результаты анализа цитотоксичности WST-8 (А) клеток Daudi, инкубированных с huCD37-3-SMCC-DM1, huCD37-38-SMCC-DM1, huCD37-50-SMCC-DM1, huCD37-51-SMCC-DM1, huCD37-56-SMCC-DM1, huCD37-57-SMCC-DM1, и (В) клеток Granta-519, инкубированных с huCD37-3-SMCC-DM1, huCD37-38-SMCC-DM1, huCD37-50-SMCC-DM1, huCD37-51-SMCC-DM1 или несвязывающимся контрольным конъюгатом huIgG1-SMCC-DM1 в концентрациях в интервале от 3×10-8 М до 1×10-11 М в течение 5 дней.
[0063] На Фигуре 25 представлены результаты исследования на установленной ксенотрансплантатной модели с использованием клеток лимфомы BJAB, имплантированных подкожно мышам с ТКИН. Животные получали однократно на 12 день после инокуляции либо 10 мг/кг (А) антитела huCD37-3, huCD37-3-SMCC-DM1, антитела huCD37-50, huCD37-50-SMCC-DM1, либо (В) антитела huCD37-38, huCD37-38-SMCC-DM1, антитела huCD37-56, huCD37-56-SMCC-DM1. Представлена зависимость среднего объема опухоли в различных терапевтических группах от времени после инокуляции опухолевых клеток.
[0064] На Фигуре 26 представлены результаты исследования на установленной ксенотрансплантатной модели с использованием клеток лимфомы BJAB, имплантированных подкожно мышам с ТКИН. Животные получали однократно на 9 день после инокуляции либо 10 мг/кг антитела huCD37-3, huCD37-3-SMCC-DM1, huCD37-3-sulfo-mal-DM4, либо 5 мг/кг huCD37-3-SPP-DM1. Представлена зависимость среднего объема опухоли в различных терапевтических группах от времени после инокуляции опухолевых клеток.
[0065] На Фигуре 27 показаны результаты экспериментов с использованием установленной ксенотрансплантатной модели клеток диффузной В-крупноклеточной лимфомы SU-DHL-4, имплантированных подкожно мышам с ТКИН. Животные получали однократно на 17 день после инокуляции либо 10 мг/кг антитела huCD37-3, huCD37-3-SMCC-DM1, huCD37-3-sulfo-mal-DM4, либо 5 мг/кг huCD37-3-SPP-DM1. Построены графики зависимости медианного объема опухоли в различных терапевтических группах от времени после инокуляции опухолевых клеток.
[0066] На Фигуре 28 представлены результаты исследования на установленной ксенотрансплантатной модели с использованием клеток лимфомы BJAB, имплантированных подкожно мышам с ТКИН. Животные получали однократно на 9 день после инокуляции 10 мг/кг антитела huCD37-3, huCD37-3-SMCC-DM1, huCD37-3-PEG4-mal-DM1. Представлена зависимость среднего объема опухоли в различных терапевтических группах от времени после инокуляции опухолевых клеток.
[0067] На Фигуре 29 показаны результаты экспериментов с использованием установленной ксенотрансплантатной модели клеток диффузной В-крупноклеточной лимфомы SU-DHL-4, имплантированных подкожно мышам с ТКИН. Животные получали однократно на 15 день после инокуляции 10 мг/кг антитела huCD37-3, huCD37-3-SMCC-DM1, huCD37-3-PEG4-mal-DM1. Представлена зависимость среднего объема опухоли в различных терапевтических группах от времени после инокуляции опухолевых клеток.
[0068] На Фигуре 30 представлены результаты исследования на установленной ксенотрансплантатной модели с использованием В-клеток фолликулярной лимфомы DoHH-2, имплантированных подкожно мышам с ТКИН. Животные, начиная с 12 дня после инокуляции, получали (i) одну дозу по 10 мг/кг антитела huCD37-3, (ii) одну дозу по 10 мг/кг конъюгата huCD37-3-SMCC-DM1, (iii) шесть доз по 2 мг/кг Ритуксимаба два раза в неделю в течение трех недель, (iv) режим из одной дозы по 40 мг/кг циклофосфамида и 0,5 мг/кг винкристина, вместе с пятью ежедневными дозами по 0,2 мг/кг преднизона (CVP), либо (v) контрольную терапию растворителем. Построены графики зависимости медианного объема опухоли в различных терапевтических группах от времени после инокуляции опухолевых клеток.
[0069] На Фигуре 31 представлены результаты исследования на установленной ксенотрансплантатной модели с использованием клеток JVM3 CLL, имплантированных подкожно мышам с ТКИН. Животные, начиная с 7 дня после инокуляции, получали (i) одну дозу 10 мг/кг антитела huCD37-3, (ii) одну дозу 5 мг/кг конъюгата huCD37-3-SMCC-DM1, (iii) дозу 10 мг/кг конъюгата huCD37-3-SMCC-DM1, (iv) шесть доз по 5 мг/кг офатумумаба два раза в неделю в течение трех недель, (v) одну дозу 50 мг/кг бендамустина либо (vi) контрольную терапию растворителем. Построены графики зависимости медианного объема опухоли в различных терапевтических группах от времени после инокуляции опухолевых клеток.
[0070] На Фигуре 32 представлены уровни экспрессии CD37 и CD20, измеренные у различных клеточных линий опухолей НХЛ и ХЛЛ (А), и цитотоксичность in vitro huCD37-3-SMCC-DM1, измеренная по отношению к этим клеточным линиям (В).
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0071] В настоящем изобретении предлагается новый класс CD37-связывающих молекул, обладающих высокой активностью в следующих трех цитотоксических воздействиях, направленных против клеток, экспрессирующих CD37 (например, положительных) клеток: индукции апоптоза, АЗКЦ, КЗЦ. Кроме того, иммуноконъюгаты антител против CD37 неожиданно эффективно приводят к гибели CD37-экспрессирующих клеток, что было продемонстрировано на опухолевых моделях in vivo.
I. Определения
[0072] Для облегчения понимания настоящего изобретения ниже даны определения ряда терминов и оборотов.
[0073] Термин CD37 при использовании здесь относится к любому нативному CD37, если не указано иное. CD37 также обозначается как GP52-40, лейкоцитарный антиген CD37, Тетраспанин-26. Термин «CD37» охватывает «полноразмерный» непроцессированный CD37, а также любую форму CD37, получающуюся при процессинге в клетке. Термин также охватывает природные варианты CD37, например, сплайс-варианты, аллельные варианты и изоформы. Полипептиды CD37, описанные здесь, могут быть выделены из множества источников, например, из человеческих тканей или из иных источников, либо быть получены рекомбинантными или синтетическими способами.
[0074] Термин «антитело» обозначает молекулу иммуноглобулина, которая распознает и специфически связывается с мишенью, например, белком, полипептидом, пептидом, углеводом, полинуклеотидом, липидом или комбинацией перечисленного, через по меньшей мере один сайт распознавания антигена в вариабельной области молекулы иммуноглобулина. При использовании здесь термин «антитело» охватывает неизмененные поликлональные антитела, неизмененные моноклональные антитела, фрагменты антител (например, фрагменты Fab, Fab', F(ab')2 и Fv), одноцепочечные мутанты Fv (scFv), мультиспецифические антитела, например биспецифические антитела, полученные по меньшей мере из двух неизмененных антител, химерные антитела, гуманизированные антитела, человеческие антитела, слитые белки, содержащие антиген-определяющую часть антитела, и иные модифицированные молекулы иммуноглобулинов, содержащие антигенраспознающий сайт, при условии проявления антителами желаемой биологической активности. Антитело может принадлежать к одному из пяти основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM либо их подклассов (изотипов) (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2), в зависимости от типа константных доменов тяжелой цепи, называемых альфа, дельта, эпсилон, гамма и мю, соответственно. Различные классы иммуноглобулинов обладают различными и хорошо известными структурами субъединиц и трехмерными конфигурациями. Антитела могут быть свободными либо конъюгированными с иными молекулами, например токсинами, радиоизотопами и т.д.
[0075] «Блокирующее» антитело или «антитело-антагонист» - антитело, которое ингибирует или уменьшает биологическую активность антигена, который оно связывает, например, CD37. В некоторых вариантах воплощения блокирующие антитела или антитела-антагонисты частично или полностью ингибируют биологическую активность антигена. Биологическая активность может быть уменьшена на 10%, 20%, 30%, 50%, 70%, 80%, 90%, 95% или даже 100%.
[0076] Термины «антитело против CD37» или «антитело, которое связывается с CD37» относятся к антителу, которое способно связывать CD37 с аффинностью, достаточной для использования антитела в диагностических или терапевтических целях по отношению к CD37. Излишнее связывание антитела против CD37 с несоответствующим белком, не являющимся CD37, может составлять менее приблизительно 10% от связывания антитела с CD37 по данным, например, радиоиммунологического анализа (РИА). В определенных вариантах воплощения антитело, которое связывается с CD37, обладает константой диссоциации (Kd)≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ либо ≤0,1 нМ.
[0077] Термин «фрагмент антитела» относится к части неизмененного антитела и относится к антиген-определяющим вариабельным областям интактного антитела. Примерами фрагментов антител служат, не ограничиваясь перечисленным, фрагменты Fab, Fab', F(ab')2 и Fv, линейные антитела, одноцепочечные антитела, мультиспецифические антитела, образованные из фрагментов антител.
[0078] «Моноклональное антитело» относится к гомогенной популяции антител, вовлеченной в высокоспецифическое распознавание и связывание одной антигенной детерминанты - эпитопа. Этим они отличаются от поликлональных антител, которые обычно включают различные антитела, направленные против разных антигенных детерминант. Термин «моноклональное антитело» охватывает неизмененные полноразмерные антитела, а также фрагменты антител (например, фрагменты Fab, Fab', F(ab')2 и Fv), одноцепочечные мутанты (scFv), слитые белки, содержащие часть антитела и иные модифицированные молекулы иммуноглобулинов, содержащие антиген-распознающий сайт. Кроме того, «моноклональное антитело» относится к таким антителам, изготовленным любым количеством способов, включая, но не ограничиваясь перечисленным, использование гибридом, фаговой селекции, рекомбинантной экспрессии и трансгенных животных.
[0079] Термин «гуманизированное антитело» относится к формам нечеловеческих (например, мышиных) антител, являющихся специфическими иммуноглобулиновыми цепями, химерными иммуноглобулинами или их фрагментами, содержащими минимальные нечеловеческие (например, мышиные) последовательности. Как правило, гуманизированные антитела являются человеческими иммуноглобулинами, у которых остатки из определяющей комплементарность области (CDR) заменены на остатки CDR нечеловеческого вида (например, мыши, крысы, кролика, хомячка), обладающие желательными специфичностью, аффинностью, способностью (Jones et al., 1986, Nature, 321:522-525; Riechmann et al., 1988, Nature, 332:323-327; Verhoeyen et al., 1988, Science, 239:1534-1536). В некоторых случаях остатки Fv-каркасной области (FR) человеческого иммуноглобулина заменены на соответствующие остатки антитела нечеловеческого вида, обладающие желательной специфичностью, аффинностью и способностью. Гуманизированное антитело может быть далее модифицировано замещением дополнительных остатков в Fv-каркасной области и/или в заменяемых нечеловеческих остатках для улучшения и оптимизации специфичности, аффинности и/или способности антитела. В общем гуманизированное антитело содержит все из по меньшей мере одного, а как правило - двух или трех вариабельных доменов, содержащих все или практически все CDR-области, которые соответствуют нечеловеческому иммуноглобулину, в которых практически все из FR-областей происходят от человеческой консенсусной последовательности иммуноглобулина. Гуманизированное антитело также может содержать по меньшей мере часть константной области или домена иммуноглобулина (Fc), как правило, человеческого иммуноглобулина. Примеры и способы получения гуманизированных антител описаны в патенте США 5225539.
[0080] «Вариабельная область» антитела относится к вариабельной области легкой цепи антитела или вариабельной области тяжелой цепи, по отдельности или в комбинации. Вариабельные области тяжелой и легкой цепей состоят из четырех каркасных областей (FR), соединенных тремя областями, определяющими комплементарность (CDR), также известных как гипервариабельные области. Области, определяющие комплементарность, в каждой цепи держатся близко с каркасными областями и с областями, определяющими комплементарность, другой цепи, образуя антигенсвязывающий сайт антитела. Известно по меньшей мере две техники определения CDR: (1) подход, основанный на перекрестно-видовой вариабельности последовательностей (например, Kabat et al. Sequences of Proteins of Immunological Interest, (5th ed., 1991, National Institutes of Health, Bethesda Md.)); и (2) подход, основанный на кристаллографическом исследовании комплексов антиген-антитело (Al-lazikani et al (1997) J. Molec. Biol. 273:927-948)). Помимо этого, для определения CDR в данной области техники иногда применяются эти подходы в комбинации.
[0081] Система нумерации Kabat, как правило, используется для обозначения остатка в вариабельном домене (приблизительно остатки 1-107 легкой цепи и остатки 1-113 тяжелой цепи) (например, Kabat et al., Sequences of Immunological Interest. 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)).
[0082] Нумерация позиций аминокислот Kabat относится к системе нумерации, использующейся для вариабельных доменов тяжелой цепи или вариабельных доменов легкой цепи в обзоре антител Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Вифезда, Мэриленд. (1991). При использовании этой системы нумерации актуальная линейная аминокислотная последовательность может содержать меньшее количество аминокислот или дополнительные аминокислоты, что соответствует укорачиванию или внедрению в FR или CDR вариабельного домена. К примеру, вариабельный домен тяжелой цепи может содержать вставку одной аминокислоты (остаток 52а согласно Kabat) после остатка 52 H2 и внедренные остатки (например, остатки 82а, 82b и 82c, и т.д., согласно Kabat) после 82 остатка FR. Нумерация остатков Kabat может быть определена для заданного антитела путем выравнивания последовательности в гомологических участках с антителом со «стандартной» нумерацией последовательности Kabat. Система Chothia использует вместо этого расположение структурных петель (Chothia, Lesk J. Mol. Biol. 196:901-917 (1987)). Конец петли Chothia CDR-H1 по нумерации Kabat соответствует H32-H34, в зависимости от длины петли (потому что в системе нумерации Kabat вставки располагаются между Н35A и Н35B; если 35A и 35B отсутствуют, петля кончается на 32; если присутствует только 35A, петля кончается на 33; если присутствуют и 35A, и 35B, петля кончается на 34). Гипервариабельные области AbM представляют компромисс между CDR Kabat и структурными петлями Chothia и используются ПО моделирования антител Oxford Molecular's AbM.
[0083] Термин «человеческое антитело» обозначает антитело, продуцируемое человеком, или антитело с аминокислотной последовательностью, соответствующей антителу, продуцируемому человеком, изготовленному по любой технике, известной в данной области техники. Это определение человеческого антитела включает неизмененные или полноразмерные антитела, их фрагменты и/или антитела, содержащие по меньшей мере один полипептид человеческой тяжелой и/или легкой цепей, например, антитело, содержащее полипептиды мышиной легкой цепи и человеческой тяжелой цепи.
[0084] Термин «химерные антитела» относится к антителам, у которых аминокислотная последовательность молекулы иммуноглобулина происходит от двух и более видов. Как правило, вариабельные области легкой и тяжелой цепей соответствуют вариабельным областям антител, полученных от одного вида млекопитающих (например, мыши, крысы, кролика и т.д.), с желательной специфичностью, аффинностью и активностью, в то время как константные области гомологичны последовательностям антител, полученных от другого вида (обычно человека) для исключения формирования иммунного ответа у этого вида.
[0085] Термины «эпитоп» или «антигенная детерминанта» используются здесь взаимозаменяемо и относятся к той части антигена, которая может быть распознана и специфически связана с конкретным антителом. Если антиген является полипептидом, эпитопы могут быть образованы как последовательными аминокислотами, так и непоследовательными, но расположенными рядом в третичной структуре белка. Эпитопы, образованные последовательными аминокислотами, как правило, сохраняются при денатурации белка, в то время как эпитопы, образующиеся в третичной структуре белка, как правило, не сохраняются при денатурации белка. Эпитоп, как правило, включает по меньшей мере 3, а чаще - по меньшей мере 5 или 8-10 аминокислот в уникальной пространственной конформации.
[0086] «Связывающая способность» в общем относится к суммарной силе всех нековалентных взаимодействий между одиночным связывающим сайтом молекулы (например, антитела) и ее партнером в связывании (например, антигеном). Если не указано иное, при использовании здесь, «связывающая способность» обозначает природную связывающую способность, отражающую 1:1 взаимодействие между членами связывающейся пары (например, антитела и антигена). Аффинность молекулы X к ее партнеру Y может быть охарактеризована константой диссоциации (Kd). Аффинность может быть измерена обычными способами, известными в данной области техники, включая те, которые описаны здесь. Низкоаффинные антитела, как правило, связывают антиген медленно и легко диссоциируют, в то время как высокоаффинные антитела, как правило, быстро связывают антиген и остаются связанными дольше. В данной области техники известно множество способов измерения связывающей аффинности, любой из которых может использоваться для целей настоящего изобретения. Специфические иллюстративные варианты воплощения описаны ниже.
[0087] «Или лучше», при использовании здесь, относится к более сильному связыванию между молекулой и ее партнером по связыванию. «Или лучше», при использовании здесь, относится к более сильному связыванию, что характеризуется меньшим численным значением величины Kd. К примеру, у антитела, обладающего аффинностью к антигену «0,6 нМ или лучше», аффинность антитела к антигену составляет <0,6 нМ, например 0,59 нМ, 0,58 нМ, 0,57 нМ или любую величину, меньшую 0,6 нМ.
[0088] Под «специфически связывается», как правило, понимается антитело, которое связывается с эпитопом через его антигенсвязывающий домен, причем связывание влечет за собой некоторую комплементарность между антигенсвязывающим доменом и эпитопом. В соответствии с этим определением про антитело говорят, что оно «специфически связывается» с эпитопом, если оно соединяется с этим эпитопом через антигенсвязывающий домен лучше, чем со случайным неродственным эпитопом. Термин «специфичность» используется здесь для качественного описания относительной аффинности, с которой конкретное антитело связывается с конкретным эпитопом. К примеру, у антитела «A» может предполагаться более высокая специфичность к заданному эпитопу, чем у антитела «B», либо антитело «A» может связываться с эпитопом «С» с большей специфичностью в сравнении с эпитопом «D».
[0089] Под «предпочтительно связывается» понимается, что антитело специфически связывается с эпитопом в лучшей степени, нежели с родственным, похожим, гомологичным или аналогичным эпитопом. Таким образом, антитело, которое «предпочтительно связывается» с заданным эпитопом, будет с большей вероятностью связываться с этим эпитопом, нежели с родственным, даже если такое антитело способно перекрестно взаимодействовать с родственным эпитопом.
[0090] Антитело «конкурентно ингибирует» связывание антитела сравнения с заданным эпитопом, если оно предпочтительно связывается с этим эпитопом в такой степени, что оно блокирует до некоторой степени связывание антитела сравнения с эпитопом. Конкурентное ингибирование может быть определено любым способом, известным в данной области техники, например, конкурентными ELlSA-анализами. Антитело может конкурентно ингибировать связывание антитела сравнения с заданным эпитопом по меньшей мере на 90%, по меньшей мере на 80%, по меньшей мере на 70%, по меньшей мере на 60% или по меньшей мере на 50%.
[0091] Фразы «практически одинаковый» или «практически такой же», при использовании здесь, обозначают значительно высокую степень сходства двух цифровых величин (как правило, одной, характеризующей антитело по изобретению, и другой, характеризующей референтное антитело или антитело сравнения), такую, что специалист в данной области техники сочтет разность между двумя величинами малой или не имеющей биологического и/или статистического значения в контексте биологических характеристик, измеряющихся упомянутыми величинами (например, Kd-величинами). Разность между указанными двумя величинами может быть меньше чем приблизительно 50%, меньше чем приблизительно 40%, меньше чем приблизительно 30%, меньше чем приблизительно 20% либо меньше чем приблизительно 10% относительно величины референтного антитела или антитела сравнения.
[0092] Полипептид, антитело, полинуклеотид, вектор, клетка или композиция, которые «изолированы» - полипептид, антитело, полинуклеотид, вектор, клетка или композиция, которые находятся в форме, необнаруживаемой в природе. Изолированные полипептиды, антитела, полинуклеотиды, векторы, клетки или композиции включают те, которые были очищены до такой степени, что они более не присутствуют в форме, обнаруживаемой в природе. В некоторых вариантах воплощения изолированные антитело, полинуклеотид, вектор, клетка или композиция являются практически чистыми.
[0093] При использовании здесь термин «практически чистый» относится к материалу, который по меньшей мере на 50% чист (то есть свободен от примесей), по меньшей мере на 90% чист, по меньшей мере на 95% чист, по меньшей мере на 98% чист либо по меньшей мере на 99% чист.
[0094] Термин «иммуноконъюгат» или «конъюгат», при использовании здесь, относится к соединению или производному, которое связано с агентом, соединяющимся с клеткой (например, с антителом против CD37 или его фрагментом), и определяется общей формулой: C-L-A, где C=цитотоксин, L=линкер, A=агент, соединяющийся с клеткой, либо антитело против CD37 или его фрагмент. Иммуноконъюгаты также могут быть определены обратной общей формулой: A-L-С.
[0095] «Линкер» - любая химическая группа, которая может стабильно, ковалентно связывать соединение, как правило, препарат, например, майтансиноид, с агентом, соединяющимся с клеткой, например, антителом против CD37 или его фрагментом. Линкеры могут быть чувствительны или частично устойчивы к кислотному расщеплению, световому расщеплению, пептидазному расщеплению, эстеразному расщеплению, расщеплению дисульфидных связей в условиях, при которых соединение или антитело остается активным. Подходящие линкеры хорошо известны в данной области техники и включают, к примеру, дисульфидные группы, тиоэфирные группы, кислото-лабильные группы, фотолабильные группы, петидаза-лабильные группы и эстераза-лабильные группы. Линкеры также включают заряженные линкеры и их гидрофильные формы, как описано здесь и известно в данной области техники.
[0096] Термины «онкологическое заболевание» и «раковый» относятся к или описывают физиологическое состояние у млекопитающих, при котором популяция клеток характеризуется нерегулируемым клеточным ростом. Примеры онкологических заболеваний включают, не ограничиваясь перечисленным, карциному, лимфому, бластому, саркому, лейкемию. «Опухоль» и «новообразование» относятся к одной или более клеток, возникшим вследствие избыточного клеточного роста или пролиферации, и могут быть доброкачественными (нераковыми) или злокачественными (раковыми), включая предраковые поражения. Примеры «раковых» или «опухолегенных» заболеваний, которые могут лечиться или профилактироваться, включают B-клеточные лимфомы, включая НХЛ, прекурсорные B-клеточные лимфобластные лейкемию/лимфому и неоплазмы зрелых B-клеток, например, B-клеточную хроническую лимфоцитную лейкемию (ХЛЛ)/мелкоклеточную лимфоцитарную лимфому (МЛЛ), B-клеточную пролимфоцитную лейкемию, лимфоплазмацитную лимфому, лимфому клеток мантийной зоны (ЛКМЗ), фолликулярную лимфому (ФЛ), включая слабую, среднюю и тяжелую ФЛ, кожную центрально-фолликулярную лимфому, B-клеточную лимфому маргинальной зоны (MALT-типа, узлового и селезеночного типа), волосатоклеточный лейкоз (ВКЛ), диффузную B-крупноклеточную лимфому, лимфому Беркитта, плазмацитому, плазмаклеточную миелому, посттрансплантационное лимфопролиферативное расстройство, макроглобулинемию Вальденстрема, а также анапластическую крупноклеточную лимфому (АККЛ).
[0097] Термины «раковая клетка», «опухолевая клетка» и их грамматические эквиваленты относятся к общей популяции клеток, происходящих от опухолевого или предракового поражения, включающих как неопухолегенные клетки, содержащие популяцию опухолевых клеток, так и опухолегенные стволовые клетки (раковые стволовые клетки). При использовании здесь термин «опухолевая клетка» будет заменен на термин «неопухолегенный» в случае обозначения лишь тех опухолевых клеток, которые не могут обновляться, чтобы отличать их от опухолевых клеток из стволовых раковых клеток.
[0098] Термин «субъект» относится к любому животному (например, млекопитающему), включая, но не ограничиваясь перечисленным, людей, нечеловекообразных приматов, грызунов и т.п., являющемуся реципиентом конкретного лечения. Как правило, термины «субъект» и «пациент» используются здесь взаимозаменяемо по отношению к человеческому субъекту.
[0099] Введение «в комбинации с» одним и более дополнительных терапевтических агентов включает одновременное (сопутствующее) и последовательное введение в любом порядке.
[0100] Термин «фармацевтическая композиция» относится к такой форме препарата, в которой эффективно проявляется биологическая активность активного ингредиента и который не содержит дополнительных компонентов с неприемлемой токсичностью по отношению к субъекту, которому вводится композиция. Композиция может быть стерильной.
[0101] «Эффективное количество» антитела здесь понимается как количество, достаточное для достижения нужной цели. «Эффективное количество» может быть определено эмпирически обычным способом в зависимости от установленной цели.
[0102] Термин «терапевтически эффективное количество» относится к количеству антитела или иного препарата, эффективному для «лечения» заболевания или нарушения у субъекта или млекопитающего. В случае рака терапевтически эффективное количество препарата может уменьшать количество раковых клеток, уменьшать размер опухоли, ингибировать (например, останавливать или замедлять до некоторой степени) инфильтрацию раковых клеток в периферические органы, ингибировать (например, останавливать или замедлять до некоторой степени) метастазирование опухоли, ингибировать до некоторой степени опухолевый рост и/или ослаблять до некоторой степени один и более симптомов, ассоциированных с раком. См. определение термина «лечение», приведенное здесь. В случае, если препарат способен предотвращать рост и/или убивать существующие опухолевые клетки, он может быть цитостатическим и/или цитотоксическим. «Профилактически эффективное количество» относится к такому количеству, которое, при необходимых дозировках и периодах введения, эффективно для достижения желаемого профилактического результата. Как правило, но не обязательно, если профилактическая доза используется у субъектов до развития заболевания или на его ранних стадия, профилактически эффективное количество ниже терапевтически эффективного количества.
[0103] Слово «метка», при использовании здесь, относится к детектируемому соединению или композиции, которые конъюгируются прямо или косвенно с антителом, образуя «меченое» антитело. Метка может быть детектируема прямо (например, радиоизотопные или флуоресцентные метки) либо, в случае ферментной метки, может катализировать химическое изменение субстрата или вещества, или композиции, которые уже являются детектируемыми.
[0104] «Химиотерапевтический агент» - химическое соединение, подходящее для лечения онкологического заболевания, независимо от механизма действия. Химиотерапевтические агенты включают, к примеру, антагонисты CD20, например Ритуксимаб и циклофосфамид, доксорубицин, винкристин, преднизон, флударабин, этопозид, метотрексат, леналидомид, хлорамбуцил, бентамустин и/ли модифицированные версии подобных химиотерапевтических средств.
[0105] Такие термины как «лечение» или «терапия», или «лечить», или «облегчение», или «облегчать» относятся к обоим пунктам, включающим: 1) терапевтические меры, которые излечивают, замедляют, ослабляют симптомы и/или останавливают прогрессирование диагностированного патологического состояния или нарушения, и 2) профилактические или предотвращающие меры, которые предотвращают и/или замедляют развитие целевого патологического состояния или нарушения. Таким образом, к нуждающимся в терапии относятся те лица, у которых уже наблюдается заболевание; те лица, которые предрасположены к развитию заболевания; и те лица, у которых заболевание необходимо предотвратить. В определенных вариантах воплощения субъект успешно «лечится» от онкологического заболевания, согласно способам настоящего изобретения, если у пациента наблюдается одно или более из следующего: уменьшение количества раковых клеток или полное их отсутствие; уменьшение размера опухоли; ингибирование или отсутствие инфильтрации раковых клеток в периферические органы, включая, к примеру, распространение рака в мягкие ткани и кости; ингибирование или отсутствие метастазов опухолей; ингибирование или отсутствие роста опухоли; ослабление одного или более симптомов, ассоциированных со специфическим онкологическим заболеванием; понижение заболеваемости и смертности; повышение качества жизни; понижение опухолегенности, опухолегенной частоты или опухолегенной емкости опухоли; понижение количества стволовых раковых клеток в опухоли; дифференциация опухолегенных клеток в неопухолегенное состояние; или какая-либо комбинация эффектов.
[0106] «Полинуклеотид» и «нуклеиновая кислота» здесь используются взаимозаменяемо и относятся к полимерам нуклеотидов любой длины, включая ДНК и РНК. Нуклеотиды могут быть дезоксирибонуклеотидами, рибонуклеотидами, модифицированными нуклеотидами или основаниями и/или их аналогами, либо любым субстратом, который может быть внедрен в полимер ДНК- или РНК-полимеразой. Полинуклеотид может содержать модифицированные нуклеотиды, например, метилированные нуклеотиды и их аналоги. Если они присутствуют, то изменения в структуре нуклеотидов могут быть внесены до или после их соединения в полимер. Последовательность нуклеотидов может прерываться ненуклеотидными компонентами. Полинуклеотид может быть, помимо этого, модифицирован после полимеризации, например, конъюгированием с компонентом-меткой. Другие типы модификаций включают, к примеру, «кэпы», замещение одного и более встречающихся в природе нуклеотидов на аналоги, межнуклеотидные модификации, например, с незаряженными связями (например, метилфосфонаты, фосфотриэфиры, фосфоамидаты, кабаматы и т.д.) и с заряженными связями (например, фосфоротиоаты, фосфородитиоаты и т.д.), со свободными фрагментами, например, белками (например, нуклеазами, токсинами, антителами, сигнальными пептидами, ply-L-лизином и т.д.), с интеркаляторами (например, акридином, псораленом и т.д.), с хелаторами (например, металлами, радиоактивными металлами, бором, металлами-окислителями и т.д.), с алкиляторами, например, модифицированными связями (например, альфа-аномерными нуклеиновыми кислотами и т.д.), а также с немодифицированными формами полинуклеотида(ов). Помимо этого, любая гидроксильная группа, обычно присутствующая в сахарах, может быть заменена, например, на фосфонатные группы, фосфатные группы, защищенные стандартными защитными группами, либо может быть активирована для того, чтобы получить дополнительные связи с дополнительными нуклеотидами, или может быть конъюгирована с твердыми подложками. 5'- и 3'-терминальные ОН могут быть фосфорилированы или замещены на амины, или кэпированы органическими фрагментами, содержащими 1-20 атомов углерода. Также другие гидроксилы могут быть замещены на стандартные защитные группы. Полинуклеотиды также могут содержать аналоги рибозы или дезоксирибозы, хорошо известные в данной области техники, к примеру, 2'-O-метил-, 2'-O-аллил, 2'-фтор- или 2'-азидо-рибозу, карбоциклические аналоги сахаров, .альфа.-аномерные сахара, эпимерные сахара, например, арабинозу, ксилозу или ликсозу, пиранозные сахара, фуранозные сахара, седогептулозы, ациклические аналоги и нуклеозидные аналоги с удаленными азотистыми основаниями, например, метилрибозид. Одна и более фосфодиэфирных связей может быть заменена на альтернативные связывающие группы. Данные альтернативные связывающие группы включают, не ограничиваясь перечисленным, варианты воплощения, в которых фосфат замещен на P(O)S («тиоат»), P(S)S («дитиоат»), «(O)NR2 («амидат»), P(O)R, P(O)OR', CO или CH2 («формацеталь»), где каждый R или R' является, независимо, H или замещенным или незамещенным ал килом (1-20 C), необязательно содержащим простую эфирную (--O--) связь, арильную, алкенильную, циклоалкильную, циклоалкенильную или аральдильную. Не все связи в полинуклеотиде должны быть идентичными. Предшествующее описание относится ко всем полинуклеотидам, упоминающимся здесь, включая РНК и ДНК.
[0107] Термин «вектор» обозначает конструкцию, которая способна доставлять и, необязательно, экспрессировать один или более интересующих генов или последовательностей в клетке-хозяине. Примеры векторов включают, не ограничиваясь перечисленным, вирусные векторы, свободные ДНК- или РНК-векторы экспрессии, плазмиды, космиды или фаговые векторы, ДНК- или РНК-векторы экспрессии, соединенные с катионными конденсирующими агентами, ДНК- или РНК-векторы экспрессии, помещенные в липосомы, определенные эукариотные клетки, например, клетки-продуценты.
[0108] Термины «полипептид», «пептид» и «белок» используются взаимозаменяемо для обозначения полимеров аминокислот любой длины. Полимер может быть линейным или разветвленным, он может содержать модифицированные аминокислоты и может содержать вставки, отличные от аминокислотных. Термины также охватывают аминокислотный полимер, который был модифицирован природно или по изобретению, к примеру, с образованием дисульфидной связи, гликозилированием, липидированием, ацетилированием, фосфорилированием или иной манипуляцией либо модификацией, например, конъюгированием с компонентом-меткой. Также в определение включены, к примеру, полипептиды, содержащие один или более аналогов аминокислот (включая, к примеру, неприродные аминокислоты и т.д.), а также иные модификации, известные в данной области техники. Следует понимать, что, поскольку полипептиды по настоящему изобретению основываются на антителах, в некоторых вариантах воплощения полипептиды могут присутствовать в виде одинарных цепей или связанных цепей.
[0109] Термины «идентичный» или процентная «идентичность», в контексте двух или более нуклеиновых кислот или полипептидов, относятся к двум или более последовательностей, которые одинаковы или обладают определенным процентным количеством одинаковых нуклеотидов или аминокислот при сравнении и выравнивании (при необходимости - с введением брешей) для максимального соответствия, причем консервативные аминокислотные замены не рассматриваются как идентичные. Процентная идентичность может быть измерена при помощи ПО или алгоритмов для сравнения последовательностей либо ручным подсчетом. В данной области техники известны различные алгоритмы и ПО, которые могут быть использованы для выравнивания нуклеотидных или аминокислотных последовательностей. Один нелимитирующий пример алгоритма выравнивания последовательностей - алгоритм, описанный в Karlin et al, 1990, Proc. Natl. Acad. Sci., 87:2264-2268, с изменениями согласно Karlin et al., 1993, Proc. Natl. Acad. Sci., 90:5873-5877, который используется в программах NBLAST и XBLAST (Altschul et al., 1991, Nucleic Acids Res., 25:3389-3402). В некоторых вариантах воплощения может использоваться Gapped BLAST согласно Altschul et al., 1997, Nucleic Acids Res. 25:3389-3402. BLAST-2, WU-BLAST-2 (Altschul et al., 1996, Methods in Enzymology, 266:460-480), ALIGN, ALIGN-2 (Genentech, South San Francisco, California) и Megalign (DNASTAR) - дополнительные свободные программы, которые могут использоваться для выравнивания последовательностей. В определенных вариантах воплощения процентная идентичность двух нуклеотидных последовательностей определяется при помощи программы GAP в ПО GCG (например, с использованием показателей NWSgapdna.CMP matrix и gap weight, равных 40, 50, 60, 70 или 90, показателя length weight, равного 1, 2, 3, 4, 5 или 6). В определенных альтернативных вариантах воплощения программа GAP в пакете GCG, в которой используется алгоритм Needleman и Wunsch (J. Mol. Biol. (48):444-453 (1970)), может применяться для определения процентной идентичности двух аминокислотных последовательностей (например, с использованием либо матрицы Blossum 62, либо матрицы РАМ250 и показателя gap weight, равного 16, 14, 12, 10, 8, 6 или 4, а также показателя length weight, равного 1, 2, 3, 4, 5). Альтернативно в определенных вариантах воплощения процентная идентичность нуклеотидных или аминокислотных последовательностей определяется по алгоритму Myers и Miller (CABIOS, 4:11-17 (1989)). К примеру, процентная идентичность может быть определена при помощи программы ALIGN (версии 2.0) и использовании РАМ 120 с таблицей остатков, параметром gap length penalty, равным 12, и gap penalty, равным 4. Параметры, подходящие для максимального выравнивания в конкретном ПО для выравнивания, могут быть определены специалистом в данной области техники. В определенных вариантах воплощения применяются параметры по умолчанию, определенные в ПО для выравнивания. В определенных вариантах воплощения процентная идентичность «X» первой аминокислотной последовательности со второй аминокислотной последовательностью рассчитывается по формуле 100x(Y/Z), где Y - количество аминокислотных остатков, определенных как идентичные в выравнивании первой и второй последовательностей (при ручном выравнивании или конкретной программой выравнивания последовательностей), a Z - общее количество остатков во второй последовательности. Если длина первой последовательности больше длины второй, процентная идентичность первой последовательности со второй будет выше процентной идентичности второй последовательности с первой.
[0110] В качестве неограничивающего примера, наличие определенной процентной идентичности (например, по меньшей мере 80% идентичности, по меньшей мере 85% идентичности, по меньшей мере 90% идентичности, а в некоторых вариантах воплощения - по меньшей мере 95%, 96%, 97%, 98% или 99% идентичности) конкретного полипептида с референтной последовательностью в определенных вариантах воплощения может быть установлено при помощи программы Bestfit (Пакет Wisconsin Sequence Analysis Package, Версия 8 для Unix, Genetics Computer Group, University Research Park, 575 Science Drive, Madison, WI 53711). В BESTFIT используется алгоритм «локальной гомологии» Smith и Waterman, Advances in Applied Mathematics 2: 482-489 (1981) для поиска наилучшего сегмента гомологии между двумя последовательностями. При использовании Bestfit или иной программы выравнивания последовательностей для определения того, идентична ли конкретная последовательность, например, на 95% референтной последовательности по настоящему изобретению, параметры устанавливаются так, чтобы процентная идентичность рассчитывалась по полной длине референтной нуклеотидной последовательности и чтобы были разрешены бреши в гомологичности вплоть до 5% от общего количества нуклеотидов референтной последовательности.
[0111] В некоторых вариантах воплощения две нуклеиновые кислоты или два полипептида по изобретению в значительной степени идентичны, обладая по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, а в некоторых вариантах воплощения - по меньшей мере 95%, 96%, 97%, 98%, 99% нуклеотидной или аминокислотной идентичностью при сравнении и максимальном выравнивании, согласно алгоритму сравнения последовательностей или ручному подсчету. Идентичность может наблюдаться в области последовательности, имеющей по меньшей мере приблизительно 10, приблизительно 20, приблизительно 40-60 остатков или любую целую величину в этом интервале, а также в области длиной более чем 60-80 остатков, к примеру, по меньшей мере приблизительно 90-100 остатков, а в некоторых вариантах воплощения последовательности практически идентичны по всей длине сравниваемых последовательностей; к примеру, могут быть идентичны кодирующие области нуклеотидной последовательности.
[0112] «Консервативная аминокислотная замена» это такая замена, при которой одна аминокислота заменяется на другую аминокислоту с похожей боковой цепью. Семейства аминокислотных остатков по схожести боковых цепей определены в данной области техники и включают основные боковые цепи (например, лизин, аргинин, гистидин), кислотные боковые цепи (например, аспарагиновая кислота, глутаминовая кислота), незаряженные полярные боковые цепи (например, глицин, аспарагин, глутамин, серии, треонин, тирозин, цистеин), неполярные боковые цепи (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан), бета-разветвленные боковые цепи (например, треонин, валин, изолейцин) и ароматические боковые цепи (например, тирозин, фенилаланин, триптофан, гистидин). К примеру, замена фенилиаланина на тирозин является консервативной заменой. В некоторых вариантах воплощения консервативные замены в последовательностях полипептидов и антител по изобретению не приводят к исчезновению связывания полипептида или антитела, содержащего аминокислотную последовательность, с антигеном(ами), с которым(и) они обычно связываются, например, с CD37. Способы идентификации нуклеотидных и аминокислотных консервативных замен, не приводящих к исчезновению связывания с антигеном, хорошо известны в данной области техники (см., например, Brummell et al., Biochem. 32: 1180-1187 (1993); Kobayashi et al. Protein Eng. 12(10):879-884 (1999); и Burks et al. Proc. Natl Acad. Sci. USA 94:412-417 (1997)).
[0113] При использовании в настоящей заявке и формуле изобретения формы единственного числа включают и формы множественного числа, если из контекста явно не следует иное.
[0114] Следует понимать, что какие-либо варианты воплощения, описанные здесь с употреблением слова «содержащий», являются аналогами вариантов воплощения, описанных терминами «состоящий из» и/или «преимущественно состоящий из».
[0115] Термин «и/или» при использовании здесь во фразе типа «А и/или B» включает и «А и B», и «А или В», и «А» и «В». Аналогично термин «и/или» в такой фразе как «А, В, и/или C» охватывает каждое из следующих вариантов воплощений: А, В и C; А, В или C; А или C; А или B; В или C; А и C; А и В; В и С; А (одно), В (одно) и С (одно).
II. CD37-связывающие агенты
[0116] В настоящем изобретении предлагаются агенты, которые специфически связываются с CD37. Эти агенты называются здесь «CD37-связывающими агентами». Полноразмерные аминокислотные последовательности для CD37 человека, макаки, мыши известны в данной области техники и представлены здесь в SEQ ID NOs:1-3, соответственно.
[0117] CD37 человека:
[0118] MSAQESCLSLIKYFLFVFNLFFFVLGSLIFCFGIWILIDKTSFVSFVGLAFVPLQIWSKV LAISGIFTMGIALLGCVGALKELRCLLGLYFGMLLLLFATQITLGILISTQRAQLERSLRDVVEKTI QKYGTNPEETAAEESWDYVQFQLRCCGWHYPQDWFQVLILRGNGSEAHRVPCSCYNLSATNDS TILDKVILPQLSRLGHLARSRHSADICAVPAESHIYREGCAQGLQKWLHNNLISIVGICLGVGLLE LGFMTLSIFLCRNLDHVYNRLAYR (SEQ ID NO:1)
[0119] CD37 макаки:
[0120] MSAQESCLSL1KYFLFVFNLFFFVILGSLIFCFGIWILIDKTSFVSFVGLAFVPLQIWSKV LAISGVFTMGLALLGCVGALKELRCLLGLYFGMLLLLFATQITLGILISTQRAQLERSLQDIVEKTI QRYHTNPEETAAEESWDYVQFQLRCCGWHSPQDWFQVLTLRGNGSEAHRVPCSCYNLSATNDS T1LDKVILPQLSRLGQLARSRHSTDICAVPANSHIYREGCARSLQKWLHNNLISIVGICLGVGLLEL GFMTLSIFLCRNLDHVYNRLRYR (SEQ ID NO:2)
[0121] CD37 мыши (NP_031671):
[0122] MSAQESCLSLIKYFLFVFNLFFFVLGGLIFCFGTWILIDKTSFVSFVGLSFVPLQTWSK VLAVSGVLTMALALLGCVGALKELRCLLGLYFGMLLLLFATQITLGILISTQRVRLERRVQELVL RTIQSYRTNPDETAAEESWDYAQFQLRCCGWQSPRDWNKAQMLKANESEEPFVPCSCYNSTAT NDSTVFDKLFFSQLSRLGPRAKLRQTADICALPAKAHIYREGCAQSLQKWLHNNIISIVGICLGVG LLELGFMTLSIFLCRNLDHVYDRLARYR (SEQ ID NO:3)
[0123] В определенных вариантах воплощения CD37-связывающие агенты являются антителами, иммуноконъюгатами или полипептидами. В определенных вариантах воплощения CD37-связывающие агенты являются гуманизированными антителами.
[0124] В определенных вариантах воплощения CD37-связывающие агенты оказывают один или более из следующих эффектов: ингибирование пролиферации опухолевых клеток, уменьшение опухолегенности опухоли путем уменьшения частотности раковых стволовых клеток в опухоли, ингибирование роста опухоли, повышение выживаемости, запуск клеточной смерти опухолевых клеток, дифференциация опухолегенных клеток в неопухолевое состояние либо предотвращение метастазирования опухолевых клеток.
[0125] В определенных вариантах воплощения CD37-связывающие агенты способны индуцировать комплемент-зависимую цитотоксичность. К примеру, обработка клеток CD37-связывающими агентами может приводить к КЗЦ-активности, понижающей жизнеспособность клеток до менее чем примерно 80%, менее чем примерно 70%, менее чем примерно 60%, менее чем примерно 50%, менее чем примерно 40% или менее чем примерно 35% от жизнеспособности необработанных клеток. Обработка клеток CD37-связывающими агентами может также приводить к КЗЦ-активности, понижающей жизнеспособность клеток до примерно 70-80%, примерно 60-70%, примерно 50-60%, примерно 40-50%, примерно 30-40% от жизнеспособности необработанных клеток. В некоторых определенных вариантах воплощения CD37-связывающие агенты способны индуцировать комплемент-зависимую цитотоксичность у клеток Ramos.
[0126] В определенных вариантах воплощения CD37-связывающие агенты способны индуцировать антитело-зависимую клеточно-опосредованную цитотоксичность (АЗКЦ). К примеру, обработка клеток CD37-связывающими агентами может приводить к АЗКЦ-активности, дающей по меньшей мере приблизительно 15%, по меньшей мере приблизительно 20%, по меньшей мере приблизительно 25%, по меньшей мере приблизительно 30%, по меньшей мере приблизительно 35%, по меньшей мере приблизительно 40%, по меньшей мере приблизительно 45%, по меньшей мере приблизительно 50% либо по меньшей мере приблизительно 60% лизиса клеток. Обработка клеток CD37-связывающими агентами может приводить к АЗКЦ-активности, дающей по меньшей мере приблизительно 10-20%, приблизительно 20-30%, приблизительно 30-40% либо приблизительно 40-50%) лизиса клеток. Обработка клеток CD37-связывающими агентами может также приводить к АЗКЦ-активности, дающей по меньшей мере приблизительно 10-50%, приблизительно 20-50%, приблизительно 30-50%, либо приблизительно 40-50% лизиса клеток. В некоторых определенных вариантах воплощения CD37-связывающие агенты способны индуцировать АЗКЦ у клеток Daudi, Ramos и/или Granta-519.
[0127] В некоторых вариантах воплощения CD37-связывающие агенты способны индуцировать апоптоз. К примеру, обработка клеток CD37-связывающими агентами может индуцировать апоптоз у по меньшей мере приблизительно 15%, по меньшей мере приблизительно 20%, по меньшей мере приблизительно 25%, по меньшей мере приблизительно 30%, по меньшей мере приблизительно 35%, по меньшей мере приблизительно 40%, по меньшей мере приблизительно 45%, по меньшей мере приблизительно 50% либо по меньшей мере у приблизительно 55% клеток. В некоторых определенных вариантах воплощения CD37-связывающие агенты способны индуцировать апоптоз у клеток Ramos и/или клеток Raji.
[0128] В некоторых вариантах воплощения CD37-связывающие агенты способны уменьшать объем опухоли. Способность CD37-связывающего агента уменьшать объем опухоли может быть оценена, к примеру, измерением величины % T/C, то есть медианного объема опухоли субъектов, проходящих терапию, разделенного на медианный объем опухоли контрольных субъектов. В некоторых вариантах воплощения обработка клеток CD37-связывающими агентами приводит к величине % T/C менее чем приблизительно 55%, менее чем приблизительно 50%, менее чем приблизительно 45%, менее чем приблизительно 40%, менее чем приблизительно 35%, менее чем приблизительно 30%, менее чем приблизительно 25%, менее чем приблизительно 20%, менее чем приблизительно 15%, менее чем приблизительно 10% или менее чем приблизительно 5%. В ряде отдельных воплощений CD37-связывающие агенты могут уменьшать объем опухоли в ксенотрансплантатной модели BJAB и/или ксенотрансплантатной модели SU-DHL-4.
[0129] В определенных вариантах воплощения иммуноконъюгаты или иные агенты, которые специфически связываются с человеческим CD37, запускают клеточную смерть посредством цитотоксического агента. К примеру, в некоторых вариантах воплощения антитело против человеческого CD37 конъюгировано с майтансиноидом, который активируется в опухолевых клетках, экспрессирующих CD37, при интернализации белка. В определенных альтернативных вариантах воплощения агент или антитело не конъюгированы.
[0130] В определенных вариантах воплощения CD37-связывающие агенты способны ингибировать рост опухоли. В определенных вариантах воплощения CD37-связывающие агенты способны ингибировать рост опухоли in vivo (например, в ксенотрансплантатной мышиной модели и/или у людей, страдающих раком).
[0131] CD37-связывающие агенты включают CD37-антитела CD37-3, CD37-12, CD37-38, CD37-50, CD37-51, CD37-56 и CD37-57, а также их фрагменты, варианты и производные. CD37-связывающие агенты также включают CD37-связывающие агенты, которые специфически связываются с тем же самым CD37-эпитопом, что и антитело, выбранное из группы, состоящей из CD37-3, CD37-12, CD37-38, CD37-50, CD37-51, CD37-56 и CD37-57. CD37-связывающие агенты также включают CD37-связывающие агенты, которые конкурентно ингибируют антитело, выбранное из группы, состоящей из CD37-3, CD37-12, CD37-38, CD37-50, CD37-51, CD37-56 и CD37-57.
[0132] В ряде конкретных воплощений для связывания CD37-связывающих агентов с CD37 не требуются аминокислоты 109-138 человеческого CD37. Таким образом, некоторые CD37-связывающие агенты соединяются с полипептидом, содержащим аминокислотную последовательность SEQ ID NO: 180. В иных вариантах воплощения связывание CD37-связывающих агентов с CD37 нарушено при мутации в аминокислотах 202-243 человеческого CD37. Таким образом, некоторые CD37-связывающие агенты не соединяются с полипептидом, содержащим аминокислотную последовательность SEQ ID NO:184.
[0133] В некоторых вариантах воплощения CD37-связывающие агенты соединяются с полипептидом SEQ ID NO: 180 и с полипептидом SEQ ID NO: 183, но не соединяются с полипептидом SEQ ID NO:184.
[0134] В некоторых вариантах воплощения CD37-связывающие агенты соединяются с полипептидом SEQ ID NO:190. В некоторых вариантах воплощения CD37-связывающие агенты соединяются с полипептидом SEQ ID NO:190 и с полипептидом SEQ ID NO:189. В некоторых вариантах воплощения CD37-связывающие агенты соединяются с полипептидом SEQ ID NO:190 и с полипептидом SEQ ID NO:188.
[0135] В некоторых вариантах воплощения CD37-связывающий агент соединяется с полипептидом SEQ ID NO:192, но не соединяется с полипептидом SEQ ID NO:194. В некоторых вариантах воплощения CD37-связывающий агент соединяется с полипептидом SEQ ID NO: 193, но не соединяется с полипептидом SEQ ID NO:194.
[0136] CD37-пептидные фрагменты, с которыми связываются определенные CD37-связывающие агенты, включают, не ограничиваясь перечисленным, CD37-фрагменты, содержащие в основном из, состоящие в основном из или содержащие аминокислоты 200-243 SEQ ID NO:1, аминокислоты 202-220 SEQ ID NO:1 или аминокислоты 221-243 SEQ ID NO:1. В некоторых вариантах воплощения CD37-связывающий агент специфически соединяется с человеческим эпитопом CD37, который содержит аминокислоты 202-243 SEQ ID NO: 1. В некоторых вариантах воплощения для связывания CD37-связывающего агента с CD37 требуются аминокислоты 202-243 SEQ ID NO:1. В некоторых вариантах воплощения для связывания CD37-связывающего агента с CD37 требуются аминокислоты 200-220 SEQ ID NO:1. В некоторых вариантах воплощения для связывания CD37-связывающего агента с CD37 требуются аминокислоты 221-243 SEQ ID NO:1.
[0137] CD37-связывающие агенты также включают CD37-связывающие агенты, которые содержат последовательности определяющих комплементарность областей тяжелой и легкой цепей CD37-3, CD37-12, CD37-38, CD37-50, CD37-51, CD37-56 или CD37-57. Определяющие комплементарность области тяжелой и легкой цепей CD37-38, CD37-50, CD37-51, CD37-56 и CD37-57 содержат родственные последовательности. Таким образом, CD-37-связывающие агенты могут также содержать последовательности определяющих комплементарность областей тяжелой и легкой цепей, которые содержат консенсусную последовательность, полученную при выравнивании CD37-38, CD37-50, CD37-51, CD37-56 и CD37-57. Последовательности определяющих комплементарность областей CD37-3, CD37-12, CD37-38, CD37-50, CD37-51, CD37-56 и CD37-57, а также консенсусная последовательность CD37-38, CD37-50, CD37-51, CD37-56 и CD37-57 приведены в Таблицах 1 и 2 ниже.
[0138] CD37-связывающие молекулы могут быть антителами или антиген-связывающими фрагментами, которые специфически связываются с CD37, включающими определяющие комплементарность области CD37-3, CD37-12, CD37-50, CD37-51, CD37-56 или CD37-57, которые содержат до четырех (т.е. 0, 1, 2, 3 или 4) консервативных аминокислотных замен на определяющую комплементарность область.
[0139] Полипептиды могут содержать одну из индивидуальных вариабельных легких цепей или вариабельных тяжелых цепей, описанных здесь. Антитела и полипептиды также могут содержать как вариабельную легкую цепь, так и вариабельную тяжелую цепь. Последовательности вариабельной легкой цепи и вариабельной тяжелой цепи мышиных, химерных и гуманизированных антител CD37-3, CD37-12, CD37-50, CD37-51, CD37-56 и CD37-57 представлены в Таблицах 3 и 4 ниже.


[0140] Также предлагаются полипептиды, которые содержат: (а) полипептид с по меньшей мере 90%-й идентичностью последовательности с SEQ ID NOs:55-71; и/или (б) полипептид с по меньшей мере 90%-й идентичностью последовательности с SEQ ID NOs:72-87. В определенных вариантах воплощения полипептид содержит полипептид, который обладает по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% либо по меньшей мере приблизительно 99% идентичностью последовательности с SEQ ID NOs:55-87. Таким образом, в определенных вариантах воплощения полипептид содержит (а) полипептид с по меньшей мере 95%-й идентичностью последовательности с SEQ ID NOs:55-71; и/или (б) полипептид с по меньшей мере 95%-й идентичностью последовательности с SEQ ID NOs:72-87. В определенных вариантах воплощения полипептид содержит (а) полипептид с аминокислотной последовательностью SEQ ID NOs: 55-71; и/или (б) полипептид с аминокислотной последовательностью SEQ ID NOs:72-87. В определенных вариантах воплощения полипептид является антителом и/или полипептидом, специфически связывающимся с CD37. В определенных вариантах воплощения полипептид является мышиным, химерным или гуманизированным антителом, специфически связывающимся с CD37. В определенных вариантах воплощения полипептид с определенной процентной идентичностью последовательности с SEQ ID NOs: 55-87 отличается от SEQ ID NOs:55-87 только консервативными замещениями аминокислот.
[0141] Полипептиды могут содержать одну из индивидуальных легких цепей или тяжелых цепей, описанных здесь. Антитела и полипептиды также могут содержать как легкую цепь, так и тяжелую цепь. Последовательности легкой цепи и тяжелой цепи мышиных, химерных и гуманизированных антител CD37-3, CD37-12, CD37-50, CD37-51, CD37-56 и CD37-57 представлены в Таблицах 5 и 6 ниже.
[0142] Также предлагаются полипептиды, которые содержат: (а) полипептид с по меньшей мере 90%-й идентичностью последовательности с SEQ ID NOs:88-104; и/или (б) полипептид с по меньшей мере 90%-й идентичностью последовательности с SEQ ID NOs:105-120. В определенных вариантах воплощения полипептид содержит полипептид, который обладает по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% либо по меньшей мере приблизительно 99% идентичностью последовательности с SEQ ID NOs:88-120. Таким образом, в определенных вариантах воплощения полипептид содержит (а) полипептид с по меньшей мере 95%-й идентичностью последовательности с SEQ ID NOs:88-104; и/или (б) полипептид с по меньшей мере 95%-й идентичностью последовательности с SEQ ID NOs:105-120. В определенных вариантах воплощения полипептид содержит (а) полипептид с аминокислотной последовательностью SEQ ID NOs:88-104; и/или (б) полипептид с аминокислотной последовательностью SEQ ID NOs:105-120. В определенных вариантах воплощения полипептид является антителом и/или полипептидом, специфически связывающимся с CD37. В определенных вариантах воплощения полипептид является мышиным, химерным или гуманизированным антителом, специфически связывающимся с CD37. В определенных вариантах воплощения полипептид с определенной процентной идентичностью последовательности с SEQ ID NOs: 88-120 отличается от SEQ ID NOs:88-120 только консервативными замещениями аминокислот.
[0143] В определенных вариантах воплощения CD37-антитело может быть антителом, которое продуцируется гибридомой, выбранной из группы, состоящей из: депонента АТСС номер РТА-10664, депонированного АТСС 18 февраля 2010; депонента АТСС номер РТА-10665, депонированного АТСС 18 февраля 2010; депонента АТСС номер РТА-10666, депонированного АТСС 18 февраля 2010; депонента АТСС номер РТА-10667, депонированного АТСС 18 февраля 2010; депонента АТСС номер РТА-10668, депонированного АТСС 18 февраля 2010; депонента АТСС номер РТА-10669, депонированного АТСС 18 февраля 2010; и депонента АТСС номер РТА-10670, депонированного АТСС 18 февраля 2010 (АТСС располагается по адресу 10801 University Boulevard, Manassas, Virginia 20110). В определенных вариантах воплощения антитело содержит VH-CDR и VL-CDR антитела, продуцируемого гибридомой, выбранной из группы, содержащей РТА-10665, РТА-10666, РТА-10667, РТА-10668, РТА-10669 и РТА-10670.
[0144] В определенных вариантах воплощения CD37-антитело может содержать легкую цепь, кодируемую рекомбинантной плазмидной ДНК phuCD37-3LC (депозит АТСС номер РТА-10722, депонированный АТСС 18 марта 2010). В определенных вариантах воплощения CD37-антитело может содержать тяжелую цепь, кодируемую рекомбинантной плазмидной ДНК phuCD37-3HCv.1.0 (депозит АТСС номер РТА-10723, депонированный АТСС 18 марта 2010). В определенных вариантах воплощения CD37-антитело может содержать легкую цепь, кодируемую рекомбинантной плазмидной ДНК phuCD37-3LC (РТА-10722), и тяжелую цепь, кодируемую рекомбинантной плазмидной ДНК phuCD37-3HCv.1.0 (РТА-10723). В определенных вариантах воплощения CD37-антитело может содержать VL-CDR, кодируемые рекомбинантной плазмидной ДНК phuCD37-3LC (РТА-10722) и VH-CDR, кодируемые рекомбинантной плазмидной ДНК phuCD37-3HCv.1.0 (РТА-10723).
[0145] Моноклональные антитела могут быть приготовлены гибридомными способами, например, описанными Kohler и Milstein (1975) Nature 256:495. Используя гибридомный способ, мышь, хомячок или иное подходящее животное-носитель иммунизируется так, как описано выше, для того, чтобы достичь выделения лимфоцитами антител, которые специфически связываются с иммунизирующим антигеном. Лимфоциты также могут быть иммунизированы in vitro. После иммунизации лимфоциты выделяют и сливают с подходящей миеломной клеточной линией, используя, к примеру, полиэтиленгликоль, для образования гибридомных клеток, которые затем могут быть отделены от неслившихся лимфоцитов и миеломных клеток. Гибридомы, которые продуцируют моноклональные антитела, направленные специфически против выбранного антигена, согласно данным иммунопреципитации, иммуноблоттинга либо анализа связывания in vitro (например, радиоиммунологического анализа (РИА); энзим-связанного иммуносорбентного анализа (ELISA)), могут затем быть размножены в культуре in vitro стандартными способами (Goding, Monoclonal Antibodies: Principles and Practice, Academic Press, 1986) или in vivo в виде асцитных опухолей у животных. Моноклональные антитела затем могут быть очищены из питательной среды или асцитной жидкости так, как описано выше для поликлональных антител.
[0146] Альтернативно моноклональные антитела могут также быть изготовлены способами, использующими рекомбинантную ДНК, как описано в патенте США 4816567. Полинуклеотиды, кодирующие моноклональное антитело, выделяют из зрелых В-клеток или клеток гибридомы, например, способом ОТ-ПЦР с использованием олигонуклеотидных праймеров, которые специфически усиливают гены, кодирующие тяжелые и легкие цепи антитела, а их последовательности определяют обычными процедурами. Изолированные полинуклеотиды, кодирующие тяжелую и легкую цепи, затем клонируют в подходящие вектора экспрессии, которыми трансфицируют клетки-хозяева, например, клетки Е.coli, клетки COS, клетки яичника китайского хомячка (СНО), либо миеломные клетки, которые в иных случаях не продуцируют иммуноглобулиновых белков, моноклональные антитела образуются клетками-хозяевами. Также рекомбинантные моноклональные антитела желаемых видов или их фрагменты могут быть изолированы из фаговых дисплейных библиотек, экспрессирующих определяющие комплементарность области желаемых видов, как было описано (McCafferty et al., 1990, Nature, 348:552-554; Clackson et al., 1991, Nature, 352:624-628; и Marks et al., 1991, J. Mol. Biol., 222:581-597).
[0147] Полинуклеотид(ы), кодирующие моноклональное антитело, могут, помимо этого, быть модифицированы множеством различных способов с использованием технологии рекомбинантных ДНК для получения альтернативных антител. В некоторых вариантах воплощения константные домены легкой и тяжелой цепей, например, мышиного моноклонального антитела, могут быть замещены 1) на области, к примеру, человеческого антитела - для получения химерного антитела или 2) на неиммуноглобулиновый полипептид - для получения слитого антитела. В некоторых вариантах воплощения константные области усечены или удалены для получения желательного фрагмента моноклонального антитела. Сайт-направленный или высокоплотный мутагенез вариабельной области может применяться для оптимизации специфичности, аффинности и т.д. моноклонального антитела.
[0148] В некоторых вариантах воплощения моноклональное антитело против человеческого CD37 является гуманизированным антителом. В определенных вариантах воплощения подобные антитела используются терапевтически для уменьшения антигенности и ответов НАМА (человеческое анти-мышиное антитело) при введении человеческому субъекту. Гуманизированные антитела могут быть получены с использованием различных техник, известных в данной области техники. В определенных альтернативных вариантах воплощения антитело против CD37 является человеческим антителом.
[0149] Человеческие антитела могут быть прямо получены с использованием различных техник, известных в данной области техники. Иммортализованные человеческие В-лимфоциты иммунизированы in vitro или выделены от иммунизированного индивидуума, который образует антитело против антигена-мишени (See, e.g., Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. iss, p.77 (1985); Boemer et al., 1991, J. Immunol., 147 (l):86-95; и Патент США 5750373). Также человеческое антитело может быть выбрано из фаговой библиотеки, в которой экспрессируются человеческие антитела, например, согласно Vaughan et al., 1996, Nat. Biotech., 14:309-314, Sheets et al., 1998, Proc. Nat'l. Acad. Sci., 95:6157-6162, Hoogenboom и Winter, 1991, J. Mol. Biol., 227:381, и Marks et al., 1991, J. Mol. Biol., 222:581). Техники получения и использования фаговых библиотек антител также представлены в патентах США под номерами 5969108, 6172197, 5885793, 6521404, 6544731, 6555313, 6582915, 6593081, 6300064, 6653068, 6706484 и 7264963 и Rothe et al., 2007, J. Mol. Bio., doi:10.1016/jjmb.2007.12.018 (каждый источник включен во всей полноте путем ссылки). Также в данной области техники известны стратегии созревания аффинности и перетасовки цепей (Marks et al., 1992, Bio/Technology 10:779-783, включено во всей полноте путем ссылки), которые могут использоваться для получения высокоаффинных человеческих антител.
[0150] Гуманизированные антитела также могут быть получены в трансгенных мышах, содержащих локусы человеческих иммуноглобулинов, которые после иммунизации способны производить полный репертуар человеческих антител в отсутствие эндогенной продукции иммуноглобулина. Этот подход описан в патентах США 5545807, 5545806, 5569825, 5625126, 5633425 и 5661016.
[0151] Изобретение также охватывает биспецифические антитела, которые специфически распознают CD37. Биспецифические антитела - антитела, которые способны специфически распознавать и связываться с по меньшей мере двумя различными эпитопами. Различные эпитопы могут находиться или в одной и той же молекуле (например, в CD37), или в разных молекулах, к примеру, антитела могут специфически распознавать и связываться с CD37, а также, к примеру, 1) с эффекторной молекулой лейкоцита, например, T-клеточным рецептором (например, CD3) или Fc-рецептором (например, CD64, CD32 или CD16), или 2) с цитотоксическим агентом, что детально описано ниже.
[0152] Примерные биспецифические антитела могут связываться с двумя различными эпитопами, по меньшей мере один из которых происходит от полипептида по изобретению. Альтернативно анти-антигенное плечо молекулы иммуноглобулина может быть комбинировано с плечом, связывающимся с триггерной молекулой лейкоцита, например, Т-клеточной рецепторной молекулой (например, CD2, CD3, CD28 или B7) либо с Fc-рецепторами к IgG, так, чтобы оказывать направленное действие на механизмы клеточной защиты клетки, экспрессирующей конкретный антиген. Биспецифические антитела также могут использоваться для локализации цитотоксических агентов у клеток, экспрессирующих конкретный антиген. Данные антитела обладают антиген-связывающим плечом и плечом, связывающим цитотоксический агент или радионуклидный хелатор, например, EOTUBE, DPTA, DOTA или ТЕТА. Техники получения биспецифических антител хорошо известны в данной области техники (Millstein et al., 1983, Nature 305:537-539; Brennan et al., 1985, Science 229:81; Suresh et al, 1986, Methods in Enzymol. 121:120; Traunecker et al., 1991, EMBO J. 10:3655-3659; Shalaby et al., 1992, J. Exp.Med. 175:217-225; Kostelny et al., 1992, J. Immunol. 148:1547-1553; Gruber et al., 1994, J. Immunol. 152:5368; патент США 5731168). Также охватываются антитела с более чем двумя валентностями. К примеру, могут быть получены триспецифические антитела (Tutt et al., J. Immunol. 147:60 (1991)). Таким образом, в определенных вариантах воплощения антитела против CD37 мультиспецифичны.
[0153] В определенных вариантах воплощения фрагмент антитела предлагается для повышения проникновения в опухоль. Для получения фрагментов антител известны различные техники. Традиционно подобные фрагменты получали посредством протеолитического расщепления целых антител (см., например, Morimoto et al., 1993, Journal of Biochemical and Biophysical Methods 24:107-117; Brennan et al., 1985, Science, 229:81). В определенных вариантах воплощения фрагменты антител получают рекомбинантными способами. Фрагменты Fab, Fv и scFv могут быть экспрессированы и секретированы из Е.coli или иных клеток-хозяев, что позволяет выделять большие количества данных фрагментов. Подобные фрагменты антител могут быть выделены из библиотек антител фагов, обсуждавшихся выше. К примеру, фрагмент антитела может являться линейным антителом, описанным в патенте США 5641870, а также может быть моноспецифическим или биспецифическим. Иные техники получения фрагментов антител очевидны опытному специалисту.
[0154] Техники могут быть адаптированы, согласно настоящему изобретению, для получения одноцепочечных антител, специфических к CD37 (см. патент США №4946778). Помимо этого, способы могут быть адаптированы для конструирования библиотек экспрессии Fab (Huse, et al., Science 246:1275-1281 (1989)) для быстрой и эффективной идентификации моноклональных Fab-фрагментов с желаемой специфичностью к CD37 либо их производных, фрагментов или гомологов. Фрагменты антител могут быть получены способами, известными в данной области техники, включая, но не ограничиваясь перечисленным: (а) фрагмент F(ab')2, полученный при расщеплении молекулы антитела пепсином; (б) фрагмент Fab, образованный восстановлением дисульфидных мостиков фрагмента F(ab')2, (в) фрагмент Fab, полученный обработкой молекулы антитела папином и восстановителем, и (г) фрагменты Fv.
[0155] Помимо этого, может быть желательным, особенно - в случае фрагментов антител, модифицировать антитело, чтобы увеличить его период полужизни в сыворотке. Это может быть достигнуто, к примеру, внедрением эпитопа связывания спасательного рецептора во фрагмент антитела мутированием соответствующей области фрагмента антитела или внедрением эпитопа в пептидный тег, который затем сливается с фрагментом антитела на любом конце или в середине (например, ДНК-синтезом или пептидным синтезом).
[0156] Настоящим изобретением также охватываются гетероконъюгатные антитела. Гетероконъюгатные антитела составлены двумя ковалентно связанными антителами. Подобные антитела были предложены для нацеливания иммунных клеток на нежелательные клетки (патент США №4676980). Предполагается, что антитела могут быть приготовлены in vitro способами, известными в синтетической химии белков, включая способы, в которых применяются перекрестносшивающие агенты. К примеру, иммунотоксины могут быть сконструированы с использованием дисульфидной обменной реакции или путем образования тиоэфирной связи. Примерами реактивов, пригодных для этой цели, служат иминотиолят и метил-4-меркаптобутиримидат.
[0157] Для целей настоящего изобретения следует отметить, что модифицированные антитела могут содержать любой тип вариабельной области, который предлагается для связывания антитела с полипептидами человеческого CD37. В этой связи вариабельная область может содержать или может происходить от любого типа млекопитающего, у которого может быть индуцирован гуморальный ответ и могут быть образованы иммуноглобулины против желательного ассоциированного с опухолью антигена. В силу этого вариабельная область модифицированных антител может, к примеру, происходить от человека, мыши, нечеловекообразных приматов (например, яванских обезьян, макаков и т.д.) либо волков. В некоторых вариантах воплощения и вариабельная, и константная области модифицированных иммуноглобулинов являются человеческими. В иных вариантах воплощения вариабельные области сравнимых антител (обычно происходящих из нечеловеческих источников) могут быть сконструированы или специфически приспособлены так, чтобы улучшить связывающую способность или понизить иммуногенность молекулы. В этой связи вариабельные области, используемые в настоящем изобретении, могут быть гуманизированы или изменены иным образом посредством внедрения импортируемых аминокислотных последовательностей.
[0158] В определенных вариантах воплощения вариабельные домены и в тяжелой, и в легкой цепях изменены по меньшей мере частичной заменой одной или более областей, определяющих комплементарность, и, при необходимости, заменой каркасной области и изменением последовательности. Хотя определяющие комплементарность области могут происходить от антитела того же класса или даже подкласса, что и антитело, от которого происходит каркасная область, предусматривается, что определяющие комплементарность области будут происходить от антитела иного класса и, возможно, от антитела другого вида. Не всегда необходимо заменять все определяющие комплементарность области полной определяющей комплементарность областью от донорской вариабельной области, чтобы передать антиген-связывающую способность одного вариабельного домена другому. В некоторых случаях необходимо только перенести те остатки, которые необходимы для поддержания активности антиген-связывающего сайта. Пояснения представлены в патентах США под номерами 5585089, 5693761 и 5693762; в компетенции специалиста в данной области техники проводить обычные эксперименты или исследования и тесты ошибок для получения функционального антитела с пониженной иммуногенностью.
[0159] Несмотря на изменения в вариабельной области, специалисту в данной области техники понятно, что модифицированные антитела по настоящему изобретению охватывают антитела (например, полноразмерные антитела или их иммунореактивные фрагменты), в которых по меньшей мере часть одного или более константных доменов была удалена или иным образом изменена для получения желаемых биохимических характеристик, например, повышения локализации опухолии или понижения времени полужизни в сыворотке в сравнении с антителом с приблизительно такой же иммуногенностью, обладающим нативной или неизмененной константной областью. В некоторых вариантах воплощения константная область модифицированного антитела содержит человеческую константную область. Модификации константной области, совместимые с данным изобретением, включают вставки, делеции или замещения одной или более аминокислот в одном или более доменов. Иными словами, модифицированные антитела, описанные здесь, могут содержать изменения или модификации одного или более из трех константных доменов тяжелой цепи (CH1, CH2 или CH3) и/или константных доменов легкой цепи (CL). В некоторых вариантах воплощения подразумеваются модифицированные константные области, в которых один или более доменов частично или полностью удалены. В некоторых вариантах воплощения модифицированные антитела содержат конструкции или варианты с удаленными доменами, в которых был полностью удален домен CH2 (ΔСН2-конструкции). В некоторых вариантах воплощения отсутствующий константный домен замещен коротким аминокислотным спейсером (например, с 10 остатками), который обеспечивает некоторую молекулярную гибкость, обычно придаваемую отсутствующей константной областью.
[0160] Помимо конфигурирования, в данной области техники известно, что константная область опосредует некоторые эффекторные функции. К примеру, связывание Cl-компонента комплемента с антителом запускает систему комплемента. Активация комплемента важна для опсонизации и лизиса клеточных патогенов. Активация комплемента также стимулирует воспалительный ответ и может быть вовлечена в аутоиммунную гиперчувствительность. Помимо этого, антитела связываются через Fc-область посредством Fc-рецепторного сайта в Fc-области, связывающегося с Fc-рецептором (FcR) на клетке. Имеется ряд Fc-рецепторов, специфических для различных классов антител, включая IgG (гамма-рецепторы), IgE (эта-рецепторы), IgA (альфа-рецепторы) и IgM (мю-рецепторы). Связывание антитела с Fc-рецепторами на клеточных поверхностях запускает множество важных и разнообразных биологических ответов, включая поглощение и расщепление покрытых антителом частиц, выведение иммунных комплексов, лизис покрытых антителом клеток клетками-киллерами (называемый антитело-зависимой клеточно-опосредованной цитотоксичностью или АЗКЦ), высвобождение воспалительных медиаторов, плацентарный перенос и контроль продукции иммуноглобулинов.
[0161] В определенных вариантах воплощения CD37-связывающие антитела обеспечивают измененные эффекторные функции, что, в свою очередь, влияет на биологический профиль вводимого антитела. К примеру, делеция или инактивация (через точечные мутации или иные способы) домена константной области может уменьшать Fc-рецепторное связывание циркулирующего модифицированного антитела, повышая локализацию опухоли. В других случаях модифицирование константных областей, согласно изобретению, может изменять связывание с комплементом, уменьшая период полужизни в сыворотке и приводя к неспецифическому ассоциированию конъюгированного цитотоксина. Могут использоваться и иные модификации константной области для удаления дисульфидных связей или олигосахаридных фрагментов, повышающие локализацию вследствие повышения антигенной специфичности или гибкости антитела. Аналогично модификации константной области, в соответствии с настоящим изобретением, могут быть легко сделаны известными биохимическими техниками или техниками молекулярного инжиниринга, известными опытному специалисту.
[0162] В определенных вариантах воплощения CD37-связывающий агент, который является антителом, не обладает одной или более эффекторных функций. К примеру, в некоторых вариантах воплощения антитело не проявляет антитело-зависимой клеточной цитотоксичности (АЗКЦ) и/или не проявляет комплемент-зависимой цитотоксичности (КЗЦ). В определенных вариантах воплощения антитело не связывается с Fc-рецептором и/или факторами комплемента. В определенных вариантах воплощения антитело не обладает эффекторной функцией.
[0163] Следует заметить, что в некоторых вариантах воплощения модифицированные антитела могут быть сконструированы таким образом, что СН3-домен слит непосредственно с шарнирной областью соответствующих модифицированных антител. В других конструкциях может быть желательно внедрять пептидный спейсер между шарнирной областью и модифицированными доменами CH2 и/или СНЗ. К примеру, совместимые конструкции могут экспрессироваться с удаленным СН2-доменом и сохраненным СН3-доменом (модифицированным или немодифицированным), присоединенным к шарнирной области через спейсер, содержащий 5-20 аминокислот. Подобный спейсер может быть добавлен, к примеру, для того, чтобы регуляторные элементы константного домена оставались свободными и доступными или для того, чтобы шарнирная область оставалась гибкой. Однако следует заметить, что аминокислотные спейсеры могут в некоторых случаях быть иммуногенными и вызывать нежелательный иммунный ответ против конструкции. Соответственно, в определенных вариантах воплощения любой спейсер, добавленный к конструкции, будет относительно неиммуногенным или даже полностью неиммуногенным, чтобы обеспечить желательные биохимические свойства модифицированных антител.
[0164] Помимо делеции целых доменов константных областей, следует принять во внимание, что антитела по настоящему изобретению могут быть получены частичной делецией или заменой нескольких или даже одной аминокислоты. К примеру, мутация одной аминокислоты в выбранных областях СН2-домена может быть достаточна для частичного уменьшения Fc-связывания и, как следствие, для повышения локализации в опухоль. Аналогично может быть желательным удалить ту часть одного или более доменов константных областей, которая контролирует модулируемую эффекторную функцию (например, CLQ-связывание с комплементом). Подобные частичные делеции константных областей могут улучшать выбранные характеристики антитела (период полужизни в сыворотке), не затрагивая иные желательные функции, ассоциированные с доменом константной области субъекта. Более того, как показано выше, константные области предлагаемых антител могут быть модифицированы посредством мутирования или замещения одной или более аминокислот, улучшая профиль полученной конструкции. В этой связи возможно нарушить активность, обеспечиваемую сохраненным сайтом связывания (например, Fc-связывание), частично сохранив конфигурацию и иммуногенный профиль модифицированного антитела. Некоторые воплощения могут включать добавление одной или более аминокислот в константную область для улучшения желаемых характеристик, например, для понижения или повышения эффекторной функции или для присоединения большего количества цитотоксинов или углеводов. В таких вариантах воплощения может быть желательным внедрять или реплицировать специфические последовательности, происходящие из выбранных доменов константных областей.
[0165] Настоящее изобретение, помимо этого, охватывает варианты и эквиваленты, которые в значительной степени гомологичны химерным, гуманизированным и человеческим антителам или их фрагментам, описанным далее. Они могут содержать, к примеру, мутации консервативного замещения, то есть замещение одной или более аминокислот на родственные. К примеру, консервативное замещение относится к замещению аминокислоты на другую аминокислоту, относящуюся к тому же классу, например, одну кислотную аминокислоту на другую кислотную аминокислоту, одну основную аминокислоту на другую основную аминокислоту или одну нейтральную аминокислоту на другую нейтральную аминокислоту. То, что понимается под консервативным замещением аминокислоты, хорошо известно в данной области техники.
[0166] Полипептиды по настоящему изобретению могут быть рекомбинантными полипептидами, натуральными полипептидами или синтетическими полипептидами, содержащими антитело против человеческого CD37 или его фрагмент. Некоторые аминокислотные последовательности по изобретению могут варьироваться без существенного влияния на структуру и функцию белка. Таким образом, изобретение, помимо этого, включает вариации полипептидов с выраженной активностью или вариации, содержащие области антитела против белка CD37 или его фрагмент. Такие мутанты содержат делеции, вставки, инверсии, повторы и типовые замены.
[0167] Полипептиды и аналоги могут быть далее модифицированы с внедрением дополнительных химических групп, которые обычно не входят в состав белков. Эти дериватизированные группы могут улучшать растворимость, биологический период полужизни или абсорбцию белка. Группы также могут понижать или устранять нежелательные побочные эффекты белков и т.п. Обзор таких групп представлен в REMINGTON'S PHARMACEUTICAL SCIENCES, 20th ed., Mack Publishing Co., Easton, PA (2000).
[0168] Изолированные полипептиды, описанные здесь, могут изготавливаться любым подходящим способом, известным в данной области техники. Такие способы варьируются от способов прямого синтеза белка до конструирования ДНК-последовательности, кодирующей изолированные полипептидные последовательности и экспрессирующей эти последовательности в подходящем трансформированном носителе. В некоторых вариантах воплощения ДНК-последовательность конструируется по рекомбинантной технологии с выделением или синтезом ДНК-последовательности, кодирующей интересующий белок дикого типа. Необязательно последовательность может быть мутагенизирована сайт-специфическим мутагенезом для получения ее функциональных аналогов. См., например, Zoeller et al., Proc. Nat'l. Acad. Sci. USA 81:5662-5066 (1984) и патент США №4588585.
[0169] В некоторых вариантах воплощения ДНК-последовательность, кодирующая интересующий полипептид, конструируется химическим синтезом с использованием олигонуклеотидного синтезатора. Такие олигонуклеотиды могут быть разработаны на основании аминокислотной последовательности желаемого полипептида с выбором тех кодонов, которые предпочтительны у клетки-хозяина, в которой производится интересующий рекомбинантный полипептид. Могут использоваться стандартные способы синтеза изолированной полинуклеотидной последовательности, кодирующей интересующий изолированный полипептид. К примеру, для конструирования обратно-транслируемого гена может использоваться полная аминокислотная последовательность. Помимо этого, может быть синтезирован ДНК-олигомер, содержащий нуклеотидную последовательность, кодирующую отдельный изолированный полипептид. К примеру, могут быть синтезированы, а затем связаны несколько малых олигонуклеотидов, кодирующих части желаемого полипептида. Индивидуальные олигонуклеотиды, как правило, содержат 5'- или 3'- липкие концы для комплементарного соединения.
[0170] После сборки (синтезом, сайт-направленным мутагенезом или иным способом) полинуклеотидные последовательности, кодирующие конкретный интересующий полипептид, будут внедрены в вектор экспрессии и оперативно связаны с последовательностью контроля экспрессии, необходимой для экспрессии белка в желаемом хозяине. Правильность сборки может быть подтверждена секвенированием нуклеотидной последовательности, рестрикционным картированием и экспрессией биологически активного полипептида в подходящем хозяине. Как известно в данной области техники, чтобы достичь высоких уровней экспрессии трансфицированного гена у хозяина, ген должен быть оперативно связан с последовательностями контроля транскрипции и трансляции, функциональных у выбранного хозяина.
[0171] В определенных вариантах воплощения для амплификации и экспрессии ДНК, кодирующей антитела против человеческого CD37 или их фрагменты, используются рекомбинантные векторы экспрессии. Рекомбинантные векторы экспрессии - реплицируемые ДНК-конструкции, содержащие синтетические или полученные из кДНК фрагменты ДНК, кодирующие полипептидную цепь антитела против CD37 или его фрагмент, оперативно связанные с подходящими транскрипционными или трансляционными регуляторными элементами, происходящими из генов млекопитающих, микробов, вирусов или насекомых. Транскрипционная единица, как правило, содержит объединение (1) генетического элемента или элементов, обладающих регуляторной ролью при экспрессии гена, к примеру, транскрипционные промоторы или энхансеры, (2) структурной или кодирующей последовательности, транскрибируемой в мРНК и транслируемой в белок, и (3) подходящих последовательностей запуска и останова транскрипции и трансляции, как детально описано ниже. Подобные регуляторные элементы могут включать операторную последовательность для контроля транскрипции. Дополнительно могут предусматриваться: способность к репликации в хозяине, обусловленная, как правило, источником репликации, и селекционный ген для облегчения распознавания трансформантов. ДНК-области оперативно связаны, если они функционально относятся друг к другу. К примеру, ДНК сигнального пептида (секреторного лидера) оперативно связана с ДНК полипептида, если она экспрессируется в виде прекурсора, который участвует в секреции полипептида; промотор оперативно связан с кодирующей последовательностью, если он контролирует транскрипцию последовательности; либо рибосомный связывающий сайт оперативно связан с кодирующей последовательностью, если он расположен таким образом, чтобы позволять трансляцию. Структурные элементы, предназначенные для использования в системе экспрессии дрожжей, включают лидерную последовательность, позволяющую внеклеточную секрецию клеткой-хозяином транслируемого белка. Альтернативно, если рекомбинантный белок экспрессируется без лидерной или транспортной последовательностей, он может содержать N-терминальный остаток метионина. Этот остаток может затем отщепляться от экспрессируемого рекомбинантного белка для получения конечного продукта.
[0172) Выбор последовательности, контролирующей экспрессию, и вектора экспрессии зависит от выбора хозяина. Может использоваться большое количество комбинаций хозяев и векторов экспрессии. Пригодные векторы экспрессии для эукариотных хозяев включают, к примеру, векторы, содержащие контрольные последовательности экспрессии из SV40, бычьего вируса папилломы, аденовируса и цитомегаловируса. Пригодные векторы экспрессии в бактериальных хозяевах включают известные бактериальные плазмиды, например, плазмиды из Esherichia coli, включая pCR 1, pBR322, рМВ9 и их производные, более широкий интервал плазмид, например, М13 и одноцепочечные ДНК нитчатых фагов.
[0173] Подходящие клетки-хозяева для экспрессии CD37-связывающего полипептида или антитела (или CD37-белка для использования в качестве антигена) включают клетки прокариотов, дрожжей, насекомых и клетки высших эукариотов под контролем соответствующих промоторов. Прокариоты включают грамотрицательные и грамположительные организмы, к примеру, Е.coli или бациллы. Высшие эукариотные клетки включают установленные линии клеток млекопитающих, описанные выше. Также могут использоваться бесклеточные системы трансляции. Подходящие векторы клонирования и экспрессии для использования с клетками-хозяевами бактерий, грибов, дрожжей, млекопитающих были описаны в источнике Pouwels et al. (Cloning Vectors: A Laboratory Manual, Elsevier, N.Y., 1985), сущность которого включена в настоящий документ во всей полноте путем ссылки. Дополнительная информация о способах получения белков, включая получение антител, доступна, к примеру, в патентной заявке США №2008/0187954, патентах США под номерами 6413746 и 6660501, а также в международной патентной заявке №WO 04009823, каждая из которых включена в настоящий документ во всей полноте путем ссылки.
[0174] Для экспрессии рекомбинантного белка также могут успешно использоваться различные культуры клеток млекопитающих или насекомых. Экспрессия рекомбинантных белков в клетках млекопитающих может проводиться потому, что такие белки подвергаются правильному фолдингу, модифицированию и полностью функциональны. Примерами подходящих клеток-хозяев млекопитающих служат линия COS-7 клеток почки обезьяны, описанная Gluzman (Cell 23:175, 1981), другие клеточные линии, способные к экспрессированию соответствующего вектора, включая, к примеру, L-клетки, С127, 3Т3, клетки яичника китайского хомячка (СНО), клеточные линии HeLa и ВНК. Векторы экспрессии у млекопитающих могут содержать нетранскрибируемые элементы, например, точку начала репликации, подходящие промотор и энхансер, связанные с экспрессируемым геном, другие 5' или 3' фланкирующие нетранскрибируемые последовательности и 5' или 3' нетранслируемые последовательности, например, необходимые сайты связывания с рибосомами, сайт полиаденилирования, донорный и акцепторный сайты сплайсинга и транскрипционные последовательности останова. Обзор бакуловирусных систем производства гетерологических белков в клетках насекомых представлен в Luckow и Summers, Bio/Technology 6:47 (1988).
[0175] Белки, продуцируемые трансформированным хозяином, могут быть очищены любым подходящим способом. Такие стандартные способы включают хроматографию (например, ионный обмен, аффинную и эксклюзионную колонную хроматографию), центрифугирование, дифференциальную растворимость или иные стандартные техники очистки белков. Для облегчения очистки в аффинной колонке к белку могут быть присоединены аффинные метки, например гексагистидин, связывающий мальтозу домен, поверхностная последовательность вируса гриппа и глутатион-5-трансфераза. Изолированные белки могут быть исследованы физическими способами с использованием таких техник, как протеолиз, ядерный магнитный резонанс и рентгеновская кристаллография.
[0176] К примеру, супернатанты из систем, выделяющих рекомбинантный белок в питательную среду, могут быть вначале сконцентрированы с использованием доступного в продаже фильтра для концентрации белков, к примеру, установок ультрафильтрации Amicon или Millipore Pellicon. После этапа концентрации концентрат может быть нанесен на подходящий матрикс для очистки. Альтернативно может использоваться анионообменная смола, например, матрикс или субстрат со свободными диэтиламиноэтильными группами (ДЭАЭ). Матриксы могут быть акриламидного, агарозного, декстранового, целлюлозного или иного типа, обычно используемого при очистке белков. Альтернативно может применяться этап катионного обмена. Подходящие катионообменные агенты включают различные нерастворимые матриксы, содержащие сульфопропильные или карбоксиметильные группы. Наконец, для дальнейшей очистки CD37-связывающего агента может применяться один или более этапов высокоэффективной жидкостной хроматографии с обратными фазами (ОФ-ВЭЖХ) с использованием гидрофобной ОФ-ВЭЖХ среды, например, силикагеля со свободными метальными или иными алифатическими группами. Некоторые или все из изложенных выше этапов очистки в различных комбинациях также могут применяться для получения гомогенного рекомбинантного белка.
[0177] Рекомбинантный белок, продуцируемый в бактериальной культуре, может быть выделен, к примеру, первичной экстракцией из клеточных гранул с последующими одним и более этапов концентрирования, высаливания, ионного обмена в водном растворе или эксклюзионной хроматографии. Для окончательной очистки может применяться высокоэффективная жидкостная хроматография (ВЭЖХ). Микробные клетки, участвующие в экспрессии рекомбинантного белка могут быть разрушены любым удобным способом, включая циклическое замораживание-оттаивание, разрушение ультразвуком, механическое разрушение или использование агентов, расщепляющих клетки.
[0178] Известные в данной области техники способы очистки антител и иных белков также включают способы, описанные в патентных заявках США №2008/0312425, 2008/0177048 и 2009/0187005, каждая из которых включена в настоящий документ во всей полноте посредством ссылки.
[0179] В определенных вариантах воплощения CD37-связывающий агент - полипептид, не являющийся антителом. В данной области техники известно множество способов идентифицирования и продуцирования полипептидов, не являющихся антителами, но связывающихся с высокой аффинностью с белками-мишенями. См., например, Skerra, Curr. Opin. Biotechnol., 18:295-304 (2007), Hosse et al., Protein Science, 15:14-27 (2006), Gill et al., Curr. Opin. Biotechnol., 17:653-658 (2006), Nygren, FEBS J., 275:2668-76 (2008) и Skerra, FEBS J., 275:2677-83 (2008), каждый источник включен в настоящий документ во всей полноте посредством ссылки. В определенных вариантах воплощения для идентификации и продуцирования CD37-связывающего полипептида применяют технологию фагового дисплея. В определенных вариантах воплощения полипептид содержит каркасный белок, относящийся к типу, выбранному из группы, состоящей из белка A, липокалина, домена фибронектина, консенсусного повторного домена анкирина и тиоредоксина.
[0180] В некоторых вариантах воплощения агент является небелковой молекулой. В некоторых вариантах воплощения агент является малой молекулой. Комбинаторные химические библиотеки и техники, подходящие для идентификации небелковых CD37-связывающих агентов, известны специалистам в данной области техники. См., например, Kennedy et al., J. Comb. Chem, 10:345-354 (2008), Dolle et al, J. Comb. Chem., 9:855-902 (2007) и Bhattacharyya, Curr. Med. Chem., 8:1383-404 (2001), которые включены в настоящий документ во всей полноте посредством ссылки. Еще в некоторых вариантах воплощения агент является углеводом, гликозаминогликаном, гликопротеином или протеогликаном.
[0181] В некоторых вариантах воплощения агент является аптамером нуклеиновой кислоты. Аптамеры это полинуклеотидные молекулы, выбранные (например, из случайных или мутагенизированных пулов) на основании их способности связываться с другой молекулой. В некоторых вариантах воплощения аптамер содержит ДНК-полинуклеотид. В определенных альтернативных вариантах воплощения аптамер содержит РНК-полинуклеотид. В определенных вариантах воплощения аптамер содержит один или более модифицированных остатков нуклеиновых кислот. Способы получения и скрининга аптамеров нуклеиновых кислот на связывание с белками хорошо известны в данной области техники. См., например, патент США №5270163, патент США №5683867, патент США №5763595, патент США №6344321, патент США №7368236, патент США №5582981, патент США №5756291, патент США №5840867, патент США №7312325, патент США №7329742, Международную Патентную Публикацию №WO 02/077262, Международную Патентную Публикацию №WO 03/070984, Патентную Заявку США №2005/0239134, Патентную Заявку США №2005/0124565 и Патентную Заявку США №2008/0227735; каждый источник включен в настоящий документ во всей полноте путем ссылки.
III. Иммуноконъюгаты
[0182] Настоящее изобретение также направлено на конъюгаты (также называемые иммуноконъюгатами), содержащие антитела против CD37, фрагменты антител, функциональные эквиваленты, описанные здесь, связанные или конъюгированные с препаратом или его пролекарством. Пригодные препараты и их пролекарства известны в данной области техники. Препаратами или их пролекарствами могут являться цитотоксические препараты. Цитотоксический агент, используемый в цитотоксическом конъюгате согласно настоящему изобретению, может быть любым соединением, приводящим клетку к гибели или индуцирующим гибель клетки, или некоторым образом уменьшающим жизнеспособность клетки, и может включать, к примеру, майтансиноиды и аналоги майтансиноидов. Иные подходящие цитотоксические агенты могут быть, к примеру, бензодиазепинами, таксоидами, СС-1065 и аналогами СС-1065, дуокармицином и аналогами дуокармицина, энедиинами, например, калихеамицинами, доластатином и аналогами доластатина, включая ауристатины, производными томаимицина, производными лептомицина, метотрексатом, цисплатином, карбоплатином, даунорубицином, доксорубицином, винкристином, винбластином, мелфаланом, митомицином С, хлорамбуцилом и морфолино-доксорубицином.
[0183] Такие конъюгаты могут быть получены с использованием сшивающей группы, чтобы соединить препарат либо его пролекарство с антителом или его функциональным эквивалентом. Подходящие сшивающие группы хорошо известны в данной области техники и включают, к примеру, дисульфидные группы, тиоэфирные группы, кислото-лабильные группы, фотолабильные группы, пептидаза-лабильные группы и эстераза-лабильные группы.
[0184] Препарат или его пролекарство могут быть, например, соединены с антителом против CD37 или его фрагментом через дисульфидную связь. Сшивающая молекула или перекрестносшивающий агент содержат реактивную химическую группу, которая может взаимодействовать с антителом против CD37 или его фрагментом. Реактивными химическими группами для взаимодействия с агентом, связывающимся с клеткой, могут являться N-сукцинимидиловые сложные эфиры и N-сульфосукцинимидиловые сложные эфиры. Дополнительно сшивающая молекула содержит реактивную химическую группу, которая может быть дитиопиридильной группой и которая может взаимодействовать с препаратом с образованием дисульфидной связи. Сшивающие молекулы включают, к примеру, N-сукцинимидил 3-(2-пиридилдитио) пропионат (SPDP) (см., например, Carlsson et al., Biochem. J., 173: 723-131 (1978)), N-сукцинимидил 4-(2-пиридилдитио)бутаноат (SPDB) (см., например, патент США №4563304), iV-сукцинимидил 4-(2-пиридилдитио)2-сульфобутаноат (sulfo-SPDB) (см. публикацию США №20090274713),.N-сукцинимидил 4-(2-пиридилдитио) пентаноат (SPP) (см., например, CAS 341498-08-6), 2-иминотиолан или уксусноянтарный ангидрид. К примеру, антитело или агент, связывающий клетку, может быть модифицирован перекрестносшивающими реагентами, и антитело или агент, связывающий клетку, содержащий свободные или защищенные тиоловые группы, затем взаимодействует с дисульфид- или тиол-содержащим майтансиноидом с образованием конъюгатов. Конъюгаты могут быть очищены хроматографией, включая, но не ограничиваясь перечисленным, ВЭЖХ, эксклюзионную, адсорбционную, ионообменную и аффинную хроматографию, либо фильтрацией в тангенциальном потоке.
[0185] В ином аспекте настоящего изобретения антитело против CD37 соединено с цитотоксическими препаратами через дисульфидные связи и полиэтиленгликолевый спейсер для увеличения активности, растворимости или эффективности иммуноконъюгата. Подобные расщепляемые гидрофильные линкеры описаны в WO 2009/0134976. Дополнительным преимуществом такого типа линкеров является желаемое высокое количество мономеров и минимальная агрегация конъюгатов антитело-препарат.В данном аспекте специфически рассматриваются конъюгаты агентов, связывающих клетки, и препаратов, соединенных через дисульфидную группу (-S-S-), несущие полиэтиленгликолевые спейсеры ((CH2CH2O)n=1-14) с узким интервалом нагрузки препаратом в 2-8, которые обладают относительной высокой активностью против опухолевых клеток и обладают желаемыми биохимическими свойствами, а именно -высоким выходом конъюгации и высоким содержанием мономера с минимальной агрегацией белка.
[0186] В данном аспекте специфически рассматривается конъюгат антитела против CD37 и препарата формулы (I) или конъюгат формулы (I’):
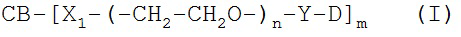
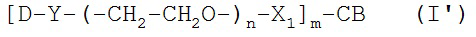
где:
[0187] CB обозначает антитело против CD37 или его фрагмент;
[0188] D обозначает препарат;
[0189] X обозначает алифатическую, ароматическую или гетероциклическую единицу, присоединенную к агенту, связывающемуся с клеткой через тиоэфирную связь, амидную связь, карбаматную связь или эфирную связь;
[0190] Y обозначает алифатическую, ароматическую или гетероциклическую единицу, присоединенную к препарату через дисульфидную связь;
[0191] 1 равно 0 или 1;
[0192] m является целым числом от 2 до 8; и
[0193] n является целым числом от 1 до 24.
[0194] В некоторых вариантах воплощения m является целым числом от 2 до 6.
[0195] В некоторых вариантах воплощения m является целым числом от 3 до 5.
[0196] В некоторых вариантах воплощения п является целым числом от 2 до 8. Альтернативно, как показано, например, в патентах США под номерами 6441163 и 7368565, препарат вначале может быть модифицирован с внедрением реактивной сложноэфирной группы, способной взаимодействовать с агентом, связывающимся с клеткой. Взаимодействие данных препаратов, содержащих активированный сшивающий фрагмент, с агентом, связывающимся с клеткой - еще один метод получения конъюгата агента, связывающегося с клеткой, и препарата. Майтансиноиды также могут быть сшиты с антителом против CD37 или его фрагментом при помощи сшивающих групп ПЭГ, как описано, например, в патенте США 6716821. Данные нерасщепляемые ПЭГ-группы растворимы в воде и неводных растворителях и могут использоваться для соединения одного и более цитотоксических агентов с агентом, связывающимся с клеткой. Примерами ПЭГ-связывающих групп служат гетеробифункциональные ПЭГ-линкеры, реагирующие с цитотоксическими агентами и агентами, связывающимися с клеткой на противоположных концах линкеров - через функциональную сульфгидрильную или дисульфидную группу на одном конце и активную сложноэфирную группу на другом конце. В качестве общего примера синтеза цитотоксического конъюгата с использованием ПЭГ-линкерных групп, дается ссылка на патент США 6716821, который включен в настоящий документ во всей полноте путем ссылки. Синтез начинается со взаимодействия одного или более цитотоксических агентов, несущих реактивный ПЭГ-фрагмент с агентом, связывающимся с клеткой, что приводит к замещению терминальной активной сложноэфирной группы каждого реактивного ПЭГ-фрагмента на аминокислотный остаток агента, связывающегося с клеткой, с образованием цитотоксического конъюгата, содержащего один или более цитотоксических агентов, ковалентно связанных с агентом, связывающимся с клеткой через ПЭГ-линкерную группу. Альтернативно клеточное связывание может быть модифицировано бифункциональным ПЭГ-перекрестно-сшивающим агентом для введения реактивного дисульфидного фрагмента (например, пиридилдисульфида), который затем может быть обработан тиол-содержащим майтансиноидом с образованием конъюгата. В ином способе клеточное связывание может быть модифицировано бифункциональным ПЭГ-перекрестно-сшивающим агентом для введения тиолового фрагмента, который затем может быть обработан реактивным дисульфид-содержащим (например, пиридилдисульфид-содержащим) майтансиноидом с образованием конъюгата.
[0197] Также могут быть получены конъюгаты антитело-майтансиноид с нерасщепляемыми связями. Подобные перекрестно-сшивающие агенты описаны в данной области техники (см. публикацию США №20050169933) и включают, не ограничиваясь перечисленным, N-сукцинимидил-4-(малеимидометил) циклогексанкарбоксилат (SMCC). В некоторых вариантах воплощения антитело модифицировано перекрестносшивающими реагентами, например, сукцинимидил 4-(N-малеимидометил)-циклогексан-1-кабоксилатом (SMCC), сульфо-SMCC, малеимидобензоил-N-гидроксисукцинимидным сложным эфиром (MBS), сульфо-MBS или сукцинимидил-иодоацетатом, как описано в литературе, для внедрения 1-10 реактивных групп (Yoshitake et al., Eur. J. Biochem., 101:395-399 (1979); Hashida et al, J. Applied Biochem., 56-63 (1984); и Liu et al, Biochem., 18:690-697 (1979)). Модифицированное антитело затем взаимодействует с тиол-содержащим производным майтансиноида с получением конъюгата. Конъюгат может быть очищен путем гель-фильтрации через колонку Sephadex G25 или диализом, или фильтрацией в тангенциальном потоке. Модифицированные антитела обрабатывают тиол-содержащим майтансиноидом (1-2 молярных эквивалента/малеимидную группу), конъюгаты антитело-майтансиноид очищают гель-фильтрацией через колонку Sephadex G-25, хроматографией на керамической колонке с гидроксиапатитом, диализом или фильтрацией в тангенциальном потоке, или при помощи комбинации способов. Обычно к одному антителу присоединяется 1-10 майтансиноидов. Один способ заключается в модификации антител с сукцинимидил 4-(N-малеимидометил)-циклогексан-1-карбоксилатом (SMCC) для внедрения малеимидных групп с последующим взаимодействием модифицированного антитела с тиол-содержащим майтансиноидом с образованием тиоэфир-связанного конъюгата. В нем также получаются конъюгаты, содержащие 1-10 молекул препарата на одну молекулу антитела. Конъюгаты майтансиноидов с антителами, фрагментами антител и другими белками получают аналогичным образом.
[0198] В другом аспекте изобретения CD37-антитело соединено с препаратом через нерасщепляемую связь, посредством ПЭГ-спейсера. Подходящие перекрестносшивающие реактивы, содержащие гидрофильные цепи ПЭГ, образующие сшивки между препаратом и антителом против CD37, хорошо известны в данной области техники или доступны в продаже (к примеру, у Quanta Biodesign, Пауэлл, Огайо). Подходящие перекрестносшивающие реактивы, содержащие ПЭГ, также могут быть синтезированы из доступных в продаже ПЭГ с использованием стандартных техник химического синтеза, известных специалистам в данной области техники. Препараты могут взаимодействовать с бифункциональными ПЭГ-содержащими линкерами с образованием соединений следующей формулы: Z-X1-(-CH2-CH2-O-)n-Yp-D способами, подробными описанным в патентной публикации США 20090274713 и в WO 2009/0134976, которые затем могут взаимодействовать с агентом, связывающимся с клеткой с образованием конъюгата. Альтернативно клеточное связывание может быть модифицировано бифункциональным ПЭГ-перекрестносшивающим агентом для введения тиол-реактивной группы (например, малеимидной или галоацетамидной), который затем может быть обработан тиол-содержащим майтансиноидом с образованием конъюгата. В ином способе клеточное связывание может быть модифицировано бифункциональным ПЭГ-перекрестносшивающим агентом для введения тиол-реактивного майтансиноида (например, майтансиноида, несущего малеимидную или галоацетамидную группу) с образованием конъюгата.
[0199] Соответственно, иной аспект настоящего изобретения - конъюгат антитела против CD37 формулы (II) или формулы (II’):
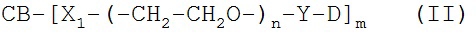
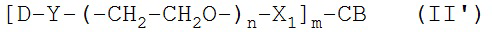 ,
,
где CB обозначает антитело против CD37 или его фрагмент;
[0200] D обозначает препарат;
[0201] X обозначает алифатическую, ароматическую или гетероциклическую единицу, присоединенную к агенту, связывающемуся с клеткой через тиоэфирную связь, амидную связь, карбаматную связь или простую эфирную связь;
[0202] Y обозначает алифатическую, ароматическую или гетероциклическую единицу, присоединенную к препарату через ковалентную связь, выбранную из группы, состоящей из тиоэфирной связи, амидной связи, карбаматной связи, простой эфирной связи, аминной связи, углерод-углеродной связи и гидразоновой связи;
[0203] l равно 0 или 1;
[0204] p равно 0 или 1;
[0205] m является целым числом от 2 до 15; и
[0206] n является целым числом от 1 до 2000.
[0207] В некоторых вариантах воплощения m является целым числом от 2 до 8; и
[0208] В некоторых вариантах воплощения п является целым числом от 1 до 24.
[0209] В некоторых вариантах воплощения m является целым числом от 2 до 6.
[0210] В некоторых вариантах воплощения m является целым числом от 3 до 5.
[0211] В некоторых вариантах воплощения n является целым числом от 2 до 8. Примерами подходящих ПЭГ-содержащих линкеров служат линкеры, обладающие N-сукцинимидил сложноэфирным или N-сульфосукцинимидил сложноэфирным фрагментом, способные взаимодействовать с антителом против CD37 или с его фрагментом, а также малеимидный или галоацетиловый фрагмент для реакции с соединением. ПЭГ-спейсер может быть внедрен в любой перекрестносшивающий агент, известный в данной области техники, способами, описанными здесь.
[0212] Множество линкеров подробно описаны в патентных публикациях США под номерами 20050169933 и 20090274713, а также в WO 2009/0134976, содержимое которых включено в настоящий документ во всей полноте путем ссылки.
[0213] Настоящее изобретение включает аспекты, в которых от примерно 2 до примерно 8 молекул препарата («нагрузка препарата»), к примеру, майтансиноида, присоединены к антителу против CD37 или его фрагменту, причем противоопухолевый эффект конъюгата гораздо более высок, чем в случае нагрузки препарата меньшим или большим количеством молекул препарата, присоединенных к такому же агенту, соединяющемуся с клеткой. «Нагрузка препарата», при использовании здесь, относится к количеству молекул препарата (например, майтансиноида), которые могут быть присоединены к агенту, связывающемуся с клеткой (например, с антителом против CD37 или его фрагментом). В одном аспекте количество молекул препарата, которые могут быть присоединены к агенту, связывающемуся с клеткой, может быть равно в среднем от приблизительно 2 до приблизительно 8 (например, 1,9, 2,0, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3,0, 3,1, 3,2, 3,3, 3,4, 3,5, 3,6, 3,7, 3,8, 3,9, 4,0, 4,1, 4,2, 4,3, 4,4, 4,5, 4,6, 4,7, 4,8, 4,9, 5,0, 5,1, 5,2, 5,3, 5,4, 5,5, 5,6, 5,7, 5,8, 5,9, 6,0, 6,1, 6,2, 6,3, 6,4, 6,5, 6,6, 6,7, 6,8, 6,9, 7,0, 7,1, 7,2, 7,3, 7,4, 7,5, 7,6, 7,7, 7,8, 7,9, 8,0, 8,1). Могут использоваться N2’-деацетил-N2’-(3-меркапто-1-оксопропил)-майтансин (DM1) и N2’-деацетил-N2’-(4-меркапто-4-метил-1-оксопентил) майтансин (DM4).
[0214] Таким образом, в одном аспекте иммуноконъюгат содержит 1 майтансиноид на антитело. В другом аспекте иммуноконъюгат содержит 2 майтансиноида на антитело. В другом аспекте иммуноконъюгат содержит 3 майтансиноида на антитело. В другом аспекте иммуноконъюгат содержит 4 майтансиноида на антитело. В другом аспекте иммуноконъюгат содержит 5 майтансиноидов на антитело. В другом аспекте иммуноконъюгат содержит 6 майтансиноидов на антитело. В другом аспекте иммуноконъюгат содержит 7 майтансиноидов на антитело. В другом аспекте иммуноконъюгат содержит 8 майтансиноидов на антитело.
[0215] В одном аспекте иммуноконъюгат содержит от примерно 1 до примерно 8 майтансиноидов на антитело. В другом аспекте иммуноконъюгат содержит от примерно 2 до примерно 7 майтансиноидов на антитело. В другом аспекте иммуноконъюгат содержит от примерно 2 до примерно 6 майтансиноидов на антитело. В другом аспекте иммуноконъюгат содержит от примерно 2 до примерно 5 майтансиноидов на антитело. В другом аспекте иммуноконъюгат содержит от примерно 3 до примерно 5 майтансиноидов на антитело. В другом аспекте иммуноконъюгат содержит от примерно 3 до примерно 4 майтансиноидов на антитело.
[0216] В одном аспекте в композиции, содержащей иммуноконъюгаты, содержится в среднем от приблизительно 2 до приблизительно 8 (например, 1,9, 2,0, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3,0, 3,1, 3,2, 3,3, 3,4, 3,5, 3,6, 3,7, 3,8, 3,9, 4,0, 4,1, 4,2, 4,3, 4,4, 4,5, 4,6, 4,7, 4,8, 4,9, 5,0, 5,1, 5,2, 5,3, 5,4, 5,5, 5,6, 5,7, 5,8, 5,9, 6,0, 6,1, 6,2, 6,3, 6,4, 6,5, 6,6, 6,7, 6,8, 6,9, 7,0, 7,1, 7,2, 7,3, 7,4, 7,5, 7,6, 7,7, 7,8, 7,9, 8,0, 8,1) молекул препарата (например, майтансиноидов), присоединенных к антителу. В одном аспекте в композиции, содержащей иммуноконъюгаты, содержится в среднем от приблизительно 1 до приблизительно 8 молекул препарата (например, майтансиноидов) на антитело. В одном аспекте в композиции, содержащей иммуноконъюгаты, содержится в среднем от приблизительно 2 до приблизительно 7 молекул препарата (например, майтансиноидов) на антитело. В одном аспекте в композиции, содержащей иммуноконъюгаты, содержится в среднем от приблизительно 2 до приблизительно 6 молекул препарата (например, майтансиноидов) на антитело. В одном аспекте в композиции, содержащей иммуноконъюгаты, содержится в среднем от приблизительно 2 до приблизительно 5 молекул препарата (например, майтансиноидов) на антитело. В одном аспекте в композиции, содержащей иммуноконъюгаты, содержится в среднем от приблизительно 3 до приблизительно 5 молекул препарата (например, майтансиноидов) на антитело. В одном аспекте в композиции, содержащей иммуноконъюгаты, содержится в среднем от приблизительно 3 до приблизительно 4 молекул препарата (например, майтансиноидов) на антитело.
[0217] В одном аспекте в композиции, содержащей иммуноконъюгаты, содержится в среднем приблизительно 2±0,5, приблизительно 3±0,5, приблизительно 4±0,5, приблизительно 5±0,5, приблизительно 6±0,5, приблизительно 7±0,5 или приблизительно 8±0,5 молекул препарата (например, майтансиноидов), присоединенных к антителу. В одном аспекте в композиции, содержащей иммуноконъюгаты, содержится в среднем приблизительно 3,5±0,5 молекул препарата (например, майтансиноидов) на антитело.
[0218] Антитело против CD37 или его фрагмент могут быть модифицированы при взаимодействии антитела против CD37 или его фрагмента с бифункциональным перекрестносшивающим реагентом, образуя ковалентно связанную молекулу линкера с антителом против CD37 или его фрагментом. При использовании здесь термин «бифункциональный перекрестносшивающий реагент» - любой химический фрагмент, который ковалентно соединяет агент, соединяющийся с клеткой, с препаратом, например, препаратом, описанным здесь. В другом способе часть связывающего фрагмента предоставляется препаратом. В этой связи препарат содержит связывающий фрагмент, являющийся частью большей молекулы линкера, который используется для сочленения агента, соединяющегося с клеткой, с препаратом. К примеру, для образования майтансиноида DM1, боковая цепь С-3-гидроксильной группы майтансина модифицируется таким образом, чтобы в ней содержалась свободная сульфгидрильная группа (SH). Данная тиолированная форма майтансина может взаимодействовать с модифицированным агентом, связывающимся с клеткой, с образованием конъюгата. Таким образом, в итоге линкер состоит из двух компонентов: одного, предоставленного перекрестносшивающим реактивом, и второго, предоставленного боковой цепью DM1.
[0219] Молекулы препаратов также могут быть связаны с молекулами антител через промежуточную молекулу-носителя, например, альбумина сыворотки.
[0220] При использовании здесь выражение «связанный с агентом, соединяющимся с клеткой» или «связанный с антителом против CD37 или его фрагментом» относится к конъюгатной молекуле, содержащей по меньшей мере одно производное препарата, связанное с агентом, соединяющимся с клеткой, антителом против CD37 или его фрагментом через подходящую сшивающую группу или ее прекурсор. Одна сшивающая группа - SMCC.
[0221] В определенных вариантах воплощения цитотоксические агенты, использующиеся в настоящем изобретении, - майтансиноиды и аналоги майтансиноидов. Примеры подходящих майтансиноидов включают сложные эфиры майтансинола и аналоги майтансинола. Также включены любые препараты, ингибирующие образование микротрубочек, высокотоксичные для клеток млекопитающих, такие как майтансинол и его аналоги.
[0222] Примерами подходящих сложных эфиров майтансинола служат эфиры с модифицированным ароматическим кольцом и эфиры с модификациями в других позициях. Такие подходящие майтансиноиды описаны в патентах США под номерами 4424219, 4256746, 4294757, 4307016, 4313946, 4315929, 4331598, 4361650, 4362663, 4364866, 4450254, 4322348, 4371533, 5208020, 5416064, 5475092, 5585499, 5846545, 6333410, 7276497 и 7473796.
[0223] В определенном варианте воплощения в иммуноконъюгатах по настоящему изобретению в качестве цитотоксического агента используется тиолсодержащий майтансиноид (DM1), который по номенклатуре называется N-деацетил-N-(3-меркапто-1-оксопропил)-майтансином. DM1 имеет следующую структурную формулу (III):
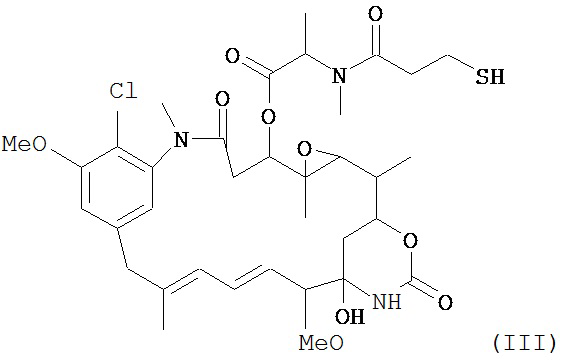
[0224] В ином варианте воплощения в конъюгатах по настоящему изобретению в качестве цитотоксического агента используется N2’-деацетил-N2’(4-метил-4-меркапто-1-оксопентил)-майтансин (например, DM4). DM4 имеет следующую структурную формулу (IV):
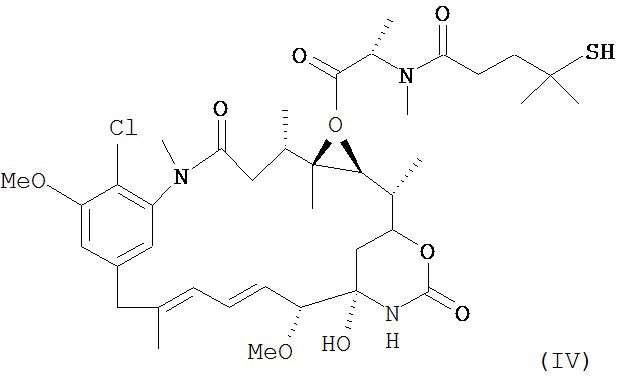
[0225] Иным майтансиноидом, содержащим боковую цепь со стерической тиоловой связью, является N2’-деацетил-N2’(4-меркапто-1-оксопентил)-майтансин (называемый DM3), обладающий следующей структурной формулой (V):
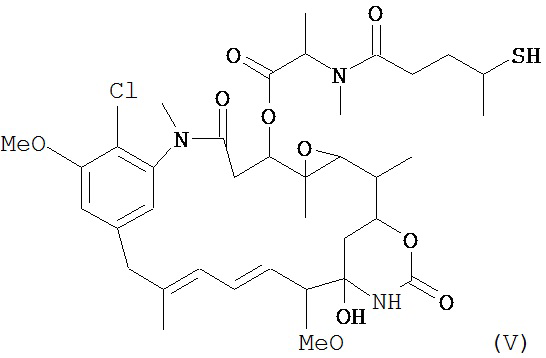
[0226] Любой майтансиноид, описанный в патентах США под номерами 5208020 и 7276497, может использоваться в конъюгате по настоящему изобретению. В этой связи раскрытие 5208020 и 7276697 полностью включено в настоящий документ путем ссылки.
[0227] Множество положений в майтансиноидах может служить для химического связывания с линкером. К примеру, ожидается, что подходящим будет положение С-3 с гидроксильной 15 группой, положение C-14, модифицированное гидроксиметильной группой, положение С-15, модифицированное гидроксильной группой, и положение С-20 с гидроксильной группой. В некоторых вариантах воплощения положение C-3 служит положением для химического связывания связывающей группы, а в некоторых вариантах воплощения положение С-3 майтансинола служит положением для химического связывания связывающей группы.
[0228] Структуры некоторых конъюгатов показаны ниже:
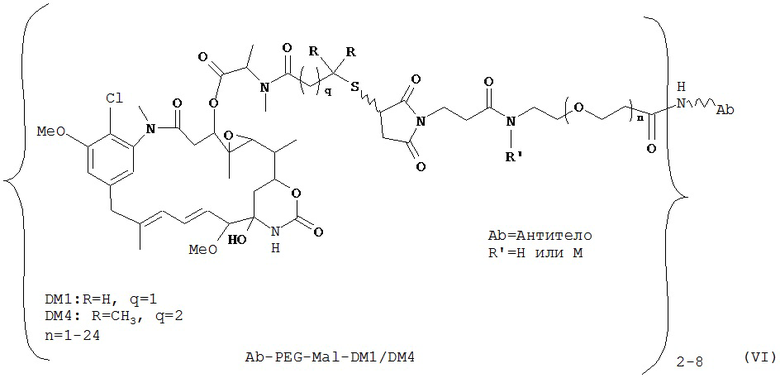
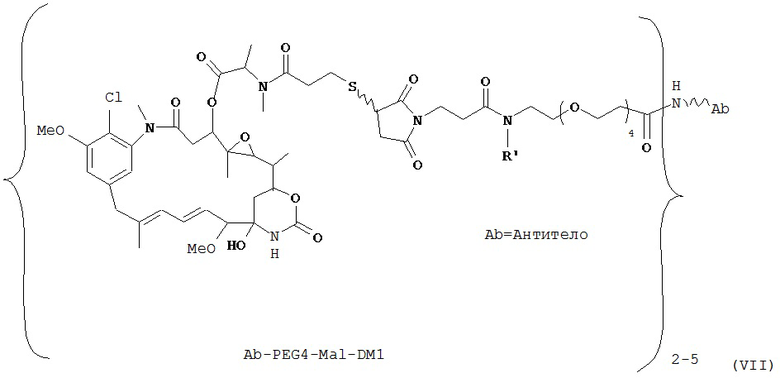
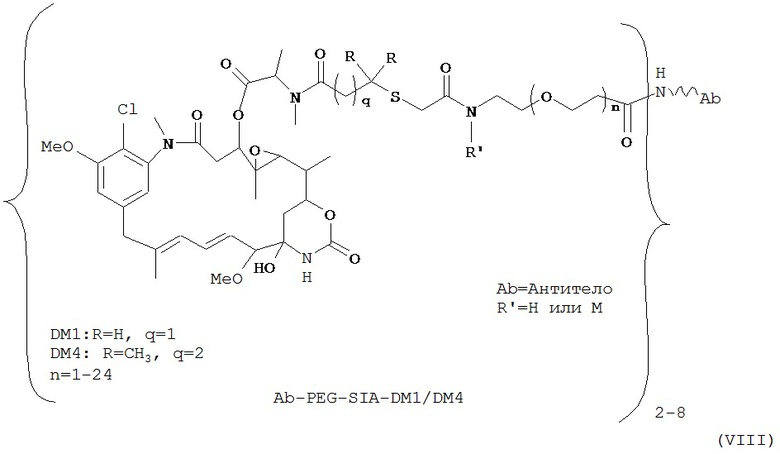
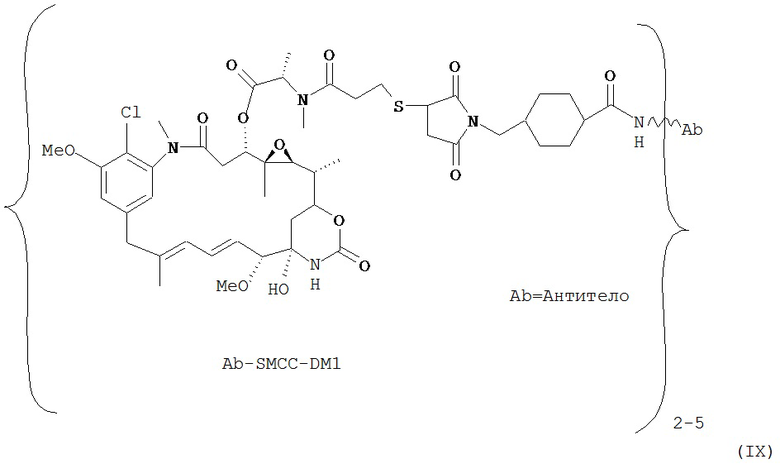
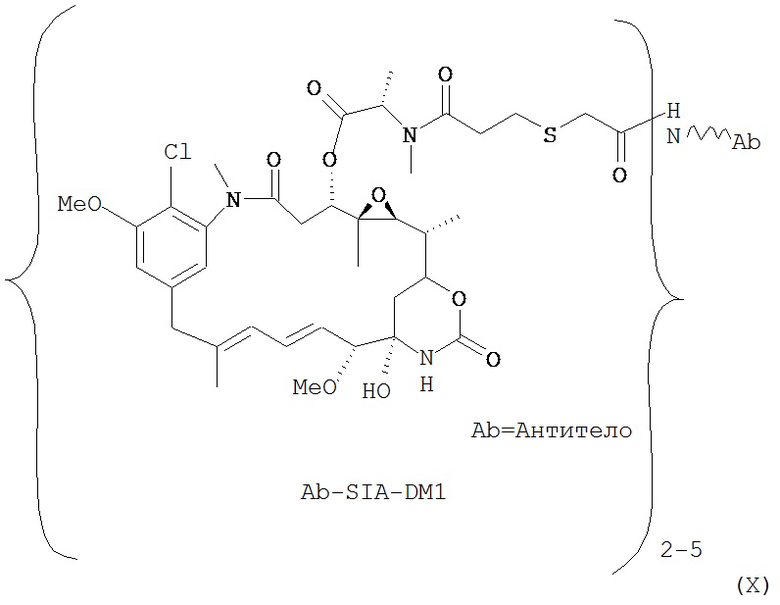
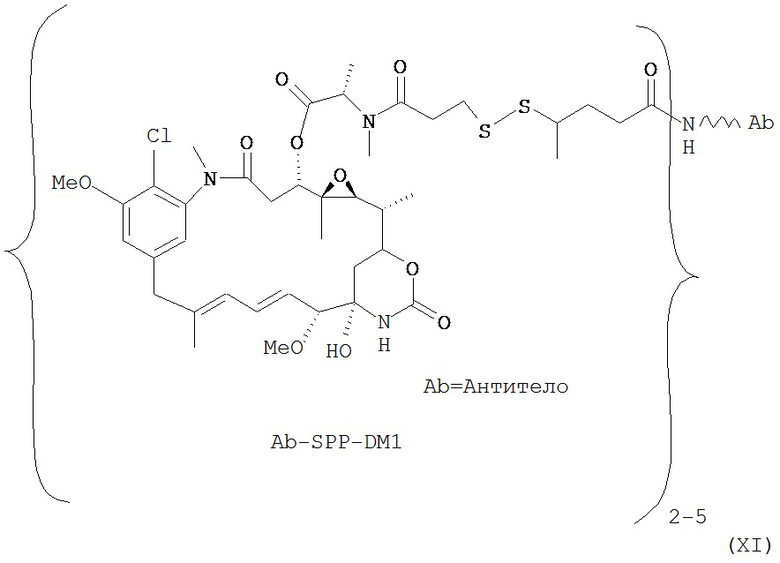
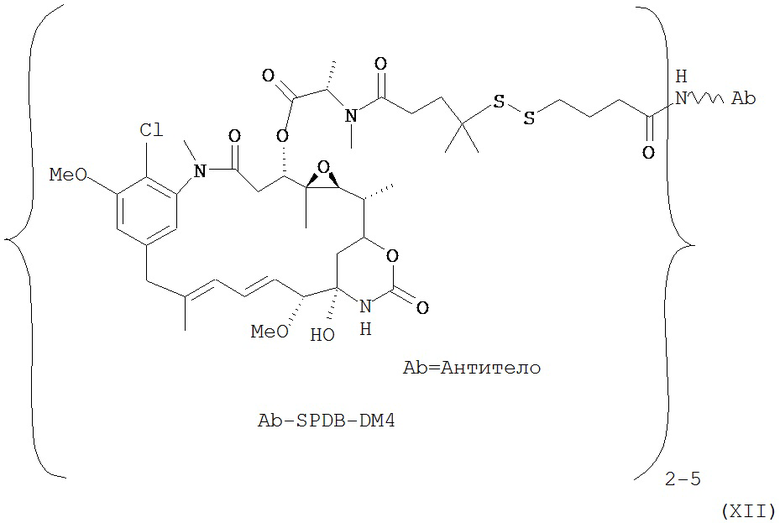
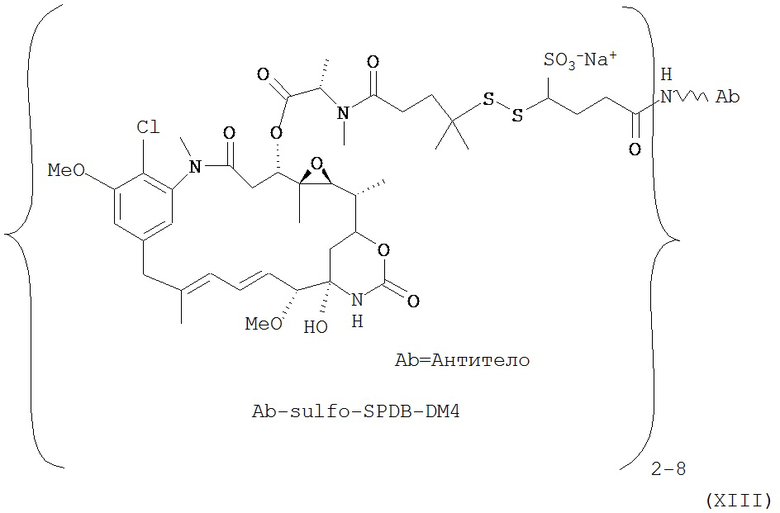
[0229] Ряд описаний получения подобных конъюгатов антитело-майтансиноид представлен в патентах США под номерами 6333410, 6441163, 6716 821 и 7368565, каждый из которых включен в настоящий документ во всей полноте.
[0230] В общем раствор антитела в водном буфере может быть инкубирован с молярным избытком майтансиноидов с дисульфидной группой, несущей реактивную группу. Реакция может быть остановлена добавлением избытка амина (например, этаноламина, таурина и т.д.). Конъюгат майтансиноид-антитело затем может быть очищен гель-фильтрацией.
[0231] Число молекул майтансиноида, связавшихся с молекулой антитела, может быть определено спектрофотометрическим измерением соотношения абсорбции на 252 нм и 280 нм. Среднее количество молекул майтансиноида/антитело может составлять, к примеру, приблизительно 1-10, 2-5, 3-4 или приблизительно 3,5. В одном аспекте среднее количество молекул майтансиноида/антитело равно приблизительно 3,5±0,5.
[0232] Антрациклиновые соединения, а также их производные, интермедиаты и модифицированные версии также могут использоваться для приготовления иммуноконъюгатов против CD37. К примеру, в конъюгатах против CD37 могут использоваться доксорубицин, производные доксорубицина, интермедиаты доксорубицина и модифицированные доксорубицины. Примеры соединений описаны в WO 2010/009124, который включен в настоящий документ посредством ссылки во всей полноте. Подобные соединения включают, к примеру, соединения следующей формулы:
 ,
,
где R1 - атом водорода, гидроксильная или метоксильная группа, a R2 - C1-C3 алкокси-группа либо их фармацевтически приемлемая соль.
[0233] Конъюгаты антител с майтансиноидными или иными препаратами могут быть оценены на их способность подавлять пролиферацию различных нежелательных клеток in vitro. К примеру, для оценивания цитотоксичности данных соединений с легкостью могут использоваться клеточная линия человеческой лимфомы Daudi и клеточная линия человеческой лимфомы Ramos. Исследуемые клетки могут быть подвергнуты воздействию веществ в течение 4-5 дней, выжившие фракции клеток измеряют прямым анализом известными способами. Затем по данным анализов могут быть вычислены величины IC50.
[0234] В некоторых вариантах воплощения описанных здесь, иммуноконъюгаты могут быть интернализированы внутрь клеток. Иммуноконъюгат, таким образом, может проявлять терапевтический эффект при захвате или интернализации клеткой, экспрессирующей CD37. В некоторых конкретных вариантах воплощения иммуноконъюгат содержит антитело, фрагмент антитела или полипептид, соединенные с цитотоксическим агентом через расщепляемый линкер, и цитотоксический агент отщепляется от антитела, фрагмента антитела или полипептида при интернализации клеткой, экспрессирующей CD37.
[0235] В некоторых вариантах воплощения иммуноконъюгаты способны уменьшать объем опухоли. К примеру, в некоторых вариантах воплощения обработка иммуноконъюгатом приводит к величине % T/C, которая составляет менее чем приблизительно 50%, менее чем приблизительно 45%, менее чем приблизительно 40%, менее чем приблизительно 35%, менее чем приблизительно 30%, менее чем приблизительно 25%, менее чем приблизительно 20%, менее чем приблизительно 15%, менее чем приблизительно 10% или менее чем приблизительно 5%. В ряде отдельных воплощений иммуноконъюгаты могут уменьшать объем опухоли в ксенотрансплантатной модели BJAB и/или ксенотрансплантатной модели SU-DHL-4.
[0236] В другом аспекте изобретения, вместо лекарственного препарата, с антителами по настоящему изобретению могут быть связаны молекулы миРНК. миРНК может быть связана с антителами по настоящему изобретению способами, обычно используемыми для модифицирования олигонуклеотидов (см., к примеру, патентные публикации США 20050107325 и 20070213292). Таким образом, миРНК в 3'- или 5'-фосфорамидитных формах может взаимодействовать с одним концом перекрестносшивающего линкера, несущим гидроксильную группу, с образованием сложноэфирной связи между миРНК и перекрестносшивающим линкером. Аналогично взаимодействие миРНК в фосфорамидитной форме с перекрестносшивающим линкером с терминальной аминогруппой приводит к связыванию перекрестносшивающего линкера с миРНК через аминную связь. Альтернативно миРНК может быть замещена стандартными химическими способами с введением тиоловой группы. Подобная тиол-содержащая миРНК может взаимодействовать с антителом, которое было модифицировано введением активного дисульфидного или малеимидного фрагмента, с образованием расщепляемого или нерасщепляемого конъюгата. Данным способом с антителом может связаться 1-20 молекул миРНК.
III. Полинуклеотиды
[0237] В определенных вариантах воплощения изобретение охватывает полинуклеотиды, которые кодируют полипептид, специфически связывающийся с CD37 или фрагментом этого полипептида. К примеру, в изобретении предлагается полинуклеотид, содержащий нуклеиновую последовательность, кодирующую антитело к человеческому CD37 или фрагмент такого антитела. Полинуклеотиды по изобретению могут быть в виде РНК или ДНК. ДНК включает кДНК, геномную ДНК и синтетическую ДНК и может быть двуцепочечной или одноцепочечной, в последнем случае цепочка может быть кодирующей или некодирующей (антисмысловой).
[0238] В определенных вариантах воплощения полинуклеотиды изолированы. В определенных вариантах воплощения полинуклеотиды в значительной степени очищены.
[0239] В изобретении предлагается полинуклеотид, содержащий полинуклеотид, кодирующий последовательность, выбранную из группы, состоящей из SEQ ID NOs:4-120.
[0240] Помимо этого, в изобретении предлагается полинуклеотид, содержащий последовательность, выбранную из последовательностей, показанных в Таблицах 7-10 ниже.
[0241] Также предлагается полинуклеотид с по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% либо с по меньшей мере 99% идентичностью последовательности с SEQ ID NOs:121-170. Таким образом, в определенных вариантах воплощения полипептид содержит (а) полипептид с по меньшей мере 95%-й идентичностью последовательности с SEQ ID NOs:121-135 или 152-161; и/или (б) полипептид с по меньшей мере 95%-й идентичностью последовательности с SEQ ID NOs:136-151 или 162-170. В определенных вариантах воплощения полипептид содержит (а) полипептид с аминокислотной последовательностью SEQ ID NOs: 121-135 или 152-161; и/или (б) полипептид с аминокислотной последовательностью SEQ ID NOs: 136-151 или 162-170.
[0242] В некоторых вариантах воплощения полинуклеотид кодирует легкую цепь, кодируемую рекомбинантной плазмидной ДНК phuCD37-3LC (депонент АТСС номер РТА-10722, депонированный АТСС 18 марта 2010), или легкую цепь, которая по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 99% идентична легкой цепи, кодируемой phuCD37-3LC (РТА-10722). В некоторых вариантах воплощения полинуклеотид кодирует тяжелую цепь, кодируемую рекомбинантной плазмидной ДНК phuCD37-3HCv.l.O (депозит АТСС номер РТА-10723, депонированный АТСС 18 марта 2010), или тяжелую цепь, которая по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 99% идентична тяжелой цепи, кодируемой phuCD37-3HCv.l.O (РТА-10723). В определенных вариантах воплощения полинуклеотид является рекомбинантной плазмидной ДНК phuCD37-3LC (РТА-10722) или рекомбинантной плазмидой phuCD37-3HCv.l.O (РТА-10723).
[0243] В определенных вариантах воплощения полинуклеотиды содержат кодирующую последовательность зрелого полипептида, слитого в одной рамке считывания с полинуклеотидом, способствующим, к примеру, экспрессии и секреции полипептида из клетки-хозяина (например, с лидерной последовательностью, которая работает в качестве секреторной последовательности для контролируемого транспорта полипептида из клетки). Полипептид с лидерной последовательностью - белок-предшественник и может обладать лидерной последовательностью, отщепляемой клеткой-хозяином от зрелой формы полипептида. Полинуклеотиды также могут кодировать пропротеин, который представляет собой зрелый белок с дополнительными 5'-аминокислотными остатками. Зрелый белок с пропоследовательностью - пропротеин, являющийся неактивной формой протеина. При отщеплении пропоследовательности остается зрелый активный белок.
[0244] В определенных вариантах воплощения полинуклеотиды содержат кодирующую последовательность зрелого полипептида, слитого в одной рамке считывания с маркерной последовательностью, способствующей, к примеру, очистке кодируемого полипептида. К примеру, в случае бактериального хозяина маркерная последовательность может быть гексагистидиновым тегом от вектора pQE-9, предназначенным для очистки зрелого полипептида, слитого с маркером, а в случае использования в качестве хозяев клеток млекопитающих (например, клеток COS-7) маркерная последовательность может быть гемагглютининовым тегом (НА), полученным из гемагглютинина вируса гриппа.
[0245] Настоящее изобретение, помимо этого, относится к вариантам описанных выше полинуклеотидов, кодирующих, к примеру, фрагменты, аналоги и производные.
[0246] Полинуклеотидные варианты могут содержать изменения в кодирующих областях, некодирующих областях или в обоих типах областей. В некоторых вариантах воплощения полинуклеотидные варианты содержат изменения, которые приводят к молчащим заменам, вставкам или делециям, не влияющим на свойства или активность кодируемого полипептида. В некоторых вариантах воплощения нуклеотидные варианты продуцируются молчащими заменами, обусловленными вырожденностью генетического кода. Полинуклеотидные варианты могут быть получены по множеству причин, например, для оптимизации экспрессии кодонов у конкретного хозяина (изменение кодонов человеческой мРНК на те, которые предпочтительны для бактериального хозяина типа Е.coli).
[0247] Также предлагаются векторы и клетки, содержащие описанные здесь полинуклеотиды.
IV. Способы применения и фармацевтические композиции
[0248] CD37-связывающие агенты (включая антитела, иммуноконъюгаты и полипептиды) по изобретению пригодны для использования во множестве приложений, включая, но не ограничиваясь перечисленным, терапевтические способы, такие как лечение рака, в том числе В-клеточных злокачественных опухолей. В определенных вариантах воплощения агенты полезны для ингибирования роста опухоли, включая стимулирование дифференциации, уменьшение объема опухоли и/или уменьшение опухолегенности опухоли. Используемые способы могут быть способами in vitro, ex vivo или in vivo. В определенных вариантах воплощения CD37-связывающий агент или антитело, или иммуноконъюгат, или полипептид являются антагонистами к человеческому CD37, с которым они связываются.
[0249] В одном аспекте антитела против CD37 и иммуноконъюгаты по изобретению полезны для определения присутствия CD37 в биологическом образце. Термин «детектирование», при использовании здесь, охватывает качественное или количественное детектирование. В определенных вариантах воплощения биологический образец содержит клетку или ткань. В определенных вариантах воплощения подобные ткани включают нормальные и/или раковые ткани, которые экспрессируют CD37 в большей степени, нежели другие ткани, к примеру, В-клетки и/или ткани, ассоциированные с В-клетками.
[0250] В одном аспекте в изобретении предлагается способ определения присутствия CD37 в биологическом образце. В определенных вариантах воплощения способ включает контактирование биологического образца и антитела против CD37 в условиях, позволяющих связывание антитела против CD37 с CD37, и детектирование образования комплекса между антителом против CD37 и CD37.
[0251] В одном аспекте в изобретении предлагается способ диагностирования нарушения, ассоциированного с повышенной экспрессией CD37. В определенных вариантах воплощения способ содержит контактирование тестируемой клетки с антителом против CD37, определение уровня экспрессии (количественно или качественно) CD37 тестируемой клеткой путем определения связывания антитела против CD37 с CD37, и сравнивание уровня экспрессии CD37 тестируемой клеткой с уровнем экспрессии CD37 контрольной клеткой (например, нормальной клеткой из той же ткани, что и тестируемая клетка, или клеткой, экспрессирующей CD37 на уровнях, сравнимых с нормальными клетками), причем больший уровень экспрессии CD37 тестируемой клеткой относительно контрольной клетки свидетельствует о наличии нарушения, связанного с повышенной экспрессией CD37. В определенных вариантах воплощения тестируемая клетка получена от субъекта, у которого подозревается нарушение, связанное с повышенной экспрессией CD37. В определенных вариантах воплощения нарушение является клеточным пролиферативным нарушением, например, раком или опухолью.
[0252] В определенных вариантах воплощения способ диагностики или детектирования, например, описанный выше, содержит детектирование связывания антитела против CD37 с CD37, экспрессируемым на поверхности клетки или содержащимся в препарате мембраны, полученном из клетки, экспрессирующей CD37 на ее поверхности. В определенных вариантах воплощения способ включает контактирование клетки и антитела против CD37 в условиях, позволяющих связывание антитела против CD37 с CD37, и детектирование образования комплекса между антителом против CD37 и CD37 на клеточной поверхности. Пример анализа, предназначенного для детектирования связывания антитела против CD37 с CD37, экспрессируемым на поверхности клетки, - анализ «FACS».
[0253] Для детектирования связывания антител против CD37 с CD37 могут использоваться и другие способы. Подобные способы включают, не ограничиваясь перечисленным, анализы связывания антигенов, хорошо известные в данной области техники, например, вестерн-блоттинг, радиоиммунологические анализы, ELISA (энзим-связанный иммуносорбентный анализ), «сандвич»-иммуноанализы, анализы иммунопреципитации, флуоресцентные иммуноанализы, иммуноанализы с протеином A и иммуногистохимический способ (IHC).
[0254] В определенных вариантах воплощения антитела против CD37 помечены. Метки включают, не ограничиваясь перечисленным, метки или фрагменты, которые детектируются непосредственно (например, флуоресцентные, хромофорные, электронноплотные, хемилюминесцентные и радиоактивные), а также фрагменты, например, ферменты или лиганды, которые детектируются косвенно, например, посредством ферментной реакции или молекулярного взаимодействия.
[0255] В определенных вариантах воплощения антитела против CD37 иммобилизированы на нерастворимом матриксе. Иммобилизация приводит к отделению антитела против CD37 от любого CD37, остающегося свободным в растворе. Как правило, это осуществляется либо переведением антитела против CD37 в нерастворимую форму перед анализом, либо адсорбцией на водонерастворимом матриксе или поверхности (Bennich et al., Патент США №3720760), либо ковалентным спариванием (к примеру, с использованием глутаральдегидного перекрестного сшивания), либо переведением антитела против CD37 в нерастворимую форму после образования комплекса антитела против CD37 и CD37, например, иммунопреципитацией.
[0256] Любое из перечисленных выше воплощений диагностики или детектирования может осуществляться с использованием иммуноконъюгата по изобретению вместо антитела против CD37 или вместе с ним.
[0257] В определенных вариантах воплощения заболевание, которое подвергается терапии с CD37-связывающим агентом или антагонистом (например, антителом против CD37) - онкологическое заболевание. В определенных вариантах воплощения онкологическое заболевание характеризуется наличием CD37-экспрессирующих клеток, с которыми связывается CD37-связывающий агент (например, антитело).
[0258] В настоящем изобретении предлагаются способы терапии онкологического заболевания, включающие введение терапевтически эффективного количества CD37-связывающего агента субъекту (например, субъекту, нуждающемуся в терапии). В некоторых вариантах воплощения онкологическое заболевание является В-клеточной злокачественной опухолью. В определенных вариантах воплощения онкологическое заболевание выбрано из группы, включающей В-клеточные лимфомы, НХЛ, прекурсорные В-клеточные лимфобластные лейкемию/лимфому и неоплазмы зрелых В-клеток, В-клеточную хроническую лимфоцитную лейкемию (ХЛЛ)/мелкоклеточную лимфоцитарную лимфому (МЛЛ), В-клеточную пролимфоцитную лейкемию, лимфоплазмацитную лимфому, лимфому клеток мантийной зоны (ЛКМЗ), фолликулярную лимфому (ФЛ), включая высокодифференцированную, среднедифференцированную и низкодифференцированную ФЛ, кожную центрально-фолликулярную лимфому, В-клеточную лимфому маргинальной зоны, В-клеточную лимфому маргинальной зоны MALT-типа, В-клеточную лимфому маргинальной зоны узлового типа, В-клеточную лимфому маргинальной зоны селезеночного типа, волосатоклеточный лейкоз (ВКЛ), диффузную В-крупноклеточную лимфому, лимфому Беркитта, плазмацитому, плазмаклеточную миелому, посттрансплантационное лимфопролиферативное расстройство, макроглобулинемию Вальденстрема, а также анапластическую крупноклеточную лимфому (АККЛ). В некоторых вариантах воплощения субъект является человеком.
[0259] В настоящем изобретении, помимо этого, предлагаются способы ингибирования роста опухолей, в которых применяются антитела или иные агенты, описанные здесь. В определенных вариантах воплощения способ ингибирования роста опухоли включает контактирование клетки с CD37-связывающим агентом (например, антителом,) in vitro. К примеру, иммортализированная клеточная линия или линия раковых клеток, экспрессирующая CD37, культивируются в среде, к которой добавляются антитело или иной агент, ингибирующие рост опухоли. В некоторых вариантах воплощения опухолевые клетки выделены от такого образца, взятого у пациента, как, например, биоптат тканей, плевральная эффузия или образец крови, и культивированы в среде, к которой добавлен CD37-связывающий агент для ингибирования роста опухоли.
[0260] В некоторых вариантах воплощения способ ингибирования роста опухоли включает контактирование опухоли или опухолевых клеток с CD37-связывающим агентом (например, антителом) in vivo. В определенных вариантах воплощения контактирование опухоли или опухолевой клетки с CD37-связывающим агентом осуществляется в животной модели. К примеру, CD37-связывающие агенты могут вводиться в ксенотрансплантаты, экспрессирующие один или более CD37, выращенных у иммунокомпрометированных мышей (например, мышей NOD/ТКИН) для ингибирования роста опухоли. В некоторых вариантах воплощения раковые стволовые клетки выделены от такого образца, взятого у пациента, как, например, биоптат тканей, плевральная эффузия или образец крови, и введены иммунокопрометированным мышам, которым затем вводится CD37-связывающий агент для ингибирования роста клеток опухоли. В некоторых вариантах воплощения CD37-связывающий агент вводится одновременно или спустя небольшое время после введения опухолегенных клеток животному для предотвращения роста опухоли. В некоторых вариантах воплощения CD37-связывающий агент вводится в качестве терапевтического средства после того, как опухолегенные клетки доросли до определенного размера.
[0261] В определенных вариантах воплощения способ ингибирования роста опухоли включает введение субъекту терапевтически эффективного количества CD37-связывающего агента. В некоторых вариантах воплощения субъект является человеком. В некоторых вариантах воплощения у субъекта имеется опухоль либо субъект имел опухоль, которая была впоследствии удалена.
[0262] В определенных вариантах воплощения опухоль экспрессирует CD37, с которым связывается CD37-связывающий агент или антитело. В определенных вариантах воплощения опухоль избыточно экспрессирует CD37.
[0263] Помимо этого, в изобретении предлагается способ понижения опухолегенности опухоли у субъекта, включающий введение терапевтически эффективного количества CD37-связывающего агента субъекту. В определенных вариантах воплощения опухоль содержит раковые стволовые клетки. В определенных вариантах воплощения уровень раковых стволовых клеток в опухоли понижается при введении агента.
[0264] Помимо этого, в изобретении предлагаются способы дифференцирования опухолегенных клеток в неопухолегенные клетки, включающие контактирование опухолегенных клеток с CD37-связывающим агентом (к примеру, введение CD37-связывающего агента субъекту с опухолью, содержащей опухолегенные клетки, или субъекту, имевшему такую опухоль, которая была впоследствии удалена).
[0265] Также предлагается использование CD37-связывающих агентов, полипептидов или антител, описанных здесь, для индуцирования дифференциации клеток, включая опухолевые клетки, но не ограничиваясь ими. К примеру, предусматриваются способы индуцирования клеток для дифференциации, включающие контактирование клеток с эффективным количеством CD37-связывающего агента (например, антитела против CD37), описанного здесь. Также предлагаются способы индуцирования клеток опухоли у субъекта для дифференциации, включающие введение терапевтически эффективного количества CD37-связывающего агента, полипептида или антитела субъекту. В некоторых вариантах воплощения опухоль является опухолью поджелудочной железы. В других вариантах воплощения опухоль является опухолью толстого кишечника. В некоторых вариантах воплощения терапевтические способы содержат введение терапевтически эффективного количества CD37-связывающего агента, полипептида или антитела субъекту.
[0266] В настоящем изобретении, помимо этого, предлагаются фармацевтические композиции, содержащие один или более CD37-связывающих агентов, описанных здесь. В определенных вариантах воплощения фармацевтические композиции, помимо этого, содержат фармацевтически приемлемый носитель. Данные фармацевтические композиции применяются для ингибирования роста опухолей и лечения рака у людей.
[0267] В определенных вариантах воплощения композиции изготавливаются для хранения и применения путем комбинирования очищенного антитела или агента по настоящему изобретению с фармацевтически приемлемым носителем (например, средой, добавкой) (Remington, The Science and Practice of Pharmacy 20th Edition Mack Publishing, 2000). Подходящие фармацевтически приемлемые носители включают, не ограничиваясь перечисленным, нетоксичные буферы, например фосфатный, цитратный и на базе других органических солей; соли, например натрия хлорид; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (например, октадецилдиметилбензиламмония хлорид; гексаметония хлорид; бензалкония хлорид; бензетония хлорид; фенол, бутиловый или бензиловый спирт; алкилпарабены, например метил- или пропилпарабен; пирокатехин; резорцин; циклогексанол; 3-пентанол; и м-крезол); низкомолекулярные полипептиды (например, содержащие менее 10 аминокислотных остатков); белки, например альбумин сыворотки, желатин или иммуноглобулины; гидрофильные полимеры, например поливинилпирролидон; аминокислоты, например глицин, глутамин, аспарагин, гистидин, аргинин или лизин; углеводы, например моносахариды, дисахариды, глюкозу, маннозу или декстрины; хелатирующие агенты, например ЭДТА; сахара, например сахарозу, маннитол, трегалозу или сорбитол; солеобразующие противоионы, например натрий; комплексы металлов (например, комплексы Zn-белок); и неионные ПАВ, например TWEEN или полиэтиленгликоль (ПЭГ).
[0268] Фармацевтические композиции по настоящему изобретению могут вводиться любым количеством путей как для местной, так и для системной терапии. Введение может осуществляться местно (например, через слизистые оболочки, включая вагинальный и ректальный пути), например, трансдермальными пластырями, мазями, лосьонами, кремами, гелями, каплями, суппозиториями, спреями, жидкостями и порошками; через легкие (например, ингаляцией или инсуффляцией порошков или аэрозолей, включая небулайзеры; интратрахеально, интраназально, эпидермально и трансдермально); перорально; либо парентерально, включая внутривенное, внутриартериальное, подкожное, внутрибрюшинное или внутримышечное введения или инфузии; либо интракраниально (например, интратекально или интравентрикулярно).
[0269] Антитело или иммуноконъюгат по изобретению могут быть комбинированы в фармацевтической комбинированной композиции либо в режиме дозирования, например, в виде комбинированной терапии, со вторым соединением, обладающим противоопухолевыми свойствами. Второе соединение в фармацевтической комбинированной композиции или в режиме дозирования может обладать синергичным эффектом с конъюгатом антитело-препарат в комбинации, не влияя отрицательно друг на друга. Также предлагаются фармацевтические композиции, содержащие CD37-связывающий агент и второй противоопухолевый агент. К примеру, CD37-связывающие агенты могут вводиться в комбинации с CD20-антагонистами, например Ритуксимабом.
[0270] При лечении заболевания нужная доза антитела или агента по настоящему изобретению зависит от типа заболевания, от тяжести и течения заболевания, от чувствительности заболевания, от того, вводятся ли антитела или конъюгаты в профилактических или терапевтических целях, от предыдущей терапии, анамнеза пациента и ответа на лечение и т.д., а также от суждений лечащего врача. Антитело или агент могут вводиться однократно или несколько раз в течение периода времени от нескольких дней до нескольких месяцев или вплоть до излечения либо уменьшения выраженности заболевания (например, уменьшения размера опухоли). Оптимальные режимы дозирования могут быть рассчитаны, исходя из измерений аккумуляции препарата в организме пациента, и будут зависеть от относительной активности индивидуального антитела или агента. Лечащий врач может с легкостью определить оптимальные дозировки, принципы дозирования и частоту введений. В определенных вариантах воплощения дозировка находится в пределах 0,01 мкг-100 мг/кг массы тела, и препарат может вводиться один или более раз в день, неделю, месяц или год. В определенных вариантах воплощения антитело или иной CD37-связывающий агент вводится один раз в две недели или один раз в три недели. В определенных вариантах воплощения дозировка антитела или иного CD37-связывающего агента находится в пределах от приблизительно 0,1 мг до приблизительно 20 мг на кг массы тела. Лечащий врач может оценить частоту введений на основании измеренных времени выведения и концентраций препарата в тканях или жидкостях тела.
[0271] Комбинированная терапия может проявлять «синергию» и быть «синергической», то есть проявляться в том, что эффект при совместном использовании активных компонентов выше, чем эффект, оказываемый при раздельном использовании соединений. Синергический эффект может быть достигнут, если активные компоненты: (1) находятся в одной композиции и вводятся или доставляются одновременно в комбинированной единичной дозированной формуле; (2) доставляются чередованием или параллельным введением отдельных формул, либо (3) иным режимом. При чередующейся терапии синергический эффект может быть достигнут, если соединения вводятся или доставляются последовательно, например, различными инъекциями отдельными шприцами. В общем при чередующейся терапии эффективная доза каждого активного компонента вводится последовательно, например, серийно, в то время как при комбинированной терапии эффективные дозы двух или более активных компонентов вводятся совместно.
VI. Наборы, содержащие CD37-связывающие агенты
[0272] В настоящем изобретении предлагаются наборы, которые содержат антитела, иммуноконъюгаты или иные агенты, описанные здесь, и которые могут использоваться способами, описанными здесь. В определенных вариантах воплощения набор содержит по меньшей мере одно очищенное антитело против CD37 в одном или более контейнеров. В некоторых вариантах воплощения наборы содержат все компоненты, нужные и/или достаточные для проведения анализа детектирования, включая все контрольные образцы, указания по проведению анализов и любое ПО, необходимое для анализа и представления результатов. Специалист в данной области техники легко поймет, что предложенные по настоящему изобретению антитела, иммуноконъюгаты или иные агенты могут быть с легкостью встроены в один из установленных форматов наборов, хорошо известных в данной области техники.
[0273] Помимо этого, предлагаются наборы, содержащие CD37-связывающий агент (например, CD37-связывающее антитело), а также второй противоопухолевый агент. В определенных вариантах воплощения второй противоопухолевый агент является химиотерапевтическим агентом (например, ритуксимабом).
* * *
[0274] Варианты воплощения настоящего изобретения могут быть, помимо этого, определены ссылкой на следующие нелимитирующие примеры, в которых подробно описывается получение определенных антител по настоящему раскрытию и способы применения антител по настоящему раскрытию. Специалисту в данной области техники будет понятно, что может быть внесено множество изменений как в материалы, так и в способы без отклонения от объема настоящего изобретения.
Примеры
[0275] Следует понимать, что примеры и варианты воплощения, описанные здесь, предназначены лишь для иллюстративных целей и что множество модификаций или изменений, предложенных специалистами в данной области техники, соответствуют духу и находятся в пределах охвата настоящей заявки.
Клеточные линии и рост
[0276] Все клеточные линии были выращены в среде RPMI-1640 с добавкой 10% фетальной бычьей сыворотки, 2 мМ глутамина и 1% пенициллин-стрептомицина (все реактивы от Invitrogen) при 37°C в инкубаторе с увлажненным 5% CO2. Клетки были пассированы разбавлением в свежую среду два раза в неделю, их численность поддерживали на уровне от 0,2 до 1×106 клеток/мл.
Пример 1
Получение мышиных антител против CD37
[0277] Была сконструирована плазмида экспрессии pSRa-CD37, содержащая целую кодирующую последовательность CD37 (CDS), фланкированную сайтами рестрикции Xbal и BamHI, позволяющими экспрессию человеческого CD37. Клетки 300-19 - пре-В-клеточная линия, полученная от мышей Balb/c (М.G.Reth et al. 1985, Nature, 317; 353-355), - были подвергнуты трансфекции данной плазмидой экспрессии для стабильного экспрессирования высоких уровней человеческого CD37 на клеточной поверхности и использовались для иммунизации мышей Balb/c VAF. Мыши были иммунизированы подкожно при помощи примерно 5x106 CD37-экспрессирующих клеток 300-19 на мышь каждые 2-3 недели согласно стандартным протоколам иммунизации, используемым в ImmunoGen, Inc. Иммунизированные мыши были подвергнуты бустингу другой дозой антигена за три дня до умерщвления для получения гибридомы. Селезенки мышей были собраны согласно стандартным протоколам по работе с животными, и они были перетерты между двумя стерильными замороженными микроскопными стеклами до получения отдельноклеточной суспензии в среде RPMI-1640. Клетки селезенки были центрифугированы, осадок был отделен, промыт и соединен с клетками миеломы мыши, например, P3X63Ag8.653 (J.F.Kearney et al., J Immunol, 123: 1548-1550) с использованием полиэтиленгликоля-1500 (Roche 783 641). Слитые клетки были ресуспендированы в селекционной среде RPMI-1640, содержащей гипоксантин-аминоптерин-тимидин (HAT) (Sigma Н-0262), и селектированы по росту в 96-луночных культуральных планшетах с плоским дном (Corning-Costar 3596, 200 мкл клеточной суспензии на лунку) при 37°C с 5% С02. Спустя 5 дней инкубации 100 мкл супернатанта культуры были извлечены из каждой лунки и заменены на 100 мкл среды RPMI-1640, содержащей добавку гипоксантинна-тимидина (НТ) (Sigma Н-0137). Инкубирование при 37°С с 5% С02 продолжалось до тех пор, пока клоны гибридомы не были готовы для скрининга антител. Также могут использоваться иные методики иммунизации и получения антител, включая те, которые описаны в J.Langone, Н.Vunakis (Eds., Methods in Enzymology, Vol.121, "Immunochemical Techniques, Part I"; Academic Press, Florida) и E. Harlow, D.Lane ("Antibodies: A Laboratory Manual"; 1988; Cold Spring Harbor Laboratory Press, New York).
Скрининг и селекция гибридом
[0278] Супернатанты культур гибридомы были подвергнуты скринингу методом проточной цитометрии на предмет секреции мышиных моноклональных антител, связывающихся с CD37-экспрессирующими клетками 300-19, но не с нетрансфицированными клетками 300-19. 100 мкл супернатанта гибридомы было инкубировано 3 ч с либо CD37-экспрессирующими клетками 300-19, либо с нетрансфицированными клетками 3 00-19 (1×105 клеток в образце) в 100 мкл буфера FACS (среда RPMI-1640 с добавкой 2% нормальной козьей сыворотки). Затем клетки были осаждены, промыты и инкубированы 1 ч с 100 мкл РЕ-конъюгированных козьих анти-мышиных IgG-антител (например, доступны в продаже у Jackson Laboratory, 6 мкг/мл в буфере FACS). Клетки были вновь осаждены, промыты буфером FACS и ресуспендированы в 200 мкл фосфатно-солевого буфера, содержащего 1% формальдегида. Образцы были собраны при помощи проточного цитометра FACSCalibur с многолуночным сэмплером HTS или матричного проточного цитометра FACS и проанализированы при помощи CellQuest Pro (все оборудование от BD Biosciences, Сан-Диего, США).
[0279] Клоны, положительные по гибридоме, были субклонированы ограниченным разведением. Для последующего анализа было выбрано по одному субклону каждой гибридомы, обладавшему такой же реактивностью против CD37, как и родительские клетки, согласно проточной цитометрии. Стабильные субклоны были культивированы, изотип каждого секретируемого антитела против CD37 определялся при помощи изотипирующих реагентов, доступных в продаже (Roche 1493027).
[0280] Во время данного исследования было проведено 45 отдельных экспериментов по сплавлению. Каждый эксперимент по сплавлению давал, как правило, приблизительно 200-1000 клонов гибридом. Все полученные клоны гибридом прошли скрининг на CD37-связывание при помощи проточной цитометрии, 184 клона гибридомы проявляли специфическое связывание с CD37.
Выделение антител
[0281] Антитела были выделены из субклоновых супернатантов гибридомы с использованием стандартных методов, например хроматографии с протеином А или G (HiTrap Protein А или G HP, 1 мл, Amersham Biosciences). Вкратце, супернатант был подготовлен для хроматографии путем добавления 1/10 объема 1 М Трис/HCl буфера, рН 8,0. рН-скорректированный супернатант был профильтрован через фильтровальную мембрану 0,22 мкм и загружен в колонку, уравновешенную связывающим буфером (фосфатно-солевой буфер, рН 7,3). Колонка была промыта связывающим буфером до достижения стабильного уровня фона без абсорбции на 280 нм. Антитела были элюированы 0,1 М буфером с уксусной кислотой, содержащим 0,15 М NaCl, рН 2,8, на скорости потока 0,5 мл/мин. Фракции объемом приблизительно 0,25 мл были собраны и нейтрализованы путем добавления 1/10 объема 1М Трис/HCl, рН 8,0. Пиковая(ые) фракция(и) была диализирована в течение ночи дважды относительно 1х фосфатно-солевого буфера и стерилизована фильтрованием через 0,2 мкм фильтровальную мембрану. Количество антител определяли, судя по абсорбции на А280.
[0282] Фракции, очищенные с протеином A, были потом доочищены способами ионообменной хроматографии (IEX) и хроматографии с четвертичным аммонием (Q) для мышиных антител. Вкратце, образцы, очищенные с протеином A, были обменены в связывающем буфере (10 мМ Трис, 10 мМ натрия хлорида, рН 8,0) и профильтрованы через фильтр калибра 0,22 мкм. Подготовленный образец был затем загружен на смолу Q (GE Lifesciences), уравновешенную со связывающим буфером на потоке 120 см/ч. Размер колонки подбирался таким образом, чтобы связывать все моноклональные антитела в образце. Затем колонка была промыта связывающим буфером до достижения стабильного уровня фона без абсорбции на 280 нм. Антитела элюировали градиентом от 10 мМ до 500 мМ натрия хлорида в количестве 20 объемов колонки (ОК). Пиковые фракции собирали, основываясь на измерениях абсорбции на 280 нм (А280). Процентное количество мономера оценивалось эксклюзионной хроматографией (SEC) на геле TSK G3000SWXL в колонке 7,8x300 мм с предохранительной колонкой SWXL 6,0x40 мм (Tosoh Bioscience, Монтгомеривилль, Пенсильвания) с использованием ВЭЖХ-системы Agilent HPLC 1100 (Agilent, Санта-Клара, Калифорния). Фракции с содержанием мономера выше 95% были объединены, буфер был заменен на фосфатно-солевой буфер (рН 7,4), используя систему TFF, а затем стерилизованы фильтрованием через фильтр с мембраной 0,2 мкм. Концентрацию IgG в очищенных антителах определяли измерением абсорбции на А280 с коэффициентом затухания 1,47. Для доочистки антител также с хорошей селективностью применялись альтернативные методы, например очистка с керамическим гидроксиапатитом (СНТ). Смола СНТ II типа с размером частиц 40 мкм (Bio-Rad Laboratories) использовалась по методикам, аналогичным методикам, описанным для ионообменной хроматографии. Связывающий буфер для СНТ содержит 20 мМ натрия фосфата, имеет рН 7,0; антитела элюировали градиентом 20-160 мМ натрия фосфата в количестве 20 ОК.
Пример 2
Определение характеристик связывания способом проточной цитометрии
[0283] Специфичность связывания определялась способом проточной цитометрии с использованием очищенных антител. Диаграммы FACS, демонстрирующие связывание muCD37-3, muCD37-12, muCD37-38, muCD37-50, muCD37-51, muCD37-56 и muCD37-57 с CD37-экспрессирующими клетками 300-19 в отсутствие связывания с родительскими клетками 300-19, показаны на Фигуре 1 и Фигуре 2. Все мышиные антитела были инкубированы 3 ч с либо CD37-экспрессирующими клетками 300-19, либо нетрансфицированными клетками 3 00-19 (1x105 клеток в образце) в 100 мкл буфера FACS (среда RPMI-1640 с добавкой 2% нормальной козьей сыворотки). Затем клетки были осаждены, промыты и инкубированы 1 ч с 100 мкл FITC-конъюгированных козьих анти-мышиных IgG-антител (например, доступны в продаже у Jackson Laboratory, 6 мкг/мл в буфере FACS). Клетки были вновь осаждены, промыты буфером FACS и ресуспендированы в 200 мкл фосфатно-солевого буфера, содержащего 1% формальдегида. Образцы были собраны при помощи проточного цитометра FACSCalibur с многолуночным самплером HTS или матричного проточного цитометра FACS и проанализированы при помощи CellQuest Pro (все оборудование от BD Biosciences, Сан-Диего, США).
[0284] FACS-гистограммы CD37-экспрессирующих клеток 300-19, инкубированных с muCD37-3, muCD37-12, muCD37-38, muCD37-50, muCD37-51, muCD37-56 или muCD37-57, показали сдвиг флуоресценции, а родительские клетки 300-19 его не показали. Также при инкубировании любой из этих клеточной линий только с FITC-конъюгированным козьим антимышиным IgG-антителом существенного сдвига флуоресценции не наблюдалось (Фигура 1, внизу).
[0285] Чтобы удостовериться в том, что антитела также могут связываться с эндогенно экспрессируемым CD37, были проведены исследования связывания с CD37-положительными клетками лимфомы WSU-DLCL-2 и антителами muCD37-3, muCD37-12, muCD37-8, muCD37-10 или muCD37-14. Клетки WSU-DLCL-2 были инкубированы с различными концентрациями мышиных антител и обработаны так, как описано выше для анализа способом проточной цитометрии. Анализ данных проводился с использованием CellQuest Pro (BD Biosciences, Сан-Диего, США), для каждого образца снималась средняя интенсивность флуоресценции для FL1 (MFI), после чего строился полулогарифмический график ее зависимости от концентрации антитела (Фигура 3). Кривая зависимости эффекта от дозы была построена нелинейной регрессией, величины ЕС50 каждой кривой, соответствующие кажущейся константе диссоциации (Kd) каждого антитела, были рассчитаны при помощи GraphPad Prism v4 (GraphPad software, Сан-Диего, Калифорния). Для всех протестированных антител наблюдался выраженный сдвиг флуоресценции, величины Kd соответствуют 0,52 нМ, 1,7 нМ, 2,7 нМ, 1,1 нМ или 0,91 нМ для антител muCD37-3, muCD37-8, muCD37-10, muCD37-12 или muCD37-14, соответственно.
[0286] Аналогичным образом выраженное связывание наблюдалось при использовании CD37-положительных клеток лимфомы BJAB для такого же анализа способом проточной цитометрии, что и описанный выше. Величины Kd были рассчитаны так, как описано выше, и соответствовали 0,2 нМ, 0,4 нМ, 0,6 нМ, 0,4 нМ и 1 нМ для muCD37-3, muCD37-38, muCD37-50, muCD37-51, muCD37-56 и muCD37-57, соответственно.
Пример 3
Проапоптозная активность мышиных антител
[0287] Мышиные антитела против CD37 индуцировали апоптоз клеточных линий лимфом Ramos и Raji. Степень апоптоза измерялась проточной цитометрией после окрашивания FITC-конъюгатами Аннексина-V (Invitrogen) и TO-PRO-3 (Invitrogen). В нормальных здоровых клетках фосфатидилсерин экспрессируется на внутренней части мембранного бислоя, переход фосфатидилсерина из внутреннего в наружный слой плазматической мембраны - один из самых ранних детектируемых сигналов апоптоза. Аннексин-V связывает фосфатидилсерин наружного слоя, но не внутреннего бислоя мембраны целых клеток. Таким образом, степень связывания Аннексина-V - показатель индукции апоптоза. TO-PRO-3 - мономерный цианиновый краситель для нуклеиновых кислот, который может проникать через плазматическую мембрану только при нарушении ее целостности, что происходит на поздних стадиях апоптоза. На двухцветной проточной цитометрии различимы три популяции клеток: неапоптозные клетки (Аннексин-V отрицательные и TO-PRO-3 отрицательные), клетки на ранней стадии апоптоза (Аннексин-V положительные и TO-PRO-3 отрицательные) и некротические клетки, или клетки на поздней стадии апоптоза (Аннексин-V положительные и TO-PRO-3 положительные).
[0288] Экспоненциально растущие клетки были высеяны по примерно 2x105 клеток/мл на 24-луночные планшеты в среду RMPI-1640 с добавками 10% фетальной телячьей сыворотки (FBS), 2 мМ L-глутамина и 50 мкг/мл гентамицина (далее называемую полной средой RMPI-1640). Клетки выращивались в полной среде RMPI-1640, если не указано иное. Клетки были инкубированы с 10 нМ антител против CD37 20-24 ч при 37°С в инкубаторе с увлажненным 5% CO2. Затем клетки были осаждены, дважды промыты 500 мкл фосфатно-солевого буфера, ресуспендированы в 100 мкл связывающего буфера (10 мМ Hepes-NaOH, рН 7,4, 140 мМ NaCl, 2,5 мМ CaCl2) и окрашены 5 мкл Аннексин-V-FITC в течение 15 минут на льду. Затем к смеси было добавлено 400 мкл связывающего буфера с 1 мкМ TO-PRO-3, сразу же после этого была измерена клеточно-ассоциированная флуоресценция FITC и TO-PRO-3 способом проточной цитометрии. Для каждого образца собирались пять тысяч наблюдений. При помощи ПО BD CellQuest были построены точечные графики флуоресценции TO-PRO-3 (FL4-H; ось у) и флуоресценции Аннексина-V-FITC (FL1-H; ось х).
[0289] Процентное количество Аннексин-V-положительных клеток (включая TO-PRO-3 положительные и отрицательные клетки) определялось для каждого образца, исходя из данных графиков, данные для клеток Ramos представлены на Фигуре 4. Ряд антител, выделенных при скрининге антител, был проверен на проапоптозную активность в сравнении с ритуксимабом. Неожиданным явилось то, что некоторые из выделенных мышиных антител против CD37, например muCD37-3 и muCD37-12, обладали выраженной проапоптозной активностью. Приблизительно 39% клеток Ramos, экспонированных muCD37-3, и 46% клеток Ramos, экспонированных muCD37-12, были Аннексин-V-положительными. В отличие от этого, обработка антителом против CD20 ритуксимабом давала лишь 13% Аннексин-V-положительных клеток, в необработанных контрольных образцах содержалось 5% Аннексин-V-положительных клеток. У нескольких изолированных мышиных антител против CD37 не наблюдалось проапоптозной активности. К примеру, при обработке клеток Ramos антителами muCD37-8, muCD37-10 или muCD37-14 наблюдалось нулевое или небольшое увеличение процентного количества Аннексин-V-положительных клеток в сравнении с необработанными клетками. Это наблюдается, несмотря на то, что они обладают сравнимой связывающей активностью с CD37 согласно Фигуре 3.
[0290] Были изолированы дополнительные антитела, которые затем были подвергнуты скринингу на предмет способности индуцировать апоптоз у клеток Ramos. Из множества изолированных антител, связывавшихся с CD37 с высокой аффинностью, лишь у некоторых отмечалась проапоптозная активность. Результаты исследования с Аннексином-V показаны на Фигуре 4В. Мышиные антитела muCD37-38, muCD37-50, muCD37-51, muCD37-56 и muCD37-57 были способны индуцировать апоптоз, давая 38-45% Аннексин-V-положительных клеток Ramos в сравнении с 5% в необработанных контрольных образцах. Аналогично предыдущему исследованию при обработке антителом против CD20 ритуксимабом наблюдалось лишь 18% Аннексин-V-положительных клеток.
[0291] Помимо этого, мышиные антитела были проверены на их способность индуцировать апоптоз у клеток лимфомы Raji. Аналогично клеткам Ramos из множества изолированных антител, связывавшихся с CD37 с высокой аффинностью, лишь у некоторых отмечалась проапоптозная активность. При обработке muCD37-3 или muCD37-12 наблюдалось 36% или 49% Аннексин-V-положительных клеток, соответственно. Напротив, при обработке антителом против CD20 ритуксимабом наблюдалось лишь 20% Аннексин-V-положительных клеток, а в необработанных контрольных образцах содержалось 4% Аннексин-V-положительных клеток.
[0292] Аналогично приблизительно 60% клеток Raji, подвергнутых воздействию muCD37-3, muCD37-38, muCD37-50, muCD37-51, muCD37-56 или muCD37-57, были Аннексин-V-положительными в сравнении с 15% необработанных клеток.
Пример 4
Анализы пролиферации
[0293] Способность антител против CD37 ингибировать клеточный рост измерялась с использованием анализов цитотоксичности in vitro. Клетки-мишени были высеяны по 5000 клеток на лунку в 100 мкл полной среды RPMI (RPMI-1640, 10% фетальной телячьей сыворотки, 2 мМ глутамина, 1% пенициллина-стрептомицина, все реактивы от Invitrogen). Антитела были разбавлены полной средой RPMI с использованием серий 3-кратного разбавления и добавлены по 100 мкл в лунку. Итоговая концентрация варьировалась от 3×10-8 М до 4,6×10-12 М. Клетки были инкубированы при 37°C в инкубаторе с увлажненным 5% CO2 в течение 4-5 дней. Жизнеспособность оставшихся клеток определялась колориметрическим анализом WST-8 (Dojindo Molecular Technologies, Inc., Роквилль, Мэриленд, США). WST-8 восстанавливался дегидрогеназами живых клеток с образованием оранжевого формозанового продукта, растворимого в питательной среде. Количество образующегося формозана прямо зависело от количества живых клеток. WST-8 был добавлен к 10% итогового объема, планшеты были инкубированы при 37°C в инкубаторе с увлажненным 5% CO2 в течение еще 2-4 часов. Планшеты были проанализированы путем измерения абсорбции на 450 нм (А450) в многолуночном планшет-ридере. Фоновую абсорбцию А450-лунок, содержащих только среду и WST-8, вычитали из всех величин. Процентную жизнеспособность рассчитывали делением величины каждого образца на среднюю величину, определенную для лунок с необработанными клетками. Процентная жизнеспособность=100*(А450 обработанного образца - А450 фоновая)/(А450 необработанного образца - А450 фоновая). Для каждой обработки были построены полулогарифмические графики зависимости процентной выживаемости от концентрации антитела.
[0294] Результаты типического анализа пролиферации с использованием мышиных CD37-антител и клеток лимфомы SU-DHL-4 представлены на Фигуре 5. Очевидно, что некоторые мышиные антитела были способны в значительной степени ингибировать пролиферацию клеток SU-DHL-4 дозозависимым образом, в то время как другие не обладали этим эффектом. К примеру, при обработке muCD37-3 жизнеспособность клеток уменьшалась до 34% при наивысшей проверенной концентрации антител с ЕС50 0,17 нМ. Аналогично при обработке muCD37-38 жизнеспособность клеток уменьшалась до 25% при наивысшей проверенной концентрации антител с ЕС50 0,19 нМ. Аналогично при обработке muCD37-50 или muCD37-51 жизнеспособность клеток уменьшалась до 38% при наивысшей проверенной концентрации антител с ЕС50 0,25 нМ или 0,5 нМ, соответственно. Напротив, при обработке, к примеру, CD37-16, жизнеспособность клеток не уменьшалась дозозависимо.
Пример 5
Клонирование и секвенирование VL- и VH-областей антитела CD37-3
[0295] Тотальная клеточная РНК была приготовлена из 5x10б клеток гибридомы CD37-3 с использованием набора RNeasy (QIAgen) согласно рекомендациям производителя. кДНК затем была синтезирована из тотальной РНК с использованием набора для синтеза кДНК Superscript II (Invitrogen).
[0296] Процедура первого раунда ПЦР с вырожденными праймерами на кДНК, происходящей из клеток гибридомы, основывалась на способах, описанных Wang et al. ((2000) J Immunol Methods. 233-167-77) и Co et al. ((1992) J Immunol. 745:1149-54). VH-последовательности были амплифицированы ПЦР с использованием следующих вырожденных праймеров: EcoMH1 CTTCCGGAATTCSARGTNMAGCTGSAGSAGTC (SEQ ID NO:171), EcoMH2 CTTCCGGAATTCSARGTNMAGCTGSAGSAGTCWGG (SEQ ID NO:172) и BamIgG1 GGAGGATCCATAGACAGATGGGGGTGTCGTTTTGGC (SEQ ID NO:173). VL-последовательности были амплифицированы ПЦР с использованием следующих вырожденных праймеров: SacIMK GGAGCTCGAYATTGTGMTSACMCARWCTMCA (SEQ ID NO:174) и HindKL TATAGAGCTCAAGCTTGGATGGTGGGAAGATGGATACAGTTGGTGC (SEQ ID NO:175). (Смешанные основания обозначаются следующим образом: N=G+A+T+C, S=G+C, Y=C+T, M=A+C, R=A+G, W=A+T). ПЦР-реакционные смеси были затем выдержаны на 1% легкоплавком агарозном геле, цепочки с 300^100 парами оснований были вырезаны, выделены с использованием мини колонок Zymo DNA, а затем направлены в Agencourt Biosciences для секвенирования. Соответствующие 5' и 3' ПЦР-праймеры использовались как секвенирующие праймеры для получения вариабельной области кДНК с обоих направлений. Аминокислотные последовательности VH- и VL-областей были определены из результатов ДНК-секвенирования.
[0297] Поскольку вырожденные праймеры, использовавшиеся для клонирования VL и VH кДНК-последовательностей, меняют 5'-концы последовательностей, для проверки полных последовательностей были необходимы дополнительные попытки секвенирования. Предварительные последовательности кДНК использовались для поиска по сайту NCBI IgBlast (http://www.ncbi.nlm.nih.gov/igblast/) с целью выявления зародышевых мышиных последовательностей, от которых происходили антитела. Затем были разработаны ПЦР-праймеры для отжига с зародышевой лидерной последовательностью мышиного антитела таким образом, чтобы новая ПЦР-реакция давала полную вариабельную область последовательности кДНК, не измененную ПЦР-праймерами. ПЦР-реакции, зональная очистка и секвенирование проводились так, как описано выше.
Определение массы для подтверждения последовательности
[0298] Информация о последовательности кДНК для вариабельной области комбинировалась с зародышевой последовательностью константной области для того, чтобы получить полные последовательности кДНК антител. Затем рассчитывались молекулярные массы легкой и тяжелой цепей, которые затем сравнивались с молекулярными массами мышиного антитела CD37-3 по данным ЖХ/МС. Измерения молекулярных масс согласовывались с последовательностями кДНК для тяжелой и легкой цепей CD37-3.
Химеризация
[0299] Вариабельную последовательность вариабельной области легкой цепи клонируют в сайты EcoRI и BsiWI плазмиды pchCD37-3LCZ. Вариабельную область тяжелой цепи клонируют в сайты Hindlll и Apa1 плазмиды pchCD37-3HCN. Эквивалентные плазмиды были сконструированы для chCD37-12. Данные плазмиды использовались для экспрессирования химерных антител в клетках НЕК-293Т с использованием стандартной кальций-фосфатной процедуры (BD Biosciences, CalPhos Mammalian Transfection Kit, Cat №631312). Супернатант был очищен по стандартным процедурам хроматографии с протеином AА таким образом, как это описано выше, с этапом доочистки, проводившимся с использованием карбоксиметильной (СМ) смолы для ионного обмена (IEX) (GE Lifesciences) и связывающего буфера с 10 мМ калия фосфата и 10 мМ натрия хлорида (рН 7,5), либо альтернативными методами хроматографии, описанными выше.
Пример 6
Гуманизация антител
[0300] Антитела CD37-3 и huCD37-50 были гуманизированы согласно методам перестраивания, описанным ранее, например, в Roguska et al., Proc. Natl. Acad. Sci., USA, 91(3):969-973 (1994) и Roguska et al., Protein Eng. 9(10):895-904 (1996), которые включены в настоящий документ во всей полноте посредством ссылки. Перестраивание, как правило, включает идентификацию поверхностных остатков каркасной области вариабельных областей легкой и тяжелой цепей и их замену на человеческие эквиваленты. Мышиные области, определяющие комплементарность, сохраняются в перестроенном антителе. Примерные области, определяющие комплементарность CD37-3 и CD37-50, определены так, как показано в Таблице 11. Помимо определений CDR2 тяжелой цепи, использовавшихся при перестройке, в таблице представлены примерные Kabat-определенные CDR2 тяжелых цепей для мышиных и человеческих CD37-3 и CD37-50. Подчеркнутые последовательности обозначают части Kabat тяжелой цепи CDR2, не рассматриваемые для перестраивания CDR.
Человеческий CDR2: DTSNLPY (SEQ ID NO: 40)
[0301]
[0302] CDR легкой и тяжелой цепей CD37-3 и CD37-50, как определено для перестраивания, приведены в качестве примера в Таблице 11. Лизин 53 в CDR2 легкой цепи мышиного CD37-50 был заменен на аспарагин в гуманизированном CD37-50 (показано курсивом), поэтому приведены обе версии LC CDR2. Также и для мышиного, и для человеческого CD37-3 приведены определения Kabat тяжелой цепи CDR2. Подчеркнутые последовательности обозначают части Kabat тяжелой цепи CDR2, не рассматриваемые для перестраивания CDR.
[0303] Позиции поверхностных остатков понимались как позиции с относительной доступностью в 30% и выше (Pedersen J.T. et. Al, J. Mol. Biol. 1994; 235: 959-973). Поверхностные остатки затем были выравнены с человеческими зародышевыми поверхностными позициями, чтобы идентифицировать наиболее гомологичную человеческую поверхностную последовательность. В случае CD37-3 для перестраивания VL и VH использовались человеческие зародышевые последовательности IGKV1/OR2-0*01 и IGHV4-34*09, соответственно. В случае CD37-50 для перестраивания VL и VH использовались человеческие зародышевые последовательности IGKV3/OR2-268*01 и IGHV4-31*03, соответственно. Как показано на Фигуре 6, в CD37-3 всего семь поверхностных остатков в легкой цепи и семь в тяжелой цепи были замещены на человеческие заместители. Как показано на Фигуре 7 для CD37-50, общее количество поверхностных остатков, которые были замещены на человеческие, составляет семь и пять для VL и VH, соответственно. В CD37-3 остаток 61 тяжелой цепи находится в тесной близости с CDR-H2, поэтому его замена на человеческий остаток пролина могла привести к уменьшению связывающей способности, поэтому была получена вторая перестроенная версия с сохраненным мышиным остатком серина. При тестировании этих антител в качестве цитотоксических конъюгатов лизин 53 легкой цепи CDR2 CD37-50 был замещен на аспарагин, чтобы избежать конъюгирования с лизином, которое может повлиять на связывающую способность. На Фигуре 8 показано выравнивание перестроенных последовательностей вариабельных доменов легкой и тяжелой цепей CD37-3 и CD37-50 с их мышиными эквивалентами.
Рекомбинантная экспрессия антитела huCD37-3
[0304] Последовательности вариабельных областей huCD37-3 и CD37-50 были кодон-оптимизированы и синтезированы Blue Heron Biotechnology. Последовательности фланкированы сайтами ферментативной рестрикции для клонирования внутри рамки считывания с соответствующими константными последовательностями в одноцепочечных плазмидах экспрессии млекопитающих. Вариабельную область легкой цепи клонируют в сайты EcoRI и BsiWI плазмиды pAbKZeo. Вариабельную область тяжелой цепи клонируют в сайты Hindlll и Apa1 плазмиды pAbG1Neo. Данные плазмиды могут использоваться для экспрессирования рекомбинантных антител как со временной, так и с постоянной трансфекцией клеток млекопитающих. Временная трансфекция для экспрессирования рекомбинантных антител клетками НЕК-293Т проводилась с использованием модифицированной процедуры PEI (Durocher, Y. et al., Nucleic Acids Res. 30:E9 (2002)). Супернатант был очищен на Протеине А с последующей доочисткой хроматографией с использованием стандартных процедур, описанных выше для химерных антител.
Экспрессия TRU-016
[0305] Для сравнения активности изолированных антител против CD37 были клонированы и экспрессированы ранее идентифицированные антитела против CD37. ДНК-последовательность модульного белка малого размера против CD37 была взята из US2007/0059306, использовалась последовательность SEQ ID 51. Последовательность была фланкирована сайтами ферментной рестрикции Hindlll и Xho1 для клонирования в плазмиду экспрессии млекопитающих pAbG1Neo. Экспрессирование и очистка проводились так же, как описано для huCD37-3 выше.
Пример 7
Связывающая способность химерных антител
[0306] Химерные антитела chCD37-3 и chCD37-12 были проанализированы на их связывающую способность с клетками Ramos в сравнении с мышиными аналогами. Были проведены тесты связывания способом проточной цитометрии с использованием клеток Ramos и антител muCD37-3, chCD37-3, muCD37-12 и chCD37-12, результаты были проанализированы так, как описано в Примере 2, с использованием вторичных FITC-конъюгированных козьих антимышиных и анти-человеческих антител. На Фигуре 9А представлены кривые доза-ответ, полученные при использовании нелинейной регрессии для каждого антитела. Величина кажущейся константы диссоциации (Kd) каждого антитела была рассчитана при помощи GraphPad Prism v4 (GraphPad software, Сан-Диего, Калифорния). Химеризация не влияла на связывающую способность всех антител, поскольку Kd muCD37-3, chCD37-3, muCD37-12 и chCD37-12 равнялась 0,4 нМ, 0,8 нМ, 0,8 нМ и 1,2 нМ, соответственно.
Связывающая способность huCD37-3v1.0 и huCD37-3vl.01
[0307] Для оценивания связывающей способности химерных и гуманизированных версий CD37-3 использовались проточная цитометрия с клетками BJAB и конкурентное связывание. Клетки BJAB были инкубированы с 1 нМ РЕ-меченого антитела muCD37-3, было измерено конкурентное связывание при добавлении различных количеств muCD37-3, chCD37-3, huCD37-3vl.O или huCD37-3vl.01. Образцы были инкубированы 3 ч при 4°C. Затем клетки были осаждены, промыты буфером FACS и ресуспендированы в 200 мкл фосфатно-солевого буфера, содержащего 1% формальдегида. Образцы были собраны при помощи проточного цитометра FACSCalibur с многолуночным самплером HTS и проанализированы при помощи CellQuest Pro (все оборудование от BD Biosciences, Сан-Диего, США). Был построен полулогарифмический график зависимости полученной средней РЕ-флуоресценции от количества конкурирующего антитела. На Фигуре 9B представлены кривые доза-ответ, полученные при использовании нелинейной регрессии для каждого антитела. Величина кажущейся константы диссоциации (Kd) каждого антитела была рассчитана при помощи GraphPad Prism v4 (GraphPad software, Сан-Диего, Калифорния). Из этого следует, что химеризация или гуманизация не влияли на связывающую способность CD37-3, поскольку все версии конкурировали одинаково при связывании с мышиным родительским антителом. ЕС50 конкурентного связывания для muCD37-3, chCD37-3, huCD37-3vl.O или huCD37-3vl.01 составляет 0,8 нМ, 0,7 нМ, 1 нМ и 0,6 нМ, соответственно.
Связывающая способность гуманизированных антител
[0308] Гуманизированные антитела huCD37-38, huCD37-50, huCD37-51, huCD37-56 и chCD37-57 были проанализированы на их связывающую способность с клетками BJAB в сравнении с мышиными аналогами. Были проведены тесты связывания способом проточной цитометрии с использованием вторичных FITC-конъюгированных козьих анти-мышиных и анти-человеческих антител, результаты были проанализированы так, как описано в Примере 2, затем были построены дозозависимые кривые для каждого антитела при помощи нелинейной регрессии. Величина кажущейся константы диссоциации (Kd) каждого антитела была рассчитана при помощи GraphPad Prism v4 (GraphPad software, Сан-Диего, Калифорния). Из этого следует, что гуманизация существенно не влияла на связывающую способность антител. Kd muCD37-3 и huCD37-3 равна 0,2 нМ, a Kd muCD37-38 и huCD37-38 равна 0,4 нМ и 0,3 нМ, соответственно. Аналогично Kd muCD37-50 и huCD37-50 равна 0,6 нМ и 0,2 нМ, соответственно, a Kd muCD37-51 и huCD37-51 равна 0,6 нМ и 0,8 нМ, соответственно. Наконец, Kd muCD37-56 и huCD37-56 равна 0,4 нМ и 0,2 нМ, соответственно, a Kd muCD37-57 и huCD37-57 равна 1,0 нМ и 0,3 нМ, соответственно.
Пример 8
Экспрессия CD37 макаки
[0309] Последовательность CD37 АА CD37 макаки была получена из Genbank (GI: 718718). Последовательность была кодон-оптимизирована и синтезирована Blue Heron Biotechnology. Была сконструирована плазмида экспрессии pSRa-CD37mac, содержащая целую кодирующую последовательность CD37 макаки (CDS), фланкированную сайтами рестрикции XbaI и BamHI, позволяющими экспрессию CD37 макаки. Клетки 300-19 - пре-В-клеточная линия, полученная от мышей Balb/c (М. G. Reth et al. 1985, Nature, 317: 353-355), - были подвергнуты трансфекции данной плазмидой экспрессии для стабильного экспрессирования CD37 макаки на клеточной поверхности.
Связывающая способность мышиных антител с CD37 макаки
[0310] Мышиные антитела muCD37-3, muCD37-12, muCD37-38, huCD37-50, muCD37-51, muCD37-56 и muCD37-57 были проанализированы на способность связываться с клетками 300-19/CD37mac, экспрессирующими CD37 макаки. Были проведены тесты связывания способом проточной цитометрии с использованием вторичных FITC-конъюгированных козьих антимышиных или козьих анти-человеческих антител, результаты были проанализированы так, как описано в Примере 2. Связывание сравнивалось с описанными ранее антителом против CD37 WR17 и антителом против CD37 SMIP TRU-016. Как показано на Фигуре 10А, несколько изолированных антител против CD37, muCD37-38, huCD37-50, muCD37-51, muCD37-56 и muCD37-57 могут связываться с антигеном CD37 макаки. Напротив, muCD37-3, muCD37-12, описанные ранее антитело против CD37 WR17 и антитело против CD37 SMIP TRU-016 были не способны связываться с антигеном CD37 макаки.
Связывающая способность гуманизированных антител с CD37 макаки
[0311] Гуманизированные антитела huCD37-38, huCD37-50, huCD37-51, huCD37-56 и huCD37-57 были проанализированы на их связывающую способность с клетками 300-19/CD37mac, экспрессирующими CD37 макаки. Были проведены тесты связывания способом проточной цитометрии с использованием вторичных FITC-конъюгированных козьих анти-человеческих антител, результаты были проанализированы так, как описано в Примере 2, затем были построены дозозависимые кривые для каждого антитела при помощи нелинейной регрессии. Величина кажущейся константы диссоциации (Kd) каждого антитела была рассчитана при помощи GraphPad Prism v4 (GraphPad software, Сан-Диего, Калифорния). Из Фигуры 10В следует, что некоторые изолированные гуманизированные антитела связываются с CD37 макаки, в то время как huCD37-3 не связывается. Величина Kd для huCD37-38, huCD37-50, huCD37-51, huCD37-56 и huCD37-57 равна 1,1 нМ, 1,8 нМ, 14 нМ, 5 нМ и 2 нМ, соответственно. Таким образом, гуманизация не влияет на специфичность связывания изолированных антител.
Пример 9
Проапоптозная активность химерных и гуманизированных антител
[0312] Проапоптозная активность химерных и гуманизированных антител оценивалась на клетках Ramos. Клетки были инкубированы с 10 нМ антител или антител изотипного контроля huIgG в течение 20 часов с последующими окрашиванием Аннексином-V-FITC и TO-PRO-3 и проточной цитометрией. ChCD37-12 сохраняло выраженную проапоптозную активность, свойственную muCD37-12. Приблизительно 40% клеток Ramos были Аннексин-V-положительными после обработки антителом muCD37-12 или chCD37-12 в сравнении с 4% необработанных контрольных клеток. Аналогично приблизительно 40% клеток Ramos были Аннексин-V-положительными после обработки huCD37-3, huCD37-38, huCD37-50, huCD37-51, huCD37-56 или huCD37-57 в сравнении с 4% клеток, обработанных изотопным контролем или необработанных клеток. В отличие от этого, обработка антителом против CD20 ритуксимабом давала лишь 13% Аннексин-V-положительных клеток. Этот результат показывает, что выраженная проапоптозная активность изолированных мышиных антител против CD37 сохраняется у полученных из них химерных или гуманизированных антител. Таким образом, на уникальную функциональную характеристику этой группы антител против CD37 - выраженную проапоптозную активность в отсутствие перекрестного сшивания - химеризация или гуманизация отрицательно не влияют.
Проапоптозная активность huCD37-3 и TRU-016
[0313] Проапоптозная активность huCD37-3 против клеток Ramos и Raji сравнивалась с активностью модульного белка малого размера против CD37 TRU-016. TRU-016, как известно, не проявляет проапоптозной активности в отсутствие перекрестного связывания со вторичным антителом. Очевидно, что примерные антитела против CD37 huCD37-3 и chCD37-38 обладают гораздо большей проапоптозной активностью против обеих клеточных линий лимфомы. При обработке huCD37-3 или chCD37-38 наблюдалось 40% или 49% Аннексин-V-положительных клеток Ramos в сравнении с 3% для необработанных контрольных клеток. При обработке Ритуксимабом наблюдалось лишь 15% Аннексин-V-положительных клеток Ramos. В отличие от этого, при обработке TRU-016 процентное количество Аннексин-V-положительных клеток Ramos не увеличивалось. Аналогично при обработке huCD37-3 или chCD37-38 наблюдалось 34% или 30% Аннексин-V-положительных клеток Raji в сравнении с 7% для необработанных контрольных клеток. При обработке Ритуксимабом наблюдалось лишь 19% Аннексин-V-положительных клеток Raji. В отличие от этого, при обработке TRU-016 процентное количество Аннексин-V-положительных клеток Ramos не увеличивалось.
Дозовый ответ проапоптозной активности гуманизированных антител
[0314] Различные количества каждого антитела были инкубированы с клетками Ramos в течение 20 часов с последующими окрашиванием Аннексином-V-FITC и TO-PRO-3 и проточной цитометрией. Были построены полулогарифмические графики зависимости процентного количества Аннексин-V-положительных клеток относительно концентрации антител, с использованием которых, согласно анализу нелинейной регрессии, были определены величины ЕС50. Очевидно, что все гуманизированные антитела обладают выраженной проапоптозной активностью с максимальным процентным количеством Аннексин-V-положительных клеток по меньшей мере 40%. Фигура 11. ЕС50 для данной активности соответствует 0,08, 0,08 и 0,11 нМ для huCD37-3, huCD37-38 и huCD37-50, соответственно. Помимо этого, ЕС50 для данной активности соответствует 0,41, 0,57 и 1,01 нМ для huCD37-51, huCD37-56 и huCD37-57, соответственно. В отличие от этого, обработка антителом против CD20 ритуксимабом давала максимальное процентное количество Аннексин-V-положительных клеток, равное 15%), в сравнении с 4% клеток при обработке контрольным изотипным антителом.
Пример 10
Анализы пролиферации для химерных и гуманизированных антител против CD37
[0315] Способность химерных и гуманизированных антител против CD37 ингибировать клеточный рост измерялась с использованием анализов цитотоксичности in vitro, как описано в Примере 4. Результаты типичного анализа пролиферации с использованием клеток лимфомы SU-DHL-4 и DOHH-2 представлены на Фигуре 12. Очевидно, что все антитела были способны в значительной степени ингибировать пролиферацию клеток SU-DHL-4 дозозависимо. К примеру, при обработке muCD37-3 жизнеспособность клеток SU-DHL-4 уменьшалась до 35% с ЕС50 0,07 нМ. Аналогично при обработке с chCD37-3, huCD37-3v1.0 или huCD37-3vl.01 жизнеспособность клеток SU-DHL-4 уменьшалась до приблизительно 30% при наивысшей проверенной концентрации антител с ЕС50 0,03 нМ, 0,06 нМ или 0,03 нМ, соответственно. Аналогично все антитела были способны в значительной степени ингибировать пролиферацию клеток фолликулярной лимфомы DOHH-2 дозозависимо. К примеру, при обработке muCD37-3 жизнеспособность клеток DOHH-2 уменьшалась до 45% с ЕС50 0,05 нМ. Аналогично при обработке с chCD37-3, huCD37-3v1.0 или huCD37-3v1.01 жизнеспособность клеток DOHH-2 уменьшалась до приблизительно 35% при наивысшей проверенной концентрации антител с ЕС50 0,06 нМ, 0,07 нМ или 0,05 нМ, соответственно. Этот результат свидетельствует о том, что различные версии антитела CD37-3 обладают схожей антипролиферативной активностью, на которую не влияют химеризация или гуманизация.
[0316] Дополнительные гуманизированные антитела против CD37 были протестированы в схожих анализах цитотоксичности in vitro. Все протестированные антитела были способны в значительной степени ингибировать пролиферацию клеток SU-DHL-4 дозозависимо. К примеру, при обработке с huCD37-38 жизнеспособность клеток SU-DHL-4 уменьшалась до 24% с ЕС50 0,42 нМ, а при обработке с huCD37-50 жизнеспособность клеток SU-DHL-4 уменьшалась до 31% с ЕС50 0,39 нМ. В отличие от этого, при обработке антителом против CD20 ритуксимабом жизнеспособность клеток SU-DHL-4 уменьшалась до 35% с ЕС50 1,6 нМ. Помимо этого, при обработке huCD37-51 или huCD37-56 жизнеспособность клеток SU-DHL-4 уменьшалась до 24% с ЕС50 0,60 нМ или 0,68 нМ, соответственно. Кроме того, при обработке huCD37-57 жизнеспособность клеток SU-DHL-4 уменьшалась до 31% с ЕС50 0,42 нМ. Обработка изотопным контрольным антителом не влияла на жизнеспособность клеток SU-DHL-4.
Антипролиферативная активность huCD37-3 в сравнении с другими антителами
[0317] Для дальнейшей характеристики антипролиферативной активности изолированных антител против CD37 сравнивался эффект примерного антитела huCD37-3 с эффектом соединения против CD37 SMIP TRU-16. Иммуногистохимический анализ, в котором использовались микропанели опухолей, подтвердил, что CD37 и CD20 проявляют схожие схемы экспрессии и распространенность по субтипам НХЛ. См. Таблицу 12 ниже. Также были произведены сравнения с антителом против CD20 ритуксимабом. Панель клеточных линий включала клетки лимфом Granta-519, SU-DHL-4, Namalwa и Daudi. Фигура 13.
[0318] Во всех случаях при обработке huCD37-3 наблюдалось дозозависимое понижение жизнеспособности клеток. К примеру, при обработке huCD37-3 жизнеспособность клеток Granta-519 уменьшалась до приблизительно 37% с ЕС50 0,062 нМ. При обработке ритуксимабом жизнеспособность клеток Granta-519 уменьшалась до приблизительно 47% с ЕС50 0,36 нМ. К примеру, при обработке huCD37-3 жизнеспособность клеток SU-DHL-4 уменьшалась до приблизительно 17% с ЕС50 0,053 нМ. При обработке ритуксимабом жизнеспособность клеток SU-DHL-4 уменьшалась до приблизительно 20% с ЕС50 0,2 нМ. В отличие от этого, при обработке TRU-016 не наблюдалось значимого дозозависимого уменьшения жизнеспособности клеток Granta-519 или SU-DHL-4. В других примерах при обработке huCD37-3 жизнеспособность клеток Namalwa уменьшалась до приблизительно 47% с ЕС50 0,1 нМ, а жизнеспособность клеток Daudi уменьшалась до приблизительно 68% с ЕС50 0,25 нМ. Обработка ритуксимабом не влияла на клетки Namalwa, но уменьшала жизнеспособность клеток Daudi до приблизительно 69% с ЕС50 2,6 нМ. В отличие от этого, при обработке TRU-016 не наблюдалось значимого дозозависимого уменьшения жизнеспособности клеток Namalwa или Daudi. Наконец, при обработке huCD37-3 жизнеспособность клеток Ramos уменьшалась до приблизительно 53% с ЕС50 0,08 нМ, в то время как ни TRU-016, ни ритуксимаб не оказывали какого-либо влияния на жизнеспособность клеток Ramos. Этот результат подчеркивает уникальность антипролиферативной активности изолированных антител против CD37.
Пример 11
КЗЦ-активность СР37-антител
[0319] Для оценивания активности комплемент-зависимой цитотоксичности (КЗЦ) химерных и гуманизированных антител против CD37 проводились клеточные анализы согласно опубликованному способу (Gazzano-Santoro Н, J Immunol Methods. 1997 202(2): 163-71). Антитела были аликвотированы в двух повторностях по 50 мкл/лунку в 96-луночный планшет культивирования тканей с плоским дном в различных концентрациях от 5 мкг/мл (=3,3×10-8 М) до 2,3 нг/мл (=1,5×10-11 М) в среде RHBP (RPMI-1640, 20 мМ HEPES, 0,1% альбумина бычьей сыворотки, 1% пенициллина-стрептомицина). Клетки-мишени были добавлены к антителам в количестве 5×104 клеток в 100 мкл среды RHBP на лунку. Лиофилизированный человеческий комплемент (Sigma-Aldrich, Сент-Луис, США) был восстановлен 1 мл стерильной очищенной воды на флакон и разбавлен в 5 раз до 20% базового раствора средой RHBP непосредственно перед использованием. В каждую лунку было добавлено 50 мкл/лунку раствора комплемента до получения конечной концентрации в 5%. Планшеты были инкубированы 2 ч при 37°C в инкубаторе с увлажненным 5% CO2 для комплемент-обусловленного лизиса. По истечении данного времени инкубирования в каждую лунку добавляли реактив Alamar Blue (Invitrogen) до конечной концентрации в 10% для измерения жизнеспособности оставшихся клеток. Планшет был инкубирован 16-20 часов при 37°C до измерения флуоресценции (в относительных единицах флуоресценции, RFU) на ЕХ540/ЕМ590 нм. Контроль включал лунки в трех повторностях со средой и комплементом, но без клеток (только среда, 0% выживаемость), и лунки с клетками и комплементом, но без антитела (только клетки, 100% жизнеспособность). Процентная специфическая клеточная жизнеспособность для каждого образца определялась по следующей формуле: Процентная жизнеспособность=(образец - только среда)/(только клетки - только среда).
[0320] Результат примерного КЗЦ-анализа с использованием клеток Ramos показан на Фигуре 14. Неожиданным было то, что chCD37-12 обладает выраженной КЗЦ-активностью против клеток Ramos. Оно уменьшало жизнеспособность клеток Ramos до 32% при наивысшей проверенной концентрации антител с ЕС50 0,037 мкг/мл. Помимо этого, несколько изолированных антител проявляли против Ramos КЗЦ-активность разной степени. Обработка huCD37-3, huCD37-38, huCD37-50 приводила к уменьшению жизнеспособности клеток до 59%, 50% и 45%, соответственно. Обработка huCD37-51, huCD37-56 или huCD37-56 в средней степени понижала жизнеспособность клеток Ramos до приблизительно 70-80% при наивысшей проверенной концентрации антител.
Пример 12
АЗКЦ активность СР37-антител
[0321] Анализ высвобождения лактатдегидрогеназы (LDH) использовался для измерения антитело-зависимой клеточно-опосредованной цитотоксичности (АЗКЦ) линий опухолевых клеток с использованием свежевыделенных клеток-натуральных киллеров (НК) в качестве эффекторных клеток (Shields RL, J Biol Chem. 2001 275(9):6591-604). НК-клетки были вначале выделены из человеческой крови здорового донора (Research Blood Components, Inc., Брайтон, Миннесота) по модифицированному протоколу, использующемуся для NK Isolation Kit II (Miltenyi Biotech, 130-091-152). Кровь была в 2 раза разбавлена 1х фосфатно-солевым буфером. 25 мл разбавленной крови было осторожно налито поверх 25 мл Ficoll Paque в 50 мл коническую пробирку и центрифугировано на 400 г 45 минут при комнатной температуре. Мононуклеарные клетки периферической крови (МКПК) были отобраны из границы раздела, перенесены в новую коническую пробирку вместимостью 50 мл и однократно промыты 1х фосфатно-солевым буфером. МКПК были ресуспендированы в 2 мл НК-изолирующего буфера (1х фосфатно-солевого буфера, 0,5% альбумина бычьей сыворотки, 2 мМ ЭДТА), затем к клеточной суспензии было добавлено 500 мкл коктейля биотин-антитело. Коктейль биотин-антитело содержит биотинилированные антитела, связывающиеся с лимфоцитами, за исключением НК-клеток, что дает отрицательную селекцию НК-клеток. Смесь инкубировали при 4°C 10 минут, затем добавляли 1,5 мл НК-изолирующего буфера и 1 мл микрогранул Anti-Biotin Micro Beads. Смесь клеток и антител инкубировали еще 15 минут при 4°C. Затем клетки были один раз промыты 50 мл НК-изолирующего буфера и ресуспендированы в 3 мл НК-изолирующего буфера. Затем в сепаратор autoMACS (Miltenyi Biotech) была установлена колонка MACS LS, которую предварительно промыли 3 мл НК-изолирующего буфера. Клеточную суспензию автоматически вводили в колонку, промывали, выходящую фракцию с немечеными НК-клетками собирали в новую коническую пробирку вместимостью 50 мл. Полученные NK-клетки высевали в 30 мл полной среды RPMI (RPMI-1640 с добавками 5% фетальной телячьей сыворотки, 1% пенициллина-стрептомицина, 1 мМ HEPES, 1 мМ натрия пирувата, 1% 100Х MEM раствора незаменимых аминокислот) и выдерживали в течение ночи. Последующие анализы и разбавления проводились в среде RHBP (RPMI-1640 с добавками 20 мМ HEPES, pH 7,4, 0,1% альбумина бычьей сыворотки и 1% пенициллина-стрептомицина).
[0322] Различные концентрации растворов антител в среде RHBP были аликвотированы в двух повторностях по 50 мкл/лунку в 96-луночный круглодонный планшет. Клетки-мишени были ресуспендированы по 106 клеток/мл в среде RHBP и добавлены по 100 мкл/лунку в каждую лунку с разведениями антител. Планшет с клетками-мишенями и разведениями антител инкубировали 30 минут при 37°C. Затем в лунки с клетками-мишенями добавляли НК-клетки по 50 мкл/лунку. Типичное соотношение составляло 1 клетка-мишень на 3-4 НК-клетки. Для каждого эксперимента применялись следующие контроли: только НК-клетки, только клетки-мишени (спонтанное высвобождение LDH), клетки-мишени с НК-клетками (антитело-независимое высвобождение LDH), клетки-мишени с 10% TritonX-100 (максимальное высвобождение LDH). Смеси инкубировали при 37°C 4 ч для лизиса клеток. Планшеты центрифугировали 10 минут при 1200 об/мин, 100 мкл супернатанта осторожно переносили в новый 96-луночный плоскодонный планшет. В каждую лунку добавляли LDH-реакционную смесь (100 мкл/лунку) из набора Cytotoxicity Detection Kit (Roche 1 644 793), инкубировали при комнатной температуре 5-30 мин. Оптическую плотность образцов измеряли на 490 нм (OD490). Процентный специфический лизис каждого образца определяли по следующей формуле: процентный специфический лизис=(величина образца - спонтанное высвобождение)/(максимальное высвобождение -спонтанное высвобождение)*100.
[0323] При инкубировании с гуманизированными антителами наблюдалась выраженная АЗКЦ-активность против клеток лимфом Daudi, Ramos и Granta-519 в присутствии человеческих эффекторных НК-клеток. Их АЗКЦ-активность против клеток лимфомы Daudi сравнивалась с АЗКЦ-активностью TRU-016 (Фигура 15).
[0324] При обработке антителами huCD37-3, huCD37-38, huCD37-50 наблюдался лизис примерно 41%, 39% или 40% клеток Daudi с величиной ЕС50 0,42 нг/мл, 1,31 нг/мл или 2,42 нг/мл, соответственно. Эта активность была такой же, как и при обработке TRU-016, наблюдался лизис 42% клеток Daudi с величиной ЕС50 0,93 нг/мл. Помимо этого, при обработке антителами huCD37-51, huCD37-56 и huCD37-57 наблюдался лизис примерно 39%, 36% или 36% клеток Daudi с величиной ЕС50 5,7 нг/мл, 4,3 нг/мл или 7,9 нг/мл, соответственно.
[0325] АЗКЦ-активность изолированных антител против клеток лимфомы Ramos сравнивалась с АЗКЦ-активностью TRU-016. При обработке антителами huCD37-3, huCD37-38 или huCD37-50 наблюдался лизис примерно 43%, 42% или 46% клеток Ramos с величиной ЕС50 0,95 нг/мл, 2,0 нг/мл или 3,0 нг/мл, соответственно. Эта активность была такой же, как и при обработке TRU-016, наблюдался лизис 59% клеток Ramos с величиной ЕС50 1,53 нг/мл. Помимо этого, при обработке антителами huCD37-51, huCD37-56 и huCD37-57 наблюдался лизис примерно 53%, 43%) или 44% клеток Ramos с величиной ЕС50 5,7 нг/мл, 4,3 нг/мл или 7,9 нг/мл, соответственно.
[0326] В дополнительных экспериментах АЗКЦ-активность huCD37-3 и chCD37-38 против клеток Granta-519 сравнивалась с АЗКЦ-активностью TRU-016. При обработке антителами huCD37-3 или chCD37-38 наблюдался лизис примерно 19% или 18% клеток Granta-519 с величиной ЕС50 0,13 нг/мл или 0,73 нг/мл, соответственно. При обработке TRU-016 наблюдался лизис 16% клеток Granta-519 с величиной ЕС50 0,83 нг/мл.
Пример 13
Картирование эпитопов
[0327] Требования к расположению аминокислот в эпитопах различных CD37-антител могут помочь связать обычные или уникальные функциональные характеристики со специфическими молекулярными взаимодействиями. Внеклеточный домен CD37 содержит две внеклеточные петли - малую петлю, содержащую приблизительно 18 остатков, и большую петлю, содержащую приблизительно 135 остатков. Эпитопные требования не были ранее описаны для опубликованных CD37-антител. Для дальнейшей характеристики изолированных CD37-антител по данному изобретению авторами были сконструированы несколько вариантов антигена CD37 с аланиновым замещением в большой внеклеточной петле.
Клонирование и экспрессия вариантов CD37
[0328] Были построены плазмиды экспрессии млекопитающих, содержащие полную последовательность CD37 кДНК либо человека, либо макаки, кодон-оптимизированную и синтезированную Blue Heron Biotechnologies, фланкированную сайтами рестрикции XbaI и BamHI для клонирования во множественный сайт клонирования вектора pSRa. Поскольку последовательности CD37 высокогомологичны (Фигура 16), экспрессия этих конструкций позволит отличить кросс-реактивные антитела человека и макаки от тех, которые распознают эпитопы с по меньшей мере одни из 11 внеклеточных CD37 аминокислотных отличий между этими двумя видами, описанных в Примере 8.
[0329] Для дальнейшей характеристики эпитопов CD37-антитела была построена серия химерных мышиных-человеческих CD37-конструкций. Из-за размера и высокой гомологичности малой внеклеточной петли CD37 попытки локализации эпитопа были ограничены большой внеклеточной петлей. Кассета EcoRV-Pst1, кодирующая остатки I108-Q235 большой внеклеточной петли, была перестроена с сегментированием на 5 секций путем внедрения 4 уникальных сайтов рестрикции, которые могут сохраняться между последовательностями CD37 человека, мыши и макаки (Фигура 17). Были созданы следующие химерные человек-мышь конструкции CD37:
[0330] hCD37-M1
MSAQESCLSL1KYFLFVFNLFFFVLGSLIFCFGIWILIDKTSFVSFVGLAFVPLQIWSKVLAISGIFTM GIALLGCVGALKELRCLLGLYFGMLLLLFATQITLGILISTQRVRLERRVQELVLRTIQSYRTNPDE TAAEESWDYVQFQLRCCGWHYPQDWFQVL1LRGNGSEAHRVPCSCYNLSATNDSTILDKVILPQ LSRLGHLARSRHSADICAVPAESHIYREGCAQGLQKWLHNNLISIVGICLGVGLLELGFMTLSIFL CRNLDHVYNRLARYR (SEQ ID NO:180)
[0331] hCD37-M2
MSAQESCLSLIKYFLFVFNLFFFVLGSLIFCFGIWILIDKTSFVSFVGLAFVPLQIWSKVLAISGIFTM GIALLGCVGALKELRCLLGLYFGMLLLLFATQITLGILISTQRAQLERSLRDVVEKTIQKYGTNPE TAAEESWDYAQFQLRCCGWQSPRDWNICAQMLKANESEEPRVPCSCYNLSATNDSTILDKVILP QLSRLGHLARSRHSADICAVPAESHIYREGCAQGLQKWLHNNLISIVGICLGVGLLELGFMTLSIF LCRNLDHVYNRLARYR (SEQ ID NO:181)
[0332] hCD37-M3
MSAQESCLSLIKYFLFVFNLFFFVLGSLIFCFGIWILIDKTSFVSFVGLAFVPLQIWSKVLAISGIFTM GIALLGCVGALKELRCLLGLYFGMLLLLFATQITLGILISTQRAQLERSLRDVVEKTIQKYGTNPE ETAAEESWDYVQFQLRCCGWHYPQDWFQVLILRGNGSEAHRVPCSCYNSTATNDSTVFDKLFF SQLSRLGHLARSRHSADICAVPAESHIYREGCAQGLQKWLHNNLISIVGICLGVGLLELGFMTLSI FLCRNLDHVYNRLARYR (SEQ ID NO:182)
[0333] hCD37-M45
MSAQESCLSLIKYFLFVFNLFFFVLGSLIFCFGIWILIDKTSFVSFVGLAFVPLQIWSKVLAISGIFTM GIALLGCVGALKELRCLLGLYFGMLLLLFATQITLGILISTQRAQLERSLRDVVEKTIQKYGTNPE ETAAEESWDYVQFQLRCCGWHYPQDWFQVLILRGNGSEAHRVPCSCYNLSATNDSTILDKVILP QLSRLGPRAKLRQTADICALPAKAHIYREGCAQSLQKWLHNNLISIVGICLGVGLLELGFMTLSIF
LCRNLDHVYNRLARYR (SEQ ID NO:183)
[0334] muCD37-R176
ISTQRVRLERRVQELVLRTIQSYRTNPDETAAEESWDYAQFQLRCCGWQSPRDWNKAQMLKAN ESEEPRVPCSCYNSTATNDSTVFDKLFFSQLSRLGPRAKLRQTADICALPAKAHIYREGCAQSLQ (SEQ ID NO:184).
[0335] Для сохранения одного такого сайта рестрикции, Kpn1, человеческий R176 был включен во все мышиные/человеческие химерные конструкции. Мышиные и человеческие CD37-кассеты были получены у Blue Heron и клонированы в вектор pSRa вместе 5'-концевым фрагментом оригинальной человеческой CD37-конструкции, полученной ПЦР для внедрения сайта EcoRV, и с 3'-концевым рестрикционным фрагментом Pstl-Xbal, взятым от оригинальной конструкции CD37 макаки. Затем были построены мышиные и человеческие химерные CD37-кассеты с использованием стандартных рестрикционных расщепляющих и сшивающих агентов с предпочтением к обычным уникальным сайтам рестрикции.
[0336] Вариант hCD37-M1 был создан внедрением рестрикционного фрагмента EcoRV-SacII, кодирующего АА S109-A138 аналогичной мышиной последовательности CD37. Вариант hCD37-M3 был создан внедрением рестрикционного фрагмента KpnI-Blp1, кодирующего АА V177-L201 аналогичной мышиной последовательности CD37. Вариант hCD37-M45 был создан внедрением рестрикционного фрагмента Blp1-PstI, кодирующего АА S202-I243 аналогичной мышиной последовательности CD37. Полученные клоны были проверены рестрикционным ферментативным расщеплением с последующим ДНК-секвенированием.
[0337] Стабильные клеточные линии были созданы трансфекцией CD37-вариантной мышиной и человеческой химерной плазмиды экспрессии в клетки 300-19 по стандартным процедурам электропорации. Вкратце, 5x106 клеток 300-19 было электропорировано в холодной среде RPMI-1640 с использованием BioRad Gene Pulser, установленного на 260 В и 960 мкФ. Затем клетки были разведены и высеяны в 96-луночные планшеты в среду RPMI-1640 с добавками 10% фетальной телячьей сыворотки и 50 мкМ β-меркаптоэтанола. Спустя 24 часа был добавлен G418 (Invitrogen) в конечной концентрации 2 мг/мл для того, чтобы выбрать трансфицированные клетки. Спустя 2 недели были выделены единичные колонии, затем они были проанализированы на поверхностную экспрессию CD37 и подвергнуты экспансии.
Связывание антител с вариантами CD37
[0338] Проточной цитометрией было проанализировано связывание различных антител против CD37 с клетками, экспрессирующими CD37 дикого типа и вариантами; использовалось по 1,5 мкг/мл каждого антитела. Изолированные антитела по изобретению сравнивались с продажным CD37-антителом WR17, а также с TRU-016 SMIP. Как показано на Фигуре 18А, все антитела связывались с клетками, экспрессирующими CD37 дикого типа. Аналогично все протестированные антитела связывались с вариантом hCD37-M3 (Фигура 18B). В отличие от этого, изолированные антитела по данному изобретению связывали вариант hCD37-M1, в то время как TRU-016 и WR17 не связывали вариант hCD37-Ml (Фигура 19A). Антитела CD37-50 и CD37-51, и TRU-016 также связывались с вариантом hCD37-M45. WR17 частично связывалось с вариантом hCD37-M45, в то время как другие антитела CD37-3, CD37-12, CD37-38, CD37-56 и CD37-57 с ним не связывались (Фигура 19В). Исходя из этого, можно предположить, что все изолированные антитела по настоящему изобретению не нуждаются в 12 АА-остатках варианта hCD37-Ml, которые были изменены на соответствующие мышиные АА-остатки для связывания с антигеном CD37. В отличие от этого, антитела CD37-3, CD37-12, CD37-38, CD37-56 и CD37-57 нуждаются в по меньшей мере одном из 10 АА-остатков варианта hCD37-M45, которые были заменены на соответствующие мышиные АА-остатки для связывания с антигеном CD37.
[0339] Неожиданным оказалось то, что изолированные антитела по настоящему изобретению представляют собой новый класс CD37-антител с уникальной комбинацией функциональных характеристик.
[0340] Помимо этого, схожие конструкции построены в одинаковой манере. Конструкции содержат различные комбинации последовательностей мыши, человека и/или макаки, кодирующие большую внеклеточную петлю CD37 (см. Фигуру 17). Примерами конструкций с одной человеческой секцией, внедренной в мышиную последовательность большой внеклеточной цепи, служат:
[0341] hCD37mECD-H1:
MSAQESCLSLIKYFLFVFNLFFFVLGSLIFCFGIWILIDKTSFVSFVGLAFVPLQIWSKVLAISGIFTM GIALLGCVGALKELRCLLGLYFGMLLLLFATQITLGILISTQRAQLERSLRDVVEKTIQKYGTNPE ETAAEESWDYAQFQLRCCGWQSPRDWNKAQMLKANESEEPRVPCSCYNSTATNDSTVFDKLFF SQLSRLGPRAKLRQTADICALPAKAHIYREGCAQSLQKWLHNNLISIVGICLGVGLLELGFMTLSI FLCRNLDHVYNRLARY (SEQ ID NO:185)
[0342] hCD37mECD-H2:
MSAQESCLSLIKYFLFVFNLFFFVLGSLIFCFGIWILIDKTSFVSFVGLAFVPLQIWSKVLAISGIFTM GIALLGCVGALKELRCLLGLYFGMLLLLFATQITLGILISTQRVRLERRVQELVLRTIQSYRTNPDE TAAEESWDYVQFQLRCCGWHYPQDWFQVL1LRGNGSEAHRVPCSCYNSTATNDSTVFDKLFFS QLSRLGPRAKLRQTADICALPAKAHIYREGCAQSLQKWLHNNLISIVGICLGVGLLELGFMTLSIF LCRNLDHVYNRLARYR (SEQ ID NO:186)
[0343] hCD37mECD-H3:
MSAQESCLSLIKYFLFVFNLFFFVLGSLIFCFGIWILIDKTSFVSFVGLAFVPLQIWSKVLAISGIFTM GIALLGCVGALKELRCLLGLYFGMLLLLFATQITLGILISTQRVRLERRVQELVLRTIQSYRTNPDE TAAEESWDYAQFQLRCCGWQSPRDWNKAQMLKANESEEPRVPCSCYNLSATNDSTILDKVILP QLSRLGPRAKLRQTADICALPAKAHIYREGCAQSLQKWLHNNLISIVGICLGVGLLELGFMTLSIF LCRNLDHVYNRLARYR (SEQ ID NO:187)
[0344] hCD37mECD-H4:
MSAQESCLSLIKYFLFVFNLFFFVLGSLIFCFGIWILIDKTSFVSFVGLAFVPLQIWSKVLAISGIFTM GIALLGCVGALKELRCLLGLYFGMLLLLFATQITLGILISTQRVRLERRVQELVLRTIQSYRTNPDE TAAEESWDYAQFQLRCCGWQSPRDWNKAQMLKANESEEPRVPCSCYNSTATNDSTVFDKLFFS QLSRLGHLARSRHSADICALPAKAHIYREGCAQSLQKWLHNNLISIVGICLGVGLLELGFMTLSIF LCRNLDHVYNRLARYR (SEQ ID NO:188)
[0345] hCD37mECD-H5
MSAQESCLSLIKYFLFVFNLFFFVLGSLIFCFGIWILIDKTSFVSFVGLAFVPLQIWSKVLAISGIFTM GIALLGCVGALKELRCLLGLYFGMLLLLFATQITLGILISTQRVRLERRVQELVLRTIQSYRTNPDE TAAEESWDYAQFQLRCCGWQSPRDWNKAQMLKANESEEPRVPCSCYNSTATNDSTVFDKLFFS QLSRLGPRAKLRQTADICAVPAESHIYREGCAQGLQKWLHNNLISIVGICLGVGLLELGFMTLSIF LCRNLDHVYNRLARYR (SEQ ID NO:189)
[0346] и hCD37mECD-H45
MSAQESCLSLIKYFLFVFNLFFFVLGSLIFCFGIWILIDKTSFVSFVGLAFVPLQIWSKVLAISGIFTM GIALLGCVGALKELRCLLGLYFGMLLLLFATQITLGILISTQRVRLERRVQELVLRTIQSYRTNPDE TAAEESWDYAQFQLRCCGWQSPRDWNKAQMLKANESEEPRVPCSCYNSTATNDSTVFDKLFFS QLSRLGHLARSRHSADICAVPAESHIYREGCAQGLQKWLHNNLISIVGICLGVGLLELGFMTLSIF LCRNLDHVYNRLARYR (SEQ ID NO:190).
[0347] Еще одними примерами конструкций с одной секцией от макаки, внедренной в человеческую последовательность большой внеклеточной цепи, служат:
[0348] hCD37-Mac12:
MSAQESCLSLIKYFLFVFNLFFFVLGSLIFCFGIWILIDKTSFVSFVGLAFVPLQIWSKVLAISGIFTM GIALLGCVGALKELRCLLGLYFGMLLLLFATQITLGILISTQRAQLERSLQDIVEKTIQRYHTNPEE TAAEESWDYVQFQLRCCGWHSPQDWFQVLTLRGNGSEAHRVPCSCYNLSATNDSTILDKVILPQ LSRLGHLARSRHSADICAVPAESHIYREGCAQGLQKWLHNNLISIVGICLGVGLLELGFMTLSIFL CRNLDHVYNRLARYR (SEQ ID NO:191)
[0349] hCD37-Mac4:
MSAQESCLSLIKYFLFVFNLFFFVLGSLIFCFGIWILIDKTSFVSFVGLAFVPLQIWSKVLAISGIFTM GIALLGCVGALKELRCLLGLYFGMLLLLFATQITLGILISTQRAQLERSLRDVVEKTIQKYGTNPE ETAAEESWDYVQFQLRCCGWHYPQDWFQVLILRGNGSEAHRVPCSCYNLSATNDSTILDKVILP QLSRLGQLARSRHSTDICAVPAESHIYREGCAQGLQKWLHNNLISIVGICLGVGLLELGFMTLSIF LCRNLDHVYNRLARYR (SEQ ID NO:192)
[0350] hCD37-Mac5:
MSAQESCLSLIKYFLFVFNLFFFVLGSLIFCFGIWILIDKTSFVSFVGLAFVPLQIWSKVLAISGIFTM GIALLGCVGALKELRCLLGLYFGMLLLLFATQ1TLGILISTQRAQLERSLRDVVEKTIQKYGTNPE ETAAEESWDYVQFQLRCCGWHYPQDWFQVLILRGNGSEAHRVPCSCYNLSATNDSTILDKVILP QLSRLGHLARSRHSADICAVPANSHIYREGCARSLQKWLHNNLISIVGICLGVGLLELGFMTLSIF LCRNLDHVYNRLARYR (SEQ ID NO:193)
[0351] HhCD37-Mac45:
MSAQESCLSLIKYFLFVFNLFFFVLGSLIFCFGIWILIDKTSFVSFVGLAFVPLQIWSKVLAISGIFTM GIALLGCVGALKELRCLLGLYFGMLLLLFATQITLGILISTQRAQLERSLRDVVEKTIQKYGTNPE ETAAEESWDYVQFQLRCCGWHYPQDWFQVLILRGNGSEAHRVPCSCYNLSATNDSTILDKVILP QLSRLGQLARSRHSTDICAVPANSHIYREGCARSLQKWLHNNLISIVGICLGVGLLELGFMTLSIF LCRNLDHVYNRLARY (SEQ ID NO:194).
Кроме того, в человеческую последовательность большой внеклеточной цепи внедрялись одинарные точечные мутации, чтобы идентифицировать остатки, необходимые для связывания антитела.
[0352] Связывание CD37-связывающих агентов с клетками, экспрессирующими SEQ ID NOs:185-194, анализировалось проточной цитометрией так, как это описано выше.
Пример 14
Получение huCD37-3-SPP-DM1
[0353] Линкер N-сукцинимидил 4-(2-пиридилдитио)пентаноат (SPP) был растворен в этаноле. Антитело huCD37-3 было инкубировано в концентрации 5 мг/мл с 7-кратным молярным избытком линкера SPP в течение приблизительно 100 минут при комнатной температуре в 50 мМ калий-фосфатного буфера (pH 6,5), содержащего 50 мМ NaCl, 2 мМ ЭДТА и 5% этанола. Реакционная смесь была очищена с использованием колонки SEPHADEX™ G25F, уравновешенной указанным выше калий-фосфатным буфером. Фракции, содержащие антитела, были объединены и использовались для последующих этапов.
[0354] Майтансиноид DM1 был растворен в диметилацетамиде (DMA, конечная концентрация 3%), затем по каплям был добавлен его 1,7-кратный молярный избыток относительно линкера к SPP-модифицированному антителу. После инкубирования в течение ночи при комнатной температуре конъюгированное антитело было очищено хроматографией на SEPHADEX™ G25F, уравновешенной фосфатно-солевым буфером (PBS), рН 6,5. Конъюгат huCD37-3-SPP-DM1 затем был диализирован в буфере, содержащем 10 мМ гистидина, 250 мМ глицина, 1% сахарозы с рН 5,5. Количество молекул DM1, присоединенных к одной молекуле антитела определялось с использованием описанных ранее коэффициентов ослабления для антитела и DM1 (Liu et al., Proc. Natl. Acad. Sci. USA, 93, 8618-8623 (1996)). Процентное количество свободного майтансиноида, присутствующего после реакции конъюгации, определялось путем инжектирования 20-50 мкг конъюгата в колонку HiSep, уравновешенную 25% ацетонитрила в 100 мМ аммоний-ацетатном буфере, pH 7,0, с последующим элюированием ацетонитрилом. Площадь пика общих свободных майтансиноидов разных видов (элюированных в градиенте и идентифицированных сравнением времени элюирования с известными эталонами) измерялась с использованием детектора абсорбции, настроенного на длину волны 252 нм, затем она сравнивалась с пиком, обусловленным связанным майтансиноидом (элюированным в пике конъюгата в проточных фракциях), и рассчитывалось процентное содержание свободных майтансиноидов. Были получены конъюгаты с 3,5-4 молекулами DM1 на антитело huCD37-3, присутствовало <1% неконъюгированных майтансиноидов.
Получение huCD37-3-SMCC-DM1
[0355] Линкер (сукцинимидил 4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC, Pierce Biotechnology, Inc) был растворен в ДМА. Антитело huCD37-3 было модифицировано с SMCC для введения малеимидных групп в антитело путем инкубирования при концентрации 5 мг/мл в 50 мМ калий-фосфатного буфера, содержащем 50 мМ NaCl, 2 мМ ЭДТА, pH 6,5 с 10-кратным молярным избытком SMCC. После выдерживания приблизительно в течение 100 минут при комнатной температуре реакционная смесь была очищена с использованием колонки SEPHADEX™ G25, уравновешенной указанным выше калий-фосфатным буфером. Фракции, содержащие антитела, были объединены и использовались для последующих этапов.
[0356] SMCC-модифицированное антитело взаимодействовало с 10 мМ раствора DM1, взятым в 1,7-молярном избытке относительно малеимидного линкера. Реакционную смесь перемешивали при комнатной температуре в течение примерно 18 часов. Реакционная конъюгатная смесь была профильтрована через гелевую фильтровальную колонку SEPHADEX™ G25, уравновешенную 1×фосфатно-солевого буфера с pH 6,5. Конъюгат huCD37-3-SMCC-DM1 затем был диализирован в буфере, содержащем 10 мМ гистидина, 250 мМ глицина, 1% сахарозы с pH 5,5. Количество молекул DM1, присоединившихся к молекуле антитела, и процентное содержание свободных майтансиноидов определялось так, как описано выше. Были получены конъюгаты с 3,5-4 молекулами DM1 на антитело huCD37-3, присутствовало <1% неконъюгированных майтансиноидов.
Получение huCD37-3-sulfo-mal-DM4
[0357] Были приготовлены растворы тиол-ОМ4 и гетеробифункционального линкера 1-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)-4-(2,5-диоксопироолидин-1-илокси)-4-оксобутан-2-сульфоновой кислоты (3-sulfo-mal) в N,N-диметилацетамиде (ДМА) с концентрациями 30-60 мМ. Линкер и DM4 были смешаны друг с другом в ДМА, содержащем до 40% объем/объем 200 мМ сукцинатного буфера, 2 мМ ЭДТА, рН 5,0, в соотношении DM4 к линкеру, равном 1,6, с конечной концентрацией DM4, равной 15 мМ. После этого к смеси добавили смесь антител huCD37-3 в фосфатном буфере (pH 7,5) и выдержали 2 ч в финальных условиях конъюгирования: 4 мг/мл антитела, 90% фосфатный буфер/10% ДМА, рН 7,5. Конъюгирование проводили 2 ч при комнатной температуре. Конъюгат huCD37-3-sulfo-mal-DM4 был очищен от избытка непрореагировавшего DM4 и неконъюгированных линкерных продуктов диализом в фосфатно-солевом буфере с последующим финальным диализом в буфере, содержащем 10 мМ гистидина, 250 мМ глицина, 1% сахарозы, pH 5,5. Конъюгат фильтровался через фильтр 0,22 мкм для последующего хранения. Количество молекул DM4, присоединившихся к молекуле антитела huCD37-3 (среднее) в финальном конъюгате, и процентное содержание свободных майтансиноидов определялись так, как описано выше. Были получены конъюгаты с 3,5-4 молекул DM4 на антитело huCD37-3, присутствовало <1% неконъюгированных майтансиноидов.
Получение huCD37-3-PEG4-mal-DM1
[0358] Реактив N-гидроксисукцинимидил-(полиэтиленгликоль)4-(N-малеимидометил)-ОМ 1 (NHS-PEG4-mal-DM1) был растворен в ДМА. Антитело huCD37-3 было инкубировано при концентрации 5 мг/мл в 50 мМ калий-фосфатного буфера, содержащего 150 мМ NaCl, 2 мМ ЭДТА, pH 7,5, с 7-кратным молярным избытком NHS-PEG4-mal-DM1 (всего 10% ДМА). После выдерживания приблизительно в течение 2 часов при комнатной температуре реакционная смесь была очищена с использованием колонки SEPHADEX™ G25, уравновешенной 1×фосфатно-солевым буфером, рН 7,4. Содержащие антитела фракции были объединены и диализированы в буфере, содержащем 10 мМ гистидина, 250 мМ глицина, 1% сахарозы, рН 5,5. Количество молекул DM1, присоединившихся к антителу, и процентное содержание свободных майтансиноидов определялось так, как описано выше. Были получены конъюгаты с 3,5-4 молекулами DM4 на антитело huCD37-3, присутствовало <1% неконъюгированных майтансиноидов.
Пример 15
Связывающая способность майтансиноидных конъюгатов
[0359] Связывающая способность примерного huCD37-3 после конъюгирования с SMCC-DM1, SPP-DM1 или sulfo-mal-DM4 была проанализирована проточной цитометрией так, как описано в примере выше. Величины кажущихся констант диссоциации (Kd) были рассчитаны из кривых связывания, представленных на Фигуре 20А, и соответствовали 0,26 нМ для конъюгатов huCD37-3, 0,46 - для huCD37-3-SMCC-DM1, 0,56 нМ - для huCD37-3-SPP-DM1 и 0,89 нМ - для huCD37-3-sulfo-mal-DM4. Эти результаты показывают, что конъюгирование с SMCC-DM1, SPP-DM1 или sulfo-mal-DM4 не влияет значимым образом на аффинность примерного антитела (например, huCD37-3).
[0360] Связывающая способность huCD37-38 после конъюгирования с SMCC-DM1 была проанализирована способом проточной цитометрии так, как описано в примере выше. Величины кажущихся констант диссоциации (Kd) были рассчитаны из кривых связывания, представленных на Фигуре 20 В, и соответствовали 1,04 нМ для конъюгатов huCD37-38 и 1,2 нМ - для huCD37-38-SMCC-DM1. Эти результаты показывают, что конъюгирование с SMCC-DM1 не влияет значимым образом на аффинность антитела huCD38. Аналогично связывающая способность huCD37-50, huCD37-51, huCD37-56 и huCD37-57 после конъюгирования с SMCC-DM1 была проанализирована способом проточной цитометрии. Величины кажущихся констант диссоциации (Kd) были рассчитаны из кривых связывания и соответствовали 0,43 нМ для huCD37-50, 0,70 нМ - для huCD37-50-SMCC-DM1, 2,0 нМ - для huCD37-51, 1,6 нМ - для huCD37-51-SMCC-DM1, 0,3 нМ - для huCD37-56, 0,34 нМ - для huCD37-56-SMCC-DM1, 0,30 - для huCD37-57 и 0,34 - для huCD37-57-SMCC-DM1. Эти результаты показывают, что конъюгирование с SMCC-DM1 также не влияет значимым образом на аффинность антител huCD37-50, huCD37-51, huCD37-56 и huCD37-57.
Связывающая способность конъюгатов PEG4-mal-DM1
[0361] Связывающая способность примерных антител huCD37-3 и huCD37-50 после конъюгирования с PEG4-mal-DM1 была проанализирована способом проточной цитометрии так, как описано в примере выше. Величины кажущихся констант диссоциации (Kd) были рассчитаны из кривых связывания и соответствовали 0,28 нМ для конъюгатов huCD37-3, 0,35 нМ - для huCD37-3-PEG4-mal-DM1, 0,68 нМ - для huCD37-50 и 1,1 нМ - для huCD37-50-PEG4-mal-DM1. Эти результаты показывают, что конъюгирование с PEG4-mal-DM1 не влияет значимым образом на аффинность примерных антител huCD37-3 или huCD50.
Проапоптозная активность конъюгатов huCD37-3-SMCC-DM1
[0362] Проапоптозная активность huCD37-3 после конъюгирования с SMCC-DM1 оценивалась окрашиванием Аннексином-V на клетках Ramos, как описано выше. При обработке конъюгатом антител huCD37-3 или huCD37-3-SMCC-DM1 наблюдалось 40% Аннексин-V-положительных клеток Ramos с величиной ЕС50 приблизительно 0,09 нМ (Фигура 21А). Клетки Ramos, обработанные несвязывающим контрольным антителом или несвязывающим контрольным конъюгатом SMCC-DM1, содержали только до 4% Аннексин-V-положительных клеток. Для сравнения, обработка антителом против CD20 ритуксимабом приводила лишь к 16% Аннексин-V-положительных клеток с величиной ЕС50 приблизительно 2 нМ. В отличие от этого, при обработке TRU-016 процентное количество Аннексин-V-положительных клеток Ramos не увеличивалось. Это свидетельствует о том, что выраженная проапоптозная активность человеческого антитела против CD37 huCD37-3 сохраняется после конъюгирования с SMCC-DM1.
КЗЦ-активность конъюгатов huCD37-3-SMCC-DM1
[0363] КЗЦ-активность huCD37-3 после конъюгирования с SMCC-DM1 оценивалась на клетках Ramos в присутствии 5% человеческого комплемента. Обработка huCD37-3 или huCD37-3-SMCC-DM1 приводила к уменьшению жизнеспособности клеток до 53% и 73%, соответственно (Фигура 21B). Таким образом, КЗЦ-активность примерного антитела huCD37-3 сохраняется при конъюгировании с майтансиноидом.
АЗКЦ-активность конъюгатов
[0364] АЗКЦ-активность huCD37-3 после конъюгирования с SMCC-DM1 или PEG4-mal-DM1 оценивалась на клетках Ramos и Daudi в присутствии человеческих НК-эффекторных клеток способом анализа высвобождения лактатдегидрогеназы (LDH), как описано выше. Как показано на Фигуре 22А, конъюгаты huCD37-3-SMCC-DM1 или huCD37-3-PEG4-mal-DM1 обладают такой же АЗКЦ-активностью, что и неконъюгированные антитела huCD37-3 по отношению к клеткам Daudi. При обработке антителами huCD37-3, huCD37-3 SMCC-DM1 или huCD37-3-PEG4-mal-DM1 наблюдался лизис примерно 41%, 39% или 36% клеток Daudi с величинами ЕС50 0,42 нг/мл, 1,13 нг/мл или 0,91 нг/мл, соответственно. Аналогичные результаты были получены при использовании клеток Ramos в качестве клеток-мишеней. Как и ранее, конъюгаты huCD37-3-SMCC-DM1 или huCD37-3-PEG4-mal-DM1 обладают сравнимой АЗКЦ-активностью с активностью неконъюгированных антител huCD37-3 по отношению к клеткам Ramos (Фигура 22B). При обработке антителами huCD37-3, huCD37-3 SMCC-DM1 или huCD37-3-PEG4-mal-DM1 наблюдался лизис примерно 43%, 41% или 42% клеток Ramos с величинами ЕС50 0,95 нг/мл, 1,33 нг/мл или 1,57 нг/мл, соответственно. Таким образом, АЗКЦ-активность примерного антитела huCD37-3 сохраняется при конъюгировании с майтансиноидом.
Индукция останова клеточного цикла, оказываемая huCD37-3-SMCC-DM1
[0365] Способность антител против CD37 и конъюгатов индуцировать останов клеточного цикла клеточных линий оценивалась окрашиванием с пропридия иодидом (PI) с последующим анализом проточной цитометрией. Экспоненциально растущие клетки собирались центрифугированием при 1300 об/мин в течение 5 минут при комнатной температуре с последующим суспендированием до концентрации 0,5×106 клеток/мл в полной среде RPMI. Клетки переносились по 1 мл на лунку в 24-луночный планшет (Falcon 3077), что соответствует 0,5×106 клеток/анализ. Исследуемые соединения добавлялись в каждую лунку до конечной концентрации 10 нМ. Полная среда RPMI добавлялась в необработанные контрольные лунки. Клетки были инкубированы в течение ночи, то есть 16-20 ч, при 37°C в инкубаторе с увлажненным 5% CO2. На следующий день клетки были собраны переносом в полистироловые пробирки объемом 5 мл, промыты однократно 3 мл фосфатно-солевого буфера и зафиксированы в 1 мл 70% этанола 30 минут на льду. Затем образцы были вновь однократно промыты 3 мл фосфатно-солевого буфера и ресуспендированы в 0,5 мл фосфатно-солевого буфера. К образцу было добавлено 5 мкл/мл рибонуклеазы, затем он был инкубирован при 37°C 30 минут. Затем образцы были окрашены пропидия иодидом с финальной концентрацией 50 мкг/мл. Образцы были собраны в течение 24 часов после окрашивания пропидия иодидом. Образцы были исследованы на приборе FACS Calibur (BD Biosciences, Сан-Диего). Параметр FL2-A был установлен на линейную шкалу, а FL2 РТМ был настроен таким образом, чтобы расположить пик G1 на 200. Образцы собирались на низкой скорости, для каждого образца было снято 10000 импульсов. Распределение клеток по различным фазам клеточного цикла определялось при помощи ПО ModFit (Версия 5.11, Verity Software House Inc., США). В этой программе применяются техники сопоставления пиков для автоматического моделирования данных по пропидия иодиду с выдачей желательных количественных данных. Данные анализировались со стандартными установками программы.
[0366] Влияние huCD37-3 и huCD37-3-SMCC-DM1 на останов клеточного цикла клеток лимфом BJAB и RL оценивалось спустя 16-20 часов инкубирования каждого соединения в концентрации 10 нМ с последующим окрашиванием пропидия иодидом (PI) и проточной цитометрией. При инкубировании с huCD37-3-SMCC-DM1 наблюдалось повышение процентного количества клеток в фазе G2/M от 13% для необработанных клеток лимфомы BJAB до 95% для клеток, обработанных huCD37-3-SMCC-DM1 (Фигура 23A). Аналогично при инкубировании с huCD37-3-SMCC-DM1 наблюдалось повышение процентного количества клеток в фазе G2/M от 12% для необработанных клеток лимфомы RL до 33% для клеток, обработанных huCD37-3-SMCC-DM1 (Фигура 23B). В отличие от этого, антитело huCD37-3 не влияло на клеточные циклы ни клеток BJAB, ни RL. Помимо этого, несвязывающий конъюгат SMCC-DM1, проанализированный при той же концентрации, не оказывает влияния на клеточный цикл клеток обоих типов. Это свидетельствует о том, что майтансиноидные конъюгаты, изготовленные с изолированными антителами против CD37, вызывают специфический останов клеточного цикла CD37-положительных клеточных линий лимфомы.
Пример 16
Анализы цитотоксичности in vitro
[0367] Способность конъюгатов антител против CD37 ингибировать клеточный рост измерялась с использованием анализов цитотоксичности in vitro, как описано в Примере 10 для антител. Клетки-мишени были высеяны по 5000 клеток на лунку в 100 мкл полной среды RPMI (RPMI-1640, 10% фетальной телячьей сыворотки, 2 мМ глутамина, 1% пенициллина-стрептомицина, все реактивы от Invitrogen). Конъюгаты были разбавлены полной средой RPMI с использованием серий 3-кратного разбавления и добавлены по 100 мкл в лунку. Итоговая концентрация варьировалась от 3×10-8 М до 4,6×10-12 М. Клетки были инкубированы при 37°C в инкубаторе с увлажненным 5% CO2 в течение 4-5 дней. Жизнеспособность оставшихся клеток определялась колориметрическим анализом WST-8, как определено для анализов антител, определялась абсорбция при 450 нм (А450) в многолуночном планшет-ридере (Dojindo Molecular Technologies, Inc., Роквилль, Мэриленд, США). Процентную жизнеспособность рассчитывали делением величины каждого образца на среднюю величину, определенную для лунок с необработанными клетками. Для каждой обработки были построены полулогарифмические графики зависимости процентной выживаемости от концентрации конъюгата антитела.
Цитотоксичность in vitro, проявляемая конъюгатами различных антител с SMCC-DM1
[0368] Цитотоксичность in vitro конъюгатов SMCC-DM1 с различными антителами против CD37 сравнивалась с активностью неспецифического конъюгата huIgG-SMCC-DM1. Результаты типичного анализа цитотоксичности представлены на Фигуре 24А для клеток Daudi, инкубированных с huCD37-3-SMCC-DM1, huCD37-38-SMCC-DM1, huCD37-50-SMCC-DM1, huCD37-51-SMCC-DM1, huCD37-56-SMCC-DM1, huCD37-57-SMCC-DM1 либо с несвязывающим контрольным конъюгатом huIgG1-SMCC-DM1. Все специфические конъюгаты специфически приводили к гибели клетки, в сравнении с контрольным конъюгатом, и понижали жизнеспособность клеток полностью в наивысших использованных концентрациях. Величины ЕС50 соответствовали 0,067 нМ, 0,098 нМ, 0,13 нМ, 0,20 нМ, 0,31 нМ и 0,35 нМ для конъюгатов SMCC-DM1 с huCD37-3, huCD37-38, huCD37-50, huCD37-51, huCD37-56 и huCD37-57, соответственно. В отличие от этого, конъюгаты SMCC-DM1 с несвязывающимся изотипным контрольным антителом приводили клетки к гибели с величиной ЕС50 лишь 20 нМ.
[0369] Аналогично на Фигуре 24В представлены результаты типичного анализа цитотоксичности для клеток Granta-519, инкубированных в течение 5 дней с huCD37-3-SMCC-DM1, huCD37-38-SMCC-DM1, huCD37-50-SMCC-DM1, huCD37-51-SMCC-DM1 либо с несвязывающим контрольным конъюгатом huIgG1-SMCC-DM1. При обработке специфическим SMCC-DM1 жизнеспособность полностью понижалась при наивысших проверенных концентрациях с ЕС50 0,047 нМ, 0,074 нМ, 0,12 нМ и 0,25 нМ для конъюгатов SMCC-DM1 с huCD37-3, huCD37-38, huCD37-50 и huCD37-51, соответственно. В отличие от этого, конъюгаты SMCC-DM1 с несвязывающимся изотипным контрольным антителом приводили клетки к гибели с величиной ЕС50 лишь 20 нМ.
Цитотоксичность in vitro, проявляемая конъюгатами huCD37-3-SMCC-DM1, -SPP-DM1 и sulfo-mal-DM4
[0370] Цитотоксичность in vitro конъюгатов huCD37-3-SMCC-DM1, -SPP-DM1 и sulfo-mal-DM4 по отношению к клеткам Daudi, Granta-519 и BJAB сравнивалась с активностью ритуксимаба и неспецифического конъюгата huIgG-MCC-DM1. Все проверенные конъюгаты полностью снижали жизнеспособность клеток Daudi при наивысших проверенных концентрациях с ЕС50 0,065 нМ, 0,12 нМ и 0,14 нМ для huCD37-3-SMCC-DM1, huCD37-3-SPP-DM1 и huCD37-3-sulfo-mal-DM4, соответственно. В отличие от этого, неспецифический конъюгат huIgG-SMCC-DM1 обладал ЕС50 19 нМ. Аналогично все проверенные конъюгаты полностью снижали жизнеспособность клеток Granta-519 при наивысших проверенных концентрациях с ЕС50 0,047 нМ, 0,13 нМ и 0,088 нМ для huCD37-3-SMCC-DM1, huCD37-3-SPP-DM1 и huCD37-3-sulfo-mal-DM4, соответственно. В отличие от этого, неспецифический конъюгат huIgG-SMCC-DM1 обладал ЕС50 19 нМ. Наконец, все проверенные конъюгаты полностью снижали жизнеспособность клеток BJAB при наивысших проверенных концентрациях с ЕС50 0,041 нМ, 0,11 нМ и 0,11 нМ для huCD37-3-SMCC-DM1, huCD37-3-SPP-DM1 и huCD37-3-sulfo-mal-DM4, соответственно. В отличие от этого, неспецифический конъюгат huIgG-SMCC-DM1 обладал ЕС50 16 нМ.
Цитотоксичность in vitro, проявляемая конъюгатами huCD37-3-SMCC-DM1 и huCD37-3-PEG4-mal-DM1
[0371] Цитотоксичность in vitro конъюгатов huCD37-3-SMCC-DM1 и huCD37-3-PEG4-mal-DM1 по отношению к панели лимфомных клеточных линий сравнивалась с активностью неспецифического конъюгата huIgG-SMCC-DM1. При обработке конъюгатами huCD37-3 жизнеспособность клеток Daudi полностью уменьшалась при наивысшей проверенной концентрации с ЕС50 0,036 нМ или 0,018 нМ для конъюгатов huCD37-3-SMCC-DM1 или huCD37-3-PEG4-mal-DM1, соответственно. В противоположность этому, несвязывающие конъюгаты изотипного контроля понижали жизнеспособность с ЕС50 16 нМ и более 30 нМ для huIgG-SMCC-DM1 или huIgG-PEG4-mal-DM1, соответственно. Аналогично при обработке конъюгатами huCD37-3 жизнеспособность клеток Granta-519 полностью уменьшалась при наивысшей проверенной концентрации с ЕС50 0,014 нМ или 0,012 нМ для конъюгатов huCD37-3-SMCC-DM1 или huCD37-3-PEG4-mal-DM1, соответственно. В отличие от этого, несвязывающие конъюгаты изотипного контроля понижали жизнеспособность с ЕС50 6,5 нМ и более 12 нМ для huIgG-SMCC-DM1 или huIgG-PEG4-mal-DM1, соответственно.
[0372] Цитотоксичность in vitro конъюгатов huCD37-3-SMCC-DM1 и huCD37-3-PEG4-mal-DM1 по отношению к панели лимфомных клеточных линий сравнивалась с активностью неспецифического конъюгата huIgG-SMCC-DM1. При обработке конъюгатами huCD37-3 жизнеспособность клеток BJAB полностью уменьшалась при наивысшей проверенной концентрации с ЕС50 0,019 нМ или 0,010 нМ для конъюгатов huCD37-3-SMCC-DM1 или huCD37-3-PEG4-mal-DM1, соответственно. В отличие от этого, несвязывающие конъюгаты изотипного контроля понижали жизнеспособность с ЕС50 13 нМ и 17 нМ для huIgG-SMCC-DM1 или huIgG-PEG4-mal-DM1, соответственно. Аналогично при обработке конъюгатами huCD37-3 жизнеспособность клеток SU-DHL-4 полностью уменьшалась при наивысшей проверенной концентрации с ЕС50 0,031 нМ или 0,024 нМ для конъюгатов huCD37-3-SMCC-DM1 или huCD37-3-PEG4-mal-DM1, соответственно. В отличие от этого, несвязывающие конъюгаты изотипного контроля понижали жизнеспособность с ЕС50 более 30 нМ для huIgG-SMCC-DM1 и huIgG-PEG4-mal-DM1. Конъюгат huCD37-3-SMCC-DM1 также проявлял активность против клеточной линии фолликулярной лимфомы DOHH-2, а также против клеточных линий ХЛЛ, например JVM-2 и JVM-3 (Фигура 32B).
[0373] При обработке конъюгатами huCD37-3 жизнеспособность клеток Raji полностью уменьшалась при наивысшей проверенной концентрации с ЕС50 0,071 нМ или 0,045 нМ для конъюгатов huCD37-3-SMCC-DM1 или huCD37-3-PEG4-mal-DM1, соответственно. В отличие от этого, несвязывающие конъюгаты изотипного контроля понижали жизнеспособность с ЕС50 24 нМ и 47 нМ для huIgG-SMCC-DM1 или huIgG-PEG4-mal-DM1, соответственно. Затем те же конъюгаты проверялись винкристин-резистентным клоном Raji, называемым Raji-VCR. Как было показано для родительских клеток Raji, оба конъюгата специфически приводили клетки к гибели. При обработке конъюгатами huCD37-3 жизнеспособность клеток Raji-VCR полностью уменьшалась при наивысшей проверенной концентрации с ЕС50 0,11 нМ или 0,037 нМ для конъюгатов huCD37-3-SMCC-DM1 или huCD37-3-PEG4-mal-DM1, соответственно. В отличие от этого, несвязывающие конъюгаты изотипного контроля понижали жизнеспособность с ЕС50 46 нМ и 100 нМ для hulgG-SMCC-DM1 или huIgG-PEG4-mal-DM1, соответственно.
[0374] При обработке конъюгатами huCD37-3 жизнеспособность клеток Namalwa полностью уменьшалась при наивысшей проверенной концентрации с ЕС50 0,033 нМ или 0,024 нМ для конъюгатов huCD37-3-SMCC-DM1 или huCD37-3-PEG4-mal-DM1, соответственно. В отличие от этого, несвязывающие конъюгаты изотипного контроля понижали жизнеспособность с ЕС50 20 нМ и более 30 нМ для huIgG-SMCC-DM1 или huIgG-PEG4-mal-DM1, соответственно. Аналогично при обработке конъюгатами huCD37-3 жизнеспособность клеток Ramos полностью уменьшалась при наивысшей проверенной концентрации с ЕС50 0,16 нМ или 0,069 нМ для конъюгатов huCD37-3-SMCC-DM1 или huCD37-3-PEG4-mal-DM1, соответственно. В отличие от этого, несвязывающие конъюгаты изотипного контроля понижали жизнеспособность с ЕС50 20 нМ для hulgG-SMCC-DM1 и более 30 нМ для huIgG-PEG4-mal-DM1.
Цитотоксичность in vitro huCD37-3-SMCC-DM1 по отношению к антиген-отрицательным клеткам Molt-4
[0375] Для дальнейшей проверки специфичности цитотоксичности huCD37-3-SMCC-DM1 его активность сравнивалась с активностью неспецифического конъюгата huIgG-MCC-DM1 против неэкспрессирующих CD37 клеточной линии Т-клеточной острой лимфобластной лейкемии Molt-4. Чтобы заметить относительно слабую неспецифическую цитотоксичность, в данном эксперименте применялись повышенные концентрации обоих конъюгатов. huCD37-3-SMCC-DM1 и неспецифический конъюгат обладали примерно одинаковой цитотоксичностью с ЕС50 38 нМ и 42 нМ, соответственно.
Обзор цитотоксичности in vitro, проявляемой конъюгатами антител против CD37 с майтансиноидом
[0376] При совокупном рассмотрении результатов цитотоксичности ясно, что конъюгаты с изолированными антителами против CD37 обладают специфической цитотоксичностью против панели CD37-положительных клеточных линий лимфом (Фигура 32В). В каждом случае наблюдается существенное окно специфичности для каждой CD37-экспрессирующей клеточной линии, что свидетельствует о том, что цитотоксичность есть следствием связывания специфических антител против CD37 с клетками-мишенями. Помимо этого, huCD37-3-SMCC-DM1 и неспецифический конъюгат проявляли одинаковую незначительную цитотоксичность против антиген-отрицательных клеток Molt-4. Это свидетельствует о том, что цитотоксичность, наблюдаемая у этого примерного конъюгата, зависит от экспрессии CD37. Антитело huCD37-3 также было активно против множества клеточных линий, включая DOHH-2, Granta-519, SU-DHL-4, JVM-2 и JVM-3. В отличие от этого, соединение против CD37 SMIP TRU-016 прямо не влияло на жизнеспособность любой из этих клеточных линий. Антитело против CD20 обладало меньшей непосредственной активностью, нежели huCD37-3 по отношению к большинству из этих клеточных линий, несмотря на зачастую большие уровни экспрессии CD20 по данным количественной проточной цитометрии (Фигура 32A).
Пример 17
Эффективность in vivo антител против CD37 и их конъюгатов с SMCC-DM1 на модели ксенотрансплантата BJAB
[0377] Антитела против CD37 и их конъюгаты с SMCC-DM1 были протестированы на эффективность в установленной ксенотрансплантатной модели с использованием клеток лимфомы BJAB, подкожно имплантированных мышам с ТКИН. Животные были рандомизированы по объемам опухолей в терапевтические группы, когда опухоли достигли среднего объема в приблизительно 120 мм3, и получали однократно на 12 день после инокуляции либо 10 мг/кг (А) антитела huCD37-3, huCD37-3-SMCC-DM1, антитела huCD37-50, huCD37-50-SMCC-DM1 либо (В) антитела huCD37-38, huCD37-38-SMCC-DM1, антитела huCD37-56, huCD37-56-SMCC-DM1. На Фигуре 25 представлены графики зависимости среднего объема опухоли в различных терапевтических группах от времени после инокуляции опухолевых клеток. Очевидно, что при обработке любым из этих антител наблюдалось уменьшение среднего объема опухоли, хотя при терапии любым из конъюгатов SMCC-DM1 наблюдалось более выраженное уменьшение среднего объема опухолей. Помимо этого, для каждого варианта терапии рассчитывалась величина % T/C, которая соответствует медианному объему опухоли в каждой терапевтической группе, деленному на средний объем опухоли в группе терапии растворителем. Терапия, показавшая величину % T/C ниже 42%, считалась активной, а терапия, показавшая величину % T/C ниже 12%, считалась высокоактивной. При терапии всеми проверенными конъюгатами с SMCC-DM1 наблюдалось значительное уменьшение медианного объема опухоли. Величина % T/C на 29 день после инокуляции клеток соответствовала 20%, 20%, 9% или 4% для huCD37-3-SMCC-DM1, huCD37-50-SMCC-DM1, huCD37-38-SMCC-DM1 или huCD37-56-SMCC-DM1, соответственно.
Эффективность in vivo антитела huCD37-3, sulfo-mal-DM4, -SPP-DM1 и SMCC-DM1 на модели ксенотрансплантата BJAB
[0378] Чтобы оценить эффективность in vivo дополнительных майтансиноидных конъюгатов, конъюгаты sulfo-raal-DM4 и SPP-DM1 примерного антитела huCD37-3 сравнивались с конъюгатами SMCC-DM1 на ксенотрансплантатной модели с использованием клеток лимфомы BJAB, имплантированных внутривенно мышам с ТКИН.
[0379] Животные были рандомизированы по объемам опухолей в терапевтические группы, когда опухоли достигли среднего объема в приблизительно 120 мм3, и получали однократно на 9 день после инокуляции либо 10 мг/кг антитела huCD37-3, huCD37-3-SMCC-DM1, huCD37-3-sulfo-mal-DM4, либо 5 мг/кг huCD37-3-SPP-DM1. На Фигуре 26 представлены графики зависимости среднего объема опухоли в различных терапевтических группах от времени после инокуляции опухолевых клеток. Очевидно, что при терапии любым из конъюгатов наблюдалось более выраженное уменьшение среднего объема опухолей. Величина % T/C рассчитывалась так, как описано выше, для каждой терапии с использованием медианного объема опухоли для каждой терапевтической группы. Величина % T/C на 21 день после инокуляции клеток соответствовала 49%, 5%, 7% или 4% для huCD37-3, huCD37-3-SMCC-DM1, huCD37-3-sulfo-mal-DM4 и huCD37-3-SPP-DM1, соответственно. В конце исследования, на день 121, при терапии huCD37-3-sulfo-mal-DM4 было 3 из 8 выживших мышей без опухолей (TFS), а при терапии huCD37-3-SPP-DM1 - 1 из 8 TFS. В группах терапии антителом huCD37-3, huCD37-3-SMCC-DM1 или в контрольной группе терапии фосфатно-солевым буфером выживших мышей без опухолей не было. Это свидетельствует о том, что майтансиноидные конъюгаты антитела huCD37-3, например конъюгаты SMCC-DM1, sulfo-mal-DM4 или SPP-DM1, были высокоактивны на модели BJAB.
Эффективность in vivo антитела huCD37-3, sulfo-mal-DM4, -SPP-DM1 и SMCC-DM1 на мышиной модели ксенотрансплантата SU-DHL-4
[0380] Во второй ксенотрансплантатной модели использовались клетки диффузной В-крупноклеточной лимфомы SU-DHL-4, имплантированные подкожно мышам с ТКИН для того, чтобы оценить эффективность in vivo конъюгатов sulfo-mal-DM4 и SPP-DM1 примерного антитела huCD37-3 в сравнении с конъюгатами SMCC-DM1. Животные были рандомизированы по массам тела в терапевтические группы после развития опухолей и получали однократно на 17 день после инокуляции либо 10 мг/кг антитела huCD37-3, huCD37-3-SMCC-DM1, huCD37-3-sulfo-mal-DM4, либо 5 мг/кг huCD37-3-SPP-DM1. На Фигуре 27 построены графики зависимости медианного объема опухоли в различных терапевтических группах от времени после инокуляции опухолевых клеток. Очевидно, что при обработке антителом huCD37-3 наблюдалось уменьшение среднего объема опухоли, хотя при терапии любым из конъюгатов уменьшение среднего объема опухолей было более выраженным. Величина % T/C рассчитывалась так, как описано выше, для каждой терапии. Величина % T/C на 37 день после инокуляции клеток соответствовала 32%, 1%, 1% или 3% для huCD37-3, huCD37-3-SMCC-DM1, huCD37-3-sulfo-mal-DM4 и huCD37-3-SPP-DM1, соответственно. В конце исследования, на день 125, при терапии huCD37-3-SMCC-DM1 или huCD37-3-sulfo-mal-DM4 было 8 из 10 выживших мышей без опухолей (TFS), а при терапии huCD37-3-SPP-DM1 - 9 из 10 TFS. В группах терапии антителом huCD37-3 или в контрольной группе терапии фосфатно-солевым буфером выживших мышей без опухолей не было. Это свидетельствует о том, что антитело huCD37-3 было активно при одиночном введении в дозе 10 мг/кг на модели SU-DHL-4. Помимо этого, майтансиноидные конъюгаты, например конъюгаты SMCC-DM1, sulfo-mal-DM4 или SPP-DM1, повышали эффективность антитела и были еще более активны в этой модели.
Эффективность in vivo антитела huCD37-3, конъюгатов PEG4-mal-DM1 и SMCC-DM1 на модели ксенотрансплантата BJAB
[0381] Антитело против huCD37-3 и его конъюгаты PEG4-mal-DM1 и SMCC-DM1 были протестированы на эффективность в установленной ксенотрансплантатной модели с использованием клеток лимфомы BJAB, подкожно имплантированных мышам с ТКИН. Животные были рандомизированы по объемам опухолей в терапевтические группы, когда опухоли достигли среднего объема в приблизительно 120 мм3, и получали однократно на 9 день после инокуляции либо 10 мг/кг антитела huCD37-3, huCD37-3-SMCC-DM1, либо huCD37-3-PEG4-mal-DM1. Как показано на Фигуре 28, при терапии любым из конъюгатов наблюдалось более выраженное уменьшение среднего объема опухолей. Величина % TT/C рассчитывалась так, как описано выше, для каждой терапии с использованием медианного объема опухоли для каждой терапевтической группы. Величина % T/C на 24 день после инокуляции клеток соответствовала 48%, 16% или 5% для huCD37-3, huCD37-3-SMCC-DM1 и huCD37-3-PEG4-mal-DM1, соответственно. На 74 день после инокуляции клеток при терапии huCD37-3-SMCC-DM1 была 1 из 9 выживших мышей без опухолей (TFS), а при терапии huCD37-PEG4-mal-DM1 - 1 из 9 TFS. В группах терапии антителом huCD37-3 или в контрольной группе терапии фосфатно-солевым буфером выживших мышей без опухолей не было. Помимо этого, huCD37-3-SMCC-DM1 был также активен в данной модели при введении в одной дозе по 5 мг/кг с величиной % T/C на 24 день после инокуляции клеток, равной 34%. Это свидетельствует о том, что майтансиноидные конъюгаты антитела huCD37-3, например конъюгаты SMCC-DM1 или PEG4-mal-DM1, были высокоактивны на модели BJAB.
Эффективность in vivo антитела huCD37-3, конъюгатов PEG4-mal-DM1 и SMCC-DM1 на модели ксенотрансплантата SU-DHL-4
[0382] Антитело против huCD37-3 и его конъюгаты PEG4-mal-DM1 и SMCC-DM1 были протестированы на эффективность в установленной ксенотрансплантатной модели с использованием клеток диффузной В-крупноклеточной лимфомы SU-DHL-4, подкожно имплантированных мышам с ТКИН. Животные были рандомизированы по массе тела в терапевтические группы и получали однократно на 15 день после инокуляции 10 мг/кг антитела huCD37-3, huCD37-3-SMCC-DM1 или huCD37-3-PEG4-mal-DM1. Зависимость среднего объема опухоли в различных терапевтических группах от времени после инокуляции опухолевых клеток представлена на Фигуре 29. Очевидно, что при обработке антителом huCD37-3 наблюдалось уменьшение среднего объема опухоли, хотя при терапии любым из конъюгатов уменьшение среднего объема опухолей было более выраженным. Величина % T/V рассчитывалась так, как описано выше, для каждой терапии с использованием медианного объема опухоли для каждой терапевтической группы. Величина % T/C на 38 день после инокуляции клеток соответствовала 34%, 4% или 2% для huCD37-3, huCD37-3-SMCC-DM1 и huCD37-3-PEG4-mal-DM1, соответственно. На 74 день после инокуляции клеток при терапии huCD37-3-SMCC-DM1 было 8 из 10 выживших мышей без опухолей (TFS), а при терапии huCD37-3-PEG4-mal-DM1 - 10 из 10 TFS. В группах терапии антителом huCD37-3 или в контрольной группе терапии фосфатно-солевым буфером выживших мышей без опухолей не было. Это свидетельствует о том, что антитело huCD37-3 было активно при одиночном введении в дозе 10 мг/кг на модели SU-DHL-4. Помимо этого, майтансиноидные конъюгаты, например, конъюгаты SMCC-DM1 или PEG4-mal-DM1, обладали повышенной эффективностью, в сравнении с неконъюгированным антителом, и были еще более активны в этой модели. Конъюгат huCD37-3-SMCC-DM1 был также более эффективен в данной модели при введении в одной дозе по 2,5 или 5 мг/кг с величиной % T/C на 37 день после инокуляции клеток, равной 18% и 6%, соответственно.
Эффективность in vivo антитела huCD37-3, конъюгата huCD37-3-SMCC-DM1, антитела ритуксимаба и режима, состоящего из циклофосфамида, винкристина и преднизона (CVP) на модели ксенотрансплантата DoHH2
[0383] Антитело против huCD37-3 и его конъюгат с SMCC-DM1 были протестированы на эффективность в установленной ксенотрансплантатной модели с использованием клеток фолликулярной лимфомы DoHH2, подкожно имплантированных мышам с ТКИН. Животные были рандомизированы по объемам опухолей в терапевтические группы и, начиная с 12 дня после инокуляции, получали либо одну дозу по 10 мг/кг антитела huCD37-3, либо одну дозу по 10 мг/кг конъюгата huCD37-3-SMCC-DM1; шесть доз по 2 мг/кг Ритуксимаба два раза в неделю в течение трех недель, либо режим из одной дозы по 40 мг/кг циклофосфамида и 0,5 мг/кг винкристина вместе с пятью ежедневными дозами по 0,2 мг/кг преднизона (CVP). На Фигуре 30 построены графики зависимости медианного объема опухоли в различных терапевтических группах от времени после инокуляции опухолевых клеток. Очевидно, что при терапии антителом huCD37-3 наблюдалось уменьшение среднего объема опухоли, хотя при терапии конъюгатом huCD37-3-SMCC-DM1 уменьшение среднего объема опухоли было более выраженным. Конъюгат huCD37-3-SMCC-DM1 давал уменьшение медианного объема опухоли, аналогичное терапии Ритуксимабом, и более выраженное уменьшение медианного объема в сравнении с режимом CVP. Задержка роста опухоли (величина Т-С) определялась как медианное время (в днях), необходимое опухолям у животных терапевтической группы (T) и контрольной группы (C) для достижения предустановленного размера, и рассчитывалась для каждой группы за вычетом выживших животных без опухолей. Величина T-C для достижения медианной величины опухоли в 800 мм3 соответствовала 8, 25, 24 и 13 дням для huCD37-3, huCD37-3-SMCC-DM1, ритуксимаба и CVP, соответственно. В конце исследования, на день 130 после инокуляции клеток, при терапии huCD37-3-SMCC-DM1 было 1 из 9 выживших мышей без опухолей (TFS). В группах терапии антителом huCD37-3, ритуксимабом, CVP или в контрольной группе терапии фосфатно-солевым буфером выживших мышей без опухолей не было. Конъюгат SMCC-DM1 проявлял сравнимую с ритуксимабом задержку роста опухоли и более выраженную задержку роста опухоли в сравнении с неконъюгированным антителом и режимом CVP на модели DoHH2.
Эффективность in vivo антитела huCD37-3, конъюгата huCD37-3-SMCC-DM1, антитела офатумумаба и бендамустина на модели ксенотрансплантата JVM-3
[0384] Антитело против huCD37-3 и его конъюгат huCD37-3-SMCC-DM1 были протестированы на эффективность в установленной ксенотрансплантатной модели с использованием клеток хронического лимфоцитного лейкоза JVM-3, подкожно имплантированных мышам с ТКИН. Животные были рандомизированы по объемам опухолей в терапевтические группы и, начиная с 7 дня после инокуляции, получали либо одну дозу по 10 мг/кг антитела huCD37-3, либо одну дозу по 5 или 10 мг/кг конъюгата huCD37-3-SMCC-DM1; шесть доз по 5 мг/кг офатумумаба два раза в неделю в течение трех недель, либо одну дозу 50 мг/кг бендамустина. На Фигуре 31 построены графики зависимости медианного объема опухоли в различных терапевтических группах от времени после инокуляции опухолевых клеток. Очевидно, что при терапии антителом huCD37-3 наблюдалось уменьшение среднего объема опухоли, хотя при терапии конъюгатом huCD37-3-SMCC-DM1 уменьшение среднего объема опухоли было более выраженным. Величина % T/С рассчитывалась так, как описано выше, для каждой терапии с использованием медианного объема опухоли для каждой терапевтической группы. Величина % T/C на 20 день после инокуляции клеток соответствовала 31%, 19%, 10%, 35% и 38% для huCD37-3, 5 мг/кг huCD37-3-SMCC-DM1, 10 мг/кг huCD37-3-SMCC-DM1, офатумумаба и бендамустина, соответственно. В конце исследования, на день 76 после инокуляции, при терапии huCD37 и офатумумабом была 1 из 10 выживших мышей без опухолей (TFS), а при терапии huCD37-3-SMCC-DM1 в дозе 5 и 10 мг/кг - 1 и 2 TFS из 10, соответственно. В группах терапии бендамустином или в контрольной группе терапии фосфатно-солевым буфером выживших мышей без опухолей не было. Это свидетельствует о том, что антитело huCD37-3 было активно при одиночном введении в дозе 10 мг/кг на модели JVM-3. Майтансиноидный конъюгат huCD37-3-SMCC-DM1 обладал повышенной активностью в сравнении с неконъюгированным антителом. Помимо этого, в данной модели майтансиноидный конъюгат huCD37-3-SMCC-DM1 обладал большей активностью, нежели офатумумаб или бендамустин.
Обзор эффективности in vivo конъюгатов антител против CD37
[0385] CD37 не оценивался в качестве мишени для майтансиноидных иммуноконъюгатов, в то время как CD20 оценивался. CD37 структурно аналогичен CD20, поскольку оба антигена являются белками клеточной поверхности, содержащими 4 трансмембранных домена, одну малую и одну большую внеклеточную петлю. Была показана способность обоих антигенов к медленной интернализации и медленному или среднему внутриклеточному метаболизму (Press et al. 1989, Cancer Res. 49(17):4906-12 и Press et al. 1994, Blood. 83(5): 1390-7). Иммуноконъюгаты антител против CD20 были исследованы ранее. В одном случае нерасщепляемые конъюгаты MCC-DM1 с антителом против CD20 обладали такой же эффективностью, что и неконъюгированное антитело, в то время как расщепляемый конъюгат SPP-DM1 такого же антитела обладал повышенной эффективностью в ксенотрансплантатной модели Granta-519 у мышей с ТКИН (Poison AG, Cancer Res 2009; 69:2358-64). Аналогично конъюгаты калихеамицина с ритуксимабом, сделанные посредством кислотоустойчивого амидного линкера, не повышали эффективность in vivo в ксенотрансплантатной модели Ramos на голых мышах. Только конъюгаты калихеамицина и ритуксимаба, сделанные с кислотолабильным диметилгидразидным Ac-But линкером, обладали повышенной эффективностью in vivo в данном исследовании (DiJoseph JF, Cancer Immunol Immunotherapy 2007; 56:1107-1117).
[0386] В отличие от этого, нерасщепляемые конъюгаты SMCC-DM1 некоторых изолированных антител против CD37 по настоящему изобретению обладали повышенной эффективностью in vivo в ксенотрансплантатных моделях BJAB, SU-DHL-4, DoHH2 и JVM-3 в сравнении с неконъюгированным антителом. Вследствие этого можно выдвинуть предположение о том, что изолированные антитела обладают уникальными свойствами, которые позволяют им быть более эффективными in vivo в виде майтансиноидных конъюгатов, к примеру, конъюгатов SMCC-DM1.
****
[0387] Следует понимать, что для интерпретирования формулы изобретения предназначен раздел Детальное описание, а не разделы Сущность и Реферат. В разделах Сущность и Реферат представлены одно или более, но не все примерные варианты воплощения настоящего изобретения, согласно задумке изобретателя(ей), и, таким образом, они не должны пониматься как ограничивающие каким-либо образом настоящее изобретение и прилагаемую формулу.
[0388] Настоящее изобретение было описано выше при помощи функциональных составляющих блоков, иллюстрирующих реализацию указанных функций и их связей. Границы данных функциональных составляющих блоков были произвольно определены в настоящем документе для удобства описания. Могут быть определены и иные границы при надлежащем определении указанных функций и связей.
[0389] Представленное ниже описание специфических вариантов воплощения в такой полноте раскрывает общую сущность изобретения, чтобы другие специалисты, основываясь на знаниях, известных в данной области техники, легко могли модифицировать и/или адаптировать его для различных приложений, например, специфических вариантов воплощения, без нужды в излишнем экспериментировании и не отдаляясь от общей концепции настоящего изобретения. Таким образом, на основании рекомендаций и инструкций, представленных здесь, могут быть сделаны адаптации и модификации в пределах и в охвате эквивалентов предложенных вариантов воплощения. Следует понимать, что фразеология и терминология настоящего документа предназначена для целей описания, а не ограничения; терминология или фразеология настоящей спецификации должна пониматься опытным специалистом в свете рекомендаций и инструкций.
[0390] Широта и охват настоящего изобретения не должны ограничиваться любым из перечисленных выше примерных вариантов воплощения, но должны определяться лишь в соответствии с приведенной ниже формулой изобретения и ее эквивалентами.
| название | год | авторы | номер документа |
|---|---|---|---|
| CD37-СВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ И ИХ ИММУНОКОНЪЮГАТЫ | 2011 |
|
RU2742743C2 |
| АНТИТЕЛА ПРОТИВ РЕЦЕПТОРА ФОЛИЕВОЙ КИСЛОТЫ 1, ИХ ИММУНОКОНЪЮГАТЫ И ИСПОЛЬЗОВАНИЕ | 2011 |
|
RU2610663C2 |
| АНТИТЕЛА ПРОТИВ РЕЦЕПТОРА ФОЛИЕВОЙ КИСЛОТЫ 1, ИХ ИММУНОКОНЪЮГАТЫ И ИСПОЛЬЗОВАНИЕ | 2011 |
|
RU2740479C2 |
| СПОСОБЫ КОНЪЮГАЦИИ | 2010 |
|
RU2765240C2 |
| СПОСОБЫ КОНЪЮГАЦИИ | 2010 |
|
RU2595424C2 |
| АНТИТЕЛА ПРОТИВ CD20 И ИХ ПРИМЕНЕНИЕ | 2011 |
|
RU2573994C2 |
| АНТИМЕЗОТЕЛИНОВЫЕ ИММУНОКОНЪЮГАТЫ И ИХ ПРИМЕНЕНИЕ | 2010 |
|
RU2575612C2 |
| ИММУНОКОНЪЮГАТЫ, НАПРАВЛЕННЫЕ НА CD138, И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2547939C2 |
| АНТИТЕЛА К FcRH5, ИХ ИММУНОКОНЪЮГАТЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2583270C2 |
| АГЕНТЫ ПРОТИВ КЛЕТКИ-МИШЕНИ, НАЦЕЛЕННЫЕ НА CD138, И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2537265C2 |


































































































































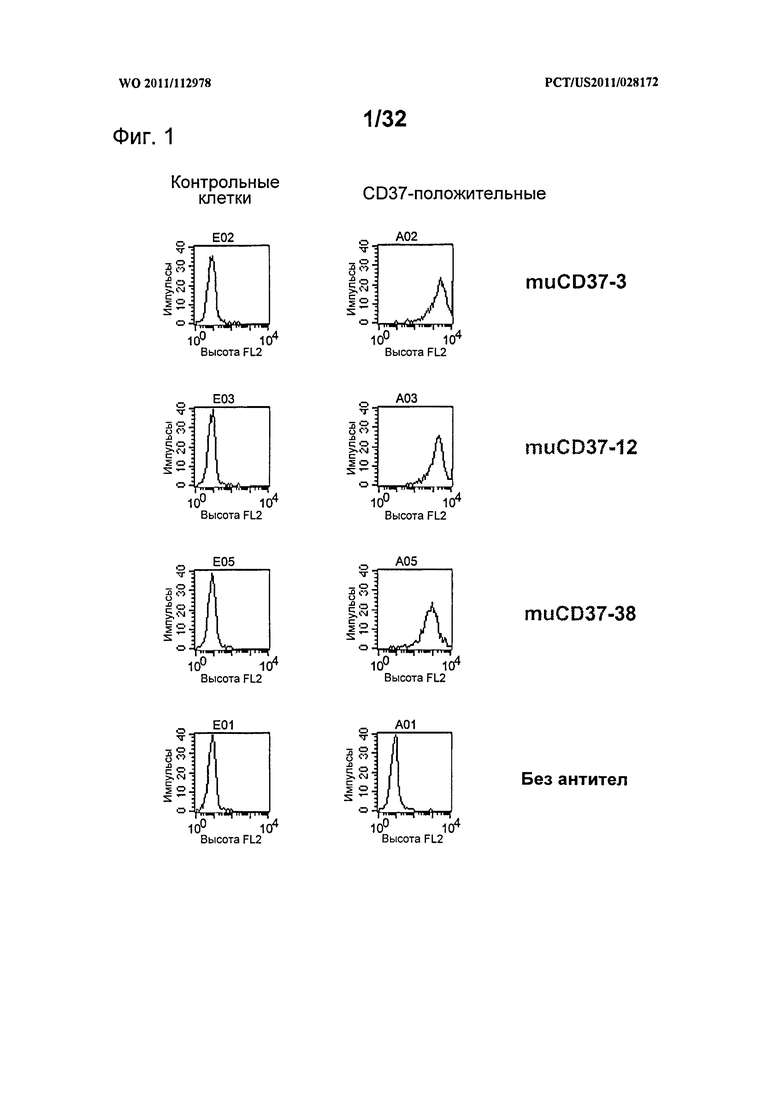
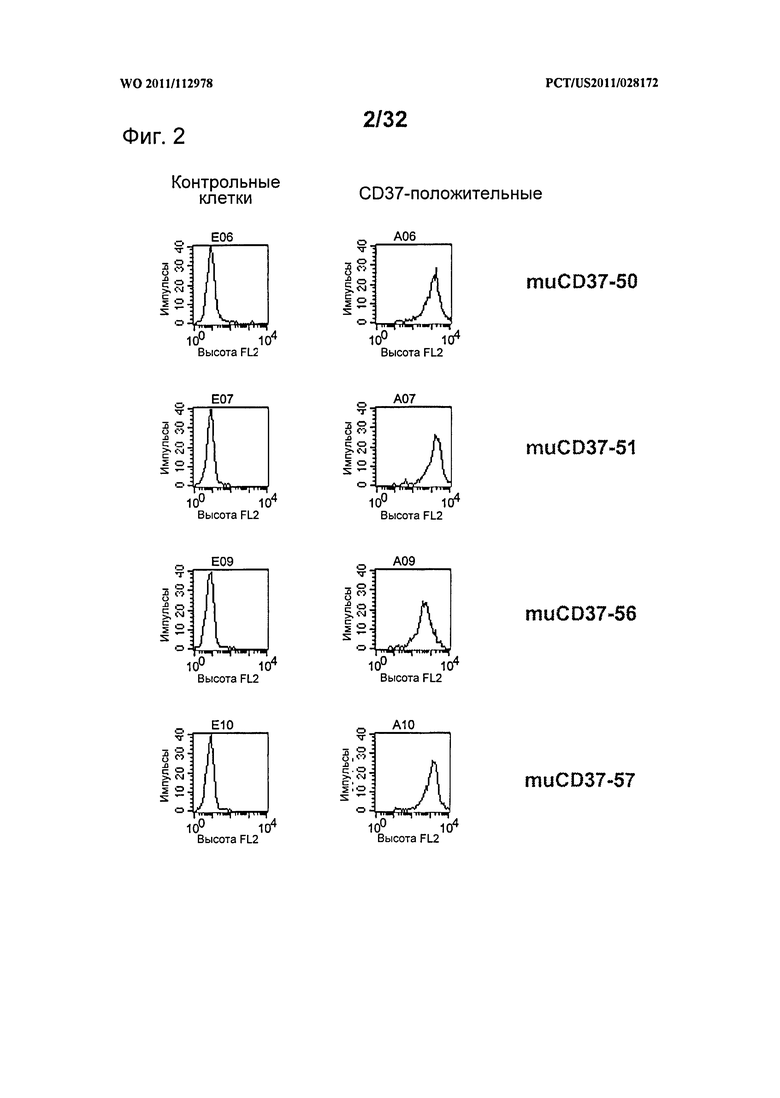
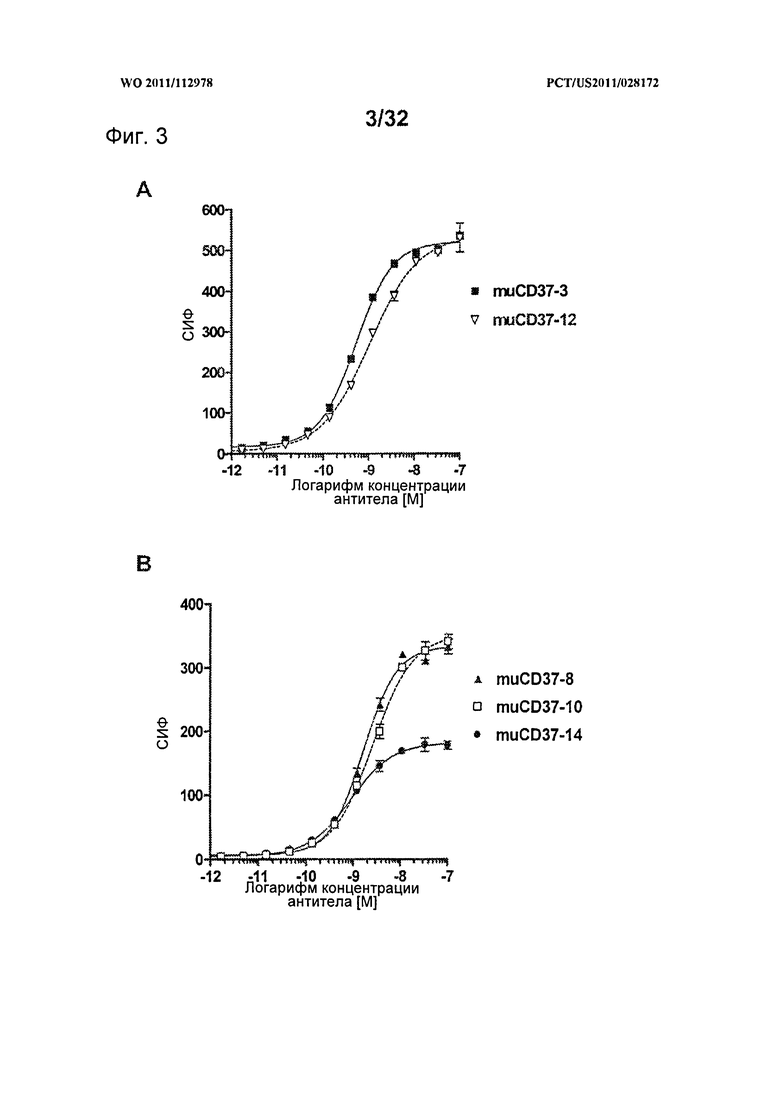
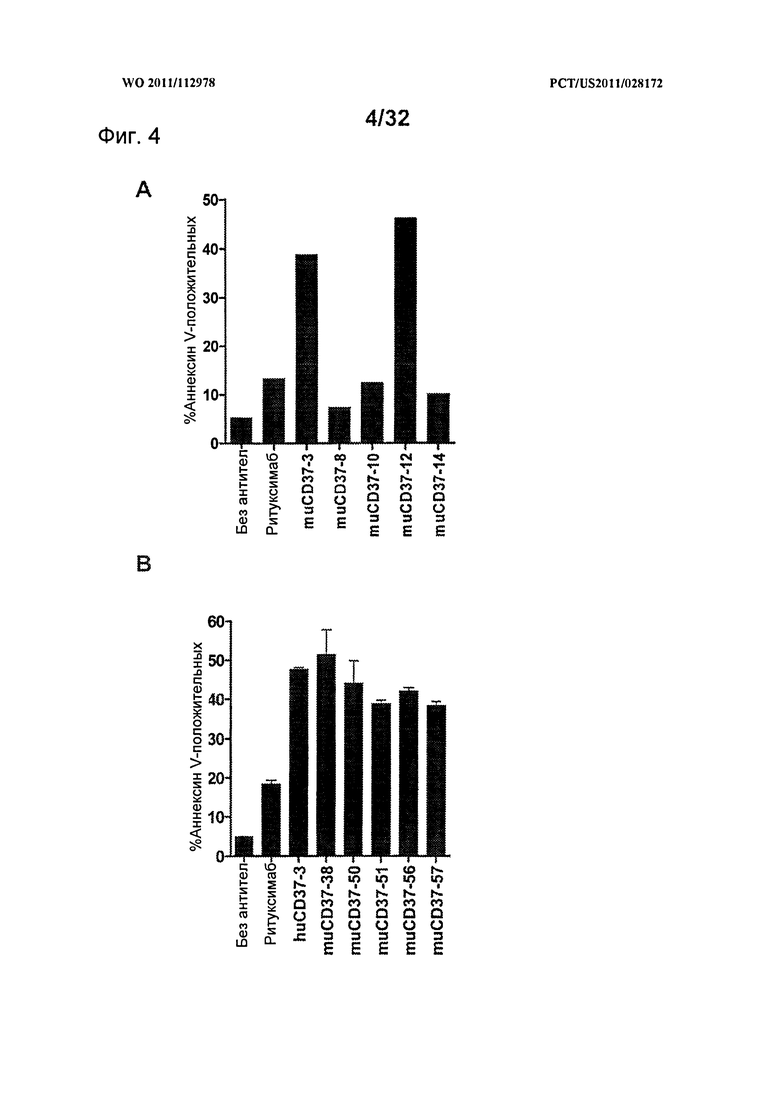
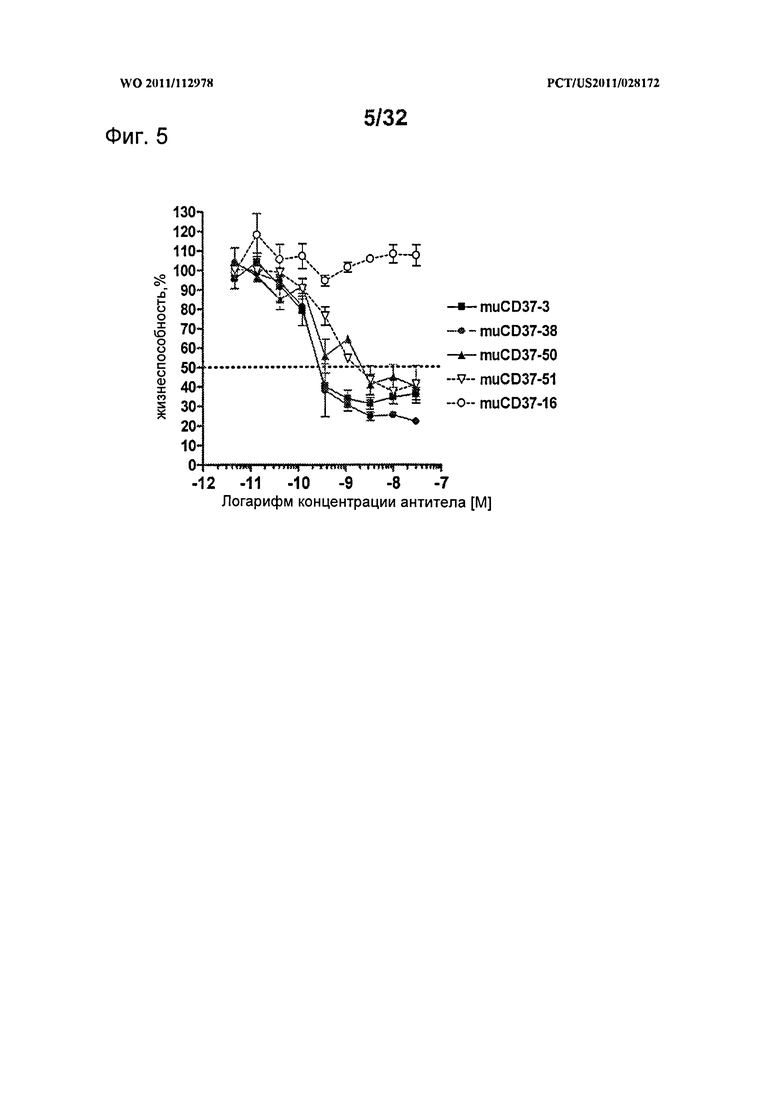
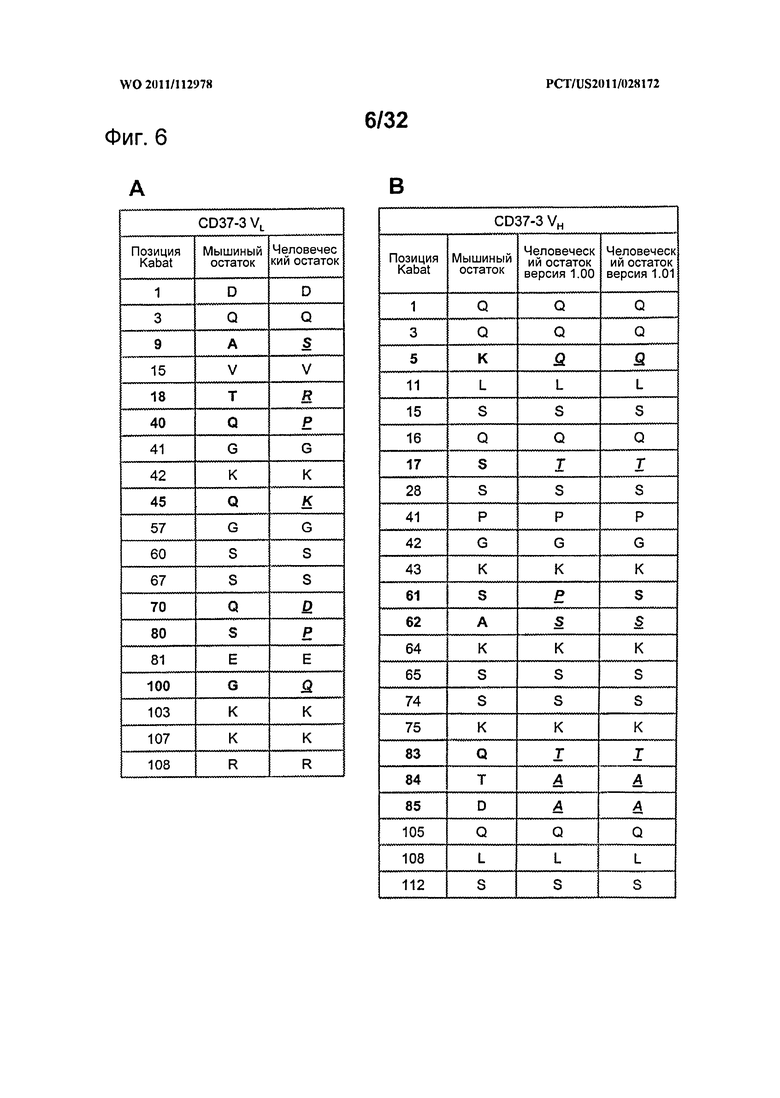
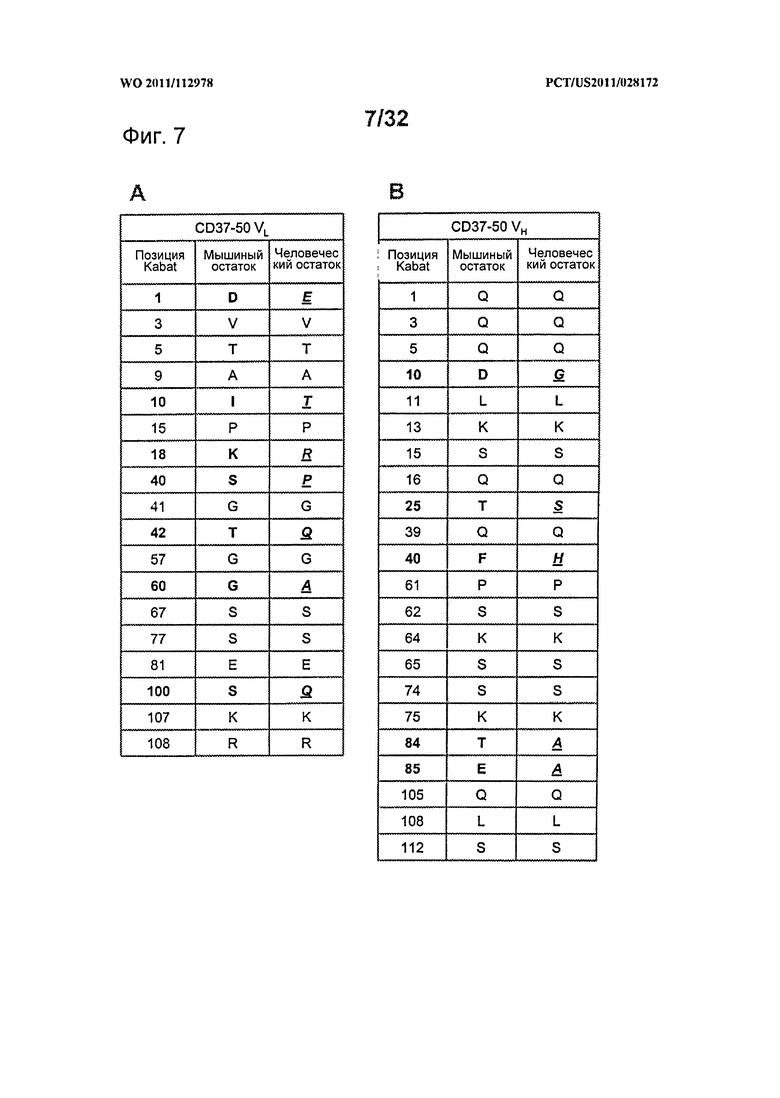
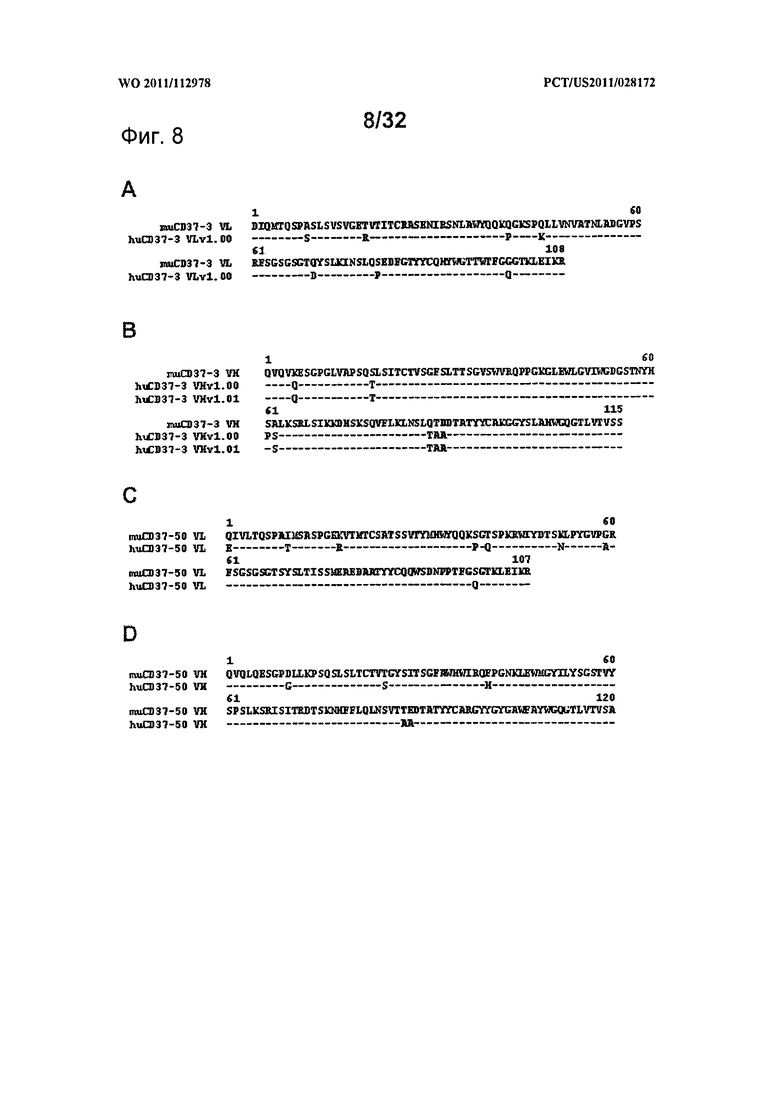
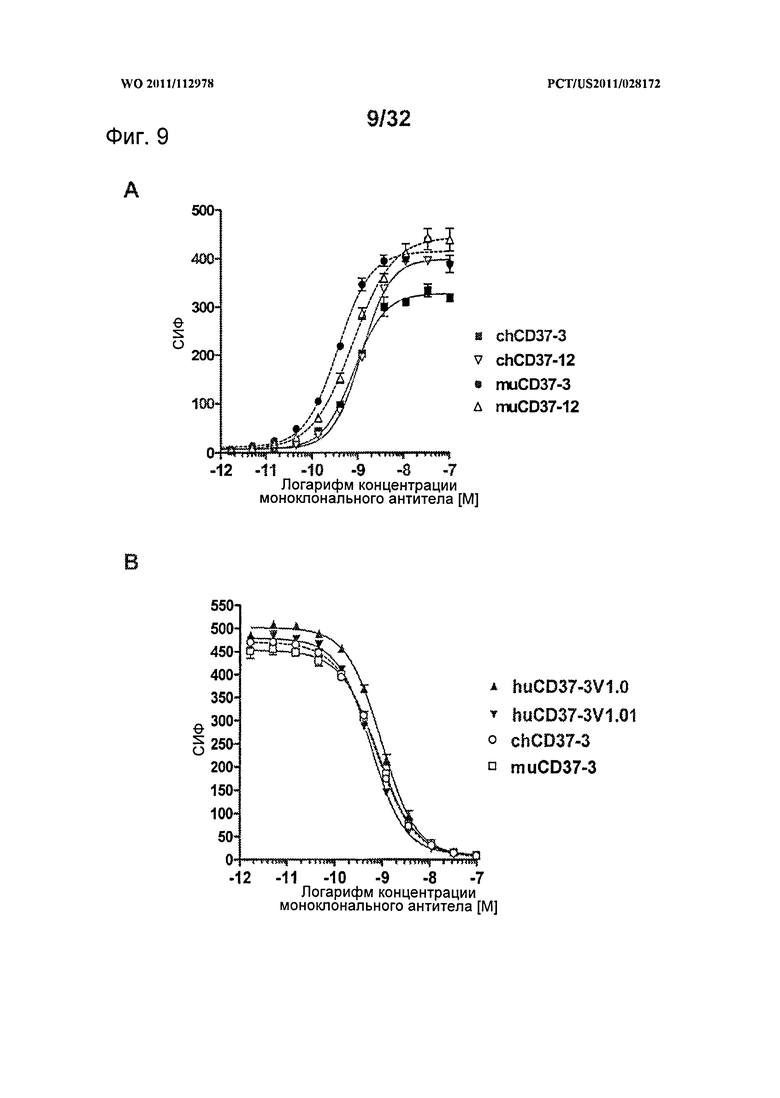
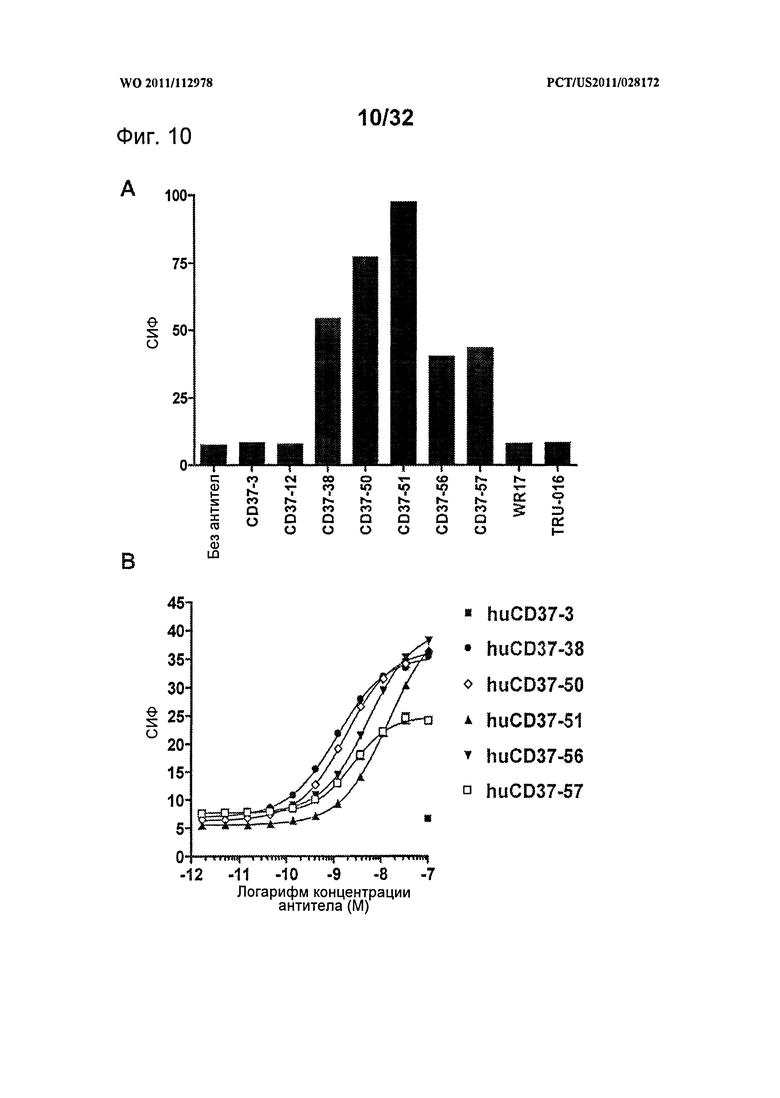
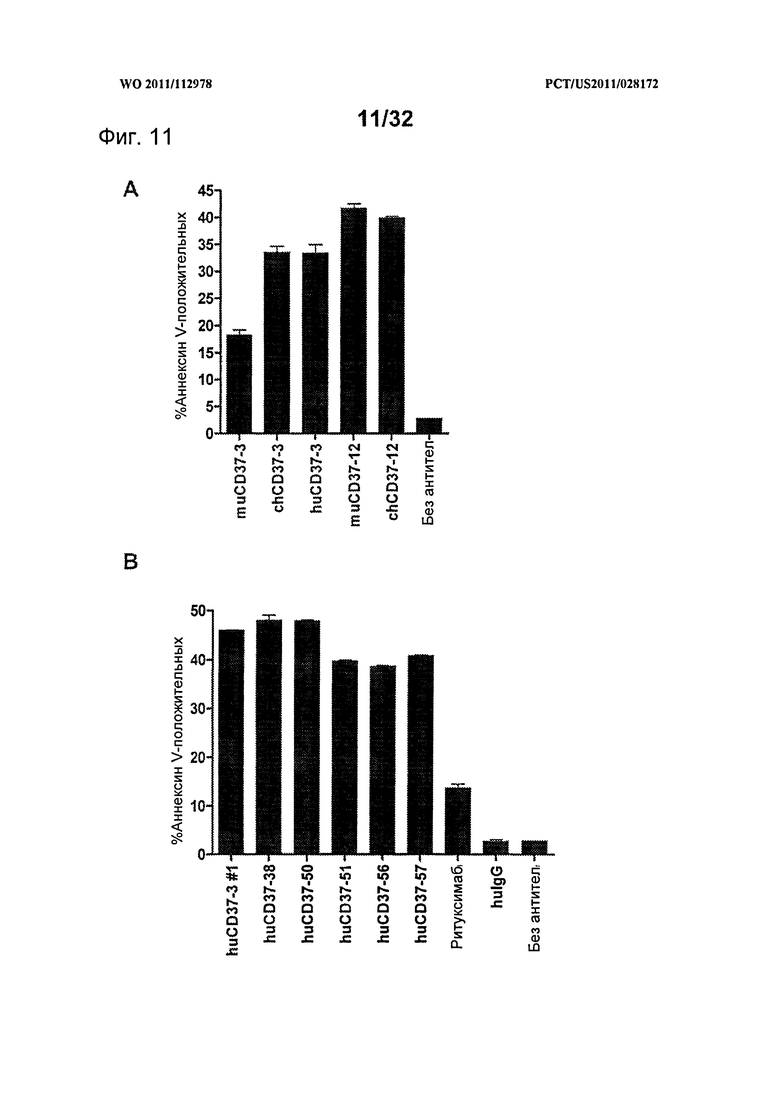
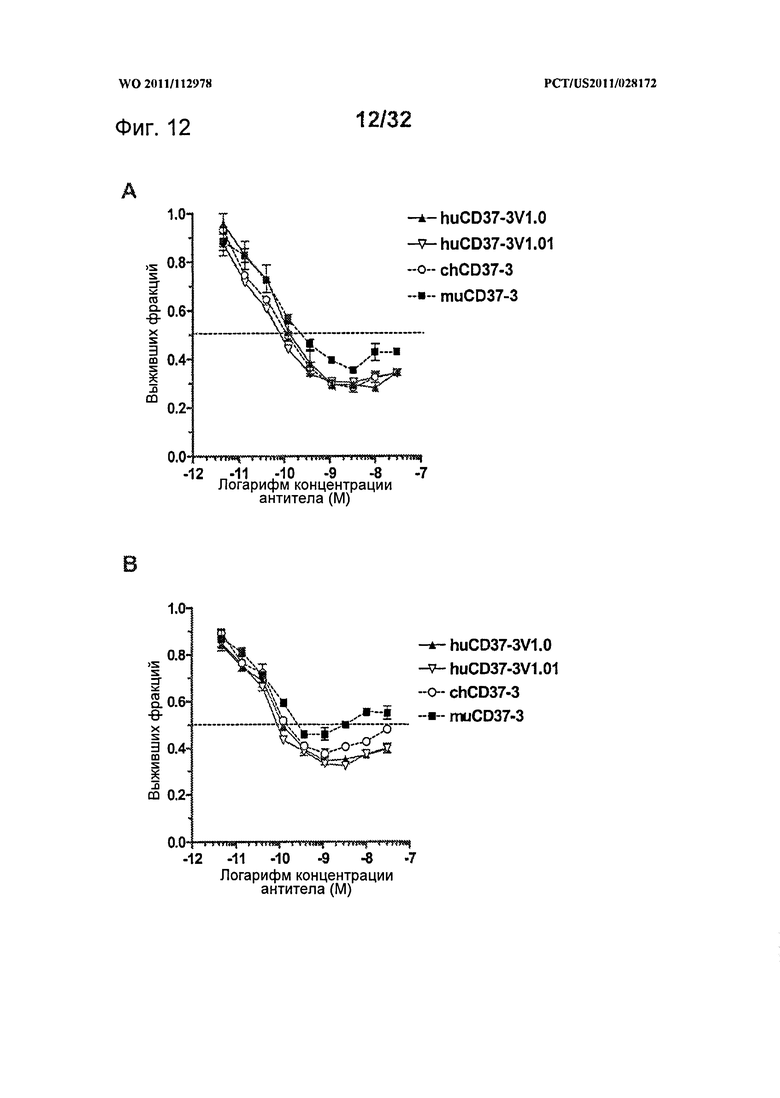
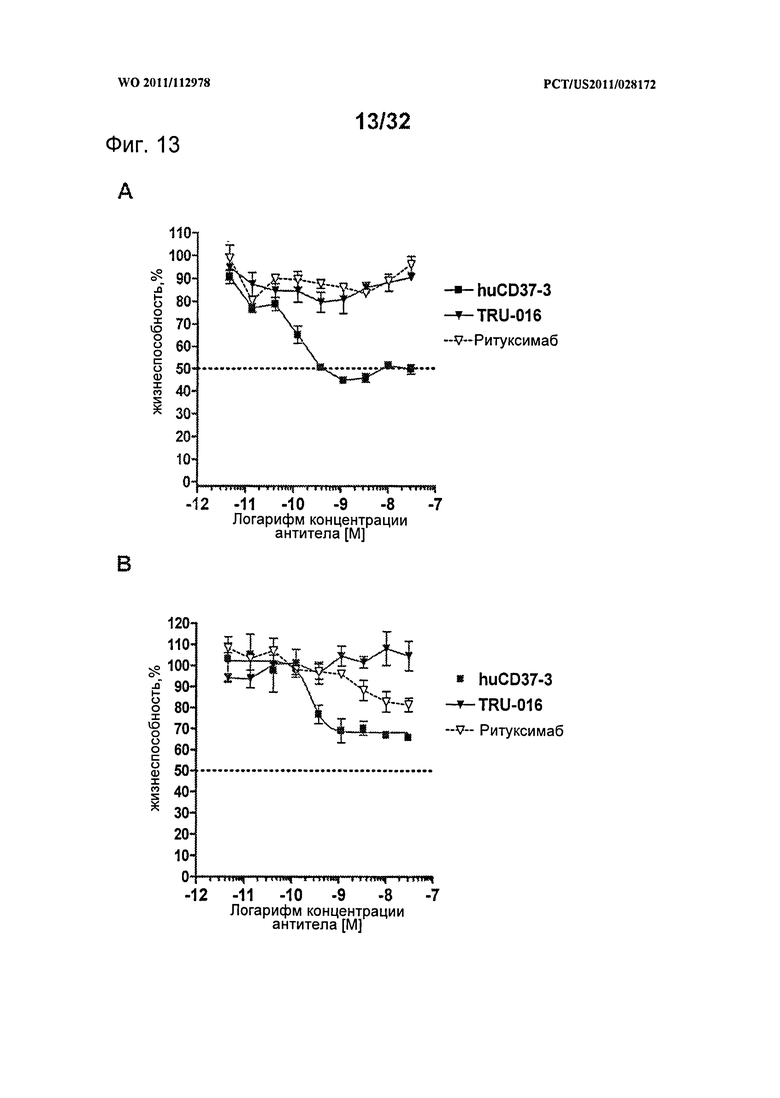
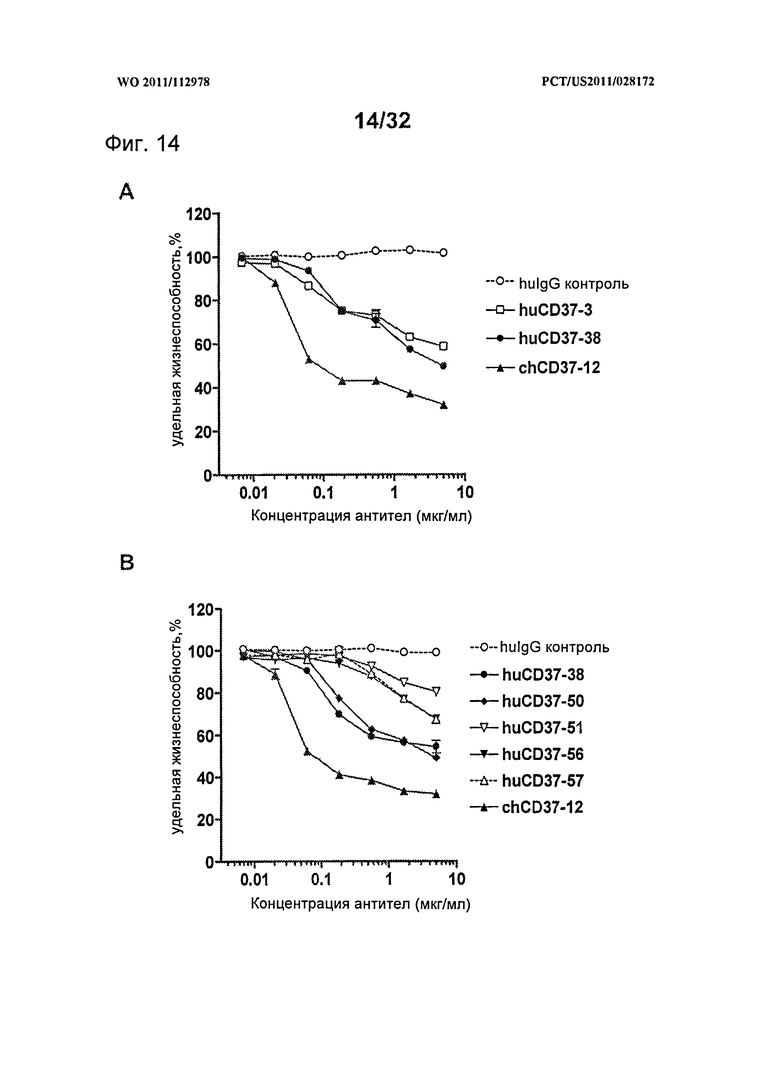
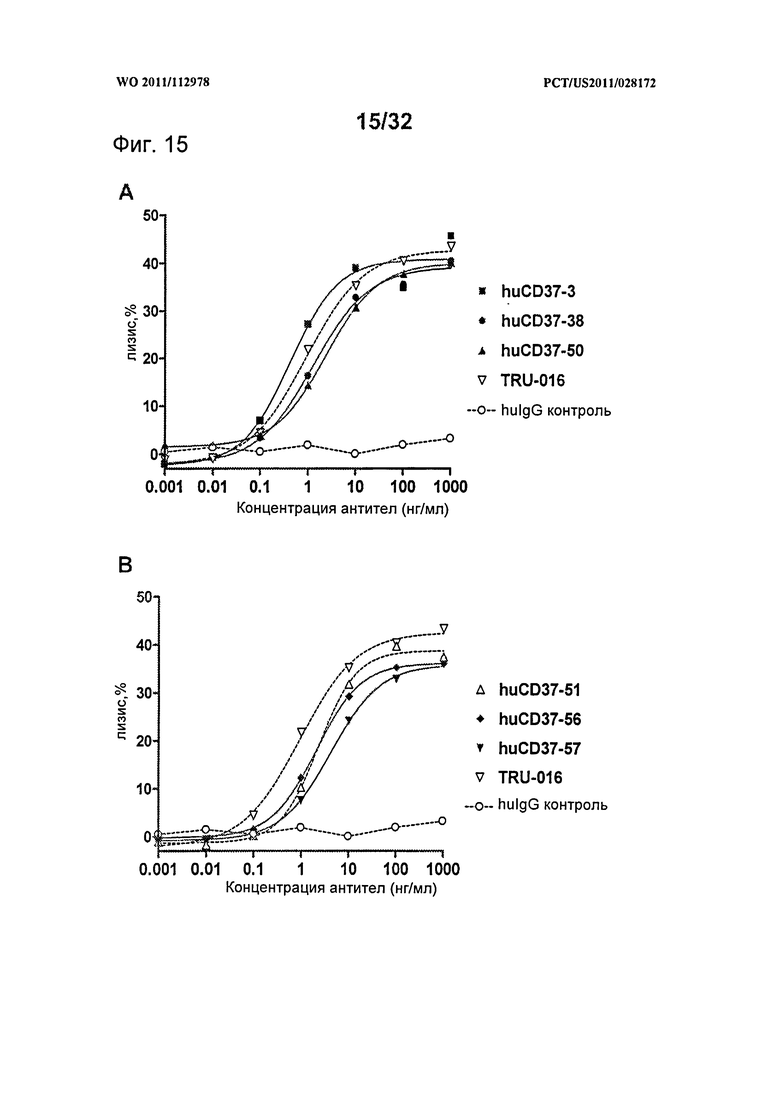

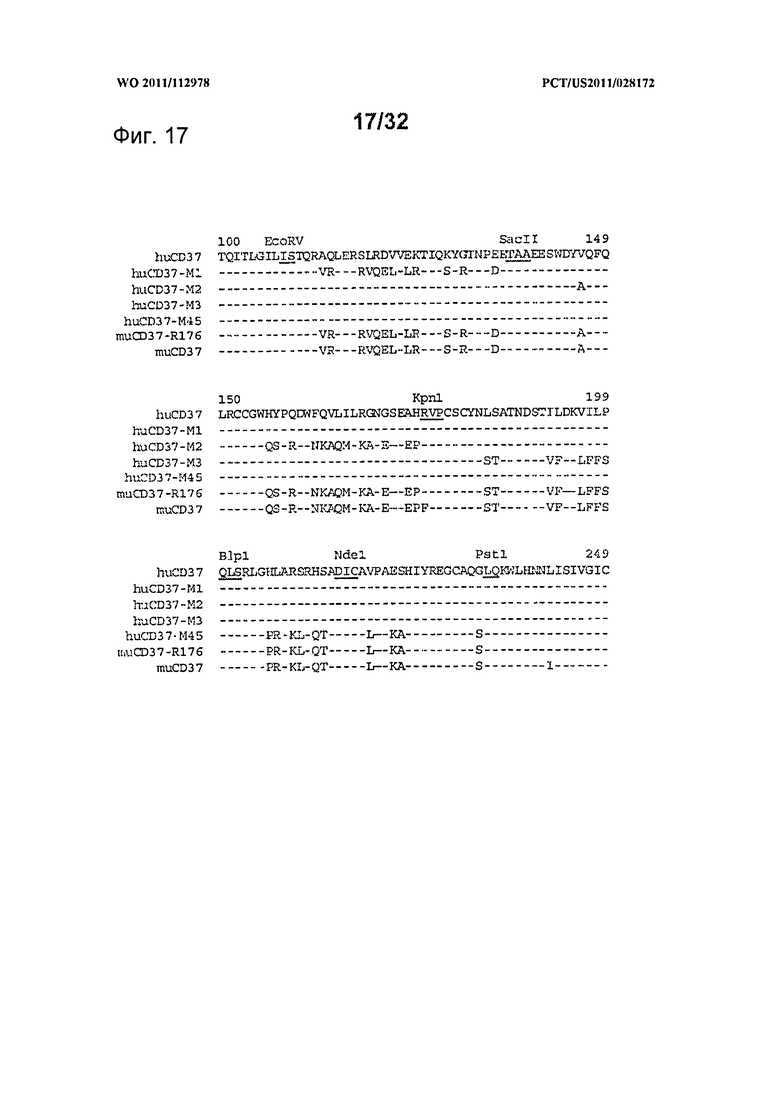
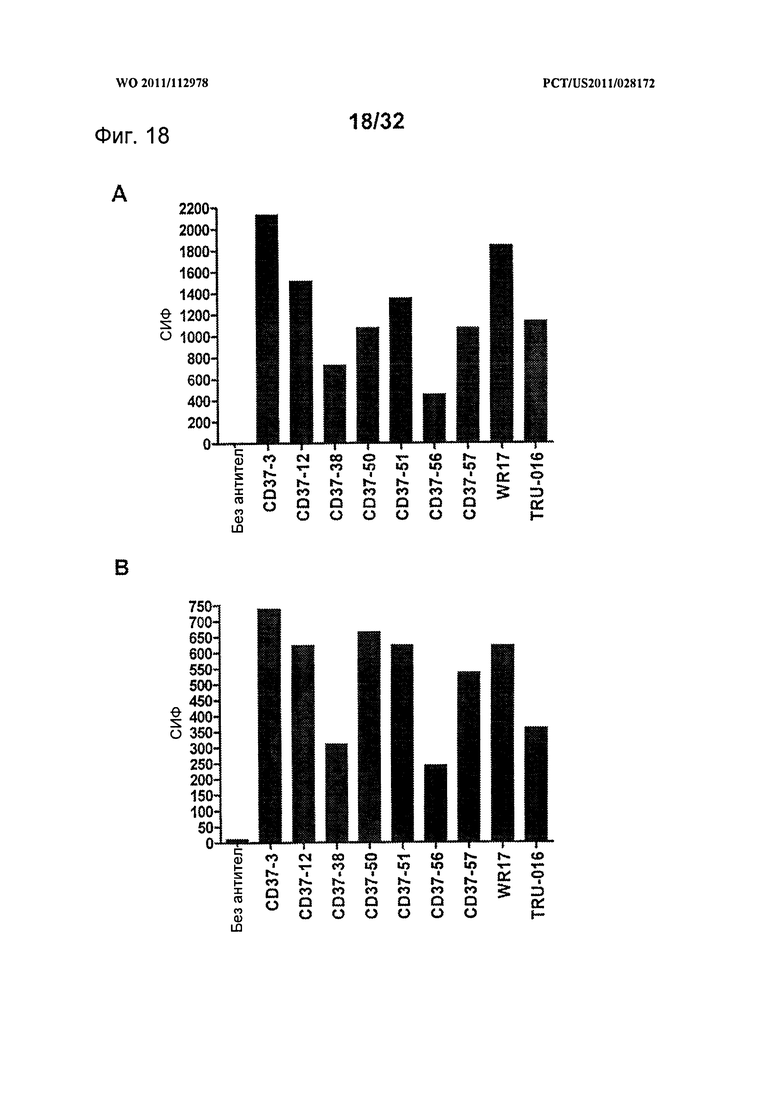
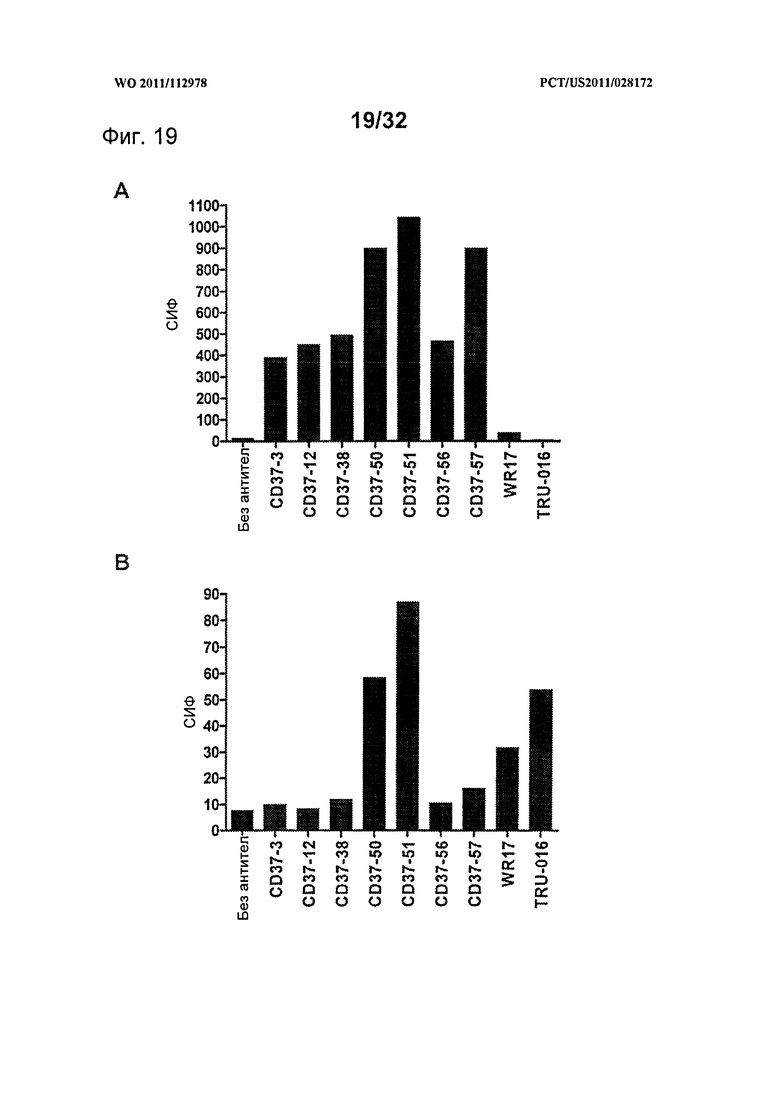
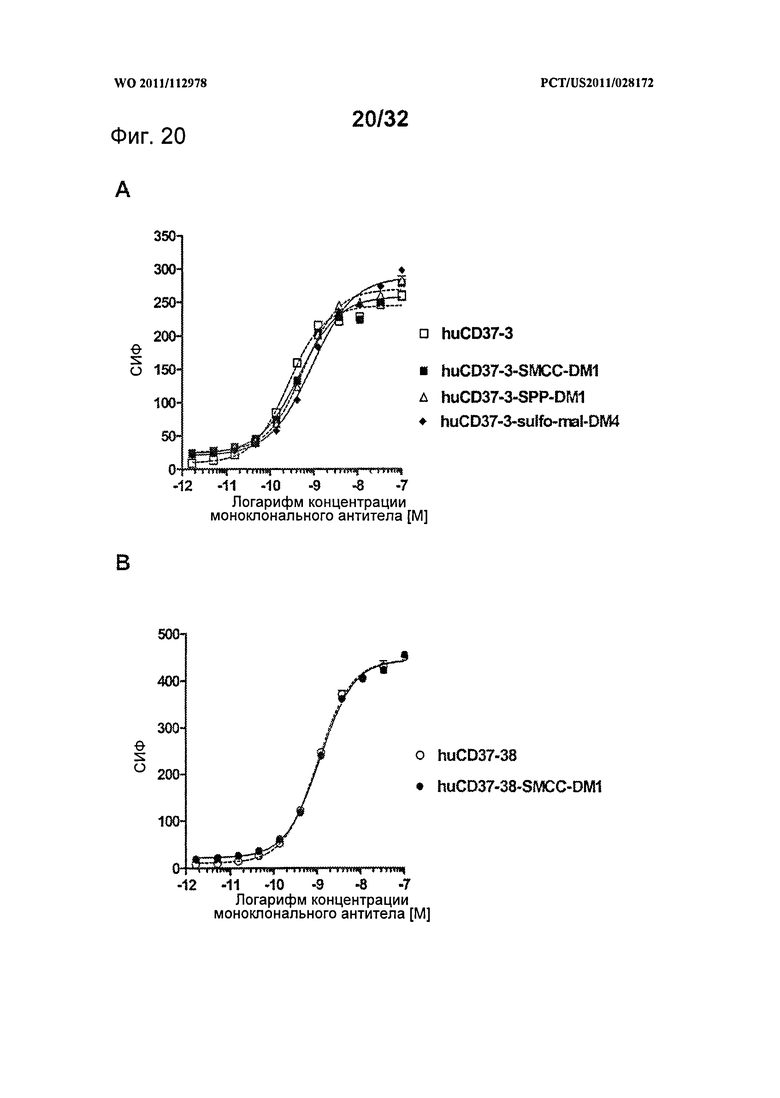
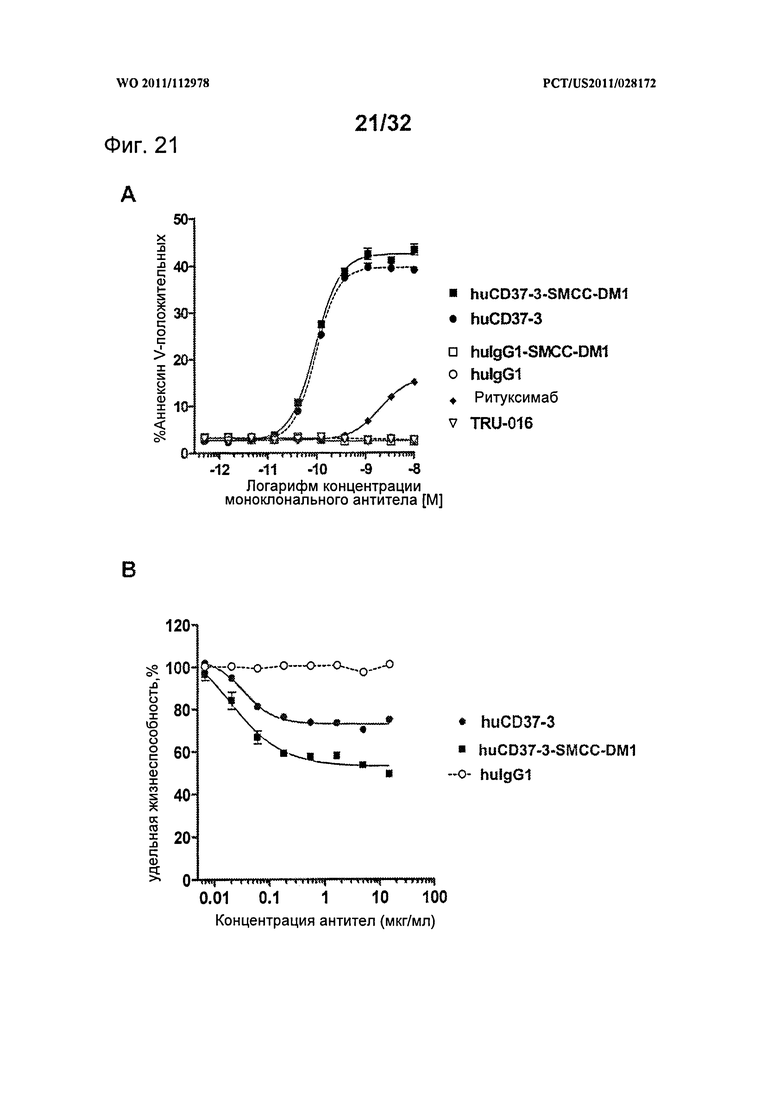
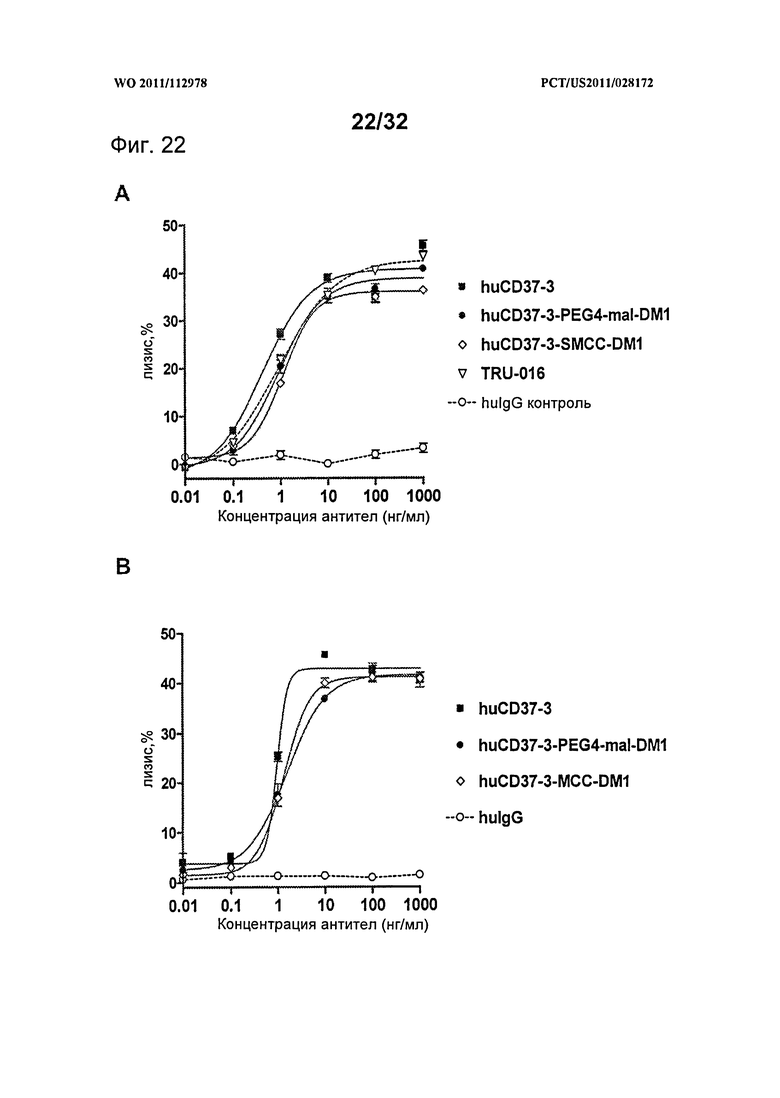
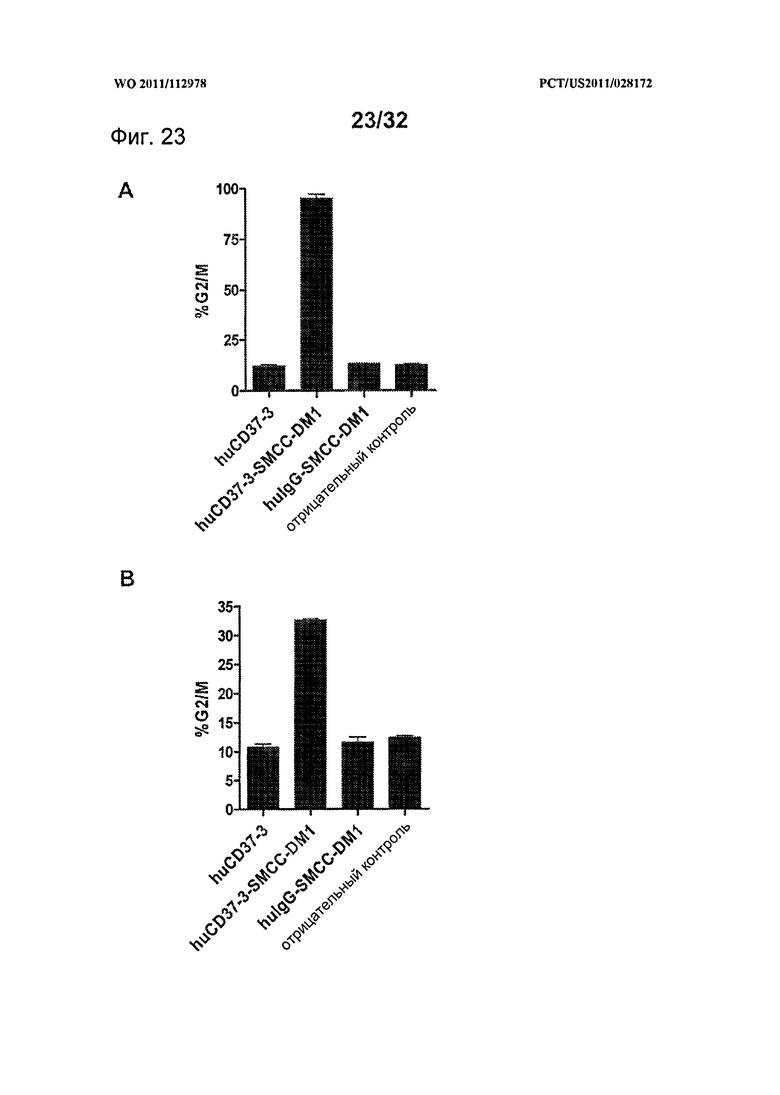
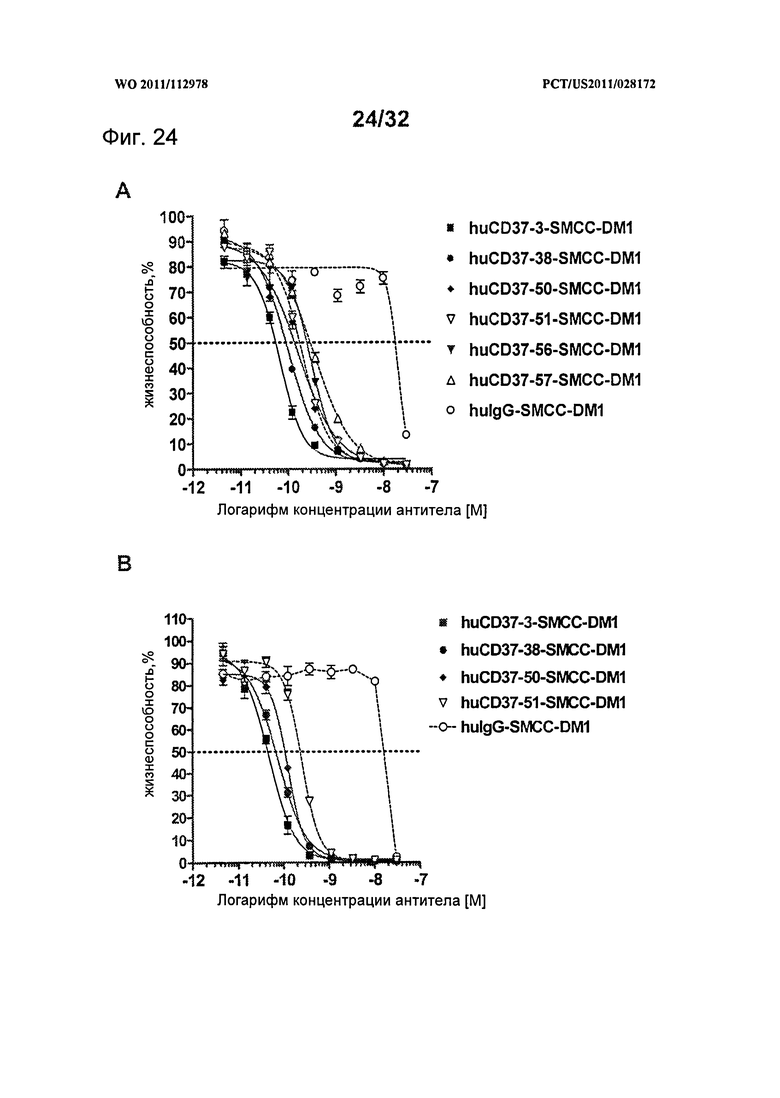
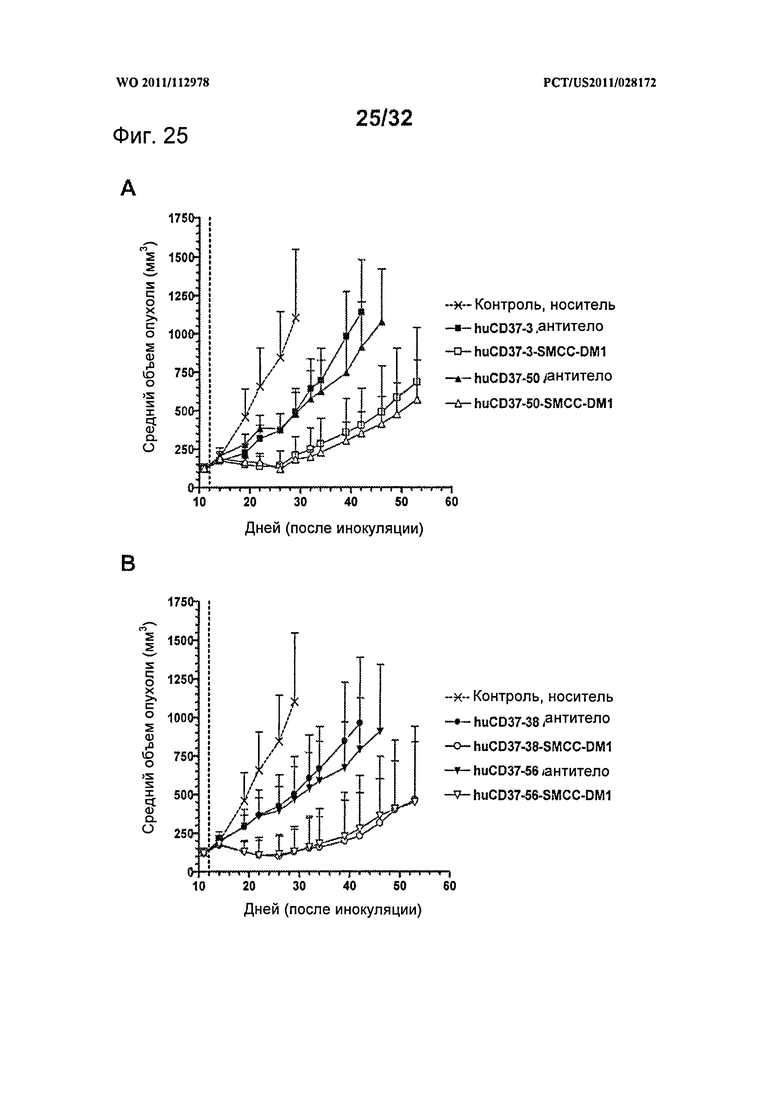
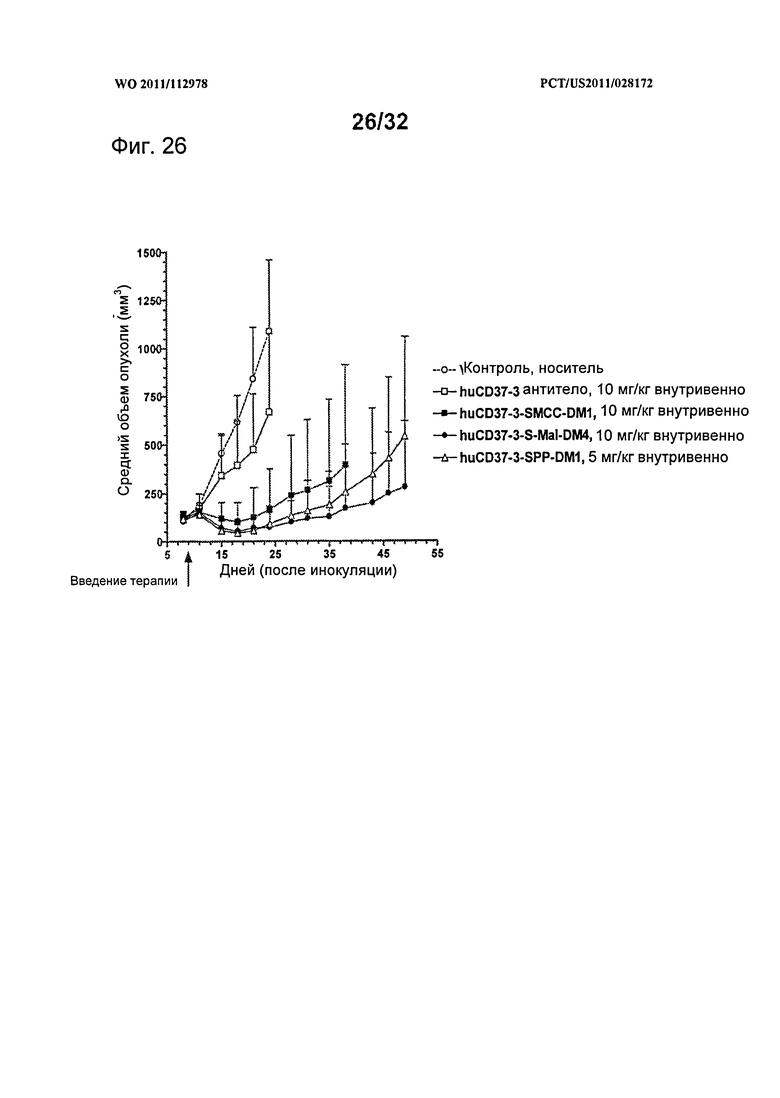
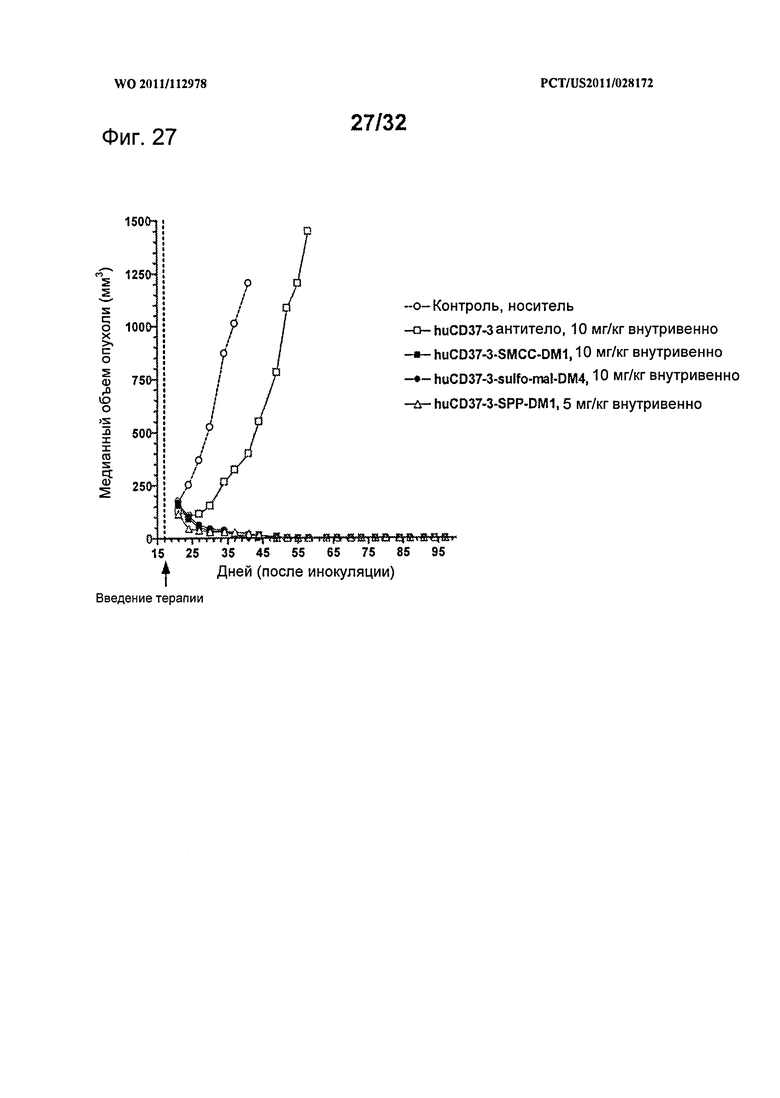
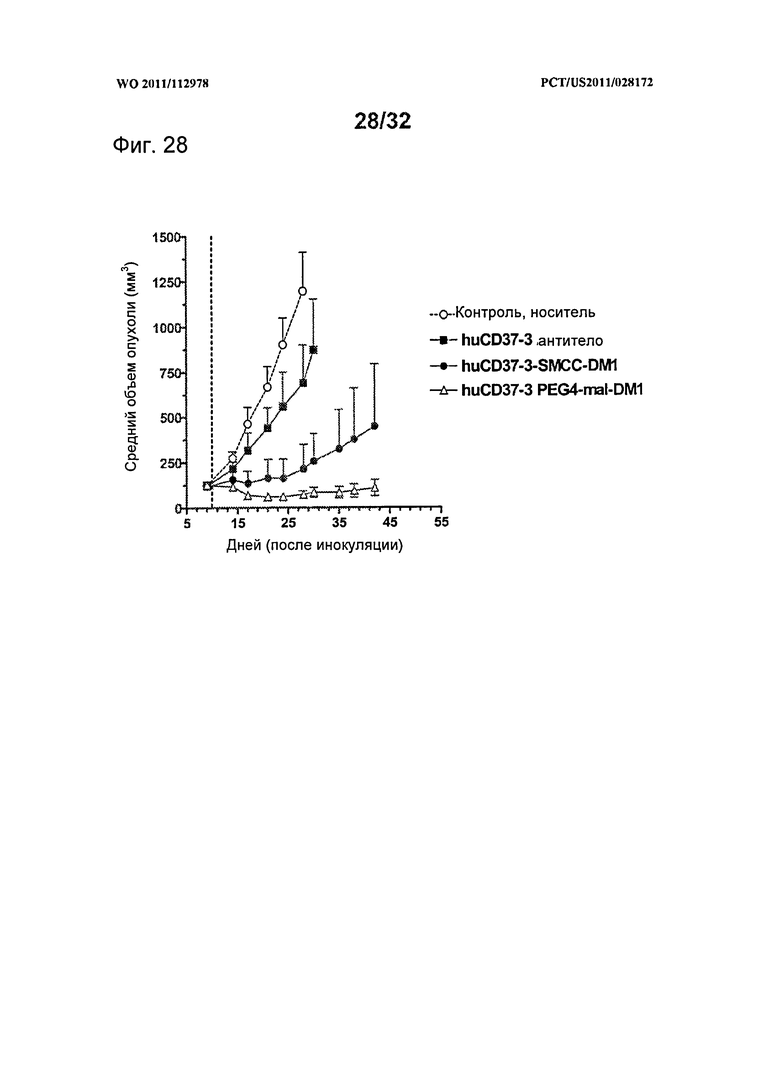
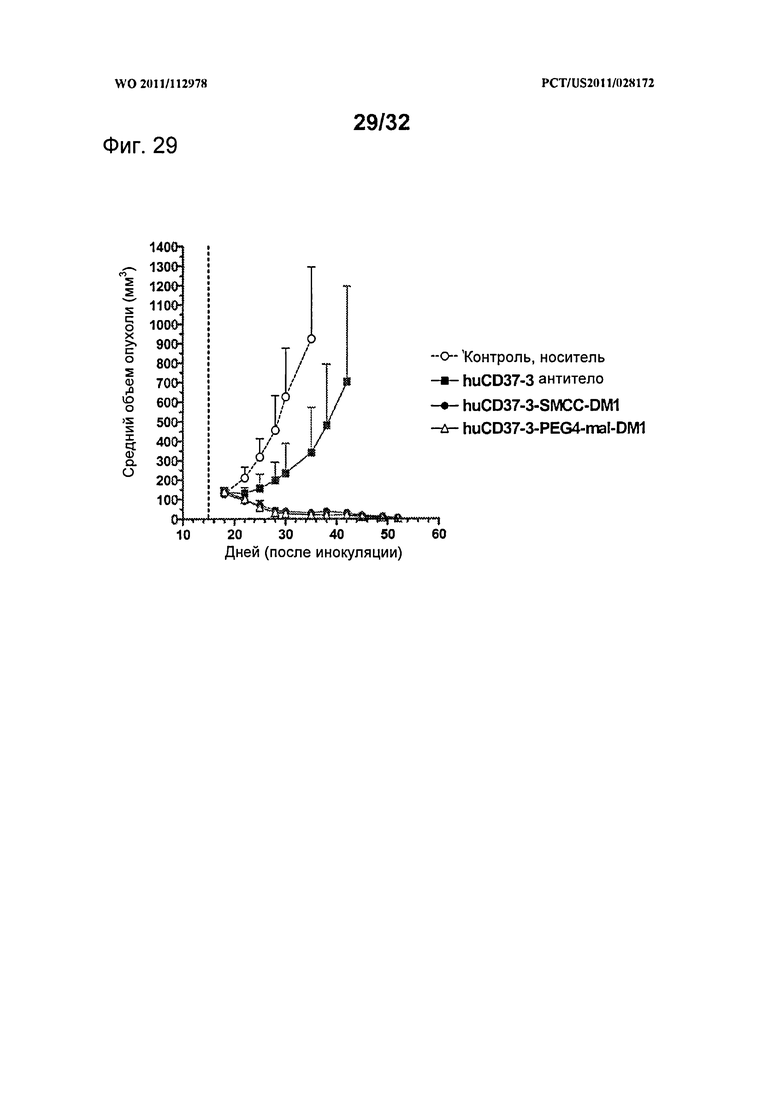
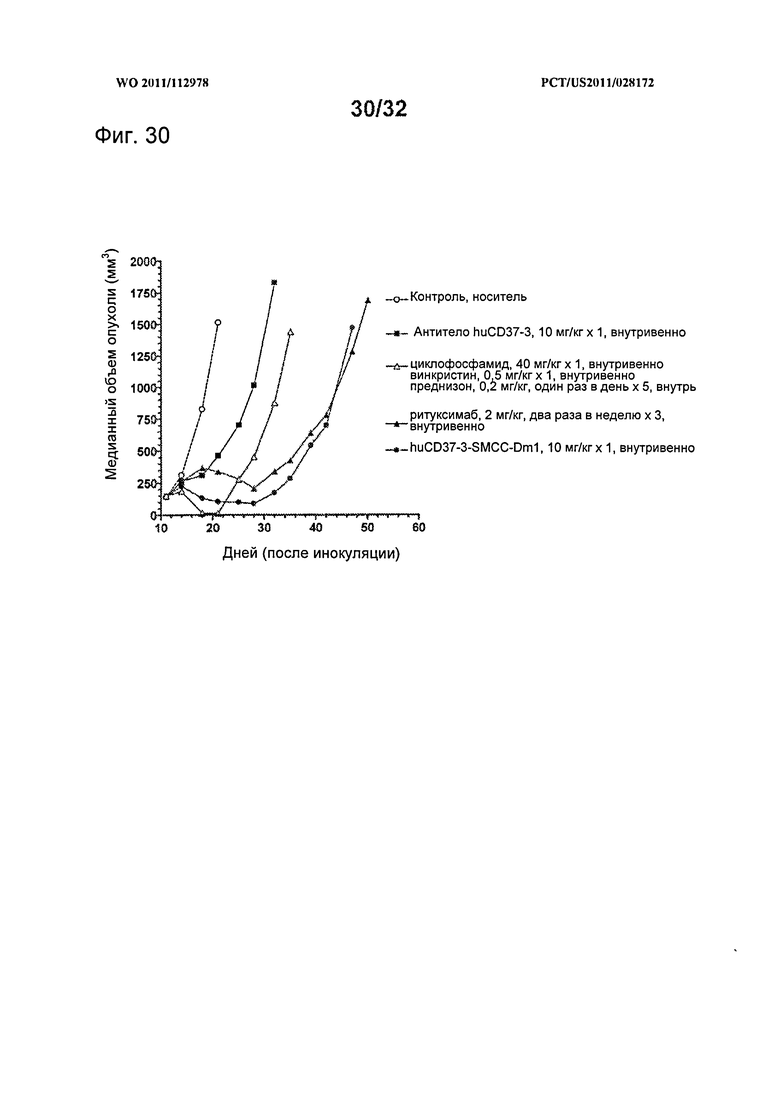
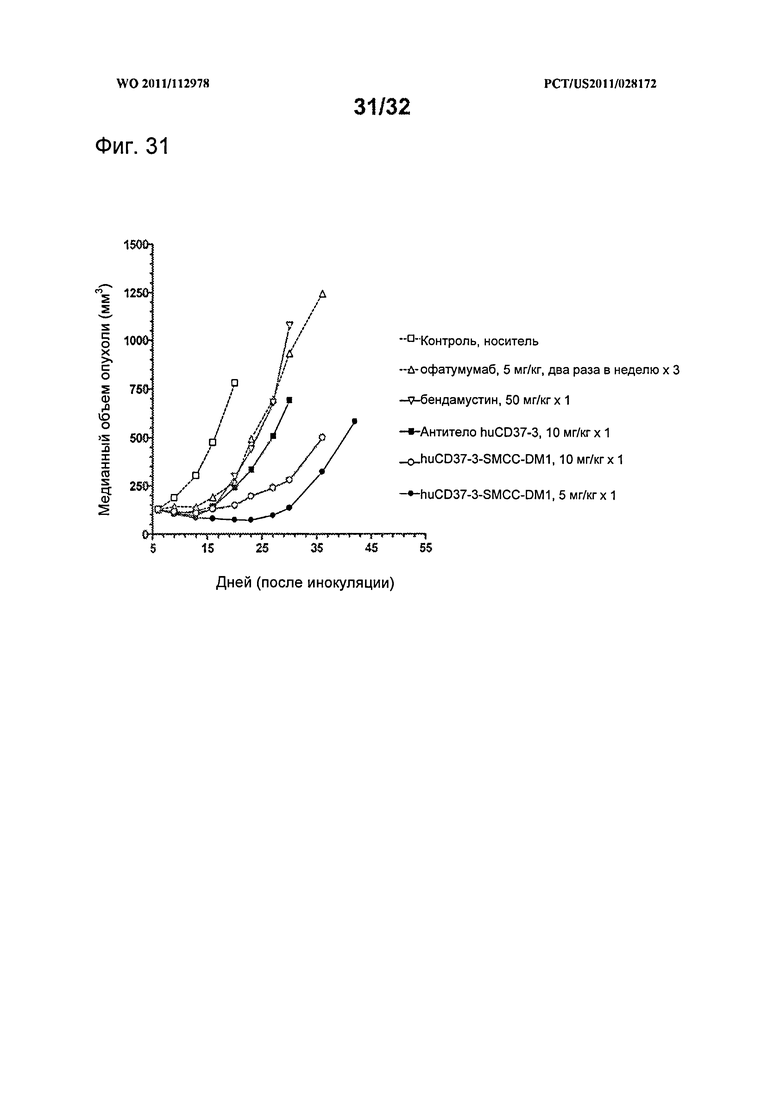
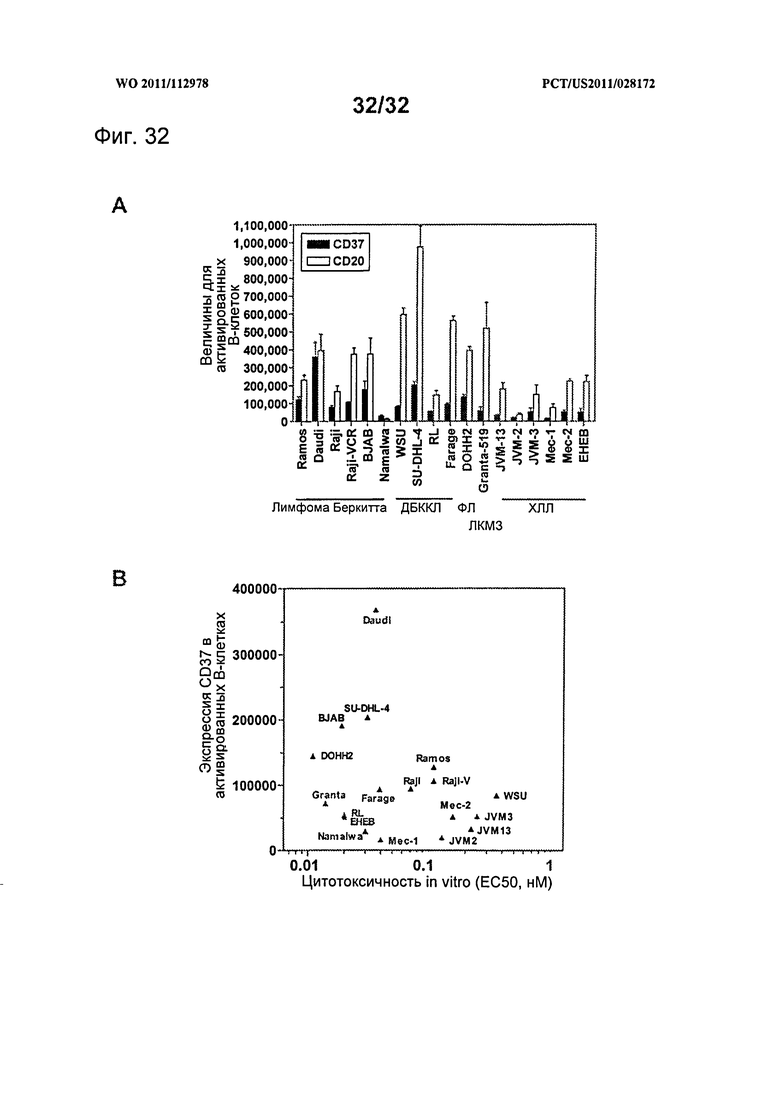
Изобретение относится к области биотехнологии и иммунологии. Описаны антитела, специфично связывающиеся с CD37 человека и CD37 макаки. Также описан иммуноконъюгат, состоящий из антитела и цитотоксического агента, и применение антитела или иммуноконъюгата для лечения онкологического заболевания. Предложенная группа изобретений может быть использована в медицине. 7 н. и 18 з.п. ф-лы, 32 ил., 11 табл., 17 пр.
1. Антитело или его антигенсвязывающий фрагмент, специфично связывающиеся с CD37 человека и CD37 макаки, причем указанное антитело или его антигенсвязывающий фрагмент содержит аминокислотные последовательности вариабельной области CDR1, CDR2 и CDR3 тяжелой цепи и легкой цепи, выбранные из группы, состоящей из:
(а) SEQ ID NO: 10, 11, и 12 и SEQ ID NO: 34, 35, и 36, соответственно;
(б) SEQ ID NO: 13, 14, и 15 и SEQ ID NO: 37, 38, и 39, соответственно;
(в) SEQ ID NO: 13, 14, и 15 и SEQ ID NO: 37, 40, и 39, соответственно;
(г) SEQ ID NO: 16, 17, и 18 и SEQ ID NO: 41, 42, и 43, соответственно;
(д) SEQ ID NO: 19, 20, и 21 и SEQ ID NO: 44, 45, и 46, соответственно;
(е) SEQ ID NO: 19, 20, и 21 и SEQ ID NO: 44, 47, и 46, соответственно;
(ж) SEQ ID NO: 22, 23, и 24 и SEQ ID NO: 48, 49, и 50, соответственно;
(з) SEQ ID NO: 22, 23, и 24 и SEQ ID NO: 48, 51, и 50, соответственно; и
(и) SEQ ID NO: 25, 26, и 27 и SEQ ID NO: 52, 53, и 54, соответственно.
2. Антитело или его антигенсвязывающий фрагмент по п. 1, отличающиеся тем, что указанные антитело или антигенсвязывающий фрагмент антитела способны индуцировать антитело-зависимую клеточную цитотоксичность (АЗКЦ).
3. Антитело или его антигенсвязывающий фрагмент по п. 1, отличающиеся тем, что указанные антитело или антигенсвязывающий фрагмент антитела, специфично связывающиеся с CD37, также специфично связываются с полипептидом, имеющим последовательность SEQ ID NO: 180, и не связываются с полипептидом, имеющим последовательность SEQ ID NO: 184.
4. Антитело или его антигенсвязывающий фрагмент по п. 1, отличающиеся тем, что указанное антитело или его антигенсвязывающий фрагмент содержит аминокислотные последовательности, по меньшей мере на 90% идентичные полипептидным последовательностям, выбранным из группы, состоящей из:
(а) SEQ ID NO: 61 и SEQ ID NO: 77;
(б) SEQ ID NO: 62 и SEQ ID NO: 78;
(в) SEQ ID NO: 63 и SEQ ID NO: 79;
(г) SEQ ID NO: 197 и SEQ ID NO: 80;
(д) SEQ ID NO: 65 и SEQ ID NO: 81;
(е) SEQ ID NO: 66 и SEQ ID NO: 82;
(ж) SEQ ID NO: 67 и SEQ ID NO: 83;
(з) SEQ ID NO: 68 и SEQ ID NO: 84;
(и) SEQ ID NO: 69 и SEQ ID NO: 85;
(к) SEQ ID NO: 70 и SEQ ID NO: 86; и
(л) SEQ ID NO: 71 и SEQ ID NO: 87.
5. Антитело или его антигенсвязывающий фрагмент по п. 4, отличающиеся тем, что указанное антитело или его антигенсвязывающий фрагмент содержит аминокислотные последовательности, выбранные из группы, состоящей из:
(а) SEQ ID NO: 63 и SEQ ID NO: 79;
(б) SEQ ID NO: 65 и SEQ ID NO: 81;
(в) SEQ ID NO: 67 и SEQ ID NO: 83;
(г) SEQ ID NO: 69 и SEQ ID NO: 85; и
(д) SEQ ID NO: 71 и SEQ ID NO: 87.
6. Антитело или его антигенсвязывающий фрагмент по п. 5, отличающиеся тем, что указанное антитело или его антигенсвязывающий фрагмент содержит аминокислотные последовательности SEQ ID NO: 65 и SEQ ID NO: 81.
7. Антитело или его антигенсвязывающий фрагмент по п. 1, отличающиеся тем, что указанное антитело или его антигенсвязывающий фрагмент является перестроенным.
8. Антитело или его антигенсвязывающий фрагмент по п. 1, отличающиеся тем, что указанное антитело получено из гибридомы, выбранной из группы, состоящей из: депонента АТСС номер РТА-10667, депонированного АТСС 18 февраля 2010; депонента АТСС номер РТА-10666, депонированного АТСС 18 февраля 2010; депонента АТСС номер РТА-10668, депонированного АТСС 18 февраля 2010; депонента АТСС номер РТА-10669, депонированного АТСС 18 февраля 2010; и депонента АТСС номер РТА-10670, депонированного АТСС 18 февраля 2010.
9. Иммуноконъюгат, подходящий для лечения онкологического заболевания, имеющий формулу (А) - (L) - (С) или (С) - (L) - (А), где:
(А) представляет собой антитело или его антигенсвязывающий фрагмент по любому из пп. 1-8;
(L) представляет собой линкер; и
(С) является цитотоксическим агентом,
причем указанный линкер (L) связывает (А) с (С).
10. Иммуноконъюгат по п. 9, отличающийся тем, что указанный линкер выбран из группы, состоящей из: N-сукцинимидил 4-(2-пиридилдитио)пентаноата (SPP) или N-сукцинимидил 4-(2-пиридилдитио)-2-сульфопентаноата (сульфо-SPP); N-сукцинимидил 4-(2-пиридилдитио)бутаноата (SPDB) или N-сукцинимидил 4-(2-пиридилдитио)-2-сульфобутаноата (сульфо-SPDB); N-сукцинимидил 4-(малеимидометил) циклогексанкарбоксилата (SMCC); N-сульфосукцинимидил 4-(малеимидометил) циклогексанкарбоксилата (сульфоSMCC); N-сукцинимидил-4-(иодоацетил)-аминобензоата (SIAB); и N-сукцинимидил-[(N-малеимидопропионамидо)-тетраэтиленгликолевого]эфира (NHS-PEG4-малеимида).
11. Иммуноконъюгат по п. 9, отличающийся тем, что цитотоксический агент представляет собой майтанзиноид, выбранный из группы, состоящей из: N(2')-деацетил-N(2')-(3-меркапто-1-оксопропил)-майтансина (DM1) и N(2')-деацетил-N(2')-(4-меркапто-4-метил-1-оксопентил)-майтансина (DM4).
12. Иммуноконъюгат по п. 9, отличающийся тем, что (А) представляет собой антитело, содержащее вариабельную область тяжелой цепи, имеющую последовательность SEQ ID NO: 65, и вариабельную область легкой цепи, имеющую последовательность SEQ ID NO: 81.
13. Иммуноконъюгат по п. 12, отличающийся тем, что указанный (L) представляет собой N-сукцинимидил 4-(малеимидометил) циклогексанкарбоксилат (SMCC); и указанный (С) представляет собой N(2')-деацетил-N(2')-(3-меркапто-1-оксопропил)-майтансин (DM1).
14. Иммуноконъюгат по п. 9, отличающийся тем, что (А) представляет собой антитело, содержащее вариабельную область тяжелой цепи, имеющую последовательность SEQ ID NO: 65, и вариабельную область легкой цепи, имеющую последовательность SEQ ID NO: 81.
15. Иммуноконъюгат по п. 14, отличающийся тем, что указанный (L) представляет собой N-сукцинимидил 4-(малеимидометил) циклогексанкарбоксилат (SMCC); и указанный (С) представляет собой N(2')-деацетил-N(2')-(3-меркапто-1-оксопропил)-майтансин (DM1).
16. Выделенный полинуклеотид, который кодирует полипептид вариабельной области тяжелой цепи антитела или его антигенсвязывающего фрагмента по п. 1, представленный в SEQ ID NO: 63, 65, 67, 69 и 71.
17. Выделенный полинуклеотид, который кодирует полипептид вариабельной области легкой цепи антитела или его антигенсвязывающего фрагмента по п. 1, представленный в SEQ ID NO: 79, 81, 83, 85 и 87.
18. Диагностический реагент, подходящий для определения наличия CD37, содержащий антитело или его антигенсвязывающий фрагмент по любому из пп. 1-8, снабженное меткой.
19. Фармацевтическая композиция, подходящая для лечения онкологического заболевания, содержащая терапевтически эффективное количество антитела или его антигенсвязывающего фрагмента по любому из пп. 1-8 и фармацевтически приемлемый носитель.
20. Фармацевтическая композиция по п. 19, отличающаяся тем, что антитело или его антигенсвязывающий фрагмент конъюгирован с цитотоксическим агентом посредством линкера.
21. Фармацевтическая композиция по п. 20, отличающаяся тем, что антитело или его антигенсвязывающий фрагмент содержат в среднем от приблизительно 3 до приблизительно 4 цитотоксических агентов на антитело или антигенсвязывающий фрагмент.
22. Применение антитела или его антиген-связывающего фрагмента по любому из пп. 1-8 в изготовлении лекарственного средства для лечения онкологического заболевания.
23. Применение по п. 22, отличающееся тем, что онкологическое заболевание представляет собой лейкемию или лимфому.
24. Применение по п. 22, отличающееся тем, что антитело или его антигенсвязывающий фрагмент конъюгированы с цитотоксическим агентом посредством линкера.
25. Применение по п. 22, отличающееся тем, что онкологическое заболевание выбрано из группы, состоящей из следующего: В-клеточные лимфомы, НХЛ, лимфобластный лейкоз/лимфома из предшественников В-клеток и неоплазии зрелых В-клеток, В-клеточная хроническая лимфоцитная лейкемия (ХЛЛ)/мелкоклеточная лимфоцитарная лимфома (МЛЛ), В-клеточная пролимфоцитная лейкемия, лимфоплазмацитная лимфома, лимфома клеток мантийной зоны (ЛКМЗ), фолликулярная лимфома (ФЛ), низкодифференцированная, среднедифференцированная и высокодифференцированная ФЛ, кожная фолликулярная лимфома, В-клеточная лимфома маргинальной зоны, В-клеточная лимфома маргинальной зоны MALT-типа, В-клеточная лимфома маргинальной зоны узлового типа, В-клеточная лимфома маргинальной зоны селезеночного типа, волосатоклеточный лейкоз (ВКЛ), диффузная В-крупноклеточная лимфома, лимфома Беркитта, плазмацитома, плазмаклеточная миелома, посттрансплантационное лимфопролиферативное расстройство, макроглобулинемия Вальденстрема и анапластическая крупноклеточная лимфома (АККЛ).
| WO 2007014278 A2, 01.02.2007 | |||
| US 20100034820 A1, 11.02.2010 | |||
| WO 2009126944 A1, 15.10.2009 | |||
| ROBAK T | |||
| ET AL., TRU-016, a humanized anti-CD37 IgG fusion protein for the potential treatment of B-cell malignancies, Curr Opin Investig Drugs | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| Устройство для соединения камер пневматических секционных шин | 1924 |
|
SU1383A1 |
| US2008227198 A1, 18.09.2008 | |||
| WO2009019312 A2, 12.09.2009 | |||
| Приспособление к прессу для периодической подачи материала посредством вальцев | 1926 |
|
SU7905A1 |
Авторы
Даты
2017-02-14—Публикация
2011-03-11—Подача