Перекрестная ссылка на родственные заявки
Настоящая заявка притязает на приоритет предварительной заявки на патент США 61/016630, поданной 26 декабря 2007 г., которая полностью включена в настоящее описание изобретения ссылкой.
Область техники, к которой относится изобретение
Настоящее изобретение относится к улучшенным агентам против антигена CD138, а также к композициям, включающим агент против антигена, и способам их применения.
Уровень техники
CD138, действующий в качестве рецептора внеклеточного матрикса, сверхэкспрессирован на клетках множественной миеломы (ММ) и, как было установлено, влияет на развитие и/или пролиферацию клеток ММ. CD138 экспрессирован также на клетках карциномы яичника, карциномы почки, карциномы желчного пузыря, карциномы молочной железы, рака предстательной железы, рака легкого, карциномы ободочной кишки, лимфомы Ходжкина и неходжкинской лимфомы, хронического лимфолейкоза (CLL) и многих других.
Публикации и другие материалы, включая патенты, использованные в настоящем описании изобретения для иллюстрации изобретения и, в частности, для более подробного описания возможностей осуществления настоящего изобретения, включены в качестве ссылки. Публикации, приведенные в нижеследующем описании изобретения только с указанием автора и даты публикации, перечислены в алфавитном порядке по имени автора в прилагаемом библиографическом разделе.
Тассон и др. (2004) сообщили в превосходном связывании антитела В-В4 IgG1 мыши с антигеном CD138, экспрессированным на поверхности клеток ММ. Тассон также отметил высокую цитотоксическую активность иммуноконъюгата В-В4-DM1, включающего митанзиноид DM1 в качестве эффекторной молекулы, против клеток множественной миеломы (см. также публикацию патента США 20070183971).
Существует потребность в агенте против клетки-мишени, в частности в антителе против клетки-мишени, созданном на основе антитела В-В4, у которого отсутствуют определенные свойства и/или функции, характерные для антитела В-В4. Такое антитело против клетки-мишени может включать одну или несколько областей человеческого антитела. В частности, существует потребность в химерном антителе, созданном на основе антитела В-В4, которое связывается с CD138 так же эффективно, как В-В4, но может быть введено человеку без возникновения значительных побочных эффектов. Кроме того, существует потребность в агенте против клетки-мишени, обладающем сродством связывания, которое выше сродства связывания антитела В-В4. Существует также потребность в агенте против клетки-мишени, созданном на основе антитела В-В4, который обладает одним или несколькими благоприятными свойствами по сравнению с мышиным антителом. Такие свойства включают лучшее связывание с антигеном, в частности с CD138-экспрессирующими опухолевыми клетками и А-клетками, или более гомогенное связывание.
Сущность изобретения
Настоящее изобретение относится к способу гомогенного связывания с CD138, который включает
получение генетически созданного антитела против клетки-мишени, включающего
антигенсвязывающую область против CD138, выделенную из антитела, отличного от человеческого, и
дополнительную область антитела, по крайней мере часть которой выделена из человеческого антитела, и
введение указанного генетически созданного антитела против CD138-экспрессирующих клеток, которое гомогенно связывается с CD138, экспрессированным на указанных CD138-экспрессирующих клетках.
Настоящее изобретение относится также к выделенному полипептиду, включающему аминокислотную последовательность тяжелой цепи иммуноглобулина или ее части, которая по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 98% идентична SEQ ID NO:1, при этом агент против клетки-мишени, включающий тяжелую цепь иммуноглобулина или ее часть, направленно воздействует на CD138.
Последовательность указанной тяжелой цепи иммуноглобулина или ее части может быть по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% идентична остаткам 31-35, остаткам 51-68 и остаткам 99-111 SEQ ID NO:1, и указанный агент против клетки-мишени может быть генетически созданным антителом против клетки-мишени.
Константная область указанной тяжелой цепи иммуноглобулина или ее части может быть константной областью изотипа IgG4.
Указанный агент против клетки-мишени может быть химерным антителом ”мышь-человек”.
Указанный агент против клетки-мишени или генетически созданное антитело против клетки-мишени может быть гуманизированным антителом.
Выделенный полипептид может далее включать аминокислотную последовательность легкой цепи иммуноглобулина или ее части, которая по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 98% идентична SEQ ID NO:2.
Выделенный полипептид может далее включать аминокислотную последовательность легкой цепи иммуноглобулина или ее части, которая по меньшей мере на 75%, по меньшей мере на 85%, по меньшей мере на 95% или по меньшей мере на 97% идентична остаткам 24-34, остаткам 50-56 и остаткам 89-97 SEQ ID NO:2.
Указанная тяжелая цепь иммуноглобулина может быть идентична последовательности SEQ ID NO:1.
Указанная легкая цепь иммуноглобулина может быть идентична последовательности SEQ ID NO:2.
Настоящее изобретение относится также к генетически созданному антителу против клетки-мишени, узнающему CD138, которое включает
антигенсвязывающую область против CD138, выделенную из антитела, отличного от человеческого, и
дополнительную область антитела, по меньшей мере часть которой выделена из антитела, отличного от человеческого, при этом указанное генетически созданное антитело против клетки-мишени
(а) связывается с CD138 со сродством связывания, которое выше сродства связывания указанного антитела, отличного от человеческого; и/или
(b) обеспечивает гомогенное связывание с CD138 на CD138-экспрессирующих клетках.
Указанная дополнительная область антитела может быть по меньшей мере одной константной областью, включающей константную область тяжелой цепи или ее части, выделенную из человеческого антитела, при этом указанное генетически созданное антитело относится к изотипу IgG4.
Указанное генетически созданное антитело против клетки-мишени может быть химерным антителом, и указанное антитело, отличное от человеческого, может быть антителом В-В4.
Указанное генетически созданное антитело против клетки-мишени может быть гуманизированным антителом, и указанное антитело, отличное от человеческого, может быть антителом В-В4.
Последовательность указанной тяжелой цепи может быть по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 98% идентична SEQ ID NO:1.
Указанное генетически созданное антитело против клетки-мишени может включать по меньшей мере одну легкую цепь, последовательность которой по меньшей мере на 70%, по меньшей мере на 80%, по меньшей на 90%, по меньшей мере на 95% или по меньшей мере на 98% идентична SEQ ID NO:2.
Последовательность указанной тяжелой цепи может быть по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 100% идентична остаткам 31-35, остаткам 51-68 и/или остаткам 99-111 SEQ ID NO:1. Последовательность указанной тяжелой цепи может быть по меньшей мере на 75%, по меньшей мере на 85%, по меньшей мере на 95%, по меньшей мере на 97% или 100% идентичная остаткам 24-34, остаткам 50-56 и/или остаткам 89-97 SEQ ID NO:2.
Дополнительная область антитела может включать
(а) аминокислотные остатки 123-448 SEQ ID NO:1 и/или
(b) аминокислотные остатки 108-214 SEQ ID NO:2 и их мутации, которые сохраняют или снижают антителозависимую цитотоксичность и/или комплементзависимую цитотоксичность генетически созданного антитела против клетки-мишени и/или стабилизируют генетически созданное антитело против клетки-мишени.
Указанная дополнительная область антитела может быть константной областью тяжелой цепи человеческого антитела.
Указанное генетически созданное антитело против клетки-мишени может связываться с CD138 с изменчивостью направленного воздействия менее 150%, 140%, 130%, 120%, 110%, 100%, 90%, 80%, 70%, 60% или 50%.
Последовательность указанной тяжелой цепи может быть по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 98% идентична SEQ ID NO:1.
Указанное генетически созданное антитело против клетки-мишени может включать по меньшей мере одну легкую цепь, последовательность которой по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 98% идентична SEQ ID NO:2.
Последовательность указанной тяжелой цепи может быть по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% идентична остаткам 31-35, остаткам 51-68 и остаткам 99-111 SEQ ID NO:1.
Последовательность указанной тяжелой цепи может быть по меньшей мере на 75%, по меньшей мере на 85%, по меньшей мере на 95% или по меньшей мере на 97% идентична остаткам 24-34, остаткам 50-56 и остаткам 89-97 SEQ ID NO:2.
Настоящее изобретение относится также к фармацевтической композиции, включающей или по существу состоящей из генетически созданного антитела против клетки-мишени и фармацевтически приемлемого носителя.
Гибридома, продуцирующая генетически созданное антитело против клетки-мишени, также входит в объем настоящего изобретения.
Настоящее изобретение относится также к анализу на основе антитела, который включает генетически созданное антитело против клетки-мишени.
Настоящее изобретение относится к генетически созданному антителу против клетки-мишени по настоящему изобретению, предназначенному для использования в медицине. В частности, указанное генетически созданное антитело против клетки-мишени включает
антигенсвязывающую область против CD138, выделенную из антитела, отличного от человеческого, и
дополнительную область антитела, по крайней мере часть которой выделена из человеческого антитела.
Генетически созданное антитело против клетки-мишени, в частности, предназначено для использования при лечении, направленно воздействующем на опухолевые клетки.
Настоящее изобретение относится также к применению генетически созданного антитела против клетки-мишени по настоящему изобретению для приготовления лекарственного средства для направленного воздействия на опухолевые клетки. В частности, генетически созданное антитело против клетки-мишени включает
антигенсвязывающую область против CD138, выделенную из антитела, отличного от человеческого, и
дополнительную область антитела, по меньшей мере часть которой выделена из человеческого антитела.
В соответствии с медицинскими примениями по настоящему изобретению генетически созданное антитело против клетки-мишени вводят субъекту, в организме которого имеются CD138-экспрессирующие клетки. Кроме того, генетически созданное антитело против клетки-мишени может гомогенно связываться с CD138, экспрессированным на указанных CD138-экспрессирующих клетках.
Краткое описание фигур
На фиг. 1 схематически изображено антитело nBT062 с присоединенными эффекторными молекулами.
На фиг. 2 показана химическая структура ВТ062.
На фиг. 3 показано превращение ансамитоцина Р-3 в майтанзинол (стереохимия опущена для простоты восприятия).
На фиг. 4 показана типичная схема синтеза DM4.
На фиг. 5 схематически изображена конъюгация антитела (nBT062 с DM4).
На фиг. 6 показан анализ связывания nBT062-SPDB-DM4, nBT062-SPP-DM1, nBT062-SMCC-DМ1 и антитела nBT062 с клетками ОРМ-2. Клетки подвергали воздействию антитела nBT062 и конъюгатов в разных концентрациях и измеряли среднее значение флуоресценции при помощи анализа методом FACS.
На фиг. 7(А)-(D) показана цитотоксичность in vitro конъюгатов nBT062-DMx в отношении клеток MOLP-8 (CD138+) и BJAB (CD138-). Клетки культивировали на плоскодонных планшетах и инкубировали с иммуноконъюгатами в указанных концентрациях в течение 5 дней. Реагент WST добавляли в течение дополнительных 3 часов для оценки жизнеспособности клеток. На фиг. 7(D) показан анализ цитотоксической активности иммуноконъюгата nBT062-SPDB-DM4 в присутствии или в отсутствие блокирующего антитела (1 мкМ nBT062).
На фиг. 8 показаны объемы опухолей у отдельных мышей, которым вводили (А) PBS, (В) антитело nBT062, (С) свободный DM4 или (D) конъюгат huC242-DM4 ненаправленного действия, образовавшихся в течение определенного периода времени (дни) после инокуляции опухолевыми клетками MOLP-8.
На фиг. 9 показаны объемы опухолей у отдельных мышей, которым вводили (А) PBS, (B) nBT062-SPDB-DM4, (C) B-B4-SPP-DM1 или (D) nBT062-SPP-DM1, образовавшихся в течение определенного периода времени (дни) после инокуляции опухолевыми клетками MOLP-8.
На фиг. 10 показан средний объем опухоли (± стандартное отклонение) ксенотрансплантатов клеток множественной миеломы человека MOLP-8 у мышей SCID CB.17, образовавшейся в течение определенного периода времени (дни) после инокуляции.
На фиг. 11А и В показана противоопухолевая активность nBT062-DMx в отношении CD138+ опухолевых клеток MOLP-8 в объемной модели опухоли MOLP-8 у мышей SCID. Объем опухоли выражен в виде среднего значения (± стандартное отклонение) для каждой группы.
Подробное описание разных и предпочтительных вариантов осуществления изобретения
Настоящее изобретение относится к агентам против клетки-мишени, в частности, к антителам против антигена CD138, более конкретно, к генетически созданным антителам против CD138. Иммуноконъюгаты, включающие указанные агенты против клетки-мишени, обеспечивают доставку эффекторных молекул к сайтам-мишеням и сайт-специфическое высвобождение эффекторных молекул в клетках-мишенях, тканях и органах или рядом с ними. Эффекторные молекулы могут быть активированы отщеплением/диссоциацией от агента против клетки-мишени иммуноконъюгата на сайте-мишени.
Антитела по настоящему изобретению и/или иммуноконъюгаты, включающие указанные антитела, можно вводить субъекту, нуждающемуся в терапевтическом лечении, или в клетки, выделенные у такого субъекта, нуждающегося в терапевтическом лечении. Одна или несколько эффекторных молекул могут высвобождаться из иммуноконъюгата в результате отщепления/диссоциации в клетке-мишени, ткани или органе или рядом с ними.
В качестве одного примера можно привести использование антитела nBT062 в хроматографическом анализе. Ткань субъекта фиксируют в формалине и заливают парафином. Антитело nBT062 добавляют в качестве первичного антитела, и экспрессированный на поверхности CD138 ткани связывается с указанным антителом. Добавляют детектирующее антитело, которое связывается с nBT062. На конечной стадии определяют связывание детектирующего антитела, содержащего хромоген. Антитело nBT062 используют для идентификации плазмоцитов человека в гемопоэтических клетках и, таким образом, для диагностики разных злокачественных новообразований кроветворной системы. Указанный метод позволяет также следить за развитием определенных карцином. При использовании антитела nBT062 в отличие от мышиного антитела уменьшается неспецифическое обнаружение вследствие меньшего перекрестного взаимодействия с Fc-рецепторами.
В качестве второго примера можно привести использование антитела nBT062 и иммуноконъюгата, включающего антитело nBT062 и по меньшей мере одно высокотоксичное лекарственное средство или иммунотоксин в качестве эффекторной молекулы, для введения субъекту, страдающему раком. В данном примере антитело nBT062, используемое в эффективном количестве, защищает CD138-экспрессирующие неопухолевые клетки от воздействия иммуноконъюгата, вводимого субъекту позднее внутривенно в терапевтически эффективном количестве, который концентрируется в раковых клетках. Одна или несколько эффекторных молекул высвобождаются из антитела против клетки-мишени под воздействием внешних факторов и индуцируют гибель клетки или остановку непрерывного клеточного цикла раковых клеток.
CD138 или синдекан-1 (определяемый также как SYND1, СИНДЕКАН, SDC, SCD1, АНТИГЕН CD138, номер доступа SwissProt: Р18827 человека) является мембранным гликопротеином, который, как первоначально было указано, присутствует на клетках эпителиального происхождения и затем был обнаружен на гемопоэтических клетках (Sanderson, 1989). CD138 имеет длинный внеклеточный домен, который связывается с растворимыми молекулами (например, факторами роста EGF, FGF, HGF) и нерастворимыми молекулами (например, с компонентами внеклеточного матрикса коллагеном и фибронектином) при помощи цепей сульфата гепарина (Langford, 1998; Yang, 2007) и действует в качестве рецептора внеклеточного матрикса. CD138 также опосредует межклеточную адгезию при помощи гепаринсвязывающих молекул, экспрессируемых смежными клетками. Установлено, что CD138 является корецептором факторов роста миеломных клеток (Bisping, 2006). Исследования дифференцировки плазмоцитов показали, что CD138 следует также считать дифференцировочным антигеном (Bataille, 2006).
В случае злокачественного гемопоэза антиген CD138 высоко экспрессирован на большинстве клеток ММ, клетках карциномы яичника, карциномы почки, карциномы желчного пузыря, карциномы молочной железы, рака предстательной железы, рака легкого, карциномы ободочной кишки, клетках лммфомы Ходжкина и неходжскинской лимфомы, хронического лимфолейкоза (CLL) (Horvathova, 1995), острого лимфобластного лейкоза (ALL), острого миелобластного лейкоза (AML) (Seftalioglu, 2003 (a); Deftalioglu, 2003 (b)), клетках солидных тканевых сарком, карциномы ободочной кишки и других гематологических злокачественных новообразований и солидных опухолей, экспрессирующих CD138 (Carbone et al., 1999; Sebestyen et al., 1999; Han et al., 2004; Charnaux et al., 2004; O'Connell et al., 2004; Orosz and Kopper, 2001).
Другими видами рака, которые, как было установлено, экспрессируют CD138, являются многие аденокарциномы яичника, переходно-клеточная карцинома мочевого пузыря, светлоклеточная карцинома почки, плоскоклеточная карцинома легкого, карцинома молочной железы и рак матки (см., например, публикации Davies et al., 2004; Barbareschi et al., 2003; Mennerich et al., 2004; Anttonen et al., 2001; Wijdenes, 2002).
В нормальном гематопоэтическом компартменте человека экспрессия CD138 ограниченеа плазмоцитами (Wijdenes, 1996; Chilosi, 1999), и CD138 не экспрессирован на лимфоцитах, моноцитах, гранулоцитах и эритроцитах периферической крови. В частности, CD34+ стволовые клетки и клетки-предшественники не экспрессируют CD138, и моноклональные антитела против CD138 не воздействуют на ряд колониеобразующих единиц в культурах гемопоэтических стволовых клеток (Wijdenes, 1996). В негемопоэтических компартментах CD138 в основном экспрессирован на простом и многослойном эпителии в легком, печени, коже, почке и кишечнике. На эндотелиальных клетках было обнаружено только слабое окрашивание (Bernfield, 1992; Vooijs, 1996). В научной литературе было отмечено, что CD138 существует в полиморфных формах в клетках лимфомы человека (Gattei, 1999).
Моноклональные антитела В-В4, ВС/В-В4, B-B2, DL-101, 1 D4, MI15, 1.BB.210, 2Q1484, 5F7, 104-9, 281-2, в частности, В-В4, как было указано в научной литературе, являются специфичными к CD138. Из вышеуказанных моноклональных антител В-В4, 1D4 и MI15 узнают как интактную молекулу, так и центральный белок антигена CD138, и могут узнавать одинаковые или близкородственные эпитопы (Gattei, 1999). Предшествующие исследования показали, что В-В4 не узнает растворимый CD138 и узнает только CD138 в мембраносвязанной форме (Wijdenes, 2002).
В-В4, моноклональное антитело IgG1 мыши, связывается с линейным эпитопом между остатками 90-95 центрального белка на синдекане-1 человека (CD138) (Wijdenes, 1996; Dore, 1998). Было установлено, что в соответствии с паттерном экспрессии CD138 антитело В-В4 активно взаимодействует с линией плазмоцитов RPMI8226, но не взаимодействует с эндотелиальными клетками. Также в соответствии с паттерном экспрессии CD138 антитело В-В4 взаимодействует с линиями эпителиальных клеток А431 (выделенными из кератиноцитов) и HepG2 (выделенными из гепатоцитов). Иммунотоксин В-В4-сапорин также являлся высокотоксичным для линии плазмоцитов RPMI8226, фактически более токсичным, чем свободный сапорин. Однако при исследовании двух линий эпителиальных клеток В-В4-сапорин был токсичен только для линии клеток А431, хотя при выполнении клоногенного анализа В-В4-сапорин не оказывал ингибирующего воздействия на рост клеток А431 (Vooijs, 1996). Другие исследователи сообщали об отсутствии специфичности ММ-ассоциированных антигенов в отношении опухолей (Couturier, 1999).
Термин ”антитело, по существу состоящее из” определенных компонентов в контексте настоящего изобретения означает, что данное антитело состоит из точно определенных компонентов и любых дополнительных веществ или компонентов, которые не влияют на основные характеристики антитела.
В настоящем изобретении использован термин ”опухолевая клетка”, который означает раковые клетки, а также предраковые клетки, которые могут образовывать или не образовывать часть солидной опухоли.
“Агент против клетки-мишени” по настоящему изобретению может связываться с молекулой, экспрессированной клеткой-мишенью, и включает пептиды и непептиды. В частности, агенты против клетки-мишени по настоящему изобретению являются антителами против клетки-мишени и молекулами против клетки-мишени, отличными от иммуноглобулина, которые могут быть созданы на основе белков, отличных от иммуноглобулина, и включают, не ограничиваясь ими, молекулы AFFILIN®, ANTICALINS® и AFFIBODIES®. Молекулы против клетки-мишени, отличные от иммуноглобулина, включают также непептидные молекулы против клетки-мишени, такие как олигонуклеотиды ДНК и РНК против клетки-мишени (аптамеры), а также физиологические лиганды, в частности, лиганды рассматриваемого антигена, такого как CD138.
“Антитело против клетки-мишени” по настоящему изобретению является природным антителом или антителом, созданным на его основе, синтезированным или генетически созданным антителом и связывается с антигеном на представляющей интерес клетке или клетках (клетках-мишенях). Антитело против клетки-мишени по настоящему изобретению включает моноклональное антитело, поликлональное антитело, полиспецифическое антитело, например, биспецифическое антитело) или фрагмент антитела. Антитело против клетки-мишени может быть создано, например, для улучшения сродства к клеткам-мишеням (Ross, 2003) или уменьшения иммуногенности. Антитело против клетки-мишени может быть присоединено к липосомному препарату, включающему эффекторные молекулы (Carter, 2003). Фрагмент антитела включает часть интактного антитела, предпочтительно антигенсвязывающую или вариабельную область интактного антитела. Примеры фрагментов антител по настоящему изобретению включают Fab, Fab', F(ab')2 и Fv фрагменты, а также диатела; доменспецифические антитела (dAb) (Ward, 1989; патент США № 6005079); линейные антитела; одноцепочечные антитела и полиспецифические антитела, образованные из фрагментов антител. В антителе, включающем одноцепочечный фрагмент (scFv) вариабельной области, тяжелая и легкая цепи (VH и VL) могут быть связаны коротким аминокислотным линкером, например, последовательностью (глицин4серин)n, которая обладает достаточной гибкостью, чтобы собрать из двух доменов функциональный антигенсвязывающий карман. Добавление разных сигнальных последовательностей может обеспечить более точную направленную доставку антитела против клетки-мишени. Добавление константной области легкой цепи (CL) обеспечивает димеризацию при помощи дисульфидных связей, в результате чего достигается более высокая устойчивость и авидность. Вариабельные области для создания scFv, если имеется моноклональное антитело против представляющей интерес мишени, могут быть получены методом ПЦР с обратной транскрипцией, который позволяет клонировать вариабельные области из мРНК, экстрагированной из родительской гибридомы. Альтернативно, scFv может быть создан de novo методом фагового дисплея (Smith, 2001). В использованном здесь значении термин “функциональный фрагмент” применительно к антителу против клетки-мишени означает часть антитела против клетки-мишени, которая может специфически связываться с антигеном, с которым специфически связывается указанное антитело. Биспецифическое антитело по настоящему изобретению может, например, иметь по меньшей мере одно плечо, которое взаимодействует с тканью-мишенью, и одно плечо, которое взаимодействует с линкером (публикация патента США 20020006379). Биспецифическое антитело по настоящему изобретению может также связываться с несколькими антигенами на клетке-мишени (Carter, 2003). Антитело по настоящему изобретению может быть модифицировано, например, путем введения остатков цистеина для введения тиоловых групп (Olafsen, 2004).
В соответствии с настоящим изобретением антитело против клетки-мишени может быть выделено из любого источника и может быть, не ограничиваясь ими, верблюжьим антителом, мышиным антителом, химерным антителом ”мышь-человек” или химерным антителом ”обезьяна-человек”, в частности химерным антителом ”мышь-человек”, таким как nBT062.
Гуманизированные антитела являются антителами, которые содержат последовательности, выделенные из человеческого антитела и антитела, отличного от человеческого, и также входят в объем настоящего изобретения. Приемлемые методы гуманизации антител включают трансплантацию CDR-области (трансплантация области, определяющей комплементарность) (ЕР 0239400; WO 91/09967; патенты США № 5530101 и 5585089), маскировку или облицовку (ЕР 0592106; ЕР 0519596; Padlan, 199; Studnicka et al., 1994; Roguska et al., 1994), перестановку цепи (патент США № 5565332) и Delmmunosation™ (Biovation, LTD). В соответствии с методом трансплантации CDR-области определяющие комплементарность области (CDR) мыши, например из моноклонального антитела В-В4, трансплантируют в остовные области вариабельных областей человека, которые затем соединяют с константными областями человека с созданием человеческого антитела В-В4 (hB-B4). В настоящее время в клинической практике используют несколько антител, гуманизированных методом трансплантации CDR-области, включая МИЛОТАРГ (Sievers et al., 2001) и ГЕЦЕПТИН (Pegram et al., 1998).
Метод маскировки предполагает использование комбинации молекулярного моделирования, статистического анализа и мутагенеза для изменения не являющихся CDR-областями поверхностей вариабельных областей антитела с целью имитации поверхностей известных антител хозяина-мишени. Стратегии и методы маскировки антител и другие методы уменьшения иммуногенности антител в другом хозяине описаны, например, в патенте США № 5639641. Человеческие антитела могут быть получены разными методами, известными в данной области, включая методы фагового дисплея. См. также патенты США № 4444887, 4716111, 5545806 и 5814318 и публикации международных заявок на патент WO 98/46645, WO 98/50433, WO 98/24893, WO 98/16654, WO 96/34096, WO 96/33735 и WO 91/10741.
Антитела против клетки-мишени, которые были подвергнуты любым неприродным модификациям, такие как химерные антитела ”мышь-человек” или химерные антитела ”обезьяна-человек”, гуманизированные антитела или антитела, которые были созданы, например, для улучшения их сродства к клеткам-мишеням или уменьшения иммуногенности, а также фрагменты антител, в частности, функциональные фрагменты таких антител против клетки-мишени, которые были подвергнуты любым неприродным модификациям, диатела, доменспецифические антитела, линейные антитела, одноцепочечные антитела и полиспецифические антитела, определяются в настоящем описании изобретения как генетически созданные антитела против клетки-мишени.
Химерные антитела сохраняют область связывания (ABR или Fab-область) антитела, отличного от человеческого, например, мышиного антитела, на основе которого они созданы, в то время как любые константные области могут быть выделены, например, из человеческого антитела. Как правило, химеризация и/или замена константных областей антитела не влияет на сродство антитела, так как области антитела, участвующие в связывании антигена, не затрагиваются такой заменой. В предпочтительном варианте осуществления настоящего изобретения генетически созданное, в частности, химерное антитело по настоящему изобретению, может обладать более высоким сродством связывания (выраженным значениями КD) по сравнению с соответствующим антителом, отличным от человеческого, на основе которого оно создано. В частности, антитело nBT062 и антитела на его основе могут обладать более высоким сродством связывания, чем мышиное антитело В-В4. В другом предпочтительном варианте осуществления настоящего изобретения иммуноконъюгаты, содержащие указанные генетически созданные/химерные антитела, также характеризуются более высоким сродством связывания. В некоторых вариантах осуществления изобретения указанные иммуноконъюгаты могут также обладать другими полезными свойствами, такими как лучшее уменьшение опухолевой массы, по сравнению с иммуноконъюгатами, содержащими мышиное антитело В-В4. В предпочтительном варианте осуществления изобретения генетически созданные, в частности, химерные антитела против клетки-мишени обладают сродством связывания, которое определяется константами диссоциации КD (нМ) менее 1,6, менее 1,5 или около или менее 1,4, в то время как мышиные антитела характеризуются константами диссоциации КD (нМ) около или более 1,6. Иммуноконъюгаты, включающие агенты против клетки-мишени, такие как антитела против клетки-мишени, могут характеризоваться константами диссоциации КD (нМ) менее 2,6, менее 2,5, менее 2,4, менее 2,3, менее 2,2, менее 2,1, менее 2,0, менее или около 1,9, в то время как иммуноконъюгаты, включающие мышиные антитела, могут характеризоваться константами диссоциации КD (нМ) около или более 2,6 (ср. данные, приведенные в таблице 3 раздела ”Вещества и методы”).
Могут быть также использованы полностью человеческие антитела. Указанные антитела могут быть отобраны методом фагового дисплея, при осуществлении которого используют CD138 или его антигенную детерминанту для селективного связывания с фагом, экспрессирующим, например, вариабельные области антитела В-В4 (см. публикацию Krebs, 2001). Данный метод успешно сочетается с методом созревания аффинности для улучшения сродства антитела. Все антитела, рассмотренные в настоящем описании изобретения, являются выделенными антителами.
В одном варианте осуществления изобретения антитело против клетки-мишени является в неконъюгированном виде умеренно или плохо интернализированным. Умеренная интернализация предполагает интернализацию антитела от около 30% до около 75%, плохая интернализация предполагает интернализацию от около 0,01% до около 30% после инкубации в течение 3 часов при 37°С. В другом предпочтительном варианте осуществления изобретения антитело против клетки-мишени связывается с антигеном CD138; такими антителами являются, например, антитела В-В4, ВС/B-B4, B-B2, DL-101, 1 D4, MI15, 1.BB.210, 2Q1484, 5F7, 104-9, 281-2, в частности, В-В4. Клетки гибридомы, полученные путем гибридизации миеломных клеток SP02/0 с клетками селезенки мышей Balb/c, депонированы в DSMZ-Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH, Mascheroder Weg 1, D-38124 Braunschweig 11 декабря 2007 г. Указанные клетки гибридомы, экспрессирующие В-В4, имеют идентифицирующий номер DSM ACC2874. В другом варианте осуществления изобретения антитело против клетки-мишени по существу не связывается с CD138, экспрессированным не на поверхности клетки. Название конкретного антитела, определяемое в контексте настоящего изобретения термином ”антитело против клетки-мишени”, таким как ”антитело против клетки-мишени nBT062”, означает, что данное антитело против клетки-мишени обладает специфичностью связывания антитела nBT062. Указание на то, что антитело против клетки-мишени создано ”на основе” конкретного антитела, означает, что данное антитело против клетки-мишени обладает специфичностью связывания указанного антитела, но может принимать любую форму, сопоставимую с приведенным выше описанием антитела против клетки-мишени. Название конкретного антитела, объединенное в контексте настоящего изобретения с термином ”антитело против клетки-мишени”, таким как ”антитело против CD138”, означает, что антитело против клетки-мишени обладает специфичностью связывания с CD138. Указание в контексте настоящего изобретения на то, что антитело против клетки-мишени делает что-то ”селективно”, например, ”селективно воздействует на экспрессированный на поверхности клетки CD138”, или является ”селективным” в отношении чего-то, означает, что для данного антитела характерна значительная селективность (то есть более высокое сродство к CD138-положительным клеткам по сравнению с CD138-отрицательными клетками), например, в данном примере, к экспрессированному на поверхности клетки CD138 по сравнению с любыми другими антигенами. Благодаря такой селективности значительно уменьшаются или даже полностью устраняются вредные побочные эффекты в данной среде.
Термин ”молекулы против клетки-мишени, отличные от иммуноглобулина” по настоящему изобретению означают молекулы против клетки-мишени, выделенные из белков, отличных от иммуноглобулина, а также непептидные молекулы против клетки-мишени. Мелкие белки, отличные от иммуноглобулина, входящие в данное определение, обладают специфическим сродством, например, в отношении экспрессированного на поверхности CD138. Указанные мелкие белки, отличные от иммуноглобулина, включают молекулы, созданные на основе каркаса, такие как молекулы AFFILIN®, которые имеют относительно небольшую молекулярную массу, например, в пределах от 10 кДа до 20 кДа. Соответствующий каркас включает, например, кристаллическую гамма-структуру. Указанные молекулы в естественном состоянии не обладают специфической активностью связывания в отношении молекул-мишеней. Благодаря созданию белковых поверхностей путем локальной рандомизации аминокислот, подвергаемых воздействию растворителя, могут быть созданы совершенно новые сайты связывания. Таким образом, исходные не связывающиеся белки превращаются в специфически связывающиеся белки. Такие молекулы могут быть специально созданы для связывания с мишенью, такой как CD138 и могут обеспечивать специфическую доставку одной или нескольких эффекторных молекул (см. scil Proteins GmbH на сайте www.scilproteins.com, 2004). Молекулы против клетки-мишени, отличные от иммуноглобулина, другого типа, получаемые из липокалинов, включают, например, ANTICALINS®, которые имеют структуру, подобную в некоторой степени иммуноглобулинам. Однако липокалины состоят из одной полипептидной цепи, содержащей 160-180 аминокислотных остатков. Связывающий карман липокалинов может быть изменен для узнавания представляющей интерес молекулы с высоким сродством и специфичностью (см., например, публикацию Beste et al., 1999). В объем настоящего изобретения входят также искусственные бактериальные рецепторы, такие как продаваемые на рынке под торговым названием AFFIBODIES® (аффибоди АВ). Указанные молекулы искусственных бактериальных рецепторов являются мелкими простыми белками и могут состоять из трех спиралей, полученных на каркасе из одного из IgG-связывающих доменов белка А (Staphylococcus aureus). Свойства связывания указанных молекул подобны многим иммуноглобулинам, но такие молекулы значительно меньше и имеют молекулярную массу, которая часто не превышает 10 кДа, и являются также сравнительно устойчивыми. Приемлемые молекулы искусственных бактериальных рецепторов описаны, например, в патентах США № 5831012, 6534628 и 6740734.
“Эффекторная молекула” по настоящему изобретению является молекулой, ее производным или аналогом, которая присоединена к агенту против клетки-мишени, в частности, к антителу против клетки-мишени и/или генетически созданному антителу против клетки-мишени, и оказывает требуемое действие, например, вызывает апоптоз или гибель клетки другого типа, остановку непрерывного клеточного цикла в одной или нескольких клетках-мишенях. Эффекторные молекулы по настоящему изобретению являются молекулами, которые могут оказывать требуемое действие в клетке-мишени и включают, не ограничиваясь ими, токсины, лекарственные средства, в частности низкомолекулярные цитотоксические лекарственные средства, радиоактивные изотопы, модификаторы биологических реакций, порообразующие агенты, рибонуклеазы, белки сигнальных путей активации апоптоза, способные индуцировать апоптоз, цитотоксические ферменты, ферменты, активирующие пролекарства, антисмысловые олигонуклеотиды, антитела или цитокины, а также их функциональные производные или аналоги/фрагменты. Токсины могут быть бактериальными токсинами, включающими, не ограничиваясь ими, дифтерийный токсин или экзотоксин А, растительными токсинами, такими как рицин, но не ограничиваясь им. Белки сигнальных путей активации апоптоза, способные индуцировать апоптоз, включают, не ограничиваясь ими, гранзим В, гранзим А, каспазу-3, каспазу-7, каспазу-8, каспазу-9, усеченный бид (tBid), бакс и бак.
В предпочтительном варианте осуществления изобретения эффектор повышает доставку эффектора иммуноконъюгатом, в частности тогда, когда природное антитело, на основе которого создано антитело против клетки-мишени иммуноконъюгата, плохо интернализировано. В другом предпочтительном варианте осуществления изобретения эффектор в нативной форме является неселективным. В определенных вариантах осуществления изобретения эффектор в нативной форме обладает высокой неселективной токсичностью, включая системную токсичность. Термин ”нативная форма” эффекторной молекулы по настоящему изобретению означает форму эффекторной молекулы до присоединения к агенту против клетки-мишени с образованием иммуноконъюгата. В другом предпочтительном варианте осуществления изобретения неселективная токсичность эффекторной молекулы по существу полностью устраняется при конъюгации с агентом против клетки-мишени. В другом предпочтительном варианте осуществления изобретения эффекторная молекула вызывает при достижении клетки-мишени гибель или остановку непрерывного клеточного цикла в клетке-мишени. Эффекторная молекула, являющаяся лекарственным средством, включает, не ограничиваясь ими, такие лекарственные средства как, например, низкомолекулярные высокотоксичные лекарственные средства, которые действуют в качестве ингибиторов полимеризации тубулина, например, майтанзиноиды, доластатины, ауристатин и критофицин; ДНК-алкилирующие агенты, подобные аналогам или производным СС-1065 (патенты США № 5475092, 5585499, 6716821) и дуокармицин, энедииновые антибиотики, такие как калихеамицин и эсперамицин, и сильнодействующие таксоидные (таксан) лекарственные средства (Payne, 2003). Майтанзиноиды и калихеамицины являются особенно предпочтительными. Майтанзиноидный эффектор включает майтанзиноиды любого происхождения, в том числе, не ограничиваясь ими, синтетический майтанзинол, аналог и производное майтанзинола. Доксорубицин, дауномицин, метотрексат, винбластин, неокарзиностатин, макромицин, тренимон и α-аманитин являются некоторыми другими эффекторными молекулами, входящими в объем настоящего изобретения. Кроме того, в объем настоящего изобретения в качестве эффекторных молекул входят также молекулы антисмысловой ДНК. Когда название, например, конкретного лекарственного средства или класса лекарственных средств использовано в сочетании с термином ”эффектор” или “эффекторная молекула”, имеется в виду эффектор иммуноконъюгата по настоящему изобретению, созданный на основе указанного лекарственного средства или класса лекарственных средств.
Майтанзин является природным продуктом, первоначально выделенным из эфиопского кустарника Maytenus serrata (Remillard, 1975; патент США № 3896111). Указанное лекарственное средство ингибирует полимеризацию тубулина, что вызывает митотическую блокаду и гибель клетки (Remillard, 1975; Bhattacharyya, 1977; Kupchan, 1978). Цитотоксичность майтанзина в 200-1000 раз выше, чем у противораковых средств, используемых в клинической практике, которые воздействуют на полимеризацию тубулина, таких как алкалоиды барвинка или таксол. Однако клинические испытания майтанзина показали, что он не может быть использован в клинической медицине из-за высокой системной токсичности. Майтанзин и майтанзиноиды являются высокоцитотоксическими веществами, но их клиническое применение при лечении рака сильно ограничено из-за тяжелых системных побочных эффектов, связанных главным образом с плохой селективностью в отношении опухолей. Клинические испытания майтанзина выявили серьезное вредное влияние на центральную нервную систему и желудочно-кишечный тракт.
Майтанзиноиды были также выделены из других растений, в том числе из семян Trewia nudiflora (патент США № 4418064).
Некоторые микробы также продуцируют майтанзиноиды, такие как майтанзинол и сложные эфиры майтанзинола С-3 (патент США № 4151042).
Настоящее изобретение относится к майтанзиноидам любого происхождения, включая синтетический майтанзинол и аналоги майтанзинола, описанные, например, в патентах США № 4137230, 4248870, 4256746, 4260608, 4265814, 4294757, 4307016, 4308268, 4308269, 4309428, 4313946, 4315929, 4317821, 4322348, 4331598, 4361650, 4362663, 4364866, 4371533, 4424219 и 4151042.
В предпочтительном варианте осуществления изобретения майтанзиноид является тиолсодержащим майтанзиноидом, который более предпочтительно получают способами, описанными в патенте США № 6333410, выданном Chari et al., или в публикации Chari et al. (Chari, 1992).
DM-1 (N2-деацетил-N2-(3-меркапто-1-оксопропил)майтанзин) является предпочтительной эффекторной молекулой в контексте настоящего изобретения. DM-1 в 3-10 раз более цитотоксичен, чем майтанзин, и превращается в пролекарство при связывании дисульфидной связью с моноклональным антителом против опухолеспецифического антигена. Некоторые такие конъюгаты (иногда именуемые ”опухолеактивируемыми пролекарствами” (TAP)) не являются цитотоксическими в кровяном русле, так как указанные конъюгаты активируются при связывании с клетками-мишенями и интернализируются, высвобождая лекарственное средство (Blättler, 2001). Было создано несколько конъюгатов антитело-DM1 (Payne, 2003), которые прошли клинические испытания. Например, субъекты, страдающие колоректальным раком, хорошо переносили лечение конъюгатом huC242-DM1, который не вызывал какой-либо обнаруживаемой иммунной реакции и характеризовался продолжительным временем нахождения в кровотоке (Tolcher, 2003).
Другие особенно предпочтительные майтанзиноиды имеют боковую цепь, содержащую тиоловую связь со стерическим препятствием, и включают, не ограничиваясь ими, такие майтанзиноиды как N2'-деацетил-N2'-(4-меркапто-1-оксопентил)майтанзин, именуемый также ”DM3”, и N2'-деацетил-N2'-(4-метил-4-меркапто-1-оксопентил)майтанзин, именуемый также ”DM4”. Синтез DM4 показан на фиг. 3 и 4 и описан в настоящем описании изобретения. DM4 отличается от DM1 и DM3 тем, что содержит метильные группы в положении αС. Благодаря этому образуется стерическое препятствие при присоединении DM4 с помощью линкера, который включает, не ограничиваясь им, линкер, имеющий дисульфидную связь, к агенту против клетки-мишени, такому как антитело nBT062. Целый ряд майтанзиноидов, содержащих тиоловую группу со стерическим препятствием (имеющую один или два заместителя, в частности, алкильных заместителя, таких как метильные заместители DM4), описан в публикации патента США 2004/0235840, опубликованной 25 ноября 2004 г., которая полностью включена в настоящее описание изобретения в качестве ссылки. Как отмечали Голдмахер (Goldmahker) и др. в публикации патента США 2006/0233814, такое препятствие вызывает алкилирование (например, метилирование) свободного лекарственного средства после высвобождения лекарственного средства в клетке-мишени. Алкилирование может повышать устойчивость лекарственного средства, вызывая так называемый эффект неспецифического цитолиза. Однако, как должно быть понятно специалисту в данной области, другие эффекторные молекулы, включающие такие заместители, как алкильные группы в положениях, образующих стерическое препятствие при присоединении эффектора к агенту против клетки-мишени с помощью линкера, также входят в объем настоящего изобретения. Такое препятствие предпочтительно вызывает химическую модификацию, такую как алкилирование свободного лекарственного средства, что повышает его устойчивость, благодаря чему лекарственное средство не только индуцирует гибель клетки или остановку непрерывного клеточного цикла в CD138-экспрессирующих опухолевых клетках, но также необязательно воздействует на А-клетки, которые, например, поддерживают или защищают опухоль от лекарственных средств, в частности, клетки стромы и сосудистой сети опухоли, и обычно не экспрессируют CD138, обеспечивая ослабление или утрату поддерживающей или защитной функции таких клеток.
ДНК-алкилирующие агенты также являются особенно предпочтительными эффекторными молекулами и включают, не ограничиваясь ими, аналоги или производные СС-1065. СС-1065 является сильнодействующим противоопухолевых антибиотиком, выделенным из культур Streptomyces zelensis, и, как установлено, обладают исключительно высокой цитотоксичностью in vitro (патент США № 4169888). В объем настоящего изобретения входят, например, аналоги или производные СС-1065, описанные в патентах США № 5475092, 5585499 и 5739350. Как должно быть понятно специалисту в данной области, в объем настоящего изобретения входят также модифицированные аналоги или производные СС-1065, описанные в патенте США № 5846545, и пролекарства аналогов или производных СС-1065, описанные, например, в патенте США № 6756397. В некоторых вариантах осуществления изобретения аналоги или производные СС-1065, например, могут быть синтезированы способом, описанным в патенте США № 6534660.
К другой группе соединений, являющихся предпочтительными эффекторными молекулами, относятся таксаны, особенно сильнодействующие таксаны и таксаны, содержащие тиоловые или дисульфидные группы. Таксаны являются митотическими веретенообразными ядами, которые ингибируют деполимеризацию тубулина, увеличивая таким образом скорость сборки микротрубочек и гибель клетки. Таксаны, входящие в объем настоящего изобретения, описаны, например, в патентах США № 6436931, 6340701, 6706708 и публикациях патентов США 20040087649, 20040024049 и 20030004210. Другие таксаны описаны, например, в патенте США № 6002023, патенте США № 5998656, патенте США № 5892063, патенте США № 5763477, патенте США № 5705508, патенте США № 5703247 и патенте США № 5367086. Как должно быть понятно специалисту в данной области, в объем настоящего изобретения входят также пегилированные таксаны, аналогичные описанным в патенте США № 6596757.
Эффекторные молекулы калихеамицина по настоящему изобретению включают гамма 1I, N-ацетилкалихеамицин и другие производные калихеамицина. Калихеамицин связывается специфично к последовательности с малой бороздкой ДНК, реаранжируется и открывает свободные радикалы, разрывая таким образом двухцепочечную ДНК, что вызывает апоптоз и гибель клетки. Один пример эффекторной молекулы калихеамицина, которая может быть использована в контексте настоящего изобретения, приведен в патенте США № 5053394.
Иммуноконъюгат по настоящему изобретению включает по меньшей мере один агент против клетки-мишени, в частности, антитело против клетки-мишени, такое как генетически созданное антитело против клетки-мишени, и одну эффекторную молекулу. Иммуноконъюгат может далее включать, например, стабилизирующие молекулы. Для иммуноконъюгатов термин ”конъюгация” обычно используется для определения функционального связывания агента против клетки-мишени с одной или несколькими эффекторными молекулами и не относится к какому-либо одному типу функционального связывания, в частности, не ограничивается химическим ”сопряжением”. Любой способ присоединения является приемлемым, если агент против клетки-мишени способен связываться с сайтом-мишенью и присоединенный эффектор действует должным образом, особенно после доставки к сайту-мишени. Методы конъюгации по настоящему изобретению включают, не ограничиваясь ими, прямое присоединение эффекторной молекулы к антителу против клетки-мишени с выполнением предварительной модификации или без предварительной модификации эффекторной молекулы и/или антитела против клетки-мишени, или присоединение с помощью линкеров. Линкеры могут быть классифицированы с точки зрения функциональности, например, на кислотолабильные линкеры, фотолабильные линкеры, линкеры, расщепляемые ферментами, например, линкеры, расщепляемые пептидазами. Расщепляемые линкеры являются предпочтительными во многих вариантах осуществления изобретения. Такие расщепляемые линкеры могут расщепляться в условиях клеточной среды, в частности внутриклеточной среды, и не оказывают вредного влияния на лекарственное средство, высвобождаемое в результате расщепления. Кислотолабильные линкеры могут расщепляться при низких значениях рН, таких как рН 4-5, имеющих место в определенных внутриклеточных отделах, в то время как фотолабильные линкеры могут расщепляться, например, под воздействием инфракрасного света. Однако линкеры, которые расщепляются в физиологических условиях, имеющих место в большинстве клеток, являются более предпочтительными и определяются в настоящем описании изобретения как физиологически расщепляемые линкеры. Таким образом, дисульфидные линкеры являются предпочтительными во многих вариантах осуществления изобретения. Указанные линкеры расщепляются в результате дисульфидного обмена, который может происходить в физиологических условиях. Предпочтительные гетеробифункциональные дисульфидные линкеры включают, не ограничиваясь ими, N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP) (см., например, публикацию Carlsson et al., 1978), N-сукцинимидил-4-(2-пиридилдитио)бутаноат (SPDB) (см., например, патент США № 4563304), N-сукцинимидил-4-(2-пиридилдитио)пентаноат (SPP) (см., например, регистрационную запись CAS № 341498-08-6), N-сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC) (см., например, публикацию Yoshitake et al., (1979) и N-сукцинимидил-4-метил-4-[2-(5-нитропиридил)дитио]пентаноат (SMNP) (см., например, патент США № 4563304). Наиболее предпочтительными линкерными молекулами, пригодными для использования в настоящем изобретении, являются SPP, SMCC и SPDB.
Другие приемлемые линкеры могут включать ”нерасщепляемые” связи, такие как, например, сульфосукцинимидилмалеимидометилциклогексанкарбоксилат (SMCC), который является гетеробифункциональным линкером, способным связывать соединения с SH-содержащими соединениями. В объем настоящего изобретения входят также бифункциональные и гетеробифункциональные линкерные молекулы, в частности, углевод-направленные гетеробифункциональные линкерные молекулы, такие как S-(2-тиопиридил)-L-цистеингидразид (ТРСН) (Vogel, 2004). Эффекторная молекула, такая как майтанзиноид, может быть конъюгирована с антителом против клетки-мишени двухстадийным способом, на первой стадии которого антитело против клетки-мишени модифицируют перекрестно-сшивающим реагентом, таким как N-сукцинимидилпиридилдитиопропионат (SPDP), для введения дитиопиридильных групп в антитело против клетки-мишени. На второй стадии к модифицированному антителу может быть добавлен реакционноспособный майтанзиноид, содержащий тиоловую группу, такой как DM1, в результате чего происходит замещение тиопиридильных групп в модифицированном антителе и образование цитотоксического конъюгата майтанзиноид-антитело, связанного дисульфидной связью (патент США № 5208020). Однако в объем настоящего изобретения входят также одностадийные способы конъюгации, аналогичные описанным в публикации патента США 20030055226, выданного Чари (Chari) и др. В одном варианте осуществления настоящего изобретения к антителу против клетки-мишени присоединяют несколько эффекторных молекул одинакового или разного типа.
Аналоги или производные СС-1065 могут быть конъюгированы с агентом против клетки-мишени при помощи полиэтиленгликолевых (PEG) связующих групп, описанных в патенте США № 6716821.
Калихеамицины могут быть конъюгированы с антителами против клетки-мишени при помощи линкеров (патент США № 5877296 и патент США № 5773001) или методами конъюгации, описанными в патенте США № 5712374 и патенте США № 5714586. Другой предпочтительный способ получения конъюгатов калихеамицина описан в публикации патента США 20040082764. Иммуноконъюгаты по настоящему изобретению могут иметь форму рекомбинантных слитых белков.
Термин “идентичность последовательностей” означает меру идентичности нуклеотидных последовательностей или аминокислотных последовательностей. Последовательности обычно подвергают сравнительному анализу до достижения соответствия высшего порядка. Термин “идентичность” сам по себе имеет известное значение в данной области, при этом идентичность может быть вычислена при помощи опубликованных методов. (См., например, публикации Computational Molecular Biology, Lesk, A. M., ed., Oxford University Press, New York, 1988; Biocomputing: Informatics and Genome Projects, Smith, D. W., ed., Academic Press, New York, 1993; Computer Analysis of Sequence Data, Part I, Griffin, A. M., and Griffin, H. G., eds., Humana Press, New Jersey, 1994; Sequence Analysis in Molecular Biology, von Heinje, G., Academic Press, 1987; и Sequence Analysis Primer, Gribskov, M. and Devereux, J., eds., M Stockton Press, New York, 1991). Несмотря на то, что существует много методов измерения идентичности двух полинуклеотидных или полипептидных последовательностей, термин “идентичность” хорошо известен квалифицированным специалистам (Carillo, H. & Lipton, D., SIAM J. Applied Math. 48:1073 (1988)).
То, что любая конкретная молекула нуклеиновой кислоты по меньшей мере на 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична, например, последовательности нуклеиновой кислоты антитела nBT062 или ее части, можно определить при помощи известных компьютерных программ, таких как программное обеспечение DNAsis (Hitachi Software, San Bruno, Calif.), предназначенных для выполнения первоначального сравнительного анализа последовательностей, с последующим выполнением программы ESEE, версия 3.0, для анализа ДНК/белковых последовательностей (cabot@trog.mbb.sfu.ca), предназначенной для сравнительного анализа множества последовательностей.
То, что аминокислотная последовательность по меньшей мере на 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична, например, SEQ ID NO:1 или SEQ ID NO:2 или ее части, можно определить при помощи известных компьютерных программ, таких как программа BESTFIT (Wisconsin Sequence Analysis Package, Version 8 for Unix, Genetics Computer Group, University Research Park, 575 Science Drive, Madison, Wis. 53711). В программе BESTFIT использован алгоритм локальной гомологии, представленный в публикации Smith and Waterman, Advances in Applied Mathematics 2:482-489 (1981), который предназначен для поиска лучшего гомологичного сегмента в двух последовательностях.
При использовании программ DNAsis, ESEE, BESTFIT или любой другой программы для сравнительного анализа последовательностей с целью определения того, что конкретная последовательность, например, на 95% идентична эталонной последовательности по настоящему изобретению, параметры задают с возможностью вычисления процентного значения идентичности на протяжении всей длины эталонной последовательности нуклеиновой кислоты или аминокислотной последовательности, при этом допускаются разрывы гомологии до 5% от общего числа нуклеотидов в эталонной последовательности.
Если в контексте настоящего изобретения указана идентичность определенной последовательности с комбинацией остатков конкретной последовательности, это значит, что идентичность последовательности относится к сумме всех указанных остатков.
Основная молекула антитела имеет бифункциональную структуру, в которой вариабельные области связываются с антигеном, в то время как реакции оставшихся константных областей не зависят от антигена. Основные классы антител, IgA, IgD, IgE, IgG и IgM, определяются по константным областям. Указанные классы могут быть далее разделены на подклассы (изотипы). Например, класс IgG имеет четыре изотипа, а именно IgG1, IgG2, IgG3 и IgG4, которые определяются по константным областям. Известно, что из разных классов человеческих антител только IgG1, IgG2, IgG3 и IgM человека эффективно активируют систему комплементов. Несмотря на то, что константные области не образуют антигенсвязывающих центров, расположение константных областей и шарнирной области может сообщать молекуле сегментную гибкость, которая позволяет молекуле связываться с антигеном.
Разные изотипы IgG могут связываться с Fc-рецепторами на таких клетках, как моноциты, В-клетки и NK-клетки, активируя таким образом клетки с целью высвобождения цитокинов. Разные изотипы могут также активировать комплемент, вызывая местное или системное воспаление. В частности, разные изотипы IgG могут связываться с FcγR в разной степени. FcγR представляют собой группу поверхностых гликопротеинов, относящихся к надсемейству Ig и экспрессированных главным образом на лейкоцитах. Гликопротеины FcγR разделены на три класса, обозначенные FcγRI (СD64), FcγRII (CD32) и FcγRIII (CD16). В то время как IgG1, IgG2 и IgG3 сильно связываются с разными гликопротеинами FcγR указанных классов, IgG4 отличается гораздо более слабым связыванием. В частности, IgG4 связывается с FcγRI со средней силой, что является причиной относительно низкой ADCC или даже полного отсутствия ADCC (антителозависимая клеточно-опосредованная цитотоксичность), и не связывается с FcγRIIIA или FcγRIIA. IgG4 также слабо связывается с FcγRIIB, который является ингибирующим рецептором. Кроме того, IgG4 опосредует только слабую фиксацию комплемента или не опосредует такую фиксацию и вызывает слабую комплементзависимую цитотоксичность (CDC) или не вызывает такую цитотоксичность. В контексте настоящего изобретения IgG4 может быть специально использован для предотвращения Fc-опосредованного направленного воздействия на FcR печени, так как IgG4 не взаимодействует с FcRγII на клетках LSEC (синусоидальные эндотелиальные клетки печени), не взаимодействует или слабо взаимодействует с FcRγI-III на клетках Капффера (макрофаги) и не взаимодействует с FcRγIII на NK-клетках печени. В объем настоящего изобретения входят также определенные мутации, которые еще больше уменьшают CDC. Например, известно, что остатки IgG4 в положениях 327, 330 и 331 уменьшают ADCC (антителозависимая клеточно-опосредованная цитотоксичность) и CDC (Amour, 1999; Shields, 2001). Одна или несколько мутаций, стабилизирующих антитело, также являются частью настоящего изобретения (в настоящем описании изобретения определяются также как ”стабилизирующие мутации”). Указанные мутации, в частности, включают мутации с заменой лейцина глутаминовой кислотой в СН2-области IgG4 и с заменой серина пролином в шарнирной области IgG4. В некоторых вариантах осуществления изобретения указанные мутации уменьшают количество полумолекул до менее 10%, менее 5% и предпочтительно менее 2% или 1%. Кроме того, время полужизни in vivo стабилизированных антител может быть увеличено на несколько дней, в том числе на 1, 2, 3, 4 или больше, чем на 5 дней (Schuurman, 1999).
Агенты против клетки-мишени, включающие антитела против клетки-мишени, в частности, генетически созданные антитела против клетки-мишени, рассмотренные в настоящем описании изобретения, могут быть также определены с учетом их сродства связывания с антигеном, в частности, с CD138. Предпочтительное сродство связывания агентов против клетки-мишени, таких как антитела против клетки-мишени, характеризуется константами диссоциации КD (нМ) менее 1,6, менее 1,5 или около или менее 1,4. Для иммуноконъюгатов, включающих указанные агенты против клетки-мишени, такие как антитела против клетки-мишени, предпочтительными являются константы диссоциации КD (нМ) менее 1,6, менее 1,5, менее 2,5, менее 2,4, менее 2,3, менее 2,2, менее 2,1, менее 2,0, менее или около 1,9.
Антигенсвязывающая область (ABR) по настоящему изобретению может изменяться в зависимости от типа антитела против клетки-мишени или генетически созданного антитела против клетки-мишени. В природном антителе и в большинстве химерных и гуманизированных антител антигенсвязывающая область состоит из легкой цепи и первых двух доменов тяжелой цепи. Однако в антителе с тяжелой цепью, не имеющем легких цепей, антигенсвязывающая область может состоять, например, только из первых двух доменов тяжелой цепи, в то время как в одноцепочечных антителах (ScFv), которые объединяют в одной полипептидной цепи вариабельные области легкой и тяжелой цепей, ABR образуется только одной полипептидной молекулой. FAB-фрагменты, обычно получаемые в результате расщепления папаином, имеют одну легкую цепь и часть тяжелой цепи и, таким образом, включают ABR только с одним антигенсвязывающим центром. С другой стороны, диатела являются мелкими фрагментами антитела с двумя антигенсвязывающими областями. Однако в контексте настоящего изобретения антигенсвязывающая область антитела против клетки-мишени или генетически созданного антитела против клетки-мишени является любой областью, которая определяет главным образом специфичность связывания антитела против клетки-мишени или генетически созданного антитела против клетки-мишени.
Если указано, что антигенсвязывающая область или другая область антитела против клетки-мишени является областью ”определенного антитела”, например, человеческого антитела или антитела, отличного от человеческого, это значит в контексте настоящего изобретения, что антигенсвязывающая область (ABR) или идентична соответствующей природной ABR, или создана на ее основе. Антигенсвязывающая область считается созданной на основе природной ABR, если она обладает специфичностью связывания природной ABR. Однако такая антигенсвязывающая область может включать, например, точковые мутации, добавления, делеции или посттрансляционную модификацию, такую как гликозилирование. Такая антигенсвязывающая область, в частности, может иметь последовательность, которая более, чем на 70%, более, чем на 80%, более, чем на 90%, предпочтительно более, чем на 95%, более, чем на 98% или более, чем на 99% идентична последовательности природной ABR.
Гомогенное направленное воздействие агента против клетки-мишени, такого как антитело против клетки-мишени, и, в частности, иммуноконъюгата, содержащего такой агент, в контексте настоящего изобретения является мерой дисперсии при достижении требуемого результата указанного направленного воздействия агента против клетки-мишени. В определенных вариантах осуществления изобретения требуемый результат достигается при простом связывании с мишенью. Именно так обстоит дело, например, в тех вариантах осуществления изобретения, в которых определенный агент против клетки-мишени обеспечивает защиту от последующего связывания. Однако гомогенность агента против клетки-мишени можно легко оценить, например, путем определения эффективности иммуноконъюгата, включающего указанный агент против клетки-мишени. Например, эффективность указанного иммуноконъюгата против опухолевого антигена, такого как CD138, который включает эффектор, нацеленный на разрушение опухолевых клеток и/или остановку роста опухоли, можно определить по степени подавления роста опухоли, включающей клетки, экспрессирующие антиген CD138. Такой иммуноконъюгат может характеризоваться высокой дисперсией эффективности. Например, в одних случаях иммуноконъюгат может останавливать рост опухоли с высокой эффективностью, а в других случаях с эффективностью, едва превышающей эффективность контрольного вещества. Низкая дисперсия эффективности конъюгата, с другой стороны, показывает, что данный иммуноконъюгат и/или соответственно агент против клетки-мишени обеспечивают согласованное достижение требуемого результата. Одним способом количественного определения гомогенности направленного воздействия является вычисление изменчивости направленного воздействия. Применительно к остановке роста опухоли иммуноконъюгатом, включающим определенный агент против клетки-мишени, изменчивость направленного воздействия можно вычислить, определяя время, необходимое для достижения опухолью заранее определенного объема, например, 300 мм3. Заранее определенный объем предпочтительно выбирают таким образом, чтобы рост опухоли до и после достижения указанного заранее определенного объема постоянно увеличивался с примерно одинаковой скоростью. После определения такого времени для группы субъектов вычисляют среднее значение указанного времени (Тm) в группе субъектов (например, у мышей SCID или в другой приемлемой модели, характеризующейся гомогенным ростом опухоли). Затем значение Тm коррелируют с данными наблюдений, полученными у субъекта в группе с наименьшей эффективностью направленного воздействия и, следовательно, с наименьшим временем (Тf), необходимым для достижения опухолью заранее определенного объем, и, с другой стороны, у субъекта в группе с наибольшей эффективностью направленного воздействия и, следовательно, с наибольшим временем (Тs), необходимым для достижения опухолью заранее определенного объема, вычисляя изменчивость направленного воздействия для заранее определенного объема по следующей формуле:
Ts-Tf/Tm×100
В предпочтительном варианте осуществления изобретения изменчивость направленного воздействия генетически созданного антитела против клетки-мишени по настоящему изобретению, составляет менее 150%, менее 140%, менее 130%, менее 120%, менее 110%, менее 100%, менее 90%, менее 80%, менее 70%, менее 60% или менее 50% и в определенных вариантах осуществления изобретения даже менее 45%. Изменчивость направленного воздействия предпочтительно находится в пределах от около 10% до около 150%, предпочтительно от около 10% до около 100%, от около 10% до около 80%, от около 10% до около 70%, от около 10% до около 60%, от около 10% до около 50%.
Гомогенность направленного воздействия (определяемую также как гомогенность связывания с конкретным антигеном) можно также количественно определить другим способом, например, путем определения задержки роста опухоли. Кроме того, специалисту в данной области должно быть понятно, что объем опухоли определенного размера является только одним параметром, на основании которого можно определить изменчивость направленного воздействия. В зависимости от требуемого результата можно использовать другие параметры, которые включают время (например, для измерения задержки роста опухоли) или % связывания. Специалист в данной области может легко определить такие параметры.
Антитело nBT062 (см. также фиг. 1) является химерным моноклональным антителом IgG4 ”мышь-человек”, химерным вариантом антитела В-В4. Химерный вариант антитела В-В4 был создан с целью ослабления реакции НАМА (антитела человека против антитела мыши) при сохранении функциональности области связывания антитела В-В4 в отношении CD138. Удивительным открытием было то, что такое химерное антитело характеризуется лучшим сродством связывания по сравнению с антителом В-В4. Кроме того, удивительным является то, что данное химерное антитело оказывает гомогенное направленное воздействие, которое уменьшает расхождение результатов, полученных при использовании антитела или иммуноконъюгата, включающего такое антитело. Ниже описан способ получения антитела nBT062. Клетки яичника китайского хомячка, экспрессирующие антитело nBT062, были депонированы в DSMZ-Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH, Mascheroder Weg 1, D-38124 Braunschweig 11 декабря 2007 г. Указанные клетки имеют идентифицирующий номер DSM ACC2875. CD138-специфическое химерное антитело, созданное на основе антитела В-В4, определяется в настоящем описании изобретения как с-В-В4.
Аминокислотная последовательность для тяжелой и легкой цепей была прогнозирована в результате трансляции нуклеотидной последовательности для nBT062. Аминокислотные последовательности, прогнозированные для тяжелой цепи и легкой цепи, приведены в таблице 1. Прогнозированные вариабельные области выделены жирным шрифтом, прогнозированные CDR-области подчеркнуты.

С-концевой лизин может быть вырезан, но может присутствовать вследствие неполной вырезки, поэтому не является частью SEQ ID NO:1.

ВТ062 является иммуноконъюгатом, включающим химерное антитело nBT062 против CD138, присоединенное с помощью линкера, в данном случае SPDB, к цитостатическому производному майтанзиноида DM4. Химическая структура ВТ062 показана на фиг. 1 и 2. Иммуноконъюгаты, включающие антитело nBT062 и эффекторную молекулу майтанзиноида, часто определяются с указанием линкера и эффектора майтанзиноида, например, nBT062-SMCC-DM1 является иммуноконъюгатом, включающим nBT062, SMCC (“нерасщепляемый” линкер, содержащий сложную тиоэфирную связь) и DM1 в качестве эффектора. Иммуноконъюгат, содержащий nBT062 и эффекторную молекулу, может быть также описан как nBT062-линкер-эффектор или просто как nBT062-эффектор (nBT062N, где N означает любой эффектор, рассмотренный в настоящем описании изобретения).
В настоящем описании изобретения рассмотрен иммуноконъюгат без стерического препятствия (UI: иммуноконъюгат без стерического препятствия), включающий генетически созданное антитело против CD138, присоединенное к эффекторной молекуле с помощью расщепляемого линкера (CL); такой иммуноконъюгат, определяемый как UICL, противопоставлен иммуноконъюгату, в котором указанная эффекторная молекула имеет стерическое препятствие и содержит расщепляемый линкер (HICL). Иммуноконъюгат UICL эквивалентен иммуноконъюгату HICL, включающему генетически созданное антитело против клетки-мишени и эффекторную молекулу, которая, однако, не имеет стерического препятствия. Примерами двух иммуноконъюгатов HICL/UICL являются ВТ062 и nBT062-SPP-DM1. Иммуноконъюгат без стерического препятствия, включающий нерасщепляемый линкер, (UINCL) эквивалентен иммуноконъюгату, включающему генетически созданное антитело против клетки-мишени, в котором эффекторная молекула не имеет стерического препятствия и включает нерасщепляемый линкер. Для ВТ062 иммуноконъюгат nBT062-SMCC-DM1 является примером такого иммуноконъюгата без стерического препятствия, включающего нерасщепляемый линкер.
Активность иммуноконъюгата, ингибирующая рост опухоли, является относительной единицей измерения. Данная единица измерения определяет активность иммуноконъюгата, ингибирующую рост опухоли, относительно активности наиболее эффективного иммуноконъюгата, активность которого принята равной 100%. Например, если активность наиболее эффективного иммуноконъюгата, скажем, ВТ062, который задерживает рост опухоли (TGD) на 32 дня, принята равной 100%, то активность, например, nBT062-DM1, который задерживает рост опухоли (TGD) на 18 дней, вычисляют следующим образом:
100×(TGDnBT062-DM1/TGDBT062),
в более общем представлении:
100×TGDобразца/TGDэталона).
(*) Задержка роста опухоли в днях (TGD) в виде среднего времени в днях для экспериментальной группы до достижения заранее определенного размера (160 мм3) минус среднее время для контрольной группы до достижения указанного заранее определенного размера.
(**) Активность, ингибирующая рост опухоли =100×TGDобразца/TGDВТ062). Активность ВТ062 определена равной 100%.
В примере, приведенном в таблице 2, ВТ062 обладает активностью, ингибирующей рост опухоли, которая выше, чем у иммуноконъюгата без стерического препятствия (nBT062-SPP-DM1) на 60%, и активностью, ингибирующей рост опухоли, которая выше, чем у иммуноконъюгата без стерического препятствия с нерасщепляемым линкером (nBT062-SMCC-DM1) на 44%.
Ранее сообщалось, что расщепляемый линкер в иммуноконъюгате может создавать так называемый эффект неспецифического цитолиза. Голдмахер и др. (публикация патента США 2006/0233814) также указали, что эффект неспецифического цитолиза является особенно выраженным, когда эффекторная молекула подвергается дальнейшей модификации, в частности алкилированию, после отщепления от агента против клетки-мишени. Голдмахер и др. также показали, что UICL характеризуется лучшей TGD по сравнению с соответствующим иммуноконъюгатом UINCL, что также было объяснено эффектом неспецифического цитолиза (см., например, фиг. 6 в публикации патента США № 2006/0233814). Было установлено, что результаты введения иммуноконъюгата UICL в высокой однократной дозе (250 мкг/кг) фактически не были лучше, чем у UINCL. Значение TGD в днях, которое было получено для иммуноконъюгата UICL при введении в указанном режиме, было ниже аналогичного значения иммуноконъюгата UINCL. Данное наблюдение было более выраженным при увеличении дозы (450 мкг/кг). В общем иммуноконъюгат HICL превосходил иммуноконъюгат UICL в экспериментах по введению однократной дозы в неожиданной степени. Кроме того, иммуноконъюгат UICL превосходил иммуноконъюгат UINCL при введении в более высоких дозах.
Агенты против клетки-мишени, в частности, антитела против клетки-мишени, и/или иммуноконъюгаты по настоящему изобретению можно вводить любым способом, включая внутривенное, парентеральное, пероральное, внутримышечное, интратекальное введение или введение в виде аэрозоля. Способ доставки зависит от требуемого эффекта. Специалист в данной области может легко определить лучший способ введения для проведения конкретного лечения по настоящему изобретению. Соответствующая доза зависит от способа введения и назначенного лечения и может быть легко определена специалистом в данной области с учетом современных методов лечения.
Фармацевтические композиции, содержащие неконъюгированный агент против клетки-мишени и иммуноконъюгат по настоящему изобретению в качестве активных ингредиентов, могут быть получены стандартными методами приготовления фармацевтических препаратов. См., например, Remington's Pharmaceutical Sciences, 17th Ed. (1985, Mack Publishing Co., Easton, Pa.). Активные ингредиенты в эффективных количествах обычно смешивают с фармацевтически приемлемым носителем. Носитель может быть использован в разных видах в зависимости от формы препарата, предназначенного, например, для внутривенного, перорального, парентерального, интратекального, чрескожного введения или для введения в виде аэрозоля.
В случае перорального введения агент против клетки-мишени и/или иммуноконъюгат могут быть получены в виде твердых или жидких препаратов, таких как капсулы, пилюли, таблетки, лепешки, расплавы, порошки, суспензии или эмульсии. При получении композиций в виде лекарственной формы для перорального введения могут быть использованы любые обычно применяемые фармацевтические среды, такие как, например, вода, гликоли, масла, спирты, ароматизаторы, консерванты, охлаждающие агенты, суспендирующие агенты и тому подобные, в случае жидких препаратов для перорального введения (таких как, например, суспензии, эликсиры и растворы); или носители, такие как крахмалы, сахара, разбавители, гранулирующие агенты, смазывающие вещества, связывающие вещества, дезинтеграторы и тому подобные, в случае твердых препаратов для перорального введения (таких как, например, порошки, капсулы и таблетки). Благодаря простоте введения таблетки и капсулы являются наиболее предпочтительными лекарственными формами для перорального введения, в которых использованы твердые фармацевтические носители. При желании на таблетки может быть нанесено сахарное покрытие или энтеросолюбильное покрытие стандартными методами. Активный агент должен оставаться устойчивым при прохождении через желудочно-кишечный тракт. При необходимости могут быть использованы приемлемые агенты, обеспечивающие устойчивое прохождение, которые могут включать фосфолипиды или производные лецитина, описанные в научной литературе, а также липосомы, микрочастицы (в том числе микросферы и макросферы).
В случае парентерального введения агент против клетки-мишени и/или иммуноконъюгат могут быть растворены в фармацевтическом носителе и введены в виде раствора или суспензии. Примерами приемлемых носителей являются вода, физиологический раствор, физиологический раствор с фосфатным буфером (PBS), растворы декстрозы, растворы фруктозы, этанол или животные, растительные или синтетические масла. Носитель может также содержать другие ингредиенты, например, консерванты, суспендирующие агенты, растворители, буферы и тому подобные. При церебровентрикулярном или интратекальном введении неконъюгированный агент против клетки-мишени и/или иммуноконъюгат могут быть также растворены в цереброспинальной жидкости.
Дозы, вводимые субъекту, могут быть определены в виде количества на площадь поверхности субъекта (данное положение относится как к человеку, так и к животным, отличным от человека). Субъекту может быть введена доза в количестве, которое предпочтительно равно, не исключая других количеств, от около 5 мг/м2 до около 300 мг/м2, включая примерно 20 мг/м2, примерно 50 мг/м2, примерно 100 мг/м2, примерно 150 мг/м2, примерно 200 мг/м2 и примерно 250 мг/м2. Агенты против клетки-мишени/иммуноконъюгаты вводят один или несколько раз. При использовании схемы многократного введения указанные количества можно вводить один раз в день, один раз в неделю, один раз в две недели, один раз в три недели, один раз в четыре недели, один раз в пять недель или один раз в шесть недель. В соответствии с предпочтительным вариантом осуществления изобретения вводят одну высокую дозу или альтернативно более низкие дозы через короткие промежутки времени с последующим введением доз через более продолжительные периоды времени. В предпочтительном варианте осуществления изобретения время введения доз субъекту определяют таким образом, чтобы перед введением второй и/или любой последующей дозы прошло достаточно времени для метаболизации предшествующей дозы, но при этом количество иммуноконъюгата, присутствующего в организме субъекта, по-прежнему позволяло ингибировать, задерживать и/или предотвращать рост опухоли. Типичная схема ”повторного введения однократной дозы” включает введение первоначальной дозы иммуноконъюгата, равной примерно 200 мг/м2, один раз в три недели. Альтернативно после высокой первоначальной дозы два раза в неделю вводят поддерживающую дозу, равную примерно 150 мкг/м2. Однако могут быть использованы другие схемы введения доз. Ход лечения можно легко контролировать при помощи известных методов и анализов. Доза может изменяться в зависимости от профилактического или терапевтического введения, предшествующего лечения, клинической истории субъекта, реакции на воздействие агента против клетки-мишени/иммуноконъюгата и решения лечащего врача.
В соответствии с настоящим изобретением множественную миелому можно лечить следующим образом, используя в качестве примера nBT062 и ВТ062. Данный пример никоим образом не ограничивает настоящее изобретение, и специалист в данной области может легко определить другие системы на основе иммуноконъюгата или nBT062, которые входят в объем настоящего изобретения, и другие схемы лечения, которые могут быть использованы для лечения таких заболеваний как множественная миелома.
Благодаря селективной экспрессии CD138 на клетках множественной миеломы субъекта, доступности клеток в кровотоке, специфичности nBT062 и устойчивости ВТ062 в кровотоке, ВТ062 устраняет системную токсичность DM4 и создает возможность для направленной доставки эффекторных(ой) молекул(ы) DM4. Введение nBT062 позволяет эффективно защищать слабоэкспрессирующие CD138-положительные неопухолевые клетки от связывания с BT062 и предпочтительно от разрушения, в то время как иммуноконъюгаты являются средством эффективной доставки эффекторных молекул к сайтам на клетке, где они могут высвобождаться из иммуноконъюгатов. Такая направленная доставка и высвобождение создают значительное преимущество при лечении множественной миеломы по сравнению с современными методами химиотерапии, которые иногда не обеспечивают достижения полной ремиссии.
Настоящее изобретение далее описано со ссылкой на нижеследующие примеры, которые приведены в качестве иллюстрации и не ограничивают объем настоящего изобретения. Использованы стандартные методы, хорошо известные в данной области, или методы, специально описанные ниже.
Вещества и методы
Создание химерного антитела (сВ-В4: nBT062)
В-В4
В описанных экспериментах было использовано ранее исследованное мышиное антитело В-В4 (Wijdenes et al., Br. J. Haematol., 94 (1996), 318).
Клонирование и экспрессия В-В4 и сВ-В4/nBT062
Выполняли стандартные методы рекомбинантных ДНК, подробно описанные в учебниках, например, в J. Sambrook; Molecular Cloning, A Laboratory Manual; 2nd Ed. (1989), Cold Spring Harbor Laboratory Press, USA, или рекомендованные в инструкции производителя в случае использования наборов. Клонирование и модификацию вариабельных областей мыши выполняли с помощью стандартных методов ПЦР. Были использованы затравки, указанные в соответствующем разделе “Результаты”.
Экспрессия сВ-В4/nBT062
Клетки COS в экспоненциальной фазе роста, культивируемые в среде DMEM, содержащей 10% FCS, 580 мкг/мл L-глутамина, 50 ед/мл пенициллина и 50 мкг/мл стрептомицина, собирали, обрабатывая трипсином, центрифугировали и промывали в PBS. Клетки повторно ресуспендировали в PBS до конечной концентрации, равной 1×107 клеток/мл. 700 мкл взвеси клеток COS переносили в кювету импульсного генератора Gene Pulser и смешивали с ДНК вектора экспрессии тяжелой цепи и легкой каппа-цепи (по 10 мкм каждого вектора или 13 мкг супервектора). Клетки электропорировали при 1900 В, 25 мкф с помощью импульсного генератора Gene Pulser компании Bio-Rad. Трансформированные клетки культивировали в среде DMEM, содержащей 10% FBS без гамма-глобулина, 580 мкг/мл L-глутамина, 50 ед/мл пенициллина и 50 мкг/мл стрептомицина, в течение 72 часов, после чего собирали супернатанты культур клеток, содержащих антитело.
Метод ELISA с захватом антитела для измерения уровней экспрессии сВ-В4/nBT062
96-луночные планшеты сенсибилизировали 100 мкл аликвотами 0,4 мкг/мл антитела козы против IgG человека, разведенного в PBS (4°С, в течение ночи). Планшеты трижды промывали 200 мкл/лунка промывочного буфера (PBS+0,1% твина-20). Клетки блокировали 0,2% BSA, 0,02% твина-20 в PBS и добавляли 200 мкл супернатантов культур клеток, содержащих секретированное антитело (инкубация при 37°С в течение одного часа). Лунки шесть раз промывали промывочным буфером и обнаруживали связанное антитело, используя конъюгат антитела козы против легкой каппа-цепи человека с пероксидазой.
Очистка сВ-В4/nBT062 от супернатантов культур клеток
Антитело сВ-В4 очищали от супернатантов трансформированных клеток COS 7, используя набор ImmunoPure Plus, содержащий белок А (Pierce, Rockford, IL), в соответствии с рекомендациями производителя.
Конкурентно-связывающий анализ антитела сВ-В4
Анализ активности связывания антител В-В4 и сВ-В4 с CD138 выполняли, используя набор Diaclone, содержащий sCD138 (Besancon, France), в соответствии с рекомендациями производителя, принимая во внимание изменения, описанные в разделе “Результаты”.
Получение РНК и синтез кДНК
Клетки гибридомы В-В4 выращивали и обрабатывали с помощью набора Qiagen Midi (Hilden, Germany) для выделения РНК в соответствии с инструкциями производителя. Примерно 5 мкг РНК клеток В-В4 подвергали обратной транскрипции для получения кДНК В-В4, используя набор для синтеза 1-й цепи Amersham Biosciences (Piscataway, NJ) в соответствии с инструкциями производителя.
Клонирование кДНК иммуноглобулина В-В4
кДНК тяжелой цепи иммуноглобулина (IgH) амплифицировали методом ПЦР, используя затравку MHV7 для IgH (5'-ATGGGCATCAAGATGGAGTCACAGACCCAGG-3') [SEQ ID NO:3] и затравку MHCG1 для константной области IgG1 (5'-CAGTGGATAGACAGATGGGGG-3') [SEQ ID NO:4]. Легкую цепь иммуноглобулина (IgL) амплифицировали аналогичным образом, используя три разные затравки для Igκ, а именно MKV2 (5'-ATGGAGACAGACACACTCCTGCTATGGGTG-3') [SEQ ID NO:5], MKV4 (5'-ATGAGGGCCCCTGCTCAGTTTTTTGGCTTCTTG-3') [SEQ ID NO:6] и MKV9 (5'-ATGGTATCCACACCTCAGTTCCTTG-3') [SEQ ID NO:7], каждая в комбинации с затравкой МКС (5'-ACTGGATGGTGGGAAGATGG-3') [SEQ ID NO:8]. Все продукты амплификации лигировали в вектор pCR2.1-TOPO, используя набор для клонирования TOPO-TA (Invitrogen, Carlsbad, CA), в соответствии с инструкциями производителя.
Бактерии ТОР10 E. coli (Invitrogen), трансформированные лигированными конструкциями вектора pCR2.1, отбирали на агаровых пластинках с LB-ампициллин-Xgal. Небольшие культуры инокулировали единичными белыми колониями, выращивали в течение ночи и выделяли плазмиды, используя набор QIAprep Spin Miniprep в соответствии с инструкциями производителя.
Определение последовательности кДНК
Плазмиды секвенировали, используя готовый реакционный набор для циклического секвенирования BigDye Termination v3.0 (ABI, Foster City, CA). Каждую отобранную плазмиду секвенировали в обоих направлениях, используя затравки 1210 и 1233, циклизованные в устройстве для ПЦР GeneAmp9600. Электрофоретический анализ последовательности выполняли в капиллярном секвенаторе ABI.
Полный цикл ПЦР с обратной транскрипцией, клонирование и анализ последовательности ДНК повторяли для получения трех полностью независимых наборов информации о последовательности для каждой цепи иммуноглобулина.
Последовательность ДНК вариабельной области каппа-цепи (Vκ) В-В4
1-ю цепь синтезировали, выполняя три независимые реакции. Продукты ПЦР, полученные при использовании затравок МКС и MKV2 (приведенные выше последовательности), лигировали в векторы pCR2.1-TOPO в соответствии с инструкциями производителя. Клоны, полученные в результате выполнения независимых серий ПЦР с обратной транскрипцией, секвенировали в обоих направлениях. Последовательность продукта, полученная с помощью затравки MKV2, была в высшей степени подобна стерильным транскриптам каппа-цепи, полученным из миеломной клетки-партнера, таким как МОРС-21, SP2 и Ag8 (Carroll et al., Mol. Immunol., 25 (1988), 991; Cabilly et al., Gene, 40 (1985); 157), и поэтому не принимались во внимание.
Продукты ПЦР, полученные при использовании затравки МКС с затравками MKV4 и MKV9, были подобны друг другу и отличались только неоднозначными положениями в затравке для лидерной последовательности.
Последовательность ДНК вариабельной области тяжелой цепи (VH) В-В4
1-ю цепь синтезировали, выполняя три независимые реакции, затем продукты ПЦР клонировали и секвенировали из каждого продукта 1-й цепи. Из каждой 1-й цепи секвенировали пять клонов.
Создание векторов экспрессии химерного антитела сВ-В4
Создание векторов экспрессии химерного антитела предполагает добавление приемлемой лидерной последовательности к VH и Vκ, которой предшествует сайт рестрикции BamHI и последовательность Козака. Консенсусная последовательность Козака имеет важное значение для эффективной трансляции последовательности вариабельной области. Данная последовательность определяет правильный кодон AUG, из которого рибосома может начать трансляцию, при этом единственным наиболее значимым основанием является аденин (или менее предпочтительно гуанин) в положении -3, вверху от начала AUG. Лидерную последовательность выбирают как наиболее подобную последовательность в базе данных Кабата (Kabat et al., NIH National Technical Information Service, 1991). Указанные добавления кодируют в верхних (For) затравках (имеющих последовательность 5'-AGAGAAGCTTGCCGCCACCATGATTGCCTCTGCTCAGTTCCTTGGTCTCC-3' [SEQ ID NO:9]; сайт рестрикции подчеркнут; последовательность Козака выделена жирным шрифтом). Кроме того, создание векторов экспрессии химерного антитела предполагает введение 5'-концевого фрагмента константной области гамма-цепи 1 человека до природного сайта рестрикции ApaI, смежного с 3'-концом J-области антитела В-В4, и добавление сайта донора сплайсированного фрагмента и сайта HindIII для легкой цепи. Последовательность донора сплайсированного фрагмента имеет важное значение для правильного присоединения в остове вариабельной области к соответствующей константной области, сплайсируя таким образом интрон V:C. Интрон каппа-цепи + СК кодированы экспрессирующей конструкцией, расположенной внизу от последовательности Vκ В-В4. Аналогичным образом СН гамма-цепи 4 кодирована экспрессирующей конструкцией, расположенной внизу от последовательности VH В-В4.
Гены VH и Vκ В-В4 сначала тщательно анализировали для идентификации любых нежелательных сайтов донора сплайсированного фрагмента, сайтов акцептора сплайсированного фрагмента, последовательностей Козака и наличия любых дополнительных сайтов рестрикции субклонирования, которые позднее могут мешать субклонированию и/или экспрессии функционального полного антитела. Нежелательный сайт HindIII, обнаруженный в последовательности Vκ, был удален путем сайтнаправленного мутагенеза при помощи ПЦР без изменения аминокислотной последовательности. Для выполнения указанных реакций были использованы олигонуклеотидные затравки ВТ03 (5'-CAACAGTATAGTAAGCTCCCTCGGACGTTCGGTGG-3') [SEQ ID NO:10] и ВТ04 (5'-CCACCGAACGTCCGAGGGAGCTTACTATACTGTTG-3') [SEQ ID NO:11], и мутагенез выполняли в соответствии с инструкциями к набору для мутагенеза Quickchange компании Stratagene (La Jolla, CA).
Затравки для химеризации каппа-цепи
Не вызывающую сомнений лидерную последовательность Vκ В-В4, независимо от последовательности затравки для ПЦР, подвергали сравнительному анализу с мышиными лидерными последовательностями в базе данных Кабата. Ближайшей совместимой последовательностью для лидерной последовательности VH В-В4 была последовательность VK-10 ARS-A (Sanz et al., PNAS, 84 (1987), 1085). Указанная лидерная последовательность была точно вырезана в соответствии с прогнозом, сделанным с помощью алгоритма SignaIP (Nielsen et al., Protein Eng, 10 (1997); 1). Затравки СВВ4Kfor (см. выше) и g2258 (5'-CGCGGGATCCACTCACGTTTGATTTCCAGCTTGGTGCCTCC-3' [SEQ ID NO:12]; сайт рестрикции подчеркнут) были созданы для получения продукта ПЦР, содержащего указанную полную лидерную последовательность, Vκ-область В-В4 и концевые сайты рестрикции HindIII и BamHI, с целью клонирования в экспрессирующем векторе pKN100. Верхняя затравка СВВ4К вводит сайт рестрикции HindIII, сайт инициации трансляции Козака и лидерную последовательность VK-10 ARS-A. Нижняя затравка g2258 вводит сайт донора сплайсированного фрагмента и сайт рестрикции BamHI. Полученный фрагмент клонировали в сайты рестрикции HindIII/BamHI вектора pKN100.
Затравки для химеризации тяжелой цепи
Не вызывающую сомнений лидерную последовательность VH В-В4, независимо от последовательности затравки для ПЦР, подвергали сравнительному анализу с мышиными лидерными последовательностями в базе данных Кабата. Ближайшей совместимой последовательностью для лидерной последовательности VK В-В4 была последовательность VH17-1A (Sun et al., PNAS, 84 (1987), 214). Указанная лидерная последовательность была точно вырезана в соответствии с прогнозом, сделанным с помощью алгоритма SignaIP. Затрвки cBB4Hfor (см. выше) и g22949 (5'-CGATGGGCCCTTGGTGGAGGCTGAGGAGACGGTGACTGAGGTTCC-3' [SEQ ID NO:13]; сайт рестрикции подчеркнут) были созданы для получения продукта ПЦР, содержащего лидерную последовательность VH17-1A, VH-область В-В4 и концевые сайты рестрикции HindIII и AlaI, с целью клонирования в экспрессирующем векторе pG4D200. Верхняя затравка cBBHFor вводит сайт рестрикции HindIII, сайт инициации трансляции Козака и лидерную последовательность VH17-1A. Нижняя затравка g22949 вводит 5'-конец С-области гамма-цепи 4 и природный сайт рестрикции APaI. Полученный фрагмент клонировали в сайты рестрикции HindIII/ApaI вектора pG4D200, в результате чего был получен вектор pG4D200cBB4.
Получение антитела сВВ4
Одну пробирку с клетками COS 7 оттаивали и клетки выращивали в среде DMEM, содержащей 10% фетальной сыворотки клона I с антибиотиками. Через одну неделю клетки (0,7 мл в количестве 107 клеток/мл) электропорировали вектором pG4D200cBB4 с pKN100cBB4 (10 мкг ДНК каждого) или без ДНК. Клетки культивировали в 8 мл питательной среды в течение 4 дней. Электропорацию повторяли семь раз.
Обнаружение химерного антитела
Сэндвич-метод ELISA использовали для измерения концентраций антител в супернатантах клеток COS 7. Временно трансформированные клетки COS 7 секретировали примерно 6956 нг/мл антителоа (данные не показаны).
Связывающая активность антитела сВ-В4
Связывающую активность антитела сВ-В4 в супернатантах культур клеток COS 7 анализировали при помощи твердофазного сэндвич-метода ELISA с использованием набора Diaclone, содержащего sCD138. Моноклональным антителом, специфичным к sCD138, сенсибилизировали лунки титровального микропланшета. Во время первой инкубации sCD138 и биотинилированное антитело В-В4 (био-В-В4) инкубировали вместе, выполняя серию разведений немеченого испытуемого антитела (В-В4 или сВ-В4).
Концентрации био-В-В4 при выполнении данного анализа были уменьшены для конкуренции с немеченым антителом в низких концентрациях (концентрация сВ-В4 в супернатантах культур клеток COS 7 в противном случае была слишком низкой для достижения достаточной конкуренции). Результаты данного анализа показывают, что оба антитела обладают одинаковой специфичностью к CD138 (данные не показаны).
Очистка антитела сВ-В4
Химерное антитело В-В4 очищали от супернатантов клеток COS 7, используя набор ImmunoPure Plus, содержащий белок А (Pierce), в соответствии с рекомендациями производителя (данные не показаны).
Определение К D : сравнение nBT062/BB4
Очистка растворимого антигена CD138
Растворимый антиген CD138 из супернатанта культуры клеток U-266 очищали методом FPLC, используя 1 мл NHS-активируемую НР колонку HiTrap, связанную с В-В4. В колонку вводили супернатант культуры клеток в физиологическом растворе с фосфатным буфером при рН 7,4 и антиген CD138 элюировали 50 мМ триэтиламина с рН 11 в 2 мл фракциях. Элюированный антиген CD138 сразу же нейтрализовали 375 мкл 1 М раствора трис-буфера с HCl, рН 3, для предотвращения структурных и/или функциональных разрушений.
Биотинилирование CD138
Антиген CD138 метили сульфо-NHS-LC (Pierce). NHS-активируемые биотины эффективно взаимодействуют с первичными аминогруппами, такими как остатки лизина, в буферах с рН 7-9 с образованием устойчивых амидных связей.
Для биотинилирования антигена CD138 50 мкл CD138 обессоливали, используя центрифужные колонки для обессоливания белка (Pierce). Биотинилирующий реагент (сульфо-NHS-LC-биотин с EZ-линкером, Pierce) растворяли в ожлаждаемой льдом деионизированной Н2О до конечной концентрации 0,5 мг/мл. Раствор биотинилирующего реагента и улавливающего реагента смешивали с 12-кратным молярным избытком биотинилирующего реагента по сравнению с улавливающим реагентом (50 пмоль антигена CD138 на 600 пмоль биотинилирующего реагента) и инкубировали в течение 1 часа при комнатной температуре, осторожно встряхивая пробирку. Несвязанный биотинилирующий реагент удаляли в колонках для обессоливания белка.
Иммобилизация bCD138
Сенсорный чип (сенсорный чип SA, Biacore AB), использованный в анализе BIACORE, предназначен для связывания биотинилированных молекул с целью выполнения анализа взаимодействия в системах BIACORE. Поверхность состоит из матрицы из карбоксиметилированного декстрана, предварительно иммобилизованной стрептавидином, которая готова для высокоаффинного улавливания биотинилированных лигандов. bCD138 иммобилизовали на сенсорном чипе SA со скоростью потока 10 мкл/мин путем ручного введения. Поверхность чипа обрабатывали, производя три последовательных одноминутных впрыскивания 1 М раствора NaCl в 50 мМ NaOH. Затем в течение 1 минуты вводили биотинилированный антиген CD138.
Определение К D разных антител с использованием программы BIACORE
В программном обеспечении BIACORE C использованы заранее определенные маски, так называемые ”мастера”, предназначенные для разных экспериментов, в которых могут быть изменены только определенные установки. Так как программное обеспечение BIACORE C было первоначально разработано для измерения концентраций, в нем отсутствует мастер, служащий для выполнения измерений сродства. Однако при соответствующих установках мастер для измерения ”неспецифического связывания” может быть использован для измерения констант сродства и следовательно для определения KD. С помощью данного мастера было произведено измерение двух проточных кювет при установке фазы диссоциации на 90 с путем выполнения ”регенерации 1” с помощью разделяющего буфера BIACORE. “Регенерацию 2”, которая эквивалентна действительной регенерации, выполняли, используя 10 мМ гидрохлорида глицина, рН 2,5. После выполнения данной стадии лиганд CD138 снова находился в компетентном состоянии связывания. В течение всей процедуры в качестве разделяющего и разбавляющего буфера использовали HBS-EP. Для определения связывания разных антител (~150 кДа) с CD138 анализировали ассоциацию и диссоциацию при разных концентрациях (100, 50, 25, 12,5, 6,25 и 3,13 нМ). Константы равновесия диссоциации определяли, вычисляя константы скорости kа и kd. Значения КD веществ, определяемых при анализе, вычисляли с учетом коэффициента kd и ka при помощи программного обеспечения BIAevaluation. Результаты приведены в таблице 4.
1,4
1,5
1,7
1,6
1,9
1,9
2,7
2,6
Рассмотрение результатов
Средние значения КD для каждого антитела были вычислены по результатам трех независимых экспериментов. Полученные данные показывают, что при выполнении всех измерений антитело nBT062 характеризуется несколько меньшими значениями КD по сравнению с В-В4 (средние значения КD были соответственно равны 1,4 и 1,6 нМ).
Получение иммуноконъюгатов
nBT062-DM1 и huC242-DM1
Тиолсодержащий майтанзиноид DM1 синтезировали из продукта ферментации микробов ансамитоцина Р-3 способом, описанным Чари (Chari et al., Cancer Res. 1 (1992), 127). Получение гуманизированного антитела С242 (huC242) было описано ранее (Roguska et al., PNAS, 91 (1994), 969). Конъюгаты антитела с лекарственным средством были получены ранее описанным способом (Liu et al., PNAS, 93 (1996), 8618). С одной молекулой антитела в среднем было связано 3,5 молекулы DM1.
nBT062-DM4
ВТ062 является конъюгатом антитела с лекарственным средством, состоящим из цитотоксического майтанзиноида DM4, связанного дисульфидными связями при помощи линкера с химерным моноклональным антителом nBT062. Майтанзиноиды являются антимитотическими агентами, ингибирующими полимеризацию тубулина и сборку микротрубочек (Remillard et al., Science 189 (1977), 1002). Химическая структура и схематическое изображение ВТ062 (nBT062-DM4) показаны на фиг. 1 и 2.
Синтез DM4
DM4 получают из хорошо известного производного майтанзинола (Kupchan et al., J. Med. Chem., 21 (1978), 31). Майтанзинол получают путем восстановительного расщепления сложноэфирной части продукта ферментации микробов ансамитоцина Р3 с помощью триметоксиалюмогидрида лития (см. фиг. 3).
DM4 синтезируют путем ацилирования майтанзинола N-метил-N-(4-метилдитиопентаноил)-L-аланином (боковая цепь DM4) в присутствии дициклогексилкарбодиимида (DCC) и хлорида цинка с образованием дисульфид-содержащего майтанзиноида DM4-SMe. DM4-SMe восстанавливают дитиотреитолом (DTT), получая при этом требуемый тиолсодержащий майтанзиноид DM4 (см. фиг. 4 для ознакомления с блок-схемой процесса получения DM4).
Иммуноконъюгат ВТ062
Способ получения nBT062-DM4 показан на фиг. 5. Антитело nBT062 модифицируют N-сукцинимидил-4-(2-пиридилдитио)бутиратом (линкер SPDB) для введения дитиопиридильных групп. DM4 смешивают с модифицированным антителом в концентрации, превышающей эквиваленты дитиопиридильных групп. Конъюгат ВТ062 получают путем реакции дисульфидного обмена между тиоловой группой DM4 и дитиопиридильными группами, введенными в антитело с помощью линкера. Хроматографическая очистка и диафильтрация позволяют удалить низкомолекулярные реагенты (DM4) и продукты реакции (тиопиридин), а также агрегаты конъюгированного антитела с образованием нерасфасованного лекарственного средства.
Анализ методом FACS и анализы цитотоксичности с использованием водорастворимой соли тетразолия (WST)
Анализ методом FACS
Клетки ОРМ-2 представляют собой линии клеток плазмаклеточного лейкоза, экспрессирующие антиген CD138 на высоком уровне. Клетки ОРМ-2 инкубировали с nBT062, nBT062-SPDB-DM4, nBT062-SPP-DM1 или nBT062-SMCC-DM1 в разных концентрациях (указанных на фиг. 6). Клетки промывали и CD138-связанное антитело или конъюгаты обнаруживали, используя вторичное антитело, меченное флуоресцеином, при помощи анализа методом клеточного сортинга с возбуждением флуоресценции (FACS). Средние значения флуоресценции, измеренные в указанных экспериментах, представлены в виде графика зависимости от концентрации антитела.
Анализ жизнеспособности клеток
CD138+ клетки MOLP-8 высевали на плоскодонные планшеты в количестве 3000 клеток/лунка. Контрольные CD138- клетки BJAB высевали в количестве 1000 клеток/лунка. Клетки обрабатывали nBT062-SPDB-DM4, nBT062-SPP-DM1 или nBT062-SMCC-DM1 в разных концентрациях (указанных на фиг. 7) в течение пяти дней. Реагент WST (водорастворимая соль тетразолия, ROCHE), используемый для измерения жизнеспособности клеток, добавляли в соответствии с инструкциями производителя (ROCHE). Указанный реагент инкубировали в течение 7,5 часа на клетках MOLP-8 и в течение 2 часов на клетках BJAB. Фракцию выживших клеток вычисляли на основании оптической плотности, которую измеряли в спектрометре для прочтения микропланшетов стандартными методами.
Рассмотрение результатов
Связывание nBT062-SPDB-DM4, nBT062-SPP-DM1, nBT062-SMCC-DM1 или nBT062 анализировали методом FACS. CD138+ клетки ОРМ-2, используемые в качестве клеток-мишеней, инкубировали с nBT062 или иммуноконъюгатами и связанные с клетками молекулы обнаруживали с помощью вторичного антитела, меченного флуоресцеином. На фиг. 6 средние значения флуоресценции в качестве меры количества связанного с клетками антитела представлены в виде графика зависимости от разных концентраций антитела или конъюгата. Полученные данные показывают, что nBT062-SPDB-DM4, nBT062-SPP-DM1 и nBT062-SMCC-DM1 имеют очень схожие характеристики связывания. Кроме того, полученные результаты позволяют предположить, что на характеристики связывания неконъюгированного антитела не влияют конъюгированные токсины.
При выполнении анализов жизнеспособности клеток анализировали цитотоксическую активность антитела против CD138+ клеток-мишеней MOLP-8 и против контрольных CD138- клеток В-лимфобластомы BJAB. Обе линии клеток высевали на плоскодонные планшеты и инкубировали с иммуноконъюгатами в возрастающих концентрациях. Неконъюгированное антитело было использовано в качестве контрольного антитела. Цитотоксическую активность анализировали в течение пяти дней после добавления иммуноконъюгатов, используя реагент WST для измерения жизнеспособности клеток. На фиг. 7 (А)-(С) фракция выживших клеток по сравнению с контрольными клетками, которые обрабатывали контрольным наполнителем, представлена в виде графика зависимости от возрастающих концентраций иммуноконъюгатов. Полученные данные показывают, что цитотоксическая активность nBT062-SPDB-DM4, nBT062-SPP-DM1 и nBT062-SMCC-DM1 против клеток MOLP-8 является очень схожей. Как ожидалось, контрольные CD138- клетки BJAB не были уничтожены иммуноконъюгатами, из чего следует, что все иммуноконъюгаты действуют путем клеточно-специфического связывания с CD138. При выполнении экспериментов по конкурентному связыванию клетки MOLP-8 предварительно инкубировали с молярным избытком неконъюгированного антитела nBT062. Предварительная инкубация по существу блокировала цитотоксичность nBT062-SPDB-DM4, что стало еще одним свидетельством того, что иммуноконъюгаты уничтожают клетки путем специфического связывания с CD138 на поверхности клетки (фиг. 7(D)).
Эксперименты с использованием мышей, несущих ксенотрансплантаты
Для оценки важности направленного воздействия на CD138 для противоопухолевой активности конъюгатов антитела с майтанзиноидом при использовании человеческого химерного варианта антитела В-В4, nBT062, выполняли эксперименты с использованием мышей, несущих ксенотрансплантаты. Были получены два варианта конъюгатов nBT062 с майтанзиноидом, которые отличались химической стойкостью дисульфидных связей (nBT062-SPP-DM1 и nBT062-SPDB-DM4). Противоопухолевую активность указанных конъюгатов антитела с лекарственным средством сравнивали с активностью конъюгата В-В4-SPP-DM1 (включающего мышиное родительское антитело), а также неконъюгированного свободного майтанзиноида (DM4), нативного немодифицированного антитела nBT062 и конъюгата IgG1 с майтанзиноидом ненаправленного действия (нерелевантный конъюгат). Конъюгаты оценивали с использованием CD138-положительной модели ксенотрансплантата (MOLP-8) множественной миеломы человека у мышей с тяжелым комбинированным иммунодефицитом (SCID).
У указанных мышей вызывали образование подкожных опухолей (самки мышей SCID CB.17) путем инокуляции взвеси клеток MOLP-8. Лечение в виде однократной внутривенной инъекции ударной дозы проводили, когда объем опухоли достигал в среднем 113 мм3. Изменение объема опухоли и массы тела контролировали два раза в неделю. Эксперименты выполняли в течение 68 дней после инокуляции опухолевых клеток.
Эксперименты А с использованием мышей, несущих ксенотрансплантаты
Мыши
Самки мышей SCID CB.17 в возрасте пяти недель были приобретены в компании Charles River Laboratories.
Линии опухолевых клеток человека
MOLP-8, линия клеток множественной миеломы человека, была получена из АТСС. Клетки MOLP-8, экспрессирующие антиген CD138 на поверхности клеток и образующие ксенотрансплантаты опухолей у мышей SCID, сохраняли в среде RPMI-1640, содержащей 4 мМ L-глутамина (Biowhittaker, Walkersville, MD), 10% фетальной телячьей сыворотки (Hyclone, Logan, Utah) и 1% стрептомицина/пенициллина, при 37°С во влажной атмосфере, содержащей 5% СО2.
Часть I
Рост опухолей у мышей
Каждой мыши подкожно инокулировали 1×107 клеток MOLP-8 в область под правым плечом. Общий объем клеток составлял 0,2 мл/мышь, при этом отношение бессывороточной среды к матригелю (BD Bioscience, Bedford, MA) было равно 1/1 (об./об.). До начала лечения ежедневно контролировали образование ксенотрансплантатов опухолей. Объем опухолей достигал почти 113 мм3 примерно через 11 дней после инокуляции опухолевых клеток. Образование опухолей у мышей SCID CB.17 было равно 100%.
Через одиннадцать дней после инокуляции опухолевых клеток отбирали 42 мыши с учетом объемов опухолей и массы тела. Объем опухоли находился в пределах от 68,2 до 135,9 мм3. Сорок две мыши произвольно распределяли в семь групп (А-G) по шесть животных в каждой группе с учетом объема опухоли.
Каждой из шести мышей в группе А вводили 200 мкл PBS в качестве контрольного наполнителя. Каждой мыши в группе В вводили 13,8 мг/кг голого антитела nBT062. Указанная доза эквивалентна количеству антитела nBT062 в 250 мкг/кг связанного майтанзиноида. Отношение молекулярных масс майтанзиноидов к антителу nBT062 в молекуле конъюгата равно примерно 1/55. Каждой мыши в группе С вводили 250 мкг/кг DM4. Каждой мыши в группе D вводили 250 мкг/кг huC242-DM4. Мышам в группах Е, F и G вводили соответственно 250 мкг/кг nBT062-SPDB-DM4, B-B4-SPP-DM1 и nBT062-SPP-DM1.
Все агенты вводили внутривенно в виде одной инъекции ударной дозы через боковую хвостовую вену с помощью 1 мл шприца, оснащенного иглой 27 калибра длиной 1,25 см (1/2 дюйма). Перед введением исходные растворы антитела nBT062, конъюгатов nBT062-SPDB-DM4 и nBT062-SPP-DM1 разбавляли стерильным PBS до концентраций 2 мг/мл, 28,1 мкг/мл и 28,1 мкг/мл таким образом, чтобы объем, вводимый каждой мыши, был равен 120-220 мкл.
Часть II
Во второй серии экспериментов клетки MOLP-8 (1,5×107 клеток/мышь), взвешенные в смеси бессывороточной среды и матригеля в соотношении 50:50, инъецировали подкожно в количестве 100 мкл в область под правым плечом. На 11-й день объемы опухолей достигли примерно 80 мм3, при этом среднее значение у контрольных животных было равно примерно 750 мм3 на 25-й день после инокуляции клеток. Время удвоения опухоли было равно 4,58 дня. Каждой мыши в контрольной группе (n=6) вводили (внутривенно) 0,2 мл стерильного PBS в боковую хвостовую вену в виде инъекции ударной дозы (i.v.). Все дозы определяли на основании конъюгированного майтанзиноида. Животным в девяти группах (n=6) делали одну внутривенную инъекцию nBТ062-SMCC-DM1, nBT062-SPDB-DM4 или nBT062-SPP-DM1 в дозах, равных 450, 250 и 100 мкг/кг. Животным в дополнительной группе (n=6) вводили 250 мкг/кг nBT062-SMCC-DM1 в виде повторных доз (один раз в неделю в течение пяти недель). Мышей произвольно распределяли в одиннадцать групп (n=6) с учетом объема опухоли в соответствии с программой LabCat. Объемы опухолей находились в пределах от 40,0 до 152,5 мм3. Дозы для мышей определяли на основании массы тела.
Размер опухоли измеряли два раза в неделю в трех направлениях, используя систему LabCat (Tumor Measurement and Tracking, Innovative Programming Associated, Inc., Princeton, NJ). Объем опухоли в мм3 вычисляли с помощью метода, описанного в публикации Tomayko et al., Cancer Chemother. Pharmacol. 24 (1989), 148:
Log10 лизиса клеток вычисляли по формуле, описанной в публикации Bissery et al., Cancer Res., 51 (1991), 4845:
где (Т-С) или задержка роста опухоли означает среднее время в днях, необходимое для достижения опухолями заранее определенного размера (600 мм3) в экспериментальной группе (Т) и контрольной группе (С). Td означает время удвоения опухоли, определяемое на основании среднего объема опухоли у контрольных мышей, и 3,32 означает число удвоений клеток на log роста опухоли.
Результаты
Рост опухолей у отдельных мышей показан на фиг. 8 и 9. Среднее значение (± стандартное отклонение) роста опухолей для каждой группы показано на фиг. 10.
При сравнении с ростом опухолей у животных, которым вводили PBS, введение антитела nBT062, неконъюгированного свободного DM4 или нерелевантного конъюгата ненаправленного действия huC242-DM4 не вызывало значительного ингибирования роста опухолей.
Все три конъюгата против CD138, nBT062-SPDB-DM4, B-B4-SPP-DM1 и nBT062-SPP-DM1, вводимые в дозе 250 мкг/кг, вызывали значительную задержку роста опухоли. С учетом средних объемов опухолей, измеренных в экспериментальных группах, конъюгат с DM4 nBT062-SPDB-DM4 был наиболее активным, в то время как конъюгат nBT062-SPP-DM1 характеризовался несколько более высокой активностью по сравнению с мышиным конъюгатом В-В4-SPP-DM1 (фиг. 10). Результаты, полученные у отдельных мышей, кроме того, показывают, что противоопухолевая активность конъюгата В-В4-SPP-DM1 являются более гетерогенной и поэтому менее прогнозируемой по сравнению с конъюгатом nBT062-SPP-DM1. С точки зрения гомогенности противоопухолевой активности другой конъюгат, в котором использовано антитело nBT062 в качестве антитела против клетки-мишени, nBT062-SPDB-DM4 действовал подобно конъюгату nBT062-SPP-DM1.
Ни в одной экспериментальной группе не было отмечено уменьшение массы тела, из чего следует, что мыши хорошо переносили лечение.
Рассмотрение результатов
Результаты анализа трех конъюгатов против CD138, вводимых экспериментальным животным, показывают важное значение направленной доставки противоопухолевой активности. В то время как конъюгаты майтанзиноида с человеческим химерным антителом nBT062 и мышиным антителом В-В4 характеризовались значительной активностью при измерении с помощью log лизиса клеток, при лечении неконъюгированным DM4, немодифицированным нативным антителом huBT062 или контрольным конъюгатом ненаправленного действия (huC242-DM4) не было отмечено значительного воздействия на рост опухоли.
Иммуноконъюгат, полученный из человеческого химерного антитела, nBT062-SPP-DM1 характеризовался несколько более высокой противоопухолевой активностью по сравнению с конъюгатом, полученным из мышиного антитела В-В4-SPP-DM1. Кроме того, введение nBT062-SPP-DM1 и nBT062-SPDB-DM4 вызвало более гомогенные реакции у отдельных мышей по сравнению с введением В-В4-SPP-DM1. То, что для В-В4-SPP-DM1 фактически были получены несколько лучшие результаты, чем для nBT062-SPP-DM1 (данные не показаны) при измерении среднего объема опухолей (± стандартное отклонение) ксенотрансплантатов множественной миеломы человека MOLP-8 у мышей SCID CB.17 через некоторое время (дней) после инокуляции, объяснялось высокой изменчивостью связывания В-В4-SPP-DM1. Рассмотренная особенность иммуноконъюгатов с использованием nBT062 в качестве антитела против клетки-мишени кажется особенно полезной для терапевтического использования указанных конъюгатов.
И наконец, самым сильнодействующим из конъюгатов майтанзиноида после однократного внутривенного введения в моделях ксенотрансплантатов MOLP-8 у мышей SCID был конъюгат nBT062-SPDB-DM4.
Эксперименты В с использованием мышей, несущих ксенотрансплантаты
В данной серии экспериментов восьмидесяти пяти мышам подкожно инокулировали клетки MOLP-8 (1,5×107 клеток/мышь) в правое плечо. Опухоль образовалась у 100% мышей. Шестьдесят шесть мышей SCID, имеющих объемные опухоли MOLP-8 со средним объемом опухоли около 80 мм3, произвольно распределяли в одиннадцать экспериментальных групп (n=6). Мышам вводили однократную дозу одного из трех конъюгатов (nBT062-SMCC-DM1, nBT062-SPDB-DM4 или nBT062-SPP-DM1). Дополнительной группе вводили пять еженедельных доз nBT062-SMCC-DM1 и контрольной группе вводили однократную дозу PBS. Средние объемы опухолей показаны на фиг. 11А. Определяли реакцию на дозу каждого конъюгата. У мышей, которым вводили PBS, опухоль достигла среднего объема, равного 750 мм3, на 25-й день. Время удвоения опухоли, определенное методом наилучшего приближения линейной регрессионной кривой на логарифмическом линейном графике роста контрольной опухоли, было равно 4,58 дня. Животные, которым вводили nBT062-SPDB-DM4 в дозе 450 мкг/кг, характеризовались наибольшим log лизиса клеток (LCK=2,89), несколько более низкий показатель имели животные, которым еженедельно вводили nBT062-SMCC-DM1 в дозе 250 мкг/кг (LCK=2,1; см. таблицу 5). Сравнение кривых среднего роста опухолей для экспериментальных групп при повторных измерениях методом ANOVA с использованием множественного t-критерия сравнения Даннетта свидетельствовало о значительном расхождении между контрольной группой, которой вводили PBS, и группами, которым вводили 450 мкг/кг nBT062-SPDB-DM4 (p<0,01), 250 мкг/кг nBT062-SPDB-DM4 (р<0,05) и пять еженедельных доз, равных 250 мкг/кг nBT062-SMCC-DM1 (р<0,05). Ни в одной из экспериментальных групп не произошла частичная или полная регрессия опухоли за исключением одного животного, которому вводили 450 мкг/кг nBT062-SPDB-DM4, у которого наблюдалась частичная регрессия опухоли до 85-го дня после инокуляции.






| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ УЛУЧШЕНИЯ НАПРАВЛЕННОГО ВОЗДЕЙСТВИЯ НА CD138-ЭКСПРЕССИРУЮЩИЕ ОПУХОЛЕВЫЕ КЛЕТКИ И АГЕНТЫ ДЛЯ ИХ ОСУЩЕСТВЛЕНИЯ | 2008 |
|
RU2486203C2 |
| ИММУНОКОНЪЮГАТЫ, НАПРАВЛЕННЫЕ НА CD138, И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2547939C2 |
| ПРИМЕНЕНИЯ ИММУНОКОНЪЮГАТОВ, МИШЕНЬЮ КОТОРЫХ ЯВЛЯЕТСЯ CD138 | 2010 |
|
RU2561041C2 |
| ПРИМЕНЕНИЯ ИММУНОКОНЪЮГАТОВ, МИШЕНЬЮ КОТОРЫХ ЯВЛЯЕТСЯ CD138 | 2012 |
|
RU2632108C2 |
| АНТИТЕЛА ПРОТИВ РЕЦЕПТОРА ФОЛИЕВОЙ КИСЛОТЫ 1, ИХ ИММУНОКОНЪЮГАТЫ И ИСПОЛЬЗОВАНИЕ | 2011 |
|
RU2610663C2 |
| CD37-СВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ И ИХ ИММУНОКОНЪЮГАТЫ | 2011 |
|
RU2610662C9 |
| ПРОТИВООПУХОЛЕВЫЕ КОМБИНАЦИИ, ВКЛЮЧАЮЩИЕ КОНЪЮГАТЫ НА ОСНОВЕ АНТИТЕЛА К CEACAM5, ТРИФЛУРИДИН И ТИПИРАЦИЛ | 2021 |
|
RU2835019C1 |
| СХЕМЫ ПРИМЕНЕНИЯ ИММУНОКОНЪЮГАТА АНТИ-FOLR1 | 2014 |
|
RU2696579C2 |
| СХЕМЫ ПРИМЕНЕНИЯ ИММУНОКОНЪЮГАТА АНТИ-FOLR1 | 2014 |
|
RU2801307C1 |
| ПРИМЕНЕНИЕ ИММУНОКОНЪЮГАТОВ К CEACAM5 ДЛЯ ЛЕЧЕНИЯ РАКА ЛЕГКОГО | 2020 |
|
RU2828374C2 |






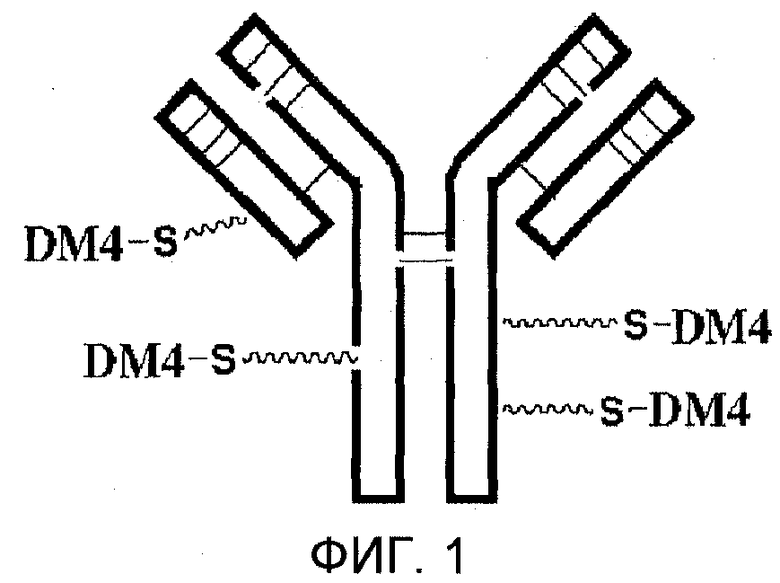
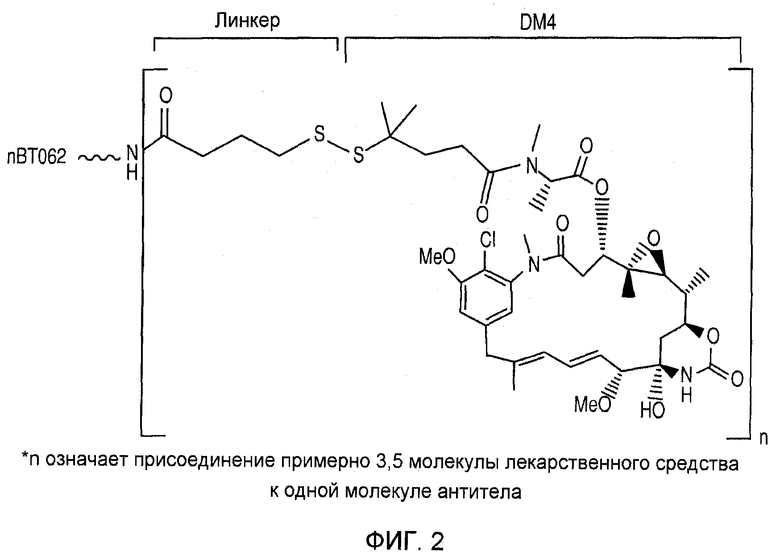
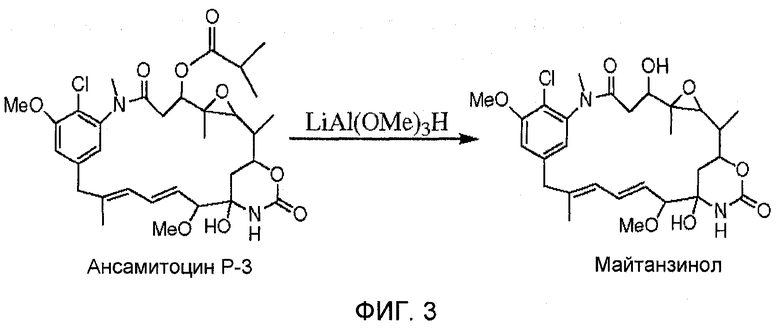
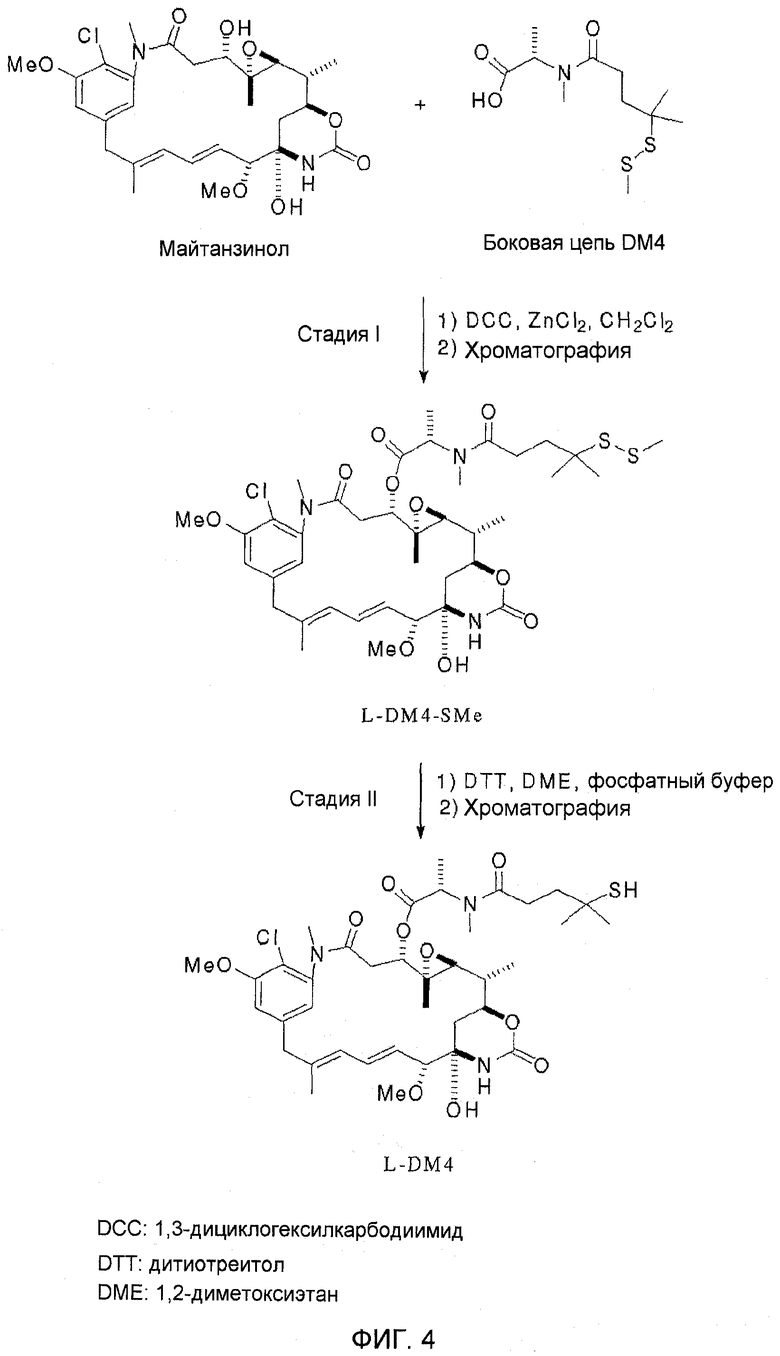
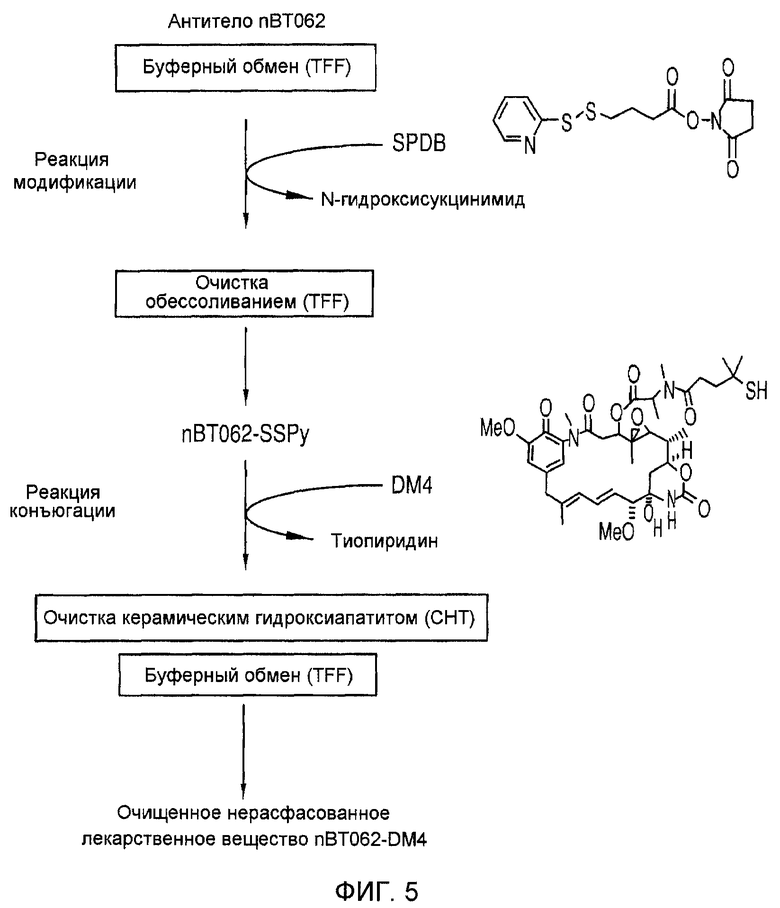
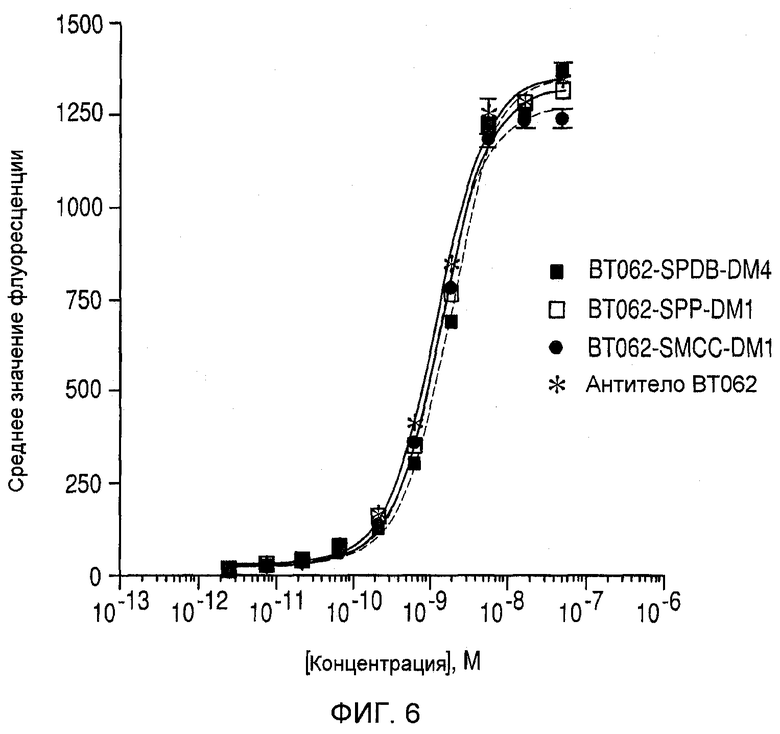
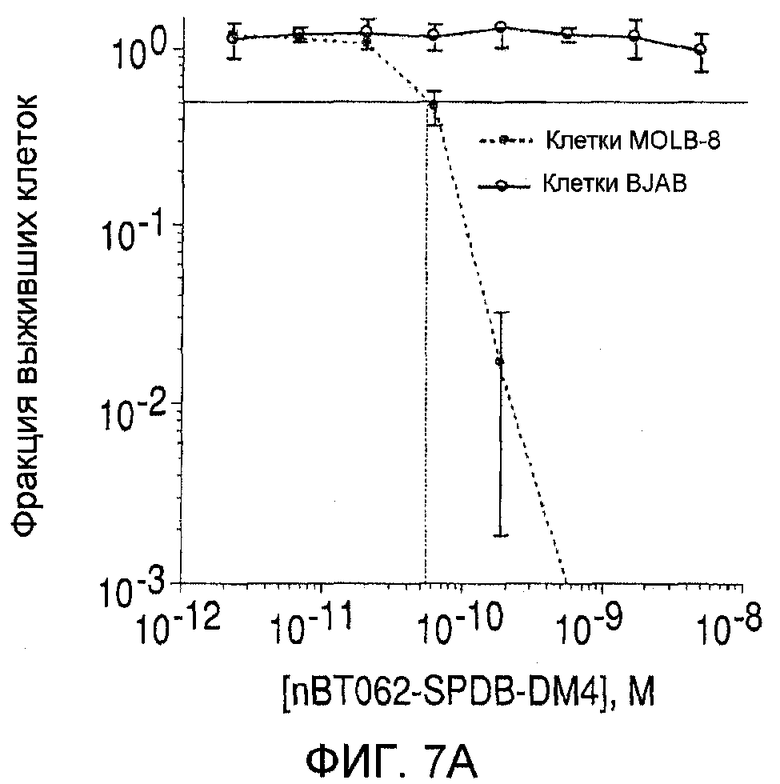
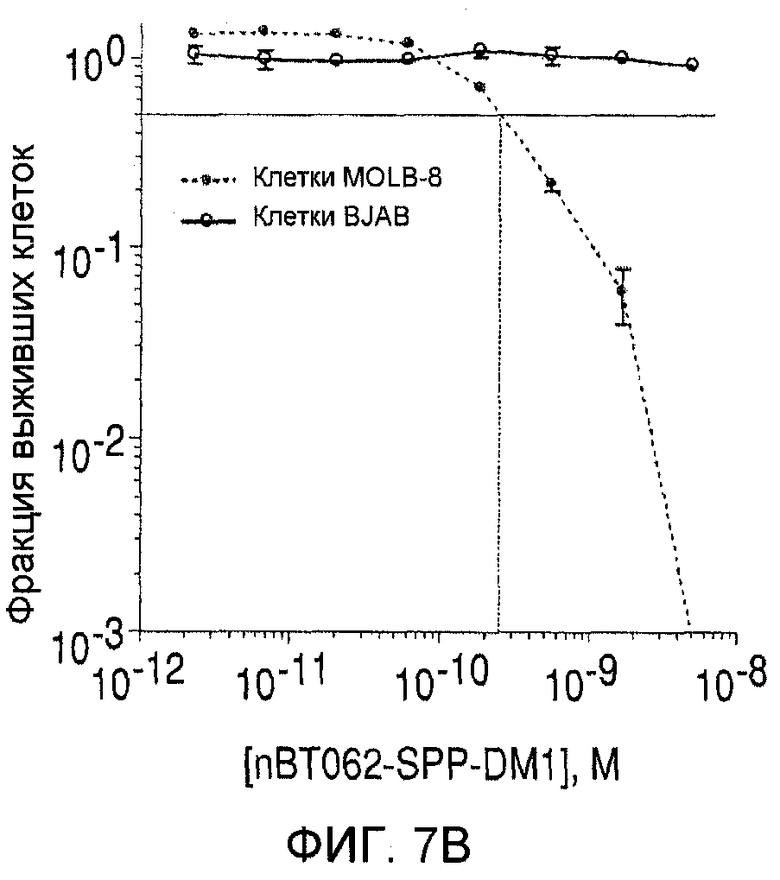
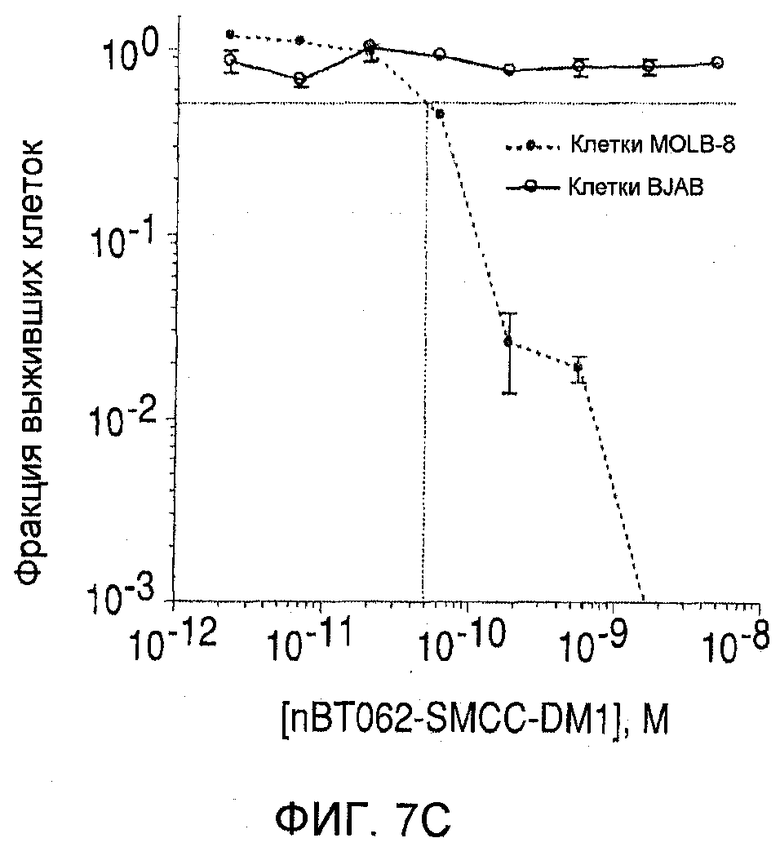
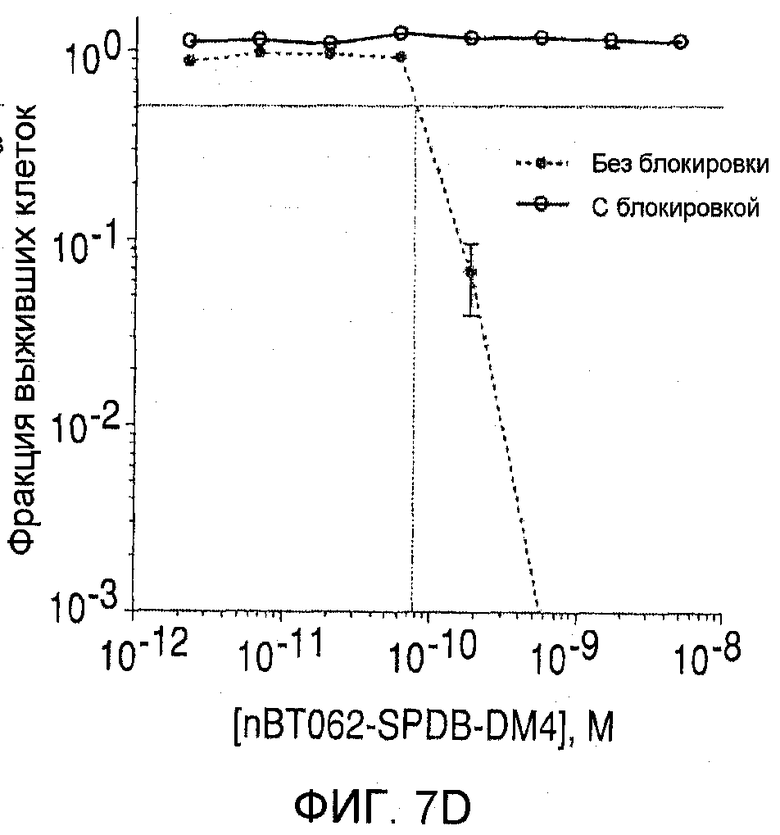
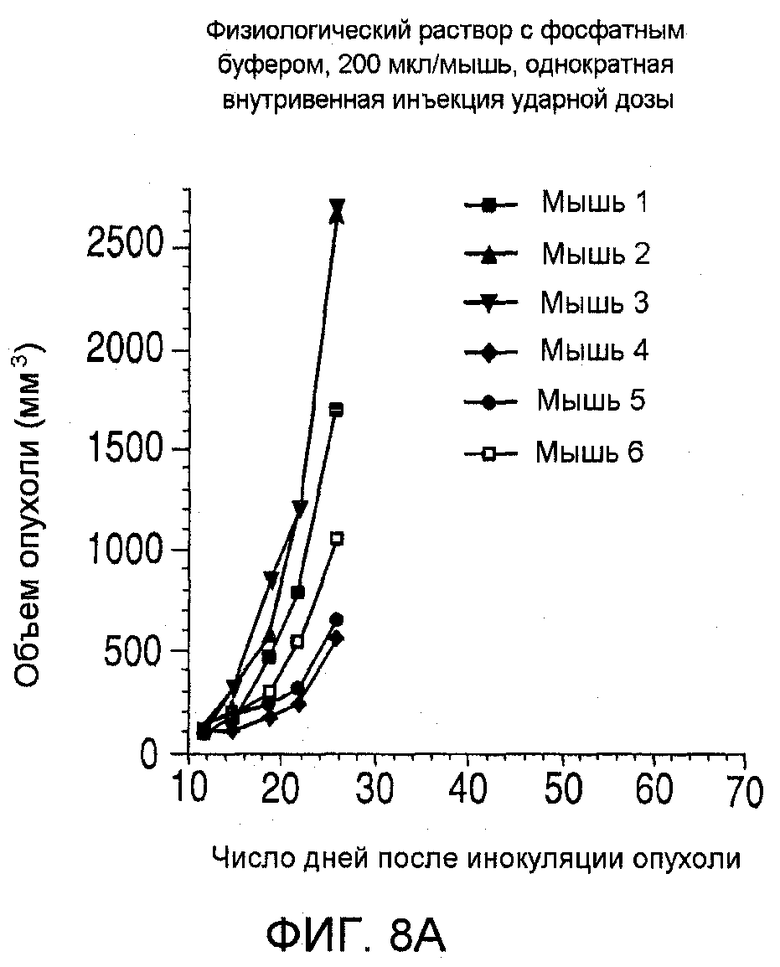
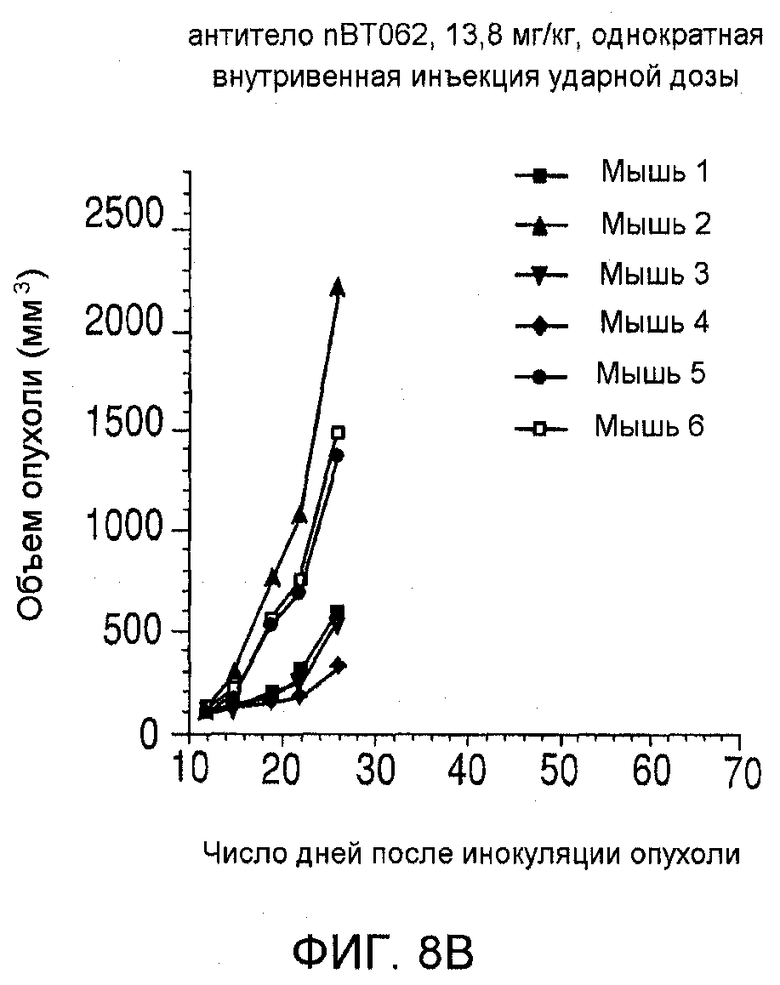
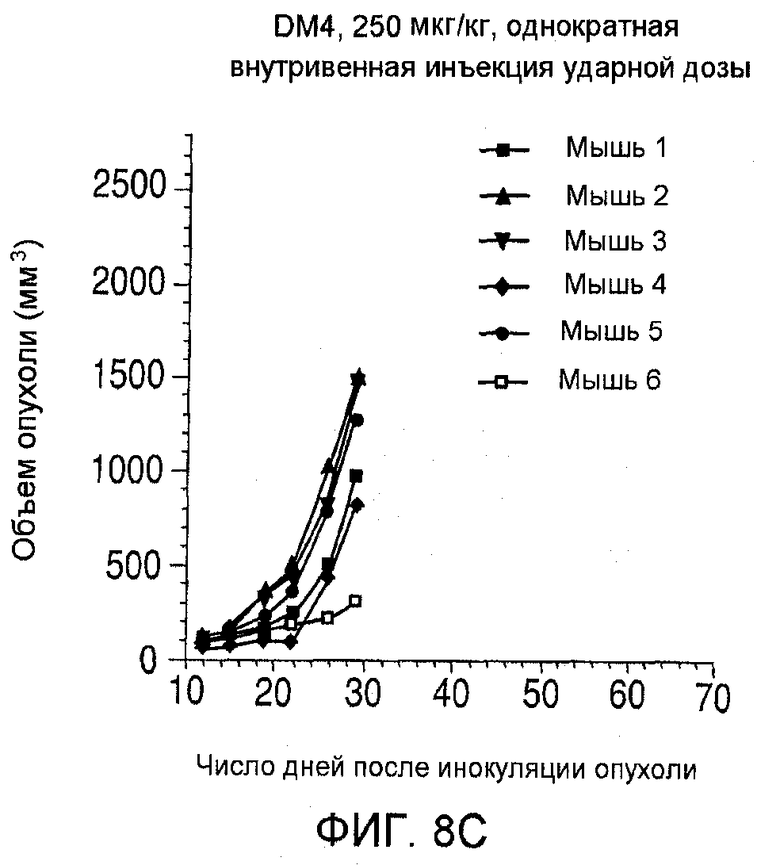
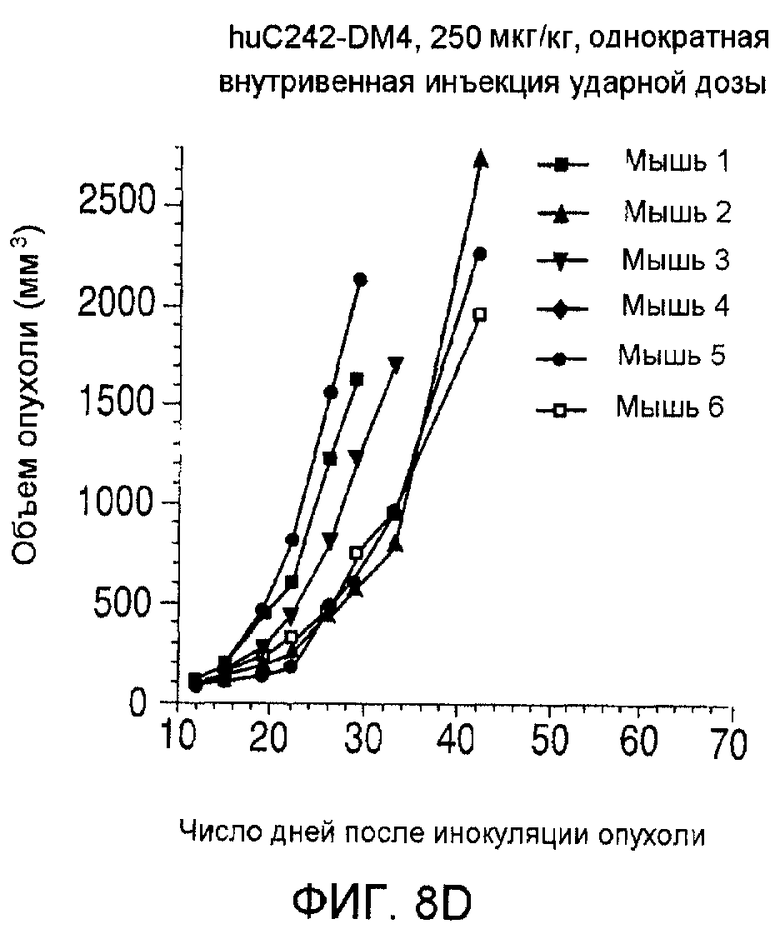
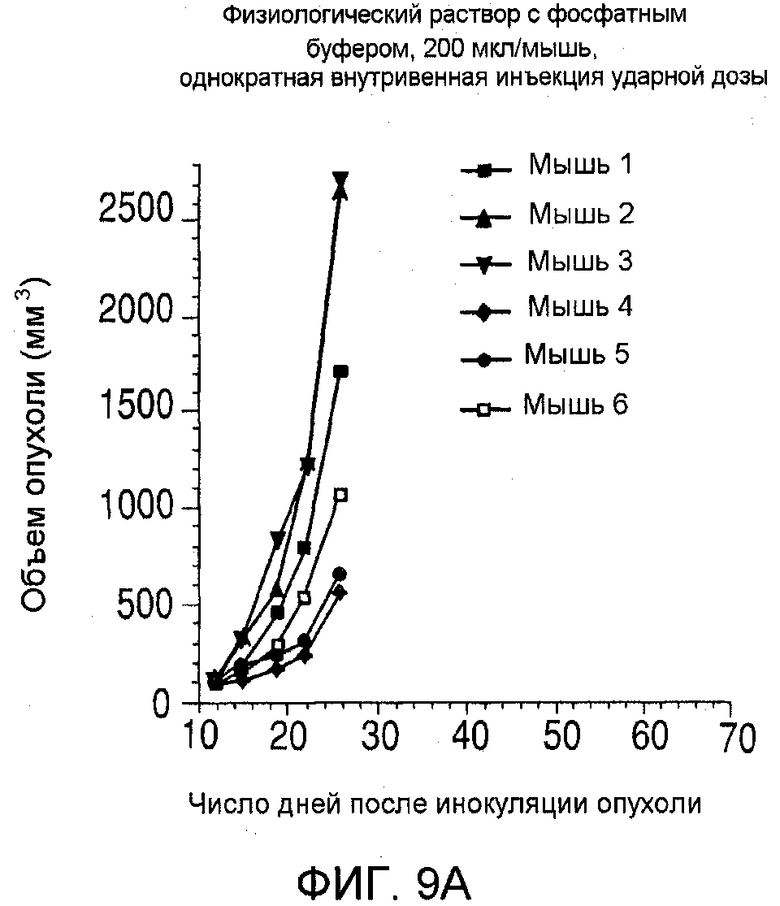
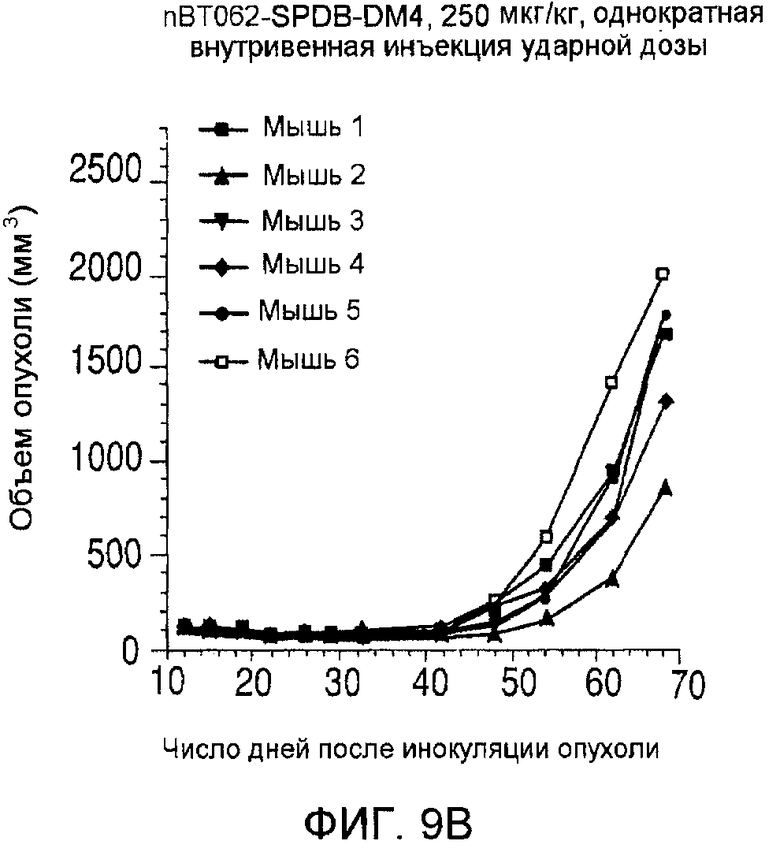
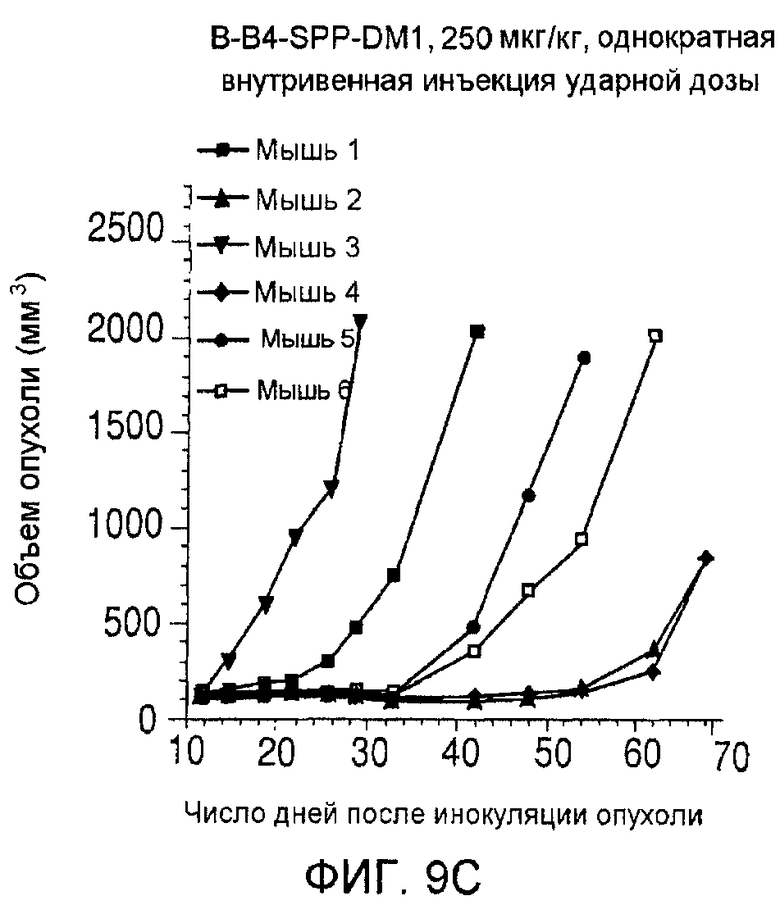
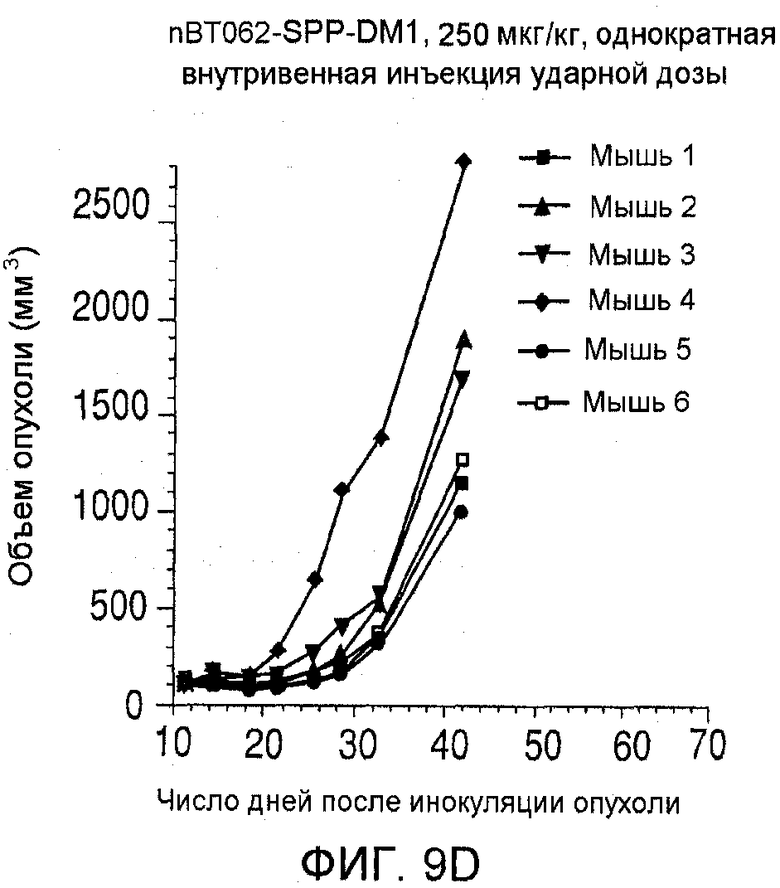

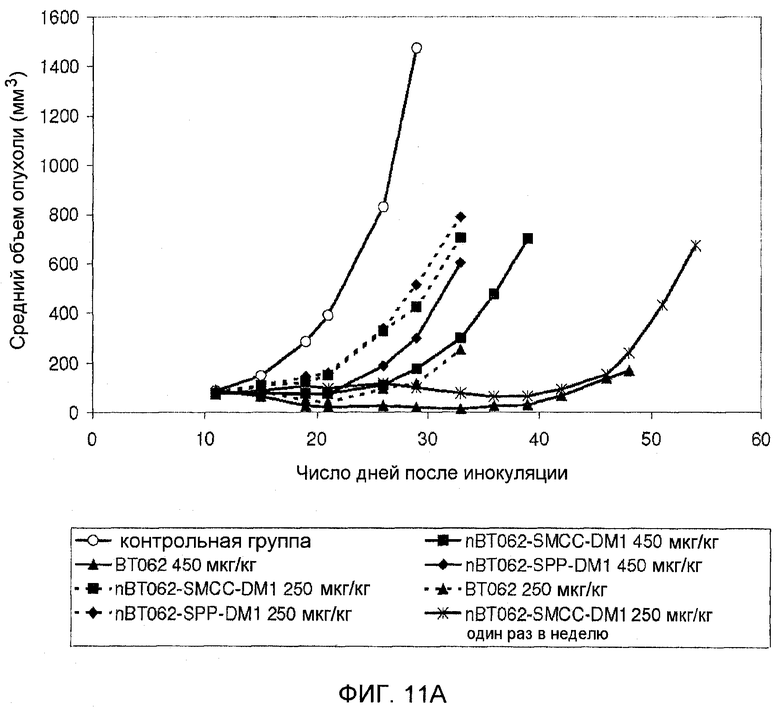
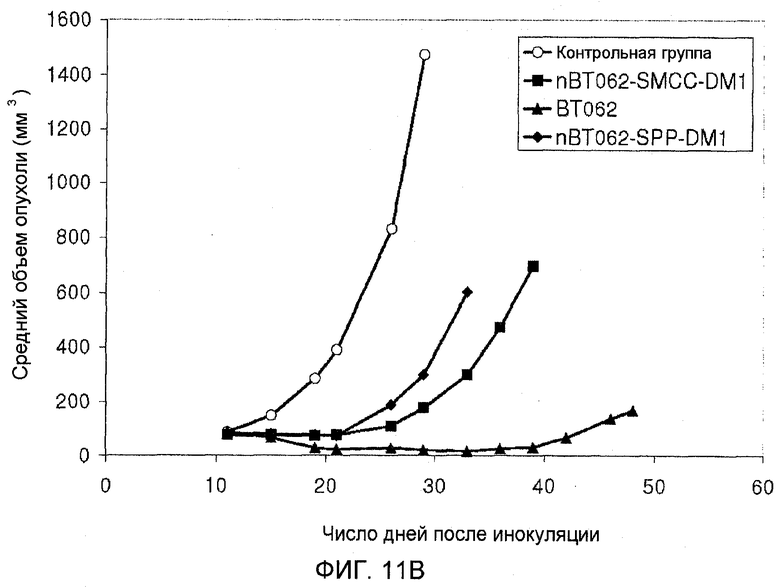
Изобретение относится к области биотехнологии и иммунологии. Предложено генетически созданное антитело, способное связывать CD138 человека. Описаны последовательности его тяжелой и легкой цепей, а также их CDR. Предложенное антитело может быть использовано, в составе фармацевтической композиции, для лечения опухолей. 6 н. и 7 з.п. ф-лы, 21 ил., 5 табл.
1. Генетически созданное антитело, способное связывать CD138 человека в клетках, экспрессирующих CD138 человека, содержащее
тяжелую цепь, которая по меньшей мере на 90% идентична последовательности SEQ ID NO:1, и легкую цепь, которая по меньшей мере на 90% идентична последовательности SEQ ID NO:2, где:
(a) тяжелая цепь содержит аминокислотные остатки 31-35 (CDR1), 51-68 (CDR2) и 99-111 (CDR3) последовательности SEQ ID NO:1; и
(b) легкая цепь содержит аминокислотные остатки 24-34 (CDR1), 50-56 (CDR2) и 89-97 (CDR3) последовательности SEQ ID NO:2, и указанное генетически созданное антитело относится к изотипу IgG4.
2. Генетически созданное антитело по п.1, которое связывается с CD138 человека с аффинностью связывания, превышающей аффинность связывания с антителом В-В4 мыши.
3. Генетически созданное антитело, способное связывать CD138 человека в клетках, экспрессирующих CD138 человека, содержащее
тяжелую цепь, которая по меньшей мере на 90% идентична последовательности SEQ ID NO:1, и легкую цепь, которая по меньшей мере на 90% идентична последовательности SEQ ID NO:2, где:
(a) тяжелая цепь содержит аминокислотные остатки 31-35 (CDR1), 51-68 (CDR2) и 99-111 (CDR3) последовательности SEQ ID NO:1; и
(b) легкая цепь содержит аминокислотные остатки 24-34 (CDR1), 50-56 (CDR2) и 89-97 (CDR3) последовательности SEQ ID NO:2,
указанное генетически созданное антитело относится к изотипу IgG4,
и которое дополнительно содержит:
(c) аминокислотные остатки 123-448 последовательности SEQ ID NO:1 и/или
(d) аминокислотные остатки 108-214 последовательности SEQ ID NO:2, соответственно
и их мутации, которые стабилизируют генетически созданное антитело,
где указанные мутации выбраны из мутаций замены лейцина на глутаминовую кислоту в CH2-области IgG4 и мутаций замены серина на пролин в шарнирной области IgG4.
4. Генетически созданное антитело по п.1 или 3, где генетически созданное антитело дополнительно содержит эффекторную молекулу для индукции смерти клеток.
5. Генетически созданное антитело по п.1, где указанное генетически созданное антитело является химерным антителом человек/мышь.
6. Генетически созданное антитело по любому из пп.1 или 2, где
(a) тяжелая цепь по меньшей мере примерно на 95% идентична SEQ ID NO:1; и/или
(b) легкая цепь по меньшей мере примерно на 95% идентична SEQ ID NO:2.
7. Генетически созданное антитело по п.1, которое содержит тяжелую цепь с последовательностью SEQ ID NO:1 и легкую цепь с последовательностью SEQ ID NO:2.
8. Фармацевтическая композиция, содержащая генетически созданное антитело по любому из пп.1-7 и фармацевтически приемлемый носитель для применения для лечения путем нацеливания на опухолевые клетки, экспрессирующие CD138 человека.
9. In vitro способ связывания с CD138, включающий:
получение генетически созданного антитела по любому из пп.1-7 и
введение указанного генетически созданного антитела в клетки, экспрессирующие CD138, где указанные генетически созданные антитела связываются с CD138, экспрессированным на указанных клетках, экспрессирующих CD138.
10. Связывающийся с CD138 выделенный полипептид, содержащий аминокислотную последовательность тяжелой цепи иммуноглобулина, при этом последовательность указанной тяжелой цепи иммуноглобулина по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 98% идентична SEQ ID NO:1,
в котором тяжелая цепь иммуноглобулина содержит аминокислотные остатки 31-35 (CDR1), 51-68 (CDR2) и 99-111 (CDR3) последовательности SEQ ID NO:1,
в котором константная область указанной тяжелой цепи иммуноглобулина или указанной его части представляет собой константную часть изотипа IgG4,
и где выделенный полипептид дополнительно содержит аминокислотную последовательность легкой цепи иммуноглобулина, где последовательность указанной легкой цепи иммуноглобулина по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 98% идентична последовательности SEQ ID NO:2,
в котором указанная легкая цепь иммуноглобулина содержит аминокислотные остатки 24-34 (CDR1), 50-56 (CDR2) и 89-97 (CDR3) последовательности SEQ ID NO:2.
11. Выделенный полипептид по п.10, в котором указанная последовательность тяжелой цепи иммуноглобулина идентична последовательности SEQ ID NO:1.
12. Выделенный полипептид по п.10 или 11, в котором указанная последовательность тяжелой цепи иммуноглобулина идентична последовательности SEQ ID NO:2.
13. Способ лечения путем нацеливания на опухолевые клетки, экспрессирующие CD138 человека у индивида, включающий
получение генетически созданного антитела по п.1 или 4, и
введение генетически созданного антитела в CD138-экспрессирующие клетки, при этом указанное генетически созданное антитело связывается с CD138 человека, экспрессированным на указанных клетках экспрессирующих CD138, и
где способ включает введение генетически созданного антитела индивиду в количестве от около 5 мг/м2 до 300 мг/м2 на площадь поверхности индивида.
| СПОСОБ МОДИФИКАЦИИ ПОВЕРХНОСТИ МЕТАЛЛОВ | 2011 |
|
RU2486285C2 |
| TASSONE P | |||
| at al., "Cytotoxic activity of the maytansinoid immunoconjugate B-B4-DM1 against CD138+ multiple myeloma cells", Blood | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| ГЛИКОЗИЛИРОВАННЫЕ АНТИТЕЛА (ВАРИАНТЫ), ОБЛАДАЮЩИЕ ПОВЫШЕННОЙ АНТИТЕЛОЗАВИСИМОЙ КЛЕТОЧНОЙ ЦИТОТОКСИЧНОСТЬЮ | 2002 |
|
RU2321630C2 |
Авторы
Даты
2014-12-27—Публикация
2008-12-23—Подача