ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к иммуногенным пептидам и их применению для лечения инфекционных заболеваний, аутоиммунных заболеваний, иммунных ответов на аллогенные факторы, аллергических заболеваний, опухоли, отторжения трансплантата и иммунных ответов против вирусных векторов, используемых для генной терапии или генной вакцинации.
УРОВЕНЬ ТЕХНИКИ
Терапия многих заболеваний у млекопитающих ограничена отсутствием специализированных лекарственных средств.
При инфекциях, вызываемых внутриклеточными патогенами, инфекция персистирует, вследствие недостаточности иммунного ответа, который распознавал бы и устранял инфицированные клетки. Многие патогены снижают поверхностную экспрессию молекул, таких как главный комплекс гистосовместимости класса I (класс I MHC), в клетках, в которые проникли указанные патогены, тем самым, снижая способность иммунной системы индуцировать цитолитический иммунный ответ, который индуцируется, когда T-лимфоциты CD8+ ростка распознают MHC класса I, представляющим происходящие из патогена эпитопы, и активируются им. В значительной степени желательна альтернативная стратегия, посредством которой цитолитические лимфоциты могут устранять клетки, в которые проник патоген. Была предложена такая стратегия (EP 2059256), в которой ограниченные по классу II эпитопы, происходящие из внутриклеточных патогенов и связанные с мотивом тиолоксидоредуктазы, используют для индукции цитолитических CD4+ T-клеток, которые индуцируют антигенпредставляющую клетку (APC) представляющую узнаваемый ей эпитоп. Однако привлечение и активация альтернативной подгруппы цитолитических T-клеток представляют собой другую возможность усилить устранение клеток, инфицированных внутриклеточным патогеном.
При аутоиммунных заболеваниях, как и при иммунных ответах на введение аллогенного фактора и при аллергических заболеваниях, является преимущественным устранение клеток, представляющих пептиды из аутоантигена, аллогенного фактора или аллергена, так чтобы предотвратить какие-либо нежелательные иммунные ответы и, тем самым, заболевания, обусловленные такими нежелательными иммунными ответами. В таких обстоятельствах эпитопы из аутоантигенов, аллогенных факторов или аллергенов, главным образом, представляются MHC класса II, и комплекс, образующийся между эпитопом и детерминантами класса II, активирует T-лимфоциты CD4+ ростка. Это приводит к активации B-лимфоцитов и продукции антител против указанных аутоантигенов, аллогенных факторов или аллергенов. Способ, который обеспечивает устранение APC путем цитолиза, предотвратил бы активацию CD4+ T-клеток и, тем самым, продукцию антител. Такая стратегия была предложена и описана в патентной заявке WO 2008/017517 A1, в которой используют ограниченные по классу II эпитопы аутоантигенов или аллергенов или аллогенных факторов, соответственно, связанные с мотивом тиолоксидоредуктазы. Цитолитические ограниченные по классу II CD4+ T-клетки, индуцированные воздействием ограниченных по классу II эпитопов, связанных с указанным мотивом, индуцируют апоптоз APC, представляющих узнаваемый ей эпитоп. Однако привлечение и активация альтернативных цитолитических T-клеток может обеспечивать ценную альтернативную стратегию.
В случае опухолей, клетки избегают уничтожения путем подавления поверхностной экспрессии детерминант MHC класса I и класса II. Таким образом, любая стратегия, в которой индуцируются цитолитические T-клетки, специфичные к опухолевым антигенам, представляет собой в значительной степени желательную стратегию для лечения опухолей. В WO 2009/101205 описано, что цитолитические T-клетки, активированные ограниченным по классу II представлением происходящих из опухоли антигенов, применимы для устранения опухоли. Однако этот подход ограничивается низкой экспрессией детерминант MHC класса II опухолями.
При отторжении трансплантата процесс хронического отторжения запускается путем непрямого представления антигенов, отделяющихся от трансплантата и представляемых антигенпредставляющими клетками реципиента его/ее собственным T-лимфоцитам. Непрямое представление происходит путем представления происходящих из трансплантата эпитопов с помощью эпитопов как класса I, так и класса II. T-лимфоциты CD8 ростка, активированные представлением антигенов трансплантата посредством MHC класса I, мигрируют в трансплантат, где они опосредуют отторжение путем распознавания узнаваемых ими эпитопов непосредственно на трансплантированных клетках. Тем не менее, активация CD8-клеток требует помощи CD4-клеток, активируемых путем непрямого представления происходящих из трансплантата антигенов детерминантами MHC класса II. В WO 2009/100505 описано, что использование ограниченных по классу II T-клеточных эпитопов, происходящих из трансплантата и связанных с мотивом тиолоксидоредуктазы, позволяет устранение с помощью апоптоза APC, участвующих в непрямом представлении. Однако в высокой степени желательна альтернативная стратегия, посредством которой образовывалась бы другая подгруппа цитолитических T-клеток.
Аналогично, новые терапевтические подходы, такие как генная терапия и генная вакцинация, в высокой степени ограничены иммунным ответом хозяина на вирусные векторы, используемые для трансгенеза или вакцинации. В обеих из этих ситуаций, антигены, происходящие из вирусных векторов, отделяются от клеток, трансдуцированных вектором, и представляются лимфацитам хозяина посредством APC хозяина, а именно, путем непрямого представления антигенов. Следует отметить тот факт, что многие вирусные векторы не только активируют адаптивную иммунную систему, что приводит к продукции специфических антител и активации специфических T-клеток, но указанные вирусные векторы также активируют врожденную иммунную систему. Активация врожденного иммунитета служит в качестве адъюванта для адаптивного ответа. В WO 2009/101204 описано, что ограниченные по классу II эпитопы, происходящие из вирусных векторов и связанные с мотивом тиолоксидоредуктазы, могут индуцировать активацию цитолитических ограниченных по классу II CD4 T-клеток. Однако в высокой степени желательна альтернативная стратегия, которая подавляла бы активацию врожденной иммунной системы.
Во всех приведенных в настоящем описании примерах очевидно, что для специалиста в данной области представляли бы большую ценность альтернативные стратегии, посредством которых индуцировались бы специфичные к антигену цитолитические T-клетки, которые устраняли бы специфичным к антигену образом APC, представляющие указанный специфический антиген.
Настоящее изобретение обеспечивает такую альтернативную стратегию.
Естественные киллерные T-клетки (NKT) представляют собой отдельную подгруппу нетипичных T-лимфоцитов, которые распознают антигены, представляемые неклассической молекулой комплекса MHC CD1d. В настоящее время описаны две подгруппы NKT-клеток. NKT-клетки 1 типа, также называемые инвариантными NKT-клетками (iNKT), являются наиболее распространенными. Они характеризуются наличием альфа-бета T-клеточного рецептора (TCR), образованного из инвариантной альфа-цепи, Valpha14 у мыши и Valpha24 у человека. Эта альфа-цепь ассоциирована с вариабельным, хотя и ограниченным, количеством бета-цепей. NKT-клетки 2 типа имеют альфа-бета TCR, но с полиморфной альфа-цепью. Однако очевидно, что существуют другие подгруппы NKT-клеток, фенотип которых все еще не полностью определен, однако которые имеют общие характеристики, являясь активируемыми гликолипидами, присутствующими в контексте молекулы CD1d.
NKT-клетки, как правило, экспрессируют комбинацию рецептора естественных киллерных (NK) клеток, включая NKG2D и NK1.1. NKT-клетки являются частью врожденной иммунной системы, которая может быть отличена от адаптивной иммунной системы благодаря тому факту, что она не требуют экспансии перед приобретением полной эффекторной способности. Большинство из их медиаторов образованы заранее и не требуют транскрипции. Было показано, что NKT-клетки являются основными участниками иммунного ответа против внутриклеточных патогенов и отторжения опухоли. Также предполагается их роль в контроле аутоиммунных заболеваний и отторжении трансплантата.
Распознающий элемент, молекула CD1d, имеет структуру, в высокой степени сходную со структурой молекулы MHC класса I, включая наличие бета-2-микроглобулина. Он характеризуется глубокой щелью, ограниченной двумя альфа-цепями и содержащей высоко гидрофобные остатки, которые акцептируют липидные цепи. Щель является открытой на обоих концах, что позволяет вмещать более длинные цепи. Каноническим лигандом для CD1d является синтетический альфа-галактозилцерамид (альфа-GalCer). Однако описаны многие природные альтернативные лиганды, включая глико- и фосфолипиды, природный липидный сульфатид, встречающийся в миелине, микробный фосфоинозитолманнозид и альфа-глюкуронозилцерамид. В настоящее время в данной области существует согласованное мнение о том (см. обзоры, такие как Matsuda et al. Current Opinion in Immunology 2008, 20:358-368 и Godfrey et al. Nature reviews Immunology 2010, 11: 197-206), что CD1d связывает только лиганды, содержащие цепи липидов, или, как правило, общую структуру, образованную из липидной концевой части, погруженной в CD1d, и головной группы из остатков сахаров, которая выступает из CD1d.
Пептиды не считают способными активировать NKT-клетки через представление посредством CD1d. Однако было предположено, что длинные гидрофобные пептиды, содержащие объемные аминокислотные остатки, могут связываться с CD1d (Castano et al. Science 1995, 269: 223-226). Наблюдения, проведенные с использованием библиотек фагового дисплея, экспрессирующих пептиды со случайной последовательностью без определенного физиологического значения, позволили установить теоретический консенсусный мотив (Castano et al. Science 1995, 269: 223-226 и см. ниже).
В действительности, Castano et al. показали, что клетки, которые активируются, представляют собой CD8+ T-клетки, а именно ограниченные по MHC класса I клетки, а не NKT-клетки. Эти данные указывают специалисту в данной области на то, что отсутствуют доказательства того, что гидрофобные пептиды представляются молекулами CD1d. Физиологическое значение заявления, сделанного Castano et al. было далее оспорено вследствие неспособности индуцировать NKT-клетки согласно общепринятым протоколам иммунизации (Matsuda et al. Current Opinion in Immunology 2008, 20:358-368 и Brutkiewicz Journal of Immunology 2006, 177: 769-775). Искусственные системы, такие как иммунизация клетками, трансфицированными для сверхэкспрессии CD1d и нагруженными in vitro происходящим из овальбумина пептидом, были способны индуцировать NKT-клетки. Аналогично, внутрикожная иммунизация плазмидной ДНК вместе с CD1d мыши и костимуляторными молекулами индуцирует цитолитические ограниченные по CD1d T-клетки (Lee et al. Journal of Experimental Medicine 1998, 187: 433-438). Castano et al. (Science 269: 223, 1995) утверждают, что гидрофобные пептиды, содержащие структурный мотив, образованный из ароматических остатков в положениях P1 и P7, которые соответствуют заякоривающим остаткам для связывания с гидрофобными карманами CD1d, расположенными на каждом конце молекулы CD1d, и алифатической цепи в положении P4, содержат центральный мотив для связывания эпитопов CD1d. Как описано выше, заключения, сделанные Castano et al., не подтверждаются данными.
Авторы настоящего изобретения сделали неожиданное открытие, что пептиды, охватывающие гидрофобную аминокислотную последовательность, в действительности способны индуцировать активацию клеток NKT. Примером такой последовательности является мотив [FW]-xx-[ILM]-xx-[FW], где [FW] представляет собой аминокислоту, выбранную из фенилаланина или триптофана, и [ILM] представляет собой аминокислоту, выбранную из изолейцина, лейцина или метионина. [FW] в P7 называют пермиссивной, что означает, что либо F, либо W, могут быть заменены на T или H.
Далее, авторы настоящего изобретения обнаружили, что CD1d-связывающий мотив был особенно эффективным в отношении модулирования активности NKT, когда он был связан с мотивом тиолоксидоредуктазы. Этот мотив имеет общую структуру C-XX-C, в которой C представляет собой цистеин и X представляет собой любую аминокислоту, за исключением тирозина, фенилаланина и триптофана. В патентной заявке WO 2008/017517 A1 описано, что ограниченные по классу II T-клеточные эпитопы, связанные с мотивом тиолоксидоредуктазы, приобретают свойство трансформации фенотипа и функции ограниченных по классу II CD4 T-клеток в мощные цитолитические клетки, индуцирующие апоптоз APC. Этот эффект является следствием увеличенного образования синапсов между APC- и T-клетками вследствие укорочения и изомеризации молекулы CD4 на поверхности T-клеток.
Значительное большинство NKT-клеток имеют корецептор CD4, роль которого остается неопределенной. Однако в недавней публикации было предположено, что CD4 связывается с молекулой CD1d в значительной степени аналогично тому, как она связывается с MHC класса II (Thedrez et al. Blood 110: 251-258, 2007). Кроме того, было показано, что присутствие CD4 требуется для полной активации NKT-клеток.
Таким образом, настоящее изобретение относится к применению гидрофобных пептидов, имеющих способность связываться с CD1d и, тем самым, привлекать и активировать NKT-клетки, связанных с мотивом тиолоксидоредуктазы. Такие пептиды обеспечивают специфичность к антигену и отражают ценный подход для лечения:
(1) инфекционных заболеваний с внутриклеточными патогенами, в которых инфицированные клетки представляют гидрофобные пептиды, происходящие из патогена и связанные с CD1d. Увеличенное привлечение и/или активность таких NKT-клеток, таким образом, будет обеспечивать устранение инфицированных клеток;
(2) аутоиммунные заболевания, иммунные ответы на введение аллогенного фактора и аллергические заболевания, при которых антигены, ассоциированные с каждым из этих 3 типов заболеваний, образуют гидрофобные пептиды, представляемые CD1d. Увеличенное привлечение и/или активность специфичных к антигену NKT-клеток, таким образом, может помочь устранить антигенпредставляющие клетки и, тем самым, устранить нежелательный иммунный ответ;
(3) опухоли, поскольку опухолевые клетки часто экспрессируют CD1d, несущий опухолеспецифические антигены, которые могут распознаваться NKT-клетками. Увеличение активности и привлечение таких NKT-клеток привело бы к увеличению устранения опухоли;
(4) отторжение трансплантата, поскольку антигенпредставляющие клетки хозяина представляют гидрофобные пептиды, происходящие из трансплантата, в контексте CD1d. Распознавание этих пептидов NKT-клетками хозяина привело бы к устранению антигенпредставляющих клеток и прервало бы хронический процесс отторжения трансплантата;
(5) генная терапия и генная вакцинация, где антигены из вирусных векторов и отделяющиеся от трансдуцированных клеткок представляются детерминантами CD1d. Привлечение и активация NKT-клеток, устраняющих APC хозяина через распознавание антигенов вирусных векторов, было бы благоприятным как для продолжения экспрессии трансгена, так и для поддержания полной иммуногенности трансгена при генной вакцинации.
В дополнение к интересу к настоящему изобретению с терапевтической точки зрения, авторы настоящего изобретения сделали неожиданное наблюдение, что добавление мотива оксидоредуктазы во фланкирующие остатки эпитопов CD1d увеличивает связывание TCR, что приводит к значительно увеличенному выявлению CD4+ NKT-клеток. Пептиды, охватывающие природные ограниченные по CD1d эпитопы и по меньшей мере один мотив тиоредуктазы формата CxxC, в которых C означает цистеин и x означает любые аминокислоты, за исключением цистеина или объемных остатков, как описано в рамках настоящего изобретения, представляют, таким образом, значительный интерес для:
(1) аналитических целей: выявление частоты клеток-предшественников NKT до вакцинации, оценка аффинности связывания пептида с комплексами CD1d, наблюдение специфических NKT-клеток в ходе вакцинации или при иммуносупрессии, идентификация клеток, независимо от их биологической активности, идентификация клеток, вовлеченных в механизм заболевания, истощение специфических NKT-клеток и детекция NKT-клеток in situ, как например, в биоптатах органов;
(2) препаративные цели: получение специфических NKT-клеток для оценки функции и получение NKT-клеток для культивирования и очистки;
(3) контроль качества для популяции клеток с целью клеточной терапии;
(4) терапевтические цели, включая истощение специфических CD4+ NKT-клеток перед трансплантацией органа.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к применению выделенных иммуногенных пептидов для профилактики и лечения инфекции внутриклеточным патогеном у индивидуума путем увеличения иммунного ответа на специфические антигены, происходящие из указанного внутриклеточного патогена.
Настоящее изобретение также относится к применению выделенных иммуногенных пептидов для профилактики и лечения аутоиммунных ответов, иммунных ответов на введение аллогенных факторов и иммунных ответов на воздействие аллергенов.
Кроме того, настоящее изобретение относится к применению выделенных иммуногенных пептидов для лечения опухолей.
Настоящее изобретение также относится к применению выделенных иммуногенных пептидов для профилактики отторжения трансплантата.
Настоящее изобретение также относится к применению выделенных иммуногенных пептидов для профилактики иммунного ответа против вирусных белков, используемых для генной терапии и/или генной вакцинации.
Настоящее изобретение также относится к пептидам для выявления, получения и истощения NKT-клеток.
В одном аспекте настоящее изобретение относится к применению по меньшей мере одного выделенного иммуногенного пептида, содержащего (i) эпитоп NKT-клетки, происходящий из ассоциированного с патогеном антигена и (ii) мотив тиолоксидоредуктазы (кратко тиоредокс-мотив) в качестве лекарственного средства для профилактики и/или лечения у индивидуума инфекции указанным патогеном.
В следующем аспекте изобретение также охватывает применение по меньшей мере одного выделенного иммуногенного пептида, содержащего (i) эпитоп NKT-клетки, происходящий из аутоантигена, аллогенного фактора или аллергена, и (ii) тиоредокс-мотив, в качестве лекарственного средства для профилактики и/или лечения у индивидуума иммунных ответов против аутоантигенов, аллогенных факторов и/или аллергенов.
В следующем аспекте изобретение также охватывает применение по меньшей мере одного выделенного иммуногенного пептида, содержащего (i) эпитоп NKT-клетки, происходящий из ассоциированного с опухолью антигена, и (ii) тиоредокс-мотив, в качестве лекарственного средства для лечения у индивидуума опухоли.
В следующем аспекте изобретение также охватывает применение по меньшей мере одного выделенного иммуногенного пептида, содержащего (i) эпитоп NKT-клетки, происходящий из аллоантигена, и (ii) тиоредокс-мотив, в качестве лекарственного средства для профилактики у индивидуума отторжения трансплантата.
В следующем аспекте изобретение также охватывает применение по меньшей мере одного выделенного иммуногенного пептида, содержащего (i) эпитоп NKT-клетки, происходящий из вирусного вектора для генной терапии или генной вакцинации, и (ii) тиоредокс-мотив, в качестве лекарственного средства для профилактики у индивидуума иммунного ответа против вирусного вектора.
В следующем аспекте изобретение также охватывает применение по меньшей мере одного выделенного иммуногенного пептида, содержащего (i) эпитоп NKT-клетки, происходящий из ассоциированного с патогеном антигена, аутоантигена, аллогенного фактора, аллергена, ассоциированного с опухолью антигена, аллоантигена или антигена вирусного вектора, и (ii) тиоредокс-мотив, в качестве лекарственного средства для повышения активации, продуцирования цитокинов и цитолитической активности CD4+ NKT-клеток у указанного индивидуума.
Главным образом, изобретение относится к иммуногенным пептидам, содержащим (i) эпитоп NKT-клеток, происходящий из ассоциированного с патогеном антигена, аутоантигена, аллогенного фактора, аллергена, ассоциированного с опухолью антигена, аллоантигена или антигена вирусного вектора, и (ii) тиоредокс-мотив, для применения для профилактики или лечения инфекции внутриклеточным патогеном, профилактики или лечения иммунного ответа против аутоантигенов, аллогенных факторов, аллергенов, лечения опухолей, профилактики иммунизации против аллоантигенов или против антигенов вирусных векторов, у реципиента путем увеличения ответа CD4+ NKT-клеток у указанного реципиента.
Настоящее изобретение также относится к NKT-клеткам либо подгруппы типа 1 (iNKT), либо подгруппы типа 2, а также к менее охарактеризованным подгруппам NKT, причем все из них характеризуются как имеющие корецептор CD4 и цепь TCR-бета, способную распознавать связанный с CD1d пептид.
Также настоящее изобретение относится к гидрофобным пептидам, способным связываться с CD1d, для представления NKT-клеток.
Настоящее изобретение относится к гидрофобным пептидам, охватывающим по меньшей мере один ограниченный по CD1d T-клеточный эпитоп. Структура молекулы CD1d указывает на то, что требуются гидрофобные аминокислотные остатки для занятия двух гидрофобных карманов, расположенных на концах щели CD1d, и что алифатический остаток должен занимать положение в центре щели. Таким образом, в качестве общего примера связывающей CD1d последовательности можно использовать мотив [FW]-xx-[ILM]-xx-[FWTH], в котором [FW] указывает на то, что либо F, либо W, может занимать первый заякоривающий остаток (P1), что положение P4 может занимать I, L или M, и что P7 может занимать F, W, T или H. x в этом общем модельном мотиве означает любую аминокислоту. Специалисту в данной области должно быть понятно, что возможны различные комбинации этих аминокислотных остатков. В конкретном варианте осуществления общий модельный мотив может быть представлен как перевернутая последовательность, такая как [FWTH]-xx-[ILM]-xx-[FW].
Указанный тиоредокс-мотив образован из консенсусной последовательности ([CST]-XX-[CST]), где [CST] представляет собой аминокислоту, выбранную из цистеина, серина и треонина, и X может представлять собой любую аминокислоту, за исключением тирозина (Y), фенилаланина (F) и триптофана (W). Указанный тиоредокс-мотив добавляют к пептиду либо на N-конце, либо на С-конце, или на обоих концах, и он потенциально отделен от указанного ограниченного по CD1d T-клеточного эпитопа линкером из 1-7 аминокислот.
В конкретном варианте осуществления указанный линкер содержит аминокислоты, которые являются частью природных фланкирующих остатков.
Кроме того, изобретение относится к способам получения или индукции популяций NKT-клеток, как описано выше, причем указанные способы включают стадии:
(i) предоставление выделенных естественных CD4+ T-клеток;
(ii) контактирование этих клеток с иммуногенным пептидом, содержащим T-клеточный эпитоп, представляемый молекулой CD1d, и соседний с указанным T-клеточным эпитопом или отделенный от него линкером из не более чем 7 аминокислот мотив C-XX-[CST] или [CST]-XX-C; и
(iii) увеличение в количестве указанных клеток в присутствии IL-2/IL-15 и/или IL-7
В следующем аспекте, изобретение относится к способу идентификации популяции CD4+ NKT-клеток, причем указанный способ включает стадии:
(i) предоставление выделенных природных CD4+ T-клеток;
(ii) предоставление CD4+ T-клеток, предположительно являющихся цитотоксическими; и
(iii) определение того, что T-клетки, предоставленные в (ii), проявляют, по сравнению с T-клетками, предоставленными в (i), описанные выше характеристики.
В любом из указанных выше применений указанный ассоциированный с внутриклеточным патогеном антиген может представлять собой любой антиген, происходящий из вирусов, бактерий, микобактерий или паразитов с внутриклеточным жизненным циклом.
В любом из описанных выше применений указанный аутоантиген может представлять собой любой антиген, ассоциированный с аутоиммунным заболеванием. Примерами таких заболеваний являются инсулин-зависимый диабет, рассеянный склероз, миастения и тиреоидит.
В любом из описанных выше применений, указанные аллогенные факторы представляют собой полипептиды или белки и факторы, используемые для заместительной терапии при дефектах свертываемости крови или фибринолитических дефектах, включая фактор VIII, фактор IX и стафилокиназу, гормоны, такие как инсулин и гормон роста, цитокины и факторы роста, такин как интерферон-альфа, интерферон-бета, интерферон-гамма, GM-CSF и G-CSF, антитела для модулирования иммунных ответов, включая антитела против IgE при аллергических заболеваниях, антитела против CD3, антитела против CD4 и антитела против CD20 при отторжении трансплантата и при различных аутоиммунных заболеваниях, антитела против TNF-альфа при ревматоидном артрите, и эритропоэтин при почечной недостаточности.
В любом из описанных выше применений указанный аллерген представляет собой ингаляционный аллерген, такой как аллергены, происходящие из клещей домашней пыли, из пыльцы или из домашних животных, аллергены пищи, такие как арахис, овальбумин, злаки, фрукты и бобовые растения, и контактные антигены, такие как латекс. Заболевания, характеризующиеся сенсибилизацией к аллергену, включают аллергическую астму, аллергический риносинусит, анафилактический шок, крапивницу, атопический дерматит и контактный дерматит.
В любом из описанных выше применений указанные ассоциированные с опухолью антигены представляют собой онкоген, протоонкоген, происходящий из вируса белок, фактор выживания или клонотипическую детерминанту, такую как идиотипическая детерминанта, происходящая из B-клеточного рецептора.
В любом из описанных выше применений указанные аллоантигены представляют собой главные антигены гистосовместимости, второстепенные антигены гистосовместимости или тканеспецифические антигены. Указанные антигены вовлечены в отторжение трансплантата клеток и тканей.
В любом из описанных выше применений указанные вирусные векторы происходят из аденовируса, аденоассоциированного вируса, ретровируса или лентивируса.
В любом из описанных выше применений указанный тиоредокс-мотив может быть соседним с указанным эпитопом NKT-клеток или он может быть отделен от указанного эпитопа NKT-клеток линкером. В конкретных вариантах осуществления линкер состоит из не более, чем 7 аминокислот.
В следующем варианте осуществления иммуногенного пептида в описанных выше применениях указанный тиоредокс-мотив не встречается в природе в области из 8 аминокислот на N- или C-конце рядом с эпитопом NKT-клеток в указанном ассоциированном с патогеном антигене, аутоантигене, аллогенном факторе, аллергене, ассоциированном с опухолью антигене, аллоантигене или антигене вирусного вектора. В частности, указанный тиоредокс-мотив расположен на N-конце эпитопа NKT-клеток.
В конкретном варианте осуществления иммуногенного пептида для описанных выше применений иммуногенный пептид дополнительно содержит нацеливающую на эндосомы последовательность. Любой из описанных выше иммуногенных пептидов можно получать химическим синтезом или путем рекомбинантной экспрессии.
Следующий способ по изобретению нацелен на получение популяции NKT-клеток, причем указанный способ включает стадии:
(i) предоставления иммуногенного пептида, содержащего эпитоп NKT-клетки, происходящий из ассоциированного с внутриклеточным патогеном антигена, аутоантигена, аллофактора, аллергена, ассоциированного с опухолью антигена, аллоантигена или антигена вирусного вектора, и (ii) тиоредокс-мотив;
(ii) введение иммуногенного пептида индивидууму; и (в присутствии адъюванта)
(iii) получение популяции CD4+ NKT-клеток.
Популяции CD4+ NKT-клеток, получаемые описанными выше способами, также являются частью изобретения, также как и их применение в качестве лекарственного средства для профилактики или лечения у индивидуума инфекции указанным внутриклеточным патогеном, профилактики или лечения аутоиммунного заболевания, иммунного ответа на аллогенный фактор, профилактики или лечения аллергических заболеваний, лечения опухолей, профилактики отторжения трансплантата, и профилактики иммунного ответа на вирусный вектор, используемый для генной терапии или генной вакцинации.
Следующий аспект изобретения относится к выделенным иммуногенным пептидам, содержащим эпитоп NKT-клеток, происходящий из ассоциированного с внутриклеточным патогеном антигена или из аутоантигена, аллогенного фактора, аллергена, ассоциированного с опухолью антигена, аллоантигена или антигена вирусного вектора, и соседний с эпитопом NKT-клеток или отделенный от эпитопа NKT-клеток линкером тиоредокс-мотив.
Следующий аспект изобретения относится к выделенному пептиду, содержащему эпитоп NKT-клеток, происходящий из ассоциированного с внутриклеточным патогеном антигеном или из аутоантигена, аллогенного фактора, аллергена, ассоциированного с опухолью антигена, аллоантигена или антигена вирусного вектора, и соседний с эпитопом NKT-клеток или отделенный от эпитопа NKT-клеток линкером тиоредокс-мотив, для выявления, получения или истощения NKT-клеток.
Кроме того, изобретение охватывает выделенные вирусные векторы, характеризующиеся тем, что они содержат по меньшей мере один ассоциированный с патогеном антиген, или по меньшей мере один аутоантиген, или по меньшей мере один аллогенный фактор, или по меньшей мере один аллерген, или по меньшей мере один ассоциированный с опухолью антиген, или по меньшей мере один аллоантиген, или по меньшей мере один антиген вирусного вектора, содержащий эпитоп NKT-клеток, и соседний с указанным эпитопом NKT-клеток или отделенный от эпитопа NKT-клеток линкером тиоредокс-мотив.
Более конкретно, изобретение относится к выделенным вирусным векторам, характеризующимся тем, что по меньшей мере один эпитоп NKT-клеток, присутствующий по меньшей мере в одном из ассоциированных с патогеном антигенов, или аутоантигенов, или аллогенных факторов, или аллергенов, или ассоциированных с опухолью антигенов, или аллоантигенов, или антигенов вирусного вектора модифицирован встраиванием в указанный ассоциированный с патогеном антиген, указанный аутоантиген, указанный аллогенный фактор, указанный аллерген, указанный ассоциированный с опухолью антиген, указанный аллоантиген, или указанный антиген вирусного вектора, соседнего с указанным эпитопом NKT-клеток или отделенного от указанного эпитопа NKT-клеток линкером тиоредокс-мотива.
Определения
Термин "пептид", когда его используют в настоящем описании, относится к молекуле, содержащей аминокислотную последовательность из от 2 до 200 аминокислот, соединенных пептидными связями, но которые в конкретном варианте осуществления могут содержать неаминокислотные структуры (например, такие как линкерное органическое соединение). Пептиды по изобретению могут содержать любую из общепринятых 20 аминокислот или их модифицированных вариантов, или могут содержать не встречающиеся в природе аминокислоты, включенные путем химического синтеза пептидов или путем химической или ферментативной модификации.
Термины "пептид" или "иммуногенный пептид" используют взаимозаменяемо, однако "иммуногенный пептид" обычно является предпочтительным для пептида, используемого в терапевтических целях, в то время как "пептид" является предпочтительным для выявления, получения и истощения NKT-клеток.
Термин "эпитоп", когда его используют в настоящем описании, относится к одной или нескольким частям (которые могут определять конформационный эпитоп) белка, которые специфично распознаются и связываются антителом или его частью (Fab’, Fab2’, и т.д.) или рецептором, представленном на клеточной поверхности B- или T-лимфоцита, и которые способны путем указанного связывания индуцировать иммунный ответ.
Термин "антиген", когда его используют в настоящем описании, относится к структуре макромолекулы, содержащей один или несколько гаптен(ов) и/или содержащий один или несколько T-клеточных эпитопов. Как правило, указанная макромолекула представляет собой белок или пептид (с полисахаридами или без них) или образована из белковой композиции и содержит один или несколько эпитопов; причем указанная макромолекула альтернативно в настоящем описании может быть обозначена как "антигенный белок" или "антигенный пептид".
Термин "эпитоп T-клеток" или "T-клеточный эпитоп" в контексте настоящего изобретения относится к доминанте, субдоминанте или второстепенному T-клеточному эпитопу, т.е. части антигенного белка, которая специфично распознается и связывается рецептором на клеточной поверхности T-лимфоцита. То, является ли эпитоп доминантным, субдоминантным или второстепенным, зависит от иммунной реакции, индуцируемой против эпитопа. Доминантность зависит от частоты, с которой такие эпитопы распознаются T-клетками и способны активировать их, среди всех возможных T-клеточных эпитопов белка. В частности, T-клеточный эпитоп представляет собой эпитоп, связываемый молекулами MHC класса I или MHC класса II.
Термин "эпитоп NKT-клеток" относится к части антигенного белка, которая специфично распознается и связывается рецептором на клеточной поверхности T-лимфоцита. В частности, эпитоп NKT-клеток представляет собой эпитоп, связываемый молекулами CD1d.
Термин "CD4+ эффекторные клетки" относится к клеткам, относящимся к CD4-положительной подгруппе T-клеток, функцией которых является обеспечение помощи другим клеткам, например, таким как B-клетки. Эти эффекторные клетки обычно обозначают как Th-клетки (от T-хелперных клеток) с различными подгруппами, такими как клетки Th0, Th1, Th2 и Th17.
Термин "NKT-клетки" относится к клеткам врожденной иммунной системы, характеризующимся тем, что они имеют рецепторы, такие как NK1.1 и NKG2D, и распознают эпитопы, представляемые молекулой CD1d. В контексте настоящего изобретения NKT-клетки могут относиться либо к подгруппе типа 1 (инвариантные), либо к подгруппе типа 2, или к любым из менее охарактеризованных NKT-клеток с более полиморфными T-клеточными рецепторами, чем у NKT-клеток типа 1 или типа 2.
"Молекула CD1d" относится к происходящей не из MHC молекуле, образованной из 3 альфа-цепей и набора антипараллельных бета-цепей, расположенных в глубоком гидрофобном желобке, открытом с двух сторон, и способных представлять липиды, гликолипиды или гидрофобные пептиды NKT-клеткам.
Термин "иммунные нарушения" или "иммунные заболевания" относится к заболеваниям, где реакция иммунной системы ответственна за или поддерживает нарушение функции или нефизиологическое состояние в организме. Иммунные нарушения в контексте настоящего изобретения относятся к патологии, индуцируемой инфекционными агентами и опухолевым надзором.
Термин "аллогенный фактор" относится к белку, пептиду или фактору (т.е. любой молекуле), проявляющему полиморфизм при сравнении между двумя индивидуумами одного и того же вида, и, более часто, любой белок, пептид или фактор, который индуцирует (аллореактивный) иммунный ответ у индивидуума, которому ввели аллогенный фактор.
Термин "аллоантиген" или "антиген аллотрансплантата", когда его используют в настоящем описании, относится к антигену, происходящему из (отделяющемуся от и/или присутствующему в) клетки или ткани, который при переносе от донора к реципиенту может распознаваться и связываться антителом B- или T-клеточного рецептора реципиента. Аллоантигены, как правило, представляют собой продукты полиморфных генов. Аллоантиген представляет собой белок или пептид, который, при сравнении между донором и реципиентом (относящимся к одному и тому же виду), проявляет небольшие структурные отличия. Присутствие такого донорного антигена в организме реципиента может индуцировать иммунный ответ у реципиента. Такой аллореактивный иммунный ответ является специфичным к аллоантигену.
Термин "мотив тиолоксидоредуктазы", "мотив тиоредуктазы", "тиоредокс-мотив" или "редокс-мотив" используют в настоящем описании в качестве синонимических терминов и они относятся к мотиву с общей последовательностью [CST]-XX-[CST], в которой C обозначает цистеин, S обозначает серин, T обозначает треонин и X обозначает любую аминокислоту, за исключением тирозина, фенилаланина или триптофана.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится способам профилактики или лечения у индивидуума инфекции внутриклеточным патогеном. Кроме того, оно относится к способам профилактики и лечения аутоиммунных заболеваний, иммунных ответов после введения аллогенного фактора или аллергенов. Кроме того, оно относится к способам лечения опухолей, профилактики отторжения трансплантата и профилактики иммунного ответа против вирусных векторов.
В частности, изобретение относится к способам усиления экспансии и функциональной активности CD4+ NKT-клеток. Такие клетки обычно подразделяют на две отдельных подгруппы, а именно, NKT-клетки подгруппы 1, несущие инвариантную альфа-цепь TCR (Valpha14 у мыши, Valpha24 у человека), или NKT-клетки типа 2, которые имеют разнообразный набор альфа-цепей. Однако последние данные позволили сделать предположение о существовании альтернативных подгрупп NKT-клеток, которые не соответствуют категории типа 1 или типа 2. Цель настоящего изобретения подразумевает включение этих нетипичных NKT-клеток, при условии, что они несут корецептор CD4. При представлении антигена, связанного с CD1d, NKT-клетки быстро активируются и секретируют ряд цитокинов, предположительно определяющих влияние на другие клетки как врожденной, так и адаптивной иммунной системы, и оказывающих мощную активность уничтожения CD1d+ антигенпредставляющих клеток. Этот механизм считается ключевым для защиты против инфекции внутриклеточными агентами, а также надзора за опухолевыми клетками и устранения опухоли. Тот же механизм играет роль в контроле нежелательных иммунных ответов, возникающих при аутоиммунных заболеваниях, иммунных ответах против аллогенных факторов или против аллергенов.
При отторжении трансплантата, аллоантигены, отделяющиеся от трансплантата, представляются иммунной системе реципиента непрямым путем. Это означает, что отделяющиеся антигены аллотрансплантата захватываются антигенпредставляющими клетками хозяина, которые представляют указанный аллоантиген T-клеткам хозяина ограниченным по CD1d образом. Механизм, посредством которого указанные антигенпредставляющие клетки хозяина уничтожаются путем уничтожения после распознавания их CD4+ NKT-клетками, таким образом, является благоприятным для реципиента трансплантата.
При иммунном ответе против вирусных векторов, используемых для генной терапии и генной вакцинации, антигены, отделяющиеся с трансдуцированных клеток, захватываются антигенпредставляющими клетками хозяина с последующим непрямым представлением, как в случае отторжения трансплантата.
Когда NKT-клетки активируются пептидом, модифицированным так, чтобы он обладал активностью тиоредуктазы, последняя значительно усиливает свойства NKT-клеток и, тем самым, усиливает уничтожение клеток, несущих внутриклеточные микроорганизмы, а также опухолевых клеток. Уничтожение клеток, представляющих аутоантигены, аллогенные факторы или аллергены, антигенспецифическими CD4+ NKT-клетками подавляет иммунный ответ против указанных аутоантигенов, аллогенных факторов или аллергенов. Уничтожение клеток-хозяев, представляющих антигены, происходящие из трансплантата или из трансдуцированных клеток, прерывает отторжение или ответ на антиген вирусного вектора, соответственно.
Таким образом, доказывается важность NKT-клеток в увеличивающемся количестве инфекционных заболеваний. Они включают инфекции микобактериями (включая mycobacterium tuberculosis), паразитами, такими как Leishmania, бактериями, такими как Listeria monocytogenes, Salomonella, pseudomonas aeruginosa, streptococcus pneumoniae и Borrelia, и вирусами, такими как вирус простого герпеса (Chiba et al. Journal of Immunology 181: 2292-2302, 2008; Mattner et al. Nature 434: 525529, 2005; Tupin et al. Nature Reviews. Microbiology 5: 405-417, 2007). В дополнение к прямому уничтожению инфицированных клеток, NKT-клетки, благодаря их способности продуцировать высокие концентрации цитокинов, и, в частности, IFN-гамма, могут запускать механизмы неспецифического уничтожения в инфицированных клетках. Эти механизмы включают индукцию индоламиноксидазы, синтазы оксида азота и продукцию активных форм кислорода.
Участие NKT-клеток в контроле иммунных ответов при аутоиммунных заболеваниях или против аллогенных факторов или аллергенов было сообщено в ряде случаев (Jahng et al. Journal of experimental Medicine 199: 947-957, 2004; Van Belle и von Herrath, Molecular Immunology 47: 8-11, 2009), однако его трудно описать. В контексте настоящего изобретения авторы настоящего изобретения неожиданно обнаружили, что пептиды могут представляться молекулой CD1d. Характерным признаком молекулы CD1d является то, что она состоит из 2 антипараллельных альфа-цепей, образующих щель, расположенную сверху платформы, образованной двумя антипараллельными бета-цепями. Щель является узкой и глубокой и акцептирует только гидрофобные остатки, и традиционно считалось, что ими являются только липиды. В действительности, пептиды с гидрофобными остатками способны связываться с щелью CD1d. Помимо этого, поскольку щель является открытой с двух сторон, могут размещаться пептиды длиннее 7 аминокислот. Гидрофобные пептиды, несущие мотив CD1d, находятся в аутоантигенах, аллогенных факторах и аллергенах, тем самым придавая указанному аутоантигену, аллогенному фактору или аллергену способность активировать CD4+ NKT-клетки. Прямое устранение путем уничтожения клеток, представляющих указанный аутоантиген, аллогенный фактор или аллерген, устраняет способность индуцировать иммунный ответ против этих антигенов/факторов.
Было продемонстрировано, что NKT-клетки участвуют в защите против опухолей, либо непрямо путем продуцирования цитокинов, способных усиливать как врожденный, так и адаптивный ответ на опухолевые клетки, либо прямо путем уничтожения опухолевых клеток, представляющих липидные эпитопы, распознаваемые NKT-клетками (Crowe et al, Journal of experimental Medicine 196:119-127, 2002; Tachibana et al, Clinical Cancer Research 11: 7322-7327, 2005; Dhodapkar et al. Journal of experimental Medicine 197: 1667-1676, 2003; Song et al. Journal of clinical Investigation 119:15241536, 2009). Прямое уничтожение вовлекает продукцию гранзима и перфорина. Было показано, что экспериментальные опухоли, такие как саркомы, индуцируемые канцерогенными агентами или путем делеции гена-супрессора опухоли p53, а также спонтанные опухоли, такие как миеломы, подавляются NKT-клетками. Опухоли, чувствительные к лечению с помощью настоящего изобретения, включают опухоли, экспрессирующие онкогены, такие как MAGE, идентифицированный в некоторых меланомах, или тирозинкиназы, такие как ALK (киназа анапластической лимфомы), идентифицированная в карциномах эктодермального происхождения, протоонкогены, такие как циклин D1, экспрессируемый на карциномах мягких тканей, таких как карциномы почки или паращитовидной железы, а также в множественной миеломе, происходящие из вирусов белки, такие как белки вируса Эпштейна-Барр в некоторых карциномах и в некоторых лимфомах ходжкинского типа, факторы выживания, такие как фактор выживания или bcl2, и клонотипические детерминанты, такие как идиотипические детерминанты, происходящие из B-клеточного рецептора в фолликулярных лимфомах или множественных миеломах, или детерминанты T-клеточных рецепторов в T-клеточных злокачественных опухолях.
Клетки, являющиеся частью трансплантата, либо тканевого трансплантата, либо клеточного трансплантата, не несут молекулу CD1d или несут ее только минимально. То же самое справедливо для клеток, трансдуцированных при генной терапии или генной вакцинации. В обеих из этих ситуаций нежелательных иммунных ответов, ведущих либо к отторжению трансплантата, либо к иммунизации против вирусного вектора, ответ индуцируется путем непрямого представления антигена антигенпредставляющими клетками хозяина T-клеткам хозяина. Прямое устранение путем уничтожения антигенпредставляющих клеток хозяина после их взаимодействия с NKT-клетками устраняет способность индуцировать иммунный ответ против аллоантигенов или антигенов вирусного вектора.
Настоящее изобретение относится к получению пептидов, содержащих гидрофобные остатки, которые обеспечивают способность связываться с молекулой CD1d. При введении такие пептиды захватываются APC, направляются в позднюю эндосому, где они нагружаются на CD1d, и представляются на поверхности APC. Указанные гидрофобные пептиды характеризуются мотивом, соответствующим общей последовательности [FW]-xx-[ILM]-xx-[FWTH] или [FWTH]-xx-[ILM]-xx-[FW], в которой положения P1 и P7 заняты гидрофобными остатками, такими как фенилаланин (F) или триптофан (W). Однако P7 является пермиссивным в том смысле, что он допускает альтернативные фенилаланину или триптофану гидрофобные остатки, такие как треонин (T) или гистидин (H). Положение P4 занято алифатическим остатком, таким как изолейцин (I), лейцин (L) или метионин (M).
В международной заявке WO 2009/101206 описаны иммуногенные пептиды, способные индуцировать активацию ограниченных по главному комплексу гистосовместимости класса II CD4+ клеток, включая пептид CGHCGGFTNMFATWSPSK. Из WO 2009/101206 неизвестно, способны ли пептиды связываться с молекулой CD1d. Настоящее изобретение, таким образом, относится к пептидам, связывающимся с CD1d и активирующим NKT-клетки при условии, что пептид не является CGHCGGFTNMFATWSPSK.
Настоящее изобретение относится к пептидам, образованным из гидрофобных остатков, которые в природе составляют CD1d-связывающий мотив. В некоторых вариантах осуществления аминокислотные остатки указанного мотива модифицированы, обычно путем замены остатками, которые увеличивают способность связываться с CD1d. В конкретном варианте осуществления мотивы модифицированы, чтобы они в большей степени соответствовали общему мотиву [FW]-xx-[ILM]-xx-[FWTH]. Более конкретно, пептиды получают так, чтобы они содержали F или W в положении 7.
Пептиды по настоящему изобретению также содержат мотив тиоредуктазы, соседний с гидрофобными остатками или отделенный от таких остатков линкером. После представления молекулой CD1d, мотив тиоредуктазы усиливает способность активировать NKT-клетки, тем самым повышая их противоинфекционную и/или противоопухолевую активность, их способность подавлять иммунные ответы против аутоантигенов, аллогенных факторов, аллергенов, антигенов аллотрансплантатов и антигенов из вирусных векторов, используемых для генной терапии или генной вакцинации.
Общее описание полного мотива, таким образом, может представлять собой [CST]-XX-[CST]-линкер-[FW]-xx-[ILM]-xx-[FWTH] или [FW]-xx-[ILM]-xx-[FWTH]-линкер-[CST]-XX-[CST], в соответствии с тем фактом, что мотив тиоредуктазы может быть добавлен либо на N-конце, либо на C-конце. Добавление линкера является необязательным. Когда такой линкер присутствует, он может составлять от 1 и вплоть до 7 аминокислот. Специалисту в данной области должно быть очевидно, что это общее описание представлено только для общего понимания изобретения.
Настоящее изобретение также относится к NKT-клеткам, полученным и активированным in vitro, для пассивного повторного введения хозяину для увеличения его способности устранять клетки, инфицированные патогеном, клетки, представляющие пептиды, происходящие из аутоантигенов, аллогенных факторов или аллергенов, опухолевые клетки, клетки, представляющие аллоантигены, отделяющиеся от трансплантатов или от вирусных белков, используемых в генной терапии/генной вакцинации. В качестве альтернативы стимуляции in vitro NKT-клеток посредством CD1d-положительных APC, изобретение также относится к способам трансфекции или трансдукции APC с использованием генетической конструкции, способной запускать экспрессию иммуногенного пептида в позднюю эндосому для нагрузки на молекулу CD1d.
В частности, изобретение относится к способам увеличения в количестве специфических NKT-клеток, с увеличением вследствие этого их активности, включающим, но не ограничивающимся ими:
(i) увеличенную продукцию цитокинов
(ii) увеличенное зависимое от контакта и растворимого фактора устранение антигенпредставляющих клеток.
Таким образом, результатом является более эффективный ответ против внутриклеточных патогенов, аутоантигенов, аллогенных факторов, аллергенов, опухолевых клеток и более эффективное подавление иммунных ответов против белков трансплантата и вирусных белков, используемых в генной терапии/генной вакцинации.
Также настоящее изобретение относится к идентификации NKT-клеток с требуемыми свойствами в жидкостях организма или органах. Способ включает идентификацию NKT-клеток по их поверхностному фенотипу, включая экспрессию NK1.1, CD4, NKG2D и CD244. Затем клетки контактируют с эпитопами NKT-клеток, определяемыми как пептиды, способные быть представленными молекулой CD1d. Затем клетки увеличивают в количестве in vitro в присутствии IL-2, или IL-15, или IL-7.
Таким образом, настоящее изобретение относится к пептидам, содержащим CD1d-связывающий мотив и мотив тиоредуктазы для выявления, получения и истощения NKT-клеток. В предпочтительном варианте осуществления такие пептиды нагружены на выделенную молекулу CD1d, либо мономерную, либо, предпочтительно, мультимерную. Молекула CD1d может быть в растворимой форме или связанной с твердой подложкой.
Настоящее изобретение должно считаться терапией для излечения, проводимой, либо когда инфекция приобретена, либо когда опухоль уже присутствует. Это является следствием того факта, что NKT-клетки, как полагают, не входят в цикл запоминания. Когда NKT-клетки активированы, они увеличиваются в количестве в течение нескольких суток, а затем популяция входит в фазу сокращения и возможного кратковременного отсутствия ответа. Однако в некоторых обстоятельствах может быть целесообразным проведение терапии путем активной иммунизации пептидами по изобретению профилактически. Примерами таких пациентов являются пациенты с высоким риском приобретения инфекционного заболевания, например, сразу после контактирования с инфицированным индивидуумом. Таким образом, настоящее изобретение охватывает также профилактическое применение терапии, либо путем активной вакцинации, либо путем пассивного переноса клеток.
В одном аспекте настоящее изобретение относится к применению по меньшей мере одного выделенного гидрофобного иммуногенного пептида, содержащего (i) эпитоп NKT-клетки, происходящий из ассоциированного с патогеном антигена, и (ii) мотив тио-оксидоредуктазы (кратко, тиоредокс-мотив) в качестве лекарственного средства для профилактики и/или лечения у индивидуума инфекции указанным патогеном.
В следующем аспекте изобретение также охватывает применение по меньшей мере одного выделенного гидрофобного иммуногенного пептида, содержащего (i) эпитоп NKT-клетки, происходящий из аутоантигена, аллогенного фактора или/и аллергена, и (ii) тиоредокс-мотив, в качестве лекарственного средства для профилактики и/или лечения у индивидуума иммунных ответов против аутоантигенов, аллогенных факторов и/или аллергенов.
В следующем аспекте изобретение также охватывает применение по меньшей мере одного выделенного гидрофобного иммуногенного пептида, содержащего (i) эпитоп NKT-клетки, происходящий из ассоциированного с опухолью антигена, и (ii) тиоредокс-мотив, в качестве лекарственного средства для лечения у индивидуума опухоли.
В следующем аспекте изобретение также охватывает применение по меньшей мере одного выделенного гидрофобного иммуногенного пептида, содержащего (i) эпитоп NKT-клетки, происходящий из аллоантигена, и (ii) тиоредокс-мотив, в качестве лекарственного средства для профилактики у индивидуума отторжения трансплантата.
В следующем аспекте изобретение также охватывает применение по меньшей мере одного выделенного гидрофобного иммуногенного пептида, содержащего (i) эпитоп NKT-клетки, происходящий из вирусного вектора для генной терапии или генной вакцинации, и (ii) тиоредокс-мотив, в качестве лекарственного средства для профилактики у индивидуума иммунного ответа против вирусного вектора.
В следующем аспекте изобретение также охватывает применение по меньшей мере одного выделенного иммуногенного пептида, содержащего (i) эпитоп NKT-клетки, происходящий из ассоциированного с патогеном антигена, аутоантигена, аллогенного фактора, аллергена, ассоциированного с опухолью антигена, аллоантигена или антигена вирусного вектора, и (ii) тиоредокс-мотив, в качестве лекарственного средства для увеличения активации, продукции цитокинов и цитолитической активности CD4+ NKT-клеток у указанного индивидуума.
Дополнительное преимущество настоящего изобретения связано с очень ограниченной степенью полиморфизма молекулы CD1d. Это позволяет использовать единичный или ограниченное количество пептидов для терапии аутбредных популяций, таких как люди или животные. Более того, NKT-клетки, индуцированные у одного донора, можно использовать для пассивного переноса множеству реципиентов. Это в значительной степени противоположно ситуации, в которой пептиды представляются молекулами MHC класса I или класса II, полиморфизм которых препятствует использованию единичных пептидов для множества реципиентов.
Общая структура эпитопов NKT-клеток содержит гидрофобный остаток в положении P1 и P7, причем положение P4 занимает алифатическая цепь. Таким образом, общая структура в конечном итоге может быть определена как [FWHY]-xx-[ILMV]-xx-[FWHY], в которой x означает любую аминокислоту. В положении P1, P4 и P7 может присутствовать любая из приведенных аминокислот. Аминокислоты могут представлять собой природные аминокислоты или неприродные аминокислоты. Примеры неприродных аминокислот включают D-аминокислоты.
Как правило, органическое соединение с восстанавливающей активностью представляет собой пептидную последовательность. Пептидные фрагменты с восстанавливающей активностью встречаются в тиоредуктазах, которые представляют собой небольшие восстанавливающие дисульфид ферменты, включающие глутаредоксины, нуклеоредоксины, тиоредоксины и другие тиол/дисульфидоксидоредуктазы. Они проявляют восстанавливающую активность в отношении дисульфидных связей на белках (таких как ферменты) через окислительно-восстановительные активные остатки цистеина в консенсусных последовательностях консервативного активного домена: C-XX-C, C-XX-S, C-XX-T, S-XX-C, T-XX-C (Fomenko et al. (2003) Biochemistry 42, 11214-11225), где X обозначает любую аминокислоту. Такие домены также встречаются в более крупных белках, таких как дисульфидизомераза белков (PDI) и фосфоинозитид-специфическая фосфолипаза C. В частности, иммуногенные пептиды содержат в качестве редокс-мотива мотив последовательности тиоредуктазы [CST]-XX-[CST], в следующем его варианте осуществления указанный мотив [CST]-XX-[CST] расположен на N-конце T-клеточного эпитопа. Более конкретно, в указанном редокс-мотиве по меньшей мере одно из положений [CST] занято Cys; таким образом, мотив представляет собой либо [C]-XX-[CST], либо [CST]-XX-[C]. В настоящей заявке такой тетрапептид называется "мотивом" или “редокс-мотивом”. Более конкретно, иммуногенные пептиды могут содержать мотив последовательности [C]-XX-[CS] или [CS]-XX-[C]. Еще более конкретно, иммуногенные пептиды содержат мотив последовательности C-XX-S, S-XX-C или C-XX-C.
Мотив в указанных выше иммуногенных пептидах расположен либо непосредственно рядом с последовательностью эпитопа в пептиде, либо отделен от T-клеточного эпитопа линкером. Более конкретно, линкер содержит аминокислотную последовательность из 7 аминокислот или менее. Более конкретно, линкер содержит 1, 2, 3 или 4 аминокислоты. Типичными аминокислотами, используемыми в линкерах, являются серин и треонин. Примерами пептидов с линкерами в соответствии с настоящим изобретением являются C-XX-C-G-эпитоп, C-XX-C-GG-эпитоп C-XX-C-SSS-эпитоп C-XX-C-SGSG-эпитоп и т.п. В другом конкретном варианте осуществления линкерная последовательность охватывает аминокислоты, естественным образом присутствующие в полипептидной последовательности, из которой происходит CD1d-связывающий мотив. Либо на N-, либо на C-концах, или на обоих концах пептида могут быть включены различные количества таких природных аминокислот.
Иммуногенные пептиды могут содержать дополнительные короткие аминокислотные последовательности, на N- или C-конце (искусственной) последовательности, содержащей эпитоп NKT-клеток и восстанавливающее соединение (мотив). Такую аминокислотную последовательность, главным образом, называют в настоящем описании "фланкирующей последовательностью". Фланкирующая последовательность может быть расположена на N- и/или C-конце редокс-мотива и/или T-клеточного эпитопа в иммуногенном пептиде. Когда иммуногенный пептид содержит нацеливающую на эндосомы последовательность, фланкирующая последовательность может присутствовать между эпитопом и нацеливающей на эндосомы последовательностью и/или между восстанавливающим соединением (например, мотивом) и нацеливающей на эндосомы последовательностью. Более конкретно фланкирующая последовательность представляет собой последовательность из вплоть до 10 аминокислот, или из от 1 до 7 аминокислот, такую как последовательность из 2 аминокислот. Более конкретно, фланкирующая последовательность содержит объемные аминокислотные остатки, которые пригодны для стабилизации пептида в молекулу CD1d.
В конкретных вариантах осуществления изобретения редокс-мотив в иммуногенном пептиде расположен на N-конце эпитопа.
Как подробно описано выше, иммуногенные пептиды содержат восстанавливающий мотив, как описано в настоящем описании, связанный с последовательностью эпитопа NKT-клеток. В конкретных случаях, эпитопы NKT-клеток происходят из белков, которые не содержат в их нативной природной последовательности аминокислотной последовательности с окислительно-восстановительными свойствами из 11 аминокислот на N- или C-конце рядом с представляющим интерес эпитопом NKT-клеток.
В конкретных вариантах осуществления эпитоп NKT-клеток происходит из внутриклеточного патогена. Такие патогены могут представлять собой вирусы, бактерии или паразитов. Вирусы включают оцДНК-, дцДНК- и РНК-вирусы, примерами которых являются Herpesviridae, Flaviviridae и Picornaviridae, вирус гриппа, вирус кори и вирус иммунодефицита. Бактерии и микобактерии включают mycobacterium tuberculosis, другие микобактерии, патогенные для человека или животных, Yersinia, Brucella, Chlamydiae, Mycoplasma, Rickettsiae, Salmonellae и Shigellae. Паразиты включают Plasmodiums, Leishmanias, Trypanosomas, Toxoplasma gondii, Listeria, Histoplasma.
В конкретных вариантах осуществления эпитоп NKT-клеток происходит из аутоантигенов, включая тиреоглобулин, пероксидазу щитовидной железы, рецептор TSH при заболеваниях щитовидной железы; инсулин (проинсулин), декарбоксилазу глутаминовой кислоты (GAD), тирозинфосфатазу IA-2, белок теплового шока HSP65, специфичный для островков белок, родственный каталитической субъединице глюкозо-6-фосфатазы (IGRP) при диабете 1 типа; 21-OH гидроксилазу при аутоиммунном адреналите; 17-альфа гидроксилазу, гистидиндекарбоксилазу, триптофангидроксилазу, тирозингидроксилазу при аутоиммунных полиэндокринных синдромах; внутренний фактор H+/K+ ATP-азы при аутоиммунном гастрите и пернициозной анемии; олигодендроцитарный гликопротеин миелина (MOG), основной белок миелина (MBP), протеолипидный белок (PLP) при рассеянном склерозе; рецептор ацетилхолина при миастении; ретинол-связывающий белок (RBP) при аутоиммунных глазных синдромах; коллаген типа II и типа IX при аутоиммунных заболеваниях внутреннего уха; тканевую трансглутаминазу при глютеновой болезни; белок гистона H1 pANCA при воспалительных заболеваниях кишечника; белок теплового шока HSP60 и окисленные протеины низкой плотности при атеросклерозе, и синуклеин при болезни Паркинсона.
В конкретных вариантах осуществления эпитоп NKT-клеток происходит из аллогенных факторов, включая любой пептид или полипептид, используемый: (1) для заместительной терапии дефектов свертываемости крови или фибринолитических дефектов, включая фактор VIII, фактор IX и стафилокиназу; (2) гормоны, такие как гормон роста или инсулин; (3) цитокины и факторы роста, такие как интерферон-альфа, интерферон-гамма, GM-CSF и G-CSF; (4) антитела для модулирования иммунных ответов, включая антитела против IgE при аллергических заболеваниях, антитела против CD3 и антитела против CD4 при отторжении трансплантата и различных аутоиммунных заболеваниях, антитела против CD20 при неходжкинских лимфомах; (5) эритропоэтин при почечной недостаточности и; (6) генетически модифицированные антигены.
В конкретных вариантах осуществления эпитоп NKT-клеток происходит из аллергенов, включая ингаляционные аллергены, такие как аллергены, происходящие из клещей домашней пыли, из пыльцы или из домашних животных, пищевые аллергены, такие как арахис, овальбумин, злаки, фрукты и бобовые растения, и контактные аллергены, такие как латекс. Заболевания, характеризующиеся сенсибилизацией к аллергену, включают аллергическую астму, аллергический риносинусит, анафилактический шок, крапивницу, атопический дерматит и контактный дерматит.
В конкретных вариантах осуществления эпитоп NKT-клеток происходит из опухоли, включая любой пептид или полипептид, происходящий из: (1) онкогенов, таких как MAGE, идентифицированный в некоторых меланомах; (2) протоонкогенов, таких как циклин D1, экспрессируемый в карциномах мягких тканей, таких как карциномы почки или паращитовидной железы, а также в множественной миеломе; (3) происходящих из вируса белков, таких как белки из вируса Эпштейна-Барр в некоторых карциномах и в некоторых лимфомах ходжкинского типа; (4) факторов выживания, которые представляют собой антиапоптотические факторы, такие как сурвивин или bcl2; (5) клонотипических детерминант, таких как идиотипические детерминанты, происходящие из B-клеточного рецептора в фолликулярных лимфомах или множественных миеломах, или детерминанты T-клеточного рецептора в T-клеточных злокачественных опухолях.
В конкретных вариантах осуществления эпитоп NKT-клеток происходит из аллоантигена, включая любой пептид или полипептид, происходящий из детерминант главного комплекса гистосовместимости класса I или класса II, второстепенных комплексов гистосовместимости или родственных тканям антигенов. Указанные пептиды или полипептиды могут быть вовлечены в отторжение клеток или солидных органов. Клеточные трансплантаты включают трансплантат клеток пуповинной крови, трансплантат стволовых клеток или трансплантат клеток островков поджелудочной железы. Трансплантаты солидных органов включают почку, легкое, сердце, печень, поджелудочную железу, кость, кожу или мягкие ткани.
В конкретных вариантах осуществления эпитоп NKT-клеток происходит из вирусного вектора, используемого для генной терапии или генной вакцинации, включая любой пептид или полипептид РНК-вирусов (гамма-ретровирусы и лентивирусы) или ДНК-вирусов (аденовирусы, аденоассоциированные вирусы, вирусы герпеса и поксвирусы).
NKT-клетки, индуцируемые и активируемые иммуногенными пептидами по настоящему изобретению, могут подавлять патогенез даже с помощью комплексных антигенов. Минимальным требованием для активации таких клеток является распознавание пептида, представляемого молекулой CD1d, ведущее к уничтожению нагруженной патогеном клетки или уничтожению APC, представляющих аутоантиген, аллогенный фактор или аллерген, или уничтожению опухолевых клеток, или уничтожению APC, представляющих аллоантиген, или APC, представляющих антиген, происходящий из вирусного вектора.
Во всех из описанных выше ситуаций, указанные иммуногенные пептиды активируют продукцию цитокинов, таких как IFN-гамма, которые активируют другие эффекторные клетки, включая CD4+ T-клетки и CD8+ T-клетки. Как CD4+, так и CD8+ T-клетки могут участвовать в устранении клетки, представляющей внутриклеточный патоген, аутоантиген, аллогенный фактор, аллерген, опухолевый антиген, аллоантиген или антиген, происходящий из вирусного вектора.
В ситуациях, в которых у индивидуума присутствует более одного антигена, одни и те же APC могут не представлять все соответствующие антигены, поскольку такие антигены могут захватываться различными APC. Таким образом, ожидается, что комбинацию двух или более иммуногенных пептидов можно использовать для профилактики или лечения заболевания. Специалисту в данной области должно быть понятно, что предусматривается любая комбинация указанных иммуногенных пептидов. Примеры такой комбинации включают пептиды для подавления продукции антител к аллогенному фактору, такому как фактор VIII каскада свертывания крови, и пептиды для подавления иммунных ответов на вирусные векторы, используемые для генной терапии гемофилии A (отсутствие функционального фактора VIII). Другие примеры включают комбинацию инфекций патогенами, такими как ВИЧ и микобактериальные инфекции.
Иммуногенные пептиды для применения в контексте настоящего изобретения идентифицируют способами, известными специалисту в данной области. В предпочтительном варианте осуществления могут быть идентифицированы пептиды, содержащие общую последовательность [FWHY]-xx-[ILMV]-xx-[FWHY]. Указанные пептиды идентифицируют способами, известными специалистам в данной области с использованием алгоритмов, доступных через интернет. Например, пептиды можно идентифицировать путем введения последовательности на следующем web-сайте: http://www.expasy.ch/tools/scanprosite/
Затем пептиды можно получать путем синтеза с использованием, например, твердофазного синтеза fmoc, хорошо известного в данной области.
Однако общую последовательность, предусмотренную в рамках изобретения, следует рассматривать как индикатор того, что пептид содержит CD1d-связывающий мотив. Затем указанные пептиды должны быть исследованы in vitro в отношении реактивности к NKT-клеткам. Для этого CD1d+ APC получают либо из животного, либо из человека. Затем клетки инкубируют с представляющим интерес пептидом и источником NKT-клеток. Активацию последних можно идентифицировать по пролиферации, продукции цитокинов, таких как IFN-гамма и IL-4, и поверхностных маркеров. Эти способы хорошо описаны в данной области. Кроме того, можно использовать тетрамеры молекулы CD1d после нагрузки пептидом по изобретению для выявления NKT-клеток, специфичных к такому пептиду. Одной из возможностей является использование флуоресцентно меченных тетрамеров и детекции с использованием системы флуоресцентной сортировки (facs).
Иммуногенные пептиды по изобретению можно получать с помощью рекомбинантной технологии с использованием экспрессирующих систем, таких как бактериальные клетки, клетки дрожжей, клетки насекомых, клетки растений или клетки млекопитающих.
В соответствии с настоящим изобретением предусматриваются лекарственные средства для лечения инфекции внутриклеточными патогенами, для лечения аутоиммунных заболеваний, иммунных ответов на аллогенные факторы или аллергены, для лечения опухолей, лечения отторжения трансплантата, или лечения иммунных ответов на вирусные векторы, используемые для генной терапии или генной вакцинации. Во многих из этих ситуаций лечение может быть предусмотрено в качестве профилактической терапии. Лекарственное средство по изобретению обычно, хотя и не обязательно, представляет собой (фармацевтический) состав, содержащий в качестве активного ингредиента по меньшей мере один из иммуногенных пептидов по изобретению, популяцию NKT-клеток против указанных иммуногенных пептидов или вектор для генной терапии, способный экспрессировать указанный иммуногенный пептид. Помимо активного ингредиента(ов), такой состав содержит по меньшей мере один (фармацевтически приемлемый) разбавитель, носитель или адъювант. В частности, фармацевтическая композиция по изобретению представляет собой вакцину для профилактического или терапевтического применения.
В соответствии с настоящим изобретением предусмотрены лекарственные средства для лечения аутоиммунных заболеваний, лечения иммунных ответов на аллогенные факторы, лечения аллергических заболеваний, лечения опухолей, лечения отторжения трансплантата и лечения иммунных ответов, индуцируемых против вирусных векторов, используемых для генной терапии и для генной вакцинации.
Таким образом, изобретение относится к иммуногенным пептидам, которые содержат по меньшей мере один эпитоп NKT-клеток из ассоциированного с патогеном антигена, аутоантигена, аллергена, аллогенного фактора, опухолевого антигена, антигена, отделяющегося с трансплантата или происходящего из вирусного вектора, используемого в генной терапии или генной вакцинации, сопряженного с мотивом тиоредуктазы с последовательностью последовательность [CST]-XX-[CST].
N-концевой цистеин в мотиве осуществляет нуклеофильную атаку на дисульфидный мостик белка-мишени. Дисульфидный мостик восстанавливается, и обмен электронами с вторым цистеином мотива высвобождает белок-мишени в восстановленной форме, после чего следует изомеризация и/или гомодимеризация белка-мишени. В некоторых случаях гетеродимеризация может происходить путем обмена электронами с другим белком. Конечным результатом является либо изменение конфигурации белка-мишени (изомеризация), либо образование димеров или полимеров более высокого порядка. Этот механизм предоставлен в настоящем описании в качестве примера без какого-либо намерения ограничения.
Эпитоп NKT-клеток и мотив тиоредуктазы необязательно разделены линкерной последовательностью. В следующих необязательных вариантах осуществления иммуногенный пептид, кроме того, содержит нацеливающую на эндосомы последовательность (например нацеливающую на поздние эндосомы последовательность) и/или дополнительные “фланкирующие” последовательности.
Как подробно объяснено далее, иммуногенные пептиды по настоящему изобретению можно получать химическим синтезом, который позволяет включение неприродных аминокислот. Таким образом, остатки цистеина в мотиве тиоредуктазы можно заменять другой аминокислотой с тиольной группой, такой как меркаптовалин, гомоцистеин или другие природные или неприродные аминокислоты с тиольной функциональной группой. Чтобы иметь восстанавливающую активность, остатки цистеина не должны встречаться в качестве части дисульфидного мостика между остатками цистеина. Тем не менее, остатки цистеина могут быть модифицированы, например, путем метилирования, поскольку метилированный цистеин преобразуется в цистеин со свободными тиольными группами in vivo.
В иммуногенных пептидах по настоящему изобретению, содержащих описанный выше мотив тиоредуктазы, указанный мотив расположен так, чтобы, когда эпитоп соответствует желобку CD1d, указанный мотив оставался вне связывающего желобка CD1d. Указанный мотив помещают либо непосредственно рядом с последовательностью эпитопа в пептиде, либо его отделяют от T-клеточного эпитопа линкером. Более конкретно, линкер содержит аминокислотную последовательность из 7 аминокислот или менее. Наиболее конкретно, линкер содержит 1, 2, 3 или 4 аминокислоты. В тех конкретных вариантах осуществления пептидов по изобретению, где указанный мотив расположен рядом с последовательностью эпитопа, это обозначается как положение от P-4 до P-1 или от P+1 до P+4 относительно последовательности эпитопа. Помимо пептидного линкера в качестве линкера для связывания частей иммунногенного пептида друг с другом можно использовать другие органические соединения.
В конкретных вариантах осуществления изобретения мотив тиоредуктазы в иммуногенном пептиде расположен на N-конце от эпитопа.
Как описано выше, иммуногенные пептиды по изобретению содержат, в дополнение к мотиву тиоредуктазы, эпитоп NKT-клеток, происходящий из ассоциированного с патогеном антигена, ауто- или аллогенного фактора, аллергена, происходящего из опухоли антигена, антигена, отделяющегося от трансплантата, или антигена, происходящего из вирусных векторов, используемых в генной терапии или генной вакцинации. Эпитоп NKT-клеток в белковой последовательности можно идентифицировать с помощью функциональных анализов и/или одного или нескольких анализов прогнозирования in silico. Аминокислоты в последовательности эпитопа NKT-клеток пронумерованы в соответствии с их положением в связывающем желобке белков CD1d. В конкретных вариантах осуществления эпитоп NKT-клеток, присутствующий в пептидах по изобретению, состоит из 7-25 аминокислот, более конкретно, из 7-16 аминокислот, еще более конкретно состоит из 7, 8, 9, 10, 11, 12, 13, 14, 15 или 16 аминокислот. В более конкретном варианте осуществления эпитоп NKT-клеток состоит из последовательности из 7 аминокислот. В следующем конкретном варианте осуществления эпитоп NKT-клеток представляет собой эпитоп, который представляется NKT-клеткам молекулами CD1d. В конкретных вариантах осуществления настоящего изобретения последовательность эпитопа NKT-клеток представляет собой последовательность эпитопа, которая соответствует щели белка CD1d, более конкретно пептид из 7 аминокислот, соответствующий щели CD1d. Эпитоп NKT-клеток иммуногенных пептидов по изобретению может соответствовать либо природной последовательности эпитопа белка, либо он может представлять собой его модифицированный вариант, при условии, что модифицированный эпитоп NKT-клеток сохраняет его способность связываться в щели CD1d, аналогично природной последовательности эпитопа NKT-клеток. Модифицированный эпитоп NKT-клеток может иметь ту же аффинность связывания с белком CD1d, что и природный эпитоп, но также он может иметь сниженную аффинность. В конкретных вариантах осуществления аффинность связывания модифицированного пептида не менее чем в 10 раз меньше аффинности связывания исходного пептида, более конкретно, не менее чем в 5 раз меньше. Открытием в рамках настоящего изобретения является то, что пептиды по настоящему изобретению имеют стабилизирующий эффект на белковые комплексы. Таким образом, стабилизирующий эффект комплекса пептид-CD1d компенсирует сниженную аффинность модифицированного эпитопа к молекуле CD1d.
В конкретных вариантах осуществления иммуногенные пептиды по изобретению, кроме того, содержат аминокислотную последовательность (или другое органическое соединение), способствующую захвату пептида в (поздние) эндосомы для процессинга и представления в детерминантах CD1d. Нацеливание на поздние эндосомы опосредуется сигналами, присутствующими в цитоплазматическом конце белков и соответствуют точно установленным пептидным мотивам, таким как мотив на основе дилейцина [DE]XXXL[LI] или DXXLL (например DXXXLL), мотив на основе тирозина YXXø или так называемый мотив кислотного кластера. Символ ø обозначает аминокислотные остатки с объемными гидрофобными боковыми цепями, такие как Phe, Tyr и Trp. Последовательности нацеливания на поздние эндосомы позволяют процессинг и эффективное представление происходящего из антигена T-клеточного эпитопа молекулами CD1d. Такие нацеливающие на эндосомы последовательности содержатся, например, в белке gp75 (Vijayasaradhi et al. (1995) J Cell Biol 130, 807-820), белке CD3-гамма человека, HLA-BM β (Copier et al. (1996) J. Immunol. 157, 1017-1027), цитоплазматическом конце рецептора DEC205 (Mahnke et al. (2000) J Cell Biol 151, 673-683). Другие примеры пептидов, которые функционируют в качестве сигналов сортировки в эндосомы, описаны в обзоре Bonifacio and Traub (2003) Annu. Rev. Biochem. 72, 395-447. Альтернативно последовательность может представлять собой последовательность субдоминантного или второстепенного T-клеточного эпитопа из белка, которая способствует захвату в позднюю эндосому без преодоления ответа NKT-клеток на ассоциированный с патогеном эпитоп NKT-клеток, происходящий из ауто- или аллогенного фактора эпитоп NKT-клеток, происходящий из аллергена эпитоп NKT-клеток, происходящий из опухолевого антигена эпитоп NKT-клеток, или эпитоп NKT-клеток, происходящий из аллоантигенов, отделяющихся от трансплантатов, или антигенов с вирусных векторов, используемых в генной терапии или генной вакцинации.
В следующих конкретных вариантах осуществления иммуногенные пептиды по изобретению представляют собой пептиды, содержащие эпитопы NKT-клеток, которые не содержат мотив тиоредуктазы в их природной последовательности. Однако в альтернативных вариантах осуществления эпитоп NKT-клеток, связывающийся с щелью CD1d, может содержать мотив тиооксидоредуктазы, такой как описано в настоящем описании в его последовательности эпитопа; иммуногенные пептиды в соответствии с изобретением, содержащие такой эпитоп NKT-клеток, должны, кроме того, содержать другой свободный мотив тиооксидоредуктазы, присоединенный (рядом или отделенный линкером) со стороны N- или C-конца эпитопа, так чтобы присоединенные остатки могли обеспечивать активность восстановления (в противоположность мотиву тиооксидоредуктазы, присутствующему в эпитопе, который погружен в щель).
Другой аспект настоящего изобретения относится к способам получения иммуногенных пептидов по настоящему изобретению, описанных в настоящем описании. Такие способы включают идентификацию эпитопов NKT-клеток из ассоциированных с патогеном антигенов, из представляющих интерес аутоантигенов или аллогенных факторов, аллергенов, связанных с опухолью антигенов, аллоантигенов, отделяющихся от трансплантатов, или антигенов, происходящих из вирусных векторов, используемых в генной терапии или генной вакцинации. Способы идентификации эпитопов NKT-клеток in vitro и in silico широко известны в данной области, и некоторые аспекты приведены далее. Такие способы, кроме того, включают получение иммуногенных пептидов по изобретению, включающих идентифицированный эпитоп NKT-клеток и мотив тиоредуктазы (с линкером(ами), фланкирующей последовательностью(ями) или нацеливающей на эндосомы последовательностью, или без них). Полученные иммуногенные пептиды далее оценивают в отношении способности индуцировать CD4+ NKT-клетки против ассоциированного с патогеном антигена, аутоантигенов, аллогенных факторов, аллергенов, происходящих из опухоли антигенов, аллоантигенов, отделяющихся от трансплантатов, или антигенов, происходящих из вирусных векторов, используемых для генной терапии или генной вакцинации.
Иммуногенные пептиды согласно изобретению получают, начиная с эпитопов NKT-клеток из ассоциированных с патогеном антигенов, или аутоантигенов, или аллогенных факторов, или аллергенов, или опухолей, или аллоантигенов, или вирусных векторов, используемых для генной терапии или генной вакцинации.
В частности, используемый эпитоп NKT-клеток может представлять собой доминантный эпитоп NKT-клеток. Идентификация и селекция эпитопов NKT-клеток из ассоциированного с патогеном антигена, из аутоантигена, аллогенного фактора, аллергена, происходящего из опухоли антигена, аллоантигена, отделяющегося трансплантатом, или антигенов, происходящих из вирусных вевкторов, используемых в генной терапии или генной вакцинации для применения в контексте настоящего изобретения известны специалисту в данной области. Например, пептидные последовательности, выделенные из ассоциированного с патогеном антигена, из аутоантигена или аллогенного фактора, аллергена, происходящего из опухоли антигена, аллоантигена, отделяющегося трансплантатом или антигенов, происходящих из вирусных векторов, используемых в генной терапии или генной вакцинации, исследуют, например, способами биологии T-клеток для определения того, индуцируют ли пептидные последовательности ответ NKT-клеток. Те пептидные последовательности, для которых обнаружено, что они индуцируют ответ NKT-клеток, определяют как имеющие активность стимуляции NKT-клеток. Активность стимуляции NKT-клеток человека можно далее исследовать путем культивирования NKT-клеток, полученных от индивидуума, сенсибилизированного к ассоциированному с патогеном антигену, аутоантигену или аллогенному фактору, аллергену, происходящему из опухоли антигену, аллоантигену, отделяемому трансплантатом, или антигенами, происходящими из вирусных векторов, используемых в генной терапии или генной вакцинации с пептидом/эпитопом, происходящим из указанных антигенов, и определения того, происходит ли пролиферация NKT-клеток в ответ на пептид/эпитоп при измерении, например, по клеточному захвату тритированного тимидина. Индексы стимуляции для ответов NKT-клеток на пептиды/эпитопы можно вычислять в качестве максимального значения CPM в ответ на пептид/эпитоп, деленного на контрольное значение CPM. Индекс стимуляции NKT-клеток (S.I.), равный или превышающий двукратный фоновый уровень, считают "положительным". Положительные результаты используют для вычисления среднего индекса стимуляции для каждого пептида/эпитопа в исследуемой группы пептидов/эпитопов. Кроме того, неприродные (или модифицированные) эпитопы NKT-клеток можно необязательно исследовать в отношении их аффинности связывания с молекулами CD1d. Связывание неприродных (или модифицированных) эпитопов NKT-клеток с молекулами CD1d можно осуществлять различными путями. Например, растворимые CD1d молекулы получают и преобразуют в тетрамерную форму путем синтеза или химического присоединения. Молекулу CD1d очищают аффинной хроматографией. Растворимые молекулы CD1d инкубируют с меченным биотином эталонным пептидом, полученным благодаря его высокой аффинности связывания с этой молекулой CD1d. Затем пептиды, подлежащие оценке связывания с CD1d, инкубируют при различных концентрациях, и их способность вытеснять эталонный пептид из связывания с CD1d вычисляют путем добавления нейтравидина. Способы могут быть найдены, например, в Texier et al., (2000)J. Immunology 164, 3177-3184). Иммуногенные пептиды по изобретению имеют средний индекс стимуляции NKT-клеток, превышающий или равный 2,0. Иммуногенный пептид, имеющий индекс стимуляции NKT-клеток, превышающий или равный 2,0, считают пригодным в качестве профилактического или терапевтического средства. Более конкретно, иммуногенные пептиды согласно изобретению имеют средний индекс стимуляции NKT-клеток по меньшей мере 2,5, по меньшей мере 3,5, по меньшей мере 4,0, или даже по меньшей мере 5,0. Кроме того, такие пептиды, как правило, имеют индекс положительности (P.I.) по меньшей мере приблизительно 100, по меньшей мере 150, по меньшей мере приблизительно 200 или по меньшей мере приблизительно 250. Индекс положительности для пептида определяют умножением среднего индекса стимуляции NKT-клеток на процент индивидуумов в популяции индивидуумов, чувствительных к антигену вирусного вектора (например, по меньшей мере 9 индивидуумов, по меньшей мере 16 индивидуумов или по меньшей мере 29 или 30, или даже больше), которые имеют NKT-клетки, которые отвечают на пептид (таким образом, он соответствует SI, умноженному на случайный характер пептида/эпитопа). Таким образом, индекс положительности отражает как силу ответа NKT-клеток на пептид (S.I.), так и частоту ответа NKT-клеток на пептид в популяции индивидуумов, чувствительных к антигену вирусного вектора. Для определения оптимальных эпитопов NKT-клеток, например, способами точного картирования, пептид, имеющий активность стимуляции T-клеток и, таким образом, содержащий по меньшей мере один эпитоп T-клеток, определяемый способами биологии T-клеток, модифицируют добавлением или делецией аминокислотных остатков либо на N-конце, либо на C-конце пептида, и исследуют для определения изменения реактивности NKT-клеток к модифицированному пептиду. Если определяют, что два или более пептидов, которые обладают областью перекрывания в нативной белковой последовательности, имеют активность стимуляции NKT-клеток человека, при определении способами биологии T-клеток, можно получать дополнительные пептиды, содержащие все или часть таких пептидов, и эти дополнительные пептиды можно исследовать сходным образом. После этого, пептиды отбирают и получают рекомбинантными способами или синтетически. Эпитопы или пептиды NKT-клеток отбирают на основе различных факторов, включающих силу ответа NKT-клеток на пептид/эпитоп (например, индекс стимуляции) и частоту ответа NKT-клеток на пептид в популяции индивидуумов.
Способы, используемые для идентификации ассоциированного с патогеном антигена, аутоантигена или аллогенного фактора, аллергена, происходящего из опухоли антигена, аллоантигена, отделяющегося трансплантатом, или антигенов, происходящих из вирусных векторов, используемых в генной терапии или генной вакцинации, известны в данной области. Таким образом, для идентификации антигенов-кандидатов можно использовать стратегии позиционного клонирования или экспрессионного клонирования. Для полного описания методологии, см. например Mendoza et al, Immunity, 7: 461-472, 1997. Альтернативно пептиды, в действительности представляемые APC в молекулах CD1d, можно элюировать и разделять различными способами хроматографии. Полное описание такой методологии представлено в Scott et al, Immunity, 12: 711-720, 2000. Антигены-кандидаты можно подвергать скринингу с помощью одного или нескольких алгоритмов in vitro для идентификации последовательности эпитопа NKT-клеток в антигенном белке. Подходящие алгоритмы включают, но не ограничиваются ими, алгоритмы, представленные на следующем web-сайте: http://www.expasy.ch/tools/scanprosite/.
Более конкретно, такие алгоритмы позволяют предсказание в антигенном белке одной или нескольких пептидных последовательностей, которые будут соответствовать желобку молекулы CD1d.
Иммуногенные пептиды по изобретению можно получать путем рекомбинантной экспрессии, например, в бактериальных клетках (например Escherichia coli), клетках дрожжей (например, виды Pichia, виды Hansenula, виды Saccharomyces или Schizosaccharomyces), клетках насекомых (например, из Spodoptera frugiperda или Trichoplusia ni), клетках растений или клетках млекопитающих (например, клетки CHO, COS). Таким образом, конструирование требуемых подходящих экспрессирующих векторов (включая дополнительную информацию, такую как промоторные и терминирующие последовательности) вовлекает при этом стандартные способы рекомбинантных ДНК. Полученные рекомбинантными способами иммуногенные пептиды по изобретению можно получать из более крупного белка-предшественника, например, путем ферментативного расщепления участков расщепления ферментом, встроенных рядом с N- и/или C-концом иммуногенного пептида, а затем подходящей очистки.
Ввиду ограниченный длины иммуногенных пептидов по изобретению, их можно получать химическим синтезом пептидов, где пептиды получают связыванием различных аминокислот друг с другом. Химический синтез особенно пригоден для включения, например, D-аминокислот, аминокислот с не встречающимися в природе боковыми цепями или природных аминокислот с модифицированными боковыми цепями, таких как метилированный цистеин. Способы химического синтеза пептидов подробно описаны, и пептиды можно приобретать в компаниях, таких как Applied Biosystems и другие компании. Синтез пептидов можно осуществлять либо в качестве твердофазного синтеза пептидов (SPPS), либо напротив, в качестве синтеза пептидов в жидкой фазе. Наиболее известными способами SPPS являются способы твердофазной химии с t-Boc и Fmoc, которые хорошо известны специалисту в данной области. Кроме того, пептиды могут быть связаны друг с другом с образованием более длинных пептидов с использованием стратегии лигирования (химиоселективное связывание двух незащищенных пептидных фрагментов), как первоначально описано Kent (Schnolzer & Kent (1992) Int. J. Pept. Protein Res. 40, 180-193) и рассмотрено, например, в Tam et al. (2001) Biopolymers 60, 194-205. Это обеспечивает огромный потенциал к осуществлению синтеза белка, который выходит за пределы SPPS. С помощью этого способы были успешно синтезированы многие белки размером 100-300 остатков. Синтетические пептиды продолжают играть все возрастающую ключевую роль в областях исследования биохимии, фармакологии, нейробиологии, ферментологии и молекулярной биологии, вследствие колоссальных достижений в SPPS.
Физические и химические свойства представляющего интерес иммуногенного пептида (например, растворимость, стабильность) исследуют для определения того, является ли/будет ли пептид пригодным для применения в терапевтических композициях. Как правило, это оптимизируют коррекцией последовательности пептида. Необязательно, пептид можно модифицировать после синтеза (химические модификации, например добавление/удаление функциональных групп) с использованием способов, известных в данной области.
Таким образом, в следующем аспекте настоящее изобретение относится к способам получения ассоциированных с патогеном специфичных к антигену CD4+ NKT-клеток, или специфичных к аутоантигену или аллогенному фактору CD4+ NKT-клеток, или специфичных к аллергену CD4+ NKT-клеток, или специфичных к опухолевому антигену CD4+ NKT-клеток, или CD4+ NKT-клеток, специфичных к аллоантигенам, отделяющимся от трансплантатов, или CD4+ NKT-клеток, специфичных к антигенам из вирусных белков, используемых в генной терапии или генной вакцинации, либо in vivo, либо in vitro (ex vivo). В частности, указанные NKT-клетки отвечают с мощными пролиферативными свойствами на любую клетку, представляющую указанные антигены, и их можно получить в качестве популяции клеток. Кроме того, в частности, указанные NKT-клетки отвечают на сильные супрессивные свойства в отношении любой клетки, представляющей ауто- или аллоантиген, аллерген, антигены, отделяющиеся от трансплантата или происходящие из вирусных белков, используемых в генной терапии или генной вакцинации, и их можно получать в качестве популяции клеток.
Изобретение охватывает такие (популяции) специфичные к антигену CD4+ NKT-клетки, которые можно получить описанными в настоящем описании способами.
В одном варианте осуществления предусмотрены способы, которые включают выделение клеток периферической крови, стимуляцию клеточной популяции in vitro путем контактирования иммуногенного пептида по изобретению с выделенными клетками периферической крови и экспансию стимулированной популяции клеток, более конкретно, в присутствии IL-2 или IL-15 и IL-7. Способы по изобретению имеют то преимущество, что получают более высокие количества CD4+ NKT-клеток и что можно получать указанные клетки, которые являются специфичными к ассоциированному с патогеном антигену, или ауто- или аллоантигену, аллергену, связанному с опухолью антигену, антигенам, отделяющимся от трансплантатов, или антигенам, из вирусных белков, используемых в генной терапии или генной вакцинации (с использованием пептида, содержащего антигенспецифический эпитоп).
В альтернативном варианте осуществления CD4+ NKT-клетки можно получать in vivo, т.е. путем введения иммуногенного пептида, описанного в настоящем описании, индивидууму и взятия CD4+ NKT-клеток, образовавшихся in vivo.
Специфичные к ассоциированному с патогеном антигену CD4+ NKT-клетки, получаемые описанными выше способами, представляют особый интерес для применения в качестве лекарственного средства для профилактики заболеваемости и/или смертности индивидуума, обусловленных инфекцией вирусами, бактериями или паразитами. Специфичные к аутоантигену или аллогенному фактору CD4+ NKT-клетки, получаемые описанными выше способами, представляют особый интерес для применения в качестве лекарственного средства для подавления заболеваемости и/или смертности, обусловленных аутоиммунными заболеваниями или реакцией против аллогенных факторов. Специфичные к аллергену CD4+ NKT-клетки, получаемые описанными выше способами, представляют особый интерес для применения в качестве лекарственного средства для подавления заболеваемости и/или смертности, обусловленных аллергическими заболеваниями. Специфичные к опухолевому антигену CD4+ NKT-клетки, получаемые описанными выше способами, представляют особый интерес для применения в качестве лекарственного средства для подавления заболеваемости и/или смертности, обусловленных опухолями. Специфичные к аллоантигену трансплантата CD4+ NKT, получаемые описанными выше способами, представляют особый интерес для профилактики отторжения трансплантата. Специфичные к вирусному белку CD4+ NKT-клетки, получаемые описанными выше способами, представляют особый интерес для применения в качестве лекарственного средства для подавления заболеваемости и/или смертности, обусловленных генной терапией или генной вакцинацией.
Для любого из описанных выше применений иммуногенных пептидов по изобретению, указанные пептиды можно заменять указанными CD4+ NKT-клетками. Предусматривается применение как аллогенных, так и аутогенных клеток. Любой способ, включающий введение указанных антигенспецифических CD4+ NKT-клеток индивидууму, нуждающемуся в этом (т.е. для профилактики заболеваемости, обусловленной инфекцией внутриклеточным патогеном, профилактики или лечения заболеваемости, обусловленной аутоиммунными заболеваниями, реакцией на аллогенный фактор, воздействием аллергена, отторжением трансплантата и реакцией против антигенов вирусного вектора) является частью настоящего изобретения.
Настоящее изобретение также относится к последовательностям нуклеиновых кислот, кодирующим иммуногенные пептиды по настоящему изобретению и к способам их применения, например, для рекомбинантной экспрессии или для генной терапии. В частности, указанные последовательности нуклеиновых кислот способны экспрессировать иммуногенные пептиды по изобретению.
Иммуногенные пептиды по изобретению можно вводить индивидууму, нуждающемуся в этом, с использованием любого подходящего способа генной терапии. В любом применении или способе по изобретению для профилактики заболеваемости/смертности, обусловленных патогеном, или для подавления иммунного ответа на аутоантиген или аллогенный фактор иммунизацию иммуногенным пептидом по изобретению можно комбинировать с адоптивным переносом клеток. При комбинировании указанную иммунизацию, адоптивный перенос клеток и генную терапию можно использовать одновременно или последовательно в любой возможной комбинации.
В генной терапии рекомбинантные молекулы нуклеиновых кислот, кодирующие иммуногенные пептиды, можно использовать в качестве простой ДНК или в липосомах или других липидных системах для доставки в клетки-мишени. Другие способы прямого переноса плазмидной ДНК в клетки для применения в генной терапии у человека хорошо известны специалистам в данной области и вовлекают нацеливание ДНК на рецепторы на клетках путем образования комплекса плазмидной ДНК с белками. В его наиболее простой форме, генный перенос можно проводить, просто инъецируя малые количества ДНК в ядро клетки с помощью процесса микроинъекции. После введения рекомбинантных генов в клетку, они могут распознаваться нормальными клеточными механизмами транскрипции и трансляции, и генный продукт будет экспрессироваться. Также были предприняты другие способы введения ДНК в более высокие количества клеток. Эти способы включают: трансфекцию, где ДНК осаждают с фосфатом кальция и она захватывается пиноцитозом; электропорацию, где клетки подвергают воздействию высоковольтных импульсов для обеспечения отверстий в мембране); липофекцию/слияние липосом, где ДНК упаковывают в липофильные везикулы, которые сливаются с клеткой-мишенью; и бомбардировку частицами с использованием ДНК, связанной с мелкими снарядами. Другим способом введения ДНК в клетки является связывание ДНК с химически модифицированными белками. Аденовирусные белки способны дестабилизировать эндосомы и усиливать захват ДНК в клетки. Смешение аденовируса с растворами, содержащими комплексы ДНК, или связывание ДНК с полилизином, ковалентно связанным с аденовирусом, с использованием средств для сшивания белков, существенно повышает захват и экспрессию рекомбинантного гена. Аденоассоциированные вирусные векторы также можно использовать для доставки генов в клетки сосудов. Как используют в рамках изобретения, "генный перенос" означает процесс введения чужеродной молекулы нуклеиновой кислоты в клетку, который обычно проводят для обеспечения экспрессии конкретного продукта, кодируемого геном. Указанный продукт может включать белок, полипептид, антисмысловую ДНК или РНК, или ферментативно активную РНК. Генный перенос можно проводить в культивированных клетках или путем прямого введения млекопитающим. В другом варианте осуществления предусмотрен вектор, содержащий последовательность молекулы нуклеиновой кислоты, кодирующей иммуногенный пептид по изобретению. В конкретных вариантах осуществления вектор получают таким образом, чтобы последовательность молекулы нуклеиновой кислоты экспрессировалась только в конкретной ткани. Способы обеспечения тканеспецифической экспрессии генов хорошо известны в данной области, например, путем помещения последовательности, кодирующей иммуногенный пептид по изобретению, под контроль промотора, который направляет экспрессию пептида специфично в одну или несколько ткань(ей) или орган(ов). Экспрессирующие векторы, происходящие из вирусов, таких как ретровирусы, вирусы осповакцины, аденовирус, аденоассоциированный вирус, вирус герпеса, РНК-вирусы или вирусы папилломы крупного рогатого скота, можно использовать для доставки нуклеотидных последовательностей (например, кДНК), кодирующих пептиды, их гомологи или производные в соответствии с изобретением в ткани-мишени или популяцию клеток-мишеней. Способы, которые хорошо известны специалистам в данной области, можно использовать для конструирования рекомбинантных вирусных векторов, содержащих такие кодирующие последовательности. Альтернативно в генной терапии можно использовать полученные способами инженерии клетки, содержащие молекулу нуклеиновой кислоты, кодирующую иммуногенный пептид в соответствии с изобретением.
Специалисту в данной области должно быть понятно, что пептид или полипептид, используемый в генной терапии, может быть частью полного антигена, из которого происходит пептид или полипептид.
Когда введение одного или нескольких пептидов по изобретению обеспечивается генным переносом (т.е. введением нуклеиновой кислоты, которая обеспечивает экспрессию пептидов по изобретению при введении in vivo), соответствующую дозировку нуклеиновой кислоты можно определять на основе количества пептида, экспрессирующегося в результате введения нуклеиновой кислоты.
Лекарственное средство по изобретению обычно, но не обязательно, представляет собой (фармацевтический) состав, содержащий в качестве активного ингредиента по меньшей мере один из иммуногенных пептидов по изобретению, иммуногенный пептид (популяции) CD4+ NKT-клеток или вектор для генной терапии, способный экспрессировать указанный иммуногенный пептид. Помимо активного ингредиента(ов), такой состав содержит по меньшей мере один из (фармацевтически приемлемого) разбавителя, носителя или адъюванта. Как правило, фармацевтически приемлемые соединения (такие как разбавители, носители и адъюванты) могут быть найдены, например, в фармакопее (например, в фармакопее США, Европы или международной фармакопее). Лекарственное средство или фармацевтическая композиция по изобретению обычно содержит (профилактически или терапевтически) эффективное количество активного ингредиента(ов), где эффективность представляет собой эффективность в отношении состояния или нарушения, подлежащего профилактике или лечению. В частности, фармацевтические композиции по изобретению представляют собой вакцины для профилактического или терапевтического применения.
Может быть необходимым, чтобы лекарственное средство или фармацевтическую композицию по изобретению вводили индивидууму, нуждающемуся в этом, в качестве части профилактического или терапевтического режима, включающего многократное введение указанного лекарственного средства или композиции. Указанное многократное введение обычно проводят последовательно, и временной интервал между двумя введениями может варьировать, и его будут корректировать, в зависимости от природы активного ингредиента и природы состояния, подлежащего профилактике или лечению. Количество активного ингредиента, вводимое индивидууму, нуждающемуся в этом, при однократном введении, также может варьировать и зависит от таких факторов, как физическое состояние индивидуума (например, масса тела, возраст), состояние, подлежащее профилактике или лечению, и опыт лечащего врача, терапевта или медицинской сестры.
Термин “разбавители” относится, например, к физиологическим солевым растворам. Термин “адъювант” обычно относится к фармакологическому или иммунологическому средству, которое модифицирует (предпочтительно увеличивает) эффект других средств (например, лекарственных средств, вакцин), между тем имея небольшие, если имеет, прямые эффекты при введении отдельно. В качестве одного примера приводится адъювант гидроксид алюминия (квасцы), на который может быть адсорбирован иммуногенный пептид по изобретению. Кроме того, в данной области известны многие другие адъюванты, и их можно использовать, при условии, что они способствуют представлению пептида в CD1d и активации NKT-клеток. Термин "фармацевтически приемлемый носитель" означает любой материал или вещество, с которым активный ингредиент составляют для облегчения его применения или распространения в область, подлежащую лечению, например, путем растворения, диспергирования или диффундирования указанной композиции, и/или для облегчения его хранения, транспорта или обработки без нарушения его эффективности. Они включают любые и все растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые средства (например, фенол, сорбиновая кислота, хлорбутанол), изотонические средства (такие как сахара или хлорид натрия) и т.п. Для контроля длительности действия активного ингредиента в композиции могут быть включены дополнительные ингредиенты. Фармацевтически приемлемый носитель может представлять собой твердое вещество, или жидкость, или газ, сжатый в форму жидкости, т.е. композиции по настоящему изобретению можно пригодным образом использовать в качестве концентратов, эмульсий, растворов, гранулятов, присыпок, спреев, аэрозолей, суспензий, мазей, кремов, таблеток, драже или порошков. Подходящие фармацевтические носители для применения в указанных фармацевтических композициях и их составе хорошо известны специалистам в данной области, и нет конкретного ограничения на их выбор в рамах настоящего изобретения. Они также могут включать добавки, такие как смачивающие вещества, диспергирующие вещества, связующие вещества, адгезивы, эмульгаторы, растворители, покрытия, антибактериальные и противогрибковые вещества (например, фенол, сорбиновая кислота, хлорбутанол), изотонические вещества (такие как сахара или хлорид натрия) и т.п., при условии, что они согласуются с фармацевтической практикой, т.е. носители и добавки, которые не вызывают длительного повреждения у млекопитающих. Фармацевтические композиции по настоящему изобретению можно получать любым известным путем, например, путем однородного смешения, покрытия и/или растирания активных ингредиентов, в одностадийном или многостадийном процессе, с выбранным материалом носителя и, когда это целесообразно, другими добавками, такими как поверхностно-активные вещества. Их также можно получать путем микронизации, например, для получения их в форме микросфер, обычно имеющих диаметр приблизительно 1-10 мкм, а именно, для изготовления микрокапсул для контролируемого или непрерывного высвобождения активных ингредиентов.
Иммуногенные пептиды, их гомологи или производные по изобретению (и их физиологически приемлемые соли или фармацевтические композиции, все их которых включены в термин "активные ингредиенты") можно вводить любым путем, подходящим для состояния, подлежащего профилактике и лечению, и подходящие для соединений, в данном случае иммуногенных белков, подлежащих введению. Возможные пути включают регионарный, системный, пероральный (твердая форма или ингаляция), ректальный, назальный, местный (включая глазной, букальный и сублингвальный), вагинальный и парентеральный (включая подкожный, внутримышечный, внутривенный, внутрикожный, внутриартериальный, интратекальный и эпидуральный). Предпочтительный путь введения может варьировать, в зависимости от состояния реципиента или от состояния, подлежащего профилактике или лечению.
Составы могут удобным образом находиться в единичной дозированной форме и их можно получать любыми способами, хорошо известными в области фармацевтики. Составы по настоящему изобретению, подходящие для перорального введения, могут находиться в качестве дискретных единиц, таких как капсулы, крахмальные капсулы или таблетки, все из которых содержат заданное количество активного ингредиента; в качестве порошка или гранул; в качестве раствора или суспензии в водной жидкости или неводной жидкости; или в качестве жидкой эмульсии типа “масло-в-воде” или жидкой эмульсии типа “вода-в-масле”. Активный ингредиент также может находиться в качестве болюса, электуария или пасты. Таблетку можно получать путем прессования или формования, необязательно с одним или несколькими вспомогательными ингредиентами. Прессованные таблетки можно получать путем прессования в подходящем устройстве активного ингредиента в свободнотекучей форме, такой как порошок или гранулы, необязательно смешанной со связующим веществом, смазывающим веществом, инертным разбавителем, консервантом, поверхностно-активным или диспергирующим веществом. Формованные таблетки можно получать путем формования в подходящем устройстве смеси соединения в порошковой форме, смоченного инертным жидким разбавителем. Таблетки необязательно могут быть покрытыми или могут иметь насечку или они могут быть составлены так, чтобы обеспечить медленное или контролируемое высвобождение активного ингредиента, находящегося в них.
Следующий аспект изобретения относится к выделенным иммуногенным пептидам, содержащим эпитоп NKT-клеток из ассоциированного с патогеном антигена, из аутоантигена или аллогенного фактора, из аллергена, ассоциированного с опухолью антигена, аллоантигена, отделяющегося от трансплантата, или антигенов из вируса, используемого для генной терапии или генной вакцинации, и соседний с указанным эпитопом NKT-клеток или отделенный от указанного эпитопа NKT-клеток линкером мотив тиоредуктазы.
Вирусные векторы для целей генной терапии или генной вакцинации в высокой степени поддаются модификации с помощью технологии рекомбинантных нуклеиновых кислот. Ввиду вышесказанного, специалист в данной области может легко предвидеть, что модификацию эпитопа NKT-клеток из вирусного вектора, используемого в иммуногенных пептидах и их применениях по изобретению, можно вносить непосредственно в сам вирусный вектор. По существу, вакцинация иммуногенными пептидами, содержащими эпитоп NKT-клеток ассоциированного с патогеном антигена, аутоантигена или аллогенного фактора, аллергена, антигена, ассоциированного с опухолью, аллоантигена из трансплантата, или антигенов вирусных векторов, используемых для генной терапии или генной вакцинации, и мотив тиоредуктазы (и/или соответствующая генная вакцинация и/или соответствующий адоптивный перенос клеток), могут стать ненужными, поскольку тех же благоприятных эффектов можно достигнуть с помощью модифицированного вирусного вектора. Таким образом, изобретение, кроме того, охватывает модифицированные вирусные векторы, определяемые как выделенные вирусные векторы, отличающиеся тем, что по меньшей мере один эпитоп NKT-клеток, присутствующий по меньшей мере в одном из белков вирусного вектора, модифицирован встраиванием в указанный белок вирусного вектора соседнего с указанным эпитопом NKT-клеток или отделенного от указанного эпитопа NKT-клеток линкером мотива тиоредуктазы. В одном его варианте осуществления указанный вирусный вектор далее характеризуется тем, что указанный модифицированный эпитоп NKT-клеток способен представляться молекулой CD1d. В другом варианте осуществления указанные выделенные вирусные векторы далее характеризуются тем, что их свойства трансдуцировать клетки не значительно изменены по сравнению с тем же вирусным вектором, не несущим модификацию эпитопа NKT-клеток.
Настоящее изобретение далее проиллюстрировано с помощью следующих примеров, которые предоставлены без намерения ограничения. Более того, все ссылки, описанные в настоящем описании, полностью включены в настоящее описание в качестве ссылок.
ПРИМЕРЫ
Пример 1
Контроль активации ограниченных по классу II CD4+ T-клеток, специфичных к фактору VIII, путем иммунизации пептидом, содержащим ограниченный по CD1d T-клеточный эпитоп и мотив тиоредуктазы во фланкирующих остатках.
Мышей BALB/c Factor VIII KO (группа A) иммунизировали 4 раза с интервалом 1 неделя 50 мкг пептида 2196, который содержит ограниченный по CD1d эпитоп NKT-клеток и мотив тиоредуктазы C-XX-C во фланкирующих остатках (SEQ ID1).
SEQ ID1: CGH CGG FTN MFA TWS PSK
Затем подкожно инъецировали фактор VIII человека с использованием 10 МЕ на инъекцию 5 раз с интервалом одна неделя. Через десять суток после последней иммунизации мышей умерщвляли и CD4+ T-клетки селезенки получали магнитной сортировкой клеток. Такие клетки дважды стимулировали иммунизирующим пептидом и FVIII in vitro, а затем проводили оценку их состояния активации, измеряемого по продукции IL-4 и IFN-гамма. В контрольной группе (B) введение проводили в соответствии с тем же протоколом, но не проводили вакцинацию пептидом.
Результаты (фиг.1) показывают 10-кратное снижение продукции IL-4 специфичными к фактору VIII CD4+ T-клетками, полученными от мышей, иммунизированных пептидом, по сравнению с контрольной группой, и 7-кратное снижение продукции IFN-гамма.
Результаты представлены в качестве средних значений + SEM.
Пример 2
Подавление ответа IgG-антител против Ad5 путем иммунизации пептидом, содержащим ограниченный по CD1d эпитоп NKT-клеток и мотив тиоредуктазы
Мышей C57BL/6 (n=6) иммунизировали с помощью четырех подкожных инъекций пептида SEQ ID2 в количестве 50 мкг в квасцах, проводимых с интервалом одна неделя.
SEQ ID2: CHG CGG FIGLMYY
Такой пептид содержит ограниченный по CD1d эпитоп NKT-клеток из белка гексона аденовируса 5 (Ad5) и мотив тиоредуктазы во фланкирующих остатках. В контрольной группе (n=6) мышей вводили физиологическую сыворотку в квасцах вместо пептида. Затем всем мышам проводили 2 инъекции по 109 вирусных частиц Ad5 в/в путем с интервалом 1 неделя. Через десять суток после последней инъекции Ad5 у мышей отбирали кровь и концентрацию тотальных IgG-антител к частицам Ad5 измеряли в ELISA прямого связывания. В кратком изложении, вирусные частицы Ad5 переводили в нерастворимую форму на полистироловых чашках, а затем промывали и инкубировали с разведением сыворотки мыши. После второго промывания проводили определение связывания антител мыши против Ad5 путем добавления антисыворотки козы к IgG мыши. У мышей, которым предварительно вводили пептид (черные столбики гистограмма; фиг.2) не продуцировались значительные количества антител, в то время как у неиммунизированных мышей (незакрашенные столбики гистограммы) продуцируется сильный ответ после второй инъекции Ad5.
Результаты приведены в произвольных единицах в качестве средних значений + SEM.
** указывает на значимость при p<0,001.
Пример 3
Индукция апоптоза опухолевых клеток CD4+ NKT-клетками, индуцированными путем иммунизации мыши пептидом, охватывающим ограниченный по CD1d эпитоп NKT, содержащий мотив тиоредуктазы.
Мышей C57BL/6 (n=6) иммунизировали с помощью четырех подкожных инъекций пептида SEQ ID3 в количестве 50 мкг в квасцах, проводимых с интервалом одна неделя.
SEQ ID3: CGH CGG FDKLPGF
Такой пептид содержит ограниченный по CD1d эпитоп NKT-клеток, происходящий из овальбумина, и мотив тиоредуктазы во фланкирующих остатках. В контрольной группе (n=6) мышей вводили физиологическую сыворотку в квасцах вместо пептида. Через десять суток после последней иммунизации мышей умерщвляли и CD4+ T-клетки селезенки получали путем магнитной сортировки клеток. Такие клетки стимулировали два раза иммунизирующим пептидом in vitro, а затем проводили их состояние активации, измеряемого по продукции IL-4 и IFN-гамма.
Затем линии CD4+ NKT-клеток анализировали in vitro в отношении их способности уничтожать опухолевые клетки EG7. Опухолевые клетки EG7 (H-2b) происходят из тимомы, трансдуцированной конструкцией ova. Такие клетки представляют ограниченный по CD1d эпитоп ova, который, как известно, является недостаточным для запуска активации NKT и уничтожения клеток опухоли.
Клетки EG7 метили на уровне мембраны с помощью 1 мкМ DiOC18 (3,3’-диоктадециклоксакарбоцианин перхлорат от Invitrogen). Затем клетки EG7 (1×105 на лунку) культивировали в течение 18 ч при 37°С в присутствии линий NKT-клеток в соотношениях 1/1-1/5 (клетки EG7 против NKT-клеток). Линии NKT-клеток сначала стимулировали в течение 4 ч in vitro антигенпредставляющими клетками, нагруженными пептидом SEQ ID3. Через 18 ч клетки собирали и окрашивали на аннексин V и 7-AAD в соответствии с инструкциями изготовителя (Apoptosis Detection kit; BD Biosciences) и анализировали на проточном цитометре FACSCantoII (BD Biosciences).
Результаты показывают, что в клетках EG7, инкубированных с линиями NKT-клеток, полученными от мышей, иммунизированных пептидом SEQ ID3, индуцируется апоптоз, в то время как NKT-клетки, полученные от контрольных мышей, которым вводили физиологическую сыворотку вместо пептида, не индуцировали значительную степень апоптоза опухолевых клеток.
Пример 4
Применение тетрамеров молекул CD1d для выявления MOG-специфических CD4+ NKT-лимфоцитов
Рассеянный склероз представляет собой хроническое демиелинизирующее заболевание, где CD4+ NKT-клетки против аутоантигенов, таких как олигодендроцитарный гликопротеин (MOG), вероятно, играют ключевую роль. Его экспериментальный эквивалент EAE (экспериментальный аутоиммунный энцефаломиелит) имитирует большинство из характерных признаков заболевания у человека и его используют для понимания патогенетических механизмов и разработки новых способов лечения.
Таким образом, подсчет MOG-специфических CD4+ NKT-клеток может быть прогностическим для исхода заболевания.
Связывающий CD1d эпитоп идентифицирован в белке MOG мыши путем комбинации алгоритмов и функционального анализа, как описано выше, и он соответствует последовательность с 200 по 206.
CD4+ NKT-клетки получают из селезенки мышей C57BL/6, у которых был индуцирован EAE. CD4(-)-клетки сначала удаляют из суспензии клеток селезенки с использованием магнитных гранул.
Тетрамеры молекул CD1d (H-2b), включающие флуоресцентную метку, такую как фикоэритрин, получают, как известно в данной области.
Синтетический пептид, который охватывает ограниченный по CD1d эпитоп MOG NKT-клеток и мотив тиоредуктазы, получают путем инкубации в течение ночи:
CGPCGGFLRVPCWKI (SEQ ID 4), который содержит линкер, связывающий мотив тиоредуктазы (CGPC) и CD1d-связывающий мотив.
Тетрамеры нагружают пептидом SEQ ID 4 в течение ночи при комнатной температуре. Затем нагруженные тетрамеры промывают и инкубируют с CD4+ T-клетками в течение 2 ч при 37°С. Затем суспензию считывают с помощью системы для активированной флуоресценции сортировки клеток и оценивают долю NKT-клеток, специфичных к пептиду MOG.
Пример 5
Прямое уничтожение опухолевых клеток H-2b (R113) NKT-клетками, индуцированными с помощью ограниченного по CD1d эпитопа NKT-клеток, происходящего из киназы анапластической лимфомы (ALK).
Киназа анапластической лимфомы представляет собой трансмембранную рецепторную тирозинкиназу, которая экспрессируется на многих клетках в ходе онтогенеза, но только на опухолях эктодермального происхождения во взрослой жизни. Таким образом, она считается онкогеном, прямо связанным со всеми опухолями эктодермального происхождения, как показано как в моделях на животных, так и в опухолях человека. Например, вплоть до 60% опухолей при раке молочной железы человека экспрессируют ALK. ALK+ опухолевые клеточные линии мышей являются доступными и их можно использовать для оценки того, способны ли ALK-специфические цитолитические CD4+ T-клетки по изобретению уничтожать опухолевые клетки.
CD4 T-клетки (C57BL/6, H-2b, исходные клетки), полученные из селезенки наивных мышей, стимулировали четыре раза аутологичеными дендритными клетками, нагруженными ограниченным по CD1d эпитопом NKT-клеток из ALK, во фланкирующие остатки которого был добавлен мотив тиоредуктазы формата CxxC. (пептид SEQ ID5: CHGCGGWLQIVTWWGPGS (мотив тиоредуктазы подчеркнут и в качестве линкера между мотивом и ограниченного по CD1d эпитопа использовали 2 остатка глицина))
Поскольку NKT-клетки сами по себе имеют цитолитическую активность, авторы настоящего изобретения включили клетки, которые стимулировали в параллельном эксперименте путем воздействия того же ограниченного по CD1d эпитопа NKT в природной последовательностси без тиоредокс-мотива (WLQIVTWWGPGS).
Через десять суток после последней стимуляции, CD4 T-клетки промывали и добавляли в микропланшеты для культивирования клеток, содержавшие 104 опухолевых клеток R113 в соотношении 2 к 1 (CD4 к опухолевым клеткам). R113 представляет собой линию B-клеточной опухоли, полученную из мышей C57BL/6, которая конститутивно экспрессирует ALK.
После кокультивирования в течение 20 ч клетки опухоли R113 оценивали в отношении связывания аннексина V, использованного в качестве маркера апоптоза клеток.
На фиг.3 показано, что в присутствии NKT-клеток, культивированных с пептидом с последовательностью 1, происходит увеличение в 4,5 раз гибели опухолевых клеток (18%; средний столбик гистограмма) по сравнению с опухолевыми клетками, культивированными отдельно (3,8%; левый столбик гистограммы). Как и ожидалось, NKT-клетки, активированные взаимодействием CD1d и пептидом с природной последовательностью демонстрируют промежуточный % гибели клеток (11%, правый столбик гистограммы). среднее значение ±SD для трех экземпляров.
Таким образом, был сделан вывод, что:
(1) пептиды могут представляться в контексте детерминант CD1d;
(2) в истинных опухолевых клетках можно индуцировать апоптоз путем воздействия NKT-клеток, полученных активацией через распознавание ограниченного по CD1d эпитопа;
(3) в значительно более высокой доле опухолевых клеток апоптоз индуцировался, когда NKT-клетки активировали путем воздействия ограниченного по CD1d эпитопа NKT-клеток, содержащего мотив тиоредуктазы во фланкирующих остатках остатки.
Во втором эксперименте наивные CD4 T-клетки из альтернативного генетического фона (мыши BALB/c, H-2d исходные клетки) получали из селезенки наивных мышей и стимулировали четыре раза аутологичными дендритными клетками, нагруженными пептидом SEQ ID5.
Кокультивирование с происходящей из BALB/c ALK+ опухолевой клеточной линией (VAC) проводили, как описано выше. Апоптоз опухолевых клеток измеряли путем оценки связывания аннексина-V с помощью faccs.
На фиг.4 показано, что в присутствии NKT-клеток, культивированных с пептидом с последовательностью 1, происходит значительное увеличение гибели опухолевых клеток (25%; средний столбик гистограммы) по сравнению с опухолевыми клетками, культивируемыми отдельно (5,6%; левый столбик гистограммы) или в присутствии пептида с природной последовательностью (15%; правый столбик гистограммы). среднее значение ±SD для трех экземпляров.
Эти данные указывают на то, что во второй, неродственной опухолевой клеточной лини может быть индуцирован апоптоз путем воздействия NKT-клеток, и что этот эффект значительно возрастает после стимуляции NKT-клеток путем воздействия ограниченных по CD1d эпитопов, содержащих мотив тиоредуктазы во фланкирующих остатках.
Пример 6
Предупреждение EAE путем предварительной иммунизации пептидом, связывающимся с CD1d, и содержащим мотив тиоредуктазы
EAE (экспериментальный аутоиммунный энцефаломиелит) представляет собой модельное заболевание, при котором происходит демиелинизация центральной нервной системы и которое считается экспериментальным эквивалентом рассеянного склероза. Считается, что в индукцию и поддержание заболевания вовлечено небольшое количество аутоантигенов, среди которых находятся MOG (олигодендроцитарный гликопротеин миелина). Заболевание можно индуцировать у мышей C57BL/6 путем иммунизации MOG с использованием эпитопа CD4+ T-клеток, охватывающего аминокислоты 35-55 MOG.
MOG содержит последовательность, которая связывается с CD1d и активирует NKT-клетки. Таким образом, пептид с последовательностью PHFLRVPCWKI получают путем синтеза, также как и содержащий тиоредуктазу пептид с последовательностью CHGCGGFLRVPCWKI (пептид SEQ ID6, в котором мотив тиоредуктазы подчеркнут и между мотивом и CD1d-связывающим мотивом расположен линкер из 2 остатков глицина).
Группы мышей C57BL/6 иммунизировали четыре раза подкожно (50 мкг) пептидом с SEQ ID6 или, в качестве контроля, пептидом с природной последовательностью. Через десять суток после последней имунизации, у всех мышей, включая группу наивных неиммунизированных животных, индуцируют заболевание путем подкожной инъекции 100 мкг пептида MOG 35-55 /400 мкг Mycobacterium butyricum в CFA и в/б инъекции 300 нг Bortetella pertussis в NaCl. На сутки +2, проводят вторую инъекцию B. pertussis.
Признаки EAE наблюдают с течением времени. Выявлено, что у мышей, предварительно иммунизированных пептидом SEQ ID6, не развивается EAE, в то время как у контрольных наивных мышей и в группе, предварительно иммунизированной пептидом с природной последовательностью, развиваются выраженные признаки заболевания.
Пример 7
Предупреждение и подавление спонтанного инсулинзависимого диабета с помощью происходящих из GAD65 пептидов
Мыши с диабетом без ожирения (NOD) представляет собой подходящую модель на животных для спонтанного инсулин-зависимого диабета. У таких животных, как и у человека, наблюдают ранний иммунный ответ на аутоантиген декарбоксилазу глутаминовой кислоты (GAD65) в то время, когда можно наблюдать инсулит, с которого ответ распространяется путем внутримолекулярного и межмолекулярного распространения. Индукция толерантности к GAD65 путем введения белка новорожденным препятствует возникновению диабета.
GAD65 содержит аминокислотные последовательности, способные связываться с CD1d. Таким образом, последовательность PQHTNVCFWFV, соответствующую аминокислотам 501-507 GAD65, получают путем синтеза, также как и ее аналог, охватывающий мотив тиоредуктазы во фланкирующих остатках: пептид SEQ ID7: CHGCGGHTNVCFWFV (мотив тиоредуктазы подчеркнут и между этим мотивом и CD1d-связывающим мотивом находится линкер из 2 остатков глицина).
Самок мышей NOD иммунизируют, начиная с возраста 4 недели, путем 4 подкожных инъекций пептидов либо SEQ ID7, либо с природной последовательностью, и в каждой из этих групп наблюдают за гликемией по сравнению с неиммунизированной группой. Выявлено, что у мышей NOD, предварительно иммунизированных пептидом SEQ ID7, предотвращалась гипергликемия, в то время как у мышей, которым вводили природную последовательность, и неиммунизированных животных развивалась гипергликемия, начинающаяся после 14-ой недели.
Пример 8
Предупреждение астмы, индуцируемой воздействием аллергена Der p 1
Аллергены из клещей домашней пыли, D. pteronyssinus, часто вовлечены в аллергическую астму. Der p 1 является главным аллергеном D. pteronyssinus. Последовательность Der p 1 содержит CD1d-связывающий мотив, соответствующий аминокислотной последовательности 38-44. Пептид с последовательностью WAFSGVAATES получают путем синтеза, также как и его аналог, содержащий мотив тиоредуктазы. Таким образом, пептид SEQ ID8 CGPCGGFSGVAATES содержит мотив тиоредуктазы (подчеркнут) и линкер из 2 остатков глицина между мотивом и CD1d-связывающим мотивом.
Аллергическую астму можно индуцировать у мышей BALB/c путем назальных вливаний 100 мкг Der p 1 в течение 3 последовательных дней. Астма характеризуется гиперреактивностью бронхов и привлечением эозинофильных инфильтратов в легкое.
Мышей BALB/c иммунизируют с помощью 4 инъекций либо 50 мкг пептида SEQ ID8, либо пептида с природной последовательностью в качестве контроля. Der p 1 вводят путем назального вливания через 10 суток после последней иммунизации. Можно видеть, что у мышей, предварительно иммунизированных пептидом SEQ ID8, не развивается реактивность дыхательных путей на ингаляцию метахолина и они не проявляют инфильтрации эозинофилов в легкие.






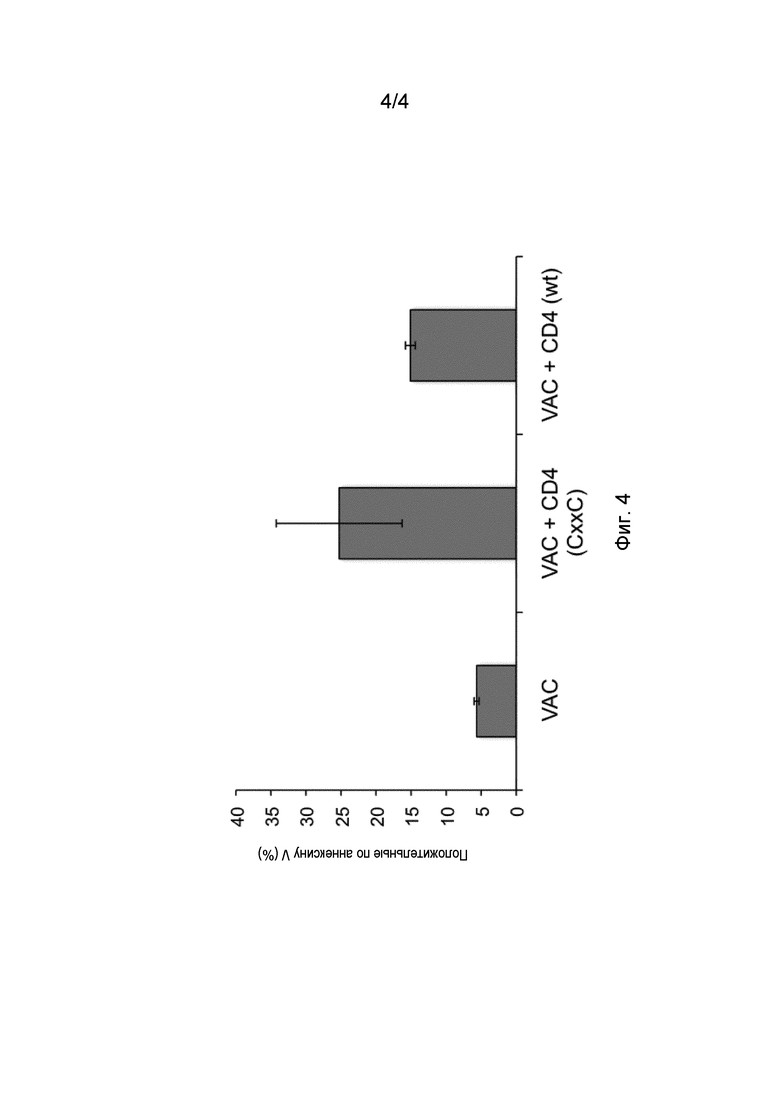
Изобретение относится к области биотехнологии, конкретно к новым пептидам, содержащим эпитопы, распознаваемые CD4+ естественными киллерными T(NKT)-клетками, и может быть использовано в медицине. Получают иммуногенный слитый пептид, связывающий CD1d и содержащий мотивы [FWHY]-xx-[ILMV]-xx-[FWHY] и [CST]-xx-C или C-xx-[CST]. Изобретение позволяет увеличить активности T(NKT)-клеток для применения при инфекционных заболеваниях, аутоиммунных заболеваниях, иммунной реакции на введение аллогенных факторов, аллергических заболеваний, для терапии опухолей, для предупреждения отторжения трансплантата и для предупреждения иммунизации против вирусных белков. 14 н. и 6 з.п. ф-лы, 4 ил., 8 пр.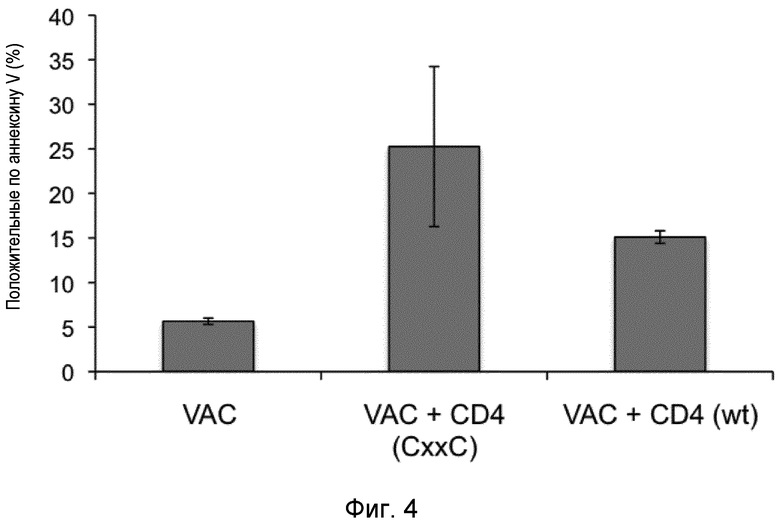
1. Иммуногенный слитый пептид, связывающийся с CD1d и таким образом рекрутирующий и активирующий клетки NKT, происходящий из антигенного белка, причем указанный пептид содержит:
(1) эпитоп естественных киллерных Т(NKT)-клеток из указанного антигенного белка, содержащий мотив [FWHY]-хх-[ILMV]-хх-[FWHY], где x обозначает любую аминокислоту;
(2) мотив тиоредуктазы [CST]-хх-С или С-хх-[CST], где x обозначает любую аминокислоту за исключением Tyr, Phe или Trg, который либо является непосредственно соседним с указанным эпитопом (NKT)-клеток, либо отделен от указанного эпитопа (NKT)-клеток линкером не более чем из 7 аминокислот; и
(3) в случае необходимости фланкирующую аминокислотную последовательность из вплоть до 10 аминокислот на N- и/или С-конце пептида,
причем указанный антигенный белок выбран из группы, состоящей из аутоантигена, аллофактора, аллергена, аллоантигена, отделяющегося от трансплантата, антигена внутриклеточного патогена и антигена вирусного вектора, используемого для генной терапии или генной вакцинации, и
причем указанный антиген не содержит в своей природной последовательности мотив [CST]-хх-С или С-хх-[CST] из 11 аминокислот на N- или С-конце рядом с указанным эпитопом NKT-клеток.
2. Пептид по п. 1, в котором фланкирующая аминокислотная последовательность на N- и/или С-конце пептида имеет длину до 7 аминокислот.
3. Пептид по п. 1 или 2, где указанный мотив тиоредуктазы отделен от эпитопа клеток NKT линкером из самое большее 4 аминокислот.
4. Пептид по любому из пп. 1-3, где указанный эпитоп NKT-клеток содержит мотив [FW]-хх-[ILMV]-хх-[FW].
5. Пептид по любому из пп. 1-4, где указанный мотив тиоредуктазы имеет последовательность С-хх-С.
6. Нуклеиновая кислота, кодирующая иммуногенный слитый пептид, связывающийся с CD1d и таким образом рекрутирующий и активирующий клетки NKT, причем указанный пептид содержит:
(1) эпитоп естественных киллерных Т(NKT)-клеток из указанного антигенного белка, содержащий мотив [FWHY]-хх-[ILMV]-хх-[FWHY], где x обозначает любую аминокислоту;
(2) мотив тиоредуктазы [CST]-хх-С или С-хх-[CST], где x обозначает любую аминокислоту, за исключением Tyr, Phe или Tyr, который либо является непосредственно соседним с указанным эпитопом (NKT)-клеток, либо отделен от указанного эпитопа (NKT)-клеток линкером не более чем из 7 аминокислот; и
(3) в случае необходимости фланкирующую аминокислотную последовательность из вплоть до 10 аминокислот на N- и/или С-конце пептида,
причем указанный антигенный белок выбран из группы, состоящей из аутоантигена, аллофактора, аллергена, аллоантигена, отделяющегося от трансплантата, антигена внутриклеточного патогена и антигена вирусного вектора, используемого для генной терапии или генной вакцинации, и
причем указанный антиген не содержит в своей природной последовательности мотив [CST]-хх-С или С-хх-[CST] из 11 аминокислот на N- или С-конце рядом с указанным эпитопом NKT-клеток.
7. Применение пептида по любому из пп. 1-5 или нуклеиновой кислоты, кодирующей пептид, по п. 6 в качестве лекарственного средства для профилактики или лечения у млекопитающего аутоиммунного заболевания, иммунного ответа на аллогенный фактор, иммунного ответа на воздействие аллергена, отторжения аллотрансплантата и иммунного ответа против вирусного вектора, используемого для генной терапии или генной вакцинации.
8. Применение пептида по любому из пп. 1-5 или нуклеиновой кислоты, кодирующей пептид, по п. 6 в качестве лекарственного средства для профилактики или лечения у млекопитающего инфекции внутриклеточным патогеном.
9. Применение пептида по любому из пп. 1-5 или применение нуклеиновой кислоты по п. 6 для получения лекарственного средства для профилактики или лечения у млекопитающего аутоиммунного заболевания, иммунного ответа на аллогенный фактор, иммунного ответа на воздействие аллергена, отторжения аллотрансплантата и иммунного ответа против вирусного вектора, используемого для генной терапии или генной вакцинации.
10. Применение пептида по любому из пп. 1-5 или применение нуклеиновой кислоты по п. 6 для получения лекарственного средства для профилактики или лечения у млекопитающего инфекции внутриклеточным патогеном.
11. Применение in vitro пептида по любому из пп. 1-6 для выявления, получения или истощения CD4 +Т-лимфоцитов.
12. Способ получения пептида, способного индуцировать активацию NKT-клеток, включающий стадии:
(1) идентификации в антигенном белке последовательности эпитопа NKT-клеток, содержащей мотив [FWHY]-хх-[ILMV]-хх-[FWHY], где x обозначает любую аминокислоту, причем указанный антиген не содержит в своей природной последовательности мотив [CST]-хх-С или С-хх-[CST] из 11 аминокислот на N- или С-конце рядом с указанным эпитопом NKT-клеток;
(2) получения пептида, содержащего:
a) последовательность мотива [FWHY]-хх-[ILMV]-хх-[FWHY], идентифицированного на стадии (1);
b) последовательность мотива тиоредуктазы [CST]-хх-С или С-хх-[CST], где x обозначает любую аминокислоту, за исключением Tyr, Phe или Trp, так чтобы указанный мотив тиоредуктазы и указанный эпитоп NKT-клеток находились рядом друг с другом или были разделены линкером не более чем из 7 аминокислот, и
c) в случае необходимости дополнительно на N- и/или С-конце пептида фланкирующую аминокислотную последовательность из вплоть до 10 аминокислот.
13. Способ по п. 12, в котором в с) фланкирующая аминокислотная последовательность представляет собой последовательность из вплоть до 7 аминокислот.
14. Способ по п. 12, в котором в b) мотив тиоредуктазы отделен от эпитопа клеток NKT линкером из самое большее 4 аминокислот.
15. Способ получения популяции специфичных к антигену NKT-клеток in vitro, включающий стадии:
- получения CD4+ Т-клеток;
- контактирования указанных CD4+ Т-клеток in vitro с иммуногенным слитым пептидом, связывающимся с CDld и таким образом рекрутирующим и активирующим клетки NKT, происходящим из антигенного белка, причем указанный пептид содержит:
(1) эпитоп естественных киллерных Т(NKT)-клеток из указанного антигенного белка, содержащий мотив [FWHY]-хх-[ILMV]-хх-[FWHY], где x обозначает любую аминокислоту;
(2) мотив тиоредуктазы [CST]-хх-С или С-хх-[CST], где х обозначает любую аминокислоту, за исключением Tyr, Phe или Trp, который либо является непосредственно соседним с указанным эпитопом (NKT)-клеток, либо отделен от указанного эпитопа (NKT)-клеток линкером не более чем из 7 аминокислот; и
(3) в случае необходимости фланкирующую аминокислотную последовательность из вплоть до 10 аминокислот на N- и/или С-конце пептида,
причем указанный антигенный белок выбран из группы, состоящей из аутоантигена, аллофактора, аллергена, аллоантигена, отделяющегося от трансплантата, антигена внутриклеточного патогена и антигена вирусного вектора, используемого для генной терапии или генной вакцинации, и
причем указанный антиген не содержит в своей природной последовательности мотив [CST]-хх-С или С-хх-[CST] из 11 аминокислот на N- или С-конце рядом с указанным эпитопом NKT-клеток; и
- увеличения указанных клеток в количестве в присутствии IL-2, или IL-15, или IL-7.
16. Популяция специфичных к антигену NKT-клеток, уничтожающих клетки, презентирующие антиген через презентирование CD1d, полученная способом по п. 15.
17. Применение популяции специфичных к антигену NKT-клеток по п. 16 в профилактике или лечении аутоиммунного ответа и иммунной реакции на аллогенный фактор, иммунного ответа на аллерген, отторжения аллотрансплантата или иммунного ответа на вирусные белки, используемые в генной терапии или генной вакцинации.
18. Применение популяции специфичных к антигену NKT-клеток по п. 16 в профилактике или лечении инфекции внутриклеточным патогеном.
19. Применение популяции специфичных к антигену NKT-клеток по п. 16, причем указанный антиген выбран из группы, состоящей из аутоантигена, аллофактора, аллергена, аллоантигена, отделяющегося от трансплантата, или антигена вирусного вектора, используемого для генной терапии или генной вакцинации, в получении лекарственного средства для профилактики или лечения аутоиммунного ответа, и иммунной реакции на аллогенный фактор, иммунного ответа на аллерген, роста опухоли, отторжения аллотрансплантата или иммунного ответа на вирусные белки, используемые в генной терапии или генной вакцинации.
20. Применение популяции специфичных к антигену NKT-клеток по п. 16 в получении лекарственного средства для профилактики или лечения инфекции внутриклеточным патогеном.
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Колосоуборка | 1923 |
|
SU2009A1 |
| CASTANO A.R | |||
| ET AL., PEPTIDE BINDING AND PRESENTATION BY MOUSE CD1, SCIENCE, 1999, v.269, n.5221, p.223-226 | |||
| BALATO A., Natural killer T cells: an unconventional T-cell subset with diverse effector and regulatory functions, J | |||
| Invest | |||
| Dermatol., 2009, v.129, is.7, p.1628-1642 | |||
| ZENG Z | |||
| et al., Crystal structure of mouse CD1: An MHC-like fold with a large hydrophobic binding groove, Science, 1997, v.18, is.277(5324), p.339-345 | |||
| RU 2008140732 A, 20.04.2010 | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
Авторы
Даты
2017-04-04—Публикация
2011-11-24—Подача