Изобретение относится к созданию технологических процессов получения иммобилизованных ферментных препаратов. Оно может быть широко использовано в различных отраслях, особенно в фармацевтической промышленности, для производства стабильных, активных и безопасных в применении лекарственных препаратов пролонгированного действия.
Наиболее эффективным способом стабилизации соединений белкового или иного характера в физиологическом растворе является химическая конъюгация на высокомолекулярных носителях [Parveen S, Sahoo S.K., Clin Pharmacokinet. 2006; 45(10), c. 965; Duncan R., PEGylated Protein Drugs: Basic Science and Clinical Applications. Ed:.  Basel 2009; Harris J.M, Chess RB. Effect of pegilation on pharmaceuticals. // Nat Rev Drug Discov, 2003, 2(3), c. 214.
Basel 2009; Harris J.M, Chess RB. Effect of pegilation on pharmaceuticals. // Nat Rev Drug Discov, 2003, 2(3), c. 214.
Ковалентное связывание лекарственных белков с полимерным носителем многократно повышает конформационную стабильность белковых молекул и устойчивость к действию протеаз и специфических ингибиторов, что позволяет создавать макромолекулярные физиологически активные препараты пролонгированного действия на их основе [Некрасов А.В., Пучкова Н.Г., Иммунология, 2006; 27(2), с. 1].
На сегодняшний день известно множество полимерных носителей для получения конъюгатов с белковыми и небелковыми соединениями. Наиболее хорошо известны различные конъюгаты на основе полиэтиленгликоля (ПЭГ), которые используются в качестве лекарственных препаратов [Бейлон П.С., Паллерони А.В. / Конъюгаты интерферона, Патент РФ 2180595. Бург Й, Хильгер Б., Йозель Х.-П., Патент RU 2232163; Курочкин С.Н., Парканский А.А., Патент RU 2298560].
Известны водорастворимые полимерные гетероциклические амины, например, производные N-оксида поли-1,4-этиленпиперазина. Полимерные амины уникальны по своим свойствам и применимости в качестве полимерного носителя для конъюгации. Сополимер N-оксида 1,4-этиленпиперазина и (N-карбоксиметил)-1,4-этиленпиперазиний галогенида (полиоксидоний) нетоксичен, обладает антирадикальными и детоксикационными свойствами, биодеградируемый за счет N-оксидных групп. Сополимер разрешен к применению в медицинской практике и используется как иммуномодулятор, адъювант или полимерный носитель [Некрасов А.В., Пучкова Н.Г., Иванова A.С. Производные поли-1,4-этиленпиперазина, обладающие иммуномодулирующей, противовирусной, антибактериальной активностями. Патент RU №2073031]. Это делает актуальным и важным направления по разработке доступных и простых технологических процессов производства полимерных носителей, отвечающих всем предъявляемым к ним требованиям, и различных процессов конъюгации на их основе.
В патенте RU 2185388 (опубликован 20.07.2002) описывается окисление поли-1,4-этиленпиперазина в водном растворе, содержащем растворитель и окислитель, способном образовывать атомарный кислород в нормальных условиях. В качестве окислителя целесообразно использовать органические и неорганические перекиси и гидроперекиси, соли кислородсодержащих галогенокислот, озон, кислород, полученный электролизом воды.
В качестве кислотного растворителя можно использовать, например, концентрированный водный раствор уксусной кислоты.
Окисление целесообразно проводить путем смешивания поли-1,4-этиленпиперазина (ПЭП) с водным раствором уксусной кислоты (УК) и пероксида водорода (ПВ) в мольном соотношении: ПЭП:УК:ПВ=1:0,45:0,7. Процесс окисления проводят в гетерогенной среде до достижения полного растворения полимера. Затем проводят алкилирование полученного N-оксида поли-1,4-этиленпиперазина в присутствии алкилирующего агента, которое осуществляют в водной среде. В качестве алкилирующего агента рекомендуется использовать вещества, ковалентно связывающиеся с атомом третичного азота в полимерной цепи в условиях температур 30-100°С, например галогенокислоты или их эфиры циклического или ациклического строения.
Предпочтительно, в качестве алкилирующего агента использовать этиловый эфир бромуксусной кислоты.
Полученный в процессе алкилирования раствор сополимера N-оксида поли-1,4-этиленпиперазина и (N-карбоксиэтил)-1,4-этиленпиперазиний бромида (С-ПНО) после очистки, например, ультрафильтрацией может быть использован для дальнейшего синтеза высокомолекулярных водорастворимых биогенных соединений, в частности конъюгатов или комплексов с биологически активными веществами.
В патенте RU 2556378 (опубликован 10.07.2015) описывается конъюгат гликопротеина, обладающего активностью эритропоэтина и его способ получения. Способ включает окисление полиэтиленпиперазина до N-оксида и алкилирование бромуксусной кислотой, с получением сополимера N-оксида поли-1,4-этиленпиперазина и (N-карбоксиметил)-1,4-этиленпиперазиний бромида), а также очистку полученного сополимера. Конъюгацию сополимера с эритропоэтином проводят карбодиимидным или гидразидным методом.
Наиболее близким к предлагаемому изобретению является изобретение, описанное в патенте RU 2112542 (опубликован 10.06.1998). Патент относится к препарату, содержащему конъюгат фермента гиалуронидазы, для лечения патологических состояний соединительных тканей. В патенте описывается способ получения конъюгата фермента гиалуронидазы с высокомолекулярным носителем - сополимером N-оксида поли-1,4-этиленпиперазина и (N-карбоксиэтил)-1,4-этиленпиперазиний бромида (полиоксидонием), мол.м 40000-100000 Д, и соотношением фермент: носитель 1:(1-5) соответствующим общей формуле 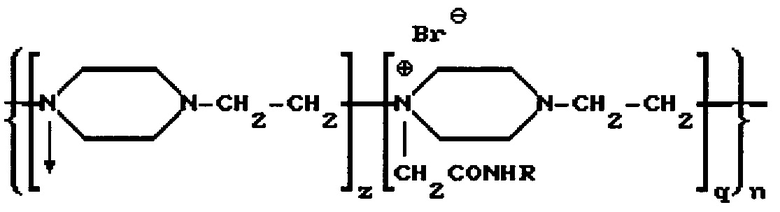
где R - фермент гиалуронидазы; n=300-700 - количество элементарных звеньев; q=0,2-0,4 - количество алкилированных звеньев; z=0,4-0,8 - количество окисленных звеньев. При этом в качестве фермента в препарате может быть использована гиалуронидаза, выделенная из семенников крупного рогатого скота. Способ заключается в конъюгации гиалуронидазы с полиоксидонием с использованием азидного метода, либо метода активированных сукцинимидных эфиров. При использовании азидного метода конъюгат получают в две стадии: на первой - из полиоксидония получают гидразид полиоксидония, а на второй - получают конъюгат реакцией конденсации азида полиоксидония с ферментом. При использовании метода активированных эфиров вначале получают сукцинимидный эфир полиоксидония, а затем конъюгируют с ферментом. Конъюгированный препарат назван в описании как «Лонгидаза». Способ получения сополимера N-оксида поли-1,4-этиленпиперазина и (N-карбоксиэтил)-1,4-этиленпиперазиний бромида в патенте не описывается.
Востребованность препаратов со свойствами препарата «Лонгидаза» на фармацевтическом рынке, экономические и экологические требования послужили причиной усовершенствования используемого в производстве процесса с целью исключения в нем определенных недостатков и повышения производительности.
Во всех вышеперечисленных патентах не рассматривается распределение молекулярных звеньев в структуре сополимера, или конъюгата, полученного на его основе.
Как показали исследования, распределение молекулярных звеньев в структуре сополимера оказывает влияние на свойства получаемого конъюгата, а именно на степень конъюгации, выходы целевого продукта и стабильность конъюгированных препаратов.
Задачей настоящего изобретения является разработка способа получения конъюгата фермента гиалуронидазы с полимерным носителем, содержащим сополимер N-оксида поли-1,4-этиленпиперазина и (N-карбоксиметил)-1,4-этиленпиперазиний бромида обладающего одновременно свойствами подавления гиперплазии соединительной ткани и противовоспалительным действием, пригодных для лечения патологических состояний соединительных тканей с улучшенными свойствами и повышенным выходом способа.
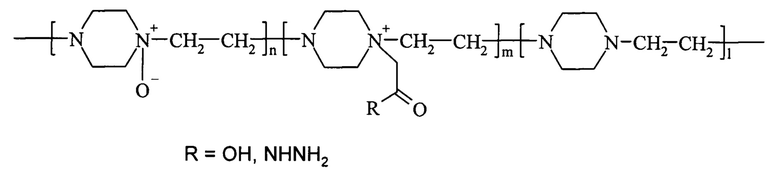
Решение поставленной задачи достигается способом получения активного конъюгата фермента гиалуронидазы с сополимером, содержащим N-оксид 1,4-этиленпиперазина и (N-карбоксиметил)-1,4-этиленпиперазиний галогенид с использованием карбодиимидного или азидного метода конъюгации, очистки, концентрирования и лиофильной сушки. Для конъюгации используют водорастворимый сополимер, который представляет собой сополимер N-оксида 1,4-этиленпиперазина, (N-карбоксиметил)-1,4-этиленпиперазиния или его гидразидное производное и 1,4-этиленпиперазина общей формулы (I)
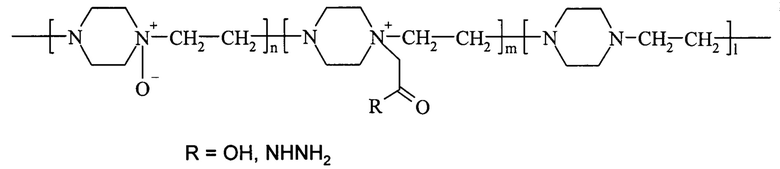
где n составляет от 40% до 90% от общего количества звеньев,
m составляет от 3% до 40% от общего количества звеньев,
n+m+1=100%,
полученный из поли-1,4-этиленпиперазина с использованием стадий окисления окислителем, способным образовывать атомарный кислород в нормальных условиях в присутствии мочевины, алкилирования низшей галогеналкановой кислотой или ее алкиловым эфиром и, в случае азидного метода, гидразинолиза.
Мочевину на стадии окисления добавляют в количестве 1-10 мас. %, предпочтительно 3-6%, мочевины в расчете на общую массу реакционной смеси, включая воду.
Для конъюгации используют гиалуронидазу из семенников животного происхождения (семенников крупного рогатого скота).
Очистку осуществляют поэтапно путем отмывки очищенной водой на полупроницаемых кассетах с нижним пределом отсекания частиц от 1 до 30 кДа.
Используемый сополимер является статистическим полимером, звенья в структуре молекулы которого расположены неупорядоченно и могут быть в любом порядке и сочетании.
От характера распределения функциональных групп зависит реакционная способность полимерного носителя в реакции конъюгации, а также стабильность сополимера и получаемых на его основе конъюгатов.
Полученный разными способами сополимер с одними и теми же количественными характеристиками с идентичными активными группами (N-оксидные и карбоксильные группы) проявляет совершенно разную реакционную способность в реакциях конъюгации. Это объясняется тем, что карбоксильные группы могут быть малодоступны по стерическим причинам и/или не быть активированы при наличии рядом находящихся N-оксидных групп. Использование полимерного носителя с малореакционноспособными карбоксильными группами приводит к существенному снижению выходов и степени конъюгации, ухудшает молекулярно-массовое распределение получаемых конъюгатов. До настоящего изобретения гетероциклический N-оксидный полимерный носитель не имел нужного количества реакционноспособных групп (карбоксильных или гидразидных), что не позволяло получать гарантированно высокую степень конъюгации с ферментом гиалуронидазы карбодиимидным или азидным методом конъюгации. Разработанные в настоящем изобретении способы производства позволяют получать препараты гиалуронидазы со степенью конъюгации не менее 90% даже в промышленных масштабах.
Наличие больших участков молекулы сополимера, содержащих только N-оксидные группы, делает полимерную молекулу малостабильной. Изучение стабильности показало, что конъюгаты на основе таких полимерных молекул со временем подвержены деструкции. Скорость деструкции полимерного носителя с неравномерным распределением N-оксидных групп не постоянна, деструкция происходит гораздо быстрее в первые месяцы хранения. Напротив, полимерный носитель с равномерным распределением N-оксидных групп намного более стабилен, скорость деструкции меньше и постоянна. Стабильность конъюгата и равномерность распределения N-оксидных групп в полимерном носителе также зависит от условий способа получения сополимера для конъюгации (см. таблицу 1 и таблицу 2).
Предлагаемое изобретение, относящееся к способу производства конъюгатов гиалуранидазы, позволяет получать полимерный носитель не только с заданными количественными характеристиками (количество различных звеньев в полимере), но с необходимым распределением звеньев, что качественно меняет свойства как самого полимерного носителя, так и конъюгата с ферментом на его основе.
Изобретение делает возможным выпускать безопасный, высокоэффективный и стабильный лекарственный препарат, обладающий одновременно свойствами подавления гиперплазии соединительной ткани и противовоспалительным действием, представляющий собой конъюгат гиалуронидазы (терапевтического фермента, выделенного из семенников крупного рогатого скота) и водорастворимого сополимера общей формулы (I).
В случае азидного метода конъюгации алкилирование проводят алкиловым эфиром галогеналкановой кислоты, и стадии алкилирования и гидразинолиза совмещены. Конъюгацию с гиалуронидазой проводят азидным методом при температуре от 0 до 25°С
Очистка представляет собой трехкратную поэтапную отмывку очищенной водой на полупроницаемых кассетах с нижним пределом отсекания частиц от 1 до 30 кДа после завершения стадий окисления, алкилирования и гидразинолиза и конъюгации.
Для конъюгации используют водорастворимый сополимер общей формулы (I), содержащий в своей цепи гидразидные группы от 3-20%.
В случае карбодиимидного метода конъюгации поли-1,4-этиленпиперазин сначала алкилируют, а затем подвергают окислению в водной среде. При этом алкилирование проводят галогеналкановой кислотой.
Очистку при карбодиимидном методе осуществляют поэтапно путем отмывки очищенной водой на полупроницаемых кассетах с нижним пределом отсекания частиц от 1 до 30 кДа после завершения стадии получения сополимера и конъюгации.
Для конъюгации используют водорастворимые сополимеры N-оксида поли-1,4-этиленпиперазина общей формулы (I), содержащие в своей цепи до 25% карбоксильных групп, и используют любые водорастворимые карбодиимиды в количестве от 3 до 50% от взятого в реакции сополимера.
Объектом изобретения также является активная субстанция конъюгата, обладающая свойствами подавления гиперплазии соединительной ткани и противовоспалительным действием, полученная любым из предлагаемых способов для приготовления лекарственного средства в виде лекарственной формы, выбранной из суппозитория, мази, инъекций или косметических средств, в том числе лекарственных средств для ветеринарии.
Ниже приводится подробное описание предлагаемого способа с использованием азидного и карбодиимидного методов конъюгации производства Лонгидазы с конкретными свойствами, включая характеристики сополимера, подробно описанными в 10 примерах и представленными в таблице 1 и в таблице 3.
В условиях предлагаемой технологии получения полимерного носителя и конъюгатов гиалуронидазы, как было обнаружено, происходит необходимое распределение функциональных звеньев в структуре сополимера, при которых полимерный носитель и конъюгаты на его основе получаются устойчивыми в процессе длительного хранения. Указанный результат достигается тем, что осуществляют реакцию окисления полиэтиленпиперазина в диссоциирующих условиях путем добавления мочевины. При этом разрушаются нековалентные межмолекулярные связи полиэтиленпиперазина, в реакциях участвуют отдельные молекулы полимера, а не молекулы в составе мицеллы, и достигается необходимое равномерное распределение функциональных групп по цепи полимера, повышается ферментативная активность (на 30-65% таблица 1), степень конъюгации и выходы целевого продукта (на 15-20%, см. таблицу 1), а также стабильность конъюгата гиалуронидазы. Ферментативная активность препаратов «Лонгидаза» при хранении при температуре 2-8°С в течение 1 года падала на 4-6% для образцов, полученных с использованием мочевины и на 24-27% - без применения мочевины (таблица 1, пример 4 и пример 9).
Получение конъюгата осуществляют двумя способами:
способом производства конъюгата гиалуронидазы с использованием азидного метода конъюгации,
и способом производства конъюгата гиалуронидазы с использованием карбодиимидного метода конъюгации.
В качестве исходного сырья для всех способов производства используется поли-1,4-этиленпиперазин (ПЭП) с молекулярной массой от 20 до 60 кДа.
ПЭП получают в результате катионной полимеризации, которая является эффективным методом синтеза монодисперсных высокомолекулярных соединений с заранее заданной молекулярной массой и структурой.
1. Способ производства конъюгата с использованием азидного метода конъюгации
Способ производства состоит из основных этапов технологического процесса: окисления в присутствии мочевины, алкилирования, гидразинолиза, проведения конъюгации азидным методом.
Окисление поли-1,4-этиленпиперазина проводят в кислой среде пероксидом водорода в присутствии мочевины при температуре 45-55°С в течение 12-24 часов в реакторе с водяной рубашкой. Затем реакционную смесь разбавляют, фильтруют на патронном фильтре, снабженном фильтрующим элементом с размером пор 0,45 нм, проводят диафильтрацию на ультрафильтрационной установке с кассетами, имеющими нижний предел отсекания частиц 5 кДа, и фильтруют на патронном фильтре, снабженном фильтрующим элементом с размером пор 0,22 нм. Далее лиофильно высушивают, анализируют на соответствие требованиям НД и сдают на склад.
На втором этапе полученный N-оксид поли-1,4-этиленпиперазина алкилируют эфиром галогеноалкановой кислоты в водно-органическом растворе (смесь вода и N-метилформамид) при перемешивании в интервале температур 35-50°С в течение 4-6 часов и проводят гидразинолиз алкильного производного полиэтиленпиперазина обработкой гидразингидратом при температуре 2-8°С. Реакционную массу фильтруют на патронном фильтре, снабженном фильтрующим элементом с 0,45 нм, проводят очистку на ультрафильтрационной установке с кассетами, имеющими нижний предел отсекания частиц 10 кДа (количество гидразингидрата не более 0,001%), проводят стерилизующую фильтрацию на патронном фильтре и разливают во флаконы. Анализируют на соответствие требованиям НД и сдают на склад.
На последнем третьем этапе процесс конъюгации гиалуронидазы с гидразидным производным карбоксиметилсодержащего N-оксида полиэтиленпиперазина, содержащим в своей цепи более 3% гидразидных групп, проводят азидным методом путем обработки нитритом натрия при рН 0-1 и последующей конъюгации азидного производного с гиалуронидазой в течение 18-22 часов при комнатной температуре. Конъюгат гиалуронидазы фильтруют, очищают отмывкой на ультрафильтрационной установке (кассеты с нижним пределом отсекания частиц 5 кДа), концентрируют, стерилизуют фильтрацией и лиофильно высушивают или хранят в виде концентрата. Результаты анализов приведены в таблице 1 (примеры 1-3).
Предлагаемым способом производства, включающим этапы алкилирования, окисления, но без добавления мочевины, гидразинолиз, конъюгацию азидным методом и процедуру очистки, получают образец Лонгидазы. Результаты анализов последнего представлены в таблице 1 (пример 4). Сравнительные исследования показывают, что добавление мочевины увеличивает ферментативную активность, степень конъюгации и выход целевого продукта, а также стабильность конъюгата (таблица 1).
Полученный лиофилизат расфасовывают во флаконы и сдают на склад в виде активной субстанции конъюгата с активностью, которой обладает Лонгидаза®.
В дальнейшем полученную лекарственную субстанцию используют для получения инъекционной формы препарата в жидком или лиофилизованном виде. Для этого раствор разбавляют с таким расчетом, чтобы в 1 мл раствора ферментативная активность составила 3000 ME (терапевтическая доза) и анализируют по всем параметрам на соответствие требованиям НД на готовую лекарственную форму. После этого раствор можно лиофильно высушить (лиофилизованная форма препарата) или, не высушивая, укупоривают, этикетируют жидкую лекарственную форму и контролируют по всем параметрам на соответствие требованиям НД на готовую лекарственную форму.
Предлагаемый согласно настоящему изобретению карбодиимидный метод позволяет провести процесс без органических растворителей и вредных реагентов, улучшить качество и повысить стабильность конечного препарата - конъюгата гиалуронидазы с производными полиэтиленпиперазина.
2. Способ производства Лонгидазы с использованием карбодиимидного метода конъюгации
Последовательная технология производства состоит из основных этапов технологического процесса: алкилирования, окисления в присутствии мочевины, проведения конъюгации карбодиимидным методом.
Используют поли-1,4-этиленпиперазин с заданными свойствами (см. выше), который алкилируют бромуксусной кислотой в водной среде при температуре 40-95°С при весовом соотношении (85:15)-(70:30) соответственно. Смесь перемешивают при температуре 50-70°С в течение 3 часов, затем в реакционную массу добавляют мочевину, уксусную кислоту и пероксид водорода, после этого при непрерывном перемешивании оставляют на 18-22 часов. Далее проверяют полноту протекания реакции окисления при помощи аммиачного теста (аналогично примеру 1). Реакционную массу фильтруют на патронном фильтре, снабженном фильтрующим элементом с размером пор 0,45 нм, полимер очищают отмывкой на ультрафильтрационной установке с нижним пределом отсекания частиц 5 кДа до содержания пероксида водорода не более 0,001% (тест на перекись водорода). Раствор концентрируют до 10-15%, содержание карбоксильных групп в полимере должно быть не менее 6%. В реакционную среду при перемешивании вводят рассчитанное количество гиалуронидазы и доводят рН среды до значения 4,8.
Продолжая перемешивание, добавляют водорастворимый карбодиимид с таким расчетом, чтобы его количество составляло 25-50% от введенной гиалуронидазы (в пересчете на белок). Реакционную смесь выдерживают при температуре 0-25°С в течение 1-1,5 часов, после чего проводят контроль степени конъюгации, которая должна быть не ниже 95%. При положительном результате реакционную смесь отмывают очищенной водой, подщелачивают до значения рН 6,8-7,0 и фильтруют на дисковом фильтре, снабженном глубинным фильтром марки АР-15. После предварительной фильтрации реакционную смесь продолжают очищать отмывкой очищенной водой на Пелликон-кассете с таким расчетом, чтобы общее количество воды составляло бы не менее 200 л на 1 кг сухих веществ. Затем раствор субстанции с активностью Лонгидазы® концентрируют, стерильно фильтруют на патронном фильтре, снабженном фильтрующей мембраной с размером пор 0,22 нм и расфасовывают во флаконы в виде жидкой субстанции. Также можно полученный стерильный концентрат лиофильно высушить, получая при этом субстанцию с активностью, которой обладает препарат «Лонгидаза»® в сухом виде. Проводят контроль на соответствие требованиям НД и сдают на склад готовой продукции. Результаты анализов субстанции приведены в таблице 1 (примеры 6-8).
Предлагаемым способом производства, включающим этапы алкилирования, окисления, но без добавления мочевины, конъюгации карбодиимидным методом и процедуры очистки, получен образец Лонгидазы, результаты анализов которого представлены в таблице 1 (пример 9). Так же, как и в случае способа производства Лонгидазы с использованием азидного метода конъюгации, добавление мочевины увеличивает ферментативную активность, степень конъюгации и выход целевого продукта, а также стабильность конъюгата (таблица 1, таблица 2).
Стерильный раствор конъюгата гиалуронидазы используют по назначению. Полученную лекарственную субстанцию используют для приготовления инъекционных форм в жидком или лиофилизованном виде. Для этого раствор разбавляют с таким расчетом, чтобы в 1 мл раствора ферментативная активность составила 3000 ME (терапевтическая доза) и разливают во флаконы и лиофильно высушивают (лиофилизованная форма препарата) или, не высушивая, укупоривают, этикетируют жидкую лекарственную форму и контролируют по всем параметрам на соответствие требованиям НД на готовую лекарственную форму.
В процессе получения конъюгата гиалуронидазы с производными полиэтиленпиперазина используют ультрафильтрационную очистку на кассетах с отсечением 1-30 кДа для удаления технологических примесей. Отмывку проводят после завершения стадий алкилирования и окисления, а также в конце технологического процесса. Предложенный карбодиимидный способ конъюгации осуществляют исключительно в водной среде.
Таким образом, технический результат предлагаемого способа заключается в разработке новых подходов в технологии получения иммобилизованных соединений на полимерном носителе нового класса в виде водорастворимых производных ПЭП по азидному и карбодиимидному методам, позволяющих получать высокий выход целевого продукта и высокое качество конечного продукта. Достигается указанный технический результат благодаря тому, что сополимер получают химической модификацией из ПЭП в присутствии мочевины, что в процессе дальнейшей конъюгации способствует значительному повышению гиалуронидазной активности, степени конъюгации, выхода препарата с активностью Лонгидазы и ее стабильности при хранении. При этом технологический процесс с использованием карбодиимидного метода обеспечивает более высокую степень конъюгации и активность конечного продукта и процесс осуществляется исключительно в водном растворе.
Изобретательский уровень разработанных способов производства конъюгата гиалуронидазы с производными полиэтиленпиперазина подтверждается отсутствием в данном направлении деятельности технологических процессов непрерывного характера и тем, что получение N-оксида полиэтиленпиперазина проводилось с использованием мочевины. При промышленном применении карбодиимидного метода последний является более предпочтительным, чем азидный метод. Применение разработанных способов в производстве пролонгированных форм соединений различного назначения позволяет улучшить производство нового препарата с активностью, превышающей активность препарата «Лонгидаза»®.
Изучение деструкции сополимеров N-оксида 1,4-этиленпиперазина, (N-карбоксиметил)-1,4-этиленпиперазиния и 1,4-этиленпиперазина показало, что при температурах не выше 70°С в водной среде с рН не более 9 деструкция происходит исключительно по N-оксидным звеньям. Термическое разложение N-оксидов протекает посредством перегруппировки Мезенгеймера:
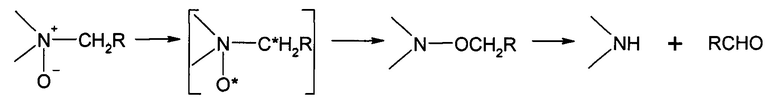
Сополимер, имеющий равномерное распределение различных звеньев, не может иметь большие участки, состоящие только из одного вида звеньев. Так, при содержании 50% и более N-оксидных звеньев и их равномерном распределении по полимерной цепочке, сополимер не должен иметь большие участки, состоящие только из незамещенных звеньев 1,4-этиленпиперазина (звенья 1). Основываясь на этом, был разработан метод качественной и количественной оценки равномерности распределения звеньев, содержащих N-оксидные группы по цепочке сополимера. Метод заключается в контролируемой деструкции сополимера с последующим физико-химическим анализом получаемых фрагментов. Было установлено, что при использовании в процессе окисления мочевины продукты деструкции не содержат низкомолекулярный полимер с содержанием одного вида звеньев:
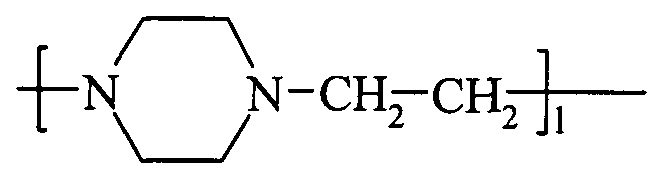
где 1 = 3 и выше.
Наличие этого вещества в продуктах деструкции сополимера говорит о большой неравномерности распределения N-оксидных звеньев в исходном сополимере.
При анализе сополимера серии 111114 методом деструкции было выделено вещество
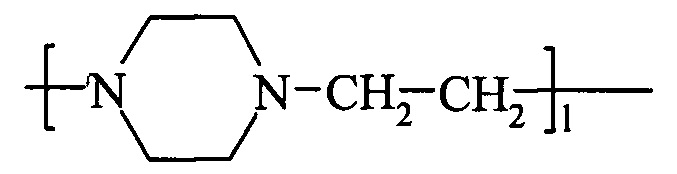
где 1 = от 4 до 6.
Проанализировав количество и качественный состав этого вещества, можно качественно и количественно судить о характере распределения N-оксидных групп в исследуемом сополимере. Однако разработанный метод измерения требует много времени (контролируемая деструкция сополимера по N-оксидным группам занимает 5 недель) и большого количества вещества для анализа. С учетом этого был разработан качественный метод быстрой оценки равномерности распределения звеньев.
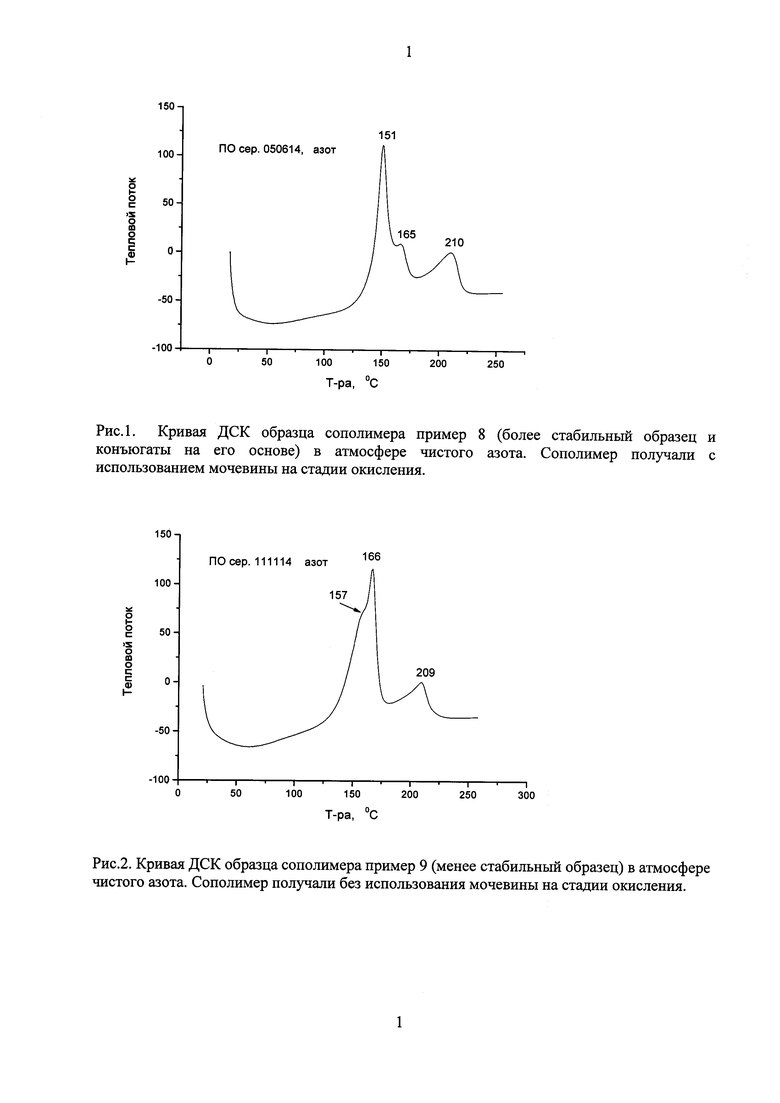
В исследованиях разных образцов сополимеров методом ДСК (дифференциальной сканирующей калориметрии) было показано, что полимеры данного типа интенсивно разлагаются при температуре около 160°С с выделением тепла. При этом наблюдаются разные формы экзотермического пика разложения у образцов, полученных с применением мочевины и без. Так, были исследованы 2 образца полимерного носителя с одинаковыми количественными показателями - молекулярный вес, молекулярно-массовое распределение, количество карбоксильных и N-оксидных групп, полученных с применением мочевины на стадии окисления и без. При этом конъюгаты, полученные на одном полимерном носителе, были стабильными, на другом носителе нет.
Кривые ДСК сополимеров приведены на рис. 1 и 2.
На кривых ДСК (рис. 1 и 2) наблюдается значительное различие соотношения интенсивностей пиков в интервале 150-170°C. Полученные результаты указывают на связь структуры полимера (характер распределения звеньев) с его термической устойчивостью. Полученные результаты были подтверждены исследованиями других носителей и демонстрируют возможность различать образцы полимерных носителей с разной устойчивостью, обусловленной характером распределения функциональных групп в молекуле полимерного носителя.
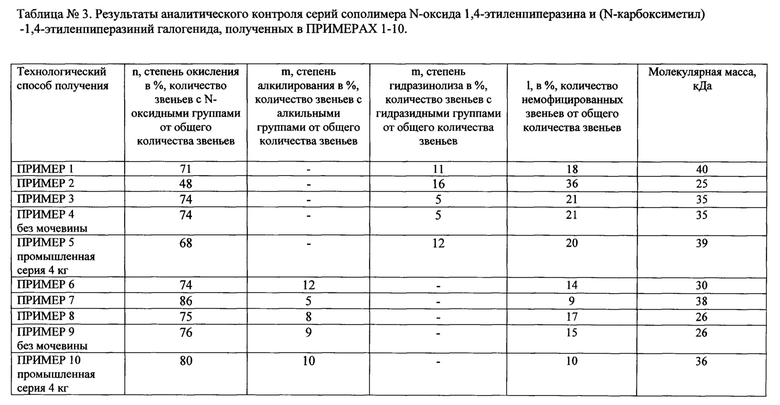
Ниже приведены конкретные параметры, которые сведены в таблицу 1 и представлены в примерах 1-3 и 6-8. В таблице 1 также указаны результаты промышленных серий (пример 5 и пример 10). В примерах 4 и 9 приведены данные, подтверждающие преимущества способа производства в присутствии мочевины. Конкретные параметры сополимера представлены в таблице 3.
Пример 1
Способ производства конъюгата гиалуронидазы с производными полиэтиленпиперазина с использованием азидного метода конъюгации
Берут 200 г стружки поли-1,4-этиленпиперазина с молекулярной массой 50 кДа, предварительно измельченной и очищенной по методу четырехкратной отмывки очищенной водой. Стружку окисляют в смеси 50 мл уксусной кислоты, 140 мл 30%-ного раствора перекиси водорода в воде в присутствии 50 г мочевины. Количество воды добавляют таким образом, чтобы концентрация по ПЭПу была 15% мас., т.е. объем реакционной среды должен составлять 1,5 л. Реакционную смесь нагревают до 50°С и при непрерывном перемешивании выдерживают в течение 24 часов. Полноту окисления проверяют с помощью аммиачного теста. Аммиачный тест состоит в следующем, к 1 мл реакционной смеси добавляют 10 мл 25% раствора аммиака. Положительным результатом считается отсутствие мути в растворе после выдержки в течение 20 минут. При положительном результате реакционную смесь разбавляют, фильтруют на патронном фильтре, снабженном фильтрующим элементом с размером пор 0,45 нм, очищают и концентрируют на ультрафильтрационной установке с кассетами, имеющими нижний предел отсекания частиц 5 кДа, и фильтруют на патронном фильтре, снабженном фильтрующим элементом с размером пор 0,22 нм. Далее лиофильно высушивают и получают 204 г N-оксида поли-1,4-этиленпиперазина в виде лиофилизата, который анализируют на соответствие требованиям НД и сдают на склад.
Полученный N-оксид поли-1,4-этиленпиперазина растворяют в 1500 мл дистилированной воды и добавляют 6000 мл N-метилформамида. В полученный раствор добавляют 275 мл эфира бромалкановой кислоты и при перемешивании выдерживают при температуре 35-50°С в течение 4-6 часов. Затем реакционную массу охлаждают до 2-8°С и при перемешивании добавляют 250 мл гидразингидрата. Реакционную смесь разбавляют очищенной водой в 10 раз, фильтруют на патронном фильтре, снабженном фильтрующим элементом с 0,45 нм и очищают водой очищенной методом ультрафильтрации на Пиликон-кассетах (с нижним пределом отсекания частиц 10 кДа) до содержания следовых количеств гидразингидрата (не более 0,001%). Далее реакционную смесь концентрируют до 10-12% (по целевому веществу), стерильно фильтруют и разливают во флаконы. Получают 2200 мл раствора гидразидного производного N-оксида поли-1,4-этиленпиперазина, анализируют на соответствие требованиям НД (таблица 3, пример 1) и сдают на склад.
В полученный на предыдущей стадии раствор охлаждают до 2-6°С и при перемешивании и охлаждении добавляют соляную кислоту до рН 0-1. Затем при перемешивании и охлаждении порциями добавляют 360 г нитрита натрия и выдерживают реакционную массу 1,5 часа. После этого реакционную среду подщелачивают сухим поташом до рН 6,8-7 и, при температуре до 10°С, при перемешивании добавляют 10%-ный раствор, содержащий 65 г препарата гиалуронидазы (70% белка). Реакционную смесь продолжают перемешивать в течение 1,5 часа, затем отбирают пробу для контроля степени конъюгации. При положительном результате степени конъюгации (не ниже 70%) реакционную массу фильтруют на дисковом фильтре, снабженном глубинным фильтром марки АР-15, и отмывают 50 л очищенной воды на ультрафильтрационной установке с кассетами, имеющими нижний предел отсекания частиц 5 кДа. Раствор концентрируют, стерильно фильтруют и фасуют в стерильные флаконы (жидкая субстанция). Стерильный раствор также лиофильно высушивают и фасуют в стерильные флаконы (лиофилизованная субстанция). Получают 231 г, выход 86%. Результаты анализа полученной субстанции конъюгата представлены в таблице 1 (пример 1). Полученная субстанция используется для приготовления готового лекарственного средства с видом активности, идентичным активности известного препарата «Лонгидаза», в виде суппозитория вагинального и ректального 3000 МЕ.
Пример 2
Проводят аналогично Примеру 1, с той разницей, что используют измельченный и очищенный ПЭП в количестве 200 г с молекулярной массой 40 кДа и на стадии окисления используют 60 г мочевины. Результаты контроля сополимера представлены в таблице 3, пример 2. Получают 227 г субстанции с видом активности, идентичным активности известного препарата «Лонгидаза», в виде лиофилизата, выход 84%. Результаты анализа представлены в таблице 1, пример 2.
Полученная субстанция используется для приготовления крема и мазей для наружного применения, 1000 ME.
Пример 3
Проводят аналогично Примеру 1, с той разницей, что используют измельченный и очищенный ПЭП в количестве 200 г с молекулярной массой 55 кДа и на стадии окисления используют 80 г мочевины. Результаты контроля сополимера представлены в таблице 3, пример 3. Получают 235 г субстанции с видом активности, идентичным активности известного препарата «Лонгидаза», в виде лиофилизата, выход 87%. Результаты анализа представлены в таблице 1, пример 3.
Субстанция используется для приготовления инъекционной формы.
Пример 4
Проводят аналогично Примеру 1, с той разницей, что на стадии окисления не добавляют мочевину. Результаты контроля сополимера представлены в таблице 3, пример 4. Получают 215 г субстанции с активностью Лонгидазы®, в виде лиофилизата, выход 74%. Результаты анализа Лонгидазы® представлены в таблице 1, пример 4.
Субстанция с видом активности, идентичным активности известного препарата «Лонгидаза», используется для приготовления инъекционной формы.
Пример 5
Проводят аналогично Примеру 1, с той разницей, что используют измельченный и очищенный ПЭП в количестве 4000 г с молекулярной массой 45 кДа, а также тем, что на стадии окисления добавляют 2000 г мочевины. Результаты контроля сополимера представлены в таблице 3, пример 5. Получают 4700 г субстанции с видом активности, идентичным активности известного препарата «Лонгидаза», в виде лиофилизата, выход 87%. Результаты анализа представлены в таблице 1 (пример 5).
Дозируя требуемое количество полученной субстанции в суппозиторные, мазевые или кремовые основы, получают соответственно суппозитории, кремы, мази, содержащие активную субстанцию. Также субстанция используется для приготовления инъекционной формы.
Пример 6
Способ с использованием карбодиимидного метода конъюгации
Поли-1,4-этиленпиперазин 200 г с молекулярной массой 30 кДа добавляют в 1,2 л кипящего водного раствора, содержащего 58 г бромуксусной кислоты, и продолжают нагревать при 70°С в течение 3 часов при непрерывном перемешивании. Затем в реакционную массу добавляют 40 мл уксусной кислоты, 140 мл 30%-ного водного раствора пероксида водорода, 50 г мочевины и перемешивают при температуре 38-42°С в течение 18-20 часов. Далее проводят проверку на полноту степени окисления с помощью аммиачного теста (тест описан выше). При положительном результате реакционную смесь разбавляют до концентрации 1-2% и фильтруют на патронном фильтре, содержащем фильтрующий элемент с размерами пор 0,45 нм, очищают отмывкой очищенной водой на Пиликон-кассете с нижним пределом отсекания частиц 5 кДа. В процессе отмывания раствор подщелачивают до значения рН 11,0-11,5 с целью полной очистки от следов низкомолекулярных органических кислот. Очистку продолжают до количества пероксида водорода не более 0,001% (тест на пероксид водорода) и концентрируют до 10% по целевому веществу. Результаты контроля сополимера представлены в таблице 3, пример 5. Полученный раствор подкисляют соляной кислотой до значения рН 4,8-4,9, после чего вводят 50 г гиалуронидазы. Производят корректировку значения рН, оно должно быть 4,8-4,9. В реакционную смесь при перемешивании вводят раствор, содержащий 2,1 г N-(3-диметиламинопропил)-N'-этилкарбодиимида гидрохлорида в 210 мл воды в течение 1,5-2 часов. Реакцию конъюгации проводят при температуре 2-25°С. После введения последней порции раствора конденсирующего агента, реакционную массу выдерживают при перемешивании 30 минут при заданной температуре и отбирают пробу для определения степени конъюгации. При положительном результате степень конъюгации должна быть не менее 90%, реакционную массу выдерживают в течение 18-20 часов, подщелачивают сухим поташом до значения рН 6,8-7,0, отмывают и фильтруют на дисковом фильтре с фильтрующим материалом в виде глубинного фильтра марки АР-15. Затем реакционную массу очищают водой очищенной методом ультрафильтрации на Пиликон-кассете с нижним пределом отсекания частиц 5 кДа. Очищенный раствор концентрируют до концентрации 8-10% и стерильно фильтруют на патронном фильтре, содержащем фильтрующий элемент с размером пор 0,22 нм. Полученный раствор конъюгата гиалуронидазы с производными полиэтиленпиперазина можно разбавлять до концентрации, содержащей в одном миллилитре раствора 3000 ME ферментативной активности и получить в конечном итоге инъекционную форму (в жидком виде) или лиофильно высушить (в лиофилизованном виде). При лиофильном высушивании получают 261 г субстанции с видом активности, идентичным активности известного препарата «Лонгидаза»®, выход 97%. Результаты анализа представлены в таблице 1, пример 6.
Дозируя требуемое количество субстанции в суппозиторную основу, получают соответственно суппозитории.
Пример 7
Проводят аналогично Примеру 6, с той разницей, что используют измельченный и очищенный ПЭП в количестве 200 г с молекулярной массой 38 кДа и на стадии окисления используют 60 г мочевины. Результаты контроля сополимера представлены в таблице 3, пример 7. Получают 265 г субстанции с видом активности, идентичным активности известного препарата «Лонгидаза»®, в виде лиофилизата, выход 98%. Результаты анализов представлены в таблице 1, пример 7.
Субстанция используется для приготовления мази.
Пример 8
Проводят аналогично Примеру 6, с той разницей, что используют измельченный и очищенный ПЭП в количестве 200 г с молекулярной массой 26 кДа и на стадии окисления используют 70 г мочевины. Результаты контроля сополимера представлены в таблице 3, пример 8. Получают 264 г субстанции с видом активности, идентичным активности известного препарата «Лонгидаза»®, в виде лиофилизата, выход 98%. Результаты анализов представлены в таблице 1, пример 8.
Субстанция используется для приготовления инъекционной формы.
Пример 9
Проводят аналогично Примеру 6, с той разницей, что используют измельченный и очищенный ПЭП в количестве 200 г с молекулярной массой 26 кДа и на стадии окисления не добавляют мочевину. Результаты контроля сополимера представлены в таблице 3, пример 9. Получают 217 г субстанции с видом активности, идентичным активности известного препарата «Лонгидаза», в виде лиофилизата, выход 82%. Результаты анализа представлены в таблице 1, пример 9.
Субстанция используется для приготовления инъекционной формы, содержащей Лонгидазу.
Пример 10
Проводят аналогично Примеру 6, с той разницей, что используют измельченный и очищенный ПЭП в количестве 4000 г с молекулярной массой 36 кДа, а также тем, что на стадии окисления добавляют 1500 г мочевины. Результаты контроля сополимера представлены в таблице 3, пример 10. Получают 5130 г субстанции с видом активности, идентичным активности известного препарата «Лонгидаза», в виде лиофилизата, выход 95%. Результаты анализа представлены в таблице 1 (пример 10).
Дозируя требуемое количество полученной субстанции в суппозиторные, мазевые или кремовые основы, получают соответственно суппозитории, кремы, мази, содержащие активную субстанцию. Также используется для приготовления инъекционной формы. Предлагаемый непрерывный карбодиимидный метод позволяет исключить из процесса органические растворители, упростить технологический процесс, повысить качество и выход целевого продукта, достичь высокого значения степени конъюгации, повысить устойчивость Лонгидазы® (в лиофилизованном и жидком виде) при воздействии на нее различных внешних факторов в процессе переработки и хранения.
Предлагаемые способы позволяют улучшить технологические процессы производства конъюгатов пролонгированного действия на основе носителей нового класса соединений в виде водорастворимых производных гетероциклических алифатических аминополимерных N-оксидов, содержащих в цепи азидные или карбоксильные группы, и нестабильных соединений белкового или иного характера, содержащих в своем составе активные аминные группы. Способ имеет большое практическое значение в обеспечении фармацевтического производства пролонгированными медицинскими препаратами, которые широко востребованы на рынке медицинских препаратов, а также может быть использован для приготовления ветеринарных лекарственных средств. Разработанные технологические процессы в перспективе могут быть широко использованы для решения многих насущных проблем в различных отраслях народного хозяйства страны в целом.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОНЪЮГАТ ГЛИКОПРОТЕИНА, ОБЛАДАЮЩЕГО АКТИВНОСТЬЮ ЭРИТРОПОЭТИНА, С ПРОИЗВОДНЫМИ N-ОКСИДА ПОЛИ-1,4-ЭТИЛЕНПИПЕРАЗИНА (ВАРИАНТЫ), ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ПОЛУЧЕНИЯ КОНЪЮГАТА | 2013 |
|
RU2556378C2 |
| ПРЕПАРАТ ДЛЯ ЛЕЧЕНИЯ ПАТОЛОГИЧЕСКИХ СОСТОЯНИЙ СОЕДИНИТЕЛЬНОЙ ТКАНИ | 1997 |
|
RU2112542C1 |
| СТАБИЛЬНАЯ КОСМЕТИЧЕСКАЯ КОМПОЗИЦИЯ НА ОСНОВЕ ИММОБИЛИЗОВАННОЙ ГИАЛУРОНИДАЗЫ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2015 |
|
RU2604160C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИ-1,4-ЭТИЛЕНПИПЕРАЗИНА И ЕГО ПРОИЗВОДНЫХ | 2000 |
|
RU2185388C2 |
| Сополимеры ди-N-оксидов поли-1,4-этиленпиперазина и способы их получения | 2018 |
|
RU2737271C2 |
| КОНЪЮГАТЫ ИНТЕРФЕРОНОВ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2011 |
|
RU2466138C1 |
| ВАКЦИНА ПРОТИВ ВИРУСА ГРИППА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2000 |
|
RU2164148C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВАКЦИНЫ ПРОТИВ ХОЛЕРЫ | 1991 |
|
RU2021816C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВАКЦИНЫ ПРОТИВ ХОЛЕРЫ | 1991 |
|
RU2021817C1 |
| ВАКЦИНА ПРОТИВ ГЕЛЬМИНТОЗОВ | 1996 |
|
RU2095082C1 |
Группа изобретений относится к области медицины, а именно к вариантам способа получения активного конъюгата фермента гиалуронидазы с сополимером с использованием карбодиимидного или азидного метода конъюгации, очистки, концентрирования и лиофильного высушивания (или разбавления), при этом сополимер представляет собой водорастворимый сополимер N-оксида 1,4-этиленпиперазина, (N-карбоксиметил)-1,4-этиленпиперазиния или его гидразида и 1,4-этиленпиперазина общей формулы: 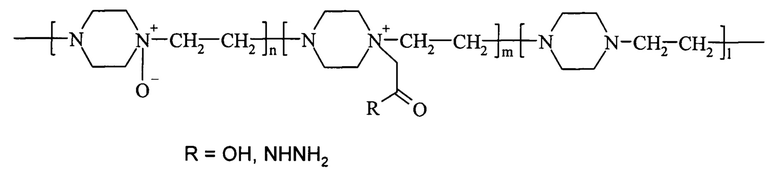 , где n составляет от 40% до 90% от общего количества звеньев, m составляет от 3% до 40% от общего количества звеньев, n+m+1=100%, полученный из поли-1,4-этиленпиперазина путем окисления, алкилирования и, в случае азидного метода, гидразинолиза. Также раскрывается лекарственное средство, обладающее свойствами подавления гиперплазии соединительной ткани и противовоспалительным действием, полученное одним из указанных вариантов способа, в форме суппозитория, мази, инъекции или косметического средства. Группа изобретений обеспечивает повышение гиалуронидазной активности, степени конъюгации, выхода, стабильности препарата при хранении. 4 н. и 11 з.п. ф-лы, 10 пр., 3 табл., 2 ил.
, где n составляет от 40% до 90% от общего количества звеньев, m составляет от 3% до 40% от общего количества звеньев, n+m+1=100%, полученный из поли-1,4-этиленпиперазина путем окисления, алкилирования и, в случае азидного метода, гидразинолиза. Также раскрывается лекарственное средство, обладающее свойствами подавления гиперплазии соединительной ткани и противовоспалительным действием, полученное одним из указанных вариантов способа, в форме суппозитория, мази, инъекции или косметического средства. Группа изобретений обеспечивает повышение гиалуронидазной активности, степени конъюгации, выхода, стабильности препарата при хранении. 4 н. и 11 з.п. ф-лы, 10 пр., 3 табл., 2 ил.
1. Способ получения активного конъюгата фермента гиалуронидазы с сополимером, с использованием карбодиимидного или азидного метода конъюгации, очистки, концентрирования и лиофильной сушки, характеризующийся тем, что сополимер представляет собой водорастворимый сополимер N-оксида 1,4-этиленпиперазина, (N-карбоксиметил)-1,4-этиленпиперазиния или его гидразида и 1,4-этиленпиперазина общей формулы
где n составляет от 40% до 90% от общего количества звеньев,
m составляет от 3% до 40% от общего количества звеньев,
n+m+1=100%,
полученный из поли-1,4-этиленпиперазина путем окисления, алкилирования и, в случае азидного метода гидразинолиза, причем окисление проводят окислителем, способным образовывать атомарный кислород в нормальных условиях в присутствии мочевины, а алкилирование проводят низшей галогеналкановой кислотой или ее алкиловым эфиром.
2. Способ по п. 1, характеризующийся тем, что стадию окисления проводят с добавлением 1-10% мас., предпочтительно 3-6% мас., мочевины в расчете на общую массу реакционной смеси, включая воду.
3. Способ по п. 1, характеризующийся тем, что для конъюгации используют гиалуронидазу из семенников животного происхождения.
4. Способ по п. 1, характеризующийся тем, что осуществляют поэтапную очистку путем отмывки очищенной водой на полупроницаемых кассетах с нижним пределом отсекания частиц от 1 до 30 кДа.
5. Способ получения активного конъюгата фермента гиалуронидазы с сополимером, с использованием азидного метода конъюгации, очистки, концентрирования и лиофильного высушивания, характеризующийся тем, что сополимер представляет собой водорастворимый сополимер N-оксида 1,4-этиленпиперазина, гидразида (N-карбоксиметил)-1,4-этиленпиперазиния и 1,4-этиленпиперазина общей формулы
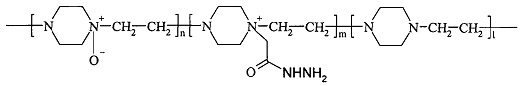
где n составляет от 40% до 90% от общего количества звеньев,
m составляет от 3% до 20% от общего количества звеньев,
n+m+1=100%,
полученный из поли-1,4-этиленпиперазина путем окисления, алкилирования и гидразинолиза, причем окисление проводят окислителем, способным образовывать атомарный кислород в нормальных условиях в присутствии мочевины, алкилирование проводят алкиловым эфиром галогеналкановой кислоты, где стадии алкилирования и гидразинолиза совмещены.
6. Способ по п. 5, характеризующийся тем, что стадию окисления проводят с добавлением 1-10% мас., предпочтительно 3-6% мас., мочевины в расчете на общую массу реакционной смеси, включая воду.
7. Способ по п. 5, характеризующийся тем, что очистка представляет собой трехкратную поэтапную отмывку очищенной водой на полупроницаемых кассетах с нижним пределом отсекания частиц от 1 до 30 кДа после завершения стадий окисления, алкилирования, гидразинолиза и конъюгации.
8. Способ по п. 5, характеризующийся тем, что водорастворимый сополимер содержит в своей цепи гидразидные группы в количестве от 3-20%.
9. Способ по п. 5, характеризующийся тем, что конъюгацию проводят при температуре от 0 до 25°С.
10. Способ получения активного конъюгата фермента гиалуронидазы с сополимером с использованием карбодиимидного метода конъюгации, очистки, концентрирования, разбавления или лиофильного высушивания, характеризующийся тем, что сополимер представляет собой водорастворимый сополимер N-оксида 1,4-этиленпиперазина, (N-карбоксиметил)-1,4-этиленпиперазиния и 1,4-этиленпиперазина общей формулы
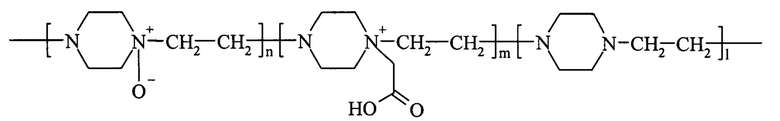
где n составляет от 40% до 90% от общего количества звеньев,
m составляет от 3% до 40% от общего количества звеньев,
n+m+1=100%,
полученный из поли-1,4-этиленпиперазина путем алкилирования и окисления в водной среде, причем окисление проводят окислителем, способным образовывать атомарный кислород в нормальных условиях в присутствии мочевины, а алкилирование проводят галогеналкановой кислотой.
11. Способ по п. 10, характеризующийся тем, что стадию окисления проводят с добавлением 1-10% мас., предпочтительно 3-6% % мас., мочевины в расчете на общую массу реакционной смеси, включая воду.
12. Способ по п. 10, характеризующийся тем, что очистку осуществляют поэтапно путем отмывки очищенной водой на полупроницаемых кассетах с нижним пределом отсекания частиц от 1 до 30 кДа после завершения стадии получения сополимера и конъюгации.
13. Способ по п. 10, характеризующийся тем, что водорастворимый сополимер содержит в своей цепи до 25% карбоксильных групп.
14. Способ п. 10, характеризующийся тем, что на стадии конъюгации используют любые водорастворимые карбодиимиды в количестве от 3 до 50% мас. от взятого в реакции белка.
15. Лекарственное средство, обладающее свойствами подавления гиперплазии соединительной ткани и противовоспалительным действием, полученное способом по любому из пп. 1-14, в форме суппозитория, мази, инъекции или косметического средства.
| ПРЕПАРАТ ДЛЯ ЛЕЧЕНИЯ ПАТОЛОГИЧЕСКИХ СОСТОЯНИЙ СОЕДИНИТЕЛЬНОЙ ТКАНИ | 1997 |
|
RU2112542C1 |
| КОНЪЮГАТ ГЛИКОПРОТЕИНА, ОБЛАДАЮЩЕГО АКТИВНОСТЬЮ ЭРИТРОПОЭТИНА, С ПРОИЗВОДНЫМИ N-ОКСИДА ПОЛИ-1,4-ЭТИЛЕНПИПЕРАЗИНА (ВАРИАНТЫ), ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ПОЛУЧЕНИЯ КОНЪЮГАТА | 2013 |
|
RU2556378C2 |
| RU 2073031 C1, 10.02.1997 | |||
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ГИАЛУРОНИДАЗУ И ЛИПОСОМЫ ДЛЯ НАРУЖНОГО ПРИМЕНЕНИЯ | 2008 |
|
RU2417097C2 |
Авторы
Даты
2017-04-17—Публикация
2015-12-04—Подача