2420-178004RU/010
ЛЕЧЕНИЕ СВЯЗАННЫХ С ГЕНОМ-СУПРЕССОРОМ ОПУХОЛЕЙ ЗАБОЛЕВАНИЙ ПОСРЕДСТВОМ ИНГИБИРОВАНИЯ ПРИРОДНОГО ТРАНСКРИПТА В
АНТИСМЫСЛОВОЙ ОРИЕНТАЦИИ ОТНОСИТЕЛЬНО ЭТОГО ГЕНА
ПЕРЕКРЕСТНАЯ ССЫЛКА
По настоящей заявке испрашивается приоритет предварительной заявки на патент США с № 61/119973, поданной 4 декабря 2008, предварительной заявки на патент США с № 61/157249, поданной 4 марта 2009, предварительной заявки на патент США с № 61/166381, поданной 3 апреля 2009, и предварительной заявки на патент США с № 61/154594, поданной 23 февраля 2009, все из которых включены в настоящее изобретение в целом посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
Варианты осуществления настоящего изобретения включают олигонуклеотиды, модулирующие экспрессию и/или функцию генов-супрессоров опухолей и связанных молекул.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Гибридизация ДНК-РНК и РНК-РНК важна во многих аспектах функционирования нуклеиновых кислот, ключающих репликацию ДНК, транскрипцию и трансляцию. Гибридизация также является важнейшей в ряде технологий, с помощью которых либо выявляют конкретную нуклеиновую кислоту, либо изменяют ее экспрессию. Антисмысловые нуклеотиды, например, нарушают экспрессию гена посредством гибридизации с РНК-мишенью, внося, тем самым, помехи в сплайсинг РНК, транскрипцию, трансляцию и репликацию. Антисмысловая ДНК обладает дополнительным свойством, заключающимся в том, что гибриды ДНК-РНК служат в качестве субстрата для расщепления рибонуклеазой H, активность которой присутствует в большинстве типов клеток. Антисмысловые молекулы можно доставить в клетки, так же, как и олигодезоксинуклеотиды (ODN), или они могут быть экспрессированы с эндогенных генов в виде молекул РНК. Недавно Управление по контролю за пищевыми продуктами и лекарственными средствами разрешило антисмысловое лекарственное средство, VITRAVENETM (для лечения вызванного цитомегаловирусом ретинита), что служит отражением того, что антисмысловая молекула обладает терапевтической эффективностью.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Это краткое изложение обеспечивается для предоставления краткого изложения настоящего изобретения, чтобы кратко выразить природу и сущность настоящего изобретения. Оно предоставляется с оговоренным условием, что оно не будет использоваться для интерпретации или ограничения объема или значения формулы настоящего изобретения.
В одном варианте осуществления настоящим изобретением обеспечиваются способы ингибирования действия природного антисмыслового транскрипта посредством использования антисмыслового олигонуклеотида(ов), нацеленного на любой участок природного антисмыслового транскрипта, что приводит к увеличению экспрессии соответствующего смыслового гена. В настоящем изобретении также предусматривается, что ингибирования природного антисмыслового транскрипта можно достичь с помощью коротких интерферирующих РНК (киРНК), рибозимов и небольших молекул, которые, как считается, находятся в пределах объема настоящего изобретения.
В одном варианте осуществления обеспечивается способ модулирования функции и/или экспрессии полинуклеотида гена-супрессора опухолей в клетках или тканях пациента in vivo или in vitro, включающий контактирование указанных клеток или тканей с антисмысловым олигонуклеотидом длиной от 5 до 30 нуклеотидов, причем указанный олигонуклеотид идентичен по последовательности по меньшей мере на 50% обратному комплементу полинуклеотида, включающего от 5 до 30 последовательных нуклеотидов в пределах нуклеотидов 1-1675 SEQ ID NO: 8, или нуклеотидов 1-518 SEQ ID NO: 9, или нуклеотидов 1-759 SEQ ID NO: 10, или нуклеотидов 1-25892 SEQ ID NO: 11, или нуклеотидов 1-279 SEQ ID NO: 12, или нуклеотидов 1-1982 SEQ ID NO: 13, или нуклеотидов 1-789 SEQ ID NO: 14, или нуклеотидов 1-467 SEQ ID NO: 15 (фиг. 5), посредством чего осуществляется модулирование функции и/или экспрессии полинуклеотида гена-супрессора опухолей в клетках или тканях пациента in vivo или in vitro.
В другом предпочтительном варианте осуществления мишенью олигонуклеотида является природная антисмысловая последовательность полинуклеотидов генов-супрессоров опухолей, например, нуклеотиды, представленные в SEQ ID NO: 8, 9, 10, 11, 12, 13, 14 или 15, или любые их варианты, аллели, гомологи, мутанты, производные, фрагменты и комплементарные им последовательности. Примеры антисмысловых олигонуклеотидов представлены как SEQ ID NO: 16-36 (фиг. 6-9).
В другом варианте осуществления обеспечивается способ модулирования функции и/или экспрессии полинуклеотида гена-
супрессора опухолей в клетках или тканях пациента in vivo или in vitro, включающий контактирование указанных клеток или тканей с антисмысловым олигонуклеотидом длиной от 5 до 30 нуклеотидов, причем указанный олигонуклеотид идентичен по последовательности по меньшей мере на 50% обратному комплементу антисмысловой последовательности полинуклеотида гена-супрессора опухолей; посредством чего осуществляется модулирование функции и/или экспрессии полинуклеотида гена-супрессора опухолей в клетках или тканях пациента in vivo или in vitro.
В другом варианте осуществления обеспечивается способ модулирования функции и/или экспрессии полинуклеотида гена-супрессора опухолей в клетках или тканях пациента in vivo или in vitro, включающий контактирование указанных клеток или тканей с антисмысловым олигонуклеотидом длиной от 5 до 30 нуклеотидов, причем указанный олигонуклеотид идентичен по последовательности по меньшей мере на 50% антисмысловому олигонуклеотиду, который связывается с антисмысловым полинуклеотидом гена-супрессора опухолей; посредством чего осуществляется модулирование функции и/или экспрессии полинуклеотида гена-супрессора опухолей в клетках или тканях пациента in vivo или in vitro.
В предпочтительном варианте осуществления композиция включает один или несколько антисмысловых олигонуклеотидов, которые связываются со смысловым и/или антисмысловым полинуклеотидами гена-супрессора опухолей.
В другом предпочтительном варианте осуществления олигонуклеотиды включают один или несколько модифицированных или замещенных нуклеотидов.
В другом предпочтительном варианте осуществления олигонуклеотиды включают одну или несколько модифицированных связей.
В еще одном варианте осуществления модифицированные нуклеотиды включают модифицированные основания, включающие фосфоротиоат, метилфосфонат, пептидонуклеиновые кислоты, 2'-O-метил, фтор или углерод, метилен или другие молекулы замкнутых нуклеиновых кислот (LNA). Предпочтительно модифицированными нуклеотидами являются молекулы замкнутых нуклеиновых кислот, включая α-L-LNA.
В другом предпочтительном варианте осуществления олигонуклеотиды вводят пациенту подкожно, внутримышечно, внутривенно или внутрибрюшинно.
В другом предпочтительном варианте осуществления олигонуклеотиды вводят в фармацевтической композиции. Схема лечения включает по меньшей мере однократное введение антисмысловых соединений пациенту; однако это лечение может быть изменено с включением многократных доз в течение периода времени. Лечение может быть скомбинировано с одним или несколькими другими типами терапий.
В другом предпочтительном варианте осуществления олигонуклеотиды включены в липосому или присоединены к молекуле носителя (например, холестерину, пептиду TAT).
В одном варианте осуществления обеспечивается способ модулирования функции и/или экспрессии полинуклеотида гена-супрессора опухолей в клетках или тканях пациента in vivo или in vitro, включающий контактирование указанных клеток или тканей с по меньшей мере одним антисмысловым олигонуклеотидом длиной от 5 до 30 нуклеотидов, причем указанный по меньшей мере один олигонуклеотид идентичен по последовательности по меньшей мере на 50% обратному комплементу природной антисмысловой последовательности полинуклеотида гена-супрессора опухолей; посредством чего осуществляется модулирование функции и/или экспрессии полинуклеотида гена-супрессора опухолей в клетках или тканях пациента in vivo или in vitro.
В другом варианте осуществления обеспечивается способ модулирования функции и/или экспрессии полинуклеотида гена-супрессора опухолей в клетках или тканях пациента in vivo или in vitro, включающий контактирование указанных клеток или тканей с антисмысловым олигонуклеотидом длиной от 5 до 30 нуклеотидов, причем указанный олигонуклеотид идентичен по последовательности по меньшей мере на 50% антисмысловому олигонуклеотиду, который связывается с полинуклеотидом гена-супрессора опухолей; посредством чего осуществляется модулирование функции и/или экспрессии полинуклеотида гена-супрессора опухолей в клетках или тканях пациента in vivo или in vitro.
В другом варианте осуществления обеспечивается способ модулирования функции и/или экспрессии полинуклеотида гена-супрессора опухолей в клетках или тканях пациента in vivo или in vitro, включающий контактирование указанных клеток или тканей с по меньшей мере одним антисмысловым олигонуклеотидом, мишенью которого является участок природной антисмысловой последовательности полинуклеотида гена-супрессора опухолей, посредством чего осуществляется модулирование функции и/или экспрессии полинуклеотида гена-супрессора опухолей в клетках или тканях пациента in vivo или in vitro.
В варианте осуществления функции и/или экспрессии полинуклеотида гена-супрессора опухолей увеличивается in vivo или in vitro относительно контроля.
В другом варианте осуществления мишенью по меньшей мере одного антисмыслового олигонуклеотида является природная антисмысловая последовательность полинуклеотида гена-супрессора опухолей.
В варианте осуществления мишенью по меньшей мере одного антисмыслового олигонуклеотида является последовательность нуклеиновой кислоты, включающая кодирующие и/или не кодирующие нуклеотидные последовательности полинуклеотида гена-супрессора опухолей.
В варианте осуществления мишенью по меньшей мере одного антисмыслового олигонуклеотида являются перекрывающиеся и/или не перекрывающиеся последовательности полинуклеотида гена-супрессора опухолей.
В конкретном варианте осуществления по меньшей мере один антисмысловый олигонуклеотид включает одну или несколько модификаций, выбираемых из по меньшей мере одной модифицированной молекулы сахара, по меньшей мере одной модифицированной межнуклеозидной связи, по меньшей мере одного модифицированного нуклеотида и их комбинаций.
В связанном варианте осуществления одна или несколько модификаций включают по меньшей мере одну модифицированную молекулу сахара, выбираемую из 2'-O-метоксиэтил-модифицированной молекулы сахара, 2'-метокси-модифицированной молекулы сахара, 2'-О-алкил-модифицированной молекулы сахара, модифицированной молекулы в виде бициклического сахара и их комбинаций.
В другом варианте осуществления одна или несколько модификаций включают по меньшей мере одну модифицированную межнуклеозидную связь, выбираемую из фосфоротиоата, 2'-О-метоксиэтила (МОЕ), 2'-фтора, алкилфосфоната, фосфородитиоата, алкилфосфонотиоата, фосфорамидата, карбамата, карбоната, триэфира фосфорной кислоты, ацетамидата, карбоксиметилового эфира и их комбинаций.
В варианте осуществления одна или несколько модификаций включают по меньшей мере один модифицированный нуклеотид, выбираемый из пептидонуклеиновой кислоты (ПНК), замкнутой нуклеиновой кислоты (LNA), арабинонуклеиновой кислоты (FANA), их аналога, производного и комбинаций.
В другом варианте осуществления по меньшей мере один олигонуклеотид включает по меньшей мере одну из последовательностей олигонуклеотидов, представленных как SEQ ID NO: 16-36.
Настоящим изобретением также обеспечивается способ модулирования функции и/или экспрессии гена-супрессора опухолей в клетках или тканях млекопитающих in vivo или in vitro, включающий контактирование указанных клеток или тканей с по меньшей мере одним олигонуклеотидом короткой интерферирующей РНК (киРНК) длиной от 5 до 30 нуклеотидов, являющейся специфичной в отношении антисмыслового полинуклеотида гена-супрессора опухолей, причем указанный олигонуклеотид идентичен по
последовательности по меньшей мере на 50% комплементарной последовательности из по меньшей мере приблизительно пяти последовательных нуклеиновых кислот антисмысловой и/или смысловой молекулы нуклеиновой кислоты полинуклеотида гена-супрессора опухолей; и модулирование функции и/или экспрессии гена-супрессора опухолей в клетках или тканях млекопитающих in vivo или in vitro.
В варианте осуществления олигонуклеотид идентичен по последовательности по меньшей мере на 80% комплементарной последовательности из по меньшей мере приблизительно пяти последовательных нуклеиновых кислот антисмысловой и/или смысловой молекулы нуклеиновой кислоты полинуклеотида гена-супрессора опухолей.
В другом варианте осуществления обеспечивается способ модулирования функции и/или экспрессии гена-супрессора опухолей в клетках или тканях млекопитающего in vivo или in vitro, включающий контактирование указанных клеток или тканей с по меньшей мере одним антисмысловым олигонуклеотидом длиной от 5 до 3 0 нуклеотидов, специфичным в отношении некодирующей и/или кодирующей последовательностей смысловой и/или природной антисмысловой цепи полинуклеотида гена-супрессора опухолей, причем указанный по меньшей мере один олигонуклеотид идентичен по последовательности по меньшей мере на 50% по меньшей мере одной последовательности нуклеиновой кислоты, представленной как SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 и 15; и модулирование функции и/или экспрессии гена-супрессора опухолей в клетках или тканях млекопитающего in vivo или in vitro.
В одном варианте осуществления обеспечивается синтетический, модифицированный олигонуклеотид, включающий по меньшей мере одну модификацию, причем по меньшей мере одну модификацию выбирают из по меньшей мере одной модифицированной молекулы сахара, по меньшей мере одной модифицированной межнуклеотидной связи, по меньшей мере одного модифицированного нуклеотида и их комбинаций; а, кроме того, указанный олигонуклеотид является антисмысловым соединением, которое гибридизуется с полинуклеотидом гена-супрессора опухолей и модулирует его экспрессию и/или функцию in vivo или in vitro по сравнению с нормальным контролем.
В варианте осуществления по меньшей мере одна модификация включает межнуклеотидную связь, выбираемую из группы, состоящей из фосфоротиоата, алкилфосфоната, фосфородитиоата, алкилфосфонотиоата, фосфорамидата, карбамата, карбоната, триэфира фосфорной кислоты, ацетамидата, карбоксиметилового эфира и их комбинаций.
В другом варианте осуществления олигонуклеотид включает по меньшей мере одну фосфоротиоатную межнуклеотидную связь.
В связанном варианте осуществления олигонуклеотид включает остов из фосфоротиоатных межнуклеотидных связей.
В варианте осуществления олигонуклеотид включает по меньшей мере один модифицированный нуклеотид, выбираемый из пептидонуклеиновой кислоты, замкнутой нуклеиновой кислоты (LNA), их аналога, производного и комбинации.
В другом варианте осуществления олигонуклеотид включает множество модификаций, причем указанные модификации включают межнуклеотидные связи, выбираемые из фосфоротиоата, алкилфосфоната, фосфородитиоата, алкилфосфонотиоата, фосфорамидата, карбамата, карбоната, триэфира фосфорной кислоты, ацетамидата, карбоксиметилового эфира и их комбинации.
В варианте осуществления олигонуклеотид включает множество модификаций, причем указанные модификации включают модифицированные нуклеотиды, выбираемые из пептидонуклеиновых кислот, замкнутых нуклеиновых кислот (LNA), их аналогов, производных и комбинации.
В другом варианте осуществления олигонуклеотид включает по меньшей мере одну модифицированную молекулу сахара, выбираемую из 2'-O-метоксиэтил-модифицированной молекулы сахара, 2'-метокси-модифицированной молекулы сахара, 2'-O-алкил-модифицированной молекулы сахара, модифицированной молекулы в виде бициклического сахара и их комбинаций.
В другом варианте осуществления олигонуклеотид включает множество модификаций, причем указанные модификации включают модифицированные молекулы сахара, выбираемые из 2'-O-метоксиэтил-модифицированной молекулы сахара, 2'-метокси-модифицированной молекулы сахара, 2'-O-алкил-модифицированной молекулы сахара, модифицированной молекулы в виде бициклического сахара и их комбинации.
В другом варианте осуществления длина олигонуклеотида составляет по меньшей мере приблизительно 5-30 нуклеотидов, и он гибридизуется с антисмысловой и/или смысловой цепью полинуклеотида гена-супрессора опухолей, причем указанный олигонуклеотид идентичен по последовательности по меньшей мере приблизительно на 20% комплементарной последовательности по меньшей мере из приблизительно пяти последовательных нуклеиновых кислот антисмысловой и/или смысловой кодирующей и/или некодирующей последовательностей нуклеиновых кислот полинуклеотида гена-супрессора опухолей.
В другом варианте осуществления олигонуклеотид идентичен по последовательности по меньшей мере приблизительно на 80% комплементарной последовательности по меньшей мере приблизительно из пяти последовательных нуклеиновых кислот антисмысловой и/или смысловой кодирующей и/или некодирующей последовательностей нуклеиновых кислот полинуклеотида гена-супрессора опухолей.
В другом варианте осуществления указанный олигонуклеотид гибридизуется с по меньшей мере одним полинуклеотидом гена-супрессора опухолей и модулирует его экспрессию и/или функцию in vivo или in vitro, по сравнению с нормальным контролем.
В варианте осуществления олигонуклеотид включает одну из последовательностей, представленных как SEQ ID NO: 16-36.
Настоящим изобретением, кроме того, обеспечивается композиция, включающая один или несколько олигонуклеотидов, специфичных в отношении одного или нескольких полинуклеотидов генов-супрессоров опухолей, при этом указанные полинуклеотиды включают антисмысловые последовательности, комплементарные последовательности, аллели, гомологи, изоформы, варианты, производные, мутанты, фрагменты или их комбинации.
В определенном варианте осуществления олигонуклеотиды
идентичны по последовательности по меньшей мере приблизительно на 40% по сравнению с любой из нуклеотидных последовательностей, представленных как SEQ ID NO: 16-36.
В варианте осуществления один или несколько олигонуклеотидов включают любую из нуклеотидных последовательностей, представленных как SEQ ID NO: 16-36.
В другом варианте осуществления олигонуклеотиды, представленные как SEQ ID NO: 16-36, включают одну или несколько модификаций или замен нуклеотидов.
В другом варианте осуществления одну или несколько модификаций выбирают из фосфоротиоата, метилфосфоната, пептидонуклеиновой кислоты, молекул замкнутых нуклеиновых кислот (LNA) и их комбинаций.
В варианте осуществления настоящего изобретения обеспечивается способ профилактики или лечения заболевания, связанного с по меньшей мере одним полинуклеотидом гена-супрессора опухолей и/или по меньшей мере одним кодируемым им продуктом, включающий введение пациенту терапевтически эффективной дозы по меньшей мере одного антисмыслового олигонуклеотида, который связывается с природной антисмысловой последовательностью указанного по меньшей мере одного полинуклеотида гена-супрессора опухолей и модулирует экспрессию указанного по меньшей мере одного полинуклеотида гена-супрессора опухолей; посредством чего осуществляется предупреждение или лечение заболевания, связанного с по меньшей мере одним полинуклеотидом гена-супрессора опухолей и/или по меньшей мере одним кодируемым им продуктом.
В определенном варианте осуществления заболевание, связанное с по меньшей мере одним полинуклеотидом гена-супрессора опухолей, выбирают из заболевания, связанного со сниженным или повышенным апоптозом, старения тканей/клеток, рака (в том числе злокачественных опухолей, приведенных в таблице 1), аутоиммунного заболевания, болезни иммунодефицита, включающей СПИД, физиологического старения, нейродегенеративного заболевания или нарушения (например, болезни Альцгеймера, атаксии-телеангиэктазии, болезни Паркинсона, бокового амиотрофического склероза, болезни Хантингтона и т.д.), гиперпластического заболевания (например, келоида), ревматоидного артрита, коронарной болезни сердца, ишемической гибели клеток, лимфопролиферативного нарушения, атеросклероза, остеопороза, миелодиспластического синдрома, вызванного токсином заболевания, вирусной инфекции, заживления раны, болезни Каудена (CD), болезни Лермитта-Дуклоса (LDD), синдрома Баннайана-Зонана (BZS, также известного как синдром Баннайана-Райли-Рувалкаба, синдром Рувалкаба-Мири-Смита и синдром Райли-Смита), трансплантации, связанного с апоптозом заболевания или нарушения, болезни обмена веществ или метаболического состояния (например, диабета), болезней или нарушений почки, инфаркта миокарда/сердечной недостаточности, ишемии, сепсиса, воспалительного заболевания, при котором преобладают конкретные гемопоэтические клетки, пролиферативного заболевания или заболевания или нарушения, в случае которого примером терапии является лечение воспалительного заболевания через увеличение апоптоза.
В варианте осуществления обеспечивается способ идентификации и отбора по меньшей мере одного олигонуклеотида для in vivo введения, включающий отбор полинуклеотида-мишени, связанного с болезненным состоянием; идентификацию по меньшей мере одного олигонуклеотида, включающего по меньшей мере пять последовательных нуклеотидов, которые комплементарны выбранному полинуклеотиду-мишени или находятся в антисмысловой ориентации относительно него; измерение температурной точки плавления гибрида антисмыслового олигонуклеотида и полинуклеотида-мишени в жестких условиях гибридизации и отбор по меньшей мере одного олигонуклеотида для in vivo введения на основе полученной информации.
Другие аспекты описываются ниже.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1:
Фиг. 1А и 1В являются диаграммой результатов ПЦР в режиме реального времени, на которой демонстрируется кратность изменения в мРНК ТР73 после обработки клеток HepG2 олигонуклеотидами с фосфоротиоатными связями, вводимыми с использованием липофектамина 2000, по сравнению с контролем. Результаты ПЦР в режиме реального времени показывают, что уровни мРНК р73 в клетках HepG2 значительно увеличиваются через 48 ч после обработки одним из олигонуклеотидов, разработанных против p73as (фиг. 1А). В тех же образцах уровни РНК p73as значительно снижались после обработки олигонуклеотидами против p73as (Fig. 1B). Столбцы, обозначенные как oligo 1, oligo 2 и oligo 3, соответствуют образцам, обработанным SEQ ID NO: 16, 17 и 18,
соответственно.
Фиг. 1С является диаграммой результатов ПЦР в режиме реального времени, на которой демонстрируется кратность изменения + среднеквадратическое отклонение в мРНК ТР73 после обработки клеток HepG2 олигонуклеотидами в виде киРНК, вводимыми с использованием липофектамина 2000, по сравнению с контролем. Результаты ПЦР в режиме реального времени показывают, что уровни мРНК р73 в клетках HepG2 значительно увеличиваются через 48 ч после обработки двумя из олигонуклеотидов, разработанных против антисмыслового полинуклеотида р73, Hs.668503 и одним из олигонуклеотидов, разработанных против антисмыслового
полинуклеотида р73, Hs.674463. Столбцы, обозначенные как as р73 Hs.668503_l, р73 Hs.668503_2, р73 Hs.674463_1 и р73 Hs.674463_2, соответствуют образцам, обработанным SEQ ID NO: 19, 20, 21 и 22, соответственно.
Фиг. 1D является диаграммой результатов ПЦР в режиме реального времени, на которой демонстрируется кратность изменения + среднеквадратическое отклонение в мРНК ТР73 после обработки клеток ТМ4 олигонуклеотидами с фосфоротиоатными связями, вводимыми с использованием липофектамина 2000, по сравнению с контролем. Результаты ПЦР в режиме реального времени показывают, что уровни мРНК р73 в мышиных клетках ТМ4 значительно увеличиваются через 48 ч после обработки одним из олигонуклеотидов, разработанных против антисмыслового полинуклеотида мышиного р73, Hs.668503 и одним из олигонуклеотидов, разработанных против антисмыслового полинуклеотида мышиного р73, WDR8. Столбцы, обозначенные как р73
мыши Hs.668503_1, р73 мыши Hs.668503_10, р73 мыши Hs.668503_14, р73 мыши Hs.668503_15, р73 мыши WDr8_1, р73 мыши WDr8_7, р73 мыши WDr8_8 и р73 мыши WDr8_3, соответствуют образцам, обработанным SEQ ID NO: 23-30, соответственно.
Фиг. 2 является диаграммой результатов ПЦР в режиме реального времени, на которой демонстрируется кратность изменения в мРНК р53 после обработки клеток HUVEC олигонуклеотидами с фосфоротиоатными связями, вводимыми с использованием липофектамина 2000, по сравнению с контролем. Результаты ПЦР в режиме реального времени показывают, что уровни мРНК р53 в клетках HUVEC значительно увеличиваются через 48 ч после обработки всеми из киРНК, разработанных против p53as (oligo1 Р=0,003, oligo2 Р=0,001 и oligo2 Р=0,03). Столбцы, обозначенные как oligo1, oligo2 и oligo3, соответствуют образцам, обработанным SEQ ID NO: 31, 32 и 33 соответственно.
Фиг. 3 является диаграммой результатов ПЦР в режиме реального времени, на которой демонстрируется кратность изменения в мРНК PTEN после обработки клеток HepG2 олигонуклеотидами с фосфоротиоатными связями, вводимыми с использованием липофектамина 2000, по сравнению с контролем. Результаты ПЦР в режиме реального времени показывают, что уровни мРНК PTEN в клетках HepG значительно увеличиваются через 48 ч после обработки одним из олигонуклеотидов, разработанных против антисмыслового полинуклеотида PTEN, Hs.624903. Столбцы, обозначенные как PTEN Hs.607931_2, PTEN Hs.624903_2, PTEN Hs.624903_3, соответствуют образцам, обработанным SEQ ID NO: 34, 35 и 36, соответственно.
На фиг. 4 представлены:
SEQ ID NO: 1: вариант 1 транскрипта с гена-супрессора опухолей (ТР73) Homo sapiens, мРНК (входящий №в NCBI: NM_005427.2)
SEQ ID NO: 2 демонстрирует геномную последовательность р73 (экзоны отображены заглавными буквами, интроны - строчными буквами).
SEQ ID NO: 3 демонстрирует мышиную геномную последовательность р73 (экзоны отображены заглавными буквами, интроны - строчными буквами).
SEQ ID NO: 4: опухолевый белок р53 (ТР53) Homo sapiens, вариант 1 транскрипта, мРНК (входящий №в NCBI: NM_000546.4)
SEQ ID NO: 5 демонстрирует геномную последовательность р53 (экзоны отображены заглавными буквами, интроны - строчными буквами).
SEQ ID NO: 6: фосфатаза и гомолог тенсина (PTEN) Homo sapiens, мРНК (входящий № в NCBI: NM_000314).
SEQ ID NO: 7 демонстрирует геномную последовательность PTEN (экзоны отображены заглавными буквами, интроны - строчными буквами).
На фиг. 5 представлены:
SEQ ID NO: 8: природная антисмысловая последовательность p73as (входящий № в NCBI: NM_017818.2)
SEQ ID NO: 9: природная антисмысловая последовательность р73: Hs.668503.
SEQ ID NO: 10: природная антисмысловая последовательность р73: Hs.674463
SEQ ID NO: 11: мышиная природная антисмысловая последовательность р73
SEQ ID NO: 12: мышиная природная антисмысловая последовательность р73: Hs.668503 (Совпадающие основания в последовательности кДНК и геномной последовательности указаны заглавными буквами.)
SEQ ID NO: 13: природная антисмысловая последовательность р53 (входящий №в NCBI: NM_018081.2)
SEQ ID NO: 14: природная антисмысловая последовательность PTEN (Hs.624903)
SEQ ID NO: 15: природная антисмысловая последовательность PTEN (Hs.607931)
На фиг. 6 представлены антисмысловые олигонуклеотиды, SEQ ID NO: 16-22. 'r' означает РНК, a * означает фосфотиоатную связь.
На фиг. 7 представлены антисмысловые олигонуклеотиды, SEQ ID NO: 23-30. * означает фосфотиоатную связь.
На фиг. 8 представлены р53-антисмысловые олигонуклеотиды, связывающиеся с природной антисмысловой последовательностью NM_18081, SEQ ID NO: 31-33.
На фиг. 9 представлены PTEN-антисмысловые олигонуклеотиды, связывающиеся с природной антисмысловой последовательностью Hs.624903 и Hs.607931, SEQ ID NO: 34-36. 'r' означает РНК.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Несколько аспектов настоящего изобретения описываются ниже со ссылкой на примерные применения ради иллюстрации. Следует понимать, что многочисленные конкретные элементы, взаимосвязи и способы изложены для обеспечения полного понимания настоящего изобретения. Однако специалист со средним уровнем компетентности в релевантной области техники без труда поймет, что настоящее изобретение может быть осуществлено на практике без одного или нескольких конкретных элементов или с использованием других способов. Настоящее изобретение не ограничивается порядком действий или событий, поскольку некоторые действия могут происходить в отличных порядках и/или одновременно с другими действиями или событиями. Кроме того, не все проиллюстрированные действия или события требуются для реализации методологии в соответствии с настоящим изобретением.
Предполагается, что все гены, названия генов и продукты генов, описываемые здесь, соответствуют гомологам из любого вида, для которого применимы описываемые здесь композиции и способы. Таким образом, термины включают, но без ограничения, гены и продукты генов людей и мышей. Понятно, что, когда описывается ген или продукт гена конкретного вида, это описание, как предполагается, приводится лишь в качестве примера и не должно интерпретироваться как ограничение, если контекст, в котором оно обнаруживается, однозначно не свидетельствует об ином. Таким образом, например, в случае описываемых здесь генов, которые в некоторых вариантах осуществления относятся к нуклеотидным и аминокислотным последовательностям млекопитающих, они, как предполагается, охватывают гомологичные и/или ортологичные гены и продукты генов из других животных, включающих, но без ограничения, других млекопитающих, рыбу, земноводных, рептилий и птиц. В предпочтительных вариантах осуществления гены или последовательности нуклеиновых кислот являются человеческими.
Определения
Используемая здесь терминология предназначена лишь для описания конкретных вариантов осуществления и, как предполагается, не является ограничивающей настоящее изобретением. Предполагается, что используемые здесь формы единственного числа «a», «an» и «the» включают также формы множественного числа, если контекст однозначно не свидетельствует об ином. Кроме того, в тех случаях, когда термины «включающий», «включает», «имеющий», «имеет», «с» или их варианты используются или в подробном описании изобретения, или/и формуле изобретения, такие термины, как предполагается, являются включающими подобным термину «включающий» образом.
Термин «приблизительно» или «примерно» означает в пределах приемлемого диапазона ошибки для конкретного числа, определяемого специалистом со средним уровнем компетентности в данной области техники, который будет зависеть частично от того, каким образом измеряют или определяют число, т.е. от ограничений системы измерения. Например, «приблизительно» может означать в пределах 1 или более 1 среднеквадратического отклонения, в соответствии с практикой в данной области техники. Альтернативно, «приблизительно» может означать диапазон, составляющий вплоть до 20%, предпочтительно вплоть до 10%, более предпочтительно вплоть до 5% и все еще более предпочтительно вплоть до 1% от конкретного числа. Альтернативно, особенно относительно биологических систем или процессов, термин может означать в пределах порядка величины, предпочтительно 5-кратного и более предпочтительно 2-кратного, числа. Если конкретные числа приведены в описании изобретения и формуле изобретения, следует считать термин «приблизительно» означающим в пределах приемлемого диапазона ошибки для конкретного числа, кроме особо оговоренных случаев.
Используемый здесь термин «мРНК» означает известный в настоящее время транскрипт(ы) в виде мРНК целевого гена и любые дополнительные транскрипты, которые могут быть выявлены.
Под «антисмысловыми олигонуклеотидами» или «антисмысловым соединением» подразумевается молекула РНК или ДНК, которая связывается с другой РНК или ДНК (РНК-, ДНК-мишенью). Например, если он представляет собой олигонуклеотид в виде РНК, он связывается с другой РНК-мишенью посредством РНК-РНК взаимодействий и изменяет активность РНК-мишени (Eguchi et al, (1991) Ann. Rev. Biochem. 60, 631-652). Антисмысловой олигонуклеотид может повышать или понижать экспрессию и/или функцию конкретного полинуклеотида. Подразумевается, что это определение включает любую чужеродную молекулу РНК или ДНК, которая полезна в терапевтическом, диагностическом или другом разрезе. Такие молекулы включают, например, антисмысловые молекулы РНК или ДНК, РНК, участвующие в интерференции (РНК- интерференции), микроРНК, молекулы РНК-ловушек, киРНК, ферментативные РНК, терапевтические корректирующие РНК и РНК-агонист и -антагонист, антисмысловые олигомерные соединения, антисмысловые олигонуклеотиды, олигонуклеотиды внешних вспомогательных последовательностей (EGS), продукты альтернативного сплайсинга, праймеры, зонды и другие олигомерные соединения, которые гибридизуются с по меньшей мере частью нуклеиновой кислоты-мишени. Как таковые, эти соединения могут вводиться в форме одноцепочечных, двухцепочечных, частично одноцепочечных или кольцевых олигомерных соединений.
В контексте этого изобретения термин «олигонуклеотид» относится к олигомеру или полимеру рибонуклеиновой кислоты (РНК) или дезоксирибонуклеиновой кислоты (ДНК), или их миметиков. Термин «олигонуклеотид» также включает линейные или кольцевые олигомеры природных и/или модифицированных мономеров или связей, включающих дезоксирибонуклеозиды, рибонуклеозиды, их замещенные и альфа-аномерные формы, пептидонуклеиновые кислоты (ПНК), закрытые нуклеиновые кислоты (LNA), фосфоротиоат, метилфосфонат и т.п. Олигонуклеотиды способны к специфическому связыванию с полинуклеотидом-мишенью через посредство обычного характера взаимодействий мономера с мономером, такого как тип спаривания основания Уотсона-Крика, хугстиновский (Hoogsteen) или обратный Hoogsteen типы спаривания оснований, или т.п.
Олигонуклеотид может быть «химерным», т.е. состоять из различных участков. В контексте этого изобретения «химерные соединения» представляют собой олигонуклеотиды, которые содержат два или более химических участков, например, участок (участки) ДНК, участок (участки) РНК, участок (участки) ПНК и т.д. Каждый химический участок состоит из по меньшей мере одной мономерной единицы, т.е. нуклеотида в случае олигонуклеотидов. Эти олигонуклеотиды типично включают по меньшей мере один участок, в котором олигонуклеотид модифицирован для проявления одного или нескольких желательных свойств. Желательные свойства олигонуклеотида включают, но без ограничения, например, повышенную устойчивость к деградации нуклеазами, увеличенное поступление в клетку и/или повышенное сродство связывания с нуклеиновой кислотой-мишенью. Следовательно, различные участки олигонуклеотида могут обладать различными свойствами. Химерные олигонуклеотиды настоящего изобретения могут быть образованы в виде смешанных структур двух или более олигонуклеотидов, модифицированных олигонуклеотидов, олигонуклеозидов и/или аналогов олигонуклеотидов, описанных выше.
Олигонуклеотид может состоять из участков, которые могут быть соединены в «список», т.е. когда мономеры связаны последовательно, как в природной ДНК, или соединены через спейсеры. Предполагается, что спейсеры являются ковалентным «мостиком» между участками и имеют в предпочтительных случаях длину, не превышающую приблизительно 100 атомов углерода. Спейсеры, являющиеся липофильными, индуцирующими особые вторичные структуры, вроде, например, содержащих аланин пептидов, индуцирующих альфа-спирали, могут нести различные функциональные свойства, например, имея положительный или отрицательный заряд, несут особые свойства связывания с нуклеиновыми кислотами (интеркаляторов, связующих элементов бороздок, токсинов, флуорофоров и т.д.).
Как здесь используется, «ген-супрессор опухолей» охватывает все члены семейства, мутанты, аллели, фрагменты, разновидности, кодирующие и некодирующие последовательности, смысловую и антисмысловую полинуклеотидные цепи и т.д.
Как здесь используются, слова опухолевый белок 73, p73, TP73 используются взаимозаменяемо в настоящей заявке.
Как здесь используются, слова TRP53, белок-супрессор опухолей p53, p53, антиген NY-CO-13 Р53, клеточный опухолевый антиген p53, FLJ92943, LFS1 и фосфопротеин p53 используются взаимозаменяемо в настоящей заявке.
Как здесь используются, слова PTEN, 10q23del, BZS, MGC11227, MHAM, MMAC1, мутированный во множестве злокачественных опухолей на поздней стадии белок 1, фосфатаза и гомолог тенсина, фосфатидилинозит-3,4,5-трифосфат-3-фосфатаза и белок фосфатаза с двойной специфичностью PTEN, PTEN1, TEP1 используются взаимозаменяемо в настоящей заявке.
Используемый здесь термин «олигонуклеотид, специфичный в отношении» или «олигонуклеотид, мишенью которого является» относится к олигонуклеотиду, имеющему последовательность, (i) способную к образованию стабильного комплекса с частью целевого гена или (ii) способную к образованию стабильного дуплекса с частью транскрипта в виде мРНК целевого гена. Стабильность комплексов и дуплексов можно определить с помощью теоретических расчетов и/или in vitro исследований. Приводимые в качестве примеров исследования для определения стабильности образуемых при гибридизации комплексов и дуплексов описаны в примерах ниже.
Используемый здесь термин «нуклеиновая кислота-мишень» охватывает ДНК, РНК (включающую премРНК и мРНК), транскрибируемую с такой ДНК, а также кДНК, получаемую на основе такой РНК, кодирующие, некодирующие последовательности, смысловые или антисмысловые полинуклеотиды. Специфическая гибридизация олигомерного соединения со своей мишенью-нуклеиновой кислотой вносит помехи в нормальное функционирование нуклеиновой кислоты. Эту модуляцию функции нуклеиновой кислоты-мишени соединениями, которые специфически гибридизуются с ней, обычно называют «антисмысловой». Функции ДНК, в которые вносятся помехи, включают, например, репликацию и транскрипцию. Функции РНК, в которые вносятся помехи, включают все необходимые для жизни функции, такие как, например, транслокация РНК в сайт трансляции белка, трансляция белка с РНК, сплайсинг РНК для производства одной или нескольких разновидностей мРНК, и каталитическую активность, в которую может быть привлечена РНК или которой способствует РНК. Общим эффектом такого внесение помех в функционирование нуклеиновой кислоты-мишени является модуляция экспрессии кодируемого продукта или олигонуклеотидов.
РНК-интерференция опосредуется молекулами двухцепочечных РНК (дцРНК), которые гомологичны по последовательности последовательностям своих «мишеней» - нуклеиновых кислот (Caplen, N.J., et al. (2001) Proc. Natl. Acad. Sci. USA 98: 9742-9747). В определенных вариантах осуществления настоящего изобретения медиаторами являются дуплексы «коротких интерферирующих» РНК (киРНК) длиной 5-25 нуклеотидов. киРНК получаются в результате процессирования дцРНК под действием фермента РНКазы, известного как дайсер (Bernstein, E., et al. (2001) Nature 409: 363-366). Продукты в виде дуплексов киРНК привлекаются в мультибелковые-киРНК комплексы, называемые RISC (индуцированный РНК комплекс сайленсинга). Не желая ограничиваться какой-либо конкретной теорией, при этом полагают, что RISC направляется к нуклеиновой кислоте-мишени (подходяще, мРНК), где дуплекс киРНК взаимодействует специфическим в отношении последовательности образом с опосредованием расщепления каталитическим образом (Bernstein, E., et al. (2001) Nature 409: 363-366; Boutla, A., et al. (2001) Curr. Biol. 11: 1776-1780). Короткие интерферирующие РНК, которые могут использоваться в соответствии с настоящим изобретением, можно синтезировать и использовать согласно процедурам, которые широко известны в данной области техники и которые давно известны специалисту со средним уровнем компетентности. Подходяще, когда короткие интерферирующие РНК для использования в способах настоящего изобретения включают от приблизительно 1 до приблизительно 50 нуклеотидов. В примерах не ограничивающих вариантов осуществления киРНК могут включать от приблизительно 5 до приблизительно 40 нуклеотидов, от приблизительно 5 до приблизительно 30 нуклеотидов, от приблизительно 10 до приблизительно 30 нуклеотидов, от приблизительно 15 до приблизительно 25 нуклеотидов или приблизительно 20-25 нуклеотидов.
Выбор подходящих олигонуклеотидов облегчается посредством использования компьютерных программ, которые автоматически совмещают последовательности нуклеиновых кислот и показывают участки идентичности или гомологии. Такие программы используются для сравнения последовательностей нуклеиновых кислот, полученных, например, посредством исследования баз данных, таких как GenBank, или посредством секвенирования продуктов ПЦР. Сравнение последовательностей нуклеиновых кислот из ряда видов позволяет отобрать последовательности нуклеиновых кислот, которые демонстрируют подходящую степень идентичности между видами. В случае генов, которые не были секвенированы, выполняют блоттинги по Саузерну для того, чтобы сделать возможным определение степени идентичности между генами в целевом виде и другом виде. Посредством выполнения блоттингов по Саузерну при изменяющихся степенях жесткости, как хорошо известно в данной области техники, можно получить приближенный показатель идентичности. Эти процедуры позволяют отобрать олигонуклеотиды, которые проявляют высокую степень комплементарности последовательностям нуклеиновых кислот-мишеней у субъекта, который должен подвергаться контролю, и более низкую степень комплементарности соответствующим последовательностям нуклеиновых кислот у другого вида. Квалифицированный в данной области техники специалист поймет, что существует значительная широта в выборе подходящих участков генов для использования в настоящем изобретении.
Под «ферментативной РНК» подразумевается молекула РНК с ферментативной активностью (Cech, (1988) J. American. Med. Assoc. 260, 3030-3035). Ферментативные нуклеиновые кислоты (рибозимы) действует посредством сначала связывания с РНК-мишенью. Такое связывание имеет место благодаря связывающей мишень части ферментативной нуклеиновой кислоты, которая удерживается в непосредственной близости от ферментативной части молекулы, которая действует с расщеплением РНК-мишени. Таким образом, ферментативная нуклеиновая кислота сначала распознает, а затем связывает РНК-мишень благодаря спариванию оснований, а после связывания в правильном сайте действует ферментативно с разрезанием РНК-мишени.
Под «РНК-ловушкой» подразумевается молекула РНК, которая имитирует природный домен связывания лиганда. Поэтому РНК-ловушка конкурирует с природной связывающей мишенью за связывание специфического лиганда. Например, было установлено, что при сверхпредставленности реакции трансактивации (TAR) у ВИЧ РНК может действовать в качестве «ловушки» и эффективно связывает белок tat ВИЧ, препятствуя, тем самым, его связыванию с последовательностями TAR, кодируемыми в РНК ВИЧ (Sullenger et al. (1990) Cell, 63, 601-608). Подразумевается, что это является конкретным примером. Специалистам в данной области техники будет понятно, что он не является одним примером, и другие варианты осуществления могут быть без труда созданы с использованием общеизвестных в данной области техники методов.
Используемый здесь термин «мономеры» обычно означает мономеры, связанные фосфодиэфирными связями или их аналогами с образованием олигонуклеотидов, размер которых колеблется от небольшого числа мономерных единиц, например, приблизительно 3-4, до приблизительно нескольких сотен мономерных единиц. Аналоги фосфодиэфирных связей включают фосфоротиоат, фосфородитиоат, метилфосфонаты, фосфороселеноат, фосфорамидат и т.п., подробнее описываемые ниже.
Термин «нуклеотид» охватывает встречающиеся в природе нуклеотиды, а также не встречающиеся в природе нуклеотиды. Квалифицированному в данной области техники специалисту должно быть понятно, что различные нуклеотиды, которые ранее считались «не встречающимися в природе», были впоследствии обнаружены в природе. Таким образом, «нуклеотид» включает не только известные содержащие гетероциклы пурины и пиримидины молекулы, но также их гетероциклические аналоги и таутомеры. Иллюстративными примерами других типов нуклеотидов являются молекулы, содержащие аденин, гуанин, тимин, цитозин, урацил, пурин, ксантин, диаминопурин, 8-оксо-N6-метиладенин, 7-деазаксантин, 7-деазагуанин, N4,N4-этаноцитозин, N6,N6-этано-2,6-диаминопурин, 5-метилцитозин, 5-(C3-C6)-алкинилцитозин, 5-фторурацил, 5-бромурацил, псевдоизоцитозин, 2-гидрокси-5-метил-4-триазолопиридин, изоцитозин, изогуанин, инозин, и «не встречающиеся в природе» нуклеотиды, описанные Benner и др. в патенте США № 5432272. Предполагается, что термин «нуклеотид» охватывает каждый и все из этих примеров, а также их аналоги и таутомеры. Нуклеотиды, содержащие аденин, гуанин, тимин, цитозин и урацил, которые считаются встречающимися в природе нуклеотидами, являются вызывающими особый интерес нуклеотидами в связи с терапевтическим и диагностическим применением для людей. Нуклеотиды включают природные сахара с 2'-дезокси и 2'-гидроксилом, описанные, например, в Kornberg and Baker, DNA Replication, 2nd Ed. (Freeman, San Francisco, 1992), а также их аналоги.
«Аналог» со ссылкой на нуклеотиды включает синтетические нуклеотиды, имеющие модифицированные составляющие в виде оснований и/или модифицированные молекулы сахара (см., например, аналоги, широко описанные в Scheit, Nucleotide Analogs, John Wiley, New York, 1980; Freier & Altmann, (1997) Nucl. Acid. Res., 25(22), 4429-4443, Toulme, J.J., (2001) Nature Biotechnology 19: 17-18; Manoharan M., (1999) Biochemica et Biophysica Acta 1489: 117-139; Freier S. M., (1997) Nucleic Acid Research, 25: 4429-4443, Uhlman, E., (2000) Drug Discovery & Development, 3: 203-213, Herdewin P., (2000) Antisense & Nucleic Acid Drug Dev., 10: 297-310); 2’-O, 3’-C-связанные [3.2.0]бициклоарабинонуклеозиды (см., например, N.K Christiensen., et al, (1998) J. Am. Chem. Soc, 120: 5458-5463; Prakash TP, Bhat B. (2007) Curr Top Med Chem. 7(7): 641-649; Cho EJ, et al. (2009) Annual Review of Analytical Chemistry, 2, 241-264). Такие аналоги включают синтетические нуклеотиды, призванные усилить связывающие свойства, например, стабильность дуплекса или триплекса, специфичность или т.п.
Как здесь используется, «гибридизация» означает спаривание в значительной степени комплементарных цепей олигомерных соединений. В один механизм спаривания вовлечено образование водородных связей, которое может быть образованием водородных связей Уотсона-Крика, хугстиновских (Hoogsteen) или обратных Hoogsteen водородных связей, между комплементарными нуклеозидами или нуклеотидными основаниями (нуклеотидами) цепей олигомерных соединений. Комплементарными нуклеотидами являются, например, аденин и тимин, которые спариваются благодаря образованию водородных связей. Гибридизация может происходить при изменяющихся обстоятельствах.
Антисмысловое соединение является «специфически гибридизуемым», когда связывание соединения с нуклеиновой кислотой-мишенью вносит помехи в нормальное функционирование нуклеиновой кислоты-мишени с вызовом модуляции функции и/или активности, и существует достаточная степень комплементарности во избежание неспецифического связывания антисмыслового соединения с не являющимися мишенями последовательностями нуклеиновых кислот в условиях, при которых желательным является специфическое связывание, т.е. в физиологических условиях в случае in vivo исследований или терапевтического лечения и в условиях, при которых выполняют исследования, в случае in vitro исследований.
Используемое здесь выражение «жесткие условия гибридизации» или «жесткие условия» относится к условиям, при которых соединение настоящего изобретения будет гибридизоваться с являющейся его мишенью последовательностью, но с минимальным числом других последовательностей. Жесткие условия зависят от последовательности и будут различными в различных случаях, и в контексте этого изобретения «жесткие условия», при которых олигомерные соединения гибридизуются с последовательностью-мишенью, определяются природой и составом олигомерных соединений и исследованиями, в которых их изучают. Как правило, жесткие условия гибридизации включает низкие концентрации (<0,15 М) солей с неорганическими катионами, такими как Na++ или K++ (т.е. низкую ионную силу), температуру, превышающую 20-25°C, но ниже Tm комплекса олигомерное соединение: последовательность-мишень, и присутствие денатурирующих агентов, таких как формамид, диметилформамид, диметилсульфоксид, или детергента натрия додецилсульфата (SDS). Например, степень гибридизации снижается на 1,1% в случае каждого 1% формамида. Примером условия гибридизации высокой жесткости является 0,1X SSC (содержащий натрия хлорид-натрия цитрат буфер)/0,1% (в отношении веса к объему) SDS при 60°C в течение 30 минут.
Используемый здесь термин «комплементарные» относится к способности к точному спариванию двух нуклеотидов на одной или двух олигомерных цепях. Например, если нуклеиновое основание в определенном положении антисмыслового соединения способно к образованию водородном связи с нуклеиновым основанием в определенном положении нуклеиновой кислоты-мишени, являющейся ДНК, РНК или молекулой олигонуклеотида, считается, что положение образования водородной связи между олигонуклеотидом и нуклеиновой кислотой-мишенью является комплементарным положением. Олигомерное соединение и дополнительная молекула ДНК, РНК или олигонуклеотида являются комплементарными друг другу, когда достаточное число комплементарных положений в каждой молекулы занимают нуклеотиды, которые могут образовывать водородную связь друг с другом. Таким образом, «специфически гибридизуемые» и «комплементарные» являются терминами, которые используются для указания на достаточную степень точного спаривания или комплементарности относительно достаточного числа нуклеотидов, так что происходит стабильное и специфическое связывание между олигомерным соединением и нуклеиновой кислотой-мишенью.
В данной области техники подразумевается, что не требуется, чтобы последовательность олигомерного соединения была комплементарной на 100% последовательности являющейся его мишенью нуклеиновой кислоты, чтобы быть специфически гибридизуемой. Кроме того, олигонуклеотид может гибридизоваться в пределах одного или нескольких сегментов, так что в событие гибридизации не вовлечены промежуточные или примыкающие сегменты (например, петлевая структура, не соответствующая или шпилечная структура). Олигомерные соединения настоящего изобретения комплементарны по последовательности по меньшей мере приблизительно на 70%, или по меньшей мере приблизительно 75%, или по меньшей мере приблизительно 80%, или по меньшей мере приблизительно 85%, или по меньшей мере приблизительно 90%, или по меньшей мере приблизительно 95%, или по меньшей мере приблизительно 99% участку-мишени внутри последовательности нуклеиновой кислоты-мишени, на который они нацелены. Например, антисмысловое соединение, в котором 18 из 20 нуклеотидов антисмыслового соединения являются комплементарными участку-мишени, а, следовательно, будет, вероятно, специфически гибридизоваться, будет представлять 90 процентов комплементарности. В этом примере остальные некомплементарные нуклеотиды могут быть сгруппированы или отделены комплементарными нуклеотидами и необязательно являются прилегающими друг к другу или к комплементарным нуклеотидам. Как таковое, антисмысловое соединение длиной 18 нуклеотидов, имеющее 4 (четыре) некомплементарных нуклеотида, которые фланкированы двумя участками полной комплементарности нуклеиновой кислоте-мишени, будет иметь составляющую 77,8% общую комплементарность нуклеиновой кислоте-мишени, а, следовательно, попадет в объем настоящего изобретения. Процент комплементарности антисмыслового соединения участку нуклеиновой кислоты-мишени можно определить в установленном порядке, используя программы BLAST (средства поиска основного локального совмещения) и программы PowerBLAST, известные в данной области техники (Altschul et al, (1990) J. Mol. Biol, 215, 403-410; Zhang and Madden, (1997) Genome Res., 7, 649-656). Гомологию, идентичность или комплементарность последовательностей в процентах можно определить с использованием, например, программы Gap (Wisconsin Sequence Analysis Package, версию 8 для Unix, Genetics Computer Group, University Research Park, Madison Wis.), используя параметры по умолчанию, в которой используется алгоритм Smith и Waterman {Adv. Appl. Math., (1981) 2, 482-489).
Используемый здесь термин «температурная точка плавления (Tm)» относится к температуре, при определенной ионной силе, pH и концентрации нуклеиновой кислоты, при которой 50% олигонуклеотидов, комплементарных последовательности-мишени, подвергаются гибридизации с последовательностью-мишенью при равновесии. Обычно жесткими условиями будут условия, при которых концентрация соли составляет по меньшей мере приблизительно от 0,01 до 1,0 M концентрации ионов Na (или других солей) при pH 7,0-8,3, а температура составляет по меньшей мере приблизительно 30°C в случае коротких олигонуклеотидов (например, длиной 10-50 нуклеотидов). Жестких условий можно также достичь с помощью добавления дестабилизирующих агентов, таких как формамид.
Как здесь используется, «модулирование» означает либо повышение (стимуляцию), либо понижение (ингибирование) экспрессии гена.
Термин «вариант», при использовании в связи с последовательностью полинуклеотида, может охватывать последовательность полинуклеотида, родственную гену дикого типа. Это определение может также включать, например, «аллельные» варианты, «варианты сплайсинга», «видовые» или «полиморфные» варианты. Вариант сплайсинга может быть в значительной степени идентичен эталонной молекуле, но будет, как правило, иметь большее или меньшее число нуклеотидов вследствие альтернативного сплайсинга экзонов во время процессирования мРНК. Соответствующий полипептид может обладать дополнительными функциональными доменами или характеризоваться отсутствием доменов. Видовыми вариантами являются последовательности полинуклеотидов, которые меняются при переходе от одного вида у другого. Особенно полезными в настоящем изобретении являются варианты продуктов гена дикого типа. Варианты могут быть следствием по меньшей мере одной мутации в последовательности нуклеиновой кислоты и могут иметь следствием измененные мРНК или полипептиды, структура или функция которых может быть или может не быть измененной. Любой конкретный природный или рекомбинантный ген может не иметь, иметь одну или множество аллельных форм. Обычные мутационные изменения, которые порождают варианты, обычно относят за счет природных делеций, добавлений или замен нуклеотидов. Каждый из этих типов изменений может возникать отдельно, или в сочетании с другими, один или несколько раз в конкретной последовательности.
Результирующие полипептиды будут, как правило, в значительной степени идентичны по аминокислотной последовательности друг другу. Полиморфный вариант представляет собой вариацию в полинуклеотидной последовательности конкретного гена между индивидуумами конкретного вида. Полиморфные варианты также могут включать «однонуклеотидные полиморфизмы» (SNP) или мутации единичного основания, при которых последовательность полинуклеотида варьирует по одному основанию. Присутствие SNP может служить признаком, например, определенной популяции с предрасположенностью к болезненному состоянию, т.е. чувствительностью в сравнение с резистентностью.
Производные полинуклеотиды включают нуклеиновые кислоты, подвергнутые химической модификации, например, замене водорода алкильной, ацильной группой или аминогруппой. Производные, например, производные олигонуклеотиды, могут включать не встречающиеся в природе части, такие как измененные молекулы сахара или связи между сахарами. Среди них иллюстративными являются фосфоротиоат и другие серосодержащие разновидности, которые известны в данной области техники. Производные нуклеиновые кислоты могут также содержать метки, включающие радионуклеотиды, ферменты, флуоресцентные вещества, хемилюминесцентные вещества, хромогенные вещества, субстраты, кофакторы, ингибиторы, магнитные частицы и т.п.
«Производным» полипептидом или пептидом является полипептид или пептид, который модифицирован, например, посредством гликозилирования, ПЭГилирования, фосфорилирования, сульфатирования, восстановления/алкилирования, ацилирования, химического соединения или обработки формалином в мягких условиях. Производное может быть также модифицировано так, что оно содержит метку, поддающуюся обнаружению либо непосредственно, либо опосредованно, включающую, но без ограничения, радиоизотоп, флуоресцентную и ферментативную метку.
Подразумевается, что используемый здесь термин «животное» или «пациент» включает, например, людей, овцу, лосей, оленя, чернохвостого оленя, норок, млекопитающих, обезьян, лошадей, крупный рогатый скот, свиней, коз, собак, кошек, крыс, мышей, птиц, курицу, рептилий, рыбу, насекомых и паукообразных насекомых.
«Млекопитающие» включают теплокровных млекопитающих, которые обычно находятся в условиях проявления медицинской помощи, (например, людей и домашних животных). Примеры включают семейство кошачьих, собачьих, лошадиных, жвачных животных и человека, а также лишь человека.
«Лечение» включает лечение болезненного состояния у млекопитающего и включает (a) предотвращение возникновения болезненного состояния у млекопитающего, в частности, когда такое млекопитающее имеет предрасположенность к болезненному состоянию, но наличие которого у него еще не диагностировано; (b) подавление болезненного состояния, например, остановку его развития; и/или (c) ослабление болезненного состояния, например, вызов регрессии болезненного состояния до достижения желаемого конечного положения. Лечение также включает уменьшение интенсивности симптома заболевания (например, уменьшение боли или дискомфорта), причем такое уменьшение интенсивности может оказывать или может не оказывать прямое влияние на заболевание (например, причину, передачу, выраженность и т.д.).
Используемый здесь термин «рак» относится к любой злокачественной опухоли, возникающей, в частности, в легком, почке или щитовидной железе. Рак обнаруживается в виде «опухоли» или ткани, включающей злокачественные клетки рака. Примеры опухолей включают саркомы и карциномы, такие как, но без ограничения, фибросаркома, миксосаркома, липосаркома, хондросаркома, остеогенная саркома, хордома, ангиосаркома, эндотелиосаркома, лимфангиосаркома, лимфангиоэндотелиосаркома, синовиома, мезотелиома, опухоль Юинга, лейомиосаркома, рабдомиосаркома, рак ободочной кишки, рак поджелудочной железы, рак молочной железы, рак яичника, рак предстательной железы, плоскоклеточный рак, базальноклеточный рак, аденокарцинома, карцинома потовых желез, карцинома сальных желез, папиллярная карцинома, папиллярная аденокарцинома, цистаденокарцинома, медуллярный рак, бронхогенная карцинома, почечно-клеточная карцинома, гепатома, карцинома желчного протока, хориокарцинома, семинома, эмбриональная карцинома, опухоль Вильмса, рак шейки матки, опухоль яичка, рак легкого, мелкоклеточный рак легкого, карцинома мочевого пузыря, эпителиальный рак, глиома, астроцитома, медуллобластома, краниофарингиома, эпендимальная глиома, пинеалома, гемангиобластома, невринома слухового нерва, олигодендроглиома, менингиома, меланома, нейробластома и ретинобластома. Как отмечено выше, настоящим изобретением обеспечивается, в частности, дифференциальная диагностика опухолей легкого, почки и щитовидной железы.
Полинуклеотидные и олигонуклеотидные композиции и молекулы
Мишени: В одном варианте осуществления мишени включают нуклеотидные последовательности гена-супрессора опухолей, включающие, но без ограничения, смысловые и/или антисмысловые некодирующие и/или кодирующие последовательности, связанные с геном-супрессором опухолей.
Супрессоры опухолей являются генами, продукты которых функционируют для контролирования деления клеток. Они отличаются от онкогенов тем, что супрессоры опухолей продуцируют продукты, которые ингибируют деление клеток, если не удовлетворены условия для роста. Условия, которые, вероятно, включают «тормозную систему» клеток, включают повреждение ДНК, отсутствие факторов роста или дефекты в системы деления. Когда ген-супрессор опухолей мутирован с вызовом утраты или ослабления его функции, клетка может развиваться в рак, обычно в сочетании с другими генетическими изменениями. В отличие от этого онкогены в своей мутантной форме имеют увеличенную функцию (или теряют способность быть контролируемыми). Примеры генов-супрессоров опухолей включают p53 (TP53): транскрипционный фактор, который контролирует деление клеток; Rb: изменяет активность транскрипционных факторов и, следовательно, контролирует деление клеток; APC: контролирует обеспеченность транскрипционного фактора; BRCA: вовлечен в репаративный синтез ДНК.
Супрессор опухолей p53 проявляет антипролиферативные эффекты, включающие остановку роста, апоптоз и старение клеток, в ответ на различные типы стресса (Levine A.J., (1997) Cell 88: 323-31; Oren M., (1999) J. Biol. Chem. 274: 36031-034). p53 можно представить себе как центральный узел регуляторной цепи, которая контролирует пути передачи сигналов от разнообразных источников, включающей ответные реакции на повреждение ДНК (например, активацию ATM/ATR), патологические онкогенные явления (например, активацию Myc или Ras) и повседневные клеточные процессы (например, стимуляцию факторами роста). Хотя мутации в p53 были в более чем половине всех опухолей человека (Hollstein et al, (1999) Mutat Res. 431: 199-209), в опухолевых клетках, в которых сохраняется p53 дикого типа, замечены дефекты в других компонентах пути с участием p53, таких как супрессор опухолей ARF (Sherr, C.J., (2001) Nat Rev Mol Cell Biol 2: 731-737; Sharpless N.E., et al, (2004) J Clin Invest 113: 160-8). Активация пути с участием p53, по-видимому, является общим, если не универсальным, признаком рака человека.
Лечению рака и других нарушений, при которых анормальная пролиферация клеток играет роль, могла бы весьма помочь регуляция этих полинуклеотидов. Например, p53 является короткоживущим белком, активность которого сохраняется на низких уровнях в нормальных клетках. В молекулярное функционирование p53, который требуется для подавления опухолей, вовлечена способность p53 действовать в качестве транскрипционного фактора в регулировании экспрессии эндогенных генов. Таким образом, регуляция самого p53 важна для его эффекта на образование опухолей и сохранение нормального клеточного роста. Антисмысловое соединение является специфически гибридизуемым, когда связывание соединения с ДНК- или РНК-мишенью вызывает утрату эффективности, и существует достаточная степень комплементарности во избежание неспецифического связывания антисмыслового соединения с не являющимися мишенями последовательностями в условиях, при которых желательным является специфическое связывание, т.е. в физиологических условиях в случае in vivo исследований или терапевтического лечения и в условиях, при которых выполняют исследования, в случае in vitro исследований.
В таблице 1 представлен перечень некоторых генов-супрессоров опухолей
Предполагается, что этот перечень является не исчерпывающим, и что настоящим изобретением охватывается использование других супрессоров опухолей, которые не включены, в частности, в этот перечень. Специалист, работающий в области супрессоров опухолей, может идентифицировать дополнительные супрессоры опухолей, описанные, например, в опубликованной литературе.
Следует принять во внимание, что в вышеприведенной таблице 1 указанный ген означает ген и все его известные в настоящее время варианты, в том числе различные транкрипты в виде мРНК, которые ген и его варианты могут породить, и дополнительные варианты гена, которые могут быть выявлены, и антисмысловые последовательности. Перечень также включает некодирующие молекулы РНК или части полинуклеотидов. Однако такие варианты будут, как правило, в значительной степени идентичны по последовательности любого полинуклеотида в вышеприведенной таблице 1, например, вариант будет идентичен по последовательности по меньшей мере приблизительно на 70%, обычно по меньшей мере приблизительно на 75, 80, 85, 90, 95, 97, 98 или 99% последовательности вышеприведенной таблицы 1. Идентичность по последовательности варианта можно определить с помощью любого ряда стандартных методов, таких как программа BLAST (ncbi.nclm.nih.gov/blast/).
В другом варианте осуществления олигонуклеотиды являются специфичными в отношении одной или нескольких молекул, которые ингибируют анормальный клеточный рост или опухоли. Такая молекула включает факторы, которые ингибируют молекулярные активности, такие как, например, трансформация клеток, факторы, вовлеченные в предопухолевые стадии, злокачественную опухоль, стадию до метастазирования, метастаз и т.п. Другие примеры включают, без ограничения, продукты связанных с развитием генов (например, адгезивную молекулу, ингибиторы циклин-киназы, члены семейства Wnt, члены семейства Pax, члены семейства Winged-helix, члены семейства Hox, цитокины/лимфокины и их рецепторы, факторы роста/дифференциации и их рецепторы, нейромедиаторы и их рецепторы); продукты онкогенов (например, ABL1, BCL1, BCL2, BCL6, CBFA2, CBL, CSF1R, ERBA, ERBB, ERB2, ETS1, ETV6, FGR, FOS, FYN, HCR, HRAS, JUN, KRAS, LCK, LYN, MDM2, MLL, MYB, MYC, MYCL1, MYCN, NRAS, PIM1, PML, RET, SRC, TAL1, TCL3, AND YES); продукты генов-супрессоров опухолей (например, APC, BRCA1, BRCA2, MADH4, MCC, NF1, NF2, RBI, TP53 и WTl) и ферменты (например, ACC-синтазы и -оксидазы, ACP-десатуразы и -гидролазы, АДФ-глюкозо-пирофосфорилазы, АТФазы, алкогольдегидрогеназы, амилазы, амилоглюкозидазы, каталазы, целлюлазы, хальконсинтазы, хитиназы, циклооксигеназы, декарбоксилазы, декстриназы, ДНК- и РНК-полимеразы, галактозидазы, глюканазы, глюкозооксидазы, связанные с гранулами синтазы крахмала, ГТФазы, хеликазы, гемицеллюлазы, интегразы, инулиназы, инвертазы, изомеразы, киназы, лактазы, липазы, липоксигеназы, лизоцимы, нопалинсинтазы, октопинсинтазы, пектинэстеразы, пероксидазы, фосфатазы, фосфолипазы, фосфорилазы, фитазы, синтетазы регуляторов роста растений, полигалактуроназы, протеиназы и пептидазы, пулланазы, рекомбиназы, обратные транскриптазы, RUBISCO, топоизомеразы и ксиланазы.
Приводимые в качестве примеров опосредованные генами-супрессорами опухолей заболевания и нарушения, которые можно подвергать лечению клетками/тканями, регенерированными из стволовых клеток, полученными с использованием антисмысловых соединений, включают заболевания, связанные со сниженным или повышенным апоптозом, старение тканей/клеток, рак (в том числе злокачественные опухоли, приведенные в таблице 1), аутоиммунные заболевания, болезни иммунодефицита, включающие СПИД, физиологическое старение, нейродегенеративное заболевание или нарушение (например, болезнь Альцгеймера, атаксию-телеангиэктазию, болезнь Паркинсона, боковой амиотрофический склероз (ALS), болезнь Хантингтона и т.д.), гиперпластические заболевания (например, келоид), ревматоидный артрит, коронарную болезнь сердца, ишемическую гибель клеток, лимфопролиферативные нарушения, атеросклероз, остеопороз, миелодиспластические синдромы, вызванные токсином заболевания, вирусные инфекции, заживление раны, болезнь Каудена (CD), болезнь Лермитта-Дуклоса (LDD), синдром Баннайана-Зонана (BZS, также известный как синдром Баннайана-Райли-Рувалкаба, синдром Рувалкаба-Мири-Смита и синдром Райли-Смита), трансплантацию, связанные с апоптозом заболевания или нарушения, болезнь обмена веществ или метаболическое состояние (например, диабет), модулирующая(ее) апоптоз при острых заболеваниях, болезни и нарушения почки, инфаркт миокарда/сердечную недостаточность, ишемию, сепсис, воспалительные заболевания, при которых преобладают конкретные гемопоэтические клетки, и пролиферативные заболевания, или когда примером терапии является лечение воспалительного заболевания через увеличение апоптоза.
В предпочтительном варианте осуществления олигонуклеотиды являются специфичными в отношении полинуклеотидов гена-супрессора опухолей, который включает, без ограничения, некодирующие участки. Мишени в виде гена-супрессора опухолей включают варианты гена-супрессора опухолей; мутанты гена-супрессора опухолей, включающие SNP; некодирующие последовательности гена-супрессора опухолей; аллели, фрагменты и т.п. Предпочтительно олигонуклеотидом является антисмысловая молекула РНК.
В соответствии с вариантами осуществления настоящего изобретения являющаяся мишенью молекула нуклеиновой кислоты не ограничивается только полинуклеотидами гена-супрессора опухолей, а распространяется на любую из изоформ, рецепторов, гомологов, некодирующих участков и т.п. гена-супрессора опухолей.
В другом предпочтительном варианте осуществления мишенью олигонуклеотида является природная антисмысловая последовательность (природная антисмысловая последовательность, комплементарная кодирующим и некодирующим участкам) мишеней в виде гена-супрессора опухолей, включающая, без ограничения, варианты, аллели, гомологи, мутанты, производные, фрагменты и комплементарные ей последовательности. Предпочтительно олигонуклеотидом является антисмысловая молекула РНК или ДНК.
В другом предпочтительном варианте осуществления олигомерные соединения настоящего изобретения также включают варианты, в которых присутствует отличное основание в одном или нескольких положениях нуклеотидов соединения. Например, если первым нуклеотидом является аденин, можно создать варианты, которые содержат тимидин, гуанозин, цитидин или другие природные или неприродные нуклеотиды в этом положении. Это можно выполнить в любом из положений антисмыслового соединения. Эти соединения затем проверяют, используя описываемые здесь способы, для определения их способности к ингибированию экспрессии нуклеиновой кислоты-мишени.
В некоторых вариантах осуществления гомология, идентичность или комплементарность по последовательности между антисмысловым соединением и мишенью составляет от приблизительно 50% до приблизительно 60%. В некоторых вариантах осуществления гомология, идентичность или комплементарность по последовательности составляет от приблизительно 60% до приблизительно 70%. В некоторых вариантах осуществления гомология, идентичность или комплементарность по последовательности составляет от приблизительно 70% до приблизительно 80%. В некоторых вариантах осуществления гомология, идентичность или комплементарность по последовательности составляет от приблизительно 80% до приблизительно 90%. В некоторых вариантах осуществления гомология, идентичность или комплементарность по последовательности составляет приблизительно 90%, приблизительно 92%, приблизительно 94%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98%, приблизительно 99% или приблизительно 100%.
Антисмысловое соединение является специфически гибридизуемым, когда связывание соединения с нуклеиновой кислотой-мишенью вносит помехи в нормальное функционирование нуклеиновой кислоты-мишени с вызовом потери активности, и существует достаточная степень комплементарности во избежание неспецифического связывания антисмыслового соединения с не являющимися мишенями последовательностями нуклеиновых кислот в условиях, при которых желательным является специфическое связывание. Такие условия включают физиологические условия в случае in vivo исследований или терапевтического лечения и условия, при которых выполняют исследования, в случае in vitro исследований.
Антисмысловое соединение, любое из ДНК, РНК, химерного, замещенного и т.д., является специфически гибридизуемым, когда связывание соединения с являющейся мишенью молекулой ДНК или РНК вносит помехи в нормальное функционирование являющейся мишенью ДНК или РНК с вызовом потери эффективности, и существует достаточная степень комплементарности во избежание неспецифического связывания антисмыслового соединения с не являющимися мишенями последовательностями в условиях, при которых желательным является специфическое связывание, т.е. в физиологических условиях в случае in vivo исследований или терапевтического лечения и в условиях, при которых выполняют исследования, в случае in vitro исследований.
В другом предпочтительном варианте осуществления нацеленность на ген-супрессор опухолей, в том числе, без ограничения, антисмысловые последовательности, которые идентифицируют и увеличивают, используя, например, ПЦР, гибридизацию и т.д., одну или несколько последовательностей, представленных как SEQ ID NO: 8, 9, 10, 11, 12, 13, 14 и 15, и т.п., модулирует экспрессию или функцию гена-супрессора опухолей. В одном варианте осуществления экспрессия или функция повышается по сравнению с контролем. В другом предпочтительном варианте осуществления экспрессия или функция понижается по сравнению с контролем.
В другом предпочтительном варианте осуществления олигонуклеотиды включают последовательности нуклеиновых кислот, представленные как SEQ ID NO: 16-36, в том числе антисмысловые последовательности, которые идентифицируют и увеличивают, используя, например, ПЦР, гибридизацию и т.д. Эти олигонуклеотиды могут включать один или несколько модифицированных нуклеотидов, более короткие или более длинные фрагменты, модифицированные связи и т.п. Примеры модифицированных связей или межнуклеотидных связей включают фосфоротиоат, фосфородитиоат или т.п. В другом предпочтительном варианте осуществления нуклеотиды включают фосфорное производное. Фосфорное производное (или модифицированная фосфатная группа), которое может быть присоединено к составляющей в виде сахара или сахарного аналога в модифицированных олигонуклеотидах настоящего изобретения, может быть монофосфатом, дифосфатом, трифосфатом, алкилфосфатом, алканфосфатом, фосфоротиоатом и т.п. Приготовление
вышеотмеченных фосфатных аналогов и их включение в нуклеотиды, модифицированные нуклеотиды и олигонуклеотиды, сами по себе, также известны, и их описание здесь не требуется.
Специфичность и чувствительность антисмысловой молекулы также используются в максимальной мере квалифицированными в данной области техники специалистами в случае терапевтических применений. Антисмысловые олигонуклеотиды были использованы в качестве составляющих терапевтических средств при лечении болезненных состояний у животных и человека. Антисмысловые олигонуклеотиды вводились без риска и с эффективностью людям, и в настоящее время в процессе проведения находятся многочисленные клинические испытания. Таким образом, установлено, что олигонуклеотиды могут быть полезными терапевтическими средствами, которым можно придать такую форму, которая применима в схемах лечения для лечения клеток, тканей и животных, особенно людей.
В вариантах осуществления настоящего изобретения олигомерные антисмысловые соединения, в частности, олигонуклеотиды связываются с являющимися мишенями молекулами нуклеиновых кислот и модулируют экспрессию и/или функцию молекул, кодируемых геном-мишенью. Функции ДНК, в которые вносятся помехи, включают, например, репликацию и транскрипцию. Функции РНК, в которые вносятся помехи, включают все необходимые для жизни функции, такие как, например, транслокация РНК в сайт трансляции белка, трансляция белка с РНК, сплайсинг РНК для производства одной или нескольких разновидностей мРНК, и каталитическую активность, в которую может быть привлечена РНК или которой способствует РНК. Функции могут возрастать или ингибироваться в зависимости от желательных функций.
Антисмысловые соединения включают антисмысловые олигомерные соединения, антисмысловые олигонуклеотиды, олигонуклеотиды внешних вспомогательных последовательностей (EGS), продукты альтернативного сплайсинга, праймеры, зонды и другие олигомерные соединения, которые гибридизуются с по меньшей мере частью нуклеиновой кислоты-мишени. Как таковые, эти соединения могут вводиться в форме одноцепочечных, двухцепочечных, частично одноцепочечных или кольцевых олигомерных соединений.
Нацеливание антисмыслового соединения на конкретную молекулу нуклеиновой кислоты, в связи с этим изобретением, может быть многостадийным процессом. Процесс обычно начинается с идентификации нуклеиновой кислоты-мишени, функция которой должна быть модулирована. Эта нуклеиновая кислота-мишень может быть, например, клеточным геном (или мРНК, транскрибируемой с гена), экспрессия которого связана с конкретным нарушением или болезненным состоянием, или молекулой нуклеиновой кислоты из инфекционного агента. В настоящем изобретении нуклеиновая кислота-мишень кодирует ген-супрессор опухолей.
Процесс нацеливания обычно также включает определение по меньшей мере одного участка-, сегмента- или сайта-мишени внутри нуклеиновой кислоты-мишени ради возникновения антисмыслового взаимодействия, так что будет наступать желаемый эффект, например, модуляция экспрессии. В контексте настоящего изобретения термин «участок» определяют как часть нуклеиновой кислоты-мишени, имеющую по меньшей мере одну идентифицируемую структуру, функцию или характеристику. Внутри участков нуклеиновых кислот-мишеней находятся сегменты. «Сегменты» определяют как меньшие части и подчасти участков внутри нуклеиновой кислоты-мишени. «Сайты», как используются в настоящем изобретении, определяют как положения внутри нуклеиновой кислоты-мишени.
В предпочтительном варианте осуществления антисмысловые олигонуклеотиды связываются с природными антисмысловыми последовательностями гена-супрессора опухолей и модулируют экспрессию и/или функцию гена-супрессора опухолей (SEQ ID NO: 1, 4 и 7). Примеры антисмысловых последовательностей включают SEQ ID NO: 8-36.
В другом предпочтительном варианте осуществления антисмысловые олигонуклеотиды связываются с одним или несколькими сегментами полинуклеотидов гена-супрессора опухолей и модулируют экспрессию и/или функцию гена-супрессора опухолей. Сегменты включают по меньшей мере пять последовательных нуклеотидов смыслового или антисмыслового полинуклеотидов гена-супрессора опухолей.
В другом предпочтительном варианте осуществления антисмысловые олигонуклеотиды являются специфичными в отношении природных антисмысловых последовательностей гена-супрессора опухолей, причем связывания олигонуклеотидов с природными антисмысловыми последовательностями гена-супрессора опухолей модулируют экспрессию и/или функцию гена-супрессора опухолей.
В другом предпочтительном варианте осуществления олигонуклеотидные соединения включают последовательности,
представленные как SEQ ID NO: 16-36, антисмысловые последовательности, которые идентифицируют и увеличивают, используя, например, ПЦР, гибридизацию и т.д. Эти олигонуклеотиды могут включать один или несколько модифицированных нуклеотидов, более короткие или более длинные фрагменты, модифицированные связи и т.п. Примеры модифицированных связей или межнуклеотидных связей включают фосфоротиоат, фосфородитиоат или т.п.В другом предпочтительном варианте осуществления нуклеотиды включают фосфорное производное. Фосфорное производное (или модифицированная фосфатная группа), которое может быть присоединено к составляющей в виде сахара или сахарного аналога в модифицированных олигонуклеотидах настоящего изобретения, может быть монофосфатом, дифосфатом, трифосфатом, алкилфосфатом, алканфосфатом, фосфоротиоатом и т.п.Приготовление вышеотмеченных фосфатных аналогов и их включение в нуклеотиды, модифицированные нуклеотиды и олигонуклеотиды, сами по себе, также известны, и их описание здесь не требуется.
Поскольку, как известно в данной области техники, кодоном инициации трансляции обычно является 5'-AUG (в транскрибированных молекулах мРНК; 5'-ATG в соответствующей молекуле ДНК), кодон инициации трансляции также называют «кодоном AUG», «инициирующим кодоном» или «инициирующим кодоном AUG». Меньшая часть генов имеет кодон инициации трансляции, имеющий последовательность в РНК 5'-GUG, 5'-UUG или 5'-CUG; и было установлено, что 5'-AUA, 5'-ACG и 5'-CUG функционируют in vivo. Таким образом, термины «кодон инициации трансляции» ипредставленные как SEQ ID NO: 10-30, антисмысловые последовательности, которые идентифицируют и увеличивают, используя, например, ПЦР, гибридизацию и т.д. Эти олигонуклеотиды могут включать один или несколько модифицированных нуклеотидов, более короткие или более длинные фрагменты, модифицированные связи и т.п. Примеры модифицированных связей или межнуклеотидных связей включают фосфоротиоат, фосфородитиоат или т.п. В другом предпочтительном варианте осуществления нуклеотиды включают фосфорное производное. Фосфорное производное (или модифицированная фосфатная группа), которое может быть присоединено к составляющей в виде сахара или сахарного аналога в модифицированных олигонуклеотидах настоящего изобретения, может быть монофосфатом, дифосфатом, трифосфатом, алкилфосфатом, алканфосфатом, фосфоротиоатом и т.п. Приготовление вышеотмеченных фосфатных аналогов и их включение в нуклеотиды, модифицированные нуклеотиды и олигонуклеотиды, сами по себе, также известны, и их описание здесь не требуется.
Поскольку, как известно в данной области техники, кодоном инициации трансляции обычно является 5'-AUG (в транскрибированных молекулах мРНК; 5'-ATG в соответствующей молекуле ДНК), кодон инициации трансляции также называют «кодоном AUG», «инициирующим кодоном» или «инициирующим кодоном AUG». Меньшая часть генов имеет кодон инициации трансляции, имеющий последовательность в РНК 5'-GUG, 5'-UUG или 5'-CUG; и было установлено, что 5'-AUA, 5'-ACG и 5'-CUG функционируют in vivo. Таким образом, термины «кодон инициации трансляции» и «инициирующий кодон» могут охватывать множество последовательностей кодонов, несмотря на то, что инициирующей аминокислотой в каждом случае обычно является метионин (у эукариот) или формилметионин (у прокариот). Эукариотические и прокариотические гены могут иметь два или более альтернативных инициирующих кодона, любой из который может предпочтительно использоваться для инициации трансляции в конкретном типе клеток или ткани, или в конкретной совокупности условий. В контексте настоящего изобретения «инициирующий кодон» и «кодон инициации трансляции» относится к кодону или кодонам, которые используются in vivo для инициации трансляции мРНК, транскрибируемой с гена, кодирующего ген-супрессор опухолей, независимо от последовательности(ей) таких кодонов. Кодон терминации трансляции (или «стоп-кодон») гена может иметь три последовательности, т.е. 5'-UAA, 5'-UAG и 5'-UGA (соответствующими последовательностями ДНК являются 5'-TAA, 5'- TAG и 5'-TGA, соответственно).
Термины «участок инициирующего кодона» и «участок кодона инициации трансляции» относится к части такой мРНК или гена, которая охватывает от приблизительно 25 до приблизительно 50 последовательных нуклеотидов в любом из двух направлений (т.е. 5' или 3') от кодона инициации трансляции. Так же термины «участок стоп-кодона» и «участок кодона терминации трансляции» относится к части такой мРНК или гена, которая охватывает от приблизительно 25 до приблизительно 50 последовательных нуклеотидов в любом из двух направлений (т.е. 5' или 3') от кодона терминации трансляции. Соответственно, и «участок инициирующего кодона» (или «участок кодона инициации трансляции»), и «участок стоп-кодона» (или «участок кодона терминации трансляции») являются участками, на которые можно эффективно нацелить антисмысловые соединения настоящего изобретения.
Открытая рамка считывания (ORF) или «кодирующая область», которая, как известно в данной области техники, относится к участку между кодоном инициации трансляции и кодоном терминации трансляции, также является участком, который можно эффективно сделать мишенью. В связи с настоящим изобретением целевым участком является внутригенный участок, включающий кодон инициации или терминации трансляции открытой рамки считывания (ORF) гена.
Другой участок-мишень включает 5' нетранслируемый участок (5'UTR), который, как известно в данной области техники, относится к части мРНК в 5' направлении от кодона инициации трансляции и, следовательно, включает нуклеотиды между 5' сайтом кэппирования и кодоном инициации трансляции мРНК (или соответствующие нуклеотиды гена). Еще один участок-мишень включает 3' нетранслируемый участок (3'UTR), который, как известно в данной области техники, относится к части мРНК в 3' направлении от кодона терминации трансляции и, следовательно, включает нуклеотиды между кодоном терминации трансляции и 3'-концом мРНК (или соответствующие нуклеотиды гена). 5' сайт кэппирования мРНК включает остаток N7-метилированного гуанозина, соединенный с находящимся в самом меньшей 5'-положении остатком мРНК благодаря 5'-5' трифосфатной связи. Считается, что 5' участок кэппирования мРНК включает саму 5' кэп-структуру, а также первые 50 нуклеотидов, примыкающие к сайту кэппирования. Другим участком-мишенью в случае этого изобретения является 5' участок кэппирования.
Хотя некоторые эукариотические транскрипты в виде мРНК транслируются непосредственно, многие транскрипты содержат один или несколько участков, известных как «интроны», которые удаляются из транскрипта до того, как он транслируется. Остающиеся (а, следовательно, транслируемые) участки известны как «экзоны» и соединяются вместе с образованием непрерывной последовательности мРНК. В одном варианте осуществления нацеливание на сайты сплайсинга, т.е. места соединения интрон-экзон или места соединения экзон-интрон, особенно применимо в ситуациях, при которых в заболевание вовлечен аберрантный сплайсинг, или при которых в заболевание вовлечена сверхпродукция конкретного продукта сплайсинга. Аберрантное вследствие реарранжировки или делеции место соединения является другим вариантом сайта-мишени. Транскрипты в виде мРНК, продуцированные через посредство процесса сплайсинга двух (или более) мРНК из различных источников генов, известны как «гибридные транскрипты». Интроны можно эффективно сделать мишенями, используя антисмысловые соединения, нацеленные, например, на ДНК или пре-мРНК.
В другом предпочтительном варианте осуществления антисмысловые олигонуклеотиды связываются с кодирующими и/или некодирующими участками полинуклеотида-мишени и модулируют экспрессию и/или функцию молекулы-мишени.
В другом предпочтительном варианте осуществления антисмысловые олигонуклеотиды связываются с природными антисмысловыми полинуклеотидами и модулируют экспрессию и/или функцию молекулы-мишени.
В другом предпочтительном варианте осуществления антисмысловые олигонуклеотиды связываются со смысловыми полинуклеотидами и модулируют экспрессию и/или функцию молекулы-мишени.
Альтернативные РНК-транскрипты могут продуцироваться с одного и того геномного участка ДНК. Эти альтернативные транскрипты обычно известны как «варианты». Конкретнее, «варианты пре-мРНК» являются транскриптами, продуцируемыми с одной и той же геномной ДНК, которые отличаются от других транскриптов, продуцируемых с той же геномной ДНК, по положению либо инициации, либо терминации и содержат как интронные, так экзонные последовательности.
После удаления одного или нескольких экзонных или интронных участков, или их частей, во время сплайсинга на основе вариантов пре-мРНК создаются более маленькие «варианты мРНК». Соответственно, варианты мРНК являются процессированными вариантами пре-мРНК, и на основе каждого уникального варианта пре-мРНК должен всегда создаваться уникальный вариант мРНК в результате сплайсинга. Эти варианты мРНК также известны как «альтернативные варианты сплайсинга». Если сплайсинг варианта пре-мРНК не происходит, то вариант пре-мРНК идентичен варианту мРНК.
Варианты могут продуцироваться благодаря использованию альтернативных сигналов для инициации или терминации транскрипции. Пре-мРНК и мРНК могут обладать более чем одним инициирующим кодоном или стоп-кодоном. Варианты, возникающие из пре-мРНК или мРНК, в случае которой используются альтернативные инициирующие кодоны», известны как «варианты альтернативной инициации» этой пре-мРНК или мРНК. Те транскрипты, в случае которых используется альтернативный стоп-кодон, известны как «варианты альтернативной терминации» этой пре-мРНК или мРНК. Одним специфическим типом варианта альтернативной терминации является «вариант полиА», в случае которого множество продуцируемых транскриптов являются следствием альтернативного выбора одного из «стоп-сигналов полиА» транскрипционным аппаратом, посредством чего продуцируются транскрипты, которые заканчиваются на уникальных сайтах полиА. В связи с настоящим изобретением описанные здесь типы вариантов являются также вариантами нуклеиновых кислот-мишеней.
Места на нуклеиновой кислоте-мишени, с которыми гибридизуются антисмысловые соединения, определяют как часть длиной по меньшей мере 5 нуклеотидов участка-мишени, на который нацелено активное антисмысловое соединение.
Хотя здесь представлены конкретные последовательности определенных, приводимых в качестве примеров сегментов-мишеней, квалифицированному в данной области техники специалисту будет понятно, что они служат для иллюстрации и описания конкретных вариантов осуществления в пределах объема настоящего изобретения. Дополнительные сегменты-мишени являются легко идентифицируемыми специалистом со средним уровнем компетентности в данной области техники в свете этого описания изобретения.
Считается, что сегменты-мишени длиной 5-100 нуклеотидов, включающие участок из по меньшей мере пяти (5) последовательных нуклеотидов, выбираемый изнутри иллюстративных предпочтительных сегментов-мишеней, являются также подходящими для нацеливания.
Сегменты-мишени могут включать последовательности ДНК или РНК, которые включают по меньшей мере 5 последовательных нуклеотидов с 5'-конца одного из иллюстративных предпочтительных сегментов-мишеней (при этом остальные нуклеотиды являются непрерывным участком той же ДНК или РНК, начинающимся сразу же выше 5'-конца сегмента-мишени и продолжающимся до вмещения от приблизительно 5 до приблизительно 100 нуклеотидов ДНК или РНК). Так же предпочтительные сегменты-мишени представлены последовательностями ДНК или РНК, которые включают по меньшей мере 5 последовательных нуклеотидов с 3'-конца одного из иллюстративных предпочтительных сегментов-мишеней (при этом остальные нуклеотиды являются непрерывным участком той же ДНК или РНК, начинающимся сразу же ниже 3'-конца сегмента-мишени и продолжающимся до вмещения от приблизительно 5 до приблизительно 100 нуклеотидов ДНК или РНК). Квалифицированный в данной области техники специалист, вооруженный проиллюстрированными здесь сегментами-мишенями, будет способен, без чрезмерного экспериментирования, идентифицировать дополнительные предпочтительные сегменты-мишени.
После идентификации одного или нескольких участков-, сегментов- или сайтов-мишеней выбирают антисмысловые соединения, которые являются в значительной степени комплементарными мишенями, т.е. гибридизуются достаточно хорошо и с достаточной специфичностью, для обеспечения желаемого эффекта.
В вариантах осуществления настоящего изобретения олигонуклеотиды связываются с антисмысловой цепью конкретной мишени. Длина олигонуклеотидов составляет по меньшей мере 5 нуклеотидов, и их можно синтезировать так, что каждый олигонуклеотид нацелен на перекрывающиеся последовательности, из условия, чтобы олигонуклеотиды были синтезированы с охватом всей длины полинуклеотида-мишени. Мишени также включают кодирующие, а также некодирующие участки.
В одном варианте осуществления предпочтительным является нацеливание антисмысловых олигонуклеотидов на конкретные нуклеиновые кислоты. Нацеливание антисмыслового соединения на конкретную молекулу нуклеиновой кислоты является многостадийным процессом. Процесс обычно начинается с идентификации последовательности нуклеиновой кислоты, функция которой должна быть модулирована. Эта последовательность может быть, например, клеточным геном (или мРНК, транскрибируемой с гена), экспрессия которого связана с конкретным нарушением или болезненным состоянием, или некодирующим полинуклеотидом, таким как, например, некодирующая РНК.
РНК можно отнести к (1) информационным РНК (мРНК), которые подвергаются трансляции в белки, и (2) не кодирующим белки РНК. Не кодирующие белки РНК включают микроРНК, антисмысловые транскрипты и другие транскрипционные единицы (TU), которые характеризуются высокой плотностью стоп-кодонов и в которых отсутствует какая-либо протяженная «открытая рамка считывания». Многие не кодирующие белки РНК, по-видимому, начинаются с сайтов инициации в 3' нетранслируемых участках (3'UTR) кодирующих белки локусов. Часто не кодирующие белки РНК являются редко встречающимися, и по меньшей мере половина не кодирующих белки РНК, которые были секвенированы консорциумом FANTOM, является, по-видимому, не полиаденилированными РНК. По очевидным причинам большинство исследователей уделяли особое внимание полиаденилированным мРНК, которые подвергаются процессингу и экспортируются в цитоплазму. Недавно было установлено, что совокупность не полиаденилированных ядерных РНК может быть очень большой, и что многие из таких транскриптов происходят из так называемых межгенных участков (Cheng, J. et al. (2005) Science 308 (5725), 1149-1154; Kapranov, P. et al. (2005). Genome Res 15 (7), 987-997). Механизм, с помощью которого не кодирующие белки РНК могут регулировать экспрессию генов, происходит при спаривании оснований с транскриптами-мишенями. РНК, которые действуют посредством спаривания оснований, можно подразделить на группы (1) цис-кодируемые РНК, которые кодируются в том же генетическом месте, но на противоположной цепи, что и РНК, на которые они воздействуют, и поэтому демонстрируют полную комплементарность своей мишени, и (2) транс-кодируемые РНК, которые кодируются в хромосомном месте, отличном от такового РНК, на которые они воздействуют, и обычно не проявляют идеальную способность к спариванию оснований со своими мишенями.
Без связи с какой-либо теорией, вносимая описываемыми здесь антисмысловыми олигонуклеотидами помеха в антисмысловой полинуклеотид может изменять экспрессию соответствующих смысловых информационных РНК. Однако эта регуляция может быть или дискордантной (выключение антисмыслового полинуклеотида приводит к повышению информационной РНК), или конкордантной (выключение антисмыслового полинуклеотида приводит к сопутствующему снижению информационной РНК). В этих случаях антисмысловые олигонуклеотиды могут быть нацелены на перекрывающиеся или не перекрывающиеся части антисмыслового транскрипта, приводя к его выключению или изоляции. Кодирующий, а также некодирующий антисмысловой полинуклеотид может быть сделан мишенью идентичным образом, и любая их этих двух категорий нацеливания способна к регуляции соответствующих смысловых транскриптов - либо конкордантно, либо дискордантно. Стратегии, которые используются для идентификации новых олигонуклеотидов для использования против мишеней, могут основываться на выключении антисмысловых РНК-транскриптов антисмысловыми олигонуклеотидами или любом другом способе модулирования желаемой мишени.
Стратегия 1: В случае дискордантной регуляции выключение антисмыслового транскрипта повышает экспрессию обычного (смыслового) гена. Если бы этот ген кодировал известную или предполагаемую мишень лекарственного средства, выключение его антисмысловой составляющей могло бы, как можно представить, имитировать действие агониста рецептора или стимулятора фермента.
Стратегия 2: В случае конкордантной регуляции можно одновременно выключить и антисмысловой, и смысловой транскрипты и, следовательно, достичь синергетического снижения экспрессии обычного (смыслового) гена. Если используется, например, антисмысловой олигонуклеотид, чтобы достичь выключения, то можно использовать эту стратегию с применением одного антисмыслового олигонуклеотида, мишенью которого является смысловой транскрипт, и другого антисмыслового олигонуклеотида против соответствующего антисмыслового транскрипта, или единичного полностью симметричного антисмыслового олигонуклеотида, который одновременно нацелен на перекрывающиеся смысловой и антисмысловой транскрипты.
В соответствии с настоящим изобретением антисмысловые соединения включают антисмысловые олигонуклеотиды, рибозимы, олигонуклеотиды внешних вспомогательных последовательностей (EGS), соединения в виде киРНК, одно- или двухцепочечные соединения, участвующие в РНК-интерференции, такие как соединения в виде киРНК, и другие олигомерные соединения, которые гибридизуются с по меньшей мере частью нуклеиновой кислоты-мишени и модулируют ее функцию. Как таковые, они могут быть ДНК, РНК, ДНК-подобными, РНК-подобными или их смесями или могут быть миметиками одного или нескольких из этих соединений. Эти соединения могут быть одноцепочечными, двухцепочечными, кольцевыми или шпилечными олигомерными соединениями и могут содержать такие структурные элементы, как внутренние или концевые выпуклости, несоответствия или петли. Антисмысловые соединения обычно готовят линейными, но они могут быть соединены или по иному приготовлены так, чтобы быть кольцевыми и/или разветвленными. Антисмысловые соединения могут включать такие конструкции, как, например, две цепи, подвергнутые гибридизации с образованием полностью или частично двухцепочечного соединения, и единичная цепь с самокомплементарностью, достаточной для допуска гибридизации и образования полностью или частично двухцепочечного соединения. Две цепи могут связываться между собой, оставляя свободными 3' или 5' концы, или могут быть связаны с образованием непрерывной шпилечной структуры или петли. Шпилечная структура может содержать выступ на либо 5', либо 3' конце, создавая удлинение одноцепочечного типа. Двухцепочечные соединения необязательно могут включать выступы на концах. Дополнительные модификации могут включать конъюгатные группы, присоединенные к одному из концов, выбранным положениям нуклеотидов, положениям сахаров или к одной из межнуклеозидных связей. Альтернативно, две цепи могут быть соединены через посредство не являющейся нуклеиновой кислотой составляющей или линкерной группы. При образовании из только одной цепи дцРНК может принимать форму самокомплементарной молекулы шпилечного типа, которая отгибается на себя с образованием дуплекса. Таким образом, дцРНК может быть полностью или частично двухцепочечной. Специфической модуляции экспрессии гена можно достичь при стабильной экспрессии шпилечных структур дцРНК в трансгенных клеточных линиях, однако в некоторых вариантах осуществления экспрессия или функция гена повышается. При образовании из двух цепей, или одной цепи, которая принимает форму самокомплементарной молекулы шпилечного типа, которая отгибается на себя с образованием дуплекса, две цепи (или образующие дуплекс участки одной цепи) являются комплементарными цепями РНК, которые подвергаются спариванию оснований способом Уотсона-Крика.
После введения в систему соединения настоящего изобретения могут индуцировать действие одного или нескольких ферментов или структурных белков для осуществления расщеплении или другой модификации нуклеиновой кислоты-мишени или могут функционировать через основанный на захвате механизм. В общем, нуклеиновые кислоты (в том числе олигонуклеотиды) можно охарактеризовать как «ДНК-подобные» (т.е. обычно имеющие один или несколько 2'-дезоксисахаров и обычно основания T, а не U) или «РНК-подобные» (т.е. обычно имеющие один или несколько сахаров с 2'-гидроксилом или 2'-модифицированных сахаров и обычно основания U, а не T). Спирали нуклеиновых кислот могут принимать более чем один тип структуры, чаще всего A- и B-формы. Полагают, что, в общем, олигонуклеотиды, которые имеют структуру вроде B-формы, являются «ДНК-подобными», а олигонуклеотиды, которые имеют структуру вроде A-формы, являются «РНК-подобными». В некоторых (химерных) вариантах осуществления антисмысловое соединение может содержать участки как A-, так и B-формы.
В другом предпочтительном варианте осуществления желательные олигонуклеотиды или антисмысловые соединения включают по меньшей мере одно из следующего: антисмысловую РНК, антисмысловую ДНК, химерные антисмысловые олигонуклеотиды, антисмысловые олигонуклеотиды, включающие модифицированные связи, молекулу, участвующую в РНК-интерференции, короткую интерферирующую РНК (киРНК); интерферирующую микроРНК; небольшую, короткоживущую РНК; короткую шпилечную РНК (кшРНК); короткую РНК, вызывающую активацию гена; короткие активирующие РНК или их комбинации.
дцРНК могут также активировать экспрессию гена, механизм, названный «вызванная короткой РНК активация гена». дцРНК, нацеленные на промоторы генов, вызывают сильную активацию транскрипции связанных генов. В клетках человека была установлена вызванная короткой РНК активация гена при использовании синтетических дцРНК, названных «короткими активирующими РНК». В настоящее время неизвестно, является ли вызванная короткой РНК активация гена консервативной в других организмах.
Установлено, что короткие двухцепочечные РНК (дцРНК), такие как короткая интерферирующая РНК (киРНК) и микроРНК, запускают эволюционно консервативный механизм, известный как РНК-интерференция. РНК-интерференция всегда приводит к сайленсингу гена через посредство ремодулирования хроматина с подавлением, тем самым, транскрипции, деградации комплементарной мРНК или блокированию трансляции белка. Однако, в случаях, описанных подробно в следующем разделе «Примеры», установлено, что олигонуклеотиды повышают экспрессию и/или функцию полинуклеотидов гена-супрессора опухолей и кодируемых ими продуктов. дцРНК могут также действовать как короткие активирующие РНК. Без желания ограничиваться какой-либо теорией, при нацеленности на последовательности в промоторах генов короткие активирующие РНК, вероятно, индуцируют экспрессию гена-мишени в феномене, названном вызванной дцРНК активацией транскрипции.
В дальнейшем варианте осуществления «предпочтительные сегменты-мишени», идентифицированные здесь, могут использоваться при скрининге на дополнительные соединения, которые модулируют экспрессию полинуклеотидов гена-супрессора опухолей. «Модуляторами» являются такие соединения, которые понижают или повышают экспрессию молекулы нуклеиновой кислоты, кодирующей ген-супрессор опухолей, и которые включают часть длиной по меньшей мере 5 нуклеотидов, которая комплементарна предпочтительному сегменту-мишени. Способ скрининга включает стадии приведения предпочтительного сегмента-мишени молекулы нуклеиновой кислоты, кодирующей смысловой или антисмысловой полинуклеотиды гена-супрессора опухолей, с одним или несколькими модуляторами-кандидатами, и отбора одного или нескольких модуляторов-кандидатов, которые понижают или повышают экспрессию молекулы нуклеиновой кислоты, кодирующей полинуклеотиды гена-супрессора опухолей, например SEQ ID NO: 16-36. После установления того, что модулятор-кандидат или модуляторы-кандидаты способны к модуляции (например, либо понижению, либо повышению) экспрессии молекулы нуклеиновой кислоты, кодирующей полинуклеотиды гена-супрессора опухолей, модулятор может после этого использоваться в дальнейших поисковых исследованиях функции полинуклеотидов гена-супрессора опухолей или для применения в качестве агента для исследования, диагностического или терапевтического агента в соответствии с настоящим изобретением.
Предпочтительно, когда нацеленность на природную антисмысловую последовательность модулирует функцию гена-мишени, например, гена р73 (входящий номер в NCBI: NM_005427.2), генаp53 (входящий № в NCBI: NM_000546.4) и гена PTEN (входящий № в NCBI: NM_000314). В предпочтительном варианте осуществления мишенью является антисмысловлй полинуклеотид гена-супрессора опухолей. В предпочтительном варианте осуществления антисмысловой олигонуклеотид нацелен на смысловые и/или природные антисмысловые последовательности полинуклеотидов генов-супрессоров опухолей (p73: входящий № в NCBI -NM_005427.2; p53: входящий № в NCBI - NM_000546.4; PTEN: входящий № в NCBI - NM_000314), их варианты, аллели, изоформы, гомологи, мутанты, производные, фрагменты и комплементарные им последовательности. Предпочтительно, когда олигонуклеотидом является антисмысловая молекула, а мишени включают кодирующие и некодирующие участки антисмысловых и/или смысловых полинуклеотидов генов-супрессоров опухолей.
Предпочтительные сегменты-мишени настоящего изобретения могут быть также объединены с соответствующими комплементарными им антисмысловыми соединениями настоящего изобретения с образованием стабилизированных двухцепочечных (образующих дуплекс) олигонуклеотидов.
В данной области техники установлено, что составляющие в виде таких двухцепочечных олигонуклеотидов модулируют экспрессию мишени и регулируют трансляцию, а также процессирование РНК через посредство антисмыслового механизма. Кроме того, двухцепочечные составляющие можно подвергнуть химическим модификациям (Fire et al, (1998) Nature, 391: 806-811; Timmons and Fire, (1998) Nature, 395: 854; Timmons et al, (2001) Gene, 263: 103-112; Tabara et al, (1998) Science, 282: 430-431; Montgomery et al, (1998) Proc. Natl. Acad. Sci. USA, 95: 15502-15507; Tuschl et al, (1999) Genes Dev., 13, 3191-3197; Elbashir et al, (2001) Nature, 411: 494-498; Elbashir et al, (2001) Genes Dev. 15: 188-200). Например, установлено, что такие двухцепочечные составляющие ингибируют мишень посредством классической гибридизации антисмысловой цепи дуплекса с мишенью, запускающей, тем самым, ферментативную деградацию мишени (Tijsterman et al., (2002) Science, 295: 694-697).
В предпочтительном варианте осуществления антисмысловой олигонуклеотид нацелен на полинуклеотиды генов-супрессоров опухолей (р73: входящий №в NCBI -NM_005427.2; р53: входящий №в NCBI - NM_000546.4; PTEN: входящий №в NCBI - NM_000314), их варианты, аллели, изоформы, гомологи, мутанты, производные, фрагменты и комплементарные им последовательности. Предпочтительно, когда олигонуклеотидом является антисмысловая молекула.
В соответствии с вариантами осуществления настоящего изобретения являющаяся мишенью молекула нуклеиновой кислоты не ограничивается только геном-супрессором опухолей, а распространяется на любую из изоформ, рецепторов, гомологов и т.п.молекул гена-супрессора опухолей.
В другом предпочтительном варианте осуществления олигонуклеотид нацелен на природную антисмысловую последовательность полинуклеотидов генов-супрессоров опухолей, например, полинуклеотидов, представленных как SEQ ID NO: 8, 9, 10, 11, 12, 13, 14 и 15, и любые ее варианты, аллели, гомологи, мутанты, производные, фрагменты и комплементарные ей последовательности. Примеры антисмысловых олигонуклеотидов представлены как SEQ ID NO: 10-30.
В одном варианте осуществления олигонуклеотиды комплементарны нуклеотидным последовательностям антисмыслового полинуклеотида гена-супрессора опухолей, в том числе, но без ограничения, некодирующим смысловым и/или антисмысловым последовательностям, связанным с полинуклеотидами гена-супрессора опухолей, или связываются с ними и модулируют экспрессию и/или функцию молекул гена-супрессора опухолей.
В другом предпочтительном варианте осуществления олигонуклеотиды комплементарны нуклеотидным последовательностям природного антисмыслового полинуклеотида гена-супрессора опухолей, представленным как SEQ ID NO: 8, 9, 10, 11, 12, 13, 14 и 15, или связываются с ними и модулируют экспрессию и/или функцию молекул гена-супрессора опухолей.
В предпочтительном варианте осуществления олигонуклеотиды включают последовательности из по меньшей мере 5 последовательных нуклеотидов SEQ ID NO: 16-36 и модулируют экспрессию и/или функцию молекул гена-супрессора опухолей.
Полинуклеотиды-мишени включают ген-супрессор опухолей, в том числе члены его семейства, варианты гена-супрессора опухолей; мутанты гена-супрессора опухолей, включающие SNP; некодирующие последовательности гена-супрессора опухолей; аллели гена-супрессора опухолей; видовые варианты, фрагменты и т.п.Предпочтительно, когда олигонуклеотидом является антисмысловая молекула.
В другом предпочтительном варианте осуществления олигонуклеотиды, нацеленные на полинуклеотиды гена-супрессора опухолей, включают антисмысловую РНК, молекулу, участвующую в РНК-интерференции, короткую интерферирующую РНК (киРНК); интерферирующую микроРНК; небольшую, короткоживущую РНК; короткую шпилечную РНК (кшРНК); короткую РНК, вызывающую активацию гена, или короткую активирующую РНК.
В другом предпочтительном варианте осуществления нацеленность на полинуклеотиды гена-супрессора опухолей, например, SEQ ID NO: 8, 9, 10, 11, 12, 13, 14 и 15, модулирует экспрессию или функцию этих мишеней. В одном варианте осуществления экспрессия или функция повышается по сравнению с контролем. В другом предпочтительном варианте осуществления экспрессия или функция понижается по сравнению с контролем.
В другом предпочтительном варианте осуществления антисмысловые соединения включают последовательности, представленные как SEQ ID NO: 16-36. Эти олигонуклеотиды могут включать один или несколько модифицированных нуклеотидов, более короткие или более длинные фрагменты, модифицированные связи и т.п.
В другом предпочтительном варианте осуществления SEQ ID NO: 16-36 включают один или несколько нуклеотидов в виде LNA.
Модулирование желательной нуклеиновой кислоты-мишени можно осуществить несколькими путями, известными в данной области техники, с использованием, например, антисмысловых олигонуклеотидов, киРНК и т.д. Ферментативные молекулы нуклеиновых кислот (например, рибозимы) являются молекулами нуклеиновых кислот, обладающими способностью катализировать одну
или более из ряда реакций, в том числе способностью к многократному расщеплению других разъединенных молекул нуклеиновых кислот специфическим в отношении последовательности нуклеотидных оснований образом. Такие ферментативные молекулы нуклеиновых кислот могут использоваться, например, для превращения в мишень в сущности любого РНК-транскрипта (Zaug et al., 324, Nature 429 1986; Cech, 260 JAMA 3030, 1988; и Jefferies et al., 17 Nucleic Acids Research 1371, 1989).
Вследствие своей специфичности в отношении последовательности транс-расщепляющие ферментативные молекулы нуклеиновых кислот являются перспективными в качестве терапевтических средств в случае заболевания у человека (Usman & McSwiggen, (1995) Ann. Rep. Med. Chem. 30, 285-294; Christoffersen and Marr, (1995) J. Med. Chem. 38, 2023-2037). Ферментативные молекулы нуклеиновых кислот можно сконструировать так, чтобы они расщепляли специфические РНК-мишени в фоновом содержании клеточной РНК. Такое событие расщепления переведет мРНК в нефункциональную РНК и аннулирует экспрессию белка с этой РНК. Этим способом можно селективно ингибировать синтез белка, связанного с болезненным состоянием.
В общем, ферментативные нуклеиновые кислоты с активностью расщепления РНК действует посредством сначала связывания с РНК-мишенью. Такое связывание имеет место благодаря связывающей мишень части ферментативной нуклеиновой кислоты, которая удерживается в непосредственной близости от ферментативной части молекулы, которая действует с расщеплением РНК-мишени. Таким образом, ферментативная нуклеиновая кислота сначала распознает, а затем связывает РНК-мишень благодаря спариванию комплементарных оснований, а после связывания в правильном сайте действует ферментативно с разрезанием РНК-мишени. Оперативное расщепление такой РНК-мишени лишит ее способности к непосредственному синтезу кодируемого белка. После того, как ферментативная нуклеиновая кислота связалась со своей РНК-мишенью и расщепила ее, она отделяется от этой РНК для поиска другой мишени и может повторно связываться с новыми мишенями и расщеплять их.
Несколько подходов, таких как стратегии in vitro отбора (эволюции) (Orgel, (1979) Proc. R. Soc. London, B 205, 435), были использованы для выявления новых катализаторов -нуклеиновых кислот, способных к катализу ряду реакций, таких как расщепление и лигирование фосфодиэфирных связей и амидных связей (Joyce, (1989) Gene, 82: 83-87; Beaudry et al, (1992) Science 257: 635-641; Joyce, (1992) Scientific American 267: 90-97; Breaker et al, (1994) TIBTECH 12: 268; Bartel et al, (1993) Science 261: 1411-1418; Szostak, (1993) TIBS 17: 89-93; Kumar et al, (1995) FASEB J., 9: 1183; Breaker, (1996) Curr. Op. Biotech., 1: 442).
Разработка рибозимов, являющихся оптимальными в отношении каталитической активности, вероятно, внесет значительный вклад в любую стратегию, в которой используются расщепляющие РНК рибозимы с целью регуляции экспрессии генов. Рибозим типа «головка молотка», например, функционируют со скоростью каталитической реакции (kcat), составляющей приблизительно 1 мин-1 в присутствии насыщающих (10 мМ) концентраций кофактора Mg2+. Установлено, что рибозим в виде искусственной «РНК-лигазы» катализируют реакцию соответствующей самомодификации со скоростью, составляющей приблизительно 100 мин-1. Кроме того, известно, что некоторые модифицированные рибозимы типа «головка молотка», которые имеют связывающие субстрат плечи, изготовленные из ДНК, катализируют расщепление РНК со скоростями множественной оборачиваемости, которые достигают 100 мин-1. Наконец, замена специфического остатка внутри каталитического ядра «головки молотка» определенными аналогами нуклеотидов дает модифицированные рибозимы, которые демонстрируют вплоть до 10-кратного увеличения скорости каталитической реакции. Эти факты показывают, что рибозимы могут активировать химические превращения со скоростями каталитических реакций, которые значительно выше скоростей, проявляемых in vitro большей частью природных, самостоятельно расщепляющих рибозимов. К тому же, вероятно, можно оптимизировать структуры определенных самостоятельно расщепляющих рибозимов с обеспечением максимальной каталитической активности, или можно создать совершенно новые РНК-мотивы, которые проявляют значительно большие скорости в отношении расщепления фосфодиэфирных связей в РНК.
Межмолекулярное расщепление субстрата в виде РНК катализатором в виде РНК, который соответствует модели «головки молотка», было впервые продемонстрировано в 1987 (Uhlenbeck, O. C. (1987) Nature, 328: 596-600). РНК-катализатор был выделен и введен в реакции с множеством молекул РНК, демонстрируя, что он является действительно каталитическим.
Каталитические РНК, разработанные на основе мотива «головки молотка», были использованы для расщепления специфических последовательностей-мишеней посредством внесения соответствующих изменений оснований в каталитическую РНК с сохранением необходимого спаривания по основаниям с последовательностями-мишенями (Haseloff and Gerlach, (1988) Nature, 334: 585; Walbot and Bruening, (1988) Nature, 334: 196; Uhlenbeck, O. C. (1987) Nature, 328: 596-600; Koizumi, M., et al. (1988) FEBS Lett., 228: 228-230). Это позволило использовать каталитическую РНК для расщепления специфических последовательностей-мишеней и означает, что каталитические РНК, разработанные в соответствии с моделью «головки молотка», могут, вероятно, расщеплять специфические субстраты - РНК in vivo (см. Haseloff and Gerlach, (1988) Nature, 334, 585; Walbot and Bruening, (1988) Nature, 334, 196; Uhlenbeck, O. C. (1987) Nature, 328: 596-600).
РНК-интерференция стала мощным способом модулирования экспрессии генов у млекопитающих и в клетках млекопитающих. В случае этого подхода требуется доставка коротких интерферирующих РНК (киРНК) либо в виде самой РНК, либо в виде ДНК, используя экспрессионную плазмиду или вирус и последовательность, кодирующую короткие шпилечные РНК, которые подвергаются процессированию до киРНК. Эта система создает возможность для эффективного переноса пре-киРНК в цитоплазму, где они являются активными, и позволяет использовать регулируемые и тканеспецифические промоторы для экспрессии генов.
В предпочтительном варианте осуществления олигонуклеотид или антисмысловое соединение включает олигомер или полимер рибонуклеиновой кислоты (РНК) и/или дезоксирибонуклеиновой кислоты (ДНК), или его миметик, химеру, аналог или гомолог. Этот термин включает олигонуклеотиды, состоящие из встречающихся в природе нуклеотидов, сахаров и ковалентных межнуклеозидных (остовных) связей, а также олигонуклеотиды, имеющие не встречающиеся в природе части, которые функционируют аналогично. Часто такие модифицированные или замещенные олигонуклеотиды являются желательнее природных форм вследствие таких желательных свойств, как, например, увеличенное поступление в клетку, повышенное сродство к нуклеиновой кислоте-мишени или повышенная стабильность в присутствии нуклеаз.
В соответствии с настоящим изобретением олигонуклеотиды или «антисмысловые соединения» включают антисмысловые олигонуклеотиды (например, РНК, ДНК, их миметик, химеру, аналог или гомолог), рибозимы, олигонуклеотиды внешних вспомогательных последовательностей (EGS), соединения в виде киРНК, одно- или двухцепочечные соединения, участвующие в РНК-интерференции, такие как соединения в виде киРНК, короткую активирующую РНК, вызывающую активацию гена короткую РНК и другие олигомерные соединения, которые гибридизуются с по меньшей мере частью нуклеиновой кислоты-мишени и модулируют ее функцию. Как таковые, они могут быть ДНК, РНК, ДНК-подобными, РНК-подобными или их смесями или могут быть миметиками одного или нескольких из этих соединений. Эти соединения могут быть одноцепочечными, двухцепочечными, кольцевыми или шпилечными олигомерными соединениями и могут содержать такие структурные элементы, как внутренние или концевые выпуклости, несоответствия или петли. Антисмысловые соединения обычно готовят линейными, но они могут быть соединены или по иному приготовлены так, чтобы быть кольцевыми и/или разветвленными. Антисмысловые соединения могут включать такие конструкции, как, например, две цепи, подвергнутые гибридизации с образованием полностью или частично двухцепочечного соединения, и единичная цепь с самокомплементарностью, достаточной для допуска гибридизации и образования полностью или частично двухцепочечного соединения. Две цепи могут связываться между собой, оставляя свободными 3' или 5' концы, или могут быть связаны с образованием непрерывной шпилечной структуры или петли. Шпилечная структура может содержать выступ на либо 5', либо 3' конце, создавая удлинение одноцепочечного типа. Двухцепочечные соединения необязательно могут включать выступы на концах. Дополнительные модификации могут включать конъюгатные группы, присоединенные к одному из концов, выбранным положениям нуклеотидов, положениям сахаров или к одной из межнуклеозидных связей. Альтернативно, две цепи могут быть соединены через посредство не являющейся нуклеиновой кислотой составляющей или линкерной группы. При образовании из только одной цепи дцРНК может принимать форму самокомплементарной молекулы шпилечного типа, которая отгибается на себя с образованием дуплекса. Таким образом, дцРНК может быть полностью или частично двухцепочечной. Специфической модуляции экспрессии гена можно достичь при стабильной экспрессии шпилечных структур дцРНК в трансгенных клеточных линиях (Hammond et al, (1991) Nat. Rev. Genet., 2, 110-119; Matzke et al, (2001) Curr. Opin. Genet. Dev., 11, 221-227; Sharp, (2001) Genes Dev., 15, 485-490). При образовании из двух цепей, или одной цепи, которая принимает форму самокомплементарной молекулы шпилечного типа, которая отгибается на себя с образованием дуплекса, две цепи (или образующие дуплекс участки одной цепи) являются комплементарными цепями РНК, которые подвергаются спариванию оснований способом Уотсона-Крика.
После введения в систему соединения настоящего изобретения могут индуцировать действие одного или нескольких ферментов или структурных белков для осуществления расщеплении или другой модификации нуклеиновой кислоты-мишени или могут функционировать через основанный на захвате механизм. В общем, нуклеиновые кислоты (в том числе олигонуклеотиды) можно охарактеризовать как «ДНК-подобные» (т.е. обычно имеющие один или несколько 2'-дезоксисахаров и обычно основания T, а не U) или «РНК-подобные» (т.е. обычно имеющие один или несколько сахаров с 2'-гидроксилом или 2'-модифицированных сахаров и обычно основания U, а не T). Спирали нуклеиновых кислот могут принимать более чем один тип структуры, чаще всего A- и B-формы. Полагают, что, в общем, олигонуклеотиды, которые имеют структуру вроде B-формы, являются «ДНК-подобными», а олигонуклеотиды, которые имеют структуру вроде A-формы, являются «РНК-подобными». В некоторых (химерных) вариантах осуществления антисмысловое соединение может содержать участки как A-, так и B-формы.
Антисмысловые соединения в соответствии с настоящим изобретением могут включать антисмысловую часть длиной от приблизительно 5 до приблизительно 80 нуклеотидов (т.е. от приблизительно 5 до приблизительно 80 связанных нуклеотидов). Это относится к длине антисмысловой цепи или части антисмыслового соединения. Другими словами, одноцепочечное антисмысловое соединение настоящего изобретения включает от 5 до приблизительно 80 нуклеотидов, а двухцепочечное антисмысловое соединение настоящего изобретения (такое как дцРНК, например) включает смысловую цепь и антисмысловую цепь или часть длиной от 5 до приблизительно 80 нуклеотидов. Специалисту со средним уровнем компетентности в данной области техники будет понятно, что этим охватываются антисмысловые части длиной 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79 или 80 нуклеотидов, или любой диапазон внутри указанного диапазона.
В одном варианте осуществления антисмысловые соединения настоящего изобретения имеют антисмысловые части длиной от 10 до 50 нуклеотидов. Специалисту со средним уровнем компетентности в данной области техники будет понятно, что этим охватываются олигонуклеотиды, имеющие антисмысловые части длиной 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 или 50 нуклеотидов, или любой диапазон внутри указанного диапазона. В некоторых вариантах осуществления длина олигонуклеотидов составляет 15 нуклеотидов.
В одном варианте осуществления антисмысловые или олигомерные соединения настоящего изобретения имеют антисмысловые части длиной от 12 или 13 до 30 нуклеотидов. Специалисту со средним уровнем компетентности в данной области техники будет понятно, что этим охватываются антисмысловые соединения, имеющие антисмысловые части длиной 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 нуклеотидов, или любой диапазон внутри указанного диапазона.
В другом предпочтительном варианте осуществления олигомерные соединения настоящего изобретения также включают варианты, в которых присутствует отличное основание в одном или нескольких положениях нуклеотидов соединения. Например, если первым нуклеотидом является аденозин, можно создать варианты, которые содержат тимидин, гуанозин или цитидин в этом положении. Это можно выполнить в любом из положений антисмысловых соединений или соединений в виде дцРНК. Эти соединения затем проверяют, используя описываемые здесь способы, для определения их способности к ингибированию экспрессии нуклеиновой кислоты-мишени.
В некоторых вариантах осуществления гомология, идентичность или комплементарность по последовательности между антисмысловым соединением и мишенью составляет от приблизительно 40% до приблизительно 60%. В некоторых вариантах осуществления гомология, идентичность или комплементарность по последовательности составляет от приблизительно 60% до приблизительно 70%. В некоторых вариантах осуществления гомология, идентичность или комплементарность по последовательности составляет от приблизительно 70% до приблизительно 80%. В некоторых вариантах осуществления гомология, идентичность или комплементарность по последовательности составляет от приблизительно 80% до приблизительно 90%. В некоторых вариантах осуществления гомология, идентичность или комплементарность по последовательности составляет приблизительно 90%, приблизительно 92%, приблизительно 94%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98%, приблизительно 99% или приблизительно 100%.
В другом предпочтительном варианте осуществления антисмысловые олигонуклеотиды, такие как, например, молекулы нуклеиновых кислот, представленные в SEQ ID NO: 16-36, включают одну или несколько замен или модификаций. В одном варианте осуществления нуклеотиды замещены замкнутыми нуклеиновыми кислотами (LNA).
В другом предпочтительном варианте осуществления олигонуклеотиды нацелены на один или несколько участков молекул нуклеиновых кислот - смысловой и/или антисмысловой цепей кодирующих и/или некодирующих последовательностей, связанных с геном-супрессором опухолей, и последовательностей, представленных как SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 и 15. Олигонуклеотиды также нацелены на перекрывающиеся участки SEQ ID NO: 1-15.
Некоторые предпочтительные олигонуклеотиды этого изобретения являются химерными олигонуклеотидами. В контексте этого изобретения «химерные олигонуклеотиды» или «химеры» представляют собой олигонуклеотиды, которые содержат два или более химически отличающихся участков, каждый из которых состоит
из по меньшей мере одного нуклеотида. Эти олигонуклеотиды типично содержат по меньшей мере один участок модифицированных нуклеотидов, который придает одно или несколько полезных свойств (таких как, например, повышенная устойчивость к нуклеазам, увеличенное поступление в клетки, увеличенное сродство связывания с мишенью), и участок, который является субстратом для ферментов, способных к расщеплению гибридов РНК:ДНК или РНК:РНК. В качестве примера, РНКаза Н является клеточной эндонуклеазой, которая расщепляет цепь РНК дуплекса РНК:ДНК. Следовательно, активация РНКазы Н приводит к расщеплению РНК-мишени, увеличивая значительно, тем самым, эффективность антисмысловой модуляции экспрессии гена. Следовательно, сопоставимые результаты можно часто получить с использованием более коротких олигонуклеотидов, когда используются химерные олигонуклеотиды, по сравнению с олигодезоксинуклеотидами с фосфоротиоатными связями, гибридизующимися с тем же участком-мишенью. Расщепление РНК-мишени можно в установленном порядке выявить с помощью гель-электрофореза и, в случае необходимости, методов гибридизации связываемых нуклеиновых кислот, известных в данной области техники. В одном предпочтительном варианте осуществления химерный олигонуклеотид включает по меньшей мере один участок, модифицированный для увеличения сродства связывания с мишенью, и обычно участок, который функционирует как субстрат для РНКазы Н. Сродство олигонуклеотидов к своей мишени (в этом случае нуклеиновой кислоте, кодирующей ras) в установленном порядке определяют с помощью измерения Tm пары олигонуклеотид/мишень, которая является температурой, при которой олигонуклеотид и мишень подвергаются диссоциации; диссоциацию выявляют спектрофотометрически. Чем выше Tm, тем выше сродство олигонуклеотида к мишени.
Химерные антисмысловые соединения настоящего изобретения могут быть образованы в виде смешанных структур из двух или более олигонуклеотидов, модифицированных олигонуклеотидов, олигонуклеозидов и/или миметиков олигонуклеотидов, описанных выше. Такие соединения также упоминались в данной области техники как гибриды или олигомеры с пропусками. Репрезентативные патенты Соединенных Штатов, в которых приведены наставления в отношении приготовления таких гибридных структур, включают, но без ограничения, патенты США № 5013830; 5149797; 5220007; 5256775; 5366878; 5403711; 5491133; 5565350; 5623065; 5652355; 5652356 и 5700922, каждый из которых включен сюда посредством ссылки.
В другом предпочтительном варианте осуществления участок олигонуклеотида, который является модифицированным, включает по меньшей мере один нуклеотид, модифированный в 2'-положении сахара, наиболее предпочтительно нуклеотид, модифицированный присоединением 2'-O-алкила, 2'-O-алкил-O-алкила или 2'-фтора. В других предпочтительных вариантах осуществления модификации РНК включают модификации в виде 2'-фтор, 2'-амино и 2'-O-метил на рибозе пиримидинов, остатки с удаленными азотистыми основаниями или инвертированное основание на 3'-конце РНК. Такие модификации в установленном порядке включают в олигонуклеотиды, и установлено, что эти олигонуклеотиды имеют более высокую Tm (т.е. более высокое сродство связывания с мишенью), чем 2'-дезоксиолигонуклеотиды относительно конкретной мишени. В результате такого увеличения сродства значительно усиливается ингибирование экспрессии гена под действием участвующих в РНК-интерференции олигонуклеотидов. РНКаза Н является клеточной эндонуклеазой, которая расщепляет цепь РНК дуплекса РНК:ДНК; следовательно, активация этого фермента приводит к расщеплению РНК-мишени и поэтому может значительно увеличить эффективность ингибирования при РНК-интерференции. Расщепление РНК-мишени можно в установленном порядке продемонстрировать с помощью гель-электрофореза. В другом предпочтительном варианте осуществления химерный олигонуклеотид также является модифицированным для увеличения устойчивости к нуклеазам. Клетки содержат ряд экзо- и эндонуклеаз, которые могут деградировать нуклеиновые кислоты. Установлено, что ряд модификаций нуклеотидов и нуклеозидов делают олигонуклеотид, в который они введены, более устойчивым к расщеплению нуклеазами, чем природные олигодезоксинуклеотиды. Устойчивость к нуклеазам в установленном порядке определяют посредством инкубации олигонуклеотидов с клеточными экстрактами или растворами выделенных нуклеаз и измерения степени интактного олигонуклеотида, остающегося с течением времени, обычно с помощью гель-электрофореза. Олигонуклеотиды, которые были модифицированы для увеличения их устойчивости к нуклеазам, остаются интактными в течение большего периода времени, чем не модифицированные олигонуклеотиды. Установлено, что ряд модификаций олигонуклеотидов увеличивают или придают устойчивость к нуклеазам. Олигонуклеотиды, которые содержат по меньшей мере одну модификацию в виде фосфоротиоата, являются в настоящей момент более предпочтительными. В некоторых случаях модификации олигонуклеотидов, которые увеличивают сродство связывания с мишенью, также, независимо, способны к увеличению устойчивости к нуклеазам. Некоторые желательные модификации можно найти в De Mesmaeker et al. (1995) Ace. Chem. Res., 28: 366-374.
Конкретные примеры некоторых предпочтительных олигонуклеотидов, предусматриваемых в случае этого изобретения, включают олигонуклеотиды, включающие модифицированные остовы, например, фосфоротиоаты, фосфоротриэфиры, метилфосфонаты, короткоцепочечные алкильные или циклоалкильные связи между сахарами или короткоцепочечные, включающие гетероатом(ы) или гетероцикл(ы) связи между сахарами. Наиболее предпочтительными являются олигонуклеотиды с фосфоротиоатными остовами и олигонуклеотиды с включающими гетероатом(ы) остовами, в частности, CH2--NH--O--CH2, CH--N(CH3)--O-CH2 [известный как метиленовый (метилиминосодержащий) или MMI-остов], остовы CH2--O--N(CH3)--CH2, CH2-N(CH3)--N(CH3)--CH2 и O--N(CH3)--CH2--CH2, в которых природный фосфодиэфирный остов представлен в виде в виде O-P-O-CH2-). Также предпочтительными являются амидные остовы, описанные в De Mesmaeker et al. (1995) Ace. Chem. Res. 28: 366-374. Также предпочтительными являются олигонуклеотиды, имеющие морфолиновые остовные структуры (Summerton and Weller, патент США № 5034506). В других предпочтительных вариантах осуществления, таких как остов из пептидонуклеиновых кислот (ПНК), фосфодиэфирный остов олигонуклеотида замещен полиамидным остовом, при этом нуклеотиды связаны непосредственно или опосредованно с атомами аза-азота полиамидного остова (Nielsen et al. (1991) Science 254, 1497). Олигонуклеотиды могут также включать одну или несколько замещенных сахарных составляющих. Предпочтительные олигонуклеотиды включают один из следующих заместителей в 2'-положении: OH, SH, SCH3, F, OCN, OCH3OCH3, OCH3O(CH2)nCH3, O(CH2)nNH2 или O(CH2)nCH3, где n является числом от 1 до приблизительно 10; C1-C10 низший алкил, алкоксиалкокси, замещенный низший алкил, алкарил или аралкил; Cl; Br; CN; CF3; OCF3; O--, S-- или N-алкил; O--, S-- или N-алкенил; SOCH3; SO2CH3; ONO2; NO2; N3; NH2; гетероциклоалкил; гетероциклоалкарил; аминоалкиламино; полиалкиламино; замещенный силил; расщепляющую РНК группу; группу рекомбинантного генератора сигнала о супрессоре опухолей; интеркалятор; группу для улучшения фармакокинетических свойств олигонуклеотида или группу для улучшения фармакодинамических свойств олигонуклеотида и другие заместители, имеющие схожие свойства. Предпочтительная модификация включает 2'-метоксиэтокси [2'-O-CH2CH2OCH3, также известный как 2'-O-(2-метоксиэтил)] (Martin et al, (1995) Helv. Chim. Acta, 78, 486). Другие предпочтительные модификации включают 2'-метокси (2'-O--CH3), 2'-пропокси (2'-OCH2CH2CH3) и 2'-фтор (2'-F). Схожие модификации могут быть также осуществлены в других положениях олигонуклеотида, в частности, в 3'-положении сахара в 3'-концевом нуклеотиде и в 5'-положении 5'-концевого нуклеотида. Олигонуклеотиды могут также включать миметики сахаров, такие как циклобутилы вместо пентофуранозильной группы.
Олигонуклеотиды могут также включать, дополнительно или альтернативно, модификации или замены нуклеинового основания (часто называемого в данной области техники просто «основанием»). Как здесь используются, «немодифицированные» или «природные» нуклеотиды включают аденин (A), гуанин (G), тимин (T), цитозин (C) и урацил (U). Модифицированные нуклеотиды включают нуклеотиды, обнаруживаемые лишь в редких случаях или мимолетно в природных нуклеиновых кислотах, например, пироксантин, 6-метиладенин, 5-метилпиримидины, в частности, 5-метилцитозин (также называемый 5-метил-2'-дезоксицитозином и часто упоминаемый в данной области техники как 5-Me-C), 5-гидроксиметилцитозин (HMC), гликозил-HMC и гентобиозил-HMC, а также синтетические нуклеотиды, например, 2-аминоаденин, 2- (метиламино)аденин, 2-(имидазолилалкил)аденин, 2-(аминоалкиламино)аденин или другие гетерозамещенные алкиладенины, 2-тиоурацил, 2-тиотимин, 5-бромурацил, 5-гидроксиметилурацил, 8-азагуанин, 7-деазагуанин, N6(6-аминогексил)аденин и 2,6-диаминопурин (Kornberg, A., DNA Replication, W. H. Freeman & Co., San Francisco, 1980, pp.75-77; Gebeyehu, G., (1987) et al. Nucl. Acids Res. 15: 4513). Может быть включено «универсальное» основание, известное в данной области техники. Установлено, что замены на 5-Me-C повышают стабильность дуплекса из нуклеиновых кислот на 0,6-1,2°C (Sanghvi, Y. S., in Crooke, S.T. and Lebleu, B., eds., Antisense Research and Applications, CRC Press, Boca Raton, 1993, pp. 276-278) и в настоящее время являются предпочтительными заменами оснований.
Другая модификация олигонуклеотидов настоящего изобретения включает химическое соединение с олигонуклеотидом одной или нескольких составляющих или конъюгатов, которые усиливают активность или поступление в клетки олигонуклеотида. Такие составляющие включают, но без ограничения, липидные составляющие, такие как холестериновая составляющая (Letsinger et al, (1989) Proc. Natl. Acad. Sci. USA 86, 6553), холевую кислоту (Manoharan et al (1994) Bioorg. Med. Chem. Let. 4, 1053), тиоэфир, например, гексил-S-тритилтиол (Manoharan et al. (1992) Ann. NY. Acad. Sci. 660, 306; Manoharan et al. (1993) Bioorg. Med. Chem. Let. 3, 2765), тиохолестерин (Oberhauser et al., (1992) Nucl. Acids Res. 20, 533), алифатическую цепь, например, додекандиольные или ундецильные остатки (Saison-Behmoaras et al. EMBO J. 1991, 10, 111; Kabanov et al. (1990) FEBS Lett. 259, 327; Svinarchuk et al. (1993) Biochimie 75, 49), фосфолипид, например, дигексадецил-rac-глицерин или триэтиламмония 1,2-ди-O-гексадецил-rac-глицеро-3-H-фосфонат (Manoharan et al. (1995) Tetrahedron Lett. 36, 3651; Shea et al. (1990) Nucl. Acids Res. 18, 3777), полиамин или цепь полиэтиленгликоля (Manoharan et al. (1995) Nucleosides & Nucleotides, 14, 969) или адамантан-уксусную кислоту (Manoharan et al. (1995) Tetrahedron Lett. 36, 3651). Олигонуклеотиды, включающие липофильные составляющие, и способы приготовления таких олигонуклеотидов известны в данной области техники, например, из патентов США № 5138045, 5218105 и 5459255.
Не требуется, чтобы все положения в конкретном олигонуклеотиде были единообразно модифицированными, и в действительного более чем одна из вышеотмеченных модификаций может быть включена в один олигонуклеотид или даже в один нуклеозид внутри олигонуклеотида. Настоящее изобретение также включает олигонуклеотиды, которые являются химерными олигонуклеотидами, определенными выше.
В другом варианте осуществления молекула нуклеиновой кислоты настоящего изобретения конъюгирована с другой составляющей, включающей, но без ограничения, нуклеотиды с удаленными азотистыми основаниями, полиэфир, полиамин, полиамиды, пептиды, углероды, липид или полиуглеводородные соединения. Квалифицированным в данной области техники специалистам будет понятно, что эти молекулы можно связать с одним или несколькими из любых нуклеотидов в составе молекулы нуклеиновой кислоты, в нескольких положениях на сахаре, основании или фосфатной группе.
Олигонуклеотиды, используемые в соответствии с этим изобретением, можно в удобном и установленном порядке приготовить благодаря широко известному методу твердофазного синтеза. Оборудование для такого синтеза продается несколькими фирмами-поставщиками, такими как Applied Biosystems. Можно также использовать любой другой способ такого синтеза; фактический синтез олигонуклеотидов полностью находится в пределах способностей специалиста со средним уровнем компетентности в данной области техники. Использование схожих методов для приготовления других олигонуклеотидов, таких как фосфоротиоаты и алкилированные производные, также хорошо известно. Также хорошо известно использование схожих методов и имеющихся в продаже модифицированных амидитов и продуктов из стекла с контролируемым размером пор (CPG), таких как модифицированные присоединением биотина, флуоресцеина, акридина или псоралена амидиты и/или CPG (доступные от Glen Research, Sterling VA), для синтеза флуоресцентно меченных, биотинилированных или других модифицированных олигонуклеотидов, таких как модифицированные присоединением холестерина олигонуклеотиды.
В соответствии с настоящим изобретением обеспечивается использование модификаций, например, использование мономеров LNA для усиления активности, специфичности и продолжительности действия и расширения путей введения олигонуклеотидов, в составе находящихся в обращении химических технологий, таких как MOE, ANA, FANA, PS и т.д. (Uhlman, et al. (2000) Current Opinions in Drug Discovery & Development Vol. 3 No 2). Это можно успешно выполнить посредством замены некоторых из мономеров в существующих олигонуклеотидах мономерами LNA. LNA-модифицированные олигонуклеотиды могут иметь размер, схожий с таковым исходного соединения, или могут быть больше или предпочтительного меньше. Предпочтительно, чтобы такие LNA-модифицированные олигонуклеотиды содержали менее чем приблизительно 70%, более предпочтительно менее чем приблизительно 60%, наиболее предпочтительно менее чем приблизительно 50% мономеров LNA, и чтобы их размеры находились между приблизительно 5 и 25 нуклеотидами, более предпочтительно меду приблизительно 12 и 20 нуклеотидами.
Предпочтительные модифицированные остовы олигонуклеотидов включают, но без ограничения, фосфоротиоаты, хиральные фосфоротиоаты, фосфородитиоаты, фосфотриэфиры, аминоалкилфосфотриэфиры, метилфосфонаты и другие алкилфосфонаты, включающие 3'-алкиленфосфонаты и хиральные фосфонаты, фосфинаты, фосфорамидаты, включающие 3'-аминофосфорамидат и аминоалкилфосфорамидаты, тионофосфорамидаты, тионоалкилфосфонаты, тионоалкилфосфотриэфиры и борфосфаты, имеющие обычные 3'-5' связи, их 2'-5'-связанные аналоги и аналоги, имеющие обратную полярность, при которой соседние пары нуклеотидных единиц соединены так, что пара, имеющая 3'-5'-связь, соединена с парой, имеющей 5'-3'-связь, или пара, имеющая 2'-5', с парой, имеющей 5'-2'. Также включены различные соли, смешанные соли и формы свободных кислот.
Репрезентативные патенты Соединенных Штатов, в которых приведены наставления в отношении создания вышеотмеченных фосфорсодержащих связей, включают, но без ограничения, патенты США № 3687808; 4469863; 4476301; 5023243; 5177196; 5188897; 5264423; 5276019; 5278302; 5286717; 5321131; 5399676; 5405939; 5453496; 5455233; 5466677; 5476925; 5519126; 5536821; 5541306; 5550111; 5563253; 5571799; 5587361 и 5625050, каждый из которых включен сюда посредством ссылки.
Предпочтительные модифицированные остовы олигонуклеотидов, которые не включают в себе атом фосфора, имеют остовы, которые образованы короткоцепочечными алкильными или циклоалкильными межнуклеозидными связями; смешанными, включающими гетероатом(ы) и алкил или циклоалкил межнуклеозидными связями; или одной или несколькими короткоцепочечными включающими гетероатом(ы) или гетероцикл(ы) межнуклеозидными связями. Они включают те, которые имеют морфолино-связи (образованные отчасти из сахарной части нуклеозида); силоксановые остовы; сульфид, сульфоксидные и сульфоновые остовы; формацетильные и тиоформацетильные остовы; метиленформацетильные и тиоформацетильные остовы; алкиленсодержащие остовы; сульфаматные остовы; метилениминовые и метиленгидразиновые остовы; сульфонатные и сульфоамидные остовы; амидные остовы и другие, имеющие комплексные компоненты N, O, S и CH2.
Репрезентативные патенты Соединенных Штатов, в которых приведены наставления в отношении приготовления вышеотмеченных олигонуклеотидов, включают, но без ограничения, патенты США № 5034506; 5166315; 5185444; 5214134; 5216141; 5235033; 5264562; 5264564; 5405938; 5434257; 5,466,677; 5470967; 5489677; 5541307; 5561225; 5596086; 5602240; 5610289; 5602240; 5608046; 5610289; 5618704; 5623070; 5663312; 5633360; 5677437 и 5677439, каждый из которых включен сюда посредством ссылки.
В других предпочтительных миметиках олигонуклеотидов новыми группами замещают как сахар, так и межнуклеозидную связь, т.е. остов, нуклеотидных единиц. Единицы в виде оснований сохраняют, чтобы обеспечить гибридизацию с соответствующим соединением в виде нуклеиновой кислоты-мишени. Одно такое олигомерное соединение, миметик олигонуклеотида, который, как установлено, обладает превосходными гибридизациоными свойствами, называют пептидонуклеиновой кислотой (ПНК). В соединениях ПНК полисахаридный остов олигонуклеотида замещен амидсодержащим остовом, в частности, аминоэтилглициновым остовом. Нуклеиновые основания сохранены и соединены непосредственно или опосредованно с атомами аза-азота амидной части остова. Репрезентативные патенты Соединенных Штатов, в которых приведены наставления в отношении приготовления соединений ПНК, включают, но без ограничения, патенты США № 5539082; 5714331 и 5719262, каждый из которых включен сюда посредством ссылки. Дальнейшие наставления в отношении компонентов ПНК можно найти в Nielsen, et al. (1991) Science 254, 1497-1500.
В другом предпочтительном варианте осуществления настоящего изобретения обеспечиваются олигонуклеотиды с фосфоротиоатными остовами и олигонуклеотиды с остовами, включающими гетероатом(ы), и в частности -CH2-NH-O-CH2-, -CH2-N(CH3)-O-CH2-, известным как метиленовый (метилиминосодержащий) или MMI-остов, -CH2-O-N(CH3)-CH2-, -CH2N(CH3)-N(CH3)CH2- и -O-N(CH3)-CH2-CH2-, в которых природный фосфодиэфирный остов представлен в виде O-P-O-CH2-, упомянутого выше патента США № 5489677 и амидными остовами упомянутого выше патента США № 5602240. Также предпочтительными являются олигонуклеотиды, имеющие морфолиновые остовные структуры упомянутого выше патента США № 5034506.
Модифицированные олигонуклеотиды могут также содержать одну или несколько замещенных сахарных составляющих. Предпочтительные олигонуклеотиды включают один из следующих заместителей в 2'-положении: OH; F; O-, S- или N-алкил; O-, S- или N-алкенил; O-, S- или N-алкинил; или O-алкил-O-алкил, причем алкил, алкенил и алкинил могут быть замещенным или незамещенным C1-C10 алкилом или C2-C10 алкенилом и алкинилом. Особенно предпочтительными являются O(CH2)nOmCH3, O(CH2)nOCH3, O(CH2)nNH2, O(CH2)nCH3, O(CH2)nONH2 и O(CH2)n[ON(CH2)nCH3)]2, где n и m могут быть числами от 1 до приблизительно 10. Другие предпочтительные олигонуклеотиды содержат в 2'-положении один из следующих заместителей: C1-C10 низший алкил, замещенный низший алкил, алкарил, O-алкарил или O-аралкил, SH, SCH3, OCN, Cl, Br, CN, CF3, OCF3, SOCH3, SO2CH3, ONO2, NO2, N3, NH2, гетероциклоалкил, гетероциклоалкарил, аминоалкиламино, полиалкиламино, замещенный силил, расщепляющую РНК группу; группу рекомбинантного генератора сигнала о супрессоре опухолей; интеркалятор; группу для улучшения фармакокинетических свойств олигонуклеотида или группу для улучшения фармакодинамических свойств олигонуклеотида и другие заместители, имеющие схожие свойства. Предпочтительная модификация включает 2'-метоксиэтокси (2'-O-CH2CH2OCH3, также известный как 2'-O-(2-метоксиэтил) или 2'-MOE) (Martin et al, (1995) Helv. Chim. Acta, 78, 486-504), т.е. алкоксиалкоксигруппу. Дальнейшие предпочтительные модификации включают 2'-диметиламинооксиэтокси, т.е. группу O(CH2)2ON(CH3)2, также известную как 2'-DMAOE, как описывается здесь далее в примерах, и 2'-диметиламиноэтоксиэтокси (также известный в данной области техники как 2'-O-диметиламиноэтоксиэтил или 2'-DMAEOE), т.е. 2'-O-CH2-O-CH2-N(CH2)2.
Другие предпочтительные модификации включают 2'-метокси (2'-O-CH3), 2'-аминопропокси (2'-OCH2CH2CH2NH2) и 2'-фтор (2'-F). Схожие модификации могут быть также осуществлены в других положениях олигонуклеотида, в частности, в 3'-положении сахара в 3'-концевом нуклеотиде или 2'-5' связях олигонуклеотидов, и в 5'-положении 5'-концевого нуклеотида. Олигонуклеотиды могут также включать миметики сахаров, такие как циклобутилы вместо пентофуранозильной молекулы сахара. Репрезентативные патенты Соединенных Штатов, в которых приведены наставления в отношении приготовления таких модифицированных сахарных структур, включают, но без ограничения, патенты США № 4981957; 5118800; 5319080; 5359044; 5393878; 5446137; 5466786; 5514785; 5519134; 5567811; 5576427; 5591722; 5597909; 5610300; 5627053; 5639873; 5646265; 5658873; 5670633 и 5700920, каждый из которых включен сюда посредством ссылки.
Олигонуклеотиды могут также включать модификации или замены нуклеинового основания (часто называемого в данной области техники просто «основанием»). Как здесь используются, «немодифицированные» или «природные» нуклеотиды включают пуриновые основания аденин (A) и гуанин (G) и пиримидиновые основания тимин (T), цитозин (C) и урацил (U). Модифицированные нуклеотиды включают другие синтетические и природные нуклеотиды, такие как 5-метилцитозин (5-Me-C), 5-гидроксиметилцитозин, ксантин, гипоксантин, 2-аминоаденин, 6-метиладенин и 6-метилгуанин и другие алкильные производные аденина и гуанина, 2-пропиладенин и 2-пропилгуанин и другие алкильные производные аденина и гуанина, 2-тиоурацил, 2-тиотимин и 2-тиоцитозин, 5-галогенурацил и -цитозин, 5-пропинилурацил и -цитозин, 6-азаурацил, -цитозин и -тимин, 5-урацил (псевдоурацил), 4-тиоурацил, 8-галоген-, 8-амино-, 8-тиол-, 8-тиоалкил, 8-гидрокси и другие 8-замещенные аденины и гуанины, 5-галоген-, в частности 5-бром-, 5-трифторметил- и другие 5-замещенные урацилы и цитозины, 7-метилгуанин и 7-метиладенин, 8-азагуанин и 8-азааденин, 7-деазагуанин и 7-деазааденин, и 3-деазагуанин и 3-деазааденин.
Кроме того, нуклеотиды включают нуклеотиды, описанные в патенте США № 3687808, нуклеотиды, описанные в 'The Concise Encyclopedia of Polymer Science And Engineering', pages 858-859, Kroschwitz, J.I., ed. John Wiley & Sons, 1990, нуклеотиды, описанные Englisch и др. в 'Angewandle Chemie, International Edition', 1991, 30, page 613, и нуклеотиды, описанные в Sanghvi, Y. S., Chapter 15, 'Antisense Research and Applications', pages 289-302, Crooke, S.T. and Lebleu, B. ea., CRC Press, 1993. Некоторые их этих нуклеотидов особенно полезны для увеличения сродства связывания олигомерных соединений настоящего изобретения. Они включают 5-замещенные пиримидины, 6-азапиримидины и N-2-, N-6- и O-6-замещенные пурины, в том числе 2-аминопропиладенин, 5-пропинилурацил и 5-пропинилцитозин. Установлено, что замены на 5-метилцитозин повышают стабильность дуплекса из нуклеиновых кислот на 0,6-1,2°C (Sanghvi, Y.S., Crooke, S.T. and Lebleu, B., eds, Antisense Research and Applications', CRC Press, Boca Raton, 1993, pp. 276-278) и в настоящее время являются предпочтительными заменами оснований, даже предпочтительнее в сочетании с модификациями присоединением к сахару 2'-O-метоксиэтила.
Репрезентативные патенты Соединенных Штатов, в которых приведены наставления в отношении приготовления вышеотмеченных модифицированных нуклеотидов, а также других модифицированных нуклеотидов, включают, но без ограничения, патент США № 3687808, а также 4845205; 5130302; 5134066; 5175273; 5367066; 5432272; 5457187; 5459255; 5484908; 5502177; 5525711; 5552540; 5587469; 5596091; 5614617; 5750692 и 5681941, каждый из которых включен сюда посредством ссылки.
Другая модификация олигонуклеотидов настоящего изобретения включает химическое соединение с олигонуклеотидом одной или нескольких составляющих или конъюгатов, которые усиливают активность, клеточное распределение или поступление в клетки олигонуклеотида.
Такие составляющие включают, но без ограничения, липидные составляющие, такие как холестериновая составляющая (Letsinger et al, (1989) Proc. Natl. Acad. Sci. USA 86, 6553-6556), холевую кислоту (Manoharan et al (1994) Bioorg. Med. Chem. Let. 4, 1053-1060), тиоэфир, например, гексил-S-тритилтиол (Manoharan et al. (1992) Ann. NY. Acad. Sci. 660, 306-309; Manoharan et al. (1993) Bioorg. Med. Chem. Let. 3, 2765-2770), тиохолестерин (Oberhauser et al., (1992) Nucl. Acids Res. 20, 533-538), алифатическую цепь, например, додекандиольные или ундецильные остатки (Kabanov et al. (1990) FEBS Lett. 259, 327-330; Svinarchuk et al. (1993) Biochimie 75, 49-54), фосфолипид, например, дигексадецил-rac-глицерин или триэтиламмония 1,2-ди-O-гексадецил-rac-глицеро-3-H-фосфонат (Manoharan et al. (1995) Tetrahedron Lett. 36, 3651-3654; Shea et al. (1990) Nucl. Acids Res. 18, 3777-3783), полиамин или цепь полиэтиленгликоля (Mancharan et al. (1995) Nucleosides & Nucleotides, 14, 969-973) или адамантан-уксусную кислоту (Manoharan et al. (1995) Tetrahedron Lett. 36, 3651-3654), пальмитильную составляющую (Mishra et al, (1995) Biochim. Biophys. Acta, 1264, 229-237) или октадециламин, или гексиламинокарбонил-оксихолестериновую составляющую (Crooke et al, (1996) J. Pharmacol. Exp. Ther., 277, 923-937).
Репрезентативные патенты Соединенных Штатов, в которых приведены наставления в отношении приготовления таких конъюгатов олигонуклеотидов, включают, но без ограничения, патенты США № 4828979, 4948882, 5218105, 5525465, 5541313, 5545730, 5552538, 5578717, 5580731, 5580731, 5591584, 5109124, 5118802, 5138045, 5414077, 5486603, 5512439, 5578718, 5608046, 4587044, 4605735, 4667025, 4762779, 4789737, 4824941, 4835263, 4876335, 4904582, 4958013, 5082830, 5112963, 5214136, 5082830, 5112963, 5214136, 5245022, 5254469, 5258506, 5262536, 5272250, 5292873, 5317098, 5371241, 5391723, 5416203, 5451463, 5510475, 5512667, 5514785, 5565552, 5567810, 5574142, 5585481, 5587371, 5595726, 5597696, 5599923, 5599928 и 5688941, каждый из которых включен сюда посредством ссылки.
Поиск новых лекарств: Соединения настоящего изобретения могут также применяться в областях поиска новых лекарств и подтверждения правильности выбора мишени. В настоящем изобретении подразумевается использование соединений и предпочтительных сегментов-мишеней, идентифицированных здесь при попытках поиска новых лекарств, для выявления связей, которые существуют между полинуклеотидами генов-супрессоров опухолей и болезненным состоянием, фенотипом или состоянием. Эти способы включают выявление или модулирование полинуклеотидов генов-супрессоров опухолей, включающее контактирование образца, ткани, клетки или организма с соединениями настоящего изобретения, измерение полинуклеотидов генов-супрессоров опухолей на уровне нуклеиновых кислот или белковом уровне и/или связанного фенотипического или химического конечного показателя в некоторый момент времени после лечения и необязательно сравнение измеренной величины с не подвергнутым обработке образцом или образцом, обработанным дополнительным соединением настоящего изобретения. Эти способы могут также выполняться параллельно или в сочетании с другими экспериментами для определения функции неизвестных генов в случае процесса подтверждения правильности выбора мишени или для определения правильности выбора продукта конкретного гена в качестве мишени для лечения или предупреждения конкретного заболевания, состояния или фенотипа.
Оценка повышения или ингибирования экспрессии гена:
Перенос экзогенной нуклеиновой кислоты в клетку- или организм-хозяина можно определить посредством прямого выявления присутствия нуклеиновой кислоты в клетке или организме. Такое выявление можно успешно выполнить несколькими способами, хорошо известными в данной области техники. Например, присутствие экзогенной нуклеиновой кислоты можно выявить с помощью блоттинга по Саузерну или с помощью метода с использованием полимеразной цепной реакции (ПЦР), используя праймеры, которые позволяют специфически амплифицировать нуклеотидные последовательности, связанные с нуклеиновой кислотой. Экспрессию экзогенных нуклеиновых кислот можно также измерить с использованием общепринятых способов, включающих анализ экспрессии генов. Например, мРНК, продуцируемую с экзогенной нуклеиновой кислоты, можно выявить и количественно проанализировать, используя Нозерн-блоттинг и ПЦР с использованием обратной транскрипции (ОТ-ПЦР).
Экспрессию РНК с экзогенной нуклеиновой кислоты можно также выявить посредством измерения ферментативной активности или активности белка-репортера. Например, модулирующую активность антисмысловой молекулы можно определить опосредованно в виде понижения или повышения экспрессии нуклеиновой кислоты-мишени в качестве показателя того, что экзогенная нуклеиновая кислота продуцирует эффекторную РНК. На основе консерватизма последовательностей можно разработать и использовать для амплификации кодирующих областей генов-мишеней праймеры. Сначала для построения модельного контрольного гена может использоваться кодирующая область, подвергаемая самой высокой экспрессии, из каждого гена, хотя может использовать любая кодирующая или некодирующая область. Каждый контрольный ген собирают посредством встраивания каждой кодирующей области между кодирующей репортер областью и ее поли(А) сигналом. Эти плазмиды могли бы продуцировать мРНК с гена рекомбинантного генератора сигнала о супрессоре опухолей в 5’ части гена и потенциальную мишень РНК-интерференции в 3’ некодирующей области. Эффективность отдельных антисмысловых олигонуклеотидов можно было бы проанализировать по модуляции гена рекомбинантного генератора сигнала о супрессоре опухолей. Гены рекомбинантного генератора сигнала о супрессоре опухолей, применимые в способах настоящего изобретения, включают синтазу ацетогидроксикислот (AHAS), щелочную фосфатазу (AP), бета-галактозидазу (LacZ), бета-глюкоронидазу (GUS), хлорамфеникол-ацетилтрансферазу (CAT), зеленый флуоресцентный белок (GFP), красный флуоресцентный белок (RFP), желтый флуоресцентный белок (YFP), голубой флуоресцентный белок (CFP), пероксидазу хрена (HRP), люциферазу (Luc), нопалинсинтазу (NOS), октопинсинтазу (OCS) и их производные. В наличие имеется множество селектируемых маркеров, которые придают резистентность к ампициллину, блеомицину, хлорамфениколу, гентамицину, гигромицину, канамицину, линкомицину, метотрексату, фосфинотрицину, пуромицину и тетрациклину. Способы определения модуляции гена рекомбинантного генератора сигнала о супрессоре опухолей хорошо известны в данной области техники и включают, но без ограничения, флуорометрические способы (например, флуоресцентную спектроскопию, клеточный сортинг с возбуждением флуоресценции (FACS), флуоресцентную микроскопию), определение резистентности к антибиотикам.
Наборы, реагенты для исследования, диагностические и терапевтические средства
Соединения настоящего изобретения могут использоваться для диагностики, терапии и профилактики и в качестве реагентов для исследования и компонентов набора. Кроме того, антисмысловые олигонуклеотиды, которые способны ингибировать экспрессию генов с высокой специфичностью, часть используются специалистами со средним уровнем компетентности для выяснения функции конкретных генов или для проведения различий между функциями различных членов биологического пути.
В случае использования в наборах и диагностических средствах, и в различных биологических системах соединения настоящего изобретения, либо отдельно, либо в комбинации с другими соединениями или терапевтическими средствами, применимы в качестве средств в дифференциальных и/или комбинаторных анализах для выяснения характеров экспрессии части или всего состава генов, экспрессируемых в клетках или тканях.
Используемый здесь термин «биологическая система» или «система» определяют как любой организм, клетка, культура клеток или ткань, которая экспрессирует продукты генов-супрессоров опухолей или сделана компетентной в отношении экспрессии таких продуктов. Они включают, но без ограничения, людей, трансгенных животных, клетки, культуры клеток, ткани, ксенотрансплантаты, трансплантаты и их комбинации.
В качестве одного не ограничивающего примера, характеры экспрессии в клетках или тканях, обработанных одним или несколькими антисмысловыми соединениями, сравнивают с контрольными клетками или тканями, не обработанными антисмысловыми соединениями, и полученные характеры анализируют в отношении дифференциальных уровней экспрессии генов, поскольку они имеют отношение, например, к связи с заболеванием, пути передачи сигналов, клеточной локализации, уровню экспрессии, размеру, структуре или функции исследуемых генов. Эти анализы можно выполнить на подвергнутых стимуляции или не подвергнутых стимуляции клетках и в присутствии или в отсутствие других компонентов, которые влияют на характеры экспрессии.
Примеры способов анализа экспрессии генов, известных в данной области техники, включают ранжированные ряды ДНК или микрочипы (Brazma and Vilo, (2000) FEBS Lett, 480, 17-24; Celis, et al, (2000) FEBS Lett, 480, 2-16), SAGE (последовательный анализ экспрессии генов) (Madden, et al, (2000) Drug Discov. Today, 5, 415-425), READS (амплификацию расщепленных кДНК с использованием рестрикционных ферментов) (Prashar and Weissman, (1999) Methods Enzymol, 303, 258-72), TOGA (общий анализ экспрессии генов) (Sutcliffe, et al, (2000) Proc. Natl. Acad. Sci. U.S.A., 97, 1976-1981), ранжированные ряды белков или протеомику (Celis, et al, (2000) FEBS Lett., 480, 2-16; Jungblut, et al., Electrophoresis, 1999, 20, 2100-2110), секвенирование маркеров экспрессируемых последовательностей (EST) (Celis, et al., FEBS Lett., 2000, 480, 2-16; Larsson, et al., J. BiotechnoL, 2000, 80, 143-157), субтрактивный фингерпринтинг РНК (SuRF) (Fuchs, et al, (2000) Anal. Biochem. 286, 91-98; Larson, et al, (2000) Cytometry 41, 203-208), субтрактивное клонирование, дифференциальный дисплей (DD) (Jurecic and Belmont, (2000) Curr. Opin. Microbiol 3, 316-321), сравнительную геномную гибридизацию (Carulli, et al, (1998) J. Cell Biochem. Suppl, 31, 286-296), методы FISH (флуоресцентной гибридизации in situ) (Going and Gusterson, (1999) Eur. J. Cancer, 35, 1895-1904) и способы масс-спектрометрии (To, Comb. (2000) Chem. High Throughput Screen, 3, 235-241).
Соединения настоящего изобретения применимы для исследования или диагностики, поскольку эти соединения гибридизуются с нуклеиновыми кислотами, кодирующими ген-супрессор опухолей. Например, олигонуклеотиды, которые гибридизуются с такой эффективностью и в таких условиях, которые здесь описываются, чтобы быть эффективными модуляторами гена-супрессора опухолей, являются эффективными праймерами или зондами в условиях, благоприятствующих амплификации или выявлению гена, соответственно. Эти праймеры или зонды применимы в способах, в которых необходимо специфическое выявление молекул нуклеиновых кислот, кодирующих ген-супрессор опухолей, и при амплификации указанных молекул нуклеиновых кислот для выявления или для применения в дальнейших исследованиях гена-супрессора опухолей. Гибридизацию антисмысловых олигонуклеотидов, в частности, праймеров и зондов, настоящего изобретения с нуклеиновой кислотой, кодирующей ген-супрессор опухолей, можно выявить с помощью средства, известного в данной области техники. Такое средство может включать конъюгацию фермента с олигонуклеотидом, мечение олигонуклеотида радиоактивным изотопом или любое другое подходящее средство выявления. Можно также приготовить наборы, в которых используется средство выявления, для определения уровня гена-супрессора опухолей в образце.
Специфичность и чувствительность антисмысловой молекулы также используются в максимальной мере квалифицированными в данной области техники специалистами в случае терапевтических применений. Антисмысловые соединения были использованы в качестве составляющих терапевтических средств при лечении болезненных состояний у животных, в том числе людей. Лекарственные средства в виде антисмысловых олигонуклеотидов вводились без риска и с эффективностью людям, и в настоящее время в процессе проведения находятся многочисленные клинические испытания. Таким образом, установлено, что антисмысловые соединения могут быть полезными терапевтическими средствами, которым можно придать такую форму, которая применима в схемах лечения для лечения клеток, тканей и животных, особенно людей.
В случае терапии животного, предпочтительно человека, с подозрением на наличие заболевания или нарушения, которое можно лечить посредством модулирования экспрессии полинуклеотидов гена-супрессора опухолей, подвергают лечению посредством введения антисмысловых соединений в соответствии с настоящим изобретением. Например, в одном не ограничивающем варианте осуществления способы включают стадию введения нуждающемуся в таком лечении животному терапевтически эффективного количества модулятора гена-супрессора опухолей. Модуляторы гена-супрессора опухолей настоящего изобретения эффективно модулируют активность гена-супрессора опухолей или модулируют экспрессию белка гена-супрессора опухолей. В одном варианте осуществления активность или экспрессия гена-супрессора опухолей у животного ингибируется приблизительно на 10% по сравнению с контролем. Предпочтительно, когда активность или экспрессия гена-супрессора опухолей у животного ингибируется приблизительно на 30%. Более предпочтительно, когда активность или экспрессия гена-супрессора опухолей у животного ингибируется на 50% или более. Таким образом, олигомерные соединения модулируют экспрессию мРНК гена-супрессора опухолей по меньшей мере на 10%, по меньшей мере на 50%, по меньшей мере на25%, по меньшей мере на 30%, по меньшей мере на40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 98%, по меньшей мере на 99% или по меньшей мере на 100% по сравнению с контролем.
В одном варианте осуществления активность или экспрессия гена-супрессора опухолей у животного повышается приблизительно на 10% по сравнению с контролем. Предпочтительно, когда активность или экспрессия гена-супрессора опухолей у животного повышается приблизительно на 30%. Более предпочтительно, когда активность или экспрессия гена-супрессора опухолей у животного повышается на 50% или больше. Таким образом, олигомерные соединения модулируют экспрессию мРНК гена-супрессора опухолей по меньшей мере на 10%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 98%, по меньшей мере на 99% или по меньшей мере на 100% по сравнению с контролем.
Например, понижение экспрессии гена-супрессора опухолей можно определить в сыворотке, крови, жировой ткани, печени или другой жидкости организма, ткани и органе животного. Предпочтительно, когда клетки, содержащиеся в указанных жидкостях, тканях или органах, подвергаемых анализу, содержат молекулу нуклеиновой кислоты, кодирующую пептиды гена-супрессора опухолей и/или сам белок гена-супрессора опухолей.
Соединения настоящего изобретения могут использоваться в фармацевтических композициях при добавлении эффективного количества соединения к подходящему фармацевтически приемлемому разбавителю или носителю. Применение соединений и способы настоящего изобретения могут быть также полезны в профилактическом плане.
Конъюгаты
Другая модификация олигонуклеотидов настоящего изобретения включает химическое соединение с олигонуклеотидом одной или нескольких составляющих или конъюгатов, которые усиливают активность, клеточное распределение или поступление в клетки олигонуклеотида. Эти составляющие или конъюгаты могут включать конъюгатные группы, ковалентно связанные с такими функциональными группами, как первичные или вторичные гидроксильные группы. Конъюгатные группы настоящего изобретения включают интеркаляторы, молекулы рекомбинантных генераторов сигнала о супрессоре опухолей, полиамины, полиамиды, полиэтиленгликоли, полиэфиры, группы, улучшающие фармакодинамические свойства олигомера, и группы, улучшающие фармакокинетические свойства олигомеров. Типичные конъюгатные группы включают холестерины, липиды, фосфолипиды, биотин, феназин, фолат, фенантридин, антрахинон, акридин, флуоресцеины, родамины, кумарины и красители. В контексте настоящего изобретения группы, улучшающие фармакодинамические свойства, включают группы, которые увеличивают поглощение, повышают устойчивость к деградации и/или усиливают специфическую в отношении последовательности гибридизацию с нуклеиновой кислотой-мишенью. В контексте настоящего изобретения группы, улучшающие фармакокинетические свойства, включают группы, которые улучшают поглощение, распределение, метаболизм или выведение соединений настоящего изобретения. Репрезентативные конъюгатные группы описаны в международной заявке на патент № PCT/US92/09196, поданной 23 октября 23, 1992, и в патенте США № 6287860, которые включены сюда посредством ссылки. Конъюгатные составляющие включают, но без ограничения, липидные составляющие, такие как холестериновая составляющая, холевую кислоту, тиоэфир, например, гексил-S-тритилтиол, тиохолестерин, алифатическую цепь, например, додекандиольные или ундецильные остатки, фосфолипид, например, дигексадецил-rac-глицерин или триэтиламмония 1,2-ди-O-гексадецил-rac-глицеро-3-H-фосфонат, полиамин или цепь полиэтиленгликоля, или адамантан-уксусную кислоту, пальмитильную составляющую, или октадециламин, или гексиламинокарбонил-оксихолестериновую составляющую. Олигонуклеотиды настоящего изобретения можно также конъюгировать с активными лекарственными веществами, например, аспирином, варфарином, фенилбутазоном, ибупрофеном, супрофеном, фенбуфеном, кетопрофеном, (S)-(+)-пранопрофеном, карпрофеном, дансилсаркозином, 2,3,5-трийодбензойной кислотой, флуфенамовой кислотой, фолиновой кислотой, бензотиадиазидом, хлортиазидом, диазепином, индометицином, барбитуратом, цефалоспорином, сульфамидным препаратом, противодиабетическим средством, антибактериальным средством или антибиотиком.
Репрезентативные патенты Соединенных Штатов, в которых приведены наставления в отношении приготовления таких конъюгатов олигонуклеотидов, включают, но без ограничения, патенты США № 4828979; 4948882; 5218105; 5525465; 5541313; 5545730; 5552538; 5578717; 5580731; 5580731; 5591584; 5109124; 5118802; 5138045; 5414077; 5486603; 5512439; 5578718; 5608046; 4587044; 4605735; 4667025; 4762779; 4789737; 4824941; 4835263; 4876335; 4904582; 4958013; 5082830; 5112963; 5214136; 5082830; 5112963; 5214136; 5245022; 5254469; 5258506; 5262536; 5272250; 5292873; 5317098; 5371241, 5391723; 5416203; 5451463; 5510475; 5512667; 5514785; 5565552; 5567810; 5574142; 5585481; 5587371; 5595726; 5597696; 5599923; 5599928 и 5688941.
Препараты
Соединения настоящего изобретения можно также смешать, инкапсулировать, конъюгировать или иным образом соединить с другими молекулами, структурами молекул или смесями соединений, например, липосомами, нацеленными на рецепторы молекулами, пероральными, ректальными препаратами, препаратами для местного применения или другими препаратами, для способствования поглощению, распределению и/или абсорбции. Репрезентативные патенты Соединенных Штатов, в которых приведены наставления в отношении приготовления таких препаратов для способствования поглощению, распределению и/или абсорбции, включают, но без ограничения, патенты США № 5108921; 5354844; 5416016; 5459127; 5521291; 5543165; 5547932; 5583020; 5591721; 4426330; 4534899; 5013556; 5108921; 5213804; 5227170; 5264221; 5356633; 5395619; 5416016; 5417978; 5462854; 5469854; 5512295; 5527528; 5534259; 5543152; 5556948; 5580575 и 5595756, каждый из которых включен сюда посредством ссылки.
Хотя для модуляции экспрессии и/или функции мишени введение антисмысловых олигонуклеотидов в связи с вектором не требуется, вариант осуществления настоящего изобретения относится к конструкциям в виде экспрессионных векторов для экспрессии антисмысловых олигонуклеотидов, включающим промоторы, гибридные промоторные последовательности гена, и обладает сильной конститутивной промоторной активностью или промоторной активностью, которую можно индуцировать в желаемом случае.
В варианте осуществления осуществление на практике настоящего изобретения включает введение по меньшей мере одного из вышеприведенных антисмысловых олигонуклеотидов с использованием подходящей системы достатка нуклеиновых кислот. В одном варианте осуществления эта система включает не являющиеся вирусами векторы, функционально связанные с полинуклеотидом. Примеры таких не являющихся вирусами векторов включают только олигонуклеотид (например, любую одну или несколько из SEQ ID NO: 16-36) или олигонуклеотид в сочетании с подходящим белковым, полисахаридным или липидным препаратом.
Кроме того, подходящие системы доставки нуклеиновых кислот включают вирусный вектор, обычно последовательность из по меньшей мере одного из аденовируса, аденоассоциированного вируса (AAV), зависимого от вируса-помощника аденовируса, ретровируса или вируса Сендай (HVJ)-липосомного комплекса. Предпочтительно вирусный вектор включает сильный эукариотический промотор, функционально связанный с полинуклеотидом, например, промотор цитомегаловируса (CMV).
Кроме того, предпочтительные векторы включают вирусные векторы, гибридные белки и химические конъюгаты. Ретровирусные векторы включают вирусы мышиного лейкоза Молони и вирусы на основе ВИЧ. Один предпочтительный вирусный вектор на основе ВИЧ включает по меньшей мере два вектора, причем гены gag и pol происходят из генома ВИЧ, а ген env происходит из другого вируса. Предпочтительными являются ДНК-содержащие вирусные векторы. Эти векторы включают поксвирусные векторы, такие как ортопоксвирусные векторы или векторы на основе вируса-возбудителя оспы у птиц, векторы на основе вируса герпеса, такие как вектор на основе вируса простого герпеса I (HSV) [Geller, A.I. et al, (1995) J. Neurochem, 64: 487; Lim, F., et al, in DNA Cloning: Mammalian Systems, D. Glover, Ed. (Oxford Univ. Press, Oxford England) (1995); Geller, A.I. et al, (1993) Proc. Natl. Acad. Sci U.S.A., 90: 7603; Geller, A.I., et al., (1990) Proc Natl. Acad. Sci USA, 87: 1149], аденовирусные векторы (LeGal LaSall et al., Science, 259: 988 (1993); Davidson, et al., (1993) Nat. Genet. 3: 219; Yang, et al, (1995) J. Virol. 69: 2004), и векторы на основе аденоассоциированного вируса (Kaplitt, M.G., et al, (1994) Nat. Genet. 8:148).
Антисмысловые соединения настоящего изобретения включают любые фармацевтически приемлемые соли, сложные эфиры или соли таких эфиров, или любое другое соединение, которое после введения животному, в том числе человеку, способно обеспечить (непосредственно или опосредованно) его биологически активный метаболит или остаток.
Термин «фармацевтически приемлемые соли» относится к физиологически и фармацевтически приемлемым солям соединений настоящего изобретения, т.е. солям, которые сохраняют желаемую биологическую активность исходного соединения и не придают ему нежелательные токсикологические эффекты. В случае олигонуклеотидов предпочтительные примеры фармацевтически приемлемых солей и их применения описаны дополнительно в патенте США № 6287860, который включен сюда посредством ссылки.
Настоящее изобретение также включает фармацевтические композиции и препараты, которые включают антисмысловые соединения по настоящему изобретению. Фармацевтические композиции по настоящему изобретению могут вводиться рядом способов в зависимости от того, является ли желательным местное или системное лечение, и от подвергаемой лечению области. Введение может быть местным (в том числе в глаз и на слизистые оболочки, в том числе вагинальной и ректальной доставкой), легочным, например, с помощью ингаляции или инсуффляции порошков или аэрозолей, в том числе с помощью распылителя; интратрахеальным, интраназальным, эпидермальным или чрескожным), оральным или парентеральным. Парентеральное введение включает внутривенную, внутриартериальную, подкожную, внутрибрюшинную или внутримышечную инъекцию или инфузию; или внутричерепное, например, интратекальное или внутрижелудочковое, введение. Считается, что олигонуклеотиды с по меньшей мере одной модификацией в результате присоединения 2'-O-метоксиэтила особенно применимы в случае орального введения. Фармацевтические композиции и препараты для местного применения могут включать пластыри для чрескожного введения, мази, лосьоны, кремы, гели, капли, суппозитории, аэрозоли, жидкости и порошки. Могут быть необходимы или желательны общепринятые фармацевтические носители, содержащие воду, порошкообразные или на масляных основах, загустители и т.п. Могут также применяться презервативы, перчатки с покрытием и т.п.
Фармацевтические препараты настоящего изобретения, которые можно обычно представить в стандартной лекарственной форме, можно приготовить в соответствии с общепринятыми методами, хорошо известными в фармацевтической промышленности. Такие методы включают стадию соединения активных ингредиентов с фармацевтическим носителем(ями) или наполнителем(ями). Обычно препараты готовят посредством соединения активных ингредиентов с жидкими носителями или тонкоизмельченными твердыми носители, или и теми и другими, с получением однородной и тщательно перемешенной смеси, а затем, при необходимости, формования продукта.
Композиции настоящего изобретения можно составить в любую из множества возможных лекарственных форм, таких как, но без исключения, таблетки, капсулы, гелевые капсулы, жидкие сиропы, мягкие гели, суппозитории и клизмы. Композиции настоящего изобретения можно также составить в виде суспензий в водной, неводной или смешанной средах. Водные суспензии могут, кроме того, содержать вещества, которые увеличивают вязкость суспензии, включающие, например, натриевую соль карбоксиметицеллюлозы, сорбит и/или декстран. Суспензия может также содержать стабилизаторы.
Фармацевтические композиции настоящего изобретения включают, но без ограничения, растворы, эмульсии, пены и содержащие липосомы препараты. Фармацевтические композиции и препараты настоящего изобретения могут включать один или несколько усилителей проникновения, носителей, наполнителей или других активных или неактивных ингредиентов.
Эмульсии обычно представляют собой гетерогенные системы одной жидкости, распределенной в другой в виде капелек с диаметром, превышающим 0,1 мкм. Помимо дисперсионных фаз эмульсии могут содержать дополнительные компоненты и активное лекарственное средство, которое может присутствовать в виде раствора либо в водной фазе, масляной фазе, либо присутствовать само в виде отдельной фазы. Микроэмульсии включены в качестве варианта осуществления настоящего изобретения. Эмульсии и их применения хорошо известны в данной области техники и описываются дополнительно в патенте США № 6287860.
Препараты настоящего изобретения включают липосомальные препараты. Используемый в настоящем изобретении термин «липосома» означает везикулу, состоящую из амфифильных липидов, организованных в сферические двухслойные структуры или бислои. Липосомы являются однослойными или многослойными везикулами, которые имеют мембрану, образованную из липофильного материала, и внутреннюю часть, которая содержит доставляемую композицию. Катионные липосомы являются положительно заряженными липосомами, которые, как считается, взаимодействуют с отрицательно заряженными молекулами ДНК с образованием стабильного комплекса. Считается, что липосомы, которые являются чувствительными к рН или отрицательно заряженными, захватывают ДНК, а не образуют комплекс с ней. Как катионные, так и некатионные липосомы были использованы для доставки ДНК в клетки.
Липосомы также включают «стерически стабилизированные» липосомы, термин, который, как здесь используется, относится к липосомам, включающим один или несколько специализированных липидов. После включения в липосомы эти специализированные липиды дают в результате липосомы с увеличенной продолжительностью циркуляции относительно липосом, в которых отсутствуют такие специализированные липиды. Примерами стерически стабилизированных липосом являются те, в которых часть образующих везикулу липидов липосомы включает один или несколько гликолипидов или является дериватизированной с использованием одного или нескольких гидрофильных полимеров, таких как составляющая в виде полиэтиленгликоля (ПЭГ). Липосомы и их применения описаны дополнительно в патенте США № 6287860.
Фармацевтические препараты и композиции настоящего изобретения могут также включать поверхностно-активные вещества. Использование поверхностно-активных веществ в лекарственных продуктах, препаратах и в эмульсиях известно в данной области техники. Поверхностно-активные вещества и их применения описаны дополнительно в патенте США № 6287860, который включен сюда посредством ссылки.
В одном варианте осуществления в настоящем изобретении используются различные усилители проникновения для осуществления эффективной доставки нуклеиновых кислот, в частности, олигонуклеотидов. Помимо помощи в проникновении нелипофильных лекарственных средств через клеточные мембраны усилители проникновения также увеличивают проницаемость липофильных лекарственных средств. Усилители проникновения можно в соответствии с классификацией отнести к одному из пяти широких классов, т.е. поверхностно-активным веществам, жирным кислотам, желчным кислотам, хелатообразующим агентам и не являющимся хелатообразующими и поверхностно-активными вещества агентам. Усилители проникновения и их применения описаны дополнительно в патенте США № 6287860, который включен сюда посредством ссылки.
Квалифицированному в данной области техники специалисту будет понятно, что препараты в установленном порядке создают в соответствии с их предполагаемым применением, т.е. путем введения.
Предпочтительные препараты для местного применения включают те, в которых олигонуклеотиды настоящего изобретения находятся в смеси с агентом для местной доставки, таким как липиды, липосомы, жирные кислоты, эфиры жирных кислот, стероиды, хелатообразующие агенты и поверхностно-активные вещества. Предпочтительными липидами и липосомами являются нейтральные (например, диолеоилфосфатидил-DOPE-этаноламин, димиристоилфосфатидилхолин-DMPC, дистеаролфосфатидилхолин), отрицательные (например, димиристоилфосфатидилглицерин-DMPG) и катионные (например, диолеоилтетраметиламинопропил-DOTAP и диолеоилфосфатидилэтаноламин-DOTMA).
В случае местного или другого применения олигонуклеотиды настоящего изобретения можно включить в липосомы, или они могут образовывать комплексы с ними, особенно с катионными липосомами. Альтернативно, можно образовать комплексы олигонуклеотидов с липидами, особенно с катионными липидами. Предпочтительные жирные кислоты и их эфиры, фармацевтически приемлемые соли и их применения описаны дополнительно в патенте США № 6287860.
Композиции и препараты для орального введения включают порошки или гранулы, микрочастицы, наночастицы, суспензии или растворы в водных или неводных средах, капсулы, гелевые капсулы, саше, таблетки или минитаблетки. Могут быть желательны загустители, корригенты, разбавители, эмульгаторы, диспергаторы или связующие агенты. Предпочтительными пероральными препаратами являются те, в случае которых олигонуклеотиды настоящего изобретения вводят в соединении с одним или несколькими усилителями проникновения: поверхностно-активными веществами и хелаторами. Предпочтительные поверхностно-активные вещества включают жирные кислоты и/или их эфиры или соли, желчные кислоты и/или их соли. Предпочтительные желчные кислоты/соли и жирные кислоты, и их применения описаны дополнительно в патенте США № 6287860, который включен сюда посредством ссылки. Также предпочтительными являются комбинации усилителей проникновения, например, жирные кислоты/соли в сочетании с желчными кислотами/солями. Особенно предпочтительной комбинацией является натриевая соль лауриновой кислоты, каприновой кислоты и UDCA. Дополнительные усилители проникновения включают полиоксиэтилен-9-лауриновый эфир, полиоксиэтилен-20-цетиловый эфир. Олигонуклеотиды настоящего изобретения могут доставляться перорально, в гранулярной форме, включающей высушенные распылением частицы, или образовывать комплексы с созданием микро- или наночастиц. Образующие комплексы с олигонуклеотидами агенты и их применения описаны дополнительно в патенте США № 6287860, который включен сюда посредством ссылки.
Композиции и препараты для парентерального, интратекального или внутрижелудочного введения могут включать стерильные водные растворы, которые могут также содержать буферы, разбавители и другие подходящие добавки, такие как, но без ограничения, усилители проникновения, соединения-носители и другие фармацевтически приемлемые носители или наполнители.
В определенных вариантах осуществления настоящего изобретения обеспечиваются фармацевтические композиции, содержащие одно или несколько олигомерных соединений и одно или несколько других химиотерапевтических средств, которые действуют не по антисмысловому механизму. Примеры таких химиотерапевтических средств включают, но без ограничения, противораковые химиотерапевтические средства, такие как даунорубицин, дауномицин, дактиномицин, доксорубицин, эпирубицин, идарубицин, эзорубицин, блеомицин, мафосфамид, ифосфамид, цитозин-арабинозид, бисхлорэтил-нитрозомочевину, бисульфан, митомицин C, актиномицин D, митрамицин, преднизон, гидроксипрогестерон, тестостерон, тамоксифен, дакарбазин, прокарбазин, гексаметилмеламин, пентаметилмеламин, митоксантрон, амсакрин, хлорамбуцил, метилциклогексилнитрозомочевину, азотистый иприт, мелфалан, циклофосфамид, 6-меркаптопурин, 6-тилгуанин, цитарабин, 5-азацитидин, гидроксимочевину, дезоксикоформицин, 4-гидроксипероксициклофосфорамид, 5-фторурацил (5-FU), 5-фтордезоксиуридин (5-FUdR), метотрексат (MTX), колхицин, таксол, винкристин, винбластин, этопозид (VP-16), триметрексат, иринотекан, топотекан, гемцитабин, тенипозид, цисплатин и диэтилстильбэстрол (DES). При использовании с соединениями настоящего изобретения такие химиотерапевтические средства могут использоваться по отдельности (например, 5-FU и олигонуклеотид), последовательно (например, 5-FU и олигонуклеотид в течение периода времени, за которым следует назначение MTX и олигонуклеотида) или в комбинации с одним или несколькими другими такими химиотерапевтическими средствами (например, 5-FU, MTX и олигонуклеотид, или 5-FU, лучевая терапия и олигонуклеотид). В композиции настоящего изобретения могут быть также включены противовоспалительные средства, включающие, но без ограничения, нестероидные противовоспалительные средства и кортикостероиды, и противовирусные лекарственные средства, включающие, но без ограничения, рибивирин, видарабин, ацикловир и ганцикловир. Комбинации антисмысловых соединений с другими антисмысловыми лекарственными средствами также находятся в пределах объема этого изобретения. Два или более объединяемых соединения могут использоваться вместе или последовательно.
В другом связанном варианте осуществления композиции настоящего изобретения могут содержать одно или несколько антисмысловых соединений, в частности, олигонуклеотидов, нацеленных на первую нуклеиновую кислоту, и одно или несколько дополнительных антисмысловых соединений, нацеленных на вторую нуклеиновую кислоту-мишень. Например, первой мишенью может быть конкретная антисмысловая последовательность гена-супрессора опухолей, а второй мишенью может быть участок другой нуклеотидной последовательности. Альтернативно, композиции настоящего изобретения могут содержать два или более антисмысловых соединений, нацеленных на различные участки одной и той же мишени в виде нуклеиновой кислоты гена-супрессора опухолей. Многочисленные примеры антисмысловых соединений проиллюстрированы здесь, а другие можно выбрать из числа соответствующих соединений, известных в данной области техники. Два или более объединяемых соединения могут использоваться вместе или последовательно.
Введение доз:
Считается, что составление терапевтических композиций и их последующее введение (введение доз) находятся в рамках профессиональных знаний специалистов в данной области техники. Введение доз зависит от тяжести и чувствительности подвергаемого лечению болезненного состояния, при этом курс лечения длится от нескольких дней до нескольких месяцев, или до обеспечения излечения, или достижения ослабления болезненного состояния. Оптимальные схемы введения доз можно рассчитать на основе измерений накопления лекарственного средства в организме пациента. Специалисты со средним уровнем компетентности могут без труда определить оптимальные дозы, методики введения доз и частоты повторений. Оптимальные дозы могут колебаться в зависимости от относительной активности отдельных олигонуклеотидов и могут быть обычно определены на основе EC50, которые, как установлено, являются эффективными в in vitro или in vivo моделях на животных. Обычно доза составляет от 0,01 мкг до 100 г на кг веса тела и может назначаться один или более раз в день, раз в неделю, раз в месяц или раз в год, или даже один раз каждые 4-30 лет. Специалисты со средним уровнем компетентности могут без труда определить частоты повторений введения доз на основе определенных периодов времени пребывания и концентраций лекарственного средства в жидкостях или тканях организма. После успешного лечения может быть желательным подвергание пациента поддерживающей терапии для предотвращения рецидива болезненного состояния, при этом олигонуклеотиды вводят в поддерживающих дозах, колеблющихся от 0,01 мкг до 100 г на кг веса тела, от одного или более раз в день до одного раза каждые 20 лет.
Хотя выше были описаны различные варианты осуществления настоящего изобретения, следует понимать, что они были представлены исключительно в качестве примера, а не ограничения. В описанные варианты осуществления могут быть внесены многочисленные изменения в соответствии с вышеприведенным описанием без отступления от сущности или объема настоящего изобретения. Таким образом, широта и объем настоящего изобретения не должны ограничиваться каким-либо из описанных выше вариантов осуществления.
Все упоминаемые здесь документы включены сюда посредством ссылки. Все публикации и патентные документы, процитированные в этой заявке, включены посредством ссылки для всех целей в той же степени, как если бы каждая отдельная публикация или патентный документ была отмечена отдельно. При приведении заявителями различных ссылок в этом документе не допускается, что конкретная ссылка является «прототипом» их изобретения. Варианты осуществления относящихся к изобретению композиций и способов проиллюстрированы в следующих примерах.
ПРИМЕРЫ
Следующие не ограничивающие примеры служат для иллюстрации выбранных вариантов осуществления настоящего изобретения. Учитывается, что вариации в соотношениях и альтернативные варианты представленных компонентов будут очевидны квалифицированным в данной области техники специалистам и находятся в пределах объема вариантов осуществления настоящего изобретения.
Пример 1: Конструирование антисмысловых олигонуклеотидов, специфичных в отношении молекулы нуклеиновой кислоты - антисмысловой и/или смысловой цепи полинуклеотида гена-супрессора опухолей
Как указывалось выше, термин «олигонуклеотид, специфичный в отношении» или «олигонуклеотид, мишенью которого является» относится к олигонуклеотиду, имеющему последовательность, (i) способную к образованию стабильного комплекса с частью целевого гена или (ii) способную к образованию стабильного дуплекса с частью транскрипта в виде мРНК целевого гена.
Выбор подходящих олигонуклеотидов облегчается посредством использования компьютерных программ, которые автоматически совмещают последовательности нуклеиновых кислот и показывают участки идентичности или гомологии. Такие программы используются для сравнения последовательностей нуклеиновых кислот, полученных, например, посредством исследования баз данных, таких как GenBank, или посредством секвенирования продуктов ПЦР. Сравнение последовательностей нуклеиновых кислот из ряда видов позволяет отобрать последовательности нуклеиновых кислот, которые демонстрируют подходящую степень идентичности между видами. В случае генов, которые не были секвенированы, выполняют блоттинги по Саузерну для того, чтобы сделать возможным определение степени идентичности между генами в целевом виде и другом виде. Посредством выполнения блоттингов по Саузерну при изменяющихся степенях жесткости, как хорошо известно в данной области техники, можно получить приближенный показатель идентичности. Эти процедуры позволяют отобрать олигонуклеотиды, которые проявляют высокую степень комплементарности последовательностям нуклеиновых кислот-мишеней у субъекта, который должен подвергаться контролю, и более низкую степень комплементарности соответствующим последовательностям нуклеиновых кислот у другого вида. Квалифицированный в данной области техники специалист поймет, что существует значительная широта в выборе подходящих участков генов для использования в настоящем изобретении.
Антисмысловое соединение является «специфически гибридизуемым», когда связывание соединения с нуклеиновой кислотой-мишенью вносит помехи в нормальное функционирование нуклеиновой кислоты-мишени с вызовом модуляции функции и/или активности, и существует достаточная степень комплементарности во избежание неспецифического связывания антисмыслового соединения с не являющимися мишенями последовательностями нуклеиновых кислот в условиях, при которых желательным является специфическое связывание, т.е. в физиологических условиях в случае in vivo исследований или терапевтического лечения и в условиях, при которых выполняют исследования, в случае in vitro исследований.
Гибридизационые свойства описываемых здесь олигонуклеотидов можно определить с помощью одного или нескольких in vitro анализов, известных в данной области техники. Например, свойства описываемых здесь олигонуклеотидов можно определить посредством определения прочности связывания являющегося мишенью природного антисмыслового полинуклеотида с являющими возможными лекарственными средствами молекулами, используя анализ кривой плавления.
Прочность связывания являющегося мишенью природного антисмыслового полинуклеотида с являющейся возможным лекарственным средством молекулой (молекулой) можно определить, используя любой из признанных способов измерения силы межмолекулярных взаимодействий, например, анализ кривой плавления.
С помощью анализа кривой плавления определяют температуру, при которой в случае комплекса природный антисмысловой полинуклеотид/молекула происходит быстрый переход двухцепочечной формы в одноцепочечную форму. Эта температуры получила широкое признание в качестве надежного показателя силы взаимодействий между двумя молекулами.
Анализ кривой плавления можно выполнить, используя копию в виде кДНК фактической природной антисмысловой молекулы РНК или синтетический ДНК- или РНК-олигонуклеотид, соответствующий сайту связывания молекулы. В наличии имеется множество наборов, содержащих все необходимые для выполнения этого анализа реагенты (например, набор MeltDoctor от Applied Biosystems Inc.). Эти наборы включают подходящий буферный раствор, содержащий один из красителей, связывающих двухцепочечную ДНК (дцДНК) (такой как красители ABI HRM dyes, SYBR Green, SYTO и т.д.). Свойства дцДНК-связывающих красителей таковы, что они почти не порождают флуоресценцию в свободной форме, но являются в высокой степени флуоресцентными после связывания дцДНК.
Для выполнения анализа кДНК или соответствующий олигонуклеотид смешивают с молекулой в концентрациях, определяемых конкретными протоколами производителя. Смесь нагревают до 95°C для диссоциации предварительно образованных комплексов дцРНК, затем медленно охлаждают до комнатной температуры или другой более низкой температуры, определяемой производителем набора, для создания возможности для отжига молекул ДНК. Вновь образованные комплексы затем медленно нагревают до 95°C с одновременным непрерывным сбором данных об интенсивности флуоресценции, порождаемой реакцией. Интенсивность флуоресценции обратно пропорциональна количествам дцРНК, присутствующим в реакции. Данные можно собрать, используя прибор для ПЦР в режиме реального времени, совместимый с набором (например, систему STumor Suppressor genene Plus Real Time PCR System от ABI или прибор LightTyper, Roche Diagnostics, Lewes, Соединенное Королевство).
Пики плавления выводят посредством нанесения на график производной флуоресценции от температуры (-d(Флуоресценция)/dT) по оси y) в зависимости от температуры (ось х), используя подходящее программное обеспечение (например, LightTyper (Roche) или SDS Dissociation Curve, ABI). Данные анализируют для идентификации температуры быстрого перехода комплекса дцРНК в одноцепочечные молекулы. Эта температура названа Tm и прямо пропорциональна силе взаимодействия между двумя молекулами. Типично Tm будет превышать 40°C.
Пример 2: Модулирование экспрессии гена-супрессора опухолей с помощью олигонуклеотидов
Обработка клеток HEPG2 антисмысловыми олигонуклеотидами
Клетки HepG2 от ATCC (каталожный № HB-8065) выращивали в среде для роста (MEM/EBSS (Hyclone, каталожный № SH30024, или Mediatech, каталожный № MT-10-010-CV) +10% FBS (Mediatech, каталожный № MT35-011-CV) + пенициллин/стрептомицин (Mediatech, каталожный № MT30-002-CI)) при 37°C и 5% CO2. За день до эксперимента клетки пересевали с созданием плотности 1,5x105/мл в 6-луночные планшеты и инкубировали при 37°C и 5% CO2. В день эксперимента среду в 6-луночных планшетах заменяли новой средой для роста. Все антисмысловые олигонуклеоиды разводили до концентрации, составляющей 20 мкМ. Два мкл этого раствора инкубировали с 400 мкл среды Opti-MEM (Gibco, каталожный № 31985-070) и 4 мкл липофектамина 2000 (Invitrogen, каталожный № 11668019) при комнатной температуре в течение 20 мин и вносили в каждую лунку 6-луночных планшетов с клетками HepG2. Ради псевдо-трансфецированных контролей использовали схожие смеси, включающие 2 мкл воды вместо раствора олигонуклеотида. После инкубации в течение 3-18 ч при 37°C и 5% CO2 среду заменяли новой средой для роста. Через 48 ч после добавления антисмысловых олигонуклеотидов среду отбрасывали, и из клеток экстрагировали РНК, используя систему для выделения тотальной РНК SV от Promega (каталожный № Z3105) или набор для выделения тотальной РНК RNeasy от Qiagen (каталожный № 74181), следуя инструкциям производителя. 600 нг РНК добавляли к реакционной смеси для обратной транскрипции, выполняемой с использованием набора для приготовления кДНК Verso от Thermo Scientific (каталожный № АВ1453В) или набора для мощной обратной транскрипции с получением кДНК (каталожный №4368813), как описано в протоколе производителя. Полученную в результате этой реакции обратной транскрипции кДНК использовали для проверки экспрессии гена с помощью ПЦР в режиме реального времени, используя смесь Taqman gene Expression Mix от ABI (каталожный №4369510) и праймеры/зонды, разработанные ABI. Использовали следующий цикл ПЦР: 50°С в течение 2 мин, 95°С в течение 10 мин, и 40 следующих циклов: 95°С в течение 15 сек, 60°С в течение 1 мин, используя устройство StepOne Plus Real Time PCR Machine (Applied Biosystems Inc.) или термоциклер Mx4000 (Stratagene).
Кратность изменения экспрессии гена после обработки антисмысловыми олигонуклеотидами рассчитывали на основе различия в приведенных к 18S значениях dCt между подвергнутыми обработке и псевдо-трансфецированными образцами.
Использовали анализы экспрессии р73 (ABI, каталожный №), все зонды с использованием MGB
р73: Hs00232088_ml (последовательность-мишень 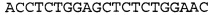 , экзон 2 SEQ ID NO: 42)
, экзон 2 SEQ ID NO: 42)
p73as: Hs00215135_ml (последовательность-мишень 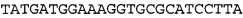 , экзон 7 SEQ ID NO: 42) и Hs00892470_gl
, экзон 7 SEQ ID NO: 42) и Hs00892470_gl
Результаты:
Результаты ПЦР в режиме реального времени показывают, что уровни мРНК с гена-супрессора опухолей в клетках HepG2 значительно увеличиваются через 48 ч после обработки двумя из киРНК, разработанных против гена-супрессора опухолей (гена-супрессора опухолей_1, P=0,02, и гена-супрессора опухолей_2, P=0,04, фиг. 1A). В тех же образцах уровни РНК с гена-супрессора опухолей могли быть сниженными после обработки киРНК против гена-супрессора опухолей (фиг. 1B).
На фиг. 1C результаты ПЦР в режиме реального времени показывают, что уровни мРНК с гена-супрессора опухолей в клетках HepG2 значительно увеличиваются через 48 ч после обработки двумя из олигонуклеотидов, разработанных против антисмыслового полинуклеотида гена-супрессора опухолей, Hs.668503 и одним из олигонуклеотидов, разработанных против антисмыслового полинуклеотида гена-супрессора опухолей, Hs.674463.
Результаты ПЦР в режиме реального времени показывают, что уровни мРНК PTEN в клетках HepG2 значительно увеличиваются через 48 ч после обработки одним из олигонуклеотидов, разработанных против антисмыслового полинуклеотида PTEN, hs.624903 (фиг. 3). (Зонды для выявления: Taqman Gene Expression Assay от Applied Biosystems: Hs02621230_sl)
Обработка клеток TM4 антисмысловыми олигонуклеотидами
Клетки TM4 от ATCC (каталожный № CRL-1715) выращивали в среде для роста (MEM/EBSS (Hyclone, каталожный № SH30024, или Mediatech, каталожный № MT-10-010-CV) +10% FBS (Mediatech, каталожный № MT35-011-CV) + пенициллин/стрептомицин (Mediatech, каталожный № MT30-002-CI)) при 37°C и 5% CO2. За день до эксперимента клетки пересевали с созданием плотности 1,5x105/мл в 6-луночные планшеты и инкубировали при 37°C и 5% CO2. В день эксперимента среду в 6-луночных планшетах заменяли новой средой для роста. Все антисмысловые олигонуклеоиды разводили до концентрации, составляющей 20 мкМ. Два мкл этого раствора инкубировали с 400 мкл среды Opti-MEM (Gibco, каталожный № 31985-070) и 4 мкл липофектамина 2000 (Invitrogen, каталожный № 11668019) при комнатной температуре в течение 20 мин и вносили в каждую лунку 6-луночных планшетов с клетками ТМ4. Ради псевдо-трансфецированных контролей использовали схожие смеси, включающие 2 мкл воды вместо раствора олигонуклеотида. После инкубации в течение 3-18 ч при 37°C и 5% CO2 среду заменяли новой средой для роста. Через 48 ч после добавления антисмысловых олигонуклеотидов среду отбрасывали, и из клеток экстрагировали РНК, используя систему для выделения тотальной РНК SV от Promega (каталожный № Z3105) или набор для выделения тотальной РНК RNeasy от Qiagen (каталожный № 74181), следуя инструкциям производителя. 600 нг РНК добавляли к реакционной смеси для обратной транскрипции, выполняемой с использованием набора для приготовления кДНК Verso от Thermo Scientific (каталожный № AB1453B) или набора для мощной обратной транскрипции с получением кДНК (каталожный № 4368813), как описано в протоколе производителя. Полученную в результате этой реакции обратной транскрипции кДНК использовали для проверки экспрессии гена с помощью ПЦР в режиме реального времени, используя смесь Taqman gene Expression Mix от ABI (каталожный № 4369510) и праймеры/зонды, разработанные ABI (Taqman gene Expression Assay от Applied Biosystems: Mm00660220_ml от Applied Biosystems Inc., Foster City CA). Использовали следующий цикл ПЦР: 50°C в течение 2 мин, 95°C в течение 10 мин, и 40 следующих циклов: 95°C в течение 15 сек, 60°C в течение 1 мин, используя устройство StepOne Plus Real Time PCR Machine (Applied Biosystems).
Кратность изменения экспрессии гена после обработки антисмысловыми олигонуклеотидами рассчитывали на основе различия в приведенных к 18S значениях dCt между подвергнутыми обработке и псевдо-трансфецированными образцами.
Результаты:
Результаты ПЦР в режиме реального времени показывают, что уровни мРНК с гена-супрессора опухолей в мышиных клетках TM4 значительно увеличиваются через 48 ч после обработки одним из олигонуклеотидов, разработанных против антисмыслового полинуклеотида гена-супрессора опухолей, Hs.668503 и одним из олигонуклеотидов, разработанных против антисмыслового полинуклеотида гена-супрессора опухолей, WDR8 (фиг. 1D).
Обработка клеток HUVEC антисмысловыми олигонуклеотидами
Клетки HUVEC от ATCC (Promo Cell, каталожный № C-12253) выращивали в среде для роста эпителиальных клеток (Promo Cell, каталожный № C-22010) при 37°C и 5% CO2. За день до эксперимента клетки пересевали, используя набор для отсоединения клеток Promo Cell (каталожный № C-41200), с созданием плотности 1,5x105/мл в 6-луночные планшеты и инкубировали при 37°C и 5% CO2. В день эксперимента среду в 6-луночных планшетах заменяли новой средой для роста эпителиальных клеток. Все антисмысловые олигонуклеоиды разводили до концентрации, составляющей 20 мкМ. Два мкл этого раствора инкубировали с 400 мкл среды Opti-MEM (Gibco, каталожный № 31985-070) и 4 мкл липофектамина 2000 (Invitrogen, каталожный № 11668019) при комнатной температуре в течение 20 мин и вносили в каждую лунку 6-луночных планшетов с клетками HUVEC. Ради псевдо-трансфецированных контролей использовали схожие смеси, включающие 2 мкл воды вместо раствора олигонуклеотида. После инкубации в течение 3-18 ч при 37°C и 5% CO2 среду заменяли новой средой для роста. Через 48 ч после добавления антисмысловых олигонуклеотидов среду отбрасывали, и из клеток экстрагировали РНК, используя систему для выделения тотальной РНК SV от Promega (каталожный № Z3105) или набор для выделения тотальной РНК RNeasy от Qiagen (каталожный № 74181), следуя инструкциям производителя. 600 нг РНК добавляли к реакционной смеси для обратной транскрипции, выполняемой с использованием набора для приготовления кДНК Verso от Thermo Scientific (каталожный № AB1453B), как описано в протоколе производителя. Полученную в результате этой реакции обратной транскрипции кДНК использовали для проверки экспрессии гена с помощью ПЦР в режиме реального времени, используя смесь Taqman gene Expression Mix от ABI (каталожный № 4369510) и праймеры/зонды, разработанные ABI (Taqman gene Expression Assay от Applied Biosystems: Hs00153340_ml и Hs00216360_ml от Applied Biosystems Inc., Foster City CA). Использовали следующий цикл ПЦР: 50°C в течение 2 мин, 95°C в течение 10 мин, и 40 следующих циклов: 95οC в течение 15 сек, 60°C в течение 1 мин, используя устройство StepOne Plus Real Time PCR Machine (Applied Biosystems) или термоциклер Mx4000 (Stratagene).
Кратность изменения экспрессии гена после обработки антисмысловыми олигонуклеотидами рассчитывали на основе различия в приведенных к 18S значениях dCt между подвергнутыми обработке и псевдо-трансфецированными образцами.
Использовали анализы экспрессии р53 (ABI, каталожный №), все зонды с использованием FAM/MGB: 18S: 4319413Е
Р53: Hs00153340_ml (последовательность-мишень  , SEQ ID NO: 43)
, SEQ ID NO: 43)
P53as: Hs00216360_ml (последовательность-мишень 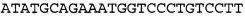 , SEQ ID NO: 44)
, SEQ ID NO: 44)
Результаты:
Результаты ПЦР в режиме реального времени показывают, что уровни мРНК р53 в клетках HUVEC значительно увеличиваются через 48 ч после обработки всеми из киРНК, разработанными против p53as (фиг. 2).
Хотя настоящее изобретение было проиллюстрировано и описано применительно к одному или нескольким осуществлениям, эквивалентные изменения и модификации придут на ум квалифицированным в данной области техники специалистам после прочтения и постижения смысла этого описания изобретения и приложенных чертежей. Кроме того, хотя конкретный признак настоящего изобретения, возможно, был раскрыт относительно только одного из нескольких осуществлений, такой признак может сочетаться с одним или несколькими другими признаками других осуществлений, что может быть желательным и преимущественным в случае любого данного или конкретного применения.
Реферат позволит читателю быстро установить сущность технического раскрытия. Он предоставляется с оговореннымусловием, что он не будет использоваться для интерпретации или ограничения объема или значения формулы настоящего изобретения.











































































































































































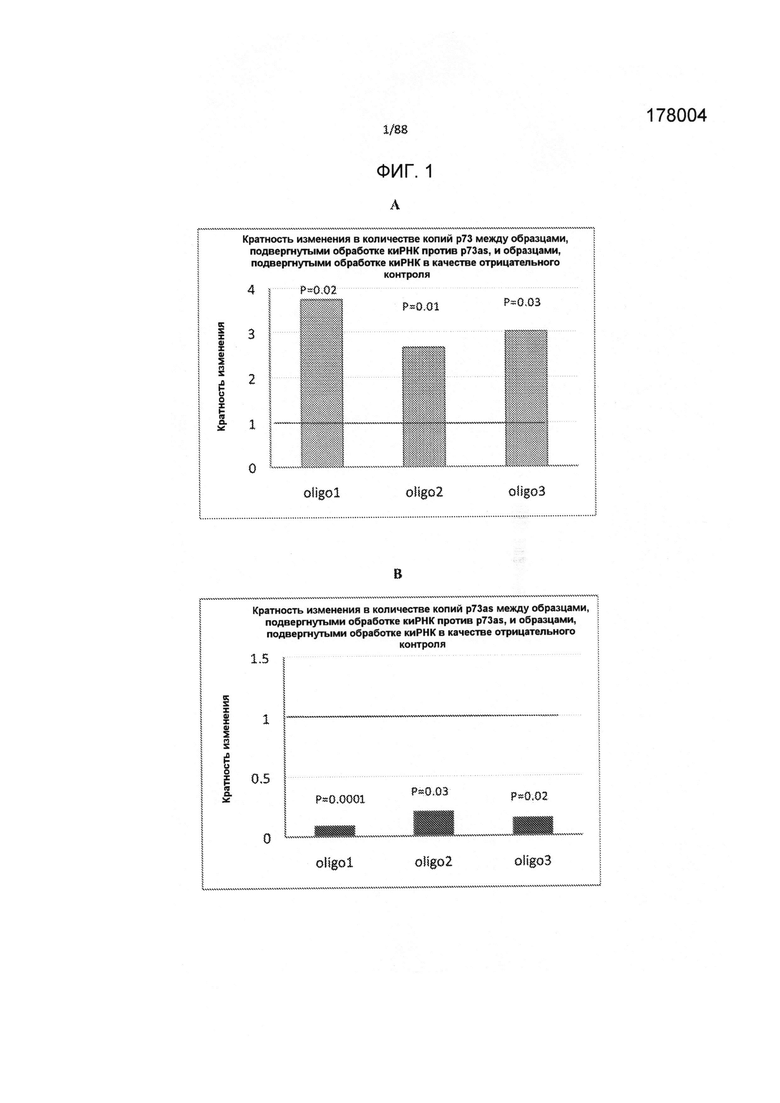
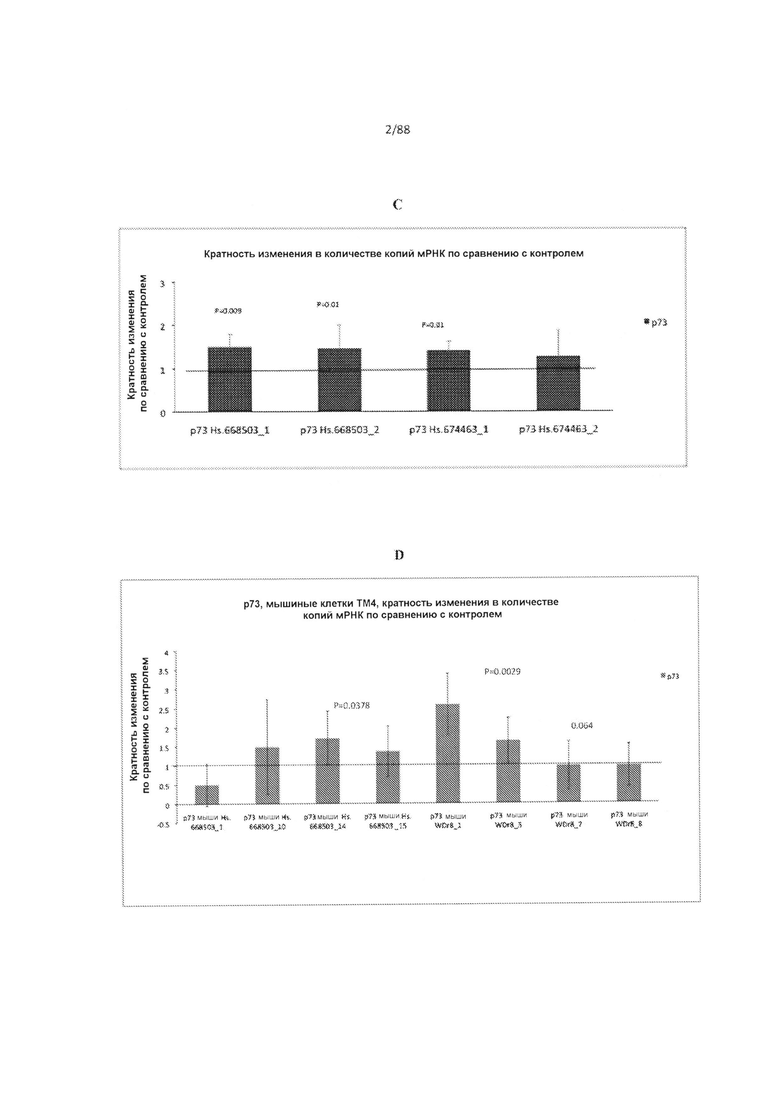






















































































Изобретение относится к биохимии. Заявлен способ повышения экспрессии полинуклеотида PTEN в клетках или тканях пациента in vivo или in vitro, включающий контактирование указанных клеток или тканей с по меньшей мере одним антисмысловым олигонуклеотидом длиной от 10-30 нуклеотида, мишенью которого является природный антисмысловой полинуклеотид PTEN, выбранный из SEQ ID NOs: 14 и 15; посредством чего осуществляется повышение экспрессии полинуклеотида PTEN в клетках или тканях пациента in vivo. Также представлены соответствующий олигонуклеотид, композиция, его содержащая, и способ профилактики или лечения заболевания, связанного с по меньшей мере одним полинуклеотидом PTEN и/или по меньшей мере одним кодируемым им продуктом с помощью данного олигонуклеотида. Изобретение расширяет арсенал средств для лечения профилактики или лечения заболевания, связанного с по меньшей мере одним полинуклеотидом PTEN и/или по меньшей мере одним кодируемым им продуктом. 4 н. и 16 з.п. ф-лы, 9 ил., 1 табл., 2 пр.
1. Способ повышения экспрессии полинуклеотида PTEN в клетках или тканях пациента in vivo или in vitro, включающий контактирование указанных клеток или тканей с по меньшей мере одним антисмысловым олигонуклеотидом длиной от 10-30 нуклеотида, мишенью которого является природный антисмысловой полинуклеотид PTEN, выбранный из SEQ ID NOs: 14 и 15; посредством чего осуществляется повышение экспрессии полинуклеотида PTEN в клетках или тканях пациента in vivo.
2. Способ по п. 1, в котором мишенью по меньшей мере одного антисмыслового олигонуклеотида является нуклеотидная последовательность, включающая кодирующие и/или не кодирующие нуклеотидные последовательности полинуклеотида PTEN.
3. Способ по п. 1, в котором мишенью по меньшей мере одного антисмыслового олигонуклеотида являются природный антисмысловой полинуклеотид, имеющий перекрывающиеся или не перекрывающиеся последовательности с полинуклеотидом PTEN.
4. Способ по п. 1, в котором по меньшей мере один антисмысловой олигонуклеотид включает одну или несколько модификаций, выбираемых из по меньшей мере одной модифицированной молекулы сахара, по меньшей мере одной модифицированной межнуклеозидной связи, по меньшей мере одного модифицированного нуклеотида и их комбинаций.
5. Способ по п. 1, в котором одна или несколько модификаций включают по меньшей мере одну модифицированную молекулу сахара, выбираемую из 2'-О-метоксиэтил-модифицированной молекулы сахара, 2'-метокси-модифицированной молекулы сахара, 2'-О-алкил-модифицированной молекулы сахара, молекулы бициклического сахара и их комбинаций.
6. Способ по п. 5, в котором одна или несколько модификаций включают по меньшей мере одну модифицированную межнуклеозидную связь, выбираемую из фосфоротиоата, 2'-О-метоксиэтила (МОЕ), 2'-фтора, алкилфосфоната, фосфородитиоата, алкилфосфонотиоата, фосфорамидата, карбамата, карбоната, триэфира фосфорной кислоты, ацетамидата, карбоксиметилового эфира и их комбинаций.
7. Способ по п. 5, в котором одна или несколько модификаций включают по меньшей мере один модифицированный нуклеотид, выбираемый из пептидонуклеиновой кислоты (ПНК), замкнутой нуклеиновой кислоты (LNA), арабинонуклеиновой кислоты (FANA), их аналога, производного и комбинаций.
8. Синтетический, модифицированный олигонуклеотид для повышения экспрессии полинуклеотида PTEN in vivo, где указанный олигонуклеотид имеет длину из 10-30 нуклеотида и гибридизуется с природным антисмысловым полинуклеотидом PTEN, выбранным из SEQ ID NOs: 14 и 15, где указанный олигонуклеотид дополнительно включает по меньшей мере одну модификацию, причем по меньшей мере одну модификацию выбирают из по меньшей мере одной модифицированной молекулы сахара, по меньшей мере одной модифицированной межнуклеотидной связи, по меньшей мере одного модифицированного нуклеотида и их комбинаций.
9. Олигонуклеотид по п. 8, в котором по меньшей мере одна модификация включает межнуклеотидную связь, выбираемую из группы, состоящей из фосфоротиоата, алкилфосфоната, фосфородитиоата, алкилфосфонотиоата, фосфорамидата, карбамата, карбоната, триэфира фосфорной кислоты, ацетамидата, карбоксиметилового эфира и их комбинаций.
10. Олигонуклеотид по п. 8, который включает по меньшей мере одну фосфоротиоатную межнуклеотидную связь.
11. Олигонуклеотид по п. 8, который включает остов из фосфоротиоатных межнуклеотидных связей.
12. Олигонуклеотид по п. 8, который включает по меньшей мере один модифицированный нуклеотид, выбираемый из пептидонуклеиновой кислоты, замкнутой нуклеиновой кислоты (LNA), их аналога, производного и комбинаций.
13. Олигонуклеотид по п. 8, который включает множество модификаций, причем указанные модификации включают межнуклеотидные связи, выбираемые из фосфоротиоата, алкилфосфоната, фосфородитиоата, алкилфосфонотиоата, фосфорамидата, карбамата, карбоната, триэфира фосфорной кислоты, ацетамидата, карбоксиметилового эфира и их комбинации.
14. Олигонуклеотид по п. 8, который включает множество модификаций, причем указанные модификации включают модифицированные нуклеотиды, выбираемые из пептидонуклеиновых кислот, замкнутых нуклеиновых кислот (LNA), их аналогов, производных и комбинаций.
15. Олигонуклеотид по п. 8, который включает по меньшей мере одну модифицированную молекулу сахара, выбираемую из 2'-O-метоксиэтил-модифицированной молекулы сахара, 2'-метокси-модифицированной молекулы сахара, 2'-О-алкил-модифицированной молекулы сахара, молекулы бициклического сахара и их комбинации.
16. Олигонуклеотид по п. 8, который включает множество модификаций, причем указанные модификации включают модифицированные молекулы сахара, выбираемые из 2'-О-метоксиэтил-модифицированной молекулы сахара, 2'-метокси-модифицированной молекулы сахара, 2'-О-алкил-модифицированной молекулы сахара, молекулы бициклического сахара и их комбинации.
17. Композиция для повышения экспрессии полинуклеотида PTEN в клетках или тканях пациента in vivo или in vitro, включающая один или несколько олигонуклеотидов по п. 8 и фармацевтически приемлемый эксципиент.
18. Композиция по п. 17, где указанный один или несколько олигонуклеотидов включает одну или несколько модификаций, выбранных из фосфоротиоата, метилфосфоната, пептидонуклеиновой кислоты, молекул замкнутых нуклеиновых кислот (LNA) и их комбинаций.
19. Способ профилактики или лечения заболевания, связанного с по меньшей мере одним полинуклеотидом PTEN и/или по меньшей мере одним кодируемым им продуктом, включающий введение пациенту терапевтически эффективной дозы по меньшей мере одного антисмыслового олигонуклеотида по п. 8, который связывается с природной антисмысловой последовательностью указанного по меньшей мере одного полинуклеотида PTEN и повышает экспрессию указанного по меньшей мере одного полинуклеотида PTEN; посредством чего осуществляется профилактика или лечение заболевания, связанного с по меньшей мере одним полинуклеотидом PTEN и/или по меньшей мере одним кодируемым им продуктом.
20. Способ по п. 19, в котором заболевание, связанное с по меньшей мере одним полинуклеотидом PTEN, является раком.
| US 20090258925 A1, 15.10.2009 | |||
| ДЕФЕКТНЫЙ РЕКОМБИНАНТНЫЙ АДЕНОВИРУСНЫЙ ВЕКТОР (ВАРИАНТЫ) | 1994 |
|
RU2219241C2 |
| СПОСОБ БЕСКЛЕТОЧНОЙ ТРАНСКРИПЦИИ ДНК-МАТРИЦЫ, СПОСОБ ИДЕНТИФИКАЦИИ ИСПЫТУЕМОГО ВЕЩЕСТВА, ДНК-МАТРИЦА | 1998 |
|
RU2235787C2 |
Авторы
Даты
2017-05-10—Публикация
2009-12-03—Подача