Изобретение относится к автоматизированному способу ин витро для анализа транскрипции вирусных и клеточных генов, который рациональным и экономически приемлемым образом пригоден для массового скрининга в целях обнаружения специфических, селективно влияющих на активность гена химических главных структур.
Скрининг природных соединений в отношении биологически активных ингредиентов получил новый стимул для развития после того, как оказалось, что только с помощью рациональной конструкции биологически активного вещества невозможен успешный поиск биологически активных веществ. Так, наряду с химическими библиотеками веществ и комбинационными библиотеками в центре внимания снова находятся экстракты природных соединений в качестве источников веществ. Это связано прежде всего с многообразием содержащихся в этих экстрактах веществ. С помощью современных аналитических методов можно обнаружить, что экстракты микробной ферментации содержат около 500 соединений, структурно различающихся классов. Тем самым в отношении своего разнообразия они намного превосходят химические и комбинационные библиотеки веществ.
Число приемлемых информативных способов, с помощью которых можно испытывать потенциальные биологические активные вещества, ограничено для фармакологического использования богатого и до сих пор в значительной степени неисследованного потенциала природных соединений. В особенности необходимы способы, которые можно использовать для идентификации высокоспецифических фармакологически активных веществ, введение которых связано по возможности с незначительными побочными действиями.
Нижеописываемый способ основывается на исходной смеси, в которой испытывают вещества на их потенциал, путем вмешательства уже на первой стадии преобразования генетической информации регулируют транскрипцию генов. С помощью такого способа можно идентифицировать вещества, которые могут прямо или косвенно, положительно или отрицательно влиять на транскрипцию.
Сила транскрипции гена определяется ген-регулирующими элементами этого гена, в особенности промотором, энхансером или силенсером. Действию ген-регулирующих элементов способствуют и преобразовывают его факторы транскрипции и кофакторы. Эти факторы транскрипции могут влиять как отрицательно, так и также положительно на скорость транскрипции гена и благодаря этому способствуют силе транскрипции. Между тем, идентифицировано множество факторов транскрипции в качестве важных "молекулярных переключателей" в ходе многих клеточных процессов, включая сигнальную трансдукцию, контроль клеточного цикла, дифференциацию и контролируемую гибель клетки (апоптоз).
В большинстве случаев получаемые клеткой сигналы, которые влияют на силу транскрипции генов, "регистрируются" трансмембранными протеинами, передаются дальше внутриклеточно через цепи сигнальной трансдукции и преобразуются факторами транскрипции. Примерами протеинов, получающих сигналы снаружи, являются протеины, связывающие циклический аденозинмонофосфат, сенсоры сигналов роста (как сывороточный ответный фактор, SRF), гормональные рецепторы или факторы транскрипции, которые принимают участие в экспрессии цитокинов, так называемые SТАТ-протеины (сигнальные трансдукторы и активаторы транскрипции).
Между тем, известен целый ряд веществ, которые прямо или косвенно влияют на силу транскрипции генов. Такие вещества используют, в частности, в качестве фармакологически активных веществ в лекарственных средствах, хотя действие этих веществ часто не является специфическим. Поэтому прием таких лекарственных средств часто также связан с нежелательными побочными действиями.
Например, для лечения иммунологических заболеваний используют лекарственные средства, которые содержат циклоспориновые и стероидные производные в качестве активных веществ. Циклоспорин А образует комплекс с циклофилином, который ингибирует кальцийнейрин, находящуюся повсюду фосфатазу, дефосфорилирует протеины различными реакциями обмена веществ. Кальцийнейрин регулирует, например, перемещение субъединицы фактора транскрипции NFAT от цитозола в клеточное ядро (Liu J., Immynology Today, 14, 290-295 (1993)). NFAT (нуклеарный фактор активированных Т-клеток) принимает участие в активации некоторых иммунологически релевантных генов. Циклоспорин А (СsА) косвенно, через влияние NFAT (нуклеарный фактор активированных Т-клеток) регулирует экспрессию этих генов. Так как циклоспорин А, однако, только косвенно, а именно через находящийся повсюду кальцийнейрин, регулирует активность NFAT, этот циклоспорин А действует также через другие метаболические пути сосудосужающе, а также нефротоксически и нейротоксически.
Если бы было известно фармакологически активное вещество, с помощью которого можно было специфически, возможно непосредственно, ингибировать NFAT, то лекарственное средство, содержащее это активное вещество, вероятно вызывало бы меньшие побочные действия.
К фармакологически активным веществам причисляют также глюкокортикоиды, которые наряду с желательным действием вызывают также сильное побочное действие. Глюкокортикоиды уже много лет используют для стандартной терапии при аллергиях, ревматических заболеваниях, воспалениях и других заболеваниях, которые сводятся к сверхреактивной иммунной системе. Они вызывают, в частности, ингибирование активации фактора транскрипции NFkB специфического для типа клеток (Scheinmann R.I., Cogswell Р.С., Lofquist А.К. и Baldwin A.S., Jr.Science, 270, 283-286 (1995); Auphan N., DiDonato J.A., Rosette C., Helmberg A, и Karin M., Science, 270, 286-290 (1995 )), тем они стимулируют образование клеточного ингибитора NFkB IkB-протеином. IkB в свою очередь предотвращает перенос активных NFkB-димеров в клеточное ядро и таким образом активацию важных иммунологических генов-мишеней. Влияние глюкокортикоидов на ген-экспрессию, подобно как и в случае СsА, относительно неспецифическое, так как глюкокортикоиды действуют не только на NFkB, но и также на другие протеины.
Эти примеры показывают, что существует большая потребность в фармакологически активных веществах, которые обладают по возможности специфическим профилем действия. При поиске новых химических структур с соответствующими свойствами нужно испытывать множество веществ в отношении их специфической активности.
Несмотря на идентичное "ген-обеспечение", в зависимости от типа клетки и/или определенных заболеваний или дефектов, а также соответствующей степени развития и дифференциации отдельных клеток всегда экспрессируются только определенные протеины. В качестве основы этой индивидуальности клеток можно рассматривать специфический набор ген-регуляторных протеинов, например, специфическое для типа клетки и развития обеспечение определенными факторами транскрипции и кофакторами (примесные протеины), которые регулируют координируемую и контролируемую транскрипцию отдельных генов.
Специфические фармакологически активные вещества поэтому должны селективно активировать или ингибировать транскрипцию патологически релевантных генов в клетках определенного типа. Для идентификации таких активных веществ необходим способ транскрипции, в случае которого при определенных условиях можно непосредственно определять воздействие испытываемых активных веществ на транскрипцию отдельных генов, то есть на регуляцию участвующих в транскрипции протеинов и на ген-регуляторные элементы. Так как нужно подвергать испытанию множество потенциально активных веществ, способ, сверх того, должен быть прост в осуществлении и автоматизируемым.
Первый бесклеточный способ транскрипции описан Вайлом и др. (Weil P.A., Luse D.S., Segall J., Roeder R.G., Cell, 18, 469-484 (1979)). При этом обогащенные экстракты из клеточных ядер, так называемые S100-экстракты (Weil P.A., Segall J., Harris В., Ng S.Y., Roeder R.G., Biol. Chem., 254, 6163-6173 (1979)), и очищенную РНК-полимеразу II используют для транскрипции ин витро. Без экзогенной РНК-полимеразы II эти обогащенные, однако, далее не очищенные ядерные экстракты неспособны к транскрипции (Weil P.A., Luse D.S., Segall J., Roeder R.G., Cell, 18, 469-484 (1979)); Dignam J.D., Martin P.L., Shastry B.S., Roeder R.G., Methods in Enzymology, 101, 582-598 (1983)).
Исходя из таких ядерных экстрактов затем разработаны способы, с помощью которых можно выделять факторы транскрипции путем многоступенчатых стадий очистки. В частности эти способы включают стадии очистки, при которых ядерные экстракты очищают хромотографически при использовании материалов, связывающих нуклеарные протеины, как, например, с помощью фосфоцеллюлозных колонок. В рамках этих дорогостоящих, многоступенчатых способов для одной из стадий очистки Дигнам и др. впервые описали применение продажной Р11-системыR (Ватман, Мидстоун, Великобритания) (Dignam J.D., Martin P.L., Shastry B.S., Roeder R.G., Methods in Enzymology, 101, 582-598 (1983)).
Многоступенчатые способы очистки всегда более адаптируются, так что между тем можно с помощью дорогостоящих способов из экстрактов клеточных ядер выделять отдельные факторы транскрипции. Сверх того, отдельные факторы, соответственно, их субъединицы, в настоящее время являются рекомбинантно доступными, как, например, TFIIA, TFIIB, TFIIEα, TFIIEβ и TFIIF (Zawel L. и Reinberg D., Annu Rev. Biochem., 64, 533-561 (1995)).
Поэтому в настоящее время уже имеются системы транскрипции, которые состоят из смеси рекомбинантных и природных очищенных факторов. Для способа скрининга с высокой производительностью в отношении числа анализируемых образцов такие системы транскрипции до сих пор, однако, слишком дорогостоящие с точки зрения технологии. В других системах транскрипции, например, при использовании экстрактов из клеточных ядер вместо рекомбинантных или очищенных факторов, напротив, возникает много побочных реакций. В недостаточной степени очищенных или в неочищенных ядерных экстрактах (грубые экстракты) прежде всего нуклеиновые кислоты и ДНК-связывающие протеины, например, репрессоры, как, например, гистон, мешают транскрипции ин витро. В случае содержащихся в грубых экстрактах нуклеиновых кислот в особенности мешают ДНК- последовательности, которые кодируют транспортные рибонуклеиновые кислоты (тРНК). Так как гены транспортных рибонуклеиновых кислот транскрибируются примерно в 100 раз сильнее, чем гены матричных рибонуклеиновых кислот (мРНК), то кодирующие эти тРНК последовательности приводят к избытку неспецифических транскриптов. Неспецифические транскрипты затем нужно отделять лишь с помощью дорогостоящих стадий очистки, прежде, чем можно обнаружить специфические транскрипты.
Для того чтобы можно было количественно определять результаты транскрипции ин витро, созданы векторы, в случае которых транскрибируемая последовательность ДНК не содержит никаких гуаниновых оснований (так называемая G-свободная последовательность, соответственно, G-свободная кассета), причем за G-свободной последовательностью при необходимости следует отрезок последовательности, который содержит очень много гуанинов. Благодаря использованию этих векторов можно осуществлять транскрипцию в отсутствие гуанозинтрифосфата (GTP). Благодаря этому транскрибируются только G-свободные последовательности, но не другие, G-содержащие последовательности. Таким образом получают специфические транскрипты, которые, сверх того, имеют (почти) одинаковую длину. Sawadogo и Roeder впервые описали использование вектора для транскрипций, в котором имеется последовательность длиной 400 нуклеотидов при контроле ML-(аденовирусного главного позднего промотора). С помощью этого вектора получают транскрипты длиной примерно 400 нуклеотидов (Sawadogo М. и Roeder R.G., Proc. Natl. Acad. Sci. USA, 82, 4394-4398 (1985)).
С помощью этих векторов получают отчетливо менее неспецифические транскрипты, вследствие чего с тех пор многократно описано использование этих векторов в реакциях транскрипции. (Goppelt A., Stelzer G., Lottspeich F., Meisterernst M., EMBO J., 15, 3105-3115 (1996); Kretzschmar M., Kaiser K., Lottspeich F., Meisterernst M., Cell, 78, 525-534 (1994); Meisterernst M., Roy A.L., Lieu H.M. и Roeder R.G., Cell, 66, 981-993 (1991)). До сих пор, однако, используют исключительно векторы, в которых длина G-свободной последовательности не превышает 400 нуклеотидов.
Для того чтобы количественно и качественно определить результаты описанных до сих пор способов транскрипции, осуществляют транскрипцию в присутствии радиоактивно маркированных нуклеотидов и после фенолизации и осаждения на геле отделяют радиоактивно маркированные транскрипты. Таким образом не только ошибочно инициированные или ошибочно терминированные транскрипты, а также неспецифически маркированные нуклеиновые кислоты (например, вызываемые благодаря плазмиде транскрипты или транспортные рибонуклеиновые кислоты), но и также избыточные нуклеотиды отделяют от специфического транскрипта. Соотношение активностей избыточных, радиоактивно маркированных нуклеотидов к радиоактивно маркированным транскриптам составляет в нежелательных случаях примерно 10000:1, так что маркированные транскрипты нужно обогащать примерно в 10000 раз. Это обогащение специфического транскрипта достигается благодаря стадии осаждения и благодаря электрофоретическому отделению. Эти стадии обогащения, однако, непригодны для автоматизированного массового скрининга, вследствие чего необходимо разрабатывать альтернативные способы, чтобы удалять маркированные нуклеотиды в той степени, которая уже позволяет проводить количественную оценку результатов транскрипции.
Транскрипцию можно также осуществлять путем нанесения реакционного раствора на мембрану, например мембрану из диэтиламиноэтилцеллюлозы. Радиоактивно маркированные транскрипты затем можно детектировать прямо на мембране. Однако до сих пор успешно используют мембраны только для обнаружения транскриптов из транскрипций ин витро, которые осуществляют в присутствии очищенных РНК-полимераз II (Roeder R.G., J.Biol.Chem., 249, 241-248 (1974)) или очищенных базальных факторов транскрипции (Ohkuma Y., Sumimoto H., Horikoshi M., Roeder R.G., Proc. Natl. Acad. Sci. USA, 87, 9163-9167 (1990)). Не дается никакого указания на то, что транскрипты, которые получают с помощью обогащенных и при необходимости предварительно очищенных экстрактов из клеточных ядер, таким образом можно определять.
Использование транскрипции генов для скрининга активных веществ уже описано в международной заявке WO 96/26959. В этой заявке описываются последовательности человеческих NFATs (hNFAT) и их возможное применение в количественных анализах транскрипции, которые в свою очередь должны использоваться для массового скрининга природных соединений по возможности автоматизированного. В противоположность нижеописываемому способу транскрипции, в случае этого количественного анализа транскрипции речь идет о чистом анализе на связывание, при котором не осуществляется никакой реакции транскрипции.
Дальнейший анализ на связывание, который можно использовать для скрининга веществ, способных ингибировать связывание факторов транскрипции нуклеиновыми кислотами, описывается в патенте США 5563036. Также в случае этого анализа не осуществляется никакой транскрипции.
Следующий пример в отношении анализа на связывание, который также используют для обнаружения веществ, способных ингибировать связывание протеина, в этом случае ассоциированного с рецептором фактора некроза опухоли (TRADD), с определенными ДНК-последовательностями, описывается в патенте США 5563039.
Задачей настоящего изобретения является разработка простого и воспроизводимого, универсально используемого, в особенности пригодного для массового скрининга способа анализа транскрипции генов, например, клеточных и вирусных генов, при определенных реакционных условиях.
Изобретение относится к способу бесклеточной транскрипции ин витро ДНК-матрицы, которая содержит транскрибируемую ДНК-последовательность, находящуюся под контролем одного или нескольких ген-регуляторных элементов, и причем
а) для транскрипции используют обогащенный и при необходимости очищенный экстракт клеточных ядер, который при необходимости может быть дополнен факторами транскрипции и/или кофакторами, соответственно, частично или полностью заменен ими, и, по крайней мере, один маркированный нуклеотид;
б) после транскрипции содержащиеся в смеси протеины при необходимости отделяют и/или подвергают деградации;
в) маркированный транскрипт связывают с твердым носителем;
г) удаляют избыточные маркированные нуклеотиды; и
д) определяют количество маркированного транскрипта. Способ включает собственно реакцию транскрипции (а), отделение специфического транскрипта (б, в, г) и определение специфического транскрипта (д).
Способ включает особые формы осуществления отделения специфического транскрипта, причем указанная очередность б, в, и г представляет собой только один возможный вариант. Последовательность отделения специфического транскрипта при необходимости может также представлять собой в, г, б или г, б, в. Далее, в случае определенных вариантов осуществления изобретения можно отказаться от отдельной стадии отделения. Например, способ транскрипции может включать только стадии а, в, г и д или только стадии а, в и д или только а, б, вид или только а, б, г и д или только а, б и д или только а, г и д.
Особым признаком способа является то, что все стадии способа, следовательно, собственно реакция транскрипции (транскрипция), а также отделение и детектирование специфического транскрипта, могут быть автоматизированы, причем возможно простое и достоверное определение количества специфического транскрипта, полученного при соответствующих реакционных условиях, и тем самым скорости транскрипции.
Скорость транскрипции указывает на то, как часто определенный ген транскрибируется в единицу времени, соответственно, в описываемом способе транскрипции, как часто транскрибируемая ДНК-последовательность транскрибируется в единицу времени. Для определения скорости транскрипции определяют количество радиоактивно маркированного транскрипта, которое получают спустя определенную единицу времени.
Способ заключается в том, что транскрипцию осуществляют в присутствии активаторов и/или ингибиторов, то есть в присутствии компонентов, которые положительно или отрицательно влияют на транскрипцию. Например, можно использовать способный к транскрипции экстракт клеточных ядер для базальной транскрипции. Эту базальную систему транскрипции можно дополнять активаторами и/или ингибиторами. По сравнению с базальной транскрипцией ингибирование транскрипции ведет к пониженной скорости транскрипции и тем самым к меньшему количеству специфического транскрипта в единицу времени, в то время как активация транскрипции ведет к повышенной скорости транскрипции и тем самым к большему количеству специфического транскрипта в единицу времени.
Транскрипцию генов можно подразделять на несколько стадий: образование прединициирующего комплекса (PIC), активация PIC, инициация, очищение промотора, элонгация и терминация. Для инициации транскрипции в случае эукариотов необходимы РНК-полимеразы (для транскрипции кодирующих протеины генов - РНК-полимераза II) и связывающие ДНК протеины, которые позволяют протекать специфическому взаимодействию РНК-полимеразы II с ДНК. Эти связывающие ДНК протеины обозначают как факторы транскрипции, причем общие факторы транскрипции участвуют по существу во взаимодействии с промотором, в то время как специфические факторы транскрипции способствуют действию ген-регуляторных элементов, которые локализованы ниже и выше промотора.
В транскрипции эукариотических генов принимают участие общие факторы транскрипции TFIIA, TFIIB, TFIID, TFIIF и TFIIH. Способная к транскрипции протеиновая фракция, которая ответственна за незначительную, базальную активность генов, в зависимости от промотора содержит все, соответственно, большинство этих общих факторов транскрипции и РНК- полимеразу II (РНК Pol II). Базальная активность ML-промотора достигается, например, благодаря ТВР (ТАТА-связывающая субъединица TFIID), TFIIB, TFIIE, TFIIF и РНК Pol II. Протеиновые фракции, которые вызывают такую базальную активность, обозначают как базальные системы транскрипции. Это понятие согласно изобретению также используют для обогащенного и при необходимости очищенного экстракта клеточных ядер. Транскрипцию, которую осуществляют с помощью базальной системы транскрипции, обозначают как базальную транскрипцию. Для осуществления бесклеточной транскрипции ин витро требуется по крайней мере одна система транскрипции, нуклеотиды и транскрибируемая ДНК-матрица.
Для активированной транскрипции дополнительно к общим факторам транскрипции, соответственно, к базальной системе транскрипции необходимы специфические факторы транскрипции и кофакторы (примесные протеины) (Kaiser К., Stelzer G. и Meisterernst M., EMBO J., 14, 3520-3527 (1995)). Специфические факторы транскрипции способны многократно усиливать только незначительную базальную транскрипцию определенных генов и регулировать частоту инициации транскрипции. Связывающие ДНК протеины таким образом в значительной степени ответственны за то, как часто ген транскрибируется (скорость транскрипции). В этом процессе регуляции принимают участие также другие протеины, которые не прямо связываются с ДНК, а через протеин-протеиновые взаимодействия влияют на активности факторов транскрипции или РНК-полимераз II, как, например, кофакторы.
Способ заключается также в том, что для базальной транскрипции используют обогащенный экстракт клеточных ядер (экстракт клеточных ядер, соответственно, ядерный экстракт). Что касается этого параметра, способ применяется универсально; это относится как к используемой клетке, так и к используемому эукариотическому виду. Например, можно получать, например, обогащенные ядерные экстракты из человеческих или животных линий клеток. В особенности пригодны клетки, которые можно культивировать и размножать в ферментерах в большом масштабе, как, например, HeLa-клетки. Далее, можно использовать экстракты клеточных ядер выбранных типов клеток, в особенности таких, которые отличаются, например, своим специфическим в отношении типа клетки, клеточного цикла, развития, дифференциации или заболевания обеспечением факторами транскрипции и/или кофакторами. В особенности можно использовать типы клеток, которым отводится центральная роль при возникновении заболеваний, как, например, клетки иммунной системы (например. В- и Т-клетки).
Особым преимуществом способа является то, что можно выделять и использовать также ядерные экстракты из тканей или опухолевых клеток. Это особенно предпочтительно в случаях, в которых нет никаких пригодных линий клеток. В особенности можно выделять и использовать в способе ядерные экстракты из легко доступных тканей, как из животных или человеческих пупочных канатиков, животных или человеческих отходов после трансплантации, животного или человеческого материала биопсии или животной, или человеческой опухолевой ткани (например, удаленная путем операции ткань), животной или человеческой плаценты.
В целях обогащения ядерных протеинов из клеточных ядер свежих или подвергнутых глубокому замораживанию клеток или из свежих или подвергнутых глубокому замораживанию клеточных ядер способ включает получение обогащенных ядерных экстрактов по известным способам, например по способу, описанному Дигнамом и др. (Dignam J.D., Martin P.L., Shastry B.S., Roeder R.G., Methods in Enzymology, 101, 582-598 (1983); Dignam J.D., Lebovitz R.M., Roeder R/G/, Nucleic Acid Res., 11, 1475-1489 (1983)). Особым вариантом осуществления способа является то, что для получения обогащенного ядерного экстракта используют способы, которые включают гомогенизацию клеточных ядер с последующим диализом гомогената.
Важный вариант осуществления способа состоит в том, что обогащенный экстракт клеточных ядер очищают путем одной или нескольких стадий очистки, в особенности однократной очисткой, в такой степени, что он способен к транскрипции, то есть из него при осуществлении способа получают специфический транскрипт. Например, экстракт можно очищать путем хроматографии. Очистку можно осуществлять, например, при использовании связывающих ядерный протеин материалов, как фосфоцеллюлоза, диэтиламиноэтилцеллюлоза или также гепарин-сефароза. Альтернативно, для очистки можно использовать колонки с катионо- и/или анионообменными смолами или специфические колонки для аффинной хроматографии, например, такие, в случае которых с материалом колонки связаны антитела или олигонуклеотиды.
Особый вариант осуществления способа включает очистку обогащенного ядерного экстракта при использовании колонки с фосфоцеллюлозой, в особенности Р11R-колонки (Р11R-система, Ватман, Мидстоун, Великобритания). Другой особенно предпочтительный вариант осуществления способа включает очистку обогащенного ядерного экстракта только в одну-единственную стадию, например, при использовании одной-единственной Р11R-колонки или одной-единственной колонки с материалом, который содержит диэтиламиноэтилцеллюлозу или гепарин-сефарозу.
В случае специального варианта осуществления Р11R-очистки, ядерный экстракт сначала в присутствии буфера, содержащего наряду с другими компонентами 0,05-0,15 моль, предпочтительно 0,1 моль, хлорида калия, связывают с фосфоцеллюлозой. Благодаря промывке нагруженной колонки с помощью пригодных буферов, предпочтительно с помощью буфера, который содержит 0,05-0,15 моль хлорида калия, предпочтительно 0,1 моль хлорида калия, из колонки вымывают неспецифические и побочные компоненты. Способные к транскрипции компоненты элюируют из колонки предпочтительно в виде двух фракций, причем сначала используют буфер, содержащий, например, от 0,4 до 0,6 моль хлорида калия, и затем буфер, который содержит, например, от 0,7 до 1 моль хлорида калия, предпочтительно 0,85 моль хлорида калия.
Особый вариант осуществления способа состоит в осуществлении транскрипции с помощью обогащенного, при необходимости очищенного ядерного экстракта в присутствии экзогенной РНК-полимеразы II. В качестве РНК-полимеразы можно использовать предпочтительно эукариотическую РНК-полимеразу типа II (РНК-полимеразы II), в особенности животную или человеческую РНК-полимеразу 11.
Следующий вариант осуществления способа состоит в том, что обогащенный и при необходимости очищенный ядерный экстракт можно дополнять, соответственно, частично или полностью заменять за счет добавки протеинов, например факторов транскрипции и/или кофакторов (примесные протеины). Эти протеины можно получать, например, из ядер клеток путем очистки или рекомбинантным путем.
Специальный вариант осуществления способа заключается в том, что ядерный экстракт дополняют только за счет фактора транскрипции и/или кофактора. В другом случае, способ состоит в том, что способную к транскрипции протеиновую фракцию (базальная система транскрипции) составляют полностью из очищенных или рекомбинантным путем полученных факторов транскрипции и/или кофакторов, а также РНК-полимераз.
В качестве факторов транскрипции можно использовать, например, общие и/или специфические факторы транскрипции, соответственно, их части, при необходимости в виде слитых протеинов.
В качестве общих факторов транскрипции можно использовать, например; TFIIA, TFIIB, TFIID, TFIIE, TFIIF, TFIIH, TFIIJ и ТВТ (ТАТА-связывающий протеин).
В качестве специфических факторов транскрипции можно использовать, например, NFkB, API, NFAT, GATA3, TCF/Lef, CBF, Tat, члены fos/jun-семейства, Oct-семейства (Oct-1, Oct-2) и тем самым взаимодействующие факторы, как, например, Воbl, ОСА-В или OBF, Ets-семейства, активаторы семейства ATF/CREB-протеинов, нуклеарные рецепторы, как, например, PPARα, или соответствующие специфические для типа клеток изоформы факторов транскрипции (Kel O.V., Romaschenko A.G., Kel А.Е., Wingender Е., Kolachenov N.A., Nucl. Acids. Res., 20, 3-16 (1995)).
Другими примерами специфических факторов транскрипции являются следующие:
1) протоонкогены, например jun, fos, ets, myc, bc-изоформы и erb;
2) гормональные рецепторы, например (erb), глюкокортикоидные рецепторы, эстрогенные рецепторы, рецепторы ретинолевой кислоты, рецепторы витамина D или
3) супрессоры опухолей, например р53, NF1, WT1, RB;
4) вирусные патогены, например протеины герпесвируса, как, например, VP16 или ICP4; вируса папилломы, как, например, Е1, Е2, Е6 или Е7; цитомегаловируса, как, например, IE86; вируса гепатита Б, как, например, рХ; вируса иммунодефицита человека, как, например. Tat или Rev;
5) специфические для типа клеток и/или тканей факторы, как, например, миогенные факторы, Pit-1, Oct-2, Pu-1, OCA-B или HNFs, или специфические для Т-клеток факторы, как Ets-1, GATA3, NCF/Lef, CBF;
6) STAT-протеины (сигнальные трансдукторы и активаторы транскрипции), например, активированные цитокином факторы транскрипции, как, например, IL-1 Stat, IL-2 Stat, IL-3 Stat, IL-4 Stat, IL-5 Stat, IL-6 Stat, IL-7 Stat, IL-8 Stat, IL-9 Stat, IL-10 Stat, IL-11 Stat, IL-12 Stat (IL означает интерлейкин; "Stat" означает протеин, который способствует действию); или
7) протеины, которые принимают участие во вторичных информационных каскадах трансдукции, например CREB или аbl;
8) нуклеарные рецепторы, например "вторичные информационные" рецепторы (например, сАМР- или IР3-рецепторы, Са2+-зависимые рецепторы), рецепторы ретинолевой кислоты, глюкокортикоидные рецепторы или стероидные рецепторы;
9) ген-специфические активаторы или ингибиторы, например специфические активаторы IL-2-гена, как NFkB, API или NFAT;
10) факторы транскрипции, экспрессируемые для специфических стадий развития, для специфических стадий клеточного цикла и зависимые от дифференциации.
Кофакторы, например, через протеин-протеиновые взаимодействия и/или протеин-ДНК-взаимодействия прямо или косвенно принимают участие в транскрипции. Некоторые кофакторы уже имеются в базальной системе транскрипции, другие - лишь в активированной системе транскрипции. Кофакторы могут положительно или отрицательно влиять на скорость транскрипции. В качестве кофакторов можно использовать, например, следующие:
- ТВР-ассоциированные факторы (TAFs), например ТАFII30, TAFII40, ТАFII55, ТАFII60, TAFII110, ТАFII150, ТАFII250 (Verrijzer С.Р. и Tjian R., Trends Biochem. Sci., 21, 338-342 (1996); TAFs вместе с ТВР образуют TFIID-комплекс, причем состав TAFs в TFIID может значительно меняться);
- медиаторы, то есть кофакторы, которые ассоциированы с РНК-полимеразой II, как, например, CTD (карбокситерминальный домен) - взаимодействующие протеины и/или репрессоры, и/или активаторы РНК-полимеразы II, в особенности RAP 30, RAP 74, RAP 38, SR7 (супрессор РНК-полимеразы В, SRB), циклины или киназы (например, CKII);
- общие кофакторы;
- кофакторы, которые содержатся в USA (стимулирующей активность в обратном направлении) - фракции (Kaiser К. и Meisterernst M., Trends Biochem. Sci., 342-345 (1996));
- положительные кофакторы, например, РС1, РС2, РС4(р15), РС5, РС6, Dr2 (D-penpeccop 2)/PC3, ACF (активирующий кофактор), CofA (кофактор А), HMG-протеины (протеины группы высокой подвижности, ассоциированные с хроматином);
- отрицательные кофакторы, например NC1, NC2 и/или
- специфические кофакторы.
Способ включает использование для транскрипции ДНК-матрицы, которая содержит один или несколько ген-регуляторных элементов и транскрибируемую ДНК-последовательность.
Предметом изобретения является ДНК-матрица, которую можно использовать в описанном способе для бесклеточной транскрипции ин витро. ДНК-матрица содержит один или несколько ген-регуляторных элементов и транскрибируемую ДНК-последовательность. ДНК-матрица дополнительно может содержать другие отрезки последовательностей.
Ген-регуляторный элемент может представлять собой известный или исследуемый ген-регуляторный элемент или конструкцию из одного или нескольких известных или одного или нескольких исследуемых ген-регуляторных элементов.
Ген-регуляторный элемент может содержать любые участвующие в ген-регуляции ДНК-последовательности или их отрезки. В отношении ген-регуляторного элемента ДНК-матрица, соответственно, способ являются универсальными, причем ген-регуляторный элемент происходит предпочтительно от эукариотического гена или соответствует ему. Ген-регуляторный элемент может представлять собой клеточный или вирусный ген-регуляторный элемент или синтетический ген-регуляторный элемент. Ген-регуляторный элемент предпочтительно содержит, в частности, ДНК-последовательности, сайты связывания для связывающих ДНК протеинов (связывающие протеин ДНК-последовательности, например, сайты связывания факторов транскрипции или слитых протеинов). Ген-регуляторный элемент может содержать промотор (промоторная последовательность) и/или один или несколько энхансеров (энхансерная последовательность) и/или один или несколько силенсеров (силенсерная последовательность). Ген-регуляторный элемент предпочтительно может содержать природные и/или искусственно полученные промоторные, энхансерные и/или силенсерные последовательности или их части.
Промотор может содержать "ТАТА"-блок и/или инициирующую область(INR) (исходная точка транскрипции). Промотор может содержать "GС"-блок и/или "GААТ"-блок.
В специальном варианте осуществления ДНК-матрицы ген-регуляторным элементом является модельный промотор.
Модельный промотор содержит промотор и дополнительные, связывающие протеин ДНК-последовательности и при необходимости другие ген-регуляторные элементы. Предпочтительно модельный промотор содержит "ТАТА"-блок и инициирующую область. В специальном варианте осуществления модельный промотор содержит "ТАТА"-блок человеческого Т-клеточного рецептора Vβ 8.1 и инициирующую область ML-промотора. Эти оба базальных промоторных элемента делают возможной базальную транскрипцию ин витро. Сверх того, этот специальный модельный промотор имеет 5 сайтов связывания для протеина дрожжей Ga14. Модельный промотор можно изменять любым образом, например с помощью методов молекулярной биологии, например, тем, что модельный промотор дополняют, например, исследуемым ген-регуляторным элементом и/или тем, что отдельные участки модельного промотора заменяют другими ген-регуляторными элементами, например исследуемым ген-регуляторным элементом.
Для того чтобы можно было манипулировать с модельным промотором, он предпочтительно содержит один или несколько сингулярных сайтов рестрикции для рестрикционных эндонуклеаз. В специальном варианте осуществления модельного промотора по крайней мере один сингулярный сайт рестрикции для рестрикционной эндонуклеазы локализован между "ТАТА"-блоком и сайтом связывания Ga14.
В модельный промотор дополнительно к уже имеющимся связывающим протеины последовательностям (например, дополнительно к Gа14-последовательностям) можно интегрировать другие, связывающие протеины последовательности. Это представляет интерес в особенности тогда, когда, например, к уже исследованной системе транскрипции добавляют другие исследуемые, например, специфические факторы транскрипции.
Способ состоит в том, что в комбинации с модельным промотором можно также использовать слитые протеины в качестве активаторов и/или ингибиторов транскрипции. Такие слитые протеины могут состоять, например, из ДНК-связывающего домена, как, например, ДНК-связывающий домен протеина дрожжей Ga14, и специфического активаторного домена, как, например, активаторный домен HSV-активатора VP16. С помощью слитых протеинов можно без помех анализировать определенные активаторы и/или ингибиторы, соответственно, их части например их активаторные домены, соответственно, ингибиторные домены, в отношении исследуемого ген-регуляторного элемента. Например, это возможно тогда, когда ДНК-связывающие домены происходят от ДНК-связывающего протеина, который не содержится в используемой системе транскрипции (например, в обогащенном ядерном экстракте). Например, активатор (активаторный домен) фактора транскрипции, который находится в виде слитого протеина с сайтом связывания дрожжей Ga14, можно анализировать без помех, когда в способе используют обогащенный ядерный экстракт из клеток млекопитающих, так как ядерные экстракты из клеток млекопитающих не содержат никакого Ga14.
В качестве ген-регуляторных элементов и исследуемых ген-регуляторных элементов можно использовать определенные человеческие и/или животные, и/или вирусные ген-регуляторные элементы, в особенности ген-регуляторные элементы, представляющие интерес с точки зрения патологии генов. Примерами таких элементов являются ген-регуляторные элементы адгезионных молекул, факторов роста, фосфодиэстераз, фосфатаз, киназ, аденозинтрифосфатаз, мембранных рецепторов, вторичных информационных рецепторов, гормональных рецепторов, например стероидных рецепторов, металлопротеаз, иммунофилинов, NO-синтаз, 5-липоксигеназ или иммунологических клеток-мишеней, как ген-регуляторные элементы цитокинов, например интерлейкинов, как промоторы специфически экспрессированных в отношении Т- или В-клеток генов, например, СD4-рецептора, NCR или BCR (рецепторы Т- или В-клеток), как промоторы лимфоидспецифических генов, например, фактора некроза опухоли, или как ген-регуляторные элементы специфических для Т-клеток ретровирусов, как, например, HLTV-1 (вирус Т-клеточной лимфомы человека) или ВИЧ-1 (вирус иммунодефицита человека).
Особое преимущество способа, соответственно, модельного промотора состоит в том, что в качестве ген-регуляторных элементов можно использовать как такие промоторы, которые содержат "ТАТА"-блок, как, например, промотор гена, который кодирует интерлейкин-2 (IL-2), так и промоторы, которые не содержат никакого "ТАТА"-блока, как, например, промотор гена, который кодирует β-цепь рецептора Т-клеток. Например, промоторы, которые не содержат никакого "ТАТА"-блока, можно интегрировать в модельный промотор, соответственно, в универсальную репортерную плазмиду pGS100 и использовать для транскрипции.
Транскрибируемая ДНК-последовательность отличается тем, что в этой последовательности не содержатся одно или несколько оснований нуклеиновых кислот. Предпочтительно транскрибируемая ДНК не содержит ни гуанина (G), ни цитозина (С), ни тимина (Т), то есть последовательность является G-свободной, С-свободной или Т-свободной. Далее, последовательность может не содержать также нескольких оснований нуклеиновых кислот, как, например, гуанин и тимин или гуанин и цитозин или цитозин и тимин.
В особенности используют G-свободные, Т-свободные или С-свободные последовательности, в которых G-свободная, Т-свободная или С-свободная последовательность имеет длину более чем 400 нуклеотидов, предпочтительно 400-2000 нуклеотидов или длиннее. В особенности используют последовательности, которые имеют длину примерно в 500, 600, 700, 800, 900, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 5000 или более нуклеотидов. Особенно предпочтительными длинами последовательностей, которые не содержат особого основания нуклеиновой кислоты, являются длины примерно в 800, 1200, 1600, 2200 нуклеотидов.
ДНК-матрица может представлять собой линейную или циклическую ДНК-последовательность, например, ДНК-матрица может представлять собой линейную последовательность, полученную с помощью цепной реакции полимеразы или плазмиду.
Один вариант осуществления состоит в том, что ДНК-матрица представляет собой плазмиду и построена из целого или части вектора, модельного промотора и транскрибируемой ДНК-последовательности, которая является, например, G-свободной, Т-свободной или С-свободной.
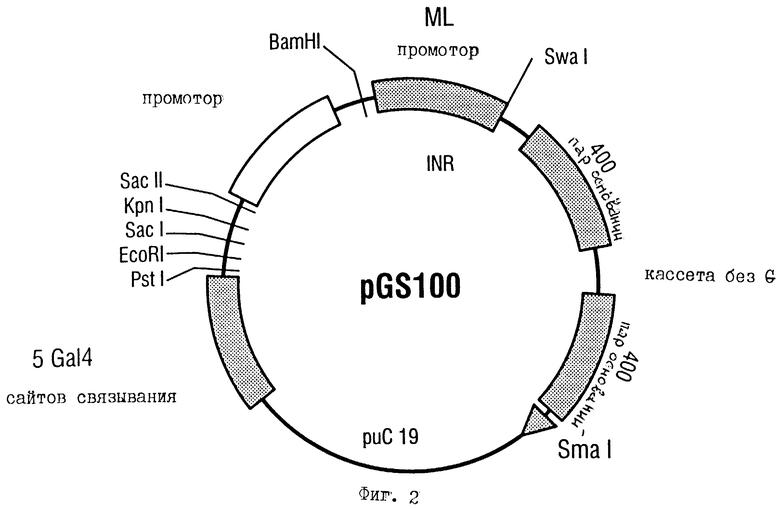
Предметом изобретения является универсально используемая репортерная плазмида (универсальная репортерная плазмида). Универсальная репортерная плазмида содержит сингулярные сайты рестрикции для рестрикционных эндонуклеаз PstI, EcoRI, SaсI, KpnI, SacII, BamHI, SwaI, часть плазмиды pUC19, пять сайтов связывания для протеина дрожжей Ga14, "ТАТА"-блок человеческого рецептора Т-клеток Vβ 8.1 между сайгами рестрикции SacII и BamHI, инициаторный (INR) участок ML-промотора (аденовирусного главного позднего промотора) между сайгами рестрикции BamHI и SwaI и G-свободную последовательность длиной примерно 800 нуклеотидов (пар оснований). Модельный промотор в универсальной репортерной плазмиде представляет собой синтетический промотор, который содержит пять сайтов связывания дрожжей Ga14, сингулярные сайты рестрикции PstI, EcoRI, SaсI, KpnI, SacII, BamHI и SwaI, "ТАТА"-блок человеческого рецептора Т-клеток Vβ 8.1 и INR ML-промотора. В эту промоторную область можно интегрировать любые исследуемые ген-регуляторные элементы. Можно удалять части модельного промотора или весь модельный промотор и заменять исследуемыми ген-регуляторными элементами.
Один вариант осуществления универсальной репортерной плазмиды обозначают как pGS100 (фиг.2).
Один вариант осуществления универсальной репортерной плазмиды pGS100 отличается тем, что синтетический промотор в области последовательности находится между положениями нуклеотидов 2168 и 2337. Инициирующая область аденовирусного "главного позднего" (ML) промотора находится между положениями нуклеотидов 2322-2337, а область с ТАТА-блоком человеческого рецептора Т-клеток Vβ8.1 промотора находится между положениями нуклеотидов 2289-2316. Пять сайтов связывания протеина дрожжей Ga14 находится между положениями нуклеотидов 2168-2260.
Другой вариант осуществления универсальной репортерной плазмиды pGS100 представляет собой нуклеотидную последовательность (последовательность №1), указанную в таблице 1.
Следующий вариант осуществления универсальной репортерной плазмиды pGS100 депонирован в DSMZ - Немецкой Коллекции Микроорганизмов и Культур Клеток Гмбх, Mascheroder Weg I, D-38124, Брауншвейг, - под DSM-номером 11450 согласно Постановлениям Будапештского Договора о международном признании депонирования микроорганизмов для целей производства по выдаче патента.
Способ состоит в том, что протеины, которые прямо или косвенно мешают определению специфического транскрипта таким образом, что невозможно однозначное обнаружение специфического транскрипта, после транскрипции отделяют и/или подвергают деградации. Отделение или деградация охватывает в особенности просто осуществляемые стадии способа, как, например, такие, при которых благодаря химической и/или механической и/или ферментативной стадии способа реакцию прекращают и транскрипт при необходимости одновременно освобождают от мешающих протеинов таким образом, что после этой стадии способа избыточные маркированные нуклеотиды можно отделять от специфических транскриптов, например, путем промывки.
Этот вариант осуществления способа заключается в том, что, например, после реакции транскрипции протеины можно подвергать деградации с помощью протеаз. В качестве протеаз можно использовать, например, цинкпротеазы, серинпротеазы, тиолпротеазы и карбоксипротеазы. В особенности можно использовать протеиназу К, трипсин, химотрипсин, карбоксипептидазу А, папаин и пепсин. Особый вариант осуществления способа состоит в том, что после транскрипции осуществляют расщепление протеиназой К.
Для того чтобы можно было определить масштаб транскрипции, то есть скорость транскрипции, нужно определять количество специфического транскрипта.
Способ заключается в том, что транскрипцию осуществляют в присутствии маркированных нуклеотидов или маркируют специфический транскрипт. Транскрипт можно маркировать, например, не радиоактивно, когда для транскрипции используют соответствующие, не радиоактивно маркированные нуклеотиды. В качестве маркерных групп для нуклеотидов можно использовать, например, флуоресцирующие группы, как дансильные (=N-диметил-1-аминонафтил-5-сульфонил-), флуоресцеиновые или кумариновые производные, или хемлюминесцирующие группы, как акридиновые производные. Указанные маркерные группы позволяют непосредственно обнаруживать специфический транскрипт. Сверх того, можно использовать также маркерные группы, которые пригодны для непрямого обнаружения транскрипта. Примерами таких маркерных групп являются дигоксигенин, который можно обнаруживать с помощью специфических антител против дигоксигенина, например при твердофазном иммунном анализе; биотин, который можно обнаруживать через биотин/авидин-систему; и линкер-спейсеры, содержащие функциональные группы, которые позволяют осуществлять дополнительную дериватизацию с помощью обнаруживаемой репортерной группы. Примером указанной последней возможности является, например, аминоалкильный линкер, который после транскрипции можно вводить во взаимодействие с активным акридиниевым сложным эфиром с получением хемилюминисцентной пробы и осуществлять детектирование.
Особый вариант осуществления способа состоит в том, что транскрипцию осуществляют в присутствии радиоактивно маркированных нуклеотидов. Нуклеотиды можно маркировать, например, радиоактивно с помощью фосфора (32Р или 33Р), серы (35S) или трития (3H).
Особый вариант осуществления способа состоит в том, что специфические транскрипты выделяют из реакционной смеси путем связывания с твердой фазой (твердым носителем), например путем связывания с титрационным микропланшетом, или путем связывания специфического транскрипта со специальными фильтрами, мембранами или другими твердыми фазами, в особенности путем связывания с "загруженной" мембраной или "загруженным" фильтром, предпочтительно из найлона или нитроцеллюлозы, особенно предпочтительно путем связывания с мембраной, которая содержит "загружающие группы, как, например, диэтиламиноэтильные группы, как, например, мембрана из диэтиламиноэтилцеллюлозы. Этот вариант осуществления заключается в том, что связанные с твердым носителем специфические транскрипты путем стадии промывки можно освобождать от избыточных маркированных нуклеотидов настолько, что возможно однозначное детектирование специфических транскриптов.
Неожиданно с помощью этого способа, по сравнению с обычным отделением и детектированием, состоящим в фенолизации, осаждении и последующем отделении транскриптов на денатурирующем геле, также можно получать однозначно обнаруживаемые специфические сигналы (см. пример 7 и фиг.3).
Способ пригоден для получения специфических сигналов, возбуждаемых, например, за счет специфической транскрипции в присутствии, например, активатора (активированная транскрипция) или ингибитора (ингибированная транскрипция), которые по крайней мере на фактор 7, предпочтительно на фактор 8, в особых случаях даже на фактор 9 или 10 отклоняются от базальной интенсивности сигнала, возбуждаемой благодаря базальной транскрипции, например, без активатора или ингибитора (см. пример 7 и фиг.3).
Важный вариант осуществления способа заключается в том, что его можно использовать для скрининга фармакологически активных веществ. Для испытания потенциальных фармакологически активных веществ в отношении их активности (например, активирующее, соответственно, ингибирующее свойство) транскрипцию осуществляют в присутствии испытуемого активного вещества. При необходимости отдельные компоненты, например обогащенный ядерный экстракт, можно предварительно инкубировать с испытуемым активным веществом. Сверх того, можно характеризовать специфичность испытуемого активного вещества тем, что транскрипцию осуществляют в присутствии испытуемого активного вещества параллельно в нескольких смесях для транскрипции, причем каждая смесь содержит различные компоненты и затем путем сравнения определяют скорость транскрипции.
Испытуемыми активными веществами могут быть, например, природные соединения и/или вещества из химических и комбинационных библиотек. Природные соединения выделяют, например, из растений, животных, секретов растений или животных и в особенности из микроорганизмов, как, например, из грибов, дрожжей, бактерий или водорослей.
Следующий особый вариант осуществления способа заключается в том, что транскрипцию осуществляют в присутствии испытуемого активного вещества, фактора транскрипции, кофактора или специфического для типа клеток ядерного экстракта и параллельно в отсутствие испытуемого активного вещества, фактора транскрипции, кофактора или специфического для типа клеток ядерного экстракта, однако в остальном при равных условиях, и из разницы количеств маркированного транскрипта определяют активность (например, ингибирующую, активирующую), соответственно, эффект испытуемого активного вещества, фактора транскрипции, кофактора или специфического для типа клеток ядерного экстракта в отношении исследуемого ген-регуляторного элемента (соответственно, гена) и/или фактора транскрипции и/или кофактора.
Способ включает определение эффекта исследуемого участвующего в ген-регуляции протеина с помощью осуществляемых параллельно при одинаковых условиях транскрипций, причем исследуемые протеины содержатся только в одной из обеих реакционных смесей.
Один вариант осуществления способа состоит в том, что
а) осуществляют по крайней мере две транскрипции параллельно при одинаковых условиях; причем
б) смеси для транскрипции различаются только тем, что они содержат различные количества испытуемого активного вещества и/или по крайней мере одного фактора транскрипции, и/или по крайней мере одного кофактора, и/или обогащенного ядерного экстракта;
в) после транскрипции в каждой смеси определяют полученное количество маркированного транскрипта; и
г) из разницы полученных количеств маркированного транскрипта определяют эффективность и/или специфичность испытуемого активного вещества, фактора транскрипции, кофактора и/или обогащенного ядерного экстракта в отношении ген-регуляторного элемента.
С помощью этого способа можно целенаправленно испытывать действие любых индивидуальных компонентов (например, на ядерный экстракт [то есть на определенный тип клеток] или определенный фактор транскрипции), которые содержатся в смеси для транскрипции. Например, можно анализировать действие исследуемого активного на определенный ген-регуляторный элемент. При этом решающим является то, чтобы точно можно было определить реакционные условия транскрипции.
Способ включает возможность целенаправленно влиять на действие отдельных факторов на патологическую ген-экспрессию, так как соответствующие реакционные условия можно точно устанавливать, соответственно, задавать путем выбора ген-регуляторного элемента, а также факторов транскрипции и/или кофакторов, и/или специфических для типа клеток ядерных экстрактов.
Особое преимущество способа состоит в том, что таким образом можно идентифицировать фармакологически активные вещества, которые могут положительно или отрицательно влиять на транскрипцию при определенных условиях, в особенности такие, которые активируют или ингибируют транскрипцию определенных генов (генов-мишеней), причем эти активные вещества оказывают специфическое воздействие на определенные ген-регуляторные элементы и/или определенные факторы транскрипции, кофакторы и/или специфические для типа клеток ядерные экстракты.
Изобретение относится к применению способа для идентификации специфических фармакологически активных веществ. Например, способ можно использовать для того, чтобы охарактеризовать испытуемое активное вещество при определенных условиях. Например, способ можно использовать для того, чтобы охарактеризовать таким образом идентифицированное активное вещество в отношении его специфичности при определенных условиях. Например, идентифицированное с помощью способа фармакологически активное вещество при определенных условиях должно ингибировать или активировать транскрипцию транскрибируемой ДНК-последовательности, находящейся под контролем ген-регуляторного элемента.
Другим особенно предпочтительным свойством способа является то, что все стадии можно простым образом автоматизировать. Например, для этого можно использовать автоматическое устройство для пипетирования Biomek 2000R (фирма Бекман, Мюнхен), включающее автоматический модуль обеспечения. Связанные с твердой фазой транскрипты затем можно промывать вручную или автоматически, например, с помощью конвейера.
Настоящее изобретение включает оснащение автоматического устройства для пипетирования, например, Biomek 2000R, отдельными компонентами реакции, как протеиновая фракция (например, ядерный экстракт и другие протеины), ДНК-матрица, буфер для транскрипции, исследуемые путем транскрипции вещества, наконечники для пипеток, титрационные микропланшеты и мембраны. Из этих компонентов составляют реакционные смеси, например, в лунках титрационных микропланшетов, причем все стадии пипетирования осуществляют автоматически. Таким образом при незначительных объемах проб, в особенности объемах меньше 100 мкл, предпочтительно 10-50 мкл, в особенности 20 мкл, можно одновременно обрабатывать 96 или более различных смесей для транскрипции на планшет. Каждая транскрипция длится примерно 1-1,5 часа, так что при оптимальном времени инкубации таким образом можно осуществлять вплоть до 1000 или более транскрипций в день.
Транскрипцию можно осуществлять, например, при температурах от 20 до 50°С. Особенно предпочтительно осуществлять транскрипцию при температуре примерно 30°С.
Так как в особенности испытуемые активные вещества, факторы транскрипции, кофакторы и при необходимости также обогащенные ядерные экстракты доступны только в незначительных количествах, однако эти вещества нужно испытывать в самых различных реакционных условиях во множестве транскрипций, к способу предъявляется требование, чтобы для реакции транскрипции требовались по возможности незначительные объемы проб. Поэтому в особенности имеет значение то, что этот способ пригоден также для осуществления в нанолитровом масштабе, то есть при использовании реакционных объемов примерно 50-500 нл.
Способ транскрипции используется универсально. Его можно применять для идентификации и охарактеризовывания ген-регуляторных элементов (то есть специфический ген в качестве мишени), факторов транскрипции и/или кофакторов, и/или других протеинов, которые прямо или косвенно принимают участие в регуляции ген-транскрипции (то есть специфический протеин в качестве мишени) и/или обогащенных ядерных экстрактов (то есть специфический ядерный экстракт, соответственно, специфический тип клеток в качестве мишени). В особенности способ транскрипции можно использовать для идентификации новых, представляющих интерес с точки зрения патологии, ген-регуляторных элементов и соотнесения ген-регуляторных протеинов, которые способствуют действию этих элементов, к соответствующим ген-регуляторным элементам.
По сравнению с клеточными анализами описанный способ транскрипции обладает более высокой специфичностью к мишени. В противоположность клеточным анализам поступление в клетки отдельных компонентов не оказывает никакого воздействия на эффективность транскрипции. Сверх того, описанный способ можно осуществлять просто и быстро (например, отдельные компоненты можно приготовлять и хранить в замороженном состоянии).
Способ можно просто стандартизировать и универсально использовать, так как его можно применять почти к любому типу клеток и любому гену.
С помощью способа можно идентифицировать фармакологически активные вещества, которые можно использовать для получения лекарственных средств. Идентифицированные с помощью этого способа транскрипции активные вещества по сравнению с известными активными веществами должны вызывать значительно меньшие побочные действия. Например, можно испытывать, соответственно идентифицировать, активные вещества, которые могут быть использованы для получения лекарственных средств в целях лечения (ауто) иммунных заболеваний, болезней обмена веществ, раковых заболеваний, сердечно-сосудистых заболеваний, инфекционных заболеваний, ревматизма, диабета, дегенеративных и психических заболеваний, в особенности для получения лекарственных средств в целях лечения ревматоидного артрита, рассеянного склероза, сахарного диабета, аллергических заболеваний, астмы, анафилаксии, атопического дерматита, болезни Альцгеймера, болезни Паркинсона, СПИДа, болезни Крейтцфельда-Якоба, эпилепсии, шизофрении, артериосклероза и туберкулеза.
Сверх того, этот универсальный способ представляет множество других возможностей применения. Способ аналогично можно использовать, например, также в случае патологии животных и при разведении животных, в случае защиты растений или при выращивании растений для обнаружения специфических, фармакологически активных веществ, когда используют соответствующие базальные системы транскрипции из соответствующих организмов и специфические ген-регуляторные элементы, факторы транскрипции и/или кофакторы, и/или другие, прямо или косвенно участвующие в реакции транскрипции протеины.
В принципе этот способ транскрипции ин витро аналогичным образом также можно использовать для идентификации веществ, которые могут найти применение при консервации материалов и пищевых продуктов, когда используют, соответственно, ген-регуляторные элементы, способные к транскрипции системы, факторы транскрипции и/или кофакторы микроорганизмов, например дрожжей, грибов, бактерий или насекомых.
Чертежи описываются следующим образом.
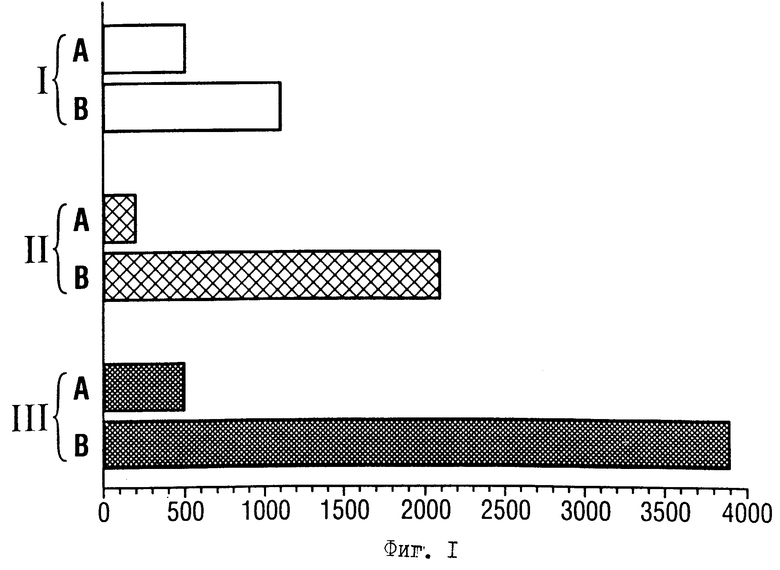
Фиг.1. Радиоактивное "чтение" реакций транскрипции, причем используются различные ген-регуляторные элементы и репортерные плазмиды, которые обладают G-свободными последовательностями различной длины.
Представлено сравнение двух стандартных промоторов с универсальной репортерной плазмидой pGS100 (фиг.2). Реакцию транскрипции осуществляют, как описывается в примере 6.
А) Базальная транскрипция: количество радиоактивного транскрипта (в относительных единицах), которое получают без активации промотора (базальная интенсивность сигнала);
Б) активированная транскрипция: количество радиоактивного транскрипта (в относительных единицах), которое получают при активации промотора с помощью Gа14-полиглутамина.
I) В качестве репортерной плазмиды используют pMRG5 (Kretschmar M., Kaiser К., Lottspeich F., Meisterernst M., Cell, 78, 525-534 (1994)). Синтетический промотор в pMRG5 содержит ТАТА-блок ВИЧ-промотора, инициатор ML-промотора и G-свободную последовательность длиной примерно 400 нуклеотидов в pUC19.
II) В качестве репортерной плазмиды используют pVβML. Репортерная плазмида имеет такое же строение, как и репортерная плазмида pGS100, однако вместо последовательности длиной 800 нуклеотидов содержит G-свободную последовательность длиной только 400 нуклеотидов.
III) В качестве репортерной плазмиды используют pGS100, которая имеет G-свободную последовательность длиной примерно 800 нуклеотидов.
Сравнивают, соответственно, базальную транскрипцию (А) с активированной транскрипцией (Б). В качестве активатора используют слитый протеин, состоящий из домена Gа14-связывания (94 аминоконцевых аминокислоты) и домена активированного полиглутамина (синтетический пептид из 11 глутаминовых кислот). После вычета фоновых величин получают абсолютные значения (в относительных единицах, которые получают с помощью анализа по "образу" фосфора). В случае реакций транскрипции, при которых используют pGS100 в качестве репортерной плазмиды, достигают как более высоких абсолютных значений, так и лучшей по сравнению с pMRGS активируемости, что обусловлено различным строением синтетических промоторов. Сверх того, становится отчетливым положительное влияние G-свободной последовательности, которая имеет длину более чем 400 нуклеотидов.
Фиг.2. Универсальная репортерная плазмида pGS100.
Универсальная репортерная плазмида pGS100 содержит синтетическую промоторную область в качестве модельного промотора перед длиной примерно 800 пар оснований G-свободной областью в pUC19. Внутри сайтов рестрикции BamHI и SwaI находится инициирующая область аденовирусного "главного позднего" (ML) промотора. Между сайтами рестрикции SacII и BamHI находится область с ТАТА-блоком человеческого Т-клеточного рецептора Vβ 8.1 промотора. Эти оба базальных промоторных элемента (инициатор и ТАТА-блок) делают возможной базальную транскрипцию ин витро. Так как они в потенциальных генах-мишенях могут иметь специфическое значение для скрининга, то их по отдельности можно заменять на соответствующие области исследуемых генов (соответствующие ген-регуляторные элементы). В полилинкер базального промотора по направлению вниз можно включать любые ген-регуляторные области генов-мишеней (специфическая активация). Альтернативно, можно заменять всю промоторную область. По направлению вверх полилинкера (от SacII до PstI) pGS100 содержит пять сайтов связывания протеина дрожжей Ga14. Он делает возможным также анализ синтетических активаторов транскрипции, например, слитых протеинов, которые состоят из любого домена активаторного (например, герпесвирусного трансактиватора VP16) и домена связывания Ga14 ДНК. Существенным элементом pGS100 является G-свободная последовательность.
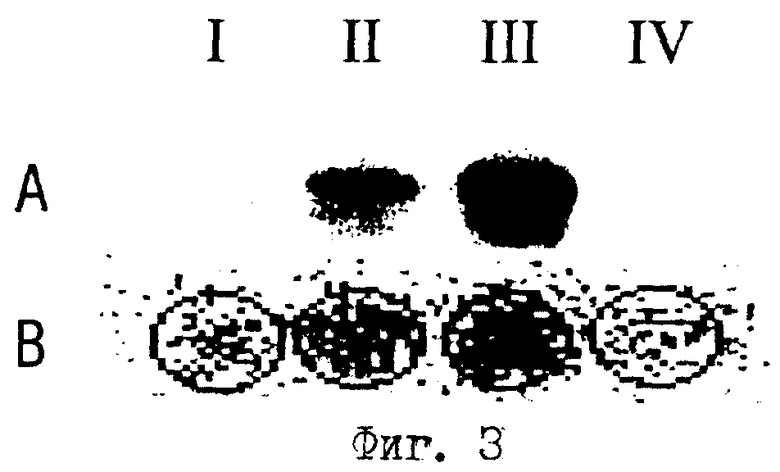
Фиг.3. Сравнение эффективности обычного стандартного способа транскрипции с описываемым бесклеточным способом транскрипции ин витро.
На фиг.3 представлено сравнение интенсивностей сигналов (в качестве меры количества транскрипта и тем самым силы транскрипции), которые получают при различных реакционных условиях. Реакции транскрипции осуществляют как описывается в примере 7.
А) Обычный стандартный способ транскрипции, в случае которого транскрипты освобождают от протеинов и избыточных нуклеотидов путем фенолизации, осаждения этанолом и последующего денатурирующего гель-электрофореза;
Б) описываемый способ транскрипции ин витро, в случае которого протеины расщепляют благодаря протеиназе К и избыточные нуклеотиды удаляют путем промывки связанных с фильтром из диэтиламиноэтилцеллюлозы, специфических транскриптов;
I) для транскрипции используют способный к транскрипции очищенный при использовании Р11R-колонки экстракт из ядер HeLa-клеток без соответствующей ДНК-матрицы (контрольный эксперимент);
II) базальная транскрипция: к смеси, соответствующей таковой из п.I, в качестве ДНК-матрицы добавляют репортерную плазмиду pMRG5 и осуществляют реакцию транскрипции; таким образом определяют базальную интенсивность сигнала;
III) активированная транскрипция: к смеси, соответствующей таковой из п.II, дополнительно добавляют активатор транскрипции, слитый протеин, состоящий из домена связывания ДНК Ga14 и активаторного домена VP16 (Ga14-VP16), и осуществляют транскрипцию; таким образом получают активированную интенсивность сигнала;
IV) к смеси, соответствующей смеси для транскрипции из п.III, добавляют α-аманитин в качестве ингибитора РНК-полимеразы II (контрольный эксперимент).
Сравнение интенсивностей сигналов, которые получают при различных реакционных условиях с помощью двух различных способов, показывает, что как базальную (II), так и также активированную (III) транскрипцию можно определять с помощью описываемого в данном случае способа транскрипции ин витро, причем интенсивности сигналов сравнимы с таковыми, которые получают с помощью обычного способа транскрипции.
Тот факт, что также измерима базальная интенсивность сигнала, имеет решающее значение для использования описываемого способа транскрипции также для скрининга ингибиторов транскрипции. С помощью специфического ингибитора РНК-полимеразы-II α-аманитина достигают уменьшения сигнала, примерно в восемь раз (сравнение III и IV).
Примеры
Пример 1. Получение HeLa-ядерных экстрактов
Ядерные экстракты получают исходя из ядер HeLa-клеток. HeLa-клеточные ядра выпускаются в продажу различными фирмами (например, "4°С", Монс; Сигма, Мюнхен; Санта Круз Биотехноложи/ Гейдельберг). С помощью ТРИС в буферах устанавливают рН=6,8 при комнатной температуре, это соответствует рН=7,3 при температуре 4°С. Перед употреблением к буферам добавляют дитиотреитол (1 М исходный раствор в воде) до конечной концентрации 5 ммоль и фенилметилсульфонилфторид (ФМСФ) (200 мМ исходный раствор в диметилсульфоксиде) до конечной концентрации 1 ммоль.
Обработка клеточных ядер включает следующие стадии:
1. Клеточные ядра размораживают на льду и определяют объем NPV (объем нуклеарного центрифугата).
2. В два отдельных стеклянных стакана вносят, соответственно, в каждый, 1/2 объема NPV в 0,02 М KCl-буфере (буфер с низким содержанием соли: 20 мл 1 М ТРИС, рН=6,8 при комнатной температуре; 250 мл 100%-ного глицерина; 6,67 мл 3 М раствора КСl; 1,5 мл 1 М раствора хлорида магния; 0,4 мл 0,5 М раствора этилендиаминтетрауксусной кислоты (ЭДТК); вода до общего объема 1000 мл) и 1/2 объема NPV в 1,2 М КСl-буфере (буфер с высоким содержанием соли: 20 мл 1 М ТРИС, рН=6,8 при комнатной температуре; 250 мл 100%-ного глицерина; 400 мл 3 М раствора КСl; 1,5 мл 1 М раствора хлорида магния; 0,4 мл 0,5 М раствора ЭДТК; вода до общего объема 1000 мл).
К каждому буферу добавляют 0,0007 × NPV/2 β-меркаптоэтанола и 0,001 × NPV/2 0,2 М раствора ФМСФ. Центрифугат снова суспендируют в 1/2 объема 0,02 М КСl-буфера и "мягко" гомогенизируют с помощью пестика (6 ×).
3. Гомогенат помещают в стеклянный стакан и в течение 30 минут по каплям смешивают с 1,2 М KCl-буфером при постоянном перемешивании. Экстракция заканчивается после перемешивания в течение следующих 30 минут. После центрифугирования (центрифуга Бекмана, SS34-ротор, при скорости 14 000 оборотов в минуту, 30 минут, температура 4°С) центрифугат и супернатант обрабатывают далее раздельно.
4. Супернатант диализируют в буфере 1 (40 мл 1 М ТРИС, рН=6/8 при комнатной температуре; 400 мл глицерина; 0,8 мл 0,5 М ЭДТК; вода до общего объема 2000 мл) до тех пор, пока не будет достигнута электропроводность буфера 2 (40 мл 1 М ТРИС, рН=6,8 при комнатной температуре; 400 мл глицерина; 0,8 мл 0,5 М ЭДТК; 66,7 мл 3 М раствора хлорида калия; вода до общего объема 2000 мл) (45-55 минут).
5. Диализированный супернатант подвергают центрифугированию (центрифуга Бекмана, SS34-ротор; 18000 оборотов в минуту; 20 минут, температура 4°С). HeLa-ядерный экстракт находится в супернатанте (HeLa-нуклеарный экстракт=НеLа-NЕ). Аликвоты экстракта замораживают в жидком азоте. Центрифугат из процесса экстракции ядер переносят в гомогенизатор, смешивают с 10 мл TGME/5 ммоль дитиотреитола (TGME на 1 л: 250 мл 100%-ного глицерина; 50 мл ТРИС, рН=7,3 при комнатной температуре; 5 мл 1 М раствора хлорида магния; 0,2 мл 500 мМ ЭДТК, рН=8,0), гомогенизируют 20 × с помощью пестика (интенсивно) и замораживают в жидком аммиаке (HeLa-нуклеарный центрифугат).
Пример 2. Подготовка колонки с фосфоцеллюлозой для очистки ядерного экстракта
1. P11R-Колоночный материал многократно промывают водой. Определяют объем набухшего материала.
2. Добавляют 5 объемов 0,5 н раствора гидроксида натрия, оставляют стоять в течение 5 минут, затем тотчас отсасывают через складчатый фильтр.
3. Промывают водой до достижения рН=11.
4. Добавляют 25 объемов 0,5 н соляной кислоты, оставляют стоять в течение 5 минут, затем тотчас отсасывают.
5. Промывают водой до достижения рН=3.
6. Промывают с помощью 1 М ТРИС, рН=7, вплоть до достижения постоянного значения рН=7. Колоночный материал хранят при температуре 4°С. Лучше всего уравновешивать в течение ночи.
Пример 3. Хроматографическая очистка ядерного экстракта путем хроматографии с использованием фосфоцеллюлозы
Емкость Р11R-материала составляет 10 мг протеина/1 мл материала. Хроматографию осуществляют следующим образом:
1. Р11 R-Материал помещают в колонку и уравновешивают в буфере 2 (со свежедобавленным дитиотреитолом и ФМСФ, см. пример 1). Колонку присоединяют к насосу.
2. Нагружают ядерным экстрактом (в буфере 2) (со скоростью 1 объем колонки (ОК) в час).
3. Колонку промывают с помощью буфера 2 в количестве 5 ОК (5-10 ОК/час).
4. Элюируют с помощью буфера 3 (40 мл 1 М ТРИС, рН=6,8 при комнатной температуре; 400 мл глицерина; 0,8 мл 0,5 М ЭДТК; 200 мл 3 М раствора хлорида калия; вода до общего объема 2 000 мл; 2 ОК/час). После того, как больше не элюируется никакой протеин, пропускают следующие 2 ОК буфера 3.
5. Элюируют с помощью буфера 4 (40 мл 1 М ТРИС, рН=6,8 при комнатной температуре; 400 мл глицерина; 0,8 мл 0,5 М ЭДТК; 333 мл 3 М раствора хлорида калия; вода до общего объема 2 000 мл; 2 ОК/час) и собирают "пиковые" фракции.
6. Элюируют с помощью буфера 5 (40 мл 1 М ТРИС, рН=6,8 при комнатной температуре; 400 мл глицерина; 0,8 мл 0,5 М ЭДТК; 567 мл 3 М раствора хлорида калия; вода до общего объема 2 000 мл; 2 ОК/час) и собирают "пиковые" фракции.
7. Каждый из обоих элюатов диализируют от буфера 2, пока электропроводность не станет постоянной, и затем аликвоты замораживают в жидком азоте.
Пример 4. Стандартный способ транскрипции при использовании полиакриламидного геля для отделения транскриптов
Смесь для транскрипции (конечный объем 20 мкл) может состоять из следующих компонентов:
а) общие факторы транскрипции (в форме предварительно очищенных ядерных экстрактов или полученных рекомбинантным путем) дополняют другими специфическими факторами транскрипции, активаторами, ингибиторами или слитыми протеинами;
б) ДНК-матрица (например, вектор pGS100 с исследуемым ген-регуляторным элементом);
в) буфер для транскрипции, который содержит, например, исследуемое активное вещество;
г) маркированные и немаркированные нуклеотиды;
к п.а): элюат, полученный с помощью буфера 4, и элюат, полученный с помощью буфера 5, (из примера 3) содержит способный к транскрипции ядерный экстракт (все общие факторы транскрипции). Оптимальные количества элюата, получаемого с помощью буфера 4, и элюата, получаемого с помощью буфера 5, нужно определять для каждого приготовления снова (примерно 3 мкл получаемого с помощью буфера 4 элюата и 2 мкл получаемого с помощью буфера 5 элюата на смесь);
к п.б): обычно используют 100 нг ДНК-матрицы (ген-регуляторный элемент в репортерной плазмиде, например, в pGS100) на смесь;
к п.в): буфер для транскрипции (5 мМ MgCl2; 25 мМ ГЕПЕС КОН; рН=8,2; 0,5 мкл ацетилированного бычьего сывороточного альбумина (исходный продукт; 20 мг/мл); примерно 10% глицерина; примерно 70 мМ КСl; 0,2 мМ ФМСФ; 10 мМ ди-тиотреитола) в каждом случае с 20 Ед. рибонуклеазы в качестве ингибитора на смесь;
к п.г): нуклеозидтрифосфаты (аденозинтрифосфат, уридинтрифосфат: конечная концентрация по 100 мкмоль; цитидинтрифосфат: конечная концентрация 5 мкмоль; о-м-гуанозинтрифосфат: конечная концентрация 20 мкмоль; α-32Р-цитидинтрифосфат: конечная концентрация примерно 0,12 мкмоль, 3000 Ки/ммоль или 10 мКи/мл).
1. Берут буфер для транскрипции и нуклеозидтрифосфаты согласно п.г) и добавляют ДНК-матрицу.
2. Добавляют активатор транскрипции и полученные с помощью буферов 4 и 5 элюаты.
3. Для осуществления реакции транскрипции инкубируют в течение 1 часа при температуре 30°С.
4. Добавляют 400 мкл стоп-смеси (7 моль мочевины; 10 ммоль ТРИС-НСl, рН=7,8; 10 ммоль ЭДТК/NaOH, рН=8; 0,5% додецилсульфата натрия; 100 ммоль хлорида лития; 100 мкг/мл тРНК; 300 ммоль ацетата натрия) и 400 мкл смеси фенола с хлороформом и изоамиловым спиртом в соотношении 25:24:1. Смешивают и центрифугируют (SS34-ротор; центрифуга Бекмана; 5 минут; 14000 оборотов в минуту; комнатная температура). Супернатант отбирают, добавляют 400 мкл изопропанола и смешивают, затем инкубируют в течение 1 часа при температуре -20°С.
5. Центрифугируют (SS34-ротop; центрифуга Бекмана; 14000 оборотов в минуту; 30 минут; температура 4°С); центрифугат промывают с помощью 70%-ного этанола и затем высушивают в вакуумном аппарате для быстрого высушивания.
6. Центрифугат вносят в 10 мкл загрузочного буфера (955 мкл 100%-ного формамида (деионизирован); 10 мкл 0,5 М ЭДТК; 20 мкл 1 М ТРИС, рН=7; по 0,003% бромфенолового синего и ксиленцианола; вода до общего объема 1 мл) и инкубируют в течение 15 минут при температуре 50°С.
7. Транскрипты отделяют в 5%-ном денатурирующем мочевино-полиакриламидном геле с помощью 1 × ТВЕ в качестве рабочего буфера. Предварительная обработка в течение 20 минут при 60 мА. Гель нагружают. Пропускание через гель примерно в течение 1 часа при 60 мА.
8. Гель фиксируют в 10%-ной уксусной кислоте, высушивают и экспонируют на рентгеновской пленке в PhosphoimagerR.
Пример 5. Протокол описанного автоматизируемого способа транскрипции ин витро при использовании фильтра для связывания транскриптов
1. Берут буфер для транскрипции и нуклеозидтрифосфаты согласно п.г) и добавляют ДНК-матрицу.
2. Добавляют полученные с помощью буферов 4 и 5 элюаты и возможно активатор транскрипции или ингибитор транскрипции.
3. Для осуществления реакции транскрипции инкубируют в течение 1 часа при температуре 30°С.
4. Добавляют 5 мкл смеси с протеиназой К (1 мкл раствора протеиназы К [20 мг/мл]; 1 мкл 10%-ного додецилсульфата натрия; 0,5 мкл 0,5 М ЭДТК, рН=8; 1 мкл 50 мМ ТРИС, рН=7,8; вода до общего объема 5 мкл).
5. Инкубируют в течение 15 минут при температуре 30°С.
6. Диэтиламиноэтилцеллюлозную мембрану NA 45R (Schleicher и Schuell) в течение короткого времени промывают буфером для промывки мембран (100 мМ натрийфосфатного буфера, рН=7,5; 250 мМ хлорида натрия; 2% пирофосфата натрия).
7. 5 мкл смеси наносят пипеткой на мембрану и оставляют высыхать в течение 5 минут.
8. Мембрану 4 раза по 15 минут слегка встряхивают примерно в 100 мл буфера для промывки мембран (+1% Тритона).
9. Мембрану переносят на бумагу Ватман 3 ММR (фирма Ватман, Мидстоун, Великобритания), оставляют высыхать на воздухе, покрывают пленкой и фильтр экспонируют на рентгеновской пленке при использовании PhosphoimagersR.
Пример 6. Осуществление реакции транскрипции по описанному способу транскрипции ин витро при использовании фильтра параллельно с тремя различными репортерными плазмидами
Реакцию транскрипции осуществляют как описано в примерах 1-3. В качестве репортерных плазмид используют pMRGS (ТАТА-блок ВИЧ-промотора; инициирующая область ML-промотора и длиной примерно 400 нуклеотидов G-свободная кассета в pUC19 [Kretschmar M., Kaiser К., Lottspeich F., Meisterernst M., Cell, 78, 525-534 (1994)]), pGS100 (фиг.2) и pVβML (строения как pGS100, однако вместо G-свободной кассеты длиной 800 пар оснований содержит G-свободную кассету длиной только 400 пар оснований). Для реакции транскрипции используют в каждом случае 100 нг ДНК-матрицы и 3 мкл Р11R-фракций (полученный с помощью буфера 4 элюат и полученный с помощью буфера 5 элюат). Реакции осуществляют в каждом случае параллельно без активатора и с активатором (слитый протеин, состоящий из домена связывания Ga14 и активированного домена полиглутамина). Результаты представлены на фиг.1 и пояснены.
Пример 7. Сравнение интенсивности сигнала (как меры количества транскрипта и тем самым силы транскрипции) радиоактивно маркированных транскриптов, полученных с помощью стандартного способа транскрипции, с таковыми, полученными с помощью описанного способа транскрипции ин витро.
Реакции транскрипции осуществляют как описано в примерах 1-5 и параллельные реакционные смеси анализируют при использовании фильтра (пример 5), соответственно, геля (пример 4). Для реакций используют в каждом случае 200 нг pMRGS в качестве ДНК-матрицы. Некоторые реакции транскрипции проводят в присутствии 30 нг Ga14-VP16, который используют в качестве активатора. Результаты представлены на фиг.3 и описаны.
Таблица 1: Последовательность №1:



Изобретение относится к биотехнологии и может быть использовано для анализа ин витро транскрипции вирусных и клеточных генов. Бесклеточную транскрипцию ин витро ДНК-матрицы осуществляют с использованием обогащенного экстракта из клеточных ядер и маркированного нуклеотида. Маркированный транскрипт определяют. ДНК-матрица содержит уникальные сайты рестрикции для рестрикционных эндонуклеаз Pst1, EcoR1, Sac1, Kpu1, Sac11, BamH1, Swa1, часть плазмиды pUC19, пять сайтов связывания для протеина дрожжей Ga14, “TATA”-блок человеческого рецептора Т-клеток Vβ 8.1 между сайтами рестрикции Sac11 и BamH1, инициаторный участок аденовирусного главного позднего промотора между сайтами рестрикции BamH1 и Swa1 и G-свободную последовательность длиной примерно 800 нуклеотидов. Изобретение позволяет осуществлять детектирование специфического транскрипта в автоматическом режиме. 3 н. и 47 з.п.ф-лы, 3 ил. 1 табл.
| Приспособление в пере для письма с целью увеличения на нем запаса чернил и уменьшения скорости их высыхания | 1917 |
|
SU96A1 |
| Транскрипция и трансляция/Под ред | |||
| Б.Хеймса, С.Хиггинса | |||
| - М.: Мир, 1987, с.89-109 | |||
| US 5563036, 08.10.1996. | |||
Авторы
Даты
2004-09-10—Публикация
1998-03-11—Подача