Изобретение относится к области химико-фармацевтической промышенности.
Ингибиторы протеазы (ИП) ВИЧ, к которым относится лопинавир и ритонавир - это вещества, обладающие сродством к активному центру протеазы ВИЧ, которая должна расщеплять полипротеин вируса Gag-Pol на отдельные функциональные белки. В результате действия ингибиторов протеаза не выполняет свою функцию, и образуются вирусные частицы, не способные заражать новые клетки. ИП нередко оказывают побочное действие на ЖКТ. При длительном применении возможны нарушения липидного обмена разной степени тяжести и развитие липодистрофии.
Среди ингибиторов ВИЧ-протеазы известны такие вещества, как нелфинавир, саквинавир, типранавир, дарунавир, индинавир, атазанавир, ритонавир, лопинавир, палинавир, фосампренавир.
Известно, что практически все ингибиторы протеазы ВИЧ являются малорастворимыми в воде субстанциями. В связи с этим возникают технологические сложности в процессе создания готовых лекарственных форм на основе этих субстанций. Кроме того, очень трудной задачей является подобрать состав вспомогательных веществ таким образом, чтобы улучшить фармакокинетические параметры готовой лекарственной формы и соответственно биодоступность АФС, а так же увеличить комфортность приема препарата уменьшив массу готовой лекарственной формы.
Из уровня техники известен препарат Калетра® таблетки, покрытые пленочной оболочкой (Лопинавир 200 мг + Ритонавир 50 мг)» производства Эбботт ГмбХ и Ко.КГ, Германия, который описан в патенте ЕА 011924 и принят за прототип.
Как следует из патента ЕА 0011924 авторами была предпринята попытка улучшить биодоступность твердой лекарственной формы лопинавира + ритонавира. Данная задача была решена путем введения в состав готовой лекарственной формы водорастворимых полимеров в достаточно большом количестве от примерно 50 до примерно 85 мас. % и фармацевтически приемлемое поверхностно-активное вещество в количестве от примерно 2 до примерно 20 вес. % относительно веса дозированной формы, а так же использование технологии термопластичной экструзии.
Существует постоянная необходимость в разработке улучшенных твердых дозированных форм. В частности, востребованными являются полимерные композиции-носители для образования твердых дисперсий, которые обнаруживают более высокую способность к растворению лекарства и/или делают возможным уменьшение вязкости расплава без ухудшения механических свойств и устойчивости при хранении дозированной формы.
Одним из способов улучшения биодоступности труднорастворимых веществ, является использование технологии экструзии из расплава. Обязательными этапами данной технологи является расплавление или подплавление смеси из полимерного связующего и активного фармацевтического ингредиента и, возможно, но не обязательно, дополнительных вспомогательных веществ и формирование из расплава экструдата. На следующих стадиях экструдат обрабатывается, с целью подготовки к формированию готовой лекарственной формы, любыми подходящими методами. В результате проведения процесса по данной технологии формируется твердый раствор активного фармацевтического ингредиента в матрице. Существует ряд трудностей при подборе подходящей композиции вспомогательных веществ и технологических параметров. Ведутся постоянные исследования, направленные на разработку новых композиций подходящих для решения поставленной задачи.
В WO 01/00175 раскрыты механически стабильные фармацевтические дозированные формы, которые являются твердыми растворами активных ингредиентов в матрице вспомогательного реагента. Матрица содержит гомополимер или сополимер N-винилпирролидона и жидкое или полужидкое поверхностно-активное вещество.
В WO 00/57854 раскрыты механически стабильные фармацевтические дозированные формы для перорального введения, которые содержат, по меньшей мере, одно активное соединение, по меньшей мере, одно термопластично формующееся образующее матрицу вспомогательное вещество и от более 10 и до 40% мас. поверхностно-активного вещества, которое обладает значением ГЛБ (показатель гидрофильно-липофильного баланса) равным от 2 до 18, является жидким при 20°C или обладает температурой каплепадения, равной от 20 до 50°C.
Используемые сокращения
ГЛБ - Гидрофильно-липофильный балланс
BCS - биофармацевтическая классификационная система.
ИП - Ингибиторы протеазы
ВИЧ - Вирус иммунодефицита человека
ПЭГ - полиэтиленгликоль
МУРР - малоугловое рентгеновскогое рассеяние
АФС - активная фармацевтическая субстанция
Краткое описание фигур
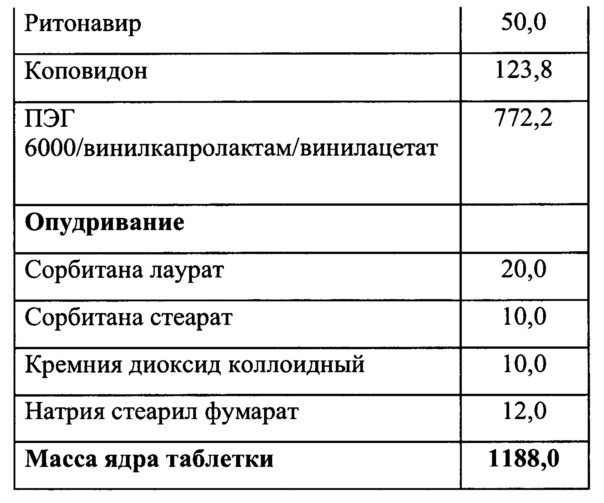
Фигура 1. Анализ степени кристалличности фармацевтической композиции по примеру 2 проанализированного с помощью малоуглового рентгеновского рассеяния - МУРР (Anton Paar). Красный цвет - лопинавир, синий - смесь полимеров входящих в состав экструдата, зеленый - смесь полимеров и АФС (экструдат).
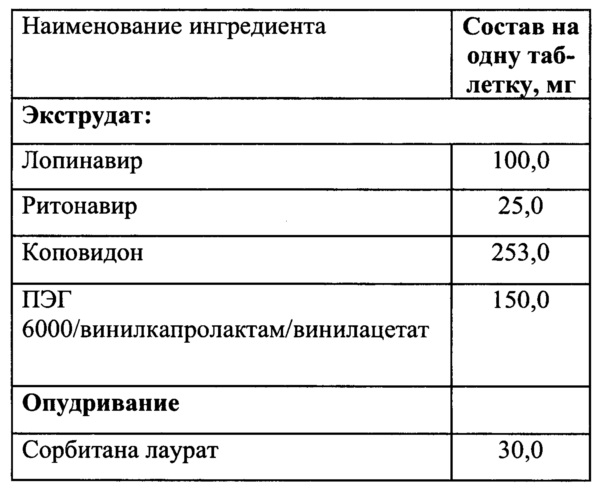
Фигура 2. Анализ степени кристалличности фармацевтической композиции по примеру 2 проанализированного с помощью МУРР (Anton Paar). Зеленый цвет - лопинавир, Синий цвет - ритонавир, Красный цвет - смесь полимеров и АФС после экструзии (экструдат) после 6 месяцев хранения, черный цвет - смесь полимеров после экструзии после 6 месяцев хранения.
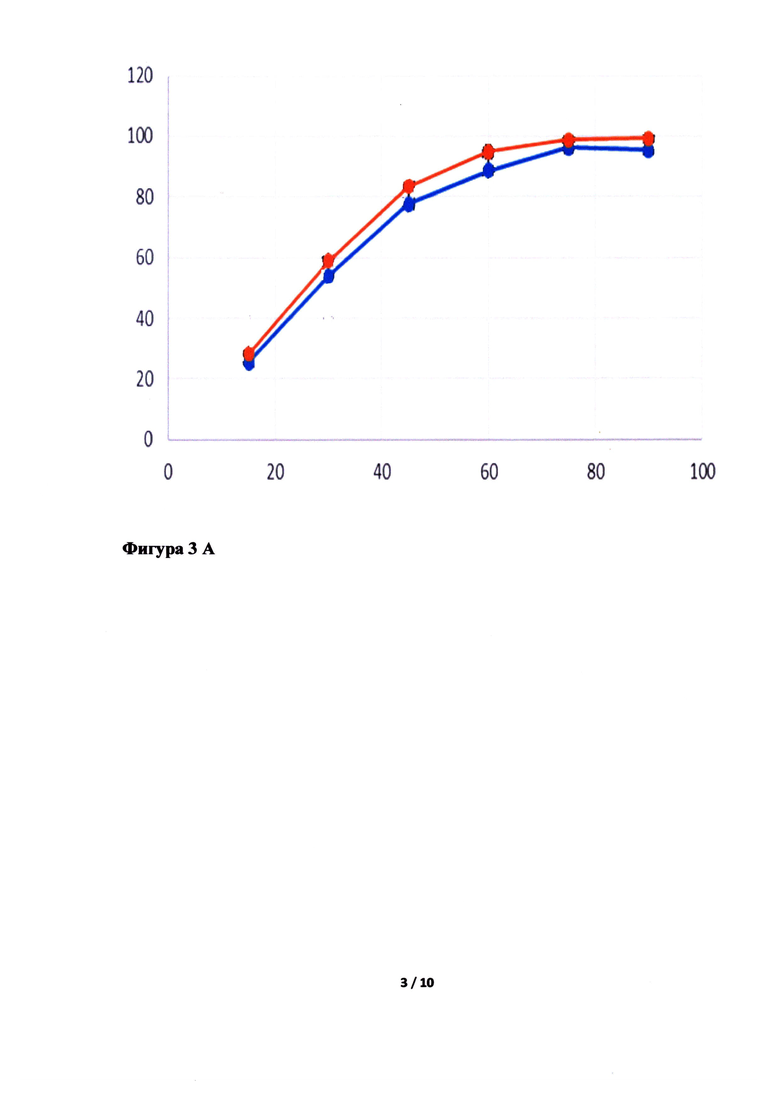
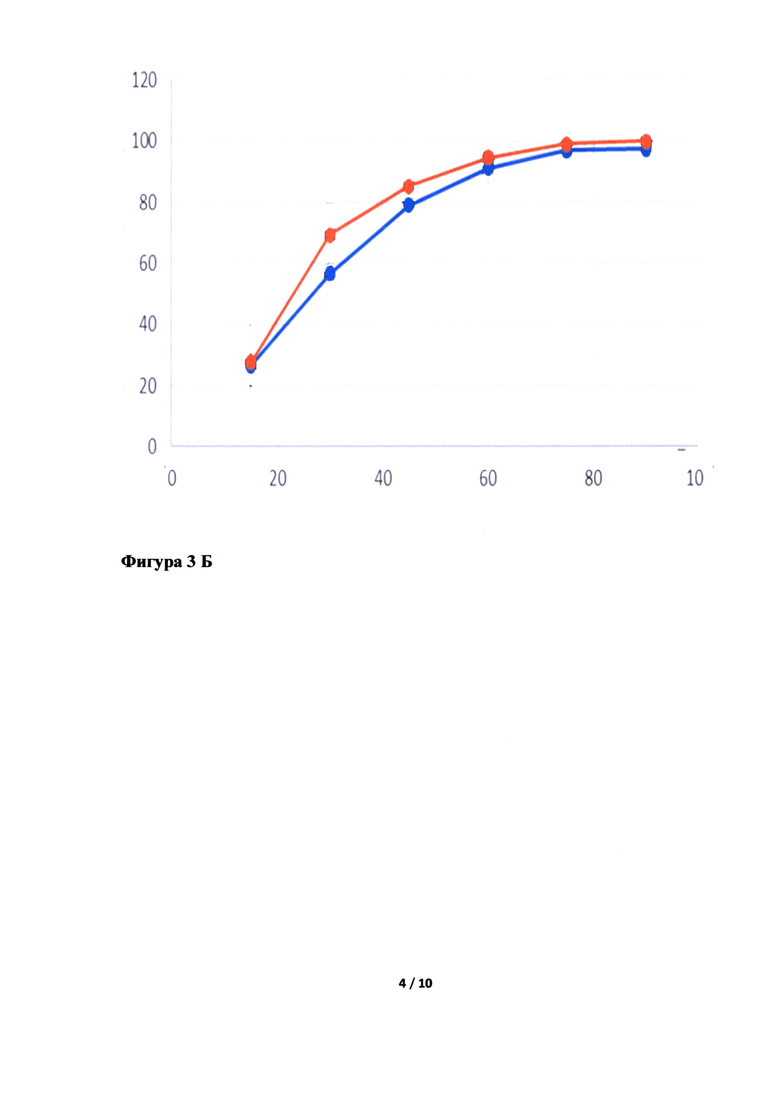
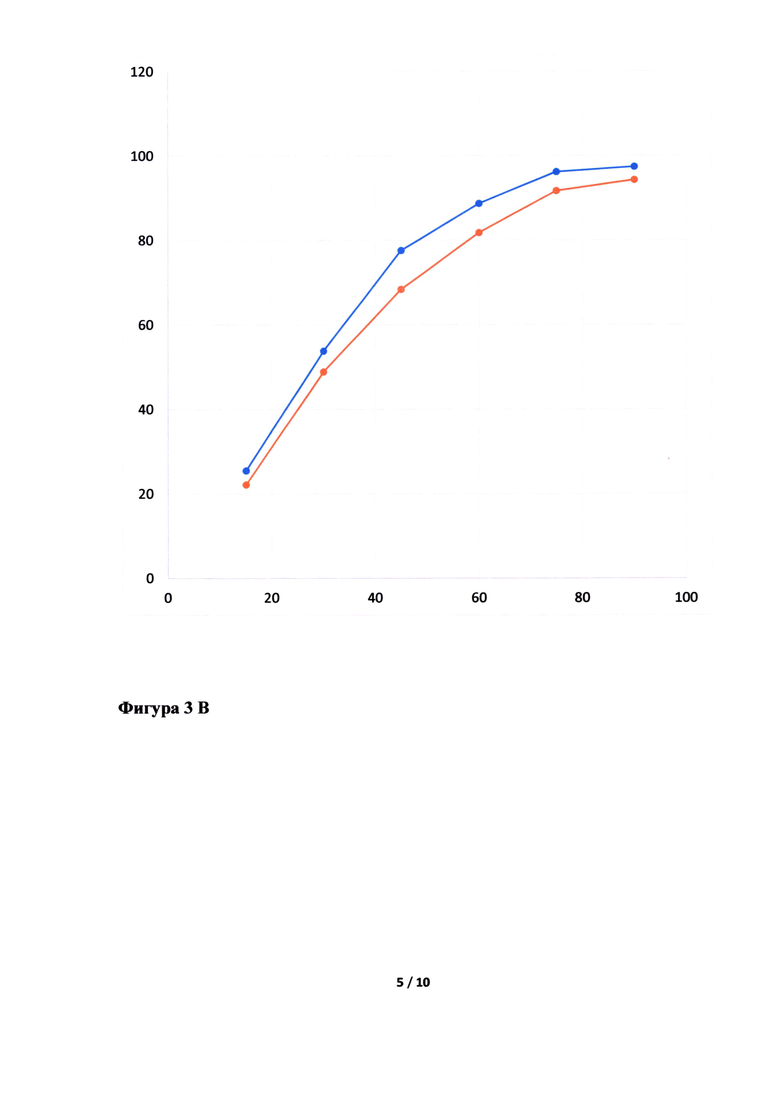
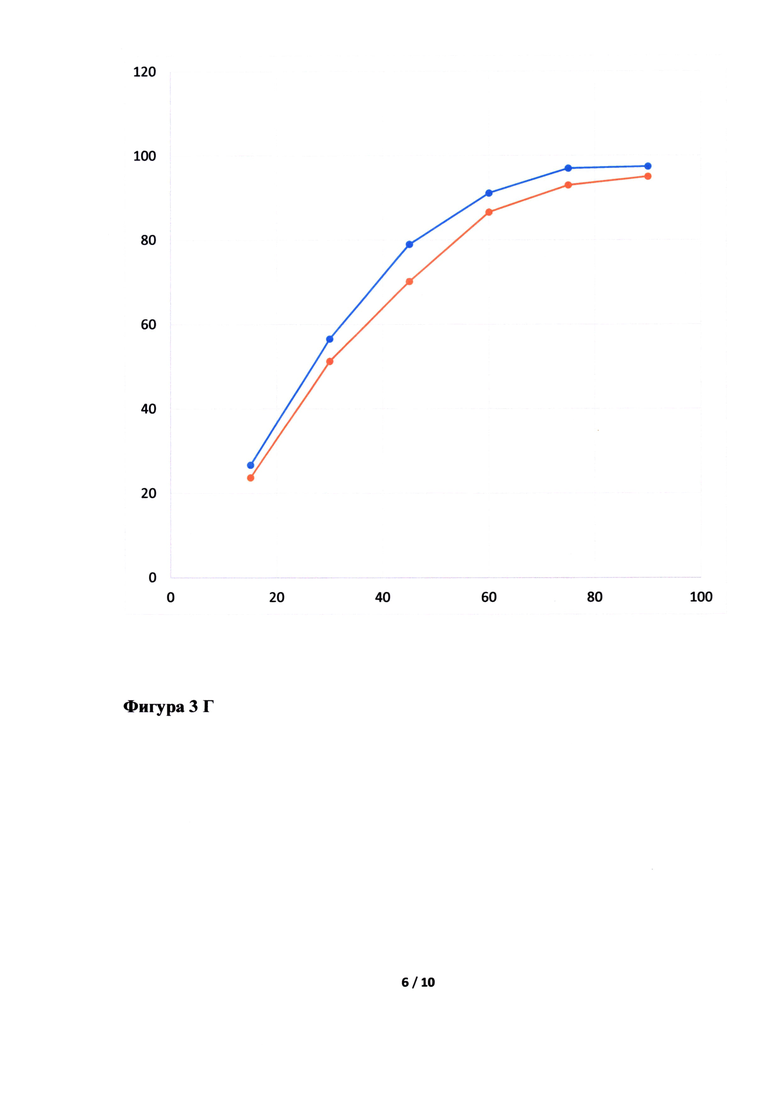
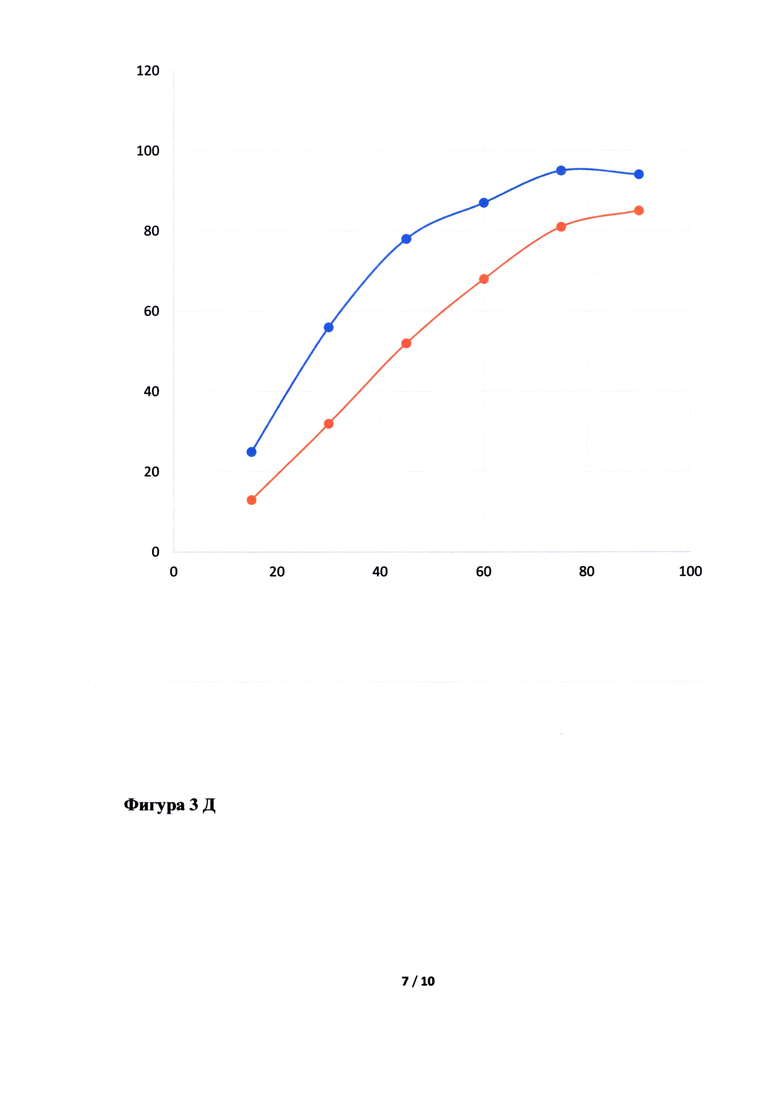
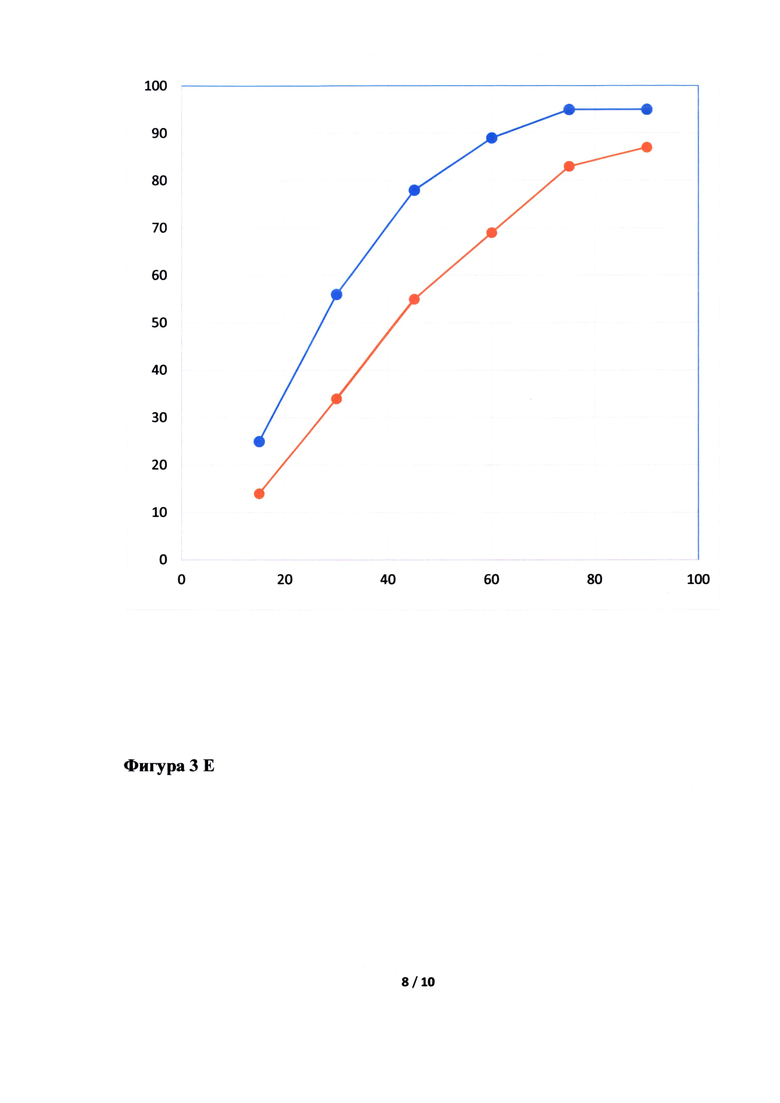
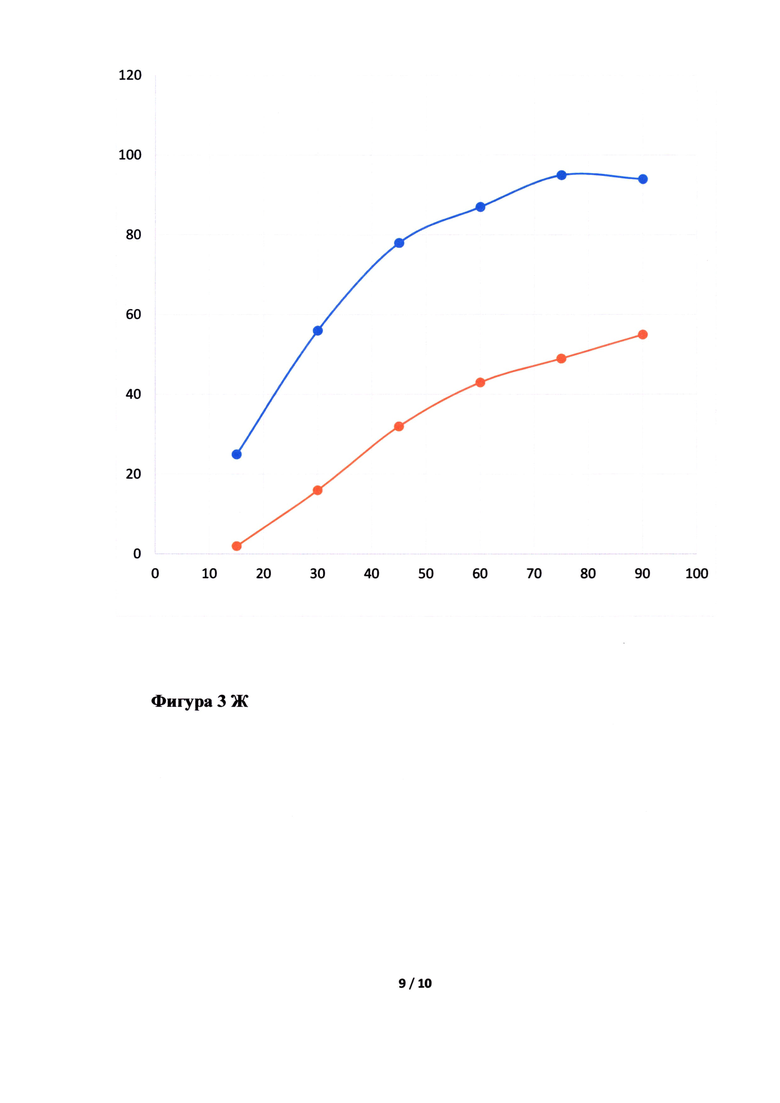
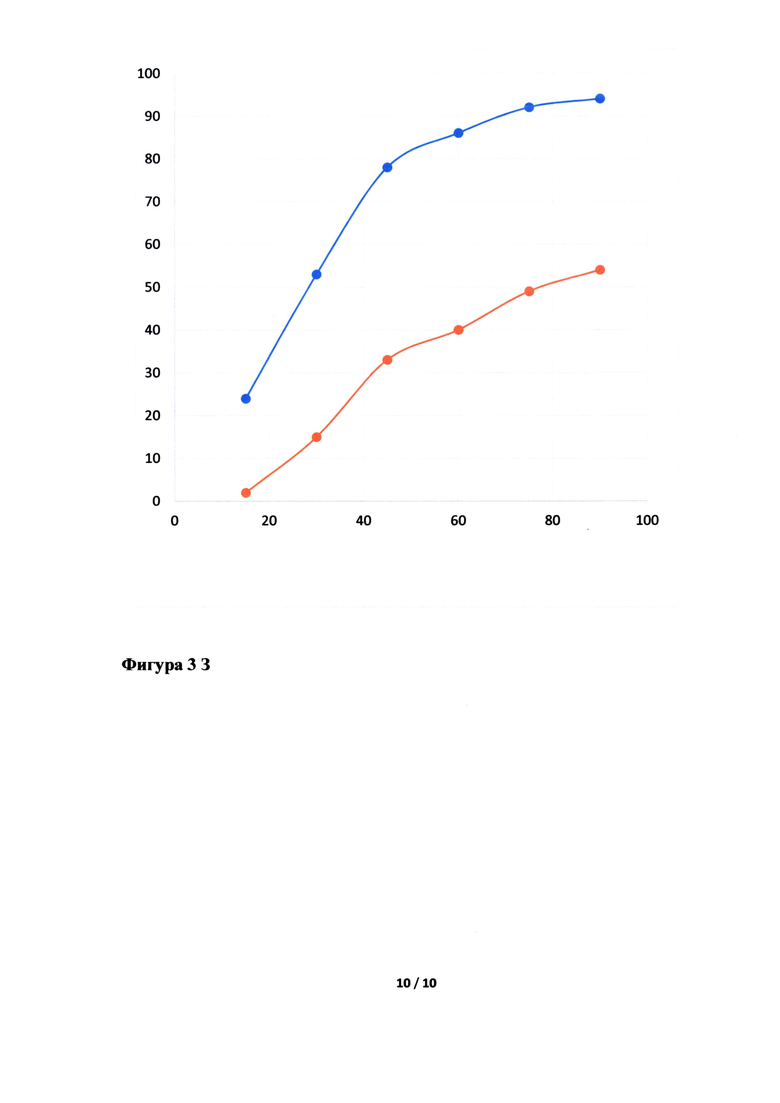
Фигура 3. Исследование кинетики высвобождения лопинавира (Фигура 3А, В, Д, Ж) и ритонавира (Фигура 3Б, Г, Е, З) из Исследуемого препарата (ИП) - Лопинавир и Ритонавир (оранжевым цветом), таблетки, покрытые пленочной оболочкой из примера 5, 7, 8 и 4, соответственно, в сравнении с Препаратом сравнения (ПС) - Калетра (голубым цветом). По оси ординат указано количество вещества, перешедшее в раствор в %, а по оси абсцисс - время отбора пробы, мин.
Задачей изобретения является разработка альтернативных составов и технологий производства лекарственной формы препарата (ингибитора протеазы ВИЧ), улучшение фармакокинетических параметров препарата.
Неожиданно было обнаружено, что в случае использования в качестве основного полимера матричного полимера, состоящего из ПЭГ 6000/винилкапролактам/винилацетат в комбинации с коповидоном в определенных соотношениях, вместо используемых в прототипе, удалось улучшить кинетику растворения действующего вещества из ГЛФ. Причем содержание коповидона в готовой лекарственной форме должно быть от 5 до 65% от массы готовой лекарственной формы, а матричного полимера ПЭГ 6000/винилкапролактам/винилацетат - от 5 до 55%. Предпочтительно содержание коповидона в готовой лекарственной форме должно быть от 45 до 65%, а ПЭГ 6000/винилкапролактам/винилацетат - от 5 до 25%. В случае изменения содержания указанных веществ или исключения одного из веществ из готовой лекарственной формы, улучшить кинетику растворения действующих веществ не удалось (см. Фигуру 3Д, Е, Ж и З).
Как видно из приложенных фигур 3А и 3Б, удалось добиться улучшения скорости растворения. Для оценки полученных изменений введены дополнительные числовые характеристики графиков: AUC - площадь под кривой, ограниченной временем испытания (водится с целью эмпирической характеристики влияния отношения скоростей растворения исследуемых препаратов на фармакокинетические показатели), C1/2 - время перехода половины действующего вещества в раствор (вводится с целью эмпирической оценки влияния отношения скорости растворения на отношение фармакокинетических показателей). Очевидным образом, данные характеристики не могут быть прямо экстраполированы на известные фармакокинетические показатели, однако их улучшение, очевидно, положительно влияет на фармакокинетические показатели, т.к. оба действующих вещества препарата относятся ко второму классу BCS.
Как видно из полученных графиков AUC ритонавира (препарата сравнения) составила - 5842,50, AUC ритонавира (испытуемого препарата) - 6204,75, AUC лопинавира (препарата сравнения) составила - 5986,50, AUC лопинавира (испытуемого препарата) - 6387,00. Отличия числовых характеристик почти в 10% позволяют утверждать наличие влияния скорости растворения на фармакокинетические показатели.
Как видно из полученных графиков C1/2 ритонавира (препарата сравнения) составила - 28 минут, С1/2 ритонавира (испытуемого препарата) - 25 минут, C1/2 лопинавира (препарата сравнения) составила - 27 минут, C1/2 лопинавира (испытуемого препарата) - 23 минуты. Различие показателей времени перехода половины действующего вещества в раствор между препаратом сравнения и испытуемым препаратом позволяет утверждать улучшение фармакокинетических показателей испытуемого препарата относительно показателей препарата сравнения.
Поставленная задача решается тем, что авторами настоящего изобретения была разработана фармацевтическая композиция, включающая лопинавир, ритонавир, матричный полимер состоящий из ПЭГ 6000/винилка-пролактам/винилацетат/ в комбинации с коповидном и фармацевтически приемлемые вспомогательные вещества при определенном количественном соотношении компонентов.
В качестве матричного полимера может быть использован ПЭГ 6000/винилкапролактам/винилацетат.
Наряду с активными веществами и матричным полимером в комбинации с коповидном фармацевтическая композиция может при этом содержать обычные вспомогательные вещества, принятые в технологии приготовления лекарственных средств, такие как связующие, наполнители, консерванты, регуляторы текучести, смягчители, смачиватели, диспергаторы, эмульгаторы, растворители, антиокислители и/или пропелленты, пролонгаторы действия Sucker et al.: Pharmazeutische Technologie, Thieme-Verlag, Stuttgard, 1991.
В качестве наполнителя фармацевтическая композиция содержит одно или несколько веществ из следующих: сахара и их производные (лактоза, модифицированная лактоза, сахароза, глюкоза, маннит, модифицированный маннит, сорбит, фруктоза), полисахариды (целлюлоза и ее производные, крахмал, модифицированный крахмал, декстрин, декстроза, декстрат, мальтодекстрин, кальций и его соли (фосфаты, карбонаты, хлориды), кросповидон, коповидоны, циклодекстрины, альгиновая кислота и ее соли, сахарин и его соли, натрий и его соли (хлорид, цитрат, фумарат, карбонат), аспартам, молочная кислота и ее соли, янтарная кислота, аскорбиновая кислота, тартаровая кислота, коллоидная двуокись кремния.
Предпочтительно, фармацевтическая композиция содержит от 0,5 до 60 масс. % перечисленных выше наполнителей (в пересчете на 100 мас. % всей твердой лекарственной формы).
Кроме матричного полимера готовая лекарственная форма может содержать другие фармацевтически приемлемые полимеры, которые можно выбрать из группы, включающей растворимые в воде полимеры, диспергирующиеся в воде полимеры и набухающие в воде полимеры и любые их смеси. Полимеры считаются растворимыми в воде, если они образуют прозрачный гомогенный раствор в воде. После растворения при 20°C в воде при концентрации 2% (мас./об.) растворимый в воде полимер предпочтительно обладает вязкостью, равной от 1 до 5000 мПа⋅с, более предпочтительно - от 1 до 700 мПа⋅с и наиболее предпочтительно - от 5 до 100 мПа⋅с. Диспергирующимися в воде полимерами являются такие, которые при взаимодействии с водой образуют коллоидные дисперсии, а не прозрачный раствор. При взаимодействии с водой или водными растворами набухающие в воде полимеры обычно образуют каучукообразный гель.
Например, предпочтительные фармацевтически приемлемые полимеры можно выбрать из группы, включающей водорастворимые полимеры, подходящие для использования в составе фармацевтической композиции по настоящему изобретению, включая, но не ограничиваясь следующими веществами: гомополимеры и сополимеры N-виниллактамов, особенно гомополимеры и сополимеры N-винилпирролидона, например поливинилпирролидон (PVP), сополимеры N-винилпирролидона и винил-ацетата или винилпропионата; высокомолекулярные полиалкилен-оксиды, такие как полиэтиленоксид и полипропиленоксид и сополимеры этиленоксида и пропиленоксида; полиакрилаты и полиметакрилаты, такие как метакриловая кислота/этилакрилатные сополимеры, метакриловая кислота/метилметакрилатные сополимеры, бутилметакрилат/2-диметиламиноэтилметакрилатные сополимеры, поли(гидроксиалкилакрилаты), поли(гидроксиалкилметакрилаты); полиакриламиды; винилацетатные полимеры, такие как сополимеры винилацетата и кротоновой кислоты; поливиниловый спирт; олиго- и полисахариды, такие как каррагинаны; сложные эфиры целлюлозы и простые эфиры целлюлозы, в частности метилцеллюлозу и этилцеллюлозу, гидроксиалкилцеллюлозу, гидроксиаэтилцеллюлозу, в частности гидроксипропилметилцеллюлозу, в частности гидроксипропилцеллюлозу, сукцинаты целлюлозы, в частности сукцинат гидроксипропилметилцеллюлозы или ацетатсукцинат гидроксипропилметилцеллюлозы. В преимущественном воплощении указанный гидрофильный полимер включает поливинилпирролидон, полиалкиленоксид, в частности полиэтиленоксид и/или производные целлюлозы, в частности гидроксипропилметилцеллюлозу.
Водонерастворимые полимеры, которые могут использоваться в настоящем изобретении, включают, но не ограничиваются следующими веществами: целлюлоза микрокристаллическая, гипролоза (гидрокси-пропилцеллюлоза) низкозамещенная.
Предпочтительно, фармацевтическая композиция содержит от 10 до 70,0 масс. % полимера (в пересчете на 100 мас. % всей твердой лекарственной формы).
Поверхностно-активные вещества, подходящие для использования в составе фармацевтической композиции по настоящему изобретению, включают, но не ограничиваются следующими веществами: полисорбат 80 (например, полисорбат марки ТВИН-80), макрогол 6000 (полиэтиленгликоль 6000), сорбитановые моноэфиры жирных кислот, такие как Спан® 20, Спан® 40 и Спан® 60; или смеси одного или более из них; полиоксиэтиленовые производные касторового масла, например полиоксиэтиленглицеринтририцинолеат или полиоксил 35 касторовое масло (Кремофор® EL; BASF Corp.), или полиоксиэтиленглицериноксистеарат, такой как полиэтиленгликоль 40 гидрированное касторовое масло (Кремофор® RH 40) или полиэтиленгликоль 60 гидрированное касторовое масло (Кремофор® RH 60); альфа-токоферилполиэтиленгликольсукцинат, который обычно имеет сокращенно обозначают как витамин Е ТПГС; а также полиалкоксилированные глицериды, выпускаемые фирмой Gattefosse под торговыми наименованиями Gelucire® и Labrafil®, например Gelucire® 44/14 (лауроилмакрогол-32-глицерид, получаемый путем переэтерификации гидрированного масла семян масличной пальмы полиэтиленгликолем марки PEG 1500), Gelucire® 50/13 (стеаро-илмакрогол-32-глицерид, получаемый путем переэтерификации гидрированного пальмового масла полиэтиленгликолем марки PEG 1500) или Labrafil Ml944 CS (олеоилмакрогол-6-глицерид, получаемый путем переэтерификации масла из ядер абрикосовых косточек полиэтиленгликолем марки PEG 300), Softisan 601.
Предпочтительно, фармацевтическая композиция содержит от 0,3 до 10,0 масс. % поверхностно-активных веществ (в пересчете на 100 мас. % всей твердой лекарственной формы).
Готовая лекарственная форма может дополнительно включать в себя одно или несколько смазывающих веществ и глидантов, которые могут включать в себя стеариновую кислоту и ее производные или сложные эфиры, такие как: стеарат натрия, стеарат магния, стеарат кальция и соответствующие сложные эфиры, такие как: стеарил фумарат натрия; тальк и диоксид кремния соответственно, но не ограничиваются ими. Количество смазки и/или глиданта предпочтительно находится в диапазоне от 0,25% масс до 5% масс от массы композиции.
Предпочтительно лекарственное средство может быть изготовлено в виде порошков, таблеток, комбинированных таблеток, капсул, драже, гранул, покрытых оболочкой, суппозиторий, порошков для приготовления суспензий. Лекарственные формы могут быть выполнены традиционным способом («Фармацевтическая технология. Технология лекарственных форм», 2-е изд., Москва, 2006 г).
Фармацевтическая композиция по изобретению может вводиться перорально. Дозировка зависит от возраста, состояния и веса пациента.
Представленные ниже примеры иллюстрируют (без ограничения объема притязаний) наиболее предпочтительные варианты осуществления изобретения, а также подтверждают возможность получения фармацевтической композиции и достижения указанных технических результатов.
Для получения твердых дозированных форм из соответствующих компонентов при повышенной температуре, то есть при температуре размягчения полимера или более высокой температуре, составляющей по меньшей мере 70°C, получают формуемую массу, которую затем охлаждают, при необходимости, после реализации стадии формования. Обычно температура расплава находится в интервале от приблизительно 40°C до приблизительно 200°C, предпочтительно от приблизительно 50°C до приблизительно 160°C.
Перемешивание компонентов и приготовление формуемой массы могут быть осуществлены разными путями. Перемешивание можно осуществлять до, в процессе и/или после нагревания отдельных или всех компонентов массы. Например, для получения формуемой массы соответствующие компоненты сначала могут быть перемешаны, а затем нагреты. Кроме того, они могут быть одновременно перемешаны и нагреты. Часто осуществляют дополнительную гомогенизацию формуемой массы, чтобы обеспечить высокодисперсное распределение биологически активного вещества.
Нагревание осуществляют в обычно используемых для этой цели устройствах. Особенно пригодными являются обогреваемые экструдеры или смесители, в частности смесители непрерывного действия (например, типа ORP, CRP, АР или DTB фирмы List, типа Reaktotherm фирмы Krauss-Maffei или червячные смесители типа Бейкер-Перкинс фирмы Buss), двухлопастные двухлотковые смесители (корытные мешалки), плунжерные (внутренние) смесители или системы типа ротор/статор (например, Dispax фирмы IKA).
В качестве экструдеров можно использовать одночервячные экструдеры, гребневые шнековые экструдеры, а также многочервячные, в частности двухчервячные экструдеры, при необходимости оснащенные месильными дисками, с однонаправленным или разнонаправленным вращением червяков. Особенно предпочтительными являются двухчервячные экструдеры фирмы Werner u. Pfleiderer конструктивного ряда ZSK.
Массу в экструдеры или смесители в зависимости от их конструкции загружают обычным способом непрерывно или периодически. Порошкообразные компоненты можно загружать самотеком, например, посредством дифференциальных дозировочных весов. Пластичные массы могут подаваться непосредственно из экструдера или при помощи шестеренчатого насоса, использование которого является предпочтительным в случае высоких значений вязкости и давления. Жидкие среды можно дозировать пригодным для этого насосом.
Полученные массы обладают тестообразной или пастообразной консистенцией. Их, как правило, подвергают формованию. При этом в зависимости от типа формующего инструмента и способа формования формуемым массам может быть придана самая разнообразная форма. Например, в случае использования экструдера экструдированный жгут может быть подвергнут формованию между одной лентой и одним валком, между двумя лентами или двумя валками, как описано в европейской заявке на патент ЕР-А-358105, или путем переработки на каландре, снабженном двумя формующими валками (см. например, европейскую заявку на патент ЕР-А-240904).
Путем экструзии и горячей или холодной рубки экструдированного жгута могут быть получены, например, мелкие гранулы. Кроме того, охлажденная масса может быть подвергнута размолу до порошкообразного состояния и последующему обычному прессованию порошка для получения таблеток. При этом дополнительно можно использовать предназначенные для таблетирования вспомогательные вещества.
Приведенные ниже примеры служат для более подробного пояснения изобретения.
Пример 1
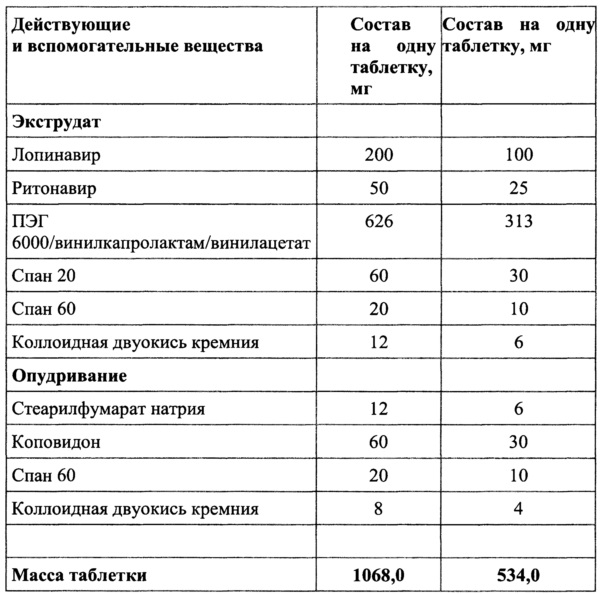
Смешать ПЭГ 6000/винилкапролактам/винилацетат, спан 60, коллоидную двуокись кремния и добавить спан 20, гомогенизировать, добавить лопинавир и ритонавир и перемешать.
Полученную смесь экструдировать при 135°C, опудрить, таблетировать.
Пример 2
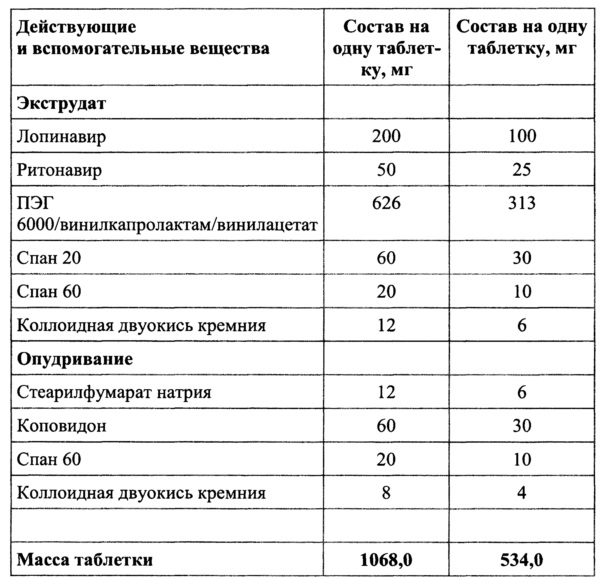
Смешать ПЭГ 6000/винилкапролактам/винилацетат, спан 60, коллоидную двуокись кремния и добавить спан 20, гомогенизировать, добавить лопинавир и ритонавир и перемешать.
Полученную смесь экструдировать при температуре от 105 до 145°C, опудрить, таблетировать.
Пример 3
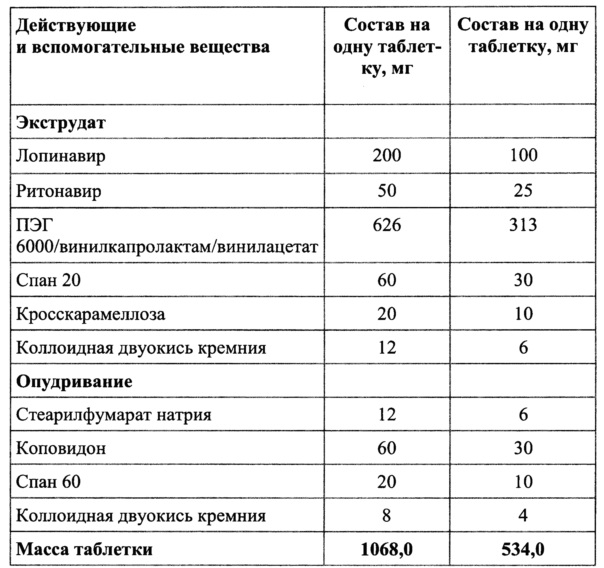
Смешать ПЭГ 6000/винилкапролактам/винилацетат, коллоидную двуокись кремния добавить спан 20 и кросскарамеллозу, гомогенизировать, добавить лопинавир и ритонавир и перемешать.
Полученную смесь экструдировать при температуре от 105 до 145°C, опудрить, таблетировать.
Пример 4
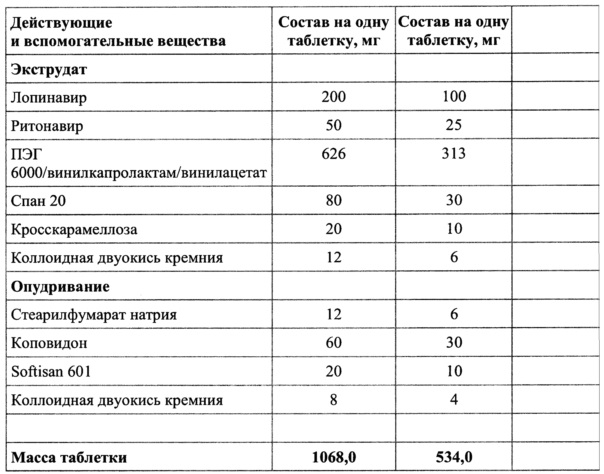
Смешать ПЭГ 6000/винилкапролактам/винилацетат, коллоидную двуокись кремния добавить спан 20 и кросскарамеллозу, гомогенизировать, добавить лопинавир и ритонавир и перемешать.
Полученную смесь экструдировать при температуре от 105 до 145°C, опудрить, таблетировать.
Пример 5

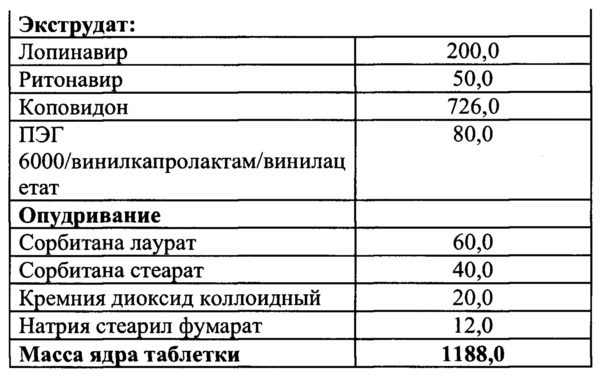
Смешать ПЭГ 6000/винилкапролактам/винилацетат и коповидон, гомогенизировать, добавить лопинавир и ритонавир и перемешать.
Полученную смесь экструдировать при температуре от 105 до 145°C, опудрить, таблетировать.
Пример 6
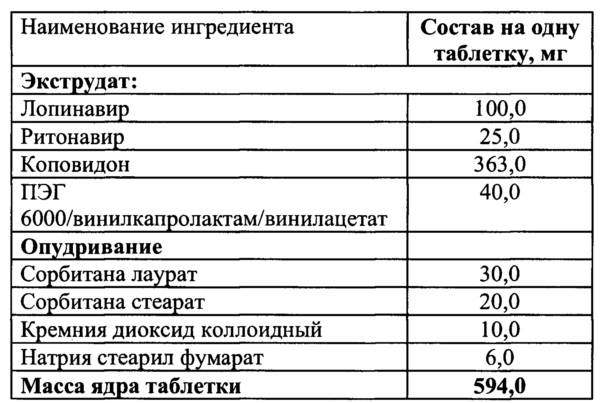
Смешать ПЭГ 6000/винилкапролактам/винилацетат и коповидон, гомогенизировать, добавить лопинавир и ритонавир и перемешать.
Полученную смесь экструдировать при температуре 135°C, опудрить, таблетировать.
Пример 7
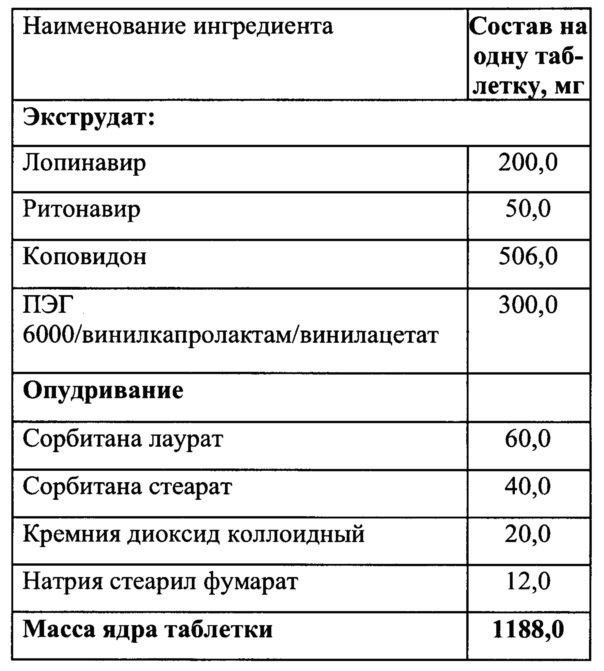
Смешать ПЭГ 6000/винилкапролактам/винилацетат и коповидон, гомогенизировать, добавить лопинавир и ритонавир и перемешать.
Полученную смесь экструдировать при температуре 120°C, опудрить, таблетировать.
Пример 8
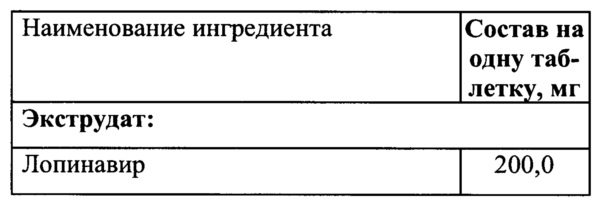
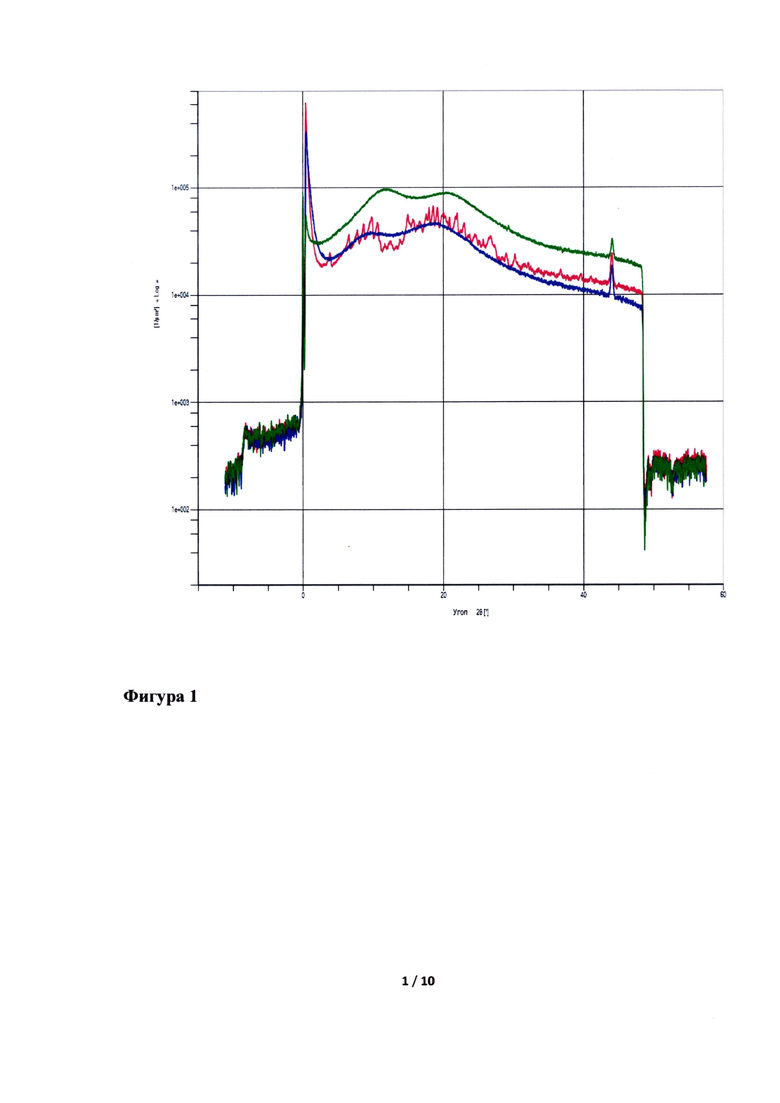
Смешать ПЭГ 6000/винилкапролактам/винилацетат и коповидон, гомогенизировать, добавить лопинавир и ритонавир и перемешать.
Полученную смесь экструдировать при температуре 120°C, опудрить, таблетировать.
Пример 9

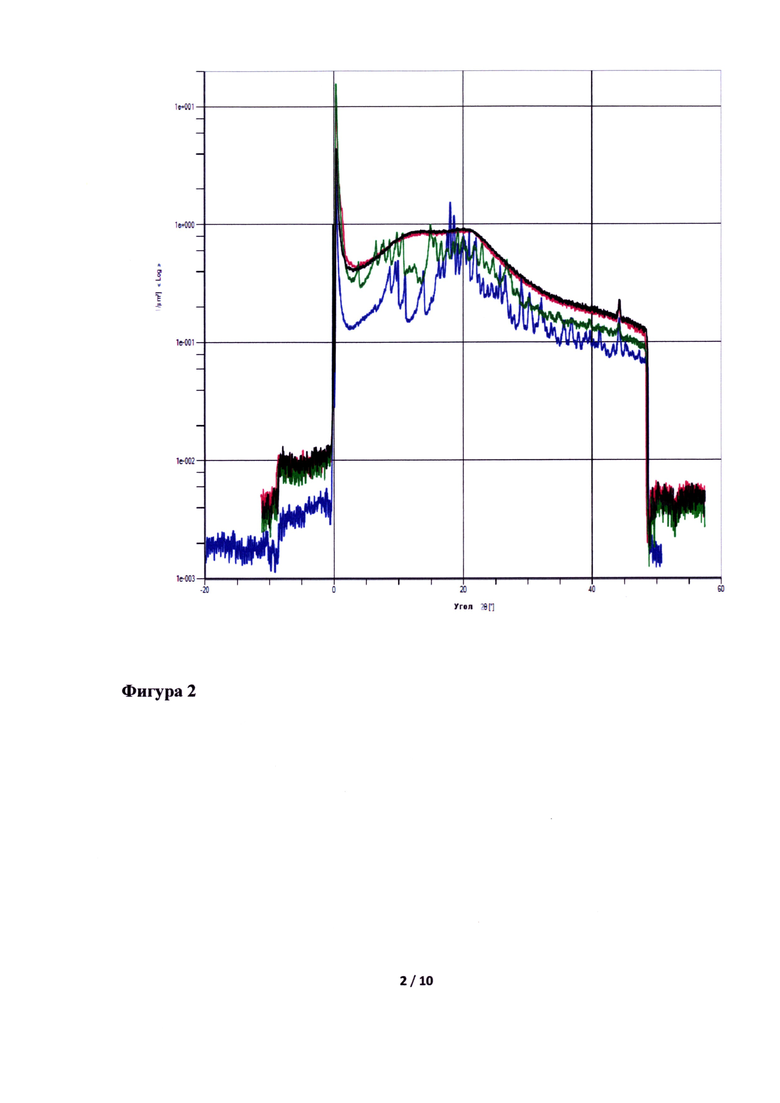
Смешать ПЭГ 6000/винилкапролактам/винилацетат и коповидон, гомогенизировать, добавить лопинавир и ритонавир и перемешать.
Полученную смесь экструдировать при температуре 125°C, опудрить, таблетировать.
Пример 10
Экструдат (пример 1) и компоненты входящие в состав экструдата были анализированы с помощью SAXS на предмет кристалличности материалов. Система SAXSpace - МалоУгловое Рентгеновское Рассеяние (SAXS или МУРР) это недеструктивный метод для исследования кристалличности и ориентации материалов, стабильности дисперсий.
Отсутствие у экструдата характерно выраженных пиков в области до 5-10 градусов указывает на то, что АФС находится в аморфном состоянии в свежеприготовленном экструдате (Фигура 1) и после 6 месяцев хранения экструдата при 20°C/60HD (Фигура 2).
Пример 11
Кинетика растворения испытуемого препарата из примера 5 (Фигура 3А и Б), 7 (Фигура 3В и Г), 8 (Фигура 3Д и Е) и 4 (Фигура 3Ж и З) в сравнении с оригинальным препаратом.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения фармацевтической композиции с такролимусом (варианты) и фармацевтическая композиция, полученная указанными способами | 2022 |
|
RU2792098C1 |
| Фармацевтическая композиция, обладающая активностью против ВИЧ-инфекции | 2017 |
|
RU2659693C1 |
| ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЮБИЛИЗИРУЮЩАЯ КОМПОЗИЦИЯ И СОДЕРЖАЩАЯ ЕЕ ФАРМАЦЕВТИЧЕСКАЯ ДОЗИРОВАННАЯ ФОРМА | 2007 |
|
RU2469708C2 |
| Фармацевтическая композиция, содержащая вещество с анальгетической активностью | 2023 |
|
RU2831791C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ВИЧ-ИНФЕКЦИИ, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И СПОСОБ ЛЕЧЕНИЯ | 2012 |
|
RU2505286C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ВИЧ-ИНФЕКЦИИ, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И СПОСОБ ЛЕЧЕНИЯ | 2013 |
|
RU2543322C1 |
| Экструдат с микофенолятом натрия для получения пероральной твердой лекарственной формы | 2018 |
|
RU2723255C2 |
| НОВАЯ АНТИРЕТРОВИРУСНАЯ КОМБИНАЦИЯ | 2008 |
|
RU2508105C2 |
| УСТРОЙСТВО ДЛЯ ПОЛУЧЕНИЯ ТВЕРДОЙ ДИСПЕРСИИ АКТИВНОГО ИНГРЕДИЕНТА | 2007 |
|
RU2448688C2 |
| Пероральная твердая лекарственная форма с микофенольной кислотой или ее солью для использования в качестве иммунодепрессанта для лечения или предупреждения отторжения трансплантата органа или ткани и способ ее получения | 2016 |
|
RU2670447C2 |
Изобретение относится к области химико-фармацевтической промышленности. Фармацевтическая композиция для лечения ВИЧ-инфекции включает лопинавир, ритонавир в эффективном количестве и полимер. При этом фармацевтическая композиция получена экструзией. В качестве полимера композиция содержит матричный полимер, состоящий из ПЭГ 6000/винилкапролактам/винилацетат от 5 до 25% от массы фармацевтической композиции в комбинации с коповидоном от 45 до 65% от массы фармацевтической композиции. Экструзию композиции проводят при температуре от 105 до 145 °С. Изобретение позволяет расширить арсенал лекарственных средств с улучшенными фармакокинетическими свойствами. 8 з.п. ф-лы, 3 ил., 11 пр.
1. Фармацевтическая композиция для лечения ВИЧ-инфекции, полученная экструзией и включающая лопинавир, ритонавир в эффективном количестве и полимер, отличающаяся тем, что в качестве полимера содержит матричный полимер, состоящий из ПЭГ 6000/винилкапролактам/винилацетат от 5 до 25% от массы фармацевтической композиции в комбинации с коповидоном от 45 до 65% от массы фармацевтической композиции.
2. Фармацевтическая композиция по п. 1, отличающаяся тем, что экструзию проводят с нагреванием.
3. Фармацевтическая композиция по п. 2, отличающаяся тем, что температура проведения экструзии от 105 до 145°C.
4. Фармацевтическая композиция по п. 3, отличающаяся тем, что температура проведения экструзии 135°C.
5. Фармацевтическая композиция по п. 1, отличающаяся тем, что дополнительно содержит глидант, поверхностно-активное вещество и дезинтегрант.
6. Фармацевтическая композиция по п. 5, отличающаяся тем, что в качестве глиданта содержит стеарил фумарат натрия.
7. Фармацевтическая композиция по п. 5, отличающаяся тем, что в качестве дезинтегранта содержит кросскармеллозу.
8. Фармацевтическая композиция по п. 5, отличающаяся тем, что в качестве поверхностно-активного вещества содержит смесь спан 60 и спан 20.
9. Фармацевтическая композиция по п. 5, отличающаяся тем, что в качестве поверхностно-активного вещества содержит смесь Softisan 601 и спан 20.
| Токарный резец | 1924 |
|
SU2016A1 |
| Камера горения для двигателя | 1928 |
|
SU11924A1 |
| Учебный патрон | 1929 |
|
SU20992A1 |
| ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЮБИЛИЗИРУЮЩАЯ КОМПОЗИЦИЯ И СОДЕРЖАЩАЯ ЕЕ ФАРМАЦЕВТИЧЕСКАЯ ДОЗИРОВАННАЯ ФОРМА | 2007 |
|
RU2469708C2 |
| Четырехбегунная чаша для мокрого дробления руды | 1925 |
|
SU14446A1 |
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| Dr | |||
| Florian Wildschek | |||
| Фармацевтические полимеры для экструзии методом расплава - назначение и применение, BASF SE, Benet, EDAN, Leuven, March 18-20, 2007, 39 стр. | |||
Авторы
Даты
2017-05-18—Публикация
2016-09-21—Подача