ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
В настоящей заявке испрашивается приоритет согласно § 119(е) 35-го раздела Кодекса США по предварительной патентной заявке США № 62/719217, поданной 17 августа 2018, которая полностью включена в настоящую заявку посредством ссылки.
ЗАЯВЛЕНИЕ ОТНОСИТЕЛЬНО ФЕДЕРАЛЬНО СПОНСИРОВАННЫХ ИССЛЕДОВАНИЙ ИЛИ РАЗРАБОТОК
Данное изобретение было выполнено с помощью правительственного гранта под номером 2R01 HL102016, предоставленного Национальным институтом болезней сердца, легких и крови. Правительство имеет определенные права на изобретение.
УРОВЕНЬ ТЕХНИКИ
Воспаление легких является важным компонентом в патогенезе синдрома острого повреждения легких (ALI), который имеет различную этиологию. Воспаление легких, связанное с продукцией активных форм кислорода (ROS), является важным фактором для синдрома ALI. Активация NADPH-оксидазы 2-го типа (NOX2), являющейся основным источником ROS в легких, требует активности фосфолипазы A2 (PLA2) пероксиредоксина 6 (Prdx6).
Современные методы лечения ALI являются поддерживающими, и в настоящее время не одобрено ни одно лекарственное средство, специально предназначенное для его профилактики или лечения. Поэтому в данной области существует потребность в способах и композициях, которые защищают от ALI. Настоящее изобретение решает эту потребность.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В одном аспекте изобретение относится к композиции, содержащей полипептид, состоящий из:
SEQ ID NO: 4 X1X2X3X4X5LX6X7X8X9HQIL
где:
X1 может присутствовать или отсутствовать, и если присутствует, представляет собой E;
X2 может присутствовать или отсутствовать, и если присутствует, представляет собой L;
X3 может присутствовать или отсутствовать, и если присутствует, представляет собой Q;
X4 может присутствовать или отсутствовать, и если присутствует, представляет собой A или T;
X5 может присутствовать или отсутствовать, и если присутствует, представляет собой T или E;
X6 представляет собой H или Y;
X7 представляет собой D или E;
X8 представляет собой F или I; и
X9 представляет собой R или K.
В различных вариантах осуществления полипептид выбирают из группы, состоящей из SEQ ID NO: 5 ELQTELYEIKHQIL, SEQ ID NO: 6 QTELYEIKHQIL и SEQ ID NO: 7 ELYEIKHQIL.
В различных вариантах осуществления полипептид выбирают из группы, состоящей из SEQ ID NO: 1 LHDFRHQIL, SEQ ID NO: 2 LYEIKHQIL или SEQ ID NO: 3 LYDIRHQIL.
В различных вариантах осуществления композиция дополнительно включает фармацевтически приемлемый носитель.
В различных вариантах осуществления полипептид инкапсулируют в один или несколько липосом.
В различных вариантах осуществления состав изготавливают для аэрозольной ингаляции или внутритрахеальной или внутривенной инъекции. В различных вариантах фармацевтическую композицию вводят субъекту посредством внутривенной инъекции.
В другом аспекте изобретение относится к способу лечения острого повреждения легких у субъекта, включающему в себя введение субъекту эффективного количества фармацевтической композиции, содержащей полипептид, состоящий из:
SEQ ID NO: 4 X1X2X3X4X5LX6X7X8X9HQIL
где:
X1 может присутствовать или отсутствовать, и если присутствует, представляет собой E;
X2 может присутствовать или отсутствовать, и если присутствует, представляет собой L;
X3 может присутствовать или отсутствовать, и если присутствует, представляет собой Q;
X4 может присутствовать или отсутствовать, и если присутствует, представляет собой A или T;
X5 может представлять собой T или E;
X6 представляет собой H или Y;
X7 представляет собой D или E;
X8 представляет собой F или I; и
X9 представляет собой R или K;
и фармацевтически приемлемый носитель.
В различных вариантах осуществления полипептид выбирают из группы, состоящей из SEQ ID NO: 5 ELQTELYEIKHQIL, SEQ ID NO: 6 QTELYEIKHQIL и SEQ ID NO: 7 ELYEIKHQIL.
В различных вариантах осуществления полипептид выбирают из группы, состоящей из SEQ ID NO: 1 LHDFRHQIL, SEQ ID NO: 2 LYEIKHQIL или SEQ ID NO: 3 LYDIRHQIL.
В различных вариантах осуществления полипептид инкапсулируют в одну или несколько липосом.
В различных вариантах осуществления фармацевтическую композицию вводят субъекту посредством аэрозольной ингаляции или путем внутритрахеальной или внутривенной инъекции.
В другом аспекте изобретение относится к способу лечения сепсиса у субъекта, включающему в себя введение субъекту эффективного количества фармацевтической композиции, содержащей полипептид, состоящий из:
SEQ ID NO: 4 X1X2X3X4X5LX6X7X8X9HQIL
где:
X1 может присутствовать или отсутствовать, и если присутствует, представляет собой E;
X2 может присутствовать или отсутствовать, и если присутствует, представляет собой L;
X3 может присутствовать или отсутствовать, и если присутствует, представляет собой Q;
X4 может присутствовать или отсутствовать, и если присутствует, представляет собой A или T;
X5 может представлять собой T или E;
X6 представляет собой H или Y;
X7 представляет собой D или E;
X8 представляет собой F или I; и
X9 представляет собой R или K;
и фармацевтически приемлемый носитель.
В различных вариантах осуществления полипептид выбирают из группы, состоящей из SEQ ID NO: 5 ELQTELYEIKHQIL, SEQ ID NO: 6 QTELYEIKHQIL и SEQ ID NO: 7 ELYEIKHQIL.
В различных вариантах осуществления полипептид выбирают из группы, состоящей из SEQ ID NO: 1 LHDFRHQIL, SEQ ID NO: 2 LYEIKHQIL или SEQ ID NO: 3 LYDIRHQIL.
В различных вариантах осуществления полипептид инкапсулируют в одну или несколько липосом.
В различных вариантах осуществления фармацевтическую композицию вводят субъекту посредством аэрозольной ингаляции или путем внутритрахеальной или внутривенной инъекции. В различных вариантах осуществления фармацевтическую композицию вводят субъекту посредством внутривенной инъекции.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Нижеследующее подробное описание предпочтительных вариантов осуществления изобретения будет лучше понято при рассмотрении совместно с прилагаемыми чертежами. С целью иллюстрации изобретения на чертежах показаны варианты осуществления, которые в настоящее время являются предпочтительными. Однако следует понимать, что изобретение не ограничено точными конструкциями и средствами вариантов осуществления, показанными на чертежах.
Фиг. 1A и 1B: мышам C57B1/6 дикого типа в возрасте 8-10 недель вводили по 2 мкг/г веса тела PIP-2 либо через внутритрахеальный катетер (IT), либо внутривенно (IV). Введенный пептид растворяли в физиологическом растворе или вводили в однослойные липосомы, состоящие из дипальмитоилфосфатидилхолина (DPPC), яичного фосфатидилхолина (PC), фосфатидилглицерина (PG) и холестерина (молярное соотношение липидов составляло 50:25:10:15). Авторы изобретения определили, что липосомы, содержащие либо 75% DPPC, либо 75% яичного PC (плюс PG и холестерин), были одинаково эффективны по сравнению с липосомами, содержащими DPPC/PC/PG/холестерин, в отношении внутриклеточной доставки PIP-2. Мышей умерщвляли через 5 минут, легкие перфузировали до удаления крови, и затем подвергали рециркуляционной перфузии в условиях контролируемой температуры (37°С) в присутствии флуоресцентного индикатора Amplex red плюс пероксидаза хрена (HRP) для того, чтобы контролировать окисление Amplex red перекисью (H2O2). Флуоресценцию аликвот перфузата измеряли в указанные моменты времени и выражали в виде произвольных единиц флуоресценции (AFU). Увеличение флуоресценции во время перфузии указывает на продукцию H2O2, отражающую активацию клеточной NADPH-оксидазы (NOX2). Введение PIP-2 в физиологическом растворе не влияет на скорость продукции H2O2, но PIP-2 в липосомах, введенный либо IT (фиг. 1A), либо IV (фиг. 1B), значительно ингибирует образование H2O2.
На фиг. 2А-2F показана временная кривая повреждения легких после внутритрахеальной инъекции липополисахарида (LPS) по следующим различным маркерам окисления тканей и воспаления легких. Бактериальный (E.coli) липополисахарид (LPS) вводили мышам C57B1/6 дикого типа путем внутритрахеальной (IT) инъекции в дозировке 5 мкг/г веса тела. Мышей умерщвляли через 12, 16, 24 или 48 часов после введения LPS, как указано. Легкие извлекали и промывали физиологическим раствором через трахею, получая жидкость бронхоальвеолярного лаважа (BALf); затем легкие гомогенизировали. Параметры повреждения легких представляют собой содержащие ядра клетки и белок в BALf и соотношение влажного и сухого веса легких (W/D); для определения W/D вес левой верхней доли легкого измеряли до и после сушки до постоянного веса в печи. Показателями окислительного стресса в ткани (нижний ряд) являлись активные формы тиобарбитуровой кислоты (TBARS), 8-изопростанолы и карбонилы белков, измеренные в гомогенате легких. Значения представляют собой среднее значение±для n=4. *P<0,05 относительно всех других значений; §p<0,05 относительно 12 ч, 16 ч и 24 ч. На фигуре 2А изображены активные формы тиобарбитуровой кислоты (TBARS). На фигуре 2В показаны 8-изопростанолы. На фиг. 2С показаны карбонилы белков в гомогенате легких. На фигуре 2D показано количество клеток в жидкости бронхоальвеолярного лаважа (BALF). На фиг.2Е показан общий белок в BALF. На фигуре 2F показано соотношение влажного и сухого веса легкого.
Фиг. 3A-3F: острое повреждение легких (ALI) получали внутритрахеальным введением LPS (5 мг/г веса тела). PIP-2 (2 мкг/г веса тела) в липосомах вводили IT вместе с LPS (0-й час) или внутривенно (IV) через 12 или 16 часов после введения LPS. PIP-2 вводили внутривенно для того, чтобы избежать второй травмы трахеи. Мышей умерщвляли через 24 часа и оценивали легкие в отношении повреждения легких и окислительного стресса в ткани. Результаты представляют собой среднее±SE для n=4. *P<0,05 относительно всех других групп. На фиг.3А показано количество клеток в BALF. На фиг. 3B показан общий белок в BALF. На фигуре 3С показано соотношение влажного и сухого веса легких. На фиг. 3D показан уровень TBARS. На фиг. 3Е показан уровень 8-изопростанолов. На фигуре 3F показан уровень карбонилов белка в гомогенате легких.
Фиг. 4А и 4В: активность фосфолипазы А2 у Prdx6 (aiPLA2) измеряли по высвобождению пальмитиновой кислоты из дипальмитоилфосфатидилхолина в кислых условиях (рН 4) в отсутствие Ca2+. Фиг. 4А: влияние увеличения концентрации PIP-2 на aiPLA2-активность рекомбинантного Prdx6 человека. На фиг. 4В показано воздействие LPS и PIP-2 на aiPLA2-активность в легких мышей. Мышам (n=3 для каждого условия) внутритрахеально вводили LPS (2 мкг/г веса тела) без или с PIP-2 (2 мкг/г веса тела) в липосомах. Животных умерщвляли через 6, 12 или 24 ч после введения LPS. Легкие освобождали от крови и гомогенизировали. Контрольные легкие получали от мышей, которым не вводили LPS. *P<0,05 относительно соответствующего контроля и относительно LPS+PIP-2; §p<0,05 относительно LPS через 12 и 24 часа.
Фиг. 5А и 5В: PIP-2, включенный в липосомы, закапывали внутритрахеально до извлечения легких. Фиг. 5А: извлеченные легкие перфузировали в рециркуляционной системе с искусственным носителем. Активность NOX2 стимулировали добавлением ангиотензина II (Ang II). Amplex red вместе с пероксидазой хрена добавляли к перфузату для выявления продукции ROS. Аликвоты перфузата анализировали через определенные интервалы времени с помощью спектрофотометрии для определения окисления Amplex red, указывающего на продукцию ROS. Результаты представляют собой среднее±SE для N=3-4. Фиг. 5В: мышей умерщвляли через 6, 12 или 24 ч после введения LPS (5 мг/г веса тела), и легкие перфузировали in situ в течение 15 минут физиологическим раствором, содержащим флуорофор (дифторфлуоресцеиндиацетат, DFFDA). Затем легкие гомогенизировали и измеряли флуоресценцию гомогената легких в качестве показателя продукции ROS. Результаты для фиг.5A и фиг. 5B представляют собой среднее±SE для N=4. *P<0,05 относительно соответствующих данных для LPS и LPS+PIP-2; §p<0,05 относительно 12 часов и 24 часов после введения LPS; ΔP<0,05 относительно соответствующего введения LPS.
Фиг. 6: PIP-2 в липосомах вводили мышам либо внутритрахеально (IT), либо внутривенно (IV) в 0-й временной точке. Легкие собирали с интервалами между 4 и 72 ч после введения PIP-2, гомогенизировали и анализировали на активность Prdx6-PLA2. PIP-2 эффективен при введении либо IT, либо IV путем с рассчитанным половинным временем для восстановления, составляющим примерно 50 ч. Результаты представляют собой среднее±SE для N=3-4.
На фиг.7А и 7В показаны графики Каплана-Мейера по выживаемости. Всем мышам вводили LPS (15 мг/г веса тела) либо, как показано на на фиг. 7A: внутритрахеально (IT), либо, как показано на фиг. 7B: внутрибрюшинной (IP) инъекцией. PIP-2 в липосомах или плацебо (только липосомы) вводили внутривенно (IV) через 12 часов после введения LPS (это время обработки принимали за ноль), а затем с 12 или 24-часовыми интервалами вводили всего 5 доз, как указано стрелками. Фиг. 7A: PIP-2 вводили в дозировке 2 мкг/г веса тела; N=14 для каждой группы. Фиг. 7В: PIP-2 вводили в дозировке 2 или 20 мкг/г веса тела; группа плацебо, n=8; PIP-2, 2 мг; группа n=7; PIP-2, 20 мг; n=10.
Фиг. 8: PLA2-ингибирующий пептид (PIP-2) ингибирует продукцию ROS, стимулированную ангиотензином II (Ang II) в изолированных перфузированных легких мышей. PIP-2 (2 мкг/г веса тела) вводили интактным мышам дикого типа (WT) IV путем. Группы WT-базальная, WT-контрольная и NOX2-нулевая не получали пептида. Через 30 минут легкие извлекали из анестезированных мышей и перфузировали в рециркуляционной системе с добавлением Ang II (50 мкМ) в качестве активатора Nox2 и Amplex Red плюс пероксидаза хрена для выявления ROS в перфузате. Легкие мышей WT-базальной группы не стимулировали введением Ang II. После 15-минутного периода уравновешивания (называемого нулевым временем) отбирали аликвоты с 15-минутными интервалами для анализа флуоресценции. Каждая кривая представляет среднее значение±SE для n=3. Линии были получены методом наименьших средних квадратов. Средние скорости снижения ROS, вычисленные по наклону каждой строки, указаны в скобках. *Р<0,05 относительно других 3 кривых.
Фиг. 9A и 9B: PIP-2 ингибирует увеличенную aiPLA2-активность в легких и увеличенное образование ROS после введения LPS. LPS (5 мкг/г веса тела) вводили капельно внутритрахеально (IT) вместе с одним липосомами (указано как LPS) или с PIP-2 в липосомах (указано как +PIP-2). Контроль представлял собой только липосомы без LPS (указано как контроль). Мышей умерщвляли через 6, 12 или 24 часов после введения LPS, и легкие перфузировали in situ в течение 15 минут физиологическим раствором, содержащим флуорофор дифторфторфлуоресцеиндиацетат (DFF-DA). Затем легкие гомогенизировали и анализировали на следующие параметры: фиг. 9A - aiPLA2-активность; фиг. 9B - флуоресценция гомогената легких в качестве индекса продукции ROS. Результаты представляют собой среднее±SE для N=3 для A и N=4 для B. *Р<0,05 относительно контролея и +PIP-2 в одной и той же временной точке; ΔP<0,05 относительно соответствующего значения в 6 часов.
Фиг. 10: влияние липосомальной композиции на доставку PIP-2 в легкие после внутривенного введения. Использовали тот же протокол для опосредованной липосомами доставки PIP-2 путем внутривенной инфузии, как и для эксперимента, показанного на фиг.5A-5B. * - % от общего содержания липидов; все липосомы также содержали 15% холестерина. Ɨ - среднее±SE для n=3 или диапазон для n=2. PC или DPPC в липосомах имеют сходную эффективность для внутриклеточной доставки PIP-2. Исключение PG приводит к снижению эффективности приблизительно на 10%.
Фиг. 11: «защита» от повреждения легких (%) с помощью PIP-2, оцененная через 24 часа после IT-введения LPS. *Значения для эффекта PIP-2 при введении через 0, 12 или 16 часов после введения LPS. Защиту (%) от повреждения легких рассчитывали как [1-(повреждение с введением PIP-2 - контроль)/(только LPS -контроль)]. «Защита», обеспечиваемая PIP-2, составляет >75%.
Фиг. 12: показатели повреждения легких у мышей, получавших PIP-2, которые выживали при высокой дозе LPS. Мышам вводили LPS (15 мкг/г веса) либо внутритрахеально (IT) (строка В), либо внутрибрюшинно (IP) (строка С). Пять выживших мышей умерщвляли через 108 часов после начала введения (120 часов после введения LPS). Результаты сравнивали со значениями для контрольных мышей (без LPS) в одинаковых временных точках (строка А). BALf, бронхоальвеолярная лаважная жидкость; TBARS, активные формы тиобарбитуровой кислоты. Значения представляют собой среднее±SE для n=4 в случае контроля и n=5 в случае LPS+PIP-2. Мыши, получавшие PIP-2, которые выживали через 5 дней после введения LPS, имели нормальные легкие.
Фиг. 13: влияние PIP-2 на вызванное вентиляцией повреждение легких (VILI). Анестезированных мышей подключали к механической вентиляции в течение 6 часов с приливным объемом 12 мл/кг веса тела с частотой дыханий 120/мин и положительным давлением в конце выдоха (PEEP), составляющим 2 см водяного столба. PIP-2 (2 мкг/г веса тела) в липосомах вводили IT в начале механической вентиляции, и мышей умерщвляли через 6 часов. Контроль представляет собой значения для нормальных (невентилируемых) легких. % защиты рассчитывали, как в таблице 1. Результаты представляют собой среднее±SE для n=4. *P<0,05 для VILI+PIP относительно VILI. PIP-2 защищал от повреждения легких, связанного с механической вентиляцией.
ПОДРОБНОЕ ОПИСАНИЕ
Определения
Если не указано иное, все технические и научные термины, используемые в данном описании, имеют то же значение, которое обычно понимается специалистом в области техники, к которой относится изобретение. Хотя в практике для тестирования настоящего изобретения могут быть использованы любые способы и материалы, аналогичные или эквивалентные тем, которые описаны в настоящем документе, предпочтительные материалы и способы описаны в настоящем документе. В описании и формуле настоящего изобретения будет использоваться приведенная ниже терминология.
Также следует понимать, что используемая в настоящем документе терминология предназначена только для описания конкретных вариантов осуществления и не предназначена для ограничения изобретения.
Термины в единственном числе используются в настоящем документе для обозначения одного или более чем одного (те по меньшей мере одного) грамматического объекта. В качестве примера, «элемент» означает один элемент или несколько элементов.
Термин «примерно», используемый в настоящем документе при ссылке на измеримое значение, такое как величина, временная продолжительность и т.п., предназначен для охвата вариаций±20% или±10%, более предпочтительно±5%, еще более предпочтительно±1% и еще более предпочтительно±0,1% от заданного значения, поскольку такие изменения подходят для осуществления раскрытых способов.
В контексте настоящего описания термин «острое повреждение легких» относится к синдрому, характеризующемуся быстрым появлением двухстороннего легочного инфильтрата с гипоксемией, которая не связана с сердечной недостаточностью.
Заболевание или расстройство может быть облегчено, если тяжесть симптомов заболевания или нарушения, частота, с которой такой симптом ощущается пациентом, или и оба этих признака, уменьшаются.
Используемый в настоящем документе термин «композиция» или «фармацевтическая композиция» относится к смеси по меньшей мере одного соединения, полезного в настоящем изобретении, с фармацевтически приемлемым носителем. Фармацевтическая композиция облегчает введение соединения пациенту или субъекту. В данной области существует множество методик введения соединения, включая, но не ограничиваясь ими, внутривенное, пероральное, аэрозольное, парентеральное, офтальмологическое, легочное и местное введение.
Термины «эффективное количество» или «терапевтически эффективное количество» соединения представляют собой такое количество соединения, которое является достаточным для обеспечения благоприятного эффекта у субъекта, которому вводят соединение. «Эффективное количество» средства доставки представляет собой количество, достаточное для эффективного связывания или доставки соединения.
Термины «пациент», «субъект», «индивидуум» и т.п. используются в настоящем документе взаимозаменяемо и относятся к любому животному или их клеткам независимо от того, in vitro или in situ, являющимися подходящими для способов, описанных в настоящем документе. В некоторых не ограничивающих вариантах осуществления пациент, субъект или индивидуум являются человеком.
Используемый в настоящем документе термин «фармацевтически приемлемый» относится к материалу, такому как носитель или разбавитель, который не отменяет биологическую активность или свойства соединения и является относительно нетоксичным, т.е. материал может быть введен индивидууму, не вызывая нежелательных биологических эффектов или взаимодействуя с любым из компонентов композиции, в которой он содержится.
Используемый в настоящем документе термин «фармацевтически приемлемый носитель» означает фармацевтически приемлемый материал, композицию или носитель, такой как жидкий или твердый наполнитель, стабилизатор, диспергирующий агент, суспендирующий агент, разбавитель, эксципиент, загуститель, растворитель или инкапсулирующий материал, участвующий в переносе или транспортировке соединения, полезного в изобретении, внутрь или на поверхность тела пациента на таким образом, что он может выполнять его предполагаемую функцию. Обычно такие конструкции переносят или транспортируют от одного органа или части тела к другому органу или части тела. Каждый носитель должен быть фармацевтически приемлемым в отношении совместимости с другими ингредиентами композиции, включая соединение, полезное в настоящем изобретении, и не быть вредным для пациента. Некоторые примеры материалов, которые могут служить в качестве фармацевтически приемлемых носителей, включают сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлозу и ее производные, такие как натрийкарбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы; порошкообразный трагакант; солод; желатин; тальк; наполнители, такие как масло какао и воски для суппозиториев; масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; гликоли, такие как пропиленгликоль; многоатомные спирты, такие как глицерин, сорбит, маннит и полиэтиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; буферные агенты, такие как гидроксид магния и гидроксид алюминия; поверхностно-активные агенты; альгиновую кислоту; апирогенную воду; изотонический солевой раствор; раствор Рингера; этиловый спирт; фосфатно-буферные растворы; и другие нетоксичные совместимые вещества, применяемые в фармацевтических составах. В данном описании фармацевтически приемлемый носитель также включает любые и все покрытия, антибактериальные и противогрибковые агенты и агенты, замедляющие абсорбцию, и т.п., которые совместимы с активностью соединения, полезного в настоящем изобретении, и являются физиологически приемлемыми для пациента. В композиции также могут быть включены дополнительные действующие соединения. Термин «фармацевтически приемлемый носитель» может дополнительно включать фармацевтически приемлемую соль соединения, полезного в изобретении. Другие дополнительные ингредиенты, которые могут быть включены в фармацевтические композиции, используемые при осуществлении изобретения, известны в данной области и описаны, например, в Remington's pharmaceutical Sciences (Genaro, Ed, Mack Publishing Co. 1985, Easton, PA), который включен в настоящее описание в качестве ссылки.
В контексте настоящего изобретения «PIP-2» означает пептид, имеющий SEQ ID NO: 1 LHDFRHQIL.
В контексте настоящего изобретения «PIP-4» означает пептид, имеющий SEQ ID NO: 2 LYEIKHQIL.
В контексте настоящего изобретения «PIP-5» означает пептид, имеющий SEQ ID NO: 3 LYDIRHQIL.
Используемый в настоящем документе термин «лечение заболевания или расстройства» означает снижение частоты, с которой у пациента присутствует симптом заболевания или расстройства. Термины заболевание и расстройство используются в настоящем документе взаимозаменяемо.
Используемый в настоящем документе термин «сепсис» является потенциально опасным для жизни состоянием, вызванным ответом организма на инфекцию, и может привести к множественному повреждению органов.
Используемые в настоящем документе термины «лечение» или «лечить» охватывают профилактику и/или терапию. Соответственно, композиции и способы по настоящему изобретению не ограничиваются терапевтическим применением и могут быть использованы в профилактических целях. Таким образом, лечение заболевания, расстройства или состояния включает: (i) предотвращение или замедление появления клинических симптомов заболевания, расстройства или состояния, развивающихся у субъекта, который может страдать или быть предрасположенным к заболеванию, расстройству или состоянию, но еще не испытывает или не имеет клинических или субклинических симптомов заболевания, расстройства или состояния, (ii) ингибирование заболевания, расстройства или состояния, т.е. остановку или уменьшение развития заболевания или по меньшей мере одного клинического или субклинического симптома, или (iii) ослабление заболевания, т.е. вызывая регрессию заболевания, расстройства или состояния или по меньшей мере одного из его клинических или субклинических симптомов.
Диапазоны: в данном описании различные аспекты изобретения могут быть представлены в формате диапазона. Следует понимать, что описание в формате диапазона дано просто для удобства и краткости и не должно рассматриваться как негибкое ограничение объема изобретения. Соответственно, описание диапазона должно рассматриваться как имеющее специально раскрытые все возможные поддиапазоны, а также отдельные числовые значения в пределах этого диапазона. Например, описание диапазона, например, от 1 до 6, должно рассматриваться как имеющее специально раскрытые поддиапазоны, такие как от 1 до 3, от 1 до 4, от 1 до 5, от 2 до 4, от 2 до 6, от 3 до 6 и т.д., а также отдельные числа в пределах этого диапазона, например 1, 2, 2,7, 3, 4, 5, 5,3 и 6. Это применимо вне зависимости от широты диапазона.
Описание
Композиции
Изобретение частично основано на разработке специфических пептидных ингибиторов aiPLA2, которые могут быть использованы для лечения ALI. aiPLA2-ингибирующая активность нескольких пептидов по изобретению показана ниже в таблице 1
Таблица 1: влияние пептидов на aiPLA2-активность рекомбинантного hPrdx6
Таблица 2: оптимизация размера ингибирующего пептида путем воздействия на aiPLA2-активность рекомбинантного белка человека
Таблица 3: замены в PIP-2 - эффект на ингибирование aiPLA2-активности рекомбинантного Prdx6 человека
(PIP-4)*
*Природный
(SEQ ID NO: 2 LYEIKHQIL)
Не тестировался
Соответственно, в одном аспекте изобретение относится к композиции, содержащей полипептид, состоящий из:
SEQ ID NO: 4 X1X2X3X4X5LX6X7X8X9HQIL
где:
X1 может присутствовать или отсутствовать, и если присутствует, представляет собой E;
X2 может присутствовать или отсутствовать, и если присутствует, представляет собой L;
X3 может присутствовать или отсутствовать, и если присутствует, представляет собой Q;
X4 может присутствовать или отсутствовать, и если присутствует, представляет собой A или T;
X5 может присутствовать или отсутствовать, и если присутствует, представляет собой T или E;
X6 представляет собой H или Y;
X7 представляет собой D или E;
X8 представляет собой F или I; и
X9 представляет собой R или K.
В различных вариантах осуществления композиция содержит полипептид, состоящий из SEQ ID NO: 1 LHDFRHQIL (PIP-2), SEQ ID NO: 2 LYEIKHQIL (PIP-4) или SEQ ID NO: 3 LYDIRHQIL (PIP-5). Композиция по изобретению может быть предоставлена субъектам в виде фармацевтической композиции. Соответственно, в различных вариантах осуществления композиция дополнительно включает фармацевтически приемлемый носитель. Как показано на фиг. 1, полипептиды можно эффективно вводить в липосомы. Соответственно, в различных вариантах осуществления полипептид инкапсулируется в одну или несколько липосом. В различных вариантах осуществления композицию изготавливают для аэрозольной ингаляции или внутритрахеальной или внутривенной инъекции. Подходящие фармацевтически приемлемые носители, а также ингаляционные или инъекционные составы описаны в настоящем описании.
Способы лечения острого повреждения легких
В другом аспекте изобретение относится к способу лечения острого повреждения легких у субъекта, включающему в себя введение субъекту эффективного количества фармацевтической композиции, содержащей полипептид, состоящий из:
SEQ ID NO: 4 X1X2X3X4X5LX6X7X8X9HQIL
где:
X1 может присутствовать или отсутствовать, и если присутствует, представляет собой E;
X2 может присутствовать или отсутствовать, и если присутствует, представляет собой L;
X3 может присутствовать или отсутствовать, и если присутствует, представляет собой Q;
X4 может присутствовать или отсутствовать, и если присутствует, представляет собой A или T;
X5 может представлять собой T или E;
X6 представляет собой H или Y;
X7 представляет собой D или E;
X8 представляет собой F или I; и
X9 представляет собой R или K;
и фармацевтически приемлемый носитель. В различных вариантах осуществления полипептид может представлять собой полипептид, состоящий из SEQ ID NO: 1 LHDFRHQIL, SEQ ID NO: 2 LYEIKHQIL или SEQ ID NO: 3 LYDIRHQIL. В различных вариантах осуществления полипептид, вводимый субъекту, инкапсулируют в одну или несколько липосом. В различных вариантах осуществления фармацевтическую композицию вводят субъекту посредством аэрозольной ингаляции или путем внутритрахеальной или внутривенной инъекции.
Способы лечения сепсиса
В другом аспекте изобретение относится к способу лечения сепсиса у субъекта, включающему в себя введение субъекту эффективного количества фармацевтической композиции, содержащей полипептид, состоящий из:
SEQ ID NO: 4 X1X2X3X4X5LX6X7X8X9HQIL
где:
X1 может присутствовать или отсутствовать, и если присутствует, представляет собой E;
X2 может присутствовать или отсутствовать, и если присутствует, представляет собой L;
X3 может присутствовать или отсутствовать, и если присутствует, представляет собой Q;
X4 может присутствовать или отсутствовать, и если присутствует, представляет собой A или T;
X5 может представлять собой T или E;
X6 представляет собой H или Y;
X7 представляет собой D или E;
X8 представляет собой F или I; и
X9 представляет собой R или K;
и фармацевтически приемлемый носитель. В различных вариантах осуществления полипептид может представлять собой полипептид, состоящий из SEQ ID NO: 1 LHDFRHQIL, SEQ ID NO: 2 LYEIKHQIL или SEQ ID NO: 3 LYDIRHQIL. В различных вариантах осуществления полипептид, вводимый субъекту, инкапсулируют в одну или несколько липосом. В различных вариантах осуществления фармацевтическую композицию вводят субъекту посредством аэрозольной ингаляции или путем внутритрахеальной или внутривенной инъекции. В различных вариантах осуществления фармацевтическую композицию вводят субъекту посредством внутривенной инъекции.
Введение/дозировка/составы
Схема введения может влиять на величину, составляющую эффективное количество. Терапевтические композиции можно вводить субъекту либо до, либо после начала повреждения. Кроме того, несколько разделенных доз, так же как и дозы с задержкой введения, могут вводиться ежедневно или последовательно, или дозу можно вводить путем непрерывной инфузиии, или доза может представлять собой болюсную инъекцию. Кроме того, дозировки терапевтических композиций могут быть пропорционально увеличены или уменьшены, как показано в зависимости от терапевтической или профилактической ситуации.
Введение композиций по настоящему изобретению пациенту, предпочтительно, млекопитающему, более предпочтительно, человеку, может быть осуществлено с использованием известных методик, в дозировках и в течение периодов времени, эффективных для лечения повреждения легких у пациента. Эффективное количество терапевтического соединения, необходимое для достижения терапевтического эффекта, может варьировать в зависимости от таких факторов, как состояние заболевания или расстройства у пациента; возраст, пол и вес пациента; и способность терапевтического соединения лечить или предотвращать острое повреждение легких у пациента. Схемы введения можно регулировать для обеспечения оптимальной терапевтической реакции. Например, несколько разделенных доз могут вводиться ежедневно, или доза может быть пропорционально уменьшена, как показано в зависимости от терапевтической ситуации. Неограничивающий пример эффективной дозы для терапевтического соединения по изобретению составляет от около 1 до 5000 мг/кг веса тела/в день. Специалист в данной области сможет изучить значимые факторы и определить эффективное количество терапевтического соединения без излишних экспериментов.
Фактические уровни доз действующих ингредиентов в фармацевтических композициях данного изобретения могут варьироваться так, чтобы получить количество действующего ингредиента, которое является эффективным для достижения желаемого терапевтического ответа для конкретного пациента, композиции и способа введения, не будучи токсичным для пациента.
В частности, выбранный уровень дозировки зависит от различных факторов, включая активность конкретного используемого соединения, время введения, скорость выделения или распада соединения, продолжительность лечения, другие лекарственные средства, соединения или материалы, используемые в комбинации с соединением, возраст, пол, вес, состояние заболевания, общее состояние здоровья и предшествующую медицинскую историю пациента, подвергающегося лечению, и аналогичные факторы, хорошо известные в области медицины.
Лечащий врач, например врач или ветеринар, являясь специалистом в данной области, может легко определить и прописать эффективное количество требуемой фармацевтической композиции. Например, врач или ветеринар может начать с введения соединений по изобретению, используемых в фармацевтической композиции, на уровне, меньшем, чем требуется для достижения желаемого терапевтического эффекта и постепенного увеличивая дозировки до достижения желаемого эффекта.
В конкретных вариантах осуществления изобретения особенно предпочтительно представить соединение в виде стандартной лекарственной формы для простоты введения и однородности дозировки. Термин «стандартная лекарственная форма», используемый в настоящем документе, относится к физически дискретным единицам, пригодным в качестве единичных доз для пациентов, подлежащих лечению; причем каждая единичная доза содержит определенное количество терапевтического соединения, рассчитанное для получения желаемого терапевтического эффекта в сочетании с требуемым фармацевтическим носителем. Лекарственные формы по изобретению диктуются и непосредственно зависят от (а) уникальных характеристик терапевтического соединения и конкретного терапевтического эффекта, которое должно быть достигнуто, и (b) ограничений, присущих уровню техники изготовления лекарственных средств/составления рецептур для такого терапевтического соединения для лечения повреждения легких у пациента.
Носитель может представлять собой растворитель или дисперсионную среду, содержащую, например, воду, этанол, многоатомный спирт (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и т.п.), их подходящие смеси и растительные масла.
В некоторых вариантах осуществления композиции по изобретению вводят пациенту в дозировках с частотой от одного до пяти раз в день или более. В других вариантах осуществления композиции изобретения вводят пациенту в диапазоне доз, которые включают, но не ограничиваются этим, частоту введения от одного раза в день, каждые два дня, каждые три дня до одного раза в неделю и одного раза в две недели. Специалисту в данной области очевидно, что частота введения различных комбинированных композиций изобретения изменяется от индивидуума к индивидууму в зависимости от многих факторов, включающих, но не ограниченных этим, возраст, заболевание или расстройство, подлежащее лечению, пол, общее состояние здоровья и другие факторы. Таким образом, изобретение не должно рассматриваться как ограниченное какой-либо конкретной схемой введения, а точная доза и композиция, вводимая любому пациенту, определяются лечащим врачом, учитывающим все другие факторы у пациента.
Соединения по изобретению для введения могут находиться в диапазоне от примерно 1 мкг до примерно 10000 мг, от примерно 20 мкг до примерно 9500 мг, от примерно 40 мкг до примерно 9000 мг, от примерно 75 мкг до примерно 8500 мг, от примерно 150 мкг до примерно 7500 мг, от примерно 200 мкг до примерно 7000 мг, от примерно 350 мкг до примерно 6000 мг, от примерно 500 мкг до примерно 5000 мг, от примерно 750 мкг до примерно 4000 мг, от примерно 1 мг до примерно 3000 мг, от примерно 10 мг до примерно 2500 мг, от примерно 20 мг до примерно 2000 мг, от примерно 25 мг до примерно 1500 мг, от примерно 30 мг до примерно 1000 мг, от примерно 40 мг до примерно 900 мг, от примерно 50 мг до примерно 800 мг, от примерно 60 мг до примерно 750 мг, от примерно 70 мг до примерно 600 мг, от примерно 80 мг до примерно 500 мг, и могут иметь любые все целые или дробные промежуточные значения в диапазонах.
В некоторых вариантах осуществления доза соединения по изобретению составляет от примерно 1 мг до примерно 2500 мг. В некоторых вариантах осуществления доза соединения по изобретению, используемого в композициях, описанных в данном документе, составляет примерно менее 10000 мг, или примерно менее 8000 мг, или примерно менее 6000 мг, или примерно менее 5000 мг, или примерно менее 3000 мг, или примерно менее 2000 мг, или примерно менее 1000 мг, или примерно менее 500 мг, или примерно менее 200 мг, или примерно менее 50 мг. Аналогичным образом, в некоторых вариантах осуществления изобретения, доза второго соединения, описанного в данном документе, составляет примерно менее 1000 мг, или примерно менее 600 мг, или примерно менее 500 мг, или примерно менее 400 мг, или примерно менее 300 мг, или примерно менее 200 мг, или примерно менее 100 мг, или примерно менее 50 мг, или примерно менее 40 мг, или примерно менее 30 мг, или примерно менее 25 мг, или примерно менее 20 мг, или примерно менее 15 мг, или примерно менее 10 мг, или примерно менее 20 мг, или примерно менее 15 мг, или примерно менее 10 мг, или примерно менее 5 мг, или примерно менее 2 мг, или примерно менее 1 мг, или примерно менее 0,5 мг, и любые все целые или дробные промежуточные значения.
В некоторых вариантах осуществления настоящее изобретение относится к упакованной фармацевтической композиции, содержащей контейнер, содержащий терапевтически эффективное количество соединения по изобретению, по отдельности или в комбинации со вторым фармацевтическим агентом; и инструкции по применению соединения для лечения, профилактики или уменьшения одного или нескольких симптомов острого повреждения легких у пациента.
Составы могут быть использованы в смесях с обычными эксципиентами, т.е. фармацевтически приемлемыми органическими или неорганическими носителями, пригодными для перорального, парентерального, назального, внутривенного, подкожного, энтерального или любого другого подходящего способа введения, известного в данной области. Фармацевтические препараты могут быть стерилизованы и при желании смешаны с вспомогательными агентами, например, смазывающими веществами, консервантами, стабилизаторами, смачивающими агентами, эмульгаторами, солями для регулирования осмотического давления в буферах, красителями, вкусовыми и/или ароматическими веществами и т.п. Они также могут быть объединены, где это желательно, с другими действующими агентами, например, другими анальгетическими агентами.
Пути введения любой из композиций по изобретению включают пероральный, назальный, ректальный, интравагинальный, парентеральный, трансбуккальный, сублингвальный или местный. Соединения для применения в изобретении могут быть составлены для введения любым подходящим путем, таким как пероральное или парентеральное, например трансдермальное, трансмукозальное (например, сублингвальное, лингвальное, (транс)буккальное, (транс)уретральное, вагинальное (например, транс- и перивагинальное), (интра)назальное и (транс)ректальное), интравезикальное, внутрилегочное, интрадуоденальное, внутрижелудочное, интратекальное, подкожное, внутримышечное, внутрикожное, внутриартериальное, внутривенное, внутрибронхиальное, ингаляционное и местное введение.
Подходящие композиции и лекарственные формы включают, например, таблетки, капсулы, каплеты, пилюли, гелевые капсулы, пастилки, дисперсии, суспензии, растворы, сиропы, гранулы, шарики, трансдермальные пластыри, гели, порошки, пеллеты, болтушки, лепешки, кремы, пасты, пластыри, лосьоны, диски, суппозитории, жидкие спреи для назального или перорального введения, сухие порошки или аэрозольные композиции для ингаляции, композиции и составы для интравезикального введения и т.п. Следует понимать, что составы и композиции, которые могут быть использованы в настоящем изобретении, не ограничиваются конкретными составами и композициями, которые описаны в настоящем документе.
Пероральное введение
Для орального применения особенно подходят таблетки, драже, жидкости, капли, суппозитории или капсулы, каплеты и гелевые капсулы. Композиции, предназначенные для перорального применения, могут быть получены любым способом, известным в данной области, и такие композиции могут содержать один или несколько агентов, выбранных из группы, состоящей из инертных нетоксичных фармацевтических эксципиентов, которые подходят для производства таблеток. Такие наполнители включают, например, инертный разбавитель, такой как лактоза; гранулирующие и дезинтегрирующие агенты, такие как кукурузный крахмал; связывающие агенты, такие как крахмал; и смазывающие агенты, такие как стеарат магния. Таблетки могут быть без покрытия или они могут быть покрыты с помощью известных методик для улучшения внешнего вида или для задержки высвобождения действующих ингредиентов. Композиции для перорального применения также могут быть представлены в виде твердых желатиновых капсул, в которых действующий ингредиент смешан с инертным разбавителем.
Настоящее изобретение также включает многослойную таблетку, содержащую слой, обеспечивающий отложенное высвобождение одного или нескольких соединений по изобретению, и дополнительный слой, обеспечивающий немедленное высвобождение лекарственного средства для лечения некоторых заболеваний или нарушений. С использованием восковой/pH-чувствительной полимерной смеси может быть получена нерастворимая в желудке композиция, в которой заключается действующий ингредиент, что обеспечивает его отложенное высвобождение.
Парентеральное введение
Для парентерального введения соединения по изобретению могут быть изготовлены для инъекции или инфузии, например, внутривенной, внутримышечной или подкожной инъекции или инфузии, или для введения в виде болюсной дозы и/или с помощью непрерывной инфузии. Суспензии, растворы или эмульсии в масляном или водном наполнителе, необязательно содержащие другие формулирующие агенты, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты, могут быть использованы.
Дополнительные лекарственные формы
Дополнительные лекарственные формы по настоящему изобретению включают лекарственные формы, описанные в патентах США №№ 6340475, 6488962, 6451808, 5972389, 5582837 и 5007790. Дополнительные лекарственные формы по данному изобретению также включают лекарственные формы, описанные в заявках на патенты США №№ 20030147952, 20030104062, 20030104053, 20030044466, 20030039688 и 20020051820. Дополнительные лекарственные формы по настоящему изобретению также включают лекарственные формы, описанные в заявках РСТ №№ WO 03/35041, WO 03/35040, WO 03/35029, WO 03/35177, WO 03/35039, WO 02/96404, WO 02/32416, WO 01/97783, WO 01/56544, WO 01/32217, WO 98/55107, WO 98/11879, WO 97/47285, WO 93/18755 и WO 90/11757.
Препараты с контролируемым высвобождением и системы доставки лекарственных средств
В некоторых вариантах осуществления составы по настоящему изобретению могут иметь, но не ограничиваются этим, немедленное быстрое начало высвобождения лекарственного средства, а также могут иметь регулируемое высвобождение лекарственного средства, как, например, препараты с замедленным высвобождением, отложенным высвобождением и импульсным высвобождением.
Термин «замедленное высвобождение» используется в своем обычном смысле для обозначения лекарственной формы, которая обеспечивает постепенное высвобождение лекарственного средства в течение длительного периода времени, и которая может, хотя и необязательно, приводить к, по существу, постоянному уровню лекарственного средства в крови в течение длительного периода времени. Период времени может составлять 1 месяц или более, и должен быть длительнее, чем период времени для того же количества агента, вводимого в форме болюса.
Для замедленного высвобождения соединения могут быть соединены с подходящим полимерным или гидрофобным материалом, который обеспечивает свойство замедленного высвобождения для соединений. Как таковые, соединения для применения в способе по изобретению могут быть введены в форме микрочастиц, например, путем инъекции или в форме пластин или дисков путем имплантации.
В одном варианте осуществления изобретения соединения по изобретению вводят пациенту, отдельно или в комбинации с другим фармацевтическим агентом, с использованием композиции с замедленным высвобождением.
Термин «отложенное высвобождение» используется в настоящем документе в своем обычном смысле для обозначения лекарственной формы, которая обеспечивает первоначальное высвобождение лекарственного средства после некоторой задержки после введения лекарственного средства, и которая, хотя и необязательно, включает в себя задержку от приблизительно 10 минут до приблизительно 12 часов.
Термин «импульсное высвобождение» используется в настоящем документе в своем обычном смысле для обозначения лекарственной формы, которая обеспечивает высвобождение лекарственного средства таким образом, чтобы получить импульсные плазменные профили лекарственного средства после введения лекарственного средства.
Термин «немедленное высвобождение» используется в своем обычном смысле для обозначения лекарственной формы, которая обеспечивает высвобождение лекарственного средства сразу после введения лекарственного средства.
Используемый в настоящем документе, термин «немедленное высвобождение» относится к любому периоду времени вплоть до и включая примерно 8 часов, примерно 7 часов, примерно 6 часов, примерно 5 часов, примерно 4 часа, примерно 3 часа, примерно 2 часа, примерно 1 час, примерно 40 минут, примерно 20 минут или примерно 10 минут и любые или все целые или дробные промежуточные значения этих интервалов после введения лекарственного средства.
Используемый в настоящем документе, термин «быстрое начало» относится к любому периоду времени вплоть до и включая примерно 8 часов, примерно 7 часов, примерно 6 часов, примерно 5 часов, примерно 4 часов, примерно 3 часов, примерно 2 часов, примерно 1 часа, примерно 40 минут, примерно 20 минут или примерно 10 минут и любые или все целые или дробные промежуточные значения этих интервалов после введения лекарственного средства.
Дозировки
Терапевтически эффективные количество или доза соединения по настоящему изобретению зависят от возраста, пола и веса пациента, текущего состояния здоровья пациента и прогрессирования острого повреждения легких у пациента, подвергающегося лечению. Специалист в данной области может определить подходящие дозы в зависимости от этих и других факторов.
Подходящая доза соединения по настоящему изобретению может находиться в диапазоне от примерно 0,01 мг до примерно 5000 мг в день, например, от примерно 0,1 мг до примерно 1000 мг, например, от примерно 1 мг до примерно 500 мг, например, от примерно 5 мг до примерно 250 мг в день. Дозу можно вводить в виде одной дозы или в нескольких дозах, например от 1 до 4 или большее число раз в день. При использовании нескольких доз количество каждой дозы может быть одинаковым или различным. Например, дозу 1 мг в день можно вводить в виде двух доз 0,5 мг с интервалом 12 часов между дозами.
Понятно, что количество соединения, вводимого за день, можно введено, в неограничивающих примерах, каждый день, через день, каждые 2 дня, каждые 3 дня, каждые 4 дня или каждые 5 дней. Например, при введении через день доза 5 мг в сутки может быть введена в понедельник с первой последующей дозой 5 мг в день, вводимой в среду, второй последующей дозой 5 мг в день, вводимой в пятницу, и так далее.
В случае, когда состояние пациента улучшается, по усмотрению врача введение ингибитора по изобретению необязательно продолжается; в альтернативном варианте доза вводимого лекарственного средства временно уменьшается, или временно не вводится в течение определенного периода времени (то есть, «выходные дни от лекарств»). Длина «выходных дней», необязательно, изменяется в пределах от 2 дней до 1 года, включая, только для примера, 2 дня, 3 дня, 4 дня, 5 дней, 6 дней, 7 дней, 10 дней, 12 дней, 15 дней, 20 дней, 28 дней, 35 дней, 50 дней, 70 дней, 100 дней, 120 дней, 150 дней, 180 дней, 200 дней, 250 дней, 280 дней, 300 дней, 320 дней, 350 дней или 365 дней. Снижение дозы во время введения лекарства включает от 10% до 100%, включая, только для примера, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100%.
После того как произошло улучшение состояния пациента, при необходимости вводят поддерживающую дозу. Затем дозу или частоту введения, или оба параметра, уменьшают в зависимости от вирусной нагрузки до уровня, при котором сохраняется улучшение при заболевании. В некоторых вариантах осуществления пациенты в периодическом лечении в течение продолжительного времени при любом рецидиве симптомов и/или инфекции.
Соединения для применения в способе по изобретению могут быть изготовлены в виде стандартной лекарственной формы. Термин «стандартная лекарственная форма» относится к физически дискретным единицам, пригодным в качестве разовой дозы для пациентов, подвергающихся лечению, причем каждая доза содержит определенное количество действующего вещества, рассчитанное для получения желаемого терапевтического эффекта, необязательно, в сочетании с подходящим фармацевтическим носителем. Стандартная лекарственная форма может представлять собой разовую дневную дозу или одну из нескольких дневных доз (например, которую вводят от 1 до 4 или большее число раз в день). При использовании нескольких дневных доз стандартная лекарственная форма может совпадать и различаться с каждой дозой.
Токсичность и терапевтическая эффективность таких терапевтических схем, необязательно, определяются на клеточных культурах или на экспериментальных животных, включая, но не ограничиваясь этим, определение LD50 (доза, летальная для 50% популяции) и ED50 (доза, терапевтически эффективная в 50% популяции). Соотношение доз между токсическим и терапевтическим эффектами представляет собой терапевтический индекс, который выражается как соотношение между LD50 и ED50. Данные, полученные из анализов на клеточных культурах и исследований на животных, необязательно, используют при составлении интервала диапазонов для применения у человека. Дозировка таких соединений находится, предпочтительно, в пределах диапазона циркулирующих концентраций, которые включают ED50 с минимальной токсичностью. Дозировка, необязательно, изменяется в этом диапазоне в зависимости от используемой лекарственной формы и пути введения.
Специалисты в данной области техники определят или смогут установить, используя не более чем рутинные эксперименты, многочисленные эквиваленты конкретных процедур, вариантов осуществления, формул изобретения и примеров, описанных в настоящем документе. Такие эквиваленты рассматриваются как входящие в объем данного изобретения и охватываемые прилагаемой формулой изобретения. Например, следует понимать, что замены в реакционных условиях, включая, но не ограничиваясь этим, время реакции, размер/объем реакции и экспериментальные реагенты, такие как растворители, катализаторы, давление, атмосферу, например атмосферу азота, и восстановительные/окислительные агенты, на признанные альтернативы и не более чем рутинные эксперименты находятся в пределах объема настоящего изобретения.
Следует понимать, что везде, где указаны значения и диапазоны, все значения и диапазоны, охватываемые этими значениями и диапазонами, входят в объем настоящего изобретения. Кроме того, все значения, которые попадают в эти диапазоны, а также верхние или нижние пределы диапазона значений, также предусмотрены настоящей заявкой.
ЭКСПЕРИМЕНТАЛЬНЫЕ ПРИМЕРЫ
Далее изобретение подробно описано со ссылкой на нижеследующие экспериментальные примеры. Эти примеры представлены только в иллюстративных целях и не предназначены для ограничения, если не указано иное. Таким образом, изобретение никоим образом не должно рассматриваться как ограниченное нижеследующими примерами, а скорее должно рассматриваться как охватывающее любые и все изменения, которые становятся очевидными в результате идей, представленных в настоящем документе.
Без дополнительного описания предполагается, что специалист в данной области техники может, используя предыдущее описание и нижеследующие иллюстративные примеры, изготовить и использовать соединения по настоящему изобретению и на практике использовать заявленные способы. Нижеследующие рабочие примеры, таким образом, конкретно указывают на предпочтительные варианты осуществления настоящего изобретения и не должны рассматриваться как ограничивающие каким-либо образом остальную часть раскрытия изобретения.
Пример 1: активность пептидов PIP in vivo
Мышам вводили PIP-2 (2 мкг/г веса тела) в липосомах (см. фиг. 1) либо IT (фиг. 1A), либо IV (фиг. 1B); эти липосомы содержали метку [3H] в 9,10-положении sn-2-пальмитате DPPC. Легкие извлекали из мышей и исследовали в изолированной системе. Наклон кривых указывает на производство оксидантов (H2O2).
PIP-2 в липосомах, вводимых IV или IT, ингибирует активность Prdx6 в гомогенате легких. Максимальное ингибирование наблюдали в течение 4 часов после введения PIP-2. Восстановление после ингибирования начиналось через приблизительно 36 часов и завершалось через 48 часов. Результаты были аналогичными для PIP-1,2,4 (PIP-3 и -5 не тестировали). На основе результатов, полученных на мышах, PIP-2 или 4 можно вводить один раз каждые 24-36 часов для поддержания максимального ингибирования активности Prdx6 и активации NOX2. Эффективность требует применения липосом для доставки пептида. Ингибирование после введения по IT или IV пути было аналогичным. Данные представлены в таблицах 4-6 ниже
Таблица 4: aiPLA2-активность в легких мышах через 24 часа после инъекции PIP-4 IV и без липосом для доставки
PIP-4=2 мкг/г веса мыши. Среднее +/- SE; n=3.
Таблица 5: aiPLA2-активность в гомогенате легких мышей при увеличении времени после IT-или IV-инъекции PIP-2: устойчивость in vivo
Таблица 6: Prdx6-PLA2-активность в гомогенате легких мышей при увеличении времени после IT-или IV-инъекции пептидов PIP
PIP-1
PIP-1
PIP-2
PIP-4
*До анализа проводили лаваж легких, чтобы избежать возможных эффектов неинтернализированного пептида SP-A.
Пример 2: временная кривая повреждения после IT введения LPS
Бактериальный (E.coli) липополисахарид (LPS) вводили мышам C57b1/6 дикого типа путем внутритрахеальной (IT) инъекции в дозе 5 мкг/г. Мышей умерщвляли через 12, 16, 24 или 48 часов после LPS, как указано. Легкие извлекали и промывали физиологическим раствором через трахею, получая BALF; затем легкое гомогенизировали. Измеряемыми параметрами были зародышевые клетки и белки в БАЛЖ, активные формы тиобарбитуровой кислоты (TBARS), 8-изопростанолы и карбонилы белков в гомогенате легких, и соотношение влажного и сухого веса легких (W/D). Значения представляют собой среднее значение±для n=4.
Как показано на фиг. 2, увеличение количества клеток в BALF отражает воспаление, белок в BALF и увеличенное соотношение влажного и сухого веса легких отражают измененную альвеолярную проницаемость; TBARS и 8-изопростанолы отражают окисление липидов клеточных мембран, а карбонилы белков отражают окисление белков ткани. Эти эффекты являются характеристиками синдрома ALI. После однократной дозы LPS наблюдалось значительное повреждение легких, которое по существу не изменяется между 12-24 часами после введения LPS. Частичное восстановление наблюдается через 48 часов. Повреждение легких под действием LPS является относительно стабильным в течение 12-24 часов; вероятно, это отражает баланс между процессом продолжающегося повреждения и процессом восстановления легких. Данные представлены в таблице 7.
Таблица 7: временная кривая повреждения после IT введения LPS
LPS, 5 мкг/г
Пример 3: PIP-2 защищает от повреждения легких
IT-модель острого повреждения легких (ALI), данные по которой показаны в таблице 9, использовали для исследования влияния PIP-2. PIP-2 (2 мкг/г веса тела) в липосомах вводили IT вместе с LPS (0 часов) или внутривенно (IV) через 12 или 16 часов после введения LPS. Внутривенное введение PIP-2 использовали для того, чтобы избежать второй травмы трахеи. Мышей умерщвляли через 24 часа, и оценивали повреждения в легких, описанные в таблице 9. Защиту (в %) от поражения легких рассчитывали как [1-(повреждение с введением PIP-2 -контроль)/(только LPS - контроль)]. Результаты представляют собой среднее±SE для n=4 *P<0,01 относительно контроля. †P<0,01 относительно введения без PIP, 24 часа.
Как показано на фиг. 3, введение PIP-2 вместе с LPS полностью предотвращало повреждение легких при оценке через 24 часа после введения LPS. PIP-2, вводимый через 12 или 16 часов после LPS, обеспечивал приблизительно 85-95% защиты от повреждения легких, оцениваемого через 24 часа после введения LPS. Эффекты PIP-2 были весьма выраженными. PIP-2 или PIP-4 предотвращают повреждение легких при введении в 0-е время и при введении через 12-16 часов предотвращают дальнейшее повреждение, позволяя пораженному легкому заживать в течение интервала между 12-16 часами после введения LPS и умерщвлением через 24 часа (ч). Таким образом, PIP-2 и PIP-4 могут как предотвращать, так и лечить повреждение легких. Данные для различных маркеров повреждения легких представлены в таблицах 8-11.
Таблица 8: влияние PIP-2 на воспаление и отек после LPS
n= 4, концентрация PIP-2 составляла 2 мкг/г веса мыши, LPS - 5 мкг/г веса мыши.
Таблица 9: влияние PIP-2 на окислительные процессы в легких после введения LPS
пмоль/мг белка
пмоль/мг белка
n= 4, концентрация PIP-2 составляла 2 мкг/г веса мыши, LPS - 5 мкг/г веса мыши.
Таблица 10: влияние PIP-4 на воспаление и отек после введения LPS
(PIP в липосомах)
n= 4, концентрация PIP-2 составляла 2 мкг/г веса мыши, LPS - 5 мкг/г веса мыши.
Таблица 11: влияние PIP-4 на окисление легочной ткани после введения LPS
(PIP в липосомах)
n= 4, концентрация PIP-2 составляла 2 мкг/г веса мыши, LPS - 5 мкг/г веса мыши.
Пример 4: PIP-2 является стабильным в виде сухого порошка.
aiPLA2-активность измеряли через определенные интервалы времени для определения того, насколько долго пептид мог сохранять свою эффективность в качестве ингибитора aiPLA2-активности. Пептид был стабилен в течение 4 месяцев наблюдений.
Таблица 12: активность PIP-2 в течение 4 месяцев хранения в виде сухого порошка при комнатной температуре указывает на стабильность.
нмоль/мин/мг белка
Пример 5
Далее описаны материалы и методы, используемые в нижеследующих примерах.
Животные
Мыши C57b1/6J или NADPH-оксидаза(Nox2)-нулевые мыши были получены из Jackson Laboratories (Bar Harbor, ME) и содержались при в фильтрованном через НЕРА воздухе, С 12-часовыми циклами освещения/темноты в Ресурсном центре лабораторных животных университета Пенсильвании (ULAR).
Реагенты
Оценочная чистота пептидов, определенная масс-спектроскопией, составляла >89%. Липополисахарид (LPS), полученный из клеточных мембран Escherichia coli 0111:B4, и очищенный гель-фильтрацией, получали от Sigma-Aldrich (St. Louis, Mo, USA, кат.№ L3012). Набор Amplex red/пероксидаза хрена (HRP) (кат.№ A22188) и карбоксильные аддукты восстановленного дифторфлуоресцеиндиацетата (DFF-DA, кат.№ 13293) были приобретены в Life Technologies, Grand Island, NY, USA (через Thermo-Fisher Scientific). Ангиотензин II (Ang II) получали от Bachem, Torrance, CA, USA (кат.№ 4095850,0005). Аутентичные липиды приобретали у Sigma-Aldrich, St Louis, МО, USA, и липосомы получали путем выпаривания досуха с последующим восстановлением в физиологическом растворе, как описано ранее для имитации композиции легочного поверхностно-активного вещества; липосомальная композиция имела состав в мольных долях: 0,5 дипальмитоилфосфатидилхолина (DPPC), 0,25 яичного фосфатидилхолина (PC), 0,10 фосфатидилглицерина (PG) и 0,15 холестерина. PIP-2 добавляли в количестве 0,15 мкг PIP-2/мкг липидов.
Введение LPS и PIP-2
Анестезированным мышам вводили LPS (5 или 15 мкг/г веса тела) в 20 мкл физиологического раствора, который закапывали в легкое через эндотрахеальный катетер, расположенный на уровне трахеи. Ранее было показано, что PIP-2 является неэффективным при введении в виде чистого вещества, в то время как он ингибирует aiPLA2-активность с половинным временем 50 ч при инкапсулировании его в липосомы. PIP-2 в липосомах суспендировали в 20 мкл физиологического раствора для IV или IT инъекций. Для изучения влияния PIP-2 в нулевое время введение LPS сопровождалось введением липосом±PIP-2, также вводимыми посредством IT инстилляции. Для исследования влияния PIP-2, вводимого в более поздние сроки после LPS, липосомы±PIP-2 вводили инъекцией в глазную артерию. Это смещение в пути введения было использовано для минимизации повреждения трахеи мыши, которое могло бы при повторной трахеостомии и приводить к непредсказуемым эффектам на легкие. Доза PIP-2, используемая для лечения после внутритрахеального введения LPS, составляла 2 мкг/г веса тела мыши; у контрольных мышей эта доза PIP-2, как было показано, ингибирует aiPLA2-активность в легких максимально в течение по меньшей мере 24 часов. Авторы вводили вторую дозу PIP-2 через 12 часов, чтобы она была определенной максимальной зоной покрытия, и затем проходили на каждые 24 часа для введения PIP-2. Для модели сепсиса LPS (15 мкг/г веса тела) в 20 мкл физиологического раствора вводили внутрибрюшинно, и мышам вводили IV PIP-2 в количестве 2 или 20 мкг/г веса тела; следует отметить, что начальную дозу PIP-2 для этой модели сепсиса вводили IV, а не IT. Авторы использовали одни и те же периоды введения PIP-2 в модели сепсиса, которые использовали для модели LPS, вводимого IT. После восстановления от наркоза всех мышей содержали в виварии с доступом к пище и воде.
Оценка поражения легких
В конце каждого эксперимента с IT LPS (через 24 или 120 ч) выживших мышей умерщвляли путем обескровливания под анестезией. Легкие освобождали от крови in situ путем перфузии через легочную артерию и затем промывали через трахею физиологическим раствором. Затем легкие извлекали из грудной клетки для анализа ткани. Авторы оценивали влияние LPS на повреждение легких путем измерения количества содержащих ядра клеток и содержания белка в жидкости бронхоальвеолярного лаважа (BALf), соотношения влажного и сухого веса легких, используя левую верхнюю долю легкого, и активные формы тиобарбитуровой кислоты (TBARS), 8-изопростанолов и карбонилов белков в гомогенате легких для определения окисления липидов и белковых компонентов в легочной ткани. Для исследования смертности мышей строили графики выживания с использованием процедуры Каплана-Мейера.
Измерение продукции ROS в легких и aiPLA2-активности
Действие пептидов PIP на продукцию ROS в контрольных (необработанных) легких определяли in vitro с использованием изолированных перфузированных легких. PIP-2 в липосомах вводили в количестве 2 мкг/г веса мыши IV путем. Через 30 минут мышей анестезировали, и легкие извлекали, осветляли от крови и перфузировали в рециркуляционной системе перфузатом, содержащим Ang II (50 мМ) в качестве активатора Nox2 и Amplex Red с пероксидазой хрена для выявления ROS. Легкие мышей дикого типа и легких от NOX2-нулевых мышей, которым не вводили PIP-2, использовали в качестве контролей. Базальную скорость продукции ROS оценивали с использованием легких животных дикого типа, которые перфузировали в отсутствие Ang II. Протокол перфузии включал в себя 15-минутный период уравновешивания, за которым следовал 60-минутный экспериментальный период. Аликвоты перфузата отбирали через 15-минутные интервалы и анализировали по флуоресценции резоруфина (λ возбуждения=568 нм, λ эмиссии=581 нм), продукта окисления Amplex red. Скорость окисления Amplex red рассчитывали и выражали в виде произвольных единиц флуоресценции (AFU) с нормализацией по массе тела мыши. При отсутствии HRP в перфузате наблюдали низкую скорость окисления Amplex red (приблизительно 7% флуоресценции, стимулированной Ang II), которая показывала опосредованное не ROS окисление флуорофора; это значение вычитали для получения приведенных значений.
Для определения продукции ROS в легких после воздействия LPS интактным мышам вводили LPS (5 мкг/г)±PIP-2 (2 мкг/г). Мышей анестезировали через 6, 12 или 24 часа после введения LPS, и легкие in situ очищали от крови и затем перфузировали в течение 10 минут физиологическим раствором, содержащим флуорофор DFF-DA, который гидролизуется внутриклеточно до DFF. Затем легкие гомогенизировали и измеряли флуоресценцию гомогената при возбуждении 495 нм и эмиссии 525 нм. Флуоресценцию легких выражали в виде AFU на минуту перфузии при нормализации на вес тела мыши.
Статистический анализ
Данные выражаются как среднее±стандартная ошибка (SE). Наклон линейных графиков рассчитывали методом наименьших средних квадратов. Для оценки статистической значимости использовали программное обеспечение SigmaStat (Jandel Scientific, San Jose, CA). Средние значения для групповых различий оценивали с помощью одностороннего ANOVA с последующим тестом Бонферрони. Для сравнения 2 групп средние значения сравнивали с помощью t-критерия Стьюдента. Различия между средними значениями считались статистически значимыми при P<0,05.
Результаты:
Ингибирование продукции ROS в легких с помощью PIP
Для того чтобы подтвердить ингибирующее действие соединений PIP на активацию NOX2, авторы исследовали продукцию ROS в изолированных перфузируемых легких в присутствии Ang II, известного активатора NOX2. В качестве индекса получения ROS использовали окисление Amplex red. Базовая скорость продукции ROS в перфузируемых легких в контрольных условиях очень низкая, т.е. когда не добавляли стимулятор активности NOX2 (фиг. 8, базальный уровень WT). Продукция ROS значительно увеличивалось при добавлении Ang II к перфузату для активации NOX2 (фиг. 8, контроль WT). Образование ROS снижалось на 76% у NOX2-нулевых животных по сравнению с легкими животных дикого типа (WT), что указывает на то, что NOX2 является основным источником ROS, входящим в перфузат после стимуляции Ang II. Добавление PIP-2 (в липосомах) в легкие животных WT ингибировало продукцию ROS (приблизительно на 75%) подобно NOX2-нулевым животным, как показано ранее. Таким образом, PIP-2 приводил к практически полному ингибированию образования АФК, опосредованному NOX2.
Далее авторы определяли действие PIP-2 (в липосомах) на aiPLA2-активность и продукцию ROS в легких после введения LPS. Эти параметры определяли через 6, 12 и 24 часа после IT введения LPS. aiPLA2-активность в гомогенате легких повышалась приблизительно на 50% по сравнению с контролем через 6 часов после обработки LPS и увеличивалась еще на 50% через 12 и 24 часа (фиг. 9A). Авторы использовали внутриклеточный флуорофор (DFF-DA) для определения образования ROS в легких. Индуцированная ROS флуоресценция была очень низкой в контрольных легких, не обработанных LPS, но увеличивалась приблизительно в 10 раз через 6 часов и приблизительно в 20 раз через 12 и 24 часа в мышиных легких, обработанных LPS (фиг. 9В). Это увеличение флуоресценции DFF в легких после введения LPS может быть слегка недооценено из-за разбавления сигнала вследствие отека в этих легких (см. ниже). Предварительное введение мышам PIP-2 до введения LPS приводило к резкому снижению aiPLA2-активности и флуоресценции, генерируемой ROS, в течение всех 3 периодов времени до значений, подобных полученным для не обработанного LPS контроля. Эти результаты показывают, что внутритрахеальное введение LPS приводит к повышению продукции ROS в легких, которое поддерживается в течение по меньшей мере 24 часов, и может быть ингибировано почти полностью путем предварительного введения PIP-2 в легкие.
Временная кривая LPS-опосредованного повреждения легких
Чувствительность к опосредованному LPS повреждению легких значительно варьирует у различных линий мышей. В этом исследовании авторы определили временную кривую повреждения легких для линии мышей C57B1/6J, получавших LPS IT в количестве 5 мкг/г веса тела (фиг. 2A-2 F). Значительное повреждение легких наблюдалось через 12 часов после введения LPS, как показано с помощью увеличенных количества содержащих ядра клеток в BALf, повышенном белке в BALf и повышенном соотношении влажного и сухого веса легких (p<0,05). Эти результаты совместимы с воспалением легких (клетки в BALf), изменением проницаемости альвеолярно-капиллярного барьера (белок в BALf) и накоплением жидкости в легких (соотношение влажного и сухого веса легких). Увеличение в легочной ткани содержания TBARS, 8-изопростанолов и карбонилов белков указывает на окислительный стресс при окислении липидов легочной ткани и белковых компонентов. Эти показатели повреждения легких показали одинаковые значения через 12, 16 или 24 ч после введения LPS (фиг. 2A-2 F), свидетельствуя о том, что степень повреждения легких оставалась по существу стабильной через 12-24 часа после этой нелетальной дозы LPS. Частичное восстановление (приблизительно на 50%, р<0,05) в показателях повреждения легких наблюдали через 48 часов, хотя они были все еще повышены по сравнению с контролем (р<0,05).
Влияние PIP-2 на опосредованное LPS повреждение легких
Для изучения влияния введения PIP-2 на повреждение легких мышей обрабатывали вводили LPS (5 мкг/г веса тела) внутритрахеально (IT). Дозу LPS выбирали на основании предыдущих исследований с использованием одной и той же партии LPS, которая показала относительно низкий уровень повреждения легких в дозировке 1 мкг/г веса тела и большее повреждение без значительной смертности с использованием 5 мкг LPS/г веса тела. PIP-2 (2 мкг/г веса тела в липосомах) вводили через 0, 12 или 16 часов после введения LPS. Ранее было показано, что эта доза PIP-2 может ингибировать aiPLA2-активность легких приблизительно на 90% в течение по меньшей мере 24 часов. PIP-2 вводили IT в момент времени 0 и IV через 12 или 16 часов для того, чтобы избежать чрезмерного повреждения трахеи. Животных умерщвляли, и легкие исследовали через 24 часа после введения LPS. Все показатели повреждения легких, отражающие воспаление легких, дисфункцию альвеолярного капиллярного барьера, накопление легочной жидкости и окислительного стресса в ткани были повышены у мышей, получавших LPS, по сравнению с контролем (р<0,05). PIP-2, вводимый в 0-е время, полностью предотвращает повреждение легких при оценке через 24 часа после введения LPS (фиг.3А-3F). Показатели повреждения ткани в легких мышей, получивших PIP-2 через 12 и 16 часов, также заметно снижались по сравнению с одним LPS, и значения несущественно отличались от контрольных значений (фиг. 3A-3F). Поскольку повреждение легких присутствовало в легких через 12 и 16 часов после введения LPS, нормальные значения через 24 часа в легких у мышей, получавших LPS с введением PIP-2 через 12 или 16 часов, могут означать, что легкие могли полностью восстановиться от своих повреждений в течение 8-12 часов между временем введения PIP-2 и временем проведения исследования легких.
Введение PIP-2 предотвращает гибель мышей, получивших высокую дозу LPS.
Хотя мыши, получившие низкую дозу LPS (5 мкг/г веса тела), имеют значительные повреждения легких, они являются временными и, по существу, все мыши восстанавливаются после введения (не показано). Для того чтобы проверить действие лечения с использованием PIP-2 на более тяжелой модели повреждения, мышам вводили более высокую дозу LPS (15 мкг/г веса тела). Данные по выживаемости наносили на график с начальной обработкой PIP-2 в нулевой временной точке; LPS вводили за 12 часов до PIP-2 (-12 часов, что не показано на графике на фиг.7А и фиг.7В). При этой более высокой дозе LPS мыши, которые получали плацебо (только липосомы), имели 73%-ю смертность через 24 ч после введения LPS и 100%-ю смертность через 48 ч. Для лечебной группы PIP-2 вводили через 12, 24, 48, 72 и 96 часов после LPS, и мышей умерщвляли через 120 ч. Мыши, которым вводили PIP-2, показали только 17% смертности (83%-ая выживаемость) через 36 часов после начала лечения с использованием PIP-2 и не показывали дополнительной смертности в течение всего периода наблюдения. В дополнение к влиянию на смертность наблюдалось заметное различие в поведении мышей, которые получили PIP-2 после LPS с возвращением большинства мышей к нормальной физической активности через 12 часов после введения PIP-2. Показатели повреждения легких у мышей из лечебной группы, которые были умерщвлены через 120 часов после введения LPS, не имели нарушений (таблица 13).
Таблица 13: повреждение легких восстанавливается у мышей, которые выживают, после введения высокой дозы LPS.
+PIP-2
Мышам закапывали LPS IT (15 мкг/г веса тела); PIP-2 (2 мкг/г веса тела) в липосомах вводили (IV) в моменты времени, показанные на фиг.7. Пять выживших мышей умерщвляли через 120 часов после введения LPS; контрольным мышам вводили липосомы, но не LPS. BALf, бронхоальвеолярная лаважная жидкость; TBARS, активные формы тиобарбитуровой кислоты. Значения представляют собой среднее±SE для N=4 для контроля и N=5 для LPS+PIP-2. Ни одно из средних значений для LPS+PIP-2 не было статистически достоверно отличимым (p>0,05) от соответствующего контроля.
Далее авторы оценивали влияние PIP-2 на мышей, которым вводили LPS (15 мкг LPS/г веса тела) внутрибрюшинно в качестве модели для ALI, связанного с системным сепсисом. Авторы выбрали дозу LPS на основе предыдущего исследования, которое показало 60% смертности при введении 10 мкг LPS/г веса тела; цель авторов состояла в том, чтобы получить 100%-ю смертность у мышей, получавших плацебо, подобно той, что наблюдалась при исследовании с высокой дозой LPS, вводимой внутритрахеально. Выживаемость мышей, получавших плацебо (только липосомы), составляла менее 40% через 24 часа после введения LPS, и 100% мышей умирали в течение 48 часов (фиг. 7В). Напротив, лечение мышей PIP-2 (2 мкг/г веса тела) увеличивало выживаемость через 36 часов после введения LPS до 86%, и 43% мышей восстанавливались полностью. При более высокой дозе PIP-2 (20 мкг/г веса тела), выживаемость в течение продолжительного времени была значительно выше и составляла 70%. Таким образом, PIP-2 заметно увеличивает выживаемость мышей в этой модели ALI, связанной с системным сепсисом.
ALI представляет собой серьезный синдром с коэффициентом смертности приблизительно 40%. Воспаление представляет собой важный фактор, который может усиливать повреждение легких, связанное с первичным поражением. До настоящего времени не было одобренного фармакологического лечения воспалительного компонента синдрома. Механизмы повреждения легких во время воспаления легких являются сложными, но избыточная продукция ROS, по-видимому, играет главную роль. Было показано, что aiPLA2-активность Prdx6 необходима для активации продукции ROS через NOX2, и было описано несколько нонапептидов, полученных из белка-сурфактанта легких A (SP-A), которые ингибируют aiPLA2-активность и, таким образом, ингибируют активацию NOX2 в клетках легких. Данное исследование подтверждает, что эти пептиды, называемые PLA2-ингибирующими пептидами (PIP-2, PIP-4 и PIP-5), ингибируют продукцию ROS в результате действия ангиотензин-активированной NOX2 в изолированном легком мыши. Хотя PIP-2, по-видимому, является немного более активным, чем другие два пептида, все 3 пептида PIP являются эффективными в качестве ингибиторов, предположительно отражающих, в части, высокую степень консервативности аминокислотной последовательности Prdx6 среди видов. Авторы продемонстрировали, что сайт связывания 16-аминокислотного предшественника PIP относится к аминокислотной последовательности, содержащей аминокислоты 195-204 Prdx6. Последовательность для данного фрагмента Prdx6 человека представляет собой: SEQ ID NO: 34 195-EEEAKKLFPK-204; соответствующая мышиная последовательность является той же самой для 8 из 10 аминокислот с Q, а не К в положении 200 и C, а не L в положении 201. Аминокислотная последовательность PIP-2 представляет собой SEQ ID NO:1 LHDFRHQIL.
Основная цель настоящего исследования состояла в оценке влияния PIP-2 на повреждение легких, связанное с внутритрахеальным введением LPS. Авторы впервые показали, что PIP-2 заметно ингибировал AngII-опосредованное образование ROS; Ang II является известным активатором NOX2 и, как было показано ранее, активация требует aiPLA2-активности. Авторы показали, что обработка LPS приводила как к заметному увеличению aiPLA2-активности в легких, так и к заметному увеличению продукции ROS в результате активации NOX2; как LPS-опосредованное увеличение aiPLA2-активности, так и продукция ROS, оба процесса также ингибировались PIP-2.
Первым исследованием эффективности PIP-2 в модели повреждения легких является одновременное введение PIP-2 с LPS, который заметно защищает от последующего повреждения легких. Измерения для оценки острого повреждения легких после введения LPS включали: a) содержащие ядра клетки в BALf (воспаление); b) белок в BALf (проницаемость альвеолярно-капиллярной мембраны); c) соотношение влажного и сухого веса легких (отек легких); и d) TBARS, 8-изопростанолы и карбонилы белков (окисление липидов и белков тканей). Все эти показатели повреждения были значительно повышены в легких, которые оценивали через 12-24 часа после введения LPS. Однако ни один из этих показателей повреждения ткани не был изменен в легких, когда PIP-2 вводили одновременно с LPS. Таким образом, PIP-2 может предотвращать ALI, связанный с введением LPS у мышей.
В следующем исследовании было проведено изучение влияния PIP-2, вводимого через 12 или 16 часов после введения LPS в качестве варианта лечения (в противоположность профилактическому введению). Как показано на фиг. 3А-3F, повреждение ткани, связанное с нелетальным количеством LPS, является максимальным в этот момент времени. При введении PIP-2 через 12 или 16 часов после LPS параметры повреждения легких возвращались к по существу нормальным значениям при исследовании через 24 часа после введения LPS. Из этого исследования было сделано заключение о том, что PIP-2 предупреждает продолжение повреждения легких, связанного с LPS, и позволяет легким восстановить свое состояние в течение 8-12 часов между введением PIP-2 и умерщвлением животного.
В своем финальном исследовании авторы оценивали влияние PIP-2 на функции легких мышей и выживаемость после введения смертельной дозы LPS. PIP-2 вводили каждые 12-24 ч после введения LPS, что приводило к значительному улучшению в поведении мышей, значительно снижало смертность у мышей и приводило к возвращению показателей повреждения легких к нормальному уровню. Таким образом, нонапептидный ингибитор PLA2-активности Prdx6 предотвращал образование ROS после активации NOX2 и предотвращал смертность, связанную с введением летальной дозы LPS. Эти результаты показывают, что PIP-2 может как предотвратить, так и лечить мышиную модель индуцированного LPS ALI.
Настоящие результаты с PIP-2 позволяют сделать тот же вывод, что и в предыдущих исследованиях, которые показали защиту от индуцированного LPS острого повреждения легких с использованием нескольких различных средств для ингибирования aiPLA2-активности и последующей активации NOX2. Они включали: а) введение MJ33, липидного ингибитора aiPLA2-активности; b) использование Prdx6-нулевых мышей (менее совершенной модели, поскольку пероксидазная активность Prdx6 также была утрачена); и c) мышей с мутацией аминокислоты D140 в Prdx6, существенного компонента активного сайта aiPLA2. Получавшие ингибитор MJ33 мыши, мыши с мутацией D140A и мыши, получавшие PIP-2, сохраняют пероксидазную активность Prdx6, в то время как эта активность элиминируется в Prdx6-нулевых мышах. В этих предшествующих исследованиях LPS вводили IT в a) и b) в качестве модели для прямого повреждения легких и внутрибрюшинным путем в c) в качестве модели неинфекционного сепсиса. Авторы настоящего изобретения предположили, что механизм защиты, обеспечиваемый PIP-2, представляет собой его ингибирование aiPLA2-активности в Prdx6 в результате аллостерического эффекта, возникающего в результате связывания пептида с Prdx6. Пептиды PIP не ингибируют другие aiPLA2-ферменты в легких, как показано экспериментально, и, как ожидалось, на основании отсутствия подобия потенциальных сайтов связывания на различных белках. Ингибирование aiPLA2-активности предотвращает образование lysoPC и его последующих продуктов, тем самым предотвращая активацию Rac, необходимого кофактора активации Nox2. Следует отметить, что холестеринснижающее лекарственное средство симвастатин также ингибирует активацию Rac, и, как было показано, ингибирует продукцию ROS эндотелиальными клетками и является защитным на мышиных моделях индуцированного LPS острого поражения легких. Несмотря на то, что не существует четкого доказательства, возможно, что ингибирование активации Rac оказывает благотворное действие на неопосредованные ROS проявления ALI в дополнение к его действию на активацию NOX2.
Настоящие и предшествующие исследования показали, что NOX2 является основным источником ROS в легких, и что фермент активируется в присутствии LPS. В дополнение к модели с использованием LPS было показано, что образование ROS через NOX2 играет центральную роль в нескольких других родственных, а также отличающихся животных моделях ALI, включая грамотрицательный сепсис, введение эндотоксина, тяжелую травму, геморрагический шок и инстилляцию олеиновой кислоты. Предположительно, основным проявлением окислительного стресса, связанного с активацией NOX2, является окисление макромолекул ткани, как показано в настоящем исследовании. Однако другая важная патофизиологическая роль, связанная с NOX2-продуцируемыми ROS, основана на доказательстве, что ROS ответственны за сигналы, ведущие к рекрутингу нейтрофилов в легкие, и возникающее в результате воспаление легких, которое характерное для ALI. Заметное снижение содержащих ядра клеток в BALf после введения PIP-2 свидетельствует о том, что эта функция ROS важна для восстановления после повреждения легких. В этом отношении пептидный ингибитор миристоилированного аланин-богатого C-киназного субстрата (Marcks) также защищает от повреждения легких, вызываемого LPS, у мышей. Хотя этот последний пептид не показан для ингибирования активации NOX2, его эффекты могут опосредоваться измененной подвижностью клеток, которая предотвращает приток PMN в легкие. Таким образом, PIP-2, симвастатин, белковый ингибитор Marcks и, возможно, ингибиторы NOX2, такие как апиронирин, могут предотвратить приток PMN в легкие после введения LPS, тем самым снимая воспаление и связанное с ним повреждение легких.
На основе настоящих результатов пептидные ингибиторы активации NOX2 могут быть эффективными в качестве профилактических агентов для пациентов с риском ALI, а также для лечения пациентов с установленным ALI. Хотя токсичность этих небольших пептидов не ожидается исходя из их нормальной экспрессии в легких в качестве компонента белка SP-А, которая все еще должна быть исследована. Антигенный потенциал пептидов теоретически является низким, но он должен быть подтвержден у человека. Другие возможные побочные эффекты пептидов включают те, которые связаны с ингибированием активации Rac, а также потери сигнальных и регуляторных функций ROS. Следует отметить, что не сообщалось ни основных эффектов, которые могут быть связаны с ингибированием Rac, ассоциированных с широко применяемым лекарственным средством симвастатином. Потенциально более важным побочным эффектом лечения с помощью PIP может быть эффект ингибирования продукции ROS на бактерицидную активность воспалительных клеток (PMN и AM), которые используют супероксиданион, образующийся в результате активности NOX2, для уничтожения бактерий. Кроме того, было показано, что некоторые антибиотики требуют ROS для максимальной эффективности. Несмотря на теоретическую возможность изменения ответной реакции на инфекцию, ингибитор активации NOX2 не снижал бактерицидную активность PMN в модели ALI, вызванного LPS. Это может отражать способность не связанных с NOX2 путей компенсировать потерю ROS, полученных в результате активности NOX2. Несмотря на то, что это подчеркивает важную роль для охвата антибиотиками у пациентов, подвергавшихся лечению ингибиторами NOX2, важно отметить, что применение только антибиотиков не было эффективным для снижения смертности при этом заболевании до значения значительно ниже 40%.
Описания каждого патента, патентной заявки и публикации, цитированных в настоящем документе, полностью включены в данное описание посредством ссылки.
Хотя настоящее изобретение было описано со ссылкой на конкретные варианты осуществления, очевидно, что другие варианты осуществления и изменения настоящего изобретения могут быть разработаны другими специалистами в данной области техники без отклонения от истинной сути и объема изобретения. Подразумевается, что прилагаемая формула изобретения охватывает все такие варианты осуществления и эквивалентные варианты.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> The Trustees of the University of Pennsylvania
Fisher, Aron B.
Feinstein, Sheldon I.
<120> Композиции и способы для лечения острого повреждения легких
<130> 046483-7211WO1(02047)
<150> US 62/719,217
<151> 2018-08-17
<160> 34
<170> PatentIn version 3.5
<210> 1
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Ингибиторный пептид.
<400> 1
Leu His Asp Phe Arg His Gln Ile Leu
1 5
<210> 2
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Ингибиторный пептид.
<400> 2
Leu Tyr Glu Ile Lys His Gln Ile Leu
1 5
<210> 3
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Ингибиторный пептид.
<400> 3
Leu Tyr Asp Ile Arg His Gln Ile Leu
1 5
<210> 4
<211> 14
<212> Белок
<213> Искусственная последовательность
<220>
<223> Ингибиторный пептид.
<220>
<221> Прочие признаки
<222> (1)..(5)
<223> Xaa может представлять собой любую природную аминкислоту
<220>
<221> Прочие признаки
<222> (7)..(10)
<223> Xaa может представлять собой любую природную аминкислоту
<400> 4
Xaa Xaa Xaa Xaa Xaa Leu Xaa Xaa Xaa Xaa His Gln Ile Leu
1 5 10
<210> 5
<211> 14
<212> Белок
<213> Искусственная последовательность
<220>
<223> Ингибиторный пептид.
<400> 5
Glu Leu Gln Thr Glu Leu Tyr Glu Ile Lys His Gln Ile Leu
1 5 10
<210> 6
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> Ингибиторный пептид.
<400> 6
Gln Thr Glu Leu Tyr Glu Ile Lys His Gln Ile Leu
1 5 10
<210> 7
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> Ингибиторный пептид.
<400> 7
Glu Leu Tyr Glu Ile Lys His Gln Ile Leu
1 5 10
<210> 8
<211> 16
<212> Белок
<213> Искусственная последовательность
<220>
<223> Ингибиторный пептид.
<400> 8
Asp Glu Glu Leu Gln Ala Thr Leu His Asp Phe Arg His Gln Ile Leu
1 5 10 15
<210> 9
<211> 16
<212> Белок
<213> Искусственная последовательность
<220>
<223> Ингибиторный пептид.
<400> 9
Asp Glu Glu Leu Gln Thr Glu Leu Tyr Glu Ile Lys His Gln Ile Leu
1 5 10 15
<210> 10
<211> 14
<212> Белок
<213> Искусственная последовательность
<220>
<223> Ингибиторный пептид.
<400> 10
Glu Leu Gln Thr Glu Leu Tyr Glu Ile Lys His Gln Ile Leu
1 5 10
<210> 11
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> Ингибиторный пептид.
<400> 11
Gln Thr Glu Leu Tyr Glu Ile Lys His Gln Ile Leu
1 5 10
<210> 12
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> Ингибиторный пептид.
<400> 12
Glu Leu Tyr Glu Ile Lys His Gln Ile Leu
1 5 10
<210> 13
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Ингибиторный пептид.
<400> 13
Tyr Glu Ile Lys His Gln Ile Leu
1 5
<210> 14
<211> 14
<212> Белок
<213> Искусственная последовательность
<220>
<223> Ингибиторный пептид.
<400> 14
Asp Glu Glu Leu Gln Thr Glu Leu Tyr Glu Ile Lys His Gln
1 5 10
<210> 15
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> Ингибиторный пептид.
<400> 15
Asp Glu Glu Leu Gln Thr Glu Leu Tyr Glu Ile Lys
1 5 10
<210> 16
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Ингибиторный пептид.
<400> 16
Asp Glu Glu Leu Gln Thr Glu Leu Tyr Glu Ile
1 5 10
<210> 17
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Ингибиторный пептид.
<400> 17
Asp Glu Glu Leu Gln Thr Glu Leu
1 5
<210> 18
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> Ингибиторный пептид.
<400> 18
Thr Leu His Asp Phe Arg His Gln Ile Leu
1 5 10
<210> 19
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Ингибиторный пептид.
<400> 19
Thr Leu His Asp Phe Arg His Gln Ile
1 5
<210> 20
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Ингибиторный пептид.
<400> 20
Leu His Asp Phe Arg His Gln Ile
1 5
<210> 21
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Ингибиторный пептид.
<400> 21
Glu Leu Tyr Glu Ile Lys His Gln Ile
1 5
<210> 22
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Ингибиторный пептид.
<400> 22
Leu Tyr Glu Ile Lys His Gln Ile
1 5
<210> 23
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Ингибиторный пептид.
<400> 23
Leu Lys Ile Glu Tyr His Gln Ile Leu
1 5
<210> 24
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Ингибиторный пептид.
<400> 24
Leu Arg Phe Asp His His Gln Ile Leu
1 5
<210> 25
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Ингибиторный пептид.
<400> 25
Leu His Glu Phe Lys His Gln Ile Leu
1 5
<210> 26
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Ингибиторный пептид.
<400> 26
Leu Phe Lys Leu Glu His Gln Ile Leu
1 5
<210> 27
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Ингибиторный пептид.
<400> 27
Leu His Asp Phe Arg Asp Gln Ile Leu
1 5
<210> 28
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Ингибиторный пептид.
<400> 28
Leu His Asp Phe Arg Pro Gln Ile Leu
1 5
<210> 29
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Ингибиторный пептид.
<400> 29
Leu His Asp Phe Arg His Asn Ile Leu
1 5
<210> 30
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Ингибиторный пептид.
<400> 30
Leu His Asp Phe Arg His Ile Ile Leu
1 5
<210> 31
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Ингибиторный пептид.
<400> 31
Leu His Asp Phe Arg His Gln Leu Leu
1 5
<210> 32
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Ингибиторный пептид.
<400> 32
Leu His Asp Phe Arg His Gln Thr Leu
1 5
<210> 33
<211> 10
<212> Белок
<213> Homo sapiens
<400> 33
Glu Glu Glu Ala Lys Lys Leu Phe Pro Lys
1 5 10
<210> 34
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> Ингибиторный пептид.
<400> 34
Ile Lys His Gln Ile Leu
1 5
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| КОНСТРУКЦИИ ДНК-АНТИТЕЛ ДЛЯ ПРИМЕНЕНИЯ ПРОТИВ БОЛЕЗНИ ЛАЙМА | 2017 |
|
RU2813829C2 |
| АНТИ-C5 АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2774716C2 |
| АНТИ-C5a-АНТИТЕЛА И ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2773779C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИ-C5 АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2792237C2 |
| ПРОЛЕКАРСТВО ИНТЕРФЕРОНА ДЛЯ ЛЕЧЕНИЯ РАКА | 2018 |
|
RU2788736C2 |
| ГЛИКАНЗАВИСИМЫЕ ИММУНОТЕРАПЕВТИЧЕСКИЕ МОЛЕКУЛЫ | 2016 |
|
RU2754661C2 |
| АНТИТЕЛА ПРОТИВ ФАКТОРА D И ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2799044C2 |
| АНТИ-αvβ8 АНТИТЕЛА И КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2812478C2 |
| ТЕРАПЕВТИЧЕСКИЕ СРЕДСТВА И СПОСОБЫ ДЛЯ ЛЕЧЕНИЯ TLR2-ОПОСРЕДОВАННЫХ ЗАБОЛЕВАНИЙ И НАРУШЕНИЙ | 2019 |
|
RU2791022C2 |
| ВАКЦИНА И СПОСОБЫ ОБНАРУЖЕНИЯ И ПРОФИЛАКТИКИ ФИЛЯРИОЗА | 2021 |
|
RU2832185C1 |
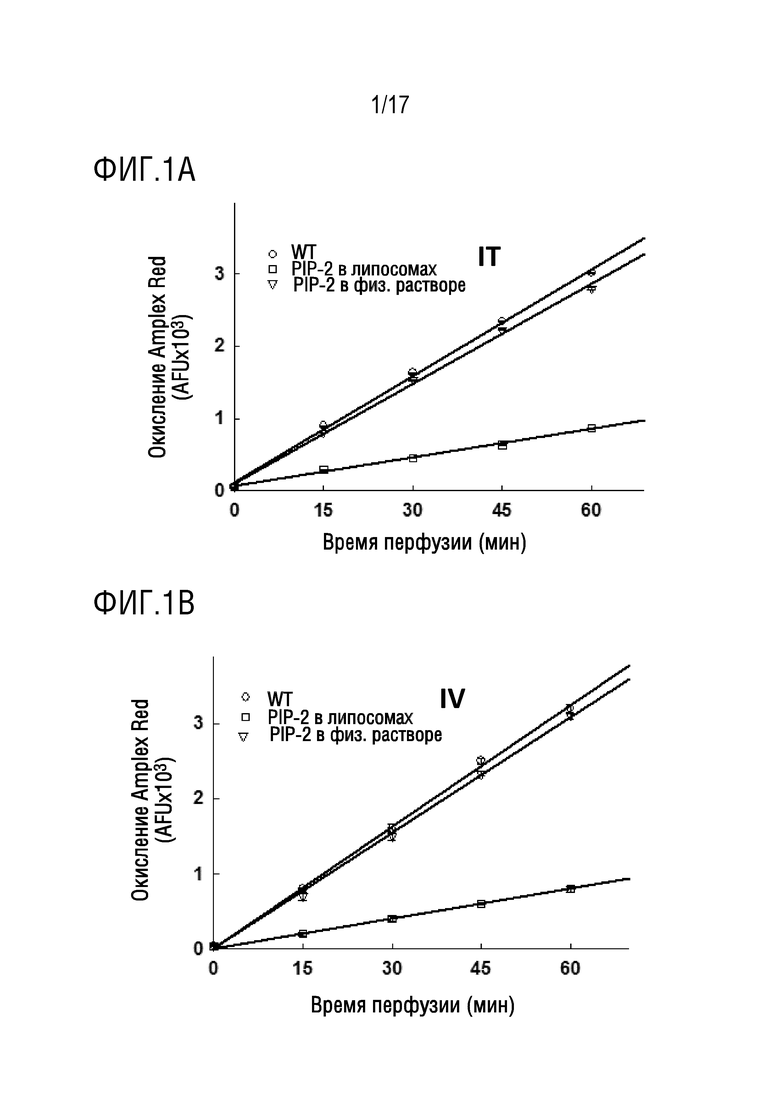
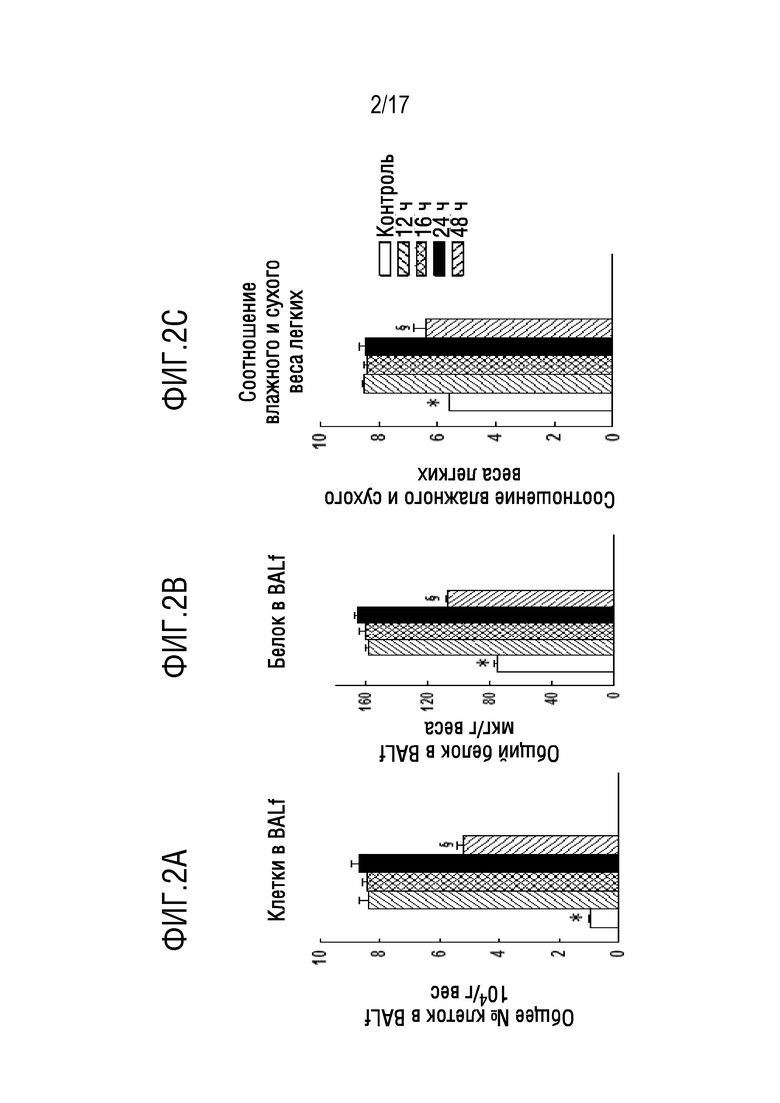
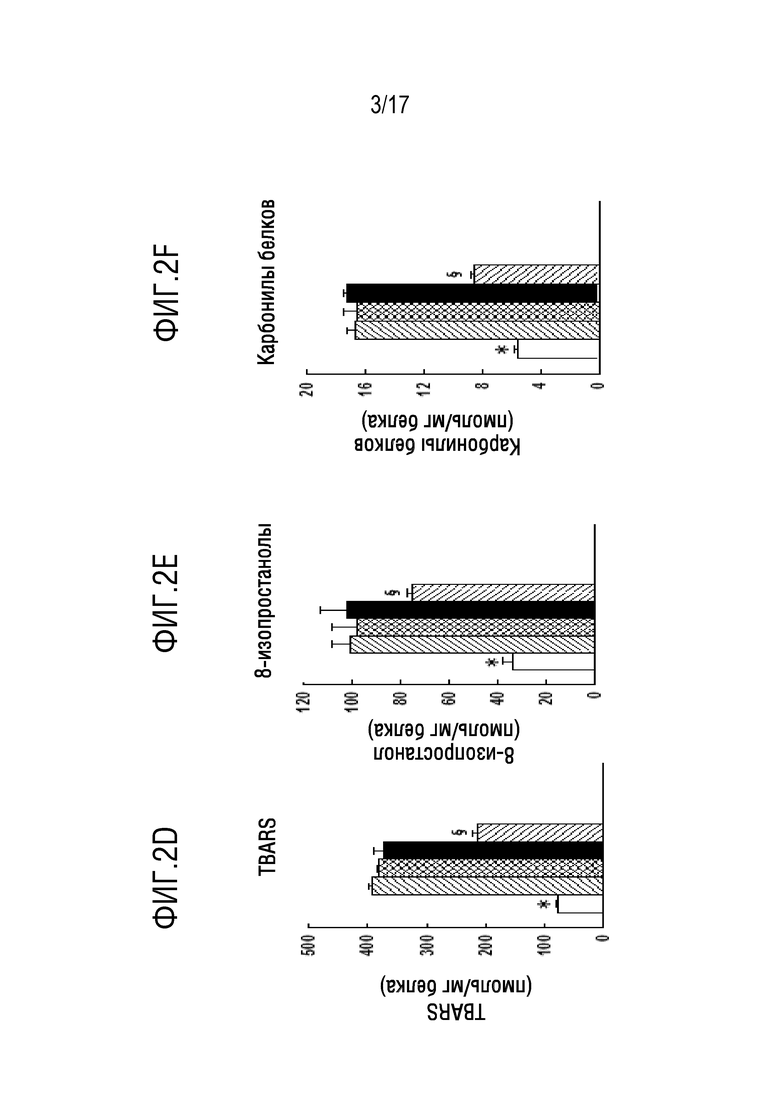
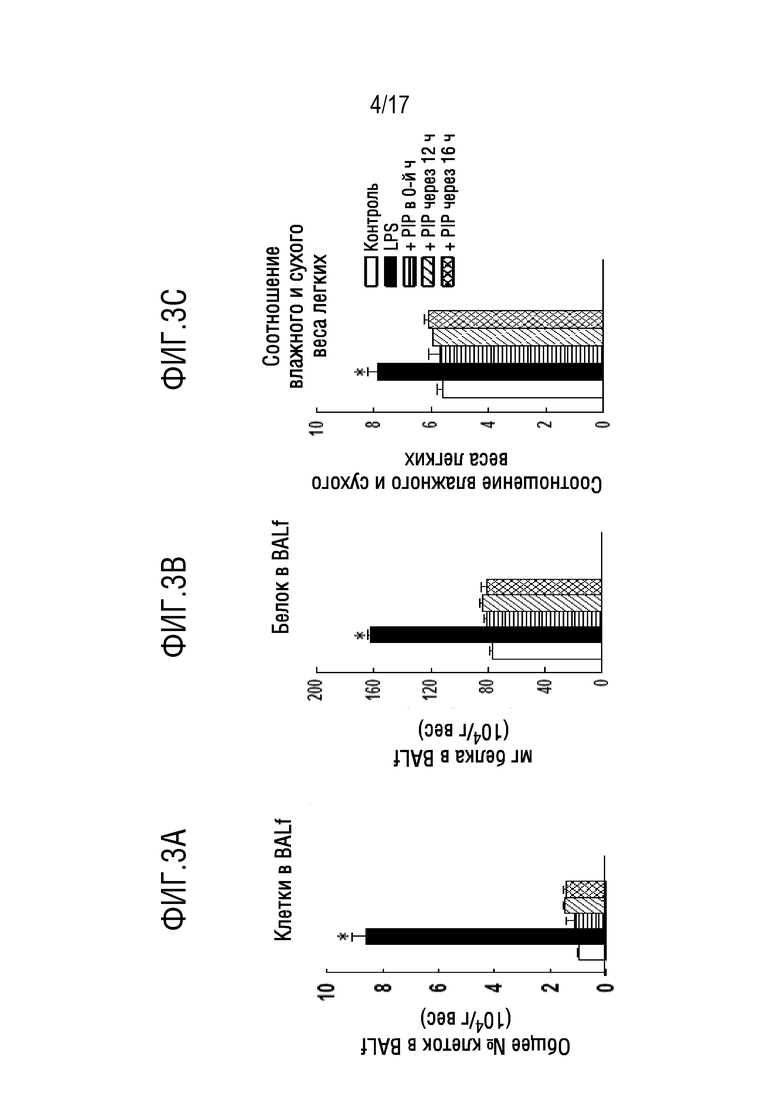
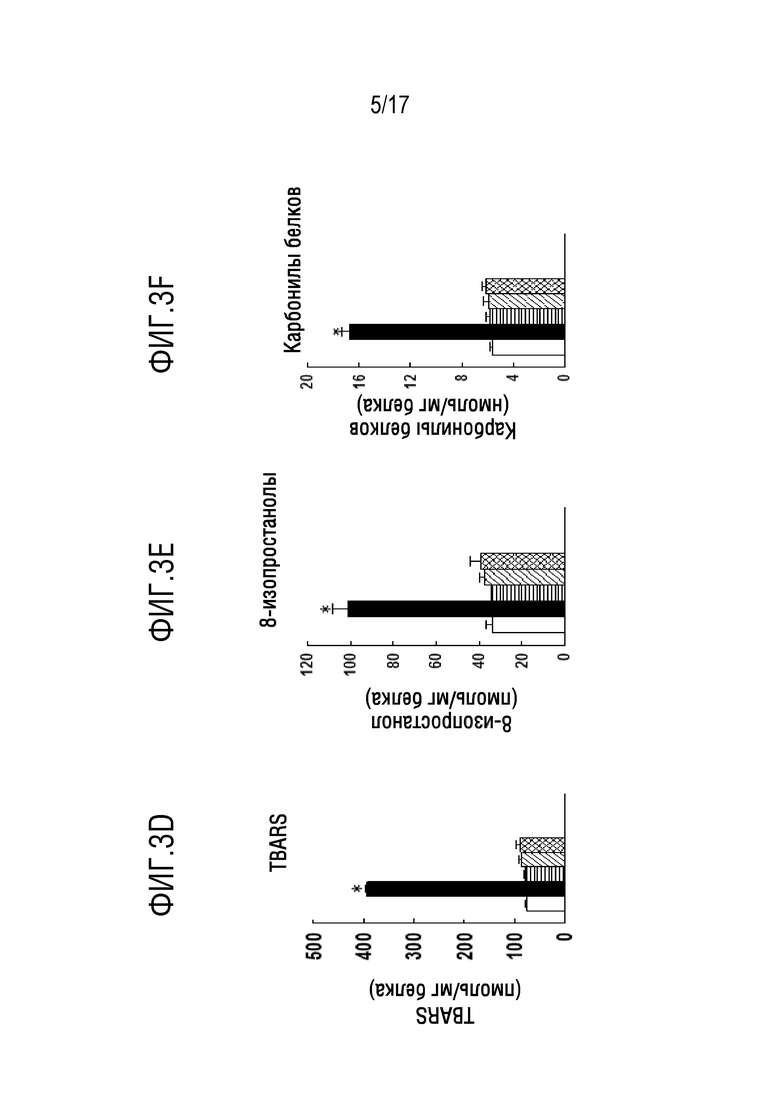
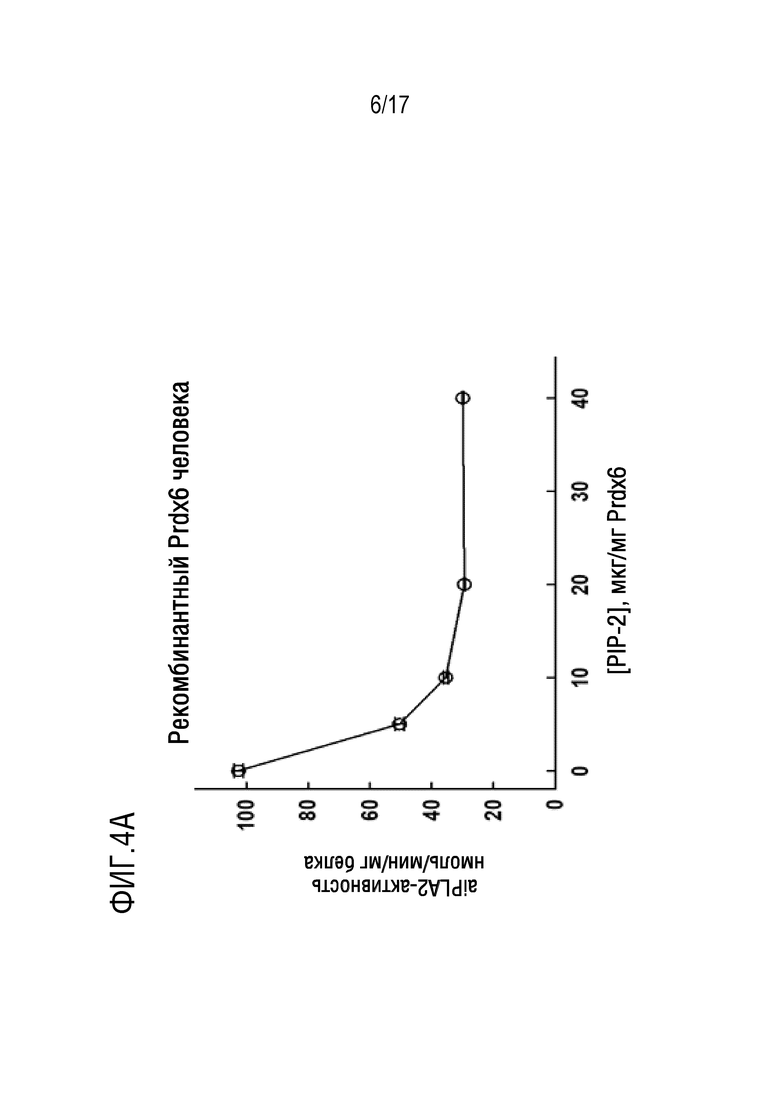
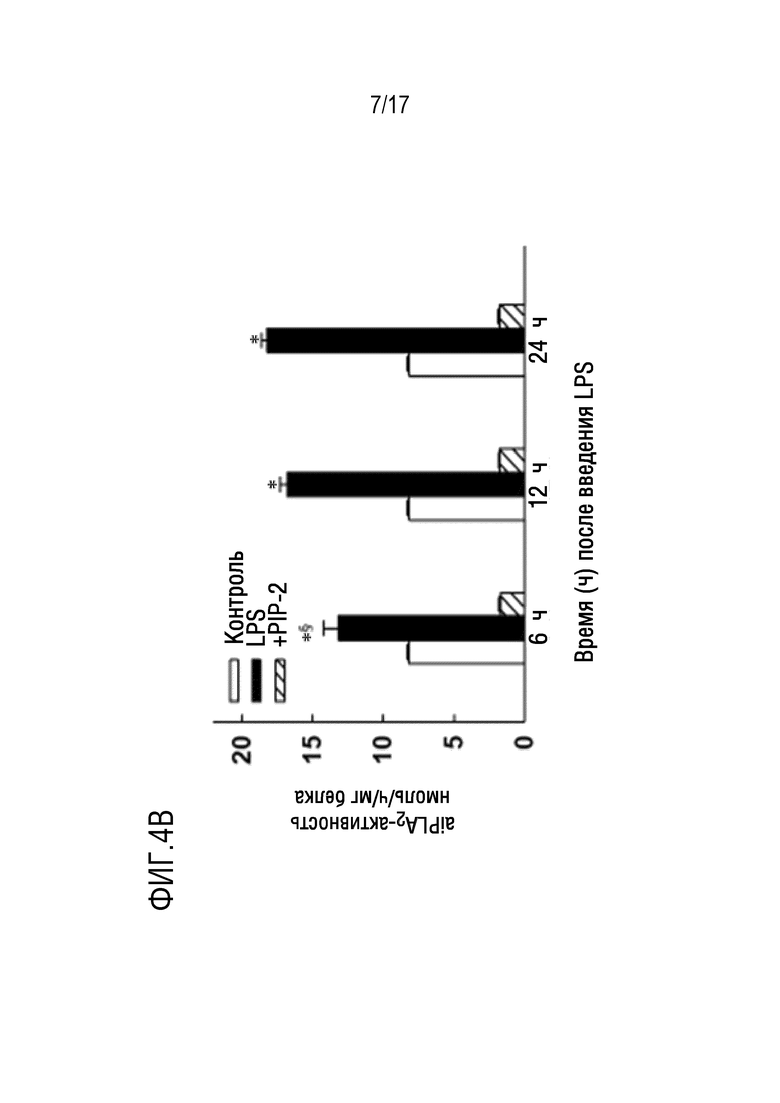
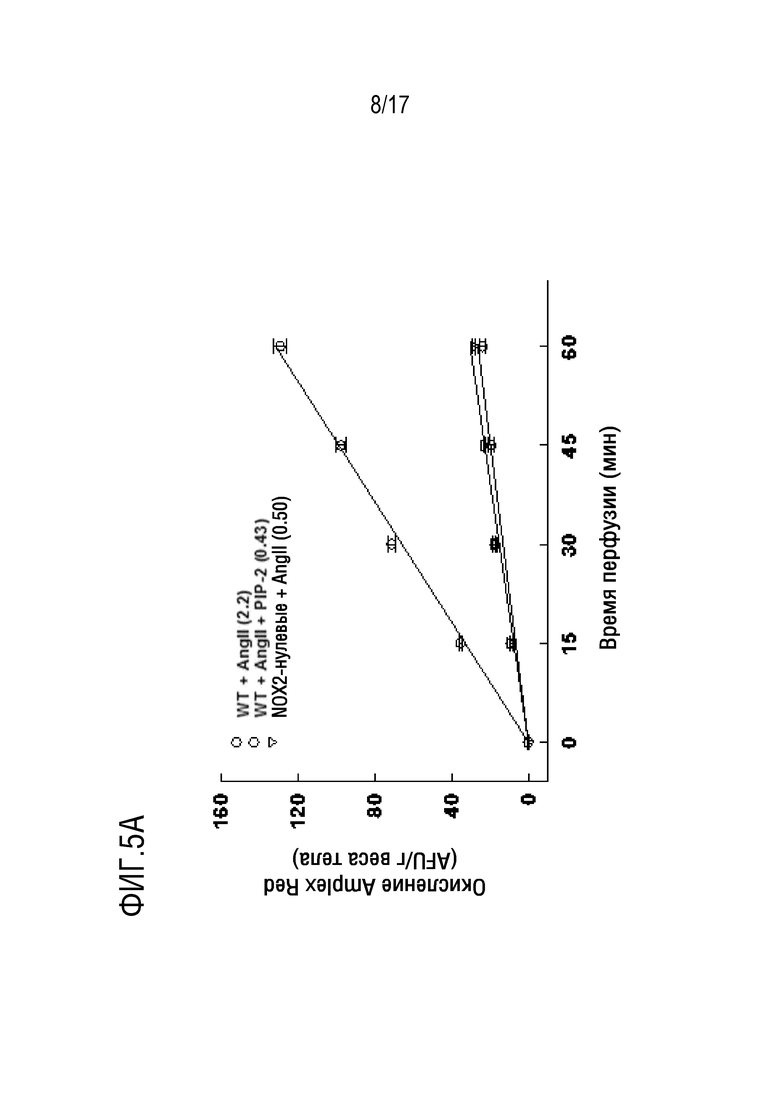
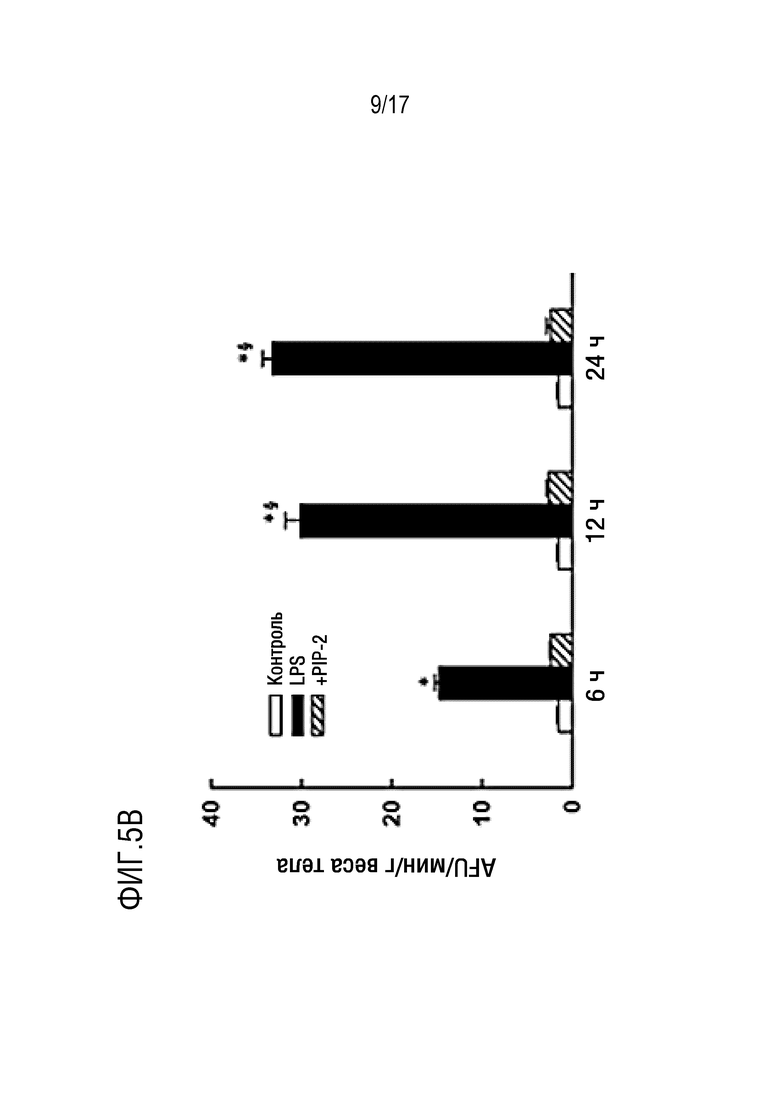
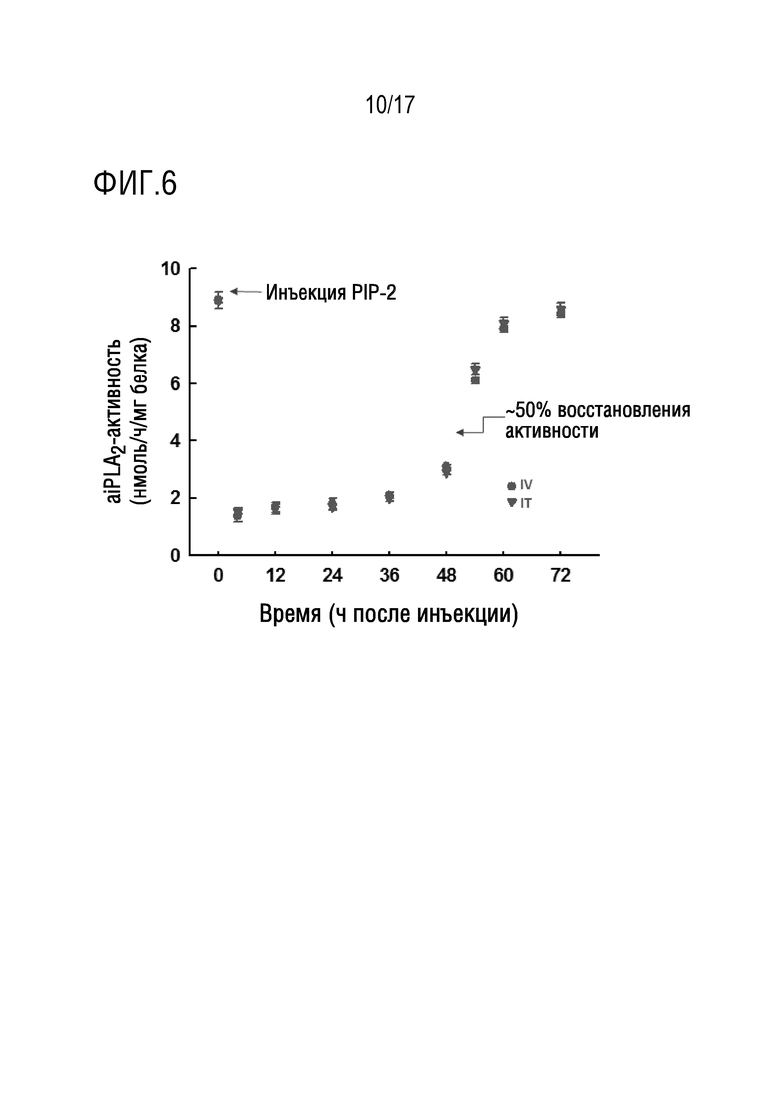
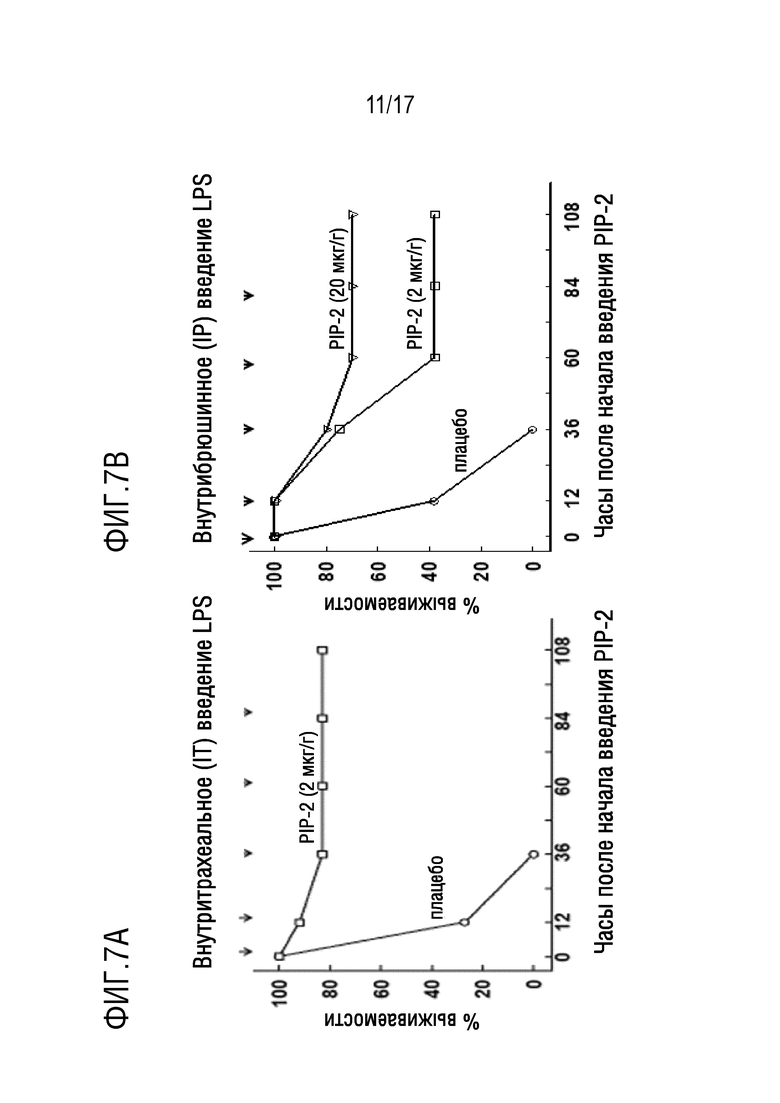
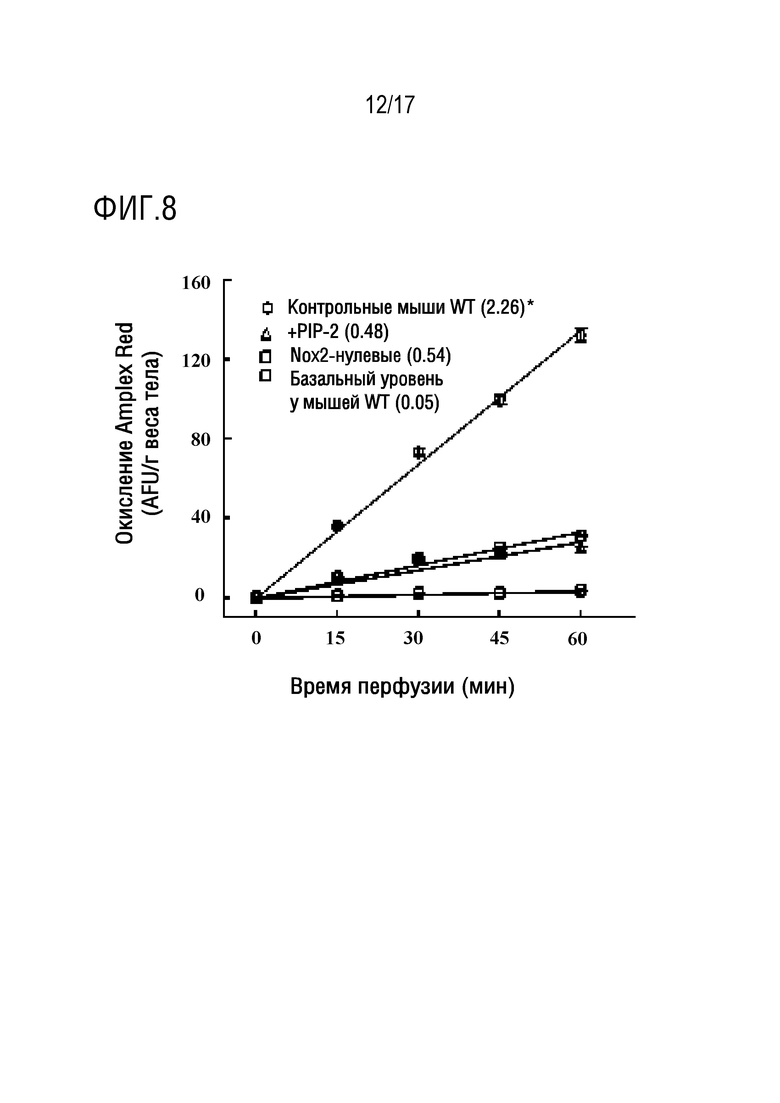
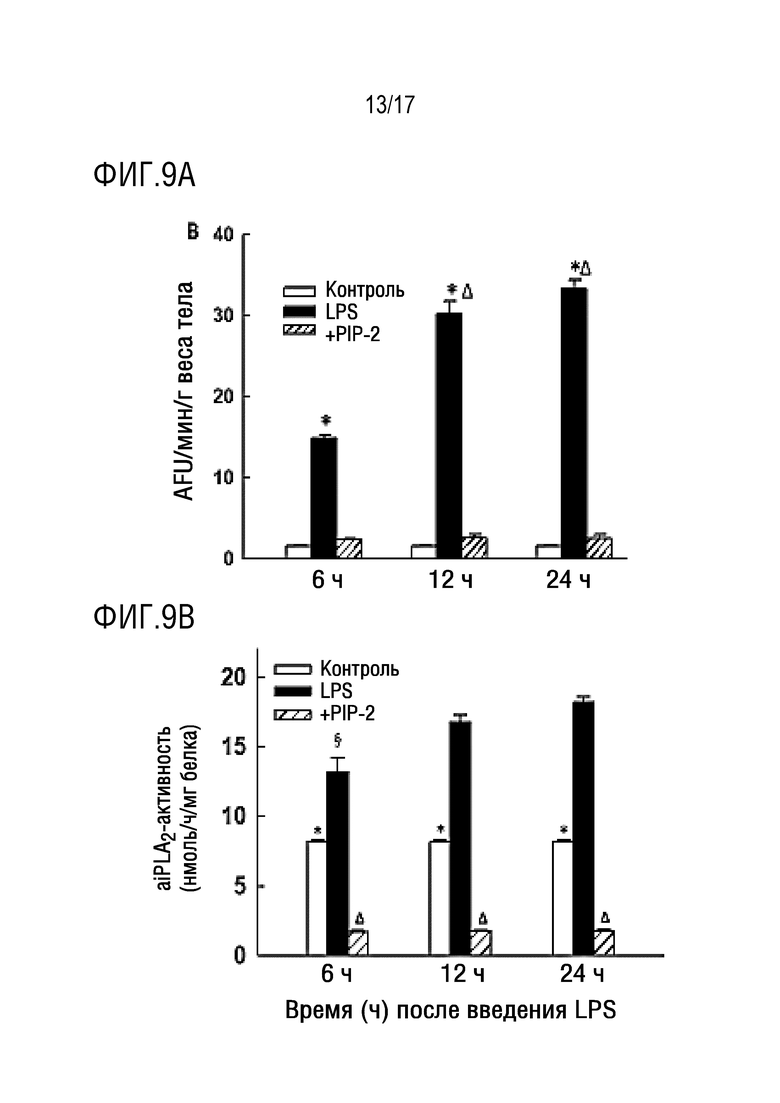
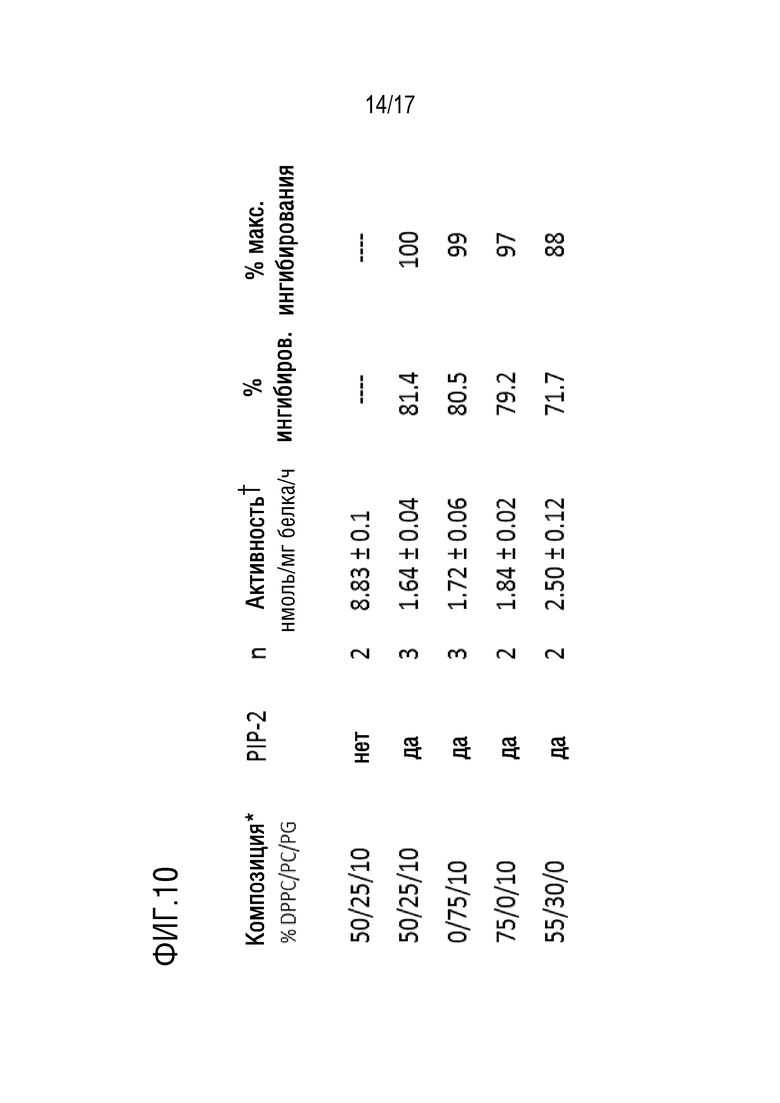
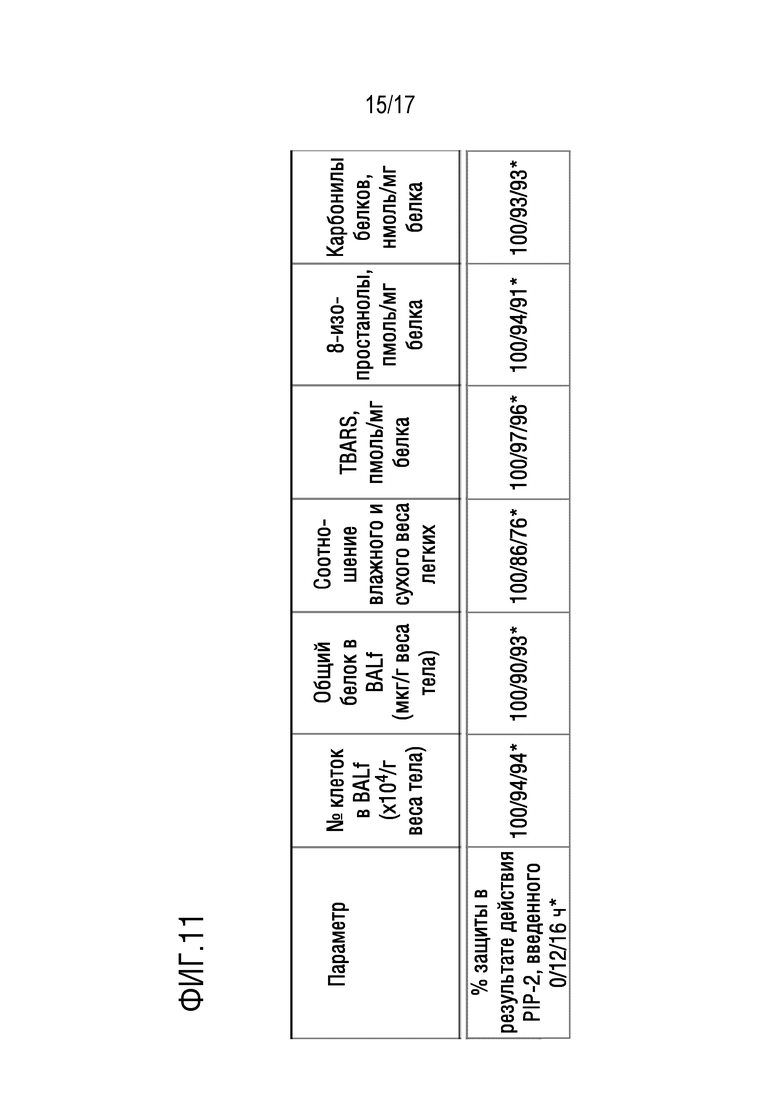
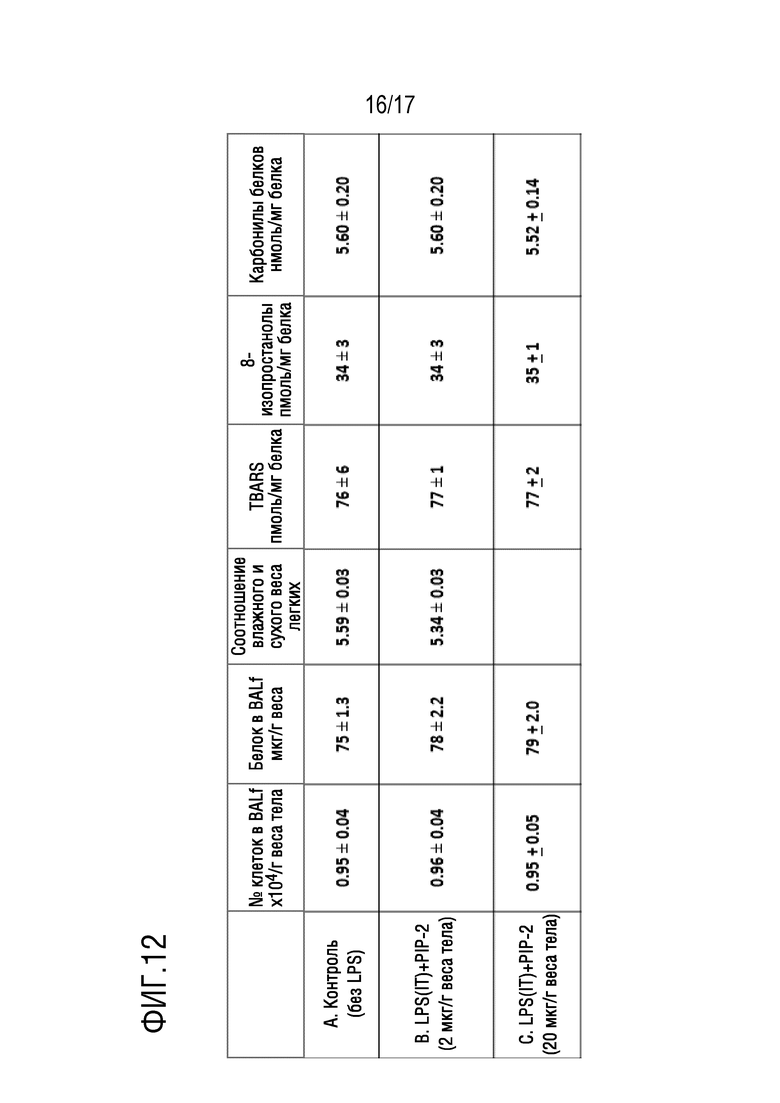
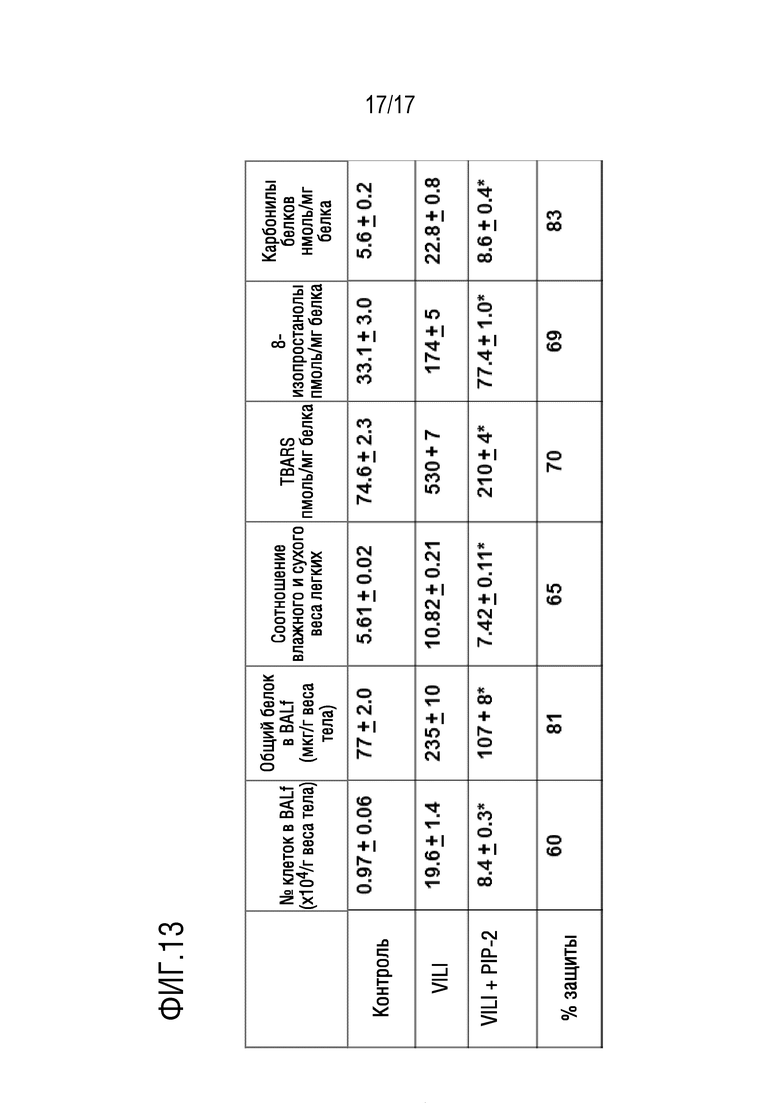
Изобретение относится к области биотехнологии. Предложены композиции и способы, пригодные для лечения острого повреждения легких и сепсиса. Изобретение может найти применение в терапии. 4 н. и 14 з.п. ф-лы, 28 ил., 13 табл., 5 пр.
1. Композиция для лечения острого повреждения легких у субъекта, где композиция содержит полипептид, состоящий из аминокислотной последовательности SEQ ID NO: 1 LHDFRHQIL или SEQ ID NO: 2 LYEIKHQIL.
2. Композиция по п. 1, дополнительно включающая фармацевтически приемлемый носитель.
3. Композиция по п. 1, где полипептид инкапсулируют в одну или несколько липосом.
4. Композиция по п. 1, где композицию изготавливают для аэрозольной ингаляции или внутритрахеальной или внутривенной инъекции.
5. Композиция по п. 1, где полипептид состоит из SEQ ID NO: 1.
6. Композиция для лечения сепсиса у субъекта, содержащая полипептид, состоящий из аминокислотной последовательности SEQ ID NO: 1 LHDFRHQIL или SEQ ID NO: 2 LYEIKHQIL.
7. Композиция по п. 6, дополнительно содержащая фармацевтически приемлемый носитель.
8. Композиция по п. 6, где полипептид инкапсулирован в одну или несколько липосом.
9. Композиция по п. 6, где композицию изготавливают для аэрозольной ингаляции или интратрахеальной или внутривенной инъекции.
10. Композиция по п. 6, где полипептид состоит из SEQ ID NO: 1.
11. Способ лечения острого повреждения легких у субъекта, включающий в себя введение субъекту эффективного количества фармацевтической композиции, содержащей полипептид, состоящий из аминокислотной последовательности SEQ ID NO: 1 LHDFRHQIL или SEQ ID NO: 2 LYEIKHQIL.
12. Способ по п. 11, где полипептид инкапсулируют в одну или несколько липосом.
13. Способ по п. 11, где фармацевтическую композицию вводят субъекту посредством аэрозольной ингаляции или путем внутритрахеальной или внутривенной инъекции.
14. Способ по п. 11, где полипептид состоит из SEQ ID NO: 1.
15. Способ лечения сепсиса у субъекта, включающий в себя введение субъекту эффективного количества фармацевтической композиции, содержащей полипептид, состоящий из аминокислотной последовательности SEQ ID NO: 1 LHDFRHQIL или SEQ ID NO: 2 LYEIKHQIL.
16. Способ по п. 15, где полипептид инкапсулируют в одну или несколько липосом.
17. Способ по п. 15, где фармацевтическую композицию вводят субъекту посредством аэрозольной ингаляции или путем внутритрахеальной или внутривенной инъекции.
18. Способ по п. 15, где полипептид состоит из SEQ ID NO: 1.
| KRISHNAIAH SAIKUMARI Y et al | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Колосниковая решетка | 1924 |
|
SU1864A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| СПОСОБ ПРИГОТОВЛЕНИЯ ЖЕЛЕЙПОЙ Л\АССЫ | 0 |
|
SU206301A1 |
| LEE I | |||
| et al | |||
| A Novel Nontoxic Inhibitor of the Activation of NADPH Oxidase Reduces Reactive Oxygen Species | |||
Авторы
Даты
2024-04-23—Публикация
2019-08-15—Подача