Перекрестная ссылка на родственную заявку
Настоящая заявка испрашивает приоритет предварительной заявки на патент № 61/511658, поданной 26 июля 2011 г., которая полностью включена в настоящее описание изобретения в качестве ссылки.
Уровень техники
Гены, кодирующие Cry1F и Cry1Ac synpro (Cry1Ac), способны сообщать трансгенным растениям устойчивость к насекомым, например, устойчивость к чешуекрылым насекомым, и ген, кодирующий РАТ (фосфинотрицинацетилтрансферазу), способен сообщать трансгенным растениям устойчивость к гербициду фосфинотрицину (глюфозинат). РАТ был успешно экспрессирован в сое в качестве селектируемого маркера при создании устойчивых к насекомым трансгенных сельскохозяйственных культур и белка, сообщающего трансгенным культурам устойчивость к гербициду глюфозинату в промышленном масштабе.
Известно, что на экспрессию чужеродных генов в растениях влияет их локализация в геноме растения, вероятно, вследствие структуры хроматина (например, гетерохроматина) или близости регулирующих транскрипцию элементов (например, энхансеров) к сайту интеграции (Weising et al., Ann. Rev. Genet. 22:421:477, 1988). В то же время наличие трансгена в других положениях в геноме по-разному влияет на общий фенотип растения. По указанной причине часто необходимо исследовать большое число трансформантов, чтобы обнаружить трансформант, характеризующийся оптимальной экспрессией введенного гена. Например, установлено, что растения и другие организмы могут характеризоваться широким диапазоном изменения уровней экспрессии введенного гена в разных трансформантах. Кроме того, могут иметь место различия в пространственных или временных паттернах экспрессии, например, различия в относительной экспрессии трансгена в разных тканях растения, которые не соответствуют паттернам, предполагаемым на основании регулирующих транскрипцию элементов, присутствующих в конструкции введенного гена. Поэтому обычно получают сотни и тысячи разных трансформантов, которые исследуют с целью обнаружения единственного трансформанта, характеризующегося требуемыми уровнями экспрессии трансгена и паттернами, пригодными для промышленных целей. Трансформант, обладающий требуемыми уровнями или паттернами экспрессии трансгена, пригоден для интрогрессии данного трансгена в другие генетические среды в результате ауткроссинга стандартными методами селекции. Потомство таких гибридов сохраняет характеристики экспрессии трансгена первичного трансформанта. Такая методика позволяет гарантировать надежную экспрессию гена в целом ряде сортов, хорошо адаптированных к местным условиям произрастания.
Необходим метод, позволяющий обнаружить наличие конкретного трансформанта и определить возможность сохранения в потомстве гибрида трансгена или группы представляющих интерес трансгенов. Кроме того, метод обнаружения конкретного трансформанта должен удовлетворять требованиям апробации до поступления на рынок и маркировки продуктов питания, получаемых из рекомбинантных сельскохозяйственных культур, например, в случае контроля за состоянием окружающей среды, контроля признаков сельскохозяйственных культур в полевых условиях или контроля продуктов, полученных из сельскохозяйственных культур, а также для гарантии соответствия положениям или условиям договора.
Трансгенный трансформант можно обнаружить любым методом обнаружения нуклеиновой кислоты, известным в данной области, который включает, не ограничиваясь ими, полимеразную цепную реакцию (ПЦР) или гибридизацию ДНК с использованием зондов к нуклеиновым кислотам. Указанные методы обнаружения обычно основаны на часто используемых генетических элементах, таких как промоторы, терминаторы, гены-маркеры и т.д., так как кодирующая область является взаимозаменяемой для многих конструкций ДНК. Вследствие этого такие методы не позволяют различать разные трансформанты, в частности, такие трансформанты, которые были получены при использовании одной конструкции ДНК или очень схожих конструкций, если не известна последовательность фланкирующей ДНК, расположенная рядом с вставленной гетерологичной ДНК. Например, трансформантспецифический анализ методом ПЦР описан в заявке на патент США № 2006/0070139 для трансформанта кукурузы DAS-59122-7. Необходим простой и чувствительный метод идентификации трансформанта сои pDAB9582.814.19.1.
Сущность изобретения
Настоящее изобретение относится к способу обнаружения нового объекта трансформации трансгенной сои, устойчивого к насекомым и толерантного к гербицидам, который был определен как трансформант сои pDAB9582.814.19.1. В качестве части данного изобретения по меньшей мере 2500 семян линии сои, содержащей трансформант pDAB9582.814.19.1, было депонировано в Американскую коллекцию типовых культур (АТСС) по адресу: 10801 University Boulevard, Manassas, VA, 20110. Указанный депозит был зарегистрирован в АТСС в качестве патентного депозита РТА-12006 21 июля 2011 г. Данный депозит был сделан и будет храниться в соответствии с условиями Будапештского договора о международном признании депонирования семян для целей патентной процедуры.
ДНК растений сои, содержащих данный трансформант, включает соединительные/фланкирующие последовательности, рассмотренные в настоящем описании изобретения, которые определяют локализацию ДНК, введенной в геном сои. Трансформант сои pDAB9582.814.19.1 можно диагностировать на основании SEQ ID NO:1 и SEQ ID NO:2. В частности, трансформант сои pDAB9582.814.19.1 можно диагностировать на основании последовательностей, окружающих места соединения в положении 1400/1401 п.о. и 1536/1537 п.о. SEQ ID NO:1 и 152/153 п.о. SEQ ID NO:2. В нижеследующем абзаце [0009] приведены примеры последовательностей, включающих указанные места соединения, характерные для ДНК сои, содержащей трансформант pDAB9582.814.19.1.
Настоящее изобретение относится к способу обнаружения трансформанта сои pDAB9582.814.19.1 в образце, содержащем ДНК сои, который включает:
(а) приведение указанного образца в контакт с первым праймером длиной по меньшей мере 10 п.о., который избирательно связывается с фланкирующей последовательностью в положении 1-1400 п.о. SEQ ID NO:1 или ее комплементом, и со вторым праймером длиной по меньшей мере 10 п.о., который избирательно связывается со вставочной последовательностью в положении 1401-1836 п.о. SEQ ID NO:1 или ее комплементом;
(b) исследование ампликона, образованного между указанными праймерами; или приведение указанного образца в контакт с первым праймером длиной по меньшей мере 10 п.о., который избирательно связывается с вставочной последовательностью в положении 1-152 п.о. SEQ ID NO:2 или ее комплементом, и со вторым праймером длиной по меньшей мере 10 п.о., который избирательно связывается с фланкирующей последовательностью в положении 153-1550 п.о. SEQ ID NO:2 или ее комплементом; и
(с) исследование ампликона, образованного между указанными праймерами.
Другой вариант осуществления изобретения относится к молекуле выделенной ДНК, позволяющей диагностировать трансформант сои pDAB9582.814.19.1. Такие молекулы включают, помимо SEQ ID NO:1 и 2, участок длиной по меньшей мере 25 п.о., содержащий 1400-1401 п.о. SEQ ID NO:1, и по меньшей мере 10 п.о. SEQ ID NO:1 в каждом направлении от места соединения в положении 1400/1401 п.о.; ампликоны длиной по меньшей мере 25 п.о., содержащие 152-153 п.о. SEQ ID NO:2, и по меньшей мере 10 п.о. SEQ ID NO:2 в каждом направлении от места соединения в положении 152-153 п.о. В качестве примеров можно привести 1385-1415 п.о. SEQ ID NO:1; 1350-1450 п.о. SEQ ID NO:1; 1300-1500 п.о. SEQ ID NO:1; 1200-1600 п.о. SEQ ID NO:1; 137-168 п.о. SEQ ID NO:2; 103-203 п.о. SEQ ID NO:2 и 3-303 п.о. SEQ ID NO:2 и их комплементы.
Настоящее изобретение также относится к анализам, позволяющим обнаружить данный трансформант в образце (например, в образце сои). Указанные анализы могут быть основаны на последовательности ДНК рекомбинантной конструкции, введенной в геном сои, и на геномных последовательностях, фланкирующих инсерционный сайт. В объем настоящего изобретения также входят наборы и условия выполнения указанных анализов.
Настоящее изобретение частично относится к клонированию и анализу последовательностей ДНК краевых областей, образующихся в результате инсерции Т-ДНК из pDAB9582 в линиях трансгенной сои. Указанные последовательности являются уникальными. На основании вставочных и соединительных последовательностей могут быть созданы и были созданы трансформантспецифические праймеры. Анализ методом ПЦР показал, что указанные трансформанты могут быть идентифицированы в результате анализа ампликонов ПЦР, созданных при использовании наборов трансформантспецифических праймеров. Таким образом, для идентификации линий сои, содержащих трансформант по настоящему изобретению, могут быть использованы вышеуказанные и другие родственные методы.
Краткое описание последовательностей
SEQ ID NO:1 является 5'-концевой фланкирующей краевой последовательностью ДНК трансформанта сои 9582.814.19.1. Нуклеотиды 1-1400 являются геномной последовательностью. Нуклеотиды 1401-1535 являются реаранжированной последовательностью из pDAB9582. Нуклеотиды 1536-1836 являются вставочной последовательностью.
SEQ ID NO:2 является 3'-концевой фланкирующей краевой последовательностью ДНК трансформанта сои 9582.814.19.1. Нуклеотиды 1-152 являются вставочной последовательностью. Нуклеотиды 153-1550 являются геномной последовательностью.
SEQ ID NO:3 является последовательностью ДНК из pDAB9582, которая приведена ниже в таблице 1.
SEQ ID NO:4 является олигонуклеотидным праймером 81419_FW3, используемым для подтверждения 5'-концевой краевой геномной ДНК.
SEQ ID NO:5 является олигонуклеотидным праймером 81419_RV1, используемым для подтверждения 3'-концевой краевой геномной ДНК.
SEQ ID NO:6 являектся олигонуклеотидным праймером 81419_RV2, используемым для подтверждения 3'-концевой краевой геномной ДНК.
SEQ ID NO:7 яляется олигонуклеотидным праймером 81419_RV3, используемым для подтверждения 3'-концевой краевой геномной ДНК.
SEQ ID NO:8 является олигонуклеотидным праймером 5'IREnd-01, используемым для подтверждения 5'-концевой краевой геномной ДНК.
SEQ ID NO:9 является олигонуклеотидным праймером 5'IREnd-02, используемым для подтверждения 5'-концевой краевой геномной ДНК.
SEQ ID NO:10 является олигонуклеотидным праймером AtUbi10RV1, используемым для подтверждения 5'-концевой краевой геномной ДНК.
SEQ ID NO:11 является олигонуклеотидным праймером AtUbi10RV2, используемым для подтверждения 5'-концевой краевой геномной ДНК.
SEQ ID NO:12 является олигонуклеотидным праймером 3'PATEnd05, используемым для подтверждения 3'-концевой краевой геномной ДНК.
SEQ ID NO:13 является олигонуклеотидным праймером 3'PATEnd06, используемым для подтверждения 3'-концевой краевой геномной ДНК.
SEQ ID NO:14 является подтвержденной последовательностью трансформанта сои 9582.814.19.1, которая включает 5'-концевую геномную фланкирующую последовательность, вставку Т-цепи pDAB9582 и 3'-концевую геномную фланкирующую последовательность.
SEQ ID NO:15 является олигонуклеотидным праймером 81419_3'F, используемым для выполнения анализа TAQMAN с целью обнаружения 3'-концевого края трансформанта сои 9582.814.19.1.
SEQ ID NO:16 является олигонуклеотидным праймером 81419_3'R, используемым для выполнения анализа TAQMAN с целью обнаружения 3'-концевого края трансформанта сои 9582.814.19.1.
SEQ ID NO:17 является олигонуклеотидным зондом 81419_3'P, используемым для выполнения анализа TAQMAN с целью обнаружения 3'-концевого края трансформанта сои 9582.814.19.1. Указанный зонд имеет флуоресцентную часть FAM, добавленную к 5'-концу, и гаситель MGB, добавленный 3'-концу.
SEQ ID NO:18 является олигонуклеотидным праймером GMS116F, используемым для выполнения анализа TAQMAN с целью обнаружения эндогенного эталонного гена GMFL01-25-J19 (GenBank: A286292.1).
SEQ ID NO:19 является олигонуклеотидным праймером GMS116R, используемым для выполнения анализа TAQMAN с целью обнаружения эндогенного эталонного гена GMFL01-25-J19 (GenBank: AK286292.1).
SEQ ID NO:20 является олигонуклеотидным зондом GMS116, используемым для выполнения анализа TAQMAN с целью обнаружения эндогенного эталонного гена GMFL01-25-J19 (GenBank: AK286292.1). Указанный зонд имеет флуоресцентную часть НЕХ, добавленную к 5'-концу, и гаситель BHQ, добавленный к 3'-концу.
Краткое описание чертежей
На фиг. 1 изображена плазмидная карта pDAB9582, содержащего полигенный экспрессирующий кластер cry1F, cry1Ac и pat.
На фиг. 2 показана локализация праймеров, используемых для подтверждения 5'- и 3'-концевой краевой последовательности трансформанта сои pDAB9582.814.19.1.
На фиг. 3 показано расположение геномной последовательности в трансформанте сои pDAB9582.814.19.1.
На фиг. 4 показана локализация праймеров и зондов, используемых для выполнения анализа TAQMAN трансформанта сои pDAB9582.814.19.1.
Подробное описание изобретения
Оба конца инсерции трансформанта сои 9582.814.19.1 были секвенированы и исследованы. Были разработаны трансформантспецифические анализы. Указанный трансформант был также картирован на хромосоме 02 генома сои. Данный трансформант может быть введен в другие элитные линии.
Как было указано выше в разделе ”Уровень техники”, введение и интеграция трансгена в геном растения предполагает образование некоторых произвольных трансформантов (отсюда и название ”трансформант” для данной экспрессированной инсерции). То есть при использовании многих методов трансформации, таких как трансформация Agrobacterium, биолистическая трансформация (то есть генное ружье) и трансформация, опосредуемая карбидом кремния, (то есть WHISKERS), невозможно прогнозировать, в какое место генома будет введен трансген. Поэтому идентификация фланкирующей геномной ДНК растения с обеих сторон вставки может иметь важное значение для идентификации растения, содержащего данный инсерционный трансформант. Например, могут быть созданы праймеры для ПЦР, образующие ампликон ПЦР в области соединения вставки с геномом хозяина. Такой ампликон ПЦР может быть использован для идентификации уникального или отличающегося типа инсерционного трансформанта.
В настоящем описании изобретения приведены определения терминов и примеры, способствующие пониманию настоящего изобретения и помогающие специалистам в данной области осуществить настоящее изобретение на практике. За исключением особо оговоренных случаев термины имеют значения, известные специалистам в данной области. Номенклатура оснований ДНК соответствует приведенной в разделе 37 Свода федеральных правил, §1.822.
В использованном здесь значении термин ”потомство” означает потомство любого поколения родительского растения, содержащего трансформант сои pDAB9582.814.19.1.
Трансгенный ”трансформант” получают путем трансформации растительных клеток гетерологичной ДНК, то есть конструкцией нуклеиновой кислоты, включающей представляющие интерес трансгены, регенерации популяции растений, полученной в результате инсерции указанного трансгена в геном растения, и отбора конкретного растения, характеризующегося наличием инсерции в определенном положении в геноме. Термин ”трансформант” относится к первичному трансформанту и потомству указанного трансформанта, включающему гетерологичную ДНК. Термин ”трансформант” также относится к потомству, полученному в результате ауткроссинга трансформанта с другим сортом, включающим геномную/трансгенную ДНК. Даже после повторного обратного скрещивания с родительской формой, с которой гибрид скрещивается вновь, введенная трансгенная ДНК и фланкирующая геномная ДНК (геномная/трансгенная ДНК) из трансформированной родительской формы присутствует в потомстве гибрида в том же положении в хромосоме. Термин ”трансформант” также относится к ДНК первичного трансформанта и его потомства, включающего введенную ДНК и фланкирующую геномную последовательность рядом с введенной ДНК, которые должны быть переданы потомству, включая представляющий интерес трансген, в результате скрещивания одной родительской формы, включающей введенную ДНК (например, первичный трансформант и потомство, полученное в результате самоопыления), с родительской формой, не содержащей введенную ДНК.
“Соединительная последовательность” или ”краевая последовательность” заполняет участок, на котором ДНК, введенная в геном, связывается с ДНК нативного генома сои, фланкирующей инсерционный участок, при этом для диагностики трансформанта достаточно идентифицировать или обнаружить одну или несколько соединительных последовательностей в генетическом материале растения. К таким последовательностям относятся последовательности ДНК, заполняющие места вставки трансформантов сои по настоящему изобретению, и фланкирующие ДНК одинаковой длины. В настоящем описании изобретения приведены конкретные примеры таких диагностических последовательностей; однако, другие последовательности, которые перекрывают места соединения инсерций или места соединения инсерций и геномной последовательности, также являются диагностическими и могут быть использованы в соответствии с настоящим изобретением.
Настоящее изобретение частично относится к идентификации таких фланкирующих, соединительных и вставочных последовательностей. В объем настоящего изобретения входят соответствующие праймеры и ампликоны ПЦР. В соответствии с настоящим изобретением для обнаружения или идентификации промышленных сортов трансгенной сои или линий, выделенных из линий трансгенной сои, являющихся частной собственностью, могут быть использованы методы ПЦР с применением ампликонов, расположенных рядом с введенной ДНК и ее краевыми последовательностями.
Фланкирующие/соединительные последовательности позволяют диагностировать трансформант сои pDAB9582.814.19.1. На основании указанных последовательностей были созданы трансформантеспецифические праймеры. Анализ методом ПЦР показал, что указанные линии сои можно идентифицировать в разных генотипах сои в результате анализа ампликонов ПЦР, образованных при использовании указанных наборов трансформантспецифических праймеров. Таким образом, вышеуказанные и другие родственные методы могут быть использованы для уникальной идентификации линий сои. Последовательности, идентифицированные в настоящем описании изобретения, являются уникальными.
Методы обнаружения по настоящему изобретению особенно полезны в сочетании с селекцией растений для определения потомства растений, включающего данный трансформант, который был получен после скрещивания родительского растения, включающего представляющий интерес трансформант, с другой линией растений с целью сообщения указанному потомству одного или нескольких дополнительных признаков. Указанные методы ПЦР позволяют эффективно разрабатывать программы селекции сои и контролировать качество, в частности, промышленных семян трансгенной сои. В настоящее время также могут быть созданы и использованы наборы для обнаружения методом ПЦР указанных линий трансгенной сои. Указанные методы также позволяют регистрировать и хранить продукты.
Кроме того, фланкирующие/геномные последовательности сои могут быть использованы для специфической идентификации положения каждой вставки в геноме. Такая информация может быть использована для создания систем молекулярных маркеров, специфичных к каждому трансформанту. Указанные последовательности могут быть использованы для ускоренной селекции и получения данных о сцеплении генов.
Информация о фланкирующих последовательностях может быть далее использованы для изучения и исследования процессов интеграции трансгенов, определения сайтов для интеграции трансгенов в геноме, сортировки трансформантов, определения устойчивости трансгенов и их фланкирующих последовательностей и экспрессии генов (особенно в отношении сайленсинга генов, паттернов метилирования трансгенов, влияния положения и возможных элементов, определяющих экспрессию, таких как MAR [области присоединения матрицы] и тому подобных).
В свете настоящего описания изобретения должно быть ясно, что в объем настоящего изобретения входят семена, депонированные в АТСС под номером, указанным в абзаце [0005]. Настоящее изобретение также относится к растению сои, устойчивому к гербицидам, выращенному из семени, депонированного в АТСС под номером, указанным в абзаце [0005]. Настоящее изобретение далее относится к частям указанного растения, таким как листья, образцы тканей, семена, произведенные указанным растением, пыльца и тому подобные (которые включают cry1F, cry1Ac, par и SEQ ID NO:1 и 2).
В использованном здесь значении термин ”соя” означает вид Glycine max и включает все сорта данного вида, которые могут быть получены путем селекции растения сои.
Молекулы ДНК по настоящему изобретению могут быть использованы в качестве молекулярных маркеров при осуществлении метода селекции с использованием маркеров (МАВ). Молекулы ДНК по настоящему изобретению (такие как маркеры AFLP, маркеры RFLP, маркеры RAPD, SNP и SSR) могут быть использованы в методах, позволяющих идентифицировать генетически связанные агрономически полезные признаки, известные в данной области. Признаки устойчивости к насекомым и гербицидам могут быть прослежены в потомстве гибрида растения сои по настоящему изобретению (или в его потомстве и в любом другом культиваре или сорте сои) с помощью методов МАВ. Молекулы ДНК являются маркерами данного признака, и методы МАВ, хорошо известные в данной области, могут быть использованы для отслеживания признака устойчивости к гербицидам в растениях сои, если по меньшей мере одна линия сои по настоящему изобретению или ее потомство было родителем или предком. Способы по настоящему изобретению могут быть использованы для идентификации любого сорта сои, имеющего трансформант по настоящему изобретению.
В использованном здесь значении термин ”линия” означает группу растений, характеризующихся незначительной или отсутствием наследственной изменчивости среди особей в отношении по меньшей мере одного признака. Такие линии могут быть созданы несколькими поколениями самоопыления и селекции или вегетативного размножения из одной родительной формы при помощи методов с использованием культур тканей или клеток.
В использованном здесь значении термины ”культивар” и “сорт” являются синонимами и означают линию, используемую для промышленного производства.
Термин ”устойчивость” или “устойчивый” применительно к определенному компоненту означает сохранение данного компонента из поколения в поколение, предпочтительно на протяжении по меньшей мере трех поколений.
Термин ”коммерческая полезность” означает хорошую мощность растения и высокую фертильность, благодаря которым фермеры могут выращивать данную сельскохозяйственную культуру с использованием обычных сельскохозяйственных машин и могут экстрагировать из семени масло с описанными компонентами при помощи обычного измельчающего и экстрагирующего оборудования.
Термин ”агрономически элитная” означает линию, которая обладает требуемыми агрономическими характеристиками, такими как урожайность, созревание, устойчивость к болезням и тому подобные, помимо устойчивости к насекомых и гербицидам, благодаря наличию одного или нескольких трансформантов по настоящему изобретению. Любые и все указанные агрономические характеристики и данные могут быть использованы для идентификации таких растений на основании одного признака, части диапазона или всего диапазона характеристик, используемых для определения таких растений.
Как должно быть понятно специалисту в данной области в свете настоящего описания изобретения, предпочтительные варианты наборов для обнаружения признаков по настоящему изобретению могут включать, например, зонды и/или праймеры, предназначенные для создания и/или включающие ”соединительные последовательности” или “переходные последовательности” (где геномная фланкирующая последовательность сои стыкуется с вставочной последовательностью). Например, данный набор включает полинуклеотидные зонды, праймеры и/или ампликоны, созданные для идентификации одной или обеих соединительных последовательностей (где вставка стыкуется с фланкирующей последовательностью), представленные в приведенной выше таблице. Одной общей особенностью такого набора является наличие одного праймера, гибридизирующего в фланкирующей области, и одного праймера, гибридизирующего в вставке. Такие праймеры часто имеют длину, равную по меньшей мере примерно ~15 остаткам. Указанные праймеры могут быть использованы для создания/амплификации обнаруживаемого ампликона, указывающего на наличие трансформанта по настоящему изобретению. Праймеры могут быть использованы для создания ампликона, заполняющего (и включающего) вышеуказанную соединительную последовательность.
Праймер, ”обеспечивающий соединение” в фланкирующей последовательности, обычно не гибридизирует на расстоянии более примерно 1200 оснований или за пределами соединения. Таким образом, типичные фланкирующие праймеры включают по меньшей мере 15 остатков цепи в пределах 1200 оснований фланкирующих последовательностей от начала вставки. То есть в объем настоящего изобретения входят праймеры, включающие последовательность соответствующей длины, состоящую из (или гибридизирующую с) пар оснований 800-1400 SEQ ID NO:14 и/или пар оснований 13897-14497 SEQ ID NO:14. Праймеры для вставки могут быть созданы аналогичным образом в любом месте вставки, но для создания таких праймеров могут быть также использованы пары оснований 1400-2000 SEQ ID NO:14 и/или пары оснований 13297-13896 SEQ ID NO:14.
Специалисту в данной области должно быть также известно, что праймеры и зонды могут быть созданы с возможностью гибридизации в стандартных условиях гибридизации и/или ПЦР, когда праймер или зонд не являются полностью комплементарными приведенной последовательности. То есть допустима некоторая степень ошибочного спаривания. Например, в праймере, состоящем примерно из 20 нуклеотидов, обычно один, два или около того нуклеотидов могут не связываться с противоположной цепью, если ошибочно спаренное основание находится внутри или у конца праймера, противоположного ампликону. Ниже приведены разные приемлемые условия гибридизации. В зондах также могут быть использованы синтетические аналоги нуклеотидов, такие как инозин. Также могут быть использованы пептидные зонды нуклеиновых кислот (PNA), а также ДНК- и РНК-зонды. Важно, чтобы такие зонды и праймеры позволяли диагностировать (однозначно идентифицировать и выявлять) наличие трансформанта по настоящему изобретению.
Следует отметить, что при амплификации методом ПЦР могут возникать ошибки, вызывающие, например, незначительные ошибки секвенирования. То есть, за исключением особо оговоренных случаев, последовательности, приведенные в настоящем описании изобретения, были определены в результате создания длинных ампликонов из геномных ДНК сои, после чего ампликоны клонировали и секвенировали. В последовательностях, созданных и определенных таким образом, вполне вероятно, могут быть обнаружены небольшие отличия и незначительные расхождения, связанные с многочисленными циклами амплификации, необходимыми для создания ампликона достаточной длины для секвенирования из геномных ДНК. Специалисту в данной области должно быть понятно, что в объем настоящего изобретения входят любые корректировки, необходимые в связи с возникновением обычных ошибок секвенирования или расхождений указанных типов.
Следует также отметить, что возможно удаление некоторой геномной последовательности, например, при введении последовательности в процессе создания трансформанта. Таким образом, фланкирующие последовательности по настоящему изобретению могут несколько отличаться от геномных последовательностей, представленных, например, в базе данных GENBANK.
Компоненты “вставки” последовательности ДНК показаны на фигурах и более подробно рассмотрены ниже в разделе ”Примеры”. Полинуклеотидные последовательности ДНК указанных компонентов или их фрагменты могут быть использованы в качестве ДНК-праймеров или зондов при осуществлении способов по настоящему изобретению.
Некоторые варианты осуществления изобретения относятся к способам обнаружения трансгена/инсерционной области генома в растениях, семенах и подобных частях растения сои, и композициям для осуществления указанных способов. Созданы последовательности ДНК, включающие 5'-концевую соединительную последовательность трансгена/инсерционной области генома по настоящему изобретению (между 800-1400 парами оснований SEQ ID NO:14), их сегменты, комплементы приведенных последовательностей и любые их сегменты. Созданы последовательности ДНК, включающие 3'-концевую соединительную последовательность трансгена/инсерционной области генома по настоящему изобретению (между 13897-14497 парами оснований SEQ ID NO:14), их сегменты, комплементы приведенных последовательностей и любые их сегменты. Соединительная последовательность инсерционной области заполняет место соединения между гетерологичной ДНК, введенной в геном, и ДНК из клетки сои, фланкирующей инсерционный сайт. Такие последовательности позволяют диагностировать данный трансформант.
На основании указанной вставки и краевых последовательностей могут быть созданы трансформантспецифические праймеры. Анализ методом ПЦР показал, что линии сои по настоящему изобретению могут быть идентифицированы в разных генотипах сои путем анализа ампликонов ПЦР, созданных с помощью наборов трансформантспецифических праймеров. Для идентификации линий сои по настоящему изобретению могут быть использованы вышеуказанные и другие родственные методы. Таким образом, ампликоны ПЦР, полученные из таких пар праймеров, являются уникальными и могут быть использованы для идентификации указанных линий сои.
Некоторые варианты осуществления изобретения относятся к последовательностям ДНК, включающим смежный фрагмент нового трансгена/инсерционной области генома. В объем настоящего изобретения входят последовательности ДНК, включающие полинуклеотиды вставочной последовательности трансгена достаточной длины и полинуклеотиды геномной последовательности сои достаточной длины, из одного или более чем из трех вышеуказанных растений сои, и/или последовательности, пригодные для использования в качестве последовательностей праймеров с целью получения ампликона, позволяющего диагностировать одно или несколько указанных растений сои.
Родственные варианты осуществления изобретения относятся к последовательностям ДНК, включающим по меньшей мере 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 или более смежных нуклеотидов части трансгена последовательности ДНК, идентифицированной в настоящем описании изобретения (такой как SEQ ID NO:1 и ее сегменты), или ее комплементов, и фланкирующей последовательности ДНК сои аналогичной длины из указанных последовательностей или их комплементов. Такие последовательности могут быть использованы в качестве ДНК-праймеров при осуществлении методов амплификации ДНК. Ампликоны, полученные с помощью указанных праймеров, позволяют диагностировать любые трансформанты сои по настоящему изобретению. Поэтому настоящее изобретение также относится к ампликонам, полученным с помощью таких ДНК-праймеров и гомологичных праймеров.
Настоящее изобретение также относится к способам обнаружения в образце ДНК, соответствующей трансформанту сои по настоящему изобретению. Такие способы могут включать: (а) приведение образца, включающего ДНК, в контакт с набором праймеров, которые при использовании в реакции амплификации нуклеиновой кислоты с ДНК по меньшей мере одного из указанных трансформантов сои, образуют ампликон, позволяющий диагностировать указанный трансформант; (b) выполнение реакции амплификации нуклеиновой кислоты с образованием ампликона; и (с) обнаружение полученного ампликона.
Другие способы обнаружения по настоящему изобретению включают способ обнаружения в образце ДНК, соответствующей указанному трансформанту, который включает: (а) приведение образца, включающего ДНК, в контакт с праймером, который гибридизирует в строгих условиях гибридизации с ДНК по меньшей мере одного из указанных трансформантов сои и не гибридизирует в строгих условиях гибридизации с ДНК контрольного растения сои (ДНК не представляющего интереса трансформанта); (b) гибридизацию образца и зонда в строгих условиях гибридизации; и (с) обнаружение гибридизации зонда с указанной ДНК.
Наборы для обнаружения ДНК могут быть созданы с использованием композиций по настоящему изобретению и методов, хорошо известных в области обнаружения ДНК. Указанные наборы могут быть использованы для идентификации ДНК трансформанта сои по настоящему изобретению в образце и в процессе селекции растений сои, содержащих указанную ДНК. Наборы включают последовательности ДНК, гомологичные или комплементарные ампликонам, рассмотренным в настоящем описании изобретения, или последовательности ДНК, гомологичные или комплементарные ДНК, содержащейся в генетических элементах трансгена трансформантов по настоящему изобретению. Указанные последовательности ДНК могут быть использованы при осуществлении реакций амплификации ДНК или в качестве зондов в процессе гибридизации ДНК. Наборы могут также содержать реагенты и вещества, необходимые для выполнения данного метода обнаружения.
Термин ”зонд” означает выделенную молекулу нуклеиновой кислоты, к которой присоединена стандартная детектируемая метка или репортерная молекула (такая как радиоактивный изотоп, лиганд, хемилюминесцентное вещество или фермент). Такой зонд является комплементарным цепи нуклеиновой кислоты-мишени в случае настоящего изобретения, цепи геномной ДНК одного из указанных трансформантов сои из растения сои или образца, включающего ДНК данного трансформанта. Зонды по настоящему изобретению включают не только дезоксирибонуклеиновые или рибонуклеиновые кислоты, но также полиамиды и другие вещества зонда, которые специфически связываются с последовательностью ДНК-мишени и могут быть использованы для обнаружения указанной последовательности ДНК-мишени.
Термин ”праймеры” означает выделенные/синтезированные нуклеиновые кислоты, которые гибридизированы с цепью комплементарной ДНК-мишени методом гибридизации нуклеиновых кислот с образованием гибрида между праймером и цепью ДНК-мишени и затем удлинены по цепи ДНК-мишени полимеразой, например, ДНК-полимеразой. Пары праймеров по настоящему изобретению используют для амплификации последовательности нуклеиновой кислоты-мишени, например, при помощи полимеразной цепной реакции (ПЦР) или других стандартных методов амплификации нуклеиновых кислот.
Зонды и праймеры обычно состоят из



или большего числа полинуклеотидов. Такие зонды и праймеры специфически гибридизируют с последовательностью-мишенью в строгих условиях гибридизации. Зонды и праймеры по настоящему изобретению предпочтительно обладают полным сходством последовательности с последовательностью-мишенью, хотя стандартными методами могут быть созданы зонды, отличающиеся от последовательности-мишени, но сохраняющие способность гибридизировать с последовательностями-мишенями.
Методы получения и использования зондов и праймеров описаны, например, в публикации Molecular Cloning: A Laboratory Manual, 2nd ed., vol. 1-3, ed. Sambrook et al., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1989. Пары праймеров для ПЦР могут быть выделены из известной последовательности, например, при помощи компьютерных программ, предназначенных для указанной цели.
Праймеры и зонды на основе фланкирующих последовательностей ДНК и вставочных последовательностей по настоящему изобретению могут быть использованы для подтверждения (и при необходимости для коррекции) рассмотренных последовательностей стандартными методами, например, методами повторного клонирования и секвенирования таких последовательностей.
Зонды и праймеры нуклеиновых кислот по настоящему изобретению гибридизируют в строгих условиях с последовательностью ДНК-мишени. Для идентификации ДНК из трансгенного трансформанта в образце могут быть использованы любые стандартные методы гибридизации или амплификации нуклеиновых кислот. Молекулы нуклеиновых кислот или их фрагменты могут специфически гибридизировать с другими молекулами нуклеиновых кислот в определенных условиях. Как указано в настоящем описании изобретения, две молекулы нуклеиновых кислот могут специфически гибридизировать друг с другом, если такие молекулы способны образовывать непараллельную двухцепочечную структуру нуклеиновой кислоты. Считается, что молекула нуклеиновой кислоты является ”комплементом” другой молекулы нуклеиновой кислоты, если указанные молекулы являются полностью комплементарными. Как указано в настоящем описании изобретения, молекулы являются ”полностью комплементарными”, если каждый нуклеотид одной молекулы комплементарен нуклеотиду другой молекулы. Две молекулы считаются ”минимально комплементарными”, если указанные молекулы способны гибридизировать друг с другом с достаточной степенью устойчивости для сохранения гибрида по меньшей мере в условиях пониженной строгости. Аналогичным образом молекулы считаются ”комплементарными”, если указанные молекулы способны гибридизировать друг с другом с достаточной степенью устойчивости для сохранения гибрида в стандартных строгих условиях. Стандартные строгие условия гибридизации описаны в публикации Sambrook et al., 1989. Отклонения от полной комплементарности допустимы, если такие отклонения полностью не аннулируют способность молекул образовывать двухцепочечную структуру. Молекула нуклеиновой кислоты, которая может быть использована в качестве праймера или зонда, должна иметь достаточно комплементарную последовательность, способную образовывать устойчивую двухцепочечную структуру при определенных концентрациях растворителя и соли.
В использованном здесь значении по существу гомологичная последовательность является последовательностью нуклеиновой кислоты, которая специфически гибридизирует с комплементом последовательности нуклеиновой кислоты, сравниваемой в строгих условиях гибридизации. Термин ”строгие условия” применительно к гибридизации зонда к нуклеиновой кислоте с нуклеиновой кислотой-мишенью (то есть с конкретной, представляющей интерес последовательностью нуклеиновой кислоты) методом специфической гибридизации описан в публикации Sambrook et al., 1989, стр. 9.52-9.55. См. также публикацию Sambrook et al., 1989, стр. 9.47-9.52 и 9.56-9.58. Таким образом, нуклеотидные последовательности по настоящему изобретению могут быть использованы благодаря их способности избирательно образовывать дуплексные молекулы с комплементарными участками фрагментов ДНК.
В зависимости от предполагаемого применения можно использовать разные условия гибридизации для достижения разных степеней избирательности зонда в отношении последовательности-мишени. Для применений, требующих высокой избирательности, обычно используют относительно строгие условия образования гибридов, например, могут быть выбраны условия, характеризующиеся относительно низкой концентрацией соли и/или высокой температурой, например, достигаемые при использовании от около 0,02 М до около 0,15 М NaCl при температуре от около 50°С до около 70°С. Строгие условия, например, могут включать по меньшей мере двукратную промывку фильтра для гибридизации строгим промывающим буфером (0,2-кратный объем SSC, 0,1% SDS, 65°С). Специалистам в данной области известны соответствующие строгие условия, стимулирующие гибридизацию ДНК, например, 6,0-кратный объем хлорида натрия/цитрата натрия (SSC) при температуре около 45°С с последующей промывкой 2,0-кратным объемом SSC при 50°С. Например, концентрация соли на стадии промывки может быть выбрана в диапазоне от условий пониженной строгости, включающих использование примерно 2,0-кратного объема SSC при 50°С, до строгих условий, включающих использование примерно 0,2-кратного объема SSC при 50°С. Кроме того, температура на стадии промывки может быть повышена от комнатной температуры, примерно 22°С, создаваемой в условиях пониженной строгости, до температуры около 65°С, применяемой в строгих условиях. Могут быть изменены как температура, так и концентрация соли, либо один из параметров, температура или концентрация соли, может оставаться постоянным при изменении другого параметра. Такие избирательные условия допускают незначительные, если вообще допускают, ошибочные спаривания между зондом и матрицей или цепью-мишенью. Специалистам в данной области хорошо известны методы обнаружения последовательностей ДНК путем гибридизации, и в качестве примера таких анализов методом гибридизации можно привести патенты США №№ 4965188 и 5176995.
В особенно предпочтительном варианте осуществления изобретения нуклеиновая кислота по настоящему изобретению специфически гибридизирует в строгих условиях с одним или несколькими праймерами (ампликонами или другими последовательностями), приведенными или предложенными в настоящем описании изобретения, включая их комплементы и фрагменты. В одном объекте настоящего изобретения маркерная молекула нуклеиновой кислоты по настоящему изобретению включает последовательность нуклеиновой кислоты, представленную в одной из приведенных последовательностей, ее комплементы и/или фрагменты.
В другом объекте настоящего изобретения маркерная молекула нуклеиновой кислоты по настоящему изобретению включает последовательность, которая идентична таким последовательностям нуклеиновых кислот на 80%-100% или 90%-100%. В еще одном объекте настоящего изобретения маркерная молекула нуклеиновой кислоты по настоящему изобретению идентична такой последовательности на 95%-100%. Такие последовательности могут быть использованы в качестве маркеров в процессе селекции растений для идентификации потомства генетических гибридов. Гибридизацию зонда с молекулой ДНК-мишени можно обнаружить разными методами, известными специалистам в данной области, которые включают, не ограничиваясь ими, флуоресцентные метки, радиоактивные метки, метки на основе антител и хемилюминесцентные метки.
В случае амплификации последовательности-мишени нуклеиновой кислоты (например, методом ПЦР) с использованием конкретной пары праймеров для амплификации ”строгие условия” представляют собой условия, в которых указанная пара праймеров гибридизирует только с последовательностью-мишенью нуклеиновой кислоты, с которой праймер, имеющий соответствующую последовательность дикого типа (или ее комплемент), должен связываться и предпочтительно продуцировать уникальный продукт амплификации, ампликон.
Термин ”специфичный к (последовательности-мишени)” означает, что зонд или праймер гибридизирует в строгих условиях гибридизации только с последовательностью-мишенью в образце, включающем такую последовательность-мишень.
В использованном здесь значении термин ”амплифицированная ДНК” или “ампликон” означает продукт амплификации нуклеиновой кислоты последовательности-мишени нуклеиновой кислоты, являющейся частью матрицы нуклеиновой кислоты. Например, для определения наличия в растении сои, полученном в результате полового скрещивания, геномной ДНК трансгенного трансформанта из растения сои по настоящему изобретению, ДНК, экстрагированная из образца ткани растения сои, может быть подвергнута амплификации нуклеиновой кислоты с использованием пары праймеров, из которых один праймер выделен из фланкирующей последовательности, локализованной в геноме растения рядом с инсерционным сайтом вставленной гетерологичной ДНК, и второй праймер выделен из вставленной гетерологичной ДНК, для продуцирования ампликона, позволяющего диагностировать наличие ДНК трансформанта. Трансформант также можно диагностировать на основании длины и последовательности ампликона. Длина ампликона может быть равна общей длине пар праймеров и одной пары нуклеотидных оснований и/или общей длине пар праймеров и примерно



или большему числу пар нуклеотидных оснований (плюс или минус любое число вышеуказанных приращений). Альтернативно пара праймеров может быть выделена из фланкирующей последовательности с обеих сторон вставленной ДНК с образованием ампликона, включающего всю нуклеотидную последовательность вставки. Один член пары праймеров, выделенной из геномной последовательности растения, может быть расположен на расстоянии от вставленной последовательности ДНК. Указанное расстояние может составлять от одной пары нуклеотидных оснований примерно до двадцати тысяч пар нуклеотидных оснований. В определение термина ”ампликон” входят димеры праймеров, которые могут быть образованы при выполнении термической реакции амплификации ДНК.
Нуклеиновая кислота может быть амплифицирована разными методами амплификации нуклеиновых кислот, известными в данной области, включая полимеразную цепную реакцию (ПЦР). В данной области известны разные методы амплификации, которые описаны, наряду с прочими публикациями, в патенте США № 4683195 и патенте США № 4683202. Методами ПЦР можно амплифицировать до 22 т.п.о. геномной ДНК. При осуществлении настоящего изобретения могут быть использованы указанные методы, а также другие методы амплификации ДНК, известные в данной области. Последовательность ДНК-вставки или фланкирующей геномной последовательности гетерологичного трансгена из трансформанта сои по настоящему изобретению может быть проверена (и при необходимости скорректирована) путем амплификации таких последовательностей трансформанта с помощью праймеров, выделенных из последовательностей по настоящему изобретению, стандартными методами секвенирования ДНК ампликона ПЦР или клонированной ДНК.
Ампликон, полученный указанными методами, может быть обнаружен разными методами. Электрофорез в агарозном геле и окрашивание бромидом этидия является общепринятым, хорошо известным методом обнаружения ампликонов ДНК. Другим таким методом является генетический двоичный анализ с использованием олигонуклеотида ДНК, перекрывающего смежную фланкирующую геномную последовательность ДНК и вставленную последовательность ДНК. Указанный олигонуклеотид иммобилизуют в лунках микропланшета. После ПЦР представляющей интерес области (с использованием одного праймера во вставленной последовательности и одного праймера в смежной фланкирующей геномной последовательности) одноцепочечный продукт ПЦР может быть гибридизирован с иммобилизованным олигонуклеотидом и использован в качестве матрицы для выполнения реакции удлинения на одно основание с использованием ДНК-полимеразы и меченых ddNTP, специфичных к предполагаемому следующему основанию. Считывание может быть произведено при помощи флуоресцентного анализа или ELISA. Сигнал указывает на наличие вставки/фланкирующей последовательности вследствие успешной амплификации, гибридизации и удлинения на одно основание.
Другим методом является метод пиросеквенирования, описанный в публикации Winge, Innov. Pharma. Tech. 00:18-24, 2000. При выполнении указанного метода создают олигонуклеотид, который перекрывает место соединения смежной геномной ДНК и вставленной ДНК. Олигонуклеотид гибридизируют с одноцепочечным продуктом ПЦР из представляющей интерес области (один праймер во вставленной последовательности и один праймер во фланкирующей геномной последовательности) и инкубируют в присутствии ДНК-полимеразы, АТР, сульфурилазы, люциферазы, апиразы, аденозин-5'-фосфосульфата и люциферина. Отдельно добавляют DNTP, в результате чего возникает световой сигнал, который измеряют. Световой сигнал свидетельствует о наличии вставки/фланкирующей последовательности трансгена вследствие успешной амплификации, гибридизации и удлинения на одно или несколько оснований.
Поляризация флуоресценции является еще одним методом, который может быть использован для обнаружения ампликона по настоящему изобретению. В соответствии с данным методом создают олигонуклеотид, который перекрывает место соединения геномной фланкирующей последовательности и вставленной ДНК. Олигонуклеотид гибридизируют с одноцепочечным продуктом ПЦР из представляющей интерес области (один праймер во вставленной ДНК и один праймер во фланкирующей геномной последовательности ДНК) и инкубируют в присутствии ДНК-полимеразы и меченного флуоресцентным красителем ddNTP. Удлинение на одно основание вызывает включение ddNTP. Такое включение можно измерить в виде изменения поляризации при помощи флуорометра. Изменение поляризации свидетельствует о наличии вставки/фланкирующей последовательности трансгена вследствие успешной амплификации, гибридизации и удлинения на одно основание.
TAQMAN (PE Applied Biosystems, Foster City, Calif.) является методом обнаружения и количественного определения наличия последовательности ДНК. В кратком изложении данный метод включает создание олигонуклеотидного зонда FRET, который перекрывает место соединения геномной фланкирующей и вставочной ДНК. Зонд FRET и праймеры для ПЦР (один праймер в последовательности вставочной ДНК и один праймер во фланкирующей геномной последовательности) подвергают циклической обработке в присутствии термостойкой полимеразы и dNTP. В процессе специфической амплификации taq полимераза ДНК отщепляется и высвобождает флуоресцентную часть из гасящей части зонда FRET. Флуоресцентный сигнал свидетельствует о наличии фланкирующей/вставочной последовательности трансгена вследствие успешной амплификации и гибридизации.
Для обнаружения последовательности был предложен метод молекулярных маяков. В кратком изложении данный метод включает создание олигонуклеотидного зонда FRET, который перекрывает место соединения фланкирующей геномной и вставочной ДНК. Уникальная структура зонда FRET позволяет получить вторичную структуру, содержащую флуоресцентную и гасящую части в непосредственной близости друг от друга. Зонд FRET и праймеры для ПЦР (один праймер в последовательности вставочной ДНК и один праймер во фланкирующей геномной последовательности) подвергают циклической обработке в присутствии термостойкой полимеразы и dNTP. После успешной амплификации методом ПЦР гибридизация зонда FRET с последовательностью-мишенью вызывает удаление вторичной структуры зонда и пространственное отделение флуоресцентной и гасящей частей. Возникает флуоресцентный сигнал. Флуоресцентный сигнал свидетельствует о наличии фланкирующей геномной/вставочной последовательности трансгена вследствие успешной амплификации и гибридизации.
Помимо рассмотренного положения в геноме сои, которое является наиболее подходящим для инсерции, настоящее изобретение также относится к семени сои и/или растению сои, включающему по меньшей мере одну вставку, отличную от трансформанта сои 9582.814.19.1, в непосредственной близости от данного положения в геноме. Один вариант осуществления изобретения относится к замене трансформанта pDAB9582.814.19.1, рассмотренного в настоящем описании изобретения, другой вставкой. Для указанной цели может быть использована, например, направленная гомологичная рекомбинация. Данный метод описан, например, в WO 03/080809 A2 и соответствующей опубликованной заявке на патент США (US 20030232410). Таким образом, настоящее изобретение относится к растениям и растительным клеткам, включающим гетерологичную вставку (вместо или вместе с несколькими копиями генов cry1F, cry1Ac или pat), фланкированную полными фланкирующими последовательностями или узнаваемыми частями фланкирующих последовательностей по настоящему изобретению (пары оснований 1-1400 SEQ ID NO:1 и пары оснований 153-1550 SEQ ID NO:2). Подобным образом может быть использована для вставки дополнительная копия (или дополнительные копии) генов cry1F, cry1Ac или pat.
Все патенты, заявки на патент, предварительные заявки и публикации, приведенные в настоящем изобретении, полностью включены в настоящее описание изобретения в качестве ссылки в той мере, в какой они соответствуют положениям настоящего изобретения.
Приведенные ниже примеры иллюстрируют способы осуществления изобретения и демонстрируют определенные предпочтительные варианты осуществления изобретения. Указанные примеры не ограничивают объем изобретения. Специалистам в данной области должно быть понятно, что методы, описанные в нижеследующих примерах, представляют определенные подходы, используемые для иллюстрации предпочтительных вариантов осуществления изобретения. Однако специалистам в данной области должно быть понятно в свете настоящего описания изобретения, что в конкретные варианты осуществления изобретения могут быть внесены многие изменения, позволяющие получить аналогичные или подобные результаты, не выходя за пределы существа и объема изобретения. За исключением особо оговоренных случаев все проценты являются массовыми процентами и соотношения смесей растворителей являются объемными соотношениями.
За исключением особо оговоренных случаев в настоящем описании изобретения использованы следующие аббревиатуры.
Варианты осуществления настоящего изобретения представлены в следующих примерах. Следует отметить, что указанные примеры приведены только в целях иллюстрации. На основании приведенного выше описания изобретения и примеров специалист в данной области может ознакомиться с основными характеристиками настоящего изобретения и, не выходя за пределы существа и объема изобретения, внести разные изменения и модификации в варианты осуществления изобретения, позволяющие адаптировать изобретение к разным применениям и условиям реализации. Таким образом, специалистам в данной области, помимо вышеописанных вариантов осуществления изобретения, должны быть очевидны многие другие модификации вариантов осуществления изобретения. Такие модификации также входят в объем прилагаемой формулы изобретения.
Все публикации, приведенные в настоящем изобретении, полностью включены в настоящее описание изобретения в качестве ссылки.
Примеры
Пример 1. Трансформация и отбор трансформанта сои pDAB9582.814.19.1, включающего Cry1F и Cry1Ac
Трансгенная соя (Glycine max), содержащая трансформант pDAB9582.814.19.1, была создана в результате опосредованной Agrobacterium трансформации эксплантатов семядольного узла сои. Для инициации трансформации был использован штамм Agrobacterium EHA101 без плеча хромосомы (Hood et al., 1993), содержащий двойной вектор pDAB9582 (фиг. 1) с селектируемым маркером pat v6 и представляющими интерес генами cry1F v3 и cry1Ac в области Т-цепи ДНК. Последовательность ДНК для вектора pDAB9582 приведена в SEQ ID NO:3, которая представлена в таблице 1.
Опосредованная Agrobacterium трансформация была выполнена при помощи модифицированного метода, описанного в публикации Zeng et al. (2004). Семена сои (сорта Maverick) проращивали на базальной среде, семядольные узлы удаляли и инфицировали Agrobacterium. В среду для образования ростков, удлинения ростков и укоренения добавляли цефотаксим, тиментин и ванкомицин для удаления Agrobacterium. Для ингибирования роста нетрансформированных ростков использовали глюфозинат. Отобранные ростки переносили в среду для укоренения, обеспечивающую развитие корневой системы, и затем переносили в почвенную смесь для акклиматизации ростков.
Верхушечные листья отобранных ростков окрашивали глюфозинатом для скрининга предполагаемых трансформантов. Исследованные ростки переносили в теплицу, оставляли для акклиматизации и окрашивали листья глюфозинатом для подтверждения устойчивости и выявления предполагаемых трарнсформантов. Брали образцы исследованных растений и выполняли молекулярные анализы для подтверждения наличия гена селектируемого маркера и/или представляющего интерес гена. Растения Т0 оставляли в теплице для самоопыления, в результате чего было получено семя Т1.
Трансформант сои pDAB9582.814.19.1 был получено из независимого трансформированного изолята. Растения Т1 подвергали обратному скрещиванию и использовали для интрогрессии в элитные сорта в последующих поколениях. Данный трансформант был отобран на основании уникальных характеристик, таких как один инсерционный сайт, нормальное менделевское расщепления, устойчивая экспрессия и великолепная комбинация эффективности, включающая устойчивость к гербицидам и агрономическую продуктивность. В нижеследующих примерах представлены данные, которые были использованы для исследования трансформанта сои pDAB9582.814.19.1.
Пример 2. Исследование экспрессии белка в трансформанте сои pDAB9582.814.19.1
Были исследованы биохимические свойства рекомбинантных белков Cry1F, Cry1Ac и PAT, экспрессированных в трансформантах сои 9582.814.19.1. Количественный твердофазный иммуноферментный анализ (ELISA) является биохимическим анализом, известным в данной области, который может быть использован для исследования биохимических свойств белков и подтверждения экспрессии указанных белков в трансформанте сои 9582.814.19.1.
Пример 2.1. Экспрессия белков РАТ, Cry1F и Crey1Ac в тканях растений
Из исследуемых растений выделяли образцы тканей сои, которые использовали при выполнении анализа экспрессии. Белок РАТ был экстрагирован из тканей растения сои при помощи физиологического раствора с фосфатным буфером, который содержал детергент твин-20 (PBST), включающий 0,5% бычьего сывороточного альбумина (BSA). Ткань растения центрифугировали; водный супернатант собирали, при необходимости разбавляли соответствующим буфером и анализировали при помощи набора ELISA для белка РАТ в виде сэндвича. Указанный набор был использован в соответствии с протоколом, предложенным производителем (Envirologix, Portland, ME). В результате выполнения данного анализа было измерено содержание экспрессированного белка РАТ.
Белок Cry1F был экстрагирован из тканей растения сои при помощи физиологического раствора с фосфатным буфером, который содержал детергент твин-20 (PBST). Ткань растения центрифугировали; водный супернатант собирали, при необходимости разбавляли соответствующим буфером и анализировали при помощи набора ELISA для белка Cry1F в виде сэндвича. Указанный набор был использован в соответствии с протоколом, предложенным производителем (Strategic Diagnostics Inc., Newark, DE). В результате выполнения данного анализа было измерено содержание экспрессированного белка Cry1F.
Белок Cry1Ac был экстрагирован из тканей растения сои при помощи физиологического раствора с фосфатным буфером, который содержал детергент твин-20 (PBST), включающий 0,5% бычьего сывороточного альбумина (BSA). Ткань растения центрифугировали; водный супернатант собирали, при необходимости разбавляли соответствующим буфером и анализировали при помощи набора ELISA для белка Cry1Ac в виде сэндвича. Указанный набор был использован в соответствии с протоколом, предложенным производителем (Strategic Diagnostics Inc., Newark, DE). В результате выполнения данного анализа было измерено содержание экспрессированного белка Cry1Ac.
Детектирующий анализ выполняли для исследования устойчивости экспрессии и наследуемости трансформанта сои pDAB9582.814.19.1 как по вертикали (между поколениями), так и по горизонтали (между линиями в одном поколении).
Пример 2.2. Экспрессия белков Cry1F, Cry1Ac и Pat в тканях растений
В трансформанте сои 9582.814.19.1 были определены уровни белков Cry1F, Cry1Ac и РАТ. Растворимые экстрагируемые белки, выделенные из ткани листа сои, измеряли при помощи количественного твердофазного иммуноферментного анализа (ELISA). В поколениях с Т2 до Т6 экспрессия трансформанта 9582.814.19.1 была устойчивой (без расщепления) и сопоставимой во всех линиях. В таблице 2 приведен средний уровень экспрессии трансгенных белков в трансформанте сои 9582.814.19.1.
Пример 3. Клонирование и исследование последовательности ДНК в вставке и фланкирующих краевых областях трансформанта сои pDAB9582.814.19.1
Для исследования и описания инсерционного сайта геномной ДНК была определена последовательность фланкирующих краевых областей геномной Т-ДНК трансформанта сои pDAB9582.814.19.1. Было установлено, что геномная последовательность трансформанта сои pDAB9582.814.19.1 содержит 1400 п.о. 5'-концевой фланкирующей краевой последовательности (SEQ ID NO:1) и 1398 п.о. 3'-концевой фланкирующей краевой последовательности (SEQ ID NO:2). Амплификация методом ПЦР на основании краевых последовательностей трансформанта сои pDAB9582.814.19.1 показала, что краевые области принадлежат сое и соединительные области представляют собой уникальные последовательности трансформанта сои pDAB9582.814.19.1. Соединительные области могут быть использованы для трансформантспецифической идентификации трансформанта сои pDAB9582.814.19.1. Также был исследован инсерционный сайт Т-цепи путем амплификации геномного фрагмента, соответствующего области идентифицированных фланкирующих краевых последовательностей из генома нетрансформированной сои. Сравнение трансформанта сои pDAB9582.814.19.1 с нетрансформированной геномной последовательностью показало, что в процессе интеграции Т-цепи из исходного локуса было удалено примерно 57 п.о. Исследование вставки и краевой последовательности трансформанта сои pDAB9582.814.19.1 показало, что в геноме сои присутствует интактная копия Т-цепи из pDAB9582.
Пример 3.1. Подтверждение геномных последовательностей сои
5'- и 3'-фланкирующие краевые последовательности сравнивали с полной непроцессированной геномной последовательностью Glycine max из хромосомы 02, в результате чего было установлено, что трансген трансформанта сои pDAB9582.814.19.1 вставлен в хромосому 02 генома сои. Для подтверждения инсерционного сайта трансформанта сои pDAB9582.814.19.1 в геноме сои была выполнена ПЦР с использованием разных пар праймеров (фиг. 2, таблица 3, таблица 4 и таблица 5). Геномная ДНК из трансформанта сои pDAB9582.814.19.1 и других трансгенных или нетрансгенных линий сои была использована в качестве матрицы. Для подтверждения правильности 5'-концевых краевых последовательностей был создан праймер, связывающийся с генным элементом промотора AtUbi10, таким как, например, AtUbi10RV1, и праймер, связывающийся с клонированной 5'-концевой краевой последовательностью в хромосоме 02 генома сои, определяемая как 81419_FW3, которые были использованы для амплификации сегмента ДНК в положении от генного элемента промотора AtUbi10 до 5'-концевой краевой последовательности. Аналогичным образом для подтверждения клонированной 3'-концевой краевой последовательности был создан специфический праймер pat, например, 3' PATEnd05, и три праймера, соответствующие клонированной 3'-концевой краевой последовательности, определяемые как 81419_RV1, 81419_RV2 и 81419_RV3, которые были использованы для амплификации сегментов ДНК от гена pat до 3'-концевой краевой последовательности. Фрагменты ДНК предполагаемого размера были амплифицировали только из геномной ДНК трансформанта сои pDAB9582.814.19.1 при использовании каждой пары праймеров и не были амплифицированы из образцов ДНК других линий трансгенной сои или нетрансгенного контрольного образца. Полученные результаты показывают, что клонированные 5'- и 3'-концевые краевые последовательности являются фланкирующими краевыми последовательностями вставки трансформанта сои pDAB9582.814.19.1 в Т-цепи.
Для дальнейшего подтверждения инсерции ДНК в геном сои методом ПЦР амплифицировали краевые последовательности сои в геномной ДНК, в которых отсутствовала вставка трансформанта сои pDAB9582.814.19.1 в Т-цепи. Для амплификации сегментов ДНК, содержащих локус со встроенной Т-цепью pDAB9582, был создан праймер 81419_FW3, соответствующий 5'-концевой краевой последовательности, и один праймер 81419-RV3, предназначенный для 3'-концевой краевой последовательности. Как и ожидалось, в результате амплификации методом ПЦР пара праймеров 81419_FW3 и 81419_RV3 позволили получить фрагмент ДНК длиной примерно 1,5 т.п.о. во всех других контрольных линиях сои за исключением pDAB9582.814.19.1. Сравнение идентифицированных 5'-и 3'-концевых краевых последовательностей трансформанта сои pDAB9582.814.19.1 с полной непроцессированной геномной последовательностью Glycine max из хромосомы 02 выявило делецию из исходного локуса примерно 57 п.о. (фиг. 3). Полученные результаты показали, что трансген трансформанта сои pDAB8294 был введен в сайт хромосомы 02 генома сои.
Пример 4. Исследование трансформанта сои pDAB9582.814.19.1 методом саузерн-блоттинга
Анализ методом саузерн-блоттинга был выполнен для определения паттерна интеграции трансформанта сои pDAB9582.814.19.1. В результате выполненных экспериментов были получены данные, свидетельствующие об интеграции и целостности трансгенов cry1Ac и cry1F в геноме сои. Трансформант сои pDAB9582.814.19.1 представляло собой полный, простой интеграционный трансформант, содержащий одну копию PTU cry1Ac и cry1F из плазмиды pDAB9582.
Данные, полученные в результате выполнения сайзерн-блоттинга, показали, что в геном трансформанта сои pDAB9582.814.19.1 был введен фрагмент Т-цепи. Детальный анализ методом саузерн-блоттинга был выполнен с использованием зондов, специфичных к генам cry1Ac и cry1F, находившимся в области интеграции трансформанта pDAB9582.814.19.1 в Т-цепи, и дескриптивных рестрикционных ферментов, имеющих сайты расщепления в плазмиде и продуцирующих гибридизирующие фрагменты внутри плазмиды или фрагменты, заполняющие место соединения плазмиды с геномной ДНК сои (краевые фрагменты). Молекулярные массы, установленные в результате гибридизации методом саузерн-блоттинга для комбинации рестрикционного фермента и зонда, были уникальными для данного трансформанта и определяли его идентифицирующие паттерны. Указанные анализы также показали, что фрагмент плазмиды был введен в геномную ДНК сои без реаранжировки PTU cry1Ac и cry1F.
Пример 4.1. Получение образца листьев сои и выделение геномной ДНК (гДНК)
Геномную ДНК экстрагировали из ткани листьев отдельных растений сои, содержащих трансформант pDAB9582.814.19.1. Кроме того, гДНК была выделена из стандартного растения сои сорта Maverick, генетический фон которого типичен для данной линии с отсутствием генов cry1Ac и cry1F. Геномную ДНК экстрагировали из лиофилизованной ткани листьев стандартным методом СТАВ (Sambrook et al. (1989)). Экстрагированную ДНК подвергали количественному спектрофлуорометрическому анализу, используя реагент Pico Green (Invitrogen, Carlsbad, CA). Затем ДНК визуализировали на агарозном геле для подтверждения результатов анализа с использованием реагента Pico Green и определения качества ДНК.
Пример 4.2. Расщепление и выделение ДНК
Для молекулярного исследования трансформанта сои pDAB9582.814.19.1 методом саузерн-блоттинга расщепляли десять микрограммов (10 мкг) геномной ДНК. Геномную ДНК из трансформанта сои pDAB9582.814.19.1 и линии нетрансгенной сои сорта Maverick расщепляли, добавляя к каждому образцу ДНК примерно пять единиц выбранного рестрикционного фермена на один мкг ДНК и соответствующий реакционный буфер. Каждый образец инкубировали в течение ночи примерно при 37°С. Для отдельных расщеплений использовали рестрикционные ферменты AseI, HindIII, NsiI и NdeI (New England Biolabs, Ipswich, MA). Для двойного расщепления одновременно использовали рестрикционные ферменты NotI и ApaL1 (New Englsnd Biolabs, Ipswich, MA). Кроме того, был получен положительный контрольный гибридизированный образец путем объединения плазмидной ДНК, pDAB9582, с геномной ДНК нетрансгенной сои сорта Maverick. Смесь плазмидной ДНК/геномной ДНК расщепляли такими же методами с использованием такого же рестрикционного фермента, что и экспериментальные образцы.
Расщепленную ДНК инкубировали в течение ночи, добавляли 25 мкл раствора QUICK-PRECIP PLUS (Edge Biosystems, Gaithersburg, MD), после чего образцы расщепленной ДНК осаждали изопропанолом. Осажденную ДНК ресуспендировали в 15 мкл 1-кратного заполняющего буфера (0,01% бромфенолового синего, 10,0 мМ EDTA, 10,0% глицерина, 1,0 мМ трис-буфера, рН 7,5). Образцы ДНК и маркеры молекулярной массы подвергали электрофорезу в 0,85% агарозном геле, используя 0,4-кратный буфер ТАЕ (Fisher Scientific, Pittsburg, PA), под напряжением 35 вольт в течение примерно 18-22 часов для отделения фрагмента. Гели окрашивали бромидом этидия (Invitrogen, Carlsbad, CA) и ДНК визуализировали в ультрафиолетовом (УФ) свете.
Пример 4.3. Перенос методом саузерн-блоттинга и обработка мембраны
Анализ методом саузерн-блоттинга выполняли в соответствии с описанием, приведенным в публикации Memelink, et al. (1994). После отделения методом электрофореза и визуализации фрагментов ДНК гели депуринизировали 0,25 М HCl в течение примерно 20 минут, погружали в денатурирующий раствор (0,4 М NaOH, 1,5 М NaCl) примерно на 30 минут и затем переносили в нейтрализующий раствор (1,5 М NaCl, 0,5 М трис-буфера, рН 7,5) по меньшей мере на 30 минут. Перенос методом сайзерн-блоттинга на нейлоновые мембраны выполняли в течение ночи, используя систему тампонов с 10-кратным раствором SSC. Перенесенную ДНК связывали с мембраной путем перекрестного связывания под воздействием УФ-света, после чего мембрану быстро промывали 2-кратным раствором SSC. В результате выполнения саузерн-блоттинга были получены мембраны, готовые для гибридизации.
Пример 4.4. Мечение ДНК-зонда и гибридизация
Фрагменты ДНК, связанные с нейлоновой мембраной, обнаруживали при помощи меченого зонда (таблица 6). Зонды были получены в результате включения методом ПЦР нуклеотида, меченного дигоксигенином (DIG), [DIG-11]-dUTP, во фрагмент ДНК, амплифицированный из плазмиды pDAB9582 с помощью праймеров, специфичных к генным элементам. ДНК-зонды были созданы путем синтеза методом ПЦР с использованием набора для синтеза DIG-меченных зондов методом ПЦР (Roche Diagnostics, Indianapolis, IN) в соответствии с рекомендациями производителя.
Меченые зонды анализировали при помощи электрофореза в агарозном геле для определения их качества и количества. Затем требуемое количество меченого зонда использовали для гибридизации с ДНК-мишенью на нейлоновых мембранах с целью обнаружения конкретных фрагментов методами, описанными для раствора, предназначенного для простой гибридизации с помощью DIG (DIG EASY HYB SOLUTION, Roche Diagnostics, Indianapolis, IN). Блоты нейлоновых мембран, содержащие фиксированную ДНК, быстро промывали 2-кратным раствором SSC и предварительно гибридизировали с 20-25 мл предварительно нагретого раствора DIG EASY HYB SOLUTION в флаконах для гибридизации в течение примерно 2 часов при температуре около 45-55°С в гибридизирующей печи. Раствор для предварительной гибридизации затем декантировали и заменяли ~15 мл предварительно нагретого раствора DIG EASY HYB SOLUTION, содержащего требуемое количество специфических зондов, денатурированных путем кипячения на водяной бане в течение примерно пяти минут. Стадию гибридизации затем выполняли в течение ночи при температуре около 45-55°С в гибридизирующей печи.
В конце гибридизации зондов растворы DIG EASY HYB SOLUTION, содержащие зонды, декантировали в чистые пробирки и хранили при температуре около -20°С. Указанные зонды могут быть использованы дважды в соответствии с рекомендациями производителя. Мембранные блоты быстро споласкивали и дважды промывали в чистых пластиковых емкостях промывочным буфером в условиях пониженной строгости (2-кратный объем SSC, 0,1% SDS) в течение примерно пяти минут при комнатной температуре и затем дважды промывали промывочным буфером в строгих условиях (0,1-кратный объем SSC, 0,1% SDS) в течение 15 минут при температуре около 65°С. Мембранные блоты быстро промывали 1-кратным буфером с малеиновой кислотой из набора промывочных и блокирующих буфером DIG (Roche Diagnostics, Indianapolis, IN) в течение примерно 5 минут. Затем производили промывку 1-кратным блокирующим буфером в течение 2 часов и инкубировали с антителом против DIG-AP (щелочная фосфатаза) (Roche Diagnostics, Indianapolis, IN) в 1-кратном блокирующем буфере также в течение минимум 30 минут. После 2-3 промывок 1-кратным промывочным буфером специфические ДНК-зонды оставались связанными с мембранными блотами, после чего DIG-меченную эталонную ДНК визуализироовали при помощи хемилюминесцентной системы обнаружения нуклеиновой кислоты CDP-STAR (Roche Diagnostics, Indianapolis, IN) в соответствии с рекомендациями производителя. Блоты подвергали воздействию хемилюминесцентной пленки в течение одного или нескольких раз для обнаружения гибридизирующих фрагментов и визуализации молекулярных эталонов. Пленки проявляли в проявителе пленок ALL-PRO 100 PLUS (Konica Minolta, Osaka, Japan) и полученные изображения сканировали. Для каждого зонда регистрировали число и размеры обнаруженных полос. DIG-меченный маркер II молекулярной массы ДНК (DIG MWM II) и DIG-меченный маркер VII молекулярной массы ДНК (DIG MWM VII), видимые после обнаружения DIG вышеописанным методом, были использованы для определения размера гибридизирующих фрагментов на саузерн-блотах.
Пример 4.5. Результаты анализа методом саузерн-блоттинга
В таблице 7 приведены размеры предполагаемых фрагментов и фрагментов, полученных для определенного гидролизата и зонда на основании известных сайтов рестрикционных ферментов PTU cry1Ac и cry1F. В результате указанных расщеплений и гибридизаций были идентифицированы фрагменты двух типов: внутренние фрагменты, где известные сайты ферментов фланкируют область зонда и полностью находятся в инсерционной области PTU cry1Ac и cry1F, и краевые фрагменты, где известный сайт фермента локализован у одного конца области зонда и второй сайт находится в геноме сои. Размеры краевых фрагментов изменяются в зависимости от трансформанта, так как в большинстве случаев сайты интеграции фрагментов ДНК являются уникальными для каждого трансформанта. Краевые фрагменты представляют собой средство локализации сайта рестрикционного фермента по отношению к интегрированной ДНК и определения числа инсерций ДНК. Анализы методов саузерн-блоттинга, выполненные в нескольких поколениях сои, содержащей трансформант pDAB9582.814.19.1, позволили получить данные, из которых следует, что в геном трансформанта сои pDAB9582.814.19.1 была введена малокопийная интактная PTU cry1Ac и cry1F из плазмиды pDAB9582.
Рестрикционные ферменты AseI и NsiI связываются с уникальными сайтами рестрикции и расщепляют их в плазмиде pDAB9582. Поэтому указанные ферменты были выбраны для исследования вставки гена cry1Ac в трансформанте сои pDAB9582.814.19.1. Было предположено, что краевые фрагменты >7286 п.о. или >9479 п.о. должны гибридизировать с зондом после расщепления ферментами AseI и NsiI (таблица 7). Отдельные полосы гибридизации cry1Ac около 7400 п.о. и >10000 п.о. были обнаружены при использовании соответственно AseI и NsiI. Гибридизация зонда с полосами указанного размера позволяет предположить наличие одного сайта инсерции для гена cry1Ac в геноме трансформанта сои pDAB9582.814.19.1. Рестрикционные ферменты NotI и ApaLI были выбраны для двойного расщепления и высвобождения фрагмента, содержащего транскрипционную единицу растения cry1Ac (PTU, промотор/ген/терминатор) (таблица 7). Прогнозированные фрагменты длиной 4550 п.о. были обнаружены при помощи зонда после двойного расщепления ферментами NotI и ApaLI. Результаты, полученные при расщеплении ферментами образцов pDAB9582.814.19.1 с последующей гибридизацией с зондом, показали, что в геном трансформанта сои pDAB9582.814.19.1 была введена интактная PTU cry1Ac из плазмиды pDAB9582.
Рестрикционные ферменты NdeI и NsiI связываются с сайтами рестрикции и расщепляют их в плазмиде pDAB9582. Поэтому указанные ферменты были выбраны для исследования вставки гена cry1F в трансформант сои pDAB9582.814.19.1. Было предположено, что краевые фрагменты >5569 п.о. и >9479 п.о. должны гибридизировать с зондом после расщепления ферментами NdeI и NsiI (таблица 7). Отдельные полосы гибридизации cry1F ~7500 п.о. и >10000 п.о. были обнаружены при использовании соответственно NdeI и NsiI. Гибридизация зонда с полосами указанного размера позволяет предположить наличие одного сайта инсерции для гена cry1F в геноме трансформанта сои pDAB9582.814.19.1. Рестрикционный фермент HindIII был выбран для высвобождения фрагмента, содержащего транскрипционную единицу растения cry1F (PTU, промотор/ген/терминатор) (таблица 7). Прогнозированный фрагмент длиной 7732 п.о. был обнаружен при помощи зонда после расщепления ферментом HindIII. Результаты, полученные при расщеплении ферментами образцов pDAB9582.814.19.1 с последующей гибридизацией с зондом, показали, что в геном трансформанта сои pDAB9582.814.19.1 была введена интактная PTU cry1F из плазмиды pDAB9582.
Пример 4.6. Отсутствие остовных последовательностей
Анализ методом саузерн-блоттинга был также выполнен для проверки отсутствия гена устойчивости к спектиномицину (specR), элемента OriRep и белка инициации репликации trfA (элемент trf A) в трансформанте сои pDAB9582.814.19.1. Предполагалось отсутствие специфической гибридизации с геном устойчивости к спектиномицину, элементом OriRep или элементом trfA при выполнении анализа методом саузерн-блоттинг положительного контрольного образца (pDAB9582, введенный в геномную ДНК сорта Maverick) и отрицательного контрольного образца (геномная ДНК сорта Maverick). После расщепления ферментом NsiI и гибридизации с зондом, специфичным к specR, в положительном контрольном образце (pDAB9582, введенный в геномную ДНК сорта Maverick) была обнаружена одна полоса предполагаемого размера, равная 15320 п.о. Зонд к specR не гибридизировал с отрицательным контрольным образцом и образцом, содержащим трансформант сои pDAB9582.814.19.1. Аналогичным образом после расщепления ферментом NsiI и гибридизации с зондом trfA в положительном контрольном образце (сорт Maverick, содержащий pDAB959582) была обнаружена одна полоса предполагаемого размера, равная 15320 п.о., которая отсутствовала в отрицательном контрольном образце и образце, содержащем трансформант сои pDAB9582.814.19.1. После расщепления ферментом NdeI и гибридизации с зондом, специфичным к OriRep, в положительном контрольном образце (pDAB9582, введенный в геномную ДНК сорта Maverick) была обнаружена другая полоса предполагаемого размера, равная 5329 п.о., которая отсутствовала в отрицательном контрольном образце и образце, содержащем трансформант сои pDAB9582.814.19.1,. Полученные данные свидетельствуют об отсутствии гена устойчивости к спектиномицину, элемента OriRep и белка инициации репликациим trfA в трансформант сои pDAB9582.814.19.1.
Пример 5. Агрономические и полевые испытания и определение устойчивости к гербицидам
Для исследования агрономических характеристик и эффективности трансформанта сои pDAB9582.814.19.1 семена, содержащие указанный трансформант, были посеяны на участке, предназначенном для испытания эффективности, в Санта-Изабель, Пуэрто-Рико, в октябре 2010 г. и феврале 2011 г. Культивар Maverick, трансформированный с возможностью продуцирования трансформанта pDAB9582.814.19.1, был посеян в каждом питомнике и использован в качестве контрольного образца в указанных экспериментах. Семя для питомника Т3 было получено в результате селекции одного растения на стадии Т2, и семя для питомника Т4 было получено в результате селекции одного растения на стадии Т3. В каждом поколении было испытано четыре линии трансформанта. Каждую линию высевали на опытном участке шириной в 4 ряда и длиной 229 см (7,5 фута). Расстояние между рядами было равно 75 см (30 дюймов). Участки получали дополнительное освещение в течение примерно 2,5 недели для компенсации короткого светового дня в Пуэрто-Рико. Каждый участок опрыскивали глюфозинатом при норме 411 г эквивалента кислоты/га. Один участок с контрольными растениями сорта Maverick опрыскивали таким же количеством глюфозината, второй участок не опрыскивали и использовали в качестве контрольного участка для сравнения с трансформантом по настоящему изобретению.
Были получены данные по всхожести, внешнему виду, мощности, высоте, полеганию и созреванию. Устойчивость к гербициду оценивали визуально в отношении хлороза, некроза листьев и гибели растений (таблица 8).
Для сравнения трансформанта сои pDAB9582.814.19.1 с сортом Maverick использовали только данные, полученные для сорта Maverick, не опрыскиваемого гербицидом. Для сравнения опрыскиваемых и неопрыскиваемых участков использовали данные, полученные для трансформанта сои pDAB9582.814.19.1, опрыскиваемого указанным гербицидом, которые сравнивали с данными, полученными для неопрыскиваемого контрольного участка, на котором была посеяна соя сорта Maverick. Трансформант сои pDAB9582.814.19.1 характеризовалсся устойчивостью к гербициду глюфозинату. В отличие от этого растения сорта Maverick не были устойчивы к воздействию указанного гербицида.
(%)
(от 1 = плохой до 9 = хороший)
Пример 6. Исследование инсектицидной активности трансформанта сои pDAB9582.814.19.1
Активность Cry1Ac и Cry1F в трансформанте сои pDAB9582.814.19.1 исследовали в полевых условиях и теплице против выведенных в лаборатории вредителей сои, включающих Anticarsia gemmatalis (гусеницы бархатного боба), Pseudoplusia includens (пяденица соевая) и Spodoptera frugiperda (совка травяная). Трансформант сои pDAB9582.814.19.1 сравнивали с нетрансформированной соей сорта Maverick для определения степени защиты растений, обеспечиваемой белками Cry1F и Cry1Ac.
В теплице исследовали растения в возрасте примерно четырех недель. Для оценки трансформанта сои pDAB9582.814.19.1 и контрольной сои сорта Maverick были использованы пятнадцать растений. Для каждого испытуемого вида насекомых (Anticarsia gemmatalis, Pseudoplusia includens и Spodoptera frugiperda) с каждого растения было срезано по 3 листа, в результате чего со всех растений было получено в общей сложности 45 листовых дисков для каждого вида насекомых. Листовые диски размером 1,4 см (1,54 см2) помещали поверх 2% водного агара, заражали одной новорожденной личинкой и закрывали перфорированной пластиковой крышкой. Гибель личинок и количество съеденного листа оценивали через 4 дня после заражения. Личинки, которые не реагировали на осторожное прикосновение щупом, считались мертвыми. Повреждение листьев определяли путем визуальной оценки съеденной насекомым части листового диска в процентном выражении.
Для оценки растений, произраставших в полевых условиях, собирали образцы листьев с растений, выращенных из семян на опытных участках в Санта-Изабель, Пуэрто-Рико, и отправляли собранные листья на исследование в Индианаполис, шт. Индиана. Опытный участок для трансформанта сои pDAB9582.814.19.1 был засеян в феврале 2011 г. и состоял примерно из 180 растений в четырех рядах. Каждый ряд был длиной 2,3 м, и расстояние между рядами было равно 76,2 см; отдельные растения произрастали на расстоянии 5,1 см друг от друга в каждом ряду. В марте 2011 г. с 10 растений сои, содержащих трансформант pDAB9582.814.19.1, и с 10 растений сорта Maverick было срезано по одному полностью развитому трилистнику главного стебля, расположенному на расстоянии примерно четырех узлов ниже меристемы. Листья были помещены в пластиковые мешки с этикетками (по одному в каждый мешок) и запечатаны. Листья в мешках были упакованы в коробки и отправлены в лабораторию. В лаборатории из каждого трилистника были изготовлены один или два листовых диска с диаметром 3,33 см (1,31 дюйма), в результате чего было получено в общей сложности 16 дисков. Каждый листовой диск помещали поверх 2% агара, заражали одной новорожденной личинкой S. frugiperda и закрывали перфорированной пластиковой крышкой. Листовые диски выдерживали в камере с контролируемой средой в течение 7 дней, на протяжении которых оценивали гибель насекомых и количество съеденного листа. Личинки, которые не реагировали на осторожное прикосновение щупом, считались мертвыми. Повреждение листьев определяли путем визуальной оценки съеденной насекомым части листового диска в процентном выражении.
Результаты, полученные в двух экспериментах, показали, что листья, содержащие трансформант сои pDAB9582.814.19.1, были значительно меньше повреждены всеми испытанными насекомыми, чем контрольные растения сорта Maverick. Таким образом, трансформант сои pDAB9582.814.19.1 обладает инсектицидной активностью в отношении широкого спектра насекомых.
Пример 7. Последовательность трансформанта сои pDAB9582.814.19.1
SEQ ID NO:14 представляет собой последовательность трансформанта сои pDAB9582.814.19.1. Данная последовательность содержит 5'-концевую геномную фланкирующую последовательность, вставку Т-цепи pDAB9582 и 3'-концевые геномные фланкирующие последовательности. В SEQ ID NO:14 остатки 1-1400 являются 5'-концевой геномной фланкирующей последовательностью, остатки 1401-1536 являются реаранжированными остатками плазмиды pDAB9582, остатки 1537-13896 являются остатками вставки Т-цепи pDAB9582 и остатки 13897-15294 являются 3'-концевой фланкирующей последовательностью. Соединительная последовательность или переход к 5'-концу вставки, таким образом, находится в положении остатков 1400-1401 SEQ ID NO:14. Соединительная последовательность или переход к 3'-концу вставки, таким образом, находится в положении остатков 13896-13897 SEQ ID NO:14.
Следует отметить, что потомство трансформанта сои pDAB9582.814.19.1 может иметь последовательности, незначительно отличающиеся от SEQ ID NO:14. В процессе интрогрессии и селекции с введением трансформанта сои pDAB9582.814.19.1 в геном растительных клеток возможны некоторые делеции или другие изменения вставки. Кроме того, в процессе амплификации методом ПЦР могут возникнуть ошибки, которые могут вызвать незначительные ошибки секвенирования. Например, фланкирующие последовательности, приведенные в настоящем описании изобретения, были определены путем создания ампликонов из геномных ДНК сои, после чего ампликоны были клонированы и секвенированы. Вполне возможны небольшие отличия и незначительные расхождения в последовательностях, созданных и определенных подобным образом, с учетом многочисленных циклов амплификации, необходимых для создания из геномных ДНК ампликона, достаточного для секвенирования. Специалисту в данной области должно быть понятно, что в объем настоящего изобретения входят любые корректировки, необходимые вследствие возникновения обычных ошибок секвенирования или расхождений указанных типов. Таким образом, соответствующий сегмент плазмидной последовательности по настоящему изобретению может включать некоторые незначительные изменения. В объем настоящего изобретения также входит растение, включающее полинуклеотид, обладающий некоторой степенью идентичности с вставочной последовательностью по настоящему изобретению. Полинуклеотидная последовательность может быть идентична последовательности SEQ ID NO:14 по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%. Таким образом, некоторые отличия SEQ ID NO:14 от потомства растений с трансформантом сои pDAB9582.814.19.1 могут быть идентифицированы и входят в объем настоящего изобретения.
Пример 8. Трансформантспецифический анализ TaqMan
Трансформантспецифический анализ TAQMAN был разработан для обнаружения трансформанта сои pDAB9582.814.19.1 и определения статуса зиготности растений в популяции, достаточной для дальнейшего размножения. Трансформант сои pDAB9582.814.19.1 содержит Т-цепь двойного вектора pDAB9582 (фиг. 1). Для обнаружения трансформанта сои pDAB9582.814.19.1 были созданы специфические праймеры и зонды TAQMAN, соответствующие последовательностям ДНК, расположенным в месте 5'-концевого (SEQ ID NO:1) или 3'-концевого (SEQ ID NO:2) соединения вставки с геномом растения (фиг. 4). Один трансформантспецифический анализ трансформанта сои pDAB9582.814.19.1 специально предназначен для обнаружения фрагмента ДНК длиной 229 п.о., заполняющего место интеграции в положении 3'-конца, и включает использование двух праймеров специфичного к мишени зонда MGB, содержащего ген-репортер FAM в положении 5'-конца, который был синтезирован в компании Applied Biosystems (ABI). Специфичность метода TAQMAN, предназначенного для обнаружения трансформанта сои pDAB9582.814.19.1, исследовали в отношении 7 разных трансформантов, содержащих PTU Cry1Ac и Cry1F, и контрольного сорта нетрансгенной сои (Maverick) в двойном формате со специфическим эндогенным эталонным геном сои GMFL01-25-J19 (кДНК Glycine max, GenBank: АК286292.1).
Пример 8.1. Выделение гДНК
В данном эксперименте были исследованы образцы гДНК 7 разных трансформантов сои и сортов нетрансгенной сои. Геномную ДНК экстрагировали, используя модифицированный набор для экстракции ДНК растений QIAGEN MAGATTRACT (Qiagen, Valencia, CA). гДНК экстрагировали из листовых дисков свежей сои, по 8 на каждый образец. В соответствии с целями данного исследования образцы разводили водой без ДНКазы с достижением концентрации, равной примерно 10 нг/мкл.
Пример 8.2. Анализ TaqMan и результаты
Специфические праймеры и зонды, использованные при выполнении анализа методом TAQMAN, были созданы специально для трансформанта сои pDAB9582.814.19.1, исследуемого методом TAQMAN. Указанные реагенты могут быть использованы в приведенных ниже условиях для обнаружения трансгена в трансформанте сои pDAB9582.814.19.1. В таблице 9 приведены последовательности праймеров и зондов, которые были созданы специально для обнаружения трансформанта сои pDAB9582.814.19.1.
Амплификация методом ПЦР была выполнена в следующих условиях: 1-кратный буфер для ПЦР компании Roche, 0,4 мкМ трансформантспецифического верхнего праймера, 0,4 мкМ трансформантспецифическоого нижнего праймера, 0,4 мкМ праймера GMS116F, 0,4 мкМ праймера GMS116R, 0,2 мкМ трансформантспецифического зонда, 0,2 мкМ зонда GMS116, 0,1% PVP, 6-20 нг гДНК в общем количестве реакционной смеси, равном 10 мкл. Смесь амплифицировали в следующих условиях: i) 95°С в течение 10 минут, ii) 95°С в течение 10 секунд, iii) 60°С в течение 40 секунд, iv) повторение стадий ii-iii на протяжении 40 циклов, v) выдерживание при 40°С. ПЦР в реальном времени выполняли в устройстве LIGHTCYCLER 480 компании Roche. Анализ данных был произведен на основе измерения точки пересечения (значение Ср), определяемой с помощью программного обеспечения LIGHTCYCLER 480, которая соответствует числу циклов ПЦР, при котором интенсивность изменения флуоресценции достигает максимума.
Метод TAQMAN, предназначенный для обнаружения трансформанта сои pDAB9582.814.19.1, исследовали в отношении 7 разных трансформантов, содержащих PTU Cry1Ac и Cry1F, и сорта нетрансгенной сои в двойном формате со специфическим эндогенным эталонным геном сои GMFL01-25-J19 (GenBank: АК286292.1). Указанный анализ позволял специфически обнаруживать трансформант сои pDAB9582.814.19.1 без каких-либо ложных положительных результатов обнаружения контрольных образцов (то есть трансформанты, содержащие PTU Cry1Ac и Cry1F, и сорт нетрансгенной сои). Для обнаружения трансформанта сои pDAB9582.814.19.1 могут быть использованы трансформантспецифические праймеры и зонды, причем указанные условия и реагенты применимы для анализов зиготности.
С учетом проиллюстрированных и описанных принципов настоящего изобретения специалистам в данной области должно быть понятно, что в изобретение могут быть внесены изменения, не выходящие за пределы таких принципов. Все модификации заявленного изобретения находятся в пределах существа и объема прилагаемой формулы изобретения.
Все приведенные публикации и опубликованные патентные документы включены в настоящее описание изобретения в качестве ссылки в той мере, в какой обосновано включение в качестве ссылки каждой отдельной публикации или заявки на патент.
| название | год | авторы | номер документа |
|---|---|---|---|
| ОБЪЕКТ СОИ 9582.814.19.1, ПРИДАЮЩИЙ УСТОЙЧИВОСТЬ К НАСЕКОМЫМ И УСТОЙЧИВОСТЬ К ГЕРБИЦИДАМ | 2012 |
|
RU2628099C2 |
| РЕЗИСТЕНТНЫЙ К НАСЕКОМЫМ И УСТОЙЧИВЫЙ К ГЕРБИЦИДАМ ТРАНСФОРМАНТ СОИ рDAB9582.816.15.1 | 2013 |
|
RU2650626C2 |
| УСТОЙЧИВЫЙ К НАСЕКОМЫМ-ВРЕДИТЕЛЯМ И ТОЛЕРАНТНЫЙ К ГЕРБИЦИДАМ СЕЛЕКЦИОННЫЙ ГИБРИД ТРАНСФОРМАНТА СОИ pDAB9582.814.19.1 и pDAB4468.04.16.1 | 2012 |
|
RU2627161C2 |
| ПАКЕТИРОВАННОЕ СОБЫТИЕ 8264.44.06.1 С УСТОЙЧИВОСТЬЮ К ГЕРБИЦИДАМ, СВЯЗАННЫЕ ТРАНСГЕННЫЕ ЛИНИИ СОИ И ИХ ДЕТЕКТИРОВАНИЕ | 2011 |
|
RU2608650C2 |
| ЛИНИИ ТРАНСГЕННОЙ СОИ, ГЕНЕТИЧЕСКОЕ СОБЫТИЕ 8264.42.32.1, УСТОЙЧИВОЕ К ГЕРБИЦИДАМ С ПАКЕТИРОВАННЫМИ ГЕНАМИ НА ЕГО ОСНОВЕ, И ИХ ДЕТЕКТИРОВАНИЕ | 2012 |
|
RU2636021C2 |
| СОБЫТИЕ 416 AAD-12, РОДСТВЕННЫЕ ЛИНИИ ТРАНСГЕННОЙ СОИ И ИХ СОБЫТИЕСПЕЦИФИЧНАЯ ИДЕНТИФИКАЦИЯ | 2010 |
|
RU2603252C2 |
| ДЕТЕКТИРОВАНИЕ AAD-12-СОБЫТИЯ 416 У СОИ | 2010 |
|
RU2573898C2 |
| МАТЕРИАЛЫ И МЕТОДЫ ДЛЯ ОБНАРУЖЕНИЯ ГЕНА АРИЛОКСИАЛКАНОАТДИОКСИГЕНАЗЫ (AAD-12) В РАСТЕНИЯХ | 2012 |
|
RU2644249C2 |
| СОБЫТИЕ DAS-40278-9 AAD-1, РОДСТВЕННЫЕ ЛИНИИ ТРАНСГЕННОЙ КУКУРУЗЫ И ИХ СОБЫТИЕ-СПЕЦИФИЧЕСКАЯ ИДЕНТИФИКАЦИЯ | 2010 |
|
RU2614120C2 |
| РАСТЕНИЯ-ТРАНСФОРМАНТЫ КУКУРУЗЫ PV-ZMIR13 (MON863) И КОМПОЗИЦИИ И СПОСОБЫ ИХ ОБНАРУЖЕНИЯ | 2003 |
|
RU2352638C2 |




















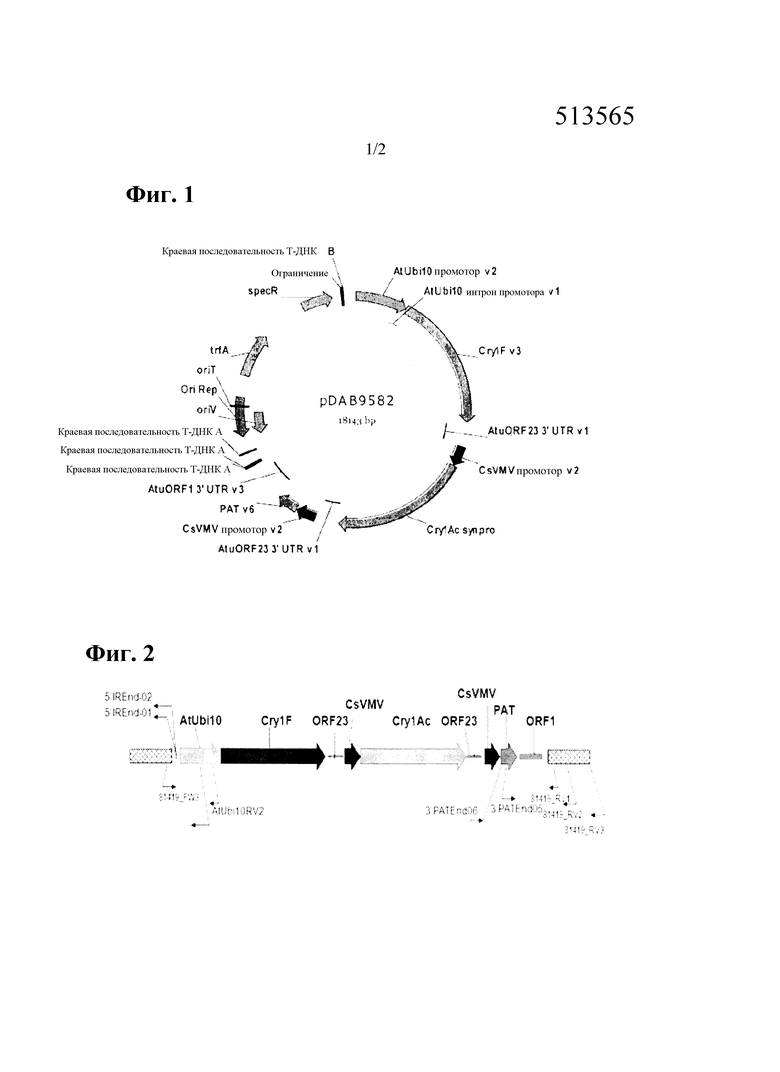
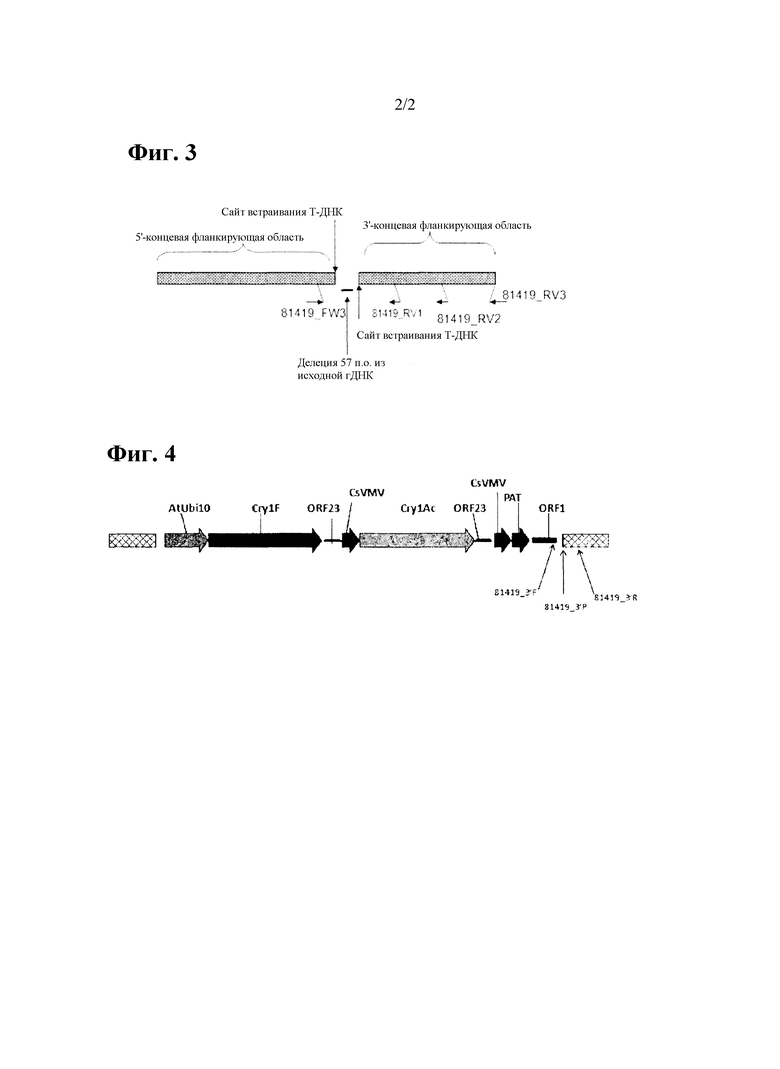
Изобретение относится к области биохимии, в частности к способу обнаружения полинуклеотида в образце, содержащем ДНК сои. Изобретение позволяет обнаружить полинуклеотид с определенной последовательностью в образце ДНК сои. 4 ил., 9 табл., 8 пр.
Способ обнаружения полинуклеотида с SEQ ID NO: 14 в образце, содержащем ДНК сои, который включает:
(a) приведение указанного образца в контакт с первым праймером, который избирательно связывается с фланкирующей последовательностью в положении пар оснований 1-1400 SEQ ID NO: 1, и со вторым праймером, который избирательно связывается с вставочной последовательностью в положении пар оснований 1401-1836 SEQ ID NO: 1, где первый праймер состоит из SEQ ID NO: 4, а второй праймер выбран из группы, состоящей из SEQ ID NO: 8, 9, 10 и 11; и исследование ампликона, образованного между указанными праймерами; или
(b) приведение указанного образца в контакт с первым праймером, который избирательно связывается с вставочной последовательностью в положении пар оснований 1-152 SEQ ID NO: 2, и со вторым праймером, который избирательно связывается с фланкирующей последовательностью в положении пар оснований 153-1550 SEQ ID NO: 2, где первый праймер выбран из группы, состоящей из SEQ ID NO: 5, 6 и 7, а второй праймер выбран из группы, состоящей из SEQ ID NO: 12 и 13; и исследование ампликона, образованного между указанными праймерами; и
обнаружение полинуклеотида с SEQ ID NO: 14 в указанном образце ДНК сои.
| US 0007179965 B2 от 20.02.2007 | |||
| US 0007304206 B2 от 04.12.2007 | |||
| US 20100180351 A1 от 15.07.2010 | |||
| US 0006713063 B1 от 30.03.2004 | |||
| СПОСОБЫ БОРЬБЫ С ВРЕДИТЕЛЕМ - СОВКОЙ AGROTIS | 2000 |
|
RU2311767C2 |
Авторы
Даты
2017-06-09—Публикация
2012-07-26—Подача