Перекрестная ссылка на родственную заявку
[0001] Эта заявка испрашивает приоритет предварительной заявки № 61/511,664, зарегистрированной 26 июля 2011, и предварительной заявки № 61/521,798, зарегистрированной 10 августа 2011, обе из которых полностью включены в настоящее описание посредством ссылки.
Уровень техники
[0002] Гены, кодирующие Cry1F и Cry1Ac synpro (Cry1Ac), способны придавать трансгенным растениям устойчивость к насекомым, например, устойчивость к чешуекрылым насекомым; и гены, кодирующие PAT (ацетилтрансфераза фосфинотрицина), способны придавать трансгенным растениям устойчивость к гербицидному фосфинотрицину (глуфосинат). PAT успешно экспрессировался в сое для применения и в качестве селектируемого маркера при получении устойчивых к насекомым трансгенных сельскохозяйственных культур, так и для придания коммерческие оправданных уровней устойчивости к гербицидному глуфосинату трансгенным сельскохозяйственным культурам.
[0003] Известно, что на экспрессирование чужеродных генов в растениях влияет их местоположение в геноме растения, возможно из-за структуры хроматина (например, гетерохроматин) или близкого расположения элементов регуляции транскрипции (например, гены - усилители) к участку интеграции (Weising et al., Ann. Rev. Genet 22:421-477, 1988). В то же самое время, присутствие трансгена в различных местах в геноме влияет на общий фенотип растения по-разному. Поэтому, часто необходимо скринировать большое количество объектов, чтобы идентифицировать объект, характеризующийся оптимальной экспрессией представляющего интерес вводимого гена. Например, в растениях и в других организмах наблюдали, что может иметь место широкая вариация в уровнях экспрессии введенного гена между объектами. Могут также быть различия в пространственных или временных паттернах экспрессии, например, различия в относительной экспрессии трансгена в различных растительных тканях, которые могут не соответствовать паттернам, ожидаемым от регулирующих транскрипцию элементов, присутствующих во введенном генном конструкте. Поэтому, как правило, получают от сотен до тысяч различных объектов и скринируют эти объекты на предмет одного единственного объекта, который обладает желаемыми в коммерческих целях уровнями и паттернами экспрессии трансгена. Объект, который обладает желаемыми уровнями и паттернами экспрессии трансгена, полезен для интрогрессии трансгена в другие генетические окружения путем полового ауткроссинга с применением обычных способов размножения. Потомство таких скрещиваний сохраняет характеристики экспрессии трансгена первоначального трансформанта. Эту стратегию применяют для того, чтобы гарантировать надежную экспрессию гена во многих сортах, которые хорошо адаптированы к местным условиям произрастания.
[0004] Желательно иметь возможность обнаруживать присутствие специфического объекта для того, чтобы определять содержит ли потомство полового скрещивания интересующий трансген или группу трансгенов. Кроме того, способ обнаружения специфического объекта был бы полезен для выполнения инструкций, требующих одобрения перед продажей, и маркировки продуктов, полученных из рекомбинантных растений сельскохозяйственных культур, например, или для применения в экологическом мониторинге, мониторинге признаков сельскохозяйственных культур в поле или мониторинге продуктов, полученных из урожая сельскохозяйственной культуры, так же как для применения в обеспечении согласия сторон, подчиняющихся нормативным или договорным условиям.
[0005] Обнаружение присутствия трансгенного объекта возможно любым способом обнаружения нуклеиновой кислоты, известным в области техники, включая, но не ограничиваясь ими, полимеразную цепную реакцию (ПЦР) или ДНК-гибридизацию с применением зонда для нуклеиновой кислоты. Эти способы обнаружения, в целом, сфокусированы на часто применяемых генетических элементах, таких как промоторы, терминаторы, маркеры и т.д., поскольку для многих ДНК-конструктов область кодирования является взаимозаменяемой. В результате, такие способы могут не быть полезными для различения между различными объектами, в частности, таких, которые получены с применением одного и того же ДНК-конструкта или очень схожих конструктов, если только не известна последовательность фланкирующей ДНК, смежная с введенной гетерологичной ДНК. Например, объект-специфический анализ ПЦР описан в патентной заявке США 2006/0070139 для объекта кукурузы DAS-59122-7. Было бы желательно иметь простой и чувствительный способ идентификации объекта сои 9582.814.19.1.
Сущность настоящего изобретения
[0006] Настоящее изобретение относится к новому объекту трансформации трансгенной сои, придающему устойчивость к насекомым и устойчивость к гербицидам, обозначаемому как объект сои 9582.814.19.1, включающему cry1F, cry1Ac и pat, как приведено в настоящем описании, введенному в специфический сайт генома клетки сои. Представительное семя сои депонировано в американской коллекции типовых культур (ATCC) под номером доступа зарегистрированного образца, идентифицированным в параграфе [0021]. ДНК растений сои, содержащих этот объект, включает примыкающие вплотную/фланкирующие последовательности, приведенные в настоящем описании, которые характеризуют местоположение введенной ДНК в геноме сои. SEQ ID NO:1 и SEQ ID NO:2 являются диагностическими для объекта сои 9582.814.19.1. Более конкретно, последовательности, окружающие примыкающие вплотную последовательности в п.о. 1400/1401 и п.о. 1536/1537 SEQ ID NO:1 и п.о. 152/153 SEQ ID NO:2, являются диагностическими для объекта сои 9582.814.19.1. Параграф [00012] ниже описывает примеры последовательностей, включающих эти примыкающие вплотную последовательности, которые характерны для ДНК сои, содержащей объект сои 9582.814.19.1.
[0007] В одном варианте осуществления настоящее изобретение предоставляет растение сои или его часть, устойчивые к Pseudoplusia includens (соевая пяденица), и которые имеют геном, включающий одну или несколько последовательностей, выбранных из группы, состоящей из п.о. 1385-1415 из SEQ ID NO:1; п.о. 1350-1450 из SEQ ID NO:1; п.о. 1300-1500 из SEQ ID NO:1; п.о. 1200-1600 из SEQ ID NO:1; п.о. 137-168 из SEQ ID NO:2; п.о. 103-203 из SEQ ID NO:2; и п.о. 3-303 из SEQ ID NO:2 и комплементарных им. В другом варианте осуществления настоящее изобретение предоставляет семена таких растений.
[0008] В другом варианте осуществления настоящее изобретение предоставляет способ борьбы с насекомыми, который включает экспонирование насекомым растений сои, резистентных к насекомым, в котором растения сои содержат геном, который содержит одну или более последовательностей, выбранных из группы, состоящей из п.о. 1385-1415 из SEQ ID NO:1; п.о. 1350-1450 из SEQ ID NO:1; п.о. 1300-1500 из SEQ ID NO:1; п.о. 1200-1600 из SEQ ID NO:1; п.о. 137-168 из SEQ ID NO:2; п.о. 103-203 из SEQ ID NO:2; и п.о. 3-303 из SEQ ID NO:2 и комплементарных им; которые характерны для присутсвия объекта сои 9582.814.19.1, чтобы, таким образом, бороться с насекомыми. Присутствие генов cry1F v3 (cry1F) и cry1Ac synpro (cry1Ac) в объекте сои 9582.814.19.1 придает устойчивость, например, к Pseudoplusia includens (соевая пяденица), Anticarsia gemmatalis (гусеница бархатных бобов), Epinotia aporema, Omoides indicatus, Rachiplusia nu, Spodoptera frugiperda, Spodoptera cosmoides, Spodoptera eridania, Heliothis virescens, Heliocoverpa zea, Spilosoma virginica и Elasmopalpus lignosellus.
[0009] В другом варианте осуществления настоящее изобретение предоставляет способ борьбы с сорняками в сельскохозяйственной культуре сои, который включает нанесение гербицида на основе глуфосината на сельскохозяйственную культуру сои, где указанная сельскохозяйственная культура сои включает растения сои, содержащие геном, включающий одну или несколько последовательностей, выбранных из группы, состоящей из п.о. 1385-1415 из SEQ ID NO:1; п.о. 1350-1450 из SEQ ID NO:1; п.о. 1300-1500 из SEQ ID NO:1; п.о. 1200-1600 из SEQ ID NO:1; п.о. 137-168 из SEQ ID NO:2; п.о. 103-203 из SEQ ID NO:2; и п.о. 3-303 из SEQ ID NO:2 и комплементарных им, которые являются диагностическими для присутствия объекта сои 9582.814.19.1. Присутствие гена pat v6 (pat) в объекте сои 9582.814.19.1 придает устойчивость к гербицидам на основе глуфосината.
[0010] В другом варианте осуществления настоящее изобретение предоставляет способ обнаружения объекта сои 9582.814.19.1 в образце, содержащем ДНК сои, где указанный способ включает:
(a) приведение в контакт указанного образца с первым праймером длиной, по меньшей мере, 10 п.о., который избирательно связывается с фланкирующей последовательностью в пределах п.о. 1-1400 из SEQ ID NO:1 или комплементарной ей, и вторым праймером длиной, по меньшей мере, 10 п.о., который избирательно связывается с последовательностью-вставкой в пределах п.о. 1401-1836 из SEQ ID NO:1 или комплементарной ей; и проведение анализа на ампликон, образующийся между указанными праймерами; или
(b) приведение в контакт указанного образца с первым праймером длиной, по меньшей мере, 10 п.о., который избирательно связывается с последовательностью-вставкой в пределах п.о. 1-152 из SEQ ID NO:2 или комплементарной ей, и вторым праймером длиной, по меньшей мере, 10 п.о., который избирательно связывается с фланкирующей последовательностью в пределах п.о. 153-1550 из SEQ ID NO:2 или комплементарной ей; и
(c) проведение анализа на ампликон, образующийся между указанными праймерами.
[0011] В другом варианте осуществления настоящее изобретение предоставляет способ обнаружения объекта сои 9582.814.19.1, включающий:
(a) приведение в контакт указанного образца с первым праймером, который избирательно связывается с фланкирующей последовательностью, выбранной из группы, состоящей из п.о. 1-1400 из SEQ ID NO:1 и п.о. 153-1550 из SEQ ID NO:2 и комплементарной ей; и вторым праймером, который избирательно связывается с SEQ ID NO:3 или комплементарной ей;
(b) проведение полимеразной цепной реакции в указанном образце; и
(c) проведение анализа на ампликон, образующийся между указанными праймерами.
[0012] В другом варианте осуществления настоящее изобретение предоставляет способ размножения растения сои, включающий: скрещивание первого растения со вторым растением сои для получения третьего растения сои, где указанное первое растение содержит ДНК, включающую одну или несколько последовательностей, выбранных из группы, состоящей из п.о. 1385-1415 из SEQ ID NO:1; п.о. 1350-1450 из SEQ ID NO:1; п.о. 1300-1500 из SEQ ID NO:1; п.о. 1200-1600 из SEQ ID NO:1; п.о. 137-168 из SEQ ID NO:2; п.о. 103-203 из SEQ ID NO:2; и п.о. 3-303 из SEQ ID NO:2 и комплементарных им; и проведение анализа указанного третьего растения сои на присутствие ДНК, включающего одну или несколько последовательностей, выбранных из группы, состоящей из п.о. 1385-1415 из SEQ ID NO:1; п.о. 1350-1450 из SEQ ID NO:1; п.о. 1300-1500 из SEQ ID NO:1; п.о. 1200-1600 из SEQ ID NO:1; п.о. 137-168 из SEQ ID NO:2; п.о. 103-203 из SEQ ID NO:2; и п.о. 3-303 из SEQ ID NO:2, и комплементарных им.
[0013] В другом варианте осуществления настоящее изобретение предоставляет изолированную молекулу ДНК, которая является диагностической для объекта сои 9582.814.19.1. Такие молекулы включают, в дополнение к SEQ ID NOS: 1 и 2, молекулы, по меньшей мере, 25 п.о. в длину, включающие п.о. 1400-1401 из SEQ ID NO:1 и, по меньшей мере, 10 п.о. из SEQ ID NO:1 в каждом направлении от прилегающей вплотную последовательности п.о. 1400/1401; ампликоны, по меньшей мере, 25 п.о. в длину, включающие 152-153 из SEQ ID NO:2 и, по меньшей мере, 10 п.о. из SEQ ID NO:2 в каждом направлении от прилегающей вплотную последовательности п.о. 152/153. Примерами являются п.о. 1385-1415 из SEQ ID NO:1; п.о. 1350-1450 из SEQ ID NO:1; п.о. 1300-1500 из SEQ ID NO:1; п.о. 1200-1600 из SEQ ID NO:1; п.о. 137-168 из SEQ ID NO:2; п.о. 103-203 из SEQ ID NO:2; и п.о. 3-303 из SEQ ID NO:2 и комплементарные им.
[0014] В другом варианте осуществления настоящее изобретение предоставляет способ борьбы с вредителями в зерне сои, семени или семенном пищевом продукте, который включает введение объекта сои 9582.814.19.1 в указанное зерно, семя или семенной пищевой продукт, что демонстрируется указанным зерном, семенем или семенным пищевым продуктом, содержащим ДНК, включающим одну или несколько последовательностей, выбранных из группы, состоящей из п.о. 1385-1415 из SEQ ID NO:1; п.о. 1350-1450 из SEQ ID NO:1; п.о. 1300-1500 из SEQ ID NO:1; п.о. 1200-1600 из SEQ ID NO:1; п.о. 137-168 из SEQ ID NO:2; п.о. 103-203 из SEQ ID NO:2; и п.о. 3-303 из SEQ ID NO:2 и комплементарных им.
[0015] Изобретение также включает растительные клетки сои и части растений, включая, но не ограничивая ими, пыльцу, семяпочку, цветки, побеги, корни и листья и ядра растительных клеток, клетки пыльцы, семя и семенной пищевой продукт и оотиды, которые содержат объект сои 9582.814.19.1.
[0016] В некоторых вариантах осуществления настоящего изобретения объект сои 9582.814.19.1 может быть объединен с другими признаками, включая, например, другие ген(ы) устойчивости к гербицидам и/или ингибирующие насекомых белки и регулирующие транскрипцию последовательности (т.е. РНК интерференция, дсРНК, факторы транскрипции и т.д.). Дополнительные признаки могут быть соединены в геноме растения путем размножения растений, перетрансформации трансгенного растения, содержащего объект сои 9582.814.19.1, или добавления новых признаков путем целенаправленной интеграции посредством гомологичной рекомбинации.
[0017] Другие варианты осуществления настоящего изобретения включают вырезание полинуклеотидных последовательностей, которые содержат объект сои 9582.814.19.1, включая например, кассету экспрессии гена pat. После вырезания полинуклеотидной последовательности модифицированный объект может быть перенаправлен на специфический хромосомный участок, на котором дополнительные полинуклеотидный последовательности соединяют с объектом сои 9582.814.19.1.
[0018] В одном варианте осуществления настоящее изобретение охватывает таргетный хромосомный участок сои, расположенный на хромосоме 02 между фланкирующими последовательностями, указанными в SEQ ID NOS:1 и 2.
[0019] В одном варианте осуществления настоящее изобретение охватывает способ создания трансгенного растения сои, включающий введение гетерологичной нуклеиновой кислоты в положение на хромосоме 02 между геномными последовательностями, указанными в SEQ ID NOS:1 и 2, т.е. между п.о. 1-1400 из SEQ ID NO:1 и п.о. 153-1550 из SEQ ID NO:2.
[0020] Дополнительно, рассматриваемое изобретение предоставляет анализы для обнаружения присутствия рассматриваемого объекта в образце (сои, например). Анализы могут быть основаны на последовательности ДНК рекомбинантного конструкта, введенного в геном сои, и на геномных последовательностях, примыкающих к участку вставки. Наборы и условия, полезные при проведении анализов, также предоставляются.
[0021] Рассматриваемое изобретение частично имеет отношение к клонированию и анализу последовательностей ДНК граничных областей, получаемых в результате вставки T-ДНК из pDAB9582 в трансгенные линии сои. Эти последовательности уникальны. В зависимости от вставки и плотно прилегающей последовательности могут быть и были получены объект-специфические праймеры. ПЦР анализ продемонстрировал, что эти объекты могут быть идентифицированы анализом ампликонов ПЦР, получаемых с этими объект-специфическими наборами праймеров. Таким образом, эти и другие связанные процедуры могут быть применены для того, чтобы уникальным образом идентифицировать линии сои, содержащие объект по рассматриваемому изобретению.
Депозит семян
[0022] Как часть этого раскрытия, по меньшей мере, 2500 семян линии сои, содержащей объект сои 9582.814.19.1, было депонировано в Американской коллекции типовых культур (ATCC), 10801 University Boulevard, Манассас, Вирджиния, 20110. Депозит, патентное обозначение депозита в ATCC - PTA 12006, был получен в ATCC 21 июля 2011. Этот депозит был создан и будет поддерживаться в соответствии с и по правилам Будапештского Соглашения в отношении депозитов семян в целях прохождения патентной процедуры. Этот депозит был создан и будет поддерживаться в соответствии с и по правилам Будапештского Соглашения в отношении депозитов семян в целях прохождения патентной процедуры.
Краткое описание последовательностей
[0023] SEQ ID NO:1 представляет собой 5'-фланкирующую пограничную последовательность ДНК для объекта сои 9582.814.19.1. Нуклеотиды 1-1400 представляют собой геномную последовательность. Нуклеотиды 1401-1535 представляют собой перегруппированную последовательностью из pDAB9582. Нуклеотиды 1536-1836 представляют собой вставляемую последовательность.
[0024] SEQ ID NO:2 представляет собой 3'-фланкирующую пограничную последовательность ДНК для объекта сои 9582.814.19.1. Нуклеотиды 1-152 представляют собой вставляемую последовательность. Нуклеотиды 153-1550 представляют собой геномную последовательностью.
[0025] SEQ ID NO:3 представляет собой последовательность ДНК pDAB9582, которая аннотирована ниже в таблице 1.
[0026] SEQ ID NO:4 представляет собой олигонуклеотидный праймер 81419_FW3 для подтверждения 5'-концевой геномной ДНК.
[0027] SEQ ID NO:5 представляет собой олигонуклеотидный праймер 81419_RV1 для подтверждения 3'-концевой геномной ДНК.
[0028] SEQ ID NO:6 представляет собой олигонуклеотидный праймер 81419_RV2 для подтверждения 3'-концевой геномной ДНК.
[0029] SEQ ID NO:7 представляет собой олигонуклеотидный праймер 81419_RV3 для подтверждения 3'-концевой геномной ДНК.
[0030] SEQ ID NO:8 представляет собой олигонуклеотидный праймер 5'IREnd-01 для подтверждения 5'-концевой геномной ДНК.
[0031] SEQ ID NO:9 представляет собой олигонуклеотидный праймер 5'IREnd-02 для подтверждения 5'-концевой геномной ДНК.
[0032] SEQ ID NO:10 представляет собой олигонуклеотидный праймер для подтверждения AtUbi10RV1 5'-концевой геномной ДНК.
[0033] SEQ ID NO:11 представляет собой олигонуклеотидный праймер AtUbi10RV2 для подтверждения 5'-концевой геномной ДНК.
[0034] SEQ ID NO:12 представляет собой олигонуклеотидный праймер 3'PATEnd05 для подтверждения 3'-концевой геномной ДНК.
[0035] SEQ ID NO:13 представляет собой олигонуклеотидный праймер 3'PATEnd06 для подтверждения 3'-концевой геномной ДНК.
[0036] SEQ ID NO:14 представляет собой подтвержденную последовательностью объекта сои 9582.814.19.1. Включая 5'- фланкирующую геномную последовательность, pDAB9582 вставку T-нити и 3'-фланкирующую геномную последовательность.
Краткое описание фигур
[0037] Фиг.1 представляет собой карту плазмиды pDAB9582, содержащей cry1F, cry1Ac и кассеты экспрессии pat.
[0038] На фиг.2 изображены месторасположения праймеров для подтверждения 5' и 3' пограничных последовательностей объекта сои pDAB9582.814.19.1.
[0039] На фиг.3 изображено устройство геномной последовательности в объекте сои pDAB9582.814.19.1
Подробное описание настоящего изобретения
[0040] Оба конца вставки объекта сои 9582.814.19.1 секвенировали и описывали. Разрабатывали объект-специфические анализы. Также наносили на карту генома сои (хромосома сои 02). Объект может быть далее введен в элитные линии.
[0041] Как приводится ссылка на вышеуказанное в разделе уровень техники, введение и интеграция трансгена в геном растения включают некоторые случайные объекты (отсюда имя «объект» для данной вставки, которая экспрессируется). Таким образом, во многих технологиях трансформации, таких как трансформация посредством Agrobacterium, биолистическая трансформация (т.е. генная пушка) и карборунд-опосредованная трансформация (т.е. WHISKERS), невозможно предсказать в какое место в геноме трансген будет вставлен. Таким образом, идентификация фланкирующей геномный ДНК растения с обеих сторон вставки может быть важна для идентификации растения, содержащего объект вставки. Например, могут быть разработаны такие ПЦР-праймеры, которые создают ампликон ПЦР через область соединения вставки и генома хозяина. Этот ампликон ПЦР может быть применен для идентификации уникального или отличительного типа объекта вставки.
[0042] Определения и примеры приведены здесь для описания настоящего изобретения и в качестве инструкции для специалистов в области техники для осуществления настоящего изобретения на практике. Если не указано иное, термины необходимо понимать в их обычном смысле применения специалистами в соответствующей области техники. Спецификация оснований ДНК применена как указано в 37 CFR §1.822.
[0043] Как применено в настоящем описании, термин «потомство» обозначает потомство любого поколения от родительского растения, которое включает объект сои 9582.814.19.1.
[0044] Трансгенный «объект» получают трансформацией растительных клеток гетерологичной ДНК, т.е. конструктом нуклеиновой кислоты, который включает представляющие интерес трансгены, получением потомства от популяции растений, полученных в результате вставки трансгена в геном растения, и селекции конкретного растения, характеризующегося вставкой в специфическое место генома. Термин «объект» относится к первоначальному трансформанту и потомству трансформанта, которое включает гетерологичную ДНК. Термин «объект» также относится к потомству, получаемому половым ауткроссингом между трансформантом и другим сортом, который содержит геномную/трансгенную ДНК. Даже после повторного обратного скрещивания с рекуррентным родителем, введенная трансгенная ДНК и фланкирующая геномная ДНК (геномная/трансгенная ДНК) от трансформированного родителя присутствуют в потомстве после скрещивания в том же самом месте хромосомы. Термин «объект» также относится к ДНК первоначального трансформанта и его потомства, содержащего введенную ДНК и фланкирующую геномную последовательность непосредственно в смежном положении со введенной ДНК, которая, как ожидается, передается потомству, которое получает введенную ДНК, включающую интересующий трансген, в результате полового скрещивания одной родительской линии, которая включает введенную ДНК (например, первоначальный трансформант и потомство, появляющееся при самоопылении), и родительской линии, которая не содержит введенной ДНК.
[0045] «Примыкающая последовательность» или «пограничная последовательность» охватывает точку, в которой ДНК, введенная в геном, связывается с ДНК естественного гена сои, примыкающей к точке вставки, при этом идентификации или определения одной или другой примыкающей последовательности в генетическом материале растения достаточно для диагностирования объекта. Включены последовательности ДНК, которые охватывают вставки в описанных здесь объектах сои, и фланкирующие ДНК схожей длины. В настоящем описании предоставлены определенные примеры таких диагностических последовательностей; однако, другие последовательности, которые схожи с примыкающими к вставкам последовательностями или с примыкающими к вставкам последовательностями и геномной последовательностью, также являются диагностическими и могут быть применены согласно рассматриваемому изобретению.
[0046] Рассматриваемое изобретение имеет отношение частично к идентификации объектов с применением таких фланкирующих, примыкающих и вводимых последовательностей. Соответствующие ПЦР-праймеры и ампликоны включены в настоящее изобретение. Согласно рассматриваемому изобретению, методы ПЦР анализа с участием ампликонов, которые покрывают введенную ДНК и ее границы, могут быть применены для обнаружения или идентификации коммерциализуемых трансгенных сортов сои или линий, получаемых из рассматриваемых патентуемых трансгенных линий сои.
[0047] Фланкирующие/примыкающие последовательности являются диагностическими для объекта сои 9582.814.19.1. На основе этих последовательностей получали объект-специфические праймеры. Анализ ПЦР показал, что эти линии сои могут быть идентифицированы в различных генотипах сои анализом ампликонов ПЦР, образующихся с этими наборами объект-специфических праймеров. Таким образом, эти и другие соответствующие процедуры могут быть применены для уникальной идентификации этих линий сои. Последовательности, идентифицируемые в настоящем описании, уникальны.
[0048] Способы обнаружения по рассматриваемому изобретению особенно полезны в связи с разведением растений для определения того, какие растения потомства включают данный объект, после того, как родительское растение, включающее объект скрещивается с другой линией растения в попытках придать потомству один или более дополнительных представляющих интерес признаков. Эти способы ПЦР анализа приносят пользу программам разведения сои так же как и контролю качества, особенно в отношении коммерциализированных трансгенных семян сои. ПЦР наборы для обнаружения этих трансгенных линий сои также теперь могут быть сделаны и применены. Это может также принести пользу для регистрации продукта и управления продуктом.
[0049] Кроме того, фланкирующие/геномные последовательности сои могут быть применены для специфичной идентификации места расположения каждой вставки в геноме. Эта информация может быть применена для создания систем молекулярных маркеров, специфических для каждого объекта. Они могут быть применены в стратегиях ускоренного размножения и для установления сцепления.
[0050] Еще дополнительно, информация о фланкирующей последовательности может быть применена для изучения и описания процессов интеграции трансгена, характеристик места интеграции генома, классификации объектов, устойчивости трансгенов и их фланкирующих последовательностей и экспрессии гена (особенно в отношении подавления активности гена, паттернов метилирования трансгена, эффектов положения и потенциальных связанных с экспрессией элементов, таких как MARS [участки прикрепления к матриксу] и т.п.).
[0051] В свете всего рассматриваемого раскрытия должно быть ясно, что рассматриваемое изобретение включает семена, доступные под номером доступа депозита ATCC, идентифицированным в параграфе [0021]. Рассматриваемое изобретение также включает устойчивое к гербициду растение сои, выращенное из семени, депонированного под номером доступа депозита ATCC, идентифицированным в параграфе [0021]. Рассматриваемое изобретение дополнительно включает части указанного растения, такие как листья, образцы ткани, семена, образуемые указанным растением, пыльцу и т.п. (которые содержат cry1F, cry1Ac, pat и SEQ ID NOS: 1 и 2).
[0052] Все еще дополнительно, рассматриваемое изобретение включает растение-потомка и/или потомство растений, выращенных из депонированных семян, предпочтительно, устойчивое к гербициду растение сои, где указанное растение имеет геном, включающий обнаруживаемую примыкающую последовательность дикого типа, как приведено в настоящем описании. Как применено в настоящем описании, термин «соя» обозначает Glycine max и включает все ее сорта, которые могут быть выведены с участием растения сои.
[0053] Это изобретение дополнительно включает способы скрещиваний с применением растения по рассматриваемому изобретению в качестве, по меньшей мере, одного родителя. Например, рассматриваемое изобретение включает гибридное растение F1, у которого одним или обоими родителями являются любое из растений, приведенных в настоящем описании в качестве примера. Также рассматриваемое изобретение охватывает семя, образуемое такими F1 гибридами по рассматриваемому изобретению. Это изобретение включает способ получения гибридного семени F1 путем скрещивания растения, приведенного в качестве примера, с другим (например, инбредным родителем) растением и сбора образующегося гибридного семени. Рассматриваемое изобретение включает растение, приведенное в качестве примера, которое является либо родителем женского пола, либо родителем мужского пола. Характеристики получаемых в результате растений могут быть улучшены путем внимательного отбора родительских растений.
[0054] Устойчивое к насекомым/глуфосинат-устойчивое растение сои по рассматриваемому изобретению может быть размножено сначала путем полового скрещивания первого родительского растения сои, представляющего собой растение сои, выращенное из семени любой из приведенных в настоящем описании линий, и второго родительского растения сои, таким образом, получая множество растений потомства первого поколения; затем, выбора растения-потомка первого поколения, устойчивого к глуфосинату; самоопыления растения-потомка первого поколения, таким образом, получая множество растений-потомков второго поколения; и затем отбора из растений-потомков второго поколения растений, устойчивых к глуфосинату. Эти стадии могут дополнительно включать обратное скрещивание растения-потомка первого поколения или растения-потомка второго поколения со вторым родительским растением сои или третьим родительским растением сои. Затем может быть культивирована сельскохозяйственная культура сои, включающая семена сои по рассматриваемому изобретению или их потомство.
[0055] Необходимо также понимать, что два различных трансгенных растения также могут быть скрещены для получения потомства, которое содержит два независимо расходящихся, добавленных, экзогенных гена. Самоопыление соответствующего потомства может дать растения, которые являются гомозиготными для обоих добавленных, экзогенных гена. Обратное скрещивание с родительским растением и ауткроссинг с нетрансгенным растением также рассматриваются как вегетативное размножение. Другие способы размножения, обычно применяемые для различных признаков и сельскохозяйственных культур, известны в области техники. Размножение обратным скрещиванием применяют для переноса генов, которые придают легко наследуемый, высоко передающийся признак в желательный гомозиготный культурный сорт растения или инбредную линию, которая является рекуррентным родителем. Источник передаваемого признака называется родителем-донором. Ожидается, что получаемое растение будет иметь признаки рекуррентного родителя (например, культурный сорт растения) и желаемый признак, переданный от донорского родителя. После исходного скрещивания отбирают индивидуальные растения, обладающие фенотипом донорского родителя, и неоднократно скрещивают (обратным скрещиванием) с рекуррентным родителем. Ожидается, что получаемый родитель будет иметь признаки рекуррентного родителя (например, культурный сорт растения) и желаемый признак, переданный от донорского родителя.
[0056] Аналогично устойчивое к насекомым/глуфосинат-устойчивое растение сои по рассматриваемому изобретению может быть трансформировано дополнительными трансгенами с применением способов, известных в области техники. Способы трансформации, такие как трансформация посредством Agrobacterium, биолистическая трансформация (т.е. генная пушка) и карборунд-опосредованная трансформация (т.е. WHISKERS), могут быть применены для введения дополнительного трансгена(ов) в геном объекта сои 9582.814.19.1. Выбор и описание трансгенных растений, содержащих нововведенные трансгены, могут быть выполнены для идентификации растений, которые содержат устойчивый интегрант нового трансгена в дополнение к генам cry1F, cry1Ac, pat по рассматриваемому изобретению.
[0057] Молекулы ДНК по настоящему изобретению могут быть применены в качестве молекулярных маркеров в способе скрещивания с применением маркера (MAB). Молекулы ДНК по настоящему изобретению могут быть применены в способах (такие как, маркеры AFLP, маркеры RFLP, маркеры RAPD, SNP и SSR) идентификации генетически связанных агрономически полезных признаков, как известно в области техники. Признаки устойчивости к насекомым и устойчивости к гербицидам могут быть прослежены в потомстве скрещивания растения сои по рассматриваемому изобретению (или их потомство и любой другой культурный сорт растения сои или сорт) с применением способов MAB. Молекулы ДНК являются маркерами этого признака, и способы MAB, которые известны в области техники, могут быть применены для отслеживания признака(ов) устойчивости к гербицидам у растений сои, где, по меньшей мере, одна линия сои по рассматриваемому изобретению или ее потомство, были родителем или предком. Способы по настоящему изобретению могут быть применены для идентификации любого сорта сои, содержащего рассматриваемый объект.
[0058] Способы по рассматриваемому изобретению включают способ получения устойчивого к насекомым/устойчивого к гербицидам растения сои, где указанный способ включает размножение с участием растения по рассматриваемому изобретению. Более конкретно, указанные способы могут включать скрещивание двух растений по рассматриваемому изобретению, или одного растения по рассматриваемому изобретению и любого другого растения. Предпочтительные способы дополнительно включают отбор из потомства указанного скрещивания путем анализа указанного потомства на предмет объекта, обнаруживаемого согласно рассматриваемому изобретению и выгодной эффективности сорта (например, урожай). Например, рассматриваемое изобретение может быть применено для того, чтобы отследить рассматриваемый объект через циклы воспроизводства с растениями, включающими другие желательные признаки, такие как агрономические признаки, устойчивость или резистентность к заболеваниям или устойчивость или резистентность к нематодам и срок созревания. Например, растения, включающие рассматриваемый объект и желаемый признак, могут быть обнаружены, идентифицированы, отобраны и сразу же применены в дополнительных циклах размножения. Рассматриваемый объект/признак может также быть объединен с дополнительным признаком(ами) устойчивости к насекомым и/или с дополнительными признаками устойчивости к гербицидам посредством размножения и отслежен согласно рассматриваемому изобретению. Вариантами осуществления последнего являются растения, включающие рассматриваемый объект, объединенный с геном aad-12, который придает устойчивость к 2,4-дихлорфеноксиуксусной кислоте и придилоксиацетатным гербицидам, или геном, придающим устойчивость к гербициду дикамба.
[0059] Таким образом рассматриваемое изобретение может быть объединено, например, признаками, придающими устойчивость к глифосату (например, растительные или бактериальные гены устойчивости EPSPS, GOX, GAT), устойчивость к глуфосинату (например, pat, bar), устойчивость к ацетолактатсинтаза (ALS)-ингибирующим гербицидам (например, имидазолиноны [такие как имазетапир], сульфонилмочевины, триазолопиримидина сульфонанилид, пирмидинилтиобензоаты и другие химические вещества [Csr1, SurA и др.]), устойчивость к бромоксинилу (например, Bxn), устойчивость к ингибиторам фермента HPPD (4-гидроксифенил-пируват-диоксигеназа), устойчивость к ингибиторам фитоендесатуразы (PDS), устойчивость к гербицидам ингибирующим фотосистему II (например, psbA), устойчивость к гербицидам ингибирующим фотосистему I, устойчивость к гербицидам ингибирующим протопорфириногеноксидазу IX (PPO) (например, PPO-1), устойчивость к гербицидам на основе фенилмочевины (например, CYP76B1), дикамба-разлагающим ферментам (см., например, США 20030135879), и другими, которые могут быть соединены по отдельности или в множестве комбинаций для обеспечения способности эффективной борьбы или предотвращения сдвигов сорняков и/или устойчивости к любому гербициду из вышеуказанных классов.
[0060] Дополнительно, объект сои 9582.814.19.1 может быть объединен с одним или более дополнительных входных (например, устойчивость к насекомым, устойчивость к патогенам или устойчивость к стрессу и др.) или выходных (например, повышенный урожай, улучшил нефтяной профиль, улучшил волоконное качество, и др.) признаков. Таким образом, рассматриваемое изобретение может быть применено для предоставления полного агрономического пакета сельскохозяйственной культуры улучшенного качества с возможностью гибкой и рентабельной борьбы с любым количеством агрономических насекомых-вредителей.
[0061] Способы интеграции полинуклеотидной последовательности в специфический участок хромосомы растительной клетки путем гомологической рекомбинации уже описаны в области техники. Например, сайт-специфическая интеграция, как описано, в патентной публикации США № 2009/0111188 A1, включенной в настоящее описание посредством ссылки, описывает применение рекомбиназ или интеграз для ускорения введения донорской полинуклеотидной последовательности в хромосомную мишень. Кроме того, международный номер патентной заявки WO 2008/021207, включенной в настоящее описание посредством ссылки, описывает гомологичную рекомбинацию опосредованную белком цинковый палец для интеграции одной или более донорских полинуклеотидных последовательностей в специфических местах генома. Применение рекомбиназ, таких как FLP/FRT, как описано в патенте США № 6720475, включенном в настоящее описание посредством ссылки, или CRE/LOX, как описано в патенте США № 5658772, включенном в настоящее описание посредством ссылки, может быть вовлечено для интеграции полинуклеотидной последовательности в специфический сайт хромосомы. Наконец, применение мегануклеаз для направления донорных полинуклеотидов на специфический сайт хромосомы описано в Puchta et al., PNAS USA 93 (1996) стр. 5055-5060).
[0062] Другие способы сайт-специфичной интеграция в растительных клетках являются общеизвестными и применимыми (Kumar et al., Trends in Plant Sci. 6 (4) (2001) стр. 155-159). Кроме того, системы сайт-специфической рекомбинации, которые были идентифицированы в нескольких прокариотических и низших эукариотических организмах, могут быть применены для растений. Примеры таких систем включают, но не ограничены ими; систему рекомбиназ R/RS из pSR1 плазмиды дрожжей Zygosaccharomyces rouxii (Araki et al. (1985) J. Mol. Biol. 182: 191-203) и Gin/gix систему бактериофага Mu (Maeser and Kahlmann (1991) Mol. Gen. Genet. 230: 170-176).
[0063] В некоторых вариантах осуществления настоящего изобретения может быть желательно провести интеграцию или соединение нового трансгена(ов) вблизи существующего трансгенного объекта. Трансгенный объект можно считать предпочтительным геномным локусом, выбранным на основе уникальных характеристик, таких как единственный участок вставки, нормальное Менделевское расщепление и устойчивая экспрессия и превосходная комбинация действия, включая устойчивость к гербицидам и агрономическую эффективность в и среди множества мест окружающей среды. Недавно интегрированные трансгены должны поддержать характеристики экспрессии трансгена существующих трансформантов. Кроме того, разработка анализов для обнаружения и подтверждения недавно интегрированного объекта были бы возможны, если геномные фланкирующие последовательности и месторасположение в хромосоме недавно интегрированного объекта уже идентифицированы. Наконец, интеграция нового трансгена в специфический сайт хромосомы, который связан с существующим трансгеном, ускорила бы интрогрессию трансгенов в другие генетические фоны половым ауткроссингом с применением обычных способов размножения.
[0064] В некоторых вариантах осуществления настоящего изобретения может быть желательно вырезание полинуклеотидной последовательности из трансгенного объекта. Например, вырезание трансгена, как описано в предварительной патентной заявке США № 61/297628, включенной в настоящее описание посредством ссылки, описывает применение нуклеаз, цинковых пальцев, для удаления полинуклеотидной последовательности, состоящей из кассеты экспрессии гена, из интегрированного в хромосому трансгенного объекта. Удаляемая полинуклеотидная последовательность может быть селектируемым маркером. При вырезании и удалении полинуклеотидной последовательности модифицированный трансгенный объект может быть перенаправлен вставкой полинуклеотидной последовательности. Вырезание полинуклеотидной последовательности и последующее перенаправление модифицированного трансгенного объекта обеспечивают преимущества, такие как повторное применение селектируемого маркера или способность преодолевать непредполагаемые изменения в транскриптоме растения, которые следуют из экспрессии специфических генов.
[0065] Рассматриваемое изобретение раскрывает в настоящем описании специфический сайт на хромосоме 02 в геноме сои, который является превосходным для вставки гетерологичних нуклеиновых кислот. Таким образом, рассматриваемое изобретение предоставляет способы для введения представляющих интерес гетерологичних нуклеиновых кислот в этот предварительно установленный таргетный сайт или около вблизи этого таргетного сайта. Рассматриваемое изобретение также охватывает семя сои и/или растение сои, включающее любую гетерологичную нуклеотидную последовательность, введенную в раскрытый таргетный сайт или в целом поблизости такого сайта. Один вариант достижения такой направленной интеграции состоит в том, чтобы вырезать и/или заменить на другую вставку кассету экспрессии pat, приведенную в настоящем описании в качестве примера. В этом общем отношении направленная гомологичная рекомбинация, например и без ограничения, может быть применена согласно рассматриваемому изобретению.
[0066] Как применено в настоящем описании ген, объект или признак «соединяют» комбинируют желаемые признаки в одну трансгенную линию. Селекционеры растений соединяют трансгенные признаки путем скрещивания родителей, каждый из которых имеет желаемый признак, и затем идентификации потомства, которое имеет оба из этих желаемых признаков. Другим способом соединения генов является одновременный перенос двух или более генов в клеточное ядро растения во время трансформации. Другим способом соединения генов является повторная трансформация трансгенного растения другим представляющим интерес геном. Например, соединение генов может быть применено для объединения двух или более различных признаков, включая, например, два или более различных признака насекомых, признак(и) устойчивости к насекомым и признак(и) устойчивости к заболеваниям, два или более признака устойчивости к гербицидам и/или признак(и) устойчивости к насекомым и признак(и) устойчивости к гербицидам. Применение селектируемого маркера в дополнение к интересующему гену можно также считать соединением генов.
[0067] «Гомологичная рекомбинация» относится к реакции между любой парой нуклеотидных последовательностей, содержащих соответствующие сайты, содержащие подобную нуклеотидную последовательность, через которую могут взаимодействовать две нуклеотидные последовательности (рекомбинировать) с образованием новой, рекомбинантной последовательности ДНК. Каждый из участков подобных нуклеотидных последовательностей в настоящем описании называется «гомологическая последовательность». В целом, частота гомологичной рекомбинации увеличивается ростом длины гомологической последовательности. Таким образом, в то время как гомологичная рекомбинация может встретиться между двумя нуклеотидными последовательностями являющимися менее, чем идентичными, частота рекомбинации (или эффективность) снижается с увеличением расхождения между этими двумя последовательностями. Рекомбинация может быть получена с применением одной гомологической последовательности на каждой из донорских и таргетных молекул, таким образом, создавая продукт рекомбинации одиночного «кроссовера». Альтернативно, две гомологические последовательности могут быть помещены на каждую из таргетных и донорских нуклеотидных последовательностей. Рекомбинация между двумя гомологическими последовательностями на доноре с двумя гомологическими последовательностями на мишени образует продукт рекомбинации «двойной кроссовер». Если гомологические последовательности на донорской молекуле примыкают к последовательности, которой необходимо управлять (например, интересующая последовательность), рекомбинация двойной кроссовер с таргетной молекулой приведет к образованию продукта рекомбинации, в котором интересующая последовательность заменяет последовательность ДНК, которая была первоначально между гомологическими последовательностями на таргетной молекуле. Обмен последовательностью ДНК между мишенью и донором через объект рекомбинации двойной кроссовер называют «заменой последовательности».
[0068] Предпочтительное растение или семя по рассматриваемому изобретению включает в своем геноме оперативные cry1F v3, cry1Ac synpro и pat v6 нуклеотидные последовательности, как идентифицировано в настоящем описании, вместе, по меньшей мере, с 20-500 или более смежных фланкирующих нуклеотидов с обеих сторон вставки, как идентифицировано в настоящем описании. Если не указано иначе, ссылка на фланкирующие последовательности относится к таковым, идентифицированным в соответствие с SEQ ID NO: 1 и 2. Можно ожидать, что все или часть этих фланкирующих последовательностей передается потомству, которое получает введенный ДНК в результате полового скрещивания родительской линии, содержащей объект.
[0069] Рассматриваемое изобретение включает культуры тканей регенерируемых клеток растения по рассматриваемому изобретению. Также включено растение, регенерированное из такой культуры тканей, особенно, когда указанное растение способно проявлять все морфологические и физиологические свойства сорта, приведенного в качестве примера. Предпочтительные растения по рассматриваемому изобретению обладают всеми физиологическими и морфологическими характеристиками растения, выращенного из депонированного семени. Это изобретение дополнительно включает потомство такого семени и семени, обладающего представляющими интерес качественными признаками.
[0070] Как применено в настоящем описании, «линия» представляет собой группу растений, которые показывают малую или никакой наследственной изменчивости между индивидуальными растениями, по меньшей мере, в одном признаке. Такие линии могут быть созданы несколькими поколениями самоопыления и селекции или вегетативного размножения от одного родителя с применением технологий клеточной ткани или культуры.
[0071] Как применено в настоящем описании, термины «культурный сорт растения» и «сорт» являются синонимами и относятся к линии, которую применяют для коммерческого получения.
[0072] «Устойчивость» или «устойчивый» обозначает, что говоря о данном компоненте, компонент поддерживается из поколения в поколение и, предпочтительно, по меньшей мере, в трех поколениях.
[0073] «Коммерческая полезность» определена как обладание растением хорошей жизненной силой и высокой плодовитостью, так, что сельскохозяйственная культура может быть получена фермерами с применением обыкновенного сельскохозяйственного оборудования, и масло с описанными компонентами может быть экстрагировано из семян с применением обыкновенного дробления и экстракционного оборудования.
[0074] «Агрономически элитный» обозначает, что линия обладает желательными агрономическими характеристиками, такими как урожай, созревание, устойчивость к заболеваниям и т.п., в дополнение к устойчивости к насекомым и устойчивости к гербицидам благодаря рассматриваемому объекту(ам). Любая и все эти агрономические характеристики и точки данных могут быть применены для идентификации таких растений, либо как точки, либо с обоих концов или оба конца диапазона характеристик, применяемых для определения таких растений.
[0075] Как специалист в области техники признает в свете этого раскрытия, предпочтительные варианты осуществления наборов для обнаружения, например, могут включать зонды и/или праймеры, направленные на и/или включающие «примыкающие последовательности» или «переходные последовательности» (где геномная фланкирующая последовательность сои встречается с последовательностью вставки). Например, это включает полинуклеотидные зонды, праймеры и/или ампликоны, разработанные для идентификации одной или обеих примыкающих последовательностей (где вставка встречается с фланкирующей последовательностью), как указано в таблице выше. Один общий дизайн подразумевает содержание одного праймера, который гибридизирует во фланкирующой области, и одного праймера, который гибридизирует на вставке. Каждый из таких праймеров часто содержит приблизительно, по меньшей мере, ~15 остатков в длину. С этим расположением праймеры могут быть применены для образования/амплифицирования обнаруживаемого ампликона, который указывает на присутствие объекта по рассматриваемому изобретению. Эти праймеры могут быть применены для образования ампликона, который охватывает (и включает) примыкающую последовательность, как указано выше.
[0076] Праймер(ы), «садящиеся» на фланкирующую последовательность, как правило, не разработаны для гибридизации вне приблизительно 1200 оснований или около того вне облсти примыкания. Таким образом, типичные фланкирующие праймеры разрабатываются так, чтобы включать, по меньшей мере, 15 остатков любой из нитей в пределах 1200 оснований во фланкирующей последовательности от начала вставки. Таким образом, праймеры, включающие последовательность соответствующего размера от (или гибридизирующие к) пар азотистых оснований 800-1400 из SEQ ID NO:14 и/или пар азотистых оснований 13897-14497 из SEQ ID NO:14, входят в объем рассматриваемого изобретения. Праймеры для вставки могут аналогично быть разработаны для любой области, кроме пар оснований 1400-2000 из SEQ ID NO:14 и/или пар оснований 13297-13896 из SEQ ID NO:14, и могут быть применены, например, неисключительно для такого дизайна праймера.
[0077] Специалист в области техники также признает, что праймеры и зонды могут быть разработаны, чтобы гибридизировать в диапазоне стандартной гибридизации и/или в условиях ПЦР, когда праймер или зонд не является совершенно комплементарным последовательности, приведенной в качестве примера. Таким образом, определенная степень несоответствия допускается. Для праймера из приблизительно 20 нуклеотидов, например, как правило, один или два или приблизительно столько нуклеотидов не должны обязательно связываться с противоположной нитью, если несоответствующее основание является внутренним или находится на конце праймера напротив ампликона. Различные подходящие условия гибридизации предоставлены ниже. Синтетические аналоги нуклеотида, такой как инозин, могут также быть применены в зондах. Зонды на основе пептидной нуклеиновой кислоты (ПНК), так же как ДНК и зонды РНК, также могут быть применены. Важно то, что такие зонды и праймеры являются диагностическими для (способны уникально идентифицировать и различать) присутствия объектов по рассматриваемому изобретению.
[0078] Нужно отметить, что в ПЦР амплификации могут встретиться ошибки, которые могут приводить к незначительными ошибками секвенирования, например. Таким образом, если иначе не указано, последовательности, перечисленные в настоящем описании, были определены путем создания длинных ампликонов из геномных ДНК сои с последующим клонированием и секвенирование ампликонов. Весьма обычно обнаружение незначительных различий и незначительных несоответствий в последовательностях, полученных и определенных таким образом, учитывая множество циклов амплификации, которые необходимы для получения достаточного количества ампликона для секвенирования из геномных ДНК. Специалист в области техники признает и возьмет на заметку, что любые корректировки, необходимые в результате этих типов общих ошибок секвенирования или несоответствий, входят в объем рассматриваемого изобретения.
[0079] Нужно также отметить, что весьма обычно удаление некоторой геномной последовательности, например, когда последовательность была вставлена во время создания объекта. Таким образом, например, некоторые различия могут также появляться между рассматриваемыми фланкирующими последовательностями и геномными последовательностями, перечисленными в GENBANK.
[0080] Компоненты «вставки» последовательности ДНК проиллюстрированы на фигурах и рассмотрены более подробно ниже в примерах. Полинуклеотидные последовательности ДНК этих компонент или их фрагменты могут быть применены в качестве праймеров или зондов ДНК в способах по настоящему изобретению.
[0081] В некоторых вариантах осуществления настоящего изобретения представлены композиции и способы для обнаружения присутствия области трансгенной/геномной вставки в растениях и семенах и т.п. из растения сои. Представлены последовательности ДНК, которые включают рассматриваемую примыкающую последовательность с 5'-областью трансгенной/геномной вставки, приведенную в настоящем описании (между парами оснований 800-1400 из SEQ ID NO:14), ее сегменты и последовательности, комплементарные ей, и любые их сегменты. В настоящем описании представлены ДНК последовательности, которые включают рассматриваемую примыкающую последовательность с 3'-областью трансгенной/геномной вставки (между парами оснований 13897-14497 из SEQ ID NO:14), их сегменты и последовательности, комплементарные приведенным в качестве примера, и любые их сегменты. Примыкающая последовательность с областью вставки охватывает область смыкания между гетерологичной ДНК, введенной в геном, и ДНК из клетки сои, примыкающей к участку вставки. Такие последовательности могут быть диагностическими для данного объекта.
[0082] На основе этих вставляемых и пограничных последовательностей могут быть получены объект-специфические праймеры. Анализ ПЦР продемонстрировал, что линии сои по рассматриваемому изобретению могут быть идентифицированы в различных генотипах сои анализом ампликонов ПЦР, образующихся с этими объект-специфическими наборами праймеров. Эти и другие соответствующие процедуры могут быть применены для того, чтобы уникально идентифицировать эти линии сои. Таким образом, ампликоны ПЦР, получаемые из таких пар праймеров, являются уникальными и могут быть применены для идентификации этих линий сои.
[0083] В некоторых вариантах осуществления последовательности ДНК, которые включают смежный фрагмент области новой трансгенной/геномной вставки, являются аспектом этого изобретения. Включены последовательности ДНК, которые включают последовательность с достаточной длиной полинуклеотидов вставки трансгена и геномную последовательность сои с достаточной длиной полинуклеотидов из одного или более трех вышеуказанных растений сои и/или последовательностей, которые полезны в качестве праймерных последовательностей для получения продукта ампликона, диагностического для одного или более из этих растений сои.
[0084] Родственные варианты осуществления относятся к последовательностям ДНК, которые включают, по меньшей мере, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 или более смежных нуклеотидов части трансгена последовательности ДНК, идентифицированной в настоящем описании (такой как SEQ ID NO:1 и ее сегменты), или комплементарным им и фланкирующей последовательности ДНК сои из этих последовательностей схожей длины или комплементарным им. Такие последовательности полезны в качестве ДНК-праймеров в способах амплификации ДНК. Ампликоны, образующиеся с применением этих праймеров, являются диагностическими для любого из объектов сои, на которые есть ссылки в настоящем описании. Поэтому, настоящее изобретение также включает ампликоны, образующиеся такими ДНК-праймерами и гомологическими праймерами.
[0085] Это изобретение также включает способы обнаружения присутствия ДНК в образце, соответствующей объекту сои, на которое приведена ссылка в настоящем описании. Такие способы могут включать: (a) приведение в контакт образца, включающего ДНК с набором праймеров, который при применении в реакции амплификации нуклеиновой кислоты с ДНК из, по меньшей мере, одного из этих объектов сои, образует ампликон, который является диагностическим для указанного объекта(ов); (b) осуществление реакции амплификации нуклеиновой кислоты, таким образом, получая ампликон; и (c) обнаружение ампликона.
[0086] Дополнительные способы обнаружения по рассматриваемому изобретению включают способ обнаружения присутствия ДНК в образце, соответствующей указанному объекту, где указанный способ включает: (a) приведение в контакт образца, включающего ДНК, с зондом, который гибридизирует в жестких условиях гибридизации с ДНК из, по меньшей мере, одного из указанных объектов сои, и который не гибридизирует в жестких условиях гибридизации с контрольным растением сои (ДНК объект не представляющий интерес); (b) создание для образца и зонда жестких условий гибридизации; и (c) обнаружение гибридизации зонда с ДНК.
[0087] Во все еще дополнительных вариантах осуществления рассматриваемое изобретение включает способы получения растения сои, включающего объект сои 9582.814.19.1 по рассматриваемому изобретению, где указанный способ включает стадии: (a) полового скрещивания первой родительской линии сои (включение кассеты экспрессии по настоящему изобретению, которые придают растениям указанной линии устойчивость к глуфосинату) и второй родительской линии сои (у которой нет этого признака устойчивости к гербицидам), таким образом, образуя множество растений потомства; и (b) отбор растения потомства при помощи молекулярных маркеров. Такие способы могут, по желанию, включать дополнительный шаг обратного скрещивания растения потомства со второй родительской линией сои для получения растения сои чистосортным разведением, которое имеет признаки устойчивости к насекомым и глуфосинату.
[0088] Согласно другому аспекту настоящего изобретения, предоставлены способы определения зиготности потомства скрещивания с указанным объектом. Указанные способы могут включать приведение в контакт образца, включающего ДНК сои, с набором праймеров по рассматриваемому изобретению. Указанные праймеры, при применении в реакции амплификации нуклеиновой кислоты с геномной ДНК из, по меньшей мере, одного из указанных объектов сои, образуют первый ампликон, который является диагностическим для, по меньшей мере, одного из указанных объектов сои. Такие способы дополнительно включают осуществление реакции амплификации нуклеиновой кислоты, таким образом, получая первый ампликон; обнаружение первого ампликона; и приведение в контакт образца, содержащего ДНК сои, со вторым набором праймеров (указанный второй набор праймеров, при применении в реакции амплификации нуклеиновой кислоты с геномной ДНК из растений сои, образует второй ампликон, включающий естественную геномную ДНК сои, гомологическую геномной области сои); и осуществление реакции амплификации нуклеиновой кислоты, таким образом, получая второй ампликон. Способы дополнительно включают обнаружение второго ампликона и сравнение первого и второго ампликонов в образце, в котором присутствие обоих ампликонов указывает на то, что образец является гетерозиготным для вставки трансгена.
[0089] Наборы для обнаружения ДНК могут быть разработаны с применением композиций, раскрытых в настоящем описании и способов, известных в области техники обнаружения ДНК. Наборы являются полезными для идентификации ДНК рассматриваемого объекта сои в образце и могут быть применены в способах размножения растений сои, содержащих эту ДНК. Наборы содержат последовательности ДНК, гомологические или комплементарные ампликонам, например, раскрытым в настоящем описании, или к последовательностям ДНК, гомологическим или комплементарным к ДНК, содержащимся в генетических элементах трансгена рассматриваемых объектов. Эти последовательности ДНК могут быть применены в реакциях амплификации ДНК или в качестве зондов в способе ДНК-гибридизации. Наборы могут также содержать реагенты и материалы, необходимые для осуществления способа обнаружения.
[0090] «Зонд» представляет собой изолированную молекулу нуклеиновой кислоты, к которой присоединена обыкновенная обнаруживаемая метка или репортерная молекула (такая как радиоактивный изотоп, лиганд, хемилюминесцентный агент или фермент). Такой зонд является комплементарным к нити таргетной нуклеиновой кислоты, в случае настоящего изобретения, к нити геномной ДНК из одного из указанных объектов сои, неважно, из растения сои или из образца, включающего ДНК из объектов. Зонды согласно настоящему изобретению включают не только дезоксирибонуклеиновые или рибонуклеиновые кислоты, но также и полиамиды и другие вещества зондов, которые специфически связываются с таргетной последовательностью ДНК и могут быть применены для обнаружения присутствия этой таргетной последовательности ДНК.
[0091] «Праймеры» представляют собой изолированные/синтезированные нуклеиновые кислоты, отожженые до комплементарной нити таргетной ДНК гибридизацией нуклеиновой кислоты, с образованием гибрида между праймером и нитью таргетной ДНК, затем удлиненные вдоль нити таргетной ДНК полимеразой, например, ДНК полимеразой. Пары праймеров по настоящему изобретению относятся к их применению для амплификации последовательности таргетной нуклеиновой кислоты, например, путем полимеразной цепной реакции (ПЦР) или другими обычными способами амплификации нуклеиновой кислоты.
[0092] Зонды и праймеры, как правило, имеют 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 259, 260, 261, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274, 275, 276, 277, 278, 279, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289, 290, 291, 292, 293, 294, 295, 296, 297, 298, 299, 300, 301, 302, 303, 304, 305, 306, 307, 308, 309, 310, 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 321, 322, 323, 324, 325, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 336, 337, 338, 339, 340, 341, 342, 343, 344, 345, 346, 347, 348, 349, 350, 351, 352, 353, 354, 355, 356, 357, 358, 359, 360, 361, 362, 363, 364, 365, 366, 367, 368, 369, 370, 371, 372, 373, 374, 375, 376, 377, 378, 379, 380, 381, 382, 383, 384, 385, 386, 387, 388, 389, 390, 391, 392, 393, 394, 395, 396, 397, 398, 399, 400, 401, 402, 403, 404, 405, 406, 407, 408, 409, 410, 411, 412, 413, 414, 415, 416, 417, 418, 419, 420, 421, 422, 423, 424, 425, 426, 427, 428, 429, 430, 431, 432, 433, 434, 435, 436, 437, 438, 439, 440, 441, 442, 443, 444, 445, 446, 447, 448, 449, 450, 451, 452, 453, 454, 455, 456, 457, 458, 459, 460, 461, 462, 463, 464, 465, 466, 467, 468, 469, 470, 471, 472, 473, 474, 475, 476, 477, 478, 479, 480, 481, 482, 483, 484, 485, 486, 487, 488, 489, 490, 491, 492, 493, 494, 495, 496, 497, 498, 499, 500 или 1000 или 2000 или 5000 или более полинуклеотидов в длину. Такие зонды и праймеры гибридизируют специфически с таргетной последовательностью в очень жестких условиях гибридизации. Предпочтительно, зонды и праймеры согласно настоящему изобретению имеют полную схожесть последовательности с таргетной последовательностью, несмотря на это обычными способами могут быть разработаны зонды, отличающиеся от таргетной последовательности и которые сохраняют способность гибридизировать с таргетной последовательностью.
[0093] Способы получения и применения зондов и праймеров описаны, например, в Molecular Cloning: A Laboratory Manual, 2-е издание, том 1-3, под редакцией Sambrook et al., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, Нью-Йорк, 1989. Пары ПЦР-праймер могут быть получены из известной последовательности, например, с применением компьютерных программ, предназначенных для этой цели.
[0094] Праймеры и зонды на основе фланкирующей ДНК и последовательностей-вставок, раскрытых в настоящем описании, могут быть применены для подтверждения (и, в случае необходимости, исправления) раскрытых последовательностей обычными способами, например, путем повторного клонирования и секвенирования таких последовательностей.
[0095] Зонды нуклеиновой кислоты и праймеры по настоящему изобретению гибридизируют в жестких условиях с таргетной последовательностью ДНК. Любая обычная гибридизация нуклеиновой кислоты или способ амплификации могут быть применены для идентификации присутствия ДНК из трансгенного объекта в образце. Молекулы нуклеиновой кислоты или ее фрагменты способны к специфической гибридизации с другими молекулами нуклеиновой кислоты при определенных условиях. Как применено в настоящем описании, говорят, что две молекулы нуклеиновой кислоты способны специфически гибридизировать друг с другом, если эти две молекулы способны образовывать антипараллельную, двухниточную структуру нуклеиновой кислоты. Говорят, что молекула нуклеиновой кислоты является «комплементарной» другой молекуле нуклеиновой кислоты, если они демонстрируют полную комплементарность. Как применено в настоящем описании, говорят, что молекулы демонстрируют «полную комплементарность», когда каждый нуклеотид одной из молекул комплементарен нуклеотиду другого. Говорят, что две молекулы являются «минимально комплементарными», если они могут гибридизировать друг с другом с достаточной устойчивостью для того, чтобы оставаться связанными друг с другом в, по меньшей мере, обычных «мягких» условиях. Точно так же, говорят, что молекулы «комплементарны», если они могут гибридизировать друг с другом с достаточной устойчивостью, чтобы оставаться связанными друг с другом в обычных «жестких» условиях. Обычные жесткие условия описаны авторами Sambrook et al., 1989. Поэтому допустимы отклонения от полной комплементарности при условии, что такие отклонения не полностью препятствуют способности молекул образовывать двухниточную структуру. Для того, чтобы молекула нуклеиновой кислоты служила праймером или зондом, она должна только быть достаточно комплементарной в последовательности, чтобы быть способной образовывать устойчивую двухниточную структуру в специфическом применяемом растворителе и концентрациях солей.
[0096] Как применено в настоящем описании, по существу гомологическая последовательность является последовательностью нуклеиновой кислоты, которая специфически гибридизирует с последовательностью, комплементарной последовательности нуклеиновой кислоты, с которой она сравнивается в жестких условиях. Термин «жесткие условия» функционально определен относительно гибридизации зонда нуклеиновой кислоты с таргетной нуклеиновой кислотой (т.е. с конкретной последовательностью нуклеиновой кислоты, представляющей интерес) путем процедуры специфической гибридизации, рассмотренной в Sambrook et al., 1989, в 9.52-9.55. См. также, Sambrook et al., 1989 в 9.47-9.52 и 9.56-9.58. Соответственно, нуклеотидные последовательности по настоящему изобретению могут быть применены благодаря их способности селективно образовывать двойные молекулы с комплементарными удлинениями фрагментов ДНК.
[0097] В зависимости от предполагаемого применения можно применять варьирующие условия гибридизации для достижения различных степеней селективности зонда по отношению к таргетной последовательности. Для применений, требующих высокой селективности, как правило, применяют относительно жесткие условия для образования гибридов, например, выбирают условия с относительно низким содержанием соли и/или высокой температурой, такие как обеспечиваемые от приблизительно 0,02 М до приблизительно 0,15 М NaCl при температурах от приблизительно 50°C до приблизительно 70°C. Жесткие условия, например, могут включать промывание фильтра для гибридизации, по меньшей мере, дважды промывочным буфером высокой жесткости (0,2X SSC, 0,1% SDS, 65°C). Соответствующие условия жесткости, которые ускоряют ДНК-гибридизацию, например, 6,0X хлорид натрия/цитрат натрия (SSC) при приблизительно 45°C с последующим промыванием 2,0X SSC при 50°C, известны специалистам в области техники. Например, концентрация соли в стадии промывания может быть выбрана от низкой жесткости приблизительно 2,0X SSC при 50°C до высокой жесткости приблизительно 0,2X SSC при 50°C. Кроме того, температура в стадии промывания может быть увеличена с условий низкой жесткости при комнатной температуре, приблизительно 22°C, до условий высокой жесткости при приблизительно 65°C. И температура и содержание соли могут быть различными, или либо температура, либо концентрация соли может поддерживаться постоянной, в то время как другая переменная изменяется. В таких селективных условиях возможно малое, если таковое вообще возможно, несоответствие между зондом и образцовой или таргетной нитью. Обнаружение последовательностей ДНК посредством гибридизации известно специалистам в области техники, и руководства патента США № 4965188 и 5176995 являются типовыми для способов гибридизационного анализа.
[0098] В особенно предпочтительном варианте осуществления нуклеиновая кислота по настоящему изобретению специфически гибридизирует с одним или более праймеров (или ампликонов или других последовательностей), приведенных в качестве примера или предложенных в настоящем описании, включая комплементарные им последовательности и их фрагменты, в жестких условиях. В одном аспекте настоящего изобретения молекула маркерной нуклеиновой кислоты по настоящему изобретению имеет последовательность нуклеиновой кислоты как указано в настоящем описании в одной из последовательностей, приведенных для примера, или комплементарных им и/или их фрагментов.
[0099] В другом аспекте настоящего изобретения молекула маркерной нуклеиновой кислоты по настоящему изобретению имеет между 80% и 100% или 90% и 100% идентичности последовательности с таковыми последовательностями нуклеиновой кислоты. В дополнительном аспекте настоящего изобретения молекула маркерной нуклеиновой кислоты по настоящему изобретению имеет между 95% и 100% идентичности последовательности с такой последовательностью. Такие последовательности могут быть применены в качестве маркеров в способах разведения растений для идентификации потомства генетических скрещиваний. Гибридизация зонда с таргетной молекулой ДНК может быть обнаружена любым количеством способов, известных специалистам в области техники, они могут включать, но не ограничены ими, флуоресцентные метки, радиоактивные метки, метки на основе антител и хемилюминесцентные метки.
[00100] В отношении амплификации таргетной последовательности нуклеиновой кислоты (например, путем ПЦР) с применением конкретной пары праймеров амплификации, «жесткие условия» представляют собой условия, которые позволяют паре праймеров гибридизировать только с таргетной последовательностью нуклеиновой кислоты, с которой праймер, содержащий соответствующую последовательность дикого типа (или комплементарную ей), мог бы связаться и, предпочтительно, образовать уникальный продукт амплификации, ампликон.
[00101] Термин «специфический для (таргетная последовательность)» указывает на то, что зонд или праймер гибридизируют в жестких условиях гибридизации только с таргетной последовательностью в образце, включающем таргетную последовательность.
[00102] Как применено в настоящем описании, «амплифицированная ДНК» или «ампликон» относятся к продукту амплификации нуклеиновой кислоты таргетной последовательности нуклеиновой кислоты, которая является частью матрицы нуклеиновой кислоты. Например, чтобы определить, содержит ли растение сои, полученное половым скрещиванием, трансгенный объект геномной ДНК из растения сои по настоящему изобретению, ДНК, изолированная из образца ткани растения сои, может быть подвергнута способу амплификации нуклеиновой кислоты с применением пары праймеров, которая включает праймер, полученный из фланкирующей последовательности в геноме растения, смежной с участком вставки введенной гетерологичной ДНК, и второй праймер, получаемый из введенной гетерологичной ДНК для получения ампликона, который является диагностическим для присутствия ДНК объекта. Ампликон имеет длину и последовательность, которая также является диагностической для объекта. Ампликон может варьировать в длину от общей длины пар праймеров с одной парой нуклеотидных оснований и/или до общей длины пар праймеров с приблизительно 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 259, 260, 261, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274, 275, 276, 277, 278, 279, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289, 290, 291, 292, 293, 294, 295, 296, 297, 298, 299, 300, 301, 302, 303, 304, 305, 306, 307, 308, 309, 310, 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 321, 322, 323, 324, 325, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 336, 337, 338, 339, 340, 341, 342, 343, 344, 345, 346, 347, 348, 349, 350, 351, 352, 353, 354, 355, 356, 357, 358, 359, 360, 361, 362, 363, 364, 365, 366, 367, 368, 369, 370, 371, 372, 373, 374, 375, 376, 377, 378, 379, 380, 381, 382, 383, 384, 385, 386, 387, 388, 389, 390, 391, 392, 393, 394, 395, 396, 397, 398, 399, 400, 401, 402, 403, 404, 405, 406, 407, 408, 409, 410, 411, 412, 413, 414, 415, 416, 417, 418, 419, 420, 421, 422, 423, 424, 425, 426, 427, 428, 429, 430, 431, 432, 433, 434, 435, 436, 437, 438, 439, 440, 441, 442, 443, 444, 445, 446, 447, 448, 449, 450, 451, 452, 453, 454, 455, 456, 457, 458, 459, 460, 461, 462, 463, 464, 465, 466, 467, 468, 469, 470, 471, 472, 473, 474, 475, 476, 477, 478, 479, 480, 481, 482, 483, 484, 485, 486, 487, 488, 489, 490, 491, 492, 493, 494, 495, 496, 497, 498, 499, или 500, 750, 1000, 1250, 1500, 1750, 2000 или более пар нуклеотидных оснований (плюс или минус любое из указанных выше приращений). Альтернативно, пара праймеров может быть получена из фланкирующей последовательности с обеих сторон введенной ДНК так, чтобы получить ампликон, который включает всю нуклеотидную последовательность вставки. Звено пары праймеров, полученной из геномной последовательности растения, может быть расположено на расстоянии от введенной последовательности ДНК. Это расстояние может колебаться от одной пары нуклеотидных оснований до приблизительно двадцати тысяч пар нуклеотидных оснований. Применение термина «ампликон» специфично исключает димеры праймеров, которые могут быть образованы в термической реакции амплификации ДНК.
[0103] Амплификация нуклеиновой кислоты может быть выполнена любым из различных способов амплификации нуклеиновой кислоты, известных в области техники, включая полимеразную цепную реакцию (ПЦР). Множество способов амплификации известно в области техники и описано, среди прочего, в патенте США № 4683195 и патенте США № 4683202. Способы амплификации путем ПЦР разрабатывались для амплификации до 22 кб геномной ДНК. Эти способы так же как другие способы, известные в области техники амплификации ДНК, могут быть применены на практике настоящего изобретения. Последовательность гетерологичной трансгенной ДНК вставки или фланкирующая геномная последовательность из рассматриваемого объекта сои может быть подтверждена (и скорректирована в случае необходимости) путем амплификации таких последовательностей из объекта с применением праймеров, получаемых из последовательностей, приведенных здесь, с последующим стандартным ДНК секвенированием ампликона ПЦР или клонированной ДНК.
[0104] Ампликон, образующийся этими способами, может быть обнаружен множеством способов. Электрофорез на геле агарозы и окрашивание бромидом этидия являются общим известным способом обнаружения ампликонов ДНК. Другим таким способом является анализ Genetic Bit Analysis, в котором разрабатывается такой олигонуклеотид ДНК, что он накладывается и на смежную фланкирующую геномную последовательность ДНК и на введенную последовательность ДНК. Олигонуклеотид закрепляют в лунках микролуночного планшета. Следом за ПЦР интересующей области (с применением одного праймера во введенной последовательности и одного в смежной фланкирующей геномной последовательности), одноцепочечный продукт ПЦР может быть гибридизирован с зафиксированным олигонуклеотидом и может служить матрицей для реакции удлинения с одним основанием с применением ДНК полимеразы и маркированных дидезоксинуклеотидов, специфических к ожидаемому следующему основанию. Считывание может быть флуоресцентным или основанным на ELISA. Сигнал указывает на присутствие вставленной/фланкирующей последовательности в результате успешной амплификации, гибридизации и удлинения цепи на одно основание.
[0105] Другой способ пиросеквенирования описан Winge (Innov. Pharma. Tech. 00:18-24, 2000). В этом способе применяют такой олигонуклеотид, который накладывается на смежную геномную ДНК и на вставленную примыкающую ДНК. Олигонуклеотид гибридизирует с одноцепочечным продуктом ПЦР из представляющей интерес области (один праймер во введенной последовательности и один во фланкирующой геномной последовательности) и инкубируется в присутствии полимеразы ДНК, АТФ, сульфурилазы, луциферазы, апиразы, аденозин-5' фосфосульфата и люциферина. дНТФ добавляют по отдельности и добавление приводит к получению светового сигнала, который измеряют. Световой сигнал указывает на присутствие трансгенной вставляемой/примыкающей последовательности благодаря успешной амплификации, гибридизации и удлинения цепи на одно или много оснований.
[0106] Флюоресцентная поляризация является другим способом, который может быть применен для обнаружения ампликона по настоящему изобретению. По этому способу применяют такой олигонуклеотид, который накладывается на геномную фланкирующую и примыкающую последовательность ДНК. Олигонуклеотид гибридизирует с одноцепочечным продуктом ПЦР из представляющей интерес области (один праймер во введенной ДНК и один во фланкирующой геномной последовательности ДНК) и инкубируется в присутствии полимеразы ДНК и флуоресцентно маркированного ддНТФ. Удлинение на одно основание приводит к включению ддНТФ. Включение может быть измерено по изменению поляризации с применением флуорометра. Изменение в поляризации указывает на присутствие трансгенной вставленно/фланкирующей последовательности благодаря успешной амплификации, гибридизации и удлинению на одно основание.
[0107] TAQMAN® (PE Applied Biosystems, Фостер-Сити, Калифорния) является способом обнаружения и определения количества присутствующей последовательности ДНК. Кратко, разрабатывают такой олигонуклеотидный зонд FRET, который накладывается на геномную фланкирующую и вставленную последовательность ДНК. Зонд FRET и ПЦР-праймеры (один праймер находится в области вставленной последовательности ДНК и один в области фланкирующей геномной последовательности) циклически амплифицируются в присутствии термоустойчивой полимеразы и дНТФ. Во время специфической амплификации Taq ДНК полимераза выщепляет и высвобождает флуоресцентный фрагмент из связи с гасителем на зонде FRET. Флуоресцентный сигнал указывает на присутствие последовательности вставки примыкания/трансгена из-за успешной амплификации и гибридизации.
[0108] Молекулярные маяки описаны для применения в секвенировании. Кратко, разрабатывают такой олигонуклеотидный зонд FRET, который накладывается на геномную фланкирующую и вставленную последовательность ДНК. Уникальная структура зонда FRET приводит к тому, что в содержащейся в нем вторичной структуре, находятся флуоресцентные и гасящие фрагменты в непосредственной близости. Зонд FRET и ПЦР-праймеры (один праймер в ДНК-вставке и один во фланкирующой геномной последовательности) циклизуются в присутствии термоустойчивой полимеразы и дНТФ. После успешной амплификации ПЦР, гибридизация зонда FRET с таргетной последовательностью приводит к исчезновению вторичной структуры зонда и пространственному разделению флуоресцентных и гасящих фрагментов. Появляется флуоресцентный сигнал. Флуоресцентный сигнал указывает на присутствие фланкирующой геномной/трансгенной последовательности-вставки в результате успешной амплификации и гибридизации.
[0109] Раскрыв место в геноме сои, которое превосходно подходит для вставки, рассматриваемое изобретение также включает семя сои и/или растение сои, включающее, по меньшей мере, один не соевый объект-вставку 9582.814.19.1 в близкой окрестности этого места в геноме. Одним вариантом является замена на другую вставку вместо объекта сои pDAB9582.814.19.1, приведенного в качестве примера в настоящем описании. С этих общих позиций, направленная гомологическая рекомбинация, например, может быть применена согласно рассматриваемому изобретению. Этот тип технологии является предметом, например, WO 03/080809 A2 и соответствующей опубликованной заявки США (US 20030232410). Таким образом, рассматриваемое изобретение включает растения и растительные клетки, включающие гетерологичную вставку (вместо или вместе с мультикопиями генов cry1F, cry1Ac или pat), фланкирующую со всеми или распознаваемой частью фланкирующих последовательностей, идентифицированных в настоящем описании (п.о. 1-1400 из SEQ ID NO:1 и п.о. 153-1550 из SEQ ID NO:2). Дополнительная копия (или дополнительные копии) cry1F, cry1Ac или pat могут также быть нацелены на вставку таким/такими путем(ями).
[0110] Все патенты, патентные заявки, предварительные заявки и публикации, на которые сделаны ссылки или приведенные в настоящем описании, полностью включены посредством ссылки в такой степени, когда они не являются несоответствующими подробными инструкциями этой спецификации.
[0111] Следующие примеры включены для иллюстрации процедур для практики настоящего изобретения и для демонстрации определенных предпочтительных вариантов осуществления настоящего изобретения. Эти примеры не должны быть рассмотрены как ограничение. Специалистам в области техники будет ясно, что способы, раскрытые в следующих примерах, представляют собой определенные подходы, применяемые для иллюстрации предпочтительных режимов для его осуществления на практике. Однако, специалисты в области техники, в свете настоящего раскрытия, оценят, что много изменений может быть сделано в этих специфических вариантах осуществления, все еще получая при этом схожие или подобные результаты, не отступая от сущности и объема настоящего изобретения. Если иначе не указано, все проценты являются массовыми, и все доли растворителя в смеси являются объемными, если не указано иначе.
[0112] Применены следующие аббревиатуры, если не указано иначе.
[0113] Варианты осуществления настоящего изобретения дополнительно определены в следующих примерах. Необходимо понимать, что эти примеры приведены только для иллюстрации. Из вышеуказанного обсуждения и этих примеров специалист в области техники может удостовериться в существенных характеристиках этого изобретения, и не отступая от его сущности и объема, может вносить различные изменения и модификации в варианты осуществления изобретения для его адаптации к различным применениям и условиям. Таким образом, различные модификации вариантов осуществления настоящего изобретения, в дополнение к показанным и описанным здесь, будут очевидны специалистам в области техники из предшествующего описания. Подразумевается, что такие модификации также попадают в объема приложенной формулы изобретения.
[0114] Раскрытие каждой ссылки, приведенной в настоящем описании, включено в настоящее описание полностью посредством ссылки.
ПРИМЕРЫ
Пример 1: Трансформация и выбор Cry1F и Cry1Ac объекта сои pDAB9582.814.19.1
[0115] Трансгенную сою (Glycine max), содержащую объект сои pDAB9582.814.19.1, создали посредством Agrobacterium-опосредованной трансформации эксплантатов семядольного узла сои. Нейтрализованный штамм Agrobacterium EHA101 (Hood et al., 1993), несущий бинарный вектор pDAB9582 (фиг.1), содержащий селектируемый маркер pat v6 и представляющие интерес гены cry1F v3 и cry1Ac synpro внутри T-цепочки ДНК, применяли для инициирования трансформации. Последовательность ДНК для pDAB9582 приведена в SEQ ID NO:3, которая аннотирована ниже в таблице 1.
Генетические элементы, расположенные на pDAB9582
[0116] Agrobacterium-опосредованную трансформацию осуществляли с применением модифицированной процедуры Zeng et al. (2004). Кратко, семена сои (cv Maverick) проращивали на базальных средах, и семядольные узлы выделяли и заражали Agrobacterium. Инициация отростков, удлинение отростков и укоренение в среде подкрепляли цефотаксимом, тиментином и ванкомицином для удаления Agrobacterium. Выборку глуфосината применяли для ингибирования роста нетрансформированных отростков. Выбранные отростки переносили в питательную среду для укоренения и развития корня и затем переносили в почвенную смесь для адаптации сеянцев.
[0117] Листовую поверхность концевых листочков отобранных сеянцев окрашивали глуфосинатом, чтобы скринировать на предполагаемые трансформанты. Скринированные сеянцы переносили в оранжерею, позволяли акклиматизироваться и затем окрашивали листовую поверхность глуфосинатом, чтобы гарантировать устойчивость и считать предполагаемыми трансформантами. Отбирали образцы скринированых растений и проводили молекулярные анализы для подтверждения селектируемого маркерного гена и/или представляющего интерес гена. Растениям T0 позволяли самоопыляться в оранжерее, чтобы получить семена T1.
[0118] Этот объект, объект сои pDAB9582.814.19.1, получали из независимого трансформированного изолята. Растения T1 скрещивали обратным скрещиванием и проводили интрогрессию в элитные сорта в последующих поколениях. Объект выбирали на основе его уникальных характеристик, таких как участок единичного встраивания, нормальная Менделевская сегрегация, устойчивая экспрессия и превосходная комбинация действия, включая действие устойчивости к гербицидам и агрономическое действие. Следующие примеры содержат данные, которые были применены для характеристики объекта в сое pDAB9582.814.19.1.
Пример 2: Исследование Экспрессии Белка в Объекте Сои pDAB9582.814.19.1
[0119] Характеризовали биохимические свойства рекомбинантных белков Cry1F, Cry1Ac и PAT, экспрессируемых в объекте сои 9582.814.19.1. Количественный твердофазный иммуноферментный анализ (ELISA) является биохимическим анализом, известным в области техники, который может быть применен для характеристики биохимических свойств белков и подтверждения экспрессии этих белков в объекте сои 9582.814.19.1.
Пример 2.1: Экспрессия белков PAT, Cry1F и Cry1Ac в растительных тканях
[0120] Образцы тканей сои выделяли из испытательных растений и подготавливали к анализу экспрессии генов. Белок PAT выделяли из растительных тканей сои фосфатно-солевым буферным раствором, содержащим детергент Твин-20 (PBST), содержащим 0,5% бычьего сывороточного альбумина (BSA). Растительную ткань центрифугировали; собирали водный надосадочный раствор, разбавляли соответствующим буфером по мере необходимости и анализировали с применением набора PAT ELISA в многослойном формате. Набор применяли по предложенному протоколу изготовителя (Envirologix, Portland, ME). В этом анализе измеряли экспрессирующийся белок PAT.
[0121] Белок Cry1F экстрагировали из растительных тканей сои фосфатно-солевым буферным раствором, содержащим детергент Твин-20 (PBST). Растительную ткань центрифугировали; собирали водный надосадочный раствор, разбавляли соответствующим буфером по мере необходимости и анализировали с применением набора Cry1F ELISA в многослойном формате. Набор применяли по предложенному протоколу изготовителя (Strategic Diagnostics Inc., Ньюарк, Делавэр). В этом анализе измеряли экспрессируемый белок Cry1F.
[0122] Белок Cry1Ac экстрагировали из растительных тканей сои фосфатно-солевым буферным раствором, содержащим детергент Твин-20 (PBST), содержащим 0,5% бычьего сывороточного альбумина (BSA). Растительную ткань центрифугировали; водный надосадочный раствор собирали, разбавляли соответствующим буфером по мере необходимости и анализировали с применением набора Cry1Ac ELISA в многослойном формате. Набор применяли по предложенному протоколу изготовителя (Strategic Diagnostics Inc., Ньюарк, Делавэр). В этом анализе измеряли экспрессируемый белок Cry1Ac.
[0123] Анализ обнаружения проводили для исследования устойчивости экспрессии и наследуемости, как вертикальной (между поколениями), так и горизонтальной (между клеточными линиями в пределах одного поколения), в объекте сои pDAB9582.814.19.1.
Пример 2.2: Экспрессия белков PAT, Cry1F и Cry1Ac в растительных тканях
[0124] Уровни белков Cry1F, Cry1Ac и PAT определяли в объекте сои 9582.814.19.1. Растворимые, экстрагируемые белки измеряли способом с применением количественного твердофазного иммуноферментного анализа (ELISA) в ткани листа сои. В поколениях от T2 до T6 объектов сои 9582.814.19.1, экспрессирование было устойчивым (не разделяющимся) и согласующимся во всех клеточных линиях. В таблице 2 перечислены средние уровни экспрессии трансгенных белков в объекте сои 9582.814.19.1.
Средний уровень экспрессии различных трансгенных белков в объекте сои pDAB9582.814.19.1.
Пример 3: Клонирование и характеристика последовательности ДНК во вставке и фланкирующих пограничных областях объекта сои pDAB9582.814.19.1
[0125] Чтобы охарактеризовать и описать геномный участок вставки определяли последовательность фланкирующих геномных пограничных областей T-ДНК объекта сои pDAB9582.814.19.1. Геномную последовательность объекта сои pDAB9582.814.19.1 подтверждали, включая 1400 п.о. 5'-фланкирующей пограничной последовательности (SEQ ID NO:1) и 1398 п.о. 3'-фланкирующей пограничной последовательности (SEQ ID NO:2). Амплификация ПЦР на пограничных последовательностях объекта сои pDAB9582.814.19.1 подтвердила, что пограничные области имеют соевое происхождение и что области примыкания являются уникальными последовательностями объекта сои pDAB9582.814.19.1. Области примыкания могут быть применены для объект-специфического определения объекта сои pDAB9582.814.19.1. Кроме того, участок вставки T-нити характеризовали амплификацией геномного фрагмента, соответствующего области идентифицированных фланкирующих пограничных последовательностей из генома нетрансформированной сои. Сравнение объекта сои pDAB9582.814.19.1 с нетрансформированной геномной последовательностью выявило, что во время интеграции T-нити произошло удаление приблизительно 57 п.о. из первоначального локуса. В целом, характеристика вставки и пограничной последовательности объекта сои pDAB9582.814.19.1 указывает на то, что интактная копия T-нити из pDAB9582 присутствовала в геноме сои.
Список праймеров и их последовательностей, примененных в подтверждении геномный ДНК сои в объекте сои pDAB9582.814.19.1.
(от 5' до 3')
AAATAAATCTGCTCC
TCATACAAACCTCCA
Условия для стандартной амплификации ПЦР пограничных областей и объект-специфических последовательностей в объекте сои pDAB9582.814.19.1
(°C/с.)
5'IREnd-01
81419_RV2
81419_RV3
81419_RV2
81419_RV3
81419_RV3
ПЦР смесь для стандартной амплификации ПЦР пограничных областей и объект-специфических последовательностей в объекте сои pDAB9582.814.19.1.
(мкл)
(мкл)
Пример 3.1: Подтверждение Сои Геномные Последовательности
[0126] 5' и 3'- участки фланкирующей области, выравнивают на полногеномную последовательность хромосомы 02, подвергнутой Glycine max фрагментированию, показывая на то, что трансген объекта сои pDAB9582.814.19.1 выровнен по хромосоме 02 генома сои. Чтобы подтвердить область вставки объекта сои pDAB9582.814.19.1 в геноме сои, проводили ПЦР с различными парами праймеров (фиг.2, таблица 3, таблица 4 и таблица 5). Геномную ДНК из объекта сои pDAB9582.814.19.1 и других трансгенных или нетрансгенных линий сои применяли в качестве матрицы. Чтобы подтвердить, что 5'-граничные последовательности являются правильными разрабатывали праймеры для связывания с промотором Ubi10, например AtUbi10RV1 и праймер, разработанный, чтобы связываться с областью клонированной 5'-концевой границей на хромосоме 02 генома сои, праймер, обозначенный 81419_FW3, применяли для амплификации сегмента ДНК, который покрывает область от промотора Ubi10 до 5'-конца граничной последовательности. Схожим образом, для подтверждения клонированной 3'-граничной последовательности применяли pat-специфический праймер, например 3'PATEnd05, и три праймера, разработанных согласно клонированной 3'-граничной последовательности, обозначенных 81419_RV1, 81419_RV2 и 81419_RV3, для амплификации сегментов ДНК, которые покрывают область гена pat до 3'-граничной последовательности. Фрагменты ДНК с ожидаемыми размерами амплифицировали только с геномной ДНК объекта сои pDAB9582.814.19.1 с каждой парой праймеров, но не от образцов ДНК из других трансгенных линий сои или нетрансгенного контроля. Результаты указывают на то, что клонированные 5' и 3'-граничные последовательности являются фланкирующими пограничными последовательностями вставки T-нити для объекта сои pDAB9582.814.19.1.
[0127] Чтобы дополнительно подтвердить ДНК-вставку в геноме сои, проводили ПЦР амплификацию области, покрывающей граничные последовательности сои, проводили на геномной ДНК, которая не содержит вставку T-нити для объекта сои pDAB9582.814.19.1. Праймер 81419_FW3, разработанный согласно 5'-граничной последовательности, и один праймер 81419-RV3, разработанный для 3'-граничной последовательности, применяли для амплификации сегментов ДНК, которые содержат локус, в который интегрирована pDAB9582 T-нить. Как ожидалось, амплификация ПЦР, осуществленная с парой праймеров 81419_FW3 и 81419_RV3, давала фрагмент ДНК размером приблизительно 1,5 кб из всех других контрольных линий сои, кроме pDAB9582.814.19.1. Выравнивание идентифицированных 5' и 3'-граничных последовательностей объекта сои pDAB9582.814.19.1 на полногеномную последовательностью хромосомы 02, фрагментированную с помощью Glycine max, выявило удаление приблизительно 57 п.о. из первоначального локуса. (Фиг.3). Эти результаты продемонстрировали, что трансген объекта сои pDAB8294 был вставлен в участок хромосомы 02 генома сои.
Пример 4: Характеристика объекта сои pDAB9582.814.19.1 при помощи саузерн блоттинга
[0128] Анализ саузерн-блоттинг применяли для установления структуры интеграции объекта сои pDAB9582.814.19.1. В этих экспериментах получили данные, которые продемонстрировали интеграцию и целостность трансгенов cry1Ac и cry1F в пределах генома сои. Объект сои pDAB9582.814.19.1 охарактеризовали как объект полной длины с простой интеграцией, содержащий одну копию единицы транскрипции растения (PTU) cry1Ac и cry1F из плазмиды pDAB9582.
[0129] Данные саузерн-блоттинга указывают на то, что фрагмент T-нити вставлен в геном объекта сои pDAB9582.814.19.1. Подробный саузерн-блотинг проводили с применением зондов, специфичных к определенным генам cry1Ac и cry1F, содержащимся в области интеграции T-нити pDAB9582.814.19.1, и характерных ферментов рестрикции, которые содержат сайты расщепления, расположенные в пределах плазмиды и образующие гибридизирующие фрагменты внутри плазмиды или фрагментов, которые образуют соединение плазмиды с геномной ДНК сои (граничные фрагменты). Молекулярные массы, полученные по результатам саузерн гибридизации для комбинации фермента рестрикции и зонда, были уникальными для объекта и имели свои идентификационные структуры. Эти анализы также показали, что фрагмент плазмиды был введен в геномную ДНК сои без реаранжировки cry1Ac и cry1F PTU.
Пример 4.1: Коллекция образцов листьев сои и выделение геномной ДНК (гДНК)
[0130] Геномную ДНК экстрагировали из ткани листьев, собранных с отдельных растений сои, содержащих объект сои pDAB9582.814.19.1. Кроме того, гДНК выделяли из обычного растения сои Maverick, с генетическим фоном, представительным для линии с отсутствием генов cry1Ac и cry1F. Индивидуальную геномную ДНК экстрагировали из лиофилизированной ткани листа после стандартного метода CTAB (Sambrook et al. (1989)). После экстракции ДНК количественно измеряли спектрофлуорометрически с применением реагента Pico Green (Invitrogen, Карлсбад, Калифорния). Затем ДНК визуализировали на агарозном геле, чтобы подтвердить значения анализа Pico Green и определить качество ДНК.
Пример 4.2: ДНК расщепление и разделение
[0131] Для молекулярной характеристики объекта сои pDAB9582.814.19.1 саузерн-блоттингом расщепляли десять микрограммов (10 мкг) геномной ДНК. Геномную ДНК из объекта сои pDAB9582.814.19.1 и нетрансгенной линии сои Maverick расщепляли путем добавления приблизительно пяти единиц выбранного фермента рестрикции на мг ДНК и соответствующего реакционного буфера к каждому образцу ДНК. Каждый образец инкубировали при приблизительно 37°C в течение ночи. Ферменты рестрикции AseI, HindIII, NsiI и NdeI применяли индивидуально для одиночного расщепления (New England Biolabs, Ипсуич, Массачусетс). Ферменты рестрикции NotI и ApaLI применяли вместе для двойного расщепления (New England Biolabs, Ипсуич, Массачусетс). Кроме того, контрольный образец положительной гибридизации получали путем комбинирования плазмиды ДНК, pDAB9582 с геномной ДНК от нетрансгенного сорта сои, Maverick. Смесь из плазмиды ДНК/геномной ДНК расщепляли с применением тех же самых процедур и фермент рестрикции в качестве испытательных образцов.
[0132] После того, как продукты расщепления инкубировали в течение ночи добавляли 25 мкл QUICK-PRECIP PLUS SOLUTION (Edge Biosystems, Гейтерсбург, Мэриленд) и расщепленные образцы ДНК осаждали изопропанолом. Осажденную таблетку ДНК повторно суспендировали в 15 мкл 1X загрузочного буфера (0,01% бромфенола синего, 10,0 мМ ЭДТА, 10,0% глицерина, 1,0 мМ Трис с pH 7,5). Затем проводили электрофорез образцов ДНК и молекулярных маркеров на 0,85% агарозных гелях с 0,4X TAE буфером (Fischer Scientific, Питсбург, Пенсильвания) при 35 В в течение приблизительно 18-22 часов для достижения разделения фрагмента. Гели окрашивали этилбромидом (Invitrogen, Карлсбад, Калифорния), и ДНК визуализировали под ультрафиолетовым (МКВ) светом.
Пример 4.3: Саузерн-блоттинг и обработка мембраны
[0133] Саузерн-блоттинг осуществляли по существу как описано в Memelink et al. (1994). Кратко, после электрофоретического разделения и визуализации фрагментов ДНК, гели депуринировали посредством 0,25M HCl в течение приблизительно 20 минут, и затем подвергали воздействию денатурирующего раствора (0,4 М NaOH, 1,5 М NaCl) в течение приблизительно 30 минут с последующей обработкой нейтрализирующим раствором (1,5 М NaCl, 0,5 М pH Трис 7,5) в течение, по меньшей мере, 30 минут. Саузерн-блоттинг осуществляли в течение ночи на нейлоновые мембраны с применением капиллярной системы 10X SSC. После переноса ДНК была связана с мембраной перекрестной сшивкой под действием УФ, с последующей краткой промывкой мембраны раствором 2X SSC. Этим способом получали саузерн-блоттинг мембраны, готовые к гибридизации.
Пример 4.4: Мечение ДНК-зонда и гибридизация
[0134] С применением маркированного зонда обнаруживали фрагменты ДНК, связанные с нейлоновой мембраной (таблица 6). Зонды создавали ПЦР-основанным введением дигоксигенин-маркированного нуклеотида (DIG), [DIG-11]-dUTP, во фрагмент ДНК, амплифицированный из плазмиды pDAB9582 с применением праймеров, специфических к генным элементам. Генерацию ДНК-зондов ПЦР синтезом проводили с применением набора PCR DIG Probe Synthesis Kit (Roche Diagnostics, Индианаполис, Индиана) после рекомендуемых изготовителем процедур.
[0135] Маркированные зонды анализировали электрофорезом на агарозном геле для определения их качества и количества. Затем желаемое количество маркированного зонда применяли для гибридизации с таргетной ДНК на нейлоновых мембранах для обнаружения специфических фрагментов с применением процедур по существу так, как описано для DIG EASY HUB SOLUTION (Roche Diagnostics, Индианаполис, Индиана). Кратко, нейлоновые мембраны, содержащие фиксированную ДНК, промывали небольшими порциями 2X SSC и предварительно гибридизировали с 20-25 мл предварительно нагретого DIG EASY HUB SOLUTION в баллонах для гибридизации при приблизительно 45-55°C в течение приблизительно 2 часов в сушильном шкафу для гибридизации. Предгибридизационный раствор затем декантировали и замещали ~15 мл предварительно нагретого раствора DIG EASY HYB SOLUTION, содержащего желаемое количество специфических зондов, денатурировавших в результате кипячения на водяной бане в течение приблизительно пяти минут. Затем стадию гибридизации проводили при приблизительно 45-55°C в течение ночи в сушильному шкафу для гибридизации.
[0136] В конце гибридизации зонда, растворы DIG EASY HYB SOLUTIONS, содержащие зонды, декантировали в чистые тюбики и хранили при приблизительно -20°C. Эти зонды могли быть повторно применены до двух раз согласно способу, рекомендуемому изготовителем. Мембраны промывали небольшими порциями и дважды промывали в чистых пластмассовых емкостях буфером со слабой ионной силой (2X SSC, 0,1% СДС) в течение приблизительно пяти минут при комнатной температуре, с последующим промыванием дважды буфером с высокой ионной силой (0,1X SSC, 0,1% СДС) по 15 минут каждое при приблизительно 65°C. Мембраны промывали небольшими порциями 1X буфер малеиновой кислоты из набора DIG WASH AND BLOCK BUFFER SET (Roche Diagnostics, Индианаполис, Индиана) в течение приблизительно 5 минут. За этим следовало блокирование в 1X блокирующем буфере в течение 2 часов и инкубация с анти-DIG-AP (щелочная фосфатаза) антителом (Roche Diagnostics, Индианаполис, Индиана) в 1X блокирующем буфере также в течение минимум 30 минут. После 2-3 промываний 1X промывочным буфером, специфические ДНК-зонды оставались связанными с мембраной, и DIG-маркированные ДНК стандарты визуализировали с применением хемилюминесцентной системы обнаружения нуклеиновой кислоты CDP-STAR (Roche Diagnostics, Индианаполис, Индиана) по инструкции изготовителя. Мембраны экспонировали к хемилюминесцентной пленке в один или более моментов времени для обнаружения гибридизирующих фрагментов и визуализации стандартов размеров молекул. Пленки проявляли при помощи ALL-PRO 100 PLUS проявителя пленки (Konica Minolta, Осака, Япония), и изображения сканировали. Количество и размеры обнаруженных полос регистрировали для каждого зонда. DIG-маркированный маркер молекулярного веса ДНК II (DIG MWM II) и DIG-маркированный маркер молекулярного веса ДНК VII (DIG MWM VII), видимые после обнаружения DIG как описано, применяли для определения размера гибридизирующего фрагмента в саузерн-блоттинге.
Месторасположение и длина зондов, примененных в саузерн-блоттинге
Пример 4.5: Результаты саузерн-блоттинга
[0137] Ожидаемые и наблюдаемые размеры фрагментов со специфическим расщеплением и зондом, на основе известных участков фермента рестрикции для cry1Ac и cry1F PTU, приведены в таблице 7. Идентифицировали два типа фрагментов по этим расщеплениям и гибридизациям: внутренние фрагменты, где известные ферментные участки примыкают к области зонда и полностью содержащиеся в области вставки cry1Ac и cry1F PTU, и пограничные фрагменты, где известный ферментный участок расположен на одном конце области зонда и второй участок ожидается в геноме сои. Размеры пограничных фрагментов изменяются от объекта к объекту, поскольку в большинстве случаев участки интеграции фрагмента ДНК являются уникальными для каждого объекта. Размеры пограничных фрагментов обеспечивают средства для расположения участка фермента рестрикции относительно интегрированной ДНК и оценки количества ДНК-вставок. Саузерн-блоттинг анализы, выполненные на множестве генераций сои, содержащей объект сои pDAB9582.814.19.1, давали в результате данные, которые указывали на то, что низкокопийные, интактные cry1Ac и cry1F PTU из плазмиды pDAB9582 были вставлены в геном сои объекта сои pDAB9582.814.19.1.
Предсказанные и наблюдаемые гибридизирующие фрагменты в саузерн-блотинг анализе. 1. Ожидаемые размеры фрагментов основаны на карте плазмиды pDAB9582. 2. Наблюдаемые размеры фрагментов оцениваются приблизительно из этих анализов и основываются на указанных размерах фрагментов DIG-маркированного маркера молекулярного веса ДНК II и маркера VII
[0138] Ферменты рестрикции AseI и NsiI связывают и расщепляют уникальные участки рестрикции в плазмиде pDAB9582. Поэтому эти ферменты выбирали для характеристики генной вставки cry1Ac в объект сои pDAB9582.814.19.1. Предполагали, что фрагменты границы >7286 п.о. или >9479 п.о. будут гибридизировать с зондом после расщепления посредством AseI и NsiI, соответственно (таблица 7). Одиночные полосы гибридизации cry1Ac размером приблизительно 7400 и >10000 п.о. наблюдали при расщеплении посредством AseI и NsiI, соответственно. Гибридизация зонда с полосами этого размера указывает на присутствие единственного участка вставки для cry1Ac гена в геноме сои объекта сои pDAB9582.814.19.1. Ферменты рестрикции NotI и ApaLI выбирали для того, чтобы осуществить двойное расщепление и высвобождение фрагмента, который содержит cry1Ac единицу транскрипции растения (PTU; промотор/ген/терминатор) (таблица 7). Предсказанные фрагменты размером 4550 п.о. наблюдали с зондом после двойного расщепления посредством NotI и ApaLI. Результаты, полученные с ферментативным расщеплением образцов pDAB9582.814.19.1 с последующей гибридизацией зонда, указывают на то, что интактный cry1Ac PTU из плазмиды pDAB9582 был вставлен в геном сои объекта сои pDAB9582.814.19.1.
[0139] Ферменты рестрикции NdeI и NsiI связывают и расщепляют участки рестрикции в плазмиде pDAB9582. Поэтому эти ферменты выбирали для того, чтобы характеризовать cry1F генную вставку в объекте сои pDAB9582.814.19.1. Ожидали, что пограничные фрагменты размером >5569 п.о. и >9479 будут гибридизировать с зондом после расщепления посредством NdeI и NsiI, соответственно (таблица 7). Одиночные полосы гибридизации cry1F размером ~7500 п.о. и >10000 п.о. наблюдали при применении NdeI и NsiI, соответственно. Гибридизация зонда с полосами этого размера указывает на присутствие единственного участка вставки для cry1F гена в геноме сои объекта сои pDAB9582.814.19.1. Фермент рестрикции HindIII выбирали для того, чтобы высвободить фрагмент, который содержит cry1F единицу транскрипции растения (PTU; промотор/ген/терминатор) (таблица 7). Ожидаемые фрагменты размером 7732 п.о. наблюдали с зондом после расщепления посредством HindIII. Результаты, полученные с ферментативным расщеплением образцов pDAB9582.814.19.1 с последующей гибридизацией зонда, указывают на то, что интактный cry1F PTU из плазмиды pDAB9582 был вставлен в геном сои объекта сои pDAB9582.814.19.1.
Пример 4.6: Отсутствие последовательностей основы
[0140] Саузерн-блот-анализ также проводили для того, чтобы проверить отсутствие гена устойчивости к спектиномицину (specR), элемента Ori Rep и белка инициирования репликации trfA (trf A элемент), в объекте сои pDAB9582.814.19.1. Никакой специфической гибридизации с устойчивостью к спектиномицину, элементом Ori Rep или trf A, не ожидается, когда соответствующие положительный (pDAB9582 добавленный к геномной ДНК Maverick) и отрицательный (геномная ДНК Maverick) контроли включены в саузерн-блоттинг анализ. После расщепления посредством NsiI и гибридизации со specR специфическим зондом, наблюдали одну ожидаемую полосу размера 15320 п.о. в образце положительного контроля (pDAB9582 добавленный к ДНК Maverick). Зонд specR не гибридизировал с образцами отрицательного контроля и объекта сои pDAB9582.814.19.1. Схожим образом одну ожидаемую полосу размера 15320 п.о. обнаружили в образце положительного контроля (pDAB9582 плюс Maverick), но она отсутствовала в образцах отрицательного контроля и объекте сои pDAB9582.814.19.1 после расщепления посредством NsiI и гибридизации с зондом trfA. Другую ожидаемую полосу размера 5329 п.о. обнаружили в образце положительного контроля (pDAB9582 добавленный к геномной ДНК Maverick), но она отсутствовала в образцах отрицательного контроля и объекте сои pDAB9582.814.19.1 после расщепления посредством NdeI и гибридизации с OriRep специфическим зондом. Эти данные указывают на отсутствие гена устойчивости к спектиномицину, элемента Ori Rep и белка инициирования репликации trfA в объекте сои pDAB9582.814.19.1.
Пример 5: Агрономическое и полевое урожайное испытание и устойчивость к гербицидам
[0141] Для тестирования на агрономические характеристики и эффективность объекта сои pDAB9582.814.19.1 объект высаживали в на испытательном участке в Санта-Исабеле, Пуэрто-Рико в октябре 2010 и феврале 2011. Сорт Maverick, который первоначально трансформировали для получения объекта pDAB9582.814.19.1, высаживали в каждом питомнике и включали в качестве контроля в эксперименты. Семя для питомника T3 получали от отдельно выбранных растений в стадии T2, и семя для питомника T4 получали от отдельно выбранных растений в стадии T3. Четыре линии объекта тестировали в каждой генерации. Каждую линию высаживали на участке шириной в 4 ряда и длиной 7,5 футов. Расстояние между рядами составляло 30 дюймов. Выращивание на участках осуществляли под освещением в течение приблизительно 2,5 недель, чтобы компенсировать короткую продолжительность дня в Пуэрто-Рико. В каждом питомнике распыляли глуфосинат в норме внесения 411 г аэ/га. Один участок контрольных растений Maverick обрызгивали с той же нормой внесения глуфосината, а второй участок не обрызгивали и он служил сравнительным контролем для объекта.
[0142] Данные собирали по всхожести, общему виду, жизненной силе, высоте, полеганию и созреванию. Устойчивость к гербицидам оценивали путем визуального наблюдения на предмет хлороза, некроза листьев и отмирания растения (таблица 8).
[0143] Для сравнений объекта сои pDAB9582.814.19.1 с Maverick, брали данные только необрызганного блока с Maverick. Для сравнения обработок с обрызгиванием и без обрызгивания брали данные по объекту сои pDAB9582.814.19.1 в блоке с данной обработкой обрызгиванием по сравнению с данными блока не обрызганных контрольных растений Maverick. Объект сои pDAB9582.814.19.1 показывал устойчивость к применению гербицида на основе глуфосината. Напротив, ни одно из растений Maverick не было устойчивым к обработкам с гербицидом.
Сравнение объекта сои pDAB9582.814.19.1 с Maverick. Значения являются средними для питомников T3 и T4. В каждом питомнике с объектом сои pDAB9582.814.19.1 разбрызгивали глуфосинат на стадии V3 в норме внесения 411 г аэ/га.
Пример 6: Характеристика инсектицидного действия для объекта сои 9582.814.19.1
[0144] Проводили полевые и оранжерейные оценки для того, чтобы охарактеризовать действие Cry1Ac и Cry1F в объекте сои pDAB9582.814.19.1 против лабораторно выращенных вредителей сои, включая Anticarsia gemmatalis (бархатная гусеница), Pseudoplusia includens (соевая пяденица) и Spodoptera frugiperda (совка травяная). Объект сои pDAB9582.814.19.1 сравнивали с нетрансформированным сортом сои Maverick для того, чтобы определить уровень защиты растения, обеспечиваемый белками Cry1F и Cry1 Ac.
[0145] Испытания в оранжереях проводили на приблизительно четырехнедельных растениях. Объект сои pDAB9582.814.19.1 оценивали по пятнадцати растениями и контролю Maverick. Для каждого тестированного вида насекомых (Anticarsia gemmatalis, Pseudoplusia includes и Spodoptera frugiperda) пробивали по 3 листовых отверстия у каждого растения для в общей сложности 45 комбинаций листовой диск/растение/вид насекомого. Листовые диски диаметром 1,4 см (или 1,54 см2) помещали на испытательную площадку на поверхности 2%-ого водного агар-агара, зараженного новорожденными личинками и запечатывали перфорированной пластмассовой крышкой. Смертность и потребление листа оценивали спустя 4 дня после заражения. Личинки, которые не реагировали на легкое потыкивание, считались отмершими. Размер повреждения листа оценивали визуально по проценту листового диска, потребленного насекомым.
[0146] Полевые оценки проводили путем сбора образцов листьев с участков наращивания семян в питомнике в Санта-Исабеле, Пуэрто-Рико и отправки этих листьев в Индианаполис, Индиана, для тестирования. Участок питомника для объекта сои pDAB9582.814.19.1 засаживали в феврале 2011 и он состоял из приблизительно 180 растений, расположенных в четыре ряда. Каждый ряд имел длину 2,3 м и межрядное расстояние 76,2 см; индивидуальные растения располагались на расстоянии 5,1 см друг от друга внутри каждого ряда. В марте 2011 по одному полностью распустившемуся трехлистному лист на главном стебле, отстоящему приблизительно на четыре узла вниз от меристемы, отсекали у 10 растений объектов сои pDAB9582.814.19.1 и 10 растений «Maverick». Листья помещали в маркированные полиэтиленовые пакеты, (по одному в пакет) и запечатывали. Сложенные в пакеты листья были упакованы и транспортированы в лабораторию. В лаборатории один или два листовых диска диаметром 3,33 см (1,31 дюйма) перфорировали на каждом листе трехлистника, чтобы получить в общей сложности 16 листовых дисков. Каждый листовый диск помещали на испытательную площадку на поверхности 2%-ого агар-агара, зараженного одной новорождённой личинкой S. frugiperda, и запечатывали перфорированной пластмассовой крышкой. Листовые диски держали в климатической камере в течение 7 дней, в течение которых оценивали время отмирания и потребление листа. Личинки, не чувствительные к легкому покалыванию, считались отмершими. Размер повреждения листа оценивали визуально по проценту листового диска, потребленного насекомым.
[0147] Результаты, полученные из этих повторных экспериментов, указывали на то, что объект сои pDAB9582.814.19.1 обеспечивал значительно более низкое повреждение по сравнению с контрольными растениями «Maverick» для всех тестированных насекомых. Таким образом, объект сои pDAB9582.814.19.1 обладает инсектицидным действием в этом широком диапазоне растений-хозяев.
Пример 7: Последовательность объекта сои pDAB9582.814.19.1
[0148] SEQ ID NO:14 предоставляет последовательность объекта сои pDAB9582.814.19.1. Эта последовательность содержит 5'-геномную фланкирующую последовательность, вставку T-нити pDAB9582 и 3'-геномные фланкирующие последовательности. Относительно SEQ ID NO:14 остатки 1-1400 являются 5'-геномными фланкирующими последовательностями, остатки 1401-1536 являются остатками перестановки из pDAB9582 плазмиды, и 1537-13896 являются остатками вставки T-нити pDAB9582, и остатки 13897-15294 являются 3'-фланкирующей последовательностью. Примыкающая последовательность или перемещение относительно 5'-конца вставки, таким образом, встречается при остатках 1400-1401 из SEQ ID NO:14. Примыкающая последовательность или перемещение относительно 3'-конца вставки, таким образом, встречается при остатках 13896-13897 из SEQ ID NO:14.
[0149] Нужно отметить, что потомство объекта сои pDAB9582.814.19.1 может содержать последовательности, слегка отличные от SEQ ID NO:14. Во время интрогрессии и размножения вводимого объекта сои pDAB9582.814.19.1 в геном растительных клеток, появление некоторых удалений или других изменений вставки весьма часто встречаются. Кроме того, могут происходить ошибки амплификации ПЦР, которые могут приводить к незначительным ошибками секвенирования. Например, фланкирующие последовательности, перечисленные в настоящем описании, были определены путем образования ампликонов из геномный ДНК сои, с последующим клонированием и секвенированием ампликонов. Весьма обычно обнаружение незначительных различий и незначительных несоответствий в последовательностях получаемых и определяемых таким образом, учитывая множество раундов амплификации, которые необходимы для получения достаточного количества ампликона для секвенирования из геномной ДНК. Специалист в области техники должен признать и принять к сведению, что любые корректировки, необходимые вследствие этих типов стандартных ошибок секвенирования или несоответствий, входят в объем рассматриваемого изобретения. Таким образом, соответствующий сегмент последовательности плазмиды, приведенный здесь, может включать некоторые незначительные вариации. Таким образом, растение, включающее полинуклеотид, имеющий некоторый диапазон идентичности с рассматриваемой вставляемой последовательностью, входит в объем рассматриваемого изобретения. Идентичной с последовательностью SEQ ID NO:14 может быть полинуклеотидная последовательность, с, по меньшей мере, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичностью последовательности с последовательностью, приведенной в качестве примера или описанной здесь. Таким образом, некоторые различия между SEQ ID NO:14 и растениями потомства объекта сои pDAB9582.814.19.1 могут быть идентифицированы и входят в объем настоящего изобретения.
[0150] После иллюстрации и описания принципов настоящего изобретения специалистам в области техники должно быть очевидно, что настоящее изобретение может быть изменено в аранжировке и деталях, не отступая от таких принципов. Авторы изобретения патентуют все модификации, которые находятся в пределах сущности и объема приложенной формулы изобретения.
[0151] Все публикации и опубликованные патентные документы, приведенные в этой спецификации, включены в настоящее описание посредством ссылки в такой степени, как если бы было указано, что каждая индивидуальная публикация или патентная заявка специфически и индивидуально включена посредством ссылки.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОБНАРУЖЕНИЯ ТРАНСФОРМАНТА СОИ рDAB9582.814.19.1 | 2012 |
|
RU2622079C2 |
| РЕЗИСТЕНТНЫЙ К НАСЕКОМЫМ И УСТОЙЧИВЫЙ К ГЕРБИЦИДАМ ТРАНСФОРМАНТ СОИ рDAB9582.816.15.1 | 2013 |
|
RU2650626C2 |
| УСТОЙЧИВЫЙ К НАСЕКОМЫМ-ВРЕДИТЕЛЯМ И ТОЛЕРАНТНЫЙ К ГЕРБИЦИДАМ СЕЛЕКЦИОННЫЙ ГИБРИД ТРАНСФОРМАНТА СОИ pDAB9582.814.19.1 и pDAB4468.04.16.1 | 2012 |
|
RU2627161C2 |
| ПАКЕТИРОВАННОЕ СОБЫТИЕ 8264.44.06.1 С УСТОЙЧИВОСТЬЮ К ГЕРБИЦИДАМ, СВЯЗАННЫЕ ТРАНСГЕННЫЕ ЛИНИИ СОИ И ИХ ДЕТЕКТИРОВАНИЕ | 2011 |
|
RU2608650C2 |
| ЛИНИИ ТРАНСГЕННОЙ СОИ, ГЕНЕТИЧЕСКОЕ СОБЫТИЕ 8264.42.32.1, УСТОЙЧИВОЕ К ГЕРБИЦИДАМ С ПАКЕТИРОВАННЫМИ ГЕНАМИ НА ЕГО ОСНОВЕ, И ИХ ДЕТЕКТИРОВАНИЕ | 2012 |
|
RU2636021C2 |
| ДЕТЕКТИРОВАНИЕ AAD-12-СОБЫТИЯ 416 У СОИ | 2010 |
|
RU2573898C2 |
| СОБЫТИЕ 416 AAD-12, РОДСТВЕННЫЕ ЛИНИИ ТРАНСГЕННОЙ СОИ И ИХ СОБЫТИЕСПЕЦИФИЧНАЯ ИДЕНТИФИКАЦИЯ | 2010 |
|
RU2603252C2 |
| РАСТЕНИЕ КУКУРУЗЫ DBN9858, УСТОЙЧИВОЕ К ГЕРБИЦИДУ, И НУКЛЕОТИДНАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ И СПОСОБ ДЛЯ ЕЕ ВЫЯВЛЕНИЯ | 2016 |
|
RU2712730C2 |
| Нуклеиновокислотная последовательность для обнаружения наличия трансгенного трансформанта сои DBN9004 в биологическом образце, набор, содержащий такую последовательность, и способ такого обнаружения | 2017 |
|
RU2743397C2 |
| МАТЕРИАЛЫ И МЕТОДЫ ДЛЯ ОБНАРУЖЕНИЯ ГЕНА АРИЛОКСИАЛКАНОАТДИОКСИГЕНАЗЫ (AAD-12) В РАСТЕНИЯХ | 2012 |
|
RU2644249C2 |



















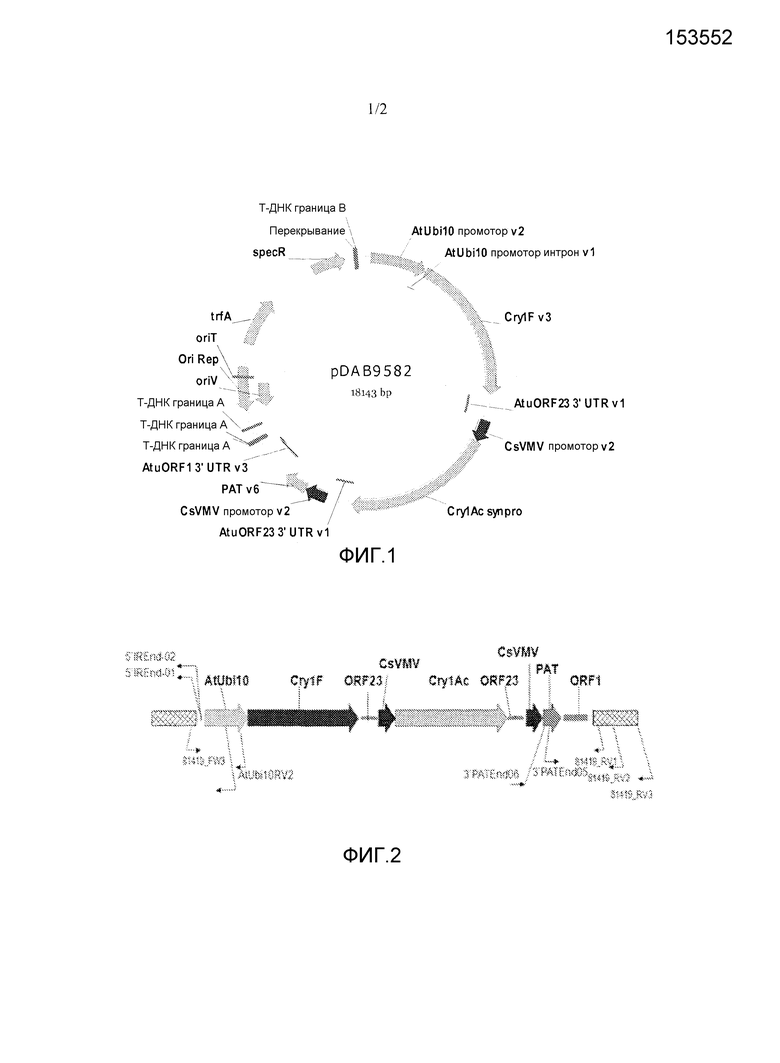

Изобретение относится к области биохимии, в частности к способу борьбы с чешуекрылыми насекомыми. Также раскрыта выделенная нуклеиновая последовательность, которая является праймером. Раскрыты растение сои, которое устойчиво к Pseudoplusia includens (соевой пяденице), семя для выращивания указанного растения сои и часть растения сои, которая устойчива к Pseudoplusia includens (соевой пяденице). Изобретение позволяет эффективно бороться с чешуекрылыми насекомыми. 5 н. и 2 з.п. ф-лы, 3 ил., 8 табл., 7 пр.
1. Способ борьбы с чешуекрылыми насекомыми, который включает экспонирование к указанным насекомым растений сои, резистентных к насекомым, где указанные растения сои содержат последовательность ДНК, состоящую из SEQ ID NO: 14, чтобы, таким образом, бороться с чешуекрылыми насекомыми, где указанные насекомые выбраны из группы, состоящей из Pseudoplusia includens (соевой пяденицы), Anticarsia gemmatalis (гусеницы бархатных бобов) и Spodoptera frugiperda (совки травяной).
2. Выделенная последовательность ДНК, состоящая из одной или нескольких последовательностей, выбранных из группы, состоящей из SEQ ID NO: 4, 5, 6, 7, 8, 9, 10, 11, 12 и 13, где указанная последовательность является последовательностью праймера, причем указанный праймер является диагностическим признаком для присутствия ДНК с SEQ ID NO: 14.
3. Растение сои, устойчивое к Pseudoplusia includens (соевой пяденице) и содержащее последовательность ДНК, которая состоит из SEQ ID NO: 14.
4. Семя растения по п. 3 для выращивания растения сои, которое устойчиво к Pseudoplusia includens (соевой пяденице), где указанное семя содержит последовательность ДНК, состоящую из SEQ ID NO: 14.
5. Растение сои по п. 3, где указанное растение сои депонировано в американской коллекции типовых культур под номером доступа зарегистрированного образца РТА-12006.
6. Часть растения сои, которая устойчива к Pseudoplusia includens (соевой пяденице) и содержит последовательность ДНК, которая состоит из SEQ ID NO: 14, где указанная часть растения сои представляет собой лист растения сои.
7. Часть растения сои по п. 6, где указанное растение сои депонировано в американской коллекции типовых культур под номером доступа зарегистрированного образца РТА-12006.
| US 0007883850 B2 от 08.02.2011 | |||
| US 0007179965 B2 от 20.02.2007 | |||
| СПОСОБЫ БОРЬБЫ С ВРЕДИТЕЛЕМ - СОВКОЙ AGROTIS | 2000 |
|
RU2311767C2 |
| US 0006673990 B2 от 06.01.2004 | |||
| US 0007618942 B2 от 17.11.2009. | |||
Авторы
Даты
2017-08-14—Публикация
2012-07-26—Подача