Изобретение относится к области биомедицинской оптики, в частности, к измерению степени оксигенации крови оптическими средствами, и может быть использовано при диагностике патологического состояния организма человека.
Насыщение крови кислородом является важным клиническим параметром, определяющим состояние пациента, что особенно важно при диагностике патологий, при назначении терапевтического лечения, в процессе проведения хирургических операций, поскольку позволяет указать на необходимость введения больному физиологических растворов или повышения содержания кислорода во вдыхаемом воздухе.
Известен способ неинвазивного определения содержания кислорода в крови оптическим методом с использованием обратно рассеянного или отраженного света [1]. Способ предусматривает облучение ткани зондирующим светом на двух длинах волн красного и инфракрасного диапазонов и регистрацию диффузно рассеянного излучения на фиксированных расстояниях от точки ввода зондирующего излучения.
Недостатками данного способа являются 1) использование для определения степени оксигенации крови облучение ткани двумя длинами волн, 2) зависимость от параметров эпидермиса, что приводит к усложнению способа и снижению его точности.
Известен способ неинвазивного измерения насыщения крови кислородом [2]. Способ основан на определении коэффициента отражения оптического излучения и включает облучение участков кожи и биоткани монохроматическими излучениями с длинами волн λ1=650±30 нм; λ2=830±80 им, и двухканальную фоторегистрацию рассеянного сигнала. После фоторегистрации по первому каналу производят селекцию доплеровского сигнала в полосе f1=2nvr/λ1, а но второму - в полосе f2=2nvr/λ2, при этом vr - скорость движения эритроцитов в исследуемом отделе системы микроциркуляции, а n - оптический показатель преломления среды. Затем осуществляют амплитудное детектирование, выделение переменной (пульсовой или дыхательной) и постоянной частей сигнала по каждому из каналов, нормировку переменной к постоянной составляющей сигнала по каждому из каналов. Затем выделяют из сигнала второго капала часть, синфазную с сигналом первого канала, и вычисляют отношение сигнала первого канала с выделенной частью сигнала второго канала.
Недостатками указанного способа являются 1) использование для определения степени оксигенации крови облучением ткани двух длин волн, 2) зависимость от параметров эпидермиса, что приводит к усложнению способа и снижению его точности.
Наиболее близким является способ измерения степени оксигенации крови, заключающийся в имплантации нескольких монохроматических источников света и приемника излучения в область биоткани, где следует определить степень оксигенации S капиллярной крови, при последовательном облучении биоткани светом от источников и регистрации пропущенного излучения с помощью приемника [3]. Определяют интенсивность пропущенного света для каждой длины волны и вычисляют отношение сигналов приемника на используемых длинах волн. Полученные данные затем используются для определения степени оксигенации S капиллярной крови.
Недостатком указанного способа является необходимость использования нескольких длин волн для определения интенсивности пропущенного света, что приводит к усложнению способа и снижению его точности.
Задачей настоящего изобретения является упрощение способа и повышение точности измерения степени оксигенации S капиллярной крови.
Решение поставленной задачи достигается следующим образом.
1) Под поверхность ткани на глубину Z порядка 1-5 мм в том месте, где следует определить степень оксигенации S капиллярной крови, имплантируют приемник излучения.
2) Поверхность ткани над приемником облучают когерентным импульсным светом па длине волны λ=600-640 им, длительность импульса короче 1 мкс.
3) Приемник регистрирует интенсивность света, пропущенного слоем ткани толщиной Z, в различных точках своей светочувствительной площадки.
4) Измеряют контраст K спекл-структуры по формуле (Еmax-Еmin)/(Еmax+Еmin), где Еmax и Еmin - соответственно максимальное и минимальное значения освещенности, зарегистрированные приемником.
5) Строят градировочный график зависимости контраста K спекл-структуры на длине волны A от степени оксигенации S капиллярной крови на глубине Z нахождения приемника при известной объемной концентрации кровеносных капилляров в дерме Cb [4].
6) По измеренному контрасту и градировочному графику находят степень оксигенации S капиллярной крови.
Суть изобретения состоит в следующем.
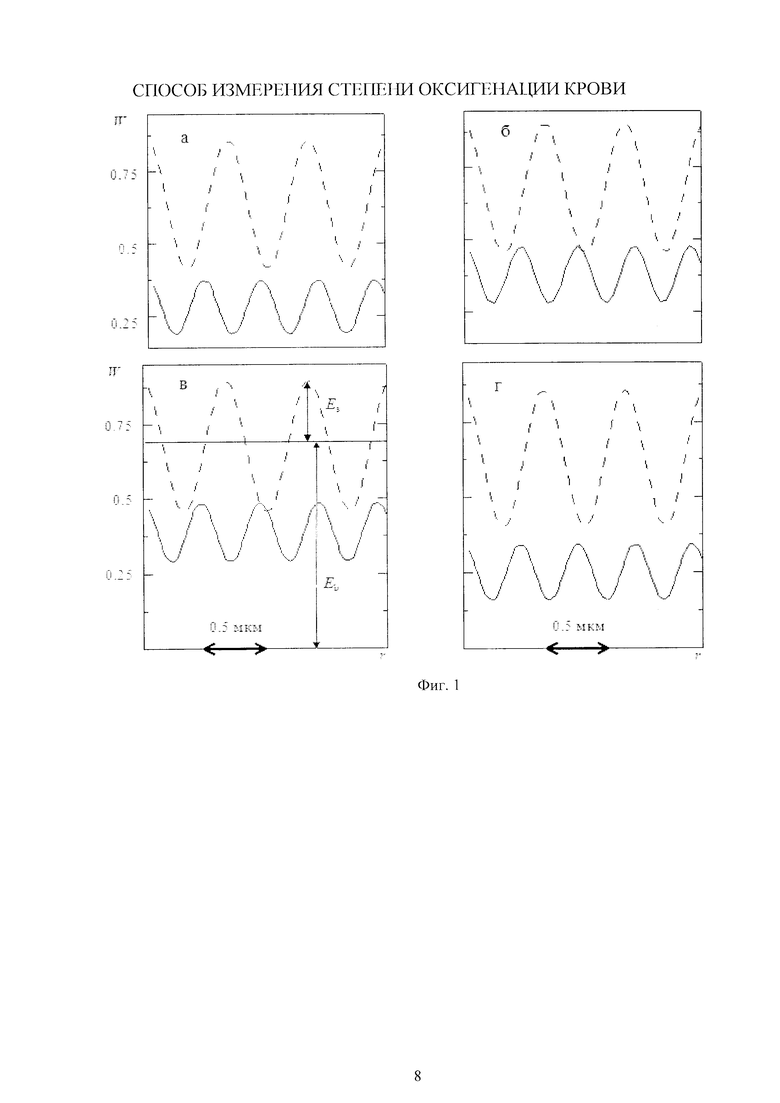
На фиг. 1 показано радиальное распределение W спекл-структуры в дерме на длинах волн 600 нм (сплошные кривые) и 700 нм (штриховые) при S=0.5 (а) и 0.97 (б), объемная концентрация капилляров в дерме Сb=0.04 (а, б); Cb=0.02 (в) и 0.08 (г), S=0.5 (в, г); z=1 мм, объемная концентрация меланина в эпидермисе Cm=0.08.
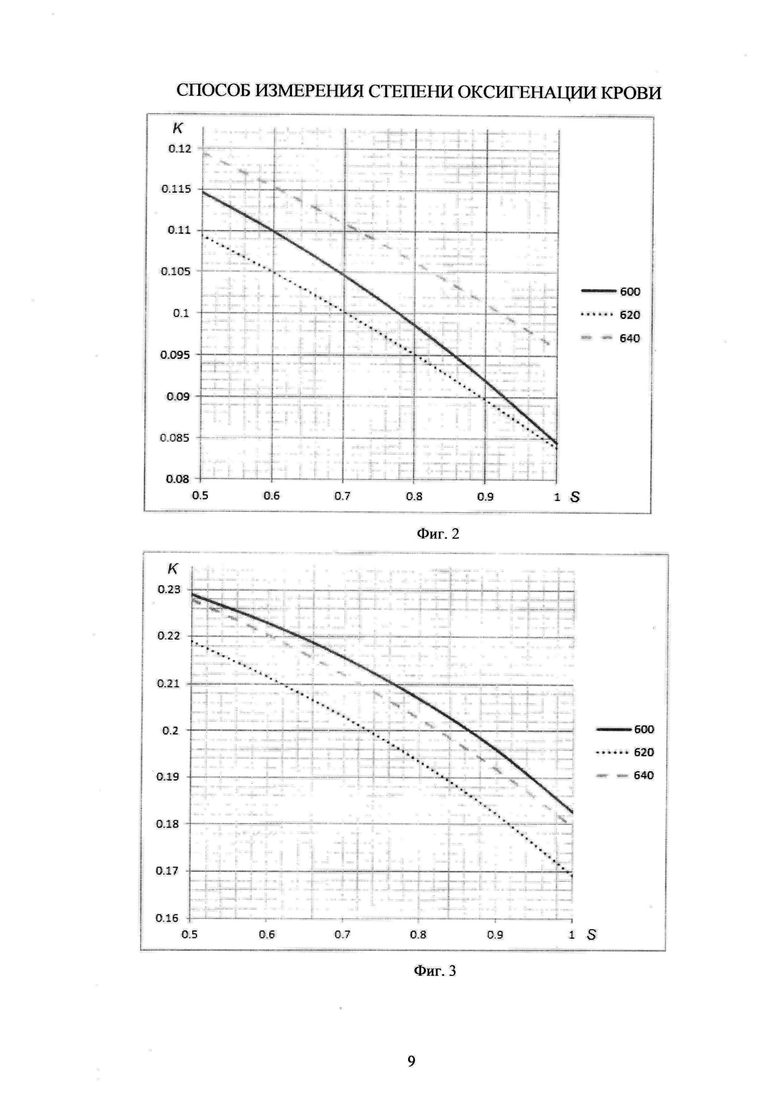
На фиг. 2 показан градировочный график зависимости контраст K спекл-структуры (ось Y) от степени оксигенации S капиллярной крови (ось X) для длин волн λ=600 нм (сплошная линия), 620 нм (пунктирная) и 640 нм (штриховая) при объемных концентрациях меланина в эпидермисе (Cm=4%) и капилляров в дерме (Cb=4%) на глубине Z=1,5 мм.
На фиг. 3 показан градировочный трафик зависимости контраст K спекл-структуры (ось Y) от степени оксигенации S капиллярной крови (ось X) для длин волн λ=600 нм (сплошная линия), 620 нм (пунктирная) и 640 нм (штриховая) при величинах объемных концентраций меланина в эпидермисе (Cm=4%) и капилляров в дерме (Cb=8%) на глубине Z=1,5 мм.
Известно, что при облучении рассеивающей среды и, в частности, биологической ткани когерентным светом в среде формируется спекл-структура или пятнистая картина, содержащая области повышенной и пониженной интенсивности. Этот механизм можно представить следующим образом. Интерференция когерентного прямого света от источника приводит к образованию максимумов и минимумов поля излучения, расстояние между которыми определяется угловой расходимостью θsrs падающего пучка. Чем θsrs больше, тем меньше это расстояние. При рассеянии в направлении «вперед» угол схождения интерферирующих пучков в целом возрастает по сравнению с θsrs, так что с увеличением числа актов рассеяния спекл-структура становится все более мелкомасштабной. Интерференция света, рассеянного на большие углы, дает практически равномерный фон спекл-структуры, который с точки зрения фотометрии можно считать некогерентным.
Аналитическая методика расчета характеристик интерференционной картины, формируемой многократно рассеянным светом в многослойной биологической ткани типа кожи человека на длинах волн видимого и ближнего ИК-диапазонов спектра при облучении лазером, описана в работах [5, 6]. При вычислениях полагали, что рассеивающие частицы неподвижны (т.е. получены соответственно верхняя и нижняя оценки контраста и размеров спеклов) или что имеет место импульсное освещение поверхности среды при длительности импульса много меньше характерного времени перемещения рассеивающих центров. Методика [5, 6] включает вычисление интенсивностей Eb и Es некогерентного фона и ярких участков интерференционной картины соответственно. На фиг. 1 показан пример радиальной зависимости интенсивности W спекл-структуры, созданной многократно рассеянным светом в глубине биоткани. На основе значений Eb и Es можно рассчитать контраст K спекл-структуры по формуле
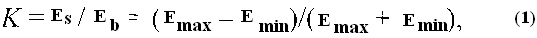
где Emax и Еmin - соответственно максимальное и минимальное значения освещенности, зарегистрированные приемником (фиг. 1).
Рассмотрим зависимость контраста от биофизических (степень оксигенации S капиллярной крови, объемные концентрации меланина в эпидермисе Cm и капилляров в дерме Cb) и структурных (толщина de эпидермиса) параметров ткани. Расчеты показали, что эпидермис можно рассматривать как спектральный фильтр, ослабляющий интенсивности Eb и Es в ехр(-μ(λ) de) раз относительно интенсивности падающего светового пучка, где μ(λ) - показатель поглощения меланина па длине волны λ. По этой причине контраст K спекл-структуры (1) не зависит от параметров эпидермиса.
Повышение точности измерения достигается следующим образом.
Пусть X=X1/X2, где X1 и X2 - сигналы (независимые) на 1-й и 2-й длинах воли. Тогда погрешность измерения X есть (получаем прямым дифференцированием и ставим знак + во 2-м слагаемом, чтобы получить максимальную погрешность):
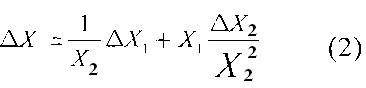
Или ΔX/X=ΔX1/X1+ΔX2/X2, т.е. погрешности измерения двух сигналов складываются (примерно удваиваются).
Если измерять на одной длине волны, то имеем погрешность ΔX1/X1.
В качестве источника можно использовать твердотельный импульсный He-Ne лазер на 632 им, приемника - ПЗС-линейку TCD-1304.
ИСТОЧНИКИ ИНФОРМАЦИИ
1. Патент RU 2040912, МПК A61B 5/14, A61B 5/02, A61B 5/06.
2. Патент RU 2173082, МПК A61B 5/00, A61B 5/145.
3. Патент US 8385999 B1, МПК A61B 5/00, 2006.
4. Патент RU 2234853, МПК A61B 5/05, 2010.
5. Абрамович Н.Д., Барун В.В., Дик С.К., Иванов А.П., Терех А.С. Аналитическая методика оценки контраста спекл-структуры светового поля, рассеянного мягкими биотканями // Сб мат. V Троицкой конф. «Медицинская физика и инновации в медицине». - Троицк: ИСЛН. - 2012 - Т 1. - С. 212-214.
6. Абрамович H.Д., Барун В.В., Дик С.К., Иванов А.П., Моделирование структуры светового спекл-поля внутри многослойной ткани кожи человека // Инж.-физ. ж. - 2013. - Т. 86, №6. - С. 1288-1295.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПТИЧЕСКОГО ЗАХВАТА ЧАСТИЦЫ В МЯГКОЙ БИОЛОГИЧЕСКОЙ ТКАНИ | 2013 |
|
RU2550990C1 |
| СПОСОБ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2010 |
|
RU2438733C1 |
| СПОСОБ ПОВЫШЕНИЯ КОНЦЕНТРАЦИИ МОЛЕКУЛЯРНОГО КИСЛОРОДА В ДЕРМЕ КОЖНОЙ ТКАНИ | 2011 |
|
RU2484860C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИЙ ПРОИЗВОДНЫХ ГЕМОГЛОБИНА В БИОЛОГИЧЕСКИХ ТКАНЯХ | 2013 |
|
RU2517155C1 |
| СПОСОБ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2013 |
|
RU2539367C1 |
| СПОСОБ ЛОКАЛЬНОГО ПОВЫШЕНИЯ КОНЦЕНТРАЦИИ МОЛЕКУЛЯРНОГО КИСЛОРОДА В ДЕРМЕ КОЖНОЙ ТКАНИ | 2011 |
|
RU2484861C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ БИЛИРУБИНА | 2012 |
|
RU2511747C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ОПТИЧЕСКИХ И БИОФИЗИЧЕСКИХ ПАРАМЕТРОВ БИОТКАНИ | 2012 |
|
RU2510506C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ФИЗИКО-БИОЛОГИЧЕСКИХ ПАРАМЕТРОВ КОЖИ И КОНЦЕНТРАЦИЙ ПРОИЗВОДНЫХ ГЕМОГЛОБИНА В КРОВИ | 2013 |
|
RU2545814C1 |
| СПОСОБ НЕИНВАЗИВНОГО ИЗМЕРЕНИЯ НАСЫЩЕНИЯ КРОВИ КИСЛОРОДОМ | 2000 |
|
RU2173082C1 |
Изобретение относится к области биомедицинской оптики и может быть использовано для определения степени оксигенации S капиллярной крови в биологической ткани. Осуществляют измерение интенсивности пропущенного света при помощи имплантированного приемника. Поверхность ткани облучают монохроматическим когерентным световым импульсом. Измеряют интенсивность в различных точках светочувствительной площадки приемника. Определяют контраст K спекл-структуры рассеянного света. Строят градировочный график зависимости контраста K спекл-структуры на длине волны облучения от степени оксигенации S капиллярной крови на глубине нахождения приемника Z при известной объемной концентрации кровеносных капилляров в дерме Cb. По найденному контрасту K спекл-структуры и градировочному графику определяют степень оксигенации S капиллярной крови. Способ обеспечивает повышение точности измерения за счет использования показателя, независимого от параметров эпидермиса. 2 з.п. ф-лы, 3 ил.
1. Способ определения степени оксигенации S капиллярной крови в биологической ткани, основанный на измерении интенсивности пропущенного света при помощи имплантированного приемника, отличающийся тем, что поверхность ткани облучают монохроматическим когерентным световым импульсом, измеряют интенсивность в различных точках светочувствительной площадки приемника, определяют контраст K спекл-структуры рассеянного света, строят градировочный график зависимости кон траста K спекл-структуры на длине волны облучения от степени оксигенации S капиллярной крови на глубине нахождения приемника Z при известной объемной концентрации кровеносных капилляров в дерме Cb, по найденному контрасту K спекл-структуры и градировочному графику определяют степень оксигенации S капиллярной крови.
2. Способ по п. 1, отличающийся тем, что длительность монохроматического когерентного светового импульса короче 1 мкс.
3. Способ по п. 1, отличающийся тем, что длина волны монохроматического когерентного светового импульса λ=600-640 им.
| US 0008385999 B1 26.02.2013 | |||
| СПОСОБ НЕИНВАЗИВНОГО ИЗМЕРЕНИЯ НАСЫЩЕНИЯ КРОВИ КИСЛОРОДОМ | 2000 |
|
RU2173082C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ОПТИЧЕСКИХ И БИОФИЗИЧЕСКИХ ПАРАМЕТРОВ БИОТКАНИ | 2012 |
|
RU2510506C2 |
| ОПТИЧЕСКИЙ СПОСОБ ОПРЕДЕЛЕНИЯ ОКСИГЕНАЦИИ КРОВИ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1993 |
|
RU2040912C1 |
| ДИАГНОСТИЧЕСКОЕ УСТРОЙСТВО ДЛЯ ИЗМЕРЕНИЯ ФИЗИКО-БИОЛОГИЧЕСКИХ ХАРАКТЕРИСТИК КОЖИ И СЛИЗИСТЫХ ОБОЛОЧЕК IN VIVO | 2002 |
|
RU2234853C1 |
| WO 2007144817 A1 21.12.2007 | |||
| АБРАМОВИЧ H.Д | |||
| Моделирование структуры светового спекл-поля внутри многослойной ткани кожи человека // Инж.-физ | |||
| ж | |||
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| Пюпитр для работы на пишущих машинах | 1922 |
|
SU86A1 |
| Обмотка для альтернаторов высокого напряжения | 1924 |
|
SU1288A1 |
Авторы
Даты
2017-06-21—Публикация
2015-12-18—Подача