Настоящее изобретение относится к штаммам лактобактерий и бифидобактерий, оказывающим ингибирующее/уменьшающее действие на рост различных биотипов E. coli (грамотрицательные), включая E. coli O157:H7 и O104:Н4, и различных видов бактерий, принадлежащих к семейству Clostridiaceae (анаэробные, грамположительные палочки), которые ответственны за гнилостное разложение и серьезные кишечные инфекции (Clostridium difficile).
Кроме того, настоящее изобретение относится к штаммам лактобактерий, обладающим специфической антимикробной активностью в отношении Listeria monocytogenes (грамположительные), Enterococcus sp. и Klebsiella sp.(грамотрицательные). Кроме того, настоящее изобретение относится к фармацевтической или пищевой композиции, или добавке, или медицинскому устройству, содержащим по меньшей мере один из указанных штаммов лактобактерий и/или бифидобактерий, возможно в комбинации с ацетилцистеином и/или лизоцимом.
Известно, что бактерия Escherichia coli - сокращенно Е. coli - является самым известным видом рода Escherichia: у нее установлен по меньшей мере 171 серотип, характеризующийся различными комбинациями антигенов О, Н, К, F. Она является одним из основных видов бактерий, которые живут в нижней части кишечника теплокровных животных (птиц и млекопитающих, включая человека) и которые необходимы для правильного переваривания пищи. Ее присутствие в водоемах указывает на наличие условий фекального загрязнения (она является основным индикатором фекальной контаминации наряду с энтерококками).
Род Escherichia, наряду с другими родами, такими как, например, Enterobacter, Klebsiella, Citrobacter и Serratia, объединены под названием колиформные бактерии. Формально «колиформная группа» включает неспорообразующие аэробные и анаэробные бактерии.
Несмотря на то, что она является нормальным обитателем кишечника и играет важнейшую роль в процессе пищеварения, существуют ситуации, при которых Е. coli может вызывать заболевания у человека и животных. Некоторые штаммы Е. coli являются возбудителями кишечных и внекишечных заболеваний, таких как инфекции мочевых путей, менингит, перитонит, септицемия и пульмонит. Некоторые штаммы Е. coli являются токсинообразующими, то есть они продуцируют токсины, которые помимо всего прочего могут быть причиной диареи. Дизентерия, вызванная Е. coli, является обычной пищевой токсикоинфекцией, так как ею заражаются, главным образом, через контаминированные пищевые продукты. Контаминация может происходить через плохо приготовленное инфицированное мясо, через непастеризованное молоко и сделанные из него сыры и через другие пищевые продукты, контаминированные фекалиями. Е. coli продуцирует четыре вида токсинов, которые подразделяют по их различной чувствительности к термической обработке на термолабильные и термостабильные и по их токсикогенному действию - шигатоксины и гемолитические токсины, HlyA.
Термолабильный токсин, называемый LT, очень похож по структуре и функциям на холерный токсин. Он содержит субъединицу 'А' и пять субъединиц 'В' в голотоксине. Субъединицы В способствуют адгезии и проникновению токсина в клетки кишечника хозяина, где субъединица А стимулирует высвобождение воды клетками, вызывая диарею.
«Штамм» Е. coli представляет собой группу с определенными характеристиками, которые дают возможность сделать его узнаваемым среди других штаммов Е. coli, аналогично способу, посредством которого можно отличать животных различных пород. Различные штаммы Е. coli живут в различных видах животных, так что возможно установить, попадает ли фекальное вещество в воду, например, из организмов людей или птиц.
Новые штаммы Е. coli постоянно возникают из-за природного биологического процесса мутации, и некоторые из этих штаммов обладают свойствами, которые могут быть опасными для животного-хозяина. Хотя у большинства взрослых людей патогенный штамм, вероятно, не вызвал бы ничего, кроме диареи, и не смог бы породить никаких симптомов, у маленьких детей, или больных людей, или людей, ослабленных недавно перенесенными заболеваниями или подвергающихся особым видам лечения, новый штамм может стать причиной серьезных заболеваний или даже смерти. Примером чрезвычайно вирулентного штамма Е. coli является E. coli O157:H7. Штаммы энтерогеморрагической Е. coli являются основными штаммами, ответственными за заболевание в промышленно развитых странах. Серотипом, ответственным в большинстве случаев за эти заболевания, является E. coli O157:H7.
Е. coli O157:H7 или энтерогеморрагическая Escherichia coli (EHEC) представляет собой энтерогеморрагический штамм бактерии Escherichia coli, который является причиной заболеваний, передающихся через пищу. Инфекция часто приводит к геморрагической диарее, а иногда к почечной недостаточности, гемолитико-уремическому синдрому (ГУС), особенно у молодых людей, детей и пожилых людей.
Передача происходит посредством фекально-орального пути, и большинство случаев заболевания связано с употреблением в пищу сырых или недоваренных продуктов, загрязненных землей или контаминированной водой, или употреблением овощей, загрязненных такой водой. У жвачных животных она живет в кишечнике в качестве симбионта, но не вызывает патологии из-за недостатка рецепторов токсина, продуцируемого бактерией. Что касается рода Clostridium, известно, что многие пищевые продукты содержат эти бактерии, которые ответственны за процессы расщепления самих пищевых продуктов, и что если они проглатываются вместе с пищей и достигают кишечника, они способны изменять состав микрофлоры и вызывать гнилостное разложение.
Пищевыми продуктами, обычно обуславливающими эти пищевые токсикоинфекции, являются виды свежего мяса, контаминированного, в частности, Clostridium perfringens, С. sporogenes, С. Bifermentans и так далее, которые могут гидролизовать сахара, образуя вещества с неприятным запахом, такие как индол, аммиак и меркаптаны.
С другой стороны, рыба может быть поражена другим видом Clostridium, С. botulinum, который может развиваться и продуцировать токсин даже при низких температурах (4°С). Среди клостридий наиболее опасной для человека является Clostridium difficile, которая может продуцировать энтеротоксины, ответственные за случаи геморрагической диареи, псевдомембранозного колита с серьезными осложнениями, такими как перфорация, септицемия и смерть. Бактерия образует споры, устойчивые к нагреванию, и переносится от человека к человеку посредством фекально-орального пути.
В основном патогенез, обусловленный С. difficile, связан с применением антибиотиков, которые вызывают заметный дисбаланс в кишечной микрофлоре, обуславливая преобладание вызывающих гниение видов в ущерб видам с ферментативным действием.
С. difficile распространена повсеместно, в частности в больничной среде, и может колонизировать кишечник небольшой части здоровых индивидуумов (примерно 5%). Применение антибиотиков сопряжено с ее чрезмерным ростом и серьезными патологическими проявлениями вследствие ее резистентности к большинству антибиотиков. После того как споры проглатывают, они, преодолев желудочный барьер, оседают в толстом кишечнике, где они прорастают и развиваются в вегетативные формы, которые путем бинарного деления образуют многочисленную популяцию, обуславливающую множественные патологические формы, которые создают особенно серьезные проблемы для людей пожилого возраста.
По имеющимся оценкам, в настоящее время этим организмом заражены более 30% пациентов, получающих лечение в больницах Соединенных Штатов. Кроме того, Listeria monocytogenes является повсеместно распространенным патогеном, ответственным за листериоз человека, потенциально смертельную инфекцию пищевого происхождения.
Пробиотические бактерии (лактобациллы и бифидобактерии) являются микроорганизмами, которые приносят пользу здоровью хозяина, и по этой причине в большинстве случаев употребляются постоянно возрастающим числом людей, которые выбирают пищевые продукты, кисломолочные продукты, йогурт и пищевые добавки, содержащие пробиотические бактерии.
Поэтому сохраняется потребность иметь доступные пробиотические бактерии, способные колонизировать кишечник и оказывать благоприятные воздействия на организм-хозяина. В частности, сохраняется необходимость иметь доступные пробиотические бактерии, способные преобладать над патогенными видами с последующей пользой для здоровья. И даже более конкретно, сохраняется необходимость иметь доступные пробиотические бактерии, способные предупреждать и/или лечить инфекции и/или патологии, связанные с патогенными бактериями (грамположительными и грамотрицательными).
После интенсивной научно-исследовательской работы заявитель неожиданно обнаружил, что отобранные бактерии способны соответствующим образом отвечать вышеупомянутым потребностям.
Более того, заявитель неожиданно обнаружил, что при использовании N-ацетилцистеина, который обладает свойством разрушать бактериальные биопленки, обычно продуцируемые для самозащиты патогенными микроорганизмами, действие бактериоцинов отобранных пробиотических штаммов гораздо более эффективно.
Кроме того, неожиданно обнаружено, что при использовании конкретной методики микроинкапсулирования в липидную матрицу предпочтительно растительного происхождения, которая дает защиту от желудочного сока лизоциму, последний способен проходить неповрежденным через гастродуоденальную область пищеварительного тракта, чтобы быть активированным на уровне толстого кишечника и проявлять свое литическое действие в отношении спор всех видов клостридий. В результате этого гидролитического действия на споры рода Clostridium, и в частности С. difficile, в момент их прорастания, образование вегетативных клеток, обуславливающих увеличение популяции патогена и образование токсинов, не происходит.
Комбинированное действие пробиотических штаммов с ферментативной активностью и барьерным эффектом против вызывающих гниение видов, включая клостридий, в сочетании с прямым действием лизоцима, который фактически предотвращает прорастание спор клостридий, составляет исключительную и инновационную стратегию в отношении этой опасной группы патогенов.
Вся комбинация (пробиотические бактерии по настоящему изобретению, продуцирующие бактериоцины, и/или N-ацетилцистеин, который разрушает бактериальную биопленку, и/или лизоцим, предпочтительно в микроинкапсулированной форме в липидной матрице, который блокирует прорастание спор) представляет собой инновационное средство, способное бороться с большим количеством патогенных штаммов, в отношении которых до сих пор нет эффективной стратегии противодействия.
Объектом настоящего изобретения является отбор штаммов лактобактерий и/или бифидобактерий, которые способны продуцировать бактериоцины, и/или метаболиты, и/или перекись водорода, для применения в профилактическом и/или терапевтическом лечении инфекций и/или патологий, связанных с: различными патогенами, включая Е. coli, и в частности Е. coli O157:Н7 и O104:Н4; и/или вызывающими гниение микроорганизмами, принадлежащими к семейству Clostndiaceae, Clostridium difficile; и/или патогенами Listeria monocytogenes, Enterococcus sp., Klebsiella sp., причем указанные бактерии также возможно использовать в комбинации с N-ацетилцистеином и/или лизоцимом. Лизоцим может быть микроинкапсулирован и защищен от желудочного сока в липидной матрице. В предпочтительном воплощении липидная матрица имеет растительное происхождение, обладая температурой плавления, составляющей от 30 до 80°С, предпочтительно от 40 до 70°С, даже более предпочтительно от 50 до 60°.
Другим объектом настоящего изобретения является фармацевтическая или пищевая композиция, или добавка, или медицинское устройство, содержащие по меньшей мере один из указанных штаммов бактерий для применения в профилактическом и/или терапевтическом лечении инфекций и/или патологий, связанных с патогенами Е. coli, включая Е. coli O157:Н7; и/или вызывающими гниение микроорганизмами, принадлежащими к семейству Clostridiaceae, включая Clostridium difficile; и/или патогенами Listeria monocytogenes, Enterococcus sp., Klebsiella sp.
Другим объектом настоящего изобретения является фармацевтическая или пищевая композиция, или добавка, или медицинское устройство, содержащие по меньшей мере один из указанных штаммов бактерий в комбинации с N-ацетилцистеином.
Другим объектом настоящего изобретения является фармацевтическая или пищевая композиция, или добавка, или медицинское устройство, содержащие по меньшей мере один из указанных штаммов бактерий в комбинации с лизоцимом. В предпочтительном воплощении лизоцим является микроинкапсулированным.
Другим объектом настоящего изобретения является фармацевтическая или пищевая композиция, или добавка, или медицинское устройство, содержащие по меньшей мере один из указанных штаммов бактерий в комбинации с N-ацетилцистеином и с лизоцимом. В предпочтительном воплощении лизоцим является микроинкапсулированным в липидную матрицу. В предпочтительном воплощении липидная матрица имеет растительное происхождение, обладая температурой плавления, составляющей от 30 до 80°С, предпочтительно от 40 до 70°С, даже более предпочтительно от 50 до 60°.
Другие предпочтительные воплощения настоящего изобретения описаны в продолжении описания и будут заявлены в прилагаемых зависимых пунктах формулы изобретения.
Перечень таблиц и графических материалов
В таблице 1 показан список 14 штаммов лактобацилл, 4 штаммов бифидобактерий и 2 штаммов стрептококков, которые были протестированы в отношении 4 биотипов Е coli.
В таблицах 2-5 перечислены штаммы, которые продуцируют бактериоцины, и/или метаболиты, и/или перекись водорода и которые способны бороться, ингибировать или уменьшать рост патогенных бактерий, принадлежащих к виду E. coli, включая Е. coli O157:Н7.
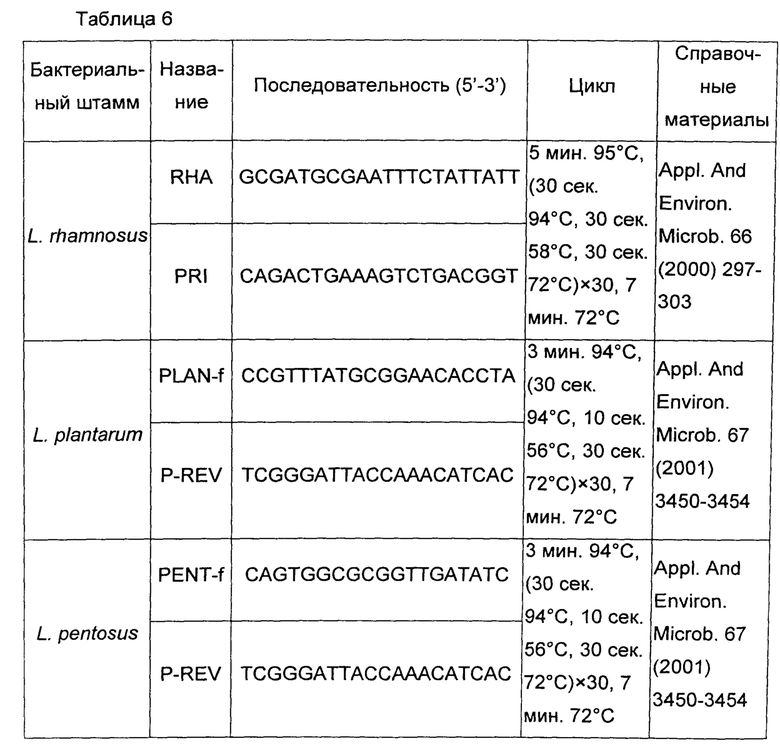
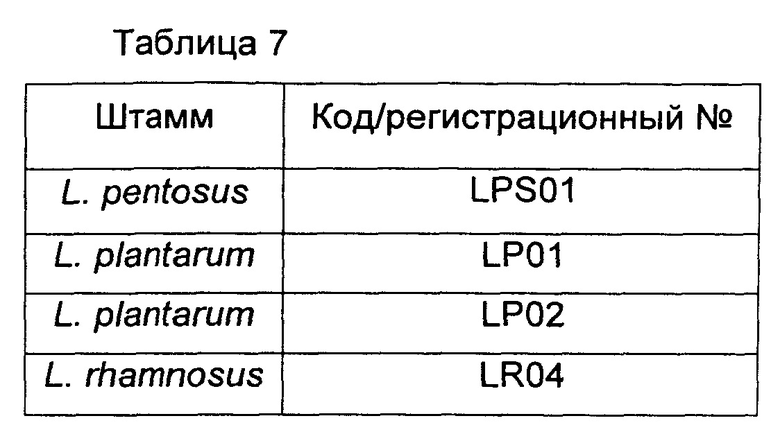
Таблицы 6 и 7 относятся к штаммам рода Lactobacillus.
На фиг. 1 показана методика, использованная для тестирования штаммов, которые являются объектом настоящего изобретения.
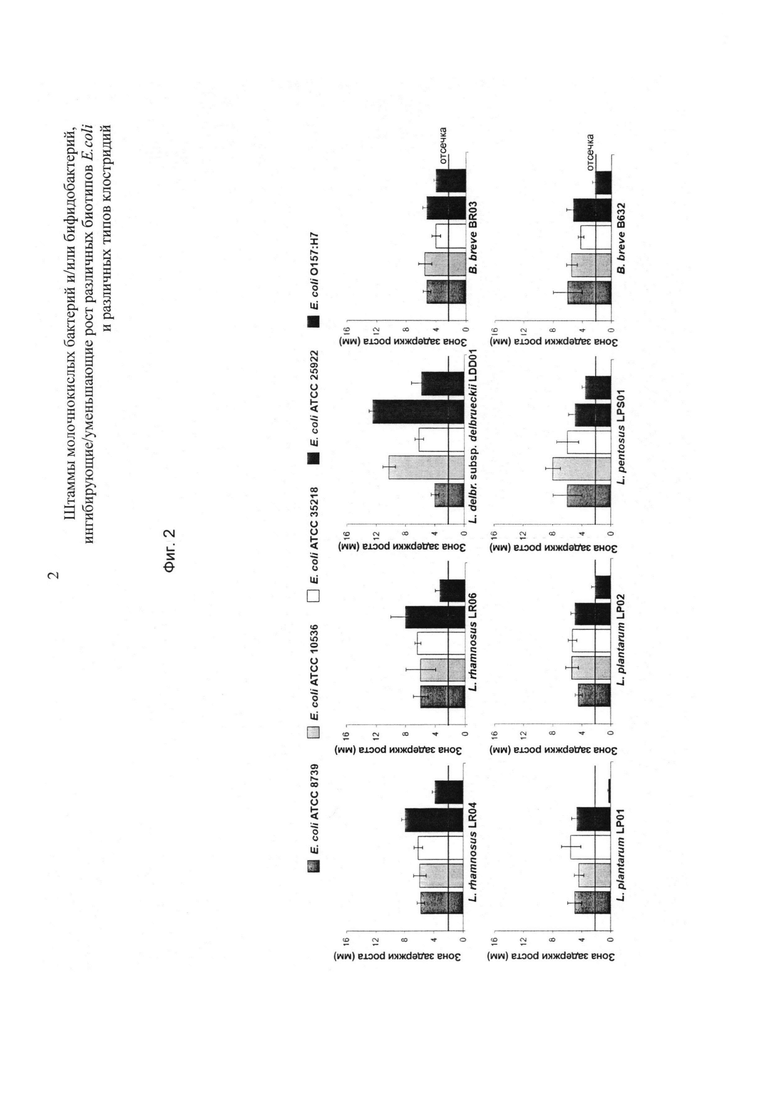
На фиг. 2 показаны зоны задержки роста, образованные штаммами, перечисленными в таблице 4, в отношении Е. coli (АТСС 8739, АТСС 10536, АТСС 35218, АТСС 25922) и серотипа O157:Н7 (CQ 9485).
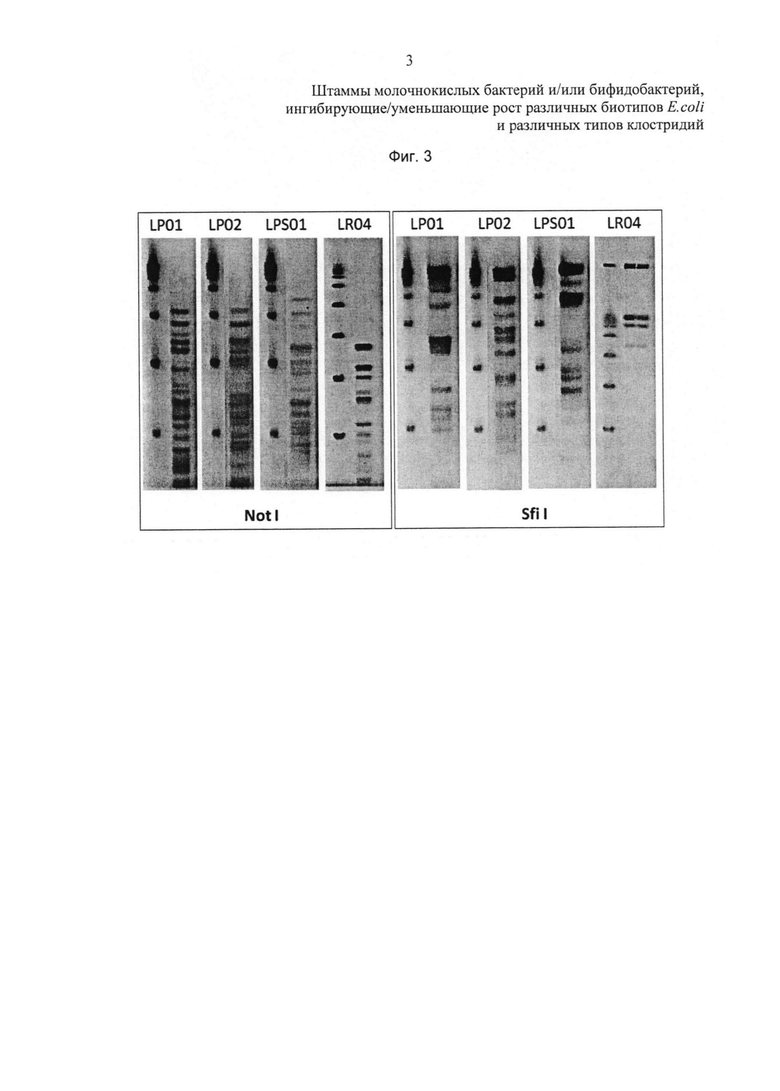
Фиг. 3 относится к данным, показанным в таблицах 6 и 7.
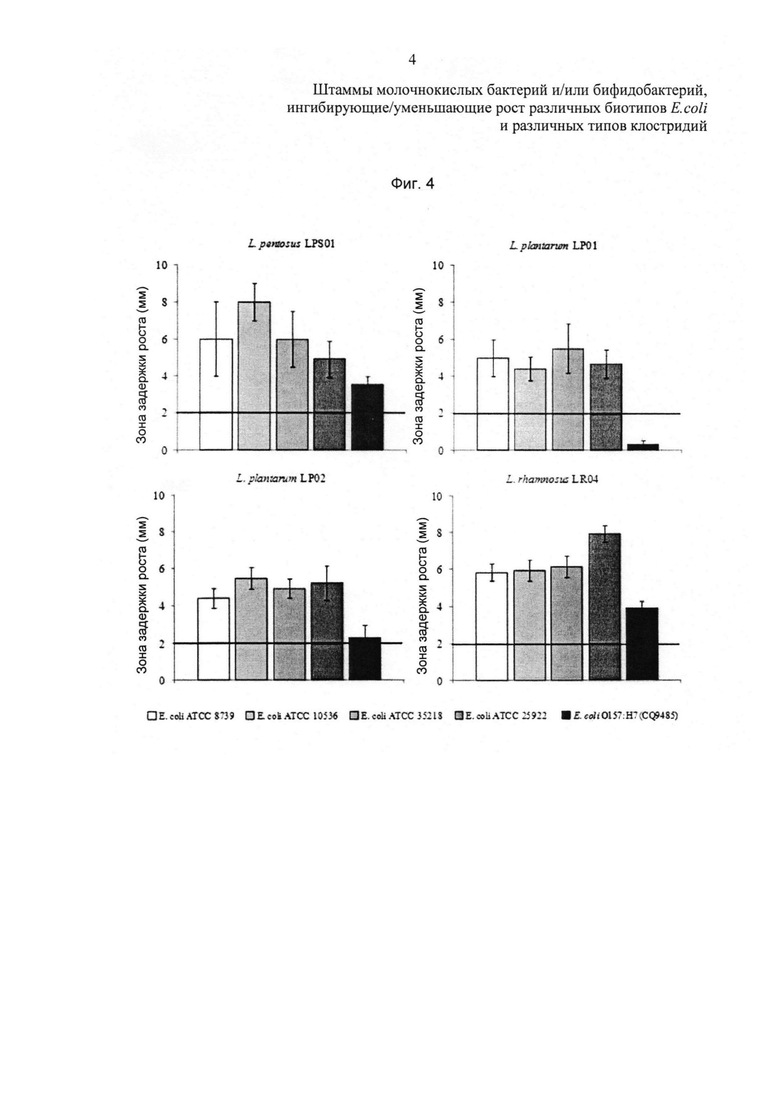
Фиг. 4 относится к in vitro ингибиторной активности штаммов пробиотических бактерий в отношении E. coli. Результаты (выражены в мм) представляют собой среднее значение ± стандартное отклонение (SD) 3 независимых экспериментов.
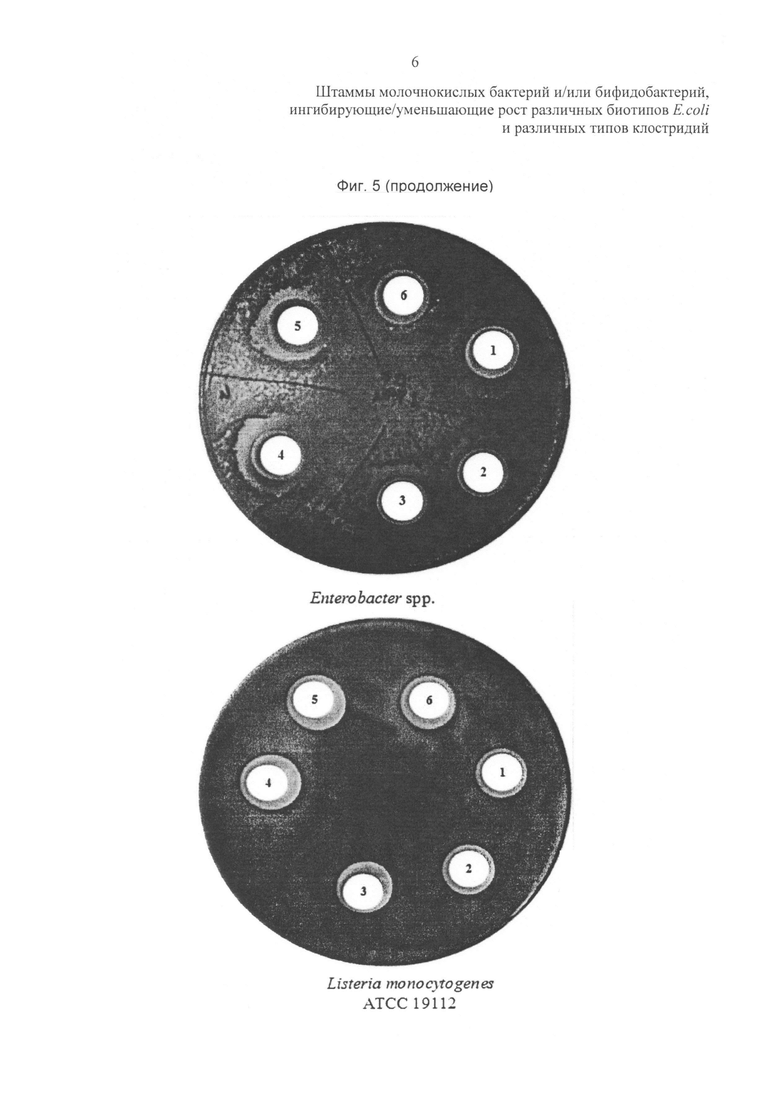
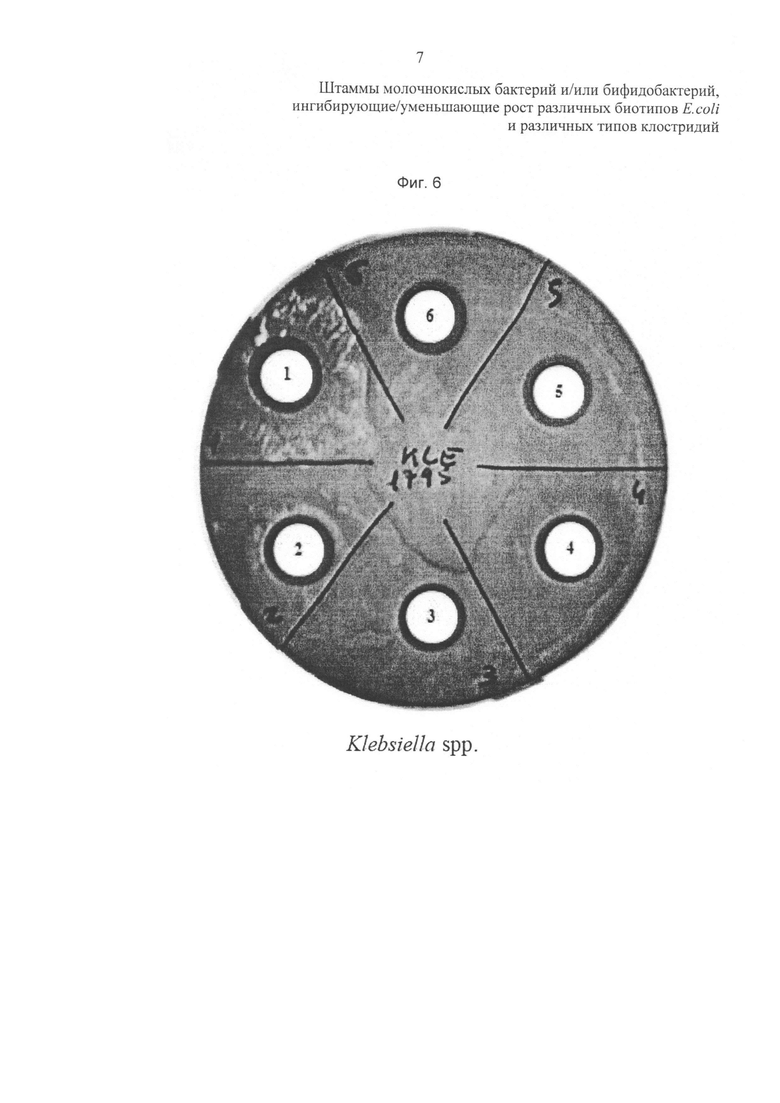
Фиг. 5 и 6 относятся к in vitro ингибиторной активности штаммов пробиотических бактерий в отношении других энтеропатогенных бактерий. На фиг. 5 результаты (выражены в мм) представляют собой средние значения ± стандартное отклонение (SD) 3 независимых экспериментов. Условные обозначения на фиг. 6: L. rhamnosus LR04 (диск 5); L. plantarum LP01 (диск 4), L. pentosus LPS01 (диск 2) и L. plantarum LP02 (диск 1).
Заявитель провел значительную исследовательскую работу и скрининговые исследования, начав с очень обширной группы штаммов бактерий. По окончании этого исследования заявитель обнаружил и отобрал группу штаммов бактерий, принадлежащих к виду или к нескольким видам, выбранным из группы, содержащей или, альтернативно, состоящей из Lactobacillus delbrueckii, Lactobacillus delbrueckii subsp. delbrueckii, Lactobacillus plantarum, Lactobacillus rhamnosus, Lactobacillus pentosus и Bifidobacterium breve. Отобранные штаммы способны продуцировать бактериоцины, и/или метаболиты, и/или перекись водорода, а они представляют собой вещества, которые способны эффективно бороться, ингибировать или уменьшать рост патогенных бактерий. Эти штаммы имеют обоснованное применение и использование в профилактическом и/или терапевтическом лечении инфекций и/или патологий, связанных с грамотрицательными и/или грамположительными патогенными бактериями.
Патогенные бактерии выбраны из группы, содержащей колиформные бактерии и клостридии. Колиформные бактерии представляют собой группу бактерий, принадлежащих к семейству Enterobacteriaceae. В частности, колиформные бактерии представляют собой палочковидные, грамотрицательные, аспорогенные, аэробные и факультативные анаэробные бактерии, которые сбраживают лактозу с образованием газа и кислот при 35-37°С за 48 часов и обладают ферментом бета-галактозидазой. Они являются повсеместно распространенными организмами; некоторые присутствуют в фекальном веществе и поэтому используются в качестве индикатора загрязнения как воды, так и пищи, источником других являются вода или почва. Группа содержит более пятидесяти родов, среди них Citrobacter, Enterobacter, предпочтительно Enterobacter cloacae, Escherichia, предпочтительно Е. coli, Hafnia, Klebsiella, предпочтительно Klebsiella pneumoniae, Serratia и Yersinia. Другие патогены, во всех случаях представляющие интерес в контексте настоящего изобретения, принадлежат к семейству Clostridiaceae, в особенности относятся к С. difficile. Антагонистическое действие проявляется также в отношении видов, выбранных из группы, содержащей Salmonella enteriditis, Campylobacter jejunii, Helicobacter pylori, Listeria monocytogenes, Enterococcus sp. и Klebsiella sp.
Объектом настоящего изобретения является фармацевтическая или пищевая композиция, или добавка, или медицинское устройство, содержащие по меньшей мере один бактериальный штамм, принадлежащий к виду или к нескольким видам, выбранным из группы, содержащей или, альтернативно, состоящей из: Lactobacillus delbrueckii, Lactobacillus delbrueckii subsp.delbrueckii, Lactobacillus plantarum, Lactobacillus rhamnosus, Lactobacillus pentosus, Lactobacillus reuteri и Bifidobacterium breve, способный продуцировать бактериоцины, и/или метаболиты, и/или перекись водорода, для применения в профилактическом и/или терапевтическом лечении инфекций и/или патологий, связанных с патогенами, такими как Е. coli, С. difficile, Listeria monocytogenes, Enterococcus sp. и Klebsiella sp.
В одном воплощении фармацевтическая или пищевая композиция, или добавка, или медицинское устройство содержат по меньшей мере один бактериальный штамм, принадлежащий к виду или к нескольким видам, выбранным из группы, содержащей или, альтернативно, состоящей из: Lactobacillus plantarum, Lactobacillus rhamnosus и Lactobacillus pentosus, способный продуцировать бактериоцины, и/или метаболиты, и/или перекись водорода, для применения в профилактическом и/или терапевтическом лечении инфекций и/или патологий, связанных с патогенами, такими как Е. coli, С. difficile, Listeria monocytogenes, Enterococcus sp. и Klebsiella sp.
Штамм и/или различные возможные комбинации вышеупомянутых штаммов (смотри также таблицы 1-5 ниже), выбранные для указанной цели, могут быть использованы отдельно или в комбинации с N-ацетилцистеином; или в комбинации с микроинкапсулированным лизоцимом; или в комбинации с N-ацетилцистеином и микроинкапсулированным лизоцимом.
В одном воплощении патоген Е. coli выбран из Е coli O157:Н7 и Е. coli O104:Н4.
В таблице 1 показан список 14 штаммов лактобацилл, 4 штаммов бифидобактерий и 2 штаммов стрептококков, которые были протестированы в отношении 4 биотипов Е coli. Величины выражены в зонах задержки роста (мм).
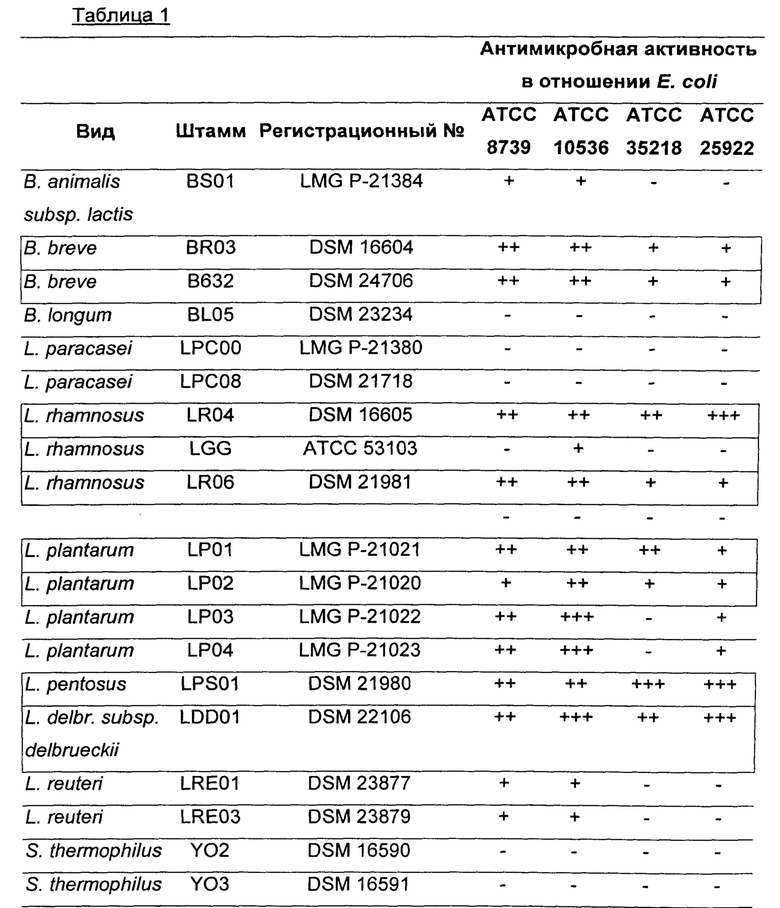
Протестированные бактерии, представленные в таблице 1, взятые отдельно или в комбинации друг с другом, имеют обоснованное применение в контексте настоящего изобретения.
В одном воплощении штаммы бактерий выбраны из группы, содержащей или, альтернативно, состоящей из бактерий, перечисленных в таблице 2.
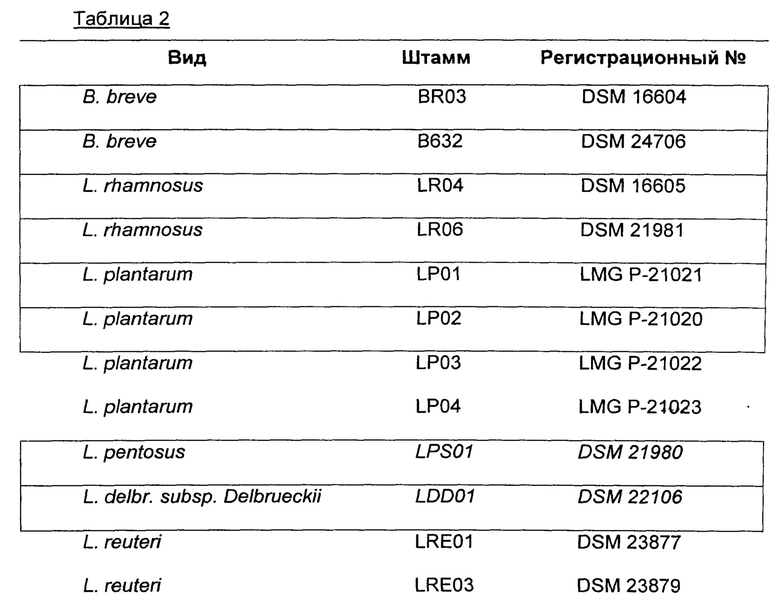
Штаммы, представленные в таблице 2, способны продуцировать бактериоцины, и/или метаболиты, и/или перекись водорода, которые могут бороться, ингибировать и уменьшать рост патогенных бактерий, принадлежащих к виду Е. coli, включая Е. coli O157:Н7.
Штаммы, представленные в таблице 2, тестировали по отдельности с целью определения их способности проявлять антагонизм (ингибировать рост или уменьшать число одного или более чем одного опасного или патогенного вида/рода микроорганизмов), как указано в четырех колонках справа в таблице 1.
Все штаммы, описанные и/или заявленные в настоящей заявке на патент, депонированы в соответствии с Будапештским договором и предоставляются в распоряжение общественности по запросу в компетентный орган по депонированию.
В другом воплощении штаммы бактерий выбраны из группы, содержащей или, альтернативно, состоящей из бактерий, перечисленных в таблице 3.
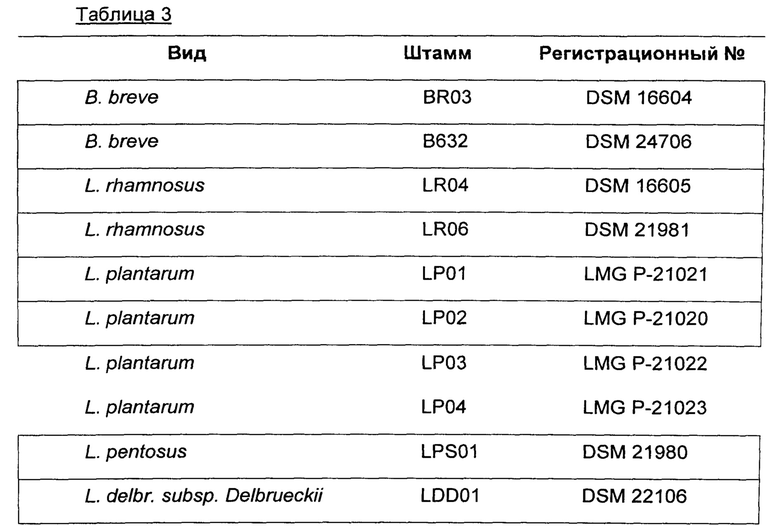
В дополнительном воплощении штаммы бактерий выбраны из группы, содержащей или, альтернативно, состоящей из бактерий, перечисленных в таблице 4.
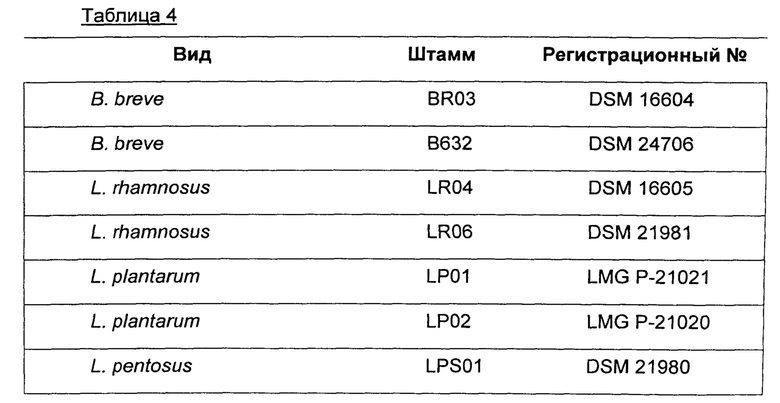

Композиция по настоящему изобретению имеет дополнительное обоснованное применение также для применения в профилактическом и/или терапевтическом лечении инфекций и/или патологий, связанных с патогенами Е. coli, Н. pylori и Clostridium difficile.
В одном воплощении композиция по настоящему изобретению содержит или, альтернативно, состоит из 1-8 штаммов, выбранных из группы, содержащей или, альтернативно, состоящей из штаммов, перечисленных в таблице 4.
В другом предпочтительном воплощении композиция по настоящему изобретению содержит или, альтернативно, состоит из 1-6 штаммов, предпочтительно 2-5 штаммов, даже более предпочтительно 3-4 штаммов, выбранных из группы, содержащей или, альтернативно, состоящей из штаммов, перечисленных в таблице 4.
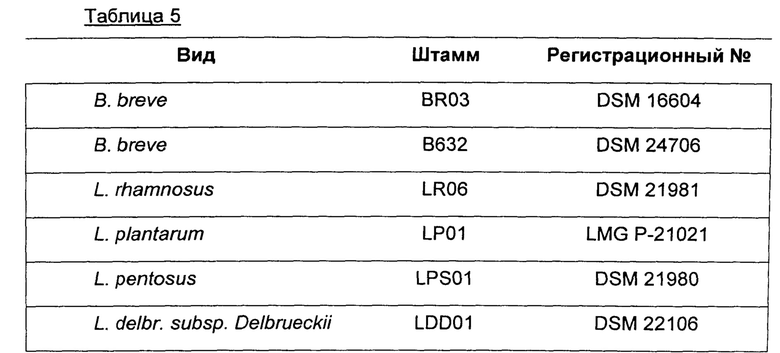
В предпочтительном воплощении композиция содержит или, альтернативно, состоит из шести штаммов, которые перечислены в таблице 5; или из 4 лактобацилл, перечисленных в таблице 5.
Заявитель обнаружил, что штаммы бактерий, выбранных из группы, содержащей или, альтернативно, состоящей из L. pentosus LPS01 DSM 21980, L. plantarum LP01 LMG P-21021, L. plantarum LP02 LMG P-21020 и L. rhamnosus LR04 DSM 16605, способны проявлять ингибиторную активность в отношении 4 штаммов Е. coli; в частности, штаммы L rhamnosus LR04 DSM 16605 и L. pentosus LPS01 DSM 21980 демонстрируют более заметную активность также в отношении серотипа O157:Н7.
Более того, заявитель обнаружил, что штамм L. plantarum LP01 LMG Р-21021 демонстрировал ингибиторную способность в отношении всех энтеропатогенных бактерий, в частности в отношении Listena monocytogenes.
Объектом настоящего изобретения является фармацевтическая или пищевая композиция, или добавка, или медицинское устройство, содержащие по меньшей мере один бактериальный штамм, принадлежащий к виду или к нескольким видам, выбранным из группы, содержащей или, альтернативно, состоящей из: Lactobacillus plantarum, Lactobacillus rhamnosus и Lactobacillus pentosus, который способен продуцировать бактериоцины, и/или метаболиты, и/или перекись водорода, для применения в профилактическом и/или терапевтическом лечении инфекций и/или патологий, связанных с патогенами, такими как Е. coli, включая серотип O157:Н7, и Listena monocytogenes.
В одном воплощении указанная фармацевтическая или пищевая композиция, или добавка, или медицинское устройство содержат по меньшей мере один бактериальный штамм, выбранный из группы, содержащей или, альтернативно, состоящей из L. pentosus LPS01 DSM 21980, L. plantarum LP01 LMG P-21021, L. plantarum LP02 LMG P-21020 и L. rhamnosus LR04 DSM 16605; предпочтительно она содержит или состоит из штаммов L rhamnosus LR04 DSM 16605 и L. pentosus LPS01 DSM 21980; или она содержит или состоит из штамма L. plantarum LP01 LMG P-21021.
В композиции по настоящему изобретению смесь штаммов бактерий находится в количестве, составляющем от 0,5 до 20% по массе от общей массы композиции, предпочтительно от 2,5 до 10%. В предпочтительном воплощении композиция может к тому же содержать по меньшей мере одно пребиотическое волокно и/или углевод, обладающий бифидогенным действием.
Пребиотическое волокно, которое находит применение в композиции по настоящему изобретению, представляет собой волокно, которое должно быть использовано штаммами бактерий, присутствующими в композиции, но не патогенами, для противодействия которым оно предназначено.
Кроме того, композиция может также содержать другие активные ингредиенты и/или компоненты, такие как витамины, минералы, биоактивные пептиды, вещества с антиокислительным, гипохолестеринемическим, гипогликемическим и противовоспалительным действием и агенты, маскирующие сладкий вкус, в количестве, обычно составляющем от 0,001 до 20% по массе, предпочтительно от 0,01 до 5% по массе, всегда в зависимости от вида активного компонента и его рекомендованной суточной дозы, если он присутствует, от общей массы композиции.
Пищевую композицию, которая является объектом настоящего изобретения, например симбиотическую композицию, или добавку, или фармацевтическую композицию, или медицинское устройство, получают исходя из методик и оборудования, известных специалистам в данной области техники.
В предпочтительном воплощении композиция содержит бактерии в концентрации, составляющей от 1×106 до 1×1011 колониеобразующих единиц (КОЕ)/г смеси, предпочтительно от 1×108 до 1×1010 КОЕ/г смеси.
В предпочтительном воплощении композиция содержит бактерии в концентрации, составляющей от 1×106 до 1×1011 КОЕ/доза, предпочтительно от 1×108 до 1×1010 КОЕ/доза.
Доза может составлять от 0,2 до 10 г, например она составляет 0,25 г, 1 г, 3 г, 5 г или 7 г.
Пробиотические бактерии, используемые в настоящем изобретении, могут находиться в твердой форме, в частности в форме порошка, дегидрированного порошка или лиофилизированного.
Все композиции по настоящему изобретению готовят согласно методикам, известным специалистам в данной области техники, и при использовании известного оборудования.
В предпочтительном воплощении композиция, которая является объектом настоящего изобретения, содержит к тому же ацетилцистеин (или N-ацетилцистеин), который представляет собой N-ацилированное производное аминокислоты цистеина, и лизоцим, предпочтительно микроинкапсулированный и защищенный от желудочного сока в липидной матрице, как описано выше.
Заявитель обнаружил, что применение ацетилцистеина в сочетании с одним или двумя штаммами бактерий, описанных в таблицах 1-5 или в различных предпочтительных воплощениях, упомянутых выше, способствует разрушению бактериальной биопленки, продуцируемой самими патогенными бактериями и которая используется указанными патогенами в качестве защиты. На практике видно, что патогенные бактерии способны образовывать защитное покрытие (биопленку) вокруг клеток. Биопленка делает клетки патогенов более трудноуязвимыми и лучше защищенными. Ацетилцистеин способен проникать в биопленку клеток и разрушать ее, облегчая атаку на патогенные клетки с помощью бактериоцинов, и/или метаболитов, и/или перекиси водорода, продуцируемых штаммами бактерий, которые являются объектом настоящего изобретения.
Количество ацетилцистеина, присутствующего в композиции для введения, которая является объектом настоящего изобретения, составляет от 10 до 1000 мг/сутки, предпочтительно оно составляет от 200 до 600 мг/сутки. Ацетилцистеин предпочтительно в твердой форме смешивают с пробиотическими бактериями предпочтительно в твердой или лиофилизированной форме при использовании методик и оборудования, известных специалистам в данной области техники.
Количество лизоцима, предпочтительно микроинкапсулированного, присутствующего в композиции для введения, которая является объектом настоящего изобретения, составляет от 10 до 2000 мг/сутки, предпочтительно оно составляет от 400 до 1000 мг/сутки. Лизоцим (предпочтительно микроинкапсулированный) находится предпочтительно в твердой форме, и его смешивают с пробиотическими бактериями предпочтительно в твердой или лиофилизированной форме при использовании методик и оборудования, известных специалистам в данной области техники.
Количества ацетилцистеина и микроинкапсулированного лизоцима, присутствующих в композиции для введения, которая является объектом настоящего изобретения, соответственно составляют от 10 до 1000 мг/сутки, предпочтительно от 200 до 600 мг/сутки, тогда как микроинкапсулированный лизоцим составляет от 10 до 2000 мг/сутки, предпочтительно от 400 до 1000 мг/сутки; их смешивают с пробиотическими бактериями в твердой форме, предпочтительно в твердой или лиофилизированной форме, при использовании методик и оборудования, известных специалистам в данной области техники. Количество N-ацетилцистеина, присутствующего в композиции, которая является объектом настоящего изобретения, составляет от 10 до 1000 мг/сутки, предпочтительно от 50 до 200 мг/сутки, даже более предпочтительно от 60 до 150 мг/сутки. N-ацетилцистеин имеется в продаже в фармацевтически приемлемой форме, предпочтительно в твердой форме, и его смешивают с пробиотическими бактериями, предпочтительно в твердой или лиофилизированной форме, при использовании методик и оборудования, известных специалистам в данной области техники, с получением гомогенной композиции.
Количество лизоцима, предпочтительно микроинкапсулированного и защищенного от желудочного сока, присутствующего в композиции, которая является объектом настоящего изобретения, составляет от 10 до 2000 мг/сутки, предпочтительно оно составляет от 400 до 1000 мг/сутки, даже более предпочтительно от 500 до 800 мг/сутки, предпочтительно в твердой форме; его смешивают с пробиотическими бактериями, предпочтительно в твердой или лиофилизированной форме, при использовании методик и оборудования, известных специалистам в данной области техники, с получением гомогенной композиции. Лизоцим имеется в продаже в фармацевтически приемлемой форме.
Экспериментальная часть
Антимикробную активность 14 штаммов лактобацилл, 4 штаммов бифидобактерий и 2 штаммов стрептококков тестировали в отношении 4 биотипов E coll. АТСС 8739, АТСС 10536, АТСС 35218 и АТСС 25922; они являются общественно доступными. Величины выражают в виде зон задержки роста (мм). Данные показаны в таблице 1.
Для определения антимикробной активности штаммы тестировали согласно протоколу, изложенному в Santini et al. (2010) Characterization of probiotic strains: an application as feed additives in poultry against Campylobacter jejuni. IntJ Food Microbiol. 2010 Jul 31; 141 Supp 11:398-108. Epub 2010 Apr 8.
Штаммы бактерий, перечисленные в таблице 1, культивировали в бульоне MRS (среда де Манн, Рогоза и Шарпа (deMann, Rogosa и Sharpe)) при 37°С в течение 18 часов при использовании системы для создания анаэробной атмосферы (GasPack System). Различные биотипы Е. coli активировали в триптическом соевом бульоне (TBS) и инкубировали в аэробных условиях при 37°С в течение 18 часов. Перед экспериментами штаммы пересевали по меньшей мере три раза. Для капельного теста на агаре (тест, известный специалистам в данной области техники) проводили следующую процедуру. На практике, 10 микролитров культуры вышеупомянутых штаммов лактобацилл, выращенных при 37°С в течение ночи (культуральная жидкость плюс среда), помещали (наносили в виде капель) на поверхность чашки с агаризованной средой (содержащей агаризованную среду TBS). Чашку инкубировали в течение 18 часов при 37°С, давая возможность штамму (пятну на месте нанесения капли) разрастись. Биотипы Е. coli (0,1%) инкубировали в триптическом соевом мягком агаре и разливали на пятна в чашки, указанные выше. Как только верхний слой агара застывал, чашки переворачивали и инкубировали в аэробных условиях при 37°С в течение 24 часов. Каждый тест повторяли дважды. Через 24 часа чашки визуально исследовали путем осмотра и определения зон задержки роста. Наличие зоны задержки роста 2 мм или более вокруг пятна лактобацилл считали положительным результатом (смотри фиг. 1 с кратким описанием используемого способа).
Для бифидобактерий использовали такую же методику, как и для лактобацилл.
Методика использования верхнего слоя агара:
Штамм Е. coli, высеянный штрихом на чашку Петри с агаризованной средой (агаризованная среда МакКонки), инкубируют в аэробных условиях в течение 24 часов. 1 или 2 колонии отбирают и разводят в 1 мл стерильной воды до достижения ими величины мутности 0,5 по шкале МакФарланда (известная шкала, упоминаемая в справочных таблицах).
100 мкл этой суспензии инокулируют в 50 мл мягкой агаризованной среды (LAPTg с 0,7% агара) при температуре примерно 45°С, так чтобы поддерживать ее в жидком состоянии.
3 мл мягкого агара выливают на поверхность чашки с предварительно выращенными лактобациллами.
Подсушивают (дают агару затвердеть) и инкубируют при 37°С в аэробных условиях в течение 18-20 часов.
Результаты получают посредством измерения зоны задержки роста.
Результаты
A. In vitro скрининг штаммов по настоящему изобретению, обладающих активностью в отношении биотипов E. coli.
Активность по ингибированию роста Е. coli определяли при использовании живых бактериальных культур штаммов, перечисленных в таблице 1. Положительные результаты получали для всех штаммов, перечисленных в таблице 2. В частности, штаммы, перечисленные в таблицах 3-5, отличались сильным ингибирующим/уменьшающим рост воздействием на все протестированные биотипы E. coli.
В. Отбор штаммов по настоящему изобретению, обладающих ингибиторной активностью в отношении токсинообразующей бактерии Е. coli O157:Н7.
Штаммы, перечисленные в таблице 1, также тестировали в отношении Е. coli O157:Н7. Ингибиторную активность в отношении роста Е. coli O157:Н7 определяли при использовании живых бактериальных культур штаммов, перечисленных в таблице 1.
Как показано на фиг.2, только 5 протестированных штаммов демонстрировали способность ингибировать/уменьшать рост биотипов протестированных Е. coli, включая энтерогеморрагическую Е. coli O157:Н7 (CQ9485). На фиг. 2 результаты выражены в виде стандартного отклонения (SD) зон задержки роста, подсчитанных по трем различным тестам и при допуске значения отсечки 2 мм.
Из экспериментальных данных, представленных выше, можно сделать вывод, что 6 лактобацилл и 2 бифидобактерии (таблица 4) демонстрируют in vitro активность по ингибированию/уменьшению роста четырех штаммов Е. coli (АТСС 8739, АТСС 10536, АТСС 35218, АТСС 25922), которые ответственны за выработку широкого спектра биогенных аминов, таких как, например, меркаптан, гистамин, кадаверин, путресцин и тирамин, путем декарбоксилирования аминокислот. Эти биогенные амины считают ответственными за опасные системные интоксикации. Кроме того, при наличии нитритов и нитратов могут быть образованы N-нитрозамины, которые демонстрируют сильную мутагенную активность, которая может быть причиной некоторых видов рака. Наконец, экспериментальные данные, представленные выше, показывают, что пять штаммов протестированных бактерий являются активными в отношении патогенного штамма Е. coli O157:Н7 (CQ9485), который способен продуцировать один или более чем один шигатоксин, который является очень опасным для здоровья человека и может даже приводить к смерти.
Экспериментальная часть
Материалы и методы: микроорганизмы и условия культивирования
В настоящем исследовании использовали 4 различных вида пробиотических бактерий, принадлежащих к роду Lactobacillus (таблицы 6 и 7). Все бактерии культивировали в среде де Манн, Рогоза и Шарпа (MRS), (поставляемой компанией Becton Dickinson, Милан, Италия) при 37°С в течение 18 часов в анаэробных условиях (GasPak, Becton Dickinson, Милан, Италия). Следующие 4 биотипа Е. соli были использованы в качестве штаммов-мишеней: Е. coli АТСС 8739, Е. coli АТСС 10536, Е. coli АТС С 35218 и Е. coli АТСС 25922, закупаемые у Американской коллекции типовых культур (АТСС, Роквилл, Мэриленд, США). Энтерогеморрагический штамм Е. coli O157:Н7 (CQ 9485) был предложен отделением гастроэнтерологии больницы Maggiore della Carita, Новара, Италия. Listena monocytogenes АТСС 19112 закупали у Американской коллекции типовых культур; Enterococcus sp. и Klebsiella sp. выделяли из образцов кала новорожденных, подверженных коликам (Болонский университет, Италия). Все биотипы Е. coli, Enterococcus sp. и Klebsiella sp. культивировали в триптон-соевом бульоне (TSB) (Biotest, Рокуэй, Нью-Джерси, США) и инкубировали в аэробных условиях при 37°С в течение 18 часов. Listena monocytogenes культивировали в среде Фразера (Oxoid, Гэмпшир, Великобритания) и инкубировали в аэробных условиях при 37°С в течение 18 часов. Все бактериальные штаммы пересевали по меньшей мере три раза, перед тем как использовать в экспериментах по ингибированию.
Ферментативный профиль при использовании тест-системы API 50 CHL
Виды пробиотических бактерий, принадлежащих к роду Lactobacillus, культивировали в течение 18 часов при 37°С, дважды промывали в стерильной воде и центрифугировали при 6000 об/мин в течение 5 минут. После ресуспендирования в воде в пробирку, содержащую 5 мл воды, добавляли количество образца так, чтобы достичь величины мутности 2 по шкале МакФарланда. Количество образца, равное двойному количеству, использованному ранее, добавляли в 10 мл среды API 50 CHL (системы API, BioMerieux). 200 мкл суспензии переносили в каждую лунку тест-панели API 50 СН. Все лунки перекрывали парафиновым маслом для обеспечения анаэробных условий. Тест-панели увлажняли и инкубировали при 37°С. Изменение исходного цвета (пурпурный) проверяли через 1 и 2 суток инкубирования.
Праймеры и видоспецифический ПНР-анализ
Геномную ДНК (дезоксирибонуклеиновую кислоту) каждого штамма Lactobacillus экстрагируют с помощью набора MicroLysis™ (Labogen, Po, Италия). А именно 2 мкл каждой бактериальной культуры добавляют в лизирующий буфер и лизис проводят с помощью амплификатора/термоциклера Gene Amp PCR System 9700 (Perkin-Elmer, Монца, Италия), следуя инструкциям производителя.
Для штаммов L. plantarum и L. pentosus праймеры, используемые для реакции ПЦР (полимеразная цепная реакция), конструировали на основе гена recA, тогда как для штамма L. rhamnosus использовали межгенный участок, заключенный между 16S и 23S рибосомальной РНК (рибонуклеиновой кислоты) (таблица 6). Все праймеры были синтезированы фирмой Sigma-Aldrich.
Для амплификации составляли смесь (25 мкл) из 2х GoTaq Green Master Mix (Promega), 1 мкл ДНК после лизиса и набора видоспецифичных праймеров (0,30 мМ). Циклы ПЦР проводили с помощью амплификатора/термоциклера Gene Amp PCR System 9700. Программы амплификации показаны в таблице 6.
PFGE (гель-электрофорез в пульсирующем поле)
Штаммы Lactobacillus культивируют в среде MRS до тех пор, пока оптическая плотность при 600 нм (OD600) не достигает 0,8. После промывания в буферном растворе, состоящем из 10 мМ Tris (трис(гидроксиметил)аминометана), 20 мМ NaCl, 50 мМ ЭДТА (этилендиаминтетрауксусной кислоты), с рН 7,2 клетки ресуспендируют в 300 мкл такого же буферного раствора. После добавления 300 мкл 2% агарозы (Bio-Rad) образцы выливают в заливочные формы.
Застывшие гелевые матриксы инкубируют в течение 18 часов при 37°С в лизирующем буферном растворе (6 мМ Tris, 1 М NaCl, 100 мМ ЭДТА, 1% саркосила, 0,2% дезоксихолата, рН 7,6) при добавлении 2,5 мг/мл лизоцима (Sigma) и 4 Ед/мл мутанолизина (Sigma). Обработку протеиназой К (1 мг/мл) проводили в буферном растворе, содержащем 100 мМ ЭДТА, 1% саркосила, 0,2% дезоксихолата, при рН 8,0 в течение 24 часов при 50°С. Матриксы промывают 4 раза буферным раствором, содержащим 20 мМ Tris, 50 мМ ЭДТА, при рН 8,0, добавляя в первые 2 промывки 1 мМ фенилметилсульфонилфторида (Sigma). Перед расщеплением эндонуклеазой рестрикции матриксы дважды промывают буфером ТЕ (Tris-ЭДТА) и затем уравновешивают в течение 1 часа в соответствующем рестрикционном буфере. Процессы расщепления эндонуклеазами рестрикции проводят в течение 18 часов при 37°С с эндонуклеазой Notl и при 50°С с эндонуклеазой Sfil. Электрофоретический цикл проводят в аппарате CHEF DR III (Bio-Rad) при использовании 1% агарозного геля (Bio-Rad) в 0,5 М буфере ТВЕ (Tris-борат-ЭДТА).
Цикл задается со следующими параметрами: Notl (время пульса: 1-11 с, напряженность поля 6 В/см, температура буфера 14°С, время цикла 27 ч); Sfil (время пульса: 1-15 с, напряженность поля 5 В/см, температура буфера 14°С, время цикла 22 ч). Агарозный гель окрашивают этидиум бромидом (0,5 мг/мл) и рассматривают в УФ свете.
Оценка in vitro ингибиторной активности
Антимикробную активность в отношении E. coli оценивали при использовании протокола, описанного Santini С. et al. Вкратце, 10 мкл каждой LAB культуры с оптической плотностью при 600 нм примерно 1,0 заливают (наносят в виде капель) на поверхность чашки Петри с агаризованной средой LAPTg и инкубируют в анаэробных условиях в течение 24 часов при 37°С, создавая возможность бактериального роста (пятна). Штамм-мишень Е. coli (0,1%) инокулируют в триптический соевый мягкий агар и заливают на чашки, содержащие пятна. После застывания чашки переворачивают и инкубируют в аэробных условиях в течение 24 часов при 37°С.
Каждый эксперимент проводили в двух повторностях. Наличие свободной от роста исследуемого патогена зоны (зоны задержки роста) считали положительным результатом.
Количественное определение ингибиторной активности пробиотика в отношении различных штаммов Е. coli проводили в лабораториях отдела исследований и разработок компании Biolab Research, MofinAlce Group, тогда как количественное определение, относящееся к энтерогеморрагическому штамму Е. coli O157:Н7, проводили квалифицированные специалисты частной клиники «I Cedri», Фара-Новарезе, Италия.
Антимикробную активность в отношении Listeria monocytogenes, Enterococcus sp. и Klebsiella sp.оценивали при использовании диско-диффузионного метода. Вкратце, LAB культуры культивировали в среде MRS в течение 24 часов при 37°С, затем промывали и ресуспендировали в свежей среде. Патоген равномерно высевают на поверхность чашки Петри, содержащей агаризованную среду, селективную для исследуемых патогенных видов. Различные бумажные диски размещают на поверхности чашки с патогеном и затем пропитывают каждый диск 100 мкл LAB культуры. Чашки инкубируют при 37°С в течение 24 часов. Наличие свободной от роста исследуемого патогена зоны (зоны задержки роста) считали положительным результатом. Результаты выражают в виде зон задержки роста (мм). При определении порог значимости результата составляет 2 мм.
Результаты
In vitro ингибиторная активность пробиотических штаммов в отношении патогенных бактерий
Антимикробная активность некоторых штаммов лактобацилл в отношении патогенных бактерий имеет многофакторный характер и включает выработку перекиси водорода, молочной кислоты, известных молекул, таких как бактериоцины, и неизвестных молекул, устойчивых к нагреванию.
Как показано на фиг. 4, результаты, полученные с помощью капельного метода на агаре и живых клеток, подчеркнули тот факт, что все тестируемые бактерии демонстрируют ингибиторную активность в отношении четырех штаммов Е. coli. Пробиотическими штаммами, которые демонстрируют наибольшую ингибиторную активность, являются L. rhamnosus LR04 и L. pentosus LPS01. Данные, полученные при использовании в качестве мишени также и энтерогеморрагического штамма Escherichia coli, серотип O157:1-17, продемонстрировали наилучшую ингибиторную активность в присутствии L. rhamnosus LR04 и L. pentosus LPS01 (фиг. 4).
Для лучшей характеристики исследуемых пробиотических штаммов анализ был расширен на другие патогенные виды, которые поражают желудочно-кишечный тракт человека, с использованием диско-диффузионного метода. Штамм L. plantarum LP01 неожиданно продемонстрировал наилучшую ингибиторную способность в отношении всех протестированных энтеропатогенных бактерий, в частности в отношении Listeria monocytogenes.


Предложено применение фармацевтической композиции, пищевой композиции или пищевой добавки для ингибирования или уменьшения роста патогенных бактерий, принадлежащих к серотипу Е. coli O157:Н7, Listeria monocytogenes АТСС 19112 и Klebsiella sp. При этом фармацевтическая композиция, пищевая композиция или пищевая добавка содержит по меньшей мере один бактериальный штамм, выбранный из группы, состоящей из Lactobacillus rhamnosus LR04 DSM 16605, Lactobacillus plantarum LP01 LMG P-21021, Lactobacillus plantarum LP02 LMG P-21020 и Lactobacillus pentosus LPS01 DSM 21980. Группа изобретений обеспечивает эффективное ингибирование или уменьшение роста бактерий Е. coli O157:Н7, Listeria monocytogenes АТСС 19112 и Klebsiella sp. 3 н. и 24 з.п. ф-лы, 6 ил., 7 табл.
1. Применение фармацевтической композиции, содержащей по меньшей мере один бактериальный штамм, выбранный из группы, состоящей из Lactobacillus rhamnosus LR04 DSM 16605, Lactobacillus plantarum LP01 LMG P-21021, Lactobacillus plantarum LP02 LMG P-21020 и Lactobacillus pentosus LPS01 DSM 21980, для ингибирования или уменьшения роста патогенных бактерий, принадлежащих к серотипу Е. coli O157:Н7, Listeria monocytogenes АТСС 19112 и Klebsiella sp.
2. Применение по п.1, где указанная композиция содержит или, альтернативно, состоит из двух, или трех, или четырех указанных штаммов, принадлежащих к одному или более чем одному виду.
3. Применение по п.1, где указанные штаммы бактерий выбраны из группы, состоящей из штаммов L. rhamnosus LR04 DSM 16605 и L. pentosus LPS01 DSM 21980, для ингибирования или уменьшения роста патогенных бактерий, принадлежащих к серотипу Е. coli O157:Н7.
4. Применение по п.1, где бактериальный штамм представляет собой L. plantarum LP01 LMG Р-21021 для ингибирования или уменьшения роста патогенных бактерий, принадлежащих к виду Listeria monocytogenes.
5. Применение по п.1, где указанная композиция дополнительно содержит ацетилцистеин.
6. Применение по п.1, где указанная композиция дополнительно содержит лизоцим.
7. Применение по п.1, где указанная композиция дополнительно содержит лизоцим, микроинкапсулированный в липидной матрице, предпочтительно природного происхождения, обладающей температурой плавления, составляющей от 30 до 80°С, предпочтительно от 40 до 70°С, даже более предпочтительно от 50 до 60°С.
8. Применение по п.1, где указанная композиция дополнительно содержит ацетилцистеин и лизоцим, микроинкапсулированный в липидной матрице, предпочтительно природного происхождения, обладающей температурой плавления, составляющей от 30 до 80°С, предпочтительно от 40 до 70°С, даже более предпочтительно от 50 до 60°С.
9. Применение по любому из пп.1-8, где указанная композиция дополнительно содержит по меньшей мере одно пребиотическое волокно и/или углеводы, обладающие бифидогенным действием.
10. Применение пищевой композиции, содержащей по меньшей мере один бактериальный штамм, выбранный из группы, состоящей из Lactobacillus rhamnosus LR04 DSM 16605, Lactobacillus plantarum LP01 LMG P-21021, Lactobacillus plantarum LP02 LMG P-21020 и Lactobacillus pentosus LPS01 DSM 21980, для ингибирования или уменьшения роста патогенных бактерий, принадлежащих к серотипу Е. coli O157:Н7, Listeria monocytogenes АТСС 19112 и Klebsiella sp.
11. Применение по п.10, где указанная композиция содержит или, альтернативно, состоит из двух, или трех, или четырех указанных штаммов, принадлежащих к одному или более чем одному виду.
12. Применение по п.10, где указанные штаммы бактерий выбраны из группы, состоящей из штаммов L. rhamnosus LR04 DSM 16605 и L. pentosus LPS01 DSM 21980.
13. Применение по п. 10, где бактериальный штамм представляет собой L. plantarum LP01 LMG P-21021.
14. Применение по п.10, где указанная композиция дополнительно содержит ацетилцистеин.
15. Применение по п.10, где указанная композиция дополнительно содержит лизоцим.
16. Применение по п.10, где указанная композиция дополнительно содержит лизоцим, микроинкапсулированный в липидной матрице, предпочтительно природного происхождения, обладающей температурой плавления, составляющей от 30 до 80°С, предпочтительно от 40 до 70°С, даже более предпочтительно от 50 до 60°С.
17. Применение по п.10, где указанная композиция дополнительно содержит ацетилцистеин и лизоцим, микроинкапсулированный в липидной матрице, предпочтительно природного происхождения, обладающей температурой плавления, составляющей от 30 до 80°С, предпочтительно от 40 до 70°С, даже более предпочтительно от 50 до 60°С.
18. Применение по любому из пп.10-17, где указанная композиция дополнительно содержит по меньшей мере одно пребиотическое волокно и/или углеводы, обладающие бифидогенным действием.
19. Применение пищевой добавки, содержащей по меньшей мере один бактериальный штамм, выбранный из группы, состоящей из Lactobacillus rhamnosus LR04 DSM 16605, Lactobacillus plantarum LP01 LMG P-21021, Lactobacillus plantarum LP02 LMG P-21020 и Lactobacillus pentosus LPS01 DSM 21980, для ингибирования или уменьшения роста патогенных бактерий, принадлежащих к серотипу Е. coli O157:Н7, Listeria monocytogenes АТСС 19112 и Klebsiella sp.
20. Применение по п.19, где указанная добавка содержит два, или три, или четыре указанных штамма, принадлежащих к одному или более чем одному виду.
21. Применение по п.19, где указанные штаммы бактерий выбраны из группы, состоящей из штаммов L. rhamnosus LR04 DSM 16605 и L. pentosus LPS01 DSM 21980.
22. Применение по п.19, где бактериальный штамм представляет собой L. plantarum LP01 LMG P-21021.
23. Применение по п.19, где указанная добавка дополнительно содержит ацетилцистеин.
24. Применение по п.19, где указанная добавка дополнительно содержит лизоцим.
25. Применение по п.19, где указанная добавка дополнительно содержит лизоцим, микроинкапсулированный в липидной матрице, предпочтительно природного происхождения, обладающей температурой плавления, составляющей от 30 до 80°С, предпочтительно от 40 до 70°С, даже более предпочтительно от 50 до 60°С.
26. Применение по п.19, где указанная добавка дополнительно содержит ацетилцистеин и лизоцим, микроинкапсулированный в липидной матрице, предпочтительно природного происхождения, обладающей температурой плавления, составляющей от 30 до 80°С, предпочтительно от 40 до 70°С, даже более предпочтительно от 50 до 60°С.
27. Применение по любому из пп.19-26, где указанная добавка дополнительно содержит по меньшей мере одно пребиотическое волокно и/или углеводы, обладающие бифидогенным действием.
| US 20110177198 А1, 21.07.2011 | |||
| ТВЕРДОТЕЛЬНЫЙ ГАЗОВЫЙ СЕНСОР (ВАРИАНТЫ) | 2007 |
|
RU2360237C1 |
| WO 2010136891 A1, 02.12.2010 | |||
| WO 2006013588 A1, 09.02.2006 | |||
| COLLADO M.C | |||
| ET AL | |||
| Probiotic strains and their combination inhibit in vitro adhesion of pathogens to pig intestinal mucosa // Curr | |||
| Microbiol., 2007, 55:260-265 | |||
| JOHNSON-HENRY K.C | |||
| ET AL | |||
| Соломорезка | 1918 |
|
SU157A1 |
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Аппарат, предназначенный для летания | 0 |
|
SU76A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Логарифмические счеты | 1922 |
|
SU1340A1 |
| EATON K.A | |||
| ET AL | |||
| Probiotic Lactobacillus reuteri ameliorates disease due to enterohemorrhagic Escherichia coli in germfree mice // Infection and Immunity, Jan | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Цилиндрический сушильный шкаф с двойными стенками | 0 |
|
SU79A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Способ укрепления под покрышкой пневматической шины предохранительного слоя или манжеты | 1917 |
|
SU185A1 |
| ПРОБИОТИЧЕСКИЕ ШТАММЫ Lactobacillus (ВАРИАНТЫ) И ИХ ПРИМЕНЕНИЕ | 2003 |
|
RU2316586C2 |
Авторы
Даты
2017-06-30—Публикация
2012-09-10—Подача