Изобретение относится к области органической химии и химии поверхностно-активных веществ, к получению нового класса гетероциклических бетаинов морфолин-4-илпропиламидов жирных кислот растительных масел, которые проявляют свойства пенообразователей и антимикробные свойства, могут найти применение как компоненты моющих средств, шампуней, гелей для душа и т.д. Поверхностно-активные вещества, обладающие бетаиновой структурой, отличаются стабильностью пены, даже в присутствии других поверхностно-активных веществ и мыл, антибактериальными свойствами, хорошей моющей способностью без раздражающего действия даже на чувствительную кожу, поэтому они широко используются, в том числе в средствах для детей. Помимо этого бетаины находят применение в получении пенных противопожарных агентов [CN 103751941 (2014 г.)].
Процесс получения бетаинов, как правило, протекает в две стадии:
- получение третичных аминов;
- реакция кватернизации.
Бетаины получают на основе различных третичных аминов. В патенте [CN 102618244 (2011 г.)] и заявке [US 2014113842 (2014 г.)] описан способ получения бетаинов, содержащих в своей структуре бензольное кольцо. Первой стадией процесса является алкилирование ароматических соединений эфирами галогенкарбоновых кислот по реакции Фриделя-Крафтца, вторая стадия - восстановление эфиров до соответствующих спиртов, третья стадия - аминирование под действием вторичного амина, заключительная стадия - алкилирование третичного амина натриевой солью монохлоруксусной кислоты. К недостаткам данного метода можно отнести большое количество стадий, проведение реакций с использованием катализаторов и при повышенном давлении.
Преимуществом способа, предложенного авторами патента [CN 101618302 (2008 г.)], является получение бетаинов, не содержащих примесей органических и неорганических солей. Это достигается использованием в качестве алкилирующего реагента лактона β-окиспропионовой кислоты. Недостатками данного способа является применение органических растворителей и токсичных реагентов.
Китайскими учеными [CN 101607183 (2008 г.)] разработан способ получения ПАВ-близнецов из диметилэтилендиамина, который подвергается алкилированию алкилбромидами с последующей кватернизацией действием натриевой солью монохлоруксусной кислоты. К недостаткам данного метода можно отнести использование катализаторов и длительность проведения реакций.
Классическими примерами среди бетаинов, обладающих поверхностно-активными свойствами, являются карбоксибетаины на основе диметиламинопропиламидов жирных кислот. Известен непрерывный способ получения бетаинов из амидов жирных кислот как индивидуальных, так и смесей, основанный на проведении реакций амидирования в теплообменнике при температуре до 180°С, прохождении продукта через ректификационную колонну для удаления избытка амина и побочных продуктов, кватернизации действием солей галогенкарбоновых кислот при температуре 60-120°С и давлении 0,12 МПа. К недостаткам данного метода можно отнести сложное технологическое оборудование, проведение реакций при высоких температурах и повышенном давлении.
Авторами патентов [ЕР 0739878 (1996 г.), DE 3726322 (1988 г.)] разработаны способы получения высококонцентрированных текучих бетаинов. Недостатком данных методов является использование дополнительных веществ, таких как неорганические (соляная, серная, ортофосфорная) и органические (лимонная) кислоты.
Наиболее близким (прототип) является способ получения диметиламинопропилкарбоксибетаинов реакцией диметиламинопропиламидов жирных кислот и натриевой соли монохлоруксусной кислоты [CN 103524370 (2013 г.)]. К недостаткам данного метода можно отнести использование растворителя, получение продуктов с невысокой концентрацией (до 40%), содержащих в качестве примеси хлорид натрия.
Отличительными особенностями предлагаемого изобретения являются:
- использование морфолин-4-илпропиламидов жирных кислот растительных масел в качестве исходных реагентов;
- получение высококонцентрированных продуктов, очищенных от неорганических солей.
Задачей настоящего изобретения является разработка простого в исполнении способа получения бетаинов морфолин-4-илпропиламидов жирных кислот растительных масел, позволяющего осуществить синтез целевых продуктов из морфолин-4-илпропиламидов жирных кислот природного происхождения, в том числе из подсолнечного, соевого, пальмового и кокосового масел и натриевой соли монохлоруксусной кислоты при 80-85°С в течение 10 часов.
Технический результат заключается в получении новых бетаинов морфолин-4-илпропиламидов жирных кислот, обладающих антимикробными свойствами, простым и технологичным способом из морфолин-4-илпропиламидов жирных кислот растительных масел (подсолнечного, соевого, пальмового и кокосового) и натриевой соли монохлоруксусной кислоты.
Технический результат достигается:
- проведением синтеза бетаинов морфолин-4-илпропиламидов при взаимодействии морфолин-4-илпропиламидов жирных кислот растительных масел и натриевой соли монохлоруксусной кислоты (мольное соотношение амид:натриевая соль монохлоруксусной кислоты = 1:1);
- выдерживанием реакционной массы при 80-85°С в течение 10 часов,
- удалением хлорида натрия из реакционной массы фильтрованием;
- получением ранее неизученных смесей бетаинов морфолин-4-илпропиламидов, содержащих остатки жирных кислот растительных масел (C6-C22).
Технический результат подтверждают проведенные исследования с выявлением высокой пенообразующей способностью и антимикробного действия бетаинов морфолин-4-илпропиламидов в отношении Streptococcus thermophilus, Escherichia coli, Bacillus, Saccaromyces, Penicillium.
Изобретение подтверждается проиллюстрированными чертежами, схемами, графиками,
где на фиг. 1 показано влияние различных концентраций бетаинов морфолин-4-илпропиламидов жирных кислот пальмового масла I b на прирост биомассы термофильного стрептококка;
на фиг. 2 показано влияние различных концентраций бетаинов морфолин-4-илпропиламидов жирных кислот пальмового масла I b на рост термофильного стрептококка;
на фиг. 3 показано влияние различных концентраций бетаинов морфолин-4-илпропиламидов жирных кислот пальмового масла I b на прирост биомассы Escherichia coli;
на фиг. 4 показано влияние различных концентраций бетаинов морфолин-4-илпропиламидов жирных кислот пальмового масла I b I а на рост Escherichia coli;
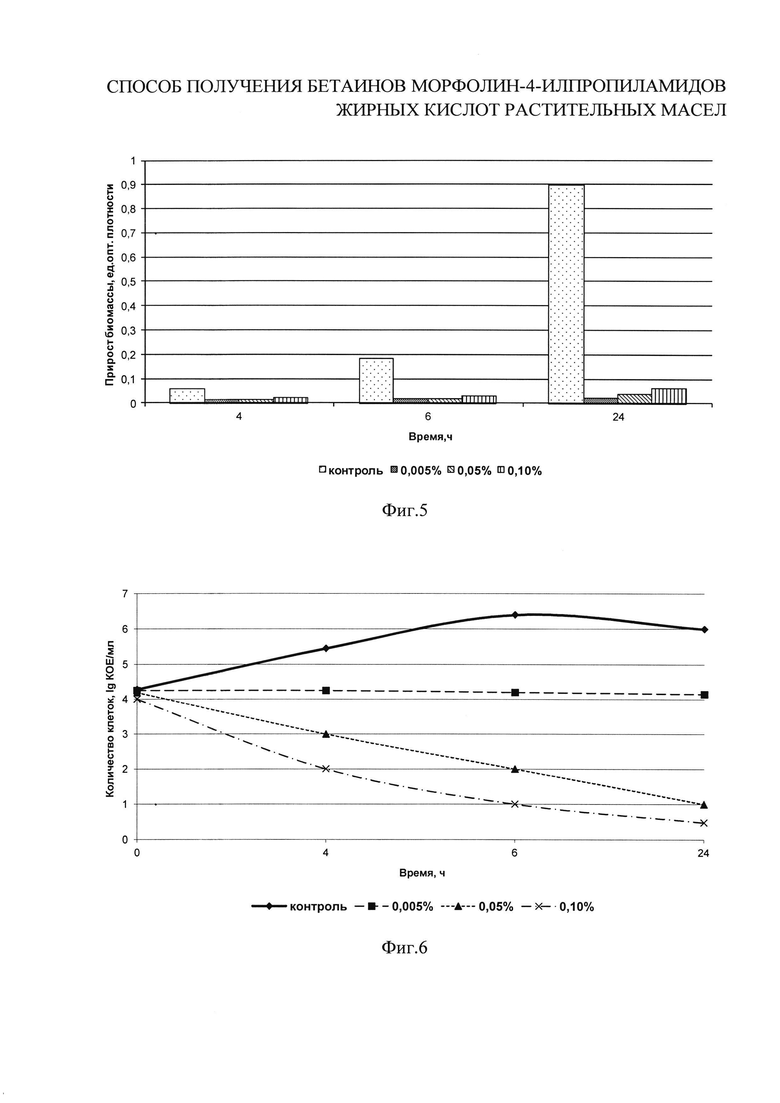
на фиг. 5 показано влияние различных концентраций бетаинов морфолин-4-илпропиламидов жирных кислот пальмового масла I b на прирост биомассы бацилл;
на фиг. 6 показано влияние различных концентраций бетаинов морфолин-4-илпропиламидов жирных кислот пальмового масла I b на рост бацилл;
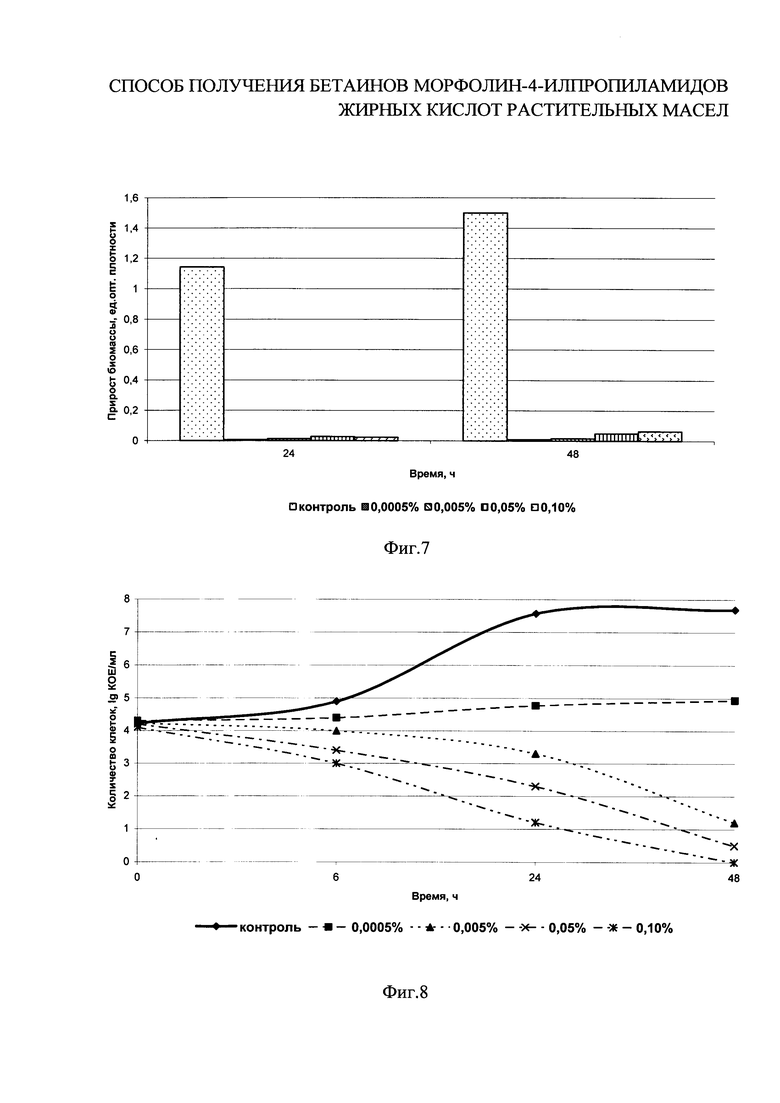
на фиг. 7 показано влияние различных концентраций бетаинов морфолин-4-илпропиламидов жирных кислот пальмового масла I b на прирост биомассы дрожжей;
на фиг. 8 показано влияние различных концентраций бетаинов морфолин-4-илпропиламидов жирных кислот пальмового масла I b на рост дрожжей;
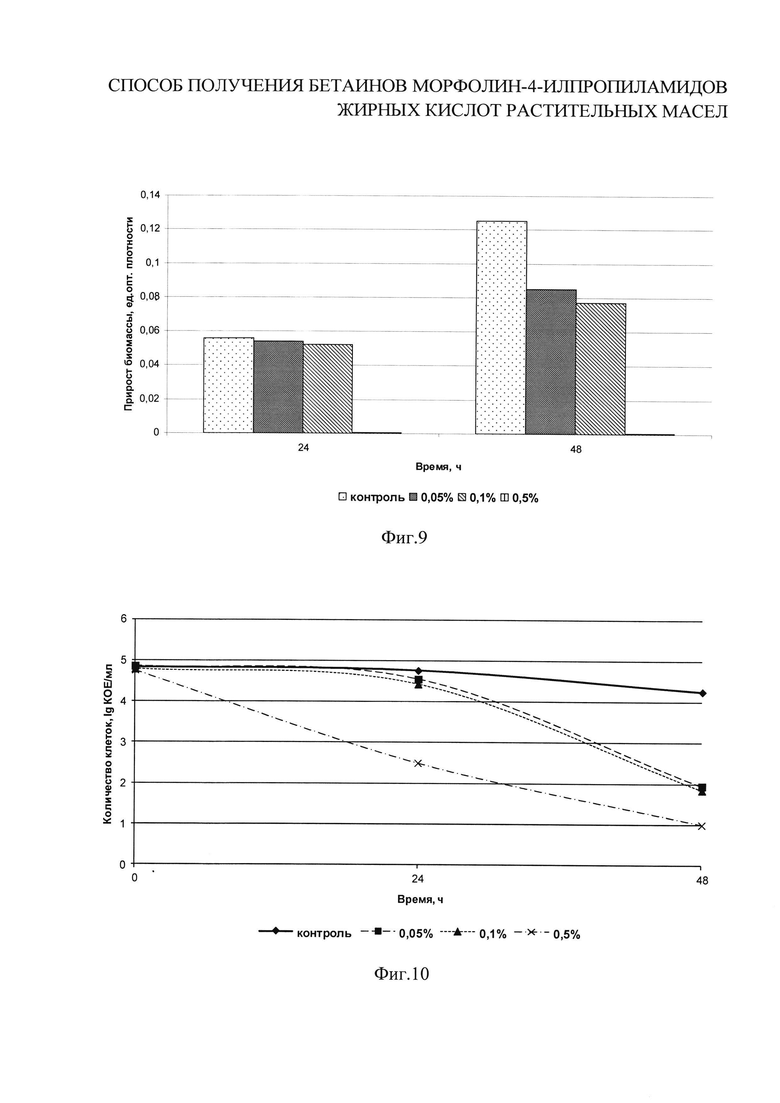
на фиг. 9 показано влияние различных концентраций бетаинов морфолин-4-илпропиламидов жирных кислот пальмового масла I b на прирост биомассы плесневых грибов;
на фиг. 10 показано влияние различных концентраций бетаинов морфолин-4-илпропиламидов жирных кислот пальмового масла I b на рост плесневых грибов.
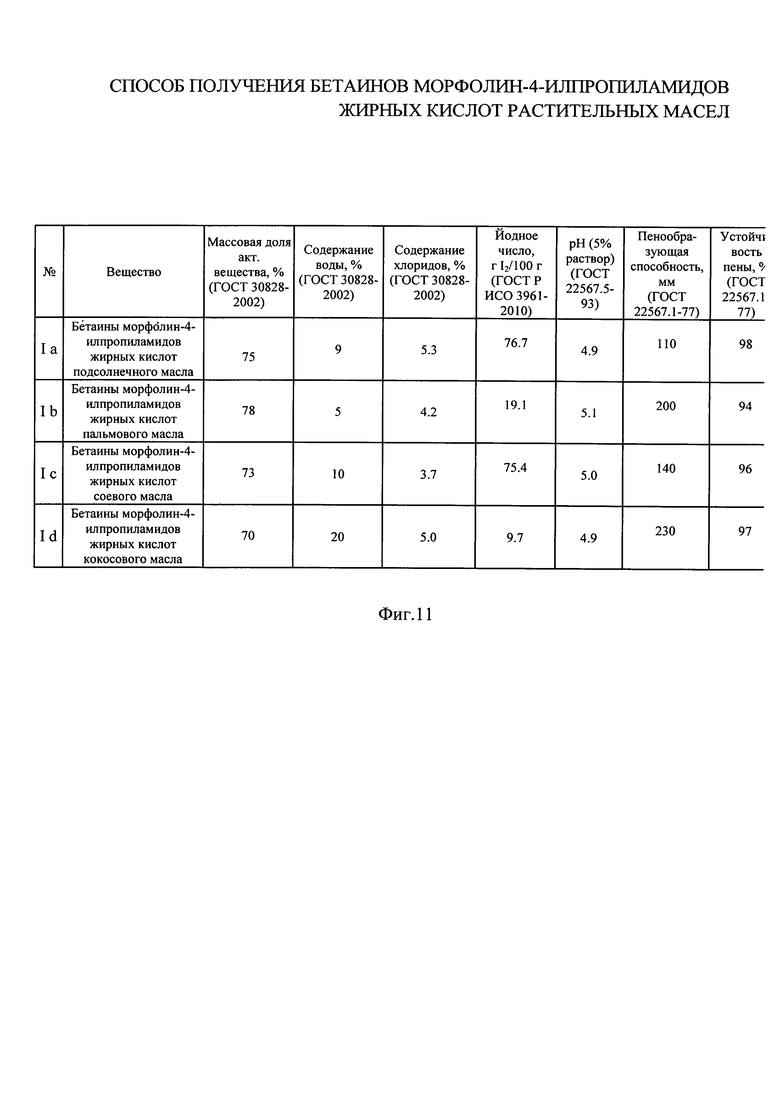
На фиг. 11 приведена таблица результатов анализа физико-химических свойств бетаинов морфолин-4-илпропиламидов жирных кислот растительных масел, в том числе пенообразующей способности.
Предлагаемый способ получения бетаинов морфолин-4-илпропиламидов жирных кислот растительных масел осуществляется следующим образом.
Бетаины морфолин-4-илпропиламидов I образуются в результате реакции алкилирования морфолин-4-илпропиламидов жирных кислот растительных масел (подсолнечного, соевого, пальмового и кокосового, содержащих от 6 до 22 атомов углерода и до 3 двойных связей) натриевой солью монохлоруксусной кислоты. В свою очередь морфолин-4-илпропиламиды жирных кислот получают взаимодействием соответствующего растительного масла с морфолин-4-илпропиламином. Максимальная конверсия исходных реагентов достигается при проведении реакции при 80-85°С в течение 10 часов в смеси этанол-вода. Очистка продуктов реакции заключается в удалении хлорида натрия фильтрованием и отгонкой этанола. Синтез осуществляют по следующей схеме:
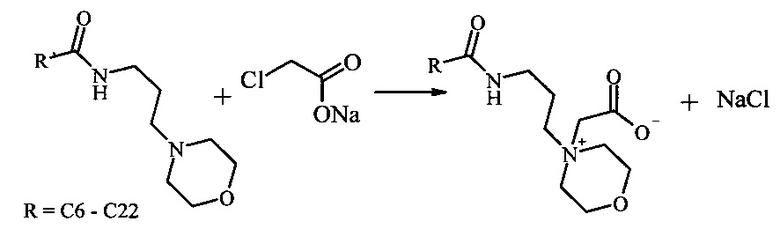
Ниже представлены конкретные примеры осуществления предлагаемого изобретения.
ПРИМЕР 1.
Синтез бетаинов морфолин-4-илпропиламидов, содержащих остатки жирных кислот подсолнечного масла I а, протекает по следующей схеме:
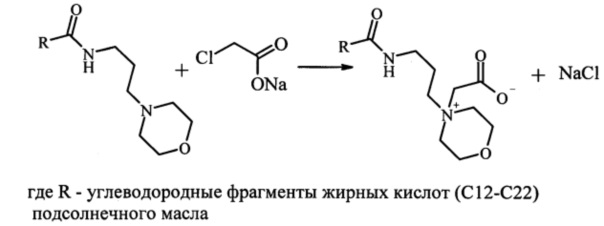
В круглодонную колбу помещают 0,15 моль (70 г) морфолин-4-илпропиламидов жирных кислот подсолнечного масла, 0,15 моль (17,5 г) натриевой соли монохлоруксусной кислоты и 100 мл смеси этанол:вода (в соотношении 5:1). Нагревают до 80-85°С и выдерживают при этой температуре в течение 10 часов. Образовавшийся осадок хлорида натрия отфильтровывают и промывают небольшим количеством этанола. Растворитель удаляют на роторном испарителе. Выход 98%.
ПРИМЕР 2.
Синтез бетаинов морфолин-4-илпропиламидов, содержащих остатки жирных кислот пальмового масла, проводят согласно способу, описанному в примере 1, где R - углеводородные фрагменты жирных кислот (С8-С18) пальмового масла. Выход 96%.
Результаты анализа антимикробного действия приведены на фиг. 1-10.
ПРИМЕР 3.
Синтез бетаинов морфолин-4-илпропиламидов, содержащих остатки жирных кислот соевого масла, проводят согласно способу, описанному в примере 1, где R - углеводородные фрагменты жирных кислот (С10-С22) соевого масла. Выход 95%.
ПРИМЕР 4.
Синтез бетаинов морфолин-4-илпропиламидов, содержащих остатки жирных кислот кокосового масла, проводят согласно способу, описанному в примере 1, где R - углеводородные фрагменты жирных кислот (С6-С18) кокосового масла. Выход 97%.
Результаты анализа физико-химических свойств бетаинов морфолин-4-илпропиламидов жирных кислот растительных масел, полученных в примерах 1-4, приведены в таблице на фиг. 11. Независимо от особенностей жирно-кислотного состава (длины углеводородного радикала, степени ненасыщенности остатков жирных кислот) соединения обладают высокой пенообразующей способностью.
ПРИМЕР 5.
Приготовление основного раствора и разведений бетаинов морфолин-4-илпропиламидов жирных кислот пальмового масла I b для дальнейших испытаний антимикробной активности.
5 г Бетаинов морфолин-4-илпропиламидов жирных кислот пальмового масла I b растворяют в 95 см3 дистиллированной воды. Получают 5% основной раствор. Из основного раствора готовят два последовательных разведения бетаинов морфолин-4-илпропиламидов жирных кислот пальмового масла. В пробирку первого разведения вносят 1 см3 основного раствора и 9 см3 дистиллированной воды. В пробирку второго разведения 1 см3 первого разведения и 9 см3 дистиллированной воды.
ПРИМЕР 6.
Порядок проведения испытаний с тест-культурой Streptococcus thermophilus
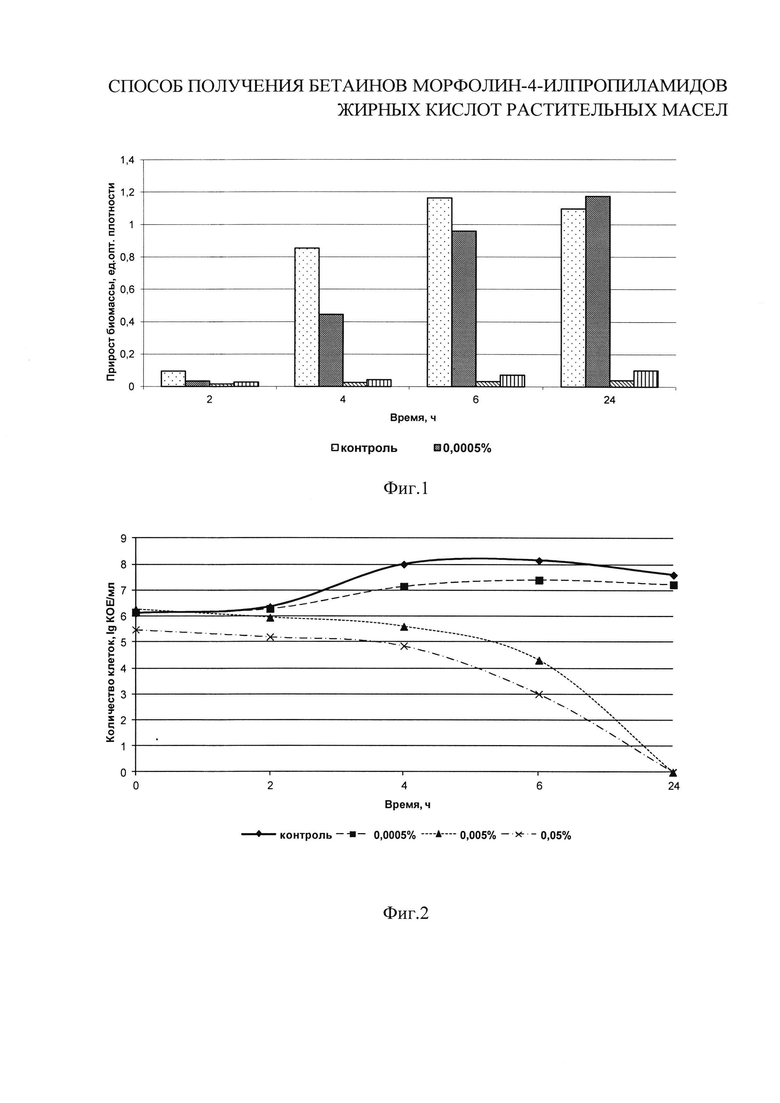
Термофильный стрептококк относится к гомоферментативным факультативно-анаэробным термофильным грамположительным коккам. Применяется в качестве тест-культуры для определения ингибирующих веществ по ГОСТ 23454-79 «Молоко. Методы определения ингибирующих веществ». Исследуемые концентрации бетаинов морфолин-4-илпропиламидов жирных кислот пальмового масла I b: 0,0005%; 0,005%; 0,05%. В колбы с 200 см3 стерильного питательного бульона на основе гидролизата белков молока вносят разведения соединений I b для достижения заданных концентраций. В первую колбу вносят 2 см3 второго разведения, во вторую - 2 см3 первого разведения, в третью - 2 см3 основного раствора I b. Затем в каждую колбу, в том числе контрольную, вносят 1% (2 см3) активной культуры Streptococcus thermophilus. Колбы культивируют при (37±1)°С в течение 24 часов. Количество жизнеспособных клеток контролируют в динамике через 0, 2, 4, 6, 24 ч путем посева культуральной жидкости на среду КМАФАнМ. Посевы инкубируют при (37±1)°С в течение 72 часов, после чего проводят подсчет КОЕ. Параллельно для подтверждения процессов развития тест-культуры проводят контроль за нарастанием биомассы клеток косвенным методом по изменению оптической плотности на спектрофотометре ПЭ-5300 ВИ при длине волны λ=700 нм в 0, 2, 4, 6 и 24 ч. Рассчитывают прирост оптической плотности через 2, 4, 6 и 24 часа культивирования.
На фиг. 1-2 приведены результаты исследований по влиянию различных концентраций бетаинов морфолин-4-илпропиламидов жирных кислот пальмового масла I b на накопление бактериальной массы тест-культурой Streptococcus thermophilus за 2, 4, 6 и 24 часа развития. Соединения I b проявляет ингибирующий эффект уже при минимальной концентрации 0,0005% в первые 2 часа культивирования, однако при данной концентрации к 24 часам антимикробное действие постепенно исчезает. Концентрации ПАВ 0,005% и 0,05% оказывают бактерицидное действие на культуру термофильного стрептококка.
ПРИМЕР 7.
Порядок проведения испытаний с тест-культурой Escherichia coli.
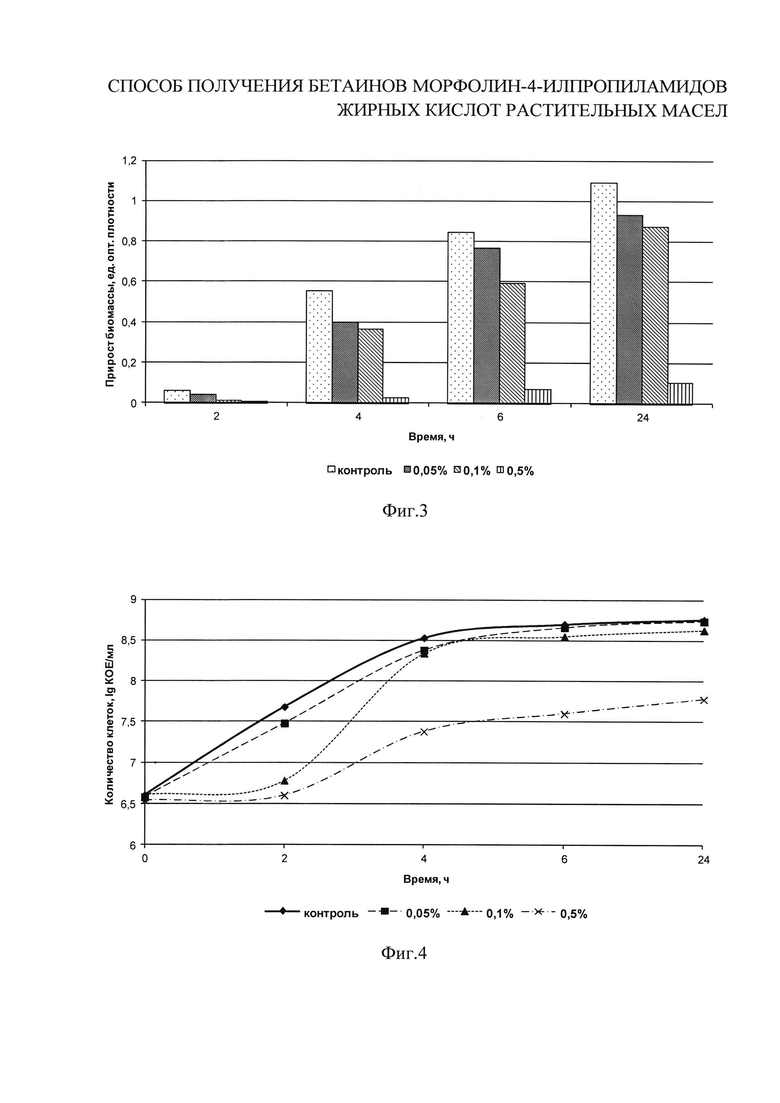
Вид Escherichia coli относится к семейству Enterobacteriacea, группе лактозоположительных энтеробактерий или БГКП. БГКП иначе называют коли-формы, т.е. закономерности роста и развития, установленные для тест-культуры Escherichia coli, с высокой степенью вероятности можно распространять на всю группу БГКП. Это грамотрицательные, неспорообразующие, каталазоположительные, оксидазоотрицательные, газообразующие, факультативно-анаэробные мезофильные палочки. Данная группа микроорганизмов крайне значима, при оценке санитарно-гигиенического состояния любого производства, готового продукта и личной гигиены работников, а также является значимой микрофлорой порчи продуктов, снижающей их качество и хранимоспособность. Исследуемые концентрации соединений I b: 0,0005%; 0,005%; 0,05%; 0,1%; 0,5%. В колбы с 200 см3 стерильного питательного бульона на основе гидролизата белков молока вносят разведения I b для достижения заданных концентраций. В первую колбу вносят 2 см3 второго разведения, во вторую - 2 см3 первого разведения, в третью - 2 см3 основного раствора, в четвертую - 4 см3 основного раствора, в пятую - 20 см3 основного раствора I b. Затем в каждую колбу, в том числе контрольную, вносят 1% (2 см3) активной культуры Escherichia coli. Колбы культивируют при (37±1)°С в течение 24 часов. Количество жизнеспособных клеток контролируют в динамике через 0, 2, 4, 6 и 24 ч путем посева культуральной жидкости на среду КМАФАнМ по ГОСТ Р 53430-2009. Посевы инкубируют при (37±1)°С в течение 72 часов. Контроль за нарастанием биомассы проводят по изменению оптической плотности на спектрофотометре в 0, 2, 4, 6 и 24 ч. Рассчитывают прирост оптической плотности через 2, 4, 6 и 24 часа культивирования. На фиг. 3-4 приведены результаты исследований по влиянию различных концентраций бетаинов морфолин-4-илпропиламидов жирных кислот пальмового масла I b на накопление бактериальной массы тест-культурой Е. coli за 2, 4, 6 и 24 часа развития. Соединения I b проявляют ингибирующий эффект уже при концентрации более 0,05% в течение всего периода наблюдений, при этом чем выше концентрация ПАВ, тем значительнее антимикробный эффект.
ПРИМЕР 8.
Порядок проведения испытаний с тест-культурой споровых аэробных микроорганизмов рода Bacillus.
Бациллы грамположительные, большинство подвижные, спорообразующие, каталазоположительные, аэробные и факультативно анаэробные палочки. В настоящее время данная группа споровых микроорганизмов является наиболее значимой микрофлорой порчи большинства пищевых продуктов. Для споровых аэробных микроорганизмов рода Bacillus взяты концентрации I b: 0,005%, 0,05% и 0,1%. В колбы с 200 см3 стерильного питательного бульона на основе гидролизата белков молока вносят разведения соединения I b для достижения заданных концентраций. В первую колбу вносят 2 см3 первого разведения, во вторую - 2 см3 основного раствора, в третью - 4 см3 основного раствора I b. Затем в каждую колбу, в том числе контрольную, вносят 1% (2 см3) активной культуры споровых аэробных микроорганизмов рода Bacillus. Колбы культивируют при (37±1)°С в течение 72 часов. Количество жизнеспособных клеток контролируют в динамике через 0, 4, 6, и 24 ч путем посева культуральной жидкости на среду КМАФАнМ по ГОСТ Р 53430-2009. Посевы инкубируют при (37±1)°С в течение 48 часов. Контроль за нарастанием биомассы проводят по изменению оптической плотности на спектрофотометре в 0, 4, 6 и 24 ч. Рассчитывают прирост оптической плотности через 4, 6 и 24 часа культивирования. На фиг. 5-6 приведены результаты исследований по влиянию различных концентраций бетаинов морфолин-4-илпропиламидов жирных кислот пальмового масла I b на накопление бактериальной массы тест-культурой споровых аэробных микроорганизмов рода Bacillus за 4, 6 и 24 часа развития. Соединения I b во всех исследованных концентрациях и в течение всего периода наблюдения практически полностью подавляют развитие споровых аэробов.
ПРИМЕР 9.
Порядок проведения испытаний с тест-культурой дрожжей рода Saccharomyces.
Дрожжи - внетаксономическая группа одноклеточных грибов, утративших мицелиальное строение, эукариотические микроскопические организмы, способные или не способные к спорообразованию. Дрожжи растут и размножаются, вызывая при этом существенные изменения в окружающей среде, вызывая порчу продуктов. Дрожжевые клетки - факультативно анаэробные или аэробные организмы, которые лучше растут при наличии кислорода. Наиболее известный и характерный для дрожжей процесс обмена веществ - спиртовое брожение. Однако дрожжи обладают также резко выраженным аэробным обменом веществ. Каждый из них характеризуется накоплением в среде специфических продуктов обмена. Большинство дрожжей являются ацидофильными организмами и способны расти при рН (5,5-4,0) и ниже. Оптимальная температура роста для большинства видов - 25-30°С, хотя многие хорошо развиваются при температурах ниже 5°С. Вегетативные клетки дрожжей погибают при низкотемпературной пастеризации, однако для гибели спор нужна температура выше 80°С. Исследуемые концентрации бетаинов морфолин-4-илпропиламидов жирных кислот пальмового масла I b: 0,0005%; 0,005%; 0,05%; 0,1%. В колбы с 200 см3 стерильного питательного бульона на основе гидролизата белков молока вносят разведения I b для достижения заданных концентраций. В первую колбу вносят 2 см3 второго разведения, во вторую - 2 см3 первого разведения, в третью - 2 см3 основного раствора, в четвертую - 4 см3 основного раствора бетаинов I b. Затем в каждую колбу, в том числе контрольную, вносят 1% (2 см3) активной культуры дрожжей рода Saccharomyces. Колбы культивируют при (30±1)°С в течение 48 часов.
Количество жизнеспособных клеток контролируют в динамике через 0, 6, 24 и 48 ч путем посева культуральной жидкости на среду КМАФАнМ по ГОСТ Р 53430-2009. Посевы инкубируют при (30±1)°С в течение 72 часов. Контроль за нарастанием биомассы проводят по изменению оптической плотности на спектрофотометре в 0, 24 и 48 ч. Рассчитывают прирост оптической плотности через 24 и 48 часов культивирования. На фиг. 7-8 приведены результаты исследований по влиянию различных концентраций соединений I b на накопление бактериальной массы тест-культурой дрожжей за 24 и 48 часов развития. Бетаины морфолин-4-илпропиламидов жирных кислот пальмового масла I b оказывают бактерицидное действие на дрожжи при минимальной концентрации, сохраняя его в течение 48 часов и для больших концентраций.
ПРИМЕР 10.
Порядок проведения испытаний с тест-культурой плесневых грибов рода Penicillium.
Плесневые грибы эукариотические микроскопические многоклеточные организмы, образующие мицелий. Весьма велико биологическое и экологическое разнообразие грибов. Они присутствуют во всех биологических нишах - в воде, на суше и в воздухе. Плесневые грибы могут расти практически повсюду. Способность плесневых грибов быстро занимать и населять подходящие экологические ниши в закрытых помещениях и на открытом воздухе, продуцировать и рассеивать огромные массы спор, возможно, объясняет их эволюционный успех в природе. Грибы растут, умирают и распадаются, и люди почти всегда подвержены различным концентрациям частиц плесневых грибов дома, на работе или на открытом воздухе. В закрытых помещениях споры присутствуют в течение года. Все плесневые грибы - аэробы, ксерофилы (способны размножаться при значениях активности воды Aw - 0,6) и ацидофилы (способны размножаться в диапазоне pH от 1,5 до 9,0). Наличие воды является критическим требованием для роста грибов, хотя многие из них могут выдерживать длительное высушивание. Атмосферная влажность воздействует не только на рост и плодоношение грибов, но также и на рассеивание спор и их распространенность. Способность плесневых грибов размножаться при значениях pH ниже 4,0 лежит в основе способов их выявления в продуктах смешанного микробиального состава, так как при таких значениях pH большинство микроорганизмов не способны давать рост и образовывать видимые колонии на плотных питательных средах. Оптимальная температура развития большинства плесневых грибов 20-35°С, максимальная - 35-50°С, а минимальная - (-5+5)°С. Таким образом, плесневые грибы проявляют ярко выраженные психотрофные свойства и могут развиваться в условиях холодильного хранения. Температуры пастеризации уничтожают вегетативные клетки, для уничтожения спор необходима температура более 85°С. Ряд грибов являются причиной грибковых инфекций - микозов и микоаллергозов, а также микотоксикозов, опасных для здоровья как человека, так и животных. Исследуемые концентрации бетаинов морфолин-4-илпропиламидов жирных кислот пальмового масла I b: 0,05%; 0,1%; 0,5%. В колбы с 200 см3 стерильного питательного бульона на основе гидролизата белков молока вносят разведения I b для достижения заданных концентраций. В первую колбу вносят 2 см3 основного раствора, во вторую - 4 см3 основного раствора, в третью - 20 см3 основного раствора бетаинов I b. Затем в каждую колбу, в том числе контрольную, вносят 0,1% (0,2 см3) активной культуры плесневых грибов рода Penicillium. Колбы культивируют при (30±1)°С в течение 48 часов. Количество жизнеспособных клеток контролируют в динамике через 0, 24 и 48 ч путем посева культуральной жидкости на среду КМАФАнМ по ГОСТ Р 53430-2009. Посевы инкубируют при (30±1)°С в течение 72 часов. Контроль за нарастанием биомассы проводят по изменению оптической плотности на спектрофотометре в 0, 24 и 48 ч. Рассчитывают прирост оптической плотности через 24 и 48 часов культивирования. На фиг. 9-10 приведены результаты исследований по влиянию различных концентраций соединений I b на накопление бактериальной массы тест-культурой плесневых грибов за 24 и 48 часов развития, которые показывают, что бетаины I b оказывают существенное антимикробное действие на плесневые грибы, при этом степень воздействия зависит от концентрации и времени.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ МОРФОЛИЛПРОПИЛАМИДОВ ЖИРНЫХ КИСЛОТ РАСТИТЕЛЬНЫХ МАСЕЛ | 2014 |
|
RU2571960C1 |
| СПОСОБ УТИЛИЗАЦИИ ЖИДКИХ ОТХОДОВ ПРОИЗВОДСТВА ПАЛЬМОВОГО МАСЛА | 1998 |
|
RU2118663C1 |
| НЕМОЛОЧНЫЙ АНАЛОГ СЫРА, СОДЕРЖАЩИЙ КОАЦЕРВАТ | 2014 |
|
RU2672489C2 |
| Способ определения чувствительности микробитестов для выявления дрожжей и плесневых грибов в молочных продуктах | 1984 |
|
SU1254007A1 |
| КОСМЕТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ СОЕДИНЕНИЕ С АКТИВНОСТЬЮ, СТИМУЛИРУЮЩЕЙ ПРОДУЦИРОВАНИЕ ИНТЕРЛЕЙКИНА-6 | 1999 |
|
RU2207139C2 |
| ФЕРМЕНТАТИВНАЯ ОБРАБОТКА МАСЕЛ | 2004 |
|
RU2377307C2 |
| ШТАММ MYCELIA STERILIA-ПРОДУЦЕНТ КОМПЛЕКСА БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ, ОБЛАДАЮЩИХ РОСТРЕГУЛЯТОРНЫМИ СВОЙСТВАМИ | 2003 |
|
RU2237088C1 |
| УПАКОВКА ДЛЯ ПРОТИВОМИКРОБНОЙ ОБРАБОТКИ РАСТЕНИЙ | 2014 |
|
RU2614063C1 |
| ПРЕПАРАТ ДЛЯ ЗАЩИТЫ РАСТЕНИЙ ОТ ВОЗБУДИТЕЛЕЙ БОЛЕЗНЕЙ СЕЛЬСКОХОЗЯЙСТВЕННЫХ КУЛЬТУР И ВИНОГРАДА С РОСТСТИМУЛИРУЮЩИМ ЭФФЕКТОМ, СПОСОБ ПОЛУЧЕНИЯ ЭТОГО ПРЕПАРАТА И ШТАММЫ ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2005 |
|
RU2313941C2 |
| 2-НИТРОГЕТЕРИЛТИОЦИАНАТЫ ДЛЯ ЛЕЧЕНИЯ ГРИБКОВЫХ ИНФЕКЦИЙ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ МЕСТНОГО ПРИМЕНЕНИЯ | 2012 |
|
RU2504541C1 |
Изобретение относится к способу получения бетаинов морфолин-4-илпропиламидов жирных кислот растительных масел формулы I
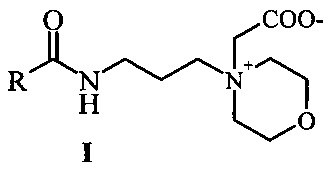 , которые могут быть применены в качестве антимикробных и пенообразующих агентов в моющих композициях. Технический результат: разработан простой и технологичный способ получения новых бетанинов морфолин-4-илпропиламидов жирных кислот из морфолин-4-илпропиламидов жирных кислот растительных масел (подсолнечного, соевого, пальмового и кокосового масел) и натриевой соли монохлоруксусной кислоты. 10 пр., 11 ил.
, которые могут быть применены в качестве антимикробных и пенообразующих агентов в моющих композициях. Технический результат: разработан простой и технологичный способ получения новых бетанинов морфолин-4-илпропиламидов жирных кислот из морфолин-4-илпропиламидов жирных кислот растительных масел (подсолнечного, соевого, пальмового и кокосового масел) и натриевой соли монохлоруксусной кислоты. 10 пр., 11 ил.
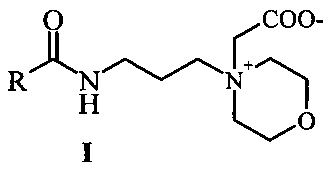
Способ получения бетаинов морфолин-4-илпропиламидов жирных кислот растительных масел формулы I
 ,
,
где R - остатки жирных кислот растительных масел, характеризующийся тем, что осуществляют путем взаимодействия морфолин-4-илпропиламидов жирных кислот растительных масел и натриевой соли монохлоруксусной кислоты при мольном соотношении реагентов амид:натриевая соль монохлоруксусной кислоты = 1:1 с выдерживанием реакционной массы при 80-85°С в течение 10 часов в смеси этанол-вода и последующей очисткой от хлорида натрия и этанола.
| CN103524370 A, 22.01.2014 | |||
| EA201001605 A1, 29.04.2011. |
Авторы
Даты
2017-07-07—Публикация
2015-10-08—Подача