Изобретение относится к пептидам-иммуногенам, способным формировать в организме эндогенные антитела узкой специфичности, направленные именно к функционально значимым участкам рецептора опухолевых клеток (EGFR) и используемым в терапевтической вакцине для лечения метастатического рака молочной железы, и может быть использовано в онкологии и медицинской иммунологии.
В настоящее время основным способом лечения онкологических заболеваний молочной железы является хирургическое лечение в комбинации с химиотерапией, гормональной терапией или таргетной терапией с использованием терапевтических моноклональных антител. Указанный способ лечения позволяет добиться хороших результатов, но при этом обладает высокой токсичностью, а в случае таргетной терапии высокой стоимостью.
Известно применение терапевтически эффективного количества анти-IL-1 alpha антитела, в частности моноклонального антитела для лечения рака, включающее введение млекопитающему, в частности человеку, нуждающемуся в этом, терапевтически эффективного количества указанных антител (заявка США №20100040574, МПК А61Р 35/00, опубл. 18.02.2010).
К недостаткам препаратов на основе моноклональных антител стоит отнести длительность курса лечения и необходимость частого внутривенного введения препарата (как правило, каждые две недели).
Эти обстоятельства вызывают в последние годы все больший интерес к препаратам с механизмом терапевтического действия, аналогичным моноклональным антителам, но при этом с продолжительным терапевтическим эффектом при минимальном количестве инъекций.
Наиболее близким аналогом (прототипом) является пептид (пептидный иммуноген), состоящий из 10-30 аминокислотных остатков, содержащий аминокислотную последовательность SEQ ID NO: 5 и являющийся производным от последовательности рецептора эпидермального фактора роста, имеющего точку мутации Т790М, и обладающий способностью индуцировать пептид-специфический ЦТЛ ответ (международная заявка № WO 2014024965, МПК А61Р 35/00; А61Р 37/04; А61Р 43/00; C07K 14/71, опубл. 13.02.2014). На основе данного пептида получена фармацевтическая композиция, представляющая собой вакцину против немелкоклеточного рака легкого человека.
Однако данный пептидный иммуноген не способен формировать в организме человека эндогенные антитела, направленные против рака молочной железы.
Техническим результатом изобретения является получение пептида-иммуногена, используемого в терапевтической вакцине для лечения метастатического рака молочной железы за счет высокой иммуногенности пептида и обеспечения формирования иммунного ответа только на протективные (функционально значимые) эпитопы целевых онкомаркеров, блокирующих основные пути роста и метастазирования опухоли.
Указанный технический результат достигается тем, что создан пептид-иммуноген, используемый в терапевтической вакцине для лечения метастатического рака молочной железы и характеризующийся следующей аминокислотной последовательностью CKGPIVLDGVIKTQPHAAEK (SEQ ID NO: 1), идентичной аминокислотным последовательностям активного центра рецептора EGFR.
Для усиления иммунного ответа пептид-иммуноген содержит ковалентно с ним связанный белок-носитель. В качестве белка-носителя он содержит бычий сывороточный альбумин (БСА), или катионизированный бычий сывороточный альбумин, или овальбумин, или гемоцианин (keyhole limpet hemocyanin - KLH).
Создаваемая вакцина на основе заявляемого пептида-иммуногена индуцирует специфический гуморальный иммунитет, направленный против основного молекулярного маркера опухоли молочной железы (EGFR).
Механизм действия вакцины. В результате иммунизации вакциной в организме формируются эндогенные антитела узкой специфичности, направленные именно к функционально значимым участкам рецептора опухолевых клеток (EGFR). Поскольку получаемые в процессе вакцинации эндогенные антитела специфически связываются с теми участками рецептора, которые ответственны за лиганд-рецепторные взаимодействия и за конформационные изменения в рецепторе, то есть специфические эндогенные антитела будут блокировать функции рецептора и, таким образом, будут подавлять рост и метастазирование опухолевых клеток. Кроме того, опухолевые клетки, опсонизированные антителами, приобретают статус чужеродного объекта с точки зрения иммунной системы и уничтожатся клетками иммунной системы.
Антитела, сформированные в ответ на вакцинацию пептидной вакциной, блокируют функции рецептора EGFR, аналогично тому как это делают доказавшие свою эффективность в клинических испытаниях терапевтические моноклональные антитела, используемые при лечении рака молочной железы человека.
Блокировка основных путей роста и метастазирования опухоли происходит за счет того, что при вакцинировании пептидной вакциной, в состав которой входит пептидная последовательность, идентичная аминокислотной последовательности активного центра рецептора EGFR, происходит индукция В-клеток иммунологической памяти и плазматических клеток, которые секретируют эпитоп-специфические иммуноглобулины, специфичные к активным центрам онкомаркеров; эпитоп-специфические иммуноглобулины находят рецептор-мишень, блокируют его сигнальную функцию стимуляции опухолевого роста и параллельно привлекают макрофаги и нейтрофилы, которые опознают комплекс антитела с антигеном по Fc-концу иммуноглобулина, эти эффекторы неспецифического иммунитета и разрушают опухолевую клетку.
Избежать иммунологическую толерантность позволяет то, что к пептиду присоединен высокомолекулярный и высокоиммуногенный белок-носитель, а в полученную на его основе вакцину вводят адъюванты.
Пример 1. Синтез пептида-иммуногена
Синтез последовательности проводился с использованием стандартного оборудования в автоматическом режиме на пептидном синтезаторе и методик твердофазного пептидного синтеза (Peptide Synthesis, 2nd edn., Pierce Chem. Co., Rickford IL), (Rodionov I.L., Baru M.B. and Ivanov V.T. A Swellographic approach to monitoring continuous flow solid phase peptide synthesis, Peptide Res., 1992, v. 5, No. 2, p. 119-125). Синтез может быть проведен с использованием любых других методик синтеза аминокислотных последовательностей, например, таких как жидкофазный пептидный синтез, синтез с использованием генетически модифицированных микроорганизмов (технологии получения рекомбинантных белков), фрагментирование нативного белка EGFR с последующим выделением соответствующих фрагментов. Пептид очищают хроматографически методом гель-фильтрации на колонке со смолой Sephadex G-10 (26×500 мм) в 1 N уксусной кислоте. Структуру пептида затем анализируют по аминокислотному составу известными специалистам, работающим в области пептидов, методами аминокислотного анализа и MALDI-спектрометрии.
Полученный пептид-иммуноген характеризуется следующей аминокислотной последовательностью CKGPIVLDGVIKTQPHAAEK (SEQ ID NO: 1), идентичной аминокислотным последовательностям активного центра рецептора EGFR.
В качестве пептидного иммуногена (противораковой вакцины) используется пептид с использованием высокомолекулярных носителей (белков-носителей), например, таких как BSA (БСА - Бычий сывороточный альбумин), cBSA (Cationized BSA), KLH (keyhole limpet hemocyanin), ВС (Concholepas concholepas hemocyanin (marketed as Blue Carrier), Ovalbumin и д.р.
Пептид конъюгируют с белками-носителями, т.е. пришивают на белок носитель посредством ковалентной связи. Ковалентную связь создают с использованием различных конъюгирующих агентов, например, таких как ГА (глутаровый альдегид), SMCC (Succinimidyl-4-(N-maleimidomethyl) cyclohexane-1-carboxylate), Sulfo-SMCC (Sulfosuccinimidyl-4-(N-maleimidomethyl) cyclohexane-1-carboxylate), EDC (1-Ethyl-3-(3-dimethylaminopropyl) carbodiimide) и многие другие.
Пример 2. Конъюгирование пептида, например, на белок носитель KLH (гемоцианин)
Готовят навеску SulfoSMCC (Thermo Scientific No22122) 2,5 мг. Растворяют в 500 мкл дистиллированной воды. К 350 мкл KLH (Thermo Scientific No77600) (10 мг/мл) добавляют 350 мкл SulfoSMCC (5 мг/мл). Инкубируют при комнатной температуре в течение 1 ч. Активированный KLH разделяют на колонке 10 мл Sepharose CL4B (Pharmacia Fine Chemicals No IB 28549) в восьмикратном ФСБ при длине волны 280 AU=0,2. Собирают первый пик. С помощью калибровочных образцов KLH строят калибровочную кривую и определяют концентрацию активированного KLH после очистки на колонке. 1 мг пептида растворяют в 250 мкл восьмикратного ФСБ. После чего добавляют активированный KLH, исходя из определенной концентрации таким образом, чтобы на 1 мг пептида приходилось 0,75 мг KLH. Инкубируют при комнатной температуре 2 ч.
Далее проводят диализ. Конъюгаты пептидов помещают в диализные кассеты (Thermo Scientific No87723) и диализуют в растворе NaCl в течение ночи.
Пример 3. Получение готовой пептидной вакцины
Для получения иммуногенной пептидной вакцины конъюгат пептида и белка носителя сорбируют на гидроокись алюминия, для этого, исходя из полученной концентрации конъюгатов, рассчитывают объем конъюгата согласно дозе вакцинного препарата, добавляют 110 мкл гидроксида алюминия и затем доводят общий объем до 1,9 мл стерильным физиологическим раствором.
Действие разработанной вакцины на основе противоопухолевого пептида можно проиллюстрировать следующими примерами 4-7.
Пример 4. Измерение ингибирования пролиферации клеток-мишеней иммунными сыворотками мышей
Для измерения ингибирования EGF-зависимой пролиферации использовали клетки А431 возрастом 18-20 ч, адгезированные на дне лунки 96-луночного культурального планшета таким образом, чтобы «распластанные» клетки находились раздельно или «островками». Для этого использовали посадочную концентрацию 30000 кл/мл в питательной среде DMEM с добавлением 10% сыворотки крови эмбрионов коров. 96-луночный планшет с клетками охлаждают при +4°C в течение 2-3 ч, после чего вносили по 20 мкл исследуемых сывороток в лунку. Сыворотки предварительно прогревают 30 мин при температуре 56°C, разведены в питательной среде DMEM в 2 раза, отцентрифугированы 10 мин при 10000 об/мин. Культура клеток А431 с внесенными сыворотками инкубируют 30 мин при температуре 37°C, в это время готовят раствор эпидермального фактора роста EGF - к 1300 мкл среды добавляют 2 мкл маточного раствора EGF (10 мкг/мл). Полученный раствор добавляют по 20 мкл в лунки микропланшета от А1 до Н8 так, чтобы конечная концентрация в лунке получилась равной 0,2 нМ. Инкубируют 1 ч при 37°С, затем заменяют питательную среду во всех лунках и вновь внесят по 20 мкл сывороткок в соответствующие лунки. Инкубируют 48 ч при 37°C, наблюдая EGF-индуцированную пролиферацию клеток ежедневно. Для измерения количества клеток в лунке используют окрашивание кристалл виолетом фиксированных альдегидом клеток. Для этого охлажденный монослой клеток промывают 1 раз охлажденным фосфатным буферным раствором. На охлажденный слой клеток наносят 150 мкл/лунку охлажденного 1%-ного раствора глутарового альдегида в фосфатном буферном растворе (15 мл ФБР + 0,63 мл ГА) на 10 мин. Проводят 4-5-кратное промывание раствором ФБР. Готовят 0,1% раствор кристалл виолета в воде и вносят по 100 мкл в лунки на 10-20 мин. Ополаскивают и промывают проточной водой из-под крана. Монослой высушивают и хранят при +4°С. Связавшиеся кристаллы виолета в лунке растворяли в 100 мкл раствора 0,2% тритон Х-100 в ФБР. Поглощение измеряли на планшетном спектрофотометре Мультискан ЕХ при длине волны 570 нм. Оптическая плотность раствора в лунке прямо пропорциональна количеству клеток в ней.
Полученные данные показывают усиление скорости пролиферации клеток А431 в результате воздействия фактора роста EGF, среднее значение оптической плотности в лунках с обработанными EGF клетками составляет 0,78 при стандартном отклонении 0,05, а в необработанных лунках эта величина составляет 0,33 (SD=0,04).
Сыворотки, полученные после иммунизации пептидными иммуногенами из функционально значимых районов EGFR, оказывают ингибирующее действие на рост клеток как после индукции EGF, так и без индукции. Средняя оптическая плотность по группе мышей, иммунизированных пептидными иммуногенами из функционально значимых районов EGFR, составила 0,43 против 0,78 в контрольной группе при стимуляции роста клеток с помощью фактора роста EGF. Без стимуляции EGF оптическая плотность по группе мышей иммунизированных пептидными иммуногенами из функционально значимых районов EGFR составила 0,22 против 0,33 в контроле.
Полученные результаты показывают, что антитела, индуцированные пептидными иммуногенами из функционально значимых районов EGFR, вызывают биологический ответ целевых клеток-мишеней, в нашем случае клеток человека А431, несущих рецепторы эпидермального фактора роста 1-го.
Пример 5. Антителозависимый цитотоксический лизис клеток-мишеней
Для измерения антителозависимого цитотоксического лизиса клеток-мишеней А431 эпидермоидной карциномы человека под действием антител иммунных мышей в качестве клеток-эффекторов использовали спленоциты, выделенные из селезенки нормальной неиммунной мыши Ballb/c. Антиген-специфические антитела из погруппно пулированных сывороток иммунных мышей выделяли методом аффинной хроматографии против соответствующих антигенных пептидов.
Получение клеток-эффекторов. Для получения спленоцитов мыши стерильно извлекали селезенку из неиммунной мыши Ballb/c и помещали ее в пенфлакон с 3 мл питательной среды DMEM с 10% фетальной сыворотки (DMEM-10) на льду. Стерильно в 6-луночный культуральный планшет вносили по 5 мл DMEM-10 в лунки. С помощью пинцета помещали стерильно ситечки (сито 70 мкм) в лунки со средой DMEM-10 на льду. Переносили с помощью пинцета селезенку из пенфлакона в ситечко и с помощью обратной стороны стерильного шприца на 5 мл аккуратно растирали селезенку в ситечке. Ситечко промывали полученной суспензией клеток несколько раз и переставляли с помощью стерильного пинцета в чистую лунку. С помощью автоматической пипетки на 1 мл переносили суспензию спленоцитов из одной лунки планшета в другую, пропустив ее сквозь 70 мкм ситечко на льду. Полученную суспензию спленоцитов мыши переносили в пробирку на 15 мл (на льду). Проводили 3-кратную отмывку клеток. Для этого суспензию клеток центрифугировали при +4°С в течение 3 мин при 1500 об/мин (400 g). Супернатант удаляли и заливали 5 мл новой DMEM-10, клетки тщательно ресуспендировали с помощью пипетки. Центрифугировали 3 мин при 1500 об/мин при +4°С и повторяли процедуру отмывки еще 1 раз. Супернатант полностью удаляли и проводили лизис эритроцитов. Для этого ресуспендировали осадок клеток в 1,5 мл АСК лизирующего буфера при комнатной температуре 10 мин в пробирке 15 мл, поворачивая пробирку вверх-вниз, после чего добавляли 9 мл DMEM-10 и центрифугировали 3 мин при 1500 об/мин при +4°С. Убедившись в отсутствии красных клеток в осадке, проводили вторую отмывку в 10 мл DMEM-10, осадок спленоцитов ресуспендировали пипеткой в 3 мл DMEM-10 на льду стерильно. Для определения концентрации клеток суспензию спленоцитов разводили в 10 раз в отдельных микропробирках и проводили подсчет клеток в камере Розенталя-Фукса. Вычисляли требуемое разведение клеток и готовили из исходной суспензии спленоцитов в 15 мл пробирках суспензии клеток с 3⋅106 лимфоцитов/мл, добавляя необходимый объем DMEM-10.
Нанесение клеток-эффекторов на клетки-мишени и учет результатов. Удаляли среду из культурального планшета с монослоем клеток-мишеней и вносили по 100 мкл новой среды DMEM-10. В первый ряд вносили по 50 мкл исследуемой сыворотки и титровали с 3-кратным шагом, перенося по 50 мкл в следующую лунку. Из последней лунки 50 мкл удаляли. Инкубировали планшет с монослоем клеток и исследуемыми антителами при 37°С 20 мин. Вносили по 100 мкл суспензии лимфоцитов в концентрации 3⋅106 лимфоцитов/мл в среде DMEM-10 в лунки. Таким образом, соотношение «эффекторы/мишени» соответствовало примерно 10:1. Планшет инкубировали при 37°С 3 ч и регистрировали антителозависимый лизис клеток-мишеней по высвобождению аденилат киназы из разрушенных клеток в культуральную жидкость. Концентрацию аденилат киназы измеряли с помощью набора ToxiLight BioAssay Kit (Lonza, Rockland, ME, USA) на планшетном люминометре Tecan Infinite 200.
Эффект антителозависимого цитотоксического лизиса рассчитывался по формуле
% Цитотоксичности = 100%⋅(ОЕЛэксперимент - ОЕЛспленоцит+мишень спонтанная)/(ОЕЛмишень максимальная - ОЕЛмишень спонтанная),
ОЕЛ = (ОЕЛклетки-ОЕЛчистая лунка) - относительная единица люминесценции, полученная путем вычитания из величины сигнала люминесценции при наличии клеток-мишеней в лунке величины сигнала люминесценции в соответствующей лунке без клеток- мишеней.
Полученные результаты показывают цитотоксическую активности на уровне 65% у антител, индуцированных пептидными иммуногенами из функционально значимых районов EGFR.
Пример 6. Протективность пептидного иммуногена из функционально значимых районов EGFR на модели опухоли мышей
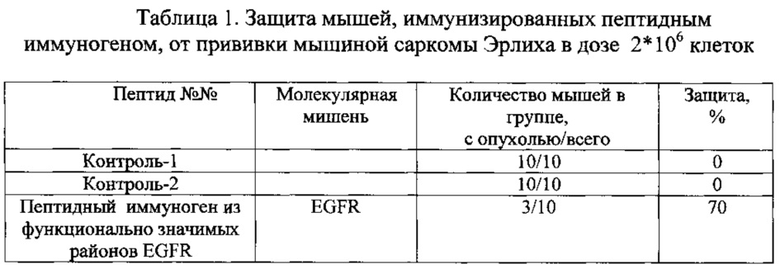
После завершения цикла иммунизации пептидным иммуногеном из функционально значимых районов EGFR мышам прививали саркому Эрлиха. В группах мышей, иммунизированных контрольными пептидами, не наблюдали защиты вообще или она была минимальной, однако в группах мышей, иммунизированных пептидными иммуногенами из функционально значимых районов EGFR, опухоль не развивалась у 70% животных. У остальных животных этих групп наблюдали торможение роста опухоли относительно контрольной группы (см. табл. 1).
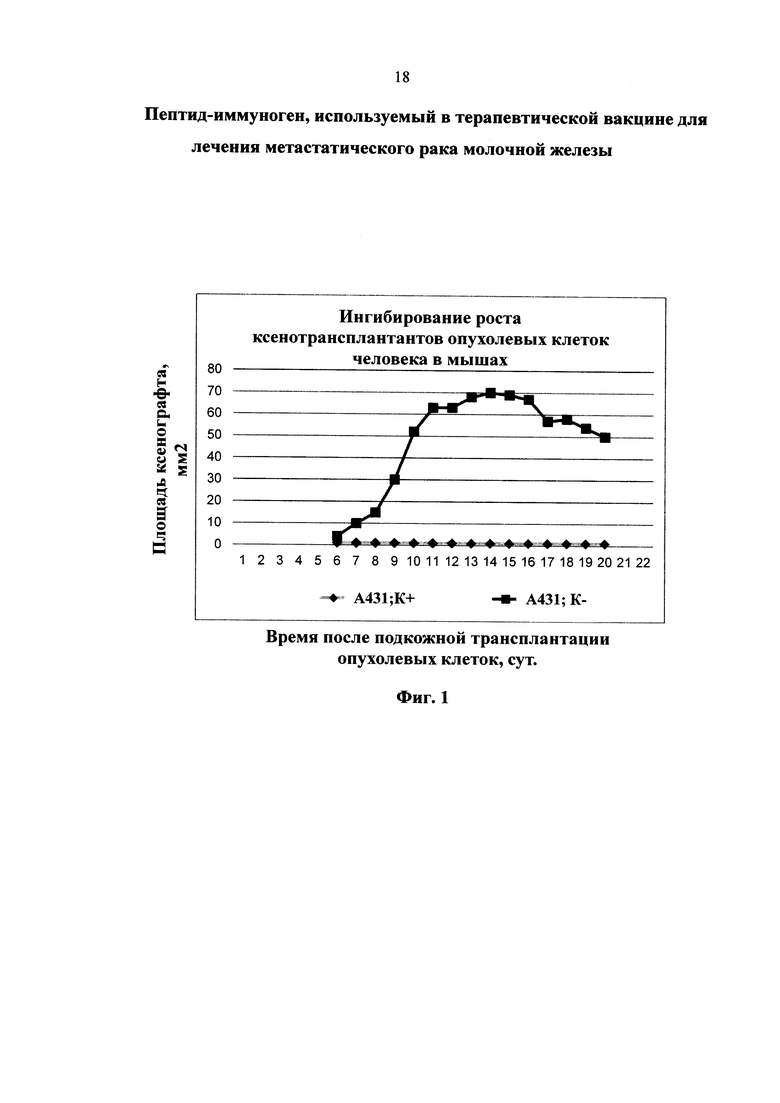
Пример 7. Протективность вакцины на модели ксенографтов опухолевых клеток человека
После завершения цикла иммунизации мышам подкожно трансплантировали культуры клеток линии А431 эпидермоидной карциномы человека. Предварительно за 1 день до трансплантации опухолевых клеток мышам вводили антитимоцитарную сыворотку для подавления ответа Т-лимфоцитов на чужеродные клетки. Антитимоцитарную сыворотку вводили с интервалом 6 дней до завершения эксперимента. В группе мышей, иммунизированных пептидными иммуногенами из функционально значимых районов EGFR, не наблюдали появление опухолевых узлов вообще, в группах, вакцинированных отдельными пептидами, опухолевые узлы проявлялись через 5-6 дней и исчезали через 1-2 недели после появления. В контрольных группах наблюдали появление твердых опухолевых узлов различных размеров на 4-6 день после трансплантации опухолевых клеток, которые не исчезали на протяжении всего эксперимента (см. фиг. 1).
Пример 8. Изучение острой токсичности пептидного иммуногена из функционально значимых районов EGFR при подкожном введении на мышах CD-1
Целью данного исследования являлось определение токсических эффектов пептидных иммуногенов из функционально значимых районов EGFR при однократном (дробно в течение суток) подкожном введении самцам и самкам мышей CD-1.
В исследовании было использовано 2 группы по 5 самцов и 5 самок мышей CD-1 в каждой. Животным 1-й группы вводили носитель. Животным 2-й группы вводили тестируемый препарат. Каждый из 4-х компонентов вакцины или носитель вводили в объеме 1 мл в отдельную область на теле животного (компонент №1 - в левую паховую область, №2 - в правую паховую область, №3 - в левую подмышечную область, №4 - в правую подмышечную область) со стороны конечности, дробно, четырехкратно по 0,25 мл в каждую точку с интервалом 3 ч. В ходе исследования у животных регистрировали прирост массы тела, потребление корма, внешние проявления токсических эффектов. На 15-й день исследования животных подвергали эвтаназии с осмотром макроповреждений органов, взвешиванием органов, их фиксацией в формалине и сбором образцов крови для гематологического анализа.
В ходе исследования гибели животных, а также признаков токсичности тестируемого препарата не наблюдалось. Статистически значимых различий между контрольными животными и животными, получавшими тестируемый препарат, по приросту массы тела и потреблению корма ни у самцов, ни у самок выявлено не было.
Результаты гематологического анализа показали, что у самцов, получавших тестируемый препарат, наблюдалось небольшое, но стастистически значимое увеличение широты распределения эритроцитов по объему (RDW) по сравнению с контрольной группой, что указывает на небольшой рост анизоцитоза эритроцитов. Кроме того, в группе самцов, получивших вакцину, зафиксировано небольшое, но стастистически значимое увеличение среднего объема тромбоцитов (MPV). У самок, получавших тестируемую вакцину, наблюдалось небольшое статистически значимое снижение значения среднего объема эритроцитов (MCV) относительно контрольной группы. Обнаруженные различия некоторых показателей относительно контрольных групп (широта распределения эритроцитов по объему RDW и средний объем тромбоцитов MPV у самцов и средний объем эритроцитов MCV у самок) незначительны и скорее всего являются случайными, не связанными с действием препарата.
При плановой некропсии в конце исследования макроскопических изменений внутренних органов, связанных с действием тестируемого препарата, обнаружено не было.
Таким образом, на основании проведенного исследования может быть сделано заключение о том, что тестируемые пептидные иммуногены из функционально значимых районов EGFR при дробном четырехкратном подкожном применении у мышей CD-I является безопасной и может быть рекомендована для проведения клинических испытаний.
Пример 9. Изучение хронической токсичности пептидного иммуногена из функционально значимых районов EGFR при подкожном введении на крысах CD
Целью данного исследования являлось определение токсических эффектов пептидных иммуногенов из функционально значимых районов EGFR при многократном подкожном введении самцам и самкам крыс CD с последующим периодом отмены.
В исследовании было использовано 2 группы по 10 самцов и 10 самок крыс CD в каждой. Животным 1-й группы вводили носитель. Животным 2-й группы вводили тестируемый препарат. Тестируемый препарат или носитель вводили подкожно, 5 раз с интервалом 14 дней. Каждый из 4-х компонентов вакцины или носитель вводили в объеме 0,5 мл в отдельную область на теле животного (компонент №1 - в левую паховую область, №2 - в правую паховую область, №3 - в левую подмышечную область, №4 - в правую подмышечную область), со стороны конечности. Носитель вводили в объеме по 0,5 мл в каждую из 4-х точек на теле животного. В ходе исследования у животных еженедельно регистрировали прирост веса тела, потребление корма и проявление клинических признаков токсичности исследуемого препарата. Ректальную температуру измеряли на следующий день после каждой инъекции. На 58-й день исследования (на следующий день после 5-й инъекции) по 5 животных из каждой группы были подвергнуты эвтаназии и некропсии с фиксацией органов для последующего гистологического анализа. Остальные животные были подвергнуты некропсии после 14-дневного периода отмены введения (72-й день исследования). При некропсии регистрировали массу внутренних органов и собирали образцы крови для биохимического и гематологического анализа.
В ходе исследования гибели животных не наблюдалось. Основными отклонениями при клиническом осмотре были уплотнения во всех 4-х областях введения у всех животных обоего пола. Данные уплотнения не были связаны с действием тестируемого вещества, поскольку наблюдались также и в группе, получавшей носитель, и по всей видимости были следствием инкапсулирования гидроксида алюминия. Другие клинические признаки включали в себя хромодакриорею, истощение и визуальную потерю веса, пилоэрекцию, сгорбленную позу, снижение мышечного тонуса и диарею. Однако эти признаки также не были связаны с действием тестируемого вещества, поскольку наблюдались как в тестируемой, так и в контрольной группе.
Статистически значимых различий между контрольными животными и животными, получавшими тестируемый препарат, по приросту массы тела и потреблению корма ни у самцов, ни у самок выявлено не было.
Данные гематололгического анализа выявили у самцов, получавших вакцину, умеренный абсолютный и относительный нейтрофилез и относительное уменьшение количества лимфоцитов и клеток средних размеров к 58-му дню исследования. Все эти параметры нормализовались к концу восстановительного периода (72-му дню исследования), и не наблюдалось статистически значимых различий между контрольной и тестируемой группами. Аналогично самцам у самок, получавших вакцину, 58-му дню исследования зарегистрирован слабый абсолютный и относительный нейтрофилез, абсолютное и относительное уменьшение количества клеток средних размеров. К 72-му дню все перечисленные параметры нормализовались, и не наблюдалось статистически значимых различий между контрольной и тестируемой группами за исключением абсолютного количества нейтрофильньтх гранулоцитов. Статистически значимых различий между контрольными животными и животными, получавшими тестируемый препарат, по всем остальным гематологическим параметрам ни у самцов, ни у самок выявлено не было.
Не наблюдалось статистически значимых различий между животными, получавшими носитель, и животными, получавшими вакцину, по массе органов за исключением массы печени у самок. Абсолютная и относительная масса печени была увеличена к 58-му дню исследования у самок, получавших вакцину, по сравнению с контрольной группой. К концу восстановительного периода различий между контрольной и тестируемой группами самок по данному параметру не наблюдалось.
При плановой некропсии в конце исследования макроскопических изменений внутренних органов обнаружено не было кроме уплотнений в местах введения препаратов.
Таким образом, на основании проведенного исследования может быть сделано заключение о том, что тестируемый пептидный иммуноген из функционально значимых районов EGFR при многократном подкожном применении у крыс CD является безопасной и может быть рекомендована для проведения клинических испытаний.

| название | год | авторы | номер документа |
|---|---|---|---|
| Пептид-иммуноген, используемый в терапевтической вакцине для лечения метастатического рака молочной железы у кошек и собак | 2015 |
|
RU2612015C2 |
| Вакцинная композиция против коронавирусной инфекции COVID-19 | 2020 |
|
RU2743595C1 |
| Пептидные иммуногены и вакцинная композиция против коронавирусной инфекции COVID-19 с использованием пептидных иммуногенов | 2020 |
|
RU2738081C1 |
| Пептидные иммуногены и вакцинная композиция против коронавирусной инфекции COVID-19 с использованием пептидных иммуногенов | 2020 |
|
RU2743593C1 |
| Пептидные иммуногены, используемые в качестве компонентов вакцинной композиции против коронавирусной инфекции COVID-19 | 2020 |
|
RU2743594C1 |
| Пептиды-иммуногены и вакцина "ЭпиВакЭбола" против лихорадки Эбола с использованием указанных пептидов | 2017 |
|
RU2635998C1 |
| НОВЫЕ ПЕПТИДЫ И ИХ ПРИМЕНЕНИЕ В ТЕРАПИИ | 2003 |
|
RU2326125C2 |
| ВАКЦИННАЯ КОМПОЗИЦИЯ ДЛЯ БОРЬБЫ С ЗАРАЖЕНИЯМИ ЭКТОПАРАЗИТАМИ | 2011 |
|
RU2585226C2 |
| Иммуногенный пептидный фрагмент металлопротеиназы ADAMTS-7 и его применение в противодействии атеросклерозу и родственным заболеваниям | 2020 |
|
RU2799526C1 |
| ПРОСТАТОАССОЦИИРОВАННЫЕ АНТИГЕНЫ И ИММУНОТЕРАПЕВТИЧЕСКИЕ СХЕМЫ НА ОСНОВЕ ВАКЦИН | 2013 |
|
RU2609651C2 |
Изобретение относится к медицине, а именно к иммунологии, и может быть использовано для получения пептида, используемого в вакцине для лечения метастатического рака молочной железы человека. Пептид-иммуноген характеризуется аминокислотной последовательностью CKGPIVLDGVIKTQPHAAEK (SEQ ID NO: 1), идентичной аминокислотным последовательностям активного центра рецептора EGFR и содержит ковалентно с ним связанный белок-носитель. В качестве белка-носителя он содержит бычий сывороточный альбумин (БСА), или катионизированный бычий сывороточный альбумин, или овальбумин или гемоцианин. Использование данного изобретения позволяет получение пептида-иммуногена, используемого в терапевтической вакцине для лечения метастатического рака молочной железы за счет высокой иммуногенности пептида и обеспечения формирования иммунного ответа только на протективные (функционально значимые) эпитопы целевых онкомаркеров, блокирующие основные пути роста и метастазирования опухоли. 1 з.п. ф-лы, 1 ил., 1 табл.
1. Пептид-иммуноген, используемый в терапевтической вакцине для лечения метастатического рака молочной железы человека, характеризующийся следующей аминокислотной последовательностью: CKGPIVLDGVIKTQPHAAEK (SEQ ID NO: 1), идентичной аминокислотным последовательностям активного центра рецептора EGFR и содержит ковалентно с ним связанный белок-носитель.
2. Пептид-иммуноген по п. 1, отличающийся тем, что в качестве белка-носителя он содержит бычий сывороточный альбумин (БСА), или катионизированный бычий сывороточный альбумин, или овальбумин, или гемоцианин.
| КОМПОЗИЦИИ РЕКОМБИНАНТНЫХ АНТИТЕЛ ПРОТИВ РЕЦЕПТОРА ЭПИДЕРМАЛЬНОГО ФАКТОРА РОСТА | 2008 |
|
RU2488596C2 |
| ВНУТРИКЛЕТОЧНЫЙ ДОМЕН БЕЛКА HER-2/NEU ДЛЯ ПРЕДУПРЕЖДЕНИЯ ИЛИ ЛЕЧЕНИЯ МАЛИГНИЗАЦИЙ | 1996 |
|
RU2236461C2 |
| US 2015218248 A1, 06.08.2015 | |||
| WO 2012051247 A2, 19.04.2012. | |||
Авторы
Даты
2017-07-07—Публикация
2015-10-20—Подача