Настоящее изобретение относится к новым пептидам и к их применению в терапии.
Активная антицитокиновая иммунизация представляет собой стратегию активной иммунотерапии, разрабатываемую с 1990 года Zagury et al., и которая описана, например, в заявке на патент WO 92/22577.
Эту идею взяли на вооружение несколько научных групп, опубликовавших в международных научных журналах сведения по активной иммунизации против целого белка IFNα, мультимеризованного обработкой глутаральдегидом (Gringeri et al., JAIDS 1999; 20:358-70), химерного белка TNFα, полученного копулированием нативного белка TNFα с эпитопом Т овальбумина (Dalum et al., Nature Biotechnology, 1999; 17:666-69), против целого IL9, копулированного с KLH (Richard et al., PNAS, 2000; 97:762-72) или целого IL5, химерного с эпитопом Т столбнячного токсина (Hertz et al., J. Immunol., 2001; 167:3792-99).
Эти подходы подтвердили осуществимость аутологичной антицитокиновой иммунизации, однако, за этими несколькими случаями успеха скрываются бесплодные попытки, описанные рядом авторов: некоторые цитокины не позволяют получить антитела, которые в достаточной степени оказывали бы защитный клинический эффект, а один и тот же цитокин, полученный в эффективном виде одним способом, не оказывался эффективным, будучи полученным другим (Richard et al., PNAS, 2000; 97:767-72).
В попытке объяснить это явление заявитель обнаружил, что до настоящего времени все авторы использовали целые цитокины (иногда слегка модифицированные), что влечет трудности, в частности, следующего плана:
ослабление иммуногенного воздействия целевых антигенных детерминант (для ответов В и Т);
возможный генезис облегчающих антител in vivo (ответ В).
Таким образом, желательно найти антигены, которые позволили бы получить антитела, проявляющие достаточный защитный эффект по отношению к цитокинам и ограничивающие их активность.
В WO-A-98/51705 описаны пептиды h RANTES, MIP1α и MIP1β, находящиеся между вторым и третьим цистеином хемокинов, связывающихся с ко-рецептором CCR5.
В WO-A-98/34631 описаны пептиды, полученные из γ-цепей рецепторов цитокинов, используемые для блокировки фиксации цитокина или активации рецептора.
В WO-A-94/01457 описаны пептиды IFNα, используемые в качестве носителей фармацевтических соединений.
В ЕР-А-0218531 описаны пептиды IL1, используемые для получения антител.
Таким образом, объектом настоящей заявки являются пептиды размером от 5 до 40 аминокислот, происходящие от цитокина, отличающиеся тем, что по меньшей мере в одной из этих аминокислот и, предпочтительно, по меньшей мере в двух последовательных аминокислотах из этих аминокислот по меньшей мере один атом расположен на расстоянии d менее 5 ангстрем от атома рецептора, соответствующего указанному цитокину, причем расстояние d оценивают на основании структурных данных (например, кристаллографии или ЯМР), и, предпочтительно, тем, что они индуцируют антитела, взаимодействующие с указанным цитокином, за исключением
пептидов, расположенных между 2-м и 3-м цистеином h RANTES, MIP1α и MIP1β; и
пептидов, расположенных между аминокислотами 123 и 140 IFNα.
Из-за своей длины пептиды цитокинов по изобретению соответствуют ограниченному числу эпитопов цитокина, обычно одному или двум эпитопам цитокина, и, следовательно, лишены многих других эпитопов, содержащихся в цитокинах.
Под «цитокином» понимают как истинные цитокины, так и хемо-аттрактивные цитокины, также называемые хемокинами. Предпочтительны цитокины человека. Под «взаимодействующими» подразумевается, что эти антитела, например, либо распознавая нативный белок, как это может быть показано в иммунологическом тесте (ELISA, Western Blot), либо блокируя связывание цитокина с его рецептором, как это может быть показано в тесте на биологическую активность или в тесте на биохимическую конкуренцию, проявляют благоприятный клинический эффект in vivo.
Из цитокинов можно назвать, например, TGFβ, IL1α, IL1β, vEGF, TNFα, IFNα и γ, IL4, 5, 6, 10, 12, 13, 15, 18, 23, IP10, MIP1α и 1β, MCP1 и Rantes. Из вышеперечисленных цитокинов предпочтительны TGFβ, IL1β, vEGF, TNFα, IFNα и γ, IL4, 5, 6, 10, 12, 13, 15, 23 или любая комбинация некоторых из этих цитокинов, в частности, IL1β, vEGF, TNFα, IL23 и IFNα или любая комбинация некоторых из этих цитокинов.
Пептиды цитокинов по изобретению происходят от или являются производными одного цитокина. Под «происходят» подразумевается, что их аминокислотная последовательность идентична аминокислотной последовательности цитокина. Под «являются производными» подразумевается, что их аминокислотная последовательность в основном идентична аминокислотной последовательности цитокина, но имеет некоторые отличия, как будет показано далее.
По меньшей мере в одной аминокислоте пептидов цитокина по изобретению и, предпочтительно, в двух последовательных аминокислотах один из атомов находится на расстоянии менее 5 ангстрем от атома рецептора, соответствующего указанному цитокину. Предпочтительно, он находится на расстоянии менее 4,5 ангстрем, в частности, менее 4 ангстрем и особенно предпочтительно менее 3,5 ангстрем от атома рецептора, соответствующего указанному цитокину.
Обычно такой атом аминокислоты находится в боковой цепи указанной аминокислоты.
В предпочтительных условиях осуществления изобретения 2, в частности, 3 и, предпочтительно, 4 последовательные аминокислоты пептида цитокина отвечают этому критерию расстояния.
Это расстояние оценивают на основании структурных данных, например, кристаллографии, или на основании ЯМР, который дает результаты, сходные с результатами кристаллографического измерения.
Указанные пептиды цитокинов предпочтительно содержат более 8, в частности, более 10, более предпочтительно, более 12 и, особенно предпочтительно, более 15 аминокислот.
В других предпочтительных условиях осуществления изобретения указанные пептиды цитокинов содержат менее 35, предпочтительно, менее 30, в частности, менее 25, и, наиболее предпочтительно, менее 20 аминокислот. Обычно наиболее короткие последовательности соответствуют пептидам, содержащим только одну группу по меньшей мере двух последовательных аминокислот, в которых по меньшей мере один атом находится на расстоянии менее 5 ангстрем от атома рецептора, соответствующего указанному цитокину, в то время как наиболее длинные последовательности обычно соответствуют пептидам по изобретению, содержащим две или даже три и более групп таких последовательных аминокислот. Эти группы могут находиться на расстоянии нескольких, например, 10 аминокислот друг от друга, как в случае IL1β.
Из вышеуказанных пептидов цитокинов можно, в частности, назвать один или более пептидов, выбранных из или происходящих от пептидов, названия которых приведены ниже:
1-APVRSLNCTL-10 (ID SEQ №1)
29-LHLQGQDMEQQ-39 (ID SEQ №2)
123-STSQAENMPV-132 (ID SEQ №3)
73-IMRIKPHQGQHIGEMS-88 (ID SEQ №4)
20-PQAEGQLQWLNRRANALLANGVELRDNQLVVPSEG-54 (ID SEQ №5)
80-ISRIAVSYQTKVNLLS-95 (ID SEQ №6)
124-FQLEKGDRLSAEINR-138 (ID SEQ №7)
1-MQDPYVKEAENLKKYFNAGHSDVADNGTLFLGILKN-36 (ID SEQ №8)
118-MAELSPAAKTGKRKRS-133 (ID SEQ №9)
20-PNMLRDLRDAFSRVKTFFQMKDQLDNLLLKE-50 (ID SEQ №10)
5-ITLQEIIKTLNSL-17 (ID SEQ №11)
70-AQQFHRHKQLIRFLKRLDRNLWGLAG-95 (ID SEQ №12)
80-LLLHKKEDGIWSTDILKDQKEPKNKTFLRCE-110 (ID SEQ №13)
135-KSSRGSSDPQG-145 (ID SEQ №14)
1-YFGKLESKLSVIRNLNDQVLFIDQGNRPLFEDMTD-35 (ID SEQ №15)
68-CEKISTLSCEN-78 (ID SEQ №16)
141-EDELGDRSIMFTVQNED-157 (ID SEQ №17)
39-VEIIATMKKKGEKRCLNPESKA-60 (ID SEQ №18)
1-IPTSALVKETLALLSTHRTLLIANET-26 (ID SEQ №19)
96-LQEFLGVMNTEWI-108 (ID SEQ №20)
25-KRDLGWKWIHE-35 (ID SEQ №21)
87-TILYYIGKTPKIEQ-100 (ID SEQ №22)
1-ANWVNVISDLKKI-13 (ID SEQ №23)
74-SSNGNVTESGCKECEELEKKNIKEFLQSFVHIVQMF-111 (ID SEQ №24)
28-KQIRYILDGISA-39 (ID SEQ №25)
114-RAVQMSTKVLIQFLQKKAKNLDAITTPDPTTNASLL-149 (ID SEQ №26)
51-ADPSEEWVQKYVSDLELSA-69 (ID SEQ №27)
52-ADPSESWVQEYVYDLELN-69 (ID SEQ №28)
8-TALRELIEEL-17 (ID SEQ №29)
57-CSAIEKTQRMLSGFCPHKVSAGQFSS-82 (ID SEQ №30)
52-GHMDLREEGDEETT-65 (ID SEQ №31)
115-LLPDSPVGQLHASLLGLSQ-133 (ID SEQ №32)
160-LLRFKILRSLQAFVAVAARV-179 (ID SEQ №33)
51-ANPEKKWVREYINSLEMS-68 (ID SEQ №34)
12-RRTLMLLAQMRK-23 (ID SEQ №35)
95-LEACVIQGVGVTETPLMKEDSILAVRK-121 (ID SEQ №36)
Вышеприведенные последовательности были выбраны в составе цитокинов, участвующих в развитии заболеваний человека в силу своей роли в воспалительной реакции или в специфическом иммунном ответе.
В частности, можно назвать следующие пептиды:
123-STSQAENMPV-132 hIL1β;
73-IMRIKPHQGQHIGEMS hvEGF;
20-PQAEGQLQWLNRRANALLANGVELRDNQLVVPSEG-54 hαTNF;
1-MQDPYVKEAENLKKYFNAGHSDVADNGTLFLGILKN-36 hIFNγ;
20-PNMLRDLRDAFSRVKTFFQMKDQLDNLLLKE-50 hIL10;
70-AQQFHRHKQLIRFLKRLDRNLWGLAG-95 hIL4;
1-YFGKLESKLSVIRNLNDQVLFIDQGNRPLFEDMTD-35 hIL18;
52-GHMDLREEGDEETT-65, 115-LLPDSPVGQLHASLLGLSQ-133 или 160-LLRFKILRSLQAFVAVAARV-179 hIL23.
Как известно специалисту в области иммунологии, возможно изменить последовательность природных пептидов в цепи без изменения природы иммунологических свойств иммуногенных пептидов. Следовательно, можно также указать производные пептидов цитокинов, в значительной степени гомологичные этим природным последовательностям, например, имеющие более 50% гомологии, в частности, более 70% гомологии и предпочтительно более 80% гомологии или даже более 90% гомологии с соответствующим нативным пептидом, которые сохраняют иммунологические свойства этого эпитопного участка нативного пептида. Их область гомологии может составлять от 5 до 40 остатков, например, от 8 до 40 остатков или от 8 до 35 остатков, предпочтительно, от 10 до 35 остатков, а также от 12 до 35 остатков, в частности, от 12 до 30 остатков, более конкретно, от 15 до 30 остатков и, наиболее предпочтительно, от 15 до 25 остатков.
Производные пептидов цитокинов могут содержать модифицированные остатки при условии, что такие модификации не снижают существенным образом иммуногенность, причем модификации представляют собой либо присоединение химических радикалов (метил, ацетил и т.д.), либо стереохимическую модификацию (использование аминокислот серии D). Пептидные производные цитокинов, как и пептиды цитокинов, индуцировать антитела, взаимодействующие с цитокином.
Пептидные производные цитокинов по изобретению могут включать в аминокислотах, из которых они состоят, одну или более модификаций, таких как делеции, замены, вставки или присоединения функциональных групп (например, ацилирование), одной или более аминокислот, при условии, что эти модификации не выходят за определенные выше рамки (иммунологический характер). Например, обычно замена лейцина на изолейцин не меняет таких свойств; модификации должны затрагивать, как правило, менее 40% аминокислот, в частности, менее 30%, предпочтительно, менее 20% и наиболее предпочтительно, менее 10% аминокислот природного пептида. Важно, чтобы антитела, индуцируемые модифицированными пептидами, были активны в отношении нативного цитокина.
Эти модификации доступны специалисту, который может отследить влияние этих модификаций с помощью простых тестов. Иммуногенность таких модифицированных производных может быть оценена методом ELISA после иммунизации мышей, причем антигеном, тестируемым в ELISA, является целый цитокин или иммунизирующий пептид цитокина, или с помощью тестов на блокировку связывания цитокин-рецептор. Возможные модификации затрагивают предпочтительно менее 8 аминокислот, более предпочтительно, менее 6 аминокислот, в частности, менее 4 аминокислот, особенно предпочтительно, 3 или менее аминокислоты, например 2 или 1 аминокислоту.
Также объектом изобретения является соединение, отличающееся тем, что оно содержит по меньшей мере один описанный выше пептид цитокина или производное пептида цитокина. Такое соединение может включать повторы одинаковых пептидов/производных или комбинации разных пептидов/производных как в линейной форме, так и в форме структур в виде канделябра или смешанных соединений с белками-носителями. Такое соединение также может находиться в циклизованной форме. Таким образом, пептиды цитокинов или пептидные производные цитокинов по изобретению могут, например, быть встроены в более длинные аминокислотные последовательности, обеспечивающие, например, лучшую конформацию, или могут быть скомбинированы с экзогенными Т-эпитопами (для иммунизации с помощью как белков, так и ДНК).
Они могут быть, предпочтительно, ковалентно ассоциированы с белками-носителями, такими как, например, KLH.
Как было показано, пептиды цитокинов по изобретению обычно соответствуют небольшому числу эпитопов цитокина. В случае, в частности, их встраивания, комбинации или ассоциации, вышеназванные соединения не содержат других эпитопов указанного цитокина.
Эти пептиды цитокинов или производные цитокинов могут быть включены в любую белковую последовательность, не содержащую гомологии с другими эпитопами природного цитокина. Например, они могут являться сайтами связывания с рецептором, к окончаниям которых просто добавляют цистеин для придания пептиду циклической структуры. Другим примером является пептид, окруженный последовательностями Т-эпитопов столбнячного токсина. Еще одним примером может являться пептид, соответствующий последовательности сайта связывания с рецептором, но в которой некоторые аминокислоты заменены их изомерами серии D во избежание проявления их агонистического эффекта. Действительно, может оказаться предпочтительным использование пептидных производных, не обладающих агонистической активностью в отношении рецептора, чтобы действие иммуногена не накладывалось на иммунный ответ.
Для усиления иммунного ответа эти пептиды цитокинов или производные цитокинов могут быть копулированы с белками-носителями. Методы копулирования и используемые белки-носители могут различаться в зависимости от выбранного пептида: можно, например, использовать белок Keyhole Limpet Hemocyanin (KLH) и Tetanus Toxoid (TT), конъюгированные с пептидами с помощью известных специалисту химических методов, таких как связывание с помощью карбодиимида, или с помощью глутаральдегида, или с помощью бис-диазотированного бензидина. Осуществление такого связывания может быть упрощено добавлением или встраиванием в последовательность аминокислот, таких, например, как лизин, гистидин, тирозин или цистеин. Такие пептидные соединения, химически или генетически связанные с экзогенным Т-эпитопом (происходящим от plasmodium falciparum, KLH и т.д.), также составляют часть изобретения.
Связывание в сетчатые структуры типа канделябра или связывание с такими молекулами, как трансферин или ферритин, может быть также осуществлено для стимуляции эффективности иммунного ответа.
Пептиды по изобретению могут быть, в частности, получены химическим синтезом или методами генной инженерии, или любым другим подходящим методом. Синтез циклических пептидов при необходимости путем прививки одной или более аминокислот к концу цепи, например, путем прививки цистеинов для создания дисульфидного мостика, позволяет частично воссоздать вторичную структуру, которую эти пептидные фрагменты имеют в составе трехмерной структуры протеина.
Пептиды цитокинов, производные цитокинов и их соединения по изобретению обладают очень интересными фармакологическими свойствами. В частности, они обладают замечательными антицитокиновыми свойствами. Действительно, они являются иммуногенами и способны генерировать в организме пациента антитела, распознающие нативный цитокин. Эти пептиды не содержат другие многочисленные эпитопы, происходящие от цитокина, которому они соответствуют.
Эти свойства продемонстрированы далее в экспериментальной части. Они подтверждают возможность применения вышеописанных пептидов в качестве лекарственных средств.
Ограничение изобретения этими пептидами, близкими к сайту связывания с рецептором, и исключение других эпитопов цитокинов позволяет, в частности, ограничить образование антител, облегчающих или потенцирующих цитокиновую активность. Кроме того, они позволяют повысить качество антицитокиновой иммунизации, поскольку сокращается число целевых антигенных детерминант.
Поэтому еще одним объектом изобретения являются лекарственные средства, отличающиеся тем, что они состоят из вышеописанных пептидов цитокинов или производных цитокинов или соединений, т.е., из вышеописанных пептидов цитокинов или производных цитокинов или иммуногенных соединений, или находящихся между 2-м и 3-м цистеином h RANTES или между 123 и 140 аминокислотами IFNα, используемые в способе терапевтического лечения организма человека или животного, а также применение такого пептида цитокина или производного цитокина или иммуногенного соединения для получения лечебного или профилактического лекарственного средства, предназначенного для лечения или профилактики нарушений, связанных с избытком или присутствием цитокинов.
Лекарственные средства по изобретению могут использоваться, например, как в лечении, так и в профилактике заболеваний, связанных с нарушениями регуляции иммунной системы, при которых наблюдается избыточная продукция цитокинов, как, например, аутоиммунные заболевания (в том числе рассеянный склероз, ревматоидный полиартрит, псориаз, аутоиммунный диабет, волчанка), аллергия или астма, рак или СПИД. Также очевидно, что борьба с IL1β или TNFα может помочь в лечении ревматоидного полиартрита, борьба с IFNγ, IL18, IL23 или IL12 может помочь в лечении рассеянного склероза или аутоиммунного диабета, борьба с IL4, IL5 и IL13 может помочь в лечении аллергии или астмы, борьба с IL10 или vEGF может помочь в лечении некоторых видов рака. В целом, в случае нарушений регуляции Th1/Th2, которые управляют самим иммунным ответом и обычно подключают IL12, IL2, IL4, IL6, IL10, IL13, IFNγ, TNFα, активная иммунизация приводит к восстановлению равновесия. Это только несколько примеров, а объектом изобретения является также любое лечение организма человека, основанное на активной иммунизации (ДНК или пептид), в которой используют вышеприведенные пептидные последовательности, за исключением других эпитопов цитокинов. Эти последовательности могут быть модифицированы, как указано в настоящем описании, и иммунизация с помощью ДНК происходит за счет простой транскрипции генетического кода.
Гуморальный иммунный ответ может быть оценен с помощью тестов ELISA или тестов, показывающих ингибирование связывания нативного цитокина со своим рецептором. Клеточный ответ может быть оценен в присутствии тестов на пролиферацию клеток в присутствии используемого пептида.
Иммуногенные действующие начала по изобретению могут быть использованы следующим образом.
Пациенту вводят пептид цитокина или производное цитокина или иммуногенное соединение по изобретению, например, подкожным или внутримышечным путем, в количестве, достаточном для эффективности в терапевтическом плане. Вводимая доза может составлять, например, от 1 до 1000 мкг, в частности, от 10 до 500 мкг при введении подкожным путем один раз в месяц в течение трех месяцев и далее периодически в зависимости от уровня индуцированных антител в сыворотке, например, каждые 2-6 месяцев. В составе одного и того же препарата можно вводить две или более разных иммуногенных молекул для индукции антител, нейтрализующих все неблагоприятные функциональные сайты, в случае, когда одна единственная иммуногенная молекула не содержит всех активных сайтов суперпродуцируемого цитокина, который требуется нейтрализовать.
Также объектом изобретения являются фармацевтические композиции, в частности, вакцины, содержащие в качестве действующего начала по меньшей мере один определенный выше пептид цитокина или производное цитокина или иммуногенное соединение.
В качестве лекарственного средства пептид цитокина или производное цитокина или иммуногенное соединение по изобретению может быть введено в состав фармацевтических композиций, предназначенных для введения любым обычным путем введения, принятым для вакцин, в частности, подкожным путем, внутримышечным путем, внутривенным путем или пероральным путем. Введение может быть осуществлено в виде однократной дозы или быть повторено один или более раз после некоторого интервала времени.
Поэтому еще одним объектом настоящей заявки является лечебная или профилактическая фармацевтическая композиция, отличающаяся тем, что она содержит в качестве действующего начала один или более пептидов цитокинов или производных цитокинов или иммуногенных соединений, являющихся новыми или находящихся между 123 и 140 аминокислотами IFNα, как они описаны выше.
Иммуногенный агент может находиться в индивидуальной форме или может быть смешан с фармацевтически приемлемым эксципиентом или смесью эксципиентов, таким как добавка. В частности, объектом настоящей заявки является вакцина, содержащая в качестве иммуногена вышеописанный пептид цитокина или производное цитокина или иммуногенное соединение.
Еще одним объектом настоящего изобретения является способ получения вышеописанной композиции, отличающийся тем, что смешивают с помощью известных методов, одно или более действующих начал с приемлемыми, в частности, фармацевтически приемлемыми, эксципиентами.
Введение пациенту пептида цитокина или производного цитокина или иммуногенного соединения по изобретению соответствует активной иммунотерапии. Также может представлять интерес проведение пассивной иммунотерапии, т.е. непосредственное введение пациенту нужных ему антител.
Вакцинные препараты могут быть приготовлены для интраназального введения в форме геля карбополом в качестве эксципиента, в форме носовых капель или спрея, а для перорального введения в форме гастрорезистентных капсул, драже или гастрорезистентных гранул.
В случае ДНК-содержащих вакцин, вводимых системно или через слизистую, галеновая форма плазмиды может представлять собой суспензию в физиологической жидкости, такой как физиологический PBS (фосфатный буфер=PBS). Плазмиды могут быть включены в микросферы из биоразлагаемых полимеров (PLG, PLA, PCL) и введены в виде гастрорезистентных капсул для переваривания (пероральный путь введения). ДНК также может экспрессироваться в живом бактериальном векторе типа сальмонеллы или в вирусном векторе типа аденовируса или поксвируса.
Еще одним объектом настоящей заявки является способ активной иммунизации пациентов, отличающийся тем, что в качестве иммуногена используют определенный выше пептид цитокина или производное цитокина, или иммуногенное соединение, предпочтительно, в комбинации с минеральной, масляной или синтетической иммунной добавкой.
Иммунизация может быть осуществлена обычными методами, в частности, с помощью пептидов или иммуногенных соединений, таких как конъюгаты, предпочтительно в присутствии добавки, например, ISA 51 или Alun. Иммунизация может быть осуществлена на основе ДНК (последовательности, гомологичные сайтам связывания, в комбинации с экзогенными Т-эпитопами) с использованием голых ДНК или вектора экспрессии, содержащего подходящий промотор, например, pCR3,1. Вводимые ДНК могут быть защищены от действия нуклеаз с помощью подходящих радикалов (CpG и т.д.). В частности, после первоначальной иммунизации с помощью ДНК могут следовать обычные повторы с помощью пептидных соединений.
Предпочтительные условия использования вышеописанных пептидов также справедливы для других вышеописанных объектов изобретения.
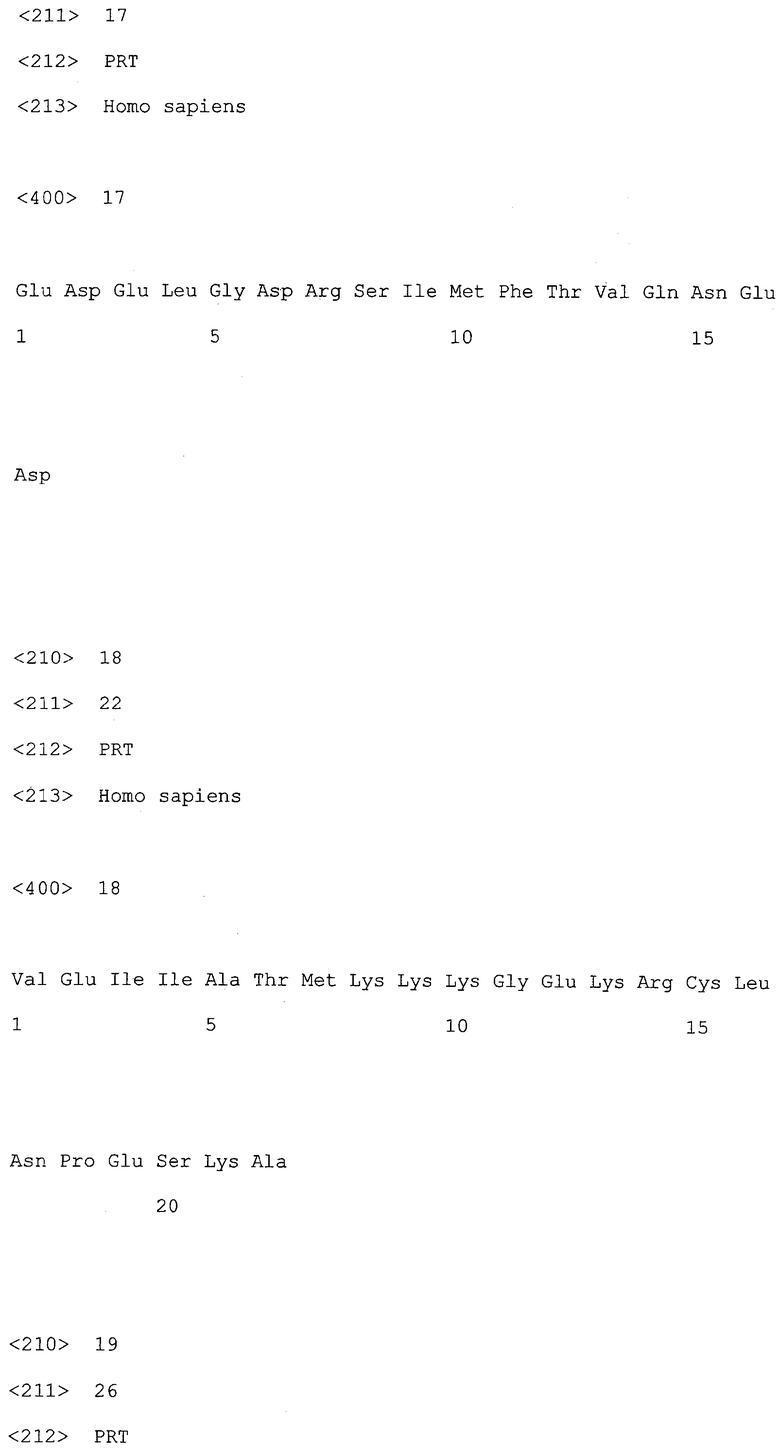
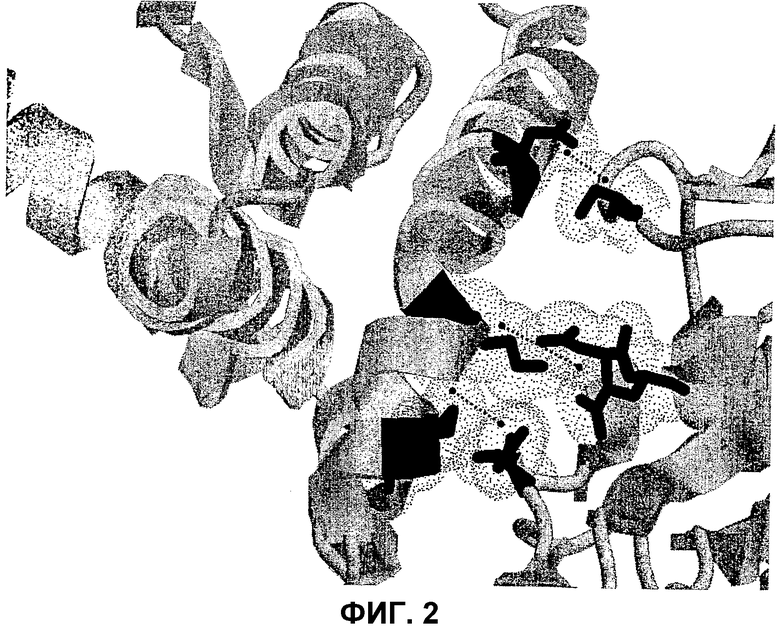
На фиг.1 и 2, представляющей собой увеличение фиг.1, представлена кристаллографическая структура пептида, происходящего от IL10, в контакте с рецептором. Различим цитокин IL10 (слева) в контакте с рецептором (справа).
На фиг.2 можно наблюдать, что аминокислоты, помеченные черным, находятся на расстоянии менее 4 ангстрем (d=пунктир между двумя черными округлыми пятнами). Они соответствуют (снизу вверх) парам:
192IL10R серин - 28IL10 аспарагиновая кислота (3,18Å), 100IL10R аспарагиновая кислота и 101IL10R глутаминовая кислота - 34IL10 лизин (3,83Å и 3,84Å), и 94IL10R аспарагин - 39IL10 метионин (3,70Å). Для каждой аминокислоты центральная точка определена как барицентр по отношению к альфа-углероду рассматриваемой аминокислоты, окончанию боковой цепи и третьей точке, выбранной на основании максимальной удаленности от двух предыдущих на боковой цепи. Измеряемое расстояние d представляет собой расстояние, разделяющее центральные точки аминокислот, соответственно, цитокина и его рецептора. Очевидно, эти расстояния можно определить, используя другие обычные методы.
Следующие примеры иллюстрируют настоящее изобретение.
Пример 1
Пептид KLHLQGQDMEQQ (ID SEQ №37) был синтезирован из последовательности IL1β человека, к природной последовательности был добавлен остаток К для обеспечения связывания с KLH с помощью глутаральдегида.
Пять мышей были иммунизированы в присутствии добавки ISA51. Для первой инъекции, осуществленной в Д0 (день 0), готовили эмульсию 40 мкг иммуногена в количестве ISA51, достаточном для получения 100 мкл эмульсии. Для повторных иммунизаций в Д21 и в Д40 готовят 100 мкл эмульсии, содержащей 20 мкг иммуногена. Пятерых мышей иммунизировали параллельно в качестве контроля, используя KLH в том же адъюванте.
В Д60 отбирали сыворотку и проводили тесты ELISA с нативным цитокином для определения присутствия антител.
Среднее поглощение, полученное для каждой мыши, представлено в следующей таблице.
Присутствие антител, нейтрализующих нативный цитокин, оценивали следующим образом: 20 единиц нативного цитокина IL1β предварительно инкубировали с сывороткой мыши (иммунизированной или контрольной) в разведениях от 1/100 до 1/2000 в течение 2 час при 37°C. Затем эти среды добавляли к клеткам EL4, помещенным в микроплашки в количестве 50000 клеток на лунку. Продукцию IL2 оценивали спустя 24 часа в супернатанте с помощью теста ELISA сэндвич (R&D diagnostics). Процент ингибирования продукции IL2 отражает процент нейтрализации IL1β. Как можно видеть, ответы наблюдаются для иммунизированных мышей и не наблюдаются для контрольных.
Пример 2
Иммунизировали 5 мышей с помощью синтетического пептида, происходящего от vEGF человека: KPHQGQHIGEMS (ID SEQ №38). Этот пептид был копулирован с белком-носителем KLH путем реакции в присутствии глутаральдегида. После иммунизации в тех же условиях, как и в примере 1, в Д60 отбирали сыворотку и проводили тесты ELISA с нативным цитокином для выявления присутствия антител.
Среднее поглощение, полученное для каждой мыши, представлено в следующей таблице.
Пример 3
Иммунизировали 5 мышей с помощью синтетического пептида, происходящего от TNFα человека: KYQAEGQLQWLNRRANALLANGVELRDNQL (ID SEQ №39). Этот пептид был копулирован с белком-носителем KLH путем реакции в присутствии диазобензидина. К природной последовательности были добавлены остатки К и Y для обеспечения связывания с KLH с помощью глутаральдегида. После иммунизации в тех же условиях, как и в примере 1, в Д60 отбирали сыворотку и проводили тесты ELISA с нативным цитокином для выявления присутствия антител.
Среднее поглощение, полученное для каждой мыши, представлено в следующей таблице.
Присутствие антител, нейтрализующих нативный цитокин, оценивали следующим образом: 50 единиц нативного цитокина TNFα предварительно инкубировали с сывороткой мыши (иммунизированной или контрольной) в разведении 1/200 в течение 2 час при 37°C. Затем эти среды добавляли к клеткам L929, помещенным в микроплашки в количестве 25000 клеток на лунку. Лизис клеток оценивали спустя 24 часа по окрашиванию нафтолом черно-синим (Sigma). Процент ингибирования лизиса отражает процент нейтрализации TNFα, и как можно видеть, ответы наблюдаются для иммунизированных мышей и не наблюдаются для контрольных.
Пример 4
Иммунизировали 5 мышей с помощью пептида, происходящего от IFNγ человека: KKYFNAGHSDVADNGTLFLGILKN (ID SEQ №40). Этот пептид был химически синтезирован в форме MAPS. Этот пептид MAPS был затем копулирован с белком-носителем Tetanus Toxoid путем реакции в присутствии глутаральдегида. После иммунизации в тех же условиях, как и в примере 1, в Д60 отбирали сыворотку и проводили тесты ELISA с нативным цитокином для выявления присутствия антител.
Среднее поглощение, полученное для каждой мыши, представлено в следующей таблице.
Присутствие антител, нейтрализующих нативный цитокин, оценивали следующим образом: 100 единиц нативного цитокина предварительно инкубировали с сывороткой мыши (иммунизированной или контрольной) в разведении 1/250 в течение 2 час при 37°C. Затем эти среды добавляли к клеткам RAW 264,7, помещенным в микроплашки в количестве 300000 клеток на лунку емкостью 2 мл. Экспрессию главного комплекса гистосовместимости (МНС) класса II на клетках оценивали поточной цитометрией спустя 24 часа, используя маркировку антителами анти-МНС класса II, связанными с флуоресцеином. Процент ингибирования экспрессии МНС класса II отражает процент нейтрализации IFNγ, и, как можно видеть, ингибирование наблюдается для иммунизированных мышей и не наблюдается для контрольных. Порог значимости в этих экспериментах составляет 30%.
Пример 5
Иммунизировали 5 мышей с помощью пептида, происходящего от IL10 человека: DECNMLRDLRDAFSRVKTFFQMKDQLDNC (ID SEQ №41). Этот пептид синтезировали химически и к каждому концу добавляли цистеин с получением циклического пептида. Этот пептид был затем копулирован с белком-носителем KLH путем реакции в присутствии карбодиимида. К природной последовательности также добавляли остаток DE для обеспечения связывания с KLH путем реакции в присутствии карбодиимида. После иммунизации в тех же условиях, как и в примере 1, в Д60 отбирали сыворотку и проводили тесты ELISA с нативным цитокином для выявления присутствия антител.
Среднее поглощение, полученное для каждой мыши, представлено в следующей таблице.
Пример 6
Иммунизировали 5 мышей с помощью пептида, соответствующего IL4 человека: KQLIRFLKRLDRNLWGLAG (ID SEQ №42). Этот пептид был копулирован с белком-носителем KLH путем реакции в присутствии глутаральдегида. После иммунизации в тех же условиях, как и в примере 1, в Д60 отбирали сыворотку и проводили тесты ELISA с нативным цитокином для выявления присутствия антител.
Среднее поглощение, полученное для каждой мыши, представлено в следующей таблице.
Пример 7
Иммунизировали 5 мышей с помощью пептида, соответствующего IL12р40 человека: KKEDGIWSTDILKDQKEPKNKTFLRCE (ID SEQ №43). Этот пептид был копулирован с белком-носителем Tetanos Toxoide путем реакции в присутствии бис-диазотированного (диазо) бензидина. После иммунизации в тех же условиях, как и в примере 1, в Д60 отбирали сыворотку и проводили тесты ELISA с нативным цитокином для выявления присутствия антител.
Среднее поглощение, полученное для каждой мыши, представлено в следующей таблице.
Пример 8
Иммунизировали 5 мышей с помощью пептида, происходящего от IL18 человека: KYFGKLESKLSVIRNLNDQVLFID (ID SEQ №44). Этот пептид был копулирован с белком-носителем KLH путем реакции в присутствии глутаральдегида. К природной последовательности был добавлен остаток К для обеспечения связывания с KLH с помощью глутаральдегида. После иммунизации в тех же условиях, как и в примере 1, в Д60 отбирали сыворотку и проводили тесты ELISA с нативным цитокином для выявления присутствия антител.
Среднее поглощение, полученное для каждой мыши, представлено в следующей таблице.
Пример 9
Иммунизировали 5 мышей с помощью синтетического пептида, происходящего от IL10 человека: KKKGEKRCLNPESKA (ID SEQ №45). Этот пептид был копулирован с белком-носителем Tetanos Toxoide путем реакции в присутствии глутаральдегида. Три остатка К, присутствующие в природной последовательности, обеспечивают связывание с KLH при помощи глутаральдегида. После иммунизации в тех же условиях, как и в примере 1, в Д60 отбирали сыворотку и проводили тесты ELISA с нативным цитокином для выявления присутствия антител.
Среднее поглощение, полученное для каждой мыши, представлено в следующей таблице.
Пример 10
Иммунизировали 5 мышей с помощью пептида, соответствующего IL5 человека: KLQEFLGVMNTEWI (ID SEQ №46). Этот пептид был копулирован с белком-носителем KLH путем реакции в присутствии глутаральдегида. К природной последовательности был добавлен остаток К для обеспечения связывания с KLH при помощи глутаральдегида. После иммунизации в тех же условиях, как и в примере 1, в Д60 отбирали сыворотку и проводили тесты ELISA с нативным цитокином для выявления присутствия антител.
Среднее поглощение, полученное для каждой мыши, представлено в следующей таблице.
Пример 11
Иммунизировали 5 мышей с помощью пептида, соответствующего TGFβ2 человека: DTILYYIGKTPKIE (ID SEQ №47). Этот пептид был копулирован с белком-носителем KLH путем реакции в присутствии карбодиимида. К природной последовательности был добавлен остаток D для обеспечения связывания. После иммунизации в тех же условиях, как и в примере 1, в Д60 отбирали сыворотку и проводили тесты ELISA с нативным цитокином для выявления присутствия антител.
Среднее поглощение, полученное для каждой мыши, представлено в следующей таблице.
Пример 12
Иммунизировали 5 мышей с помощью пептида, соответствующего IL6 человека: KQIRYILDGISA (ID SEQ №25). Этот пептид был копулирован с белком-носителем ТТ путем реакции в присутствии бис-диазотированного (диазо) бензидина. После иммунизации в тех же условиях, как и в примере 1, в Д60 отбирали сыворотку и проводили тесты ELISA с нативным цитокином для выявления присутствия антител.
Среднее поглощение, полученное для каждой мыши, представлено в следующей таблице.
Пример 13
ДНК, соответствующие пептидам 1-APVRSLNCTL-10 (GCACCTGTACGATCACTGAACTGCACGCTC) (ID SEQ №48), 29-LHLQGQDMEQQ-39 (CTCCACCTCCAGGGACAGGATATGGAGCAACAA) (ID SEQ №49) и 123-STSQAENMPV-132 (AGCACCTCTCAAGCAGAAAACATGCCCGTC) (ID SEQ №50) IL1β, были синтезированы и отделены от Т-эпитопов столбнячного токсина: AQYIKANSKFIGITEL (ID SEQ №55) (CAGTACATCAAGGCTAACTCCAAGTTCATCGGTATCACTGAGCTG) (ID SEQ №51) и KLH:VDTWRKNVDSL (GTTGACACCACCAGAAAAAATGTTGACTCCCTT) (ID SEQ №52), спейсерами GYG (GGCTACGGC)(ID SEQ №54).
Конечная нуклеотидная последовательность является следующей: GTTGACACCACCAGAAAAAATGTTGACTCCCTTGGCTACGGCGCACCTGTACGATCACTGAACTGCACGCTCGGCTACGGCGTTGACACCACCAGAAAAAATGTTGACTCCCTTGGCTACGGCCTCCACCTCCAGGGACAGGATATGGAGCAACAAGGCTACGGCCAGTACATCAAGGCTAACTCCAAGTTCATCGGTATCACTGAGCTGGGCTACGGCAGCACCTCTCAAGCAGAAAACATGCCCGTCGGCTACGGCGTTGACACCACCAGAAAAAATGTTGACTCCCTT(ID SEQ №53).
Эта последовательность ДНК, клонированная в pRSET-A, кодирует полипептидное соединение, которое получают и очищают методами генной инженерии в форме слитого белка полигистидина. Этот полипептид используют в качестве иммуногена, как описано в примере 1.
Антительный ответ у мышей был измерен с использованием нативного IL1β с помощью ELISA; получили следующие значения.
Пример 14
кДНК, соответствующие пептидам 1-APVRSLNCTL-10 (GCACCTGTACGATCACTGAACTGCACGCTC) (ID SEQ №48), 29-LHLQGQDMEQQ-39 (CTCCACCTCCAGGGACAGGATATGGAGCAACAA) (ID SEQ №49) и 123-STSQAENMPV-132 (AGCACCTCTCAAGCAGAAAACATGCCCGTC) (ID SEQ №50) IL1β были синтезированы и отделены от Т-эпитопов столбнячного токсина: AQYIKANSKFIGITEL (CAGTACATCAAGGCTAACTCCAAGTTCATCGGTATCACTGAGCTG) (ID SEQ №51) и KLH: VDTWRKNVDSL (GTTGACACCACCAGAAAAAATGTTGACTCCCTT) (ID SEQ №52) спейсерами GYG.
Конечная нуклеотидная последовательность является следующей: GTTGACACCACCAGAAAAAATGTTGACTCCCTTGGCTACGGCGCACCTGTACGATCACTGAACTGCACGCTCGGCTACGGCGTTGACACCACCAGAAAAAATGTTGACTCCCTTGGCTACGGCCTCCACCTCCAGGGACAGGATATGGAGCAACAAGGCTACGGCCAGTACATCAAGGCTAACTCCAAGTTCATCGGTATCACTGAGCTGGGCTACGGCAGCACCTCTCAAGCAGAAAACATGCCCGTCGGCTACGGCGTTGACACCACCAGAAAAAATGTTGACTCCCTT(ID SEQ №53).
Эта последовательность ДНК, клонированная в pCR3,1, кодирует полипептид IL1b под контролем промотора CMV.
Проводят первую внутримышечную инъекцию 100 мкг вектора в соляном растворе объемом 100 мкл. В Д21 и Д40 проводят повторы инъекций, используя пептид из примера 13 (иммунизация типа «prime-boost»). В Д60 антительный ответ оценивают в тесте ELISA с нативным цитокином на 5 иммунизированных мышах и 5 контрольных мышах.
Результаты являются следующими.
Пример 15
Получают вакцину в виде эмульсии вода-в-масле, состоящей из 50% ISA 51 (Seppic, Париж) и 50% водного раствора пептида из примера 1 (50 мкг/доза).
Пример 16
Вакцина на основе плазмидного иммуногена для ДНК-вакцинации системного типа IL10.
Плазмиды, кодирующие пептиды APVRSLNCTL и LHLQGQDMEQQ IL1β (20 мкг/доза) суспендируют в 0,2 мл PBS для внутримышечного введения.
Пример 17
Получили вакцину в виде эмульсии вода-в-масле из 50% ISA 51 (Seppic, Париж) и 50% водного раствора синтетического пептида KYQAEGQLQWLNRRANALLANGVELRDNQL, происходящего от TNFα человека, связанного с KLH (100 мкг/доза).
| название | год | авторы | номер документа |
|---|---|---|---|
| ВЕЩЕСТВА И СПОСОБЫ ДЛЯ ПРИМЕНЕНИЯ ПРИ ПРЕДУПРЕЖДЕНИИ И/ИЛИ ЛЕЧЕНИИ БОЛЕЗНИ ГЕНТИНГТОНА | 2015 |
|
RU2742493C2 |
| PCSK9 ВАКЦИНЫ | 2015 |
|
RU2698971C2 |
| ВАКЦИННАЯ КОМПОЗИЦИЯ ДЛЯ БОРЬБЫ С ЗАРАЖЕНИЯМИ ЭКТОПАРАЗИТАМИ | 2011 |
|
RU2585226C2 |
| Вакцинная композиция и ее применения | 2016 |
|
RU2726411C2 |
| ИММУНОГЕННЫЙ ПЕПТИД ПРОТИВ СТРЕПТОКОККОВ ГРУППЫ А | 2018 |
|
RU2775621C2 |
| ПЕПТИДНАЯ ВАКЦИНА ДЛЯ ПРЕДУПРЕЖДЕНИЯ И ИММУНОТЕРАПИИ ДЕМЕНЦИИ АЛЬЦГЕЙМЕРОВСКОГО ТИПА | 2013 |
|
RU2696566C2 |
| ИММУНОРЕГУЛЯТОРНАЯ ВАКЦИНА | 2013 |
|
RU2650709C2 |
| Иммуногенная композиция, включающая ее вакцина, набор для приготовления вышеуказанной композиции и способ лечения заболеваний, связанных с патологией секреции гастрина | 2014 |
|
RU2664197C2 |
| СИНТЕТИЧЕСКИЙ ПЕПТИД, СИНТЕТИЧЕСКИЙ ЛИПОПЕПТИД, ИММУНОГЕННЫЙ КОНЪЮГАТ (ВАРИАНТЫ), СПОСОБ ПОЛУЧЕНИЯ ОЛИГОМЕРА, ЗАЩИЩЕННЫЙ ТВЕРДЫМ МОНОМЕТИЛОВЫМ ЭФИРОМ ПОЛИЭТИЛЕНГЛИКОЛЯ ПОЛИСАХАРИД | 1993 |
|
RU2141527C1 |
| АГЕНТЫ И СПОСОБЫ, ОСНОВАННЫЕ НА ПРИМЕНЕНИИ ДОМЕНА EDA ФИБРОНЕКТИНА | 2006 |
|
RU2430738C2 |






















Изобретение относится к области биотехнологии, конкретно к получению новых пептидов, и может быть использовано в лечении и профилактике цитокинзависимых нарушений. Пептиды размером от 5 до 40 аминокислот, происходящие от цитокинов, используют в вакцине для лечения или профилактики аутоиммунных заболеваний, рассеянного склероза, ревматоидного полиартрита, псориаза, аутоиммунных диабетов, волчанки, аллергии, астмы, рака и СПИДа. Изобретение позволяет эффективно проводить иммунизацию пациентов против указанных заболеваний с минимизацией побочных эффектов. 8 з.п. ф-лы, 2 ил., 17 табл.
1-APVRSLNCTL-10 (ID SEQ №1)
29-LHLQGQDMEQQ-39 (ID SEQ №2)
123-STSQAENMPV-132 (ID SEQ №3)
73-IMRIKPHQGQHIGEMS-88 (ID SEQ №4)
20-PQAEGQLQWLNRRANALLANGVELRDNQLVVPSEG-54 (ID SEQ №5)
80-ISRIAVSYQTKVNLLS-95 (ID SEQ №6)
124-FQLEKGDRLSAEINR-138 (ID SEQ №7)
l-MQDPYVKEAENLKKYFNAGHSDVADNGTLFLGILKN-36 (ID SEQ №8)
118-MAELSPAAKTGKRKRS-133 (ID SEQ №9)
20-PNMLRDLRDAFSRVKTFFQMKDQLDNLLLKE-50 (ID SEQ №10)
5-ITLQEIIKTLNSL-17 (ID SEQ №11)
70-AQQFHRHKQLIRFLKRLDRNLWGLAG-95 (ID SEQ №12)
80-LLLHKKEDGIWSTDILKDQKEPKNKTFLRCE-110 (ID SEQ №13)
135-KSSRGSSDPQG-145 (ID SEQ №14)
1-YFGKLESKLSVIRNLNDQVLFIDQGNRPLFEDMTD-35 (ID SEQ №15)
68-CEKISTLSCEN-78 (ID SEQ №16)
141-EDELGDRSIMFTVQNED-157 (ID SEQ №17)
39-VEIIATMKKKGEKRCLNPESKA-60 (ID SEQ №18)
1-IPTSALVKETLALLSTHRTLLIANET-26 (ID SEQ №19)
96-LQEFLGVMNTEWI-108 (ID SEQ №20)
25-KRDLGWKWIHE-35 (ID SEQ №21)
87-TILYYIGKTPKIEQ-100 (ID SEQ №22)
1-ANWVNVISDLKKI-13 (ID SEQ №23)
74-SSNGNVTESGCKECEELEKKNIKEFLQSFVHIVQMF-111 (ID SEQ №24)
28-KQIRYILDGISA-39 (ID SEQ №25)
114-RAVQMSTKVLIQFLQKKAKNLDAITTPDPTTNASLL-149 (ID SEQ №26)
51-ADPSEEWVQKYVSDLELSA-69 (ID SEQ №27)
52-ADPSESWVQEYVYDLELN-69 (ID SEQ №28)
8-TALRELIEEL-17 (ID SEQ №29)
57-CSAIEKTQRMLSGFCPHKVSAGQFSS-82 (ID SEQ №30)
52-GHMDLREEGDEETT-65 (ID SEQ №31)
115-LLPDSPVGQLHASLLGLSQ-133 (ID SEQ №32)
160-LLRFKILRSLQAFVAVAARV-179 (ID SEQ №33)
51-ANPEKKWVREYINSLEMS-68 (ID SEQ №34)
12-RRTLMLLAQMRK-23 (ID SEQ №35)
95-LEACVIQGVGVTETPLMKEDSILAVRK-121 (ID SEQ №36) или функционального фрагмента этих пептидов, причем указанное производное пептида получено делецией, заменой, добавлением, циклизацией, стереохимической модификацией или добавлением функциональных групп одной или более аминокислот указанного пептида.
| FAIRBROTHER W.J | |||
| et al., Novel peptides selected to bind vascular endothelial growth factor target the receptor-binding site, Biochemistry, 1998, v.37, n.51, p.:17754-17764 | |||
| WO 9851705, 19.11.1998 | |||
| WO 9834631, 13.08.1998 | |||
| WO 9401457 A1, 20.01.2004 | |||
| МНОЖИТЕЛЬНО-ДЕЛИТЁЛЬНОЕ УСТРОЙСТВО | 0 |
|
SU218531A1 |
| RU 98105679 A, 20.02.2000. | |||
Авторы
Даты
2008-06-10—Публикация
2003-04-09—Подача