Изобретение относится к разработке профилактических противовирусных препаратов, а именно к получению вакцины против коронавирусной инфекции COVID-19 и может быть использовано для профилактики этого заболевания.
Общая характеристика коронавирусной инфекции COVID-19
Коронавирус человека был впервые выделен D. Tyrrell и М. Bynoe в 1965 г. от больного острым респираторным заболеванием (ОРВЗ), им удалось культивировать человеческий коронавирус на клетках трахеи [1]. Однако первое упоминание о коронавирусе, выделенном у цыплят, больных бронхитом, относится к 1937 г.
Свое название коронавирусы получили в 1968 году благодаря сходству выростов (пепломеры) с corona spinarum - терновым венцом вокруг головы святого на средневековых религиозных картинах [2]. Поскольку многие коронавирусы плохо размножаются в культуре клеток, то долгое время молекулярно-биологические исследования их репликации отставали от аналогичных исследований других вирусов и в течение многих лет впервые обнаруживаемые вирусы относили к группе коронавирусов только по их характерной морфологии [3]. Лишь в 1983 году были установлены характерные биохимические особенности, идентифицированы классы мРНК, их нуклеотидные последовательности, а также структурные белки [4, 5].
После открытия в 1965 году коронавирусы почти не привлекали внимание исследователей, поскольку выделенные штаммы 229Е и ОС43 вызывали относительно легкие заболевания. Врачи лечили их как обычную простуду, пока в Китае в 2002-2003 годах не была зафиксирована вспышка атипичной пневмонии, или тяжелого острого респираторного синдрома (ТОРС, SARS). Заболевание зарегистрировано в 32 странах, наибольшее количество в Китае, Сингапуре, Канаде. Всего заболело 8273 человека, а 775 умерло (летальность 9,6%).
17 марта 2003 года ВОЗ была объявлена «глобальная тревога» в связи с распространением «атипичной пневмонии». Были привлечены 13 лабораторий из 9 стран для проведения объединенных исследований этого заболевания. В качестве приоритетных задач ставилось определение этиологического агента, и затем на основании этого - разработка диагностических тест систем. В результате тесного сотрудничества ученых из лабораторий разных стран первая часть поставленной задачи была выполнена поразительно быстро. 16 апреля 2003 года ВОЗ было объявлено, что этиологическим агентом "атипичной пневмонии" является новый патоген, вирус SARS, относящийся к семейству коронавирусов, но не родственный ни одному из известных штаммов этого вируса [6]. С тех пор обнаружилось еще два коронавируса, которые тоже вызывают простуду -NL63 и HKU1. В 2012 году - почти через 50 лет после его открытия - был окончательно секвенирован полный геном штамма 229Е.
В 2012 году были зарегистрированы первые случаи заболевания, вызванного коронавирусом. Заболевание в дальнейшем получило название ближневосточного респираторного синдрома (MERS), возбудителем которого являлся коронавирус MERS-CoV [7]. В 2015 году в Южной Корее произошла вспышка ближневосточного респираторного синдрома, в ходе которой заболело 183 человека, умерло 33.
В декабре 2019 года несколько медицинских учреждений в китайском городе Ухань (провинция Хубэй) сообщили о пациентах с пневмонией [8]; клинические проявления напоминали симптомы тяжелого острого респираторного синдрома (SARS), заболевания, появившегося в 2002 году в соседнем районе - провинции Гуандун, вызванного коронавирусом SARS-CoV [9, 10]. 7 января 2020 г. был выделен новый штамм коронавируса, названный SARS-CoV-2, который вызывает коронавирусную болезнь 2019 года COVID-19. Полный геном SARS-CoV-2 уже достаточно изучен, его первая широкая публикация китайскими органами здравоохранения была сделана вскоре после обнаружения вируса, что облегчило процесс диагностики и идентификации возбудителя инфекции.
SARS-CoV-2 - одноцепочечный РНК-содержащий вирус, относится к семейству Coronaviridae, группе 2b бета-коронавирусов, который имеет по меньшей мере 70% сходство в генетической последовательности с SARS-CoV, его размер составляет около 100 нм [11].
Все известные коронавирусы (CoV) делятся на четыре рода, включая α-, β-, γ-, и δ-CoV. Представители первых двух родов способны инфицировать млекопитающих, тогда как γ- и δ-CoV инфицируют преимущественно птиц. Ранее было известно о шести коронавирусах, которые способны инфицировать человека. Это HCoV-229E и HCoV-NL63 (оба α-CoV), HCoV-HKU1 и HCoV-OC43 (оба β-CoV), - они вызывают легкие респираторные симптомы, сходные с простудой [12] Два других |3-коронавируса, SARS-CoV и MERS-CoV, приводят к тяжелым и потенциально смертельным инфекциям дыхательных путей человека [13-16]. Несмотря на тщательное изучение коронавирусов после вспышки ТОРС, пока не совсем ясно, почему три из них - SARS-CoV-1, MERS-CoV и SARS-CoV-2 (источник пандемии COVID-19) - вызывают более тяжелые симптомы и приводят к более высокому уровню смертности, в то время как другие известные четыре коронавируса человека гораздо слабее.
Классификация инфекционного агента
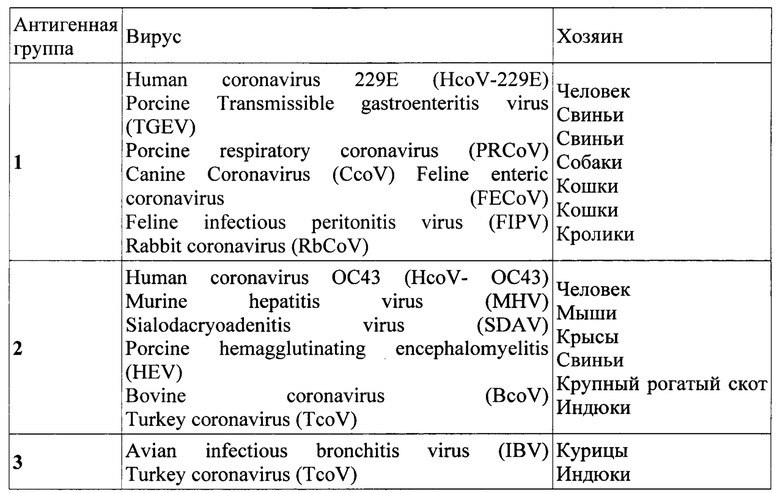
В состав семейства Коронавирусов входят род Коронавирусы и род Торовирусы. Род Коронавирусы объединяет большие, оболочечные, позитивные одноцепочечные РНК-содержащие вирусы, которые вызывают широко распространенные заболевания человека и животных. Его представители могут быть выделены в три серологические подгруппы.
Серотипы и хозяева коронавирусов:
Как и другие респираторные вирусные инфекции, возбудитель COVID-19 в основном распространяется воздушно-капельным путем, через аэрозоли, а также через загрязненные предметы и прямой контакт [12, 16].
Коронавирусы обладают широким тропизмом и могут поражать помимо дыхательных путей печень, почки, кишечник, нервную систему, сердце и глаза [13-15, 17, 18]. Типичная коронавирусная инфекция клинически проявляется гриппоподобным синдромом и/или кишечными расстройствами. При коронавирусной инфекции поражается альвеолярный эпителий. Коронавирусы, обладая способностью к индукции апоптоза, вызывают некроз пораженных тканей, а у пациентов после выздоровления остаются фиброзные рубцы в легких. Коронавирусы, индуцируя слияние клеток, оказывают сильное воздействие на проницаемость клеток, что приводит к нарушению водно-солевого баланса и транспорта белков. Вероятно, в этих условиях развиваются недостаточность сурфактанта (антиателектатический фактор), что приводит к коллапсу альвеол, и легочному дистресс-синдрому. Наиболее опасным свойством коронавирусов является их способность поражать макрофаги. Вероятнее всего, заболевание в особо тяжелой форме развивается на фоне блокирования основных звеньев иммунного ответа [16, 17, 19, 20].
Коронавирусы домашних и лабораторных животных вызывают инфекционный бронхит птиц, гепатит мышей, пневмонии у крыс, гастроэнтериты и энцефаломиелиты у свиней, часто заканчивающихся у животных смертельным исходом, что приводит к большим экономическим потерям [14].
Постановлением Главного санитарного врача РФ вирус SARS-CoV-2, как и некоторые другие представители этого семейства (вирусы SARS-CoV, MERS-CoV), отнесен ко II группе патогенности (патогенные биологические агенты, в отношении которых известны случаи летальных исходов заболевания и/или имеются сведения о высоком эпидемическом потенциале). SARS-CoV-2 включен в перечень заболеваний, представляющих опасность для окружающих [18, 21].
Случаи заболевания COVID-19 зарегистрированы в большинстве стран мира на всех континентах. 30 января ВОЗ признала вспышку нового коронавируса глобальной чрезвычайной ситуацией в области общественного здравоохранения, имеющей международное значение [12-14, 19, 20, 21]. 11 марта 2020 года Президент ВОЗ объявил COVID-19 глобальной пандемией, впервые назвав пандемией инфекционный процесс после пандемии гриппа H1N1 в 2009 году [12, 15, 19, 22].
Самый надежный способ остановить пандемию - массовая вакцинация. Разработка вакцины является критически важной задачей для системы здравоохранения. Именно поэтому работу по созданию вакцины для профилактики коронавирусной инфекции (COVID-19) ведут более 80 компаний по всему миру. По данным ВОЗ на 9 сентября 2020 года на стадии доклинических исследований находились 145 вакцин, 12 из них разрабатывались с использованием пептидов в качестве действующего начала вакцины. Клинические исследования проводились для 35 вакцин, среди них только одна из них была разработана на пептидной платформе [23].
Известен изолированный полипептид вируса SARS и вакцина для профилактики тяжелого острого респираторного синдрома (SARS) на его основе, содержащая инактивированный вирус SARS, убитый вирус SARS, ослабленный вирус SARS, препарат расщепленного вируса SARS или по крайней мере один очищенный антиген вируса SARS (заявка США №20060257852, МПК С07К 14/165, опубл. 16.11.2006 г.) [24]. Полипептид представляет собой полипептид Spike (S), полипептид Env (Е), полипептид мембраны (М), полипептид гемагглютинин-эстеразы (НЕ), полипептид нуклеокапсида (N), полипептид ORF1a, полипептид ORF1ab, протеолитический фрагмент полипептида ORF1a или протеолитический фрагмент полипептида ORF1ab. Антиген представляет собой очищенный инактивированный антиген вируса SARS в форме вирусоподобной частицы (VLP) и содержит адъювант в виде соли алюминия или MF59. Антигены выбраны из S, Е, N и М. Инактивация антигена включает обработку вируса эффективным количеством одного или нескольких из следующих агентов, выбранных из группы, состоящей из детергентов, формальдегида, формалина, β-проприолактона и УФ-излучения.
Наиболее близким аналогом (прототипом композиции) является вакцинная композиция для стимулирования иммунного ответа в отношении MERS-CoV (международная заявка №WO2015042373, МПК А61К 39/215, опубл. 26.03.2015 г.). Вакцинная композиция содержит (i) эффективное количество наночастиц MERS-CoV, где наночастица содержит по меньшей мере один тример полипептида Spike, и (ii) адъювант на основе сапонина, где адъювант на основе сапонина состоит из Matrix M1. Наночастица содержит по меньшей мере от приблизительно пяти тримеров до приблизительно 30 тримеров полипептида Spike. Концентрация наночастицы составляет по меньшей мере от приблизительно 20 мкг/мл до приблизительно 60 мкг/мл. Авторами была показана иммуногенность вакцинных композиций на основе белка S и наличие вируснейтрализующих антител в сыворотках вакцинированных животных. Полноразмерный белок S представляет широкий набор высокоиммуногенных эпитопов, индуцирующий формирование широкого спектра антител.
Однако, в исследованиях выше указанных кандидатных вакцин против коронавирусов (SARS и MERS) был отмечен риск развития антителозависимого усиления (ADE) инфекции [26, 27].
Следовательно, разработка вакцины на основе синтетических пептидов, нацеленных на белок S SARS-CoV-2, может дать более безопасную и эффективную вакцину. Также для аналогов и прототипа не показана способность индуцировать иммунный ответ, способный оказывать защитное действия против нового вируса SARS-CoV-2.
Наиболее близким аналогом (прототипом белка-носителя синтетических пептидов, используемых в вакцинах) являются такие белки-носители, как БСА (бычий сывороточный альбумин), KLH (keyhole limpet hemocyanin) - гемоцианин, овальбумин (альбумин яичного белка) или другие рекомбинантные белки (патент РФ №2635998, МПК А61Р 31/12, опубл. 17.11. 2017 г.).
Однако такие белки-носители являются балластными белками и не способствуют стимулированию специфического клеточного иммунного ответа.
В заявляемом техническом решении химерный рекомбинантный белок-носитель содержит Т-клеточные эпитопы SARS-CoV-2, вследствие чего он не только повышает стабильность пептидных иммуногенов и участвует в формировании выраженного иммунного ответа, но и стимулирует специфический клеточный иммунный ответ.
Техническим результатом изобретения является получение такого химерного рекомбинантного белка-носителя MBP-6xHis-N_nCoV-2019 и вакцинной композиции с использованием пептидных иммуногенов и белка-носителя, которые несут минимально необходимые антигенные детерминанты для формирования специфического иммунного ответа у кроликов, хорьков и хомяков и индуцируют протективный иммунитет против Covid-19.
Указанный технический результат достигается тем, что получен первый пептидный иммуноген, используемый в качестве компонента вакцины против коронавирусной инфекции COVID-19, характеризующийся аминокислотной последовательностью CRLFRKSNLKPFERDISTEIYQAGS (SEQ ID NO: 1), содержащей антигенные Т и В-клеточные эпитопы белка S коронавируса SARS Cov-2, которые способны индуцировать образование антител, обладающих антигенспецифической, вируснейтрализующей и протективной активностями.
Указанный технический результат достигается тем, что получен второй пептидный иммуноген, используемый в качестве компонента вакцины против коронавирусной инфекции COVID-19, характеризующийся аминокислотной последовательностью CKEIDRLNEVAKNLNESLIDLQE (SEQ ID NO: 2), содержащей антигенные Т и В-клеточные эпитопы белка S коронавируса SARS Cov-2, которые способны индуцировать образование антител, обладающих антигенспецифической, вируснейтрализующей и протективной активностями.
Указанный технический результат достигается тем, что получен третий пептидный иммуноген, используемый в качестве компонента вакцины против коронавирусной инфекции COVID-19, характеризующийся аминокислотной последовательностью CKNLNESLIDLQELGKYEQYIK (SEQ ID NO: 3), содержащей антигенные Т и В-клеточные эпитопы белка S коронавируса SARS Cov-2, которые способны индуцировать образование антител, обладающих антигенспецифической, вируснейтрализующей и протективной активностями.
Указанный технический результат достигается тем, что получен химерный рекомбинантный белок MBP-6xHis-N_nCoV-2019, включающий N белок коронавируса SARS Cov-2, используемый в качестве белка-носителя в вакцинной композиции против коронавирусной инфекции COVID-19 и характеризующийся аминокислотной последовательностью:
MKIEEGKLVIWINGDKGYNGLAEVGKKFEKDTGIKVTVEHPDKLEEKFPQVAATGDGPDIIFWAHDRFGGYAQSGLLAEITPDKAFQDKLYPFTWDAVRYNGKLIAYPIAVEALSLIYNKDLLPNPPKTWEEIPALDKELKAKGKSALMFNLQEPYFTWPLIAADGGYAFKYENGKYDIKDVGVDNAGAKAGLTFLVDLIKNKHMNADTDYSIAEAAFNKGETAMTINGPWAWSNIDTSKVNYGVTVLPTFKGQPSKPFVGVLSAGINAASPNKELAKEFLENYLLTDEGLEAVNKDKPLGAVALKSYEEELAKDPRIAATMENAQKGEIMPNIPQMSAFWYAVRTAVINAASGRQTVDEALKDAQTNSSSNNNNNNNNNNLGDNGPQNQRNAPRITFGGPSDSTGSNQNGERSGARSKQRRPQGLPNNTASWFTALTQHGKEDLKFPRGQGVPINTNSSPDDQIGYYRRATRRIRGGDGKMKDLSPRWYFYYLGTGPEAGLPYGANKDGIIWVATEGALNTPKDHIGTRNPANNAAIVLQLPQGTTLPKGFYAEGSRGGSQASSRSSSRSRNSSRNSTPGSSRGTSPARMAGNGGDAALALLLLDRLNQLESKMSGKGQQQQGQTVTKKSAAEASKKPRQKRTATKAYNVTQAFGRRGPEQTQGNFGDQELIRQGTDYKHWPQIAQFAPSASAFFGMSRIGMEVTPSGTWLTYTGAIKLDDKDPNFKDQVILLNKHIDAYKTFPPTEPKKDKKKKADETQALPQRQKKQQTVTLLPAADLDDLSKQLQQSMSSADSTQA (SEQ ID NO: 4).
Указанный технический результат достигается также тем, что получена вакцинная композиция против коронавирусной инфекции COVID-19, характеризующаяся тем, что содержит пептидные иммуногены по п.п. 1, 2 и 3, имеющие аминокислотные последовательности (SEQ ID NO: 1), (SEQ ID NO: 2) и (SEQ ID NO: 3) соответственно и ковалентно связанные в виде конъюгатов с белком-носителем как в смеси, так и по отдельности, причем смесь вышеуказанных конъюгатов пептидных иммуногенов и белка-носителя сорбирована на фармацевтически приемлемый адъювант.
Конъюгаты пептидных иммуногенов с белком-носителем взяты в равных соотношениях между собой и белком - носителем. В качестве белка-носителя вакцинная композиция содержит химерный рекомбинантный белок-носитель по п. 4, характеризующийся аминокислотной последовательностью (SEQ ID NO: 4). В качестве адъюванта вакцинная композиция содержит гидроокись алюминия в количестве 0,2-2,0 мг/мл.
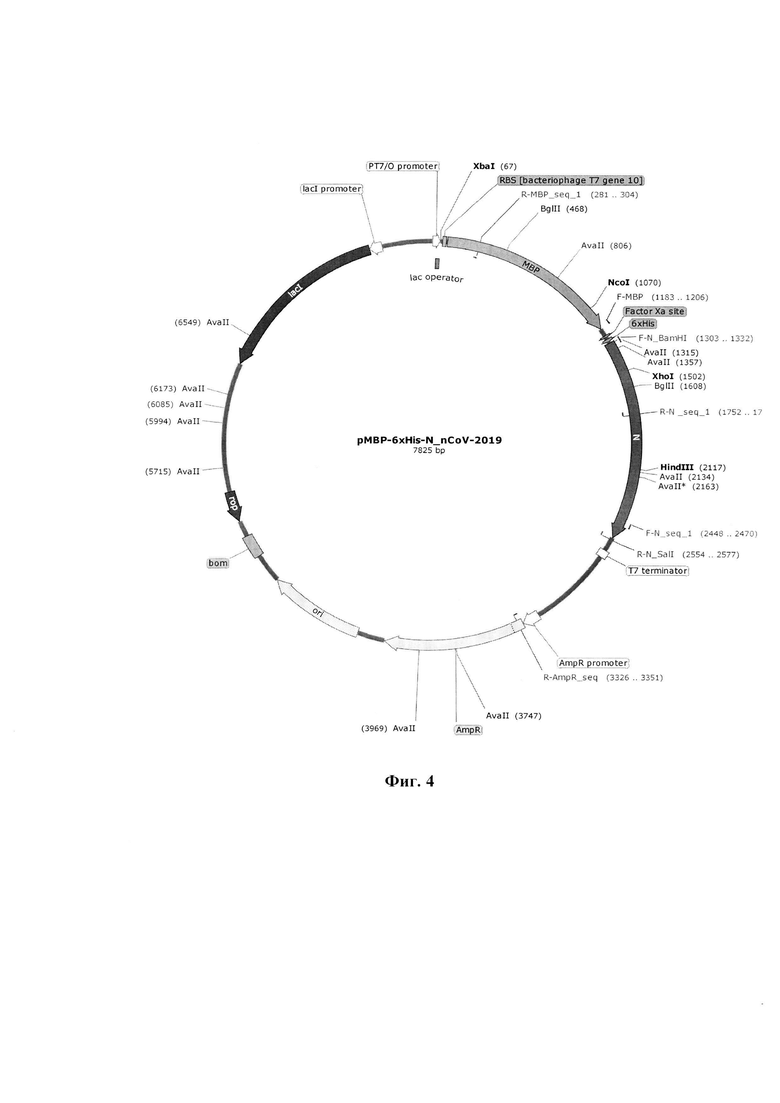
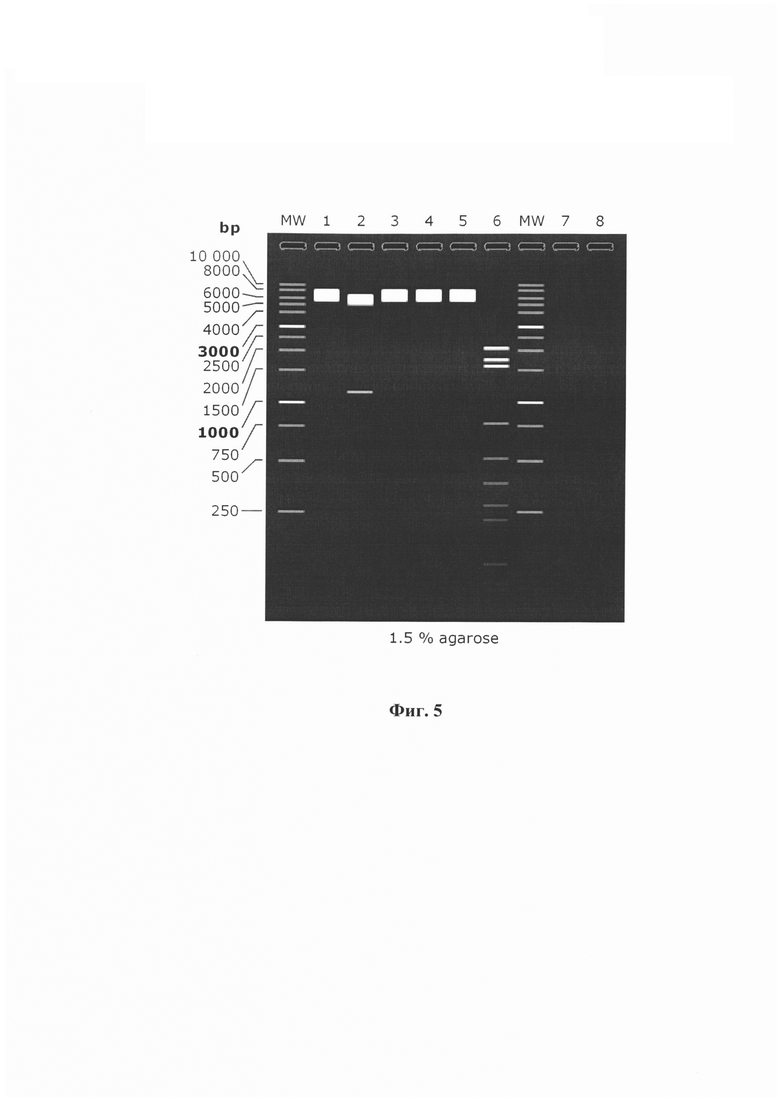
Изобретение поясняется следующими графическими материалами. На фиг. 1 представлены аминокислотные последовательности трех пептидных иммуногенов. На фиг. 2 приведена аминокислотная последовательность химерного белка «MBP-6xHis-N_nCoV-2019». На фиг. 3 представлена нуклеотидная последовательность гена химерного белка «MBP-6xHis-N_nCoV-2019». На фиг. 4 изображена генетическая и физическая карта рекомбинантной плазмидной ДНК «pMBP-6xHis-N_nCoV-2019». На фиг. 5 представлена электрофореграмма рестрикционного анализа рекомбинантной плазмидной ДНК «pMBP-6xHis-N_nCoV-2019» в 1.5% агарозном геле.
Пример 1. Получение и структура пептидных иммуногенов.
При разработке вакцины, используя литературные данные о Т- и В-клеточных эпитопах белка S нового коронавируса SARS Cov-2, были спроектированы структуры 3 пептидов - аналогов иммуногенных Т и В-клеточных эпитопов белка S нового коронавируса SARS Cov-2, которые затем были синтезированы (фиг. 1). Последовательность этих синтетических пептидов, моделирующих функционально значимые участки белка S нового коронавируса SARS Cov-2, были спроектированы таким образом, чтобы исключить присутствие элементов, ответственных за развитие иммунопатологического состояния, но сохранить способность индуцировать образование защитных антител и обеспечить защиту организма от развития COVID-19. Синтетические пептиды имеют размер от 22 до 25 аминокислотных остатков и аналогичны Т и В-клеточным эпитопам белка S нового коронавируса SARS Cov-2.
Синтез спроектированных аминокислотных последовательностей проводится с использованием стандартного оборудования и методик твердофазного пептидного синтеза и может быть проведен с использованием любых других методик синтеза аминокислотных последовательностей, например, таких как жидкофазный пептидный синтез, синтез с использованием генетически модифицированных микроорганизмов (технологии получения рекомбинантных белков), фрагментирование нативного белка с последующим выделением соответствующих фрагментов.
Ниже приведены структуры синтезированных пептидов.
Первый пептид (п. 1): CRLFRKSNLKPFERDISTEIYQAGS (0454-0477), (SEQ ID NO: 1);
Второй пептид (п. 2): CKEIDRLNEVAKNLNESLIDLQE (1179-1200), (SEQ ID NO: 2);
Третий пептид (п. 3): CKNLNESLIDLQELGKYEQYIK (1189-1209), (SEQ ID NO: 3)
Пример 2. Получение химерного рекомбинантного белка-носителя.
Белок-носитель является продуктом экспрессии гена химерного белка «MBP-6xHis-N_nCoV-2019» в прокариотической системе. Акцепторный плазмидный вектор pMBP-6xHis получен путем направленного клонирования в вектор рТ7 фрагмента гена MBP E.coli, амплифицированного из генома E.coli с использованием специфических олигонуклеотидных праймеров. Клонирование проведено по сайтам узнавания эндонуклеаз рестрикции NdeI-BamHI, где за счет обратного праймера в открытую рамку считывания МБР добавлена нуклеотидная последовательность, кодирующая аминокислотный линкер, сайт протеолитического расщепления фактора Ха и 6xHis-MeTKa, необходимая для проведения металл-хелатной аффинной хроматографии. Вектор рТ7 получен посредством направленного клонирования химически синтезированного фрагмента ДНК, кодирующего ген LacI, необходимого для контроля экспрессии за счет включения лактозного оператора LacO в транскрипционную кассету целевого гена, гена rop необходимого для контроля копийности плазмидной ДНК в бактериальной клетке, а также структурных элементов, обеспечивающих экспрессию целевого гена: модифицированного промотора бактериофага Т7 РТ7/O (Т. Giordano et al., 1989 г.), сайт связывания рибосом гена 10 бактериофага Т7 (Olins and Rangwala, 1989 г.) и терминатора транскрипции ДНК-зависимой РНК-полимеразы бактериофага Т7. Плазмидный вектор кодирует ген устойчивости к β-лактамным антибиотикам (β-лактамаза), а также ориджин репликации бактериофага F1.
Экспрессирующий вектор pMBP-6xHis-N_nCoV-2019 получен посредством направленного клонирования ампликона гена N_nCoV-2019 по сайтам узнавания эндонуклеаз рестрикции BamHI и SalI. Открытая рамка считывания гена химерного белка «MBP-6xHis-N_nCoV-2019» представлена лидирующей последовательностью мальтоза-связывающего белка MBP E.coli, аминокислотного линкера, сайта протеолитического расщепления фактора Ха, 6xHis-MeTKH для проведения металл-хелатной аффинной хроматографии, и последовательностью гена N коронавируса SARS-CoV-2 (nCoV-2019). Нуклеотидная последовательность гена химерного белка «MBP-6xHis-N_nCoV-2019» представлена на фиг. 3, а на фиг. 2 ааминокислотная последовательность химерного белка «MBP-6xHis-N_nCoV-2019». Нуклеотидная вставка в вектор pMBP-6xHis осуществлена таким образом, что ген «MBP-6xHis-N_nCoV-2019» находится под контролем модифицированного промотора бактериофага Т7 РТ7/O, старт-кодон (ATG) расположен на оптимальном расстоянии от сайта связывания рибосом гена 10 бактериофага Т7. Дополнительный лактозный оператор (LacO) позволяет контролировать уровень экспрессии целевого гена при коэкспрессии LacI. Для идентификации клонируемой последовательности используется метод определения первичной последовательности ДНК на автоматическом секвенаторе. Клонируемый фрагмент ДНК фланкирован сайтами рестрикции - BamHI-SalI. Клонируемый фрагмент ДНК содержит открытую рамку считывания гена N коронавируса SARS-CoV-2 (nCoV-2019). Положение клонируемого гена внутри кассеты, а также положение регуляторных элементов отображено на фиг. 4 - физической и генетической карте рекомбинантной плазмидной ДНК «pMBP-6xHis-N_nCoV-2019». Способ введения конструкции в прокариотической системе - трансформация клеток Escherichia coli плазмидой. Селективный маркер - ген устойчивости к β-лактамным антибиотикам (β-лактамаза).
Основные генетические элементы, содержащиеся в структуре плазмидной ДНК:
РТ7/O promoter - модифицированный промотор бактериофага Т7 РТ7/O (21-64 п. н.)
Lac operator - лактозный оператор (40-64 п. н.)
RBS [bacteriophage Т7 gene 10] - сайта связывания рибосом гена 10 бактериофага Т7 (79-101 п. н.)
МВР - мальтоза-связывающий белок MBP Е. coli (109-1209 п. н.)
Factor Ха site - сайт протеолитического расщепления фактора Ха (1258-1269 п. н.)
6xHis - 6-гистидиновая аффинная метка (1282-1299 п. н.) N - последовательность гена N коронавируса SARS-CoV-2 (nCoV-2019) (1309-2562 п. н.)
Т7 terminator - терминатор транскрипции ДНК-зависимой РНК-полимеразы бактериофага Т7 (2653-2700 п. н.)
Ori - ориджин репликации pBR322/pUC (4355-4943 п. н.)
AmpR- ген β-лактамазы (устойчивость к ампициллину) (3324-4184 п. н.)
LacI - ген репрессора LacI (6376-7455 п. н.)
Карта (электрофореграмма) рестрикционного анализа рекомбинантной плазмидной ДНК «pMBP-6xHis-N_nCoV-2019» в 1.5% агарозном геле с использованием эндонуклеаз рестрикции XbaI, BglII, XhoI, HindIII, NcoI, AvaII представлена на фиг. 5.
Фрагменты ДНК, полученные после гидролиза рекомбинантной плазмиды «pMBP-6xHis-N_nCoV-2019» эндонуклеазами рестрикции XbaI, BglII, XhoI, HindIII, NcoI, AvaII (1-6 трек, соответственно).
Ниже представлены расчетные длины фрагментов ДНК, образующихся после гидролиза соответствующими эндонуклеазами рестрикции:
1: pMBP-6xHis-N_nCoV-2019
XbaI
1.7825 bp
2: pMBP-6xHis-N_nCoV-2019
BglII
1. 6685 bp
2. 1140 bp
3: pMBP-6xHis-N_nCoV-2019
XhoI
1. 7825 bp
4: pMBP-6xHis-N_nCoV-2019
HindIII
1.7825 bp
5: pMBP-6xHis-N_nCoV-2019
NcoI
1. 7825 bp
6: pMBP-6xHis-N_nCoV-2019
AvaII

Далее рекомбинантный химерный белок-носитель MBP-6xHis-N_nCoV-2019, нарабатывают в прокариотической системе, биомассу осаждают центрифугированием, ресуспендируют в буфере 50 мМ NaH2PO4, 300 мМ NaCl, 10 мМ имидазол, 0.5 мг/мл лизоцим, рН 8.0 и охлаждают до 2-5°С. Биомассу, полученную с 10 литров питательной среды ресуспендируют в 300 мл буфера. Затем клетки разрушают в ультразвуковом дезинтеграторе до полного осветления суспензии при температуре не выше 40°С. Полученный лизат охлаждают до 2-5°С, центрифугируют при 12000 об/мин в течение 20 минут. К супернатанту добавляют насыщенный раствор сульфата аммония в соотношении 1:1 по объему и перемешивают взбалтыванием, после чего охлаждают при 4-8°С в течении 5-6 часов. Осадок отделяют центрифугированием при 12000 об/мин в течении 20 минут(температура 10°С), который затем растворяют в буфере: 50 мМ NaH2PO4, 300 мМ NaCl, 10 мМ имидазол, рН 8.0 и охлаждают при 4-8°С в течение 1 часа. Объем буфера рассчитывается как половина объема лизата. Полученный раствор центрифугируют при 12000 об/мин в течение 20 минут при температуре 10°С. Супернатант хранят при температуре 4-8°С в течение 5 дней и используют для аффинной хроматографии.
Для аффинной хроматографии используют сорбент Ni-NTA-Superflow (QIAGEN) или его аналоги. Количество сорбента берется из расчета 100 мл на 1 грамм ожидаемого количества целевого белка. Используется колонка среднего давления с высотой столба не выше 30 см. Сорбент дегазируется, наносится в колонку и уравновешивается буфером: 50 мМ NaH2PO4, 300 мМ NaCl, 10 мМ имидазол, рН 8.0. Осветленный центрифугированием супернатант лизата клеток пропускают через колонку со скоростью 2,5-4 мл/мин. Колонку промывают 5-кратным объемом буфера: 50 мМ NaH2PO4, 300 мМ NaCl, 20 мМ имидазол, рН 8.0, затем 40-кратным объемом буфера: 50 мМ NaH2PO4, 300 мМ NaCl, 30 мМ имидазол, рН 8.0. Элюцию целевого белка проводят буфером: 50 мМ NaH2PO4, 300 мМ NaCl, 300 мМ имидазол, рН 8.0. Элюцию контролируют по оптической плотности на длине волны 280 нм. Собирают одну фракцию первого пика, которую можно хранить до 5 дней при температуре 4-8°С. Полученная фракция содержит целевой продукт - химерный рекомбинантный белок-носитель MBP-6xHis-N_nCoV-2019. Расчетная молекулярная масса химерного рекомбинантного белка-носителя MBP-6xHis-N_nCoV-2019 составляет 89,2 кДа.
Поскольку химерный белок-носитель содержит Т-клеточные эпитопы SARS-CoV-2, то он не только повышает стабильность пептидных иммуногенов и участвует в формировании выраженного иммунного ответа, но и стимулирует специфический клеточный иммунный ответ.
Пример 3. Получение конъюгатов пептидных иммуногенов и белка-носителя, а также вакцинной композиции.
После синтеза пептидных иммуногенов осуществляют их конъюгирование с белком-носителем для повышения стабильности и формирования выраженного иммунного ответа.
В качестве белка-носителя в вариантах вакцины был использован рекомбинантный химерный белок, содержащий аминокислотную последовательность нуклеопротеина N нового коронавируса SARS-CoV-2, полученный по примеру 2. Кроме того, в качестве белков-носителей могут быть использованы такие белки как БСА (бычий сывороточный альбумин), KLH (keyhole limpet hemocyanin) - гемоцианин, овальбумин (альбумин яичного белка) или другие рекомбинантные белки.
Ковалентная связь между белком-носителем и пептидным иммуногеном может быть создана с использованием различных конъюгирующих агентов, например, таких как ГА (глутаровый альдегид), SMCC (Succinimidyl-4-(N-maleimidomethyl) cyclohexane-1-carboxylate), Sulfo-SMCC (Sulfosuccinimidyl-4-(N-maleimidomethyl) cyclohexane-1-carboxylate), EDC (l-Ethyl-3-(3-dimethylaminopropyl) carbodiimide), и многие другие.
Конъюгирование пептида с белком-носителем с помощью конъюгирующего агента Sulfo-SMCC проводят следующим образом: 20 мг белка-носителя растворяют в 2 мл дистиллированной воды. Непосредственно перед использованием готовят раствор Sulfo-SMCC с концентрацией 5 мг/мл. Добавляют 2 мл раствора Sulfo-SMCC. Инкубируют при комнатной температуре в течение 60 минут, или при температуре 37°С в течение 30 минут, периодически осторожно перемешивают. Для удаления избытка Sulfo-SMCC колонку 50 мл со смолой Sepharose CL4B уравновешивают 0,01 М фосфатно-солевым буферным раствором. Наносят на колонку активированный белок-носитель и собирают первый пик, при этом используют для детекции длину волны 280 нм.
Далее 20 мг пептида растворяют в 5 мл 0,01 М фосфатно-солевом буферном растворе. Немедленно смешивают пептид и активированный белок-носитель и инкубируют 2 часа при комнатной температуре. Для удаления избытка пептида колонку 50 мл с сорбентом Sepharose CL4B уравновешивают 0,01 М фосфатно-солевым буферным раствором. Наносят на колонку конъюгат пептида с белком-носителем и собирают первый пик, при этом используют для детекции длину волны 280 нм.
Для увеличения иммунного ответа используют адъювант. Существует множество известных адъювантов, включая адъювант Фрейнда (CFA or FCA), суспензии гидроксида алюминия, адъювант MF59 и др.
Полученные конъюгаты пептида и белка-носителя сорбируют на гидроксиде алюминия для получения готовой лекарственной формы в конечной концентрации (100-1000) мкг пептида в 1,0 мл препарата.
В качестве примера приведен следующий состав вакцинной композиции.
Вакцинная композиция: смесь пептидных иммуногенов, имеющих аминокислотные последовательности (SEQ ID NO: 1), (SEQ ID NO: 2) и (SEQ ID NO: 3) соответственно и ковалентно связанных в виде конъюгатов с химерным рекомбинантным белком-носителем MBP-6xHis-N_nCoV-2019, взятых в равных соотношениях и сорбированных на фармацевтически приемлемый адъювант гидроокись алюминия в количестве 1,0 мг/мл.
Пример 4. Исследование иммуногенности пептидных иммуногенов на кроликах.
Для получения иммунных сывороток используют лабораторных животных - кроликов породы Шиншилла с массой тела 2000-3000 г. Предварительно перед иммунизацией у кроликов берут пробу крови в объеме 1,0 мл из краевой вены уха и выделяют сыворотку для дальнейшего иммуноферментного анализа. Температура хранения сыворотки от минус 15°С до минус 25°С.
Каждый из 3 пептидов конъюгируют с белком-носителем гемоцианином и в смеси с неполным адьювантом Фрейнда двукратно с интервалом 7 дней подкожно вводят кроликам. Через 7 суток после второй иммунизации у кроликов берут пробу крови в объеме 1,0 мл из краевой вены уха. Из крови выделяют сыворотку для проведения иммуноферментного анализа. Сыворотки крови кроликов хранят при температуре от минус 15°С до минус 25°С.
Результаты определения титров специфических антител в сыворотках иммунных кроликов к соответсвующим пептидам и к рекомбинантному белку S представлены в Таблице 1.
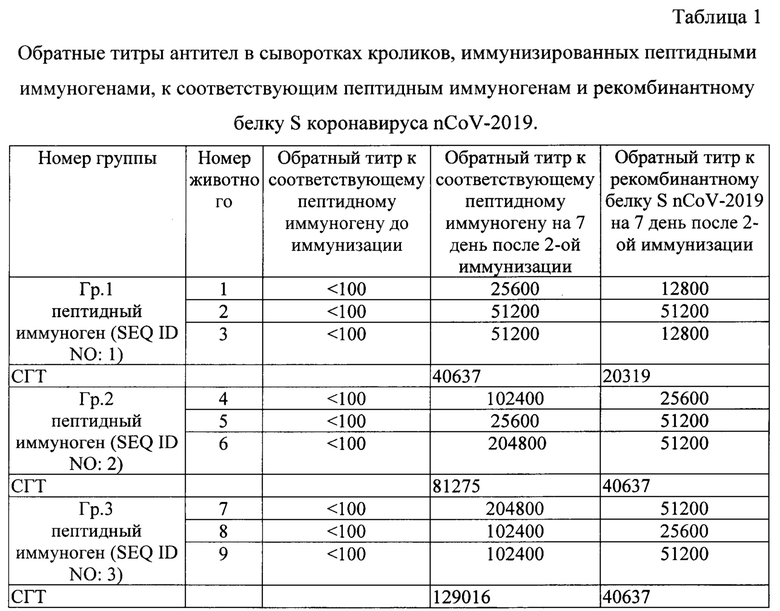
Примечание. СГТ - среднегеометрический титр по группе животных. Иммуноферментный анализ для определения титра антител к соответствующим антигенам проводят следующим образом.
В 96-ти луночный планшет вносят сорбционный буфер по 150 мкл в лунку. В качестве сорбционного буфера использовать 0,05 М карбонат-бикарбонатный буфер (рН 9,5-9,7) с добавлением соответствующего антигена с концентрацией 1 мкг/мл. Инкубируют 16 часов при комнатной температуре.
Перед нанесением испытуемых образцов сыворотки промывают иммуносорбент 0,01 М ФСБ-Т (рН 7,3-7,5). Вносят в планшет по 100 мкл разводящего буферного раствора для образца и в ряд «А» вносят образцы сывороток по 100 мкл и титруют с шагом 2. Инкубируют в термошейкере при температуре (37±2)°С, 700 об/мин в течение 45 минут.
По окончании инкубации содержимое лунок удаляют с помощью вошера и промывают 0,01 М ФСБ-Т. Вносят во все лунки по 100 мкл антивидового конъюгата и инкубируют в термошейкере при температуре (37±2)°С, 700 об/мин в течение 30 минут. По окончании инкубации содержимое лунок удаляют с помощью вошера и промывают 0,01 М ФСБ-Т. Вносят во все лунки по 100 мкл хромогенного субстрата (ТМБ) для окрашивания образовавшихся специфических АГ-АТ комплексов.
Инкубируют в темноте при комнатной температуре (24±5)°С в течение 20 минут. Вносят во все лунки по 50 мкл СТОП-реагента для прекращения реакции. Результаты ИФА регистрируют с помощью микропланшетного ридера, измеряя оптическую плотность (ОП) на длине волны 450 нм.
Титром антител считается максимальное разведение исследуемой сыворотки, при котором оптическая плотность раствора превышает ОПкрит.
Таким образом, двукратная иммунизация кроликов пептидными иммуногенами индуцирует у кроликов выработку антител к пептидным иммуногенам в диапазоне СГТ от 1:40637 до 1:129016 и к рекомбинантному белку S коронавируса SARS-CoV-2 (nCoV-2019) в диапазоне СГТ от 1:20319 до 1:40637.
Пример 5. Исследование иммуногенности пептидных иммуногенов и вакцинной композиции на мышах.
Для получения иммунных сывороток используют лабораторных животных - мышей ICR с массой тела 14-16 г. Предварительно перед иммунизацией у мышей берут пробу крови в объеме 100 мкл из ретроорбитального синуса и выделяют сыворотку для дальнейшего иммуноферментного анализа. Температура хранения сыворотки от минус 15°С до минус 25°С.
Каждый из 3 пептидов, конъюгируют с химерным рекомбинантным белком-носителем MBP-6xHis-N_nCoV-2019 по п. 4. Готовят вакцинную композицию, смешивая пептидные иммуногены в равных количествах в соответствии с п. 5 формулы изобретения. Пептидные иммуногены и вакцинную композицию сорбируют на адьювант гидроокись алюминия. Вакцинируют мышей подкожно двукратно с интервалом 14 дней. Через 14 дней после второй вакцинации из ретроорбитального синуса отбирают кровь в объеме 100 мкл. Из крови выделяют сыворотку для проведения иммуноферментного анализа. Сыворотки крови мышей хранят при температуре от минус 15°С до минус 25°С.
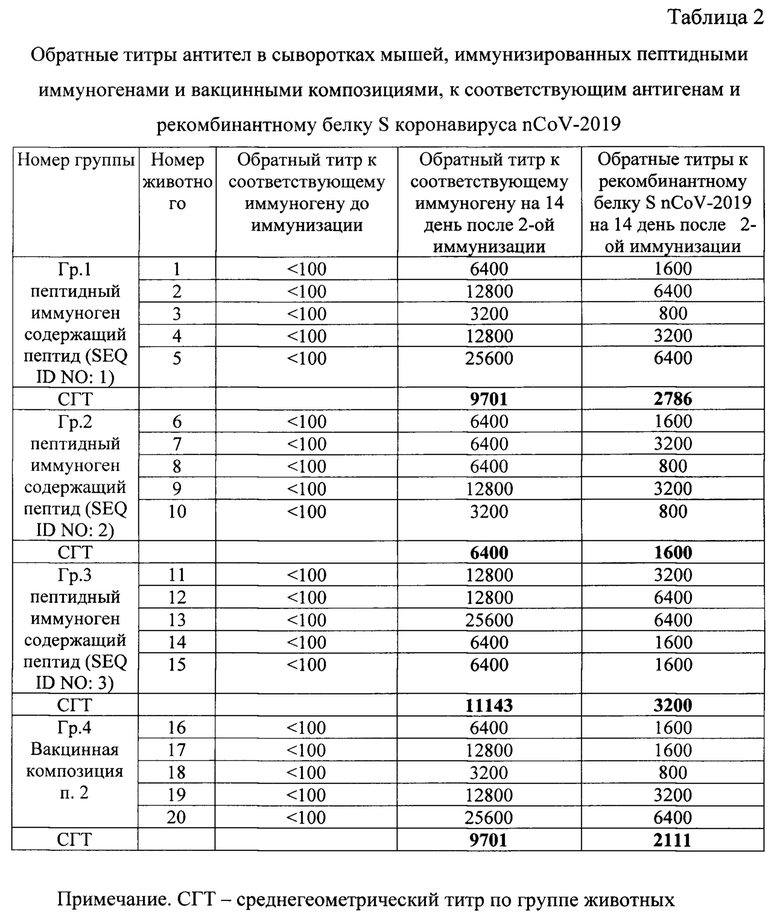
Результаты определения титров специфических антител в сыворотках иммунных мышей к соответствующим пептидным иммуногенам, вакцинной композиции и к рекомбинантному белку S коронавируса представлены в Таблице 2.
Иммуноферментный анализ для определения титра к соответсвующим антигенам проводят аналогично тому, как описано в примере 4.
Таким образом, двукратная иммунизация мышей пептидными иммуногенами и их вакцинными композициями индуцировало у мышей выработку антител к пептидным иммуногенам в диапазоне СГТ от 1:6400 до 1:11143 и к рекомбинантному белку S коронавируса SARS-CoV-2 (nCoV-2019) в диапазоне СГТ от 1:1600 до 1:2786.
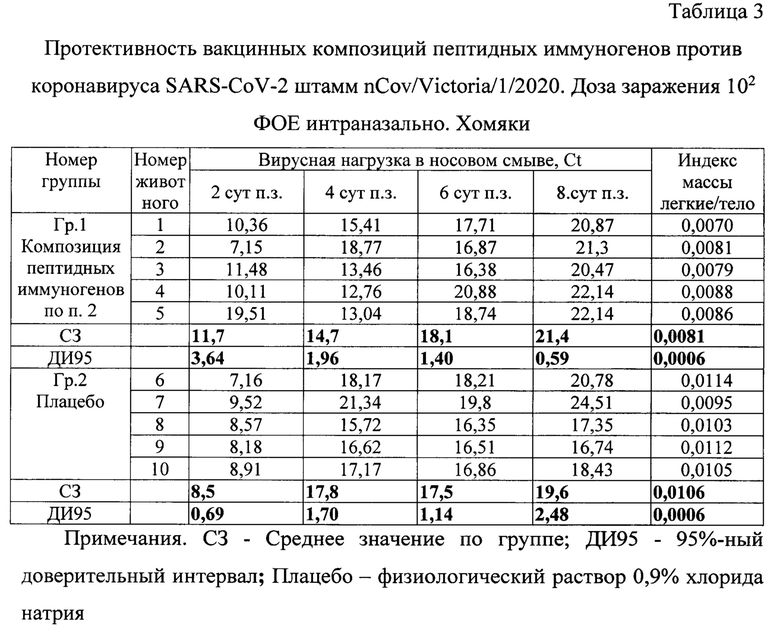
Пример 6. Протективность вакцинной композиции на основе пептидных иммуногенов на хомяках.
Исследования протективности вакцинных композиций пептидных иммуногенов проводили после 2-кратной внутримышечной иммунизации хомяков с интервалом 14 суток дозой 200,0 мкг. На 28-е сутки после первой вакцинации хомяки были интраназально заражены новым коронавирусом SARS-CoV-2 штамм nCov/Victoria/1/2020 в дозе 102 ФОЕ. На 2-е, 4-е, 6-е и 8-е сутки после заражения у животных брались носовые смывы, в ОТ-ПЦР определялась вирусная нагрузка. На 8-е сутки животных подвергали эвтаназии, извлекали легкие и вычисляли отношение (индекс) массы легких и массы тела. В таблице 3 приведены результаты измерения.
При гистологическом исследовании легких хомяков на 8-е сутки после заражения тяжелые патологические изменения наблюдались в плацебо группе животных, где обнаруживалась полная потеря эпителиальной выстилки мелких бронхов и бронхиол, очаги некротизации, плазматическое пропитывание стенок сосудов, значительные по площади зоны ателектаза. Гораздо меньшая степень проявления инфекции наблюдалась у вакцинированных животных, где явления отека и воспалительно-клеточной инфильтрации были локальными, дистрофические изменения эпителия мелких бронхов и кровеносных сосудов микроциркуляторного русла отмечались на относительно небольших участках легочной паренхимы
Таким образом, двукратное с интервалом 14 суток введение вакцинных композиций пептидных иммуногенов индуцировало у хомяков выработку антител к антигенам вакцины и цельновирионному антигену коронавируса, статистически значимо снижает индекс массы легкие/тело и обеспечивает защиту животных от развития пневмонии после интраназального заражения коронавирусом SARS-CoV-2.
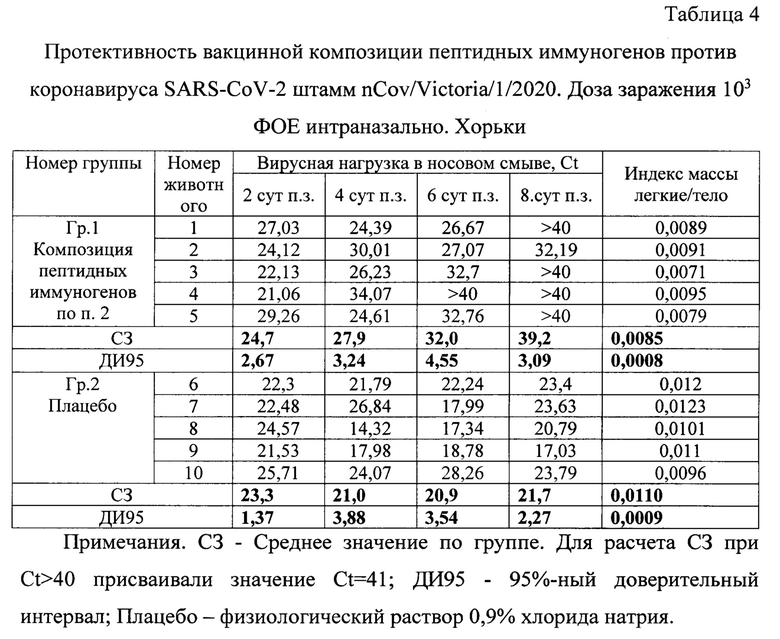
Пример 7. Протективность вакцинной композиции на основе пептидных иммуногенов на хорьках.
Исследования протективности комбинаций пептидных иммуногенов проводили после 2-кратной внутримышечной иммунизации хорьков с интервалом 14 суток дозой 200,0 мкг .На 28-е сутки после первой вакцинации хорьки были интраназально заражены новым коронавирусом SARS-CoV-2 штамм nCov/Victoria/1/2020 в дозе 103 ФОБ. На 2-е, 4-е, 6-е и 8-е сутки после заражения у животных брались носовые смывы, в ОТ-ПЦР определялась вирусная нагрузка. На 8-е сутки животных подвергали эвтаназии, извлекали легкие и вычисляли отношение (индекс) массы легких и массы тела. В таблице 4 приведены результаты измерения
Таким образом, при изучении протективных свойств вакцинной композиции на основе пептидных иммуногенов на хорьках было установлено снижение более чем в 100 раз вирусной нагрузки в группах вакцинированных животных по сравнению с группой плацебо на 6-е сутки после заражения. Вирус элиминировался из верхних дыхательных путей на 4 сут. раньше, чем в плацебо группе. Статистически значимо снижает индекс массы легкие/тело, что указывает на защиту легких от тяжелой воспалительной реакции.
Источники научно-технической и патентной информации
1. Tyrrell D.A.J., Bynoe М.А. Cultivation of novel type of commoncold virus in organ culture. Br. Med. J. - 1965. - №1. - P. 1467-1470.
2. Вирусология под редакцией Филдса Б. и Найпа Д. М: Мир, 1989, том 3.
3. Tyrrell D.A.J., Almeida I.D. Direct electron microscopy of organ cultures for the detection and characterization of viruses // Arch. Gesamte Virus forsch. -1967.-№22.-P. 417-425.
4. Siddell S.G., Wege H., ter Meulen V. The biology of coronaviruses // J Gen. Virol. - 1983. - №63. - P. 761-776.
5. Sturman L.S., Holmes K.V. The molecular biology of coronaviruses // Adv. Virus Res. №28. - P.35-112.
6. Coronavirus never before seen in humans is the cause SARS. 2003. Сайт ВОЗ. http://www.who.int/mediacentre/releases/2003/pr31/en/print.html.
7. Enserink M. SARS: chronology of the epidemic. (англ.) // Science (New York, N.Y.). - 2013. - 15 March (vol. 339, no. 6125). - P. 1266-1271. -doi:10.1126/science.339.6125.1266.
8. Huang C, Wang Y., Li X. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China // Lancet. - 2020. - Feb 15;395(10223):497-506. doi: 10.1016/S0140-6736(20)30183-5.
9. Peiris J.S.M, Guan Y., Yuen K.Y. Severe acute respiratory syndrome // Nat Med. - 2004;10 (suppl 12):S88-S97. DOI: 10,1038 / nm1143.
10. CDC, 2019 Novel Coronavirus, Wuhan, China. CDC. Available at https://www.cdc.gov/coronavirus/2019-ncov/abaut/index.html.; Accessed: January 27, 2020.
11. Hui D.S.I., Azhar E., Madani T.A., Ntoumi F., Kock R., Dar O., et al. The Continuing 2019-nCoV epidemic threat of novel coronaviruses to global health-The latest 2019 novel coronavirus outbreak in Wuhan, China // Int. J. Infect. Dis. -2020 Jan 14.91:264-266.
12. Larson H.E., Reed S.E., Tyrrell D.A.J. Isolation of rhinoviruses and coronaviruses from 38 coldsin adults // J. Med. Virol. - 1980. - №5. - P. 221 - 229.
13. Yin Y., Wunderink R.G. MERS, SARS and other coronaviruses as causes ofpneumonia//Respirology. -2018 Feb; 23(2):130-137. doi: 10.1111/resp.13196. Epub 2017 Oct 20.
14. Wege H., Siddell S., ter Meulen V. The biology and pathogenesis of coronaviruses // Curr. Top.Microbiol. Immunol. - 1982. - 99. - P, 165-200.
15. Risri H., Hovi T. Coronavirus infections of man associated with diseases other than the common cold // J. Med. Virol. - 1980. - №6. - P. 385-399.
16. Информационный Экспресс-Бюллетень. Коронавирус SARS-возбудитель атипичной пневмонии (временные методические рекомендации). - СПб-Москва, 2003.
17. Грипп и другие респираторные вирусные инфекции: эпидемиология, профилактика, диагностика и терапия // Под редакцией О. И. Киселева, И. Г. Маринича, А. А. Сомининой). - СПб.: «Боргес», 2003.
18. Постановление Правительства РФ от 01.12.2004 №715.
19. World Health Organization. WHO Director-General's opening remarks at the media briefing on COVID-19 - 11 March. Available from URL: https://www.who.int/dg/speeches/detail/who-director-general-s-opening-remarks-at-the-media-briefing-on-covid-19, 11 march 2020 (accessed April 2020).
20. Callegos A. WHO Declares Public Health Emergency for novel coronavirus // Medscape medical news. Available at https://www. Medscape, com/viewarticle/924596; Accessed: January 31, 2020.
21. Ramzy A., McNeil D.G. W.H.O. Declares Global Emergency as Wuhan Coronavirus Spreads // The New York Times. Available at https://nyti.ms/2RER70M; Accessed: January 30, 2020.
22. The New York Times. Coronavirus Live Updates: W.H.O. Declares Pandemic as Number of Infected Countries Crows. The New York Times. Available at https:// www.nytimes.com/2020/03/11/world/coronavirus-news.html#link-282e5b06. Accessed: March 11, 2020.
23. Сайт ВОЗ https://www.who.int/docs/default-source/coronaviruse/novel-coronavims-landscape-ncov.pdf?sfvrsn=b8e4a30_4&download=true.
24. Заявка США №20060257852, МПК С07К 14/165, опубл. 16.11.2006 г. (аналог).
25. WO 2015/042373, A1, Immunogenic middle east respiratory syndrome coronavirus (MERS-CoV) compositions and metods, 2015. (прототип).
26. Wang, Q. et al. Immunodominant SARS coronavirus epitopes in humans elicited both enhancing and neutralizing effects on infection in non-human primates. // ACS Infect. Dis. 2, 361-376 (2016).
27. Chen, W. H. et al. Optimization of the production process and characterization of the yeast-expressed SARS-CoV recombinant receptor-binding domain (RBD219-N1), a SARS vaccine candidate. // J. Pharm. Sci. 106, 1961-1970 (2017).
--->
ПРИЛОЖЕНИЕ
<110> Федеральное бюджетное учреждение науки «Государственный
научный центр вирусологии и биотехнологии «Вектор»
Федеральной службы по надзору в сфере защиты прав потребителей
и благополучия человека (ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора)
<120> Химерный рекомбинантный белок-носитель
MBP-6xHis-N_nCoV-2019 и вакцинная композиция против
коронавирусной инфекции COVID-19 с использованием химерного
рекомбинантного белка-носителя.
<160> Номер SEQ ID NO: 1
<210> 5
<211> 25
<212> peptide
<213> Искусственная последовательность
<223> Искусственно синтезированный пептид
<400> 1 Искусственная аминокислотная последовательность
CRLFRKSNLKPFERDISTEIYQAGS
<160> Номер SEQ ID NO: 2
<210> 5
<211> 23
<212> peptide
<213> Искусственная последовательность
<223> Искусственно синтезированный пептид
<400> 2 Искусственная аминокислотная последовательность
CKEIDRLNEVAKNLNESLIDLQE
<160> Номер SEQ ID NO: 3
<210> 5
<211> 22
<212> peptide
<213> Искусственная последовательность
<223> Искусственно синтезированный пептид
<400> 3 Искусственная аминокислотная последовательность
CKNLNESLIDLQELGKYEQYIK
<160> Номер SEQ ID NO: 4
<210> 5
<211> 817
<212> recombinant chimeric protein
<213> Искусственная последовательность
<223> Искусственно синтезированный рекомбинантный химерный белок
<400> 4 Искусственная аминокислотная последовательность
MKIEEGKLVIWINGDKGYNGLAEVGKKFEKDTGIKVTVEHPDKLE 45
EKFPQVAATGDGPDIIFWAHDRFGGYAQSGLLAEITPDKAFQDKL 90
YPFTWDAVRYNGKLIAYPIAVEALSLIYNKDLLPNPPKTWEEIPA 135
LDKELKAKGKSALMFNLQEPYFTWPLIAADGGYAFKYENGKYDIK 180
DVGVDNAGAKAGLTFLVDLIKNKHMNADTDYSIAEAAFNKGETAM 225
TINGPWAWSNIDTSKVNYGVTVLPTFKGQPSKPFVGVLSAGINAA 270
SPNKELAKEFLENYLLTDEGLEAVNKDKPLGAVALKSYEEELAKD 315
PRIAATMENAQKGEIMPNIPQMSAFWYAVRTAVINAASGRQTVDE 360
ALKDAQTNSSSNNNNNNNNNNLGIEGRGGSGHHHHHHSGSDNGPQ 405
NQRNAPRITFGGPSDSTGSNQNGERSGARSKQRRPQGLPNNTASW 450
FTALTQHGKEDLKFPRGQGVPINTNSSPDDQIGYYRRATRRIRGG 495
DGKMKDLSPRWYFYYLGTGPEAGLPYGANKDGIIWVATEGALNTP 540
KDHIGTRNPANNAAIVLQLPQGTTLPKGFYAEGSRGGSQASSRSS 585
SRSRNSSRNSTPGSSRGTSPARMAGNGGDAALALLLLDRLNQLES 630
KMSGKGQQQQGQTVTKKSAAEASKKPRQKRTATKAYNVTQAFGRR 675
GPEQTQGNFGDQELIRQGTDYKHWPQIAQFAPSASAFFGMSRIGM 720
EVTPSGTWLTYTGAIKLDDKDPNFKDQVILLNKHIDAYKTFPPTE 765
PKKDKKKKADETQALPQRQKKQQTVTLLPAADLDDLSKQLQQSMS 810
SADSTQA 817
<160> Номер SEQ ID NO: 5
<210> 5
<211> 2454
<212> recombinant chimeric gen
<213> Искусственная последовательность
<223> Искусственно синтезированный рекомбинантный химерный ген
<400> 5 Искусственная нуклеотидная последовательность
ATGAAAATCGAAGAAGGTAAACTGGTAATCTGGATTAACGGCGATAAAGG 50
CTATAACGGTCTCGCTGAAGTCGGTAAGAAATTCGAGAAAGATACCGGAA 100
TTAAAGTCACCGTTGAGCATCCGGATAAACTGGAAGAGAAATTCCCACAG 150
GTTGCGGCAACTGGCGATGGCCCTGACATTATCTTCTGGGCACACGACCG 200
CTTTGGTGGCTACGCTCAATCTGGCCTGTTGGCTGAAATCACCCCGGACA 250
AAGCGTTCCAGGACAAGCTGTATCCGTTTACCTGGGATGCCGTACGTTAC 300
AACGGCAAGCTGATTGCTTACCCGATCGCTGTTGAAGCGTTATCGCTGAT 350
TTATAACAAAGATCTGCTGCCGAACCCGCCAAAAACCTGGGAAGAGATCC 400
CGGCGCTGGATAAAGAACTGAAAGCGAAAGGTAAGAGCGCGCTGATGTTC 450
AACCTGCAAGAACCGTACTTCACCTGGCCGCTGATTGCTGCTGACGGGGG 500
TTATGCGTTCAAGTATGAAAACGGCAAGTACGACATTAAAGACGTGGGCG 550
TGGATAACGCTGGCGCGAAAGCGGGTCTGACCTTCCTGGTTGACCTGATT 600
AAAAACAAACACATGAATGCAGACACCGATTACTCCATCGCAGAAGCTGC 650
CTTTAATAAAGGCGAAACAGCGATGACCATCAACGGCCCGTGGGCATGGT 700
CCAACATCGACACCAGCAAAGTGAATTATGGTGTAACGGTACTGCCGACC 750
TTCAAGGGTCAACCATCCAAACCGTTCGTTGGCGTGCTGAGCGCAGGTAT 800
TAACGCCGCCAGTCCGAACAAAGAGCTGGCAAAAGAGTTCCTCGAAAACT 850
ATCTGCTGACTGATGAAGGTCTGGAAGCGGTTAATAAAGACAAACCGCTG 900
GGTGCCGTAGCGCTGAAGTCTTACGAGGAAGAGTTGGCGAAAGATCCACG 950
TATTGCCGCCACCATGGAAAACGCCCAGAAAGGTGAAATCATGCCGAACA 1000
TCCCGCAGATGTCCGCTTTCTGGTATGCCGTGCGTACTGCGGTGATCAAC 1050
GCCGCCAGCGGTCGTCAGACTGTCGATGAAGCCCTGAAAGACGCGCAGAC 1100
TAATTCGAGCTCGAACAACAACAACAATAACAATAACAACAACCTCGGGA 1150
TCGAGGGAAGGGGAGGATCTGGCCACCATCATCATCATCATTCTGGATCC 1200
GATAATGGACCCCAAAATCAGCGAAATGCACCCCGCATTACGTTTGGTGG 1250
ACCCTCAGATTCAACTGGCAGTAACCAGAATGGAGAACGCAGTGGGGCGC 1300
GATCAAAACAACGTCGGCCCCAAGGTTTACCCAATAATACTGCGTCTTGG 1350
TTCACCGCTCTCACTCAACATGGCAAGGAAGACCTTAAATTCCCTCGAGG 1400
ACAAGGCGTTCCAATTAACACCAATAGCAGTCCAGATGACCAAATTGGCT 1450
ACTACCGAAGAGCTACCAGACGAATTCGTGGTGGTGACGGTAAAATGAAA 1500
GATCTCAGTCCAAGATGGTATTTCTACTACCTAGGAACTGGGCCAGAAGC 1550
TGGACTTCCCTATGGTGCTAACAAAGACGGCATCATATGGGTTGCAACTG 1600
AGGGAGCCTTGAATACACCAAAAGATCACATTGGCACCCGCAATCCTGCT 1650
AACAATGCTGCAATCGTGCTACAACTTCCTCAAGGAACAACATTGCCAAA 1700
AGGCTTCTACGCAGAAGGGAGCAGAGGCGGCAGTCAAGCCTCTTCTCGTT 1750
CCTCATCACGTAGTCGCAACAGTTCAAGAAATTCAACTCCAGGCAGCAGT 1800
AGGGGAACTTCTCCTGCTAGAATGGCTGGCAATGGCGGTGATGCTGCTCT 1850
TGCTTTGCTGCTGCTTGACAGATTGAACCAGCTTGAGAGCAAAATGTCTG 1900
GTAAAGGCCAACAACAACAAGGCCAAACTGTCACTAAGAAATCTGCTGCT 1950
GAGGCTTCTAAGAAGCCTCGGCAAAAACGTACTGCCACTAAAGCATACAA 2000
TGTAACACAAGCTTTCGGCAGACGTGGTCCAGAACAAACCCAAGGAAATT 2050
TTGGGGACCAGGAACTAATCAGACAAGGAACTGATTACAAACATTGGCCG 2100
CAAATTGCACAATTTGCCCCCAGCGCTTCAGCGTTCTTCGGAATGTCGCG 2150
CATTGGCATGGAAGTCACACCTTCGGGAACGTGGTTGACCTACACAGGTG 2200
CCATCAAATTGGATGACAAAGATCCAAATTTCAAAGATCAAGTCATTTTG 2250
CTGAATAAGCATATTGACGCATACAAAACATTCCCACCAACAGAGCCTAA 2300
AAAGGACAAAAAGAAGAAGGCTGATGAAACTCAAGCCTTACCGCAGAGAC 2350
AGAAGAAACAGCAAACTGTGACTCTTCTTCCTGCTGCAGATTTGGATGAT 2400
TTCTCCAAACAATTGCAACAATCCATGAGCAGTGCTGACTCAACTCAGGC 2450
CTAA 2454
<---


Изобретение относится к биотехнологии. Описана вакцина против коронавирусной инфекции COVID-19. Указанная вакцинная композиция против коронавирусной инфекции COVID-19 характеризуется тем, что содержит: пептидные иммуногены, имеющие аминокислотные последовательности (SEQ ID NO: 1), (SEQ ID NO: 2) и (SEQ ID NO: 3), и химерный рекомбинантный белок-носитель MBP-6xHis-N_nCoV-2019, характеризующийся последовательностью (SEQ ID NO: 4). Причем пептидные иммуногены ковалентно связаны с указанным белком-носителем. Техническим результатом изобретения является получение вакцинной композиции с использованием пептидных иммуногенов и белка-носителя, которые несут минимально необходимые антигенные детерминанты для формирования специфического иммунного ответа и индуцируют протективный иммунитет против Covid-19. 2 з.п. ф-лы, 5 ил., 4 табл., 7 пр.
1. Вакцинная композиция против коронавирусной инфекции COVID-19, характеризующаяся тем, что включает пептидные иммуногены, имеющие аминокислотные последовательности (SEQ ID NO: 1), (SEQ ID NO: 2) и (SEQ ID NO: 3) соответственно, содержащие антигенные T и В-клеточные эпитопы белка S коронавируса SARS Cov-2, которые способны индуцировать образование антител, обладающих антигенспецифической, вируснейтрализующей и протективной активностями, и ковалентно связанные в виде конъюгатов с белком-носителем, представляющим собой химерный рекомбинантный белок MBP-6xHis-N_nCoV-2019, включающий N белок коронавируса SARS-CoV-2 и характеризующийся аминокислотной последовательностью (SEQ ID NO: 4), причем смесь вышеуказанных конъюгатов пептидных иммуногенов и белка-носителя сорбирована на фармацевтически приемлемый адъювант.
2. Композиция по п. 1, отличающаяся тем, что конъюгаты пептидных иммуногенов с белком-носителем взяты в равных соотношениях между собой и белком-носителем.
3. Композиция по п.1, отличающаяся тем, что в качестве адъюванта она содержит гидроокись алюминия в количестве 0,2-2 мг/мл.
| Пептидные иммуногены и вакцинная композиция против коронавирусной инфекции COVID-19 с использованием пептидных иммуногенов | 2020 |
|
RU2738081C1 |
| МУТАНТНЫЕ ШТАММЫ MYCOPLASMA HYOPNEUMONIAE | 2013 |
|
RU2689671C2 |
| КОНЪЮГАТ ДЛЯ ИММУНИЗАЦИИ И ВАКЦИНАЦИИ И СПОСОБ ПОВЫШЕНИЯ ИММУНОГЕННОСТИ | 2008 |
|
RU2378015C2 |
| CN 111458504 A, 28.07.2020 | |||
| CN 111647053 A, 11.09.2020 | |||
| CN 111533790 A, 14.08.2020 | |||
| CN 111848753 A, 30.10.2020 | |||
| ПОЛИВАЛЕНТНЫЕ ИММУНОГЕННЫЕ КОМПОЗИЦИИ PCV2 И СПОСОБЫ ПОЛУЧЕНИЯ ТАКИХ КОМПОЗИЦИЙ | 2006 |
|
RU2488407C2 |
Авторы
Даты
2021-02-20—Публикация
2020-12-09—Подача