Данная заявка заявляет преимущество предварительной заявки США №61/392855, поданной 13 октября 2010 г. Все идеи вышеуказанной заявки(ок) включены в данный документ посредством ссылки.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Посттрансляционная модификация белков посредством ацетилирования и деацетилирования лизиновых остатков играет решающую роль в регуляторных клеточных функциях, делая гистондеацетилазу привлекательной биологической мишенью, особенно для лечения рака. Например, в WO 2007/095584 описаны низкомолекулярные ингибиторы или гистондеацетилаза с чувствительной к эстеразе сложноэфирной связью. Присутствие чувствительного к эстеразе линкера обеспечивает ингибитор, который может достигать высоких локальных концентраций и снижать системную токсичность.
Некоторые небольшие молекулы, которые включают лабильные ковалентные связи, могут быть нестабильными в водных растворителях. Например, присутствие чувствительного к эстеразе линкера может вызвать сложности относительно получения подходящего состава. В связи с этим существует потребность в стабильных фармацевтических композициях ингибиторов гистондеацетилазы в тех случаях, когда ингибитор имеет лабильные ковалентные связи, такие как описанные в WO 2007/095584.
КРАТКОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к фармацевтической композиции, содержащей ингибитор гистондеацетилазы, способам применения такой фармацевтической композиции и наборам, подходящим для получения такой фармацевтической композиции.
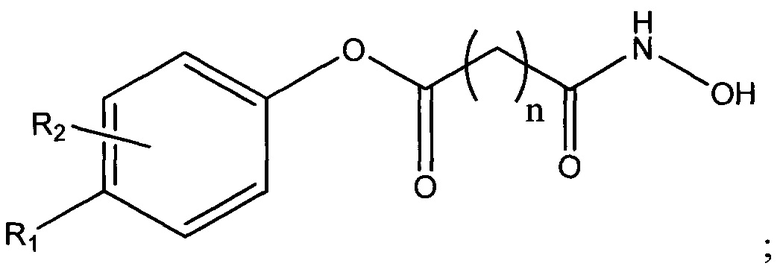
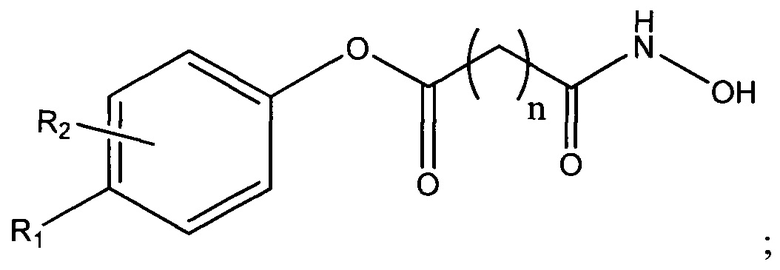
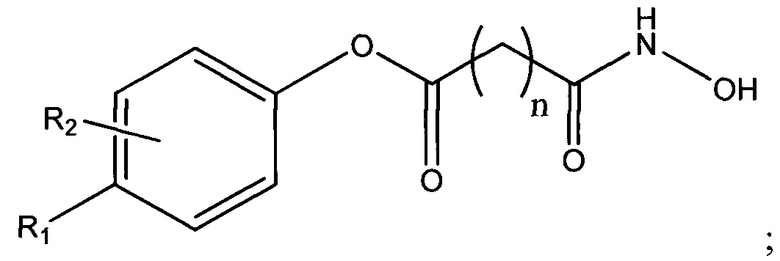
В одном варианте осуществления настоящее изобретение представляет собой фармацевтическую композицию, содержащую терапевтически эффективное количество активного фармацевтического ингредиента (API) -соединения, представленного следующей структурной формулой

по меньшей мере одно подкисляющее средство и основание-носитель, содержащее по меньшей мере один фармацевтически приемлемый неводный растворитель. В структурной формуле (I) n представляет собой целое число от 0 до 15, R1 и R2 каждый независимо представляют собой водород, галоген, алифатическую группу, гетероалифатическую группу, арил, гетероарил; -ORA; -C(O)RA; -C(O)N(RA)2; -CO2RA; -CN; -SCN; -SRA; -SORA; -SO2RA; -NO2; -N(RA)2; -NHRA; -NRAC(O)RA или -C(RA)3; и где RA в каждом случае представляет собой независимо водород, алифатическую группу, гетероалифатическую группу, ацильный фрагмент, арильный фрагмент, гетероарильный фрагмент, алкокси; арилокси; фрагмент алкилтио, арилтио, амино, алкиламино, диалкиламино, гетероарилокси или гетероарилтио.
В другом варианте осуществления настоящее изобретение представляет собой фармацевтическую композицию. Композиция содержит по меньшей мере 0,01% по весу активного фармацевтического ингредиента (API) - соединения, представленного следующей структурной формулой

по меньшей мере одно подкисляющее средство и по меньшей мере один фармацевтически приемлемый неводный растворитель. Предпочтительно n равно 6, R2 представляет собой водород, и R1 представляет собой -C(O)ORA, RA представляет собой C1-C12алкил; по меньшей мере один фармацевтически приемлемый неводный растворитель является смесью этанола и пропиленгликоля; по меньшей мере одно подкисляющее средство выбрано из одного или нескольких из лимонной кислоты и фосфорной кислоты, и измеренный pH фармацевтической композиции составляет от приблизительно 3 до приблизительно 5. В конкретном аспекте данного варианта осуществления фармацевтическая композиция дополнительно необязательно включает одно или несколько из следующего: по меньшей мере одно смачивающее средство, выбранное из глицерина и гексиленгликоля; по меньшей мере одно смягчающее средство, выбранное из диизопропиладипата и олеилового спирта; по меньшей мере один усилитель проникновения, выбранный из этанола, пропиленгликоля или олеилового спирта; гидроксипропилцеллюлозный загуститель и бутилированный гидрокситол в качестве антиоксиданта.
В другом варианте осуществления настоящее изобретение представляет собой способ лечения нарушения у субъекта, нуждающегося в этом. Способ включает накожное введение субъекту терапевтически эффективного количества фармацевтической композиции, где нарушение выбрано из пролиферативного нарушения, иммунного нарушения и кожного нарушения. Фармацевтическая композиция, применимая для осуществления способа настоящего изобретения, описана выше.
В другом варианте осуществления настоящее изобретение представляет собой набор. Набор содержит первый контейнер, содержащий активный фармацевтический ингредиент (API) - соединение, представленное следующей структурной формулой

второй контейнер, содержащий основание-носитель, содержащее по меньшей мере один фармацевтически приемлемый неводный растворитель. Значения и предпочтительные значения переменных в структурной формуле (I) определены в данном документе ниже.
Фармацевтические составы настоящего изобретения неожиданно объединяют эффективную доставку API с продолжительным сроком годности при комнатной температуре. Основание-носитель, содержащее подкисленный неводный растворитель, способствует увеличению срока годности путем замедления разрушения API, например, из-за расщепления (например, посредством гидролиза или сольволиза) лабильных ковалентных связей молекулы API.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Указанное выше будет очевидно из следующего более конкретного описания примерных вариантов осуществления настоящего изобретения, как показано на сопутствующих графических материалах, на которых подобные условные обозначения относятся к одинаковым частям на всех различных видах. Графические материалы необязательно представлены в масштабе, акцент наоборот сделан на изображение вариантов осуществления настоящего изобретения.
Фигура представляет собой блок-схему одного варианта осуществления способа производства, который можно использовать для производства фармацевтической композиции настоящего изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Ингибиторы гистондеацетилазы, такие как описанные в WO 2007/095584, включенной в настоящий документ посредством ссылки во всей своей полноте, представляют собой небольшие молекулы, которые имеют лабильные ковалентные связи, которые могут быть нестабильными в водных растворителях. Было неожиданно обнаружено, что стабильность и срок годности фармацевтических составов, содержащих ингибиторы гистондеацетилазы из WO 2007/095584, можно значительно увеличить при применении неводных растворителей, которые были подкислены.
В частности, некоторые из API-соединений, описанных в WO 2007/095584, имеют лабильную связь (например, сложноэфирную связь), которая гидролизуется при комнатной температуре. Механизм этого гидролиза может быть либо катализируемым основанием, либо катализируемым кислотой в зависимости от уровня pH. Традиционные способы замедления гидролиза включают или регулирование кислотности (рН) водного растворителя, или замещение водного растворителя неводным растворителем. Однако, доступные экспериментальные данные указывают, что ни один из этих способов отдельно не обеспечивает желаемую стабильность API. Неожиданно комбинация по меньшей мере одного неводного растворителя и по меньшей мере одного подкисляющего средства обеспечила желаемую стабильность API. Открытие пригодности данной комбинации неожиданно. Более конкретно, поскольку скорость гидролиза лабильной связи в различных растворителях как функция кислотности является непредсказуемой, открытие существования комбинации растворителя и подкисляющего средства, которая обеспечивает достаточную стабильность API, также непредсказуемо и, следовательно, неожиданно.
Определения выражений
Выражение "алифатический", как используется в настоящем документе, означает неароматическую группу, которая состоит только из углерода и водорода и может необязательно содержать одну или несколько единиц ненасыщения, например, двойные и/или тройные связи. Алифатическая группа может быть с неразветвленной цепью, разветвленной или циклической.
Выражение "гетероалифатический", как используется в настоящем документе, означает алифатическую группу, в которой один или несколько атомов углерода замещены на гетероатом, например, на О, N, S, Si, P или подобные.
Выражение "алкил", как используется в настоящем документе, если не указано иное, означает неразветвленные или разветвленные насыщенные одновалентные углеводородные радикалы формулы СпНзп+ь В некоторых вариантах осуществления n составляет от 1 до 18. В других вариантах осуществления n составляет от 1 до 12. Предпочтительно n составляет от 1 до 6. В некоторых вариантах осуществления n составляет 1-1000, например, n составляет 1-100. Алкил может необязательно быть замещен -OH, -SH, галогеном, амино, циано, нитро, C1-C12алкилом, C1-C12галогеналкилом, C1-C12алкокси, C1-C12галогеналкокси, C1-C12алкилсульфанилом, C2-C12алкенилом, C2-C12алкинильной группой, арилом или гетероарилом. К тому же, алкил может быть замещен =O =S, =M-алкилом. Дополнительные примеры подходящих заместителей на алкильной группе включают -R'OR, где каждый R и каждый R' независимо представляют собой алкильную, арильную или гетероарильную группу. Выражение алкил может также относиться к циклоалкилу.
Как используется в настоящем документе, "алкенильная группа" отдельно или как часть большего фрагмента (например, циклоалкеноксида) представляет собой предпочтительно с неразветвленной цепью или разветвленную алифатическую группу с одной или несколькими двойными связями с от 2 до приблизительно 12 атомами углерода, например, этенил, 1-пропенил, 1-бутенил, 2-бутенил, 2-метил-1-пропенил, пентенил, гексенил, гептенил или октенил, или циклоалифатическую группу с одной или несколькими двойными связями с от 3 до приблизительно 12 атомами углерода. Примерные заместители алкенильной группы описаны выше относительно алкила.
Как используется в настоящем документе, "алкинильная" группа отдельно или как часть большего фрагмента представляет собой предпочтительно с неразветвленной цепью или разветвленную алифатическую группу с одной или несколькими тройными связями с от 2 до приблизительно 12 атомами углерода, например, этинил, 1-пропинил, 1-бутинил, 3-метил-1-бутинил, 3,3-диметил-1-бутинил, пентинил, гексинил, гептинил или октинил, или циклоалифатическую группу с одной или несколькими тройными связями с от 3 до приблизительно 12 атомами углерода. Примерные заместители алкинильной группы описаны выше относительно алкила.
Выражение "циклоалкил", как используется в настоящем документе, означает насыщенные циклические углеводороды, т.е. соединения, где все кольцевые атомы являются углеродами. В некоторых вариантах осуществления циклоалкил содержит от 3 до 18 углеродов. Предпочтительно циклоалкил содержит от 3 до 6 углеродов. Примеры циклоалкила без ограничения включают циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. Примерные заместители циклоалкила описаны выше относительно алкила.
Выражение "галогеналкил", как используется в настоящем документе, включает алкил, замещенный одним или несколькими F, C1, Вг или I, где алкил определен выше. Примерные заместители галогеналкила описаны выше относительно алкила.
Выражения "алкокси", как используется в настоящем документе, означают "алкил-O-" группу, где алкил определен выше. Примеры алкоксигруппы включают метокси- или этоксигруппы. Примерные заместители алкокси описаны выше относительно алкила.
Выражения "алкилтио", как используется в настоящем документе, означают "алкил-S-''rpynny, где алкил определен выше. Примеры алкилтиогруппы включают CH3-S- или CH3-CH2-S-группы. Примерные заместители алкилтиогруппы описаны выше относительно алкила.
Выражение "арил", как используется в настоящем документе, относится к карбоциклической ароматической группе. Предпочтительно арил содержит от 6 до 18 углеродов. Примеры арильных групп без ограничения включают фенил и нафтил. Примеры арильных групп включают необязательно замещенные группы, такие как фенил, бифенил, нафтил, фенантрил, антраценил, пиренил, флуорантил или флуоренил. Арил может быть необязательно замещен на заменяемом атоме углерода. Примеры подходящих заместителей на ариле включают галоген, гидроксил, циано, нитро, C1-C12алкил, C2-C12алкенил или C2-C12алкинил, C1-C12галогеналкил, C1-C12алкокси или галогеналкоксигруппу, арилоксигруппу, ариламиногруппу, арил, гетероарильную группу. К тому же, арил может быть замещен =O, =S, =N-алкилом. Дополнительные примеры подходящих заместителей на арильной группе включают -R'OR, где каждый R и каждый R' независимо представляют собой алкильную, арильную или гетероарильную группу.
В некоторых вариантах осуществления C6-C18арил выбирают из группы, включающей фенил, инденил, нафтил, азуленил, гепталенил, бифенил, индаценил, аценафтиленил, флуоренил, феналенил, фенантренил, антраценил, циклопентациклооктенил или бензоциклооктенил. В некоторых вариантах осуществления C6-C14арил выбирают из группы, включающей фенил, нафталин, антрацен, 1H-фенален, тетрацен и пентацен.
Выражение "арилокси", как используется в настоящем документе, означает "арил-O-"группу, где арил определен выше. Примеры арилоксигруппы включают фенокси- или нафтоксигруппы. Подходящие заместители на арилоксигруппе являются такими, как определено выше относительно арильной группы.
Выражение "арилтио", как используется в настоящем документе, означает "арил-S-"группу, где арил определен выше. Примеры арилоксигруппы включают фенилтио- или нафтилтиогруппы. Подходящие заместители на арилтиогруппе являются такими, как определено выше относительно арильной группы.
Выражение "гетероарил", как используется в настоящем документе, относится к ароматическим группам, содержащим один или несколько гетероатомов (О, S или N). Гетероарильная группа может быть моноциклической или полициклической, например, моноциклическим гетероарильным кольцом, слитым с одной или несколькими карбоциклическими ароматическими группами или другими моноциклическими гетероарильными группами. Гетероарильные группы данного изобретения могут включать кольцевые системы, замещенные одним или несколькими оксофрагментами. Примеры гетероарильных групп включают без ограничения пиридинил, пиридазинил, имидазолил, пиримидинил, пиразолил, триазолил, пиразинил, хинолил, изохинолил, тетразолил, фурил, тиенил, изоксазолил, тиазолил, оксазолил, изотиазолил, пирролил, хинолинил, изохинолинил, индолил, бензимидазолил, бензофуранил, циннолинил, индазолил, индолизинил, фталазинил, пиридазинил, тиазинил, изоиндолил, пуринил, оксадиазолил, тиазолил, тиадиазолил, фуразанил, бензофуразанил, бензотиофенил, бензотриазолил, бензотиазолил, бензоксазолил, хиназолинил, хиноксалинил, нафтиридинил, дигидрохинолил, тетрагидрохинолил, дигидроизохинолил, тетрагидроизохинолил, бензофурил, фуропиридинил, пиролопиримидинил и азаиндолил.
В других вариантах осуществления 5-14-членную гетероарильную группу выбирают из группы, включающей пиридил, 1-оксо-пиридил, фуранил, бензо[1,3]диоксолил, бензо[1,4]диоксинил, тиенил, пирролил, оксазолил, имидазолил, тиазолил, изоксазолил, хинолинил, пиразолил, изотиазолил, пиридазинил, пиримидинил, пиразинил, триазинил, триазолил, тиадиазолил, изохинолинил, индазолил, бензоксазолил, бензофурил, индолизинил, имидазопиридил, тетразолил, бензимидазолил, бензотиазолил, бензотиадиазолил, бензоксадиазолил, индолил, тетрагидроиндолил, азаиндолил, имидазопиридил, хиназолинил, пуринил, пирроло[2,3]пиримидинил, пиразоло[3,4]пиримидинил, имидазо[1,2-a] пиридил и бензотиенил.
Вышеуказанные гетероарильные группы могут быть C-присоединенными или N-присоединенными (где такое возможно). Например, группа, полученная из пиррола, может быть пиррол-1-илом (N-присоединенная) или пиррол-3-илом (C-присоединенная).
Выражение "(гетеро)арилтио", как используется в настоящем документе, означает "(гетеро)арил-S-"группу, где арил определен выше. Примеры арилтиогруппы включают фенилтио- или нафтилтиогруппы.
Подходящие заместители для гетероарила являются такими, как определено выше относительно арильной группы.
В некоторых вариантах осуществления подходящие заместители для заменяемого атома углерода в ариле, гетероариле или арильной части арилалкенила включают галоген, гидроксил, C1-C12алкил, -C12алкенил или -C12алкинильную группу, C1-C12алкокси, арилоксигруппу, ариламиногруппу и C1-C12 галогеналкил.
В контексте настоящего изобретения аминогруппа может быть первичной (-NH2), вторичной (-NHRp) или третичной (-NRpRq), где Rp и Rq могут быть любыми из алкила, алкенила, алкинила, алкокси, циклоалкила, циклоалкокси, арила, гетероарила и бициклической карбоциклической группы. (Ди)алкиламиногруппа представляет собой случай аминогруппы, замещенной одним или двумя алкилами.
"Триалкиламино"группа представляет собой группу -N+(Rt)3, где Rt является алкилом, как определено выше.
Как используется в настоящем документе, выражение "ацил" относится к алканоилу, т.е. алкил-C(O)-, где "алкил" определен выше.
Выражение (гетеро)ариламин, как используется в настоящем документе, означает "(гетеро)арил-NH-", "(гетеро)арил-N(алкил)-" или "((гетеро)арил)2-N-"группы, где (гетеро)арил и алкил определены выше.
"Смачивающим средством", как используется в настоящем документе, является наполнитель, который может увеличивать уровень воды во внешних слоях кожи. Примеры смачивающих средств, одобренных FDA для применения в местных лекарственных продуктах, включают без ограничения следующие: гексиленгликоль, пропиленгликоль, сорбит, молочную кислоту, лактат натрия, метилглюцет-10, метилглюцет-20 и полиэтиленгликоли.
"Смягчающие средства", как используется в настоящем документе, представляют собой наполнитель, который может улучшать состояние кожи путем смягчения, смазывания и пережиривания кожи. Смягчающие средства могут также улучшать защитную функцию кожи и снижать испарение воды. Примеры смягчающих средств, одобренных Управлением по контролю за продуктами и лекарственными средствами США (FDA) для применения в местных лекарственных продуктах включают без ограничения следующие: диизопропиладипат, изопропилмиристат, изопропилпальмитат, цетеарилоктаноат, изопропилизостеарат, миристиллактат, октилдодеканол, олеиловый спирт, минеральное масло, вазелин, растительные жиры/растительные масла (например, арахис, соя, сафлор, оливка, миндаль, кокос), PPG-15 стеариловый эфир, PPG-26 олеат, PEG-4 дилаурат, лецитин, ланолин, ланолиновый спирт, полиоксил 75 ланолин, холестерин, воск цетиловых сложных эфиров, цетостеариловый спирт, глицерилмоностеарат, среднецепочечные триглицериды, диметикон и циклометикон.
"Подкисляющее средство", как используется в настоящем документе, относится к химическому соединению, которое отдельно или в комбинации с другими соединениями может использоваться для подкисления основания-носителя фармацевтической композиции, содержащего неводный растворитель. Приемлемым подкисляющим средством для местного состава является кислота с pKa 9,5 или ниже, более предпочтительно с pKa 7,0 или ниже, более предпочтительно с pKa 5,0 или ниже. Примеры подкисляющих средств, одобренных FDA для применения в местных лекарственных продуктах, включают без ограничения: уксусную кислоту, дегидроуксусную кислоту, аскорбиновую кислоту, бензойную кислоту, борную кислоту, лимонную кислоту, эдетовую кислоту, соляную кислоту, изостеариновую кислоту, стеариновую кислоту, молочную кислоту, азотную кислоту, олеиновую кислоту, фосфорную кислоту, сорбиновую кислоту, серную кислоту, винную кислоту и ундециленовую кислоту.
"Неводный растворитель", как используется в настоящем документе, представляет собой растворитель, отличный от воды. Примеры неводных растворителей, одобренных FDA для применения в местных лекарственных продуктах, включают без ограничения: спирт (этанол), ацетон, бензиловый спирт, моноэтиловый эфир диэтиленгликоля, глицерин, гексиленгликоль, изопропиловый спирт, полиэтиленгликоли, метоксиполиэтиленгликоли, диэтилсебацинат, диметилизосорбид, пропиленкарбонат и диметилсульфоксид. Многие смягчающие средства, которые являются жидкими при комнатной температуре, можно также применять в качестве растворителей. Они включают без ограничения: диизопропиладипат, изопропилмиристат, растительные жиры/растительные масла, минеральное масло и изопропилпальмитат.
"Антиоксидант", как используется в настоящем документе, представляет собой вещество, которое ингибирует окисление химических соединений. Примеры обычных антиоксидантов включают альфа-токоферол (все изомеры), бета-токоферол, дельта-токоферол, гамма-токоферол, токоферолы, аскорбиновую кислоту, аскорбилпальмитат, бутилированный гидроксианизол (BHA), бутилированный гидрокситолуол (BHT), фумаровую кислоту, яблочную кислоту, метионин, пропилгаллат, аскорбат натрия, метабисульфат натрия, тиосульфат натрия, бисульфат натрия. Химические соединения, защищенные от окисления антиоксидантом, включают активные фармацевтические ингредиенты (API) и наполнители, содержащие фрагменты чувствительные к окислению.
"Загуститель", как используется в настоящем документе, представляет собой соединение, которое сгущает (т.е. увеличивает вязкость) состав. Примерами являются гидроксипропилцеллюлозы, карбомер, гидроксиэтилцеллюлозы, карбоксиметилцеллюлозы, ксантановая камедь, гуаровая камедь, хитозан, поливиниловый спирт, повидон, каррагенан, метилцеллюлоза, гидроксипропилметилцеллюлоза, жирные спирты, цетиловый спирт, стеариловый спирт, цетостеариловый спирт и миристиловый спирт.В конкретном варианте осуществления загуститель представляет собой гидроксипропилцеллюлозу фармацевтического качества Klucel® MF ("Klucel MF PH"), доступную от Hercules Incorporated, Уилмингтон, Делавэр, под номером из каталога 494-9.
"Усилитель проникновения через кожу", как используется в настоящем документе, представляет собой соединение, которое увеличивает абсорбцию фармацевтически активного ингредиента через кожный покров, например, кожу.
"Измеренный pH", как используется в настоящем документе, представляет собой кислотность аликвоты фармацевтической композиции настоящего изобретения, как определено в данном документе, измеренную разбавлением аликвоты водой до приблизительно 10% по объему.
Как используется в настоящем документе, выражение "терапевтически эффективное количество" относится к количеству API, которое является достаточным для снижения или облегчения тяжести, длительности, развития или приступа нарушения, которое лечат, предотвращения развития нарушения, которое лечат, для того, чтобы вызвать рецидив, предотвратить повторное проявление, развитие, возникновение или развитие симптома, связанного с нарушением, которое лечат, или повысить или улучшить профилактический или терапевтический эффект(ы) другой терапии. Точное количество соединения, вводимое субъекту, будет зависеть от типа и тяжести заболевания или состояния и от характеристик субъекта, таких как общее состояние здоровья, возраст, пол, вес тела и устойчивость к лекарственным средствам. Оно также будет зависеть от степени, тяжести и типа нарушения, которое лечат. Специалист в данной области сможет определить подходящие дозировки, полагаясь на эти и другие факторы. При совместном введении с другими средствами, например, при совместном введении с антипролиферативным средством, "терапевтически эффективное количество" второго средства будет зависеть от типа применяемого лекарственного средства. Подходящие дозировки известны для утвержденных средств и могут быть отрегулированы специалистом в данной области относительно состояния субъекта, типа состояния(й), которое лечат, и количества соединения настоящего изобретения, которое применяют. В случаях, где количество точно не указано, эффективное количество необходимо рассчитать.
Как используется в настоящем документе, выражения "лечить", "лечение" и "который лечат" относятся к снижению или облегчению развития, тяжести и/или длительности нарушения, которое лечат, или облегчению одного или нескольких симптомов (предпочтительно одного или нескольких явных симптомов) нарушений, которое лечат, обусловленных введением одной или нескольких фармацевтических композиций настоящего изобретения. В конкретных вариантах осуществления выражения "лечить", "лечение" и "который лечат" относятся к облегчению по меньшей мере одного измеряемого физического параметра, который лечат. Например, для пролиферативного нарушения такие параметры могут включать рост опухоли, необязательно видимой пациенту. В других вариантах осуществления выражения "лечить", "лечение" и "который лечат" относятся к ингибированию развития нарушения, которое лечат, или физически путем, например, стабилизации видимого симптома, физиологически путем, например, стабилизации физического параметра, или обоих. В вариантах осуществления, в которых нарушение, которое лечат, является пролиферативным нарушением, выражения "лечить", "лечение" и "который лечат" могут относиться к уменьшению или стабилизации количества раковых клеток.
"Мазь", как используется в настоящем документе, представляет собой полутвердую лекарственную форму, как правило, содержащую менее 20% воды и летучих веществ и более 50% углеводородов, восков или полиолов в качестве носителя. Эта лекарственная форма обычно для внешнего применения на коже или слизистых оболочках.
"Полутвердый", как используется в настоящем документе, относится к агрегатному состоянию вещества, которое является нетекучим; оно не течет или не соответствует его контейнеру при комнатной температуре; оно не течет при низком напряжении сдвига и обычно проявляет пластическую текучесть.
"Гель", как используется в настоящем документе, представляет собой полутвердую лекарственную форму, которая содержит загуститель для сгущения до раствора или дисперсии мелких частиц. Сгущение состава помогает при нанесении на конкретный участок на теле. Гель может содержать суспендированные частицы.
"Дисперсия мелких частиц", как используется в настоящем документе, представляет собой систему, в которой мелкие частицы (т.е. обычно менее 10-50 мкм) распределяются однородно в жидкости.
"Пена", как используется в настоящем документе, представляет собой лекарственную форму, содержащую пузырьки газа, диспергированные в жидкости, которая содержит менее 50% воды, и в конкретном варианте осуществления не содержит воду.
Фармацевтические композиции
В одном варианте осуществления настоящее изобретение представляет собой фармацевтическую композицию, содержащую терапевтически эффективное количество активного фармацевтического ингредиента (API) - соединения, представленного следующей структурной формулой

по меньшей мере одно подкисляющее средство и основание-носитель, содержащее по меньшей мере один фармацевтически приемлемый неводный растворитель. В структурной формуле (I) n представляет собой целое число от 0 до 15, R1 и R2 каждый независимо представляет собой водород, галоген, алифатическую группу, гетероалифатическую группу, арил, гетероарил; -ORA;-C(O)RA; -C(O)N(RA)2; -CO2RA; -CN; -SCN; -SRA; -SORA; -SO2RA; -NO2; -N(RA)2; -NHRA; -NRAC(O)RA или -C(RA)3, где RA в каждом случае независимо представляет собой водород, алифатическую группу, гетероалифатическую группу, ацильный фрагмент, арильный фрагмент, гетероарильный фрагмент, алкокси; арилокси; фрагмент алкилтио, арилтио, амино, алкиламино, диалкиламино, гетероарилокси или гетероарилтио.
В некоторых вариантах осуществления в структурной формуле (I) n равно 5, 6 или 7, предпочтительно n равно 6. Значения и предпочтительные значения остальных переменных такие, как определено выше относительно структурной формулы (I).
В других вариантах осуществления в структурной формуле (I) R2 представляет собой водород, и R1 выбран из галогена, -ORA, N(RA)2, -NHRA, -C1-С6алкила, -C(O)RA, -C(O)ORA, -C(O)N(RA)2, -C(O)NH2, -CHO и -NHC(O)RA. Значения и предпочтительные значения остальных переменных такие, как определено выше относительно структурной формулы (I). Предпочтительно RA представляет собой водород или C1-C12алкил. Значения и предпочтительные значения остальных переменных такие, как определено выше относительно структурной формулы (I).
В других вариантах осуществления в структурной формуле (I) n равно 6, R2 представляет собой водород, и R1 представляет собой -C(O)ORA, и RA представляет собой C1-C12алкил. Значения и предпочтительные значения остальных переменных такие, как определено выше относительно структурной формулы (I).
В некоторых вариантах осуществления по меньшей мере одно подкисляющее средство выбрано из групп, состоящих из уксусной кислоты, дегидроуксусной кислоты, аскорбиновой кислоты, бензойной кислоты, борной кислоты, лимонной кислоты, эдетевой кислоты, соляной кислоты, изостеариновой кислоты, стеариновой кислоты, молочной кислоты, азотной кислоты, олеиновой кислоты, фосфорной кислоты, сорбиновой кислоты, серной кислоты, винной кислоты, ундециленовой кислоты, фумаровой кислоты, яблочной кислоты, малеиновой кислоты, бензолсульфоновой кислоты, цикламовой кислоты, диатризоевой кислоты, дезоксихолевой кислоты, гентизиновой кислоты, глюкуроновой кислоты, глутаминовой кислоты и янтарной кислоты. В конкретном варианте осуществления по меньшей мере одно подкисляющее средство выбрано из одной или нескольких из лимонной кислоты, уксусной кислоты и фосфорной кислоты.
В некоторых вариантах осуществления семиполярные неводные растворители являются предпочтительными (например, смешиваемые с водой, такие как этанол, пропиленгликоль). В других вариантах осуществления по меньшей мере один фармацевтически приемлемый неводный растворитель выбран из групп, состоящих из этанола, ацетона, бензилового спирта, 2-(2-этоксиэтокси)этанола, моноэтилового эфира диэтиленгликоля, глицерина, пропиленгликоля, пропиленкарбоната, ацетона, гексиленгликоля, изопропилового спирта, полиэтиленгликолей (PEG), метоксиполиэтиленгликолей, диэтилсебацината, диметилизосорбида, пропиленкарбоната, диметилсульфоксида (DMSO), диизопропиладипата, изопропилмиристата, растительных жиров, минерального масла и изопропилпальмитата. В конкретном варианте осуществления по меньшей мере один фармацевтически приемлемый неводный растворитель выбран из этанола, бензилового спирта, пропиленгликоля, 2-(2-этоксиэтокси)этанола, гексиленгликоля и диизопропиладипата.
В некоторых вариантах осуществления фармацевтическая композиция настоящего изобретения дополнительно включает по меньшей мере одно смачивающее средство. По меньшей мере одно смачивающее средство выбрано из групп, состоящих из гексиленгликоля, глицерина, пропиленгликоля, сорбита, молочной кислоты, лактата натрия, маннита, бутиленгликоля, пантенола, гиалуроновой кислоты, мочевины, хитозана, полиолов, метилглюцета-10, метилглюцета-20 и полиэтиленгликолей. В конкретном варианте осуществления по меньшей мере одно смачивающее средство выбрано из глицерина и гексиленгликоля.
В некоторых вариантах осуществления фармацевтическая композиция настоящего изобретения дополнительно включает по меньшей мере одно смягчающее средство. В некоторых вариантах осуществления по меньшей мере одно смягчающее средство выбрано из групп, состоящих из диизопропиладипата, изопропилмиристата, изопропилпальмитата, цетеарилоктаноата, изопропилизостеарата, миристиллактата, октилдодеканола, олеилового спирта, минерального масла, вазелина, растительного жира, PPG-15 стеарилового эфира, PEG-4 дилаурата, лецитина, ланолина, ланолинового спирта, полиоксил 75 ланолина, холестерина, воска цетиловых сложных эфиров, цетостеарилового спирта, глицерилмоностеарата, триглицеридов каприновой и каприловой кислот, диметикона и циклометикона. В конкретном варианте осуществления по меньшей мере одно смягчающее средство выбрано из диизопропиладипата и олеилового спирта.
В конкретных вариантах осуществления фармацевтическая композиция настоящего изобретения включает по меньшей мере одно смачивающее средство и по меньшей мере одно смягчающее средство. Значения и предпочтительные значения смачивающих средств и смягчающих средств перечислены выше. В конкретном варианте осуществления по меньшей мере одно смачивающее средство выбрано из одного или нескольких из глицерина и гексиленгликоля, и где по меньшей мере одно смягчающее средство выбрано из диизопропиладипата и олеилового спирта.
В некоторых вариантах осуществления фармацевтическая композиция настоящего изобретения дополнительно включает по меньшей мере один усилитель проникновения через кожу. Подходящие усилители проникновения через кожу включают без ограничения, диметилсульфоксид (DMSO), децилметилсульфоксид, N,N-диметилацетамид, N,N-диметилформамид, 2-пирролидон, 1-метил-2-пирролидон, 5-метил-2-пирролидон, 1,5-метил-2-пирролидон, 1-этил-2-пирролидон, 2-пирролидон-5-карбоновую кислоту, пропиленгликоль, этанол, изопропанол, олеиновую кислоту, лаурокапрам (Azone), лимонен, цинеол, диэтил-м-толуамид (DEET), додецилсульфат натрия, триметилфосфиноксид, тетрагидрофурфуриловый спирт, глицерина монолаурат, метилолеат, пропиленгликоля монолаурат и олеиловый спирт. В конкретном аспекте по меньшей мере один усилитель проникновения выбран из олеилового спирта, пропиленгликоля и этанола.
В некоторых вариантах осуществления фармацевтическая композиция настоящего изобретения дополнительно включает по меньшей мере один загуститель. В конкретных вариантах осуществления загустители представляют собой нейтральные полимеры, которые загустевают при низком рН, такие как полимеры на основе целлюлозы, например, гидроксипропилцеллюлоза. В конкретных вариантах осуществления по меньшей мере один из загустителей выбран из гидроксипропилцеллюлозы, карбомера, гидроксиэтилцеллюлозы, карбоксиметилцеллюлозы, ксантановой камеди, гуаровой камеди, хитозана, поливинилового спирта, повидона, каррагенана, метилцеллюлозы, гидроксипропилметилцеллюлозы, жирных спиртов, цетилового спирта, стеарилового спирта, цетостеарилового спирта и миристилового спирта. В конкретном варианте осуществления по меньшей мере один загуститель является гидроксипропилцеллюлозой, такой как Klucel MF PH.
В некоторых вариантах осуществления фармацевтическая композиция настоящего изобретения дополнительно включает по меньшей мере один антиоксидант.В конкретном варианте осуществления антиоксидант выбран из групп, состоящих из альфа-токоферола, бета-токоферола, дельта-токоферола, гамма-токоферола, токоферолов, аскорбиновой кислоты, аскорбилпальмитата, бутилированного гидроксианизола (BHA), бутилированного гидрокситолуола (BHT), фумаровой кислоты, яблочной кислоты, метионина, пропилгаллата, аскорбата натрия, метабисульфата натрия, тиосульфата натрия, бисульфата натрия. В конкретном варианте осуществления антиоксидантом является бутилированный гидрокситолуол (BHT).
В различных вариантах осуществления фармацевтическая композиция настоящего изобретения содержит по меньшей мере 0,01% по весу API. В некоторых вариантах осуществления фармацевтическая композиция настоящего изобретения содержит от приблизительно 0,01% до приблизительно 15% по весу API. В других вариантах осуществления фармацевтическая композиция настоящего изобретения содержит по меньшей мере приблизительно 0,1% по весу API, альтернативно - по меньшей мере 0,5% по весу API. Например, фармацевтическая композиция настоящего изобретения содержит по весу по меньшей мере приблизительно 0,01%, 0,02%, 0,03%, 0,04%, 0,05%, 0,06%, 0,07%, 0,08%, 0,09%, 0,1%, 0,1%, 0,2%, 0,3%, 0,4%, 0,5%, 0,6%, 0,7%, 0,8%, 0,9%, 1,0%, 1,5%, 2%, 2,5%, 3%, 3,5%, 4%, 4,5% или 5% API. В определенных вариантах осуществления фармацевтическая композиция настоящего изобретения содержит по меньшей мере приблизительно 10% по весу API.
В различных вариантах осуществления измеренный pH фармацевтической композиции настоящего изобретения составляет приблизительно 7. В других вариантах осуществления измеренный pH фармацевтической композиции настоящего изобретения составляет от приблизительно 3 до приблизительно 6. В конкретном варианте осуществления измеренный pH составляет от приблизительно 3 до приблизительно 5.
Пример фармацевтической композиции настоящего изобретения представляет собой фармацевтическую композицию, как определено в данном документе выше, содержащую по меньшей мере 0,01% по весу API, где основание-носитель содержит смесь этанола и пропиленгликоля, и где измеренный pH фармацевтической композиции составляет от приблизительно 3 до 5. В конкретном варианте осуществления по меньшей мере одно подкисляющее средство выбрано из одной или нескольких из лимонной кислоты и фосфорной кислоты. В некоторых вариантах осуществления фармацевтическая композиция дополнительно включает по меньшей мере одно смачивающее средство, выбранное из одного из нескольких глицерина и гексиленгликоля. В другом варианте осуществления фармацевтическая композиция дополнительно включает по меньшей мере одно смягчающее средство, выбранное из одного или нескольких из диизопропиладипата и олеилового спирта. В конкретном варианте осуществления фармацевтическая композиция дополнительно включает по меньшей мере один усилитель проникновения, выбранный из одного или нескольких из олеилового спирта, пропиленгликоля и этанола. В дополнительных вариантах осуществления фармацевтическая композиция дополнительно включает гидроксипропилцеллюлозный загуститель, такой как Klucel MF PH.
В другом примере фармацевтическая композиция настоящего изобретения содержит по меньшей мере 0,01% по весу (например, 0,01%, 0,02%, 0,03%, 0,04%, 0,05%, 0,06%, 0,07%, 0,08%, 0,09%, 0,1%, 0,1%, 0,2%, 0,3%, 0,4%, 0,5%, 0,6%, 0,7%, 0,8%, 0,9%, 1,0%, 1,5%, 2%, 2,5%, 3%, 3,5%, 4%, 4,5% или 5%) активного фармацевтического ингредиента (API) - соединения, представленного следующей структурной формулой

(I), где n равно 6, R2 представляет собой водород, и R1 представляет собой -C(O)ORA, RA представляет собой C1-C12алкил. Фармацевтическая композиция может дополнительно содержать по меньшей мере одно подкисляющее средство и по меньшей мере один фармацевтически приемлемый неводный растворитель, по меньшей мере один фармацевтически приемлемый неводный растворитель представляет собой смесь этанола и пропиленгликоля, по меньшей мере одно подкисляющее средство выбрано из одной или нескольких из лимонной кислоты и фосфорной кислоты, и измеренный pH фармацевтической композиции составляет от приблизительно 3 до приблизительно 5. Фармацевтическая композиция может дополнительно содержать по меньшей мере одно смачивающее средство, выбранное из одного из нескольких глицерина и гексиленгликоля; по меньшей мере одно смягчающее средство, выбранное из одного или нескольких из диизопропиладипата и олеилового спирта; по меньшей мере один усилитель проникновения, выбранный из одного или нескольких из олеилового спирта, пропиленгликоля и этанола; гидроксипропилцеллюлозный загуститель, такой как Klucel MF PH и бутилированный гидрокситолуол в качестве антиоксиданта.
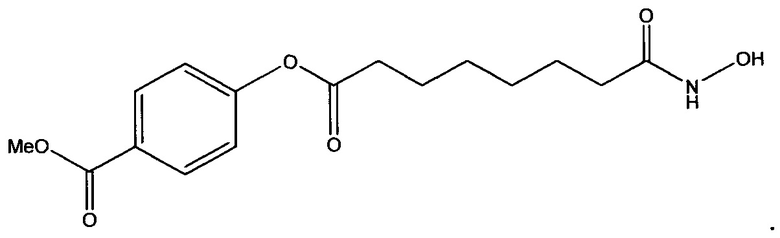
В конкретном варианте осуществления фармацевтическая композиция настоящего изобретения содержит API - соединение, представленное следующей структурной формулой

В описанных выше композициях настоящего изобретения количество фармацевтически приемлемого неводного растворителя представляет собой количество, подходящее для доведения композиции до желаемого объема и/или веса. Например, на основе вес на вес (% вес/вес) количество одного или нескольких растворителей составляет от приблизительно 5% до приблизительно 99,9%. Например, количество одного или нескольких растворителей может быть 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 99%. В других вариантах осуществления на основе вес на вес (% вес/вес) количество одного или нескольких смачивающих средств составляет, например, от приблизительно 5% до приблизительно 50%, например, 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 50%. В других вариантах осуществления на основе вес на вес (% вес/вес) количество одного или нескольких смягчающих средств составляет, например, от приблизительно 5% до приблизительно 50%, например, 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 50%. В других вариантах осуществления на основе вес на вес (% вес/вес) количество одного или нескольких антиоксидантов составляет, например, от приблизительно 0,01% до приблизительно 5%, например, 0,01%, 0,05, 0,1%, 0,15%, 0,2%, 0,5%, 1,0%, 1,5%, 2,0%, 2,5%, 3,0%, 3,5%, 4,0% или 5,0%. В других вариантах осуществления на основе вес на вес (% вес/вес) количество одного или нескольких подкисляющих средств составляет, например, от приблизительно 0,01% до приблизительно 5,0%, например, 0,01%, 0,05, 0,1%, 0,15%, 0,2%, 0,5%, 1,0%, 1,5%, 2,0%, 2,5%, 3,0%, 3,5%, 4,0% или 5,0%. В других вариантах осуществления на основе вес на вес (% вес/вес) количество одного или нескольких загустителей составляет, например, от приблизительно 0,5% до приблизительно 5,0%, например, 0,5%, 1,0%, 1,5%, 2,0%, 2,5%, 3,0%, 3,5%, 4,0% или 5,0%.
Трансдермальные, местные и для слизистых лекарственные формы настоящего изобретения включают без ограничения, офтальмологические и ушные растворы, спреи, пены, аэрозоли, кремы, лосьоны, мази, гели, растворы, эмульсии, суспензии или другие формы, известные специалисту в данной области. Смотри, например. Remington's Pharmaceutical Sciences (1980 и 1990) 16е и 18е издания. Mack Publishing, Easton PA, и Introduction to Pharmaceutical Dosage Forms (1985) 4е издание. Lea & Febiger, Philadelphia. Кроме того, Трансдермальные лекарственные формы включают пластыри "резервуарного типа" или "матричного типа", которые могут наноситься на кожу и истираются в течение конкретного периода времени, чтобы позволить проникновение желаемого количества активных ингредиентов.
Подходящие наполнители (например, носители и разбавители) и другие материалы, которые можно использовать для обеспечения трансдермальных, местных и для слизистых лекарственных форм, охваченных данным изобретением, хорошо известны специалистам в области фармации и зависят от конкретной ткани, на которую будут наносить данную фармацевтическую композицию или лекарственную форму. Смотри, например. Remington's Pharmaceutical Sciences (1980 и 1990) 16е и 18е издания. Mack Publishing, Easton, PA.
В зависимости от конкретной ткани, которую необходимо обработать, дополнительные компоненты можно применять до, вместе или после лечения активными ингредиентами настоящего изобретения. Например, усилители проникновения можно использовать для помощи в доставке активных ингредиентов к ткани.
Различные соли, гидраты или сольваты активных ингредиентов можно использовать для дополнительного регулирования свойств полученной композиции.
В конкретном варианте осуществления фармацевтические композиции настоящего изобретения можно составить в виде неводных мазей, неводных гелей или неводных пен.
Способы лечения
В некоторых вариантах осуществления настоящее изобретение представляет собой способ лечения пролиферативного нарушения, иммунного нарушения и кожного нарушения у субъекта, нуждающегося в этом. Способ включает накожное введение субъекту терапевтически эффективного количества фармацевтической композиции. Фармацевтическая композиция содержит фармацевтически эффективное количество активного фармацевтического ингредиента (API) - соединения, представленного следующей структурной формулой

по меньшей мере одно подкисляющее средство и по меньшей мере один фармацевтически приемлемый неводный растворитель. Значения и предпочтительные значения переменных в структурной формуле (I) являются такими, как определено в данном документе выше. Конкретные и необязательные компоненты и ингредиенты фармацевтических композиций, применимых в лечении пролиферативного нарушения, иммунного нарушения и кожного нарушения согласно способам настоящего изобретения, также были описаны выше.
В некоторых вариантах осуществления настоящее изобретение представляет собой способ лечения выбранного нарушения, выбранного из группы, состоящей из кожной Т-клеточной лимфомы, рака кожи, доброкачественных кожных новообразований, акне, псориаза, дерматита, актинического кератоза, базальноклеточной карциномы, нейрофиброматоза, лейкоза, злокачественной меланомы, алопеции и гиперпигментации кожи. В конкретном варианте осуществления нарушение выбрано из кожной Т-клеточной лимфомы, нейрофиброматоза, актинического кератоза, акне, базальноклеточной карциномы, псориаза, алопеции, пигментации кожи и дерматита.
Наборы, содержащие фармацевтические композиции настоящего изобретения
В некоторых вариантах осуществления настоящее изобретение представляет собой набор, содержащий первый контейнер и второй контейнер. Первый контейнер содержит активный фармацевтический ингредиент (API), представленный следующей структурной формулой
Значения и предпочтительные значения переменных в структурной формуле (I) определены в данном документе выше. Второй контейнер содержит основание-носитель. Основание-носитель включает по меньшей мере один фармацевтически приемлемый неводный растворитель и по меньшей мере одно подкисляющее средство. Конкретный фармацевтически приемлемый неводный растворитель и подкисляющие средства определены в данном документе выше.
В конкретном варианте осуществления первый контейнер содержит терапевтически эффективное количество API.
В различных вариантах осуществления набор может дополнительно содержать один или несколько из следующих компонентов: по меньшей мере один загуститель, по меньшей мере одно смачивающее средство, по меньшей мере одно смягчающее средство, по меньшей мере один усилитель проникновения через кожу и по меньшей мере один антиоксидант.Подходящие загустители, смачивающие средства, смягчающие средства, усилители проникновения через кожу и антиоксиданты определены в данном документе выше.
В некоторых вариантах осуществления набор дополнительно содержит третий контейнер, содержащий по меньшей мере один загуститель.
В некоторых вариантах осуществления второй контейнер содержит этанол, бензиловый спирт и лимонную кислоту. В других вариантах осуществления третий контейнер дополнительно содержит пропиленгликоль, гексиленгликоль, глицерин, диизопропиладипат, олеиловый спирт и бутилированный гидрокситолуол. В конкретном варианте осуществления третий контейнер дополнительно содержит пропиленгликоль, гексиленгликоль, глицерин, диизопропиладипат, олеиловый спирт и бутилированный гидрокситолуол.
Любой вариант осуществления набора может дополнительно содержать инструкции по применению такого набора. В некоторых вариантах осуществления инструкции включают этапы добавления содержимого первого контейнера во второй контейнер. В других вариантах осуществления инструкции включают этапы перемешивания содержимого первого, второго и третьего контейнеров.
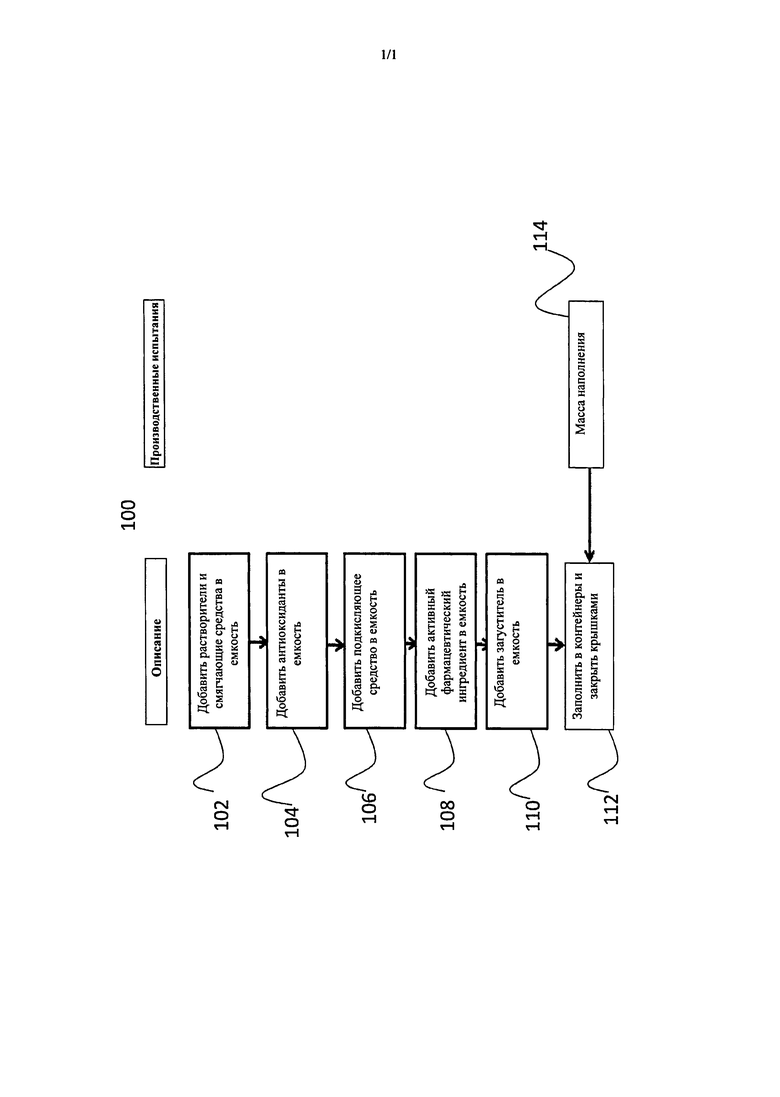
Ссылаясь на фигуру, один пример способа производства, который можно осуществить для получения фармацевтической композиции настоящего изобретения, представляет собой способ 100. На этапе 102 растворители и смягчающие средства добавляют в емкость. В конкретных вариантах осуществления растворители и смягчающие средства перемешивают до однородности. На этапе 104 один или несколько антиоксидантов добавляют в смесь. В конкретном варианте осуществления бутилированный гидрокситолуол добавляют в смесь и растворяют. На этапе 106 подкисляющее средство добавляют в емкость. В конкретном варианте осуществления безводную лимонную кислоту добавляют в смесь. На этапе 108 API добавляют в смесь. На этапе 110 загуститель добавляют в емкость. В конкретном варианте осуществления Klucel MF PH добавляют в смесь. На этапе 112 смесь переносят по аликвотам в желаемые контейнеры. Необязательно на этапе 114 массу наполнения каждого контейнера проверяют на точность.
ИЛЛЮСТРАТИВНЫЕ ПРИМЕРЫ
ПРИМЕР 1. Стабильность фармацевтических составов настоящего
изобретения
Материалы и способы
Используемый API представлял собой соединение со структурной формулой (II). Все используемые наполнители перечислены в Фармакопее США - Национальный формуляр (USP/NF). Вода и ацетонитрил для анализа HPLC были качества для HPLC. Прибор Orion 710A+ с электродом Ross Ultra (Thermo Electron Corp.) использовали для измерения pH. Образцы разбавляли 1/10 перед измерением pH для минимизации погрешностей контактной разности потенциалов при измерении. Вязкость (при 20±1°C) измеряли вискозиметром Brookfield LVF при 12 об./мин. со шпинделем №25 и 13R штативом. Затем образцы хранили при различных температурах, им позволили прийти в равновесие при температуре измерения вязкости в течение по меньшей мере 12 часов. Анализ HPLC выполняли при помощи системы HP 1050, оснащенной датчиком различных длин волн в УФ/видимой области спектра (UV/Vis). Метод градиентной HPLC подытожен в таблице 1.
Получение геля
Специалист в данной области сможет сделать вывод, что нижеприведенный способ можно модифицировать при необходимости для воспроизведения в масштабе.
Следующий способ в лабораторном масштабе применяли для производства гелеобразных составов фармацевтических композиций настоящего изобретения. (Во время данного способа емкость часть времени была открыта для того, чтобы вставить и управлять перемешивающими лопастями, присоединенными к верхнеприводной мешалке. Для компенсации испарения спирта использовали 2,0% избыток данного растворителя.)
1. Растворители и смягчающие средства добавили в подходящую емкость. Внесли магнитную мешалку, емкость закрыли и поместили плиту мешалки. Перемешивание продолжали, пока жидкости не стали однородными.
2. Пробку удалили, добавили BHT и вернули пробку на место. Раствор перемешивали, пока антиоксидант не растворится.
3. Пробку удалили, добавили кислоту и вернули пробку на место. Раствор перемешивали до однородности. Если использовали лимонную кислоту, порошок добавляли непосредственно в емкость. Если использовали фосфорную кислоту, ее взвешивали в небольшом стакане, затем прополаскивали емкость некоторым количеством запасного этанола.
4. Пробку удалили, добавили соединение (II) (только для активных составов) и вернули пробку на место. Раствор перемешивали до растворения активных веществ.
5. Пробку удалили, аккуратно удалили магнитный мешальник и вставили лопасть пропеллерной мешалки, присоединенную к верхнеприводной мешалке. Скорость перемешивания отрегулировали для формирования подходящего вихревого движения без образования лишних пустот или разбрызгивания.
6. Klucel MF PH медленно добавили в вортекс для диспергирования полимера. Скорость перемешивания отрегулировали так, чтобы состав загустевал для поддержания тщательного перемешивания лекарственного продукта без излишнего аэрирования. Емкость частично накрывали для минимизации испарения.
7. Приблизительно через 20-30 минут после добавления полимера загустевание доходило до точки, где лопасти мешалки недостаточно для поддержания тщательного перемешивания всего состава. Лопасть мешалки аккуратно удаляли, и состав стекал с лопасти в емкость (этому способствовала обработка шпателем).
8. Вводили подходящую лапу якоря, присоединенную к верхнеприводной мешалке, и продолжали перемешивание с подходящей скоростью. Емкость частично накрывали для минимизации испарения.
9. Приблизительно через 2 часа после добавления полимера гель становился однородным со слегка пятнистым внешним видом. Для минимизации испарения, пока полимер продолжал разбухать, якорную мешалку аккуратно удаляли (позволяя гелю стечь в емкость) и емкость закрывали.
10. Емкость хранили при комнатной температуре, защищая от света в течение 12-18 часов. После хранения гель повторно перемешивали в течение дополнительных 15 минут. После того, как последнее перемешивание закончили, гель заполняли в подходящий контейнер.
Результаты
В нейтральном этаноле при комнатной температуре соединение (II) разлагается на приблизительно 50% за 24 часа.
Шесть активных партий получили в размере 350 г. Уровень лимонной кислоты незначительно снизили так, что pH приблизился к 4,0. Их композиции и предварительные результаты подытожены в таблицах 2A-2B и таблицах 3A-3B, соответственно.
Результаты 6-месячного исследования стабильности составов A, B и C представлены ниже в таблицах 4-8.
1 месяц, 25°C
1 месяц, 2-8°C
98,4
99,9
98,5
99,8
98,2
99,4
1 месяц, 25°C
1 месяц, 2-8°C
99,8
99,7
100,3
99,9
99,8
99,6
1 месяц, 25°C
1 месяц, 2-8°C
3,92
3,84
3,80
3,97
3,90
3,99
1 месяц, 25°C
1 месяц, 2-8°C
19200
20400
22400
22000
20000
21600
1 месяц, 25°C
1 месяц, 2-8°C
Соответствует1
Соответствует1
Соответствует1
Соответствует1
Соответствует1
Соответствует1
2 месяц, 25°C
2 месяц 2-8°C
97,1
99,1
96,9
98,8
96,5
98,6
2 месяца, 25°C
2 месяца, 2-8°C
99,5
99,8
99,7
99,8
99,5
99,5
2 месяца, 25°C
20400
20800
23200
21200
22800
23200
Соответствует1 Соответствует1
Соответствует1 Соответствует1
Соответствует1 Соответствует1
3 месяца, 25°C
3 месяца, 2-8°C
96,4
98,6
96,1
98,3
95,6
97,5
3 месяца, 25°C
3 месяца, 2-8°C
99,7
99,5
99,7
99,4
99,6
99,9
3 месяца, 25°C 3 месяца, 2-8°C
3,95
3,82
3,81
3,84
3,96
4,05
24000
22800
24400
23200
24000
24800
3 месяца, 25°C
3 месяца, 2-8°C
Соответствует1
Соответствует1
Соответствует1
Соответствует1
Соответствует1
Соответствует1
6 месяцев, 25°C
6 месяцев 2-8°C
95,0
97,9
94,5
97,7
93,4
96,9
6 месяцев 2-8°C
6 месяцев, 25°C
6 месяцев 2-8°C
3,85
3,94
3,95
6 месяцев, 25°C
6 месяцев 2-8°C
23600
22000
23600
22400
25200
23600
6 месяцев 2-8°C
Соответствует1
Соответствует1
Соответствует1
Результаты 3-месячного исследования стабильности составов Е и F представлены ниже в таблице 9.
3 месяца, 25°C
3 месяца, 2-8°C
100,6
99,7
3 месяца, 25°C
3 месяца, 2-8°C
99,3
100,6
103,3
103,8
3 месяца, 25°C
3 месяца, 2-8°C
3,90
3,90
4,00
4,00
3 месяца, 25°C
3 месяца, 2-8°C
20800
21550
25435
25288
3 месяца, 25°C
3 месяца, 2-8°C
Соответствует1
Соответствует1
Соответствует1
Соответствует1
Результаты 6-месячного исследования стабильности состава F представлены ниже в таблице 10.
6 месяцев, 25°C
6 месяцев, 2-8°C
99,5
100,5
6 месяцев, 25°C
6 месяцев, 2-8°C
99,5
100,3
6 месяцев, 25°C
6 месяцев, 2-8°C
4,00
3,80
6 месяцев, 25°C
6 месяцев, 2-8°C
25448
24042
6 месяцев, 25°C
6 месяцев, 2-8°C
Соответствует1
Соответствует1
Результаты 6-месячного исследования стабильности состава Е представлены в таблицах 11 и 12.
Результаты 12-месячного исследования стабильности составов A и F представлены в таблицах 13 и 14.
Выводы
В нейтральном этаноле при комнатной температуре соединение (II) разлагается на приблизительно 50% за 24 часа.
Было обнаружено, что соединение (II) можно успешно составлять в подкисленный неводный гель с приемлемым косметическим результатом. При обычных температурных условиях в охлаждаемом хранилище (2-8°C) растворимость при насыщении состава для соединения (II) составляла приблизительно 1,6% вес/вес. Не произошло значительного изменения внешнего вида, pH или данных BHT-анализа для 1% гелей соединения (II) после хранения при 2-8°C (3 месяца), 25°C (3 месяца) или 40°C (2 недели). Вязкость для носителя и активных гелей показала небольшое увеличение при хранении при 2-8 или 25°C, что типично для неводных гелей Klucel. Небольшое увеличение вязкости влияло на текучесть или растекаемость (оцененные только для гелей носителя). Концентрация соединения (II) снижалась в среднем на 1,9 или 4,0% через три месяца хранения при 2-8 или 25°C, соответственно. Воздействие лабораторного света в течение до пяти дней значительно не влияло на результаты анализов для соединения (II). Все образцы прошли идентификацию и были прозрачными, бесцветными, вязкими гелеобразными растворами. Все результаты анализа, загрязненности и BHT образцов представляют собой среднее трех повторных приготовлений с верхней, средней и нижней части отдельных бутылей.
ПРИМЕР 2. Примеры составов наборов
Местные составы соединения (II) получили из набора, который содержит следующие компоненты: флакон с порошком соединения (II), флакон с растворителем и контейнер с концентратом геля. Все эти три компонента стабильны при контролируемой комнатной температуре. Во время распределения содержимое флакона с растворителем добавили во флакон с соединением (II) для растворения соединения. После того как соединение (II) растворилось, раствор добавили в концентрат геля и затем смешали с помощью подходящего устройства (т.е. шпателя) до однородности.
Примеры наборов с тремя отделениями для двух составов описаны ниже в таблице 15 и таблице 16.
Для 30 грамм загущенного раствора с конечной концентрацией соединения (II) 1% применяли следующие веса каждого компонента: 0,3 г соединения (II), 10,0 г растворителя и 19,7 г концентрата геля.
Для 30 грамм загущенного раствора с конечной концентрацией соединения (II) 1%, используя состав B, применяли следующие веса каждого компонента: 0,3 г соединения (II), 7,5 г растворителя и 22,2 г концентрата геля.
Для обоих примеров выше однородный загущенный состав получили за менее чем 4 минуты перемешивания. Составы соединения (II), полученные из набора с тремя отделениями, были стабильны в течение по меньшей мере одного месяца при контролируемой комнатной температуре или в холодильнике.
ПРИМЕР 3. Оценка впитывания через кожу соединения (II) in vitro при помощи модели Франца для конечной дозы в коже человека
В этом примере использовали растворы А и В, как описано выше. Контрольный раствор ("Ctrl") представлял собой 1% по весу раствор соединения (II) в DMSO.
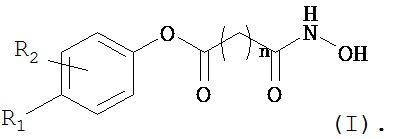
Три тестовых состава, содержащих соединение (II) - A, B и Ctrl, тестировали в трех повторностях срезов от двух различных ex vivo людей-доноров кожи с торса в отношении впитывания через кожу соединения (II) и в отношении появления соединения (III), изображенного ниже, метилпарабена и 4-OH-бензойной кислоты в течение 24-часового периода дозирования. В предварительно установленные моменты времени после нанесения дозы раствор рецепторов кожи удалили полностью, заменили свежим раствором рецепторов и аликвоту сохранили для последующего анализа. К тому же, роговой слой, эпидермис и дерму восстановили и оценили на содержание лекарственного средства. Образцы анализировали на содержание соединения (II), соединения структурной формулы (III)
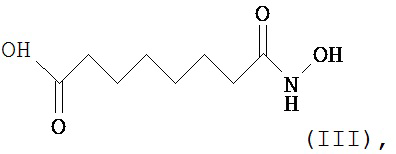
метилпарабена

и 4-OH бензойной кислоты при помощи высокоэффективной жидкостной хроматографии (HPLC).
Материалы и способы
Модель Франца in vitro для конечной дозы в коже человека оказалась ценным инструментом для исследования впитывания через кожу и определения фармакокинетики местно наносимых лекарственных средств. В модели используют ex vivo кожу трупа человека или после хирургических операций, приготовленную в специально разработанных диффузионных ячейках, что позволяет сохранять кожу при температуре и влажности, которые соответствуют обычным in vivo условиям. Конечную дозу (например, 4-7 мг/см2) состава наносят на внешнюю поверхность кожи и измеряют абсорбцию лекарственного средства путем контроля скорости его появления в растворе рецепторов, промывающего внутреннюю поверхность кожи. Данные, определяющие общую абсорбцию, скорость абсорбции, а также содержание в коже, можно точно определить в данной модели. Способ имел исторический прецедент для точного прогнозирования кинетики in vivo впитывания через кожу.
Соединение (II) разлагается до менее сильнодействующих соединений, а именно соединения (III) и метилпарабена. Соединение (III) может подвергаться дальнейшему разложению до субериновой кислоты. Метилпарабен может подвергаться разложению до 4-OH-бензойной кислоты.
В данном исследовании определяли количество соединения (II), соединения (III), метилпарабена и 4-OH-бензойной кислоты в собранных образцах.
Подготовка кожи для исследования
Впитывание через кожу измеряли при помощи техники Франца in vitro для конечной дозы в коже человека. Ех vivo кожу с туловища человека без явных признаков кожного заболевания, полученную в течение 24-48 часов после смерти, использовали в данном исследовании. Ее дерматомировали, подготовили для криоконсервирования, герметизировали в водонепроницаемый пластиковый пакет и хранили при приблизительно -70°C до дня проведения эксперимента. Перед применением ее размораживали в воде при приблизительно 37°C, затем промывали в воде для удаления любой прилипшей крови или другого материала с поверхности.
Кожу от одного донора нарезали на множество небольших фрагментов, достаточно больших для размещения в фиксированных 1,0 см2 диффузионных ячейках Франца. Камеру для кожи заполняли полностью раствором из резервуара с фосфатным буферным изотоническим солевым раствором (PBS), pH 7,4±0,1, и эпидермальные клетки (трубка) оставили открытыми для окружающих условий в лаборатории.
Все ячейки установили в диффузионный аппарат, в котором раствор для промывки кожи перемешивали магнитно при приблизительно 600 об./мин. и поддерживали температуру поверхности кожи при 32,0°C±1,0°C.
Для обеспечения чистоты каждого фрагмента кожи их проницаемость для тритиевой воды определяли перед нанесением тестовых продуктов. Следом за коротким (0,5-1 час) периодом равновесия нанесли слой 3H2O (NEN, Boston, MA, спец. активность приблизительно 0,5 мкКи/мл) по верхней части кожи так, что вся открытая поверхность была покрыта (приблизительно 200-500 мкл). Через 5 минут водный слой 3H2O удалили. Через 30 минут раствор рецепторов собрали и анализировали на содержание радиоактивности посредством подсчета при помощи жидких сцинтилляторов. Образцы кожи, в которых абсорбция 3H2O была менее 1,56 мкл-экв./см2, считали приемлемыми.
Дозирование и сбор образцов
Непосредственно перед дозированием взяли предварительно дозированный образец и заменили раствор из резервуара свежим раствором 0,1х PBS с 0,1% Volpo и 0,05% лимонной кислоты (номинальный pH 6,0). Трубку удалили из диффузионной ячейки Франца, чтобы обеспечить полный доступ к эпидермальной поверхности кожи. Все составы затем наносили на фрагменты кожи при помощи комплекта пипеток-шприцев для доставки 5 мкл состава/см2. Дозу равномерно распределили по коже при помощи стеклянной палочки. Палочку оставили для анализа для корректировки наносимой дозы. Через пять-десять минут после нанесения трубчатую часть диффузионной ячейки Франца вернули на место. В предварительно выбранные моменты времени после дозирования (6, 12 и 24 часа) раствор из резервуара удалили полностью, заменили свежим раствором из резервуара, а аликвоту предварительно определенного объема сохраняли для последующего анализа.
Были доступны запасные диффузионные ячейки без внесенной дозировки, которые, однако, применяли для оценки на появление веществ, диффундирующих из кожи, что может оказывать влияние на аналитический способ.
После того, как последний образец отобрали, поверхности промыли дважды (объемом 0,5 мл каждый) этанолом с 0,05% лимонной кислоты для сбора неабсорбированного состава с поверхности кожи. После промывки кожу разрезали на ленты для удаления рогового слоя. Ленточные соскобы экстрагировали в течение ночи в чистом ацетонитриле. Кожу затем удалили из камеры, разделили на эпидермис и дерму. Каждый экстрагировали в течение ночи в смеси этанола и 0,05% лимонной кислоты на водном льду.
Аналитические способы Образцы анализировали при помощи HPLC/MS и/или HPLC/UV.
Результаты
Результаты представлены в таблице 17 и таблице 18 ниже. (В таблицах 17 и 18 введение "0" означает, что параметр был ниже низшего предела количественного определения.)
Вывод
При использовании in vitro модели конечной дозы данные демонстрируют, что соединение (II) проникает в и через ex vivo кожу человека из составов A и Ctrl, но не из состава B (смотри таблицу 2 для составов A и B).
Профиль проникания для соединения (II) предполагает, что фактически вся чрескожная абсорбция через кожу происходит в течение 5 часов после нанесения дозы у составов А и Ctrl, и соединение (II) не наблюдалось в растворе из резервуара из состава В. Основная часть определяемого соединения (II) находилась в промывке поверхности (приблизительно 20-69%), за которой следует эпидермис (приблизительно 0,3-0,9%).
Данные также указывают на то, что все продукты разложения, которые оценили количественно (соединение (III), метилпарабен (структурная формула (IV)) и 4-OH-бензойная кислота), наблюдали как присутствующие в большинстве образцов.
Кроме того, наблюдалось, что степень разложения зависит от состава, причем большее разложение наблюдали в образцах, дозированных составом Ctrl, а затем составом A и составом B.
Общий материальный баланс (на основе количества дозы соединения (II)), как сумма всех измеренных соединений, продемонстрировал приблизительно 71% восстановления из фрагментов кожи с дозой состава В, приблизительно 55% из фрагментов кожи с дозой состава A, и приблизительно 51% из фрагментов кожи с дозой состава Ctrl. Неучтенная доза может показывать другие продукты распада, которые не были количественно учтены, или связывание выбранных соединений с поверхностями ткани или системы камер.
Хотя данное изобретение было, в частности, показано и описано со ссылкой на пример его вариантов осуществления, специалисту в данной области техники будет понятно, что различные изменения в форме и деталях можно внести в него без отклонения от объема настоящего изобретения, охваченного приложенной формулой изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИЯ ДЛЯ МЕСТНОГО ПРИМЕНЕНИЯ | 2018 |
|
RU2807884C2 |
| КОМПОЗИЦИЯ ДЛЯ МЕСТНОГО ПРИМЕНЕНИЯ, ВКЛЮЧАЮЩАЯ ТАКРОЛИМУС | 2017 |
|
RU2741504C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ НОГТЕЙ | 2008 |
|
RU2519664C2 |
| Антиперспирантные композиции | 2015 |
|
RU2700412C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ СПИРО-ОКСИНДОЛЬНОГО СОЕДИНЕНИЯ ДЛЯ МЕСТНОГО ВВЕДЕНИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ТЕРАПЕВТИЧЕСКИХ АГЕНТОВ | 2011 |
|
RU2596488C2 |
| ЖИДКИЕ КОМПОЗИЦИИ РИФАКСИМИНА | 2020 |
|
RU2823287C1 |
| ПИМЕКРОЛИМУСНАЯ ПЕННАЯ КОМПОЗИЦИЯ, ВКЛЮЧАЮЩАЯ ГЕКСИЛЕНГЛИКОЛЬ, НЕОБЯЗАТЕЛЬНО ОЛЕИЛОВЫЙ СПИРТ, ДИМЕТИЛИЗОСОРБИД И/ИЛИ ТРИГЛИЦЕРИДЫ СО СРЕДНИМИ ЦЕПЯМИ | 2005 |
|
RU2375044C2 |
| КОМПОЗИЦИЯ ДЛЯ МЕСТНОГО ПРИМЕНЕНИЯ | 2019 |
|
RU2806765C2 |
| ТРАНСДЕРМАЛЬНЫЕ СИСТЕМЫ ДОСТАВКИ МЕМАНТИНА | 2017 |
|
RU2764764C2 |
| СОСТАВ ДЛЯ МЕСТНОГО ПРИМЕНЕНИЯ | 1995 |
|
RU2181592C2 |
Описана фармацевтическая композиция для местного применения, содержащая терапевтически эффективное количество активного фармацевтического ингредиента (API) - соединения, представленного структурной формулой (I), по меньшей мере одно подкисляющее средство и основание-носитель, содержащее по меньшей мере один фармацевтически приемлемый неводный растворитель. Подкисляющее средство выбрано из лимонной кислоты, уксусной кислоты и фосфорной кислоты. Измеренное значение рН фармацевтической композиции составляет от 3 до 5. Предпочтительно фармацевтически приемлемый неводный растворитель представляет собой смесь этанола и пропиленгликоля. Также описаны набор для получения фармацевтической композиции и способ лечения пролиферативного, иммунного и кожного нарушения у субъекта. Согласно изобретению получена стабилизированная фармацевтическая композиция. Значения n, R1 и R2 в структурной формуле (I) определены в формуле изобретения. 4 н. и 22 з.п. ф-лы, 1 ил., 18 табл., 3 пр.

1. Фармацевтическая композиция для местного применения, содержащая:
терапевтически эффективное количество активного фармацевтического ингредиента (API) - соединения, представленного следующей структурной формулой
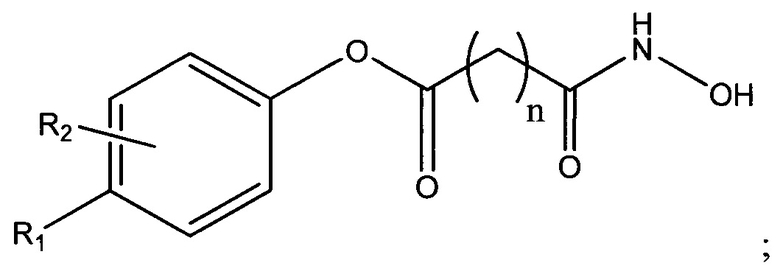
по меньшей мере одно подкисляющее средство и
основание-носитель, содержащее по меньшей мере один фармацевтически приемлемый неводный растворитель,
где
n равно 6;
R1 представляет собой -CO2RA;
RA представляет собой С1-С12-алкил; и
R2 представляет собой водород;
по меньшей мере одно подкисляющее средство выбрано из лимонной кислоты, уксусной кислоты и фосфорной кислоты; и
измеренное значение рН фармацевтической композиции составляет от приблизительно 3 до приблизительно 5.
2. Фармацевтическая композиция по п. 1, где RA представляет собой -СН3.
3. Фармацевтическая композиция по п. 2, где по меньшей мере одно подкисляющее средство выбрано из лимонной кислоты и фосфорной кислоты.
4. Фармацевтическая композиция по п. 2 или 3, где по меньшей мере один фармацевтически приемлемый неводный растворитель выбран из группы, состоящей из этанола, ацетона, бензилового спирта, 2-(2-этоксиэтокси)этанола, моноэтилового эфира диэтиленгликоля, глицерина, пропиленгликоля, пропиленкарбоната, ацетона, гексиленгликоля, изопропилового спирта, полиэтиленгликолей (PEG), метоксиполиэтиленгликолей, диэтилсебацината, диметилизосорбида, пропиленкарбоната, диметилсульфоксида (DMSO), диизопропиладипата, изопропилмиристата, растительных масел, минерального масла и изопропилпальмитата.
5. Фармацевтическая композиция по п. 2 или 3, дополнительно включающая по меньшей мере одно смачивающее средство, выбранное из группы, состоящей из гексиленгликоля, глицерина, пропиленгликоля, сорбита, молочной кислоты, лактата натрия, маннита, бутиленгликоля, пантенола, гиалуроновой кислоты, мочевины, хитозана, полиолов, метилглюцета-10, метилглюцета-20 и полиэтиленгликолей.
6. Фармацевтическая композиция по п. 2 или 3, дополнительно включающая по меньшей мере одно смягчающее средство, выбранное из группы, состоящей из диизопропиладипата, изопропилмиристата, изопропилпальмитата, цетеарилоктаноата, изопропилизостеарата, миристиллактата, октилдодеканола, олеилового спирта, минерального масла, вазелина, растительного масла, PPG-15 стеарилового эфира, PEG-4 дилаурата, лецитина, ланолина, ланолинового спирта, полиоксил 75 ланолина, холестерина, воска цетиловых сложных эфиров, цетостеарилового спирта, глицерилмоностеарата, триглицеридов каприновой и каприловой кислот, диметикона и циклометикона.
7. Фармацевтическая композиция по п. 2 или 3, дополнительно включающая по меньшей мере одно смачивающее средство и по меньшей мере одно смягчающее средство.
8. Фармацевтическая композиция по п. 7, где по меньшей мере одно смачивающее средство выбрано из глицерина и гексиленгликоля, и где по меньшей мере одно смягчающее средство выбрано из диизопропиладипата и олеилового спирта.
9. Фармацевтическая композиция по п. 2 или 3, дополнительно включающая по меньшей мере один усилитель проникновения через кожу, выбранный из одного или нескольких из олеилового спирта, пропиленгликоля и этанола.
10. Фармацевтическая композиция по п. 2 или 3, дополнительно включающая по меньшей мере один гелеобразующий агент, представляющий собой гидроксипропилцеллюлозу.
11. Фармацевтическая композиция по п. 2 или 3, дополнительно включающая по меньшей мере один антиоксидант, выбранный из группы, состоящей из альфа-токоферола, бета-токоферола, дельта-токоферола, гамма-токоферола, токоферолов, аскорбиновой кислоты, аскорбилпальмитата, бутилированного гидроксианизола (ВНА), бутилированного гидрокситолуола (ВНТ), фумаровой кислоты, яблочной кислоты, метионина, пропилгаллата, аскорбата натрия, метабисульфата натрия, тиосульфата натрия, бисульфата натрия.
12. Фармацевтическая композиция по п. 2 или 3, содержащая по меньшей мере 0,01% по весу API, предпочтительно по меньшей мере 0,1% по весу API, еще более предпочтительно по меньшей мере 0,5% по весу API.
13. Фармацевтическая композиция по п. 2 или 3, содержащая по меньшей мере 0,5% по весу API,
где основание-носитель содержит смесь этанола и пропиленгликоля; и
где измеренное значение рН фармацевтической композиции составляет от приблизительно 3 до 4.
14. Фармацевтическая композиция по п. 13, где по меньшей мере одно подкисляющее средство выбрано из лимонной кислоты и фосфорной кислоты.
15. Фармацевтическая композиция по п. 13, дополнительно включающая по меньшей мере одно смачивающее средство, выбранное из глицерина и гексиленгликоля.
16. Фармацевтическая композиция по п. 13, дополнительно включающая по меньшей мере одно смягчающее средство, выбранное из диизопропиладипата и олеилового спирта.
17. Фармацевтическая композиция по п. 13, дополнительно включающая по меньшей мере один усилитель проникновения, выбранный из этанола, пропиленгликоля или олеилового спирта.
18. Фармацевтическая композиция по п. 13, дополнительно включающая гидроксипропилцеллюлозный гелеобразующий агент.
19. Фармацевтическая композиция для местного применения, содержащая:
по меньшей мере 0,01% по весу активного фармацевтического ингредиента (API) - соединения, представленного следующей структурной формулой

по меньшей мере одно подкисляющее средство и
по меньшей мере один фармацевтически приемлемый неводный растворитель,
где
n равно 6, R2 представляет собой водород, R1 представляет собой -C(O)ORA, RA представляет собой С1-С12-алкил;
по меньшей мере один фармацевтически приемлемый неводный растворитель представляет собой смесь этанола и пропиленгликоля;
по меньшей мере одно подкисляющее средство выбрано из одной или нескольких из лимонной кислоты и фосфорной кислоты, и измеренное значение рН фармацевтической композиции составляет от приблизительно 3 до приблизительно 5,
причем фармацевтическая композиция дополнительно необязательно включает одно или несколько из следующего:
по меньшей мере одно смачивающее средство, выбранное из глицерина и гексиленгликоля;
по меньшей мере одно смягчающее средство, выбранное из диизопропиладипата и олеилового спирта;
по меньшей мере один усилитель проникновения, выбранный из этанола, пропиленгликоля или олеилового спирта;
гидроксипропилцеллюлозный гелеобразующий агент и
бутилированный гидрокситолуол в качестве антиоксиданта.
20. Фармацевтическая композиция по п. 19, где API представляет собой соединение, представленное следующей структурной формулой

21. Способ лечения нарушения у субъекта, нуждающегося в этом, включающий:
накожное введение субъекту терапевтически эффективного количества фармацевтической композиции, где нарушение выбирают из пролиферативного нарушения, иммунного нарушения и кожного нарушения, причем указанная фармацевтическая композиция содержит:
фармацевтически эффективное количество активного фармацевтического ингредиента (API) - соединения, представленного следующей структурной формулой
по меньшей мере одно подкисляющее средство и
по меньшей мере один фармацевтически приемлемый неводный растворитель,
где
n равно 6;
R1 представляет собой -CO2RA;
RA представляет собой С1-С12-алкил; и
R2 представляет собой водород;
по меньшей мере одно подкисляющее средство выбрано из лимонной кислоты, уксусной кислоты и фосфорной кислоты; и
измеренное значение рН фармацевтической композиции составляет от приблизительно 3 до приблизительно 5.
22. Способ по п. 21, где RA представляет собой -СН3.
23. Способ по п. 21, где фармацевтическая композиция содержит
по меньшей мере 0,01% по весу активного фармацевтического ингредиента (API) - соединения, представленного следующей структурной формулой
по меньшей мере одно подкисляющее средство и
по меньшей мере один фармацевтически приемлемый неводный растворитель,
где
n равно 6, R2 представляет собой водород, R1 представляет собой -C(O)ORA и RA представляет собой С1-С12алкил;
по меньшей мере один фармацевтически приемлемый неводный растворитель представляет собой смесь этанола и пропиленгликоля;
по меньшей мере одно подкисляющее средство выбрано из одной или нескольких из лимонной кислоты и фосфорной кислоты, и кислотность фармацевтической композиции составляет от рН 3 до рН 4,
фармацевтическая композиция дополнительно необязательно включает одно или несколько из следующего:
по меньшей мере одно смачивающее средство, выбранное из глицерина и гексиленгликоля;
по меньшей мере одно смягчающее средство, выбранное из диизопропиладипата и олеилового спирта;
по меньшей мере один усилитель проникновения, выбранный из этанола, пропиленгликоля или олеилового спирта; и
гидроксипропилцеллюлозный гелеобразующий агент и
бутилированный гидрокситолуол в качестве антиоксиданта.
24. Способ по п. 21, где API представляет собой соединение, представленное следующей структурной формулой
25. Способ по п. 21, где нарушение выбирают из нарушения, выбранного из группы, состоящей из кожной Т-клеточной лимфомы, рака кожи, доброкачественного кожного новообразования, акне, псориаза, дерматита, актинического кератоза, базальноклеточной карциномы, нейрофиброматоза, лейкоза, злокачественной меланомы, алопеции и гиперпигментации кожи.
26. Набор для получения фармацевтической композиции для местного применения, при этом указанный набор содержит:
первый контейнер, содержащий активный фармацевтический ингредиент (API) - соединение, представленное следующей структурной формулой
 и
и
второй контейнер, содержащий основание-носитель, содержащее по меньшей мере один фармацевтически приемлемый неводный растворитель и по меньшей мере одно подкисляющее средство, где
n равно 6;
R1 представляет -CO2RA;
RA представляет собой С1-С12-алкил и R2 представляет собой водород;
по меньшей мере одно подкисляющее средство выбрано из лимонной кислоты, уксусной кислоты и фосфорной кислоты; и
измеренное значение рН фармацевтической композиции составляет от приблизительно 3 до приблизительно 5.
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Safety, Pharmacodynamics (PD), Pharmacokinetics (PK) Study of SHP141 in 1A, 1B, or 2A Cutaneous T-Cell Lymphoma (CTCL), 09.11.2011 - найдено в интернет | |||
| Объектив с жидкой преломляющей средой | 1929 |
|
SU13769A1 |
| НОВЫЕ ЭФИРЫ ГИДРОКСАМОВЫХ КИСЛОТ И ИХ ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2004 |
|
RU2357952C2 |
Авторы
Даты
2017-07-18—Публикация
2011-10-13—Подача