ПРИТЯЗАНИЕ НА ПРИОРИТЕТ
По настоящей заявке испрашивается приоритет по временной патентной заявке США с серийным номером № 61/593555, поданной 1 февраля 2012 года, а также по временной патентной заявке США с серийным номером № 61/625222, поданной 17 апреля 2012 года.
ПОЛОЖЕНИЕ В СООТВЕТСТВИИ С 37 C.F.R. § 1.821(c) или (e) - СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ, ПРЕДОСТАВЛЕННЫЙ В КАЧЕСТВЕ ТЕКСТОВОГО ФАЙЛА ASCII
В соответствии с 37 C.F.R. § 1.821(c) или (e), файл, содержащий текстовую версию ASCII списка последовательностей, предоставлен совместно с настоящей заявкой.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к композициям и способам генетического кодирования и экспрессии полипептидов, которые нацеливаются в пластиды содержащих пластиды клеток. В определенных вариантах осуществления изобретение относится к аминокислотным последовательностям, которые нацеливают полипептиды в хлоропласты (например, высших растений), и/или к молекулам нуклеиновых кислот, кодирующим их. В определенных вариантах осуществления изобретение относится к химерным полипептидам, содержащим аминокислотную последовательность, которая контролирует транспорт химерных полипептидов в пластиды, и/или к молекулам нуклеиновых кислот, кодирующим их.
УРОВЕНЬ ТЕХНИКИ
Клетки растений содержат различные субклеточные органеллы, в общем называемые "пластидами", которые ограничены характерными мембранными системами и выполняют специализированные функции в клетке. Конкретные пластиды ответственны за фотосинтез, а также за синтез и запасание определенных химических соединений. Все пластиды происходят из пропластид, которые присутствуют в меристематических областях растения. Пропластиды могут развиваться, например, в: хлоропласты, этиопласты, хромопласты, геронтопласты, лейкопласты, амилопласты, элайопласты и протеинопласты. Пластиды существуют полуавтономным образом в клетке, они включают их собственную генетическую систему и аппарат синтеза белков, однако они зависят от тесного взаимодействия с ядерно-цитоплазматической системой в их развитии и биосинтетической активности.
В фотосинтезирующих клетках листьев высших растений наиболее заметными пластидами являются хлоропласты. Наиболее важной функцией хлоропластов является проведение запускаемых светом реакций фотосинтеза. Однако хлоропласты также осуществляют многие другие важные для клетки растения биосинтетические процессы. Например, все жирные кислоты клетки производятся ферментами в строме хлоропластов с использованием ATP, NAOPH и углеводов, которые свободно доступны в них. Более того, восстанавливающая мощность активируемых светом электронов обеспечивает восстановление нитрита (NO2-) в аммиак (NH3) в хлоропластах; этот аммиак обеспечивает растение азотом, требуемым для синтеза аминокислот и нуклеотидов.
Хлоропласт также принимает участие в процессах, имеющих особое значение для агрохимической промышленности. Например, известно, что многие гербициды действуют, блокируя функции, которые выполняют хлоропласты. В недавних исследованиях была идентифицирована конкретная мишень нескольких гербицидов. Например, происходящие из триазинов гербициды ингибируют фотосинтез путем вытеснения молекулы пластохинона из его участка связывания в полипептиде массой 32 кДа фотосистемы II. Этот полипептид массой 32 кДа кодируется в геноме хлоропластов и синтезируется аппаратом органелл. Также были получены мутантные растения, которые являются устойчивыми к триазиновым гербицидам. Эти растения содержит мутантный полипептид массой 32 кДа, из которого пластохинон более не вытесняется триазиновыми гербицидами. Сульфонилмочевины ингибируют ацетолактатсинтазу в хлоропласте. Ацетолактатсинтаза вовлечена в синтез изолейцина и валина. Глифосат ингибирует функцию 5-енолпирувил-3-фосфошикиматсинтазы (EPSPS), которая представляет собой фермент, вовлеченный в синтез ароматических аминокислот. Все эти ферменты кодируются ядерным геномом, однако они перемещаются в хлоропласт, где происходит фактический синтез аминокислот.
Большинство белков хлоропластов кодируются в ядре клетки растения, синтезируются в качестве более крупных белков-предшественников в цитозоле и посттрансляционно импортируются в хлоропласт. Импорт через наружную и внутреннюю мембраны оболочки в строму является основным путем вхождения в белки, предназначенные для поступления в строму, мембрану тилакоида и просвет тилакоида. Локализация импортированных белков-предшественников в мембране тилакоида и просвете тилакоида осуществляется четырьмя различными механизмами, включая два из них, которые гомологичны системам транспорта бактериальных белков. Таким образом, механизмы локализации белка в хлоропластах частично происходят из прокариотического эндосимбионта. Cline and Henry (1996), Annu. Rev. Cell. Dev. Biol. 12:1-26.
Белки-предшественники, предназначенные для экспрессии в хлоропластах, содержат N-концевые удлинения, известные как транзитные пептиды хлоропластов (CTP). Транзитный пептид является инструментом для специфического распознавания поверхности хлоропластов и для опосредования посттрансляционного перемещения пребелков через оболочку хлоропластов, и, таким образом, в различные субкомпартменты в хлоропласте (например, строма, тилакоид и мембрана тилакоида). Эти N-концевые транзитные пептидные последовательности содержат всю информацию, необходимую для импорта белка хлоропластов в пластиды; транзитные пептидные последовательности необходимы и достаточны для импорта в пластиду.
Гены растений, содержащие, согласно сообщениям, естественным образом кодируемые транзитные пептидные последовательности на их N-конце, включают малую хлоропластную субъединицу рибулозо-1,5-бисфосфаткарбоксилазы (RuBisCo) (de Castro Silva-Filho et al. (1996), Plant Mol. Biol. 30:769-80; Schnell et al. (1991), J. Biol. Chem. 266:3335-42); EPSPS (см., например, Archer et al. (1990), J. Bioenerg. and Biomemb. 22:789-810 и патенты США 6867293, 7045684 и Re. 36449); триптофансинтазы (Zhao et al. (1995), J. Biol. Chem. 270:6081-7); пластоцианина (Lawrence et al. (1997), J. Biol. Chem. 272:20357-63); хоризматсинтазы (Schmidt et al. (1993), J. Biol. Chem. 268:27447-57); аккумулирующий световую энергию белок, связывающий хлорофилл a/b, (LHBP) (Lamppa et al. (1988), J. Biol. Chem. 263:14996-14999); и белок хлоропластов Arabidopsis thaliana (Lee et al. (2008), Plant Cell 20:1603-22). В публикации заявки на патент США № US 2010/0071090 описаны определенные нацеливающие хлоропласты пептиды из Chlamydomonas sp.
Однако структурные требования к информации, кодируемой нацеливающими в хлоропласты пептидами, остаются неясными вследствие их высокого уровня разнообразия последовательности и отсутствия общих или консенсусных мотивов последовательности, хотя возможно, что они являются отдельными подгруппами нацеливающих в хлоропласты пептидов с независимыми структурными мотивами. Lee et al. (2008), выше. Кроме того, не все из этих последовательностей пригодны для гетерологичной экспрессии нацеленных в хлоропласты белков в высших растениях.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем описании описаны композиции и способы для нацеливания полипептидов в растении в пластиды. В некоторых вариантах осуществления композиция содержит молекулу нуклеиновой кислоты, содержащую по меньшей мере одну нуклеотидную последовательность, кодирующую синтетический происходящий из Brassica транзитный пептид хлоропластов (например, пептид TraP12 или TraP13), функционально связанный с представляющей интерес нуклеотидной последовательностью. В конкретных вариантах осуществления такие молекулы нуклеиновой кислоты могут быть полезными для экспрессии и нацеливания полипептида, кодируемого представляющей интерес нуклеотидной последовательностью, в однодольном и двудольном растении. Кроме того, описаны векторы, содержащие молекулу нуклеиновой кислоты, содержащую по меньшей мере одну нуклеотидную последовательность, кодирующую синтетический происходящий из Brassica транзитный пептид хлоропластов, функционально связанный с представляющей интерес нуклеотидной последовательностью.
В некоторых вариантах осуществления, нуклеотидная последовательность, кодирующая синтетический происходящий из Brassica CTP, может представлять собой нуклеотидную последовательность, которая происходит из эталонной нуклеотидной последовательности, полученной из гена Brassica sp. (например, B. napus, B. rapa, B. juncea и B. carinata), или ее функциональный вариант. В некоторых вариантах осуществления, нуклеотидная последовательность, кодирующая синтетический происходящий из Brassica CTP, может представлять собой химерную нуклеотидную последовательность, содержащую неполную кодирующую CTP нуклеотидную последовательность из гена Brassica sp., или ее функциональный вариант. В конкретных вариантах осуществления нуклеотидная последовательность, кодирующая синтетический происходящий из Brassica CTP, может содержать непрерывные нуклеотидные последовательности, полученные из каждого из эталонных CTP Brassica sp., и CTP из отличающегося гена Brassica sp., отличающегося Brassica sp. или отличающегося организма (например, растение, прокариотический организм и низший фотосинтезирующий эукариотический организм), или функциональные варианты любого из указанных выше. В конкретных вариантах осуществления непрерывная нуклеотидная последовательность может быть получена из ортологичной нуклеотидной последовательности эталонного CTP Brassica, которая получена из ортолога эталонного гена Brassica sp. из другого организма (например, из отличающегося генома Brassica sp.). В этих и других вариантах осуществления, нуклеотидная последовательность, кодирующая синтетический происходящий из Brassica CTP, может представлять собой химерную нуклеотидную последовательность, содержащую более одной кодирующей CTP нуклеотидной последовательности.
В некоторых примерах нуклеотидная последовательность, кодирующая синтетический происходящий из Brassica CTP, может представлять собой химерную нуклеотидную последовательность, содержащую неполную нуклеотидную последовательность CTP из B. napus, или ее функциональные варианты. В конкретных примерах нуклеотидная последовательность, кодирующая синтетический происходящий из Brassica CTP, может содержать непрерывные нуклеотидные последовательности, полученные из B. napus, или их функциональные варианты. В следующих примерах нуклеотидная последовательность, кодирующая синтетический происходящий из Brassica CTP, может содержать непрерывную нуклеотидную последовательность, полученную из гена Brassica sp., или ее функциональный вариант, и непрерывную нуклеотидную последовательность, полученную из гена Arabidopsis sp., или ее функциональный вариант.
В некоторых вариантах осуществления композиция содержит молекулу нуклеиновой кислоты, содержащую по меньшей мере одно происходящее из Brassica средство для нацеливания полипептида в хлоропласт. Кроме того, описаны молекулы нуклеиновой кислоты, содержащие молекулу нуклеиновой кислоты, содержащую по меньшей мере одно происходящее из Brassica средство для нацеливания полипептида в хлоропласт, функционально связанную с представляющей интерес нуклеотидной последовательностью. В конкретных вариантах осуществления такие молекулы нуклеиновой кислоты могут быть пригодными для экспрессии и нацеливания полипептида, кодируемого представляющей интерес нуклеотидной последовательностью, в однодольном или двудольном растении. Для целей настоящего описания, происходящее из Brassica средство для нацеливания полипептида в хлоропласт относится к конкретным синтетическим нуклеотидным последовательностям. В конкретных вариантах осуществления происходящее из Brassica средство для нацеливания полипептида в хлоропласт выбрано из группы, состоящей из нуклеотидных последовательностей, обозначаемых в настоящем описании как TraP12 и TraP13.
Также в настоящем описании описаны растительные материалы (например, но не ограничиваясь ими, растения, ткани растений и клетки растений), содержащие молекулу нуклеиновой кислоты, содержащую по меньшей мере одну нуклеотидную последовательность, кодирующую синтетический происходящий из Brassica CTP, функционально связанный с представляющей интерес нуклеотидной последовательностью. В некоторых вариантах осуществления растительный материал может иметь такую молекулу нуклеиновой кислоты, стабильно встроенную в ее геном. В некоторых вариантах осуществления, растительный материал может временно экспрессировать продукт молекулы нуклеиновой кислоты, содержащий по меньшей мере одну нуклеотидную последовательность, кодирующую синтетический происходящий из Brassica CTP, функционально связанный с представляющей интерес нуклеотидной последовательностью.
Также описаны способы экспрессии нуклеотидной последовательности в содержащей пластиду клетке (например, растении) в пластиде (например, хлоропласт) содержащей пластиду клетки. В конкретных вариантах осуществления, молекулу нуклеиновой кислоты, содержащую по меньшей мере одну нуклеотидную последовательность, кодирующую синтетический происходящий из Brassica CTP, функционально связанный с представляющей интерес нуклеотидной последовательностью, можно использовать для трансформации клетки растения, так чтобы в цитоплазме клетки растения продуцировался слитый полипептид-предшественник, содержащий синтетический происходящий из Brassica CTP, слитый с продуктом экспрессии представляющей интерес нуклеотидной последовательности, в цитоплазме клетки растений, а затем слитый полипептид транспортировался in vivo в хлоропласт клетки растения.
Кроме того, описаны способы получения трансгенного растения, содержащего молекулу нуклеиновой кислоты, содержащую по меньшей мере одну нуклеотидную последовательность, кодирующую синтетический происходящий из Brassica CTP, функционально связанный с представляющей интерес нуклеотидной последовательностью. Также описаны растительные продукты (например, семена), полученные из таких трансгенных растений.
Указанные выше и другие признаки станут более понятными из представленного ниже описания нескольких вариантов осуществления, которые предоставлены с учетом прилагаемых фигур.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг. 1 проиллюстрированы молекулы мРНК, которые являются репрезентативными для конкретных примеров синтетической происходящей из Brassica кодирующей CTP нуклеотидной последовательности (например, TraP12 и TraP13), функционально связанной с представляющей интерес нуклеотидной последовательностью. В некоторых вариантах осуществления молекула мРНК (такая как представленные молекулы мРНК) может транскрибироваться с молекулы ДНК, содержащей открытую рамку считывания, включающую синтетическую происходящую из Brassica кодирующую CTP последовательность, функционально связанную с представляющей интерес нуклеотидной последовательностью. В некоторых вариантах осуществления представляющая интерес нуклеотидная последовательность может представлять собой последовательность, кодирующую представляющий интерес пептид, например, но не ограничиваясь ими, продукт маркерного гена или пептид, нацеливаемый в пластиду.
На фиг. 2 представлено выравнивание предсказанных транзитных пептидов хлоропластов белка EPSPS из Brassica napus (SEQ ID NO: 2) и Arabidopsis thaliana (SEQ ID NO: 4). Звездочкой указано, где последовательности расщеплялись и рекомбинировали с образованием TraP12 и Trap13.
На фиг. 3 проиллюстрирована карта плазмиды pDAB101981.
На фиг. 4 проиллюстрирована карта плазмиды pDAB101989.
На фиг. 5 проиллюстрирована карта плазмиды pDAB101908.
На фиг. 6 представлено микроскопическое изображение TraP12-YFP, инфильтрировавшего ткань листьев табака, который был перенесен в хлоропласты ткани листьев табака.
На фиг. 7 представлено микроскопическое изображение TraP13-YFP, инфильтрировавшего ткань листьев табака, который был перенесен в хлоропласты ткани листьев табака.
На фиг. 8 представлено микроскопическое изображение ненацеленных контролей YFP, которые инфильтрировали листья табака, и не включались в хлоропласты ткани листьев табака.
На фиг. 9 представлено микроскопическое изображение TraP12-YFP, трансформированного в протопласты кукурузы, который был перенесен в хлоропласты протопласта кукурузы.
На фиг. 10 проиллюстрирована карта плазмиды pDAB105528.
На фиг. 11 проиллюстрирована карта плазмиды pDAB105529.
На фиг. 12 проиллюстрирована карта плазмиды pDAB107686.
На фиг. 13 проиллюстрирована карта плазмиды pDAB107687.
На фиг. 14 проиллюстрирована карта плазмиды pDAB112711.
На фиг. 15 проиллюстрирована карта плазмиды pDAB11479.
На фиг. 16 проиллюстрирована карта плазмиды pDAB112712.
На фиг. 17 проиллюстрирована карта плазмиды pDAB112710.
На фиг. 18 проиллюстрирована карта плазмиды pDAB017540.
На фиг. 19 проиллюстрирована карта плазмиды pDAB107617.
СПОСОБ(Ы) ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
I. Обзор нескольких вариантов осуществления
Транзитный пептид хлоропластов (CTP) (или транзитный пептид пластид) функционирует во время или после трансляции, направляя полипептид, содержащий CTP, в пластиду (например, хлоропласт). В некоторых вариантах осуществления изобретения либо эндогенные белки, либо гетерологичные белки, хлоропластов можно направлять в хлоропласт путем экспрессии такого белка в качестве более крупного полипептида-предшественника, содержащего CTP. В конкретных вариантах осуществления CTP может происходить из нуклеотидной последовательности, полученной из гена Brassica sp., например, но не ограничиваясь этим, путем включения по меньшей мере одной непрерывной последовательности из ортологичного гена, полученного из другого организма, или ее функционального варианта.
В иллюстративных вариантах осуществления последовательности нуклеиновой кислоты, каждая из которых кодирует CTP, выделяли из последовательностей гена EPSPS, полученных из Brassica napus (номер доступа в базе данных NCBI № P17688). Кодирующие CTP последовательности нуклеиновых кислот выделяли путем анализа последовательности гена EPSPS с помощью сервера для прогнозирования ChloroP. Emanuelsson et al. (1999), Protein Science 8:978-84 (доступный на cbs.dtu.dk/services/ChloroP). Предсказанные белковые продукты выделенных кодирующих CTP последовательностей представляют собой транзитные пептиды длиной приблизительно 60-70 аминокислот. Кодирующие CTP последовательности нуклеиновой кислоты выделяли из ортологичных генов EPSPS, полученных из Arabidopsis thaliana (номер доступа NCBI № NP_182055). В этом примере нативный CTP B. napus использовали в качестве эталонной последовательности для конструирования иллюстративных синтетических происходящих из Brassica CTP путем слияния последовательно расположенных последовательностей из CTP Arabidopsis в конкретном положении в CTP B. napus. Этот процесс конструирования иллюстрирует разработку нового синтетического CTP, в соответствии с некоторыми аспектами, из последовательности нуклеиновой кислоты Brassica и Arabidopsis sp. Эти иллюстративные синтетические происходящие из Brassica CTP обозначаются в настоящем описании как TraPs12 и 13. Эти иллюстративные синтетические TraP исследовали в отношении функции нацеливания в пластиду и было выявлено, что они проявляют нацеливание в пластиду, которое является по меньшей мере настолько же эффективным, как наблюдали для нативных последовательностей Brassica по отдельности.
В следующем иллюстративном варианте осуществления последовательности нуклеиновой кислоты, каждая из которых кодирует синтетический пептид TraP по изобретению, синтезировали независимо и функционально связанными с последовательностью нуклеиновой кислоты, кодирующей желтый флуоресцентный белок (YFP), с получением синтетических молекул нуклеиновой кислоты, каждая из которых кодировала химерный слитый полипептид TraP:YFP. Каждую из таких молекул нуклеиновой кислоты, каждая из которых кодирует химерный полипептид TraP:YFP, встраивали в бинарный вектор так, чтобы каждая кодирующая TraP:YFP последовательность нуклеиновой кислоты была функционально связана с промотором AtUbi 10.
В другом иллюстративном варианте осуществления бинарные векторы, содержавшие каждую кодирующую TraP:YFP последовательность нуклеиновой кислоты, функционально связанную с промотором AtUbi10, независимо временно трансформировали в табак (Nicotiana benthamiana) посредством опосредуемой Agrobacterium трансформации. Конфокальная микроскопия и анализ с использованием вестерн-блоттинга подтвердили, что каждый TraP успешно нацеливал YFP в хлоропласты табака.
В следующем иллюстративном варианте осуществления последовательности нуклеиновой кислоты, каждая из которых кодировала синтетический пептид TraP по изобретению, синтезировали независимо и функционально связанными с последовательностью нуклеиновой кислоты, кодирующей агрономически важную последовательность гена. Последовательности TraP подвергали слиянию с признаками устойчивости к гербициду (например, dgt-28 и dgt-14) с получением синтетических молекул нуклеиновой кислоты, каждая из которых кодировала химерный слитый полипептид TraP:DGT-28 или TraP:DGT-14. Такие молекулы нуклеиновой кислоты, каждая из которых кодировала химерный полипептид TraP:DGT-28 или TraP:DGT-14, встраивали в бинарный вектор, так чтобы каждая кодирующая TraP:dgt-28 или TraP:dgt-14 последовательность нуклеиновой кислоты была функционально связанной с промотором и другими регуляторными элементами генов. Бинарный вектор, содержащий кодирующую TraP:dgt-28 или TraP:dgt-14 последовательность нуклеиновой кислоты, использовали для трансформации различных видов растений. Трансгенные растения анализировали в отношении устойчивости к гербициду в результате сверхэкспрессии и перемещения ферментов DGT-28 или DGT-14 в хлоропласт.
В следующем иллюстративном варианте осуществления последовательности нуклеиновой кислоты, каждая из которых кодирует синтетический пептид TraP по изобретению, синтезировали независимо и функционально связанными с последовательностью нуклеиновой кислоты, кодирующей агрономически важную последовательность гена. Последовательности TraP подвергали слиянию с признаками устойчивости к насекомым (например, cry2Aa, vip3ab1, cry1F, cry1Ac и cry1Ca) с получением синтетических молекул нуклеиновой кислоты, каждая из которых кодирует химерный слитый полипептид TraP:Cry2Aa, TraP:Vip3Ab1, TraP:Cry1F, TraP:Cry1Ac или TraP:Cry1Ca. Каждую из таких молекул нуклеиновой кислоты, каждая из которых кодирует химерный полипептид TraP:cry2Aa, TraP:vip3ab1, TraP:cry1F, TraP:cry1Ac или TraP:cry1Ca, встраивали в бинарный вектор, так чтобы каждая последовательность нуклеиновой кислоты, кодирующая TraP:cry2Aa, TraP:vip3ab1, TraP:cry1F, TraP:cry1Ac или TraP:cry1Ca, была функционально связана с промотором и другими регуляторными элементами генов. Бинарный вектор, содержащий последовательность нуклеиновой кислоты, кодирующую TraP:cry2Aa, TraP:vip3ab1, TraP:cry1F, TraP:cry1Ac или TraP:cry1Ca, использовали для трансформации различных видов растений. Трансгенные растения подвергали биоанализу в отношении устойчивости к насекомым в результате экспрессии и перемещения ферментов Cry2Aa, Vip3Ab1, Cry1F, Cry1Ac или Cry1Ca в хлоропласт.
Ввиду представленного выше подробного описания иллюстративных примеров, синтетические происходящие из Brassica последовательности CTP по изобретению и нуклеиновые кислоты, кодирующие их, можно использовать для направления любого полипептида в пластиду широкого диапазона содержащих пластиды клеток. Например, с помощью способов, которые стали доступными специалистам в данной области с учетом настоящего изобретения, химерный полипептид, содержащий синтетическую происходящую из Brassica последовательность CTP, слитую с N-концом любой второй пептидной последовательности, можно вводить в (или экспрессировать в) содержащую пластиду клетку-хозяина для нацеливания в пластиду второй пептидной последовательности. Таким образом, в конкретных вариантах осуществления пептид TraP может обеспечить увеличенную эффективность импорта и процессинга пептида, для которого является желательной экспрессия в пластиде, по сравнению с нативным CTP.
II. Сокращения
III. Термины
Чтобы упростить обзор различных вариантов осуществления изобретения, предоставлены следующие пояснения конкретных терминов:
Транзитный пептид хлоропластов: как используют в рамках изобретения, термин "транзитный пептид хлоропластов" (CTP) (или "транзитный пептид пластид") может относиться к аминокислотной последовательности, которая, когда она присутствует на N-конце полипептида, направляет импорт полипептида в пластиду содержащей пластиду клетки (например, клетка растения, такая как в целом растении или в культуре клеток растения). CTP обычно необходим и достаточен для направления импорта белка в пластиду (например, первичная, вторичная или третичная пластида, такая как хлоропласт) клетки-хозяина. Предполагаемый транзитный пептид хлоропластов может быть идентифицирован с помощью одного из нескольких доступных алгоритмов (например, PSORT и ChloroP (доступные на cbs.dtu.dk/services/ChloroP)). ChloroP может особенно хорошо предсказывать CTP. Emanuelsson et al. (1999), Protein Science 8:978-84. Однако ни один из существующих алгоритмов не обеспечивает предсказание функциональных CTP со 100% эффективностью. Таким образом, важно подтвердить, что идентифицированный предполагаемый CTP действительно функционирует, например, как предусматривается в методологии in vitro или in vivo.
Транзитные пептиды хлоропластов могут быть расположены на N-конце полипептида, который импортируется в пластиду. CTP может облегчать транспорт во время трансляции или после трансляции полипептида, содержащего CTP, в пластиду. Транзитные пептиды хлоропластов, как правило, содержат от приблизительно 40 до приблизительно 100 аминокислот, и выявлено, что такие CTP содержат определенные общие характеристики. Например, CTP содержат очень мало, или даже не содержат, отрицательно заряженных аминокислот (таких как аспарагиновая кислота, глутаминовая кислота, аспарагин или глутамин); N-концевые области CTP лишены заряженных аминокислот, глицина и пролина; центральная область CTP также, вероятно, имеет высокое содержание основных или гидроксилированных аминокислот (таких как серин и треонин); и C-концевая область CTP, вероятно, обогащена аргинином и может содержать амфипатическую структуру бета-слоя. Протеазы пластид могут отщеплять CTP от оставшейся части полипептида, содержащей CTP, после импорта полипептида в пластиду.
Контакт: как используют в рамках изобретения, термин "контакт с" или "захват" клеткой, тканью или организмом (например, клеткой растения; тканью растения и растением), в отношении молекулы нуклеиновой кислоты, включает интернализацию молекулы нуклеиновой кислоты в организм, например, но не ограничиваясь этим: контактирование организма с композицией, содержащей молекулу нуклеиновой кислоты; и пропитывание организмов раствором, содержащим молекулу нуклеиновой кислоты.
Эндогенный: как используют в рамках изобретения, термин "эндогенный" относится к веществам (например, молекулы нуклеиновой кислоты и полипептиды), которые происходят из конкретного организма, ткани или клетки. Например, "эндогенный" полипептид, экспрессируемый в клетке растения, может относиться к полипептиду, который обычно экспрессируется в клетках того же типа из не модифицированных способами генной инженерии растений того же вида. В некоторых примерах эндогенный ген (например, ген EPSPS) из Brassica sp. можно использовать для получения эталонной последовательности CTP Brassica.
Экспрессия: как используют в рамках изобретения, "экспрессия" кодирующей последовательности (например, гена или трансгена) относится к процессу, посредством которого кодируемая информация транскрипционного элемента нуклеиновой кислоты (включая, например, геномную ДНК или кДНК) преобразуется в функциональную, нефункциональную или структурную часть клетки, часто включающему синтез белка. На экспрессию генов могут влиять внешние сигналы; например, воздействие на клетку, ткань или организм агента, который увеличивает или снижает экспрессию гена. Экспрессия гена также может регулироваться на любом этапе в каскаде от ДНК к РНК к белку. Регуляция экспрессии гена происходить, например, путем контроля, действующего на транскрипцию, трансляцию, транспорт и процессинг РНК, деградацию промежуточных молекул, таких как мРНК, или путем активации, инактивации, компартментализации или деградации конкретных молекул белков после их получения, или путем любой их комбинации. Экспрессию гена можно измерять на уровне РНК или на уровне белка любым способом, известным в данной области, например, но не ограничиваясь этим, нозерн-блоттинг, ОТ-ПЦР, вестерн-блоттинг или анализ(ы) активности белка in vitro, in situ и in vivo.
Генетический материал: как используют в рамках изобретения, термин "генетический материал" включает все гены и молекулы нуклеиновых кислот, такие как ДНК и РНК.
Гетерологичный: как используют в рамках изобретения, термин "гетерологичный" относится к веществам (например, молекулы нуклеиновой кислоты и полипептиды), которые не происходят из конкретного организма, ткани или клетки. Например, "гетерологичный" полипептид, экспрессируемый в клетке растения, может относиться к полипептиду, который обычно не экспрессируется в клетках того же типа из не модифицированных способами генной инженерии растений того же вида (например, полипептид, который экспрессируется в других клетках того же организма или в клетках другого организма).
Выделенный: как используют в рамках изобретения, термин "выделенный" относится к молекулам (например, молекулы нуклеиновой кислоты и полипептиды), которые по существу отделены или очищены от других молекул того же типа (например, другие молекулы нуклеиновой кислоты и другие полипептиды), с которыми молекула обычно ассоциирована в клетке организма, в котором молекула встречается естественным образом. Например, выделенная молекула нуклеиновой кислоты может быть по существу отделена или очищена от хромосомной ДНК или внехромосомной ДНК в клетке организма, в которой молекула нуклеиновой кислоты встречается естественным образом. Таким образом, термин включает рекомбинантные молекулы нуклеиновой кислоты и полипептиды, которые биохимически очищены так, чтобы другие молекулы нуклеиновой кислоты, полипептиды и клеточные компоненты, были удалены. Также термин включает рекомбинантные молекулы нуклеиновой кислоты, химически синтезированные молекулы нуклеиновой кислоты и рекомбинантно продуцированные полипептиды.
Термин "по существу очищенный", как используют в рамках изобретения, относится к молекуле, которая отделена от других молекул, обычно ассоциированных с ней в ее нативном состоянии. По существу очищенная молекула может быть преобладающим видом, присутствующим в композиции. По существу очищенная молекула может быть, например, по меньшей мере на 60% свободной, по меньшей мере на 75% свободной, или по меньшей мере на 90% свободной от других молекул, помимо растворителя, присутствующего в природной смеси. Термин "по существу очищенный" не относится к молекулам, присутствующим в их нативном состоянии.
Молекула нуклеиновой кислоты: как используют в рамках изобретения, термин "молекула нуклеиновой кислоты" может относиться к полимерной форме нуклеотидов, которая может включать как смысловую, так и антисмысловую цепи РНК, кДНК, геномной ДНК, и их синтетические формы и смешанные полимеры. Нуклеотид может относиться к рибонуклеотиду, дезоксирибонуклеотиду или модифицированной форме любого типа нуклеотида. "Молекула нуклеиновой кислоты", как используют в рамках изобретения, является синонимом "нуклеиновой кислоты" и "полинуклеотида". Молекула нуклеиновой кислоты обычно имеет по меньшей мере 10 оснований в длину, если нет иных указаний. Термин включает одноцепочечные и двухцепочечные формы ДНК. Молекулы нуклеиновой кислоты включают димерные (так называемые тандемные) формы, и продукты транскрипции молекул нуклеиновой кислоты. Молекула нуклеиновой кислоты может включать либо модифицированные нуклеотиды, либо и те, и другие, связанные вместе встречающимися в природе и/или не встречающимися в природе нуклеотидными связями.
Молекулы нуклеиновых кислот могут быть модифицированными химически или биохимически, или могут содержать неприродные или преобразованные нуклеотидные основания, как хорошо понятно специалистам в данной области. Такие модификации включают, например, метки, метилирование, замену одного или нескольких встречающихся в природе нуклеотидов аналогом, межнуклеотидные модификации (например, незаряженные связи: например, метилфосфонаты, фосфотриэфиры, фосфорамидаты, карбаматы и т.д.; заряженные связи: например, фосфоротиоаты, фосфородитиоаты и т.д.; выступающие части: например, пептиды; интеркалирующие агенты: например, акридин, псорален и т.д.; хелаторы; алкилаторы и модифицированные связи: например, альфа-аномерные нуклеиновые кислоты и т.д.). Термин "молекула нуклеиновой кислоты" также включает любую топологическую конформацию, включая одноцепочечную, двухцепочечную, частично дуплексную, триплексную, шпилечную, кольцеобразную конформации и конформацию висячего замка.
Как используют в рамках изобретения в отношении ДНК, термин "кодирующая последовательность", "структурная нуклеотидная последовательность" или "структурная молекула нуклеиновой кислоты" относится к нуклеотидной последовательности, которая в конечном итоге транслируется в полипептид через транскрипцию и мРНК, когда она находится под контролем соответствующих регуляторных последовательностей. Что касается РНК, термин "кодирующая последовательность" относится к нуклеотидной последовательности, которая транслируется в пептид, полипептид или белок. Границы кодирующей последовательности определяются путем трансляции инициирующего кодона на 5'-конце и стоп-кодона на 3'-конце. Кодирующие последовательности включают, но не ограничиваются ими: геномную ДНК; кДНК; EST и рекомбинантные нуклеотидные последовательности.
В некоторых вариантах осуществления изобретение относится к нуклеотидным последовательностям, которые могут быть выделенными, очищенными или частично очищенными, например, с использованием способов разделения, например, таких как ионообменная хроматография; способов исключения по молекулярному размеру или по аффинности; способов фракционирования на основе растворимости в различных растворителях; и способов генетической инженерии, такие как амплификация, клонирование и субклонирование.
Идентичность последовательностей: термин "идентичность последовательностей" или "идентичность", как используют в рамках изобретения в контексте двух последовательностей нуклеиновых кислот или полипептидов, может относиться к остаткам в двух последовательностях, которые являются одинаковыми при выравнивании на максимальное соответствие на протяжении указанного окна сравнения.
Как используют в рамках изобретения, термин "процент идентичности последовательностей" может относиться к величине, определяемой путем сравнения двух оптимально выровненных последовательностей (например, последовательностей нуклеиновых кислот и аминокислотных последовательностей) на протяжении окна сравнения, где часть последовательности в окне сравнения может содержать вставки или делеции (т.е. пропуски) по сравнению с эталонной последовательностью (которая не содержит вставок или делеций) для оптимального выравнивания двух последовательностей. Процент вычисляют путем определения количества положений, в которых идентичный нуклеотидный или аминокислотный остаток встречается в обеих последовательностях, с получением количества совпавших положений, деления количества совпавших положений на общее количество положений в окне сравнения, и умножения результата на 100 с получением процента идентичности последовательностей.
Способы выравнивания последовательностей для сравнения хорошо известны в данной области. Различные программы и алгоритмы выравнивания описаны, например, в: Smith and Waterman (1981) Adv. Appl. Math. 2:482; Needleman and Wunsch (1970) J. Mol. Biol. 48:443; Pearson and Lipman (1988) Proc. Natl. Acad. Sci. U.S.A. 85:2444; Higgins and Sharp (1988) Gene 73:237-44; Higgins and Sharp (1989) CABIOS 5:151-3; Corpet et al. (1988) Nucleic Acids Res. 16:10881-90; Huang et al. (1992) Comp. Appl. Biosci. 8:155-65; Pearson et al. (1994) Methods Mol. Biol. 24:307-31; Tatiana et al. (1999) FEMS Microbiol. Lett. 174:247-50. Детальное рассмотрение способов выравнивания последовательностей и вычисления гомологии может быть найдено, например, в Altschul et al. (1990) J. Mol. Biol. 215:403-10.
Basic Local Alignment Search Tool (BLASTTM; Altschul et al. (1990)) от National Center for Biotechnology Information (NCBI) доступен из нескольких источников, в том числе National Center for Biotechnology Information (Bethesda, MD), и через Интернет, для применения совместно с несколькими программами анализа последовательностей. Описание того, как определять идентичность последовательностей с использованием этой программы, доступно через интернет в разделе "help" для BLASTTM. Для сравнений последовательностей нуклеиновых кислот можно использовать функцию "Blast 2 sequences" программы BLASTTM (Blastn) с использованием матрицы BLOSUM62 по умолчанию с параметрами по умолчанию. Последовательности нуклеиновых кислот с большим сходством с эталонными последовательностями будут демонстрировать увеличение процентной идентичности при оценке этим способом.
Специфично гибридизующийся/специфически комплементарный: как используют в рамках изобретения, термины "специфично гибридизующийся" и "специфически комплементарный" представляют собой термины, которые указывают на достаточную степень комплементарности, чтобы между молекулой нуклеиновой кислоты и молекулой нуклеиновой кислоты-мишенью происходило стабильное и специфическое связывание. Гибридизация между двумя молекулами нуклеиновых кислот вовлекает формирование антипараллельного выравнивания между последовательностями нуклеиновых кислот двух молекул нуклеиновой кислоты. Затем две молекулы способны образовывать водородные связи с соответствующими основаниями на противоположной цепи с образованием дуплексной молекулы, которая, если она является достаточно стабильной, поддается выявлению с использованием способов, хорошо известных в данной области. Молекула нуклеиновой кислоты не должна быть на 100% комплементарной ее последовательности-мишени, чтобы быть специфически гибридизующейся. Однако величина комплементарности последовательностей, которая должна существовать для гибридизации, чтобы она была специфической, зависит от используемых условий гибридизации.
Условия гибридизации, обеспечивающие конкретные степени жесткости, варьируют, в зависимости от типа выбранного способа гибридизации и композиции и длины гибридизующихся последовательностей нуклеиновых кислот. Как правило, жесткость гибридизации определяется температурой гибридизации и ионной силой (особенно концентрацией Na+ и/или Mg++) буфера для гибридизации, хотя также на жесткость влияет количество раз промывания. Вычисления, касающиеся условий гибридизации, требуемых для достижения конкретных степеней жесткости, известны средним специалистам в данной области, и рассмотрены, например, в Sambrook et al. (ed.) Molecular Cloning: A Laboratory Manual, 2nd ed., vol. 1-3, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1989, chapters 9 and 11; и Hames and Higgins (eds.) Nucleic Acid Hybridization, IRL Press, Oxford, 1985. Дальнейшая детальная инструкция и руководство в отношении гибридизации нуклеиновых кислот могут быть найдены, например, в Tijssen, "Overview of principles of hybridization and the strategy of nucleic acid probe assays", Laboratory Techniques in Biochemistry and Molecular Biology-Hybridization with Nucleic Acid Probes, Part I, Chapter 2, Elsevier, NY, 1993; и Ausubel et al., Eds., Current Protocols in Molecular Biology, Chapter 2, Greene Publishing and Wiley-Interscience, NY, 1995.
Как используют в рамках изобретения, "жесткие условия" охватывают условия, при которых гибридизация происходит, только если существует менее 20% несоответствий гибридизующейся молекулой и гомологичной последовательностью в молекуле нуклеиновой кислоты-мишени. "Жесткие условия" включают другие конкретные уровни жесткости. Таким образом, как используют в рамках изобретения, условия "умеренной жесткости" представляют собой условия, в которых молекулы с более чем 20% несоответствием последовательностей не гибридизуются; условия "высокой жесткости" представляют собой условия, в которых последовательности с более чем 10% несоответствий не гибридизуются; и условия "очень высокой жесткости" представляют собой условия, при которых последовательности с более чем 5% несоответствий не гибридизуются.
Ниже представлены типичные неограничивающие условия гибридизации.
Условия высокой жесткости (выявляют последовательности, которые обладают по меньшей мере 90% идентичностью последовательностей): гибридизация в 5x буфере SSC при 65°C в течение 16 часов; промывание два раза в 2x буфере SSC при комнатной температуре в течение 15 минут каждый раз; и промывание два раза в 0,5x буфере SSC при 65°C в течение 20 минут каждый раз.
Условия умеренной жесткости (выявляют последовательности, которые обладают по меньшей мере 80% идентичностью последовательностей): гибридизация в 5x-6x буфере SSC при 65-70°C в течение 16-20 часов; промывание два раза в 2x буфере SSC при комнатной температуре в течение 5-20 минут каждый раз; и промывание два раза в 1x буфере SSC при 55-70°C в течение 30 минут каждый раз.
Нежесткие контрольные условия (гибридизуются последовательности, которые обладают по меньшей мере 50% идентичностью последовательностей): гибридизация в 6x буфере SSC при температуре от комнатной температуры до 55°C в течение 16-20 часов; промывание по меньшей мере два раза в 2x-3x буфере SSC при температуре от комнатной температуры до 55°C в течение 20-30 минут каждый раз.
Как используют в рамках изобретения, термин "по существу гомологичный" или "существенная гомология" в отношении непрерывной последовательности нуклеиновой кислоты, относится к непрерывным нуклеотидным последовательностям, которые гибридизуются в жестких условиях с эталонной последовательностью нуклеиновой кислоты. Например, последовательности нуклеиновой кислоты, которые по существу гомологичны эталонной последовательности нуклеиновой кислоты, представляют собой последовательности нуклеиновой кислоты, которые гибридизуются в жестких условиях (например, условиях умеренной жесткости и т.д., выше) с эталонной последовательностью нуклеиновой кислоты. По существу гомологичные последовательности могут иметь по меньшей мере 80% идентичность последовательностей. Например, по существу гомологичные последовательности могут обладать приблизительно от 80% до 100% идентичностью последовательностей, как например, приблизительно 81%; приблизительно 82%; приблизительно 83%; приблизительно 84%; приблизительно 85%; приблизительно 86%; приблизительно 87%; приблизительно 88%; приблизительно 89%; приблизительно 90%; приблизительно 91%; приблизительно 92%; приблизительно 93%; приблизительно 94% приблизительно 95%; приблизительно 96%; приблизительно 97%; приблизительно 98%; приблизительно 98,5%; приблизительно 99%; приблизительно 99,5% и приблизительно 100%. Свойство существенной гомологии является в значительной степени связанным со специфической гибридизацией. Например, молекула нуклеиновой кислоты является специфически гибридизующейся, когда существует достаточная степень комплементарности во избежание неспецифического связывания нуклеиновой кислоты с не являющимися мишенью последовательностями в условиях, где является желательным специфическое связывание, например, в жестких условиях гибридизации.
Как используют в рамках изобретения, термин "ортолог" (или "ортологичный") относится к гену в двух или более видах, который эволюционировал из общей нуклеотидной последовательности-предшественника и может сохранять одну и ту же функцию в двух или более видах.
Как используют в рамках изобретения, две последовательности нуклеиновых кислот называют проявляющими "полную комплементарность", когда каждый нуклеотид последовательности, читаемой в направлении от 5' к 3', комплементарен каждому нуклеотиду другой последовательности, читаемой в направлении от 3' к 5'. Нуклеотидная последовательность, которая комплементарна эталонной нуклеотидной последовательности, обладает последовательностью, идентичной обратной комплементарной последовательности для эталонной нуклеотидной последовательности. Эти термины и описания подробно определены в данной области и хорошо понятны специалистам в данной области.
При определении процентной идентичности последовательностей между аминокислотными последовательностями специалистам в данной области хорошо известно, что идентичность аминокислот в данном положении, обеспечиваемая выравниванием, может отличаться без влияния на желаемые свойства полипептидов, содержащих выровненные последовательности. В этих случаях в процентную идентичность последовательностей можно вносить поправку для учета сходства между консервативно замещенными аминокислотами. Эти поправки являются хорошо известными и широко используемыми специалистами в данной области. См., например, Myers and Miller (1988), Computer Applications in Biosciences 4:11-7.
Варианты осуществления изобретения включают функциональные варианты иллюстративных аминокислотных последовательностей транзитного пептида пластид и последовательности нуклеиновой кислоты, кодирующие их. Функциональный вариант иллюстративной последовательности транзитного пептида может представлять собой, например, фрагмент иллюстративной аминокислотной последовательности транзитного пептида (такой как N-концевой или C-концевой фрагмент), или модифицированную последовательность полноразмерной иллюстративной аминокислотной последовательности транзитного пептида или фрагмент иллюстративной аминокислотной последовательности транзитного пептида. Иллюстративную аминокислотную последовательность транзитного пептида можно модифицировать в некоторых вариантах осуществления путем внесения одной или нескольких консервативных аминокислотных замен. "Консервативная" аминокислотная замена представляет собой замену, в которой аминокислотный остаток заменен аминокислотным остатком, имеющим сходную функциональную боковую цепь, сходный размер и/или сходную гидрофобность. Семейства аминокислот, которые можно использовать для замены другой аминокислоты того же семейства для внесения консервативной замены, известны в данной области. Например, эти семейства аминокислот включают: основные аминокислоты (например, лизин, аргинин и гистидин); кислые аминокислоты (например, аспарагиновая кислота и глутаминовая кислота); незаряженные (при физиологических значениях pH) полярные аминокислоты (например, глицин, аспарагин, глутамин, серин, треонин, тирозин и цитозин); неполярные аминокислоты (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин и триптофан); бета-разветвленные аминокислоты (например, треонин, валин и изолейцин); и ароматические аминокислоты (например, тирозин, фенилаланин, триптофан и гистидин). См., например, Sambrook et al. (Eds.), выше; и Innis et al., PCR Protocols: A Guide to Methods and Applications, 1990, Academic Press, NY, USA.
Функционально связанный: первая нуклеотидная последовательность "функционально связана" со второй нуклеотидной последовательностью, когда первая нуклеотидная последовательность находится в функциональной взаимосвязи со второй нуклеотидной последовательностью. Например, промотор функционально связан с кодирующей последовательностью, если промотор влияет на транскрипцию или экспрессию кодирующей последовательности. В случае рекомбинантной продукции функционально связанные нуклеотидные последовательности, как правило, являются соседними и, когда необходимо связать две кодирующих белок области, находятся в одной и той же рамке считывания. Однако нуклеотидные последовательности не должны быть соседними, чтобы быть функционально связанными.
Термин "функционально связанный", когда его используют в отношении регуляторной последовательности и кодирующей последовательности, означает, что регуляторная последовательность влияет на экспрессию связанной с ней кодирующей последовательности. "Регуляторные последовательности" или "элементы контроля" относятся к нуклеотидным последовательностям, которые влияют на время и уровень/величину транскрипции, процессинга или стабильности РНК, или трансляции ассоциированной с ними кодирующей последовательности. Регуляторные последовательности могут включать промоторы; лидерные последовательности трансляции; интроны; энхансеры; структуры стебель-петля; связывающие репрессор последовательности; последовательности терминации; распознающие полиаденилирование последовательности и т.д. Конкретные регуляторные последовательности могут быть расположены выше и/или ниже кодирующей последовательности, функционально связанной с ней. Также конкретные регуляторные последовательности, функционально связанные с кодирующей последовательностью, могут быть расположены на ассоциированной с ними комплементарной цепи двухцепочечной молекулы нуклеиновой кислоты.
При использовании в отношении двух или более аминокислотных последовательностей, термин "функционально связанный" означает, что первая аминокислотная последовательность находится в функциональной взаимосвязи по меньшей мере с одной из дополнительных аминокислотных последовательностей. Например, транзитный пептид (например, CTP) функционально связан со второй аминокислотной последовательностью в полипептиде, содержащем обе последовательности, если транзитный пептид влияет на экспрессию или транспорт полипептида или второй аминокислотной последовательности.
Промотор: как используют в рамках изобретения, термин "промотор" относится к области ДНК, которая может быть расположена выше от начала транскрипции, и которая может быть вовлечена в распознавание и связывание РНК-полимеразы и других белков для инициации транскрипции. Промотор может быть функционально связан с кодирующей последовательностью для экспрессии в клетке или промотор может быть функционально связан с нуклеотидной последовательностью, кодирующей сигнальную последовательность, которая может быть функционально связана с кодирующей последовательностью, для экспрессии в клетке. "Промотор растений" может представлять собой промотор, способный инициировать транскрипцию в клетках растений. Примеры промоторов, находящихся под контролем стадии развития, включают промоторы, которые предпочтительно инициируют транскрипцию в определенных тканях, таких как листья, корни, семена, волокна, сосуды ксилемы, трахеиды или склеренхима. Такие промоторы называют "предпочтительными для ткани". Промоторы, которые инициируют транскрипцию только в определенных тканях, называют "тканеспецифическими". "Специфичный к типу клеток" промотор, как правило, запускает экспрессию в определенных типах клеток в одном или нескольких органах, например, в клетках сосудов в корнях или листьях. "Индуцибельный" промотор может представлять собой промотор, который может находиться под контролем условий окружающей среды. Примеры условий окружающей среды, которые могут инициировать транскрипцию индуцибельными промоторами, включают анаэробные условия и присутствие света. Тканеспецифические, предпочтительные для тканей, специфичные к типу клеток и индуцибельные промоторы составляют класс "неконститутивных" промоторов. "Конститутивный" промотор представляет собой промотор, который может быть активным при большинстве условий окружающей среды.
В некоторых вариантах осуществления изобретения можно использовать любой индуцибельный промотор. См. Ward et al. (1993) Plant Mol. Biol. 22:361-366. В случае индуцибельного промотора скорость транскрипции возрастает в ответ на индуцирующий агент. Иллюстративные индуцибельные промоторы включают, но не ограничиваются ими: промоторы из системы ACEI, которые отвечают на медь; ген In2 из кукурузы, который отвечает на антидоты бензолсульфонамидных гербицидов; Tet-репрессор из Tn10; и индуцибельный промотор из гена стероидного гормона, транскрипционная активность которого может быть индуцирована глюкокортикостероидным гормоном (Schena et al. (1991) Proc. Natl. Acad. Sci. USA 88:0421).
Иллюстративные конститутивные промоторы включают, но не ограничиваются ими: промоторы из вирусов растений, такие как промотор 35S из CaMV; промоторы из генов актина риса; промоторы убиквитина; pEMU; MAS; промотор гистона H3 кукурузы; и промотор ALS, фрагмент XbaI/NcoI с 5'-стороны от структурного гена ALS3 Brassica napus (или последовательность, сходная с указанным фрагментом XbaI/NcoI) (международная публикация PCT № WO 96/30530).
Кроме того, в некоторых вариантах осуществления можно использовать любой тканеспецифический или предпочтительный для тканей промотор. Растения, трансформированные молекулой нуклеиновой кислоты, содержащей кодирующую последовательность, функционально связанную с тканеспецифическим промотором, могут продуцировать продукт кодирующей последовательности исключительно, или предпочтительно, в конкретной ткани. Иллюстративные тканеспецифические или предпочтительные для тканей промоторы включают, но не ограничиваются ими: предпочтительный для корней промотор, такой как промотор гена фазеолина; специфический для листьев или индуцируемый светом промотор, такой как промотор из cab или rubisco; специфический для пыльника промотор, такой как промотор из LAT52; специфический для пыльцы промотор, такой как промотор из Zm13; и предпочтительный для микроспор промотор, такой как промотор из apg.
Трансформация: как используют в рамках изобретения, термин "трансформация" или "трансдукция" относится к переносу одной или нескольких молекулы(молекул) нуклеиновой кислоты(кислот) в клетку. Клетка "трансформирована" молекулой нуклеиновой кислоты, трансдуцированной в клетку, когда молекула нуклеиновой кислоты становится стабильно реплицируемой клеткой, либо путем включения молекулы нуклеиновой кислоты в клеточный геном, либо путем эписомной репликации. Как используют в рамках изобретения, термин "трансформация" охватывает все способы, посредством которых молекула нуклеиновой кислоты может быть введена в такую клетку. Примеры включают, но не ограничиваются ими: трансфекцию вирусными векторами; трансформацию плазмидными векторами; электропорацию (Fromm et al. (1986) Nature 319:791-3); липофекцию (Felgner et al. (1987) Proc. Natl. Acad. Sci. USA 84:7413-7); микроинъекцию (Mueller et al. (1978) Cell 15:579-85); опосредуемый Agrobacterium перенос (Fraley et al. (1983) Proc. Natl. Acad. Sci. USA 80:4803-7); прямой захват ДНК; и бомбардировку микроснарядами (Klein et al. (1987) Nature 327:70).
Трансген: экзогенная последовательность нуклеиновой кислоты. В некоторых примерах трансген может представлять собой последовательность, которая кодирует полипептид, содержащий по меньшей мере один синтетический происходящий из Brassica CTP. В конкретных примерах трансген может кодировать полипептид, содержащий по меньшей мере один синтетический происходящий из Brassica CTP и по меньшей мере дополнительную пептидную последовательность (например, пептидная последовательность, которая сообщает устойчивость к гербицидам), для которой является желательной экспрессия в пластиде. В этих и других примерах трансген может содержать регуляторные последовательности, функционально связанные с кодирующей последовательностью трансгена (например, промотор). Для целей настоящего описания термин "трансгенный", когда его используют для указания на организм (например, растение), относится к организму, который содержит экзогенную последовательность нуклеиновой кислоты. В некоторых примерах организм, содержащий экзогенную последовательность нуклеиновой кислоты, может представлять собой организм, в который последовательность нуклеиновой кислоты была введена способами молекулярной трансформации. В других примерах организм, содержащий экзогенную последовательность нуклеиновой кислоты, может представлять собой организм, в который последовательность нуклеиновой кислоты была введена, например, путем интрогрессии или перекрестного опыления в растении.
Транспорт: как используют в рамках изобретения, термины "транспорт(ы)", "мишень(и)" и "перенос(ы)" относится к свойству определенных аминокислотных последовательностей по изобретению, которое способствует перемещению полипептида, содержащего аминокислотную последовательность, из ядра клетки-хозяина в пластиду клетки-хозяина. В конкретных вариантах осуществления такая аминокислотная последовательность (т.е. синтетическая происходящая из Brassica последовательность CTP) может быть способна транспортировать приблизительно 100%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 60% и/или по меньшей мере приблизительно 50% полипептида, содержащего аминокислотную последовательность, в пластиды клетки-хозяина.
Вектор: молекула нуклеиновой кислоты, введенная в клетку, например, для получения трансформированной клетки. Вектор может включать последовательности нуклеиновых кислот, которые позволяют ему реплицироваться в клетке-хозяине, такие как ориджин репликации. Примеры векторов включают, но не ограничиваются ими: плазмиду; космиду; бактериофаг или вирус, которые несут экзогенную ДНК в клетку. Вектор также может включать один или несколько генов, антисмысловых молекул и/или генов селективных маркеров и другие генетические элементы, известные в данной области. Вектор может быть трансдуцирован, трансформирован в клетку или он может инфицировать клетку, тем самым обеспечивая экспрессию клеткой молекул нуклеиновых кислот и/или белков, кодируемых вектором. Вектор необязательно включает материалы, способствующие достижению проникновения молекулы нуклеиновой кислоты в клетку (например, липосомы, белковое покрытие и т.д.).
Если нет иных указаний и не предполагается иное, форма единственного числа обозначает "по меньшей мере один", как используют в рамках изобретения.
Если конкретно не указано иное, все технические и научные термины, используемые в настоящем описании, обладают тем же значением, которое обычно подразумевают специалисты в области, к которой относится настоящее изобретение. Определения общих терминов молекулярной биологии могут быть найдены, например, в Lewin B., Genes V, Oxford University Press, 1994 (ISBN 0-19-854287-9); Kendrew et al. (eds.), The Encyclopedia of Molecular Biology, Blackwell Science Ltd., 1994 (ISBN 0-632-02182-9); и Meyers R.A. (ed.), Molecular Biology and Biotechnology: A Comprehensive Desk Reference, VCH Publishers, Inc., 1995 (ISBN 1-56081-569-8). Все проценты приведены по массе и все соотношения растворителей в смеси представлены по объему, если нет иных указаний. Все температуры представлены в градусах Цельсия.
IV. Молекулы нуклеиновой кислоты, содержащие синтетическую последовательность, кодирующую происходящий из Brassica CTP
В некоторых вариантах осуществления настоящее изобретение относится к молекуле нуклеиновой кислоты, содержащей по меньшей мере одну нуклеотидную последовательность, кодирующую синтетический происходящий из Brassica CTP, функционально связанный с представляющей интерес нуклеотидной последовательностью. В конкретных вариантах осуществления представляющая интерес нуклеотидная последовательность может представлять собой нуклеотидную последовательность, которая кодирует представляющий интерес полипептид. В конкретных примерах предусматривается одна молекула нуклеиновой кислоты, которая кодирует полипептид, где последовательность TraP12 или TraP13 является слитой с N-концом представляющего интерес полипептида.
Синтетический происходящий из Brassica CTP может происходить из гена EPSPS Brassica. В конкретных примерах таких вариантов осуществления ген EPSPS Brassica может содержать последовательность нуклеиновой кислоты, указанную в качестве SEQ ID NO: 1, гомологичную последовательность нуклеиновой кислоты из другого гена EPSPS, или ортолог гена Brassica EPSPS, содержащий последовательность нуклеиновой кислоты, указанную в качестве SEQ ID NO: 1.
В некоторых вариантах осуществления синтетический происходящий из Brassica транзитный пептид хлоропластов может представлять собой химерный происходящий из Brassica CTP. Синтетический происходящий из Brassica CTP может происходить из эталонной последовательности CTP Brassica путем связывания первой непрерывной аминокислотной последовательности, содержащейся в эталонной последовательности CTP Brassica, со второй непрерывной аминокислотной последовательностью, содержащейся в отличающейся последовательности CTP (например, последовательность CTP, полученная из Arabidopsis sp.). В конкретных вариантах осуществления, отличающаяся последовательность CTP, содержащая вторую непрерывную аминокислотную последовательность, может кодироваться последовательностью гомологичного гена из генома, отличного от генома Brassica sp., из которого получена эталонная последовательность (например, отличающийся Brassica sp., растение, отличное от Brassica sp.; низший фотосинтезирующий эукариотический организм, например, хлорофит; и прокариотический организм, например, Cyanobacterium или Agrobacterium). Таким образом, нуклеотидная последовательность, кодирующая синтетический происходящий из Brassica CTP, может происходить из эталонной последовательности гена, кодирующей CTP Brassica, путем слияния нуклеотидной последовательности, которая кодирует непрерывную аминокислотную последовательность эталонной последовательности CTP Brassica с нуклеотидной последовательностью, которая кодирует непрерывную аминокислотную последовательность из отличающейся последовательности CTP, которая гомологична остальной части эталонной последовательности CTP Brassica. В этих и других примерах непрерывная аминокислотная последовательность эталонной последовательности CTP Brassica может быть расположена на 5′-конце или 3′-конце синтетического происходящего из Brassica CTP.
В некоторых вариантах осуществления синтетический химерный происходящий из Brassica CTP может происходить из множества последовательностей CTP Brassica (включая эталонную последовательность CTP Brassica) путем связывания непрерывной аминокислотной последовательности, содержащейся в одной последовательности CTP Brassica, с непрерывной аминокислотной последовательностью, содержащейся в отличающейся последовательности CTP Brassica. В конкретных вариантах осуществления, множество последовательностей CTP Brassica могут кодироваться ортологичными последовательностями генов в различных видах Brassica. В некоторых примерах множество последовательностей CTP Brassica могут представлять собой конкретно две последовательности CTP Brassica. Таким образом, нуклеотидная последовательность, кодирующая синтетический химерный происходящий из Brassica CTP, может происходить из двух гомологичных (например, по существу гомологичных) последовательности гена, кодирующих Brassica CTP (например, последовательности ортологичных генов) путем слияния нуклеотидной последовательности, которая кодирует непрерывную аминокислотную последовательность одной из последовательностей CTP Brassica с нуклеотидной последовательностью, которая кодирует непрерывную аминокислотную последовательность из других последовательностей CTP Brassica, которая гомологична остальной части первой последовательности CTP Brassica. Иллюстративными примерами такого синтетического химерного происходящего из Brassica CTP являются TraP12 и TraP13.
В некоторых вариантах осуществления синтетический химерный происходящий из Brassica может происходить из эталонной последовательности CTP Brassica вследствие связывания непрерывной аминокислотной последовательности, содержащейся в эталонной последовательности CTP Brassica, с непрерывной аминокислотной последовательностью, содержащейся во второй последовательности CTP, полученной из отличающегося организма. В конкретных вариантах осуществления вторая последовательность CTP может кодироваться последовательностью ортологичного гена в отличающемся организме. Нуклеотидная последовательность, кодирующая синтетический химерный происходящий из Brassica CTP, может происходить из эталонной последовательности CTP Brassica вследствие слияния нуклеотидной последовательности, которая кодирует непрерывную аминокислотную последовательность эталонной последовательности CTP Brassica, с нуклеотидной последовательностью, которая кодирует непрерывную аминокислотную последовательность из гомологичной (например, по существу гомологичной) кодирующей CTP последовательности гена (например, последовательность ортологичного гена) из последовательности CTP отличающегося организма, которая гомологична остальной части эталонной последовательности CTP Brassica. TraPs12 и 13 являются иллюстративными примерами такого синтетического химерного CTP, содержащего последовательности CTP, которые происходят из Brassica и Arabidopsis thaliana.
Специалисту в данной области будет понятно, что после выбора первой непрерывной аминокислотной последовательности в эталонной последовательности CTP Brassica, идентификация и выбор непрерывной аминокислотной последовательности из остальной части гомологичной последовательности CTP в соответствии с указанным выше процессом дериватизации, является однозначным и автоматическим. В некоторых примерах первая непрерывная аминокислотная последовательность может иметь длину от приблизительно 25 до приблизительно 41 аминокислот (например, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41 и 42 аминокислот в длину). В некоторых вариантах осуществления первая непрерывная аминокислотная последовательность в эталонной последовательности CTP Brassica определяется положением на 3′-конце мотива "SVSL" (SEQ ID NO: 9), который является консервативным в некоторых генах EPSPS Brassica.
Примеры синтетических химерных происходящих из Brassica последовательностей CTP в соответствии с указанным выше процессом представлены в SEQ ID NO: 6 и 8. Ввиду вырожденности генетического кода, род нуклеотидных последовательностей, кодирующих эти пептиды, непосредственно предусматривается специалистом в данной области. Эти конкретные примеры иллюстрируют структурные признаки синтетических химерных происходящих из Brassica CTP путем включения непрерывных последовательностей из гомологичного CTP из одного из нескольких ортологов ESPSP гена ESPSP B. napus.
Некоторые варианты осуществления включают функциональные варианты синтетического происходящего из Brassica транзитного пептида хлоропластов и/или нуклеиновые кислоты, кодирующих их. Такие функциональные варианты включают, например, но не ограничиваясь ими: синтетическую происходящую из Brassica кодирующую CTP последовательность, которая происходит из гомолога и/или ортолога кодирующих CTP Brassica последовательностей, указанных в качестве SEQ ID NO: 1, и/или CTP, кодируемый ей; нуклеиновую кислоту, которая кодирует синтетический происходящий из Brassica CTP, который содержит непрерывную аминокислотную последовательность в SEQ ID NO: 2, и/или CTP, кодируемый ей; укороченную синтетическую происходящую из Brassica кодирующую CTP последовательность, которая содержит непрерывную последовательность нуклеиновой кислоты в одной из SEQ ID NO: 5, 7, 11, 12, 13, 15, 17 и 19; укороченную синтетическую происходящую из Brassica последовательность CTP, которая содержит непрерывную последовательность нуклеиновой кислоты, которая по существу гомологична одной из SEQ ID NO: 5, 7, 11, 12, 13, 15, 17 и 19; укороченный синтетический происходящий из Brassica CTP, который содержит непрерывную аминокислотную последовательность в одной из SEQ ID NO: 6 и 8; нуклеиновую кислоту, которая кодирует синтетический происходящий из Brassica CTP, содержащий непрерывную аминокислотную последовательность в одной из SEQ ID NO: 6 и 8, и/или CTP кодируемый ей; нуклеиновую кислоту, которая кодирует синтетический происходящий из Brassica CTP, содержащий непрерывную аминокислотную последовательность с одной из SEQ ID NO: 6 и 8, которая обладает одной или несколькими консервативными аминокислотными заменами, и/или CTP, кодируемый ей; и нуклеиновую кислоту, которая кодирует синтетический происходящий из Brassica CTP, содержащий непрерывную аминокислотную последовательность в одной из SEQ ID NO: 6 и 8, которая обладает одной или несколькими неконсервативными аминокислотными заменами, для которых продемонстрировано, что они направляют функционально связанный пептид в пластиду в содержащей пластиду клетке, и/или CTP, кодируемый ей.
Таким образом, некоторые варианты осуществления изобретения включают молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, кодирующую синтетический химерный происходящий из Brassica CTP, содержащий одну или несколько консервативных аминокислотных замен. Такая молекула нуклеиновой кислоты может быть пригодной, например, для облегчения манипулированием кодирующей CTP последовательностью по изобретению в способах молекулярной биологии. Например, в некоторых вариантах осуществления, кодирующую CTP последовательность по изобретению можно вводить в подходящий вектор для субклонирования последовательности в экспрессирующий вектор, или кодирующую CTP последовательность по изобретению можно встраивать в молекулу нуклеиновой кислоты, которая способствует продукции другой молекулы нуклеиновой кислоты, содержащей кодирующую CTP последовательность, функционально связанную с представляющей интерес нуклеотидной последовательностью. В этих и других вариантах осуществления может быть удалено одно или несколько положений аминокислот в последовательности синтетического химерного происходящего из Brassica CTP. Например, последовательность синтетического химерного происходящего из Brassica CTP может быть модифицирована так, чтобы аминокислота(ы) в положениях 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 была удалена. Выравнивание гомологичных последовательностей CTP можно использовать для получения указаний на то, какие аминокислоты можно удалять без влияния на функцию синтетического CTP.
В конкретных примерах синтетический происходящий из Brassica транзитный пептид хлоропластов имеет длину менее 80 аминокислот. Например, синтетический происходящий из Brassica CTP может иметь длину 79, 78, 77, 76, 75, 74, 73, 72, 71, 70, 69, 68, 67, 66, 65, 64, 63, 62, 61, 60 или менее аминокислот. В определенных примерах синтетический происходящий из Brassica CTP может иметь длину приблизительно 65, приблизительно 68, приблизительно 72 или приблизительно 74 аминокислот. В этих и следующих примерах синтетический происходящий из Brassica CTP может содержать аминокислотную последовательность, указанную в одной из SEQ ID NO: 6 и 8, или функциональный вариант любого из указанных выше. Таким образом, синтетический происходящий из Brassica CTP может содержать аминокислотную последовательность, содержащую одну из SEQ ID NO: 6 и 8, или ее функциональный вариант, где длина синтетического происходящего из Brassica CTP составляет менее 80 аминокислот. В определенных примерах синтетический происходящий из Brassica CTP может содержать аминокислотную последовательность, которая, например, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 92%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или на 100% идентична одной из SEQ ID NO: 6 и 8.
Все нуклеотидные последовательности, которые кодируют конкретный синтетический происходящий из Brassica CTP, например, пептид TraP12 SEQ ID NO: 6, пептид TraP13 SEQ ID NO: 8, или функциональные варианты любого из указанных выше, включая любые конкретные делеции и/или консервативные аминокислотные замены, будут известны специалистам в данной области с учетом настоящего описания. Вырожденность генетического кода обеспечивает конечное количество кодирующих последовательностей для конкретной аминокислотной последовательности. Выбор конкретной последовательности, кодирующей синтетический происходящий из Brassica CTP, осуществляется по усмотрению практикующего специалиста. В различных применениях могут быть желательными различные кодирующие последовательности. Например, для увеличения экспрессии синтетического происходящего из Brassica CTP в конкретном хозяине можно выбирать кодирующую последовательность, которая отражает предпочтительное использование кодонов хозяином. В качестве примера, синтетический происходящий из Brassica CTP может кодироваться нуклеотидной последовательностью, указанной в качестве одной из SEQ ID NO: 5, 7, 11, 12, 13, 15, 17 и 19.
В молекулах нуклеиновой кислоты, предусматриваемых в некоторых вариантах осуществления изобретения, последний кодон нуклеотидной последовательности, кодирующей синтетический происходящий из Brassica CTP, и первый кодон представляющей интерес нуклеотидной последовательности могут быть разделены любым количеством нуклеотидных триплетов, например, без кодирования интрона или "остановки". В некоторых примерах последовательность, кодирующая первые аминокислоты зрелого белка, обычно ассоциированная с транзитным пептидом хлоропластов в природном полипептиде-предшественнике, может присутствовать между последним кодоном нуклеотидной последовательности, кодирующей синтетический происходящий из Brassica CTP, и первым кодоном представляющей интерес нуклеотидной последовательности. Последовательность, разделяющая нуклеотидную последовательность, кодирующую синтетический происходящий из Brassica CTP, и первый кодон представляющей интерес нуклеотидной последовательности может состоять, например, из любой последовательности, так чтобы было маловероятно, что кодируемая аминокислотная последовательность изменит трансляцию химерного полипептида и его перемещение в пластиду. В этих и следующих вариантах осуществления последний кодон нуклеотидной последовательности, кодирующей синтетический происходящий из Brassica CTP, может быть слит в рамке считывания с первым кодоном представляющей интерес нуклеотидной последовательности, непосредственно соседней с ним или отделенной от него не более чем на короткую пептидную последовательность, такую как пептидная последовательность, кодируемая синтетическим нуклеотидным линкером (например, нуклеотидный линкер, который можно использовать для обеспечения слияния).
В некоторых вариантах осуществления может быть желательной модификация нуклеотидов представляющей интерес нуклеотидной последовательности и/или последовательности, кодирующей синтетический происходящий из Brassica CTP, слитой с ней в одной кодирующей последовательности, например, для повышения экспрессии кодирующей последовательности в конкретном хозяине. Генетический код является избыточным при наличии 64 возможных кодонов, однако большинство организмов предпочтительно используют подгруппу этих кодонов. Кодоны, которые используются наиболее часто видом, называются оптимальными кодонами, и не используемые кодоны очень часто классифицируют как редкие кодоны или малоиспользуемые кодоны. Zhang et al. (1991), Gene 105:61-72. Кодоны можно заменять так, чтобы это отражало предпочтительное использование кодонов в конкретном хозяине в процессе, иногда обозначаемом как "оптимизация кодонов". Оптимизированные кодирующие последовательности, содержащие кодоны, предпочтительные для конкретного прокариотического или эукариотического хозяина, можно получать, например, для повышения скорости трансляции или для получения рекомбинантных РНК-транскриптов, имеющих желаемые свойства (например, более длительное время полужизни по сравнению с транскриптами, полученными из неоптимизированной последовательности).
Любой полипептид может быть нацелен в пластиду содержащей пластиду клетки путем включения последовательности синтетического происходящего из Brassica CTP. Например, в некоторых вариантах осуществления полипептид может быть связан с последовательностью синтетического происходящего из Brassica CTP так, чтобы направлять полипептид в пластиду в клетке, где экспрессируется связанная молекула полипептид-CTP. В конкретных вариантах осуществления полипептид, нацеленный в пластиду путем включения последовательности синтетического происходящего из Brassica CTP, может представлять собой, например, полипептид, который обычно экспрессируется в пластиде клетки, где полипептид экспрессируется нативным образом. Например, но не ограничиваясь этим, полипептид, нацеленный в пластиду путем включения последовательности синтетического происходящего из Brassica CTP, может представлять собой полипептид, вовлеченный в устойчивость к гербициду, устойчивость к вирусу, устойчивость к бактериальному патогену, устойчивость к насекомым, устойчивость к круглым червям или устойчивость к грибам. См., например, патенты США 5569823; 5304730; 5495071; 6329504 и 6337431. Полипептид, нацеленный в пластиду путем включения последовательности синтетического происходящего из Brassica CTP, альтернативно может представлять собой, например, но не ограничиваясь этим, полипептид, вовлеченный в активность роста и урожайность растения (включая полипептиды, вовлеченные в устойчивость к экстремальным температурам, условиям почвы, уровням освещенности, уровням воды и химической среде), или полипептид, который можно использовать в качестве маркера для идентификации растения, имеющего представляющий интерес признак (например, продукт гена селективного маркера, полипептид, вовлеченный в окрашивание и т.д.).
Неограничивающие примеры полипептидов, вовлеченных в устойчивость к гербицидам, которые могут быть связаны с пептидной последовательностью синтетического происходящего из Brassica CTP, в некоторых вариантах осуществления изобретения включают: ацетолактатсинтазу (ALS), мутантную ALS и предшественников ALS (см., например, патент США 5013659); EPSPS (см., например, патенты США 4971908 и 6225114), такую как EPSPS CP4 или EPSPS класса III; ферменты, которые модифицируют физиологический процесс, который происходит в пластиде, включая фотосинтез и синтез жирных кислот, аминокислот, масел, аротиноидов, терпеноидов, крахмала и т.д. Другие неограничивающие примеры полипептидов, которые могут быть связаны с синтетическим происходящим из Brassica пептидом CTP, в конкретных вариантах осуществления включают: зиаксантинэпоксидазу, холинмонооксигеназу, феррохелатазу, десатуразу омега-3 жирных кислот, глутаминсинтетазу, модифицирующие крахмал ферменты, полипептиды, вовлеченные в синтез незаменимых аминокислот, провитамин A, гормоны, белки Bt-токсина и т.д. Нуклеотидные последовательности, кодирующие упомянутые выше пептиды, известны в данной области, и такие нуклеотидные последовательности могут быть функционально связаны с нуклеотидной последовательностью, кодирующей синтетический происходящий из Brassica пептид CTP, для экспрессии в виде полипептида, содержащего представляющий интерес полипептид, связанный с синтетическим происходящим из Brassica пептидом CTP. Более того, дополнительные нуклеотидные последовательности, кодирующие любой из упомянутых выше пептидов, могут быть идентифицированы специалистами в данной области (например, путем клонирования генов с высокой гомологией с другими генами, кодирующими конкретный полипептид). После идентификации такой нуклеотидной последовательности, конструирование нуклеотидной последовательности, содержащей последовательность, кодирующую синтетический происходящий из Brassica CTP, функционально связанную с идентифицированной нуклеотидной последовательностью, или последовательность, кодирующую эквивалентный полипептид, является нетрудным процессом.
V. Экспрессия полипептидов, содержащих синтетический происходящий из Brassica транзитный пептид хлоропластов
В некоторых вариантах осуществления по меньшей мере одну молекулу(ы) нуклеиновой кислоты, содержащая нуклеотидную последовательность, кодирующую полипептид, содержащий по меньшей мере один синтетический происходящий из Brassica CTP или его функциональный эквивалент, можно вводить в клетку, ткань или организм для экспрессии в нем полипептида. В конкретных вариантах осуществления молекула нуклеиновой кислоты может содержать представляющую интерес нуклеотидную последовательность, функционально связанную с нуклеотидной последовательностью, кодирующей синтетический происходящий из Brassica CTP. Например, молекула нуклеиновой кислоты может содержать кодирующую последовательность, кодирующую полипептид, содержащий по меньшей мере один синтетический происходящий из Brassica CTP, и по меньшей мере дополнительную пептидную последовательность, кодируемую представляющей интерес нуклеотидной последовательностью. В некоторых вариантах осуществления молекулу нуклеиновой кислоты по изобретению можно вводить в содержащую пластиду хозяйскую клетку, ткань или организм (например, клетка растения, ткань растения и растение), так чтобы с молекулы нуклеиновой кислоты в содержащей пластиду хозяйской клетке, ткани или организме мог экспрессироваться полипептид, где экспрессированный полипептид содержит по меньшей мере один синтетический происходящий из Brassica CTP, и по меньшей мере дополнительную пептидную последовательность, кодируемую представляющей интерес нуклеотидной последовательностью. В определенных примерах синтетический происходящий из Brassica CTP такого экспрессируемого полипептида может облегчать нацеливание части полипептида, содержащей по меньшей мере дополнительную пептидную последовательность, в пластиду хозяйской клетки, ткани или организма.
В некоторых вариантах осуществления молекулу нуклеиновой кислоты по изобретению можно вводить в содержащую пластиду клетку с помощью одной из любых методик, известных специалистам в данной области. В конкретных вариантах осуществления хозяйскую клетку, ткань или организм можно контактировать с молекулой нуклеиновой кислоты по изобретению для введения молекулы нуклеиновой кислоты в клетку, ткань или организм. В конкретных вариантах осуществления клетку можно трансформировать молекулой нуклеиновой кислоты по изобретению, так чтобы в клетку была введена молекула нуклеиновой кислоты, и молекула нуклеиновой кислоты стабильно встраивалась в геном клетки. В некоторых вариантах осуществления молекула нуклеиновой кислоты, содержащая по меньшей мере одну нуклеотидную последовательность, кодирующую синтетический происходящий из Brassica CTP, функционально связанный с представляющей интерес нуклеотидной последовательностью, можно использовать для трансформации клетки, например, содержащей пластиду клетки (например, клетки растения). Для инициации или усиления экспрессии молекула нуклеиновой кислоты может содержать одну или несколько регуляторных последовательностей, которые могут быть функционально связаны с нуклеотидной последовательностью, кодирующей полипептид, содержащий по меньшей мере один синтетический происходящий из Brassica CTP.
Молекула нуклеиновой кислоты может представлять собой, например, векторную систему, включающую, например, линейную или замкнутую кольцевую плазмиду. В конкретных вариантах осуществления вектор может представлять собой экспрессирующий вектор. Последовательности нуклеиновой кислоты по изобретению можно встраивать, например, в вектор, так чтобы последовательность нуклеиновой кислоты была функционально связана с одной или несколькими регуляторными последовательностями. Для этой цели доступно множество векторов, и выбор конкретного вектора может зависеть, например, от размера нуклеиновой кислоты, подлежащей встраиванию в вектор, и конкретной клетки-хозяина, которую трансформируют вектором. Вектор, как правило, содержит различные компоненты, тип которых зависит от функции вектора (например, амплификация ДНК и экспрессия ДНК), и конкретной клетки(ок)-хозяина, с которой вектор совместим.
Некоторые варианты осуществления могут включать вектор для трансформации растений, который содержит нуклеотидную последовательность, содержащую по меньшей мере одну из описанных выше регуляторных последовательностей, функционально связанных с одной или несколькими нуклеотидной последовательностью(ями), кодирующей полипептид, содержащий по меньшей мере один синтетический происходящий из Brassica CTP. Одну или несколько нуклеотидных последовательностей можно экспрессировать под контролем регуляторной последовательности(ей), в клетке растения, ткани или организме, с получением полипептида, содержащего синтетический происходящий из Brassica CTP, который нацеливает по меньшей мере часть полипептида в пластиды клетки растения, ткани или организма.
В некоторых вариантах осуществления регуляторная последовательность, функционально связанная с нуклеотидной последовательностью, кодирующей полипептид, содержащий по меньшей мере один синтетический происходящий из Brassica CTP, может представлять собой промоторную последовательность, которая функционирует в клетке-хозяине, такой как бактериальная клетка, где молекула нуклеиновой кислоты должна амплифицироваться, или клетка растения, где молекула нуклеиновой кислоты должна экпрессироваться.
Промоторы, подходящие для применения в молекулах нуклеиновых кислот по изобретению, включают промоторы, которые являются индуцибельными, вирусными, синтетическими или конститутивными, все из которых хорошо известны в данной области. Неограничивающие примеры промоторов, которые могут быть пригодными в вариантах осуществления изобретения, предоставлены в: патентах США № 6437217 (промотор RS81 кукурузы); 5641876 (промотор актина риса); 6426446 (промотор RS324 кукурузы); 6429362 (промотор PR-1 кукурузы); 6232526 (промотор A3 кукурузы); 6177611 (конститутивные промоторы кукурузы); 5322938, 5352605, 5359142 и 5530196 (промотор 35S); 6433252 (промотор L3 олеосина кукурузы); 6429357 (промотор актина 2 риса и интрон актина 2 риса); 6294714 (индуцируемые светом промоторы); 6140078 (индуцируемые солью промоторы); 6252138 (индуцируемые патогеном промоторы); 6175060 (индуцируемые дефицитом фосфора промоторы); 6388170 (двунаправленные промоторы); 6635806 (промотор гамма-коиксина); и патентную заявку США с серийным номером № 09/757089 (промотор альдолазы хлоропластов кукурузы).
Дополнительные иллюстративные промоторы включают промотор нопалинсинтазы (NOS) (Ebert et al. (1987) Proc. Natl. Acad. Sci. USA 84(16):5745-9) и промотор октопинсинтазы (OCS) (который содержится в индуцирующих опухоль плазмидах Agrobacterium tumefaciens); промоторы колимовирусов, такие как промотор 19S вируса мозаики цветной капусты (CaMV) (Lawton et al. (1987) Plant Mol. Biol. 9:315-24); промотор 35S CaMV (Odell et al. (1985) Nature 313:810-2; промотор 35S вируса мозаики норичника (Walker et al. (1987) Proc. Natl. Acad. Sci. USA 84(19):6624-8); промотор сахарозосинтазы (Yang and Russell (1990) Proc. Natl. Acad. Sci. USA 87:4144-8); промотор комплекса генов R (Chandler et al. (1989) Plant Cell 1: 1175-83); промотор гена белка, связывающего хлорофилл a/b; CaMV35S (патенты США № 5322938, 5352605, 5359142 и 5530196); FMV35S (патенты США № 6051753 и 5378619); промотор PC1SV (патент США № 5850019); промотор SCP1 (патент США № 6677503); и промоторы AGRtunos (номер доступа GenBank № V00087; Depicker et al. (1982) J. Mol. Appl. Genet. 1: 561-73; Bevan et al. (1983) Nature 304: 184-7).
В конкретных вариантах осуществления молекулы нуклеиновой кислоты по изобретению могут содержать тканеспецифический промотор. Тканеспецифический промотор представляет собой нуклеотидную последовательность, которая обеспечивает более высокий уровень транскрипции функционально связанной нуклеотидной последовательности в ткани, для которой промотор является специфичным, относительно других тканей в организме. Примеры тканеспецифических промоторов включают, но не ограничиваются ими: специфичные для тапетума промоторы; специфичные для пыльника промоторы; специфичные для пыльцы промоторы (см., например, патент США № 7141424, и международную публикацию PCT № WO 99/042587); специфичные для семяпочки промоторы; (см., например, патентную заявку США № 2001/047525 A1); специфичные для плодов промоторы (см., например, патенты США № 4943674 и 5753475); и специфичные для семян промоторы (см., например, патенты США № 5420034 и 5608152). В некоторых вариантах осуществления в композиции или способе по изобретению можно использовать специфичный для стадии развития промотор (например, промотор, активный на более поздней стадии развития).
Дополнительные регуляторные последовательности, которые в некоторых вариантах осуществления могут быть функционально связаны с молекулой нуклеиновой кислоты, включают 5'-UTR, расположенные между промоторной последовательностью и кодирующей последовательностью, которые функционируют в качестве лидерных последовательностей трансляции. Лидерная последовательность трансляции присутствует в полностью процессированной мРНК, и она может влиять на процессинг первичного транскрипта и/или стабильность РНК. Примеры лидерных последовательностей трансляции включают лидерные последовательности белка теплового шока кукурузы и петунии (патент США № 5362865), лидерные последовательности белка оболочки вируса растений, лидерные последовательности рибулозо-1,5-бифосфаткарбоксилазы/оксигеназы растений и другие. См., например, Turner and Foster (1995) Molecular Biotech. 3(3):225-36. Неограничивающие примеры 5'-UTR представляют собой: GmHsp (патент США № 5659122); PhDnaK (патент США № 5362865); AtAntl; TEV (Carrington and Freed (1990) J. Virol. 64:1590-7); и AGRtunos (номер доступа GenBank № V00087; и Bevan et al. (1983) Nature 304:184-7).
Дополнительные регуляторные последовательности, которые в некоторых вариантах осуществления могут быть функционально связанными с молекулой нуклеиновой кислоты, также включают 3'-нетранслируемые последовательности, 3'-области терминации транскрипции или области полиаденилирования. Они представляют собой генетические элементы, расположенные ниже нуклеотидной последовательности, и включают полинуклеотиды, которые обеспечивают сигнал полиаденилирования и/или другие регуляторные сигналы, способные влиять на транскрипцию или процессинг мРНК. Сигналы полиаденилирования функционируют в растениях, обеспечивая присоединение полиаденилатных нуклеотидов к 3′-концу мРНК-предшественника. Последовательность полиаденилирования может происходить из различных генов растений или из генов T-ДНК. Неограничивающим примером 3′-области терминации транскрипции является 3′-область нопалинсинтазы (nos 3′; Fraley et al. (1983), Proc. Natl. Acad. Sci. USA 80:4803-7). Пример применения различных 3′-нетранслируемых областей предоставлен в Ingelbrecht et al., (1989), Plant Cell 1:671-80. Неограничивающие примеры сигналов полиаденилирования включают сигнал полиаденилирования из гена Pisum sativum RbcS2 (Ps.RbcS2-E9; Coruzzi et al. (1984), EMBO J. 3:1671-9) и AGRtu.nos (номер доступа в GenBank № E01312).
Рекомбинантная молекула нуклеиновой кислоты или вектор по настоящему изобретению могут содержать селективный маркер, который сообщает поддающийся селекции фенотип трансформированной клетке, такой как клетка растения. Селективные маркеры также можно использовать для селекции растений или клеток растений, которые содержат рекомбинантную молекулу нуклеиновой кислоты по изобретению. Маркер может кодировать устойчивость к биоциду, устойчивость к антибиотику (например, канамицину, генетицину (G418), блеомицину, гигромицину и т.д.), или устойчивость к гербициду (например, глифосат и т.д.). Примеры селективных маркеров включают, но не ограничиваются ими: ген neo, который кодирует устойчивость к канамицину и его селекция может быть осуществлена с использованием канамицина, G418 и т.д.; ген bar, который кодирует устойчивость к биалафосу; мутантный ген синтазы EPSP, который кодирует устойчивость к глифосату; ген нитрилазы, который сообщает устойчивость к бромксинилу; мутантный ген ацетолактатсинтазы (ALS), который сообщает устойчивость к имидазолинонму или сульфонилмочевине; и ген DHFR устойчивости к метотрексату. Доступно множество селективных маркеров, которые сообщают устойчивость к ампициллину, блеомицину, хлорамфениколу, гентамицину, гигромицину, канамицину, линкомицину, метотрексату, фосфинотрицину, пуромицину, спектиномицину, рифампицину, стрептомицину и тетрациклину и т.п. Примеры таких селективных маркеров проиллюстрированы, например, в патентах США № 5550318; 5633435; 5780708 и 6118047.
Рекомбинантная молекула нуклеиновой кислоты или вектор по настоящему изобретению также или альтернативно могут включать маркеры для скрининга. Маркеры для скрининга можно использовать для того, чтобы осуществлять мониторинг экспрессии. Иллюстративные маркеры для скрининга включают ген β-глюкуронидазы или ген uidA (GUS), который кодирует фермент, для которого известны различные хромогенные субстраты (Jefferson et al. (1987) Plant Mol. Biol. Rep. 5:387-405); ген R-локуса, который кодирует продукт, который регулирует продукцию антоцианиновых пигментов (красный цвет) в тканях растений (Dellaporta et al. (1988) "Molecular cloning of the maize R-nj allele by transposon tagging with Ac", 18th Stadler Genetics Symposium, P. Gustafson and R. Appels, eds. (New York: Plenum), pp. 263-82); ген β-лактамазы (Sutcliffe et al. (1978) Proc. Natl. Acad. Sci. USA 75:3737-41); ген, который кодирует фермент, для которого известны различные хромогенные субстраты (например, PADAC, хромогенный цефалоспорин); ген люциферазы (Ow et al. (1986) Science 234:856-9); ген xylE, который кодирует катехолдиоксигеназу, которая может конвертировать хромогенные катехолы (Zukowski et al. (1983) Gene 46(2-3):247-55); ген амилазы (Ikatu et al. (1990) Bio/Technol. 8:241-2); ген тирозиназы, который кодирует фермент, способный окислять тирозин в DOPA и допахинон, который, в свою очередь, конденсируется в меланин (Katz et al. (1983) J. Gen. Microbiol. 129:2703-14); и ген α-галактозидазы.
Пригодные способы для трансформации клеток-хозяев включают любой способ, посредством которого ДНК можно встраивать в клетку, например, и не ограничиваясь этим, трансформацию протопластов (см., например, патент США 5508184), захват ДНК, опосредуемый обезвоживанием/ингибированием (см., например, Potrykus et al. (1985) Mol. Gen. Genet. 199:183-8), электропорацию (см., например, патент США 5384253), встряхивание с волокнами из карбида кремния (см., например, патенты США 5302523 и 5464765), опосредуемую Agrobacterium трансформацию (см., например, патенты США № 5563055; 5591616; 5693512; 5824877; 5981840 и 6384301) и ускорение покрытых ДНК частиц (см., например, патенты США № 5015580; 5550318; 5538880; 6160208; 6399861 и 6403865), и т.д. С использованием способов, таких как эти, можно стабильно трансформировать клетки практически любого вида. В некоторых вариантах осуществления трансформирующую ДНК встраивают в геном клетки-хозяина. В случае многоклеточных видов, трансгенные клетки можно регенерировать в трансгенный организм. Любой из этих способов можно использовать для получения трансгенного растения, например, содержащего одну или несколько последовательностей нуклеиновой кислоты по изобретению в геноме трансгенного растения.
Наиболее широко используемый способ введения экспрессирующего вектора в растения основан на природной системе трансформации Agrobacterium. A. tumefaciens и A. rhizogenes представляют собой патогенные для растений бактерии почвы, которые генетически трансформируют клетки растений. Плазмиды Ti и Ri из A. tumefaciens и A. rhizogenes, соответственно, содержат гены, ответственные за генетическую трансформацию растения. Плазмиды Ti (индуцирующие опухоль) содержат большой сегмент, известный как T-ДНК, который переносится в трансформированные растения. Другой сегмент плазмиды Ti, область vir, ответственен за перенос T-ДНК. Область T-ДНК ограничена концевыми повторами. В модифицированных бинарных векторах индуцирующие опухоль гены удалены, и функции области vir используются для переноса чужеродной ДНК, ограниченной пограничными последовательностями T-ДНК. T-область также может содержать селективный маркер для эффективного восстановления трансгенных растений и клеток, и участок множественного клонирования для встраивания последовательностей для переноса, таких как нуклеиновая кислота, кодирующая синтетический происходящий из Brassica CTP.
Таким образом, в некоторых вариантах осуществления вектор для трансформации растений происходит из плазмиды Ti A. tumefaciens (см., например, патенты США № 4536475, 4693977, 4886937 и 5501967; и патент Европы EP 0 122 791) или плазмиды Ri A. rhizogenes. Дополнительные векторы для трансформации растений включают, например и не ограничиваясь ими, векторы, описанные Herrera-Estrella et al. (1983) Nature 303:209-13; Bevan et al. (1983) Nature 304:184-7; Klee et al. (1985) Bio/Technol. 3:637-42; и в патенте Европы EP 0 120 516, и векторы, происходящие из любого из вышесказанных. Другие бактерии, такие как Sinorhizobium, Rhizobium и Mesorhizobium, которые взаимодействуют с растениями в природе, можно модифицировать для обеспечения переноса генов в ряд разнообразных растений. Эти ассоциированные с растениями симбиотические бактерии можно делать компетентными для переноса генов путем введения как обезвреженных плазмид Ti, так и подходящего бинарного вектора.
После предоставления экзогенной ДНК реципиентным клеткам трансформированные клетки, как правило, идентифицируют для дальнейшего культивирования и регенерации растений. Для повышения способности идентифицировать трансформированные клетки может быть желательным использование селективного маркерного гена или маркерного гена для скрининга, как описано выше, с вектором, используемым для получения трансформанта. В случае, когда используют селективный маркер, трансформированные клетки идентифицируют в потенциально трансформированной популяции клеток путем воздействия на клетки селективного средства или средств. В случае, когда используют маркер для скрининга, клетки можно подвергать скринингу на желаемый признак маркерного гена.
Клетки, которые выживают после воздействия селективного средства, или клетки, оцененные как положительные в скрининговом анализе, можно культивировать в среде, которая поддерживает регенерацию растений. В некоторых вариантах осуществления любую подходящую культуральную среду для ткани растения (например, среду MS и N6) можно модифицировать путем включения дополнительных веществ, таких как регуляторы роста. Ткань можно поддерживать на основной среде с регуляторами роста до тех пор, пока не станет доступно достаточно ткани, чтобы начать попытку регенерации, или, после повторяющихся раундов селекции вручную, до тех пор, пока морфология ткани не станет пригодной для регенерации (например, по меньшей мере 2 недели), а затем переносить в среду, способствующую образованию побега. Культуры пересаживают периодически до тех пор, пока не произойдет достаточное образование побега. После образования побегов их переносят в среду, способствующую образованию корней. После образования достаточных корней, растения можно переносить в почву для дальнейшего роста и созревания.
Для подтверждения присутствия представляющей интерес молекулы нуклеиновой кислоты (например, нуклеотидная последовательность, кодирующая полипептид, содержащий по меньшей мере один синтетический происходящий из Brassica CTP) в регенерирующем растении можно проводить множество анализов. Такие анализы включают, например: молекулярно-биологические анализы, такие как саузерн-блоттинг и нозерн-блоттинг, ПЦР и секвенирование нуклеиновых кислот; биохимические анализы, такие как выявление присутствия белкового продукта, например, с помощью иммунологических средств (ELISA и/или вестерн-блоттинг) или ферментативной функции; анализы частей растений, такие как анализы листьев или корней; и анализ фенотипа целого регенерировавшего растения.
В качестве примера, встраивающиеся трансгенные объекты можно анализировать путем амплификации ПЦР с использованием, например, олигонуклеотидных праймеров, специфичных к представляющей интерес нуклеотидной последовательности. Подразумевают, что генотипирование ПЦР включает, но не ограничивается этим, амплификацию с использованием полимеразной цепной реакции (ПЦР) геномной ДНК, происходящей из выделенной ткани растения-хозяина, предположительно содержащей представляющую интерес молекулу нуклеиновой кислоты, встроенную в геном, с последующим стандартным клонированием и анализом последовательности продуктов амплификации с использованием ПЦР. Способы генотипирования с помощью ПЦР подробно описаны (см., например, Rios, G. et al (2002) Plant J. 32:243-53) и их можно применять в отношении геномной ДНК, происходящей из любого вида растений (например, Z. mays или G. max), или типа ткани, включая клеточные культуры.
Трансгенное растение, образованное с использованием способов трансформации на основе Agrobacterium, как правило, содержит одну рекомбинантную последовательность ДНК, встроенную в одну хромосому. Одну рекомбинантную последовательность ДНК называют "трансгенным объектом" или "встраивающимся объектом". Такие трансгенные растения являются гетерозиготными по встроенной последовательности ДНК. В некоторых вариантах осуществления трансгенное растение, гомозиготное в отношении трансгена, можно получать путем полового скрещивания (самоопыления) независимого сегрегантного трансгенного растения, которое содержит одну экзогенную последовательность гена, с ним же, например растения F0, с получением семян F1. Четверть полученных семян F1 будут гомозиготными в отношении трансгена. Прорастание семян F1 приводит к растениям, которые можно исследовать в отношении гетерозиготности, как правило, с использованием анализа SNP или анализа концевой амплификации, который позволяет различить гетерозиготы и гомозиготы (т.е. анализ зиготности).
В конкретных вариантах осуществления копии по меньшей мере одного полипептида, содержащего по меньшей мере один синтетический происходящий из Brassica CTP, продуцируются в содержащей пластиду клетке, в которую была введена по меньшей мере одна молекула(ы) нуклеиновой кислоты, содержащая нуклеотидную последовательность, кодирующую по меньшей мере один полипептид, содержащий по меньшей мере один синтетический происходящий из Brassica CTP. Каждый полипептид, содержащий по меньшей мере один синтетический происходящий из Brassica CTP, может экспрессироваться с множества последовательностей нуклеиновой кислоты, введенных в различных трансформирующих объектах, или с одной последовательности нуклеиновой кислоты, введенной в одном трансформирующем объекте. В некоторых вариантах осуществления множество таких полипептидов экспрессируется под контролем одного промотора. В других вариантах осуществления множество таких полипептидов экспрессируется под контролем множества промоторов. Могут экспрессироваться единичные полипептиды, которые содержат множество пептидных последовательностей, причем каждая из этих пептидных последовательностей нацелена в пластиду.
В дополнение к прямой трансформации растения рекомбинантной молекулой нуклеиновой кислоты, трансгенные растения можно получать путем скрещивания первого растения, имеющего по меньшей мере один трансгенный объект, со вторым растением, лишенным такого объекта. Например, рекомбинантную молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, кодирующую полипептид, содержащий по меньшей мере один синтетический происходящий из Brassica CTP, можно вводить в первую линию растений, которая поддается трансформации, с получением трансгенного растения, которое можно скрещивать со второй линией растений для интрогрессии нуклеотидной последовательности, которая кодирует полипептид, во вторую линию растений.
VI. Растительные материалы, содержащие полипептид, направляемый синтетически происходящим из Brassica транзитным пептидом хлоропластов
В некоторых вариантах осуществления предусматривается растение, где растение содержит клетку растения, содержащую нуклеотидную последовательность, кодирующую полипептид, содержащий по меньшей мере один синтетический происходящий из Brassica CTP. В конкретных вариантах осуществления такое растение можно получать путем трансформации ткани растения или клетки растения и регенерации целого растения. В следующих вариантах осуществления такое растение можно получать из коммерческого источника или путем интрогрессии нуклеиновой кислоты, содержащей нуклеотидную последовательность, кодирующую полипептид, содержащий по меньшей мере один синтетический происходящий из Brassica CTP, в зародышевую плазму. Также предусматриваются растительные материалы, содержащие растительную клетку, содержащую нуклеотидную последовательность, кодирующую полипептид, содержащий по меньшей мере один синтетический происходящий из Brassica CTP. Такой растительный материал можно получать из растения, содержащего клетку растения. В следующих вариантах осуществления растительный материал представляет собой растительную клетку, которая неспособна регенерировать с образованием растения.
Трансгенное растение или растительный материал, содержащий нуклеотидную последовательность, кодирующую полипептид, содержащий по меньшей мере один из синтетических происходящих из Brassica CTP, в некоторых вариантах осуществления может проявлять одну из следующих характеристик: экспрессия полипептида в клетке растения; экспрессия части полипептида в пластиде клетки растения; импорт полипептида из цитозоля клетки растения в пластиду клетки; специфическую для пластида экспрессию полипептида в клетке растения и/или локализацию полипептида в клетке растения. Кроме того, такое растение может иметь один или несколько желаемых признаков, отличных от экспрессии кодируемого полипептида. Такие признаки могут включать, например: устойчивость к насекомым, другим паразитам, болезнетворным агентам; устойчивость к гербицидам; повышенную стабильность, урожайность или срок хранения; устойчивость к факторам окружающей среды; фармацевтическое производство; производство промышленного продукта и улучшение питания.
Трансгенное растение по изобретению может представлять собой любое растение, способное быть трансформированным молекулой нуклеиновой кислоты по изобретению. Таким образом, растение может быть двудольным или однодольным. Неограничивающие примеры двудольных растений, пригодных в настоящих способах, включают Arabidopsis, люцерну, боб, брокколи, капусту, морковь, цветную капусту, сельдерей, китайскую капусту, хлопок, огурец, баклажан, салат-латук, дыню, горох, перец, арахис, картофель, тыкву обыкновенную, хрен, рапс, шпинат, сою, тыкву крупноплодную, сахарную свеклу, подсолнечник, табак, томат и арбуз. Неограничивающие примеры однодольных растений, пригодных в настоящих способах, включают кукурузу, Brassica, лук, рис, сорго, пшеницу, рожь, просо культурное, сахарный тростник, тритикале, просо прутьевидное и траву рулонного газона. Трансгенные растения по изобретению можно использовать или культивировать любым образом.
Некоторые варианты осуществления также относятся к товарным продуктам, содержащим одну или несколько нуклеотидных последовательностей, кодирующих полипептид, содержащий по меньшей мере один синтетический происходящий из Brassica CTP, например, к товарному продукту, изготовленному из рекомбинантного растения или семени, содержащего одну или несколько таких нуклеотидных последовательностей. Товарные продукты, содержащие одну или несколько нуклеотидных последовательностей, кодирующих полипептид, содержащий по меньшей мере один синтетический происходящий из Brassica CTP, включают, например, но не ограничиваются ими: продукты питания, муку, масла или размолотые или цельные зерна или семена растения, содержащего одну или несколько нуклеотидных последовательностей, кодирующих полипептид, содержащий по меньшей мере один синтетический происходящий из Brassica CTP. Обнаружение одной или нескольких нуклеотидных последовательностей, кодирующих полипептид, содержащий по меньшей мере один синтетический происходящий из Brassica CTP, в одном или нескольких товарах или товарных продуктах, является фактическим доказательством того, что товар или товарный продукт был по меньшей мере частично изготовлен из растения, содержащего одну или несколько нуклеотидных последовательностей, кодирующих полипептид, содержащий по меньшей мере один синтетический происходящий из Brassica CTP. В конкретных вариантах осуществления товарный продукт по изобретению содержит поддающееся обнаружению количество последовательности нуклеиновой кислоты, кодирующей полипептид, содержащий по меньшей мере один синтетический происходящий из Brassica CTP. В некоторых вариантах осуществления такие товарные продукты можно изготавливать, например, путем получения трансгенных растений и изготовления из них продукта питания или корма.
В некоторых вариантах осуществления трансгенное растение или семя, содержащие трансген, содержащий нуклеотидную последовательность, кодирующую полипептид, содержащий по меньшей мере один синтетический происходящий из Brassica CTP, также может содержать по меньшей мере один другой трансгенный объект в своем геноме, включая, но не ограничиваясь ими: трансгенный объект, с которого транскрибируется молекула i-РНК; ген, кодирующий инсектицидный белок (например, инсектицидный белок Bacillus thuringiensis); ген устойчивости к гербициду (например, ген, обеспечивающий устойчивость к глифосату); и ген, вносящий вклад в желаемый генотип в трансгенном растении (например, увеличенный выход, измененный метаболизм жирных кислот или восстановление цитоплазматической мужской стерильности).
VII. Опосредуемая синтетическим происходящим из Brassica транзитным пептидом хлоропластов локализация продуктов генов в пластидах
Некоторые варианты осуществления настоящего изобретения относятся к способу экспрессии и/или локализации продукта гена в пластиде (например, хлоропласт). В конкретных вариантах осуществления продукт гена может представлять собой продукт маркерного гена, например, флуоресцентную молекулу. Экспрессия продукта гена в качестве части полипептида, также содержащего синтетический происходящий из Brassica CTP, может обеспечить систему для оценки способностей к локализации в пластиде конкретной последовательности синтетического происходящего из Brassica CTP. В некоторых вариантах осуществления экспрессию продукта маркерного гена в качестве части полипептида, содержащего синтетический происходящий из Brassica CTP, используют для нацеливания экспрессии продукта маркерного гена в пластиду клетки, где полипептид экспрессируется. В определенных вариантах осуществления такой продукт маркерного гена локализован в пластиде(ах) клетки хозяина. Например, продукт маркерного гена может экспрессироваться на более высоких уровнях в пластиде(ах), чем в цитозоле или других органеллах клетки-хозяина; продукт маркерного гена может экспрессироваться на значительно более высоких уровнях в пластиде(ах); продукт маркерного гена может экспрессироваться по существу только в пластиде(ах); или продукт маркерного гена может экспрессироваться только в пластиде(ах), так что экспрессию в цитозоле или не являющихся пластидами органеллах нельзя обнаружить.
В некоторых вариантах осуществления полипептид, содержащий функциональный вариант синтетического происходящего из Brassica CTP, где полипептид функционально связан с продуктом маркерного гена, используют для оценки характеристик функционального варианта пептида. Например, последовательность синтетического происходящего из Brassica CTP можно варьировать, например, путем внесения по меньшей мере одной консервативной мутации(ий) в синтетический происходящий из Brassica CTP, и полученный вариант пептида можно связывать с продуктом маркерного гена. После экспрессии в подходящей клетке-хозяине (например, клетке, где действует один или несколько регуляторных элементов в экспрессирующей конструкции), можно определять экспрессию продукта маркерного гена. Путем сравнения субклеточной локализации продукта маркерного гена между эталонной конструкцией синтетический происходящий из Brassica CTP-маркер и вариант пептида-маркера, можно определять, обеспечивает ли вариант пептида, например, более высокую локализацию в пластиде, или по существу идентичную локализацию в пластиде. Такой вариант можно считать функциональным вариантом. Путем идентификации функциональных вариантов синтетического происходящего из Brassica CTP, которые обеспечивают более высокую локализацию в пластиде, мутации в таких вариантах можно включать в дальнейшие варианты синтетических происходящих из Brassica CTP. Проведение множество раундов этого процесса оценки, а затем включение идентифицированных подходящих мутаций в последовательность синтетического происходящего из Brassica CTP, может обеспечить повторяющийся процесс оптимизации последовательности синтетического происходящего из Brassica CTP. Такие оптимизированные последовательности синтетического происходящего из Brassica CTP и нуклеотидные последовательности, кодирующие их, считают частью настоящего изобретения, независимо от того, могут ли такие оптимизированные пептидные последовательности синтетического происходящего из Brassica CTP быть далее оптимизированы путем дополнительной мутации.
Ссылки, рассмотренные в настоящем описании, предоставлены только для их раскрытия до даты подачи настоящей заявки. Ничто в настоящем документе не следует истолковывать как допущение того, что это изобретение дает право на противопоставление факта создания изобретения с более ранним приоритетом.
Следующие примеры предоставлены для иллюстрации определенных конкретных признаков и/или аспектов. Эти примеры не следует истолковывать как ограничивающие объем описания конкретных описанных признаков или аспектов.
ПРИМЕРЫ
Пример 1: Конструирование и продуцирование последовательностей химерного транзитного пептида хлоропластов (TraP)
Пластиды представляют собой цитоплазматические органеллы, встречающихся в видах высших растений, и они присутствуют во всех тканях растений. Хлоропласты представляют собой конкретный тип пластид, встречающийся в зеленых фотосинтезирующих тканях, которые ответственны за важные физиологические функции. Например, одной из таких основных физиологических функций является синтез ароматических аминокислот, требуемых для растения. В этом биосинтетическом каскаде требуются кодируемые в ядре ферменты, и они транспортируются из цитоплазмы внутрь хлоропласта. Эти кодируемые в ядре ферменты обычно обладают N-концевым транзитным пептидом, который взаимодействует с мембраной хлоропластов, способствуя транспорту пептида в строму хлоропласта. Bruce B. (2000) Chloroplast transit peptides: structure, function, and evolution. Trends Cell Bio. 10:440-447. При импорте стромальные пептидазы расщепляют транзитные пептид, оставляя зрелый функциональный белок импортированным в хлоропласт. Richter S, Lamppa GK. (1999) Stromal processing peptidase binds transit peptides and initiates their ATP-dependent turnover in chloroplasts. Journ. Cell Bio. 147:33-43. Транзитные пептиды хлоропластов представляют собой вариабельные последовательности, которые значительно различаются по длине, композиции и организации. Bruce B. (2000) Chloroplast transit peptides: structure, function, and evolution. Trends Cell Bio. 10:440-447. Уровень сходства последовательностей транзитных пептидов хлоропластов значительно различается среди гомологичных белков из различных видов растений. Уровень отличия между транзитными пептидами хлоропластов является неожиданным, учитывая, что гомологичный белки, получаемые из различных видов растений, как правило, обладают относительно высокими уровнями сходства последовательностей при сравнении процессированного зрелого функционального белка.
Новые химерные последовательности транзитных пептидов хлоропластов конструировали, продуцировали и исследовали в растениях. Было показано, что новые химерные транзитные пептиды хлоропластов обладают эффективными свойствами перемещения и процессинга для импорта агрономически важных белков в хлоропласты. Первоначально, нативные последовательности белка 5-енолпирувилшикимат-3-фосфатсинтазы (EPSPS) из различных видов растений анализировали с помощью компьютерной программы ChloroP™ для идентификации предполагаемых последовательностей транзитного пептида хлоропластов (Emanuelsson O, Nielsen H, von Heijne G, (1999) ChloroP, a neural network-based method for predicting chloroplast transit peptides and their cleavage sites, Protein Science 8; 978-984), доступной на http://www.cbs.dtu.dk/services/ChloroP/. После идентификации нативных транзитных пептидов хлоропластов первую последовательность транзитного пептида хлоропластов выравнивали со второй последовательностью транзитного пептида хлоропластов из второго организма. На фиг. 2 проиллюстрировано выравнивание последовательностей транзитных пептидов хлоропластов EPSPS Brassica napus (номер доступа NCBI № P17688) и Arabidopsis thaliana (номер доступа NCBI № NP_182055). С использованием выравнивания последовательностей транзитного пептида хлоропластов конструировали новые химерные транзитные пептиды хлоропластов путем комбинирования первой половины последовательности транзитного пептида хлоропластов из первого организма со второй половиной последовательности транзитного пептида хлоропластов последовательность из второго организма в приблизительном соотношении 1:1. Иллюстративными последовательностями вновь сконструированных химерных транзитных пептидов хлоропластов являются TraP12 (SEQ ID NO: 6) и TraP13 (SEQ ID NO: 8). Эти новые последовательности транзитных пептидов хлоропластов происходят из белков EPSPS Brassica napus (номер доступа NCBI №: P17688) и Arabidopsis thaliana (номер доступа NCBI № NP_182055). Последовательность химерного транзитного пептида хлоропластов TraP12 (SEQ ID NO: 6) содержит N-конец, который происходит из Brassica napus, и C-конец транзитного пептида хлоропластов, который происходит из Arabidopsis thaliana. Последовательность химерного транзитного пептида хлоропластов TraP13 (SEQ ID NO: 8) содержит N-конец, который происходит из Arabidopsis thaliana, и C-конец транзитного пептида хлоропластов, который происходит из Brassica napus. Химерные транзитные пептиды хлоропластов исследовали с помощью множества анализов, которые включали систему для временной экспрессии в растениях и трансгенную экспрессию в качестве стабильного трансформирующего объекта, содержащего экспрессирующий ген элемент, слитый с агрономически важной трансгенной последовательностью.
Пример 2: Исследование временной экспрессии в растениях последовательностей химерного транзитного пептида хлоропластов (TraP)
Анализ временной экспрессии в табаке:
Последовательности химерного транзитного пептида хлоропластов Trap12 и TraP13 первоначально исследовали с помощью анализа временной экспрессии в растениях. Синтезировали полинуклеотидные последовательности, которые кодируют химерные последовательности транзитных пептидов хлолропластов Trap12 (SEQ ID NO: 5) и TraP13 (SEQ ID NO: 7). Линкерную последовательность (SEQ ID NO: 10) встраивали между последовательностью TraP и кодирующей последовательностью yfp. Полученные конструкции содержали две единицы транскрипции в растениях (PTU). Первая PTU содержала промотор убиквитина 10 Arabidopsis thaliana (промотор AtUbi10; Callis, et al., (1990) J. Biol. Chem., 265: 12486-12493), слитый ген TraP-желтый флуоресцентный белок (TraP-YFP; патентная заявка США № 2007/0298412) и 3′-нетранслируемую область ORF 23 Agrobacterium tumefaciens (AtuORF23 3′UTR; патент США № 5428147). Вторая PTU содержала промотор вируса мозаичности прожилок маниоки (промотор CsVMV; Verdaguer et al., (1996) Plant Molecular Biology, 31:1129-1139), последовательность фосфинотрицинацетилтрансферазы (PAT; Wohlleben et al., (1988) Gene, 70: 25-37), и 3′ нетранслируемую область ORF 1 Agrobacterium tumefaciens (AtuORF1 3′UTR; Huang et al., (1990) J. Bacteriol., 172:1814-1822). Конструкция pDAB101981 содержит химерный транзитный пептид хлоропластов TraP12 (фиг.3). Конструкция pDAB101989 содержит химерный транзитный пептид хлоропластов TraP13 (фиг.4). Конструировали контрольную плазмиду, 101908, которая не содержала последовательности транзитного пептида хлоропластов выше гена yfp, и ее включали в исследования (фиг.5). Конструкции подтверждали путем расщепления ферментами рестрикции и секвенирования. Наконец, конструкции трансформировали в Agrobacterium tumefaciens и хранили в качестве исходных культур в глицерине.
Из исходной культуры Agrobacterium в глицерине, полную петлю замороженной культуры инокулировали в 2 мл YPD (100 мкг/мл спектиномицина) в 14-мл стерильной пробирке. Инокулированную среду инкубировали при 28°C в течение при встряхивании при 200 об./мин. На следующие сутки приблизительно 100 мкл культуры использовали для инокуляции 25 мл YPD (100 мкг/мл спектиномицина) в 125-мл стерильной колбе с тремя перегородками, и инкубировали в течение ночи при 28°C при встряхивании при 200 об./мин. На следующие сутки культуры разбавляли до OD600 0,5 в стерильной ddH2O (pH 8,0). Разбавленный штамм Agrobacterium смешивали со вторым штаммом Agrobacterium, содержавшим белок-помощник P19, в соотношении 1:1. Культуру использовали для инфильтрации листьев табака способом Voinnet O, Rivas S, Mestre P and Baulcombe D., (2003) An enhanced transient expression system in plants based on suppression of gene silencing by the p19 белок of tomato bushy stunt virus, The Plant Journal, 33:949-956. Инфильтрированные растения табака помещали в Conviron™, установленный на 16 ч на свету при 24°C в течение по меньшей мере трех суток до анализа.
Результаты микроскопии:
Инфильтрированные Agrobacterium листья табака отделяли от нескольких растений и помещали в чашку Петри с водой для предотвращения дегидратации. Инфильтрированные листья табака наблюдали при возбуждении синим светом с помощью длинноволновых пропускающих стеклянных фильтров, закрепленных с использованием Dark Reader Hand Lamp™ (Clare Chemical Research Co.; Dolores, CO) для идентификации неповрежденных областей листьев, которые успешно экспрессировали репортерные белки YFP. Конкретные идентифицированные области листьев вырезали из листа и помещали воду для визуализации с помощью конфокальной микроскопии (Leica TCS-SP5 AOBS™; Buffalo Grove, IL). Репортерный белок YFP возбуждали с помощью спектральной линии излучения лазера при 514 нм, с использованием аргонового ионного лазера с множеством линий. Ширину щели для детекции корректировали с использованием a образца неэкспрессирующего (темного) контрольного листа для исключения фоновой аутофлуоресценции листа. Одновременно получали данные аутофлуоресценции хлорофилла во втором канале для прямого сравнения с сигналом флуоресцентного репортерного белка для определения локализации хлоропластов.
Результаты визуализации с помощью микроскопии показали, что флуоресцентный белок YFP, содержащий транзитный пептид хлоропластов TraP12 или TraP13, накапливался в хлоропластах, расположенных в цитоплазме клеток табака, по сравнению с контрольными флуоресцентными белками YFP, которые не перемещались в хлоропласты цитоплазмы клеток табака (фиг. 6 и фиг. 7). Эти результаты визуализации с помощью микроскопии указывают на то, что перемещение белка YFP в хлоропласт происходило благодаря транзитному пептиду хлоропластов TraP12 или TraP13. Как показано на фиг. 6 и фиг. 7, флуоресцентный сигнал YFP расположены в хлоропластах, которые также обладают красной флуоресценции вследствие аутофлуоресценции в условиях визуализации с помощью микроскопии. Для сравнения, на фиг. 8 предоставлено микроскопическое изображение ткани листьев табака, инфильтрированной контрольной конструкцией pDAB101908, которая не содержит транзитный пептид хлоропластов. Хлоропласты на этом изображении имеют только красную флуоресценцию вследствие аутофлуоресценции в условиях визуализации с помощью микроскопии, и они лишены какого-либо сигнала флуоресценции YFP, который проявляют инфильтрированные TraP клетки табака. Кроме того, флуоресцентный сигнал YFP в контрольных растениях табака проявляется диффузно по всей цитоплазме клеток растения табака.
Результаты вестерн-блоттинга:
Образцы инфильтрированных растений табака анализировали с помощью вестерн-блоттинга. Полученные с помощью дырокола фрагменты листьев собирали и подвергали помолу в шаровой мельнице. Приблизительно 100-200 мг материала листьев смешивали с 2 BB (Daisy; Rogers, AR) и 500 мл PBST в течение 3 минут в шаровой мельнице Kleco™. Затем образцы центрифугировали в центрифуге при 14000 x g при 4°C. Супернатант удаляли и либо прямо анализировали с помощью вестерн-блоттинга, либо подвергали иммунопреципитации. Иммунопреципитацию проводили с использованием набора Pierce Direct IP kit™ (Thermo Scientific; Rockford, IL) в соответствии с протоколом изготовителя. Приблизительно 50 мкг антитела против YFP связывали со смолой. Образцы инкубировали со смолой в течение ночи при 4°C. Далее образцы промывали и элюировали на следующее утро и подготавливали для анализа путем комбинирования равных объемов 2X буфера для образца с 8 M, а затем кипячения образцов в течение 5 минут. Прокипяченные образцы разделяли на 4-12% геле SDS-Bis Tris в буфере MOPS в течение 40 минут. Затем гель подвергали блоттингу с использованием Invitrogen iBlot™ (Life Technologies; Carlsbad, CA) в соответствии с протоколом изготовителя. Подвергнутую блоттингу мембрану блокировали в течение 10 минут с использованием 5% обезжиренного сухого молока в растворе PBS-Tween. Мембрану обрабатывали первичным антителом (моноклональное антитело кролика против GFP), использованным в разведении 1:1000, в 5% обезжиренном сухом молоке в растворе PBS-Tween в течение 1 часа. Далее, мембрану промывали три раза в течение пяти минут посредством PBS-Tween для удаления не связавшегося первичного антитела. Мембрану обрабатывали вторичным моноклональным антителом козы против антител кролика (Life Technologies), использованным в разведении 1:1000, в течение 60 минут. Мембрану промывали, как описано выше, и проявляли путем добавления субстрата Themo BCIP/NBT. Колориметрическому субстрату позволяли проявиться в течение 5-10 минут, а затем блоты ополаскивали водой, а затем высушивали.
Результаты вестерн-блоттинга показали, что белок YFP экспрессировался в инфильтрированных клетках табака. Инфильтрированные как pDAB101981, так и pDAB101989, ткани листьев табака экспрессировали белок YFP, на что указывало присутствие полосы белка, которая реагировала с антителами против YFP, и была эквивалентна по размеру полосе белка YFP, полученной для ткани листьев растений табака, инфильтрированных контрольной конструкцией YFP. Более того, эти результаты показали, что химерные транзитные пептиды хлоропластов TraP процессировались и отщеплялись от белка YFP. Конструкции TraP12-YFP и TraP13-YFP соответствуют полосе белка до процессинга, молекулярная масса которого превышает молекулярную массу контрольного белка YFP. Присутствие полос на вестерн-блоте, которые эквивалентны по размеру контрольному YFP, указывает на то, что последовательности транзитных пептидов хлоропластов TraP12 и TraP13 процессировались, что снижало размер YFP до молекулярной массы, которая эквивалентна контрольному YFP.
Анализ временной экспрессии в протопластах кукурузы:
Последовательность химерного транзитного пептида хлоропластов Trap12 (SEQ ID NO: 5) и линкерную последовательность (SEQ ID NO: 10) клонировали выше гена желтого флуоресцентного белка и включали в конструкцию для исследования с помощью анализа временной экспрессии в протопластах растений кукурузы. Полученная конструкция содержала одну единицу транскрипции растений (PTU). Первая PTU содержала промотор убиквитина 1 Zea mays (промотор ZmUbi1; Christensen, A., Sharrock R., and Quail P., (1992) Maize polyubiquitin genes: structure, thermal perturbation of expression and transcript splicing, and promoter activity following transfer to protoplasts by electroporation, Plant Molecular Biology, 18:675-689), слитый ген TraP-желтый флуоресцентный белок (TraP12-YFP; заявка на патент США 2007/0298412) и 3′-нетранслируемую область пероксидазы 5 Zea mays (ZmPer5 3′UTR; патент США № 6384207). Конструкцию подтверждали с помощью расщепления ферментами рестрикции и секвенирования.
Семена Zea mays var. B104 подвергали поверхностной стерилизации путем энергичного встряхивания в 50% Clorox (3% гипохлорит натрия), содержавшем 2-3 капли Tween 20, в течение приблизительно 20 минут. Семена тщательно ополаскивали стерильной дистиллированной водой. Стерильные семена высевали на среду ½ MS в лотках Phytatray или боксах сходного типа, и позволяли им расти в темноте (28°C) в течение 12-20 суток. Анализ временной экспрессии в протопластах кукурузы использовали для получения и трансфекции протопластов кукурузы из листьев кукурузы B104. Этот анализ протопластов кукурузы является модификацией системы, описанной Yoo, S.-D., Cho, Y.-H., and Sheen, J., (2007), Arabidopsis Mesophyll Protoplasts: A Versitile Cell System for Transient Gene Expression Analysis, Nature Protocols, 2:1565-1572. Растворы приготавливали, как описано Yoo et al., (2007), за исключением того, что концентрацию маннита, использованную для последующих экспериментов, заменяли на 0,6 M.
Трансфекцию 100-500 мкл протопластов (1-5×105) завершали путем добавления протопластов в 2-мл микроцентрифужную пробирку, содержавшую приблизительно 40 мкл плазмидной ДНК (pDAB106597), при комнатной температуре. Объем ДНК предпочтительно поддерживали на уровне приблизительно 10% от объема протопластов. Протопласты и ДНК случайным изредка перемешивали во время периода инкубации в течение 5 минут. К протопластам и ДНК медленно добавляли равный объем раствора PEG, по 2 капли за раз при перемешивании между добавлениями капель раствора PEG. Пробиркам позволяли инкубироваться в течение приблизительно 10 минут при периодическом осторожном перемешивании. Далее добавляли 1 мл раствора W5+ и перемешивали, переворачивая пробирку несколько раз. Пробирку(и) центрифугировали в течение 5 минут при 75 x g при температуре 4°C. Наконец, супернатант удаляли и осадок ресуспендировали в 1 мл раствора WI и протопласты помещали на небольшую чашку Петри (35×10 мм) или в многолуночные планшеты с 6 ячейками и инкубировали в течение ночи в темноте при комнатной температуре. Флуоресценцию YFP визуализировали с помощью микроскопии после инкубации в течение 12 часов. Условия микроскопии, описанные ранее, использовали для визуализации.
Результаты микроскопической визуализации показали, что флуоресцентный белок YFP, содержащий химерный транзитный пептид хлоропластов TraP12, накапливался в хлоропластах, расположенных в цитоплазме клеток табака, по сравнению с контрольными флуоресцентными белками YFP, которые не перемещались в хлоропласты цитоплазмы клеток табака (фиг. 9). Эти результаты микроскопической визуализации указывают на то, что перемещение белка YFP в хлоропласт было результатом химерного транзитного пептида хлоропластов TraP12.
Пример 3: Последовательности химерного транзитного пептида хлоропластов (TraP) для экспрессии агрономически важных трансгенов в Arabidopsis
Одна мутация аминокислоты (G96A) в ферменте 5-енолпирувилшикимат-3-фосфатсинтазе (EPSP-синтаза) Escherichia coli может приводить к нечувствительности к глифосату (Padgette et al., (1991); Eschenburg et al., (2002); Priestman et al., (2005); Haghani et al., (2008)). Хотя эта мутация сообщает устойчивость к глифосату, также известно, что она неблагоприятно влияет на связывание EPSP-синтазы с ее природным субстратом фосфоенолпируватом (PEP). Изменение в результате этого эффективности связывания субстрата может привести к тому, что мутантный фермент будет непригодным для обеспечения устойчивости растений к глифосату.
Базу данных Genbank NCBI подвергали скринингу in silico в отношении белковых и полинуклеотидных последовательностей EPSP-синтазы, которые естественным образом содержат аланин в положении в ферменте EPSP-синтазе, аналогичном положению мутации G96A, которая была внесена в версию фермента из E. coli (Padgette et al., (1991); Eschenburg et al., (2002); Priestman et al., (2005); Haghani et al., (2008)).
Одним ферментом, который был идентифицирован в качестве содержащего природный аланин в этом положении, был DGT-28 (GENBANK ACC NO: ZP_06917240.1) из Streptomyces sviceus ATCC29083. Дополнительное изучение данных in silico выявило три других уникальных фермента Streptomyces с более высокой гомологией с DGT-28; DGT-31 (GENBANK ACC NO: YP_004922608.1); DGT-32 (GENBANK ACC NO: ZP_04696613); и DGT-33 (GENBANK ACC NO: NC_010572). Каждый из этих ферментов содержит природный аланин в положении в ферменте EPSP-синтазе, аналогичном положению мутации G96A, которая была внесена в версию фермента из E. coli. ФИГ.1.
Поскольку белки EPSP-синтазы из различных организмов имеют различную длину, нумерация мутации для версии фермента EPSP-синтазы из E.coli не обязательно соответствует нумерации мутации для ферментов EPSP-синтаз из других организмов. Эти идентифицированные ферменты EPSP-синтазы ранее не были охарактеризованы в отношении устойчивости к глифосату или аффинности к субстрату PEP. Более того, эти ферменты EPSP-синтазы представляют собой новый класс ферментов EPSP-синтаз и они не содержат никаких мотивов последовательности, которые использовались для охарактеризации ранее описанного класса I (происходящие из растений последовательности, дополнительно описанные в патенте США № RE39247), II (происходящие из бактерий последовательности, дополнительно описанные в патенте США № RE39247) и III (происходящие из бактерий последовательности, дополнительно описанные в международной патентной заявке WO 2006/110586) ферментов EPSP-синтаз.
Новые ферменты DGT-14, DGT-28, DGT-31, DGT-32 и DGT-33 охарактеризовывали в отношении устойчивости к глифосату и аффинности к субстрату PEP путем сравнения с ферментами EPSP-синтазами класса I. Следующие ферменты класса I; DGT-1 из Glycine max, DGT-3 из Brassica napus (GENBANK ACC NO: P17688) и DGT-7 из Triticum aestivum (GENBANK ACC NO: EU977181) были взяты для сравнения. Ферменты EPSP-синтазы класса I и их мутантные варианты синтезировали и оценивали. Мутация, внесенная в ферменты EPSP-синтазы растений, состояла из мутации глицина на аланин, внесенной в фермент EPSP-синтазу в положении, сходном с положением мутации G96A из версии фермента из E. coli. Кроме того, мутации треонина на изолейцин и пролина на серин вносили в эти ферменты EPSP-синтазы класса I в аналогичных положениях с положениями аминокислоты 97 (T на I) и аминокислоты 101 (P на S) в EPSP-синтазе E. coli, как описано в Funke et al., (2009).
DGT-14:
Трансгенные растения T1 Arabidopsis, содержавшие химерные транзитные пептиды хлоропластов TraP12 и TraP13, слитые с трансгеном dgt-14, получали, как описано в заявке на патент США № 11/975658. На трансгенные растения распыляли различные дозы глифосата. Ряд различных концентраций глифосата, включая повышенные дозы, использовали в этом исследовании для определения относительных уровней устойчивости (105, 420, 1680 или 3360 г. э.к/га (g ae/ha)). Типичной 1X используемой в полевых условиях дозой глифосата является 1120 г. э.к./га. Растения T1 Arabidopsis, которые использовали в этом исследовании, варьировали только по количеству копий трансгена dgt-14. Растения T1 Arabidopsis с низким количеством копий dgt-14 идентифицировали с использованием анализов молекулярного подтверждения, описанных выше, и подвергали самоопылению и использовали для получения растений T2. В таблице 1 представлена устойчивость трансгенных растений dgt-14 по сравнению с контрольными растениями, содержащими ген устойчивости к гербициду глифосату dgt-1 (как описано в патенте США, выданном под номером № 12558351).
Сначала проводили селекцию трансформантов T1 Arabidopsis относительно исходных нетрансформированных семян с использованием схемы селекции с глюфосинатом. Для каждой конструкции T1 анализировали три плоских лотка или 30000 семян. Отобранные растения T1 подвергали молекулярной охарактеризации, а затем растения пересаживали в индивидуальные горшки и на них распыляли различные дозы коммерческого глифосата, как описано ранее. Ответ на дозу этих растений представлен в значениях % видимого повреждения через 2 недели после обработки (WAT). Данные, представленные в таблице, демонстрируют индивидуальные растения, проявляющие небольшое повреждение или отсутствие повреждения (<20%), умеренное повреждение (20-40%) или тяжелое повреждение (>40%). Для каждой конструкции, использованной для трансформации Arabidopsis, представлено арифметическое среднее значение и стандартное отклонение. Диапазон индивидуального ответа также указан в последнем столбце для каждой дозы и трансформации. Нетрансформированные Arabidopsis дикого типа (c.v. Columbia) служили в качестве чувствительного к глифосату контроля.
Уровень ответа растений варьировал в растениях T1 Arabidopsis. Это варьирование может быть связано с тем фактом, что каждое растение соответствует независимому трансформирующему объекту и, таким образом, количество копий представляющего интерес гена варьирует от растения к растению. Среднее повреждение в общей популяции в зависимости от дозы представлено в таблице 1, чтобы продемонстрировать устойчивость каждой из конструкций dgt-14, связанных с транзитным пептидом хлоропластов TraP12 v2 или TraP13 v2, относительно dgt-1 и нетрансформированных контролей дикого типа для различных доз глифосата. Трансгенные объекты содержали dgt-14, связанный с TraP12 v2 (SEQ ID NO: 11), который содержится в конструкции pDAB105528 (фиг. 10) и TraP13 v2 (SEQ ID NO: 12), который содержится в конструкции pDAB105529 (фиг. 11). Данные селекции с глифосатом для растений T1 продемонстрировали, что, когда dgt-14 был связан с этими транзитными пептидами хлоропластов, обеспечивалась надежная устойчивость к высоким уровням глифосата. Для сравнения, нетрансформированные контроли (или дикий тип) не продемонстрировали устойчивости к обработке высокими концентрациями глифосата, когда их обрабатывали сходными дозами глифосата. Кроме того, существовали примеры, когда трансгенные объекты, для которых было показано, что они содержат три или более копии dgt-14, были более чувствительными к повышенным дозам глифосата. Эти примеры продемонстрированы с помощью диапазона процентного видимого повреждения, представленного в таблице 6. Вероятно, что присутствие высоких количеств копий трансгенов в растениях Arabidopsis приводит к подавлению трансгена или другим эпигенетическим эффектам, которые приводили к чувствительности к глифосату, несмотря на присутствие трансгена dgt-14.
Ответ T1 Arabidopsis, трансформированных dgt-14, на диапазон доз глифосата, внесенных после всходов, по сравнению с сегрегирующей популяцией dgt-1 (T2) и нетрансформированным контролем. Видимый % повреждений через 2 недели после внесения
Выбранные растения T1 Arabidopsis, для которых было идентифицировано, что они содержат низкие количества копий трансгенных вставок (1-3 копии) подвергали самоопылению с получением второго поколения для дополнительной оценки устойчивости к глифосату. Второе поколение растений Arabidopsis (T2), которые содержали 1-3 копии трансгена dgt-14, слитого с химерными транзитными пептидами хлоропластов TraP12 и TraP13, далее охарактеризовывали в отношении устойчивости к глифосату и устойчивости к глюфосинату (устойчивость к глюфосинату показала, что экспрессирующая кассета PAT была интактной и не подвергалась перестройкам во время самоопыления растений T1). В поколении T2 гемизиготные и гомозиготные растения были доступны для исследования каждого трансгенного объекта и, таким образом, были включены для каждой исследованной дозы глифосата. Гемизиготные растения содержат два различных аллеля в локусе по сравнению с гомозиготными растениями, которые содержат те же два аллеля в локусе. Количество копий и уровни плоидности растений T2 подтверждали с использованием протоколов молекулярного анализа, описанного выше. Аналогично, глифосат вносили с использованием способов и доз, описанных ранее. Ответ растений на дозу представлен в значениях % видимого повреждения через 2 недели после обработки (WAT). Данные представляли в качестве гистограммы для индивидуальных растений, проявляющих небольшое повреждение или отсутствие повреждения (<20%), умеренное повреждение (20-40%) или тяжелое повреждение (>40%). Арифметическое среднее значение и стандартное отклонение представлены для каждой конструкции, использованной для трансформации Arabidopsis. Диапазон индивидуального ответа также указан в последнем столбце для каждой дозы и трансформации. Нетрансформированные Arabidopsis дикого типа (cv. Columbia) служили в качестве чувствительного к глифосату контроля. Кроме того, растения, содержащие ген устойчивости к гербициду глифосату dgt-1 (как описано в патенте США, поданном под номером № 12558351) были включены в качестве положительного контроля.
В поколении T2 трансгенные объекты dgt-14 как с одной копией, так и с низким числом копий (две или три копии), охарактеризовывали в отношении устойчивости к глифосату. Среднее повреждение в общей популяции на дозу представлено в таблице 2, чтобы продемонстрировать устойчивость, обеспечиваемую каждой из конструкций dgt-14, связанных с транзитным пептидом хлоропластов, против dgt-1 и нетрансформированных контролей дикого типа для различных доз глифосата. Трансгенные объекты поколения T2 содержали dgt-14, связанный с TraP12 v2 (pDAB105528) и TraP13 v2 (pDAB105529). Оба из этих трансгенных объектов были высокоустойчивыми к глифосату. Результаты показали, что диапазон повреждений для растений T2 Arabidopsis составлял менее чем 20% для всех исследованных концентраций глифосата. Для сравнения, нетрансформированные контроли (или дикий тип) не обеспечили устойчивость к обработке высокими концентрациями глифосата, когда их подвергали обработке сходными дозами глифосата. В общем, результаты показали, что растения, содержащие и экспрессирующие белки DGT-14, слитые с химерными транзитными пептидами TraP12 и TraP13, обеспечивали коммерческий уровень устойчивости к глифосату на уровнях, вплоть до 3 раз превышающих дозу на поле (1120 г. э.к./га).
Ответ T2 Arabidopsis, трансформированных dgt-14, на диапазон доз глифосата, внесенных после всходов, по сравнению с сегрегирующей популяцией dgt-1 (T2) и нетрансформированным контролем. Видимое % повреждение через 2 недели после внесения. Данные соответствуют выбранной линии с одной копией из каждой конструкции, которая сегрегировала в качестве одного локуса в скрининге наследуемости
Случайным образом отобранные растения T2 Arabidopsis, для которых было идентифицировано, что они содержат низкие количества копий вставок трансгена (1-3 копии), подвергали самоопылению для получения третьего поколения для дополнительной оценки устойчивости к глифосату. Семена Arabidopsis третьего поколения (T3) высевали и оценивали в отношении устойчивости к глифосату с использованием тех же протоколов, которые были описаны выше. Трансгенные объекты, исследованные в поколении T3, содержали реплики из каждой линии, которые были гомозиготными (как определено с использованием скрининга устойчивости к глюфосинату для идентификации того, продемонстрировали ли какие-либо из развившихся растений сегрегацию трансгенов). Эти трансгенные объекты анализировали с помощью LC-MS-MS для подтверждения того, что растения экспрессировали белок DGT-14. Результаты среднего повреждения в общей популяции в зависимости от дозы глифосата для поколения T3 представлены в таблице 3, в которой показана устойчивость к глифосату, обеспечиваемая каждой из конструкций dgt-14, для различных доз глифосата. Иллюстративные устойчивые трансгенные объекты T3 включали dgt-14, связанный с TraP12 v2 (pDAB105528) и TraP13 v2 (pDAB105529). Оба из этих трансгенных событий были высокоустойчивыми к глифосату. Результаты показали, что диапазон повреждений для растений T3 Arabidopsis составлял менее 20% для всех исследованных концентраций глифосата. Для сравнения, нетрансформированные контроли (или дикий тип) не обеспечили устойчивости к обработке высокими концентрациями глифосата при обработке сходными дозами глифосата. В общем, результаты показали, что растения, содержащие и экспрессирующие DGT-14, обеспечили коммерческий уровень устойчивости к глифосату при уровнях, вплоть до 3 раз превышающих уровни в поле (1120 г. э.к./га).
Ответ T3 Arabidopsis, трансформированных dgt-14, на диапазон доз глифосата, внесенных после всходов, по сравнению с сегрегирующей популяцией dgt-1 (T2) и нетрансформированным контролем. Видимое % повреждение через 2 недели после внесения. Данные соответствуют выбранной популяции с одной копией из каждой конструкции, которая сегрегировала в качестве одного локуса в скрининге наследуемости T2
DGT-28
Вновь сконструированная оптимизированная для двудольных растений полинуклеотидная последовательность dgt-28 v5 приведена в SEQ ID NO: 18. Вновь сконструированная оптимизированная для однодольных растений полинуклеотидная последовательность dgt-28 v6 приведена в SEQ ID NO: 19; эта последовательность была немного модифицирована путем включения аланина во втором положении аминокислоты для внесения участка для фермента рестрикции. Полученные последовательности ДНК обладают более высокой степенью разнообразия кодонов, желаемой композицией оснований, они содержат стратегически расположенные участки распознавания ферментами рестрикции и лишены последовательностей, которые могут препятствовать транскрипции гена или трансляции мРНК-продукта.
Синтез фрагментов ДНК, включающих SEQ ID NO: 18 и SEQ ID NO: 19, которые содержат дополнительные последовательности, такие как стоп-кодоны 6 рамок (стоп-кодоны, расположенные во всех шести рамках считывания, которые добавлены к 3′-концу кодирующей последовательности), и 5′-участок рестрикции для клонирования, проводился коммерческими поставщиками (DNA2.0, Menlo Park, CA). Затем синтетическую молекулу нуклеиновой кислоты клонировали в экспрессирующие векторы и трансформировали в растения или бактерии, как описано в примерах ниже.
Сходные стратегии оптимизации кодонов использовали для конструирования dgt-1, dgt-3 v2 (G173A), dgt-3 v3 (G173A; P178S), dgt-3 v4 (T174I; P178S), dgt-7 v4 (T168I; P172S), dgt-32 v3, dgt-33 v3 и dgt-31 v3. Кодон-оптимизированные версии этих генов приведены в качестве SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, SEQ ID NO: 26 и SEQ ID NO: 27, соответственно.
Конструирование бинарного вектора для растений. Для конструирования исходных векторов, содержащих полинуклеотидную последовательность для транзитного пептида хлоропластов, слитую в рамке считывания с dgt-28, использовали стандартные способы клонирования. Исходные векторы, содержавшие транзитный пептид (TraP), слитый с dgt-28, собирали с использованием технологии In-FusionTM Advantage Technology (Clontech, Mountain View, CA). В результате слияния первая аминокислота метионин удалилась из dgt-28. Каждый из транзитных пептидов TraP4 v2 (SEQ ID NO: 28), TraP5 v2 (SEQ ID NO: 29), TraP8 v2 (SEQ ID NO: 30), TraP9 v2 (SEQ ID NO: 31), TraP12 v2 (SEQ ID NO: 32) и TraP13 v2 (SEQ ID NO: 33) был синтезирован в DNA2.0 (Menlo Park, CA) и его подвергали слиянию с 5′-концевым фрагментом dgt-28, вплоть до и включая уникальный участок распознавания эндонуклеазы рестрикции AccI.
Бинарные плазмиды, которые содержали различные экспрессирующие кассеты для TraP и dgt-28, контролировались промотором убиквитина 10 Arabidopsis thaliana (AtUbi10 v2; Callis, et al., (1990) J. Biol. Chem., 265: 12486-12493), и они были фланкированы 3′-нетранслируемой областью двадцать третей открытой рамки считывания Agrobacterium tumefaciens (AtuORF23 3′ UTR v1; патент США № 5428147).
Собранные экспрессирующие кассеты для TraP и dgt-28 модифицировали способами инженерии с использованием технологии Gateway® Technology (Invitrogen, Carlsbad, CA) и трансформировали в растения с помощью опосредуемой Agrobacterium трансформации растений. Эндонуклеазы рестрикции получали от New England BioLabs (NEB; Ipswich, MA) и для лигирования ДНК использовали ДНК-лигазу T4 (Invitrogen). Реакции Gateway проводили с использованием смеси ферментов Gateway® LR Clonase® (Invitrogen) для сборки одного исходного вектора в один конечный вектор, который содержал кассету селективного маркера с промотором вируса мозаики прожилок маниоки (CsVMV v2; Verdaguer et al., (1996) Plant Mol. Biol., 31: 1129-1139) - DSM-2 (патентная заявка США № 2007/086813) - 3′-нетранслируемую область первой открытой рамки считывания Agrobacterium tumefaciens (AtuORF1 3′ UTR v6; Huang et al., (1990) J. Bacteriol. 172:1814-1822). Получение плазмид проводили с использованием набора NucleoSpin® Plasmid Kit (Macherey-Nagel Inc., Bethlehem, PA) или набора Plasmid Midi Kit (Qiagen) в соответствии с инструкциями поставщиков. Фрагменты ДНК выделяли с использованием набора для экстракции из геля QIAquickTM Gel Extraction Kit (Qiagen) после электрофореза на Tris-ацетатном агарозном геле.
Колонии всех собранных плазмид сначала подвергали скринингу рестрикционным расщеплением ДНК, полученной по минипрепаративной методике. Плазмидную ДНК выбранных клонов секвенировали у коммерческого поставщика, осуществляющего секвенирование (EurofinsTM MWG Operon, Huntsville, AL). Данные о последовательности собирали и анализировали с использованием программного обеспечения SequencherTM (Gene Codes Corp., Ann Arbor, MI).
Следующие бинарные конструкции экспрессируют различные слитые последовательности генов TraP:dgt-28: pDAB107527 содержит TraP4 v2:dgt-28 v5 (SEQ ID NO: 34); pDAB105530 содержит TraP5 v2: dgt-28 v5 (SEQ ID NO: 35); pDAB105531 содержит TraP8 v2: dgt-28 v5 (SEQ ID NO: 36); pDAB105532 содержит TraP9 v2: dgt-28 v5 (SEQ ID NO: 37); pDAB105533 содержит TraP12 v2: dgt-28 v5 (SEQ ID NO: 38); и pDAB105534 содержит TraP13 v2:dgt-28 v5 (SEQ ID NO: 39). Последовательность dgt-28 v5 в pDAB105534 была модифицирована, где первый кодон (gca) был заменен на (gct).
Конструирование дополнительного бинарного вектора для растений. Стратегии клонирования, сходные со стратегиями клонирования, описанными выше, использовали для конструирования бинарных плазмид, которые содержат dgt-31, dgt-32, dgt-33, dgt-1, dgt-3 и dgt-7.
Гены микробного происхождения: dgt-31, dgt-32 и dgt-33 подвергали слиянию с транзитными пептидами хлоропластов, отличающимися от описанных ранее. Использовали следующие транзитные пептиды хлоропластов: TraP14 v2 (SEQ ID NO: 40), TraP23 v2 (SEQ ID NO: 41), TraP24 v2 (SEQ ID NO: 42). pDAB107532 содержит dgt-32 v3, слитый с TraP14 v2 (SEQ ID NO: 43), pDAB107534 содержит dgt-33 v3, слитый с TraP24 v2 (SEQ ID NO: 44) и последняя конструкция содержит dgt-31 v3, слитый с TraP23 v2 (SEQ ID NO: 45). Экспрессирующие кассеты dgt контролировались промотором убиквитина 10 Arabidopsis thaliana (промотор v2 AtUbi10) и их фланкировала 3′-нетранслируемая область двадцать третьей открытой рамки считывания Agrobacterium tumefaciens (AtuORF23 3′ UTR v1). Также в бинарном векторе присутствовала маркерная кассета DSM-2, содержавшая промотор вируса мозаики прожилок маниоки (CsVMV v2) - DSM-2 - 3′-нетранслируемую область первой открытой рамки считывания Agrobacterium tumefaciens (AtuORF1 3′ UTR v6).
Конструировали дополнительные бинарные векторы, где dgt-31 v3, dgt-32 v3 и dgt-33 v3 были слиты с ранее описанными последовательностями транзитных пептидов хлоропластов. Например, последовательность v2 TraP8 подвергают слиянию с dgt-31 v3, dgt-32 v3 и dgt-33 v3, и клонируют в бинарные векторы, как описано выше.
Конструировали бинарные векторы, содержащие гены класса I (dgt-1, dgt-3 и dgt-7). Следующие бинарные векторы конструировали и трансформировали в растения: pDAB4104, которые содержит последовательность dgt-1 v4, как описано в публикации патентной заявки США № 2011/0124503, которая фланкируется последовательностями осмотина Nicotiana tabacum, как описано в публикации патентной заявки США № 2009/0064376; pDAB102715; pDAB102716; pDAB102717 и pDAB102785. Различные транзитные пептиды хлоропластов TraP, которые подвергали слиянию с dgt-28, dgt-31, dgt-32 и dgt-33, не добавляли к генам класса I, поскольку эти происходящие из растений последовательности обладают нативными транзитными пептидами хлоропластов растений. Эти векторы более подробно описаны в таблице 4.
Описание бинарных векторов, которые содержат ген EPSP-синтазы класса I (т.е. dgt-1, dgt-3 или dgt-7)
Трансформация Arabidopsis thaliana. Arabidopsis трансформировали с использованием способа погружения цветка от Clough and Bent (1998). Выбранную колонию Agrobacterium, содержавшую одну из бинарных плазмид, описанных выше, использовали для инокуляции одной или нескольких 100-мл предварительный культур среды YEP, содержавшей спектиномицин (100 мг/л) и канамицин (50 мг/л). Культуру инкубировали в течение ночи при 28°C при постоянном встряхивании при 225 об./мин. Клетки осаждали при приблизительно 5000 x g в течение 10 минут при комнатной температуре, и полученный супернатант отбрасывали. Клеточный осадок осторожно ресуспендировали в 400 мл среды для погружения, содержавшей: 5% (масс./об.) сахарозу, 10 мкг/л 6-бензиламинопурина и 0,04% SilwetTM L-77. Растение возрастом приблизительно 1 месяц погружали в среду на 5-10 минут при осторожном встряхивании. Растения клали набок и покрывали прозрачными или непрозрачными пластиковыми мешками на 2-3 часа, а затем располагали вертикально. Растения выращивали при 22°C со световым периодом 16 часов на свету/8 часов в темноте. Приблизительно через 4 недели после погружения семена собирали.
Выбор трансформированных растений. Свежесобранным семенам T1 [содержащие экспрессирующие кассеты dgt и DSM-2] позволяли высохнуть в течение 7 суток при комнатной температуре. Семена T1 высевали в лотки для прорастания размером 26,5×51 см, в каждый из которых добавляли аликвоту массой 200 мг стратифицированных семян T1 (~10000 семян), которые предварительно были суспендированы в 40 мл 0,1% раствора агарозы и которые хранили при 4°C в течение 2 суток, чтобы выполнить требования состояния покоя, и обеспечить синхронное прорастание семян.
Sunshine Mix LP5 покрывали мелкоизмельченным вермикулитом и орошали инфильтрацией раствором Хогланда до влажного состояния, а затем ему позволяли дренироваться под действием силы тяжести. Каждую аликвоту стратифицированных семян объемом 40 мл высевали равномерно на вермикулит с помощью пипетки и накрывали увлажняющими купольными камерами на 4-5 суток. Купольные камеры удаляли за 1 сутки до первоначальной селекции трансформантов с использованием послевсходового распыления глюфосината (селекция по котрансформированному гену DSM-2).
Через семь суток после посева (DAP) и снова через 11 DAP, на растения T1 (стадии семядоли и 2-4-листьев, соответственно) распыляли 0,2% раствор гербицида Liberty (200 г. а.и./л (g ai/L) глюфосината, Bayer Crop Sciences, Kansas City, MO) в распыляемом объеме 10 мл/лоток (703 л/га) с использованием наконечника для пневматического распыления DeVilbiss для доставки эффективного количества 280 г. а.и./га глюфосината на внесение. Выжившие растения (активно растущие растения) идентифицировали через 4-7 суток после последнего распыления и пересаживали по отдельности в 3-дюймовые горшки (7,6 см), подготовленные со средой для пересадки в горшки (Metro Mix 360). Пересаженные растения накрывали увлажняющими купольными камерами на 3-4 суток и помещали в камеру для выращивания при 22°C, как и ранее, или прямо переносили в теплицу. Затем купольные камеры удаляли и растения выращивали в теплице (22±5°C, 50±30% RH, 14 ч на свету:10 ч в темноте, минимум 500 мкЕ/м2с1 природный свет + дополнительный свет). Для выживших растений T1 проводили молекулярный подтверждающий анализ для подтверждения того, что ген устойчивости к глифосату стабильно встроился в геном растений.
Молекулярное подтверждение. Подтверждали присутствие трансгенов dgt-28 и DSM-2 в геноме растений Arabidopsis, которые были трансформированы pDAB107527, pDAB105530, pDAB105531, pDAB105532, pDAB105533 или pDAB105534. Присутствие этих полинуклеотидных последовательностей подтверждали посредством анализа гидролиза зондов, ПЦР экспрессирующих гены кассет (также описанная как ПЦР единиц транскрипции растений - PTU ПЦР), анализа с использованием саузерн-блоттинга и анализов с количественной ПЦР с обратной транскрипцией.
Растения Arabidopsis T1 первоначально подвергали скринингу посредством анализа гидролиза зондов, аналогично TAQMANTM, для подтверждения присутствия трансгенов DSM-2 и dgt-28. Трансгенные объекты подвергали скринингу посредством ПЦР экспрессирующих гены кассет для определения того, встроилась ли экспрессирующая dgt кассета полностью в геном без перестройки. Данные, полученные в этих исследованиях, использовали для определения количества копий трансгена и идентификации отдельных трансгенных объектов в Arabidopsis для самоопыления и перехода к поколению T2. Развившиеся растения T2 Arabidopsis также подвергали скринингу с помощью анализа гидролиза зондов для подтверждения присутствия и оценки количества копий генов DSM-2 и dgt в геноме растений. Наконец, анализ с использованием саузерн-блоттинга использовали для подтверждения оцененного количества копий на подгруппе растений T1 Arabidopsis.
Сходные анализы использовали для подтверждения присутствия трансгена dgt-1 из растений, трансформированных pDAB4101, присутствия трансгена dgt-32 из растений, трансформированных pDAB107532, присутствия трансгена dgt-33 из растений, трансформированных pDAB107534, присутствия трансгена dgt-3 из растений, трансформированных pDAB102715, присутствия трансгена dgt-3 из растений, трансформированных pDAB102716, присутствия трансгена dgt-3 из растений, трансформированных pDAB102717, и присутствия трансгена dgt-7 из растений, трансформированных pDAB102785.
Анализ гидролиза зондов. Количество копий определяли в растениях T1 и T2 Arabidopsis с использованием анализа гидролиза зондов, описанного ниже. Растения с различными количествами трансгенов идентифицировали и выращивали для последующих анализов устойчивости к глифосату.
Образцы тканей собирали в 96-луночные планшеты и лиофилизировали в течение 2 суток. Мацерацию ткани проводили с помощью распылителя для тканей KLECOTM и вольфрамовых гранул (Environ Metal INC., Sweet Home, Oregon). После мацерации ткани геномную ДНК выделяли в высокопроизводительном формате с использованием набора BiosprintTM 96 Plant kit (QiagenTM, Germantown, MD) в соответствии с предложенным изготовителем протоколом. Геномную ДНК количественно определяли с помощью набора Quant-ITTM Pico Green DNA assay kit (Molecular Probes, Invitrogen, Carlsbad, CA). Количественно определенную геномную ДНК доводили до приблизительно 2 нг/мкл для анализа гидролиза зондов с использованием автоматического устройства для обработки жидкостей BIOROBOT3000TM (Qiagen, Germantown, MD). Определение количества копий трансгена с помощью анализа гидролиза зондов проводили способом ПЦР в реальном времени с использованием системы LIGHTCYCLER®480 (Roche Applied Science, Indianapolis, IN). Анализы были разработаны для DSM-2, dgt-28 и внутреннего эталонного гена, TAFII15 (Genbank ID: NC 003075; Duarte et al., (201) BMC Evol. Biol., 10:61).
Для амплификации смесь LIGHTCYCLER®480 Probes Master mix (Roche Applied Science, Indianapolis, IN) приготавливали в 1X конечной концентрации в мультиплексной реакционной смеси объемом 10 мкл, содержащей 0,1 мкм каждого праймера для DSM-2 и dgt-28, 0,4 мкм каждого праймера для TAFII15 и 0,2 мкм каждого зонда. Таблица 5. Двухстадийную реакцию амплификации проводили с удлинением при 60°C в течение 40 секунд с получением данных флуоресценции. Все образцы анализировали и для анализа каждого образца использовали усредненные величины значения порогового цикла (Ct). Анализ данных ПЦР в реальном времени проводили с использованием программного обеспечения LightCyclerTM выпуска 1.5 с использованием модуля относительного количественного определения, и он был основан на способе ΔΔCt. Для этого в каждый анализ включали образец геномной ДНК из калибратора единичной копии и известный контроль с 2 копиями. Результаты количества копий в скрининге гидролиза зондов определяли для трансгенных растений T1 и T2 Arabidopsis.
Информация о праймерах их зондах для анализа гидролиза зондов для DSM-2, dgt-28 и внутреннего эталонного гена (TAFII15)
Подтверждение встраивания dgt-28 с помощью анализа с использованием саузерн-блоттинга. Анализ с использованием саузерн-блоттинга использовали для определения характера встраивания встроенного фрагмента ДНК с T-цепью и идентификации трансгенных объектов, которые содержали dgt-28. Данные получали, чтобы продемонстрировать встраивание и целостность трансгенных вставок в геноме Arabidopsis. Данные саузерн-блоттинга использовали для идентификации простого встраивания интактной копии ДНК с T-цепью. Детальный анализ с использованием саузерн-блоттинга проводили с использованием амплифицированного способом ПЦР зонда, специфичного к экспрессирующей кассете гена dgt-28. Гибридизация зонда с геномной ДНК, расщепленной специфическими ферментами рестрикции, идентифицировала фрагменты геномной ДНК с конкретной молекулярной массой, профили которых использовали для идентификации полноразмерных трансгенных объектов T1 с простой вставкой для развития в следующее поколение.
Образцы тканей собирали в 2-мл конические пробирки (EppendorfTM) и лиофилизировали в течение 2 суток. Мацерацию ткани проводили с помощью распылителя для тканей KLECOTM и вольфрамовых гранул. После мацерации ткани геномную ДНК выделяли с использованием методики выделения CTAB. Геномную ДНК далее очищали с использованием набора QiagenTM Genomic Tips kit. Геномную ДНК количественно определяли с помощью набора для анализа ДНК Quant-ITTM Pico Green DNA assay kit (Molecular Probes, Invitrogen, Carlsbad, CA). Количественно определенную геномную ДНК доводили до 4 мкг для подходящей концентрации.
Для каждого образца 4 мкг геномной ДНК тщательно расщепляли ферментом рестрикции SwaI (New England Biolabs, Beverley, MA) и инкубировали при 25°C в течение ночи, а затем к реакционной смеси добавляли NsiI и инкубировали при 37°C в течение 6 часов. Расщепленную ДНК концентрировали посредством преципитации с помощью Quick Precipitation SolutionTM (Edge Biosystems, Gaithersburg, MD) в соответствии с предлагаемым изготовителем протоколом. Затем геномную ДНК ресуспендировали в 25 мкл воды при 65°C в течение 1 часа. Ресуспендированные образцы наносили на 0,8% агарозный гель, приготовленный в 1X TAE и подвергнутый электрофорезу в течение ночи при 1,1 В/см в 1X буфере TAE. Затем гель подвергали денатурации (0,2 M NaOH/0,6 M NaCl) в течение 30 минут и нейтрализации (0,5 M Tris-HCl (pH 7,5)/1,5 M NaCl) в течение 30 минут.
Перенос фрагментов ДНК на нейлоновые мембраны проводили путем пассивного пропитывания через гель 20 X раствором SSC в течение ночи обработанной мембраны для переноса IMMOBILONTM NY+ (Millipore, Billerica, MA) с использованием впитывающего листа из хроматографической бумаги и бумажных полотенец. После переноса мембрану кратковременно промывали 2X SSC, поперечно сшитым с STRATALINKERTM 1800 (Stratagene, LaJolla, CA), и подвергали термической обработке в вакууме при 80°C в течение 3 часов.
Блоты инкубировали с раствором для предгибридизации (Perfect Hyb plus, Sigma, St. Louis, MO) в течение 1 часа при 65°C в стеклянных вращающихся флаконах с использованием инкубатора для гибридизации модели 400 (Robbins Scientific, Sunnyvale, CA). Зонды получали из фрагмента ПЦР, содержавшего всю кодирующую последовательность. Ампликон ПЦР очищали с использованием набора для экстракции из геля QIAEXTM II и метили α32P-dCTP с помощью набора для мечения Random RT Prime ITTM labeling kit (Stratagene, La Jolla, CA). Блоты гибридизовали в течение ночи при 65°C с денатурированным зондом, добавленным прямо в буфер для гибридизации до приблизительно 2 миллионов импульсов счета на блот на мл. После гибридизации блоты последовательно промывали при 65°C посредством 0,1X SSC/0,1% SDS в течение 40 минут. Наконец, блоты экспонировали на экранах для визуализации фосфора с длительным свечением и визуализировали с использованием системы для визуализации Molecular Dynamics Storm 860TM.
Анализы с использованием саузерн-блоттинга, проведенные в этом исследовании, использовали для определения количества копий и подтверждения того, что выбранные трансгенные объекты содержали трансген dgt-28 в геноме Arabidopsis.
Подтверждение экспрессирующей кассеты с геном dgt-28 с помощью анализа с использованием ПЦР. Присутствие гена экспрессирующей кассеты с геном dgt-28 в трансгенных объектах растений T1 выявляли с помощью ПЦР по конечной точке. Для обнаружения использовали праймеры (таблица 6), специфичные к промотору v2 AtUbi10 и областям 3′UTR v1 AtuORF23 экспрессирующей кассеты для гена dgt-28.
Олигонуклеотидные праймеры, использованные для подтверждения экспрессирующей кассеты для гена dgt-28
Для реакций ПЦР требовался стандартный трехстадийный протокол циклирования ПЦР для амплификации экспрессирующей ген кассеты. Все реакции ПЦР проводили с использованием следующих условий ПЦР: 94°C в течение трех минут, а затем 35 циклов при 94°C в течение тридцати секунд, 60°C в течение тридцати секунд и 72°C в течение трех минут. Реакции проводили с использованием набора для ПЦР EX-TAQTM (TaKaRa Biotechnology Inc. Otsu, Shiga, Япония) в соответствии с инструкциями изготовителя. После последнего цикла реакционную смесь инкубировали при 72°C в течение 10 минут. Для определения размера ампликона ПЦР использовали электрофорез с агарозным гелем с TAE. Ампликоны ПЦР ожидаемого размера указывали на то, что в геноме трансгенных объектов Arabidopsis присутствовала экспрессирующая полноразмерный ген кассета.
Относительное подтверждение транскрипции dgt-28 с помощью анализа с использованием количественной ПЦР с обратной транскрипцией. Образцы тканей растений с трансгенным dgt-28 собирали в 96-луночные планшеты и замораживали при 80°C. Мацерацию ткани проводили с помощью распылителя для тканей KLECOTM и вольфрамовых гранул (Environ Metal INC., Sweet Home, Oregon). После мацерации ткани выделяли тотальную РНК в высокопроизводительном формате с использованием набора QiagenTM Rneasy 96 kit (QiagenTM, Germantown, MD) в соответствии с предложенным изготовителем протоколом, который включал необязательную обработку ДНК-азой I на колонке. За этой стадией следовала дополнительная обработка ДНК-азой I (AmbionTM, Austin, TX) элюированной тотальной РНК. Синтез кДНК проводили с использованием тотальной РНК в качестве матрицы с помощью набора High Capacity cDNA Reverse TranscriptionTM kit (Applied Biosystems, Austin, TX) в соответствии с предложенной изготовителем методикой с добавлением олигонуклеотида TVN. Количественное определение экспрессии проводили с помощью анализа гидролиза зондов, и его осуществляли с помощью ПЦР с использованием системы LIGHTCYCLER®480 (Roche Applied Science, Indianapolis, IN). Анализы разрабатывали для dgt-28 и внутреннего эталонного гена "неизвестный белок" (номер доступа Genbank: AT4G24610) с использованием программного обеспечения LIGHTCYCLER® Probe Design Software 2.0. Для амплификации приготавливали смесь LIGHTCYCLER®480 Probes Master mix (Roche Applied Science, Indianapolis, IN) при 1X конечной концентрации в моноплексной реакционной смеси объемом 10 мкл, содержащей 0,4 мкМ каждого праймера, и 0,2 мкМ каждого зонда. Таблица 7.
Праймеры для ПЦР, использованные для анализа с использованием количественной ПЦР с обратной транскрипцией для dgt-28
Проводили двухстадийную реакцию амплификации с удлинением при 60°C в течение 40 секунд с получением данных флуоресценции. Все образцы анализировали в трех экземплярах и для анализа каждого образца использовали усредненные величины значения порогового цикла (Ct). Реакцию обратной транскрипции минус-цепи проводили для каждого образца, чтобы убедиться, что отсутствовала контаминация гДНК. Анализ данных ПЦР в реальном времени проводили на основе способа ΔΔCt. Этот анализ использовали для определения относительной экспрессии dgt-28 в трансгенных объектах Arabidopsis, которые были определены как гемизиготные и гомозиготные. Относительные уровни транскрипции мРНК dgt-28 находились в диапазоне от 2,5 раз до 207,5 раз превышающем внутренний контроль. Эти данные указывают на то, что растения с трансгенным dgt-28 содержали функциональную экспрессирующую кассету для гена dgt-28, и растения были способны транскрибировать трансген dgt-28.
Анализ с использованием вестерн-блоттинга. DGT-28 выявляли в образцах листьев, полученных из трансгенных растений Arabidopsis thaliana. Экстракты растений из трансгенных растений dgt-28 и белковых стандартов DGT-28 инкубировали с буфером для образца NUPAGE® LDS (Invitrogen, Carlsbad, CA), содержавшим DTT, при 90°C в течение 10 минут и разделяли с помощью электрофореза в предварительно залитом акриламидном геле. Затем белки подвергали электропереносу на нитроцеллюлозную мембрану с использованием протокола изготовителя. После блокирования с помощью WESTERNBREEZE® Blocking Mix (Invitrogen) белок DGT-28 выявляли с помощью антисыворотки против DGT-28, а затем антитела козы против фосфатазы кролика. Обнаруженный белок визуализировали с помощью хемилюминесцентного субстрата BCIP/NBT Western Analysis Reagent (KPL, Gaithersburg, MD). Получение интактного белка DGT-28 с помощью вестерн-блоттинга показало, что растения с трансгенным dgt-28, которые анализировали, экспрессировали белок DGT-28.
На трансгенные растения T1 Arabidopsis, содержавшие трансген dgt-28, распыляли различные дозы глифосата. Повышенные дозы использовали в этом исследовании для определения относительных уровней устойчивости (105, 420, 1680 или 3360 г. э.к/га (g ae/ha)). Типичной 1X используемой в полевых условиях дозой глифосата является 1120 г. э.к./га. Растения T1 Arabidopsis, которые использовали в этом исследовании, варьировали только по количеству копий трансгена dgt-28. Растения T1 Arabidopsis с низким количеством копий dgt-28 подвергали самоопылению и использовали для получения растений T2. В таблице 8 представлено сравнение растений с трансгенным dgt-28, проведенное для гена устойчивости к глифосату, dgt-1 и контролей дикого типа. В таблице 9 представлено сравнение dgt-32 и dgt-33, проведенное для генов устойчивости к глифосату, dgt-1 и контролей дикого типа. В таблице 10 представлено сравнение новых бактериальных ферментов EPSP-синтаз с ферментами EPSP-синтазами класса I и контролями при количестве глифосата 1680 г. э.к./га.
Результаты селекции с глифосатом Arabidopsis растений с трансформированным dgt-28. Сначала проводили селекцию трансформантов T1 Arabidopsis относительно исходных нетрансформированных семян с использованием схемы селекции с глюфосинатом. Для каждой конструкции T1 анализировали три плоских лотка или 30000 семян. Растения T1, отобранные, как описано выше, подвергали молекулярной охарактеризации, а затем растения с высоким количеством копий пересаживали в индивидуальные горшки и на них распыляли различные дозы коммерческого глифосата, как описано ранее. Ответ этих растений представлен в значениях % видимого повреждения через 2 недели после обработки (WAT). Данные, представленные в таблице, демонстрируют индивидуальные растения, проявляющие небольшое повреждение или отсутствие повреждения (<20%), умеренное повреждение (20-40%) или тяжелое повреждение (>40%). Для каждой конструкции, использованной для трансформации Arabidopsis, представлено арифметическое среднее значение и стандартное отклонение. Диапазон индивидуального ответа также указан в последнем столбце для каждой дозы и трансформации. Нетрансформированные Arabidopsis дикого типа (c.v. Columbia) служили в качестве чувствительного к глифосату контроля.
Уровень ответа растений варьировал. Это варьирование может быть связано с тем фактом, что каждое растение соответствует независимому трансгенному объекту и, таким образом, количество копий представляющего интерес гена варьирует от растения к растению. Было отмечено, что некоторые растения, которые содержали трансген, не были устойчивыми к глифосату; тщательный анализ для определения того, экспрессировали ли эти растения трансген, не был проведен. Вероятно, что присутствие высокого количества копий трансгена в растениях T1 Arabidopsis приводило к подавлению трансгена или другим эпигенетическим эффектам, которые приводили к чувствительности к глифосату, несмотря на присутствие трансгена dgt-28.
Среднее значение для повреждения в общей популяции при дозе глифосата 1680 г. э.к./га представлено в таблице 10, чтобы продемонстрировать значимое различие между растениями, трансформированными dgt-3, dgt-7, dgt-28, dgt-32 и dgt-33, против контролей dgt-1 и контролей дикого типа.
Устойчивость, обеспечиваемая новыми бактериальными EPSP-синтазами, варьировала в зависимости от конкретного фермента. DGT-28, DGT-32 и DGT-33 неожиданно обеспечили значительную устойчивость к глифосату. Гены dgt сообщали устойчивость к гербициду индивидуальным растениям T1 Arabidopsis для всех исследованных транзитных пептидов. По существу, использование дополнительных транзитных пептидов хлоропластов (т.е. TraP8 - dgt-32 или TraP8 - dgt-33) может обеспечить защиту от глифосата с уровнями повреждения, сходными с уровнями повреждения, сообщенными для данной обработки.
Ответ трансформированных dgt-28 растений T1 Arabidopsis на диапазон доз глифосата, внесенных после всходов, по сравнению с гомозиготной по dgt-1 устойчивой популяцией (T4) и нетрансформированным контролем. Видимое % повреждение через 14 суток после внесения
Ответ T1 Arabidopsis, трансформированных dgt-32 и dgt-33, на диапазон доз глифосата, внесенных после всходов, по сравнению с гомозиготной устойчивой популяцией dgt-1 (T4) и нетрансформированным контролем. Видимое % повреждение через 14 суток после внесения
Ответ T1 Arabidopsis, трансформированных dgt-28, dgt-32, dgt-33, dgt-3 и dgt-7, на глифосат, внесенный после всходов, в дозе 1680 г. э.к./га, по сравнению с гомозиготной устойчивой популяцией dgt-1 (T4) и нетрансформированным контролем. Видимое % повреждение через 14 суток после внесения
dgt-28 в качестве селективного маркера. Использование dgt-28 в качестве селективного маркера с глифосатом в качестве агента для селекции исследуют с помощью трансформированных растений Arabidopsis, описанных выше. Приблизительно 50 семян Arabidopsis поколения T4 (гомозиготные по dgt-28) добавляют приблизительно к 5000 семенам дикого типа (чувствительным к глифосату). Семена проращивают и на проростки распыляют дозу глифосата для осуществления селекции. Сравнивают несколько обработок глифосатом; в каждом лотке проводят либо одно, либо два внесения глифосата по одной из следующих схем обработки: 7 DAP (суток после посева), 11 DAP или 7, а затем 11 DAP. Поскольку все растения также содержат ген устойчивости к глюфосинату в том же векторе для трансформации, выбранные содержащие dgt-28 растения можно прямо сравнивать с содержащими DSM-2 или pat растениями, отобранными с помощью селекции с глюфосинатом.
Обработки глифосатом осуществляют с помощью наконечника распылителя DeVilbissTM, как описано ранее. Трансгенные растения, содержащие dgt-28, идентифицируют как "устойчивые" или "чувствительные" через 17 DAP. Обработка 26,25-1680 г. э.к./га глифосата, используемая через 7 и 11 суток после посева (DAP), демонстрирует эффективную селекцию трансгенных растений Arabidopsis, которые содержат dgt-28. Чувствительные и устойчивые растения подсчитывают и выявляют, что количество устойчивых к глифосату растений коррелирует с исходным количеством трансгенных семян, содержащих трансген dgt-28, которые были посеяны. Эти результаты указывают на то, что dgt-28 можно эффективно использовать в качестве альтернативного селективного маркера для популяции трансформированных Arabidopsis.
Наследуемость. Растения T1 Arabidopsis с подтвержденными трансгенными объектами подвергали самоопылению с получением семян T2. Эти семена исследовали в испытании по качеству потомства путем применения гербицида IgniteTM, содержащего глюфосинат (200 г. э.к./га), к 100 случайным сибсам T2. Каждое индивидуальное растение T2 пересаживали в 7,5-см квадратные горшки перед применением спрея (гусеничный опрыскиватель при скорости внесения 187 л/га). Семьи T1 (растения T2) сегрегировали согласно ожидаемой модели 3 устойчивых: 1 чувствительный для доминантно наследуемого единичного локуса с наследованием по менделевскому типу, при определении с помощью критерия хи-квадрат (P>0,05). Процент семейств T1, которые сегрегировали согласно ожидаемому менделевскому типу наследования, проиллюстрирован в таблице 11, и он демонстрирует, что признак dgt-28 передается поколению T2 по менделевскому типу наследования. Семена собирали от 5-15 индивидуальных растений T2 (семена T3). Двадцать пять сибсов T3 из каждого из 3-4 случайно выбранных семейств T2 исследовали в испытании по качеству потомства, как описано выше. Данные показали отсутствие сегрегации и, таким образом, продемонстрировали, что dgt-28 и dgt-3 стабильно встраиваются в хромосому и наследуются по менделевскому типу по меньшей мере в трех поколениях.
Процент семейств T1 (растения T2), сегрегирующих по принципу одного менделевского наследуемого признака в испытании по качеству потомства для 100 растений
Данные для T2 Arabidopsis. Растения второго поколения (T2) выбранных трансгенных объектов T1 Arabidopsis, которые содержали низкие количества копий трансгена dgt-28, далее охарактеризовывали в отношении устойчивости к глифосату. Глифосат вносили, как описано ранее. Ответ растений представлен в значениях % видимого повреждения через 2 недели после обработки (WAT). Данные представляли в качестве гистограммы для индивидуальных растений, проявляющих небольшое повреждение или отсутствие повреждения (<20%), умеренное повреждение (20-40%) или тяжелое повреждение (>40%). Арифметическое среднее значение и стандартное отклонение представлены для каждой конструкции, использованной для трансформации Arabidopsis. Диапазон индивидуального ответа также указан в последнем столбце для каждой дозы и трансформации. Нетрансформированные Arabidopsis дикого типа (cv. Columbia) служили в качестве чувствительного к глифосату контроля. В поколении T2 для каждого трансгенного объекта были доступны гемизиготные и гомозиготные растения и, таким образом, они были включены для каждой исследованной дозы глифосата. Гемизиготные растения содержат два различных аллеля в локусе по сравнению с гомозиготными растениями, которые содержат два одинаковых аллеля в локусе. В поколении T2 ожидается вариабельность ответа на глифосат в связи с отличиями в дозировке генов в случае гемизиготных растений по сравнению с гомозиготными растениями. Вариабельность ответа на глифосат отражена в стандартном отклонении и диапазоне ответа.
В поколении T2 как трансгенные объекты с одной копией, так и трансгенные объекты с множеством копий dgt-28, охарактеризовывали в отношении устойчивости к глифосату. В пределах трансгенного объекта растения с одной копией продемонстрировали сходные уровни устойчивости к глифосату. Характеристические данные для трансгенного объекта T2 с одной копией представлены в таблице 12. Трансгенные объекты, включающие dgt-28, связанный с TraP5 v2, не обеспечили надежной устойчивости к глифосату по сравнению с конструкциями dgt-28, которые содержали другие транзитные пептиды TraP. Однако конструкции dgt-28 TraP5 обеспечили низкий уровень устойчивости к глифосату по сравнению с нетрансформированным контролем Columbia. Существовали случаи, когда было показано, что трансгенные объекты, которые содержат две или более копий dgt-28, являются более чувствительными к повышенным дозам глифосата (данные не представлены). Это увеличение чувствительности к глифосату является сходным с данными, ранее описанными для растений T1, которые также содержали высокое количество копий трансгена dgt-28. Вероятно, что присутствие высоких количеств копий трансгена в растениях Arabidopsis приводит к подавлению трансгена или другим эпигенетическим эффектам, которые привели к чувствительности к глифосату, несмотря на присутствие трансгена dgt-28.
Эти трансгенные объекты включали dgt-28, связанный с TraP5 v2 (pDAB105530), TraP12 v2 (pDAB105533) и TraP13 v2 (pDAB105534).
В дополнение к dgt-28, трансгенные объекты T2 Arabidopsis, трансформированные dgt-3, представлены в таблице 13. Как описано для трансгенных объектов dgt-28 в таблице 12, таблица с данными содержит репрезентативный трансгенный объект, который является характеристикой ответа на глифосат для каждой конструкции. Для охарактеризации dgt-3, конструкции, содержащие одну PTU (единица трансформации растения) с геном dgt-3, контролируемым промотором AtUbi10 (pDAB102716 и pDAB10271510) сравнивали с конструкциями с тем же геном, содержащими 2 PTU гена (pDAB102719 и pDAB102718). В конструкциях, которые содержали 2 PTU, использовался промотор AtUbi10 для контроля одной копии гена и промотор CsVMV для контроля другой копии. Использование двойной PTU было предназначено для сравнения растений с трансгенным dgt-3 с растениями с трансгенным dgt-28, которые содержали две копии трансгена. Данные продемонстрировали, что трансгенные объекты T2 с одной копией dgt-3 только с одной PTU были более чувствительными к глифосату, чем исследованные трансгенные объекты с одной копией dgt-28, но были более устойчивыми, чем нетрансформированный контроль. Семейства T1, содержавшие 2 PTU гена dgt-3, обеспечили более высокий уровень видимой устойчивости к глифосату по сравнению с конструкциями с 1 PTU. В обоих случаях семьи T1 сравнивали с dgt-1 и контролями дикого типа. Данные T2 демонстрируют, что dgt-28 обеспечивает надежную устойчивость в качестве трансгенных объектов с одной копией.
Ответ выбранных индивидуальных трансгенных объектов T2 Arabidopsis, включающих dgt-28, на глифосат, внесенный после всходов в различных дозах, по сравнению с гомозиготной устойчивой популяцией dgt-1 (T4) и нетрансформированным контролем. Видимое % повреждение через 14 суток после внесения
Ответ выбранных трансгенных объектов T2 Arabidopsis, трансформированных dgt-3, на глифосат, внесенный после всходов в различных дозах. Видимое % повреждение через 14 суток после внесения
Данные для T3 Arabidopsis. Растения третьего поколения (T2) выбранных трансгенных объектов T1 Arabidopsis, которые содержали низкие количества копий трансгена dgt-28, далее охарактеризовывали в отношении устойчивости к глифосату. Глифосат вносили, как описано ранее. Ответ растений представлен в значениях % видимого повреждения через 2 недели после обработки (WAT). Данные представляли в качестве гистограммы индивидуальных растений, проявляющих небольшое повреждение или отсутствие повреждения (<20%), умеренное повреждение (20-40%) или тяжелое повреждение (>40%). Арифметическое среднее значение и стандартное отклонение представлены для каждой конструкции, использованной для трансформации Arabidopsis. Диапазон индивидуального ответа также указан в последнем столбце для каждой дозы и трансформации. Нетрансформированные Arabidopsis дикого типа (cv. Columbia) служили в качестве контроля чувствительности к глифосату. В поколении T3 гемизиготные и гомозиготные растения были доступны для исследования каждого трансгенного объекта и, таким образом, были включены для каждого исследованного уровня глифосата. Гемизиготные растения содержат два отличающихся аллеля в локусе по сравнению с гомозиготными растениями, которые содержат два одинаковых аллеля в локусе. В поколении T3 ожидается вариабельность ответа на глифосат в результате отличий в дозировке генов для гемизиготных по сравнению с гомозиготными растениями. Вариабельность ответа на глифосат отражается стандартным отклонением и диапазоном ответа.
Ответ выбранных индивидуальных трансгенных объектов T3 Arabidopsis, содержащих dgt-28, на глифосат, внесенный после всходов в различных дозах, по сравнению с гомозиготной устойчивой популяцией dgt-1 (T4) и нетрансформированным контролем. Видимое % повреждение через 14 суток после внесения
Селекция трансформированных растений. Свежесобранным семенам T1 [ген dgt-31, dgt-32 и dgt-33 v1] позволяли высохнуть при комнатной температуре, и их транспортировали в Индианаполис для исследования. Семена T1 высевали в лотки для прорастания размером 26,5×51 см (T.O. Plastics Inc., Clearwater, MN), в каждый из которых помещали аликвоты массой 200 мг стратифицированных семян T1 (~10000 семян), которые предварительно были суспендированы в 40 мл 0,1% раствора агарозы и хранились при 4°C в течение 2 суток, чтобы выполнить требования состояния покоя, и обеспечить синхронное прорастание семян.
Sunshine Mix LP5 покрывали мелкоизмельченным вермикулитом и орошали инфильтрацией раствором Хогланда до влажного состояния, а затем ему позволяли дренироваться под действием силы тяжести. Каждую аликвоту стратифицированных семян объемом 40 мл высевали равномерно на вермикулит с помощью пипетки и накрывали увлажняющими купольными камерами (KORDTM Products, Bramalea, Ontario, Канада) на 4-5 суток. Купольные камеры удаляли после прорастания семян перед первоначальной селекцией трансформантов с использованием послевсходового распыления глюфосината (селекция по котрансформированному гену dsm-2).
Через шесть суток после посева (DAP) и вновь через 10 DAP, на растения T1 (стадия семядоли и 2-4 листьев, соответственно) распыляли 0,1% раствор гербицида IgniteTM (280 г. а.и./л глюфосиината, Bayer Crop Sciences, Kansas City, MO) в объеме распыления 10 мл/лоток (703 л/га) с использованием наконечника для пневматического распыления DeVilbissTM для доставки эффективного количества 200 г. а.и./га глюфосината на внесение. Выжившие растения (активно растущие растения) идентифицировали через 4-7 суток после последнего распыления. Выжившие растения пересаживали по отдельности в 3-дюймовые горшки (7,6 см), подготовленные со средой для пересадки в горшки (Metro Mix 360TM). Растения выращивали в теплице в течение по меньшей мере 1 суток перед взятием образцов тканей для анализа количества копий.
Проводили взятие образцов растений T1 и выполняли анализ количества копий гена dgt-31, dgt-32 и dgt-33 v1. Затем растения T1 распределяли на внесение различных доз глифосата так, чтобы для каждой дозы внесения существовал диапазон копий. Для Arabidopsis, 26,25 г. э.к./га глифосата является эффективной дозой, чтобы различить чувствительные растения и растения с существенными уровнями устойчивости. Повышенные дозы использовали для определения относительного уровня устойчивости (105, 420, 1680 или 3360 г. э.к./га). В таблице 16 представлены сравнения, проведенные для dgt-1.
Все внесения гербицида глифосата проводили с помощью гусеничного опрыскивателя в распыляемом объеме 187 л/га. Использованный глифосат представлял собой коммерческий состав соли с диметиламином Durango (480 г. э.к./л, Dow AgroSciences, LLC). Растения T1 с низким количеством копий, которые проявляли устойчивость либо к глюфосинату, либо к глифосату, далее оценивали в поколении T2.
Первые трансформации Arabidopsis проводили с использованием dgt-31, dgt-32 и dgt-33 v1. Трансформантов T1 сначала отбирали из исходных нетрансформированных семян с использованием схемы селекции с глюфосинатом. Три плоских лотка или 30000 семян анализировали в отношении каждой конструкции T1. Частоту трансформации вычисляли и результаты для конструкций T1 dgt-31, dgt-32 и dgt-33 приведены в таблице 15.
Частоты трансформации конструкций T1 dgt-31, dgt-32 и dgt-33 Arabidopsis, отобранных с помощью глюфосината для селекции селективного маркерного гена DSM-2
Затем растения T1, отобранные, как описано выше, пересаживали в отдельные горшки, и на них распыляли различные дозы коммерческого глифосата. В таблице 16 сравнивается ответ dgt-31, dgt-32 и dgt-33 v1 и контрольных генов на сообщение устойчивости к глифосату трансформантам Arabidopsis T1. Ответ представлен в значениях % видимого повреждения через 2 WAT. Данные представлены в качестве индивидуальных растений, проявляющих небольшое повреждение или отсутствие повреждения (<20%), умеренное повреждение (20-40%) или тяжелое повреждение (>40%). Арифметическое среднее значение и стандартное отклонение представлены для каждой обработки. Диапазон индивидуального ответа также указан в последнем столбце для каждой дозы и трансформации. Нетрансформированные Arabidopsis дикого типа (cv. Columbia) служили в качестве чувствительного к глифосату контроля. Ген DGT-31 (v1) с транзитным пептидом (TraP23) сообщал небольшую устойчивость к гербицидам индивидуальным растениям T1 Arabidopsis по сравнению с отрицательным контролем. Как DGT-32, так и DGT-33, продемонстрировали надежную устойчивость к глифосату при исследованных дозах в отношении их соответствующего транзитного пептида хлоропластов TraP14 и TraP24, соответственно). При данной обработке уровень ответа растений значительно варьировал, что может быть связано с тем фактом, что каждое растение соответствует независимому трансгенному объекту и, таким образом, количество копий представляющего интерес гена варьирует от растения к растению. Важно отметить, что при каждой исследованной дозе глифосата существовали индивидуальные растения, которые были более устойчивыми, чем другие. Среднее значение общего повреждения популяции по дозе представлено в таблице 16, чтобы продемонстрировать значимое отличие между растениями, трансформированными dgt-31, dgt-32 и dgt-33 v1, против dgt-1 v1 или контролей дикого типа.
Ответ T1 Arabidopsis, трансформированных dgt-31, dgt-32 и dgt-33 v1, на диапазон дозировок глифосата, внесенных после всходов, по сравнению с гомозиготной устойчивой популяцией dgt-1 (T4) или нетрансформированным контролем. Видимое % повреждение через 2 недели после обработки
Трансформация кукурузы. Стандартные способы клонирования, как описано выше, использовали для конструирования бинарных векторов для применения в опосредуемой Agrobacterium tumefaciens трансформации кукурузы. В таблице 17 приведены векторы, которые конструировали для трансформации кукурузы. Следующие элементы генов использовали в векторах, которые содержали dgt-28: промотор убиквитина 1 Zea mays (ZmUbi1; патент США № 5510474) использовали для контроля кодирующей последовательности dgt-28, которая фланкируется 3′-нетранслируемой областью липазы Zea mays (ZmLip 3′UTR; патент США № 7179902), кассета селективного маркера состоит из промотора убиквитина 1 Zea mays, который использовали для контроля кодирующей последовательности aad-1 (патент США № 7838733), которая фланкируется 3′-нетранслируемой областью липазы Zea mays. Кодирующая последовательность aad-1 сообщает устойчивость к феноксиауксиновым гербицидам, таким как 2,4-дихлорфеноксиуксусная кислота (2,4-D), и к арилоксифеноксипропионатным (AOPP) гербицидам.
Конструкции dgt-28 конструировали в качестве стандартных бинарных векторов и векторов супербинарной системы Agrobacterium (Japan Tobacco, Tokyo, JP). Стандартные бинарные векторы включают pDAB107663, pDAB107664, pDAB107665 и pDAB107665. Векторы супербинарной системы Agrobacterium включают pDAB108384, pDAB108385, pDAB108386 и pDAB108387.
Получали дополнительные конструкции, которые содержат репортерный ген желтого флуоресцентного белка (yfp; патентная заявка США 2007/0298412). pDAB109812 содержит кассету репортерного гена yfp, которая контролируется промотором убиквитина 1 Zea mays и фланкируется 3′-нетранслируемой областью per5 Zea mays (Zm per5 3′UTR; патент США № 7179902), кассета селективного маркера состоит из промотора палочковидного вируса сахарного тростника (SCBV; патент США № 5994123), который используется для контроля экспрессии aad-1 и фланкируется 3′-нетранслируемой областью липазы Zea mays. pDAB101556 содержит кассету yfp, которая контролируется промотором убиквитина 1 Zea и фланкируется 3′-нетранслируемой областью per5 Zea mays, кассета селективного маркера состоит из промотора убиквитина 1 Zea mays, который используется для экспрессии aad-1 и фланкируется 3′-нетранслируемой областью липазы Zea mays. pDAB107698 содержит кассету dgt-28, которая контролируется промотором убиквитина 1 Zea mays и фланкируется 3′-нетранслируемой областью липазы Zea mays, кассету yfp, которая контролируется промотором убиквитина 1 Zea mays и фланкируется 3′-нетранслируемой областью per5 Zea mays, кассета селективного маркера состоит из промотора палочковидного вируса сахарного тростника, который используют для контроля экспрессии aad-1 и который фланкируется 3′-нетранслируемой областью липазы Zea mays. Все три из этих конструкций представляют собой стандартные бинарные векторы.
Векторы для трансформации кукурузы
Стерилизация початков и выделение зародышей. Для получения незрелых зародышей кукурузы растения инбредной линии B104 Zea mays выращивали в теплице и подвергали самоопылению и опылению сибсами для получения початков. Початки собирали приблизительно через 9-12 суток после опыления. В день эксперимента початки подвергали поверхностной стерилизации путем погружения в 20% раствор гипохлорита натрия (5%) и встряхивания в течение 20-30 минут, а затем ополаскивали три раза стерильной водой. После стерилизации незрелые зиготические зародыши (1,5-2,4 мм) в асептических условиях отрезали от початка и случайным образом распределяли в микроцентрифужные пробирки, содержавшие жидкую среду для инфицирования (основная питательная среда LS, 4,43 г/л; раствор витаминов N6 [1000X], 1,00 мл/л; L-пролин, 700,0 мг/л; сахароза, 68,5 г/л; D(+) глюкоза, 36,0 г/л; 10 мг/мл 2,4-D, 150 мкл/л). Для данного набора экспериментов использовали объединенные зародыши трех початков.
Инициация культуры Agrobacterium:
Исходные культуры в глицерине Agrobacterium, содержавшие бинарные векторы для трансформации, описанные выше, наносили штрихами на чашки с минимальной средой AB, содержавшие соответствующие антибиотики, и выращивали при 20ºC в течение 3-4 суток. Единичную колонию отбирали и наносили штрихами на чашки с YEP, содержавшие те же антибиотики, и инкубировали при 28ºC в течение 1-2 суток.
Культивирование и сокультивирование Agrobacterium. Колонии Agrobacterium отбирали из чашки с YEP, суспендировали в 10 мл среды для инфицирования в 50-мл одноразовой пробирке, и плотность клеток доводили до OD600 нм 0,2-0,4 с использованием спектрофотометра. Культуры Agrobacterium помещали на ротационное устройство для встряхивания при 125 об./мин., комнатная температура, в то время как проводили отделение зародышей. Незрелые зиготические зародыши размером 1,5-2,4 мм выделяли из стерилизованных зерен кукурузы и помещали в 1 мл среды для инфицирования и промывали один раз этой средой. В каждую пробирку добавляли суспензию Agrobacterium (2 мл) и пробирки помещали на платформу устройства для встряхивания на 10-15 минут. Зародыши переносили на среду для сокультивирования (соли MS, 4,33 гм/л; L-пролин, 700,0 мг/л; миоинозитол, 100,0 мг/л; ферментативный гидролизат казеина 100,0 мг/л; 30 мМ Dicamba-KOH, 3,3 мг/л; сахароза, 30,0 г/л; GelzanTM, 3,00 г/л; модифицированные витамины MS [1000X], 1,00 мл/л; 8,5 мг/мл AgNo3, 15,0 мг/L; DMSO, 100 мкМ), ориентированные щитком зародыша вверх и инкубировали при 25°C, при освещении в течение 24 часов с интенсивностью света 50 мкмоль м-2 с-1 в течение 3 суток.
Отбор каллюсов и регенерация предполагаемых трансгенных объектов. После периода сокультивирования зародыши переносили в среду покоя (соли MS, 4,33 г/л; L-пролин, 700,0 5; 1,2,3,5/4,6-гексагидроксициклогексан, 100 мг/л; MES [(2-(н-морфолино)этансульфоновая кислота), свободная кислота] 0,500 г/л; ферментативный гидролизат казеина 100,0 мг/л; 30 мМ Dicamba-KOH, 3,3 мг/л; сахароза, 30,0 г/л; Gelzan 2,30 г/л; модифицированные витамины MS [1000X], 1,00 мл/л; 8,5 мг/мл AgNo3, 15,0 мг/л; карбенициллин, 250,0 мг/л) без агента селекции и инкубировали при освещении в течение 24 часов с интенсивностью света 50 мкмоль м-2 с-1 и при 25°C в течение 3 суток.
Эксперименты по выявлению ответа на дозировку в виде ингибирования роста показали, что концентрации глифосата 0,25 мМ и более были достаточными для ингибирования роста клеток нетрансформированной линии кукурузы B104. Зародыши переносили в среду для селекции 1, содержавшую 0,5 мМ глифосат (соли MS, 4,33 г/л; L-пролин, 700,0 мг/л; миоинозитол, 100,0 мг/л; MES [(2-(н-морфолино)этансульфоновая кислота), свободная кислота] 0,500 г/л; ферментативный гидролизат казеина 100,0 мг/л; 30 мМ Dicamba-KOH, 3,3 мг/л; сахароза, 30,0 г/л; GelzanTM 2,30 г/л; модифицированные витамины MS [1000X], 1,00 мл/л; 8,5 мг/мл AgNo3, 15,0 мг/л; карбенициллин, 250,0 мг/л) и инкубировали либо в темноте и/либо при освещении в течение 24 часов с интенсивностью света 50 мкмоль м-2 с-1 в течение 7-14 суток при 28°C.
Пролиферирующие эмбриогенные каллюсы переносили на среду для селекции 2, содержавшую 1,0 мМ глифосат (соли MS, 4,33 г/л; L-пролин, 700,0 мг/л; 1,2,3,5/4,6-гексагидроксициклогексан, 100 мг/л; MES [(2-(н-морфолино)этансульфоновая кислота), свободная кислота] 0,500 г/л; ферментативный гидролизат казеина 100,0 мг/л; 30 мМ Dicamba-KOH, 3,3 мг/л; сахароза, 30,0 г/л; GelzanTM 2,30 г/л; модифицированные витамины MS [1000X], 1,00 мл/л; 8,5 мг/мл AgNo3, 15,0 мг/л; карбенициллин, 250,0 мг/л; R-галоксифоп-кислота 0,1810 мг/л), и инкубировали либо в темноте и/либо при освещении в течение 24 часов с интенсивностью света 50 мкмоль м-2 с-1 в течение 14 суток при 28°C. Эта стадия селекции позволяла трансгенному каллюсу далее пролиферировать и дифференцироваться. Период селекции каллюсов длился от трех до четырех недель.
Пролиферирующие эмбриогенные каллюсы переносили в среду PreReg, содержавшую 0,5 мМ глифосат (соли MS, 4,33 г/л; 1,2,3,5/4,6-гексагидроксициклогексан, 100 мг/л; L-пролин, 350,0 мг/л; MES [(2-(н-морфолино)этансульфоновая кислота), свободная кислота] 0,250 г/л; ферментативный гидролизат казеина 50,0 мг/л; NAA-NaOH 0,500 мг/л; ABA-EtOH 2,50 мг/л; BA 1,00 мг/л; сахароза, 45,0 г/л; GelzanTM 2,50 г/л; модифицированные витамины MS [1000X], 1,00 мл/л; 8,5 мг/мл AgNo3, 1,00 мг/л; карбенициллин, 250,0 мг/л) и культивировали при освещении в течение 24 часов с интенсивностью света 50 мкмоль м-2 с-1 в течение 7 суток при 28°C.
Эмбриогенные каллюсы с похожими на побеги почками переносили в среду для регенерации, содержавшую 0,5 мМ глифосат (соли MS, 4,33 г/л; 1,2,3,5/4,6-гексагидроксициклогексан, 100,0 мг/л; сахароза, 60,0 г/л; Gellan Gum G434TM 3,00 г/л; модифицированные витамины MS [1000X], 1,00 мл/л; карбенициллин, 125,0 мг/л) и культивировали при освещении в течение 24 часов с интенсивностью света 50 мкмоль м-2 с-1 в течение 7 суток.
Небольшие проростки с первичными корнями переносили в среду для укоренения (соли MS, 4,33 г/л; модифицированные витамины MS [1000X], 1,00 мл/л; 1,2,3,5/4,6-гексагидроксициклогексан, 100 мг/л; сахароза, 60,0 г/л; Gellan Gum G434TM 3,00 г/л; карбенициллин, 250,0 мг/л) в лотки для растений и инкубировали при 16/8 ч свет/темнота при интенсивности света 140-190 мкмоль м-2 с-1 в течение 7 суток при 27°C. Предполагаемые трансгенные проростки анализировали в отношении количества копий трансгена с использованием протоколов, описанных выше, и переносили в почву.
Молекулярное подтверждение присутствия трансгенов dgt-28 и aad-1 в растениях кукурузы. Присутствие полинуклеотидных последовательностей dgt-28 и aad-1 подтверждали с помощью анализов гидролиза зондов. Выделенные растения кукурузы T0 сначала подвергали скринингу с помощью анализа гидролиза зондов, аналогичного TAQMANTM, для подтверждения присутствия трансгенов aad-1 и dgt-28. Данные, полученные в этих исследованиях, использовали для определения количества копий трансгенов, и их использовали для селекции трансгенных объектов кукурузы для обратного скрещивания и перехода к поколению T1.
Образцы тканей собирали в 96-луночные планшеты, мацерацию ткани проводили с помощью распылителя для тканей KLECOTM и гранул из нержавеющей стали (Hoover Precision Products, Cumming, GA) в буфере QiagenTM RLT. После мацерации ткани геномную ДНК выделяли в высокопроизводительном формате с использованием набора BiosprintTM 96 Plant kit (QiagenTM, Germantown, MD) в соответствии с предложенным изготовителем протоколом. Геномную ДНК количественно определяли с помощью набора Quant-ITTM Pico Green DNA assay kit (Molecular Probes, Invitrogen, Carlsbad, CA). Количественно определенную геномную ДНК доводили до приблизительно 2 нг/мкл для анализа гидролиза зондов с использованием автоматического устройства для обработки жидкостей BIOROBOT3000TM (Qiagen, Germantown, MD). Определение количества копий трансгена с помощью анализа гидролиза зондов проводили способом ПЦР в реальном времени с использованием системы LIGHTCYCLER®480 (Roche Applied Science, Indianapolis, IN). Анализы были разработаны для aad-1, dgt-28 и внутреннего эталонного гена инвертазы (номер доступа Genbank №: U16123.1) с использованием программного обеспечения LIGHTCYCLER® Probe Design Software 2.0. Для амплификации смесь LIGHTCYCLER®480 Probes Master mix (Roche Applied Science, Indianapolis, IN) приготавливали в 1X конечной концентрации в мультиплексной реакционной смеси объемом 10 мкл, содержащей 0,4 мкм каждого праймера для aad-1 и dgt-28 и 0,2 мкМ каждого зонда (таблица 18).
Двухстадийную реакцию амплификации проводили с удлинением при 60°C в течение 40 секунд с получением данных флуоресценции. Все образцы анализировали и для анализа каждого образца использовали усредненные величины значения порогового цикла (Ct). Анализ данных ПЦР в реальном времени проводили с использованием программного обеспечения LightCyclerTM выпуска 1.5 с использованием модуля относительного количественного определения, и он основан на способе ΔΔCt. Контроли включали образец геномной ДНК из калибратора единичной копии и известный контроль с 2 копиями, которые были включены в каждый анализ. В таблице 19 приведены результаты анализа гидролиза зондов.
Последовательности праймеров и зондов, использованные для анализа гидролиза зондов aad-1, dgt-28 и внутреннего эталона (инвертаза)
Результаты анализа количества копий T0 для трансгенных объектов dgt-28. Трансгенные объекты с низким количеством копий включали 1-2 копий трансгена, количества с одной копией приведены в скобках. Объекты с высоким количеством копий включали 3 или более копий трансгена
Устойчивость к гербицидам в кукурузе с трансформированным dgt-28. Трансформированным объектам Zea mays (T0) с dgt-28 позволяли акклиматизироваться в теплице и их выращивали до тех пор, пока растения не переносили из культуры ткани в условия выращивания в теплице (т.е. 2-4 новых нормального вида листьев появились из завитков). Растения выращивали при 27°C в условиях 16 часов на свету:8 часов в темноте в теплице. Затем растения обрабатывали коммерческими составами Durango DMATM (содержащими гербицид глифосат) с добавлением 2% масс./об. сульфата аммония. Внесение гербицида осуществляли с помощью гусеничного опрыскивателя с объемом распыления 187 л/га, высота распыления 50 см. На растения T0 проводили распыление диапазона доз глифосата 280-4480 г. э.к./га глифосата, который способен значительно повреждать нетрансформированные листья кукурузы. Летальную дозу определяют как дозу, которая вызывает >95% повреждение растений инбредной линии B104.
Результаты для растений кукурузы T0 с dgt-28 продемонстрировали, что обеспечивалась устойчивость к дозам глифосата вплоть до 4480 г. э.к./га. Для поколения T0 использовали определенный тип среды. Минимальное замедление роста и общий рост трансформированных растений по сравнению с нетрансформированными контролями продемонстрировали, что dgt-28 обеспечивает надежную устойчивость к глифосату, когда он связан с транзитными пептидами хлоропластов TraP5, TraP8 и TraP23.
Выбранные растения T0 подвергали самоопылению или обратному скрещиванию для дальнейшей охарактеризации в следующем поколении. На 100 выбранных линий dgt-28, содержащих растения T1, распыляли 140-1120 г. э.к./га глюфосината или 105-1680 г. э.к./га глифосата. Как ген селективного маркера, так и ген устойчивости к глифосату конструируют на одной и той же плазмиде. Таким образом, если с помощью селекции отбирают один ген устойчивости к гербициду путем распыления гербицида, полагают, что присутствуют оба гена. Через 14 DAT подсчитывают устойчивые и чувствительные растения для определения процента линий, которые сегрегировали в качестве единого локуса, доминантного менделевского признака (3R:1S), при определении с помощью анализа хи-квадрат. Эти данные демонстрируют, что dgt-28 наследуется в качестве стойкого гена устойчивости к глифосату в однодольных видах. Увеличенные дозы глифосата применяют к выжившим растениям T1 или F1 для дальнейшей охарактеризации устойчивости и защиты, которая обеспечивается геном dgt-28.
Устойчивость к гербицидам после всходов в трансформированной dgt-28 кукурузе T0. Трансгенные объекты T0 с dgt-28, связанным с TraP4, TraP5, TraP8 и TraP23, получали путем трансформации Agrobacterium, и им позволяли акклиматизироваться в условиях камеры для контроля роста до тех пор, пока 2-4 новых нормального вида листа не появится из завитка. Растениям присваивали индивидуальные идентификационные номера и проводили взятие образцов для анализа количества копий как dgt-28, так и aad-1. На основе анализа количества копий растения отбирали для анализа экспрессии белков. Растения пересаживали в более крупные горшки с новой средой для роста и выращивали при 27°C в условиях 16 часов на свету:8 часов в темноте в теплице. Затем остальные растения, для которых не проводили взятие образцов в отношении экспрессии белков, обрабатывали коммерческими составами Durango DMATM (глифосат) с добавлением 2% масс./об. сульфата аммония. Обработки распределяли так, чтобы каждая группа растений включала трансгенные объекты T0 с различным количеством копий. Внесение гербицида осуществляли с помощью гусеничного опрыскивателя с объемом распыления 187 л/га, высота распыления 50 см. На растения T0 распыляли диапазон доз глифосата 280-4480 г. э.к./га глифосата, способных значительно повреждать нетрансформированные линии кукурузы. Летальную дозу определяют как дозу, которая вызывает >95% инбредной линии B104. Линия B104 являлась генетическим фоном для трансформантов.
Результаты для растений кукурузы T0 dgt-28 демонстрируют, что обеспечивалась устойчивость к глифосату в дозе вплоть до 4480 г. э.к./га. Таблица 20. Минимальная задержка роста и общий рост трансформированных растений по сравнению с нетрансформированными контролями продемонстрировали, что dgt-28 обеспечивает надежную защиту от глифосата, когда он связан с TraP5, TraP8 и TraP23.
Ответ различных количеств копий трансгенных объектов T0 с dgt-28 на дозы глифосата в диапазоне 280-4480 г. э.к./га + 2,0% масс./об. сульфата аммония через 14 суток после обработки
Анализ экспрессии белка с помощью стандартного ELISA продемонстрировал средний диапазон белка DGT-28 12,6-22,5 нг/см2 среди исследованных конструкций.
Подтверждение устойчивости к глифосату в поколении F1 в условиях теплицы. Растения T0 с одной копией, на которые не проводили распыление, подвергали скрещиванию с нетрансформированной исходной линией B104 для дальнейшей охарактеризации в следующем поколении. В поколении T1 устойчивость к глифосату оценивали для подтверждения наследования гена dgt-28. Для растений T1 гербицид Assure IITM (35 г. э.к./га квизалофоп-метил) вносили на стадии роста V1 для селекции по белку AAD-1. Как ген селективного маркера, так и ген устойчивости к глифосату, конструировали на одной и той же плазмиде. Таким образом, если путем селекции отбирают один ген, полагают, что присутствуют оба гена. Через 7 DAT, устойчивые и чувствительные растения подсчитывали, и нулевые растения удаляли из популяции. Эти данные демонстрируют, что dgt-28 (v1) наследуется в качестве стойкого гена устойчивости к глифосату в однодольных видах. Взятие образцов растений проводили для охарактеризации белка DGT-28 с помощью стандартного ELISA и уровня транскрипта РНК. На устойчивые растения распыляли 560-4480 г. э.к./га глифосата, как описано ранее. Данные демонстрируют надежную устойчивость в случае dgt-28, связанного с транзитными пептидами хлоропластов TraP4, TraP5, TraP8 и TraP23 вплоть до 4480 г. э.к./га глифосата. Таблица 21.
Ответ трансгенных объектов F1 с одной копий dgt-28, на дозы глифосата в диапазоне 560-4480 г. э.к./га + 2,0% масс./об. сульфата аммония через 14 суток после обработки
Данные экспрессии белка демонстрируют диапазон среднего уровня белка DGT-28 42,2-88,2 нг/см2 среди исследованных трансгенных объектов T1 и конструкций, что доказывает экспрессию белка в поколении T1.
Охарактеризации кукурузы dgt-28 в полевых условиях. Трансгенные объекты T1 с одной копией были отосланы в полевую местность для получения как гибридных гемизиготных, так и инбредных гомозиготных семян для дополнительной охарактеризации. Гибридные семена получали путем скрещивания трансгенных объектов T1 в линии кукурузы для трансформации B104 с инбредной линией 4XP811 с получением популяций гибридов, сегрегирующих 1:1 (гемизиготные:нулевые) по трансгенному объекту. Полученные семена транспортировали в 2 отдельных районах. Всего пять трансгенных объектов с одной копией на конструкцию высевали в каждой области по рандомизированной полной блочной схеме в трех экземплярах. Поля организовывали так, чтобы внесение глифосата происходило на стадии роста V4 и чтобы внесение для отдельных групп растений происходило на стадии роста V8. В качестве отрицательного контроля использовали общеизвестный гибрид 4XP811/B104.
Экспериментальные грядки обрабатывали 184 г. э.к./га Assure IITM (106 г. а.и./л квизалофоп-метил) для устранения нулевых сегрегирующих растений. Все участники эксперимента сегрегировали 1:1 (чувствительные:устойчивые) (p=0,05) в отношении внесения Assure IITM. Среди выбранных устойчивых растений для каждого трансгенного объекта проводили взятие образцов для количественного определения белка DGT-28 с помощью стандартного ELISA.
Растения, устойчивые к квизалофопу-метилу, обрабатывали коммерческим гербицидом Durango DMATM (480 г. э.к./л глифосат) с добавлением 2,5% масс./об. сульфата аммония на стадиях роста либо V4, либо V8. Внесение гербицида проводили с помощью штангового опрыскивателя, откалиброванного для доставки 187 л/га, высота распыления 50 см. На растения проводили распыление диапазона доз глифосата, составляющего 1120-4480 г. э.к./га глифосата, способных значительно повреждать нетрансформированные линии кукурузы. Летальную дозу определяют как доза, которая обеспечивает >95% повреждение инбредной линии 4XP811. Визуальную оценку повреждений проводили в отношении процента видимого хлороза, процента некроза, процента ингибирования роста и общего видимого повреждения через 7, 14 и 21 DAT (суток после обработки). Оценки сравнивали с необработанными контролями для каждой линии и отрицательными контролями.
Данные о видимых повреждениях для всех случаев оценки продемонстрировали надежную устойчивость к вплоть до 4480 г. э.к./га Durango DMATM в обоих районах и временах внесения. Предоставлены репрезентативные трансгенные объекты для внесения на стадии V4 из одного района, и они согласуются с другими трансгенными объектами, временем внесения и областями. Таблица 22. Один трансгенный объект на основе конструкции, содержащей dgt-28, связанный с TraP23 (pDAB107665), был устойчивым к селекции Assure IITM в отношении белка AAD-1, однако был чувствительным ко всем внесенным дозам глифосата.
Ответ для трансгенных объектов dgt-28 на внесение диапазона дозировок глифосата 1120-4480 г. э.к./га + 2,5% масс./об. сульфата аммония на стадии роста V4
Дополнительную оценку проводили во время репродуктивной стадии роста для дозы 4480 г. э.к./га глифосата. Визуальная оценка метелок, времени опыления и налива початков была сходной с необработанными контролями у каждой линии для всех конструкций, времени внесения и областей. Результаты количественного определения для белка DGT-28 продемонстрировали диапазон средней экспрессии белка 186,4-303,0 нг/см2. Данные демонстрируют надежную устойчивость кукурузы с трансформированным dgt-28 в полевых условиях на протяжении репродуктивных стадий роста к вплоть до 4480 г. э.к./га глифосата. Данные также продемонстрировали обнаружение и функцию белка DGT-28 на основе результатов устойчивости к распылению.
Подтверждение наследуемости и устойчивости кукурузы dgt-28 в гомозиготном состоянии. Семена T1S2 сеяли в тепличных условиях, как описано ранее. Те же пять линий с одной копией, которые были охарактеризованы в полевых условиях, охарактеризовывали в гомогенном состоянии. Растения выращивали до стадии роста V3 и распределяли на три дозы глифосата в диапазоне 1120-4480 г. э.к./га глифосата (Durango DMATM) и четыре реплики обработку. Внесение проводили с помощью гусеничного опрыскивателя, как описано ранее, и составление проводили в 2,0% масс./об. сульфата аммония. Использование сульфата аммония служило в качестве контроля без обработки для каждой линии. Визуальную оценку проводили через 7 и 14 суток после обработки, как описано ранее. Данные продемонстрировали надежную устойчивость к вплоть до 4480 г. э.к./га глифосата для всех исследованных трансгенных объектов. Таблица 23.
Ответ гомозиготных по dgt-28 трансгенных объектов на внесение диапазона доз глифосата 1120-4480 г. э.к./га + 2,0% масс./об. сульфата аммония
Линия из pDAB107665, которая не была устойчивой в полевых условиях, продемонстрировала отсутствие устойчивости к глифосату, и, таким образом, это согласовывалось данными наблюдения в поле (данные не представлены). За исключением одной ранее упомянутой линии, все реплики, которые были обработаны глифосатом из линий, не были чувствительными к глифосату. Таким образом, данные демонстрируют наследуемость для гомогенной популяции кукурузы с dgt-28 по менделевскому типу. Экспрессия белка DGT-28 с помощью стандартного ELISA продемонстрировала диапазон средней экспрессии белка 27,5-65,8 нг/см2 среди трансгенных объектов с одной копией, которые были устойчивыми к глифосату. Данные демонстрируют функциональный белок и стабильность белка DGT-28 среди поколений.
Использование устойчивости к послевсходовому внесению глифосата в качестве селективного маркера. Как описано ранее, трансформированные растения T0 перемещали из культуры тканей в теплицу и акклиматизировали. Исследованные трансгенные объекты включали dgt-28, связанный с транзитными пептидами хлоропластов TraP5, TraP8 и TraP23. Было продемонстрировано, что эти растения T0 обеспечили надежную устойчивость к вплоть до 4480 г. э.к./га глифосата, и контроль в виде нетрансформированных растений осуществляли при концентрации глифосата только 280 г. э.к./га. Эти данные демонстрируют, что dgt-28 можно использовать в качестве селективного маркера с использованием концентрации глифосфата в диапазоне 280-4480 г. э.к./га.
Некоторое количество семян из фиксированных линий кукурузы, которые содержат трансген dgt-28, добавляют к некоторому количеству нетрансформированных семян кукурузы. Семена высевают и позволяют им расти до стадии развития V1-V3, и в это время на проростки распыляют выбранную дозу глифосата в диапазоне 280-4480 г. э.к./га. Через 7-10 суток чувствительные и устойчивые растения подсчитывают и количество устойчивых к глифосату растений коррелирует с исходным количеством трансгенных семян, содержащих трансген dgt-28, которые высевают.
Пакетирование генов в кукурузе dgt-28. Белок AAD-1 используют в качестве селективного маркера в трансформированной кукурузе dgt-28 для целей исследования. Ген aad-1 также можно использовать в качестве признака устойчивости к гербицидам в кукурузе для обеспечения надежной устойчивости к 2,4-D при внесении в культуру на стадии вплоть до V8. Четыре трансгенных объекта на основе конструкций pDAB107663 (TraP4::dgt-28), pDAB107664 (TraP8::dgt-28) и pDAB107666 (TraP5::dgt-28) охарактеризовывали в отношении устойчивости при внесении из баковой смеси глифосата и 2,4-D. Исследование по охарактеризации проводили для семян F1 в условиях теплицы. Внесение проводили с помощью гусеничного опрыскивателя, как описано ранее, в следующих дозах: 1120-2240 г. э.к./га глифосата (селективные для гена dgt-28), 1120-2240 г. э.к./га 2,4-D (селективные для гена aad-1), или вносили баковую смесь двух гербицидов в двух описанных дозах. Растения оценивали через 7 и 14 DAT. Результаты распыления для внесения гербицидов в дозе 2240 г. э.к./га представлены в таблице 23.
Ответ кукурузы F1 aad-1 и dgt-28 на внесение 2240 г. э.к./га 2,4-D, глифосата и баковой смеси с комбинацией двух гербицидов через 14 суток после обработки
Результаты подтверждают, что dgt-28 можно успешно пакетировать с aad-1, таким образом, увеличивая спектр гербицидов, которые можно применять к представляющей интерес культуре (глифосат + феноксиуксусная кислота для dgt-28 и aad-1, соответственно). Для получения сельскохозяйственной культуры, где трудно осуществлять борьбу с широколистными сорняками или существуют устойчивые биотипы сорняков, пакетирование можно использовать в качестве средства для борьбы с сорняками и защиты представляющей интерес сельскохозяйственной культуры. Дополнительные как агротехнические, так и потребительские, признаки также можно пакетировать с геном dgt-28 в кукурузе и других растениях.
Трансформация сои. Сою (Glycine max), содержащую стабильно встроенный трансген dgt-28, получают путем опосредуемой Agrobacterium трансформации эксплантатов семядольного узелка сои. Для инициации трансформации используют разоруженный штамм Agrobacterium, содержащий бинарный вектор, включающий функциональный dgt-28.
Опосредуемую Agrobacterium трансформацию осуществляют с использованием модифицированной методики половины семядольного узла Zeng et al. (Zeng P., Vadnais D.A., Zhang Z., Polacco J.C., (2004), Plant Cell Rep., 22(7): 478-482). В кратком изложении, семена сои (cv. Maverick) проращивают на базальной среде и семядольные узлы выделяют и инфицируют Agrobacterium. Среды для закладки побегов, удлинения побегов и укоренения дополняют цефотаксимом, тиментином и ванкомицином для удаления Agrobacterium. Селекцию с помощью гербицида используют для ингибирования роста нетрансформированных побегов. Выбранные побеги переносят в среду для укоренения в целях развития корней, а затем переносят в почвенную смесь для акклиматизации проростков.
Терминальные листки выбранных проростков обрабатывают поверхностно (способ окрашивания листьев) гербицидом для скрининга предполагаемых трансформантов. Подвергнутые скринингу проростки переносят в теплицу, позволяют им акклиматизироваться, а затем листья окрашивают гербицидом для повторного подтверждения устойчивости. Проводят взятие образцов этих предполагаемых трансформированных растений T0 и используют молекулярный анализ для подтверждения присутствия гербицидного селективного маркера и трансгена dgt-28. Растениям T0 позволяют самоопыляться в теплице с получением семян T1.
Для получения дополнительных трансгенных растений сои можно использовать второй способ трансформации сои. Разоруженный штамм Agrobacterium, содержащий бинарный вектор, включающий функциональный dgt-28, используют для инициации трансформации.
Опосредуемую Agrobacterium трансформацию проводят с использованием модифицированной методики половины семени Paz et al. (Paz M., Martinez J., Kalvig A., Fonger T., и Wang K., (2005) Plant Cell Rep., 25: 206-213). В кратком изложении, зрелые семена сои стерилизуют в течение ночи с помощью газообразного хлора и пропитывают стерильной H2O за двадцать часов до опосредуемой Agrobacterium трансформации растений. Семена разрезают пополам путем продольного разреза вдоль рубчика семени для разделения семени и удаления оболочки семени. Эмбриональную ось вырезают и любые осевые побеги/почки удаляют из семядольного узелка. Полученные эксплантаты половин семян инфицируют Agrobacterium. Среды для закладки побегов, удлинения побегов и укоренения дополняют цефотаксимом, тиментином и ванкомицином для удаления Agrobacterium. Селекцию с помощью гербицида используют для ингибирования роста нетрансформированных побегов. Выбранные побеги переносят в среду для укоренения в целях развития корней, а затем переносят в почвенную смесь для акклиматизации проростков.
Терминальные листки выбранных проростков обрабатывают поверхностно (способ окрашивания листьев) гербицидом для скрининга предполагаемых трансформантов. Подвергнутые скринингу проростки переносят в теплицу, позволяют им акклиматизироваться, а затем листья окрашивают гербицидом для повторного подтверждения устойчивости. Проводят взятие образцов этих предполагаемых трансформированных растений T0 и используют молекулярный анализ для подтверждения присутствия гербицидного селективного маркера и трансгена dgt-28. Несколько трансгенных объектов идентифицируют в качестве содержащих трансгены. Эти растения T0 используют для дальнейшего анализа, и им позволяют самоопылиться в теплице с получением семян T1.
Подтверждение наследуемости dgt-28 в поколении T1. Наследуемость белка DGT-28 в поколении T1 оценивали одним из двух способов. Первый способ включал посев семян T1 на среду Metro-mix и применение 411 г. э.к./га IgniteTM 280 SL к проросшим растениям на стадии роста 1-го трилистника. Второй способ состоял в гомогенизации семян в 8 репликах с использованием шаровой опоры и Genogrinder. Затем использовали тест-полоски ELISA для обнаружения белка PAT в целях выявления наследуемых трансгенных объектов, поскольку селективный маркер находился на той же плазмиде, что и dgt-28. Для любого способа, если одно растение было устойчивым к глюфосинату или было выявлено с помощью тест-полоски ELISA для PAT, трансгенный объект демонстрировал наследуемость в поколении T1.
Всего пять конструкций подвергали скринингу на наследуемость, как описано ранее. Плазмиды содержали dgt-28, связанный с TraP4, TraP8 и TraP23. Трансгенные объекты среди конструкций продемонстрировали 68% наследуемость белка PAT::DGT-28 в поколении T1.
Устойчивость к послевсходовому гербициду в трансформированной dgt-28 сое T1. Семена трансгенных объектов T1, для которых ранее описанными способами скрининга была определена наследуемость, высевали в среду Metro-mix в условиях теплицы. Растения выращивали до тех пор, пока 1-ый трилистник не раскрывался полностью, и обрабатывали 411 г. э.к./га IgniteTM 280 SL для селекции гена pat, как описано ранее. Устойчивым растениям из каждого трансгенного объекта присваивали уникальные идентификационные обозначения и проводили взятие их образцов для анализа зиготности гена dgt-28. Данные о зиготности использовали для распределения 2 гемизиготных и 2 гомозиготных реплик на каждую вносимую дозу глифосата, с получением всего 4 реплик на обработку, когда имелось достаточно растений. Эти растения сравнивали с табаком Petite havana дикого типа. На все растения проводили распыление с помощью гусеничного опрыскивателя, установленного на 187 л/га. На растение проводили распыление в диапазоне 560-4480 г. э.к./га DurangoTM, соль диметиламина (DMA). Для всех внесений составление проводили в воде с добавлением 2% масс./об. сульфата аммония (AMS). Растения оценивали через 7 и 14 суток после обработки. Растениям присваивали оценку повреждения в отношении общего видимого замедления роста, хлороза и некроза. Поколение T1 является сегрегирующим, так что ожидается некоторый вариабельный ответ вследствие отличий в зиготности.
Результаты распыления демонстрируют через 14 DAT (сутки после обработки) надежную устойчивость к вплоть до 4480 г. э.к./га глифосата у по меньшей мере одного охарактеризованного трансгенного объекта с dgt-28 на конструкцию. Все репрезентативные трансгенные объекты конструкций с одной копией обеспечили устойчивость к вплоть до 4480 г. э.к./га по сравнению с отрицательным контролем Maverick
Защита с помощью dgt-28 от увеличенных доз глифосата в поколении T2. Испытание по качеству потомства проводили для 45 растений из от двух до пяти линий T2 с dgt-28 на конструкцию. Гомозиготные линии были выбраны на основе анализа зиготности, проведенного для предшествующего поколения. Семена сеяли, как описано ранее. Затем на растения распыляли 411 г. э.к./га Ignite 280 SL для селекции по селективному маркеру pat, как описано ранее. Через 3 DAT подсчитывали устойчивые и чувствительные растения.
Для конструкций, содержавших TraP4, связанный с dgt-28 (pDAB107543 и pDAB107548), девять из двенадцати исследованных линий не сегрегировали, тем самым подтверждая гомогенность линий в поколении T2. Линии, содержавшие TraP8, связанный с dgt-28 (pDAB107545), продемонстрировали, что две из четырех линий не имели сегрегирующих растений, и продемонстрировали менделевский тип наследования по меньшей мере до второго поколения сои с dgt-28. Проводили взятие образцов тканей устойчивых растений и белок DGT-28 количественно определяли стандартными способами ELISA. Данные продемонстрировали диапазон среднего количества белка DGT-28 32,8-107,5 нг/см2 для несегрегирующих исследованных линий T2. Линии с конструкцией pDAB107553 (TraP23::dgt-28) ранее не подвергали селекции с глюфосинатом, и ответ на дозу глифосата использовали как в качестве испытания на гомогенность, так и в качестве испытания на устойчивость к повышенным дозам глифосата. Реплики линий с конструкцией pDAB107553 были устойчивыми к дозам в диапазоне 560-4480 г. э.к./га глифосата, и, таким образом, было подтверждено, что они являются гомогенной популяцией и наследование происходило по меньшей мере в двух поколениях.
Дозы Durango DMA в диапазоне 560-4480 г. э.к./га глифосата применяли к сое на стадии 2-3 трехлистников, как описано ранее. Визуальные данные о повреждениях через 14 DAT подтвердили результаты устойчивости, которые были продемонстрированы в поколении T1.
Данные демонстрируют надежную устойчивость табака с dgt-28 к вплоть до 3360 г. э.к./га глифосата в двух поколениях по сравнению с нетрансформированным контролем
Трансформация риса посредством dgt-28. В иллюстративном способе трансформации трансгенный рис (Oryza sativa), содержащий стабильно встроенный трансген dgt-28, получают с помощью опосредуемой Agrobacterium трансформации стерилизованных семян риса. Для инициации трансформации используют разоруженный штамм Agrobacterium, содержащий бинарный вектор, включающий функциональный dgt-28.
Культуральную среду доводят до pH 5,8 с помощью 1 M KOH и загущают с помощью 2,5 г/л Phytagel (Sigma-Aldrich, St. Louis, MO). Эмбриогенные каллюсы культивируют в чашках Петри размером 100×20 мм, содержащих 30 мл полутвердой среды. Проростки риса выращивают на 50 мл среды в боксах MAGENTA. Суспензии клеток поддерживают в 125-мл конических колбах, содержащих 35 мл жидкой среды, и центрифугируют при 125 об./мин. Индукцию и поддержание эмбриогенных культур проводят в темноте при 25-26°C, и регенерацию растений и культивирование цельных растений проводят в освещенной комнате со световым периодом 16 ч (Zhang et al. 1996).
Индукцию и поддержание эмбриогенного каллюса проводят на модифицированной базальной среде NB, как описано ранее (Li et al. 1993), где среда адаптирована так, чтобы она содержала 500 мг/л глутамина. Суспензионные культуры инициируют и поддерживают в жидкой среде SZ (Zhang et al. 1998) с включением 30 г/л сахарозы вместо мальтозы. Осмотическая среда (NBO) состоит из среды NB с добавлением 0,256 M каждого из маннита и сорбита. Селекцию устойчивого к гербицидам каллюса проводят на среде NB, дополненной соответствующим селективным гербицидным агентом, в течение 3-4 недель. Предварительную регенерацию проводят на среде (PRH50) состоящей из среды NB с 2,4-дихлорфеноксиуксусной кислотой (2,4-D), 1 мг/л α-нафталинуксусной кислоты (NAA), 5 мг/л абсцизовой кислоты (ABA) и селективным гербицидом, в течение 1 недели. Регенерацию проростков осуществляют путем культивирования на среде для регенерации (RNH50), содержащей среду NB, содержащую 2,4-D, 0,5 мг/л NAA и селективный гербицид, до тех пор, пока предполагаемые трансгенные побеги не регенерируют. Побеги переносят на среду для укоренения с основными солями Мурасиге-Скуга в половинной концентрации и витаминами B5 Гамборга, дополненную 1% сахарозой и селективным гербицидом.
Зрелые высушенные семена Oryza sativa L. japonica cv. Taipei 309 стерилизуют, как описано в Zhang et al. 1996. Эмбриогенные ткани индуцируют путем культивирования стерильных зрелых семян риса на среде NB в темноте. Первичный каллюс диаметром приблизительно 1 мм удаляют из щитка зародыша и используют для инициации суспензии клеток в жидкой среде SZ. Затем суспензии поддерживают так, как описано в Zhang 1996. Происходящие из суспензии эмбриогенные ткани извлекают из жидкой культуры через 3-5 суток после предшествующего субкультивирования и помещают на осмотическую среду NBO для формирования круга размером приблизительно 2,5 см на чашке Петри и культивируют в течение 4 ч перед бомбардировкой. Через от шестнадцати до двадцати часов после бомбардировки ткани переносят из среды NBO на селективную среду NBH50, контролируя, чтобы подвергнутая бомбардировке поверхность была направлена вверх, и инкубируют в темноте в течение 14-17 суток. Затем вновь образованный каллюс отделяют от исходных подвергнутых бомбардировке эксплантатов и помещают рядом на ту же среду. После дополнительных 8-12 суток, относительно компактный непрозрачный каллюс визуально идентифицируют и переносят в предрегенерационную среду PRH50 на 7 суток в темноте. Затем растущий каллюс, который становится более компактным и непрозрачным, субкультивируют в среде для регенерации RNH50 в течение периода 14-21 суток при световом периоде 16 ч. Регенерирующие побеги переносят в боксы MAGENTA, содержащие среду ½ MSH50. Множество растений, регенерировавших из одного эксплантата, считают сибсами, и их обрабатывают как одну независимую линию растений. Растение оценивают как положительное по гену dgt-28, если оно образует толстые белые корни и энергично растет на среде ½ MSH50. После того, как ростки достигают верха боксов MAGENTA, их переносят в почву в 6-см горшках при 100% влажности на неделю, а затем переносят в камеру для выращивания со световым периодом в течение 14 ч при 30°C и в темноте при 21°C на 2-3 недели, перед пересадкой в 13-см горшки в теплице. Семена собирают и сушат при 37°C в течение одной недели перед хранением при 4°C.
Анализ T0 риса с dgt-28. Пересаженные трансформанты риса, полученные путем трансформации с помощью Agrobacterium, пересаживали в среду и акклиматизировали к условиям теплицы. Проводили взятие образцов всех растений для обнаружения с помощью ПЦР dgt-28 и результаты демонстрируют двадцать два положительных в ПЦР трансгенных объекта для pDAB110827 (TraP8::dgt-28) и минимум шестнадцать положительных в ПЦР трансгенных объекта для pDAB110828 (TraP23::dgt-28). Саузерн-анализ dgt-28 для положительных в ПЦР трансгенных объектов продемонстрировал простые (1-2 копия) трансгенные объекты для обеих конструкций. Экспрессия белка в выбранных трансгенных объектах T0 продемонстрировала, что экспрессия белка DGT-28 находится в диапазоне ниже уровней обнаружения 130 нг/см2. Выбранные трансгенные объекты T0 с конструкцией pDAB110828 обрабатывали 2240 г. э.к./га Durango DMATM, как описано ранее, и оценивали через 7 и 14 суток после обработки. Данные продемонстрировали надежную устойчивость к вносимой дозе глифосата. Всем положительным в ПЦР растениям позволяли продуцировать семена T1 для дальнейшей охарактеризации.
Наследуемость Dgt-28 в рисе. Испытание по качеству потомства для 100 растений проводили на четырех линиях T1 с dgt-28 из конструкции pDAB110827, содержащей транзитный пептид хлоропластов TraP8. Семена высевали в горшки, заполненные средой. Затем на все растения распыляли 560 г. э.к./га Durango DMATM для селекции по гену dgt-28, как описано ранее. Через 7 DAT, подсчитывали устойчивые и чувствительные растения. Две из четырех исследованных линии для каждой конструкции сегрегировали в качестве единого локуса, доминантного менделевского признака (3R:1S), как определяли с помощью анализа с использованием критерия хи-квадрат. Dgt-28 представляет собой наследуемый ген устойчивости к глифосату во множестве видов.
Устойчивость к послевсходовому гербициду в трансформированном dgt-28 рисе T1. Устойчивым растениям T1 из каждого трансгенного объекта, использованного в испытании по качеству потомства, присваивали уникальные идентификационные обозначения и проводили взятие их образцов для анализа зиготности гена dgt-28. Данные о зиготности использовали для распределения 2 гемизиготных и 2 гомозиготных реплик на каждую вносимую дозу глифосата, с получением всего 4 реплик на обработку. Эти растения сравнивали с рисом kitaake дикого типа. На все растения проводили распыление с помощью гусеничного опрыскивателя, установленного на 187 л/га. На растения проводили распыление в диапазоне 560-2240 г. э.к./га Durango DMATM. Для всех внесений составление проводили в воде с добавлением 2% масс./об. сульфата аммония (AMS). Растения оценивали через 7 и 14 суток после обработки. Растениям присваивали оценку повреждения в отношении общего видимого замедления роста, хлороза и некроза. Поколение T1 является сегрегирующим, так что ожидается некоторый вариабельный ответ вследствие отличий в зиготности.
Результаты распыления демонстрируют через 7 DAT (сутки после обработки) минимальное вегетативное повреждение при повышенных дозах глифосата (данные не представлены).
Данные о видимых повреждениях через 14 DAT демонстрируют менее чем 15% среднее видимое повреждение при вплоть до 2240 г. э.к./га глифосата
Выявление белка DGT-28 проводили для всех реплик из всех четырех исследованных линий T1, полученных с помощью pDAB110827. Данные продемонстрировали средние диапазоны белка DGT-28 20-82 нг/см2 и 21-209 нг/см2 для гемизиготных и гомозиготных реплик, соответственно. Эти результаты продемонстрировали стабильную экспрессию белка до поколения T1 и устойчивость риса с dgt-28 к вплоть до 2240 г. э.к./га глифосата после внесения 560 г. э.к./га глифосата, использованного для селекции.
Трансформация табака посредством dgt-28. Фрагменты листьев табака (cv. Petit Havana) трансформируют с использованием Agrobacterium tumefaciens, содержащих трансген dgt-28. Единичные колонии, содержащие плазмиду, которая содержит трансген dgt-28, инокулируют в 4 мл среды YEP, содержащей спектиномицин (50 мкг/мл) и стрептомицин (125 мкг/мл), и инкубируют в течение ночи при 28°C на устройстве для встряхивания при 190 об./мин. Затем культуру семян объемом 4 мл используют для инокуляции 25-мл культуры с той же средой в 125-мл колбе с перегородками Erlenmeyer. Эту культуру инкубируют при 28°C при встряхивании при 190 об./мин. до тех пор, пока она не достигнет OD600 ~1,2. Затем десять мл суспензии Agrobacterium помещают в стерильные чашки PetriTM 60×20 мм.
Свежеразрезанные фрагменты листьев (0,5 см2) из растений, выращенных в асептических условиях на среде MS (Phytotechnology Labs, Shawnee Mission, KS,) с 30 г/л сахарозы в PhytaTraysTM (Sigma, St. Louis, MO), погружают в 10 мл ночной культуры Agrobacterium на несколько минут, промакивают насухо на стерильной фильтровальной бумаге, а затем помещают на ту же среду с добавлением 1 мг/л индолуксусной кислоты и 1 мг/л 6-бензиламинопурина. Через трое суток фрагменты листьев сокультивированные с Agrobacterium, содержащими трансген dgt-28, переносят в то же среду с 5 мг/л BastaTM и 250 мг/л цифотаксима.
Через 3 недели индивидуальные проростки T0 переносят в среду MS с 10 мг/л BastaTM и 250 мг/л цефотаксима на дополнительные 3 недели перед пересадкой в почву и переносом в теплицу. Выбранным растениям T0 (идентифицированные с использованием протоколов молекулярного анализа, описанного выше) позволяют самоопылиться и собирают семена из капсул, когда они полостью высыхают. Проростки T1 подвергают скринингу в отношении зиготности и экспрессии репортерного гена (как описано ниже) и идентифицируют отдельные растения, содержащие трансген dgt-28.
Растения переносят в теплицу путем смывания агара с корней, пересадки в почву в 13,75-см квадратных горшках, помещения горшков в мешок Ziploc® (SC Johnson & Son, Inc.), добавления на дно мешка водопроводной воды, и помещения их под непрямой свет в теплице при 30°C на одну неделю. Через 3-7 суток мешки открывали, растения опыляли и позволяли им расти в открытом мешке до тех пор, пока растения не акклиматизируются в теплице, после чего мешок удаляли. Растения выращивали в обычных условиях теплой теплицы (27°C днем, 24°C ночью, день 16 часов, минимальный природный + дополнительный свет = 1200 мкЕ/м2с1).
Перед размножением проводили взятие образцов растений T0 для анализа ДНК в целях определения количества копий вставки dgt-28 с помощью ПЦР в реальном времени. Свежую ткань помещали в пробирки и лиофилизировали при 4ºC в течение 2 суток. После того, как ткань полностью высыхала, в пробирку помещали вольфрамовые гранулы (Valenite) и образцы подвергали сухому измельчению в течение 1 минуты с использованием шаровой мельницы Kelco. Затем выполняли стандартную методику выделения ДНК DNeasyTM (Qiagen, DNeasy 69109). Затем аликвоту выделенной ДНК окрашивали с помощью Pico Green (Molecular Probes P7589) и считывали на флуориметре (BioTekTM) с известными стандартами до концентрации концентрация в нг/мкл. Всего 100 нг тотальной ДНК использовали в качестве матрицы. Реакцию ПЦР проводили в термоциклере 9700 GeneampTM (Applied Biosystems) путем воздействия на образцы 94°C в течение 3 минут и 35 циклов из 94°C в течение 30 секунд, 64°C в течение 30 секунд, и 72°C в течение 1 минуты и 45 секунд, а затем 72°C в течение 10 минут. Продукты ПЦР анализировали с помощью электрофореза на 1% агарозном геле, окрашенном EtBr, и подтверждали с помощью саузерн-блоттинга.
От пяти до десяти положительных в ПЦР трансгенных объектов с 1-3 копиями гена dgt-28 из 3 компонентов, включающих различные последовательности транзитных пептидов хлоропластов (TraP4, TraP8 и TraP23) регенерировали и переносили в теплицу.
Для всех положительных в ПЦР растений проводили взятие образцов для количественного определения белка DGT-28 с помощью стандартного ELISA. Обнаружение белка DGT-28 проводили во всех положительных в ПЦР растениях, и была отмечена тенденция к увеличению концентрации белка при увеличении количества копий dgt-28.
Наследуемость aad-12 (v1) в табаке. Испытание по качеству потомков проводили для 100 растений в пяти линиях T1 с dgt-28 на конструкцию. Конструкции содержали одну из следующих последовательностей транзитного пептида хлоропластов: TraP4, TraP8 или TraP23. Семена стратифицировали, сеяли и пересаживали в основном так, как в описанной выше методике для Arabidopsis, за исключением того, что нулевые растения не удаляли путем первоначальной селекции перед пересадкой. Затем на все растения распыляли 280 г. э.к./га Ignite 280 SL для селекции по селективному маркеру pat, как описано ранее. Через 3 DAT подсчитывали резистентные и чувствительные растения.
Четыре из пяти исследованных линий для каждой конструкции сегрегировали в качестве единого локуса, доминантного менделевского признака (3R:1S), при определении в анализе с использованием критерия хи-квадрат. Dgt-28 представляет собой наследуемый ген устойчивости к глифосату в множестве видов.
Устойчивость к послевсходовым гербицидам в трансформированных посредством dgt-28 растениях табака T1. Устойчивым растениям T1 из каждого трансгенного объекта, использованного в испытании по качеству потомства, присваивали уникальные идентификационные обозначения и проводили взятие их образцов для анализа зиготности гена dgt-28. Данные о зиготности использовали для распределения 2 гемизиготных и 2 гомозиготных реплик на каждую вносимую дозу глифосата, с получением всего 4 реплик на обработку. Эти растения сравнивали с табаком Petite havana дикого типа. На все растения проводили распыление с помощью гусеничного опрыскивателя, установленного на 187 л/га. На растения проводили распыление в диапазоне 560-2240 г. э.к./га Durango DMATM. Для всех внесений составление проводили в воде с добавлением 2% масс./об. сульфата аммония (AMS). Растения оценивали через 7 и 14 суток после обработки. Растениям присваивали оценку повреждения в отношении общего видимого замедления роста, хлороза и некроза. Поколение T1 является сегрегирующим, так что ожидаются некоторый вариабельный ответ вследствие отличий в зиготности.
Результаты распыления демонстрируют через 7 DAT (сутки после обработки) минимальное вегетативное повреждение при повышенных дозах глифосата (данные не представлены). Через 14 DAT, данные видимого повреждения демонстрируют увеличенное повреждение в случае трансгенных объектов с одной копией конструкции, содержащей TraP4, по сравнению с трансгенными объектами с одной копией конструкций с TraP8 и TraP23. Таблица 28.
При дозе 2240 г. э.к./га глифосата было продемонстрировано среднее повреждение 37,5% для трансгенного объекта, включающего TraP4, где трансгенные объекты, содержащие TraP8 и TraP23, продемонстрировали среднее повреждение 9,3% и 9,5%, соответственно
Эти результаты продемонстрировали устойчивость dgt-28 к вплоть до 4480 г. э.к./га глифосата, а также отличия в устойчивости, обеспечиваемые последовательностями транзитных пептидов хлоропластов, связанными с геном dgt-28.
Защита посредством Dgt-28 от повышенных уровней глифосата в поколении T2. Испытание по качеству потомков для 25 растений проводили для от двух до трех линий T2 с dgt-28 на конструкцию. Гомозиготные линии были выбраны, исходя из анализов зиготности, проведенных для предшествующего поколения. Семена стратифицировали, высевали и пересаживали, как описано ранее. Затем на все растения распыляли 280 г. э.к./га Ignite 280 SL для селекции по селективному маркеру pat, как описано ранее. Через 3 DAT устойчивые и чувствительные растения подсчитывали. Все линии, исследованные в отношении каждой конструкции, не сегрегировали, тем самым, подтверждая гомогенные линии в поколении T2 и демонстрируя менделевское наследование dgt-28 в табаке на протяжении по меньшей мере двух поколений.
Дозы Durango DMATM в диапазоне 420-3360 г. э.к./га глифосата применяли к табаку на стадии 2-3 листьев, как описано ранее. Данные о видимом повреждении через 14 DAT подтвердили результаты устойчивости, которые были продемонстрированы в поколении T1. Результаты для листьев из линий с двумя копиями из конструкции, содержавшей TraP4, продемонстрировали сходную устойчивость с устойчивостью линий с одной копией TraP8 и TraP23 (данные не представлены).
Линии с одной копией из конструкций, содержавших TraP4 с dgt-28, продемонстрировали увеличенное повреждение по сравнению с линиями, полученными с помощью конструкций, содержавших TraP8 и TraP23 с dgt-28
Данные демонстрируют надежную устойчивость табака dgt-28 к вплоть до 3360 г. э.к./га глифосата на протяжении двух поколений по сравнению с нетрансформированным контролем.
Проводили взятие образцов выбранных растений из каждого трансгенного объекта перед применением глифосата для анализа белка DGT-28 с помощью стандартного ELISA для DGT-28. Данные продемонстрировали среднюю экспрессию белка DGT-28 в простых (1-2 копия) линиях среди конструкций в диапазоне 72,8-114,5 нг/см2. Данные демонстрируют, что dgt-28 экспрессирует белок в поколении T2 трансформированного табака и данные устойчивости подтверждают функциональный белок DGT-28.
Пакетирование с dgt-28 для увеличения спектра гербицидов. Гомозиготные растения dgt-28 (pDAB107543 и pDAB107545) и aad-12 v1 (pDAB3278) (см. PCT/US2006/042133 для последнего) в обоих случаях подвергали реципрокному скрещиванию и собирали семена F1. Семена F1, полученные при двух реципрокных скрещиваниях каждого гена, стратифицировали и обрабатывали. 6 реплик от каждого скрещивания обрабатывали 1120 г. э.к./га глифосата (селективный для гена dgt-28), 1120 г. э.к./га 2,4-D (селективный для гена aad-12) или баковой смесью двух гербицидов в описанных дозах. Растения оценивали через 14 DAT. Результаты распыления представлены в таблице 30.
Ответ F1 с aad-12 и dgt-28
Результаты подтверждают, что dgt-28 можно успешно пакетировать с aad-12 (v1), таким образом, увеличивая спектр гербицидов, которые можно применять для представляющей интерес сельскохозяйственной культуры (глифосат + феноксиуксусная кислота для dgt-28 и aad-12, соответственно). При производстве сельскохозяйственных культур, где существуют трудно контролируемые широколистные сорняки или устойчивые биотипы сорняков, пакетирование можно использовать в качестве средства для борьбы с сорняками и защиты представляющей интерес сельскохозяйственной культуры. Дополнительные агротехнические и потребительские признаки также можно пакетировать с геном dgt-28.
Устойчивость к глифосату в пшенице. Получение бинарных векторов, кодирующих DGT-28. Бинарные векторы, содержащие кассеты для экспрессии DGT-28 и селекции по PAT, конструировали и собирали с использованием навыков и способов, общеизвестных в данной области. Каждая экспрессирующая кассета DGT-28 содержала промотор, 5′-нетранслируемую область и интрон из гена убиквитина (Ubi) из Zea mays (Toki et al Plant Physiology 1992, 100 1503-07), за которой следовала кодирующая последовательность, состоящая из последовательности из одного из четырех транзитных пептидов (TraP4, TraP8, TraP23 или TraP5), слитых с 5′-концом синтетической версии гена 5-енолпирувилшикимат-3-фосфатсинтазы (DGT-28), кодон-оптимизированной для экспрессии в растениях. Экспрессирующая кассета DGT-28 завершалась 3′-нетранслируемой областью (UTR), содержащей последовательность терминации транскрипции и участок полиаденилирования гена липазы (Vp1) из Z. mays (Paek et al., Mol Cells 1998 30;8(3) 336-42). Кассета для селекции PAT содержала промотор, 5′-нетранслируемую область и интрон из гена актина (Act1) из Oryza sativa (McElroy et al., The Plant Cell 1990 2(2) 163-171), за которой следовала синтетическая версия гена фосфинотрицинцетилтрансферазы (PAT), выделенного из Streptomyces viridochromogenes, которая была кодон-оптимизированной для экспрессии в растениях. Ген PAT кодирует белок, который сообщает устойчивость к ингибиторам глутаминсинтетазы, включая фосфинотрицин, глюфосинат и биалафос (Wohlleben et al Gene 1988, 70(1), 25-37). Кассета для селекции завершалась 3′-UTR, содержащей терминатор транскрипции и участки полиаденилирования из гена 35s вируса мозаики цветной капусты (CaMV) (Chenault et al, Plant Physiology 1993 101 (4), 1395-1396).
Кассету для селекции синтезировали в коммерческой компании, осуществляющей синтез генов (GeneArt, Life Technologies), и ее клонировали в допустимый для Gateway бинарный вектор. Экспрессирующие кассеты с DGT-28 субклонировали в pDONR221. Полученный клон ENTRY использовали в реакции LR Clonase II (Invitrogen, Life Technologies) с допустимым для Gateway бинарным вектором, кодирующим экспрессирующую кассету для фосфинотрицинацетилтрансферазы (PAT). Колонии всех собранных плазмид подвергали первоначальному скринингу путем рестрикционного расщепления очищенной ДНК с использованием эндонуклеаз рестрикции, полученных от New England BioLabs (NEB; Ipswich, MA) и Promega (Promega Corporation, WI). Получение плазмидной ДНК проводили с использованием QIAprep Spin Miniprep Kit (Qiagen, Hilden) или Pure Yield Plasmid Maxiprep System (Promega Corporation, WI), в соответствии с инструкциями поставщиков. Плазмидную ДНК выбранных клонов секвенировали с использованием протокола циклического секвенирования ABI Sanger Sequencing и Big Dye Terminator v3.1 (Applied Biosystems, Life Technologies). Данные о последовательности объединяли и анализировали с использованием программного обеспечения SequencherTM (Gene Codes Corporation, Ann Arbor, MI).
Каждый из полученных четырех бинарных экспрессирующих клонов: pDAS000122 (TraP4-DGT28), pDAS000123 (TraP8-DGT28), pDAS000124 (TraP23-DGT28) и pDAS000125 (TraP5-DGT28) трансформировали в штамм EHA105 Agrobacterium tumefaciens.
Получение трансгенных объектов пшеницы с эспрессирующей dgt-28 конструкцией. Трансгенные растения пшеницы, экспрессирующие от одной до четырех экспрессирующих DGT-28 конструкций, получали путем опосредуемой Agrobacterium трансформации с использованием донорной линии пшеницы Bobwhite MPB26RH в соответствии с протоколом, сходным с Wu et al. Transgenic Research 2008, 17:425-436. Предполагаемые трансгенные объекты T0 подвергали селекции по устойчивости к фосфинотрицину (PPT) - фенотипу, сообщаемому селективным маркером PAT, и переносили в почву. Растения T0 выращивали в условиях изоляции в теплице и получали семена T1. В целом, было получено приблизительно 45 независимых трансгенных объектов T0 для каждой экспрессирующей конструкции DGT-28.
Устойчивость к глифосату трансгенных объектов пшеницы T0 с dgt-28. Трансгенным объектам T0 позволяли акклиматизироваться в теплице, и их выращивали до тех пор, пока не появятся 2-4 новых нормального вида листа из завитка (т.е. растения переносили из условий культуры ткани в условиях выращивания в теплице). Растения выращивали при 25°C при дополнительном освещении в течение 12 часов в теплице до созревания. Первоначальный скрининг устойчивости к глифосату и анализы Taqman проводили на растениях T1, выращенных в тех же условиях, которые были описаны ранее. Данные позволяли дальнейшую охарактеризацию наследуемых трансгенных объектов T1. Шесть трансгенных объектов T1 с низким числом копий (1-2 копии) и два трансгенных объекта T1 с множеством числом копий повторно сажали в условиях теплицы и выращивали до стадии 3 листьев. На растения T1 распыляли коммерческий состав глифосата (Durango DMATM) в диапазоне 420-3360 г. э.к./га, который способен значительно повреждать нетрансформированные линии пшеницы. При внесении включали добавление 2% масс./об. сульфата аммония. Летальную дозу определяют как доза, которая вызывает >75% повреждение нетрансформированного контроля Bob White MPB26RH. Вносили гербицид.
В этом примере внесение глифосата использовали как для определения сегрегации гена dgt-28 в поколении T1, так и для демонстрации устойчивости к увеличенным уровням глифосата. Ответ растений представлен в значениях шкалы видимого повреждения через 21 сутки после обработки (DAT). Данные представляли в качестве гистограммы индивидуальных растений, проявляющих менее чем 25% видимое повреждение (4), 25%-50% видимое повреждение (3), 50%-75% видимое повреждение (2) и более чем 75% повреждение (1). Арифметическое среднее значение и стандартное отклонение представлены для каждой конструкции, использованной для трансформации пшеницы. Диапазон оценки индивидуального ответа также указан в последнем столбце для каждой дозы и трансформации. Нетрансформированная пшеница дикого типа (c.v. Bob White MPB26RH) служила в качестве чувствительного к глифосату контроля. В поколении T1 гемизиготные и гомозиготные растения были доступны для исследования каждого трансгенного объекта и, таким образом, они были включены для каждой исследованной дозы глифосата. Гемизиготные растения содержат половину дозы гена гомозиготных растений, таким образом, можно ожидать вариабельности ответа на глифосат в поколении T1.
Результаты для растений пшеницы T1 с dgt-28 продемонстрировали, что устойчивость к глифосату достигалась при дозах вплоть до 3360 г. э.к./га с помощью транзитных пептидов хлоропластов TraP4, TraP5, TraP8 и TraP23. Таблица 31. Данные представлены для трансгенного объекта T1 с низким числом копий, однако они являются репрезентативными для популяций в случае каждой конструкции.
Ответ трансгенных объектов пшеницы T1 с низким числом копий dgt-28 на глифосат через 21 сутки после обработки
Через 21 DAT, устойчивые и чувствительные растения подсчитывают для определения процента линий, которые сегрегировали в качестве единого локуса, доминантного менделевского признака (3R:1S), при определении в анализе с использованием критерия хи-квадрат. Таблица 32. Эти данные демонстрируют, что dgt-28 наследуется в качестве гена надежной устойчивости к глифосату в видах однодольных растений.
Процент трансгенных обектов T1 с dgt-28 на конструкцию, которые продемонстрировали наследуемость по менделевскому типу на основе селекции с глифосатом в дозах в диапазоне 420-3360 г. э.к./га
Cry2Aa:
Оценивали эффективность химерных транзитных пептидов хлоропластов TraP12 в отношении экспрессии белка Cry2Aa в Arabidopsis thaliana. Трансгенные растения Arabidopsis, которые содержали химерные транзитные пептиды хлоропластов TraP12, слитые с белком Cry2Aa, анализировали в отношении устойчивости к насекомым соевой совке (SBL) и листовертке-почкоеду табака (TBW).
Последовательность химерного транзитного пептида хлоропластов Trap12 клонировали в конструкцию для экспрессии в растениях pDAB107540 и исследовали в Arabidopsis. Полинуклеотидные последовательности, которые кодируют последовательности химерных транзитных пептидов хлоропластов Trap12 v3 (SEQ ID NO: 13), синтезировали и встраивали в конструкцию плазмиды. Полученная конструкция содержала две единицы транскрипции в растениях (PTU). Первая PTU содержала промотор убиквитина 10 Arabidopsis thaliana (промотор AtUbi10; Callis, et al., (1990) J. Biol. Chem., 265: 12486-12493), слитый ген TraP-cry2Aa (TraP-Cry2Aa), и 3′-нетранслируемую область ORF 23 Agrobacterium tumefaciens (AtuORF23 3′UTR; патент США № 5428147). Вторая PTU содержала промотор вируса мозаики прожилок маниоки (промотор CsVMV; Verdaguer et al., (1996) Plant Molecular Biology, 31:1129-1139), ген dsm-2 (DSM2; патентная заявка США № 2011/0107455), и 3′ нетранслируемую область ORF 1 Agrobacterium tumefaciens (AtuORF1 3′UTR; Huang et al., (1990) J. Bacterioll., 172:1814-1822). Конструкция pDAB107540 содержит химерный транзитный пептид хлоропластов TraP12v3 (фиг.18). Контрольную плазмиду, 107617, которая не содержала последовательность транзитного пептида хлоропластов выше гена cry2Aa, конструировали и включали в исследования (фиг.19). Конструкции подтверждали путем расщепления ферментом рестрикции и секвенирования. Наконец, конструкции трансформировали в Agrobacterium tumefaciens и хранили в качестве исходных культур в глицерине.
Конструкцию pDAB107540 трансформировали в Arabidopsis thaliana посредством опосредуемой Agrobacterium tumefaciens трансформации. В кратком изложении, 12-15 растений Arabidopsis thaliana (экотип Columbia, Col-0) выращивали в горшках размером 4 дюйма (10,2 см) в теплице при интенсивности света 250 мкмоль/м2, 25°C, 18/6 часов свет/темнота. Первичные стебли цветков отрезали за одну неделю до трансформации. Инокуляты Agrobacterium приготавливали путем инкубации 10 мкл исходных культур рекомбинантных Agrobacterium в глицерине в 100 мл бульона LB (100 мг/л спектиномицина, 50 мг/л канамицина) при 28°C при встряхивании при 225 об./мин. в течение 72 часов. Количество культур Agrobacterium измеряли с помощью спектрометра и, когда клетки достигали OD 600 0,8, клетки собирали центрифугированием. Далее, клетки ресуспендировали в 3-4 объемах среды для инфильтрации из 5% сахарозы, и 0,04% Silwet-L77, и 10 мкг/л бензаминопурина (BA). Надземные части растения погружали в раствор Agrobacterium на 5-10 минут при осторожном встряхивании. Затем растения переносили в теплицу для нормального роста с регулярным поливом и опылением до формирования семян.
Приблизительно 200 мг совокупности семян T1 высевали равномерно в лотки для селекции (лотки для прорастания размером 10,5 дюймов (26,1 см) × 21 дюймов (53 см) × 1 дюйм (2,5 см) T.O. Plastics Inc., Clearwater, MN). На ростки распыляли 0,20% раствор (20 мкл/10 мл dH2O) гербицида глюфосината (Liberty) в объеме распыления 10 мл/лоток (703 л/га) через 5 суток после посева и вновь через 10 суток после посева с использованием наконечника для пневматического распыления DeVilbiss. От 4 до 7 суток после второго внесения глюфосината идентифицировали устойчивые к гербициду растения и их пересаживали для получения семян T2. Полученные семена T2 использовали в исследованиях, описанных ниже.
Небольшую аликвоту семян T2 (приблизительно 100-200 семян) для каждого трансгенного события суспендировали в 40 мл 0,1% раствора агарозы и распределяли на слои на холоде при 4°C в течение 24 ч. Затем распределенные на слои семена высевали с помощью 10-мл пипетки на поверхность четырех плоских лотков в плоском лотке для размножения. Плоские лотки заполняли почвенной средой Sunshine #5 (Sun Gro; Bellevue, WA) и слегка покрывали вермикулитом. Лотки насыщали удобрением Хогланда перед посевом и, при необходимости, после посева. После посева использовали купольные камеры для увлажнения, чтобы накрыть лотки, а затем их помещали в камеру для роста Conviron™, установленную на 24°C со световым периодом 16 ч. Свет от лампы накаливания и флуоресцентный свет обеспечивали уровень освещенности 200 PAR. Через 5 суток семена проращивали и купольные камеры удаляли. Первую селекцию трансформантов с помощью гербицида проводили на 6 сутки, а вторую проводили на 10 сутки. Гербицид Liberty (а.и. глюфосинат-аммоний) вносили с использованием ручного опрыскивателя с распылителем DeVilbiss в дозе 200 г. э.к./га для удаления нулевых растений. Приблизительно 25% были нулевыми растениями, как и ожидалось. Ряд контролей дикого типа также включали в селекцию и они имели 100% смертность после двух внесений гербицида. Через 14 суток растения были готовы для пересадки. Двенадцать растений отбирали для каждого трансгенного объекта для биоанализа и пересаживали в горшки диаметром 3 дюйма (7,6 см), заполненные почвой Sunshine #5, которую слегка покрывали мелкоизмельченным вермикулитом. Плоские лотки предварительно пропитывали удобрением Хогланда перед пересадкой и, при необходимости, после пересадки. Пересаженные растения размножали в не кондиционируемой воздухом теплице при 25°C с дополнительным светом в течение 14 часов. Развитие стручка ингибировали путем обрезания ножницами и, таким образом, получали больше ткани растения для исследования. Растения были готовыми для взятия образцов ДНК через 16-18 суток и готовыми для биоанализа приблизительно через 23 суток. Предполагаемые трансгенные растения подвергали скринингу с использованием анализов молекулярного подтверждения и идентифицированные трансгенные объекты использовали далее для получения результатов анализа белка и биоанализа.
Трансформированные растения, главным образом, продемонстрировали здоровый фенотип, хотя некоторые растения имели меньший размер при визуальном сравнении с диким типом. Анализ количества копий гена для каждой конструкции Arabidopsis продемонстрировал сравнимые результаты для вставки всех конструкций, причем приблизительно 50% растений имели ≥3 копии представляющего интерес гена cry2Aa и приблизительно 50% имели 1-2 копии гена.
Уровни экспрессии белка Cry2Aa трансгенных объектов T1 Arabidopsis широко варьировали. Выявление белка проводили с использованием анализа ELISA для количественного определения экспрессии белка Cry2Aa. Главным образом, уровни экспрессии белка коррелировали с высоким количеством копий вставки T-цепи для каждого трансгенного объекта. Трансгенные объекты с высоким количеством копий T-цепи (например, трансгенные объекты с >3 вставок), как правило, имели более высокие средние уровни экспрессии белка, чем трансгенные объекты с низким количеством копий T-цепи, для обоих наборов трансформирующих объектов Arabidopsis (например, трансгенные объекты pDAB107617, экспрессирующие Cry2Aa без TraP, и трансгенные объекты pDAB107540, экспрессирующие Cry2Aa с химерным транзитным пептидом хлоропластов TraP 12).
Растения Arabidopsis поколения T2 экспрессировали белок Cry2Aa на уровнях, которые были снижены по сравнению с уровнями экспрессии в растениях T1 Arabidopsis. Эти результаты показали, что экспрессия белка варьировала для каждого набора трансгенных объектов. Средние уровни экспрессии белка, полученные для гомозиготных трансгенных объектов, превышали средние уровни экспрессии белка, полученные для гемизиготных трансгенных объектов, для всех исследованных трансгенных объектов растений (например, трансгенные объекты без TraP [pDAB107617] и с TraP12 [pDAB107540]). Трансгенные объекты Arabidopsis, которые содержали более двух копий вставки T-цепи, имели более высокие уровни экспрессии, чем трансгенные объекты Arabidopsis, которые содержали только одну копию. Несмотря на снижение уровней экспрессии белка из поколения T1 в поколение T2, встраивание химерного транзитного пептида хлоропластов TraP12 в конструкции приводило к трансгенным объектам Arabidopsis, которые экспрессировали белок Cry2Aa.
Оба набора трансгенных объектов T1 Arabidopsis исследовали в экспериментах с биоанализом с помощью насекомых. Как правило, трансгенные объекты с высоким количеством копий, которые экспрессировали более высокие количества белка Cry2Aa, приводили к более низким уровням повреждения листьев по сравнению с трансгенными объектами с низким количеством копий. Существовала корреляция между экспрессией белка и защитой листьев как от SBL, так и от TBW, для трансгенных объектов Arabidopsis, экспрессирующих Cry2Aa без TraP (r2=0,49 (SBL), 0,23(TBW)), и для трансгенных объектов Arabidopsis, экспрессирующих Cry2Aa с TraP 12 (r2=0,57 (SBL), 0,30 (TBW)). В результате, увеличение экспрессии белка приводило к значительной защите от повреждения листьев (Pr<0,05).
Растения Arabidopsis были защищены от SBL в случае трансгенных объектов Arabidopsis как с TraP12, так и без TraP. Экспрессия Cry2Aa с TraP12 и без него приводила к менее чем 30% повреждению листьев с минимальной экспрессией белка приблизительно 0,75 нг/см2 для трансгенных объектов TraP12: Cry2Aa и приблизительно 1,5 нг/см2 для трансгенных объектов Cry2Aa без TraP. Оценка экспрессии в трансгенных объектах Arabidopsis Cry2Aa с TraP12 и без него приводила к менее чем 20% повреждению листьев, причем минимальная экспрессия белка составляла приблизительно 1,1 нг/см2 для трансгенных объектов TraP12 Arabidopsis и приблизительно 2,0-2,5 нг/см2 для трансгенных объектов Arabidopsis без TraP.
Растения Arabidopsis были защищены от TBW с помощью трансгенных объектов Arabidopsis как с TraP12, так и без TraP. TBW была более чувствительной к белку Cry2Aa, чем к SBL, когда их кормили растительным материалом, полученным из трансгенных объектов Arabidopsis. Концентрации белка только приблизительно 0,75 и 1,5 нг/см2 Cry2Aa приводили к менее чем 30% повреждению листьев, когда белок Cry2Aa экспрессировался в комбинации с TraP12 и без TraP, соответственно. При пороговой точке повреждения листьев 20%, защита листьев от трансгенных объектов TraP12 Arabidopsis происходила при уровнях приблизительно 1,1 нг/см2 белка Cry2Aa, в то время как для трансгенных объектов Arabidopsis, которые не обладали белком TraP, требовалось 2,0-2,5 нг/см2 экспрессированного белка Cry2Aa.
Химерные транзитные пептиды хлоропластов TraP12 не снижали эффективности экспрессии белка Cry2Aa в Arabidopsis thaliana. Трансгенные растения Arabidopsis, которые содержали химерные транзитные пептиды хлоропластов TraP12, слитые с белком Cry2Aa, экспрессировали высокие уровни белка Cry2Aa, которые обеспечили устойчивость насекомых к соевой совке (SBL) и листовертке-почкоеду табака (TBW).
Пример 4: Последовательности химерного транзитного пептида хлоропластов (TraP) для экспрессии агрономически важных трансгенов в кукурузе
Cry2Aa:
Белок Cry2Aa из Bacillus thuringiensis продемонстрировал активность против Helicoverpa zea (CEW) и Ostrinia nubilalis (ECB). Одну версию гена cry2Aa (SEQ ID NO: 14) с предпочтительными кодонами для кукурузы исследовали в кукурузе. В этом эксперименте Cry2Aa оценивали отдельно и вместе с химерным транзитным пептидом хлоропластов TraP12v4 в кукурузе для определения активности устойчивости к насекомым и для оценки эффекта, который последовательности химерного транзитного пептида хлоропластов TraP12v4 имеют на экспрессию белка Cry2Aa в кукурузе.
Последовательность химерного транзитного пептида хлоропластов Trap12v4 (SEQ ID NO: 15) и линкер в виде кодона GCA клонировали выше гена cry2Aa и включали в конструкцию pDAB107686 (фиг.12) для исследования устойчивости к насекомым в растении кукурузы. Полученная конструкция содержала две единицы транскрипции в растениях (PTU). Первая PTU содержала промотор убиквитина 1 Zea mays (промотор ZmUbi1; Christensen, A., Sharrock R., and Quail P., (1992) Maize polyubiquitin genes: structure, thermal perturbation of expression and transcript splicing, and promoter activity following transfer to protoplasts by electroporation, Plant Molecular Biology, 18:675-689), слитый ген TraP12-cry2Aa (TraP12 Cry2Aa), и 3′-нетранслируемую область липазы Zea mays (ZmLip 3′UTR; патент США № 7179902). Вторая PTU содержала промотор палочковидного вируса сахарного тростника (промотор SCBV; патент США № 6489462), ген устойчивости к гербициду aad-1, содержащий лидерную последовательность MSV и интрон 6 алкогольдегидрогеназы 1 (AAD-1; патент США № 7838733, и лидерную последовательность MSV; Genbank Acc. No. FJ882146.1, и интрон алкогольдегидрогеназы; Genbank Acc. No. EF539368.1), и 3′-нетранслируемую область липазы Zea mays (ZmLip 3′UTR). Конструировали контрольную плазмиду, pDAB107687, которая не содержала последовательность транзитного пептида хлоропластов выше гена cry2Aa, и ее включали в исследования (фиг.13). Плазмиды вводили в Agrobacterium tumefaciens для трансформации растений.
Початки Zea mays культивара B104 собирали через 10-12 суток после опыления. Собранные початки вылущивали и подвергали поверхностной стерилизации в 20% растворе коммерческого отбеливателя (Ultra Clorox® Germicidal Bleach, 6,15% гипохлорит натрия) с двумя каплями Tween 20, в течение 20 минут, а затем проводили три промывания в стерильной деионизированной воде внутри ламинарного шкафа. Незрелые зиготические зародыши (длиной 1,8-2,2 мм) отрезали в асептических условиях от каждого початка и распределяли в одну или несколько микроцентрифужных пробирок, содержащих 2,0 мл суспензии Agrobacterium, в которую было добавлено 2 мкл 10% поверхностно-активного вещества Break-Thru® S233.
После завершения выделения зародышей, пробирку с зародышами закрывали и помещали на качающую платформу на 5 минут. Затем содержимое пробирки выливали на чашку со средой для сокультивирования и в жидкую суспензию Agrobacterium удаляли с помощью стерильной одноразовой пипетки для переноса. Чашку для сокультивирования, содержавшую зародыши, помещали в заднее отделение ламинарного шкафа с приоткрытой крышкой на 30 минут; после чего зародышей ориентировали щитком зародыша вверх с использованием микроскопа. Затем чашку для сокультивирования с зародышами возвращали в заднее отделение ламинарного шкафа с приоткрытой крышкой на дополнительные 15 минут. Затем чашку закрывали, запечатывали с помощью клейкой ленты 3M Micropore, и помещали в инкубатор при 25°C с дневным светом в течение 24 часов с интенсивностью света приблизительно 60 мкмоль м-2 с-1.
После периода сокультивирования зародышей переносили в среду покоя. В каждую чашку переносили не более 36 зародышей. Чашки оборачивали клейкой лентой 3M Micropore и инкубировали при 27°C с дневным светом в течение 24 часов с интенсивностью света приблизительно 50 мкмоль м-2 с-1 в течение 7-10 суток. Затем зародыши каллюса переносили на среду для селекции I. В каждую чашку со средой для селекции I помещали не более 18 зародышей каллюса. Чашки оборачивали клейкой лентой 3M Micropore и инкубировали при 27°C с дневным светом в течение 24 часов с интенсивностью света приблизительно 50 мкмоль м-2 с-1 в течение 7 суток. Затем зародыши каллюса переносили в среду для селекции II. В каждую чашку со средой для селекции II переносили не более чем 12 зародышей каллюса. Чашки оборачивали клейкой лентой 3M Micropore и инкубировали при 27°C с дневным светом в течение 24 часов с интенсивностью света приблизительно 50 мкмоль м-2 с-1 в течение 14 суток.
На этой стадии устойчивые каллюсы переносили в среду предрегенерационную среду. В каждую чашку с предрегенерационной средой переносили не более девяти каллюсов. Чашки оборачивали клейкой лентой 3M Micropore и инкубировали при 27°C с дневным светом в течение 24 часов при интенсивности света приблизительно 50 мкмоль м-2 с-1 в течение 7 суток. Затем регенерирующие каллюсы переносили в среду для регенерации в Phytatrays™ и инкубировали при 28°C при 16 часов на свету/8 часов в темноте при интенсивности света приблизительно 150 мкмоль м-2 с-1 в течение 7-14 суток или до тех пор, пока не разовьются побеги. В каждый Phytatray™ помещали не более 5 каллюсов. Затем небольшие побеги с первичными корнями выделяли и переносили в среду для побегов/корней. Укоренившиеся ростки размером приблизительно 6 см или выше пересаживали в почву и извлекали из камеры для роста для закаливания.
Трансгенным растениям присваивали уникальные идентификационные обозначения и переносили на регулярной основе в теплицу. Растения пересаживали из Phytatrays™ в небольшие горшки, заполненные средой для роста (Premier Tech Horticulture, ProMix BX, 0581 P) и покрывали полукуполами, чтобы помочь растениям акклиматизироваться. Растения помещали в камеру для роста Conviron™ (28°C/24°C, световой период 16 часов, 50-70% RH, интенсивность света 200 мкмоль) до достижения стадии V3-V4. Эта стадия способствует акклиматизации растений к почве и более агрессивным температурам. Затем растения переносили в теплицу (тип освещения: фото или ассимиляция; верхний предел освещения: 1200 PAR; длительность дневного света 16 часов; 27°C днем/24°C ночью) и пересаживали из небольших горшков в 5,5-дюймовые (14 см) горшки. Приблизительно через 1-2 недели после пересадки в более крупные горшки проводили взятие образцов растений для биоанализа. Проводили биоанализ одного растения на трансгенный объект.
Отдельные трансгенные объекты идентифицировали для перехода к следующему поколению, исходя из количества копий генов, обнаружения белка с помощью вестерн-блоттинга и активности против насекомых в биоанализе. Трансгенные объекты, которые содержали ген устойчивости к спектиномицину, отмечали, но не обязательно исключали из перехода к следующему поколению. Трансгенные объекты, выбранные для перехода к следующему поколению, пересаживали в горшки объемом 5 галлонов (19 л). Периодически проводили наблюдения для отслеживания каких-либо аномальных фенотипов. Мешки для побегов помещали над побегами до появления метелок, чтобы предотвратить перекрестную контаминацию рассеиваемой пыльцой. Любые побеги, образовавшие метелки до покрытия, отмечали и побеги удаляли. Затем второй побег покрывали и использовали для опыления. Растения, которые продуцировали аномальные побеги или не продуцировали побегов, регистрировали в базе данных. Метелки подрезали за сутки до опыления для обеспечения равномерной щетки для принятия пыльцы, и растения подвергали самоопылению.
На растения для селекции T1 проводили распыление через 7 суток после посева. Их выращивали в 4-дюймовых (10,2 см) горшках с почвой для горшков Metro 360 с 15 горшков на плоский лоток. Стадия роста проростков представляла собой V1-V1,5. Горшки с плохим прорастанием или содержавшие очень мелкие растения (пучок листьев все еще закрыт) отмечали, чтобы не включать их в оценку при селекции. Затем целые плоские лотки растений помещали во вторичные лотки для внесения с помощью гусеничного опрыскивателя. Лотки помещали по два в гусеничный распылитель Mandel, откалиброванный для доставки 187 л/га в заданную область с использованием плоской насадки 8002E (Tee Jet). Для внесения составляли раствор 35 г. э.к./га Assure II (квизалофоп) + 1% COC (концентрат масла культуры). Для вычисления требуемого общего количества раствора для распыления использовали объем 15 мл/распыление. Вычисления: (35 г. э.к./га) × (1 га/187 л) × (1 л/97,7 г. э.к. Assure II) = 0,192% раствор или 28,74 мкл/15 мл H2O + 1% об./об.). После внесения растениям позволяли высохнуть в течение одного часа в лаборатории, в которой проводили распыление, а затем возвращали в теплицу. Приблизительно через 1-2 недели после пересадки в более крупные горшки проводили взятие образцов растений для анализа. Проводили биоанализ одного растения на трансгенный объект.
Все трансгенные объекты T0, которые прошли скрининг в молекулярном анализе, анализировали в отношении уровней экспрессии белка Cry2Aa. Трансгенные объекты из контрольной конструкции, pDAB107687, которые содержали Cry2Aa без TraP, имели значительно более высокий средний уровень экспрессии Cry2Aa (15,0 нг/см2) по сравнению с трансгенными объектами из pDAB107686 (1,4 нг/см2), которые содержали TraP12. Несмотря на сниженные уровни экспрессии в случае трансгенных объектов pDAB107686, эти трансгенные объекты, тем не менее, экспрессировали белок Cry2Aa.
Трансгенные объекты T1 также анализировали в отношении уровней экспрессии белка Cry2Aa. Трансгенные объекты из контрольной конструкции, pDAB107687, которая содержала Cry2Aa без TraP, имели значительно более высокий средний уровень экспрессии Cry2Aa (55 и 60 нг/см2) по сравнению с трансгенными объектами из pDAB107686 (приблизительно 2-3,7 нг/см2), которые содержали TraP12. Несмотря на сниженные уровни экспрессии трансгенных объектов pDAB107686, эти трансгенные объекты, тем не менее, экспрессировали белок Cry2Aa.
Трансгенные растения, содержавшие единичные копии T-цепи, содержавшей ген cry2Aa, исследовали в отношении инсектицидной активности в биоанализах, проведенных на новорожденных личинках чешуекрылых на листьях трансгенных растений. Анализированные виды чешуекрылых представляли собой мотылька кукурузного, Ostrinia nubilalis (Hübner) (ECB), и гусеницу совки хлопковой американской, Helicoverpa zea (CEW).
Лотки с 32 ячейками (C-D International, Pitman, NJ) частично заполняли 2% раствором агара, и агару позволяли застывать. С каждого растения срезали приблизительно каждый второй лист и помещали по одному в ячейки лотков с 32 ячейками. Один фрагмент листа помещали в каждую ячейку, и два фрагмента листа исследовали на растение и на насекомое. Проводили массовое заражение насекомыми с помощью кисти, помещая в каждую ячейку по десять новорожденных личинок. Лотки закрывали перфорированными клейкими крышками, которые обеспечивали вентиляцию во время испытания. Лотки помещали в условия 28°C, 40% RH, 16 часов на свету: 8 часов в темноте на трое суток. После исследования для каждого фрагмента листа получали простой показатель процентного повреждения. Показатели повреждения для каждого испытания усредняли и использовали вместе с анализом экспрессии белка для проведения анализов корреляции.
Результаты биоанализа T0 и T1 показали, что последовательность химерного транзитного пептида хлоропластов TraP12 была настолько же функциональной, как и трансгенные объекты pDAB107686, обеспечившие защиту против насекомых, исследованных в биоанализе. В случае трансгенных объектов T1 растения, экспрессирующие белок Cry2Aa без TraP (pDAB107687), имели среднее повреждение листьев, которое было значительно более высоким, чем у растений, экспрессирующих белок Cry2Aa с TraP12 (pDAB107686), среди всех исследованных видов насекомых. Хотя трансгенные объекты pDAB107686 с TraP12 имели большее повреждение листьев по сравнению с трансгенными объектами без TraP, трансгенные объекты pDAB107686 обеспечили защиту от насекомых, которых исследовали в биоанализе.
VIP3Ab1:
Белок Vip3Ab1 из Bacillus thuringiensis продемонстрировал активность против Helicoverpa zea (CEW) и совки травяной (FAW) и устойчивой совки травяной (rFAW). Гены Vip3Ab1 v6 (SEQ ID NO: 16) и Vip3Ab1 v7 (SEQ ID NO: 17) экспрессировали и исследовали в отношении устойчивости к насекомым в кукурузе. В этом эксперименте Vip3Ab1v6 и Vip3Ab1 v7 оценивали отдельно или совместно с химерным транзитным пептидом хлоропластов TraP12 в кукурузе для определения активности устойчивости к насекомым и для оценки эффекта, который последовательность химерного транзитного пептида хлоропластов TraP12 v2 имеет на экспрессию белка Vip3Ab1v6 и Vip3Ab1 v7 в кукурузе.
Конструкция pDAB112711 (фиг.14) содержит полинуклеотидную последовательность, кодирующую химерный транзитный пептид хлоропластов Trap12 v2 (SEQ ID NO: 11), и линкер в виде кодона GCA, клонированный выше гена Vip3Ab1v6, для исследования устойчивости к насекомым в растении кукурузы. Полученная конструкция содержала две единицы транскрипции в растениях (PTU). Первая PTU содержала промотор убиквитина 1 Zea mays (промотор ZmUbi1; Christensen, A., Sharrock R., and Quail P., (1992) Maize polyubiquitin genes: structure, thermal perturbation of expression and transcript splicing, and promoter activity following transfer to protoplasts by electroporation, Plant Molecular Biology, 18:675-689), слитый ген TraP12-Vip3Ab1v6 (TraP12-Vip3Ab1v6) и 3′-нетранслируемую область пероксидазы 5 Zea mays (ZmPer 5 3′UTR). Конструкцию подтверждали путем расщепления ферментом рестрикции и секвенирования. Вторая PTU состояла из промотора палочковидного вируса сахарного тростника (промотор SCBV; патент США № 6489462), ген устойчивости к гербициду aad-1, содержащий лидерную последовательность MSV и интрон 6 алкогольдегидрогеназы 1 (AAD-1; патент США № 7838733, и лидерная последовательность MSV; Genbank Acc. No. FJ882146.1, и интрон алкогольдегидрогеназы; Genbank Acc. No. EF539368.1), и 3′-нетранслируемую область липазы Zea mays (ZmLip 3′UTR). Контрольную плазмиду, pDAB111479, которая не содержала последовательность транзитного пептида хлоропластов выше гена Vip3Ab1v6, конструировали и включали в исследования (фиг.15). Плазмиды вводили в Agrobacterium tumefaciens для трансформации растений.
Конструкцию pDAB112712 (фиг.16), которая содержит последовательность химерного транзитного пептида хлоропластов Trap12 v2 (SEQ ID NO: 11) и линкер в виде кодона GCA, клонировали выше гена Vip3Ab1v7 и исследовали в отношении устойчивости к насекомым в растении кукурузы. Полученная конструкция содержала две единицы транскрипции в растениях (PTU). Первая PTU содержала промотор убиквитина 1 Zea mays (промотор ZmUbi1; Christensen, A., Sharrock R., and Quail P., (1992) Maize polyubiquitin genes: structure, thermal perturbation of expression and transcript splicing, and promoter activity following transfer to protoplasts by electroporation, Plant Molecular Biology, 18:675-689), слитый ген TraP12-Vip3Ab1v7 (TraP12-Vip3Ab1v7) и 3′-нетранслируемую область пероксидазы 5 Zea mays (ZmPer 5 3′UTR). Конструкцию подтверждали путем расщепления ферментом рестрикции и секвенирования. Вторая PTU содержала промотор палочковидного вируса сахарного тростника (промотор SCBV; патент США № 6489462), ген устойчивости к гербициду aad-1, содержащий лидерную последовательность MSV и интрон 6 алкогольдегидрогеназы 1 (AAD-1; патент США № 7838733, и лидерную последовательность MSV; Genbank Acc. No. FJ882146.1, и интрон алкогольдегидргеназы; Genbank Acc. No. EF539368.1), и 3′-нетранслируемую область Zea mays (ZmLip 3′UTR). Контрольную плазмиду, pDAB112710, которая не содержала последовательность транзитного пептида хлоропластов выше гена Vip3Ab1v7, конструировали и включали в исследования (фиг.17). Плазмиды вводили в Agrobacterium tumefaciens для трансформации растений.
Трансформацию кукурузы, экспрессию белка и биоанализы на насекомых проводили в соответствии с ранее описанными протоколами, и результаты представлены в таблице 33. Результаты биоанализов на насекомых показали, что последовательность химерного транзитного пептида хлоропластов TraP12 была функциональной, и что трансгенные объекты pDAB112711 и pDAB112712 обеспечили защиту против видов насекомых, исследованных в биоанализе. В исследованных трансгенных объектах трансгенные объекты растений, экспрессирующие белок Vip3Ab1 v6 без TraP, (pDAB111479), имели более высокий уровень повреждения листьев, чем трансгенные объекты растений, экспрессирующие белок Vip3Ab1 v6 с TraP12 (pDAB112711) для обоих видов насекомых: CEW и FAW. Однако растения, экспрессирующие белок Vip3Ab1 v7 без TraP (pDAB112710), имели среднее повреждение листьев, которое значительно не отличалось от растений, экспрессирующих белок Vip3Ab1 v7 с TraP12 (pDAB112712). Как белок Vip3Ab1 v7 без TraP (pDAB112710), так и белок Vip3Ab1 v7 с TraP12 (pDAB112712), продуцированные трансгенными объектами, обеспечили борьбу с насекомыми видов CEW и FAW. В заключение, вестерн-блоттинг и биоанализы показали, что все из исследованных трансгенных объектов экспрессировали белок Vip3 Ab1.
Результаты биохимического анализа и результаты биоанализа для последовательностей, кодирующих Vip3Ab1 v6 и Vip3Ab1 v7, которые были слиты с TraP12, по сравнению с последовательностями, кодирующими Vip3Ab1 v6 и Vip3Ab1 v7, которые не обладали последовательностью транзитного пептида хлоропластов
объекты
Пример 5: Расщепление в растениях последовательностей химерного транзитного пептида хлоропластов (TraP)
Участок расщепления химерного транзитного пептида хлоропластов TraP12 и TraP13 определяли с помощью спектрометрии MALDI и секвенирования со способом N-концевого отщепления Эдмана. Материал растений получали из трансгенных растений, которые содержали слитые гены TraP12-dgt14, TraP12-dgt28, TraP13-dgt14 и TraP13-dgt28, и анализировали для определения того, в каком положении происходило расщепление химерного транзитного пептида хлоропластов во время перемещения в хлоропласт.
Результаты MALDI:
Полуочищенные белки из образца растений разделяли способом SDS-PAGE. Полосы белка размером, эквивалентным молекулярной массе YFP, вырезали из геля, обесцвечивали и сушили. Далее высушенные полосы белка расщепляли в геле трипсином (Promega; Madison, WI) в 25 мМ бикарбонате аммония в течение ночи при 37ºC. Пептиды очищали с помощью C18 ZipTip™ (Millipore, Bedford, MA) и элюировали смесью 50% ацетонитрил/0,1% TFA. Образцы смешивали с матричной α-циано-4-гидроксикоричной кислотой в соотношении 1:1 и смесь наносили точечно на планшет для образца MALDI и сушили воздухом.
Спектр масс пептида получали с использованием спектрометра Voyager DE-PRO MALDI-TOF Mass Spectrometer™ (Applied Biosystems; Framingham, MA). Внешнюю калибровку проводили с использованием Calibration Mixture 2™ (Applied Biosystems). Внутреннюю калибровку проводили с использованием пиков аутолиза трипсина при m/z 8425081045,564 и 2211,108. Все спектры масс получали в положительной модели ионного отражателя. Анализ отпечатков масс пептидов (PMF) проводили с использованием бесплатного программного обеспечения PAWS™ (Protein Analysis WorkSheet) от Proteometrics LLC путем сопоставления PMF образца с теоретическим PMF белка-мишени, чтобы подтвердить, что образец представляет собой белок-мишень. Идентификацию белка проводили с помощью поиска в базе данных с использованием MASCOT (MatrixScience, London, Великобритания) против базы данных белков NR NCBI.
N-концевое секвенирование путем расщепления с помощью химической реакции Эдмана:
N-концевое секвенирование проводили на секвенаторе белков Procise (модедль 494) от Applied Biosystems (Foster City, CA). Образцы белка сначала разделяли с помощью SDS-PAGE, а затем подвергали блоттингу на мембрану PVDF. Полосы белка вырезали из мембраны и загружали в секвенатор Procise. Проводили восемь циклов химической реакции Эдмана для каждого образца, чтобы получить пять остатков AA на N-конце. С каждым образцом анализировали стандартную смесь 20 PTH-аминокислот (Applied Biosystems). Аминокислотные остатки после каждой деградации Эдмана определяли на основе их времени удержания на колонке C-18 против стандартов.
Результаты секвенирования MALDI показали, что белки DGT-28 и DGT14 экспрессировались и что последовательности химерных транзитных пептидов хлоропластов TraP процессировались. В таблице 34 приведены процессированные последовательности, которые были получены с использованием N-концевой деградации Эдмана и секвенирования MALDI.
Участки расщепления TraP12 и TraP13, слитые с кодирующими последовательностями dgt-14 или dgt-28.
Серая ячейка указывает на участок сплайсинга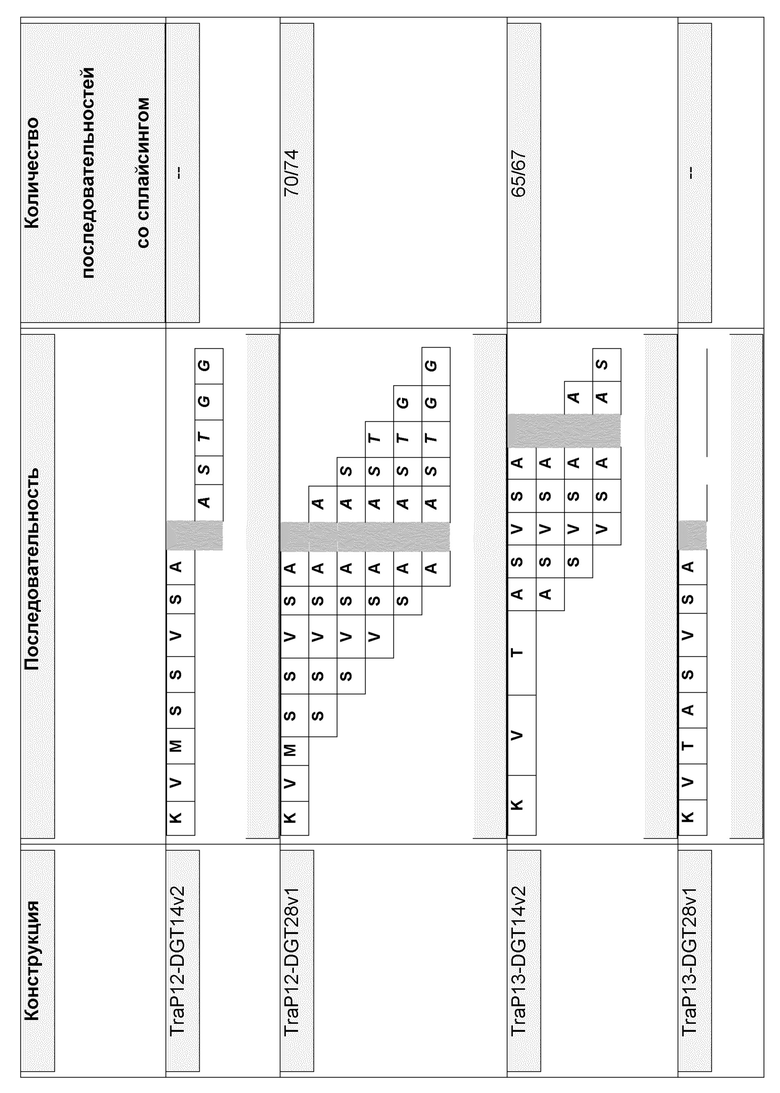
Пример 6: Пакетирование полинуклеотидных последовательностей, содержащих последовательности химерного транзитного пептида хлоропластов (TraP)
Химерный транзитный пептид TraP12 подвергали слиянию с 5′-концом последовательностей генов cry1Ac, cry1Ca и cry1F, которые пакетировали в плазмидных конструкциях с несколькими PTU для определения того, усиливал или снижал ли химерный транзитный пептид TraP12 экспрессию белков в Arabidopsis.
Конструкции, приведенные в таблице 35, собирали с использованием известных в данной области способов. Затем конструкции трансформировали в Arabidopsis thaliana с использованием опосредуемого Agrobacterium протокола трансформации, описанного ранее. Получали трансгенные растения Arabidopsis и экспрессию белка определяли с помощью вестерн-блоттинга и анализов ELISA.
Конструкции, описанные ниже, трансформировали в Arabidopsis для оценки эффектов химерного пептида хлоропластов TraP12 на экспрессию белка
Результаты количественного определения белка показали, что TraP12 имел различные эффекты на общие уровни экспрессии Cry1Ac, Cry1Ca и Cry1F. Добавление химерного транзитного пептида хлоропластов TraP12 приводило к сниженным уровням экспрессии Cry1F и увеличенным уровням экспрессии Cry1Ca и Cry1Ac. Независимо от вариабельности уровней экспрессии, все исследованные трансгенные объекты растений экспрессировали белок, и химерный транзитный пептид хлоропластов TraP12 не ингибировал экспрессию белка с трансгена. Наконец, химерный транзитный пептид хлоропластов TraP12 направлял экспрессируемые белки в хлоропласты. Перемещение экспрессированных белков в хлоропласт было показано с помощью вестерн-блотов, которые проявляли сходные молекулярные массы для экспрессируемых белков с химерным транзитным пептидом хлоропластов TraP12 или без него.
| название | год | авторы | номер документа |
|---|---|---|---|
| СИНТЕТИЧЕСКИЕ ТРАНЗИТНЫЕ ПЕПТИДЫ ХЛОРОПЛАСТОВ | 2013 |
|
RU2632648C2 |
| ТРАНЗИТНЫЙ ПЕПТИД ХЛОРОПЛАСТОВ | 2013 |
|
RU2636036C2 |
| СИНТЕТИЧЕСКИЕ ТРАНЗИТНЫЕ ПЕПТИДЫ ХЛОРОПЛАСТОВ | 2013 |
|
RU2720973C2 |
| СИНТЕТИЧЕСКИЕ ТРАНЗИТНЫЕ ПЕПТИДЫ ХЛОРОПЛАСТА ИЗ BRASSICA | 2013 |
|
RU2636035C2 |
| УСТОЙЧИВЫЕ К ГЛИФОСАТУ РАСТЕНИЯ И СПОСОБЫ, СВЯЗАННЫЕ С НИМИ | 2013 |
|
RU2627169C2 |
| НОВЫЙ КЛАСС ГЕНОВ УСТОЙЧИВОСТИ К ГЛИФОСАТУ | 2013 |
|
RU2721122C2 |
| УСТОЙЧИВЫЕ К ГЛИФОСАТУ РАСТЕНИЯ И СПОСОБЫ, СВЯЗАННЫЕ С НИМИ | 2013 |
|
RU2636037C2 |
| НОВЫЙ КЛАСС ГЕНОВ УСТОЙЧИВОСТИ К ГЛИФОСАТУ | 2013 |
|
RU2634411C2 |
| ИЗОЛИРОВАННАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ ДНК (ВАРИАНТЫ), РЕКОМБИНАНТНАЯ ДВУНИТЕВАЯ МОЛЕКУЛА ДНК И СПОСОБ ПОЛУЧЕНИЯ ГЕНЕТИЧЕСКИ ТРАНСФОРМИРОВАННЫХ РАСТЕНИЙ | 1991 |
|
RU2146290C1 |
| Белок устойчивости к гербицидам, кодирующий его ген и их применение | 2016 |
|
RU2692553C2 |


































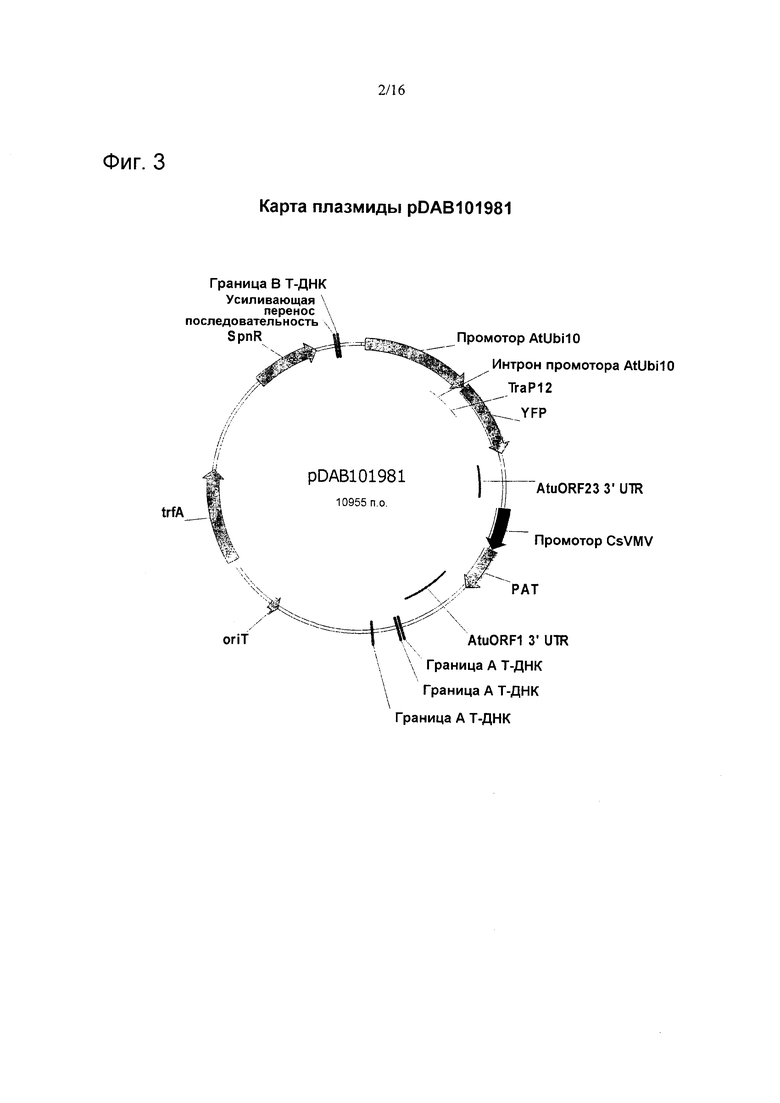
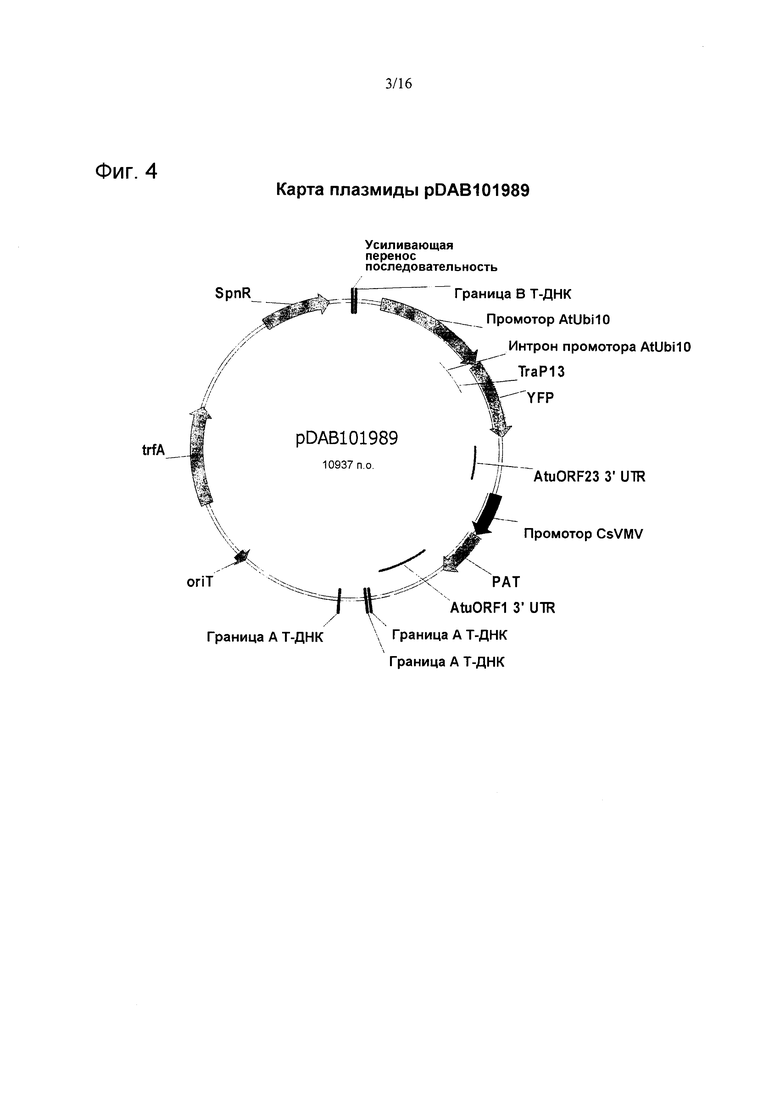



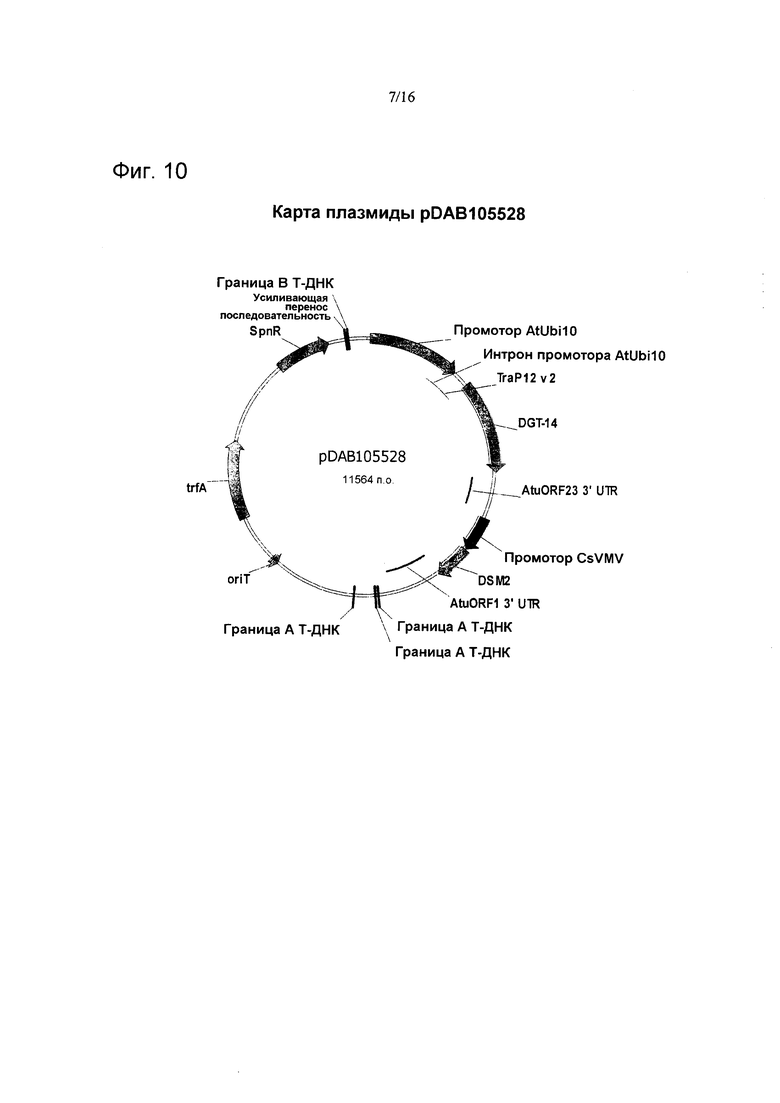
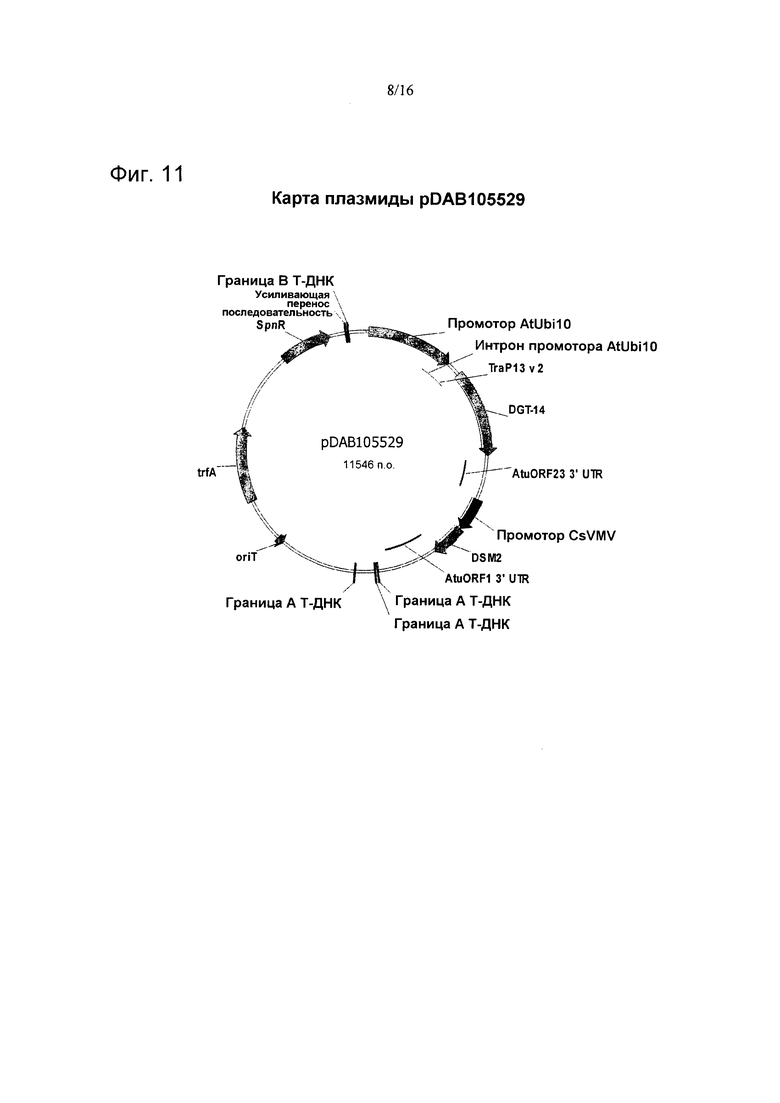
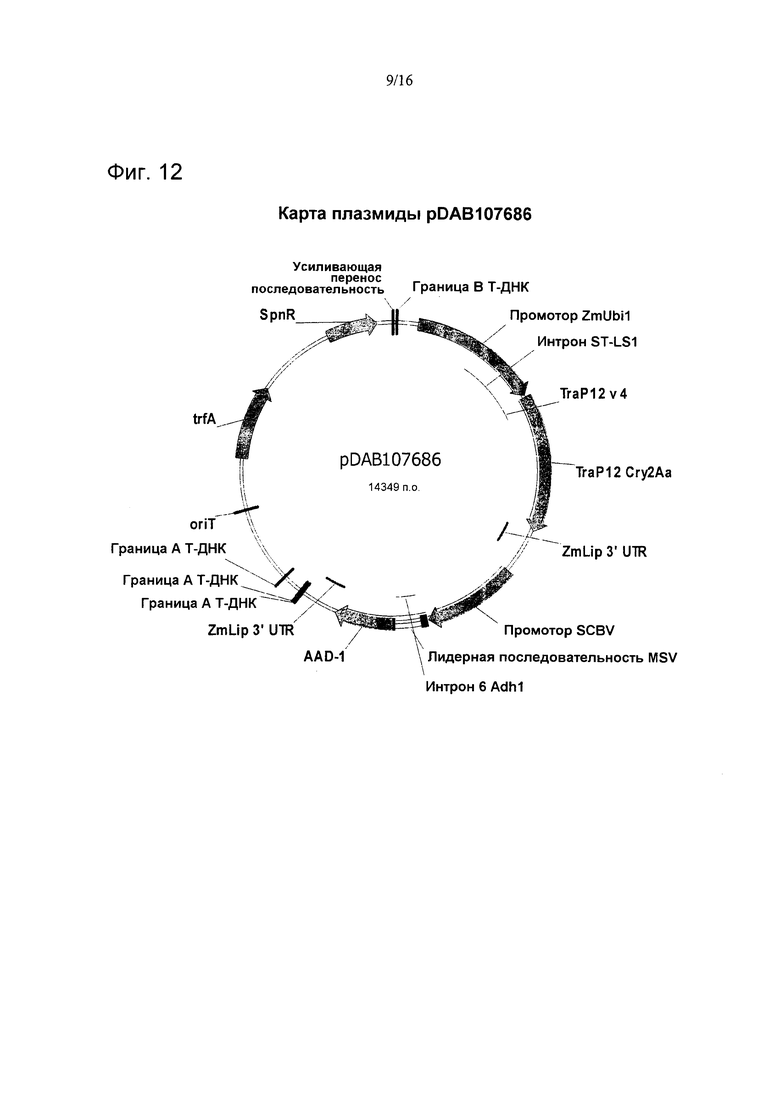
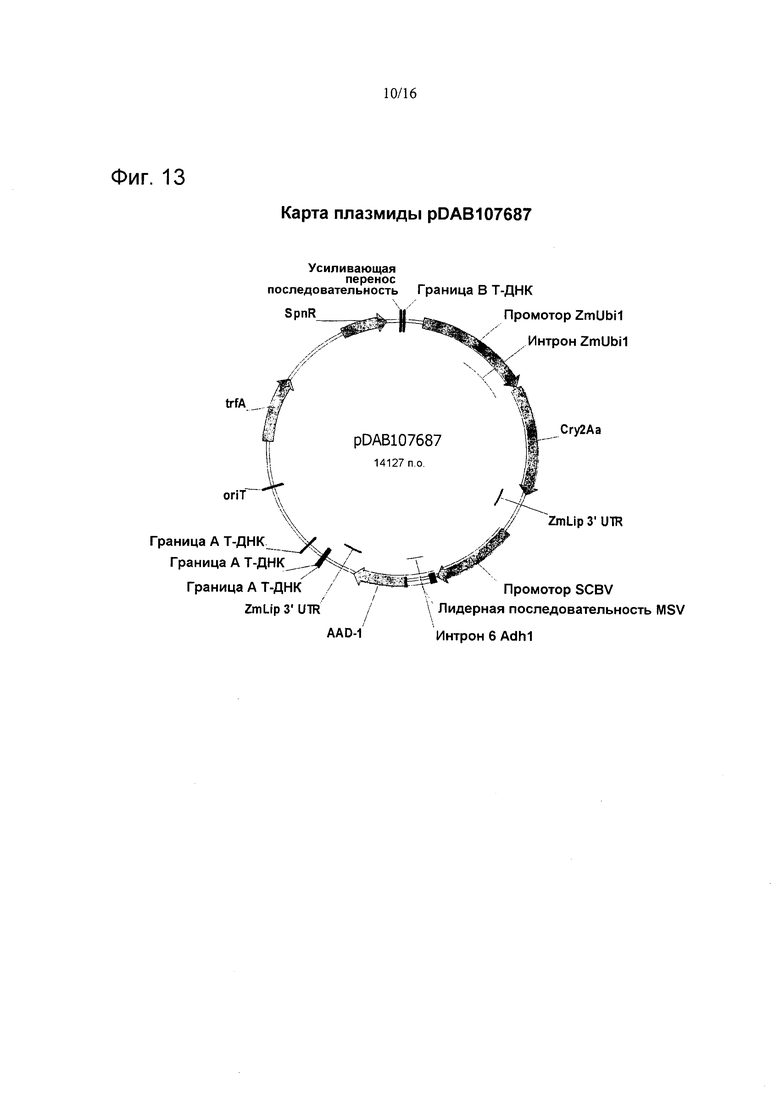
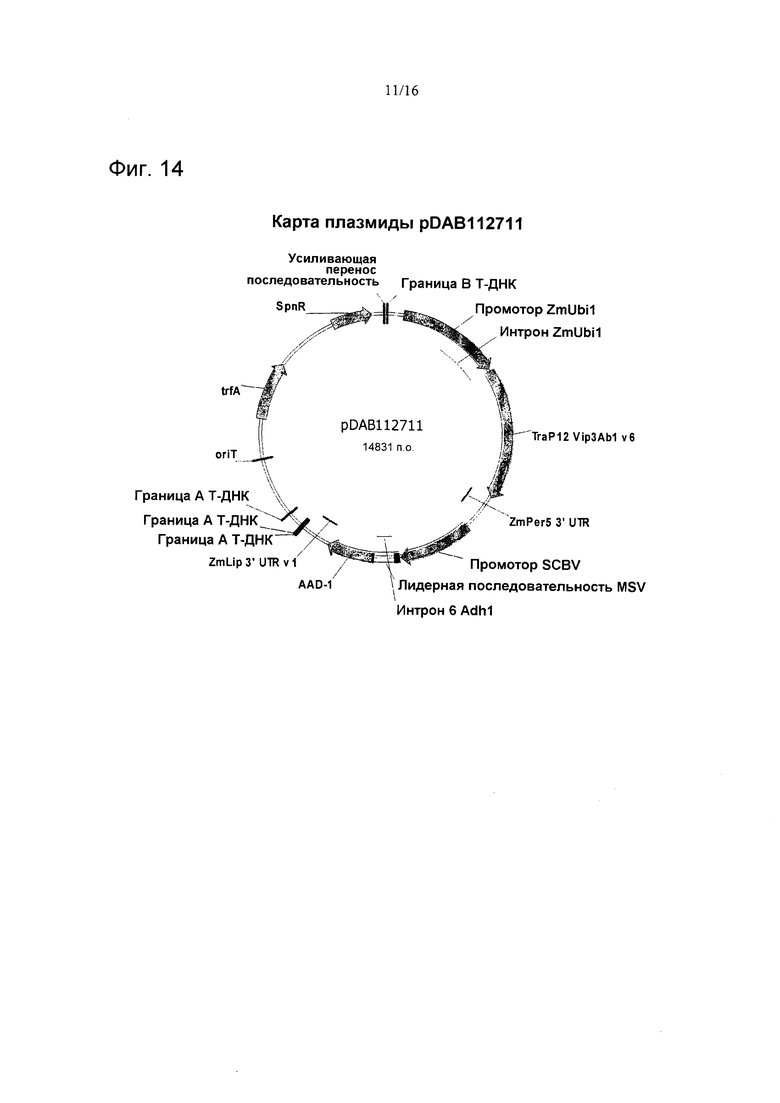


Изобретение относится к области биохимии, в частности к конструкции нуклеиновой кислоты и химерному белку для локализации полипептида в хлоропласт, а также к конструкции для экспрессии нацеливающего хлоропласты полипептида в клетке растения. Также раскрыты клетка трансгенного растения, трансгенное растение, часть трансгенного растения, семя трансгенного растения, а также культура клеток трансгенного растения, содержащие вышеуказанный химерный белок. Изобретение также относится к способу получения трансгенного растительного материала, который экспрессирует полипептид в хлоропластах, который предусматривает трансформацию растительного материала вышеуказанной конструкцией нуклеиновой кислоты для локализации полипептида в хлоропласт. Изобретение позволяет эффективно локализовать полипептид в хлоропласт. 9 н. и 17 з.п. ф-лы, 19 ил., 35 табл., 6 пр.
1. Конструкция нуклеиновой кислоты для локализации полипептида в хлоропласт, где конструкция отличается нуклеотидной последовательностью, которая кодирует синтетический транзитный пептид хлоропластов (СТР) с последовательностью SEQ ID NO: 6 или SEQ ID NO: 8, связанный непрерывно и в рамке считывания с нуклеотидной последовательностью, кодирующей полипептид.
2. Конструкция нуклеиновой кислоты по п. 1, где нуклеотидная последовательность, которая кодирует синтетический СТР, представляет собой SEQ ID NO: 5 или 7.
3. Конструкция для экспрессии нацеливающего хлоропласты полипептида в клетке растения, отличающаяся геном, состоящим из нуклеотидной последовательности SEQ ID NO: 5 или 7, связанным непрерывно и в рамке считывания с нуклеотидной последовательностью, кодирующей полипептид.
4. Химерный белок для локализации полипептида в хлоропласт клетки, где химерный белок состоит из транзитного пептида хлоропластов с последовательностью SEQ ID NO: 6 или SEQ ID NO: 8, связанного непрерывно с полипептидом.
5. Химерный белок для локализации полипептида по п. 4, где полипептид представляет собой флуоресцентный полипептид.
6. Химерный белок для локализации полипептида по п. 4, где полипептид выбран из группы, состоящей из зеаксантинэпоксидазы, холинмонооксигеназы, феррохелатазы, десатуразы омега-3 жирных кислот, глутаминсинтетазы, провитамина А и белков Bt-токсина.
7. Химерный белок для локализации полипептида по п. 4, где полипептид представляет собой маркер устойчивости к гербицидам в клетках растения.
8. Химерный белок для локализации полипептида по п. 7, где полипептид представляет собой ацетолактатсинтазу (ALS) или 3-енолпирувилшикимат-5-фосфатсинтетазу (EPSPS).
9. Конструкция нуклеиновой кислоты по п. 1, где конструкция представляет собой экспрессирующий вектор растений.
10. Клетка трансгенного растения, экспрессирующая полипептид в хлоропластах, содержащая химерный белок по п. 4, где хлоропласты клетки растения содержат полипептид.
11. Клетка трансгенного растения по п. 10, где полипептид представляет собой флуоресцентный полипептид.
12. Клетка трансгенного растения по п. 10, где полипептид представляет собой маркер устойчивости к гербицидам в клетках растения.
13. Клетка трансгенного растения по п. 10, где полипептид выбран из группы, состоящей из зеаксантинэпоксидазы, холинмонооксигеназы, феррохелатазы, десатуразы омега-3 жирных кислот, глутаминсинтетазы, провитамина А, белков Bt-токсина, ацетолактатсинтазы (ALS) и 3-енолпирувилшикимат-5-фосфатсинтетазы (EPSPS).
14. Трансгенное растение, которое экспрессирует полипептид в хлоропластах, где растение содержит клетку растения по п. 10.
15. Трансгенное растение по п. 14, где полипептид представляет собой флуоресцентный полипептид.
16. Трансгенное растение по п. 14, где полипептид представляет собой маркер устойчивости к гербицидам в клетке растения.
17. Трансгенное растение по п. 14, где полипептид выбран из группы, состоящей из зеаксантинэпоксидазы, холинмонооксигеназы, феррохелатазы, десатуразы омега-3 жирных кислот, глутаминсинтетазы, провитамина А, белков Bt-токсина, ацетолактатсинтазы (ALS) и 3-енолпирувилшикимат-5-фосфатсинтетазы (EPSPS).
18. Трансгенное растение по п. 14, где растение выбирают из группы, состоящей из Arabidopsis, люцерны, Brassica, боба, брокколи, капусты, моркови, цветной капусты, сельдерея, китайской капусты, хлопка, огурца, баклажана, салата-латука, дыни, гороха, перца, арахиса, картофеля, тыквы обыкновенной, хрена, рапса, шпината, сои, тыквы крупноплодной, сахарной свеклы, подсолнечника, табака, томата, арбуза, кукурузы, лука, риса, сорго, пшеницы, ржи, проса культурного, сахарного тростника, овса, тритикале, проса прутьевидного и травы рулонного газона.
19. Часть трасгенного растения, которая экспрессирует полипептид в хлоропластах, где часть растения содержит клетку растения по п. 10.
20. Семя трансгенного растения для выращивания растения, которое экспрессирует полипептид в хлоропластах, где семя растения содержит клетку растения по п. 10.
21. Культура клеток трансгенного растения по п. 10 для регенерации растения, которое экспрессирует полипептид в хлоропластах.
22. Способ получения трансгенного растительного материала, который экспрессирует полипептид в хлоропластах, причем способ включает трансформацию растительного материала конструкцией нуклеиновой кислоты по п. 1, таким образом получая трансгенный растительный материал, который экспрессирует химерный белок, состоящий из транзитного пептида хлоропластов с последовательностью SEQ ID NO: 6 или SEQ ID NO: 8, связанного непрерывно с полипептидом, где хлоропласты растительного материала содержат полипептид.
23. Способ по п. 22, где растительный материал выбран из группы, состоящей из клетки растения, ткани растения, культуры ткани растения, культуры каллюса, части растения и целого растения.
24. Способ по п. 22, где полипептид представляет собой флуоресцентный полипептид.
25. Способ по п. 22, где полипептид представляет собой маркер устойчивости к гербицидам в клетке растения.
26. Способ по п. 22, где полипептид выбран из группы, состоящей из зеаксантинэпоксидазы, холинмонооксигеназы, феррохелатазы, десатуразы омега-3 жирных кислот, глутаминсинтетазы, провитамина А, белков Bt-токсина, ацетолактатсинтазы (ALS) и 3-енолпирувилшикимат-5-фосфатсинтетазы (EPSPS).
| US6489542 B1, 03.12.2002 | |||
| US2006191038 A1, 24.08.2006 | |||
| US6870075 B1, 22.03.2005 | |||
| ИЗОЛИРОВАННАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ ДНК (ВАРИАНТЫ), РЕКОМБИНАНТНАЯ ДВУНИТЕВАЯ МОЛЕКУЛА ДНК И СПОСОБ ПОЛУЧЕНИЯ ГЕНЕТИЧЕСКИ ТРАНСФОРМИРОВАННЫХ РАСТЕНИЙ | 1991 |
|
RU2146290C1 |
Авторы
Даты
2017-07-28—Публикация
2013-02-01—Подача