Заявка на приоритет
Настоящая заявка претендует на приоритет предварительной патентной заявки США, серийный номер 61/593555, поданной 1 февраля 2012 года, а также предварительной патентной заявки США, серийный номер 61/625222, поданной 17 апреля 2012 года.
ЗАЯВЛЕНИЕ В СООТВЕТСТВИИ С 37 CFR § 1,821 (с) или (е) - перечень последовательностей представлен в виде текстового файла ASCII
В соответствии с 37 CFR § 1,821 (с) или (е), файл, содержащий список последовательностей в текстовой версии ASCII, представлен одновременно с настоящей заявкой, и его содержание включено в настоящее описание посредством ссылки.
Область техники
Настоящее изобретение относится к композициям и способам для генетически кодирования и экспрессии полипептидов, которые нацелены на пластиды из пластид-содержащих клеток. В некоторых вариантах осуществления изобретение относится к аминокислотным последовательностям, которые нацеливают полипептиды на хлоропласты (например, у высших растений) и/или к молекулам нуклеиновых кислот, кодирующим эти полипептиды. В некоторых вариантах осуществления изобретение относится к химерным полипептидам, содержащим аминокислотную последовательность, которая регулирует перенос химерных полипептидов в пластиды, и/или к молекулам нуклеиновых кислот, кодирующих эти полипептиды.
Уровень изобретения
Растительные клетки содержат различные субклеточные органеллы, в совокупности называемые "пластидами", которые отделены друг от друга посредством характерных мембранных систем и выполняют специализированные функции в клетке. Конкретные пластиды отвечают за фотосинтез, а также за синтез и хранение определенных химических соединений. Все пластиды происходят от пропластидов, которые присутствуют в меристемных зонах растения. Пропластиды могут развиваться, например, в хлоропласты, этиопласты, хромопласты, геронтопласты, лейкопласты, амилопласты, элайопласты и протеинопласты. Пластиды имеют самостоятельную генетическую систему и механизм синтеза белка, и существуют внутри клетки в полуавтономном режиме, но в основе их развития лежит тесное взаимодействие с ядерно-цитоплазматической системой и процессами биосинтеза.
В фотосинтезирующих клетках листьев высших растений самыми выраженными пластидами являются хлоропласты. Наиболее важной функцией хлоропластов является осуществление светоуправляемых реакций фотосинтеза. При этом хлоропласты также выполняют многие другие процессы биосинтеза, важные для растительной клетки. Например, все жирные кислоты в клетке вырабатываются с помощью ферментов, расположенных в строме хлоропласта, с использованием АТФ, NAOPH и углеводов, которые в ней легко доступны. Кроме того, уменьшение силы свето-активируемых электронов в хлоропласте приводит к восстановлению нитрита (NО2-) до аммиака (NH3), и этот аммиак обеспечивает растение азотом, необходимым для синтеза аминокислот и нуклеотидов.
Хлоропласт также вовлечен в явления, имеющие особое значение в агрохимической промышленности. Например, известно, что многие гербициды действуют путем блокирования функций, которые осуществляются в хлоропласте. В недавних исследованиях была установлена конкретная цель некоторых гербицидов. Например, гербициды - производные триазина ингибируют фотосинтез путем замещения молекулы пластохинона из ее сайта связывания в полипептиде массой 32 кДа из фотосистемы II. Этот полипептид массой 32 кДа кодируется в геном хлоропласта и синтезируется с помощью механизмов органелл. Были получены мутантные растения, обладающие устойчивостью к триазиновым гербицидам. Эти растения содержат мутантный полипептид массой 32 кДа, в котором пластохинон больше не может замещаться триазиновыми гербицидами. Сульфонилмочевины ингибируют ацетолактатсинтазу в хлоропластах. Ацетолактатсинтаза участвует в синтезе изолейцина и валина. Глифосат ингибирует функцию 5-енол-пирувил-3-фосфошикимат-синтазы (EPSPS), которая представляет собой фермент, участвующий в синтезе ароматических аминокислот. Все эти ферменты кодируются ядерным геномом, при этом они переносятся в хлоропласт, где фактически происходит синтез аминокислот.
Большинство белков хлоропласта кодируется в ядре растительной клетки, синтезируется в виде крупных белков-предшественников в цитозоле и после трансляции поступает в хлоропласт. Введение в строму через наружную и внутреннюю мембраны оболочек является основным способом поступления белков, предназначенных для стромы, тилакоидной мембраны и просвета тилакоида. Размещение поступающих белков-предшественников в тилакоидной мембране и тилакоидном просвете осуществляется четырьмя разными механизмами, включающими в себя два механизма, которые гомологичны сиситемам транспорта бактериальных белков. Таким образом, механизмы локализации белка в хлоропласте, в частности, происходят из прокариотического эндосимбионта. Cline and Henry (1996) Annu. Rev. Cell. Dev. Biol. 12: 1-26.
Белки-предшественники, предназначенные для хлоропластной экспрессии, содержат удлиняющие сегменты на N-конце, называемые транзитными пептидами хлоропластов (СТР). Транзитный пептид является инструментом для специфичного распознавания на поверхности хлоропластов и опосредования посттрансляционной транслокации белков-предшественников через оболочку хлоропласта и, следовательно, в различные подотделы в самом хлоропласте (например, в строму, тилакоид и тилакоидную мембрану). Эти последовательности N-концевого транзитного пептида содержат всю информацию, необходимую для поступления белка хлоропласта в пластиды, эти последовательности транзитного пептида являются необходимыми и достаточными для введения пластид.
Гены растений с известным наличием природно-кодируемых последовательностей транзитных пептидов на N-конце включают в себя хлоропластную малую субъединицу из рибулозо-1,5-бисфосфат кароксилазы (RuBisCo) (de Castro Silva-Filho et al. (1996) Plant Mol. Biol. 30:769-80, Schnell et al. (1991) J. Biol. Chem. 266:3335-42), EPSPS (см., например, Archer et al. (1990) J. Bioenerg. and Biomemb. 22:789-810 и патенты США 6867293, 7045684 и Re 36449), триптофансинтазу (Zhao et al. (1995) J. Biol. Chem. 270:6081-7), пластоцианин (Lawrence et al. (1997) J. Biol. Chem. (1997) 272: 20357-63), хоризматсинтазу (Schmidt et al. (1993) J. Biol. Chem. 268:27447-57), белок, связывающий образующийся на свету хлорофилл a/b (LHBP), (Lamppa et al. (1988) J. Biol. Chem. 263 14996-14999) и хлоропластный белок Arabidopsis thaliana (Lee et al. (2008) Plant Cell 20:1603-22). В американской патентной публикации US2010/0071090 представлены некоторые нацеленные на хлоропласты пептиды из Chlamydomonas sp.
Вместе с тем, остаются неясными структурные условия в отношении информации, кодируемой нацеленными на хлоропласты пептидами, в связи с высоким уровнем вариабельности последовательностей и отсутствием общих или консенсусных мотивов последовательностей, хотя вполне возможно существование отдельных подгрупп нацеленных на хлоропласты пептидов с независимыми структурными мотивами. Lee et al. (2008), см. выше. Дополнительно, не все из этих последовательностей играют роль в гетерологичной экспрессии нацеленных на хлоропласты белков у высших растений.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
В изобретении описаны композиции и способы для нацеливания полипептидов на пластиды в растении. В некоторых вариантах осуществления композиция содержит молекулу нуклеиновой кислоты, содержащую по меньшей мере одну нуклеотидную последовательность, кодирующую синтетический транзитный пептид хлоропластов (например, пептид TraP23), который функционально связан с представляющей интерес нуклеотидной последовательностью. В конкретных вариантах осуществления такие молекулы нуклеиновых кислот могут быть полезны для экспрессии и нацеливания полипептида, кодируемого представляющей интерес нуклеотидной последовательностью, в однодольных или двудольных растениях. Дополнительно описаны векторы, содержащие молекулу нуклеиновой кислоты, которая содержит по меньшей мере одну нуклеотидную последовательность, кодирующую синтетический транзитный пептид хлоропластов, функционально связанную с нуклеотидной последовательностью, представляющей интерес.
В некоторых вариантах осуществления нуклеотидная последовательность, кодирующая синтетический СТР, может представлять собой нуклеотидную последовательность, происходящую из эталонной нуклеотидной последовательности, полученную при выравнивании ферментов 5-энолпирувилшикимат-3-фосфат-синтазы (EPSPS) или ее функционального варианта. В некоторых вариантах осуществления нуклеотидная последовательность, кодирующая синтетический СТР, может представлять собой нуклеотидную последовательность, содержащую часть CTP-кодирующей нуклеотидной последовательности из различных организмов, или ее функциональный вариант. В конкретных вариантах осуществления нуклеотидная последовательность, кодирующая синтетический СТР, может содержать смежные нуклеотидные последовательности, полученные из каждой из эталонной EPSPS CTP, или из функциональных вариантов любой из вышеперечисленных последовательностей. В этих и других вариантах осуществления нуклеотидная последовательность, кодирующая синтетический СТР, может представлять собой нуклеотидную последовательность, содержащую более одной CTP-кодирующей нуклеотидной последовательности.
В некоторых примерах нуклеотидная последовательность, кодирующая синтетический СТР, может представлять собой нуклеотидную последовательность, содержащую часть нуклеотидной последовательности СТР из фермента EPSPS, или ее функциональные варианты. В конкретных примерах нуклеотидная последовательность, кодирующая синтетический СТР, может содержать смежные нуклеотидные последовательности, полученные из фермента EPSPS, или их функциональные варианты.
В некоторых вариантах осуществления композиция содержит молекулу нуклеиновой кислоты, содержащую по меньшей мере один полученный из EPSPS агент для нацеливания полипептида на хлоропласты. Дополнительно описаны молекулы нуклеиновых кислот, содержащие молекулу нуклеиновой кислоты, которая содержит по меньшей мере один полученный из EPSPS агент для нацеливания полипептида на хлоропласты, функционально связанный с представляющей интерес нуклеотидной последовательностью. В конкретных вариантах осуществления такие молекулы нуклеиновых кислот могут быть полезны для экспрессии и нацеливания полипептида, кодируемого представляющей интерес нуклеотидной последовательностью, в однодольных или двудольных растениях. Для целей настоящего изобретения, полученный из EPSPS агент для нацеливания полипептида на хлоропласт относится к конкретным синтетическим нуклеотидным последовательностям. В конкретных вариантах осуществления полученный из EPSPS агент для нацеливания полипептида на хлоропласт выбирают из группы, состоящей из нуклеотидных последовательностей, указанных в настоящем изобретении как TraP23.
Также в изобретении описаны растительные материалы (например, и без ограничения, растения, ткани растений и клетки растений), содержащие молекулу нуклеиновой кислоты, которая содержит по меньшей мере одну нуклеотидную последовательность, кодирующую синтетический СТР, функционально связанную с представляющей интерес нуклеотидной последовательностью. В некоторых вариантах осуществления растительный материал может иметь такую молекулу нуклеиновой кислоты, стабильно интегрированную в свой геном. В некоторых вариантах осуществления растительный материал может транзиторно экспрессировать продукт молекулы нуклеиновой кислоты, содержащий по меньшей мере одну нуклеотидную последовательность, кодирующую синтетический СТР, функционально связанную с представляющей интерес нуклеотидной последовательностью. В некоторых вариантах осуществления растительный материал представляет собой растительную клетку, которая неспособна к регенерации для получения растения.
В изобретении также описаны способы для экспрессии нуклеотидной последовательности в пластид-содержащей клетке (например, в растении) в пластиде (например, в хлоропласте) из пластид-содержащей клетки. В конкретных вариантах осуществления молекула нуклеиновой кислоты, содержащая по меньшей мере одну нуклеотидную последовательность, кодирующую синтетический СТР, которая функционально связана с представляющей интерес нуклеотидной последовательностью, может быть использована для трансформации растительной клетки, таким образом, что синтез полипептида-предшественника слияния, содержащего синтетический CTP, слитый с продуктом экспрессии из представляющей интерес нуклеотидной последовательности, происходит в цитоплазме растительной клетки, и затем слитый полипептид транспортируется in vivo в хлоропласт растительной клетки. В некоторых вариантах осуществления таких способов растительную клетку невозможно регенерировать для получения растения.
Дополнительно в изобретении описаны способы производства трансгенного растения, содержащего молекулу нуклеиновой кислоты, которая содержит по меньшей мере одну нуклеотидную последовательность, кодирующую синтетический СТР, функционально связанную с представляющей интерес нуклеотидной последовательностью. Также в изобретении описаны товарные растительные продукты (например, семена), полученные из таких трансгенных растений.
Вышеуказанные и другие признаки станут более очевидными из последующего подробного описания нескольких вариантов осуществления, которые выполнены со ссылкой на прилагаемые чертежи.
Краткое описание чертежей
Фигура 1 показывает молекулы мРНК, которые представляют конкретные примеры нуклеотидной последовательности, кодирующей синтетический CTP (например, TraP23), функционально связанной с представляющей интерес нуклеотидной последовательностью. В некоторых вариантах осуществления молекулы мРНК (такие, как показанные в фигуре) могут транскрибироваться из молекулы ДНК, которая содержит открытую рамку считывания, включающую в себя последовательность, кодирующую синтетический CTP, функционально связанную с представляющей интерес нуклеотидной последовательностью. В некоторых вариантах осуществления нуклеотидная последовательность, представляющая интерес, может быть последовательностью, кодирующей рассматриваемый пептид, например, и без ограничения, маркерный генный продукт или пептид для нацеливания на пластиды.
Фигура 2 показывает выравнивание нескольких последовательностей транзитных пептидов хлоропластов EPSPS. Заштрихованные аминокислотные остатки показывают аминокислотные последовательности, которые были выбраны для TraP23.
Фигура 3 показывает карту плазмиды pDAB 107640.
Фигура 4 представляет собой изображение микроскопии инфильтрации TraP23-GFP в листовой ткани табака.
Фигура 5 показывает карту плазмиды pDAB106598.
Фигура 6 представляет собой изображение микроскопии TraP23-GFP, трансформированного в протопласты кукурузы, показывающее транслокацию в хлоропласты из протопласта кукурузы.
Фигура 7 показывает карту плазмиды pDAB 109808.
Фигура 8 показывает карту плазмиды pDAB107687.
СПОСОБ (СПОСОБЫ) ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
I. Обзор некоторых вариантов
Транзитный пептид хлоропласта (CTP) (или пластидный транзитный пептид) действует ко-трансляционно или посттрансляционно, нацеливая содержащий CTP полипептид на пластиды (например, хлоропласт). В некоторых вариантах осуществления настоящего изобретения на хлоропласт могут быть нацелены как эндогенные белки хлоропластов, так и гетерологичные белки, путем экспрессии такого белка в виде более крупного полипептида-предшественника, содержащего CTP. В конкретных вариантах осуществления CTP может быть получен из нуклеотидной последовательности, полученной при выравнивании ферментов 5-энолпирувилшикимат-3-фосфат-синтазы (EPSPS), например, и без ограничения, путем включения по меньшей мере одной смежной последовательности из ортологичного гена, полученной из другого организма, или ее функционального варианта.
В примере варианта осуществления были получены последовательности нуклеиновых кислот, каждая из которых кодирует CTP, при выравнивании белковых последовательностей EPSPS (фиг. 2). CTP-кодирующие последовательности были выделены путем анализа последовательности генов EPSPS с помощью прогностического сервера ChloroP (ChloroP prediction server, Emanuelsson et al. (1999) Protein Science 8:978-84 (доступный ресурс: cbs.dtu.dk/services/ChloroP)). Предсказанные белковые продукты выделенных CTP-кодирующих последовательностей представляют собой транзитные пептиды длиной примерно 60-70 аминокислот. В этом примере для получения нового синтетического СТР использовали выравнивание последовательностей CTP EPSPS в качестве эталонной последовательности для создания образца синтетического CTP путем случайного выбора аминокислот. Этот способ конструирования демонстирует свойства получения синтетического CTP. Образец синтетического CTP в настоящем раскрытии называется TraP23. Образец синтетического TraP23 тестировали на пластид-нацеливающие функции и было показано, что он проявляет нацеливание на пластиды по меньшей мере с тем же преимуществом, которое наблюдается непосредственно у нативных CTP-последовательностей.
Еще в одном примере варианта осуществления были независимо синтезированы последовательности нуклеиновых кислот, каждая из которых кодирует синтетический пептид TraP по изобретению и функционально связана с последовательностью нуклеиновой кислоты, кодирующей зеленый флуоресцентный белок (GFP), с целью получения молекулы синтетических нуклеиновых кислот, каждая из которых кодирует химерный слитый полипептид TraP:GFP. Каждую из таких молекул нуклеиновых кислот, кодирующих химерный полипептид TraP:GFP, вставляли в бинарный вектор таким образом, что каждая последовательность нуклеиновой кислоты, кодирующая TraP: GFP, была функционально связана с промотором AtUbi10.
Еще в одном примере варианта осуществления каждый из бинарных векторов, которые содержат последовательность нуклеиновой кислоты, кодирующую TraP:GFP, функционально связанную с промотором AtUbi10, независимо друг от друга и транзиторно трансформировали в табак (Nicotiana benthamiana) посредством Agrobacterium-опросредованной трансформации. С помощью конфокальной микроскопии и Вестерн-блоттинга было подтверждено, что каждый TraP успешно нацеливал GFP на хлоропласты табака.
Еще в одном примере варианта осуществления была независимо синтезирована последовательность нуклеиновой кислоты, кодирующая синтетический пептид TraP по изобретению и функционально связанная с последовательностью нуклеиновой кислоты, кодирующей агрономически важную последовательность генов. Последовательность TraP была слита с признаком переносимости гербицидов (например, dgt-28) для получения молекулы синтетической нуклеиновой кислоты, кодирующей химерный слитый полипептид TraP:dgt-28. Такую молекулу нуклеиновой кислоты, кодирующей химерный полипептид TraP:dgt-28, вставляли в бинарный вектор, таким образом, что каждая последовательность нуклеиновой кислоты, кодирующая TraP:dgt-28, была функционально связана с промотором и другими регуляторными элементами гена. Бинарную, содержащую последовательность нуклеиновой кислоты, кодирующую TraP:dgt-28, использовали для трансформации различных видов растений. Трансгенные растения анализировали на толерантность к гербицидам, обусловленную экспрессией и транслокацией фермента dgt-28 в хлоропласте.
Еще в одном примере варианта осуществления была независимо синтезирована последовательность нуклеиновой кислоты, кодирующая синтетический пептид TraP согласно изобретению, и функционально связанная с последовательностью нуклеиновой кислоты, кодирующей агрономически важные последовательности генов. Последовательность TraP была слита с признаком устойчивости к насекомым (например, cry2Ad) для получения молекулы синтетической нуклеиновой кислоты, кодирующей химерный слитый полипептид TraP:Cry2Aa. Такую молекулу нуклеиновой кислоты, кодирующей химерный полипептид TraP:Cry2Aa, вставляли в бинарный вектор, таким образом, что каждая последовательность нуклеиновой кислоты, кодирующая TraP:cry2aa, была функционально связана с промотором и другими регуляторными элементами гена. Бинарную, содержащую последовательность нуклеиновой кислоты, кодирующую TraP:cry2aa, использовали для трансформации различных видов растений. С трансгенными растеними проводили биологические исследования на устойчивость к насекомым, обусловленную экспрессией и транслокацией фермента Cry2Aa в хлоропласте.
В свете вышеупомянутых подробных практических примеров, можно использовать последовательности синтетического CTP по изобретению и кодирующие их нуклеиновые кислоты для нацеливания любого полипептида на пластиды в широком диапазоне пластид-содержащих клеток. Например, способами, доступными специалистам в данной области техники с помощью настоящего изобретения, в пластид-содержащую клетку-хозяина можно вставлять (или экспрессировать) химерный полипептид, содержащий последовательность синтетического CTP, слитую с N-концом любой второй пептидной последовательности, для нацеливания на пластиды второй пептидной последовательности. Таким образом, в конкретных вариантах осуществления, по сравнению с нативным CTP, пептид TraP по изобретению может обеспечить повышенную эффективность введения и процессирования пептида, для которого желательна экспрессия пластид.
II. Сокращения
СТР - транзитный пептид хлоропласта
EPSPS - 3-енолпирувилшикимат-5-фосфат синтетаза
YFP - желтый флуоресцентный белок
Ti - индуцирующие опухоль (плазмиды, происходящие из А. tumefaciens)
Т-ДНК - трансферная ДНК
III. Терминология
Для облегчения понимания различных вариантов осуществления настоящего раскрытия приведены следующие пояснения специальных терминов:
Транзитный пептид хлоропласта: используемый в изобретении термин "транзитный пептид хлоропласта" (СТР) (или "транзитный пептид пластид") может относиться к аминокислотной последовательности, которая, в случае ее присутствия на N-конце полипептида, направляет поступление полипептида в пластиду из пластид-содержащей клетки (например, клетки растения, например, в цельном растении или в культуре растительных клеток). Обычно CTP необходим и достаточен для направления поступления белка в пластиду клетки-хозяина (например, в первичную, вторичную или третичную пластиду, такую как хлоропласт). Предполагаемый транзитный пептид хлоропласта может быть идентифицирован с помощью одного из нескольких доступных алгоритмов (например, PSORT и ChloroP (доступный в cbs.dtu.dk/services/ChloroP)). Алгоритм ChloroP может давать особенно хорошее предположение СТР. Emanuelsson et al. (1999) Protein Science 8: 978-84. Тем не менее с помощью любого существующего алгоритма не достигается 100% эффективности предположения функционального СТР. Поэтому важно убедиться, что идентифицированные предполагаемые CTP действительно обладают намеченной функцией, например, с помощью методик in vitro или in vivo.
Транзитные пептиды хлоропласта могут быть расположены на N-конце полипептида, который поступает в пластиды. CTP может способствовать ко-трансляционному или посттрансляционному транспорту содержащего CTP полипептида в пластиды. Обычно транзитные пептиды хлоропласта содержат приблизительно от 40 приблизительно до 100 аминокислот, и у таких CTP выявляют наличие определенных общих характеристик. Например: CTP почти не содержат отрицательно заряженных аминокислот (например, аспарагиновой кислоты, глутаминовой кислоты, аспарагина или глутамина); на N-концевых участках СТР отсутствуют заряженные аминокислоты глицин и пролин; предполагается, что центральная область CTP имеет очень высокое содержание основных или гидроксилированных аминокислот (таких как серин и треонин); и предполагается, что С-концевая область CTP богата аргинином и имеет возможность содержать амфипатическую бета-пластинчатую структуру. Протеазы пластид могут расщеплять CTP из остальной части содержащего CTP полипептида после поступления полипептида в пластиды.
Контакт: используемый в изобретении термин "контакт с" клеткой, тканью или организмом или "захват посредством" клетки, ткани или организма (например, клеток растения, ткани растения и растения), в отношении молекулы нуклеиновой кислоты включает в себя интернализацию молекулы нуклеиновой кислоты в организме, например, и без ограничения: контактирование организма с композицией, содержащей молекулу нуклеиновой кислоты, и вытяжку из организмов с раствором, содержащим молекулу нуклеиновой кислоты.
Эндогенный: используемый в изобретении термин "эндогенный" относится к веществам (например, к молекулам нуклеиновых кислот и полипептидам), которые происходят из конкретного организма, ткани или клетки. Например, "эндогенный" полипептид, экспрессируемый в клетке растения, может относиться к полипептиду, который обычно экспрессируется в клетках того же типа из не-генноинженерных растений того же вида. В некоторых примерах можно использовать эндогенный ген (например, ген EPSPS) для получения эталонной последовательности CTP.
Экспрессия: используемый в изобретении термин "экспрессия" кодирующей последовательности (например, гена или трансгена) относится к способу, с помощью которого кодированная информация о транскрипционной единице нуклеиновой кислоты (включающей в себя, например, геномную ДНК или кДНК) преобразуется в функциональную, нефункциональную или структурную части клетки, часто включая в себя синтез белка. Экспрессия генов может зависеть от внешних сигналов, например, от воздействия на клетки, ткани или организм какого-либо агента, который увеличивает или уменьшает экспрессию генов. Экспрессия гена также может регулироваться в любой части пути от ДНК к РНК в белок. Регуляция экспрессии генов происходит, например, с помощью элементов контроля, действующих в ходе транскрипции, трансляции, транспорта РНК и процессирования, деградации промежуточных молекул, таких как мРНК, или посредством активации, инактивации, компартментализации или деградации специфичных белковых молекул после их образования, или посредством комбинации этих явлений. Экспрессию гена можно измерять на уровне РНК или на уровне белка любым способом, известным в данной области, например, и без ограничения: с помощью нозерн-блоттинга, ПЦР в реальном времени (RT-PCR), вестерн-блоттинга, или путем анализа активности белка (белков) in vitro, in situ и in vivo.
Генетический материал: используемый в изобретении термин "генетический материал" включает в себя все гены и молекулы нуклеиновых кислот, такие как ДНК и РНК.
Гетерологичный: используемый в изобретении термин "гетерологичный" относится к веществам (например, молекулам нуклеиновых кислот и полипептидам), которые не происходят из конкретного организма, ткани или клетки. Например, "гетерологичный" полипептид, экспрессируемый в растительной клетке, может означать полипептид, который обычно не экспрессируется в клетках того же типа из не-генноинженерных растений того же вида (например, полипептид, который экспрессируется в разных клетках одного и того же организма или клетках другого организма).
Выделенный: используемый в изобретении термин "выделенный" относится к молекулам (например, к молекулам нуклеиновых кислот и полипептидам), которые, по существу, отделены или очищены от других молекул того же типа (например, от других молекул нуклеиновых кислот и других полипептидов), с которым эти молекулы обычно ассоциированы в клетке организма, в котором эта молекула встречается в природе. Например, выделенная молекула нуклеиновой кислоты может быть, по существу, отделена или очищена от хромосомной ДНК или внехромосомной ДНК в клетке организма, в котором молекула нуклеиновой кислоты встречается в природе. Таким образом, этот термин включает в себя рекомбинантные молекулы нуклеиновых кислот и полипептиды, которые очищены биохимически таким образом, что удалены другие молекулы нуклеиновой кислоты, полипептиды и клеточные компоненты. Этот термин также включает в себя рекомбинантные молекулы нуклеиновых кислот, химически синтезированные молекулы нуклеиновых кислот и полипептиды, полученные рекомбинантным способом.
Термин "по существу очищенный", используемый в изобретении, относится к молекуле, которая отделена от других молекул, обычно ассоциированных с ней в ее нативном состоянии. По существу очищенная молекула может являться преобладающим видом, присутствующим в композиции. По существу очищенная молекула может не содержать, например, по меньшей мере, на 60%, по меньшей мере на 75%, или по меньшей мере на 90% не содержать других молекул, кроме растворителя, присутствующего в природной смеси. Термин "по существу очищенный" не относится к молекулам, находящимся в их нативном состоянии.
Молекула нуклеиновой кислоты: используемый в изобретении термин "молекула нуклеиновой кислоты" относится к полимерной форме нуклеотидов, которые могут включать в себя как смысловые, так и антисмысловые цепочки РНК, кДНК, геномной ДНК и их синтетические и смешанные формы и полимеры. Нуклеотид может относиться к рибонуклеотиду, дезоксирибонуклеотиду или к модифицированной форме нуклеотида любого типа. Термин "молекула нуклеиновой кислоты", используемый в изобретении, является синонимом терминов "нуклеиновая кислота" и "полинуклеотид". Молекула нуклеиновой кислоты обычно имеет длину по меньшей мере 10 оснований, если не указано иное. Этот термин включает в себя одно- и двухцепочечные формы ДНК. Молекулы нуклеиновых кислот включают в себя димерные (так называемые тандемные) формы и продукты транскрипции молекул нуклеиновых кислот. Молекула нуклеиновой кислоты может включать в себя природные и модифицированные нуклеотиды, или один из них, или оба, которые связаны друг с другом посредством природных и/или неприродных нуклеотидных связей.
Молекулы нуклеиновых кислот могут быть модифицированы химически или биохимически, или могут содержать неприродные или дериватизированные нуклеотидные основания, что будет легко понять специалистам в данной области. Такие модификации включают в себя, например, метки, метилирование, замену одного или нескольких природных нуклеотидов на аналог, межнуклеотидные модификации (например, незаряженные связи: например, метилфосфонаты, фосфотриэфиры, фосфорамидаты, карбаматы и т.д.; заряженные связи: например, фосфоротиоаты, фосфородитиоаты и т.д.; боковые группы: например, пептиды; интеркаляторы: например, акридин, псорален и т.д.; энтеросорбенты; алкилирующие и модифицированные связи: например, альфа-аномерные нуклеиновые кислоты и т.д.). Термин "молекула нуклеиновой кислоты" также включает в себя любую топологическую конформацию, в том числе одноцепочечные, двухцепочечные, частично дуплексные, триплексные, шпилечные, круговые конформации и конформации типа висячий замок.
Используемый в изобретении по отношению к ДНК термин "кодирующая последовательность", "структурная нуклеотидная последовательность" или "структурная молекула нуклеиновой кислоты" относится к нуклеотидной последовательности, которая, в конечном счете, транслируется в полипептид посредством транскрипции и мРНК, находящейся под контролем подходящих регуляторных последовательностей. По отношению к РНК термин "кодирующая последовательность" относится к нуклеотидной последовательности, которая транслируется в пептид, полипептид или белок. Границы кодирующей последовательности определяются стартовым кодоном трансляции на 5'-конце и стоп-кодоном трансляции на 3'-конце. Кодирующие последовательности включают в себя без ограничения геномную ДНК, кДНК, экспрессирующиеся маркерные последовательности (EST) и рекомбинантные нуклеотидные последовательности.
В некоторых вариантах осуществления настоящее изобретение включает в себя нуклеотидные последовательности, которые могут быть выделены, очищены или частично очищены, например, способами разделения, таких как, например, ионообменная хроматография, эксклюзионным способом на основе молекулярных размеров или на основе аффинности, с помощью методик фракционирования на основе растворимости в различных растворителях и способов генной инженерии, таких как амплификация, клонирование и субклонирование.
Идентичность последовательности: термин "идентичность последовательности" или "идентичность", используемый в изобретении в отношении двух последовательностей нуклеиновых кислот или полипептидов, может относиться к остаткам в двух последовательностях, которые являются одинаковыми, при их выравнивании на максимальное соответствие на протяжении определенного окна сравнения.
Используемый в изобретении термин "процент идентичности последовательностей" может относиться к значению, определенному путем сравнения двух оптимально выровненных последовательностей (например, последовательностей нуклеиновых кислот и аминокислотных последовательностей) в окне сравнения, при этом для оптимального выравнивания двух последовательностей часть последовательности в окне сравнения может содержать добавления или делеции (т.е. пробелы) по сравнению с эталонной последовательностью (которая не содержит добавлений или делеций). Процент рассчитывают путем определения числа положений, в которых идентичный нуклеотид или аминокислотный остаток встречается в обеих последовательностях, с получением числа совпадающих положений, деления числа совпадающих положений на общее число положений в окне сравнения, и умножения результата на 100 с получением процента идентичности последовательностей.
Способы выравнивания последовательностей для сравнения хорошо известны в данной области. Описаны различные программы и алгоритмы выравнивания, например, Smith and Waterman (1981) Adv. Appl. Math. 2:482; Needleman and Wunsch (1970) J. Mol. Biol. 48:443; Pearson and Lipman (1988) Proc. Natl. Acad. Sci. U.S.A. 85:2444; Higgins and Sharp (1988) Gene 73:237-44; Higgins and Sharp (1989) CABIOS 5:151-3; Corpet et al. (1988) Nucleic Acids Res. 16:10881-90; Huang et al. (1992) Comp. Appl. Biosci. 8:155-65; Pearson et al. (1994) Methods Mol. Biol. 24:307-31; Tatiana et al. (1999) FEMS Microbiol. Lett. 174:247-50. Подробное рассмотрение способов выравнивания последовательностей и расчетов гомологии можно найти, например, в публикации Altschul et al. (1990) J. Mol. Biol. 215: 403-10.
Продукт Национального центра биотехнологической информации (NCBI) - программу Basic Local Alignment Search Tool (BLAST™, Altschul et al. (1990)) можно получить из нескольких источников, в том числе в Национальном центре биотехнологической информации (Bethesda, MD), и из Интернета, для использования в качестве программы анализа нескольких последовательностей. Описание алгоритма определения идентичности последовательности с помощью этой программы доступно в Интернете в разделе "помощь" для программы BLAST™. Для сравнения последовательностей нуклеиновых кислот можно использовать функцию "Blast 2 последовательности" программы BLAST™ (BLASTN), задействуя установки матрицы BLOSUM62 по умолчанию с параметрами по умолчанию. При оценке этим способом последовательности нуклеиновых кислот с более высоким сходством с эталонными последовательностями будут показывать возрастающий процент идентичности.
Специфично гибридизуемый/специфично комплементарный: используемые в изобретении термины "специфично гибридизуемый" и "специфично комплементарный" указывают на достаточную степень комплементарности, при которой возникает стабильное и специфичное связывание между молекулой нуклеиновой кислоты и целевой молекулой нуклеиновой кислоты. Гибридизация между двумя молекулами нуклеиновых кислот охватывает образование анти-параллельного выравнивания между нуклеиновокислотными последовательностями двух молекул нуклеиновых кислот. Эти две молекулы затем способны создавать водородные связи с соответствующими основаниями на противоположной цепи с образованием дуплексной молекулы, которая при достаточной стабильности поддается обнаружению с помощью способов, хорошо известных в данной области. Чтобы быть специфично гибридизуемой, молекула нуклеиновой кислоты не обязательно должна быть на 100% комплементарной своей целевой последовательности. Тем не менее количественные показатели комплементарности последовательностей, которые необходимы для специфичности гибридизации, зависят от применяемых условий гибридизации.
Условия гибридизации, дающие конкретные степени строгости, будут варьироваться в зависимости от природы выбранного способа гибридизации, и композиции и длины гибридизуемых последовательностей нуклеиновых кислот. В общем, строгость гибридизации будет определяться температурой гибридизации и ионной силой (в особенности концентрацией Na+ и/или Mg++) в буфере для гибридизации, при этом на строгость также влияет количество промываний. Расчеты в отношении условий гибридизации, необходимых для достижения конкретных степеней строгости, известны рядовым специалистам в данной области и описаны, например, авторами Sambrook et al. (ed.) Molecular Cloning: A Laboratory Manual, 2nd ed., vol. 1-3, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1989, главы 9 и 11; и Hames and Higgins (eds.) Nucleic Acid Hybridization, IRL Press, Oxford, 1985. Дополнительные подробные инструкции и руководство по гибридизации нуклеиновых кислот можно найти, например, в публикации Tijssen, "Overview of principles of hybridization and the strategy of nucleic acid probe assays" в издании Laboratory Techniques in Biochemistry and Molecular Biology - Hybridization with Nucleic Acid Probes, часть I, глава 2, Elsevier, NY, 1993; и Ausubel et al., Eds., Current Protocols in Molecular Biology, глава 2, Greene Publishing and Wiley-Interscience, NY, 1995.
Используемое в изобретении понятие "жесткие условия" охватывают условия, при которых гибридизация будет происходить только в случае, если имеется менее 20% несовпадений между гибридизуемой молекулой и гомологичной последовательностью в целевой молекуле нуклеиновой кислоты. "Строгие условия" включают в себя дополнительные конкретные уровни строгости. Таким образом, используемое в изобретении понятие "условия умеренной строгости" означает условия, при которых с несовпадением более чем 20% последовательностей не будет происходить гибридизация молекул; условия "высокой строгости" представляют собой условия, при которых не будет происходить гибридизация последовательностей с несовпадением более чем 10%; и условия "очень высокой строгости" представляют собой условия, при которых не будет происходить гибридизация последовательностей с несовпадением более чем 5%.
Ниже представлены типичные условия гибридизации, не ограниченные перечисленными.
Условия высокой строгости (определяют последовательности, имеющие по меньшей мере 90% идентичности последовательностей): гибридизация в 5 x SSC-буфере при 65°С в течение 16 часов, промывание два раза в 2 х SSC-буфере при комнатной температуре в течение 15 минут каждое, и промывание дважды в 0,5 x SSC-буфере при 65°С в течение 20 минут каждое.
Условия умеренной строгости (определяют последовательности, имеющие по меньшей мере 80% идентичности последовательностей): гибридизация в 5 x SSC-буфере при 65-70°С в течение 16-20 часов, промывание два раза в 2 х SSC-буфере при комнатной температуре в течение 5-20 минут каждое, и промывание дважды в 1 x SSC-буфере при 55-70°С в течение 30 минут каждое.
Нестрогие контрольные условия (гибридизуются последовательности, которые имеют идентичность последовательностей по меньшей мере 50%): гибридизация в 6 x SSC-буфере до 55°С в течение 16-20 часов, промывание по меньшей мере два раза в 2х-3х SSC-буфере при температуре от комнатной до 55°С в течение 20-30 минут каждое.
Используемый в изобретении термин "по существу гомологичный" или "по существу гомология", в отношении смежной последовательности нуклеиновой кислоты, относится к смежным нуклеотидным последовательностям, которые гибридизуются в строгих условиях с эталонной последовательностью нуклеиновой кислоты. Например, последовательности нуклеиновых кислот, которые по существу гомологичны эталонной последовательности нуклеиновой кислоты (например, SEQ ID NO: 12) представляют собой такие последовательности нуклеиновых кислот, которые гибридизуются с эталонной последовательностью нуклеиновой кислоты в строгих условиях (например, в умеренно строгих условиях, указанных выше). По существу гомологичные последовательности могут иметь идентичность последовательностей по меньшей мере 80%. Например, по существу гомологичные последовательности могут иметь идентичность последовательностей приблизительно от 80% до 100%, например, приблизительно 81%, приблизительно 82%, приблизительно 83%, приблизительно 84%, приблизительно 85%, приблизительно 86%, приблизительно 87%, приблизительно 88%, приблизительно 89%, приблизительно 90%, приблизительно 91%, приблизительно 92%, приблизительно 93%, приблизительно 94%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98%, приблизительно 98,5%, приблизительно 99%, приблизительно 99,5% и приблизительно 100%. Свойство существенной гомологии тесно связано со специфичностью гибридизации. Например, молекула нуклеиновой кислоты является специфично гибридизуемой, если имеется достаточная степень комплементарности, чтобы избежать неспецифичного связывания нуклеиновой кислоты с нецелевыми последовательностями в условиях, когда желательно специфичное связывание, например, в строгих условиях гибридизации.
Используемый в изобретении термин "ортолог" (или "ортологичный") относится к гену в двух или нескольких видах, который возник из общей предковой нуклеотидной последовательности, и может сохранять одинаковую функцию в двух или нескольких видах.
Согласно изобретению, две молекулы нуклеиновой кислоты считаются проявляющими "полную комплементарность", если каждый нуклеотид в последовательности, считываемый в направлении от 5' к 3', комплементарен каждому нуклеотиду другой последовательности при считывании в направлении от 3' к 5'. Нуклеотидная последовательность, которая является комплементарной к эталонной нуклеотидной последовательности, будет показывать последовательность, идентичную последовательности, обратно комплиментарной к эталонной нуклеотидной последовательности. Эти термины и описания четко определены в данной области техники и легко понятны рядовым специалистам в данной области.
Специалистам в данной области техники хорошо известно, что при определении процента идентичности последовательностей между аминокислотными последовательностями в заданном положении может отличаться идентичность аминокислоты, которая была достигнута посредством выравнивания, что не влияет на желательные свойства полипептидов, содержащих выровненные последовательности. В этих случаях процент идентичности последовательности может быть подобран с учетом сходства между консервативно замещенными аминокислотами. Такой подбор хорошо известен и широко используется специалистами в данной области техники. См., например, Myers and Miller (1988) Computer Applications in Biosciences 4: 11-7.
Варианты осуществления настоящего изобретения включают в себя функциональные варианты иллюстративных аминокислотных последовательностей транзитного пептида пластид и последовательностей нуклеиновых кислот, которые их кодируют. Функциональный вариант иллюстративной последовательности транзитного пептида может представлять собой, например, фрагмент иллюстративной аминокислотной последовательности транзитного пептида (например, N-концевой или С-концевой фрагмент), или модифицированную последовательность из иллюстративной аминокислотной последовательности полноразмерного транзитного пептида, или фрагмент иллюстративной аминокислотной последовательности транзитного пептида. Иллюстративную аминокислотную последовательность транзитного пептида можно модифицировать в некоторых вариантах осуществления путем введения одной или нескольких консервативных аминокислотных замен. "Консервативная" аминокислотная замена представляет собой замену, при которой аминокислотный остаток замещается аминокислотным остатком, имеющим сходную функциональную боковую цепь, аналогичный размер и/или аналогичную гидрофобность. В данной области известны семейства аминокислот, которые можно использовать для замены другой аминокислоты того же семейства в целях введения консервативной замены. Например, эти семейства аминокислот включают в себя: основные аминокислоты (например, лизин, аргинин, гистидин), кислые аминокислоты (например, аспарагиновую кислоту и глутаминовую кислоту), незаряженные (при физиологическом уровне рН) полярные аминокислоты (например, глицин, аспарагины, глутамин, серин, треонин, тирозин и цитозин), неполярные аминокислоты (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин и триптофан), бета-разветвленные аминокислоты (например, треонин, валин и изолейцин); и ароматические аминокислоты (например, тирозин, фенилаланин, триптофан и гистидин). См., например, Sambrook et al. (Eds.), выше; и Innis et al., PCR Protocols: A Guide to Methods and Applications, 1990, Academic Press, NY, USA.
Функционально связанный: первая нуклеотидная последовательность является "функционально связанной" со второй нуклеотидной последовательностью, если первая нуклеотидная последовательность находится в функциональной связи со второй нуклеотидной последовательностью. Например, промотор функционально связан с кодирующей последовательностью, если промотор действует на транскрипцию или экспрессию кодирующей последовательности. Если последовательности созданы рекомбинантным путем, функционально связанные нуклеотидные последовательности обычно являются смежными и находятся в той же рамке считывания, при необходимости соединения двух участков, кодирующих белок. Тем не менее, чтобы быть функционально связанными, нуклеотидные последовательности не обязательно должны быть смежными.
Термин "функционально связанный", используемый в отношении регуляторной последовательности и кодирующей последовательности, означает, что регуляторная последовательность влияет на экспрессию связанной кодирующей последовательности. "Регуляторные последовательности", или "элементы контроля", относятся к нуклеотидным последовательностям, которые влияют на временной режим и уровень/количество транскрипции, процессинг РНК или стабильность, или на трансляцию ассоциированной с ней кодирующей последовательности. Регуляторные последовательности могут включать в себя промоторы, трансляционные лидерные последовательности, интроны, энхансеры, структуры типа петля-на-стебле, репрессорные связывающие последовательности, последовательности терминации, последовательности распознавания полиаденилирования и т.д. Конкретные регуляторные последовательности могут быть расположены в 3'-5' направлении и/или в 5'-3' направлении от кодирующей последовательности, которая функционально связана с ней. Также отдельные регуляторные последовательности, функционально связанные с кодирующей последовательностью, могут быть расположены на соответствующей комплементарной цепи молекулы двухцепочечной нуклеиновой кислоты.
Используемый в отношении двух или нескольких аминокислотных последовательностей термин "функционально связанный" означает, что первая аминокислотная последовательность находится в функциональной связи по меньшей мере с одной из дополнительных аминокислотных последовательностей. Например, транзитный пептид (например, CTP) является функционально связанным со второй аминокислотной последовательностью в полипептиде, содержащем обе последовательности, если этот транзитный пептид влияет на экспрессию или направленную миграцию полипептида или второй аминокислотной последовательности.
Промотор: используемый в изобретении термин "промотор" относится к участку ДНК, который может находиться в 3'-5' направлении от начала транскрипции и может быть вовлечен в распознавание и связывание РНК-полимеразы и других белков для инициации транскрипции. Промотор может быть функционально связанным с кодирующей последовательностью для экспрессии в клетке, или промотор может быть функционально связанным с нуклеотидной последовательностью, кодирующей сигнальную последовательность, которая может быть функционально связана с кодирующей последовательностью, для экспрессии в клетке. "Растительным промотором" может быть промотор, который способен запускать транскрипцию в клетках растений. Примеры промоторов под контролем развития включают в себя промоторы, которые преимущественно запускают транскрипцию в некоторых тканях, например, в листьях, корнях, семенах, волокнах, сосудах ксилемы, трахеидах или в склеренхиме. Такие промоторы называют "ткане-предпочтительными". Промоторы, которые запускают транскрипцию только в определенных тканях, называются "тканеспецифичными". Промотор, "специфичный для типа клеток", преимущественно запускает экспрессию в некоторых типах клеток в одном или нескольких органах, например, в сосудистых клетках в корнях и листьях. "Индуцируемый" промотор представляет собой промотор, который может регулироваться окружающей средой. Примеры условий окружающей среды, при которых индуцируемые промоторы могут запускать транскрипцию, включают в себя анаэробные условия и наличие света. Тканеспецифичные, ткане-предпочтительные, специфичные для типа клеток и индуцируемые промоторы составляют класс "не-конститутивных" промоторов. "Конститутивный" промотор представляет собой промотор, который может быть активным в большинстве условий окружающей среды.
В некоторых вариантах осуществления настоящего изобретения может быть использован любой индуцируемый промотор. См. Ward et al. (1993) Plant Mol. Biol. 22: 361-366. При наличии индуцируемого промотора скорость транскрипции возрастает в ответ на индуцирующий агент. Примеры индуцируемых промоторов включают в себя без ограничения: промоторы из системы ACEI, которые реагируют на медь, ген In2 из кукурузы, который реагирует на антидоты к бензолсульфонамидным гербицидам, репрессор Tet из Tn10, и индуцируемый промотор из гена стероидного гормона, транскрипционная активность которого может индуцироваться глюкокортикостероидным гормоном (Schena et al. (1991), Proc. Natl. Acad. Sci. USA 88:0421).
Примеры конститутивных промоторов включают в себя без ограничения: промоторы из вирусов растений, такие как промотор 35S из CaMV, промоторы из генов актина в рисе, убиквитиновые промоторы, pEMU, MAS, промотор Н3 гистона в кукурузе и промотор ALS, Xba1/Ncol-фрагмент 5' к структурному гену ALS3 Brassica napus (или подобие нуклеотидной последовательности к указанному фрагменту Xbal/Ncol) (международная публикация РСТ WO 96/30530).
Дополнительно, в некоторых вариантах осуществления настоящего изобретения можно использовать любой ткане-специфичный или ткане-предпочтительный промотор. Растения, трансформированные молекулой нуклеиновой кислоты, содержащей кодирующую последовательность, которая функционально связана с ткане-специфичным промотором, могут вырабатывать продукт кодирующей последовательности исключительно в определенной ткани или преимущественно в определенной ткани. Иллюстративные ткане-специфичные или ткане-предпочтительные промоторы включают в себя без ограничения предпочтительный для корней промотор, например, из гена фазеолина; специфичный для листьев и свето-индуцируемый промотор, например, из cab или rubisco; специфичный для пыльника промотор, например, из LAT52; специфичный для пыльцы промотор, например, из Zm13; и предпочтительный для микроспор промотор, например, из apg.
Трансформация: используемый в изобретении термин "трансформация" или "трансдукция" относится к переносу одной молекулы или нескольких молекул нуклеиновой кислоты в клетку. Клетка является "трансформированной" посредством молекулы нуклеиновой кислоты, трансдуцированной в клетку, если молекула нуклеиновой кислоты начинает стабильно реплицироваться в клетке, как путем включения этой молекулы нуклеиновой кислоты в клеточный геном, так и путем эписомальной репликации. Используемый в изобретении термин "трансформация" охватывает все способы, с помощью которых в такую клетку можно вводить молекулу нуклеиновой кислоты. Примеры включают в себя без ограничения трансфекцию с вирусными векторами, трансформацию с плазмидными векторами, электропорацию (Fromm et al. (1986) Nature 319:791-3), липофекцию (Feigner et al. (1987) Proc. Natl. Acad. Sci. USA 84:7413-7), микроинъекцию (Mueller et al. (1978) Cell 15:579-85), Agrobacterium-опосредованный перенос (Fraley et al. (1983) Proc. Natl. Acad. Sci. USA 80:4803-7), прямой захват ДНК и бомбардировку микрочастицами (Klein et al. (1987) Nature 327: 70).
Трансген: экзогенная последовательность нуклеиновой кислоты. В некоторых примерах трансген может представлять собой последовательность, которая кодирует полипептид, содержащий по меньшей мере один синтетический СТР. В конкретных примерах трансген может кодировать полипептид, содержащий по меньшей мере один синтетический СТР и по меньшей мере одну дополнительную пептидную последовательность (например, пептидную последовательность, которая придает толерантность к гербицидам), для которых желательно экспрессия пластид. В этих и других примерах трансген может содержать регуляторные последовательности, функционально связанные с кодирующей последовательностью трансгена (например, с промотором). Для целей настоящего описания термин "трансген", используемый для обозначения организма (например, растения), относится к организму, который содержит последовательность экзогенной нуклеиновой кислоты. В некоторых примерах организм, содержащий экзогенную последовательность нуклеиновой кислоты, может представлять собой организм, в который эта последовательность нуклеиновой кислоты была введена с помощью технологий молекулярной трансформации. В других примерах организм, содержащий экзогенную последовательность нуклеиновой кислоты, может представлять собой организм, в который эта последовательность нуклеиновой кислоты была введена, например, путем интрогрессии или перекрестного опыления растения.
Транспорт: используемые в изобретении термины "транспорт (транспорты)", "мишень (мишени)" и "перенос (переносы)" относятся к свойству конкретных аминокислотных последовательностей по изобретению, который облегчает перемещение полипептида, содержащего аминокислотную последовательность, из ядра клетки-хозяина в пластиды клетки-хозяина. В конкретных вариантах осуществления такая аминокислотная последовательность (т.е. последовательность синтетического СТР) может обладать способностью к переносу в пластиды клетки-хозяина приблизительно 100% полипептида, содержащего аминокислотную последовательность, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 60% и/или по меньшей мере приблизительно 50% полипептида, содержащего аминокислотную последовательность.
Вектор: молекула нуклеиновой кислоты, которую вводят в клетку, например, для создания трансформированной клетки. Вектор может включать в себя последовательности нуклеиновых кислот, которые позволяют ему реплицироваться в клетке-хозяине, такие как сайт инициации репликации. Примеры векторов включают в себя без ограничения плазмиду, космиду, бактериофаг или вирус, который несет экзогенную ДНК в клетку. Вектор может также включать в себя один или несколько генов, антисмысловые молекулы и/или селектируемые маркерные гены и другие генетические элементы, известные в данной области. Вектор может трансдуцировать, трансформировать или инфицировать клетку, в результате чего клетка начинает экспрессировать молекулы нуклеиновых кислот, и/или белки, кодируемые этим вектором. Вектор необязательно включает в себя материалы, способствующие достижению внедрения молекулы нуклеиновой кислоты в клетку (например, липосомы, покрытие белка и т.д.).
Если это не указано или подразумевается, используемые в изобретении термины в единственном числе означают "по меньшей мере один".
Если не приведены конкретные пояснения, все используемые в изобретении технические и научные термины имеют значение, которое обычно понятно рядовому специалисту в области, к которой принадлежит настоящее раскрытие. Определения общих терминов из области молекулярной биологии можно найти, например, в следующих источниках: Lewin B., Genes V, Oxford University Press, 1994 (ISBN 0-19-854287-9); Kendrew et al. (eds.), The Encyclopedia of Molecular Biology, Blackwell Science Ltd., 1994 (ISBN 0-632-02182-9), и Meyers R.A. (ed.), Molecular Biology and Biotechnology: A Comprehensive Desk Reference, VCH Publishers, Inc., 1995 (ISBN 1-56081-569-8). Если не указано иное, все процентные значения приведены по массе и все пропорции смеси растворителей приведены по объему. Все значения температуры приведены в градусах Цельсия.
IV. Молекулы нуклеиновых кислот, содержащие последовательность, кодирующую синтетический CTP
В некоторых вариантах осуществления настоящее изобретение относится к молекуле нуклеиновой кислоты, содержащей по меньшей мере одну нуклеотидную последовательность, кодирующую синтетический СТР, которая функционально связана с представляющей интерес нуклеотидной последовательностью. В конкретных вариантах осуществления представляющей интерес нуклеотидной последовательностью может быть нуклеотидная последовательность, которая кодирует рассматриваемый полипептид. Конкретные примеры относятся к единственной молекуле нуклеиновой кислоты, кодирующей полипептид, в котором последовательность TraP23 слита с N-концом представляющего интерес полипептида.
В некоторых вариантах осуществления синтетический транзитный пептид хлоропласта может представлять собой химерный CTP. Синтетический CTP может быть получен путем рандомизированной селекции аминокислот из выравнивания ферментов EPSPS. Фигура 2 показывает выравнивание последовательностей CTP, которые были выделены из ферментов EPSPS у растений. Таким образом, можно получать аминокислотную последовательность, кодирующую синтетический СТР, путем рандомизированной селекции аминокислотных последовательностей из выравнивания последовательностей нативного транзитного пептида хлоропласта. В этих и других примерах смежная аминокислотная последовательность из эталонных последовательностей CTP, используемых для создания выравнивания, может содержать синтетический СТР.
Специалисту в данной области будет очевидно, что после селекции первой смежной аминокислотной последовательности в синтетической последовательности CTP идентификация и отбор последовательности смежных аминокислот из остальной части гомологичной последовательности CTP в соответствии с вышеизложенным способом получения становятся однозначными и автоматическими. В некоторых примерах длина первой последовательности смежных аминокислот может составлять приблизительно от 25 приблизительно до 41 аминокислоты (например, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41 и 42 аминокислоты в длину).
Примеры белковых последовательностей синтетического СТР согласно вышеуказанному способу представлены последовательностью SEQ ID NO: 11. Специалист в данной области техники сможет непосредственно предполагать род нуклеотидных последовательностей, кодирующих эти пептиды, учитывая вырожденность генетического кода. Эти конкретные примеры иллюстрируют структурные признаки синтетических СТР путем включения смежных последовательностей из выравнивания гомологичных CTP среди одного из нескольких ортологов ESPSP у разных видов растений.
Некоторые варианты осуществления включают в себя функциональные варианты синтетического транзитного пептида хлоропласта и/или кодирующие их нуклеиновые кислоты. Такие функциональные варианты включают в себя, например, и без ограничения: последовательность, кодирующую синтетический CTP, показанную в SEQ ID NO: 11, и/или CTP, кодируемый этой последовательностью; нуклеиновую кислоту, которая кодирует синтетический СТР, содержащий смежную аминокислотную последовательность в пределах SEQ ID NO: 11, и/или CTP, кодируемый этой последовательностью; усеченную последовательность, кодирующую синтетический СТР, которая содержит смежную последовательность нуклеиновой кислоты SEQ ID NO: 12; усеченную последовательность, кодирующую синтетический СТР, которая содержит смежную последовательность нуклеиновых кислот, по существу гомологичную последовательности SEQ ID NO: 12; усеченный синтетический СТР, который содержит смежную аминокислотную последовательность SEQ ID NO: 11; нуклеиновую кислоту, которая кодирует синтетический СТР, содержащий смежную аминокислотную последовательность SEQ ID NO: 11, и/или CTP кодируемый этой последовательностью; нуклеиновую кислоту, которая кодирует синтетический СТР, содержащий смежную аминокислотную последовательность в пределах SEQ ID NO: 11, имеющую одну или несколько консервативных аминокислотных замен, и/или CTP, кодируемый этой последовательностью; и нуклеиновую кислоту, которая кодирует синтетический СТР, содержащий смежную аминокислотную последовательность в пределах SEQ ID NO: 11, имеющую одну или несколько неконсервативных аминокислотных замен, которые показывают нацеливание функционально связанного пептида на пластиды в пластид-содержащей клетке и/или CTP, кодируемый этой последовательностью.
Таким образом, некоторые варианты осуществления настоящего изобретения включают в себя молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, кодирующую синтетический СТР, которая содержит одну или несколько консервативных аминокислотных замен. Такая молекула нуклеиновой кислоты может быть полезной, например, в молекулярно-биологических технологиях для облегчения манипуляций с последовательностью по изобретению, кодирующей CTP. Например, в некоторых вариантах осуществления последовательность по изобретению, кодирующую CTP, можно вставлять в подходящий вектор для субклонирования последовательности в экспрессирующий вектор, или последовательность по изобретению, кодирующую CTP, можно вводить в молекулу нуклеиновой кислоты, что облегчает получение дополнительной молекулы нуклеиновой кислоты, содержащей последовательность, кодирующую СТР, которая функционально связана с нуклеотидной последовательностью, представляющей интерес. В этих и других вариантах осуществления можно удалять одну или несколько аминокислотных позиций в последовательности синтетического CTP. Например, последовательность синтетического CTP можно модифицировать с удалением аминокислоты (аминокислот) в 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 позиции в последовательности. Выравнивание гомологичных последовательностей CTP можно использовать в качестве руководства относительно того, какие аминокислоты могут быть удалены без влияния на функцию синтетического CTP.
В конкретных примерах синтетический транзитный пептид хлоропласта имеет длину меньше 80 аминокислот. Например, синтетический СТР может иметь 79, 78, 77, 76, 75, 74, 73, 72, 71, 70, 69, 68, 67, 66, 65, 64, 63, 62, 61, 60 или меньше аминокислот в длину. В некоторых примерах синтетический СТР может иметь длину приблизительно в 65 аминокислот, приблизительно в 68, приблизительно в 72 или приблизительно в 74 аминокислоты. В этих и последующих примерах синтетический СТР может содержать аминокислотную последовательность, представленную в SEQ ID NO: 11 или функциональный вариант вышеуказанной последовательности. Таким образом, синтетический СТР может содержать аминокислотную последовательность SEQ ID NO: 11, или ее функциональный вариант, при этом длина синтетического CTP составляет менее 80 аминокислот. В некоторых примерах синтетический СТР может содержать аминокислотную последовательность, которая, например, идентична последовательности из SEQ ID NO: 11 по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 92%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или 100%.
Специалисты в данной области техники в свете настоящего описания смогут распознать все нуклеотидные последовательности, которые кодируют конкретный синтетический белок CTP, например, пептид TraP23 из SEQ ID NO: 11, или функциональные варианты любой из вышеуказанных последовательностей, включающие в себя любые конкретные делеции и/или консервативные аминокислотные замены. Вырожденность генетического кода дает конечное число кодирующих последовательностей для конкретной аминокислотной последовательности. Выбор конкретной последовательности для кодирования синтетического СТР происходит по усмотрению специалиста. Для разных применений могут быть желательными разные кодирующие последовательности. Например, для увеличения экспрессии синтетического CTP в определенном хозяине можно выбирать кодирующую последовательность, которая отражает сисиематическую ошибку при использовании кодонов хозяина. В качестве примера, синтетический СТР может быть кодирован нуклеотидной последовательностью, показанной в SEQ ID NO: 12.
В молекулах нуклеиновых кислот, представленных в некоторых вариантах осуществления настоящего изобретения, последний кодон из нуклеотидной последовательности, кодирующей синтетический СТР, и первый кодон представляющей интерес нуклеотидной последовательности, могут быть разделены с помощью любого количества нуклеотидных триплетов, например, без кодирования интрона или стоп-кодона. В некоторых примерах, последовательность, кодирующую первые аминокислоты зрелого белка, обычно ассоциированного с транзитным пептидом хлоропласта в природном полипептиде-предшественнике, может находиться между последним кодоном нуклеотидной последовательности, кодирующей синтетический СТР, и первым кодоном представляющей интерес нуклеотидной последовательности. Последовательность, отделяющая нуклеотидную последовательность, кодирующую синтетический СТР, и первый кодон представляющей интерес нуклеотидной последовательности, например, может состоять из любой последовательности, и предполагается, что таким образом кодируемая аминокислотная последовательность не может значительно изменять трансляцию химерного полипептида и его перемещение к пластиде. В этих и других вариантах осуществления последний кодон в нуклеотидной последовательности, кодирующей синтетический транзитный пептид хлоропласта, может быть слит в регистр-фазе с первым кодоном представляющей интерес нуклеотидной последовательности, непосредственно смежной с ней, или отделен от него не более чем короткой пептидной последовательностью, которая кодируется, например, нуклеотидным синтетическим линкером (например, нуклеотидным линкером, который можно использовать для достижения слияния).
В некоторых вариантах осуществления может быть желательной модификация нуклеотидов в представляющей интерес нуклеотидной последовательности и/или в последовательности, кодирующей синтетический CTP, слитой с ней в единую кодирующую последовательность, например, для усиления экспрессии кодирующей последовательности в определенном хозяине. 64 возможных кодона представляют собой избыточный генетический код, но большинство организмов преимущественно задействует подмножество этих кодонов. Наиболее часто используемые в видах организмов кодоны называются оптимальными кодонами, и кодоны, которые используются не очень часто, считаются редкими или слабо-используемыми кодонами. Zhang et al. (1991) Gene 105:61-72. Кодоны могут быть замещены, чтобы отображать использование предпочтительного кодона у конкретного хозяина, и это явление иногда называют "оптимизацией кодона". Можно получать оптимизированные кодирующие последовательности, содержащие кодоны, которые предпочтительны для конкретного прокариотического или эукариотического хозяина, например, для увеличения скорости трансляции или для получения рекомбинантных РНК-транскриптов, имеющих желательные свойства (например, более длительный период полужизни по сравнению с транскриптами, полученными из неоптимизированной последовательности).
Любой полипептид можно нацеливать на пластиду в пластид-содержащей клетке путем внедрения последовательности синтетического CTP. Например, в некоторых вариантах осуществления полипептид может быть связан с последовательностью синтетического CTP, чтобы направлять полипептид на пластиду в клетке, в которой экспрессируется молекула связанного полипептида-CTP. В конкретных вариантах осуществления полипептид, нацеленный на пластиды путем внедрения последовательности синтетического CTP, может представлять собой, например, полипептид, который обычно экспрессируется в пластидах в клетке, где существует нативная экспрессия этого полипептида. Например, и без ограничения, полипептид, нацеленный на пластиды путем внедрения последовательности синтетического CTP, может представлять собой полипептид, вовлеченный в толерантность к гербицидам, устойчивость к вирусам, устойчивость к бактериальным патогенам, устойчивость к насекомым, устойчивость к нематодам или устойчивость к грибкам. См., например, патенты США 5569823, 5304730, 5495071, 6329504 и 6337431. Полипептид, нацеленный на пластиду путем внедрения последовательности синтетического CTP, альтернативно может представлять собой, например, и без ограничения, полипептид, вовлеченный в урожайность или силу роста растений (включая в себя полипептиды, вовлеченные в толерантность к экстремальным температурам, состоянию почвы, уровню освещенности, количеству воды и химическому составу окружающей среды), или полипептид, который можно использовать в качестве маркера для идентификации растений, содержащих представляющий интерес признак (например, селектируемый маркерный генный продукт, полипептид, участвующий в окраске семян и т.д.).
Неограничивающие примеры полипептидов, вовлеченных в толерантность к гербицидам, которые могут быть связаны с последовательностью синтетического CTP, в некоторых вариантах осуществления настоящего изобретения включают в себя ацетолактат-синтазу (АЛС), мутантную АЛС и предшественники АЛС (см., например, патент США 5013659), EPSPS (см, например, патенты США 4971908 и 6225114), такие как CP4 EPSPS или EPSPS класса III, ферменты, модифицирующие физиологические процессы, которые происходят в пластидах, включающие в себя фотосинтез и синтез жирных кислот, аминокислот, масел, аротеноидов, терпеноидов, крахмала и т.д. Другие неограничивающие примеры полипептидов, которые могут быть связаны с синтетическим транзитным пептидом хлоропласта в конкретных вариантах осуществления, включают в себя зеаксантин-эпоксидазу, холин-монооксигеназу, феррохелатазу, десатуразу омега-3 жирных кислот, глутаминсинтетазу, крахмал-модифицирующие ферменты, полипептиды, участвующие в синтезе незаменимых аминокислот, провитамина А, гормонов, белков - Bt токсинов и т.д. Нуклеотидные последовательности, кодирующие указанные выше пептиды, известны в данной области техники, и такие нуклеотидные последовательности могут быть функционально связаны с нуклеотидной последовательностью, кодирующей синтетический СТР, который должен экспрессироваться в полипептиде, содержащем рассматриваемый полипептид, связанный с синтетическим CTP. Кроме того, специалисты в данной области могут идентифицировать дополнительные нуклеотидные последовательности, кодирующие любой из вышеуказанных полипептидов (например, путем клонирования генов с высоким уровнем гомологии с другими генами, кодирующими конкретный полипептид). После идентификации такой нуклеотидной последовательности не вызывает трудностей способ создания нуклеотидной последовательности, содержащей последовательность, кодирующую синтетический СТР, которая функционально связана с идентифицированной нуклеотидной последовательностью или с последовательностью, кодирующей, эквивалентный полипептид.
V. Экспрессия полипептидов, содержащих синтетический транзитный пептид хлоропласта
В некоторых вариантах осуществления в клетки, ткани или организм можно вводить по меньшей мере одну молекулу нуклеиновой кислоты (молекулы), содержащую нуклеотидную последовательность, кодирующую полипептид, который содержит по меньшей мере один синтетический СТР, или ее функциональный эквивалент, для экспрессии в полипептида в клетке, ткани или организме. В конкретных вариантах осуществления молекула нуклеиновой кислоты может содержать представляющую интерес нуклеотидную последовательность, функционально связанную с нуклеотидной последовательностью, кодирующей синтетический СТР. Например, молекула нуклеиновой кислоты может содержать кодирующую последовательность, которая кодирует полипептид, содержащий по меньшей мере один синтетический СТР, и по меньшей мере одну дополнительную пептидную последовательность, кодируемую представляющей интерес нуклеотидной последовательностью. В некоторых вариантах осуществления молекула нуклеиновой кислоты по изобретению может быть введена в пластид-содержащую клетку-хозяин, ткань или организм (например, в клетку растения, растительную ткань и растение), таким образом, что может происходить экспрессия полипептида из молекулы нуклеиновой кислоты в пластид-содержащей клетке-хозяине, ткани или организме, при этом экспрессированный полипептид содержит по меньшей мере один синтетический СТР и по меньшей мере одну дополнительную пептидную последовательность, кодируемую нуклеотидной последовательностью, представляющей интерес. В некоторых примерах синтетический СТР такого экспрессиррованного полипептида может способствовать нацеливанию части полипептида, содержащего, по меньшей мере дополнительную пептидную последовательность, на пластиду из клетки-хозяина, ткани или организма.
В некоторых вариантах осуществления молекула нуклеиновой кислоты по изобретению может быть введена в пластид-содержащие клетки с помощью одной из каких-либо методик, известных специалистам в данной области. В конкретных вариантах осуществления клетка-хозяин, ткань или организм может контактировать с молекулой нуклеиновой кислоты согласно изобретению, с целью внедрения молекулы нуклеиновой кислоты в клетку, ткань или организм. В конкретных вариантах осуществления клетки могут быть трансформированы с молекулой нуклеиновой кислоты согласно изобретению таким образом, что эта молекула нуклеиновой кислоты вводится в клетку, и эта молекула нуклеиновой кислоты стабильно интегрируется в геном клетки. В некоторых вариантах осуществления молекула нуклеиновой кислоты, содержащая по меньшей мере одну нуклеотидную последовательность, кодирующую синтетический СТР, функционально связанную с представляющей интерес нуклеотидной последовательностью, можно использовать для трансформации клетки, например, пластид-содержащей клетки (например, клетки растения). Для инициации или усиления экспрессии молекула нуклеиновой кислоты может содержать одну или несколько регуляторных последовательностей, и эти регуляторные последовательности могут быть функционально связаны с нуклеотидной последовательностью, кодирующей полипептид, который содержит по меньшей мере один синтетический СТР.
Молекула нуклеиновой кислоты может представлять собой, например, векторную систему, включающую в себя, например, линейную или замкнутую кольцевую плазмиду. В конкретных вариантах осуществления вектор может представлять собой вектор экспрессии. Последовательности нуклеиновых кислот согласно изобретению могут, например, быть встроены в вектор, так, что последовательность нуклеиновой кислоты будет функционально связана с одной или несколькими регуляторными последовательностями. Для этой цели доступно множество векторов, и выбор конкретного вектора может зависеть, например, от размера нуклеиновой кислоты, вставляемой в вектор, и от конкретной клетки-хозяина, которую трансформируют этим вектором. Вектор обычно содержит различные компоненты, идентичность которых зависит от функции вектора (например, амплификация ДНК и экспрессия ДНК) и от конкретной клетки-хозяина (клеток-хозяев), с которой вектор является совместимым.
Некоторые варианты осуществления могут включать в себя вектор для трансформации растений, который содержит нуклеотидную последовательность, содержащую по меньшей мере одну из описанных выше регуляторных последовательностей, функционально связанных с одной или несколькими нуклеотидными последовательностями, кодирующими полипептид, который содержит по меньшей мере один синтетический СТР. В растительной клетке, ткани или организме может экспрессироваться одна или несколько нуклеотидных последовательностей под контролем регуляторной последовательности (последовательностей) для создания полипептида, содержащего синтетический СТР, который нацелен по меньшей мере на участок полипептида в пластиде в растительной клетке, ткани или в организме.
В некоторых вариантах осуществления регуляторная последовательность, функционально связанная с нуклеотидной последовательностью, кодирующей полипептид, который содержит по меньшей мере один синтетический СТР, может представлять собой промоторную последовательность, которая действует в клетке-хозяине, например, в бактериальной клетке, которая предназначена для амплификации молекулы нуклеиновой кислоты, или в растительной клетке, которая предназначена для экспрессии молекулы нуклеиновой кислоты. Промоторы, подходящие для использования в молекулах нуклеиновых кислот по изобретению, включают в себя индуцируемые, вирусные, синтетические или конститутивные промоторы, все из которых хорошо известны в данной области техники. Неограничивающие примеры промоторов, которые могут быть полезны в вариантах осуществления настоящего изобретения, рассмотрены в следующих патентах: патенты США №№ 6437217 (промотор кукурузы RS81), 5641876 (промотор актина риса), 6426446 (промотор кукурузы RS324), 6429362 (промотор кукурузы PR-1), 6232526 (промотор кукурузы A3), 6177611 (конститутивные промоторы кукурузы), 5322938, 5352605, 5359142 и 5530196 (промотор 35S), 6433252 (промотор олеозина кукурузы L3), 6429357 (промотор актина риса 2 и интрон актина риса 2), 6294714 (свето-индуцируемые промоторы), 6140078 (соль-индуцируемые промоторы), 6252138 (патоген-индуцируемые промотеры), 6175060 (промоторы, индуцируемые дефицитом фосфора), 6388170 (двунаправленные промотеры), 6635806 (промотор гамма-коиксина), и в патентной заявке США серийный номер 09/757089 (промотер альдолазы хлоропластов кукурузы).
Дополнительные иллюстративные промоторы включают в себя промотор нопалин-синтазы (NOS) (Ebert et al. (1987), Proc. Natl. Acad. Sci. USA 84 (16): 5745-9), промотор октопин-синтазы (OCS), (который содержится в опухоль-индуцирующих плазмидах из Agrobacterium tumefaciens), каулимовирусные промоторы, такие как 19S промотор вируса мозаики цветной капусты (CaMV) (Lawton et al. (1987) Plant Mol. Biol. 9:315-24), промотор 35S CaMV (Odell et al. (1985) Nature 313:810-2, 35S-промотор вирус мозаики норичника (Walker et al. (1987) Proc. Natl. Acad. Sci. USA 84(19):6624-8), промотор сахарозосинтазы (Yang and Russell (1990) Proc. Natl. Acad. Sci. USA 87:4144-8), промотор генного комплекса R (Chandler et al. (1989) Plant Cell 1:1175-83), промотор гена a/b белка, связывающего хлорофилл, CaMV35S (патенты США №№ 5322938, 5352605, 5359142 и 5530196), FMV35S (патенты США №№ 6051753 и 5378619), промотор PC1 SV (патент США № 5850019), промотор SCPL (патент США № 6677503), и AGRtu.nos промотеры (GenBank регистрационный номер No. V00087, Depicker et al. (1982) J. Mol. Appl. Genet. 1:561-73, Bevan et al. (1983) Nature 304:184-7).
В конкретных вариантах осуществления молекулы нуклеиновой кислоты согласно изобретению могут включать в себя ткане-специфичный промотор. Тканеспецифичный промотор представляет собой нуклеотидную последовательность, которая определяет более высокий уровень транскрипции функционально связанной нуклеотидной последовательности в ткани, для которой этот промотор является специфичным, по сравнению с другими тканями организма. Примеры тканеспецифичных промоторов включают в себя без ограничения специфичные для тапетума промоторы, специфичные для пыльника промоторы, специфичные для пыльцы промоторы (см., например, патент US № 7141424 и международную РСТ публикацию WO 99/042587), специфичные для семяпочки промоторы (см., например, заявку на патент US 2001/047525 A1), специфичные для плодов промоторы (см., например, патенты США № 4943674 и 5753475) и специфичные для семян промоторы (см., например, патенты США № 5420034 и 5608152). В некоторых вариантах осуществления в композиции или способе по изобретению можно использовать промотор, специфичный для стадии развития (например, промотор, действующий на более поздней стадии развития).
Дополнительные регуляторные последовательности, которые в некоторых вариантах осуществления могут быть функционально связаны с молекулой нуклеиновой кислоты, включают в себя 5'-UTR (нетранслируемые области), расположенные между промоторной последовательностью и кодирующей последовательностью, которые функционируют в качестве трансляционной лидерной последовательности. Трансляционная лидерная последовательность присутствует в полностью процессированной мРНК, и она может влиять на процессирование первичного транскрипта и/или на стабильность РНК. Примеры трансляционных лидерных последовательностей включают в себя лидерные последовательности белков теплового шока кукурузы и петунии (патент США № 5362865), лидерные последовательности оболочечных белков вирусов растений, лидерные последовательности rubisco (рибулозо-1,5-бифосфаткарбоксилазы/оксигеназы) и другие. См., например, Turner and Foster (1995) Molecular Biotech. 3(3):225-36. Неограничивающие примеры 5'-UTR представлены следующими последовательностями: GmHsp (патент США № 5659122), PhDnaK (патент США № 5362865), AtAnt1, TEV (Carrington and Freed (1990) J. Virol. 64:1590-7), и AGRtunos (GenBank регистрационный номер V00087, и Bevan et al. (1983) Nature 304:184-7).
Дополнительные регуляторные последовательности, которые в некоторых вариантах осуществления могут быть функционально связаны с молекулой нуклеиновой кислоты, также включают в себя 3'-нетранслируемые последовательности, 3'-области терминации транскрипции или области полиаденилирования. Они представляют собой генетические элементы, расположенные в 5'-3' направлении от нуклеотидной последовательности, и включают в себя полинуклеотиды, которые создают сигнал полиаденилирования и/или другие регуляторные сигналы, способные влиять на транскрипцию или процессирование мРНК. Фунция сигнала полиаденилирования у растений заключается в индукции присоединения полиаденилатнуклеотидов к 3'-концу предшественника мРНК. Последовательность полиаденилирования может быть получена из разных растительных генов или из генов Т-ДНК. Неограничивающим примером области 3'-терминации транскрипции является 3'-область нопалинсинтазы (nos-3', Fraley et al. (1983), Proc. Natl. Acad. Sci. USA 80: 4803-7). Пример использования различных 3'-нетранслируемых областей представлен в публикации Ingelbrecht et al. (1989) Plant Cell 1:671-80. Неограничивающие примеры сигналов полиаденилирования включают в себя сигнал из гена Pisum sativum RbcS2 (Ps.RbcS2-E9, Coruzzi et al. (1984) EMBO J. 3: 1671-9.) и AGRtu.nos (Genbank, регистрационный номер E01312).
Рекомбинантная молекула нуклеиновой кислоты или вектор по настоящему изобретению может содержать селектируемый маркер, который придает селектируемый фенотип трансформированной клетке, например, растительной клетке. Селектируемые маркеры также можно использовать для выбора растений или растительных клеток, которые содержат рекомбинантную молекулу нуклеиновой кислоты по изобретению. Маркер может кодировать устойчивость к биоцидам, устойчивость к антибиотикам (например, к канамицину, генетицину (G418), блеомицину, гигромицину и т.д.) или толерантность к гербицидам (например, к глифосату и т.д.). Примеры селектируемых маркеров включают в себя без ограничения: ген neo, кодирующий устойчивость к канамицину, который можно выбирать для применения канамицина, G418 и т.д.; ген bar, который кодирует устойчивость к биалафосу; мутантный ген EPSPS-синтазы, который кодирует устойчивость к глифосату; ген нитрилазы, который придает устойчивость к бромоксинилу; мутантный ген ацетолактат-синтазы (АЛС), который придает устойчивость к имидазолинону или сульфонилмочевине; и ген DHFR устойчивости к метотрексату. Доступен ряд селектируемых маркеров, которые придают устойчивость к ампициллину, блеомицину, хлорамфениколу, гентамицину, канамицину, гигромицину, линкомицину, метотрексату, фосфинотрицину, пуромицину, спектиномицину, рифампицину, стрептомицину и тетрациклину и т.п. Примеры таких селектируемых маркеров показаны, например, в патентах США 5550318, 5633435, 5780708 и 6118047.
Рекомбинантная молекула нуклеиновой кислоты или вектор по настоящему изобретению могут аналогично или альтернативно содержать маркер для скрининга. Маркеры для скрининга могут быть использованы для контроля экспрессии. Примеры маркеров для скрининга включают в себя ген β-глюкуронидазы или uidA (GUS), кодирующий фермент, для которого известны различные хромогенные субстраты (Jefferson et al. (1987) Plant Mol. Biol. Rep. 5: 387-405), ген R-локуса, кодирующий продукт, который регулирует выработку пигментов антоцианов (красного цвета) в тканях растений (Dellaporta et al. (1988) "Molecular cloning of the maize R-nj allele by transposon tagging with Ac" в материалах 18-го симпозиума генетиков Stadler Genetics Symposium, P. Gustafson and R. Appels, eds. (New York: Plenum), стр. 263-82), ген β-лактамазы (Sutcliffe et al. (1978) Proc. Natl. Acad. Sci. USA 75:3737-41), ген, кодирующий фермент, для которого известны различные хромогенные субстраты (например, PADAC, хромогенный цефалоспорин), ген люциферазы (Ow et al. (1986) Science 234: 856-9.), ген xylE, кодирующий катехиндиоксигеназу, которая может превращать хромогенные катехины (Zukowski et al. (1983) Gene 46 (2-3) 247-55.), ген амилазы (Ikatu et al. (1990) Bio/Technol 8:241-2), ген тирозиназы, кодирующий фермент, который способен окислять тирозин в ДОФА и допахинон, который, в свою очередь, конденсируется до меланина (Katz et al. (1983), J. Gen. 129 2703-14.) и α-галактозидазы.
Подходящие способы трансформации клеток-хозяев включают в себя любой способ, с помощью которого в клетку можно вводить ДНК, например, и без ограничения: путем трансформации протопластов (см., например, патент США 5508184), путем опосредуемого высушиванием/ингибированием захвата ДНК (см., например, Potrykus et al. (1985) Mol. Gen. Genet. 199:183-8), путем электропорации (см., например, патент США 5384253), путем взбалтывания с волокнами карбида кремния (см., например, патенты США 5302523 и 5464765), путем Agrobacterium-опосредуемой трансформации (см., например, патенты США 5563055, 5591616, 5693512, 5824877, 5981840 и 6384301) и путем акселерации частиц, покрытых ДНК (см., например, патенты США 5015580, 5550318, 5538880, 6160208, 6399861 и 6403865) и т.д. Путем применения упомянутых способов можно стабильно трансформировать клетки практически любого вида. В некоторых вариантах осуществления трансформирующая ДНК интегрирована в геном клетки-хозяина. У многоклеточных видов трансгенные клетки можно регенерировать в трансгенный организм. Можно использовать любой из упомянутых способов для получения трансгенного растения, например, с содержанием в геноме трансгенного растения одной или нескольких последовательностей нуклеиновых кислот по изобретению.
Наиболее широко используемый способ введения вектора экспрессии в растения основан на природной системе трансформации Agrobacterium. Бактерии A. tumefaciens и A. rhizogenes представляют собой растительные патогенные почвенные бактерии, которые генетически трансформируют растительные клетки. Плазмиды Ti и Ri из A. tumefaciens и A. rhizogenes, соответственно, несут гены, ответственные за генетическую трансформацию растений. Плазмиды Ti (опухоль-индуцирующие) содержат большой сегмент, называемый Т-ДНК, который переносится в трансформированные растения. Другой сегмент плазмиды Ti, участок vir, отвечает за перенос Т-ДНК. Область Т-ДНК ограничена концевыми повторами. В некоторых модифицированных бинарных векторах удаляли опухоль-индуцирующие гены, и функции участка vir задействовали для переноса чужеродной ДНК, ограниченной пограничными последовательностями Т-ДНК. Т-область также может содержать, например, селектируемый маркер для эффективного восстановления трансгенных растений и клеток, и сайт множественного клонирования для вставки последовательностей в целях переноса, например, нуклеиновой кислоты, кодирующей синтетический СТР.
Таким образом, в некоторых вариантах осуществления вектор трансформации растений можно получать из Ti плазмиды A. tumefaciens (см., например, патенты США №№ 4536475, 4693977, 4886937 и 5501967, и Европейский патент EP 0122791) или из Ri плазмиды A. rhizogenes. Дополнительные векторы трансформации растений включают в себя, в качестве примера и без ограничения, векторы, описанные авторами Herrera-Estrella et al. (1983) Nature 303:209-13; Bevan et al. (1983) Nature 304:184-7; Klee et al. (1985) Bio/Technol (1985) 3:637-42, и в европейском патенте ЕР 0120516, и векторы, полученные из чего-либо вышеперечисленного. Можно модифицировать другие бактерии, такие как Sinorhizobium, Rhizobium и Mesorhizobium, которые в природе взаимодействуют с растениями, чтобы сделать их медиаторами переноса генов для некоторых различных растений. Эти ассоциированные с растениями симбиотические бактерии можно делать компетентными для переноса гена путем приобретения как нейтрализованной плазмиды Ti, так и подходящего бинарного вектора.
После введения экзогенной ДНК в клетки-реципиенты обычно проводят идентификацию трансформированных клеток для дальнейшего культивирования и регенерации растений. Чтобы повысить возможность идентификации трансформированных, клеток может быть желательным использовать селектируемый или скринируемый маркерный ген, как указано выше, с вектором, применяемым для создания трансформанта. В случае использования селектируемого маркера идентификацию трансформированных клеток в клеточной популяции потенциально трансформированных клеток проводят путем воздействия на клетки селективного агента или агентов. В случае использования скринируемого маркера можно проводить скрининг клеток на маркерный ген желаемого признака.
Клетки, выжившие после воздействия селективного агента, или клетки, определенные в скрининге как положительные, можно культивировать в среде, которая способствует регенерации растений. В некоторых вариантах осуществления любую подходящую среду для культивирования растительной ткани (например, среды MS и N6) можно модифицировать путем включения в нее дополнительных веществ, таких как регуляторы роста. Ткань может находиться в базовой среде с регуляторами роста, до тех пор, пока имеется достаточное количество ткани для начала попытки регенерации растений, или после неоднократных циклов ручной селекции, пока морфология ткани подходит для регенерации (например, в течение по меньшей мере 2 недель), и затем переносится в среду, способствующую образованию побегов. Перенос культуры осуществляют периодически до момента достаточного образования побегов. После образования побегов их переносят в среду, способствующую корнеобразованию. После образования достаточного количества корней растения можно переносить в почву для дальнейшего роста и созревания.
Для подтверждения присутствия в регенерирующем растении молекулы нуклеиновой кислоты, представляющей интерес (например, нуклеотидной последовательности, кодирующей полипептид, который содержит по меньшей мере один синтетический СТР), можно проводить множество анализов. Такие анализы включают в себя, например, молекулярно-биологические исследования, такие как саузерн-блоттинг, нозерн-блоттинг, ПЦР и секвенирование нуклеиновых кислот; биохимические анализы, такие как обнаружение присутствия белкового продукта, например, с помощью иммунологических способов (иммуноферментный анализ ELISA и/или вестерн-блоттинг) или посредством ферментативной функции; исследования части растений, например, анализы листьев или корней, и исследование фенотипа всего регенерированного растения.
В качестве примера, объект интеграции можно анализировать с помощью ПЦР-амплификации с использованием, например, олигонуклеотидных праймеров, специфичных для представляющей интерес нуклеотидной последовательности. Следует понимать, что ПЦР-генотипирование включает в себя без ограничения амплификацию с полимеразной цепной реакцией (ПЦР) геномной ДНК, полученной из выделенной ткани растения-хозяина, которая предположительно содержит представляющую интерес молекулу нуклеиновой кислоты, интегрированную в геном, с последующим стандартным клонированием и анализом последовательностей продуктов ПЦР-амплификации. Способы ПЦР-генотипирования хорошо описаны (см, например, Rios, G. et al. (2002) Plant J. 32: 243-53), и могут применяться к геномной ДНК, полученной из любых видов растений (например, Z. Mays или G. max) или типов тканей, в том числе из клеточных культур.
Трансгенное растение, образованное с использованием Agrobacterium-опосредуемых способов трансформации, обычно содержит единственную рекомбинантную последовательность ДНК, вставленную в одну хромосому. Эта единственная рекомбинантная последовательность ДНК называется "трансгенным объектом" или "объектом интеграции". Такие трансгенные растения являются гетерозиготными по вставленной последовательности ДНК. В некоторых вариантах осуществления можно получать трансгенное растение, гомозиготное в отношении трансгена, путем полового спаривания (самооплодотворения) независимого трансгенного растения-сегреганта, которое содержит единственную экзогенную для себя последовательность гена, например, растение F0, для получения семян F1. Одна четверть полученных семян F1 будет гомозиготной в отношении этого трансгена. Прорастающие семена F1 превращаются в растения, которые можно тестировать на гетерозиготность, обычно с помощью анализа однонуклеотидного полиморфизма (SNP) или термальной амплификации, которые позволяют определять различия между гетерозиготами и гомозиготами (т.е. анализ на зиготность).
В конкретных вариантах осуществления копии по меньшей мере, одного полипептида, содержащего по меньшей мере один синтетический СТР, получают в пластид-содержащей клетке, в которую была введена по меньшей мере одна молекула (молекулы) нуклеиновой кислоты, содержащая нуклеотидную последовательность, которая кодирует по меньшей мере один полипептид, содержащий по меньшей мере один синтетический СТР. Каждый полипептид, содержащий по меньшей мере один синтетический СТР, может экспрессироваться из множества последовательностей нуклеиновых кислот, вставленных в разные объекты трансформации, или из единственной последовательности нуклеиновой кислоты, вставленной в единственный объект трансформации. В некоторых вариантах осуществления множество таких полипептидов экспрессируется под контролем единственного промотора. В других вариантах осуществления множество таких полипептидов экспрессируется под контролем нескольких промоторов. Можно экспрессировать одиночные полипептиды, которые содержат множество пептидных последовательностей, и каждая из этих пептидных последовательностей должна быть нацелена на пластиду.
В дополнение к прямой трансформации растений с молекулой рекомбинантной нуклеиновой кислоты, трансгенные растения можно получать путем скрещивания первого растения, имеющего по меньшей мере один трансгенный объект, со вторым растением, не имеющим такого объекта. Например, молекулу рекомбинантной нуклеиновой кислоты, содержащую нуклеотидную последовательность, которая кодирует полипептид, содержащий по меньшей мере один синтетический СТР, можно вставлять в растение первой линии, которое поддается трансформации, для получения трансгенного растения, и это трансгенное растение можно скрещивать с растением второй линии, для интрогрессии нуклеотидной последовательность, которая кодирует полипептид, в растение второй линии.
VI. Растительные материалы, содержащие полипептид, ориентированный на синтетический транзитный пептид хлоропластов
В некоторых вариантах осуществления рассматривается растение, отличающееся тем, что это растение содержит растительную клетку, содержащую нуклеотидную последовательность, кодирующую полипептид, который содержит по меньшей мере один синтетический СТР. В конкретных вариантах осуществления такое растение можно получать путем трансформации ткани растения или клетки растения, и регенерации в целое растение. В других вариантах осуществления такое растение можно получать из коммерческих источников, или посредством интрогрессии нуклеиновой кислоты, содержащей нуклеотидную последовательность, кодирующую полипептид, который содержит по меньшей мере один синтетический СТР в зародышевой плазме. Также изобретение относится к растительным материалам, содержащим растительную клетку, которая содержит нуклеотидную последовательность, кодирующую полипептид, содержащий по меньшей мере один синтетический СТР. Такой растительный материал может быть получен из растения, содержащего эту растительную клетку.
Трансгенное растение или растительный материал, содержащий нуклеотидную последовательность, кодирующую полипептид, который содержит по меньшей мере один синтетический СТР, в некоторых вариантах осуществления может показывать одно или несколько из следующих свойств: экспрессию полипептида в клетке растения, экспрессию части полипептида в пластиде из клетки этого растения, поступление полипептида из цитозоля клетки этого растения в пластиды этой клетки, пластид-специфичную экспрессию полипептида в клетке этого растения, и/или локализацию полипептида в клетке этого растения. Такое растение может дополнительно иметь один или несколько других желательных признаков, кроме экспрессии кодируемого полипептида. Такие признаки могут включать в себя, например: устойчивость к насекомым, другим вредителям и болезнетворным агентам; толерантность к гербицидам, повышенную стабильность, урожайность или срок годности, толерантность к условиям окружающей среды, фармацевтическое производство, промышленное производство продукции и улучшение питательных свойств.
Трансгенное растение по изобретению может представлять собой любое растение, которые можно трансформировать с молекулой нуклеиновой кислоты согласно изобретению. Соответственно, растение может быть двудольным или однодольным. Неограничивающие примеры двудольных растений, которые можно использовать в способах настоящего изобретения, включают в себя Arabidopsis, люцерну, бобы, брокколи, капусту, морковь, цветную капусту, сельдерей, китайскую капусту, хлопок, огурцы, баклажаны, салат, дыню, горох, перец, арахис, картофель, тыкву, редис, рапс, шпинат, соевые бобы, кабачки, сахарную свеклу, подсолнечник, табак, томат и арбуз. Неограничивающие примеры однодольных растений, которые можно использовать в способах настоящего изобретения, включают в себя кукурузу, Brassica, лук, рис, сорго, пшеницу, рожь, просо, сахарный тростник, овес, тритикале, просо и газонную траву. Трансгенные растения согласно изобретению можно использовать и культивировать любым способом.
Некоторые варианты осуществления также относятся к товарным продуктам, содержащим одну или несколько нуклеотидных последовательностей, кодирующих полипептид, содержащий по меньшей мере один синтетический СТР, например, к товарному продукту, получаемому из рекомбинантного растения или семян, содержащей одну или несколько упомянутых нуклеотидных последовательностей. Товарные продукты, содержащие одну или несколько нуклеотидных последовательностей, кодирующих полипептид, который содержит по меньшей мере один синтетический СТР, включают в себя, в качестве примера и без ограничения: пищевые продукты, муку, масла, дробленые или цельные зерна или семена растений, содержащих одну или несколько нуклеотидных последовательностей, кодирующих полипептид, который содержит по меньшей мере один синтетический СТР. Обнаружение одной или нескольких нуклеотидных последовательностей, кодирующих полипептид, который содержит по меньшей мере один синтетический СТР, в одном или нескольких потребительских изделиях или товарных продуктах является фактическим доказательством, что потребительское изделие или товарный продукт по меньшей мере частично получен из растения, содержащего одну или несколько нуклеотидных последовательностей, кодирующую полипептид, который содержит по меньшей мере один синтетический СТР. В конкретных вариантах осуществления описание товарный продукт по изобретению содержит определяемое количество последовательностей нуклеиновой кислоты, кодирующих полипептид, содержащий по меньшей мере один синтетический СТР. В некоторых вариантах осуществления такие товарные продукты можно получать, например, путем создания трансгенных растений и приготовления из них пищи или корма.
В некоторых вариантах осуществления трансгенное растение или семена, содержащие трансген, который содержит нуклеотидную последовательность, кодирующую полипептид, содержащий по меньшей мере один синтетический СТР, также может содержать в своем геноме по меньшей мере один другой трансгенный объект, включающий в себя без ограничения: трансгенный объект, из которого транскрибируется молекула иРНК; ген, кодирующий инсектицидный белок (например, инсектицидный белок Bacillus Thuringiensis); ген толерантности к гербицидам (например, ген, обеспечивающий толерантность к глифосату); и ген, способствующий появлению желаемого фенотипа у трансгенного растения (например, повышенной урожайности, измененного метаболизма жирных кислот, или восстановления цитоплазматической мужской стерильности).
VII. Локализация генных продуктов в пластидах, опосредуемая синтетическим транзитным пептидом хлоропластов
Некоторые варианты осуществления настоящего изобретения относятся к способу экспрессии и/или локализации генного продукта в пластиде (например, в хлоропласте). В конкретных вариантах осуществления генным продуктом может быть маркерный генный продукт, например, флуоресцентная молекула. Экспрессия генного продукта как части полипептида, также содержащего синтетический СТР, может служить системой оценки возможности локализации в пластидах конкретной последовательности синтетического CTP. В некоторых вариантах осуществления экспрессия маркерного генного продукта как части полипептида, содержащего синтетический CTP, используется для целевой экспрессии маркерного генного продукта в пластидах в клетке, где экспрессируется полипептид. В некоторых вариантах осуществления такой маркерный генный продукт локализован в пластиде (пластидах) клетки-хозяина. Например, маркерный генный продукт может иметь более высокий уровень экспрессии в пластиде (пластидах), чем в цитозоле или в других органеллах клетки-хозяина; маркерный генный продукт может иметь гораздо более высокий уровень экспрессии в пластиде (пластидах); маркерный генный продукт может экспрессироваться по существу только в пластиде (пластидах); или маркерный генный продукт может полностью экспрессироваться в пластиде (пластидах), так что невозможно обнаружить его экспрессию в цитозоле или в не-пластидных органеллах.
В некоторых вариантах осуществления для оценки свойств функционального варианта пептида используется полипептид, содержащий функциональный вариант синтетического CTP, отличающийся тем, что этот полипептид функционально связан с маркерным генным продуктом. Например, последовательность синтетического CTP можно варьировать, например, путем вставки в синтетический СТР по меньшей мере одной консервативной мутации (мутаций), и полученный пептидный вариант можно присоединять к маркерному генному продукту. После экспрессии в подходящей клетке-хозяине (например, в клетке, в которой один или несколько регуляторных элементов в экспрессионной конструкции являются функциональными) можно определять экспрессию маркерного генного продукта. Путем сравнения субклеточной локализации маркерного генного продукта в эталонной конструкции синтетический CTP - маркер и в конструкции вариантный пептид - маркер, можно определить, имеет ли вариантный пептид, например, более значительную локализацию пластид, или, по существу, идентичную локализацию пластид. Такой вариант может рассматриваться как функциональный вариант. Путем выявления функциональных вариантов синтетического CTP, которые имеют более значительную локализацию пластид, мутации в таких вариантах могут включаться в другие варианты синтетического СТР. Проведение нескольких циклов такого способа оценки и последующая вставка выявленных полезных мутаций в последовательность синтетического CTP может в результате создать итеративный процесс для оптимизации последовательности синтетического CTP. Такие оптимизированные последовательности синтетического СТР и кодирующие их нуклеотидные последовательности считаются частью настоящего изобретения, не зависимо от возможности дополнительной оптимизации путем дополнительной мутации таких оптимизированных последовательностей синтетического CTP.
Все ссылки, включающие в себя цитируемые публикации, патенты и патентные заявки, включены в настоящее раскрытие путем ссылки в той степени, что они не противоречат явным подробностям настоящего раскрытия, и таким образом, включены в той же степени, как если бы по каждой ссылке было отдельно и конкретно указано, что она включена в качестве ссылки и изложена в полном объеме. Ссылки, упоминаемые в настоящем документе, представлены исключительно для их раскрытия до даты подачи настоящей заявки. Ничто в настоящем документе не должно быть истолковано как признание того, что авторы изобретения не имеют права датировать задним числом такое раскрытие на основании предшествующего изобретения.
Следующие примеры приведены для иллюстрации определенных конкретных признаков и/или аспектов. Эти примеры не должны рассматриваться как ограничение настоящего раскрытия конкретными описанными признаками или аспектами.
ПРИМЕРЫ
Пример 1. Конструирование и получение последовательности синтетического транзитного пептида хлоропласта (TraP)
Пластиды представляют собой цитоплазматические органеллы, выявляемые у высших видов растений и расположенные во всех тканях растений. Хлоропласты являются специфическим типом пластид, содержащихся в зеленых фотосинтезирующих тканях, и отвечают за важнейшие физиологические функции. Например, одним из таких первичных физиологических функций является синтез ароматических аминокислот, необходимых для растения. В этом пути биосинтеза необходимы кодируемые в ядре ферменты, которые транспортируются из цитоплазмы к внутренней части хлоропласта. Эти кодируемые в ядре ферменты обычно имеют N-концевой транзитный пептид, который взаимодействует с мембраной хлоропласта для облегчения транспорта пептида в строму хлоропласта. Bruce B. (2000) Chloroplast transit peptides: structure, function, and evolution. Trends Cell Bio. 10:440-447. После переноса стромальные пептидазы расщепляют транзитный пептид, оставляя зрелый функциональный белок перенесенным в хлоропласт. Richter S, Lamppa GK. (1999) Stromal processing peptidase binds transit peptides and initiates their ATP -dependent turnover in chloroplasts. Journ. Cell Bio. 147:33:-43. Транзитные пептиды хлоропластов являются вариабельными последовательности, которые в значительной степени отличаются по длине, составу и строению. Bruce B. (2000) Chloroplast transit peptides: structure, function, and evolution. Trends Cell Bio. 10:440-447. Подобие последовательностей у транзитных пептидов хлоропластов в значительной степени различается среди гомологичных белков из разных видов растений. Количество расхождений между транзитными пептидами хлоропластов является непредсказуемым, учитывая, что гомологичные белки, полученные из разных видов растений, обычно имеют относительно высокие уровни сходства последовательностей при сравнении процессированного зрелого функционального белка.
Была разработана, получена и исследована in planta последовательность нового синтетического транзитного пептида хлоропластов. Было показано, что новый синтетический транзитный пептид хлоропластов обладает эффективными свойствами транслокации и процессирования для поступления агрономических важных белков в хлоропласты. Вначале анализировали нативные белковые последовательности 5-энолпирувилшикимат-3-фосфат-синтазы (EPSPS) из разных видов растений с помощью компьютерной программы ChloroP™, чтобы определить предполагаемые последовательности транзитного пептида хлоропласта (Emanuclsson O, Nielsen H, von Heijne G, (1999) ChloroP, a neural network-based method for predicting chloroplast transit peptides and their cleavage sites, Protein Science 8; 978-984), доступной по адресу http://www.cbs.dtu.dk/services/ChloroP/. С помощью выравнивания последовательностей транзитного пептида хлоропластов были разработаны новые синтетические транзитные пептиды хлоропластов путем случайного выбора аминокислот для получения последовательности нового синтетического предполагаемого транзитного пептида хлоропластов. Иллюстративной последовательностью нового сконструированного синтетического транзитного пептида хлоропластов является TraP23 (SEQ ID NO: 11). Новый синтетический транзитный пептид хлоропластов исследовали с помощью ряда тестов, которые включали в себя транзиторное тестирование in planta системы экспрессии и трансгенное исследование в виде стабильной трансформации объекта, содержащего элемент генной экспрессии, слитый с агрономически важной последовательностью трансгена.
Пример 2. Транзиторное in planta тестирование последовательностей синтетического транзитного пептида хлоропластов (TraP)
Транзиторный анализ табака
Вначале тестировали последовательность Trap23 синтетического транзитного пептида хлоропластов посредством транзиторного анализа in planta. Была синтезирована полинуклеотидная последовательность, которая кодирует Trap23v2 (SEQ ID NO: 12) последовательности синтетического транзитного пептида хлоропластов. Полученная конструкция содержала две единицы транскрипции растений (PTU).
Первая PTU состояла из промотора Убиквитин 10 Arabidopsis thaliana (промотор AtUbi10; Callis, et al., (1990) J. Biol Chem, 265: 12486-12493), слияния генов TraP-зеленый флуоресцентный белок (Trap-GFP; патент США № 7678893) и 3'-нетранслируемой области ORF 23 Agrobacterium tumefaciens (AtuORF23 3'UTR; патент США № 5428147). Вторая PTU состояла из промотора вируса мозаики маниоки Cassava Vein Mosaic Virus (промотор CsVMV; Verdaguer et al., (1996) Plant Molecular Biology, 31: 1129-1139), DSM-2 (DSM2; патент США App № 2011/0107455) и 3'-нетранслируемой области ORF 1 Agrobacterium tumefaciens (AtuORF1 3'UTR; Huang et al., (1990) J. Bacteriol, 172: 1814-1822). Конструкция pDAB107640 содержит синтетический транзитный пептид хлоропластов TraP23v2 (фиг. 3). Конструкции подтверждали путем расщепления ферментом рестрикции и секвенирования. И наконец, конструкции трансформировали в Agrobacterium tumefaciens и сохраняли в виде глицеринового стокового раствора.
Полную петлю замороженной культуры инокулировали из глицеринового стокового раствора Agrobacterium в 2 мл пептон-декстрозы дрожжей (YPD) (100 мкг/мл спектиномицина) в стерильной пробирке объемом 14 мл. Инокулированную среду инкубировали при 28°С в течение ночи с взбалтыванием при 200 оборотах в минуту. На следующий день приблизительно 100 мкл культуры использовали для инокуляции 25 мл YPD (100 мкг/мл спектиномицина) в стерильной колбе 125 мл с тремя перегородками, и инкубировали в течение ночи при 28°С с взбалтыванием в течение ночи при 200 оборотах в минуту. На следующий день культуры разбавляли до OD600 0,5 в стерильной ddH2O (уровень рН 8,0). Разбавленный штамм Agrobacterium смешивали со вторым штаммом Agrobacterium, содержащим вспомогательный белок P19 в соотношении 1:1. Эту культуру использовали для инфильтрации листьев табака посредством способа Voinnet O, Rivas S, Mestre P., Baulcombe D., (2003) An enhanced transient expression system in plants based on suppression of gene silencing by the p19 protein of tomato bushy stunt virus, The Plant Journal, 33: 949-956. Инфильтрированные растения табака помещали в набор Conviron™ на 16 часов с освещением при температуре 24°С на срок по меньшей мере три дня до проведения анализа.
Результаты микроскопии
Agrobacterium-инфильтрованные листья табака отделяли от растения и помещали в чашки Петри с водой для предотвращения дегидратации. Инфильтрованные листья табака обследовали с возбуждением голубым светом со стеклянным длинноволновым пропускающим фильтром, фиксированном на месте, с помощью лампы Dark Reader Hand Lamp™ (Clare Chemical Research Co.; Dolores, CO), чтобы определить неповрежденные зоны листьев, которые успешно экспрессировали репортерные белки GFP. Конкретные определенные зоны листьев иссекали из листьев и помещали в воду для визуализации с помощью конфокальной микроскопии (Leica TCS-SP5 AOBS™, Buffalo Grove, IL). Репортерный белок GFP возбуждали линией лазерного излучения 514 нм с использованием многопоточного аргон-ионного лазера. Ширину щелей обнаружения регулировали с помощью не-экспрессирующего (темного) контрольного образца листьев для исключения фоновой аутофлюоресценции листьев. Аутофлюоресценцию хлорофилла одновременно выявляли во втором канале для прямого сравнения с сигналом флуоресцентного белка-репортера для определения локализации хлорпластов.
Результаты микроскопической визуализации показали, что флуоресцентный белок GFP, содержащий транзитный пептид хлоропластов TraP23, не накапливаются с обнаруживаемым количеством белка GFP в хлоропластах, расположенных в цитоплазме клеток табака (фиг. 4).
Результаты вестерн-блоттинга
Образцы инфильтрированных растений табака анализировали с помощью вестерн-блоттинга. Иссеченные зоны листьев были собраны и подвергнуты измельчению в шаровой мельнице. Приблизительно от 100 до 200 мг материала листьев смешивали с 2 BB (стальные шарики; Daisy; Rogers, AR) и 500 мл раствора фосфатного буфера - Твина (ФБР-Т) в течение 3 минут в шаровой мельнице Kleco™. Затем образцы центрифугировали в центрифуге при 14000×g при 4°С. Удаляли супернатант и анализировали или непосредственно с помощью вестерн-блоттинга или путем иммунопреципитации. Иммунопреципитацию проводили с использованием комплекта Pierce Direct IP kit™ (Thermo Scientific; Rockford, IL) в соответствии с протоколом производителя. Приблизительно 50 мкг анти-GFP связывали со смолой. Образцы инкубировали со смолой в течение ночи при 4°С. Затем следующим утром образцы промывали, элюировали и подготавливали к анализу путем объединения равных объемов 2 × 8М буфера для образцов с мочевиной, после чего образцы кипятили в течение 5 минут. Прокипяченные образцы подвергали воздействию 4-12% SDS-бис Трис геля в буфере MOPS в течение 40 минут. Затем гель блотировали с помощью Invitrogen iBlot™ (Life Technologies, Carlsbad, CA) в соответствии с протоколом производителя. Блотированную мембрану фиксировали в течение 10 минут с использованием 5% обезжиренного сухого молока в растворе ФБР-Твин. Мембрану зондировали первичными антителами (моноклональными анти-GFP в кроличьем), которые использовали в разведении 1: 1000 в 5% обезжиренном сухом молоке в растворе ФБР-Твин в течение 1 часа. Затем мембрану промывали три раза в течение пяти минут с раствором ФБР-Твин для удаления всех несвязанных первичных антител. Мембрану зондировали с вторичным моноклональным анти-кроличьим козьим антителом (Life Technologies), используемым в разведении 1:1000, в течение 60 минут. Мембрану промывали, как описано выше, и выводили путем добавления субстрата Themo BCIP/NBT. Колориметрический субстрат оставляли для развития в течение от 5 до 10 минут, а затем блоты промывали водой, после чего высушивали.
Результаты вестерн-блоттинга показали, что белок GFP экспрессируется в инфильтрированных клетках табака. В инфильтрированных pDAB 107640 тканях листьев от растений табака экспрессировался белок GFP, что определялось по наличию полосы белка, который реагировал с GFP-антителом и был эквивалентен по размеру полосы белка GFP, полученного от контрольного GFP, который не содержит транзитный пептид хлоропластов. Кроме того, эти результаты показывали, что синтетический транзитный пептид хлоропластов TraP процессировался и отщеплялся от белка GFP. Конструкция TraP23-GFP показывает полосу предварительно процессированного белка, который имеет более высокий молекулярный вес, чем контрольный белок GFP. Присутствие полос в вестерн-блоттинге, которые эквивалентны по размеру полосам контрольного GFP, указывает, что последовательности транзитного пептида хлоропластов TraP23 были процессированы, тем самым уменьшался размер GFP до значения молекулярного веса, который эквивалентен контрольному GFP.
Транзиторный анализ протопластов кукурузы
Полинуклеотидную последовательность, кодирующую синтетический транзитный пептид хлоропластнов Trap23 v2 (SEQ ID NO: 12) клонировали в 3'-5' направлении от гена зеленого флуоресцентного белка и вставляли в конструкцию pDAB 106598 (фиг. 5) для тестирования с помощью транзиторного анализа протопластов кукурузы in planta. Полученная конструкция содержала описанные ниже единицы транскрипции растений (PTU). Первая PTU состояла из промотора Убиквитин 1 Zea mays (ZmUbil промотор; Christensen, A., Sharrock R., and Quail P., (1992) Maize polyubiquitin genes: structure, thermal perturbation of expression and transcript splicing, and promoter activity following transfer to protoplasts by electroporation, Plant Molecular Biology, 18: 675-689), слияния генов TraP - зеленый флуоресцентный белок (TraP23-GFP; патент США № 7678893) и 5'-3' нетранслируемой области пероксидазы Zea mays (ZmPer5 3' UTR; патент США N 6384207). Конструкции верифицировали путем расщепления ферментом рестрикции и секвенирования.
Семена Zea mays вар. B104 подвергали поверхностной стерилизации путем энергичного взбалтывания в 50% Clorox (3% гипохлорит натрия), содержащем 2-3 капли Твина-20, в течение примерно 20 минут. Семена тщательно промывали стерильной дистиллированной водой. Стерильные семена высевали на среду 1/2 МS в боксы Phytatrays или боксы подобного типа, и оставляли для роста в темноте (28°C) в течение от 12 до 20 дней. Для получения и трансфекции протопластов кукурузы из листьев B104-кукурузы использовали транзиторный анализ протопластов кукурузы. Этот анализ протопластов кукурузы является модификацией системы, описанной авторами Yoo, S.-D., Cho, Y.-H., and Sheen, J., (2007), Arabidopsis Mesophyll Protoplasts: A Versitile Cell System for Transient Gene Expression Analysis, Nature Protocols, 2: 1565-1572. Растворы готовили, как описано в публикации Yoo et. al., (2007), с тем исключением, что используемую в дальнейших экспериментах концентрацию маннита изменяли до 0,6 М.
Трансфекцию от 100 до 500 мкл протопластов (1-5×105) осуществляли путем добавления протопластов в микроцентрифужной пробирке объемом 2 мл, содержащей приблизительно 40 мкг плазмидной ДНК (pDAB 106598), при комнатной температуре. Объем ДНК предпочтительно поддерживали примерно до 10% от объема протопластов. Протопласты и ДНК периодически перемешивали в течение 5-минутного периода инкубации. К протопластам и ДНК медленно добавляли эквивалентный объем раствора ПЭГ, 2 капли за один раз при смешивании между добавлением капель раствора ПЭГ. Пробирки инкубировали в течение примерно 10 минут при периодическом аккуратном перемешивании. Затем добавляли 1 мл раствора W5+ и смешивали путем многократного переворачивания пробирки. Прибирку (пробирки) центрифугировали в течение 5 минут при 75 g при температуре 4°С. В конце удаляли супернатант, осадок ресуспендировали в 1 мл раствора WI, и протопласты помещали в небольшую чашку Петри (35×10 мм) или в 6-луночные многолуночные планшеты и инкубировали в течение ночи в темноте при комнатной температуре. Флуоресценцию GFP визуализировали с помощью микроскопии через 12 часов инкубации. Для визуализации применяли условия микроскопии, описанные выше.
Результаты визуализации с помощью микроскопии показали, что флуоресцентный белок GFP, содержащий синтетический транзитный пептид хлоропластов TraP23, который накапливается в хлоропластах, расположен в цитоплазме клеток кукурузы, в отличие от контрольных флуоресцирующих белков GFP, которые не транслоцировались в хлоропласты цитоплазмы клеток кукурузы (фиг. 6). Эти результаты визуализации с помощью микроскопии показывают, что транслокация белка GFP в хлоропласт была обусловлена синтетическим транзитным пептидом хлоропластов TraP23.
Пример 3: Последовательности синтетического транзитного пептида хлоропластов (TraP) для экспрессии агрономически важных трансгенов в Arabidopsis
Мутация единственной аминокислоты (G96A) в ферменте 5-енолпирувилшикимат 3-фосфат-синтаза (EPSP-синтаза) Escherichia coli может вызывать отсутствие чувствительности к глифосату ((Padgette et al., (1991); Eschenburg et al, (2002); Priestman et al., (2005); Haghani et al., (2008)). Эта мутация придает толерантность к глифосату, вместе с тем также известно, что она отрицательно влияет на связывание EPSP-синтазы с его природным субстратом фосфоенолпируватом (РЕР). В результате изменений в эффективности связывания субстрата мутантный фермент может оказаться неподходящим для достижения in planta толерантности к глифосату.
В базе данных NCBI GenBank проводили скрининг in silico на белок EPSP-синтазы и полинуклеотидные последовательности, которые в природе в ферменте EPSP-синтаза содержат аланин в аналогичном положении, как и мутация G96A, которая была вставлена в фермент версии Escherichia coli (Padgette et al., (191); Eschenburg et al., (2002); Priestman et al., (2005); Haghani et al., (2008)).
Был идентифицирован один фермент, который в природе содержал аланин в этом положении, представляющий собой DGT-28 (GENBANK ACC NO: ZP_06917240.1) в Streptomyces sviceus ATCC29083. Дальнейший глубокий анализ данных in silico выявил три других уникальных фермента Streptomyces с более высокой степенью гомологии к DGT-28: DGT-31 (GENBANK ACC NO: YP_004922608.1), DGT-32 (GENBANK ACC NO: ZP 04696613) и DGT-33 (GENBANK ACC NO: NC_010572). Каждый из этих ферментов содержит природный аланин в аналогичном положении в ферменте EPSP-синтаза, как и мутация G96A, которая была вставлена в фермент версии E. coli.
Поскольку белки EPSP-синтазы из разных организмов имеют разную длину, нумерация мутации для версии E.coli фермента EPSP-синтазы не обязательно соответствуют нумерации мутации для ферментов EPSP-синтаз из других организмов. Эти идентифицированные ферменты EPSP-синтазы ранее не были описаны в отношении свойств толерантности к глифосату или аффинности РЕР-субстрата. Кроме того, эти ферменты EPSPS-синтазы представляют собой новый класс ферментов EPSP-синтазы и не содержат каких-либо мотивов последовательностей, которые были использованы для описания вышеупомянутых ферментов EPSP-синтазы класса I (последовательности растительного происхождения, дополнительно описанные в патенте США № RE39247), класса II (полученные из бактерий последовательности, дополнительно описанные в патенте США № RE39247) и класса III (полученные из бактерий последовательности, дополнительно описанные в международной патентной заявке WO 2006/110586).
Характеристики новых ферментов DGT-28, DGT-31, DGT-32 и DGT-33 были описаны в отношении толерантности к глифосату и аффинности РЕР-субстрата по сравнению с ферментами EPSP-синтазами класса I. Для сравнения взяли следующие ферменты класса I: DGT-1 из Glycine max, DGT-3 из Brassica napus (GENBANK ACC NO: PI 7688) и DGT-7 от Triticum aestivum (GENBAN ACC NO: EU977181). Были синтезированы и иследованы ферменты EPSP-синтазы класса I и мутантные варианты. Мутация, вставленная в растительные ферменты EPSP-синтазы, состояла из мутации от глицина до аланина, которую вводили в такое же месторасположение в ферменте EPSP-синтазу, как и мутацию G96A в ферменте версии E. coli. Дополнительно, в эти ферменты EPSPS-синтазы класса I были введены мутации от треонина до изолейцина и от пролина до серина в положениях, аналогичных положениям аминокислоты 97 (Т до I) и аминокислоты 101 (P до S) в EPSP-синтазе из E. coli, как описано авторами Funke et al., (2009).
DGT-28, DGT-31, DGT-32 и DGT-33
Недавно созданная полинуклеотидная последовательность двудольных растений, оптимизированная dgt-28 v5, показана в SEQ ID NO: 14. Недавно созданная полинуклеотидная последовательность двудольных растений, оптимизированная dgt-28 v6, показана в SEQ ID NO: 15, эта последовательность была незначительно модифицирована путем включения аланина в положении второй аминокислоты, для вставки сайта рестрикции фермента. Полученные последовательности ДНК имеют более высокую степень разнообразия кодонов, желательный состав оснований, содержат стратегически расположенные сайты распознавания ферментов рестрикции, и не содержат последовательностей, которые могут препятствовать транскрипции гена или трансляции продукта мРНК.
Синтез фрагментов ДНК, содержащих SEQ ID NO: 14 и SEQ ID NO: 15, несущих дополнительные последовательности, такие как 6-рамочные стоп-кодоны (стоп-кодоны, расположенные во всех шести рамках считывания, которые добавляются на 3' конце кодирующей последовательности), и 5' сайт рестрикции для клонирования, был проведен коммерческими поставщиками (DNA2.0, Menlo Park, CA). Затем молекулы синтетической нуклеиновой кислоты клонировали в векторы экспрессии и трансформировали в растения или бактерии, как описано в приведенных ниже примерах.
Подобные стратегии оптимизации кодонов были использованы для разработки dgt-1, dgt-3 v2 (G173A), dgt-3 v3 (G173A; P178S), dgt-3 v4 (T174I; P178S), dgt-7 v4 (T168I; P172S), dgt-32 v3, dgt-33 v3 и dgt-31 v3. Кодон-оптимизированные версии этих генов перечислены как SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22 и SEQ ID NO: 23, соответственно.
Конструирование бинарного вектора растений. Применяли стандартные способы клонирования при конструировании исходных векторов, содержащих полинуклеотидную последовательность транзитного пептида хлоропластов, соединенную с dgt-28 в виде лигирования с сохранением рамки считывания. Исходные векторы, содержащие транзитный пептид (TraP), слитый с dgt-28, были собраны с использованием технологии INFUSION™ Advantage Technology (Clontech, Mountain View, CA). В результате слияния из dgt-28 была удалена первая аминокислота метионин. Каждая из полинуклеотидных последовательностей, кодирующих транзитный пептид: TraP4 v2 (SEQ ID NO: 24), TraP5 v2 (SEQ ID NO: 25), TraP8 v2 (SEQ ID NO: 26), TraP9 v2 (SEQ ID NO: 27), TraP 12 v2 (SEQ ID NO: 28) и TraP 13 v2 (SEQ ID NO: 29) была синтезирована с помощью DNA2.0 (Menlo Park, CA) и слиты с 5'-концом фрагмента dgt-28, до уникального сайта AccI распознавания рестрикции эндонуклеазы и включая в себя этот сайт.
Бинарные плазмиды, которые содержали различные кассеты экспрессии TraP и dgt-28, запускались промотором Убиквитин 10 из Arabidopsis thaliana (AtUbi10 v2; Callis, et al, (1990) J. Biol. Chem, 265: 12486-12493) и фланкировались двадцать три 3' нетранслируемой областью открытой рамки считывания Agrobacterium tumefaciens (AtuORF23 3' UTR v1, патент США № 5428147).
Собранные кассеты экспрессии TraP и dgt-28 были сконструированы с использованием технологии GATEWAY® Technology (Invitrogen, Carlsbad, CA) и трансформированы в растения посредством Agrobacterium-опосредуемой трансформации растений. Эндонуклеазы рестрикции были получены из лаборатории New England Biolabs (NEB; Ipswich, MA), и для лигирования ДНК использовали Т4 ДНК-лигазы (Invitrogen). Входные реакции проводили с использованием смеси ферментов GATEWAY® LR Clonase® (Invitrogen) для сборки одного исходного вектора в векторе единственного назначения, который содержал промотор вируса мозаики маниоки Cassava Vein кассеты селектируемых маркеров (CsVMV v2; Verdaguer et al., (1996) Plant. Mol. Biol., 31: 1129-1139) - DSM-2 (патентная заявка США № 2007/086813) - первую 3' нетранслируемую область открытой рамки считывания Agrobacterium tumefaciens (AtuORF1 3' UTR V6; Huang et al, (1990) J. Bacteriol. 172:1814-1822). Плазмидные препараты были приготовлены с помощью набора NucleoSpin® Plasmid Kit (Macherey-Nagel Inc., Bethlehem, PA) или набора Plasmid Midi (Qiagen), согласно инмтрукциям производителей. Фрагменты ДНК выделяли с использованием набора QIAquick Gel Extraction™ Kit (Qiagen) после электрофореза в агарозном Трис-ацетатном геле.
Проводили исходный скрининг колоний всех собранных плазмид с помощью рестрикционного расщепления минипрепаративной ДНК. Плазмидную ДНК из отобранных клонов секвенировали с помощью коммерческого оборудования для секвенирования (Eurofins™ MWG Operon, Huntsville, AL). Данные о последовательностях собирали и анализировали с помощью программного обеспечения SEQUENCHER™ (Gene Codes Corp., Ann Arbor, MI).
Указанные ниже бинарные конструкции экспрессируют разнообразные последовательности генов слияния TraP:dgt-28: pDAB107527 содержит TraP4 v2:dgt-28 v5 (SEQ ID NO: 30), pDAB105530 содержит TraP5 V2:dgt-28 v5 (SEQ ID NO: 31), pDAB105531 содержит TraP8 V2:dgt-28 v5 (SEQ ID NO: 32), PDAB 105532 содержит TraP9 v2:dgt-28 v5 (SEQ ID NO: 33), pDAB105533 содержит TraP12 v2:dgt-28 v5 (SEQ ID NO: 34) и pDAB105534 содержит TraP13 v2:dgt-28 v5 (SEQ ID NO: 35). Последовательность dgt-28 v5 из pDAB 105534 была модифицирована, при этом первый кодон (GCA) изменялся на (GCT).
Конструирование дополнительного бинарного вектора растений. Применяли стратегии клонирования, аналогичные описанным выше, для конструирования бинарных плазмид, которые содержат dgt-31, dgt-32, dgt-33, dgt-1, dgt-3 и dgt-7.
Полученные из микроорганизмов гены dgt-31, dgt-32 и dgt-33 сливали с различными транзитными пептидами хлоропластов, как описано выше. Были использованы следующие транзитные пептиды хлоропластов: TraP14 v2 (SEQ ID NO: 36), TraP23 v2 (SEQ ID NO: 37), TraP24 v2 (SEQ ID NO: 38). pDAB107532 содержит dgt-32 v3, слитый с TraP14 v2 (SEQ ID NO: 39), pDAB107534 содержит dgt-33 v3, слитый с TraP24 v2 (SEQ ID NO: 40) и pDAB 107533 содержит dgt-31 v3, слитый с TraP23 v2 (SEQ ID NO: 41). Кассеты экспрессии dgt запускались с помощью промотора Убиквитин 10 из Arabidopsis thaliana (AtUbi10 промотор v2) и фланкировались двадцать три 3'-нетранслируемой областью открытой рамки считывания Agrobacterium tumefaciens (AtuORF23 3' UTR v1). В бинарном векторе также присутствовала кассета селектируемых маркеров DSM-2, содержащая промотор вируса мозаики маниоки Cassava Vein Mosaic Virus (CsVMV v2) - DSM-2 - первая 3' нетранслируемая область открытой рамки считывания Agrobacterium tumefaciens (AtuORFl 3' UTR v6).
Создавали дополнительные бинарные конструкции, в которых dgt-31 v3, dgt-32 v3 и dgt-33 v3 были слиты с ранее описанными последовательностями транзитного пептида хлоропластов. Например, последовательность V2 TraP8 была слита с dgt-31 v3, dgt-32 v3 и dgt-33 v3 и клонирована в бинарные векторы, как описано выше.
Были сконструированы бинарные векторы, содержащие гены класс I (dgt-1, dgt-3 и dgt-7). Были сконструированы и трансформированы в растениях следующие бинарные векторы: pDAB4104, содержащий последовательность dgt-1 v4, описанную в опубликованной патентной заявке США № 2011/0124503, который фланкирован последовательностями Nicotiana tabacum Osmotin, согласно описанию в опубликованной патентной заявке США № 2009/0064376; pDAB102715, pDAB102716, pDAB102717 и pDAB102785. К генам класса I не относятся различные транзитные пептиды хлоропластов TraP, которые были слиты с dgt-28, dgt-31, dgt-32 и dgt-33, так как эти последовательности растительного происхождения обладают нативными растительными транзитными пептидами хлоропластов. Более подробное описание упомянутых векторов приведено в таблице 1.
Описание бинарных векторов, которые содержат ген EPSPS-синтазы класса I (т.е. dgt-1, dgt-3 или dgt-7)
Трансформация Arabidopsis thaliana. Трансформацию Arabidopsis проводили с использованием способа погружения цветочных почек (Clough and Bent, 1998). Выбранную колонию Agrobacterium, содержащую одну из описанных выше бинарных плазмид, использовали для инокуляции одной или нескольких пре-культур YEP бульона в объеме 100 мл, содержащего спектиномицин (100 мг/л) и канамицин (50 мг/л). Культуру инкубировали в течение ночи при 28°С при постоянном перемешивании при 225 оборотах в минуту. Клетки преципитировали приблизительно при 5000 × g в течение 10 минут при комнатной температуре, и удаляли полученный супернатант. Клеточный осадок аккуратно ресуспендировали в 400 мл смачивающей среде, содержащей: 5% (вес/объем) сахарозы, 10 мкг/л 6-бензиламинопурина и 0,04% Silwet™ L-77. Растения в возрасте примерно 1 месяц погружали в среду на 5-10 минут с аккуратным встряхиванием. Растения укладывали на бок и накрывали прозрачными или непрозрачными пластиковыми пакетами на 2-3 часа, а затем приводили их в вертикальное положение. Растения выращивали при 22°С, с фотопериодом 16 часов освещения/8 часов темноты. Приблизительно через 4 недели после погружения собирали семена.
Селекция трансформированных растений. Свежесобранные T1 семена [содержащие кассеты экспрессии dgt и DSM-2] оставляли для высыхания в течение 7 дней при комнатной температуре. Семена T1 высевали в лотки для проращивания размером 26,5×51 см, при этом в каждый лоток вносили аликвотное количество 200 мг стратифицированных семян T1 (приблизительно 10000 семян), которые предварительно суспендировали в 40 мл 0,1% раствора агарозы и хранили при 4°С в течение 2 дней, чтобы обеспечить необходимый покой и синхронное прорастание семян.
Смесь Sunshine Mix LP5 покрывали мелким вермикулитом и слегка орошали раствором Хоагленда до увлажнения, затем позволяли жидкости стечь самотеком. Каждую аликвоту стратифицированных семян объемом 40 мл равномерно высевали на вермикулит с помощью пипетки и накрывали куполами для поддержания влажности на протяжении 4-5 дней. Купола удаляли за 1 день до начала селекции трансформантов, которую осуществляли путем послевсходового распыления глюфозината (селекция на котрансформированный ген DSM-2).
На седьмой день после посадки (ПП) и повторно на 11 день ПП растения T1 (семядоли и стадии 2-4 листьев, соответственно) опрыскивали 0,2% раствором гербицида Liberty (глуфосинат 200 г активного ингриедиента аи/л, Bayer Crop Sciences, Kansas City, MO) с объемом распыления 10 мл/на лоток (703 л/га), используя пневматический распылительный наконечник DeVilbiss для доставки эффективного количества 280 г к.э./га глуфосината при каждом применении. Выжившие растения (активно растущие растения) определяли на 4-7 день после последнего распыления и пересаживали в отдельные 3-дюймовые горшки (7,6 см) с подготовленной горшечным субстратом (Metro Mix 360). Пересаженные растения выращивали в теплице (при температуре 22±5°С, относительной влажности 50±30%, 14 часов освещения: 10 часов темноты, минимальное 500 μΕ/м2s1 естественного + дополнительного освещения). Выжившие Т1 растения подвергали молекулярному подтверждающему анализу для верификации факта стабильной интеграции в геном этих растений гена толерантности к глифосату.
Молекулярное подтверждение. Было подтверждено присутствие трансгенов dgt-28 и DSM-2 в геноме растений Arabidopsis, которые были трансформированы pDAB 107527, pDAB105530, pDAB105531, pDAB105532, pDAB105533 или pDAB105534. Присутствие этих полинуклеотидных последовательностей подтверждали с помощью анализов гидролиза зонда, ПЦР кассеты экспрессии генов (также называемой ПЦР единицы транскрипции растения - PTU ПЦР), Саузерн-блоттинга и количественной ПЦР с обратной транскрипцией. Проводили исходный скрининг Т1 растений Arabidopsis с помощью анализа гидролиза зонда, аналогичного TaqMan™ для подтверждения присутствия трансгенов dgt-28 и DSM-2. Объекты подвергали скринингу с помощью ПЦР кассеты генной экспрессии, чтобы определить, является ли кассета экспрессии dgt полностью интегрированной в геном растений без перестановок. Полученные в этих исследованиях данные использовали для определения числа копий трансгена и идентификации селектированных объектов Arabidopsis для самооплодотворения и развития до Т2 поколения. Развивающиеся T2 растения Arabidopsis также скринировали с помощью анализов гидролиза зонда, чтобы подтвердить наличие и оценить количество копий генов DSM-2 и dgt-28 в хромосоме растения. Наконец, использовали анализ Саузерн-блоттинг для подтверждения расчетного количества копий у подгруппы T1 растений Arabidopsis.
Аналогичные анализы использовали для подтверждения присутствия трансгена dgt-1 из растений, трансформированных pDAB4104, присутствие трансгена dgt-32 из растений, трансформированных pDAB 107532, присутствие трансгена dgt-33 из растений, трансформированных pDAB 107534, присутствие трансгена dgt-31 из растений, трансформированных pDAB 107533, присутствие трансгена dgt-3 из растений, трансформированных pDAB102715, присутствие трансгена dgt-3 из растений, трансформированных pDAB102716, присутствие трансгена dgt-3 из растений, трансформированных pDAB102717 и присутствие трансгена dgt-7 из растений, трансформированных pDAB 102785.
Анализ гидролиза зондов. У T1 и Т2 растений Arabidopsis определяли количество копий с использованием анализа гидролиза зондов, описанного ниже. Были выявлены растения с вариабельным количеством трансгенов, которые выращивали для последующих исследований толерантности к глифосату.
Образцы ткани собирали в 96-луночные планшеты и лиофилизировали в течение 2 дней. Мацерацию ткани проводили с помощью тканевого пульверизатора KLECKO™ и вольфрамовых шариков (Environ Metal INC., Sweet Home, Oregon). После мацерации ткани выделяли геномную ДНК в формате высокой пропускной способности с помощью набора Biosprint™ 96 Plant (Qiagen™, Germantown, MD) в соответствии с протоколом, предложенным производителем. Геномную ДНК количественно определяли с использованием набора для анализа ДНК QUANT-IT™ PICO GREEN (Molecular Probes, Invitrogen, Carlsbad, CA). Подсчитанную геномную ДНК доводили приблизительно до 2 нг/мл для анализа гидролиза зондов с использованием автоматизированного жидкостного манипулятора BIOROBOT3000™ (Qiagen, Germantown, MD). Определение количества копий трансгенов путем анализа гидролиза зондов проводили посредством ПЦР в реальном времени с помощью системы LIGHTCYCLER®480 (Roche Applied Science, Indianapolis, IN). Анализы были разработаны для DSM-2, dgt-28 и внутреннего референс-гена TAFII15 (GenBank ID: NC 003075; Duarte et al., (201) BMC Evol. Biol., 10:61).
Для амплификации готовили зонды LIGHTCYCLER®480 Probes Master mix (Roche Applied Science, Indianapolis, IN) в конечной концентрации 1× в 10 мкл объема мультиплексной реакционой смеси, содержащей 0,1 мкМ каждого праймера для DSM-2 и dgt-28, 0,4 мкМ каждого праймера для TAFII15 и 0,2 мкМ каждого зонда. Таблица 2. Двухэтапную реакцию амплификации проводили с удлинением при 60°С в течение 40 секунд с получением флуоресценции. Были проверены все образцы и использовались средние значения порогового цикла (Ct) для анализа каждого образца. Анализ данных ПЦР в реальном времени проводили с использованием программного обеспечения LightCycler™, версия 1,5, с помощью относительного количественного модуля и на основе способа ΔΔCt. Для этого анализа в каждый цикл были включены образец геномной ДНК из малокопийного калибратора и проверка 2 известных копий. Результаты по количеству копий в анализе гидролиза зондов были определены для трансгенных T1 и Т2 растений Arabidopsis.
Данные по праймерам и зондам для анализа гидролиза зондов DSM-2, dgt-28 и внутреннего референс-гена (TAFII15)
Подтверждение интеграции dgt-28 в анализе Саузерн-блоттинг. Применяли Саузерн-блоттинг для установления интегрированности структуры вставленного фрагмента Т-цепи ДНК и идентификации объектов, которые содержали dgt-28. Полученные данные должны были показать интеграцию и целостность трансгенных вставок в геноме Arabidopsis. Данные Саузерн-блоттинга использовали для определения простой интеграции интактной копии Т-цепи ДНК. Детализированный Саузерн-блот-анализ проводили с использованием ПЦР-амплифицированного зонда, специфичного для кассеты экспрессии генов dgt-28. При гибридизации зонда с геномной ДНК, которую до этого расщепляли посредством специфичных ферментов рестрикции, были выявлены ферменты геномной ДНК с конкретными значениями молекулярной массы, структуры которых были использованы для идентификации полноразмерных, простых вставленных T1 трансгенных объектов для дальнейшего развития следующего поколения.
Образцы ткани собирали в 2 мл конические пробирки (Эппендорф™) и лиофилизировали в течение 2 дней. Мацерацию ткани проводили с помощью тканевого пульверизатора KLECKO™ и вольфрамовых шариков. После мацерации тканей выделяли геномную ДНК с использованием методики выделения СТАВ. Геномную ДНК дополнительно очищали с использованием набора Qiagen Genomic™ Tips. Количественное определение геномной ДНК проводили с помощью набора для анализа ДНК Quant- IT™ Pico Green (Molecular Probes, Invitrogen, Carlsbad, CA). Подсчитанную геномную ДНК доводили до 4 мкг для соответствия концентрации.
Для каждого образца проводили полное расщепление 4 мкг геномной ДНК посредством рестриктазы Swal (New England Biolabs, Beverley, MA) и инкубировали при 25°С в течение ночи, затем к реакционной смеси добавляли Nsil и инкубировали при 37°С в течение 6 часов. Расщепленную ДНК концентрировали путем преципитации с раствором для преципитации Quick Precipitation Solution™ (Edge Biosystems, Gaithersburg, MD) в соответствии с протоколом, предложенным производителем. После этого геномную ДНК ресуспендировали в 25 мкл воды при 65°С в течение 1 часа. Ресуспендированные образцы погружали в 0,8% агарозный гель, приготовленный в 1× TAE, и подвергали электрофорезу в течение ночи при 1,1 V/см в буфере 1× ТАЕ. Гель последовательно подвергали денатурации (0,2 М NaOH/0,6 М NaCl) в течение 30 минут, и нейтрализации (0,5 М Трис-HCl (рН 7,5)/1,5 М NaCl) в течение 30 минут.
Перенос ферментов ДНК на нейлоновые мембраны проводили путем пассивного капиллярного распространения 20 × SSC раствора в течение ночи через гель на обработанную Immobilon™ NY+ мембрану для переноса (Millipore, Billerica, MA) с использованием хроматографической капиллярной бумаги и бумажных полотенец. После переноса мембрану коротко промывали раствором 2 × SSC с присоединенным Stratalinker™ 1800 (Stratagene, LaJolla, CA) и нагревали в вакууме при 80°С в течение 3 часов.
Блоты инкубировали с раствором для пре-гибридизации (Perfect Hyb plus, Sigma, St. Louis, MO) в течение 1 часа при 65°С в стеклянных роллер-флаконах с использованием гибридизационного инкубатора модели 400 (Robbins Scientific, Sunnyvale, CA). Зонды делали из ПЦР-фрагмента, содержащего полную кодирующую последовательность. ПЦР ампликон очищали с помощью набора для экстракции геля QIAEX II™ и метили с α32 P-dCTP с помощью набора случайных меток Random RT Prime IT™ (Stratagene, La Jolla, CA). Блоты гибридизовали в течение ночи при 65°С с денатурированным зондом, добавленным непосредственно в буфере для гибридизации, примерно до 2000000 импульсов на блот на мл. После гибридизации блоты последовательно промывали раствором 0,1 × SSC/0,1% SDS в течение 40 минут при 65°С. В конце на блоты воздействовали фосфором с длительным послесвечением с проецированием изображений и визуализировали с использованием системы визуализации Molecular Dynamics Storm 860™.
Проведенные в этом исследовании Саузерн-блот-анализы были использованы для определения количества копий и подтверждения, что выбранные объекты содержали трансген dgt-28 в геноме Arabidopsis.
Подтверждение кассеты генной экспрессии dgt-28 с помощью ПЦР-анализа. Обнаружение присутствия кассеты генной экспрессии dgt-28, содержащейся в объектах растений T1, проводили с помощью концевой реакции ПЦР. Для обнаружения использовали праймеры (Таблица 3), специфичные для промотора AtUbi10 v2 и AtuORF23 3'UTR v1 участков в кассете генной экспрессии dgt-28.
Олигонуклеотидные праймеры, используемые для подтверждения кассеты генной экспрессии dgt-28
Для реакций ПЦР был необходим стандартный трехэтапный протокол ПЦР для амплификации кассеты экспрессии генов. Все реакции ПЦР проводили с использованием следующих условий ПЦР: 94°С в течение трех минут с последующими 35 циклами при 94°С в течение тридцати секунд, 60°С в течение тридцати секунд и 72°С в течение трех минут. Реакции завершали с использованием набора для ПЦР EX-TAQ™ (TaKaRa Biotechnology Inc. Otsu, Shiga, Япония) в соответствии с инструкциями изготовителя. После завершающего цикла реакционную смесь инкубировали при 72°С в течение 10 минут. Использовали агарозный гель ТАЕ для определения размера ПЦР- ампликона. ПЦР-ампликоны ожидаемого размера указывали на присутствие полноразмерной кассеты генной экспрессии в геноме трансгенных объектов Arabidopsis.
Подтверждение относительной транскрипции dgt-28 с помощью количественного анализа ПЦР с обратной транскрипцией. Образцы тканей dgt-28 - трансгенных растений собирали в 96-луночные планшеты и замораживали при 80°С. Мацерацию ткани проводили с помощью тканевого пульверизатора KLECO™ и вольфрамовых шариков (Environ Metal INC., Sweet Home, Oregon). После мацерации ткани выделяли геномную ДНК в формате высокой пропускной способности с помощью набора Qiagen™ Rneasy 96 (Qiagen™, Germantown, MD) в соответствии с протоколом, предложенным производителем, который включал в себя дополнительную обработку Dnasel на колонке. После этого этапа проводили последовательно дополнительную обработку Dnasel (Ambion™, Austin TX) общей элюированой РНК. Синтез кДНК проводили с использованием общей РНК в качестве матрицы с помощью набора для обратной транскрипции кДНК с высокой пропускной способностью (High Capacity cDNA Reverse Transcription™ (Applied Biosystems, Austin, TX), в соответствии с протоколом производителя, с добавлением олигонуклеотида TVN. Количественную оценку экспрессии выполняли путем анализа гидролиза зонда и проводили ПЦР в реальном времени с помощью LightCycler® системы 480 (Roche Applied Science, Indianapolis, IN). Анализы были разработаны для dgt-28 и внутреннего референс-гена "неизвестный белок" (номер GenBank: AT4G24610) с помощью LightCycler® Software Probe, версия 2.0. Для амплификации готовили зонды LIGHTCYCLER®480 Probes Master mix (Roche Applied Science, Indianapolis, IN) в конечной концентрации 1 X в 10 мкл объема моноплексной реакционой смеси, содержащей 0,4 мкМ каждого праймера и 0,2 мкМ каждого зонда.
ПЦР-праймеры, используемые для анализа dgt-28 в количественной ПЦР с обратной транскрипцией
Двухэтапную реакцию амплификации с удлинением проводили при 60°С в течение 40 секунд с получением флуоресценции. Были проверены все образцы, и использовались средние значения порогового цикла (Ct) для анализа каждого образца. Реакцию минус обратной транскрипции проводили для каждого образца, чтобы гарантировать, отсутствие примесей геномной ДНК. Анализ данных ПЦР в реальном времени проводили на основе способа ΔΔΟ. Этот анализ использовали для определения относительной экспрессии dgt-28 в трансгенных объектах Arabidopsis, для которых была установлена гемизиготность и гомозиготность. Относительное превышение уровня транскрипции мРНК dgt-28 по сравнению с внутренним контролем варьировались от превышения в 2,5 раза до 207,5 раза. Эти данные показывают, что dgt-28 трансгенные растения содержат функциональную кассету экспрессии гена dgt-28, и растения обладают способностью к транскрипции трансгена dgt-28.
Анализ вестерн-блоттинг. В образцах листьев, полученных из трансгенных растений Arabidopsis thaliana, был обнаружен dgt-28. Растительные экстракты из dgt-28 - трансгенных растений и растений со стандартными белками dgt-28 инкубировали с буфером для образцов NuPAGE® LDS (Invitrogen, Carlsbad, CA), содержащим DTT, при 90°С в течение 10 минут, и проводили разделение с помощью электрофореза в готовом акриламидном геле. Затем электро-переносом белки помещали на нитроцеллюлозную мембрану с использованием протокола производителя. После блокировки блокирующей смесью WESTERNBREEZE® (Invitrogen) проводили обнаружение белка dgt-28 с помощью антисыворотки против dgt-28 с последующим применением козьей анти-кроличьей фосфатазы. Обнаруженный белок визуализировали с помощью хемилюминесцентной матрицы BCIP/NBT с реагентом для вестерн-блот анализа (BCIP/NBT Western Analysis Reagent (KPL, Gaithersburg, MD)). Получение интактного белка DGT-28 с помощью вестерн-блоттинга показало, что тестируемые dgt-28 - трансгенные растения экспрессировали белок DGT-28.
Трансгенные Т1 растения Arabidopsis, содержащие трансген dgt-28, опрыскивали глифосатом в разных дозах. Повышенное количество применялись в данном исследовании для определения относительных уровней устойчивости (105, 420, 1680 или 3360 г к.э./га (грамм кислотного эквивалента на гектар)). Обычный применяемый уровень дозы 1× глифосата, который контролирует нетрансформированные Arabidopsis, составляет 420 г к.э./га. Композиции глифосата с добавлением сульфата аммония применялись на T1 растениях с помощью самоходного опрыскивателя, калиброванного на 187 л/га. Используемые в этом исследовании T1 растения Arabidopsis имели вариабельное количество копий dgt-28 трансгенов. Малокопийные по dgt-28 T1 растения Arabidopsis растения были самоопыляемыми и использовались для получения T2 растений. Таблица 5 показывает сравнение dgt-28 - трансгенных растений, выведенных с геном dgt-1 устойчивости к гербициду глифосату, и контрольных растений дикого типа. В таблице 6 показано сравнение dgt-32 и dgt-33, выведенных с геном dgt-1 устойчивости к гербициду глифосату и контролем дикого типа. В таблице 7 показано сравнение новых ферментов бактериальной EPSP-синтазы с ферментами класса I EPSP-синтазы и с контролем при уровне концентрации глифосата 1680 г к.э./га.
Результаты глифосатной селекции растений Arabidopsis, трансформированных dgt-28. Проводили первую селекцию трансформантов Arabidopsis Т1 из исходных нетрансформированных семян, используя схему селекции с глюфозинатом. Для каждой конструкции Т1 были проанализированы три поддона или 30000 семян. Выбранные предварительно растения Т1 были исследованы на молекулярном уровне и затем репрезентативные растения с вариабельным количеством копий пересаживали в отдельные горшки и опрыскивали коммерческим глифосатом в разных дозах, как описано выше. Реакция этих растений представлена в виде % визуального повреждения через 2 недели после обработки (ПО). Данные представлены в таблице, где показано, что у отдельных растений не выявлено повреждений или оно незначительное (<20%), средней тяжести (20-40%) или тяжелое повреждение (>40%). Среднее арифметическое значение и стандартное отклонение представлено для каждой конструкции, используемой для трансформации Arabidopsis. Для каждой дозы и трансформации также указан диапазон индивидуальной реакции (в последнем столбце). Контролем чувствительности к глифосату служили нетрансформированные растения дикого типа Arabidopsis (Columbia CV).
Уровень реакции растений был вариабельным. Такая вариабельность может быть связана с тем, что каждое растение представляет независимый объект трансформации и, таким образом, количество копий представляющего интерес гена варьируется от растения к растению. Была отмечена непереносимость глифосата у некоторых растений, которые содержали трансген, и не был завершен тщательный анализ с целью определения наличия экспрессии трансгена у этих растений. Вполне вероятно, что наличие большого количества копий трансгена у Т1 растений Arabidopsis вызывает сайленсинг трансгена или другие эпигенетические эффекты, которые дают чувствительность к глифосату, несмотря на присутствие трансгена dgt-28.
Общее повреждение в популяции по уровню повреждения при дозе глифосата 1680 г к.э./га показано в таблице 7, чтобы продемонстрировать существенную разницу между растениями, трансформированными dgt-3, dgt-7, dgt-28, dgt-32 и dgt-33 по сравнению с контрольными растениями, трансформированными dgt-1 и растениями дикого типа.
Толерантность, обусловленная новыми бактериальными EPSP-синтазами, варьировалась в зависимости от конкретного фермента. Неожиданно было обнаружено, что DGT-28, DGT-32 и DGT-33 обеспечивают значительную толерантность к глифосату. Гены dgt придавали устойчивость к гербицидам отдельным растениям Т1 Arabidopsis среди всех протестированных транзитных пептидов. Таким образом, использование дополнительных транзитных пептидов хлоропласта (т.е. TraP8 - dgt-32 или TraP8 - dgt-33) будет обеспечивать защиту от глифосата при сходном уровне повреждения, как представлено по результатам данной обработки.
dgt-28 в качестве селектируемого маркера. Использование dgt-28 в качестве селектируемого маркера для агента глифосатной селекции тестировали с трансформированными растениями Arabidopsis, описанными выше. Примерно 50 семян T4 поколения Arabidopsis (гомозиготного по dgt-28) насыпали примерно в 5000 семян дикого типа (чувствительного к глифосату). Семена проращивали и ростки опрыскивали выбранной дозой глифосата. Проводили сравнение нескольких обработок глифосата, каждый лоток растений получал однократное или двукратное применение глифосата по одной из следующих схем обработки: на 7 день ПП (дней после посадки), на 11 день ПП или на 7 день ПП с последующей обработкой на 11 день после посадки.
Поскольку все растения также содержали ген устойчивости к глюфозинату в том же векторе трансформации, растения, содержащие dgt-28 и отселектированные по глифосату, можно непосредственно сравнивать с DSM-2- или pat- содержащими растениями, отселектированными по глюфозинату.
Обработки глифосатом проводили с распылительным наконечником DeVilbiss™, как описано выше. Определение трансгенных растений, содержащих dgt-28, как "устойчивых" или "чувствительных", проводили на 17 день ПП. Обработка глифосатом в дозе 26,25 -1680 г к.э./га, применяемая на 7 и 11 дни после посадки (ПП), показывала эффективную селекцию трансгенных растений Arabidopsis, которые содержат dgt-28. Подсчитывали количество чувствительных и устойчивых растений, при этом количество толерантных к глифосату растений коррелирует с исходным количеством посаженных трансгенных семян, содержащих трансген dgt-28. Эти результаты показывают, что dgt-28 можно эффективно использовать в качестве альтернативного селектируемого маркера для популяции трансформированных Arabidopsis.
Наследственность. Подтвержденные трансгенные объекты T1 Arabidopsis были самоопыляемыми и давали T2 семена. Эти семена тестировали на потомство путем применения гербицида Ignite™, содержащего глуфосинат (200 г к.э./га) у 100 рандомизированных сибсов T2. Каждое T2 растение было пересажено в 7,5-см квадратный горшок перед применением распыления (опрыскивание в применяемой дозе 187 л/га). Т1 семейства (T2 растения) разделялись в ожидаемой модели 3:1 по устойчивости: чувствительности в отношении доминантно наследуемого единственного локуса с менделевским наследованием, что определяли в тесте хи-квадрат (P>0,05). В таблице 8 приведен процентный показатель T1 семейств, которые разделялись по ожидаемому менделевскому наследованию, и показано, что признак dgt-28 передается Т2 поколению посредством менделевского наследования. Семена собирали от растений T2 в количестве 5 до 15 растений (Т3 семена). Двадцать пять T3 сибсов от каждого из 3-4 случайно выбранных Т2 семейств были протестированы на потомство, как описано выше. Данные показали отсутствия разделения и, таким образом, было показано, что dgt-28 и dgt-3 стабильно интегрированы в хромосому и наследуются по менделевскому принципу по меньшей мере в трех поколениях.
Процент Т1 семейств (Т2 растений), разделяющихся по принципу единичного менделевского наследования при тестировании 100 растений на потомство
Данные по растениям Т2 Arabidopsis. Второе поколение растений (T2) из выбранных Т1 объектов Arabidopsis, которые содержали небольшое количество копий трансгена dgt-28, дополнительно изучали на толерантность к глифосату. Глифосат применяли, как описано выше. Реакция растений представлена в отношении % визуального повреждения через 2 недели после обработки (ПО). Данные представлены в виде гистограммы отдельных растений, показавших отсутствие повреждения или незначительное повреждение (<20%), повреждение средней тяжести (20-40%), или тяжелое повреждение (>40%). Для каждой конструкции, используемой для трансформации Arabidopsis, представлено среднее арифметическое значение и стандартное отклонение. Диапазон индивидуальной реакции также указан в последнем столбце для каждого уровня и трансформации. Нетрансформированные растения Arabidopsis (cv. Columbia) дикого типа служили в качестве контроля чувствительности к глифосату. В поколении Т2 были доступны гемизиготные и гомозиготные растения для тестирования на каждый объект, и поэтому были включены для испытания каждой дозы глифосата. Гемизиготные растения содержат два разных аллеля в локусе, в отличие от гомозиготных растений, которые содержат одинаковые аллели в локусе. В Т2 поколении ожидается изменчивость реакции на глифосат в результате разницы по количеству генов у гемизиготных растений по сравнению с гомозиготными растениями. Изменчивость реакции на глифосат находит свое отражение в показателях стандартного отклонения и в диапазоне реакции.
И однокопийные и мультикопийные dgt-28 объекты в Т2 поколении исследовали на толерантность к глифосату. В отношении объекта, однокопийные растения показывали сходные уровни толерантности к глифосату. Данные о свойствах однокопийного T2 объекта представлены в таблице 9. Объекты, содержащие dgt-28, которые связаны с TraP5 v2, не обеспечивают надежную толерантность к глифосату, по сравнению с конструкциями dgt-28, которые содержат другие транзитные пептиды TraP. Тем не менее, конструкции dgt-28 TraP5 действительно обеспечивают низкий уровень толерантности к глифосату, по сравнению с контрольными нетрансформированными Columbia. Выявлены случаи, когда объекты, показавшие наличие двух или нескольких копий dgt-28, были более восприимчивы к повышенному уровню глифосата (данные не представлены). Такое повышение чувствительности к глифосату аналогично данным, ранее описанным для растений T1, которые также имели большое количество копий трансгена dgt-28. Предполагается, что присутствие большого количества копий трансгена в растениях Arabidopsis вызывает сайленсинг трансгенов или другие эпигенетические эффекты, которые дают чувствительность к глифосату, несмотря на присутствие трансгена dgt-28.
Эти объекты содержали dgt-28, связанный с TraP5 v2 (pDAB105530), TraP12 v2 (pDAB105533) и TraP13 v2 (pDAB105534).
В дополнение к dgt-28, в таблице 10 представлены Т2 Arabidopsis объекты, трансформированные dgt-3. Согласно описанию в таблице 9 объектов dgt-28, эта таблица данных содержит репрезентативный объект, который характерен для реакции с глифосатом для каждой конструкции. Для описания свойств dgt-3 сравнивали конструкции, содержащие единственную PTU (единицу трансформации растений) с геном dgt-3, который запускался промотором AtUbi10 (pDAB102716 и pDAB102715), с конструкциями с тем же геном, содержащими 2 PTU из этого гена (pDAB102719, pDAB102718). С конструкциями, содержащими 2 PTU, использовали промотор AtUbi10 для запуска одной копии гена и промотор CsVMV для запуска другой копии. В исследование было включено использование двойного PTU, чтобы сравнить dgt-3-трансгенные растения с dgt-28-трансгенными растениями, которые содержали две копии трансгена. Данные показали, что однокопийные T2 dgt-3 объекты только с единственной PTU были более восприимчивы к глифосату, чем протестированные однокопийные dgt-28 объекты, но имели более высокую толерантность, чем нетрансформированные контрольные объекты. T1 семейства, содержащие 2 PTU из гена dgt-3, имели более высокий уровень визуальной толерантности к глифосату, по сравнению с конструкциями с 1 PTU. В обоих случаях T1 семейства сравнивали с контролями dgt-1 и диким типом. Результаты T2 показывают, что dgt-28 обеспечивает надежную толерантность в виде однокопийного объекта.
Данные по растениям Т3 Arabidopsis. Третье поколение растений (T3) из выбранных Т2 объектов Arabidopsis, которые содержали небольшое количество копий трансгена dgt-28, дополнительно изучали на толерантность к глифосату. Двадцать пять растений на линию были отселектированы с помощью глюфозината, как описано выше, и линии от каждой исследуемой конструкции не разделялись по селектируемому маркерному гену. Глифосат применяли согласно вышеприведенному описанию. Реакция растений представлена в отношении % визуального повреждения через 2 недели после обработки (ПО). Данные представлены в виде гистограммы отдельных растений, показавших отсутствие повреждения или незначительное повреждение (<20%), повреждение средней тяжести (20-40%), или тяжелое повреждение (>40%). Для каждой конструкции, используемой для трансформации Arabidopsis, представлено среднее арифметическое значение и стандартное отклонение. Диапазон индивидуальной реакции также указан в последнем столбце для каждого уровня и трансформации. Нетрансформированные растения Arabidopsis (cv. Columbia) дикого типа служили в качестве контроля чувствительности к глифосату.
Селекция трансформированных растений. Свежесобранные T1 семена [содержащие гены dgt-31, dgt-32 и dgt-33 v1] оставляли для высыхания в течение 7 дней при комнатной температуре и отправляли в Индианаполис для тестирования. Семена T1 высевали в лотки для проращивания размером 26,5×51 см (T.O. Plastics Inc., Clearwater, MN), при этом в каждый лоток вносили аликвотное количество 200 мг стратифицированных семян T1 (приблизительно 10000 семян), которые предварительно суспендировали в 40 мл 0,1% раствора агарозы и хранили при 4°С в течение 2 дней, чтобы обеспечить необходимый покой и синхронное прорастание семян.
Смесь Sunshine Mix LP5 посыпали мелким вермикулитом и слегка орошали раствором Хоагленда до увлажнения, затем позволяли жидкости стечь самотеком. Каждую аликвоту стратифицированных семян объемом 40 мл равномерно высевали на вермикулит с помощью пипетки и накрывали куполами для поддержания влажности (KORD™ Products, Bramalea, Ontario, Canada) на период 4-5 дней. Купола удаляли за 1 день до начала селекции трансформантов, которую осуществляли путем послевсходового распыления глюфозината (селекция на котрансформированный ген dsm-2).
На шестой день после посадки (ПП) и повторно на 10 день ПП растения T1 (семядоли и стадии 2-4 листьев, соответственно) опрыскивали 0,1% раствором гербицида IGNITE™ (280 г к.э./л глуфосината, Bayer Crop Sciences, Kansas City, MO) с объемом распыления 10 мл/на лоток (703 л/га), используя пневматический распылительный наконечник DeVilbiss для доставки эффективного количества 200 г к.э./га глуфосината при каждом применении. Выжившие растения (активно растущие растения) определяли на 4-7 день после последнего распыления. Выжившие растения пересаживали в отдельные 3-дюймовые горшки (7,6 см) с подготовленной горшечным субстратом (Metro Mix 360). Растения подращивали в теплице по меньшей мере 1 день перед забором образцов тканей для анализа количества копий.
Были получены образцы T1 растений для проведения анализа количества копий для dgt-31, dgt-32 и dgt-33 v1. Затем T1 растения классифицировали по разным дозам глифосата, чтобы получить диапазон копий для каждой дозы. Чтобы установить отличия чувствительных растений от растений со значимым уровнем устойчивости, для растений Arabidopsis использовали эффективную дозу глифосата 26,25 г к.э./га. Повышенные дозы применялись для определения относительного уровня устойчивости (105, 420, 1680 или 3360 г к.э./га). Таблица 13 показывает сравнения в отношении dgt-1.
Применение гербицида глифосата во всех случаях осуществляли с помощью самоходного опрыскивателя c объемом распыления 187 л/га. Использовали коммерческий глифосат, представляющий собой композицию диметиламиновой соли Durango (480 г к.э./л, Dow AgroSciences, LLC). Малокопийные T1 растения, которые проявляли толерантность как к глюфозинату, так и к глифосату, подвергались дополнительному исследованию на T2 поколение.
Первые трансформации Arabidopsis проводили с использованием dgt-31, dgt-32 и dgt-33 v1. Вначале выбирали T1 трансформанты из исходных нетрансформированных семян с использованием схемы селекции с глюфозинатом. Три поддона или 30000 семян были проанализированы в отношении каждой T1 конструкции. Вычисляли частоту трансформации и результаты T1 конструкций dgt-31, dgt-32 и dgt-33 приведены в таблице 12.
Частота трансформации T1 конструкций dgt-31, dgt-32 и dgt-33 у растений Arabidopsis, выбранных с помощью глюфозината, для выбора селектируемого маркерного гена DSM-2
Отселектированные ранее T1 растения пересаживали в отдельные горшки и опрыскивали разными дозами коммерческого глифосата. В Таблице 13 показана сравнительная реакция dgt-31, dgt-32, dgt-33 v1 и контрольных генов в отношении придания устойчивости к глифосату у T1 трансформантов Arabidopsis. Данные представлены в виде гистограммы отдельных растений, показавших отсутствие повреждения или незначительное повреждение (<20%), повреждение средней тяжести (20-40%), или тяжелое повреждение (>40%). Для каждой конструкции, используемой для трансформации Arabidopsis, представлено среднее арифметическое значение и стандартное отклонение. Диапазон индивидуальной реакции также указан в последнем столбце для каждого уровня и трансформации. Нетрансформированные растения Arabidopsis (cv. Columbia) дикого типа служили в качестве контроля чувствительности к глифосату. Ген DGT-31 (v1) с транзитным пептидом TraP23 придавал незначительную толерантность к гербицидам отдельным T1 растениям Arabidopsis по сравнению с отрицательным контролем, при этом этот ген обусловливал повышенную толерантность с транзитным пептидом TraP8. Оба гена DGT-32 и DGT-33 показывали значительную толерантность к глифосату в дозах, проанализированных с TraP8 и с соответствующим другим транзитным пептидом хлоропласта (TraP14 и TraP24, соответственно). При этой обработке уровень реакции растений варьируется в широких пределах, что можно объяснить тем, что каждое растение дает независимый объект трансформации и, следовательно, количество копий представляющего интерес гена варьируется от растения к растению. Важное отметить, что с каждой тестированной дозой глифосата были выявлены экземляры, которые имели более выраженную толерантность, чем остальные. Общий средний уровень повреждения популяции в зависимости от дозы представлен в таблице 13, чтобы показать существенную разницу между растениями, трансформированными dgt-31, dgt-32 и dgt-33 v1, по сравнению с контрольными dgt-1 v1 или диким типом.
Трансформация кукурузы. Стандартные способы клонирования, описанные выше, были использованы в конструкциях бинарных векторов для применения в Agrobacterium tumefaciens- опосредуемой трансформации кукурузы. В Таблице 14 перечислены векторы, которые были сконструированы для трансформации кукурузы. Следующие генные элементы были использованы в векторах, которые содержали dgt-28: промотор убиквитин 1 Zea mays (ZmUbi1, патент США № 5510474) был использован для запуска dgt-28 кодирующей последовательности, фланкированной 3' нетранслируемой областью липазы Zea mays (ZmLip 3' UTR, патент США № 7179902), селектируемая маркерная кассета, состоящая из промотора Убиквитин 1 Zea mays, который использовался для запуска aad-1 кодирующей последовательности (патент США № 7838733), фланкированной 3' нетранслируемой областью липазы Zea mays, aad-1 кодирующая последовательность, придающая толерантность к феноксиауксиновым гербицидам, например, к гербицидам 2,4-дихлорфеноксиуксусной кислоте (2,4-D) и арилоксифеноксипропионату (AOPP).
Конструкции dgt-28 были сконструированы как стандартные бинарные векторы и супербинарные векторные системы Agrobacterium (Japan Tobacco, Tokyo, JP). Стандартные бинарные векторы включают в себя pDAB 107663, pDAB 107664, pDAB 107665 и pDAB 107665. Супербинарные векторные системы Agrobacterium включают в себя pDAB108384, pDAB108385, pDAB108386 и pDAB108387.
Создавались дополнительные конструкции, которые содержат ген-репортер желтого флуоресцентного белка (yfp, патентная заявка США 2007/0298412). pDAB109812 содержит кассету гена-репортера yfp, который запускается промотором убиквитин 1 Zea mays и фланкирован 5'-3' нетранслируемой областью Zea mays (Zm на 5'-3' UTR, патент США № 7179902), кассету селектируемых маркеров состоящую из промотора палочковидного вируса сахарного тростника (SCBV; патент США № 5994123), который используется для запуска экспрессии aad-1 и фланкирован 3'-нетранслируемой областью липазы Zea mays. pDAB101556 содержит кассету yfp, которая запускается промотором Убиквитин 1 Zea mays и фланкирована 5'-3'-нетранслируемой областью Zea Mays, кассету селектируемых маркеров, состоящую из промотора Убиквитин 1 Zea mays, который используется для запуска экспрессии aad-1 и фланкирована 3'-нетранслируемой областью липазы Zea mays. pDAB 107698 содержит кассету dgt-28, которая запускается промотором Убиквитин 1 Zea mays и фланкирована 3' нетранслируемой областью липазы Zea mays, кассета yfp, которая запускается промотором Убиквитин 1 Zea mays и фланкирована 5'-3' нетранслируемой областью Zea mays, кассету селектируемых маркеров, состоящую из промотора палочковидного вируса сахарного тростника, который используется для запуска экспрессии aad-1 и фланкирован 3'-нетранслируемой областью липазы Zea mays. Все эти три конструкции являются стандартными бинарными векторами.
Векторы трансформации кукурузы
Стерилизация початков и выделение зародышей. Для получения незрелых зародышей кукурузы растения Zea mays инбредной линии B104 выращивали в теплице и для получения початков проводили самоопыление или опыление сибсами. Початки собирали примерно на 9-12 день после опыления. В день эксперимента поверхность початков стерилизовали путем погружения в 20% раствор гипохлорита натрия (5%) и встряхивали в течение 20-30 минут с последующим трехкратным ополоскиванием в стерильной воде. После стерилизации незрелые зиготические зародыши (размером от 1,5 до 2,4 мм) в асептических условиях вычленяли из каждого початка и случайным образом распределяли в микро-центрифужные пробирки, содержащие жидкую инфицирующую среду (базальная среда LS 4,43 г/л, витаминный раствор N6 [1000X] 1,00 мл/л, L-пролин 700,0 мг/л, сахарозу 68,5 г/л, D(+) глюкозу 36,0 г/л, 2,4-D 10 мг/мл, 150 мкл/л). В данной серии экспериментов для каждой трансформации использовали пул зародышей из трех початков.
Постановка культуры Agrobacterium
Глицериновые стоковые растворы Agrobacterium, содержащие вышеописанные бинарные векторы трансформации, штрихами высевали на чашки с минимальной средой AB, содержащей подходящие антибиотики, и выращивали при 20°С в течение 3-4 дней. Выбирали одну колонию и штрихами высевали на чашки, содержащие те же самые антибиотики, и инкубировали при 28°С в течение 1-2 дней.
Культура Asrobacterium и со-культивирование. Колонии Agrobacterium брали из чашки YEP, суспендировали в 10 мл инфицирующей среды в одноразовых пробирках объемом 50 мл, и с помощью спектрофотометра доводили плотность клеток до OD600 нм при 0,2-0,4. На момент иссечения зародышей культуры Agrobacterium находились на роторном шейкере при 125 оборотах в минуту при комнатной температуре. Незрелые зиготические зародыши с размером от 1,5 до 2,4 мм извлекали из стерилизованных кукурузных ядер, помещали в 1 мл инфицирующей среды и промывали однократно в той же среде. В каждую пробирку добавляли суспензию Agrobacterium (2 мл) и пробирки помещали на платформу шейкера на 10-15 минут. Зародыши переносили на со-культуральную среду (соли MS 4,33 г/л, L-пролин 700,0 мг/л, миоинозит 100,0 мг/л, ферментативный гидролизат казеина 100,0 мг/л, 30 мМ Дикамба - KOH 3,3 мг/л, сахароза 30,0 г/л, Gelzan™ 3,00 г/л, модифицированные соли MS - витамин [1000 X] 1,00 мл/л, 8,5 мг/мл AgNO3, 15,0 мг/л, ДМСО 100 мкМ), располагали щитком вверх и инкубировали в течение 3 дней при 25°С при 24-часовом освещении при интенсивности освещения 50 мкмоль м-2 сек-1.
Селекция каллусов и регенерация путитативных объектов. После периода со-культивирования зародыши переносили в среду покоя (MS-соли 4,33 г/л, L-пролин 700,0 мг/л, 1,2,3,5/4,6-гексагидроксициклогексан 100 мг/л, MES-[(2-(n-морфолино)-этансульфоновая кислота), свободная кислота] 0,500 г/л, ферментативный гидролизат казеина 100,0 мг/л, дикамба - 30 мМ КОН 3,3 мг/л, сахароза 30,0 г/л, Gelzan 2,30 г/л, модифицированные соли MS - витамин [1000 X] 1,00 мл/л, 8,5 мг/мл AgNO3 15,0 мг/л, карбенициллин 250,0 мг/л), без селективного агента и инкубировали в течение 3 дней при 25°С при 24-часовом освещении при интенсивности освещения 50 мкмоль м-2 сек-1.
В экспериментах на реакцию ингибирования роста в зависимости от дозы предполагалось, что концентрации глифосата 0,25 мМ и более высокие концентрации были достаточными для ингибирования роста клеток в нетрансформированной линии B104 кукурузы. Зародыши переносили на селекционную среду 1, содержащую 0,5 мМ глифосата (MS соли 4,33 г/л, L-пролин 700,0 мг/л, миоинозит 100,0 мг/л, MES-[(2-(N-морфолино)-этансульфоновую кислоту), свободную кислоту] 0,500 г/л, ферментативный гидролизат казеина 100,0 мг/л, 30 мМ дикамба-КОН 3,3 мг/л, сахарозу 30,0 г/л, Gelzan™ 2,30 г/л, модифицированные соли MS - витамин [1000 X] 1,00 мл/л, 8,5 мг/мл AgNO3 15,0 мг/л, карбенициллин 250,0 мг/л) и инкубировали в течение 7-14 дней при 28°С или в темноте и/или при 24-часовом освещении при интенсивности освещения 50 мкмоль м-2 сек-1.
Пролиферирующие эмбриогенные каллусы переносили на селекционную среду 2, содержащую 1,0 мМ глифосата (MS соли 4,33 г/л, 1,2,3,5/4,6-гексагидроксициклогексан 100 мг/л, L-пролин 700,0 мг/л, MES [(2-(N-морфолино)-этансульфоновую кислоту), свободную кислоту] 0,500 г/л, ферментативный гидролизат казеина 100,0 мг/л, 30 мМ дикамба-КОН 3,3 мг/л, сахарозу 30,0 г/л, Gelzan™ 2,30 г/л, модифицированные соли MS - витамин [1000 X] 1,00 мл/л, 8,5 мг/мл AgNO3 15,0 мг/л, карбенициллин 250,0 мг/л, галоксифоп-Р кислоту 0,1810 мг/л), и инкубировали в течение 14 дней при 28°С или в темноте и/или при 24-часовом освещении при интенсивности освещения 50 мкмоль м-2 сек-1. Этот этап селекции позволял осуществлять дальнейшую пролиферацию и дифференцировку трансгенных каллусов. Период селекции каллусов продолжался в течение трех-четырех недель.
Пролиферирующие эмбриогенные каллусы переносили на среду PreReg, содержащую 0,5 мМ глифосата (MS соли 4,33 г/л, 1,2,3,5/4,6-гексагидроксициклогексан 100 мг/л, L-пролин 350,0 мг/л, MES-[(2-(N-морфолино)-этансульфоновую кислоту), свободную кислоту] 0,250 г/л, ферментативный гидролизат казеина 50,0 мг/л, A-нафтилуксусную кислоту (NAA)-NaOH 0,500 мг/л, абсцизовую кислоту (АВА)-EtOH 2,50 мг/л, BA 1,00 мг/л, сахарозу 45,0 г/л, Gelzan™ 2,50 г/л, модифицированные соли MS - витамин [1000 X] 1,00 мл/л, 8,5 мг/мл AgNO3 15,0 мг/л, карбенициллин 250,0 мг/л, галоксифоп-Р кислоту 0,1810 мг/л), и инкубировали в течение 7 дней при 28°С при 24-часовом освещении при интенсивности освещения 50 мкмоль м-2 сек-1.
Эмбрионогенные каллусы с побегоподобных почек переносили на регенерационную среду, содержащую 0,5 мМ глифосата (MS соли 4,33 г/л, 1,2,3,5/4,6-гексагидроксициклогексан 100,0 мг/л, сахарозу 60,0 г/л, геллановую камедь G434™ 3,00 г/л, модифицированные соли MS - витамин [1000 X] 1,00 мл/л, карбенициллин 125,0 мг/л) и культивировали в течение 7 дней при 24-часовом освещении при интенсивности освещения 50 мкмоль м-2 сек-1.
Небольшие побеги с первичными корнями переносили в фитолотки с корневым субстратом (MS соли 4,33 г/л, модифицированные соли MS - витамин [1000X] 1,00 мл/л, 1,2,3,5/4,6-гексагидроксициклогексан 100 мг/л, сахароза 60,0 г/л, геллановая камедь G434™ 3,00 г/л, карбенициллин 250,0 мг/л) и инкубировали в течение 7 дней при 27°C с циклом освещение/темнота 16/8 часов и интенсивностью освещения 140-190 мкмоль м-2 сек-1. Предполагаемые трансгенные проростки анализировали на количество копий трансгена с использованием протоколов, описанных выше, и пересаживали в почву.
Молекулярное подтверждение наличия трансгенов dgt-28 и aad-1 в растениях кукурузы. Наличие полинуклеотидных последовательностей ДГТ-28 и aad-1 подтверждалось с помощью анализов гидролиза зондов. Проводили исходный скрининг выделенных Т0 растения кукурузы с помощью анализа гидролиза зондов, аналогичного TaqMan™, чтобы подтвердить присутствие трансгенов dgt-28 и aad-1. Данные, полученные в этих исследованиях, использовались для определения количества копий трансгенов и использовались для селекции кукурузных трансгенных объектов для возвратного скрещивания и дальнейшего роста поколения Т1.
Образцы ткани собирали в 96-луночные планшеты, мацерацию ткани проводили с помощью тканевого пульверизатора KLECKO™ и шариков из нержавеющей стали (Hoover Precision Products, Cumming, GA) в буфер Qiagen™ RLT. После мацерации ткани выделяли геномную ДНК в формате высокой пропускной способности с помощью набора Biosprint™ 96 Plant (Qiagen™, Germantown, MD) в соответствии с протоколом, предложенным производителем. Геномную ДНК количественно определяли с использованием набора для анализа ДНК QUANT-IT™ PICO GREEN (Molecular Probes, Invitrogen, Carlsbad, CA). Подсчитанную геномную ДНК доводили приблизительно до 2 нг/мл для анализа гидролиза зондов с использованием автоматизированного жидкостного манипулятора BIOROBOT3000™ (Qiagen, Germantown, MD). Определение количества копий трансгенов путем анализа гидролиза зондов проводили посредством ПЦР в реальном времени с помощью системы LIGHTCYCLER®480 (Roche Applied Science, Indianapolis, IN). Анализы были разработаны для aad-1, dgt-28 и внутреннего референс-гена Invertase (номер доступа Genbank: U16123.1) с помощью программного обеспечения LightCycler® Probe версия 2.0. Для амплификации готовили зонды LIGHTCYCLER®480 Probes Master mix (Roche Applied Science, Indianapolis, IN) в конечной концентрации 1 X в 10 мкл объема мультиплексной реакционой смеси, содержащей 0,4 мкМ каждого праймера для aad-1 и dgt-28 и 0,2 мкМ каждого зонда (Таблица 15).
Двухэтапную реакцию амплификации проводили с удлинением при 60°С в течение 40 секунд с получением флуоресценции. Были проверены все образцы и использовались средние значения порогового цикла (Ct) для анализа каждого образца. Анализ данных ПЦР в реальном времени проводили с использованием программного обеспечения LightCycler™, версия 1,5, с помощью относительного количественного модуля и на основе способа ΔΔCt. Для этого анализа в каждый цикл были включены контрольные образцы, включающие в себя образец геномной ДНК из малокопийного калибратора и проверка 2 известных копий. В Таблице 16 приведены результаты анализов гидролиза зондов.
Последовательности праймеров и зондов, используемые для анализа гидролиза зондов aad-1, dgt-28 и внутреннего референс-гена (Invertase)
Количественные результаты Т0 копий для объектов dgt-28. Малокопийные объекты состояли из 1-2 трансгенных копий, количество однокопийных объектов указано в скобках. Многокопийные объекты содержали 3 или больше копий трансгенов
Толерантность к гербицидам у dgt-28-трансформированной кукурузы. Объекты dgt-28-трансформации Zea mays (Т0) оставляли для акклиматизации в теплице и выращивали до момента перехода растений из тканевой культуры до кондиции роста в теплице (т.е. до появления из мутовки 2-4 новых внешне нормальных листьев). Растения выращивали в теплице при 27°С в условиях 16 часов освещения: 8 часов темноты. Затем растения обрабатывали коммерческим препаратом Дуранго DMA™ (содержащим гербицид глифосат) с добавлением 2% вес/объем сульфата аммония. Гербициды распыляли с помощью самоходного опрыскивателя при объеме распыления 187 л/га и высотой распыления 50 см. Растения Т0 опрыскивали глифосатом в дозе от 280 до 4480 г к.э./га глифосата, который может наносить значительные повреждения нетрансформированным линиям кукурузы. Смертельной дозой считается количество, которое вызывает повреждения у >95% инбредных экземпляров B104.
Результаты, которые показали dgt-28 Т0 растения кукурузы, продемонстрировали, что толерантность к глифосату достигается при дозе до 4480 г к.э./га. Для Т0 поколения использовали конкретный тип субстрата. Минимальная задержка в росте и в целом рост трансформированных растений по сравнению с нетрансформированными контрольными растениями свидетельствовали, что dgt-28 обеспечивает надежную устойчивость к глифосату в случае соединения с транзитными пептидами хлоропластов TraP5, TraP8 и TraP23.
Отобранные T0 растения подвергали самоопылению или возвратному скрещиванию для дополнительно определения их свойств в следующем поколении. 100 выбранных dgt-28-линий, содержащих Т1 растения, опрыскивали глюфозинатом в дозе от 140 до 1120 г к.э./га или глифосатом в дозе от 105 до 1680 г к.э./га. И селектируемый маркер и ген устойчивости к гербицидам конструировали на одной и той же плазмиде. Таким образом, если выбирается один ген толерантности к гербицидам с помощью распыления гербицида, то предполагается присутствие обоих генов. Через 14 дней после обработки (ПО) подсчитывали количество устойчивых и чувствительных растений для определения процента линий с распределением в виде однолокусного доминантного менделевского признака (3R:1S), что определяли тестом хи-квадрат. Эти данные показывают, что dgt-28 является наследуемым в качестве надежного гена устойчивости к глифосату у видов однодольных растений. Для дополнительного определения свойств толерантности и защиты, обусловленных геном dgt-28, на выжившие растения T1 или F1 воздействовали повышенными дозами глифосата.
Послевсходовая толерантность к гербицидам у T0 растений кукурузы, трансформированных dgt-28. Объекты T0 dgt-28, связанные с TraP4, TraP5, TraP8 и TraP23, были получены путем Agrobacterium-трансформации и оставлены для акклиматизации в контролируемых условиях в вегетационной камере роста до появления из мутовки 2-4 новых внешне нормальных листьев. Растениям присваивали индивидуальные идентификационные номера и собирали образцы для анализа количества копий и dgt-28 и aad-1. На основе анализа количества копий были отобраны растения для анализа экспрессии белка. Растения пересаживали в горшки большего размера с новым ростовым субстратом и выращивали в теплице при 27°С в условиях 16 часов освещения: 8 часов темноты. Остальные растения, не отобранные для экспрессии белка, затем обрабатывали коммерческим препаратом Дуранго DMA™ (содержащим гербицид глифосат) с добавлением 2% вес/объем сульфата аммония. Обработки были распределены таким образом, что каждая группа растений содержала Т0 объекты с разным количеством копий. Обработку гербицидами проводили с помощью самоходного опрыскивателя при объеме распыления 187 л/га и высотой распыления 50 см. Растения Т0 опрыскивали глифосатом в дозе от 280 до 4480 г к.э./га глифосата, который может наносить значительные повреждения нетрансформированным линиям кукурузы. Смертельной дозой считается количество, которое вызывает повреждения у >95% инбредных экземпляров B104. B104 представляет собой генетический фон для трансформантов.
Показатели dgt-28 Т0 растений кукурузы продемонстрировали, что толерантность к глифосату достигается при дозе до 4480 г к.э./га. Минимальная задержка роста и в целом рост трансформированных растений по сравнению с нетрансформированными контрольными растениями свидетельствовали, что dgt-28 обеспечивает надежную устойчивость к глифосату в случае его соединения с транзитными пептидами хлоропластов TraP5, TraP8 и TraP23.
Результаты Т0 растений dgt-28-кукурузы показывают, что толерантность к глифосату достигается до дозы 4480 г к.э./га. Таблица 17. Минимальная задержка роста и в целом рост трансформированных растений по сравнению с нетрансформированными контрольными растениями свидетельствует, что dgt-28 обеспечивает надежную устойчивость к глифосату в случае соединения с TraP5, TraP8 и TraP23.
Анализы экспрессии белка путем стандартного ELISA показали что в совокупности исследуемых конструкций среднее содержание dgt-28 белка составляло от 12,6 до 5 нг/см2.
Подтверждение толерантности к глифосату у F1 поколения в тепличных условиях. Для определения дополнительных свойств в следующем поколении проводили возвратное скрещивание однокопийных T0 растений, которые не подвергались опрыскиванию, с нетрансформированными исходными B104. В поколении T1 оценивали толерантность к глифосату для подтверждения наследования гена dgt-28. Растения T1 опрыскивали гербицидом ASSURE II™ (35 г к.э./га хизалофоп-метила) на стадии V1 роста для селекции по белку ААD-1. И селектируемый маркер и ген устойчивости к гербицидам были сконструированы на одной и той же плазмиде. Таким образом, при селекции одного гена предполагается присутствие обоих генов. Через 7 дней после обработки подсчитывали устойчивые и чувствительные растения и из популяции удаляли нулевые растения. Эти данные показывают, что dgt-28 (V1) наследуется как надежный ген устойчивости к глифосату у видов однодольных растений. Образцы растений отбирали для определения свойств DGT-28 белка с помощью стандартного анализа ELISA и определения уровня РНК-транскриптов. Устойчивые растения опрыскивали глифосатом в дозе от 560 до 4480 г к.э./га, как описано выше. Полученные данные показывают надежную толерантность dgt-28, связанного с транзитными пептидами хлоропластов TraP4, TraP5, TraP8 и TraP23 до дозы глифосата 4480 г к.э./га.
Полученные данные по экспрессии белка показали, что в исследованных T1 объектах и конструкциях, создающих экспрессию белка у поколения T1, диапазон содержания dgt-28 белка составлял в среднем от 42,2 до 88,2 нг/см2.
Характеристика DGT-28 кукурузы в полевых условиях. Однокопийные T1 объекты переносили в поле на грунт для получения и гибридных гемизиготных и инбредных гомозиготных семян в целях дополнительного определения их свойств. Гибридные семена были созданы путем скрещивания T1 объектов из трансформированных линий кукурузы B104 с инбредной линией 4XP811, с получением гибридных популяций с разделением объектов 1:1 (гемизиготные:нулевые). Полученные семена вносили на 2 разных участка. В общей сложности было посажено по пять однокопийных объектов на конструкцию в каждом участке по рандомизированной полноблочной схеме в трех экземплярах. Участки поля предназначались для применения глифосата, которое осуществляли на стадии V4 роста, при этом выделяли отдельную группу растений, в которой глифосат применялся на стадии роста V8. В качестве отрицательного контроля использовали общепринятый гибрид 4XP811/B104.
Для устранения нулевых сегрегантов опытные грядки обрабатывали ASSURE II™ в дозе 184 г к.э./га (106 г к.э./л хизалофоп-метила). Все экспериментальные результаты применения ASSURE II™ разделялись в соотношении 1:1 (чувствительные: устойчивые) (р=0,05). Образцы селектированных устойчивых растений отбирались из каждого объекта для количественного определения белка DGT-28 путем стандартного анализа ELISA.
Устойчивые к хизалофоп-метилу растения обрабатывали коммерческим гербицидом Дуранго DMA™ (480 г к.э./л глифосата) с добавлением 2,5% вес/объем аммония-сульфата на стадиях роста или V4 или V8. Распыление гербицидов проводили с помощью штангового опрыскивателя, откалиброванного для доставки объема 187 л/га при высоте распыления 50 см. Растения опрыскивали глифосатом в дозах от 1120 до 4480 г к.э./га глифосата, которые могут наносить значительные повреждения нетрансформированным линиям кукурузы. Смертельная доза определяется как количество, которое вызывает повреждения у >95% инбредных экземпляров 4XP811. Визуальное обследование повреждений заключалось в определении процента визуального хлороза, процента некроза, процента ингибирования роста и общего визуального повреждения на 7, 14 и 21 день ПО (дней после обработки). Обследование проводили по сравнению с необработанными контрольными образцами для каждой линии и отрицательными контрольными образцами.
Данные визуального повреждения при обследовании на всех сроках применения показали значительную толерантность к препарату Дуранго DMA™ до дозы 4480 г к.э./га, как на разных участках применения, так и на разных сроках применения. Представлены репрезентативные объекты из одного участка применения на стадии V4, которые согласуются с другими объектами, сроками и участками применения. Таблица 19. Один объект из конструкции, содержащей связанный с TraP23 dgt-28 (pDAB 107665), обладал толерантностью к выборке ASSURE II™ по белку AAD-1, при этом был чувствителен к глифосату во всех применяемых дозах.
Дополнительные изучали применение глифосата в дозе 4480 г к.э./га на стадии репродуктивного роста. Визуальные показатели кистей, сроки опыления и наполнение початков были аналогичны показателям необработанных контрольных экземпляров из каждой линии для всех конструкций, сроков и участков применения. Количественные результаты для белка DGT-28 представляли собой среднюю экспрессию белка в диапазоне от 186,4 до 303,0 нг/см2. Этот показатель демонстрирует надежную толерантность dgt-28 трансформированной кукурузы к глифосату в дозе до 4480 г к.э./га на стадии репродуктивного роста в полевых условиях. Данные также продемонстрировали детекцию и функции белка DGT-28 на основе полученных показателей при распылении.
Подтверждение наследуемости и толерантности dgt-28 кукурузы в гомозиготном состоянии. Семена от T1S2 высевали в условиях теплицы, как описано выше. Те же самые пять однокопийных линий, свойства которых были определены в полевых условиях, исследовали для определения их характеристик в состоянии гомозиготности. Растения выращивали до стадии роста V3 и разделяли на три группы по дозе глифосата от 1120 до 4480 г к.э./га (Дуранго DMA™) при четырех повторных обработках. Распыление проводили с помощью самоходного опрыскивателя, как описано ранее, и препарат готовили в композиции с сульфатом аммония 2,0% вес/объем. Применение сульфата аммония в каждой линии являлось необработанным контролем. Визуальное обследование проводили на 7 и 14 день после обработки, как описано выше. Данные показали надежную толерантность к глифосату в дозе до 4480 г к.э./га для всех протестированных объектов. Таблица 20.
10. Нетрансформированные В104
Линия от pDAB 107665, которая не обладала толерантностью в полевых условиях, показала отсутствие толерантности к глифосату и, следовательно, соответствовала полевым наблюдениям (данные не показаны). За исключением одной ранее упомянутой линии, все репликанты из линий, обработанных глифосатом, не имели чувствительности к глифосату. Таким образом, эти данные показывают наследуемость по менделевскому типу в гомогенной популяции dgt-28 - кукурузы. Стандартный анализ ELISA экспрессии DGT-28 белка показал среднюю экспрессию белка в диапазоне от 27,5 до 65,8 нг/см2 у однокопийных объектов, обладающих толерантностью к глифосату. Данные демонстрируют функциональный белок и стабильность DGT-28 белка в поколениях.
Послевсходовое применение глифосата в качестве селектируемого маркера толерантности к гербицидам. Как описано ранее, Т0 трансформированные растения были перенесены из тканевой культуры и акклиматизировались в теплице. Тестируемые объекты содержали dgt-28, связанный с транзитными пептидами хлоропластов TraP5, TraP8 и TraP23. Было показано, что эти Т0 растения обладают надежной толернатностью в дозе глифосата до 4480 г к.э./га, и нетрансформированные растения контролировались глифосатом в таких низких концентрациях, как 280 г к.э./га. Эти данные показывают, что dgt-28 можно использовать в качестве селектируемого маркера при концентрации глифосата в диапазоне от 280 до 4480 г к.э./га.
Некое количество семян от фиксированных линий кукурузы, которые содержат трансген dgt-28, насыпали в некое количество нетрансформированных семян кукурузы. Семена высаживали и позволяли им вырасти до стадии развития V1-V3, и в это время ростки опрыскивали глифосатом в выбранных дозах в диапазоне от 280 до 4480 г к.э./га. Через 7-10 дней подсчитывали количество чувствительных и устойчивых растений, и количество толерантных к глифосату растений коррелирует с исходным количеством посаженных трансгенных семян, содержащих трансген dgt-28.
Сцепление dgt-28 у растений кукурузы. Белок ААР-1 используется в качестве селектируемого маркера у dgt-28-трансформированной кукурузы в исследовательских целях. Ген aad-1 также можно использовать в качестве признака толерантности к гербицидам у растений кукурузы для обеспечения надежной толерантности к 2,4-D в случае его применения у культуры до стадии V8. Для четырех объектов из конструкций pDAB 107663 (TraP4::dgt-28), pDAB107664 (TraP8::dgt-28) и pDAB107666 (TraP5::dgt-28) определяли свойства толерантности при применении глифосата и 2,4-D в баковой смеси. Исследование свойств проводили с семенами F1 в условиях теплицы. Применяли самоходный опрыскиватель, как описано выше, с распылением в следующих дозах: 1120-2240 г к.э./га глифосата (селективная доза для гена dgt-28), 1120-2240 г к.э./га 2,4-D (селективная доза для гена aad-1) или баковую смесь двух гербицидов в указанных дозах. Классификацию растений проводили на 7 и 14 день после обработки. Результаты распыления гербицидов в дозе 2240 г к.э./га показаны в таблице 21.
Результаты подтверждают, что dgt-28 можно успешно сцеплять с aad-1, тем самым увеличивая ассортимент гербицидов, которые можно применять на представляющей интерес сельскохозяйственной культуре (глифосат + феноксиуксусная кислота для dgt-28 и aad-1, соответственно). В растениеводстве, где прилагаются большие усилия для контроля широколиственных сорняков или устойчивых биотипов сорняков, такое сцепление можно использовать в качестве способа борьбы с сорняками и защиты представляющей интерес сельскохозяйственной культуры. Дополнительные исходные и приобретенные признаки также могут быть сцеплены с геном dgt-28 в кукурузе и других растениях.
Трансформация сои. Трансгенная соя (Glycine max), содержащая стабильно интегрированный трансген dgt-28, была получена путем Agrobacterium-опосредованной трансформации семядольных узлов эксплантов из сои. Для инициации трансформации использовали нейтрализованный штамм Agrobacterium, несущий бинарный вектор, который содержит функциональный dgt-28.
Agrobacterium-опосредованную трансформацию проводили с использованием модифицированной методики семядольных узлов эксплантов согласно публикации Zeng et al. (Zeng P., Vadnais D.A., Zhang Z., Polacco J.C., (2004), Plant Cell Rep., 22(7): 478-482). Коротко, семена сои (сорт Maverick) проращивали на базальном субстрате, и семядольные узлы выделяли и инфицировали Agrobacterium. Субстраты для появления побегов, удлинения побегов и укоренения были дополнены цефотаксимом, тиментином и ванкомицином для устранения Agrobacterium. Применяли гербицидную селекцию для ингибирования роста нетрансформированных побегов. Для развития корневой системы отдельные ростки переносили в среду для корнеобразования, а затем перемещали в почвенную смесь для акклиматизации всходов.
Концевые листочки выбранных ростков местно обрабатывали гербицидом (по методике смазывания листьев) для скрининга на предполагаемые трансформанты. После скрининга ростки переносили в теплицу, оставляли для акклиматизации, и затем листья смазывали гербицидом для подтверждения толерантности. Проводили отбор образцов таких предполагаемых трансформированных Т0 растений и молекулярные анализы для подтверждения присутствия гербицидного селектируемого маркера и трансгена dgt-28. T0 растения оставляли в теплице для самоопыления в целях получения Т1 семян.
Второй способ трансформации сои можно применять для получения дополнительных трансгенных растений сои. Для инициации трансформации использовали нейтрализованный штамм Agrobacterium, несущий бинарный вектор, который содержит функциональный dgt-28.
Agrobacterium-опосредуемую трансформацию проводили с использованием модифицированной методики половины семян Paz et al, (Paz M., Martinez J., Kalvig A., Fonger T., and Wang K., (2005) Plant Cell Rep., 25: 206-213). Коротко, перед Agrobacterium-опосредуемой трансформацией растений зрелые семена сои подвергали стерилизации в течение ночи путем обработки газообразным хлором и пропитывали стерильной H2O в течение двадцати часов. Семена разрезали на половинки продольным разрезом вдоль рубчика (хилума), чтобы отделить семена и удалить оболочку семени. Иссекали зародышевую ось и из семядоли узла удаляли все осевые побеги/почки. Полученные из половинок семян экспланты инфицировали Agrobacterium. Субстраты для появления побегов, удлинения побегов и укоренения были дополнены цефотаксимом, тиментином и ванкомицином для устранения Agrobacterium. Применяли гербицидную селекцию для ингибирования роста нетрансформированных побегов. Для развития корневой системы отдельные ростки переносили в среду для корнеобразования, а затем перемещали в почвенную смесь для акклиматизации всходов.
Проводили отбор образцов предполагаемых трансформированных Т0 растений и молекулярные анализы для подтверждения присутствия гербицидного селектируемого маркера и трансгена dgt-28. Было идентифицировано несколько объектов, содержащих трансгены. T0 растения оставляли для развития в целях последующего анализа и для самоопыления в теплице в целях получения Т1 семян.
Послевсходовая толерантность к гербицидам у dgt-28 -трансформированных Т1 семян сои. Семена от Т1 объектов, которые с помощью вышеописанные способов скрининга были признаны наследуемыми, высевали в субстрат Metro-Mix в условиях теплицы. Растения выращивали до полного раскрытия первого трилистника и обрабатывали IGNITE™ 280 SL в дозе 411 г к.э./га для селекции на ген pat, как описано выше. Устойчивым растениям из каждого объекта присваивали уникальные идентификационные номера и отбирали образцы для анализа зиготности гена dgt-28. Данные о зиготности были использованы для определения 2 гемизиготных и 2 гомозиготных репликаций на каждой применяемой дозе глифосата, что дает в общей сложности 4 репликации на обработку при наличии достаточного количества растений. Эти растения сравнивали с табаком дикого типа Petite havana tobacco. Все растения опрыскивали с помощью самоходного опрыскивателя, калиброванного на 187 л/га. На растения распыляли диметиламиновую соль Дуранго™ (DMA) в дозе от 560 до 4480 г к.э./га. Рецептуру всех применяемых препаратов делали в воде с добавлением 2% вес/объем сульфата аммония (AMS). Растения обследовали через 7 и 14 дней после обработки. Растения классифицировали по степени повреждения в плане общей визуальной задержки роста, хлороза и некроза. Наблюдалось разделение T1 поколения, поэтому предполагалась некоторая вариабельность реакции по причине разной зиготности.
dgt-28 - защита от повышенных доз глифосата в T2 поколении. Проводили тест на потомство у 45 растений от двух до пяти T2 линий dgt-28 на конструкцию. Гомозиготные линии выбирали на основе анализа зиготности, выполненного у предыдущего поколения. Семена высаживали, как описано выше. Затем растения опрыскивали IGNITE 280 SL в дозе 411 г к.э./га для селекции по селектируемому маркеру pat, как описано выше. Через 3 дня после обработки производили подсчет устойчивых и чувствительных растений.
В конструкциях, содержащих связанный с dgt-28 TraP4 (pDAB107543 и pDAB107548), девять из двенадцати протестированных линий не показывали разделение, тем самым подтверждая однородность линий в T2 поколении. Линии, содержащие связанный с dgt-28 TraP8 (pDAB107545), показали отсутствие сегрегантов в двух линиях из четырех, и показали менделевское наследование по меньшей мере в двух поколениях dgt-28 сои. Образцы ткани брали из устойчивых растений и количественно определяли белок DGT-28 с помощью стандартных способов ELISA. Результаты выявили среднее содержание белка DGT-28 в диапазоне от 32,8 до 107,5 нг/см2 для тестированных неразделяющихся Т2 линий. Линии из конструкции pDAB107553 (TraP23::dgt-28) не подвергались предварительной селекции с глюфозинатом, и в тестах на гомогенность и на толерантность к повышенным дозам глифосата использовали дозозависимую реакцию на глифосат. Репликанты от линий из конструкции pDAB 107553 обладали толерантностью к глифосату в дозе от 560 до 4480 г к.э./га, и таким образом, было подтверждено, что они представляют собой однородную популяцию и имеют наследуемость по меньшей мере в двух поколениях.
Дозы препарата Дуранго DMA в диапазоне от 560 до 4480 г к.э./га глифосата распылялись на растения сои в 2-3 трехлистной фазе, как описано выше. Визуальное обследование повреждения на 14 день после обработки подтверждало показатели толерантности, которые были продемонстрированы в поколении T1.
Трансформация риса с dgt-28. В иллюстративном способе трансформации получали трансгенный рис (Oryza Sativa), содержащий стабильно интегрированный трансген dgt-28, посредством Agrobacterium-опосредованной трансформации стерилизованных зерен риса. Для инициации трансформации использовали нейтрализованный штамм Agrobacterium, несущий бинарный вектор, содержащий функциональные dgt-28.
Уровень рН культуральной среды доводили до 5,8 с помощью 1 М КОН и отверждали культуральную среду фитогелем 2,5 г/л Phytagel (Sigma-Aldrich, St. Louis, MO). Эмбриогенные каллусы культивировали в чашках Петри 100×20 мм, содержащих 30 мл полутвердой среды. Рисовые проростки выращивали в 50 мл среды в боксах MAGENTA. Клеточные суспензии находились в конических колбах 125 мл, содержащих 35 мл жидкой среды, которые вращали со скоростью 125 оборотов в минуту. Индукцию и поддержание эмбриогенных культур проводили в темноте при 25-26°С. Регенерацию растений и культивирование цельного растения осуществляли в освещенном помещении с фотопериодом 16 часов (Zhang et al., 1996).
Индукцию и поддержание эмбриогенного каллуса осуществляли на модифицированной основной NB среде, как описано ранее (Li et al., 1993), при этом подбирали среду, содержащую 500 мг/л глутамина. Культивирование суспензий начинали и поддерживали в жидкой среде SZ (Zhang et al., 1998) с добавлением 30 г/л сахарозы вместо мальтозы. Осмотическая среда (NBO) состояла из NB среды с добавлением по 0,256 М маннита и сорбита. Сбор гербицидустойчивых каллусов проводили на NB среде с добавлением подходящего гербицидного селективного агента в течение 3-4 недель. Предварительную регенерацию проводили в течение 1 недели на среде (PRH50), состоящей из NB среды с добавлением 2,4-дихлорфеноксиуксусной кислоты (2,4-D), 1 мг/л A-нафтилуксусной кислоты (NAA), 5 мг/л абсцизовой кислоты (ABA) и селективного гербицида. Регенерацию проростков проводили после культивирования на регенерационной среде (RNH50), в которой содержалась NB среда, содержащей 2,4-D, 0,5 мг/л NAA и селективный гербицид до момента регенерации предположительно трансгенных побегов. Всходы переносили в среду для корнеобразования с полу-сильными основными солями Мурашига и Скуга (Murashige и Skoog) и витаминами B5 Gamborg, с добавлением 1% сахарозы и селективного гербицида.
Зрелые обезвоженные семена Oryza sativa L. japonica cv. Taipei 309 стерилизовали согласно публикации Zhang et al., 1996. Эмбриогенные ткани индуцировали путем культивирования стерильные зрелых семян риса на NB среде в темноте. Первичный каллус диаметром примерно 1 мм удаляли из щитка и использовали для инициирования клеточной суспензии в жидкой среде SZ. Суспензии затем поддерживали, как описано Zhang 1996. Полученные из суспензии эмбриогенные ткани удаляли из жидкой культуры через 3-5 дней после предыдущего субкультивирования и помещали на осмотическую среду NBO в чашке Петри с образованием круга диаметром примерно 2,5 см, и культивировали в течение 4 часов перед бомбардировкой. Через шестнадцать-двадцать часов после бомбардировки ткани переносили из среды NBO на селективную среду NBH50, гарантируя, что подвергнутая бомбардировке поверхность обращена вверх, и инкубировали в темноте в течение 14-17 дней. Затем свежеобразованный каллус отделяли от исходных бомбардированных эксплантов и помещали рядом на той же среде. Еще через 8-12 дней визуально определяли относительно компактный непрозрачный каллус и переносили его в среду PRH50 для пре-регенерации в течение 7 дней в темноте. Растущий каллус, который становился все более компактным и непрозрачным, впоследствии субкультивировали на регенерационной среде RNH50 в течение 14-21 дней с 16-часовым фотопериодом. Регенерирующиеся побеги переносили в боксы MAGENTA, содержащие среду ½ MSH50. Несколько растений, регенерированных из одного экспланта, считались сибсами и рассматривались как одна независимая линия растений. Растение считали положительным в отношении гена dgt-28, если на среде 1/2 MSH50 оно образует толстые, белые корни и энергично растет. После того как проростки достигали крышки бокса MAGENTA, их переносили в почву в 6-см горшки при 100% влажности в течение недели, а затем переносили в вегетационную камеру с 14-часовым периодом освещения при 30°С и при 21°С в темноте на период 2-3 недели до пересадки в 13-см горшки в теплицу. Семена собирали и сушили при 37°С в течение одной недели перед хранением при 4°С.
T0 анализ dgt-28 риса. Трансформанты риса с трансплантацией, полученные путем Agrobacterium-опосредованной трансформации, переносили в среду и акклиматизировали к условиям теплицы. Все растения были отобраны для ПЦР-детекции dgt-28, и результаты показали двадцать два ПЦР-положительных объекта для pDAB110827 (TraP8::dgt-28) и минимум шестнадцать ПЦР-положительных объектов для pDAB110828 (TraP23::dgt-28). Саузерн-анализ на dgt-28 у ПЦР-положительных объектов выявил простые (1-2-копийные) объекты для обеих конструкций. Анализ экспрессии белка выбранных T0 объектов показал, что экспрессия белка DGT-28 находится в диапазоне от уровня ниже обнаружения до 130 нг/см2. Выбранные T0 объекты из конструкции pDAB110828 обрабатывали препаратом Дуранго DMA™ в дозе 2240 г к.э./га, как описано выше, и исследовали на 7 и 14 день после обработки. Резельтаты показали надежную толерантность к применяемой дозе глифосата. Все ПЦР-положительные растения оставляли для получения T1 семян для дальнейшего исследования.
Наследуемость dgt-28 у риса. Тестирование 100 растений на потомство проводили на четырех линиях T1 dgt-28 из конструкции pDAB110827, содержащей транзитный пептид хлоропластов TraP8. Семена сажали в горшки, наполненные субстратом. Затем все растения опрыскивали препаратом Дуранго DMA™ в дозе 560 г к.э./га для селекции на ген dgt-28, как описано ранее. Через 7 дней ПО подсчитывали устойчивые и чувствительные растения. Две из четырех линий, тестированных на каждую конструкцию, разделялись как однолокусный доминантный менделевский признак (3R:1S), что определяли тестом хи-квадрат. dgt-28 является наследуемым геном устойчивости к глифосату у множества видов.
Послевсходовая толерантность к гербицидам у T1 растений риса, трансформированных dgt-28. T1 устойчивым растениям от каждого объекта, используемого в тестировании на потомство, присваивали индивидуальные идентификационные номера и собирали образцы для анализа зиготности по гену dgt-28. Данные зиготности использовали для определения 2 гемизиготных и 2 гомозиготных репликантов для каждой применяемой дозы глифосата, что в общей сложности дает 4 репликации на обработку. Эти растения сравнивали с растениями риса kitaake дикого типа. Все растения обрабатывали с помощью самоходного опрыскивателя, калиброванного на 187 л/га. Растения опрыскивали препаратом Дуранго DMA™ в дозе от 560 до 2240 г к.э./га. Рецептуру всех применяемых препаратов делали в воде с добавлением 2% вес/объем сульфата аммония (AMS). Растения обследовали через 7 и 14 дней после обработки. Растения классифицировали по степени повреждения в плане общей визуальной задержки роста, хлороза и некроза. Наблюдалось разделение T1 поколения, поэтому предполагалась некоторая вариабельность реакции по причине разной зиготности.
Результаты распыления на 7 день ПО (день после обработки) показали, что выявлены минимальные повреждения растений при повышенных дозах глифосата (данные не представлены).
Детекцию белка DGT-28 оценивали по репликантам от всех четырех T1 линий, тестированных от pDAB110827. Данные показали средний уровень белка DGT-28 в диапазоне от 20 до 82 нг/см2 и от 21 до 209 нг/см2 для гемизиготных и гомозиготных репликантов, соответственно. Эти результаты демонстируют стабильную экспрессию белка в поколении T1 и толерантность dgt-28 риса к глифосату в дозе до 2240 г к.э./га после применения глифосата в дозе 560 г к.э./га, используемой для селекции.
Трансформация табака с dgt-28. Фрагменты листьев табака (cv. Petite havana) подвергали трансформации с использованием Agrobacterium tumefaciens, содержащих dgt-28 трансген. Одиночные колонии, содержащие плазмиды, которые содержали трансген dgt-28, инокулировали в 4 мл YEP среду, содержащую спектиномицин (50 мкг/мл) и стрептомицин (125 мг/л), и инкубировали в течение ночи при 28°С на шейкере при 10 оборотов в минуту. Затем культуру семян 4 мл использовали для инокуляции 25 мл культуры в той же среде в колбе Эрленмейера с перегородками объемом 125 мл. Эту культуру инкубировали при 28°С с взбалтыванием при 190 оборотах в минуту, до достижения оптической плотности OD600 приблизительно 1,2. Затем десять мл суспензии Agrobacterium помещали в стерильные чашки Петри™ 60×20 мм.μg/mL)
Фрагменты свежесрезанных листьев (0,5 см) из растений, выращенных в асептических условиях на среде MS (Phytotechnology Labs, Shawnee Mission, KS) с 30 г/л сахарозы в боксах PhytaTrays™ (Sigma, St. Louis, MO) вымачивали в течение нескольких минут в 10 мл ночной культуры Agrobacterium, высушивали на стерильной фильтровальной бумагой, а затем помещали в ту же среду с добавлением 1 мг/л индолуксусной кислоты и 1 мг/л 6-бензиламинопурина. Через три дня фрагменты листьев, сокультивированные с несущими трансген dgt-28 Agrobacterium, переносили в ту же среду с 5 мг/л Basta™ и 250 мг/л цефотаксима.
Через 3 недели отдельные Т0 проростки переносили в среду МS с 10 мг/л Basta™ и 250 мг/л цефотаксима на дополнительные 3 недели перед их высадкой в почву и переносом в теплицу. Селектированные T0 растения (согласно определению с использованием протоколов молекулярного анализа, описанных выше) оставляли для самоопыления, затем собирали семена из оболочек после их полного высыхания. T1 саженцы подвергали скринингу на зиготность и экспрессию гена-репортера (как описано ниже), и идентифицировали выбранные растения, содержащие трансген dgt-28.
Растения переносили в теплицу с вымыванием агара из корней, пересаживали в почву в квадратные горшки 13,75 см, помещая горшок в пакет Ziploc® (SC Johnson & Son, Inc), на дно пакета наливали водопроводную воду и содержали в теплице с непрямым освещением при 30°C в течение одной недели. Через 3-7 дней пакет открывали, растения оплодотворяли и оставляли для роста в открытом пакете до их акклиматизации в теплице, после чего пакет удаляли. Растения выращивали при обычных условиях теплой теплицы (27°С день, 24°С ночью, 16 часовой день, минимальный естественный свет + дополнительное освещение = 1200 μΕ/м2s1).
Перед размножением T0 растения были отобраны для анализа ДНК, с целью определить количество вставленных копий dgt-28 с помощью ПЦР в реальном времени. Свежие ткани помещали в пробирки и лиофилизировали при температуре 4°С в течение 2 дней. После полного высушивания ткани в пробирки помещали вольфрамый шарик (Valenite) и осуществляли сухой помол образцов в течение 1 минуты с использованием шаровой мельницы Kelco. Затем начинали стандартную процедуру DNeasy™ выделения ДНК (Qiagen, DNeasy 69109). После этого аликвотные количества выделенной ДНК окрашивали Pico Green (Molecular Probes P7589) и исследовали во флуорометре (BioTek™) с известными стандартами, чтобы получить концентрацию порядка нг/мкл. Всего в качестве матрицы использовали 100 нг общей ДНК. Реакцию ПЦР проводили в амплификаторе GeneAmp 9700™ (Applied Biosystems), с воздействием на образцы циклами 94°С в течение 3 минут и 35 циклами 94°С в течение 30 секунд, 64°С в течение 30 секунд и 72°C в течение 1 минуты и 45 секунд, с последующим воздействием 72°С в течение 10 минут. ПЦР-продукты анализировали способом электрофореза в 1% агарозном геле, окрашенном EtBr, и подтверждали Саузерн-блоттингом.
Были регенерированы и перенесены в теплицу от пяти до девяти ПЦР-положительных объектов с 1-3 копиями гена dgt-28 из 3 конструкций, содержащих разные последовательности транзитного пептида хлоропластов (TraP4, TraP8 и TraP23).
Образцы всех ПЦР-положительных растений тестировали для количественного определения белка DGT-28 путем стандартного анализа ELISA. Белок DGT-28 был обнаружен во всех ПЦР-положительных растениях и отмечена тенденция к повышению концентрации белка с увеличением количества копий dgt-28.
Наследуемость aad-12 (v1) у табака. Тестирование 100 растений на потомство проводили на пяти T1 линиях dgt-28 на конструкцию. Конструкции содержали одну из следующих последовательностей транзитных пептидов хлоропластов: TraP4, TraP8 или TraP23. Семена стратифицировали, высевали и пересаживали по методике, аналогичной процедурам с Arabidopsis, примеры которых приведены выше, с тем исключением, что в исходной селекции до пересадки не удалялись нулевые растения. Затем все растения опрыскивали препаратом IGNITE 280 SL 280 в дозе г к.э./га для отбора на селектируемый маркер pat, как описано выше. Через 3 дня ПО подсчитывали количество устойчивых и чувствительных растений.
Четыре из пяти линий, тестированных на каждую конструкцию, разделялись как однолокусный доминантный менделевский признак (3R:1S), что определяли тестом хи-квадрат. dgt-28 является наследуемым геном устойчивости к глифосату у множества видов.
Послевсходовая толерантность к гербицидам у T1 растений табака, трансформированных dgt-28. T1 устойчивым растениям от каждого объекта, используемого в тестировании на потомство, присваивали индивидуальные идентификационные номера и собирали образцы для анализа зиготности по гену dgt-28. Данные зиготности использовали для определения 2 гемизиготных и 2 гомозиготных репликантов для каждой применяемой дозы глифосата, что в общей сложности дает 4 репликации на обработку. Эти растения сравнивали с растениями табака Petite havana дикого типа. Все растения обрабатывали с помощью самоходного опрыскивателя, калиброванного на 187 л/га. Растения опрыскивали препаратом Дуранго DMA™ в дозе от 560 до 4480 г к.э./га. Рецептуру всех применяемых препаратов делали в воде с добавлением 2% вес/объем сульфата аммония (AMS). Растения обследовали через 7 и 14 дней после обработки. Растения классифицировали по степени повреждения в плане общей визуальной задержки роста, хлороза и некроза. Наблюдалось разделение T1 поколения, поэтому предполагалась некоторая вариабельность реакции по причине разной зиготности.
Результаты распыления на 7 день ПО (день после обработки) показали, что выявлены минимальные повреждения растений при повышенных дозах глифосата (данные не представлены).
Таблица 24. По визуальным результатам повреждения через 14 дней ПО в среднем обнаружено менее 15% визуального повреждения глифосатом в дозе до 2240 г к.э./га. Через 14 дней после обработки визуальные результаты повреждения показали увеличение повреждений у однокопийных объектов из конструкций, содержащих TraP4, по сравнению с однокопийными объектами из конструкций TraP8 и TraP23. Таблица 25.
Эти результаты показали толерантность dgt-28 к глифосату в дозе до 4480 г к.э./га, а также различия в толерантности, обусловленные последовательностями транзитных пептидов хлоропластов, связанных с геном dgt-28.
dgt-28 - защита от повышенных доз глифосата в T2 поколении.
Проводили тест на потомство у 25 растений от двух до трех T2 линий dgt-28 на конструкцию. Гомозиготные линии выбирали на основе анализа зиготности, выполненного у предыдущего поколения. Семена стратифицировали, высевали и пересаживали, как описано выше. Затем растения опрыскивали препаратом IGNITE 280 SL в дозе 280 г к.э./га для отбора по селектируемому маркеру pat, как описано выше. Через 3 дня после обработки производили подсчет устойчивых и чувствительных растений. Все линии, тестированные по каждой конструкции, не показывали разделение, тем самым подтверждая однородность линий в T2 поколении и показывая менделевское наследование по меньшей мере в двух поколениях dgt-28 растений табака.
Дозы препарата Дуранго DMA™ в диапазоне от 420 до 3360 г к.э./га глифосата распылялись на растения табака в фазе 2-3 листьев фазе, как описано выше. Визуальное обследование повреждения на 14 день после обработки подтверждало показатели толерантности, которые были продемонстрированы в поколении T1. Результаты от листьев, полученные от двухкопийных линий с конструкцией, содержащей TraP4, показали сходную толерантность, по сравнению с результатами от однокопийных линий TraP8 и TraP23 (данные не представлены).
Полученные данные показывают надежную толерантность растений табака dgt-28 к глифосату в дозе до 3360 в г к.э./га на протяжении двух поколений по сравнению с нетрансформированными контрольными растениями.
Образцы селектированных растений с каждым объектом были отобраны перед распылением глифосата для анализов белка DGT-28 путем стандартного DGT-28 ELISA. Результаты показали, что средняя экспрессия белка DGT-28 из малокопийных (1-2 копии) линий в конструкциях составляет от 72,8 до 114,5 нг/см2. Полученные данные свидетельствуют, что dgt-28 экспрессирует белок в T2 поколении трансформированного табака, и показатели толерантности подтверждают наличие функционального белка DGT-28.
Сцепление с dgt-28 для увеличения ассортимента гербицидов у растений табака (cv. Petit Havana). Проводили реципрокное скрещивание двух гомозиготных растений dgt-28 (pDAB107543 и pDAB107545) и aad-12 v1 (pDAB3278) (см. РСТ/US2006/042133 в отношении последнего растения, которое включено в настоящее описание посредством этой ссылки во всей полноте) и собирали семена F1. Эти F1 семена из двух реципрокных скрещиваний каждого гена стратифицировали и 6 репликантов от каждого скрещивания обрабатывали глифосатом в дозе 1120 г к.э./га (селективным для гена dgt-28), 2,4-D в дозе 1120 г к.э./га (селективным для гена aad-12) или баковой смесью двух гербицидов в указанных дозах. Классификацию растений проводили на 14 день после обработки. Результаты распыления гербицидов показаны в таблице 27.
Результаты подтверждают, что dgt-28 можно успешно сцеплять с aad-12 (v1), тем самым увеличивая ассортимент гербицидов, которые можно применять на представляющей интерес сельскохозяйственной культуре (глифосат + феноксиуксусная кислота для dgt-28 и aad-12, соответственно). В растениеводстве, где прилагаются большие усилия для контроля широколиственных сорняков или устойчивых биотипов сорняков, такое сцепление можно использовать в качестве способа борьбы с сорняками и защиты представляющей интерес сельскохозяйственной культуры. Дополнительные исходные и приобретенные признаки также могут быть сцеплены с геном dgt-28.
Устойчивость к глифосату у пшеницы
Получение бинарных векторов, кодирующих DGT-28. Бинарные векторы, содержащие кассеты экспрессии DGT-28 и селективные кассеты экспрессии PAT, были сконструированы и собраны с помощью навыков и технологий, общеизвестных в данной области техники. Каждая кассета экспрессии DGT-28 содержит промотор, 5'-нетранслируемую область и интрон из гена убиквитина (Ubi) из Zea mays (Toki et al. Plant Physiology 1992, 100 1503-07), и далее располагается кодирующая последовательность, состоящая из одного из четырех транзитных пептидов (TraP4, TraP8, TraP23 или TraP5), слитых с 5'-концом синтетического варианта гена 5-енолпирувилшикимат-3-фосфат синтазы (DGT-28), которая была оптимизирована по кодонам для экспрессии в растениях. Конец кассеты экспрессии DGT-28 представляет собой 3'-нетранслируемую область (UTR), содержащую сайт терминации транскрипции и сайт полиаденилирования гена липазы (Vpl) из Z. mays (Paek et al. Mol. Cells 1998 30: 8 (3) 336-42). Селективная кассета PAT состоит из промотора, 5'-нетранслируемой области и интрона из гена Actin (Act1) из Oryza sativa (McElroy et al. The Plant Cell 1990 2 (2) 163-171), и далее располагается синтетический вариант гена фосфинотрицинацетилтрансферазы (PAT), выделенный из Streptomyces viridochromogenes, который был оптимизирован по кодонам для экспрессии в растениях. Ген PAT кодирует белок, который придает резистентность к ингибиторам глутамин-синтетазы, содержащим фофинотрицин, глуфосинат и биалафос (Wohlleben et al., Gene 1988, 70 (1), 25-37). Конец селективной кассеты представляет собой 3'-UTR, содержащую сайт терминации транскрипции и сайт полиаденилирования из гена 35s вируса мозаики цветной капусты (CaMV) (Chenault et al. Plant Physiology, 1993 101 (4), 1395-1396).
Селективная кассета была синтезирована коммерческим поставщиком генного синтеза (GeneArt, Life Technologies) и клонирована в Gateway-включенный бинарный вектор. Кассеты экспрессии DGT-28 субклонировали в pDOR221. Полученный в результате клон ENTRY использовали в реакции LR Clonase II (Invitrogen, Life Technologies) с Gateway-включенным бинарным вектором, кодирующим экспрессионную кассету фосфинотрицинацетилтрансферазы (PAT). Проводили исходный скрининг колонии всех собранных плазмид путем рестрикционного расщепления очищенной ДНК с использованием эндонуклеаз рестрикции, полученных из New England Biolabs (NEB; Ipswich, MA) и Promega (Promega Corporation, WI). Препараты плазмидной ДНК готовили с использованием набора Qiaprep Spin Miniprep Kit (Qiagen, Hilden) или системы Pure Yield Plasmid Maxiprep System (Promega Corporation, WI), в соответствии с инструкциями поставщиков. Плазмидную ДНК из селектированных клонов секвенировали с использованием протокола циклов секвенирования v3.1 (ABI Sanger Sequencing and Big Dye Terminator v3.1, Applied Biosystems, Life Technologies). Данные по последовательностям собирали и анализировали с помощью программного обеспечения SEQUENCHER™ (Gene Codes Corporation, Ann Arbor, MI).
Каждый из четырех полученных клонов бинарной экспрессии: pDAS000122 (TraP4-DGT28), pDAS000123 (TraP8-DGT28), pDAS000124 (TraP23-DGT28) и pDAS000125 (TraP5-DGT28) был трансформирован в штамм EHA105 Agrobacterium tumefaciens.
Получение трансгенных объектов пшеницы с экспрессионной конструкцией dgt-28. Трансгенные растения пшеницы, экспрессирующие одну из четырех DGT-28 экспрессирующих конструкций, были получены путем Agrobacterium-опосредуемой трансформации с использованием донорской линии пшеницы Bobwhite MPB26RH, в соответствии с протоколом, аналогичным протоколу Wu et al. Transgenic Research 2008, 17: 425-436. Проводили селекцию предполагаемых Т0 трансгенных объектов на толерантность к фосфинотрицину (РРТ), этот фенотип был обусловлен селектируемым маркером PAT, и затем растения пересаживали в почву. Т0 растения выращивали в условиях закрытой теплицы и получали T1 семена. Всего было создано приблизительно 45 отдельных Т0 объектов для каждой экспрессионной конструкции DGT-28.
Толерантность к глифосату у Т0 пшеницы dgt-28-объектов пшеницы. Т0 объекты оставляли для акклиматизации в теплице и выращивали до появления из мутовки 2-4 новых внешне нормальных листьев (т.е. растения переносили из тканевой культуры до кондиции роста в теплице). Растения выращивали при 25°С в условиях 12 часов дополнительного освещения в теплице до созревания. Исходный скрининг на толерантность к глифосату и анализ Taqman проводили с T1 растениями, выращенными в условиях, аналогичных описанным выше. Полученные данные позволили выявить наследуемые T1 объекты для дальнейшего определения их свойств. Шесть малокопийных (1-2 копии) и два мультикопийных T1 объекта пересаживали в условия теплицы и выращивали до стадии 3 листьев. T1 растения опрыскивали коммерческим препаратом глифосата (Дуранго DMA™) в дозах от 420 до 3360 г к.э./га, которые способны значительно повреждать нетрансформированные линии пшеницы. При распылении добавляли 2% вес/объем сульфата аммония. Смертельную дозу определяли как уровень содержания, который вызывает >75% повреждений у нетрансформированных контрольных растений Bob White MPB26RH.
Применение гербицидов
В этом примере распылене глифосата использовали как для определения распределения гена dgt-28 в поколении T1, так и для демонстрации толерантности к повышению содержания глифосата. Реакция растений представлена в виде шкалы визуальных повреждений через 21 день после обработки (ПО). Данные представлены в виде гистограммы отдельных растений, показавших менее чем 25% визуальных повреждений (4), 25-50% визуальных повреждений (3), 50-75% визуальных повреждений (2) и более 75% повреждений (1). Среднее арифметическое значение и стандартное отклонение представлено для каждой конструкции, используемой для трансформации пшеницы. Диапазон показателей индивидуальной реакции также указан в последнем столбце для каждой дозы и трансформации. В качестве контроля чувствительности к глифосату использовали нетрансформированную пшеницу дикого типа (сорт Bob White MPB26RH). Для тестирования каждого объекта в T1 поколении были доступны гемизиготные и гомозиготные растения, и поэтому они были включены в тестирование каждой применяемой дозы глифосата. Гемизиготные растения содержат половину дозы гена, в отличие от гомозиготных растений, поэтому в поколении T1 можно ожидать изменчивость реакции на глифосат.
Результаты T1 dgt-28 растений пшеницы показали, что толерантность к глифосату была достигнута при дозах до 3360 г к.э./га с транзитными пептидами хлоропластов TraP4, TraP5, TraP8 и TraP23. Таблица 28. Полученные данные отражают результаты малокопийных T1 объектов, при этом являются репрезентативными для популяции каждой конструкции.
На 21 день после обработки подсчитывали устойчивые и чувствительные растения для определения процента линий, которые разделяются как однолокусный доминантный менделевский признак (3R:1S), что определяют в тесте хи-квадрат. Таблица 29. Полученные данные показывают, что dgt-28 является наследуемым как ген надежной устойчивости к глифосату у видов однодольных растений.
Пример 4: Последовательности синтетических транзитных пептидов хлоропластов (TraP) для экспрессии агрономически важных трансгенов в кукурузе
Cry2Aa:
Белок Cry2Aa от Bacillus Thuringiensis проявлял активность против Helicoverpa zea (CEW) и Ostrinia nubilalis (ECB). На растениях кукурузы тестировали единственный вариант гена cry2Aa (SEQ ID NO: 13), кодон, предназначенный для кукурузы. В этом эксперименте Cry2Aa исследовали по отдельности и в сочетании с синтетическим транзитным пептидом хлоропластов в кукурузе TraP23, чтобы определить действие устойчивости к насекомым и оценить эффект, который будет оказывать последовательность синтетического транзитного пептида хлоропластов TraP23 на экспрессию белка Cry2Aa в кукурузе.
Полинуклеотидная последовательность (SEQ ID NO: 12), кодирующая Trap23 v2 синтетический транзитный пептид хлоропластов, и линкерный GCA кодон были клонированы в 3'-5' направлении от гена cry2Aa и включены в конструкцию pDAB109808 (фиг. 7) для тестирования растений кукурузы на устойчивость к насекомым. Полученная конструкция содержала две единицы транскрипции растения (PTU). Первая PTU содержала промотор убиквитин 1 Zea mays (промотор ZmUbi1, Christensen, A., Sharrock R., and Quail P., (1992) Maize polyubiquitin genes: structure, thermal perturbation of expression and transcript splicing, and promoter activity following transfer to protoplasts by electroporation, Plant Molecular Biology, 18:67518: 675-689), слитый ген TraP23-cry2Aa (TraP23 Cry2Aa), и 3'нетранслируемую область липазы Zea mays (ZmLip 3'UTR; Патент США № 7179902). Вторая PTU состояла из промотора палочковидного вируса сахарного тростника (SCBV промотор; патент США 6489462), гена aad-1 толерантности к гербицидам, содержащего лидер MSV и интрон 6 алкогольдегидрогеназы 1 (ААР-1; патент США № 7838733, и MSV лидерную последовательность, № доступа Genbank FJ882146.1, и интрон алкогольдегидрогеназы, № доступа Genbank EF539368.1), и 3'нетранслируемую область липазы Zea mays (ZmLip 3'UTR). Была сконструирована и включена в исследование контрольная плазмида pDAB107687, которая не содержит последовательность транзитного пептида хлоропласта в 3'-5' направлении от гена cry2Aa (фиг. 8). Плазмиды вводили в Agrobacterium tumefaciens для трансформации растений.
Початки культивара В104 Zea mays собирали примерно на 10-12 день после опыления. Собранные початки очищали от листовых оберток и поверхностно стерилизовали путем погружения в 20% коммерческий раствор хлорной извести (Ultra Clorox® Germicidal Bleach, 6,15% гипохлорита натрия) и две капли Твина 20 на 20 минут, с последующими тремя циклами ополоскивания в стерильной, деионизированной воде в вытяжном шкафу с ламинарным потоком. Незрелые зиготические зародыши (размером от 1,8 до 2,2 мм) в асептических условиях вычленяли из каждого початка и случайным образом распределяли в одну или несколько микроцентрифужных пробирок, содержащих 2,0 мл суспензии Agrobacterium, в которую были добавлены 2 мкл 10% поверхностно-активного вещества Break-Thru® S233.
По окончании манипуляций по выделению зародышей пробирку с зародышами закупоривали и помещали на платформу качалки на 5 минут. Затем содержимое прибирки выливали в чашку со средой для со-культивирования и удаляли жидкую суспензию Agrobacterium с помощью стерильной одноразовой пипетки. Со-культуральную чашку, содержащую зародыши, помещали около задней стенки вытяжного шкафа с ламинарным потоком с приоткрытой крышкой на 30 минут, после чего зародыши располагали щитком вверх с помощью микроскопа. Затем возвращали со-культуральные чашки с зародышами к задней стенке вытяжного шкафа с ламинарным потоком с приоткрытой крышкой еще на 15 минут. После этого чашку закрывали, укупоривали лентой 3M Micropore и помещали в термостат при 25°С с освещением 24 часа в сутки с интенсивностью света приблизительно 60 мкмоль м-2 сек-1.
После периода со-культивирования зародыши переносили в среду покоя. В каждую чашку переносили не более 36 зародышей. Чашки оборачивали лентой 3M Micropore и инкубировали в течение 7-10 дней при 27°С с освещением 24 часа в сутки с интенсивностью света приблизительно 50 мкмоль м-2 сек-1. Затем каллусные зародыши переносили на селективную среду I. В каждую чашку с селективной средой I переносили не более 18 каллусных зародышей. Чашки оборачивали лентой 3M Micropore и инкубировали в течение 7 дней при 27°С с освещением 24 часа в сутки с интенсивностью света приблизительно 50 мкмоль м-2 сек-1. Затем каллусные зародыши переносили на селективную среду II. В каждую чашку с селективной средой II переносили не более 12 каллусных зародышей. Чашки оборачивали лентой 3M Micropore и инкубировали в течение 14 дней при 27°С с освещением 24 часа в сутки с интенсивностью света приблизительно 50 мкмоль м-2 сек-1.
На этом этапе устойчивые каллусы переносили в пре-регенерационную среду. В каждую чашку для пре-регенерации переносили не более девяти каллусов. Чашки оборачивали лентой 3M Micropore и инкубировали в течение 7 дней при 27°С с освещением 24 часа в сутки с интенсивностью света приблизительно 50 мкмоль м-2 сек-1. После этого регенерирующие каллусы переносили в среду для регенерации в боксы Phytatrays™ и инкубировали при 28°С с режимом 16 часов освещения/8 часов темноты в сутки с интенсивностью света приблизительно 150 мкмоль м-2 сек-1 в течение 7-14 дней или до появления побегов. В каждый бокс Phytatray™ помещали не более пяти каллусов. Затем маленькие побеги с первичными корнями выделяли и переносили в среду для побегообразования/корнеобразования. Укоренившиеся проростки высотой приблизительно 6 см или больше пересаживали в почву и переносили в вегетационую камеру для закаливания.
Трансгенные растения получали уникальные идентификационные номера и на регулярной основе переносились в теплицу. Растения пересаживали из боксов Phytatrays™ в небольшие горшки, заполненных растовым субстратом (Premier Tech Horticulture, ProMix BX, 0581 P) и накрывали куполами для подержания влажности, что способствует акклиматизации растений. Растения до достижения стадии V3-V4 помещались в вегетационную камеру Conviron™ (28°C/24°С, фотопериод 16 часов, относительная влажность от 50 до 70%, интенсивность света 200 мкмоль). Этот этап способствует акклиматизации растений к почве и суровым температурам. Затем растения переносили в теплицу (тип световой экспозиции: фото или ассимиляция; предел освещения: 1200 PAR; продолжительность светового дня 16 часов; 27°C днем/24°C ночью) и пересаживали из маленьких горшков в горшки до 5,5 дюйма (14 см). Примерно через 1-2 недели после пересадки рассады в большие горшки отбирали образцы растений для биотестирования. Биоанализу подвергали одно растение на объект.
Были определены выбранные объекты для выращивания к следующему поколению на основании количества копий генов, детекции белка путем вестерн-блоттинга и биоанализов активности против насекомых. Объекты, которые содержали ген устойчивости к спектиномицину, были отмечены, но не обязательно исключены из дальнейшего выращивания. Объекты, выбранные для дальнейшего выращивания, пересаживали в горшки объемом 5 галлонов (19 л). Периодические наблюдения проводили для отслеживания любых аномальных фенотипов. Побеги накрывали мешочками до появления шелковых нитей, чтобы предотвратить перекрестное загрязнение случайной пыльцой. Отмечали любые побеги, образовавшие шелковые нити до накрывания мешочками, и эти побеги удаляли. Затем накрывали второй побег и использовали для опыления. Растения, у которых появлялись аномальные побеги или отсутствовали побеги, были отмечены в базе данных. Шелковые нити отрезали за один день до опыления, чтобы обеспечить прием пыльцы даже кистью, и происходило самоопыление растений.
Растения для T1 селекции опрыскивали через 7 дней после посева. Эти растения выращивались в 4-дюймовых (10,2 см) горшках с горшечной землей Metro 360 с 15 горшками в поддоне. Растения находились на стадии роста V1-V1.5. Горшки с плохой всхожестью или содержащие очень маленькие растения (с еще закрытой мутовкой) отмечались таким образом, что их не включали в селекционную оценку. Целые поддоны растений помещали в средние лотки-носители для применения опрыскивателя. Лотки размещали сразу по два лотка в самоходный опрыскиватель Mandel, откалиброванный для доставки объема 187 л/га в целевой участок, используя насадку 8002E с плоскокрылым вентилятором (Tee Jet). Для такого применения была разработана рецептура раствора 35 г к.э./га Assure II (хизалофоп) + 1% COC (концентрат растительного масла). Для расчета общего необходимого распыляемого раствора использовали объем 15 мл. Расчеты: (35 г к.э./га)×(1 га/187 л)×(1 л/97,7 га) Assure II) = 0,192% раствора или 28,74 мкл/15 мл H2О+1% объем/объем). После опрыскивания растения оставляли для обсыхания в течение одного часа в распылительной лаборатории перед возвращением в теплицу. Примерно через 1-2 недели после пересадки растений в большие горшки образцы растений собирали для биотестирования. Биоанализ проводили с одним растением на объект.
Все Т0 объекты, прошедших скрининг молекулярного анализа, были проанализированы на уровень экспрессии белка Cry2Aa. Объекты из контрольной конструкции pDAB107687, которая содержала Cry2Aa без TraP, имели значительно более высокий средний уровень экспрессии Cry2Aa (15,0 нг/см2) по сравнению с объектами из pDAB109808 (0,2 нг/см2), которые содержали TraP23. Несмотря на снижение уровней экспрессии объектов pDAB109808, эти объекты продолжали экспрессировать белок Cry2Aa.
Трансгенные растения, содержащие одиничные копии Т-нити, содержащей ген cry2Aa, были тестированы на инсектицидную активность в биопробах, проведенных с новорожденными гусеницами чешуекрылых на листьях из трансгенных растений. Тестировали следующие виды чешуекрылых: кукурузный мотылек, Ostrinia nubilalis (Hiibner) (ECB) и совка хлопковая, Helicoverpa zea (CEW).
32-луночные лотки (C-D International, Pitman, NJ) были частично наполнены 2% раствором агара и агару давали затвердеть. Фрагменты листьев, примерно каждый второй, были взяты из каждого растения и помещены по отдельности в 32-луночные лотки. Один фрагмент листа помещали в каждую лунку, и тестировали два фрагмента листьев на одно растение и на одно насекомое. Массовое заражение насекомыми проводили с помощью кисти, размещения по десять новорожденных личинок в каждую лунку. Лотки закрывали перфорированными липкими крышками, которые давали возможность вентиляции в ходе теста. Лотки размещали на три дня при 28°С, относительной влажности 40%, режиме освещения 16 часов: 8 часов темноты. После проведения теста для каждого фрагмента листа подсчитывали простой процентный показатель повреждения. Выводили средние значения повреждения для каждого теста и использовали наряду с анализом экспрессии белка для проведения корреляционных анализов.
Результаты биоанализов показали, что последовательность синтетического транзитного пептида хлоропластов TraP23 была функциональной, поскольку объекты pDAB109808 обеспечивали защиту от насекомых, протестированных в биоанализах. В случае трансгенных объектов, растения, экспрессирующие белок Cry2Aa без TraP (pDAB107687), имели среднее повреждение листьев, которое значительно превышало повреждение у растений, экспрессирующих белок Cry2Aa с TraP23 (pDAB109808), во всех видах протестированных насекомых. Несмотря на то, что объекты pDAB109808 с TraP23 имели больше повреждений листьев по сравнению с объектами без TraP, эти объекты pDAB109808 обеспечивали защиту против насекомых, протестированных в биоанализе.
--->
СПИСКИ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Lira, Justin
Cicchillo, Robert M.
Yerkes, Carla
Robinson, Andrew
<120> Синтетические транзитные пептиды хлоропластов
<130> 2971-P10295US (71607)
<160> 64
<170> PatentIn version 3.5
<210> 1
<211> 73
<212> PRT (белок)
<213> Glycine max (трансгенная соя)
<400> 1
Met Ala Gln Val Ser Arg Val His Asn Leu Ala Gln Ser Thr Gln Ile
1 5 10 15
Phe Gly His Ser Ser Asn Ser Asn Lys Leu Lys Ser Val Asn Ser Val
20 25 30
Ser Leu Arg Pro Arg Leu Trp Gly Ala Ser Lys Ser Arg Ile Pro Met
35 40 45
His Lys Asn Gly Ser Phe Met Gly Asn Phe Asn Val Gly Lys Gly Asn
50 55 60
Ser Gly Val Phe Lys Val Ser Ala Ser
65 70
<210> 2
<211> 71
<212> PRT (белок)
<213> Arabidopsis thaliana
<400> 2
Met Ala Gln Val Ser Arg Ile Cys Asn Gly Val Gln Asn Pro Ser Leu
1 5 10 15
Ile Ser Asn Leu Ser Lys Ser Ser Gln Arg Lys Ser Pro Leu Ser Val
20 25 30
Ser Leu Lys Thr Gln Gln His Pro Arg Ala Tyr Pro Ile Ser Ser Ser
35 40 45
Trp Gly Leu Lys Lys Ser Gly Met Thr Leu Ile Gly Ser Glu Leu Arg
50 55 60
Pro Leu Lys Val Met Ser Ser
65 70
<210> 3
<211> 67
<212> PRT (белок)
<213> Brassica napus
<400> 3
Met Ala Gln Ser Ser Arg Ile Cys His Gly Val Gln Asn Pro Cys Val
1 5 10 15
Ile Ile Ser Asn Leu Ser Lys Ser Asn Gln Asn Lys Ser Pro Phe Ser
20 25 30
Val Ser Leu Lys Thr His Gln Pro Arg Ala Ser Ser Trp Gly Leu Lys
35 40 45
Lys Ser Gly Thr Met Leu Asn Gly Ser Val Ile Arg Pro Val Lys Val
50 55 60
Thr Ala Ser
65
<210> 4
<211> 71
<212> PRT (белок)
<213> Phaseolus vulgaris
<400> 4
Met Ala Gln Val Asn Arg Met Ile Asn Gly Val Lys Ile Ala Phe Leu
1 5 10 15
Ser Ser Asn Leu Ser Asn Thr Ser Gln Gly Asn Ser Pro Phe Ser Leu
20 25 30
Thr Leu Ile Thr Pro Ser His Lys Ala Thr Gln Pro Ser Ser Ser Ser
35 40 45
Trp Gly Leu Lys Lys Asp Ser Met Ile Leu Ser Gly Ala Glu Leu Ser
50 55 60
Pro Phe Lys Val Met Ser Ala
65 70
<210> 5
<211> 69
<212> PRT (белок)
<213> Gossypium hirsutum
<400> 5
Met Ala Thr Gln Phe Gly Lys Ile Tyr Asn Gly Thr Gln Lys Thr Cys
1 5 10 15
Val Leu Pro Asn Val Ser Lys Thr Gln Asn Pro Lys His Val Pro Phe
20 25 30
Val Ser Phe Lys Ser Asn Leu Asn Gly Lys Thr Ser Ser Trp Gly Leu
35 40 45
Val Val Lys Asn Asn Gly Lys Phe Gly Ser Ile Lys Val Arg Ser Leu
50 55 60
Lys Val Ser Ala Ser
65
<210> 6
<211> 64
<212> PRT (белок)
<213> Oryza sativa
<400> 6
Met Ala Ala Thr Met Ala Ser Asn Ala Ala Ala Ala Ala Ala Val Ser
1 5 10 15
Leu Asp Gln Ala Val Ala Ala Ser Ala Ala Phe Ser Ser Arg Lys Gln
20 25 30
Leu Arg Leu Pro Ala Ala Ala Arg Gly Gly Met Arg Val Arg Val Arg
35 40 45
Ala Arg Gly Arg Arg Glu Ala Val Val Val Ala Ser Ala Ser Ser Ser
50 55 60
<210> 7
<211> 57
<212> PRT (белок)
<213> Triticum aestivum
<400> 7
Met Ala Met Ala Ala Ala Ala Thr Met Ala Ala Ser Ala Ser Ser Ser
1 5 10 15
Ala Val Ser Leu Asp Arg Ala Ala Pro Ala Pro Ser Arg Arg Leu Pro
20 25 30
Met Pro Ala Ala Arg Pro Ala Arg Arg Gly Ala Val Arg Leu Trp Gly
35 40 45
Pro Arg Gly Ala Ala Ala Arg Ala Thr
50 55
<210> 8
<211> 68
<212> PRT (белок)
<213> Allium macrostemon
<400> 8
Met Glu His Thr Val Met Ala Lys Ser Thr Ile Arg Ala Pro Ser Leu
1 5 10 15
His Leu Ser Ser Ile Arg Ser Pro Arg Phe Ala Ser Ser Ser Thr Ser
20 25 30
Ser Ser Ser Phe Val Arg Phe Gly Leu Arg Gly Asn Ser Lys Ile Ser
35 40 45
Ile Gly Leu Arg Ile Gly Asn Cys Arg Arg Ala Ser Val Arg Val Leu
50 55 60
Ala Ser Leu Ala
65
<210> 9
<211> 67
<212> PRT (белок)
<213> Camptotheca acuminata
<400> 9
Met Ala Gln Val Ser Asn Ile Pro Asn Gly Val Gln Asn Gly His Phe
1 5 10 15
Arg Pro Asn Phe Pro Lys Thr Gln Asn Ser Val Gln Val Tyr Ser Val
20 25 30
Phe Cys Gly Ser Lys Leu Lys Ser Ser Trp Cys Leu Asn His Gly Arg
35 40 45
Val Ala Val Asn Ser Pro Val Ile Asn Val Arg Val Pro Leu Arg Val
50 55 60
Ser Ala Ser
65
<210> 10
<211> 69
<212> PRT (белок)
<213> Conyza canadensis
<400> 10
Met Ala Val His Ile Asn Asn Ser Asn Ile Pro Ile Phe Asn Thr Ser
1 5 10 15
Asn Leu Thr Thr Gln Asn Pro Ser Ser Lys Ser Ser Ser Phe Leu Ser
20 25 30
Phe Gly Ser Asn Phe Lys Asn Pro Leu Lys Asn Asn Asn Asn Asn Asn
35 40 45
Tyr Thr Ser Val Ser Cys Asn Val Lys Asn Asn Lys Asn Pro Phe Lys
50 55 60
Val Ser Ala Phe Ser
65
<210> 11
<211> 62
<212> PRT (белок)
<213> Искусственная последовательность
<220>
<223> Синтетический транзитный пептид хлоропластов TraP23
<400> 11
Met Ala Gln Ile Asn Lys Ser Ala Asn Gly Val Arg Asn Ala Ser Leu
1 5 10 15
Ile Ser Asn Phe Ser Asn Thr Arg Gln Ala Lys Ser Pro Phe Ser Leu
20 25 30
Ser Cys Gly Thr Arg Leu Lys Asn Ser Ser Arg Gly Leu Lys Lys Val
35 40 45
Ala Val Arg Leu Ile Gly Ser Arg Val Lys Val Ser Ala Ser
50 55 60
<210> 12
<211> 186
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Полинуклеотидная последовательность, кодирующая TraP23
<400> 12
atggcacaga tcaacaagtc tgctaatggg gttaggaacg cttcactgat aagcaacttc 60
tccaataccc gtcaagccaa atcccctttc tccctctcat gcggaacaag actgaagaac 120
agcagcagag gtttgaagaa ggtggcagtt aggctcattg gctcccgtgt caaagtgtct 180
gcctca 186
<210> 13
<211> 1902
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Полинуклеотидная последовательность, кодирующая Cry2Aa
<400> 13
atgaacaacg ttctcaactc tgggagaacc accatctgcg acgcgtacaa tgtggtggca 60
cacgacccat tctcatttga gcacaagagc ctggatacga tccagaaaga gtggatggaa 120
tggaaaagga cggaccattc cttgtacgtt gctccagtgg tgggcactgt gtcctcgttc 180
ctcctcaaga aagtggggtc gctgatcggg aagcggatac tctccgaact ctggggaatc 240
atctttccgt ctggctcaac aaacttgatg caagacatac tgagagagac tgagcagttc 300
ttgaatcaga ggctgaatac ggacacgctg gcgagggtga acgctgaact cattggcctc 360
caagcgaaca ttagagagtt caatcagcaa gttgataact ttctgaaccc cacacagaat 420
ccagtgcctc tgtccatcac atcatctgtg aacacaatgc agcagctgtt cttgaatagg 480
ctgccacagt ttcagattca aggctatcaa ctgcttcttc tgcctctgtt tgctcaagct 540
gcgaacatgc acctcagctt catcagagac gtgattctga acgcagatga gtggggaatc 600
agcgctgcca ctttgaggac ctacagagat tacttgagga actatacacg cgattactca 660
aactactgca tcaacaccta tcaaacagcg tttaggggac ttaacaccag actgcacgac 720
atgcttgagt tccggactta catgttcctc aacgtctttg agtatgtctc gatttggtcc 780
ctcttcaagt atcagagcct tatggtctcc tctggtgcta acctctacgc ctcgggttcc 840
ggaccgcagc agacccagtc attcactgcc cagaactggc cattcctcta cagccttttc 900
caagtgaaca gcaactacat cttgtctggc atctctggca caaggctctc tatcacattt 960
ccgaacattg gtggcctgcc tggctccacg acgacacaca gcctcaattc cgcacgcgtc 1020
aactactcgg gtggggtctc ctccggactc attggtgcca ctaacttgaa ccataacttc 1080
aactgttcaa cggtgctgcc acccctttca actccgtttg tcagatcgtg gcttgattct 1140
ggcactgaca gagagggagt tgccacgagc accaactggc agaccgagtc cttccagacc 1200
acactttcgc tgcgctgcgg tgccttctca gcgaggggaa actcgaacta cttcccagac 1260
tacttcatac gcaacattag cggagtcccg ttggtgatcc ggaatgagga cctcaccaga 1320
cctcttcact acaatcagat acgcaacatc gaaagcccat ctgggacacc tggaggtgca 1380
agggcatact tggttagcgt tcacaaccgg aagaacaaca tctatgctgc taatgagaat 1440
gggaccatga ttcatcttgc accggaagat tacactggct tcacgatctc acccatccat 1500
gccacccaag tgaacaacca gactcgcacg ttcatctcag agaagttcgg caaccaaggt 1560
gacagcctcc gcttcgaaca gagcaacacc acagccagat acacccttag aggcaatggc 1620
aacagctaca atctctatct gagggtgtct agcattggca attcgaccat tcgggtgacg 1680
atcaatggtc gcgtttacac ggtctccaac gtcaatacga ccactaacaa tgatggggtc 1740
aatgacaatg gtgctcgctt ctccgacatc aacatcggca acatcgtcgc ttccgacaac 1800
accaatgtta cgctggacat caatgtcacc ttgaactctg gcacaccttt cgatctgatg 1860
aacatcatgt ttgtccccac caatcttcct cccctctact ga 1902
<210> 14
<211> 1248
<212> ДНК
<213> Streptomyces sviceus
<400> 14
atgagaggga tgccagcctt gtctttacct ggatcaaaga gtatcacagc tagggcactc 60
tttcttgctg ctgctgctga tggggttact actttggtga ggccattgag aagtgacgac 120
acagaaggat tcgctgaggg gttagttcgt ttaggctatc gtgtagggag gacacccgat 180
acttggcaag tcgatggcag accacaagga ccagcagtgg ctgaggctga cgtctactgt 240
agagacggag caaccaccgc tagattcttg ccaaccttag cagctgctgg tcacggaaca 300
tacagatttg atgcttcacc acagatgagg agacgtcctc ttttgccctt aagcagagcc 360
ttgagggatt tgggtgtcga tcttagacac gaagaagctg aaggtcatca ccctctgact 420
gtccgtgctg ctggggttga aggaggagag gttactttgg atgctggtca gtcaagtcag 480
tatctcactg ccttgttgct ccttggtccc cttacaagac aaggactgag gataagggtt 540
actgatttgg tgtcagcacc atacgtggag attacgcttg caatgatgag ggctttcgga 600
gttgaagtgg caagggaggg agatgtgttc gttgttccac ctggtggata tcgtgcaact 660
acgtatgcta tagaacccga cgcaagtact gcttcttact tcttcgcagc tgctgctttg 720
actcctggag ctgaagtgac tgtacctggg ttaggcacgg gagcacttca aggagatttg 780
ggatttgtag atgtcttaag gagaatggga gccgaggtgt ccgtaggagc tgatgcaacc 840
actgttagag gaactggtga attgcgtggc cttacagcca acatgagaga cataagtgat 900
acgatgccga ccctcgctgc aatagcaccc tttgctagtg ctccagttag aatcgaggat 960
gttgccaaca ctcgtgtcaa agaatgtgac agacttgagg cttgtgcaga gaaccttagg 1020
aggttgggag taagggttgc aacgggtccg gactggattg agatacaccc tggtccagct 1080
actggtgctc aagtcacaag ctatggtgat cacagaattg tgatgtcatt tgcagtgact 1140
ggacttcgtg tgcctgggat cagcttcgac gaccctggct gtgttcgtaa gacttttcct 1200
gggtttcacg aggctttcgc agaattgagg cgtggcattg ggagctga 1248
<210> 15
<211> 1251
<212> ДНК
<213> Streptomyces sviceus
<400> 15
atggcaagag ggatgccagc cttgtcgctg cctggctcaa agtcgatcac ggctagagca 60
ctctttctcg cagcagcagc cgacggagtc accacgcttg tgagaccgct gcggtcagac 120
gacaccgagg gttttgcgga aggcctcgtc agactgggct atcgggttgg gaggactccc 180
gacacgtggc aagtggacgg aaggccacaa ggtccagcag ttgccgaggc tgatgtgtat 240
tgtagagacg gtgcaacaac ggctaggttc ctccccacac tcgcagctgc tggacacggg 300
acctacagat ttgatgcctc tccccagatg aggagaaggc cactgctgcc tctttctagg 360
gctttgaggg accttggcgt tgatcttcgc cacgaggaag cggaagggca ccaccccttg 420
accgtgagag ctgctggagt cgagggaggt gaggttacac tcgatgctgg acagtcctct 480
cagtacttga cggcactgct gctgctcggt ccgctcacac gccaagggct gcggattcgc 540
gtcactgatc tggttagcgc tccgtacgtg gagattacac ttgcgatgat gagagctttt 600
ggggtcgagg ttgcacgcga aggcgacgtt ttcgtggtgc ctcctggtgg ctacagagcg 660
actacgtacg cgattgagcc agatgccagc accgcaagct acttctttgc agctgctgcg 720
ttgacacctg gagccgaggt cacagtgcct ggactcggga ccggagcgct tcaaggggat 780
ctcggcttcg tggacgtgct gcggaggatg ggtgccgagg tcagcgtggg agcagacgct 840
acgactgtta gaggcacggg tgagcttaga ggccttacag caaacatgag ggacatatcc 900
gacacgatgc cgacgcttgc tgccatcgct ccgttcgctt cagcacccgt cagaattgaa 960
gatgtggcga acactcgcgt caaagagtgc gacagacttg aagcgtgtgc cgagaacttg 1020
aggaggttgg gagtgagagt cgcaactggt ccagactgga tcgagatcca ccctggtcca 1080
gctactggag cgcaagtcac aagctatggc gaccatagga ttgttatgtc attcgcagtg 1140
accggactca gagttcctgg gatctctttc gacgaccctg gttgcgtgcg gaaaacgttc 1200
cctggcttcc acgaggcatt tgcggagctg cggagaggaa ttggttcctg a 1251
<210> 16
<211> 1599
<212> ДНК
<213> Glycine max (трансгенная соя)
<400> 16
atggctcaag tctcccgtgt tcacaatctt gctcagtcaa cccaaatctt tggacattca 60
agcaactcaa acaaactgaa gtctgtgaat tctgtctcac ttcgcccacg cctttgggga 120
gcatccaaga gtcgcatacc aatgcacaag aatgggagtt tcatgggcaa cttcaatgtt 180
gggaaaggca attctggtgt cttcaaagtt tcagcttctg ttgcagccgc agagaaaccc 240
agcacttccc ctgagattgt tcttgaaccc attaaggact tcagtggaac aatcactctg 300
cctggatcaa agagtctttc aaacagaata cttctcttgg cagctctgag tgaaggaacc 360
actgtagttg acaacctttt gtactctgaa gatattcatt acatgttggg tgctctcaga 420
actcttgggt tgagagttga agatgacaag accacaaaac aagccatagt tgaaggatgt 480
ggtgggttgt ttccaacaag caaagaatcc aaagatgaga tcaacttgtt tcttggcaat 540
gctggaattg caatgagaag cctcactgct gcagtagttg cagctggtgg gaatgcaagt 600
tatgtccttg atggtgtccc cagaatgagg gaaaggccca tcggtgacct tgtggctggc 660
ctgaaacagc ttggagcaga tgttgattgc ttcttgggca caaactgccc tccagtgaga 720
gtgaatggga agggaggttt gcctggtgga aaggtcaaac tgagtggatc agtctcttcc 780
cagtatctga ctgccttgct catggctgcc cctctggctt tgggtgatgt ggagattgaa 840
atagtggaca agttgatttc tgttccatat gtggaaatga ccctcaaact catggagagg 900
tttggagttt ctgttgaaca ttctggcaac tgggatcgtt tccttgtaca tggaggtcag 960
aagtacaaaa gccctggcaa tgcctttgtt gaaggggatg caagctctgc ttcctatctc 1020
ttggctgggg ctgccatcac tggtgggacc atcactgtga atggctgtgg cacctcatcc 1080
cttcaaggtg atgtaaagtt tgcagaggtc ttggagaaaa tgggtgccaa ggtcacctgg 1140
tctgagaaca gtgtaactgt gtctggacct cccagagact tcagtggcag aaaggttctc 1200
cgtggaattg atgtgaacat gaacaagatg ccagatgtgg ccatgaccct cgctgttgta 1260
gccctgtttg caaatggacc aactgcaatc cgtgatgttg cttcatggag ggtgaaggag 1320
acagagagga tgattgccat ttgcacagaa ctccgcaaac ttggtgcaac agttgaagag 1380
ggaccagatt actgtgtgat aaccccacct gagaagctca atgtgacagc cattgacacc 1440
tatgatgacc acagaatggc aatggctttc tcccttgctg cctgtggtga tgtgcctgtg 1500
actatcaaag accctgggtg cacaaggaag acatttccag actactttga agttttggag 1560
aggttgacaa agcactgagt agttagctta atcacctag 1599
<210> 17
<211> 1551
<212> ДНК
<213> Brassica napus
<400> 17
atggctcaat cttcaaggat ttgccacggt gttcagaacc cttgtgtgat catatccaat 60
ctcagtaaga gcaatcagaa caaatcaccc ttctctgtct ccctcaaaac tcatcaacca 120
cgtgcatcta gttggggatt gaagaaaagt gggacaatgc tgaacggatc agtcattagg 180
cctgtaaagg ttacagcctc tgtgtccacg agtgaaaagg caagcgagat cgtcttacaa 240
ccgattagag aaatctctgg gcttatcaag ttgcctggct ccaaatcact ctccaatagg 300
atacttcttt tggctgcact gagtgaaggc acaactgttg tggacaactt gctcaactcc 360
gatgatatca actacatgct tgacgccttg aagaagttag gactcaatgt ggagagagat 420
agcgttaaca atcgtgctgt cgtagaagga tgtggtggca tctttcctgc atctctggat 480
tctaagagcg acatcgagct ttacttgggc aatgctgcaa cagccatgag accgttaact 540
gctgctgtta ccgcagctgg aggaaatgct agttatgtgc ttgatggtgt tccaagaatg 600
agggaaaggc caatagggga tttggtcgtc ggactgaaac agctcggtgc tgacgttgaa 660
tgtactttag gcacaaactg tcctcccgtg cgtgttaacg caaatggtgg actgcctggt 720
ggaaaggtca agttgtctgg ctccatttcc agtcaatacc ttacggcttt gctcatggct 780
gcaccacttg ccttaggtga tgtggagatt gagatcattg acaagctcat atctgttccg 840
tacgtggaaa tgacacttaa gctgatggaa agattcggag tttcagccga acattccgat 900
agctgggatc gtttctttgt aaagggtggg cagaagtaca agtctcctgg caatgcttat 960
gtggaaggtg acgcttcttc agctagttac ttcttggctg gtgcagccat aactggcgag 1020
acagttaccg tggaaggatg cggaactacc agcctccaag gtgatgtcaa gttcgcagag 1080
gtgttggaaa agatggggtg caaagtttcc tggacagaga actcagttac tgtaacggga 1140
cctagtaggg atgcttttgg gatgcgtcac cttagggcag ttgacgtgaa catgaacaag 1200
atgccagatg tcgctatgac tttagcagtt gtggcactgt ttgccgatgg tcctacaacg 1260
attagggacg tagcttcttg gagagtcaaa gaaactgaga ggatgatcgc catttgtact 1320
gagcttcgta agttgggtgc cacagttgaa gaagggtccg attactgcgt gattactcct 1380
ccagctaaag ttaagcctgc tgagattgat acctatgatg accacagaat ggctatggcc 1440
tttagcctcg ctgcatgtgc cgatgttcca gtcacgatca aggaccctgg ctgtactaga 1500
aagacatttc ccgactactt tcaagtgctt gagtcaatca cgaaacactg a 1551
<210> 18
<211> 1551
<212> ДНК
<213> Brassica napus
<400> 18
atggctcaat cttcaaggat ttgccacggt gttcagaacc cttgtgtgat catatccaat 60
ctcagtaaga gcaatcagaa caaatcaccc ttctctgtct ccctcaaaac tcatcaacca 120
cgtgcatcta gttggggatt gaagaaaagc ggaacaatgc tgaacggatc agtcattagg 180
cctgtaaagg ttactgcatc tgtgtccacg agtgaaaagg caagcgagat cgtcttacaa 240
ccgattagag aaatctctgg gcttatcaag ttgcctggct ccaaatcact ctccaatagg 300
atacttcttt tggctgcact gagtgaaggc acaactgttg tggacaactt gctcaactcc 360
gatgatatca actacatgct tgacgccttg aagaagttag gactcaatgt ggagagagat 420
agcgttaaca atcgtgctgt cgtagaagga tgtggtggaa tctttcctgc atctctggat 480
tctaagagcg acatcgagct ttacttgggc aatgctgcaa cagccatgag atccttaact 540
gctgctgtta ccgcagctgg tggaaatgct agttatgtgc ttgatggtgt tccaagaatg 600
agggaaaggc caatagggga tttggtcgtc ggactcaaac agctcggtgc tgacgttgaa 660
tgtactttag gcacaaactg tcctcccgtg cgtgttaacg caaatggtgg actgcctggt 720
ggaaaagtca agttgtctgg ctccatttcc agtcaatacc ttacggcttt gctcatggct 780
gcaccacttg ccttaggtga tgtggagatt gagatcattg acaagctcat atctgttccg 840
tacgtggaaa tgacacttaa gctgatggaa agattcggag tttcagccga acattccgat 900
agctgggatc gtttctttgt aaagggaggg cagaagtaca agtctcctgg aaacgcatac 960
gtggaaggtg acgcttcttc agctagttac ttcttggctg gtgcagccat aactggcgag 1020
acagttaccg tggaaggatg cggaactacc agcctccaag gtgatgtcaa gttcgcagag 1080
gtgttggaaa agatggggtg caaagtttcc tggacagaga actcagttac tgtaacggga 1140
cctagtaggg atgcttttgg gatgcgtcac cttagagccg ttgacgtgaa catgaacaag 1200
atgccagatg tcgctatgac cttagctgtg gttgcactgt ttgccgatgg tcctacaacg 1260
attagggacg tagcctcttg gagagtcaaa gaaaccgaga ggatgatcgc catttgtact 1320
gagcttcgta agttgggtgc cacagttgaa gaagggtccg attactgcgt gattactcct 1380
ccagctaaag ttaagccagc agagattgat acctatgatg accacagaat ggctatggct 1440
ttcagcctcg ctgcatgtgc cgatgttcca gtcacgatca aggaccctgg ctgtactaga 1500
aagacatttc ccgactactt tcaagtgctt gagtcaatca cgaaacactg a 1551
<210> 19
<211> 1551
<212> ДНК
<213> Brassica napus
<400> 19
atggctcaat cttcaaggat ttgccacggt gttcagaacc cttgtgtgat catatccaat 60
ctcagtaaga gcaatcagaa caaatcaccc ttctctgtct ccctgaaaac tcatcaacca 120
cgtgcatcta gttggggatt gaagaaaagt ggcacaatgc tgaacggatc agtcattagg 180
cctgtaaagg ttacagcctc tgtgtccacg agtgaaaagg caagcgagat cgtcttacaa 240
ccgattagag aaatctctgg gcttatcaag ttgcctggct ccaaatcact ctccaatagg 300
atacttcttt tggctgcact gagtgaaggg acaactgttg tggacaactt gctcaactcc 360
gatgatatca actacatgct tgacgccttg aagaagttag gactcaatgt ggagagagat 420
agcgttaaca atcgtgctgt cgtagaagga tgtggtggaa tctttcctgc atctctggat 480
tctaagagcg acatcgagct ttacttgggc aatgctggca tcgccatgag atccttaact 540
gctgctgtta ccgcagctgg tggaaatgct agttatgtgc ttgatggtgt tccaagaatg 600
agggaaaggc caatagggga tttggttgtc ggactcaaac agctcggtgc tgacgttgaa 660
tgtactttag gcacaaactg tcctcccgtg cgtgttaacg caaatggtgg actgcctggt 720
ggaaaggtca agttgtctgg ctccatttcc agtcaatacc ttacggcttt gctcatggct 780
gcaccacttg ccttaggtga tgtggagatt gagatcattg acaagctcat atctgttccg 840
tacgtggaaa tgacacttaa gctgatggaa agattcggag tttcagccga acattccgat 900
agctgggatc gtttcttcgt aaagggaggg cagaagtaca agtctcctgg gaacgcatac 960
gtggaaggtg acgcttcttc agctagttac ttcttggctg gtgcagccat aactggcgag 1020
acagttaccg tggaaggatg cggaactacc agccttcaag gtgatgtcaa gttcgcagag 1080
gtgttggaaa agatggggtg caaagtttcc tggacagaga actcagttac tgtaacggga 1140
cctagtaggg atgcttttgg aatgagacac cttagggcag ttgacgtgaa catgaacaag 1200
atgccagatg tcgctatgac tttagctgta gtggcactgt tcgcagatgg tcctacaacg 1260
ataagggacg tagcctcttg gagagtcaaa gaaaccgaga ggatgatcgc catttgtact 1320
gagcttcgta agttgggtgc cacagttgaa gaagggtccg attactgcgt gattactcct 1380
ccagctaaag ttaagccagc agagattgat acctatgatg accacagaat ggctatggcc 1440
tttagcctcg ctgcatgtgc cgatgttcca gtcacgatca aggaccctgg ctgtactaga 1500
aagacatttc ccgactactt tcaagtgctt gagtcaatca cgaaacactg a 1551
<210> 20
<211> 1533
<212> ДНК
<213> Triticum aestivum
<400> 20
atggcaatgg ctgctgctgc tactatggct gcaagcgctt cctcttccgc tgtgagctta 60
gacagagcag ctccagcacc atctaggcgt ctgccaatgc cagcagctag accagctagg 120
agaggtgcag tccgtttgtg gggaccaagg ggagcagctg cacgtgctac aagtgtcgca 180
gcaccagcag caccgagtgg agctgaggaa gtcgtgcttc aacctatcag agagatcagc 240
ggtgccgtcc agctccctgg gtcaaagtca cttagcaaca gaatacttct tttgagcgca 300
ttgtcagagg gcacgacagt ggtggataac cttctgaact ctgaagatgt tcactacatg 360
cttgaggctt tggaggcatt aggtctttct gttgaagccg ataaggttgc taagcgtgct 420
gtggtggttg gttgcggagg gagattccca gttgagaaag atgctcaaga ggaagttaag 480
ctgtttctgg gaaatgctgg gattgcaatg aggagcttga ctgctgctgt ggttgctgct 540
ggtggaaatg ccacatacgt ccttgatgga gtgcctagaa tgagagagag accgattggg 600
gatctggtgg ttggccttca gcaacttgga gcagacgctg actgctttct tggaacaaac 660
tgtccacccg ttaggatcaa cgggaaagga ggtctccctg gtgggaaggt taagttgtct 720
ggatcaatct ctagtcagta tctgtcatca cttctcatgg ctgcacctct tgcacttgaa 780
gatgttgaga ttgaaatcat agacaaactc atatcagttc catacgtgga aatgacgctg 840
aagctgatgg agaggttcgg agtgacagca gagcactcag attcttggga taggttctac 900
atcaagggag gtcagaagta caaatcacct gggaacgctt acgtggaagg tgatgcctct 960
tctgcttcct acttcctcgc tggagcagca atcaccggag gaactgttac tgtcgaaggt 1020
tgcggaacta cttccttgca aggggacgtc aagttcgcag aagtcttaga aatgatggga 1080
gctaaagtta cttggaccga tacaagtgtt acagtgactg gtcctccacg tcaacccttt 1140
ggaaggaagc acctcaaagc cgttgatgtt aacatgaaca agatgccaga tgtcgccatg 1200
acgcttgccg ttgtggctct gttcgcagat ggtcccacag ccattagaga cgtggccagc 1260
tggagggtga aagaaactga aaggatggtc gccattagaa cagagttaac caaacttgga 1320
gctactgtgg aagagggacc cgactattgc atcattacac ctcccgagaa gctgaacata 1380
accgctattg acacttatga tgatcatcgt atggctatgg ccttttcatt agcagcttgc 1440
gctgaggtgc cagtaaccat tagagatcct gggtgtacta ggaaaacttt ccctaactac 1500
ttcgatgtcc tttcaacatt cgtgaagaat tga 1533
<210> 21
<211> 1281
<212> ДНК
<213> Streptomyces roseosporus
<400> 21
atgacggtga tagagatacc tgggtctaag tctgttacag ccagagcact gttcttggca 60
gctgctgccg atgggacgac tactcttctt agaccattgc gtagcgatga cactgagggc 120
ttcgcagaag gactgaggaa tctgggctat gctgtggaac aagaggctga taggtggcgt 180
gtccaaggca gaccagctgg accagcagcc acggaagcag atgtctattg cagagatggt 240
gccaccaccg ctaggttcct tccgacactg gcagcagcag ctgcttccgg aacctacaga 300
ttcgacgctt cagcacagat gcgtcgtcgt ccccttgctc cattgacaag ggcacttaca 360
gccttgggtg tggatcttag acacgaagga gcagacggac atcatccgct caccgttcgt 420
gcagctggca tcgaaggagg agaattgacg ctcgacgctg gcgagtccag ccaatacttg 480
acagcactgc tcatgctcgg acctcttaca acaaagggac ttcgcatcga agttacagaa 540
ctcgtctctg caccctacgt ggaaatcacc ctcgctatga tgagagactt tggtgtggag 600
gttgagaggg aggggaatac cttcaccgtt ccaagcccat cttcaagact taggtccaat 660
agaggtggac ccataggagg ctatagagct actacgtatg ctgtcgagcc agatgcctca 720
actgcctctt acttctttgc agctgctgcc ctcactggtc gcgaggtcac agtgcctgga 780
ttggggactg gagctttgca aggtgatttg cgtttcgtgg atgtgctgag agaaatgggt 840
gccgaggtgt ctgttggtcc ggacgccaca actgtgcgct caactggcag attgagggga 900
atcactgtga acatgagaga tatctcagac acgatgccta cactcgcagc tattgcacct 960
tatgccgatg gtccagtggt gattgaagat gttgccaaca cccgtgtgaa ggagtgtgac 1020
cgtctggagg cttgtgctga gaatctgagg gcaatgggaa tcaccgtcca tacgggtccg 1080
gataggatag aaatccatcc tggaacacct aaaccgactg ggatcgccac ccacggagat 1140
caccgcatag tcatgtcatt tgccgtcgct ggccttcgca ctcctggcct cacttacgac 1200
gaccctggct gcgtgcgtaa gaccttccct agatttcacg aggtgtttgc cgacttcgct 1260
cacgaccttg agggaaggtg a 1281
<210> 22
<211> 1248
<212> ДНК
<213> Streptomyces griseus
<400> 22
atgggtgcag tgacagtcat cgacattcct ggaagcaaga gcgtgacagc aagggcactc 60
ttcttggcag cagcagccga tggaacgaca acactgcttc gtcctctgag gtcagacgac 120
acggaggggt ttgccgaggg tcttaagaat ctcggttatg ccgttgagca agaggctgac 180
cgttggaggg tcgaaggcag accggatggt ccagctgctc cggatgcaga tgtctactgc 240
cgtgatggtg caacgactgc acgctttctt ccaaccctcg tcgcagcagc agcttctgga 300
acgtatcgtt tcgacgcctc agcacagatg aggagacgtc ccttggctcc actcactagg 360
gcactgacag ctcttggcgt ggatttgaga catggtggag aggagggtca tcatccactg 420
actgtcagag ctgctggcat agaaggtggc gatgttgtcc ttgacgctgg tgaatcttct 480
cagtatctca cagcccttct tatgttgggt ccgttgactg ccaaaggtct tagaatcgaa 540
gtcactgatc tcgtgagcgc tccttacgtt gaaatcactc tggccatgat gagagatttc 600
ggagttgatg ttagcagaga aggaaacact ttcaccgtgc cgtccggagg ctatagagct 660
acagcctacg ctgtggagcc agacgcaagc acggcttctt acttctttgc agcagctgcc 720
ctcactggac gcgaggtgac ggtccctggg ctgggaattg gtgctcttca aggagacctt 780
cgttttgtgg acgtgctgcg tgatatggga gcagaggtgt ctgttggacc agatgccacg 840
acagtgcgct caactggcag actccgtggc attacagtta ctatgagaga catttcagac 900
acgatgccaa cactcgctgc tattgcacct cacgctgatg gacccgtccg tattgaggac 960
gtggcaaaca ctcgtgtcaa ggaatgtgat aggcttgagg catgtgctca aaaccttaga 1020
gctatgggaa tcacggtgca tactgggcac gattggattg agattctccc tgggactcca 1080
aagccaacgg gaatagctac gcacggagat cacagaatcg ttatgtcctt cgcagtggct 1140
ggtttgttga cccctgggct gacatacgat gatcctggct gcgtccgcaa gacttttcca 1200
aggttccacg aagttttcgc tgactttgct gcatcacccc aagcctga 1248
<210> 23
<211> 1245
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотид DGT-31 v3
<400> 23
atgactgtga ttgacatccc tggctcaaag tcagttactg ccagagcatt gttcctcgca 60
gcagctgctg atggcactac aactcttttg agacctcttc acagcgatga cacggaaggc 120
ttcactgagg gtctcactcg tttgggatac gcagtggtta gagaacccga taggtggcac 180
atagaaggac gtccctccgg tccagcagca gcagatgcag aagttcactg tagggacggt 240
gctacaactg ctcgctttct tccaaccctt gcagctgctg ctgcctccgg aacgtatcgt 300
ttcgacgcat cagctcagat gaggcgtaga cccctcgctc ccctcacgga agctcttaga 360
acacttggag tggaccttag gcatgatgga gctgaaggcc accacccctt gacaattcaa 420
gcctctggtg ttaagggtgg aggacttacg ctcgacgctg gtgagtcatc tcagtacttg 480
acagctctgc tcatgcttgg tcctctgacc gcagagggac tgagaataga agttacggag 540
cttgtctctg ctccttatgt ggagatcacc cttgcaatga tgagaggctt tggtgtggag 600
gttgttaggg aggggaatac tttcactgtg cctcctggag gttacagagc tacaacttat 660
gccatagaac cggacgcaag cacagcttcc tacttctttg cagcagcagc cctcactggg 720
agggaagtga cggtgcctgg cttgggcact ggagcacttc aaggtgatct taggttcacg 780
gaggtcctca gaaggatgga cgctgatgtt cgcacaacgt ccgactctac aacagtgcgc 840
tcagatggtc gccttgctgg gttgactgtc aacatgaggg acataagcga cacaatgcca 900
acactggcag ctatagctcc gtacgcaagc tcaccagtta ggatcgagga tgtcgcaaac 960
acccgtgtga aggaatgtga taggctggag gcttgcgctc agaatctccg ctcaatgggc 1020
atcaccgttc gcactggacc agattggatt gagatccatc ctgggactcc tagaccgacc 1080
gagatagcca cacacggtga tcatagaatc gtcatgtcat ttgccgtggc tggacttaga 1140
acccctggga tgtcttacga tgaccctggc tgcgttcgca agacttttcc tcgttttcat 1200
gaagagtttg cagccttcgt ggagcgctca tccgctggag agtga 1245
<210> 24
<211> 213
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Транзитный пептид хлоропластов
<400> 24
atgcttgcta gacaaggtgg aagtctgaga gcttctcaat gcaacgctgg acttgctaga 60
agagttgaag ttggtgctct tgttgttcct agacctatct ctgttaacga cgttgttcct 120
cacgtttact ctgctccact ttctgttgct agaaggtctt gctctaagtc ctccattagg 180
tccactagaa ggcttcaaac tactgtgtgc tct 213
<210> 25
<211> 186
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Транзитный пептид хлоропластов
<400> 25
atgcaactcc tgaatcagag gcaagccctg cgtcttggtc gttcatctgc ttcaaagaac 60
cagcaagttg ctccactggc ctctaggcct gcttcttcct tgagcgtcag cgcatccagc 120
gtcgcacctg cacctgcttg ctcagctcct gctggagctg gaaggcgtgc tgttgtcgtg 180
agagca 186
<210> 26
<211> 198
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Транзитный пептид хлоропластов
<400> 26
atggctcaat ctagcagaat ctgccacggt gtgcagaacc catgtgtgat catttccaat 60
ctctccaaat ccaaccagaa caaatctcct ttctcagtca gcctcaagac tcaccagcag 120
cagcgtcgtg cttaccagat atctagctgg ggattgaaga agtcaaacaa cgggtccgtg 180
attcgtccgg ttaaggca 198
<210> 27
<211> 198
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Транзитный пептид хлоропластов
<400> 27
atggcacaag ccagccgtat ctgccagaat ccatgtgtga tatccaatct ccccaaaagc 60
aaccaccgta agtccccttt ctctgtctca ctcaagacgc atcagcctag agcctcttca 120
tggggactta agaagtctgg caccatgctg aacggttcag tgattagacc cgtcaaggtg 180
acagcttctg tttccgca 198
<210> 28
<211> 225
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Транзитный пептид хлоропластов
<400> 28
atggcacaat ctagcagaat ctgccacggt gtgcagaacc catgtgtgat catttcaaat 60
ctctcaaagt ccaatcagaa caaatcacct ttctccgtct ccctcaagac acaccagcat 120
ccaagggcat acccgataag cagctcatgg ggactcaaga agagcggaat gactctgatt 180
ggctctgagc ttcgtcctct taaggttatg tcctctgttt ccgca 225
<210> 29
<211> 207
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Транзитный пептид хлоропластов
<400> 29
atggcacaag ttagcagaat ctgtaatggt gtgcagaacc catctcttat ctccaatctc 60
tcaaagtcca gccaacgtaa gtctcccctc agcgtgtctc tgaaaactca gcagcccaga 120
gcttcttcat ggggtttgaa gaaatctgga acgatgctta acggctcagt cattcgtccg 180
gttaaggtga cagcctccgt ctccgct 207
<210> 30
<211> 1464
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Слияние dgt-28 v5 и TraP4 v2 внутри рамки считывания
<400> 30
atgcttgcta gacaaggtgg aagtctgaga gcttctcaat gcaacgctgg acttgctaga 60
agagttgaag ttggtgctct tgttgttcct agacctatct ctgttaacga cgttgttcct 120
cacgtttact ctgctccact ttctgttgct agaaggtctt gctctaagtc ctccattagg 180
tccactagaa ggcttcaaac tactgtgtgc tctgctgcaa gagggatgcc agccttgtct 240
ttacctggat caaagagtat cacagctagg gcactctttc ttgctgctgc tgctgatggg 300
gttactactt tggtgaggcc attgagaagt gacgacacag aaggattcgc tgaggggtta 360
gttcgtttag gctatcgtgt agggaggaca cccgatactt ggcaagtcga tggcagacca 420
caaggaccag cagtggctga ggctgacgtc tactgtagag acggagcaac caccgctaga 480
ttcttgccaa ccttagcagc tgctggtcac ggaacataca gatttgatgc ttcaccacag 540
atgaggagac gtcctctttt gcccttaagc agagccttga gggatttggg tgtcgatctt 600
agacacgaag aagctgaagg tcatcaccct ctgactgtcc gtgctgctgg ggttgaagga 660
ggagaggtta ctttggatgc tggtcagtca agtcagtatc tcactgcctt gttgctcctt 720
ggtcccctta caagacaagg actgaggata agggttactg atttggtgtc agcaccatac 780
gtggagatta cgcttgcaat gatgagggct ttcggagttg aagtggcaag ggagggagat 840
gtgttcgttg ttccacctgg tggatatcgt gcaactacgt atgctataga acccgacgca 900
agtactgctt cttacttctt cgcagctgct gctttgactc ctggagctga agtgactgta 960
cctgggttag gcacgggagc acttcaagga gatttgggat ttgtagatgt cttaaggaga 1020
atgggagccg aggtgtccgt aggagctgat gcaaccactg ttagaggaac tggtgaattg 1080
cgtggcctta cagccaacat gagagacata agtgatacga tgccgaccct cgctgcaata 1140
gcaccctttg ctagtgctcc agttagaatc gaggatgttg ccaacactcg tgtcaaagaa 1200
tgtgacagac ttgaggcttg tgcagagaac cttaggaggt tgggagtaag ggttgcaacg 1260
ggtccggact ggattgagat acaccctggt ccagctactg gtgctcaagt cacaagctat 1320
ggtgatcaca gaattgtgat gtcatttgca gtgactggac ttcgtgtgcc tgggatcagc 1380
ttcgacgacc ctggctgtgt tcgtaagact tttcctgggt ttcacgaggc tttcgcagaa 1440
ttgaggcgtg gcattgggag ctga 1464
<210> 31
<211> 1434
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Слияние dgt-28 v5 и TraP5 v2 внутри рамки считывания
<400> 31
atgcaactcc tgaatcagag gcaagccctg cgtcttggtc gttcatctgc ttcaaagaac 60
cagcaagttg ctccactggc ctctaggcct gcttcttcct tgagcgtcag cgcatccagc 120
gtcgcacctg cacctgcttg ctcagctcct gctggagctg gaaggcgtgc tgttgtcgtg 180
agagcagcaa gagggatgcc agccttgtct ttacctggat caaagagtat cacagctagg 240
gcactctttc ttgctgctgc tgctgatggg gttactactt tggtgaggcc attgagaagt 300
gacgacacag aaggattcgc tgaggggtta gttcgtttag gctatcgtgt agggaggaca 360
cccgatactt ggcaagtcga tggcagacca caaggaccag cagtggctga ggctgacgtc 420
tactgtagag acggagcaac caccgctaga ttcttgccaa ccttagcagc tgctggtcac 480
ggaacataca gatttgatgc ttcaccacag atgaggagac gtcctctttt gcccttaagc 540
agagccttga gggatttggg tgtcgatctt agacacgaag aagctgaagg tcatcaccct 600
ctgactgtcc gtgctgctgg ggttgaagga ggagaggtta ctttggatgc tggtcagtca 660
agtcagtatc tcactgcctt gttgctcctt ggtcccctta caagacaagg actgaggata 720
agggttactg atttggtgtc agcaccatac gtggagatta cgcttgcaat gatgagggct 780
ttcggagttg aagtggcaag ggagggagat gtgttcgttg ttccacctgg tggatatcgt 840
gcaactacgt atgctataga acccgacgca agtactgctt cttacttctt cgcagctgct 900
gctttgactc ctggagctga agtgactgta cctgggttag gcacgggagc acttcaagga 960
gatttgggat ttgtagatgt cttaaggaga atgggagccg aggtgtccgt aggagctgat 1020
gcaaccactg ttagaggaac tggtgaattg cgtggcctta cagccaacat gagagacata 1080
agtgatacga tgccgaccct cgctgcaata gcaccctttg ctagtgctcc agttagaatc 1140
gaggatgttg ccaacactcg tgtcaaagaa tgtgacagac ttgaggcttg tgcagagaac 1200
cttaggaggt tgggagtaag ggttgcaacg ggtccggact ggattgagat acaccctggt 1260
ccagctactg gtgctcaagt cacaagctat ggtgatcaca gaattgtgat gtcatttgca 1320
gtgactggac ttcgtgtgcc tgggatcagc ttcgacgacc ctggctgtgt tcgtaagact 1380
tttcctgggt ttcacgaggc tttcgcagaa ttgaggcgtg gcattgggag ctga 1434
<210> 32
<211> 1446
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Слияние dgt-28 v5 и TraP8 v2 внутри рамки считывания
<400> 32
atggctcaat ctagcagaat ctgccacggt gtgcagaacc catgtgtgat catttccaat 60
ctctccaaat ccaaccagaa caaatctcct ttctcagtca gcctcaagac tcaccagcag 120
cagcgtcgtg cttaccagat atctagctgg ggattgaaga agtcaaacaa cgggtccgtg 180
attcgtccgg ttaaggcagc aagagggatg ccagccttgt ctttacctgg atcaaagagt 240
atcacagcta gggcactctt tcttgctgct gctgctgatg gggttactac tttggtgagg 300
ccattgagaa gtgacgacac agaaggattc gctgaggggt tagttcgttt aggctatcgt 360
gtagggagga cacccgatac ttggcaagtc gatggcagac cacaaggacc agcagtggct 420
gaggctgacg tctactgtag agacggagca accaccgcta gattcttgcc aaccttagca 480
gctgctggtc acggaacata cagatttgat gcttcaccac agatgaggag acgtcctctt 540
ttgcccttaa gcagagcctt gagggatttg ggtgtcgatc ttagacacga agaagctgaa 600
ggtcatcacc ctctgactgt ccgtgctgct ggggttgaag gaggagaggt tactttggat 660
gctggtcagt caagtcagta tctcactgcc ttgttgctcc ttggtcccct tacaagacaa 720
ggactgagga taagggttac tgatttggtg tcagcaccat acgtggagat tacgcttgca 780
atgatgaggg ctttcggagt tgaagtggca agggagggag atgtgttcgt tgttccacct 840
ggtggatatc gtgcaactac gtatgctata gaacccgacg caagtactgc ttcttacttc 900
ttcgcagctg ctgctttgac tcctggagct gaagtgactg tacctgggtt aggcacggga 960
gcacttcaag gagatttggg atttgtagat gtcttaagga gaatgggagc cgaggtgtcc 1020
gtaggagctg atgcaaccac tgttagagga actggtgaat tgcgtggcct tacagccaac 1080
atgagagaca taagtgatac gatgccgacc ctcgctgcaa tagcaccctt tgctagtgct 1140
ccagttagaa tcgaggatgt tgccaacact cgtgtcaaag aatgtgacag acttgaggct 1200
tgtgcagaga accttaggag gttgggagta agggttgcaa cgggtccgga ctggattgag 1260
atacaccctg gtccagctac tggtgctcaa gtcacaagct atggtgatca cagaattgtg 1320
atgtcatttg cagtgactgg acttcgtgtg cctgggatca gcttcgacga ccctggctgt 1380
gttcgtaaga cttttcctgg gtttcacgag gctttcgcag aattgaggcg tggcattggg 1440
agctga 1446
<210> 33
<211> 1446
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Слияние dgt-28 v5 и TraP9 v2 внутри рамки считывания
<400> 33
atggcacaag ccagccgtat ctgccagaat ccatgtgtga tatccaatct ccccaaaagc 60
aaccaccgta agtccccttt ctctgtctca ctcaagacgc atcagcctag agcctcttca 120
tggggactta agaagtctgg caccatgctg aacggttcag tgattagacc cgtcaaggtg 180
acagcttctg tttccgcagc aagagggatg ccagccttgt ctttacctgg atcaaagagt 240
atcacagcta gggcactctt tcttgctgct gctgctgatg gggttactac tttggtgagg 300
ccattgagaa gtgacgacac agaaggattc gctgaggggt tagttcgttt aggctatcgt 360
gtagggagga cacccgatac ttggcaagtc gatggcagac cacaaggacc agcagtggct 420
gaggctgacg tctactgtag agacggagca accaccgcta gattcttgcc aaccttagca 480
gctgctggtc acggaacata cagatttgat gcttcaccac agatgaggag acgtcctctt 540
ttgcccttaa gcagagcctt gagggatttg ggtgtcgatc ttagacacga agaagctgaa 600
ggtcatcacc ctctgactgt ccgtgctgct ggggttgaag gaggagaggt tactttggat 660
gctggtcagt caagtcagta tctcactgcc ttgttgctcc ttggtcccct tacaagacaa 720
ggactgagga taagggttac tgatttggtg tcagcaccat acgtggagat tacgcttgca 780
atgatgaggg ctttcggagt tgaagtggca agggagggag atgtgttcgt tgttccacct 840
ggtggatatc gtgcaactac gtatgctata gaacccgacg caagtactgc ttcttacttc 900
ttcgcagctg ctgctttgac tcctggagct gaagtgactg tacctgggtt aggcacggga 960
gcacttcaag gagatttggg atttgtagat gtcttaagga gaatgggagc cgaggtgtcc 1020
gtaggagctg atgcaaccac tgttagagga actggtgaat tgcgtggcct tacagccaac 1080
atgagagaca taagtgatac gatgccgacc ctcgctgcaa tagcaccctt tgctagtgct 1140
ccagttagaa tcgaggatgt tgccaacact cgtgtcaaag aatgtgacag acttgaggct 1200
tgtgcagaga accttaggag gttgggagta agggttgcaa cgggtccgga ctggattgag 1260
atacaccctg gtccagctac tggtgctcaa gtcacaagct atggtgatca cagaattgtg 1320
atgtcatttg cagtgactgg acttcgtgtg cctgggatca gcttcgacga ccctggctgt 1380
gttcgtaaga cttttcctgg gtttcacgag gctttcgcag aattgaggcg tggcattggg 1440
agctga 1446
<210> 34
<211> 1473
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Слияние dgt-28 v5 и TraP12 v2 внутри рамки считывания
<400> 34
atggcacaat ctagcagaat ctgccacggt gtgcagaacc catgtgtgat catttcaaat 60
ctctcaaagt ccaatcagaa caaatcacct ttctccgtct ccctcaagac acaccagcat 120
ccaagggcat acccgataag cagctcatgg ggactcaaga agagcggaat gactctgatt 180
ggctctgagc ttcgtcctct taaggttatg tcctctgttt ccgcagcaag agggatgcca 240
gccttgtctt tacctggatc aaagagtatc acagctaggg cactctttct tgctgctgct 300
gctgatgggg ttactacttt ggtgaggcca ttgagaagtg acgacacaga aggattcgct 360
gaggggttag ttcgtttagg ctatcgtgta gggaggacac ccgatacttg gcaagtcgat 420
ggcagaccac aaggaccagc agtggctgag gctgacgtct actgtagaga cggagcaacc 480
accgctagat tcttgccaac cttagcagct gctggtcacg gaacatacag atttgatgct 540
tcaccacaga tgaggagacg tcctcttttg cccttaagca gagccttgag ggatttgggt 600
gtcgatctta gacacgaaga agctgaaggt catcaccctc tgactgtccg tgctgctggg 660
gttgaaggag gagaggttac tttggatgct ggtcagtcaa gtcagtatct cactgccttg 720
ttgctccttg gtccccttac aagacaagga ctgaggataa gggttactga tttggtgtca 780
gcaccatacg tggagattac gcttgcaatg atgagggctt tcggagttga agtggcaagg 840
gagggagatg tgttcgttgt tccacctggt ggatatcgtg caactacgta tgctatagaa 900
cccgacgcaa gtactgcttc ttacttcttc gcagctgctg ctttgactcc tggagctgaa 960
gtgactgtac ctgggttagg cacgggagca cttcaaggag atttgggatt tgtagatgtc 1020
ttaaggagaa tgggagccga ggtgtccgta ggagctgatg caaccactgt tagaggaact 1080
ggtgaattgc gtggccttac agccaacatg agagacataa gtgatacgat gccgaccctc 1140
gctgcaatag caccctttgc tagtgctcca gttagaatcg aggatgttgc caacactcgt 1200
gtcaaagaat gtgacagact tgaggcttgt gcagagaacc ttaggaggtt gggagtaagg 1260
gttgcaacgg gtccggactg gattgagata caccctggtc cagctactgg tgctcaagtc 1320
acaagctatg gtgatcacag aattgtgatg tcatttgcag tgactggact tcgtgtgcct 1380
gggatcagct tcgacgaccc tggctgtgtt cgtaagactt ttcctgggtt tcacgaggct 1440
ttcgcagaat tgaggcgtgg cattgggagc tga 1473
<210> 35
<211> 1455
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Слияние dgt-28 v5 и TraP13 v2 внутри рамки считывания
<400> 35
atggcacaag ttagcagaat ctgtaatggt gtgcagaacc catctcttat ctccaatctc 60
tcaaagtcca gccaacgtaa gtctcccctc agcgtgtctc tgaaaactca gcagcccaga 120
gcttcttcat ggggtttgaa gaaatctgga acgatgctta acggctcagt cattcgtccg 180
gttaaggtga cagcctccgt ctccgctgct agagggatgc cagccttgtc tttacctgga 240
tcaaagagta tcacagctag ggcactcttt cttgctgctg ctgctgatgg ggttactact 300
ttggtgaggc cattgagaag tgacgacaca gaaggattcg ctgaggggtt agttcgttta 360
ggctatcgtg tagggaggac acccgatact tggcaagtcg atggcagacc acaaggacca 420
gcagtggctg aggctgacgt ctactgtaga gacggagcaa ccaccgctag attcttgcca 480
accttagcag ctgctggtca cggaacatac agatttgatg cttcaccaca gatgaggaga 540
cgtcctcttt tgcccttaag cagagccttg agggatttgg gtgtcgatct tagacacgaa 600
gaagctgaag gtcatcaccc tctgactgtc cgtgctgctg gggttgaagg aggagaggtt 660
actttggatg ctggtcagtc aagtcagtat ctcactgcct tgttgctcct tggtcccctt 720
acaagacaag gactgaggat aagggttact gatttggtgt cagcaccata cgtggagatt 780
acgcttgcaa tgatgagggc tttcggagtt gaagtggcaa gggagggaga tgtgttcgtt 840
gttccacctg gtggatatcg tgcaactacg tatgctatag aacccgacgc aagtactgct 900
tcttacttct tcgcagctgc tgctttgact cctggagctg aagtgactgt acctgggtta 960
ggcacgggag cacttcaagg agatttggga tttgtagatg tcttaaggag aatgggagcc 1020
gaggtgtccg taggagctga tgcaaccact gttagaggaa ctggtgaatt gcgtggcctt 1080
acagccaaca tgagagacat aagtgatacg atgccgaccc tcgctgcaat agcacccttt 1140
gctagtgctc cagttagaat cgaggatgtt gccaacactc gtgtcaaaga atgtgacaga 1200
cttgaggctt gtgcagagaa ccttaggagg ttgggagtaa gggttgcaac gggtccggac 1260
tggattgaga tacaccctgg tccagctact ggtgctcaag tcacaagcta tggtgatcac 1320
agaattgtga tgtcatttgc agtgactgga cttcgtgtgc ctgggatcag cttcgacgac 1380
cctggctgtg ttcgtaagac ttttcctggg tttcacgagg ctttcgcaga attgaggcgt 1440
ggcattggga gctga 1455
<210> 36
<211> 186
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Транзитный пептид хлоропластов
<400> 36
atgatacttg gatctagccc aactctgcca cacgcatcac atccagccag acctggtcct 60
gccagaccga tttcagtgaa cgacgtcgtt ccccatgtct actccgctcc tctctccgtg 120
gctaggcgtt cttgtagcaa gtccagcatt aggtctacgc gtagattgca gaccacagtc 180
tgctca 186
<210> 37
<211> 186
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Транзитный пептид хлоропластов
<400> 37
atggcacaga tcaacaagtc tgctaatggg gttaggaacg cttcactgat aagcaacttc 60
tccaataccc gtcaagccaa atcccctttc tccctctcat gcggaacaag actgaagaac 120
agcagcagag gtttgaagaa ggtggcagtt aggctcattg gctcccgtgt caaagtgtct 180
gcctca 186
<210> 38
<211> 207
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Транзитный пептид хлоропластов
<400> 38
atgcaactgc tcaaccagag acaagccttg aggctcggga ggtcctctgc ctctaagaat 60
cagcaagtgg caccgcttgc cagccgtccc atttctgtga acgacgtcgt gccacacgtc 120
tacagcgcac ctctgtccgt tgctagacgc tcctgctcta agtcatcaat ccgcagcact 180
agaaggcttc agacgaccgt ttgttca 207
<210> 39
<211> 1467
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Слияние dgt-32 v3 и TraP14 v2 внутри рамки считывания
<400> 39
atgatacttg gatctagccc aactctgcca cacgcatcac atccagccag acctggtcct 60
gccagaccga tttcagtgaa cgacgtcgtt ccccatgtct actccgctcc tctctccgtg 120
gctaggcgtt cttgtagcaa gtccagcatt aggtctacgc gtagattgca gaccacagtc 180
tgctcaatga cggtgataga gatacctggg tctaagtctg ttacagccag agcactgttc 240
ttggcagctg ctgccgatgg gacgactact cttcttagac cattgcgtag cgatgacact 300
gagggcttcg cagaaggact gaggaatctg ggctatgctg tggaacaaga ggctgatagg 360
tggcgtgtcc aaggcagacc agctggacca gcagccacgg aagcagatgt ctattgcaga 420
gatggtgcca ccaccgctag gttccttccg acactggcag cagcagctgc ttccggaacc 480
tacagattcg acgcttcagc acagatgcgt cgtcgtcccc ttgctccatt gacaagggca 540
cttacagcct tgggtgtgga tcttagacac gaaggagcag acggacatca tccgctcacc 600
gttcgtgcag ctggcatcga aggaggagaa ttgacgctcg acgctggcga gtccagccaa 660
tacttgacag cactgctcat gctcggacct cttacaacaa agggacttcg catcgaagtt 720
acagaactcg tctctgcacc ctacgtggaa atcaccctcg ctatgatgag agactttggt 780
gtggaggttg agagggaggg gaataccttc accgttccaa gcccatcttc aagacttagg 840
tccaatagag gtggacccat aggaggctat agagctacta cgtatgctgt cgagccagat 900
gcctcaactg cctcttactt ctttgcagct gctgccctca ctggtcgcga ggtcacagtg 960
cctggattgg ggactggagc tttgcaaggt gatttgcgtt tcgtggatgt gctgagagaa 1020
atgggtgccg aggtgtctgt tggtccggac gccacaactg tgcgctcaac tggcagattg 1080
aggggaatca ctgtgaacat gagagatatc tcagacacga tgcctacact cgcagctatt 1140
gcaccttatg ccgatggtcc agtggtgatt gaagatgttg ccaacacccg tgtgaaggag 1200
tgtgaccgtc tggaggcttg tgctgagaat ctgagggcaa tgggaatcac cgtccatacg 1260
ggtccggata ggatagaaat ccatcctgga acacctaaac cgactgggat cgccacccac 1320
ggagatcacc gcatagtcat gtcatttgcc gtcgctggcc ttcgcactcc tggcctcact 1380
tacgacgacc ctggctgcgt gcgtaagacc ttccctagat ttcacgaggt gtttgccgac 1440
ttcgctcacg accttgaggg aaggtga 1467
<210> 40
<211> 1455
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Слияние dgt-33 v3 и TraP24 v2 внутри рамки считывания
<400> 40
atgcaactgc tcaaccagag acaagccttg aggctcggga ggtcctctgc ctctaagaat 60
cagcaagtgg caccgcttgc cagccgtccc atttctgtga acgacgtcgt gccacacgtc 120
tacagcgcac ctctgtccgt tgctagacgc tcctgctcta agtcatcaat ccgcagcact 180
agaaggcttc agacgaccgt ttgttcaatg ggtgcagtga cagtcatcga cattcctgga 240
agcaagagcg tgacagcaag ggcactcttc ttggcagcag cagccgatgg aacgacaaca 300
ctgcttcgtc ctctgaggtc agacgacacg gaggggtttg ccgagggtct taagaatctc 360
ggttatgccg ttgagcaaga ggctgaccgt tggagggtcg aaggcagacc ggatggtcca 420
gctgctccgg atgcagatgt ctactgccgt gatggtgcaa cgactgcacg ctttcttcca 480
accctcgtcg cagcagcagc ttctggaacg tatcgtttcg acgcctcagc acagatgagg 540
agacgtccct tggctccact cactagggca ctgacagctc ttggcgtgga tttgagacat 600
ggtggagagg agggtcatca tccactgact gtcagagctg ctggcataga aggtggcgat 660
gttgtccttg acgctggtga atcttctcag tatctcacag cccttcttat gttgggtccg 720
ttgactgcca aaggtcttag aatcgaagtc actgatctcg tgagcgctcc ttacgttgaa 780
atcactctgg ccatgatgag agatttcgga gttgatgtta gcagagaagg aaacactttc 840
accgtgccgt ccggaggcta tagagctaca gcctacgctg tggagccaga cgcaagcacg 900
gcttcttact tctttgcagc agctgccctc actggacgcg aggtgacggt ccctgggctg 960
ggaattggtg ctcttcaagg agaccttcgt tttgtggacg tgctgcgtga tatgggagca 1020
gaggtgtctg ttggaccaga tgccacgaca gtgcgctcaa ctggcagact ccgtggcatt 1080
acagttacta tgagagacat ttcagacacg atgccaacac tcgctgctat tgcacctcac 1140
gctgatggac ccgtccgtat tgaggacgtg gcaaacactc gtgtcaagga atgtgatagg 1200
cttgaggcat gtgctcaaaa ccttagagct atgggaatca cggtgcatac tgggcacgat 1260
tggattgaga ttctccctgg gactccaaag ccaacgggaa tagctacgca cggagatcac 1320
agaatcgtta tgtccttcgc agtggctggt ttgttgaccc ctgggctgac atacgatgat 1380
cctggctgcg tccgcaagac ttttccaagg ttccacgaag ttttcgctga ctttgctgca 1440
tcaccccaag cctga 1455
<210> 41
<211> 1431
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Конструкция DGT-31 и TraP23
<400> 41
atggcacaga tcaacaagtc tgctaatggg gttaggaacg cttcactgat aagcaacttc 60
tccaataccc gtcaagccaa atcccctttc tccctctcat gcggaacaag actgaagaac 120
agcagcagag gtttgaagaa ggtggcagtt aggctcattg gctcccgtgt caaagtgtct 180
gcctcaatga ctgtgattga catccctggc tcaaagtcag ttactgccag agcattgttc 240
ctcgcagcag ctgctgatgg cactacaact cttttgagac ctcttcacag cgatgacacg 300
gaaggcttca ctgagggtct cactcgtttg ggatacgcag tggttagaga acccgatagg 360
tggcacatag aaggacgtcc ctccggtcca gcagcagcag atgcagaagt tcactgtagg 420
gacggtgcta caactgctcg ctttcttcca acccttgcag ctgctgctgc ctccggaacg 480
tatcgtttcg acgcatcagc tcagatgagg cgtagacccc tcgctcccct cacggaagct 540
cttagaacac ttggagtgga ccttaggcat gatggagctg aaggccacca ccccttgaca 600
attcaagcct ctggtgttaa gggtggagga cttacgctcg acgctggtga gtcatctcag 660
tacttgacag ctctgctcat gcttggtcct ctgaccgcag agggactgag aatagaagtt 720
acggagcttg tctctgctcc ttatgtggag atcacccttg caatgatgag aggctttggt 780
gtggaggttg ttagggaggg gaatactttc actgtgcctc ctggaggtta cagagctaca 840
acttatgcca tagaaccgga cgcaagcaca gcttcctact tctttgcagc agcagccctc 900
actgggaggg aagtgacggt gcctggcttg ggcactggag cacttcaagg tgatcttagg 960
ttcacggagg tcctcagaag gatggacgct gatgttcgca caacgtccga ctctacaaca 1020
gtgcgctcag atggtcgcct tgctgggttg actgtcaaca tgagggacat aagcgacaca 1080
atgccaacac tggcagctat agctccgtac gcaagctcac cagttaggat cgaggatgtc 1140
gcaaacaccc gtgtgaagga atgtgatagg ctggaggctt gcgctcagaa tctccgctca 1200
atgggcatca ccgttcgcac tggaccagat tggattgaga tccatcctgg gactcctaga 1260
ccgaccgaga tagccacaca cggtgatcat agaatcgtca tgtcatttgc cgtggctgga 1320
cttagaaccc ctgggatgtc ttacgatgac cctggctgcg ttcgcaagac ttttcctcgt 1380
tttcatgaag agtttgcagc cttcgtggag cgctcatccg ctggagagtg a 1431
<210> 42
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидная праймерная последовательность
<400> 42
agccacatcc cagtaacga 19
<210> 43
<211> 17
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидная праймерная последовательность
<400> 43
cctccctctt tgacgcc 17
<210> 44
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидная последовательность зонда
<400> 44
cagcccaatg aggcatcagc 20
<210> 45
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидная праймерная последовательность
<400> 45
cttcaaggag atttgggatt tgt 23
<210> 46
<211> 17
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидная праймерная последовательность
<400> 46
gagggtcggc atcgtat 17
<210> 47
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидная последовательность зонда
<400> 47
agagaagttt cgacggattt cgggc 25
<210> 48
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидная праймерная последовательность
<400> 48
gaggattagg gtttcaacgg ag 22
<210> 49
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидная праймерная последовательность
<400> 49
gagaattgag ctgagacgag g 21
<210> 50
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидная праймерная последовательность
<400> 50
ctgcaggtca acggatcagg atat 24
<210> 51
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидная праймерная последовательность
<400> 51
tgggctgaat tgaagacatg ctcc 24
<210> 52
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидная праймерная последовательность
<400> 52
cgtccacaaa gctgaatgtg 20
<210> 53
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидная праймерная последовательность
<400> 53
cgaagtcatg gaagccactt 20
<210> 54
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидная праймерная последовательность
<400> 54
cttcaaggag atttgggatt tgt 23
<210> 55
<211> 17
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидная праймерная последовательность
<400> 55
gagggtcggc atcgtat 17
<210> 56
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидная праймерная последовательность
<400> 56
tgttcggttc cctctaccaa 20
<210> 57
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидная последовательность зонда
<400> 57
cacagaaccg tcgcttcagc aaca 24
<210> 58
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидная праймерная последовательность
<400> 58
caacatccat caccttgact ga 22
<210> 59
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидная последовательность зонда
<400> 59
cgagcagacc gccgtgtact tctacc 26
<210> 60
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидная праймерная последовательность
<400> 60
tggcggacga cgacttgt 18
<210> 61
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидная праймерная последовательность
<400> 61
aaagtttgga ggctgccgt 19
<210> 62
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидная праймерная последовательность
<400> 62
ttcagcaccc gtcagaat 18
<210> 63
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидная последовательность зонда
<400> 63
tgccgagaac ttgaggaggt 20
<210> 64
<211> 17
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидная праймерная последовательность
<400> 64
tggtcgccat agcttgt 17
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СИНТЕТИЧЕСКИЕ ТРАНЗИТНЫЕ ПЕПТИДЫ ХЛОРОПЛАСТОВ | 2013 |
|
RU2632648C2 |
| ТРАНЗИТНЫЙ ПЕПТИД ХЛОРОПЛАСТОВ | 2013 |
|
RU2636036C2 |
| СИНТЕТИЧЕСКИЕ ПРОИСХОДЯЩИЕ ИЗ BRASSICA ТРАНЗИТНЫЕ ПЕПТИДЫ ХЛОРОПЛАСТОВ | 2013 |
|
RU2626535C2 |
| СИНТЕТИЧЕСКИЕ ТРАНЗИТНЫЕ ПЕПТИДЫ ХЛОРОПЛАСТА ИЗ BRASSICA | 2013 |
|
RU2636035C2 |
| УСТОЙЧИВЫЕ К ГЛИФОСАТУ РАСТЕНИЯ И СПОСОБЫ, СВЯЗАННЫЕ С НИМИ | 2013 |
|
RU2636037C2 |
| НОВЫЙ КЛАСС ГЕНОВ УСТОЙЧИВОСТИ К ГЛИФОСАТУ | 2013 |
|
RU2721122C2 |
| НОВЫЙ КЛАСС ГЕНОВ УСТОЙЧИВОСТИ К ГЛИФОСАТУ | 2013 |
|
RU2634411C2 |
| УСТОЙЧИВЫЕ К ГЛИФОСАТУ РАСТЕНИЯ И СПОСОБЫ, СВЯЗАННЫЕ С НИМИ | 2013 |
|
RU2627169C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ЭФФЕКТИВНОГО НАЦЕЛИВАНИЯ ТРАНСГЕНОВ | 2016 |
|
RU2751238C2 |
| СПОСОБЫ ТРАНСФОРМАЦИИ РАСТЕНИЙ ДЛЯ ЭКСПРЕССИИ ДЕЛЬТА-ЭНДОТОКСИНОВ BACILLUS THURINGIENSIS | 1999 |
|
RU2234531C2 |
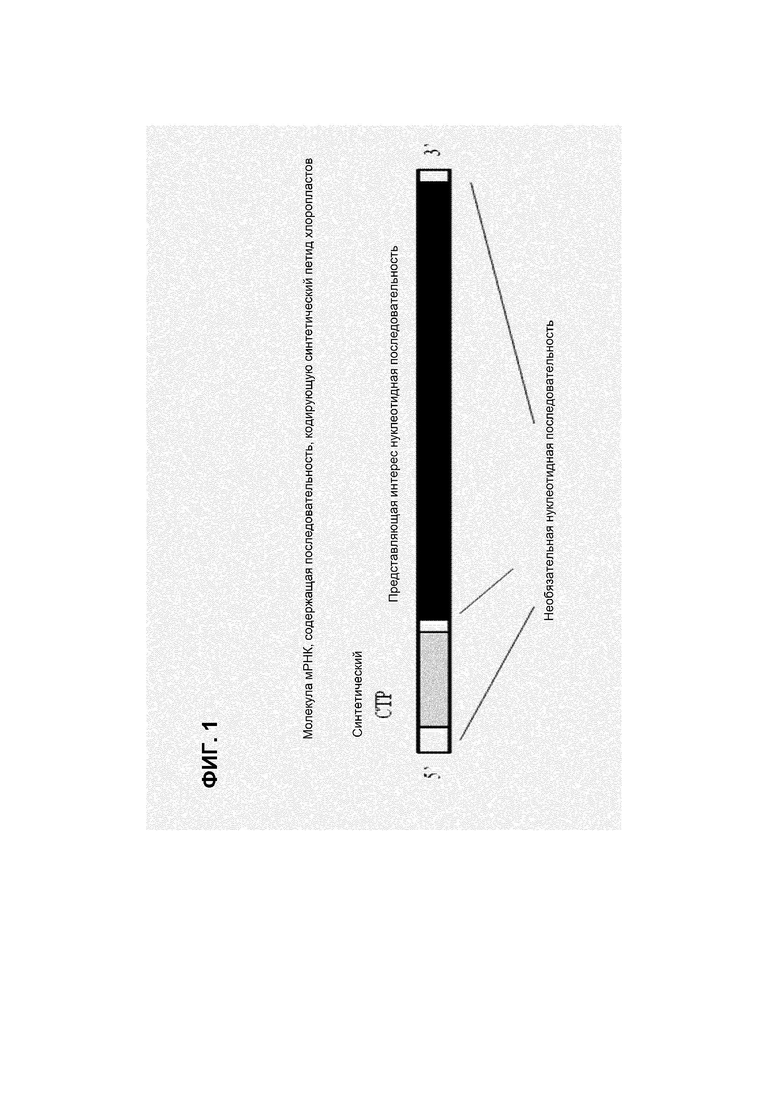



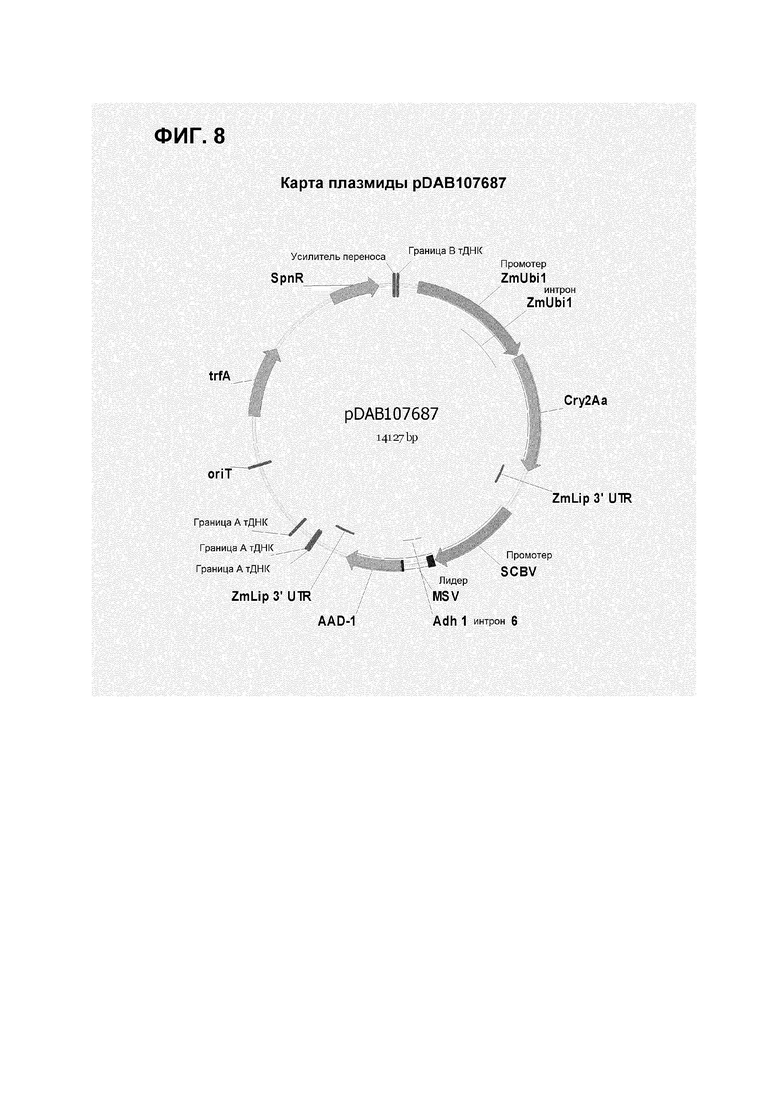
Изобретение относится к области биохимии, в частности конструкции нуклеиновой кислоты для локализации полипептида в пластиде пластид-содержащей клетки. Также раскрыты трансгенный растительный материал, содержащий вышеуказанную конструкцию, а также способ его получения. Изобретение также относится к способу получения трансгенного растения, которое экспрессирует представляющий интерес полипептид в хлоропластах, с использованием вышеуказанной конструкции. Изобретение позволяет эффективно осуществлять экспрессию представляющего интерес полипептида в хлоропластах. 4 н. и 10 з.п. ф-лы, 29 табл., 4 пр., 8 ил.,
1. Конструкция нуклеиновой кислоты для локализации полипептида в пластиде пластид-содержащей клетки, характеризующаяся полинуклеотидом, который кодирует химерный белок, включающий полипептид и синтетический транзитный пептид хлоропласта (CTP), где полинуклеотид состоит из:
первой нуклеотидной последовательности, которая кодирует синтетический CTP, состоящий из аминокислотной последовательности, которая по меньшей мере на 90% идентична:
SEQ ID NO:11, где
первая аминокислота представляет собой метионин (М),
вторая аминокислота представляет собой аланин (А), треонин (Т), глутаминовую кислоту (Е) или валин (V),
третья аминокислота представляет собой глутамин (Q), А или гистидин (H),
четвертая аминокислота представляет собой изолейцин (I), V, серин (S), фенилаланин (F), A, M или треонин (T),
пятая аминокислота представляет собой аспарагин (N), S, глицин (G), T, A или V,
шестая аминокислота представляет собой лизин (K), аргинин (R), M или N,
седьмая аминокислота представляет собой S, V, I, M или A,
восьмая аминокислота кислота представляет собой A, H, цистеин (C), I, тирозин (Y), S, K, пролин (P) или N,
девятая аминокислота представляет собой N, H, A, S или I,
десятая аминокислота представляет собой G, A, T или P,
одиннадцатая аминокислота представляет собой V, лейцин (L), T, A или I,
двенадцатая аминокислота представляет собой R, A, Q, K, M или F,
тринадцатая аминокислота представляет собой N, Q, I, K или A,
четырнадцатая аминокислота представляет собой A, S, P, T или G,
пятнадцатая аминокислота представляет собой S, T, C, F, A или H,
шестнадцатая аминокислота представляет собой L, Q, V или A,
семнадцатая аминокислота представляет собой I, L, V, S, H, F или N,
восемнадцатая аминокислота представляет собой S, F, I, L или R,
девятнадцатая аминокислота представляет собой N, H, Q, A или S,
двадцатая аминокислота представляет собой F, S, L, V, A или I,
двадцать первая аминокислота представляет собой S, V, R, P или T,
двадцать вторая аминокислота представляет собой N, K, A, L, S или Q,
двадцать третья аминокислота представляет собой T, S, A, аспарагиновую кислоту (D), P или N,
двадцать четвертая аминокислота представляет собой R, N, S, Q или P,
двадцать пятая аминокислота представляет собой Q, K, N, A, F или S,
двадцать шестая аминокислота представляет собой A, L, R, N, G, P или S,
двадцать седьмая аминокислота представляет собой K, N, F, P, S или V,
двадцать восьмая аминокислота представляет собой S, H, A или Q,
двадцать девятая аминокислота представляет собой P, V или S,
тридцатая аминокислота представляет собой F, N, L, P, R, S, T или Y,
тридцать первая аминокислота представляет собой S, F, K или R,
тридцать вторая аминокислота представляет собой L, V, Q или R,
тридцать третья аминокислота представляет собой S, T или F,
тридцать четвертая аминокислота представляет собой C, L, F или S,
тридцать пятая аминокислота представляет собой G, R, K, I или F,
тридцать шестая аминокислота представляет собой T, P, S, L или V,
тридцать седьмая аминокислота представляет собой R, Q, H, P, N или K,
тридцать восьмая аминокислота представляет собой L, Q, S, M, или F,
тридцать девятая аминокислота представляет собой K, триптофан (W), H, N, P или G,
сороковая аминокислота представляет собой N, G, P, K, A, L или S,
сорок первая аминокислота представляет собой S, K, A, C или N,
сорок вторая аминокислота представляет собой S, A, R, L или N,
сорок третья аминокислота представляет собой R, S, W, A, G или N,
сорок четвертая аминокислота представляет собой G, I, W, R, N или H,
сорок пятая аминокислота представляет собой L, P, G, S или N,
сорок шестая аминокислота представляет собой K, H, V, M, R, I или T,
сорок седьмая аминокислота представляет собой K, R, S или A,
сорок восьмая аминокислота представляет собой V, N, S, D, G или I,
сорок девятая аминокислота представляет собой A, G, S, N или R,
пятидесятая аминокислота представляет собой V, S, M, T, G, L или C,
пятьдесят первая аминокислота представляет собой R, F, T, M, I, K, P или N,
пятьдесят вторая аминокислота представляет собой L, M, F, A, I или V,
пятьдесят третья аминокислота представляет собой I, G, N, S, R, W или K,
пятьдесят четвертая аминокислота представляет собой G, N или S,
пятьдесят пятая аминокислота представляет собой S, F, A, I, R, P, C, V или N,
пятьдесят шестая аминокислота представляет собой R, N, E, V или K,
пятьдесят седьмая аминокислота представляет собой V, L, I, E, R или N,
пятьдесят восьмая аминокислота представляет собой K, V, G или R,
пятьдесят девятая аминокислота представляет собой V или A,
шестидесятая аминокислота представляет собой S, M, T, A или L,
шестьдесят первая аминокислота представляет собой A или S, и
шестьдесят вторая аминокислота представляет собой S, A, R или F; и
второй нуклеотидной последовательности, кодирующей полипептид, связанный смежно и в рамке считывания с первой нуклеотидной последовательностью.
2. Конструкция нуклеиновой кислоты по п.1, для локализации полипептида в хлоропласте в растительной клетке, где конструкция содержит промотор, который функционирует в растительной клетке, функционально связанный с полинуклеотидом, который кодирует химерный белок.
3. Конструкция нуклеиновой кислоты по п.2, в которой синтетический CTP по меньшей мере на 95% идентичен CTP SEQ ID NO: 11.
4. Конструкция нуклеиновой кислоты по п.2, в которой синтетический CTP по меньшей мере на 98% идентичен CTP SEQ ID NO: 11.
5. Конструкция нуклеиновой кислоты по любому из пп.2-4, в которой первая нуклеотидная последовательность по меньшей мере на 80% идентична SEQ ID NO: 12.
6. Конструкция нуклеиновой кислоты по любому из пп.2-5, отличающаяся тем, что конструкция представляет собой растительный вектор экспрессии.
7. Конструкция нуклеиновой кислоты по любому из пп.2-6, где полипептидом является флуоресцентный полипептид.
8. Конструкция нуклеиновой кислоты по любому из пп.2-6, где полипептид является маркером устойчивости к гербициду, выбранным из группы, состоящей из: ацетолактат-синтазы (АЛС), мутантной АЛС, предшественников АЛС, 5-энолпирувилшикимат-3-фосфат-синтазы (EPSPS), CP4 EPSPS и EPSPS класса III.
9. Конструкция нуклеиновой кислоты по любому из пп.2-6, где полипептид представляет собой 5-энолпирувилшикимат-3-фосфат-синтазу или Cry2Aa.
10. Трансгенный растительный материал для экспрессии нацеленного на хлоропласт полипептида в хлоропластах, содержащий конструкцию нуклеиновой кислоты по любому из пп.2-9, где растительный материал выбран из группы, состоящей из целого растения, растительной клетки, растительной ткани, культуры растительных тканей, каллусной культуры и части растения.
11. Трансгенный растительный материал по п.10, отличающийся тем, что растительный материал представляет собой целое растение.
12. Трансгенный растительный материал по п.10 или 11, в котором конструкция нуклеиновой кислоты стабильно интегрирована в геном растительного материала.
13. Способ получения трансгенного растительного материала, который экспрессирует нацеленный на хлоропласт полипептид в хлоропластах, включающий трансформацию растительного материала конструкцией нуклеиновой кислоты по любому из пп.2-9.
14. Способ получения трансгенного растения, которое экспрессирует представляющий интерес полипептид в хлоропластах, включающий регенерацию трансгенного растения из трансгенного растительного материала, включающего конструкцию нуклеиновой кислоты по любому из пп.2-9.
| WO2008105890 A2, 04.09.2008 | |||
| US2007295251 A1, 27.12.2007 | |||
| US2011107446 A1, 05.05.2011 | |||
| ИЗОЛИРОВАННАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ ДНК (ВАРИАНТЫ), РЕКОМБИНАНТНАЯ ДВУНИТЕВАЯ МОЛЕКУЛА ДНК И СПОСОБ ПОЛУЧЕНИЯ ГЕНЕТИЧЕСКИ ТРАНСФОРМИРОВАННЫХ РАСТЕНИЙ | 1991 |
|
RU2146290C1 |
Авторы
Даты
2020-05-15—Публикация
2013-02-01—Подача