ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к белку устойчивости к гербицидам, кодирующему его гену и их применению, в частности, к белку устойчивости к 2,4-D, кодирующему его гену и их применению.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Сорняки могут быстро вызвать обеднение почвы питательными веществами, необходимыми для роста сельскохозяйственных культур и других ценных растений. В настоящее время существует много типов гербицидов для контроля сорняков, среди которых наиболее популярен гербицид глифосат. Были созданы устойчивые к глифосату сельскохозяйственных культуры, такие как кукуруза, соя, хлопок, свекла, пшеница, рис и т.п. Таким образом, чтобы осуществлять контроль над сорняками без нанесения существенного вреда сельскохозяйственным культурам, можно распылять глифосат на полях, на которых выращивают устойчивые к глифосату сельскохозяйственные культуры.
Глифосат широко применяли во всем мире на протяжении более 20 лет, что привело к избыточной зависимости от технологий с использованием глифосата и сельскохозяйственных культур, устойчивых к глифосату. Кроме того, среди диких сорняков или растений, у которых развилась устойчивость к действию глифосата, растения, обладающие большей естественной толерантностью к глифосату, испытывают сильное давление отбора. В литературе описано, что некоторые сорняки приобрели устойчивость к глифосату, включая широколистные сорняки и травянистые сорняки, такие как Swiss ryegrass, Lolium multiflorum, Eleusine indica, Ambrosia artemisiifolia, Conyza canadensis, Conyza bonariensis и Plantago lanceolata. Кроме того, сорняки, не представлявшие проблему для сельского хозяйства до широкого применения устойчивых к глифосату сельскохозяйственных культур, постепенно распространились и плохо поддаются контролю в посевах устойчивых к глифосату сельскохозяйственных культур. Эти сорняки в основном сосуществуют с широколиственными сорняками, которые трудно подаются контролю, такими как виды Amaranthus, Chenopodium, Taraxacum и Commelinaceae (но не только).
Сельхозпроизводители могут компенсировать слабый эффект глифосата в отношении глифосат-устойчивых сорняков или видов сорняков, плохо поддающихся контролю, путем приготовления баковых смесей или применения других гербицидов, которые могут контролировать сорняки, ускользающие из-под контроля. В большинстве случаев для приготовления баковой смеси для контроля широколиственных сорняков используют популярный и эффективный препарат 2,4-дихлорфеноксиуксусную кислоту (2,4-D). 2,4-D применяли на сельскохозяйственных и незасеваемых угодьях для контроля широкого спектра широколиственных сорняков более 65 лет, и она по-прежнему остается одним из наиболее широко применяемых гербицидов в мире. Дальнейшее применение 2,4-D ограничивает то, что ее селективность в отношении двудольных растений (таких как соя или хлопок) очень низкая. Таким образом, 2,4-D обычно не применяют для чувствительных двудольных растений (и обычно не применяют вблизи них). Кроме того, применение 2,4-D против травянистых сорняков в некоторой степени ограничивается возможным повреждающим воздействием на сельскохозяйственные культуры. Комбинацию 2,4-D и глифосата уже применяли для лучшего обеззараживания почвы при нулевой обработке перед посевом сои и хлопка. Однако, из-за чувствительности этих видов двудольных растений к 2,4-D указанное обеззараживание следует проводить за 14-30 дней до посева.
2,4-De, также, как и МСРА (2-метил-4-хлорфеноксиуксусная кислота), 2-метил-4-хлорпропионовая кислота и 2,4-D-пропионовая кислота, является гербицидом, представляющим собой феноксиалкановую кислоту. 2,4-D применяют для избирательного контроля широколиственных сорняков для защиты многих однодольных сельскохозяйственных культур, таких как кукуруза, пшеница и рис, без существенного вреда для данных сельскохозяйственных культур. 2,4-D представляет собой синтетическое производное ауксина, функция которого заключается в нарушении нормального гомеостаза цитогормонов и затруднении баланса контролируемого роста.
2,4-D демонстрирует различные уровни селективности в отношении некоторых растений (например, двудольные растения более чувствительны по сравнению со злаковыми растениями). Одним из объяснений различных уровней селективности у различных растений является различный метаболизм 2,4-D. Растения обычно медленно метаболизируют 2,4-D. Таким образом, различный ответ растений на 2,4-D с большей вероятностью объясняется различиями в активности мишеней. Метаболизм 2,4-D в растениях обычно протекает в две стадии, т.е. конъюгирование с аминокислотами или с глюкозой после гидроксилирования.
С течением времени у популяций микроорганизмов постепенно развились эффективные альтернативные пути деградации данного чужеродного субстрата, приводящие к полной минерализации 2,4-D. Длительное воздействие гербицидов на микроорганизмы можно использовать для селекции микроорганизмов, использующих гербициды в качестве источника углерода, получая конкурентное преимущество в почве. По этой причине в настоящее время изготавливают 2,4-D, которая обладает относительно коротким периодом полужизни в почве и не имеет очевидных последствий для последующих культур, что способствует применению гербицида 2,4-D.
Один из организмов, у которого интенсивно изучалась способность разлагать 2,4-D, является Ralstonia eutropha. Ген, кодирующий фермент первой стадии ферментативного пути минерализации, обозначается tfdA. TfdA катализирует превращение 2,4-D кислоты в дихлорфенол (DCP) в реакции, катализируемой α-оксоглутарат-зависимой диоксигеназой. DCP едва ли обладает гербицидной активностью, сравнимой с 2,4-D. TfdA применяют для придания устойчивости к 2,4-D трансгенным двудольным растениям, которые обычно чувствительны к 2,4-D (таким как хлопок и табак).
Идентифицировали ряд генов tfdA, кодирующих белки, способные к разложению 2,4-D в окружающей среде. Многие гомологи схожи с tfdA (доля идентичных аминокислот более 85%) и обладают схожей с tfdA ферментативной активностью. Однако, не все белки имеют схожую с tfdA структуру, например, TauD, который осуществляет функцию разложения 2,4-D, а большое количество гомологов демонстрирует значительно меньшую идентичность (25-50%) с tfdA, однако при этом содержат характерные остатки, связанные с активностью α-оксоглутарат-зависимых диоксигеназ Fe2+ диоксигеназ. Таким образом, субстратная специфичность у этих различных диоксигеназ не имеет четких границ. Уникальным примером низкой гомологии с tfdA (доля идентичных аминокислот 28%) является rdpA из Sphingobium herbicidovorans. Показано, что данный фермент катализирует первую стадию минерализации (R)-2,4-D пропионовой кислоты (и других (R)-фенокси-пропионовых кислот) и 2,4-D (феноксиуксусной кислоты).
Появление сорняков, устойчивых к глифосату, и широкое применение гербицида 2,4-D вызвало необходимость придавать устойчивость к 2,4-D чувствительным к 2,4-D растениям, представляющим интерес. В настоящий момент не найдено публикаций, содержащих информацию об уровнях экспрессии в растениях 24DT11, белка устойчивости к гербицидам, и их устойчивости к гербицидам.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Задачей данного изобретения является обеспечение белка устойчивости к гербицидам, кодирующего его гена и их применения. Данное изобретение предназначено для обеспечения нового гена 24DT11, придающего растениям повышенную устойчивость к гербицидам.
Для решения указанной задачи в данном изобретении предложен белок устойчивости к гербицидам, содержащий:
(а) белок, состоящий из аминокислотной последовательности SEQ ID NO: 2; или
(б) белок, обладающий активностью арилоксиалканоатдиоксигеназы, произведенный из аминокислотной последовательности, приведенной в (а), посредством замены и/или делеции и/или добавления в нее одной или нескольких аминокислот.
Для решения указанной задачи в данном изобретении предложен ген устойчивости к гербицидам, содержащий:
(а) нуклеотидную последовательность, кодирующую указанный белок устойчивости к гербицидам; или
(б) нуклеотидную последовательность, способную гибридизоваться с нуклеотидной последовательностью, как она определена в (а), в жестких условиях и кодирующую белок, обладающий активностью арилоксиалканоатдиоксигеназы; или
(в) нуклеотидную последовательность, приведенную в SEQ ID NO: 1.
Жесткие условия можно охарактеризовать следующим образом: гибридизация в растворе 6×SSC (цитрат натрия), 0,5% SDS (додецилсульфат натрия) при 65°C с последующей однократной отмывкой мембраны с использованием 2×SSC, 0,1% SDS и 1×SSC, 0,1% SDS, соответственно.
Для решения поставленной задачи в данном изобретении также предложена экспрессионная кассета, содержащая указанный ген устойчивости к гербицидам под контролем функционально связанной регуляторной последовательности.
Для решения поставленной задачи в данном изобретении также предложен рекомбинантный вектор, содержащий указанный ген устойчивости к гербицидам или указанную экспрессионную кассету.
Для решения поставленной задачи в данном изобретении предложен способ продуцирования белка устойчивости к гербицидам, включающий:
получение клеток трансгенного организма-хозяина, содержащих ген устойчивости к гербицидам или экспрессионную кассету;
культивирование клеток трансгенного организма-хозяина в условиях, обеспечивающих продуцирование белка устойчивости к гербицидам;
выделение указанного белка устойчивости к гербицидам.
Кроме того, трансгенный организм-хозяин включает растения, животных, бактерии, дрожжи, бакуловирус, нематоду или водоросли.
Предпочтительно растение представляет собой сою, хлопок, кукурузу, рис, пшеницу, свеклу или сахарный тростник.
Для решения поставленной задачи в данном изобретении также предложен способ расширения целевого спектра гербицидов, включающий: совместную экспрессию нуклеотида, кодирующего белок устойчивости к гербицидам, или белка устойчивости к гербицидам, кодируемого экспрессионной кассетой, по меньшей мере с одним вторым нуклеотидом, кодирующим белок, отличающийся от указанного белка или белка, кодируемого указанной экспрессионной кассетой.
Кроме того, второй нуклеотид кодирует белок устойчивости к глифосату, белок устойчивости к глюфосинату аммония, диоксигеназу 4-гидроксифенилпировиноградной кислоты, ацетолактатсинтазу, белок цитохрома или протопорфириногеноксидазу.
В данном изобретении белок устойчивости к гербицидам 24DT11 экспрессируется в трансгенном растении наряду с экспрессией одного или более белков устойчивости к глюфосинату и/или белков устойчивости к глюфосинату аммония. Такая совместная экспрессия более чем одного вида белка устойчивости к гербицидам в одном и том же трансгенном растении может достигаться путем трансформации растений и экспрессии в них генов, представляющих интерес, с использованием генной инженерии. Кроме того, белок устойчивости к гербицидам 24DT11 благодаря генно-инженерным манипуляциям может экспрессироваться в одном растении (родитель 1), а белок устойчивости к глифосату и/или белок устойчивости к глюфосинату аммония благодаря генно-инженерным манипуляциям может экспрессироваться во втором растении (родитель 2). Растения-потомки, экспрессирующие все гены родителя 1 и родителя 2, могут быть получены при скрещивании родителя 1 и родителя 2.
Для решения поставленной задачи в данном изобретении также предложен способ отбора трансформированных растительных клеток, включающий стадии трансформирования совокупности растительных клеток геном устойчивости к гербицидам или экспрессионной кассетой и культивирование указанных клеток при концентрации гербицида, позволяющей расти трансформированным клеткам, экспрессирующим ген устойчивости к гербицидам или экспрессионную кассету, но вызывающей гибель нетрансформированных клеток или ингибирующей рост нетрансформированных клеток, где гербицид представляет собой фенокси-ауксин.
Для решения поставленной задачи в данном изобретении также предложен способ контроля сорняков, включающий стадию внесения эффективного количества одного или более гербицидов на поле, на котором выращивают сельскохозяйственные культуры, содержащие указанный ген устойчивости к гербицидам, указанную экспрессионную кассету или указанный рекомбинантный вектор.
Предпочтительно, гербицид представляет собой фенокси-ауксин.
Для решения поставленной задачи в данном изобретении также предложен способ защиты растений от повреждения, вызываемого гербицидами, включающий стадию введения указанного гена устойчивости к гербицидам, указанной экспрессионной кассеты или указанного рекомбинантного вектора в растения так, чтобы обеспечить продуцирование полученными растениями определенного количества белка устойчивости к гербицидам, достаточное для их защиты от повреждения, вызываемого гербицидами.
Предпочтительно указанный гербицид представляет собой фенокси-ауксин или арилоксифеноксипропионат, а указанные растения выбраны из группы, состоящей из сои, хлопка, кукурузы, риса, пшеницы, свеклы и сахарного тростника.
Для решения поставленной задачи в данном изобретении также предложен способ контроля сорняков, устойчивых к глифосату, на поле, на котором выращивают растения, устойчивые к глифосату, включающий стадию внесения эффективного количества одного или более гербицидов на поле, на котором выращивают растения, устойчивые к глифосату, где указанные устойчивые к глифосату растения содержат указанный ген устойчивости к гербицидам, указанную экспрессионную кассету или указанный рекомбинантный вектор.
Предпочтительно указанный гербицид представляет собой фенокси-ауксин, а указанное устойчивое к глифосату растение является однодольным или двудольным.
Для решения поставленной задачи в данном изобретении также предложен способ придания сельскохозяйственным культурам устойчивости к 2,4-D гербицидам, включающий стадию введения в растения указанного гена устойчивости к гербицидам, указанной экспрессионной кассеты или указанного рекомбинантного вектора.
Предпочтительно указанное растение представляет собой сою, хлопок, кукурузу, рис, пшеницу, свеклу или сахарный тростник.
Для решения поставленной задачи в данном изобретении также предложено применение белков устойчивости к гербицидам, обеспечивающих устойчивость к фенокси-ауксиновым гербицидам, содержащих:
(а) белок, состоящий из аминокислотной последовательности, приведенной в SEQ ID NO: 2; или
(б) белок, обладающий активностью арилоксиалканоатдиоксигеназы, произведенный из аминокислотной последовательности (а) в результате замены и/или делеции и/или добавления в нее одной или более аминокислот.
Ген устойчивости к гербицидам, указанную экспрессионную кассету или указанный рекомбинантный вектор вводят в растения. Стандартные способы, используемые в данном изобретении для введения чужеродной ДНК в клетки растений, включают, без ограничения, трансформацию, опосредованную агробактериями, бомбардировку частицами, прямой перенос ДНК в протопласты, электропорацию или кремний-опосредованное введение ДНК.
Гены устойчивости к 2,4-D и полученные благодаря им устойчивые сельскохозяйственные культуры согласно данному изобретению обеспечивают продуманный выбор для обеспечения контроля над устойчивыми (или высокоустойчивыми или с промежуточной устойчивостью) к глифосату видами широколиственных сорняков в посевах сельскохозяйственных культур. 2,4-D представляет собой относительно дешевый и сильный гербицид широкого спектра для борьбы с широколиственными сорняками. Более высокая устойчивость как однодольных, так и двудольных сельскохозяйственных культур повысит эффективность сельскохозяйственного производства. Устойчивые к 2,4-D трансгенные двудольные могут быть более пластичными в использовании и вносимом количестве. Другое применение свойства устойчивости к гербициду 2,4-D состоит в том, что его можно использовать для предотвращения таких вредных воздействий на сельскохозяйственные культуры с нормальной чувствительностью, как дрейф, испарение, трансформация 2,4-D (или иной феномен удаленного перемещения), неправильное применение, разрушение и т.п. Различные смеси разных фенокси-ауксинов широко применяли для борьбы с определенным спектром сорняков в окружающей среде в различных регионах. Использование гена 24DT11 в растениях может обеспечить защиту против фенокси-ауксиновых гербицида более широкого спектра так, чтобы улучшить пластичность и расширить спектр контролируемых сорняков, а также обеспечить защиту против дрейфа фенокси-ауксинов всего спектра, представленного на рынке, или иного удаленного вредного воздействия фенокси-гербицидов.
Фенокси-ауксиновые гербициды обычно представлены в виде активных кислот, но некоторые коммерческие препараты представлены в виде препаратов одного или более соответствующих сложных эфиров. Поскольку обычные эстеразы растений могут конвертировать в растениях эти эфиры в активные кислоты, их также считают субстратами фермента 24DT11 в растениях. Аналогично, они также могут представлять собой органические или неорганические соли соответствующих кислот. При экспрессии хиральной пропионовой кислоты, гербициды в виде соли пропионовой кислоты или сложного эфира пропионовой кислоты, даже если они имеют различные номера CAS, могут соответствовать оптически чистому соединению. При обозначении гербицидов рацемические (R, S) или оптически чистые (R или S) энантиомеры все еще считают одним и тем же гербицидом. Возможными диапазонами доз могут быть такие дозы, в которых гербициды применяют в отдельности или в комбинации с другими гербицидами при использовании на сельскохозяйственных или несельскохозяйственных культурах.
Установили, что ген 24DT11 придает характеристики, позволяющие использовать фенокси-ауксиновый гербицид на растениях после экспрессии генно-инженерного 24DT11 в растениях, которым устойчивость не свойственна или недостаточна для того, чтобы позволить применять указанные гербициды. Кроме того, ген 24DT11 может обеспечить защиту от фенокси-ауксиновых гербицидов, когда естественная устойчивость растений недостаточна для обеспечения селективности в растениях. Для обработки растений, содержащих только ген 24DT11, можно использовать один, два или несколько фенокси-ауксиновых гербицидов, смешиваемых непрерывно или приготовленных в виде баковых смесей. Диапазон доз каждого фенокси-ауксинового гербицида, используемого для контроля широкого спектра двудольных сорняков варьирует от 25 до 4000 г кислотных эквивалентов/га, чаще от 100 до 2000 г кислотных эквивалентов/га. Комбинирование (непрерывное смешивание или приготовление баковой смеси) на одном поле указанных гербицидов, принадлежащих к разным химическим классам и обладающих разным механизмом действия, позволяет контролировать большинство потенциальных сорняков, подлежащих контролю гербицидами.
Глифосат нашел широкое применение благодаря тому, что он контролирует очень широкий спектр видов широколиственных и травянистых сорняков. Однако повторное применение глифосата в приложении к устойчивым к глифосату культурам сельскохозяйственного и несельскохозяйственного назначения оказывает (и будет продолжать оказывать) селективное давление, имеющее результатом замену сорняков видами с большей естественной устойчивостью или устойчивым к глифосату биотипом. Для задержки появления устойчивых сорняков большинство стратегий регулирования устойчивости к гербицидам рекомендуют применять эффективное количество гербицидов-партнеров в виде баковых смесей. Гербициды-партнеры обеспечивают контроль над одними и теми же видами, но обладают различным механизмом действия. Сочетание гена 24DT11 и свойства устойчивости к глифосату (и/или свойств устойчивости к другим гербицидам) может обеспечить контроль над видами сорняков, устойчивых к глифосату (видами широколиственных сорняков, контролируемых одним или более фенокси-ауксинами), в посевах устойчивых к глифосату сельскохозяйственных культур, путем селективного внесения глифосата и фенокси-ауксина (такого как 2,4-D) по тем же самым сельскохозяйственным культурам. Применение указанных гербицидов может представлять собой индивидуальное применение отдельной гербицидной композиции в баковой смеси, содержащей два или более гербицидов с различными механизмами действия одновременно или последовательно (например, до посева, до появления всходов или после появления всходов) (временной интервал варьирует от 2 часов до 3 месяцев). Альтернативно композиции любого числа гербицидов, относящихся к каждому классу соединений, можно применять в любое время (начиная от 7 месяцев с момента посева до времени сбора (или, в случае одного гербицида, в течение предуборочного периода, в зависимости от того, какой из периодов короче)).
Для контроля широколиственных сорняков очень важна пластичность, т.е. время внесения, дозировка отдельного гербицида и возможность контролировать устойчивые или выносливые сорняки. Дозировка глифосата, которую применяют с геном устойчивости к глифосату/геном 24DT11, может варьировать от 250 до 2500 г кислотных эквивалентов/га; доза (одного или более) фенокси-ауксиновых гербицидов может варьировать от 25 до 4000 г кислотных эквивалентов/га. Оптимальная комбинация времени внесения зависит от конкретных условий, биологических видов и окружающей среды.
Композиции гербицидов (таких как сложные эфиры, кислоты или соли, или растворимые концентраты, эмульсионные концентраты или составы для растворения) и добавки в баковых смесях (такие как адъюванты или присадки) могут существенно повлиять на контроль сорняков данным гербицидом или комбинацией одного или более видов гербицидов. Любые химические комбинации любых указанных выше гербицидов входят в объем данного изобретения.
Как хорошо известно специалистам в области техники, преимущества комбинирования двух или более механизмов действия для расширения спектра контролируемых сорняков и/или контроля существующих в природе видов сорняков, обладающих большей устойчивостью или выносливостью, могут быть распространены не только на устойчивость сельскохозяйственных культур к глифосату, полученную искусственными способами (трансгенными или нетрансгенными), но также и на химические соединения, способные вызывать устойчивость к другим гербицидам. Действительно, следующие свойства устойчивости могут кодироваться по-отдельности или возможны их многочисленные сочетания, позволяющие эффективно осуществлять контроль над сорняками или предупреждать переход сорняков в любую из перечисленных категорий устойчивости к гербицидам: устойчивости к глифосату (например, устойчивости растений или бактерий, EPSPS, GOX, GAT), устойчивости к глюфосинату аммония (такой как PAT, Bar), устойчивости к гербицидам, ингибирующим ацетолактатсинтазу (ALS), таким как имидазолидинон, сульфонилмочевина, триазолпиримидин, сульфонанилид, пиримидинтиобензоат, и другие гены химической устойчивости, таким как AHAS Csrl, SurA и т.д.), устойчивости к бромоксинилу (такой как Вхп), устойчивости к ингибиторам HPPD (4-гидроксифенилпируватдиоксигеназа), устойчивости к ингибиторам фитоендесатуразы (PDS), устойчивости к гербицидам, ингибирующим фотосистему II (такой как psbA), устойчивости к гербицидам, ингибирующим фотосистему I, устойчивости к гербицидам, ингибирующим протопорфириногеноксидазу IX (РРО) (такой как РРО-1), устойчивости к гербицидам на основе фенилмочевины (такой как CYP76B1), устойчивости, опосредуемой ферментом, расщепляющим дикамбу и т.д.
Что касается других гербицидов, некоторые другие предпочтительные ингибиторы ALS включают триазолопиримидин-бензолсульфонамид (хлорансулам-метил, диклосулам, флуметсулам, метосулам и пиримидин-триазол-сульфонамид), пиримидинтиобензоат и флукарбазон. Некоторые предпочтительные ингибиторы HPPD включают мезотрион, изоксафлутол и сулкотрион. Некоторые предпочтительные ингибиторы РРО включают флумиоксазин, бутафенацил, карфентразон, сулфентразон и дифенилоксид (такие как ацифлуорфен, фомесафен, лактофен и оксифлуорфен).
Кроме того, ген 24DT11 можно использовать сам по себе в сочетании с одним или более входными (такими как устойчивость к насекомым, устойчивость к грибам или устойчивость к стрессу) или выходными параметрами (такими как повышенная урожайность, улучшенное содержание масел, улучшенное качество волокон) или использовать в сочетании с одним или более другими входными (такими как устойчивость к насекомым, устойчивость к грибам или устойчивость к стрессу) или выходными параметрами (такими как повышенная урожайность, улучшенное содержание масел, улучшенное качество волокон) после комбинации с другими свойствами устойчивых к другим гербицидам сельскохозяйственных культур. Таким образом, изобретение позволяет осуществлять пластичный и экономичный контроль любого числа сельскохозяйственных вредителей и предоставляет комплексное решение проблемы повышения качества урожая.
Ген 24DT11 по данному изобретению может осуществлять разложение 2,4-D, что лежит в основе получения сельскохозяйственных культур, устойчивых к гербицидам, и возможного использования в качестве маркера селекции.
Трансгенная экспрессия гена 24DT11 позволяет контролировать практически любые комбинации гербицидов против широколиственных сорняков. Ген 24DT11, как превосходное свойство устойчивости сельскохозяйственных культур к гербицидам, может сочетаться, например, со свойствами устойчивости сельскохозяйственных культур к другим гербицидам, такими как устойчивость к глифосату, устойчивость к глюфосинату аммония, устойчивость к ингибиторам ALS (таким как имидазолидинон, сульфонилмочевина и триазолопиримидин бензолсульфонамиды), устойчивость к бромоксинилу, устойчивость к ингибиторам HPPD, устойчивость к ингибиторам РРО и т.п.) и свойствами устойчивости к насекомым (Cry1Ab, Cry1F, Vip3, другим белкам bacillus thuringiensis или белкам устойчивости к насекомым, произведенным бактериями, не относящимися к bacillus). Кроме того, ген 24DT11 можно использовать в качестве маркера селекции для облегчения селекции первичных трансформантов растений, генетически модифицированных другим геном или группой генов.
Для введения стабильных кислотных функциональных групп в гербициды можно использовать феноксиалканоатную группу. Кислотные группы улучшают поступление гербицидов во флоэму (свойство, необходимое для реализации эффекта гербицидов) благодаря «захвату кислот» и включаются в новые гербициды для обеспечения активности. Существует множество доступных для приобретения и экспериментальных гербицидов, являющихся субстратом 24DT11. Таким образом, применение данного изобретения позволяет обеспечить устойчивость к другим гербицидам.
Свойство устойчивости сельскохозяйственных культур к гербицидам по данному изобретению можно применять в новой комбинации со свойствами устойчивости сельскохозяйственных культур к другим гербицидам (включая устойчивость к глифосату, но не ограничиваясь ей). Благодаря новоприобретенной устойчивости или собственной устойчивости к гербицидам (таким как глифосат) результатом комбинации указанных свойств являются новые способы контроля сорняков. Таким образом, помимо свойств устойчивости сельскохозяйственных культур к гербицидам данное изобретение также охватывает новые способы контроля сорняков с использованием гербицидов, в которых указанная устойчивость к гербицидам опосредована ферментом, продуцируемым трансгенными сельскохозяйственными культурами.
Данное изобретение можно применять для различных растений, таких как Arabidopsis, табак, соя, хлопок, рис, кукуруза и крестоцветные. Данное изобретение также можно применять для различных других однодольных (таких как злаковые или травянистые растения) и двудольных (таких как люцерна, клевер и виды деревьев и т.д.) сельскохозяйственных культур. Аналогично, 2,4-D (или другие субстраты 24DT11) можно применять более активно в отношении злаковых сельскохозяйственных культур с умеренной устойчивостью, а полученная устойчивость позволит сельхозпроизводителям применять эти гербициды в более эффективных дозировках в более широком интервале внесения без риска причинения ущерба сельскохозяйственным культурам.
Геномы растений, ткани растений или клетки растений, описанные в данном изобретении, относятся к любому генетическому материалу растений, тканям растений или клеткам растений и охватывают ядро, плазмиды и митохондриальные геномы.
«Устойчивость», описанная в данном изобретении, наследуется и позволяет растениям расти и размножаться в условиях осуществления эффективной обработки данных растений обычными гербицидами. Специалистам в области техники понятно, что даже если растению нанесен некоторый очевидный ущерб, растение все еще можно считать «устойчивым». Термин «выносливость», описанный в данном изобретении, шире, чем термин «устойчивость» и охватывает «устойчивость» и улучшенную способность конкретного растения переносить повреждения различной степени, вызванные гербицидами, которые обычно приводят к повреждению растений дикого типа с таким же генотипом при той же дозе гербицида.
Согласно данному описанию, полинуклеотиды и/или нуклеотиды образуют полный «ген» и кодируют белки или полипептиды в клетках-хозяевах, представляющих интерес. Специалисту в области техники очевидно, что полинуклеотиды и/или нуклеотиды по данному изобретению могут находиться под контролем регуляторных последовательностей целевого хозяина.
Как хорошо известно специалистам в области техники, ДНК обычно существует в двуцепочечном виде. При такой организации одна цепь комплементарна другой, и наоборот. Когда ДНК реплицируется в растениях, также образуются другие комплементарные цепи ДНК. Таким образом, полинуклеотиды, приведенные в качестве примера в Перечне последовательностей, а также их комплементарные цепи входят в объем изобретения. Термин «кодирующая цепь», обычно используемый в области техники, относится к цепи, связывающейся с антисмысловой цепью. Для экспрессии белка in vivo одна цепь ДНК обычно транскрибируется в комплементарную цепь мРНК, которая служит в качестве матрицы для экспрессии белка. Действительно, мРНК транскрибируется с «антисмысловой» цепи ДНК. «Смысловая цепь» или «кодирующая цепь» содержит ряд кодонов (кодон представляет собой триплет нуклеотидов, который кодирует специфическую аминокислоту), который может быть прочитан в открытой рамке считывания (ORF) с образованием целевых белков или пептидов. РНК и ПНК (пептидо-нуклеиновые кислоты), которые функционально эквивалентны приведенной в качестве примера ДНК, также входят в объем изобретения.
В данном изобретении молекулу нуклеиновой кислоты или ее фрагменты гибридизовали с геном устойчивости к гербициду в жестких условиях. В данном изобретении для идентификации наличия гена устойчивости к гербициду можно применять любые стандартные способы гибридизации или амплификации нуклеиновых кислот. Молекулы нуклеиновых кислот или их фрагменты способны специфически гибридизоваться с другими молекулами нуклеиновых кислот при определенных условиях. В данном изобретении, если две молекулы нуклеиновых кислот могут образовывать структуры нуклеиновых кислот с антипараллельными двойными цепями, можно установить, что указанные две молекулы могут специфически гибридизоваться друг с другом. Если две молекулы нуклеиновых кислот полностью комплементарны, одну из двух молекул также обозначают «комплементом» другой. В данном изобретении, когда каждый нуклеотид молекулы нуклеиновой кислоты комплементарен соответствующему нуклеотиду другой молекулы нуклеиновой кислоты, считают, что две молекулы «полностью комплементарны». Если две молекулы нуклеиновых кислот могут гибридизоваться друг с другом таким образом, что они могут отжигаться и связываться друг с другом с достаточной степенью стабильности по меньшей мере при нормальных условиях «низкой жесткости», считают, что эти две нуклеиновые кислоты «минимально комплементарны». Аналогично, если две молекулы нуклеиновых кислот могут гибридизоваться друг с другом таким образом, что они могут отжигаться и связываться друг с другом с достаточной степенью стабильности при нормальных условиях «высокой жесткости», устанавливают, что эти две нуклеиновые кислоты «комплементарны». Отклонение от «полной комплементарности» может допускаться при условии, что отклонение не предотвращает полностью образование двуцепочечной структуры двумя молекулами. Молекула нуклеиновой кислоты, которая может быть взята в качестве праймера или зонда, должна иметь достаточно комплементарных последовательностей для образования стабильной двуцепочечной структуры в определенном растворителе при определенной концентрации соли.
В данном изобретении гомологичная последовательность относится к молекуле нуклеиновой кислоты, которая может специфически гибридизоваться с комплементарной цепью другой подходящей молекулы нуклеиновой кислоты в условиях «высокой жесткости». Условия жесткости для гибридизации ДНК хорошо известны специалистам в области техники, такие как обработка раствором 6,0×хлорида натрия/цитрата натрия (SSC) при приблизительно 45°С и отмывании 2,0×SSC при 50°С. Например, концентрацию соли на стадии отмывания выбирают из 2,0×SSC и 50°С для условий «низкой жесткости» и 0,2×SSC и 50°С для условий «высокой жесткости». Кроме того, температура на стадии отмывания варьирует от 22°С для условий «низкой жесткости» до 65°С для условий «высокой жесткости». И температура, и концентрация соли могут варьировать вместе или варьирует только одна из этих двух переменных. Предпочтительно, условия жесткости, применяемые в данном изобретении, могут быть следующими. SEQ ID NO: 1 специфически гибридизуется в 6,0×SSC и 0,5%-ном растворе SDS (додецилсульфат натрия) при 65°С. Затем мембрану отмывают один раз в растворе 2×SSC и 0,1%-ном SDS и растворе 1×SSC и 0,1%-ном SDS, соответственно.
Таким образом, данное изобретение охватывает определенную последовательность, опосредующую устойчивость к гербициду, которая может гибридизоваться с SEQ ID NO: 1 при жестких условиях. Указанные последовательности гомологичны последовательностям по данному изобретению по меньшей мере на 40%-50% или гомологичны приблизительно на 60%, 65% или 70%, даже гомологичны по меньшей мере на 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более.
В данном изобретении предложены функциональные белки. «Функциональная активность» (или «активность»), раскрытая в данном описании, означает активность белков/ферментов (в отдельности или в комбинации с другим белком) в данном изобретении по разложению гербицида или снижению активности гербицида. Растения, которые продуцируют белки по данному изобретению, предпочтительно продуцируют такое эффективное количество белков, что при обработке растений гербицидами уровень экспрессии белка достаточен для обеспечения полной или частичной устойчивости, или выносливости к гербицидам (если нет специальных указаний, дозировка стандартная). Гербициды обычно применяют в дозировке, способной вызывать гибель растений-мишеней, в нормальной дозировке и концентрации, применяемых в полевых условиях. Предпочтительно клетки растений и растения по данному изобретению защищены от ингибирования роста или повреждения, вызванного обработкой гербицидом. Трансформированные растения и клетки растений по данному изобретению предпочтительно обладают устойчивостью или выносливостью к 2,4-D гербицидам, что означает, что трансформированные растения и клетки растений могут выживать в условиях с эффективным количеством 2,4-D гербицидов.
Гены и белки, описанные в данном изобретении, включают не только конкретные приведенные в качестве примера последовательности, но также части и/или фрагменты (включая делеции внутри и/или на конце полноразмерного белка), варианты, мутанты, замены (белки, содержащие замененные аминокислоты), химерные и слитые белки, сохраняющие их активность устойчивости к гербицидам. Указанные «варианты» или «вариации» относятся к нуклеотидным последовательностям, кодирующим тот же белок или кодирующим эквивалентный белок, обеспечивающий устойчивость к гербицидам. Указанный «эквивалентный белок» относится к белкам, которые обладают той же или по существу той же биологической активностью, обеспечивающей устойчивость к гербицидам, что и заявленные белки.
«Фрагмент» или «укороченные» последовательности ДНК или белка, описанные в данном изобретении, относятся к части или к искусственно модифицированной форме (например, последовательностям, подходящим для экспрессии в растениях) исходных последовательностей ДНК или белка (нуклеотидам или аминокислотам), входящим в данное изобретение. Длина указанной последовательности варьирует, но длина достаточна для того, чтобы (кодируемый) белок обеспечивал устойчивость к гербицидам. В некоторых случаях (в частности, при экспрессии в растениях) целесообразно использовать укороченный ген, который кодирует укороченный белок. Предпочтительно, укороченный ген обычно кодирует 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% целого белка.
Благодаря избыточности генетических кодонов несколько разных последовательностей ДНК могут кодировать одну и ту же аминокислотную последовательность. Специалист в области техники может получить последовательности ДНК с заменами, кодирующие один и тот же или по существу тот же белок. Изобретение также охватывает эти различные последовательности ДНК. Указанная «по существу та же» последовательность относится к последовательности, в которой некоторые аминокислоты заменены, удалены, добавлены или встроены, но обеспечиваемая ею устойчивость к гербицидам по существу не изменена, а также охватывает фрагменты, сохраняющие способность обеспечивать устойчивость к гербицидам.
Замены, делеции или добавления некоторых аминокислот в аминокислотных последовательностях по данному изобретению относятся к стандартным методам в области техники. Предпочтительно, такие аминокислотные изменения включают: минимальные изменения характеристик, т.е. замены намеченных аминокислот, которые существенным образом не влияют на укладку и/или активность белка; короткие делеции, обычно делеции приблизительно 1-30 аминокислот; короткие элонгации амино- или карбокси-конца, такие как присоединение метионина на амино-конце; короткие соединяющие пептиды, такие как длиной приблизительно 20-25 остатков.
Примерами консервативных замен являются замены, происходящие в следующих группах аминокислот: основные аминокислоты (такие как аргинин, лизин и гистидин), кислотные аминокислоты (такие как глутаминовая кислота и аспарагиновая кислота), полярные аминокислоты (например, глутамин и аспарагин), гидрофобные аминокислоты (таких как лейцин, изолейцин и валин), ароматические аминокислоты (например, фенилаланин, триптофан и тирозин) и аминокислоты с небольшой молекулой (таких как глицин, аланин, серии, треонин и метионин). Аминокислотные замены, обычно не изменяющие специфическую активность, хорошо известны в области техники и уже были описаны, например, в «Protein» под редакцией N. Neurath and R.L. Hill, опубликованной Academic Press, New York в 1979. Наиболее часто встречающимися заменами являются Ala/Ser, Val/Ile, Asp/Glu, Thu/Ser, Ala/Thr, Ser/Asn, Ala/Val, Ser/Gly, Tyr/Phe, Ala/Pro, Lys/Arg, Asp/Asn, Leu/Ile, Leu/Val, Ala/Glu и Asp/Gly, а также обратные замены.
Специалисту в области техники очевидно, что такие замены могут происходить за пределами областей, которые важны для молекулярной функции и все еще обеспечивают образование активных полипептидов. Для полипептида по данному изобретению аминокислотные остатки, необходимые для его активности и выбранные как незаменяемые остатки, можно идентифицировать, используя способы, известные в области техники, такие как сайт-специфический мутагенез или аланин-сканирующий мутагенез (см., например, Cunningham and Wells, 1989, Science 244: 1081-1085). Последняя методика выполняется путем введения мутаций в каждый положительно заряженный остаток в молекуле и выявления активности устойчивости к гербицидам полученных мутантных молекул с тем, чтобы идентифицировать аминокислотные остатки, которые важны для активности молекул. Сайты взаимодействия фермент-субстрат также можно определить, анализируя их трехмерную структуру, которую можно установить при помощи некоторых технологий, таких как ядерный магнитный резонанс (ЯМР), кристаллография или фотоаффинное мечение (см., например, de Vos et al., 1992, Science 255: 306-312; Smith, et al., 1992. J. Mol. Biol 224: 899-904; Wlodaver, et al., 1992, FEBS Letters 309: 59-64).
Таким образом, аминокислотные последовательности, обладающие определенной гомологией с аминокислотными последовательностями, приведенными в SEQ ID No. 2, также входят в объем изобретения. Сходство/гомология между этими последовательностями и последовательностями, описанными в данном изобретении, обычно составляют более 60%, предпочтительно более 75%, более предпочтительно более 80%, еще более предпочтительно более 90% и наиболее предпочтительно более 95%. Предпочтительные полинуклеотиды и белки в данном изобретении также можно определить в соответствии с более конкретными диапазонами гомологии и/или сходства. Например, они имеют гомологию и/или сходство 49%, 50%, 51%, 52%, 53%, 54%, 55%, 56%, 57%, 58%, 59%, 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% с последовательностями, описанными в данном изобретении.
Регуляторные последовательности, описанные в данном изобретении, включают, без ограничения, промотор, транзитный пептид, терминатор, энхансер, лидерную последовательность, интроны и другие регуляторные последовательности, которые могут быть функционально связаны с указанным геном 24DT11.
Указанный промотор представляет собой промотор, экспрессируемый в растениях, где указанный «промотор, экспрессируемый в растениях» относится к промотору, который обеспечивает экспрессию кодирующих последовательностей, связанных с промотором, в растительных клетках. Промотор, экспрессируемый в растениях, может представлять собой конститутивный промотор. Примеры промоторов, способных направлять конститутивную экспрессию в растениях, включают, без ограничения, промотор 35S, происходящий из вируса мозаики цветной капусты, промотор ubi, промотор гена GOS2, происходящий из риса и т.п. Альтернативно промотор, экспрессируемый в растениях, может представлять собой тканеспецифичный промотор, что означает, что уровень экспрессии, направляемой данным промотором в некоторых тканях растений, таких как хлоренхима, выше, чем в других тканях растения (может быть определен с помощью стандартного РНК анализа), такой как промотор PEP (фосфоенолпируваткарбоксилаза). Альтернативно промотор, экспрессируемый в растениях, может представлять собой промотор, индуцируемый повреждением. Промоторы, индуцируемые повреждением, или промоторы, направляющие индуцируемую повреждением экспрессию, относятся к промоторам, благодаря которым уровень экспрессии кодирующих последовательностей может быть существенно повышен при механическом повреждении растения или поранении насекомыми, по сравнению с уровнем экспрессии в условиях обычного роста. Примеры промоторов, индуцируемых повреждением, включают, без ограничения, промоторы генов ингибитора протеаз картофеля и томатов (pin I и pin II) и промоторы гена ингибитора протеазы кукурузы (MPI).
Указанный транзитный пептид (также называемый паракринной сигнальной последовательностью или лидерной последовательностью) направляет продукты трансгенеза в специфические органеллы или клеточные компартменты. Для белка рецептора указанный транзитный пептид может быть гетерогенным. Например, последовательности, кодирующие транзитный пептид хлоропласта, используют для транспорта в хлоропласт; или последовательность сохранения KDEL используют для транспорта в эндоплазматический ретикулум, или СТРР гена лектина ячменя используют для транспорта в вакуоль.
Указанные лидерные последовательности включают короткие лидерные последовательности вирусных РНК, такие как лидерная последовательность EMCV (5' некодирующая область вируса энцефаломиокардита); лидерные последовательности Y-вируса картофеля, такие как лидерная последовательность MDMV (вируса карликовой мозаики кукурузы); белок, связывающийся с тяжелой цепью иммуноглобулина человека (BiP); нетранслируемая лидерная последовательность мРНК белка оболочки вируса мозаики люцерны (AMV RNA4); лидерная последовательность вируса табачной мозаики (TMV), но не ограничиваются ими.
Указанные энхансеры включают энхансер вируса мозаики цветной капусты (CaMV), энхансер вируса мозаики норичника (FMV), энхансер вируса кольцевой гравировки гвоздики (CERV), энхансер вируса прожилковой мозаики маниока (CsVMV), энхансер вируса мозаики ночной красавицы (MMV), энхансер вируса желтых листовых завивок цеструма (CmYLCV), энхансер вируса скручивания листьев хлопка Мултан (CLCuMV), энхансер вируса желтой пятнистости коммелины (CoYMV) и энхансер вируса деформирующей мозаики гороха (PCLSV), но не ограничиваются ими.
Указанные интроны для применения в однодольных включают интроны белка теплового шока кукурузы 70 (hsp70), интроны убиквитина кукурузы, интрон Adh 1, интроны сахарозосинтазы или интроны Act1 риса, но не ограничиваются ими. Указанные интроны для применения в двудольных растениях включают интроны САТ-1, интроны pKANNIBAL, интроны PIV2 и «супер убиквитиновые» интроны, но ограничиваются ими.
Указанные терминаторы могут представлять собой специфические последовательности сигнала полиаденилирования, играющие роль в растениях. Они включают последовательность сигнала полиаденилирования, происходящую из гена нопалинсинтетазы (NOS) Agrobacterium tumefaciens, последовательность сигнала полиаденилирования, происходящую из гена ингибитора протеазы II (pin II), последовательность сигнала полиаденилирования, происходящую из гена ssRUBISCO Е9 гороха и последовательность сигнала полиаденилирования, происходящую из гена α-тубулина.
Термин «функционально связанный», описанный в данном изобретении, относится к связыванию последовательностей нуклеиновых кислот, которое придает последовательностям необходимую функцию связанных последовательностей. Термин «функционально связанный», описанный в данном изобретении, может представлять собой связь между промотором и последовательностями, представляющими интерес, которая помещает транскрипцию указанных последовательностей под контроль и регуляцию промотора. Когда последовательность, представляющая интерес, кодирует белок и требуется экспрессия указанного белка, термин «функционально связанный» указывает на то, что связь между промотором и указанной последовательностью обеспечивает эффективную трансляцию полученного транскрипта. Если связь между промотором и кодирующей последовательностью приводит к транскрипционному слиянию, и требуется экспрессия кодируемого белка, такая связь осуществляется для того, чтобы убедиться, что первый кодон инициации трансляции полученного транскрипта представляет собой инициирующий кодон кодирующей последовательности. Альтернативно, если связь между промотором и кодирующей последовательностью приводит к трансляционному слиянию, и требуется экспрессия кодируемого белка, такая связь осуществляется для того, чтобы убедиться, что первый кодон инициации трансляции 5' нетранслируемой последовательности присоединен к промотору, в результате чего полученные транслированные продукты оказываются связанными, и открытая рамка считывания кодируемого белка, представляющего интерес, слита в рамке считывания. Последовательности нуклеиновых кислот, которые могут быть «функционально связаны», включают, без ограничения, последовательности, обеспечивающие функцию экспрессии гена (т.е. элементы экспрессии гена, такие как промотор, 5' нетранслируемая область, интроны, белок-кодирующая область, 3' нетранслируемая область, сайты полиаденилирования и/или терминаторы транскрипции); последовательности, обеспечивающие функцию переноса и/или интеграции ДНК (т.е. граничные последовательности Т-ДНК, сайты распознавания сайт-специфических рекомбинантных ферментов, сайты распознавания интегразы); последовательности, обеспечивающие функцию, по которой происходит селекция (т.е. маркеры устойчивости к антибиотикам, гены, вовлеченные в биосинтез); последовательности, обеспечивающие функцию маркеров, по которым производят количественную оценку; последовательности, помогающие проводить манипуляции с последовательностями in vitro или in vivo (последовательности полилинкеров, последовательности сайт-специфической рекомбинации) и последовательности, обеспечивающие функцию репликации (т.е. ориджины репликации бактерий, автономно реплицирующиеся последовательности, центромерные последовательности).
Данное изобретение позволяет придать растениям новые свойства устойчивости к гербицидам при отсутствии нежелательных эффектов на фенотип, включая урожайность. Растения по данному изобретению могут переносить в 2 ×, 3 ×, 4 × или 5 × раз более высокий уровень внесения по меньшей мере одного гербицида. Улучшение указанных уровней устойчивости входит в объем данного изобретения. Например, возможно заранее оптимизировать и развить дальше многие технологии, известные в области техники, чтобы повысить экспрессию заданного гена.
В данном изобретении указанный белок устойчивости к гербициду представляет собой аминокислотную последовательность 24DT11, приведенную в SEQ ID NO: 2 в Перечне последовательностей. Указанный ген устойчивости к гербициду представляет собой нуклеотидную последовательность 24DT11, приведенную в SEQ ID NO: 1 в Перечне последовательностей. Для применения у растений указанный ген устойчивости к гербициду также содержит, помимо кодирующей области белка, кодируемого нуклеотидной последовательностью 24DT11, другие элементы, такие как кодирующие области, которые кодируют транзитные пептиды, кодирующие области, которые кодируют селективные маркерные белки или белки, которые придают устойчивость к насекомым.
Белок устойчивости к гербициду 24DT11, описанный в данном изобретении, обеспечивает устойчивость к большинству фенокси-ауксиновых гербицидов. Геномы растений в данном изобретении содержат экзогенные ДНК, которые содержат нуклеотидную последовательность 24DT11. Растения защищены от угрозы гербицидов благодаря экспрессии эффективного количества данного белка. «Эффективное количество» относится к количеству, которое не вызывает повреждения или вызывает незначительное повреждение. В то же время, растения должны иметь нормальную морфологию и средства их культивирования должны быть стандартными для потребления и/или получения продуктов.
Уровень экспрессии кристаллических белков устойчивости к гербицидам (ICP) в растительном материале можно определить с помощью различных методов, описанных в области техники, таких как способ количественного определения мРНК, кодирующей белок устойчивости к гербицидам в ткани, с использованием специфических праймеров, или способ прямого и специфического количественного определения белка устойчивости к гербицидам.
В данном изобретении предложен белок устойчивости к гербицидам, кодирующий ген и их применение, обеспечивающие следующие преимущества:
1. Высокая устойчивость к гербицидам. Белок устойчивости к гербицидам 24DT11 по данному изобретению высокоустойчив к гербицидам, особенно к фенокси-ауксиновым гербицидам, в частности, к 2,4-D.
2. Широкий спектр устойчивости к гербицидам. Белок устойчивости к гербицидам 24DT11 по данному изобретению демонстрирует высокую устойчивость к разнообразным фенокси-ауксиновым гербицидам растений, таким образом, потенциал его применения у растений широкий.
Прилагаемые графические материалы и примеры более подробно описывают технические решения, предложенные в данном изобретении.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг. 1 показана схема конструкции рекомбинантного клонирующего вектора DBN01-T, содержащего нуклеотидную последовательность 24DT11, использованного в белке устойчивости к гербицидам, кодирующем гене и их применениях в данном изобретении.
На Фиг. 2 показана схема конструкции рекомбинантного экспрессирующего вектора DBN100411, содержащего нуклеотидную последовательность 24DT11, использованного в белке устойчивости к гербицидам, кодирующем гене и их применениях в данном изобретении.
На Фиг. 3 показана схема конструкции рекомбинантного экспрессирующего вектора DBN100411N, содержащего контрольную последовательность, использованного в белке устойчивости к гербицидам, кодирующем гене и их применениях в данном изобретении.
На Фиг. 4 показан эффект устойчивости к гербицидам трансгенных растений Т1 Arabidopsis, обеспечиваемый белком устойчивости к гербицидам, кодирующим геном и их применениями в настоящем изобретении.
На Фиг. 5 показан эффект устойчивости к гербицидам трансгенных растений Т1 сои, обеспечиваемый белком устойчивости к гербицидам, кодирующим геном и их применениями в настоящем изобретении.
На Фиг. 6 показана схема конструкции рекомбинантного экспрессирующего вектора DBN100758, содержащего нуклеотидную последовательность 24DT11, использованного в белке устойчивости к гербицидам, кодирующем гене и их применениях в данном изобретении.
На Фиг. 7 показана схема конструкции рекомбинантного экспрессирующего вектора DBN100758N, содержащего контрольную последовательность, который применяли в данном изобретении, касающемся белка устойчивости к гербицидам, кодирующего гена и их применения.
ПОДРОБНОЕ ОПИСАНИЕ ВОПЛОЩЕНИЙ ИЗОБРЕТЕНИЯ
Техническое решение, относящееся к белку устойчивости к гербицидам, кодирующему его гену и их применению, предложенным в данном изобретении, более подробно проиллюстрировано следующими примерами.
Пример 1. Получение и синтез последовательности гена 24DT11
1. Получение последовательности гена 24DT11
Аминокислотная последовательность белка устойчивости к гербицидам 24DT11 (292 аминокислоты) приведена в Перечне последовательностей как SEQ ID NO: 2; нуклеотидная последовательность (879 нуклеотидов), кодирующая соответствующую аминокислотную последовательность белка устойчивости к гербицидам 24DT11 (292 аминокислоты) приведена в Перечне последовательностей как SEQ ID NO: 1.
2. Синтез вышеупомянутой нуклеотидной последовательности
Нуклеотидную последовательность 24DT11 (приведенную в Перечне последовательностей как SEQ ID NO: 1) синтезировали в компании GenScript Co., Ltd. Nanjing, КНР; к синтезированной нуклеотидной последовательности 24DT11 (SEQ ID NO: 1) присоединяли рестрикционный сайт SpeI на 5' конце и рестрикционный сайт KasI на 3' конце.
Пример 2. Конструирование рекомбинантных экспрессирующих векторов Arabidopsis thaliana и сои
1. Конструирование рекомбинантного клонирующего вектора DBN01-T, содержащего нуклеотидную последовательность 24DT11
Синтезированную нуклеотидную последовательность 24DT11 клонировали в клонирующий вектор pGEM-T (Promega, Мэдисон, США, кат. номер: А3600) для получения рекомбинантного клонирующего вектора DBN01-T, следуя инструкциям Promega для вектора pGEM-T и процессу конструирования, представленному на Фиг. 1 (где Amp обозначает ген устойчивости к ампициллину; f1 представляет собой ориджин репликации фага f1; LacZ представляет собой инициирующий кодон LacZ; SP6 обозначает промотор РНК-полимеразы SP6; Т7 обозначает промотор РНК-полимеразы Т7; 24DT11 обозначает нуклеотидную последовательность 24DT11 (SEQ ID NO: 1); MCS обозначает сайты множественного клонирования).
Затем рекомбинантным клонирующим вектором DBN01-T трансформировали компетентные клетки Е.coli Т1 (Transgen, Пекин, КНР, кат. номер: CD501) методом теплового шока. Условия теплового шока были следующими: 50 мкл компетентных клеток Е.coli Т1 и 10 мкл плазмидной ДНК (рекомбинантный клонирующий вектор DBN01-T) инкубировали на водяной бане при 42°С в течение 30 секунд. Затем клетки Е.coli культивировали при качании при 37°С в течение 1 ч (термостатируемая качалка при вращении со скоростью 100 об./мин) и затем в течение ночи культивировали на поверхности чашек с LB-агаром (10 г/л триптона, 5 г/л дрожжевого экстракта, 10 г/л NaCl, 15 г/л агара с доведением рН до 7,5 с помощью NaOH) с добавлением на поверхности IPTG (изопропилтио-бета-D-галактозида), X-gal (5-бромин-4-хлорин-3-индол-бета-D-галактозида) и ампициллина (100 мг/л). Отбирали белые колонии и культивировали в среде LB (10 г/л триптона, 5 г/л дрожжевого экстракта, 10 г/л NaCl, 100 мг/л ампициллина с доведением рН до 7,5 с помощью NaOH) при 37°С в течение ночи. Выделяли из них плазмиды методом щелочного лизиса следующим образом: жидкую культуру бактерий центрифугировали в течение 1 мин при 12000 об./мин, надосадочную жидкость отбрасывали и осадок ресуспендировали в 100 мкл ледяного раствора I (25 мМ Tris-HCl, 10 мМ EDTA (этилендиаминтетрауксусной кислоты) и 50 мМ глюкозы, рН=8,0); затем добавляли 200 мкл свежеприготовленного раствора II (0,2 М NaOH, 1% SDS (додецилсульфата натрия)) и переворачивали пробирку 4 раза, перемешивали и затем помещали на лед на 3-5 минут; добавляли 150 мкл холодного раствора III (3 М ацетат калия и 5 М уксусная кислота), немедленно тщательно перемешивали и инкубировали на льду в течение 5-10 минут; смесь центрифугировали при 12000 об./мин при 4°С в течение 5 минут, к надосадочной жидкости добавляли двукратный объем безводного этанола, смешивали и затем оставляли при комнатной температуре на 5 минут; смесь центрифугировали при 12000 об./мин при 4°С в течение 5 минут, надосадочную жидкость отбрасывали, осадок промывали 70%-ным этанолом (об./об.) и затем высушивали; для растворения осадка добавляли 30 мкл ТЕ (10 мМ Tris-HCl, 1 мМ EDTA, рН=8,0), содержащего РНКазу (20 мкг/мл); смесь инкубировали при 37°С на водяной бане в течение 30 мин для расщепления РНК и хранили при -20°С для последующего использования.
После того, как выделенные плазмиды верифицировали с использованием рестрикционных ферментов SpeI и KasI, положительные клоны верифицировали с помощью секвенирования. Результаты показали, что указанная нуклеотидная последовательность 24DT11, встроенная в рекомбинантный клонирующий вектор DBN01-T, представляла собой последовательность, приведенную в SEQ ID NO: 1 в Перечне последовательностей, что свидетельствовало о том, что нуклеотидная последовательность 24DT11 была встроена правильно.
2. Конструирование рекомбинантных экспрессирующих векторов DBN100411 Arabidopsis thaliana и сои, содержащих нуклеотидную последовательность 24DT11
Рекомбинантный клонирующий вектор DBN01-T и экспрессирующий вектор DBNBC-01 (основа вектора: рСАМВ1А2301, предоставляется институтом CAMBIA) расщепляли рестрикционными ферментами SpeI и KasI. Для конструирования рекомбинантного экспрессирующего вектора DBN100411 обработанный рестриктазами фрагмент нуклеотидной последовательности 24DT11 лигировали между рестрикционными сайтами SpeI и KasI экспрессирующего вектора DBNBC-01. Это стандартный хорошо известный специалистам в области техники способ конструирования экспрессирующего вектора с помощью расщепления рестрикционными ферментами. Схема конструирования представлена на Фиг. 2 (Kan: ген канамицина; RB: правая граница; AtUbi10: промотор гена убиквитина 10 Arabidopsis (убиквитин) (SEQ ID NO: 3); 24DT11: нуклеотидная последовательность 24DT11 (SEQ ID NO: 1); Nos: терминатор гена нопалинсинтетазы (SEQ ID NO: 4); prCaMV35S: промотор 35S вируса мозаики цветной капусты (SEQ ID NO:5); PAT. ген глюфосинатацетилтрансферазы (SEQ ID NO:6); tCaMV35S: терминатор 35S вируса мозаики цветной капусты (SEQ ID NO: 7); LB: левая граница).
Рекомбинантным экспрессирующим вектором DBN100411 трансформировали компетентные клетки Е.coli Т1 методом теплового шока следующим образом: 50 мкл компетентных клеток Е.coli Т1 и 10 мкл плазмидной ДНК (рекомбинантный экспрессирующий вектор DBN100411) инкубировали на водяной бане при 42°С в течение 30 секунд. Затем клетки Е.coli культивировали при 37°С при встряхивании (термостатируемая качалка при вращении со скоростью 100 об./мин) в течение 1 ч, а затем выращивали в чашках с LB-агаром (10 г/л триптона, 5 г/л дрожжевого экстракта, 10 г/л NaCl, 15 г/л агара с доведением рН до 7,5 с помощью NaOH), содержащим 50 мг/л канамицина, при 37°С в течение 12 часов. Отбирали белые колонии и культивировали в среде LB (10 г/л триптона, 5 г/л дрожжевого экстракта, 10 г/л NaCl, 50 мг/л канамицина с доведением рН до 7,5 с помощью NaOH) при 37°С в течение ночи. Выделяли из них плазмиды методом щелочного лизиса. После того, как выделенные плазмиды верифицировали с использованием рестрикционных ферментов SpeI и KasI, положительные клоны верифицировали с помощью секвенирования. Результаты демонстрируют, что указанная нуклеотидная последовательность между рестрикционными сайтами SpeI и KasI в рекомбинантном экспрессирующем векторе DBN100411 представляла собой последовательность, приведенную в SEQ ID NO: 1 в Перечне последовательностей, т.е. нуклеотидную последовательность 24DT11.
3. Конструирование рекомбинантных экспрессирующих векторов DBN100411N, содержащих контрольную последовательность, для Arabidopsis thaliana и сои
Следуя процессу конструирования рекомбинантного клонирующего вектора DBN01-T, содержащего нуклеотидную последовательность 24DT11, описанному в части 1 Примера 2, и используя контрольную последовательность (SEQ ID NO: 8), сконструировали рекомбинантный клонирующий вектор DBN01R-T, содержащий контрольную последовательность. Положительные клоны верифицировали с помощью секвенирования. Результаты показали, что контрольная нуклеотидная последовательность, встроенная в рекомбинантный клонирующий вектор DBN01R-T, представляла собой последовательность, приведенную в SEQ ID NO: 8 в Перечне последовательностей, что свидетельствовало о том, что нуклеотидная последовательность была встроена правильно.
Следуя процессу конструирования рекомбинантного экспрессирующего вектора DBN100411, содержащего нуклеотидную последовательность 24DT11, описанному в части 2 Примера 2, и используя контрольную последовательность, сконструировали рекомбинантный экспрессирующий вектор DBN100411N, содержащий контрольную последовательность, структура вектора показана на Фиг. 3 ((основа вектора: рСАМВ1А2301, предоставляется институтом CAMBIA); (Кап: ген канамицина; RB: правая граница; AtUbMO: промотор гена убиквитина 10 Arabidopsis (убиквитин) (SEQ ID NO: 3); mN: контрольная последовательность (SEQ ID NO: 8); Nos: терминатор гена нопалинсинтетазы (SEQ ID NO: 4); prCaMV35S: промотор 35S вируса мозаики цветной капусты (SEQ ID NO: 5); PAT: ген глюфосинатацетилтрансферазы (SEQ ID NO: 6); tCaMV35S: терминатор 35S вируса мозаики цветной капусты (SEQ ID NO: 7); LB: левая граница). Положительные клоны верифицировали с помощью секвенирования. Результаты показали, что контрольная последовательность, встроенная в рекомбинантный экспрессирующий вектор DBN100411N, представляла собой последовательность, приведенную в SEQ ID NO: 8 в Перечне последовательностей, что свидетельствовало о том, что контрольная последовательность была встроена правильно.
Пример 3. Получение растения Arabidopsis со встроенной нуклеотидной последовательностью 24DT22
1. Трансформация Agrobacterium tumefaciens рекомбинантными экспрессирующими векторами
Правильно сконструированными рекомбинантными экспрессирующими векторами DBN100411 и DBN100411N (контрольная последовательность) трансформировали Agrobacterium GV3101 методом быстрого замораживания в жидком азоте следующим образом: 100 мкл Agrobacterium GV3101 и 3 мкл плазмидной ДНК (рекомбинантный экспрессирующий вектор) помещали в жидкий азот на 10 минут и затем инкубировали в водяной бане при 37°С в течение 10 минут. Затем трансформированные клетки Agrobacterium GV3101 инокулировали в среду LB и культивировали при 28°С, 200 об./мин в течение 2 часов и распределяли по поверхности чашки с LB-агаром, содержащим 50 мг/л рифампицина (Rifampicin) и 50 мг/л канамицина, и следили за появлением отдельных положительных колоний. Отбирали отдельные положительные колонии, культивировали и выделяли из них плазмиды. Рекомбинантный экспрессирующий вектор DBN100411 верифицировали с помощью рестрикционных ферментов SmaI и PstI, а рекомбинантный экспрессирующий вектор DBN100411N (контрольная последовательность) верифицировали с помощью рестрикционных ферментов SmaI и BglI. Результаты показали, что рекомбинантные экспрессирующие векторы DBN100411 и DBN100411N (контрольная последовательность) имели правильную структуру.
2. Получение трансгенных растений Arabidopsis thaliana
Семена Arabidopsis дикого типа суспендировали в 0,1%-ном растворе агарозы (масс./об.) и выдерживали при 4°С в течение 2 суток, что было необходимо для их перехода в состояние покоя для обеспечения синхронного прорастания семян. Смешивали вместе вермикулит и конский навоз и смачивали водой с помощью подземного орошения. Почвенную смесь обезвоживали в течение 2 часов. Предварительно обработанные семена культивировали в почвенной смеси, покрыв увлажненным материалом, в течение 7 дней. Семена прорастали, и растения культивировали в теплице при постоянной температуре 22°C с постоянной влажностью 40-50% и длинном световом дне при интенсивности освещения 120-150 мкмоль/м2с (16 часов света / 8 часов темноты). Вначале растения орошали питательным раствором Hoagland, а затем деионизированной водой, поддерживая почву влажной, но не промокшей.
Для трансформации Arabidopsis применяли метод погружения цветочных почек. Для получения предварительной культуры отобранные колонии агробактерий инокулировали в одну или более пробирок, содержащих 15-30 мл среды YEP с добавлением 50 мг/л канамицина и 10 мг/л рифампицина. Предварительную культуру инкубировали при 28°С и 200 об./мин в течение ночи. Каждую предварительную культуру использовали для инокуляции двух культур в 500 мл среды YEP, содержащей канамицин (100 мг/л) и рифампицин (10 мг/л), и инкубировали культуры при 28°С на термостатируемой качалке в течение ночи. Культуры центрифугировали при 8700×g в течение 10 минут при комнатной температуре для осаждения клеток и полученную надосадочную жидкость отбрасывали. Клеточный осадок осторожно ресуспендировали в 500 мл среды, способствующей проникновению, содержащей 1/2 × солей MS/витамина В5, 10% (масс./об.) сахарозы, 0,044 мкМ бензиламинопурина (10 мкл/л (маточный раствор 1 мг/мл в DMSO (диметилсульфоксид))) и 300 мкл/л Silvet L-77. Растения возрастом приблизительно 1 месяц замачивали в среде на 15 секунд, чтобы самые последние соцветия были погружены. Затем растения клали на бок и накрывали (прозрачным или непрозрачным покрытием) на 24 часа, а затем промывали водой и помещали вертикально. Растения культивировали при 22°С при световом цикле 16 часов света / 8 часов темноты. Семена собирали и затем замачивали в течение 4 недель.
Свежесобранные семена Т1 (нуклеотидная последовательность 24DT11 и контрольная последовательность) высушивали при комнатной температуре в течение 7 дней. Семена культивировали в чашках для проращивания (26,5×51 см), по 200 мг семян Т1 (приблизительно 10000 семян)/чашку. Семена, суспендированные в 40 мл 0,1%-ного раствора агарозы (масс./об.), хранили при 4°С в течение 2 суток, что было необходимо для их перехода в состояние покоя для обеспечения синхронного прорастания семян.
Смешивали вместе вермикулит и конский навоз, смачивали водой с помощью подземного орошения и осушали при помощи гравитации. Предварительно обработанные семена (по 40 мл каждого) равномерно высаживали в почвенную смесь с помощью пипетки и покрывали увлажненным материалом на 4-5 дней. За 1 день до первоначального отбора трансформантов путем распыления глюфосината аммония (селекция по котрансформированному гену PAT) после прорастания семян материал убирали.
На 7 и 11 сутки после высаживания (стадия котиледона и стадия 2-4 листочков, соответственно) на растения Т1 распыляли 0,2%-ный раствор гербицида Liberty (200 г кислотных эквивалентов/л глюфосината аммония) с помощью распылителя со сжатым воздухом DeVilbiss при распыляемом объеме 10 мл/диск (703 л/га), так чтобы каждое нанесение обеспечивало эффективное количество глюфосината аммония (280 г кислотных эквивалентов/га). Выжившие растения (активно растущие растения) верифицировали через 4-7 дней после последнего распыления и переносили в квадратный горшок (7 см × 7 см) из вермикулита и конского навоза (3-5 растений на горшок). Трансплантированные растения покрывали увлажненным материалом на 3-4 дня и помещали в культуральную комнату при 22°С или непосредственно в теплицу, в соответствии с описанием выше. Затем материал убирали и растения высаживали в теплицу (22±5°С, относительная влажность 50±30%, 14 часов света: 10 часов темноты, минимум 500 мкЕ/м2с1 естественное освещение + дополнительное освещение) по меньшей мере за один день до тестирования способности 24DT11 обеспечивать устойчивость к фенокси-ауксиновому гербициду.
Пример 4. Исследование устойчивости к гербицидам трансгенного растения Arabidopsis
Ген 24DT11 использовали для трансформации Arabidopsis впервые. Вначале производили отбор трансформантов Т1, используя схему селекции с глюфосинатом аммония. Провели скрининг приблизительно 20000 семян Т1, среди которых идентифицировали 282 штамма положительных трансформантов поколения Т1 (ген PAT), т.е. эффективность трансформации составила приблизительно 1,4%. Через 18 дней после высаживания анализировали устойчивость к гербицидам диметиламмониевой соли 2,4-D и агроксону у растений Arabidopsis Т1, трансформированных нуклеотидной последовательностью 24DT11 и контрольной последовательностью, соответственно, и у растений Arabidopsis дикого типа.
На растения Arabidopsis Т1, трансформированные нуклеотидной последовательностью 24DT11, контрольной нуклеотидной
последовательностью, соответственно, и на растения Arabidopsis дикого типа распыляли диметиламмониевую соль 2,4-D (560 г кислотных эквивалентов/га, 1-кратная концентрация в полевых условиях), агроксон (560 г кислотных эквивалентов/га, 1-кратная концентрация в полевых условиях) и холостой растворитель (воду). Состояние устойчивости растений проверяли на 7 день и на 14 день после распыления. Растения, которые через 7 дней после распыления росли так же, как и те, на которые распыляли холостой растворитель (воду), классифицировали как высокоустойчивые растения; растения со скрученными листьями розетки через 7 дней после распыления классифицировали как умеренно устойчивые растения; растения, не способные к стеблеванию через 14 дней после распыления, классифицировали как растения с низкой устойчивостью, а растения, погибшие через 14 дней после распыления, классифицировали как растения, не обладающие устойчивостью. Поскольку каждое растение Arabidopsis Т1 представляет собой независимое событие трансформации, при заданной дозе возможны существенные различия в ответах отдельных Т1. Результаты представлены в Таблице 1 и на Фиг. 4.
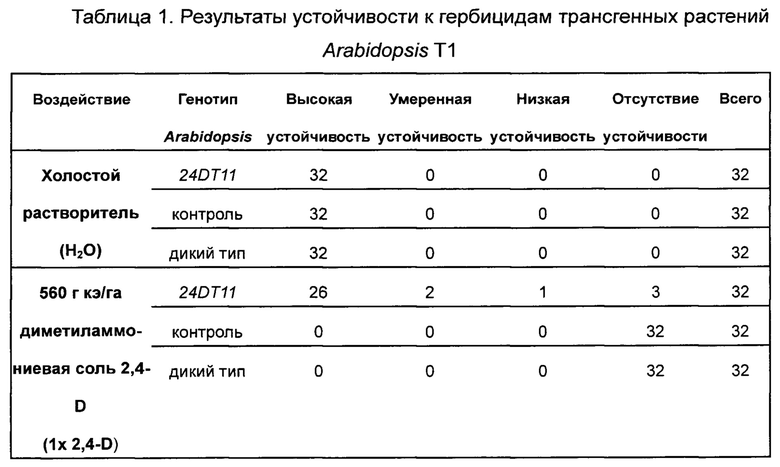
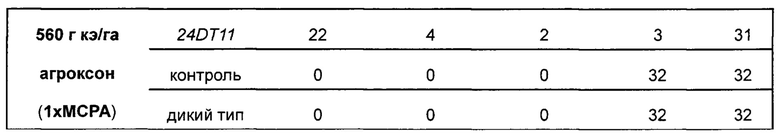
Эффективная доза 2,4-D и агроксона, позволяющая различить чувствительные растения Arabidopsis и растения со средней устойчивостью, составляет 560 г кислотных эквивалентов/га. Результаты, приведенные в Таблице 1 и на Фиг. 4, показывают, что ген 24DT11 придает устойчивость к гербицидам отдельным растениям Arabidopsis (только часть растений обладает устойчивостью, поскольку сайты встраивания у растений поколения Т1 являются случайными). Таким образом, уровни экспрессии гена, обеспечивающего устойчивость, различны, и в результате уровни устойчивости, особенно к фенокси-ауксиновым гербицидам, различаются. Растения Arabidopsis дикого типа и растения Arabidopsis, трансформированные контрольной последовательностью, не обладают устойчивостью к фенокси-ауксиновым гербицидам.
Пример 5. Получение растений сои со встроенной нуклеотидной последовательностью 24DT22
1. Трансформация Agrobacterium tumefaciens рекомбинантными экспрессирующими векторами
Правильно сконструированными рекомбинантными экспрессирующими векторами DBN100411 и DBN100411N (контрольная последовательность) трансформировали Agrobacterium LBA4404 (Irwitrogen, Чикаго, США, кат. номер: 18313-015) методом быстрого замораживания в жидком азоте, условия трансформации были следующими: Agrobacterium LBA4404 и 3 мкл плазмидной ДНК (рекомбинантный экспрессирующий вектор) помещали в жидкий азот на 10 минут и затем инкубировали на водяной бане при 37°С в течение 10 минут. Затем трансформированные клетки Agrobacterium LBA4404 инокулировали в среду LB и культивировали при 28°С, 200 об./мин в течение 2 часов и распределяли по поверхности чашки с LB-агаром, содержащим 50 мг/л рифампицина (Rifampicin) и 50 мг/л канамицина, и следили за появлением отдельных положительных колоний. Отбирали отдельные положительные колонии, культивировали и выделяли из них плазмиды. Рекомбинантный экспрессирующий вектор DBN100411 верифицировали с помощью рестрикционных ферментов SmaI и EcoRV, а рекомбинантный экспрессирующий вектор DBN100301N (контрольная последовательность) верифицировали с помощью рестрикционных ферментов SmaI и BglI. Результаты показали, что рекомбинантные экспрессирующие векторы DBN100301 и DBN100301N (контрольная последовательность) имели правильную структуру.
2. Получение трансгенных растений сои
Семядольный узел сои дикого типа (Zhonghuang 13) стерильно культивировали с Agrobacterium tumefaciens, описанной в Примере 1, для переноса в геном сои Т-ДНК рекомбинантных экспрессирующих векторов DBN100411 и DBN100411N, описанных в Примерах 2 и 3 (содержащих промоторную последовательность гена убиквитина 10 Arabidopsis thaliana, нуклеотидную последовательность 24DT11, контрольную последовательность, терминатор Nos, промотор 35S вируса мозаики цветной капусты, ген глюфосинатацетилтрансферазы и терминатор 35S вируса мозаики цветной капусты), получали растения сои, содержащие 24DT11 и контрольную нуклеотидные последовательности, а растения сои дикого типа использовали как контроль.
Вкратце, опосредованную агробактериями трансформацию сои выполняли следующим образом: зрелые семена сои проращивали в среде для проращивания сои (3,1 г/л соли В5, витамин В5, 20 г/л сахарозы, 8 г/л агара, рН 5,6) и культивировали в следующих условиях: температура 25±1°С; фотопериод (свет/темнота) 16/8 ч. Через 4-6 дней проращивания получали свежие зеленые асептические бобы сои с формирующимся семядольным узлом, отрезали гипокотиль, располагающийся на 3-4 мм ниже семядольного узла, разрезали котиледон вдоль и удаляли у котиледона верхушечную почку, латеральную почку и зародышевые корешки, повреждали семядольный узел тупой кромкой скальпеля и поврежденные ткани семядольного узла приводили в контакт с суспензией агробактерий, при этом агробактерии могли переносить нуклеотидную последовательность 24DT11 в поврежденные ткани семядольного узла (стадия 1, стадия инфицирования: на данной стадии, предпочтительно, ткани семядольного узла погружали в суспензию агробактерий (OD660=0,5-0,8, среда для инфицирования (2,15 г/л соли MS, витамин В5, 20 г/л сахарозы, 10 г/л глюкозы, 40 мг/л ацетосирингона (AS), 4 г/л 2-(N-морфолино)этансульфоновой кислоты (MES), 2 мг/л зеатина (ZT), рН 5,3)) для инициации инокуляции. Осуществляли совместное культивирование тканей семядольного узла с агробактериями в течение определенного времени (3 дня). (Стадия 2: стадия совместного культивирования). Предпочтительно, ткани семядольного узла после инфицирования культивировали в твердой среде (4,3 г/л соли MS, витамин В5, 20 г/л сахарозы, 10 г/л глюкозы, 4 г/л 2-(N-морфолино)этансульфоновой кислоты (MES), 2 мг/л зеатина, 8 г/л агара, рН 5,6). После этой стадии совместного культивирования можно переходить к стадии селективного «восстановления». На стадии «восстановления» восстанавливающая среда (3,1 г/л соли В5, витамин В5, 1 г/л 2-(N-морфолино)этансульфоновой кислоты (MES), 30 г/л сахарозы, 2 мг/л зеатина (ZT), 8 г/л агара, 150 мг/л цефалоспорина, 100 мг/л глутаминовой кислоты, 100 мг/л аспарагиновой кислоты, рН 5,6) содержит по меньшей мере один вид известного антибиотика, ингибирующего агробактерий (цефалоспорин) без селективного агента для трансфицированных растений (Стадия 3: стадия восстановления). Предпочтительно, ткани культивировали в твердой среде, содержащей антибиотик, но не содержащей селективного агента, чтобы элиминировать Agrobacterium и дать инфицированным клеткам время на восстановление. Затем инокулированные ткани культивировали на среде, содержащей селективный агент (глюфосинат) и отбирали трансформированный растущий каллус (Стадия 4: стадия селекции). Предпочтительно, ткани культивировали на селективной твердой среде, содержащей селективный агент (3,1 г/л соли В5, витамин В5, 1 г/л 2-(N-морфолино)этансульфоновой кислоты (MES), 30 г/л сахарозы, 1 мг/л 6-бензиладенина (6-ВАР), 8 г/л агара, 150 мг/л цефалоспорина, 100 мг/л глутаминовой кислоты, 100 мг/л аспарагиновой кислоты, 6 мг/л глюфосината, рН 5,6), в результате чего происходил избирательный рост трансформированных клеток. Затем каллус регенерировали в растения (Стадия 5: стадия регенерации). Предпочтительно, каллус культивировали на твердой среде, содержащей селективный агент (среда В5 для дифференцировки и среда В5 для корнеобразования) для регенерации растений.
Полученный устойчивый каллус переносили в указанную среду В5 для дифференцировки (3,1 г/л соли В5, витамин В5, 1 г/л 2-(N-морфолино)этансульфоновой кислоты (MES), 30 г/л сахарозы, 1 мг/л зеатина (ZT), 8 г/л агара, 150 мг/л цефалоспорина, 50 мг/л глутаминовой кислоты, 50 мг/л аспарагиновой кислоты, 1 мг/л гиббереллина, 1 мг/л ауксина, 6 мг/л глюфосината, рН 5,6) для культивирования и дифференцировки при 25°С. Дифференцированные проростки переносили в указанную среду В5 для корнеобразования (3,1 г/л соли В5, витамин В5, 1 г/л 2-(N-морфолино)этансульфоновой кислоты (MES), 30 г/л сахарозы, 8 г/л агара, 150 мг/л цефалоспорина и 1 мг/л индол-масляной кислоты (IBA)) и культивировали при 25°С до достижения высоты приблизительно 10 см. Затем проростки переносили в теплицу и культивировали в теплице до плодоношения. В теплице растения сои культивировали при 26°С в течение 16 часов и при 20°С в течение 8 часов ежедневно.
3. Валидация трансгенных растений сои методом TaqMan
В качестве образцов брали по 100 мг листьев каждого трансформированного растения сои (растение сои, трансформированное нуклеотидной последовательностью 24DT11 или контрольной нуклеотидной последовательностью, соответственно). Их геномную ДНК выделяли с использованием набора DNeasy Plant Maxi Kit (Qiagen) и определяли количество копий гена 24DT11 с использованием количественной ПЦР с флуоресцентными зондами Taqman. В качестве контроля брали растения сои дикого типа и анализировали согласно описанному выше процессу. Эксперименты проводили в трипликатах, результаты представляли собой средние значения.
Описание способа определения числа копий гена PAT
Стадия 11: Брали по 100 мг листьев каждого трансформированного растения сои (растение сои, трансформированное нуклеотидной последовательностью 24DT11 или контрольной нуклеотидной последовательностью, соответственно) и растения сои дикого типа и гомогенизировали в ступке в жидком азоте. Каждый образец исследовали в трипликатах.
Стадия 12. Выделяли геномную ДНК образцов, указанных выше, с помощью набора DNeasy Plant Mini Kit (Qiagen), следуя инструкциям, прилагаемым к набору
Стадия 13. Концентрации геномной ДНК указанных выше образцов определяли с использованием NanoDrop 2000 (Thermo Scientific).
Стадия 14. Концентрации геномной ДНК доводили до значений в диапазоне 80-100 нг/мкл.
Стадия 15. Число копий в образцах определяли с помощью количественной ПЦР с флуоресцентными зондами Taqman, образец с известным числом копий принимали за стандарт, а растение сои дикого типа принимали за контроль. Каждый образец исследовали в трипликатах, результаты представляли собой средние значения. Ниже приведены праймеры и флуоресцентные зонды, использованные в количественной ПЦР.
Для детекции нуклеотидной последовательности PAT использовали следующие праймеры и зонды:
Праймер 1: GAGGGTGTTGTGGCTGGTATTG, представленный в последовательности SEQ ID NO: 11 в Перечне последовательностей;
Праймер 2: TCTCAACTGTCCAATCGTAAGCG, представленный в последовательности SEQ ID NO: 12 в Перечне последовательностей;
Зонд 1: CTTACGCTGGGCCCTGGAAGGCTAG, представленный в последовательности SEQ ID NO: 13 в Перечне последовательностей;
Реакционная смесь для ПЦР (полимеразная цепная реакция):
Указанная 50× смесь праймеры/зонд содержала по 45 мкл каждого праймера (1 мМ), 50 мкл зонда (100 мкМ) и 860 мкл 1×ТЕ буфера и хранилась в темной пробирке при 4°С.
Условия проведения ПЦР:

Данные анализировали с использованием программного обеспечения SDS 2.3 (Applied Biosystems).
Результаты экспериментов показали, что нуклеотидная последовательность 24DT11 была интегрирована в указанные исследуемые растения сои. Кроме того, все растения сои, трансформированные нуклеотидной последовательностью 24DT11 или контрольной последовательностью, содержали одну копию гена, соответственно.
Пример 6. Эффект устойчивости к гербицидам трансгенных растений сои
Соответствующим образом анализировали устойчивость к гербицидам диметиламмониевой соли 2,4-D и агроксону у растений сои, содержащих нуклеотидную последовательность 24DT11 и контрольную последовательность, соответственно, и у растений сои дикого типа (стадии V3 - V4).
Брали растения сои, содержащие нуклеотидную последовательность 24DT11, контрольную нуклеотидную последовательность, и растения сои дикого типа и распыляли диметиламмониевую соль 2,4-D (2240 г кислотных эквивалентов/га, 4-кратная концентрация в полевых условиях), агроксон (2240 г кислотных эквивалентов/га, 4-кратная концентрация в полевых условиях) и холостой растворитель (воду). Степень повреждения каждого растения, вызванного гербицидами, оценивали по степени скручивания листьев и степени повреждения точки роста через 6 часов (6НАТ), два дня (2DAT), семь дней (7DAT) и 14 дней (14DAT) после распыления, соответственно: если листья были плоскими, как листья дикого типа, и точка роста интактная, степень повреждения равнялась 0%; если листья скручивались вверх и увядали, а точка роста отмирала, степень повреждения составляла 100%. Всего было три штамма (S1, S2 и S3), которые содержали перенесенную нуклеотидную последовательность 24DT11, два штамма (S4 и S5), которые содержали перенесенную контрольную последовательность, и один штамм дикого типа (CK1); для тестирования отобрали 10~15 растений каждого штамма. Результаты представлены в Таблице 2 и на Фиг. 5.

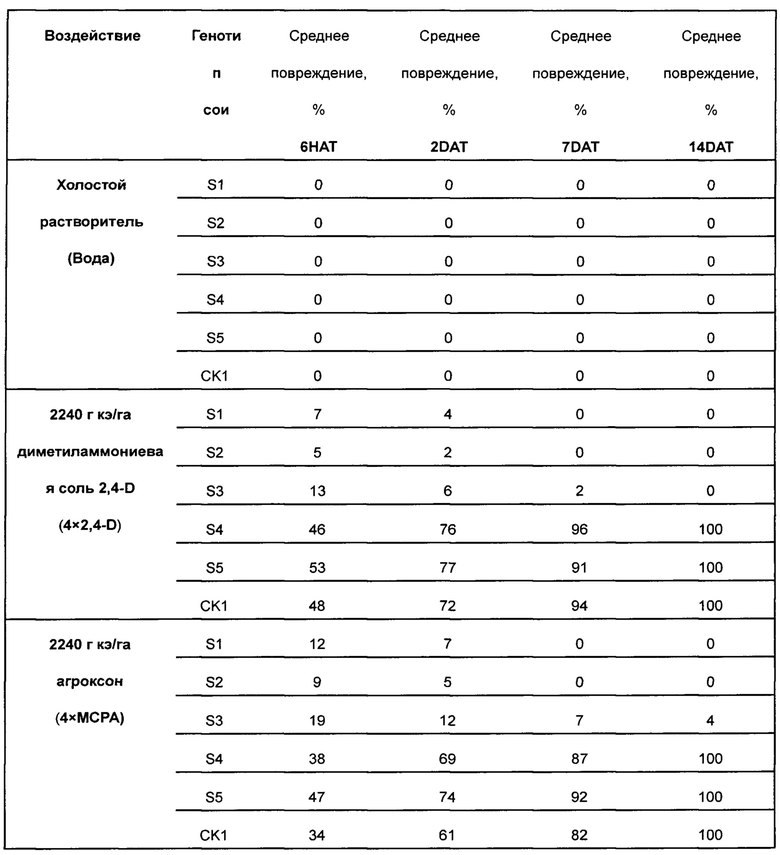
Для дифференцировки чувствительных растений сои и растений со средней устойчивостью эффективная доза 2,4-D и агроксона составляла 2240 г кислотных эквивалентов (кэ)/га. Результаты, приведенные в Таблице 2 и на Фиг.5, свидетельствуют, что ген 24DT11 обеспечивает отдельным растениям сои высокий уровень устойчивости к гербицидам, особенно к фенокси-ауксиновым гербицидам, тогда как и растения сои дикого типа, и трансформированные контрольной последовательностью растения не обладали устойчивостью к фенокси-ауксиновым гербицидам.
Пример 7. Конструирование рекомбинантного экспрессирующего вектора для кукурузы и трансформация Agrobacterium рекомбинантным экспрессирующим вектором
1. Конструирование рекомбинантного экспрессирующего вектора DBN100758 кукурузы, содержащего нуклеотидную последовательность 24DT11
Рекомбинантный клонирующий вектор DBN01-T и экспрессирующий вектор DBNBC-02 (основа вектора: рСАМВ1А2301, предоставляется институтом CAMBIA) расщепляли рестрикционными ферментами SpeI и KasI. Для конструирования рекомбинантного экспрессирующего вектора DBN100758 обработанный рестриктазами фрагмент нуклеотидной последовательности 24DT11 лигировали между рестрикционными сайтами SpeI и KasI экспрессирующего вектора DBNBC-02. Это стандартный хорошо известный способ конструирования экспрессирующего вектора с помощью расщепления рестрикционными ферментами. Рестрикционные сайты SpeI и KasI были встроены в экспрессирующий вектор DBNBC-02 с помощью стандартного способа ферментативного расщепления. Схема конструирования показана на Фиг. 6 (Kan: ген канамицина; RB: правая граница; Ubi: промотор гена убиквитина 1 кукурузы (убиквитин) (SEQ ID NO: 9); 24DT11: нуклеотидная последовательность 27DT11 (SEQ ID NO: 1); Nos: терминатор гена нопалинсинтетазы (SEQ ID NO: 4); PMI: ген фосфоманнозоизомеразы (SEQ ID NO: 10); LB: левая граница).
Рекомбинантным экспрессирующим вектором DBN100758 трансформировали компетентные клетки Е.coli Т1 методом теплового шока следующим образом: 50 мкл компетентных клеток Е.coli Т1 и 10 мкл плазмидной ДНК (рекомбинантный экспрессирующий вектор DBN100758) инкубировали на водяной бане при 42°С в течение 30 секунд. Затем клетки Е.coli культивировали со встряхиванием при 37°С в течение 1 ч (на термостатируемой качалке при вращении со скоростью 100 об./мин), а затем выращивали на чашках с LB-агаром (10 г/л триптона, 5 г/л дрожжевого экстракта, 10 г/л NaCl, 15 г/л агара с доведением рН до 7,5 с помощью NaOH), содержащим 50 мг/л канамицина (kanamycin) при 37°С в течение 12 часов. Отбирали белые колонии и культивировали в среде LB (10 г/л триптона, 5 г/л дрожжевого экстракта, 10 г/л NaCl, 50 мг/л канамицина с доведением рН до 7,5 с помощью NaOH) при 37°С в течение ночи. Выделяли из них плазмиды методом щелочного лизиса. После того, как выделенные плазмиды верифицировали с использованием рестрикционных ферментов SpeI и KasI, положительные клоны верифицировали с помощью секвенирования. Результаты показали, что указанная нуклеотидная последовательность между рестрикционными сайтами SpeI и KasI в рекомбинантном экспрессирующем векторе DBN100758 представляла собой последовательность, приведенную в SEQ ID NO: 1 в Перечне последовательностей, т.е. нуклеотидную последовательность 24DT11.
2. Конструирование рекомбинантного экспрессирующего вектора DBN100758N для кукурузы, содержащего контрольную нуклеотидную последовательность
Следуя процессу конструирования рекомбинантного клонирующего вектора DBN01-T, содержащего нуклеотидную последовательность 24DT11, описанному в части 1 Примера 2, и используя контрольную последовательность (SEQ ID NO: 8), сконструировали рекомбинантный клонирующий вектор DBN02R-T, содержащий контрольную последовательность. Положительные клоны верифицировали с помощью секвенирования. Результаты показали, что контрольная нуклеотидная последовательность, встроенная в рекомбинантный клонирующий вектор DBN02R-T, представляла собой последовательность, приведенную в SEQ ID NO: 8 в Перечне последовательностей, что свидетельствовало о том, что нуклеотидная последовательность была встроена правильно.
Следуя процессу конструирования рекомбинантного экспрессирующего вектора DBN100758, содержащего нуклеотидную последовательность 24DT11, описанному в части 1 Примера 7, и используя контрольную последовательность, сконструировали рекомбинантный экспрессирующий вектор DBN100758N, содержащий последовательность естественного происхождения, процесс конструирования показан на Фиг. 7 (остов вектора: рСАМВ1А2301, предоставляется институтом CAMBIA); Kan: ген канамицина; RB: правая граница; ZmUbil: промотор гена убиквитина 1 кукурузы (убиквитин) (SEQ ID NO: 9); mN: контрольная последовательность (SEQ ID NO: 8); Nos: терминатор гена нопалинсинтетазы (SEQ ID NO: 4); PMI: ген фосфоманнозоизомеразы (SEQ ID NO: 10); LB: левая граница). Положительные клоны верифицировали с помощью секвенирования. Результаты показали, что контрольная последовательность, встроенная в рекомбинантный экспрессирующий вектор DBN100758N, представляла собой последовательность, приведенную в SEQ ID NO: 8 в Перечне последовательностей, что свидетельствовало о том, что контрольная нуклеотидная последовательность была встроена корректно.
3. Трансформация Agrobacterium tumefaciens рекомбинантными экспрессирующими векторами для кукурузы
Правильно сконструированными рекомбинантными экспрессирующими векторами DBN100758 и DBN100758N (контрольная последовательность) трансформировали Agrobacterium LBA4404 (Invitrogen, Чикаго, США, кат. номер: 18313-015) методом быстрого замораживания в жидком азоте следующим образом: 100 мкл Agrobacterium LBA4404 и 3 мкл плазмидной ДНК (рекомбинантный экспрессирующий вектор) помещали в жидкий азот на 10 минут и затем инкубировали в водяной бане при 37°С в течение 10 минут. Затем трансформированные клетки Agrobacterium LBA4404 инокулировали в пробирки со средой LB и культивировали при 28°С, 200 об./мин в течение 2 часов и распределяли по поверхности чашки с LB-агаром, содержащим 50 мг/л рифампицина (Rifampicin) и 50 мг/л канамицина, и следили за появлением отдельных положительных колоний. Отбирали отдельные положительные колонии, культивировали и выделяли из них плазмиды. Рекомбинантный экспрессирующий вектор DBN100758 верифицировали с помощью рестрикционных ферментов SmaI и EcoRV, a DBN100758N (контрольная последовательность) верифицировали с помощью рестрикционных ферментов SmaI и BglI. Результаты показали, что рекомбинантные экспрессирующие векторы DBN100758 и DBN100758N (контрольная последовательность) имели правильную структуру.
Пример 8. Получение и верификация трансгенных растений кукурузы с встроенной нуклеотидной последовательностью 24DT11
Согласно стандартному способу трансформации с помощью Agrobacterium, кукурузу сорта Zong 31 (Z31) культивировали в стерильных условиях и молодые зародыши культивировали совместно со штаммами Agrobacterium, сконструированными в части 3 Примера 7, чтобы встроить в геном кукурузы Т-ДНК в рекомбинантных экспрессирующих векторах DBN100758 и DBN100758N (контрольная последовательность), сконструированных в частях 1 и 2 Примера 7 (включающих последовательность промотора гена убиквитина 1, нуклеотидную последовательность 24DT11, контрольную нуклеотидную последовательность, ген PMI и последовательность терминатора Nos). Получали растения кукурузы, содержащие нуклеотидную последовательность 24DT11 и контрольную нуклеотидную последовательность, соответственно, при этом растения кукурузы дикого типа использовали в качестве контроля.
Вкратце, опосредованная агробактериями трансформация кукурузы выглядела следующим образом: выделяли незрелые молодые зародыши кукурузы и приводили в контакт с суспензией агробактерий, при этом агробактерий могли доставлять нуклеотидную последовательность 24DT11 по меньшей мере в одну клетку одного молодого зародыша. (Стадия 1: стадия инфицирования). На данной стадии, предпочтительно, молодые зародыши погружали в суспензию агробактерий (OD660=0,4-0,6, среда для инфицирования (4,3 г/л соли MS, витамины MS, 300 мг/л казеина, 68,5 г/л сахарозы, 36 г/л глюкозы, 40 мг/л ацетосирингона (AS), 1 мг/л 2,4-дихлорфеноксиуксусной кислоты (2,4-D), рН 5,3)) для инициации инокуляции. Молодые зародыши и агробактерий культивировали совместно в течение определенного периода времени (3 дня) (Стадия 2: стадия совместного культивирования). Предпочтительно, после стадии инфицирования молодые зародыши культивировали на твердой среде (4,3 г/л соли MS, витамины MS, 300 мг/л казеина, 20 г/л сахарозы, 10 г/л глюкозы, 100 мг/л ацетосирингона (AS), 1 мг/л 2,4-дихлорфеноксиуксусной кислоты (2,4-D) и 8 г/л агара, рН 5,8). После этой стадии совместного культивирования можно переходить к стадии селективного «восстановления». На стадии «восстановления» среда для восстановления (4,3 г/л соли MS, витамины MS, 300 мг/л казеина, 30 г/л сахарозы, 1 мг/л 2,4-дихлорфеноксиуксусной кислоты (2,4-D) и 3 г/л Phytagel, рН 5,8) содержала по меньшей мере один вид известного антибиотика, ингибирующего агробактерий (цефалоспорин), но не содержала селективного агента для трансфицированных растений (Стадия 3: стадия восстановления). Предпочтительно, молодые зародыши культивировали на твердой культуральной среде, содержащей антибиотики без селективного агента, чтобы элиминировать Agrobacterium и обеспечить инфицированным клеткам время для восстановления. Затем инокулированные молодые зародыши культивировали на среде, содержащей селективный агент (маннозу) и отбирали трансформированный растущий каллус (Стадия 4: стадия селекции). Предпочтительно, молодые зародыши культивировали на селективной твердой среде, содержащей селективный агент (4,3 г/л соли MS, витамины MS, 300 мг/л казеина, 30 г/л сахарозы, 12,5 г/л маннозы, 1 мг/л 2,4-дихлорфеноксиуксусной кислоты (2,4-D) и 3 г/л Phytagel, рН 5,8), в результате чего происходил избирательный рост трансформированных клеток. Затем из каллуса регенерировали растения (Стадия 5: стадия регенерации). Предпочтительно, каллус культивировали на твердой среде, содержащей селективный агент (среда MS для дифференцировки и среда MS для корнеобразования) для регенерации растений.
Полученный устойчивый каллус переносили в указанную среду MS для дифференцировки (4,3 г/л соли MS, витамины MS, 300 мг/л казеина, 30 г/л сахарозы, 2 мг/л 6-бензиладенина, 5 г/л маннозы и 3 г/л Phytagel, рН 5,8) и культивировали и дифференцировали при 25°С. Дифференцированные проростки переносили в указанную среду MS для корнеобразования (2,15 г/л соли MS, витамины MS, 300 мг/л казеина, 30 г/л сахарозы, 1 мг/л индол-3-уксусной кислоты и 3 г/л Phytagel, рН 5,8)) и культивировали при 25°С до достижения высоты приблизительно 10 см. Затем проростки переносили в теплицу и культивировали в теплице до плодоношения. В теплице растения кукурузы культивировали при 28°С в течение 16 часов и при 20°С в течение 8 часов ежедневно.
2. Верификация встраивания гена 24DT11 в трансгенных растениях кукурузы с помощью методики TaqMan
В качестве образцов брали по 100 мг листьев каждого трансформированного растения кукурузы (растение кукурузы, трансформированное нуклеотидной последовательностью 24DT11 или контрольной нуклеотидной последовательностью, соответственно). Их геномную ДНК выделяли с использованием набора DNeasy Plant Maxi Kit (Qiagen) и определяли число копий гена PMI с использованием количественной ПЦР с флуоресцентными зондами Taqman для определения числа копий 24DT11. В качестве контроля брали растения кукурузы дикого типа и анализировали согласно описанному выше процессу. Эксперименты проводили в трипликатах, результаты представляли собой средние значения.
Описание способа определения числа копий гена PMI
Стадия 31: Брали по 100 мг листьев каждого трансформированного растения кукурузы (растение кукурузы, трансформированное нуклеотидной последовательностью 24DT11 или контрольной нуклеотидной последовательностью, соответственно) или растения кукурузы дикого типа и гомогенизировали в ступке в жидком азоте. Каждый образец исследовали в трипликатах.
Стадия 32. Выделяли геномную ДНК образцов, указанных выше, с помощью набора DNeasy Plant Mini Kit (Qiagen), следуя инструкциям, прилагаемым к набору.
Стадия 33. Концентрацию геномной ДНК указанных выше образцов определяли с использованием NanoDrop 2000 (Thermo Scientific).
Стадия 34. Концентрацию геномной ДНК доводили до значений в диапазоне 80-100 нг/мкл.
Стадия 35. Число копий в образцах определяли с помощью количественной ПЦР с флуоресцентными зондами Taqman, образец с известным числом копий принимали за стандарт, а растение кукурузы дикого типа принимали за контроль. Каждый образец исследовали в трипликатах, результаты представляли собой средние значения. Ниже приведены праймеры и зонды, использованные в количественной ПЦР.
Для детекции нуклеотидной последовательности PMI использовали следующие праймеры и зонды:
Праймер 3: GCTGTAAGAGCTTACTGAAAAAATTAACA, представленный в последовательности SEQ ID NO: 14 в Перечне последовательностей;
Праймер 4: CGATCTGCAGGTCGACGG, представленный в последовательности SEQ ID NO: 15 в Перечне последовательностей;
Зонд 2: TCTCTTGCTAAGCTGGGAGCTCGATCC, представленный в последовательности SEQ ID NO: 16 в Перечне последовательностей;
Реакционная смесь для ПЦР:
50× смесь праймеры/зонд содержала по 45 мкл каждого праймера (1 мМ), 50 мкл зонда (100 мкМ) и 860 мкл 1×ТЕ буфера и хранилась в темной пробирке при 4°С.
Условия проведения ПЦР:

Данные анализировали с использованием программного обеспечения SDS2.3 (Applied Biosystems).
Результаты экспериментов показали, что нуклеотидная последовательность 24DT11 и контрольная нуклеотидная последовательность, соответственно, были интегрированы в геном исследуемых растений кукурузы. Кроме того, все растения кукурузы, трансформированные нуклеотидной последовательностью 24DT11 и контрольной нуклеотидной последовательностью, содержали одну копию гена 24DT11. Пример 9. Анализ устойчивости к гербицидам трансгенных растений кукурузы
Соответствующим образом анализировали устойчивость растений кукурузы, содержащих нуклеотидную последовательность 24DT11 и контрольную последовательность, соответственно, и у растений кукурузы дикого типа (стадии V3 - V4) к гербицидам диметиламмониевой соли 2,4-D и агроксону.
Брали растения кукурузы, содержащие нуклеотидную последовательность 24DT11, контрольную нуклеотидную последовательность, соответственно, и растения кукурузы дикого типа и распыляли на них диметиламмониевую соль 2,4-D (8960 г кислотных эквивалентов/га, 16-кратная концентрация в полевых условиях), агроксон (8960 г кислотных эквивалентов/га, 16-кратная концентрация в полевых условиях) и холостой растворитель (воду), соответственно. Через 21 день после распыления оценивали развитие опорного корня. Отбирали три штамма растений кукурузы (S6, S7 и S8), трансформированные нуклеотидной последовательностью 24DT11, два штамма растений кукурузы (S9 и S10), трансформированные контрольной нуклеотидной последовательностью, и 1 штамм кукурузы дикого типа (CK2) и тестировали 10-15 растений каждого штамма. Результаты показаны в Таблице 3.
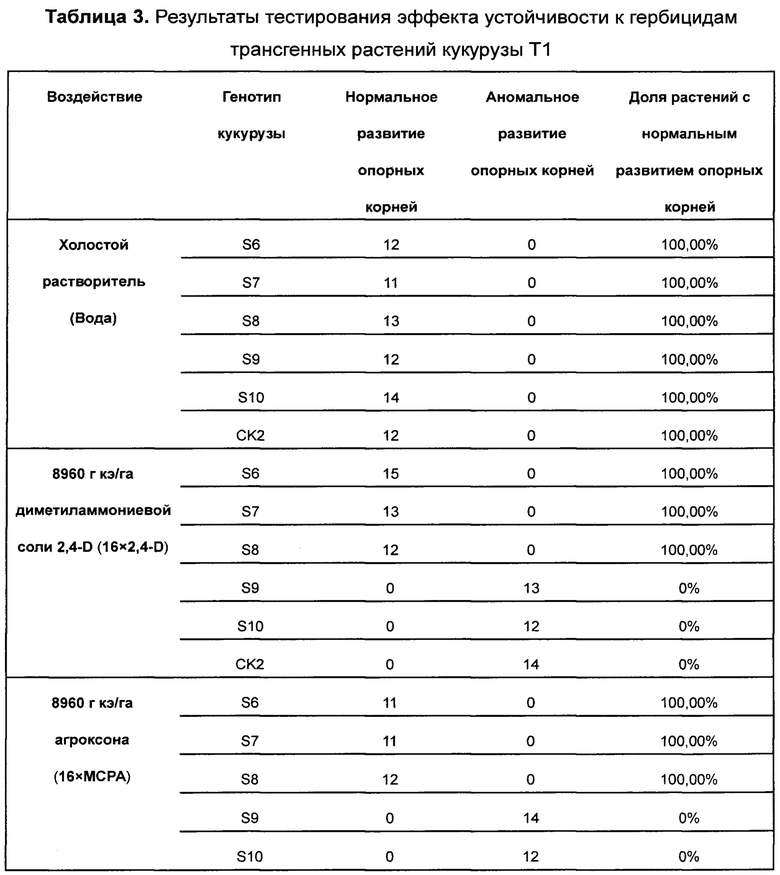

Результаты в Таблице 3 свидетельствуют, что ген 24DT11 придавал трансгенным растениям кукурузы высокую устойчивость к гербицидам, особенно к фенокси-ауксиновым гербицидам (поскольку однодольным растениям присуща некоторая устойчивость к фенокси-ауксиновым гербицидам, наблюдался высокий уровень устойчивости); при этом ни одно из растений кукурузы дикого типа и растений кукурузы, трансформированных контрольными последовательностями, не демонстрировал высокого уровня устойчивости к гербицидам.
Таким образом, растения кукурузы, сои и Arabidopsis thaliana, трансформированные нуклеотидной последовательностью 24DT11, обладали высокой устойчивостью к гербицидам. В гене устойчивости к гербицидам 24DT11 в данном изобретении использовали кодоны, предпочтительно используемые растениями, в результате ген устойчивости к гербицидам по данному изобретению подходит для экспрессии в растениях. Белок устойчивости к гербицидам 24DT11 по данному изобретению обеспечивает устойчивость к широкому спектру гербицидов, особенно к фенокси-ауксиновым гербицидам.
Наконец, следует отметить, что приведенные выше примеры всего лишь иллюстрируют технические решения, предложенные в данном изобретении, но не ограничивают объем изобретения. Несмотря на то, что данное изобретение было подробно описано и проиллюстрировано предпочтительными примерами, специалисту в данной области техники очевидно, что возможны различные модификации или эквивалентные варианты технических решений, не выходящие за пределы существа и объема данного изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| Белок устойчивости к гербицидам, кодирующие его гены и их применение | 2016 |
|
RU2681162C1 |
| ПОЛИНУКЛЕОТИД И СПОСОБ БОРЬБЫ С НАШЕСТВИЕМ НАСЕКОМЫХ | 2019 |
|
RU2781829C2 |
| ПОЛИНУКЛЕОТИД И СПОСОБ, ИСПОЛЬЗУЕМЫЙ ДЛЯ ОСУЩЕСТВЛЕНИЯ КОНТРОЛЯ НАД НАШЕСТВИЕМ НАСЕКОМЫХ | 2019 |
|
RU2775717C1 |
| ПОЛИНУКЛЕОТИД И СПОСОБ ДЛЯ ОСУЩЕСТВЛЕНИЯ КОНТРОЛЯ НАД ПОРАЖЕНИЕМ НАСЕКОМЫМИ | 2019 |
|
RU2775943C1 |
| РАСТЕНИЕ КУКУРУЗЫ DBN9858, УСТОЙЧИВОЕ К ГЕРБИЦИДУ, И НУКЛЕОТИДНАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ И СПОСОБ ДЛЯ ЕЕ ВЫЯВЛЕНИЯ | 2016 |
|
RU2712730C2 |
| ПОСЛЕДОВАТЕЛЬНОСТЬ НУКЛЕИНОВОЙ КИСЛОТЫ ДЛЯ ВЫЯВЛЕНИЯ РАСТЕНИЯ КУКУРУЗЫ DBN9501 И СПОСОБ ЕГО ВЫЯВЛЕНИЯ | 2020 |
|
RU2815214C2 |
| ПОСЛЕДОВАТЕЛЬНОСТЬ НУКЛЕИНОВОЙ КИСЛОТЫ ДЛЯ ВЫЯВЛЕНИЯ РАСТЕНИЯ СОИ DBN8002 И СПОСОБ ЕЕ ВЫЯВЛЕНИЯ | 2019 |
|
RU2818368C2 |
| СПОСОБЫ ПОВЫШЕНИЯ УРОЖАЙНОСТИ РЕЗИСТЕНТНЫХ К 2,4-D СЕЛЬСКОХОЗЯЙСТВЕННЫХ КУЛЬТУР | 2013 |
|
RU2628504C2 |
| РАСТЕНИЕ МАИСА DBN9936 И СПОСОБ ПРИМЕНЕНИЯ В ДЕТЕКТИРОВАНИИ ЕГО ПОСЛЕДОВАТЕЛЬНОСТИ НУКЛЕИНОВОЙ КИСЛОТЫ | 2016 |
|
RU2707527C2 |
| НОВЫЙ КЛАСС ГЕНОВ УСТОЙЧИВОСТИ К ГЛИФОСАТУ | 2013 |
|
RU2634411C2 |






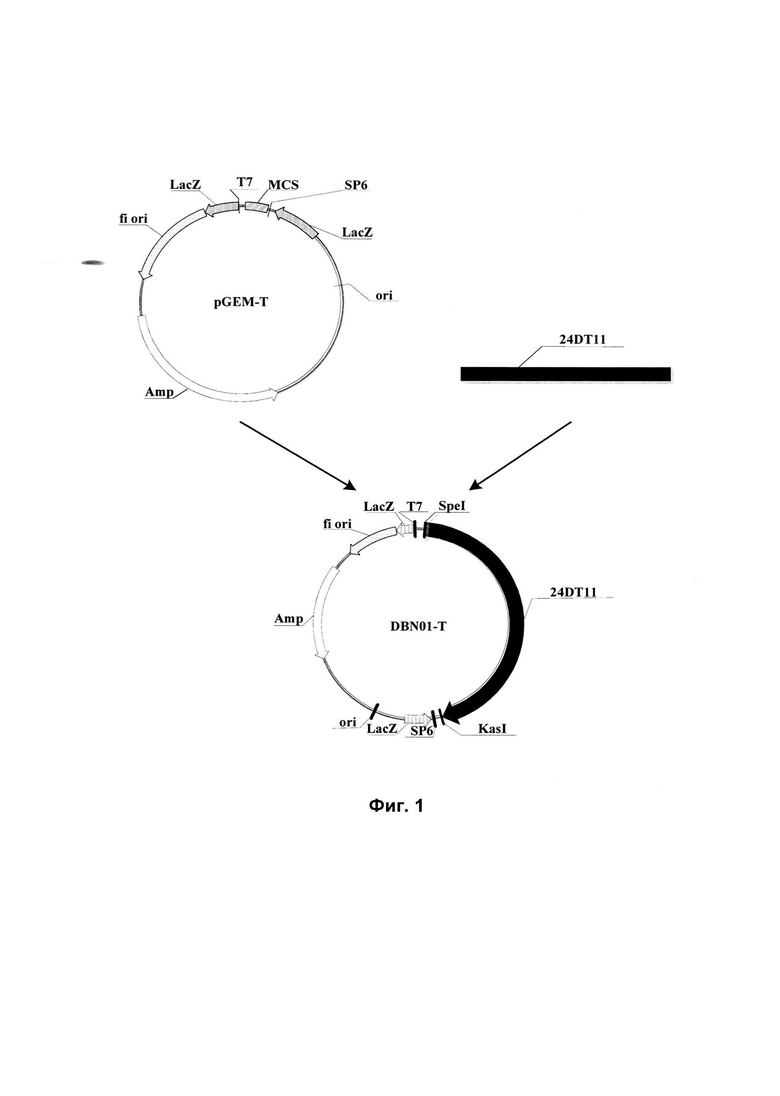
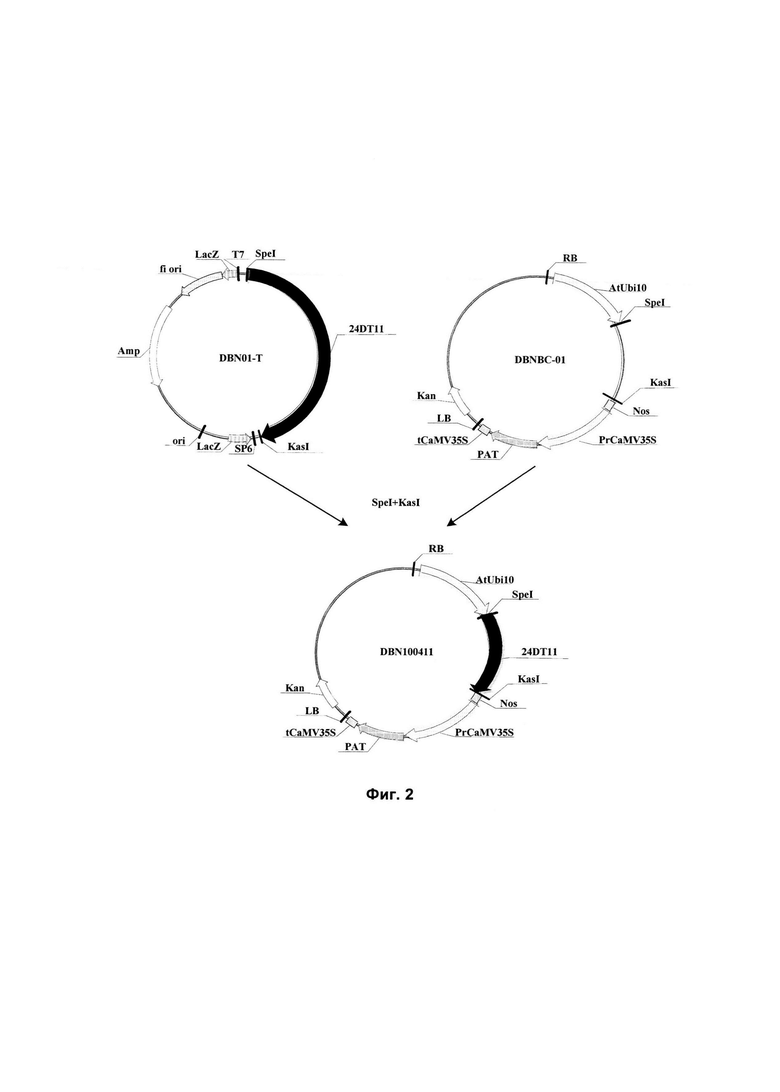
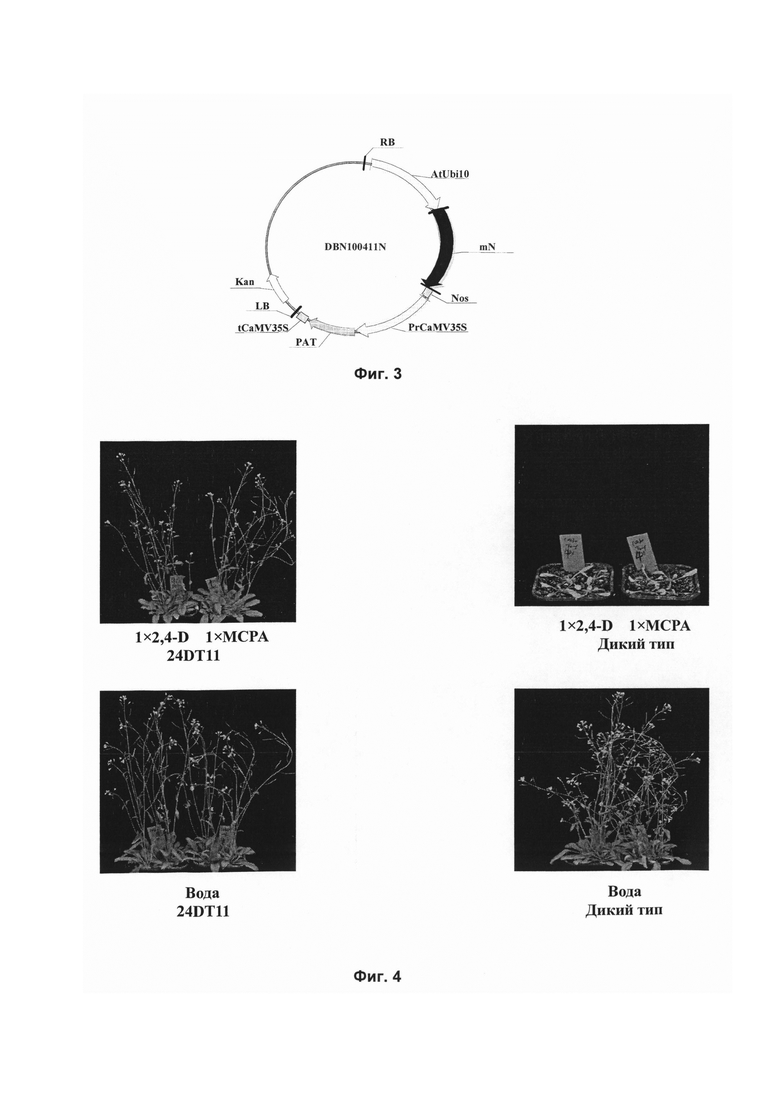

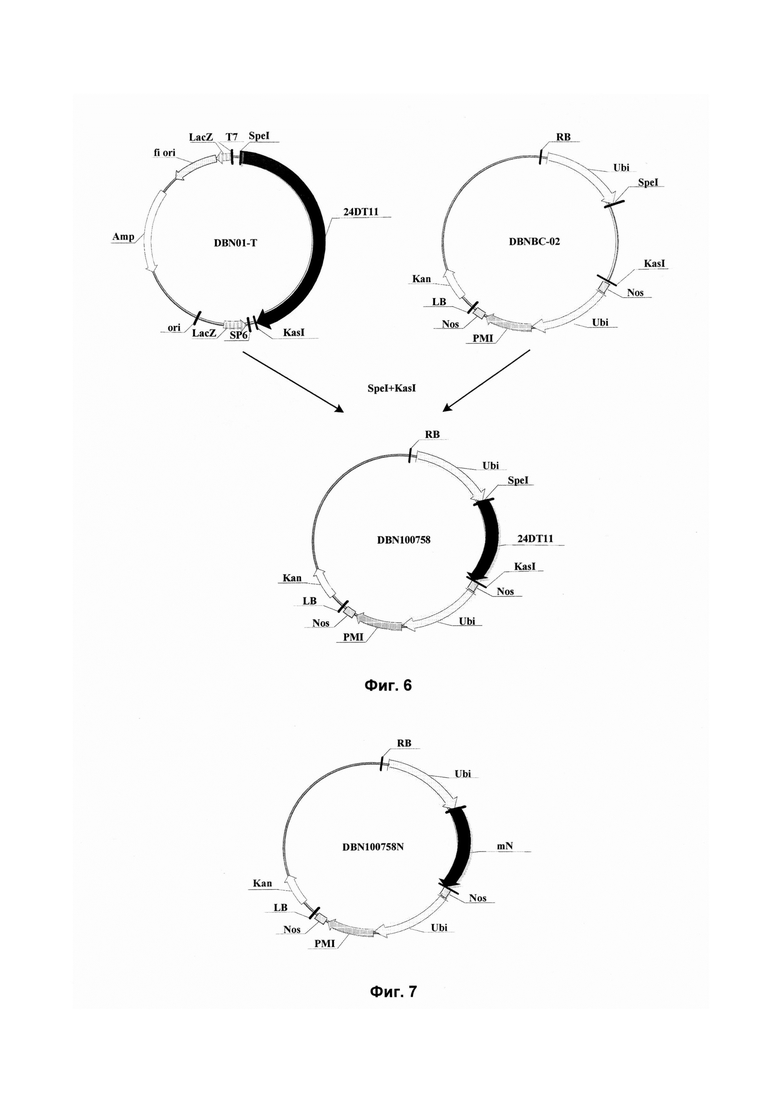
Группа изобретений относится к области биотехнологии. Предложен способ продуцирования белка устойчивости к гербицидам, включающий получение и культивирование клеток трансгенного организма-хозяина, содержащих ген устойчивости к гербицидам с нуклеотидной последовательностью SEQ ID NO: 1, или экспрессионную кассету, содержащую регуляторную последовательность и указанный ген устойчивости к гербицидам, и выделение указанного белка устойчивости к гербицидам. Предложен способ расширения целевого спектра гербицидов, включающий совместную экспрессию в растении белка устойчивости к гербицидам с последовательностью SEQ ID NO: 2, с по меньшей мере второй нуклеотидной последовательностью, кодирующей белок, отличающийся от указанного белка устойчивости к гербицидам, где указанная вторая нуклеотидная последовательность кодирует белок устойчивости к глифосату, белок устойчивости к глюфосинату аммония, диоксигеназу 4- гидроксифенилпировиноградной кислоты, ацетолактатсинтазу, белок цитохрома или протопорфириногеноксидазу. Предложен способ отбора трансформированных растительных клеток с использованием нуклеотидной последовательности, кодирующей белок устойчивости к гербицидам с последовательностью SEQ ID NO: 2. Предложен способ контроля сорняков, включающий стадию внесения эффективного количества одного или более гербицидов на поле, на котором выращивают растения, содержащие нуклеотидную последовательность, кодирующую белок устойчивости к гербицидам с последовательностью SEQ ID NO: 2, где гербицид представляет собой фенокси-ауксин. Предложен способ защиты растений от повреждения, вызываемого гербицидами, путем введения в растения нуклеотидной последовательности, кодирующей белок устойчивости к гербицидам с последовательностью SEQ ID NO: 2, где гербицид представляет собой фенокси-ауксин. Предложен способ контроля устойчивых к глифосату сорняков на поле, на котором выращивают устойчивые к глифосату растения, путем внесения эффективного количества одного или более гербицидов на указанное поле, где указанные устойчивые к глифосату растения содержат нуклеотидную последовательность, кодирующую белок устойчивости к гербицидам с последовательностью SEQ ID NO: 2. Предложен способ придания сельскохозяйственным культурам устойчивости к гербициду 2,4-D (2,4-дихлорфеноксиуксусная кислота) путем введения в указанные сельскохозяйственные культуры нуклеотидной последовательности, кодирующей белок устойчивости к гербицидам с последовательностью SEQ ID NO: 2. Предложено применение белка устойчивости к гербицидам с последовательностью SEQ ID NO: 2, обеспечивающего устойчивость к фенокси-ауксиновым гербицидам, для защиты растений от повреждения, вызываемого фенокси-ауксиновыми гербицидами. Группа изобретений обеспечивает устойчивость растений к широкому спектру гербицидов, особенно к фенокси-ауксиновым гербицидам. 8 н. и 7 з.п. ф-лы, 7 ил., 3 табл., 9 пр.
1. Способ продуцирования белка устойчивости к гербицидам, включающий следующие стадии:
получение клеток трансгенного организма-хозяина, содержащих ген устойчивости к гербицидам, состоящий из нуклеотидной последовательности, приведенной в SEQ ID NO: 1, или экспрессионную кассету, содержащую регуляторную последовательность и указанный ген устойчивости к гербицидам, состоящий из нуклеотидной последовательности, приведенной в SEQ ID NO: 1;
культивирование клеток трансгенного организма-хозяина в условиях, обеспечивающих продуцирование белка устойчивости к гербицидам;
выделение указанного белка устойчивости к гербицидам; где указанный трансгенный организм-хозяин исключает людей.
2. Способ по п. 1, отличающийся тем, что трансгенный организм-хозяин включает растения, животных, бактерии, дрожжи, бакуловирус, нематоду или водоросли.
3. Способ по п. 2, отличающийся тем, что растение выбрано из группы, состоящей из сои, хлопка, кукурузы, риса, пшеницы, свеклы или сахарного тростника.
4. Способ расширения целевого спектра гербицидов, включающий совместную экспрессию в растении белка устойчивости к гербицидам, состоящего из аминокислотной последовательности SEQ ID NO: 2, с по меньшей мере второй нуклеотидной последовательностью, кодирующей белок, отличающийся от белка устойчивости к гербицидам, состоящего из аминокислотной последовательности SEQ ID NO: 2, где указанная вторая нуклеотидная последовательность кодирует белок устойчивости к глифосату, белок устойчивости к глюфосинату аммония, диоксигеназу 4- гидроксифенилпировиноградной кислоты, ацетолактатсинтазу, белок цитохрома или протопорфириногеноксидазу.
5. Способ отбора трансформированных растительных клеток, включающий стадии трансформирования совокупности растительных клеток нуклеотидной последовательностью, кодирующей белок устойчивости к гербицидам, состоящий из аминокислотной последовательности SEQ ID NO: 2, и культивирования указанных клеток при концентрации гербицида, позволяющей расти трансформированным клеткам, экспрессирующим указанную нуклеотидную последовательность, кодирующую указанный белок устойчивости к гербицидам, но вызывающей гибель нетрансформированных клеток или ингибирующей рост нетрансформированных клеток, где гербицид представляет собой фенокси-ауксин.
6. Способ контроля сорняков, включающий стадию внесения эффективного количества одного или более гербицидов на поле, на котором выращивают растения, содержащие нуклеотидную последовательность, кодирующую белок устойчивости к гербицидам, состоящий из аминокислотной последовательности SEQ ID NO: 2, где гербицид представляет собой фенокси-ауксин.
7. Способ защиты растений от повреждения, вызываемого гербицидами, включающий стадию введения в растения нуклеотидной последовательности, кодирующей белок устойчивости к гербицидам, состоящий из аминокислотной последовательности SEQ ID NO: 2, так, чтобы обеспечить продуцирование полученными растениями указанного белка устойчивости к гербицидам в количестве, достаточном для их защиты от повреждения, вызываемого гербицидами, где гербицид представляет собой фенокси-ауксин.
8. Способ по п. 7, отличающийся тем, что указанное растение выбрано из группы, состоящей из сои, хлопка, кукурузы, риса, пшеницы, свеклы или сахарного тростника.
9. Способ контроля устойчивых к глифосату сорняков на поле, на котором выращивают устойчивые к глифосату растения, включающий стадию внесения эффективного количества одного или более гербицидов на поле, на котором выращивают устойчивые к глифосату растения, где указанные устойчивые к глифосату растения содержат нуклеотидную последовательность, кодирующую белок устойчивости к гербицидам, состоящий из аминокислотной последовательности SEQ ID NO: 2.
10. Способ по п. 9, отличающийся тем, что указанный гербицид по меньшей мере содержит фенокси-ауксин и глифосат.
11. Способ по п. 9 или 10, отличающийся тем, что указанные устойчивые к глифосату растения являются однодольными или двудольными.
12. Способ придания сельскохозяйственным культурам устойчивости к гербициду 2,4-D (2,4-дихлорфеноксиуксусная кислота), включающий стадию введения в указанные сельскохозяйственные культуры нуклеотидной последовательности, кодирующей белок устойчивости к гербицидам, состоящий из аминокислотной последовательности SEQ ID NO: 2.
13. Способ по п. 12, отличающийся тем, что указанная сельскохозяйственная культура выбрана из группы, состоящей из сои, хлопка, кукурузы, риса, пшеницы, свеклы и сахарного тростника.
14. Применение белка устойчивости к гербицидам, обеспечивающего устойчивость к фенокси-ауксиновым гербицидам, отличающееся тем, что указанный белок устойчивости к гербицидам состоит из аминокислотной последовательности, представленной в SEQ ID NO: 2, где указанное применение используют для защиты растений от повреждения, вызываемого фенокси-ауксиновыми гербицидами.
15. Применение по п. 14, отличающееся тем, что указанное применение для защиты растений от повреждения, вызываемого гербицидами, включает способ по п. 7 или 8.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| PBC]", NCBI Reference Sequence: WP_009515748.1, 01.08.2013; Найдено в Интернет по адресу: www.ncbi.nlm.nih.gov/protein/497201486?sat=46&satkey=81057263; | |||
| CN 103013938 A, 03.04.2013 | |||
| ГЕНЫ GRG23 И GRG51, ПРИДАЮЩИЕ УСТОЙЧИВОСТЬ К ГЕРБИЦИДАМ | 2006 |
|
RU2393225C2 |
| Приспособление для изготовления армированных стекол | 1927 |
|
SU17638A1 |
Авторы
Даты
2019-06-25—Публикация
2016-02-02—Подача