Ссылка на родственные заявки
По настоящей невременной заявке, поданной согласно 37 CFR § 1.53(b), испрашивается приоритет, согласно 35 USC § 119(e), временной заявки на патент США, серийный № 61/352728, поданной 8 июня 2010 года, которая приведена в настоящем описании в качестве ссылки в полном объеме.
Область техники, к которой относится изобретение
Настоящее изобретение в целом относится к антителам, полученным с помощью генной инженерии, с реакционноспособными цистеиновыми остатками, и, более конкретно, к антителам с терапевтическими или диагностическими применениями. Полученные с помощью генной инженерии антитела с цистеиновыми заменами могут быть конъюгированы с химиотерапевтическими лекарственными средствами, токсинами, аффинными лигандами, такими как биотин, и с метками для обнаружения, такими как флуорофоры. Настоящее изобретение также относится к способам использования антител и соединений конъюгатов антитело-лекарственное средство для диагностики или лечения in vitro, in situ и in vivo клеток млекопитающих или связанных с ними патологических состояний.
Уровень техники
Конъюгаты антитело-лекарственное средство (ADC) являются привлекательными химиотерапевтическими молекулами направленного действия, поскольку они объединяют идеальные свойства, как антител, так и цитотоксических лекарственных средств посредством нацеливания сильнодействующих цитотоксических лекарственных средств на антиген-экспрессирующие опухолевые клетки, тем самым повышая их антиопухолевую активность. Успешная разработка ADC для такого мишеневого антигена зависит от оптимизации выбора антитела, от стабильности линкера, от сильнодействия цитотоксического лекарственного средства и от способа конъюгирования линкера-лекарственного средства с антителом.
Обычные средства присоединения, то есть связывания с помощью ковалентных связей, остатка лекарственного средства с антителом, как правило, приводят к получению гетерогенной смеси молекул, где молекулы остатков лекарственных средств присоединены с помощью ряда активных сайтов на антителе. Например, цитотоксические лекарственные средства, как правило, конъюгируют с антителами посредством часто встречающихся многочисленных лизиновых остатков антитела, с получением гетерогенной смеси конъюгата антитело-лекарственное средство. В зависимости от условий реакции, гетерогенная смесь, как правило, содержит распределение антител с 0 до примерно 8 или более присоединенными остатками лекарственных средств. В дополнение к этому, в каждой подгруппе конъюгатов с конкретным целочисленным отношением остатков лекарственных средств к антителу имеется потенциально гетерогенная смесь, где остатки лекарственного средства присоединены на различных активных сайтах на антителе. Аналитические и препаративные способы являются неадекватными при разделении и характеризации молекул различных видов конъюгатов антитело-лекарственное средство в гетерогенной смеси, образующейся в результате реакции конъюгирования. Антитела представляют собой большие, сложные и структурно разнообразные биологические молекулы, часто имеющие множество реакционноспособных функциональных групп. Их реакционноспособность по отношению к линкерным реагентам и к промежуточным соединениям лекарственное средство-линкер зависит от таких факторов, как pH, концентрация, концентрация соли и сорастворители. Кроме того, многостадийный способ конъюгирования может быть невоспроизводимым из-за сложностей с контролем условий реакции и характеризацией реагентов и промежуточных соединений.
Тиольные группы цистеиновых остатков являются реакционноспособными при нейтральных значениях pH, в отличие от большинства аминов, которые являются протонированными и менее нуклеофильными вблизи pH 7. Поскольку свободные тиольные группы (RSH, сульфогидрил) являются относительно реакционноспособными, белки с цистеиновыми остатками часто существуют в их окисленной форме как дисульфид-связанные олигомеры или имеют внутренние мостиковые дисульфидные группы. Тиольные группы цистеиновых остатков антитела, как правило, являются более реакционноспособными, то есть более нуклеофильными по отношению к электрофильным реагентам конъюгирования, чем аминовые или гидроксильные группы антитела. Генная инженерия тиольных групп цистеиновых остатков посредством мутации различных аминокислотных остатков белка до цистеиновых аминокислот является потенциально проблематичной, особенно, в случае непарных (со свободными Cys) остатков или остатков, которые являются относительно доступными для взаимодействия или окисления. В концентрированных растворах белка, либо в периплазме E. coli, либо в супернатантах культур, либо для частично или полностью очищенного белка, непарные Cys остатки на поверхности белка могут спариваться и окисляться с образованием внутримолекулярных дисульфидов, и, следовательно, димеров или мультимеров белка. Образование дисульфидных димеров делает новые Cys остатки химически неактивными при конъюгировании с лекарственным средством, лигандом или другой меткой. Кроме того, если белок оксидативно образует внутримолекулярную дисульфидную связь между вновь полученным с помощью генной инженерии Cys остатком и существующим Cys остатком, обе Cys группы становятся недоступными для присутствия на активном сайте и для взаимодействий. Кроме того, белок может стать неактивным или неспецифичным, из-за потери укладки или потери третичной структуры (Zhang et al (2002) Anal. Biochem. 311:1-9).
Антитела с цистеиновыми заменами (ThioMab) на активных сайтах, где полученные с помощью генной инженерии цистеиновые остатки являются доступными для конъюгирования, но не изменяют складчатую структуру и сборку иммуноглобулинов или не изменяют связывание с антигенами и эффекторные функции (Junutula, et al., 2008b Nature Biotech., 26(8):925-932; Dornan et al (2009) Blood 114(13):2721-2729; патент США № 7521541; патент США № 7723485; WO2009/052249). Затем эти ThioMab могут быть конъюгированы с цитотоксическими лекарственными средствами посредством полученных с помощью генной инженерии тиольных групп цистеиновых остатков с получением конъюгатов ThioMab-лекарственное средство (TDC) с однородной стехиометрией (~2 остатка лекарственного средства на антитело). Исследования с множеством антител против различных антигенов показали, что TDC являются такими же эффективными как обычные ADC на моделях с привитыми опухолями и переносятся при более высоких дозах на релевантных предклинических моделях. Конъюгаты ThioMab - лекарственное средство получают с помощью генной инженерии с присоединением лекарственных средств в различных частях антитела (легкая цепь-Fab, тяжелая цепь-Fab и тяжелая цепь-Fc). Стабильность in vitro и in vivo, эффективность и PK (фармакокинетические) свойства TDC обеспечивают уникальное преимущество по сравнению с обычными ADC благодаря их гомогенности и сайт-специфичному конъюгированию с цитотоксическими лекарственными средствами.
Сущность изобретения
Настоящее изобретение относится к выделенному, полученному с помощью генной инженерии антителу с цистеиновыми заменами, содержащему свободную цистеиновую аминокислоту в тяжелой цепи или легкой цепи.
В одном из аспектов настоящее изобретение относится к способу получения выделенного, полученного с помощью генной инженерии антитела с цистеиновыми заменами посредством мутагенеза последовательности нуклеиновых кислот исходного антитела посредством замены одного или несколько аминокислотных остатков цистеином с целью кодирования полученного с помощью генной инженерии антитела с цистеиновыми заменами; экспрессирование полученного с помощью генной инженерии антитела с цистеиновыми заменами и изолирование полученного с помощью генной инженерии антитела с цистеиновыми заменами.
В другом аспекте настоящее изобретение относится к конъюгату выделенного, полученного с помощью генной инженерии антитела с цистеиновыми заменами, где антитело является ковалентно связанным с меткой для захвата, с меткой для обнаружения, к остатку лекарственного средства или к твердой подложке.
Краткое описание чертежей
На фигуре 1A показано трехмерное представление фрагмента антитела hu4D5Fabv7, полученное с помощью рентгеновских изображений координат центров атомов в элементарной ячейке кристалла. Положения структуры иллюстративных полученных с помощью генной инженерии Cys остатков тяжелых и легких цепей пронумерованы (в соответствии с системой последовательной нумерации).
На фигуре 1B показана схема последовательной нумерации (верхняя строка), начиная с N-конца в сравнении со схемой нумерации Kabat (нижняя строка) для 4D5v7fabH. Вставки с нумерацией Kabat отмечены как a,b,c.
На фигурах 2A и 2B показаны измерения связывания с детектированием коэффициента поглощения на 450 нм для Cys мутантных (ThioFab) вариантов фаг-hu4D5Fabv8 и -hu4D5Fabv8: (A) не-биотинилированный фаг-hu4D5Fabv8 и (B) биотинилированный фаг-hu4D5Fabv8, с помощью анализа PHESELECTOR для взаимодействия с BSA (белые столбики), HER2 (заштрихованные столбики) или стрептавидином (черные столбики).
На фигурах 3A и 3B показано измерения связывания с детектированием коэффициента поглощения на 450 нм Cys мутантных вариантов hu4D5Fabv8 (слева) и hu4D5Fabv8 (ThioFab): (A) не-биотинилированный фаг-hu4D5Fabv8 и (B) биотинилированный фаг-hu4D5Fabv8, с помощью анализа PHESELECTOR для взаимодействия с: BSA (белые столбики), HER2 (заштрихованные столбики) и стрептавидином (черные столбики). Варианты легких цепей находятся на левой стороне и варианты тяжелых цепей находятся на правой стороне. Реакционноспособность тиола = OD450нм для связывания стрептавидина ÷ OD450нм для связывания HER2 (антитело)(OD-оптическая плотность).
На фигуре 4A показаны значения доли доступной поверхности остатков на hu4D5Fabv8 дикого типа. Активные сайты на легкой цепи находятся на левой стороне, а активные сайты на тяжелой цепи находятся на правой стороне.
На фигуре 4B показаны измерения связывания с детектированием коэффициента поглощения на 450 нм биотинилированных Cys мутантных вариантов hu4D5Fabv8 (слева) и hu4D5Fabv8 (ThioFab) для взаимодействия с HER2 (день 2), стрептавидином (SA) (день 2), HER2 (день 4) и SA (день 4). Cys варианты фаг-hu4D5Fabv8 изолируют и хранят при 4°C. Конъюгирование с биотином осуществляют либо в день 2, либо в день 4, после анализов PHESELECTOR для отслеживания их взаимодействия с Her2 и стрептавидином, как описано в Примере 2, и зондирования стабильности реакционноспособных тиольных групп на полученных с помощью генной инженерии вариантах ThioFab.
На фигуре 5 показаны измерения связывания с детектированием коэффициента поглощения на 450 нм для конъюгированного с биотином-малеимидом hu4D5Fabv8 (A121C) и для небиотинилированного hu4D5Fabv8 дикого типа при связывании со стрептавидином и HER2. Каждый Fab исследуют при концентрации 2 нг и 20 нг.
На фигуре 6 показан анализ ELISA с детектированием коэффициента поглощения на 450 нм для биотинилированного ABP-hu4D5Fabv8 дикого типа (wt) и для мутантов с цистеиновыми заменами ABP-hu4D5Fabv8 V110C и A121C для связывания с альбумином кролика, стрептавидином (SA) и HER2.
На фигуре 7 показан анализ ELISA с детектированием коэффициента поглощения на 450 нм на биотинилированных мутантах с цистеиновыми заменами ABP-hu4D5Fabv8 (вариантов ThioFab): (слева направо) одинарные Cys варианты ABP-V110C, ABP-A121C и двойные Cys варианты ABP-V110C-A88C и ABP-V110C-A121C для связывания с альбумином кролика, HER2 и стрептавидином (SA), и зондирование с помощью Fab-HRP или SA-HRP.
На фигуре 8 показано связывание биотинилированного фага ThioFab и антитела против фагового HRP с HER2 (вверху) и стрептавидином (внизу).
На фигуре 9A показано схематическое изображение связывания биотинилированного антитела с иммобилизованным HER2 со связыванием с меченным HRP вторичным антителом для детектирования поглощения.
На фигуре 9B показаны измерения связывания с детектированием коэффициента поглощения на 450 нм вариантов тио-трастузумаба, конъюгированного с биотином-малеимидом, и небиотинилированного трастузумаба дикого типа со связыванием с иммобилизованным HER2. Слева направо: V110C (одинарный Cys), A121C (одинарный Cys), V110C/A121C (двойной Cys) и трастузумаб. Каждый вариант тио-IgG и трастузумаба исследуют при 1, 10 и 100 нг.
На фигуре 10A показано схематическое изображение связывания биотинилированного антитела с иммобилизованным HER2 со связыванием биотина с анти-IgG-HRP для детектирования поглощения.
На фигуре 10B показаны измерения связывания с детектированием коэффициента поглощения на 450 нм вариантов тио-трастузумаба, конъюгированного с биотином-малеимидом, и небиотинилированного трастузумаба дикого типа со связыванием с иммобилизованным стрептавидином. Слева направо: V110C (одинарный Cys), A121C (одинарный Cys), V110C/A121C (двойной Cys) и трастузумаб. Каждый вариант тио-IgG и трастузумаб исследуют при 1, 10 и 100 нг.
На фигуре 11 показан общий способ получения антитела, полученного с помощью генной инженерии, с цистеиновыми заменами (ThioMab), экспрессируемого из культуры клеток, для конъюгирования.
Подробное описание иллюстративных вариантов осуществления
Далее приведено подробное описание вариантов осуществления настоящего изобретения, примеры которых иллюстрируются в прилагаемых структурах и формулах. Хотя настоящее изобретение будет описано в сочетании с перечисленными вариантами осуществления, понятно, что они не предназначены для ограничения настоящего изобретения этими вариантами осуществления. Наоборот, настоящее изобретение, как предполагается, включает все альтернативы, модификации и эквиваленты, которые могут быть включены в рамки настоящего изобретения, как определяется формулой изобретения.
Специалисту в данной области известно множество способов и материалов, подобных тем, которые описаны в настоящем документе, или эквивалентных им, которые могут использоваться при осуществлении настоящего изобретения. Настоящее изобретение ни в коем случае не ограничивается описанными способами и материалами.
Если не определено иного, технические и научные термины, используемые в настоящем документе, имеют такое же значение, как обычно понимается специалистом в области, к которой принадлежит настоящее изобретение, и соответствуют: Singleton et al (1994) Dictionary of Microbiology and Molecular Biology, 2ND Ed., J. Wiley & Sons, New York, NY; и Janeway, C, Travers, P., Walport, M., Shlomchik (2001) Immunobiology, 5th Ed., Garland Publishing, New York.
Определения
Если не указано иного, то следующие ниже термины и фразы, как используется в настоящем документе, как предполагается, имеют следующие значения:
Если в настоящем документе используются торговые наименования, заявители предполагают независимо включить препарат продукта с этим торговым наименованием, лекарственное средство дженерик и активный фармацевтический ингредиент (ингредиенты) продукта с этим торговым наименованием.
Термин "антитело" используется в настоящем документе в широком смысле и конкретно включает моноклональные антитела, поликлональные антитела, димеры, мультимеры, мультиспецифичные антитела (например, биспецифичные антитела) и фрагменты антител, постольку, поскольку они демонстрируют желаемую биологическую активность (Miller et al (2003) Jour. of Immunology 170:4854-4861). Антитела могут представлять собой антитела мыши, антитела человека, гуманизированные антитела, химерные антитела или антитела, полученные от других видов. Антитело представляет собой белок, вырабатываемый иммунной системой, который способен распознавать конкретный антиген и связываться с ним. (Janeway, C, Travers, P., Walport, M., Shlomchik (2001) Immuno Biology, 5th Ed., Garland Publishing, New York). Мишеневый антиген, как правило, имеет множество сайтов связывания, также называемых эпитопами, распознаваемых с помощью CDR на множестве антител. Каждое антитело, которое специфично связывается с отличным от других эпитопом, имеет отличную от других структуру. Таким образом, один антиген может иметь более одного соответствующего ему антитела. Антитело включает полноразмерную молекулу иммуноглобулина или иммунологически активную часть полноразмерной молекулы иммуноглобулина, то есть, молекулу, которая содержит сайт связывания антигена, которая иммунноспецифично связывает антиген мишени, представляющей интерес, или часть его, такие мишени включают, но, не ограничиваясь этим, раковые клетки или клетки, которые продуцируют аутоиммунные антитела, связанные с аутоиммунным заболеванием. Иммуноглобулин, описываемый в настоящем документе, может принадлежать к любому типу (например, IgG, IgE, IgM, IgD и IgA), класса (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или подклассу молекул иммуноглобулина. Иммуноглобулины могут быть получены от любых видов. В одном из аспектов, однако, иммуноглобулин имеет происхождение от людей, мышей или кроликов.
"Фрагменты антител" содержат часть полноразмерного антитела, как правило, его область, связывающуюся с антигеном, или вариабельную область. Примеры фрагментов антител включают фрагменты Fab, Fab’, F(ab’)2 и Fv; диатела; линейные антитела; минитела (Olafsen et al (2004) Protein Eng. Design & Sel. 17(4):315-323), фрагменты, продуцируемые с помощью библиотеки экспрессирования Fab, антиидиотипические (анти-Id) антитела, CDR (комплементарные определяющие области) и фрагменты связывания эпитопов любых объектов, упоминаемых выше, которые иммунноспецифично связываются с антигенами раковых клеток, вирусными антигенами или микробными антигенами, одноцепочечные молекулы антител и мультиспецифичные антитела, сформированные из фрагментов антител.
Термин "моноклональное антитело", как используется в настоящем документе, относится к антителу, получаемому из популяции по существу гомогенных антител, то есть, индивидуальные антитела, составляющие популяцию, являются идентичными, за исключением естественных мутаций, которые могут присутствовать в малых количествах. Моноклональные антитела являются высокоспецифичными, будучи направленными против единственного антигенного активного сайта. Кроме того, в противоположность препаратам поликлональных антител, которые содержат различные антитела, направленные против различных детерминантов (эпитопов), каждое моноклональное антитело направлено против одного детерминанта на антигене. В дополнение к их специфичности, моноклональные антитела являются преимущественными в том, что они могут синтезироваться незагрязненными другими антителами. Прилагательное "моноклональный" показывает характер антитела, как полученного из гомогенной по существу популяции антител, и не должно рассматриваться как требующее получение антитела с помощью какого-либо конкретного способа. Например, моноклональные антитела, которые должны использоваться в соответствии с настоящим изобретением, могут быть получены с помощью гибридомного способа, описанного впервые Kohler et al (1975) Nature 256:495, или могут быть получены с помощью способов с использованием рекомбинантной ДНК (см. например: патент США № 4816567; патент США № 5807715). Моноклональные антитела могут также быть выделены из библиотек фаговых антител с использованием способов, например, описанных в Clackson et al (1991) Nature, 352:624-628; Marks et al (1991) J. Mol. Biol, 222:581-597.
Моноклональные антитела в настоящем документе конкретно включают "химерные" антитела, в которых часть тяжелой и/или легкой цепи является идентичной соответствующим последовательностям антител или гомологичной полученным из конкретных видов, или принадлежащим конкретному классу, или подклассу антителам, в то время как остальная часть цепи (цепей) является идентичной или гомологичной соответствующим последовательностям в антителах, полученных от других видов или принадлежащих к другому классу или подклассу антител, а также фрагменты таких антител, постольку, поскольку они демонстрируют желаемую биологическую активность (патент США № 4816567; и Morrison et al (1984) Proc. Natl. Acad. Sci. USA, 81:6851-6855). Химерные антитела, представляющие интерес в настоящем документе, включают "приматизированные" антитела, содержащие последовательности связывания антигена вариабельного домена, полученные от примата, иного, чем человек (например, от старосветской мартышки, человекообразной обезьяны, и тому подобное) и последовательности из константной области человека.
"Интактное антитело" в настоящем документе представляет собой антитело, содержащее домены VL и VH, а также константный домен легкой цепи (CL) и константные домены тяжелой цепи, CH1, CH2 и CH3. Константные домены могут представлять собой константные домены нативных последовательностей (например, константные домены нативной последовательности человека) или вариант их аминокислотной последовательности. Интактное антитело может иметь одну или несколько "эффекторных функций", которые относятся к их биологическим активностям, приписываемым константной области Fc (область нативной последовательности Fc или область варианта Fc аминокислотной последовательности) антитела. Примеры эффекторных функций антитела включают связывание Clq; комплимент-зависимую цитотоксичность; связывание рецепторов Fc; антитело-зависимая опосредуемая клетками цитотоксичность (ADCC); фагоцитоз и даун-регуляцию поверхностных клеточных рецепторов, таких как рецепторы B лимфоцитов и BCR.
В зависимости от аминокислотной последовательности константного домена их тяжелых цепей, интактные антитела могут быть отнесены к различным "классам". Имеется пять главных классов интактных иммуноглобулиновых антител: IgA, IgD, IgE, IgG и IgM, и несколько из них могут дополнительно быть разделены на "подклассы" (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA и IgA2. Константные домены тяжелой цепи, которые соответствуют различным классам антител, называют α, δ, ε, γ и μ, соответственно. Структуры субъединиц и трехмерные конфигурации различных классов иммуноглобулинов хорошо известны. Ig формы включают шарнирные модификации или бесшарнирные формы (Roux et al (1998) J. Immunol. 161:4083-4090; Lund et al (2000) Eur. J. Biochem. 267:7246-7256; US 2005/0048572; US 2004/0229310).
"Рецептор ErbB" представляет собой рецепторный белок тирозинкиназу, который принадлежит семейству рецепторов ErbB, члены которого являются важными медиаторами роста, дифференциации и выживаемости клеток. Семейство рецепторов ErbB включает четыре различных члена, включая рецептор эпидермального фактора роста (EGFR, ErbB1, HER1), HER2 (ErbB2 или p185neu), HER3 (ErbB3) и HER4 (ErbB4 или tyro2). Набор антител анти-ErbB2 характеризуют с использованием линии клеток опухоли груди человека SKBR3 (Hudziak et al (1989) Mol. Cell. Biol. 9(3): 1165-1172. Максимальное ингибирование получают с помощью антитела, называемого 4D5, которое ингибирует пролиферацию клеток на 56%. Другие антитела этого набора при этом анализе уменьшают пролиферацию клеток до меньшей степени. Антитело 4D5, кроме того, как обнаружено, сенсибилизирует линии клеток опухоли груди, сверхэкспрессирующие ErbB2, по отношению к цитотоксичным воздействиям TNF-α (патент США № 5677171). Антитела анти-ErbB2, обсуждаемые Hudziak et al., дополнительно характеризуются Fendly et al (1990) Cancer Research 50: 1550-1558; Kotts et al. (1990) In vitro 26(3):59A; Sarup et al. (1991) Growth Regulation 1:72-82; Shepard et al. J. (1991) Clin. Immunol. 11(3): 117-127; Kumar et al. (1991) Mol. Cell. Biol. 11(2):979-986; Lewis et al. (1993) Cancer Immunol. Immunother. 37:255-263; Pietras et al. (1994) Oncogene 9: 1829-1838; Vitetta et al. (1994) Cancer Research 54:5301-5309; Sliwkowski et al. (1994) J. Biol. Chem. 269(20): 14661-14665; Scott et al. (1991) J. Biol. Chem. 266: 14300-5; D’souza et al. Proc. Natl. Acad. Sci. (1994) 91:7202-7206; Lewis et al. (1996) Cancer Research 56: 1457-1465; и Schaefer et al. (1997) Oncogene 15:1385-1394.
Рецептор ErbB будет, как правило, содержать внеклеточный домен, который может связывать лиганд ErbB; липофильный трансмембранный домен; консервативный внутриклеточный домен тирозинкиназы; а сигнальный домен с карбоксильным концом скрывает несколько тирозиновых остатков, которые могут быть фосфорилированными. Рецептор ErbB может представлять собой рецептор ErbB с "нативной последовательностью" или его "вариант аминокислотных последовательностей". Предпочтительно, рецептор ErbB представляет собой рецептор ErbB с нативной последовательностью человека. Соответственно, "член семейства рецепторов ErbB" включает EGFR (ErbB1), ErbB2, ErbB3, ErbB4.
Термин "вариант аминокислотной последовательности" относится к полипептидам, имеющим аминокислотные последовательности, которые отличаются до некоторой степени от полипептида с нативной последовательностью. Обычно варианты аминокислотных последовательностей будут обладать по меньшей мере примерно 70% идентичностью последовательности, по меньшей мере с одним доменом связывания рецептора нативного лиганда ErbB или, по меньшей мере с одним доменом связывания лиганда нативного рецептора ErbB, предпочтительно, они будут по меньшей мере примерно на 80%, более предпочтительно, по меньшей мере примерно на 90% гомологичными по последовательностям с такими доменами связывания рецептора или лиганда. Варианты аминокислотной последовательности обладают заменами, делециями и/или инсерциями в определенных положениях в нативной аминокислотной последовательности. Аминокислоты обозначаются с помощью обычных наименований, однобуквенных и трехбуквенных кодов.
"Идентичность последовательности" определяют как процент остатков в варианте аминокислотнной последовательности, которые являются идентичными после совмещения последовательностей и введения пробелов, если это необходимо, для достижения максимального процента идентичности последовательности. Способы и компьютерные программы для совмещения хорошо известны в данной области. Одна такая компьютерная программа представляет собой программу "Align 2", разработанную Genentech, Inc., которая подана вместе с документаций для пользователей в United States Copyright Office, Washington, DC 20559, 10 декабря 1991 года.
"Нативные антитела" обычно представляют собой гетеротетрамерные гликопротеины массой примерно 150000 дальтон, состоящие из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей. Каждая легкая цепь связана с тяжелой цепью посредством одной ковалентной дисульфидной связи, в то время как количество дисульфидных связей среди тяжелых цепей различных изотипов иммуноглобулинов изменяется. Каждая тяжелая и легкая цепь также имеет расположенные на одинаковых расстояниях друг от друга межцепные дисульфидные мостики. Каждая тяжелая цепь имеет на одном конце вариабельный домен (VH) за которым следует ряд константных доменов. Каждая легкая цепь имеет вариабельный домен на одном конце (VL) и константный домен на ее другом конце. Константный домен легкой цепи совмещен с первым константным доменом тяжелой цепи, и вариабельный домен легкой цепи совмещен с вариабельным доменом тяжелой цепи. Конкретные аминокислотные остатки, как предполагается, образуют границу раздела между вариабельными доменами легкой цепи и тяжелой цепи.
Термин "вариабельный" относится к тому факту, что определенные части вариабельных доменов сильно различаются по последовательности среди различных антител и используются при связывании и при установлении специфичности каждого конкретного антитела к его конкретному антигену. Однако вариабельность не является равномерно распределенной по вариабельным доменам антител. Она концентрируется в трех сегментах, называемых гипервариабельными областями в вариабельных доменах, как в легкой цепи, так и тяжелой цепи. Более консервативные части вариабельных доменов называют каркасными областями (FR). Вариабельные домены нативных тяжелых и легких цепей, каждый, содержат четыре FR, в основном имеющих β-складчатую конфигурацию, соединенных тремя гипервариабельными областями, которые образуют петли, соединяющие, а в некоторых случаях образующие часть β-складчатой структуры. Гипервариабельные области каждой цепи удерживаются вместе в тесной близости с помощью FR и вместе с гипервариабельными областями из другой цепи вносят вклад в образование сайта связывания антитела с антигеном (смотри Kabat et al (1991) Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD). Константные домены не вовлекаются непосредственно в связывание антитела с антигеном, но демонстрируют различные эффекторные функции, такие как участие антитела в зависимой от антитела клеточной цитотоксичности (ADCC).
Термин "гипервариабельная область", когда используется в настоящем документе, относится к аминокислотным остаткам антитела, которые ответственны за связывание антигена. Гипервариабельная область, как правило, содержит аминокислотные остатки из "области, определяющей комплементарность", или "CDR" (например, остатки 24-34 (L1), 50-56 (L2) и 89-97 (L3) в вариабельном домене легкой цепи и 31-35 (H1), 50-65 (H2) и 95-102 (H3) в вариабельном домене тяжелой цепи; Kabat et al, выше) и/или такие остатки из "гипервариабельной петли" (например, остатки 26-32 (L1), 50-52 (L2) и 91-96 (L3) в вариабельном домене легкой цепи и 26-32 (H1), 53-55 (H2) и 96-101 (H3) в вариабельном домене тяжелой цепи; Chothia and Lesk (1987) J. Mol. Biol., 196:901-917). Остатки "каркасной области" или "FR" представляют собой остатки вариабельных доменов, иные, чем остатки гипервариабельной области, как определено в настоящем документе.
Обработка папаином антител дает два идентичных фрагмента связывания с антигеном, называемые фрагменты "Fab", каждый - с одним сайтом связывания антигена, и фрагмент остатков "Fc", наименование которого отражает его способность к легкой кристаллизации. Обработка пепсином дает фрагмент F(ab’)2, который имеет два сайта связывания с антигеном и по-прежнему способен к перекрестному связыванию антигена.
"Fv" представляет собой минимальный фрагмент антитела, который содержит полный сайт распознавания антигена и связывания антигена. Это область состоит из димера одной тяжелой цепи и одного вариабельного домена легкой цепи в тесной, нековалентной ассоциации. В этой конфигурации происходит то, что три гипервариабельных области каждого вариабельного домена взаимодействуют, определяя сайт связывания антигена на поверхности димера VH-VL. Коллективно, шесть гипервариабельных областей придают антителу специфичность связывания антигена. Однако, даже отдельный вариабельный домен (или половина Fv, содержащая только три гипервариабельных области, специфичных к антигену) обладает способностью к распознаванию и связыванию антигена, хотя и с более низкой аффинностью, чем сайт связывания целиком.
Fab фрагмент также содержит константный домен легкой цепи и первый константный домен (CH1) тяжелой цепи. Фрагменты Fab’ отличаются от фрагментов Fab добавлением нескольких остатков на карбокси конце домена CH1 тяжелой цепи, содержащих один или несколько цистеинов из шарнирной области антитела. Fab’-SH представляет собой обозначение в настоящем документе для Fab’, в котором цистеиновый остаток (остатки) константных доменов несет, по меньшей мере, одну свободную тиольную группу. Фрагменты F(ab’)2 антитела исходно образуются как пары фрагментов Fab’, которые имеют шарнирные цистеиновые остатки между ними. Известны также другие химические связи между фрагментами антител.
"Легкие цепи" антител от любых видов позвоночных могут быть приписаны к одному из двух различных типов, называемых каппа (κ) и лямбда (λ), на основе аминокислотных последовательностей их константных доменов.
"Одноцепочечные Fv" или "scFv" фрагменты антитела содержат домены VH и VL антитела, где эти домены присутствуют в одной полипептидной цепи. Предпочтительно, Fv полипептид дополнительно содержит полипептидный линкер между доменами VH и VL, который дает возможность scFv образовывать желаемую структуру для связывания антигена. Относительно обзора по scFv, смотри Plückthun, Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994). scFv фрагменты антитела анти-ErbB2 описаны в WO 93/16185; в патентах США № 5571894 и 5587458.
"Гуманизированные" формы антител, не происходящих от человека, (например, грызунов) представляют собой химерные антитела, которые содержат минимальную последовательность, полученную из иммуноглобулина, не принадлежащего человеку. Гуманизация представляет собой способ переноса информации для связывания антигена мышей в акцептор неиммуногенного антитела человека и приводит к получению множества терапевтически полезных лекарственных средств. Способ гуманизации, как правило, начинается с переноса всех шести областей, определяющих комплементарность (CDR) мышей, в каркас антитела человека (Jones et al, (1986) Nature 321:522-525). Эти антитела с привитыми CDR, как правило, не сохраняют их исходной аффинности к связыванию антигена, и на самом деле, аффинность часто сильно ослабляется. Кроме CDR, выбранные остатки каркаса антитела, не принадлежащие человеку, должны также включаться для поддержания соответствующей конформации CDR (Chothia et al (1989) Nature 342:877). Перенос ключевых остатков каркаса мышей в акцептор человека для поддержания структурной конформации привитых CDR, как показано, восстанавливает связывание антигена и аффинность к нему (Riechmann et al (1992) J. Mol. Biol. 224, 487-499; Foote и Winter, (1992) J. Mol. Biol. 224:487-499; Presta et al (1993) J. Immunol. 151, 2623-2632; Werther et al (1996) J. Immunol. Methods 157:4986-4995; и Presta et al (2001) Thromb. Haemost. 85:379-389). По большей части, гуманизированные антитела представляют собой иммуноглобулины человека (антитела реципиента), в которых остатки из гипервариабельной области реципиента заменены остатками из гипервариабельной области видов, отличных от человека (донорное антитело), таких как мышь, крыса, кролик или приматы, отличные от человека, имеющие желаемую специфичность, аффинность и емкость. В некоторых случаях, остатки каркасной области (FR) иммуноглобулина человека заменяются соответствующими остатками, не принадлежащими человеку. Кроме того, гуманизированные антитела могут содержать остатки, которые не обнаруживаются в антителе реципиента или в донорном антителе. Эти модификации осуществляют для дополнительного улучшения рабочих характеристик антител. Как правило, гуманизированное антитело будет содержать по существу все по меньшей мере из одного, а, как правило, из двух, вариабельных доменов, в которых все или по существу все гипервариабельные петли соответствуют петлям иммуноглобулина, не принадлежащего человеку, и все или по существу все FR представляют собой остатки последовательностей иммуноглобулина человека. Гуманизированное антитело необязательно также будет содержать, по меньшей мере, часть константной области (Fc) иммуноглобулина, как правило, иммуноглобулина человека. Относительно других деталей см. патент США № 6407213; Jones et al (1986) Nature, 321:522-525; Riechmann et al (1988) Nature 332:323-329; и Presta, (1992) Curr. Op. Struct. Biol, 2:593-596.
"Свободная цистеиновая аминокислота" относится к цистеиновому аминокислотному остатку, который получен с помощью генной инженерии в исходном антителе, имеет тиольную функциональную группу (-SH) и не спаривается в виде внутримолекулярного или межмолекулярного дисульфидного мостика.
Термин "значение реакционноспособности тиола" представляет собой количественную характеризацию реакционноспособности свободных цистеиновых аминокислот. Значение реакционноспособности тиола представляет собой процент свободной цистеиновой аминокислоты в антителе с цистеиновами заменами, полученном с помощью генной инженерии, которая взаимодействует с реагентом, реакционноспособным по отношению к тиолу, и преобразуется в максимальное значение 1. Например, свободная цистеиновая аминокислота в полученном с помощью генной инженерии антителе с цистеиновами заменами, которое взаимодействует при 100% выходе с реагентом, реакционноспособным по отношению к тиолу, таким как реагент биотин-малеимид, с образованием антитела, меченного биотином, имеет значение реакционноспособности по отношению к тиолу, равное 1,0. Другая цистеиновая аминокислота, вводимая с помощью генной инженерии в это же или иное исходное антитело, которое взаимодействует с 80% выходом с реагентом, реакционноспособным по отношению к тиолу, имеет значение реакционноспособности по отношению к тиолу примерно 0,8. Другая цистеиновая аминокислота, вводимая с помощью генной инженерии в это же или в иное исходное антитело, которое вообще не может взаимодействовать с реагентом, реакционноспособным по отношению к тиолу, имеет значение реакционноспособности по отношению к тиолу 0. Определение значения реакционноспособности по отношению к тиолу для конкретного цистеина можно осуществлять с помощью анализа ELISA, масс-спектрометрии, жидкостной хроматографии, ауторадиографии или других количественных аналитических исследований.
"Исходное антитело" представляет собой антитело, содержащее аминокислотную последовательность, в которой один или несколько аминокислотных остатков заменены одним или несколькими цистеиновыми остатками. Исходное антитело может содержать последовательность нативного или дикого типа. Исходное антитело может иметь существующие ранее модификации аминокислотной последовательности (такие как дополнения, делеции и/или замены) по отношению к другим нативным формам, к дикому типу, или к модифицированным формам антитела. Исходное антитело может быть направлено против мишеневого антигена, представляющего интерес, например, против биологически важного полипептида. Антитела, направленные против не-полипептидных антигенов (таких как связанные с опухолями гликолипидные антигены; смотри патент США № 5091178), также предусматриваются.
Иллюстративные исходные антитела включают антитела, имеющие аффинность и селективность по отношению к клеточным поверхностным и трансмембранным рецепторам и к антигенам, связанным с опухолями (TAA).
"Выделенное" антитело представляет собой антитело, которое идентифицировано и выделено и/или извлечено из компонента его природной окружающей среды. Загрязняющие компоненты его природной окружающей среды представляют собой материалы, которые могли бы отрицательно влиять на диагностические или терапевтические применения антитела, и могут включать ферменты, гормоны и другие растворенные белковые или небелковые вещества. В предпочтительных вариантах осуществления, антитело будет очищаться (1) до более чем 95% масс. антитела, как определяется с помощью метода Лоури, наиболее предпочтительно, до более чем 99% масс., (2) до уровня, достаточного для получения по меньшей мере 15 остатков последовательности аминокислот с N-концом или внутренней последовательности аминокислот посредством использования секвенатора с вращающимся стаканом, или (3) до гомогенности согласно SDS-PAGE при восстанавливающих или не восстанавливающих условиях, с использованием окрашивания кумасси голубым или, предпочтительно, серебряного окрашивания. Выделенное антитело включает антитело in situ в рекомбинантных клетках, поскольку по меньшей мере один компонент природной окружающей среды антитела не будет присутствовать. Обычно, однако, выделенное антитело будут получать с помощью по меньшей мере одной стадии очистки.
Антитело, "которое связывает" молекулярную мишень или антиген, представляющий интерес, например, антиген ErbB2, представляет собой антитело, способное связывать этот антиген с достаточной аффинностью, так что антитело является подходящим для нацеливания на клетку, экспрессирующую антиген. Когда антитело представляет собой антитело, которое связывает ErbB2, оно обычно будет, предпочтительно, связывать ErbB2 в противоположность другим рецепторам ErbB и может представлять собой антитело, которое не взаимодействует перекрестно в значительной степени с другими белками, такими как EGFR, ErbB3 или ErbB4. В таких вариантах осуществления, степень связывания антитела с этими белками, отличными от ErbB2 (например, связывание на поверхности клетки с эндогенным рецептором), будет меньше чем 10%, как определено с помощью анализа посредством сортировки клеток с флуоресцентным активированием (FACS) или радиоимунной преципитации (RIA). Иногда антитело анти-ErbB2 не будет в значительной степени перекрестно взаимодействовать с белком Neu крысы, например, как описано в Schecter et al. (1984) Nature 312:513 и Drebin et al (1984) Nature 312:545-548.
Молекулярные мишени для антител, охваченных настоящим изобретением, включают белки CD и их лиганды, такие как, но, не ограничиваясь этим: (i) CD3, CD4, CD8, CD19, CD20, CD22, CD34, CD40, CD79α (CD79a) и CD79β (CD79b); (ii) элементы семейства рецепторов ErbB, такие как рецептор EGF, рецептор HER2, HER3 или HER4; (iii) молекулы клеточной адгезии, такие как LFA-1, Mac1, p150,95, VLA-4, ICAM-1, VCAM и интегрин αv/β3, включая их либо альфа, либо бета субъединицы (например, антитела анти-CD11a, анти-CD18 или анти-CD11b); (iv) факторы роста, такие как VEGF; IgE; антигены группы крови; рецептор flk2/flt3; рецептор тучности (OB); рецептор mpl; CTLA-4; белок C, BR3, c-met, фактор тканей, β7, и тому подобное; и (v) антигены на поверхности клетки и трансмембранные антигены, связанные с опухолями (TAA).
Если не указано иного, термин "моноклональное антитело 4D5" относится к антителу, которое имеет остатки, связывающие антиген антитела 4D5 мыши (ATCC CRL 10463), или полученный из него. Например, моноклональное антитело 4D5 может представлять собой моноклональное антитело 4D5 мыши или его вариант, такой как гуманизированное 4D5. Иллюстративные гуманизированные антитела 4D5 включают huMAb4D5-1, huMAb4D5-2, huMAb4D5-3, huMAb4D5-4, huMAb4D5-5, huMAb4D5-6, huMAb4D5-7 и huMAb4D5-8 (трастузумаб, HERCEPTIN®), как в патенте США № 5821337.
Термины "лечить" и "лечение" относятся как к терапевтическому лечению, так и к профилактическим или превентативным мерам, когда целью является профилактика или замедление (уменьшение) нежелательного физиологического изменения или расстройства, такого как развитие или распространения рака. Для целей настоящего изобретения, полезные или желаемые клинические результаты включают, но, не ограничиваясь этим, облегчение симптомов, уменьшение степени заболевания, стабилизацию (то есть, отсутствие ухудшения) состояния заболевания, задержку или замедление развития заболевания, облегчение или временное ослабление болезненного состояния и ремиссию (либо частичную, либо полную), либо детектируемые, либо недетектируемые. "Лечение" может также означать более продолжительную выживаемость по сравнению с ожидаемой выживаемостью, если не принимать лечение. Те, кто нуждаются в лечении, включают тех, которые уже имеют состояние или расстройство, а также тех, кто склонен к возникновению состояния или расстройства, или тех, у которых возникновение состояния или расстройства должно быть предотвращено.
Термин "терапевтически эффективное количество" относится к количеству лекарственного средства, эффективного для лечения заболевания или расстройства у млекопитающих. В случае рака, терапевтически эффективное количество лекарственного средства может уменьшить количество раковых клеток; уменьшить размер опухоли; ингибировать (то есть, замедлить до некоторой степени, а предпочтительно, остановить) инфильтрацию раковых клеток в периферические органы; ингибировать (то есть, замедлить до некоторой степени, а предпочтительно, остановить) метастазирование опухоли; ингибировать до некоторой степени, рост опухоли и/или облегчить до некоторой степени один или несколько симптомов, ассоциируемых с раком. До той степени, до которой лекарственное средство может предотвратить рост и/или уничтожить существующие раковые клетки, оно может быть цитостатическим и/или цитотоксичным. Для терапии рака, эффективность может, например, измеряться с помощью оценки времени развития заболевания (TTP) и/или определения скорости отклика (RR).
Термины "рак" и "раковый" относятся к физиологическому состоянию у млекопитающих, которое, как правило, характеризуется нерегулируемым ростом клеток, или описывают его. "Опухоль" содержит одну или несколько раковых клеток. Примеры рака включают, но, не ограничиваясь этим, карциному, лимфому, бластому, саркому и лейкемию или лимфоидные злокачественные опухоли. Более конкретные примеры таких раковых опухолей включают рак сквамовых клеток (например, рак эпителиальных сквамовых клеток), рак легких, включая мелкоклеточный рак легких, не мелкоклеточный рак легких ("NSCLC"), аденокарциному легких и сквамовую карциному легких, рак брюшной полости, печеночно-клеточный рак, гастральный рак или рак желудка, включая желудочно-кишечный рак, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичников, рак печени, рак мочевого пузыря, гепатому, рак груди, рак толстой кишки, рак прямой кишки, рак ободочной и прямой кишки, внутриматочную карциному или карциному матки, карциному слюнных желез, рак почек или надпочечников, рак простат, рак вульвы, рак щитовидной железы, печеночную карциному, анальную карциному, карцином полового члена, а также рак головы и шеи.
"Рак, экспрессирующий ErbB", представляет собой рак, содержащий клетки, которые имеют белок ErbB, присутствующий на их клеточной поверхности. "Рак, экспрессирующий ErbB2", представляет собой рак, который продуцирует достаточные уровни ErbB2 на поверхности его клеток, так что антитело анти-ErbB2 может связываться с ним и оказывать терапевтическое воздействие по отношению к раку.
Рак, который "сверхэкспрессирует" антигенный рецептор, представляет собой рак, который имеет значительно более высокие уровни рецептора, такого как ErbB2, на поверхности его клеток, по сравнению с нераковой клеткой того же типа тканей. Такая сверхэкспрессия может вызываться амплификацией гена или повышенной транскрипцией или трансляцией. Сверхэкспрессия рецептора может определяться при диагностическом или прогностическом анализе с помощью оценки повышенных уровней рецепторного белка, присутствующего на поверхности клетки (например, посредством иммуногистохимического анализа; IHC). Альтернативно или в дополнение к этому, можно измерять уровни нуклеиновой кислоты, кодирующей рецептор, в клетке, например, посредством методик флуоресцентной гибридизации in situ (FISH; смотри WO 98/45479), саузерн блоттинга или цепной реакции полимеразы (PCR), такой как количественное PCR в реальном времени (RT-PCR).
Термин "цитотоксическое средство", как используется в настоящем документе, относится к веществу, которое ингибирует или предотвращает функционирование клеток и/или вызывает разрушение клеток. Термин, как предполагается, включает радиоактивные изотопы (например, 211At, 131I, 125I, 90Y, 186Re, 188Re, 153Sm, 212Bi, 32P, 60C и радиоактивные изотопы Lu), химиотерапевтические средства и токсины, такие как низкомолекулярные токсины или ферментативно активные токсины бактериального, грибкового, растительного или животного происхождения, включая их синтетические аналоги и производные.
"Фаговый дисплей" представляет собой методику, с помощью которой полипептиды вариантов отображаются как слитые белки с белком оболочки на поверхности фага, например, нитевидного фага, частиц. Одно из полезных свойств фагового дисплея заключается в том, что могут быстро и эффективно сортироваться большие библиотеки рандомизированных вариантов белков относительно тех последовательностей, которые связываются с целевой молекулой с высокой аффинностью. Отображение библиотек пептидов и белков на фаге используют для скрининга миллионов полипептидов на полипептиды со свойствами специфичного связывания. Способы поливалентного фагового дисплея используют для отображения малых случайных пептидов и малых белков, как правило, посредством слияния либо с pIII, либо с pVIII нитевидного фага (Wells and Lowman, (1992) Curr. Opin. Struct. Biol, 3:355-362, и ссылки, цитируемые там). При одновалентном фаговом дисплее, библиотеку белков или пептидов сливают с белком покрытия фага или его частью и экспрессируют при низких уровнях в присутствии белка дикого типа. Эффекты авидности уменьшаются по отношению к поливалентному фагу таким образом, что сортировка осуществляется на основе собственной аффинности к лиганду, и используют фагмидные векторы, которые упрощают манипуляции с ДНК. Lowman and Wells, Methods: A companion to Methods in Enzymology, 3:205-0216 (1991). Фаговый дисплей включает способы получения молекул, сходных с антителами (Janeway, C., Travers, P., Walport, M., Shlomchik (2001) Immunobiology, 5th Ed., Garland Publishing, New York, p627-628; Lee et al).
"Фагмид" представляет собой вектор плазмиды, имеющий бактериальный источник реплицирования, например, ColE1 и копию межгенной области бактериофага. Фагмид можно использовать на любом известном бактериофаге, включая нитевидный бактериофаг и бактериофаг лямбда. Плазмида также будет, как правило, содержать селектируемый маркер для стойкости к антибиотикам. Сегменты ДНК, клонируемые в эти векторы, могут распространяться как плазмиды. Когда клетки, скрывающие эти векторы, снабжаются всеми генами, необходимыми для продуцирования фаговых частиц, режим репликации плазмиды изменяется до репликации типа катящегося кольца с генерированием копий одной нити ДНК плазмиды и с упаковкой фаговых частиц. Фагмид может образовывать инфекционные или неинфекционные фаговые частицы. Этот термин включает фагмиды, которые содержат ген белка оболочки фага или его фрагмент, связанный с геном гетерологичного полипептида, как слияние генов, так что гетерологичный полипептид отображается на поверхности фаговой частицы.
"Линкер", "единица линкера" или "связь" означает химический остаток, содержащий ковалентную связь или цепь атомов, который ковалентно связывает антитело с остатком лекарственного средства. В различных вариантах осуществления, линкер указан как L. Линкеры включают двухвалентный радикал, такой как алкилдиил, арилен, гетероарилен, остатки, такие как: -(CR2)nO(CR2)n-, повторяющиеся единицы алкилокси (например, полиэтиленокси, PEG, полиметиленокси) и алкиламино (например, полиэтиленамино, Jeffamine™); и сложные эфиры и амиды дикислот, включая сукцинат, сукцинамид, дигликолят, малонат и капроамид.
Термин "метка" означает любой остаток, который может ковалентно присоединяться к антителу и который функционирует: (i) обеспечивая детектируемый сигнал; (ii) взаимодействуя со второй меткой для модификации детектируемого сигнала, обеспечиваемого первой или второй меткой, например, FRET (резонансный перенос энергии флуоресценции); (iii) стабилизируя взаимодействие или повышая аффинность связывания с антигеном или лигандом; (iv) влияя на подвижность, например, на электрофоретическую подвижность, или на клеточную проницаемость, посредством заряда, гидрофобности, формы или других физических параметров или (v) обеспечивая остаток для захвата, для модулирования аффинности к лиганду, для связывания антитело/антиген, или ионного комплексообразования.
Стереохимические определения и обозначения, используемые в настоящем документе, в целом, следуют S. P. Parker, Ed., McGraw-Hill Dictionary of Chemical Terms (1984) McGraw-Hill Book Company, New York; и Eliel, E. and Wilen, S., Stereochemistry of Organic Compounds (1994) John Wiley & Sons, Inc., New York. Многие органические соединения существуют в оптически активных формах, то есть, они имеют способность вращать плоскость поляризации плоско-поляризованного света. При описании оптически активного соединения, приставки D и L, или R и S используют для обозначения абсолютной конфигурации молекулы по отношению к ее хиральному центру (центрам). Приставки d и l, или (+) и (-) используют для обозначения знака вращения плоско-поляризованного света соединением, при этом (-) или l означает, что соединение является левовращающим. Соединение с приставкой (+) или d является правовращающим. Для данной химической структуры, эти стереоизомеры являются идентичными, за исключением того, что они представляют собой зеркальные отображения друг друга. Конкретный стереоизомер может также упоминаться как энантиомер, и смесь таких изомеров часто называют энантиомерной смесью. Смесь энантиомеров 50:50 упоминают как рацемическую смесь или рацемат, которая может существовать, когда отсутствует стереоселективность или стереоспецифичность при химической реакции или процессе. Термины "рацемическая смесь" и "рацемат" относятся к эквимолярной смеси двух энантиомерных видов, лишенной оптической активности.
Фраза "фармацевтически приемлемая соль", как используется в настоящем документе, относится к фармацевтически приемлемым органическим или неорганическим солям ADC. Иллюстративные соли включают, но, не ограничиваясь этим, сульфатные, цитратные, ацетатные, оксалатные, хлоридные, бромидные, йодидные, нитратные, бисульфатные, фосфатные, гидрофосфатные, изоникотинатные, лактатные, салицилатные, гидроцитратные, тартратные, олеатные, таннатные, пантотенатные, битартратные, аскорбатные, сукцинатные, малеатные, гентизинатные, фумаратные, глюконатные, глюкуронатные, сахаратные, формиатные, бензоатные, глютаматные, метансульфонатные, этансульфонатные, бензолсульфонатные, п-толуолсульфонатные и памоатные (то есть, 1,1’-метилен-бис-(2-гидрокси-3-нафтоатные)) соли. Фармацевтически приемлемая соль может содержать включение другой молекулы, такой как ацетатный ион, сукцинатный ион или другой противоион. Противоион может представлять собой любой органический или неорганический остаток, который стабилизирует заряд на исходном соединении. Кроме того, фармацевтически приемлемая соль может иметь более одного заряженного атома в своей структуре. Примеры, когда множество заряженных атомов представляют собой часть фармацевтически приемлемой соли, могут иметь множество противоионов. Следовательно, фармацевтически приемлемая соль может иметь один или несколько заряженных атомов и/или один или несколько противоионов.
"Фармацевтически приемлемый сольват" относится к ассоциации одной или нескольких молекул растворителя и ADC. Примеры растворителей, которые образуют фармацевтически приемлемые сольваты, включают, но, не ограничиваясь этим, воду, изопропанол, этанол, метанол, DMSO, этилацетат, уксусную кислоту и этаноламин.
Полученные с помощью генной инженерии антитела с цистеиновыми заменами
Соединения по настоящему изобретению включают полученные с помощью генной инженерии антитела с цистеиновыми заменами, где одну или несколько аминокислот антитела дикого типа или исходного антитела заменяют цистеиновой аминокислотой. С помощью генной инженерии, то есть мутаций, таким образом, может быть получена любая форма антитела. Например, Fab-фрагмент исходного антитела может быть получен с помощью генной инженерии с образованием Fab с цистеиновыми заменами, полученного с помощью генной инженерии, упоминаемого в настоящем документе как "ThioFab". Подобным же образом, исходное моноклональное антитело может быть получено с помощью генной инженерии с образованием "ThioMab". Необходимо отметить, что мутация одного сайта дает один полученный с помощью генной инженерии цистеиновый остаток на ThioFab, в то время как в ThioMab мутация одного сайта дает два полученных с помощью генной инженерии цистеиновых остатках, благодаря димерной природе антитела IgG. Мутанты с замененными ("полученными с помощью генной инженерии") цистеиновыми (Cys) остатками оценивают на реакционноспособность вновь введенных, полученных с помощью генной инженерии тиольных групп цистеиновых остатков. Значение реакционноспособности тиола представляет собой относительный, численный термин в пределах от 0 до 1,0 и может быть измерено для любого полученного с помощью генной инженерии антитела с цистеиновыми заменами. Значения реакционноспособности тиола для полученных с помощью генной инженерии антител с цистеиновыми заменами по настоящему изобретению находятся в пределах 0,6-1,0; 0,7-1,0 или 0,8-1,0.
Способы конструирования, выбора и получения по настоящему изобретению делают возможным получение полученных с помощью генной инженерии антител с цистеиновыми заменами, которые являются реакционноспособными с электрофильной функциональностью. Кроме того, эти способы делают возможными получения соединений конъюгатов антител, таких как соединения конъюгат антитело-лекарственное средство (ADC) с молекулами лекарственных средств на заданных, сконструированных, селективных активных сайтах. Реакционноспособные цистеиновые остатки на поверхности антитела делают возможным специфичное конъюгирование остатка лекарственного средства с помощью тиольной реакционноспособной группы, такой как малеимид или галогенацетил. Нуклеофильная реакционноспособность тиольной функциональной группы Cys остатка по отношению к малеимидной группе примерно в 1000 раз выше по сравнению с другими функциональными группами аминокислот в белке, таких как амино группа лизиновых остатков или амино группа с N-концом. Тиол-специфичная функциональная группа в йодацетильном и малеимидном реагентах может взаимодействовать с аминовыми группами, но требуются более высокие pH (>9,0) и более продолжительные времена реакции (Garman, 1997, Non-Radioactive Labeling: A Practical Approach, Academic Press, London).
Полученные с помощью генной инженерии антитела с цистеиновыми заменами по настоящему изобретению, предпочтительно, сохраняют способность связывания антигена от своего дикого типа, от соответствующих частей исходного антитела. Таким образом, полученные с помощью генной инженерии антитела с цистеиновыми заменами способны связывать, предпочтительно, специфично, антигены. Такие антигены включают, например, антигены, связанные с опухолями (TAA), белки рецепторов на поверхности клеток и другие молекулы на поверхности клеток, трансмембранные белки, сигнальные белки, регуляторные факторы выживаемости клеток, регуляторные факторы пролиферации клеток, молекулы, ассоциируемые с развитием или дифференциацией тканей (например, которые, как известно или как ожидается, функционально вносят вклад в него), лимфокины, цитокины, молекулы, вовлеченные в регуляцию клеточного цикла, молекулы, вовлеченные в васкулогенез, и молекулы, связанные с ангиогенезом (например, как известно или как ожидается, вносят вклад функционально в это). Антиген, связанный с опухолями, может представлять собой фактор дифференциации кластеров (например, белок CD). Антиген, с которым полученное с помощью генной инженерии антитело с цистеиновыми заменами способно связываться, может представлять собой элемент подмножества одной из рассмотренных выше категорий, при этом другое подмножество (подмножества) указанной категории включает другие молекулы/антигены, которые имеют другую характеристику (по отношению к антигену, представляющему интерес).
Исходное антитело может также представлять собой гуманизированное антитело, выбранное из huMAb4D5-1, huMAb4D5-2, huMAb4D5-3, huMAb4D5-4, huMAb4D5-5, huMAb4D5-6, huMAb4D5-7 и huMAb4D5-8 (трастузумаб, HERCEPTIN®), как описано в Таблице 3 патента США № 5821337, в явном виде включаемого в настоящий документ в качестве ссылки; из гуманизированного антитела 520C9 (WO 93/21319) и из гуманизированных антител 2C4, как описано в настоящем документе.
Полученные с помощью генной инженерии антитела с цистеиновыми заменами по настоящему изобретению могут быть сайт-специфичными и могут эффективно связываться с тиольным реакционноспособным реагентом. Тиольный реакционноспособный реагент может представлять собой реагент мультифункционального линкера, реагент захвата, то есть аффинности, реагент метки (например, биотиновый линкерный реагент), метку для обнаружения (например, флуорофорный реагент), реагент для иммобилизации на твердой фазе (например, на SEPHAROSE™, на полистироле или на стекле) или промежуточное соединение лекарственное средство-линкер. Один из примеров тиольного реакционноспособного реагента представляет собой N-этилмалеимид (NEM). В одном из иллюстративных вариантов осуществления, реакция ThioFab с биотиновым линкерным реагентом дает биотинилированный ThioFab, с помощью которого может детектироваться и измеряться присутствие, и реакционноспособность полученного с помощью генной инженерии цистеинового остатка. Реакция ThioFab с мультифункциональным линкерным реагентом обеспечивает ThioFab с функционализированным линкером, который может затем взаимодействовать с реагентом остатка лекарственного средства или с другой меткой. Реакция ThioFab с промежуточным соединением лекарственное средство-линкер дает конъюгат ThioFab и лекарственного средства.
Иллюстративные способы, описанные в настоящем документе, могут, как правило, использоваться для идентификации и получения антител, а в более общем смысле, и к другим белкам, посредством применения стадий конструирования и скрининга, описанных в настоящем документе.
Такой подход может быть использован для конъюгирования других тиольных реакционноспособных агентов, в которых реакционноспособная группа представляет собой, например, малеимид, йодацетамид, пиридилдисульфид или другой тиольный реакционноспособный партнер по конъюгированию (Haugland, 2003, Molecular Probes Handbook of Fluorescence Probes and Research Chemicals, Molecular Probes, Inc.; Brinkley, 1992, Bioconjugate Chem. 3:2; Garman, 1997, Non-Radioactive Labeling: A Practical Approach, Academic Press, London; Means (1990) Bioconjugate Chem. 1:2; Hermanson, G. in Bioconjugate Techniques (1996) Academic Press, San Diego, pp. 40-55, 643-671). Партнер может представлять собой цитотоксическое средство (например, токсин, такой как доксорубицин или токсин коклюша), флуорофор, такой как флуоресцентный краситель, подобный флуоресцеину или родамину, хелатирующее средство для получения изображения или металл для радиационной терапии, пептидильную или непептидильную метку или метку для обнаружения, или средство, модифицирующее выведение, такое как различные изомеры полиэтиленгликоля, пептид, который связывается с третьим компонентом, или другое углеводное или липофильное средство.
Активные сайты, идентифицируемые на иллюстративном фрагменте антитела, hu4D5Fabv8, в настоящем документе, находятся в основном в константном домене антитела, который является достаточно консервативным для всех видов антител. Эти активные сайты должны иметь широкое применение для других антител, без дополнительной необходимости в структурном дизайне или в знаниях о структурах конкретного антитела и без отрицательного влияния на свойства связывания антигена, присущие вариабельным доменам антитела.
Полученные с помощью генной инженерии антитела с цистеиновыми заменами, которые могут быть полезными при лечении рака, включают, но, не ограничиваясь этим, антитела против поверхностных клеточных рецепторов и антигенов, связанных с опухолями (TAA). Такие антитела можно использовать как “голые” антитела (не конъюгированные с остатком лекарственного средства или метки) или как конъюгаты антитело-лекарственное средство Формулы I (ADC). Антигены, связанные с опухолями, известны в данной области, и они могут быть получены для использования при генерировании антител с использованием способов и информации, которые хорошо известны в данной области. В попытках обнаружения эффективных клеточных мишеней для диагностики и терапии рака, исследователи пытаются идентифицировать трансмембранные или иным образом связанные с опухолями полипептиды, которые специфично экспрессируются на поверхности одного или нескольких конкретных типов раковых клеток по сравнению с одной или несколькими нормальными нераковыми клетками. Часто, такие связанные с опухолями полипептиды экспрессируются в больших количествах на поверхностях раковых клеток по сравнению с поверхностью не раковых клеток. Идентификация таких связанных с опухолями антигенных полипептидов на поверхности клеток дают возможность конкретно помечать раковые клетки для разрушения с помощью терапии на основе антител.
Примеры TAA включают, но, не ограничиваясь этим, TAA (1)-(36), перечисленные ниже. Для удобства, информация, относящаяся к этим антигенам, все они известны в данной области, приводится ниже и включает наименования, альтернативные наименования, коды доступа Genbank и основные ссылки, за которым следуют условные обозначения для идентификации последовательностей нуклеиновых кислот и белков National Center for Biotechnology Information (NCBI). Последовательности нуклеиновых кислот и белков, соответствующие TAA (1)-(36) доступны в публичных базах данных, таких как GenBank. Антигены, связанные с опухолями, на которые нацеливают антитела, включают все варианты последовательностей аминокислот и изоформы, обладающие, по меньшей мере, примерно 70%, 80%, 85%, 90% или 95% идентичностью последовательностей по отношению к последовательностям, идентифицируемым в цитируемых ссылках, или те, которые демонстрируют по существу такие же биологические свойства или характеристики, как TAA, имеющие последовательность, обнаруживаемую в цитируемых ссылках. Например, TAA, имеющий вариантную последовательность, как правило, способен специфично связываться с антителом, которое специфично связывается с TAA с соответствующей последовательностью из списка. Последовательности и описание в ссылке, конкретно цитируемой в настоящем документе, в явном виде включаются в качестве ссылок.
Антигены, связанные с опухолями (1)-(36):
(1) BMPR1B (рецептор морфогенетического белка костей типа IB, номер доступа Genbank NM_001203) ten Dijke,P., et al Science 264 (5155): 101-104 (1994), Oncogene 14 (11): 1377-1382 (1997)); WO2004063362 (пункт 2 формулы изобретения); WO2003042661 (пункт 12 формулы изобретения); US2003134790-A1 (страница 38-39); WO2002102235 (пункт 13 формулы изобретения; страница 296); WO2003055443 (страница 91-92); WO200299122 (пример 2; страница 528-530); WO2003029421 (пункт 6 формулы изобретения); WO2003024392 (пункт 2 формулы изобретения; Фиг.112); WO200298358 (пункт 1 формулы изобретения; страница 183); WO200254940 (Страница 100-101); WO200259377 (Страница 349-350); WO200230268 (пункт 27 формулы изобретения; страница 376); WO200148204 (пример; фиг.4); NP_001194 рецептор морфогенетического белка костей, тип IB /pid=NP_001194.1. Перекрестные ссылки: MIM:603248; NP_001194.1; AY065994
(2) E16 (LAT1, SLC7A5, номер доступа Genbank NM_003486) Biochem. Biophys. Res. Commun. 255 (2), 283-288 (1999), Nature 395 (6699):288-291 (1998), Gaugitsch, H.W., et al (1992) J. Biol. Chem. 267 (16): 11267-11273); WO2004048938 (пример 2); WO2004032842 (пример IV); WO2003042661 (пункт 12 формулы изобретения); WO2003016475 (пункт 1 формулы изобретения); WO200278524 (пример 2); WO200299074 (пункт 19 формулы изобретения; страница 127-129); WO200286443 (пункт 27 формулы изобретения; страницы 222, 393); WO2003003906 (пункт 10 формулы изобретения; страница 293); WO200264798 (пункт 33 формулы изобретения; страница 93-95); WO200014228 (пункт 5 формулы изобретения; страница 133-136); US2003224454 (Фиг.3); WO2003025138 (пункт 12 формулы изобретения; страница 150); NP_003477 семейство 7 переносчиков растворенных веществ (переносчик катионных аминокислот, y+система), элемент 5 /pid=NP_003477.3-Homo sapiens; перекрестные ссылки: MIM:600182; NP_003477.3; NM_015923; NM_003486_1
(3) STEAP1 (шестой трансмембранный эпителиальный антиген простаты, номер доступа Genbank NM_012449); Cancer Res. 61 (15), 5857-5860 (2001), Hubert, R.S., et al (1999) Proc. Natl. Acad. Sci. U.S.A. 96 (25): 14523-14528); WO2004065577 (пункт 6 формулы изобретения); WO2004027049 (Фиг.1L); EP1394274 (пример 11); WO2004016225 (пункт 2 формулы изобретения); WO2003042661 (пункт 12 формулы изобретения); US2003157089 (пример 5); US2003185830 (пример 5); US2003064397 (Фиг.2); WO200289747 (пример 5; страница 618-619); WO2003022995 (пример 9; Фиг.13A, пример 53; страница 173, пример 2; Фиг.2A); NP_036581 шестой трансмембранный эпителиальный антиген простаты
Перекрестные ссылки: MIM:604415; NP_036581.1; NM_012449_1
(4) 0772P (CA125, MUC16, номер доступа Genbank AF361486); J. Biol. Chem. 276 (29):27371-27375 (2001)); WO2004045553 (пункт 14 формулы изобретения); WO200292836 (пункт 6 формулы изобретения; Фиг.12); WO200283866 (пункт 15 формулы изобретения; страница 116-121); US2003124140 (пример 16); перекрестные ссылки: GI:34501467; AAK74120.3; AF361486_1
(5) MPF (MPF, MSLN, SMR, фактор потенцирования мегакариоцитов, мезотелин, номер доступа Genbank NM_005823) Yamaguchi, N., et al Biol. Chem. 269 (2), 805-808 (1994), Proc. Natl. Acad. Sci. U.S.A. 96 (20): 11531-11536 (1999), Proc. Natl. Acad. Sci. U.S.A. 93 (1): 136-140 (1996), J. Biol. Chem. 270 (37):21984-21990 (1995)); WO2003101283 (пункт 14 формулы изобретения); (WO2002102235 (пункт 13 формулы изобретения; страница 287-288); WO2002101075 (пункт 4 формулы изобретения; страница 308-309); WO200271928 (Страница 320-321); WO9410312 (Страница 52-57); перекрестные ссылки: MIM:601051; NP_005814.2; NM_005823_1
(6) Napi3b (NAPI-3B, NPTIIb, SLC34A2, семейство переносчиков растворенных веществ 34 (фосфат натрия), элемент 2, натрий-зависимый фосфатный переносчик 3b, тип II, номер доступа Genbank NM_006424) J. Biol. Chem. 277 (22): 19665-19672 (2002), Genomics 62 (2):281-284 (1999), Feild, J.A., et al (1999) Biochem. Biophys. Res. Commun. 258 (3):578-582); WO2004022778 (пункт 2 формулы изобретения); EP1394274 (пример 11); WO2002102235 (пункт 13 формулы изобретения; страница 326); EP875569 (пункт 1 формулы изобретения; страница 17-19); WO200157188 (пункт 20 формулы изобретения; страница 329); WO2004032842 (пример IV); WO200175177 (пункт 24 формулы изобретения; страница 139-140); перекрестные ссылки: MIM:604217; NP_006415.1; NM_006424_1
(7) Sema 5b (FLJ10372, KIAA1445, Mm.42015, SEMA5B, SEMAG, семафорин 5b Hlog, домен sema, семь повторяющихся единиц тромбоспондина (тип 1 и подобный типу 1), трансмембранный домен (TM) и короткий цитоплазматический домен, (семафорин) 5B, номер доступа Genbank AB040878); Nagase T., et al (2000) DNA Res. 7 (2):143-150); WO2004000997 (пункт 1 формулы изобретения); WO2003003984 (пункт 1 формулы изобретения); WO200206339 (пункт 1 формулы изобретения; страница 50); WO200188133 (пункт 1 формулы изобретения; страница 41-43, 48-58); WO2003054152 (пункт 20 формулы изобретения); WO2003101400 (пункт 11 формулы изобретения); Доступ: Q9P283; EMBL; AB040878; BAA95969.1. Genew; HGNC: 10737
(8) PSCA hlg (2700050C12Rik, C530008O16Rik, RIKEN cDNA 2700050C12, ген RIKEN cDNA 2700050C12, номер доступа Genbank AY358628); Ross et al (2002) Cancer Res. 62:2546-2553; US2003129192 (пункт 2 формулы изобретения); US2004044180 (пункт 12 формулы изобретения); US2004044179 (пункт 11 формулы изобретения); US2003096961 (пункт 11 формулы изобретения); US2003232056 (пример 5); WO2003105758 (пункт 12 формулы изобретения); US2003206918 (пример 5); EP1347046 (пункт 1 формулы изобретения); WO2003025148 (пункт 20 формулы изобретения); перекрестные ссылки: GI:37182378; AAQ88991.1; AY358628_1
(9) ETBR (рецептор эндотелина типа B, номер доступа Genbank AY275463); Nakamuta M., et al Biochem. Biophys. Res. Commun. 177, 34-39, 1991; Ogawa Y., et al Biochem. Biophys. Res. Commun. 178, 248-255, 1991; Arai H., et al Jpn. Circ. J. 56, 1303-1307, 1992; Arai H., et al J. Biol. Chem. 268, 3463-3470, 1993; Sakamoto A., Yanagisawa M., et al Biochem. Biophys. Res. Commun. 178, 656-663, 1991; Elshourbagy N.A., et al J. Biol. Chem. 268, 3873-3879, 1993; Haendler B., et al J. Cardiovasc. Pharmacol. 20, s1-S4, 1992; Tsutsumi M., et al Gene 228, 43-49, 1999; Strausberg R.L., et al Proc. Natl. Acad. Sci. U.S.A. 99, 16899-16903, 2002; Bourgeois C, et al J. Clin. Endocrinol. Metab. 82, 3116-3123, 1997; Okamoto Y., et al Biol. Chem. 272, 21589-21596, 1997; Verheij J.B., et al Am. J. Med. Genet. 108, 223-225, 2002; Hofstra R.M.W., et al Eur. J. Hum. Genet. 5, 180-185, 1997; Puffenberger E.G., et al Cell 79, 1257-1266, 1994; Attie T., et al, Hum. Mol. Genet. 4, 2407-2409, 1995; Auricchio A., et al Hum. Mol. Genet. 5:351-354, 1996; Amiel J., et al Hum. Mol. Genet. 5, 355-357, 1996; Hofstra R.M.W., et al Nat. Genet. 12, 445-447, 1996; Svensson P.J., et al Hum. Genet. 103, 145-148, 1998; Fuchs S., et al Mol. Med. 7, 115-124, 2001; Pingault V., et al (2002) Hum. Genet. 111, 198-206; WO2004045516 (пункт 1 формулы изобретения); WO2004048938 (пример 2); WO2004040000 (пункт 151 формулы изобретения); WO2003087768 (пункт 1 формулы изобретения); WO2003016475 (пункт 1 формулы изобретения); WO2003016475 (пункт 1 формулы изобретения); WO200261087 (Фиг.1); WO2003016494 (Фиг.6); WO2003025138 (пункт 12 формулы изобретения; страница 144); WO200198351 (пункт 1 формулы изобретения; страница 124-125); EP522868 (пункт формулы изобретения 8; Фиг.2); WO200177172 (пункт 1 формулы изобретения; страница 297-299); US2003109676; US6518404 (Фиг.3); US5773223 (пункт 1a формулы изобретения; Колонка 31-34); WO2004001004
(10) MSG783 (RNF124, гипотетический белок FLJ20315, номер доступа Genbank NM_017763); WO2003104275 (пункт 1 формулы изобретения); WO2004046342 (пример 2); WO2003042661 (пункт 12 формулы изобретения); WO2003083074 (пункт 14 формулы изобретения; страница 61); WO2003018621 (пункт 1 формулы изобретения); WO2003024392 (пункт 2 формулы изобретения; Фиг.93); WO200166689 (пример 6); перекрестные ссылки: LocusID:54894; NP_060233.2; NM_017763_1
(11) STEAP2 (HGNC_8639, IPCA-1, PCANAP1, STAMP1, STEAP2, STMP, ген 1, связанный с раком простаты, белок 1, связанный с раком простаты, шестой трансмембранный эпителиальный антиген простаты 2, шестой трансмембранный белок простаты, номер доступа Genbank AF455138); Lab. Invest. 82 (11): 1573-1582 (2002)); WO2003087306; US2003064397 (пункт 1 формулы изобретения; Фиг.1); WO200272596 (пункт 13 формулы изобретения; страница 54-55); WO200172962 (пункт 1 формулы изобретения; Фиг.4B); WO2003104270 (пункт 11 формулы изобретения); WO2003104270 (пункт 16 формулы изобретения); US2004005598 (пункт 22 формулы изобретения); WO2003042661 (пункт 12 формулы изобретения); US2003060612 (пункт 12 формулы изобретения; Фиг.10); WO200226822 (пункт 23 формулы изобретения; Фиг.2); WO200216429 (пункт 12 формулы изобретения; Фиг.10); перекрестные ссылки: GI:22655488; AAN04080.1; AF455138_1
(12) TrpM4 (BR22450, FLJ20041, TRPM4, TRPM4B, катионный канал с тразиторным рецепторным потенциалом, подсемейство M, элемент 4, номер доступа Genbank NM_017636); Xu, X.Z., et al Proc. Natl. Acad. Sci. U.S.A. 98 (19):10692-10697 (2001), Cell 109 (3):397-407 (2002), J. Biol. Chem. 278 (33):30813-30820 (2003)); US2003143557 (пункт 4 формулы изобретения); WO200040614 (пункт 14 формулы изобретения; страница 100-103); WO200210382 (пункт 1 формулы изобретения; Фиг.9A); WO2003042661 (пункт 12 формулы изобретения); WO200230268 (пункт 27 формулы изобретения; страница 391); US2003219806 (пункт 4 формулы изобретения); WO200162794 (пункт 14 формулы изобретения; Фиг.1A-D); перекрестные ссылки: MIM:606936; NP_060106.2; NM_017636_1
(13) CRIPTO (CR, CR1, CRGF, CRIPTO, TDGF1, фактор роста, полученный из тератокарциномы, номер доступа Genbank NP_003203 или NM_003212); Ciccodicola, A., et al EMBO J. 8 (7): 1987-1991 (1989), Am. J. Hum. Genet. 49 (3):555-565 (1991)); US2003224411 (пункт 1 формулы изобретения); WO2003083041 (пример 1); WO2003034984 (пункт 12 формулы изобретения); WO200288170 (пункт 2 формулы изобретения; страница 52-53); WO2003024392 (пункт 2 формулы изобретения; Фиг.58); WO200216413 (пункт 1 формулы изобретения; страница 94-95, 105); WO200222808 (пункт 2 формулы изобретения; Фиг.1); US5854399 (пример 2; Колонка 17-18); US5792616 (Фиг.2); перекрестные ссылки: MIM:187395; NP_003203.1; NM_003212_1
(14) CD21 (CR2 (рецептор комплемента 2) или C3DR (C3d/рецептор вируса Эпштейна-Барра), или Hs.73792 номер доступа Genbank M26004); Fujisaku et al (1989) J. Biol. Chem. 264 (4):2118-2125); Weis J.J., et al J. Exp. Med. 167, 1047-1066, 1988; Moore M., et al Proc. Natl. Acad. Sci. U.S.A. 84, 9194-9198, 1987; Barel M., et al Mol. Immunol. 35, 1025-1031, 1998; Weis J.J., et al Proc. Natl. Acad. Sci. U.S.A. 83, 5639-5643, 1986; Sinha S.K., et al (1993) J. Immunol. 150, 5311-5320; WO2004045520 (пример 4); US2004005538 (пример 1); WO2003062401 (пункт 9 формулы изобретения); WO2004045520 (пример 4); WO9102536 (Фиг.9.1-9.9); WO2004020595 (пункт 1 формулы изобретения); Accession: P20023; Q13866; Q14212; EMBL; M26004; AAA35786.1.
(15) CD79b (CD79B, CD79β, IGb (связанный с иммуноглобулином бета), B29, номер доступа Genbank NM_000626 или 11038674); Proc. Natl. Acad. Sci. U.S.A. (2003) 100 (7):4126-4131, Blood (2002) 100 (9):3068-3076, Muller et al (1992) Eur. J. Immunol. 22 (6): 1621-1625); WO2004016225 (пункт 2 формулы изобретения, Фиг.140); WO2003087768, US2004101874 (пункт формулы изобретения 1, страница 102); WO2003062401 (пункт 9 формулы изобретения); WO200278524 (пример 2); US2002150573 (пункт 5 формулы изобретения, страница 15); US5644033; WO2003048202 (пункт 1 формулы изобретения, страницы 306 и 309); WO 99/558658, US6534482 (пункт 13 формулы изобретения, Фиг.17A/B); WO200055351 (пункт 11 формулы изобретения, страницы 1145-1146); перекрестные ссылки: MIM:147245; NP_000617.1; NM_000626_1
(16) FcRH2 (IFGP4, IRTA4, SPAP1A (якорный белок фосфатазы 1a, содержащий домен SH2), SPAP1B, SPAP1C, номер доступа Genbank NM_030764, AY358130); Genome Res. 13 (10):2265-2270 (2003), Immunogenetics 54 (2):87-95 (2002), Blood 99 (8):2662-2669 (2002), Proc. Natl. Acad. Sci. U.S.A. 98 (17):9772-9777 (2001), Xu, M.J., et al (2001) Biochem. Biophys. Res. Commun. 280 (3):768-775; WO2004016225 (пункт 2 формулы изобретения); WO2003077836; WO200138490 (пункт 5 формулы изобретения; Фиг.18D-1-18D-2); WO2003097803 (пункт 12 формулы изобретения); WO2003089624 (пункт 25 формулы изобретения); перекрестные ссылки: MIM:606509; NP_110391.2; NM_030764_1
(17) HER2 (ErbB2, номер доступа Genbank М11730); Coussens L., et al Science (1985) 230(4730): 1132-1139); Yamamoto T., et al Nature 319, 230-234, 1986; Semba K., et al Proc. Natl. Acad. Sci. U.S.A. 82, 6497-6501, 1985; Swiercz J.M., et al J. Cell Biol. 165, 869-880, 2004; Kuhns J.J., et al J. Biol. Chem. 274, 36422-36427, 1999; Cho H.-S., et al Nature 421, 756-760, 2003; Ehsani A., et al (1993) Genomics 15, 426-429; WO2004048938 (пример 2); WO2004027049 (Фиг.II); WO2004009622; WO2003081210; WO2003089904 (пункт 9 формулы изобретения); WO2003016475 (пункт 1 формулы изобретения); US2003118592; WO2003008537 (пункт 1 формулы изобретения); WO2003055439 (пункт 29 формулы изобретения; Фиг.1A-B); WO2003025228 (пункт 37 формулы изобретения; Фиг.5C); WO200222636 (пример 13; страница 95-107); WO200212341 (пункт 68 формулы изобретения; Фиг.7); WO200213847 (Страница 71-74); WO200214503 (страница 114-117); WO200153463 (пункт 2 формулы изобретения; страница 41-46); WO200141787 (Страница 15); WO200044899 (пункт 52 формулы изобретения; Фиг.7); WO200020579 (пункт 3 формулы изобретения; Фиг.2); US5869445 (пункт 3 формулы изобретения; Колонка 31-38); WO9630514 (пункт 2 формулы изобретения; страница 56-61); EP1439393 (пункт 7 формулы изобретения); WO2004043361 (пункт 7 формулы изобретения); WO2004022709; WO200100244 (пример 3; Фиг.4); Accession: P04626; EMBL; M11767; AAA35808.1. EMBL; M11761; AAA35808.1
(18) NCA (CEACAM6, номер доступа Genbank M18728); Barnett T., et al Genomics 3, 59-66, 1988; Tawaragi Y., et al Biochem. Biophys. Res. Commun. 150, 89-96, 1988; Strausberg R.L., et al Proc. Natl. Acad. Sci. U.S.A. 99: 16899-16903, 2002; WO2004063709; EP1439393 (пункт 7 формулы изобретения); WO2004044178 (пример 4); WO2004031238; WO2003042661 (пункт 12 формулы изобретения); WO200278524 (пример 2); WO200286443 (пункт 27 формулы изобретения; страница 427); WO200260317 (пункт 2 формулы изобретения); Accession: P40199; Q14920; EMBL; M29541; AAA59915.1. EMBL; M18728
(19) MDP (DPEP1, номер доступа Genbank BC017023); Proc. Natl. Acad. Sci. U.S.A. 99 (26): 16899-16903 (2002)); WO2003016475 (пункт 1 формулы изобретения); WO200264798 (пункт 33 формулы изобретения; страница 85-87); JP05003790 (Фиг.6-8); W09946284 (Фиг.9); перекрестные ссылки: MIM: 179780; AAH17023.1; BC017023_1
(20) IL20Rα (IL20Ra, ZCYTOR7, номер доступа Genbank AF184971); Clark H.F., et al Genome Res. 13, 2265-2270, 2003; Mungall A.J., et al Nature 425, 805-811, 2003; Blumberg H., et al Cell 104, 9-19, 2001; Dumoutier L., et al J. Immunol. 167, 3545-3549, 2001; Parrish-Novak J., et al J. Biol. Chem. 277, 47517-47523, 2002; Pletnev S., et al (2003) Biochemistry 42: 12617-12624; Sheikh F., et al (2004) J. Immunol. 172, 2006-2010; EP1394274 (пример 11); US2004005320 (пример 5); WO2003029262 (Страница 74-75); WO2003002717 (пункт 2 формулы изобретения; страница 63); WO200222153 (страница 45-47); US2002042366 (страница 20-21); WO200146261 (страница 57-59); WO200146232 (страница 63-65); W09837193 (пункт 1 формулы изобретения; страница 55-59); Accession: Q9UHF4; Q6UWA9; Q96SH8; EMBL; AF184971; AAF01320.1.
(21) Brevican (BCAN, BEHAB, номер доступа Genbank AF229053); Gary S.C., et al Gene 256, 139-147, 2000; Clark H.F., et al Genome Res. 13, 2265-2270, 2003; Strausberg R.L., et al Proc. Natl. Acad. Sci. U.S.A. 99, 16899-16903, 2002; US2003186372 (пункт 11 формулы изобретения); US2003186373 (пункт 11 формулы изобретения); US2003119131 (пункт 1 формулы изобретения; Фиг.52); US2003119122 (пункт 1 формулы изобретения; Фиг.52); US2003119126 (пункт 1 формулы изобретения); US2003119121 (пункт 1 формулы изобретения; Фиг.52); US2003119129 (пункт 1 формулы изобретения); US2003119130 (пункт 1 формулы изобретения); US2003119128 (пункт 1 формулы изобретения; Фиг.52); US2003119125 (пункт 1 формулы изобретения); WO2003016475 (пункт 1 формулы изобретения); WO200202634 (пункт 1 формулы изобретения)
(22) EphB2R (DRT, ERK, Hek5, EPHT3, Tyro5, номер доступа Genbank NM_004442); Chan, J. и Watt, V.M., Oncogene 6 (6), 1057-1061 (1991) Oncogene 10 (5):897-905 (1995), Annu. Rev. Neurosci. 21:309-345 (1998), Int. Rev. Cytol. 196: 177-244 (2000)); WO2003042661 (пункт 12 формулы изобретения); WO200053216 (пункт 1 формулы изобретения; страница 41); WO2004065576 (пункт 1 формулы изобретения); WO2004020583 (пункт 9 формулы изобретения); WO2003004529 (страница 128-132); WO200053216 (пункт 1 формулы изобретения; страница 42); перекрестные ссылки: MIM:600997; NP_004433.2; NM_004442_1
(23) ASLG659 (B7h, номер доступа Genbank AX092328); US20040101899 (пункт 2 формулы изобретения); WO2003104399 (пункт 11 формулы изобретения); WO2004000221 (Фиг.3); US2003165504 (пункт 1 формулы изобретения); US2003124140 (пример 2); US2003065143 (Фиг.60); WO2002102235 (пункт 13 формулы изобретения; страница 299); US2003091580 (пример 2); WO200210187 (пункт 6 формулы изобретения; Фиг.10); WO200194641 (пункт 12 формулы изобретения; Фиг.7b); WO200202624 (пункт 13 формулы изобретения; Фиг.1A-1B); US2002034749 (пункт 54 формулы изобретения; страница 45-46); WO200206317 (пример 2; страница 320-321, пункт 34; страница 321-322); WO200271928 (Страница 468-469); WO200202587 (пример 1; Фиг.1); WO200140269 (пример 3; страницы 190-192); WO200036107 (пример 2; страница 205-207); WO2004053079 (пункт 12 формулы изобретения); WO2003004989 (пункт 1 формулы изобретения); WO200271928 (страница 233-234, 452-453); WO 0116318
(24) PSCA (антиген стволовых клеток простаты, номер доступа Genbank AJ297436); Reiter R.E., et al Proc. Natl. Acad. Sci. U.S.A. 95, 1735-1740, 1998; Gu Z., et al Oncogene 19, 1288-1296, 2000; Biochem. Biophys. Res. Commun. (2000) 275(3):783-788; WO2004022709; EP1394274 (пример 11); US2004018553 (пункт формулы изобретения 17); WO2003008537 (пункт 1 формулы изобретения); WO200281646 (пункт 1 формулы изобретения; страница 164); WO2003003906 (пункт 10 формулы изобретения; страница 288); WO200140309 (пример 1; Фиг.17); US2001055751 (пример 1; Фиг.1b); WO200032752 (пункт 18 формулы изобретения; Фиг.1); WO9851805 (пункт 17 формулы изобретения; страница 97); WO9851824 (пункт 10 формулы изобретения; страница 94); WO9840403 (пункт 2 формулы изобретения; Фиг.1B); Accession: О43653; EMBL; AF043498; AAC39607.1
(25) GEDA (номер доступа Genbank AY260763); AAP14954, белок, подобный партнеру по слиянию липомы HMGIC /pid=AAP14954.1-Homo sapiens (человека); WO2003054152 (пункт 20 формулы изобретения); WO2003000842 (пункт 1 формулы изобретения); WO2003023013 (пример 3, пункт 20); US2003194704 (пункт 45 формулы изобретения); перекрестные ссылки: GI:30102449; AAP14954.1; AY260763_1
(26) BAFF-R (рецептор фактора активирования B лимфоцитов, рецептор 3 BLyS, BR3, номер доступа Genbank AF116456); рецептор BAFF/pid=NP_443177.1 - Homo sapiens: Thompson, J.S., et al Science 293 (5537), 2108-2111 (2001); WO2004058309; WO2004011611; WO2003045422 (пример; страница 32-33); WO2003014294 (пункт 35 формулы изобретения; Фиг.6B); WO2003035846 (пункт 70 формулы изобретения; страница 615-616); WO200294852 (Колонка 136-137); WO200238766 (пункт 3 формулы изобретения; страница 133); WO200224909 (пример 3; Фиг.3); перекрестные ссылки: MIM:606269; NP_443177.1; NM_052945_1; AF132600
(27) CD22 (изоформа CD22-B рецептора B лимфоцитов, BL-CAM, Lyb-8, Lyb8, SIGLEC-2, FLJ22814, номер доступа Genbank AK026467); Wilson et al (1991) J. Exp. Med. 173: 137-146; WO2003072036 (пункт 1 формулы изобретения; Фиг.1); перекрестные ссылки: MIM:107266; NP_001762.1; NM_001771_1
(28) CD79a (CD79A, CD79α, связанный с иммуноглобулином альфа, специфичный к B лимфоцитам белок, который ковалентно взаимодействует с Ig бета (CD79B) и образует комплекс на поверхности с молекулами Ig M, передает сигнал, вовлеченный в дифференциацию B лимфоцитов), pI: 4,84, MW: 25028 TM: 2 [P] Gene Chromosome: 19q13.2, номер доступа Genbank NP_001774.10); WO2003088808, US20030228319; WO2003062401 (пункт 9 формулы изобретения); US2002150573 (пункт 4 формулы изобретения, страницы 13-14); W09958658 (пункт 13 формулы изобретения, Фиг.16); WO9207574 (Фиг.1); US5644033; Ha et al (1992) J. Immunol. 148(5): 126-1531; Mueller et al (1992) Eur. J. Biochem. 22: 1621-1625; Hashimoto et al (1994) Immunogenetics 40(4):287-295; Preud’homme et al (1992) Clin. Exp. Immunol. 90(1):141-146; Yu et al (1992) J. Immunol. 148(2) 633-637; Sakaguchi et al (1988) EMBO J. 7(11):3457-3464
(29) CXCR5 (рецептор 1 лимфомы Беркитта, связанный с белком G рецептор, который активируется с помощью хемокина CXCL13, функционирует при миграции лимфоцитов и при гуморальной защите, играют некоторую роль при инфекции ВИЧ-2 и, возможно, при развитии СПИДа, при лимфоме, миеломе и лейкемии); 372 aa, pI: 8,54 MW: 41959 TM: 7 [P] Gene Chromosome: 11q23.3, номер доступа Genbank NP_001707.1); WO2004040000; WO2004015426; US2003105292 (пример 2); US6555339 (пример 2); WO200261087 (Фиг.1); WO200157188 (пункт 20 формулы изобретения, страница 269); WO200172830 (страницы 12-13); WO200022129 (пример 1, страницы 152-153, пример 2, страницы 254-256); W09928468 (пункт 1 формулы изобретения, страница 38); US5440021 (пример 2, Колонка 49-52); W09428931 (страницы 56-58); W09217497 (пункт 7 формулы изобретения, Фиг.5); Dobner et al (1992) Eur. J. Immunol. 22:2795-2799; Barella et al (1995) Biochem. J. 309:773-779
(30) HLA-DOB (Бета субъединица молекулы MHC класса II (антигена Ia), которая связывает пептиды и презентирует их для T лимфоцитов CD4+); 273 aa, pI: 6,56, MW: 30820. TM: 1 [P] Gene Chromosome: 6p21.3, номер доступа Genbank NP_002111.1); Tonnelle et al (1985) EMBO J. 4(11):2839-2847; Jonsson et al (1989) Immunogenetics 29(6):411-413; Beck et al (1992) J. Mol. Biol. 228:433-441; Strausberg et al (2002) Proc. Natl. Acad. Sci USA 99: 16899-16903; Servenius et al (1987) J. Biol. Chem. 262:8759-8766; Beck et al (1996) J. Mol. Biol. 255: 1-13; Naruse et al (2002) Tissue Antigenes 59:512-519; W09958658 (пункт 13 формулы изобретения, Фиг.15); US6153408 (Колонка 35-38); US5976551 (Колонка 168-170); US6011146 (Колонка 145-146); Kasahara et al (1989) Immunogenetics 30(l):66-68; Larhammar et al (1985) J. Biol. Chem. 260(26): 14111-14119
(31) P2X5 (ионный канал 5, управляемый лигандом пуринергического рецептора P2X, ионный канал, управляемый внеклеточной ATP, может быть вовлечен в синаптическую передачу и нейрогенез, его дефицит может вносить вклад в патофизиологию идеопатической нестабильности детрузора); 422 aa), pI: 7,63, MW: 47206 TM: 1 [P] Gene Chromosome: 17p13.3, номер доступа Genbank NP_002552.2); Le et al (1997) FEBS Lett. 418(1-2): 195-199; WO2004047749; WO2003072035 (пункт 10 формулы изобретения); Touchman et al (2000) Genome Res. 10: 165-173; WO200222660 (пункт 20 формулы изобретения); WO2003093444 (пункт 1 формулы изобретения); WO2003087768 (пункт 1 формулы изобретения); WO2003029277 (страница 82)
(32) CD72 (антиген CD72 дифференциации B клеток, Lyb-2); 359 aa, pI: 8,366, MW: 40225, TM: 1 [P] Gene Chromosome: 9pl3.3, номер доступа Genbank. NP_001773.1); WO2004042346 (пункт 65 формулы изобретения); WO2003026493 (страницы 51-52, 57-58); WO200075655 (страницы 105-106); Von Hoegen et al (1990) J. Immunol. 144(12):4870-4877; Strausberg et al (2002) Proc. Natl. Acad. Sci USA 99: 16899-16903.
(33) LY64 (антиген 64 лимфоцитов (RP105), тип I, мембранный белок семейства, богатого повторяющимися единицами лейцина (LRR), он регулирует активацию и апоптоз B клеток, потеря его функционирования ассоциируется с увеличением активности заболевания у пациентов с системной красной волчанкой); 661 aa, pI: 6,20, MW: 74147 TM: 1 [P] Gene Chromosome: 5ql2, номер доступа Genbank. NP_005573.1); US2002193567; WO9707198 (пункт 11 формулы изобретения, страницы 39-42); Miura et al (1996) Genomics 38(3):299-304; Miura et al (1998) Blood 92:2815-2822; WO2003083047; WO9744452 (пункт 8 формулы изобретения, страницы 57-61); WO200012130 (страницы 24-26)
(34) FcRH1 (белок 1, подобный Fc-рецептору, предполагаемый рецептор для Fc домена иммуноглобулина, который содержит домены типа C2, подобные Ig и ITAM, может играть роль в дифференциации B лимфоцитов); 429 aa, pI: 5,28, MW: 46925 TM: 1 [P] Gene Chromosome: Iq21-lq22, номер доступа Genbank NP_443170.1); WO2003077836; WO200138490 (пункт 6 формулы изобретения, Фиг.18E-1-18-E-2); Davis et al (2001) Proc. Natl. Acad. Sci USA 98(17):9772-9777; WO2003089624 (пункт 8 формулы изобретения); EP1347046 (пункт 1 формулы изобретения); WO2003089624 (пункт 7 формулы изобретения)
(35) IRTA2 (ген, связанный 2 с транслокацией рецепторов суперсемейства иммуноглобулинов, вероятный иммунорецептор с возможной ролью при развитии B клеток и лимфомогенезе; дерегуляция гена посредством транслокации происходит при некоторых злокачественных заболеваниях, связанных с B клетками); 977 aa, pI: 6,88, MW: 106468, TM: 1 [P] Gene Chromosome: 1q21, номер доступа Genbank Human:AF343662, AF343663, AF343664, AF343665, AF369794, AF397453, AK090423, AK090475, AL834187, AY358085; Mouse:AK089756, AY158090, AY506558; NP_112571.1; WO2003024392 (пункт 2 формулы изобретения, Фиг.97); Nakayama et al (2000) Biochem. Biophys. Res. Commun. 277(1): 124-127; WO2003077836; WO200138490 (пункт 3 формулы изобретения, Фиг.18B-1-18B-2)
(36) TENB2 (TMEFF2, томорегулин, TPEF, HPP1, TR, вероятный трансмембранный протеогликан, родственный семейству EGF/херегулинов факторов роста и фоллистатину); 374 aa, NCBI Accession: AAD55776, AAF91397, AAG49451, NCBI RefSeq: NP_057276; NCBI Gene: 23671; OMIM: 605734; SwissProt Q9UIK5; номер доступа Genbank AF179274; AY358907, CAF85723, CQ782436; WO2004074320; JP2004113151; WO2003042661; WO2003009814; EP1295944 (страницы 69-70); WO200230268 (страница 329); WO200190304; US2004249130; US2004022727; WO2004063355; US2004197325; US2003232350; US2004005563; US2003124579; Horie et al (2000) Genomics 67: 146-152; Uchida et al (1999) Biochem. Biophys. Res. Commun. 266:593-602; Liang et al (2000) Cancer Res. 60:4907-12; Glynne-Jones et al (2001) Int J Cancer. Oct 15; 94(2): 178-84.
Исходное антитело может также представлять собой слитый белок, содержащий последовательность пептидов связывания с альбумином (ABP) (Dennis et al. (2002) "Albumin Binding As A General Strategy For Improving The Pharmacokinetics Of Proteins" J Biol Chem. 277:35035-35043; WO 01/45746). Антитела по настоящему изобретению включают слитые белки с последовательностями ABP, рассмотренные: (i) Dennis et al (2002) J Biol Chem. 277:35035-35043 at Tables III and IV, page 35038; (ii) US 20040001827 at [0076] и (iii) WO 01/45746 at pages 12-13, и все они включены в настоящий документ в качестве ссылки.
Мутагенез
Кодирование ДНК варианта аминокислотной последовательности исходного полипептида осуществляют с помощью различных способов, известных в данной области. Эти способы включают, но, не ограничиваясь этим, получение с помощью сайт-направленного (или медиируемого олигонуклеотидами) мутагенеза, PCR мутагенеза, и кассетного мутагенеза полученной ранее ДНК, кодирующей полипептид. Варианты рекомбинантных антител могут конструироваться также с помощью манипуляций фрагментами рестрикции или посредством PCR с перекрыванием удлиняющих сегментов с синтетическими олигонуклеотидами. Мутагенные праймеры кодируют замену (замены) цистеиновых кодонов. Стандартные технологии мутагенеза можно использовать для генерирования ДНК, кодирующей такие мутантные, полученные с помощью генной инженерии антитела с цистеиновыми заменами. Общие инструкции можно найти в Sambrook et al Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1989; и Ausubel et al Current Protocols in Molecular Biology, Greene Publishing and Wiley-Interscience, New York, N.Y., 1993.
Сайт-направленный мутагенез представляет собой один из способов получения вариантов с заменой, то есть мутантных белков. Это технология хорошо известна в данной области (смотри например, Carter (1985) et al Nucleic Acids Res. 13:4431-4443; Ho et al (1989) Gene (Amst.) 77:51-59; and Kunkel et al (1987) Proc. Natl. Acad. Sci. USA 82:488). Коротко, при осуществлении сайт-направленного мутагенеза ДНК, исходную ДНК изменяют посредством, сначала, гибридизации олигонуклеотида, кодирующего желаемую мутацию одинарной нити такой исходной ДНК. После гибридизации, используют ДНК полимеразу для синтеза всей второй нити, используя гибридизованный олигонуклеотид как праймер и используя одинарную нить исходной ДНК в качестве шаблона. Таким образом, олигонуклеотид, кодирующий желаемую мутацию, вводится в получаемую двухнитевую ДНК. Сайт-направленный мутагенез может быть осуществлен внутри гена, экспрессирующего белок, который должен мутагенизироваться в плазмиде экспрессии, и получаемая плазмида может секвенироваться для подтверждения введения желаемых мутаций с заменой цистеином (Liu et al (1998) J. Biol. Chem. 273:20252-20260). Протоколы и форматы сайт-направленного мутагенеза, включают те, которые доступны коммерчески, например, QuikChange® Multi Site-Directed Mutagenesis Kit (Stratagene, La Jolla, CA).
PCR мутагенез также подходит для получения вариантов аминокислотных последовательностей исходного полипептида. Смотри Higuchi, (1990), PCR Protocols, pp.177-183, Academic Press; Ito et al (1991) Gene 102:67-70; Bernhard et al (1994) Bioconjugate Chem. 5:126-132; и Vallette et al (1989) Nuc. Acids Res. 17:723-733. Коротко, когда малые количества шаблонной ДНК используют в качестве исходного материала для PCR, праймеры, которые слегка отличаются по последовательности от соответствующей области в шаблонной ДНК, можно использовать для генерирования относительно больших количеств конкретного фрагмента ДНК, который отличается от шаблонной последовательности только в положениях, где праймеры отличаются от шаблона.
Другой способ получения вариантов, кассетный мутагенез, основан на технологии, описанной Wells et al (1985) Gene 34:315-323. Исходный материал представляет собой плазмиду (или другой вектор), содержащий исходную ДНК полипептидов, которая должна мутировать. Кодон (кодоны) в исходной ДНК, которая должна мутировать, идентифицируют. Должен присутствовать единственный сайт рестрикции эндонуклеазы на каждой стороне идентифицированного сайта (сайтов) мутации. Если таких сайтов рестрикции не существует, они могут генерироваться с использованием описанного выше способа медиируемого олигонуклеотидами мутагенеза, для введения их в соответствующие положения в исходной ДНК полипептидов. ДНК плазмиды разрезают на этих активных сайтах для ее линеаризации. Двухнитевый олигонуклеотид, кодирующий последовательность ДНК между сайтами рестрикции, но содержащий желаемую мутацию (мутации), синтезируют с использованием стандартных процедур, где две нити олигонуклеотида синтезируют отдельно, а затем гибридизируют вместе с использованием стандартных методик. Олигонуклеотиды получают посредством способа фосфорамидитного синтеза (патент США № 4415732; патент США № 4458066; Beaucage, S. and Iyer, R. (1992) "Advances in the synthesis of oligonucleotides by the phosphoramidite approach", Tetrahedron 48:2223-2311). Этот двухнитевый олигонуклеотид упоминается как кассета. Эту кассету конструируют с получением концов 5’ и 3’, которые совместимы с концами линеаризованной плазмиды, так что она может непосредственно лигироваться с плазмидой. Эта плазмида теперь содержит последовательность мутировавшей ДНК. Мутантная ДНК, содержащая кодированные цистеиновые замены, может быть подтверждена с помощью секвенирования ДНК.
Отдельные мутации также генерируются с помощью направленного мутагенеза олигонуклеотидов, с использованием двухнитевой плазмиды ДНК в качестве шаблона, с помощью мутагенеза на основе PCR (Sambrook and Russel, (2001) Molecular Cloning: A Laboratory Manual, 3rd edition; Zoller et al (1983) Methods Enzymol. 100:468-500; Zoller, M.J. and Smith, M. (1982) Nucl. Acids Res.10:6487-6500).
В настоящем изобретении, hu4D5Fabv8, отображаемое на фаге M13 (Gerstner et al (2002) "Sequence Plasticity In The Antigen-Binding Site Of A Therapeutic Anti-HER2 Antibody", J Mol Biol. 321:851-62), используют для экспериментов в качестве модельной системы. Цистеиновые мутации вводят в конструкты hu4D5Fabv8-фаг, hu4D5Fabv8 и ABP-hu4D5Fabv8. Препараты hu4D5-ThioFab-фаг получают с использованием способа преципитации в полиэтиленгликоле (PEG), как описано ранее (Lowman, Henry B. (1998) Methods in Molecular Biology (Totowa, New Jersey) 87 (Combinatorial Peptide Library Protocol) 249-264).
Анализ PHESELECTOR
Анализ PHESELECTOR (ELISA фагов для выбора реакционноспособных тиолов) делает возможным детектирование реакционноспособных цистеиновых групп на антителах в фаговом формате ELISA. Способ нанесения в виде покрытия белка (например, антитела), представляющего интерес, на поверхности лунок, после инкубирования вместе с фаговыми частицами, а затем с меченным вторичным HRP антителом с детектированием коэффициента поглощения подробно описан в Примере 2. Мутантные белки, отображаемые на фаге, могут просматриваться быстрым, устойчивым и высокопроизводительным способом. Библиотеки полученных с помощью генной инженерии антител с цистеиновыми заменами могут быть получены и подвергнуты селекции относительно связывания с использованием такого же подхода для идентификации соответствующим образом реакционноспособных сайтов введения свободных Cys из случайных библиотек белок-фаг для антител или других белков. Эта методика включает взаимодействие мутантных белков с цистеиновыми заменами, отображаемых на фаге, с реагентом с аффинностью или с репортерной группой, которая также является реакционноспособной по отношению к тиолу. На фигуре 8 проиллюстрирован анализ PHESELECTOR с помощью схематического представления, изображающего связывание Fab или ThioFab с HER2 (вверху) и биотинилированного ThioFab со стрептавидином (внизу).
Экспрессия и очистка белков
ДНК, кодирующую полученные с помощью генной инженерии антитела с цистеиновыми заменами, легко изолируют и секвенируют с использованием обычных процедур (например, посредством использования олигонуклеотидных зондов, которые способны специфично связываться с генами, кодирующими тяжелые и легкие цепи антител мышей). Клетки гибридомы служат в качестве источника такой ДНК. После изоляции, ДНК может помещаться в векторы экспрессии, которые затем трансфицируют в клетки хозяева, такие как клетки E. coli, клетки COS обезьян, клетки яичников китайского хомячка (CHO), или в другие клетки хозяева млекопитающих, такие как клетки миеломы (патент США № 5807715; патент США № 2005/0048572; патент США № 2004/0229310), которые в других случаях не продуцируют белок антитела, для получения синтеза моноклональных антител в рекомбинантных клетках хозяевах. Выходы полученных с помощью генной инженерии антител hu4D5Fabv8 с цистеиновыми заменами сходны с диким типом hu4D5Fabv8. Обзорные статьи по рекомбинантной экспрессии в бактериях ДНК, кодирующей антитело, включают Skerra et al (1993) Curr. Opinion in Immunol. 5:256-262 и Pluckthun (1992) Immunol. Revs. 130: 151-188.
После конструирования и селекции, полученные с помощью генной инженерии антитела с цистеиновыми заменами, например, ThioFab, с очень реакционноспособными непарными Cys остатками, могут быть получены посредством: (i) экспрессии в бактериальной системе, например, E. coli, или в системе с клеточной культурой млекопитающих (WO 01/00245), например, клеток яичников китайского хомячка (CHO); и (ii) очистки с использованием обычных способов очистки белков (Lowman et al (1991) J. Biol. Chem. 266(17): 10982-10988).
ThioFab экспрессируют при индуцировании в 34B8, несупрессорном штамме E. coli (Baca et al (1997) Journal Biological Chemistry 272(16):10678-84). Смотри Пример 3a. Собранную лепешку из клеток повторно суспендируют в PBS (фосфатно-солевой буферный раствор), общий лизис клеток осуществляют посредством прохождения через микрофлуидизатор и ThioFab очищают с помощью аффинной хроматографии на SEPHAROSE™ с белком G (Amersham). ThioFab конъюгируют с биотином-PEO-малеимидом, как описано выше, и биотинилированные ThioFab дополнительно очищают с помощью гель-фильтрационной хроматографии на Superdex-200™ (Amersham), которая устраняет свободный биотин-PEO-малеимид и олигомерную фракцию ThioFab.
Масс-спектрометрический анализ
Анализ с помощью жидкостной хроматографии и масс- спектрометрии с электрораспылительной ионизацией (LC-ESI-MS) используют для точного определения молекулярной массы Fab, конъюгированного с биотином (Cole, R.B. Electro Spray Ionization Mass Spectrometry: Fundamentals, Instrumentation and Applications. (1997) Wiley, New York). Аминокислотную последовательность биотинилированного пептида hu4D5Fabv8 (A121C) определяют с помощью обработки трипсином с последующим тандемным анализом LC-ESI-MS (таблица 4, пример 3b).
Fab фрагмент антитела hu4D5Fabv8 содержит примерно 445 аминокислотных остатков, включая 10 Cys остатков (пять на легкой и пять на тяжелой цепи). Структура высокого разрешения вариабельного фрагмента гуманизированного 4D5 (Fv4D5) является установленной, смотри: Eigenbrot et al "X-Ray Structures Of The Antigen-Binding Domains From Three Variants Of Humanized Anti-P185her2 Antibody 4D5 And Comparison With Molecular Modeling" (1993) J Mol Biol. 229:969-995). Все Cys остатки присутствуют в форме дисульфидных связей, по этой причине эти остатки не имеют никаких реакционноспособных тиольных групп для конъюгирования с лекарственным средством-малеимидом (без обработки восстанавливающим средством). Следовательно, вновь получаемые с помощью генной инженерии Cys остатки, могут оставаться непарными и способны взаимодействовать, то есть конъюгироваться, с электрофильным линкерным реагентом или c промежуточным соединением лекарственное средство-линкер, таким как лекарственное средство-малеимид. Фигура 1A показывает трехмерное представление фрагмента антитела hu4D5Fabv8, полученное с помощью рентгеновских координат центров атомов в элементарной ячейке кристалла. Структурные положения полученных с помощью генной инженерии Cys остатков тяжелых и легких цепей пронумерованы в соответствии с системой последовательной нумерации. Эта система последовательной нумерации коррелирует с системой нумерации Kabat (Kabat et al, (1991) Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD) для варианта 4d5v7fabH трастузумаба в соответствии с Фигурой 1B, которая показывает схему последовательной нумерации (верхняя строка), начиная с N-конца, которая отличается от схемы нумерации Kabat (нижняя строка) по вставкам, отмеченным как a,b,c. Используя систему нумерации Kabat, реальная линейная аминокислотная последовательность может содержать меньшее количество аминокислот или дополнительные аминокислоты, соответствующие сокращению или вставке в FR или CDR вариабельного домена. Активные сайты вариантов полученных с помощью генной инженерии тяжелых цепей с цистеиновыми заменами идентифицируют посредством схем последовательной нумерации и нумерации Kabat на следующей диаграмме:
Cys мутантные Fab фагмида M13 (Фигуры 3A и 3B) могут быстро просматриваться по сравнению с белками Fab. Связывание фагмид-ThioFab с антигеном и со стрептавидином можно исследовать посредством нанесения покрытия из HER2 и стрептавидина, соответственно, на планшеты ELISA с последующим зондированием с помощью анти-Fab-HRP (пероксидаза хрена), как описано в Примере 2 и изображено на фигуре 8. Этот способ делает возможным одновременное отслеживание воздействия связывания антигена также и на реакционноспособность тиольной группы со стороны полученного с помощью генной инженерии Cys остатка/конъюгированной молекулы биотина. Также, способ может применяться к отслеживанию реакционноспособных тиольных групп с помощью любого белка, отображенного на фаге M13. Конъюгированные или неконъюгированные фагмид-ThioFab очищают с помощью простой преципитации в PEG.
Связывающий антиген фрагмент гуманизированного 4D5 (hu4D5Fab) хорошо экспрессируется в E. Coli и отображается на бактериофаге (Garrard et al (1993) Gene 128:103-109). Fab фрагмент антитела hu4D5Fabv8 отображают на фаге M13 как на модельной системе в анализе на основе ELISA для зондирования реакционноспособности тиола. На фигуре 8 представлено графическое представление анализа PHESELECTOR, изображающее связывание биотинилированного фага ThioFab и антитела анти-фаг HRP с HER2 (вверху) и стрептавидином (внизу). Пять аминокислотных остатков (L-Ala43, H-Ala40, H-Ser119, H-Ala121 и H-Ser122) сначала выбирают по информации о структуре кристалла, как удаленные от поверхности связывания антигена (Eigenbrot et al. (1993) J Mol Biol. 229:969-995). Рентгеновскую кристаллическую структуру, соответствующую базе данных для белков, обозначают как 1FVC. Cys остатки получают с помощью генной инженерии в этих положениях с помощью сайт-направленного мутагенеза. Препараты ThioFab-фаг выделяются и взаимодействуют с реагентом для биотинилирования.
Конъюгированные и неконъюгированные с биотином варианты исследуют на связывание HER2 и стрептавидина, используя анализ PHESELECTOR на основе ELISA (Фигура 8, пример 2) с помощью конъюгированного с HRP (пероксидаза хрена) антитела анти-фаг. Взаимодействие небиотинилированного фаг-hu4D5Fabv8 (Фигура 2A) и биотинилированного фаг-hu4D5Fabv8 (Фигура 2B) с BSA (белые столбики), HER2 (заштрихованные столбики) или стрептавидином (черные столбики) отслеживают с помощью антитела анти-M13- пероксидаза хрена(HRP) посредством осуществления стандартной реакции с HRP и измерения коэффициента поглощения на 450 нм. Поглощение, производимое оборотом колориметрического субстрата, измеряют на 450 нм. Реакционноспособность ThioFab с HER2 измеряет связывание антигена. Реакционноспособность ThioFab со стрептавидином измеряет степень биотинилирования. Реакционноспособность ThioFab с BSA представляет собой отрицательный контроль для неспецифичного взаимодействия. Как видно на фигуре 2A, все варианты ThioFab-фаг имеют сходное связывание с HER2 по сравнению со связыванием hu4D5Fabv8-фаг дикого типа. Кроме того, конъюгирование с биотином не влияет на связывание ThioFab с HER2 (Фигура 2B).
Неожиданно и внезапно, образцы ThioFab-фаг показывают различные уровни активности связывания стрептавидина. Из всех исследуемых конъюгатов фаг-ThioFab, полученное с помощью генной инженерии антитело с цистеиновыми заменами A121C демонстрирует максимальную реакционноспособность по отношению к тиолу. Даже если hu4D5Fabv8-фаг дикого типа инкубируют с такими же количествами биотина-малеимида, этот фаг имеет слабое связывание стрептавидина, показывая, что существующие ранее цистеиновые остатки (вовлеченные в образование дисульфидных связей) из hu4D5Fabv8 и белков оболочки фага M13 не влияют на сайт-специфичное конъюгирование биотина-малеимида. Эти результаты демонстрируют, что анализ ELISA фага можно успешно использовать для скрининга реакционноспособных тиольных групп на поверхности Fab.
Анализ PHESELECTOR делает возможным скрининг реакционноспособных тиольных групп в антителах. Идентификация варианта A121C с помощью этого способа является иллюстративной. Молекула Fab целиком может эффективно исследоваться для идентификации дополнительных вариантов ThioFab с реакционноспособными тиольными группами. Параметр, относительную доступную поверхность, используют для идентификации и количественного определения доступности растворителя для аминокислотных остатков в полипептиде. Доступность поверхности может быть выражена как площадь поверхность (Ǻ2), которая может вступать в контакт с молекулой растворителя, например, воды. Занятое водой пространство представляет собой примерно сферу радиусом 1,4 Ǻ. Программное обеспечение является доступным для всех или лицензируемым (Secretary to CCP4, Daresbury Laboratory, Warrington, WA4 4 AD, United Kingdom, Fax: (+44) 1925 603825, или через интернет: www.ccp4.ac.uk/dist/html/INDEX.html), как пакет кристаллографических программ CCP4 Suite, которые используют алгоритмы для вычисления доступности поверхности для каждой аминокислоты белка с известными координатами, полученными с помощью рентгеновской кристаллографии ("The CCP4 Suite: Programs for Protein Crystallography" (1994) Acta. Cryst. D50:760-763). Два иллюстративных модуля программного обеспечения, которые осуществляют вычисления доступности поверхности, представляют собой "AREAIMOL" и "SURFACE", на основе алгоритмов B.Lee and F.M.Richards (1971) J.Mol.Biol. 55:379-400. AREAIMOL определяет доступную для растворителя поверхность белка как положение центра сферы зонда (представляющий молекулу растворителя), когда она катится по Ван дер Ваальсовой поверхности белка. AREAIMOL вычисляет площадь поверхности доступной для растворителя посредством генерирования точек поверхности на сфере, развернутой вокруг каждого атома (на расстоянии от центра атома, равном сумме радиусов атома и зонда), и исключения точек, которые лежат внутри эквивалентных сфер, связанных с соседними атомами. AREAIMOL находит площади, доступные для растворителя, для атомов в файле координат PDB, и складывает доступную площадь по остатку, по цепи и для молекулы в целом. Доступные площади (или разности площадей) для отдельных атомов могут быть записаны в выходной файл псевдо-PDB. AREAIMOL предполагает единственный радиус для каждого элемента и распознает только ограниченное количество различных элементов. Неизвестные типы атомов (то есть те, которых нет во внутренней базе данных AREAIMOL) будут получать по умолчанию радиус 1,8 Ǻ. Список распознаваемых атомов представляет собой:
AREAIMOL и SURFACE дают абсолютные доступности, то есть количество квадратных ангстрем (Ǻ). Относительную доступность поверхности вычисляют посредством сравнения со стандартным состоянием, релевантным для аминокислоты в полипептиде. Эталонное состояние представляет собой трипептид Gly-X-Gly, где X представляет собой аминокислоту, представляющую интерес, и эталонное состояние должно представлять собой ‘растянутую’ конформацию, то есть конформацию, сходную с конформацией в бета-нитях. Растянутая конформация доводит до максимума доступность X. Вычисленную доступную площадь делят на доступную площадь в эталонном состоянии трипептида Gly-X-Gly и сообщают отношение, которое представляет собой относительную доступность. Процентная доступность представляет собой относительную доступность, умноженную на 100.
Другой иллюстративный алгоритм для вычисления доступности поверхности основывается на модуле SOLV программы xsae (Broger, C, F. Hoffman-LaRoche, Basel), которая вычисляет относительную доступность аминокислотного остатка по отношению к сферической молекуле воды на основании рентгеновских координат полипептида.
Относительную доступность поверхности каждой аминокислоты в hu4D5Fabv7 вычисляют с использованием информации о структуре кристалла (Eigenbrot et al. (1993) J Mol Biol. 229:969-995; патент США патент США № 7521541). Следующие два критерия применяют для идентификации остатков hu4D5Fabv8, которые могут с помощью генной инженерии быть заменены Cys остатками:
1. Аминокислотные остатки, которые полностью перекрыты, то есть остатки, имеющие меньше 10% относительную доступность поверхности, исключаются. Имеются 134 (легкая цепь) и 151 (тяжелая цепь) остатков hu4D5Fabv8, которые являются доступными более чем на 10% (относительная доступность поверхности). Десять наиболее доступных остатков Ser, Ala и Val выбирают из-за их близкого структурного сходства с Cys по сравнению с другими аминокислотами, вводя только минимальные структурные ограничения в антитело со стороны вновь введенных с помощью генной инженерии Cys. Другие сайты для замены цистеином также могут быть обнаружены с помощью скрининга, и они могут быть полезными для конъюгирования.
2. Остатки сортируют на основе их роли в функциональных и структурных взаимодействиях Fab. Остатки, которые не вовлечены во взаимодействие с антигеном и находятся далеко от существующих дисульфидных связей, выбирают дополнительно. Вновь введенные с помощью генной инженерии Cys остатки должны отличаться от тех, которые связывают антиген, и не влиять на них или не мешать спариванию с цистеиновыми остатками, вовлеченными в образование дисульфидных связей.
Реакционноспособность тиолов может обобщаться на любое антитело, где замещение аминокислот реакционноспособными цистеиновыми аминокислотами может осуществляться в пределах, в легкой цепи, выбранных из: от L-10 до L-20; от L-38 до L-48; от L-105 до L-115; от L-139 до L-149; от L-163 до L-173; и в пределах, в тяжелой цепи, выбранных из: от H-35 до H-45; от H-83 до H-93; от H-114 до H-127; и от H-170 до H-184, и в области Fc в пределах, выбранных из H-268 - H-291; H-319 - H-344; H-370 - H-380; и H-395 - H-405.
Реакционноспособность тиолов может также обобщаться на определенные домены антитела, такие как константный домен легкой цепи (CL) и константные домены тяжелых цепей, CH1, CH2 и CH3. Цистеиновые замены, приводящие к значениям реакционноспособности тиолов примерно от 0,8 и выше, могут осуществляться в константных доменах α, δ, ε, γ и μ тяжелой цепи интактных антител: IgA, IgD, IgE, IgG и IgM, соответственно, включая IgG подклассы: IgG1, IgG2, IgG3, IgG4, IgA и IgA2.
Из данных по кристаллическим структурам ясно, что выбранные мутанты 10 Cys находятся далеко от сайта объединения с антигеном, такого как граница раздела с HER2, в этом случае. Эти мутанты могут исследоваться экспериментально относительно опосредствованных воздействий на функциональные взаимодействия. Реакционноспособность тиолов для всех Cys вариантов Fab измеряют и вычисляют, как описано в Примерах 1 и 2, и представлено в Таблице 1. Остатки L-V15C, L-V110C, H-A88C и H-A121C имеют реакционноспособные и стабильные тиольные группы (Фигуры 3A и 3B). Мутанты V15C, V110C, A144C, S168C представляют собой Cys варианты легкой цепи. Мутанты A88C, A121C, A175C, S179C представляют собой Cys варианты тяжелой цепи. Неожиданно и внезапным является, что активные сайты с высокой относительной доступностью поверхности не дают наивысшей реакционноспособности тиолов, как вычислено с помощью анализа PHESELECTOR (Таблица 1). Другими словами, относительная доступность поверхности (Фигура 1A) не коррелирует с реакционноспособностью тиолов (Таблица 1). На самом деле, Cys остатки, полученные с помощью генной инженерии, на активных сайтах с умеренной доступностью поверхности от 20% до 80% (Фигура 4A), или частично экспонируемые сайты, подобные остаткам Ala или Val, демонстрируют лучшую реакционноспособность тиолов, то есть >0,6, (Фигура 3B, Таблица 1), чем Cys остатки, введенные на остатках Ser, что делает необходимым использование анализа PHESELECTOR при скрининге реакционноспособных сайтов тиолов, поскольку информация о кристаллической структуре сама по себе не является достаточной для выбора этих сайтов (Фигура 3B и 4A).
Данные по реакционноспособности тиолов показаны на фигурах 3A и 3B для аминокислотных остатков Cys мутантов 4D5 ThioFab: (3A) не-биотинилированных (контроль) и (3B) биотинилированных фаг-ThioFab. Реакционноспособные тиольные группы на поверхности антитело/Fab идентифицируют с помощью анализов PHESELECTOR на взаимодействие небиотинилированный фаг-hu4D5Fabv8 (3A) и биотинилированный фаг-hu4D5Fabv8 (3B) с BSA (белые столбики), HER2 (заштрихованные столбики) или стрептавидином (черные столбики). Анализ осуществляют, как описано в Примере 2. Варианты легких цепей находятся на левой стороне, а варианты с тяжелыми цепями находятся на правой стороне. Связывание небиотинилированных Cys мутантов 4D5 ThioFab является низким, как и ожидалось, но сильное связывание с HER2 сохраняется. Отношение связывания с стрептавидином и с HER2 биотинилированных Cys мутантов 4D5 ThioFab дает значения реакционноспособности тиольных групп в Таблице 1. Фоновое поглощение на 450 нм или малые количества неспецифично связанных белков для биотинилированных Cys мутантов 4D5 ThioFab с BSA также видно на Фигуре 3B. Значения относительной доступности поверхности для выбранных аминокислотных остатков, которые заменяют Cys остатком, показаны на фигуре 4A. Относительную доступность поверхности вычисляют из доступной структуры hu4D5Fabv7 (Eigenbrot et al. (1993) J Mol Biol. 229:969-995). Конформационные параметры структур hu4D5Fabv7 и hu4D5Fabv8 очень хорошо согласуются и делают возможным определение любой корреляции между вычислениями относительной доступности поверхности hu4D5Fabv7 и реакционноспособности тиолов мутантов с цистеиновыми заменами hu4D5Fabv8. Измеренная реакционноспособность тиолов Cys остатков фаг-ThioFab, введенных на частично экспонируемых остатках (Ala или Val), показывает, что они имеют лучшую реакционноспособность тиолов по сравнению с теми, которые вводят на остатках Ser (Таблица 1). По Cys мутантам ThioFab в Таблице 1 можно увидеть, что имеется только слабая корреляция между значениями реакционноспособности тио групп и относительной доступностью поверхности, или ее вообще нет.
Аминокислоты в положениях L-15, L-43, L-110, L-144, L-168, H-40, H-88, H-119, H-121, H-122, H-175 и H-179 антитела могут, как правило, мутировать (быть заменены) с помощью свободных цистеиновых аминокислот. В пределах примерно до 5 аминокислотных остатков на каждой стороне из этих положений могут также быть заменены свободными цистеиновыми кислотами, то есть от L-10 до L-20; от L-38 до L-48; от L-105 до L-115; от L-139 до L-149; от L-163 до L-173; от H-35 до H-45; от H-83 до H-93; от H-114 до H-127; и от H-170 до H-184, а также в пределах, в Fc области, выбранных из H-268 - H-291; H-319 - H-344; H-370 - H-380; и H-395 - H-405, с получением полученных с помощью генной инженерии антител с цистеиновыми заменами по настоящему изобретению.
Реакционноспособность тиольных групп фаг-ThioFab
*Реакционноспособность тиольных групп измеряют как отношение OD450 нм для связывания стрептавидина к OD450 нм для связывания HER2 (антитело) (пример 2). Значение реакционноспособности тиольных групп, равное 1, показывает полное биотинилирование цистеиновых тиолов.
Два Cys варианта легкой цепи (L-V15C и L-V110C) и два - тяжелой цепи (H-A88C и H-A121C) выбирают для дополнительного анализа, поскольку эти варианты показывают наивысшую реакционноспособность тиольных групп (Таблица 1).
В отличие от очистки фага, для получения Fab может потребовать от 2 до 3 дней, в зависимости от масштаба производства. В течение этого времени, тиольные группы могут потерять реакционноспособность из-за окисления. Для зондирования стабильности тиольных групп на hu4D5Fabv8-фаге, измеряют стабильность реакционноспособности тиольных групп фаг-ThioFab (Фигура 4B). После очистки ThioFab-фага, в день 1, день 2 и день 4, все образцы конъюгируют с биотином-PEO-малеимидом и зондируют с помощью анализа ELISA (PHESELECTOR) фага для исследования связывания HER2 и стрептавидина. L-V15C, L-V110C, H-A88C и H-A121C сохраняют значительные значения реакционноспособности тиольных групп по сравнению с другими вариантами ThioFab (Фигура 4B).
Меченые, полученные с помощью генной инженерии антитела с цистеиновыми заменами
Полученные с помощью генной инженерии антитела с цистеиновыми заменами по настоящему изобретению могут конъюгироваться с любым метящим остатком, который может ковалентно присоединяться к антителу через реакционноспособную тиольную группу цистеина (Singh et al (2002) Anal. Biochem. 304: 147-15; Harlow E. and Lane, D. (1999) Using Antibodies: A Laboratory Manual, Cold Springs Harbor Laboratory Press, Cold Spring Harbor, NY; Lundblad R.L. (1991) Chemical Reagents for Protein Modification, 2nd ed. CRC Press, Boca Raton, FL). Присоединенная метка может функционировать для: (i) обеспечения детектируемого сигнала; (ii) взаимодействия со второй меткой для модификации детектируемого сигнала, обеспечиваемого первой или второй меткой, например, с получением FRET (резонансного переноса энергии флуоресценции); (iii) для стабилизации взаимодействий или повышения аффинности связывания с антигеном или лигандом; (iv) для влияния на подвижность, например, на электролитическую подвижность, или на проницаемость клеток, посредством заряда, гидрофобности, формы или других физических параметров или (v) для получения остатка для захвата, для модулирования аффинности к лиганду, для связывания антитело/антиген, или для ионного комплексообразования.
Меченые, полученные с помощью генной инженерии антитела с цистеиновыми заменами могут быть полезными при диагностических анализах, например, для детектирования экспрессии антигена, представляющего интерес, в конкретных клетках, тканях или в сыворотке. Для диагностики, антитело, как правило, будет метиться с помощью детектируемого остатка. Доступными являются многочисленные метки, которые в целом могут быть сгруппированы в виде следующих категорий:
(a) радиоизотопы (радионуклиды), такие как 3H, 11C, 14C, 18F, 32P, 35S, 64Cu, 68Ga, 86Y, 89Zr, 99Tc, 111In, 123I, 124I, 125I, 131I, 133Xe, 177Lu, 211At или 213Bi. Радиоизотопно меченые антитела являются полезными в экспериментах по получению изображений мишеневых рецепторов. Антитело может метиться реагентами лигандов, которые связывают, хелатируют или иным образом образуют комплекс с радиоактивным изотопом металла, где реагент является реакционноспособным по отношению к полученным с помощью генной инженерии тиольным группам цистеиновых остатков антитела, используя способы, описанные в Current Protocols in Immunology, (1991) Volumes 1 and 2, Coligen et al, Ed. Wiley-Interscience, New York, NY, Pubs.. Хелатирующие лиганды, которые могут образовывать комплекс с ионом металла, включают DOTA, DOTP, DOTMA, DTPA и TETA (Macrocyclics, Dallas, TX). Радионуклеотиды могут нацеливаться посредством комплексообразования с конъюгатами антитело-лекарственное средство по настоящему изобретению (Wu et al (2005) Nature Biotechnology 23(9):1137-1146). Реагенты DOTA-малеимид взаимодействуют со свободными цистеиновыми аминокислотами полученных с помощью генной инженерии антител с цистеиновыми заменами и обеспечивают образование комплекса металла и лигандов на антителе (Lewis et al (1998) Bioconj. Chem. 9:72-86). Хелатирующие линкерные метящие реагенты, такие как DOTA-NHS (сложный моно(N-гидроксисукцинимидный эфир 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусной кислоты), являются коммерчески доступными (Macrocyclics, Dallas, TX). Получение изображений целевого рецептора с помощью меченых радионуклидами антител может обеспечить маркер активирования пути посредством детектирования и количественного определения постепенного аккумулирования антител в ткани опухоли (Albert et al (1998) Bioorg. Med. Chem. Lett. 8: 1207-1210).
Имеются комплексы металл-хелат, подходящие для использования в качестве меток для антител при экспериментах с получением изображений (US 2010/0111856; патент США № 5342606; патент США № 5428155; патент США № 5316757; патент США № 5480990; патент США № 5462725; патент США № 5428139; патент США № 5385893; патент США № 5739294; патент США № 5750660; патент США № 5834456; Hnatowich et al (1983) J. Immunol. Methods 65:147-157; Meares et al (1984) Anal. Biochem. 142:68-78; Mirzadeh et al (1990) Bioconjugate Chem. 1:59-65; Meares et al (1990) J. Cancer1990, Suppl. 10:21-26; Izard et al (1992) Bioconjugate Chem. 3:346-350; Nikula et al (1995) Nucl. Med. Biol. 22:387-90; Camera et al (1993) Nucl. Med. Biol. 20:955-62; Kukis et al (1998) J. Nucl. Med. 39:2105-2110; Verel et al (2003) J. Nucl. Med. 44:1663-1670; Camera et al (1994) J. Nucl. Med. 21:640-646; Ruegg et al (1990) Cancer Res. 50:4221-4226; Verel et al (2003) J. Nucl. Med. 44:1663-1670; Lee et al (2001) Cancer Res. 61:4474-4482; Mitchell, et al (2003) J. Nucl. Med. 44:1105-1112; Kobayashi et al (1999) Bioconjugate Chem. 10:103-111; Miederer et al (2004) J. Nucl. Med. 45:129-137; DeNardo et al (1998) Clinical Cancer Research 4:2483-90; Blend et al (2003) Cancer Biotherapy & Radiopharmaceuticals 18:355-363; Nikula et al (1999) J. Nucl. Med. 40:166-76; Kobayashi et al (1998) J. Nucl. Med. 39:829-36; Mardirossian et al (1993) Nucl. Med. Biol. 20:65-74; Roselli et al (1999) Cancer Biotherapy & Radiopharmaceuticals, 14:209-20).
(b) флуоресцентные метки, такие как хелаты редкоземельных металлов (хелаты европия), типа флуоресцеина, включая FITC, 5-карбоксифлуоресцеин, 6-карбоксифлуоресцеин; типа родамина, включая TAMRA; данзил; лиссамин; цианины; фикоэритрины; техасский красный и их аналоги. Флуоресцентные метки могут конъюгировать с антителами с использованием способов, описанных, например, в Current Protocols in Immunology, выше. Флуоресцентные красители и реагенты флуоресцентных меток включают те, которые коммерчески доступны от Invitrogen/Molecular Probes (Eugene, OR) и Pierce Biotechnology, Inc. (Rockford, IL).
Метки для обнаружения, такие как флуоресцентные красители и хемилюминесцентные красители (Briggs et al (1997) "Synthesis of Functionalised Fluorescent Dyes and Their Coupling to Amines and Amino Acids," J. Chem. Soc, Perkin-Trans. 1:1051-1058), дают детектируемый сигнал и являются, как правило, применимыми для мечения антител, предпочтительно, они имеют следующие свойства: (i) меченое антитело должно давать очень высокий сигнал с низким фоном с тем, чтобы малые количества антител могли чувствительно детектироваться как в анализах без клеток, так и в анализах на основе клеток; и (ii) меченое антитело должно быть фотостабильным с тем, чтобы флуоресцентный сигнал мог наблюдаться, отслеживаться и регистрироваться без значительного фотовыцветания. Для применений, включающих связывание на поверхности клеток меченого антитела с мембранами или клеточными поверхностями, в особенности, с живыми клетками, метки, предпочтительно, (iii) имеют хорошую растворимость в воде для получения эффективной концентрации конъюгата и чувствительности детектирования и (iv) являются нетоксичными для живых клеток с тем, чтобы не нарушать нормальные метаболические процессы в клетках или не вызывать преждевременную гибель клеток.
(c) Различные метки фермент-субстрат являются доступными или описываются (патент США № 4275149). Фермент, как правило, катализирует химическое изменение хромогенного субстрата, которое может быть измерено с использованием разнообразных способов. Например, фермент может катализировать изменение цвета субстрата, которое может быть измерено спектрофотометрически. Альтернативно, фермент может изменять флуоресценцию или хемилюминесценцию субстрата. Способы количественного определения изменения флуоресценции описаны выше. Хемилюминесцентный субстрат становится электронно возбужденным под действием химической реакции и может затем испускать свет, который измеряется (используя, например, хемилюминометр) или отдает энергию флуоресцентному акцептору. Примеры ферментативных меток включают люциферазы (например, люциферазу светлячков и бактериальную люциферазу; патент США № 4737456), люциферин, 2,3-дигидрофталазиндионы, малатдегидрогеназу, уреазу, пероксидазу, такую как пероксидаза хрена (HRP), щелочную фосфатазу (AP), β-галактозидазу, глюкоамилазу, лизозим, сахаридные оксидазы (например, глюкозаоксидазу, галактозаоксидазу и глюкоза-6-фосфатдегидрогеназу), гетероциклические оксидазы (такие как уриказа и ксантиноксидаза), лактопероксидазу, микропероксидазу, и тому подобное. Методики конъюгирования ферментов с антителами описаны в O’Sullivan et al (1981) "Methods for the Preparation of Enzyme-Antibody Conjugates for use in Enzyme Immunoassay", в Methods in Enzym. (ed J. Langone & H. Van Vunakis), Academic Press, New York, 73: 147-166.
Примеры сочетаний фермент-субстрат включают, например, (патент США № 4275149; патент США № 4318980):
(i) пероксидазу хрена (HRP) с гидропероксидазой в качестве субстрата, где гидропероксидаза окисляет предшественник красителя (например, ортофенилендиамин (OPD) или 3,3’,5,5’-тетраметилбензидин гидрохлорид (TMB));
(ii) щелочную фосфатазу (AP) с пара-нитрофенилфосфатом в качестве хромогенного субстрата; и
(iii) β-D-галактозидазу (β-D-Gal) с хромогенным субстратом (например, п-нитрофенил-β-D-галактозидазой) или флуорогенным субстратом 4-метилумбеллиферил-β-D-галактозидазой.
Метку может опосредованно конъюгировать с полученным с помощью генной инженерии антителом c цистеиновыми заменами. Например, антитело может конъюгироваться с биотином, и любая из трех широких категорий меток, рассмотренных выше, может конъюгироваться с авидином или стрептавидином, или наоборот. Биотин селективно связывается со стрептавидином, и таким образом, метка может конъюгироваться с антителом опосредованным образом. Альтернативно, для получения опосредованного конъюгирования метки с полипептидным вариантом, полипептидный вариант конъюгируют с малым гаптеном (например, с дигоксином) и одну из различных типов меток, рассмотренных выше, конъюгируют с полипептидным вариантом анти-гаптен (например, с антителом анти-дигоксин). Таким образом, может быть получено опосредованное конъюгирование метки с полипептидным вариантом (Hermanson, G. (1996) in Bioconjugate Techniques Academic Press, San Diego).
Полипептидный вариант по настоящему изобретению можно использовать в любом известном способе анализа, таком как ELISA, анализы конкурентного связывания, прямые и опосредованные сэндвич-анализы и анализы с иммунопреципитацией (Zola, (1987) Monoclonal Antibodies: A Manual of Techniques, pp.147-158, CRC Press, Inc.).
Метка для обнаружения может быть полезной при использовании для локализации, визуализации и количественного определения связывания или распознавания события. Меченые антитела по настоящему изобретению могут детектировать рецепторы на поверхности клеток. Другое использование детектируемо меченых антител представляет собой способ иммунного захвата на основе шариков, включающий конъюгирование шарика с флуоресцентно меченым антителом и детектирование сигнала флуоресценции при связывании лиганда. Сходные способы детектирования связывания используют эффект поверхностного плазмонного резонанса (SPR) для измерения и детектирования взаимодействий антитело-антиген.
Меченые, полученные с помощью генной инженерии антитела с цистеиновыми заменами по настоящему изобретению являются полезными в качестве биологических маркеров и зондов при получении изображений с помощью различных способов и методик получения биомедицинских и молекулярных изображений, таких как: (i) MRI (магнитно-резонансная томография); (ii) MicroCT (компьютерная томография); (iii) SPECT (однофотонная эмиссионная компьютерная томография); (iv) PET (позитронно-эмиссионная томография) Tinianow, J. et al (2010) Nuclear Medicine and Biology, 37(3):289-297; Chen et al (2004) Bioconjugate Chem. 15:41-49; US 2010/0111856 (v) биолюминесценция; (vi) флуоресценция; и (vii) ультразвук. Иммуносцинтиграфия представляют собой процедуру получения изображений, в которой антитела, меченные радиоактивными веществами, вводят пациенту животному или человеку и получают картину областей в организме, где локализуется антитело (патент США № 6528624). Биологические маркеры для получения изображений могут объективно измеряться и оцениваться как индикатор нормальных биологических процессов, патогенных процессов или фармакологических реакций на терапевтическое вмешательство. Биологические маркеры могут принадлежать к нескольким типам: тип 0 представляют собой маркеры естественной истории для болезни и они коррелируют по величине с известными клиническими показателями, например, при оценке с помощью MRI синовиального воспаления при ревматоидном артрите; маркеры типа I захватывают эффект вмешательства в соответствии с механизмом действия, даже если механизм не может ассоциироваться с клиническим результатом; маркеры типа II функционируют как суррогатные конечные точки, где изменения биологического маркера или сигнала от него предсказывают клинический положительный результат для "подтверждения" целевой реакции, такой как измеряемая эрозия кости при ревматоидном артрите, посредством CT. Биологические маркеры для получения изображений, таким образом, могут предоставлять фармакодинамическую (PD) терапевтическую информацию: (i) об экспрессии целевого белка, (ii) о связывании терапевтического средства с целевым белком, то есть о селективности, и (iii) фармакокинетические данные о выведении и времени полужизни в организме. Преимущества in vivo биологических маркеров для получения изображений по сравнению с биологическими маркерами на основе лабораторных исследований включают: неинвазивное лечение, количественную оценку для организма в целом, многократное дозирование и оценку, то есть множество временных точек, и потенциально переносимые эффекты от предклинических результатов (малые животные) на клинические (люди). Для некоторых применений, биологическое получение изображений уменьшает или сводит к минимуму количество экспериментов на животных в предклинических исследованиях.
Способы пептидного мечения хорошо известны. Смотри Haugland, 2003, Molecular Probes Handbook of Fluorescent Probes and Research Chemicals, Molecular Probes, Inc.; Brinkley, 1992, Bioconjugate Chem. 3:2; Garman, (1997) Non-Radioactive Labelling: A Practical Approach, Academic Press, London; Means (1990) Bioconjugate Chem. 1:2; Glazer et al (1975) Chemical Modification of Proteins. Laboratory Techniques in Biochemistry and Molecular Biology (T. S. Work and E. Work, Eds.) American Elsevier Publishing Co., New York; Lundblad, R. L. and Noyes, C. M. (1984) Chemical Reagents for Protein Modification, Vols. I and II, CRC Press, New York; Pfleiderer, G. (1985) “Chemical Modification of Proteins”, Modern Methods in Protein Chemistry, H. Tschesche, Ed., Walter DeGryter, Berlin and New York; and Wong (1991) Chemistry of Protein Conjugation and Cross-linking, CRC Press, Boca Raton, Fla.); De Leon-Rodriguez et al (2004) Chem.Eur. J. 10:1149-1155; Lewis et al (2001) Bioconjugate Chem. 12:320-324; Li et al (2002) Bioconjugate Chem. 13:110-115; Mier et al (2005) Bioconjugate Chem. 16:240-237.
Пептиды и белки, меченные с помощью двух остатков, флуоресцентного репортера и гасителя флуоресценции, в достаточной близости друг от друга подвергаются резонансному переносу энергии флуоресценции (FRET). Репортерные группы, как правило, представляют собой флуоресцентные красители, которые возбуждаются с помощью света на определенной длине волны и переносят энергию на группу акцептора или гасителя флуоресценции, с соответствующим Стоксовым сдвигом для испускания при максимальной яркости. Флуоресцентные красители включают молекулы с широкой ароматичностью, такие как флуоресцеин и родамин, и их производные. Флуоресцентный репортер может частично или полностью гаситься с помощью остатка гасителя флуоресценции в интактном пептиде. При расщеплении пептида с помощью пептидазы или протеазы, может быть измерено детектируемое увеличение флуоресценции (Knight, C. (1995) "Fluorimetric Assays of Proteolytic Enzymes", Methods in Enzymology, Academic Press, 248: 18-34).
Меченые антитела по настоящему изобретению можно также использовать в качестве аффинного агента для очистки. В этом способе, меченое антитело иммобилизуют на твердой фазе, такой как смола Sephadex или фильтровальная бумага, с использованием способов, хорошо известных в данной области. Иммобилизованное антитело вступает в контакт с образцом, содержащим антиген, который должен быть очищен, и после этого набивку промывают с помощью соответствующего растворителя, который удалит по существу весь материал в образце, за исключением антигена, который должен быть очищен, который связан с иммобилизованным полипептидным вариантом. Наконец, набивку промывают другим соответствующим растворителем, таким как глициновый буфер, при pH 5,0, который высвободит антиген с полипептидного варианта.
Метящие реагенты, как правило, несут реакционноспособную функциональную группу, которая может взаимодействовать (i) непосредственно с тиольной группой цистеинового остатка полученного с помощью генной инженерии антитела с цистеиновыми заменами, с образованием меченого антитела, (ii) с линкерным реагентом с образованием промежуточного соединения линкер-метка, или (iii) с линкерным антителом с образованием меченого антитела. Реакционноспособные функциональные группы метящих реагентов включают: малеимид, галогенацетил, йодацетамид, сложный сукцинимидиловый эфир (например, NHS, N-гидроксисукцинимид), изотиоцианат, сульфонилхлорид, 2,6-дихлортриазинил, сложный пентафторфениловый эфир и фосфорамидит, хотя можно также использовать другие функциональные группы.
Конъюгирование биотина-малеимида и ThioFab
Описанные выше свойства ThioFab устанавливают в присутствии фага, поскольку слияние Fab с белком оболочки фага могло бы в принципе изменить доступность или реакционноспособность Cys тиола. По этой причине, конструкты ThioFab клонируют в вектор экспрессии в присутствии промотора щелочной фосфатазы (Chang et al (1987) Gene 55: 189-196), и индуцируют экспрессию ThioFab, выращивая клетки E. coli в среде, не содержащей фосфата. ThioFab очищают на колонке SEPHAROSE™ с белком G и анализируют на восстанавливающих и невосстанавливающих гелях с помощью SDS-PAGE. Эти анализы делают возможной оценку того, удерживают ли ThioFab их реакционноспособную тиольную группу или становятся неактивными, посредством образования внутримолекулярных или межмолекулярных дисульфидных связей. ThioFab L-V15C, L-V110C, H-A88C и H-A121C экспрессируют и очищают с помощью колоночной хроматографии SEPHAROSE™ с белком G (смотри раздел “Методы относительно деталей”). Очищенные белки анализируют на геле для SDS-PAGE при восстанавливающих (с DTT) и невосстанавливающих (без DTT) условиях. Другие восстанавливающие агенты, такие как BME (бета-меркаптоэтанол), могут быть использованы в геле для расщепления межцепочечных дисульфидных групп. Из анализа на геле для SDS-PAGE видно, что главная доля ThioFab (~90%) находится в мономерной форме, в то время как hu4D5Fabv8 дикого типа находится по существу в мономерной форме (47 кДа).
ThioFab (A121C) и hu4D5Fabv8 дикого типа инкубируют при 100-кратном избытке биотина-малеимида в течение 3 часов при комнатной температуре, и биотинилированные Fab загружают в колонку для гель-фильтрации Superdex-200™. Эта стадия очистки является полезной при отделении мономерного Fab от олигомерного Fab, а также от избытка свободного биотина-малеимида (или свободного цитотоксического лекарственного средства).
На фигуре 5 показано подтверждение свойств вариантов ThioFab в отсутствие фагового контекста. Белки без фагового слияния, hu4D5Fabv8 и hu4D5Fabv8-A121C (ThioFab-A121C), экспрессируют и очищают с использование агарозных шариков с белком G с последующим инкубированием вместе с 100-кратным молярным избытком биотина-малеимида. Сравнивают связывание стрептавидина и HER2 для биотинилированного, полученного с помощью Cys ThioFab и небиотинилированного Fab дикого типа. Степень конъюгирования с биотином (взаимодействие с стрептавидином) и их способность к связыванию с HER2 отслеживают с помощью анализа ELISA. Каждый Fab исследуют при 2 нг и 20 нг.
Биотинилированный A121C ThioFab сохраняет связывание HER2, сравнимое с диким типом hu4D5Fabv8 (Фигура 5). Fab дикого типа и A121C-ThioFab очищают с помощью гель-фильтрационной колоночной хроматографии. Два образца исследуют на связывание HER2 и стрептавидина с помощью ELISA с использованием анти-Fab-HRP козы в качестве вторичного антитела. Как дикий тип (белые столбики), так и ThioFab (заштрихованные столбики) имеют сходное связывание с HER2, но только ThioFab сохраняет связывание со стрептавидином. Для небиотинилированного hu4D5Fabv8 дикого типа (Фигура 5) наблюдают только фоновый уровень взаимодействия со стрептавидином. Анализ масс-спектров (LC-ESI-MS) биотинилированного ThioFab (A121C) дает главный пик при 48294,5 дальтон по сравнению с диким типом hu4D5Fabv8 (47737 дальтон). Разница в 537,5 дальтона между двумя молекулами точно соответствует одному биотину-малеимиду, конъюгированному с ThioFab. Масс-спектрометрическое секвенирование белков (LC-ESI-тандемный масс-спектрометрический анализ) дает дополнительное подтверждение того, что конъюгированная молекула биотина находится на вновь полученном с помощью генной инженерии Cys остатке (Таблица 8, пример 3b).
Сайт-специфическое конъюгирование биотина-малеимида с пептидом, связывающим альбумин (ABP)-ThioFab
Связывание белков плазмы может представлять собой эффективное средство улучшения фармакокинетических свойств короткоживущих молекул. Альбумин представляет собой наиболее широко распространенный белок в плазме. Пептиды, связывающие сывороточный альбумин (ABP), могут изменять фармакодинамику белков со слитым активным доменом, включая изменение потребления в тканях, проникновение и диффузию. Эти фармакодинамические параметры могут модулироваться с помощью конкретного выбора соответствующей последовательности пептидов, связывающих сывороточный альбумин (US 20040001827). Ряд пептидов, связывающих альбумин, идентифицируют посредством скрининга с помощью фагового дисплея (Dennis et al. (2002) "Albumin Binding As A General Strategy For Improving The Pharmacokinetics Of Proteins" J Biol Chem. 277:35035-35043; WO 01/45746). Соединения по настоящему изобретению включают последовательности ABP, рассмотренные: (i) Dennis et al (2002) J Biol Chem. 277:35035-35043 at Tables III and IV, page 35038; (ii) US 20040001827 at [0076]; и (iii) WO 01/45746, pages 12-13, и все они включаются в настоящий документ в качестве ссылок.
Пептиды, связывающие альбумин (ABP)-Fab получают с помощью генной инженерии посредством слияния пептида, связывающего альбумин, с C-концом тяжелой цепи Fab при стехиометрическом отношении 1:1 (1 ABP/1 Fab). Показано, что связывание этих ABP-Fab с альбумином увеличивает их время полужизни более чем в 25 раз у кроликов и мышей. Описанные выше реакционноспособные Cys остатки могут по этой причине вводиться в эти ABP-Fab и использоваться для сайт-специфического конъюгирования с цитотоксическими лекарственными средствами с последующими исследованиями на животных in vivo.
Иллюстративные последовательности пептидов, связывающих альбумин, включают, но, не ограничиваясь этим, последовательности аминокислоты, перечисленные как SEQ ID NO:1-5:
Последовательности пептидов, связывающих альбумин (ABP), связывают альбумин от множества видов (мыши, крысы, кролики, жвачное животное, макака резус, бабуин и человек) с Kd (кролик) = 0,3 мкМ. Пептид, связывающий альбумин, не конкурирует с лигандами, известными как связывающие альбумин и имеет время полужизни (T½) у кролика 2,3 час. Белки ABP-ThioFab очищают на BSA-SEPHAPOSE™ с последующим конъюгированием с биотином-малеимидом и очисткой с помощью колоночной хроматографии на Superdex-S200, как описано в предыдущих разделах. Очищенные биотинилированные белки являются гомогенными и исключают какие-либо олигомерные формы (пример 4).
На фигуре 6 показаны свойства вариантов пептида, связывающего альбумин (ABP)-ThioFab. Анализы ELISA осуществляют для исследования способности к связыванию ABP-hu4D5Fabv8-wt, ABP-hu4D5Fabv8-V110C и ABP-hu4D5Fabv8-A121C с альбумином кролика, стрептавидином и HER2. Биотинилированные ABP-ThioFab способны связывать альбумин и HER2 с аффинностью, сходной с диким типом ABP-hu4D5Fabv8, как подтверждается с помощью анализа ELISA (Фигура 6) и анализа кинетики связывания BIAcore (Таблица 2). Планшеты ELISA покрывают альбумином, HER2 и SA, как описано. Связывание биотинилированных ABP-ThioFab с альбумином, HER2 и SA зондируют с помощью HRP анти-Fab. Биотинилированные ABP-ThioFab способны связывать стрептавидин по сравнению с небиотинилированным контролем ABP-hu4D5Fabv8-wt, показывая, что ABP-ThioFab конъюгируются с биотином-малеимидом подобно ThioFab сайт-специфичным образом, поскольку одинаковые Cys мутанты используют для обоих вариантов (Фигура 6).
Кинетический анализ BIAcore для связывания HER2 и альбумина кролика с биотинилированными ABP-hu4D5Fabv8 дикого типа и ThioFab
Альтернативно, пептид, связывающий альбумин, может связываться с антителом посредством ковалентного присоединения через линкерный остаток.
Получение с помощью генной инженерии ABP-ThioFab с двумя свободными тиольными группами на один FAB
Указанные выше результаты показывают, что все четыре варианта (L-V15C, L-V110C, H-A88C и H-A121C) ThioFab (антител Fab с цистеиновыми заменами, полученных с помощью генной инженерии) имеют реакционноспособные тиольные группы, которые можно использовать для сайт-специфичного конъюгирования с метящим реагентом, линкерным реагентом или промежуточным соединением лекарственное средство-линкер. L-V15C может экспрессироваться и очищаться, но при этом получают относительно низкие выходы. Однако выходы экспрессирования и очистки вариантов L-V110C, H-A88C и H-A121C сходны с hu4D5Fabv8. По этой причине, эти мутанты можно использовать для дополнительного анализа и повторного объединения с получением нескольких тиольных групп на Fab. Для этой цели, конструируют одну тиольную группу на легкой и одну на тяжелой цепи с получением двух тиольных групп на молекулу Fab (L-V110C/H-A88C и L-V110C/H-A121C). Эти два двойных Cys варианта экспрессируются в системе экспрессирования E. coli и очищаются. Гомогенность очищенных биотинилированных ABP-ThioFab, как обнаружено, сходна с одинарными Cys вариантами.
Исследуют эффекты получения с помощью генной инженерии двух реакционноспособных Cys остатков на Fab (Фигура 7). Присутствие второго биотина исследуют посредством зондирования связывания биотинилированного ABP-ThioFab с SA, используя стрептавидин-HRP (Фигура 7). Для анализа HER2/Fab, планшет ELISA покрывают HER2 и зондируют с помощью HRP анти-Fab. Для анализа SA/Fab, планшет ELISA покрывают SA и зондируют HRP анти-Fab. Для анализа SA/SA, планшет ELISA покрывают SA и зондируют SA-HRP (Фигура 7). Анализы ELISA для взаимодействия биотинилированных Cys вариантов ABP-hu4D5Fabv8 с HER2, стрептавидином (SA), HER2/Fab, SA/Fab и SA/SA показывают, что их взаимодействие отслеживаются с помощью анти-Fab-HRP, SA-HRP, соответственно. SA/Fab отслеживает присутствие одного биотина на Fab, и несколько биотинов на Fab отслеживается с помощью анализа SA/SA. Связывание HER2 с двойными Cys мутантами сходно с одинарными Cys вариантами (Фигура 7). Однако степень биотинилирования на двойных Cys мутантах выше по сравнению с одинарными Cys вариантами благодаря нескольким свободным тиольным группам на молекулу Fab (Фигура 7).
Получение с помощью генной инженерии тио-трастузумаб вариантов IgG
Цистеин вводят в полноразмерное моноклональное антитело, трастузумаб (HERCEPTIN®, Genentech Inc.) на определенных остатках. Одинарные Cys мутанты H-A88C, H-A121C и L-V110C трастузумаба и двойные Cys мутанты трастузумаба V110C-A121C и V110C-A121C экспрессируются в клетках CHO (яичников китайского хомячка) посредством транзиторного ферментирования в средах, содержащих 1 мМ цистеина. Последовательность тяжелой цепи мутанта A88C (450 aa) представляет собой SEQ ID NO:6. Последовательность тяжелой цепи мутанта A121C (450 aa) представляет собой SEQ ID NO:7. Последовательность легкой цепи мутанта V110C (214 aa) представляет собой SEQ ID NO:8.
EVQLVESGGGLVQPGGSLRLSCAASGFNIKDTYIHWVRQAPGKGLEWVARIYPTNGYTRY
ADSVKGRFTISADTSKNTAYLQMNSLRCEDTAVYYCSRWGGDGFYAMDYWGQGTLVTVSS
ASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSS
GLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGG
PSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYN
STYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREE
MTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRW
QQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO:6
EVQLVESGGGLVQPGGSLRLSCAASGFNIKDTYIHWVRQAPGKGLEWVARIYPTNGYTRY
ADSVKGRFTISADTSKNTAYLQMNSLRAEDTAVYYCSRWGGDGFYAMDYWGQGTLVTVSS
CSTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSS
GLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGG
PSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYN
STYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREE
MTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRW
QQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO:7
DIQMTQSPSSLSASVGDRVTITCRASQDVNTAVAWYQQKPGKAPKLLIYSASFLYSGVPS
RFSGSRSGTDFTLTISSLQPEDFATYYCQQHYTTPPTFGQGTKVEIKRTCAAPSVFIFPP
SDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLT
LSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO:8
В соответствии с одним из вариантов осуществления, антитела тио-трастузумаб с цистеиновыми заменами, полученные с помощью генной инженерии, содержат одну или несколько из следующих последовательностей тяжелых цепей вариабельной области со свободной цистеиновой аминокислотой (SEQ ID NO:9-16).
В соответствии с другим вариантом осуществления, антитела тио-трастузумаб с цистеиновыми заменами, полученные с помощью генной инженерии, содержат одну или несколько следующих последовательностей легкой цепи вариабельной области со свободной цистеиновой аминокислотой (SEQ ID NO:17-27).
Получаемые полноразмерные варианты тио-трастузумаб IgG исследуют на реакционноспособность тиольных групп и на активность связывания HER2. На фигуре 10A показано схематическое изображение биотинилированного антитела, связывающегося с иммобилизованным HER2 и с меченным вторичным антителом HRP, для детектирования поглощения. На фигуре 10B показано измерение связывания иммобилизованного HER2 с детектированием поглощения на 450 нм (слева направо): небиотинилированный трастузумаб дикого типа (Wt), варианты тио-трастузумаба, конъюгированного с биотином-малеимидом V110C (один Cys), A121C (один Cys) и V110C-A121C (два Cys). Каждый вариант тио-IgG и трастузумаба исследуют при 1, 10 и 100 нг. Измерения показывают, что биотинилированные ThioMab анти-HER2 сохраняют активность связывания HER2.
На фигуре 11A показано схематическое изображение биотинилированного антитела, связывающего иммобилизованный HER2, со связыванием биотина с анти-IgG-HRP для детектирования поглощения. На фигуре 14B показано измерение связывания с детектированием поглощения на 450 нм для конъюгированных с биотином-малеимидом вариантов тио-трастузумаба и для небиотинилированного трастузумаба дикого типа при связывании со стрептавидином. Слева направо: V110C (один Cys), A121C (один Cys), V110C/A121C (два Cys) и трастузумаб. Каждый вариант тио- IgG трастузумаба и исходный трастузумаб исследуют при 1, 10 и 100 нг. Измерения показывают, что HER2 ThioMab имеет высокую реакционноспособность тиольных групп.
Цистеин вводят в полноразмерное антитело 2H9 анти-EphB2R на определенных остатках. Одинарный Cys мутант H-A121C 2H9 экспрессируют в клетках CHO (яичников китайского хомячка) посредством транзиторного ферментирования в средах, содержащих 1 мМ цистеина. Последовательность тяжелой цепи мутанта 2H9 A121C (450 aa) представляет собой SEQ ID NO:28.
EVQLVESGGGLVQPGGSLRLSCAASGYTFTSYWMHWVRQAPGKGLEWVGFINPSTGYTDY
NQKFKDRFTISADTSKNTAYLQMNSLRAEDTAVYYCTRRPKIPRHANVFWGQGTLVTVSS
CSTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSS
GLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGG
PSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYN
STYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREE
MTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRW
QQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO:28
Антитела с цистеиновыми заменами, полученные с помощью генной инженерии, тио-2H9 содержат следующие последовательности тяжелой цепи константной Fc области со свободной цистеиновой аминокислотой (SEQ ID NO:29-38).
Цистеин вводят в полноразмерное антитело 3A5 анти-MUC16 на определенных остатках. Одинарный Cys мутант 3A5 H-A121C экспрессируют в клетках CHO (яичников китайского хомячка) посредством транзиторного ферментирования в средах, содержащих 1 мМ цистеина. Последовательность тяжелой цепи мутанта 3A5 A121C (446 aa) содержит SEQ ID NO:39.
DVQLQESGPGLVNPSQSLSLTCTVTGYSITNDYAWNWIRQFPGNKLEWMGYINYSGYTTY
NPSLKSRISITRDTSKNQFFLHLNSVTTEDTATYYCARWDGGLTYWGQGTLVTVSACSTK
GPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYS
LSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVF
LFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYR
VVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKN
QVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGN
VFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO:39
Антитела с цистеиновыми заменами, полученные с помощью генной инженерии, тио-3A5 анти-MUC16 содержат следующие последовательности тяжелой цепи вариабельной области со свободной цистеиновой аминокислотой (SEQ ID NO:40-44).
Антитела с цистеиновыми заменами, полученные с помощью генной инженерии, тио-3A5 анти-MUC16 содержат следующие последовательности легкой цепи вариабельной области со свободной цистеиновой аминокислотой (SEQ ID NO:45-49).
Получение с помощью генной инженерии и реакционноспособность тиольных групп ThioFab 4D5 анти-HER2
Цистеин вводят в каждое положение тяжелой цепи и легкой цепи Fab фрагмента антитела hu4D5Fabv8 анти-HER2. Все 440 мутантов тяжелой цепи и мутантов легкой цепи получают в соответствии со способами, описанными в настоящем документе. Реакционноспособность тиольных групп измеряют в соответствии с анализом PHESELECTOR. Последовательности тяжелой цепи нумеруют с помощью системы последовательной нумерации. Последовательности легкой цепи следуют системе нумерации Kabat. В легкой цепи, как Kabat, так и последовательная нумерация обозначает одинаковые номера.
Мутанты тяжелой цепи hu4D5Fabv8 выбирают для эффективного связывания с белком рецептора HER2 (Фигуры 2 и 3) и реакционноспособности тиольных групп с реагентом для биотинилирования, биотином-PEO-малеимидом (примеры 1 и 2). Определенные мутанты тяжелой цепи имеют ограниченное или ослабленное связывание с HER2 ECD, поскольку этот важный остаток для связывания антигена (HER2) расположен в CDR в вариабельной области антитела-Fab. Некоторые из этих остатков, находящихся в константном домене Fab, также приводят к плохому связыванию HER2, поскольку эти остатки могут вносить вклад в структуру и укладку Fab, таким образом, приводя к плохому отображению 4D5-Fab на фаге M13 (Junutula, J.R. et al. (2008) J. Immunol Methods, 332:41-52). Мутанты тяжелой цепи hu4D5Fabv8 с плохим связыванием ECD HER2 содержат цистеиновые мутации в положениях 1, 21, 31, 33-36, 38, 48-50, 59, 87, 95, 101, 104, 129, 131, 132, 136, 153, 155, 159, 166, 169, 170, 172, 197, 198, 202, 215, 219. Измеряют варианты с цистеиновыми заменами 22, 96, 147, 203, 223 дикого типа. Другие мутанты тяжелой цепи имеют ограниченную реакционноспособность тиольных групп для реагента для биотинилирования. Остаток свободной цистеиновой аминокислоты находится в центре, по сторонам его находятся остатки в последовательностях в средней колонке Таблицы 3. Замещенная аминокислота и положение в тяжелой цепи обозначены в левой колонке. Мутанты тяжелой цепи hu4D5Fabv8 SEQ ID NO:50-98 в Таблице 3 сохраняют связывание HER2 и значения реакционноспособности тиольных групп примерно 0,8 или выше, исключая варианты с цистеиновыми заменами дикого типа. Антитела с SEQ ID NO:50-98 (Таблица 3) демонстрируют реакционноспособность тиольных групп и могут быть полезными для образования ковалентных связей с меткой для захвата, с меткой для обнаружения, с остатком лекарственного средства или с твердой подложкой. Мутанты тяжелой цепи из Таблицы 3 могут конъюгироваться как ThioFab или ThioMab, например, как конъюгаты антитело-лекарственное средство.
Эффективно связывающиеся имеющие реакционноспособные тиольные группы мутанты тяжелой цепи hu4D5Fabv8
Мутанты легкой цепи hu4D5Fabv8 выбирают по эффективному связыванию с белком рецептора HER2 (Фигуры 2 и 3) и по реакционноспособности тиольных групп по отношению к реагенту биотинилирования, биотину-PEO-малеимиду (примеры 1 и 2). Определенные мутанты легкой цепи имеют ограниченное или ослабленное связывание с HER2, поскольку этот важный остаток для связывания антигена (HER2) расположен в CDR вариабельной области антитела-Fab. Некоторые остатки, расположенные в константном домене Fab, также приводят к плохому связыванию HER2, поскольку эти остатки могут вносить вклад в структуру и укладку Fab, приводя, таким образом, к плохому отображению 4D5-Fab на фаге M13 (Junutula, J.R. et al. (2008) J. Immunol Methods, 332:41-52). Мутанты легкой цепи hu4D5Fabv8 с плохим связыванием с HER2 включают мутанты с цистеиновыми заменами в положениях 4, 29-32, 35, 36, 50, 82, 86, 89-91, 113, 115, 117, 120, 126, 128, 139, 141, 146, 148, 179, 186, 192, 202. Измеряют варианты с цистеиновыми заменами 23, 134, 194, 214 дикого типа. Другие мутанты легкой цепи имеют ограниченную реакционноспособность тиольных групп по отношению к реагенту для биотинилирования. Остаток свободной цистеиновой аминокислоты находится в центре с остатками по обе стороны, показанными в последовательностях в средней колонке Таблицы 4. Замещенная аминокислота и положение в легкой цепи обозначены в левой колонке. Мутанты легкой цепи hu4D5Fabv8 SEQ ID NO:99-147 в Таблице 4 сохраняют связывание HER2 и значения реакционноспособности тиольных групп примерно 0,8 или выше, исключая варианты с цистеиновыми заменами дикого типа. Антитела с SEQ ID NO:99-147 (Таблица 4) демонстрируют реакционноспособность тиольных групп и могут быть полезными при образовании ковалентных связей с меткой для захвата, с меткой для обнаружения, с остатком лекарственного средства или с твердой подложкой. Мутанты легкой цепи из Таблицы 4 могут конъюгироваться как ThioFab или ThioMab, например, как конъюгаты антитело-лекарственное средство.
Эффективно связывающиеся, имеющие реакционноспособные тиольные группы мутанты легкой цепи hu4D5Fabv8
Реакционноспособность тиольных групп ThioMab
Реакционноспособность тиольных групп полноразмерных, полученных с помощью генной инженерии антител с цистеиновыми заменами IgG (ThioMab) измеряют с помощью биотинилирования и связывания стрептавидина (патент США № 7521541). Анализ вестерн блот осуществляют для скрининга ThioMab, который специфично конъюгирован с биотином-малеимидом. В этом анализе, антитела анализируют с помощью восстанавливающего SDS-PAGE, и присутствие биотина специфично зондируется посредством инкубирования вместе со стрептавидином-HRP. Как видно из фигуры 18, взаимодействие со стрептавидином-HRP наблюдается либо в тяжелой цепи, либо в легкой цепи, в зависимости от того, какой полученный с помощью генной инженерии Cys вариант используют, и не наблюдается взаимодействия с диким типом, это указывает на то, что варианты ThioMab специфично конъюгируют биотин на полученных с помощью генной инженерии Cys остатках. На фигуре 18 показан анализ на денатурирующем геле восстановленных, биотинилированных вариантов Тио-IgG после захвата на иммобилизованном анти-IgG-HRP (верхний гель) и на стрептавидине-HRP (нижний гель). Зона 1: 3A5 H-A121C. Зона 2: 3A5 L-V110C. Зона 3: 2H9 H-A121C. Зона 4: 2H9 L-V110C. Зона 5: исходное 2H9 анти-EphB2R дикого типа. Каждый мутант (зоны 1-4) захватывается посредством анти-IgG с детектированием HRP (вверху), это показывает, что селективность и аффинность сохраняются. Захват с помощью иммобилизованного стрептавидина с детектированием HRP (внизу) подтверждает нахождение биотина на тяжелой и легкой цепях. Положение цистеиновой мутации на полученных с помощью генной инженерии антителах с цистеиновыми заменами в зонах 1 и 3 представляет собой тяжелую цепь. Положение цистеиновой мутации на полученных с помощью генной инженерии антителах с цистеиновыми заменами в зонах 2 и 4 представляет собой легкую цепь. Активный сайт цистеиновой мутации подвергается воздействию конъюгирования с реагентом биотином-малеимидом.
Анализ полученных с помощью генной инженерии антител с цистеиновыми заменами ThioMab на Фигуре 18 и варианта 2H9 V15C с помощью LC/MS (жидкостной хроматографии/масс-спектрометрии) дает количественные показатели реакционноспособности тиольных групп (Таблица 5).
Количественное определение с помощью LC/MS биотинилирования ThioMab - реакционноспособность тиольных групп
Введение цистеина, полученного с помощью генной инженерии, осуществляют в константном домене, то есть в Fc области антител IgG. Разнообразные активные сайты аминокислот преобразуют в сайты с цистеиновыми заменами, и экспрессируемые мутанты, то есть полученные с помощью генной инженерии антитела с цистеиновыми заменами, оценивают на реакционноспособность их тиольных групп. Биотинилированные Fc варианты 2H9 ThioMab оценивают на реакционноспособность тиольных групп с помощью количественного определения HRP посредством захвата на иммобилизованном стрептавидине в анализе ELISA (Фигура 19). Анализ ELISA устанавливают для быстрого скрининга Cys остатков с реакционноспособными тиольными группами. Как изображено на схематической диаграмме, на Фигуре 19, взаимодействие стрептавидин-биотин отслеживают посредством зондирования с помощью анти-IgG-HRP с последующим измерением коэффициента поглощения на 450 нм. Эти результаты подтверждают, что ThioFc варианты 2H9 V282C, A287C, A339C, S375C и S400C имеют реакционноспособность тиольных групп, от умеренной активности до наивысшей. Степень конъюгирования с биотином Fc вариантов 2H9 ThioMab количественно определяют с помощью анализа LS/MS, как показано в Таблице 6. Анализ с помощью LS/MS подтверждает, что варианты A282C, S375C и S400C имеют 100% конъюгирование с биотином, а V284C и A339C имеют 50% конъюгирование, что указывает на присутствие реакционноспособных тиольных групп цистеиновых остатков. Другие ThioFc варианты и исходные 2H9 дикого типа имеют либо очень небольшое биотинилирование, либо вообще его не имеют.
Количественное определение с помощью LC/MS биотинилирования Fc ThioMab 2H9
Реакционноспособность тиольных групп вариантов легких цепей ThioFab 4d5
Скрининг разнообразных вариантов Fab с цистеиновыми заменами, полученных с помощью генной инженерии, легких цепей антитела 4D5 анти-ErbB2 дает ряд вариантов со значением реакционноспособности тиольных групп 0,6 и выше (Таблица 7), как измерено с помощью анализа PHESELECTOR, Фигура 8. Значения реакционноспособности тиольных групп в Таблице 7 нормированы на вариант ThioFab тяжелой цепи 4D5 (HC-A121C), который принимают за 100%, предполагая полное биотинилирование варианта HC-A121C, и представляют как процентные значения.
Процентные значения реакционноспособности тиольных групп вариантов легкой цепи ThioFab 4D5
Конъюгаты антитело-лекарственное средство
Полученные с помощью генной инженерии антитела с цистеиновыми заменами по настоящему изобретению могут конъюгироваться с любым терапевтическим средством, то есть с остатком лекарственного средства, который может ковалентно присоединяться к антителу с помощью реакционноспособной тиольной группы цистеинового остатка.
Иллюстративный вариант осуществления соединения конъюгата антитело-лекарственное средство (ADC) содержит полученное с помощью генной инженерии антитело с цистеиновыми заменами (Ab) и остаток лекарственного средства (D), где антитело имеет одну или несколько свободных цистеиновых аминокислот и антитело присоединяется через одну или несколько свободных цистеиновых аминокислот с помощью линкерного остатка (L) к D; композиция имеет Формулу I:
где p равно 1, 2, 3 или 4. Количество остатков лекарственных средств, которые могут конъюгироваться через остаток тиольного реакционноспособного линкера с молекулой антитела, ограничено количеством цистеиновых остатков, которые вводят с помощью способов, описанных в настоящем документе. Иллюстративные ADC Формулы I по этой причине содержат антитела, которые имеют 1, 2, 3 или 4 полученных с помощью генной инженерии цистеиновых аминокислот.
Другой иллюстративный вариант осуществления соединения конъюгата антитело-лекарственное средство (ADC) содержит полученное с помощью генной инженерии антитело с цистеиновыми заменами (Ab), пептид, связывающий альбумин (ABP), и остаток лекарственного средства (D), где антитело присоединяется к остатку лекарственного средства с помощью линкерного остатка (L) и антитело присоединяться к пептиду, связывающему альбумин, с помощью амидной связи или второго линкерного остатка; композиция имеет Формулу Ia:
где p равно 1, 2, 3 или 4.
Соединения ADC по настоящему изобретению включают соединения, которые могут использоваться в связи с их противораковой активностью. В частности, соединения включают, полученное с помощью генной инженерии антитело с цистеиновыми заменами, конъюгированное, то есть ковалентно связанное с помощью линкера, с остатком лекарственного средства, то есть токсином. Когда лекарственное средство не является конъюгированным с антителом, лекарственное средство имеет цитотоксичное или цитостатическое воздействие. Биологическая активность остатка лекарственного средства, таким образом, модулируется посредством конъюгирования с антителом. Конъюгаты антитело-лекарственное средство (ADC) по настоящему изобретению селективно доставляют эффективную дозу цитотоксического средства в ткани опухоли, при этом может достигаться более высокая селективность, то есть меньшая эффективная доза.
Остатки лекарственных средств
Остаток лекарственного средства (D) конъюгатов антитело-лекарственное средство (ADC) включает любое соединение, остаток или группу, которая имеет цитотоксическое или цитостатическое воздействие. Остатки лекарственных средств включают: (i) химиотерапевтические средства, которые могут функционировать в качестве ингибиторов микротубулина, ингибиторов митоза, ингибиторов топоизомеразы или интеркаляторов ДНК; (ii) белковые токсины, которые могут функционировать ферментативно; и (iii) радиоизотопы.
Иллюстративные остатки лекарственных средств включают, но, не ограничиваясь этим, майтансиноид, ауристатин, доластатин, трихотецен, CC1065, калихимицин и другие энедииновые антибиотики, таксан, антрациклин и стереоизомеры, изостеры, их аналоги или производные.
Майтансиновые соединения, подходящие для использования в качестве остатков майтансиноидных лекарственных средств, хорошо известны в данной области и могут быть выделены из природных источников в соответствии с известными способами, получены с использованием способов генной инженерии (см. Yu et al (2002) PROC. NAT. ACAD. SCI. (USA) 99:7968-7973) или представлять собой майтансинол и аналоги майтансинола, полученные в соответствии с известными способами синтеза.
Иллюстративные остатки майтансиноидных лекарственных средств включают те, которые имеют модифицированное ароматическое кольцо, такие как: C-19-дехлор (патент США № 4256746) (полученный посредством восстановления лития-алюминия гидрида ансамитоцина P2); C-20-гидрокси (или C-20-деметил) +/-C-19-дехлор (патенты США № 4361650 и 4307016) (полученный посредством деметилирования с использованием Streptomyces или Actinomyces или дехлорирования с использованием LAH); и C-20-деметокси, C-20-ацилокси (-OCOR), +/-дехлор (патент США № 4294757) (полученные посредством ацилирования с использованием ацилхлоридов) и те, которые имеют модификации в других положениях.
Иллюстративные остатки майтансиноидных лекарственных средств также включают те, которые имеют модификации, такие как: C-9-SH (патент США № 4424219) (полученный посредством взаимодействия майтансинола с H2S или P2S5); C-14-алкоксиметил(деметокси/CH2OR) (патент США № 4331598); C-14-гидроксиметил или ацилоксиметил (CH2OH или CH2OAc) (патент США № 4450254) (полученный от Nocardia); C-15-гидрокси/ацилокси (патент США № 4364866) (полученный посредством преобразования майтансинола с помощью Streptomyces); C-15-метокси (патенты США № 4313946 и 4315929) (выделенный из Trewia nudlflora); C-18-N-деметил (патенты США № 4362663 и 4322348) (полученный посредством деметилирования майтансинола с помощью Streptomyces) и 4,5-деокси (патент США № 4371533) (полученный посредством восстановления майтансинола с помощью трихлорида титана/LAH). Многие положения на майтансиновых соединениях известны как пригодные для использования в качестве положения для связывания, в зависимости от типа связи. Например, для образования сложноэфирной связи, C-3 положение, имеющее гидроксильную группу, C-14 положение, модифицированное гидроксиметилом, C-15 положение, модифицированное гидроксильной группой, и C-20 положение, имеющее гидроксильную группу, все они пригодны для использования.
Остаток лекарственного средства (D) конъюгатов антитело-лекарственное средство (ADC) Формулы I включает майтансиноиды, имеющие структуру:
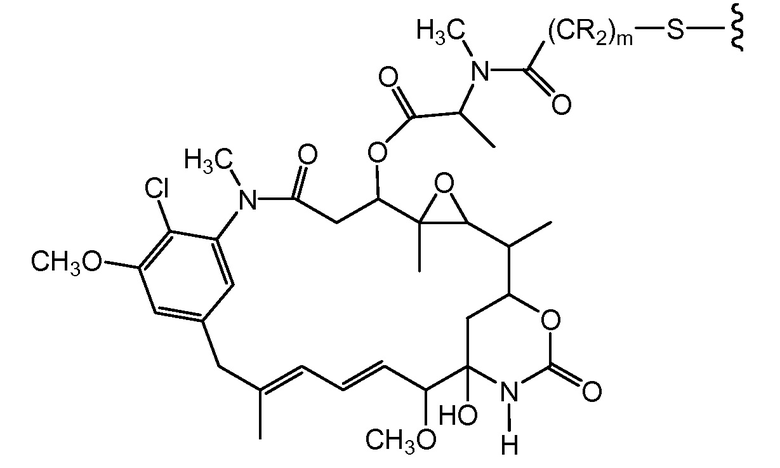
где волнистая линия показывает ковалентное присоединение атома серы D к линкеру (L) конъюгата антитело-лекарственное средство (ADC). R может независимо представлять собой H или C1-C6 алкил, выбранный из метила, этила, 1-пропила, 2-пропила, 1-бутила, 2-метил-1-пропила, 2-бутила, 2-метил-2-пропила, 1-пентила, 2-пентила, 3-пентила, 2-метил-2-бутила, 3-метил-2-бутила, 3-метил-1-бутила, 2-метил-1-бутила, 1-гексила, 2-гексила, 3-гексила, 2-метил-2-пентила, 3-метил-2-пентила, 4-метил-2-пентила, 3-метил-3-пентила, 2-метил-3-пентила, 2,3-диметил-2-бутила и 3,3-диметил-2-бутила. Алкиленовая цепь, присоединяющая амидную группу к атому серы, может представлять собой метанил, этанил или пропил, то есть m равно 1, 2, или 3.
Майтансиновые соединения ингибируют пролиферацию клеток посредством ингибирования образования микротрубочек во время митоза посредством ингибирования полимеризации белка микротубулина, тубулина (Remillard et al (1975) Science 189:1002-1005). Майтансин и майтансиноиды являются высоко цитотоксичными, но их клиническое использование при терапии рака является сильно ограниченным из-за их сильных системных побочных воздействий, связанных, прежде всего, с их плохой селективностью по отношению к опухоли. Клинические исследования с майтансином были прерваны из-за серьезных отрицательных воздействий на центральную нервную систему и желудочно-кишечную систему (Issel et al (1978) Can. Treatment. Rev. 5:199-207).
Остатки майтансиноидных лекарственных средств представляют собой привлекательные остатки лекарственных средств в конъюгатах антитело-лекарственное средство, поскольку они: (i) являются относительно доступными для получения посредством ферментирования или химической модификации, дериватизации продуктов ферментирования, (ii) являются пригодными для дериватизации с помощью функциональных групп, пригодных для конъюгирования через недисульфидные линкеры с антителами, (iii) являются стабильными в плазме и (iv) являются эффективными против разнообразных линий клеток опухоли (US 2005/0169933; WO 2005/037992; патент США № 5208020).
Как и для других остатков лекарственных средств, все стереоизомеры остатков майтансиноидных лекарственных средств рассматриваются в качестве соединений по настоящему изобретению, то есть это может быть любое сочетание R- и S-конфигураций на хиральных атомах углерода D. В одном из вариантов осуществления, остаток майтансиноидного лекарственного средства (D) будет иметь следующую стереохимию:
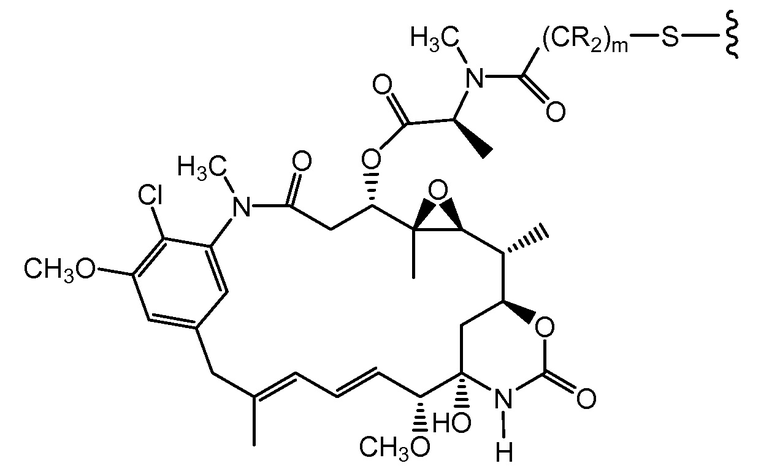
Иллюстративные варианты осуществления остатков майтансиноидных лекарственных средств включают: DM1, (CR2)m=CH2CH2; DM3, (CR2)m=CH2CH2CH(CH3); и DM4, (CR2)m=CH2CH2C(CH3)2, имеющие структуры:
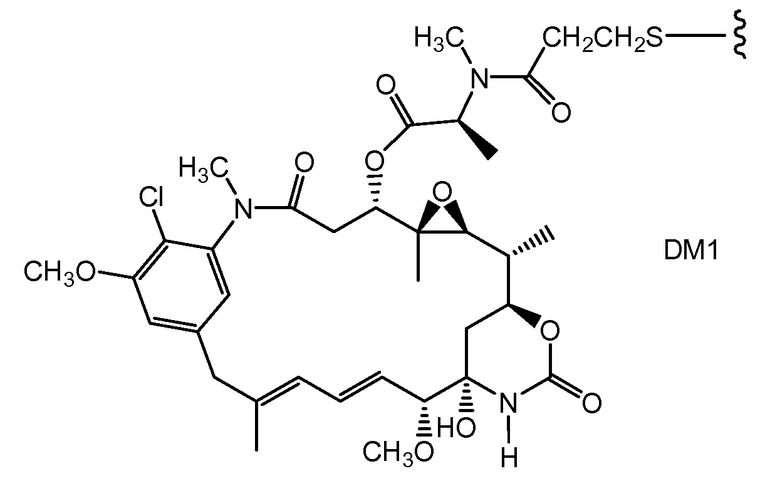
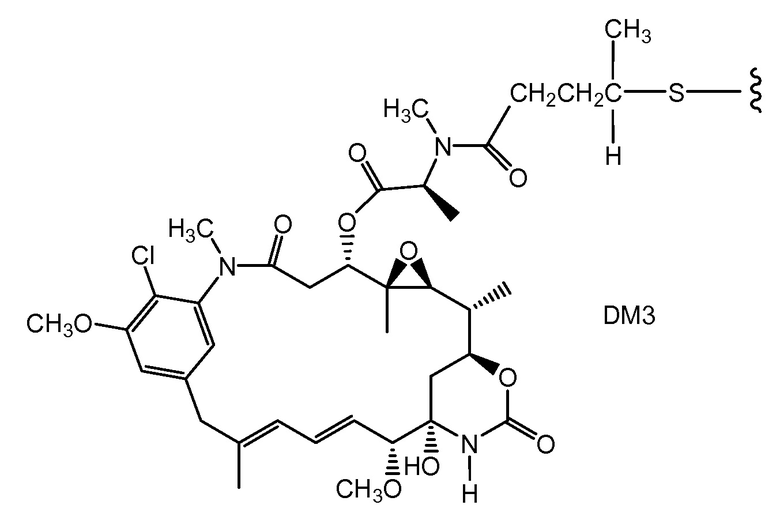
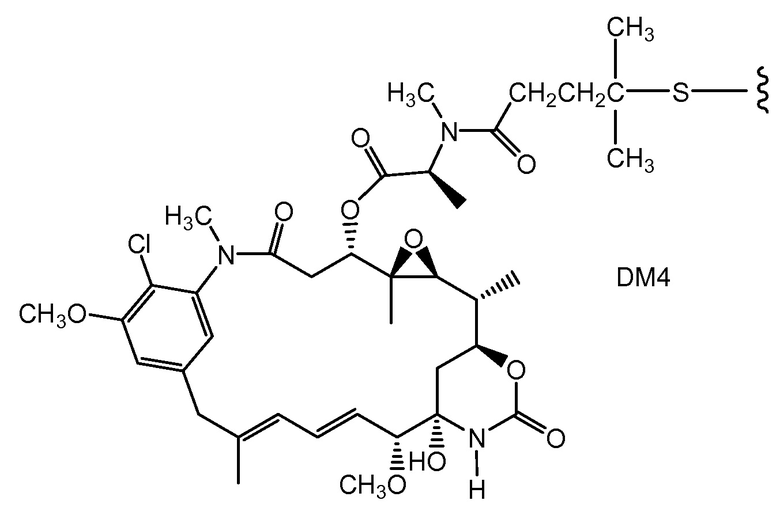
Линкер может быть присоединен к майтансиноидной молекуле в различных положениях, в зависимости от типа связи. Например, сложноэфирная связь может быть сформирована посредством реакции с гидроксильной группой с использованием обычных способов связывания. Реакция может осуществляться в C-3 положении, имеющем гидроксильную группу, в C-14 положении, модифицированном гидроксиметилом, в C-15 положении, модифицированном гидроксильной группой, и в C-20 положении, имеющем гидроксильную группу. В предпочтительном варианте осуществления, связь формируется в C-3 положении майтансинола или аналога майтансинола.
Остаток лекарственного средства (D) конъюгатов антитело-лекарственное средство (ADC) Формулы I также включает доластатины и их пептидные аналоги и производные, ауристатины (патенты США № 5635483; 5780588). Доластатины и ауристатины, как показано, отрицательно влияют на динамику микротрубочек, на гидролиз GTP, и на ядерное и клеточное деление (Woyke et al (2001) Antimicrob. Agents and Chemother. 45(12):3580-3584), и имеют противораковую (патент США № 5663149) и противогрибковую активность (Pettit et al (1998) Antimicrob. Agents Chemother. 42:2961-2965). Различные формы остатка лекарственного средства доластатина или ауристатина могут ковалентно присоединяться к антителу через N(амино)-конец или C(карбоксильный)-конец остатка пептидного лекарственного средства (WO 02/088172; Doronina et al (2003) Nature Biotechnology 21(7):778-784; Francisco et al (2003) Blood 102(4):1458-1465).
Остатки лекарственных средств включают доластатины, ауристатины (патент США № 5635483; патент США № 5780588; патент США № 5767237; патент США № 6124431), и их аналоги и производные. Доластатины и ауристатины, как показано, отрицательно влияют на динамику микротрубочек, на гидролиз GTP и на ядерное и клеточное деление (Woyke et al (2001) Antimicrob. Agents and Chemother. 45(12):3580-3584) и имеют противораковую (патент США № 5663149) и противогрибковую активность (Pettit et al (1998) Antimicrob. Agents Chemother. 42:2961-2965). Остаток лекарственного средства доластатина или ауристатина может присоединяться к антителу через N(амино)-конец или C(карбоксильное)-конец остатка пептидного лекарственного средства (WO 02/088172).
Иллюстративные варианты осуществления ауристатина включают остатки лекарственного средства монометилауристатина, связанные с N-концом DE и DF, описанные в патенте США № 7498298 и патенте США № 7659241, описание каждого из которых в явном виде включается в качестве ссылки в полном объеме.
Остаток лекарственного средства (D) конъюгатов антитело-лекарственное средство (ADC) Формулы I включает остатки монометилауристатиновых лекарственных средств MMAE и MMAF, связанные через N-конец с антителом и имеющие структуры:
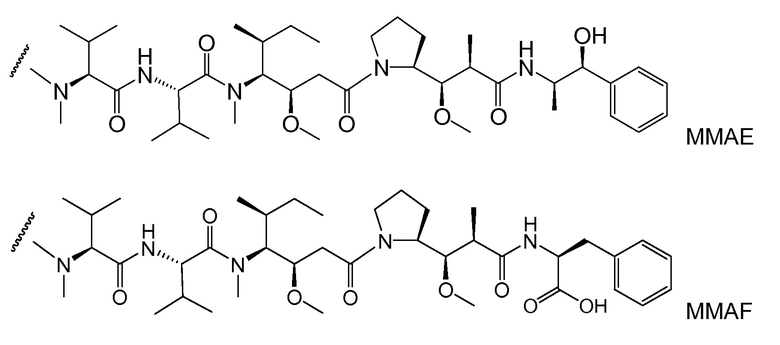
Как правило, остатки лекарственных средств на основе пептидов могут быть получены посредством формирования пептидной связи между двумя или более аминокислотами и/или пептидными фрагментами. Такие пептидные связи могут быть получены, например, в соответствии со способом жидкофазного синтеза (смотри E. Schroder and K. Lübke, "The Peptides", volume 1, pp 76-136, 1965, Academic Press), который хорошо известен в области химии пептидов.
Остаток лекарственного средства включает калихимицин и его аналоги и производные. Калихимициновое семейство антибиотиков способно осуществлять разрывы двухцепочечной ДНК при субпикомолярных концентрациях. Относительно получения конъюгатов калихимицинового семейства, смотри патент США № 5712374; патент США № 5714586; патент США № 5739116; патент США № 5767285; патент США № 5770701, патент США № 5770710; патент США № 5773001; патент США № 5877296. Структурные аналоги калихимицина, которые можно использовать, включают, но не ограничиваясь этим, γ1I, α2I, α3I, N-ацетил-γ1I, PSAG и θI1 (Hinman et al Cancer Research 53:3336-3342 (1993), Lode et al Cancer Research 58:2925-2928 (1998).
Белковые токсины включают: A цепь дифтерии, несвязывающиеся активные фрагменты токсина дифтерии, A цепь экзотоксина (от Pseudomonas aeruginosa), A цепь рицина (Vitetta et al (1987) Science, 238: 1098), A цепь абрина, A цепь модецина, альфа-сарцин, белки Aleurites fordii, диантиновые белки, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор Momordica charantia, курцин, кротин, ингибитор Sapaonaria officinalis, гелонин, митогеллин, рестристоцин, феномицин, эномицин и трикотецены (WO 93/21232).
Терапевтические радиоизотопы включают: 32P, 33P, 90Y, 125I, 131I, 131In, 153Sm, 186Re, 188Re, 211At, 212Bi, 212Pb и радиоактивные изотопы Lu.
Радиоизотопные или другие метки могут вводиться в конъюгат известными путями (Fraker et al (1978) Biochem. Biophys. Res. Commun. 80:49-57; "Monoclonal Antibodies in Immunoscintigraphy" Chatal, CRC Press 1989). Меченая углеродом 14 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPA) представляет собой иллюстративное хелатирующее средство для конъюгирования радионуклида с антителом (WO 94/11026).
Линкеры
"Линкер" (L) представляет собой бифункциональный или мультифункциональный остаток, который можно использовать для связывания одного или нескольких остатков лекарственных средств (D) и единицы антитела (Ab) с образованием конъюгатов антитело-лекарственное средство (ADC) Формулы I. Конъюгаты антитело-лекарственное средство (ADC) может быть удобным получать с использованием линкера, имеющего реакционноспособную функциональную группу для связывания с лекарственным средством и с антителом. Тиольная группа цистеинового остатка полученного с помощью генной инженерии антитела с цистеиновыми заменами (Ab) может образовывать связь с функциональной группой линкерного реагента, с остатком лекарственного средства или с промежуточным соединением лекарственное средство-линкер.
В одном из аспектов, линкер имеет реакционноспособный сайт, который имеет электрофильную группу, которая является реакционноспособной по отношению к нуклеофильному цистеину, присутствующему на антителе. Тиольная группа цистеинового остатка антитела является реакционноспособной по отношению к электрофильной группе на линкере и образует ковалентную связь с линкером. Пригодные для использования электрофильные группы включают, но, не ограничиваясь этим, малеимидные и галогенацетамидные группы.
Полученные с помощью генной инженерии антитела с цистеиновыми заменами взаимодействуют с линкерными реагентами или с промежуточными соединениями лекарственное средство - линкер, с электрофильными функциональными группами, такими как малеимид или α-галогенкарбонил, в соответствии со способом конъюгирования Klussman, et al (2004), Bioconjugate Chemistry 15 (4):765-773, на странице 766, и в соответствии с протоколом Примера 4.
Еще в одном варианте осуществления, реакционноспособная группа линкерного реагента или промежуточного соединения лекарственное средство-линкер содержит реакционноспособную по отношению к тиолу функциональную группу, которая может образовывать связь со свободной тиольной группой цистеинового остатка антитела. Примеры реакционноспособных по отношению к тиолу функциональных групп включают, но, не ограничиваясь этим, малеимид, α-галогенацетил, активированные сложные эфиры, такие как сложные сукцинимидные эфиры, сложные 4-нитрофениловые эфиры, сложные пентафторфениловые эфиры, сложные тетрафторфениловые эфиры, ангидриды, хлорангидриды, сульфонилхлориды, изоцианаты и изотиоцианаты.
В другом варианте осуществления, линкер может представлять собой линкер дендритного типа для ковалентного присоединения нескольких остатков лекарственных средств через разветвляющийся, мультифункциональный линкерный остаток к антителу (Sun et al (2002) Bioorganic & Medicinal Chemistry Letters 12:2213-2215; Sun et al (2003) Bioorganic & Medicinal Chemistry 11:1761-1768; King (2002) Tetrahedron Letters 43:1987-1990). Дендритные линкеры могут повысить молярное отношение лекарственного средства к антителу, то есть нагрузку, которая связана с сильнодействием ADC. Таким образом, когда полученное с помощью генной инженерии антитело с цистеиновыми заменами несет только одну реакционноспособную тиольную группу цистеинового остатка, через дендритный линкер можно присоединить множество остатков лекарственных средств.
Линкер может содержать аминокислотные остатки, которые связывают антитело (Ab) с остатком лекарственного средства (D) полученного с помощью генной инженерии цистеинового конъюгата антитело-лекарственное средство (ADC) по настоящему изобретению. Аминокислотные остатки могут образовывать дипептидную, трипептидную, тетрапептидную, пентапептидную, гексапептидную, гептапептидную, октапептидную, нонапептидную, декапептидную, ундекапептидную или додекапептидную единицу. Аминокислотные остатки включают те, которые встречаются в природе, а также второстепенные аминокислоты и не встречающиеся в природе аналоги аминокислот, такие как цитруллин.
Полезные единицы аминокислотных остатков могут конструироваться и оптимизироваться по их селективности для ферментативного расщепления с помощью конкретных ферментов, например, связанной с опухолями протеазы, для высвобождения активного остатка лекарственного средства. В одном из вариантов осуществления, единица аминокислотного остатка, такая как валин-цитруллин (vc или val-cit), представляет собой единицу, расщепление которой катализируется катепсином B, C и D или плазминпротеазой.
Единица линкера может относиться к саморазрушающемуся типу, такому как единица п-аминобензилкарбамоила (PAB), где ADC имеет иллюстративную структуру:

где Q представляет собой C1-C8 алкил, -O-(C1-C8 алкил), -галоген, -нитро или -циано; m представляет собой целое число в пределах от 0 до 4 и p находится в пределах от 1 до 4.
Другие примеры саморазрушающихся спейсеров включают, но не ограничиваясь этим, ароматические соединения, которые являются электронно сходными с группой PAB, такие как производные 2-аминоимидазол-5-метанола (патент США № 7375078; Hay et al. (1999) Bioorg. Med. Chem. Lett. 9:2237) и орто- или пара-аминобензилацетали. Можно использовать спейсеры, которые подвергаются циклизации при гидролизе амидных связей, такие как амиды замещенной и незамещенной 4-аминомасляной кислоты (Rodrigues et al (1995) Chemistry Biology 2:223), соответствующим образом замещенные бицикло[2.2.1] и бицикло[2.2.2] кольцевые системы (Storm et al (1972) J. Amer. Chem. Soc. 94:5815) и амиды 2-аминофенилпропионовой кислоты (Amsberry, et al (1990) J. Org. Chem. 55:5867). Устранение амин-содержащих лекарственных средств, которые замещены на глицине (Kingsbury et al (1984) J. Med. Chem. 27: 1447), также дает примеры саморазрушающегося спейсера, пригодного для использования в ADC.
В другом варианте осуществления, линкер L может представлять собой линкер дендритного типа для ковалентного присоединения нескольких остатков лекарственных средств через разветвляющийся, мультифункциональный линкерный остаток к антителу (Sun et al (2002) Bioorganic & Medicinal Chemistry Letters 12:2213-2215; Sun et al (2003) Bioorganic & Medicinal Chemistry 11:1761-1768). Дендритные линкеры могут увеличивать молярное отношение лекарственного средства к антителу, то есть нагрузку, что связано с сильнодействием ADC. Таким образом, когда полученное с помощью генной инженерии антитело с цистеиновыми заменами несет только одну реакционноспособную тиольную группу цистеинового остатка, множество остатков лекарственных средств можно присоединить через дендритный линкер (WO 2004/01993; Szalai et al (2003) J. Amer. Chem. Soc. 125: 15688-15689; Shamis et al (2004) J. Amer. Chem. Soc. 126: 1726-1731; Amir et al (2003) Angew. Chem. Int. Ed. 42:4494-4499).
Варианты осуществления соединений конъюгатов антитело-лекарственное средство Формулы Ia включают (val-cit), (MC-val-cit) и (MC-val-cit-PAB):
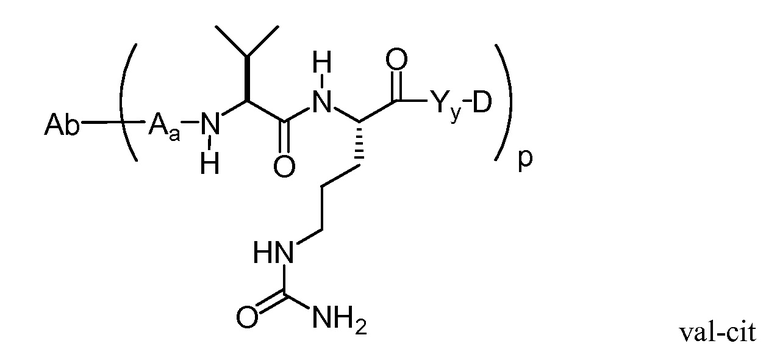
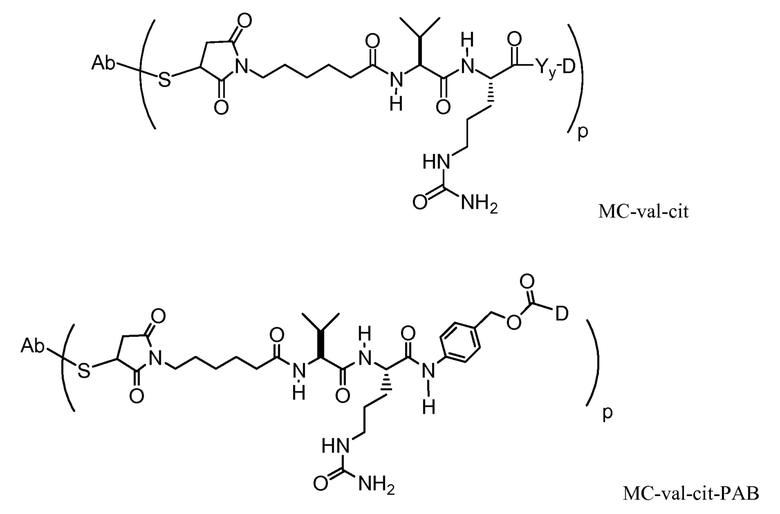
Другие иллюстративные варианты осуществления соединений конъюгатов антитело-лекарственное средство Формулы Ia включают структуры:
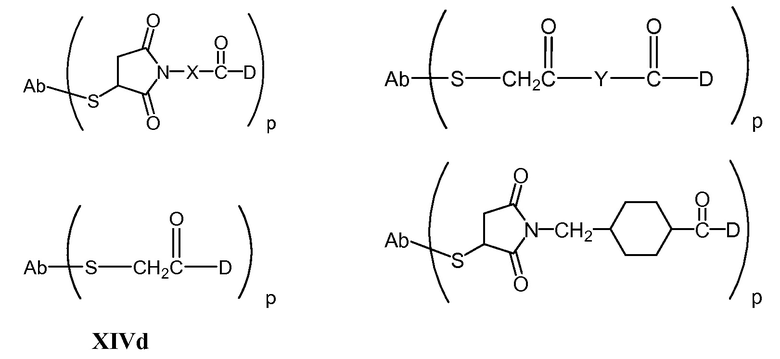
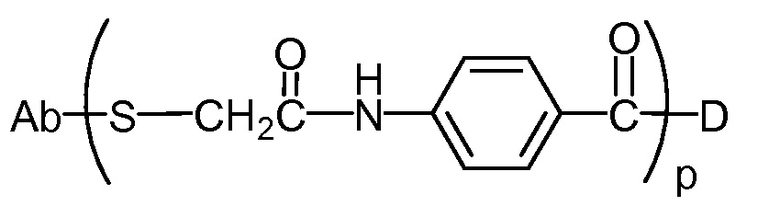
где X представляет собой:
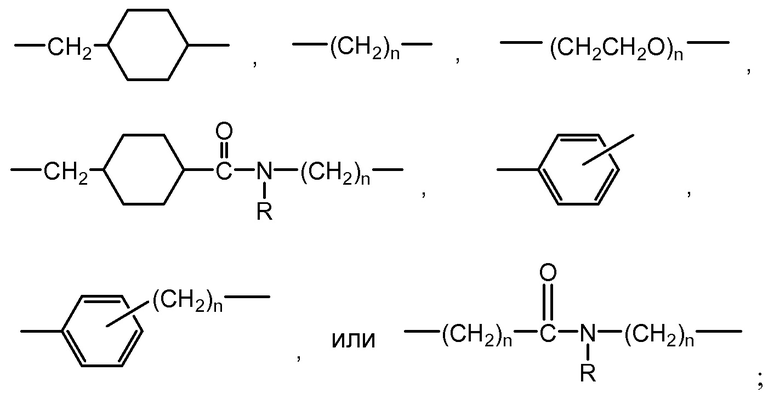
где Y представляет собой:
и R независимо представляет собой H или C1-C6 алкил; и n представляет собой 1-12.
В другом варианте осуществления, линкер имеет реакционноспособную функциональную группу, которая имеет нуклеофильную группу, которая является реакционноспособной по отношению к электрофильной группе, присутствующей на антителе. Пригодные для использования электрофильные группы на антителе включают, но, не ограничиваясь этим, альдегидные и кетоновые карбонильные группы. Гетероатом нуклеофильной группы линкера может взаимодействовать с электрофильной группой на антителе и образовывать ковалентную связь с единицей антитела. Пригодные для использования нуклеофильные группы на линкере включают, но, не ограничиваясь этим, гидразид, оксим, амино, гидразин, тиосемикарбазон, гидразинкарбоксилат и арилгидразид. Электрофильная группа на антителе обеспечивает удобный активный сайт для присоединения линкера.
Как правило, линкеры пептидного типа могут быть получены посредством формирования пептидной связи между двумя или более аминокислотами и/или пептидными фрагментами. Такие пептидные связи могут быть получены, например, в соответствии со способом жидкофазного синтеза (E. Schroder and K. Lübke (1965) "The Peptides", volume 1, pp 76-136, Academic Press), который хорошо известен в области химии пептидов.
В другом варианте осуществления, линкер может быть замещен группами, которые модулируют растворимость или реакционноспособность. Например, заряженный заместитель, такой как сульфонат (-SO3-) или аммоний, может увеличить растворимость реагента в воде и облегчить реакцию связывания линкерного реагента с антителом или с остатком лекарственного средства, или облегчить реакцию связывания Ab-L (промежуточного соединения антитело-линкер) с D или D-L (промежуточного соединения лекарственное средство-линкер) с Ab, в зависимости от способа синтеза, используемого для получения ADC.
Соединения по настоящему изобретению в явном виде предполагают, но не ограничиваясь этим, ADC, полученные с помощью линкерных реагентов: BMPEO, BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, MPBH, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC и сульфо-SMPB и SVSB (сукцинимидил-(4-винилсульфон)бензоат), и включают бис-малеимидные реагенты: DTME, BMB, BMDB, BMH, BMOE, BM(PEO)3 и BM(PEO)4, которые являются коммерчески доступными от Pierce Biotechnology, Inc., Customer Service Department, P.O. Box 117, Rockford, IL. 61105 U.S.A, 1-800-874-3723, International +815-968-0747. Смотри страницы 467-498, 2003-2004 Applications Handbook and Catalog. Бис-малеимидные реагенты делают возможным присоединение тиольной группы полученного с помощью генной инженерии антитела с цистеиновыми заменами к тиол-содержащему остатку лекарственного средства, к метке или промежуточному линкерному соединению последовательным или параллельным образом. Другие функциональные группы наряду с малеимидом, которые являются реакционноспособным по отношению к тиольной группе полученного с помощью генной инженерии антитела с цистеиновыми заменами, остатка лекарственного средства, метки или линкерного промежуточного соединения, включают йодацетамид, бромацетамид, винилпиридин, дисульфидпиридил, дисульфид, изоцианат и изотиоцианат.

Подходящие для использования линкерные реагенты могут также быть получены из других коммерческих источников, таких как Molecular Biosciences Inc. (Boulder, CO) или их можно синтезировать в соответствии с процедурами, описанными Toki et al (2002) J. Org. Chem. 67: 1866-1872; Walker, M.A. (1995) J. Org. Chem. 60:5352-5355; Frisch et al (1996) Bioconjugate Chem. 7: 180-186; патент США № 6214345; WO 02/088172; патент США № 2003130189; US2003096743; WO 03/026577; WO 03/043583 и WO 04/032828.
Иллюстративный валин-цитруллиновый (val-cit или vc) дипептидный линкерный реагент, имеющий малеимидный расширитель и пара-аминобензилкарбамоильный (PAB) саморазрушающийся спейсер, имеет структуру:
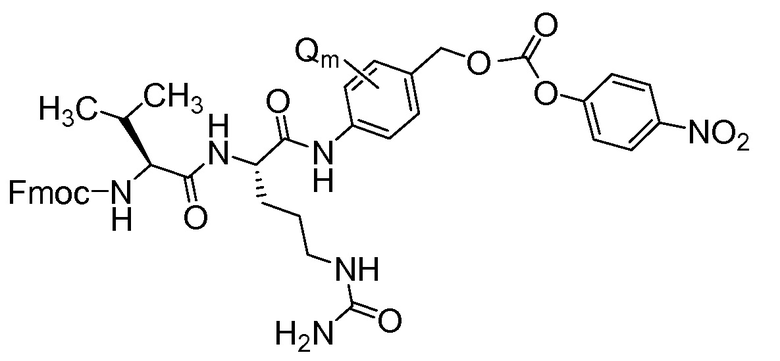
где Q представляет собой C1-C8 алкил, -O-(C1-C8 алкил), -галоген, -нитро или -циано и m представляет собой целое число в пределах от 0 до 4.
Иллюстративный phe-lys(Mtr) дипептидный линкерный реагент, имеющий малеимидную единицу расширителя и п-аминобензильную саморазрушающуюся единицу спейсера, может быть получен в соответствии с Dubowchik, et al. (1997) Tetrahedron Letters, 38:5257-60 и имеет структуру:
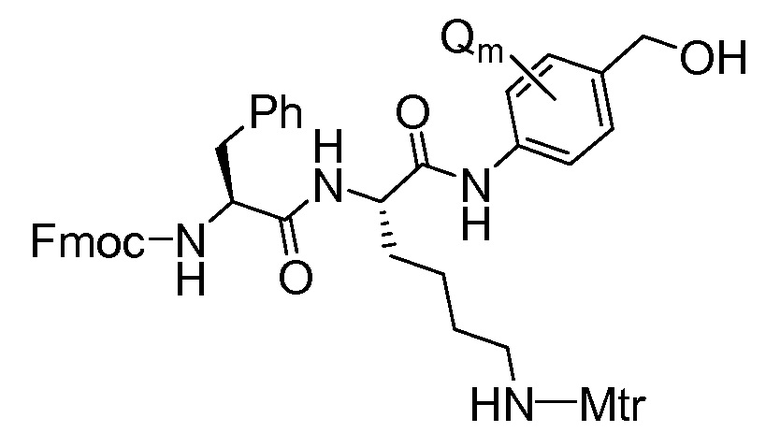
где Mtr представляет собой моно-4-метокситритил, Q представляет собой C1-C8 алкил, -O-(C1-C8 алкил), -галоген, -нитро или -циано и m представляет собой целое число в пределах от 0 до 4.
Иллюстративные соединения конъюгатов антитело-лекарственное средство по настоящему изобретению включают:
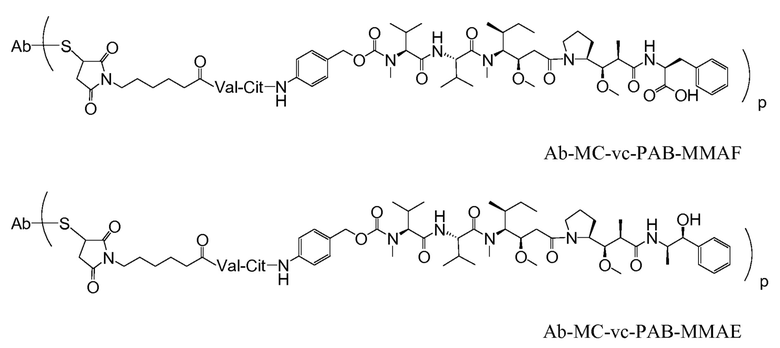
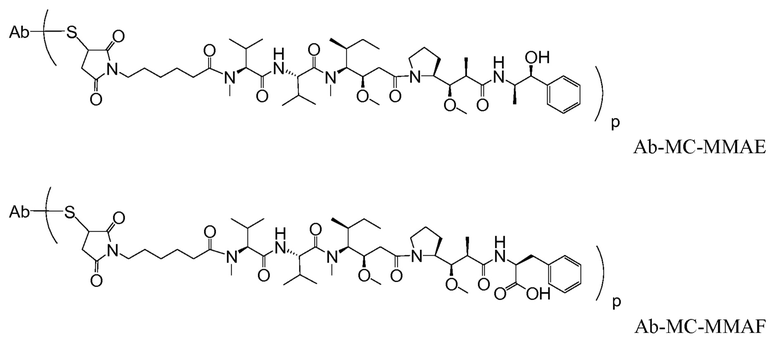
где Val представляет собой валин; Cit представляет собой цитруллин; p равно 1, 2, 3 или 4, и Ab представляет собой полученное с помощью генной инженерии антитело с цистеиновыми заменами. Другие иллюстративные конъюгаты антитело-лекарственное средство, где остаток майтансиноидного лекарственного средства DM1 связан через линкер BMPEO с тиольной группой трастузумаба, имеют структуру:
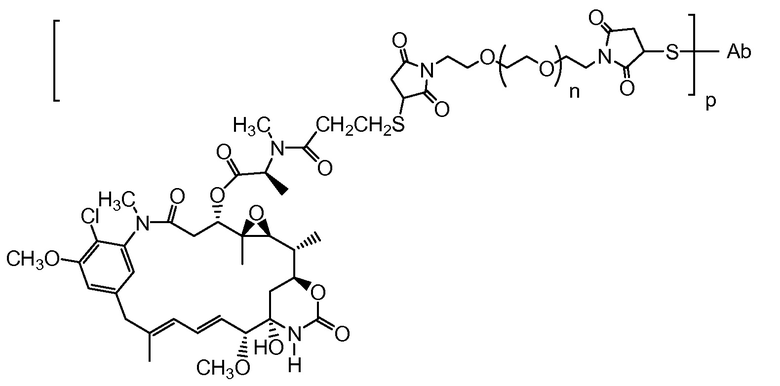
где Ab представляет собой полученное с помощью генной инженерии антитело с цистеиновыми заменами; n равно 0, 1 или 2, и p равно 1, 2, 3 или 4.
Получение конъюгатов антитело-лекарственное средство
ADC Формулы I может быть получен несколькими способами, с использованием реакций, условий и реагентов органической химии, известных специалистам в данной области, включая: (1) реакцию цистеиновой группы полученного с помощью генной инженерии антитела с цистеиновыми заменами с линкерным реагентом, с образованием промежуточного соединения антитело-линкер Ab-L, с помощью ковалентной связи, с последующей реакцией с активированным остатком лекарственного средства D; и (2) реакцию нуклеофильной группы остатка лекарственного средства с линкерным реагентом, с образованием промежуточного соединения лекарственное средство-линкер D-L, с помощью ковалентной связи, с последующей реакцией с цистеиновой группой полученного с помощью генной инженерии антитела с цистеиновыми заменами. Способы конъюгирования (1) и (2) можно использовать с разнообразными полученными с помощью генной инженерии антителами с цистеиновыми заменами, остатками лекарственных средств и линкерами для получения конъюгатов антитело-лекарственное средство Формулы I.
Тиольные группы цистеиновых остатков антитела являются нуклеофильными и способны взаимодействовать с образованием ковалентных связей с электрофильными группами на линкерных реагентах и промежуточных соединениях лекарственное средство-линкер, включая: (i) активные сложные эфиры, такие как сложные эфиры NHS, сложные эфиры HOBt, галогенформиаты и галогенангидриды; (ii) алкил- и бензилгалогениды, такие как галогенацетамиды; (iii) альдегиды, кетоны, карбоксильные и малеимидные группы и (iv) дисульфиды, включая пиридилдисульфиды, посредством сульфидного обмена. Нуклеофильные группы на остатке лекарственного средства включают, но, не ограничиваясь этим: аминовую, тиольную, гидроксильную, гидразидную, оксимовую, гидразиновую, тиосемикарбазоновую, гидразинкарбоксилатную и арилгидразидную группы, способные взаимодействовать с образованием ковалентных связей с электрофильными группами на линкерных остатках и линкерных реагентах.
Майтансин может, например, преобразовываться в May-SSCH3, который может восстанавливаться до свободного тиола May-SH и взаимодействовать с модифицированным антителом (Chari et al (1992) Cancer Research 52:127-131) с генерированием иммуноконъюгата майтансиноид-антитело с помощью дисульфидного линкера. О конъюгатах антитело-майтансиноид с дисульфидными линкерами сообщают (WO 04/016801; патент США № 6884874; US 2004/039176 A1; WO 03/068144; US 2004/001838 A1; патенты США № 6441163, 5208020, 5416064; WO 01/024763). Дисульфидный линкер SPP конструируется с помощью линкерного реагента N-сукцинимидил 4-(2-пиридилтио)пентаноата.
При определенных условиях, полученные с помощью генной инженерии антитела с цистеиновыми заменами могут быть сделаны реакционноспособными для конъюгирования с помощью линкерных реагентов посредством обработки восстанавливающим агентом, таким как DTT (реагент Клеланда, дитиотреитол) или TCEP (трис(2-карбоксиэтил)фосфин гидрохлорид; Getz et al (1999) Anal. Biochem. Vol 273:73-80; Soltec Ventures, Beverly, MA). Полноразмерные моноклональные антитела с цистеиновыми заменами, полученные с помощью генной инженерии (ThioMab), экспрессируемые в клетках CHO, восстанавливаются с помощью примерно 50 кратного избытка TCEP в течение 3 часов при 37°C для восстановления дисульфидных связей, которые могут образовываться между вновь введенными цистеиновыми остатками и цистеином, присутствующим в культурных средах. Восстановленные ThioMab разбавляют и загружают в колонку HiTrap S в 10 мМ ацетата натрия, pH 5, и элюируют с помощью PBS, содержащего 0,3 M хлорида натрия. Дисульфидные связи устанавливаются повторно между цистеиновыми остатками, присутствующими в исходном Mab, с помощью разбавленного водного раствора (200 нМ) сульфата меди (CuSO4) при комнатной температуре, в течение ночи. Можно использовать другие оксиданты, то есть окисляющие агенты и окисляющие условия, которые известны в данной области. Окисление на воздухе окружающей среды также является эффективным. Эта стадия осторожного частичного повторного окисления формирует внутрицепные дисульфиды эффективно, с высокой воспроизводимостью. Добавляют приблизительно 10-кратный избыток промежуточного соединения лекарственное средство-линкер, например, BM(PEO)4-DM1, перемешивают и оставляют стоять в течение примерно часа при комнатной температуре для осуществления конъюгирования и образования конъюгата антитело-лекарственное средство ThioMab. Смесь для конъюгирования фильтруют на геле и загружают, и элюируют через колонку HiTrap S для удаления избытка промежуточного соединения лекарственное средство-линкер и других примесей.
На фигуре 11 показан общий способ получения полученного с помощью генной инженерии антитела с цистеиновыми заменами, экспрессируемого из культуры клеток для конъюгирования. Цистеиновые аддукты, вероятно, вместе с различными межцепными дисульфидными связями, восстановительно расщепляются с получением восстановленной формы антитела. Межцепные дисульфидные связи между парными цистеиновыми остатками образуются вновь при условиях частичного окисления, таких как экспонирование для кислорода окружающей среды. Вновь введенные, полученные с помощью генной инженерии и непарные цистеиновые остатки остаются доступными для взаимодействия с линкерными реагентами или промежуточными соединениями лекарственное средство - линкер с образованием конъюгатов антител по настоящему изобретению. ThioMab, экспрессируемые в линиях клеток млекопитающих, дают конъюгированный извне аддукт Cys для полученных с помощью генной инженерии Cys посредством образования связи -S-S-. Следовательно, очищенные ThioMab должны обрабатываться с помощью процедур восстановления и окисления, как описано в Примере 11, с получением реакционноспособными ThioMab. Эти ThioMab используют для конъюгирования с содержащими мималеимид цитотоксическими лекарственными средствами, флуорофорами и другими метками.
Получают разнообразные конъюгаты ThioFab и ThioMab антитело-лекарственное средство (примеры 4-8). Цистеиновый мутант hu4D5Fabv8 (V110C) конъюгируют с остатком майтансиноидного лекарственного средства DM1 с помощью бис-малеимидо линкерного реагента BMPEO с образованием hu4D5Fabv8 (V110C)-BMPEO-DM1 (пример 8).
Анализы пролиферации клеток in vitro
Как правило, цитотоксичную или цитостатическую активность конъюгата антитело-лекарственное средство (ADC) измеряют посредством: экспонирования клеток млекопитающих, имеющих рецепторные белки, например, HER2, для антитела ADC в среде для культивирования клеток; культивирования клеток в течение периода примерно от 6 часов примерно до 5 дней и измерения жизнеспособности клеток. Анализы in vitro на основе клеток используют для измерения жизнеспособности (пролиферации), цитотоксичности и индуцирования апоптоза (активации каспазы) ADC по настоящему изобретению.
Сильнодействие in vitro конъюгатов антитело-лекарственное средство измеряют с помощью анализа пролиферации клеток (Фигуры 10 и 11, Пример 9). Коммерчески доступен Luminescent Cell Viability Assay, CellTiter-Glo® (Promega Corp., Madison, WI), гомогенный способ анализа на основе рекомбинантной экспрессии люциферазы Coleoptera (патенты США № 5583024; 5674713 и 5700670). Этот анализ пролиферации клеток определяет количество жизнеспособных клеток в культуре на основе количественного определения присутствующего ATP, индикатора метаболически активных клеток (Crouch et al (1993) J. Immunol. Meth. 160:81-88; патент США № 6602677). CellTiter-Glo® Assay осуществляют в 96-луночном формате, что делает его пригодным для автоматического высокопроизводительного скрининга (HTS) (Cree et al (1995) Anticancer Drugs 6:398-404). Процедура гомогенного анализа включает добавление одного реагента (реагент CellTiter-Glo®) непосредственно к клеткам, культивируемым в среде, дополненной сывороткой. Отмывки клеток, удаления среды и множества стадий пипетирования не требуется. Система детектирует всего лишь 15 клеток/лунка в 384-луночном формате через 10 минут после добавления реагента и перемешивания. Клетки могут обрабатываться непрерывно ADC, или они могут обрабатываться и отделяться от ADC. Как правило, клетки, обрабатываемые недолго, то есть 3 часа, показывают такие же эффекты сильнодействия, как и непрерывно обрабатываемые клетки.
Гомогенный формат "добавление-перемешивание-измерение" приводит к лизису клеток и генерированию люминисцентного сигнала, пропорционального количеству присутствующего ATP. Количество ATP прямо пропорционально количеству клеток, присутствующих в культуре. CellTiter-Glo® Assay генерирует люминисцентный сигнал "типа тлеющего разряда", получаемый от реакции люциферазы, который имеет время полужизни, как правило, большее чем пять часов, в зависимости от типа клеток и используемой среды. Жизнеспособные клетки отражаются в относительных единицах люминесценции (RLU). Субстрат, люциферин светлячков, окисидативно декарбоксилируют с помощью рекомбинантной люциферазы светлячков с одновременным преобразованием ATP в AMP и генерированием фотонов.
Эффективность in vivo
Эффективность in vivo двух конъюгатов пептид, связывающий альбумин - DM1 (майтансиноид) - антитело-лекарственное средство (ADC) по настоящему изобретению измеряют с помощью трансгенной модели эксплантатов мышей с высоким уровнем экспрессии HER2 (Фигура 12, Пример 10). Привитая опухоль распространяется от трансгенных мышей Fo5 mmtv, которые не реагируют или плохо реагируют на терапию с помощью HERCEPTIN®. Индивиды обрабатываются один раз ABP-rhuFab4D5-Cys(легкая цепь)-DM1; ABP-rhuFab4D5-Cys(тяжелая цепь)-DM1 и плацебо, буфером PBS для контроля (носитель), и их отслеживают в течение 3 недель для измерения времени удвоения опухоли, логарифма гибели клеток и уменьшения опухоли.
Введение конъюгатов антитело-лекарственное средство
Конъюгаты антитело-лекарственное средство (ADC) по настоящему изобретению могут вводиться с помощью любого способа, соответствующего состоянию, которое должно лечиться. Как правило, ADC будут вводить парентерально, то есть с помощью вливания, подкожно, внутримышечно, внутривенно, интрадермально, интратекально и эпидурально.
Фармацевтические препараты
Фармацевтические препараты терапевтических конъюгатов антитело-лекарственное средство (ADC) по настоящему изобретению, как правило, приготавливают для парентерального введения, то есть в виде болюса, внутривенной, внутриопухолевой инъекции вместе с фармацевтически приемлемым парентеральным носителем и в стандартной единичной дозированной форме для инъекций. Конъюгат антитело-лекарственное средство (ADC), имеющее желаемый уровень чистоты, необязательно смешивают с фармацевтически приемлемыми разбавителями, носителями, наполнителями или стабилизаторами (Remington’s Pharmaceutical Sciences (1980) 16th edition, Osol, A. Ed.), в форме лиофилизированного препарата или водного раствора.
Лечение с помощью конъюгата антитело-лекарственное средство
Предполагается, что конъюгаты антитело-лекарственное средство (ADC) по настоящему изобретению можно использовать для лечения различных заболеваний или расстройств, например, отличающихся сверхэкспрессированием опухолевого антигена. Иллюстративные состояния или гиперпролиферативные расстройства включают доброкачественные или злокачественные опухоли; лейкемию и лимфоидные злокачественные заболевания. Другие состояния включают нейронные, глиальные, астроцитальные, гипоталамические, гландулярные, макрофагальные, эпителиальные, стромальные, бластоцельные, воспалительные, ангиогенные и иммунологические, включая аутоиммунные расстройства.
Как правило, заболевание или расстройство, которое должно лечиться, представляет собой гиперпролиферативное заболевание, такое как рак. Примеры раковых заболеваний, которые должны лечиться, в настоящем документе включают, но не ограничиваясь этим, карциному, лимфому, бластому, саркому и лейкемию или лимфоидные злокачественные заболевания. Более конкретные примеры таких раковых заболеваний включают рак сквамовых клеток (например, эпителиальный рак сквамовых клеток), рак легких, включая мелкоклеточный рак легких, немелкоклеточный рак легких, аденокарциному легких и сквамовую карциному легких, рак брюшной полости, печеночно-клеточный рак, гастральный рак или рак желудка, включая желудочно-кишечный рак, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичников, рак печени, рак мочевого пузыря, гепатому, рак груди, рак толстой кишки, рак прямой кишки, рак ободочной и прямой кишки, внутриматочную карциному или карциному матки, карциному слюнных желез, рак почек или надпочечников, рак простат, рак вульвы, рак щитовидной железы, печеночную карциному, анальную карциному, карциному полового члена, а также рак головы и шеи.
Аутоиммунные заболевания, для которых соединения ADC можно использовать при лечении, включают ревматологические расстройства (такие, например, как ревматоидный артрит, синдром Шегрена, склеродерму, волчанку, такую как SLE и волчаночный нефрит, полимиозит/дерматомиозит, криоглобулинемию, синдром анти-фосфолипидного антитела и псориазный артрит), остеоартрит, аутоиммунные расстройства желудочно-кишечного тракта и печени (такие, например, как воспалительные заболевания желудка (например, язвенный колит и болезнь Крона), аутоиммунный гастрит и пернициозную анемию, аутоиммунный гепатит, первичный цирроз печени, первичный склерозирующий холангит и заболевание брюшной полости), васкулиты (такие, например, как ANCA-связанный васкулит, включая васкулит Чурга-Штраусса, грануломатоз Вегенера и полиартериит), аутоиммунные неврологические расстройства (такие, например, как множественный склероз, синдром опсоклонуса миоклонуса, миастения гравис, оптиконевромиелит, болезнь Паркинсона, болезнь Альцгеймера и аутоиммунные полиневропатии), почечные расстройства (такие, например, как гломерулонефрит, синдром Гудпасчура и болезнь Бергера), аутоиммунные дерматологические расстройства (такие, например, как псориаз, уртикария, крапивница, вульгарная пузырчатка, буллезный пемфигоид и острая красная волчанка), гематологические расстройства (такие, например, как тромбоцитопеническая пурпура, тромботическая тромбоцитопеническая пурпура, посттрансфузионная пурпура и аутоиммунная гемолитическая анемия), атеросклероз, увеит, аутоиммунные заболевания слуха (такие, например, как заболевание внутреннего уха и потеря слуха), болезнь Бехчета, синдром Рейно, трансплантацию органов и аутоиммунные эндокринные расстройства (такие, например, как аутоиммунные заболевания, связанные с диабетом, такие как инсулин-зависимый сахарный диабет (IDDM), болезнь Аддисона, и аутоиммунное заболевание щитовидной железы (например, болезнь Граве и тироидит)). Более предпочтительно, такие заболевания включают, например, ревматоидный артрит, язвенный колит, ANCA-ассоциируемый васкулит, волчанку, множественный склероз, синдром Шегрена, болезнь Граве, IDDM, пернициозную анемию, тироидит и гломерулонефрит.
Для профилактики или лечения заболевания, соответствующая дозировка ADC будет зависеть от типа заболевания, которое должно лечиться, как определено выше, от тяжести и хода заболевания, от того, вводится ли молекула для превентивных или терапевтических целей, от предыдущей терапии, от клинической истории пациента и реакции на антитело, и от суждения наблюдающего врача. Молекулу соответствующим образом вводят пациенту однократно или в течение ряда сеансов лечения. В зависимости от типа и тяжести заболевания, примерно от 1 мкг/кг до 15 мг/кг (например, 0,1-20 мг/кг) молекулы представляет собой пробную начальную дозу для введения пациенту, например, с помощью одного или нескольких отдельных введений или посредством непрерывного вливания. Типичная ежедневная доза может находиться в пределах примерно от 1 мкг/кг до 100 мг/кг или более, в зависимости от факторов, рассмотренных выше. Иллюстративная доза ADC, которая должна вводиться пациенту, находится в пределах примерно от 0,1 примерно до 10 мг/кг массы пациента.
Для многократных введений в течение нескольких дней или более, в зависимости от состояния, лечение продолжают до тех пор, пока не произойдет желаемое подавление симптомов заболевания. Иллюстративный режим дозирования включает введение начальной нагрузочной дозы примерно 4 мг/кг, затем еженедельной поддерживающей дозы примерно 2 мг/кг антитела анти-ErbB2. Другие режимы дозирования могут быть полезными. Прогресс этой терапии легко отслеживается с помощью обычных способов и анализов.
Способы получения изображений меченых антител
В другом варианте осуществления настоящего изобретения, полученные с помощью генной инженерии антитела с цистеиновыми заменами могут метиться с помощью тиольных групп цистеиновых остатков радионуклидами, флуоресцентными красителями, остатками субстрата, запускающего биолюминесценцию, остатками субстрата, запускающего хемилюминесценцию, ферментами и другими метками для обнаружения экспериментов с получением изображений с диагностическими, фармакодинамическими и терапевтическими применениями. Как правило, меченое, полученное с помощью генной инженерии антитело с цистеиновыми заменами, то есть "биологический маркер" или "зонд", вводят посредством инъекции, перфузии или перорального заглатывания в живой организм, например, человеку, грызуну или другому малому животному, в перфузированный орган или образец ткани. Распределение зонда детектируют в течение заданного времени и представляют с помощью изображения.
Промышленные изделия
В другом варианте осуществления настоящего изобретения, предусматривается промышленное изделие или "набор", содержащий материалы, пригодные для лечения расстройств, описанных выше. Промышленное изделие содержит контейнер и этикетку или вставку в упаковку, расположенные на контейнере или связанные с ним. Пригодные для использования контейнеры включают, например, бутылки, флаконы, шприцы, блистерную упаковку, и тому подобное. Контейнеры могут быть сформированы из разнообразных материалов, таких как стекло или пластик. Контейнер содержит композицию конъюгата антитело-лекарственное средство (ADC), которая является эффективной для лечения состояния, и может иметь стерильный порт доступа (например, контейнер может представлять собой мешок с раствором для внутривенного введения или флакон с пробкой, прокалываемой с помощью иглы для подкожных инъекций). По меньшей мере, один активный агент в композиции представляет собой ADC. Этикетка или вставка в упаковку показывает, что композицию используют для лечения выбранного состояния, такого как рак. Альтернативно или в дополнение к этому, промышленное изделие может дополнительно содержать второй (или третий) контейнер, содержащий фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекций (BWFI), фосфатно-солевой буферный раствор, раствор Рингера и раствор декстрозы. Кроме того, он может включать другие материалы, желаемые с коммерческой точки зрения и точки зрения пользователя, включая другие буферы, разбавители, фильтры, иглы и шприцы.
Примеры
Пример 1 - Получение биотинилированного ThioFab-фаг
ThioFab-фаг (5×1012 фаговых частиц) взаимодействует с 150-кратным избытком биотина-PEO-малеимида ((+)-биотинил-3-малеимидопропионамидил-3,6-диоксаоктаиндиамин, Oda et al (2001) Nature Biotechnology 19:379-382, Pierce Biotechnology, Inc.) в течение 3 часов при комнатной температуре. Избыток биотина-PEO-малеимида удаляют из фага, конъюгированного с биотином, посредством многократных преципитаций в PEG (3-4 раза). Можно использовать другие коммерчески доступные реагенты для биотинилирования с электрофильными группами, которые являются реакционноспособными по отношению к тиольным группам цистеиновых остатков, включая Биотин-BMCC, PEO-Иодацетил Биотин, Иодацетил-LC-Биотин и Биотин-HPDP (Pierce Biotechnology, Inc.) и Nα-(3-малеимидилпропионил)биоцитин (MPB, Molecular Probes, Eugene, OR). Другие коммерческие источники реагентов для биотинилирования, бифункциональных и мультифункциональных линкерных реагентов включают Molecular Probes, Eugene, OR, и Sigma, St. Louis, MO.
Пример 2 - анализ PHESELECTOR
Бычий сывороточный альбумин (BSA), внеклеточный домен erbB2 (HER2) и стрептавидин (100 мкл из 2 мкг/мл) по отдельности наносят в виде покрытия на 96-луночные планшеты Maxisorp. После блокирования с помощью 0,5% Tween-20 (в PBS), биотинилированный и небиотинилированный hu4D5Fabv8-ThioFab-фаг (2×1010 фаговых частиц) инкубируют в течение 1 часа при комнатной температуре с последующим инкубированием вместе с вторичным антителом (белок оболочки фага анти-M13, белковое антитело pVIII) меченого пероксидазой хрена (HRP). На фигуре 8 показан анализ PHESELECTOR с помощью схематического представления, изображающего связывание Fab или ThioFab с HER2 (вверху) и биотинилированного ThioFab со стрептавидином (внизу).
Осуществляют стандартную реакцию HRP и измеряют коэффициент поглощения на 450 нм. Реакционноспособность тиольных групп измеряют посредством вычисления отношения OD450 для стрептавидина/OD450 для HER2. Значение реакционноспособни тиола 1 показывает полное биотинилирование тиольных групп цистеиновых остатков. В случае измерений связывания белка Fab, используют hu4D5Fabv8 (2-20 нг) с последующим инкубированием вместе с поликлональными антителами козы анти-Fab, мечеными HRP.
Пример 3a - Экспрессирование и очистка ThioFab
ThioFab экспрессируют при индуцировании в 34B8, несупрессорном штамме E. coli (Baca et al (1997) Journal Biological Chemistry 272(16): 10678-84). Полученную лепешку из клеток повторно суспендируют в PBS (фосфатно-солевой буферный раствор), общий лизис клеток осуществляют посредством прохождения через микрофлюидизатор, и ThioFab очищают с помощью аффинной хроматографии на SEPHAROSE™ с белком G (Amersham).
ThioFab L-V15C, L-V110C, H-A88C и H-A121C экспрессируют и очищают с помощью колоночной хроматографии на SEPHAROSE™ с белком G. Олигомерный Fab присутствует во фракциях 26-30, а большая часть мономерной формы присутствует во фракциях 31-34. Фракции, состоявшие из мономерной формы, собирают и анализируют с помощью SDS-PAGE вместе с диким типом hu4D5Fabv8, и анализируют на геле SDS-PAGE при восстанавливающих (с DTT или BME) и невосстанавливающих (без DTT или BME) условиях. Фракции от гель-фильтрации A121C-ThioFab анализируют с помощью невосстанавливающего SDS-PAGE.
ThioFab конъюгируют с биотином-PEO-малеимидом, как описано выше, и биотинилированные ThioFab дополнительно очищают с помощью гель-фильтрационной хроматографии на Superdex-200™ (Amersham), это устраняет свободный биотин-PEO-малеимид и олигомерную фракцию ThioFab. Дикий тип hu4D5Fabv8 и hu4D5Fabv8-A121C-ThioFab (в количестве 0,5 мг), каждый и по-отдельности, инкубируют вместе со 100-кратным молярным избытком биотина-PEO-малеимида в течение 3 часов при комнатной температуре и загружают в колонку для гель-фильтрации на Superdex-200 для отделения свободного биотина, а также олигомерных Fab от мономерной формы.
Пример 3b - Анализ ThioFab
Фрагменты обработки ферментом биотинилированного hu4D5Fabv8 (A121C) ThioFab и дикого типа hu4D5Fabv8 анализируют с помощью жидкостной хроматографии и масс-спектрометрии с электрораспылительной ионизацией (LS-ESI-MS). Разница между первичной массой биотинилированного hu4D5Fabv8 (A121C), 48294,5 и первичной массой дикого типа hu4D5Fabv8, 47737,0 составляет 557,5 единиц массы. Этот фрагмент показывает присутствие одного остатка биотина-PEO-малеимида (C23H36N5O7S2). Таблица 8 показывает приписываемые значения фрагментации, которые подтверждают последовательность.
LC-ESI-Масс-спектрометрический анализ биотинилированного hu4D5Fabv8 ThioFab A121C после обработки трипсином
До и после гель-фильтрации на Superdex-200, осуществляют анализы на геле для SDS-PAGE, с восстановлением посредством DTT или BME и без него, биотинилированного ABP-hu4D5Fabv8-A121C, биотинилированного ABP-hu4D5Fabv8-V110C, биотинилированного двойного Cys ABP-hu4D5Fabv8-(V110C-A88C) и биотинилированного двойного Cys ABP-hu4D5Fabv8-(V110C-A121C).
Масс-спектрометрический анализ (MS/MS) hu4D5Fabv8-(V110C)-BMPEO-DM1 (после очистки гель-фильтрацией на Superdex-200): Fab+1 51607,5, Fab 50515,5. Эти данные показывают 91,2% конъюгирования. Анализ MS/MS hu4D5Fabv8-(V110C)-BMPEO-DM1 (восстановленного): LC 23447,2, LC+1 24537,3, HC (Fab) 27072,5. Эти данные показывают, что все конъюгирование DM1 происходит на легкой цепи Fab.
Пример 4 - Получение ABP-hu4D5Fabv8-(V110C)-MC-MMAE посредством конъюгирования ABP-hu4D5Fabv8-(V110C) и MC-MMAE
Линкерный реагент лекарственного средства, малеимидокапроил-монометилауристатин E (MMAE), то есть MC-MMAE, растворенный в DMSO, разбавляют в ацетонитриле и воде при известной концентрации, и добавляют к охлажденному ThioFab ABP-hu4D5Fabv8-(V110C) в физиологическом растворе с фосфатным буфером (PBS) в соответствии с патентом США № 7521541, патентом США № 7659241 и патентом США № 7498298. Примерно через один час, добавляют избыток малеимида для гашения реакции и для защиты любых непрореагировавших тиольных групп антитела. Реакционную смесь концентрируют посредством центробежного ультрафильтрования, и ABP-hu4D5Fabv8-(V110C)-MC-MMAE очищают и обессоливают посредством элюирования через смолу G25 в PBS, фильтруют через 0,2-мкм фильтры в стерильных условиях и замораживают для хранения.
Пример 5 - Получение ABP-hu4D5Fabv8-(LC V110C)-MC-MMAF посредством конъюгирования ABP-hu4D5Fabv8-(LC V110C) и MC-MMAF
ABP-hu4D5Fabv8-(LC V110C)-MC-MMAF приготавливают посредством конъюгирования ABP-hu4D5Fabv8-(LC V110C) ThioFab и MC-MMAF, следуя процедуре Примера 4.
Пример 6 - Получение ABP-HC A121C-ThioFab-MC-val-cit-PAB-MMAE посредством конъюгирования ABP-HC A121C-ThioFab и MC-val-cit-PAB-MMAE
ABP-hu4D5Fabv8-(HC A121C)-MC-val-cit-PAB-MMAE приготавливают посредством конъюгирования ABP-hu4D5Fabv8-(HC A121C) и MC-val-cit-PAB-MMAE, следуя процедуре Примера 4.
Пример 7 - Получение ABP-HC A121C-ThioFab-MC-val-cit-PAB-MMAF посредством конъюгирования ABP-HC A121C-ThioFab и MC-val-cit-PAB-MMAF
ABP-hu4D5Fabv8-(HC A121C)-MC-val-cit-PAB-MMAF приготавливают посредством конъюгирования ABP-hu4D5Fabv8-(HC A121C) и MC-val-cit-PAB-MMAF, следуя процедуре Примера 4.
Пример 8 - Получение ThioFab-BMPEO-DM1 hu4D5Fabv8-(LC V110C)
Свободный цистеин на hu4D5Fabv8-(V110C) ThioFab модифицируют с помощью бис-малеимидо реагента BM(PEO)3 (Pierce Chemical), оставляя непрореагировавшую малеимидо группу на поверхности антитела. Модификацию осуществляют посредством растворения BM(PEO)4 в 50% смеси этанол/вода до концентрации 10 мМ и добавления десятикратного молярного избытка BM(PEO)3 к раствору, содержащему ThioFab hu4D5Fabv8-(V110C) в физиологическом растворе с фосфатным буфером при концентрации приблизительно 1,6 мг/мл (10 микромоль), и позволяя им взаимодействовать в течение 1 часа. Избыток BM(PEO)3 удаляют с помощью гель-фильтрации (колонка HiTrap, Pharmacia) в 30 мМ цитратном буфере, pH 6, с 150 мМ NaCl буфера. Приблизительно 10-кратный молярный избыток DM1, растворенный в диметилацетамиде (DMA), добавляют к промежуточному соединению ThioFab-BMPEO hu4D5Fabv8-(LC V110C). Диметилформамид (DMF) также можно использовать для растворения реагента остатка лекарственного средства. Реакционной смеси позволяют взаимодействовать в течение ночи перед гель-фильтрацией или диализом в PBS для удаления непрореагировавшего лекарственного средства. Гель-фильтрацию на колонках S200 в PBS используют для удаления высокомолекулярных агрегатов и получения очищенного ThioFab-BMPEO-DM1 hu4D5Fabv8-(LC V110C).
С помощью такого же протокола получают ThioFab-BMPEO-DM1 hu4D5Fabv8 (HC A121C).
Пример 9 - Анализ пролиферации клеток in vitro
Эффективность ADC измеряют с помощью анализа пролиферации клеток, использующего следующий протокол (CellTiter Glo Luminiscent Cell Viability Assay, Promega Corp. Technical Bulletin TB288; Mendoza et al (2002) Cancer Res. 62:5485-5488):
1. Аликвоту 100 мкл культуры клеток, содержащей примерно 104 клеток (SKBR-3, BT474, MCF7 или MDA-MB-468), в среде, осаждают в каждой лунке 96-луночного планшета с полупрозрачными стенками.
2. Приготавливают контрольные лунки, содержащие среду без клеток.
3. ADC добавляют в экспериментальные лунки и инкубируют в течение 3-5 дней.
4. Планшеты уравновешивают при комнатной температуре в течение приблизительно 30 минут.
5. Добавляют объем реагента CellTiter-Glo Reagent, равный объему среды для культивирования клеток, присутствующей в каждой лунке.
6. Содержимое перемешивают в течение 2 минут на орбитальном шейкере, чтобы вызвать лизис клеток.
7. Планшет инкубируют при комнатной температуре в течение 10 минут для стабилизации сигнала люминесценции.
8. Люминесценцию регистрируют и выражают на графиках как RLU = относительные единицы люминесценции.
Определенные клетки высевают при 1000-2000/лунка (линии PC3) или 2000-3000/лунка (OVCAR-3) в 96-луночный планшет, 50 мкл/лунка. Через один (PC3) или два (OVCAR-3) дня, добавляют ADC объемами по 50 мкл, до конечной концентрации 9000, 3000, 1000, 333, 111, 37, 12,4, 4,1 или 1,4 нг/мл, при этом контрольные лунки "без ADC" принимают только среду. Условия повторяют по два или три раза. Через 3 дня (PC3) или 4-5 дней (OVCAR-3), добавляют 100 мкл/лунка Cell TiterGlo II (для анализа на основе люциферазы; пролиферацию измеряют по уровням ATP), и отсчеты клеток определяют с использованием люминометра. Данные изображают на графике как среднее значение люминесценции для каждого набора повторений, с указанием стандартного среднеквадратичного отклонения. Протокол представляет собой модификацию CellTiter Glo Luminiscent Cell Viability Assay (Promega):
1. Планшет 1000 клеток/лунка PC3/Muc16, PC3/neo (при 50 мкл/лунка) в средах. Клетки Ovcar3 должны размещаться на планшете при 2000 клеток/лунка (при 50 мкл) в своих средах, (рецепты ниже). Клеткам позволяют присоединяться в течение ночи.
2. ADC последовательно разбавляют 1:3 в средах, начиная от рабочей концентрации 18 мкг/мл (это дает конечную концентрацию 9 мкг/мл). 50 мкл разбавленного ADC добавляют к 50 мкл клеток и к средам, уже находящимся в лунке.
3. Инкубируют 72-96 часов (стандарт составляет 72 часа, но отслеживают концентрацию 0 мкг/мл для остановки анализа, когда клетки достигают конфлюентности 85-95%).
4. Добавляют 100 мкл/лунка Promega Cell Titer Glo Reagent, встряхивают 3 мин и регистрируют на люминометре
Среды: PC3/neo и PC3/MUC16 растут в 50/50/10% FBS/глютамин/250 мкг/мл G-418. OVCAR-3 растут в RPMI/20% FBS/глютамин
Пример 10 - Ингибирование роста опухоли, эффективность in vivo в трансгенных мышах с эксплантами с высоким уровнем экспрессии HER2
Животные, подходящие для трансгенных экспериментов, могут быть получены из стандартных коммерческих источников, таких как Taconic (Germantown, N.Y.). Множество штаммов являются пригодными для использования, но самки мышей FVB являются предпочтительными, благодаря их высокой предрасположенности к образованию опухоли. Самцов FVB используют для спаривания, и производители CD.1 после вазэктомии используются для стимулирования псевдобеременности. Мыши после вазэктомии могут быть получены от любого коммерческого поставщика. Основателей скрещивают либо с мышами FVB, либо с гетерозиготными мышами 129/BL6 x FVB p53. Мышей с гетерозиготностью в аллели p53 используют для потенциального увеличения образования опухолей. Однако это, как показано, не является необходимым. По этой причине, некоторые опухоли F1 происходят от смешанного штамма. Опухоли-основатели относятся только к FVB. Получили шесть основателей с некоторыми развивающимися опухолями без получения выводков.
Животные, имеющие опухоли (привитые опухоли, выросшие от трансгенных мышей Fo5 mmtv), лечатся одной или множеством доз посредством внутривенной инъекции ADC. Объем опухоли оценивают в различные моменты времени после инъекции.
У трансгенных мышей быстро возникают опухоли, которые экспрессируют мутационно активированную форму Neu крысиного гомолога HER2, но HER2, который сверхэкспрессируется при раке груди человека, не мутирует, и образование опухоли является гораздо менее устойчивым у трансгенных мышей, которые сверхэкспрессируют немутированный HER2 (Webster et al (1994) Semin. Cancer Biol. 5:69-76).
Для улучшения формирования опухоли с немутировавшим HER2, производят трансгенных мышей с использованием плазмиды цДНК HER2, в которой осуществляют делецию более раннего ATG для предотвращения начала трансляции на таких более ранних ATG кодонах, которые в другом случае уменьшали бы частоту инициирования трансляции от более позднего аутентичного кодона инициирования HER2 (например, смотри Child et al (1999) J. Biol. Chem. 274: 24335-24341). В дополнение к этому, добавляют химерный интрон на 5’ окончании, который должен также повысить уровень экспрессии, как сообщалось ранее (Neuberger and Williams (1988) Nucleic Acids Res. 16:6713; Buchman and Berg (1988) Mol. Cell. Biol. 8:4395; Brinster et al (1988) Proc. Natl. Acad. Sci. USA 85:836). Химерный интрон получают из вектора Promega, вектора экспрессии Pci-Neo млекопитающих (bp 890-1022). 3’-окончания цДНК стыкуется с боков с экзонами 4 и 5 гормона роста человека и с последовательностями полиаденилирования. Кроме того, используют мышей FVB, поскольку этот штамм более склонен к развитию опухолей. Промотор от MMTV-LTR используют для обеспечения ткане-специфичной экспрессии HER2 в молочных железах. Животных кормят диетой AIN 76A для увеличения предрасположенности к образованию опухолей (Rao et al (1997) Breast Cancer Res. And Treatment 45:149-158).
Пример 11 - Восстановление/окисление ThioMab для конъюгирования
Полноразмерные моноклональные антитела с цистеиновыми заменами, полученные с помощью генной инженерии (ThioMab), экспрессируемые в клетках CHO, восстанавливают с помощью примерно 50-кратного избытка TCEP (трис(2-карбоксиэтил)фосфина гидрохлорида; Getz et al (1999) Anal. Biochem. Vol 273:73-80; Soltec Ventures, Beverly, MA) в течение 3 часов при 37°C. Восстановленный ThioMab (Фигура 11) разбавляют и загружают в колонку HiTrap S в 10 мМ ацетата натрия, pH 5, и элюируют с помощью PBS, содержащего 0,3M хлорида натрия. Элюированный восстановленный ThioMab обрабатывают 200 нМ водного раствора сульфата меди (CuSO4) при комнатной температуре, в течение ночи. Дегидроаскорбиновая кислота (DHAA) и окисление на воздухе окружающей среды также представляют собой эффективные окислители.
Пример 12 - Конъюгирование ThioMab
Повторно окисленные ThioMab из Примера 11, включая тио-трастузумаб (HC A121C), тио-2H9 (A121C) и тио-3A5 (A121C), объединяют с 10-кратным избытком промежуточного соединения лекарственного средства-линкера, BM(PEO)3-DM1, перемешивают и оставляют стоять в течение примерно часа при комнатной температуре для осуществления конъюгирования и образования конъюгатов антитело ThioMab-лекарственное средство, включая тио-трастузумаб (HC A121C)-BMPEO-DM1, тио-2H9 (HC A121C)-BMPEO-DM1 и тио-3A5 (HC A121C)-BMPEO-DM1. Смесь для конъюгирования подвергают воздействию гель-фильтрации или загружают и элюируют через колонку HiTrap S для удаления избытка промежуточного соединения лекарственное средство-линкер и других примесей.
Настоящее изобретение не должно ограничиваться рамками конкретных вариантов осуществления, описанных в Примерах, которые рассматриваются в качестве иллюстраций нескольких аспектов настоящего изобретения, и любые варианты осуществления, которые являются функционально эквивалентными, находятся в рамках настоящего изобретения. В самом деле, различные модификации настоящего изобретения, в дополнение к тем, которые показаны и описаны в настоящем документе, будут очевидны специалистам в данной области, и они, как предполагается, попадают в рамки прилагаемой формулы изобретения.
Все патенты, заявки на патент и ссылки, цитируемые в описании, в явном виде включаются в качестве ссылок во всей их полноте и для всех целей.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛУЧЕННЫЕ С ПОМОЩЬЮ ГЕННОЙ ИНЖЕНЕРИИ АНТИТЕЛА С ЦИСТЕИНОВЫМИ ЗАМЕНАМИ И ИХ КОНЪЮГАТЫ | 2011 |
|
RU2755066C2 |
| КОНЪЮГАТЫ МЕЧЕННЫХ РАДИОАКТИВНЫМ ЦИРКОНИЕМ СКОНСТРУИРОВАННЫХ АНТИТЕЛ С ЦИСТЕИНОВЫМИ ЗАМЕНАМИ | 2010 |
|
RU2562862C2 |
| МУЛЬТИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА, АНАЛОГИ АНТИТЕЛ, КОМПОЗИЦИИ И СПОСОБЫ | 2010 |
|
RU2580038C2 |
| АНТИТЕЛА И ИММУНОКОНЪЮГАТЫ И ИХ ПРИМЕНЕНИЯ | 2007 |
|
RU2436796C9 |
| АНТИ-CD79b АНТИТЕЛА И ИММУНОКОНЪЮГАТЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2791984C2 |
| АНТИ-CD79b АНТИТЕЛА И ИММУНОКОНЪЮГАТЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2009 |
|
RU2553566C2 |
| АНТИ-CD79b АНТИТЕЛА И ИММУНОКОНЪЮГАТЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2008 |
|
RU2511410C2 |
| ПИРРОЛОБЕНЗОДИАЗЕПИНОВЫЕ КОНЪЮГАТЫ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2736725C1 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА ПРОТИВ CD79b И ИММУНОКОНЪЮГАТЫ И СПОСОБЫ ПРИМЕНЕНИЯ | 2008 |
|
RU2557319C2 |
| АНТИТЕЛА И ИММУНОКОНЪЮГАТЫ И ИХ ПРИМЕНЕНИЯ | 2007 |
|
RU2639543C9 |





































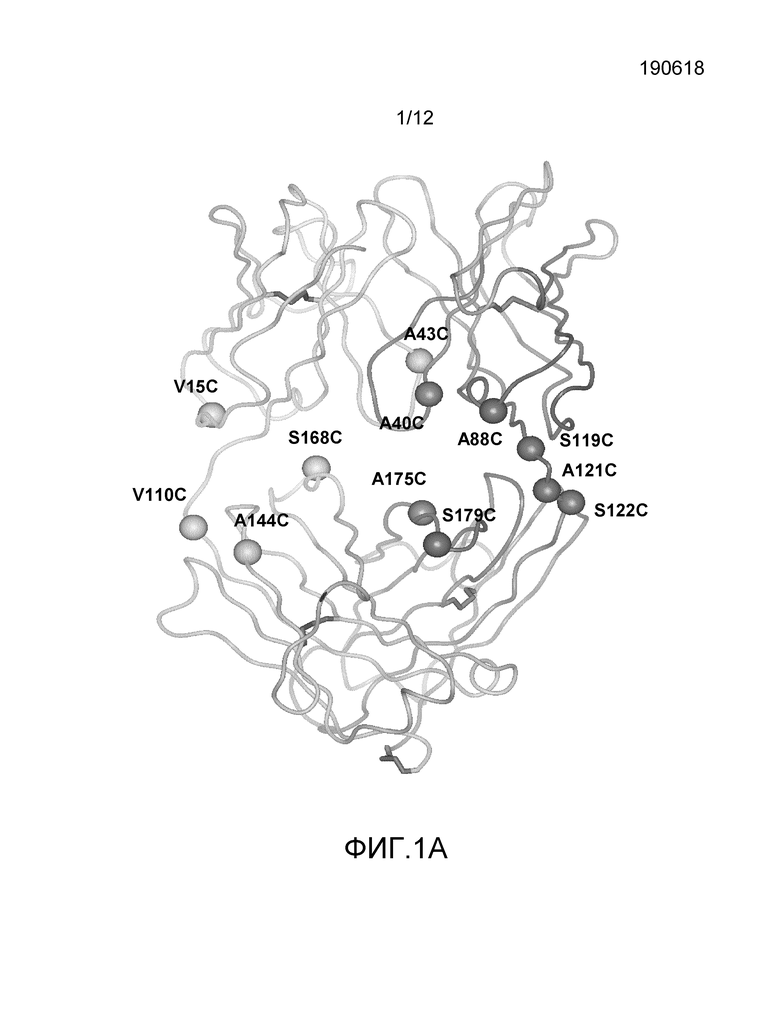

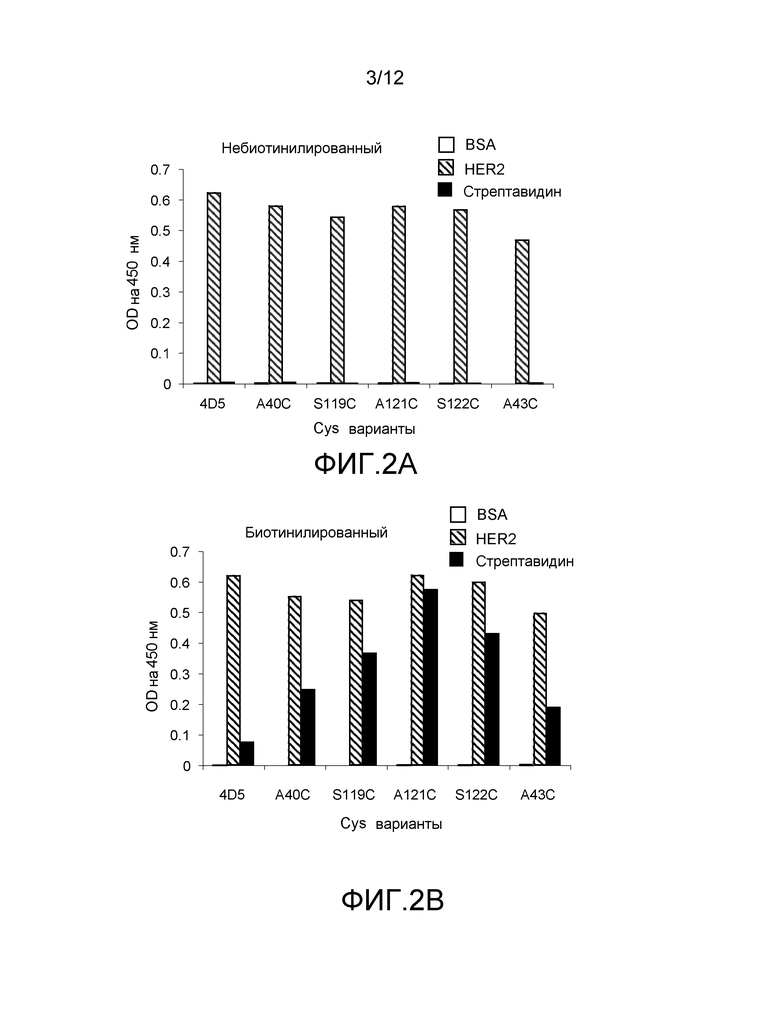
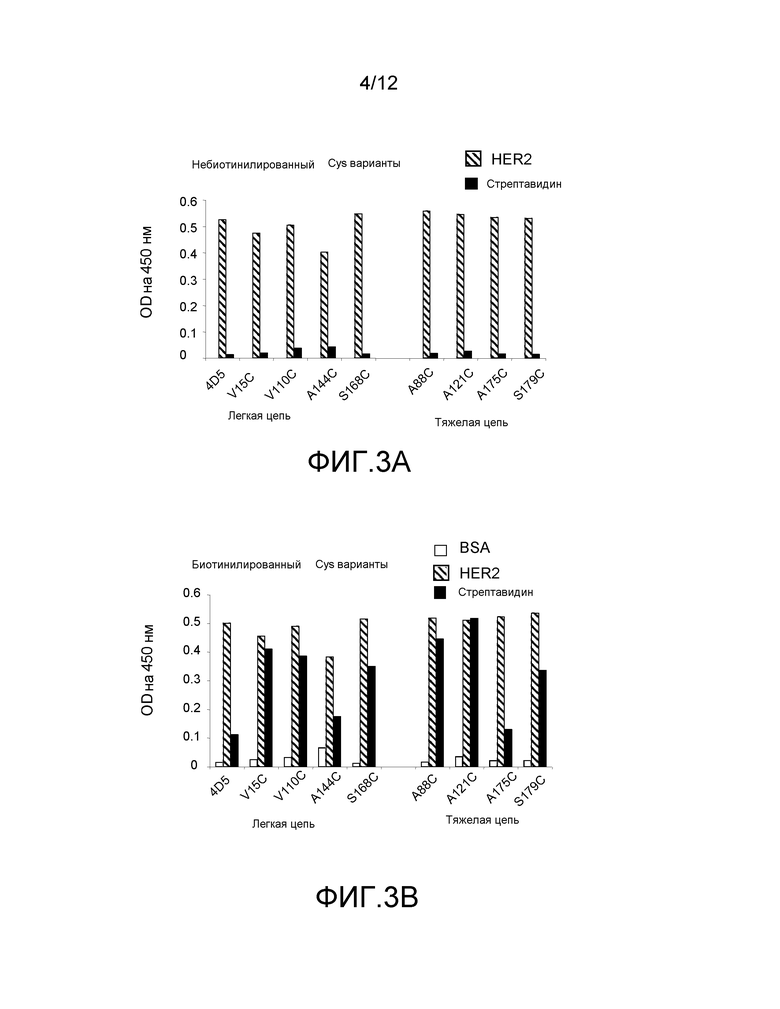
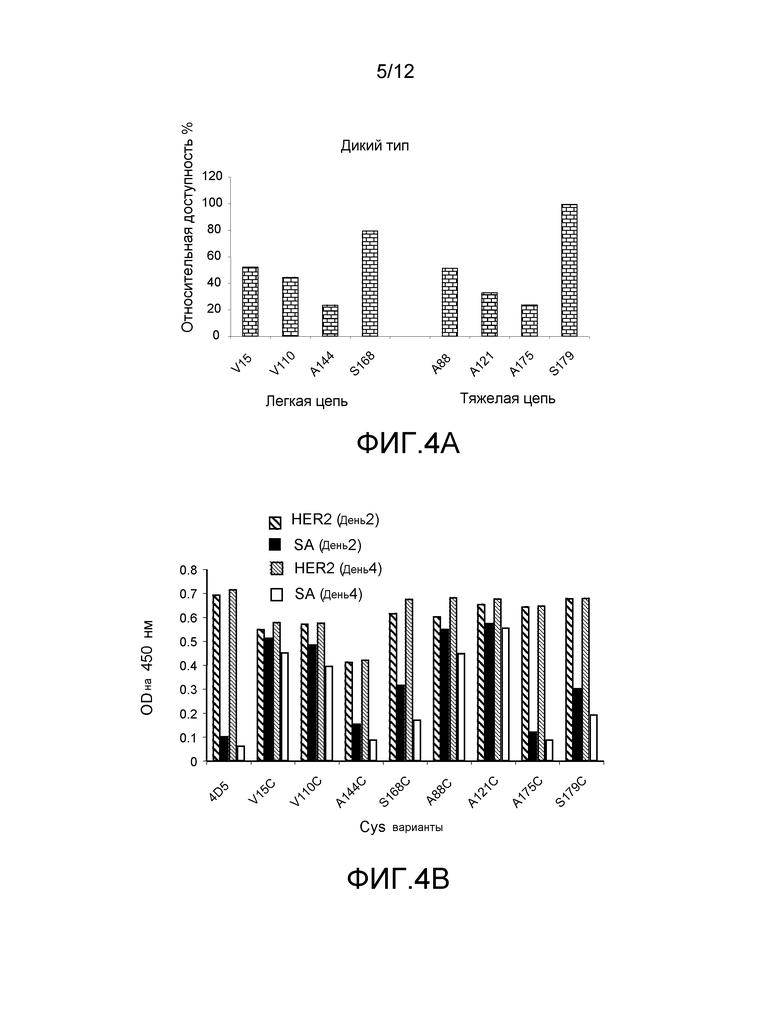
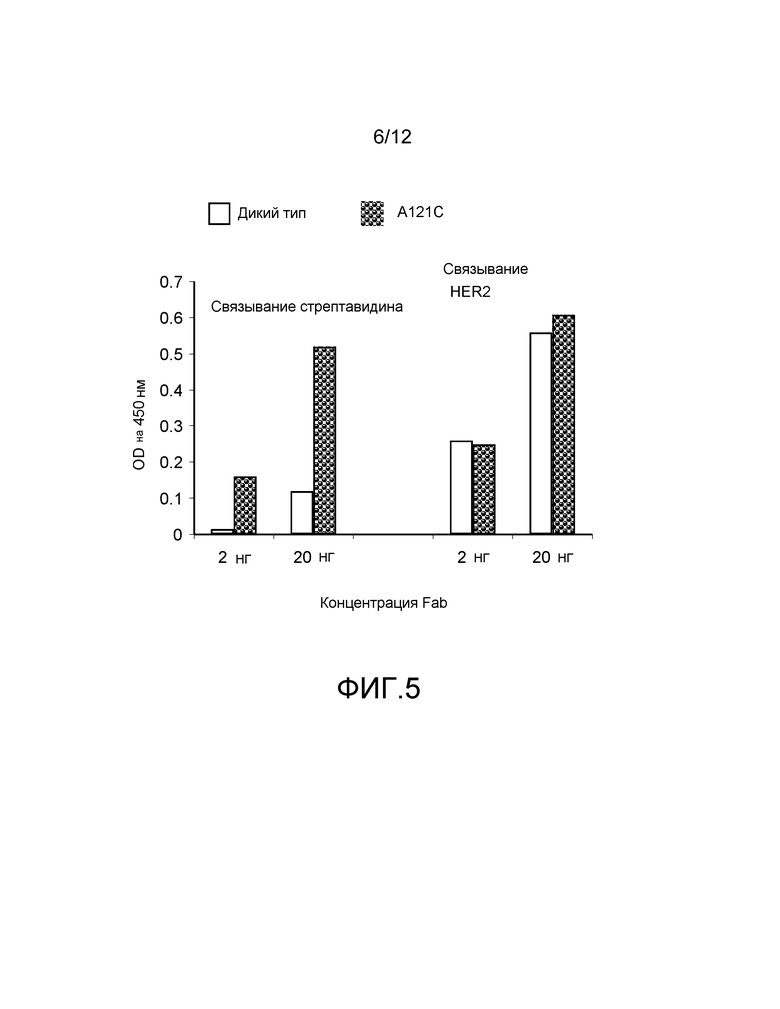
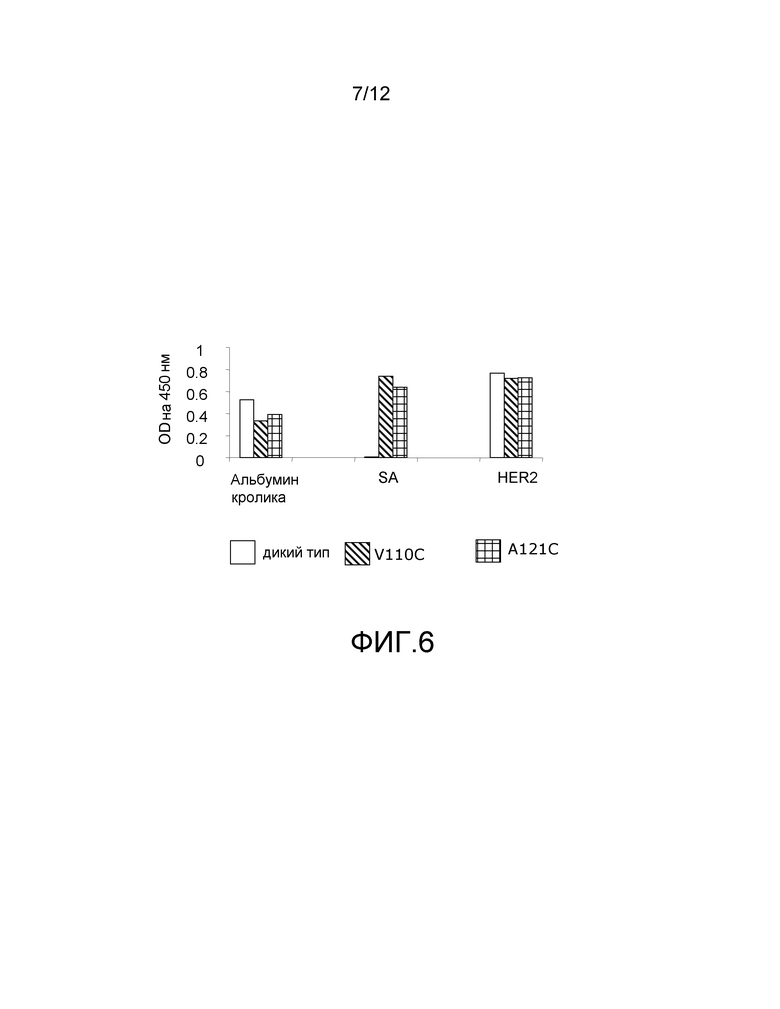
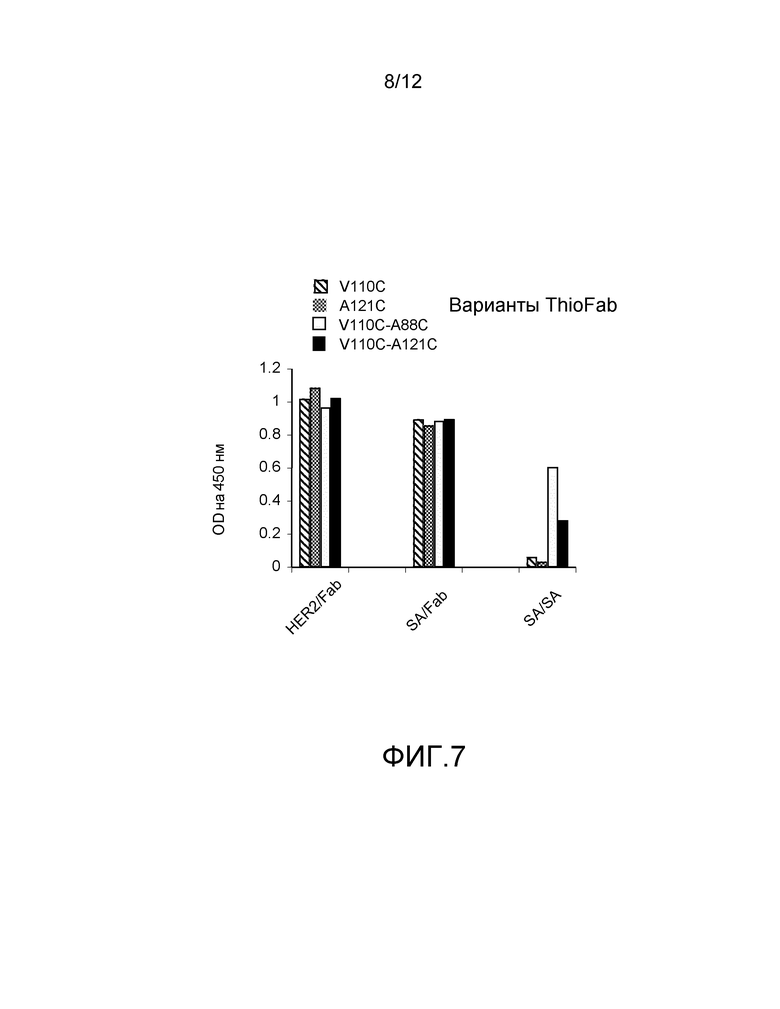
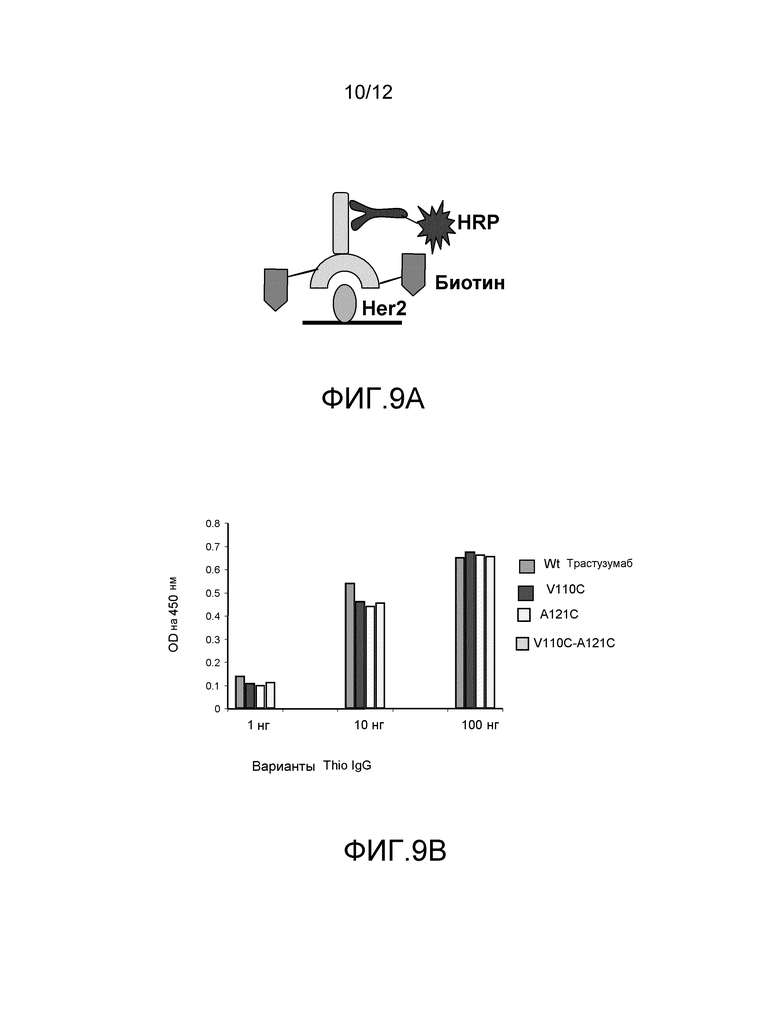
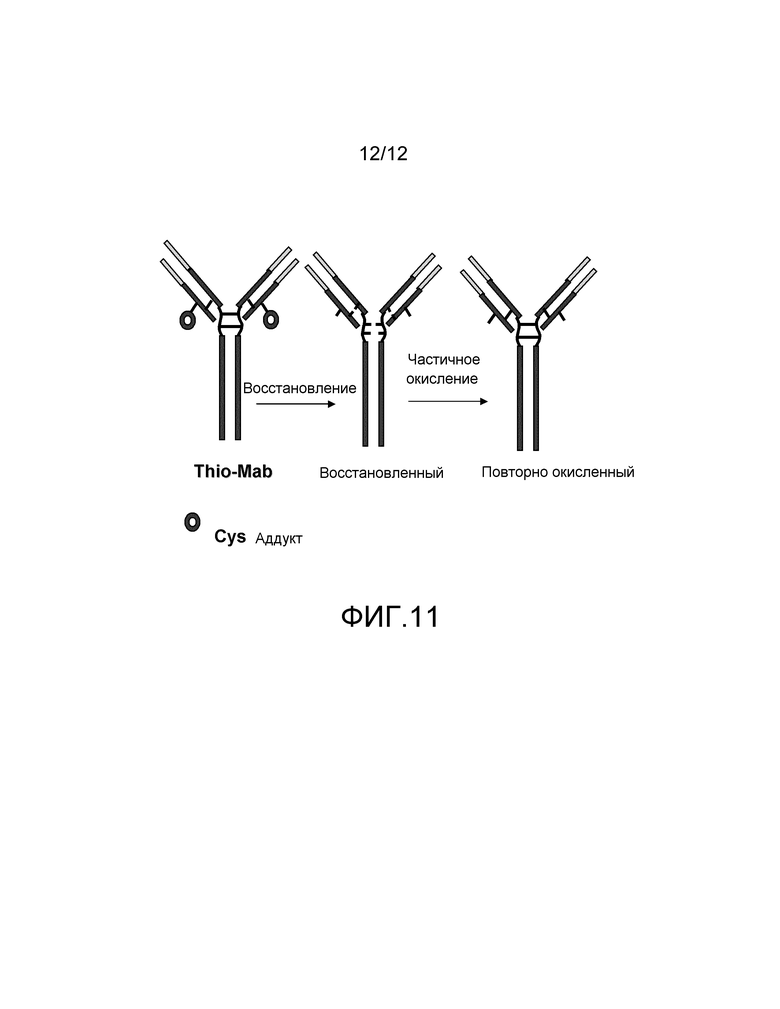
Настоящее изобретение относится к биохимии, в частности к применению последовательности в тяжёлой цепи CAASGCNIKDT, SADTSCNTAYL, DTSKNCAYLQM или KNTAYCQMNSL, или последовательности в лёгкой цепи DFTLTCSSLQP, YCQQHCTTPPT, VVCLLCNFYPR, VCLLNCFYPRE или AKVQWCVDNAL, для получения с помощью генной инженерии антитела с цистеиновыми заменами, содержащего свободную аминокислоту цистеин со значением реакционноспособности тиольных групп равным примерно 0,8 или выше. Указанные последовательности в тяжёлой или лёгкой цепи применяют также для получения иммуноконъюгата антитела, содержащего цистеин, причём антитело сохраняет способность связываться с антигеном. Указанный иммуноконъюгат содержит антитело, ковалентно присоединённое к метке для захвата, к метке для обнаружения, к остатку лекарственного средства или к твёрдой подложке через указанный цистеин. Настоящее изобретение позволяет получать антитела с повышенной тиореактивностью. 2 н. и 20 з.п. ф-лы, 11 ил., 8 табл., 12 пр.
1. Применение последовательности в тяжелой цепи, выбранной из

или последовательности в легкой цепи, выбранной из

для получения с помощью генной инженерии антитела, содержащего свободную цистеиновую аминокислоту со значением реакционноспособности тиольных групп равным примерно 0,8 или выше, где цистеин в последовательности представляет собой свободную цистеиновую аминокислоту, и где антитело сохраняет способность связываться с антигеном.
2. Применение по п. 1, где полученное с помощью генной инженерии антитело с цистеиновыми заменами получено способом, включающим:
(i) мутагенез последовательности нуклеиновой кислоты исходного антитела так, что один или несколько аминокислотных остатков заменены цистеином в кодируемом полученном с помощью генной инженерии антителе с цистеиновыми заменами;
(ii) экспрессирование полученного с помощью генной инженерии антитела с цистеиновыми заменами; и
(iii) выделение полученного с помощью генной инженерии антитела с цистеиновыми заменами.
3. Применение по п. 2, где мутагенез включает сайт-направленный мутагенез.
4. Применение по п. 2, где полученное с помощью генной инженерии антитело с цистеиновыми заменами экспрессируют на вирусной частице, выбранной из фага или частицы фагмида.
5. Применение по п. 1, где полученное с помощью генной инженерии антитело с цистеиновыми заменами выбрано из моноклонального антитела, фрагмента антитела, биспецифического антитела, химерного антитела, антитела человека и гуманизированного антитела.
6. Применение по п. 5, где фрагмент антитела представляет собой Fab фрагмент.
7. Применение по п. 5, где полученное с помощью генной инженерии антитело с цистеиновыми заменами представляет собой антитело анти-HER2.
8. Применение по п. 1, где полученное с помощью генной инженерии антитело с цистеиновыми заменами связывается с одним или несколькими из рецепторов (1)-(36):
(1) BMPR1B (рецептор морфогенетического белка костей типа IB);
(2) Е16 (LAT1, SLC7A5);
(3) STEAP1 (шестой трансмембранный эпителиальный антиген простаты);
(4) 0772Р (СА125, MUC16);
(5) MPF (MPF, MSLN, SMR, фактор потенцирования мегакариоцитов, мезотелин);
(6) Napi3b (NAPI-3B, NPTIIb, SLC34A2, семейство 34 переносчиков растворенных веществ (фосфат натрия), элемент 2, натрий-зависимый фосфатный переносчик 3b);
(7) Sema 5b (FLJ10372, KIAA1445, Mm.42015, SEMA5B, SEMAG, семафорин 5b Hlog, домен sema, семь повторяющихся единиц тромбоспондина (тип 1 и подобный типу 1), трансмембранный домен (ТМ) и короткий цитоплазматический домен, (семафорин) 5В);
(8) PSCA hlg (2700050C12Rik, C530008O16Rik, RIKEN cDNA 2700050C12, ген RIKEN cDNA 2700050C12);
(9) ETBR (рецептор эндотелина типа В);
(10) MSG783 (RNF124, гипотетический белок FLJ20315);
(11) STEAP2 (HGNC_8639, IPCA-1, PCANAP1, STAMP1, STEAP2, STMP, ген 1, связанный с раком простаты, белок 1, ассоциируемый с раком простаты, шестой трансмембранный эпителиальный антиген простаты 2, шестой трансмембранный белок простаты);
(12) TrpM4 (BR22450, FLJ20041, TRPM4, TRPM4B, катионный канал с транзиторным рецепторным потенциалом, подсемейство М, элемент 4);
(13) CRIPTO (CR, CR1, CRGF, CRIPTO, TDGF1, фактор роста, полученный из тератокарциномы);
(14) CD21 (CR2 (рецептор комплемента 2) или C3DR (C3d/рецептор вируса Эпштейна-Барра) или Hs.73792);
(15) CD79b (CD79B, CD79β, IGb (связанный с иммуноглобулином бета), В29);
(16) FcRH2 (IFGP4, IRTA4, SPAP1A (якорный белок фосфатазы 1а, содержащий домен SH2), SPAP1B, SPAP1C);
(17) HER2;
(18) NCA;
(19) MDP;
(20) IL20Rα;
(21) Brevican;
(22) EphB2R;
(23) ASLG659;
(24) PSCA;
(25) GEDA;
(26) BAFF-R (рецептор фактора активирования В лимфоцитов, рецептор 3 BLyS, BR3);
(27) CD22 (изоформа CD22-B рецептора В лимфоцитов);
(28) CD79a (CD79A, CD79α, связанный с иммуноглобулином альфа, белок, специфичный к В лимфоцитам);
(29) CXCR5 (рецептор 1 лимфомы Беркитта, рецептор, связанный с белком G);
(30) HLA-DOB (бета субъединица молекулы МНС класса II (антигена 1а));
(31) Р2Х5 (ионный канал 5, управляемый лигандом пуринергического рецептора Р2Х);
(32) CD72 (CD72 дифференциации В лимфоцитов, Lyb-2);
(33) LY64 (антиген 64 лимфоцитов (RP105), тип I, мембранный белок семейства, богатого повторяющимися единицами лейцина (LRR));
(34) FcRH1 (белок 1, подобный Fc рецептору);
(35) IRTA2 (ген, связанный с транслокацией рецептора суперсемейства иммуноглобулинов 2); и
(36) TENB2 (вероятный трансмембранный протеогликан).
9. Применение последовательности в тяжелой цепи, выбранной из

или последовательности в легкой цепи, выбранной из

для получения иммуноконъюгата генно-инженерного антитела, содержащего цистеин, причем антитело сохраняет способность связываться с антигеном, и где иммуноконъюгат содержит антитело, ковалентно присоединенное к метке для захвата, к метке для обнаружения, к остатку лекарственного средства или к твердой подложке, и где метка для захвата, метка для обнаружения, остаток лекарственного средства или твердая подложка ковалентно присоединены к антителу через цистеин в последовательности.
10. Применение по п. 9, где иммуноконъюгат содержит антитело, ковалентно присоединенное к биотиновой метке для захвата.
11. Применение по п. 9, где иммуноконъюгат содержит антитело, ковалентно присоединенное к метке для обнаружения на основе флуоресцентного красителя.
12. Применение по п. 11, где флуоресцентный краситель выбран из типа флуоресцеина, типа родамина, данзила, лиссамина, цианина, фикоэритрина, техасского красного и их аналогов.
13. Применение по п. 9, где иммуноконъюгат содержит антитело, ковалентно присоединенное к радионуклидной метке для обнаружения, выбранной из 3Н, 11С, 14С, 18F, 32Р, 35S, 64Cu, 68Ga, 86Y, 89Zr, 99Тс, 111In, 123I, 124I, 125I, 131I, 133Xe, 177Lu, 211At и 213Bi.
14. Применение по п. 9, где иммуноконъюгат содержит антитело, ковалентно присоединенное к метке для обнаружения с помощью хелатирующего лиганда.
15. Применение по п. 14, где хелатирующий лиганд выбран из DOTA, DOTP, DOTMA, DTPA и TETA.
16. Применение по п. 9, где иммуноконъюгат содержит антитело, ковалентно присоединенное к остатку лекарственного средства, выбранного из майтансиноида, ауристатина, доластатина, трихотецена, СС1065, калихимицина, энедииновых антибиотиков, таксана и антрациклина с образованием конъюгата антитело-лекарственное средство, имеющего Формулу I:

где Ab представляет собой антитело, L представляет собой линкер, D представляет собой остаток лекарственного средства и р равно 1, 2, 3 или 4.
17. Применение по п. 16, где конъюгат антитело-лекарственное средство имеет структуру:
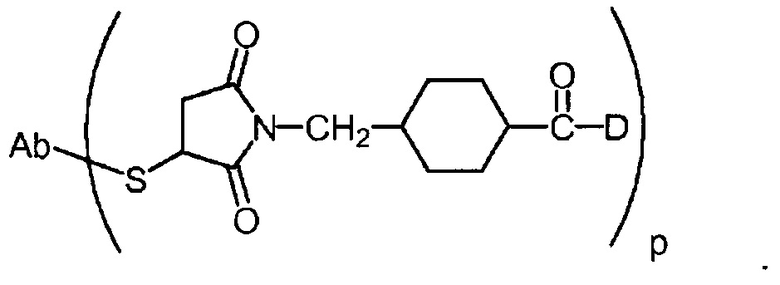
18. Применение по п. 16, где D представляет собой майтансиноид, имеющий структуру:
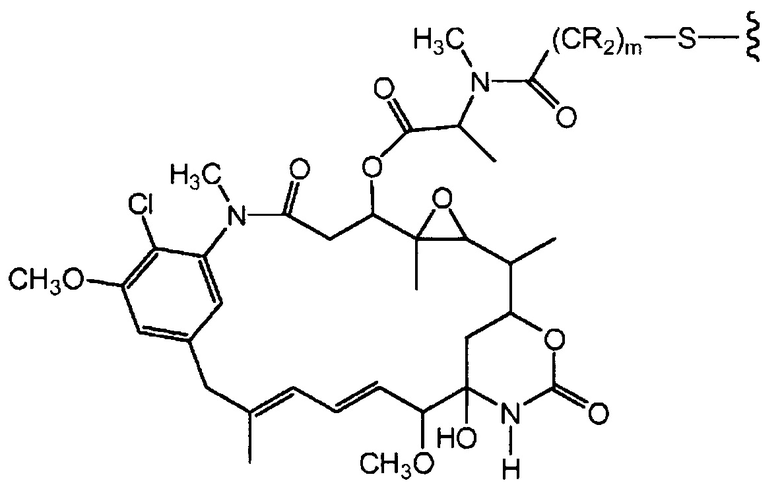
где волнистая линия показывает ковалентное присоединение атома серы D к линкеру;
R независимо выбрано из Н, метила, этила, 1-пропила, 2-пропила, 1-бутила, 2-метил-1-пропила, 2-бутила, 2-метил-2-пропила, 1-пентила, 2-пентила, 3-пентила, 2-метил-2-бутила, 3-метил-2-бутила, 3-метил-1-бутила, 2-метил-1-бутила, 1-гексила, 2-гексила, 3-гексила, 2-метил-2-пентила, 3-метил-2-пентила, 4-метил-2-пентила, 3-метил-3-пентила, 2-метил-3-пентила, 2,3-диметил-2-бутила и 3,3-диметил-2-бутила и
m равно 1, 2 или 3.
19. Применение по п. 18, где D выбрано из структур:
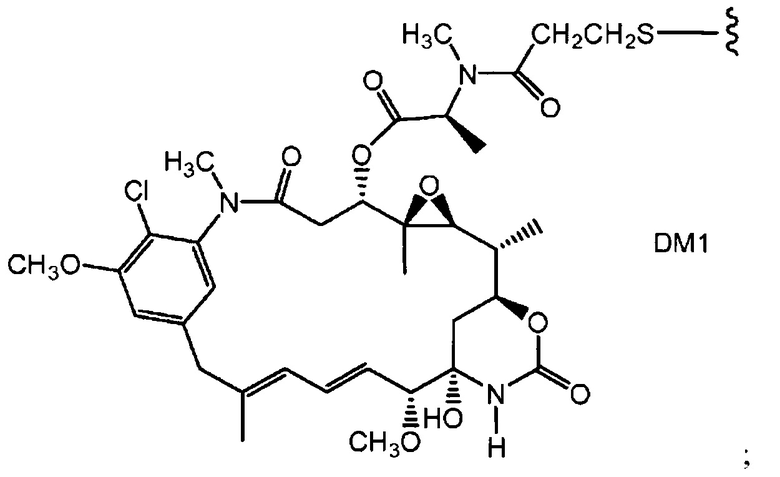
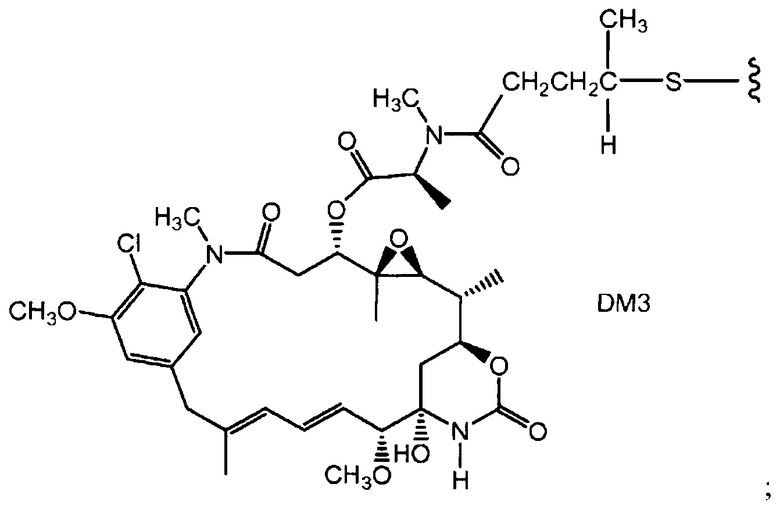
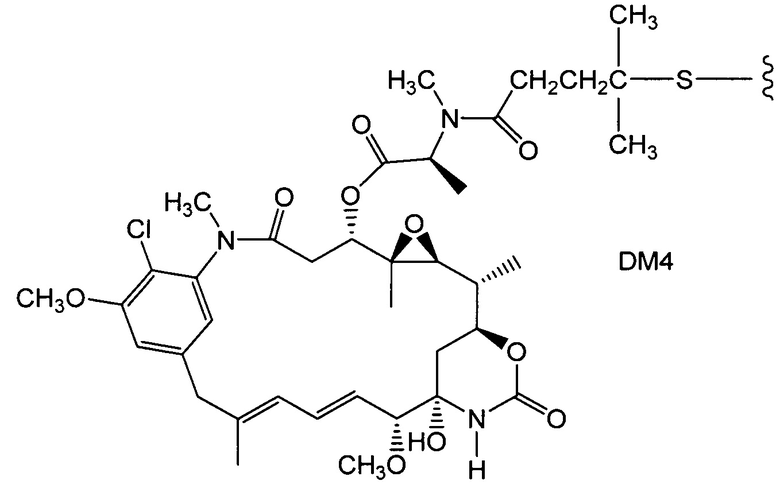
20. Применение по п. 19, где конъюгат антитело-лекарственное средство имеет структуру:
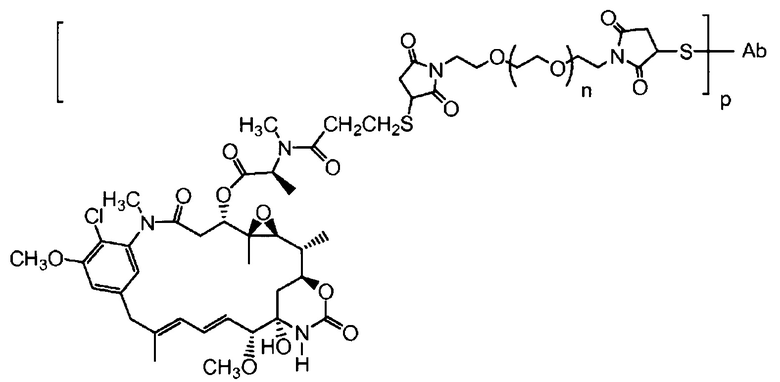
где n равно 0, 1 или 2.
21. Применение по п. 16, где D представляет собой остаток монометилауристатинового лекарственного средства ММАЕ или MMAF, имеющего структуру:
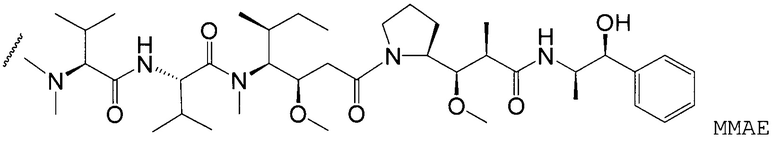
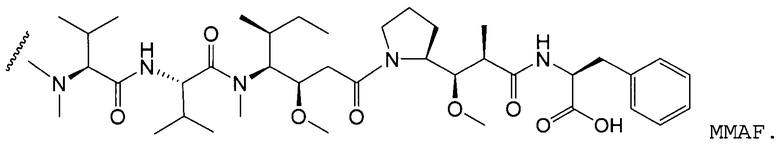
22. Применение по п. 21, где конъюгат антитело-лекарственное средство выбрано из структур:
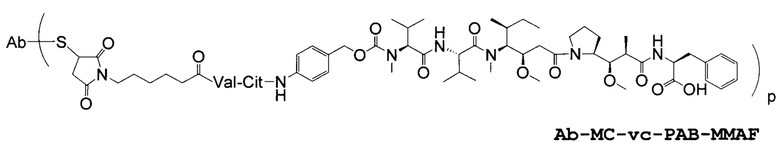
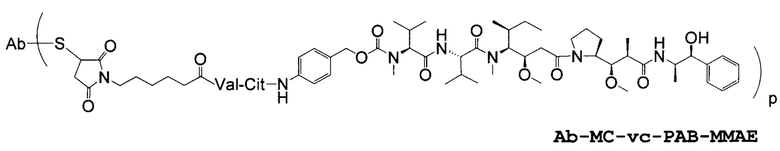
 и
и

где Val представляет собой валин;
Cit представляет собой цитруллин и
р равно 1, 2, 3 или 4.
| WO 2006034488 A, 30.03.2006 | |||
| JUNUTULA J.R., et al., Rapid identification of reactive cysteine residues for site-specific labeling of antibody-Fabs, Journal of immunological methods, 2008, 332, pp.41-52 | |||
| JUNUTULA J.R., et al., Site-specific conjugation of cytotoxic drug to an antibody improves the therapeutic index, Nature biotechnology, 2008, 26(8), pp.925-932 | |||
| RU 2006147264 A, 31.05.2005. |
Авторы
Даты
2017-07-28—Публикация
2011-06-07—Подача