ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет предварительной патентной заявки США No. 61/267006, поданной 4 декабря 2009 г., и предварительной патентной заявки США No. 61/346566, поданной 20 мая 2010 г., полное содержание которых, таким образом, приведено в настоящем документе в качестве ссылки.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Настоящая заявка содержит список последовательностей, который подан в формате ASCII через EFS-Web, и полное содержание которого таким образом приведено в качестве ссылки. Указанная копия ASCII, созданная 30 ноября 2010 г., названа P4377R1WO.txt и имеет размер 53549 байт.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Представлены мультиспецифические антитела, специфически связывающие по меньшей мере два различных эпитопа. Представлены также структурные варианты нативных антител (аналоги антител). Представлены также мультиспецифические антитела и аналоги антител с рядом видов биологической активности. Представлены мультиспецифические антитела - агонисты и антагонисты, и аналоги антител - агонисты и антагонисты. Представлены также мультиспецифические антитела и аналоги антител, конъюгированные с терапевтическими и/или диагностическими средствами, так же как мультиспецифические антитела и аналоги антител, конъюгированные со средствами для увеличения времени полужизни in vivo по сравнению с мультиспецифическими антителами и аналогами антител в отсутствие таких средств. Кроме того, представлены способы получения мультиспецифических антител и аналогов антител и композиций, содержащих мультиспецифические антитела и аналоги антител. Представлены также терапевтические, исследовательские и диагностические применения мультиспецифических антител и аналогов антител.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Моноклональные антитела обеспечивают новые лекарственные средства для лечения различных нарушений, включая злокачественные опухоли, иммунологические и неврологические нарушения, а также инфекционные заболевания. Newsome, B. W. et al., Br J Clin Pharmacol 66(1):6-19 (2008); Chames, P., et al., Br J Pharmacol 157(2):220-33 (2009); Dimitrov, D. S. et al., Methods Mol Biol 525: 1-27, xiii (2009). Эти лекарственные средства были успешными по меньшей мере, частично, из-за точного и сильного взаимодействия с белками-мишенями и уникальной специфичности, обеспечиваемых моноклональными антителами. Для относительно продолжительного времени полужизни и стабильности моноклональных антител in vivo, позволяющих желательные режимы дозирования и опосредованную клетками токсичность, можно задействовать Fc-область антитела (Tabrizi, M. A., et al., Drug Discov Today 11 (1-2):81-8 [2006]). В конкретных случаях терапевтические антитела использовали для блокирования клеточных сигналов посредством связывания и нейтрализации важных функциональных областей секретированных белков и белков поверхности клетки. Такие основные свойства моноклональных антител в настоящее время используют для разработки молекулярных лекарственных средств с механизмами действия, отличающимися по сравнению с общепринятыми антителами (Dimitrov, D. S. et al., Methods Mol Biol 525: 1-27, xiii [2009]). Такие конкретные способы находятся в клинической разработке и обладают многообещающими признаками (Chames, P., et al., Br J Pharmacol 157(2):220-33 [2009]).
Например, один способ включает специфическое для клеток нацеливание с использованием антител для доставки цитотоксических лекарственных средств к опухолям. Carter, P. J. et al., Cancer J 14(3): 154-69 (2008); Junutula, J. R., et al., Nat Biotechnol 26(8):925-32 (2008); Senter, P. D., Curr Opin Chem Biol 13(3):235-44 (2009). В этом случае, моноклональное антитело специфически направляет цитотоксические молекулы для нацеливания на клетки, таким образом, концентрируя высокую токсичность цитотоксической группы там, где необходима, в то же время минимизируя влияние на не являющиеся мишенью клетки. Такие конъюгаты антитело-лекарственное средство позволяют увеличение активности уничтожения клеток опухолей при сохранении окна дозирования, минимизирующего не направленную на мишень токсичность.
Другим примером является доставка функциональных комплексов, например, наночастиц, содержащих такие средства, как миРНК, и включающих моноклональные антитела на поверхности частиц для нацеливания. Schiffelers, R. M., et al., Nucleic Acids Res 32(19):el49 (2004); Vornlocher, H. P., Trends Mol Med 12(1): 1-3 (2006); Davis, M. E., Mol Pharm 6(3):659-68 (2009).
В другом способе используют бивалентную структуру антител для конструирования биспецифических молекул, связывающих две мишени одновременно (Fischer, N. et al., Pathobiology 74(1):3-14 [2007]). Биспецифические антитела предоставляют возможности для увеличения специфичности, расширения активности и использования новых механизмов действия, которых нельзя достичь с общепринятым моноклональным антителом. Drakeman, D. L., Expert Opin Investig Drugs 6(9): 1169-78 (1997); Kontermann, R. E., Acta Pharmacol Sin 26(1): 1-9 (2005); Marvin, J. S. et al., Acta Pharmacol Sin 26(6):649-58 (2005); Marvin, J. S., et al., Curr Opin Drug Discov Devel 9(2): 184-93 (2006); Shen, J., et al., J Biol Chem 281(16): 10706-14 (2006); Chames, P. et al., Curr Opin Drug Discov Devel 12(2):276-83 (2009). Показана эффективность в ряде применений перекрестного связывания двух различных рецепторов с использованием биспецифического антитела для ингибирования пути передачи сигнала. В одном примере, тирозинфосфатазу поверхности клеток рекрутировали в комплекс рецептора IgE для уменьшения активности фосфорилированного рецептора IgE (Jackman, et al., J. Biol. Chem. 285:20850-20859 (2010)). Этот способ являлся более эффективным, чем блокирование участка связывания лиганда, поскольку ингибирование передачи сигнала биспецифическим антителом происходило даже в присутствии высоких концентраций лиганда. Id.
Для использования биспецифических антител для рекрутирования цитотоксических T-клеток также показаны клинические возможности, когда активации T-клеток достигали вблизи клеток опухолей посредством связывающих биспецифическое антитело рецепторов одновременно на двух различных типах клеток. Bargou, R., E., et al., Science 321(5891):974-7 (2008); Shekhar, C.,Chem Biol 15(9): 877-8 (2008); Baeuerle, P. A., et al., Cancer Res 69(12):4941-4 (2009). По одному способу разработано биспецифическое антитело с одним плечом, связывающим FcγRIII, и другим, связывающим рецептор HER2, для терапии опухолей яичников и молочной железы со сверхэкспрессией антигена HER2. (Hseih-Ma et al. Cancer Research 52:6832-6839 [1992] и Weiner et al. Cancer Research 53:94-100 [1993]). Биспецифические антитела могут также опосредовать уничтожение посредством T-клеток. Как правило, биспецифические антитела связывают CD3 комплекс на T-клетках с опухолесвязанным антигеном. Полностью гуманизированное F(ab')2 биспецифическое антитело, состоящее из анти-CD3, связанного с анти-p185HER2, использовали для нацеливания T-клеток для уничтожения клеток опухолей со сверхэкспрессией рецептора HER2. Shalaby et al., J. Exp. Med. 175(1):217 (1992). Биспецифические антитела тестировали в нескольких клинических исследованиях на ранней фазе с обнадеживающими результатами. В одном из исследований 12 пациентов с раком легкого, яичников или молочной железы лечили инфузиями активированных T-лимфоцитов, нацеленных с помощью биспецифического антитела анти-CD3/против опухоли (MOC31). deLeij et al. Bispecific Antibodies and Targeted Cellular Cytotoxicity, Romet-Lemonne, Fanger and Segal Eds., Lienhart (1991) p. 249. Нацеленные клетки индуцировали значительный локальный лизис клеток опухолей, умеренную воспалительную реакцию, но не токсические побочные эффекты или ответы против антител мыши.
Кроме того, биспецифические антитела можно использовать в лечении инфекционных заболеваний (например, для нацеливания эффекторных клеток на клетки, инфицированные вирусом, таким как HIV или вирус гриппа, или простейшими, такими как Toxoplasma gondii), использовать для доставки иммунотоксинов к клеткам опухолей, или для нацеливания иммунных комплексов на рецепторы поверхности клеток. См., например, Fanger et al., Crit. Rev. Immunol. 12: 101-124 (1992). Например, что касается инфекции HIV, Berg et al., PNAS (USA) 88:4723-4727 (1991) получили химеру биспецифическое антитело-иммуноадгезин, происходящую из CD4-IgG мыши. Эти авторы сконструировали тетрамерную молекулу, имеющую два плеча. Одно плечо было составлено из CD4, слитого с константным доменом тяжелой цепи антитела вместе с CD4, слитым с константным доменом легкой цепи антитела. Другое плечо было составлено из полной тяжелой цепи анти-CD3 антитела вместе с полной легкой цепью того же самого антитела. Посредством CD4-IgG плеча, эта биспецифическая молекула связывается с CD3 на поверхности цитотоксических T-клеток. Соприкосновение цитотоксических клеток и инфицированных HIV клеток приводит к специфическому уничтожению последних клеток.
Описан ряд способов для синтеза мультиспецифических антител, включая биспецифические антитела. Способы синтеза двухвалентных фрагментов антител описаны в WO 99/64460. Однако, многие из этих способов представляют множество проблем. Например, опубликованы трудности с экспрессией и крупномасштабной продукцией, стабильностью и временем полужизни in vivo, сворачиванием и агрегацией белка. Morimoto, K., et al., J Immunol Methods 224(l-2):43-50 (1999); Kriangkum, J., et al., Biomol Eng 18(2):31-40 (2001); Segal, D. M. и B. J. Bast (2001). «Production of bispecific antibodies». Curr Protoc Immunol Chapter 2:Unit 2 13; Graziano, R. F., et al., Methods Mol Biol 283:71-85 (2004); Kontermann, R. E., et al., Methods Mol Biol 248:227-42 (2004); Das, D., et al., Methods Mol Med 109:329-46 (2005); Fischer, N. et al., Pathobiology 74(1):3-14 (2007); Shen, J., et al., J Immunol Methods 318(l-2):65-74 (2007). Кроме того, многие из этих способов являются трудоемкими и требующими больших временных затрат, таким образом, ограничивая количество и разнообразие молекул, которые можно конструировать и скринировать по желательным видам активности. Способы, описанные в настоящем документе, направлены на эти проблемы, и способы, композиции, мультиспецифические антитела и аналоги антител, описанные в настоящем документе, предоставляют дополнительные преимущества.
Полное содержание всех процитированных в настоящем документе ссылок, включая патентные заявки и публикации, приведено в качестве ссылки для всех целей.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Способы и композиции по изобретению основаны, по меньшей мере частично, на разработке способов надежной и воспроизводимой продукции мультиспецифических антител и аналогов антител высокой чистоты. В конкретных вариантах осуществления большое количество мультиспецифических или моноспецифических комбинаций можно легко получать и скринировать по желательным видам активности. В одном из аспектов представлены новые способы конструирования функции антитела на основании удивительного и неожиданного открытия, что структурные варианты нативных антител могут обладать широким спектром видов биологической активности, лежащих в диапазоне от сильного антагониста до сильного агониста с различными уровнями активности между ними. В другом аспекте с использованием способов, описанных в настоящем документе предоставлены мультиспецифические антитела и аналоги антител, полученные из предсуществующих исходных антител, обладающие новыми функциями, не связанными с исходными антителами. Способы и мультиспецифические антитела и аналоги антител, описанные в настоящем документе, предоставляют, по меньшей мере частично, новые способы продукции, скрининга, идентификации и разработки новых терапевтических и диагностических средств и исследовательских инструментов.
В одном из аспектов представлены способы синтеза мультиспецифического антитела, где проводят реакцию первого фрагмента антитела, полученного из первого исходного антитела, обладающего первой моноспецифичностью и свободной сульфгидрильной группой, с тио-реактивным кросслинкером для получения группы фрагмент антитела-кросслинкер, и где проводят реакцию группы фрагмент антитела-кросслинкер со вторым фрагментом антитела, полученным из второго исходного антитела, обладающего второй моноспецифичностью и свободной сульфгидрильной группой, для получения мультиспецифического антитела, и где первая моноспецифичность отличается от второй моноспецифичности. В конкретных вариантах осуществления первое исходное антитело выбрано из анти-Her1 и анти-Her2. В конкретных вариантах осуществления первое исходное антитело представляет собой анти-Her2, и второе исходное антитело представляет собой анти-Her1, или первое исходное антитело представляет собой анти-Her1, и второе исходное антитело представляет собой анти-Her2. В конкретных вариантах осуществления анти-Her2 выбрано из Герцептина® (трастузумаба) и 2C4 (пертузумаба). В конкретных вариантах осуществления первое исходное антитело представляет собой анти-Her2, и первый фрагмент антитела содержит последовательность легкой цепи, выбранную из SEQ ID NO:1, 2, 3, 6 и 7, и/или последовательность тяжелой цепи, выбранную из SEQ ID NO:4, 5 и 8. В конкретных вариантах осуществления анти-Her1 выбрано из D1-5 и C3-101. В конкретных вариантах осуществления первое исходное антитело представляет собой анти-Her1, и первый фрагмент антитела содержит последовательность легкой цепи, выбранную из SEQ ID NO:18, 19, 21 и 22 и/или последовательность тяжелой цепи, выбранную из SEQ ID NO:17 и 20. В конкретных вариантах осуществления анти-Her2 выбрано из трастузумаба и пертузумаба, и анти-Her1 выбрано из D1-5 и C3-101. В конкретных вариантах осуществления фрагмент антитела, полученный из анти-Her2, содержит последовательность легкой цепи, выбранную из SEQ ID NO:1, 2, 3, 6 и 7, и/или последовательность тяжелой цепи, выбранную из SEQ ID NO:4, 5, и 8; и фрагмент антитела, полученный из анти-Her1, содержит последовательность легкой цепи, выбранную из SEQ ID NO:18, 19, 21 и 22, и/или последовательность тяжелой цепи, выбранную из SEQ ID NO:17 и 20.
В следующем аспекте способов, описанных выше, первое исходное антитело выбрано из анти-FcγRIIb и анти-FcεRIα. В конкретных вариантах осуществления первое исходное антитело представляет собой анти-FcγRIIb, и второе исходное антитело представляет собой анти-FcεRIα, или первое исходное антитело представляет собой анти-FcεRIα, и второе исходное антитело представляет собой анти-FcγRIIb. В конкретных вариантах осуществления анти-FcγRIIb представляет собой 5A6. В конкретных вариантах осуществления первое исходное антитело представляет собой анти-FcγRIIb, и первый фрагмент антитела содержит последовательность легкой цепи, выбранную из SEQ ID NO:11 и 12, и/или последовательность тяжелой цепи, выбранную из SEQ ID NO:9 и 10. В конкретных вариантах осуществления анти-FcεRIα представляет собой 22E7. В конкретных вариантах осуществления первое исходное антитело представляет собой анти-FcεRIα, и первый фрагмент антитела содержит последовательность легкой цепи, выбранную из SEQ ID NO:15 и 16, и/или последовательность тяжелой цепи, выбранную из SEQ ID NO:13 и 14. В конкретных вариантах осуществления фрагмент антитела, полученный из анти-FcγRIIb, содержит последовательность легкой цепи, выбранную из SEQ ID NO:11 и 12 и/или a последовательность тяжелой цепи, выбранную из SEQ ID NO:9 и 10; и фрагмент антитела, полученный из анти-FcεRIα, содержит последовательность легкой цепи, выбранную из SEQ ID NO:15 и 16, и/или последовательность тяжелой цепи, выбранную из SEQ ID NO:13 и 14.
В другом аспекте тио-реактивный кросслинкер выбран из бис-малеимидогалогенидов, бис-алкилгалогенидов, пиридилдисульфидов, бис-ртутных солей, опосредованного 5-тио-2-нитробензойной кислотой перекрестного связывания и бис-тиосульфонатов. В одном варианте осуществления кросслинкер представляет собой бис-малеинимид. В конкретных вариантах осуществления первый фрагмент антитела и/или второй фрагмент антитела получены из сконструированного антитела с цистеиновыми заменами. В конкретных таких вариантах осуществления первый фрагмент антитела и/или вторые фрагменты антитела представляют собой тио-Fab. В конкретных вариантах осуществления сконструированное антитело с цистеиновыми заменами содержит цистеиновую замену в положении 110 или в положении 205 легкой цепи, где нумерация остатков присутствует в соответствии с системой нумерации EU. В конкретных вариантах осуществления сконструированное антитело с цистеиновыми заменами содержит цистеиновую замену в положении 118 или в положении 121 тяжелой цепи, где нумерация остатков присутствует в соответствии с системой нумерации EU. В конкретных вариантах осуществления первый фрагмент антитела и/или второй фрагмент антитела получен из нативного антитела, где нативное антитело расщепляют пепсином для получения F(ab')2 фрагмента, где F(ab')2 фрагмент очищают и обрабатывают восстанавливающим средством, а затем окисляющим средством в условиях, при которых переформируется дисульфидный мостик между тяжелой цепью и легкой цепью Fab, и остатки цистеина в шарнирной области остаются неокисленными.
В другом аспекте представлены способы синтеза аналога антитела, где проводят реакцию первого фрагмента антитела, обладающего свободной сульфгидрильной группой, с тио-реактивным кросслинкером для получения группы фрагмент антитела-кросслинкер, и где проводят реакцию группы фрагмент антитела-кросслинкер со вторым фрагментом антитела, обладающим свободной сульфгидрильной группой, для получения аналога антитела, и где первый фрагмент антитела и второй фрагмент антитела получены из одного исходного антитела. В конкретных вариантах осуществления аналог антитела обладает антигенсвязывающей областью, структурно отличающейся от антигенсвязывающей области исходного антитела. В конкретных вариантах осуществления исходное антитело выбрано из анти-Her1, анти-Her2, анти-FcεRIα и анти-FcγRIIb. В конкретных вариантах осуществления анти-Her2 выбрано из Герцептина® (трастузумаба) и 2C4 (пертузумаба). В конкретных вариантах осуществления исходное антитело представляет собой анти-Her2, и первый фрагмент антитела и второй фрагмент антитела содержат одинаковую последовательность легкой цепи, где последовательность легкой цепи выбрана из SEQ ID NO:1, 2, 3, 6 и 7, и/или одинаковую последовательность тяжелой цепи, где последовательность тяжелой цепи выбрана из SEQ ID NO:4, 5 и 8. В конкретных вариантах осуществления анти-Her1 выбрано из D1-5 и C3-101. В конкретных вариантах осуществления исходное антитело представляет собой анти-Her1, и первый фрагмент антитела и второй фрагмент антитела содержат одинаковую последовательность легкой цепи, где последовательность легкой цепи выбрана из SEQ ID NO:18, 19, 21 и 22, и/или одинаковую последовательность тяжелой цепи, где последовательность тяжелой цепи выбрана из SEQ ID NO:17 и 20. В конкретных вариантах осуществления анти-FcγRIIb представляет собой 5A6. В конкретных вариантах осуществления исходное антитело представляет собой анти-FcγRIIb, и первый фрагмент антитела и второй фрагмент антитела содержат одинаковую последовательность легкой цепи, где последовательность легкой цепи выбрана из SEQ ID NO:11 и 12 и/или одинаковую последовательность тяжелой цепи, где последовательность тяжелой цепи выбрана из SEQ ID NO:9 и 10. В конкретных вариантах осуществления анти-FcεRIα представляет собой 22E7. В конкретных вариантах осуществления исходное антитело представляет собой анти-FcεRIα, и первый фрагмент антитела и второй фрагмент антитела содержат одинаковую последовательность легкой цепи, где последовательность легкой цепи выбрана из SEQ ID NO:15 и 16, и/или одинаковую последовательность тяжелой цепи, где последовательность тяжелой цепи выбрана из SEQ ID NO:13 и 14. В конкретных вариантах осуществления исходное антитело представляет собой сконструированное антитело с цистеиновыми заменами. В конкретных вариантах осуществления исходное антитело представляет собой нативное антитело.
В следующем аспекте представлены способы синтеза мультиспецифического антитела или аналога антитела, как выше, где кросслинкер представляет собой модифицированный кросслинкер, содержащий защищенную SH-группу. В одном из вариантов осуществления модифицированный кросслинкер представляет собой бис-малеимидоацетилацетат (BMata). В конкретных вариантах осуществления проводят дополнительную реакцию мультиспецифического антитела или аналога антитела, содержащего модифицированный кросслинкер, со средством, содержащим функциональную группу. В конкретных вариантах осуществления средство выбрано из полиэтиленгликоля (PEG), альбуминсвязывающего пептида (ABP), флуоресцентной метки, средства для радиовизуализации, цитотоксического средства и миРНК. В конкретных вариантах осуществления проводят дополнительную реакцию мультиспецифического антитела или аналога антитела, содержащего модифицированный кросслинкер, с PEG. В конкретных вариантах осуществления PEG представляет собой PEG с mw 2000 (2K), PEG с mw 12000 (12K) или PEG с mw 20000 (20K).
В другом аспекте представлены способы синтеза панели мультиспецифических антител, где проводят реакцию первого фрагмента антитела, полученного из первого исходного антитела, обладающего первой моноспецифичностью и свободной сульфгидрильной группой, с тио-реактивным кросслинкером для получения группы фрагмент антитела-кросслинкер, и где проводят реакцию группы фрагмент антитела-кросслинкер попарно с каждым из двух или более дополнительных фрагментов антител, полученных из одного или нескольких исходных антител с моноспецифичностью, отличной от первого исходного антитела, каждый из которых имеет свободную сульфгидрильную группу, для получения панели мультиспецифических антител. В конкретных вариантах осуществления проводят реакцию группы фрагмент антитела-кросслинкер попарно с каждым из трех или более дополнительных фрагментов антител, или с каждым из четырех или более дополнительных фрагментов антител, или с каждым из пяти или более дополнительных фрагментов антител, или с каждым из десяти или более дополнительных фрагментов антител, или с каждым из 15 или более дополнительных фрагментов антител, или с каждым из 20 или более дополнительных фрагментов антител, или с каждым из 25 или более дополнительных фрагментов антител, или с каждым из 50 или более дополнительных фрагментов антител, или с каждым из 100 или более дополнительных фрагментов антител, в каждом случае полученными из одного или нескольких исходных антител, или двух или более исходных антител, или трех или более исходных антител, или четырех или более исходных антител, или пяти или более исходных антител, или десяти или более исходных антител, или 15 или более исходных антител, или 20 или более исходных антител, или 25 или более исходных антител, или 50 или более исходных антител, или 100 или более исходных антител, в каждом случае с моноспецифичностью, отличной от первого исходного антитела. В конкретных вариантах осуществления первое исходное антитело выбрано из анти-Her1, анти-Her2, анти-FcεRIα и анти-FcγRIIb. В конкретных вариантах осуществления первый фрагмент антитела получен из анти-Her2, и каждый из двух или более дополнительных фрагментов антител получен из анти-Her1, или первый фрагмент антитела получен из анти-Her1, и каждый из двух или более дополнительных фрагментов антител получен из анти-Her2, или первый фрагмент антитела получен из анти-FcεRIα, и каждый из двух или более дополнительных фрагментов антител получен из анти-FcγRIIb, или первый фрагмент антитела получен из анти-FcγRIIb, и каждый из двух или более дополнительных фрагментов антител получен из анти-FcεRIα. В конкретных вариантах осуществления анти-Her2 выбран из Герцептина® (трастузумаба) и 2C4 (пертузумаба). В конкретных вариантах осуществления анти-Her1 выбран из D1-5 и C3-101. В конкретных вариантах осуществления анти-Her2 выбран из трастузумаба и пертузумаба, и анти-Her1 выбран из D1-5 и C3-101. В конкретных вариантах осуществления анти-FcγRIIb представляет собой 5A6. В конкретных вариантах осуществления анти-FcεRIα представляет собой 22E7. В конкретных вариантах осуществления анти-FcγRIIb представляет собой 5A6, и анти-FcεRIα представляет собой 22E7. В конкретных вариантах осуществления тио-реактивный кросслинкер выбран из бис-малеимидогалогенидов, бис-алкилгалогенидов, пиридилдисульфидов, бис-ртутных солей, опосредованного 5-тио-2-нитробензойной кислотой перекрестного связывания и бис-тиосульфонатов. В одном варианте осуществления тио-реактивный кросслинкер представляет собой бис-малеинимид. В конкретных вариантах осуществления, первый фрагмент антитела и/или каждый из двух или более дополнительных фрагментов антител получены из сконструированного антитела с цистеиновыми заменами. В конкретных таких вариантах осуществления сконструированное антитело с цистеиновыми заменами содержит замену в положении 110 или в положении 205 легкой цепи, где нумерация остатков присутствует в соответствии с системой нумерации EU, и где замена представляет собой цистеин. В конкретных вариантах осуществления сконструированное антитело с цистеиновыми заменами содержит замену в положении 118 или в положении 121 тяжелой цепи, где нумерация остатков присутствует в соответствии с системой нумерации EU, и где замена представляет собой цистеин.
В другом аспекте представлены способы синтеза панели аналогов антител, где проводят реакцию первого фрагмента антитела, обладающего свободной сульфгидрильной группой, с тио-реактивным кросслинкером для получения группы фрагмент антитела-кросслинкер, и где проводят реакцию группы фрагмент антитела-кросслинкер попарно с каждым из двух или более дополнительных фрагментов антител, каждый из которых имеет свободную сульфгидрильную группу, для получения панели аналогов антител, где каждый из фрагментов антител получен из одного и того же исходного антитела. В конкретных вариантах осуществления проводят реакцию группы фрагмент антитела-кросслинкер попарно с каждым из трех или более дополнительных фрагментов антител, или с каждым из четырех или более дополнительных фрагментов антител, или с каждым из пяти или более дополнительных фрагментов антител, или с каждым из десяти или более дополнительных фрагментов антител, или с каждым из 15 или более дополнительных фрагментов антител, или с каждым из 20 или более дополнительных фрагментов антител, или с каждым из 25 или более дополнительных фрагментов антител, или с каждым из 50 или более дополнительных фрагментов антител, где каждый из фрагментов антител получен из одного и того же исходного антитела. В конкретных вариантах осуществления один или несколько аналогов антител из панели обладают антигенсвязывающей областью, структурно отличающейся от антигенсвязывающей области исходного антитела. В конкретных вариантах осуществления исходное антитело выбрано из анти-Her1, анти-Her2, анти-FcεRIα и анти-FcγRIIb. В конкретных вариантах осуществления анти-Her2 выбрано из трастузумаба и пертузумаба. В конкретных вариантах осуществления анти-Her1 выбрано из D1-5 и C3-101. В конкретных вариантах осуществления анти-FcγRIIb представляет собой 5A6. В конкретных вариантах осуществления анти-FcεRIα представляет собой 22E7. В конкретных вариантах осуществления тио-реактивный кросслинкер выбран из бис-малеимидогалогенидов, бис-алкилгалогенидов, пиридилдисульфидов, бис-ртутных солей, опосредованного 5-тио-2-нитробензойной кислотой перекрестного связывания и бис-тиосульфонатов. В одном из вариантов осуществления тио-реактивный кросслинкер представляет собой бис-малеинимид. В конкретных вариантах осуществления исходное антитело представляет собой сконструированное антитело с цистеиновыми заменами. В конкретных вариантах осуществления сконструированное антитело с цистеиновыми заменами содержит замену в положении 110 или в положении 205 легкой цепи, где нумерация остатков присутствует в соответствии с системой нумерации EU, и где замена представляет собой цистеин. В конкретных вариантах осуществления сконструированное антитело с цистеиновыми заменами содержит замену в положении 118 или в положении 121 тяжелой цепи, где нумерация остатков присутствует в соответствии с системой нумерации EU, и где замена представляет собой цистеин.
В следующем аспекте представлено мультиспецифическое антитело, синтензированное способом, включающим реакцию первого фрагмента антитела, полученного из первого исходного антитела, обладающего первой моноспецифичностью и свободной сульфгидрильной группой, с тио-реактивным кросслинкером для получения группы фрагмент антитела-кросслинкер, и затем реакцию группы фрагмент антитела-кросслинкер со вторым фрагментом антитела, полученным из второго исходного антитела, обладающего второй моноспецифичностью и свободной сульфгидрильной группой, для получения мультиспецифического антитела, и где первая моноспецифичность отличается от второй моноспецифичности. В конкретных вариантах осуществления первое исходное антитело выбрано из анти-Her1 и анти-Her2. В конкретных вариантах осуществления первое исходное антитело представляет собой анти-Her2, и второе исходное антитело представляет собой анти-Her1, или первое исходное антитело представляет собой анти-Her1, и второе исходное антитело представляет собой анти-Her2. В конкретных вариантах осуществления анти-Her2 выбрано из Герцептина® (трастузумаба) и 2C4 (пертузумаба). В конкретных вариантах осуществления первое исходное антитело представляет собой анти-Her2, и первый фрагмент антитела содержит последовательность легкой цепи, выбранную из SEQ ID NO:1, 2, 3, 6 и 7, и/или последовательность тяжелой цепи, выбранную из SEQ ID NO:4, 5 и 8. В конкретных вариантах осуществления анти-Her1 выбран из D1-5 и C3-101. В конкретных вариантах осуществления первое исходное антитело представляет собой анти-Her1, и первый фрагмент антитела содержит последовательность легкой цепи, выбранную из SEQ ID NO:18, 19, 21 и 22, и/или последовательность тяжелой цепи, выбранную из SEQ ID NO:17 и 20. В конкретных вариантах осуществления анти-Her2 выбран из трастузумаба и пертузумаба, и анти-Her1 выбрано из D1-5 и C3-101. В конкретных вариантах осуществления фрагмент антитела, полученный из анти-Her2, содержит последовательность легкой цепи, выбранную из SEQ ID NO:1, 2, 3, 6 и 7, и/или последовательность тяжелой цепи, выбранную из SEQ ID NO:4, 5 и 8; и фрагмент антитела, полученный из анти-Her1, содержит последовательность легкой цепи, выбранную из SEQ ID NO:18, 19, 21 и 22, и/или последовательность тяжелой цепи, выбранную из SEQ ID NO:17 и 20.
В следующем аспекте мультиспецифических антител, описанных выше, первое исходное антитело выбрано из анти-FcγRIIb и анти-FcεRIα. В конкретных вариантах осуществления первое исходное антитело представляет собой анти-FcγRIIb, и второе исходное антитело представляет собой анти-FcεRIα, или первое исходное антитело представляет собой анти-FcεRIα, и второе исходное антитело представляет собой анти-FcγRIIb. В конкретных вариантах осуществления, анти-FcγRIIb представляет собой 5A6. В конкретных вариантах осуществления первое исходное антитело представляет собой анти-FcγRIIb, и первый фрагмент антитела содержит последовательность легкой цепи, выбранную из SEQ ID NO:11 и 12, и/или последовательность тяжелой цепи, выбранную из SEQ ID NO:9 и 10. В конкретных вариантах осуществления анти-FcεRIα представляет собой 22E7. В конкретных вариантах осуществления первое исходное антитело представляет собой анти-FcεRIα, и первый фрагмент антитела содержит последовательность легкой цепи, выбранную из SEQ ID NO:15 и 16, и/или последовательность тяжелой цепи, выбранную из SEQ ID NO:13 и 14. В конкретных вариантах осуществления фрагмент антитела, полученный из анти-FcγRIIb, содержит последовательность легкой цепи, выбранную из SEQ ID NO:11 и 12, и/или последовательность тяжелой цепи, выбранную из SEQ ID NO:9 и 10; и фрагмент антитела, полученный из анти-FcεRIα, содержит последовательность легкой цепи, выбранную из SEQ ID NO:15 и 16, и/или последовательность тяжелой цепи, выбранную из SEQ ID NO:13 и 14.
В дополнительном аспекте представлено мультиспецифическое антитело, синтезированное способом, как описано выше, где первое исходное антитело специфически связывает мишень на T-клетке, и второе исходное антитело специфически связывает мишень на клетке опухоли. В конкретных вариантах осуществления первое исходное антитело представляет собой анти-CD3, и второе исходное антитело выбрано из анти-BLR1, анти-BR3, анти-CD19, анти-CD20, анти-CD22, анти-CD72, анти-CD79A, анти-CD79B, анти-CD180, анти-CR2, анти-FCER2, анти-FcRH1, анти-FcRH2, анти-FcRH5, анти-FCRL4, анти-Her2, анти-HLA-DOB, и анти-NAG14. В одном из вариантов осуществления первое исходное антитело представляет собой анти-CD3 и второе исходное антитело представляет собой анти-CD 19. В одном из вариантов осуществления первое исходное антитело представляет собой анти-CD3 и второе исходное антитело представляет собой анти-CD20. В одном из вариантов осуществления первое исходное антитело представляет собой анти-CD3, и второе исходное антитело представляет собой анти-CD22. В одном варианте осуществления первое исходное антитело представляет собой анти-CD3, и второе исходное антитело представляет собой анти-FcRH5. В одном варианте осуществления первое исходное антитело представляет собой анти-CD3, и второе исходное антитело представляет собой анти-Her2. В конкретных вариантах осуществления мультиспецифическое антитело обладает полиэпитопной специфичностью. В конкретных вариантах осуществления мультиспецифическое антитело обладает одним или несколькими видами биологической активности, неотличимыми от активности каждого из исходных антител. В конкретных вариантах осуществления мультиспецифическое антитело обладает одним или несколькими видами биологической активности, отличными от активности по меньшей мере одного из исходных антител.
В другом аспекте представлен аналог антитела, синтезированный способом, включающим реакцию первого фрагмента антитела, обладающего свободной сульфгидрильной группой, с тио-реактивным кросслинкером для получения группы фрагмент антитела-кросслинкер, и затем реакцию группы фрагмент антитела-кросслинкер со вторым фрагментом антитела, обладающим свободной сульфгидрильной группой, для получения аналога антитела, и где первый фрагмент антитела и второй фрагмент антитела получены из одного исходного антитела. В конкретных вариантах осуществления исходное антитело выбрано из анти-Her1, анти-Her2, анти-FcεRIα и анти-FcγRIIb. В конкретных вариантах осуществления анти-Her2 выбран из Герцептина® (трастузумаба) и 2C4 (пертузумаба). В конкретных вариантах осуществления исходное антитело представляет собой анти-Her2, и первый фрагмент антитела и второй фрагмент антитела содержат одинаковую последовательность легкой цепи, где последовательность легкой цепи выбрана из SEQ ID NO:1, 2, 3, 6 и 7, и/или одинаковую последовательность тяжелой цепи, где последовательность тяжелой цепи выбрана из SEQ ID NO:4, 5 и 8. В конкретных вариантах осуществления анти-Her1 выбран из D1-5 и C3-101. В конкретных вариантах осуществления исходное антитело представляет собой анти-Her1, и первый фрагмент антитела и второй фрагмент антитела содержат одинаковую последовательность легкой цепи, где последовательность легкой цепи выбрана из SEQ ID NO:18, 19, 21 и 22, и/или одинаковую последовательность тяжелой цепи, где последовательность тяжелой цепи выбрана из SEQ ID NO:17 и 20. В конкретных вариантах осуществления анти-FcγRIIb представляет собой 5A6. В конкретных вариантах осуществления исходное антитело представляет собой анти-FcγRIIb, и первый фрагмент антитела и второй фрагмент антитела содержат одинаковую последовательность легкой цепи, где последовательность легкой цепи выбрана из SEQ ID NO:11 и 12, и/или одинаковую последовательность тяжелой цепи, где последовательность тяжелой цепи выбрана из SEQ ID NO:9 и 10. В конкретных вариантах осуществления анти-FcεRIα представляет собой 22E7. В конкретных вариантах осуществления исходное антитело представляет собой анти-FcεRIα, и первый фрагмент антитела и второй фрагмент антитела содержат одинаковую последовательность легкой цепи, где последовательность легкой цепи выбрана из SEQ ID NO:15 и 16, и/или одинаковую последовательность тяжелой цепи, где последовательность тяжелой цепи выбрана из SEQ ID NO:13 и 14. В конкретных вариантах осуществления исходное антитело представляет собой сконструированное антитело с цистеиновыми заменами. В конкретных вариантах осуществления исходное антитело представляет собой нативное антитело. В конкретных вариантах осуществления аналог антитела обладает одним или несколькими видами биологической активности, неотличимыми от активности исходного антитела. В конкретных вариантах осуществления аналог антитела обладает одним или несколькими видами биологической активности, отличными от активности исходного антитела. В конкретных вариантах осуществления биологическая активность представляет собой пролиферацию клеток. В конкретных вариантах осуществления аналог антитела представляет собой антагонист Her2-экспрессирующих клеток, и исходное антитело представляет собой Герцептин® (трастузумаб). В конкретных таких вариантах осуществления аналог антитела выбран из бис-Fab 1324, бис-Fab 1328, и бис-Fab 1329. В конкретных вариантах осуществления биологическая активность аналога антитела является антагонистической, и биологическая активность исходного антитела является агонистической. В конкретных вариантах осуществления биологическая активность аналога антитела является агонистической, и биологическая активность исходного антитела является антагонистической. В конкретных вариантах осуществления аналог антитела представляет собой агонист Her2-экспрессирующих клеток, и исходное антитело представляет собой Герцептин® (трастузумаб). В конкретных таких вариантах осуществления аналог антитела выбран из бис-Fab 1188, бис-Fab 1321, бис-Fab 1322, бис-Fab 1323 и бис-Fab 1325.
В другом аспекте представлены композиции, содержащие одно или несколько мультиспецифических антител. В конкретных вариантах осуществления одно или несколько мультиспецифических антител выбраны из бис-Fab 1187, бис-Fab 1189, бис-Fab 1190, бис-Fab 1191, бис-Fab 1192, бис-Fab 1193, бис-Fab 1299, бис-Fab 1300, бис-Fab 1301, бис-Fab 1302, бис-Fab1303, бис-Fab 1304, бис-Fab 1305, бис-Fab 1306 и бис-Fab 1307.
В другом аспекте представлены композиции, содержащие один или несколько аналогов антител. В конкретных вариантах осуществления один или несколько аналогов антител выбраны из бис-Fab 1188, бис-Fab 1204, бис-Fab 1321, бис-Fab 1322, бис-Fab 1323, бис-Fab 1324, бис-Fab 1325, бис-Fab 1326, бис-Fab 1327, бис-Fab 1328, бис-Fab 1329, бис-Fab 1400 и бис-Fab 1401.
В другом аспекте представлены способы лечения злокачественных опухолей, где терапевтически эффективное количество мультиспецифического антитела, как описано выше, вводят индивиду, нуждающемуся в лечении. В конкретных вариантах осуществления первый фрагмент антитела представляет собой анти-Her2, и второй фрагмент антитела представляет собой анти-Her1. В конкретных вариантах осуществления анти-Her2 выбран из Герцептина® (трастузумаба) и 2C4 (пертузумаба). В конкретных вариантах осуществления анти-Her1 выбран из D1-5 и C3-101. В конкретных вариантах осуществления первый фрагмент антитела представляет собой анти-CD3 и второй фрагмент антитела выбран из анти-BLR1, анти-BR3, анти-CD19, анти-CD20, анти-CD22, анти-CD72, анти-CD79A, анти-CD79B, анти-CD180, анти-CR2, анти-FCER2, анти-FcRH1, анти-FcRH2, анти-FcRH5, анти-FCRL4, анти-Her2, анти-HLA-DOB и анти-NAG14. В одном из вариантов осуществления первый фрагмент антитела представляет собой анти-CD3 и второй фрагмент антитела представляет собой анти-CD19. В одном из вариантов осуществления первый фрагмент антитела представляет собой анти-CD3, и второй фрагмент антитела представляет собой анти-CD20. В одном варианте осуществления первый фрагмент антитела представляет собой анти-CD3 и второй фрагмент антитела представляет собой анти-CD22. В одном из вариантов осуществления первый фрагмент антитела представляет собой анти-CD3 и второй фрагмент антитела представляет собой анти-FcRH5. В одном из вариантов осуществления первый фрагмент антитела представляет собой анти-CD3 и второй фрагмент антитела представляет собой анти-Her2.
В другом аспекте представлены способы уничтожения или ингибирования пролиферации клеток опухолей или клеток злокачественных опухолей, включающие обработку клеток количеством мультиспецифического антитела, как описано выше, или его фармацевтически приемлемых соли или сольвата, где количество является эффективным для уничтожения или ингибирования пролиферации клеток опухолей или клеток злокачественных опухолей.
Представлены дополнительные аспекты, включающие способы лечения: аутоиммунного заболевания; или инфекционного заболевания, включающие введение индивиду, при необходимости, эффективного количества мультиспецифического антитела, как описано выше, или его фармацевтически приемлемых соли или сольвата.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
На фигуре 1 показан способ синтеза бис-Fab, как описано в примере 1. Панель 1, удаление тио-аддуктов посредством восстановления и окисления; Панель 2, реакция первого тио-Fab или шарнир-cys-Fab с бис-малеимидо-кросслинкером; Панель 3, выделение мономерных молекул, содержащих кросслинкер, эксклюзионной хроматографией (SEC), вставная панель; Панель 4, реакция мономерных связанных с кросслинкером молекул со вторым тио-Fab или шарнир-cys-Fab, на верхней вставной панели показаны результаты масс-спектрометрии и выделение продукта бис-Fab 100 кДа, на нижней вставной панели показано выделение димерного бис-Fab посредством SEC; Панель 5, схематическое изображение конечного продукта бис-Fab, анализ SDS-PAGE двух различных бис-Fab, αVEGF/αHer2 (1) и αVEGF/αVEGF (2), в невосстанавливающих и восстанавливающих (+DTT) условиях.
На фигуре 2 показана чистота и конкретные биологические свойства конкретных бис-Fab, как описано в примере 2. (A) слева, схема конкретных бис-Fab и таблица с указанием идентификационных номеров бис-Fab и источника каждого тио-Fab; справа, анализ невосстанавливающим SDS-PAGE бис-Fab, перечисленных в таблице; (B) верхняя панель, ингибирование стимулированного TGFα фосфорилирования EGFR в клетках NR-gD-EGFR посредством конкретных бис-Fab, содержащих Fab, полученные из анти-EGFR антител; нижняя панель, ингибирование индуцированного херегулином фосфорилирования Her3 в клетках MCF7 посредством конкретных бис-Fab, содержащих Fab, полученные из анти-Her2 антитела; (C) сравнение указанных молекул бис-Fab и Fab при росте клеток MDA-175; (D) сравнение указанных молекул бис-Fab, Fab и антитела при росте клеток NR6-EGFR; (E) сравнение пертузумаба и бис-Fab 1204 при росте клеток MDA-175; (F) сравнение трастузумаба, трастузумаб-Fab и бис-Fab 1188 при росте клеток BT474.
На фигуре 3 показаны получение и характеризация структурных вариантов происходящих из трастузумаба бис-Fab, как описано в примере 3. (A) Схематическое представление четырех происходящих из трастузумаба Fab, показывающее точки тио-присоединения (верхняя часть), и таблица с указанием уникального идентификатора для каждого бис-Fab и источника каждого тио-Fab (нижняя часть); (B) невосстанавливающий SDS-PAGE бис-Fab; (C) эффект бис-Fab при различных концентрациях на рост клеток BT474; (D) эффект бис-Fab 1325 (столбцы со штриховкой с наклоном вверх) в сравнении с исходным антителом Герцептином® (трастузумабом) (незакрашенные столбцы) на рост клеток BT474 с течением времени. Столбцы со штриховкой с наклоном вниз, без обработки.
На фигуре 4 показан анализ гель-фильтрации указанных бис-Fab, как описано в примере 3. Указаны относительное время удержания (горизонтальная ось) (RT) и гидродинамический радиус (Rh).
На фигуре 5 показаны результаты анализа пути передачи сигнала для Her2 бис-Fab и Герцептина® (трастузумаба) в клетках BT474, как описано в примере 3. (A) Анализ ELISA фосфорилирования AKT в ответ на обработку Герцептином® (трастузумабом), агонистом бис-Fab 1325, антагонистом бис-Fab 1329 или gD; (B) Анализ Вестерн-блоттингом состояния фосфорилирования конкретных ферментов (HER3, AKT и MAPK) пути передачи сигнала Her в клетках BT474, обработанных Герцептином® (трастузумабом), агонистом бис-Fab 1325, антагонистом бис-Fab 1329 или gD (pHER3, pAKT, pMAPK: фосфо-специфические антитела; HER3, AKT, MAPK: не-фосфо-специфические антитела; тубулин: контроль); (C) Таблица фосфорилированных пептидов, полученных при расщеплении Her2 трипсином. Интересующие фосфорилированные остатки в каждом пептиде обозначены малыми капительными жирными курсивными буквами в последовательности пептида. В таблице представлен также анализ масс-спектрометрии общего фосфорилирования участков фосфопептидов в Her2 без обработки (исходное), после обработки Герцептином® (трастузумабом), обработки агонистом бис-Fab 1325 (бис-Fab) или обработки 10 нМ херегулином, как количественно оценивали по абсолютной количественной оценке (AQUA) или по количественной оценке без метки. Данные представляют среднее из трех независимых биологических и технических повторных определений и включают стандартное отклонение (SD); (D) Перечисление в таблице синтетических пептидов, содержащих тяжелые атомы, использованных для AQUA (AQUA пептиды); «+13C»: количество тяжелых атомов углерода в AQUA пептиде; «+15N»: количество тяжелых атомов азота в AQUA пептиде; «дополнительная масса»: общее увеличение массы AQUA пептида по сравнению с массой природного пептида; «тяжелый моноизотопный MH+»: общая масса тяжелого пептида в однозарядном состоянии; остатки в AQUA пептиде, содержащие тяжелые атомы, обозначены большими капительными жирными курсивными подчеркнутыми буквами; участки фосфорилирования в AQUA пептиде обозначены малыми капительными жирными курсивными буквами; (E) Попарное сравнение трех групп обработки бис-Fab 1325 (BF агонист, верхний график), трастузумаб (Herc, средний график) и херегулин (Hrg, нижний график), каждая в сравнении с отсутствием обработки. Участки фосфорилирования указаны по горизонтальной оси нижнего графика; различия в среднем проценте фосфорилирования указаны по вертикальной оси каждого графика.
На фигурах 6A и 6B показан эффект увеличивающихся концентраций указанных бис-Fab на высвобождение гистамина из клеток RBL, экспрессирующих как FcεRIα, так и FcγRIIb, как измерено посредством ELISA, как описано в примере 4.
На фигуре 7 показан синтез модифицированного кросслинкера, BMata (A) и общая схема синтеза пегилированного бис-Fab (B), как описано в примере 5.
На фигуре 8 показан анализ SDS-PAGE (A) и анализ гель-фильтрацией S-200 (B) бис-Fab C3-101V110C/HercV110C, модифицированного для содержания PEG различных размеров или ABP, как описано в примере 5.
На фигуре 9 показаны фармакокинетические анализы бис-Fab C3-101V110C/HercV110C, немодифицированного (“голого”) или модифицированного для содержания PEG различных размеров или ABP, после введения мышам (A) или “голым” крысам (B), как описано в примере 5.
На фигуре 10 показан анализ SDS-PAGE очищенного 20K PEG-бис-Fab 2C4V110C/D1-5V110C (A) и анализ ингибирования роста клеток с использованием клеток Calu3 (B), как описано в примере 5.
На фигуре 11 показан фармакокинетический эксперимент для 20K PEG-2C4V110C/D1-5V110C бис-Fab (дитиоFab) у мышей SCID Beige, как описано в примере 5. (A) График концентрации в сыворотке в зависимости от времени; (B) График концентрации в сыворотке/дозу в зависимости от времени.
На фигуре 12 показан эффект 20K PEG-2C4V110C/D1-5V110C бис-Fab и каждого из исходных антител, 2C4 и D1-5, на рост клеток опухоли на модели ксенотрансплантата Calu3 у мышей, как описано в примере 5.
На фигуре 13 показан эффект 20K PEG-2C4V110C/D1-5V110C бис-Fab и каждого из исходных антител, 2C4 и D1-5, на рост клеток опухоли на модели ксенотрансплантата Calu3 у мышей, анализированный как время, затрачиваемое опухолями на удвоение размера (2xVo), как описано в примере 5. (A) Анализ Каплана-Мейера; (B) однофакторный анализ.
На фигуре 14 показан эффект 20K PEG-2C4V110C/D1-5V110C бис-Fab и каждого из исходных антител, 2C4 и D1-5, на рост клеток опухоли на модели ксенотрансплантата Calu3 у мышей, анализированный как время, затрачиваемое опухолями на достижение объема 1500 мм3, как описано в примере 5. (A) Анализ Каплана-Мейера; (B) однофакторный анализ.
ПОДРОБНОЕ ОПИСАНИЕ КОНКРЕТНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
В настоящее время сделана подробная ссылка на конкретные варианты осуществления изобретения, примеры которых проиллюстрированы в сопутствующих структурах и формулах. В то время как изобретение описано в отношении перечисленных вариантов осуществления, понятно, что они не предназначены для ограничения изобретения этими вариантами осуществления. Напротив, изобретение предназначено, чтобы включать все альтернативы, модификации и эквиваленты, которые могут быть включены в объем настоящего изобретения, как определено пунктами прилагаемой формулы изобретения.
Специалисту в данной области известно множество способов и материалов, подобных или эквивалентных описанным в настоящем документе, которые можно использовать в практике настоящего изобретения. Настоящее изобретение никаким образом не является ограниченным описанными способами и материалами.
Если не определено иначе, технические и научные термины, применяемые в настоящем документе, обладают таким же значением, какое является общепринятым для специалиста в области, к которой относится настоящее изобретение. В Singleton et al., Dictionary of Microbiology and Molecular Biology 2nd ed., J. Wiley & Sons (New York, N.Y. 1994); March, Advanced Organic Chemistry Reactions, Mechanisms and Structure 4th ed., John Wiley & Sons (New York, N.Y. 1992); и Janeway, C, Travers, P., Walport, M., Shlomchik (2001) Immunobiology, 5th Ed., Garland Publishing, New York для специалиста в данной области предоставлено общее указание на множество терминов, используемых в настоящей заявке.
КОНКРЕТНЫЕ ОПРЕДЕЛЕНИЯ
Для целей интерпретации настоящего описания используют следующие определения и по возможности, термины, используемые в единственном числе, включают также множественное число и наоборот. В случае, когда какое-либо определение, указанное ниже, противоречит какому-либо документу, содержание которого приведено в настоящем документе в качестве ссылки, определение, указанное ниже, имеет преимущество.
При использовании торговых наименований в настоящем документе, авторы настоящего изобретения подразумевают независимое включение состава продукта под торговым наименованием, аналога патентованного лекарственного средства и активного фармацевтического ингредиента(ингредиентов) продукта под торговым наименованием.
Термин «антитело» в настоящем документе используют в самом широком смысле, и он относится к любой молекуле иммуноглобулина (Ig), содержащей две тяжелые цепи и две легкие цепи, и любому ее фрагменту, мутанту, варианту или производному, пока они обладают желательной биологической активностью, (например, эпитопсвязывающей активностью). См., например, Miller et al. Jour, of Immunology 170:4854-4861(2003). Антитела включают, в качестве неограничивающих примеров, моноклональные антитела, поликлональные антитела, мультиспецифические антитела, аналоги антител и фрагменты антител. Антитела могут быть антителами мыши, человечка, гуманизированными антителами, химерными антителами или антителами, полученными из других видов.
Остатки антител в настоящем документе пронумерованы в соответствии с системой нумерации Kabat и с системой нумерации EU. Систему нумерации Kabat, как правило, используют по отношению к остатку в вариабельном домене (приблизительно остатки 1-107 легкой цепи и остатки 1-113 тяжелой цепи) (например, Kabat et al., Sequences of Immunological Interest. 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)). «Систему нумерации EU» или «индекс EU», как правило, используют по отношению к остатку в константной области тяжелой цепи иммуноглобулина (например, индекс EU, опубликованный в Kabat et al., выше). «Индекс EU, как по Kabat» относится к нумерации остатков EU антитела IgG1 человека. Если в настоящем документе не указано иначе, ссылки на номера остатков в вариабельных доменах антител обозначают нумерацию остатков по системе нумерации Kabat. Если в настоящем документе не указано иначе, ссылки на номера остатков в константных доменах антител обозначают нумерацию остатков по системе нумерации EU.
Термин «мультиспецифическое антитело» использован в настоящем документе в самом широком смысле и конкретно включает антитело, обладающее полиэпитопной специфичностью. Мультиспецифические антитела включают, но без ограничения, антитело, содержащее вариабельный домен тяжелой цепи (VH) и вариабельный домен легкой цепи (VL), где звено VHVL обладает полиэпитопной специфичностью, антитела, обладающие двумя или более доменами VL и VH, где каждое звено VHVL связывается с различным эпитопом, антитела, обладающие двумя или несколькими отдельными вариабельными доменами, где каждый отдельный вариабельный домен связывается с различным эпитопом, полноразмерные антитела и антитела, содержащие один или несколько фрагментов антител, так же как антитела, содержащие фрагменты антител, связанные ковалентно или нековалентно. В одном из вариантов осуществления мультиспецифическое антитело представляет собой антитело IgG, связывающееся с каждым эпитопом с аффинностью 5 мкМ-0,001 пМ, 3 мкМ-0,001 пМ, 1 мкМ-0,001 пМ, 0,5 мкМ-0,001 пМ или 0,1 мкМ-0,001 пМ.
Термин «полиэпитопная специфичность» относится к способности мультиспецифического антитела специфически связываться с двумя или более различными эпитопами на одной и той же мишени или на различных мишенях.
Термины «моноспецифический» и «моноспецифичность» относятся к способности антитела связывать только один эпитоп и конкретно включают молекулу, специфически связывающуюся с молекулой-мишенью.
Термин «аналог антитела» использован в настоящем документе в самом широком смысле и конкретно включает молекулу, специфически связывающуюся с молекулой-мишенью с моноспецифичностью и отличающуюся по структуре от нативного антитела. Аналоги антител могут содержать один или несколько фрагментов антител из нативного антитела. Аналоги антител включают, но без ограничения, аналог антитела, содержащий вариабельный домен (VH) тяжелой цепи и вариабельный домен (VL) легкой цепи, где звено VHVL является моноспецифическим, аналоги антител, обладающие двумя или более доменами VL и VH, где каждое звено VHVL является моноспецифическим для одного и того же эпитопа, аналоги антител, обладающие двумя или более одиночными вариабельными доменами, где каждый одиночный вариабельный домен связывается с тем же самым эпитопом, аналоги антител, содержащие один или несколько фрагментов антител, аналоги антител, содержащие фрагменты антител, связанные ковалентно или нековалентно, и аналоги антител, где звенья VHVL, одиночные вариабельные домены, и/или фрагменты антител находятся в конфигурации, отличной от конфигурации нативных антител.
«Фрагменты антител» содержат часть интактного антитела, как правило, антигенсвязывающую область или вариабельную область интактного антитела. Фрагменты антител включают, в качестве неограничивающих примеров, Fab, Fab', F(ab')2, Fv, диатела (Db); тандемные диатела (taDb), линейные антитела (см. Патент США No. 5641870, Пример 2; Zapata et al., Protein Eng. 8(10): 1057-1062 (1995)); антитела с одним плечом, антитела с одиночным вариабельным доменом, минитела (Olafsen et al (2004) Protein Eng. Design & Sel. 17(4):315-323), одноцепочечные молекулы антител, фрагменты, полученные из экспрессирующей библиотеки Fab, анти-идиотипические (анти-Id) антитела, CDR (определяющую комплементарность область) и эпитопсвязывающие фрагменты.
Термин «Fab» относится к фрагменту антитела, состоящему из полной L цепи (VL и CL) вместе с доменом вариабельной области H цепи (VH), и первым константным доменом тяжелой цепи (CH1)- Расщепление папаином интактного антитела можно использовать для получения двух Fab фрагментов, каждый из которых содержит одиночный антигенсвязывающий участок. Как правило, фрагмент L цепи и H цепи Fab, полученного расщеплением папаином, связаны межцепьевой дисульфидной связью.
Термин «Fc» относится к фрагменту антитела, содержащему карбокси-концевые части обеих H цепей (CH2 и CH3) и часть шарнирной области, удерживаемые вместе дисульфидными связями. Эффекторные функции антител определяются последовательностями в Fc-области; эту область также частично распознают Fc рецепторы (FcR), обнаруженные на конкретных типах клеток. Один Fc фрагмент можно получить расщеплением папаином интактного антитела.
Термин «F(ab')2» относится к фрагменту антитела, полученному расщеплением пепсином интактного антитела. F(ab')2 фрагменты содержат два Fab фрагмента и часть шарнирной области, удерживаемые вместе дисульфидными связями. F(ab')2 фрагменты обладают двухвалентной антигенсвязывающей активностью и способны к перекрестному связыванию антигена.
Термин Fab' относится к фрагменту антитела, являющемуся продуктом восстановления F(ab')2 фрагмента. Fab' фрагменты отличаются от Fab фрагментов наличием нескольких дополнительных остатков на карбокси-конце CH1 домена, включая один или несколько остатков цистеина из шарнирной области антитела. Fab'-SH в настоящем документе является обозначением для Fab', в котором остаток(остатки) цистеина константных доменов несут свободную тиоловую группу.
Термин «шарнирная область» относится к части антитела, простирающейся от Glu216 до Pro230 IgG1 человека (Burton, Molec. Immunol.22: 161-206 (1985)). Шарнирные области других изотипов IgG можно выравнивать с последовательностью IgGl посредством помещения первого и последнего остатков цистеина, формирующих S-S связи между тяжелыми цепями, в одинаковые положения.
Термин «Fv» относится к фрагменту антитела, состоящему из димера вариабельной области одной тяжелой цепи и вариабельной области одной легкой цепи в тесной, нековалентной связи. Из сворачивания этих двух доменов происходят шесть гипервариабельных петель (по 3 петли из каждой из H и L цепей), предоставляющие аминокислотные остатки для связывания антигена и придающие антигенсвязывающую специфичность антителу. Однако, даже один вариабельный домен (или половина Fv, содержащая только три CDR, специфические для антигена) обладает способностью распознавать и связывать антиген, хотя часто с более низкой аффинностью, чем целый связывающий участок.
Термин «одноцепочечные Fv», обозначаемые также «sFv» или «scFv», относятся к фрагментам антител, содержащим домены антитела VH и VL, соединенные в одной полипептидной цепи. Как правило, полипептид scFv дополнительно содержит полипептидный линкер между VH и VL доменами, позволяющий scFv формировать желательную структуру для связывания антигена. Обзор scFv смотри в Pluckthun in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994); Malmborg et al., J. Immunol. Methods 183:7-13, 1995.
Термин «диатела» относится к малым фрагментам антител, полученным конструированием scFv фрагментов с короткими линкерами (как правило, приблизительно 5-10 остатков) между VH и VL доменами, так что достигают межцепьевого, но не внутрицепьевого спаривания V доменов, что приводит к двухвалентному фрагменту, т.е., фрагменту, обладающему двумя антигенсвязывающими участками. Биспецифические диатела представляют собой гетеродимеры из двух «кроссоверных» sFv фрагментов, в которых домены VH и VL из двух антител присутствуют на различных полипептидных цепях. Иллюстративные диатела описаны, например, в EP 404097; WO 93/11161; и Hollinger et al., Proc. Natl. Acad. Sci. USA 90:6444-6448 (1993).
Термин «антитело с одним плечом» относится к антителу, содержащему (1) вариабельный домен, соединенный пептидной связью с полипептидом, содержащим CH2 домен, CH3 домен или CH2-CH3 домен и (2) второй CH2, CH3 или CH2-CH3 домен, лишенный вариабельного домена. Антитела с одним плечом могут содержать 3 полипептида (1) первый полипептид, содержащий вариабельный домен (например, VH), CH1, CH2 и CH3, (2) второй полипептид, содержащий вариабельный домен (например, VL) и CL домен, и (3) третий полипептид, содержащий CH2 и CH3 домен. Антитела с одним плечом могут обладать частичной шарнирной областью, содержащей два остатка цистеина, формирующие дисульфидные связи, связывающие две константных области тяжелых цепей. Как правило вариабельные домены антитела с одним плечом формируют антигенсвязывающую область. В конкретных случаях, вариабельные домены антитела с одним плечом представляют собой одиночные вариабельные домены, где каждый одиночный вариабельный домен представляет собой антигенсвязывающую область.
Термин «однодоменные антитела» (sdAb) или «антитела с одним вариабельным доменом (SVD)» относится к антителам, в которых одиночный вариабельный домен (VH или VL) обеспечивает связывание антигена. Иными словами, одиночный вариабельный домен не нуждается во взаимодействии с другим вариабельным доменом для распознавания и связывания антигена-мишени. Примеры однодоменных антител включают антитела, полученные из верблюжьих (лам и верблюдов) и хрящевых рыб (например, акул-нянек) и антитела, полученные рекомбинантными способами из антител человека и мыши (Nature (1989) 341:544-546; Dev Comp Immunol (2006) 30:43-56; Trend Biochem Sci (2001) 26:230-235; Trends Biotechnol (2003):21:484-490; WO 2005/035572; WO 03/035694; Febs Lett (1994) 339:285-290; WO00/29004; WO 02/051870).
Термин «линейные антитела» относится к антителам, описанным в Zapata et al., Protein Eng. 8(10): 1057-1062 (1995). Кратко, эти антитела содержат пару тандемных Fd фрагментов (VH-CH1-VH-CH1), которые вместе с полипептидами комплементарной легкой цепи формируют пару антигенсвязывающих областей. Линейные антитела могут быть биспецифическими или моноспецифическими.
Термин «моноклональные антитело» относится к антителу, полученному из популяции по существу однородных антител, т.е., отдельные антитела, составляющие популяцию, являются идентичными за исключением возможных встречающихся в природе мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела являются высоко специфичными, являясь направленными против одного антигенного участка. Более того, в отличие от препаратов поликлональных антител, включающих различные антитела, нацеленные против различных детерминант (эпитопов), каждое моноклональное антитело нацелено против отдельной детерминанты антигена. В дополнение к их специфичности, моноклональные антитела являются преимущественными в том смысле, что их можно синтезировать без контаминации другими антителами. Определение «моноклональные» указывает на характер антитела, как полученного из по существу гомогенной популяции антител, и его не следует истолковывать как требующее получения антитела каким-либо конкретным способом. Например, моноклональные антитела для использования в соответствии с настоящим изобретением можно получать способом гибридомы, впервые описанным Kohler et al. (1975) Nature 256:495, или их можно получать способами рекомбинантной ДНК (см., например: US 4816567; US 5807715). Моноклональные антитела можно выделять также из фаговых библиотек антител с использованием способов, описанных, например, в Clackson et al. (1991) Nature, 352:624-628; Marks et al. (1991) J. Mol. Biol, 222:581-597.
«Интактное антитело» относится к антителу, содержащему домены VL и VH, так же как константный домен (CL) легкой цепи и константные домены тяжелой цепи CH1, CH2 и CH3. Константные домены могут представлять собой константные домены с нативной последовательностью (например, константные домены с природной последовательностью человека) или вариант их аминокислотной последовательности. Интактное антитело может обладать одной или несколькими «эффекторными функциями», которые относятся к тем видам биологической активности, которые можно приписать константной области Fc (нативной последовательности Fc-области или варианту аминокислотной последовательности Fc-области) антитела. Примеры эффекторных функций антител включают связывание C1q; комплементзависимую цитотоксичность; связывание Fc-рецептора; антителозависимую опосредуемую клетками цитотоксичность (ADCC); фагоцитоз; и понижающую регуляцию рецепторов поверхности клеток, таких как B-клеточный рецептор.
В зависимости от аминокислотных последовательностей константных доменов их тяжелых цепей, интактные антитела можно отнести к различным «классам». Существует пять главных классов интактных иммуноглобулинов антител: IgA, IgD, IgE, IgG и IgM, и некоторые из них можно далее разделить на «подклассы» (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA и IgA2. Константные домены тяжелых цепей, соответствующие различным классам иммуноглобулинов, называют α, δ, ε, γ и μ, соответственно. Субъединичные структуры и трехмерные конфигурации различных классов иммуноглобулинов хорошо известны. Формы Ig включают модификации шарнира или бесшарнирные формы (Roux et al (1998) J. Immunol. 161:4083-4090; Lund et al. (2000) Eur. J. Biochem. 267:7246-7256; US 2005/0048572; US 2004/0229310).
«Рецептор ErbB» представляет собой рецепторную протеинтирозинкиназу, принадлежащую к семейству рецепторов ErbB, члены которого являются важными медиаторами роста, дифференцировки и выживаемости клеток. Семейство рецепторов ErbB включает четыре отдельных члена, включая рецептор эпидермального фактора роста (EGFR, ErbB1, HER1), HER2 (ErbB2 или p185neu), HER3 (ErbB3) и HER4 (ErbB4 или tyro2). Панель анти-ErbB2 антител охарактеризована с использованием линии клеток опухоли молочной железы человека SKBR3 (Hudziak et al (1989) Mol. Cell. Biol. 9(3): 1165-1172. Максимальное ингибирование получено с антителом, называемым 4D5, ингибирующим пролиферацию клеток на 56%. Другие антитела в панели в этом анализе уменьшали пролиферацию клеток в меньшей степени. Кроме того, обнаружено, что антитело 4D5 сенсибилизирует линии клеток опухоли молочной железы со сверхэкспрессией ErbB2 к цитотоксическим эффектам TNF-α (Патент США No. 5677171). Анти-ErbB2 антитела, обсуждаемые в Hudziak et al., дополнительно охарактеризованы в Fendly et al (1990) Cancer Research 50: 1550-1558; Kotts et al. (1990) In Vitro 26(3):59A; Sarup et al. (1991) Growth Regulation 1:72-82; Shepard et al. J. (1991) Clin. Immunol. 11(3): 117-127; Kumar et al. (1991) Mol. Cell. Biol. 11(2):979-986; Lewis et al. (1993) Cancer Immunol. Immunother. 37:255-263; Pietras et al. (1994) Oncogene 9: 1829-1838; Vitetta et al. (1994) Cancer Research 54:5301-5309; Sliwkowski et al. (1994) J. Biol. Chem. 269(20): 14661-14665; Scott et al. (1991) J. Biol. Chem. 266: 14300-5; D'souza et al. Proc. Natl. Acad. Sci. (1994) 91:7202-7206; Lewis et al. (1996) Cancer Research 56: 1457-1465; и Schaefer et al. (1997) Oncogene 15: 1385-1394.
Рецептор ErbB, как правило, содержит внеклеточный домен, который может связывать лиганд ErbB; липофильный трансмембранный домен; консервативный внутриклеточный домен тирозинкиназы; и карбокси-концевой сигнальный домен, несущий несколько остатков тирозина, которые могут быть фосфорилированы. Рецептор ErbB может представлять собой рецептор ErbB с «нативной последовательностью» или «вариант его аминокислотной последовательности». Известно несколько членов семейства рецепторов ErbB, и они включают EGFR (ErbB1, HER1), ErbB2 (HER2), ErbB3 (HER3) и ErbB4 (HER4).
Термины «ErbB1», «рецептор эпидермального фактора роста», «EGFR» и «HER1» используют в настоящем документе взаимозаменяемо, и они относятся к EGFR, как описано, например, в Carpenter et al. (1987) Ann. Rev. Biochem., 56:881-914, включая их природные мутантные формы (например, делеционный мутант EGFR, как в Humphrey et al. (1990) Proc. Nat. Acad. Sci. (USA) 87:4207-4211). Термин erbB1 относится к гену, кодирующему белковый продукт EGFR. Антитела против HER1 описаны, например, в Murthy et al. (1987) Arch. Biochem. Biophys., 252:549-560 и в WO 95/25167.
Термины «ERRP», «родственный EGF-рецептору белок», «родственный EGFR белок» и «родственный рецептору эпидермального фактора роста белок» используют в настоящем документе взаимозаменяемо, и они относятся к ERRP, как описано, например, в US 6399743 и в публикации США No. 2003/0096373.
Термины «ErbB2» и «HER2» используют в настоящем документе взаимозаменяемо, и они относятся к белку HER2 человека, описанному, например, в Semba et al. (1985) Proc. Nat. Acad. Sci. (USA) 82:6497-6501 и Yamamoto et al. (1986) Nature, 319:230-234 (номер доступа в Genebank X03363). Термин «erbB2» относится к гену, кодирующему ErbB2 человека, и «neu» относится к гену, кодирующему p185neu крысы.
Термины «ErbB3» и «HER3» используют в настоящем документе взаимозаменяемо, и они относятся к полипептиду рецептора, как описано, например, в патентах США No. 5183884 и 5480968, так же как в Kraus et al. (1989) Proc. Nat. Acad. Sci. (USA) 86:9193-9197. Антитела против ErbB3 известны в данной области и описаны, например, в патентах США No. 5183884, 5480968 и в WO 97/35885.
Термины «ErbB4» и «HER4» используют в настоящем документе взаимозаменяемо, и они относятся к полипептиду рецептора, как описано, например, в Патентной заявке EP No 599274; Plowman et al. (1993) Proc. Natl. Acad. Sci. USA 90: 1746-1750; и Plowman et al. (1993) Nature 366:473-475, включая их изоформы, например, как описано в WO 99/19488. Антитела против HER4 описаны, например, в WO 02/18444.
Антитела против рецепторов ErbB являются коммерчески доступными из ряда источников, включая, например, Santa Cruz Biotechnology, Inc., California, USA.
Термин «вариант аминокислотной последовательности» относится к полипептидам, обладающим аминокислотными последовательностями, отличающимися до некоторой степени от полипептида с нативной последовательностью. Обычно варианты аминокислотной последовательности обладают по меньшей мере приблизительно 70% идентичностью последовательности по меньшей мере с одним связывающим рецептор доменом нативного лиганда ErbB или по меньшей мере с одним связывающим лиганд доменом нативного рецептора ErbB или они по меньшей мере приблизительно на 80% или по меньшей мере приблизительно на 90% гомологичны по последовательности таким связывающим рецептор или лиганд доменам. Варианты аминокислотной последовательности имеют замены, делеции и/или вставки в конкретных положениях внутри аминокислотной последовательности нативной аминокислотной последовательности. Аминокислоты обозначают общепринятыми наименованиями, в однобуквенном и трехбуквенном кодах.
«Идентичность последовательности» определяют как процент остатков в варианте аминокислотной последовательности, являющихся идентичными после выравнивания последовательностей и введения пропусков, если необходимо, для достижения максимальной процентной идентичности последовательностей. Способы и компьютерные программы для выравнивания хорошо известны в данной области. Одной из таких компьютерных программ является «Align 2», авторство которой принадлежит Genentech, Inc. и подано с пользовательской документацией в Бюро регистрации авторских прав США, Washington, DC 20559, 10 декабря 1991 г.
«Антителозависимая опосредуемая клетками цитотоксичность» и «ADCC» относятся к опосредованной клетками реакции, при которой неспецифические цитотоксические клетки, экспрессирующие Fc-рецепторы (FcR) (например, клетки естественные киллеры (NK), нейтрофилы, и макрофаги), распознают связанное антитело на клетке-мишени и затем вызывают лизис клетки-мишени. Первичные клетки, опосредующие ADCC, NK клетки, экспрессируют только FcγRIII, в то время как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Экспрессия FcR на гематопоэтических клетках обобщена в таблице 3 на странице 464 в Ravetch and Kinet, (1991) «Annu. Rev. Immunol.» 9:457-92. Для оценки активности ADCC интересующей молекулы можно проводить анализ ADCC in vitro, такой как описан в патентах США No. 5500362 и 5821337. Подходящие эффекторные клетки для таких анализов включают мононуклеарные клетки периферической крови (PBMC) и клетки естественные киллеры (NK). Альтернативно или дополнительно, активность ADCC интересующей молекулы можно оценивать in vivo, например, в модели на животных, такой, как описана в Clynes et al., Proc. Natl. Acad. Sci. USA 95:652-656 (1998).
«Эффекторные клетки человека» представляют собой лейкоциты, которые экспрессируют один или несколько рецепторов константной области (FcR) и выполняют эффекторные функции. Как правило, эффекторные клетки экспрессируют по меньшей мере FcγRIII и выполняют эффекторную функцию ADCC. Примеры лейкоцитов человека, которые опосредуют ADCC, включают мононуклеарные клетки периферической крови (PBMC), клетки естественные киллеры (NK), моноциты, цитотоксические T-клетки и нейтрофилы. Эффекторные клетки можно выделять из их природного источника, например, из крови или PBMC.
Термины «Fc-рецептор» или «FcR» используют для описания рецептора, который связывается с константной областью Fc антитела. Как правило FcR представляет собой FcR, который связывается с антителом IgG (гамма-рецептор) и включает рецепторы подклассов FcγRI, FcγRII, и FcγRIII, включая аллельные варианты и формы альтернативного сплайсинга этих рецепторов. Рецепторы FcγRII включают FcγRIIA («активирующий рецептор») и FcγRIIB («ингибирующий рецептор»), обладающие сходными аминокислотными последовательностями, которые отличаются, в первую очередь, в их цитоплазматических доменах. Активирующий рецептор FcγRIIA содержит иммунорецепторный активирующий мотив, основанный на тирозине (ITAM) в его цитоплазматическом домене. Ингибирующий рецептор FcγRIIB содержит иммунорецепторный ингибирующий мотив, основанный на тирозине (ITIM), в его цитоплазматическом домене. (См. обзор M. в Daëron, «Annu. Rev. Immunol.» 15:203-234 (1997)). Обзор FcR приведен в Ravetch and Kinet, «Annu. Rev. Immunol», 9:457-92 (1991); Capel et al (1994) Immunomethods 4:25-34; и de Haas et al (1995) J. Lab. Clin. Med. 126:330-41. Другие FcR включены в термин «FcR» в настоящем документе. Термин включает также неонатальный рецептор, FcRn, который является ответственным за перенос материнских IgG к плоду (Guyer et al. (1976) J. Immunol, 117:587 и Kim et al (1994) J. Immunol. 24:249).
«Комплементзависимая цитотоксичность» или «CDC» относится к способности молекулы лизировать мишень в присутствии комплемента. Путь активации комплемента запускается связыванием первого компонента системы комплемента (C1q) с молекулой (например, антителом) в комплексе с родственными ей антигеном. Для оценки активации комплемента можно проводить анализ CDC, например, как описано в Gazzano-Santoro et al J. Immunol. Methods, 202: 163 (1996).
Термин «нативное антитело» относится к природной основной 4-цепочечной единице антитела, которая представляет собой гетеротетрамерный гликопротеин, состоящий из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей (антитело IgM состоит из 5 основных гетеротетрамерных единиц вместе с дополнительным полипептидом, называемым J-цепью, и таким образом содержит 10 антигенсвязывающих участков, в то время как секретируемые IgA антитела могут полимеризоваться с образованием поливалентных комплексов, содержащих 2-5 основных 4-цепочечных единиц вместе с J-цепью). В случае IgG, 4-цепочечная единица, как правило, составляет приблизительно 150000 дальтон. Каждая L цепь связана с H цепью одной ковалентной дисульфидной связью, в то время как две H цепи связаны друг с другом одной или несколькими дисульфидными связями в зависимости от изотипа H цепи. Каждая H и L цепь обладает также равномерно расположенными внутрицепьевыми дисульфидными мостиками. Каждая H цепь обладает, на N-конце, вариабельным доменом (VH) с следующими за ним тремя константными доменами (CH) для каждой из α и γ цепей, и четырьмя (CH) доменами для μ и ε изотипов. Каждая L цепь обладает, на N-конце, вариабельным доменом (VL) со следующим за ним константным доменом (CL) на другом конце. VL расположен параллельно VH, и CL расположен параллельно первому константному домену тяжелой цепи (CH1). Полагают, что конкретные аминокислотные остатки формируют поверхность контакта между вариабельными доменами легкой цепи и тяжелой цепи. Объединение VH и VL вместе формирует один антигенсвязывающий участок. Структуру и свойства различных классов антител, см., например, в Basic and Clinical Immunology, 8th edition, Daniel P. Stites, Abba I. Terr and Tristram G. Parslow (eds.), Appleton & Lange, Norwalk, CT, 1994, страница 71 и раздел 6. L цепь из любых видов позвоночных можно отнести к одному из двух четко различимых типов, называемых каппа и лямбда, на основании аминокислотных последовательностей их константных доменов.
Термин «вариабельный» относится к тому факту, что конкретные части вариабельных доменов сильно отличаются по последовательности среди антител и используются в связывании и специфичности каждого конкретного антитело для его конкретного антигена. Однако вариабельность не является равномерно распределенной на протяжении вариабельных доменов антител. Она сконцентрирована в трех участках, называемых гипервариабельными областями, в вариабельных доменах как на легкой цепи, так и на тяжелой цепи. Наиболее высоко консервативные части вариабельных доменов называют каркасными областями (FR). Каждый из вариабельных доменов нативных тяжелых и легких цепей содержит четыре FR, преимущественно принимающие конфигурацию β-листа, соединенные тремя гипервариабельными областями, формирующими петли, соединяющие структуры β-листа, и в некоторых случаях формирующие их часть. Гипервариабельные области на каждой цепи удерживаются вместе в непосредственной близости посредством FR и, вместе с гипервариабельными областями из другой цепи, участвуют в формировании антигенсвязывающего участка антител (см. Kabat et al (1991) Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD). Константные домены не являются непосредственно вовлеченными в связывание антитела с антигеном, но обладают различными эффекторными функциями, такими как участие антитела в антителозависимой клеточной токсичности (ADCC).
Термин «гипервариабельная область», «HVR», или «HV» обозначает области вариабельного домена антитела, которые являются гипервариабельными по последовательности и/или формируют петли определенной структуры. Как правило, антитела содержат шесть HVR; три в VH (H1, H2, H3) и три в VL (L1, L2, L3). В нативных антителах H3 и L3 обладают наибольшим разнообразием из шести HVR, и, в частности, считают, что H3 играет уникальную роль в обеспечении тонкой специфичности антител. См., например, Xu et al. Immunity 13:37-45 (2000); Johnson and Wu in Methods in Molecular Biology 248:1-25 (Lo, ed., Human Press, Totowa, NJ, 2003). Действительно, природные антитела верблюжьих, состоящие только из тяжелой цепи, являются функциональными и стабильными в отсутствие легкой цепи. Смотри, например, Hamers-Casterman et al., Nature 363:446-448 (1993) и Sheriff et al., Nature Struct. Biol. 3:733-736 (1996).
Используют ряд определений границ гипервариабельных областей, и они включены в настоящий документ. Определяющие комплементарность области (CDR) по Kabat основаны на вариабельности последовательности и являются наиболее общеупотребительными (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)). Вместо этого, по Chothia обозначена локализация структурных петель (Chothia and Lesk J. Mol. Biol. 196:901-917 (1987)). HVR по AbM представляют собой компромисс между CDR по Kabat и структурными петлями по Chothia, и их используют в программном обеспечении для моделирования антител Oxford Molecular's AbM. «Контактные» HVR основаны на анализе доступных кристаллических структур комплексов. Остатки из каждой из этих HVR указаны ниже.
HVR могут содержать «расширенные HVR» следующим образом: 24-36 или 24-34 (L1), 46-56 или 50-56 (L2) и 89-97 или 89-96 (L3) в VL, и 26-35 (H1), 50-65 или 49-65 (H2) и 93-102, 94-102 или 95-102 (H3) в VH. Остатки вариабельного домена пронумерованы согласно Kabat et al., выше, для каждого из этих определений.
«Каркасные области» (FR) представляют собой остатки вариабельного домена, отличные от остатков CDR. Каждый вариабельный домен, как правило, имеет четыре FR, обозначенные как FR1, FR2, FR3 и FR4. Если CDR определены согласно Kabat, остатки FR легкой цепи расположены приблизительно в остатках 1-23 (LCFR1), 35-49 (LCFR2), 57-88 (LCFR3) и 98-107 (LCFR4), а остатки FR тяжелой цепи расположены приблизительно в остатках 1-30 (HCFR1), 36-49 (HCFR2), 66-94 (HCFR3) и 103-113 (HCFR4) тяжелой цепи. Если CDR содержат аминокислотные остатки из гипервариабельных петель, остатки FR легкой цепи расположены приблизительно в остатках 1-25 (LCFR1), 33-49 (LCFR2), 53-90 (LCFR3) и 97-107 (LCFR4) в легкой цепи, а остатки FR тяжелой цепи расположены приблизительно в остатках 1-25 (HCFR1), 33-52 (HCFR2), 56-95 (HCFR3) и 102-113 (HCFR4) в остатках тяжелой цепи. В некоторых случаях, когда CDR содержит как аминокислоты из CDR, как определено по Kabat, так и аминокислоты из гипервариабельной петли, остатки FR корректируют соответствующим образом. Например, когда CDRH1 включает аминокислоты H26-H35, остатки FR1 тяжелой цепи находятся в положениях 1-25, и остатки FR2 находятся в положениях 36-49.
«Консенсусная каркасная область человека» представляет собой каркасную область, представляющую наиболее часто встречающиеся аминокислотные остатки в выборке последовательностей каркасной области VL или VH иммуноглобулина человека. Как правило, выборка последовательностей VL или VH иммуноглобулина человека происходит из подгруппы последовательностей вариабельного домена. Как правило, подгруппа последовательностей представляет собой подгруппу, как по Kabat. В конкретных случаях, для VL, подгруппа представляет собой подгруппу каппа I, как по Kabat. В конкретных случаях, для VH, подгруппа представляет собой подгруппу III, как по Kabat.
«Химерные антитела» относится к антителам, в которых часть тяжелой и/или легкой цепи является идентичной или гомологичной соответствующим последовательностям в антителах, полученных из конкретного вида или принадлежащих к конкретному классу или подклассу антител, в то время как остаток цепи(цепей) является идентичным или гомологичным соответствующим последовательностям в антителах, полученных из другого вида или принадлежащих к другому классу или подклассу антител, так же как фрагменты таких антител, пока они обладают желательной биологической активностью (патент США No. 4816567; и Morrison et al., Proc. Natl. Acad. Sci. USA 81:6851-6855 (1984)). Химерные антитела включают приматизированные антитела, содержащие антигенсвязывающие последовательности вариабельного домена, полученные из не относящегося к человеку примата (например, обезьяны Старого Света, обезьяны и т.д.), и последовательности константной области человека.
«Гуманизированные» формы антител, не являющихся антителами человека (например, антител грызунов), представляют собой химерные антитела, содержащие минимальную последовательность, полученную из не относящегося к человеку антитела. Большей частью гуманизированные антитела представляют собой иммуноглобулины человека (антитело-реципиент), в которых остатки из гипервариабельной области реципиента заменены остатками из гипервариабельной области не относящихся к человеку видов (антитело-донор), таких как мышь, крыса, кролик или не относящийся к человеку примат, обладающими желаемой специфичностью, аффинностью и емкостью. В некоторых случаях, остатки каркасной области (FR) иммуноглобулина человека заменяют соответствующими не присутствующими у человека остатками. Кроме того, гуманизированные антитела могут содержать остатки, не обнаруженные в антителе-реципиенте или в антителе-доноре. Такие модификации выполняют для дальнейшего усовершенствования характеристик антитела. Как правило, гуманизированное антитело содержит в основном все из по меньшей мере одного, и как правило, двух вариабельных доменов, в которых все или в основном все гипервариабельные петли соответствуют петлям в не относящемся к человеку иммуноглобулине, и все или в основном все FR являются FR с последовательностью иммуноглобулина человека. Гуманизированное антитело, не обязательно, содержит также по меньшей мере часть константной области (Fc) иммуноглобулина, как правило, иммуноглобулина человека. Более подробно см. в Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-329 (1988); и Presta, Curr. Op. Struct. Biol. 2:593-596 (1992).
«Комплекс» или «образовавшие комплекс», как используют в настоящем документе, относится к объединению двух или более молекул, взаимодействующих друг с другом посредством связей и/или сил (например, сил Ван-дер-Ваальса, гидрофобных, гидрофильных сил), не являющихся пептидными связями. В конкретных случаях комплекс является гетеромультимерным. Следует понимать, что термины «белковый комплекс» или «полипептидный комплекс», как применяют в настоящем документе, включают комплексы, обладающие небелковой группой, конъюгированной с белком в белковом комплексе (например, включая, но без ограничения, химические молекулы, такие как токсин, кросслинкер или средство для детекции).
Термин «гетеромультимер» или «гетеромультимерный», как используют в настоящем документе, описывает два или более полипептидов, взаимодействующих друг с другом посредством непептидной, ковалентной связи (например, дисульфидной связи) и/или нековалентного взаимодействия (например, водородных связей, ионных связей, сил Ван-дер-Ваальса и гидрофобных взаимодействий), где по меньшей мере два из полипептидов имеют аминокислотные последовательности, отличающиеся друг от друга.
Антитело, «которое связывает» молекулярную мишень или интересующий антиген, представляет собой антитело, способное связывать этот антиген с достаточной аффинностью, так что антитело подходит для нацеливания на белок или клетку, или ткань, экспрессирующую антиген, и не обладает значительной перекрестной реактивностью для других белков. Такие антитела подходят, например, в качестве диагностических и/или лекарственных средств и/или исследовательских инструментов. Как правило, степень связывания антитела с «не являющимся мишенью» белком составляет менее приблизительно 10% связывания антитела с его конкретным белком-мишенью, как определено типичными способами измерения, например, анализом активированной флуоресценцией сортировки клеток (FACS) или радиоиммунопреципитацией (RIA) или ELISA.
Термин «специфическое связывание» или «специфически связывается с» или является «специфическим для» относится к связыванию антитела с молекулой-мишенью, например, конкретным полипептидом или эпитопом на конкретной полипептидной мишени, и обозначает связывание, измеримо отличное от неспецифического взаимодействия (например, неспецифическое взаимодействие может представлять собой связывание с бычьим сывороточным альбумином или казеином). Специфическое связывание можно измерять, например, посредством определения связывания молекулы-мишени по сравнению со связыванием контрольной молекулы. Например, специфическое связывание можно определять посредством конкуренции с контрольной молекулой, сходной с мишенью, например, с избытком немеченой мишени. В этом случае показывают специфическое связывание, если связывание меченой мишени с зондом конкурентно ингибируется избытком немеченой мишени. Термин «специфическое связывание» или «специфически связывается с» или является «специфическим для» конкретного полипептида или эпитопа на конкретной полипептидной мишени, как используют в настоящем документе, можно проиллюстрировать, например, молекулой, обладающей Kd для мишени по меньшей мере приблизительно 200 нМ, альтернативно по меньшей мере приблизительно 150 нМ, альтернативно по меньшей мере приблизительно 100 нМ, альтернативно по меньшей мере приблизительно 60 нМ, альтернативно по меньшей мере приблизительно 50 нМ, альтернативно по меньшей мере приблизительно 40 нМ, альтернативно по меньшей мере приблизительно 30 нМ, альтернативно по меньшей мере приблизительно 20 нМ, альтернативно по меньшей мере приблизительно 10 нМ, альтернативно по меньшей мере приблизительно 8 нМ, альтернативно по меньшей мере приблизительно 6 нМ, альтернативно по меньшей мере приблизительно 4 нМ, альтернативно по меньшей мере приблизительно 2 нМ, альтернативно по меньшей мере приблизительно 1 нМ или более. В конкретных случаях, термин «специфическое связывание» относится к связыванию, где молекула связывается с конкретным полипептидом или эпитопом на конкретном полипептиде без существенного связывания с любым другим полипептидом или полипептидным эпитопом. Молекулы-мишени включают, в качестве неограничивающих примеров, растворимые белки сыворотки и их рецепторы, такие как цитокины и рецепторы цитокинов, адгезины, факторы роста и их рецепторы, гормоны, вирусные частицы (например, RSV F белок, CMV, StaphA, вирус гриппа, вирус гепатита C), микроорганизмы (например, белки бактериальной клетки, клетки грибов), адгезины, CD белки и их рецепторы.
«Аффинность связывания» относится к силе общей суммы нековалентеных взаимодействий между одним участком связывания молекулы (например, антитела) и его партнера по связыванию (например, антигена). Если нет иных указаний, как используют в настоящем документе, «аффинность связывания» относится к истинной аффинности связывания, отражающей взаимодействие 1:1 между членами пары связывания (например, антителом и антигеном). Аффинность молекулы X для ее партнера Y можно в общем представлять ее константой диссоциации (Kd). Например, Kd может составлять приблизительно 200 нМ, 150 нМ, 100 нМ, 60 нМ, 50 нМ, 40 нМ, 30 нМ, 20 нМ, 10 нМ, 8 нМ, 6 нМ, 4 нМ, 2 нМ, 1 нМ или сильнее. Аффинность можно измерять общепринятыми способами, известными в данной области, включая способы, описанные в настоящем документе. Антитела с низкой аффинностью, как правило, связывают антиген медленно и проявляют тенденцию к быстрой диссоциации, в то время как антитела с высокой аффинностью, как правило, связывают антиген быстрее и проявляют тенденцию дольше оставаться связанными. Для измерения аффинности связывания в данной области известно множество способов.
Как используют в настоящем документе, «Kd» или «значение Kd» относится к константе диссоциции, измеренной с использованием анализов поверхностного плазмонного резонанса, например, с использованием a BIAcore(TM)-2000 или BIAcore(TM)-3000 (BIAcore, Inc., Piscataway, NJ) при 25°C с антигеном, иммобилизованным на чипах CM5 при ~10 единиц ответа (RU). Кратко, по этому способу используют биосенсорные чипы с карбоксиметилированным декстраном (CM5, BIAcore Inc.), активированные гидрохлоридом N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимидом (NHS) в соответствии с инструкциями поставщиков. Антиген разводят 10 мМ ацетатом натрия, рН 4,8, до 5 мкг/мл (~0,2 мкМ) перед инъекцией при скорости потока 5 мкл/минуту для достижения величины приблизительно 10 единиц ответа (RU) связанного белка. После инъекции антигена для блокирования непрореагировавших групп вводят 1М этаноламин. Для измерений кинетики реакции вводят инъекции двукратных серийных разведений Fab (например, 0,78 нМ-500 нМ) в PBS с 0,05% Твин-20 (PBST) при 25°С при скорости потока приблизительно 25 мкл/мин. Скорости ассоциации (kon) и скорости диссоциации (koff) вычисляют с использованием простой лангмюровской модели связывания один-к-одному (программное обеспечение BIAcore® Evaluation версии 3.2) при одновременном построении сенсограмм ассоциации и диссоциации. Равновесную константу диссоциации (Кd) вычисляют как отношение koff/kon. См., например, Chen et al., J. Mol. Biol. 293:865-881 (1999). Если скорость ассоциации превышает 106 М-1с-1 по анализу поверхностного плазмонного резонанса выше, тогда скорость ассоциации можно определять с использованием способа гашения флуоресценции, измеряющего увеличение или уменьшение интенсивности флуоресцентного излучения (возбуждение = 295 нм; излучение = 340 нм, полоса пропускания 16 нм) при 25°С для 20 нМ антитела против антигена (в Fab-форме) в PBS, рН 7,2, в присутствии возрастающих концентраций антигена, как измерено на спектрофотометре, таком как спектрометр, снабженный ограничителем потока (Aviv Instrumtnts), или на спектрофотометре SLM-Aminco серии 8000 (ThermoSpectronic), снабженном кюветой с перемешиванием.
«Свободная аминокислота цистеин» относится к остатку аминокислоты цистеина в полипептиде, например, антителе или фрагменте антитела, который имеет тиоловую функциональную группу (-SH) и не является спаренным в качестве внутримолекулярного или межмолекулярного дисульфидного мостика. В конкретных случаях, остаток свободной аминокислоты цистеина сконструирован в исходном антителе, как описано, например, в публикации патента США No. 2007/0092940 и Junutula, J. R., et al., J Immunol Methods 332(1-2):41-52 (2008).
Термин «значение реакционной способности тиола» представляет собой количественную характеристику реакционной способности свободных цистеиновых аминокислот. Значение реакционной способности тиола представляет собой процент свободной аминокислоты цистеина в сконструированном антителе с цистеиновыми заменами, вступающий в реакцию с реакционноспособным по отношению к тиолу реагентом, и преобразованный до максимального значения 1. Например, свободная аминокислота цистеин в сконструированном антителе с цистеиновыми заменами, которая вступает в реакцию со 100% выходом с реакционноспособным по отношению к тиолу реагентом, таким как биотин-малеинимидный реагент, с формированием меченного биотином антитела, имеет значение реакционной способности тиола 1,0. Другая аминокислота цистеин, введенная при конструировании в такое же или другое исходное антитело, которая вступает в реакцию с 80% выходом с реакционноспособным по отношению к тиолу реагентом, имеет значение реакционной способности тиола 0,8. Другая аминокислота цистеин, введенная при конструировании в такое же или другое исходное антитело, которая совсем не вступает в реакцию с реакционноспособным по отношению к тиолу реагентом, имеет значение реакционной способности тиола 0. Определение значения реакционной способности тиола конкретного цистеина можно проводить анализом ELISA, масс-спектроскопией, жидкостной хроматографией, радиоавтографией или другими количественными аналитическими тестами.
«Исходное антитело» представляет собой антитело, являющееся источником одного или нескольких фрагментов антител. Исходное антитело может содержать нативную последовательность или последовательность дикого типа. Исходное антитело может содержать аминокислотную последовательность, один или несколько аминокислотных остатков из которой заменены одним или несколькими остатками цистеина. Исходное антитело может обладать предсуществующими модификациями аминокислотной последовательности (такими как добавления, делеции и/или замены) по сравнению с другими нативными формами, формами дикого типа или модифицированными формами антитела. Исходное антитело может быть нацелено против представляющего интерес антигена-мишени, например, биологически важного полипептида. Исходное антитело может быть нацелено против неполипептидных антигенов (таких как опухолесвязанные гликолипидные антигены; см., например, Патент США No. 5091178). Характерные исходные антитела включают, но без ограничения, антитела, обладающие аффинностью и избирательностью для рецепторов поверхности клеток и трансмембранных рецепторов, и опухолесвязанных антигенов (TAA).
«Выделенное» антитело или полипептид представляет собой антитело или полипептид, которое идентифицировано и отделено и/или выделено из компонента его природного окружения. Загрязняющие компоненты его природного окружения представляют собой материалы, которые могут мешать, например, его диагностическим или терапевтическим применениям, и могут включать ферменты, гормоны и другие белковые или небелковые растворенные вещества. Как правило, антитело или полипептид является очищенным (1) до более чем 95% по массе антитела, как определено способом Лоури, или до более чем 99% по массе, (2) до степени, достаточной для получения по меньшей мере 15 остатков N-концевой или внутренней аминокислотной последовательности при использовании секвенатора с вращающимся стаканом, или (3) до гомогенности в SDS-PAGE в невосстанавливающих или восстанавливающих условиях с использованием окраски Кумасси синим или серебром. Выделенное антитело или полипептид включает антитело или полипептид in situ в рекомбинантных клетках, с тех пор, когда перестает присутствовать по меньшей мере один из компонентов природного окружения антитела или полипептида. Обычно, однако, выделенное антитело или полипептид получают посредством по меньшей мере одной стадии очистки.
Фразы «по существу гомогенный», «по существу гомогенная форма» и «существенная гомогенность» используют для указания того, что продукт является по существу свободным от побочных продуктов, происходящих от нежелательных комбинаций полипептидов (например, гомомультимеров). Выраженная в отношении чистоты, существенная гомогенность означает, что количество побочных продуктов не превышает 10%, 9%, 8%, 7%, 6%, 4%, 3%, 2% или 1% по массе или составляет менее 1% по массе. Как правило, побочный продукт составляет менее 5%.
«Участок расщепления эндопептидазой Lys-C», как используют в настоящем документе, представляет собой остаток лизина в аминокислотной последовательности, который можно отщепить с C-концевой стороны посредством эндопептидазы Lys-C. Эндопептидаза Lys-C расщепляет с C-концевой стороны остатка лизина.
Если нет иных указаний, термин «моноклональное антитело 4D5» обозначает антитело, обладающее антигенсвязывающими остатками антитела 4D5 мыши (ATCC CRL 10463), или полученное из него. Например, моноклональное антитело 4D5 может представлять собой моноклональные антитело 4D5 мыши или его вариант, такой как гуманизированное 4D5. Иллюстративные гуманизированные антитела 4D5 включают huMAb4D5-1, huMAb4D5-2, huMAb4D5-3, huMAb4D5-4, huMAb4D5-5, huMAb4D5-6, huMAb4D5-7 и huMAb4D5-8 (трастузумаб, ГЕРЦЕПТИН®), как в патенте США No. 5821337.
Термины «лечить» или «лечение» относятся как к терапевтическому лечению, так и к профилактическим или предупредительным мерам, где целью является предотвратить или замедлить (уменьшить) нежелательное физиологическое изменение или нарушение. Преимущественные или желательные клинические результаты включают, но без ограничения, облегчение симптомов, уменьшение степени заболевания, стабилизацию (т.е., отсутствие ухудшения) состояния заболевания, отсрочку или замедление прогрессирования заболевания, улучшение или облегчение состояния заболевания и ремиссию (частичную или полную), поддающиеся или не поддающиеся детекции. «Лечение» может также обозначать продление выживаемости (как, например, при лечении злокачественных опухолей) по сравнению с ожидаемой выживаемостью при отсутствии лечения. Нуждающиеся в лечении включают уже страдающих от состояния или нарушения, так же как склонных к состоянию или нарушению, или тех, у кого необходимо предотвратить состояние или нарушение.
Термин «терапевтически эффективное количество» относится к количеству антитела, фрагмента или производного антитела, например, мультиспецифического антитела или аналога антитела, для лечения заболевание или нарушения у индивида. В случае опухоли (например, злокачественной опухоли), эффективное количество антитела или фрагмента антитела (например, мультиспецифического антитела или аналога антитела) может уменьшать количество клеток злокачественных опухолей; уменьшать размер первичной опухоли; ингибировать (т.е. в определенной степени замедлять и, предпочтительно, останавливать) инфильтрацию злокачественных клеток в периферические органы; ингибировать (т.е. в определенной степени замедлять и, предпочтительно, останавливать) метастазирование опухолей; в определенной степени ингибировать рост опухоли; и/или в определенной степени ослаблять один или несколько симптомов, связанных с нарушением. В зависимости от степени, в которой антитело или фрагмент антитела (например, мультиспецифическое антитело или аналог антитела) может предотвращать рост существующих клеток злокачественных опухолей и/или уничтожать их, оно может быть цитостатическим и/или цитотоксическим. В случае лечения злокачественных опухолей эффективность in vivo можно, например, измерять, оценивая продолжительность выживаемости, время до прогрессирования заболевания (TTP), коэффициент ответа (RR), продолжительность ответа и/или качество жизни.
Под «уменьшать или ингибировать» понимают способность вызывать общее уменьшение на 20% или более, или на 50% или более, или на 75%, 85%, 90%>, 95% или более. Уменьшать или ингибировать может относится к симптомам нарушения, подлежащего лечению, наличию или размеру метастазов, размеру первичной опухоли, или размеру или количеству кровеносных сосудов при ангиогенных нарушениях.
Термин «биодоступность» относится к системной доступности (т.е., уровням в крови/плазме) данного количества лекарственного средства, введенного пациенту. Биодоступность представляет собой абсолютный термин, показывающий измерение как времени (скорости), так и общего количества (доли) лекарственного средства, достигающего общего кровотока, из введенной лекарственной формы.
Термины «злокачественная опухоль» и «злокачественный» обозначают или описывают физиологическое состояние у млекопитающих, которое, как правило, характеризуется нерегулируемыми ростом/пролиферацией клеток. «Опухоль» содержит одну или несколько злокачественных клеток. Злокачественная опухоль включает в качестве неограничивающих примеров карциному, лимфому, бластому, саркому и лейкоз или лимфолейкозы. Более конкретные примеры таких злокачественных опухолей включают плоскоклеточный рак (например, эпителиальный плоскоклеточный рак), рак легкого, включая мелкоклеточный рак легкого, немелкоклеточный рак легкого («NSCLC»), аденокарциному легкого и плоскоклеточную карциному легкого, злокачественную опухоль брюшины, гепатоцеллюлярный рак, рак желудка, включая злокачественную опухоль желудочно-кишечного тракта, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак толстого кишечника, рак прямой кишки, колоректальный рак, карциному эндометрия или матки, карциному слюнной железы, рак почки или печени, рак предстательной железы, рак женских наружных половых органов, рак щитовидной железы, гепатокарциному, анальную карциному, карциному полового члена, так же как рак головы и шеи.
«Экспрессирующая ErbB злокачественная опухоль» представляет собой злокачественную опухоль, содержащую клетки с присутствующим на их клеточной поверхности белком ErbB. «Экспрессирующая ErbB2-злокачественная опухоль» представляет собой злокачественную опухоль, продуцирующую достаточные уровни ErbB2 на поверхности ее клеток, так что анти-ErbB2 антитело может связываться с ней и оказывает терапевтический эффект по отношению к злокачественной опухоли.
Злокачественная опухоль со «сверхэкспрессией» антигенного рецептора представляет собой злокачественную опухоль, обладающую значительно более высокими уровнями рецептора, такого как ErbB2, на поверхности ее клеток, по сравнению с незлокачественными клетками из ткани такого же типа. Такая сверхэкспрессия может быть вызвана амплификацией генов или увеличенной транскрипцией или трансляцией. Сверхэкспрессию рецептора можно определять в диагностическом или прогностическом анализе посредством оценки увеличенных уровней рецепторного белка, присутствующего на поверхности клетки (например, посредством иммуногистохимического анализа; IHC). Альтернативно или дополнительно, можно измерять уровни кодирующей рецептор нуклеиновой кислоты в клетке, например, посредством способов флуоресцентной гибридизации in situ (FISH; см. WO 98/45479), Саузерн-блоттинга или полимеразной цепной реакции (ПЦР), такой как количественная ПЦР с детекцией в реальном времени (РВ-ПЦР).
Опухоли со сверхэкспрессией ErbB2 (HER2) оценивают по иммуногистохимическим баллам, соответствующим количеству копий молекул HER2, экспрессированных на клетку, и это можно определять биохимически: 0 = 0-10000 копий/клетку, 1+ = по меньшей мере приблизительно 200000 копий/клетку, 2+ = по меньшей мере приблизительно 500000 копий/клетку, 3+ = приблизительно 1-2 × 106 копий/клетку. Сверхэкспрессия HER2 на уровне 3+, приводящая к лиганд-независимой активации тирозинкиназы (Hudziak et al (1987) Proc. Natl. Acad. Sci. USA, 84:7159-7163), возникает в приблизительно 30% случаев рака молочной железы, и у этих пациентов безрецидивная выживаемость и общая выживаемость снижены (Slamon et al (1989) Science, 244:707-712; Slamon et al (1987) Science, 235: 177-182).
Термин «цитотоксическое средство», как применяют в настоящем документе, обозначает вещество, ингибирующее или предупреждающее функционирование клеток и/или вызывающее разрушение клеток. Термин предназначен, чтобы включать радиоактивные изотопы (например, 211At, 131I, 125I, 90Y, 186Re, 188Re, 153Sm, 212Bi, 32P, 60C и радиоактивные изотопы Lu), химиотерапевтические средства и токсины, такие как низкомолекулярные токсины или ферментативно активные токсины бактериального, грибного, растительного или животного происхождения, включая их синтетические аналоги и производные.
«Аллергическое или воспалительное нарушение» в настоящем документе относится к заболеванию или нарушению, возникающему в результате гиперактивации иммунной системы индивидуума. Иллюстративные аллергические или воспалительные нарушения включают, но без ограничения, астму, псориаз, ревматоидный артрит, атопический дерматит, рассеянный склероз, системную волчанку, эритематоз, экзему, трансплантацию органов, связанную с возрастом дегенерацию желтого пятна, болезнь Крона, язвенный колит, эозинофильный эзофагит и аутоиммунные заболевания, связанные с воспалением.
«Аутоиммунное заболевание» в настоящем документе представляет собой заболевание или нарушение, возникающее из собственных тканей или органов индивиддума и направленное против собственных тканей или органов индивиддума, косегрегирующее с ним заболевание или его проявление, или происходящее от него состояние. Для многих из этих аутоиммунных и воспалительных нарушений может существовать ряд клинических и лабораторных маркеров, включая, но без ограничения, гипергаммаглобулинемию, высокие уровни аутоантител, накопление комплекса антиген-антитело в тканях, преимущества от лечения кортикостероидами или иммуносупрессивного лечения и агрегаты лимфоидных клеток в пораженных тканях. Без связи с какой-либо теорией относительно опосредованного B-клетками аутоиммунного заболевания, считают, что B-клетки оказывают патогенный эффект на аутоиммунные заболевания человека через множество определяющих механизмы путей, включая продукцию аутоантител, формирование иммунного комплекса, активацию дендритных клеток и T-клеток, синтез цитокинов, прямое высвобождение хемокинов и образование очага эктопического неолимфогенеза. Каждый из этих путей может вовлекаться до различных степеней в патологии аутоиммунных заболеваний. Аутоиммунное заболевание может представлять собой органоспецифическое заболевание (т.е., иммунный ответ, специфически направленный против системы органов, такой как эндокринная система, гематопоэтическая система, кожа, сердечно-легочная система, желудочно-кишечная система и система печени, система почек, щитовидная железа, уши, нервно-мышечная система, центральная нервная система и т.д.) или системное заболевание, которое может поражать множество систем органов (например, системная красная волчанка (SLE), ревматоидный артрит, полимиозит и т.д.).
Термин «цитостатический» относится к эффекту ограничения функции клеток, такому как ограничение роста или пролиферации клеток.
«Химиотерапевтическое средство» представляет собой химическое соединение, подходящее для лечения злокачественных опухолей. Примеры химиотерапевтических средств включают эрлотиниб (ТАРЦЕВА®, Genentech/OSI Pharm.), Бортезомиб (ВЕЛКЕЙД®, Millennium Pharm.), фулвестрант (ФАЗЛОДЕКС®, Astrazeneca), Sutent (SU11248, Pfizer), лектрозол (ФЕМАРА®, Novartis), мезилат иматиниба (ГЛИВЕК®, Novartis), PTK787/ZK 222584 (Novartis), оксалиплатин (Элоксатин®, Sanofi), 5-FU (5-фторурацил), лейковорин, рапамицин (Сиролимус, РАПАМУН®, Wyeth), лапатиниб (GSK572016, GlaxoSmithKline), лонафарниб (SCH 66336), сорафениб (BAY43-9006, Bayer Labs.) и гефитиниб (ИРЕССА®, Astrazeneca), AG1478, AG1571 (SU 5271; Sugen), алкилирующие средства, такие как тиотепа и ЦИТОКСАН® циклофосфамид; алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включая алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметиломеламин; ацетогинины (особенно буллатацин и буллатацинон); камптотецин (включая синтетический аналог топотекан); бриостатин; каллистатин; CC-1065 (включая его синтетические аналоги адозелезин, карзелезин и бизелезин); криптофицины (в частности криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги KW-2189 и CB1-TM1); элеутеробин; панкриастатин; саркодиктиин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, хлорофосфамид, эстрамустин, ифосфамид, мехлорэтамин, гидрохлорид мехлорэтаминоксида, мелфалан, новэмбихин, фенестерин, преднемустин, трофосфамид, урамустин; нитромочевины, такие как кармустин, хлорзотоцин, фотемустин, ломустин, нимустин и ранимнустин; антибиотики, такие как эндииновые антибиотики (например, калихеамицин, особенно калихеамицин гамма 1I и калихеамицин омега I1 (Angew Chem Intl. Ed. Engl. (1994) 33:183-186); динемицин, включая динемицин A; бисфосфонаты, такие как клодронат; эсперамицин; так же как хромофор неокарциностатина и родственные хромофоры хромопротеиновых энедииновых антибиотиков), аклациномизины, актиномицин, антрамицин, азасерин, блеомицины, сактиномицин, карабицин, карминомицин, карцинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, АДРИАМИЦИН® доксорубицин (включая морфолино-доксорубицин, цианоморфолино-доксорубицин, 2-пирролино-доксорубицин и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марселломицин, митомицины, такие как митомицин C, микофеноловая кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурина, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидина, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калюстерон, пропионат дромостанолона, эпитиостанол, мепитиостан, тестолактон; средства, подавляющие функцию коры надпочечников, такие как аминоглутетимид, митотан, трилостан; компенсатор фолиевой кислоты, такой как фролиновая кислота; ацеглатон; гликозид альдофосфамида; аминолевулиновую кислоту; энилурацил; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демекольцин; диазиквон; эльфорнитин; ацетат эллиптиния; эпотилон; этоглуцид; нитрат галлия; гидроксимочевина; лентинан; лонидаинин; майтанзиноиды, такие как майтанзин и ансамитоцины; митогуазон; митоксантрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лозоксантрон; подофиллиновую кислоту; 2-этилгидразид; прокарбазин; PSK® полисахаридный комплекс (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновую кислоту; триазиквон; 2,2',2''-трихлортриэтиламин; трихотецены (особенно T-2 токсин, верракурин A, роридин A и ангвидин); уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид («Ара-C»); циклофосфамид; тиотепа; таксоиды, например, ТАКСОЛ® паклитаксел (Bristol-Myers Squibb Oncology, Princeton, N. J.), не содержащая кремофора, сконструированная на основе альбумина композиция наночастиц паклитаксела АБРАКСАН™ (American Pharmaceutical Partners, Schaumberg, Illinois), и ТАКСОТЕР® доксетаксел (Rhone-Poulenc Rorer, Antony, France); хлорамбуцил; ГЕМЗАР® гемцитабин; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин; платину; этопозид (VP-16); ифосфамид; митоксантрон; винкристин; НАВЕЛБИН® винорелбин; новантрон; тенипозид; эдатрексат; дауномицин; аминоптерин; кселода; ибандронат; CPT-11; ингибитор топоизомеразы RFS 2000; дифлорометилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота; капецитабин; и фармацевтически приемлемые соли, кислоты или производные любого из вышеперечисленного.
В это определение «химиотерапевтического средства» включены также: (i) антигормональные средства, которые действуют для регуляции или ингибирования действия гормонов на опухоли, такие как антиэстрогены и селективные модуляторы рецептора эстрогена (SERM), включая, например, тамоксифен (включая НОЛВАДЕКС® тамоксифен), ралоксифен, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен ФАРЕСТОН; (ii) ингибиторы ароматазы, которые ингибируют фермент ароматазу, регулирующий продукцию эстрогена в надпочечниках, например, такие как 4(5)-имидазолы, аминоглутетимид, ацетат мегестрола MEGASE®, экземестан АРОМАЗИН®, форместан, фадрозол, ворозол RIVISOR®, летрозол ФЕМАРА®, и анастрозол АРИМИДЕКС®; (iii) антиандрогены, такие как флутамид, нилутамид, бикалутамид, леупролид и гозерелин; так же как троксацитабин (аналог нуклеозида цитозина с 1,3-диоксоланом); (iv) ингибиторы ароматазы; (v) ингибиторы протеинкиназы; (vi) ингибиторы киназы липидов; (vii) антисмысловые олигонуклеотиды, в частности те, которые ингибируют экспрессию генов в путях передачи сигнала, вовлеченных в нарушенную пролиферацию клеток, например, таких как гены PKC-альфа, Ralf и H-Ras; (viii) рибозимы, такие как ингибитор экспрессии VEGF (например, рибозим АНГИОЗИМ®) и ингибитор экспрессии HER2; (ix) вакцины, такие как генотерапевтические вакцины, например, вакцина АЛЛОВЕКТИН®, вакцина ЛЕЙВЕКТИН® и вакцина ВАКСИД®; ПРОЛЕЙКИН® rIL-2; ингибитор топоизомеразы 1 ЛУРТОТЕКАН®; АБАРЕЛИКС® rmRH; (x) антиангиогенные средства, такие как бевацизумаб (АВАСТИН®, Genentech); и (xi) фармацевтически приемлемые соли, кислоты или производные любого из вышеперечисленного.
«Ингибирующее рост средство» при использовании в настоящем документе относится к соединению или композиции, которые ингибируют рост клетки in vitro или in vivo. Таким образом, ингибирующее рост средство может представлять собой средство, значительно уменьшающее процент в S-фазе. Примеры ингибирующих рост средств включают средства, которые блокируют продолжение клеточного цикла (в отличном от S-фазы периоде), такие как средства, которые вызывают арест в G1 и арест в M-фазе. Классические блокаторы M-фазы включают алкалоиды барвинка (например, винкристин и винбластин), таксаны и ингибиторы топоизомеразы II, такие как доксорубицин, эпирубицин, даунорубицин, этопозид и блеомицин. Действие таких средств, которые вызывают арест в G1, также распространяется на арест в S-фазе, например, действие алкилирующих ДНК средств, таких как тамоксифен, преднизон, дакарбазин, мехлорэтамин, цисплатин, метотрексат, 5-фторурацил и ара-C. Дополнительную информацию можно найти в The Molecular Basis of Cancer. Mendelsohn and Israel, eds., Chapter 1, entitled «Cell cycle regulation, oncogenes, and antineoplastic drugs» by Murakami et al. (WB Saunders: Philadelphia, 1995), особенно p. 13. Таксаны (паклитаксел и доцетаксел) представляют собой противораковые лекарственные средства, оба полученные из тиса. Доцетаксел (ТАКСОТЕР®, Rhone-Poulenc Rorer), полученный из тиса европейского, представляет собой полусинтетический аналог паклитаксела (ТАКСОЛ®, Bristol-Myers Squibb). Паклитаксел и доцетаксел стимулируют сборку микротрубочек из димеров тубулина и стабилизируют микротрубочки посредством предотвращения деполимеризации, что приводит к ингибированию митоза в клетках.
«Противораковая терапия», как используют в настоящем документе, относится к терапии, уменьшающей или ингибирующей злокачественную опухоль у индивида. Примеры противораковой терапии включают цитотоксическую радиотерапию, так же как введение терапевтически эффективного количества цитотоксического средства, химиотерапевтического средства, ингибирующего рост средства, противораковой вакцины, ингибитора ангиогенеза, пролекарства, цитокина, антагониста цитокина, кортикостероида, иммуносупрессивного средства, противорвотного средства, антитела или фрагмента антитела, или анальгетика индивиду.
Под «антагонистом цитокина» понимают молекулу, которая частично или полностью блокирует, ингибирует или нейтрализует биологическую активность по меньшей мере одного цитокина. Например, антагонисты цитокинов могут ингибировать активность цитокинов посредством ингибирования экспрессии и/или секреции цитокинов, или посредством связывания с цитокином или с рецептором цитокина. Антагонисты цитокинов включают антитела, синтетические пептиды или пептиды с нативной последовательностью, иммуноадгезины и низкомолекулярные антагонисты, связывающиеся с цитокином или рецептором цитокина. Антагонист цитокина, необязательно, конъюгируют или сливают с цитотоксическим средством. Иллюстративными антагонистами TNF являются этанерцепт (ЭНБРЕЛ®), инфликсимаб (РЕМИКЕЙД®), и адалимумаб (ХУМИРА™).
Термин «иммуносупрессивное средство», как используют в настоящем документе, относится к веществам, которые действуют посредством подавления или маскировки иммунной системы индивида, подлежащего лечению. Эти вещества включают вещества, которые подавляют продукцию цитокинов, снижают или подавляют экспрессию аутоантигенов, или маскируют антигены MHC. Примеры иммуносупрессивных средств включают 2-амино-6-арил-5-замещенные пиримидины (смотри патент США No. 4665077); микофенолят, такой как СЕЛЛСЕПТ®; азатиоприн (ИМУРАН®, АЗАСАН®/6-меркаптопурин; бромкриптин; даназол; дапзон; глутаровый альдегид (который маскирует антигены MHC, как описано в патенте США No. 4120649); антиидиотипические антитела к антигенам МНС и фрагментам МНС; циклоспорин А, стероиды, такие как кортикостероиды и глюкокортикостероиды, например, преднизон, преднизолон, такой как ПЕДИАПРЕД® (фосфат преднизолона натрия) или ОРАПРЕД® (пероральный раствор фосфата преднизолона натрия), метилпреднизолон и дексаметазон; метотрексат (пероральный или подкожный) (РЕВМАТРЕКС®, ТРЕКСАЛЛ™; гидроксихлороквин/хлороквин; сульфасалазин; лефлуномид; антагонисты цитокина или рецепторов цитокина, включая антитела против интерферона -γ, -β или -α, антитела против фактора некроза опухолей α (инфликсимаб или адалимумаб), анти-TNFα иммуноадгезин (ЭНБРЕЛ®, этанерцепт), антитела против фактора некроза опухолей β, антитела против интерлейкина-2 и антитела против рецептора IL-2; антитела против LFA-1, включая антитела против CD11a и против CD18; антитела против L3T4; гетерологичный антилимфоцитарный глобулин; поликлональные или пан-Т-антитела, или моноклональные антитела против CD3 или против CD4/CD4a; растворимый пептид, содержащий связывающий LFA-3 домен (WO 90/08187), стрептокиназа; TGF-β; стрептодорназа; РНК или ДНК хозяина; FK506; RS-61443; дезоксиспергуалин; рапамицин; T-клеточный рецептор (Cohen et al., Патент США No. 5114721); фрагменты T-клеточного рецептора (Offher et al. Science 251:430-432 (1991); WO 90/11294; Ianeway, Nature 341:482 (1989); и WO 91/01133); антитела против T-клеточного рецептора (EP 340109), такие как T10B9; циклофосфамид (ЦИТОКСАН®); дапзон; пеницилламин (КУПРИМИН®); плазмаферез; или внутривенный иммуноглобулин (IVIG). Их можно использовать по отдельности или в сочетании друг с другом, в частности, комбинации стероида и другого иммуносупрессивного средства или такие комбинации с последующим поддержанием дозы с помощью нестероидного средства для уменьшения необходимости стероидов.
«Анальгетик» относится к лекарственному средству, действующему для сдерживания или подавления боли у индивида. Иллюстративные анальгетики включают нестероидные противовоспалительные лекарственные средства (NSAID), включая ибупрофен (МОТРИН®), напроксен (НАПРОСИН®), ацетилсалициловую кислоту, индометацин, сулиндак и толметин, включая их соли и производные, так же как различные другие лекарственные средства, используемые для уменьшения острых болей, которые могут возникать, включая противосудорожные препараты (габапентин, фенилоин, карбамазепин) или трициклические антидепрессанты. Конкретные примеры включают ацетаминофен, аспирин, амитриптилин (ЭЛАВИЛ®), карбамазепин (ТЕГРЕТОЛ®), фенитоин (ДИЛАНТИН®), габапентин (НЕЙРОНТИН®), (E)-N-ванилил-8-метил-6-ноненамид (КАПСАИЦИН®) или нейроблокатор.
«Кортикостероид» относится к любому из нескольких синтетических или природных веществ с общей химической структурой стероидов, имитирующих или усиливающих эффекты природных кортикостероидов. Примеры синтетических кортикостероидов включают преднизон, преднизолон (включая метилпреднизолон), дексаметазон, триамцинолон и бетаметазон.
«Противораковая вакцина», как применяют в настоящем документе, представляет собой композицию, стимулирующую у индивида иммунный ответ против злокачественной опухоли. Противораковые вакцины, как правило, состоят из источника связанных со злокачественной опухолью материала или клеток (антигена), которые могут являться аутологичными (собственными) или аллогенными (чужеродными) для индивида, вместе с другими компонентами (например, адъювантами) для дополнительной стимуляции и вторичной стимуляции иммунного ответа против антигена. Противораковые вакцины могут приводить к стимуляции иммунной системы индивида для продукции антител против одного или нескольких специфических антигенов, и/или для продукции T-клеток - киллеров для атаки на клетки злокачественных опухолей, имеющие эти антигены.
«Цитотоксическая радиотерапия», как применяют в настоящем документе, относится к радиотерапии, ингибирующей или предотвращающей функционирование клеток и/или вызывающей разрушение клеток. Радиотерапия может включать, например, внешнее облучение или терапию средством с радиоактивной меткой, таким как антитело. Термин предназначен, чтобы включать использование радиоактивных изотопов (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, Ra223, P32 и радиоактивные изотопы Lu).
Как используют в настоящем документе, термин «нацеленное на EGFR лекарственное средство» относится к лекарственному средству, которое связывается с EGFR и, необязательно, ингибирует активацию EGFR. Примеры таких средств включают антитела и малые молекулы, связывающие EGFR. Примеры антител, связывающих EGFR, включают MAb 579 (ATCC CRL HB 8506), MAb 455 (ATCC CRL HB8507), MAb 225 (ATCC CRL 8508), MAb 528 (ATCC CRL 8509) (см., патент США No. 4943533, Mendelsohn et al.) и их варианты, такие как химеризованное 225 (C225 или цетуксимаб; ЭРБИТУКС®) и реконструированное человеческое 225 (H225) (см., WO 96/40210, Imclone Systems Inc.); антитела, связывающие мутантный EGFR II типа (патент США No. 5212290); гуманизированные и химерные антитела, связывающие EGFR, как описано в US 5891996; и антитела человека, связывающие EGFR, такие как ABX-EGF (см. WO 98/50433, Abgenix). Антитело против EGFR можно конъюгировать с цитотоксическим средством, таким образом, получая иммуноконъюгат (см., например, EP 659439A2, Merck Patent GmbH). Примеры малых молекул, связывающих EGFR, включают ZD1839 или гефитиниб (ИРЕССА™; Astra Zeneca), эрлотиниб HCl (CP-358774, ТАРЦЕВА™; Genentech/OSI) и AG1478, AG1571 (SU 5271; Sugen).
Ингибиторы протеинкиназ включают ингибиторы тирозинкиназ, ингибирующие до определенной степени тирозинкиназную активность тирозинкиназы, такой как рецептор ErbB. Примеры таких ингибиторов включают направленные против EGFR лекарственные средства, указанные в предыдущем абзаце, так же как хиназолины, такие как PD 153035, 4-(3-хлоранилино)хиназолин; пиридопиримидины; пиримидопиримидины; пирролопиримидины, такие как CGP 59326, CGP 60261 и CGP 62706, и пиразолопиримидины, 4-(фениламино)-7H-пирроло[2,3-d]пиримидины, куркумин (диферулоилметан, 4,5-бис-(4-фторанилино)фталимид); тирфостины, содержащие группы нитротиофена; PD-0183805 (Warner-Larnber); антисмысловые молекулы (например, молекулы, которые связываются с кодирующей ErbB нуклеиновой кислотой); хиноксалины (патент США No. 5804396); трифостины (патент США No. 5804396); ZD6474 (Astra Zeneca); PTK-787 (Novartis/Schering AG); общие ингибиторы ErbB, такие как CI-1033 (Pfizer); аффинитак (ISIS 3521; Isis/Lilly); мезилат иматиниба (Gleevac; Novartis); PKI 166 (Novartis); GW2016 (Glaxo SmithKline); CI-1033 (Pfizer); EKB-569 (Wyeth); семаксиниб (Sugen); ZD6474 (AstraZeneca); PTK-787 (Novartis/Schering AG); INC-1C11 (Imclone); или как описано в любой из следующих патентных публикаций: WO 99/09016 (American Cyanamid); WO 98/43960 (American Cyanamid); WO 97/38983 (Warner Lambert); WO 99/06378 (Warner Lambert); WO 99/06396 (Warner Lambert); WO 96/30347 (Pfizer, Inc); WO 96/33978 (Zeneca); WO 96/3397 (Zeneca); и WO 96/33980 (Zeneca).
«Антиангиогенное средство» относится к соединению, которое блокирует развитие кровеносных сосудов, или до некоторой степени препятствует ему. Антиангиогенный фактор, например, может представлять собой малую молекулу или антитело, которые связываются с фактором роста или с рецептором фактора роста, вовлеченного в стимуляцию ангиогенеза. В конкретных случаях антиангиогенный фактор по настоящему изобретению представляет собой антитело, которое связывается с фактором роста эндотелия сосудов (VEGF).
«Противорвотное средство» представляет собой соединение, уменьшающее или предотвращающее тошноту у индивида. Противорвотные соединения включают, например, антагонисты рецептора нейрокинина-1, антагонисты рецептора 5HT3 (такие как ондансетрон, гранизетрон, трописетрон и затисетрон), агонисты рецепторов GABAB, такие как баклофен, кортикостероиды, такие как дексаметазон, КЕНАЛОГ®, АРИСТОКОРТ® или НАЗАЛИД®, антидофаминергические средства, фенотиазины (например, прохлорперазин, флуфеназин, тиоридазин и мезоридазин), дронабинол, метоклопрамид, домперидон, галоперидол, циклизин, лоразепам, прохлорперазин и левомепромазин.
Термин «цитокин» является общим термином для белков, высвобождаемых одной популяцией клеток, которые воздействуют на другую клетку в качестве межклеточных медиаторов. Примерами таких цитокинов являются лимфокины, монокины и общепринятые полипептидные гормоны. Цитокины включают гормоны роста, такие как гормон роста человека, гормон роста человека с N-метионилом и бычий гормон роста; паратиреоидный гормон; тироксин; инсулин; проинсулин; релаксин; прорелаксин; гликопротеиновые гормоны, такие как фолликулостимулирующий гормон (FSH), тиреоидстимулирующий гормон (TSH) и лютеинизирующий гормон (LH); фактор роста печени; фактор роста фибробластов; пролактин; плацентарный лактоген; фактор некроза опухолей-α и -β; ингибирующее вещество Мюллера; гонадотропин-связанный пептид мыши; ингибин; активин; фактор роста эндотелия сосудов; интегрин; тромбопоэтин (TPO); факторы роста нервов, такие как NGF-β; фактор роста тромбоцитов; трансформирующие факторы роста (TGF), такие как TGF-α и TGF-β; инсулиноподобный фактор роста-I и -II; эритропоэтин (EPO); остеоиндуктивные факторы; интерфероны, такие как интерферон-α, -β, и -γ; колониестимулирующие факторы (CSF), такие как макрофагальный CSF (M-CSF); гранулоцитарно-макрофагагальный CSF (GM-CSF); и гранулоцитарный CSF (G-CSF); интерлейкины (IL), такие как IL-1, IL-1α, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12; фактор некроза опухолей, такой как TNF-α или TNF-β; и другие полипептидные факторы, включая LIF и лиганд kit (KL). Как используют в настоящем документе, термин цитокин включает белки из природных источников или из рекомбинантных клеточных культур и биологически активные эквиваленты цитокинов с нативной последовательностью.
Термин «пролекарство», как используют в настоящем документе, относится к форме предшественника или производного фармацевтически активного вещества, которая является менее цитотоксичной для клеток опухолей по сравнению с исходным лекарственным средством и которую можно ферментативно или гидролитически активировать или перевести в более активную исходную форму. См., например, Wilman, «Prodrugs in Cancer Chemotherapy» Biochemical Society Transactions, 14, pp. 375-382, 615th Meeting Belfast (1986) и Stella et al., «Prodrugs: A Chemical Approach to Targeted Drug Delivery,» Directed Drug Delivery, Borchardt et al., (ed.), pp. 247-267, Humana Press (1985). Пролекарства по настоящему изобретению включают в качестве неограничивающих примеров, содержащие фосфат пролекарства, содержащие тиофосфат пролекарства, содержащие сульфат пролекарства, содержащие пептид пролекарства, модифицированные D-аминокислотами пролекарства, гликозилированные пролекарства, содержащие бета-лактам пролекарства, содержащие, необязательно, замещенный феноксиацетамид пролекарства или содержащие, необязательно, замещенный фенилацетамид пролекарства, 5-фторцитозин и другие пролекарства для 5-фторуридина, которые можно превратить в более активное свободное цитотоксическое лекарственное средство. Примеры цитотоксических лекарственных средства, которые можно дериватизировать до формы пролекарства, включают, но без ограничения, химиотерапевтические средства, описанные выше.
«Липосома» представляет собой небольшой пузырек, состоящий из различных типов липидов, фосфолипидов и/или поверхностно-активных веществ, пригодных для доставки лекарственного средства (такого как антитела против ErbB2, описанные в настоящем документе, и, необязательно, химиотерапевтического средства) млекопитающему. Компоненты липосомы обычно организуются в бислой, аналогичный липидному слою биологических мембран.
Термин «вкладыш в упаковку» используют для обозначения инструкций, обычно включаемых в коммерческие упаковки лекарственных средств, содержащих информацию о показаниях, использовании, дозировании, введении, противопоказаниях, и/или предупреждения относительно использования таких терапевтических продуктов.
«Фаговый дисплей» представляет собой способ, посредством которого варианты полипептидов экспонируют в виде белков, слитых с белком оболочки, на поверхности частиц фага, например, нитевидного фага. Одно из применений фагового дисплея основано на факте, что большие библиотеки рандомизированных вариантов белка можно быстро и эффективно отсортировать по тем последовательностям, которые связывают антиген-мишень с высокой аффинностью. Экспонирование пептидных и белковых библиотек на фаге использовали для скрининга миллионов полипептидов для отбора полипептидов со специфическими свойствами связывания. Способы поливалентного фагового дисплея использовали для экспонирования малых случайных пептидов и малых белков, как правило, посредством слияния с pIII или pVIII нитевидного фага (Wells and Lowman, (1992) Curr. Opin. Struct. Biol, 3:355-362, и процитированные в этом документе ссылки). В моновалентном фаговом дисплее белковую или пептидную библиотеку сливают с белком оболочки фага или его частью, и экспрессируют на низких уровнях в присутствии белка дикого типа. Эффекты авидности снижены по сравнению с поливалентным фагом, так что отбор проходит на основе собственной аффинности лиганда, и используют фагмидные векторы, упрощающие манипуляции с ДНК. Lowman and Wells, Methods: A companion to Methods in Enzymology, 3:205-0216 (1991). Фаговый дисплей включает способы получения антителоподобных молекул (Janeway, C, Travers, P., Walport, M., Shlomchik (2001) Immunobiology, 5th Ed., Garland Publishing, New York, p627-628; Lee et al ).
«Фагмида» представляет собой плазмидный вектор, обладающий бактериальной точкой начала репликации, например, ColE1, и копией межгенной области бактериофага. Фагмиду можно использовать для любого известного бактериофага, включая нитевидный бактериофаг и лямбдоидный бактериофаг. Плазмида также, как правило, содержит селективный маркер для устойчивости к антибиотику. Фрагменты ДНК, клонированные в эти векторы, можно размножать в форме плазмид. Когда клетки, несущие эти векторы, обеспечивают всеми генами, необходимыми для продукции фаговых частиц, тип репликации плазмиды меняется на репликацию по типу катящегося кольца для получения копий одной цепи плазмидной ДНК и упаковки фаговых частиц. Фагмиды могут формировать инфекционные или неинфекционные фаговые частицы. Этот термин включает фагмиды, содержащие ген белка оболочки фага или его фрагмент, связанный с геном гетерологичного полипептида в форме слитого гена, так что гетерологичный полипептид экспонирован на поверхности фаговых частиц.
Термины «линкер», «линкерное звено», «связь», «кросслинкер» и «перекрестная связь», используемые в настоящем документе взаимозаменяемо, относятся к химической группе, содержащей ковалентную связь или цепь атомов, которые ковалентно присоединяют антитело к компоненту лекарственного средства. Линкеры включают двухвалентный радикал, такой как алкилдиил, арилен, гетероарилен, такие группы как: -(CR2)nO(CR2)n-, повторяющиеся звенья алкилокси (например, полиэтиленокси, PEG, полиметиленокси) и алкиламино (например, полиэтиленамино, Jeffamine™); и сложные эфиры и амиды двухосновных кислот, включая сукцинат, сукцинамид, дигликолят, малонат и капроамид. Дополнительные линкеры или кросслинкеры включают бис-малеимидо- и бис-алкилгалогениды, пиридилдисульфиды, бис-ртутные соли, опосредованное 5-тио-2-нитробензойной кислотой перекрестное связывание и бис-тиосульфонаты. Коммерчески доступные кросслинкеры включают в качестве неограничивающих примеров, 1,4-бис(малеимидо)бутан, (1,4-бисмалеимидил-2,3-дигидроксибутан), бис(малеимидо)гексан, бис(малеимидо)этан, 1,4-ди-[3'-(2'-пиридилдитио)пропионамидо]бутан, 1,6-гексан-бис-винилсульфон, дитио-бис-малеимидоэтан, 1,8-бис-малеимидодиэтиленгликоль и 1,11-бис-малеимидотриэтиленгликоль. В конкретных случаях в качестве кросслинкера можно использовать гомо-трифункциональный реагент, например, трис[2-малеимидоэтил]амин.
Термин «метка» обозначает любую группу, которую можно ковалентно присоединять к антителу, и которая функционирует для: (i) обеспечения поддающегося детекции сигнала; (ii) взаимодействия со второй меткой для модификации поддающегося детекции сигнала, обеспечиваемого первой или второй меткой, например, FRET (резонансный перенос энергии флуоресценции); (iii) стабилизации взаимодействий или увеличения аффинности связывания с антигеном или лигандом; (iv) влияния на подвижность, например, электрофоретическую подвижность, или клеточную проницаемость, посредством заряда, гидрофобности, формы или других физических параметров, или (v) предоставления связывающей группы, для модуляции аффинности лиганда, связывания антитело/антиген, или образования комплексных ионов.
Стереохимические определения и обозначения, используемые в настоящем документе, в основном, следуют S. P. Parker, Ed., McGraw-Hill Dictionary of Chemical Terms (1984) McGraw-Hill Book Company, New York; и Eliel, E. and Wilen, S., Stereochemistry of Organic Compounds (1994) John Wiley & Sons, Inc., New York. Многие органические соединения существуют в оптически активных формах, т.е., они обладают способностью вращать плоскость плоскополяризованного света. При описании оптически активного соединения, префиксы D и L, или R и S, используют для обозначения абсолютной конфигурации молекулы вокруг ее хирального центра(центров). Префиксы d и l или (+) и (-) используют для обозначения знака вращения плоскополяризованного света соединением, где (-) или l обозначает, что соединение является левовращающим. Соединение с префиксом (+) или d является правовращающим. Для данной химической структуры, эти стереоизомеры являются идентичными, за исключением того, что они являются зеркальными отражениями друг друга. Конкретный стереоизомер можно обозначать также, как энантиомер, и смесь таких изомеров часто называют энантиомерной смесью. Смесь энантиомеров 50:50 обозначают рацемической смесью или рацематом, которые могут возникать в отсутствие стереоизбирательности или стереоспецифичности химической реакции или процесса. Термины «рацемическая смесь» и «рацемат» относятся к эквимолярной смеси двух видов энантиомеров, лишенной оптической активности.
Фраза «фармацевтически приемлемая соль», как используют в настоящем документе, относится к фармацевтически приемлемым органическим или неорганическим солям. Соли включают, в качестве неограничивающих примеров, соли сульфат, цитрат, ацетат, оксалат, хлорид, бромид, иодид, нитрат, бисульфат, фосфат, кислый фосфат, изоникотинат, лактат, салицилат, кислый цитрат, тартрат, олеат, таннат, пантотенат, битартрат, аскорбат, сукцинат, малеат, гентизинат, фумарат, глюконат, глюкуронат, сахарат, формат, бензоат, глутамат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат и памоат (т.е., 1,1'-метилен-бис-(2-гидрокси-3-нафтоат)). Фармацевтически приемлемая соль может предполагать включение другой молекулы, такой как ион ацетата, ион сукцината или другой противоион. Противоион может представлять собой любую органическую или неорганическую группу, стабилизирующую заряд исходного соединения. Более того, фармацевтически приемлемая соль может иметь в структуре более одного заряженного атома. В случаях, когда несколько заряженных атомов составляют часть фармацевтически приемлемой соли, она может иметь несколько противоионов. Таким образом, фармацевтически приемлемая соль может иметь один или несколько заряженных атомов и/или один или несколько противоионов.
«Фармацевтически приемлемый сольват» обозначает ассоциацию одной или нескольких молекул растворителя и антитела. Растворители, формирующие фармацевтически приемлемые сольваты, включают в качестве неограничивающих примеров, воду, изопропанол, этанол, метанол, DMSO, этилацетат, уксусную кислоту и этаноламин.
Следующие аббревиатуры использованы в настоящем документе и имеют следующие определения: BME представляет собой бета-меркаптоэтанол, Boc представляет собой N-(т-бутоксикарбонил), cit представляет собой цитруллин (2-амино-5-уреидопентановая кислота), dap представляет собой долапроин, DCC представляет собой 1,3-дициклогексилкарбодиимид, DCM представляет собой дихлорметан, DEA представляет собой диэтиламин, DEAD представляет собой диэтилазодикарбоксилат, DEPC представляет собой диэтилфосфорилцианидат, DIAD представляет собой диизопропилазодикарбоксилат, DIEA представляет собой N,N-диизопропилэтиламин, dil представляет собой долаизолейцин, DMA представляет собой диметилацетамид, DMAP представляет собой 4-диметиламинопиридин, DME представляет собой диметиловый эфир этиленгликоля (или 1,2-диметоксиэтан), DMF представляет собой N,N-диметилформамид, DMSO представляет собой диметилсульфоксид, doe представляет собой долафенин, dov представляет собой N,N-диметилвалин, DTNB представляет собой 5,5'-дитиобис(2-нитробензойную кислоту), DTPA представляет собой диэтилентриаминпентауксусную кислоту, DTT представляет собой дитиотреитол, EDCI представляет собой гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида, EEDQ представляет собой 2-этокси-1-этоксикарбонил-1,2-дигидрохинолин, ES-MS представляет собой масс-спектрометрию с электрораспылением, EtOAc представляет собой этилацетат, Fmoc представляет собой N-(9-флуоренилметоксикарбонил), gly представляет собой глицин, HATU представляет собой гексафторфосфат O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония, HOBt представляет собой 1-гидроксибензотриазол, HPLC представляет собой высокоэффективную жидкостную хроматографию, ile представляет собой изолейцин, lys представляет собой лизин, MeCN (CH3CN) представляет собой ацетонитрил, MeOH представляет собой метанол, Mtr представляет собой 4-анизилдифенилметил (или 4-метокситритил), nor представляет собой (1S,2R)-(+)-норэфедрин, PAB представляет собой п-аминобензилкарбамоил, PBS представляет собой фосфатно-солевой буфер (pH 7), PEG представляет собой полиэтиленгликоль, Ph представляет собой фенил, Pnp представляет собой п-нитрофенил, MC представляет собой 6-малеимидокапроил, phe представляет собой L-фенилаланин, PyBrop представляет собой гексафторфосфат бром-трис-пирролидинофосфония, SEC представляет собой эксклюзионную хроматографию, Su представляет собой сукцинимид, TFA представляет собой трифторуксусную кислоту, TLC представляет собой тонкослойную хроматографию, UV представляет собой ультрафиолет, и val представляет собой валин.
«Индивид» представляет собой позвоночного, такого как млекопитающее, например, человек. Млекопитающие включают, но без ограничения, сельскохозяйственных животных (таких как коровы), спортивных животных, домашних животных (таких как кошки, собаки и лошади), приматы, мыши и крысы.
Коммерчески доступные реагенты, упомянутые в примерах, использовали согласно инструкциям производителя, если нет иных указаний. Источник этих клеток идентифицирован в следующих примерах и на протяжении описания, посредством номеров доступа ATCC в Американской коллекции типовых культур, Manassas, VA. Если не указано иначе, по настоящему изобретению используют общепринятые способы технологии рекомбинантной ДНК, такие как описаны выше и в следующих руководствах: Sambrook et al., выше; Ausubel et al., Current Protocols in Molecular Biology (Green Publishing Associates и Wiley Interscience, N.Y., 1989); Innis et al., PCR Protocols: A Guide to Methods and Applications (Academic Press, Inc.: N.Y., 1990); Harlow et al., Antibodies: A Laboratory Manual (Cold Spring Harbor Press: Cold Spring Harbor, 1988); Gait, Oligonucleotide Synthesis (IRL Press: Oxford, 1984); Freshney, Animal Cell Culture, 1987; Coligan et al., Current Protocols in Immunology, 1991.
На протяжении настоящего описания и формулы изобретения, слово «содержать» или его варианты, такие как «содержит» или «содержащий», следует понимать как подразумевающее включение указанного целого числа или группы целых чисел, но не как исключение любого другого целого числа или группы целых чисел.
Ряд дополнительных терминов определено или иным образом охарактеризовано в настоящем документе.
КОМПОЗИЦИИ И СПОСОБЫ
МУЛЬТИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА И АНАЛОГИ АНТИТЕЛ
Для конструирования мультиспецифических антител, включая биспецифические антитела и аналоги антител, как описано в настоящем документе, получены фрагменты антител, имеющие по меньшей мере одну свободную сульфгидрильную группу. Фрагменты антител можно получать из исходных антител, как определено выше, включая сконструированные антитела с цистеиновыми заменами. Исходные антитела можно подвергать ферментативному расщеплению для получения фрагментов антител. Способы ферментативного расщепления включают в качестве неограничивающих примеров, расщепление пепсином, папаином и Lys-C. Фрагменты антител включают в качестве неограничивающих примеров Fab, Fab', F(ab')2, Fv, диатела (Db); тандемные диатела (taDb), линейные антитела (см. патент США No. 5641870, Пример 2; Zapata et al., Protein Eng. 8(10): 1057-1062 (1995)); антитела с одним плечом, антитела с одиночным вариабельным доменом, минитела (Olafsen et al (2004) Protein Eng. Design & Sel. 17(4):315-323), молекулы одноцепочечного антитела, фрагменты, полученные из экспрессирующей библиотеки Fab, анти-идиотипические (анти-Id) антитела, CDR (определяющую комплементарность область) и эпитоп-связывающие фрагменты. Фрагменты антител можно также клонировать, в форме фрагментов ДНК, кодирующих указанные фрагменты антител, в плазмидные векторы экспрессии или фагмидные векторы и экспрессировать непосредственно в E. Coli. Способы ферментативного расщепления антител, клонирования ДНК и способы экспрессии рекомбинантных белков хорошо известны специалистам в данной области, и иллюстративные способы представлены в настоящем документе.
Фрагменты антител можно очищать с использованием общепринятых способов и подвергать восстановлению для получения свободной тиоловой группы. Проводят реакцию фрагментов антител, обладающих свободной тиоловой группой, с кросслинкером, например, бис-малеинимидом. Такие фрагменты антител с кросслинкером очищают и затем проводят реакцию с вторым фрагментом антитела, обладающего свободной тиоловой группой. Конечный продукт, в котором сшиты два фрагмента антител, очищают. В конкретных вариантах осуществления каждый фрагмент антитела представляет собой Fab, и конечный продукт, в котором два Fab связаны посредством бис-малеинимида, обозначен в настоящем документе как бис-малеимидо-(тио-Fab)2 или бис-Fab.
Такие мультиспецифические антитела и аналоги антител, включая бис-Fab, можно использовать для быстрого синтеза большого количества комбинаций фрагментов антител или структурных вариантов природных антител, или комбинаций конкретных фрагментов антител и для их скрининга в биологических анализах по желательной активности.
СКОНСТРУИРОВАННЫЕ АНТИТЕЛА С ЦИСТЕИНОВЫМИ ЗАМЕНАМИ
Сконструированные антитела с цистеиновыми заменами описаны ранее. Публикация патента США No. 2007/0092940 и Junutula, J. R., et al., J Immunol Methods 332(1-2):41-52 (2008). Сконструированные антитела с цистеиновыми заменами могут быть исходными антителами. Они подходят для получения фрагментов антител, обладающих свободным цистеином в конкретном положении, как правило, в константной области, например, CL или CH1. Исходное антитело, сконструированное с содержанием цистеина, обозначено в настоящем документе как «ТиоMab», и Fab фрагменты, полученные из таких сконструированных антител с цистеиновыми заменами, независимо от способа получения, обозначены в настоящем документе как «ТиоFab». Как описано ранее (публикация патента США No. 2007/0092940 и Junutula, J. R., et al., J Immunol Methods 332(l-2):41-52 [2008]), мутанты с замененными («сконструированными») остатками цистеина (Cys) оценивали по реакционной способности вновь введенных, сконструированных тиоловых групп цистеина. Значение реакционной способности тиола является относительным числовым термином в диапазоне от 0 до 1,0, и его можно измерять для любого сконструированного антитела с цистеиновыми заменами. В дополнение к обладанию реакционноспособной тиоловой группой, ТиоMab следует отбирать так, чтобы они сохраняли способность связывания антигена. Конструирование, отбор и получение сконструированных антител с цистеиновыми заменами подробно описаны ранее. Публикация патента США Pub. No. 2007/0092940 и Junutula, J. R., et al., J Immunol Methods 332(1-2):41-52 (2008).
Аминокислотные последовательности конкретных иллюстративных легких цепей (LC) и тяжелых цепей (HC) таких сконструированных антител с цистеиновыми заменами и соответствующих последовательностей дикого типа перечислены ниже (положение сконструированного цистеина показано жирным курсивом и подчеркнуто). Поскольку сконструированные остатки цистеина введены в константные области тяжелой или легкой цепей, понятно, что положения, представленные ниже для введения цистеина в эти конкретные антитела можно использовать для любого антитела, содержащего эти, или в основном сходные, константные области.
1. HercLC (дикий тип) (SEQ ID NO:1)
DIQMTQSPSSLSASVGDRVTITCRASQDVNTAVAWYQQKPGKAPKLLIYSASFLYSGVPS
RFSGSRSGTDFTLTISSLQPEDFATYYCQQHYTTPPTFGQGTKVEIKRTVAAPSVFIFPP
SDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLT
LSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
1. HercLC110Cys (SEQ ID NO:2)
DIQMTQSPSSLSASVGDRVTITCRASQDVNTAVAWYQQKPGKAPKLLIYSASFLYSGVPS
RFSGSRSGTDFTLTISSLQPEDFATYYCQQHYTTPPTFGQGTKVEIKRT C AAPSVFIFPP
SDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLT
LSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
2. HercLC205Cys (SEQ ID NO:3)
DIQMTQSPSSLSASVGDRVTITCRASQDVNTAVAWYQQKPGKAPKLLIYSASFLYSGVPS
RFSGSRSGTDFTLTISSLQPEDFATYYCQQHYTTPPTFGQGTKVEIKRTVAAPSVFIFPP
SDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLT
LSKADYEKHKVYACEVTHQGLSSP C TKSFNRGEC
4. HercHC (дикий тип) (SEQ ID NO:4)
EVQLVESGGGLVQPGGSLRLSCAASGFNIKDTYIHWVRQAPGKGLEWVARIYPTNGYTRY
ADSVKGRFTISADTSKNTAYLQMNSLRAEDTAVYYCSRWGGDGFYAMDYWGQGTLVTVSS
ASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSS
GLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGG
PSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYN
STYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREE
MTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRW
QQGNVFSCSVMHEALHNHYTQKSLSLSPGK
5. HercHC118Cys (SEQ ID NO:5)
EVQLVESGGGLVQPGGSLRLSCAASGFNIKDTYIHWVRQAPGKGLEWVARIYPTNGYTRY
ADSVKGRFTISADTSKNTAYLQMNSLRAEDTAVYYCSRWGGDGFYAMDYWGQGTLVT C SS
ASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSS
GLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGG
PSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYN
STYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREE
MTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRW
QQGNVFSCSVMHEALHNHYTQKSLSLSPGK
6. 2C4LC (дикий тип) (SEQ ID NO:6)
DIQMTQSPSSLSASVGDRVTITCKASQDVSIGVAWYQQKPGKAPKLLIYSASYRYTGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYYIYPYTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
7. 2C4LC110Cys (SEQ ID NO:7)
DIQMTQSPSSLSASVGDRVTITCKASQDVSIGVAWYQQKPGKAPKLLIYSASYRYTGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYYIYPYTFGQGTKVEIKRT C AAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
8. 2C4HC (VH-CH1) (дикий тип) (SEQ ID NO:8)
EVQLVESGGGLVQPGGSLRLSCAASGFTFTDYTMDWVRQAPGKGLEWVADVNPNSGGSIYNQRFKGRFTLSVDRSKNTLYLQMNSLRAEDTAVYYCARNLGPSFYFDYWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHT
9. 5A6HC (VH-CH1) (дикий тип) (SEQ ID NO:9)
EVKLEESGGGLVQPGGSMKLSCVASGFTFSDAWMDWVRQSPERGLEWVAEIRSKPNNHATYYAESVKGRFTISRDDSKSSVYLQMTSLRPEDTGIYYCTHFDYWGQGTTLTVSSAKTTGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHT
10. 5A6HC121C (SEQ ID NO:10)
EVKLEESGGGLVQPGGSMKLSCVASGFTFSDAWMDWVRQSPERGLEWVAEIRSKPNNHATYYAESVKGRFTISRDDSKSSVYLQMTSLRPEDTGIYYCTHFDYWGQGTTLTVSS C KTTGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHT
11. 5A6LC (дикий тип) (SEQ ID NO:11)
DIQMTQSPSSLSASLGERVSLTCRASQEISGYLSWFQQKPDGTIKRLIYAASALDSGVPKRFSGSWSGSDYSLTISSLESEDFADYYCLQYVSYPLTFGAGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
12. 5A6LC110Cys (SEQ ID NO:12)
DIQMTQSPSSLSASLGERVSLTCRASQEISGYLSWFQQKPDGTIKRLIYAASALDSGVPKRFSGSWSGSDYSLTISSLESEDFADYYCLQYVSYPLTFGAGTKVEIKRT C AAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
13. 22E7HC (VH-CH1) (дикий тип) (SEQ ID NO:13)
EVKLVESGGGLVKPGGSLKLSCAASGFTFSSYGMSWVRQTPEKRLEWVATISGGNNYTFYPDNLKGRFTISRDNAKNILYLQISSLRSVDTALYYCASLWYRASFAYWGQGTLVTVSSAKTTGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHT
14. 22E7HC121C (SEQ ID NO:14)
EVKLVESGGGLVKPGGSLKLSCAASGFTFSSYGMSWVRQTPEKRLEWVATISGGNNYTFYPDNLKGRFTISRDNAKNILYLQISSLRSVDTALYYCASLWYRASFAYWGQGTLVTVSS C KTTGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHT
15. 22E7LC (дикий тип) (SEQ ID NO:15)
DIMMTQSPSSMYASLGERVTITCKASQDINSYLSWFQQKPGKSPKTLISRANRLVDGVPSRFSGSGSGQDYSLTISSLEYEDMGIYYCLQYDDFPFTFGGGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
16. 22E7LC110Cys (SEQ ID NO:16)
DIMMTQSPSSMYASLGERVTITCKASQDINSYLSWFQQKPGKSPKTLISRANRLVDGVPSRFSGSGSGQDYSLTISSLEYEDMGIYYCLQYDDFPFTFGGGTKVEIKRT C AAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
17. D1-5HC (VH-CH1) (дикий тип) (SEQ ID NO:17)
EVQLVESGGGLVQPGGSLRLSCAASGFTFTGNWIHWVRQAPGKGLEWVGEISPSGGYTDYADSVKGRFTISADTSKNTAYLQMNSLRAEDTAVYYCARESRVSYEAAMDYWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTH
18. D1-5LC (дикий тип) (SEQ ID NO:18)
DIQMTQSPSSLSASVGDRVTITCRASQDVSTAVAWYQQKPGKAPKLLIYSASFLYSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSYPTPYTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
19. D1-5LC110Cys (SEQ ID NO:19)
DIQMTQSPSSLSASVGDRVTITCRASQDVSTAVAWYQQKPGKAPKLLIYSASFLYSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSYPTPYTFGQGTKVEIKRT C AAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
20. C3-101HC (VH-CH1) (дикий тип) (SEQ ID NO:20)
EVQLVESGGGLVQPGGSLRLSCAASGFTFSNYWISWVRQAPGKGLEWVGTINPYSGATDYADSVKGRFTISADTSKNTAYLQMNSLRAEDTAVYYCARLAVGVFANRYFDYWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTH
21. C3-101LC (дикий тип) (SEQ ID NO:21)
DIQMTQSPSSLSASVGDRVTITCRASQDVSTAVAWYQQKPGKAPKLLIYSASFLYSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSYTTPRTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
22. C3-101LC110Cys (SEQ ID NO:22)
DIQMTQSPSSLSASVGDRVTITCRASQDVSTAVAWYQQKPGKAPKLLIYSASFLYSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSYTTPRTFGQGTKVEIKRT C AAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
Поскольку сконструированные антитела с цистеиновыми заменами отбирают так, чтобы они сохраняли способность связывания антигена соответствующих им эквивалентов исходного антитела дикого типа, они способны специфически связывать антигены. Такие антигены включают, например, опухолесвязанные антигены (TAA), рецепторные белки поверхности клеток и другие молекулы поверхности клеток, трансмембранные белки, сигнальные белки, регулирующие выживаемость клеток факторы, регулирующие пролиферацию клеток факторы, молекулы, связанные с развитием или дифференцировкой тканей (например, как известно или как предполагают, вносящие в них функциональный вклад), лимфокины, цитокины, молекулы, вовлеченные в регуляцию клеточного цикла, молекулы, вовлеченные в васкулогенез и молекулы, связанные с ангиогенезом (например, как известно или как предполагают, вносящие в него функциональный вклад). Опухолесвязанный антиген может представлять собой фактор кластера дифференцировки (т.е., CD белок). Антиген, с которым способно связываться сконструированное антитело с цистеиновыми заменами, может быть членом подгруппы одной из вышеупомянутых категорий, где другая подгруппа(подгруппы) указанной категории содержит другие молекулы/антигены, обладающие отличной характеристикой (по отношению к интересующему антигену).
Исходное антитело может представлять собой также гуманизированное антитело, выбранное из huMAb4D5-1, huMAb4D5-2, huMAb4D5-3, huMAb4D5-4, huMAb4D5-5, huMAb4D5-6, huMAb4D5-7 и huMAb4D5-8 (Трастузумаб, ГЕРЦЕПТИН®), как описано в таблице 3 патента США No. 5821337, содержание которого конкретно приведено в настоящем документе в качестве ссылки; антитела гуманизированное 520C9 (WO 93/21319) и гуманизированное 2C4.
МУЛЬТИФУНКЦИОНАЛЬНЫЕ МУЛЬТИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА И АНАЛОГИ АНТИТЕЛ
Мультиспецифические антитела и аналоги антител можно синтезировать с модифицированными кросслинкерами, так что дополнительные функциональные группы можно присоединять к мультиспецифическому антителу или аналогу антитела. Модифицированные кросслинкеры позволяют присоединение любой реакционноспособной по отношению к сульфгидрилу группы. В одном из вариантов осуществления N-сукцинимидил-S-ацетилтиоацетат (SATA) присоединяют к бис-малеинимиду для получения бис-малеимидоацетилтиоацетата (BMata). После снятия защиты маскированной тиоловой группы можно присоединять любую функциональную группу, обладающую реакционноспособной по отношению к сульфгидрилу (или реакционноспособной по отношению к тиолу) группой.
Характерные реакционноспособные по отношению к тиолу реагенты включают мультифункциональный линкерный реагент, реагент со связывающей, т.е. аффинной, меткой (например, биотин-линкерный реагент), метку для детекции (например, флуорофорный реагент), реагент для иммобилизации на твердой фазе (например, SEPHAROSE™, полистирол или стекло) или промежуточное соединение лекарственное средство-линкер. Одним из примеров реакционноспособного по отношению к тиолу реагента является N-этилмалеинимид (NEM). Можно проводить дополнительную реакцию таких мультиспецифических антител или аналогов антител, содержащих модифицированные кросслинкеры, с реагентом с группой лекарственного средства или с другой меткой. Реакцией мультиспецифического антитела или аналога антитела с промежуточным соединением лекарственное средство-линкер получают конъюгат мультиспецифического антитела с лекарственным средством или конъюгат аналога антитела с лекарственным средством, соответственно.
Такой способ можно использовать для конъюгации других реакционноспособных по отношению к тиолу средств, в которых реакционноспособная группа представляет собой, например, малеинимид, иодацетамид, пиридилдисульфид, или другой реакционноспособный по отношению к тиолу партнер для конъюгации (Haugland, 2003, Molecular Probes Handbook of Fluorescent Probes and Research Chemicals, Molecular Probes, Inc.; Brinkley, 1992, Bioconjugate Chem. 3:2; Garman, 1997, Non-Radioactive Labelling: A Practical Approach, Academic Press, London; Means (1990) Bioconjugate Chem. 1:2; Hermanson, G. in Bioconjugate Techniques (1996) Academic Press, San Diego, pp. 40-55, 643-671). Партнер может представлять собой цитотоксическое средство (например, токсин, такой как доксорубицин или токсин коклюша), флуорофор, такой как флуоресцентный краситель, подобный флуоресцеину или родамину, хелатирующий агент для получения изображений или металлсодержащее радиотерапевтическое средство, пептидильную или непептидильную метку или метку для детекции, или модифицирующее выведение средство, такое как различные изомеры полиэтиленгликоля, пептид, связывающий третий компонент, или другой углевод или липофильное средство.
Можно проводить также реакцию последовательности альбуминсвязывающего пептида (ABP) (Dennis et al. (2002) «Albumin Binding As A General Strategy For Improving The Pharmacokinetics Of Proteins» J Biol Chem. 277:35035-35043; WO 01/45746) с мультиспецифическими антителами или аналогами антител, имеющими модифицированные кросслинкеры. Характерные последовательности ABP описаны в: (i) Dennis et al (2002) J Biol Chem. 277:35035-35043 в таблицах III и IV, страница 35038; (ii) US 20040001827 в SEQ ID NO:9-22; и (iii) WO 01/45746 на страницах 12-13, в SEQ ID NO:z1-z14.
МУТАГЕНЕЗ
ДНК, кодирующую вариант аминокислотной последовательности исходного полипептида, получают множеством способов, известных в данной области. Эти способы включают, но без ограничения, получение посредством сайт-специфического (или опосредованного олигонуклеотидом) мутагенеза, ПЦР-мутагенеза и кассетного мутагенеза ранее полученной ДНК, кодирующей полипептид. Варианты рекомбинантных антител можно также конструировать посредством манипуляций с рестрикционными фрагментами или посредством ПЦР с удлинением перекрывающихся фрагментов с использованием синтетических олигонуклеотидов. Праймеры для мутагенеза кодируют замену(замены) кодонов на кодоны для цистеина. Общепринятые способы мутагенеза можно использовать для получения ДНК, кодирующей такие мутантные сконструированные антитела с цистеиновыми заменами. Общее руководство можно найти в Sambrook et al Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1989; и Ausubel et al Current Protocols in Molecular Biology, Greene Publishing and Wiley-Interscience, New York, N.Y., 1993.
Сайт-специфический мутагенез является одним из способов получения вариантов с заменами, т.е. мутантных белков. Этот способ хорошо известен в данной области (см., например, Carter (1985) et al Nucleic Acids Res. 13:4431-4443; Ho et al (1989) Gene (Amst.) 77:51-59; и Kunkel et al (1987) Proc. Natl. Acad. Sci. USA 82:488). Кратко, при проведении сайт-специфического мутагенеза ДНК, исходную ДНК изменяют, сначала проводя гибридизацию олигонуклеотида, кодирующего желательную мутацию, с одной цепью такой исходной ДНК. После гибридизации используют ДНК-полимеразу для синтеза полной второй цепи с использованием прогибридизовавшегося олигонуклеотида в качестве праймера, и с использованием одной цепи исходной ДНК в качестве матрицы. Таким образом олигонуклеотид, кодирующий желательную мутацию, включают в полученную двухцепочечную ДНК. Сайт-специфический мутагенез можно проводить в гене, экспрессирующем белок, подлежащий мутагенезу, в экспрессирующей плазмиде, и полученную плазмиду можно секвенировать для подтверждения вставки желательных мутаций замены на цистеин (Liu et al. (1998) J. Biol. Chem. 273:20252-20260). Способы и форматы сайт-специфического мутагенеза включают коммерчески доступные способы и форматы, например, набор для множественного сайт-специфического мутагенеза QuikChange® (Stratagene, La Jolla, CA).
ПЦР-мутагенез также подходит для получения вариантов аминокислотной последовательности исходного полипептида. См. Higuchi, (1990) in PCR Protocols, pp.177-183, Academic Press; Ito et al (1991) Gene 102:67-70; Bernhard et al (1994) Bioconjugate Chem. 5: 126-132; и Vallette et al (1989) Nuc. Acids Res. 17:723-733. Кратко, когда малые количества ДНК-матрицы используют в качестве исходного материала для ПЦР, праймеры, которые немного отличаются по последовательности от соответствующей области в ДНК-матрице, можно использовать для получения относительно больших количеств специфического фрагмента ДНК, отличающегося от последовательности матрицы только в положениях, в которых праймеры отличаются от матрицы.
Другой способ получения вариантов, кассетный мутагенез, основан на способе, описанном Wells et al. (1985) Gene 34:315-323. Исходный материал представляет собой плазмиду (или другой вектор), содержащий ДНК исходного полипептида, подлежащего мутагенезу. Идентифицируют кодон(ы) в исходной ДНК, подлежащие мутагенезу. Должны присутствовать участки для уникальной рестрикционной эндонуклеазы с каждой стороны идентифицированного участка(участков) мутации. Если таких участков рестрикции не существует, их можно получить с использованием вышеописанного способа опосредованного олигонуклеотидами мутагенеза для введения их в подходящие положения ДНК исходного полипептида. Плазмидную ДНК разрезают в этих участках, чтобы линеаризовать ее. Двухцепочечный олигонуклеотид, кодирующий последовательность ДНК между участками рестрикции, но содержащий желательную мутацию(мутации), синтезируют с использованием общепринятых способов, когда две цепи олигонуклеотида синтезируют по отдельности и затем гибридизуют вместе с использованием общепринятых способов. Этот двухцепочечный олигонуклеотид обозначают кассетой. Эту кассету конструируют с наличием 5'- и 3'-концов, совместимых с концами линеаризованной плазмиды, так что ее можно напрямую лигировать в плазмиду. Эта плазмида теперь содержит последовательность ДНК с мутацией. Мутантную ДНК, содержащую закодированные цистеиновые замены, можно подтверждать секвенированием ДНК.
Отдельные мутации получают также направляемым олигонуклеотидами мутагенезом с использованием двухцепочечной плазмидной ДНК в качестве матрицы, посредством основанного на ПЦР мутагенеза (Sambrook and Russel, (2001) Molecular Cloning: A Laboratory Manual, 3rd edition; Zoller et al (1983) Methods Enzymol. 100:468-500; Zoller, M.J. and Smith, M. (1982) Nucl. Acids Res. 10:6487-6500).
Олигонуклеотиды получают способом фосфорамидитного синтеза (US 4415732; US 4458066; Beaucage, S. and Iyer, R. (1992) «Advances in the synthesis of oligonucleotides by the phosphoramidite approach», Tetrahedron 48:2223-2311). Фосфорамидитный способ включает циклическое добавление нуклеотидных мономерных звеньев с реакционноспособной 3'-фосфорамидитной группой к олигонуклеотидной цепи, растущей на твердой подложке, состоящей из стекла с контролируемым размером пор или полистирола с высокой степенью сшивки, и, наиболее часто, в направлении от 3' к 5', где 3'-концевой нуклеозид присоединяют к твердой подложке в начале синтеза (US 5047524; US 5262530). Способ обычно осуществляют на практике с использованием автоматических, коммерчески доступных синтезаторов (Applied Biosystems, Foster City, CA). Олигонуклеотиды можно химически метить с помощью неизотопных групп для детекции, захвата, стабилизации или других целей (Andrus, A. «Chemical methods for 5' non-isotopic labelling of PCR probes and primers» (1995) in PCR 2: A Practical Approach, Oxford University Press, Oxford, pp. 39-54; Hermanson, G. in Bioconjugate Techniques (1996) Academic Press, San Diego, pp. 40-55, 643-671; Keller, G. and Manak, M. in DNA Probes Second Edition (1993), Stockton Press, New York, pp. 121-23).
Детекцию реакционноспособных групп цистеина в антителах можно проводить с использованием формата фагового ELISA (PHESELECTOR [фаговый ELISA для отбора реакционноспособных тиолов]), как описано в публикации патента США No. 2007/0092940 и Junutula, J. R., et al., J Immunol Methods 332(l-2):41-52 (2008).
ЭКСПРЕССИЯ И ОЧИСТКА БЕЛКА
ДНК, кодирующую антитела или фрагменты антител, легко выделяют и секвенируют с использованием общепринятых способов (например, с использованием олигонуклеотидных зондов, способных специфически связываться с генами, кодирующими тяжелые и легкие цепи антител мыши). Клетки гибридомы могут служить источником такой ДНК. После выделения ДНК можно помещать в экспрессирующие векторы, которыми затем трансфицируют клетки-хозяева, такие как клетки E. coli, клетки обезьяны COS, клетки яичников китайского хомяка (CHO) или другие клетки-хозяева млекопитающих, такие как клетки миеломы (US 5807715; US 2005/0048572; US 2004/0229310), которые в ином случае не продуцируют белка антитела, для получения синтеза моноклональных антител в рекомбинантных клетках-хозяевах. Обзорные статьи по рекомбинантной экспрессии в бактериях ДНК, кодирующей антитело, включают Skerra et al (1993) Curr. Opinion in Immunol. 5:256-262 и Pluckthun (1992) Immunol. Revs. 130: 151-188.
Сконструированные антитела с цистеиновыми заменами, например, ТиоFab, с неспаренными остатками Cys с высокой реакционной способностью, можно получать посредством: (i) экспрессии в бактериальной системе, например, E. coli, или в системе культуры клеток млекопитающих (WO 01/00245), например, клеток яичников китайского хомяка (CHO); и (ii) очистки с использованием общепринятых способов очистки белка (Lowman et al (1991) J. Biol. Chem. 266(17): 10982-10988).
Характерные способы очистки включают: фракционирование на иммуноаффинных или ионообменных колонках, осаждение этанолом; обращеннофазовую HPLC; хроматографию на силикагелевой или катионообменной смоле, такой как DEAE; хроматофокусирование; SDS-PAGE; осаждение сульфатом аммония и гель-фильтрацию с использованием, например, Sephadex G-75.
В одном из аспектов белок A иммобилизуют на твердой фазе для иммуноаффинной очистки полноразмерных продуктов антител по изобретению. Белок A представляет собой белок клеточной стенки 41 кДа из Staphylococcus aureus, с высокой аффинностью связывающий Fc-область антител. Lindmark et al (1983) J. Immunol. Meth. 62: 1-13. Твердая фаза, на которой иммобилизован белок A, предпочтительно, представляет собой колонку, содержащую стеклянную или силикагелевую поверхность, более предпочтительно, стеклянную колонку с контролируемым размером пор или колонку с кремниевой кислотой. Для некоторых применений колонку покрывают реагентом, таким как глицерин, для возможного предупреждения неспецифической адгезии загрязнений.
В качестве первой стадии очистки препарат, полученный из культуры клеток, как описано выше, наносят на твердую фазу с иммобилизованным белком A, чтобы позволить специфическое связывание интересующего антитела с белком A. Затем твердую фазу промывают для удаления загрязнений, неспецифически связавшихся с твердой фазой. Интересующее антитело можно выделять с твердой фазы посредством элюции в раствор, содержащий хаотропный агент или мягкий детергент. Иллюстративные хаотропные агенты и мягкие детергенты включают, но без ограничения, гуанидин-HCl, мочевину, перхлорат лития, Аргинин, Гистидин, SDS (додецилсульфат натрия), Твин, Тритон и NP-40, которые все являются коммерчески доступными. Разведение антитела в растворе, содержащем хаотропный агент или мягкий детергент, после элюции с колонки (например, колонки mAbSure) поддерживает стабильность антитела после элюции и позволяет дальнейшие манипуляции, как описано в настоящем документе.
МЕЧЕНЫЕ МУЛЬТИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА И АНАЛОГИ АНТИТЕЛ
Мультиспецифические антитела и аналоги антител по изобретению, в частности синтезированные с модифицированными кросслинкерами, обладающими свободной сульфгидрильной группой, можно конъюгировать с любой группой метки, которую можно ковалентно присоединять к антителу посредством реакционноспособной тиоловой группы цистеина (Singh et al (2002) Anal. Biochem. 304: 147-15; Harlow E. и Lane, D. (1999) Using Antibodies: A Laboratory Manual, Cold Springs Harbor Laboratory Press, Cold Spring Harbor, NY; Lundblad R.L. (1991) Chemical Reagents for Protein Modification, 2nd ed. CRC Press, Boca Raton, FL). Присоединенная метка может функционировать для: (i) обеспечения поддающегося детекции сигнала; (ii) взаимодействия со второй меткой для модификации поддающегося детекции сигнала, обеспечиваемого первой или второй меткой, например, для получения FRET (резонансного переноса энергии флуоресценции); (iii) стабилизации взаимодействий или увеличения аффинности связывания с антигеном или лигандом; (iv) влияния на подвижность, например, электрофоретическую подвижность или клеточную проницаемость, посредством заряда, гидрофобности, формы или других физических параметров, или (v) предоставления связывающей группы, для модуляции аффинности лиганда, связывания антитело/антиген, или образования комплексных ионов.
Меченные мультиспецифические антитела могут быть полезными для диагностических анализов, например, для детекции экспрессии интересующего антигена в специфических клетках, тканях или сыворотке. Для диагностических применений антитело, как правило, метят поддающейся детекции группой. Доступно множество меток, которые можно в общем сгруппировать по следующим категориям:
(a) Радиоизотопы (радиоактивные изотопы), такие как 3H, 11C, 14C, 18F, 32P, 35S, 64Cu, 68Ga, 86Y, 99Tc, 111In, 123I, 124I, 125I, 131I, 133Xe, 177Lu, 211At или 213Bi. Меченные радиоизотопами антитела являются полезными в экспериментах получения изображений, направленных на рецепторы. Антитело можно метить с помощью реагентов с лигандами, которые связывают, образуют хелат или другой комплекс с радиоизотопом металла, где реагент является реакционноспособным по отношению к сконструированному тиолу антитела, с использованием способов, описанных в Current Protocols in Immunology, Volumes 1 и 2, Coligen et al., Ed. Wiley-Interscience, New York, NY, Pubs. (1991). Хелатирующие лиганды, которые могут образовывать комплексы с ионом металла, включают DOTA, DOTP, DOTMA, DTPA и TETA (Macrocyclics, Dallas, TX). Радиоактивные изотопы можно нацеливать посредством образования комплексов с конъюгатами антитело-лекарственное средство по изобретению (Wu et al (2005) Nature Biotechnology 23(9): 1137-1146).
Металл-хелатные комплексы, подходящие в качестве меток для антитела для экспериментов по получению изображений, описаны в: патентах США 5342606; 5428155; 5316757; 5480990; 5462725; 5428139; 5385893; 5739294; 5750660; 5834456; Hnatowich et al (1983) J. Immunol. Methods 65:147-157; Meares et al (1984) Anal. Biochem. 142:68-78; Mirzadeh et al (1990) Bioconjugate Chem. 1:59-65; Meares et al (1990) J. Cancer1990, Suppl. 10:21-26; Izard et al (1992) Bioconjugate Chem. 3:346-350; Nikula et al (1995) Nucl. Med. Biol. 22:387-90; Camera et al (1993) Nucl. Med. Biol. 20:955-62; Kukis et al (1998) J. Nucl. Med. 39:2105-2110; Verel et al (2003) J. Nucl. Med. 44:1663-1670; Camera et al (1994) J. Nucl. Med. 21:640-646; Ruegg et al (1990) Cancer Res. 50:4221-4226; Verel et al (2003) J. Nucl. Med. 44:1663-1670; Lee et al (2001) Cancer Res. 61:4474-4482; Mitchell, et al (2003) J. Nucl. Med. 44:1105-1112; Kobayashi et al (1999) Bioconjugate Chem. 10:103-111; Miederer et al (2004) J. Nucl. Med. 45:129-137; DeNardo et al (1998) Clinical Cancer Research 4:2483-90; Blend et al (2003) Cancer Biotherapy & Radiopharmaceuticals 18:355-363; Nikula et al (1999) J. Nucl. Med. 40:166-76; Kobayashi et al (1998) J. Nucl. Med. 39:829-36; Mardirossian et al (1993) Nucl. Med. Biol. 20:65-74; Roselli et al (1999) Cancer Biotherapy & Radiopharmaceuticals, 14:209-20.
(b) Флуоресцентные метки, такие как хелаты редкоземельных элементов (хелаты европия), типы флуоресцеина, включая FITC, 5-карбоксифлуоресцеин, 6-карбоксифлуоресцеин; типы родамина, включая TAMRA; данзил; лиссамин; цианины; фикоэритрины; Техасский Красный; и их аналоги. Флуоресцентные метки можно конъюгировать с антителами с использованием способов, описанных, например, в Current Protocols in Immunology, выше. Реагенты с флуоресцентными красителями и флуоресцентной меткой включают реагенты, коммерчески доступные из Invitrogen/Molecular Probes (Eugene, OR) и Pierce Biotechnology, Inc. (Rockford, IL).
(c) Различные фермент-субстратные метки доступны или описаны (US 4275149). Фермент, как правило, катализирует химическое изменение хромогенного субстрата, которое можно измерять с использованием различных способов. Например, фермент может катализировать изменение окраски субстрата, которое можно измерять спектрофотометрически. Альтернативно, фермент может изменять флуоресценцию или хемилюминесценцию субстрата. Способы количественного определения изменения флуоресценции описаны выше. Хемилюминесцентный субстрат становится электронно-возбужденным посредством химической реакции и может затем испускать свет, который можно измерять (например, с использованием хемилюминометра) или передавать энергию акцептору флуоресценции. Примеры ферметнтых меток включают люциферазы (например, люциферазу светлячков и бактериальную люциферазу; US 4737456), люциферин, 2,3-дигидрофталазиндионы, малатдегидрогеназу, уриназу, пероксидазу, такую как пероксидаза хрена (HRP), щелочную фосфатазу (AP), β-галактозидазу, глюкоамилазу, лизоцим, оксидазы сахаридов (например, оксидазу глюкозы, оксидазу галактозы и глюкоза-6-фосфатдегидрогеназу), гетероциклические оксидазы (такие как уриказа и ксантиноксидаза), лактопероксидазу, микропероксидазу и т.п. Способы конъюгации ферментов с антителами описаны в O'Sullivan et al (1981) «Methods for the Preparation of Enzyme-Antibody Conjugates for use in Enzyme Immunoassay», in Methods in Enzym. (ed J. Langone & H. Van Vunakis), Academic Press, New York, 73: 147-166.
Примеры комбинаций фермент-субстрат включают, например:
(i) пероксидазу хрена (HRP) с перекисью водорода в качестве субстрата, где перекись водорода окисляет предшественник красителя (например, ортофенилендиамин (OPD) или 3,3',5,5'-тетраметилбензидингидрохлорид (TMB));
(ii) щелочную фосфатазу (AP) с пара-нитрофенилфосфатом в качестве хромогенного субстрата; и
(iii) β-D-галактозидазу (β-D-Gal) с хромогенным субстратом (например, п-нитрофенил-β-D-галактозидазой) или флуорогенным субстратом 4-метилумбеллиферил-β-D-галактозидазой.
Множество других комбинаций фермент-субстрат доступно специалистам в данной области. Общий обзор см. в US 4275149 и US 4318980.
Метку можно опосредованно конъюгировать с мультиспецифическим антителом или аналогом антитела. Например, антитело можно конъюгировать с биотином и любую метку из трех широких категорий, указанных выше, можно конъюгировать с авидином или стрептавидином, или наоборот. Биотин избирательно связывается со стрептавидином и, таким образом, метку можно конъюгировать с антителом данным опосредованным образом. Альтернативно, для достижения опосредованной конъюгации метки с вариантом полипептида, вариант полипептида конъюгируют с небольшим гаптеном (например, дигоксином) и одну из различных типов меток, указанных выше, конъюгируют с полипептидным вариантом против гаптена (например, антителом против дигоксина). Таким образом можно достигать опосредованной конъюгации метки с вариантом полипептида (Hermanson, G. (1996) in Bioconjugate Techniques Academic Press, San Diego).
Такие меченые мультиспецифические антитела или меченые аналоги антител можно использовать в любом известном способе анализа, таком как ELISA, анализы конкурентного связывания, прямом и непрямом сэндвич-анализах, и анализах иммунопреципитации (Zola, (1987) Monoclonal Antibodies: A Manual of Techniques, pp.147-158, CRC Press, Inc.).
Метка для детекции может быть подходящей для локализации, визуализации и количественной оценки события связывания или распознавания. Меченые мультиспецифические антитела и меченые аналоги антител по изобретению могут детектировать рецепторы поверхности клеток. Другим применением для меченных поддающейся детекции меткой антител является способ иммунного связывания с помощью бусин, включающий конъюгацию бусин с флуоресцентно меченным антителом и детекцию сигнала флуоресценции при связывании лиганда. В сходных способах детекции связывания используют эффект поверхностного плазмонного резонанса (SPR) для измерения и детекции взаимодействий антитело-антиген.
Такие метки для детекции, как флуоресцентные красители и хемилюминесцентные красители (Briggs et al (1997) «Synthesis of Functionalised Fluorescent Dyes and Their Coupling to Amines and Amino Acids», J. Chem. Soc, Perkin-Trans. 1:1051-1058), обеспечивают поддающийся детекции сигнал, и являются общепринятыми для мечения антител, предпочтительно, со следующими свойствами: (i) меченое антитело должно производить очень сильный сигнал с низким фоном, так что небольшие количества антител можно с большой чувствительностью детектировать как в бесклеточных, так и в основанных на клетках анализах; и (ii) меченое антитело должно быть фотостабильным, так чтобы флуоресцентный сигнал можно было наблюдать, мониторировать и регистрировать без значительного фото-обесцвечивания. Для применений, включающих связывание на поверхности клетки меченого антитела с мембранами или поверхностями клеток, особенно живых клеток, метки как правило (iii) обладают хорошей растворимостью в воде для достижения эффективных концентраций конъюгата и чувствительности детекции и (iv) являются нетоксичными для живых клеток, так чтобы не нарушать нормальных процессов метаболизма клеток или не вызывать преждевременной гибели клеток.
Прямую количественную оценку интенсивности клеточной флуоресценции и подсчет событий флуоресцентного мечения, например, связывания на поверхности клеток конъюгатов пептид-краситель, можно проводить в системе (FMAT® 8100 HTS System, Applied Biosystems, Foster City, Calif.), автоматизирующей нерадиоактивные анализы смешивания и считывания с живыми клетками или бусинами (Miraglia, «Homogeneous cell- and bead-based assays for high throughput screening using fluorometric microvolume assay technology», (1999) J. of Biomolecular Screening 4: 193-204). Применения меченых антител включают также анализы связывания с рецептором на поверхности клеток, анализы иммунного связывания, твердофазные иммунофлуоресцентные анализы (FLISA), анализы расщепления каспазой (Zheng, «Caspase-3 controls both cytoplasmic and nuclear events associated with Fas-mediated apoptosis in vivo», (1998) Proc. Natl. Acad. Sci. USA 95:618-23; US 6372907), анализы апоптоза (Vermes, «A novel assay for apoptosis. Flow cytometric detection of phosphatidylserine expression on early apoptotic cells using fluorescein labelled Annexin V» (1995) J. Immunol. Methods 184:39-51) и анализы цитотоксичности. Способ флуориметрического анализа в микрообъемах можно использовать для идентификации повышающей или понижающей регуляции посредством молекулы, нацеленной на поверхность клеток (Swartzman, «A homogeneous and multiplexed immunoassay for high-throughput screening using fluorometric microvolume assay technology», (1999) Anal. Biochem. 271:143-51).
Меченые мультиспецифические антитела и меченые аналоги антител по изобретению являются подходящими в качестве биомаркеров и зондов для получения изображений различными методами и способами получения биомедицинских и молекулярных изображений, такими как: (i) МРТ (магнитно-резонансная томография); (ii) МикроКТ (компьютерная томография); (iii) SPECT (однофотонная эмиссионная компьютерная томография); (iv) ПЭТ (позитронная эмиссионная томография) Chen et al (2004) Bioconjugate Chem. 15:41-49; (v) биолюминесценция; (vi) флуоресценция; и (vii) ультразвук. Иммуносцинтиография представляет собой способ получения изображений, в котором антитела, меченные радиоактивными веществами, вводят пациенту - животному или человеку, и получают изображение в участках организма, где локализовано антитело (US 6528624). Биомаркеры для получения изображений можно объективно измерять и оценивать в качестве показателя нормальных биологических процессов, патогенных процессов, или фармакологических ответов на терапевтическое вмешательство. Биомаркеры могут принадлежать к нескольким типам: маркеры типа 0 представляют собой маркеры естественного течения заболевания и по длительности проявления коррелируют с известными клиническими показателями, например, оценкой ЯМР синовиального воспаления при ревматоидном артрите; маркеры типа I фиксируют эффект вмешательства вне зависимости от механизма действия, даже несмотря на то, что механизм может не быть связан с клиническим исходом; маркеры типа II функционируют как суррогатные конечные точки, где по изменению биомаркера или по сигналу от биомаркера прогнозируют клиническое преимущество для «подтверждения» намеченного ответа, например, измерение эрозии костной ткани при ревматоидном артрите посредством КТ. Биомаркеры для получения изображений таким образом могут предоставлять фармакодинамическую (PD) терапевтическую информацию относительно: (i) экспрессии белка-мишени, (ii) связывания лекарственного средства с белком-мишенью, т.е., избирательности, и (iii) фармакокинетических данных о выведении и времени полужизни. Преимущества биомаркеров для получения изображений in vivo по сравнению с биомаркерами для лабораторных исследований включают: неинвазивную обработку, количественную оценку целого организма, повторяющиеся введение и оценку, т.е. множественные временные точки, и эффекты, потенциально переносимые от доклинических результатов (для мелких животных) к клиническим результатам (для человека). Для некоторых применений получение изображений биологических объектов заменяет эксперименты на животных или минимизирует количество экспериментов на животных в доклинических исследованиях.
Метки для получения изображений с радиоактивными изотопами включают такие радиоактивные изотопы, как 3H, 11C, 14C, 18F, 32P, 35S, 64Cu, 68Ga, 86Y, 99Tc, 111In, 123I, 124I, 125I, 131I, 133Xe, 177Lu, 211At или 213Bi. Можно получать комплекс иона радиоактивного изотопа металла с хелатирующим линкером, таким как DOTA. Линкерные реагенты, такие как DOTA-малеинимид (4-малеимидобутирамидобензил-DOTA), можно получать реакцией аминобензил-DOTA с 4-малеимидомасляной кислотой (Fluka), активированной изопропилхлорформатом (Aldrich), с последующим использованием способа Axworthy et al (2000) Proc. Natl. Acad. Sci. USA 97(4): 1802-1807). DOTA-малеинимидные реагенты вступают в реакцию со свободным сульфгидрилом модифицированного кросслинкера мультиспецифических антител или аналогов антител по изобретению и обеспечивают наличие на антителе образующего комплексы с металлами лиганда (Lewis et al (1998) Bioconj. Chem. 9:72-86). Реагенты для мечения с хелатирующим линкером, такие как DOTA-NHS (сложный моно(N-гидроксисукцинимидный) эфир 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусной кислоты), являются коммерчески доступными (Macrocyclics, Dallas, TX). Нацеленное на рецепторы получение изображений с помощью меченных радиоактивным изотопом антител может обеспечивать маркер активации пути посредством детекции и количественной оценки возрастающего накопления антител в ткани опухоли (Albert et al (1998) Bioorg. Med. Chem. Lett. 8: 1207-1210). Конъюгированные радиоактивные металлы могут оставаться внутри клеток после лизосомальной деградации.
Способы мечения пептидов хорошо известны. См. Haugland, 2003, Molecular Probes Handbook of Fluorescent Probes and Research Chemicals, Molecular Probes, Inc.; Brinkley, 1992, Bioconjugate Chem. 3:2; Garman, (1997) Non-Radioactive Labelling: A Practical Approach, Academic Press, London; Means (1990) Bioconjugate Chem. 1:2; Glazer et al (1975) Chemical Modification of Proteins. Laboratory Techniques in Biochemistry and Molecular Biology (T. S. Work и E. Work, Eds.) American Elsevier Publishing Co., New York; Lundblad, R. L. and Noyes, C. M. (1984) Chemical Reagents for Protein Modification, Vols. I и II, CRC Press, New York; Pfleiderer, G. (1985) «Chemical Modification of Proteins», Modern Methods in Protein Chemistry, H. Tschesche, Ed., Walter DeGryter, Berlin and New York; и Wong (1991) Chemistry of Protein Conjugation and Cross-linking, CRC Press, Boca Raton, Fla.); De Leon-Rodriguez et al (2004) Chem.Eur. J. 10: 1149-1155; Lewis et al (2001) Bioconjugate Chem. 12:320-324; Li et al (2002) Bioconjugate Chem. 13: 110-115; Mier et al (2005) Bioconjugate Chem. 16:240-237.
Пептиды и белки, меченные двумя группам, флуоресцентным репортером и тушителем в достаточной близости, подвергаются резонансному переносу энергии флуоресценции (FRET). Репортерные группы, как правило, представляют собой флуоресцентные красители, возбуждаемые светом определенной длины волны и переносящие энергию на группу акцептора, или тушителя, с соответствующим сдвигом Стокса для излучения с максимальной яркостью. Флуоресцентные красители включают молекулы с большими ароматическими группами, такие как флуоресцеин и родамин, и их производные. Флуоресцентный репортер может подвергаться частичному или полному тушению группой тушителя в интактном пептиде. При расщеплении пептида пептидазой или протеазой можно измерять поддающееся детекции увеличение флуоресценции (Knight, C. (1995) «Fluorimetric Assays of Proteolytic Enzymes», Methods in Enzymology, Academic Press, 248: 18-34).
Меченые мультиспецифические антитела и меченые аналоги антител по изобретению можно использовать также в качестве средства для аффинной очистки. По этому способу, меченое антитело иммобилизуют на твердой фазе, такой как смола Sephadex или фильтровальная бумага, с использованием способов, хорошо известных в данной области. Иммобилизованное антитело приводят в контакт с образцом, содержащим антиген, подлежащий очистке, и затем подложку промывают подходящим растворителем, удаляющим в основном весь материал образца, за исключением антигена, подлежащего очистке, который является связанным с иммобилизованным вариантом полипептида. Наконец, подложку промывают другим подходящим растворителем, таким как глициновый буфер, pH 5,0, высвобождающим антиген с варианта полипептида.
Реагенты для мечения, как правило, несут реакционноспособную функциональную группу, которая может вступать в реакцию (i) неспосредственно с сульфгидрилом модифицированного кросслинкера с образованием меченого мультиспецифического антитела или меченого аналога антитела, (ii) с линкерным антителом для получения меченого антитела. Реакционноспособные функциональные группы реагентов для мечения включают: малеинимид, галоацетил, сложный эфир иодацетамида и сукцинимидила (например, NHS, N-гидроксисукцинимид), изотиоцианат, сульфонилхлорид, 2,6-дихлортриазинил, сложный эфир пентафторфенила и фосфорамидит, хотя можно использовать также другие функциональные группы.
Характерной реакционноспособной функциональной группой является N-гидроксисукцинимидиловый сложный эфир (NHS) карбоксильной группы заместителя поддающейся детекции метки, например, биотина или флуоресцентного красителя. NHS сложный эфир метки может быть заранее полученным, выделенным, очищенным и/или охарактеризованным, или он может образовываться in situ и вступать в реакцию с нуклеофильной группой антитела. Как правило, карбоксильную форму метки активируют посредством реакции с некоторой комбинацией карбодиимидного реагента, например, дициклогексилкарбодиимида, диизопропилкарбодиимида или урониевого реагента, например, TSTU (тетрафторборат (O-(N-сукцинимидил)-N,N,N',N'-тетраметилурония), HBTU (гексафторфосфат O-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония), или HATU (гексафторфосфат O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония), активатора, такого как 1-гидроксибензотриазол (HOBt), и N-гидроксисукцинимида для получения NHS сложного эфира метки. В некоторых случаях, метку и антитело можно связывать активацией метки in situ и реакцией с антителом с образованием конъюгата метка-антитело в одну стадию. Другие реагенты для активации и связывания включают TBTU (гексафторфосфат 2-(1H-бензотриазо-1-ил)-1-1,3,3-тетраметилурония), TFFH (2-фтор-гексафторфосфат N,N',N'',N'''-тетраметилурония), PyBOP (гексафторфосфат бензотриазол-1-ил-окси-трис-пирролидинофосфония), EEDQ (2-этокси-1-этоксикарбонил-1,2-дигидрохинолин), DCC (дициклогексилкарбодиимид); DIPCDI (диизопропилкарбодиимид), MSNT (1-(мезитилен-2-сульфонил)-3-нитро-1H-1,2,4-триазол и арилсульфонилгалогениды, например, триизопропилбензолсульфонилхлорид.
АЛЬБУМИНСВЯЗЫВАЮЩИЙ ПЕПТИД (ABP)-СОДЕРЖАЩИЕ МУЛЬТИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА И АНАЛОГИ АНТИТЕЛ
Связывание с белком плазмы может быть эффективным способом улучшения фармакокинетических свойств короткоживущих молекул. Альбумин является наиболее распространенным белком в плазме. Связывающие сывороточный альбумин пептиды (ABP) могут изменять фармакодинамику слитых с ними активных доменов белков, включая изменение поглощения, проникновения и диффузии в тканях. Эти фармакодинамические параметры можно регулировать специфическим выбором подходящей последовательности связывающего сывороточный альбумин пептида (US 20040001827). Серию альбуминсвязывающих пептидов идентифицировали скринингом фагового дисплея (Dennis et al. (2002) «Albumin Binding As A General Strategy For Improving The Pharmacokinetics Of Proteins» J Biol Chem. 277:35035-35043; WO 01/45746). Соединения по изобретению включают ABP последовательности, объясняемые в: (i) Dennis et al (2002) J Biol Chem. 277:35035-35043 в таблицах III и IV, страница 35038; (ii) US 20040001827 в [0076] SEQ ID NO:9-22; и (iii) WO 01/45746 на страницах 12-13, SEQ ID NO:z1-z14.
Альбуминсвязывающий пептид (ABP)-содержащие мультиспецифические антитела синтезировали посредством реакции малеимидо-ABP с мультиспецифическим антителом или аналогом антитела, содержащим модифицированный кросслинкер, несущий свободную сульфгидрильную группу.
Характерные последовательности альбуминсвязывающего пептида включают, но без ограничения, аминокислотные последовательности, перечисленные в SEQ ID NO:23-27:
CDKTHTGGGSQRLMEDICLPRWGCLWEDDF SEQ ID NO:23
QRLMEDICLPRWGCLWEDDF SEQ ID NO:24
QRLIEDICLPRWGCLWEDDF SEQ ID NO:25
RLIEDICLPRWGCLWEDD SEQ ID NO:26
DICLPRWGCLW SEQ ID NO:27
Последовательности альбуминсвязывающих пептидов (ABP) связывают альбумин множества видов (мыши, крысы, кролика, быка, макака-резуса, бабуина и человека) с Kd (кролик) = 0,3 мкМ. Альбуминсвязывающий пептид не конкурирует с лигандами, как известно, связывающими альбумин, и обладает временем полужизни (T½) у кролика 2,3 час.
КОНЪЮГАТЫ ЛЕКАРСТВЕННОГО СРЕДСТВА
Мультиспецифические антитела и аналоги антител по изобретению, в частности, синтезированные с модифицированными кросслинкерами, обладающими свободной сульфгидрильной группой, можно конъюгировать с любым лекарственным средством, т.е. группой лекарственного средства, которое можно ковалентно присоединять к антителу через реакционноспособную сульфгидрильную группу.
Иллюстративный вариант осуществления соединения - конъюгата антитело-лекарственное средство (ADC) содержит мультиспецифическое антитело или аналог антитела (каждый из которых в последующем обсуждении обозначен как Ab), и группу лекарственного средства (D), где мультиспецифическое антитело или аналог антитела синтезировано с модифицированным кросслинкером, обладающим свободной сульфгидрильной группой (L), и антитело присоединено через свободную сульфгидрильную группу к D; где композиция обладает формулой I:
где p представляет собой 1, 2, 3 или 4. Количество групп лекарственного средства, которые можно конъюгировать посредством реакционноспособной по отношению к тиолу группы линкера с мультиспецифическим антителом или аналогом антитела ограничено количеством реакционноспособных тиолов, введенных способами, описанными в настоящем документе.
Другой иллюстративный вариант осуществления соединения конъюгата антитело-лекарственное средство (ADC) содержит мультиспецифическое антитело или аналог антитела (Ab), альбуминсвязывающий пептид (ABP) и группу лекарственного средства (D), где антитело присоединено к группе лекарственного средства посредством группы линкера (L), и антитело присоединено к альбуминсвязывающему пептиду посредством амидной связи или второй группы линкера; где композиция обладает формулой Ia:
где p представляет собой 1, 2, 3 или 4.
ADC соединения по изобретению включают соединения, полезные благодаря противораковой активности. В частности, соединения содержат антитело, конъюгированное, т.е. ковалентно соединенное посредством линкера с группой лекарственного средства, т.е. токисном. Когда лекарственное средство не является конъюгированным с антителом, лекарственное средство оказывает цитотоксический или цитостатический эффект. Биологическую активность группы лекарственного средства таким образом модулируют посредством конъюгации с антителом. Конъюгаты мультиспецифическое антитело-лекарственное средство и конъюгаты аналог антитела-лекарственное средство (ADC) по изобретению избирательно доставляют эффективную дозу цитотоксического средства к ткани опухоли, посредством чего можно достигать большей избирательности, т.е. более низкой эффективной дозы.
В одном из вариантов осуществления биодоступность ADC по изобретению или внутриклеточного метаболита ADC, улучшена у млекопитающего при сравнении с соединением лекарственного средства, содержащим группу лекарственного средства ADC и лишенным компонента антитела. Биодоступность ADC или внутриклеточного метаболита ADC улучшена у млекопитающего при сравнении с компонентом антитела ADC, лишенным группы лекарственного средства.
ГРУППЫ ЛЕКАРСТВЕННОГО СРЕДСТВА
Группа лекарственного средства (D) конъюгатов антитело-лекарственное средство (ADC) включает любое соединение, фрагмент или группу, оказывающие цитотоксический или цитостатический эффект. Группы лекарственного средства включают: (i) химиотерапевтические средства, которые могут функционировать как ингибиторы микротубулина, ингибиторы митоза, ингибиторы топоизомеразы или интеркалирующие в ДНК средства; (ii) белковые токсины, которые могут функционировать как ферменты; и (iii) радиоактивные изотопы.
Лекарственные средства включают в качестве неограничивающих примеров, майтанзиноид, ауристатин, доластатин, трихотецен, CC1065, калихеамицин и другие эндииновые антибиотики, таксан, антрациклин и стереоизомеры, изостеры, их аналоги или производные.
Соединения майтанзина, подходящие для использования в качестве групп майтанзиноидного лекарственного средства, хорошо известны в данной области, и их можно выделять из природных источников известными способами, получать с использованием способов генной инженерии (см. Yu et al (2002) PROC. NAT. ACAD. SCI. (USA) 99:7968-7973), или майтанзинол и аналоги майтанзинола, полученные известными способами синтеза.
Характерные группы майтанзиноидного лекарственного средства включают группы, обладающие модифицированным ароматическим кольцом, таким как: C-19-дехлоро (US 4256746) (получено восстановлением алюмогидридом лития анзамитоцина P2); C-20-гидрокси (или C-20-деметил) +/-C-19- дехлоро (патенты США No. 4361650 и 4307016) (получено деметилированием с использованием Streptomyces или Actinomyces или отщеплением хлора с использованием LAH); и C-20-деметокси, C-20-ацилокси (-OCOR), +/-дехлоро (Патент США No. 4294757) (получено ацилированием с использованием ацилхлоридов), и группы, обладающие модификациями в других положениях.
Иллюстративные группы майтанзиноидного лекарственного средства включают также группы, обладающие такими модификациями, как: C-9-SH (патент США No. 4424219) (получено реакцией майтанзинола с H2S или P2S5); C-14-алкоксиметил(деметокси/CH2OR)(US 4331598); C-14-гидроксиметил или ацилоксиметил (CH2OH или CH2OAc) (патент США No. 4450254) (получено из Nocardia); C-15-гидрокси/ацилокси (патент США No. 4364866) (получено превращением майтанзинола посредством Streptomyces); C-15-метокси (Патенты США No. 4313946 и 4315929) (выделено из Trewia nudlflora); C-18-N-деметил (патенты США No. 4362663 и 4322348) (получено деметилированием майтанзинола посредством Streptomyces); и 4,5-дезокси (U.S. 4371533) (получено восстановлением майтанзинола трихлоридом титана/LAH). Известно, что многие положения в соединениях майтанзина подходят в качестве положений для связывания, в зависимости от типа связи. Например, для образования сложноэфирной связи подходят все из положения C-3, обладающего гидроксильной группой, положения C-14, модифицированного гидроксиметилом, положения C-15, модифицированного гидроксильной группой, и положения C-20, обладающего гидроксильной группой.
Группа лекарственного средства (D) конъюгатов антитело-лекарственное средство (ADC) формулы I включает майтанзиноиды, обладающие структурой:
 ,
,
где волнистая линия указывает на ковалентное присоединение атома серы D к линкеру (L) конъюгата антитело-лекарственное средство (ADC). R может независимо представлять собой H или C1-C6 алкил, выбранные из метил, этил, 1-пропил, 2-пропил, 1-бутил, 2-метил-1-пропил, 2-бутил, 2-метил-2-пропил, 1-пентил, 2-пентил, 3-пентил, 2-метил-2-бутил, 3-метил-2-бутил, 3-метил-1-бутил, 2-метил-1-бутил, 1-гексил, 2-гексил, 3-гексил, 2-метил-2-пентил, 3-метил-2-пентил, 4-метил-2-пентил, 3-метил-3-пентил, 2-метил-3-пентил, 2,3-диметил-2-бутил и 3,3-диметил-2-бутил. Цепь алкилена, присоединяющая амидную группу к атому серы, может представлять собой метанил, этанил или пропил, т.е. m представляет собой 1, 2 или 3.
Соединения майтанзина ингибируют пролиферацию клеток посредством ингибирования формирования микротрубочек в ходе митоза посредством ингибирования полимеризации белка микротубулина, тубулина (Remillard et al (1975) Science 189: 1002-1005). Майтанзин и майтанзиноиды обладают высокой цитотоксичностью, но их клиническое применение в терапии злокачественных опухолей сильно ограничено их тяжелыми системными побочными эффектами, в первую очередь относящуюся к их слабой избирательности по отношению к опухолям. Клинические исследования с майтанзином прекращены из-за тяжелых неблагоприятных эффектов на центральную нервную систему и желудочно-кишечную систему (Issel et al (1978) Can. Treatment. Rev. 5: 199-207).
Группы майтанзиноидного лекарственного средства являются привлекательными группами лекарственного средства в конъюгатах антитело-лекарственное средство, поскольку они являются: (i) относительно доступными для получения посредством ферментации или химической модификации, дериватизации продуктов ферментации, (ii) поддающимися дериватизации с помощью функциональных групп, подходящими для конъюгации через не относящиеся к дисульфидным линкерам к антителам, (iii) стабильными в плазме, и (iv) эффективными против множества линий клеток опухоли (US 2005/0169933; WO 2005/037992; патент США No. 5208020).
Как и в случае с другими группами лекарственного средства, все стереоизомеры группы майтанзиноидного лекарственного средства предусмотрены для соединений по изобретению, т.е., любая комбинация конфигураций R и S на хиральных атомах углерода D. В одном варианте осуществления группа майтанзиноидного лекарственного средства (D) обладает следующей стереохимией:
Иллюстративные варианты осуществления групп майтанзиноидного лекарственного средства включают: DM1, (CR2)m=CH2CH2; DM3, (CR2)m=CH2CH2CH(CH3); и DM4, (CR2)m=CH2CH2C(CH3)2, обладающие структурами:

Линкер можно присоединять к молекуле майтанзиноида в различных положениях, в зависимости от типа связи. Например, сложноэфирную связь можно формировать посредством реакции с гидроксильной группой с использованием общепринятых способов присоединения. Реакция может происходить в положении C-3, обладающем гидроксильной группой, в положении C-14, модифицированном гидроксиметилом, в положении C-15, модифицированном гидроксильной группой и в положении C-20, обладающем гидроксильной группой. В предпочтительном варианте осуществления связь формируют в положении C-3 майтанзинола или аналога майтанзинола.
Группа лекарственного средства (D) конъюгатов антитело-лекарственное средство (ADC) формулы I включает также доластатины и их пептидные аналоги и производные, ауристатины (патенты США No. 5635483; 5780588). Показано, что доластатины и ауристатины мешают динамике микротрубочек, гидролизу GTP, и делению ядер и клеток (Woyke et al (2001) Antimicrob. Agents and Chemother. 45(12):3580-3584) и обладают противораковой (патент США No. 5663149) и противогрибковой активностью (Pettit et al (1998) Antimicrob. Agents Chemother. 42:2961-2965). Различные формы групп доластатинового или ауристатинового лекарственного средства можно ковалентно присоединять к антителу через N (амино)-конец или C (карбокси)-конец группы пептидного лекарственного средства (WO 02/088172; Doronina et al (2003) Nature Biotechnology 21(7):778-784; Francisco et al (2003) Blood 102(4): 1458-1465).
Группы лекарственного средства включают доластатины, ауристатины (патенты США No. 5635483; 5780588; 5767237; 6124431), и их аналоги и производные. Показано, что доластатины и ауристатины мешают динамике микротрубочек, гидролизу GTP, и делению ядер и клеток (Woyke et al (2001) Antimicrob. Agents and Chemother. 45(12):3580-3584) и обладают противораковой (US 5663149) и противогрибковой активностью (Pettit et al (1998) Antimicrob. Agents Chemother. 42:2961-2965). Группы доластатинового или ауристатинового лекарственного средства можно присоединять к антителу через N (амино)-конец или C (карбокси)-конец группы пептидного лекарственного средства (WO 02/088172).
Иллюстративные варианты осуществления ауристатина включают присоединенные по N-концу группы монометилауристатинового лекарственного средства DE и DF, описанные в: WO 2005/081711; Senter et al., Proceedings of the American Association for Cancer Research, Volume 45, Abstract Number 623, presented March 28, 2004.
Группы лекарственного средства (D) конъюгатов антитело-лекарственное средство (ADC) формулы I включают группы монометилауристатинового лекарственного средства MMAE и MMAF, присоединенные по N-концу к антителу и обладающие структурами:
Как правило, группы лекарственного средства на основе пептидов можно получать посредством формирования пептидной связи между двумя или более аминокислотами и/или пептидными фрагментами. Такие пептидные связи можно получать, например, способом жидкофазного синтеза (см. E. Schroder and K. Lubke, «The Peptides», volume 1, pp 76-136, 1965, Academic Press), хорошо известным в области химии пептидов.
Группа лекарственного средства включает калихеамицин, и его аналоги и производные. Антибиотики семейства калихеамицина способны вызывать двухцепочечные разрывы ДНК в суб-пикомолярных концентрациях. Получение конъюгатов для семейства калихеамицина, см. патент США No. 5712374; 5714586; 5739116; 5767285; 5770701, 5770710; 5773001; 5877296. Структурные аналоги калихеамицина, которые можно использовать, включают, но без ограничения, γ1 I, α2 I, α3 I, N-ацетил-γ1 I, PSAG и θI 1 (Hinman et al Cancer Research 53:3336-3342 (1993), Lode et al Cancer Research 58:2925-2928 (1998).
Белковые токсины включают: A-цепь дифтерийного токсина, несвязывющие активные фрагменты дифтерийного токсина, A-цепь экзотоксина (из Pseudomonas aeruginosa), A-цепь рицина (Vitetta et al (1987) Science, 238: 1098), A-цепь абрина, A-цепь модецина, альфа-сарцин, белки Aleurites fordii, белки-диантины, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор momordica charantia, курцин, кротин, ингибитор sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трикотецены (WO 93/21232).
Терапевтические радиоактивные изотопы включают: 32P, 33P, 90Y, 125I, 131I, 131In, 153Sm, 186Re, 188Re, 211At, 212Bi, 212Pb и радиоактивные изотопы Lu.
Радиоактивный изотоп или другие метки можно вводить в конъюгат известными способами (Fraker et al (1978) Biochem. Biophys. Res. Commun. 80: 49-57; «Monoclonal Antibodies in Immunoscintigraphy» Chatal, CRC Press 1989). Меченная углеродом-14 1-изотиоцианатбензил-3-метилдиэтилен триаминпентауксусная кислота (MX-DTPA) представляет собой иллюстративный хелатирующий агент для конъюгации радиоактивного изотопа с антителом (WO 94/11026).
ЛИНКЕРЫ
«Линкер» (L) представляет собой бифункциональную или мультифункциональную группу, которую можно использовать для соединения одной или нескольких групп лекарственного средства (D) и звена антитела (Ab) с образованием конъюгатов мультиспецифическое антитело-лекарственное средство или конъюгатов аналог антитела-лекарственное средство (ADC) формулы I. ADC можно удобно получать с использованием линкера, обладающего реакционноспособной функциональной группой для связывания с лекарственным средством и с Ab. Ab может образовывать связь с функциональной группой линкерного реагента, группой лекарственного средства или промежуточным соединением лекарственное средство-линкер.
В одном из аспектов линкер имеет реакционноспособный участок с электрофильной группой, являющейся реакционноспособной по отношению к нуклеофильному цистеину, присутствующему в антителе или фрагменте антитела. Тиол цистеина антитела или фрагмента антитела является реакционноспособным по отношению к электрофильной группе линкера и образует ковалентную связь с линкером. Подходящие электрофильные группы включают в качестве неограничивающих примеров малеинимидные и галоацетамидные группы.
Сконструированные антитела с цистеиновыми заменами вступают в реакцию с линкерными реагентами или промежуточными соединениями лекарственное средство-линкер, с электрофильными функциональными группами, такими как малеинимид или α-галокарбонил, согласно способу конъюгации на странице 766 в Klussman, et al (2004), Bioconjugate Chemistry 15(4):765-773, и согласно способам, описанным в разделе “Примеры”.
В одном из вариантов осуществления линкер L ADC имеет формулу:
-A a -W w -Y y -,
где:
-A- представляет собой расширительное звено, ковалентно присоединенное к тиолу цистеина антитела (Ab);
a имеет значения 0 или 1;
каждый -W- независимо представляет собой аминокислотное звено;
w независимо представляет собой целое число в диапазоне от 0 до 12;
-Y- представляет собой спейсерное звено, ковалентно присоединенное к группе лекарственного средства; и
y имеет значения 0, 1 или 2.
РАСШИРИТЕЛЬНОЕ ЗВЕНО
Расширительное звено (-A-), если присутствует, способно связывать звено антитела с аминокислотным звеном (-W-). В этом отношении, антитело (Ab) обладает тиоловой группой свободного цистеина или другой свободной тиоловой группой, которая может образовывать связь с электрофильной функциональной группой расширительного звена. Характерные расширительные звенья из этого варианта осуществления показаны внутри квадратных скобок формул IIIa и IIIb, где Ab-, -W-, -Y-, -D, w и y являются такими, как определено выше, и R17 представляет собой двухвалентный радикал, выбранный из (CH2)r, C3-C8-карбоциклила, O-(CH2)r, арилена, (CH2)r-арилена, -арилена-(CH2)r-, (CH2)r-(C3-C8-карбоциклила), (C3-C8-карбоциклила)-(CH2)r, C3-C8-гетероциклила, (CH2)r-(C3-C8-гетероциклила), -(C3-C8-гетероциклила)-(CH2)r-, -(CH2)rC(O)NRb(CH2)r-, -(CH2CH2O)r-, -(CH2CH2O)r-CH2-, -(CH2)rC(O)NRb(CH2CH2O)r-, -(CH2)rC(O)NRb(CH2CH2O)r-CH2-, -(CH2CH2O)rC(O)NRb(CH2CH2O)r-, -(CH2CH2O)rC(O)NRb(CH2CH2O)r-CH2- и -(CH2CH2O)rC(O)NRb(CH2)r-; где Rb представляет собой H, C1-C6-алкил, фенил или бензил; и r независимо представляет собой целое число в диапазоне 1-10.
Арилен включает двухвалентные ароматические углеводородные радикалы из 6-20 атомов углерода, полученные удалением двух атомов водорода из исходной системы ароматического кольца. Характерные ариленовые группы включают, но без ограничения, радикалы, полученный из бензола, замещенного бензола, нафталина, антрацена, бифенила и т.п.
Гетероциклические группы включают кольцевую систему, в которой один или несколько атомов кольца представляет собой гетероатом, например, азот, кислород и серу. Гетероциклический радикал содержит 1-20 атомов углерода и 1-3 гетероатома, выбранных из N, O, P и S. Гетероцикл может представлять собой моноцикл, имеющий 3-7 членов кольца (2-6 атомов углерода и 1-3 гетероатомов, выбранных из N, O, P и S) или бицикл, имеющий 7-10 членов кольца (4-9 атомов углерода и 1-3 гетероатомов, выбранных из N, O, P и S), например: бицикло-система [4,5], [5,5], [5,6] или [6,6]. Гетероциклы описаны в Paquette, Leo A.; «Principles of Modern Heterocyclic Chemistry» (W.A. Benjamin, New York, 1968), в частности, Chapters 1, 3, 4, 6, 7, и 9; «The Chemistry of Heterocyclic Compounds, A series of Monographs» (John Wiley & Sons, New York, 1950 to present), в частности Volumes 13, 14, 16, 19, и 28; и J. Am. Chem. Soc. (1960) 82:5566.
Примеры гетероциклов включают в качестве примера, а не ограничения, пиридил, дигидропиридил, тетрагидропиридил (пиперидил), тиазолил, тетрагидротиофенил, тетрагидротиофенил с окисленной серой, пиримидинил, фуранил, тиенил, пирролил, пиразолил, имидазолил, тетразолил, бензофуранил, тианафталенил, индолил, индоленил, хинолинил, изохинолинил, бензимидазолил, пиперидинил, 4-пиперидонил, пирролидинил, 2-пирролидонил, пирролинил, тетрагидрофуранил, бис-тетрагидрофуранил, тетрагидропиранил, бис-тетрагидропиранил, тетрагидрохинолинил, тетрагидроизохинолинил, декагидрохинолинил, октагидроизохинолинил, азоцинил, триазинил, 6H-1,2,5-тиадиазинил, 2H,6H-1,5,2-дитиазинил, тиенил, тиантренил, пиранил, изобензофуранил, хроменил, ксантенил, феноксатинил, 2H-пирролил, изотиазолил, изоксазолил, пиразинил, пиридазинил, индолизинил, изоиндолил, 3H-индолил, 1H-индазолил, пуринил, 4H-хинолизинил, фталазинил, нафтиридинил, хиноксалинил, хиназолинил, циннолинил, птеридинил, 4Ah-карбазолил, карбазолил, β-карболинил, фенантридинил, акридинил, пиримидинил, фенантролинил, феназинил, фенотиазинил, фуразанил, феноксазинил, изохроманил, хроманил, имидазолидинил, имидазолинил, пиразолидинил, пиразолинил, пиперазинил, индолинил, изоиндолинил, хинуклидинил, морфолинил, оксазолидинил, бензотриазолил, бензизоксазолил, оксиндолил, бензоксазолинил и изатиноил.
Карбоциклические группы включают насыщенное или ненасыщенное кольцо, имеющее 3-7 углеродных атомов в виде моноцикла или 7-12 углеродных атомов в виде бицикла. Моноциклические карбоциклы имеют 3-6 атомов в кольце, более обычно, 5 или 6 атомов в кольце. Бициклические карбоциклы имеют 7-12 атомов в кольце, например, расположенных в виде бициклосистемы [4,5], [5,5], [5,6] или [6,6], или 9 или 10 атомов в кольце, расположенных в виде бициклосистемы [5,6] или [6,6]. Примеры моноциклических карбоциклов включают циклопропил, циклобутил, циклопентил, 1-циклопент-1-енил, 1-циклопент-2-енил, 1-циклопент-3-енил, циклогексил, 1-циклогекс-1-енил, 1-циклогекс-2-енил, 1-циклогекс-3-енил, циклогептил и циклооктил.
Из всех иллюстративных вариантов осуществления ADC формулы I, таких как III-VI, понятно, даже если не обозначено буквально, что от 1 до 4 групп лекарственного средства присоединены к антителу (p=1-4), в зависимости от количества реакционноспособных тиоловых групп.
Иллюстративное расширительное звено представляет собой звено формулы IIIa, и получено из малеимидокапроила (MC), где R17 представляет собой -(CH2)5-:
Иллюстративное расширительное звено представляет собой звено формулы IIIa, и получено из малеимидопропаноила (MP), где R17 представляет собой -(CH2)2-:
Другое иллюстративное расширительное звено представляет собой звено формулы IIIa, где R17 представляет собой -(CH2CH2O)r-CH2-, и r представляет собой 2:
Другое иллюстративное расширительное звено представляет собой звено формулы IIIa, где R17 представляет собой -(CH2)rC(O)NRb(CH2CH2O)r-CH2-, где Rb представляет собой H, и каждый r представляет собой 2:
Другое иллюстративное расширительное звено представляет собой звено формулы IIIb, где R17 представляет собой -(CH2)5-:
В другом варианте осуществления расширительное звено присоединено к звену антитела посредством дисульфидной связи между атомом серы звена антитела и атомом серы расширительного звена. Репрезентативное расширительное звено из этого варианта осуществления показано внутри квадратных скобок формулы IV, где R17, Ab-, -W-, -Y-, -D, w и y являются такими, как определено выше.
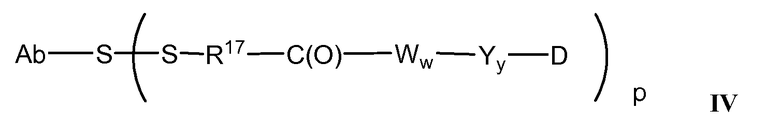
В другом варианте осуществления реакционноспособная группа расширителя содержит реакционноспособную по отношению к тиолу функциональную группу, которая может формировать связь с тиолом свободного цистеина или другого свободного тиола антитела. Примеры реакционных по отношению к тиолу функциональных групп включают, но без ограничения, малеинимид, α-галоацетил, активированные сложные эфиры, такие как сложные эфиры сукцинимида, сложные эфиры 4-нитрофенила, сложные эфиры пентафторфенила, сложные эфиры тетрафторфенила, ангидриды, хлорангидриды, сульфонилхлориды, изоцианаты и изотиоцианаты. Репрезентативные расширительные звенья из этого варианта осуществления показаны внутри квадратных скобок формул Va и Vb, где -R17-, Ab-, -W-, -Y-, -D, w и y являются такими, как определено выше;
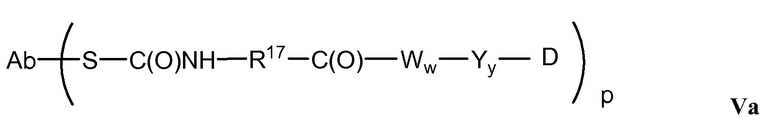
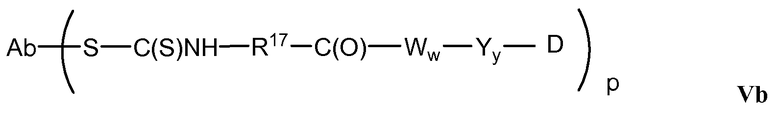
В другом варианте осуществления линкер может представлять собой линкер древовидного типа для ковалентного присоединения более одной группы лекарственного средства через разветвленную, мультифункциональную линкерную группу к антителу (Sun et al (2002) Bioorganic & Medicinal Chemistry Letters 12:2213-2215; Sun et al (2003) Bioorganic & Medicinal Chemistry 11:1761-1768; King (2002) Tetrahedron Letters 43: 1987-1990). Линкеры древовидного типа могут увеличивать молярное оотношение лекарственного средства к антителу, т.е. нагрузку, связанную с активностью ADC. Таким образом, когда сконструированное антитело с цистеиновыми заменами несет только одну реакционноспособную тиоловую группу цистеина, множество циркониевых групп можно присоединять через линкер древовидного типа.
АМИНОКИСЛОТНОЕ ЗВЕНО
Линкер может содержать аминокислотные остатки. Аминокислотное звено (-Ww-), если присутствует, связывает антитело (Ab) с группой лекарственного средства (D) конъюгата антитело-лекарственное средство (ADC) по изобретению.
-Ww- представляет собой дипептидное, трипептидное, тетрапептидное, пентапептидное, гексапептидное, гептапептидное, октапептидное, нонапептидное, декапептидное, ундекапептидное или додекапептидное звено. Аминокислотные остатки, которые содержит аминокислотное звено, включают природные остатки, так же как минорные аминокислоты и неприродные аналоги аминокислот, такие как цитруллин. Каждое звено -W- независимо обладает формулой, указанной ниже в квадратных скобках, и w представляет собой целое число в диапазоне 0-12:
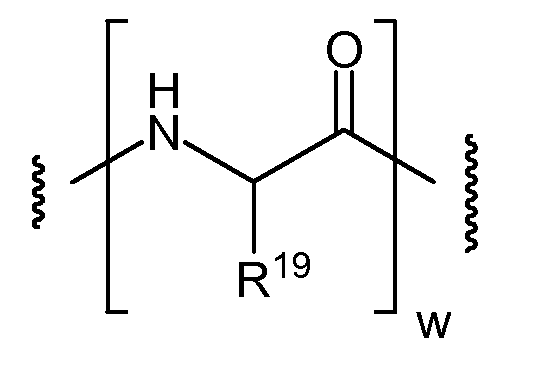 ,
,
где R19 представляет собой водород, метил, изопропил, изобутил, втор-бутил, бензил, п-гидроксибензил, -CH2OH, -CH(OH)CH3, -CH2CH2SCH3, -CH2CONH2, -CH2COOH, -CH2CH2CONH2, -CH2CH2COOH, -(CH2)3NHC(=NH)NH2, -(CH2)3NH2, -(CH2)3NHCOCH3, -(CH2)3NHCHO, -(CH2)4NHC(=NH)NH2, -(CH2)4NH2, -(CH2)4NHCOCH3, -(CH2)4NHCHO, -(CH2)3NHCONH2, -(CH2)4NHCONH2, -CH2CH2CH(OH)CH2NH2, 2-пиридилметил-, 3-пиридилметил-, 4-пиридилметил-, фенил, циклогексил,
Аминокислотное звено можно подвергать ферментативному отщеплению посредством одного или нескольких ферментов, включая опухолесвязанную протеазу, для высвобождения группы лекарственного средства (-D), которая в одном из вариантов осуществления подвергается протонированию in vivo после высвобождения с образованием лекарственного средства (D).
Подходящие звенья -Ww- можно разрабатывать и оптимизировать по их избирательности для ферментативного отщепления конкретными ферментами, например, опухолесвязанной протеазой. В одном из вариантов осуществления, звено -Ww- представляет собой звено, отщепление которого катализирует катепсин B, C и D, или протеаза плазмин.
Иллюстративные аминокислотные звенья -Ww- включают дипептид, трипептид, тетрапептид или пентапептид. Иллюстративные дипептиды включают: валин-цитруллин (vc или val-cit), аланин-фенилаланин (af или ala-phe). Иллюстративные трипептиды включают: глицин-валин-цитруллин (gly-val-cit) и глицин-глицин-глицин (gly-gly-gly).
Когда R19 отличается от водорода, атом углерода, к которому присоединен R19, является хиральным. Каждый атом углерода, к которому присоединен R19, независимо находится в конфигурации (S) или (R), или представляет собой рацемическую смесь. Аминокислотные звенья могут, таким образом, быть энантиомерно чистыми, рацемическими или диастереомерными.
СПЕЙСЕРНОЕ ЗВЕНО
Спейсерное звено (-Yy-), если присутствует (y = 1 или 2), связывает аминокислотное звено (-Ww-) с группой лекарственного средства (D), если аминокислотное звено присутствует (w=1-12). Альтернативно, спейсерное звено связывает расширительное звено с группой лекарственного средства, если аминокислотное звено отсутствует. Спейсерное звено также связывает группу лекарственного средства со звеном антитела, если как аминокислотное звено, так и расширительное звено отсутствуют (w, y=0). Спейсерные звенья существуют двух главных типов: самоуничтожаемые и не самоуничтожаемые. Не самоуничтожаемое спейсерное звено представляет собой звено, в котором часть или все из спейсерного звена остается связанным с группой лекарственного средства после отщепления, в частности, ферментативного, аминокислотного звена от конъюгата антитело-лекарственное средство или группа лекарственного средства-линкер. Когда ADC, содержащий глицин-глициновое спейсерное звено или глициновое спейсерное звено, подвергается ферментативному расщеплению посредством связанной с клетками опухоли протеазы, связанной с клетками злокачественной опухоли протеазы или связанной с лимфоцитами протеазы, группа глицин-глицин-лекарственное средство или группа глицин-лекарственное средство отщепляется от Ab-Aa-Ww-. В одном варианте осуществления независимая реакция гидролиза имеет место внутри клетки-мишени для расщепления связи глицин-группа лекарственного средства и высвобождения лекарственного средства.
В другом варианте осуществления -Yy- представляет собой звено п-аминобензилкарбамоила (PAB) (см. схемы 2 и 3), фениленовая часть которого является замещенным Qm, где Q представляет собой -C1-C8 алкил, -O-(C1-C8 алкил), -галоген, -нитро или -циано; и m представляет собой целое число в диапазоне 0-4.
Иллюстративными вариантами осуществления не самоуничтожаемого спейсерного звена (-Y-) являются: -Gly-Gly-; -Gly-; -Ala-Phe-; -Val-Cit-.
В одном варианте осуществления представлены группа лекарственное средство-линкер или ADC, в которых спейсерное звено отсутствует (y=0), или их фармацевтически приемлемая соль или сольват.
Альтернативно, ADC, содержащий самоуничтожаемое спейсерное звено, может высвобождать -D. В одном варианте осуществления -Y- представляет собой группу PAB, связанную с -Ww- через атом азота аминогруппы группы PAB, и напрямую связанную с -D через группу карбоната, карбамата или простого эфира, где ADC обладает иллюстративной структурой:
 ,
,
где Q представляет собой -C1-C8 алкил, -O-(C1-C8 алкил), -галоген, -нитро или -циано; m представляет собой целое число в диапазоне 0-4; и p лежит в диапазоне 1-4.
Другие примеры самоуничтожаемых спейсеров включают, но без ограничения, ароматические соединения, электронно эквивалентные группе PAB, такие как производные 2-аминоимидазол-5-метанола (Hay et al. (1999) Bioorg. Med. Chem. Lett. 9:2237) и орто- или пара-аминобензилацетали. Можно использовать спейсеры, которые подвергаются циклизации при гидролизе амидной связи, такие как замещенные и незамещенные амиды 4-аминомасляной кислоты (Rodrigues et al (1995) Chemistry Biology 2:223), соответствующим образом замещенные бицикло[2.2.1] и бицикло[2.2.2] кольцевые системы (Storm et al (1972) J. Amer. Chem. Soc. 94:5815) и амиды 2-аминофенилпропионовой кислоты (Amsberry, et al (1990) J. Org. Chem. 55:5867). Уничтожение содержащих амин лекарственных средств, которые являются замещенными по глицину (Kingsbury et al (1984) J. Med. Chem. 27: 1447), также является примером способов с самоуничтожаемыми спейсерами, которые можно применять к ADC.
В одном варианте осуществления, спейсерное звено представляет собой разветвленный бис(гидроксиметил)стирол (BHMS), которое можно использовать для введения и высвобождения множественных лекарственных средств, обладающих структурой:
 ,
,
содержащей дендримерное звено 2-(4-аминобензилиден)пропан-1,3-диола (WO 2004/043493; de Groot et al (2003) Angew. Chem. Int. Ed. 42:4490-4494), где Q представляет собой -C1-C8 алкил, -O-(C1-C8 алкил), -галоген, -нитро или -циано; m представляет собой целое число в диапазоне 0-4; n представляет собой 0 или 1; и p лежит в диапазоне 1-4.
ДРЕВОВИДНЫЕ ЛИНКЕРЫ
В другом варианте осуществления линкер L может представлять собой линкер древовидного типа для ковалентного присоединения более одной группы лекарственного средства через группу разветвленного, многофункционального линкера к антителу (Sun et al (2002) Bioorganic & Medicinal Chemistry Letters 12:2213-2215; Sun et al (2003) Bioorganic & Medicinal Chemistry 11: 1761-1768). Древовидные линкеры могут увеличивать молярное соотношение лекарственного средства к антителу, т.е. нагрузку, связанную с активностью ADC. Таким образом, когда антитело несет только одну реакционноспособную тиоловую группу, множество групп лекарственного средства можно присоединять через древовидный линкер.
Следующие иллюстративные варианты осуществления древовидных линкерных реагентов позволяют конъюгацию вплоть до девяти реагентов - нуклеофильных групп лекарственного средства посредством реакции с функциональными группами хлорэтила азотистого иприта:

В другом варианте осуществления спейсерного звена, разветвленные, древовидные линкеры с самоуничтожаемыми дендримерными звеньями 2,6-бис(гидроксиметил)-п-крезола и 2,4,6-трис(гидроксиметил)-фенола (WO 2004/01993; Szalai et al (2003) J. Amer. Chem. Soc. 125: 15688-15689; Shamis et al (2004) J. Amer. Chem. Soc. 126: 1726-1731; Amir et al (2003) Angew. Chem. Int. Ed. 42:4494-4499) можно использовать в качестве линкеров в соединениях по изобретению.
В другом варианте осуществления группы D являются одинаковыми.
В другом варианте осуществления группы D являются различными.
В одном из аспектов спейсерные звенья (-Yy-) представлены формулами (X)-(XII):
 ,
,
где Q представляет собой -C1-C8 алкил, -O-(C1-C8 алкил), -галоген, -нитро или -циано; и m представляет собой целое число в диапазоне 0-4;
Варианты осуществления формулы I соединений конъюгата антитело-лекарственное средство включают XIIIa (val-cit), XIIIb (MC-val-cit), XIIIc (MC-val-cit-PAB):
Другие иллюстративные варианты осуществления формулы Ia соединений конъюгата антитело-лекарственное средство включают XIVa-e:
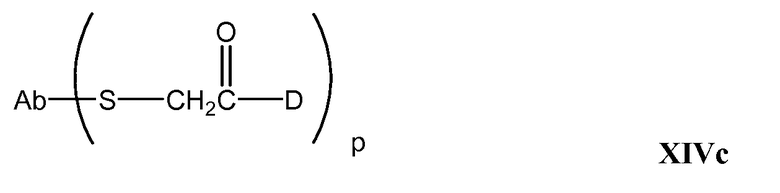
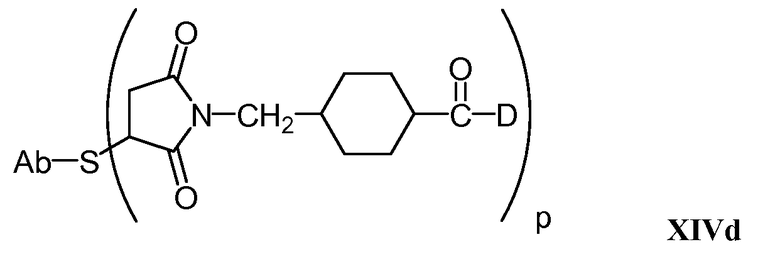
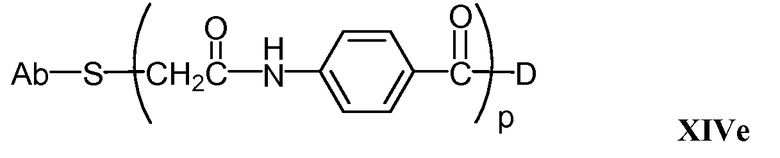 ,
,
где X представляет собой:
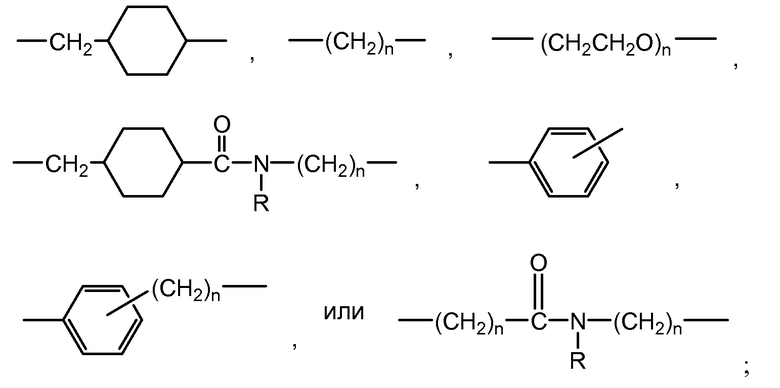
Y представляет собой:
и R независимо представляет собой H или C1-C6 алкил; и n представляет собой 1-12.
В другом варианте осуществления линкер обладает реакционноспособной функциональной группой, обладающей нуклеофильной группой, которая является реакционноспособной по отношению к электрофильной группе, присутствующей на антителе. Пригодные электрофильные группы на антителе включают, но без ограничения, карбонильные группы альдегидов и кетонов. Гетероатом нуклеофильной группы линкера может вступать в реакцию с электрофильной группой антитела и формировать ковалентную связь со звеном антитела. Пригодные нуклеофильные группы линкера включают, но без ограничения, гидразид, оксим, амино, гидразин, тиосемикарбазон, гидразинкарбоксилат и арилгидразид. Электрофильная группа антитела обеспечивает удобный участок для присоединения к линкеру.
Как правило, линкеры пептидного типа можно получать посредством формирования пептидной связи между двумя или более аминокислотными и/или пептидными фрагментами. Такие пептидные связи можно получать, например, способом жидкофазного синтеза (E. Schröder and K. Liibke (1965) «The Peptides», volume 1, pp 76-136, Academic Press), хорошо известным в области химии пептидов.
Линкерные промежуточные соединения можно составлять с помощью любой комбинации или последовательности реакций, включающих спейсерное, расширительное и аминокислотное звенья. В спейсерном, расширительном и аминокислотном звеньях можно использовать реакционноспособные функциональные группы, которые по своей природе представляют собой электрофильный, нуклеофильный или свободный радикал. Реакционноспособные функциональные группы включают, но без ограничения:
 ,
,
где X представляет собой уходящую группу, например, O-мезил, O-тозил, -Cl, -Br, -I; или малеинимид.
В другом варианте осуществления линкер может быть замещенным группами с модулированной растворимостью или реакционной способностью. Например, заряженный заместитель, такой как сульфонат (-SO3 -) или аммоний, может увеличивать растворимость реагента в воде и облегчать реакцию связывания линкерного реагента с антителом или группой лекарственного средства или облегчать реакцию связывания Ab-L (промежуточного соединения антитело-линкер) с D, или D-L (промежуточного соединения лекарственное средство-линкер) с Ab, в зависимости от способа синтеза, используемого для получения ADC.
Соединения по изобретению конкретно включают, но без ограничения, ADC, полученные с помощью линкерных реагентов: BMPEO, BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, MPBH, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC и сульфо-SMPB, и SVSB (сукцинимидил-(4-винилсульфон)бензоат), и включая бис-малеинимидные реагенты: DTME, BMB, BMDB, BMH, BMOE, BM(PEO)3 и BM(PEO)4, коммерчески доступные из Pierce Biotechnology, Inc., Customer Service Department, P.O. Box 117, Rockford, IL. 61105 U.S.A, U.S.A 1-800-874-3723, International +815-968-0747. См. pages 467-498, 2003-2004 Applications Handbook and Catalog. Бис-малеинимидные реагенты позволяют присоединение тиоловой группы сконструированного антитела или фрагмента антитела с цистеиновыми заменами к содержащей тиол группе лекарственного средства, метке или промежуточному соединению линкера, последовательным или одновременным образом. Другие функциональные группы, помимо малеинимида, которые являются реакционноспособными по отношению к тиоловой группе сконструированного антитела с цистеиновыми заменами, группы лекарственного средства, метки или линкерного промежуточного соединения включают иодацетамид, бромацетамид, винилпиридин, дисульфид, пиридилдисульфид, изоцианат, и изотиоцианат.
Пригодные линкерные реагенты можно также получать из других коммерческих источников, таких как Molecular Biosciences Inc. (Boulder, CO), или синтезировать в соответствии со способами, описанными в Toki et al (2002) J. Org. Chem. 67: 1866-1872; Walker, M.A. (1995) J. Org. Chem. 60:5352-5355; Frisch et al (1996) Bioconjugate Chem. 7: 180-186; US 6214345; WO 02/088172; US 2003130189; US2003096743; WO 03/026577; WO 03/043583; и WO 04/032828.
Расширительные звенья формулы (IIIa) можно вводить в линкер посредством реакции следующих линкерных реагентов с N-концом аминокислотного звена:
 ,
,
где n представляет собой целое число в диапазоне 1-10, и T представляет собой -H или -SO3Na;
 ,
,
где n представляет собой целое число в диапазоне 0-3;
Расширительные звенья можно вводить в линкер посредством реакции следующих бифункциональных реагентов с N-концом аминокислотного звена:
 ,
,
где X представляет собой Br или I. Расширительные звенья формулы можно также вводить в линкер посредством реакции следующих бифункциональных реагентов с N-концом аминокислотного звена:
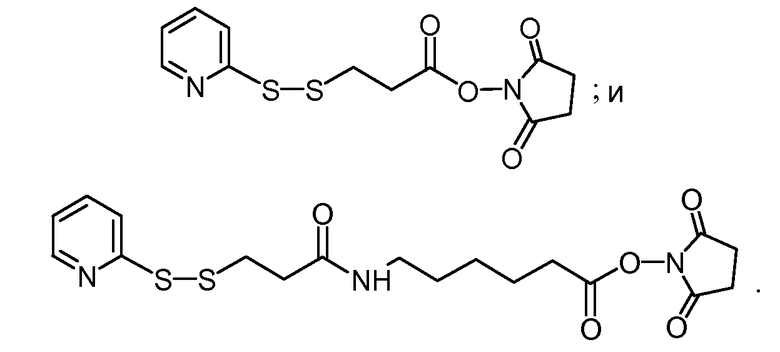
Расширительные звенья формулы (Va) можно вводить в линкер реакцией следующих промежуточных соединений с N-концом аминокислотного звена:
Изотиоцианатные расширительные звенья формулы, показанной ниже, можно получать из хлоридов изотиоцианаткарбоновой кислоты, как описано в Angew. Chem., (1975) 87(14), 517.
 ,
,
где -R17- является таким, как описано в настоящем документе.
Иллюстративный дипептидный линкерный реагент валин-цитруллин (val-cit или vc), обладающий малеинимидным расширительным звеном и пара-аминобензилкарбамоильным (PAB) самоуничтожаемым спейсером, имеет структуру:
 ,
,
где Q представляет собой -C1-C8 алкил, -O-(C1-C8 алкил), -галоген, -нитро или -циано; и m представляет собой целое число в диапазоне 0-4.
Иллюстративный дипептидный линкерный реагент phe-lys(Mtr), обладающий малеинимидным расширительным звеном и п-аминобензильным самоуничтожаемым спейсерным звеном, может быть получен согласно Dubowchik, et al. (1997) Tetrahedron Letters, 38:5257-60, и имеет структуру:
 ,
,
где Mtr представляет собой моно-4-метокситритил, Q представляет собой -C1-C8 алкил, -O-(C1-C8 алкил), -галоген, -нитро или -циано; и m представляет собой целое число в диапазоне 0-4.
Иллюстративные соединения конъюгата антитело-лекарственное средство по изобретению включают:
 ,
,
где Val представляет собой валин; Cit представляет собой цитруллин; p представляет собой 1, 2, 3 или 4; и Ab представляет собой мультиспецифическое антитело или аналог антитела. Другие иллюстративные конъюгаты антитела с лекарственным средством, где группа майтанзиноидного лекарственного средства DM1 связана через линкер BMPEO с тиоловой группой трастузумаба, имеет структуру:
 ,
,
где Ab представляет собой антитело; n имеет значения 0, 1 или 2; и p имеет значения 1, 2, 3 или 4.
ПОЛУЧЕНИЕ КОНЪЮГАТОВ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО
ADC формулы I можно получать несколькими способами с использованием реакций, условий и реагентов органической химии, известных специалистам в данной области, включая: (1) реакцию цистеиновой группы сконструированного антитела или фрагмента антитела с цистеиновыми заменами с линкерным реагентом для образования промежуточного соединения антитело-линкер Ab-L, посредством ковалентной связи, с последующей реакцией с активированной группой лекарственного средства D; и (2) реакцию нуклеофильной группы из группы лекарственного средства с линкерным реагентом для образования промежуточного соединения лекарственное средство-линкер D-L, посредством ковалентной связи, с последующей реакцией с цистеиновой группой сконструированного антитела с цистеиновыми заменами. Способы конъюгации (1) и (2) можно использовать со множеством сконструированных антител с цистеиновыми заменами, групп лекарственного средства и линкеров для получения конъюгатов антитело-лекарственное средство формулы I.
Тиоловые группы цистеина антитела являются нуклеофильными и способными вступать в реакцию для формирования ковалентных связей с электрофильными группами линкерных реагентов и промежуточных соединений лекарственное средство-линкер, включая: (i) активные сложные эфиры, такие как сложные эфиры NHS, сложные эфиры HOBt, галоформаты и галогенангидриды; (ii) алкил и бензилгалиды, такие как галоацетамиды; (iii) альдегиды, кетоны, карбоксильные и малеинимидные группы; и (iv) дисульфиды, включая пиридилдисульфиды, посредством сульфидного обмена. Нуклеофильные группы на группе лекарственного средства включают, но без ограничения: группы амина, тиола, гидроксила, гидразида, оксима, гидразина, тиосемикарбазона, гидразинкарбоксилата и арилгидразида, способные вступать в реакцию для формирования ковалентных связей с электрофильными группами линкерных групп и линкерных реагентов.
Майтанзин, например, можно превращать в May-SSCH3, который можно восстанавливать до свободного тиола, May-SH, и подвергать реакции с модифицированным антителом (Chari et al (1992) Cancer Research 52:127-131) для получения иммуноконъюгата майтанзиноид-антитело с дисульфидным линкером. Конъюгаты антитело-майтанзиноид с дисульфидными линкерами опубликованы (WO 04/016801; US 6884874; US 2004/039176 A1; WO 03/068144; US 2004/001838 A1; Патенты США No. 6441163, 5208020, 5416064; WO 01/024763). Дисульфидный линкер SPP конструируют с линкерным реагентом N-сукцинимидил-4-(2-пиридилтио)пентаноатом.
В определенных условиях сконструированные антитела или фрагменты антител с цистеиновыми заменами можно сделать реакционноспособными для конъюгации с линкерными реагентами посредством обработки восстанавливающим средством, таким как DTT (реактив Клеланда, дитиотреитол) или TCEP (трис(2-карбоксиэтил)фосфингидрохлорид; Getz et al (1999) Anal. Biochem. Vol 273:73-80; Soltec Ventures, Beverly, MA). Полноразмерные, сконструированные моноклональные антитела или Fab (ТиоMab; ТиоFab) с цистеиновыми заменами, экспрессированные в клетках CHO, можно восстанавливать с помощью приблизительно 50-кратного избытка TCEP в течение 3 час при 37°C для восстановления дисульфидных связей, которые могут формироваться между вновь введенными остатками цистеина и цистеином, присутствующим в культуральной среде. Восстановленные ТиоMab или ТиоFab можно разводить и наносить на колонку HiTrap S в 10 мМ ацетате натрия, pH 5, и элюировать с помощью PBS, содержащего 0,3 M хлорид натрия. Дисульфидные связи могут вновь образовываться между остатками цистеина, присутствующими в исходном Mab, с помощью разведенного (200 нМ) водного сульфата меди (CuSO4) при комнатной температуре, в течение ночи. Можно использовать другие окислители, т.е. окисляющие агенты и окисляющие условия, известные в данной области. Окисление атмосферным воздухом также является эффективным. Эта стадия мягкого, частичного повторного окисления формирует внутрицепьевые дисульфиды эффективно с высокой точностью. Приблизительно 10-кратный избыток промежуточного соединения лекарственное средство-линкер, например, BM(PEO)4-DM1, можно добавлять, перемешивать и оставлять приблизительно на один час при комнатной температуре для осуществления конъюгации и образования конъюгата антитело-лекарственное средство. Смесь после конъюгации можно подвергать гель-фильтрации, наносить на колонку HiTrap S и проводить элюцию для удаления избытка промежуточного соединения лекарственное средство-линкер и других примесей.
АНАЛИЗЫ ПРОЛИФЕРАЦИИ КЛЕТОК IN VITRO
Как правило, цитотоксическую или цитостатическую активность антитела, например, мультиспецифического антитела или аналога антитела по изобретению, или конъюгата антитело-лекарственное средство по изобретению (ADC) измеряют посредством: подвергания клеток млекопитающих, обладающих рецепторными белками, например, HER2, воздействию антитела или ADC в культуральной среде; культивирования клеток в течение периода от приблизительно 6 часов до приблизительно 5 суток; и измерения жизнеспособности клеток. Анализы на основе клеток in vitro используют для измерения жизнеспособности (пролиферации), цитотоксичности и индукции апоптоза (активации каспазы) посредством мультиспецифических антител, аналогов антител и ADC по изобретению.
Активность in vitro мультиспецифических антител, аналогов антител и ADC измеряют посредством анализа пролиферации клеток. Люминесцентный анализ жизнеспособности клеток CellTiter-Glo® представляет собой коммерчески доступный (Promega Corp., Madison, WI), способ гомогенного анализа, основанный на рекомбинантной экспрессии люциферазы Coleoptera (Патенты США No. 5583024; 5674713 и 5700670). В этом анализе пролиферации клеток определяют количество жизнеспособных клеток в культуре на основании количественного определения присутствующего ATP, показателя метаболически активных клеток (Crouch et al (1993) J. Immunol. Meth. 160:81-88; US 6602677). Анализ CellTiter-Glo® можно проводить в 96-луночном формате, что делает его пригодным для автоматизированного высоко производительного скрининга (HTS) (Cree et al (1995) Anticancer Drugs 6:398-404). Способ гомогенного анализа включает добавление единственного реагента (реагент CellTiter-Glo®) непосредственно к клеткам, культивируемым в дополненной сывороткой среде. Не требуются промывка клеток, удаление среды и множественные стадии пипетирования. Система детектирует настолько мало, как 15 клеток/лунку в 384-луночном формате в течение 10 минут после добавления реагента и смешивания. Клетки можно непрерывно обрабатывать мультиспецифическим антителом, аналогом антитела или ADC, или их можно обрабатывать и отделять от антител или ADC. Как правило, для клеток после короткой обработки, т.е., в течение 3 часов, показывают такую же активность, как для непрерывно обрабатываемых клеток.
Гомогенный формат «добавление-смешивание-измерение» приводит к лизису клеток и получению люминесцентного сигнала, пропорционального количеству присутствующего ATP. Количество ATP прямо пропорционально количеству клеток, присутствующих в культуре. При анализе CellTiter-Glo® получают люминесцентный сигнал «типа свечения», образуемый при реакции люциферазы, обладающий временем полужизни, как правило, более пяти часов, в зависимости от типа клеток и используемой среды. Жизнеспособные клетки выражают в относительных единицах люминесценции (RLU). Субстрат, люциферин жука, подвергают окислительному декарбоксилированию посредством рекомбинантной люциферазы светляка с сопутствующим превращением ATP в AMP и образованием фотонов. Увеличенное время полужизни исключает необходимость использования инжекторов для реагентов и обеспечивает гибкость для непрерывного или периодического способа обработки множества планшетов. Этот анализ пролиферации клеток можно использовать в различных многолуночных форматах, например, 96 или 384-луночном формате. Данные можно регистрировать посредством люминометра или устройства для получения изображений с CCD камерой. Выход люминесценции представляют в форме относительных единиц свечения (RLU), измеренных с течением времени. Альтернативно, фотоны при люминесценции можно подсчитывать в сцинтиляционном счетчике в присутствии сцинтиллятора. Затем единицы свечения можно представлять как CPS - импульсов в секунду.

ВВЕДЕНИЕ IN VIVO
Мультиспецифические антитела, аналоги антител и конъюгаты антитело-лекарственное средство (ADC) по изобретению можно вводить любым способом, подходящим для состояния, подлежащего лечению. Такие антитела, как правило, вводят парентерально, т.е. инфузией, подкожно, внутримышечно, внутривенно, внутрикожно, интратекально и эпидурально.
ФАРМАЦЕВТИЧЕСКИЕ СОСТАВЫ
Фармацевтические составы терапевтических мультиспецифических антител, аналогов антител и конъюгатов антитело-лекарственное средство (ADC) по изобретению, как правило, получают для парентерального введения, т.е. болюсной, внутривенной, внутриопухолевой инъекции вместе с фармацевтически приемлемым парентеральным носителем и в пригодной для инъекции единичной лекарственной форме. Мультиспецифическое антитело, аналог антитела или конъюгат антитело-лекарственное средство (ADC), обладающий желательной степенью чистоты, необязательно, смешивают с фармацевтически приемлемыми разбавителями, носителями, наполнителями или стабилизаторами (Remington's Pharmaceutical Sciences (1980) 16th edition, Osol, A. Ed.), в форме лиофилизированного состава или водного раствора.
Приемлемые разбавители, носители, наполнители и стабилизаторы в используемых дозах и концентрациях не токсичны для реципиентов и включают буферы, такие как фосфатный, цитратный и относящиеся к другим органическим кислотам; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметэтония; хлорид бензалкония, хлорид бензэтония; феноловый, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцинол; циклогексанол; 3-пентанол; и м-крезол); полипептиды с низкой молекулярной массой (менее чем приблизительно 10 остатков); белки, такие как сывороточный альбумин, желатин, или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТА; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металла (например, комплексы Zn-белок); и/или неионные поверхностно-активные вещества, такие как ТВИН™, ПЛЮРОНИК™ или полиэтиленгликоль (PEG). Например, лиофилизированные составы анти-ErbB2 антитела описаны в WO 97/04801, содержание которой конкретно приведено в настоящем документе в качестве ссылки.
Активные фармацевтические ингредиенты можно заключать также в микрокапсулы, полученные, например, способами коацервации или межповерхностной полимеризации, например, гидроксиметилцеллюлозные или желатиновые микрокапсулы и поли-(метилметацилатные) микрокапсулы, соответственно, в коллоидные системы для доставки лекарственных средств (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие способы описаны в Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980).
Можно получать препараты с замедленным высвобождением. Подходящие примеры препаратов с замедленным высвобождением включают содержащие ADC полупроницаемые матрицы из твердых гидрофобных полимеров, где матрицы находятся в виде изделий с заданной формой, например, пленок или микрокапсул. Примеры матриц с замедленным высвобождением включают сложные полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат), или поливиниловый спирт)), полилактиды (US 3773919), сополимеры L-глутаминовой кислоты и гамма-этил-L-глутамата, неразлагаемый ацетат этиленвинила, разлагаемые сополимеры молочной кислоты-гликолевой кислоты, такие как LUPRON DEPOT™ (подходящие для инъекции микросферы, состоящие из сополимера молочной кислоты-гликолевой кислоты и ацетата леупролида), и поли-D-(-)-3-гидроксимасляную кислоту.
Подлежащие использованию для введения in vivo составы должны быть стерильными, что легко осуществить фильтрацией через стерильные мембраны для фильтрации.
Составы включают составы, подходящие для вышеуказанных способов введения. Составы можно для удобства предоставлять в единичной дозированной форме, и их можно получать любыми способами, хорошо известными в данной области фармацевтики. Способы и составы в основном можно найти в Remington's Pharmaceutical Sciences (Mack Publishing Co., Easton, PA). Такие способы включают стадию объединения активного ингредиента с носителем, представляющим собой один или несколько вспомогательных ингредиентов. Как правило, составы получают посредством однородного и тесного объединения активного ингредиента с жидкими носителями или тонкоизмельченными твердыми носителями, или и с теми, и с другими, и затем, при необходимости, формования продукта.
Водные суспензии по изобретению содержат активные вещества в смеси с наполнителями, подходящими для изготовления водных суспензий. Такие наполнители включают суспендирующее вещество, такое как карбоксиметилцеллюлоза натрия, кроскармеллоза, повидон, метилцеллюлоза, гидроксипропилметилцеллюлоза, альгинат натрия, поливинилпирролидон, трагакантовая камедь и гуммиарабик, и диспергирующие или увлажняющие средства, такие как природный фосфатид (например, лецитин), продукт конденсации алкиленоксида с жирной кислотой (например, полиоксиэтиленстеарат), продукт конденсации этиленоксида с алифатическим спиртом с длинными цепями (например, гептадекаэтиленоксицетанол), продукт конденсации этиленоксида с неполным сложным эфиром, полученным из жирной кислоты и ангидрид гексита (например, моноолеат полиоксиэтиленсорбитана). Водная суспензия может содержать также один или несколько консервантов, таких как этил- или н-пропил-п-гидроксибензоат, одно или несколько окрашивающих средств, одно или несколько придающих вкус средств и один или несколько подсластителей, таких как сахароза или сахарин.
Фармацевтические композиции могут присутствовать в форме стерильного пригодного для инъекции препарата, такого как стерильная пригодная для инъекции водная или масляная суспензия. Эту суспензию можно составлять, как известно в данной области, с использованием тех подходящих диспергирующих или увлажняющих средств и суспендирующих средств, которые упомянуты выше. Стерильный подходящий для инъекции препарат может представлять собой также стерильные подходящие для инъекции раствор или суспензию в нетоксичном пригодном для парентерального введения разбавителе или растворителе, например, раствор в 1,3-бутандиоле, или может представлять собой лиофилизированный порошок. Среди подходящих носителей и растворителей, которые можно использовать, присутствуют вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, стерильные жирные масла являются общепринятыми в качестве растворителя или суспендирующего вещества. Для этой цели можно использовать любое легкое жирное масло, включая синтетические моно- или диглицериды. Кроме того, жирные кислоты, такие как олеиновая кислота, можно подобным образом использовать для получения пригодных для инъекции препаратов.
Количество активного ингредиента, которое можно объединять с материалом носителя для получения единичной лекарственной формы, меняется в зависимости от обрабатываемого хозяина и конкретного способа введения. Например, водный раствор, предназначенный для внутривенной инфузии, может содержать приблизительно 3-500 мкг активного ингредиента на миллилитр раствора, чтобы могла происходить инфузия подходящего объема со скоростью приблизительно 30 мл/час.
Составы, подходящие для парентерального введения, содержат водные и неводные стерильные растворы для инъекции, которые могут содержать анти-окислители, буферы, бактериостатические средства и растворенные вещества, делающие состав изотоническим с кровью предполагаемого реципиента; и водные и неводные стерильные суспензии, которые могут включать суспендирующие средства и загустители.
Хотя пероральное введение белковых лекарственных средств нежелательно из-за гидролиза или денатурации в кишечнике, составы мультиспецифических антител, аналогов антител или ADC, подходящих для перорального введения, можно получать в форме единичных лекарственных форм, таких как капсулы, саше или таблетки, каждая из которых содержит предопределенное количество антитела или ADC.
Составы можно упаковывать в контейнеры для единичных доз или множественных доз, например, герметично закрытые ампулы и флаконы, и можно хранить в высушенном замораживанием (лиофилизированном) состоянии, требующем только добавления стерильного жидкого носителя, например, воды, для инъекции, непосредственно перед использованием. Приготовленные для немедленного использования растворы и суспензии для инъекций получают из стерильных порошков, гранул и таблеток описанного ранее вида. Конкретные единичные дозированные составы представляют собой составы, содержащие ежесуточную дозу активного ингредиента или единичную часть ежесуточной дозы, как перечислено в настоящем документе выше, или ее подходящую часть.
Представлены также ветеринарные композиции, содержащие по меньшей мере один активный ингредиент, как определено выше, вместе с ветеринарным носителем, соответственно. Ветеринарные носители представляют собой материалы, подходящие для цели введения композиции, и могут представлять собой твердые, жидкие или газообразные материалы, которые в ином случае являются инертными или приемлемыми в области ветеринарии и являются совместимыми с активным ингредиентом. Эти ветеринарные композиции можно вводить парентерально, перорально или любым другим желательным способом.
ТЕРАПЕВТИЧЕСКИЕ ПРИМЕНЕНИЯ
Мультиспецифические антитела, аналоги антител и ADC, описанные в настоящем документе, можно использовать для терапевтических применений. Например, такие антитела и фрагменты антител, и конъюгаты антитело-лекарственное средство можно использовать для лечения опухолей, включая предзлокачественные, не метастазирующие, метастазирующие и злокачественные опухоли (например, злокачественную опухоль на ранней стадии), для лечения аллергических или воспалительных нарушений, или для лечения аутоиммунного заболевания, или для лечения индивида, подверженного риску развития злокачественной опухоли (например, рак молочной железы, колоректальный рак, рак легкого, почечноклеточный рак, глиому или рак яичника), аллергическое или воспалительное нарушение, или аутоиммунное заболевание.
Термин злокачественная опухоль включает набор пролиферативных нарушений, включая, но без ограничения, предзлокачественные опухоли, доброкачественные опухоли и злокачественные опухоли. Доброкачественные опухоли остаются локализованными в участке возникновения и не обладают способностью к инфильтрации, инвазии или метастазированию к отдаленным участкам. Злокачественные опухоли могут инвазировать в другие ткани вокруг и разрушать их. Они могут также приобретать способность отрываться от места, откуда они начинались, и распространяться к другим участкам организма (метастазировать), обычно через кровоток или через лимфатическую систему, где локализованы лимфатические узлы. Первичные опухоли классифицируют по типу ткани, из которой они возникают; метастатические опухоли классифицируют по типу ткани, из которой происходят клетки злокачественных опухолей. С течением времени клетки злокачественной опухоли становятся более аномальными и выглядят менее подобными нормальным клеткам. Это изменение внешнего вида клеток злокачественных опухолей называют степенью злокачественности опухоли, и клетки злокачественных опухолей описывают как являющиеся высоко дифференцированными, умеренно дифференцированными, низко дифференцированными или недифференцированными. Высоко дифференцированные клетки имеют достаточно нормальный внешний вид и напоминают нормальные клетки, из которых они происходят. Недифференцированные клетки представляют собой клетки, которые становятся настолько аномальными, что больше невозможно определить источник клеток.
Опухоль может представлять собой солидную опухоль или несолидную опухоль или опухоль мягких тканей. Примеры опухолей мягких тканей включают лейкоз (например, хронический миелогенный лейкоз, острый миелогенный лейкоз, острый лимфобластный лейкоз взрослых, острый миелогенный лейкоз, острый лимфобластный лейкоз зрелых B-клеток, хронический лимфоцитарный лейкоз, полимфоцитарный лейкоз, или волосатоклеточный лейкоз) или лимфому (например, неходжскинскую лимфому, Т-клеточную лимфому кожи или болезнь Ходжкина). Солидная опухоль включает любую злокачественную опухоль тканей организма, отличных от крови, костного мозга или лимфатической системы. Солидные опухоли можно далее разделить на опухоли, происходящие из эпителиальных клеток, и опухоли, происходящие из не эпителиальных клеток. Примеры солидных опухолей из эпителиальных клеток включают опухоли желудочно-кишечного тракта, ободочной кишки, молочной железы, предстательной железы, легкого, почки, печени, поджелудочной железы, яичника, головы и шеи, ротовой полости, желудка, двенадцатиперстной кишки, тонкого кишечника, толстого кишечника, ануса, желчного пузыря, губы, носоглотки, кожи, матки, мужских половых органов, органов мочевыделительной системы, мочевого пузыря и кожи. Солидные опухоли не эпителиального происхождения включают саркомы, опухоли мозга и опухоли костей.
Эпителиальные злокачественные опухоли, как правило, развиваются от доброкачественной опухоли на преинвазивной стадии (например, карциномы in situ) до злокачественной опухоли, которая проникает через базальную мембрану и инвазирует в субэпителиальную строму.
Мультиспецифические антитела, аналоги антител и ADC также можно использовать для этих терапевтических применений, и антитела, связывающие HER2, можно, в частности, использовать для лечения рака молочной железы, колоректального рака, рака легкого, почечноклеточного рака, глиомы или рака яичника.
Другие индивиды, являющиеся кандидатами для введения композиций по настоящему изобретению, страдают аномальной пролиферацией сосудисто-волокнистой ткани, розовыми угрями, синдромом приобретенного иммунодефицита, окклюзией артерии, атопическим кератитом, бактериальными язвами, болезнью Бехчета, происходящими из клеток крови опухолями, обструктивным заболеванием сонных артерий, хориоидальной неоваскуляризацией, хроническим воспалением, хроническим отслоением сетчатки, хроническим увеитом, хроническим витритом, переутомлением от ношения контактных линз, отторжением трансплантата роговицы, неоваскуляризацией роговицы, неоваскуляризацией трансплантата роговицы, болезнью Крона, болезнью Илза, эпидемическим кератоконъюнктивитом, грибковыми язвами, инфекциями простого герпеса, инфекциями опоясывающего герпеса, синдромами повышенной вязкости крови, саркомой Капоши, лейкозом, липидной дегенерацией, болезнью Лайма, краевым кератолизом, язвой Морена, инфекциями Mycobacteria, отличными от лепрозных, миопией, заболеванием неоваскуляризации глаза, врожденными ямками в диске зрительного нерва, синдромом Ослера-Вебера (Ослера-Вебера-Рандю), остеоартритом, болезнью Педжета, Pars planitis, пемфигоидом, филектенулезным конъюнктивитом, полиартериитом, осложнениями после лазерной терапии, протозойными инфекциями, эластичной псевдоксантомой, сухим кератитом птеригия, радиальной кератотомией, неоваскуляризацией сетчатки, ретинопатиями недоношенных, ретролентальными фиброплазиями, саркоидом, склеритом, серповидно-клеточной анемией, синдромом Шегрена, солидными опухолями, болезнью Штаргарта, болезнью Стивенса-Джонсона, кератитом верхних конечностей, сифилисом, системной красной волчанкой, краевой дегенерацией Терриена, токсоплазмозом, опухолями саркомы Эвинга, опухолями нейробластомы, опухолями остеосаркомы, опухолями ретинобластомы, опухолями рабдомиосаркомы, язвенным колитом, окклюзией вен, дефицитом витамина А, саркоидозом Вегенера, нежелательным ангиогенезом, связанным с диабетом, вызванными паразитами заболеваниями, аномальным заживлением ран, гипертрофией после хирургической операции, повреждения или травмы (например, острого повреждения легких/ARDS), замедлением роста волос, подавлением овуляции и образования желтого тела, замедлением имплантации и подавлением развития эмбриона в матке, или подвержены риску их развития.
Примеры аллергических или воспалительных нарушений или аутоиммунных заболеваний или нарушений, которые можно лечить с использованием мультиспецифического антитела, аналога антитела, бис-Fab, ADC или любого другого антитела, полученного способами, описанными в настоящем документе включают, но без ограничения, артрит (ревматоидный артрит, такой как острый артрит, хронический ревматоидный артрит, подагрический артрит, острый подагрический артрит, хронический воспалительный артрит, дегенеративный артрит, инфекционный артрит, артрит Лайма, пролиферативный артрит, псориатический артрит, артрит позвоночника, и юношеский ревматоидный артрит, остеоартрит, хронический прогредиентный артрит, деформирующий артрит, хронический первичный полиартрит, реактивный артрит и анкилозирующий спондилит), воспалительные гиперпролиферативные заболевания кожи, псориаз, такой как бляшковидный псориаз, каплевидный псориаз, пустулезный псориаз и псориаз ногтей, дерматит, включая контактный дерматит, хронический контактный дерматит, аллергический дерматит, аллергический контактный дерматит, герпетиформный дерматит и атопический дерматит, Х-сцепленный гипер-IgM синдром, крапивницу, такую как хроническая аллергическая крапивница и хроническая идиопатическая крапивница, включая хроническую аутоиммунную крапивницу, полимиозит/дерматомиозит, юношеский дерматомиозит, токсический эпидермальный некролиз, склеродермию (включая системную склеродермию), склероз, такой как системная склеродермия, рассеянный склероз (MS), такой как спино-оптический MS, первично прогрессирующий MS (PPMS), и рецидивирующе-ремиттирующий MS (RRMS), прогрессивную системную склеродермию, атеросклероз, артериосклероз, склеротическая деменция и атактический склероз, воспалительное заболевание кишечника (IBD) (например, Болезнь Крона, опосредованные аутоиммунитетом желудочно-кишечные заболевания, колит, такой как язвенный колит, микроскопический колит, коллагенозный колит, полипозный колит, некротизирующий энтероколит и трансмуральный колит, и аутоиммунное воспалительное заболевание кишечника), гангренозную пиодермию, узловатую эритему, первичный склерозирующий холангит, эписклерит), синдром дыхательной недостаточности, включая синдром дыхательной недостаточности взрослых или синдром острой дыхательной недостаточности (ARDS), менингит, воспаление всей или части увеи, ирит, хороидит, аутоиммунное гематологическое нарушение, ревматоидный спондилит, внезапную потерю слуха, опосредованные IgE заболевания, такие как анафилаксия и аллергический и атопический ринит, энцефалит, такой как энцефалит Расмуссена и энцефалит конечностей и/или ствола головного мозга, увеит, такой как передний увеит, острый передний увеит, гранулематозный увеит, негранулематозный увеит, факогенный увеит, задний увеит или аутоиммунный увеит, гломерулонефрит (GN) с нефротическим синдромом и без, например, хронический или острый гломерулонефрит, такой как первичный GN, иммуноопосредованный GN, мембранный GN (мембранная нефропатия), идиопатический мембранный GN или идиопатическая мембранная нефропатия, мембрано- или мембранный пролиферативный GN (MPGN), включая тип I и тип II, и быстро прогрессирующий GN, аллергические состояния, аллергическую реакцию, экзему, включая аллергическую или атопическую экзему, астму, такую как бронхиальная астма и аутоиммунная астма, состояния, включающие инфильтрацию T-клеток и хронические воспалительные ответы, хроническое воспалительное заболевание легких, аутоиммунный миокардит, нарушение адгезии лейкоцитов, системную красную волчанку (SLE) или системную красную волчанку, такую как кожная SLE, подострая красная волчанка, синдром волчанки новорожденных (NLE), рассеянную красную волчанку, волчанку (включая нефрит, энцефалит, детскую, не почечную, внепочечную, дискоидную волчанку, алопецию), юношеский сахарный диабет (типа I), включая детский инсулинзависимый сахарный диабет (IDDM), сахарный диабет взрослых (диабет типа II), аутоиммунный диабет, идиопатический несахарный диабет, иммунные ответы, связанные с острой и отсроченной гиперчувствительностью, опосредованной цитокинами и T-лимфоцитами, туберкулез, саркоидоз, гранулематоз, включая лимфоматоидный гранулематоз, гранулематоз Вегенера, агранулематоз, васкулитид, включая васкулит (включая васкулит крупных сосудов (включая ревматическую полимиалгию и артериит гигантских клеток (Такаясу)), васкулит средних сосудов (включая болезнь Кавасаки и узелковый полиартериит), микроскопический полиартериит, васкулит CNS, некротизирующий, кожный или опосредованный гиперчувствительностью васкулит, системный некротизирующий васкулит, и ANCA-связанный васкулит, такой как васкулит или синдром Черджа-Строс (CSS)), височный артериит, апластическую анемию, аутоиммунную апластическую анемию, гемолитическую анемию с положительным тестом Кумбса, анемию Диамонда-Блэкфана, гемолитическую анемию или имунную гемолитическую анемию, включая аутоиммунную гемолитическую анемию (AIHA), пернициозную анемию (anemia perniciosa), болезнь Аддисона, врожденную истинную эритроцитарную анемию или аплазию (PRCA), дефицит фактора VIII, гемофилию A, аутоиммунную нейтропению, панцитопению, лейкопению, заболевания, вовлекающие диапедез лейкоцитов, воспалительные нарушения CNS, синдром полиорганной недостаточности, такой как синдром, вторичный по отношению к септицемии, травме или кровоизлиянию, опосредованные комплексом антиген-антитело заболевания, гломерулонефрит с образованием антител против базальной мембраны, синдром образования антител против фосфолипидов, аллергический неврит, болезнь Бехчета, синдром Кастельмана, синдром Гудпасчера, синдром Рейно, синдром Шегрена, синдром Стивенса-Джонсона, пемфигоид, такой как буллезный пемфигоид и кожный пемфигоид, пемфигус (включая обыкновенную пузырчатку, эксфолиативную пузырчатку, пемфигус - пемфигоид слизистых оболочек, и эритематозный пемфигус), аутоиммунные полиэндокринопатии, болезнь или синдром Рейтера, иммуно-комплексный нефрит, опосредованный антителами нефрит, оптиконевромиелит, полиневропатии, хроническую невропатию, такие как IgM полиневропатии или опосредованная IgM невропатия, тромбоцитопения (например, такая, какая развивается у пациентов с инфарктом миокарда), включая тромботическую тромбоцитопеническую пурпуру (TTP) и аутоиммунную или иммуноопосредованную тромбоцитопению, такую как идиопатическая тромбоцитопеническая пурпура (ITP), включая хроническую или острую ITP, аутоиммунное заболевание яичек и яичников, включая аутоиммунный орхит и оофорит, первичный гипотиреоз, гипопаратиреоз, аутоиммунные эндокринные заболевания, включая тиреоидит, такой как аутоиммунный тиреоидит, болезнь Хашимото, хронический тиреоидит (тиреоидит Хашимото) или подострый тиреоидит, аутоиммунный тиреоидит, идиопатический гипотиреоз, Болезнь Грэйва, полигландулярные синдромы, такие как аутоиммунные полигландулярные синдромы (или плюригландулярные эндокринопатические синдромы), паранеопластические синдромы, включая неврологические паранеопластические синдромы, такие как миастенический синдром Ламберта-Итона или синдром Итона-Ламберта, синдром скованного человека или мышечной скованности, энцефаломиелит, такой как аллергический энцефаломиелит и экспериментальный аллергический энцефаломиелит (EAE), миастению, такую как связанная с тимомой миастения, мозжечковую дегенерацию, нейромиотонию, синдром опсоклонус или синдром опсоклонус-миоклонус (OMS), и сенсорную невропатию, мультифокальную моторную невропатию, синдром Шихана, аутоиммунный гепатит, хронический гепатит, волчаночный гепатит, гигантоклеточный гепатит, хронический активный гепатит или аутоиммунный хронический активный гепатит, лимфоидный интерстициальный пневмонит, облитерирующий бронхиолит (нетрансплантационный), в отличие от NSIP, синдром Гийена-Барре, болезнь Бергера (IgA нефропатию), идиопатическую IgA нефропатию, линейный IgA дерматоз, первичный биллиарный цирроз, пневмоцирроз, синдром аутоиммунной энтеропатии, глютенчувствительную целиакию, целиакию, брюшные афты (глютеновую энтеропатию), рефрактерные афты, идиопатические афты, криоглобулинемию, боковой амиотрофический склероз (ALS; болезнь Лу Геринга), болезнь коронарных артерий, аутоиммунное заболевание уха, такое как аутоиммунное заболевание внутреннего уха (AIED), аутоиммунную потерю слуха, синдром опсоклонус-миоклонус (OMS), полихондрит, такой как устойчивый или рецидивирующий полихондрит, легочный альвеолярный протеиноз, амилоидоз, склерит, не злокачественный лимфоцитоз, первичный лимфоцитоз, включающий моноклональный B-клеточный лимфоцитоз (например, доброкачественная моноклональная гаммопатия и моноклональная гаммопатия неясной этиологии, MGUS), периферическая невропатия, паранеопластический синдром, каналопатии, такие как эпилепсия, мигрень, аритмия, мышечные нарушения, глухота, слепота, периодический паралич и каналопатии CNS; аутизм, воспалительную миопатию и фокальный сегментарный гломерулосклероз (FSGS), эндокринную офтальмопатию, увеоретинит, хориоретинит, аутоиммунное гепатологическое нарушение, фибромиалгию, множественную эндокринную недостаточность, синдром Шмидта, адреналит, атрофию желудка, пресенильную деменцию, демиелинизирующие заболевания, такие как аутоиммунные демиелинизирующие заболевания, диабетическую нефропатию, синдром Дресслера, очаговую алопецию, синдром CREST (кальциноз, феномен Рейно, нарушение моторики пищевода, склеродактилия, и телеангиэктозия), мужское и женское аутоиммунное бесплодие, смешанное заболевание соединительной ткани, болезнь Чагаса, ревматическую атаку, привычный выкидыш, альвеолит у сельскохозяйственных рабочих, полиформную эритему, посткардиотомный синдром, синдром Кушинга, легочную аллергию птицеловов, аллергический гранулематоз и ангиит, доброкачественный лимфоцитарный ангиит, синдром Альпорта, альвеолит, такой как аллергический альвеолит и фиброзирующий альвеолит, интерстициальную легочную болезнь, трансфузионную реакцию, лепру, малярию, лейшманиоз, трипаносомоз, шистозоматоз, аскариоз, аспергиллез, синдром Самптера, синдром Каплана, денге, эндокардит, эндомиокардиальный фиброз, диффузный интерстициальный пульмонарный фиброз, интерстициальный фиброз легких, идиопатический пульмонарный фиброз, кистозный фиброз, эндофтальмит, возвышенную стойкую эритему, гемолитическую болезнь новорожденных, эозинофильный фасциит, синдром Шульмана, синдром Фелти, филариоз, циклит, такой как хронический циклит, гетерохронический циклит, иридоциклит, или Циклит Фукса, пурпуру Шенлейна-Геноха, инфекцию вирусом иммунодефицита человека (HIV), инфекцию эховирусом, кардиомиопатию, болезнь Альцгеймера, инфекцию парвовирусом, инфекцию вирусом краснухи, синдром пост-вакцинации, инфекцию врожденной краснухи, инфекцию вирусом Эпштейна-Барр, свинку, синдром Эванса, аутоиммунную гонадную дисфункцию, хорею Сидсегама, постстрептококковый нефрит, облитерирующий тромбангиит, тиреотоксикоз, сухотку спинного мозга, хориоидит, гигантоклеточную полимиалгию, эндокринную офтальмопатию, хронический пневмонит гиперчувствительности, сухой кератоконъюнктивит, эпидемический кератоконъюнктивит, идиопатический нефритический синдром, нефропатия минимальных изменений, доброкачественное семейное и ишемически-реперфузионное повреждение, аутоиммунные нарушения сетчатки, воспаление суставов, бронхит, хроническое обструктивное заболевание дыхательных путей, силикоз, афты, афтозный стоматит, атеросклеротические нарушения, асперматогенез, аутоиммунный гемолиз, болезнь Бека, криоглобулинемию, контрактуру Дюпюитрена, факоанафилактическую эндофтальмию, аллергический энтерит, чешуйчатую узловатую эритему, идиопатический паралич лица, синдром хронической усталости, ревматическая лихорадка, заболевание Хаммена-Рича, сенсоневральную потерю слуха, пароксизмальную гемоглобинурию, гипогонадизм, регионарный илеит, лейкопению, инфекционный мононуклеоз, поперечный миелит, первичную идиопатическую микседему, нефроз, симпатическую офтальмию, гранулематозный орхит, панкреатит, острый полирадикулит, гангренозную пиодермию, тиреоидит Де Кервена, приобретенную атрофию селезенки, бесплодие из-за антител против сперматозоидов, незлокачественную тимому, витилиго, связанные с SCID и вирусом Эпштейна-Барр заболевания, синдром приобретенного иммунодефицита (СПИД), заболевания, вызванные паразитами, такими как Leishmania, синдром токсического шок, пищевое отравление, состояния, вовлекающие инфильтрацию T-клеток, нарушение адгезии лейкоцитов, иммунные ответы, связанные с острой и отсроченной гиперчувствительностью, опосредованной цитокинами и T-лимфоцитами, заболевания, вовлекающие диапедез лейкоцитов, синдром полиорганной недостаточности, опосредованные комплексом антиген-антитело заболевания, гломерулонефрит с образованием антител против базальной мембраны, аллергический неврит, аутоиммунные полиэндокринопатии, оофорит, первичную микседему, аутоиммунный атрофический гастрит, симпатическую офтальмию, ревматические заболевания, смешанное заболевание соединительной ткани, нефротический синдром, инсулит, полиэндокринное нарушение, периферическую невропатию, аутоиммунный полигландулярный синдром типа I, идиопатический гипопаратиреоз взрослых (AOIH), общую алопецию, дилатационную кардиомиопатию, приобретенный буллезный эпидермолиз (EBA), гемохроматоз, миокардит, нефротический синдром, первичный склерозирующий холангит, гнойный или не гнойный синусит, острый или хронический синусит, решетчатый, фронтальный синусит, гайморит или сфеноидальный синусит, связанное с эозинофилами нарушение, такое как эозинофилия, первичная инфильтрующая эозинофилия, синдром эозинофилии-миалгии, синдром Леффлера, хроническую эозинофильную пневмонию, местную легочную эозинофилию, бронхопневмонический аспергиллез, аспергиллому или гранулемы, содержащие эозинофилы, анафилаксия, серонегативные спондилоартриты, полиэндокринное аутоиммунное заболевание, склерозирующий холангит, повреждение склеры, эписклеры, хронический кандидоз кожи и слизистых оболочек, синдром Брутона, преходящую гипогаммаглобулинемию детей, синдром Вискотта-Олдрича, атаксическую телеангиэктозию, аутоиммунные нарушения, связанные с коллагенозом, ревматизм, неврологическое заболевание, ишемически-реперфузионное повреждение, снижение реакции кровяного давления, дисфункцию сосудов, ангиэктазию, повреждения тканей, сердечно-сосудистую ишемию, гипералгезию, церебральную ишемию и заболевание, сопровождающее васкуляризацию, нарушения с аллергической гиперчувствительностью, гломерулонефрит, реперфузионное повреждение, реперфузионное повреждение миокарда или другой ткани, дерматозы с острыми воспалительными компонентами, острый гнойный менингит или другие воспалительные нарушения центральной нервной системы, воспалительные нарушения глаз и глазниц, связанные с переливаниями гранулоцитов синдромы, индуцированную цитокинами токсичность, острое тяжелое воспаление, хроническое неустранимое воспаление, пиелит, пневмоцирроз, диабетическую ретинопатию, диабетическое повреждение крупных сосудов, внутриартериальную гиперплазию, пептическую язву, вальвулит и эндометриоз.
В дополнение к терапевтическим применениям, антитела по изобретению можно использовать для других целей, включая способы диагностики, такие как способы диагностики заболеваний и состояний, описанных в настоящем документе.
КОМБИНИРОВАННАЯ ТЕРАПИЯ
Мультиспецифическое антитело, аналог антитела или конъюгат антитело-лекарственное средство (ADC) по изобретению можно комбинировать в комбинированном фармацевтическом составе, или режиме дозирования в качестве комбинированной терапии, где второе соединение обладает, например, противораковыми свойствами. Второе соединение из комбинированного фармацевтического состава или режима дозирования, предпочтительно, обладает активностью, дополняющей активность антитела или ADC из комбинации, так что они не оказывают отрицательного влияния друг на друга.
Второе соединение может представлять собой химиотерапевтическое средство, цитотоксическое средство, цитокин, ингибирующее рост средство, антигормональное средство и/или кардиопротектор. Такие молекулы, соответственно, присутствуют в сочетании в количествах, эффективных для предназначенной цели. Фармацевтическая композиция, содержащая мультиспецифическое антитело, аналог антитела или ADC по изобретению, может также содержать терапевтически эффективное количество химиотерапевтического средства, такого как ингибитор формирования тубулина, ингибитор топоизомеразы или связывающее ДНК средство.
Другие терапевтические режимы можно комбинировать с введением противоракового средства. Комбинированную терапию можно проводить в одновременном или последовательном режиме. При последовательном введении комбинацию можно вводить за два или более введений. Комбинированное введение включает совместное введение, с использованием отдельных составов или одного фармацевтического состава, и последовательное введение в любом порядке, где, предпочтительно, существует период времени, когда оба (или все) активные средства одновременно проявляют свою биологическую активность.
В одном из вариантов осуществления лечение мультиспецифическим антителом, аналогом антитела или ADC включает комбинированное введение противоракового средства, указанного в настоящем документе, и одного или нескольких химиотерапевтических средств или ингибирующих рост средств, включая совместное введение коктейлей различных химиотерапевтических средств. Химиотерапевтические средства включают таксаны (такие как паклитаксел и доцетаксел) и/или антрациклиновые антибиотики. Получение и режимы дозирования для таких химиотерапевтических средств можно использовать согласно инструкциям производителя или по эмпирическому определению практикующего специалиста в данной области. Получение и режимы дозирования для такой химиотерапии описаны также в «Chemotherapy Service», (1992) Ed., M.C. Perry, Williams & Wilkins, Baltimore, Md.
Мультиспецифическое антитело, аналог антитела или ADC можно комбинировать с антигормональным соединением; например, антиэстрогеновым соединением, таким как тамоксифен; антипрогестероном, таким как онапристон (EP 616812); или антиандрогеном, таким как флутамид, в дозах, известных для таких молекул. Когда злокачественная опухоль, подлежащая лечению, является гормон-независимой злокачественной опухолью, пациента могли ранее подвергать антигормональной терапии, и, после того как злокачественная опухоль стала гормон-независимой, пациенту можно вводить антитело или ADC (и необязательно, другие средства, как описано в настоящем документе). Может быть преимущественным совместное введение также кардиопротектора (для предотвращения или уменьшения дисфункции миокарда, связанной с терапией) или одного или нескольких цитокинов пациенту. В дополнение к вышеуказанным терапевтическим режимам, пациента могут подвергать хирургическому удалению клеток злокачественных опухолей и/или радиотерапии.
Подходящие дозы для любого из вышеуказанных вводимых совместно средств являются такими, какие используют в настоящее время, и их можно понижать благодаря комбинированному действию (синергизму) нового идентифицированного средства и других химиотерапевтических средств или обработок.
Комбинированная терапия может обеспечивать «синергизм» и является доказанной, как «синергическая», т.е., эффект, достигаемый с помощью активных ингредиентов, используемых совместно, выше, чем сумма эффектов, получаемых при использовании соединений по отдельности. Синергического эффекта можно достигать, когда активные ингредиенты: (1) составляют совместно и вводят или доставляют одновременно в комбинированном составе для единичного дозирования; (2) доставляют с чередованием или параллельно в форме отдельных составов; или (3) посредством какого-либо другого режима. При введении в чередующейся терапии, синергического эффекта можно достигать, когда соединения вводят или доставляют последовательно, например, посредством различных инъекций в отдельных шприцах. Как правило, в ходе чередующейся терапии, эффективную дозу каждого активного ингредиента вводят последовательно, т.е. сериями, в то время как при комбинированной терапии, эффективные дозы двух или более активных ингредиентов вводят совместно.
КОНКРЕТНЫЕ ИЛЛЮСТРАТИВНЫЕ МОЛЕКУЛЫ-МИШЕНИ
Примеры молекул, на которые могут быть нацелены мультиспецифические антитела и аналоги антител по настоящему изобретению, включают, но без ограничения, растворимые белки сыворотки и их рецепторы, и другие связанные с мембраной белки (например, адгезины).
В других вариантах осуществления аналог антитела по изобретению является способным связывать один, и мультиспецифическое антитело по изобретению является способным связывать один, два или несколько цитокинов, родственных цитокинам белков и рецепторов цитокинов, выбранных из BMP1, BMP2, BMP3B (GDF1O), BMP4, BMP6, BMP8, CSF1 (M-CSF), CSF2 (GM-CSF), CSF3 (G-CSF), EPO, FGF1 (aFGF), FGF2 (bFGF), FGF3 (int-2), FGF4 (HST), FGF5, FGF6 (HST-2), FGF7 (KGF), FGF9, FGF10, FGF11, FGF12, FGF12B, FGF14, FGF16, FGF17, FGF19, FGF20, FGF21, FGF23, IGF1, IGF2, IFNA1, IFNA2, IFNA4, IFNA5, IFNA6, IFNA7, IFNB1, IFNG, IFNW1, FEL1, FEL1 (EPSELON), FEL1 (ZETA), IL1A, IL1B, IL2, IL3, IL4, IL5, IL6, IL7, IL8, IL9, IL10, IL11, IL12A, IL12B, IL13, IL14, IL15, IL16, IL17, IL17B, IL18, IL19, IL20, IL22, IL23, IL24, IL25, IL26, IL27, IL28A, IL28B, IL29, IL30, PDGFA, PDGFB, TGFA, TGFB1, TGFB2, TGFB3, LTA (TNF-b), LTB, TNF (TNF-a), TNFSF4 (лиганд OX40), TNFSF5 (лиганд CD40), TNFSF6 (FasL), TNFSF7 (лиганд CD27), TNFSF8 (лиганд CD30), TNFSF9 (лиганд 4-1BB), TNFSF10 (TRAIL), TNFSF11 (TRANCE), TNFSF12 (APO3L), TNFSF13 (April), TNFSF13B, TNFSF14 (HVEM-L), TNFSF15 (VEGI), TNFSF18, HGF (VEGFD), VEGF, VEGFB, VEGFC, IL1R1, IL1R2, IL1RL1, LL1RL2, IL2RA, IL2RB, IL2RG, IL3RA, IL4R, IL5RA, IL6R, IL7R, IL8RA, IL8RB, IL9R, IL10RA, IL10RB, IL11RA, IL12RB1, IL12RB2, IL13RA1, IL13RA2, IL15RA, IL17R, IL18R1, IL20RA, IL21R, IL22R, IL1HY1, IL1RAP, IL1RAPL1, IL1RAPL2, IL1RN, IL6ST, IL18BP, IL18RAP, IL22RA2, AIF1, HGF, LEP (лептин), PTN и THPO.
В другом варианте осуществления молекула-мишень представляет собой хемокин, рецептор хемокинов или родственный хемокину белок, выбранный из CCL1 (I-309), CCL2 (MCP-1/MCAF), CCL3 (MIP-Ia), CCL4 (MIP-Ib), CCL5 (RANTES), CCL7 (MCP-3), CCL8 (mcp-2), CCLH (эотаксин), CCL13 (MCP-4), CCL15 (MIP-Id), CCL16 (HCC-4), CCL17 (TARC), CCL18 (PARC), CCL19 (MDP-3b), CCL20 (MIP-3a), CCL21 (SLC/exodus-2), CCL22 (MDC/STC-I), CCL23 (MPIF-I), CCL24 (MPIF-2/эотаксин-2), CCL25 (TECK), CCL26 (эотаксин-3), CCL27 (CTACK/ILC), CCL28, CXCL1 (GRO1), CXCL2 (GRO2), CXCL3 (GR03), CXCL5 (ENA-78), CXCL6 (GCP-2), CXCL9 (MIG), CXCL10 (IP 10), CXCL11 (I-TAC), CXCL12 (SDF1), CXCL13, CXCL14, CXCL16, PF4 (CXCL4), PPBP (CXCL7), CX3CL1 (SCYD1), SCYE1, XCL1 (лимфотактин), XCL2 (SCM-Ib), BLR1 (MDR15), CCBP2 (D6/JAB61), CCR1 (CKR1/HM145), CCR2 (mcp-1RB/RA), CCR3 (CKR3/CMKBR3), CCR4, CCR5 (CMKBR5/ChemR13), CCR6 (CMKBR6/CKR-L3/STRL22/DRY6), CCR7 (CKR7/EBI1), CCR8 (CMKBR8/TER1/CKR-LI), CCR9 (GPR-9-6), CCRL1 (VSHK1), CCRL2 (L-CCR), XCR1 (GPR5/CCXCR1), CMKLR1, CMKOR1 (RDC1), CX3CR1 (V28), CXCR4, GPR2 (CCRlO), GPR31, GPR81 (FKSG80), CXCR3 (GPR9/CKR-L2), CXCR6 (TYMSTR/STRL33/Bonzo), HM74, IL8RA (IL8Ra), IL8RB (IL8Rb), LTB4R (GPR16), TCPlO, CKLFSF2, CKLFSF3, CKLFSF4, CKLFSF5, CKLFSF6, CKLFSF7, CKLFSF8, BDNF, C5R1, CSF3, GRCClO (ClO), EPO, FY (DARC), GDF5, HDF1A, DL8, PRL, RGS3, RGS13, SDF2, SLIT2, TLR2, TLR4, TREM1, TREM2 и VHL.
В других вариантах осуществления, аналог антитела по изобретению является способным связывать одну, и мультиспецифическое антитело по изобретению является способным связывать одну или несколько мишеней, выбранных из ABCF1; ACVR1; ACVR1B; ACVR2; ACVR2B; ACVRL1; AD0RA2A; аггрекана; AGR2; AICDA; AIF1; AIG1; AKAP1; AKAP2; AMH; AMHR2; ANGPT1; ANGPT2; ANGPTL3; ANGPTL4; ANPEP; APC; APOC1; AR; AZGP1 (цинк-a-гликопротеин); B7.1; B7.2; BAD; BAFF (BLys); BAG1; BAI1; BCL2; BCL6; BDNF; BLNK; BLR1 (MDR15); BMP1; BMP2; BMP3B (GDFlO); BMP4; BMP6; BMP 8; BMPR1A; BMPRIB; BMPR2; BPAG1 (плектин); BR3; BRCAl; C19orflO (IL27w); C3; C4A; C5; C5R1; CANT1; CASP1; CASP4; CAV1; CCBP2 (D6/JAB61); CCL1 (1-309); CCLI1 (эотаксин); CCL13 (MCP-4); CCL15 (MIP-Id); CCL16 (HCC-4); CCL17 (TARC); CCL18 (PARC); CCL19 (MIP-3b); CCL2 (MCP-1); MCAF; CCL20 (MIP-3a); CCL21 (MTP-2); SLC; exodus-2; CCL22 (MDC/STC-I); CCL23 (MPIF-1); CCL24 (MPIF-2/эотаксин-2); CCL25 (TECK); CCL26 (эотаксин-3); CCL27 (CTACK/ILC); CCL28; CCL3 (MTP-Ia); CCL4 (MDP-Ib); CCL5 (RANTES); CCL7 (MCP-3); CCL8 (mcp-2); CCNA1; CCNA2; CCND1; CCNE1; CCNE2; CCR1 (CKR1/HM145); CCR2 (mcp-lRB/RA); CCR3 (CKR3/CMKBR3); CCR4; CCR5 (CMKBR5/ChemR13); CCR6 (CMKBR6/CKR-L3/STRL22/DRY6); CCR7 (CKR7/EBI1); CCR8 (CMKBR8/TER1/CKR-L1); CCR9 (GPR-9-6); CCRL1 (VSHK1); CCRL2 (L-CCR); CD164; CD19; CD1C; CD20; CD180 (RP105); CD200; CD307 (FcRH5); CD22; CD24; CD28; CD3; CD37; CD38; CD3E; CD3G; CD3Z; CD4; CD40; CD40L; CD44; CD45RB; CD52; CD69; CD72; CD74; CD79A; CD79B; CD8; CD80; CD81; CD83; CD86; CDH1 (E-кадгерин); CDH10; CDH12; CDH13; CDH18; CDH19; CDH20; CDH5; CDH7; CDH8; CDH9; CDK2; CDK3; CDK4; CDK5; CDK6; CDK7; CDK9; CDKN1A (p21Wapl/Cipl); CDKN1B (p27Kipl); CDKN1C; CDKN2A (P16INK4a); CDKN2B; CDKN2C; CDKN3; CEBPB; CER1; CHGA; CHGB; хитиназ; CHST10; CKLFSF2; CKLFSF3; CKLFSF4; CKLFSF5; CKLFSF6; CKLFSF7; CKLFSF8; CLDN3; CLDN7 (клаудин-7); CLN3; CLU (кластерин); CMKLR1; CMKOR1 (RDC1); CNR1; COL18A1; COL1A1; COL4A3; COL6A1; CR2; CRP; CSF1 (M-CSF); CSF2 (GM-CSF); CSF3 (GCSF); CTLA4; CTNNB1 (b-катенин); CTSB (катепсин B); CX3CL1 (SCYD1); CX3CR1 (V28); CXCL1 (GROl); CXCL10 (IP-10); CXCLI1 (I-TAC/IP-9); CXCL12 (SDF1); CXCL13; CXCL14; CXCL16; CXCL2 (GRO2); CXCL3 (GRO3); CXCL5 (ENA-78/LIX); CXCL6 (GCP-2); CXCL9 (MIG); CXCR3 (GPR9/CKR-L2); CXCR4; CXCR6 (TYMSTR/STRL33/Bonzo); CYB5; CYC1; CYSLTR1; DAB2IP; DES; DKFZp451J0118; DNCLl; DPP4; E2F1; ECGFl; EDGl; EFNAl; EFNA3; EFNB2; EGF; EGFR; ELAC2; ENG; ENO1; ENO2; ENO3; EPHB4; EPO; ERBB2 (Her-2); EREG; ERK8; ESR1; ESR2; F3 (TF); FADD; FasL; FASN; FCER1A; FCER2; FCGR3A; FcRH1; FcRH2; FCRL4; FGF; FGF1 (aFGF); FGF10; FGF11; FGF12; FGF12B; FGF13; FGF14; FGF16; FGF17; FGF18; FGF19; FGF2 (bFGF); FGF20; FGF21; FGF22; FGF23; FGF3 (int-2); FGF4 (HST); FGF5; FGF6 (HST-2); FGF7 (KGF); FGF8; FGF9; FGFR3; FIGF (VEGFD); FEL1 (EPSILON); FIL1 (ZETA); FLJ12584; FLJ25530; FLRT1 (фибронектин); FLT1; FOS; FOSL1 (FRA-I); FY (DARC); GABRP (GABAa); GAGEBl; GAGECl; GALNAC4S-6ST; GATA3; GDF5; GFI1; GGT1; GM-CSF; GNAS1; GNRH1; GPR2 (CCRlO); GPR31; GPR44; GPR81 (FKSG80); GRCClO (ClO); GRP; GSN (гельсолин); GSTP1; HAVCR2; HDAC4; HDAC5; HDAC7A; HDAC9; HGF; HIF1A; HDP1; гистамин и рецепторы гистамина; HLA-A; HLA-DOB; HLA-DRA; HM74; HMOX1; HUMCYT2A; ICEBERG; ICOSL; ID2; IFN-a; IFNA1; IFNA2; IFNA4; IFNA5; IFNA6; IFNA7; IFNB1; IFNгамма; DFNW1; IGBP1; IGF1; IGF1R; IGF2; IGFBP2; IGFBP3; IGFBP6; IL-I; IL10; IL10RA; IL10RB; IL11; IL11RA; IL-12; IL12A; IL12B; IL12RB1; IL12RB2; IL13; IL13RA1; IL13RA2; IL14; IL15; IL15RA; IL16; IL17; IL17B; IL17C; IL17R; IL18; IL18BP; IL18R1; IL18RAP; IL19; ILlA; ILlB; ILlF10; IL1F5; IL1F6; IL1F7; IL1F8; IL1F9; IL1HY1; IL1R1; IL1R2; IL1RAP; IL1RAPL1; IL1RAPL2; IL1RL1; IL1RL2, IL1RN; IL2; IL20; IL20RA; IL21R; IL22; IL22R; IL22RA2; IL23; IL24; IL25; IL26; IL27; IL28A; IL28B; IL29; IL2RA; IL2RB; IL2RG; IL3; IL30; IL3RA; IL4; IL4R; IL5; IL5RA; IL6; IL6R; IL6ST (гликопротеин 130); EL7; EL7R; EL8; IL8RA; DL8RB; IL8RB; DL9; DL9R; DLK; INHA; INHBA;INSL3; INSL4; IRAKI; ERAK2; ITGA1; ITGA2; ITGA3; ITGA6 (интегрин a6); ITGAV; ITGB3; ITGB4 (интегрин b 4); JAG1; JAK1; JAK3; JUN; K6HF; KAI1; KDR; KITLG; KLF5 (GC Box BP); KLF6; KLKlO; KLK12; KLK13; KLK14; KLK15; KLK3; KLK4; KLK5; KLK6; KLK9; KRT1; KRT19 (кератин 19); KRT2A; KHTHB6 (специфический для волос кератин типа H); LAMAS; LEP (лептин); Lingo-p75; Lingo-Troy; LPS; LTA (TNF-b); LTB; LTB4R (GPR16); LTB4R2; LTBR; MACMARCKS; MAG или Omgp; MAP2K7 (c-Jun); MDK; MIB1; мидкин; MEF; MIP-2; MKI67; (Ki-67); MMP2; MMP9; MS4A1; MSMB; MT3 (металлотионектин-III); MTSS1; MUC1 (муцин); MYC; MYD88; NAG 14; NCK2; нейрокан; NFKB1; NFKB2; NGFB (NGF); NGFR; NgR-Lingo; NgR-Nogo66 (Nogo); NgR-p75; NgR-Troy; NME1 (NM23A); N0X5; NPPB; NROB1; NR0B2; NR1D1; NR1D2; NR1H2; NR1H3; NR1H4; NR1I2; NR1I3; NR2C1; NR2C2; NR2E1; NR2E3; NR2F1; NR2F2; NR2F6; NR3C1; NR3C2; NR4A1; NR4A2; NR4A3; NR5A1; NR5A2; NR6A1; NRP1; NRP2; NT5E; NTN4; ODZ1; OPRD1; P2RX5; P2RX7; PAP; PARTl; PATE; PAWR; PCA3; PCNA; PDGFA; PDGFB; PECAMl; PF4 (CXCL4); PGF; PGR; фосфакан; PIAS2; PIK3CG; PLAU (uPA); PLG; PLXDC1; PPBP (CXCL7); PPID; PR1; PRKCQ; PRKD1; PRL; PROC; PROK2; PSAP; PSCA; PTAFR; PTEN; PTGS2 (COX-2); PTN; RAC2 (p21Rac2); RARB; RGS1; RGS13; RGS3; RNFIlO (ZNF144); ROBO2; S100A2; SCGB1D2 (липофилин B); SCGB2A1 (маммаглобин 2); SCGB2A2 (маммаглобин 1); SCYE1 (эндотелиальный активирующий моноциты цитокин); SDF2; SERPINA1; SERPINA3; SERP1NB5 (маспин); SERPINE1 (PAI-I); SERPDMF1; SHBG; SLA2; SLC2A2; SLC33A1; SLC43A1; SLIT2; SPP1; SPRR1B (Sprl); ST6GAL1; STAB1; STAT6; STEAP; STEAP2; TB4R2; TBX21; TCPlO; TDGF1; TEK; TGFA; TGFB1; TGFB1I1; TGFB2; TGFB3; TGFBI; TGFBR1; TGFBR2; TGFBR3; TH1L; THBS1 (тромбоспондин-1); THBS2; THBS4; THPO; TIE (Tie-1); TMP3; тканевой фактор; TLRlO; TLR2; TLR3; TLR4; TLR5; TLR6; TLR7; TLR8; TLR9; TNF; TNF-a; TNFAEP2 (B94); TNFAIP3; TNFRSFIlA; TNFRSFlA; TNFRSFlB; TNFRSF21; TNFRSF5; TNFRSF6 (Fas); TNFRSF7; TNFRSF8; TNFRSF9; TNFSF1O (TRAIL); TNFSF11 (TRANCE); TNFSF12 (APO3L); TNFSF13 (April); TNFSF13B; TNFSF14 (HVEM-L); TNFSF15 (VEGI); TNFSF18; TNFSF4 (лиганд OX40); TNFSF5 (лиганд CD40); TNFSF6 (FasL); TNFSF7 (лиганд CD27); TNFSF8 (лиганд CD30); TNFSF9 (4-lBB лиганд); TOLLIP; Toll-подобные рецепторы; TOP2A (топоизомеразы Ea); TP53; TPM1; TPM2; TRADD; TRAF1; TRAF2; TRAF3; TRAF4; TRAF5; TRAF6; TREM1; TREM2; TRPC6; TSLP; TWEAK; VEGF; VEGFB; VEGFC; версикан; VHL C5; VLA-4; XCL1 (лимфотактин); XCL2 (SCM-Ib); XCR1(GPR5/CCXCR1); YY1; и ZFPM2.
В конкретных вариантах осуществления одна или несколько молекул - молекулярных мишеней для антител, включенных в настоящее изобретение, включают CD белки, выбранные из CD3, CD4, CD8, CD16, CD19, CD20, CD34, CD64, CD79A, CD79B, CD180 (RP105), CD200 и CD307 (FcRH5); члены семейства рецепторов ErbB, выбранные из рецептора EGF (HER1), рецептора HER2, HER3 или HER4; молекулы клеточной адгезии, выбранные из LFA-1, Mac1, p150.95, VLA-4, ICAM-1, VCAM, интегрина альфа4/бета7 и интегрина альфаv/бета3, включая их альфа или бета-субъединицы (например, анти-CD11a, анти-CD18 или анти-CD11b антитела); факторы роста, выбранные из VEGF-A, VEGF-C; тканевого фактора (TF); альфа интерферон (альфаIFN); TNFальфа, интерлейкина, выбранного из IL-1 бета, IL-3, IL-4, IL-5, IL-8, IL-9, IL-13, IL17A/F, IL-18, IL-13Rальфа1, IL13Rальфа2, IL-4R, IL-5R, IL-9R, IgE; антигены группы крови; рецептор flk2/flt3; рецептор ожирения (OB); рецептор mpl; CTLA-4; RANKL, RANK, белок F RSV, белок C.
В WO 96/16673 описано биспецифическое антитело анти-ErbB2/анти-FcγRIII и в патенте США No. 5837234 описано биспецифическое антитело анти-ErbB2/анти-FcγRI. Биспецифическое анти-ErbB2/Fcα антитело показано в WO98/02463. В патентах США No. 5821337 и 6407213 описаны биспецифические антитела анти-ErbB2/анти-CD3. Описаны дополнительные биспецифические антитела, связывающие один эпитоп на CD3 антигене и второй эпитоп. См., например, Патенты США No. 5078998 (против CD3/антигена клеток опухоли); 5601819 (анти-CD3/IL-2R; анти-CD3/CD28; анти-CD3/CD45); 6129914 (против CD3/антигена злокачественных B-клеток); 7112324 (анти-CD3/CD19); 6723538 (анти-CD3/CCR5); 7235641 (анти-CD3/EpCAM); 7262276 (против CD3/антигена опухоли яичников); и 5731168 (анти-CD3/CD4IgG).
В одном из вариантов осуществления мультиспецифическое антитело по настоящему изобретению связывает по меньшей мере две молекулы-мишени, выбранные из IL-1альфа и IL-1бета, IL-12 и IL-18; IL-13 и IL-9; IL-13 и IL-4; IL-13 и IL-5; IL-5 и IL-4; IL-13 и IL-1 бета; IL-13 и IL-25; IL-13 и TARC; IL-13 и MDC; IL-13 и MEF; IL-13 и TGF-β; IL-13 и агониста LHR; IL-12 и TWEAK, IL-13 и CL25; IL-13 и SPRR2a; IL-13 и SPRR2b; IL-13 и ADAM8, IL-13 и PED2, IL17A и IL17F, CD3 и CD19, CD138 и CD20; CD138 и CD40; CD19 и CD20; CD20 и CD3; CD38 и CD138; CD38 и CD20; CD38 и CD40; CD40 и CD20; CD-8 и IL-6; CD20 и BR3, TNF альфа и TGF-бета, TNF альфа и IL-1 бета; TNF альфа и IL-2, TNF альфа и IL-3, TNF альфа и IL-4, TNF альфа и IL-5, TNF альфа и IL6, TNF альфа и IL8, TNF альфа и IL-9, TNF альфа и IL-10, TNF альфа и IL-11, TNF альфа и IL-12, TNF альфа и IL-13, TNF альфа и IL-14, TNF альфа и IL-15, TNF альфа и IL-16, TNF альфа и IL-17, TNF альфа и IL-18, TNF альфа и IL-19, TNF альфа и IL-20, TNF альфа и IL-23, TNF альфа и IFN альфа, TNF альфа и CD4, TNF альфа и VEGF, TNF альфа и MIF, TNF альфа и ICAM-1, TNF альфа и PGE4, TNF альфа и PEG2, TNF альфа и RANK лиганда, TNF альфа и Te38; TNF альфа и BAFF; TNF альфа и CD22; TNF альфа и CTLA-4; TNF альфа и GP130; TNFα и IL-12p40; VEGF и HER2, VEGF-A и HER2, VEGF-A и PDGF, HER1 и HER2, VEGF-A и VEGF-C, VEGF-C и VEGF-D, HER2 и DR5, VEGF и IL-8, VEGF и MET, VEGFR и рецептора MET, VEGFR и EGFR, HER2 и CD64, HER2 и CD3, HER2 и CD16, HER2 и HER3; EGFR(HER1) и HER2, EGFR и HER3, EGFR и HER4, IL-13 и CD40L, IL4 и CD40L, TNFR1 и IL-1R, TNFR1 и IL-6R и TNFR1 и IL-18R, EpCAM и CD3, MAPG и CD28, EGFR и CD64, CSPG и RGM A; CTLA-4 и BTNO2; IGF1 и IGF2; IGF1/2 и Erb2B; MAG и RGM A; NgR и RGM A; NogoA и RGM A; OMGp и RGM A; PDL-I и CTLA-4; и RGM A и RGM B.
В одном из вариантов осуществления мультиспецифическое антитело по настоящему изобретению связывает CD3 и по меньшей мере одну дополнительную молекулу-мишень, выбранную из BLR1, BR3, CD19, CD20, CD22, CD72, CD79A, CD79B, CD 180 (RP105), CR2, FcRH1, FcRH2, FcRH5, FCER2, FCRL4, HLA-DOB и NAG14.
Растворимые антигены или их фрагменты, необязательно, конъюгированные с другими молекулами, можно использовать в качестве иммуногенов для получения антител. В случае трансмембранных молекул, таких как рецепторы, их фрагменты (например, внеклеточный домен рецептора) можно использовать в качестве иммуногена. Альтернативно, клетки, экспрессирующие трансмембранную молекулу, можно использовать в качестве иммуногена. Такие клетки могут быть получены из природного источника (например, линии клеток злокачественной опухоли) или могут представлять собой клетки, трансформированные рекомбинантными способами для экспрессии трансмембранных молекул. Другие антигены и их формы, пригодные для получения антител, очевидны специалистам в данной области.
МЕТАБОЛИТЫ КОНЪЮГАТОВ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО
В объем настоящего изобретения входят также продукты метаболизма in vivo соединений ADC, описанных в настоящем документе, в той степени, в которой такие продукты являются новыми и неочевидными из предшествующей области техники. Такие продукты могут возникать, например, в результате окисления, восстановления, гидролиза, амидирования, эстерификации, ферментативного расщепления и т.п., введенного соединения. Соответственно, изобретение относится к новым и неочевидным соединениям, полученным способом, включающим контакт соединения по настоящему изобретению с млекопитающим в течение периода времени, достаточного для получения продукта его метаболизма.
Продукты метаболизма, как правило, идентифицируют получением радиоактивно меченного (например, 14C или 3H) ADC, введением его парентерально в поддающейся детекции дозе (например, более приблизительно 0,5 мг/кг) животному, такому как крыса, мышь, морская свинка, обезьяна, или человеку, предоставлением достаточного времени для прохождения метаболизма (как правило, приблизительно от 30 секунд до 30 часов) и выделением продуктов его превращения из мочи, крови или других биологических образцов. Эти продукты легко выделять, поскольку они являются мечеными (другие выделяют с использованием антител, способных связывать эпитопы, сохраняющиеся в метаболите). Структуры метаболитов определяют общепринятым способом, например, посредством анализа MS, LC/MS или ЯМР. Как правило, анализ метаболитов проводят таким же способом, как общепринятые исследования метаболизма лекарственного средства, хорошо известные специалистам в данной области. Продукты превращения, при условии, что в ином случае их не обнаруживают in vivo, являются пригодными для диагностических анализов для терапевтического дозирования соединений ADC по изобретению.
СПОСОБЫ ВИЗУАЛИЗАЦИИ
В других вариантах осуществления мультиспецифические антитела или аналоги антител можно метить через реакционноспособный тиол с помощью радиоактивных изотопов, флуоресцентных красителей, запускающих биолюминесценцию групп субстрата, запускающих хемилюминесценцию групп субстрата, ферментов и других детектирующих меток для экспериментов получения изображений с диагностическими, фармакодинамическими и терапевтическими применениями. Как правило, меченое мультиспецифическое антитело или меченый аналог антитела, т.е. «биомаркер» или «зонд», вводят посредством инъекции, перфузии, или перорального приема внутрь в живой организм, например, человека, грызуна или другого мелкого животного, в перфузируемый орган или образец ткани. Распределение зонда детектируют с течением времени и представляют посредством изображения.
ИЗДЕЛИЯ
Другой вариант осуществления изобретения относится к изделию, или «набору», содержащему материалы, подходящие для лечения нарушений, описанных выше. Изделие содержит контейнер и этикетку или листовку-вкладыш на контейнере или приложенные к контейнеру. Подходящие контейнеры включают, например, флаконы, ампулы, шприцы, блистерные упаковки и т.д. Контейнеры можно изготавливать из множества материалов, таких как стекло или пластик. Контейнер содержит композицию мультиспецифического антитела, аналога антитела или ADC, являющуюся эффективной для лечения состояния, и может обладать стерильным отверстием для доступа (например, контейнер может представлять собой пакет с раствором для внутривенного введения или флакон с пробкой, прокалываемой стерильной иглой для подкожных инъекций). По меньшей мере одно активное средство в композиции представляет собой мультиспецифическое антитело, аналог антитела или ADC. На этикетке или в листовке-вкладыше указано, что композицию применяют для лечения выбранного состояния, такого как злокачественная опухоль. Альтернативно или дополнительно, изделие может дополнительно содержать второй (или третий) контейнер, содержащий фармацевтически пригодный буфер, такой как бактериостатическая вода для инъекций (BWFI), фосфатно-солевой буфер, раствор Рингера и раствор декстрозы. Оно может дополнительно содержать другие материалы, желательные с коммерческой или пользовательской точки зрения, включая другие буферы, разбавители, фильтры, иглы и шприцы.
ПРИМЕРЫ
Далее приведены примеры способов и композиций по изобретению. Понятно, что на практике можно осуществлять различные другие варианты осуществления, принимая во внимание общее описание, представленное выше.
Пример 1 - Получение тио-Fab и шарнир-cys-Fab, получение белка и синтез биспецифических бис-Fab
Получение тио-Fab и шарнир-cys-Fab
Несколько способов использовали для получения фрагментов антител со свободными сульфгидрильными группами для использования в последующих реакциях. По одному способу, цистеиновые замены вводили в конструкции антител в различных положениях в константных доменах легких цепей или тяжелых цепей посредством сайт-специфического мутагенеза для получения тио-Mab, как описано ранее в Junutula, et al. J Immunol Methods 332(1-2): 41-52 (2008). Тио-Fab получали ферментативным способом из тио-Mab посредством разведения тио-Mab до 1 мг/мл в 25 мМ Трис, pH 8,0, и ферментативного расщепления при 37°C в течение 1 час с использованием Lys-C (Wako Chemicals USA, Inc., Richmond, VA) при оотношении фермента к антителу 1:1000 (масс/масс). Расщепление Lys-C останавливали с помощью 5 мкМ ингибитора протеаз тозил-L-лизинхлорметилкетона (TLCK) (Bachem, Torrence, CA) и проводили очистку катионообменной хроматографией на 5 мл колонке Hi-Trap SP FF (GE Healthcare, Piscataway, NJ) с использованием буфера 50 мМ ацетата натрия и 10 CV градиента 0-300 мМ NaCl. Тио-Fab, полученные этим способом, иногда обозначают в настоящем документе как «ферментативные тио-Fab». По другому способу, конструкции ДНК, кодирующие Fab, имеющие сконструированный остаток cys, или конструкции ДНК, кодирующие фрагменты тяжелой цепи, содержащие один природный остаток cys в шарнирной области, субклонировали в плазмидные векторы экспрессии и экспрессировали непосредственно в E. coli. Тио-Fab, полученные этим способом, иногда обозначают в настоящем документе как «рекомбинантные тио-Fab». Третий способ использовали для антител, лишенных сконструированного остатка cys, и с расчетом на природный остаток(остатки) cys, присутствующий в шарнирной области IgG. Этот способ использован для получения «шарнир-cys-Fab», и более подробно описан ниже.
Для получения шарнир-cys-Fab из природных антител, которые не содержат сконструированного цистеина для использования в реакциях синтеза, авторы настоящего изобретения использовали следующий ферментативный способ. В то время как следующий способ использовали для трастузумаба, способ в общем можно использовать для любого IgG. Трастузумаб расщепляли пепсином (1% масс./масс.) посредством обработки в буфере ацетате натрия при pH 4,5. После расщепления в течение 1 час, F(ab')2 выделяли из смеси для расщепления посредством связывания с катионообменной смолой SP-HP и очистки 10 CV градиента соли 0-1 M NaCl. Затем F(ab')2 восстанавливали в буфере, содержащем 25 мМ MES, pH 5,8, 2 мМ ЭДТА и 300 мМ NaCl. После восстановления с помощью 1 мМ TCEP Fab окисляли добавлением 5 мМ DHAA для повторного формирования дисульфида между тяжелой цепью и легкой цепью. Авторы настоящего изобретения обычно наблюдали, что в этих условиях реакции, повторно формировался только дисульфид между тяжелой цепью и легкой цепью; два остатка цистеина в шарнирной области оставались неокисленными.
Затем проводили реакцию двух свободных тиолов (остатков cys) в шарнире с 1 молярным эквивалентом N-этилмалеинимида (NEM) (Sigma Aldrich, St. Louis, MO). Затем проводили реакцию полученной смеси, содержащей Fab с одной модификацией, с двумя модификациями и без модификаций с избытком бис-малеимидо-кросслинкера. В этих условиях реакции получали три продукта: Fab с одним кросслинкером и одним NEM, Fab с двумя NEM и Fab, содержащие только один кросслинкер. Обнаружили, что Fab, содержащие только один кросслинкер, не имеют свободного цистеина. Таким образом, в этих условиях реакции один кросслинкер очень эффективно вступает в реакцию с обоими остатками цистеина с образованием молекулы, где остатки цистеина циклизованы посредством кросслинкера. Материал, содержащий вышеуказанные три продукта реакции, очищали от реакционной смеси (для удаления нежелательных компонентов реакционной смеси) гель-фильтрацией и использовали для соединения с другими шарнир-cys-Fab, полученными сходным способом, или с тио-Fab. Только шарнир-cys-Fab или тио-Fab, полученные, как описано, и содержащие один кросслинкер, один свободный малеимидо и один свободный сульфгидрил, являлись способными вступать в реакции синтеза бис-Fab, подробно описанные ниже.
Экспрессия и очистка белка
Экспрессию белка в E. coli проводили посредством культивирования в течение ночи во встряхиваемых колбах или в 10-литровом ферментере, как описано ранее. См., например, Carter, et al., Biotechnology (N Y) 10(2): 163-7 (1992); Simmons, et al., J Immunol Methods 263(1-2): 133-47 (2002). В случае трастузумаба (полноразмерный Герцептин®), сконструированного с содержанием реакционноспособного остатка цистеина (hu4D5-тио-Mab), антитело экспрессировали и очищали, как описано в Junutula, et al. J Immunol Methods 332(1-2): 41-52 (2008). Осадки клеток E. coli, экспрессирующих рекомбинантные тио-Fab или рекомбинантные шарнир-cys-Fab, ресуспендировали в буфере, содержащем 25 мМ Трис, pH 7,5, 125 мМ NaCl, 5 мМ ЭДТА (TEB) и лизировали с использованием микрофлюидайзера. Экстракт обрабатывали флокулирующим полиэтиленимином (0,4%), доведенным до pH 9,0, в течение 1 часа с перемешиванием с последующим центрифугированием в течение 45 минут при 15000 x g. Тио-Fab или шарнир-cys-Fab очищали общепринятыми способами, известными в данной области с использованием хроматографии с белком G и катионообменной хроматографии. Конкретно, супернатанты фильтровали через фильтр 0,22 микрон и затем наносили непосредственно на смолу с белком G, как правило, Hi-Trap Protein G (GE Healthcare, Piscataway, NJ). Проводили элюцию с помощью 0,2 M уксусной кислоты с последующим связыванием с катионообменной смолой SP-HP (GE Healthcare, Piscataway, NJ). Тио-Fab или шарнир-cys-Fab элюировали 10 CV градиента 0-1 M NaCl. Очищенные тио-Fab характеризовали посредством SDS-PAGE и масс-спектрометрии. При этой характеризации часто показывали увеличения массы на 275 Да и 306 Да. Обнаружили, что эти увеличения массы представляют собой дисульфидные аддукты на неспаренном цистеине, которые удаляли восстановлением и окислением для подготовки тио-Fab для сшивания с бис-малеинимидом. Восстановление и окисление тио-Fab проводили следующим образом. Сначала тио-Fab восстанавливали в течение 24 час добавлением 2 мМ трис(2-карбоксиэтил)фосфин HC1 (TCEP-HC1; обозначаемого также TCEP) (Pierce [Thermo Fisher Scientific], Rockford, IL) в буфере, содержащем 25 мМ MES, pH 5,8, 300 мл NaCl и 5 мМ ЭДТА. После восстановления белок окисляли добавлением 5 мМ дегидроаскорбиновой кислоты (DHAA) (Sigma-Aldrich, St. Louis, MO). Выделенные тио-Fab анализировали посредством SDS-PAGE и масс-спектрометрии, чтобы убедиться, что белки правильно восстановлены и окислены.
Синтез бис-Fab
На фигуре 1 показана схема синтеза бис-Fab. На первой стадии синтеза бис-Fab использовали тио-Fab или шарнир-cys-Fab с неспаренным цистеином. Как правило, тио-Fab или шарнир-cys-Fab находился в том же буфере, в котором проводили восстановление и окисление (MES, pH 5,8, 2 мМ ЭДТА и 300 мМ NaCl) при концентрации белка 1 мг/мл (Фиг. 1, панель 1). На этой стадии существуют два потенциальных нежелательных продукта реакции, дисульфидные димеры и димеры кросслинкера. Авторы настоящего изобретения обнаружили, что концентрация белка 1 мг/мл на этой стадии синтеза является важной, поскольку димеризация являлась минимальной при этой концентрации белка. Кроме того, контроль реакции с использованием буфера с низким pH с ЭДТА помогал минимизировать димеризацию. Пятикратный избыток бис-малеимидо-кросслинкера (Quanta BioDesign, Powell, OH) добавляли в реакционную смесь (Фиг. 1, панель 2). Этот 5-кратный избыток кросслинкера также являлся полезным для минимизации нежелательной димеризации. Реакционную смесь инкубировали при комнатной температуре (RT) или 37°C в течение четырех часов до завершения. Затем смесь концентрировали до объема, подходящего для гель-фильтрации (Фиг. 1, панель 3). Авторы настоящего изобретения, как правило, использовали 22 мл колонку S-200 Tricorn (GE Healthcare, Piscataway, NJ) для синтеза в количествах от мкг до мг. Эта первая стадия гель-фильтрации позволяла удаление несвязанного кросслинкера с получением очищенного тио-Fab или шарнир-cys-Fab, конъюгированного с кросслинкером. Условия, описанные выше, как правило, приводили по меньшей мере к 90% или более желаемого продукта. Ни тио-Fab, ни шарнир-cys-Fab не оставались в форме свободного тиола, поскольку все они являлись конъюгированными с кросслинкером или связанными посредством дисульфида с другим тио-Fab или шарнир-cys-Fab через неспаренные остатки цистеина.
Затем выделенные и очищенные молекулы тио-Fab (или шарнир-cys-Fab) плюс кросслинкер добавляли ко второму тио-Fab (или шарнир-cys-Fab) и концентрировали до 5 мг/мл или более, как правило, до объема, подходящего для гель-фильтрации (Фиг. 1, панель 4). Авторы настоящего изобретения обнаружили, что концентрация белка по меньшей мере 5 мг/мл в ходе этой стадии синтеза являлась важной, чтобы довести реакцию до завершения. Более низкие концентрации белка приводили к образованию только небольших количеств соединенных крослинкером бис-Fab димеров. Без связи с какой-либо теорией, авторы настоящего изобретения выдвинули гипотезу, что стерический эффект или связанные с вязкостью изменения, мешающие формированию соединенных крослинкером бис-Fab димеров преодолевают увеличивающимися концентрациями реагентов. Кроме того, авторы настоящего изобретения тестировали диапазон концентраций белка вплоть до 65 мг/мл, включительно. Авторы настоящего изобретения обнаружили такую корреляцию между концентрацией белка и временем реакции, что чем выше концентрация белка, тем быстрее реакция достигает завершения (данные не представлены). Через 2-24 часов при RT или 37°C реакция завершалась, как определяли масс-спектрометрией (Фиг. 1, панель 4). Как правило, один реагент присутствовал в избытке и оставался несвязанным в конечной смеси. Реакционную смесь после завершения реакции снова очищали гель-фильтрацией; в этот раз авторы настоящего изобретения собрали пик димеров, содержащий 100 кДа бис-Fab, необратимо сшитый через свободную аминокислоту цистеин (в случае тио-Fab) или через неспаренный цистеин, локализованный в шарнирной области (в случае немодифицированных шарнир-cys-Fab) (Фиг. 1, панель 4). Прохождение реакции в ходе обеих стадий часто мониторировали посредством масс-спектрометрии, которая ясно показала присутствие обоих реагентов и формирование продукта бис-Fab (Фиг. 1, панель 4). Чистоту желаемого продукта после второй гель-фильтрации определяли посредством масс-спектрометрии и SDS-PAGE. После восстановления и анализа SDS-PAGE, необратимое сшивание наблюдали по присутствию полосы 50 кДа, представляющей не поддающиеся восстановлению сшитые цепи (Фиг. 1, панель 5). С использованием способа, описанного выше в малом масштабе, авторы настоящего изобретения, как правило, достигали микрограммовых выходов при микрограммовых количествах исходных материалов. Кроме того, в более крупном масштабе, авторы настоящего изобретения, как правило, достигали миллиграммовых выходов из миллиграммовых количеств исходных материалов.
Пример 2 - Синтез бис-Fab, нацеленных на Her2 и Her1, и анализ биологической активности бис-Fab in vitro
Для исследования различной биологической активности бис-Fab авторы настоящего изобретения синтезировали бис-Fab, нацеленные на мишени-компоненты пути Her, конкретно, Her2 и Her1. Важность пути Her в управлении ростом клеток злокачественных опухолей хорошо документирована, и различные сильные ингибирующие антитела легко доступны. См., например, Kumar, R. et al., Semin Oncol 27(6 Suppl 11):84-91; обсуждение в 92-100 (2000); Yarden, Y. et al., Nat Rev Mol Cell Biol 2(2): 127-37 (2001); Takai, N. et al., Cancer 104(12):2701-8 (2005); Patel, D. et al., Int J Oncol 34(l):25-32 (2009). Предположили, что комбинированная молекула может предоставлять дополнительное или даже синергическое преимущество по сравнению с терапией одним антителом. См., например, Ranson, et al., Oncology 63 Suppl 1: 17-24 (2002); Jackson, J. et al., Cancer Res 64(7):2601-9 (2004); Lee-Hoeflich, S. T. et al., Cancer Res 68(14):5878-87 (2008). Это в частности представляет собой случай, когда, как и по настоящему изобретению, два рецептора активно действуют совместно для управления ростом клеток опухоли.
Авторы настоящего изобретения получили биспецифические бис-Fab из двух различных антител, нацеленных на Her2 и из двух различных антител, нацеленных на Her1 (EGFR). Два нацеленных на Her2 антитела представляли собой пертузумаб (2C4) и трастузумаб (Herc). Оба этих антитела являются хорошо охарактеризованными молекулами, включая знания о том, как они связывают свои мишени. Nature 421(6924):756-60 (2003); Cancer Cell (4):317-28 (2004). Два нацеленных на Her1 антитела представляли собой D1-5 и C3-101. Оба этих антитела связывают внеклеточный домен (ECD) EGFR, и области, с которыми они связываются на ECD EGFR, известны (Публикация международной патентной заявки No. WO 2010/108127).
Для каждого из этих четырех антител рекомбинантные тио-Fab продуцировали в E. Coli, как описано. Затем авторы настоящего изобретения синтезировали бис-Fab из этих четырех тио-Fab в комбинаторном формате с использованием матрицы синтеза. Авторы настоящего изобретения начинали приблизительно с 5 мг каждого тио-Fab. Авторы настоящего изобретения комбинировали различные тио-Fab для синтеза 10 уникальных молекул, как показано жирным шрифтом в таблице 1 ниже.
Матрица синтеза бис-Fab
(1204)
(1191)
(1188)
(1192)
(1189)
(1400)
(1187)
(1190)
(1193)
(1401)
Приблизительно один мг каждого бис-Fab, перечисленных в таблице 1, выделяли после синтеза. Каждому из бис-Fab присваивали уникальный идентификатор, как указано в таблице 1 (номер в скобках). Чистоту каждого бис-Fab анализировали посредством SDS-PAGE (показано на фиг. 2A) и масс-спектрометрии (данные не представлены). Эти молекулы тестировали для определения, сохраняют ли они способность ингибировать передачу сигналов в клетках и пролиферацию клеток, подобно исходным антителам. Авторы настоящего изобретения тестировали два специфических вывода данных по активности передачи сигнала в клетках, фосфорилированию EGFR в ответ на трансформирующий фактор роста (TGFα) и фосфорилированию Her 3 после обработки херегулином (HRG). В анализе фосфорилирования Her3 специфически тестируют способность Her2 димеризоваться с Her3 в ответ на херегулин (Junttila, T. T., et al., Cancer Cell 15(5): 429-40 (2009)). Димеризация позволяет Her2 фосфорилировать Her3 и аткивировать путь передачи сигнала, и это ингибируют посредством Герцептина® и Герцептин® Fab. ld.
Для анализа анти-EGFR (анти-Her1) активности бис-Fab клетки NR6-EGFR обрабатывали 5 нМ TGFα для стимуляции тирозинового фосфорилирования EGFR с последующей обработкой указанными бис-Fab (Фиг. 2B, верхняя панель) в однократной дозе 50 нМ. Каждый из тестированных бис-Fab, 1187, 1189, 1190 и 1192, содержал один Fab, происходящий из анти-EGFR (анти-Her1) антитела, D1-5 или C3-101. Активность фосфорилирования анализировали Вестерн-блоттингом с α-pTyr в качестве зонда, как описано в Junttila, T. T., et al., Cancer Cell 15(5): 429-40 (2009). Как показано на Фиг. 2B, верхняя панель, для каждого из тестированных бис-Fab показали сильное ингибирование фосфорилирования EGFR в клетках NR6-EGFR. Эрбитукс® (цетуксимаб) представляет собой моноклональные антитело, продаваемое Bristol-Meyers Squibb Co., которое специфически связывает ECD EGFR и которое использовали в качестве положительного контроля. Блоты анализировали с α-тубулином в качестве зонда для нормализации нагрузки белка в каждой дорожке.
Для анализа ингибирования димеризации Her2-Her3, индуцированное херегулином (HRG) тирозиновое фосфорилирование Her3 в клетках MCF7 мониторировали Вестерн-блоттингом против тирозина, как описано в Junttila, T. T., et al., Cancer Cell 15(5): 429-40 (2009). Клетки MCF7 обрабатывали 5нМ HRG для стимуляции фосфорилирования Her3 с последующей обработкой указанными бис-Fab (Фиг. 2B, нижняя панель) в однократной дозе 50 нМ. Каждый из тестированных бис-Fab, 1187, 1191, 1192 и 1204, содержал один по меньшей мере один Fab, происходящий из анти-Her2 антитела, 2C4. Как показано на фиг. 2B, нижняя панель, для каждого из тестированных бис-Fab показали сильное ингибирование фосфорилирования Her3, что является результатом предотвращения фосфорилирования Her2-Her3. Исходное антитело 2C4 (пертузумаб) использовали в качестве положительного контроля. Блоты анализировали с α-тубулином в качестве зонда для нормализации нагрузки белка в каждой дорожке. Титрования молекул с помощью бис-Fab показали, что молекулы сохраняли эффективные ингибирующие концентрации, сходные с концентрациями Fab исходного антитела (данные не представлены).
Затем авторы настоящего изобретения исследовали эффект различных бис-Fab на рост клеток в культуре. Линии клеток опухоли молочной железы, MDA-175 (ATCC HTB-25) или BT474 (ATCC No. HTB-20), использовали для тестирования бис-Fab, содержащих Fab, происходящий(происходящие) из анти-Her2. В экспериментах, не показанных в настоящем документе, авторы настоящего изобретения определили, что клетки MDA-175 экспрессируют рецептор Her2. Линию клеток фибробластов мыши, стабильно трансфицированных EGFR человека, клеток NR6-EGFR (см. Glading et al., J. Biol. Chem. 275:2390-98 [2000]; Cancer Res. 67(3): 1228-38 [2007]), использовали для тестирования бис-Fab, содержащих Fab, происходящий(происходящие) из анти-Her1. Каждую из этих линий клеток поддерживали и размножали с использованием общепринятых способов культивирования клеток. Для анализов пролиферации клетки выращивали до конфлюентности, и среду меняли на свежую среду (DMEM:F12, 10% FCS, PenStrep, Glutamax). Клетки обрабатывали трипсином для сбора, промывали посредством центрифугирования, и меняли среду на новую, содержащую 1% сыворотку. Клетки доводили до плотности 20000 клеток на мл, и 250 мкл добавляли в каждую лунку 96-луночного планшета (5000 клеток/лунку). Рассеянные клетки выращивали в течение ночи, и затем стимулировали на следующие сутки посредством добавления реагентов антител (например, бис-Fab) непосредственно в лунки. Клетки выращивали в этих условиях в течение пяти суток, после чего среду отбирали из лунок и заменяли на 250 мкл свежей среды. Аламар синий (25 мкл) добавляли в каждую лунку и инкубировали при 37°C в течение 3-4 часов. Планшет считывали в флуоресцентном считывателе для планшетов при 545/590 нм (возбуждение/излучение). Уровень пролиферации клеток указывали либо непосредственно в относительных единицах флуоресценции (RFU), либо с нормализацией по контролю.
На фигурах 2C и 2D показаны результаты тестирования различных бис-Fab на указаных линиях клеток по их эффектам на рост клеток. На фиг. 2C показано, что бис-Fab 1191 и 1204, каждый из которых содержит два анти-Her2 Fab, являлись наиболее сильными ингибиторами роста клеток MDA-175. Молекулы с одним Fab, 2C4-Fab и Herc-Fab, являлись наименее сильными ингибиторами, и бис-Fab 1192, содержащий один анти-Her2 Fab и один анти-Her1 Fab, являлся промежуточным по способности ингибировать рост клеток MDA-175 в этом эксперименте. На фиг. 2D показано, что бис-Fab 1193, содержащий два анти-Her1 Fab, являлся сильным ингибитором роста клеток NRG-EGFR, подобно моноклональному антителу D1-5 (анти-Her1). Бис-Fab, содержащие один анти-Her1 Fab, так же как C3-101-Fab, в то время как еще обладали ингибирующей рост активностью, являлись менее сильными ингибиторами. Соответственно, эти результаты показывают, что 2C4- и Herc-содержащие бис-Fab (1192, 1204 и 1191), являлись способными ингибировать пролиферацию клеток в клетках MDA-175, экспрессирующих Her2. И бис-Fab, содержащие один или несколько анти-EGFR Fab (1187, 1190, 1192 и 1193), являлись способными ингибировать пролиферацию клеток в экспрессирующих EGFR линиях клеток (NR6-EGFR).
Затем авторы настоящего изобретения напрямую сравнивали активность ингибирования роста клеток in vitro двух бис-Fab, являющихся структурными аналогами своих исходных антител, с активностью ингибирования роста клеток in vitro их исходных антител. Первое сравнение проводили между пертузумабом (2C4) и бис-Fab 1204 (2C4V110C/2C4V110C) на клетках MDA-175. На фиг. 2E показано, что LC-110C-связанный 2C4 бис-Fab, по-видимому, обладал двухфазной активностью ингибирования пролиферации клеток MDA-175 в этом эксперименте. При более низких концентрациях (1 нМ), бис-Fab, по-видимому, стимулировал рост, в то время как при более высоких концентрациях - ингибировал. Половина максимального ингибирования по сравнению с исходным антителом, пертузумабом, присутствовала при ~ 2 нМ.
Второе сравнение проводили между трастузумабом и бис-Fab 1188 (HercV110C/HercV110C) на клетках BT474 со сверхэкспрессией Her2. Авторы настоящего изобретения включили также трастузумаб-Fab в этот эксперимент. Результаты показаны на фиг. 2F. На основании результатов, наблюдаемых авторами настоящего изобретения с пертузумабом и бис-Fab 1204, обсуждаемых выше, авторы настоящего изобретения ожидали наблюдать в этом эксперименте, что бис-Fab 1188 ингибирует пролиферацию клеток BT474, подобно исходному антителу, трастузумабу. На фиг. 2F показано, что, как ожидалось, трастузумаб сильно ингибировал пролиферацию клеток BT474, и трастузумаб-Fab являлся менее сильным ингибитором роста клеток. Неожиданно, однако, авторы настоящего изобретения наблюдали, что бис-Fab 1188 оказывает прямо противоположный эффект на пролиферацию клеток. Как ясно показано на фиг. 2F, бис-Fab 1188 сильно стимулировал рост клеток BT474. Клетки BT474 быстро пролиферировали даже в отсутствие каких-либо экзогенных агонистов, и фактически, не существует известных агонистов для этой линии клеток. Принимая во внимание эти свойства пролиферации линии клеток BT474, открытие, что бис-Fab 1188 может функционировать как агонист этих клеток, было особенно удивительным и неожиданным.
Единственным структурным отличием между плечами Fab трастузумаба и Fab бис-Fab 1188 является участок конъюгации. В отличие от исходного антитела, обладающего типичной структурой IgG с Fab, соединенными через тяжелые цепи, два тио-Fab бис-Fab 1188 конъюгированы через легкие цепи в положении между вариабельным и первым константным доменом. Поскольку не идентифицированы лиганды для Her2, непосредственно активирующие рецептор (Yarden, Y. et al., Nat Rev Mol Cell Biol 2(2): 127-37 (2001); Jackson, J. et al., Cancer Res 64(7):2601-9 (2004)), было неожиданным, что такое структурное отличие между бис-Fab и исходным антителом может приводить к бис-Fab, обладающему активностью агониста, а не активностью антагониста исходного антитела. Таким образом, идентификация аналога трастузумаба, обладающего активностью агониста в этих условиях, являлась достаточно неожиданной. Авторы настоящего изобретения заинтересовались, могут ли другие варианты структуры влиять на биологическую активность молекул. Таким образом, авторы настоящего изобретения разработали массив структур, или библиотеку аналогов, для сшитых вариантов посредством получения четырех различных тио-Fab, происходящих из трастузумаба. Их более подробно обсуждают ниже.
Пример 3 - Синтез и характеризация структурных вариантов происходящих из трастузумаба бис-Fab
С использованием способа матрицы рекомбинации, описанного выше авторы настоящего изобретения синтезировали серию структурных вариантов происходящих из трастузумаба бис-Fab. Авторы настоящего изобретения выбрали четыре различных точки тио-присоединения для синтеза бис-Fab; два положения находились в тяжелой цепи, и два положения находились в легкой цепи. Fab, содержащие точки тио-присоединения, были получены из трех различных источников; 1) тио-Mab с цистеиновыми заменами, которые расщепляли Лизин-C для высвобождения тио-Fab из антитела, 2) тио-Fab с цистеиновыми заменами, которые экспрессировали непосредственно в E. coli и очищали из E. coli, и 3) шарнир-cys-Fab, полученные ферментативным способом, описанным выше, для присоединения одного кросслинкера к шарнирной области немодифицированного антитела после расщепления пепсином. Этим способом получили четыре различных точки замещения в тио-Fab для рекомбинации с другими тио-Fab, таким образом, получив панель структурных вариантов (Фиг. 3A). Четыре различных положения замещения находятся в легкой цепи в положении 110 (LC110Cys), в легкой цепи в положении 205 (LC205Cys), в тяжелой цепи в положении 118 (HC118Cys) и в тяжелой цепи в шарнирной области (HCHg-Cys). Синтез проводили в формате матрицы, в котором набор из четырех тио-Fab сначала конъюгировали с кросслинкером и затем рекомбинировали друг с другом с получением 16 молекул, 10 из которых являлись уникальными по массе и структуре. Тио-Fab схематически изображены на фиг. 3A вместе со списком уникальных идентификаторов для синтезированных бис-Fab и источником каждого тио-Fab для каждого бис-Fab. Конечные очищенные продукты реакций синтеза характеризовали масс-спектрометрией, чтобы убедиться в чистоте тестируемого материала. Кроме того, авторы настоящего изобретения анализировали молекулярную массу бис-Fab посредством невосстанавливающего SDS-PAGE (Фиг. 3B). Как показано на фиг. 3B, все структурные варианты бис-Fab имели очень разные кажущиеся молекулярные массы, интересный результат с учетом того, что каждый из источников тио-Fab обладал такой же молекулярной массой, и один и тот же кросслинкер использовали для синтеза каждого бис-Fab. Наиболее вероятным объяснением различных кажущихся молекулярных масс является то, что участки связывания (точки тио-присоединения) создают структурные варианты, наблюдаемые в линейно развернутом полипептиде, возникающем в денатурирующих условиях.
Затем авторы настоящего изобретения тестировали каждый из структурных вариантов бис-Fab по эффекту на пролиферацию клеток BT474 по сравнению с трастузумабом. На фиг. 3C показан эффект каждого из бис-Fab и исходного антитела, трастузумаба, тестированных при различных концентрациях (указанных на горизонтальной оси), на рост клеток BT474. Количество жизнеспособных клеток определяли по окрашиванию Аламаром синим и выражали как процент от максимума, нормализованного по контролю без обработки (% от максимума на вертикальной оси). Как показано на фиг. 3C, структурные варианты бис-Fab трастузумаба обладают широким диапазоном активности, распространяющемуся от антагонистов, обладающих активностью, сходной с активностью исходного антитела (бис-Fab 1324, 1328 и 1329), до очень сильных агонистов (бис-Fab 1321, 1322, 1323 и 1325). Интересно, что четыре из этих бис-Fab-агонистов являлись более сильными агонистами, чем исходный идентифицированный агонист, бис-Fab 1188 (Фиг. 3C). В этом анализе наиболее сильным агонистом являлся бис-Fab 1325, представляющий собой комбинацию HercHC118Cys и HercLC205Cys. Наконец, проводили эксперимент по определению зависимости от времени с тестированием эффекта бис-Fab 1325 по сравнению с Герцептином® (трастузумабом) на рост клеток BT474. Как показано на фиг. 3D, Герцептин® (трастузумаб) (незакрашенные столбцы) ингибировал рост клеток в ходе эксперимента, в то время как бис-Fab 1325 (столбцы со штриховкой с наклоном вверх) стимулировали рост клеток, в соответствии с анализом роста клеток, описанным выше. Столбцами со штриховкой с наклоном вниз показаны контрольные клетки, не подвергавшиеся обработке.
Авторы настоящего изобретения рассматривали различные комбинации связывания бис-Fab в связи с конкретными физическими свойствами молекул. Как показано на фиг. 3B, анализ SDS-PAGE выявил различия в кажущейся молекулярной массе между различными бис-Fab. Однако, это не являлось надежным прогностическим параметром активности бис-Fab по отношению к пролиферации клеток BT474. Прежде всего, для наиболее сильного агониста в анализе BT474, HercHC118Cys-HercLC205Cys, показали кажущуюся молекулярную массу, очень близкую к кажущейся молекулярной массе сильных антагонистов. В дополнение к наблюдаемым различиям в подвижности при SDS-PAGE, вероятно, обусловленным локализацией участков связывания, авторы настоящего изобретения анализировали другие физические свойства. Авторы настоящего изобретения тестировали интернализацию, аффинность к рецептору-мишени по анализу Скэтчарда, элюцию SEC-MALS, молекулярную массу и гидродинамический радиус. Результаты анализа константы диссоциации с поверхности клеток (Kd) и количество участков на клетку для указанных молекул показано в таблица 2 ниже. Не наблюдали значительных различий между молекулами агонистов и антагонистов. На фиг. 4 представлен анализ гель-фильтрации на Shodex SEC, показывающий относительное время удержания (указанное на горизонтальной оси) (RT) и гидродинамический радиус (Rh) указанных молекул. Снова не наблюдали значительных различий между молекулами агонистов и антагонистов. Соответственно, эти эксперименты не выявили никаких значительных различий в этих физических свойствах между молекулами агонистов и антагонистов, только разница в подвижности при SDS-PAGE (Фиг. 3B) и слабый сдвиг в удержании на SEC (Фиг. 4).
Kd с поверхности клеток и количество участков на клетку для антагонистов и агонистов.
(агонист)
(трастузумаб) (антагонист)
(трастузумаб-Fab)
(антагонист)
(агонист)
(трастузумаб) (антагонист)
Затем авторы настоящего изобретения анализировали путь передачи сигнала Her, конкретно, исследованием активации рецептора в клетках BT474 после обработки агонистом. В линиях клеток со сверхэкспресией Her2, таких как BT474, Герцептин® (трастузумаб) ингибирует лиганд-независимые взаимодействия между Her2 и Her3, отвечающие за антипролиферативные эффекты антитела в культуре клеток (Junttila, T. T., et al. Cancer Cell 15(5):429-40 (2009)). Нарушение взаимодействий Her2/Her3 Герцептином® (трастузумабом) приводит к потере фосфорилирования Her3 и уменьшению активности серин/треонин киназы, AKT. Id.
Авторы настоящего изобретения сравнивали эффекты агониста бис-Fab 1325, антагониста бис-Fab 1329, исходного антитела, Герцептин® (трастузумаб) и контрольного антитела, лишенного действия фосфорилирования, gD, на фосфорилирование AKT и Her3. Клетки BT474 обрабатывали каждой из этих молекул. Клетки собирали через 10 минут, 30 минут и два часа после начала обработки. Для лизатов клеток измеряли фосфорилирование AKT посредством ELISA с анти-фосфо AKT антителами. Результаты показаны на фиг. 5A. Антагонисты Герцептин® (трастузумаб) и бис-Fab 1329 уменьшали количество фосфорилированного AKT, как измеряли посредством ELISA, в то время как агонист бис-Fab 1325 увеличивал количество фосфорилированного AKT (Фиг. 5A). Ингибирующую активность антитела и бис-Fab 1329 наблюдали через десять минут, и она продолжала слабо увеличиваться вплоть до двух часов. Бис-Fab антагонист 1329 являлся немного менее сильным, чем исходное антитело в первые тридцать минут эксперимента, но достигал такого же уровня ингибирования за 2 час. (Фиг. 5A). Агонист бис-Fab 1325, однако, приводил к увеличению уровню фосфо-AKT через десять минут, и уровень фосфо-AKT продолжал немного увеличиваться на протяжении двух часов обработки (Фиг. 5 A). Эффект антитела наблюдали с gD, где уровни фосфо-AKT немного увеличивались после обработки. Эффект, однако, лежит в диапазоне изменчивости значений без обработки. Анализ Вестерн-блоттингом с использованием антител против фосфо-AKT также показал, что уровень фосфо-AKT увеличивался в ответ на агонист бис-Fab 1325 (Фиг. 5B, сравни ряд pAKT с рядом AKT).
Авторы настоящего изобретения исследовали также уровни фосфорилирования Her3, поскольку показано, что обработка Герцептином® (трастузумабом) снижает уровни фосфорилированного Her3 (Cancer Cell 15(5):429-40 [2009]). Для этих экспериментов клетки BT474 обрабатывали Герцептином® (трастузумабом), бис-Fab 1325, бис-Fab 1329 или gD в 96-луночных планшетах в течение вплоть до двух часов. Через указанные промежутки времени (10 минут, 30 минут или 2 часов) клетки солюбилизировали. Анализ Вестерн-блоттинга лизатов клеток проводили следующим образом. Лизаты клеток разделяли посредством SDS-PAGE и переносили на нитроцеллюлозные мембраны. Нитроцеллюлозные мембраны обрабатывали указанными фосфо-специфическими (pHER3, pAKT или pMAPK) или не-фосфо-специфическими антителами (HER3, AKT или MAPK) в качестве зондов для оценки состояния активации указанных ферментов пути передачи сигнала Her. Антитело против тубулина использовали в качестве контроля. Как показано на фиг. 5B, анализ Вестерн-блоттингом с использованием антител против Her3 с фосфотирозином показал характерное и ожидаемое уменьшение фосфо-Her3 в ответ на антагонисты Герцептин® (трастузумаб) и бис-Fab 1329, возникающее через два часа (Фиг. 5B, сравни ряд pHER3 с рядом HER3). Обработка клеток антителом gD не оказывало эффекта на уровень фосфорилирования Her3 (Фиг. 5B, сравни ряд pHER3 с рядом HER3. Неожиданно, авторы настоящего изобретения не наблюдали предполагаемого увеличения уровня фосфо-Her3 посредством обработки агонистом бис-Fab 1325 (Фиг. 5B, сравни ряд pHER3 с рядом HER3). Фактически, присутствовало небольшое уменьшение количества фосфо-Her3 на протяжении периода времени два часа, сходное с уменьшением, наблюдаемым для антагонистов (Фиг. 5B). Наблюдаемое фосфорилирование MAPK в ответ на обработку бис-Fab 1325 (Фиг. 5B, сравни ряд pMAPK с рядом MAPK) указывает на то, что агонист может активировать путь, в общем связанный с индуцированной лигандом активации. Этот неожиданный результат вызывает вопросы относительно механизмов, посредством которых действуют бис-Fab агонисты Her2.
Таким образом, затем авторы настоящего изобретения исследовали, присутствует ли непосредственное влияние на фосфорилирование Her2, когда клетки обрабатывают агонистом бис-Fab 1325. Ранее было показано, что обработка Герцептином® (трастузумабом) существенно не изменяет состояние фосфорилирования Her2. Kito, K. et al., Curr Genomics 9(4):263-74 (2008). Поскольку Her2 является высоко фосфорилированным в исходном состоянии (см. Id.), авторы настоящего изобретения использовали количественную масс-спектрометрию для тестирования изменений участков фосфорилирования в Her2 в ответ на различные молекулы. С использованием способов фосфо-картирования авторы настоящего изобретения определили, что ряд участков в Her2 были фосфорилированы до различных уровней в необработанных клетках BT474 (Фиг. 5C, исходный столбец). В таблице на фиг. 5C представлен список фосфорилированных пептидов, полученных при расщеплении Her2 трипсином. Аминокислота в каждой последовательности пептида, обозначенная малой капительной жирной курсивной буквой, указывает на интересующий фосфорилированный остаток. Количественное измерение этих участков показало, что после обработки Герцептином® (трастузумабом), присутствовали небольшие изменения уровня фосфорилирования фосфопептидов по сравнению с необработанными клетками (Фиг. 5C и 5E). Однако для обработки агонистом бис-Fab 1325 показали несколько участков фосфорилирования с увеличенным уровнем фосфорилирования по сравнению с необработанными клетками (Фиг. 5C и 5E). Уровень фосфорилирования некоторых из этих участков фосфорилирования также увеличивался после обработки херегулином, известным агонистом пути PI3K (Фиг. 5C и 5E). Авторы настоящего изобретения проводили также статистический тест. Для каждого пептида модель смешанных эффектов подбирали под относительный уровень фосфорилирования, с обработкой в качестве фиксированного эффекта и с образцом в качестве случайного эффекта. Как показано на фиг. 5E, попарные сравнения групп проводили с использованием способа Тьюки-Крамера для поправки на множественные сравнения. Это контролирует общее количество ложноположительных значений, связанное с проведением множественных статистических тестов для каждого пептида. В общем, эти результаты выявляют возможную лиганд-независимую и Her3-независимую активацию путей передачи сигналов в клетках, приводящих к пролиферации. Кроме того, такие результаты могут приводить к идентификации дополнительных сигнальных компонентов, вовлеченных в пролиферацию клеток, таким образом, приводя к новым терапевтическим мишеням для нарушений пролиферации клеток, таких как, но без ограничения, злокачественная опухоль.
Пример 4 - Синтез и характеризация бис-Fab
Нацеливание на FcγRIIb и FcεRI
Для тестирования общей применимости способа синтеза бис-Fab к другим молекулярным мишеням, авторы настоящего изобретения разработали матрицу биспецифических бис-Fab с использованием тио-Fab или шарнир-cys-Fab, происходящего из одного антитела (5A6), нацеленного на FcγRIIb, и тио-Fab или шарнир-cys-Fab, происходящего из одного антитела, нацеленного на FcεRIα (22E7). Антитела 5A6 и 22E7 описаны в Публикации Патента США No. 20060073142 и Jackman, et al., J. Biol. Chem. 285:20850-20859 (2010). Белок поверхности клеток FcγRIIb представляет собой протеинтирозинфосфатазу, которая может дефосфорилировать близлежащие тирозинкиназные рецепторы, такие как FcεRIα, для ингибирования их активности. Авторы настоящего изобретения ранее описали биспецифические IgG, нацеленные на эти два рецептора на поверхности тучных клеток (Id.). Кроме того, авторы настоящего изобретения показали, что биспецифическое антитело связывает и соединяет FcεRIα и FcγRIIb, формируя гетеродимерный рецепторный комплекс, сильно ингибирующий передачу сигнала в клетках и высвобождение гистамина, запускаемое связыванием IgE с FcεRIα. Id. На основании этого механизма действия биспецифического IgG, авторы настоящего изобретения постулировали, что бис-Fab, нацеленное на FcγRIIb и FcεRIα на поверхности тучных клеток, может обладать аналогичным механизмом действия. Таким образом, без связи с теорией авторы настоящего изобретения выдвинули гипотезу, что обработка бис-Fab, нацеленным на FcγRIIb и FcεRIα, может приводить к рекрутированию FcγRIIb в активированный рецепторный комплекс и приводит к ингибированию высвобождения гистамина.
Для синтеза бис-Fab, нацеленного на FcγRIIb и FcεRIα, авторы настоящего изобретения получили тио-Fab из каждого из исходных антител, обладающие cys заменами в положении 110 в легкой цепи и в положении 121 тяжелой цепи. Авторы настоящего изобретения получили также шарнир-cys-Fab из каждого из исходных антител, обладающие только одним cys в шарнирной области. Эти шарнир-cys-Fab получали с использованием способов рекомбинантный ДНК, т.е., посредством субклонирования фрагмента ДНК исходного антитело Fab и его экспрессии в E. coli, с последующей очисткой. Все способы рекомбинантной ДНК и способы очистки белка являлись общепринятыми способами, хорошо известными специалистам в данной области и в общем описанные выше. В таблице 3 ниже показана матрица синтеза бис-Fab с указанием точек тио-присоединения и предоставлением уникального идентификационного номера для каждого бис-Fab (в скобках).
Матрица синтеза бис-Fab.
(1307)
(1301)
(1304)
(1305)
(1299)
(1302)
(1306)
(1300)
(1303)
Авторы настоящего изобретения ранее описали получение вариантов линии клеток RBL, экспрессирующих как FcεRIα, так и FcγRIIb (Jackman, et al., J. Biol. Chem. 285:20850-20859 (2010)). Авторы настоящего изобретения тестировали эффект каждого из бис-Fab, перечисленных в таблице 3, на высвобождение гистамина из клеток RBL, экспрессирующих как FcεRIα, так и FcγRIIb. Клетки обрабатывали увеличивающимися концентрациями каждого из бис-Fab, и высвобождение гистамина измеряли посредством ELISA. Результаты показаны на фиг. 6A-B. Как можно видеть, для различных бис-Fab показали диапазон активности. Для некоторых из сильных антагонистов, наивысший уровень активности ингибирования наблюдали при концентрациях 370-110 нг/мл. Это предположительно представляет собой концентрацию, при которой формируется максимальное количество ингибирующих комплексов. При более высоких концентрациях одно плечо бис-Fab может связаться со своим рецептором, когда другое плечо может не связаться с другим рецептором из ингибирующего комплекса. Это может являться аналогичным колоколообразным кривым активности, которыми обладают некоторые димерные гормоны, когда димеризация рецептора необходима для получения внутриклеточных сигналов (например, VEGF и его рецептор). Кроме того, для некоторых молекул не показали какой-либо ингибирующей активности, в то время как для одной молекулы показали необычайное ингибирование. Эти результаты показаны на фиг. 6B. Четыре молекулы, для которых не показали сильного ингибирования (1299, 1300, 1301, 1302), содержат по меньшей мере одну связь 121Cys в тяжелой цепи. Наиболее сильно ингибирующая молекула, 1303, связана по обоим тио-fab через шарнир-cys.
Пример 5 - Модифицированные бис-Fab и активность in vivo
Одним из свойств бис-Fab, описанных выше, является ожидаемое короткое время полужизни in vivo, обусловленное, по меньшей мере частично, отсутствием Fc-области в молекуле. Для конкретных применений in vivo может являться желательным, чтобы бис-Fab обладал фармакокинетическими свойствами, сходными со свойствами нативного антитела. Соответственно, авторы настоящего изобретения разработали способ получения модифицированных кросслинкеров для использования в синтезе бис-Fab. Использование таких модифицированных кросслинкеров, как подробно описано ниже, позволяет добавление реагентов, пригодных для модификации времени полужизни in vivo, таких как, но без ограничения, полиэтиленгликоль (PEG). Кроме того, модифицированные кросслинкеры, как описано в настоящем документе, позволяют добавление реагентов, пригодных в качестве средств для получения изображений или детекции, таких как, но без ограничения, флуоресцентные метки или цитотоксические средства, такие как, но без ограничения, монометилауристатин E (MMAE), или реагенты, обладающие другими желательными свойствами или функциями, такие как, но без ограничения, миРНК.
Синтез модифицированного кросслинкера и модифицированных бис-Fab
Авторы настоящего изобретения разработали способ синтеза модифицированного кросслинкера, позволяющий присоединение любой реакционноспособной по отношению к сульфгидрилу группы. Ниже описан способ присоединения N-сукцинимидил-S-ацетилтиоацетата (SATA) к бис-малеинимиду для получения бис-малеимидоацетилтиоацетата (BMata), обладающего защищенной SH-группой, которую можно использовать в дополнительных реакциях для присоединения желательных функциональных групп.
Авторы настоящего изобретения начали с бис-малеинимидамина (MW 546,62), полученного из Quanta BioDesign Limited, Powell, OH. Шестьдесят микролитров (32 мг) растворяли в 100 мкл диметиламина (DMA) и разводили в 1 мл ацетонитрила. Сто тридцать микромоль (31 мг) SATA (N-сукцинимидил-S-ацетилтиоацетат, MW 231,23, Thermo Fisher Scientific) растворяли в 1 мл ацетонитрила и добавляли в раствор бис-малеинимида. Добавляли буфер Hepes (калиевую соль, pH 7,1, 0,5 M) до конечной концентрации 0,15 M, и реакционную смесь инкубировали в течение ночи в темноте при 4°C. Смесь разводили в 4 раза 0,1% трифторуксусной кислотой (TFA) перед разделением на колонке 10×250 мм C4 (Vydac) с помощью градиента ацетонитрила 15-50% в 0,1% TFA). Фракции, содержащие бис-малеимидоацетилтиоацетат (MW 662,29), как оценивали масс-спектрометрией с электрораспылением (Agilent 6210 TOF), объединяли, высушивали центрифугированием в вакууме и сохраняли при -20°C. Реакция для синтеза этого модифицированного кросслинкера, BMata, показана на фиг. 7A.
Одним из реагентов, который можно присоединять к BMata, является PEG, для которого авторы настоящего изобретения исследовали эффекты на время полужизни модифицированных бис-Fab in vivo. Авторы настоящего изобретения следовали следующему способу для получения бис-Fab, содержащего BMata для последующей реакции с PEG.
Одну партию бис-Fab, нацеленного на EGFR (Her1) (C3-101 тио-FabV110C) и Her2 (трастузумаб (Herc) тио-FabV110C), получали с кросслинкером BMata. Приблизительно 500 мг модифицированного бис-Fab синтезировали с использованием 500 мг каждого тио-Fab в качестве исходного материала. Тио-Fab экспрессировали в E. coli и очищали, как описано выше. Бис-Fab синтезировали, сначала проводя химическую реакцию BMata с тио-FabV110C трастузумаба. Комплекс выделяли гель-фильтрацией и проводили реакцию с C3-101 тио-FabV110C для получения сшитого биспецифического полипептида. Конечный комплекс снова выделяли гель-фильтрацией и характеризовали посредством масс-спектрометрии и SDS-PAGE, как описано выше.
Благодаря маскированному тиолу в Bmata (Фиг. 7A), бис-Fab, полученный с использованием этого кросслинкера, поддается пегилированию малеимидо-содержащими полимерами после снятия защиты блокирующей группы с помощью гидроксиламина. Для осуществления этого, бис-Fab сначала разделяли на несколько аликвот приблизительно по 50-60 мг каждая. К каждой аликвоте добавляли одну десятую объема 0,5 M гидроксиламина, 25 мМ ЭДТА в фосфатно-солевом буфере (PBS) при pH 7,2. Снятие защиты продолжали при комнатной температуре в течение приблизительно двух часов. Удаление защитной группы гидроксиламином приводило к потере 42 дальтон, которое можно наблюдать по изменению массы бис-Fab посредством масс-спектрометрии (данные не представлены). После снятия защиты 1:1 молярный эквивалент PEG-малеимидо добавляли к аликвотам бис-Fab и позволяли реакции проходить в течение 2-20 часов. Это приводило к почти полному превращению бис-Fab в молекулы с более высокой молекулярной массой, содержащие один PEG (данные не представлены). Общая схема реакции показана на фиг. 7B.
Начиная с соединенных с помощью кросслинкера BMata бис-Fab C3-101V110C/HercV110C, несколько различных размеров полимеров PEG использовали в реакции синтеза, описанной выше для получения пегилированного бис-Fab, несущего PEG различной молекулярной массы. Различные полимеры PEG закупали в форме малеимидо-производных из NOF Corporation (Japan). После реакции с PEG-реагентами пегилированные бис-Fab очищали гель-фильтрацией S-200 в 25 мМ MES, pH 5,8, 300 мМ NaCl и 1 мМ ЭДТА. На фиг. 8A показан анализ SDS-PAGE очищенных бис-Fab. Показаны пять различных продуктов реакции, слева направо. Начиная слева, это BMata бис-Fab после реакции с N-этилмалеинимидным (NEM) кэпом, затем BMata бис-Fab после реакции с линейными цепями PEG 2 кДа, 12 кДа и 20 кДа, соответственно, и наконец, BMata бис-Fab после реакции с малеимидо-альбуминсвязывающим пептидом, ABP, mal-H, QRLMEDICLPRWGCLWEDDF (SEQ ID NO:24). Nguyen et al., Prot. Engineering, Design and Selection 19:291-97 (2006). Бис-Fab-ABP синтезировали для исследования группы ABP в качестве альтернативы PEG в качестве средства для увеличения времени полужизни бис-Fab посредством увеличения связывания с сывороточным альбумином. См. Id.
Эти пять модифицированных бис-Fab анализировали гель-фильтрационной хроматографией и показали, что они обладают сильно увеличенным гидродинамическим радиусом. Наблюдали, что содержащие 20 K PEG и 12 K PEG бис-Fab и содержащий ABP бис-Fab элюировались при гель-фильтрации на S-200 значительно раньше, чем типичное IgG человека (время удержания 25,2 мин) (Фиг. 8B). Затем авторы настоящего изобретения исследовали фармакокинетические параметры, включая время полужизни каждого из этих пяти модифицированных C3-101V110C/HercV110C бис-Fab у мышей и голых крыс. Эти эксперименты и результаты подробно описаны ниже.
Фармакокинетика бис-Fab
Два отдельных эксперимента проводили для оценки эффектов модификаций BMata-PEG или BMata-ABP, описанных выше, на время полужизни в сыворотке in vivo C3-101V110C/HercV110C бис-Fab. Однократную болюсную дозу 5 мг/кг IV вводили мышам или голым крысам, и бис-Fab, присутствующий в сыворотке, анализировали в течение вплоть до 14 суток. Индивидуальных мышей использовали для каждой точки данных, тогда как у крыс образцы сыворотки отбирали от одних и тех же животных на протяжении всего эксперимента.
Анализ ELISA разрабатывали для детекции интактного биспецифического бис-Fab в сыворотке мыши и крысы. Подробное описание ELISA является следующим.
Концентрацию бис-Fab в сыворотке грызунов определяли с использованием ELISA. Кратко, EGFR-Fc (Genentech Reagent), разведенным до 1 мкг/мл в PBS, покрывали 384-луночные полистироловые планшеты Maxisorb (Nalgate Nunc International Cat# 464718). Через 16-72 час покрытие удаляли, и планшеты блокировали блокирующим буфером (PBS/0,5% BSA/Proclin 300) в течение 0,5-3 часов. Разведения стандарта бис-Fab (0,156-20 нг/мл) получали в буфере для анализа (PBS/0,5% BSA/0,05% Твин 20/0,25% CHAPS/5 мМ ЭДТА/0,2% BGG/0,35 М NaCl/15 ppm Proclin 300). Образцы (сыворотка крысы или мыши, содержащая бис-Fab) разводили до минимального разведения 1/100 в буфере для анализа, и затем серийно разводили 8 раз в диапазоне анализа. Блокированные планшеты промывали 3 раза буфером для промывки (PBS/0,05% Твин 20) и стандарты и образцы добавляли в соответствующие лунки для анализа. После 1-часовой инкубации планшеты промывали 6 раз буфером для промывки. Связанный бис-Fab детектировали с использованием биотинилированного HER2 ECD (биотинилирование Genentech Reagent Lot 39575-15 проводили с использованием химических реакций NHS-сукцинимида (Biotin-X-NHS Research Organics 10554B-2)). После 1-часовой инкубации, планшеты промывали 6 раз буфером для промывки, и связанную со стрептавидином пероксидазу хрена (GE Healthcare RPN1231), разведенную 1/40000 в буфере для конъюгата (PBS/0,5% BSA/0,05% Твин 20/15 ppm Proclin 300) добавляли во все лунки для анализа. После 30-минутной инкубации планшеты промывали 6 раз, и субстрат TMB (KPL Cat# 50-65-02) добавляли во все лунки для анализа. Реакцию с субстратом останавливали через 15-20 минут 1M фосфорной кислотой. Планшеты считывали при 450 нм с использованием контрольной длины волны 620 нм. Концентрации образцов определяли сравнением результатов со стандартами с использованием алгоритма аппроксимации кривой по 4 параметрам.
Как у мышей, так и у крыс, добавление PEG к бис-Fab снижало скорость выведения молекулы (Фиг. 9A-B, Таблица 4). Обнаружено, что пегилирование 2K уменьшало выведение вдвое (Фиг. 9A-B, Таблица 4). Посредством добавления 20K PEG время полужизни бис-Fab можно продлевать до 30-35 часов (Фиг. 9A-B, Таблица 4). Эти результаты показывают, что для бис-Fab можно достигать диапазона дозирования и что PK молекулы можно модулировать для приспособления к различным нуждам посредством изменения размера присоединенного PEG. Выведение непегилированного бис-Fab являлось приблизительно таким, как ожидали для F(ab')2, и 20K пегилированный бис-Fab обладал временем полужизни и выведением, близкими к IgG. Кроме того, существовали небольшие различия во времени полужизни между 12K-бис-Fab и 20K-бис-Fab (Фиг. 9A-B, Таблица 4), указывая на то, что больший PEG может значительно не увеличивать время полужизни. Наконец, периоды времени полужизни ABP-бис-Fab значительно не увеличивались по сравнению с немодифицированными бис-Fab в этих экспериментах. (Фиг. 9A-B, Таблица 4). Дополнительные фармакокинетические данные представлены в таблице 4 ниже.
Фармакокинетические параметры на основании двухкамерной модели.
Активность бис-Fab in vivo
Для исследований модели ксенотрансплантата у мышей in vivo авторы настоящего изобретения конструировали пегилированный бис-Fab следующим образом. Сначала получали соединенный с помощью кросслинкера BMata бис-Fab, содержащий нацеленный на Her2 тио-Fab, 2C4V110C и нацеленный на EGFR (Her1) тио-Fab, D1-5V110C. Затем проводили реакцию этого соединенного с помощью кросслинкера BMata бис-Fab с гидроксиламином и 1:1 молярным эквивалентом 20K mal-PEG для получения пегилированного бис-Fab. Пегилированный бис-Fab очищали и анализировали посредством SDS-PAGE (Фиг. 10A). Пегилированный бис-Fab тестировали по его способности ингибировать пролиферацию клеток Calu3 in vitro. Известно, что клетки Calu3 экспрессируют как Her2, так и EGFR (данные не представлены). Для анализа рассевали 8500 клеток на лунку и обрабатывали 2 нМ херегулином и 5 нМ TGFα. Затем авторы настоящего изобретения тестировали различные концентрации бис-Fab и исходных антител (концентрации, указанные на горизонтальной оси Фиг. 10B) по способности блокировать стимулированный лигандом рост клеток. Аламар синий (25 мкл) добавляли в каждую лунку и инкубировали при 37°C в течение 3-4 часов. Планшет считывали в флуоресцентном считывателе для планшетов при 545/590 нм. Уровень пролиферации клеток указывали либо непосредственно в относительных единицах флуоресценции (RFU), либо с нормализацией по контролю. На фиг. 10B показано, что пегилированный бис-Fab являлся сильным ингибитором пролиферации Calu3 в этом эксперименте. Действительно, он являлся более сильным, чем исходные антитела, 2C4 и D1-5.
Затем авторы настоящего изобретения оценивали фармакокинетику 20K PEG-2C4V110C/D1-5V110C бис-Fab у мышей SCID Beige. Анализ связывания на основе ELISA, подобный описанному выше для C3-101V110C/HercV110C бис-Fab, использовали для определения количества молекулы в сыворотке. На фиг. 11A показаны результаты, нанесенные на график в виде концентрации в сыворотке в зависимости от времени, в то время как на фиг. 11B показаны результаты, нанесенные на график в виде концентрации в сыворотке/дозу в зависимости от времени. 20K PEG-2C4V110C/D1-5V110C бис-Fab более быстро выводился из сыворотки, чем 20K-PEG-C3-101V110C/HercV110C бис-Fab (сравни Фиг. 11 A-B с Фиг. 9A). Авторы настоящего изобретения считают, что перекрестная реактивность с белками хозяина является причиной более быстрого выведения 20K PEG-2C4V110C/D1-5V110C бис-Fab. Цифровые данные, представленные в таблице 5 ниже, дополнительно иллюстрируют относительно короткое время полужизни 20K PEG-2C4V110C/D1-5V110C бис-Fab в этом эксперименте.
Фармакокинетические параметры
HL-лямбда_z обозначает время полужизни, связанное с фазой элиминации, CLнабл обозначает наблюдаемое выведение, AUCбескон-набл обозначает площадь под кривой концентрация в сыворотке - время, экстраполированной до бесконечности.
Затем авторы настоящего изобретения исследовали эффекты 20K PEG-2C4V110C/D1-5V110C бис-Fab по сравнению с исходными антителами 2C4 и D1-5 на модели ксенотрансплантата Calu3 у мышей SCID Beige. Инъецировали 5 миллионов клеток Calu3/мышь с последующими ежесуточными инъекциями 20K PEG-2C4V110C/D1-5V110C бис-Fab (50 мг/кг), 2C4 (25 мг/кг), или D1-5 (25 мг/кг). Объемы опухолей измеряли периодически (временные точки указаны на фиг. 12) на протяжении эксперимента. Результаты, показанные на фиг. 12, показывают, что 20K PEG-2C4V110C/D1-5V110C бис-Fab являлся эффективным для замедления роста опухолей в этой концентрации, с эффективностью, сравнимой с эффективностью, наблюдаемой для каждого исходного антитела.
Затем авторы настоящего изобретения провели расширенное исследование для оценки эффектов 20K PEG-2C4V110C/D1-5V110C бис-Fab на рост клеток опухоли, выращенной на модели ксенотрансплантата Calu3 у мышей, описанной выше, и по сравнению с исходными антителами, 2C4 (пертузумаб) и D1-5. Сначала авторы настоящего изобретения анализировали период времени, необходимый для прогрессирования опухоли, определенный как время, затрачиваемое опухолями на удвоение размера (2xVo), или время выживаемости при отсутствии прогрессирования объема опухоли.
Для проведения этих экспериментов 5 миллионов клеток Calu3 (суспендированных в HBSS) инокулировали подкожно мышам SCID beige (мыши получены из Charles River Labs, San Diego facility). Исходные антитела, 2C4 и D1-5, дозировали при 25 мг/кг (концентрация материала составляла 5 мг/мл), IP, один раз в неделю в течение четырех недель. 20K PEG-2C4V110C/D1-5 V110C бис-Fab дозировали при 50 мг/кг (концентрация материала составляла 7,5 мг/мл), IP ежесуточно в течение 28 суток. Во всех случаях первая доза составляла 2X нагрузочную дозу (т.е. 50 мг/кг 2C4 и D1-5 [концентрация материала составляла 10 мг/мл] и 100 мг/кг 20K PEG-2C4V110C/D1-5V110C бис-Fab [концентрация материала составляла 7,5 мг/мл]).
Анализ Каплана-Мейера показан на фиг. 13A, и однофакторный анализ показан на фиг. 13B. Затем авторы настоящего изобретения анализировали период времени, необходимый для прогрессирования опухоли, определенный как время, затрачиваемое опухолями на достижение объема 1500 мм3 или время выживаемости при отсутствии прогрессирования объема опухоли. Анализ Каплана-Мейера показан на фиг. 14A, и однофакторный анализ показан на фиг. 14B. Результаты этих исследований показывают, что 20K PEG-2C4V110C/D1-5V110C бис-Fab являлся эффективным для ингибирования роста клеток опухоли при дозе обработки, приближаясь к эффективности каждого из исходных антител. Соответственно, формат биспецифического антитела, описанный в настоящем документе, является пригодной платформой для разработки терапевтических молекул.
Обсуждение
Her2 вовлечен в нормальное развитие и рост клеток в тканях сердца, молочной железы и нервной ткани, и связан с развитием других систем органов. Falls, D. L. et al., Exp Cell Res 284(1): 14-30 (2003); Casalini, P., et al., J Cell Physiol 200(3):343-50 (2004); Negro, A., et al., Recent Prog Horm Res 59: 1-12 (2004); Britsch, S. Adv Anat Embryol Cell Biol 190: 1-65 (2007). Особенно важным является вовлечение сверхэкспрессии Her2 в пролиферацию клеток при раке молочной железы, и использование сверхэкспрессии Her2 в качестве диагностического маркера для идентификации пациентов с раком молочной железы, которые могут получить преимущество от Герцептина® (трастузумаба). Lee, K. F., et al., Nature 378(6555):394-8 (1995); Erickson, S. L., et al., Development 124(24):4999-5011 (1997); Britsch, S., et al., Genes Dev 12(12): 1825-36 (1998); Morris, J. K., et al., Neuron 23(2): 273-83 (1999); Woldeyesus, M. T., et al., Genes Dev 13(19):2538-48 (1999); Lin, W., et al., Proc Natl Acad Sci USA 97(3): 1299-304 (2000); Park, S. K., et al., J Cell Biol 154(6): 1245-58 (2001); Leu, M., et al., Development 130(11):2291-301 (2003); Brufsky, A. Am J Clin Oncol. Aug. 11, 2009 (EPub PMID: 19675448). Герцептин® (трастузумаб) представляет собой моноклональное антитело, связывающее четвертый домен рецептора около трансмембранной области (Cho, H. S., et al., Nature 421(6924): 756-60 [2003]). Her2 является одним из семейства из четырех рецепторов, которые вносят вклад в рост и развитие клеток и также являются мишенями для терапии заболеваний (Casalini, P., et al., J Cell Physiol 200(3):343-50 [2004]). Координированное действие более одного рецептора часто отвечает за управление ростом клеток опухоли (Yarden, Y. et al., Nat Rev Mol Cell Biol 2(2): 127-37 (2001); Lee-Hoefiich, S. T., et al., Cancer Res 68(14): 878-87 [2008]). В связи с этим нейтрализация активности более одного рецептора может быть желательной для обеспечения особенно эффективной терапии для определенных опухолей. Одним из способов сборки и разработки таких молекул является использование способов биспецифических антител, благодаря которым одна молекула антитела обладает двумя уникальными моноклональными активными участками (Drakeman, D. L., et al., Expert Opin Investig Drugs 6(9): 1169-78 (1997); Kontermann, R. E. Acta Pharmacol Sin 26(1): 1-9 (2005); Chames, P. et al., Curr Opin Drug Discov Devel 12(2):276-83 [2009]).
Авторы настоящего изобретения разработали способ бис-Fab, описанный в настоящем документе, по меньшей мере частично, в качестве средства для скрининга таких молекул и для поиска тех, которые могут обеспечить увеличенную эффективность по сравнению с отдельным антителом или комбинацией антител. Авторы настоящего изобретения показали в настоящем документе, что способ синтеза бис-Fab является надежным и простым способом для получения биспецифических молекул. Авторы настоящего изобретения определили, что, как правило, бис-Fab молекулы обладали объединенной биохимической активностью обоих исходных антител. Авторы настоящего изобретения наблюдали небольшое падение аффинности к поверхности клеток для некоторых бис-Fab, вероятно, из-за моновалентной структуры этих молекул. Однако, это можно обойти рядом способов. Например, можно синтезировать бис-Fab, нацеленные на два рецептора на поверхности одной клетки, можно нацелиться на два домена одного и того же рецептора, или можно увеличить аффинность моновалентного Fab. Синтезом набора бис-Fab, нацеленных на Her2 и EGFR, с использованием описанного способа матрицы, получили молекулы высокой чистоты в количестве, достаточном для различных анализов.
С использованием бис-Fab в анализах на основе клеток авторы настоящего изобретения обнаружили несколько уникальных видов активности. Например, для бис-Fab 1191 показали сильное ингибирование пролиферации клеток с нехарактерным спуском кривой ингибирования (Фиг. 2C). Интересным аспектом этой молекулы является то, что она связывает два различных домена Her2 одновременно. Плечо 2C4 бис-Fab нацелено на домен II ECD, и плечо Herc бис-Fab нацелено на домен IV (Franklin, M. C, et al., Cancer Cell 5(4):317-28 (2004); Schmitz, K. R., et al., Exp Cell Res 315(4):659-70 [2009]). Вид кривой соответствует кооперативному действию и можно предполагать механизм действия, являющийся уникальным для молекулы, связывающей два домена на одной и той же мишени. Такая молекула может предоставлять преимущества по эффективности по сравнению либо с каждым антителом в отдельности, либо с комбинацией двух отдельных моноклональных антител в конкретных терапевтических условиях.
Другое более поразительное открытие, однако, сделано с тио-Fab трастузумаба, связанными друг с другом для формирования бис-Fab 1188. В этом случае бис-Fab является структурно сходным с одиночным исходным антителом, за исключением того, что в нем отсутствует Fc часть, и Fab ковалентно связаны в участке, отличающемся от природной дисульфидной связи в шарнире. Для бис-Fab 1188, Herc LC110Cys-Herc LC110Cys, показали неожиданную резкую стимуляцию пролиферации клеток с действием в качестве агониста вместо сильного антагониста (Фиг. 2F). Это являлось неожиданным не только из-за того, что активность являлась противоположной активности его структурно сходного исходного антитела, но также из-за того, что пролиферация клеток для клеток BT474 со сверхэкспрессией Her2 не является лиганд-зависимой и, как считают, является максимально стимулированной в исходном состоянии. Кроме того, другой бис-Fab с соединением двух 2C4 Fab вместе обладал активностью, сходной с активностью его исходного антитела (Фиг. 2E). Без связи с теорией, вероятно, различные механизмы действия Fab, полученных из различных антител, являются причиной различных результатов, наблюдаемых для бис-Fab. В то время как 2C4 связывает домен II и ингибирует димеризацию Her2 с ним самим и с другими членами семейства Her, трастузумаб, по-видимому, влияет на формирование комплекса иным образом, поскольку домен IV не является доменом димеризации. Эпитоп трастузумаба очень близок к трансмембранной области, в положении, в котором антитело может оказывать значительное влияние на ориентацию трансмембранных областей, что влияет на ориентацию двух доменов киназы (Cho, H. S., et al., Nature 421(6924):756-60 [2003]). На аллостерические или другие непосредственные взаимодействия с активным участком киназы может влиять связывание антитела или бис-Fab с двумя молекулами рецептора в непосредственной близости (Bocharov, E. V., et al., J Biol Chem 283(11):6950-6 (2008); Schmitz, K. R., et al., Exp Cell Res 315(4):659-70 [2009]).
Поскольку 1188 бис-Fab является структурным аналогом Герцептина® (трастузумаба), авторы настоящего изобретения исследовали, может ли изменение участков прикрепления связи далее изменять функцию этих молекул. Авторы настоящего изобретения исследовали также эффекты тио-Fab, полученных из различных источников. Авторы настоящего изобретения показали возможность получения хороших результатов с использованием шарнирной области природного антитела после расщепления пепсином. Это позволяет использование любого источника антитела в качестве исходной точки для сборки бис-Fab без необходимости получения мутантной (сконструированной с cys заменами) формы молекулы. Разумеется, поскольку точка тио-присоединения ограничена шарнирной областью, можно получать только определенные структурные варианты. Авторы настоящего изобретения показали также возможность получения хороших результатов с использованием тио-Fab, происходящих из тио-Mab, полученных протеолитическим расщеплением с помощью лизин-C. Кроме того, рекомбинантный тио-Fab конструировали, экспрессировали в E. coli, очищали и успешно использовали для получения бис-Fab, с которыми также получили хорошие результаты. Таким образом, все эти способы предоставляют общие возможности для синтеза и обнаружения новых бис-Fab.
Исследование авторами настоящего изобретения изменений связей Herc бис-Fab привело к идентификации полного спектра активности в диапазоне от сильных агонистов до антагонистов и молекулы, оказывающих небольшой эффект на рост клеток. Таким образом, являлось возможным идентифицировать молекулы, обладающие активностью, отличной от активности исходных антител. Ранее показано, что изменения в шарнирной области антител влияют на функцию антител (Dillon, T. M., et al., J Biol Chem 283(23): 16206-15 [2008]). Не всегда возможно идентифицировать антитела, обладающие желательной активностью, активирующей или ингибирующей, или идентифицировать антитела с различными уровнями активности. Таким образом, варианты связывания бис-Fab предоставляют способ дальнейшей модификации желательной активности. Кроме того, предшествующие исследования с анти-CD20 антителами показали, что очень небольшие изменения того, каким образом антитело взаимодействует с эпитопом, могут влиять на функцию (Ernst, J. A., et al., Biochemistry 44(46): 15150-8 [2005]). Типичный способ конструирования антител, таким образом, можно расширять для включения ковалентного взаимодействия Fab, чтобы способствовать сборке более активных, эффективных терапевтических молекул-кандидатов.
Авторы настоящего изобретения исследовали также конкретные физические и биохимические свойства бис-Fab-агонистов 1325 и 1188 по сравнению с сильным бис-Fab-антагонистом, 1329, и Герцептином® (трастузумабом). Авторы настоящего изобретения не обнаружили различий в количестве участков связывания рецептора на поверхности клеток BT474 между агонистами и антагонистами. Более того, не присутствовало различий в аффинности молекулы для поверхности клеток, как определено по анализу Скэтчарда. кДа составляла приблизительно 3 нМ для обоих типов молекул. Авторы настоящего изобретения оценивали также молекулярную массу, удержание при гель-фильтрации и гидродинамический радиус каждой из молекул, но вновь не обнаружили больших различий в этих физических свойствах. Существовала незначительная тенденция, что молекулы - агонисты имеют больший гидродинамический радиус по анализу SEC-MALS; однако, наблюдаемые различия находились в пределах ошибки. Единственное большое аналитическое различие в структуре обнаружили при SDS-PAGE, где для этих молекул, почти идентичных по молекулярной массе, показали большие различия подвижности в геле. Денатурирующие условия SDS-PAGE не коррелируют с анализами в растворенном состоянии. Например, различия, обнаруженные в геле, не выявили системы, связанной с активностью, поскольку наиболее сильный агонист, 1325, мигрировал между крайними положениями и сходным образом с сильным антагонистом, 1324. Единственным большим различием этих молекул является ориентация Fv областей по отношению друг к другу. Это может служить причиной различий активности между молекулами. Настоящий анализ не выявил прогностической системы структуры-функции, однако, более детальное исследование структуры-функции может позволить разработку способа 3D-моделирования для понимания взаимодействий активности. В настоящее время, функциональные варианты любого антитела или комбинации антител можно легко идентифицировать с использованием эмпирического способа на основе матрицы синтеза, описанного в настоящем документе, и анализов функциональноый активности, доступных для интересующего антитела(антител).
С использованием наиболее сильного агониста, полученного из комбинаторной матрицы тио-Fab трастузумаба, 1325, авторы настоящего изобретения исследовали путь передачи сигнала, вовлеченный в распространение сигнала пролиферации клеток. Для тестирования пути передачи сигнала авторы настоящего изобретения обратились к хорошо охарактеризованному анализу активности трастузумаба, опубликованному недавно. В нем показано, что трастузумаб ингибирует взимодействие Her2 и Her3 на клетках со сверхэкспрессией Her2 (Junttila, T. T., et al., Cancer Cell 15(5):429-40 [2009]). Эти два рецептора присутствуют в комплексе, рекрутирующем и активирующем PI3K в исходном состоянии. Активация этой киназы приводит к фосфорилированию и активации ключевой сигнальной киназы AKT. В исследовании авторов настоящего изобретения, описанном выше, AKT являлась фосфорилированной до намного более высокого уровня в клетках, обработанных агонистом бис-Fab 1325. Это являлось тем, чего ожидали авторы настоящего изобретения и что согласуется с путями передачи сигнала пролиферации клеток, известными для Her2. Отличным и неожиданным было то, что уровень фосфорилирования Her3 не изменялся при добавлении агониста. Фактически, по-видимому, присутствовало даже небольшое уменьшение уровня фосфотирозина в Her3 на протяжении промежутка времени два часа. Это позволяет предполагать, что агонист может обходить взаимодействие Her2/Her3 для стимуляции активности AKT. Это можно осуществлять изменением состояния фосфорилирования непосредственно Her2. Авторы настоящего изобретения тестировали состояние фосфорилирования Her2 анализом масс-спектрометрии для рассмотрения отдельных фосфопептидов во внутриклеточном домене (ICD) рецептора. Сначала авторы настоящего изобретения идентифицировали несколько пептидов, фосфорилированных в исходном состоянии в клетках BT474. Затем авторы настоящего изобретения рассматривали процент фосфорилирования Her2 в ответ на обработку трастузумабом или агонистом 1325. В общем, авторы настоящего изобретения наблюдали, что некоторые из этих участков фосфорилирования изменялись в ответ на агонист, но не в ответ на трастузумаб. По-видимому, агонист дополнительно активирует рецептор, но эта активация не приводит к увеличенному фосфорилированию Her3. Это указывает на то, что немного отличающийся активирующий комплекс может распространять сигнал и позволяет предполагать, что бис-Fab 1325 может подходить для активации Her2 даже в отсутствие Her 3 или лиганда.
Таким образом, авторы настоящего изобретения исследовали возможные области терапии, где может быть полезной активация Her2. Опубликована связь между Герцептином® (трастузумабом) и состоянием тканей сердца. Chien, K. R. N Engl J Med 354(8):789-90 (2006); Perik, P. J., et al., Eur J Heart Fail 9(2): 173-7 (2007); Suter, T. M., et al., J Clin Oncol 25(25):3859-65 (2007). В ходе терапии Герцептином® (трастузумабом) может возникать кардиотоксичность. Показано, что в присутствии конкретных химиотерапевтических лекарственных средств, например, антрациклинов, частота возникновения кардиотоксичности в ходе терапии Герцептином® (трастузумабом) значительно возрастает (Morris, P. G., et al., Breast Cancer Res Treat DOI 10,1007/s10549-008-0172-5 (2008); Popat, S., et al., Nat Clin Pract Oncol 5(6):324-35 [2008]). Хорошо понятно, что антрациклин отдельно вызывает кардиотоксичность, приводящую к кардиомиопатии и застойной сердечной недостаточности (Annals of Internal Medicine 125(l):47-58 [1996]). Повреждения, связанные с комбинацией антрациклина и Герцептина® (трастузумаба) могут быть обусловлены нарушением нормальной функции Her2 в естественном процессе репарации поврежденных тканей сердца. Таким образом, авторы настоящего изобретения заключили, что, из-за эффектов на ткани сердца, иногда наблюдаемых у пациентов при лечении Герцептином® (трастузумабом) и из-за того, что активность Her2, вероятно, связана с ростом клеток сердца (Freedman, N. J., et al., J Am Coll Cardiol 48(7): 1448-50 [2006]), возможно, что агонист Her2 может предоставлять преимущества для пациентов с заболеваниями сердца. Недавно однозначно показано, что, вопреки предшествующему убеждению, кардиомиоциты продолжают пролиферацию в ходе взрослой жизни (Bergmann, O., R. et al., Science 324(5923):98-102 (2009); Bersell, K., S., et al., Cell 138(2):257-70 (2009); Doggen, K., et al., J Mol Cell Cardiol 46(l):33-8 [2009]). Соответственно, авторы настоящего изобретения предположили, что поисходящие из трастузумаба молекулы бис-Fab-агонисты, такие как бис-Fab 1325, могут активировать Her2 в растущих кардиомиоцитах взрослых, таким образом, обеспечивая возможный способ лечения конкретных типов заболеваний сердца.
Некоторые другие типы клеток, тканей и клеточных процессов также зависят от активации Her2 и других членов семейства HER. Эти рецепторы активируются членами семейства лигандов нейрорегулина, для которого наблюдали множество важных функций передачи сигнала. Эти типы клеток, тканей и процессов включают мышечные клетки, кардиомиоциты, шванновские клетки, олигодендроциты, нервно-мышечный синапс, сенсорные нейроны черепных нервов, моторные и сенсорные нейроны, периферические и черепные нервы, симпатические нейроны, предшественники кортикальных нейронов, зернистые клетки мозжечка, гипоталамус, парасимпатическую нервную ткань, гиппокамп, ткани сердца, развитие сердечного клапана, АВ-перегородку, рост, репарацию и выживаемость кардиомиоцитов, ангиогенез, развитие эпителия легких, миогенез, гонадогенез и пролиферацию эпителия желудка. Falls, D. L. Exp Cell Res 284(1): 14-30 (2003); Falls, D.L. J. Neurocytol. 32(5-8):619-47 (2003); Britsch, S. Adv Anat Embryol Cell Biol 190: 1-65 (2007). Соответственно, эти типы клеток являются дополнительными потенциальными мишенями для агонистов Her2. Кроме того, поддержание и дифференцировка эмбриональных стволовых клеток человека (hECS) зависит от активности Her2 и может обеспечивать другое важное применение молекулы-агониста Her2 (Jones, F. E., et al., Oncogene 18(23):3481-90 (1999); Leone, F., E., et al., J Leukoc Biol 74(4):593-601 (2003).
Авторы настоящего изобретения исследовали также, обладает ли этот способ общей применимостью благодаря разработке бис-Fab к дополнительным молекулярным мишеням. Авторы настоящего изобретения синтезировали бис-Fab, нацеленные на FcγRIIb и FcεRIα, и тестировали эффекты каждого на высвобождение гистамина из клеток RBL, экспрессирующих как FcεRIα, так и FcγRIIb. Результаты показали, что для различных бис-Fab показан диапазон активности.
Кроме того, авторы настоящего изобретения описали способ получения модифицированных кросслинкеров для использования для синтеза бис-Fab. Авторы настоящего изобретения показали, что такие модифицированные кросслинкеры пригодны для добавления реагентов, пригодных для модификации времени полужизни in vivo, таких как PEG. Авторы настоящего изобретения показали также, что бис-Fab, содержащие PEG, обладали улучшенным временем полужизни в сыворотке по сравнению с бис-Fab без PEG. Наконец, с использованием моделей на мышах ксенотрансплантата in vivo, авторы настоящего изобретения показали, что бис-Fab, содержащие PEG, являлись эффективными для ингибирования роста клеток опухоли, подтверждая их потенциал в качестве терапевтических кандидатов, нацеленных на солидные опухоли.
Этот новый способ, описанный в настоящем документе для синтеза антителоподобных молекул, которые авторы настоящего изобретения назвали бис-Fab, может являться полезным новым инструментом для разработки молекулярной терапии и содействовать фундаментальным исследованиям. В качестве способа скрининга, этот способ можно использовать, например, для идентификации наиболее подходящей комбинации биспецифических антител для данного применения или в качестве инструмента для тестирования путей передачи сигнала рецептором. Он является пригодным также для быстрого и точного получения молекул для исследований и предоставляет новые возможности для получения широкого диапазона активности, который в ином случае может быть недостижимым с помощью природных структур иммуноглобулинов.
Настоящее изобретение не предназначено для ограничения по объему конкретными вариантами осуществления, описанными в примерах, которые предназначены в качестве иллюстраций некоторых аспектов изобретения, и любые варианты осуществления, которые являются функционально эквивалентными, входят в объем настоящего изобретения. Действительно, различные модификации изобретения в дополнение к показанным и описанным в настоящем документе, очевидны для специалистов в данной области и предназначены для включения в объем прилагаемой формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛУЧЕННЫЕ С ПОМОЩЬЮ ГЕННОЙ ИНЖЕНЕРИИ АНТИТЕЛА С ЦИСТЕИНОВЫМИ ЗАМЕНАМИ И ИХ КОНЪЮГАТЫ | 2011 |
|
RU2626537C2 |
| ПОЛУЧЕННЫЕ С ПОМОЩЬЮ ГЕННОЙ ИНЖЕНЕРИИ АНТИТЕЛА С ЦИСТЕИНОВЫМИ ЗАМЕНАМИ И ИХ КОНЪЮГАТЫ | 2011 |
|
RU2755066C2 |
| КОНЪЮГАТЫ МЕЧЕННЫХ РАДИОАКТИВНЫМ ЦИРКОНИЕМ СКОНСТРУИРОВАННЫХ АНТИТЕЛ С ЦИСТЕИНОВЫМИ ЗАМЕНАМИ | 2010 |
|
RU2562862C2 |
| АНТИ-CD79b АНТИТЕЛА И ИММУНОКОНЪЮГАТЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2009 |
|
RU2553566C2 |
| КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ АНТИТЕЛО, КОТОРОЕ СВЯЗЫВАЕТСЯ С ДОМЕНОМ II HER2, И ЕГО КИСЛЫЕ ВАРИАНТЫ | 2009 |
|
RU2543664C2 |
| АНТИ-CD79b АНТИТЕЛА И ИММУНОКОНЪЮГАТЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2008 |
|
RU2511410C2 |
| АНТИТЕЛА, СПОСОБНЫЕ СПЕЦИФИЧЕСКИ СВЯЗЫВАТЬСЯ С HER2 | 2014 |
|
RU2628094C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИ-SIRPα АНТИТЕЛА | 2019 |
|
RU2812199C2 |
| АНТИ-НЕR2 АНТИТЕЛО И ЕГО КОНЪЮГАТ | 2014 |
|
RU2656161C1 |
| ЛЕЧЕНИЕ РАКА БИСПЕЦИФИЧЕСКИМИ АНТИТЕЛАМИ К HER2XCD3 В КОМБИНАЦИИ С МОНОКЛОНАЛЬНЫМ АНТИТЕЛОМ К HER2 | 2020 |
|
RU2793296C1 |































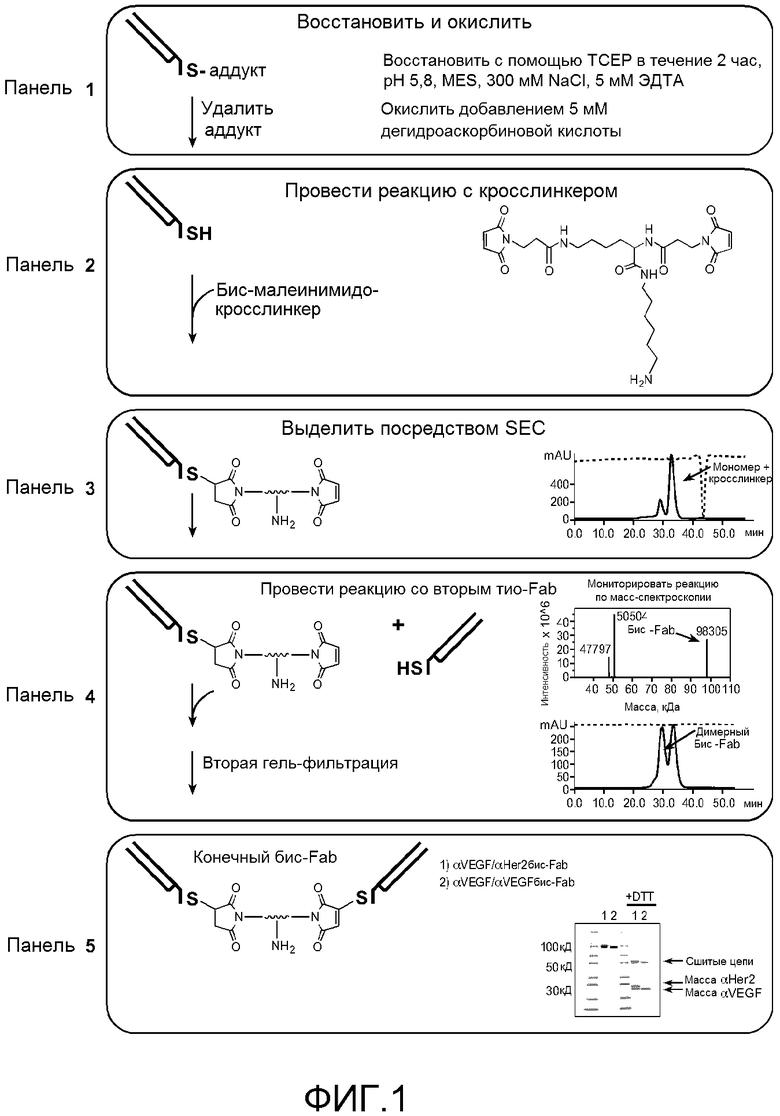
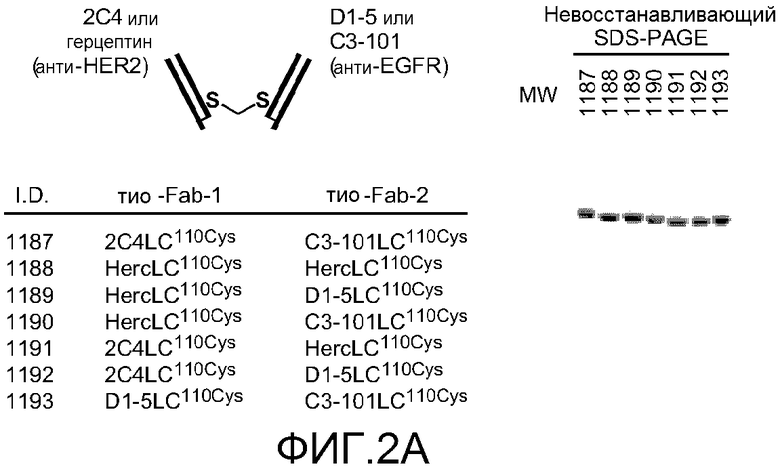


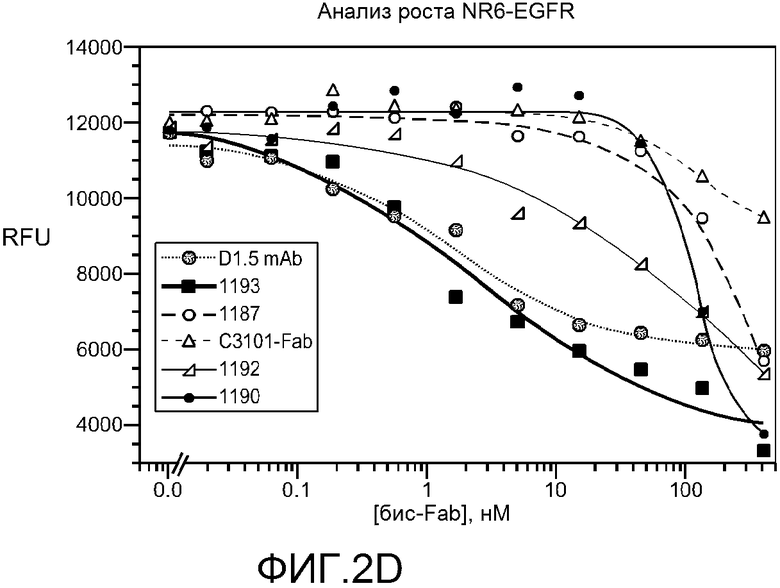
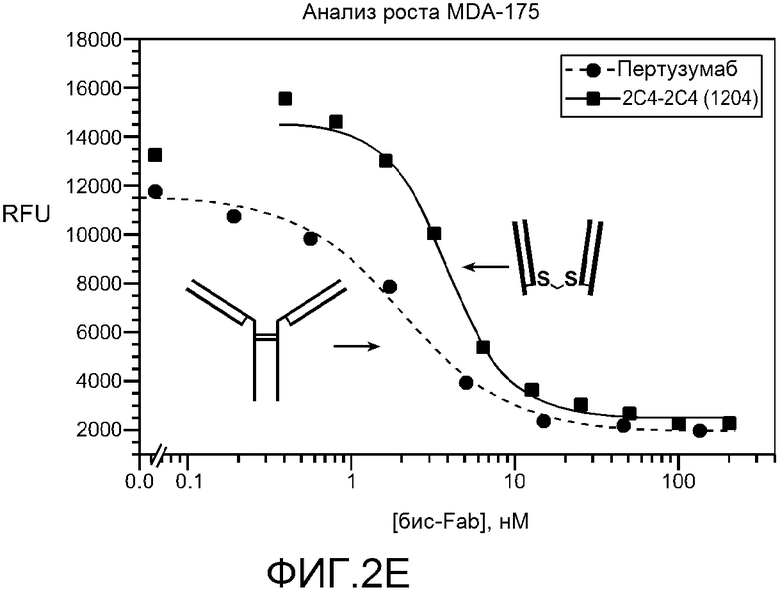


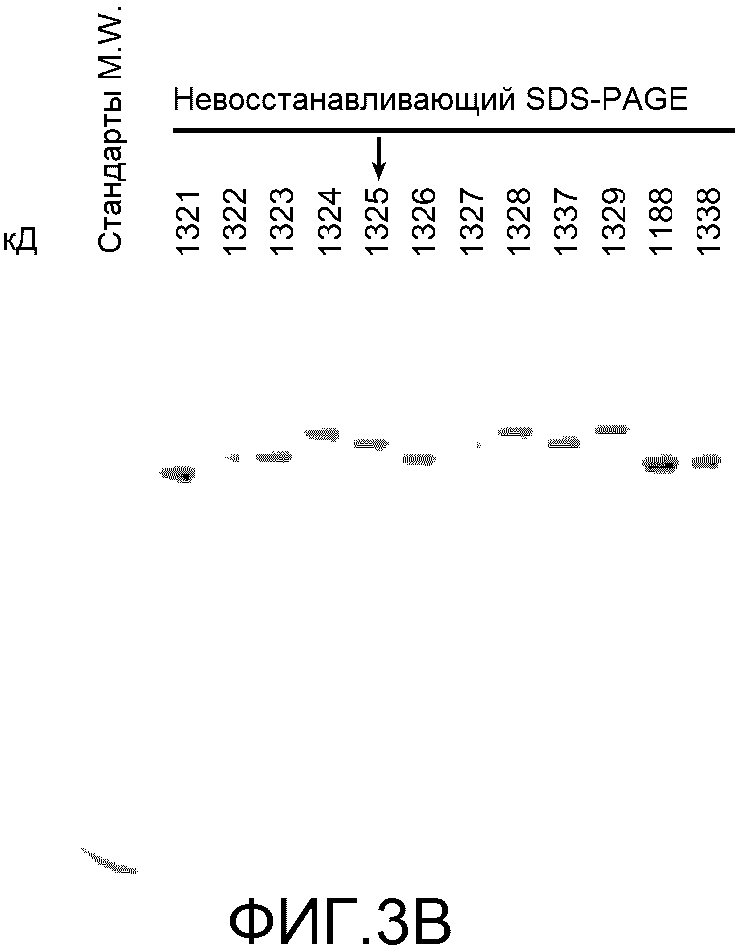
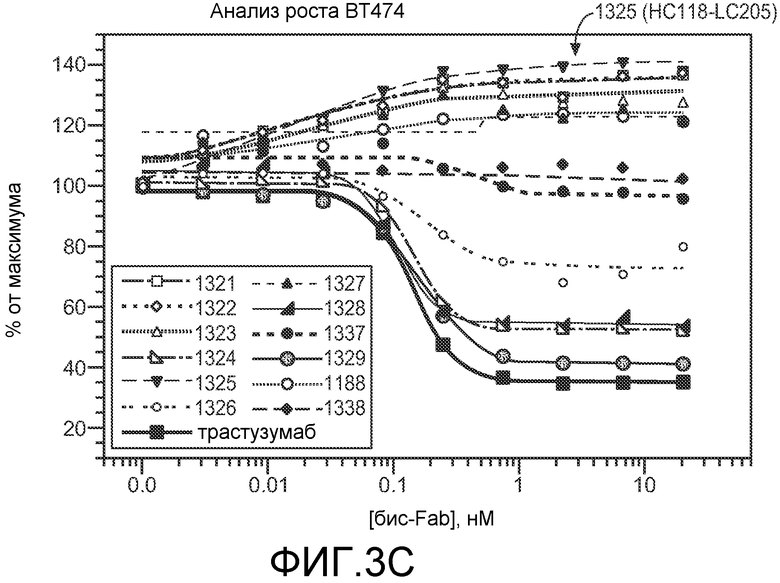
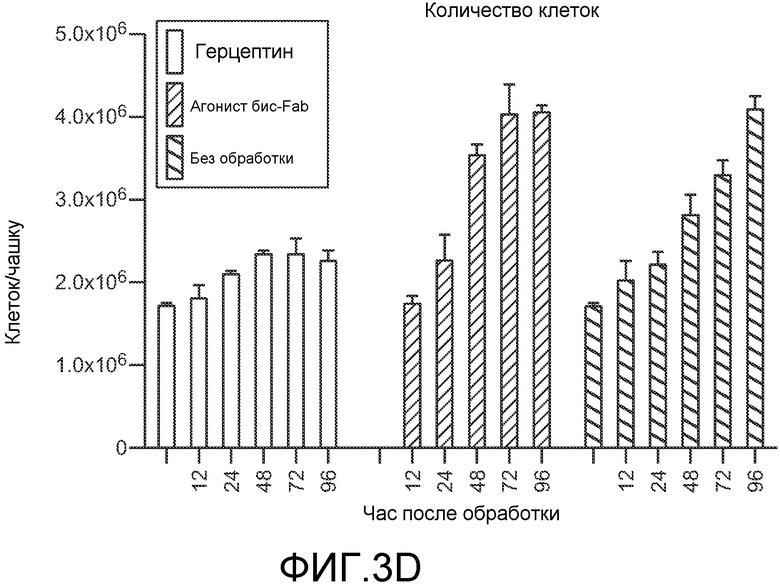
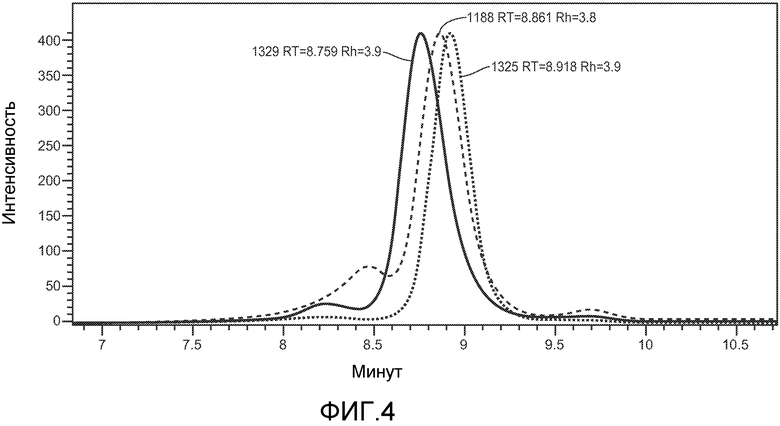
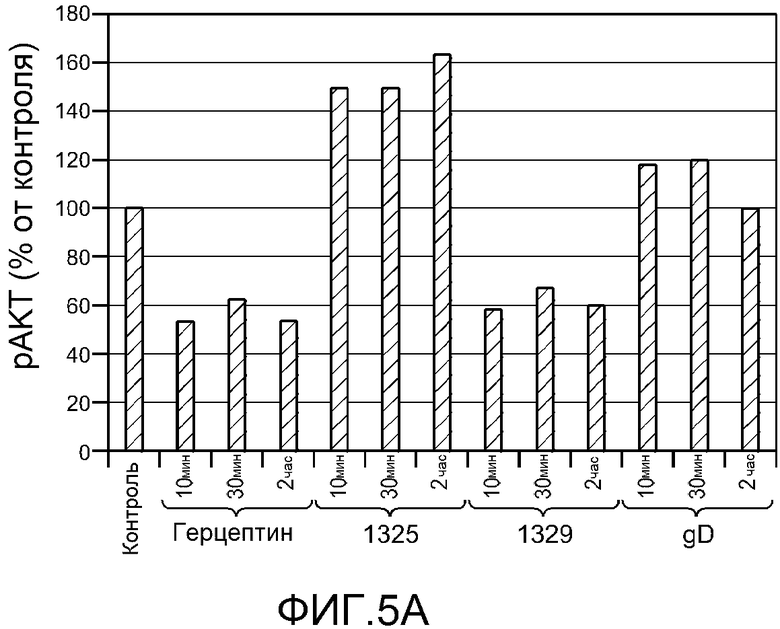
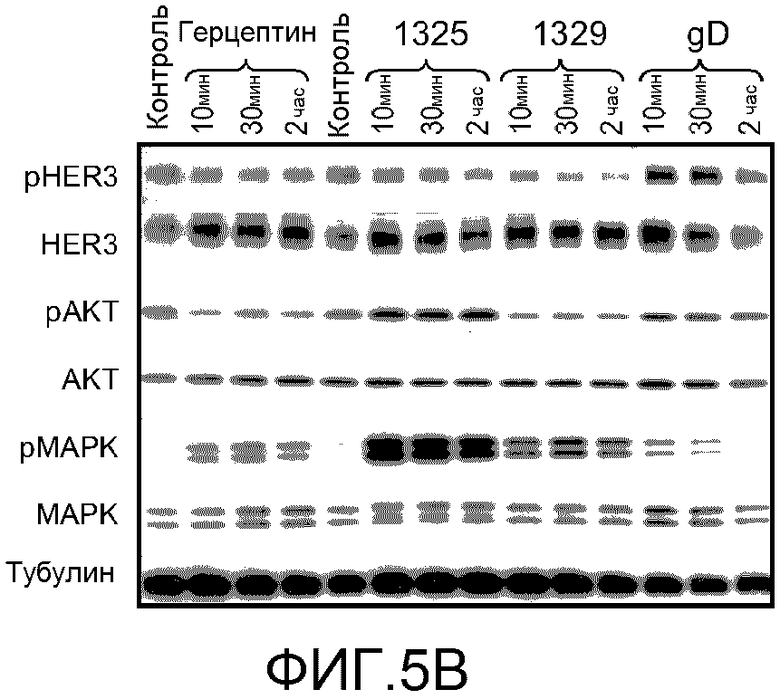


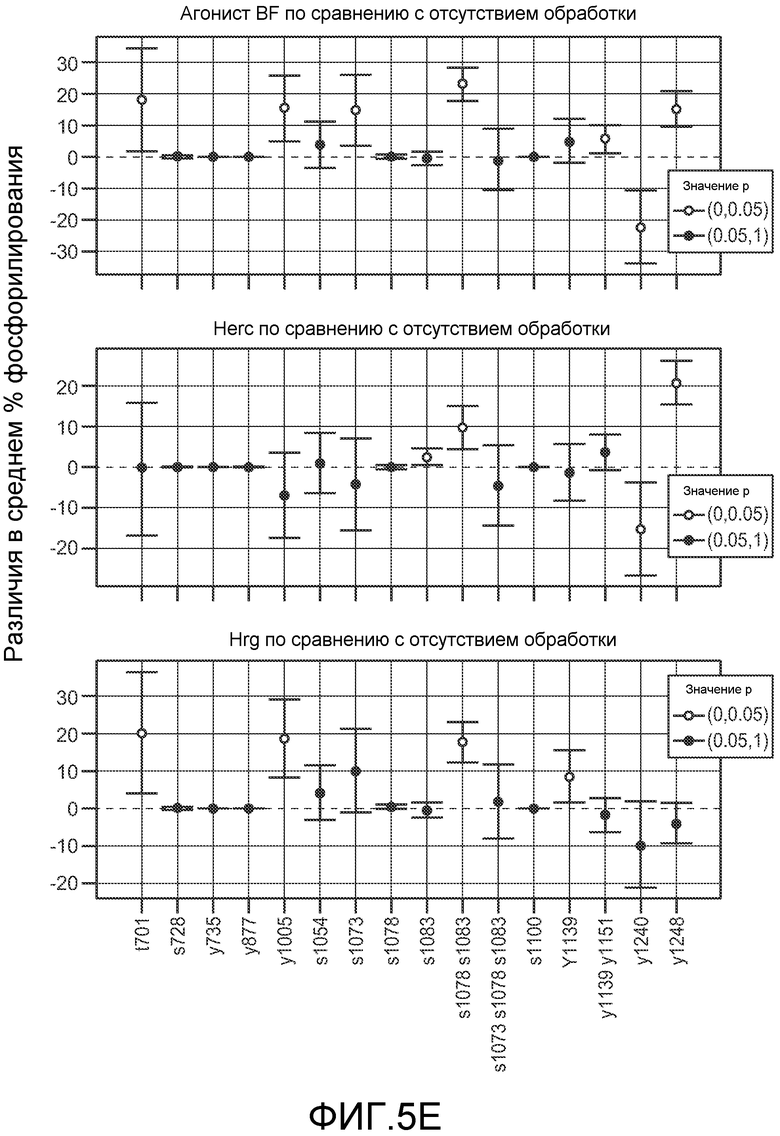
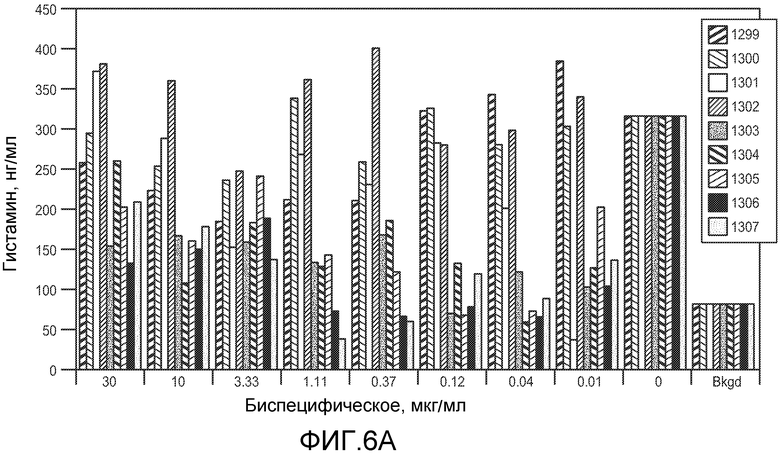
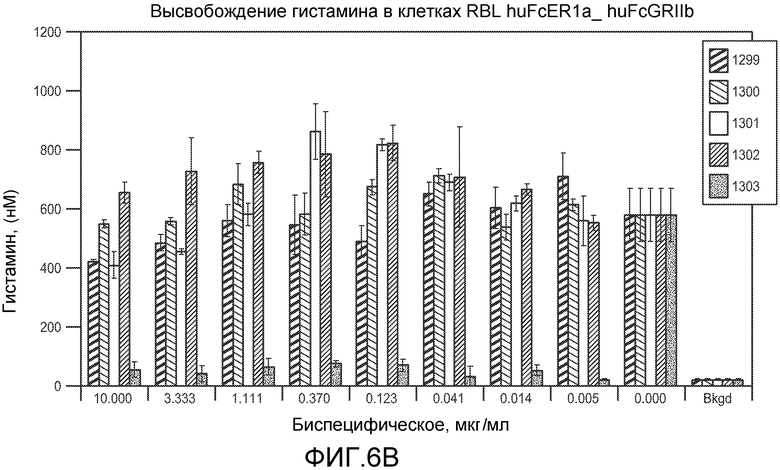
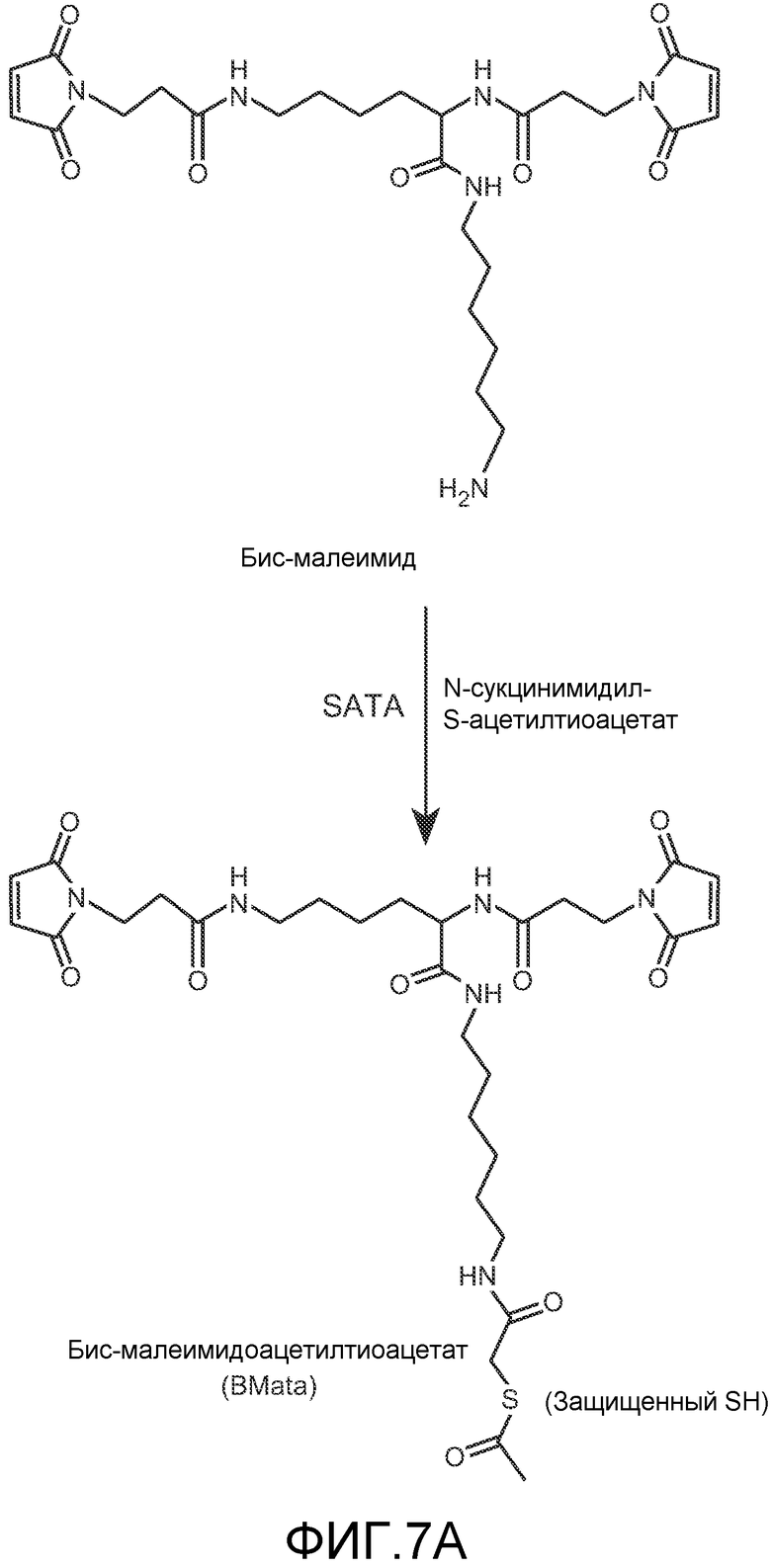
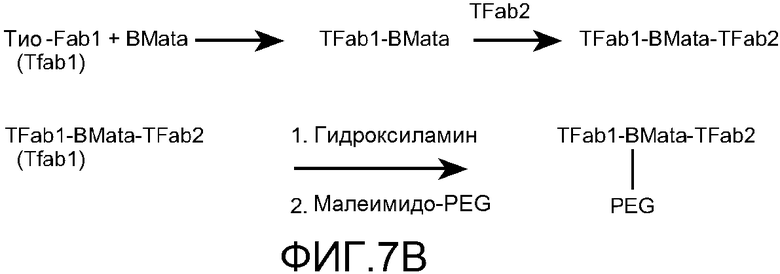


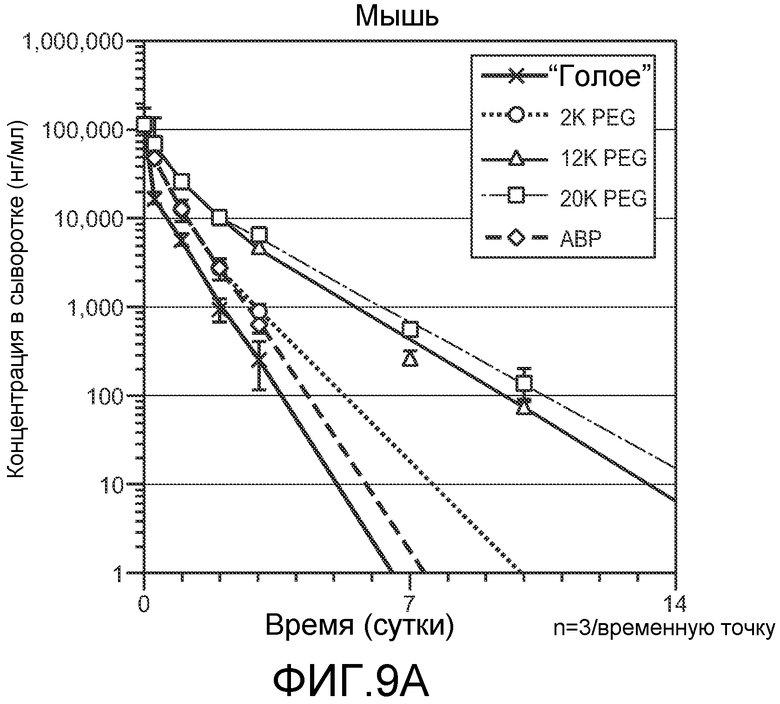
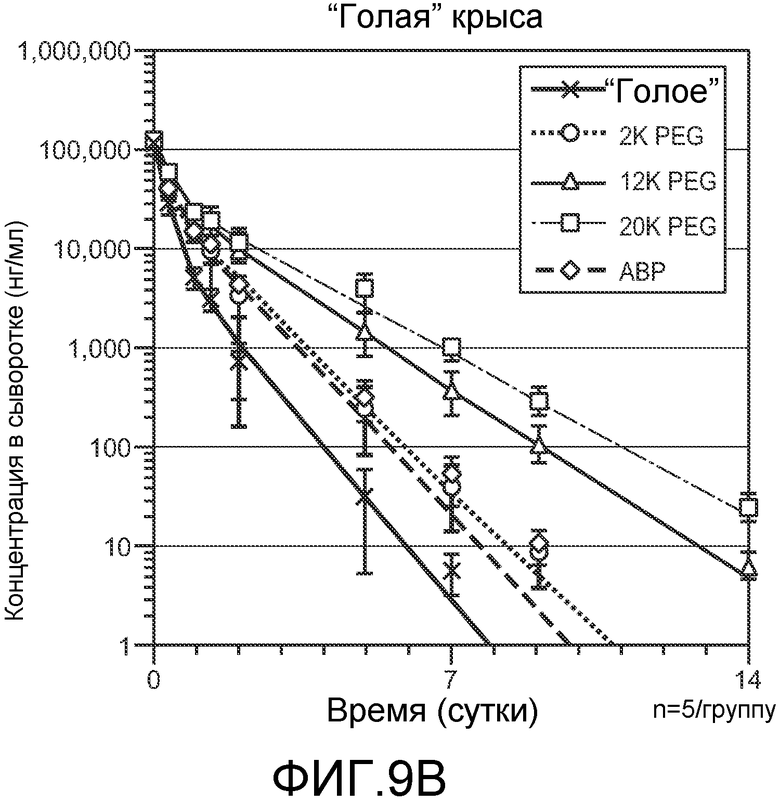

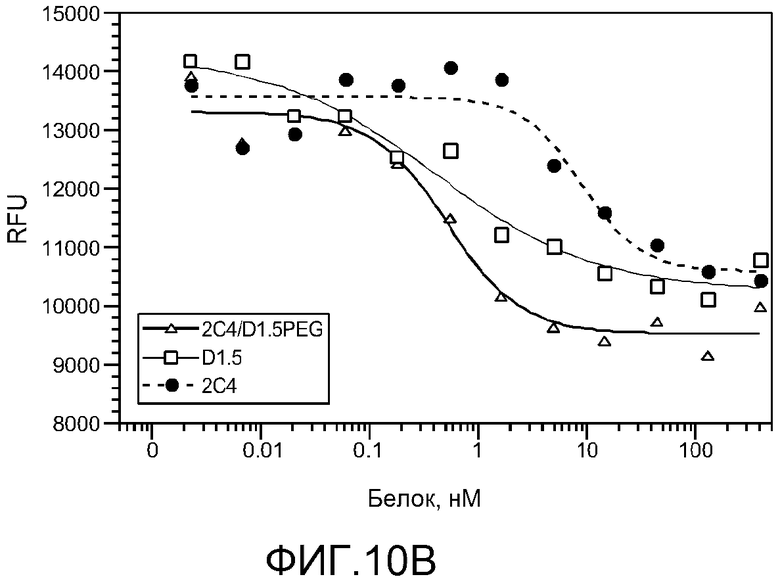

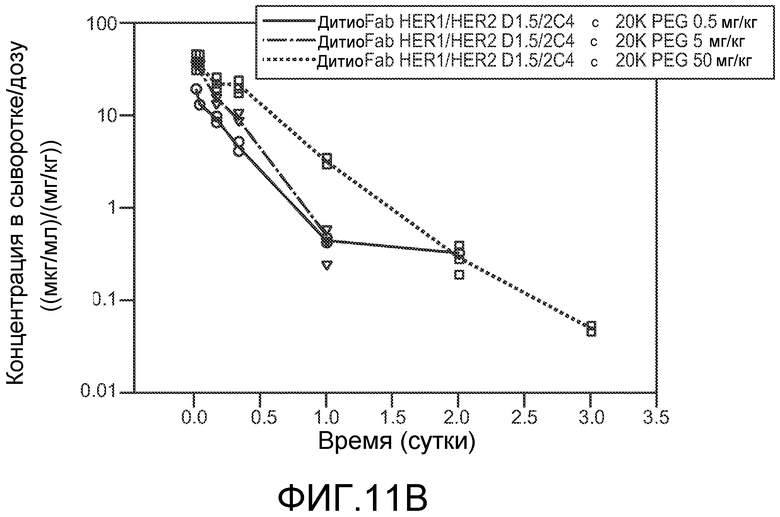



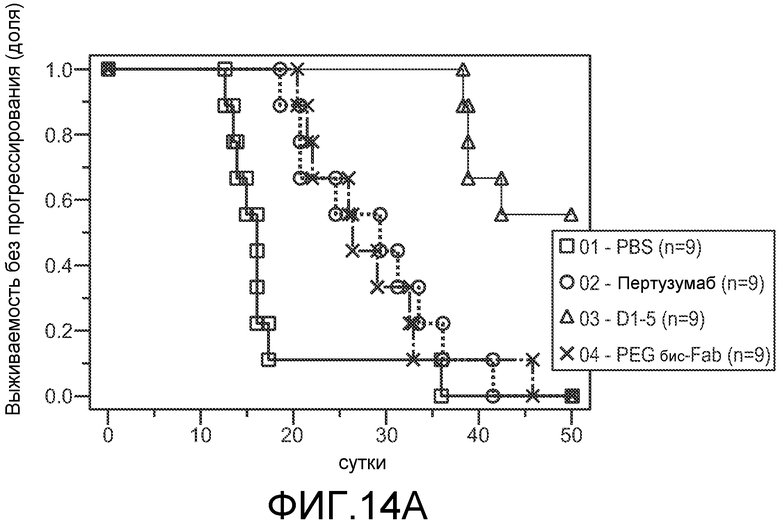
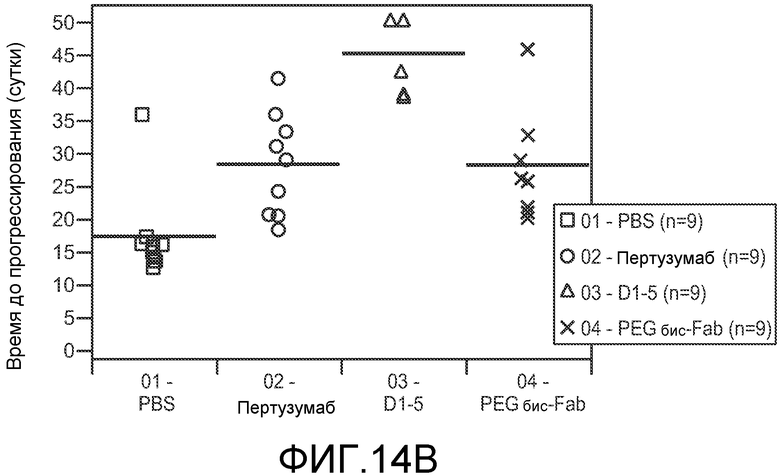
Изобретение относится к области биотехнологии. Представлен способ синтеза панели мультиспецифических антител для терапии, диагностики или исследований, где проводят реакцию первого фрагмента антитела, имеющего первую моноспецифичность, полученного из первого исходного антитела, и обладающего свободной сульфгидрильной группой, с тио-реактивным кросслинкером для получения группы фрагмент антитела-кросслинкер и где проводят реакцию группы фрагмент антитела-кросслинкер попарно с каждым из трех или более дополнительных фрагментов антител, имеющих различную моноспецифичность, отличную от первого фрагмента антитела, каждый из которых имеет свободную сульфгидрильную группу, для получения панели мультиспецифических антител. Кроме того, также предложен способ синтеза панели аналогов антител для терапии, диагностики или исследований, где проводят реакцию первого фрагмента антитела, обладающего свободной сульфгидрильной группой, с тио-реактивным кросслинкером для получения группы фрагмент антитела-кросслинкер и где проводят реакцию группы фрагмент антитела-кросслинкер попарно с каждым из трех или более дополнительных фрагментов антител, каждый из которых имеет свободную сульфгидрильную группу, для получения панели аналогов антител, где каждый из фрагментов антител получен из одного и того же исходного антитела. Изобретение позволяет получать панели мультиспецифических антител или аналогов антител, предназначенных для терапии, диагностики или исследований. 2 н. и 33 з.п. ф-лы, 14 ил., 5 табл., 5 пр.
1. Способ синтеза панели мультиспецифических антител для терапии, диагностики или исследований, где проводят реакцию первого фрагмента антитела, имеющего первую моноспецифичность, полученного из первого исходного антитела, и обладающего свободной сульфгидрильной группой, с тио-реактивным кросслинкером для получения группы фрагмент антитела-кросслинкер и где проводят реакцию группы фрагмент антитела-кросслинкер попарно с каждым из трех или более дополнительных фрагментов антител, имеющих различную моноспецифичность, отличную от первого фрагмента антитела, каждый из которых имеет свободную сульфгидрильную группу, для получения панели мультиспецифических антител.
2. Способ по п. 1, где первое исходное антитело выбрано из группы, состоящей из антител анти-Her1, анти-Her2, анти-FcεRIα и анти-FcγRIIb.
3. Способ по п. 2, где первый фрагмент антитела получен из анти-Her2 и каждый из трех или более дополнительных фрагментов антител получен из анти-Her1, или первый фрагмент антитела получен из анти-Her1 и каждый из трех или более дополнительных фрагментов антител получен из анти-Her2, или первый фрагмент антитела получен из анти-FcεRIα и каждый из двух или более дополнительных фрагментов антител получен из анти-FcγRIIb, или первый фрагмент антитела получен из анти-FcγRIIb и каждый из трех или более дополнительных фрагментов антител получен из анти-FcεRIα.
4. Способ по п. 2, где первое исходное антитело представляет собой анти-Her2 и выбрано из группы, состоящей из трастузумаба и пертузумаба.
5. Способ по п. 2, где первое исходное антитело представляет собой анти-Her1 и выбрано из группы, состоящей из D1-5 (SEQ ID NO: 17 и 18) и С3-101 (SEQ ID NO: 20 и 21).
6. Способ по п. 3, где анти-Her2 выбрано из группы, состоящей из трастузумаба и пертузумаба, и анти-Her1 выбрано из группы, состоящей из D1-5 (SEQ ID NO: 17 и 18) и С3-101 (SEQ ID NO: 20 и 21).
7. Способ по п. 1, где первое исходное антитело представляет собой 5А6 (SEQ ID NO: 9 и 11).
8. Способ по п. 1, где первое исходное антитело 22Е7 (SEQ ID NO: 13 и 15).
9. Способ по п. 3, где анти-FcγRIIb представляет собой 5А6 (SEQ ID NO: 9 и 11) и анти-FcεRIα представляет собой 22Е7 (SEQ ID NO: 13 и 15).
10. Способ по п. 1, где тио-реактивный кросслинкер выбран из группы, состоящей из бис-малеимидогалогенидов, бис-алкилгалогенидов, пиридилдисульфидов, бис-ртутных солей, опосредованного 5-тио-2-нитробензойной кислотой перекрестного связывания и бис-тиосульфонатов.
11. Способ по п. 1, где тио-реактивный кросслинкер представляет собой бис-малеинимид.
12. Способ по п. 1, где первый фрагмент антитела и/или каждый из трех или более дополнительных фрагментов антител получены из сконструированного антитела с цистеиновыми заменами.
13. Способ по п. 1, где свободные сульфгидрильные группы каждого дополнительного фрагмента антитела расположены по меньшей мере в трех разных положениях.
14. Способ по п. 12, где сконструированное антитело с цистеиновыми заменами содержит замену в положении 110 или в положении 205 легкой цепи, где нумерация остатков присутствует в соответствии с системой нумерации EU, и где замена представляет собой цистеин.
15. Способ по п. 12, где сконструированное антитело с цистеиновыми заменами содержит замену в положении 118 или в положении 121 тяжелой цепи, где нумерация остатков присутствует в соответствии с системой нумерации EU, и где замена представляет собой цистеин.
16. Способ синтеза панели аналогов антител для терапии, диагностики или исследований, где проводят реакцию первого фрагмента антитела, обладающего свободной сульфгидрильной группой, с тио-реактивным кросслинкером для получения группы фрагмент антитела-кросслинкер и где проводят реакцию группы фрагмент антитела-кросслинкер попарно с каждым из трех или более дополнительных фрагментов антител, каждый из которых имеет свободную сульфгидрильную группу, для получения панели аналогов антител, где каждый из фрагментов антител получен из одного и того же исходного антитела.
17. Способ по п. 16, где исходное антитело выбрано из группы, состоящей из анти-Her1, анти-Her2, анти-FcεRIα и анти-FcγRIIb.
18. Способ по п. 17, где исходное антитело представляет собой анти-Her2 и выбрано из группы, состоящей из трастузумаба и пертузумаба.
19. Способ по п. 17, где исходное антитело представляет собой анти-Her1 и выбрано из группы, состоящей из D1-5 (SEQ ID NO: 17 и 18) и С3-101 (SEQ ID NO: 20 и 21).
20. Способ по п. 17, где исходное антитело представляет собой 5А6 (SEQ ID NO: 9 и 11).
21. Способ по п. 17, где исходное антитело представляет собой 22Е7 (SEQ ID NO: 13 и 15).
22. Способ по п. 16, где тио-реактивный кросслинкер выбран из группы, состоящей из бис-малеимидогалогенидов, бис-алкилгалогенидов, пиридилдисульфидов, бис-ртутных солей, опосредованного 5-тио-2-нитробензойной кислотой перекрестного связывания и бис-тиосульфонатов.
23. Способ по п. 22, где тио-реактивный кросслинкер представляет собой бис-малеинимид.
24. Способ по п. 16, где исходное антитело представляет собой сконструированное антитело с цистеиновыми заменами.
25. Способ по п. 16, где свободные сульфгидрильные группы каждого дополнительного фрагмента антитела расположены по меньшей мере в трех разных положениях.
26. Способ по п. 24, где сконструированное антитело с цистеиновыми заменами содержит замену в положении 110 или в положении 205 легкой цепи, где нумерация остатков присутствует в соответствии с системой нумерации EU, и где замена представляет собой цистеин.
27. Способ по п. 24, где сконструированное антитело с цистеиновыми заменами содержит замену в положении 118 или в положении 121 тяжелой цепи, где нумерация остатков присутствует в соответствии с системой нумерации EU, и где замена представляет собой цистеин.
28. Способ по п. 1, где первый фрагмент антитела, второй фрагмент антитела и/или каждый из трех или более дополнительных фрагментов антитела получен из природного антитела,
где природное антитело расщеплено пепсином с получением фрагмента F(ab′)2,
где фрагмент F(ab′)2 очищен и обработан восстанавливающим средством, а затем окисляющим средством в условиях, при которых переформируется дисульфидный мостик между тяжелой цепью и легкой цепью Fab и остатки цистеина в шарнирной области остаются неокисленными.
29. Способ по п. 1, где кросслинкер представляет собой модифицированный кросслинкер, содержащий защищенную группу SH.
30. Способ по п. 29, где модифицированный кросслинкер представляет собой бис-малеимидоацетилацетат (BMata).
31. Способ по п. 29, где антитело содержит модифицированный кросслинкер, который дополнительно взаимодействует со средством, содержащим функциональную группу.
32. Способ по п. 31, где средство выбрано из полиэтиленгликоля (PEG), альбуминсвязывающего пептида (АВР), флуоресцентной метки, средства для радиовизуализации, цитотоксического средства и миРНК.
33. Способ по п. 31, где средство представляет собой PEG и PEG выбран из 2000 mw (2К) PEG, 12000 mw (12К) PEG и 20000 mw (20К) PEG.
34. Способ по п. 1, где первое родительское антитело специфически связывается с мишенью на Т-клетке и второе родительское антитело специфически связывается с мишенью на опухолевой клетке.
35. Способ по п. 34, где первое родительское антитело представляет собой анти-CD3 и второй родительское антитело выбрано из анти-BLR1, анти-BR3, анти-CD19, анти-CD20, анти-CD22, анти-CD72, анти-CD79A, анти-CD79В, анти-CD180, анти-CR2, анти-FCER2, анти-FcRH1, анти-FcRH2, анти-FcRH5, анти-FCRL4, анти-Her2, анти-HLA-DOB и анти-NAG14.
| US 2009092582 A1 (BOGIN OREN [US]; et al), 09.04.2009. | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| С | |||
| М | |||
| ДЕЕВ, Е | |||
| Н | |||
| ЛЕБЕДЕНКО "Современные технологии создания неприродных антител для клинического применения", Acta naturae, N 1, 2009, стр | |||
| Способ образования коричневых окрасок на волокне из кашу кубической и подобных производных кашевого ряда | 1922 |
|
SU32A1 |
Авторы
Даты
2016-04-10—Публикация
2010-12-03—Подача