Изобретение относится к иммунологии, медицине, а именно к лабораторной диагностике наличия и количественной оценки уровня нейтрализующих антител (HAT) в сыворотке крови больных рассеянным склерозом (PC), получавших терапию препаратами интерферона-бета (ИФНβ). Описанный способ исследования направлен на оценку эффективности лечения препаратами у пациентов, в течение длительного времени подвергавшихся лечению препаратами ИФНβ. Практическим результатом диагностической процедуры с использованием заявленного способа является коррекция выбранной схемы лечения по назначению/замене и количеству используемого препарата.
Рассеянный склероз (PC) - хроническое, этиологически мультифакториальное прогрессирующее демиелинизирующее заболевание центральной нервной системы [1, 2]. Превентивная терапия, основанная на применении препаратов интерферона бета (ИФНβ) и используемая с 1990-х годов, позволила совершить поистине революционный переворот и изменить течение и прогноз этой болезни. Она проводится в период ремиссии и стабилизации (вне обострения PC) и нацелена на предупреждение обострений при прогрессировании инвалидизации, при ремиттирующем и вторично прогрессирующем течении болезни [1, 2, 3].
ИФНβ (1а и 1b), используемые в терапии PC, как продукты генноинженерных технологий, являются белковыми субстанциями. В этой связи они потенциально иммуногенны. HAT против ИФНβ возникают в результате нарушения иммунотолерантности, ассоциированной с процессами повторного представления антигена [2, 4]. Эффекторами иммунного ответа на введение терапевтических препаратов ИФНβ выступают т.н. нейтрализующие антитела (HAT), блокирующие активность молекул ИФН на этапе их связывания со специфическими рецепторами [5]. Сообщается, что HAT могут быть обнаружены в крови пациентов с PC, получающих ИФНβ, уже по прошествии 3-6 мес после инициации лечения [1, 4]. Частота их появления зависит от используемых препаратов ИФН-бета. Так, по данным Т.Е. Шмидт и Н.Н. Яхно (2010), HAT к ИФНβ-1b появляются у 28-45% больных, к ИФНβ-1а для подкожного введения - у 11-24%, а к ИФНβ-1a для внутримышечного введения - лишь у 2-5% пациентов [1, 2].
В различных публикациях сообщается, что у НАТ-позитивных пациентов с PC (особенно с высокими титрами) существенно снижается эффективность терапии ИФНβ [1, б].
Определение HAT является чрезвычайно трудоемким процессом, поскольку использование скрининг-исследований на основе методы ELISA, белкового иммуноблота, радиоиммунопреципитации или аффинной хроматографии не позволяет дифференцировать обнаруженную активность связывания ИФНβ между связывающими антителами (CAT) и HAT [1]. Поэтому выявление HAT основано на специфических функциональных клеточных тестах.
При исследовании HAT in vitro D. Hess и соавт. (2007, 2009) использовали тест, получивший название «индукции МхА» [1, 7, 8]. Этот метод позволяет определить способность HAT, присутствующих в сыворотке крови пациентов, к снижению ИФНβ-индуцированной экспрессии специфического маркера ИФН - МхА (в форме мРНК или на белковом уровне). МхА - это белок резистентности к миксовирусам. Предполагается, что мРНК маркера МхА является наиболее чувствительным показателем при исследовании HAT; он получает все большее распространение [1,4].
В настоящее время перспективным методом исследования является так называемое люциферазное исследование, основанное на использовании клеток фибросаркомы человека с внесенной люциферазной кассетой гена-репортера (при наличии HAT связывания молекулы ИФНβ с соответствующим рецептором и активации трансклеточного сигнального механизма с последующей транкрипцией гена люциферазы не происходит) [1,9].
К традиционным методам определения активности HAT к ИФНα, β и γ относится биологическое тестирование путем титрования сыворотки пациента с ИФН-содержащим препаратом на газоне культуры клеток с последующей обработкой тест-вирусом и исследования эффектов цитопатических свойств патогена [10]. Практическое применение данного метода основано на владении основами техники культивирования клеток эукариот и вирусологических исследований.
Из уровня техники известны патенты с описанием лечебного эффекта ИФН-НАТ при системных заболеваниях аутоимунной природы.
Патент RU 2431638 «Моноклональные антитела против интерферона-альфа» описывает разработку фармакологического препарата HAT, которые избирательно нейтрализуют биоактивность по крайней мере двух подтипов белка интерферона-альфа (ИФНα). Антитела согласно изобретению эффективны для выявления подтипов ИФНα в образце или ткани и/или для терапевтического применения, включающего в себя лечение и/или улучшение состояния при связанных с ИФНα заболеваниях, таких как системная красная волчанка, диабет типа I, псориаз, СПИД и реакция "трансплантат против хозяина".
Аналогичное по направлению применения и способу реализации изобретение описано в патенте RU 2314317 «АНТИТЕЛА ПРОТИВ ИНТЕРФЕРОНА-АЛЬФА». Использование изобретения позволяет одновременно подавлять биологическую активность, по крайней мере, семи подтипов ИФНα человека, а именно ИФНα1, ИФНα2, ИФНα4, ИФНα5, ИФНα8, ИФНα10, ИФНα21, что может найти применение в диагностике и терапии различных заболеваний человека, опосредуемых ИФНα, таких как инсулинозависимый сахарный диабет или системная красная волчанка.
Наиболее близкий к заявленному способу определения ИФНβ-НАТ с использованием постоянной линии клеток фибросаркомы трансфецированных репортерной системой активности ИФНβ основан на измерении индуцированной экспрессии гена люциферазы и требует наличия специальных реактивов и оборудования [Lallemand С, Meritet J.F., Erickson R., et al., Quantification of neutralizing antibodies to human type I interferons using division-arrested frozen cells carrying an interferon-regulated reporter-gene, J. Interferon Cytokine Res., V. 28, N 6, 393-404, 2008].
Несмотря на возрастающую актуальность проблемы, в доступной базе данных отсутствуют патенты, связанные с описанием системам обнаружения HAT против лекарственных субстанций, обладающих потенциальной иммуногенностью.
Задача изобретения: своевременное выявление и количественное определение интерферон-нейтрализующих антител (ИФН-НАТ).
Технический результат изобретения: обеспечивается качественное и количественное определения ИНФβ нейтрализующих антител, основанное на оценке индуцированного тест-вирусом цитопатического эффекта в отношении чувствительных культур прикрепляемых клеток фибробластов легкого эмбриона человека (ФЛЭЧ) и бессывороточной линии клеток эпителия почечных канальцев зеленой мартышки (Vero-SF).
Указанный технический результат достигается за счет того, что заявлен способ определения нейтрализующих антител (HAT) в сыворотке крови больных рассеянным склерозом, леченных препаратами интерферона-бета (ИФНβ), характеризующийся применением цитопатического теста с использованием чувствительной к вирусу энцсфаломиокардита мышей (ЕМС) культуры клеток фибробластов легкого эмбриона человека (ФЛЭЧ), причем определение HAT к препарату ИФНβ проводят при помощи реакции нейтрализации антивирусной активности методом титрования сыворотки рефрактерного к лечению соответствующим препаратом пациента, определением HAT к препарату ИФНβ путем культивирования клеток ФЛЭЧ в условиях 37±2°С в атмосфере CO2 5,0±0,5% и 90±5% влажности в среде DMEM с 10% эмбриональной телячьей сыворотки (ЭТС) в течение 1 суток в ячейках плоскодонного 96-луночного планшета в количестве 20-50 тыс.кл./яч., а в день постановки теста разводят контрольную ЭТС и испытуемую сыворотку пациента в 10 или в 20 раз; затем в ячейках круглодонного планшета готовят по 100 мкл разведений препарата ИНФβ в нсобогащенной сывороткой среде RPMI-1640: 2000; 1000; 500; 250; 125; 63; 31; 16; 8; 4; 2; 1; 0,5; 0,25; 0 МЕ/мл; в ячейки с двумя приготовленными разведениями препарата ИФНβ параллельно вносят по 100 мкл разведенные в 10 или 20 раз сыворотки пациента и контрольной ЭТС; инкубируют планшет 1 час в условиях СО2-инкубатора; удаляют среду из культуральных планшетов с преинкубированными клетками ФЛЭЧ и в ячейки вносят по 100 мкл приготовленных разведений препарата с сывороткой пациента; проводят инкубацию планшетов с клетками в течение 22-24 часов, далее в необогащенную сывороткой основу среды DMEM вносят вирус-индикатор ЕМС или VSV (вирус энцефаломиокардита мышей/вирус везикулярного стоматита, штамм «Индиана») в дозе, составляющей 102±0,25 ТЦД50 в 0,1 мл; проводят инкубирование в термостате 22-24 часа; через сутки оценивают цитопатическое действие вируса в зависимости от наличия нейтрализующей ИНФβ активности сыворотки пациента по формуле: HAT (НЕ/мл)=А (МЕ/мл)×Z, где: А (МЕ/мл) - максимальная нейтрализуемая активность препарата ИНФ-бета, при которой наблюдается цитодеструктивное действие вируса на монослой чувствительной культуры ФЛЭЧ, выраженная в международных единицах на 1 мл; Z - разведение сыворотки пациента.
Способ может отличаться использованием чувствительных к вирусу везикулярного стоматита (VSV) клеток бессывороточной линии Vero-SF, причем в качестве среды культивирования клеток и последующего внесения вируса используют бессывороточную среду для прикрепляемых клеток Гибрис-1-П.
Осуществление изобретения
Изобретение реализуется за счет комбинированного введения сыворотки пациентов с ИФНβ в сосуды с чувствительными к ИФН клеточными культурами и последующей обработкой тест-вирусом. Наличие HAT в сыворотке блокирует активность ИФН и способствует цитодеструктивному поражению монослоя тест-культуры клеток. Таким образом, определение HAT к препарату ИФНβ связано с реакцией нейтрализации индуцируемой антивирусной активности методом биологического титрования с сывороткой рефрактерного к лечению соответствующим препаратом пациента. В целом заявленный способ определения нейтрализующих антител (HAT) в сыворотке крови больных рассеянным склерозом, леченных препаратами интерферона-бета (ИФНβ), основан на применении цитопатического теста с использованием чувствительной к вирусу энцефаломиокардита мышей (ЕМС) культуры псеадолинии клеток фибробластов легкого эмбриона человека (ФЛЭЧ). Проведенные авторами исследования показали, что использование чувствительных к вирусу везикулярного стоматита (VSV) клеток бессывороточной линии Vero-SF демонстрирует более точные и стабильные результаты теста при определении активности HAT.
С целью проведения теста определения HAT к препарату ИФНβ получают газон клеток тест-культуры (ФЛЭЧ, Vero-SF) путем посева и инкубации в течение 1 суток в ячейках плоскодонного 96-луночного планшета 20-50 тыс.кл./яч в условиях (37±2)°С, атмосфере С02 (5,0±0,5)% и (90±5)% влажности, в среде DMEM с 10% эмбриональной телячьей сыворотки (ЭТС) для клеток ФЛЭЧ или Гибрис-1-П для клеток Vero-SF. В день постановки теста разводят контрольную (эмбриональную телячью - ЭТС) и испытуемую сыворотку пациента в 10 или в 20 раз; затем в ячейках круглодонного планшета готовят по 100 мкл разведений препарата ИНФβ в необогащенной сывороткой среде RPMI-1640: 2000; 1000; 500; 250; 125; 63; 31; 16; 8; 4; 2; 1; 0,5; 0,25; 0 МЕ/мл; в ячейки с двумя приготовленными разведениями препарата ИФНβ параллельно вносят по 100 мкл разведенных в 10 или 20 раз сыворотки пациента и контрольной ЭТС; инкубируют планшет 1 час в условиях СО2-инкубатора; удаляют среду из культуральных планшетов с преинкубированными клетками ФЛЭЧ и в ячейки вносят по 100 мкл приготовленных разведений препарата с сывороткой пациента; проводят инкубацию планшетов с клетками в течение 22-24 часов. Для выявления/количественного определения ИФНβ-НАТ, в необогащенной сывороткой основе среды DMEM или бессывороточной среде Гибрис-1-П, вносят рабочую дозу тест-вируса или вируса-индикатора EMC/VSV (вирус энцефаломиокардита мышей/вирус везикулярного стоматита, штамм «Индиана»), составляющую 10(2±0,25) ТЦД50 в 0,1 мл; проводят инкубирование в термостате 22-24 ч; через сутки оценивают цитопатическое действие вируса в зависимости от наличия нейтрализующей ИНФβ активности в сыворотке пациента; при этом определяется максимальная концентрация препарата, при которой наблюдается цитодеструктивное действие вируса на монослой чувствительной культуры в соответствие со схемой, представленной в Примере 1.
Пример 1
Определение HAT к препарату ИФНβ проводят при помощи реакции нейтрализации антивирусной активности методом биологического титрования с сывороткой рефрактерного к лечению соотв. препаратом пациента, с использованием культуры клеток псевдолинии ФЛЭЧ (фибробласты легких эмбриона человека). Для этого клетки ФЛЭЧ культивируют в условиях (37±2)°С в атмосфере СО2 (5,0±0,5)% и (90±5)% влажности в среде DMEM с 10% эмбриональной телячьей сыворотки (ЭТС) течение 1 сут в ячейках плоскодонного 96-луночного планшета в количестве 20-50 тыс./яч. В день постановки теста разводят контрольную (эмбриональную телячью - ЭТС) и испытуемую сыворотку пациента в 10 или в 20 раз.
В ячейках круглодонного 96-луночного планшета готовят по 100 мкл разведений препарата ИНФβ в необогащенной сывороткой среде RPMI-1640: 2000; 1000; 500; 250; 125; 63; 31; 16; 8; 4; 2; 1; 0,5; 0,25; 0 МЕ/мл.
В ячейки с двумя приготовленными разведениями препарата ИФНβ параллельно вносят по 100 мкл разведенных в 10 или 20 раз сыворотки пациента и контрольной ЭТС. Инкубируют планшет 1 час в условиях СО2-инкубатора. Удаляют среду из культуральных планшетов с преинкубированными клетками ФЛЭЧ и в ячейки вносят по 100 мкл приготовленных разведений препарата с сывороткой пациента. Проводят инкубацию планшетов с клетками в течение 22-24 часов.
Для выявления/количественного определения ИФНβ-НАТ, в необогащенной сывороткой основе среды DMEM вносится рабочая доза тест-вируса или вируса-индикатора EMC/VSV (вирус энцефаломиокардита мышей/вирус везикулярного стоматита, штамм «Индиана»), составляющая 10(2±0,25) ТЦД50 в 0,1 мл. Проводится инкубирование в термостате 22-24 ч. Через сутки оценивают цитопатическое действие вируса в зависимости от наличия нейтрализующей ИНФβ активности в сыворотке пациента. При этом определяется максимальная концентрация препарата, при которой наблюдается цитодеструктивное действие вируса на монослой чувствительной культуры ФЛЭЧ.
Общая схема титрования препарата ИФНβ с исследуемой сывороткой крови пациента представлена в Табл. 1.
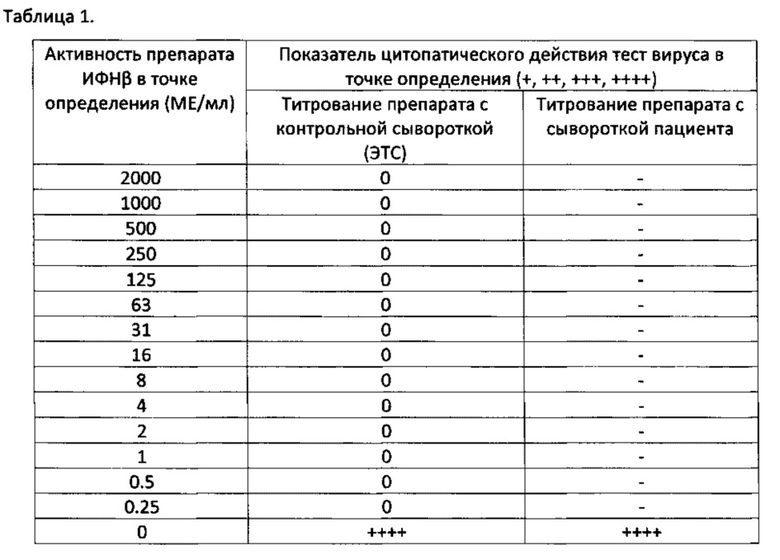
Активность нейтрализующих антител в сыворотке пациента выражается ее нейтрализующей активностью (НА), выраженной в нейтрализующих единицах:
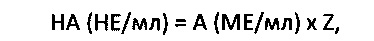
где А (МЕ/мл) - максимальная нейтрализуемая активность препарата ИНФ-бета, выраженная в международных единицах на 1 мл; Z - разведение сыворотки пациента (10 или 20-кратное).
Пример 2
Отличается использованием адаптированной бессывороточной линии клеток Vero-SF (ООО НПП «ПанЭко»). Поддержание линии и все манипуляции при исследовании проводят в специальной бессывороточной среде для прикрепляемых клеток «Гибрис-1-П» (ООО НПП «ПанЭко»). Использование постоянной линии Vero-SF позволяет максимально стандартизовать метод «цитопатического теста» в условиях контролируемого роста клеток в бессывороточной среде, а также отсутствия дополнительных интерферирующих и связывающих сывороточных субстанций ксеногенного происхождения. Наиболее близкий к заявленному способу определения ИНФ-бета-НАТ с использованием постоянной линии клеток фибросаркомы трансфецированных репортерной системой активности ИНФ-бета основан на измерении индуцированной экспрессии гена люциферазы и требует наличия специальных реактивов и оборудования [11].
В качестве тест-вируса для заражения клеток Vero-SF в бессывороточной среде «Гибрис-1-П» эффективен вирус везикулярного стоматита VSV (штамм «Индиана»).
Все манипуляции по нейтрализации препарата ИФНβ, индукции противовирусной резистентности клеток, инфекции тест-вирусом, учета результатов исследования проводят аналогично описанным в Примере 1.
Пример 3
Проводили исследование статуса ИФНβ-НАТ в сыворотке крови 28 больных PC, получавших длительное лечение препаратами ИНФ-бета.
У всех пациентов был поставлен диагноз PC, согласно обновленным критериям W.J. MacDonald в модификации 2010 г., (ремиттирующее течение у 23 пациентов, вторично-прогредиентное течение (ВПТ), у 5 в стадии неполной ремиссии заболевания. Все пациенты проходили лечение в неврологическом отделении Моники.
Результаты объективного неврологического обследования оценивались по общепринятой шкале клинической оценки функционального состояния проводящих систем при этом заболевании, предложенной J.Kurtzke, и шкале инвалидизации EDSS (Expanded Disability Status Scale). Пациенты: женщины n=16, мужчины n=12, с продолжительностью болезни 7,63±4,87 лет, легкой и в основном средней степени тяжести ремиттирующего течения (EDSS в ремиссии в среднем составила 2,96±1,14 баллов); тяжелой степени при ВПТ (EDSS 6,2±0,27 баллов).
Пациенты получали препараты рекомбинантного ИФНβ-1b в дозе 8-9 млн ME. Все пациенты были разделены на 3 группы в зависимости от продолжительности приема препарата: 1 группа - 0.5-1 год; 2 группа - 1-2 года; 3 группа - более 2 лет.
Проведено определение содержания HAT в сыворотках пациентов по результатам реакции нейтрализации антивирусной активности препарата ИФНβ методом цитопатического теста. Оценку анти-ИФНβ нейтрализующей активности (НА) в сыворотках пациентов проводили параллельно на клеточных культурах ФЛЭЧ и Vero-SF и измеряли в нейтрализующих единицах (НЕ/мл) (см. Пример 1). Результаты определения статуса ИНФβ-НАТ у пациентов всех 3 групп представлены в Табл. 2.
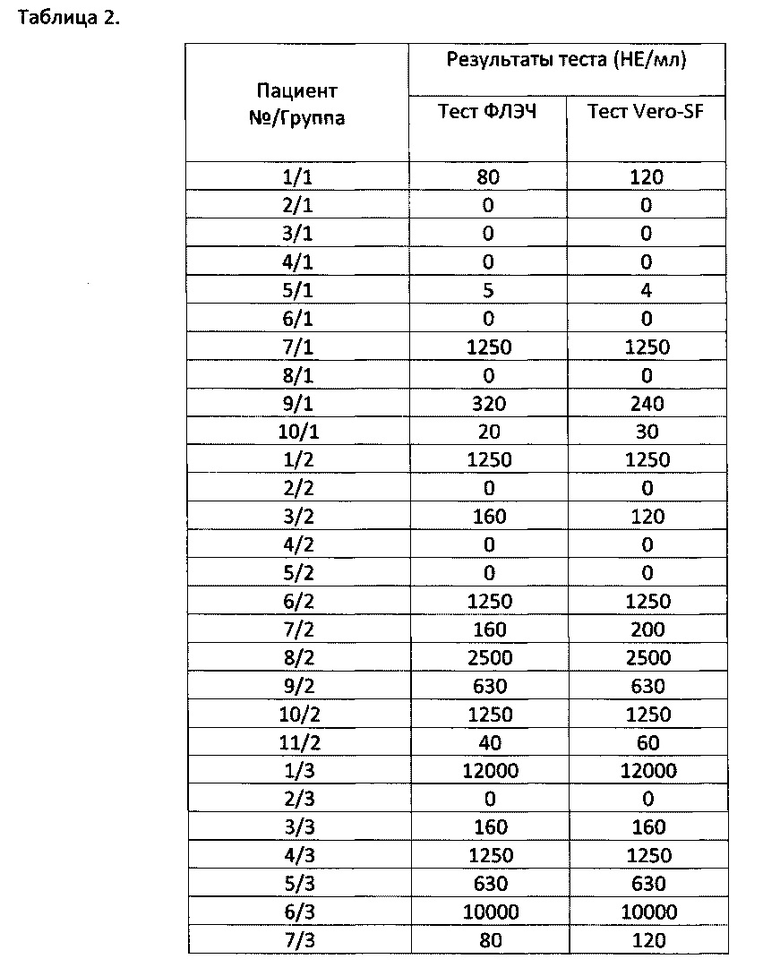
Данные нашего исследования показывают, что вероятность образования специфических HAT и их содержание в сыворотке периферической крови пациентов увеличивается в течение более длительного применения ИФНβ препаратов. В связи с этим определение статуса ИФНβ-НАТ является важным критерием оценки эффективности ИФН-терапии при PC.
С точки зрения патентной ценности в рамках заявки на изобретение, полученные результаты демонстрируют высокую сходимость результатов цитопатического теста для систем тестирования использующих диплоидные клетки ФЛЭЧ и бессывороточную культуру постоянной клеточной линии Vero-SF. Отмечено, что использование бессывороточной системы тестирования обеспечивает более высокие показатели нейтрализующей активности сыворотки пациентов при низких титрах лекарственного препарата ИФНβ. Это, очевидно, связано с увеличенным временем репликации вируса в клетках бессывороточной культуры Vero-SF. Вместе с тем линия клеток приматов Vero-SF является наиболее удобным инструментом вследствие неограниченной способности к пассированию в контролируемых условиях бессывороточного культивирования.
Источники информации
1. Б.И. Бурсагова, и др., Проблема нейтрализующих антител в терапии рассеянного склероза, Педиатрическая фармакология, т. 8, №5, 61-64, 2011.
2. Шмидт Т.Е., Яхно Н.Н. Рассеянный склероз: руководство для врачей. 2-е изд. - М.: МЕДпресс-информ, 2010. - 272 с.
3. Damal К., Stoker Е., Foley J.F. Optimizing therapeutics in the management of patients with multiple sclerosis: a review of drug efficacy, dosing, and mechanisms of action. Biologies, V. 7, 247-258, 2013.
4. Sorensen P.S. Neutralizing antibodies against interferon-beta, Ther. Adv. Neurol. Disord. - 2008; 1: 62-78.
5. Noronha A., Neutralizing antibodies to interferon, Neurology, V. 68, N 12, 16-22, 2007.
6. Bertolotto A., Capobianco M, Amato MP, et al., Guidelines on the clinical use for the detection of neutralizing antibodies (NAbs) to IFN beta in multiple sclerosis therapy: report from the Italian Multiple Sclerosis Study group, Neurol. Sci., V. 35, N 2, 307-16, 2014.
7. Hesse D., Sorensen P. S. Using measurements of neutralizing antibodies: the challenge of IFN-beta therapy, Eur. J. Neurol., V. 14, 850-859, 2007.
8. Hesse D., Sellebjerg F., Sorensen P.S. Absence of MxA induction by interferon beta in patients with MS reflects complete loss of bioavailability, Neurology, V. 73, 372-377, 2009.
9. Farrell, R., Espasandin, M., Lakdawala, et al., Incorporation of an interferon-beta neutralizing antibody assay into routine clinical practice. Mult. Scler., V. 17, 1333-1340, 2011.
10. Massart C, Gibassier J., Oger J., et al., Neutralizing antibodies to interferon beta in multiple sclerosis: analytical evaluation for validation of a cytopathic effect assay. Clin. Chim. Acta, V. 377, 185-191, 2006.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ ПРОДУКЦИИ ИНТЕРФЕРОНОВ КАК ПАРАМЕТРОВ ВРОЖДЕННОГО ИММУНИТЕТА | 2017 |
|
RU2657808C1 |
| Штаммы гибридных клеток животных Mus. Musculus - продуценты моноклональных антител к белку GP вируса Эбола (subtype Zaire) и моноклональные антитела к белку GP вируса Эбола (subtype Zaire) | 2017 |
|
RU2686630C1 |
| Способ получения антигена вируса Зика, обладающего иммуногенными и антигенными свойствами | 2019 |
|
RU2717993C1 |
| Рекомбинантный штамм вируса гриппа A/PR8-NS124-Luc и способ оценки поствакцинальных нейтрализующих антител с использованием биолюминесцентной детекции | 2019 |
|
RU2759054C2 |
| ПРОИЗВОДНОЕ ИНДОЛ-3-КАРБОНОВОЙ КИСЛОТЫ, ОБЛАДАЮЩЕЕ ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ SARS-COV-2 | 2022 |
|
RU2820633C1 |
| Штамм гибридных клеток животных Mus musculus 2E1B5 - продуцент моноклонального антитела к рецептор-связывающему домену белка S вируса SARS-CoV-2 | 2021 |
|
RU2771288C1 |
| ПОЛУЧЕНИЕ ВОДОРАСТВОРИМОГО СОЕДИНЕНИЯ ДИГИДРОХЛОРИДА 6-БРОМ-1-МЕТИЛ-5-МЕТОКСИ-2-(1-ПИПЕРИДИНОМЕТИЛ)-3-(2-ДИЭТИЛАМИНОЭТОКСИ) КАРБОНИЛИНДОЛА | 2024 |
|
RU2835077C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ НЕЙТРАЛИЗУЮЩИХ АНТИТЕЛ К SARS-CoV-2 В СЫВОРОТКЕ ИЛИ ПЛАЗМЕ КРОВИ ЛЮДЕЙ, ПЕРЕНЕСШИХ COVID-19 ИЛИ ПРИВИТЫХ ВАКЦИНАМИ ДЛЯ ПРОФИЛАКТИКИ НОВОЙ КОРОНАВИРУСНОЙ ИНФЕКЦИИ COVID-19, С ИСПОЛЬЗОВАНИЕМ НАБОРА РЕАГЕНТОВ ДЛЯ ИММУНОФЕРМЕНТНОГО АНАЛИЗА, СОДЕРЖАЩЕГО РЕКОМБИНАНТНЫЙ РЕЦЕПТОР-СВЯЗЫВАЮЩИЙ ДОМЕН (RBD) ПОВЕРХНОСТНОГО ГЛИКОПРОТЕИНА S КОРОНАВИРУСА SARS-COV-2 И РЕКОМБИНАНТНЫЙ ЧЕЛОВЕЧЕСКИЙ РЕЦЕПТОР АСЕ2 | 2021 |
|
RU2784655C1 |
| Вирусоподобные химерные частицы для индукции специфического иммунитета против вируса тяжелого острого респираторного синдрома SARS-CoV-2, содержащие белки коронавируса и ротавируса | 2022 |
|
RU2779810C1 |
| СПОСОБ РЕПЛИКАЦИИ ВИРУСА ГРИППА В КУЛЬТУРЕ | 2007 |
|
RU2491339C2 |
Изобретение относится к медицине, а именно к иммунологии, и может быть использовано для определения нейтрализующих антител (HAT) в сыворотке крови больных рассеянным склерозом, леченных препаратами интерферона-бета (ИФНβ). Для этого применяют цитопатический тест с использованием чувствительной к вирусу энцсфаломиокардита мышей (ЕМС) культуры клеток фибробластов легкого эмбриона человека (ФЛЭЧ). Определение HAT к препарату ИФНβ проводят при помощи реакции нейтрализации антивирусной активности методом титрования сыворотки рефрактерного к лечению соответствующим препаратом пациента, определением HAT к препарату ИФНβ. Проводят культивирование клеток ФЛЭЧ в условиях 37±2°С в атмосфере CO2 5,0±0,5% и 90±5% влажности в среде DMEM с 10% эмбриональной телячьей сыворотки (ЭТС) в течение 1 суток в ячейках плоскодонного 96-луночного планшета в количестве 20-50 тыс.кл./яч. В день постановки теста разводят контрольную ЭТС и испытуемую сыворотку пациента в 10 или в 20 раз. Затем в ячейках круглодонного планшета готовят по 100 мкл разведений препарата ИНФβ в нсобогащенной сывороткой среде RPMI-1640: 2000; 1000; 500; 250; 125; 63; 31; 16; 8; 4; 2; 1; 0,5; 0,25; 0 МЕ/мл; в ячейки с двумя приготовленными разведениями препарата ИФНβ параллельно вносят по 100 мкл разведенные в 10 или 20 раз сыворотки пациента и контрольной ЭТС. Инкубируют планшет 1 час в условиях CO2-инкубатора. Далее удаляют среду из культуральных планшетов с преинкубированными клетками ФЛЭЧ и в ячейки вносят по 100 мкл приготовленных разведений препарата с сывороткой пациента. Проводят инкубацию планшетов с клетками в течение 22-24 часов, далее в необогащенную сывороткой основу среды DMEM вносят вирус-индикатор ЕМС или VSV (вирус энцефаломиокардита мышей/вирус везикулярного стоматита, штамм «Индиана») в дозе составляющей 102±0,25 ТЦД50 в 0,1 мл. Проводят инкубирование в термостате 22-24 часа. Через сутки оценивают цитопатическое действие вируса в зависимости от наличия нейтрализующей ИНФβ активности сыворотки пациента по формуле: HAT (НЕ/мл)=А (МЕ/мл)×Z, где А (МЕ/мл) - максимальная нейтрализуемая активность препарата ИНФ-бета, при которой наблюдается цитодеструктивное действие вируса на монослой чувствительной культуры ФЛЭЧ, выраженная в международных единицах на 1 мл; Z - разведение сыворотки пациента. Использование данного способа позволяет оценку эффективности лечения препаратами у пациентов, в течение длительного времени подвергавшихся лечению препаратами ИФНβ путем количественного определения ИНФβ нейтрализующих антител. 1 з.п. ф-лы, 3 пр., 2 табл.
1. Способ определения нейтрализующих антител (HAT) в сыворотке крови больных рассеянным склерозом, леченных препаратами интерферона-бета (ИФНβ), характеризующийся применением цитопатического теста с использованием чувствительной к вирусу энцсфаломиокардита мышей (ЕМС) культуры клеток фибробластов легкого эмбриона человека (ФЛЭЧ), причем определение HAT к препарату ИФНβ проводят при помощи реакции нейтрализации антивирусной активности методом титрования сыворотки рефрактерного к лечению соответствующим препаратом пациента, определением HAT к препарату ИФНβ путем культивирования клеток ФЛЭЧ в условиях 37±2°С в атмосфере CO2 5,0±0,5% и 90±5% влажности в среде DMEM с 10% эмбриональной телячьей сыворотки (ЭТС) в течение 1 суток в ячейках плоскодонного 96-луночного планшета в количестве 20-50 тыс.кл./яч., а в день постановки теста разводят контрольную ЭТС и испытуемую сыворотку пациента в 10 или в 20 раз; затем в ячейках круглодонного планшета готовят по 100 мкл разведений препарата ИНФβ в нсобогащенной сывороткой среде RPMI-1640: 2000; 1000; 500; 250; 125; 63; 31; 16; 8; 4; 2; 1; 0,5; 0,25; 0 МЕ/мл; в ячейки с двумя приготовленными разведениями препарата ИФНβ параллельно вносят по 100 мкл разведенные в 10 или 20 раз сыворотки пациента и контрольной ЭТС; инкубируют планшет 1 час в условиях CO2-инкубатора; удаляют среду из культуральных планшетов с преинкубированными клетками ФЛЭЧ и в ячейки вносят по 100 мкл приготовленных разведений препарата с сывороткой пациента; проводят инкубацию планшетов с клетками в течение 22-24 часов, далее в необогащенную сывороткой основу среды DMEM вносят вирус-индикатор ЕМС или VSV (вирус энцефаломиокардита мышей/вирус везикулярного стоматита, штамм «Индиана») в дозе, составляющей 102±0,25 ТЦД50 в 0,1 мл; проводят инкубирование в термостате 22-24 часа; через сутки оценивают цитопатическое действие вируса в зависимости от наличия нейтрализующей ИНФβ активности сыворотки пациента по формуле HAT (НЕ/мл)=А (МЕ/мл)×Z, где А (МЕ/мл) - максимальная нейтрализуемая активность препарата ИНФ-бета, при которой наблюдается цитодеструктивное действие вируса на монослой чувствительной культуры ФЛЭЧ, выраженная в международных единицах на 1 мл; Z - разведение сыворотки пациента.
2. Способ по п. 1 отличающийся использованием чувствительных к вирусу везикулярного стоматита (VSV) клеток бессывороточной линии Vero-SF, причем в качестве среды культивирования клеток и последующего внесения вируса используют бессывороточную среду для прикрепляемых клеток Гибрис-1-П.
| WO 2005017529 A1, 24.02.2005 | |||
| СПОСОБ ДИАГНОСТИКИ РАССЕЯННОГО СКЛЕРОЗА | 2003 |
|
RU2369874C2 |
| БУРГАСОВА Б.И | |||
| и др | |||
| Проблема нейтрализующих антител в терапии рассянного склероза // Педиатрическая фармакология, 2011, том 8, N5, стр.61-54 | |||
| LALLEMAND С | |||
| et al | |||
| Quantification of neutralizing antibodies to human type I interferons using division-arrested frozen cells carrying an interferon-regulated reporter-gene // J | |||
| Interferon Cytokine Res., 2008, V | |||
| Видоизменение прибора с двумя приемами для рассматривания проекционные увеличенных и удаленных от зрителя стереограмм | 1919 |
|
SU28A1 |
Авторы
Даты
2017-08-02—Публикация
2016-03-02—Подача