Область техники
Группа изобретений относится к области биотехнологии и генной инженерии, в частности к технологии получения вирусоподобных химерных частиц. Частицы содержат капсидные гены ротавируса (VP2 и VP6), а также S белок коронавируса разных штаммов (Уханьского, Британского, Южно-Африканского, Индийского, Омикрона), синтезированных в бакуловирусной системе экспрессии и собранных в вирусоподобные частицы (VLP). Предложенные вирусоподобные химерные частицы могут применяться для индукции специфического иммунитета против вируса тяжелого острого респираторного синдрома SARS-CoV-2.
Уровень техники
Актуальность разработки антивирусных препаратов или вакцин для профилактики COVID-2019 не вызывает сомнений. Появление нового коронавируса SARS-CoV-2 с высоким эпидемическим потенциалом вызвало глобальную пандемию коронавирусной инфекции COVID-19. Вспышка данного заболевания впервые была зафиксирована в Ухане (Китай), в декабре 2019 года. 30 января 2020 года Всемирная организация здравоохранения объявила эту вспышку чрезвычайной ситуацией в области общественного здравоохранения, имеющей международное значение, а 11 марта — пандемией. В настоящее время COVID-19 зарегистрирован в 188 странах мира, при этом заболели более 36 миллионов человек, и больше миллиона умерло. В России общее количество зараженных SARS-CoV-2 достигло более миллиона человек. Вирус SARS-CoV-2 относится к семейству Coronaviridae роду Betacoronavirus.
Разработка профилактических препаратов имеет первостепенное значение. В мире на разных стадиях разработки находится более 170 вариантов вакцины, в России зарегистрированы 4 вакцины. Несмотря на то что разработан ряд вакцин, при создании профилактических препаратов для профилактики COVID-19, разработка нескольких платформ (технологий, используемых в производстве вакцины) для создания эффективных и безопасных вакцин просто необходима.
Одной из таких технологий является создание рекомбинантных вакцин на основе вирусоподобных частиц или viruslikeparticle (ВПЧ или VLP). Вирусоподобные частицы или viruslikeparticle (ВПЧ или VLP) представляют собой структуры размером порядка 100-150 нм, которые являются результатом самосборки вирусных белков без нуклеиновой кислоты генома внутри.
VLP содержат большое количество повторяющихся фрагментов вирусных поверхностных и/или коровых белков, представляющих собой конформационные вирусные эпитопы, которые могут вызывать Т-клеточный и В-клеточный иммунный ответы. При иммунизации VLP стимулируют дендритные клетки, которые захватывают соответствующие антигены для презентации T- и В-лимфоцитам [Roy P., Noad R. Virus-likeparticlesas a vaccinedeliverysystem. Mythsandfacts. Hum. Vaccines. 2008; 4 (1): 5–8.]. Поскольку VLP не могут реплицироваться, они обеспечивают более безопасную альтернативу живым вакцинам на основе аттенуированных вирусов. Вирусные структурные белки могут в процессе самосборки объединяться в организованные макромолекулярные структуры (капсиды), по своему строению и морфологии схожие с аутентичными вирионами и содержащие функционально активные и иммунологически соответствующие структурные белки.
VLP могут продуцироваться в различных экспрессионных системах. Наиболее перспективными считаются VLP на основе белков, полученных в бакуловирусной системе экспрессии. Эта системы дают высокие уровни экспрессии рекомбинантных белков и позволяют организовать последующее крупномасштабное производство вакцины. VLP, продуцируемые в клетках насекомых, считаются более безопасными, чем другие системы экспрессии, поскольку бакуловирусы обнаруживаются в овощах и не способны реплицироваться в клетках млекопитающих. Кроме того, клетки насекомых можно адаптировать для роста в бессывороточной, не содержащей животных продуктах, среде, могут быть идентифицированы с помощью анализа кариотипа и изофермента, свободны от загрязняющих микроорганизмов, случайных агентов, ретровирусов и, как было показано, не являются онкогенными. Считается, что данная технология безопасна и используется для широкомасштабного производства VLP[Rong R, Progressinvaccinedevelopmentbasedonbaculovirusexpressionvectorsystem PMID: 31001944 DOI: 10.13345/j.cjb.180301].
В данный момент на стадии доклинических и клинических исследований находятся несколько вакцин от коронавируса, основанных на бакуловирусной системе экспрессии [M. GALDIEROetal. SARS-CoV-2 vaccine development: where are we? European Review for Medical and Pharmacological Sciences 2021; 25: 2752-2784, Table VI. SARS-CoV-2 virus-like particles candidate vaccines under development.]:
1. NVX-CoV2373 (Novavax);
2. Кандидатная вакцина от Sanofi и GSK;
3. Рекомбинантная вакцина против SARS-CoV-2 (клетка Sf9) (Западно-Китайская больница Сычуаньского университета);
4. Белок RBD + адъювант FAR Сквален (FarmacológicosVeterinarios SAC (FARVET SAC)/Universidad Peruana Cayetano Heredia (UPCH)).
Представленные выше вакцины являются субъединичными вакцинами на основе рекомбинантного S белка коронавируса, полученного в бакуловирусной системе экспрессии. Недостатком рекомбинантных субъединичных вакцин, как и традиционных субъединичных вакцин, являются то, что презентация антигена может отличаться от природного вируса и будут вырабатываться антитела, не способные эффективно нейтрализовать патоген. Решением указанного недостатка может быть получение антигенов в виде вирусоподобной частицы, которая имитирует природный вирион и презентация антигена также близка к таковой у вирусной частицы.
Наиболее близким аналогом заявленного изобретения является документ (EP 1261629 B1, опубл. 02.11.2006), в котором раскрывается техническое решение, относящиеся к рекомбинантному бакуловирусу, содержащему экспрессирующие белки VP2, VP6, VP7 и/или VP4 ротовируса, а также содержащему капсидный ген MS2. Также в материалах патента раскрыто получение вирусоподобных частиц на основе бакуловируса. Недостатком данного технического решения является то, что данная конструкция содержит поверхностные антигены ротавируса (VP7 и/или VP4) и не содержит белков S коронавируса, следовательно не вызывает образование антител против поверхностных белков коронавируса, которые и позволяют сформировать специфический иммунный ответ.
Таким образом, существует потребность в создании VLP, сформированных нуклеокапсидом ротавируса (белки VP2, VP6) и поверхностными S белками коронавируса, позволяющими эффективно формировать специфический иммунитет.
Раскрытие сущности изобретения
Технической задачей изобретения является разработка вирусоподобных химерных частиц, состоящих из S белков коронавируса SARS-CoV-2 с универсальным набором поверхностных антигенов,а также из капсидных генов ротавируса VP2 и VP6,которые способны самособираться в частицу, имитирующие вирион коронавируса и вызывать специфический иммунный ответ против вируса тяжелого острого респираторного синдрома SARS-CoV-2.
Технический результат заключается в получении устойчивых вирусоподобных частиц, содержащих капсидные гены ротавируса VP2 и VP6 и актуальные антигены SARS-CoV-2, которые способны самособираться в клетках насекомых, имитирующие химерный вирион (капсидротавируса и поверхностные антигена коронавируса), который способен индуцировать специфический иммунный ответ против вируса тяжелого острого респираторного синдрома SARS-CoV-2.
Указанный технический результат достигается за счет того, что создана вирусоподобная химерная частица для индукции специфического иммунитета против вируса тяжелого острого респираторного синдрома SARS-CoV-2, содержащая один или несколько рекомбинантных S белков различных штаммов коронавируса, имеющие нуклеотидные последовательности SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, и рекомбинантные белки ротавируса VP2 и VP6, имеющие нуклеотидные последовательности SEQ ID NO:6, SEQ ID NO:7, которые получены в бакуловирусной системе экспрессии насекомых, при этом вирусоподобная частица имитирует вирион SARS-CoV-2.
А также технический результат достигается за счет того, что разработан способ получения заявленной вирусоподобной химерной частицы для индукции специфического иммунитета против вируса тяжелого острого респираторного синдрома SARS-CoV-2, включающий: а) получение рекомбинантных бакуловирусов, содержащих гены S белков различных штаммов коронавируса, имеющие нуклеотидные последовательности SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, и гены белков ротавируса VP2 и VP6, имеющие нуклеотидные последовательности SEQ ID NO:6, SEQ ID NO:7; б) коинфекцию перевиваемой линии клеток насекомых T.ni различными сочетаниями рекомбинантных бакуловирусов; в) получение вирусоподобных химерных частиц и их очистку.
Краткое описание чертежей
На фиг. 1 представлена схема получения бакуловирусных рекомбинантных вирусов.
На фиг. 2А показана проверка методом ПЦР 10 колоний на наличие вставки. На фиг. 2Б показана проверка рекомбинантных бакмид на наличие вставки. Показан электрофорез после проведения ПЦР на наличие вставки в геноме бакуловируса.
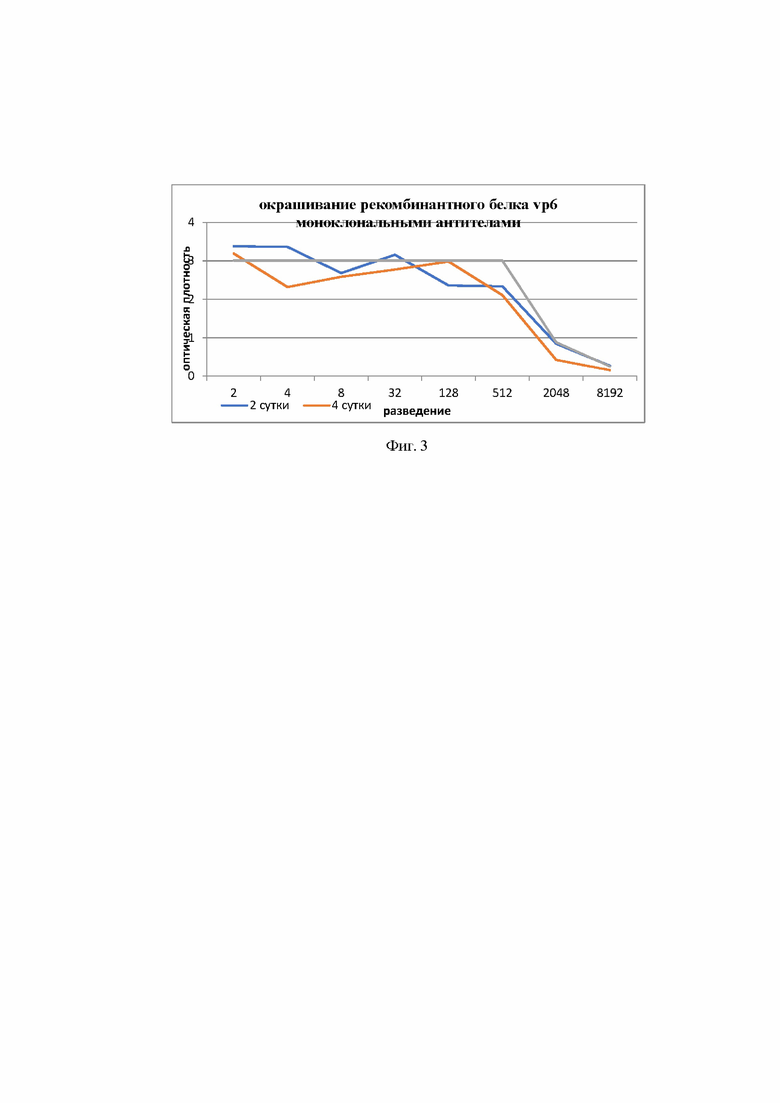
На фиг. 3 представлены результаты взаимодействия рекомбинантного белка VP6 со специфическими моноклональными антителами RG23B9С5Н11.
На фиг 4. показано определение антигенной активности рекомбинантного белка SSARS-CoV-2, штамма Дельта методом иммуноблоттинга. Вестерн-блот сыворотки «+» (А) и сыворотки «–» (Б). Слева отмечены молекулярные массы, кДа, Дорожка 1 – положительный контроль, Дорожка 2 – отрицательный контроль, Дорожка 3 – белок S в супернатанте клеток насекомых после инфицирования рекомбинантным бакуловирусом.
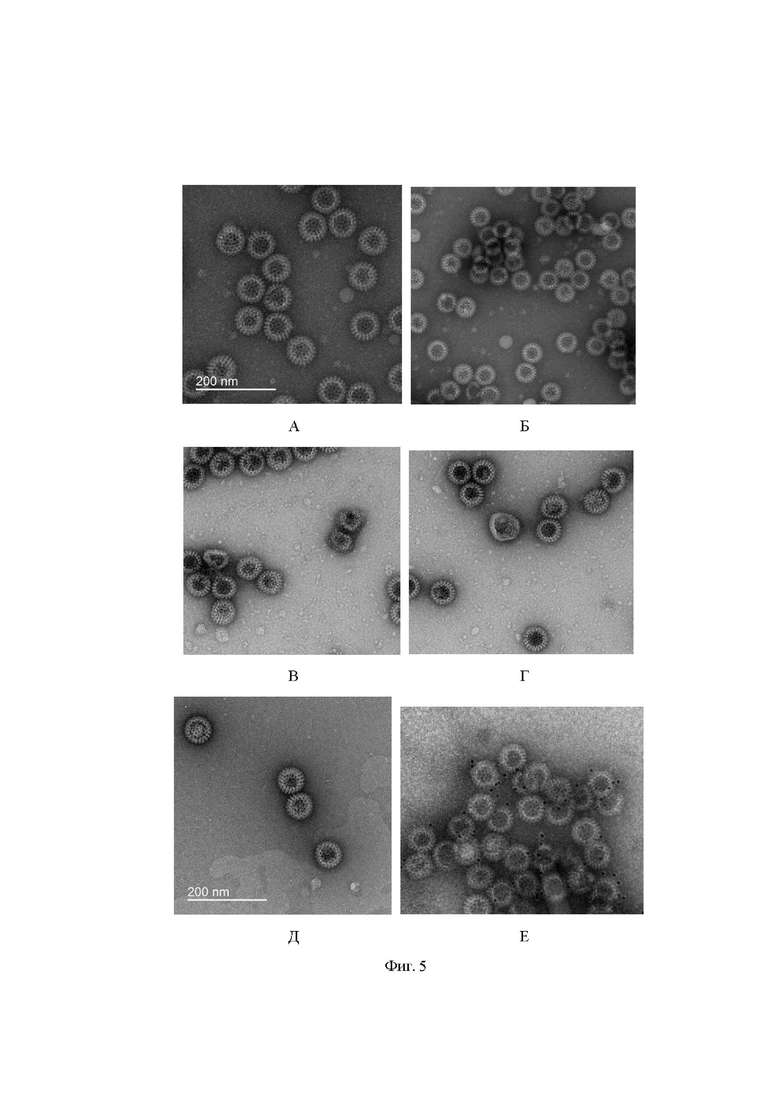
На фиг. 5 представлено изображение вирусоподобной частицы методом электронной микроскопии. А – химерная VLP, содержащая белки нуклеокапсидаротавируса VP2/VP6 и белок S коронавируса Южно-Африканского штамма, Б – химерная VLP, содержащая белки нуклеокапсидаротавируса VP2/VP6 и белок S коронавируса Английского штамма. В – химерная VLP, содержащая белки нуклеокапсидаротавируса VP2/VP6 и белок S коронавируса штамма, подобного Уханьскому. Г – химерная VLP, содержащая белки нуклеокапсидаротавируса VP2/VP6 и белок S коронавируса Индийского штамма, Д- химерная VLP, содержащая белки нуклеокапсидаротавируса VP2/VP6 и белок S коронавируса штамма Омикрон, Е - химерная VLP, содержащая белки нуклеокапсидаротавируса VP2/VP6 и 5 белков S коронавируса (штамма, подобного Уханьскому, Южно-Африканского, Английского, Индийского и Омикрон штаммов)
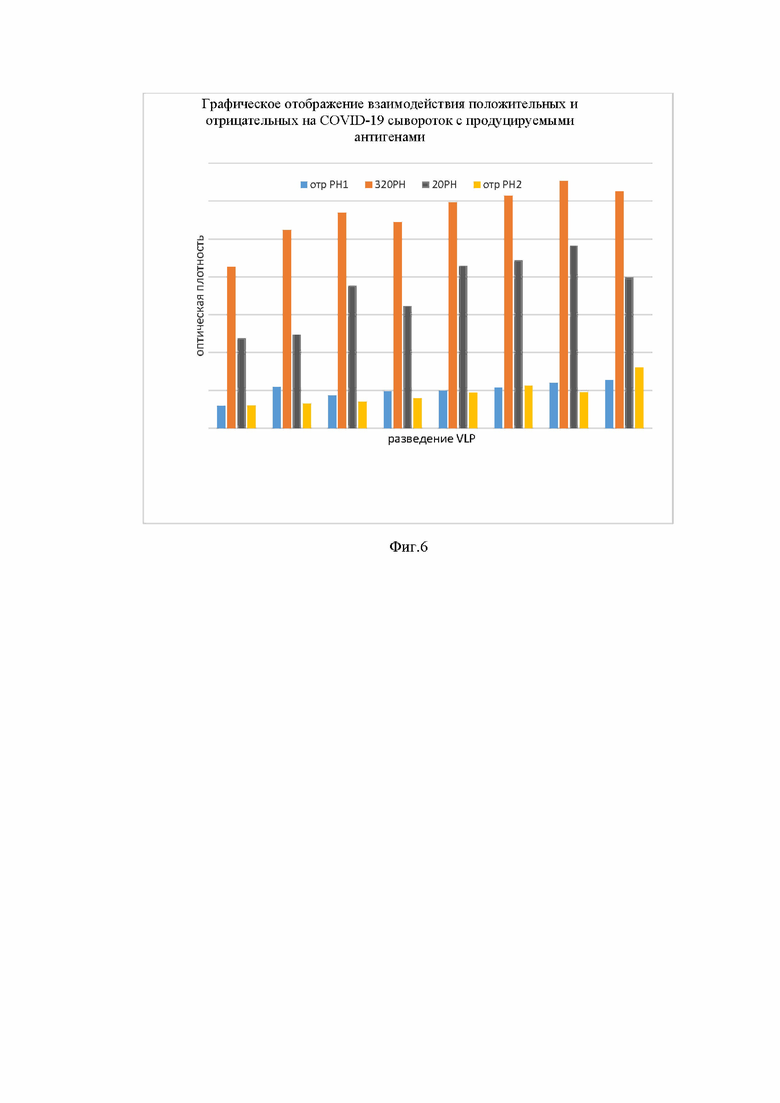
На фиг.6 представлены результаты испытания специфичности VLP (ВПЧ) в ИФА с сыворотками людей, охарактеризованных в реакции нейтрализации (РН).
Осуществление изобретения
Получение вирусоподобных частиц состоит из нескольких этапов.
На первом этапе кодирующие последовательности были получены синтетическим путем, частота использования кодонов при этом была оптимизирована для культуры клеток насекомых. В 1994 году Estes с соавторами[Crawford S.E., Labbé M., Cohen J., Burroughs M.H., Zhou Y.J., Estes M.K. Characterization of virus-like particles produced by the expression of rotavirus capsid proteins in insect cells. JVirol., 1994, 68(9):5945-52] показали, что для самосборки ВПЧ достаточно двух белков ротавируса. Мы выбрали VP2 и VP6 наиболее распространенного генотипа ротавирусов группы А (РВА) человека, циркулирующего на территории РФи восточной Европы. Последовательности S белков были также отобраны на основе молекулярно-генетического и эпидемиологического анализа.
Для получения химерных частиц были использованы следующие последовательности:
- оптимизированная последовательность гена, кодирующего S белок коронавируса (штамм, подобный Уханьскому, циркулирующий в конце 2020 г) (SEQ ID NO:1);
- оптимизированная последовательность гена, кодирующего S белок коронавируса (Индийский штамм) (SEQ ID NO:2);
- оптимизированная последовательность гена, кодирующего S белок коронавируса (Южно-Африканский штамм) (SEQ ID NO:3);
- оптимизированная последовательность гена, кодирующего S белок коронавируса (Английский штамм) (SEQ ID NO:4).
- оптимизированная последовательность гена, кодирующего S белок коронавируса (штамм Омикрон) (SEQ ID NO:5).
- оптимизированная нуклеотидная последовательность гена, кодирующего VP2 ротавируса (SEQ ID NO.6)
- оптимизированная нуклеотидная последовательность гена, кодирующего VP6 ротавируса (SEQ ID NO.7)
Следующим этапом создания вирусоподобных частиц является получение рекомбинантных белков. Для создания каждой генетической конструкции, с которой нарабатывались один или два рекомбинантных белка, мы использовали систему экспрессии Bac-to-Bac.
Пример 1. Получение рекомбинантных бакуловирусов.
Для получения бакуловируса, экспрессирующего различные белки использовали трансферный вектор (pFastBac донорную плазмиду). Схематичное получение бакуловирусных рекомбинантных вирусов представлено на фиг.1
pFastBac донорная плазмида содержит экспрессионную кассету, в которой помимо клонированных генов находится фланкирующие последовательности транспозона Tn7. Рекомбинантная трансферная плазмида используется для трансформации клеток DH10Bac E.coli, которые содержат модифицированный бакуловирусный геном в виде большой плазмиды (бакмиды) и вектор-помощник, кодирующий фермент транспозазу.
После провели клонирование ПЦР-фрагмента в плазмиду pFastBacDual (Invitrogen), после этого повторно выделили ДНК с использованием SilicaBeadDNAGelExtraction. Далее компетентные клетки TopTen трансформировали методом электропорации: 1мкл лигазной смеси, инкубировали смесь при 37°С в течение 45 минут. После инкубации высевали лигазную смесь на чашки, инкубировали ночь при 37°С. Утром 10 произвольных колоний пересевали штрихом на новую чашку и брали их же для ПЦР анализа (фиг. 2А).
Для наращивания плазмиды выбирали два клона, ставили ночную культуру при 37°С. Выделяли плазмиду набором GeneJetPlasmidMiniprepkit (ThermoFischer). Трансформировали компетентные клетки DH10Bac. Затем культуру высевали на чашки и инкубировали 48 часов при 37°С. Выросшие белые колонии повторно пересевали на чашку и параллельно ставили ПЦР(фиг. 2Б).
Для дальнейшей работы отбирали клоны, из которых выделили бакмиды. Выделенные рекомбинантные бакмиды смешивают с липосомным агентом Cellfectin для трансфекции клеток насекомых Sf-9 или Sf-21. Проникшая в клетку кольцевая молекула бакмидной ДНК инфекционна и запускает жизненный цикл бакуловируса в клетке. Таким образом, получаются рекомбинантные бакуловирусы.
Трансфекцию перевиваемой линии клеток Spodopterafrugiperda Sf-21 проводили очищенными препаратами бакмидной ДНК, содержащей оптимизированные гены коронавируса, с использованием катионного липосомного агента Cellfectin (Invitrogen, США), для каждой конструкции использовали по два клона (посевная концентрация клеток 5×105/мл, 10 мкл бакмиды). После трансфекции проводили еще два пассажа на клетках Sf-9 или Sf-21.
Выделенные рекомбинантные бакмиды смешивают с липосомным агентом Cellfectin для трансфекции клеток насекомых Sf-9 или Sf-21. Проникшая в клетку кольцевая молекула бакмидной ДНК инфекциона и запускает жизненный цикл бакуловируса в клетке. Таким образом, получаются рекомбинантные бакуловирусы:
- Рекомбинантный бакуловирус, содержащий ген, кодирующий S белок коронавируса (штамм, подобный Уханьскому, циркулирующий в конце 2020 г.);
- Рекомбинантный бакуловирус, содержащий ген, кодирующий S белок коронавируса (Индийский штамм);
- Рекомбинантный бакуловирус, содержащий ген, кодирующий S белок коронавируса (Южно-Африканский штамм);
- Рекомбинантный бакуловирус, содержащий ген, кодирующий S белок коронавируса (Английский штамм);
- Рекомбинантный бакуловирус, содержащий ген, кодирующий S белок коронавируса (штамм Омикрон);
- Рекомбинантный бакуловирус, содержащий ген, кодирующий белки VP2 и VP6 ротавируса.
Рекомбинантные бакуловирусы проверяли на способность синтезировать рекомбинантные белки ротавируса и коронавируса. Концентрацию белка в растворах определяли с использованием коммерческого набора “Micro BCA ProteinAssayKit” (Thermo, США).
Анализ структурных белков SARS-CoV-2 проводили методом электрофореза в 12% полиакриламидном геле с додецилсульфатом натрия (ПААГ-ДСН) по методу Laemmli (1970) Электрофорез проводили в пластинах полиакриламидного геля размером 70 х 100 х 0,75 на приборе Mini-PROTEAN II (Bio-Rad, США) в восстанавливающих условиях при постоянном напряжении 200 V. Разделяющий гель содержал 12% акриламида, 0,5% N,N-метилен-бис-акриламида, 0,375 М трис-HCl, pH 8,8 и 0,1% ДСН. Фокусирующий гель содержал 4% акриламида, 10% N,N-метилен-бисакриламида в 0,125 М трис-HCl буфере pH 6,8. Для полимеризации в оба геля вносили по 0,025% персульфата аммония и 0,075% TEMED. Электродный буфер содержал 0,025 М трис-HCl, 0,192 М глицина, pH 8,3 и 0,1% ДСН. Все испытуемые пробы содержали лизирующий буфер с восстановителем (0,125 М трис-HCl, pH 6,8, 5% ДСН, 0,5% β -меркаптоэтанола, 10,8% глицерина, 0,01% бромфенолового синего) и были прогреты в течение 5 минут при 100°С. Заливку геля и подготовку аппарата для электрофореза к работе проводили согласно рекомендациям изготовителя. Белки в гелях окрашивали в течение 1 часа 0,1% раствором Кумасси ярко-голубого (CBB R-350) в водном растворе, содержащем 10% уксусной кислоты и 30% метанола. Избыток красителя отмывали 10% раствором уксусной кислотой такое же время с несколькими его сменами. В качестве белков-маркеров молекулярной массы использовали β-галактозидазу - 116 кД; фосфорилазу В - 94 кД, БСА- 66 кД, овальбумин - 45 кД, карбонат ангидразу - 30 кД, ингибитор трипсина - 20,1 кД.
Клетки Vero E6, инфицированные SARS-CoV-2 (положительный контроль), клетки sf9, инфицированные бакуловирусом без вставки (отрицательный контроль) клетки sf9, инфицированные рекомбинантным бакуловирусом, содержащим в геноме вставку гена белка S Sars-CoV-2 лизировали коммерческим буфером (RIPA LysisBufferKit, SantaCrusBiotechnology) на хладагенте. 10 мкг общего белка разделяли в 12% полиакриламидном геле с применением буферной системы для SDS-электрофореза по Лэммли. Для этого использовали ячейку для электрофореза Mini-PROTEAN 3 cat. № 165-330 (Bio-Rad, США) и переносили на нитроцеллюлозную мембрану (0.45 μm; «Schleicher&Schuell», Germany) в мини ячейке MiniTrans-Blot (Bio-Rad, cat. № 170-3930). Электрофорез и блоттинг проводили согласно методике, описанной в инструкции фирмы производителя. Для контроля молекулярного веса использовали маркеры молекулярного веса фирмы ThermoScientific™ cat. № 26634. Эффективность переноса белков контролировали окрашиванием мембраны 2% раствором Ponceau S (Amresco, США) в течение 30 мин. Мембраны инкубировали с сыворотками, содержащими антитела к SARS-CoV-2 (сыворотка «+») /сыворотка переболевшего SARS-CoV-2, РН ˃1:1280/ и не содержащими антитела к SARS-CoV-2 (сыворотка «–») в разведении 1:50. Блоты инкубировали в течение 1 ч с конъюгированными с пероксидазой хрена вторичными античеловеческими антителами (1:100) и проявляли с использованием SuperSignal™ WestFemtoMaximum (ThermoScientific, США) в соответствии с протоколом производителя. Для детекции сигнала хемилюминесценции на мембране экспонировали зеленочувствительную рентгеновскую фотопленку (cat. №126041, Carestream, США). Пленку проявляли с использованием проявителя и фиксажа фирмы ВИПС-МЕД (Россия) согласно методике фирмы-производителя. На рисунке приведен пример определения наличия в супернатанте клеток насекомых белка S штамма Дельта. (фиг.4)
Таким образом, было определено, что были получены S белки коронавируса.
Для определения антигенной активности структурных белков SARS-CoV-2 использовали иммуноблоттинг.
Для оценки вирусного продукта VP6 проводили иммуноферментный анализ. Рекомбинантный белок VP6 был окрашен специфическими моноклональными антителами RG23B9С5Н11(любезно предоставлены профессором LindaSaif, OSU) (фиг.3).
Поскольку белки VP2 и VP6 были клонированы в одной кассете, то экспрессия VP6 одновременно подтверждала экспрессию VP2.
Таким образом, были получены капсидные белки ротавируса VP2 и VP6.
Для определения антигенной активности структурных белков антигена РВА использовали иммуноблоттинг (ИБ).
Таким образом, были подобраны оптимальные рекомбинантные бакуловирусы для каждой конструкции, а также длительность инкубации культуры клеток насекомых, инфицированных различными рекомбинантными бакуловирусами.
Полученные данные были использованы для проведения коинфекции, то есть одновременного заражения перевиваемой линии клеток насекомых T.ni различными сочетаниями рекомбинантных бакуловирусов.
Пример 2. Получение химерных VLP на основе рекомбинантных белков, синтезированных в бакуловирусной системе экспрессии.
VLP получали методом коинфекции, то есть одновременного заражения перевиваемой линии клеток насекомых T.ni различными сочетаниями рекомбинантных бакуловирусов. Перевиваемую культуру клеток насекомых Trichoplusiani, культивировали в течение 4 суток после заражения. Был использован 2 пассаж рекомбинантных бакуловирусов. Таким образом можно получать VLPc различными поверхностными S белками.
Были получены следующие вирусоподобные частицы (фиг.5):
1. Химерная VLP, содержащая белки нуклеокапсидаротавируса VP2 и VP6 и белок S коронавируса Южно-Африканского штамма (фиг.5А)
2. Химерная VLP, содержащая белки нуклеокапсидаротавируса VP2 и VP6 и белок S коронавируса Английского штамма (фиг.5Б)
3. Химерная VLP, содержащая белки нуклеокапсидаротавируса VP2 и VP6 и белок S коронавируса штамма, подобного Уханьскому (фиг.5В).
4. Химерная VLP, содержащая белки нуклеокапсидаротавируса VP2 и VP6 и белок S коронавируса Индийского штамма (фиг.5Г)
5. Химерная VLP, содержащая белки нуклеокапсидаротавируса VP2 и VP6 и белок S коронавируса штамма Омикрон (фиг.5Д).
6. Химерная VLP, содержащая белки нуклеокапсидаротавируса VP2 и VP6 и несколько S белков коронавируса(фиг. 5Е)
Таким образом, получены рекомбинантные химерные частицы на основе ротавирусногонуклеокапсида и поверхностного белка S коронавируса, причем из различных циркулирующих штаммов.
Пример 3. Очистка химерных VLP коронавируса.
Культуральную жидкость, содержащую вирус или вирусоподобные частицы, подвергали низкоскоростному центрифугированию, освобождаясь от клеток и клеточного дебриса при 1000 об/мин в течение 5 минут и при 6000 об/мин в течение 20 минут соответственно (+4°С, ротор Sorval® SS34). После этого супернатант использовался для выделения и очистки SARS-VLP методом ультрацентрифугирования.
Полученные осветлённые суспензии наслаивали на 6 мл 25% или 35% (w/v) сахарозы, приготовленной на буфере TNС (10 mMTris–HCl, 140 mMNaCl, 10 mM CaCl2 рН 7.4). Центрифугировали в течение 2 часов при 28 000 об/мин (центрифуга Оptima XE-100, ротор SW 32Ti, BeckmanCoulter, +4°С). Полученные осадки ресуспендировали в буфере TNС, и хранили при температуре +4°С.
Таким образом, был получен препарат, содержащий очищенные VLP.
Пример 4. Определение VLP методом электронной микроскопии
3 мкл препарата, содержащего VLP, с концентрацией 12-30 мг/мл наносили на медную сетку, покрытую углеродной подложкой (TedPella, США) и обработанную в атмосфере тлеющего разряда, инкубировали 30 секунд при комнатной температуре. Затем на сетку наносили каплю 2% раствора ацетата урана, выдерживали 30 секунд, излишки раствора удаляли с сетки фильтровальной бумагой. Окрашенные сетки хранили в пластиковых контейнерах до использования. Исследование образцов производили в просвечивающем электронном микроскопе JEOL 2100 (JEOL, Япония), оборудованном катодом из гексаборита лантана, при ускоряющем напряжении 200 кВ. Изображения получали с увеличением х25000 с помощью ПЗС-камеры Gatan X100 с размером матрицы 2000х2000 пикселей (Gatan, США). Вирусоподобные частицы, визуализированные методом электронной микроскопии, представлены на фиг.5А-5Д.
Пример 5. Определение специфичности VLP (ВПЧ) в ИФА с сыворотками людей, охарактеризованных в реакции нейтрализации (РН)
В лунки планшета сорбировали VLP в разведении от 1:2 до 1:256. Планшет инкубировали ночь при +4°С. Сыворотки крови людей, отобранные на основании РН, добавляли в лунки планшета в разведении 1:100. Каждая сыворотка (отрРН1 – отрицательная в РН, 320РН – положительная в РН (титр 1:320), 20РН - положительная в РН (титр 1: 20) и отрРН2 – сыв-ка, взятая более 20 лет назад) в отдельный ряд (стрип) с раститрованным антигеном. Наличие взаимодействующих антител в сыворотках с белками вируса SARS-CoV-2 выявляли добавлением анти-IgG-человека конъюгированных с пероксидазой хрена. Результаты представлены в таблице 1 и на фиг. 6.
Таблица 1. Результаты испытания специфичности VLP (ВПЧ) в ИФА с сыворотками людей, охарактеризованных в реакции нейтрализации (РН)
Исследование специфичности вирусоподобных частиц (VLP) показало, что полученные частицы эффективно связывают антитела в сыворотке крови людей, перенесших COVID-19. При этом наблюдается корреляция между титром в реакции нейтрализации и оптической плотностью в иммуноферментном анализе, что доказывает наличие специфически взаимодействующих антител с полученными VLP. Таким образом, подтверждается презентация антигенных детерминант в антигене, подобная той, которая наблюдается в вирионе SARS-CoV-2.
Пример 6. Индукция специфического иммунного ответа in vivo против вируса тяжелого острого респираторного синдрома SARS-CoV-2.
Полученные VLP, содержащие различные S смешивали в равных долях и использовали в препарате с общим содержанием антигена 40 мкг/доза. При этом добавляли адъювант SWE фирмы SEPPIC, составляющее 50% от общего объема дозы.
Для оценки иммуногенности в качестве моделей использовали следующие модели лабораторных животных:
сирийских хомячков (Mesocricetusauratus)[Imai M., Iwatsuki-Horimoto K., Hatta M., Loeber S., Halfmann P.J., Nakajima N., et al. Syrian hamsters as a small animal model for SARS-CoV-2 infection and countermeasure development. Proc. Natl. Acad. Sci. USA. 2020; 117(28): 16587-95. https://doi.org/10.1073/pnas.2009799117].
Также использовали крыс и кроликов, поскольку данные модели используются для проведения ряда доклинических исследований, поэтому необходимо было проверить, вызывают ли химерные VLP специфический иммунный ответ.
Определение антител к S-белку SARS-CoV-2
Уровень антител к S-белку вируса SARS-CoV-2 после иммунизации определяли методом непрямого ИФА. Для этого рекомбинантный белок RBD (иммуногенный фрагмент S-белка вируса SARS-CoV-2) сорбировали в лунках микропланшета в 0,1 М карбонатном буфере, рН=9,5 в концентрации 5 мкг/мл по 100 мкл в лунку в течение ночи при 40С. После 4-кратной отмывки планшета в лунки вносили по 100 мкл исследуемой сыворотки мыши, разведенной в фосфатно-солевом буфере (ФСБ) рН=7.5, содержащим 0.01% Твин 20 и 0.5% бычьего сывороточного альбумина (БСА). Инкубировали планшет 1 час при +37°С. После промывания планшета вносили по 0.1 мл пероксидазного конъюгата антител к IgG мыши или хомяка. Инкубировали планшет 1 час при +37°С. После промывания планшета вносили по 0.1 мл субстратного раствора с тетраметилбензидином. Инкубировали 15 мин при комнатной температуре в темноте и добавляли 0.1 мл 1 М H2SO4 для остановки реакции. Оптическую плотность при 450 нм (А450) измеряли на спектрофотометре с вертикальным лучом Multiscan ЕХ (Thermo, США). О
Определение нейтрализующих антител к SARS-CoV-2
Реакцию нейтрализации проводили микрометодом в 96-луночных планшетах (Costar, США) на перевиваемой культуре клеток Vero E6, выращенной на среде Игла с добавлением 5% эмбриональной телячьей сыворотки. Поддерживающая среда содержала 1% сыворотки. При постановке реакции нейтрализации (РН) использовали разведение КЖ, содержащее 100 ТЦИД50 в 100 мкл.
Из сывороток вакцинированных животных готовили разведения от 1:10 до 1:1280 и вносили по 100 мкл в лунки 96-луночного планшета. К разведениям сывороток добавляли по 100 мкл вируссодержащей суспензии и инкубировали смесь в течение часа при 37°С. Затем смесь переносили в 96-ти луночный планшет с монослоем клеток VeroE6. Через 72 часа реакцию учитывали, просматривая лунки планшета в микроскоп. Если в сыворотке крови есть нейтрализующие вирус антитела, вирус не будет вызывать ЦПД клеток. Титром сыворотки (последним нейтрализующим разведением) считали разведение, при котором обеспечивается 100% защита клеток (нет ЦПД). Реакцию нейтрализации с сыворотками животных проводили аналогичным образом. Первым разведением, как правило, было 1:5. Реакцию нейтрализации против штамма Дельта и Омикрон вируса SARS-CoV-2 проводили аналогичным образом.
Полученные результаты представлены в таблице 2.
Таблица 2. Результаты выявления специфических антител и нейтрализующих у сирийских хомячков, крыс и кроликов после двукратной иммунизации.
--->
<?xml version="1.0" encoding="UTF-8"?>
<!DOCTYPE ST26SequenceListing PUBLIC "-//WIPO//DTD
Sequence Listing 1.3//EN" "ST26SequenceListing_V1_3.dtd">
<ST26SequenceListing originalFreeTextLanguageCode="ru"
dtdVersion="V1_3" fileName="chimeric coronavirus
rotavirus.xml" softwareName="WIPO Sequence"
softwareVersion="2.1.1" productionDate="2022-07-15">
<ApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText></ApplicationNumberText>
<FilingDate></FilingDate>
</ApplicationIdentification>
<ApplicantFileReference>1</ApplicantFileReference>
<ApplicantName languageCode="ru">федеральное государственное
бюджетное учреждение «Национальный исследовательский центр
эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи»
Министерства здравоохранения Российской Федерации</ApplicantName>
<ApplicantNameLatin>federalnoe gosudarstvennoe biudzhetnoe
uchrezhdenie Natsionalnyi issledovatelskii tsentr epidemiologii i
mikrobiologii imeni pochetnogo akademika N F Gamalei Ministerstva
zdravookhraneniia Rossiiskoi Federatsii</ApplicantNameLatin>
<InventionTitle languageCode="ru">Вирусоподобные химерные
частицы для индукции специфического иммунитета против вируса
тяжелого острого респираторного синдрома SARS-CoV-2,
содержащие белки коронавируса и ротавируса</InventionTitle>
<SequenceTotalQuantity>7</SequenceTotalQuantity>
<SequenceData sequenceIDNumber="1">
<INSDSeq>
<INSDSeq_length>3822</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..3822</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q2">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>atgttcgttttcctcgtgctcctccccctcgtttcctcccaatgcgtcaacctc
actacccgtacccagctcccaccagcctacaccaacagcttcactcgcggtgtgtactaccccgacaaggtc
ttccgttccagcgtgctgcacagcactcaggacctgttcctgccattcttctctaacgtgacctggttccac
gccatccacgtgagcggcaccaacggcactaagcgcttcgacaaccctgtgctgcccttcaacgacggtgtc
tacttcgcttccaccgagaagtctaacatcatccgtggatggatcttcggcaccactctggactcaaagact
cagtccctgctgatcgtcaacaacgccaccaacgtggtcatcaaggtgtgcgagttccagttctgcaacgac
cctttcctgggcgtctactaccacaagaacaacaagagctggatggagtctgagttccgcgtctactcttca
gctaacaactgcactttcgagtacgtgagccagcccttcctgatggacctggaaggaaagcagggtaacttc
aagaacctgagggagttcgtgttcaagaacatcgacggatacttcaagatttactcaaagcacacccctatc
aacctggtgcgcgacctgccacagggtttctccgctctggagcctctggtggacctgcccatcggcatcaac
atcacccgcttccagactctgctggctctgcaccgttcctacctgactcctggcgactccagctctggatgg
accgccggagctgccgcttactacgtgggttacctgcaacccaggaccttcctgctgaagtacaacgaaaac
ggaaccatcacagacgctgtggactgcgctctggaccccctgagcgaaaccaagtgcactctgaagtctttc
accgtggagaagggcatctaccagactagcaacttcagggtgcagccaaccgaatctatcgtcagattcccc
aacatcactaacctgtgcccattcggagaggtcttcaacgccaccagattcgcttccgtgtacgcctggaac
aggaagagaatcagcaactgcgtcgctgactactctgtgctgtacaacagcgcctctttctcaaccttcaag
tgctacggcgtgagccctactaagctgaacgacctgtgcttcaccaacgtctacgccgactctttcgtgatc
aggggagacgaggtcagacagatcgctcccggccagactggaaagatcgccgactacaactacaagctgcca
gacgacttcaccggctgcgtcatcgcttggaactcaaacaacctggactccaaagtgggtggcaactacaac
tacctgtaccgcctgttccgtaagagcaacctgaagcctttcgagagggacatctcaactgaaatctaccag
gctggttccaccccctgcaacggtgtcgagggcttcaactgctacttcccactgcaatcttacggtttccag
cctactaacggtgtgggctaccagccctacagagtggtcgtgctgtcattcgaactgctgcacgccccagct
actgtgtgcggtcctaagaagtccaccaacctggtcaagaacaagtgcgtgaacttcaacttcaacggcctg
accggaactggtgtcctgaccgagtcaaacaagaagttcctgccattccagcagttcggaagggacatcgct
gacaccactgacgctgtgcgcgaccctcagaccctggaaatcctggacatcactccttgcagcttcggaggt
gtctctgtgatcacccctggcaccaacacttccaaccaggtcgctgtgctgtaccaggacgtcaactgcacc
gaggtgcctgtggctatccacgctgaccagctgaccccaacttggcgcgtgtactccaccggctccaacgtc
ttccagactcgtgctggttgcctgatcggcgccgagcacgtgaacaactcatacgaatgcgacatcccaatc
ggcgctggaatctgcgcctcctaccagacccagactaactcacctcgccgtgctcgctccgtcgcctcccag
agcatcatcgcttacaccatgagcctgggcgctgaaaactctgtggcctactccaacaacagcatcgccatc
ccaaccaacttcactatctcagtgaccactgagatcctgcctgtctcaatgaccaagacttccgtggactgc
actatgtacatctgcggagactcaaccgaatgctccaacctgctgctgcaatacggctccttctgcacccag
ctgaaccgtgctctgactggaatcgccgtggagcaggacaagaacactcaggaagtcttcgctcaggtgaag
caaatctacaagacccctcccatcaaggacttcggcggattcaacttctcccagatcctgcccgacccatct
aagccttcaaagcgctccttcatcgaggacctgctgttcaacaaggtcaccctggccgacgctggattcatc
aagcagtacggagactgcctgggtgacatcgccgctcgtgacctgatctgcgctcagaagttcaacggtctg
accgtgctgccacctctgctgactgacgaaatgatcgcccagtacacttcagccctgctggctggaaccatc
acttccggttggaccttcggtgctggtgctgctctgcaaatccccttcgctatgcagatggcctacaggttc
aacggaatcggtgtcacccagaacgtgctgtacgagaaccagaagctgatcgctaaccagttcaacagcgcc
atcggaaagatccaggactcactgtcatccactgcctccgctctgggcaagctgcaagacgtcgtgaaccag
aacgcccaggctctgaacaccctggtcaagcagctgtcctccaacttcggtgctatctcatccgtgctgaac
gacatcctgtctcgcctggacaaggtcgaggccgaagtgcagatcgaccgcctgatcaccggccgcctgcaa
tccctgcaaacctacgtgactcagcagctgatcagggccgctgaaatcagagcctctgctaacctggccgct
accaagatgtcagagtgcgtcctgggtcagtccaagcgtgtggacttctgcggcaagggataccacctgatg
agcttcccccagtctgctccacacggcgtcgtgttcctgcacgtcacctacgtgcctgcccaggagaagaac
ttcaccactgcccccgctatctgccacgacggcaaggctcacttcccaagggaaggtgtcttcgtgtcaaac
ggcacccactggttcgtcactcagagaaacttctacgagcctcagatcatcaccactgacaacactttcgtg
tccggaaactgcgacgtcgtgatcggtatcgtcaacaacaccgtgtacgacccactgcaacctgagctggac
agcttcaaggaggaactggacaaatacttcaagaaccacacctctcccgacgtggacctgggtgacatcagc
ggaatcaacgcttctgtcgtgaacatccagaaggagatcgaccgtctgaacgaagtggctaagaacctgaac
gaatccctgatcgacctgcaagagctgggcaagtacgaacagtacatcaagtggccttggtacatctggctg
ggtttcatcgctggcctgatcgccatcgtcatggtgaccatcatgctgtgctgcatgactagctgctgctct
tgcctgaagggctgctgctcatgcggttcctgctgcaagttcgatgaagacgattccgagcccgttctcaaa
ggagtgaagttgcattacacataa</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="2">
<INSDSeq>
<INSDSeq_length>3786</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..3786</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q3">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>tcctcccaatgcgtcaacctcactacccgtacccagctcccaccagcctacacc
aacagcttcactcgcggtgtgtactaccccgacaaggtcttccgttccagcgtgctgcacagcactcaggac
ctgttcctgccattcttctctaacgtgacctggttccacgccatccacgtgagcggcaccaacggcactaag
cgcttcgacaaccctgtgctgcccttcaacgacggtgtctacttcgcttccaccgagaagtctaacatcatc
cgtggatggatcttcggcaccactctggactcaaagactcagtccctgctgatcgtcaacaacgccaccaac
gtggtcatcaaggtgtgcgagttccagttctgcaacgaccctttcctgggcgtctactaccacaagaacaac
aagagctggatggagtctgagttccgcgtctactcttcagctaacaactgcactttcgagtacgtgagccag
cccttcctgatggacctggaaggaaagcagggtaacttcaagaacctgagggagttcgtgttcaagaacatc
gacggatacttcaagatttactcaaagcacacccctatcaacctggtgcgcgacctgccacagggtttctcc
gctctggagcctctggtggacctgcccatcggcatcaacatcacccgcttccagactctgctggctctgcac
cgttcctacctgactcctggcgactccagctctggatggaccgccggagctgccgcttactacgtgggttac
ctgcaacccaggaccttcctgctgaagtacaacgaaaacggaaccatcacagacgctgtggactgcgctctg
gaccccctgagcgaaaccaagtgcactctgaagtctttcaccgtggagaagggcatctaccagactagcaac
ttcagggtgcagccaaccgaatctatcgtcagattccccaacatcactaacctgtgcccattcggagaggtc
ttcaacgccaccagattcgcttccgtgtacgcctggaacaggaagagaatcagcaactgcgtcgctgactac
tctgtgctgtacaacagcgcctctttctcaaccttcaagtgctacggcgtgagccctactaagctgaacgac
ctgtgcttcaccaacgtctacgccgactctttcgtgatcaggggagacgaggtcagacagatcgctcccggc
cagactggaaagatcgccgactacaactacaagctgccagacgacttcaccggctgcgtcatcgcttggaac
tcaaacaacctggactccaaagtgggtggcaactacaactacctgtaccgcctgttccgtaagagcaacctg
aagcctttcgagagggacatctcaactgaaatctaccaggctggttccaccccctgcaacggtgtcgagggc
ttcaactgctacttcccactgcaatcttacggtttccagcctactaacggtgtgggctaccagccctacaga
gtggtcgtgctgtcattcgaactgctgcacgccccagctactgtgtgcggtcctaagaagtccaccaacctg
gtcaagaacaagtgcgtgaacttcaacttcaacggcctgaccggaactggtgtcctgaccgagtcaaacaag
aagttcctgccattccagcagttcggaagggacatcgctgacaccactgacgctgtgcgcgaccctcagacc
ctggaaatcctggacatcactccttgcagcttcggaggtgtctctgtgatcacccctggcaccaacacttcc
aaccaggtcgctgtgctgtaccaggacgtcaactgcaccgaggtgcctgtggctatccacgctgaccagctg
accccaacttggcgcgtgtactccaccggctccaacgtcttccagactcgtgctggttgcctgatcggcgcc
gagcacgtgaacaactcatacgaatgcgacatcccaatcggcgctggaatctgcgcctcctaccagacccag
actaactcacctcgccgtgctcgctccgtcgcctcccagagcatcatcgcttacaccatgagcctgggcgct
gaaaactctgtggcctactccaacaacagcatcgccatcccaaccaacttcactatctcagtgaccactgag
atcctgcctgtctcaatgaccaagacttccgtggactgcactatgtacatctgcggagactcaaccgaatgc
tccaacctgctgctgcaatacggctccttctgcacccagctgaaccgtgctctgactggaatcgccgtggag
caggacaagaacactcaggaagtcttcgctcaggtgaagcaaatctacaagacccctcccatcaaggacttc
ggcggattcaacttctcccagatcctgcccgacccatctaagccttcaaagcgctccttcatcgaggacctg
ctgttcaacaaggtcaccctggccgacgctggattcatcaagcagtacggagactgcctgggtgacatcgcc
gctcgtgacctgatctgcgctcagaagttcaacggtctgaccgtgctgccacctctgctgactgacgaaatg
atcgcccagtacacttcagccctgctggctggaaccatcacttccggttggaccttcggtgctggtgctgct
ctgcaaatccccttcgctatgcagatggcctacaggttcaacggaatcggtgtcacccagaacgtgctgtac
gagaaccagaagctgatcgctaaccagttcaacagcgccatcggaaagatccaggactcactgtcatccact
gcctccgctctgggcaagctgcaagacgtcgtgaaccagaacgcccaggctctgaacaccctggtcaagcag
ctgtcctccaacttcggtgctatctcatccgtgctgaacgacatcctgtctcgcctggacaaggtcgaggcc
gaagtgcagatcgaccgcctgatcaccggccgcctgcaatccctgcaaacctacgtgactcagcagctgatc
agggccgctgaaatcagagcctctgctaacctggccgctaccaagatgtcagagtgcgtcctgggtcagtcc
aagcgtgtggacttctgcggcaagggataccacctgatgagcttcccccagtctgctccacacggcgtcgtg
ttcctgcacgtcacctacgtgcctgcccaggagaagaacttcaccactgcccccgctatctgccacgacggc
aaggctcacttcccaagggaaggtgtcttcgtgtcaaacggcacccactggttcgtcactcagagaaacttc
tacgagcctcagatcatcaccactgacaacactttcgtgtccggaaactgcgacgtcgtgatcggtatcgtc
aacaacaccgtgtacgacccactgcaacctgagctggacagcttcaaggaggaactggacaaatacttcaag
aaccacacctctcccgacgtggacctgggtgacatcagcggaatcaacgcttctgtcgtgaacatccagaag
gagatcgaccgtctgaacgaagtggctaagaacctgaacgaatccctgatcgacctgcaagagctgggcaag
tacgaacagtacatcaagtggccttggtacatctggctgggtttcatcgctggcctgatcgccatcgtcatg
gtgaccatcatgctgtgctgcatgactagctgctgctcttgcctgaagggctgctgctcatgcggttcctgc
tgcaagttcgatgaagacgattccgagcccgttctcaaaggagtgaagttgcattacaca</INSDSeq_sequenc
e>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="3">
<INSDSeq>
<INSDSeq_length>3786</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..3786</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q5">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>tcctcccaatgcgtcaacctcactacccgtacccagctcccaccagcctacacc
aacagcttcactcgcggtgtgtactaccccgacaaggtcttccgttccagcgtgctgcacagcactcaggac
ctgttcctgccattcttctctaacgtgacctggttccacgccatccacgtgagcggcaccaacggcactaag
cgcttcgacaaccctgtgctgcccttcaacgacggtgtctacttcgcttccaccgagaagtctaacatcatc
cgtggatggatcttcggcaccactctggactcaaagactcagtccctgctgatcgtcaacaacgccaccaac
gtggtcatcaaggtgtgcgagttccagttctgcaacgaccctttcctgggcgtctactaccacaagaacaac
aagagctggatggagtctgagttccgcgtctactcttcagctaacaactgcactttcgagtacgtgagccag
cccttcctgatggacctggaaggaaagcagggtaacttcaagaacctgagggagttcgtgttcaagaacatc
gacggatacttcaagatttactcaaagcacacccctatcaacctggtgcgcgacctgccacagggtttctcc
gctctggagcctctggtggacctgcccatcggcatcaacatcacccgcttccagactctgctggctctgcac
cgttcctacctgactcctggcgactccagctctggatggaccgccggagctgccgcttactacgtgggttac
ctgcaacccaggaccttcctgctgaagtacaacgaaaacggaaccatcacagacgctgtggactgcgctctg
gaccccctgagcgaaaccaagtgcactctgaagtctttcaccgtggagaagggcatctaccagactagcaac
ttcagggtgcagccaaccgaatctatcgtcagattccccaacatcactaacctgtgcccattcggagaggtc
ttcaacgccaccagattcgcttccgtgtacgcctggaacaggaagagaatcagcaactgcgtcgctgactac
tctgtgctgtacaacagcgcctctttctcaaccttcaagtgctacggcgtgagccctactaagctgaacgac
ctgtgcttcaccaacgtctacgccgactctttcgtgatcaggggagacgaggtcagacagatcgctcccggc
cagactggaaacatcgccgactacaactacaagctgccagacgacttcaccggctgcgtcatcgcttggaac
tcaaacaacctggactccaaagtgggtggcaactacaactacctgtaccgcctgttccgtaagagcaacctg
aagcctttcgagagggacatctcaactgaaatctaccaggctggttccaccccctgcaacggtgtcaagggc
ttcaactgctacttcccactgcaatcttacggtttccagcctacttacggtgtgggctaccagccctacaga
gtggtcgtgctgtcattcgaactgctgcacgccccagctactgtgtgcggtcctaagaagtccaccaacctg
gtcaagaacaagtgcgtgaacttcaacttcaacggcctgaccggaactggtgtcctgaccgagtcaaacaag
aagttcctgccattccagcagttcggaagggacatcgctgacaccactgacgctgtgcgcgaccctcagacc
ctggaaatcctggacatcactccttgcagcttcggaggtgtctctgtgatcacccctggcaccaacacttcc
aaccaggtcgctgtgctgtaccaggacgtcaactgcaccgaggtgcctgtggctatccacgctgaccagctg
accccaacttggcgcgtgtactccaccggctccaacgtcttccagactcgtgctggttgcctgatcggcgcc
gagcacgtgaacaactcatacgaatgcgacatcccaatcggcgctggaatctgcgcctcctaccagacccag
actaactcacctcgccgtgctcgctccgtcgcctcccagagcatcatcgcttacaccatgagcctgggcgct
gaaaactctgtggcctactccaacaacagcatcgccatcccaaccaacttcactatctcagtgaccactgag
atcctgcctgtctcaatgaccaagacttccgtggactgcactatgtacatctgcggagactcaaccgaatgc
tccaacctgctgctgcaatacggctccttctgcacccagctgaaccgtgctctgactggaatcgccgtggag
caggacaagaacactcaggaagtcttcgctcaggtgaagcaaatctacaagacccctcccatcaaggacttc
ggcggattcaacttctcccagatcctgcccgacccatctaagccttcaaagcgctccttcatcgaggacctg
ctgttcaacaaggtcaccctggccgacgctggattcatcaagcagtacggagactgcctgggtgacatcgcc
gctcgtgacctgatctgcgctcagaagttcaacggtctgaccgtgctgccacctctgctgactgacgaaatg
atcgcccagtacacttcagccctgctggctggaaccatcacttccggttggaccttcggtgctggtgctgct
ctgcaaatccccttcgctatgcagatggcctacaggttcaacggaatcggtgtcacccagaacgtgctgtac
gagaaccagaagctgatcgctaaccagttcaacagcgccatcggaaagatccaggactcactgtcatccact
gcctccgctctgggcaagctgcaagacgtcgtgaaccagaacgcccaggctctgaacaccctggtcaagcag
ctgtcctccaacttcggtgctatctcatccgtgctgaacgacatcctgtctcgcctggacaaggtcgaggcc
gaagtgcagatcgaccgcctgatcaccggccgcctgcaatccctgcaaacctacgtgactcagcagctgatc
agggccgctgaaatcagagcctctgctaacctggccgctaccaagatgtcagagtgcgtcctgggtcagtcc
aagcgtgtggacttctgcggcaagggataccacctgatgagcttcccccagtctgctccacacggcgtcgtg
ttcctgcacgtcacctacgtgcctgcccaggagaagaacttcaccactgcccccgctatctgccacgacggc
aaggctcacttcccaagggaaggtgtcttcgtgtcaaacggcacccactggttcgtcactcagagaaacttc
tacgagcctcagatcatcaccactgacaacactttcgtgtccggaaactgcgacgtcgtgatcggtatcgtc
aacaacaccgtgtacgacccactgcaacctgagctggacagcttcaaggaggaactggacaaatacttcaag
aaccacacctctcccgacgtggacctgggtgacatcagcggaatcaacgcttctgtcgtgaacatccagaag
gagatcgaccgtctgaacgaagtggctaagaacctgaacgaatccctgatcgacctgcaagagctgggcaag
tacgaacagtacatcaagtggccttggtacatctggctgggtttcatcgctggcctgatcgccatcgtcatg
gtgaccatcatgctgtgctgcatgactagctgctgctcttgcctgaagggctgctgctcatgcggttcctgc
tgcaagttcgatgaagacgattccgagcccgttctcaaaggagtgaagttgcattacaca</INSDSeq_sequenc
e>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="4">
<INSDSeq>
<INSDSeq_length>3775</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..3775</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q6">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>tcctcccaatgcgtcaacctcactacccgtacccagctcccaccagcctacacc
aacagcttcactcgcggtgtgtactaccccgacaaggtcttccgttccagcgtgctgcacagcactcaggac
ctgttcctgccattcttctctaacgtgacctggttccacgccatcagcggcaccaacggcactaagcgcttc
gacaaccctgtgctgcccttcaacgacggtgtctacttcgcttccaccgagaagtctaacatcatccgtgga
tggatcttcggcaccactctggactcaaagactcagtccctgctgatcgtcaacaacgccaccaacgtggtc
atcaaggtgtgcgagttccagttctgcaacgaccctttcctgggcgtctaccacaagaacaacaagagctgg
atggagtctgagttccgcgtctactcttcagctaacaactgcactttcgagtacgtgagccagcccttcctg
atggacctggaaggaaagcagggtaacttcaagaacctgagggagttcgtgttcaagaacatcgacggatac
ttcaagatttactcaaagcacacccctatcaacctggtgcgcgacctgccacagggtttctccgctctggag
cctctggtggacctgcccatcggcatcaacatcacccgcttccagactctgctggctctgcaccgttcctac
ctgactcctggcgactccagctctggatggaccgccggagctgccgcttactacgtgggttacctgcaaccc
aggaccttcctgctgaagtacaacgaaaacggaaccatcacagacgctgtggactgcgctctggaccccctg
agcgaaaccaagtgcactctgaagtctttcaccgtggagaagggcatctaccagactagcaacttcagggtg
cagccaaccgaatctatcgtcagattccccaacatcactaacctgtgcccattcggagaggtcttcaacgcc
accagattcgcttccgtgtacgcctggaacaggaagagaatcagcaactgcgtcgctgactactctgtgctg
tacaacagcgcctctttctcaaccttcaagtgctacggcgtgagccctactaagctgaacgacctgtgcttc
accaacgtctacgccgactctttcgtgatcaggggagacgaggtcagacagatcgctcccggccagactgga
aagatcgccgactacaactacaagctgccagacgacttcaccggctgcgtcatcgcttggaactcaaacaac
ctggactccaaagtgggtggcaactacaactacctgtaccgcctgttccgtaagagcaacctgaagcctttc
gagagggacatctcaactgaaatctaccaggctggttccaccccctgcaacggtgtcgagggcttcaactgc
tacttcccactgcaatcttacggtttccagcctacttacggtgtgggctaccagccctacagagtggtcgtg
ctgtcattcgaactgctgcacgccccagctactgtgtgcggtcctaagaagtccaccaacctggtcaagaac
aagtgcgtgaacttcaacttcaacggcctgaccggaactggtgtcctgaccgagtcaaacaagaagttcctg
ccattccagcagttcggaagggacatcgacgacaccactgacgctgtgcgcgaccctcagaccctggaaatc
ctggacatcactccttgcagcttcggaggtgtctctgtgatcacccctggcaccaacacttccaaccaggtc
gctgtgctgtaccagggcgtcaactgcaccgaggtgcctgtggctatccacgctgaccagctgaccccaact
tggcgcgtgtactccaccggctccaacgtcttccagactcgtgctggttgcctgatcggcgccgagcacgtg
aacaactcatacgaatgcgacatcccaatcggcgctggaatctgcgcctcctaccagacccagactaactca
cmycgccgtgctcgctccgtcgcctcccagagcatcatcgcttacaccatgagcctgggcgctgaaaactct
gtggcctactccaacaacagcatcgccatcccaaycaacttcactatctcagtgaccactgagatcctgcct
gtctcaatgaccaagacttccgtgactgcactatgtacatctgcggagactcaaccgaatgctccaacctgc
tgctgcaatacggctccttctgcacccagctgaaccgtgctctgactggaatcgccgtggagcaggacaaga
acactcaggaagtcttcgctcaggtgaagcaaatctacaagacccctcccatcaaggacttcggcggattca
acttctcccagatcctgcccgacccatctaagccttcaaagcgctccttcatcgaggacctgctgttcaaca
aggtcaccctggccgacgctggattcatcaagcagtacggagactgcctgggtgacatcccgctcgtgacct
gatctgcgctcagaagttcaacggtctgaccgtgctgccacctctgctgactgacgaaatgatcgcccagta
cacttcagccctgctggctggaaccatcacttccggttggaccttcggtgctggtgctgctctgcaaatccc
cttcgctatgcagatggcctacaggttcaacggaatcggtgtcacccagaacgtgctgtacgagaaccagaa
gctgatcgctaaccagttcaacagcgccatcggaaagatccaggactcactgtcatccactgcctccgctct
gggcaagctgcaagacgtcgtgaaccagaacgcccaggctctgaacaccctggtcaagcagctgtcctccaa
cttcggtgctatctcatccgtgctgaacgacatcctggctcgcctggacaaggtcgaggccgaagtgcagat
cgaccgcctgatcaccggccgcctgcaatccctgcaaacctacgtgactcagcagctgatcagggccgctga
aatcagagcctctgctaacctggccgctaccaagatgtcagagtgcgtcctgggtcagtccaagcgtgtgga
cttctgcggcaagggataccacctgatgagcttcccccagtctgctccacacggcgtcgtgttcctgcacgt
cacctacgtgcctgcccaggagaagaacttcaccactgcccccgctatctgccacgacggcaaggctcactt
cccaagggaaggtgtcttcgtgtcaaacggcacccactggttcgtcactcagagaaacttctacgagcctca
gatcatcaccactcacaacactttcgtgtccggaaactgcgacgtcgtgatcggtatcgtcaacaacaccgt
gtacgacccactgcaacctgagctggacagcttcaaggaggaactggacaaatacttcaagaaccacacctc
tcccgacgtggacctgggtgacatcagcggaatcaacgcttctgtcgtgaacatccagaaggagatcgaccg
tctgaacgaagtggctaagaacctgaacgaatccctgatcgacctgcaagagctgggcaagtacgaacagta
catcaagtggccttggtacatctggctgggtttcatcgctggcctgatcgccatcgtcatggtgaccatcat
gctgtgctgcatgactagctgctgctcttgcctgaagggctgctgctcatgcggttcctgctgcaagttcga
tgaagacgattccgagcccgttctcaaaggagtgaagttgcattacaca</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="5">
<INSDSeq>
<INSDSeq_length>3786</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..3786</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q7">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>tcctcccaatgcgtcaacctcactacccgtacccagctcccaccagcctacacc
aacagcttcactcgcggtgtgtactaccccgacaaggtcttccgttccagcgtgctgcacagcactcaggac
ctgttcctgccattcttctctaacgtgacctggttccacgccatccacgtgagcggcaccaacggcactaag
cgcttcgacaaccctgtgctgcccttcaacgacggtgtctacttcgcttccaccgagaagtctaacatcatc
cgtggatggatcttcggcaccactctggactcaaagactcagtccctgctgatcgtcaacaacgccaccaac
gtggtcatcaaggtgtgcgagttccagttctgcaacgaccctttcctgggcgtctactaccacaagaacaac
aagagctggatggagtctgagttccgcgtctactcttcagctaacaactgcactttcgagtacgtgagccag
cccttcctgatggacctggaaggaaagcagggtawcttcaagaacctgagggagttcgtgttcaagaacatc
gacggatacttcaagatttactcaaagcacacccctatcaacctggtgcgcgacctgccacagggtttctcc
gctctggagcctctggtggacctgcccatcggcatcaacatcacccgcttccagactctgctggctctgcac
cgttcctacctgactcctggcgactccagctctggatggaccgccggagctgccgcttactacgtgggttac
ctgcaacccaggaccttcctgctgaagtacaacgaaaacggaaccatcacagacgctgtggactgcgctctg
gaccccctgagcgaaaccaagtgcactctgaagtctttcaccgtggagaagggcatctaccagactagcaac
ttcagggtgcagccaaccgaatctatcgtcagattccccaacatcactaacctgtgcccattcggagaggtc
ttcaacgccaccarattcgcttccgtgtacgcctggaacaggaagagaatcagcaactgcgtcgctgactac
tctgtgctgtacaacagcgcctctttctcaaccttcaagtgctacggcgtgagccctactaagctgaacgac
ctgtgcttcaccaacgtctacgccgactctttcgtgatcaggggagacgaggtcagacagatcgctcccggc
cagactggaaagatcgccgactacaactacaagctgccagacgacttcaccggctgcgtcatcgcttggaac
tcaaacaagctggactccaaagtgagcggcaactacaactacctgtaccgcctgttccgtaagagcaacctg
aagcctttcgagagggacatctcaactgaaatctaccaggctggttccaccccctgcaacggtgtcgctggc
ttcaactgctacttcccactgcgctcttacggtttcaggcctactaacggtgtgggccaccagccctacaga
gtggtcgtgctgtcattcgaactgctgcacgccccagctactgtgtgcggtcctaagaagtccaccaacctg
gtcaagaacaagtgcgtgaacttcaacttcaacggcctaaccggaactggtgtcctgaccgagtcaaacaag
aagttcctgccattccagcagttcggaagggacatcgctgacaccactgacgctgtgcgcgaccctcagacc
ctggaaatcctggacatcactccttgcagcttcggaggtgtctctgtgatcacccctggcaccaacacttcc
aaccaggtcgctgtgctgtaccaggacgtcaactgcaccgaggtgcctgtggctatccacgctgaccagctg
accccaacttggcgcgtgtactccaccggctccaacgtcttccagactcgtgctggttgcctgatcggcgcc
gagcacgtgaacaactcatacgaatgcgacatcccaatcggcgctggaatctgcgcctcctaccagacccag
actaagtcacctcagcaggctcagtccgtcgcctcccagagcatcatcgcttacaccatgagcctgggcgct
gaaaactctgtggcctactccaacaacagcatcgccatcccaaccaacttcactatctcagtgaccactgag
atcctgcctgtctcaatgaccaagacttccgtggactgcactatgtacatctgcggagactcaaccgaatgc
tccaacctgctgctgcaatacggctccttctgcacccagctgaaccgtgctctgactggaatcgccgtggag
caggacaagaacactcaggaagtcttcgctcaggtgaagcaaatctacaagacccctcccatcaaggacttc
ggcggattcaacttctcccagatcctgcccgacccatctaagccttcaaagcgctccttcatcgaggacctg
ctgttcaacaaggtcaccctggccgacgctggattcatcaagcagtacggagactgcctgggtgacatcgcc
gctcgtgacctgatctgcgctcagaagttcaacggtctgaccgtgctgccacctctgctgactgacgaaatg
atcgcccagtacacttcagccctgctggctggaaccatcacttccggttggaccttcggtgctggtgctgct
ctgcaaatccccttcgctatgcagatggcctacaggttcaacggaatcggtgtcacccagaacgtgctgtac
gagaaccagaagctgatcgctaaccagttcaacagcgccatcggaaagatccaggactcactgtcatccact
gcctccgctctgggcaagctgcaagacgtcgtgaaccagaacgcccaggctctgaacaccctggtcaagcag
ctgtcctccaacttcggtgctatctcatccgtgctgaacgacatcctgtctcgcctggacccacccgaggcc
gaagtgcagatcgaccgcctgatcaccggccgcctgcaatccctgcaaacctacgtgactcagcagctgatc
agggccgctgaaatcagagcctytgctaacctggccgctaccaagatgtcagagtgcgtcctgggtcagtcc
aagcgtgtggacttytgcggcaagggataccacctgatgagcttcccccagtctgctccacacggcgtcgtg
ttcctgcacgtcacctacgtgcctgcccaggagaagaacttcaccactgcccccgctatctgccacgacggc
aaggctcacttcccaagggaaggtgtcttcgtgtcaaacggcacccactggttcgtcactcagagaaacttc
tacgagcctcagatcatcaccactgacaacactttcgtgtccggaaactgcgacgtcgtgatcggtatcgtc
aacaacaccgtgtacgacccactgcaacctgagctggacagcttcaaggaggaactggacaaatacttcaag
aaccacacctctcccgacgtggacctgggtgacatcagcggaatcaacgcttctgtcgtgaacatccagaag
gagatcgaccgtctgaacgaagtggctaagaacctgaacgaatccctgatcgacctgcaagagctgggcaag
tacgaacagtacatcaagtggccttggtacatctggctgggtttcatcgctggcctgatcgccatcgtcatg
gtgaccatcatgctgtgctgcatgactagctgctgctcttgcctgaagggctgctgctcatgcggttcctgc
tgcaagttcgatgaagacgattccgagcccgttctcaaaggagtgaagttgcattacaca</INSDSeq_sequenc
e>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="6">
<INSDSeq>
<INSDSeq_length>2687</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..2687</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q8">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>ggctattaaaggttcaatggcgtacaggaaacgtggagcgcgccgtgaggcgaa
tataaataataatgaccgaatgcaagagaaagatgacgagaaacaagatcaaaacaatagaatgcagttgtc
tgataaagtactttcaaagaaagaggaagtcgtaaccgacagtcaagaagaaattaaaattgctgatgaagt
gaagaaatcgacgaaagaagaatctaaacaattgcttgaagttttgaaaacaaaagaagagcaccaaaaaga
gatacaatatgaaattttgcaaaaaacgataccaacatttgaaccaaaagagtcaatattgaaaaaattgga
ggatatcaaaccggaacaagcgaagaagcagactaagctatttagaatatttgaaccgagacagctaccaat
ttatagagcgaatggtgaaaaagagttgcgtaacagatggtattggaagctgaagaaagatactttaccaga
tggagattatgatgttagagaatactttctaaatttgtatgatcaggttcttactgaaatgccagattattt
actattaaaagatatggcagttgaaaataaaaattcgagagatgccggtaaagttgttgattctgaaacagc
aagtatctgtgatgctatatttcaagatgaggaaacagaaggtgcagtgagacgattcattgcggagatgag
acagcgcgtacaagctgacagaaacgttgtcaattacccatcaatattgcatccaatagattacgcttttaa
tgagtattttttgcaacaccaattagttgaaccattgaataatgatataatattcaattacattcctgaaag
gataaggaatgacgttaactatatacttaatatggacagaaatctgccatcaacagctagatatataagacc
taatttactacaagacagactgaatttgcatgacaattttgaatccttgtgggatacaataacaacttcaaa
ctatattctggcaagatcggtagtaccagatttaaaggaattagtttcaaccgaagcgcaaattcaaaaaat
gtcacaagacttgcaactagaagcattaacaatacagtcagaaacgcagtttttaacaggtataaactcaca
agcagcaaatgactgtttcaaaactctgattgcagcaatgttaagtcaacgaaccatgtcgcttgatttcgt
gactacaaattatatgtcattaatttcaggcatgtggttactaactgtagtgccaaatgacatgttcataag
ggaatcattggttgcatgtcaactggctatagtgaatacaataatatatccagcgttcggaatgcaacgaat
gcattatagaaacggagacccacaaagaccatttcagatagcagaacaacaaatacaaaattttcaagtagc
gaattggctgcattttgtcaataacaatcaatttagacaagtagttattgatggtgtattgaatcaggtgct
gaatgacaatattagaaatggacatgtcattaatcaattgatggaagctttaatgcaactatcacgacaaca
gtttccaacaatgcctgttgattataagaggtcaatccagcgtggaatattattgctatcaaataggcttgg
tcaattagttgatttaactaggttattagcttacaactacgaaacactaatggcatgtgttacgatgaatat
gcaacatgttcagactttgacaacagaaaaattacagttaacttcagtcacatcgttgtgtatgcttattgg
aaatgcaaccgttatacccagcccgcagacattgtttcactattataatgttaatgttaattttcattcaaa
ttataatgaaagaattaatgatgcagtggccataataactggagctaatagactaaatttatatcagaaaaa
gatgaaggcaatagttgaagattttttaaaaagattacatattttcgatgtagctagagttccagatgatca
aatgtatagattaagggatagactacgactattgccagtagaagtaagacgattggatatttttaatttgat
actgatgaacatggatcagatagaacgcgcatcagataaaattgcgcaaggtgttattattgcgtaccgcga
tatgcaattggaaagagacgaaatgtatggctacgtgaatatagctagaaatttagatgggttccagcaaat
aaacctagaagaattgatgagaacaggcgattatgcacaaataactaacatgctcttgaataatcaaccagt
agcgctagttggagctcttccatttgttacagactcgtcagtcatatcgttgatagcgaacgttgacgctac
agtttttgcccaaatagttaaattacggaaagttgataccttgaaaccaatattgtataaaataaattcaga
ttcgaatgacttttacctagttgccaactatgattgggtgcctacttcaaccacaaaagtatataagcaagt
tccacagcaatttgatttcagaaattcgatgcatatgttaacatcaaatcttactttcactgtttactctga
tctgcttgcattcgtatcggccgatacagtagaacctataaatgcagttgcatttgataatatgcgcatcat
gaacgagttgtaaacgccaaccccactgtggagatatgacc</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="7">
<INSDSeq>
<INSDSeq_length>1224</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..1224</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q9">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>atggaagtcctgtactccttgagcaagactctgaaagatgcccgtgacaagatc
gtggaaggcactctctactccaacgtgtctgacctgatccagcagttcaatcagatgatcgtgaccatgaat
ggaaacgactttcagactggtggcattggcaaccttcctatcaggaactggacctttgactttggtctcctt
ggcactacactgttgaatctggatgccaattacgttgagaccgccaggactaccattgagtacttcatcgac
ttcatcgacaacgtgtgcatggatgagatggcccgtgagtctcagcgcaatggtgtcgctccacagtctgaa
gctctgcgcaaacttgctggcatcaagttcaagcgcatcaacttcaacaacagctctgagtatatcgagaac
tggaacttacagaacagacgtcaacgcactggcttcgtgtttcacaaacccaacatctttccatactctgcc
tccttcaccttgaacagatctcaacctatgcacgacaacctcatgggaaccatgtggctgaatgctggctct
gagattcaagttgctggctttgctggctctgagattcaagttgctggctttgactacagctgtgcactgaat
gctcctgccaatattcaacagtttgaacacatcgtccaactgcgtagagccttgaccactgccaccatcact
ctgttgcctgatgctgagcgcttcagcttccctagagtgatcaactctgctgatggtgccactacatggttc
ttcaatcccatcattctgagacccaacaatgtggaagttgagttcttgctgaatggtcagatcattaacacc
taccaagctaggtttggcaccatcattgctcgcaactttgacaccattcgtctgtccttccaactgatgaga
cctcccaacatgactccagctgtgaatgctctctttcctcaagctcaaccctttcaacaccatgccaccgtt
ggtctgactcttcgcatcgagtctgctgtgtgtgaatcagtgcttgccgatgccaatgagaccttgcttgct
aatgtgactgctgttcgtcaagagtatgccattccagttggtcctgtgtttccacctggcatgaactggact
gaactgatcaccaactactctccttcccgtgaagacaacttgcaaagagtcttcaccgttgccagcatccgt
agcatgttgatcaagtaa</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
</ST26SequenceListing>
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Иммунобиологическое средство на основе вирусоподобных частиц для индукции специфического иммунитета против инфекции, вызываемой ротавирусом А человека | 2022 |
|
RU2795055C1 |
| Рекомбинантные вирусоподобные частицы для индукции специфического иммунитета против вируса тяжелого острого респираторного синдрома SARS-CoV-2 | 2021 |
|
RU2769224C1 |
| Вакцина против ротавирусной инфекции человека на основе вирусоподобных частиц ротавируса | 2024 |
|
RU2829862C1 |
| Вакцина на основе вирусоподобных частиц (VLP) для профилактики COVID-19 для парентерального применения | 2024 |
|
RU2834060C1 |
| Вакцина на основе вирусоподобных частиц (VLP) для профилактики COVID-19 для интраназального применения | 2024 |
|
RU2828323C1 |
| ПОЛУЧЕНИЕ ВИРУСОПОДОБНЫХ ЧАСТИЦ В РАСТЕНИЯХ | 2011 |
|
RU2655431C2 |
| Вакцинная композиция против коронавирусной инфекции COVID-19 | 2020 |
|
RU2743595C1 |
| Пептидные иммуногены и вакцинная композиция против коронавирусной инфекции COVID-19 с использованием пептидных иммуногенов | 2020 |
|
RU2738081C1 |
| Пептидные иммуногены и вакцинная композиция против коронавирусной инфекции COVID-19 с использованием пептидных иммуногенов | 2020 |
|
RU2743593C1 |
| Пептидные иммуногены, используемые в качестве компонентов вакцинной композиции против коронавирусной инфекции COVID-19 | 2020 |
|
RU2743594C1 |


Группа изобретений относится к области биотехнологии и генной инженерии. Раскрыта вирусоподобная химерная частица, содержащая один или несколько рекомбинантных S белков различных штаммов коронавируса, имеющих нуклеотидные последовательности SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, и рекомбинантные белки ротавируса VP2 и VP6, имеющие нуклеотидные последовательности SEQ ID NO:6, SEQ ID NO:7, которые получены в бакуловирусной системе экспрессии насекомых, при этом вирусоподобная частица имитирует вирион SARS-CoV-2. Также раскрыт способ получения вирусоподобной химерной частицы, включающий получение рекомбинантных бакуловирусов, содержащих гены S белков различных штаммов коронавируса и гены белков ротавируса VP2 и VP6; коинфекцию перевиваемой линии клеток насекомых T.ni различными сочетаниями рекомбинантных бакуловирусов; получение вирусоподобных химерных частиц и их очистку. Изобретение позволяет получать вирусоподобные химерные частицы для индукции специфического иммунитета против вируса тяжелого острого респираторного синдрома SARS-CoV-2. 2 н.п. ф-лы, 6 ил., 2 табл., 6 пр.
1. Вирусоподобная химерная частица для индукции специфического иммунитета против вируса тяжелого острого респираторного синдрома SARS-CoV-2, содержащая один или несколько рекомбинантных S белков различных штаммов коронавируса, имеющих нуклеотидные последовательности SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, и рекомбинантные белки ротавируса VP2 и VP6, имеющие нуклеотидные последовательности SEQ ID NO:6, SEQ ID NO:7, которые получены в бакуловирусной системе экспрессии насекомых, при этом вирусоподобная частица имитирует вирион SARS-CoV-2.
2. Способ получения вирусоподобной химерной частицы по п.1, включающий: а) получение рекомбинантных бакуловирусов, содержащих гены S белков различных штаммов коронавируса, имеющие нуклеотидные последовательности SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, и гены белков ротавируса VP2 и VP6, имеющие нуклеотидные последовательности SEQ ID NO:6, SEQ ID NO:7; б) коинфекцию перевиваемой линии клеток насекомых T.ni различными сочетаниями рекомбинантных бакуловирусов; в) получение вирусоподобных химерных частиц и их очистку.
| Ультразвуковой томограф | 1984 |
|
SU1261629A1 |
| WO 2021176397 A2, 10.09.2021 | |||
| ПОЛУЧЕНИЕ ВИРУСОПОДОБНЫХ ЧАСТИЦ В РАСТЕНИЯХ | 2011 |
|
RU2655431C2 |
| РОМАН ДМИТРИЕВ и др | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Самый полный и подробный обзор в мире., портал Мосмедпрепараты.ru, 03.02.2020 https://mosmedpreparaty.ru/articles/19949 найдено в интернет 26.08.2022. | |||
Авторы
Даты
2022-09-13—Публикация
2022-07-19—Подача