Предлагаемое изобретение относится к области медицинской микробиологии, а именно к лабораторной диагностике, и может быть использовано при молекулярно-генетическом внутривидовом типировании токсигенных штаммов Vibrio cholerae O1 Eltor.
В настоящее время холера продолжает оставаться опасным инфекционным заболеванием (Гаити, 2010 г.). Все случаи холеры последних десятилетий на территории Российской Федерации были вызваны завозом токсигенных клонов Vibrio cholerae O1 Eltor из стран, неблагополучных по этой инфекции. Поэтому для практического здравоохранения важно быстро и достоверно определять происхождение выделенных токсигенных клонов.
Кроме того, знание происхождения штаммов важно при ретроспективном анализе старых вспышек холеры, когда нужно оценить пути завоза и распространения возбудителя, что имеет большое значение при совершенствовании тактики работы противоэпидемических служб.
Среди широкого арсенала лабораторных тестов только методики молекулярного типирования позволяют детектировать уникальные генетические маркеры и на основании полученных результатов определять происхождение штаммов холерных вибрионов. Одним из маркеров токсигенных клонов вибрионов являются интегративные коньюгативные элементы Integrative conjugative elements (ICEs) - мобильные генетические элементы, сообщающие хозяину резистентность к различным антибактериальным препаратам и другим неблагоприятным факторам (1).
Известно существование нескольких типов ICE, которые являются удобными генетическими маркерами происхождения токсигенных штаммов, а их детекция широко используется при лабораторных исследованиях (2).
Известны способы, основанные на выявлении уровня фактической устойчивости к различным антибиотикам и способности к переносу выявленных генов антибиотикорезистентности другим хозяевам. Исследования эти чрезвычайно трудоемки и длительны (3).
Самым достоверным является проведение полногеномного анализа нуклеотидной последовательности изучаемого штамма и выявление специфических нуклеотидных последовательностей для каждого типа ICE элемента (2).
Недостатком этого способа является его трудоемкость, длительность, дороговизна, так как требует наличия дорогостоящего оборудования (секвенаторов ДНК), обученного персонала, расходных материалов и компьютерных мощностей.
Известен способ выявления ICE элементов (1), заключающийся в детекции специфической интегразы с помощью пары специфических праймеров.
Однако несмотря на простоту и быстроту воспроизводства способа, использование одной пары праймеров не позволяет судить о типе ICE элемента.
За прототип выбран способ определения типа ICE элемента с помощью мультиплексной полимеразной цепной реакции (4), заключающийся в выделении ДНК из исследуемой культуры токсигенного штамма, постановки мультиплексной ПЦР со специфическими праймерами к типам ICEVchInd5 и ICEVchMoz10, и учете полученных результатов, последний проводят путем электрофореза продуктов амплификации в 1,5% геле агарозы, при этом в случае получения специфического фрагмента 423 п. о. регистрируют наличие ICE элемента индийского типа (ICEVchInd5), наличие фрагмента массой 712 п.о., что свидетельствует о присутствии ICE элемента мозамбикского типа (ICEVchMoz10.
Однако недостатком данного способа является необходимость учета результатов реакции с помощью электрофореза, а это требует дополнительного времени, наличия сложного оборудования (печи для плавления агарозы, прибора для проведения элекрофореза, источника тока, трансиллюминатора, регистрирующей аппаратуры) и расходных материалов (агарозы, буферов).
Кроме того, в соответствии с действующими нормативными документами (МУ 1.3.2569-09) для учета результатов реакции амплификации нуклеиновых кислот методом электрофореза необходима отдельная рабочая зона (4-1), которая должна быть расположена изолированно от других помещений для предотвращения контаминации продуктами амплификации через воздушный поток.
При этом зона 4-1 для проведения электрофореза должна быть оснащена минимальным набором соответствующего лабораторного оборудования, а выполнение работ должно осуществляться отдельным персоналом, не задействованным на других этапах проведения ПЦР анализа. Эти обстоятельства усложняют и удорожают использование метода ПЦР с учетом результатов с помощью электрофореза в геле.
Технической задачей предлагаемого изобретения является разработка нового, простого, невысокой себестоимости способа, позволяющего определять наличие у токсигенных вибрионов ICE элемента индийского или мозамбикского типа.
Поставленная задача достигается тем, что в известном способе молекулярно-генетического внутривидового типирования токсигенных штаммов Vibrio cholerae O1 Eltor, включающем выделение ДНК из исследуемого штамма Vibrio cholerae O1 Eltor, постановку ПЦР со специфическими праймерами и учет полученных результатов, амплификацию исследуемой ДНК проводят сконструированными праймерами к каждому ICE элементов индийского и мозамбикского типов, в присутствии интеркалирующего красителя Siber Green, и состоящих из двух пар праймеров:
и
при этом продукты амплификации подвергают плавлению в течение 25 минут в температурном интервале (65-94)°С с шагом каждого этапа 0,5°С, учет результатов проводят по температурным пикам плавления и размеру ампликона, если ампликоны синтезируются и показывают на кривой плавления характерные пики с температурой плавления 87°С и размером 300 п.о., то регистрируют наличие ICE индийского типа, а при температуре плавления 79°С и размере ампликона 149 п.о., то подтверждают ICE мозамбикский тип.
Обоснование выбора праймеров.
Важнейшим этапом при разработке ПЦР, обеспечивающим получение корректного результата, является правильный подбор мишеней для посадки праймеров. С помощью программного обеспечения PrimerM, разработанного во ФКУЗ РостНИПЧИ Роспотребнадзора (г.Ростов-на-Дону), был проанализирован участок генома токсигенных штаммов Vibrio cholerae O1 Eltor, содержащий ICE элементы индийского или мозамбикского типа. В результате идентификации специфических для ICE элементов индийского или мозамбикского типов участков ДНК удалось сконструировать набор праймеров для мультиплексной ПЦР, состоящий из двух пар праймеров:
и
Способ осуществляется следующим образом.
Перед постановкой ПЦР проводят предварительную подготовку материала, а именно выделение ДНК. Массу бактерий, сформировавших колонию или газон на плотной питательной среде, стерильной палочкой помещают в микропробирку объемом 1,5 мл, содержащую 200 мкл дистиллированной воды, после чего выделяют ДНК как принято (Метод. Указания МУ1.3.1791-9 «Организационные работы при исследовании методом ПЦР материала, инфицированного микроорганизмами 1 и 2 группы патогенности-М.2003-38 с.»). В качестве матрицы используют геномную ДНК, полученную из разных штаммов холерного микроба.
Затем с полученной ДНК проводят реакцию амплификации: мультиплексную со специфическими праймерами ICE-Ind-1, ICE-Ind-12, ICE-Moz-1 и ICE-Moz-12 в присутствии интеркалирующего красителя SYBR GREEN I.
Условия проведения реакции амлификации.
Инкубационная смесь объемом 25 мкл содержит: 1,5 мМ Mg-буфер, 0,2 мМ смеси дНТФ, 1,0 мкМ смеси праймеров (по 0,5 мкМ каждого праймера ICE-Ind-1, ICE-Ind-12, ICE-Moz-1, ICE-Moz-12), 25 нг ДНК - матрицы, 0,25 ед. ДНК-полимеразы, а в качестве индикатора интеркалирующий краситель SYBR GREEN I («НПФ СИНТОЛ», Россия) - 1 мкл, оставшийся объем - вода. Далее полученные образцы помещают в амплификатор для проведения амплификации в режиме реального времени (например, DTlite 5, производства НПФ «ДНК-технология», Москва) для проведения ПЦР в режиме реального времени.
Амплификацию проводят по следующей схеме: денатурация при 95°С - 3 мин (1 цикл); затем 35 циклов: денатурация при 95°С - 20 с, отжиг при 60°С - 20 с, синтез при 72°С - 20 с; синтез при 72°С - 1 мин (1 цикл). Непосредственно после окончания амплификации проводят плавление полученных ампликонов в этом же приборе. Для проведения реакции плавления используют программу: канал регистрации FAM, начальная температура 94°С, конечная температура 65°С, шаг каждого этапа 0,5°С. Длительность процедуры не превышает 25 минут.
Праймеры подобраны таким образом, что полученные ампликоны, специфичные для ICE элементов индийского или мозамбикского типа у токсигенных штаммов Vibrio cholerae O1 Eltor, отличаются не только по размеру ампликона, но и по температуре плавления (см. таблицу 1).
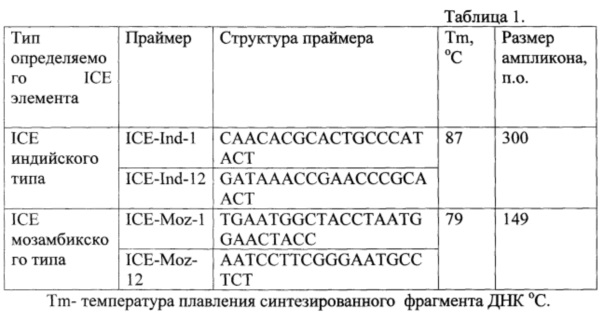
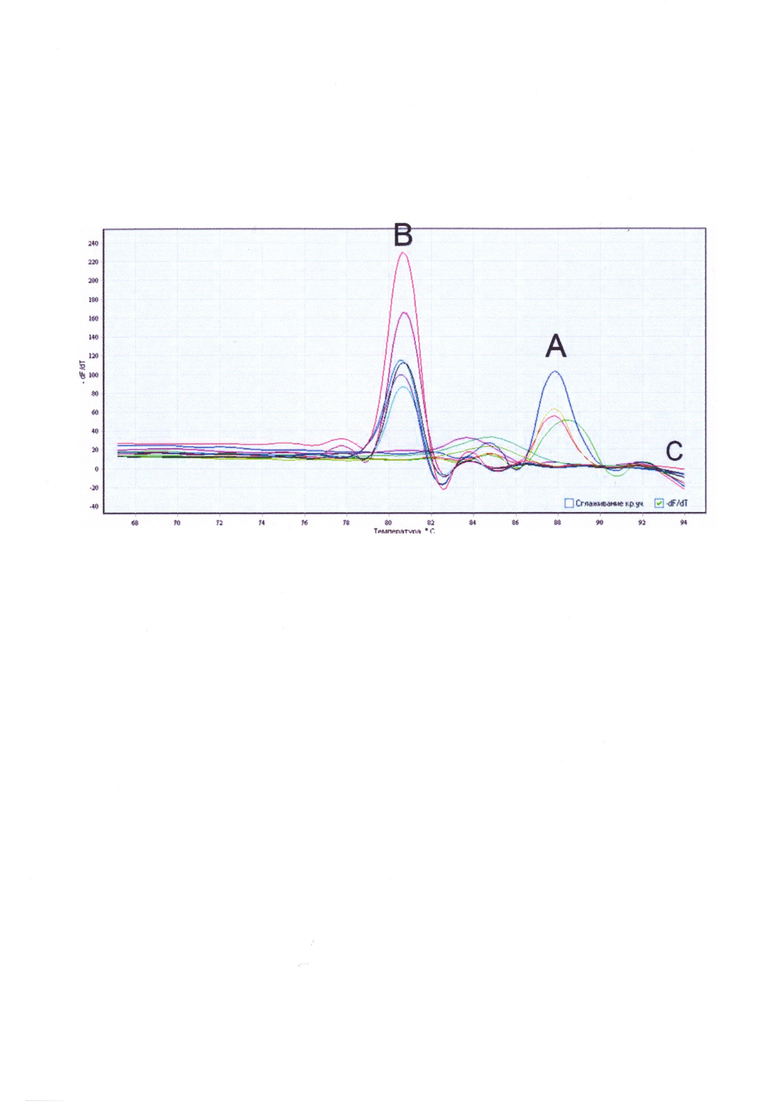
Учет результатов способа осуществляют по температуре плавления полученных ампликонов (см. рисунок). Различие в температуре плавления двух специфических ампликонов достигает 8°С. Это позволяет легко дискриминировать ICE индийского и мозамбикского типов. В случае если полученный продукт имеет температуру плавления 87°С, то регистрируют наличие ICE индийского типа (кривые А), плавление при 79°С характерно для ICE мозамбикского типа (кривые В) (см. таблицу 1 и рисунок).
На рисунке изображены кривые плавления специфических ампликонов ICE элемента у токсигенных штаммов Vibrio cholerae O1 Eltor, полученные в амплификаторе DTlite 5; обозначения: А - ампликоны ICE элементов индийского типа (температура плавления 87°С), В - ампликоны ICE элементов мозамбикского типа (температура плавления 79°С).
При отсутствии в исследуемой пробе ДНК ICE элементов индийского или мозамбикского типов специфические ампликоны не синтезируются и кривая плавления не содержит характерных пиков с температурой плавления 87°С и 79°С (кривые С).
Пример 1. ПЦР-анализ четырех культур Vibrio cholerae O1 Eltor, выделенных в Дагестане в 1993 году. Штаммы: 16302, 16303, 16304, 16312 взяты из коллекции Ростовского проивочумного института Роспотребнадзора (РПЧИ).
По технологии, приведенной выше, выделяют ДНК из исследуемой культуры токсигенного штамма, проводят постановку мультиплексную ПЦР со специфическими праймерами ICE индийского и мозамбикского типов, продукты амплификации подвергают плавлению и проводят учет результатов по температурным пикам плавления (см. таблицу 2).
Результаты, приведенные в таблице 2, свидетельствуют, что эпидемические события в республике Дагестан в 1993 году были вызваны заносом токсигенного штамма Vibrio cholerae O1 Eltor, содержащего ICE мозамбикского типа. Атоксигенный штамм 16312, выделенный в это же время, не содержит ICE элемент.
Пример 2. ПЦР-анализ девяти культур Vibrio cholerae O1 Eltor, выделенных в Дагестане в 1994 году.
Штаммы: 16312, 16228, 16262, 17322, 17356, 17446 из коллекции РПЧИ. Исследование проводили, как в примере 1. Результаты приведены в Таблице 3.
Из таблицы 3 видно, что эпидемические события в республике Дагестан в 1994 году, в отличие от вспышки 1993 года, были вызваны заносом двух типов токсигенных штаммов Vibrio cholerae O1 Eltor, содержащих ICE индийского типа (штаммы 16262 и 17296) и мозамбикского типа (шесть оставшихся культур). Полученные результаты ретроспективного анализа позволяют утверждать, что эпидемические события в республике Дагестан вызваны как минимум двумя заносами токсигенных штаммов Vibrio cholerae, которые получили распространение на данной территории.
Пример 3. ПЦР-анализ семи культур Vibrio cholerae O1 Eltor, выделенных на территории Российской Федерации в 2001-2013 гг. Штаммы: 18332, 19187, 301, 19191,81, 15, 2613 из коллекции РПЧИ.
Исследования проводят, как в примере 1.
Результаты приведены в таблице 4, из которой видно что, начиная с 2001 года, на территорию Российской Федерации происходят заносы токсигенных штаммов, содержащих только ICE индийского типа. В то же время в мире описана циркуляция токсигеных штаммов, содержащих ICE элементы двух типов (2). Атоксигенные штаммы 15 и 2613 не содержат ICE элементов.
Использование предлагаемого способа выявления ICE элементов у токсигенных штаммов Vibrio cholerae O1 Eltor позволяет выявлять уникальный генетический маркер штаммов Vibrio cholerae сероваров O1. Новое, простое в исполнении тестирование и невысокая себестоимость дает возможность применять его в практике работы специализированных учреждений, занимающихся мониторингом холеры.
Кроме того, на основании полученной информации о типе ICE элементов можно создавать базы данных о штаммах холерного вибриона, циркулирующих в различных регионах мира, сравнивая данные с эталонным маркером осуществлять молекулярное типирование.
Источники информации
1. B. М. R. N. S. Kutar, N. Rajpara, Н. Upadhyay, Т. Ramamurthy, А. К. В. Clinical Isolates оf Vibrio cholerae O1 El Tor Ogawa of 2009 from Kolkata, India: Preponderance of SXT Element and Presence of Haitian ctxB Variant// PLOS ONE | www.plosone.org February 2013 | Volume 8 | Issue 2 | e56477
2. Michel A. Marin, Erica L. Fonseca, Bruno N. Andrade, Adriana C. Cabral, Ana Carolina P. Vicente Worldwide Occurrence of Integrative Conjugative Element Encoding Multidrug Resistance Determinants in Epidemic Vibrio cholerae O1// PLOS ONE | www.plosone.org September 2014 | Volume 9 | Issue 9 | el08728
3. Waldor M.K, Tschape H., Mekalanos J.J. A new type of conjugative transposon encodes resistance to sulfamethoxazole, trimethoprim, and streptomycin in Vibrio cholerae O139//J Bacteriol 1996. 178: 4157-4165.
4. M. Spagnoletti, D. Ceccarelli, M.M. Colombo. Rapid detection by multiplex PCR of Genomic Islands, prophages and Integrative Conjugative Elements in V. cholerae 7th pandemic variants// Journal of Microbiological Methods 88 (2012) 98-102.
5. Методические указания МУ 1.3.2569-09 организация работы лабораторий, использующих методы амплификации и нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I-IV групп патогенности.
Праймеры для выявления ICE элементов индийского или мозамбикского типа у токсигенных штаммов Vibrio cholerae O1 Eltor с помощью мультиплексной ПЦР с учетом результатов по температуре плавления полученных амликонов.
Результат выявления ICE элементов у токсигенных штаммов Vibrio cholerae O1 Eltor, выделенных в Дагестане в 1993 году с помощью мультиплексной ПЦР с учетом результатов по температуре плавления полученных амликонов.

Результат выявления ICE элементов у токсигенных штаммов Vibrio cholerae O1 Eltor, выделенных в Дагестане в 1994 году с помощью мультиплексной ПЦР с учетом результатов по температуре плавления полученных амликонов.
Результат выявления ICE элементов у токсигенных штаммов и нетоксигенных Vibrio cholerae O1 Eltor, выделенных на территории Российской Федерации в 2001-2013 гг. с помощью мультиплексной ПЦР с учетом результатов по температуре плавления полученных ампликонов.
ICE-Ind-1 CAACACGCACTGCCCATACT
ICE-Ind-12 GATAAACCGAACCCGCAACT
ICE-Moz-1 TGAATGGCTACCTAATGGAACTACC
ICE-Moz-12 AATCCTTCGGGAATGCCTCT
Изобретение относится к области биохимии. Заявлен способ молекулярно-генетического внутривидового типирования токсигенных штаммов Vibrio cholerae O1 Eltor. Способ включает выделение ДНК из исследуемого штамма Vibrio cholerae O1 Eltor, постановку ПЦР со специфическими праймерами и учет полученных результатов. Амплификацию исследуемой ДНК проводят сконструированными праймерами к каждому из ICE элементов индийского и мозамбикского типов, в присутствии интеркалирующего красителя Siber Green. Затем продукты амплификации подвергают плавлению, учет результатов проводят по температурным пикам плавления и размеру ампликона. При температуре плавления 87°С и размере ампликона 300 п.о. регистрируют наличие ICE индийского типа. При температуре плавления 79°С и размере ампликона 149 п.о. регистрируют наличие ICE мозамбикского типа. Изобретение позволяет быстро и достоверно определять происхождение выделенных токсигенных штаммов V. cholerae O1 Eltor. 1 ил., 4 табл., 3 пр.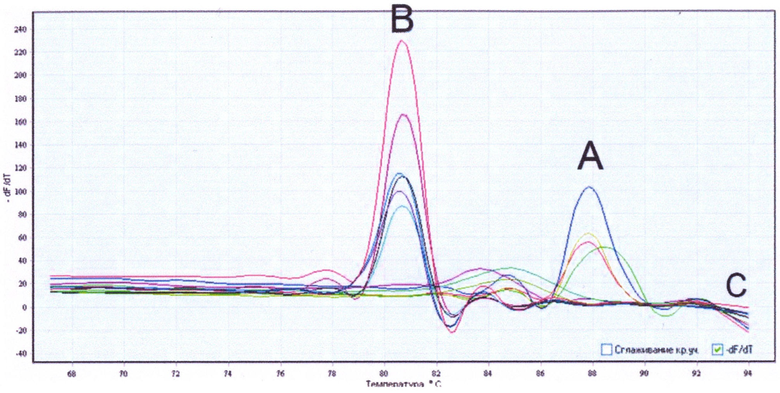
Способ молекулярно-генетического внутривидового типирования токсигенных штаммов Vibrio cholerae O1 Eltor, включающий выделение ДНК из исследуемого штамма Vibrio cholerae O1 Eltor, постановку ПЦР со специфическими праймерами и учет полученных результатов, отличающийся тем, что амплификацию исследуемой ДНК проводят сконструированными праймерами к каждому ICE элементов индийского и мозамбикского типов, в присутствии интеркалирующего красителя Siber Green, и состоящих из двух пар праймеров:
ICE-Ind-1 CAACACGCACTGCCCATACT
ICE-Ind-12 GATAAACCGAACCCGCAACT
и
ICE-Moz-1 TGAATGGCTACCTAATGGAACTACC
ICE-Moz-12 AATCCTTCGGGAATGCCTCT
при этом продукты амплификации подвергают плавлению в течение 25 минут в температурном интервале (65-94)°C с шагом каждого этапа 0,5°C, учет результатов проводят по температурным пикам плавления и размеру ампликона, если ампликоны синтезируются и показывают на кривой плавления характерные пики с температурой плавления 87°C и размером 300 п.о., то регистрируют наличие ICE индийского типа, а при температуре плавления 79°C и размере ампликона 149 п.о. подтверждают ICE мозамбикский тип.
| SPAGNOLETTI M | |||
| et al., Rapid detection by multiplex PCR of Genomic Islands, prophages and Integrative Conjugative Elements in V | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| TAVIANI E | |||
| et al., Genomic analysis of a novel integrative conjugative element in Vibrio cholerae, FEBS Letters, 2009, vol.583, pp.3630-3636 | |||
| СПОСОБ ИДЕНТИФИКАЦИИ ТОКСИГЕННЫХ ШТАММОВ V. CHOLERAE O1, ОПРЕДЕЛЕНИЯ ИХ БИОВАРА И ДИФФЕРЕНЦИАЦИИ ШТАММОВ БИОВАРА ЭЛЬТОР НА ТИПИЧНЫЕ И ИЗМЕНЕННЫЕ МЕТОДОМ МУЛЬТИПЛЕКСНОЙ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ И ТЕСТ-СИСТЕМА ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2011 |
|
RU2458141C1 |
| СПОСОБ ДЕТЕКЦИИ И ОПРЕДЕЛЕНИЯ БИОТИПА, СЕРОГРУППЫ И ТОКСИГЕННОСТИ ВОЗБУДИТЕЛЯ ХОЛЕРЫ И НАБОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2007 |
|
RU2360972C1 |
Авторы
Даты
2017-08-03—Публикация
2016-05-04—Подача