Предлагаемое изобретение относится к области медицинской микробиологии и генетической инженерии и может быть использовано в лабораторной диагностике при проведении мониторинга за холерой и проведении исследований связанных с изучением особенностей биологии возбудителя, включая идентификацию штаммов возбудителя холеры способных успешно конкурировать с нетоксигенными культурами.
Эндемичные по холере регионы, являющиеся источником многочисленных заносов возбудителя, находятся в южных широтах характеризующихся теплым климатом. Для обширной территории Российской Федерации характерна низкая температура осенне-зимнего периода.
В пробах воды поверхностных водоемов Российской Федерации регулярно обнаруживают нетоксигенные штаммы холерных вибрионов, что указывает на их возможное стабильное сохранение в окружающей среде в течение нескольких лет даже на территориях с холодным климатом (1-3). В тоже время выделение токсигенных культур из воды носит единичный и спорадический характер, причем практически все случаи являются завозными (4,5). Этот факт можно расценивать как отсутствие у токсигенных вибрионов механизмов способности успешно конкурировать с нетоксигенными культурами за счет устойчивости к неблагоприятному воздействию факторов внешней среды, в том числе к низким температурам. Совершенно очевидно, что токсигенный штамм, способный успешно конкурировать с нетоксигенными культурами, обитающими в водоемах РФ, будет представлять большую угрозу за счет повышенной выживаемости.
Вместе с тем, проведение полномасштабной работы по оценке внутривидовой конкуренции между токсигенными и нетоксигенными штаммами Vibrio cholerae невозможно без простых и точных методов, способных уверенно дифференцировать в смеси токсигенные и нетоксигенные штаммы.
Известен способ анализа внутривидовой конкуренции штаммов Vibrio cholerae с помощью INDEL-маркеров (6), заключающийся в том, что проводят ПЦР с праймерами к INDEL-маркеру «VC2429», позволяющего дифференцировать токсигенные и нетоксигенные штаммы холерных вибрионов, при этом токсигенные штаммы образовывали амплификат размером 100 п.о., а нетоксигенные штаммы из-за делеции участка в 16 нуклеотидов формировали амплификат размером 84 п.о.
Наиболее близким к предлагаемому изобретению по совокупности существенных признаков является способ выявления в одном образце нетоксигенных и токсигенных штаммов за счет способности формировать при проведении ПЦР с использованием праймеров к INDEL-локусу 1699 ампликоны различной молекулярной массы массой. Нетоксигенные культуры формируют ампликон массой 132 п.о., а токсигенные - массой 116 п.о. (7)
Недостатком данного способа является невозможность точной оценки количества токсигенных и нетоксигенных вибрионов в исследуемом образце по интенсивности полосы специфического ампликона.
Кроме того, проведение данного способа требует помимо постановки ПЦР этапа электрофоретического анализа для определения размера ампликона.
Осуществление электрофореза требует дополнительного времени, наличия сложного оборудования (как минимум, печи для плавления агарозы, прибора для проведения электрофореза, источника тока, трансиллюминатора, регистрирующей аппаратуры, набора расходных материалов) и средств защиты персонала.
При этом в соответствии с действующими нормативными документами (МУ 1.3.2569-09) для учета результатов реакции амплификации нуклеиновых кислот методом электрофореза необходима отдельная рабочая зона 4-1 которая должна быть расположена изолировано от других помещений для предотвращения контаминации продуктами амплификации через воздушный поток. Дополнительной трудностью при проведении работ по использованию электрофореза является необходимость проведения комплекса мероприятий по дегазации образовавшихся отходов (гели и буферы), содержащих крайне опасный интеркалирующий агент - бромистый этидий.
Технической задачей предлагаемого изобретения является разработка нового способа, позволяющего быстро и достоверно проводить оценку внутривидовой конкуренции токсигенных и нетоксигенных штаммов Vibrio cholerae O1 и O139 серогруппы с помощью мультиплексной ПЦР в формате реального времени.
Поставленная задача достигается тем, что в способе оценки внутривидовой конкуренции токсигенных и нетоксигенных штаммов Vibrio cholerae O1 и O139 с помощью ПЦР в режиме реального времени, включающем выделение ДНК из исследуемого материала, постановку ПЦР со специфическими праймерами и последующим анализом реакции амплификации, отличие заключается в том, что амплификацию исследуемой ДНК проводят с помощью двух пар праймеров и двух зондов:
ctxA5; GTTCCTCTTGCATGATCATAAAG
ctxA6; TATCGGGCAGATTCTAGACC
ctxA5Z; /ROX/-ACTCTGTCCTCTTGGCATAAGACCACCT-/BHQ2/
и
cold1 ACAGGTTCGGTTAAGTGGTTT
cold2 ACCTGAAGTGATCGAATTGAAGT
coldZ_12 /R6G/ACTCCTGATAGTGGCGGCTCTGA /BHQ1/
при этом в одной пробе одновременно определяют концентрацию токсигенных и нетоксигенных холерных вибрионов, первая пара праймеров и зонд ctxA5Z фиксируют токсигенные вибрионы по присутствию гена ctx, а вторая пара использует в качестве маркерного гена для нетоксигенных штаммов ген холодового шока csh1, оценку внутривидовой конкуренции проводят по каналам HEX и ROX количества мишеней стандартных образцов ДНК, количественный результат вносят в соответствующие графы протокола, которые выражаются в виде десятичного логарифма количества клеток, чем больше концентрация при низких температурах, тем выше конкуренция штамма в возможности выживания.
При этом перед постановкой ПЦР готовят стандартные препараты, содержащие известное количество ДНК токсигенных и нетоксигенных Vibrio cholerae, для этого массу токсигенного и нетоксигенного штаммов выращивают в течение суток на агаре Мартена рН 7,4 при температуре 37°С, потом готовят 1 млрд. бактериальной взвеси в 0,9% растворе хлорида натрия при рН 7,2 по стандартным образцам мутности, которые 10-кратно разводят до разведения 103, после смешивают полученные суспензии в разных разведениях, содержащих 108, 107 и 106 м.к./мл токсигенного и нетоксигенного штаммов, затем из трех полученных образцов выделяют ДНК, которые хранят при температуре 4°С до 30 суток для использования при постановке ПЦР.
Кроме того, ПЦР проводят в объеме 25 мкл, и реакционная смесь содержит: 2,5 мкл буфера, 1 Ед Taq ДНК-полимеразы, 0,2 мкМ смеси дНТФ, 1,0 мкМ каждого из четырех праймеров ctxA5, ctxA6 и зонд ctxA5Z, меченный по ROX для выявления токсигенных вибрионов по наличию гена ctx, cold1, cold2 и зонд coldZ_12, меченный по R6G, 0,5 мкМ каждого из двух праймеров 5 мкл ДНК -ДНК матрицы, оставшийся объем - вода.
При этом ПЦР реакции проводят с соблюдением режимов: денатурация при 95°С - 2 мин (1 цикл); затем 30 циклов: денатурация при 95°С - 20 с, отжиг и учет по каналу FAM при 67°С - 20 с.
Обоснование выбора праймеров.
Важнейшим этапом при разработке ПЦР, обеспечивающим получение корректного результата, является правильный подбор мишеней для посадки праймеров. С помощью комплекса программного обеспечения, разработанного в ФКУЗ Ростовский-на-Дону противочумный институт Роспотребнадзора были проанализированы нуклеотидные последовательности с целью поиска генов характерных токсигенных и нетоксигенных штаммов холерного вибриона. В качестве гена, характерного для токсигенных штаммов выбран ген ctx, детерминирующий продукцию холерного токсина. В качестве маркерного гена для нетоксигенных штаммов выбран ген csh1, детерминирующий продукцию гена холодового шока (8).
В результате были сконструированы две пары праймеров первая пара ctxA5- ctxA6 и зонд ctxA5Z, меченный по ROX для выявления токсигенных вибрионов по наличию гена ctx и вторая пара cold1- cold2 и зонд coldZ_12, меченный по R6G:
ctxA5; GTTCCTCTTGCATGATCATAAAG
ctxA6; TATCGGGCAGATTCTAGACC
ctxA5Z; /ROX/-ACTCTGTCCTCTTGGCATAAGACCACCT-/BHQ2/
и
cold1 ACAGGTTCGGTTAAGTGGTTT
cold2 ACCTGAAGTGATCGAATTGAAGT
coldZ_12[R6G] ACTCCTGATAGTGGCGGCTCTGA[BHQ1
Объектом защиты настоящего изобретения является набор из двух пар праймеров и двух зондов первая пара ctxA5- ctxA6 и зонд ctxA5Z, меченный по ROX для выявления токсигенных вибрионов по наличию гена ctx и вторая пара cold1- cold2 и зонд coldZ_12, меченный по R6G для выявления нетоксигенных вибрионов по наличию гена холодового шока csh1. Результат достигается тем, что при постановке ПЦР в формате реального времени учет количества токсигенных и нетоксигенных клеток проводят каналам HEX и ROX амплификатора относительно стандартных образцов.
Способ осуществляется следующим образом.
Перед постановкой ПЦР проводят приготовление стандартных препаратов, содержащих известное количество ДНК токсигенных и нетоксигенных Vibrio cholerae. С этой целью Vibrio cholerae выращивают в течение суток на агаре Мартена рН 7,4±0,2 при температуре 37°С. Далее готовят 1 млрд. бактериальные взвеси в 0,9% растворе хлорида натрия (рН 7,2±0,1) по стандартным образцам мутности, которые 10-кратно разводят до разведения 103. Затем смешивают полученные суспензии в разных разведениях для получения суспензий, содержащих 108, 107 и 106 м.к./мл токсигенного и нетоксигенного штаммов.
Из трех полученных образцов выделяют ДНК как принято (Метод. МУ 1.3.1791-9 «Организ. работы при исследовании методом ПЦР материала, инфицированного микроорганизмами 1 и 2 группы патогенности-М.2003-38 с») с помощью любого коммерческого набора для выделения ДНК. Полученные таким образом препараты ДНК стандартов, содержащие по 108, 107и 106 м.к./мл токсигенного и нетоксигенного штаммов, хранят при 4°С до 30 суток и используют при постановке ПЦР.
Постановку ПЦР проводят согласно МУ 1.3.2569-09 с использованием двух пар праймеров и двух зондов первая пара ctxA5- ctxA6 и зонд ctxA5Z, меченный по ROX для выявления токсигенных вибрионов по наличию гена ctx и вторая пара cold1 - cold2 и зонд coldZ_12, меченный по R6G. В качестве стандартов используют три ранее полученных препарата ДНК стандартов.
Инкубационная смесь объемом 25 мкл содержит: 2,5 мкл буфера, 1 Ед Taq ДНК-полимеразы, 0,2 мкМ смеси дНТФ, (производства ЗАО Евроген, Москва), 1,0 мкМ каждого из четырех праймеров ctxA5, ctxA6 и зонд ctxA5Z, меченный по ROX для выявления токсигенных вибрионов по наличию гена ctx, cold1, cold2 и зонд coldZ_12, меченный по R6G, 0,5 мкМ каждого из двух праймеров 5 мкл ДНК -ДНК матрицы, оставшийся объем - вода.
Амплификацию проводят в амплификаторе, например, (DTlite5 производства НПФ, ДНК-технология), по следующей схеме: денатурация при 95°С - 2 мин (1 цикл); затем 30 циклов: денатурация при 95°С - 20 с, отжиг и учет по каналу FAM при 67°С - 20 с.
Учет проводят для выявления нетоксигенных вибрионов по каналу HEX, а токсигенных вибрионов по каналу ROX.
Для количественного учета ПЦР в соответствующие графы протокола вносят данные о количестве мишеней в стандартных образцах ДНК. Результат выражают в виде десятичного логарифма количества клеток используя встроенное программное обеспечение амплификатора.
Сущность предлагаемого изобретения поясняется следующими примерами:
Пример 1. Анализ внутривидовой конкуренции токсигенного штамма Vibrio cholerae O139 №16077 ctx+tcpA+csh1- и нетоксигенного штамма Vibrio cholerae O1 №20000 ctx-tcpA-csh1+ в биопленке на хитиновом субстрате с помощью мультиплексной ПЦР в формате реального времени. Для проведения примеров все культуры взяты из коллекции Ростовского противочумного института.
Способ проводят по этапам:
Первоначально получают препарат хитина как описано (Патент RU 2685878) (7), для этого панцири широкопалого речного рака Astacusastacus разрезают на фрагменты величиной порядка 0,5×0,5 мм, помещают в количестве 10-15 штук во флакон емкостью 100 мл содержащий 30 мл отстоянной речной воды и автоклавируют 10 минут при 120°С. После охлаждения во флакон вносят взвесь исследуемых культур V. cholerae O139№. 16077 ctx+tcpA+csh1- и Vibrio cholerae O1 №20000 ctx-tcpA-csh1+ до конечной концентрации 104 м.к./мл. Инкубацию проводят при 25°С в течение 7 суток. Далее эти же образцы сформировавшихся зрелых биопленок переносят в условия 10°С и 25°С и продолжают инкубацию.
Образцы зрелой биопленки, сформированной токсигенным Vibrio cholerae O139 №16011 ctx+tcpA+csh1- и атоксигенным штаммом Vibrio cholerae O1 №20000 ctx-tcpA-csh1+ на хитиновом субстрате, получали как описано выше.
Анализ результатов образования биопленок проводят вторым этапом с помощью ПЦР. Предварительно в необходимые интервалы времени пластинки хитина извлекают стерильным пинцетом, избыток жидкости удаляют стерильной фильтровальной бумагой. Каждую отдельную пластинку переносят в пробирку емкостью 1,5 мл, содержащую 0,5 мл дистиллированной воды. Затем проводят лизис клеток и выделение путем прогревания при 99°С в течение 30 минут. Далее проводят высев на специфическую стерильность. Полученный препарат хранят при 4°С.
Постановку ПЦР проводят согласно МУ 1.3.2569-09 с использованием двух пар праймеров и двух зондов первая пара ctxA5- ctxA6 и зонд ctxA5Z, меченный по ROX для выявления токсигенных вибрионов по наличию гена ctx и вторая пара cold1 - cold2 и зонд coldZ_12, меченный по R6G. В качестве стандартов используют три ранее полученных препарата ДНК стандартов.
Инкубационная смесь объемом 25 мкл содержит: 2,5 мкл буфера, 1 Ед Taq ДНК-полимеразы, 0,2 мкМ смеси дНТФ, (производства ЗАО Евроген, Москва), 1,0 мкМ каждого из четырех праймеров ctxA5, ctxA6 и зонд ctxA5Z, меченный по ROX для выявления токсигенных вибрионов по наличию гена ctx, cold1, cold2 и зонд coldZ_12, меченный по R6G, 0,5 мкМ каждого из двух праймеров 5 мкл ДНК -ДНК матрицы, оставшийся объем - вода.
Амплификацию проводят в амплификаторе, например, (DTlite5 производства НПФ, ДНК-технология), по следующей схеме: денатурация при 95°С - 2 мин (1 цикл); затем 30 циклов: денатурация при 95°С - 20 с, отжиг и учет по каналу FAM при 67°С - 20 с.
Учет проводим по каналам HEX и ROX. Для количественного учета ПЦР в соответствующие графы протокола вносят данные о количестве мишеней в стандартных образцах ДНК. Результат выражают в виде десятичного логарифма количества клеток используя встроенное программное обеспечение амплификатора.
Результаты анализ внутривидовой конкуренции штаммов токсигенного штамма Vibrio cholerae O139 №16077ctx+tcpA+csh1- и нетоксигенного штамма Vibrio choleraeO1 №20000 ctx-tcpA-csh1+ в зрелой биопленке на хитиновом субстрате с помощью мультиплексной ПЦР в формате реального времени представлены в таблице 1.
Из таблицы видно, что при температуре 25°С концентрация токсигенных и нетоксигенных V. cholerae в составе биопленки на хитиновом субстрате до 21 суток нарастала на четыре-пять порядков по сравнению с первоначальной инфицирующей дозой. При этом разница в концентрации между токсигенным и нетоксигенным штаммов не превышала полтора порядка. Это наблюдение указывает, что клетки токсигенной культуры V. cholerae O139 №.16077 при 25°С способны противостоять ингибирующей активности V cholerae O1 №20000 и сохраняться на биотическом субстрате в составе зрелой биопленки.
При инкубации зрелой биопленки при пониженной температуре 10°С, концентрация токсигенного штамма V. cholerae к 14 суткам снижалась на 2,5 порядка в то время как концентрация нетоксигенного штамма 20000 сохранялась на прежнем уровне.
Полученные данные свидетельствуют, что предлагаемый способ оценки внутривидовой конкуренции штаммов V. cholerae с помощью мультиплексной ПЦР в формате реального времени позволяет в одной пробирке количественно определять концентрацию токсигенного и нетоксигенного штаммов V. cholerae в составе биопленки. Токсигенный штамм Vibrio cholerae Q139 №16077 обладает сниженной способностью к выживанию при 10°С по сравнению с условиями при 25°С.
Пример 2. Анализ внутривидовой конкуренции штаммов токсигенного штамма Vibrio cholerae O1 №19613ctx+tcpA+csh1- и нетоксигенного штамма Vibrio cholerae O1 №20000 ctx-tcpA-csh1+ в зрелой биопленке на хитиновом субстрате с помощью мультиплексной ПЦР в формате реального времени.
Образцы зрелой биопленки, сформированной токсигеннымУШгю cholerae O1 №19613 ctx+tcpA+csh1- и нетоксигенным штаммом Vibrio cholerae O1 №20000 ctx-tcpA-csh1+, получали как описано выше.
Результаты анализа внутривидовой конкуренции штаммов токсигенного штамма V. cholerae O1 №19613ctx+tcpA+csh1- и нетоксигенного штамма Vibrio cholerae O1 №20000 ctx-tcpA-csh1+ в зрелой биопленке на хитиновом субстрате с помощью мультиплексной ПЦР в формате реального времени смотри таблицу 2.
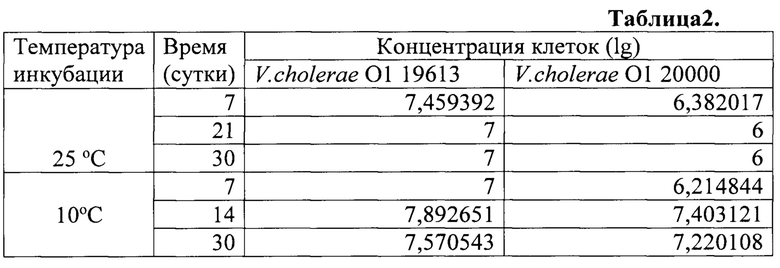
Полученные результаты свидетельствуют, что в составе биопленки на хитиновом субстрате клетки токсигенного штамма V. cholerae O1 №19613 успешно противостоят конкурентной активности нетоксигенного штамма V. cholerae O1 №20000 при двух изученных температурах инкубации 25°С и 10°С.
Этим они отличаются от клеток V. cholerae O139 №16077, неспособных конкурировать с клетками нетоксигенного штамма V. cholerae O1 №20000 при 10°С. Данный результат объясняет отсутствие укоренения штаммов V. cholerae серовара O139.
Пример 3. Анализ внутривидовой конкуренции штаммов токсигенного штамма V.cholerae O1 №19613 ctx+tcpA+csh1- и нетоксигенного штамма Vibrio cholerae O1 №20000 ctx-tcpA-csh1+ в зрелой биопленке на пластиковом субстрате с помощью мультиплексной ПЦР в формате реального времени.
Образцы зрелой биопленки, сформированной токсигенным Vibrio cholerae O1 №19613 ctx+tcpA+csh1- и нетоксигенным штаммом Vibrio cholerae O1 №20000 ctx-tcpA-csh1+ на пластиковом субстрате, получают как описано в примере 1.
С этой целью фрагменты пищевого пластика величиной порядка 0,5×0,5 мм, помещают в количестве 10-15 штук во флакон емкостью 100 мл содержащий 30 мл отстоянной речной воды и автоклавируют 10 минут при 120°С. Далее все манипуляции проводили как описано в Примерах 1 и 2.
Результаты анализа внутривидовой конкуренции штаммов токсигенного штамма V.cholerae O1 №9613ctx+tcpA+csh1- и нетоксигенного штамма Vibrio cholerae O1 №20000 ctx-tcpA-csh1+ в зрелой биопленке на пластиковом субстрате с помощью мультиплексной ПЦР в формате реального времени, смотри таблицу 3.
Вывод в составе биопленки на пластиковом субстрате клетки токсигенного штамма Vcholerae O1 №19613 неспособны противостоят конкурентной активности нетоксигенного штамма V. cholerae O1 №20000 при 25°С поскольку к 21 и 30 суткам инкубации отсутствует ДНК токсигенного штамма, в то время как концентрация нетоксигенного штамма V. cholerae O1 №20000 сохраняется в пределах исходной величины. При снижении температуры инкубации до 10°С клетки токсигенного штамма V. cholerae O1 №19613 неспособны формировать биопленку, поскольку биопленка представлена исключительно клетками нетоксигенного штамма V. cholerae O1 №20000.
Пример 4. Анализ внутривидовой конкуренции штаммов токсигенного штамма Vibrio cholerae O139 №17259ctx+tcpA+csh1- и ненетоксигенного штамма Vibrio cholerae O1 №20000 ctx-tcpA-csh1+ в планктонной форме в стерильной речной воды с помощью мультиплексной ПЦР в формате реального времени
В заданные интервалы времени отбирают 0,5 мл пробыречной воды, проводят лизис клеток и выделяют ДНК путем прогревания при 99°С в течение 30 минут. Далее проводят высев на специфическую стерильность. Полученный препарат до проведения мультиплексной ПЦР в формате реального времени хранят при 4°С.
Результаты анализа внутривидовой конкуренции штаммов токсигенного штамма Vibrio cholerae O139 №17259 ctx+tcpA+csh1- и ненетоксигенного штамма Vibrio cholerae O1 №20000 ctx-tcpA-csh1+в планктонной форме в стерильной речной воде с помощью мультиплексной ПЦР в формате реального времени отражены в таблице4.
Полученные результаты свидетельствуют, что при 25°С в стерильной речной воде планктонная форма токсигенного штамма Vibrio cholerae O139 №11259 ctx+tcpA+csh1- успешно конкурируют с неатоксигенным штаммом Vibrio cholerae O1 №2000 ctx-tcpA-csh1+. Однако при 10°С количество клеток нетоксигенного штамма Vibrio cholerae O1 №20000 ctx-tcpA-csh1+ более чем в 100 раз превышает аналогичный показатель токсигенного штамма. Это свидетельствует об сниженной способности токсигенного штамма Vibrio cholerae O139 №17259 ctx+tcpA+csh1- к выживанию при низких температурах.
Во всех примерах время проведения ПЦР и получения результата с момента получения образцов ДНК не превышало 1,5 часов.
Использование предлагаемого изобретения позволяет быстро и достоверно за счет подбора двух пар праймеров и двух зондов с помощью ПЦР в формате реального времени проводить оценку внутривидовой конкуренции штаммов Vibrio cholerae O1 и O139, что крайне важно при проведении мониторинга за холерой и анализе биологических свойств в случае выделения токсигенных штаммов Vibrio cholerae O1 и O139 серогрупп и их оценки к выживанию в водоемах при пониженной температуре.
Источники информации.
1. Москвитина Э.А., Мазрухо А.Б., Адаменко О.Л., Кругликов В.Д.,«Холера в начале XXI века. Прогноз на глобальном уровне» // Проблемы особо опасных инфекций. 2012. №. 1. С. 11-16.
2. Носков А.К., Кругликов В.В., Лопатин А.А., Чемисова О.С., Левченко Д.А., Иванова С.М., Монахова Е.В., Архангельская И.В., Водопьянов А.С., Гаевская Н.Е., Подойницына О.А., Ежова М.И., «Результаты мониторинга холеры на административных территориях России в период с 2013 по 2019 год» // Журнал микробиологии, эпидемиологии и иммунобиологии. 2021. №.2. С. 163-175.
3. Носков А.К., Кругликов В.В., Лопатин А.А., Чемисова О.С., Левченко Д.А., Иванова С.М., Монахова Е.В., Архангельская И.В., Водопьянов А.С., Гаевская Н.Е., Подойницына О.А., Ежова М.И., «Результаты мониторинга холеры на административных территориях России в период с 2013 по 2019 год» // Журнал микробиологии, эпидемиологии и иммунобиологии. 2021. №. 2. С. 163-175
4. Титова С.В., Кругликов В.Д., Ежова М.И., Водопьянов А.С., Архангельская И.В., Водопьянов C.O., Москвитина Э.А., «Анализ динамики выделения и биологических свойств штаммов V. cholerae O1 ElTor, изолированных из водных объектов на территории Ростовской области в 2003-2014 гг.» // Здоровье населения и среда обитания. 2015. №2. С. 39-41.
5. Савельев В.Н., Ковалев Д.А., Савельева И.В., Таран Т.В., Подопригора Е.И., Васильева О.В., Шапаков Н.А., Алехина Ю.А., Куличенко А.Н., «Эволюция фенотипических свойств и молекулярно-генетической организации геномов штаммов Vibrio cholerae O1 биовара Эль Тор, выделенных от больных и из объектов окружающей среды на Кавказе с 1970 по 1998 год.», журнал Здоровье населения и среда обитания - ЗНиСО. 2020; (Т2): 56-61. https://doi.org/10.35627/2219-5238/2020-333-12-56-61
6. «Анализа внутривидовой конкуренции штаммов Vibrio cholerae с помощью INDEL-маркеров», Водопьянов C.O., Водопьянов А.С, Олейников И.П., Лысова Л.К., Титова С.В., журнал Здоровье населения и среда обитания, 2016 г., №4. С. 35-38.)
7. «Способ моделирования биопленок, формируемых Vibriocholerae 01 серогруппы на поверхности хитина », патент №2685878, кл. C12N 11/00, опубл. 23.04.2019 №12.
8.«Способ выявления гена холодового шока csh1 у штаммов Vibriocholerae с помощью ПЦР в режиме реального времени», патент №2783023, кл. C12N 15/00, C12Q 1/68, опубл. 08.11.2022 г., Бюл. №31.
--->
<?xml version="1.0" encoding="UTF-8"?>
<!DOCTYPE ST26SequenceListing PUBLIC "-//WIPO//DTD Sequence Listing
1.3//EN" "ST26SequenceListing_V1_3.dtd">
<ST26SequenceListing originalFreeTextLanguageCode="ru"
nonEnglishFreeTextLanguageCode="ru" dtdVersion="V1_3"
fileName="Титова- конкуренция.xml" softwareName="WIPO Sequence"
softwareVersion="2.2.0" productionDate="2023-03-23">
<ApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>186</ApplicationNumberText>
<FilingDate>2023-03-23</FilingDate>
</ApplicationIdentification>
<ApplicantFileReference>186</ApplicantFileReference>
<ApplicantName languageCode="ru">Ростовский- на –Дону противочумный
институт Роспотребнадзора</ApplicantName>
<ApplicantNameLatin>Rostov-on-Don Plague Control Research Institute
of the Rospotrebnadzor</ApplicantNameLatin>
<InventorName languageCode="ru">Водопьянов Сергей
Олегович</InventorName>
<InventorNameLatin>Vodopyanov Sergey Olegovich</InventorNameLatin>
<InventionTitle languageCode="ru">Способ оценки внутривидовой
конкуренции токсигенных и атоксигенных штаммов Vibrio cholerae 01 и
0139 серогруппы с помощью ПЦР в режиме реального
времени</InventionTitle>
<SequenceTotalQuantity>6</SequenceTotalQuantity>
<SequenceData sequenceIDNumber="1">
<INSDSeq>
<INSDSeq_length>23</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..23</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>genomic DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q2">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>Vibrio cholerae</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>gttcctcttgcatgatcataaag</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="2">
<INSDSeq>
<INSDSeq_length>20</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..20</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>genomic DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q4">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>Vibrio cholerae </INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>tatcgggcagattctagacc</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="3">
<INSDSeq>
<INSDSeq_length>28</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..28</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>genomic DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q6">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>Vibrio cholerae </INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>actctgtcctcttggcataagaccacct</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="4">
<INSDSeq>
<INSDSeq_length>21</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..21</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>genomic DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q8">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>Vibrio cholerae </INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>acaggttcggttaagtggttt</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="5">
<INSDSeq>
<INSDSeq_length>23</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..23</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>genomic DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q10">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>Vibrio cholerae </INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>acctgaagtgatcgaattgaagt</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="6">
<INSDSeq>
<INSDSeq_length>23</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..23</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>genomic DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q12">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>Vibrio cholerae</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>actcctgatagtggcggctctga</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
</ST26SequenceListing>
<---
Изобретение относится к области медицинской микробиологии и генетической инженерии. Описан способ оценки токсигенных и нетоксигенных штаммов Vibrio cholerae O1 и O139 серогрупп с помощью ПЦР в режиме реального времени. Выделяют ДНК из исследуемого материала, осуществляют постановку ПЦР со специфическими праймерами и последующим анализом реакции амплификации. Амплификацию исследуемой ДНК проводят с помощью двух пар праймеров и двух зондов: ctxA5; GTTCCTCTTGCATGATCATAAAG, ctxA6; TATCGGGCAGATTCTAGACC, ctxA5Z; /ROX/-ACTCTGTCCTCTTGGCATAAGACCACCT-/BHQ2/ и cold1 ACAGGTTCGGTTAAGTGGTTT, cold2 ACCTGAAGTGATCGAATTGAAGT, coldZ_12 /R6G/ACTCCTGATAGTGGCGGCTCTGA /BHQ1/. В одной пробе одновременно определяют концентрацию токсигенных и атоксигнных холерных вибрионов. Первая пара праймеров и зонд ctxA5Z фиксируют токсигенные вибрионы по присутствию гена ctx, а вторая пара использует в качестве маркерного гена для нетоксигенных штаммов ген холодового шока csh1. Оценку внутривидовой конкуренции проводят по каналам HEX и ROX амплификатора относительно количества мишеней стандартных образцов ДНК, количественный результат вносят в соответствующие графы протокола, которые выражаются в виде десятичного логарифма количества клеток, чем больше концентрация при низких температурах, тем выше конкуренция штамма в возможности выживания. При этом перед постановкой ПЦР готовят стандартные препараты, содержащие известное количество ДНК токсигенных и нетоксигенных Vibrio cholerae, для этого массу токсигенного и нетоксигенного штаммов выращивают в течение суток на агаре Мартена рН 7,4 при температуре 37°С, потом готовят 1 млрд. бактериальной взвеси в 0,9% растворе хлорида натрия при рН 7,2 по стандартным образцам мутности, которые 10-кратно разводят до разведения 103, после смешивают полученные суспензии в разных разведениях, содержащих 108, 107 и 106 м.к./мл токсигенного и нетоксигенного штаммов, затем из трех полученных образцов выделяют ДНК, которые хранят при температуре 4°С до 30 суток для использования при постановке ПЦР. Кроме того, ПЦР проводят в объеме 25 мкл, и реакционная смесь содержит: 2,5 мкл буфера, 1 Ед Taq ДНК-полимеразы, 0,2 мкМ смеси дНТФ, 1,0 мкМ каждого из четырех праймеров ctxA5, ctxA6 и зонд ctxA5Z, меченный по ROX для выявления токсигенных вибрионов по наличию гена ctx, cold1, cold2 и зонд coldZ_12, меченный по R6G,0,5 мкМ каждого из двух праймеров 5 мкл ДНК -ДНК матрицы, оставшийся объем - вода. ПЦР реакции проводят с соблюдением режимов: денатурация при 95°С - 2 мин (1 цикл); затем 30 циклов: денатурация при 95°С - 20 с, отжиг и учет по каналу FAM при 67°С - 20 с. Изобретение может быть использовано в лабораторной диагностике при проведении мониторинга за холерой и проведении исследований связанных с изучением особенностей биологии возбудителя, включая идентификацию штаммов возбудителя холеры, способных успешно конкурировать с нетоксигенными культурами. 3 з.п. ф-лы, 4 табл., 4 пр.
1. Способ оценки внутривидовой конкуренции токсигенных и нетоксигенных штаммов Vibrio cholerae O1 и O139 серогрупп с помощью ПЦР в режиме реального времени, включающий выделение ДНК из исследуемого материала, постановку ПЦР со специфическими праймерами и последующим анализом реакции амплификации, отличающийся тем, что амплификацию исследуемой ДНК проводят с помощью двух пар праймеров и двух зондов:
ctxA5; GTTCCTCTTGCATGATCATAAAG
ctxA6;TATCGGGCAGATTCTAGACC
ctxA5Z; /ROX/-ACTCTGTCCTCTTGGCATAAGACCACCT-/BHQ2/
и
cold1 ACAGGTTCGGTTAAGTGGTTT
cold2 ACCTGAAGTGATCGAATTGAAGT
coldZ_12 /R6G/ACTCCTGATAGTGGCGGCTCTGA /BHQ1/,
при этом в одной пробе одновременно определяют концентрацию токсигенных и атоксигнныххолерных вибрионов, первая пара праймеров и зонд ctxA5Z фиксируют токсигенныевибрионы по присутствию гена ctx, а вторая пара использует в качестве маркерного гена для нетоксигенных штаммов ген холодового шока csh1, оценку внутривидовой конкуренции проводят по каналам HEX и ROX амплификатора относительно количества мишеней стандартных образцовДНК, количественный результат вносят в соответствующие графы протокола, которые выражаются в виде десятичного логарифма количества клеток, чем больше концентрация при низких температурах, тем выше конкуренция штамма в возможности выживания.
2. Способ по п. 1, отличающийся тем, что перед постановкой ПЦР готовят стандартные препараты, содержащие известное количество ДНК токсигенных и нетоксигенных Vibrio cholerae, для этого массу токсигенного и нетоксигенного штаммов выращивают в течение суток на агаре Мартена рН 7,4 при температуре 37°С, потом готовят 1 млрд. бактериальной взвеси в 0,9% растворе хлорида натрия при рН 7,2 по стандартным образцам мутности, которые 10-кратно разводят до разведения 103, после смешивают полученные суспензии в разных разведениях, содержащих 108, 107 и 106 м.к./мл токсигенного и нетоксигенного штаммов, затем из трех полученных образцов выделяют ДНК, которые хранят при температуре 4°С до 30 суток для использования при постановке ПЦР.
3. Способ по п. 1, отличающийся тем, что ПЦР проводят в объеме 25 мкл и реакционная смесь содержит: 2,5 мкл буфера, 1 Ед Taq ДНК-полимеразы, 0,2 мкМ смеси дНТФ, 1,0 мкМ каждого из четырех праймеров ctxA5, ctxA6 и зонд ctxA5Z, меченный по ROX для выявления токсигенных вибрионов по наличию гена ctx.cold1, cold2 и зонд coldZ_12, меченный по R6G,0,5 мкМ каждого из двух праймеров 5 мкл ДНК -ДНК матрицы, оставшийся объем - вода.
4. Способ по п. 1, отличающийся тем, что ПЦР реакции проводят с соблюдением режимов: денатурация при 95°С - 2 мин (1 цикл); затем 30 циклов: денатурация при 95°С - 20 с, отжиг и учет по каналу FAM при 67°С -20 с.
| СПОСОБ ВЫЯВЛЕНИЯ ТОКСИГЕННЫХ ШТАММОВ 01 VIBRIO CHOLERAE "ПОСТГАИТЯНСКОЙ" ЛИНИИ МЕТОДОМ ПЦР В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ | 2021 |
|
RU2766192C1 |
| СПОСОБ ОДНОВРЕМЕННОЙ ИДЕНТИФИКАЦИИ ТОКСИГЕННЫХ ШТАММОВ ГЕНОВАРИАНТОВ ВОЗБУДИТЕЛЯ ХОЛЕРЫ ЭЛЬ ТОР И ИХ ДИФФЕРЕНЦИАЦИИ ПО ЭПИДЕМИЧЕСКОМУ ПОТЕНЦИАЛУ МЕТОДОМ МУЛЬТИПЛЕКСНОЙ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ | 2014 |
|
RU2560280C2 |
| СПОСОБ ДЕТЕКЦИИ И ОПРЕДЕЛЕНИЯ БИОТИПА, СЕРОГРУППЫ И ТОКСИГЕННОСТИ ВОЗБУДИТЕЛЯ ХОЛЕРЫ И НАБОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2007 |
|
RU2360972C1 |
| CN 111826316 A, 27.10.2020 | |||
| US 20200299360 A1, 24.09.2020. | |||
Авторы
Даты
2023-11-01—Публикация
2023-04-19—Подача