Предполагаемое изобретение относится к области медицинской микробиологии и генетической инженерии и может быть использовано в лабораторной диагностике при проведении мониторинга за холерой и проведении исследований связанных с изучением особенностей биологии возбудителя, включающего идентификацию генетических структур, обеспечивающих адаптацию холеры к неблагоприятным факторам внешней среды.
Одним из уникальных факторов внешней среды, актуальных для на территории Российской Федерации, является низкая температура, характерная для осеннее-зимнего периода. В то же время эндемичные по холере регионы, являющиеся источником многочисленных заносов возбудителя, находятся в южных широтах, для которых не характерны периоды холодной погоды. Тем не менее механизм устойчивости холерных вибрионов к низким температурам изучались многими группами исследователей (1-3).
На модели других микроорганизмов установлено, что одним из универсальных механизмов адаптации микроорганизмов к низкой температуре является продукция белков холодового шока (4). Итогом исследований явилось выявление у холерных вибрионов двух белков холодового шока с молекулярной массой 7.7 kDa и 7.5 kDa кодируемых генами cspA и cspV, которые присутствовали у токсигенных и нетоксигенных штаммов (2).
При изучении нуклеотидной последовательности ctx- tcp-штамма Vibrio cholerae O1 20000 (NCBI accession number CP036500.1) в составе второй хромосомы идентифицирован ген холодового шока, обозначенный заявителем как csh1. Ген относился к семейству CspA и был локализован в позиции 846905-846693, его размер составил 213 нуклеотидов (5).
Исследование значения выявленного гена холодового шока для персистенции вибрионов в условиях регионов Российской Федерации сдерживает отсутствие простого, воспроизводимого и быстрого способа выявления данного гена.
Наиболее современным способом выявления гена холодового шока csh1 является только полногеномное секвенирование изучаемого штамма Vibrio cholerae с последующим биоинформационным анализом результатов с помощью пакета программ.
Однако данный прием занимает несколько дней, требует больших финансовых и трудовых затрат на проведение секвенирования (работа высококвалифицированного персонала, амортизация дорогостоящих секвенаторов, использование катриджей, расходных материалов, компьютеров для анализа результатов сиквенсов и пр.). Поэтому данный прием не может широко применяться при анализе большого числа культур и при необходимости быстрого получения ответа.
Наиболее близким по классическим приемом выявления известных генов является полимеразная цепная реакция со специфическими праймерами с последующим электрофоретическим разделением для выявления специфического ампликона нужного размера в геле агарозы или полиакриламида. Данный прием менее затратен по сравнению с полногеномным секвенированием, занимает меньше времени (в пределах суток) и может быть проведен в отношении большого числа культур (б).
Принципиальным недостатком данного способа выявления специфических генов является необходимость учета продуктов реакции (выявление специфического ампликона) с помощью электрофореза в геле полиакриламида или агарозы. Проведение электрофореза требует дополнительного времени, наличия сложного оборудования (как минимум, печи для плавления агарозы, прибора для проведения электрофореза, источника тока, трансиллюминатора, регистрирующей аппаратуры) и набора расходных материалов (маркеров молекулярного веса, агарозы, буферов) и средств защиты персонала.
Кроме того, в соответствии с действующими нормативными документами (МУ 1.3.2569-09) для учета результатов реакции амплификации нуклеиновых кислот методом электрофореза необходима отдельная рабочая зона 4-1, которая должна быть расположена изолировано от других помещений для предотвращения контаминации продуктами амплификации через воздушный поток. Кроме того зона 4-1 для проведения электрофореза должна быть оснащена минимальным набором соответствующего лабораторного оборудования, а выполнение работ должно осуществляться отдельным персоналом, не задействованным на других этапах проведения ПЦР анализа. Дополнительной трудностью при проведении работ по использованию электрофореза является необходимость проведения комплекса мероприятий по дегазации образовавшихся отходов (гели и буферы), содержащих крайне опасный интеркалирующий агент - бромистый этидий (7).
Упомянутые причины ограничивают и удорожают использование метода ПЦР с учетом результатов с помощью электрофореза в геле.
Технической задачей предполагаемого изобретения является разработка простого и достоверного способа выявления гена холодового шока csh1 у штаммов Vibrio cholerae с помощью ПЦР в формате реального времени.
Поставленная задача достигается тем, что в известном способе выявления гена холодового шока csh1 у штаммов Vibrio cholerae с помощью ПЦР в режиме реального времени, включающем выделение ДНК из исследуемого штамма, постановку ПЦР со специфическими праймерами и последующим учетом реакции амплификации, отличие заключается в том, что амплификацию исследуемой ДНК проводят с парой праймеров:
CSh 1; ACAGGTTCGGTTAAGTGGTTT,
CSh 2; TTCACAGCCTGTAGACCCTT,
при этом в инкубационную смесь вносят 0,5 мкл интеркалирующего красителя SYBR Green I для выявления продуктов амплификации с последующим плавлением образовавшихся ампликонов, а по их температуре плавления, в диапазоне 72-94°С и по динамике изменения показателя флюоресценции по каналу FAM амплификатора, проводят учет результатов по геометрическому методу путем регистрации показателя Ср, при наличии целевого продукта - гена холодового шока csh1 - формируется амплификон с низким Ср и температурой плавления 81-82,5°С, подтверждая присутствие гена холодового шока, а при отсутствии специфической мишени реакция с парой праймеров CSh 1 - CSh 2 образует другие амплификоны с высоким Ср и температурой плавления 77-78°С.
При этом ПЦР проводят в объеме 25 мкл и реакционная смесь содержит: : 2,5 мкл буфера, 1 Ед Taq ДНК-полимеразы, 0,2 мкМ смеси дНТФ, 0,5 мкл 50Х SYBR Green I, 1,0 мкМ каждого из праймеров, 5 мкл ДНК -ДНК матрицы, оставшийся объем - вода.
Кроме того ПЦР реакции проводят с соблюдением режимов: денатурация при 94°С - 2 мин (1 цикл); затем 35 циклов: денатурация при 94°С - 8 секунд, отжиг и учет по каналу FAM при 60°С - 12 секунд.
Обоснование выбора праймеров
Важнейшим этапом при разработке ПЦР, обеспечивающим получение корректного результата, является правильный подбор мишеней для посадки праймеров. С помощью комплекса программного обеспечения, разработанного во ФКУЗ РостНИПЧИ Роспотребнадзора (г. Ростов-на-Дону), были проанализированы нуклеотидные последовательности холерного вибриона. В результате анализа были сконструированы праймеры CSh 1 - CSh 2.
Объектом защиты настоящего изобретения является набор праймеров CSh 1 - CSh 2 для выявления гена холодового шока csh1 у штаммов Vibrio cholerae 01 с помощью ПЦР в формате реального времени и последующего плавления специфических ампликонов с использованием интекалирующего красителя SYBR Green I.
Препарат ДНК из исследуемого штамма анализируют с помощью ПЦР-РВ с праймерами CSh 1 - CSh 2, и последующего плавления специфических ампликонов. Использование интекалирующего красителя SYBR Green I необходимо для выявления продуктов амплификации и по определению температуры плавления ампликонов по динамики изменения показателя флюоресценции по каналу FAM амплификатора.
Дизайн разработанных праймеров делает ненужным использование внутреннего контроля, используемого для оценки присутствия различных ингибиторов. Решаемая задача достигается тем, что при наличии целевого продукта- гена холодового шока csh1 формируется ампликон в пределах Ср 9-13 цикла с температурой плавления (Tm°С) 81-82,5°С, а при отсутствии специфической мишени реакция с парой CSh 1 - CSh 2 происходит с образованием других ампликонов с Ср в диапазоне 25-29 цикла и отличающихся от целевого продукта меньшей температурой плавления (Tm°С) 77-78°С. Если в пробе присутствует ингибитор амплификации, то нарастания флюоресценции не регистрируют.
Способ осуществляется следующим образом.
Перед постановкой ПЦР проводят предварительную подготовку материала (выделение ДНК). Массу бактерий, сформировавших газон на плотной питательной среде, стерильной палочкой перемещают в пробирку, содержащую 3-5 мл физиологического раствора. Доводят плотность суспензии до 109 клеток на мл среды по оптической плотности, после чего выделяют ДНК для постановки ПЦР (7) с помощью любого коммерческого набора для выделения ДНК.
С полученной таким образом ДНК проводят реакцию амплификации с праймерами CSh 1 - CSh 2 в присутствии интеркалирующего красителя SYBR Green I с последующим плавлением образовавшихся ампликонов.
Условия проведения реакции в формате реального времени
Инкубационная смесь объемом 25 мкл содержит: 2,5 мкл буфера, 1 Ед. Taq ДНК-полимеразы, 0,2 мкМ смеси дНТФ, 0,5 мкл 50Х SYBR Green I (производства ЗАО Евроген, Москва), 1,0 мкМ каждого из праймеров, 5 мкл ДНК - ДНК матрицы, оставшийся объем - вода.
Амплификация и последующее плавление ампликонов проводят в амплификаторе, например, (DTlite5 производства НПФ ДНК-технология), по следующей схеме: денатурация при 94°С - 2 мин (1 цикл); затем 35 циклов: денатурация при 94°С - 8 секунд, отжиг и учет по каналу FAM при 60°С - 12 секунд. Последующее плавление ампликонов проводим в этом же приборе, не вынимая пробирок, в диапазоне температур- 94-72°С. Учет реакции проводят по каналу FAM.
Сущность изобретения поясняется следующими примерами. Все штаммы взяты из коллекции живых культур ФКУЗ Ростовского-на-Дону противочумного института.
Пример 1. ПЦР-анализ двух культур O1 Vibrio cholerae
В ходе биоинформационного анализа ген холодового шока csh1 был идентифицирован в атоксигенном штамме Vibrio cholerae О1 20000. В то же время при проведении подобного анализа в геноме штамма 19613 ген холодового шока отсутствовал. Поэтому для первой серии экспериментов в качестве положительного контроля использовали штамм 20000. В качестве отрицательного контроля использовали штамм 19613, лишенный гена csh1.
ДНК матрицы двух штаммов вносили в инкубационную смесь объемом 25 мкл содержащую: 2,5 мкл буфера, 1 Ед. Taq ДНК-полимеразы, 0,2 мкМ смеси дНТФ, 0,5 мкл 50Х SYBR Green I (производства ЗАО Евроген, Москва), 1,0 мкМ каждого из праймеров CSh 1 и CSh 2, 5 мкл ДНК - ДНК матрицы анализируемого штамма, оставшийся объем - вода.
Амплификацию проводили в амплификаторе, DTlite5 производства НПФ ДНК-технология по следующей схеме: денатурация при 94°С - 2 мин (1 цикл); затем 35 циклов: денатурация при 94°С - 8 секунд, отжиг и учет по каналу FAM при 60°С - 12 секунд. Последующее плавление ампликонов проводим в этом же приборе, не вынимая пробирок, в диапазоне температур - 94-72°С. Учет проводим по каналу FAM.
Учет результатов (см. таблицу 1) проводили по геометрическому методу путем регистрации Ср с последующим плавлением ампликонов.
Нарастание флюоресценции по каналу FAM свидетельствовала об успешном протекании процесса амплификации и об отсутствии ингибиторов в пробах ДНК
При этом образование специфического ампликона в случае наличия целевого гена происходило, как минимум, на 10 циклов раньше, чем при отсутствии гена холодового шока csh1. Последующее плавление подтвердило, что штамм 20000, несущий ген холодового шока csh1, формирует специфический ампликон с температурой плавления 81,6°С, в то время как cshl негативный штамм образует ампликон с гораздо меньшей температурой плавления 77,1°С. Разница в температуре плавления составляет порядка 4°С, что позволяет четко дискриминировать специфический ампликон. Этот результат (более раннее образование ампликона и более высокая температура плавления) свидетельствует о наличии гена холодового шока csh1 в клетках V. cholerae 20000. Общее время проведения реакции, с момента получения препаратов ДНК составило 1,5 часа.
Пример 2. ПЦР-анализ восьми культур штаммов О1 Vibrio cholerae
Условия проведения и учета реакции как в примере 1. В качестве положительно и отрицательного контролей служили ДНК из штаммов O1 Vibrio cholerae 19613 и 20000, использованные в примере 1.
Изучаемые штаммы холерного вибриона приведены в таблице 2.
В таблице 3 приведены результаты выявления гена холодового шока csh1 у восьми штаммов Vibrio cholerae O1 с помощью ПЦР с праймерами CSh 1 - CSh 2 в формате реального времени и последующего плавления ампликонов.
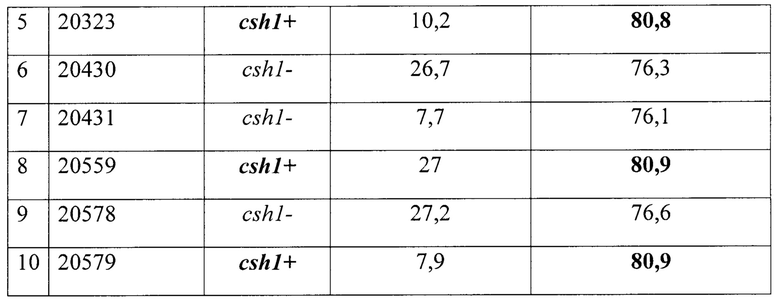
Вывод: полученный результат свидетельствует, что все восемь исследуемых образцов ДНК и два контрольных препарата пригодны для анализа, поскольку во всех случаях зарегистрирован положительный результат с парой праймеров CSh 1 - CSh 2 оцениваемый по показателю Ср. Анализ нарастания формирования амплификонов, по величине Ср и кривых плавления(Tm°С) показал наличие гена холодового шока csh1 у штаммов 20323, 20559 и 20579 (выделены жирным штифтом).
Пример 3. ПЦР-анализ восьми культур штаммов O1 Vibrio cholerae
Условия проведения и учета реакции как в Примере 1. В качестве положительно и отрицательного контролей служили ДНК из штаммов O1 Vibrio cholerae 19613 и 20000, использованные в примере 1.
Изучаемые штаммы холерного вибриона приведены в таблице 4.
Результат выявления гена холодового шока csh1 у восьми штаммов Vibrio cholerae O1 с помощью ПЦР с праймерами CSh 1 - CSh 2 в формате реального времени и последующего плавления ампликонов (см. таблицу 5).
Полученный результат свидетельствует, что семь исследуемых образцов ДНК и два контрольных препарата пригодны для анализа, поскольку во всех случаях зарегистрирован положительный результат с парой праймеров CSh 1 - CSh 2. Образец ДНК из штамма 20587 не пригоден для исследования, вероятно из-за возможного присутствия ингибиторов ПЦР.
Шесть исследованных штаммов, выделенных жирным шрифтом, (20291, 20324, 20325, 20326, 20327, 20328) содержат ген холодового шока csh1 поскольку для них характерно более раннее образование ампликона (оцениваемое по показателю Ср) и более высокая температура его плавления (Tm°С). Разница в скорости формирования ампликонов (не менее 10 циклов) и по температуре ампликонов (порядка 4°С) позволяет легко учитывать результат реакции.
Использование предполагаемого изобретения позволяет достоверно, просто и быстро за счет использования пары праймеров CSh 1 - CSh 2 с помощью ПЦР в формате реального времени и последующего плавления ампликонов выявлять у штаммов O1 Vibrio cholerae ген холодового шока csh1. Это крайне важно при проведении мониторинга холеры и проведения исследований о роли гена холодового шока csh1 O1 Vibrio cholerae в обеспечении персистенции вибрионов в условиях низких температур, характерных для регионов Российской Федерации.
Источники информации
1. Carroll J.W., Mateescu М.С., Chava K., Colwell R.R., Bej A.K. Response and tolerance of toxigenic Vibro cholerae O1 to cold temperatures. Antonie Van Leeuwenhoek. 2001; 79: 377-84. https://doi.org/10.1023/a:1012004725373.
2. Datta P.P., Bhadra R.K. Cold shock response and major cold shock proteins of Vibrio cholerae. Appl Environ Microbiol. 2003; 69(11):6361-9. https://doi.org/10.1128/AEM.69.11.6361-6369.2003.
3. Заднова С.П., Агафонов Д.А., Шашкова А.В., Смирнова Н.И. Сравнительная устойчивость типичных и генетически измененных штаммов Vibrio cholerae биовара El Tor к действию неблагоприятных факторов внешней среды. Журнал микробиологии, эпидемиологии и иммунобиологии 2014; 2: 11-17
4. Barria С., Malecki М., Arraiano С.М. Bacterial adaptation to cold. Microbiology. 2013;159():2437-2443. https://doi.org/10.1099/mic. 0.052209-0
5. Бородина О.В., Водопьянов С.О., Водопьянов А.С., Олейников И.П., Чемисова О.С., Полеева М.В. Географическое распространение встречаемости гена холодового шока csh1 у Vibrio cholerae, циркулирующих на территории Российской Федерации. Актуальные вопросы обеспечения эпидемиологического благополучия в трансграничных природных очагах чумы и других опасных инфекционных болезней. Материалы XV Межгосударственной научно-практической конференции 5-6 октября 2021 г., Иркутск. С. 49-50.
6. Способ молекулярно-генетического внутривидового типирования Vibrio cholerae O1 и O139 серогрупп. Патент №2575046 от 18 января 2016 г. Опубликовано 10.02. 2016. Бюл. №4. Авторы: Водопьянов А.С., Водопьянов C.O., Олейников И.П. Мишанькин Б.Н.
7. МУ 1.3.2569-09 Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I-IV групп патогенности (утв. Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом РФ 22 декабря 2009 г.).
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ выявления гена холодового шока csh1 у штаммов Vibrio cholerae O1 и неО1/неО139 методом петлевой изотермической амплификации (LAMP) | 2023 |
|
RU2819101C1 |
| Способ молекулярного типирования типичных (O1) и атипичных (RO) нетоксигенных штаммов V. cholerae El Tor с помощью ПЦР в режиме реального времени | 2022 |
|
RU2792156C1 |
| Способ выявления гена tcpA Classical V. cholerae El Tor с помощью ПЦР в режиме реального времени | 2024 |
|
RU2837089C1 |
| Способ оценки внутривидовой конкуренции токсигенных и нетоксигенных штаммов Vibrio cholerae О1 и О139 серогрупп с помощью ПЦР в режиме реального времени | 2023 |
|
RU2806564C1 |
| Способ молекулярно-генетического внутривидового типирования токсигенных штаммов Vibrio cholerae О1 Eltor | 2016 |
|
RU2627193C1 |
| СПОСОБ ВЫЯВЛЕНИЯ ТОКСИГЕННЫХ ШТАММОВ 01 VIBRIO CHOLERAE "ПОСТГАИТЯНСКОЙ" ЛИНИИ МЕТОДОМ ПЦР В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ | 2021 |
|
RU2766192C1 |
| Способ идентификации штаммов VIBRIO CHLERAE O1, определения их токсигенности и биовара с дифференциацией биовара ЭльТор на типичные и генетически измененные варианты методом мультиплексной полимеразной цепной реакции и тест-система для его осуществления с учетом результатов в режиме "реального времени" | 2019 |
|
RU2732448C1 |
| Способ выявления токсигенных штаммов О1 Vibrio cholerae "гаитянской" группы методом ПЦР в режиме реального времени по конечной точке | 2019 |
|
RU2729218C1 |
| Способ моделирования биоплёнок, формируемых Vibrio cholerae 01 серогруппы на поверхности хитина | 2018 |
|
RU2685878C1 |
| СПОСОБ ДИФФЕРЕНЦИАЦИИ ТОКСИГЕННЫХ И АТОКСИГЕННЫХ ШТАММОВ ХОЛЕРНЫХ ВИБРИОНОВ 01 СЕРОГРУППЫ ПО ИНГИБИРУЮЩЕЙ АКТИВНОСТИ | 2015 |
|
RU2596401C1 |
Изобретение относится к области биотехнологии. Представлен способ выявления гена холодового шока csh1 у штаммов Vibrio cholerae с помощью ПЦР, включающий выделение ДНК из исследуемого штамма, постановку ПЦР со специфическими праймерами CSh 1 и CSh с последующим учетом реакции амплификации. При этом в инкубационную смесь вносят 0,5 мкл интеркалирующего красителя SYBR Green I для выявления продуктов амплификации с последующим плавлением образовавшихся ампликонов, а по их температуре плавления, в диапазоне 72-94°С и по динамике изменения показателя флюоресценции по каналу FAM амплификатора, проводят учет результатов по геометрическому методу путем регистрации показателя Ср. При наличии целевого продукта - гена холодового шока cshl - формируется амплификон с низким Ср, а при отсутствии специфической мишени реакция с парой праймеров CSh 1- CSh 2 образует другие амплификоны с высоким Ср. Изобретение позволяет использовать его в лабораторной диагностике при проведении мониторинга холеры и проведении исследований, связанных с изучением особенностей биологии возбудителя, включающего идентификацию генетических структур, обеспечивающих адаптацию холеры к неблагоприятным факторам внешней среды. 2 з.п. ф-лы, 5 табл., 3 пр.
1. Способ выявления гена холодового шока csh1 у штаммов Vibrio cholerae с помощью ПЦР в режиме реального времени, включающий выделение ДНК из исследуемого штамма, постановку ПЦР со специфическими праймерами и последующим учетом реакции амплификации, отличающийся тем, что амплификацию исследуемой ДНК проводят с парой праймеров:
при этом в инкубационную смесь вносят 0,5 мкл интеркалирующего красителя SYBR Green I для выявления продуктов амплификации с последующим плавлением образовавшихся ампликонов, а по их температуре плавления в диапазоне 72-94°С и по динамике изменения показателя флюоресценции по каналу FAM амплификатора проводят учет результатов по геометрическому методу путем регистрации показателя Ср, при наличии целевого продукта- гена холодового шока csh1 - формируется амплификон с низким Ср и температурой плавления 81-82,5°С, подтверждая присутствие гена холодового шока, а при отсутствии специфической мишени реакция с парой праймеров CSh 1 - CSh 2 образует другие амплификоны с высоким Ср и температурой плавления 77-78°С.
2. Способ по п. 1, отличающийся тем, что ПЦР проводят в объеме 25 мкл и реакционная смесь содержит: 2,5 мкл буфера, 1 Ед. Taq ДНК-полимеразы, 0,2 мкМ смеси дНТФ, 0,5 мкл 50Х SYBR Green I, 1,0 мкМ каждого из праймеров, 5 мкл ДНК – ДНК матрицы, оставшийся объем - вода.
3. Способ по п. 1, отличающийся тем, что ПЦР реакции проводят с соблюдением режимов: денатурация при 94°С - 2 мин (1 цикл); затем 35 циклов: денатурация при 94°С - 8 секунд, отжиг и учет по каналу FAM при 60°С - 12 секунд.
| CARROLL J.W., MATEESCU М.С., CHAVA K., et | |||
| al., "Response and tolerance of toxigenic Vibro cholerae O1 to cold temperatures | |||
| Antonie Van Leeuwenhoek", 2001; 79: 377-84 | |||
| DATTA P.P., BHADRA R.K | |||
| "Cold shock response and major cold shock proteins of Vibrio cholerae", Appl Environ Microbiol | |||
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| ЗАДНОВА С.П., АГАФОНОВ Д.А., ШАШКОВА | |||
Авторы
Даты
2022-11-08—Публикация
2021-12-14—Подача