ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Заявка, рассматриваемая в данный момент, содержит перечень последовательностей, который представлялся в формате ASCII посредством системы EFS-web и включен путем отсылки в полном объеме в настоящую заявку. Указанный документ ASCII, созданный 8 января 2013 года, называется ETH562WO.txt и имеет размер 3742 байта.
ОБЛАСТЬ ПРИМЕНЕНИЯ ИЗОБРЕТЕНИЯ
Данное изобретение относится к области антимикробных составов, точнее к области составов, содержащих тауролидин и протамин, для использования в различных медицинских устройствах.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Больничные инфекции представляют серьезную проблему как для врачей, так и для пациентов. Относительно обыденное хирургическое вмешательство может иметь разрушительные для здоровья последствия, если в операционном поле возникнет инфекция, даже если само по себе хирургическое вмешательство прошло удачно. В больницах имеются четкие правила контроля и предотвращения инфекции, и медицинский персонал обязан принимать определенные меры для снижения заболеваемости пациентов так называемыми больничными инфекциями. К числу таких мер относятся создание и поддержание стерильных областей в операционных, процедуры стерилизации инструментов, медицинской одежды и перчаток, установка фильтров НЕРА в воздуховодах, использование антимикробной протирки для обработки операционного поля перед хирургическим вмешательством, инструкции по чистке оборудования и т. п. Однако несмотря на эти инструкции и протоколы при использовании медицинского устройства в операционных условиях создается риск инфекции, даже если само по себе устройство стерильно и поставляется в упаковке. Риск инфекции значительно возрастает при работе с инвазивными или имплантируемыми медицинскими устройствами, такими как внутривенные катетеры, артериальные имплантаты, подоболочечные или внутричерепные шунты, сетки, шовный материал, герметики и протезы, так как при этом открываются врата инфекции, и патогены могут оказаться в тесном контакте с тканями тела и физиологическими жидкостями. Часто инфекция в операционном поле связывается с бактериями, которые образуют биопленку, размножаясь на поверхности медицинского устройства. Например, во время хирургического вмешательства бактерии из окружающей среды могут проникнуть в стерильное пространство операционного поля и закрепиться на поверхности медицинского устройства, которое либо контактирует с пациентом, либо предназначено для имплантации в его организм. Бактерии могут использовать имплантированное медицинское устройство как способ проникнуть в окружающие ткани. Результатом такого заселения бактериями медицинских устройств может стать инфекция, что приводит к осложнениям и повышению смертности.
Разработано множество способов уменьшения риска инфекции, связанной с использованием инвазивных или имплантируемых медицинских устройств, которые предусматривают использование антимикробных веществ на поверхности или в составе таких медицинских устройств, например в виде антимикробного покрытия или полимерных материалов, входящих в состав устройства и содержащих такие вещества. Желательно, чтобы такие устройства обеспечивали достаточно действенные уровни антимикробных веществ, которые были бы способны противодействовать любому бактериальному загрязнению, которое могло бы попасть в организм пациента после установки устройства, в том числе могли бы подавлять образование биопленок, которые очень сложно устранять. Распространенные антимикробные составы, используемые ранее в имплантируемых устройствах, включали триклозан, серебро и хлоргексидина глюконат, а также могли включать антибиотики, такие как рифампин, миноциклин, клиндамицин и гентамицин. Однако следует предположить, что использование антибиотиков с такими целями может вызвать проблемы, связанные с резистентностью к ним. Антимикробные вещества, не будучи антибиотиками, обычно не вызывают резистентности.
Науке известны антимикробные составы, используемые для обработки медицинских устройств. Такие составы могут быть нанесены на устройства с помощью обыкновенного процесса создания покрытий или же могут быть внедрены в состав полимеров, используемых при изготовлении таких устройств. Однако существует различие между устройствами, которые имплантируются в тело пациента, и устройствами, которые ограниченно контактируют с тканями тела и физиологическими жидкостями. Токсичность эффективного антимикробного препарата, используемого в устройстве, не предназначенном для имплантации, может быть препятствием для использования этого же состава в имплантате или на его поверхности. В особенности это верно для больших имплантатов, отличающихся значительной площадью поверхности.
Отдельной проблемой при изготовлении крупных имплантатов с антимикробными свойствами, таких как хирургические сетки, является необходимость использования антимикробных препаратов в количестве, достаточном для безопасной и эффективной защиты имплантата от обсеменения бактериями после имплантации без ущерба для функциональности устройства и без возникновения у пациента вредных побочных эффектов. Тауролидин известен как средней силы антибактериальный препарат, ранее уже успешно использовавшийся как средство для внутреннего применения (in vivo), поэтому он может безопасно применяться для обработки имплантируемых медицинских устройств. Одной из проблем, связанной с тауролидином при его использовании для обработки имплантатов, является необходимость применять его в довольно значительных количествах для достижения эффективности. Это может сказаться на некоторых функциональных характеристиках устройства, например на его внешнем виде (покрытие может выглядеть как пятна) и на удобстве в обращении (покрытие может повлиять на гибкость устройства). Кроме того, большое количество антимикробного препарата может проявиться токсичностью после имплантации. Выраженность токсического воздействия часто соотносится с количеством антимикробного вещества, находящегося на поверхности устройства или входящего в его состав.
Чаще всего тауролидин используется для обработки катетеров или жидкостных затворов. В качестве антикоагулянтов для обработки таких затворов часто используется протамина сульфат. Такие варианты обработки не предусматривают длительной имплантации медицинских устройств, так как длительное применение антикоагулянтов противопоказано по вполне очевидным соображениям.
Следовательно, возникает потребность в новых улучшенных безопасных и эффективных антимикробных препаратах для обработки имплантируемых медицинских устройств, которые обладают улучшенными антимикробными свойствами при меньшем количестве веществ, необходимых для достижения эффекта.
ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Соответственно в изобретении раскрываются новые антимикробные препараты. Антимикробные препараты полезны при обработке медицинских устройств. Препараты содержат примерно от 50 до 99% весовых тауролидина и от 1 до 50% протамина или протаминовой соли.
Другой аспект данного изобретения представлен медицинским устройством, по меньшей мере часть или участок поверхности которого покрыты вышеописанным антимикробным составом. В предпочтительном варианте осуществления изобретения медицинское устройство представляет собой имплантат.
Еще один аспект данного изобретения представлен антимикробным покрытием, то есть составом, содержащим вышеописанный антимикробный препарат. Такое покрытие из препарата особенно полезно при обработке имплантируемых медицинских устройств.
Дополнительный аспект данного изобретения заключается в способе нанесения вышеуказанного антимикробного состава или покрытия по меньшей мере на часть или участок поверхности медицинского устройства. Способ в особенности полезен для обработки имплантируемых медицинских устройств.
Дополнительный аспект данного изобретения представлен медицинским устройством, выполненным из полимерной смолы в сочетании с вышеописанным антимикробным составом. В предпочтительном варианте осуществления изобретения такое устройство является имплантируемым.
Эти и другие характеристики и преимущества данного изобретения будут разъяснены далее в описаниях и сопутствующих чертежах.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
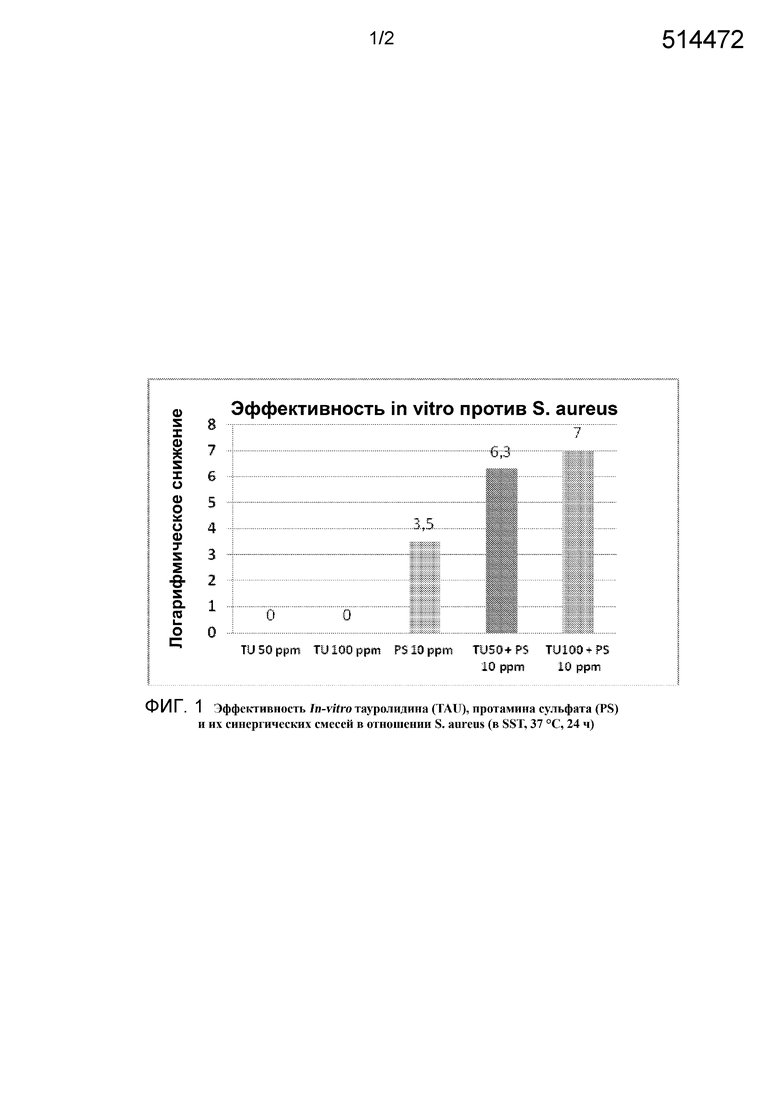
Фиг. 1 представляет собой график, на котором показан синергический характер действия тауролидина и протамина сульфата in vitro в отношении бактерии S. aureus.
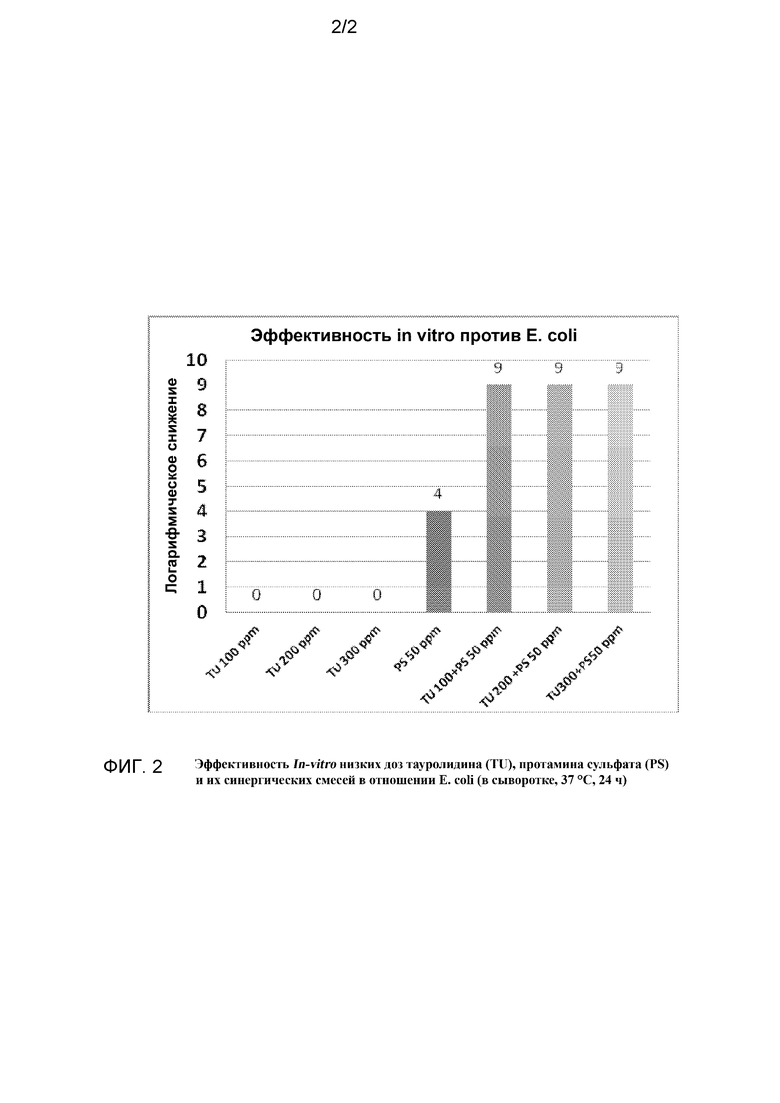
Фиг. 2 представляет собой график, на котором показан синергический характер действия тауролидина и протамина сульфата in vitro в отношении бактерии E. coli.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В данном документе выражение «имплантируемое медицинское устройство» определяется в его обыкновенном значении и относится к любому устройству или имплантату, выполненному из биологически совместимого материала для внедрения или имплантации в тело животного или человека, в том числе, среди прочего, к стентам (например, коронарным артериальным стентам, сосудистым стентам, в том числе стентам для периферических сосудов и стентам-трансплантатам, стентам для мочевыводящих путей, уретральным/простатическим стентам, ректальным стентам, эфзофагальным стентам, стентам желчевыводящих путей и стентам для выводящих протоков поджелудочной железы), хирургическому шовному материалу, хирургическим иглам, сеткам, электродам, катетерам, отведениям, имплантируемым кардиостимуляторам, корпусам кардиовертеров или дефибрилляторов, суставам, винтам, стержням, офтальмологическим имплантатам, бедренным штифтам, костным пластинам, тканевым трансплантатам, анастомозным устройствам, околососудистым оберткам, шовному материалу, скобкам, шунтам для отвода ликвора, диализным тканевым имплантатам, устройствам для крепления колостомических мешков, трубкам для дренирования ушной полости, отведениям кардиостимуляторов и имплантируемых кардиовертеров и дефибрилляторов, позвоночным дискам, костным штифтам, устройствам для фиксации швов, гемостатическим барьерным материалам, зажимам, винтам, пластинам, клипсам, сосудистым имплантатам, клеям и герметикам для соединения тканей тела, опорному материалу для наращивания тканей, различным типам повязок (например, к раневым повязкам), заменителям костей, внутрипросветным устройствам, опорным устройствам для сосудов и т. п. и к эквивалентным им устройствам.
Имплантируемые медицинские устройства могут быть выполнены из любого биологически совместимого материала, в том числе из полимеров (включая стабильные или инертные полимеры, органические полимеры, органическо-неорганические полимеры, неорганические полимеры и биологически разлагаемые полимеры), металлов, металлических сплавов, неорганических материалов, таких как силикон, стекло и композитные материалы, включая многослойные материалы, в которых сердечник выполнен из одного материала, а сверху расположено одно или несколько покрытий из другого материала. Эти материалы могут быть биологически рассасывающимися, частично рассасывающимися или нерассасывающимися. В данном документе термин «биологически рассасывающийся» определяется в своем обычном значении как такой материал, по большей части полимерный, который рассасывается в месте имплантации менее чем за три года. При этом биологически рассасывающийся полимер может быть биологически разлагаемым, при этом основная цепь или боковые цепи такого полимера распадаются или растворяются на части с меньшим молекулярным весом, которые затем подвергаются обмену веществ и/или экскреции из организма.
Биологически рассасывающиеся полимеры могут включать обычные биологически совместимые рассасывающиеся полимеры, в том числе полиэфиры, такие как полиэтиленгликоль или полиэтиленоксид, поливинилпирролидон, поливиниловый спирт, полигидроксикислоты, полилактиды, полигликолиды, полигидроксибутираты, полигидроксивалериаты, поликапролактамы, синтетические и естественные олиго- и полиаминокислоты, полифосфазены, полиангидриды, полиортоэфиры, полиоксоэфиры, полифосфаты, полифосфонаты, полиспирты, полисахариды, полиэфиры, полиамиды, алифатические полиэфиры, ароматические полиэфиры, сополимеры полимеризующихся веществ и резорбирующиеся биостекла. К числу нерассасывающихся полимеров относятся обычные биологически совместимые полимеры, в том числе полиалкены, полипропилен, полиэтилен, частично галогенированные полиолефины, полностью галогенированные полиолефины, фторированные полиолефины, политетрафторэтилен, поливинилиденфторид, полиизопрены, полистиролы, полисиликоны, поликарбонаты, полиарилэфиркетоны, эфиры полиметакриловой кислоты, эфиры полиакриловой кислоты, полиимиды, неразлагаемые полисахариды, такие как целлюлоза, бактериальная целлюлоза, а также сополимеры полимеризующихся веществ.
Составляющие антимикробных препаратов, представленных в данном изобретении, включают метилолсодержащие соединения, такие как тауролидин и протамин, или, что более предпочтительно, протаминовые соли, такие как протамина сульфат или протамина гидрохлорид, в виде растворителя либо в виде раствора для нанесения покрытия.
«Метилолсодержащее соединение», или «вещество - переносчик метилола», означает соединение, которое содержит молекулу метилола или способно отщеплять ее в условиях организма. Метилолсодержащие вещества характеризуются наличием группы R-CH2-OH, в которой R представляет собой алкильную, арильную или гетерогруппу. Изобретение также включает использование веществ, которые способны к выработке такой группы или к превращению в вещества, содержащие структуру R-CH2-OH.
Тауролидин (бис(1,1-диоксопергидро-1,2,4-тиадиазинил-4)-метан) является производным аминокислоты таурина и обладает антимикробными свойствами. Считается, что действие тауролидина обусловлено его химической реакцией со структурами, образующими клетки бактериальной стенки. Под воздействием этого соединения бактерии гибнут, а выделяющиеся клеточные токсины инактивируются. Было показано, что тауролидин безопасен и хорошо переносится при системных дозах свыше 40 г/сутки и в кумулятивной дозе свыше 300 г. Тауролидин использовался для лечения пациентов с перитонитом и применялся в качестве раствора в катетерном затворе для предотвращения инфекций, связанных с установкой центрального венозного катетера. По сравнению с другими известными антимикробными препаратами тауролидин обладает относительно слабым антимикробным действием, поэтому для достижения эффекта нужны большие дозы препарата. Несмотря на то, что количества тауролидина, необходимые для достижения эффективности при обработке конкретного медицинского устройства, могут быть безопасными и подвергаются разложению в организме, физические свойства покрытия, наносимого на медицинское устройство и содержащего такие относительно высокие дозы препарата, могут значительно ухудшиться. Поэтому использование тауролидина для обработки медицинских устройств требует наличия высокоэффективных препаратов, содержащих меньшее количество антимикробного вещества. Вещества, подобные тауролидину, - это таурултам (38668-01-8), циклотауролидин (220928-22-3) или молекулы, обладающие сходным действием, например силаг 61 (531-18-0) или ноксифлекс S (15599-39-0), которые могут быть использованы как альтернатива тауролидину или в сочетании с ним при осуществлении данного изобретения.
Протамин - это пептид с высокими катионными свойствами, небольшого размера, богатый аргинином. Протамин в комплексе с некоторыми нуклеиновыми кислотами был обнаружен в сперме определенных видов рыб, обладает свойством нейтрализовать действие гепарина. Протамина сульфат обычно назначается для того, чтобы подавить действие высоких доз гепарина, назначаемых при определенного рода хирургических вмешательствах. Протамин может использоваться в свободной форме или в виде соли. Для целей данного изобретения может быть полезен, например, протамина сульфат или протамина гидрохлорид. При осуществлении данного изобретения на практике желательно пользоваться протамином из источников, одобренных фармакопеей (класса USP).
Протамин также используется в виде смеси пептидов. Согласно Hvass (2005), Hvass A and Skelbaek-Pedersen B, J. Pharm Biomed Anal 37(3):551-7 (2005), доступные на рынке протамины обычно получаются в виде сульфатов, для препаратов инсулина обычно используют протамин рыбы из семейства лососевых (сальмин). Сальмин может быть классифицирован как монопротамин, так как он содержит только одну базовую аминокислоту - аргинин. Четыре основных пептида, составляющих почти весь азотсодержащий материал сальмина, были полностью описаны.
Согласно Block (1937), Yale J Biol Med. 1937 May; 9(5): 445-503,
в зависимости от содержания главной или основной аминокислоты протамины могут быть разделены на четыре группы; эти группы содержат:
(1) только аргинин (монопротамины),
(2) аргинин и лизин (дипротамины),
(3) аргинин и гистидин (дипротамины),
(4) аргинин, гистидин и лизин (трипротамины).
Примеры протаминов и их полезных гидролизированных фрагментов приведены ниже.
- Гидролизированный протамин (1030905-03-3, последовательность: 1 RRRRGGRRRR) (ID № ПОСЛ.: 1)
- Низкомолекулярный протамин (121052-30-0, длина последовательности: 14, последовательность: 1 VSRRRRRRGG RRRR) (ID № ПОСЛ.: 2)
- Низкомолекулярный протамин (756860-86-3, длина последовательности: 6, последовательность: 1 PRRRRR) (ID № ПОСЛ.: 3)
- Низкомолекулярный протамин (756860-88-5, длина последовательности: 13, последовательность: 1 ASRRRRRGGR RRR) (ID № ПОСЛ.: 4)
- Низкомолекулярный протамин (1115247-45-4, длина последовательности: 10, последовательность: 1 PRRRRSSPPR) (ID № ПОСЛ.: 5)
- Стеллин C (142847-28-7, длина последовательности: 26, последовательность: 1
- RRRRRHASTK LKRRRRRRRH GKKSHK) (ID № ПОСЛ.: 6)
- Протамин 1a (молоки Oncorhynchus mykiss) (78473-81-1, длина последовательности: 30, последовательность: 1 PRRRRASRRV RRRRRPRVSR RRRRGGRRRR) (ID № ПОСЛ.: 7)
- Протамин (восстановленная крысиная сперма) (119370-87-5, длина последовательности: 50, последовательность: 1 ARYRCCRSKS RSRCRRRRRR CRRRRRRCCR RRRRRCCRRR RSYTFRCKRY) (ID № ПОСЛ.: 8)
1 Протамин St 1 (восстановленная конская сперма) (110616-21-2, длина последовательности: 49, последовательность: ARYRCCRSQS QSRCRRRRRR RCRRRRRRSV RQRRVCCRRY TVLRCRRRR) (ID № ПОСЛ.: 9)
- Протамин (Dicentrarchus labrax) (147414-03-7, длина последовательности: 34,
последовательность:
1 PRRRRQASRP VRRRRRTRRS TAERRRRRVV RRRR) (ID № ПОСЛ.: 10)
- Экмолин (8001-16-9) и трипротамин
- Дополнительные протаминоподобные молекулы, действующие как антигепариновые вещества, такие как полибрен, терлипрессин, ромиплостим, эльтромбопаг, или конденсированные ДНК, такие как полиаргинин, полилизин, и, наконец, протаминоподобные белки или протаминоподобные пептиды, входящие в группу базовых ядерных протеинов спермы (SNBP) совместно с протаминовым и гистоновым типом. Протаминоподобные SNBP представляют собой наиболее структурно разнородную группу, состоящую из базовых протеинов, богатых одновременно лизином и аргинином. Дополнительные протаминоподобные пептиды иногда описывают согласно заявке US5614494 как синтетические протаминоподобные поликатионные пептиды с общим катионным зарядом меньшим, нежели у n-протамина.
- Дополнительные протаминоподобные молекулы могут иметь тот же самый образ действия в случае инсулиновых препаратов продленного действия, таких как сурфен (дихрохлорид 5424-37-3 или основание 3811-56-1), глобин, опционально содержащий следовые количества цинка.
Количество тауролидина и протамина в антимикробных препаратах, отвечающих данному изобретению, должно быть достаточным для обеспечения эффективной антимикробной активности без сопряженной с этим значительной токсичности. Обычно содержание тауролидина в таких препаратах составляет примерно от 50 до 99% весовых, чаще от 60 до 90% весовых, предпочтительно от 70 до 90% весовых. Обычно содержание протамина в таких препаратах составляет примерно от 1 до 50% весовых, чаще от 5 до 50% весовых, предпочтительно от 10 до 50% весовых.
Антимикробные составы, предусмотренные данным изобретением, могут использоваться в разнообразных сочетаниях с медицинским устройствами для обеспечения антимикробного эффекта. Препараты могут входить в составы, используемые для нанесения покрытий на поверхность медицинских устройств с помощью обычных процессов, таких как окунание в раствор, нанесение кистью или пульверизатором. Антимикробные составы также могут входить в состав медицинских устройств другими распространенными способами, в том числе в составе полимеров, из которых затем отливают или экструзией изготавливают медицинские устройства.
Для нанесения составов и покрытий на поверхность медицинских устройств и имплантатов могут использоваться обычные методики и процессы. Эти методики в числе прочего могут включать создание покрытия погружением, опрыскиванием, при помощи струйного принтера (со струей растворителя), нанесение порошкового покрытия с последующим спеканием, инъекционное литье, плазменное или лазерное осаждение и т. п. Как уже упоминалось выше, при желании антимикробные составы, относящиеся к данному изобретению, можно ввести в состав полимерного материала или смешать с ним, после чего такие смеси или составы в твердой или полудикой форме могут быть использованы в виде гранул или порошков. Такие смеси полимеров могут затем обрабатываться обычными способами, включая прессование в таблетки, экструзионное литье, инъекционное литье и т. п.
В одном из предпочтительных вариантов осуществления данного изобретения антимикробное покрытие наносится в виде жидкого состава, применяемого для получения покрытий. Жидкие препараты для нанесения покрытий обычно имеют в составе один или несколько жидких растворителей или носителей, и в зависимости от назначения могут использоваться разнообразные растворители.
К числу обычных растворителей, используемых для получения составов для нанесения антимикробных покрытий в соответствии с данным изобретением, относятся вода для инъекций, смесь этанола и воды, смесь изопропанола и воды, смесь глицерина и воды, растворы белков, кровь и сыворотка крови. При желании в состав таких антимикробных препаратов, используемых в рамках данного изобретения для нанесения покрытий, могут быть включены обычные биологически совместимые компоненты, такие как ПАВ, загустители, поливинилпирролидоны, полиэтиленгликоли, карбоксиметилцеллюлоза, гидроксиэтилкрахмал, гидроксипропилкрахмал, декстран, сополимеры полиоксипропилена и полиоксиэтилена, полиэтоксилированное касторовое масло и т. п., а также различные их сочетания. Антимикробные покрытия, отвечающие данному изобретению, должны содержать антимикробные препараты, предусмотренные данным изобретением, в количестве, достаточном для обеспечения антимикробного эффекта, но при этом без развития значительного уровня токсичности. Например, количество антимикробного препарата, отвечающего данному изобретению, в составе покрытия обычно оказывается в диапазоне от 0,1 до 10% весовых, еще чаще от 2 до 4,5% весовых и предпочтительно около 2% весовых, а остальное приходится на растворитель или растворители и другие возможные добавки. Лица, сведущие в данной области науки, понимают, что эти количества могут варьироваться в зависимости от нескольких факторов, включая размер и форму медицинского устройства, местонахождение имплантированного устройства в теле пациента, состав имплантируемого устройства, возраст и вес пациента, длительность пребывания имплантата в теле пациента, площадь поверхности имплантата и т. п.
При использовании антимикробных препаратов, отвечающих данному изобретению, в составе покрытий с антимикробными свойствами такие покрытия могут изготовляться обычными способами. Например, требуемое количество антимикробного препарата смешивается с растворителем в обычной смесительной емкости следующим образом. Берут обычный сосуд подходящей вместимости, оснащенный мешалкой (магнитной или лопастной). Растворитель или смесь растворителей наливают в сосуд и добавляют определенное количество протамина или протаминовой соли, например сульфата протамина, перемешивая при этом содержимое сосуда. При необходимости смесь нагревают до нужной температуры, после чего добавляют определенное количество тауролидина. Для коррекции окончательной концентрации данной смеси добавляют любые дополнительные растворители или смеси растворителей. Сведущие в данной области науки люди понимают, что в состав таких покрытий могут входить и дополнительные компоненты, такие как смолы, поверхностно-активные вещества, пигменты и т. п.
Для инъекций или внутреннего употребления, например для внутрибрюшинного лаважа, предпочтительнее использовать системы на водной основе, такие как раствор Рингера, изотонический раствор хлорида натрия или глюкозы. Водородный показатель корректируется до значения 5-7 единиц при помощи соляной кислоты, серной или фосфорной кислоты. При необходимости можно добавить загустители, такие как КМЦ, ПВП или ГЭК. Можно также добавить допустимые инъекционные консерванты, такие как метил-4-гидроксибензоат или пропил-4-гидроксибензоат. Такие растворы используются для обработки имплантируемых медицинских устройств непосредственно перед использованием, например путем погружения, промывки или обливания.
В зависимости от назначения могут использоваться дисперсии одного или нескольких компонентов. Приготовление частиц гепарина/протамина может быть сделано согласно Mori (2010) в присутствии тауролидина или путем добавления тауролидина на отдельном этапе, Mori et al. (2010), Mori Y, Nakamura S, Kishimoto S, Kawakami M, Suzuki S, Matsui T, Ishihara M, International Journal of Nanomedicine Vol 5, 147-155 (2010).
Для местного применения может использоваться некоторое количество спирта, например этанола или изопропанола, такое, чтобы не вызывать флокуляции протамина, как правило, это количество составляет менее 40% (объемных), если нужен спиртовой раствор. В других случаях предпочтительнее использовать воду для инъекций, соляную кислоту для корректировки рН, макрогол 4000 и хлорид натрия. Дополнительные необязательные составляющие могут включать (3-амидопропилкокоат) диметиламмония ацетат, D-глюконат натрия, 85%-й глицерин, хлорид натрия и очищенную воду.
Однопроцентный раствор протамина сульфата совместим в соотношениях от 1:9 до 1:1 с концентратом «Лавасепт» (20% полигексанида и 1% макрогола 4000) или с продуктом «Октенисепт». К этому раствору может быть добавлен тауролидин в количестве, достаточном для получения раствора с концентрацией тауролидина, равной 2%.
Для создания покрытия на медицинском изделии перед его упаковкой с обеспечением устройства с покрытием, предусмотренного данным изобретением, могут использоваться несколько типов растворов, содержащих антимикробные препараты, согласно данному изобретению, в зависимости от того, какой результат желательно получить, а также от процесса, способа нанесения и т. п. Раствор для нанесения покрытия делается на основе водного раствора смеси протамина/тауролидина без связующих или с водорастворимыми связующими, такими как ПВП, ПЭГ, КМЦ, ГЭК, декстран, плюроникс, хремофорс и т. п. Если покрытие должно содержать более 2% тауролидина по весу, то тауролидин можно растворить в смеси ацетона и воды в соотношении от 90/10 до 70/30 вплоть до 4 процентов весовых, после чего имплантат обрабатывается сначала тауролидином. Если нужно полимерное связующее, такое как PLA или PGLA, полимер можно дополнительно растворить в смеси ацетона/воды. На втором этапе выполняется покрытие протамином из водного раствора. Этапы нанесения покрытия можно изменить, можно также добавить промежуточный этап высушивания. Количество вспомогательного полимерного связующего, используемого для получения составов-покрытий, должно быть достаточным для того, чтобы дополнительно обеспечивать механическую стойкость покрытия при обращении с устройством, и при этом не препятствовать высвобождению тауролидина.
Состав антимикробных препаратов, отвечающих данному изобретению, может быть достигнут в случае полимерных смол при соотношении тауролидина и основного полимера (например, полидиоксанона) в случае хирургической сетки, которое превышает 30% весовых и может достигать 70% весовых, желательно от 50% весовых и выше, чтобы обеспечивалось заметное высвобождение препарата. В случае костных имплантатов для более медленного высвобождения и длительного действия требуется больше полимера. Смесь тауролидина/протамина предпочтительно соединяется с полидиоксаноном при температуре ниже 150°С и желательно в защитной газовой атмосфере, например аргоновой или азотной. Состав может быть затем преобразован в изделия различной формы, включая медицинские изделия, с использованием обычных процессов, таких как инъекционное литье и экструзия, или же может быть нанесен на поверхность медицинского устройства такими обычными способами, как приклеивание, пришивание, вязание, наплавление и т. п. Согласно заявке EP1251794, включенной в текст данного документа путем ссылки, в примере 16 приведен один из предпочтительных способов, при котором небольшие шарики наносятся на имплантируемый шнур. Шарики диаметром от 1 до 3 мм могут быть изготовлены смешиванием, прессованием или заключением в капсулы. Такой имплантат является предпочтительно рассасывающимся и может использоваться, например, как альтернативная, не содержащая антибиотиков форма систем Septopal Chain TM для лечения остеомиелита.
В другом варианте осуществления данного изобретения антимикробные составы, отвечающие данному изобретению, заключаются между двумя пленками, которые могут иметь поры нужного размера, которые бы позволяли удерживать антимикробные составы внутри, обеспечивая достаточно эффективное высвобождение. Антимикробные составы, отвечающие данному изобретению, могут содержаться также в тканевых пакетах, сделанных из рассасывающихся полимеров, предпочтительно из тканых или нетканых материалов с небольшими порами во избежание распыления содержимого.
При некоторых показаниях предпочтительно использовать еще дополнительные действующие вещества в сочетании с антимикробными составами, отвечающими данному изобретению. Выбор и использование действующего вещества в сочетании с составами, отвечающими данному изобретению, зависит от того, какое желаемое преимущество мы хотим получить. Например, может быть полезно обеспечить такой имплантат (с покрытием или из соответствующего материала), в составе которого содержится антимикробный препарат, отвечающий данному изобретению, который имеет в составе по меньшей мере еще один биологически активный ингредиент или вещество, которое, возможно, может высвобождаться местно после имплантации. Вещества, приемлемые в качестве действующих веществ, могут быть естественного или синтетического происхождения и включать, в числе прочего, например, антибиотики, антимикробные вещества, антибактериальные вещества, антисептики, вещества для химиотерапии, цитостатики, ингибиторы метастазирования, противодиабетические вещества, противогрибковые вещества, гинекологические препараты, урологические препараты, противоаллергические вещества, половые гормоны, ингибиторы половых гормонов, гемостатики, гормоны, пептидные гормоны, антидепрессанты, витамины, такие как витамин С, антигистамины, безоболочечную ДНК, плазмидную ДНК, катионные ДНК-комплексы, РНК, клеточные составляющие, вакцины, естественные клетки тела или генетически модифицированные клетки. Действующие вещества могут присутствовать в инкапсулированной или адсорбированной форме. При наличии таких веществ прогноз состояния пациента может быть улучшен в соответствии с достигаемым терапевтическим эффектом (например, это может быть улучшение ранозаживления, подавление или уменьшение воспаления).
В качестве предпочтительных действующих веществ выступают обычные антибиотики, такие как гентамицин или антибиотики марки ZEVTERA™ (цефтобирпол, медокарил) (изготовитель - компания Basilea Pharmaceutica Ltd., Basel Switzerland). Наиболее предпочтительными являются антимикробные вещества широкого спектра действия с высокой эффективностью, способные подавлять развитие бактерий и дрожжей даже в присутствии физиологических жидкостей, такие как октенидин, октенидина дигидрохлорид (действующее начало препарата Octenisept® производства компании Schulke & Mayr, Norderstedt, Германия), полигексаметиленбигунаид (ПГМБ) (действующее вещество препарата Lavasept® компании Braun, Швейцария), триклозан, медь (Cu), серебро (Ag), наносеребро, золото (Au), селен (Se), галлий (Ga), N-хлоротаурин, спиртовые антисептики, такие как зубной эликсир Listerine(R), N -альфалаурил-L-аргинина этиловый эфир, этил-N-альфалаурил-L-аргината гидрохлорид, (LAE), миристамидопропилдиметиламин (MAPD, действующее вещество препарата SCHERCODINE™ M), олеамидопропилдиметиламин (OAPD, действующее вещество препарата SCHERCODINE™ O), стеарамидопропилдиметиламин (SAPD, действующее вещество препарата SCHERCODINE™ S) и ранее упоминавшиеся ПГМБ и октенидина дигидрохлорид (октенидин).
Количество вспомогательных действующих веществ, которые могут входить в состав антимикробных препаратов, отвечающих данному изобретению, должно быть достаточно для эффективного подавления бактериального обсеменения, образования и, следовательно, снижения риска инфекции.
Кроме того, в антимикробные препараты или антимикробные покрытия, соответствующие настоящему изобретению, можно включить обычные контрастные вещества. Такие контрастные вещества могут представлять собой биологически совместимые красители, предназначенные для создания визуальной метки, как показано в документе EP 1392198B1, или такие вещества, как газы или газообразующие вещества для ультразвукового контрастирования или МРТ-контрастирования, такие как комплексы металлов, например GdDTPA, или суперпарамагнитные наночастицы (Resovist™ или Endorem™), как показано в документе EP 1324783B1. Как показано в документе EP 1251794B1, могут использоваться видимые в рентгеновских лучах вещества (рентгенонепрозначные), такие как чистый диоксид циркония, стабилизированный диоксид циркония, нитрид циркония, карбид циркония, тантал, пятиокись тантала, сульфат бария, серебро, йодид серебра, золото, платина, палладий, иридий, медь, оксиды железа (II), сталь для имплантатов со слабой намагничиваемостью, немагнитная сталь для имплантатов, титан, йодиды щелочных металлов, йодированные ароматические соединения, йодированные алифатические соединения, йодированные олигомеры, йодированные полимеры, сплавы указанных в данном пункте веществ, если они позволяют сплавленные и тому подобные вещества.
Следующие примеры иллюстрируют принципы и способы осуществления настоящего изобретения, хотя не ограничиваются ими.
ПРИМЕР 1
Синергическая смесь тауролидина и протамина сульфата на грыжевой сетке, содержащей пленку.
Сетка, ламинированная пленкой из поли-g-капрона, сравнимая с изделием компании Ethicon PhysioMesh - сетчатым имплантатом для коррекции грыжи (производитель - компания Ethicon, Inc, Somerville, NJ США), но без маркера, была изготовлена и отштампована в диски диаметром 1,5 см.
Был приготовлен раствор тауролидина концентрацией 4% весовых/по объему в смеси, содержащей 70% ацетона и 30% воды по объему. Протамина сульфат растворили в воде при нагревании до получения концентрации в 10% весовых/по объему. 50 мкл раствора тауролидина (TU) и 20 мкл раствора протамина сульфата (PS) нанесли из пипетки на каждый диск, после чего их высушили при 50°C до испарения большей части жидкости, после чего оставили храниться под вакуумом. Первым наносился раствор тауролидина, после чего сразу же - раствор протамина сульфата. Был разработан тест на обсеменение бактериями in vitro, который был полезен для демонстрации того, насколько сетка-прототип способна предотвращать развитие биопленки. Так как бактериальная обсемененность поверхности - это первый этап формирования биопленки, обработка поверхности, которая ингибирует обсемененность поверхности бактериями, снижает шансы на формирование биопленки. Опыт проводился на среде SST (сывороточно-солевой TSB), которая имитирует условия in vivo и условия клинической практики. В состав среды SST входит триптический соевый бульон (TSB):сыворотка:физраствор в соотношении 1:2:7. Каждый испытуемый образец инкубировался в среде SST с засеванием бактериями Staphylococcus aureus ACTT 6538 или Escherichia coli ATCC 25922 из расчета примерно 10 в степени 6 КОЕ/мл. После 4 часов инкубации с вращением со скоростью 60 об/мин при 37°C диски промывали трижды в физиологическом растворе, чтобы удалить незакрепившиеся бактерии. Бактерии, успевшие закрепиться на сетке, собирались обработкой ультразвуком в физиологическом растворе с добавлением нейтрализующего вещества. Жизнеспособные популяции бактерий определялись подсчетом колоний, выращенных на среде TSA (триптический соевый агар) с добавлением нейтрализующих веществ. Использование нейтрализующих веществ в суспензии бактерий и в среде для выращивания и подсчета колоний было необходимо для того, чтобы прекратить возможное воздействие остаточных количеств антимикробных веществ, попавших в культуру из покрытия. Чашки инкубировали при 37°C в течение 24 часов. Количество жизнеспособных бактерий, закрепившихся на сетке, выражалось в КОЕ/диск.
Данные в таблице 1 показывают, что поверхность сетки, обработанной сочетанием TU и PS, полностью ингибировала возможность S. aureus и E. coli закрепиться на ней в среде, содержащей сыворотку крови, тогда как сетки, обработанные только TU в той же самой дозировке, демонстрировали менее выраженное ингибирование по сравнению с комбинацией.
Обсемененность сетки жизнеспособными бактериями (сетка Ethicon PhysioMesh® производства компании Ethicon, Inc.). Диаметр диска d=1,5 см, 4 часа инкубации в бактериально-сывороточном бульоне (pH 7,4).
E. coli
ПРИМЕР 2
Бактерицидные составы синергического действия, содержащие тауролидин и протамина сульфат, в условиях сывороточной среды (SST)
В среде SST была создана двумерная матрица концентраций TU и PS (за счет их разбавления). Интересующие исследователей бактерии были высеяны в среду из расчета около 10 в степени 6 КОЕ/мл. В данном примере 2 использовались S. aureus штамма ACTT 6538 или E. coli штамма ATCC 25922. После инкубации при 37°C в течение 24 часов количество жизнеспособных бактерий на сетках определялось посевом на чашки и подсчетом колоний. Логарифмическое снижение концентрации (LR) использовалось в качестве конечной точки для определения эффективности и определялось как Log КОЕ/мл необработанного контрольного образца - Log КОЕ/мл обработанного образца. Показатель синергичности (SI) определялся как LR для данного сочетания концентраций - сумма LR отдельных компонентов в той же концентрации, что и в сочетании. SI=0 означает аддитивный эффект, SI=1 указывает на уменьшение бактериальной обсемененности на 90%, SI=2 указывает на уменьшение обсемененности на 99%, SI=3 означает уменьшение обсемененности на 99,9% в сочетании по сравнению с отдельно взятыми веществами при том же уровне использования, т. е. указывает на синергический эффект.
В среде, содержащей сыворотку крови, был отмечен значительный синергический эффект для сочетания протамина сульфата (PS) с тауролидином (TU). При использовании по отдельности TU в концентрации 100 мг/л не был эффективен (LR=0), а PS при концентрации 10 мг/л показал некоторую эффективность (LR=3,5) против S. aureus. Сочетание 10 мг/л PS с 50 или 100 мг/л TU привели к значительному сокращению логарифмической концентрации, как показано на графике, приведенном на фиг. 1. Наблюдался также значительный синергический эффект сочетания PS=TU в отношении E. coli, как показывает график, приведенный на фиг. 2.
ПРИМЕР 3
Эффективность in vitro хирургических имплантатов, покрытых тауролидином и протамина сульфатом
В соответствии с примером 1 были приготовлены диски из хирургической сетки, покрытые затем по отдельности тауролидином и протамина сульфатом и их различными сочетаниями. При разработке примера 3 были использованы протоколы нанесения покрытия на сетки и определения обсемененности бактериями in vitro, приведенные в примере 1. Данные представлены в таблице 2.
Обсемененность бактериями (S. aureus) композитных сеток, покрытых тауролидином или смесями тауролидина и протамина сульфата после 4 часов инкубации в среде SST при 37°C
Данные в таблице 2 показывают умеренный подъем синергического эффекта при небольшой дозе TU, составляющей 0,5 мг/диск, и то, что при более высоких концентрациях TU (1,0 или 2,0 мг) синергический эффект становится более выраженным при добавлении 50 мкг PS. LR>6 и SI>3 при 1 и 2 мг TU+50 мкг PS показывает, что это сочетание полностью ингибирует способность S. aureus закрепляться на поверхности сетки, эффективность сочетания была на >99,9% выше суммы отдельно взятого эффективного результата.
Пример 4
Синергическое соотношение протамина сульфата (PS) и тауролидина (TU)
Диапазон соотношений компонентов синергических антимикробных препаратов, отвечающих данному изобретению, был получен в условиях исследования in vitro MBC (определение минимальной бактериальной концентрации). Исследование проводилось в среде SST, засеянной 106КОЕ/мл Staphylococcus aureus штамма ACTT 6538. Эффективность in vitro оценивалась для различных соотношений PS и TU по сравнению с отдельно взятыми компонентами в тех же концентрациях, что и в составном препарате. После инкубации при 37°C в течение 24 часов количество жизнеспособных бактерий на сетках определялось посевом на чашки и подсчетом колоний. Логарифмическое снижение (LR) использовалось в качестве конечной точки для определения эффективности и рассчитывалось как разность Log КОЕ/мл необработанного образца - Log КОЕ/мл обработанного образца. Показатель синергичности (SI) определялся как LR для данного сочетания концентраций - сумма LR отдельных компонентов в той же концентрации, что и в сочетании. SI=0 означает аддитивный эффект, SI=1 указывает на уменьшение бактериальной обсемененности на 90%, SI=2 указывает на уменьшение обсемененности на 99%, SI=3 означает уменьшение обсемененности на 99,9% в сочетании по сравнению с отдельно взятыми веществами при том же уровне использования, т. е. указывает на синергический эффект.
Данные для этих испытаний приведены в таблице 3 и показывают, что синергическое сочетание PS и TU наблюдается в диапазоне соотношений от 1:1 до 1:100. Соотношения TU и PS за пределами данного диапазона соотношений либо не демонстрировали синергического эффекта, либо были менее эффективны, чем взятые по отдельности составляющие.
Эффективность In vitro против S. Aureus в единицах логарифмического снижения
Биопленка представляет собой совокупность микроорганизмов, объединенных полисахаридной матрицей и прикрепленных к твердой поверхности. Биопленкам свойственна клиническая значимость, поскольку они ответственны почти за восемьдесят процентов больничных инфекций. Известно, что биопленки чрезвычайно устойчивы к иммунологической терапии и антибиотикам. Микробные биопленки возникают тогда, когда микробы необратимо связываются с поверхностью и выделяют внеклеточные полимеры, которые способствуют адгезии и образуют структурную матрицу. Зрелая матрица - высокофункциональная защита микробов от неблагоприятных условий среды, при этом она постоянно распространяет свободные клетки, которые колонизируют свободные поверхности. Поэтому крайне важно препятствовать закреплению бактерий на поверхностях.
Медицинские устройства, такие как стеки, снабженные эффективным антимикробным покрытием, смогут эффективно ингибировать закрепление бактерий на поверхностях устройств, тем самым в значительной мере препятствуя образованию биопленки. Данные в примерах 1 и 3 демонстрируют эффективность синергических составов, отвечающих данному изобретению, в части препятствования прикреплению бактерий к поверхности сетки-прототипа в среде, содержащей сыворотку крови. Данные позволяют предположить многообещающие полезные эффекты от использования синергических составов для защиты медицинских устройств от образования биопленки.
Антимикробные составы, отвечающие данному изобретению, и покрытые ими медицинские устройства или устройства, содержащие такие составы, обладают множеством преимуществ. Эти преимущества включают наличие синергического антимикробного состава, который обеспечивает повышенную эффективность и уменьшение расхода препарата. За счет снижения расхода повышается диапазон безопасности, улучшается биологическая совместимость, улучшаются характеристики устройства и уменьшаются материальные затраты. Более широкий спектр воздействия, обеспечиваемый составами, соответствующими данному изобретению, приводит к тому, что такие составы обеспечивают эффективную обработку, защищающую от многих видов микроорганизмов. Составы, отвечающие данному изобретению, эффективно подавляют прикрепление бактерий к поверхности медицинских устройств и помогают предотвращать образование биопленок. Поскольку тауролидин не является антибиотиком, случаи резистентности к нему неизвестны. Кроме того, составы, отвечающие данному изобретению, нетоксичны и разрешены для внутреннего применения.
Хотя настоящее изобретение было показано и описано применительно к его подробным вариантам осуществления, специалистам в данной области будет понятно, что возможны различные изменения в форме и деталях без отступления от сущности и объема заявляемого изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИМИКРОБНЫЕ КОМПОЗИЦИИ | 2013 |
|
RU2694758C2 |
| АБСОРБИРУЕМЫЕ СОПОЛИМЕРЫ ДИГЛИКОЛЯТА ПОЛИЭТИЛЕНА ДЛЯ УМЕНЬШЕНИЯ АДГЕЗИИ МИКРОБОВ К МЕДИЦИНСКИМ УСТРОЙСТВАМ И ИМПЛАНТАТАМ | 2010 |
|
RU2540924C2 |
| УСТРОЙСТВА ДЛЯ ВОССТАНОВЛЕНИЯ ТКАНИ С БЫСТРЫМ ВПИТЫВАНИЕМ ТЕРАПЕВТИЧЕСКИХ СРЕДСТВ | 2012 |
|
RU2608461C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ПОКРЫТИЯ МЕДИЦИНСКИХ ИМПЛАНТАТОВ | 2003 |
|
RU2341296C2 |
| ПОСТ-ЗАГРУЗКА ПОКРЫТЫХ ЦЕОЛИТОМ ПЛАСТИКОВ АНТИМИКРОБНЫМИ ИОНАМИ МЕТАЛЛОВ | 2010 |
|
RU2552939C2 |
| СПОСОБ ПОЛУЧЕНИЯ МАТЕРИАЛА С АНТИМИКРОБНЫМИ СВОЙСТВАМИ | 1998 |
|
RU2157244C2 |
| АНТИМИКРОБНЫЕ/АНТИБАКТЕРИАЛЬНЫЕ МЕДИЦИНСКИЕ УСТРОЙСТВА, ПОКРЫТЫЕ ТРАДИЦИОННЫМИ СРЕДСТВАМИ КИТАЙСКОЙ МЕДИЦИНЫ | 2009 |
|
RU2524635C2 |
| БИОЛОГИЧЕСКИ АКТИВНАЯ ПОЛИМЕРНАЯ МЕДИЦИНСКАЯ КОМПОЗИЦИЯ (ВАРИАНТЫ) | 2010 |
|
RU2447902C2 |
| ФАРМАЦЕВТИЧЕСКАЯ ПРОТИВОГЕРПЕТИЧЕСКАЯ КОМПОЗИЦИЯ | 2004 |
|
RU2291690C2 |
| Полимерный гель для локальной антибактериальной терапии инфекционных осложнений травм и операций на опорно-двигательном аппарате и способ его приготовления | 2023 |
|
RU2822155C1 |



Группа изобретений относится к области медицины и предназначена для антимикробной обработки имплантируемых медицинских устройств. Антимикробный состав для нанесения антимикробного покрытия на медицинские устройства содержит приблизительно от 50 до 99 вес.% тауролидина и приблизительно от 1 до 50 вес.% протамина. Для нанесения покрытия на медицинское устройство осуществляют предоставление медицинского устройства по меньшей мере с одной поверхностью и нанесение по меньшей мере на часть поверхности указанного антимикробного покрытия. Также обеспечивается полимерная смола для изготовления медицинских устройств, которая содержит указанный состав. Использование группы изобретений обеспечивает антимикробный состав, эффективный в отношении широкого спектра микробов. 6 н. и 74 з.п. ф-лы, 2 ил., 3 табл., 4 пр.
1. Антимикробный состав, содержащий
приблизительно от 50 до 99 вес.% тауролидина и
приблизительно от 1 до 50 вес.% протамина.
2. Состав по п. 1, в котором протамин представляет собой протаминовую соль.
3. Состав по п. 2, в котором протаминовая соль выбирается из группы, состоящей из сульфата протамина и гидрохлорида протамина.
4. Состав по п. 3, в котором протаминовая соль представляет собой протамина сульфат.
5. Состав по п. 1, дополнительно содержащий растворитель.
6. Состав по п. 5, в котором растворитель выбирается из группы, представленной водой, смесью воды/этанола и смесью воды/изопропанола.
7. Состав по п. 1, содержащий
приблизительно от 70 до 90 вес.% тауролидина и
приблизительно от 10 до 30 вес.% протамина.
8. Состав по п. 7, в котором протамин представляет собой протаминовую соль.
9. Состав по п. 8, в котором протаминовая соль выбирается из группы, состоящей из сульфата протамина и гидрохлорида протамина.
10. Состав по п. 9, в котором протаминовая соль представляет собой протамина сульфат.
11. Состав по п. 1, дополнительно содержащий антибиотик.
12. Состав по п. 11, в котором антибиотик выбирается из группы, состоящей из аминогликозидов, карбапенемов, гликопептидов цефалоспоринов, макролидов, линкозамидов, пенициллинов, полипептидов, хинолонов и тетрациклинов.
13. Состав по п. 12, в котором антибиотик выбирается из группы, состоящей из (гентамицина), имипенема, цефазолина, ванкомицина, эритромицина, клиндамицина, ампициллина, полимиксина В, левофлоксацина и миноциклина.
14. Состав по п. 1, одновременно содержащий антимикробные вещества, выбранные из группы, включающей таурултам, циклотауролидин, силаг 61 и ноксифлекс S.
15. Состав по п. 1, в котором состав пригоден для имплантации.
16. Состав для нанесения антимикробного покрытия на медицинские устройства, который содержит
антимикробный состав, содержащий
приблизительно от 50 до 99 вес.% тауролидина и
приблизительно от 1 до 50 вес.% протамина,
и растворитель.
17. Состав по п. 16, в котором растворитель выбирается из группы, представленной водой, смесью воды/этанола и смесью воды/изопропанола.
18. Состав по п. 16, в котором протамин представляет собой протаминовую соль.
19. Состав по п. 18, в котором протаминовая соль выбирается из группы, состоящей из сульфата протамина и гидрохлорида протамина.
20. Состав по п. 19, в котором протаминовая соль представляет собой протамина сульфат.
21. Состав по п. 16, в котором антимикробный состав содержит
приблизительно от 70 до 90 вес.% тауролидина и
приблизительно от 10 до 30 вес.% протамина.
22. Состав по п. 21, в котором протамин представляет собой протаминовую соль.
23. Состав по п. 22, в котором протаминовая соль выбирается из группы, состоящей из сульфата протамина и гидрохлорида протамина.
24. Состав по п. 23, в котором протаминовая соль представляет собой протамина сульфат.
25. Состав по п. 16, дополнительно содержащий антибиотик.
26. Состав по п. 25, в котором антибиотик выбирается из группы, состоящей из аминогликозидов, карбапенемов, гликопептидов цефалоспоринов, макролидов, линкозамидов, пенициллинов, полипептидов, хинолонов и тетрациклинов.
27. Состав по п. 26, в котором антибиотик выбирается из группы, состоящей из гентамицина, имипенема, цефазолина, ванкомицина, эритромицина, клиндамицина, ампициллина, полимиксина В, левофлоксацина и миноциклина.
28. Состав по п. 16, в котором антимикробный состав дополнительно содержит антимикробные вещества, выбранные из группы, включающей таурултам, циклотауролидин, силаг 61 и ноксифлекс S.
29. Состав по п. 16, дополнительно содержащий полимерное связующее.
30. Состав по п. 29, в котором полимерное связующее выбирается из группы, состоящей из веществ, выбранных из группы, включающей поливинилпирролидоны, полиэтиленгликоли, карбоксиметилцеллюлозу, гидроксиэтилкрахмал, гидроксипропилкрахмал, декстран, сополимеры полиоксипропилена и полиоксиэтилена, полиэтоксилированное касторовое масло, полигидроксикислоты, полилактиды, полигликолиды, полигидроксибутираты, полигидроксивалериаты, поликапролактоны, полидиоксаноны, синтетические и естественные олиго- и полиаминокислоты, полифосфазены, полиангидриды, полиортоэфиры, полиоксоэфиры, полифосфаты, полифосфонаты, полиспирты, полисахариды, полиэфиры (простые), полиамиды, алифатические полиэфиры (сложные), ароматические полиэфиры, сополимеры указанных веществ, рассасывающиеся стекла, фибрин, коллаген, альбумин, неразлагаемые полимеры, полиалкены, полипропилен, полиэтилен, частично галогенированные полиолефины, полностью галогенированные полиолефины, фторированные полиолефины, политетрафторэтилен, поливинилиденфторид, полиизопрены, полистиролы, полисиликоны, поликарбонаты, полиарилэфиркетоны, эфиры полиметакриловой кислоты, эфиры полиакриловой кислоты, полиимиды, неразлагаемые полисахариды, такие как целлюлоза, бактериальная целлюлоза, а также сополимеры полимеризующихся веществ из этого списка.
31. Состав по п. 16, в котором покрытие пригодно для нанесения на имплантируемые медицинские устройства.
32. Медицинское устройство с покрытием, в составе которого содержится
медицинское устройство по меньшей мере с одной поверхностью и
антимикробное покрытие, нанесенное по меньшей мере на часть указанной поверхности, при этом такое покрытие содержит
приблизительно от 50 до 99 вес.% тауролидина и
приблизительно от 1 до 55 вес.% протамина.
33. Медицинское устройство по п. 32, при этом устройство выбирается из группы, состоящей из хирургического шовного материала, хирургических игл, сеток, катетеров, скобок, скрепок, стентов, зажимов, пластин, винтов, шовных фиксаторов, ортопедических имплантатов, субстратов для выращивания тканей, полотен для восстановления ткани, имплантатов молочных желез, хирургических пеноматериалов, мешков, сердечных клапанов, шовных колец, кардиостимуляторов и повязок.
34. Медицинское устройство по п. 32, при этом данное устройство содержит материал, выбранный из группы, включающей полимеры, металлы, керамику, композиты, биоматериалы и их сочетания.
35. Медицинское устройство по п. 32, в котором протамин представляет собой протаминовую соль.
36. Медицинское устройство по п. 35, в котором протаминовая соль выбирается из группы, состоящей из сульфата протамина и гидрохлорида протамина.
37. Медицинское устройство по п. 36, в котором протамин представляет собой протаминовую соль.
38. Медицинское устройство по п. 32, в котором антимикробное покрытие содержит
приблизительно от 70 до 90 вес.% тауролидина и
приблизительно от 10 до 30 вес.% протамина.
39. Медицинское устройство по п. 38, в котором протамин представляет собой протаминовую соль.
40. Медицинское устройство по п. 39, в котором протаминовая соль выбирается из группы, состоящей из сульфата протамина и гидрохлорида протамина.
41. Медицинское устройство по п. 40, в котором протамин представляет собой протаминовую соль.
42. Медицинское устройство по п. 32, в котором антимикробное покрытие дополнительно содержит антибиотик.
43. Медицинское устройство по п. 42, в котором антибиотик выбирается из группы, состоящей из аминогликозидов, карбапенемов, гликопептидов цефалоспоринов, макролидов, линкозамидов, пенициллинов, полипептидов, хинолонов и тетрациклинов.
44. Медицинское устройство по п. 43, в котором антибиотик выбирается из группы, состоящей из гентамицина, имипенема, цефазолина, ванкомицина, эритромицина, клиндамицина, ампициллина, полимиксина В, левофлоксацина и миноциклина.
45. Медицинское устройство по п. 32, в котором антимикробный состав дополнительно содержит антимикробные вещества, выбранные из группы, включающей таурултам, циклотауролидин, силаг 61 и ноксифлекс S.
46. Медицинское устройство по п. 32, в котором антимикробное покрытие дополнительно содержит полимерное связующее.
47. Медицинское устройство по п. 46, в котором полимерное связующее выбирается из группы, включающей поливинилпирролидоны, полиэтиленгликоли, карбоксиметилцеллюлозу, гидроксиэтилкрахмал, гидроксипропилкрахмал, декстран, сополимеры полиоксипропилена и полиоксиэтилена, полиэтоксилированное касторовое масло, полигидроксикислоты, полилактиды, полигликолиды, полигидроксибутираты, полигидроксивалериаты, поликапролактоны, полидиоксаноны, синтетические и естественные олиго- и полиаминокислоты, полифосфазены, полиангидриды, полиортоэфиры, полиоксоэфиры, полифосфаты, полифосфонаты, полиспирты, полисахариды, полиэфиры (простые), полиамиды, алифатические полиэфиры (сложные), ароматические полиэфиры, сополимеры указанных веществ, рассасывающиеся стекла, фибрин, коллаген, альбумин, неразлагаемые полимеры, полиалкены, полипропилен, полиэтилен, частично галогенированные полиолефины, полностью галогенированные полиолефины, фторированные полиолефины, политетрафторэтилен, поливинилиденфторид, полиизопрены, полистиролы, полисиликоны, поликарбонаты, полиарилэфиркетоны, эфиры полиметакриловой кислоты, эфиры полиакриловой кислоты, полиимиды, неразлагаемые полисахариды, такие как целлюлоза, бактериальная целлюлоза, а также сополимеры полимеризующихся веществ из этого списка.
48. Медицинское устройство по п. 33, в котором полотно для восстановления ткани выбрано из группы, состоящей из сеток, тканых материалов, нетканых материалов и лент.
49. Медицинское устройство по п. 34, в котором полимер выбирается из группы, состоящей из полигидроксикислот, полиалкенов, полисиликонов, фторированных полиолефинов, фибрина и коллагена.
50. Медицинское устройство по п. 32, при этом устройство является имплантируемым.
51. Способ нанесения покрытия на медицинское устройство, содержащий этапы:
предоставления медицинского устройства по меньшей мере с одной поверхностью и
нанесения по меньшей мере на часть поверхности антимикробного покрытия, в составе которого содержится
приблизительно от 50 до 99 вес.% тауролидина и
приблизительно от 1 до 50 вес.% протамина.
52. Способ по п. 51, в котором протамин представляет собой протаминовую соль.
53. Способ по п. 52, в котором протаминовая соль выбирается из группы, состоящей из сульфата протамина и гидрохлорида протамина.
54. Способ по п. 53, в котором протаминовая соль представляет собой протамина сульфат.
55. Способ по п. 51, в котором покрытие дополнительно содержит растворитель.
56. Способ по п. 55, в котором растворитель выбирается из группы, представленной водой, смесью воды/этанола и смесью воды/изопропанола.
57. Способ по п. 51, в котором антимикробный состав содержит приблизительно от 70 до 90 вес.% тауролидина и приблизительно от 10 до 30 вес.% протамина.
58. Способ по п. 57, в котором протамин представляет собой протаминовую соль.
59. Способ по п. 58, в котором протаминовая соль выбирается из группы, состоящей из сульфата протамина и гидрохлорида протамина.
60. Способ по п. 57, в котором протаминовая соль представляет собой протамина сульфат.
61. Способ по п. 51, в котором антимикробное покрытие дополнительно содержит антибиотик.
62. Способ по п. 61, в котором антибиотик выбирается из группы, состоящей из аминогликозидов карбапенемов, гликопептидов цефалоспоринов, макролидов, линкозамидов, пенициллинов, полипептидов, хинолонов и тетрациклинов.
63. Способ по п. 62, в котором антибиотик выбирается из группы, состоящей из аминогликозидов карбапенемов, гликопептидов цефалоспоринов, макролидов, линкозамидов, пенициллинов, полипептидов, хинолонов и тетрациклинов.
64. Способ по п. 51, в котором антимикробный состав для нанесения покрытий дополнительно содержит антимикробные вещества, выбранные из группы, включающей таурултам, циклотауролидин, силаг 61 и ноксифлекс S.
65. Способ по п. 51, в котором антимикробное покрытие дополнительно содержит полимерное связующее.
66. Способ по п. 65, в котором полимерное связующее выбирается из группы, включающей поливинилпирролидоны, полиэтиленгликоли, карбоксиметилцеллюлозу, гидроксиэтилкрахмал, гидроксипропилкрахмал, декстран, сополимеры полиоксипропилена и полиоксиэтилена, полиэтоксилированное касторовое масло, полигидроксикислоты, полилактиды, полигликолиды, полигидроксибутираты, полигидроксивалериаты, поликапролактоны, полидиоксаноны, синтетические и естественные олиго- и полиаминокислоты, полифосфазены, полиангидриды, полиортоэфиры, полиоксоэфиры, полифосфаты, полифосфонаты, полиспирты, полисахариды, полиэфиры (простые), полиамиды, алифатические полиэфиры (сложные), ароматические полиэфиры, сополимеры указанных веществ, рассасывающиеся стекла, фибрин, коллаген, альбумин, неразлагаемые полимеры, полиалкены, полипропилен, полиэтилен, частично галогенированные полиолефины, полностью галогенированные полиолефины, фторированные полиолефины, политетрафторэтилен, поливинилиденфторид, полиизопрены, полистиролы, полисиликоны, поликарбонаты, полиарилэфиркетоны, эфиры полиметакриловой кислоты, эфиры полиакриловой кислоты, полиимиды, неразлагаемые полисахариды, такие как целлюлоза, бактериальная целлюлоза, а также сополимеры полимеризующихся веществ из этого списка.
67. Способ по п. 51, при этом устройство выбирается из группы, состоящей из хирургического шовного материала, хирургических игл, сеток, катетеров, скобок, скрепок, стентов, зажимов, пластин, винтов, шовных фиксаторов, ортопедических имплантатов, субстратов для выращивания тканей, материалов для ремонта тканей тела, имплантатов молочных желез, хирургических пеноматериалов, мешков, сердечных клапанов, шовных колец, кардиостимуляторов и повязок.
68. Способ по п. 51, при этом данное устройство содержит материал, выбранный из группы, включающей полимеры, металлы, керамику, композиты, биоматериалы и их сочетания.
69. Способ по п. 51, в котором устройство является имплантируемым.
70. Антимикробный состав, содержащий
приблизительно от 50 до 99 вес.% по меньшей мере одного метилолсодержащего вещества и
приблизительно от 1 до 50 вес.% протамина.
71. Состав по п. 70, в котором метилолсодержащее вещество представлено тауролидином.
72. Состав по п. 70, одновременно содержащий антимикробные вещества, выбранные из группы, включающей таурултам, циклотауролидин, силаг 61 и ноксифлекс S.
73. Состав по п. 70, дополнительно содержащий антимикробный компонент, выбранный из группы, включающей триклозан, медь (Cu), серебро (Ag), наносеребро, золото (Au), селен (Se), галлий (Ga), N-хлортаурин, листерин (R) и такие компоненты, как ментол, тимол, метилсалицилат и эвкалиптол.
74. Состав по п. 70, в котором протамин представляет собой протаминовую соль.
75. Состав по п. 74, в котором протаминовая соль выбирается из группы, состоящей из сульфата протамина и гидрохлорида протамина.
76. Состав по п. 74, в котором протаминовая соль представляет собой протамина сульфат.
77. Полимерная смола для изготовления медицинских устройств, в которой содержится
полимерная смола и
антимикробный состав, содержащий
приблизительно от 50 до 99 вес.% тауролидина и
приблизительно от 1 до 50 вес.% протамина.
78. Смола по п. 77, в которой протамин представляет собой протаминовую соль.
79. Смола по п. 78, в котором протаминовая соль выбирается из группы, состоящей из сульфата протамина и гидрохлорида протамина.
80. Смола по п. 79, в которой протаминовая соль представляет собой протамина сульфат.
| US 6350251 B1, 26.02.2002 | |||
| WO 2007000790 A1, 04.01.2007 | |||
| US 2008086091 A1, 10.04.2008 | |||
| US 2007202177 A1, 30.08.2007 | |||
| WO 2008141416 A1, 27.11.2008. |
Авторы
Даты
2017-08-18—Публикация
2012-09-26—Подача