Область техники изобретения
Настоящее изобретение относится к устройству типа "лаборатория на микросхеме" и способу для определения времени свертывания жидкой среды, в частности, для определения времени свертывания крови. Изобретение также относится к измерительному устройству, такому как коагулометр, для использования в комбинации с предложенной "лабораторией на микросхеме".
Описание известного уровня техники
У здоровых субъектов вязкость и густота крови регулируются процессом, известным как гемостаз. Этот механизм препятствует потере крови из сосудистой системы.
Коагуляцию крови регулирует сложный процесс, который направлен на остановку любого кровотечения в организме. В результате взаимодействия факторов коагуляции белков, кровеносных сосудов и тромбоцитов образуются устойчивые сгустки. Этот процесс продолжается после выздоровления разложением сгустка крови.
На первых стадиях образования сгустка слипаются тромбоциты, и при этом активизируется явление, известное как каскад свертывания крови. В этом процессе фибриноген (растворимый блок, присутствующий в плазме крови) превращается в нерастворимую фибриновую сетку, или сгусток крови. Катализатором такого превращения является тромбин - фермент, который присутствует в крови обычно в его неактивной форме, известной как протромбин.
Заболевания крови возникают в результате нарушений гемостаза. Они могут иметь наследственный характер, как, например, гемофилия или болезнь фон Виллебранда, возникать вследствие других нарушений, таких как антифосфолипидный синдром, синдром раздраженного кишечника, или рак, или вызываться внешними факторами, например, у пациентов, принимающих перорально антикоагулянты для лечения или профилактики тромботических осложнений, сердечных или сосудистых заболеваний.
Широкое применение имеет терапия пероральным антикоагулянтом, таким как варфорин, которая требует частого контроля ввиду узкого терапевтического индекса этого препарата. Его дозировка нуждается в периодической коррекции, чтобы исключить возникновение тромбоза или риск кровотечения.
Удобной, простой и дешевой альтернативой применяемым в настоящее время клиническим исследованиям свертывания для таких пациентов, а также для пациентов с известными условиями для предрасположенности, а именно, малоподвижным образом жизни, тучностью, медиацией, или подвергшихся хирургическому или стоматологическому лечению, было бы наличие надежных тестов, которые бы позволили им регулярно контролировать свертывание в домашних условиях. Такие тесты можно было бы также применять как предварительную помощь в диагностике нарушений гемостаза.
Наиболее распространенным в мире показателем коагуляции является так называемое "международное нормализованное отношение" (МНО). Это отношение вычисляется на основании протромбинового времени (ПВ), т.е. времени, которое прошло после активации коагулирующим реагентом до начала свертывания крови. Активирующим агентом является тканевый фактор, или тромбопластин, и этот механизм называется "внешней системой коагуляции". МНО было предложено из-за различий между разными партиями и производителями тканевого фактора (продукта, получаемого биологическим путем), чтобы можно было унифицировать результаты. МНО - это отношение протромбинового времени пациента к среднему протромбиновому времени (СПВ) по меньшей мере 20 здоровых нормальных людей, в степени значения международного индекса чувствительности (МИЧ) тромбопластина для используемого контрольного образца. Каждый производитель присваивает МИЧ любому выпускаемому им тканевому фактору, чтобы указать как данная конкретная партия тканевого фактора соотносится с международным унифицированным образцом.
Существует также второй, хотя и менее распространенный вид показателя, который основан на аналогичном механизме коагуляции через "внешнюю систему коагуляции" и называется активированное частичное тромбопластиновое время (АЧТВ). Оба этих показателя в настоящей заявке называются временем свертывания.
В Европе такие анализы обычно выполняются в лабораториях, где перед определением ПВ обычно требуется подготовка образца крови. В последнее время возникла тенденция к применению устройств диагностики на месте (POC) или экспресс-диагностики (NPT), которые используются непосредственно медицинской сестрой или врачом, или автономно пациентом, которая в значительной степени вытеснила традиционные методы.
В известных методах, разработанных изначально, требуется получение больших или точных объемов крови посредством венопункции, обработка крови перед выполнением анализа и опытный персонал для выполнения этой процедуры и интерпретации результатов. В противоположность этим методам, для коагулометров РОС, также известных как портативные коагулометры, требуется всего капля цельной крови из пальца, чтобы получить немедленные результаты МНО.
В заявке на патент WO92/21028 описан способ детектирования, основанный на явлении ферромагнетизма. Устройство содержит коагуляционную камеру и контрольную камеру, каждая из которых снабжена перемешивающей лопастью, вращающейся в колеблющемся магнитном поле. Вращение лопасти в коагуляционной камере замедляется, как только начинается коагуляции крови, оказывая сопротивление ее движению. Время коагуляции измеряется как момент, когда изменяется относительное движение перемешивающих лопастей в камерах.
В других устройствах, например, описанных в патенте США 5110727, используется образец крови с диспергированными в нем металлическими частицами. При приложении колебательного магнитного поля возникает движение частиц вперед и назад, которое замедляется при коагуляции крови. Это уменьшение скорости коррелирует с увеличением вязкости образца крови или началом коагуляции.
В заявках на патент WO 00/06761 и WO 02/48707 А2 описано устройство, содержащее электроды в контакте с неподвижным образцом крови, которое измеряет, соответственно, изменения электропроводности и тока с увеличением вязкости крови.
В WO 2004/059317 А1 описано недорогое одноразовое устройство для определения времени свертывания крови. Это устройство содержит микродатчик, по меньшей мере частично контактирующий с жидкостью, который измеряет полное сопротивление и электрическую емкость крови в канале, когда кровь свертывается и ее движение прекращается.
Однако высокая стоимость производства этих устройств ограничивает возможности их применения в качестве устройств для одноразового использования.
Следовательно, все еще существует потребность в точных, недорогих микросхемах для одноразового использования и способах определения времени свертывания методом POC и/или NPT.
Проводились разработки, направленные на создание детектирующих тестовых средств меньшего размера, требующих меньших проб цельной крови произвольного объема в масштабе микролитра, основанные на достижениях в области материаловедения и электронных и оптических методах.
В заявке на патент WO 2007/025559 А1 описано многослойное устройство для определения коагуляции в образце плазмы или цельной крови, содержащее один или более детектирующих участков, на каждом из которых предусмотрен по меньшей мере один реагент, стимулирующий коагуляцию.
В заявке US 2007/0122849А1 описана конструкция для анализа образца в микрожидкостной микросхеме, предназначенная для количественного анализа и обнаружения аналитов.
В ЕР 0394070 В1 описано микрожидкостное устройство с одним капиллярным каналом, оптимизированное для определения АЧТВ в образце цельной крови объемом 40 мкл при времени пребывания 200 сек. В этом устройстве в качестве реагента используется смесь активированного реагента для измерения активированного частичного тромбопластинового времени и смесь фосфолипидов. По ходу капилляров применяется визуальный или оптический способ детектирования, например, светодиодный, и АЧТВ определяется в момент прекращения движения крови вдоль устройства.
В патенте США 6900021 описано микрожидкостное устройство для исследований in vitro реакции и влияния различных соединений на клетки. Движение жидкости регулируется с помощью насосов, разности давления или электрических полей, но не капиллярным действием микрожидкостного канала. Предусмотрено два впускных пути для жидкости, которые пересекаются и сливаются с основным путем, чтобы позволить произойти реакции. Основной путь не имеет участка, содержащего реагент. Реагенты также отсутствуют на микросхеме, но добавляются в разных точках и в разное время, что позволяет использовать данную микросхему для анализа различных реакций с различными реагентами.
Несмотря на эти разработки современные коагулометры для диагностики на месте все еще имеют ряд существенных недостатков, которые перечислены ниже:
- несмотря на то, что многие используемые микросхемы или тестовые полоски используются однократно, они содержат несколько компонентов, таких как средство для забора образца крови, средство для измерения изменения проводимости или средство для измерения изменения вязкости. Наличие таких активных компонентов, как электрохимические контакты или колеблющиеся частицы, в полоске усложняет и удорожает производство одноразовой микросхемы. Кроме того, уменьшение размера такой полоски невозможно без ущерба для ее качества.
- Несмотря на успехи, достигнутые в отношении необходимого объема пробы крови для анализа, этот объем в лучшем случае все еще составляет около 10 мкл, что неудобно для пациента. Это гораздо больше, например, объема, необходимого для других анализов, например, для измерения глюкозы, которую можно точно измерить на образце крови объемом 1 мкл или меньше.
- Устройства для детектирования и измерения, которые используются с известными тестовыми полосками или микросхемами, все еще довольно сложные. В некоторых случаях им необходимы дополнительные средства для передачи или перемещения образца крови, такие как магнитные поля или насосы. В других случаях устройство нуждается в нескольких детектирующих средствах: электрохимическом или магнитном средстве для измерения изменения некоторых свойств в образце, которое требует калибровочных микросхем, и дополнительное детектирующее средство для считывания дополнительных встроенных систем контроля качества. Это повышает сложность, а значит и стоимость портативного устройства.
Учитывая перечисленные выше недостатки, в основу настоящего изобретения положена задача создания усовершенствованного микрожидкостного устройства и способа для определения времени свертывания в жидкой среде, такой как кровь или плазма, которые бы требовали минимума операций, имели низкую себестоимость и могли использоваться пациентом автономно. Еще одна задача изобретения - создать измерительное устройство для применения с микрожидкостным устройством, таким как коагулометр, для определения и контролирования времени свертывания образца, присутствующего в микрожидкостном устройстве и для контроля качества, простое в производстве, компактное и используемое пациентом автономно.
Сущность изобретения
Согласно аспекту настоящего изобретения предложен способ определения времени свертывания в жидкой среде, такой как кровь или плазма, согласно которому
выполняют микрожидкостное устройство, содержащее, по меньшей мере, средство для введения образца жидкой среды, область, соединенную со средством для введения образца и обеспечивающую перемещение жидкой среды по длине микрожидкостного канала, причем микрожидкостной канал, по меньшей мере, частично покрыт гидрофильным материалом так, что жидкая среда протекает только под действием капиллярных сил, и участок в начале первой области, содержащий реагент, вступающий в реакцию с упомянутой жидкой средой и запускающий каскад свертывания, подают образец жидкой среды в средство для введения образца жидкой среды, непрерывно контролируют положение фронта жидкости как функции времени, получают теоретическое значение распространения фронта жидкой среды как функции времени, если свертывание не произошло, при этом время свертывания определяют как время, прошедшее от момента, когда началась реакция, до момента, когда контролируемая функция свертывания отклоняется от теоретического значения на более чем конкретный порог.
Предпочтительно контролируемая функция свертывания отклоняется от теоретического значения на более чем конкретный порог, когда кривая ее логарифма от логарифма времени меняет наклон.
Предпочтительно согласно способу функция Y=Y(u)=log L(t) получена из контролируемой функции свертывания, являясь изменением переменной u=log t, причем кривая log L(t) от log (t) меняет наклон, если первая производная dY/du отклоняется от постоянного значения 0,5 на более чем конкретный порог, или если затухание второй производной d2Y/d2u отклоняется от 0 на более чем конкретный порог.
Таким образом, согласно настоящему изобретению предложен способ, обеспечивают точное определение протромбинового времени на минимальном образце крови, и поэтому пациент может легко использовать его автономно без венопункции.
Изобретение будет описано более подробно на примерах его воплощения, представленных далее ниже.
Краткое описание чертежей
Признаки, задачи и преимущества настоящего изобретения поясняются в приведенном ниже подробном описании со ссылками на чертежи, на которых представлено следующее:
фиг. 1 – перспективный вид варианта устройства в соответствии с настоящим изобретением в разобранном виде, показывающий отдельно два слоя;
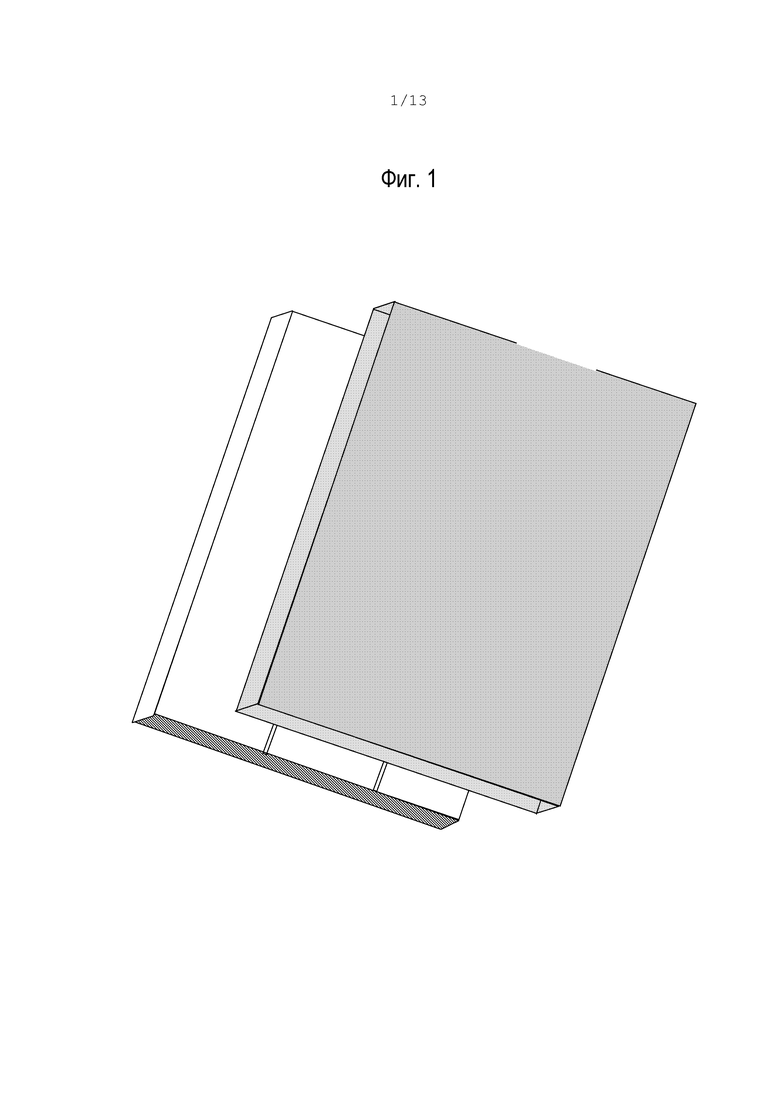
фиг.2 - вид сверху (левая часть) и сбоку (правая часть) устройства согласно варианту, изображенному на фиг.1;
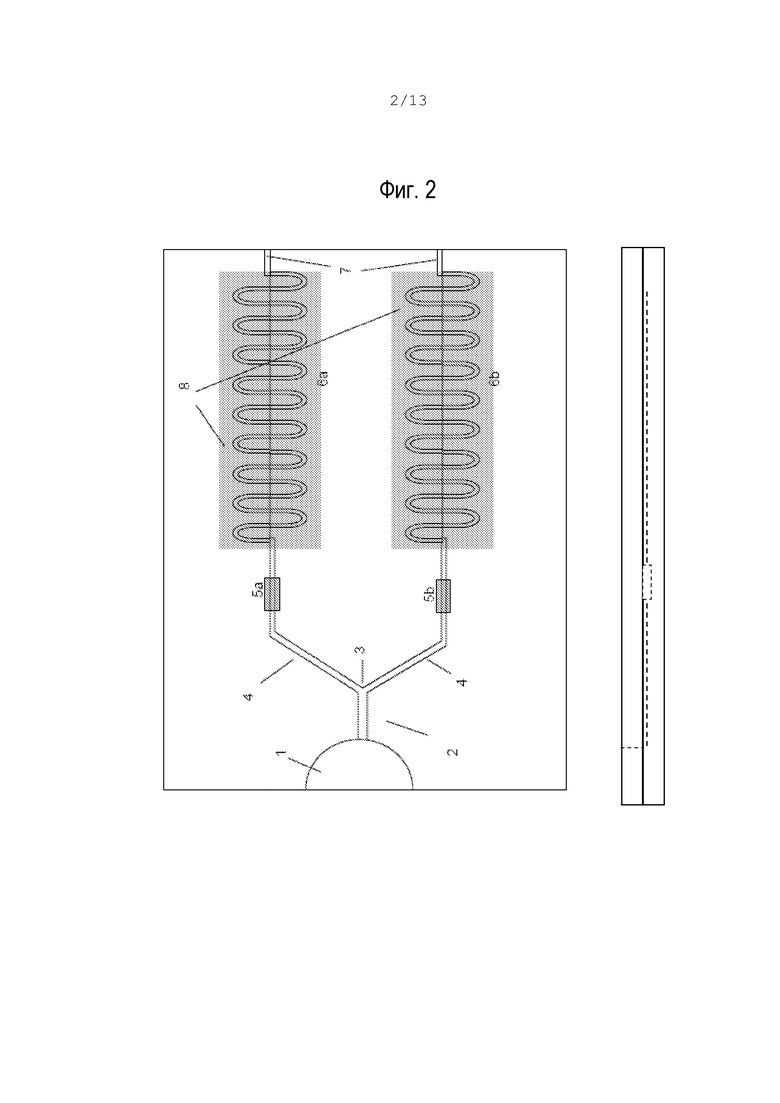
фиг.2А – вид сверху другого варианта микрожидкостного устройства;
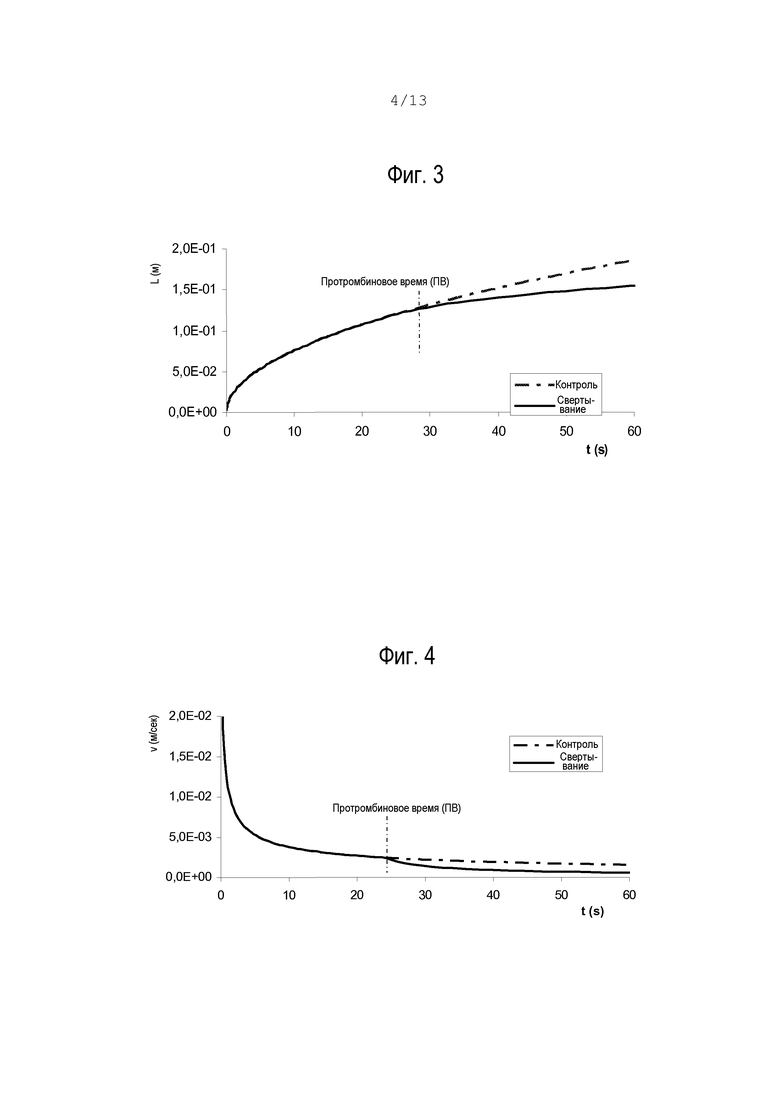
фиг.3 – графическое представление наложения положений фронта потока в каналах свертывания и контроля;
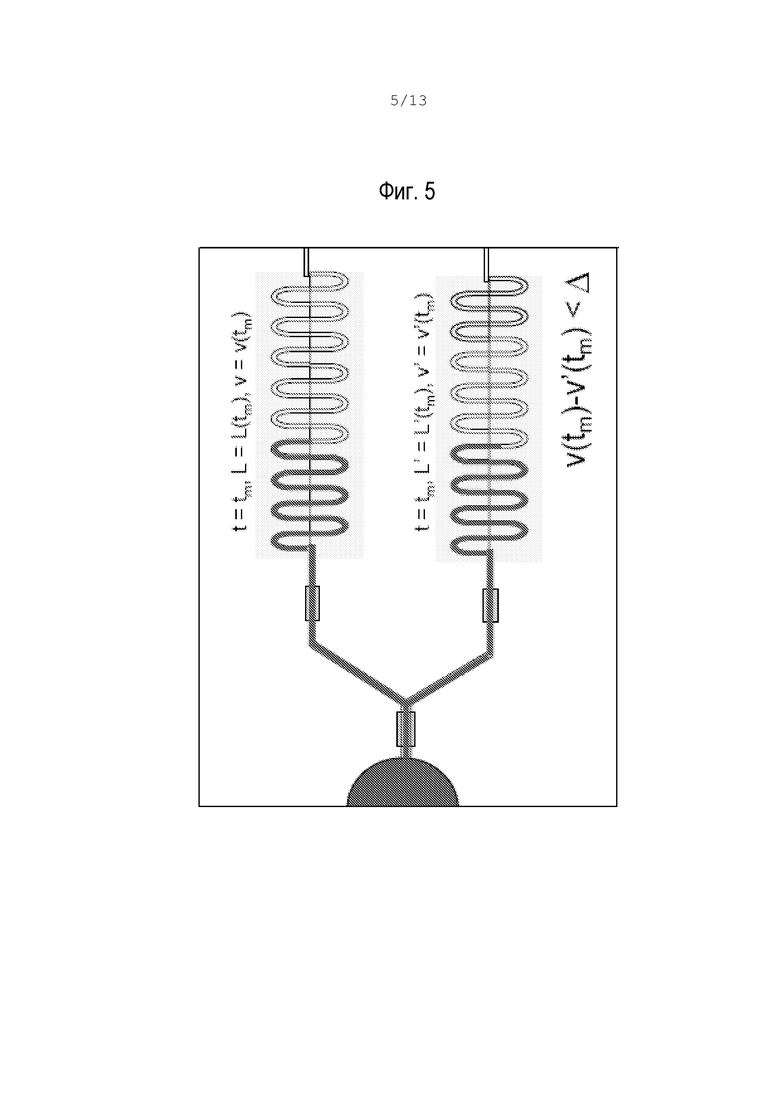
фиг.4 - графическое представление наложения скоростей фронта потока в каналах свертывания и контроля;
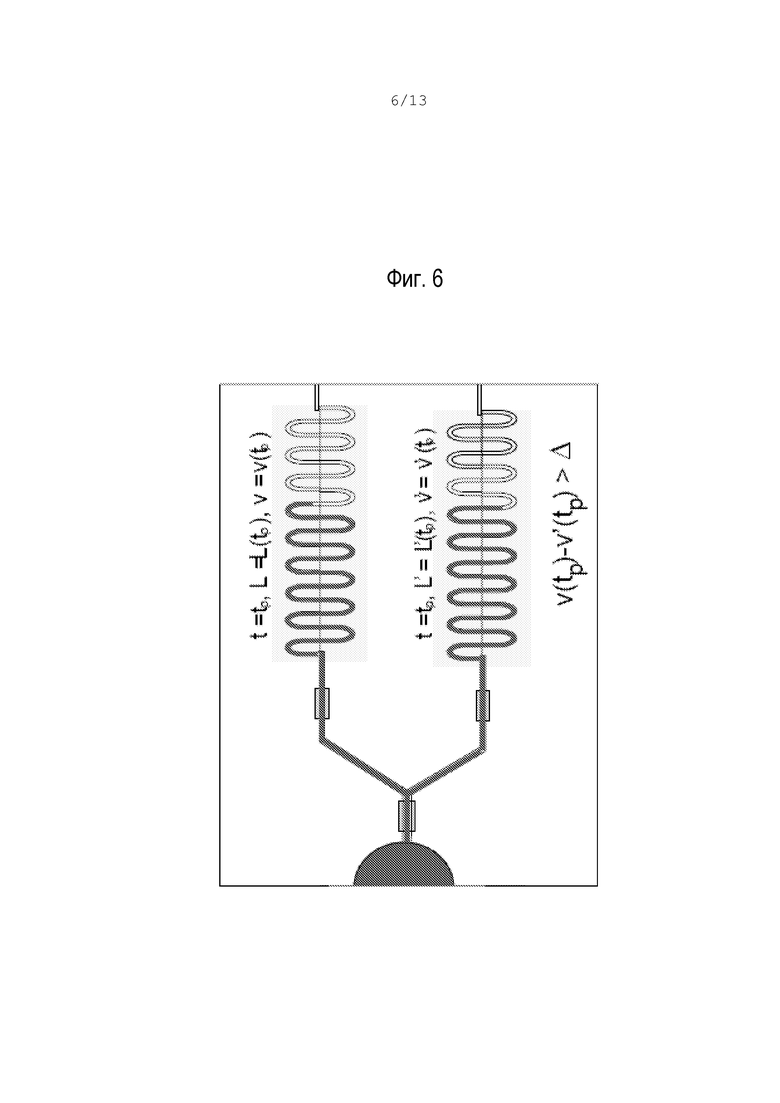
фиг.5 – схематический вид положений фронта потока перед свертыванием в варианте по фиг.1;
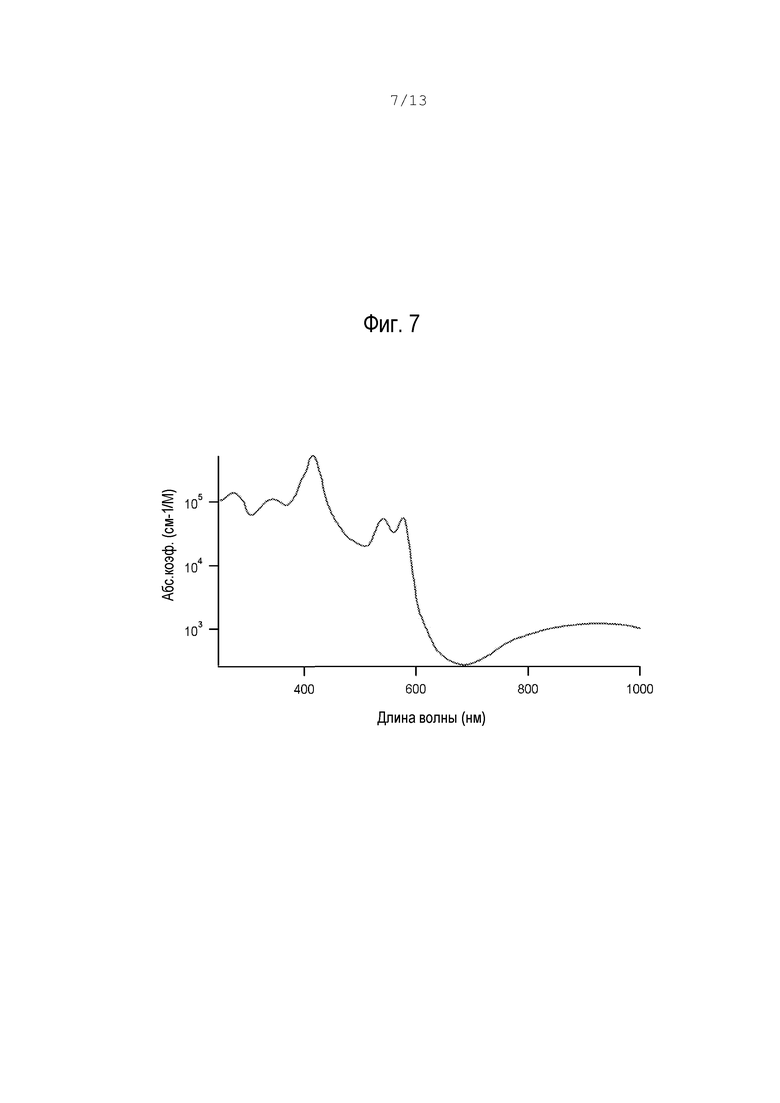
фиг.6 - схематический вид положений фронта потока после свертывания в варианте по фиг.1;
фиг.7 – отношение коэффициента абсорбции крови к длине волны;
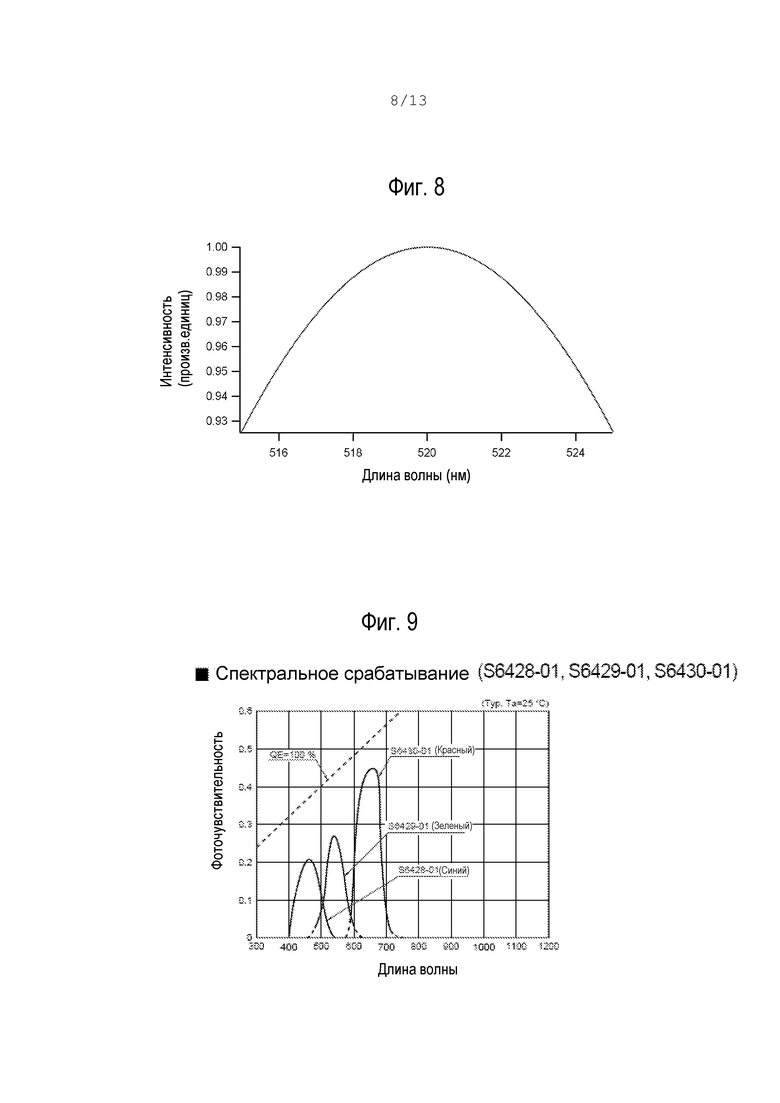
фиг.8 – спектр излучения светодиода;
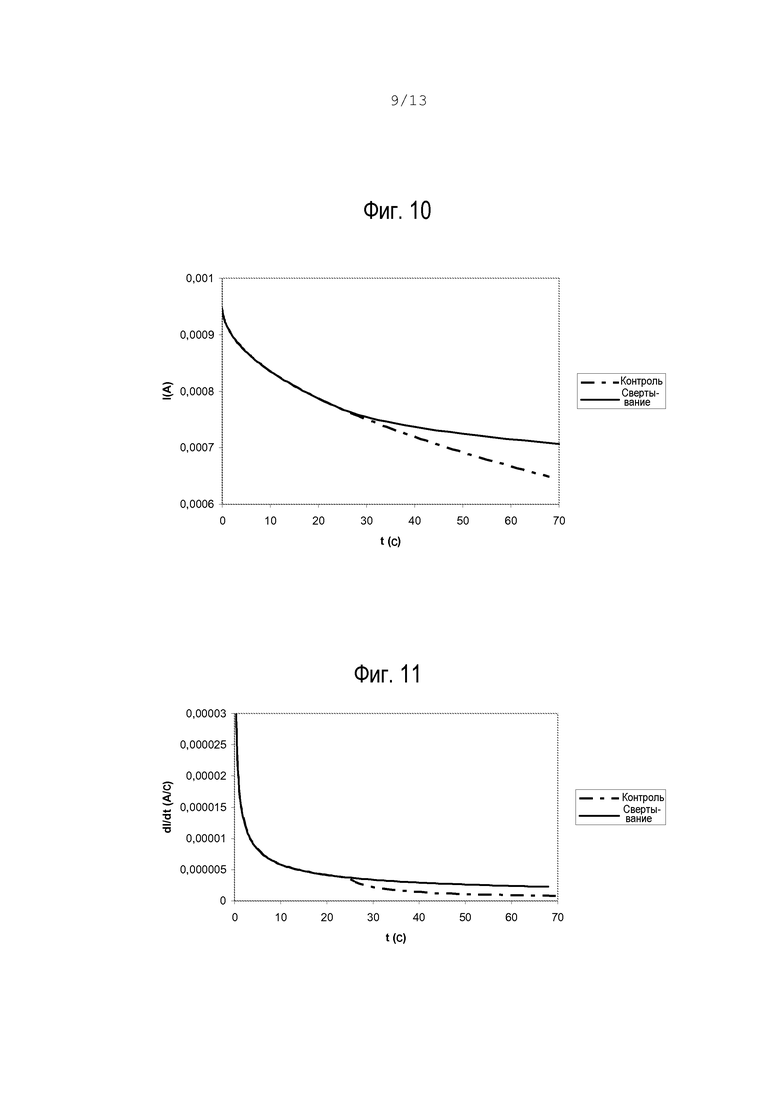
фиг.9 - кривая срабатывания фотодиода, оптимизированного на обнаружение длин волны сине-зеленой области спектра;
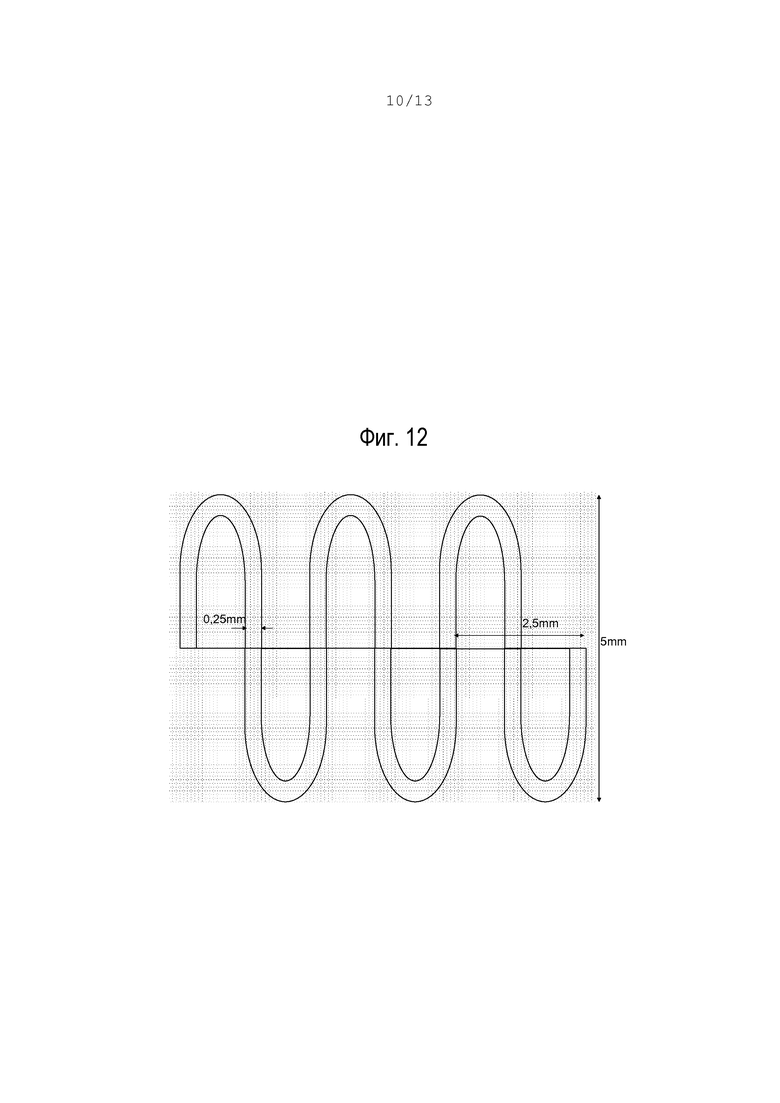
фиг.10 – отношение обнаруженной интенсивности тока к времени в двух микросхемах различного размера для каналов свертывания и контроля;
фиг.11 - производные кривых интенсивности тока на фиг.10;
фиг.12 - наложение змеевидной кривой в варианте по фиг.1 и матрица ПЗС с размером пикселей 19×19 мкм.
Фиг.13-16 – графики уравнений, использованных для определения времени свертывания с помощью теоретических кривых;
Фиг.17 - типичные данные, полученные на этапе 3 реальных тестов коагуляции и времени свертывания, определенные в соответствии с теоретическим методом 1 или 2.
На всех чертежах одинаковые элементы обозначены одинаковыми ссылочными номерами.
Подробное описание изобретения
Согласно изобретению предложено устройство в форме микросхемы или одноразовой тестовой полоски для определения времени свертывания жидкости, такой как кровь или плазма, измерительное устройство для использования в качестве портативного коагулометра с предложенной тестовой полоской, и способ определения времени свертывания с использованием микрожидкостного устройства согласно изобретению.
Портативный коагулометр, как устройство для диагностики на месте, представляет собой технологию, обеспечивающую четыре основных усовершенствования: снижение стоимости, уменьшение объема пробы крови, контроль качества и улучшение портативности. Все эти четыре аспекта особенно важны для экономичного и надежного самотестирования пациентом.
Настоящее изобретение обеспечивает следующие существенные преимущества по сравнению с известными портативными тестовыми полосками и коагулометрами:
- Снижение стоимости: одноразовая микрожидкостная микросхема представляет собой очень простой (пассивный) компонент, который можно изготовить с использованием крупносерийных и экономичных технологий производства и материалов.
- Уменьшение объема образца крови: технология микрожидкостной микросхемы позволяет тестировать образцы крови объемом менее 5 мкл с необходимым контролем качества и точностью.
- Контроль качества: в предлагаемом одноразовом устройстве можно предусмотреть несколько отдельных контролей качества, которые считываются одним детектором. Кроме того, устройство позволяет использовать калиброванные плазмы в качестве внешнего контроля качества.
- Улучшение портативности: системы детектирования очень компактные, недорогие и могут встраиваться в тонкие портативные устройства.
В основу изобретения положен тот факт, что соответствующий микрожидкостной канал обеспечивает капиллярное движение образца жидкости, такой как кровь или плазма, при этом возможен точный контроль за положением или скоростью фронта жидкости с помощью простых средств пассивным образом, без контакта с образцом жидкости. Реологические изменения образца жидкости после инициирования каскада свертывания (когда образец вступает в контакт с коагулирующим реагентом) и, в частности, наглядные изменения вязкости в конечной точке свертывания, существенно влияют на контролируемые динамические параметры.
Эти параметры можно контролировать с помощью одного и того же простого средства детектирования и сравнивать либо с контрольным образцом, который не содержит коагулирующего реагента или содержит другой контрольный реагент, либо, в качестве альтернативы, сравнивать с теоретически предсказанным значением.
Не желая связывать себя теорией, авторы полагают, что микрожидкостная система согласно изобретению является в некотором роде имитацией микрокапиллярной структуры капиллярных сосудов и динамики текущей крови. Из-за сложности и высокой чувствительности этапов коагуляции крови (инициации, усиления, распространения и формирования сгустка) очень желательно как можно ближе воспроизвести среду гемостаза in vivo. Согласно опубликованному отчету Чикагского Университета [Kastrup, C. J. Runyon, M. K. Shen, F. Ismagilov, R. F. Modular chemical mechanism predicts spatiotemporal dynamics of initiation in the complex network of hemostasis (Модульный химический механизм предсказывает пространственно-временную динамику инициирования в сложной сети гемостаза), Department of Chemistry and institute for Biophysical Dynamics, University of Chicago, Edited by George M. Whitesides, Harvard University], микрожидкостная среда in vitro может имитировать действительное поведение свертывания крови в человеческих капиллярах, что, по мнению авторов, имеет важное значение для определения времени свертывания.
Кроме того, изобретение позволяет непрерывно контролировать динамику течения, так что можно обнаружить молекулярные изменения гемостаза с высокой точностью и воспроизводимостью. В частности, образование первых нерастворимых фибринов оказывает измеримый эффект на реологические свойства благодаря размеру микрокапиллярной структуры.
Как показано на фиг.1, один вариант микрожидкостного устройства в соответствии с настоящим изобретением представляет собой двухслойный узел, содержащий нижнюю плоскую пластину и покрывающий слой. На нижней пластине сформирована микроструктура системы распределения образца, образующая ряд каналов или трубок, соединенная на одном конце с помощью соответствующего средства с участком введения образца.
Капиллярные силы в этих каналах обуславливают движение жидкости. Специалист сможет подобрать размер и форму канала в микроструктуре на нижней пластине, чтобы получить положение или скорость течения, которые он сможет точно контролировать. Для капиллярного движения образца жидкости в канале должна иметься гидрофильная поверхность, чтобы создать достаточное отрицательное давление. Эта гидрофильная поверхность может быть предусмотрена на нижней пластине или на покрывающем слое.
В одном варианте нижняя пластина выполнена из пластика. Если этот пластик гидрофобный, то гидрофильность можно придать каналу посредством таких известных методов как, например, химическая обработка, нанесение покрытия химическим методом или плазменная обработка, чтобы обеспечить требуемую поверхностную энергию или угол контакта.
В предпочтительном варианте гидрофильная поверхность обеспечивается покрывающим слоем, который покрывает микрожидкостные каналы, образованные на нижнем слое. В этом варианте покрывающий слой выполняется либо из гидрофильного материала, либо из материала, подвергшегося гидрофильной обработке, как описано выше.
Альтернативно, в предпочтительном варианте гидрофильные свойства придаются верхнему слою с помощью связывающего материала, используемого для связи двух слоев, которые образуют эту микросхему. В этом случае важно, чтобы выбранное связывающее покрытие не вступало в реакцию с образцом крови или не мешало реакции свертывания.
Следовательно, покрывающий слой может состоять из клейких полимерных пленок разного типа, таких как термоклеевые и самоклеющиеся пленки. Можно использовать гидрофильные составы с добавлением поверхностно-активных веществ в связывающий материал. Предпочтительно использовать твердые связывающие материалы, чтобы предотвратить блокировку канала в результате течения связывающего материала на этапе соединения или в результате ползучести.
На фиг.2 и 2А показан вид сверху различных вариантов микрожидкостного устройства согласно изобретению, которое содержит описанные ниже элементы.
Средство (1) для введения образца жидкой среды, состоящее в основном из впускного отверстия. Впускное отверстие соединено с распределительным капиллярным каналом (2), за которым следует разветвление (3), которое делит распределительный канал (2) на первую область (6а) и вторую область (6b), позволяющие жидкой среде перемещаться по длине этих областей. Факультативно, распределительный канал может содержать ячейковый фильтр (показан только на фиг.1).
В предпочтительном варианте первая область (6а) и вторая область (6b) имеют идентичную структуру.
Каждая из областей (6а и 6b) содержит, в направлении от распределительного канала, участок (5а, 5b) и по меньшей мере один микрожидкостной канал, который в данном контексте будет называться сканирующим участком (8). Первый участок (5а) содержит первый реагент, способный реагировать с данной жидкой средой, и побуждает микрожидкостной канал в области (6а) функционировать как реакционный канал, в то время как второй участок (5b) либо пустой, либо содержит другой реагент, так что микрожидкостной канал в области (6b) выполняет функцию контрольного канала. Предпочтительно первый реагент способен инициировать свертывание данной жидкой среды.
В другом варианте в микросхеме предусмотрено более двух областей. Одна из областей работает как реакционный канал. описанный выше, а две или более других областей являются контрольными каналами.
Для реализации встроенного контроля качества образец крови может перемещаться капиллярными силами вдоль контрольных каналов, где реакционные камеры содержат специальные соединения, обеспечивающие известное постоянное (или изменяющееся в узком интервале) время коагуляции. Например, можно предусмотреть два типа такого контроля - нормированный контроль и аномальный контроль, чтобы получить низкое и высокое эталонное время свертывания.
Контрольные каналы содержат реагент, имеющий состав, отличный от состава реагента, присутствующего в реакционном канале.
Так, в одном варианте имеется нормированный контрольный канал, в котором в качестве реагента может использоваться, например, фактор свертывания, зависимый от витамина К. Такие факторы свертывания можно получать из высушенной или лиофилизированной нормальной плазмы пациента. В другом варианте предусмотрен аномальный контрольный канал, который содержит ингибитор фактора свертывания, такой как гепарины, цитраты, оксалаты, и т.п. Кроме того, он может содержать те же зависимые от витамина К факторы свертывания, что и в нормированном контрольном канале.
Далее будут проиллюстрированы предпочтительные варианты осуществления изобретения с описанием количества областей и их функциями:
- 2 области: Один реакционный канал для определения времени свертывания образца крови относительно контрольного канала, не содержащего коагулирующий реагент или содержащего ингибитор коагуляции.
- 2 области: Один реакционный канал для определения времени свертывания образца крови на основании теоретических кривых и один контрольный канал, который обеспечивает нормированное время свертывания.
- 3 области: Один реакционный канал для определения времени свертывания образца крови относительно контрольного канала, не содержащего коагулирующий реагент или содержащего ингибитор коагуляции. Кроме того, имеется другой контрольный канал, обеспечивающий нормированное время свертывания.
- 3 области: Один реакционный канал для определения времени свертывания образца крови на основании сравнения с теоретическими кривыми. Кроме того, имеется другой контрольный канал, обеспечивающий нормированное время свертывания и еще один контрольный канал, обеспечивающий известное аномально высокое время свертывания.
Все эти и другие варианты осуществления изобретения, очевидные для специалиста, подпадают под объем настоящего изобретения.
В предложенном устройстве движение жидкости вызывают только капиллярные силы, поэтому микросхема или тестовая полоска являются пассивным устройством, не требующим внешних сил. Поверхности гидрофильных каналов позволяют мениску смачивания перемещаться вдоль каналов по направлению к отрицательному капиллярному давлению, в то время как мениск несмачивания остается во входном отверстии. Движение жидкости прекращается останавливающими клапанами, образованными посредством введения гидрофобной поверхности или выполнения подходящего отверстия канала. В предпочтительном варианте каждая область (6а, 6b) содержит средство (7) для вентиляции, предпочтительно вентиляционное отверстие, которое также действует как клапан остановки движения. Хотя на фиг.2 вентиляционные отверстия (7) показаны в конце канала, их можно расположить в других местах вдоль микрожидкостных каналов. Например, соединительные вентиляционные отверстия (7) с перекрытием течения на выходе реакционных камер позволяют максимально ускорить капиллярное движение к этой точке, как показано на фиг.2А. В других вариантах каждый канал имеет более одного вентиляционного отверстия (7), которые позволяют контролировать и модулировать скорость и реологические свойства жидкости.
По меньшей мере какое-либо свойство жидкой среды, предпочтительно положение или скорость фронта жидкости, контролируется по мере того, как жидкая среда проходит сканирующие участки (8) первой (6а), второй (6b) и необязательной третьей областей. Сравнение этих свойств в упомянутых различных областях позволяет определить момент, когда происходит реакция в первой области (6а), и определить время свертывания для образца жидкости. Эти области предпочтительно являются капиллярными каналами.
Принципы работы этого устройства основаны на микрогидродинамике, основные принципы которой радикально отличаются от обычной теории течения из-за малых масштабов системы.
Основные принципы
Динамическое заполнение в соответствии с ньютоновским поведением капиллярной трубки постоянного сечения можно определить через объемный расход Q, который зависит от вязкости η, общего сопротивления потоку RFR и разности давления ΔP между мениском смачивания (передним) и мениском несмачивания (задним):

Для канала, имеющего длину "L" и прямоугольное поперечное сечение A, ширину "a" и глубину "b", сопротивление потоку RRF можно выразить как
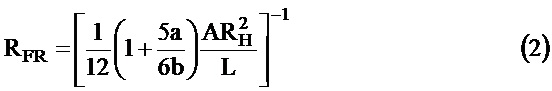
где "RH" - гидравлический радиус, который определяется как 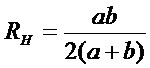 .
.
Для определения L=L(t), т.е. положения фронта потока во времени, необходима интеграция уравнения (1) со временем. Таким образом, L и скорость, вычисленная как производная L от времени, выражаются как
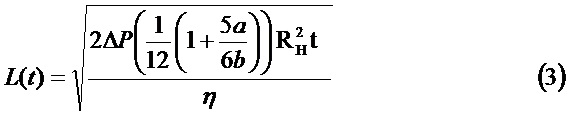
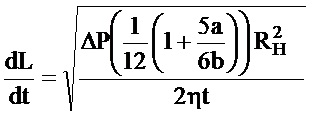
Эти уравнения являются основными уравнениями для течения жидкости перед свертыванием, так как вязкость была принята постоянной. Когда начинается свертывание, вязкость зависит от времени с ростом по экспоненциальному закону, поэтому согласно уравнению (1) расход, который имеет обратно пропорциональную линейную зависимость от вязкости, подвергнется внезапному снижению. Кривые L(t) и производные, показанные далее, были численно определены для переменной вязкости.
С помощью уравнений (1) и (3) можно предварительно спроектировать длины канала, необходимые для обеспечения постоянного течения вплоть до максимального времени свертывания. Объем образца "V" для трубки постоянного сечения можно оценить как
V=a bL(t)
Следовательно, необходимо спроектировать устройство и выбрать размер каналов согласно существующей зависимости (4) между геометрическими параметрами каналов a, b и L, необходимым объемом образца и максимальным временем свертывания.
Определение времени свертывания по теоретическим кривым
В одном варианте изобретения, воспользовавшись непрерывным контролированием динамики течения, можно определять или контролировать время свертывания путем сравнения измеренного свойства образца с теоретически предсказанным значением.
Так как динамическое поведение до свертывания хорошо предсказывается, время свертывания можно определить как момент, когда контролируемая кривая свертывания отклоняется сверх конкретного порога от теоретических кривых из уравнений (3). Можно применить всего несколько математических операций, чтобы это отклонение зависело только от качественного, но не от количественного динамического поведения потока. Далее описываются два различных, но похожих подхода:
Метод 1
Этап 1
Согласно уравнению (3) для длины капилляра в соответствии с ньютоновским поведением, L(t) является степенной функцией времени. Начиная со значений L(t) и t, полученных из системы детектирования, можно построить следующую кривую:
L(t)=Kt0,5
Контролируемая кривая (коагуляционный канал) и теоретическая кривая нанесены на график на фиг.13.
Этап 2
Применив логарифмы на обеих сторонах упомянутого выражения, получаем линейную кривую с наклоном 0,5 (см. также график на фиг.14):
log L(t)=log K+0,5 log t
log K является количественным членом, а 0,5 log t - качественным.
Этап 3
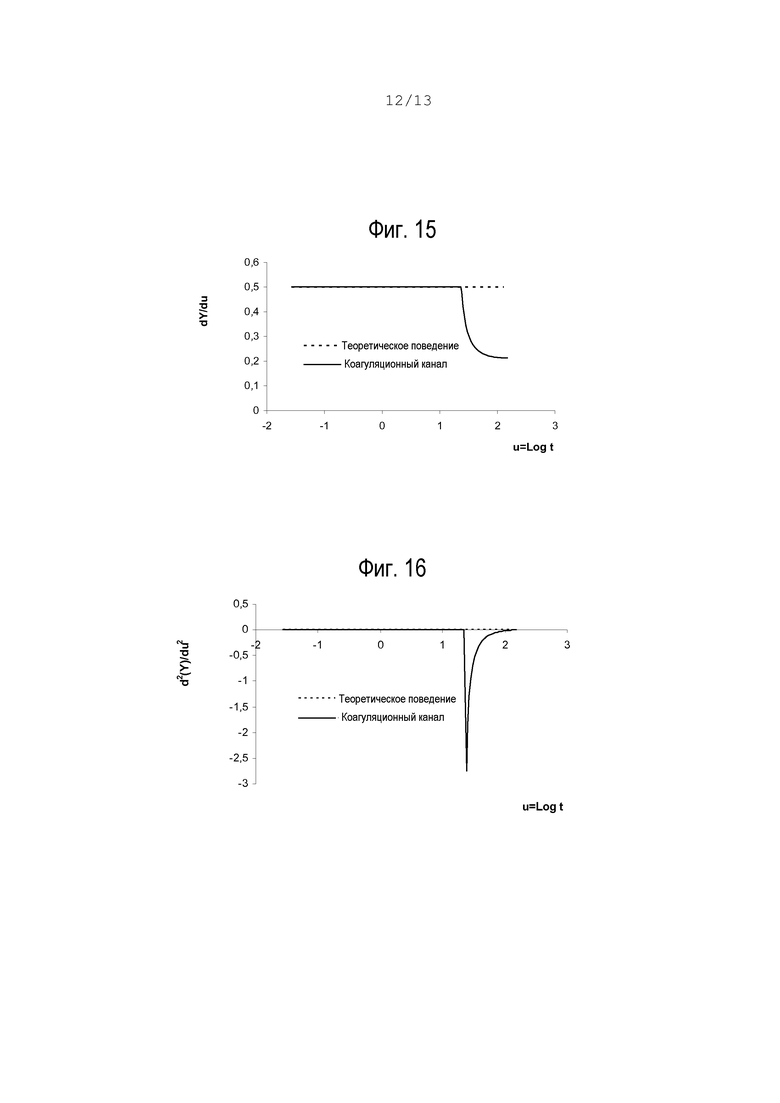
Изменяя переменную (u=log t), можно определить новую функцию Y=Y(u) и дифференцировать ее относительно u (см. также график на фиг.15):
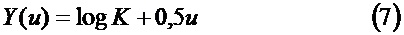
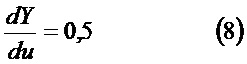
Этап 4
Выполняется второе дифференцирование Y относительно u (фиг.16)
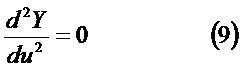
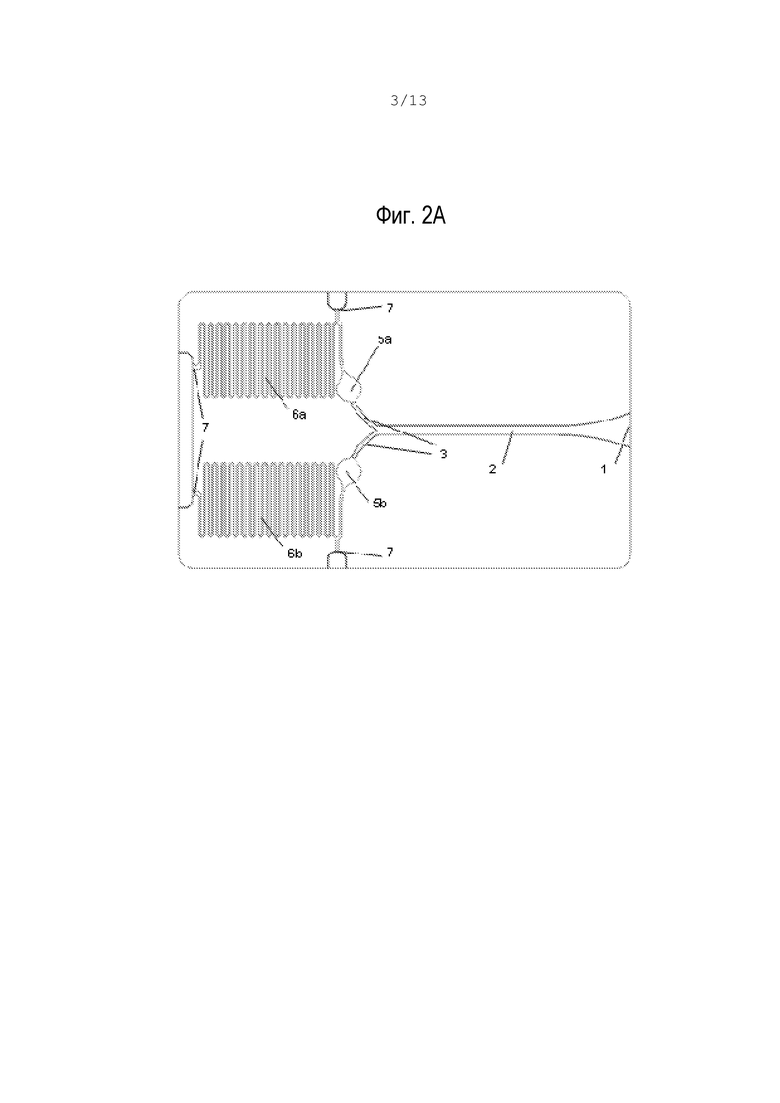
Затухание от постоянного значения ниже заданного порога кривых либо скорости 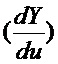 , либо ускорения
, либо ускорения 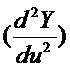 определяет время свертывания. Описанные выше операции служат математической основой алгоритма, который позволяет определить время свертывания с помощью всего одного независимого коагулирующего канала.
определяет время свертывания. Описанные выше операции служат математической основой алгоритма, который позволяет определить время свертывания с помощью всего одного независимого коагулирующего канала.
Микрожидкостная микросхема в соответствии с настоящим изобретением выполнена так, что движущаяся кровь имеет преобладающее ньютоновское поведение перед свертыванием. Отклонение от этого поведения возможно только под действием псевдопластического эффекта, который появляется при низких скоростях течения. Но даже в этом случае предложенный метод все еще применим и работает достаточно корректно, потому что псевдопластический эффект гораздо слабее, чем эффект свертывания, и его можно отличить на кривых ускорения.
Метод 2
Второй, похожий математический подход к теоретическому определению времени свертывания можно вкратце описать следующим образом. Начиная с тех же самым необработанных данных, т.е. значений L(t) и t, полученных на этапе 1, можно построить следующую кривую:

Эта кривая пропорциональна вязкости (η), как можно определить из уравнения (3). Следующие этапы (2, 3 и 4) применяются также, как описано выше (т.е. логарифм, получение первой производной и второй производной), чтобы построить кривые скорости и ускорения.
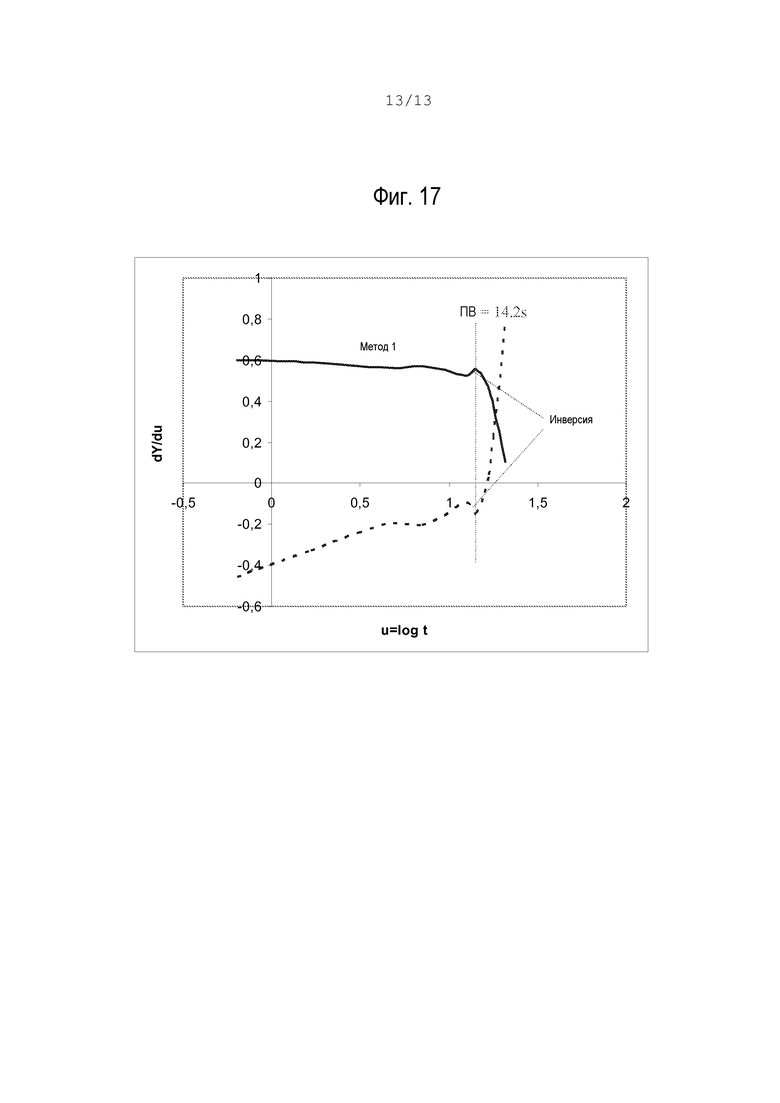
Как подтверждено данными реального тестирования, оба метода дают одинаковое время свертывания (ПВ). Практически на всех контролируемых кривых (как показанные на фиг.17) был обнаружен неожиданный результат - начальное поведение отличается от эффекта коагуляции; см. выделенные участки на обеих кривых под надписью "инверсия". Этот эффект фактически представляет собой переходное уменьшение вязкости длительностью около 1 или 2 секунд, которое всегда наблюдается перед моментом свертывания. Такое поведение позволяет легче идентифицировать время свертывания как момент ПВ, так как является наглядной точкой перегиба кривой: либо максимума в методе 1, либо минимума в методе 2. Хотя причина этого неожиданного поведения неизвестна, есть предположение, что оно вызвано образованием нерастворимых мономеров фибрина, связанным с эффектом Фореуса-Линдквиста, который снижает эффективную вязкость перед образованием фибриновых полимеров.
Кроме определения времени свертывания описанный выше теоретический принцип можно также использовать для контроля качества путем корреляции тестовых кривых с теоретическими прогнозами. В случае нормального оператора (т.е. при отсутствии ошибки пациента) и корректных условий устройства течение образца крови перед свертыванием должно быть близким к описанному линейному поведению. Системы контроля течения и процессор могут обнаружить любое значительное отклонение от такого поведения и выдать команду отмены теста.
Согласно предпочтительному варианту изобретения жидкой средой является кровь, предпочтительно цельная капиллярная кровь из пальца пациента, а для внешнего контроля качества можно использовать калиброванную плазму с известным временем свертывания. Реагент, способный вступать в реакцию с данной жидкой средой, является свертывающим реагентом, более предпочтительно тканевым фактором или тромбопластином.
В этом случае устройство и способ в соответствии с настоящим изобретением особенно пригодны для определения протромбинового времени, т.е. времени, истекшего между активизацией свертывания и началом свертывания.
Устройство можно спроектировать в соответствии со стандартными значениями МНО; рекомендованный максимальный показатель МНО составляет около 8, что означает ПВ около 100 секунд. Размеры, необходимые для достижения такого максимального МНО, показаны в таблице 1. Как уже упоминалось выше, необходимые размеры и общие объемы "Vt" различных конструкций трубок определяются уравнением (3).
Необходимые длины и суммарные объемы "Vt" различных конструкций трубок для достижения максимального показателя МНО (100 сек)
Из таблицы видно, что путем простого уменьшения масштаба этой гидродинамической конструкции до микромасштаба можно достичь стандартного интервала МНО, используя всего маленькую каплю крови.
Форма и размеры каналов в соответствии с настоящим изобретением позволяют определить время свертывания образца крови объемом не более 15 мкл, а общий объем в случае заполнения всех схем составляет менее 10 мкл, так что объем, остающийся во впускном отверстии, позволяет зафиксировать мениск несмачивания во впускном отверстии. Микрожидкостные каналы позволяют непрерывное течение продолжительностью от нескольких секунд до более ста секунд, поэтому можно определять ПВ в продолжительном интервале времени. Следовательно, микросхема и способ в соответствии с настоящим изобретением позволяют точно измерять время свертывания и МНО на маленьких образцах крови, предпочтительно менее 10 мкл, более предпочтительно менее 5 мкл, и наиболее предпочтительно около 1 мкл или меньше. Это очень важно для удобства пациента.
Длина капиллярных каналов (6а, 6b) должна быть достаточно большой, чтобы позволить реакции реагента с жидкостью завершиться до того, как фронт жидкости достигнет конца канала. В предпочтительном варианте капиллярные каналы (6а, 6b) имеют криволинейную форму, более предпочтительно форму змеевидной дорожки, чтобы минимизировать площадь устройства, сохраняя длину каналов.
Предпочтительное поперечное сечение каналов прямоугольное в силу технологических ограничений, что позволяет простую двухмерную геометрию, упрощающую процесс литья под давлением. Конкретные размеры должны быть вычислены очень тщательно, так как динамика течения и используемый суммарный объем очень чувствительны к размерам каналов. Как было показано, значения размеров выше 100 мкл требуют очень большой длины каналов, чтобы позволить течению продолжаться до максимального времени свертывания, и требуется образец крови более значительного объем. При микрожидкостной конструкции или, иными словами, при поперечном сечении канала около 100 мкм или меньше, длину каналов и количество используемой крови можно уменьшить. При этом также существенно уменьшается размер микросхемы и ее стоимость.
Предпочтительно реакционный и контрольный каналы имеют поперечное сечение, при котором a=b. В этом случае а и b предпочтительно составляют от 30 до 125 мкм, более предпочтительно от 50 до 100 мкм, и еще более предпочтительно около 80 мкм.
Также размеры участка, содержащего реагент, предпочтительно реакционной ячейки, должны позволить разместить в ней достаточный объем для выдачи реагента в жидком состоянии. Кроме того, эта конструкция должна быть спроектирована так, чтобы время диффузии позволяло достичь достаточной концентрации реагента для получения максимального объема активизированной крови. Этого можно достичь путем максимального увеличения отношения поверхности к объему в реакционной камере. Предпочтительно площадь основания камеры должна быть круглой, чтобы адаптировать ее к форме выдаваемой капли, диаметр которой составляет от 1 до 4 мм, а высота – от 40 до 150 мкм. Более предпочтительно диаметр составляет около 1,5 мм, а высота около 80 мкм.
Высота распределительного канала предпочтительно составляет 150-350 мкм, более предпочтительно около 250 мкм.
Впускное отверстие для крови предпочтительно представляет собой зазор между покрывающим слоем и пластиной-основанием на краю микросхемы в распределительном канале, и поэтому может иметь высоту распределительного канала. Объем, выделенный в распределительном канале, может быть немного больше, чем объем, предусмотренный в последующей капиллярной структуре, чтобы при полном заполнении жидкостью распределительный канал никогда не становился пустым. Этот объем определяет требование к минимальному объему тестового образца.
Чтобы удовлетворить конструктивные требования и ограничения по размерам, можно изменять расход Q с помощью пассивных клапанов регулирования расхода, сформированных путем изменения поперечного сечения микрожидкостных каналов, например, сужения сегментов микрожидкостных каналов или введения сужающихся микрожидкостных каналов.
Работа микрожидкостного устройства
Согласно настоящему изобретению требуется ввести образец крови или плазмы во впускное отверстие, через которое кровь или плазма поступает в распределительный канал, вдоль которого та же кровь или плазма разделяется на реакционный/коагулирующий канал и один или более контрольных каналов.
В момент tm перед свертыванием крови положения фронта потока в каналах можно представить следующим образом:
L=L(tm)
L’=L’(tm)
где L и L’ – соответственно положение коагуляции и контроля. t=0 – это момент, когда поток выходит из реакционной камеры коагулирующего канала, т.е. момент, когда тканевый фактор или тромбопластин разжижается и инициируются механизмы реакции.
Разделенные потоки имеют почти идентичную динамику движения до тех пор, пока в канале свертывания не будет инициирована коагуляция. Этот момент, когда происходит первое свертывание крови, идентифицируется как протромбиновое время, и возникает внезапное повышение вязкости. В этот момент динамика течения вдоль коагулирующего канала замедляется относительно контрольного канала (каналов). Путем постоянного контролирования (8) положения фронта потока как функции времени можно вычислить производную положения от времени, которую можно назвать скоростью фронта потока.
На фиг.3 показано, как можно определить положения фронта потока в двух каналах, и протромбиновое время. Эти кривые были определены численно при показанных ниже допущениях, где переменные а, b, η и ПВ имеют значение, указанное ранее, а γ – поверхностное натяжение крови.
Допущения для численного определения
Перед ПВ различие между каналами должно быть минимальным, его могут вызвать только неодинаковые внешние условия, производственные допуски и шум при регистрации. Производная от кривых времени является предпочтительной, так как она более чувствительна к изменениям вязкости, которые можно назвать скоростями фронта потока. Аналогично, в момент времени tm перед ПВ контролируются скорости для свертывания (V) и контроля (V’):
V=V(tm)
V’=V’(tm)
Эти кривые показаны на фиг.4.
ПВ можно определить путем нахождения подходящего порога "Δ" для разности между скоростями V(tm)-V’(tm). До ПВ вязкость постоянная, а положения фронта потока и скорости имеют минимальные различия, как схематически показано на фиг.5.
В момент времени tp разность скорости только что перешла порог (см. фиг.6), и этот момент является ПВ.
Средства детектирования
Для непрерывного детектирования или контролирования движения фронта потока L=L(t) или v=v(t) можно применять различные методы детектирования:
- Детектирование с помощью фотодиода,
- Детектирование с помощью оптических датчиков, таких как прибор с зарядовой связью (ПЗС) или комплементарная структура "металл-оксид-полупроводник" (КМОП).
На графике на фиг.7 показан коэффициент абсорбции крови. Можно заметить, что абсорбция происходит в основном на длине волны 400 нм, а также вокруг зеленого спектра (530 нм).
Детектирование с помощью фотодиода
Змеевидная структура освещается светодиодом, а пропускаемый свет обнаруживается с помощью фотодиода. Движущийся фронт потока линейно увеличивает абсорбцию, следовательно, обнаруживаемая интенсивность соответственно уменьшается. При использовании усилителя сигнала можно контролировать малейшие приращения положения потока.
Далее будут описаны некоторые вычисления, которые были выполнены для оценки эффективности такой схемы контролирования, с использованием недорогих стандартных компонентов.
Были выбраны недорогие светодиод и фотодиод от общедоступных поставщиков.
Светодиод имел размер 3 мм и излучал в пределах угла 20°. Интенсивность составляла 1500 мКд=0,0309 Вт/стерадиан, следовательно, для полного телесного угла 20° (0,095 стерадиан) полная мощность излучения достигала 0,00294.
На фиг.8 и 9 показаны спектр излучения светодиода и ответная кривая фотодиода, в качестве которого использовался стандартный кремниевый фотодиод, но оптимизированный для обнаружения излучения с длиной волны сине-зеленого спектра.
Приняв упомянутые допущения и получив площадь сканирования (8), размеры канала и действительную кривую L(t) из фиг.3, можно получить сигнал интенсивности, детектированный фотодиодом. Для простоты также было принято допущение, что микросхема имеет идеальную прозрачность и в ней отсутствуют френелевские отражения. Сигнал интенсивности на графике на фиг.10 также содержит имитацию фонового шума темнового тока 20 пА, указанный производителем. Эта кривая соответствует сечению канала 250х250 мкм. Вычислив производную сигнала интенсивности от времени, можно получить сигнал, пропорциональный скорости потока, как показано на фиг.11.
Два представленных графика (фиг.10 и 11) демонстрируют, что можно контролировать фронт потока с достаточно высокой чувствительностью, о чем свидетельствует влияние незначительного шума на эти кривые. Кроме того, фотодиод имеет очень высокую динамическую реакцию, что позволяет обеспечить частоту выборки до 10 МГц, а сам усилитель ограничить до 10 КГц. Эти значения на порядок величины выше частоты, необходимой для точного контролирования, около 20 Гц.
Детектирование с помощью оптических датчиков
При этой схеме детектирования в системе используется похожая конфигурация, но с другим устройством детектирования. В этом случае используется датчик ПЗС или КМОП, поэтому положение фронта потока определяется путем обработки данных, полученных после высокочастотного отображения сканирующей поверхности.
Система светодиода может быть подобна описанной в предыдущем случае. Интересно, что в этом случае не требуется высокая чувствительность, так как каждая ячейка или пиксель в ПЗС должны обнаружить присутствие или отсутствие потока в этом положении. Как показано на фиг.12, при наложении эффективной площади ПЗС стандарта на змеевидную структуру растровое изображение позволяет идентифицировать положение фронта потока с достаточным разрешением и динамической реакцией (>1 КГц).
Этот метод требует обработки данных изображения, чтобы можно было определить положение мениска из расплывчатого изображения. В результате повышается сложность системы контроля. Однако в отличие от схемы детектирования с помощью фотодиода чувствительность каждой ячейки или пикселя менее ограничена, так что в этом смысле схема детектирования с помощью ПЗС имеет предпочтение.
Для улучшения качества детектирующего сигнала можно встроить оптическое средство, например, линзу. В настоящее время существуют очень недорогие, серийные жесткие блоки, объединяющие линзу и датчик, например, миниатюрные камеры, выпускаемые для производства средств мобильной связи. Эти блоки имеют размеры в пределах всего нескольких миллиметров, что позволяет интегрировать их очень компактно и точно в портативные системы, такие как портативный коагулометр.
Детектированный сигнал обрабатывается микропроцессором с встроенным программным обеспечением. Формируются кривые динамических данных потока и применяются алгоритмы для определения времени свертывания, а также для различных контролей качества.
Как пояснялось выше, микросхема (тестовая полоска) и способ в соответствии с настоящим изобретением имеют еще одно важное преимущество, заключающееся в том, что одно и то же средство детектирования можно использовать для контролирования движения образца жидкости и для выполнения различных задач контроля качества.
При реализации средства детектирования с искусственной видеосистемой, такой как датчик ПЗС/КМОП или микрокамера, можно выполнять три основных контроля качества, обычно применяемых в тестовых полосках для коагулометров, путем обработки изображения поля зрения такой видеосистемы.
Встроенные индикаторы внешних условий для контроля стабильности: можно контролировать внешние условия, такие как температура и влажность, с помощью цветочувствительных соединений для этих факторов. Выбранные соединения необратимо изменяют цвета под действием пороговой температуры и влажности, что является сигналом дефектной микросхемы. Эти соединения можно ввести непосредственно в реакционные камеры, на пластину-основание или на покрывающую поверхность под полем зрения детектора. Для этого можно использовать комбинацию различных чувствительных соединений. Примерами термочувствительных соединений являются лейкокрасители, оксазиновые красители, кристаллический фиолетовый лактон, фенолфталеин и т.п. Чувствительные к влажности соединения включают в себя металлические соли: хлорид кобальта, сульфат кальция и т.п. N-оксид или нитрозосоединения являются соединениями, чувствительными и к температуре, и к влажности.
Это позволяет измерительному устройству (такому как портативный коагулометр) информировать пациента о том, что данная тестовая полоска не прошла контроль качества, и ее следует выбросить.
Внешний контроль качества: можно использовать калиброванные плазмы с известным временем свертывания, выпускаемые серийно для выполнения тестовых калибровок МНО и ПВ, для внешнего контроля качества, позволяющего оценить систему портативного коагулометра в целом. В этих вариантах искусственная видеосистема регулируется так, чтобы позволить осуществлять детектирование движущихся плазм. Хотя плазма представляет собой почти прозрачную жидкость, для эффективного слежения за течением плазмы требуется небольшая настройка системы освещения светодиодами и обработки изображения, чтобы движущаяся плазма распознавалась как серая тень, перемещающаяся вдоль ярких каналов.
Напечатанный штрихкод: напечатанный код может содержать помимо другой релевантной информации калибровочные данные, данные прослеживаемости и данные истечения срока. Стандартные матричные коды данных размером несколько миллиметров, используемые в этом виде тестовых полосок, можно напечатать на покрывающем слое микросхемы или на прозрачном ярлыке.
Описанные выше подходящие средства детектирования и/или контроля находятся во внешнем устройстве (коагулометре), который имеет гнездо для приема микрожидкостного устройство в соответствии с настоящим изобретением и выполнен с возможностью взаимодействия с этим микрожидкостным устройством.
Кроме того, внешнее устройство содержит средство для обработки данных, передаваемых средством детектирования и/или контроля, и выдачи выходного сигнала в средство отображения.
Изготовление
Предложенное микрожидкостное устройство можно легко изготовить с помощью современных технологий тиражирования и сборки изделий из пластика. Предложенный узел формируют из двух герметично соединенных компонентов: нижней пластины, на которой образована микроструктура, и верхней пластины, или покрывающего элемента, как показано на фиг.1.
Материалы, пригодные как для нижней пластины, так и для покрывающего слоя устройства, включают в себя широкий спектр полимерных термоотверждаемых и/или термопластичных материалов, которые должны иметь хорошие оптические средства и хорошую размерную стабильность. Например, можно использовать СОС, ПММА, РС, полисульфон, сополимер стирола и акрилонитрила, полиэтилентерефталат сополимер, полистирол и полипропилен.
Большинство полимерных материалов по своей природе гидрофобные. Поэтому, если для пластины с микроструктурой выбирается сильно гидрофобный материл, то необходимо в следующей технологической операции придать некоторым поверхностям гидрофильность, как пояснялось выше. По этой причине рекомендуются гидрофильные или, по меньшей мере, не гидрофобные пластики (с углом контакта <90°).
Кроме других хорошо известных материалов к ним относятся полиметилакрилат, ацетат целлюлозы, СОС, полистирол и полипропилен. Особенно предпочтительным является полиметилакрилат благодаря его хорошему углу контакта, оптическим свойствам и размерной стабильности.
Нижнюю пластину можно легко тиражировать с помощью ряда современных технологий с очень высокой точностью и низкими допусками микроэлементов. Наиболее подходящими методами выполнения такой микроструктуры являются микролитьевая формовка, горячее тиснение и мягкая литографическая печать.
Этап соединения можно реализовать многими хорошо известными методами, такими как термокомпрессионное соединение, клеевое соединение, плазменное соединение, ультразвуковое соединение, лазерная сварка и другие.
Крышку предпочтительно изготавливают из гидрофильной пленки. Она предпочтительно прозрачная, чтобы можно было точно контролировать движение жидкости. Как пояснялось выше, гидрофильные пленки представляют собой очень экономически выгодное средство, которое позволяет осуществить соединение и гидрофилизацию каналов без обработки поверхности. В этом случае технология производства заключается в стандартных процессах ламинирования, которые могут требовать контроля давления и температуры. Другие способы включают рельефное тиснение или прессование.
Как было описано выше, в реакционные камеры можно поместить ряд сухих реагентов для различных целей. Основным соединением является тромбопластин, который инициирует каскад свертывания. Благодаря миниатюрным размерам реакционной камеры можно добавлять высокоэффективные соединения без существенного увеличения стоимости производства.
Человеческие рекомбинантные тромбопластины имеют очень полезные свойства с точки зрения солюбилизации и чувствительности благодаря их химической чистоте. Первое свойство традиционно усиливают с помощью определенных добавок. В конструкции согласно настоящему изобретению можно использовать всего долю микролитра этого человеческого рекомбинантного фактора, чтобы получить отличные результаты с точки зрения солюбилизации и чувствительности.
Для обеспечения корректного функционирования сухого реагента могут применяться некоторые дополнительные реагенты. Их можно использовать не только для быстрой солюбилизации, но также для контроля параметров диффузии, улучшения технологических операций и повышения стабильности реагента, или для решения следующих задач:
(а) Для модуляции поглощения жидкости сухим реагентом: простые полимеры, такие как гидроксипропилцеллюлоза, поливиниловый спирт, полиэтиленгликоль и т.п.
(б) Для быстрой солюбилизации, стабилизации и сокращения процесса сушки: альбумин, глютамат, сахариды (такие как глюкоза, сахароза, трехалоза и т.д.) и т.п.
(в) Для контроля смачиваемости: тринитротолуол, Triton, Macol, Tetronic, Silwet, Zonyl, Pluronoc и т.п.
(г) Цветовой индикатор для контроля стабильности и дозирования: лейкокрасители в качестве термочувствительных соединений (оксазиновые красители, кристаллический фиолетовый лактон, фенолфталеин и т.п.). Металлические соли в качестве чувствительных к влажности соединений, такие как хлорид кобальта, сульфат кальция и т.п. N-оксид или нитрозосоединения являются соединениями, чувствительными и к температуре, и к влажности.
(д) Для повышения стабильности внешних условий: органортутные соединения, такие как тимеросал и т.п.
(е) Другие соединения для реализации различных функций: полибрен (антигепариновый реагент) и буферы.
Эти сухие реагенты можно наносить на реакционную камеру или альтернативно на покрывающую пластину посредством ряда хорошо известных методов: нанесения жидкой капли, геля, струйного нанесения, трафаретной печати, шаберного мелования, избирательного напыления и налива пленки. За этапом нанесения следует этап сушки.
Предпочтительно сухой реагент наносят на реакционную камеру в жидком состоянии с образованием капли, которая занимает большую часть камеры и после сушки превращается в тонкий слой реагента.
Положительной чертой способа изготовления и получаемой микросхемы (тестовой полоски) является их простота, отсутствие необходимости в каких-либо встроенных элементах типа электродов или в любой форме многослойной структуры. Современные технологии позволяют производить дешевые одноразовые устройства низкозатратными методами.
Благодаря микрожидкостной структуре настоящее изобретение является очень чувствительным и точным средством для определения времени свертывания. Под временем свертывания (таким как протромбиновое время) подразумевается момент, когда молекулы нерастворимого фибрина начинают полимеризироваться в виде "сетки", которая превращается в сгусток. Образование фибрин-полимеров, обычно размером порядка нескольких микрометров, приводит к резкому повышению эффективной вязкости движущейся крови, особенно когда поперечное сечение канала такое маленькое, как в предложенной микрожидкостной структуре. С точки зрения точности и чувствительности устройство обеспечивает описанные выше преимущества по сравнению с известными устройствами для определения времени свертывания.
Кроме того, комбинация микросхемы и измерительного устройства в соответствии с настоящим изобретением обеспечивает совокупные преимущества. Использование одного оптического средства детектирования позволяет одновременно детектировать изменения потока жидкости и осуществлять различный контроль качества. Это значит, что портативное измерительное устройство будет менее сложным и более компактным при использовании стандартных элементов. Фактически такое измерительное устройство может иметь размер мобильного телефона. Также существенно повышаются точность и чувствительность по сравнению с известными устройствами, особенно теми, которые основаны на движении крови, поскольку контролирование движения крови осуществляется непрерывно с высокой частотой выборки. Это позволяет точно определить момент, когда образование сгустка оказывает первое тормозящее действие на движение крови.
Специалистам будет понятно, что идеи изобретения, описанные в настоящей заявке, можно изменять и модифицировать для широкого спектра применений.
Соответственно, объем объекта изобретения не ограничен каким-либо описанным в качестве примера методом, а охарактеризован прилагаемой формулой изобретения. Любые ссылочные обозначения в формуле изобретения не следует рассматривать как ограничительные.
| название | год | авторы | номер документа |
|---|---|---|---|
| МИКРОЖИДКОСТНОЕ УСТРОЙСТВО И СПОСОБ ДЛЯ ОПРЕДЕЛЕНИЯ ВРЕМЕНИ СВЕРТЫВАНИЯ ЖИДКОСТИ | 2008 |
|
RU2477480C2 |
| Кювета для коагулометра и устройство для определения времени свертывания текучего образца | 2017 |
|
RU2655774C1 |
| АНАЛИЗЫ | 2009 |
|
RU2521639C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ МЕЖДУНАРОДНОГО НОРМАЛИЗОВАННОГО ОТНОШЕНИЯ (МНО) ПО ВЕЛИЧИНЕ ПРОТРОМБИНОВОГО ВРЕМЕНИ КАПИЛЛЯРНОЙ КРОВИ | 2005 |
|
RU2271004C1 |
| ТЕСТ-СИСТЕМА КОАГУЛЯЦИИ | 2005 |
|
RU2394648C2 |
| АНАЛИЗАТОР ДЛЯ АВТОМАТИЧЕСКОГО ОПРЕДЕЛЕНИЯ ПОКАЗАТЕЛЕЙ ГЕМОСТАЗА | 2010 |
|
RU2452936C2 |
| Способ прогнозирования тромбоэмболических осложнений у женщин при носительстве мутаций гена протромбина [F2(20210)GA] | 2019 |
|
RU2722280C1 |
| УПРАВЛЕНИЕ ТЕКУЧЕЙ СРЕДОЙ | 2017 |
|
RU2734293C2 |
| Способ прогнозирования тяжелой преэклампсии у беременных при носительстве мутации гена протромбина, генотип F2G20210A | 2019 |
|
RU2723627C1 |
| Лекарственная форма ДНК-аптамера | 2019 |
|
RU2730000C1 |
Изобретение относится к определению времени свертывания жидкой среды, такой как кровь или плазма. Способ определения времени свертывания в жидкой среде, такой как кровь или плазма, включает получение микрожидкостного устройства, введение в него образца, непрерывный контроль положения фронта жидкости как функции времени L(t) и получение теоретического значения распространения фронта жидкой среды как функции времени перед свертыванием. Время свертывания определяют как время, прошедшее от момента, когда началась реакция, до момента, когда контролируемая функция L(t) свертывания отклоняется от теоретического значения на более чем пороговую величину. При этом микрожидкостное устройство содержит средство для введения образца жидкой среды, соединенную с указанным средством область, обеспечивающую перемещение жидкой среды по длине микрожидкостного канала, по меньшей мере, частично покрытого гидрофильным материалом, так, что жидкая среда протекает только под действием капиллярных сил, и участок в начале упомянутой области, содержащий реагент, вступающий в реакцию с упомянутой жидкой средой и запускающий каскад свертывания. Изобретение облегчает идентификацию времени свертывания. 3 з.п. ф-лы, 17 ил., 2 табл.
1. Способ для определения времени свертывания в жидкой среде, такой как кровь или плазма, согласно которому
выполняют микрожидкостное устройство, содержащее, по меньшей мере, средство (1) для введения образца жидкой среды, область, соединенную со средством (1) для введения образца и обеспечивающую перемещение жидкой среды по длине микрожидкостного канала, причем микрожидкостной канал, по меньшей мере, частично покрыт гидрофильным материалом так, что жидкая среда протекает только под действием капиллярных сил, и участок в начале упомянутой области, содержащий реагент, вступающий в реакцию с упомянутой жидкой средой и запускающий каскад свертывания,
подают образец жидкой среды в средство (1) для введения образца жидкой среды,
непрерывно контролируют положение фронта жидкости как функции времени L(t),
получают теоретическое значение распространения фронта жидкой среды как функции времени перед свертыванием,
при этом время свертывания определяют как время, прошедшее от момента, когда началась реакция, до момента, когда контролируемая функция L(t) свертывания отклоняется от теоретического значения на более чем пороговую величину.
2. Способ по п. 1, согласно которому предполагается, что контролируемая функция L(t) свертывания отклоняется от теоретического значения на более чем пороговую величину, когда наклон кривой log L(t) от log (t) затухает от постоянного значения 0,5.
3. Способ по п. 1, согласно которому из контролируемой функции L(t) свертывания получают функцию Y=Y(u)=log L(t), являющуюся изменением переменной u=log t, причем предполагается, что контролируемая функция L(t) свертывания отклоняется на более чем пороговую величину от теоретического значения, когда первая производная dY/du затухает от постоянного значения 0,5 на более чем пороговую величину.
4. Способ по п. 1, согласно которому из контролируемой функции L(t) свертывания получают функцию Y=Y(u)=log L(t), являющуюся изменением переменной u=log t, причем предполагается, что контролируемая функция свертывания отклоняется на более чем пороговую величину от теоретического значения, когда вторая производная d2Y/d2u затухает от 0 на более чем пороговую величину.
| US 6900021 B1, 31.05.2005 | |||
| WO 1999047907 A1, 23.09.1999 | |||
| US 20060015261 A1, 19.01.2006 | |||
| УСТРОЙСТВО ДЛЯ ОПРЕДЕЛЕНИЯ ВРЕМЕНИ КОАГУЛЯЦИИ КРОВИ | 1988 |
|
RU2051383C1 |
Авторы
Даты
2017-08-22—Публикация
2012-12-12—Подача