Область техники, к которой относится изобретение
Изобретение относится к медицине и ветеринарии, в частности к области разработки новых эффективных фитопрепаратов-иммуномодуляторов.
Уровень техники
Известно, что значение иммуномодуляторов в настоящее время в клинической медицине и ветеринарии возрастает. Иммуномодуляторы, позволяющие реализовать адекватный иммунный ответ на болезнетворный агент, обеспечив лечение без применения токсичных химиотерапевтических средств, воспринимаются как наиболее перспективный путь развития фармацевтики. Восстановление и стимуляция иммунного ответа имеет большое значение не только при инфекционных заболеваниях, но и в онкологии, т.к. купирование иммунодепрессии, вызванной химиотерапией и самой опухолью, существенно повышает шансы больных на выздоровление. По этим причинам за последние годы в клинику введено большое количество препаратов-иммуномодуляторов, характеризующихся либо иммунопротективным действием, либо в определенной степени стимулирующих некоторые иммунные функции (фагоцитоз, активность Т-киллеров, натуральных киллеров и т.п.). Большую часть препаратов составляют ксенобиотики, из которых можно упомянуть циклоферон (меглюмина акридонацетат), тилорон (амиксин), глутоксим, левамизол, полиоксидоний [РЛС Энциклопедия лекарств, 8-е изд., под ред. Ю.Ф. Крылова, М., 2001], леакадин [РЛС Энциклопедия лекарств, М., 2004], галавит, кагоцел, иммунофан [РЛС Энциклопедия лекарств, М., 2007], диуцифон [RU 2292892, опубл. 10.02.2007], сульпифон [RU 2136668, опубл. 10.09.1999], ингавирин [Справочник Видаль, 17-е изд., М., 2011], тимоген [М.Д. Машковский, Лекарственные средства, 16-е изд., М., 2012] и др. Общим недостатком веществ данной категории является несбалансированное воздействие на сложную иммунную систему, что нередко вызывает тяжелые побочные эффекты (агранулоцитоз, аутоиммунные заболевания и т.п.). С другой стороны, препараты-ксенобиотики часто обладают гепатотоксичностью. Более безопасными представляются препараты природного происхождения - настойки левзеи, элеутерококка, родиолы розовой, женьшеня, эхинацеи (Иммунал), стандартизованный экстракт проростков картофеля (Панавир) и др. Наиболее широко в качестве иммуномодуляторов используются экстракты и настойки эхинацеи, которые собственно и относятся к иммуномодуляторам (настойки левзеи, элеутерококка, родиолы розовой, женьшеня и др. относят к адаптогенам). В 1996 г., к примеру, в США препараты эхинацеи были самыми популярными среди фитопрепаратов [Бертрам Г. Катцунг, Базисная и клиническая фармакология, 2-е изд., Т. 2, 2008]. Не остаются без внимания терапевтов препараты эхинацеи и в России [РЛС Энциклопедия лекарств, М., 2007; В.Ю. Мартов, А.Н. Окороков, Лекарственные средства в практике врача, 2-е изд., М., 2010; Справочник Видаль, 17-е изд., М., 2011; М.Д. Машковский, Лекарственные средства, 16-е изд., М., 2012], с каждым годом их номенклатура расширяется на рынке [РЛС России, 8-е изд., под ред. Ю.Ф. Крылова, М., 2001; РЛС России, М., 2007]. В эксперименте in vitro сок Е. purpurea повышал выработку фагоцитами человека интерлейкинов-1, -6, -10 и фактора некроза опухоли-α, увеличивал активность натуральных киллеров и уровень антителозависимой цитотоксичности. Также экстракты эхинацеи обнаруживают и противовоспалительные эффекты, связанные с ингибированием циклооксигеназы [Бертрам Г. Катцунг, Базисная и клиническая фармакология, 2-ое изд., Т. 2, 2008]. В клинике их применение существенно уменьшает выраженность симптомов ОРЗ и сроки выздоровления. Учитывая очень низкую токсичность и сравнительно редко встречающиеся побочные эффекты, интерес к разработке иммуномодуляторов на основе сока или экстрактов растений рода эхинацея очень велик. Только за последнее время было создано большое число препаратов и БАД для применения в медицине (RU 2468810 опубл. 10.12.2012, RU 2137490 опубл. 20.09.1999, RU 2182011 опубл. 10.05.2002, ЕР 0464298 опубл. 08.01.1992 и др.) и ветеринарии (CN 102716164 опубл. 10.10.2012, RU 2525426 опубл. 10.08.2014, RU 2356557 опубл. 27.05.2009 и др.). Однако лекарственные средства из растений рода эхинацея далеко не решают задачу безопасного воздействия на иммунную систему. Во-первых, эффект этих препаратов несбалансированный, они способны усугублять аутоиммунные заболевания [Бертрам Г. Катцунг, Базисная и клиническая фармакология, 2-е изд., Т. 2, 2008], и их применение противопоказано при иммунодефицитных состояниях (СПИД, онкозаболевания), аутоиммунных заболеваниях любой этиологии, туберкулезе и других нозологиях, при которых больные как раз и нуждаются в безопасных иммуномодуляторах. Во-вторых, не обнаружено достоверное повышение резистентности к заболеваниям при профилактическом применении [Бертрам Г. Катцунг, Базисная и клиническая фармакология, 2-е изд., Т. 2, 2008; М.Д. Машковский, Лекарственные средства, 16-е изд., М., 2012]. В-третьих, большинство препаратов на основе эхинацеи содержит большое количество этанола, что ограничивает их использование в педиатрии и опасно при одновременном приеме с лекарственными средствами, обладающими ингибирующим эффектом на алкогольдегидрогеназу. В-четвертых, эхинацея - растение семейства сложноцветных, а к этим растениям относительно часто развиваются аллергические реакции [Бертрам Г. Катцунг, Базисная и клиническая фармакология, 2-е изд., Т. 2, 2008], в т.ч. и достаточно тяжелые - анафилаксия, приступы бронхиальной астмы.
Разработан ряд препаратов с высокой иммуномодулирующей и противовирусной активностью на основе пептидогликанов и кислых гликанов, выделенных из растущих побегов различных растений [RU 2195308 опубл. 27.12.2002, RU 2151600 опубл. 27.06.2000, RU 2028303 опубл. 09.02.1995, RU 2003110010 опубл. 20.10.2004]. В медицинскую практику было введено лекарственное средство «Панавир», которое зарекомендовало себя как безопасный и эффективный иммуномодулятор [М.Д. Машковский, Лекарственные средства, 16-е изд., М., 2012]. Недостатком указанных препаратов является узкое и ограниченное воздействие на иммунную систему и необходимость использования инъекционного введения в условиях стационара.
Предложено много комплексных фитопрепаратов с иммуномодулирующим эффектом на основе компонентов, для которых известно определенное влияние на иммунную систему - растения рода эхинацея, облепиха крушиновидная, солодка, алоэ, чага, левзея, аралия маньчжурская, женьшень, лимонник, кошачий коготь, родиола розовая, элеутерококк [RU 2516932 опубл. 20.05.2014, RU 2510277 опубл. 27.03.2014, CN 103933097 опубл. 23.07.2014, UA 49851 опубл. 11.05.2010, RU 2401121 опубл. 10.10.2010, RU 2236244 опубл. 20.09.2004, RU 2438694 опубл. 10.01.2012, RU 2525426 опубл. 10.08.2014, CN 103877437 опубл. 25.06.2014, KR 20140003866 опубл. 10.01.2014, CN 101828703 опубл. 15.09.2010, RU 2516886 опубл. 20.05.2014, RU 2129433 опубл. 27.04.1999, CN 101361774 опубл. 11.02.2009, US 2012039918 опубл. 16.02.2012, RU 2496510 опубл. 27.10.2013, RU 2393871. опубл. 10.07.2010, CN 103860906 опубл. 18.06.2014, RU 2283657 опубл. 20.09.2006 и др.]. Недостатком этих препаратов является вариабельный клинический эффект и чрезвычайная сложность стандартизации многокомпонентных фитопрепаратов.
Наиболее близким к предлагаемому нами лекарственному средству является разработка монгольских ученых [MN2031, выдан 27.09.2002] - препарат «Салимон», представляющий водно-этанольный экстракт травы солянки лиственничнолистной (Salsola laricifolia). Салимон показал неплохую эффективность при лечении онкобольных (в комплексе с другими препаратами и процедурами) [MN2031, выдан 27.09.2002; Монголын анагаах ухаан, 2001, 1(114), Шинэсэрхуу бударганы дархлал сэргээх уйлдлийн судалгаа; Монголын анагаах ухаан, 2002, 1(118), «Салимон эмийн эмнэл зуйн судалгааны дун»; Эруул Мэндийн Шинжлэх Ухаан, 2013, 9(3)(25), Шинэсэрхуу бударгана "Salsola laricifolia Turcz. ex Litv" ургамлын хавдрын эсрэг уйлдлийн судалгаа], а также было выявлено достоверное повышение неспецифической резистентности к вирусным заболеваниям [Эруул Мэндийн Шинжлэх Ухаан, 2013, 9(6)(28), Зарим ургамлын нийлмэл найрлагын дархлаа зугшруулэх уйлдлийн судалаа; Монголын анагаах ухаан, 1995, 4(93), Эмийн бодисын иммун заслын уйлдлийн эрчимжилт, мембраны телвеес хамаарахуй]. Недостатком данного лекарственного средства является неудовлетворительная эффективность экстракции сильнополярных полисахаридов и гликозидов водно-этанольными смесями. К тому же использование этанола в производстве лекарственных препаратов влечет определенные экономические затраты и организационные сложности, в результате чего продукт становится нерентабельным, либо недоступным по цене для потребителя. Хранение, перевозка и продажа ГЛФ также связана с большими трудностями из-за пожароопасности таких продуктов и жесткой регламентации оборота спиртосодержащих продуктов в России. В частности, не допускается использование спиртовых экстрактов для изготовления биологически активных добавок и препаратов для детей младших возрастов. В ветеринарии использование фитопрепаратов на основе спиртовых экстрактов также затруднительно из-за негативной реакции животных на сильный и резкий запах этанола.
Предпринимались попытки использования в эксперименте чисто водных экстрактов (отваров, настоев) солянки лиственничнолистной [Монголын анагаах ухаан, 1995, 4(93), Эмийн бодисын иммун заслын уйлдлийн эрчимжилт, мембраны телвеес хамаарахуй; П. Болормаа «Шинэсэрхуу бударгана, хуурмаг булчирхайт ортуузын иммунотроп уйлдлийн фармакологи», дисс. на соиск. уч.ст.докт.вет. наук], однако в этом случае препараты оказались менее эффективными и не стабильны при хранении и применения в практике не нашли.
Раскрытие изобретения
Целью разработки было создание высокоэффективного и безопасного фитопрепарата-иммуномодулятора из растения, не относящегося к семейству сложноцветных, повышающего неспецифическую резистентность млекопитающих и птиц к заболеваниям различной этиологии, не содержащего в своем составе этилового спирта.
Изобретение реализовано тем, что предложено лекарственное средство с иммуномодулирующим и противовирусным действием, повышающее неспецифическую резистентность организма теплокровных животных к бактериальным и вирусным инфекциям, представляющее собой экстракт травы солянки лиственничнолистной (Salsola laricifolia), полученный экстракцией сухой травы солянки лиственничнолистной (Salsola laricifolia) 30-80% водным раствором многоатомного спирта при 60-90°С; при этом используют соотношение экстрагент: сухая трава равное 1:(0,003-0,6) соответственно.
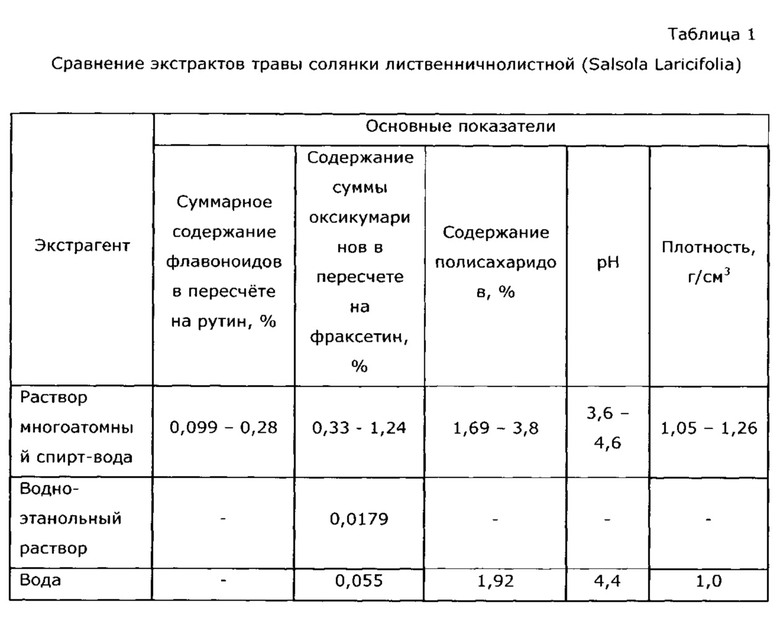
Неожиданным оказалось, что экстракция сухой травы солянки лиственничнолистной (Salsola laricifolia) водными растворами таких многоатомных спиртов как 1,2-пропиленгликоль и/или глицерин, и/или эритритол, и/или ксилит, и/или сорбит, и/или маннит, и/или дульцит, и/или инозит, или их смесей проходит более эффективно, чем экстракция водно-этанольным раствором или водой (см. таблицу 1).
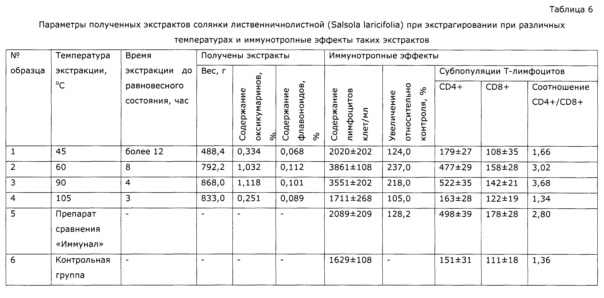
Поскольку водные растворы многоатомных спиртов обладают повышенной вязкостью, целесообразно проводить экстракцию при умеренно повышенных температурах (60-90)°С; при температуре ниже 60°С раствор излишне вязкий и удерживается шротом, что резко снижает выход продукта, при температуре выше 90°С возможна деструкция биологически активных компонентов экстракта (пример 4). Изучение кинетики экстракции показало, что в этих условиях равновесные концентрации индикаторных компонентов (флавоноидов, оксикумаринов, полисахаридов) устанавливаются через 4-10 часов в зависимости от температуры и экстрагента, в то время как при использовании в качестве экстрагента 30-50% этанола при комнатной температуре равновесные концентрации устанавливаются через 3-5 суток (примеры 14, 31).
В качестве экстрагента для сухой травы используют 30-80% водный раствор многоатомного спирта. При концентрации многоатомного спирта меньше 30% резко снижается эффективность экстракции полифенольных соединений, при большей концентрации, нежели 80%, возрастает вязкость, что препятствует отделению полученного экстракта от шрота фильтрацией и снижает выход готового продукта (пример 1).
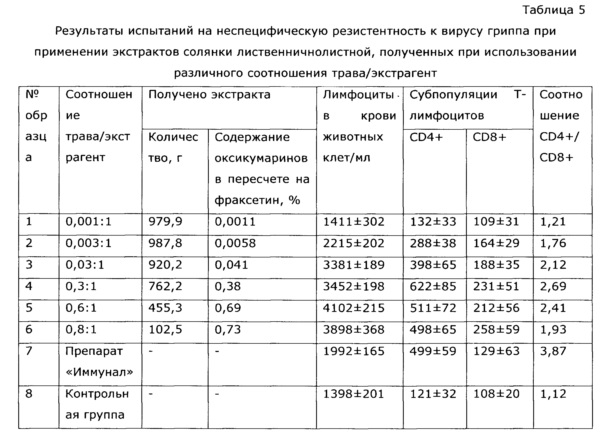
Количество экстрагент: сухая трава солянки лиственничнолистной оптимально в весовом соотношении 1:(0,2-0,6). Увеличение количества сухой травы более 0,6 весовых частей технически не выполнимо из-за свойств травы; пористость и влагоемкость даже спрессованной сухой травы такова, что количество экстрагента не заполняет объем до верхнего уровня "пакета" травы, и следовательно, часть загруженной травы не подвергается экстракции. На экстракцию можно брать меньше 0,2 весовых частей травы, вплоть до 0,003 как при получении ветеринарного препарата, однако при этом резко снижается экономичность процесса, возрастают энергозатраты, возникают проблемы со стандартизацией экстракта (см. пример 30).
Экстракцию при заданном соотношении экстрагент - сухая трава можно проводить как одной процедурой, так и многократной экстракцией небольшими порциями экстрагента, до достижения заданного соотношения. Оба способа имеют свои преимущества, но получаемые в результате экстракты не отличаются существенно ни по составу (содержанию сигнальных компонентов), ни по биологической активности, и относятся к общеизвестным способам получения фитоэкстрактов [Минина С.А., Каухова И.Е. / Химия и технология фитопрепаратов: учебное пособие. М.: ГЭОТАР-Медиа. 2009. 560С. ISBN 978-5-9704-0878-0], по этой причине мы не сочли необходимым вводить в формулу изобретения указанные технологические нюансы. Однократная процедура реализуется быстро, но требует при промышленной реализации использования оборудования неприемлемо большой емкости; многократная экстракция длительна, но позволяет использовать оборудование приемлемых размеров (примеры 12, 14, 26, 36-38); в этом случае необходимую производительность аппаратурной схемы достигают последовательным использованием «батареи» экстракторов приемлемых размеров [Минина С.А., Каухова И.Е. / Химия и технология фитопрепаратов: учебное пособие. М.: ГЭОТАР-Медиа. 2009. 560С. ISBN 978-5-9704-0878-0]. При использовании для приготовления экстрагента многоатомных спиртов с низкой растворимостью в холодной воде, но достаточной растворимостью в условиях экстракции (60-90°С), неожиданным оказалось, что при охлаждении экстракта некоторые многоатомные спирты выкристаллизовываются, при этом они практически не содержат компонентов фитоэкстракта (см. пример 20, 23, 24). Высокочистый многоатомный спирт легко отделяется фильтрацией и может быть использован для последующих экстракций. Концентрированный таким образом экстракт с уменьшенным содержанием многоатомного спирта и высокой концентрацией активных компонентов, стабилен при хранении, имеет приятный, не приторно-сладкий вкус, характерный для многоатомных спиртов.
В предлагаемых условиях экстракции в шроте практически не остается экстрактивных веществ, предложенный способ получения лекарственного препарата позволяет максимально извлечь биологически активные вещества при минимальной потере ценных компонентов. Данный способ получения высококонцентрированных экстрактов травы солянки лиственничнолистной не был обнаружен в доступной литературе. При этом экстракт, полученный при использовании в качестве экстрагента водного раствора многоатомного спирта, проявил значимо более высокую иммуномодулирующую активность по используемым тестам, нежели спиртовые экстракты (см. примеры 14. 43. 44), в то же время оказались приемлемы для разных видов животных (пример 7-9, 14, 37, 38), не огнеопасны, применимы в педиатрии и в других случаях, где ограничивается применение спиртовых экстрактов
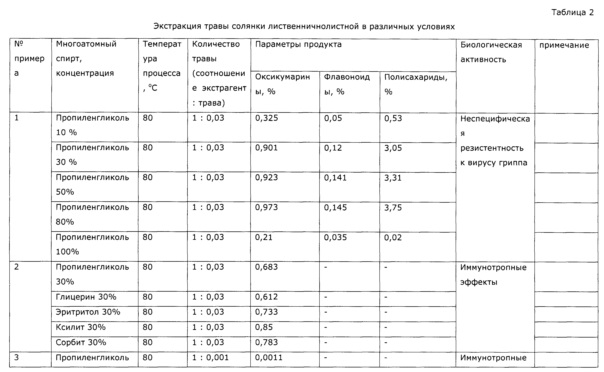
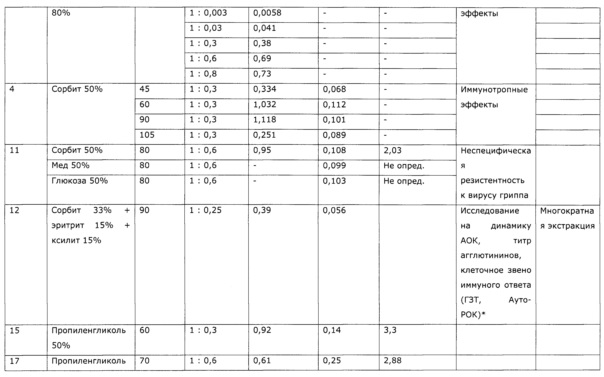
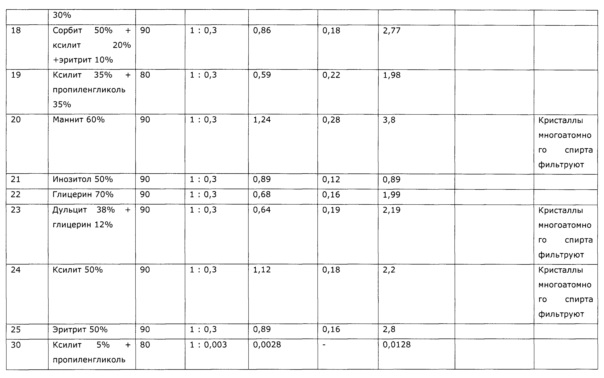
Результаты получения экстрактов солянки лиственничнолистной (Salsola laricifolia) в различных условиях при разном соотношении сухая трава: экстрагент приведены в таблице 2.
Разработанные на основе экстрактов солянки лиственничной (Salsola laricifolia) лекарственные препараты для медицинского и ветеринарного применения проверены на токсические свойства. Результаты изучения острой токсичности и токсикометрии лекарственного препарата, полученного по примеру 28, позволяют отнести его к V классу практически нетоксичных лекарственных веществ [Н. Hodge et al. Clinical Toxicology of Commercial Products. Acute Poisoning. Ed. IV, Baltimore, 1975, 427 p.] и малоопасным веществам (IV класс опасности по ГОСТ 12.1.007-76) (см. пример 41). Идентичные результаты токсикометрии получены и для ветеринарного препарата, приготовленного по примеру 29 (см. пример 42).
Фармакологическая активность медицинского препарата по изобретению изучена на модели лечения острой гриппозной пневмонии у мышей (см. пример 39, 43). В качестве препаратов сравнения использовали широко известный препарат из эхинацеи пурпурной «Иммунал», а также препарат, изготовленный по примеру 31 - прототип. Все исследуемые препараты мало повлияли на интенсивность размножения вируса гриппа в легочной ткани, препарат по прототипу вообще не оказал эффекта, а в случае «Иммунала» и экспериментального средства титр вируса был ниже, на уровне 83,8% от контроля; хотя это различие нельзя отнести к достоверным, тем не менее просматривается тенденция, позволяющая считать, что имеется слабовыраженное прямое ингибирование размножения вируса гриппа. Значительно более выраженными оказались клинические эффекты. Так, степень поражения легких при применении препарата по примеру 28, оказалась, более чем в 2 раза ниже, чем у контрольной группы, и значительно ниже, чем в группе, использующей прототип. Морфологический анализ паренхимы легких также подтвердил двукратное снижение поражения структур легких. При этом антиоксидантная активность легочной ткани возросла в 2,5 раза, а также снизился по сравнению с контролем уровень продуктов перекисного окисления, что свидетельствует об активации защитных и репаративных процессов под воздействием экспериментального препарата. Лечебный эффект проявился как в бронхиальных структурах, так и в альвеолах, гиперплазия эпителия в обоих случаях была ниже практически в 3 раза по сравнению с контролем, воспалительная инфильтрация снизилась в 2 раза, по этим параметрам препарат по изобретению существенно превосходил прототип и препарат сравнения. Результат исследования коры надпочечников показал, что все три изучаемых лекарственных средства примерно в равной степени ингибировали стрессиндуцированные изменения клеток коры надпочечников; клетки по размерам в 2 раза превосходили клетки контрольных животных.
Была изучена профилактическая активность препарата, полученного по примеру 28, при гриппозной инфекции (см. пример 44). Эффект оказался существенно выше, нежели в случае препарата-прототипа, полученного по примеру 31, и сравним с эффектом препарата «Иммунал».
Оптимальный иммунный ответ достигается только при взаимодействии гуморального и клеточного звеньев иммунитета. В-клетки отвечают за гуморальное звено приобретенного иммунитета, то есть вырабатывают антитела, в то время как Т-клетки представляют собой основу клеточного звена специфического иммунного ответа. Под действием разработанного препарата наблюдалось усиление В-клеточного звена иммунитета животных; увеличение количества антителообразующих клеток в селезенке опытных животных в ответ на введение тимусзависимого антигена достоверно приводило к повышению индекса стимуляции в 2,5 раза по сравнению с контролем, аналогично возросли титры агглютининов в сыворотке крови почти в 4 раза (см. примеры 12, 45-47). Усиление Т-клеточного звена иммунитета произошло за счет увеличения количества аутологичных розеткообразующих клеток (ауто-РОК) как в абсолютном, так и относительном выражении и составило соответственно 2 и 10 раз. Результаты проведенных тестов свидетельствуют о значительной активизации Т- и В-клеточных звеньев иммунитета под воздействием экспериментального лекарственного средства, что говорит об иммуномодулирующем действии препарата.
Было изучено профилактическое и лечебное применение разработанного препарата при бактериальных респираторных заболеваниях щенков. В контрольных группах, несмотря на использование антибиотиков, летальность составляла 15%. При профилактическом применении экспериментального препарата летальность отсутствовала, в случае наступления болезни собаки быстро выздоравливали. В комплексной терапии лечения препаратом летальность хотя и имелась, но была снижена. Период реконвалесценции по сравнению с контролем был в 2 раза короче (см. пример 48).
При герпесной инфекции кошек, сопровождающейся в тяжелых случаях летальностью приблизительно 30% и реабилитационным периодом у выживших животных более 1,5 месяцев, применение препарата позволило исключить гибель животных и сократить сроки выздоровления. Применение препарата в начальной стадии заболевания уменьшило время реконвалесценции до 7-9 суток (см. пример 49).
Препарат оказал высокую эффективность после хирургических вмешательств у собак и кошек, исключив возникновение осложнений и сократив сроки выздоровления (см. пример 50, 51).
Известно, что применение антибиотиков и химиотерапии всегда сопровождается выраженной иммунодепрессией, это удлиняет период выздоровления и способствует возникновению осложнений. Применение препарата по изобретению позволило быстро нормализовать гематологические и биохимические показатели крови животных, что существенно сократило сроки реконвалесценции (см. пример 52).
Большой проблемой в ветеринарии мелких домашних животных является вирусный энтерит кошек, высоко контагиозное заболевание, сопровождающееся массовой гибелью котят и молодых животных. Специфические препараты для лечения вирусных энтеритов кошек отсутствуют. Применение разработанного препарата с профилактической и лечебной целью позволило избежать летальности и уменьшить период выздоровления животных (см. пример 53).
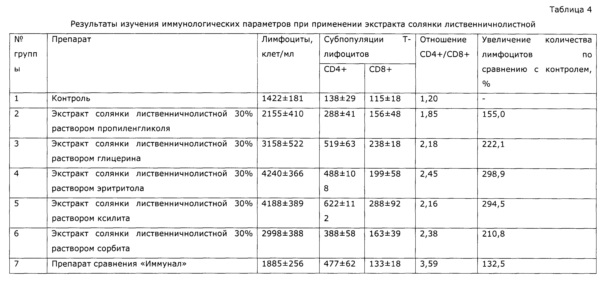
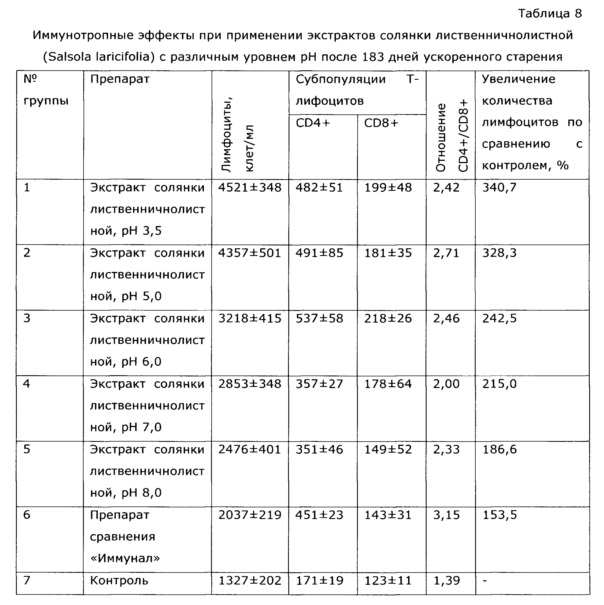
У собак часто наблюдаются тяжелые заболевания желудочно-кишечного тракта с выраженным дисбактериозом, сопровождающиеся патологическими изменениями иммунной системы. Эти состояния, хотя и имеют бактериальную природу, очень трудно поддаются терапии. Введение в комплекс лечебных мероприятий разработанного препарата позволило уменьшить в 2 раза период реконвалесценции и быстро нормализовать иммунологический статус животных. Так, при отсутствии клинических проявлений заболевания после проведенного лечения у контрольной группы животных наблюдались низкий иммуннорегуляторный индекс (CD4+/CD8+) 1,38, снижение функции фагоцитов и т.д.; у животных, получавших экспериментальное средство, в этот же период времени все исследованные показатели находились в пределах нормы, что подтверждает иммуномодулирующее действие предложенного препарата. Препарат эффективно повышал неспецифическую резистентность у продуктивных животных (пример 37); оказывал значимый иммуномодулирующий эффект при выращивании бройлеров (пример 38). Сравнение нативных экстрактов, полученных с использованием различных многоатомных спиртов (пример 40) выявило, что биологический эффект во всех случаях различался очень незначительно, при некоторой корреляции между полярностью экстрагента и проявлением иммуномодулирующего эффекта. То же самое обнаружено в эксперименте по примеру 2.
Разработанное лекарственное средство позволяет осуществлять эффективное лечение иммунодепрессивных состояний, при этом восстанавливается адекватный иммунный ответ и сокращаются сроки выздоровления (см. пример 52, 54 и др.). Предложенный способ лечения иммунодепрессивных состояний заключается в длительном, до нормализации иммунных функций, перроральном введении разработанного препарата, может быть использован как в виде монотерапии, так и сопровождаться применением других терапевтических агентов - антибиотиков, витаминов, спазмолитиков и т.д. (см. пример 48, 49, 53, 54).
Экстракт солянки лиственничнолистной (Salsola laricifolia), полученный путем экстракции травы водными растворами многоатомных спиртов, может быть использован, в соответствии с ОФС.1.4.1.0018.15 в течение суток после получения, либо в течение несколько более продолжительного времени при хранении при низкой температуре, в целом эти фито-экстракты потенциально могут поддерживать рост микроорганизмов, поэтому длительное хранение при нормальных условиях невозможно; хотя некоторые многоатомные спирты (пропиленгликоль, ксилит) проявляют собственное бактериостатическое действие и экстракты с их использованием сохраняются относительно долго (примеры 37, 38). Тем не менее, все же основной фактор риска нестабильности безспиртовых фитоэкстрактов - возможный рост микроорганизмов (бактерий и грибов), что недопустимо само по себе, т.к. микроорганизмы продуцируют токсины, и к тому же вегетатирующие микроорганизмы быстро разрушают биологически активные вещества фитоэкстрактов. Для предотвращения роста микроорганизмов в фитоэкстракты вводят фармацевтически приемлемые консерванты - сорбаты, бензоаты, бензиловый спирт, парабены, сульфиты и т.п., большинство из перечисленных консервантов существенно более эффективны в слабокислой среде. Следует подчеркнуть, что, как было обнаружено в процессе разработки, экстракты солянки лиственничнолистной водными растворами многоатомных спиртов для длительного хранения (что обеспечивает удобство использования препарата в практике) требуют стабилизации - а именно, поддержания рН в области максимальной стабильности биологически активных веществ (экспериментально выявлен интервал значений рН 3,5-5,0), блокирующих нежелательные процессы окисления флавоноидов, лигнанов и др. компонентов фенольной структуры, и бактериостатиков-консервантов. В качестве слабых нетоксичных кислот, удобных для стабилизации рН, без изменения биологических свойств лекарственного средства, может быть взята пищевая нетоксичная кислота: янтарная, яблочная, уксусная, молочная, фосфорная, пропионовая, глюконовая и т.п., однако нами выбрана для реализации изобретения предпочтительна аскорбиновая кислота, т.к. она обладает также и антиоксидантными свойствами, стабилизируя биофенолы (что упрощает состав и технологию производства), обладает приятным вкусом, недорога и доступна на рынке. В качестве антиоксиданта, также без изменения биологических свойств лекарственного препарата, может быть использован любой из известных пищевых стабилизаторов-антиоксидантов: эфиры аскорбиновой кислоты и ее соли, пропилгаллат, ионол, трет-бутилгидрокси анизол, сульфиты и другие. Однако по сравнению с аскорбиновой кислотой они обладают некоторыми недостатками, а именно, требуют дополнительно использования кислоты для регулирования рН, часто придают неприятный вкус, плохо и медленно растворяются в водных растворах многоатомных спиртов. При длительном применении некоторые из них обладают нежелательными токсическими эффектами. К примеру, ионол и трет-бутилгидрокси анизол могут проявлять гепатотоксичность, а сульфиты относительно аллергенны и опасны для больных с бронхиальной астмой [особые указания для растворов в/в и в/м введения препаратов Метадоксил и Но-шпа на www.webvidal.ru] [Е226, Е227, Е228 www.procook.ru/articles.php?do=68], [Hugot D., Causeret J., Leclerc J. Effets d I'ingest on de sulfites sur l'excretion du calcium chez Ie rat. Ann. Biol. Anim. Biochim. Biophys., 5, 53-59 (1965)], [Вредные вещества в промышленности. Неорганические и элементорганические соединения: Справочник. / Под ред. проф. Н.В. Лазарева, Изд. 7-е перер. и доп. - Л.: Химия, 1977, стр. 65], [Rehm H.J., Wittmann Н. Beitrag zur Kenntnis der antimikrobiellen Wirkung der schwefligen Saure. II. Mitteilung. Die Wirkung der dissoziierten und undissoziierten Saure auf verschiedene Mikroorganismen. Z. Lebensin. Unters. Forsch., 120 (6), 465-478 (1963)].
Аналогично в качестве консерванта-бактериостатика может быть использован любой известный достаточно эффективный пищевой консервант: сорбиновая и бензойная кислоты, их соли, бензиловый спирт, бензилбензоат, низин, натамицин, парабены, феноксиэтанол и другие. Сорбиновая и бензойная кислота, и отчасти бензиловый спирт, оцениваются как одни из самых безопасных консервантов, в эффективных дозах не влияют на вкус, и вместе с тем доступны на рынке и недороги. Минимальные значения приемлемых концентраций консервантов (0,01% масс. сорбаты и бензоаты, 0,014% - бензиловый спирт) приняты из условия эффективности бактериостатического эффекта по отношению к обнаруживаемым резистентным микроорганизмам - контаминантам (примеры 6, 10, 25); верхние допустимые уровни ограничиваются влиянием на органолептические свойства лекарственного средства, а также в соответствии с нормами ТР/ТС.
Для получения стабильного лекарственного средства не существенно какой конкретно стабилизатор и консервант используется. Как мы считаем, оптимальным стабилизатором является аскорбиновая кислота, обладающая приятным вкусом, витаминной активностью, являющаяся антиоксидантом, но это не исключает использование других карбоновых кислот в качестве стабилизаторов. С ее помощью легко поддерживают значение рН в области максимальной химической стабильности компонентов фитоэкстракта - от 3,5 до 5,0. В этой же области рН наиболее эффективны пищевые консерванты (см. пример 10). При рН больше 5,0 наблюдается быстрая деструкция оксикумаринов и флавоноидов (гидролиз, окисление), что снижает биологический эффект при хранении лекарственного средства. При рН менее 3,5 лекарственное средство становится неприемлемым по ррганолептическим свойствам (кислый вкус). Оптимальное значение рН достигается обычно при концентрации аскорбиновой кислоты в интервале от 0,1 до 3,05 масс. % и зависит от параметров фитосырья.
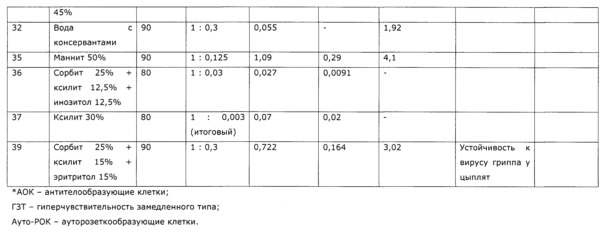
В качестве бактериостатиков-консервантов могут быть использованы признанные безопасными бензойная кислота или ее фармацевтически приемлемые соли в концентрации (0,01-0,5) масс. % и/или сорбиновая кислота или ее фармацевтически приемлемые соли в концентрации (0,01-0,6) масс. %, и/или бензиловый спирт в концентрации (0,014-0,6) масс. %. При концентрации консервантов менее 0,01% лекарственное средство не выдерживает заявленного срока годности (2 года) по микробиологической чистоте (см. примеры 10, 25). Использование консервантов в  количествах, чем предложено, нецелесообразно по экономическим причинам и, как обнаружено, сказывается отрицательно на органолептических свойствах экстракта (сильно раздражает слизистую поверхность гортани). Известные в качестве бактериостатиков-стабилизаторов для «фитоэкстрактов» эфиры п-оксибензойной кислоты («парабены») также могут быть использованы, но они менее приемлемы ввиду известных побочных эффектов и неприятного вкуса. Определение эффективных концентраций консервантов приведено в примере 6.
количествах, чем предложено, нецелесообразно по экономическим причинам и, как обнаружено, сказывается отрицательно на органолептических свойствах экстракта (сильно раздражает слизистую поверхность гортани). Известные в качестве бактериостатиков-стабилизаторов для «фитоэкстрактов» эфиры п-оксибензойной кислоты («парабены») также могут быть использованы, но они менее приемлемы ввиду известных побочных эффектов и неприятного вкуса. Определение эффективных концентраций консервантов приведено в примере 6.
Целевые добавки - консерванты и стабилизаторы, технически просто добавлять в готовый экстракт, с получением продукта, обладающего должной для промышленного производства лекарственного средства, стабильностью - 2 и более лет при естественном хранении (примеры 8, 9). Однако в этом случае при вынужденных остановках процесса экстракции (см. пример 13) возможно возникновение аварийной ситуации - бурный рост микрофлоры в экстракторе, что ведет к экономическим потерям. Для исключения этого явления целевые добавки лучше добавлять в экстрагент (пример 14-26) или в процессе экстракции (пример 5-7), последнее удобно в случае, если экстрактор снабжен перемешивающим устройством и средством контроля уровня рН.
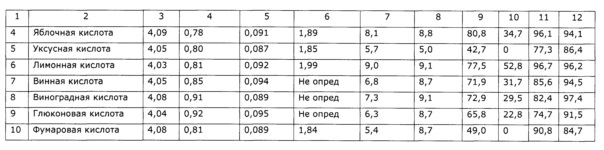
Следует заметит, что целевые добавки закономерно влияют на стабильность лекарственного средства, но не влияют на биологические эффекты (см. пример 7). При этом наиболее благоприятно влияют на органолептические свойства продукта, что имеет значение при коммерческом применении, в первую очередь аскорбиновая кислота и отчасти лимонная, в то время как другие стабилизаторы (к примеру, уксусная кислота) ухудшают органолептические свойства (вкус, запах) (см. примеры 7, 8).
Как следует из проведенных исследований, уже очень небольшие количества экстрактивных веществ из солянки лиственничнолистной (Salsola laricifolia) оказывают выраженный иммуномодулирующий эффект (примеры 3). При этом эффект в области эффективных доз экстрактивных веществ практически не увеличивается (примеры 3, 39); хотя даже в очень больших дозах экстракты солянки лиственничнолистной не проявляют токсических (пример 3) и сенсибилизирующих (пример 55) эффектов, по экономическим причинам, учитывая что солянка лиственничнолистная (Salsola laricifolia) - эндемичное растение Монгольской Гоби и относительно дорогостоящее сырье, целесообразно минимизировать используемые количества фитосырья. Технически можно получить сразу экстракты с минимально эффективной концентрацией экстрактивных веществ (пример 14), но с точки зрения организации экономически рентабельного производства фитопрепарата и для ветеринарного, и для медицинского применения, целесообразно получать концентрированный экстракт, затем стандартизировать разбавлением до определенных концентраций сигнальных компонентов (пример 27) и далее использовать для изготовления конкретных препаратов, БАД и кормовых добавок, вводя необходимое количество фармацевтически приемлемого разбавителя. В качестве последнего можно использовать как очищенную воду (пример 39), так и растворы многоатомных спиртов (примеры 27-29), что обеспечивает необходимые органолептические свойства (примеры 39) препаратов, кроме того, в качестве фармацевтически приемлемого разбавителя можно использовать физиологический раствор, растворы Рингера и др. При этом необходимо обеспечивать эффективные концентрации консервантов, препятствующих росту микроорганизмов (см. пример 6) и стабилизаторов, обеспечивающих рН препаратов в области стабильности и приемлемых органолептических свойств - от 3,5 до 5,0 (примеры 7, 8).
Таким образом, разработан высокоэффективный и безопасный фитопрепарат-иммуномодулятор из растения, не относящегося к семейству сложноцветных, повышающий неспецифическую резистентность организма млекопитающих и птиц к заболеваниям различной этиологии, пригодный для использования в онкологии, не содержащий в своем составе этиловый спирт, что дает возможность применения его в ветеринарии и для лечения детей младших возрастов, а также исключает известные сложности обращения с препаратами, содержащими высокие концентрации этанола, обладающего токсичностью, наркотическими свойствами и пожароопасностью.
Краткое описание чертежей.
На Фиг. 1 показана динамика высвобождения флавоноидов при экстракции солянки лиственничнолистной (Salsola laricifolia) растворами пропиленгликоля. Флавоноиды определяли СФ-методом по окрашиванию алюминиевого комплекса в пересчете на рутин, где: 1 - экстракция с использованием 80% раствора пропиленгликоля; 2 - экстракция с использованием 50% раствора пропиленгликоля; 3 - экстракция с использованием 30% раствора пропиленгликоля; 4 - экстракция с использованием 10% раствора пропиленгликоля; 5 - экстракция с использованием чистого пропиленгликоля (100%).
На Фиг. 2 показана динамика высвобождения оксикумаринов при экстракции солянки лиственничнолистной (Salsola laricifolia) растворами пропиленгликоля. Оксикумарины определяли СФ-методом в пересчете на фраксетин, где: 1 - экстракция с использованием 80% раствора пропиленгликоля; 2 - экстракция с использованием 50% раствора пропиленгликоля; 3 - экстракция с использованием 30% раствора пропиленгликоля; 4 - экстракция с использованием 10% раствора пропиленгликоля; 5 - экстракция с использованием чистого пропиленгликоля (100%).
На Фиг. 3 показана Динамика высвобождения полисахаридов при экстракции солянки лиственничнолистной (Salsola laricifolia) растворами пропиленгликоля. Полисахариды определяли СФ-методом, где: 1 - экстракция с использованием 80% раствора пропиленгликоля; 2 - экстракция с использованием 50% раствора пропиленгликоля; 3 - экстракция с использованием 30% раствора пропиленгликоля; 4 - экстракция с использованием 10% раствора пропиленгликоля; 5 - экстракция с использованием чистого пропиленгликоля (100%).
На Фиг. 4 показана динамика высвобождения оксикумаринов при экстракции солянки лиственничнолистной (Salsola laricifolia) растворами многоатомных спиртов. Оксикумарины определяли СФ-методом в пересчете на фраксетин, где: 1 - экстракция 30% раствором ксилита; 2 - экстракция 30% раствором сорбита; 3 - экстракция 30% раствором эритритола; 4 - экстракция 30% раствором пропиленгликоля; 5 -экстракция 30% раствором глицерина.
На Фиг. 5 показана динамика высвобождения оксикумаринов при экстракции солянки лиственничнолистной (Salsola laricifolia) в зависимости от температуры экстрагирования. Оксикумарины определяли СФ-методом в пересчете на фраксетин, где: 1 - экстракция при 105°С; 2 - экстракция при 90°С; 3 - экстракция при 60°С; 4 - экстракция при 45°С.
На Фиг. 6 показана динамика изменения содержания оксикумаринов в экстрактах солянки лиственничнолисной (Salsola laricifolia) в зависимости от уровня рН при ускоренном старении (40°С). Оксикумарины определяли СФ-методом в пересчете на фраксетин, где: 1 - уровень рН 3,5; 2 - уровень рН 5,0; 3 - уровень рН 6,0; 4 - уровень рН 7,0; 5 - уровень рН 8,0.
На Фиг. 7 показан образец экстракта солянки лиственничнолистной (Salsola laricifolia) без целевых добавок на 4-ый день хранения при естественных условиях. Наблюдается сплошной рост грибов (среда №2).
На Фиг. 8 показан образец экстракта солянки лиственничнолистной (Salsola laricifolia) без целевых добавок на 4-ый день хранения при естественных условиях. Наблюдаются отдельные колонии грибов (среда №1).
На Фиг. 9 показана аппаратурная схема промышленного получения экстракта солянки лиственничнолистной (Salsola laricifolia). P1 - эмалированный реактор рабочим объемом 2 м3, Дф(П)2 - эмалированный перколятор рабочим объемом 0,2 м3, Р3 - эмалированный реактор рабочим объемом 0,2 м3, Р4 - эмалированный реактор рабочим объемом 2 м3, Р6 - эмалированный реактор рабочим объемом 2 м3 на расчетное давление 6 атм.
Осуществление изобретения
Пример 1 (разные концентрации экстрагента, пропиленгликоль)
В термостат-шейкер 1ТЖ-0-03 с нагретым предварительно до 80°С теплоносителем (триэтиленгликоль) помещают 5 мерных колб объемом 1 л, в каждую из которых помещают 30 г травы резанной солянки лиственничнолистной (Salsola laricifolia); в колбы помещают следующий экстрагент в количестве 1 кг - в колбу №1 - 10% раствор пропиленгликоля, в колбу №2 - 30% раствор пропиленгликоля, в колбу №3 - 50% раствор пропиленгликоля, в колбу №4 - 80% раствор пропиленгликоля, в колбу №5 - сухой (влажность 0,11% по К. Фишеру) пропиленгликоль. Ведут экстракцию, периодически раз в 30 минут отбирают пробу и определяют содержание оксикумаринов в пересчете на фраксетин спектрофотометрическим методом, содержание флавоноидов по окраске алюминиевого комплекса в пересчете на рутин и полисахаридов СФ-методом. Экстрактивные вещества извлекаются в экстрагент, концентрации сигнальных компонентов возрастают. По полученным результатам анализа строят кинетические кривые экстракции (Фиг. 1-3), из которых видно, что через некоторое время устанавливается равновесие, и дальнейшая экстракция прекращается. Для тестирования эффективности полученных образцов экстрактов в качестве иммуномодулирующего средства использовали тест, основанный на изучении неспецифической резистентности животных к вирусу гриппа. В опыте использовали белых беспородных мышей массой 15-20 г. Всего было сформировано семь групп экспериментальных животных (каждая группа включала по 20 животных):
1. Контрольная группа, получавшая воду;
2. Опытная группа, получавшая экстракт солянки лиственничнолистной, полученный экстрагированием травы 10% раствором пропиленгликоля;
3. Опытная группа, получавшая экстракт солянки лиственничнолистной, полученный экстрагированием травы 30% раствором пропиленгликоля;
4. Опытная группа, получавшая экстракт солянки лиственничнолистной, полученный экстрагированием травы 50% раствором пропиленгликоля;
5. Опытная группа, получавшая экстракт солянки лиственничнолистной, полученный экстрагированием травы 80% раствором пропиленгликоля;
6. Опытная группа, получавшая экстракт солянки лиственничнолистной, полученный экстрагированием травы сухим пропиленгликолем;
7. Группа получала препарат «Иммунал».
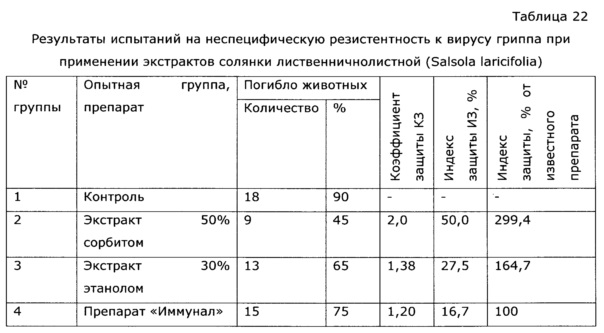
Препараты вводили животным внутрижелудочно в дозе 100 мг/кг 2 раза в день на протяжении 15 дней, препарат сравнения вводили в той же дозе. Животные в контрольной группе получали эквивалентное количество воды дистиллированной. На 16-й день после начала опыта животных заражали интраназально патогенным для них штаммом вируса гриппа A/Pr/8/34 (H0N1) в объеме 0,05 мл на мышь; летальную дозу вируса определяли в предварительном опыте путем титрования вируса на мышах с последующим вычислением ЛД50. Результаты опыта оценивали на 5 день, регистрируя летальность мышей в контрольной и опытных группах. Для определения индекса защиты (ИЗ) вычисляли коэффициент защиты (КЗ) мышей препаратом
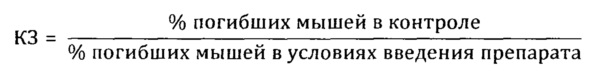
Индекс защиты вычисляли следующим образом:
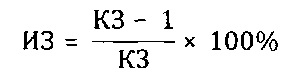
Из таблицы видно, что пропиленгликольные экстракты солянки лиственничнолистной (Salsola laricifolia) при концентрации экстрагента от 30% до 80% показали существенно большую эффективность в идентичных дозах, нежели известный растительный препарат «Иммунал». Экстракт солянки лиственничнолистной сухим пропиленгликолем биологическую активность не обнаружил.
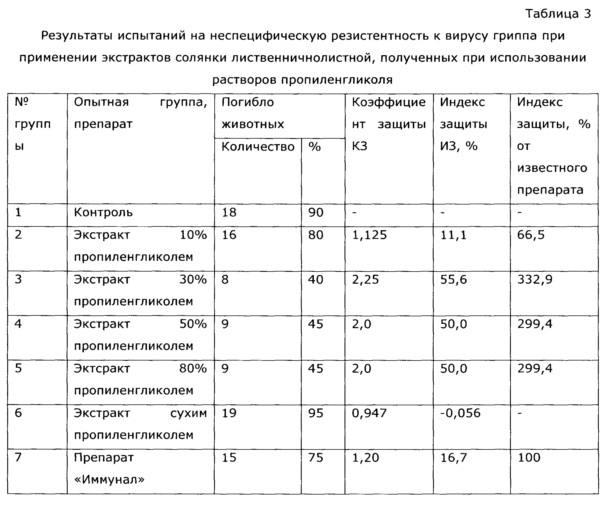
Пример 2 (разные многоатомные спирты, 30%)
Опыт проводили в условиях, аналогичных опыту 1, но в качестве экстрагента берут 30% водные растворы пропиленгликоля, глицерина, эритритола, ксилита, сорбита; экстракцию проводят при 80°С. Аналогично предыдущему опыту определяют в качестве сигнальных компонентов сумму оксикумаринов СФ-методом в пересчете на фраксетин, пробы отбирают один раз в 30 минут. Концентрация оксикумаринов закономерно возрастает до равновесного значения, и далее не изменяется, что свидетельствует о прекращении экстракции (см. Фиг. 4). Полученные экстракты в горячем виде фильтруют на воронках Шотта, охлаждают, и используют в качестве иммуномодулирующего средства в эксперименте; при этом образцы хранят в холодильнике при температуре от +4 до +5°С, а перед введением животным подогревают до комнатной температуры. В качестве препарата сравнения используют известный препарат «Иммунал».
В эксперименте использованы 35 белых мышей линии Balb/C [Виварий ФГБУН НЦБМТ ФМБА России] массой 20-25 г. Животные разделены на 7 групп; препараты вводили внутижелудочно через зонд 2 раза в день, в дозе 100 мл на кг (аналогично примеру 1). Препараты давали животным в течение 2 суток, после чего определяли содержание в крови лимфоцитов и методом проточной цитометрии (содержание CD4+T, CD8+T клеток в периферической крови измеряли с помощью «Monoclonal antibody to CD4, CD8 mouse» («Exbio-Praha», Czech Republic), раствора, лизирующего эритроциты периферической крови - «Excellyse-I» («Exbio-Praha», Czech Republic) и автоанализатора проточной цитометрии «FACS-Apogee Universal-50») содержание субпопуляций Т-лимфоцитов CD4+ и CD8+. Результаты опыта приведены в таблице 4. Введение животным экстрактов солянки лиственничнолистной (Salsola laricifolia) существенно повлияло на определенные иммунологические показатели, при этом спектр изменений достоверно отличался от опыта с использованием известного препарата «Иммунал», но существенной разницы между опытами с использованием разных многоатомных спиртов не обнаруживается.
Пример 3 (разные соотношение трава-экстрагент)
Траву солянки лиственничнолистной (Salsols laricifolia) размалывают на ножевой мельнице Retsch SM 300 с ситом 0,5 мм 800 об/мин.
В мерные колбы объемом 2 л помещают 1 г молотой сухой травы солянки лиственничнолистной (Salsola laricifolia) (образец №1), 3 г сухой молотой травы (образец №2), 30 г сухой молотой травы (образец №3), 300 г сухой молотой травы (образец №4), 600 г сухой молотой травы (образец №5), 800 г сухой молотой травы (образец №6). В колбы приливают по 1 кг нагретого до 80°С 80%-ного пропиленгликоля и помещают в шкаф-термостат, предварительно нагретый до 80°С; при 80°С образцы выдерживают 12 часов. Затем горлышки колб обвязывают фильтрующей тканью (Арт. 56202-ВТ) и переворачивают, сливая экстракт в предварительно взвешенные цилиндры; процедуру проводят в термошкафе. После прекращения стока экстракта полученные образцы взвешивают и определяют содержание оксикумаринов СФ-методом в пересчете на фраксетин, а затем определяют влияние на иммунологические показатели животных аналогично примеру №2. Результаты опыта приведены в таблице 5.
Пример 4 (разная температура экстракции)
В термостат-шейкер 1ТЖ-0-03 с нагретым предварительно до заданной температуры теплоносителем, помещают мерную колбу объемом 1 л, в которую помещают 300 г резанной сухой травы солянки лиственничнолистной (Salsola laricifolia) и 1 кг 50% раствора сорбита, включают перемешивание и ведут экстракцию, отбирая пробы для анализа через каждые 30 минут. В пробах определяют оксикумарины СФ-методом в пересчете на фраксетин, и флавоноиды по окраске алюминиевого комплекса СФ-методом в пересчете на рутин. Опыт последовательно повторяют при температурах 45°С, 60°С, 90°С и 105°С; экстракцию ведут до установления равновесного состояния по концентрации оксикумаринов. Полученные экстракты отфильтровывают, охлаждают и используют для определения влияния на иммунологическе показатели животных аналогично опыту 2. Результаты опыта приведены в таблице 6 и на Фиг. 5. Из них видно, что при температуре ниже 60°С экстракция сильно замедляется и возастают потери экстракта из-за удерживания на шроте; при температурах более 90°С обнаруживается деструкция сигнальных компонентов, а полученный экстракт проявляет пониженную иммуномодулирующую активность.
Пример 5 (Влияние рН (при экстракции) на стабильность + экстракт)
Для опыта предварительно готовят буферную смесь-консерванты, для чего в 2-литровый стакан, снабженный лопастной фторопластовой мешалкой загружают 1 кг воды очищенной затем при перемешивании вводят 100 г сорбата калия и 100 г бензоата натрия, затем суспензируют 450 г лимонной кислоты. К суспензии при перемешивании медленно добавляют карбонат натрия безводный, при этом выделяется углекислота и масса пенится. В общей сложности добавляют 460 г карбоната натрия, достигая устойчивого значения рН 10±0,1. Полученная цитратная смесь представляет собой сиропообразную прозрачную жидкость, стабильную при хранении.
В четырехгорлую круглодонную колбу объемом 4 л, снабженную лопастной фторопластовой мешалкой, термометром и электродами для измерения значения рН, загружают 1 кг воды очищенной, при включенной мешалке порциями загружают 1 кг сорбита, перемешивают до растворения и подогреве, массу нагревают до 70°С. В раствор вводят 20 мл цитратной смеси, затем небольшими порциями добавляют аскорбиновую кислоту до рН 3,5. Продолжая перемешивание, в экстрагент загружают 600 г резанной сухой травы солянки лиственничнолистной (Salsola laricifolia); наблюдающееся при этом возрастание значение рН купируют добавлением небольших количеств аскорбиновой кислоты. Процесс экстракции ведут до прекращения роста содержания сигнальных компонентов - оксикумаринов, определяемых СФ-методом; это происходит через 4,5 часа. Суспензию фильтруют от шрота на воронке с пористой стеклянной пластиной, полученный фильтрат анализируют и используют в дальнейших исследованиях.
Аналогичным образом получают образцы экстракта с значениями рН 5, 6, 7, 8; эти образцы проверяют на стабильность согласно ОФС.1.1.0009.15. Результаты исследования стабильности приведены в таблице 7 и Фиг. 6.
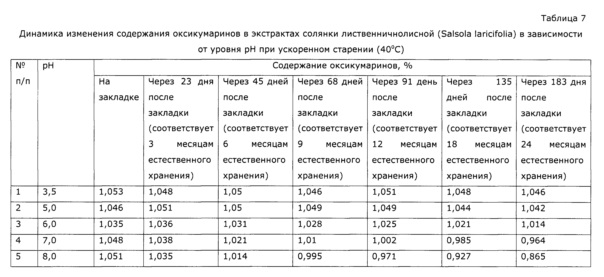
Из полученных результатов видно, что экстракты солянки лиственничнолистной, полученные при рН 3,5-5,0 и сохраняющие эти значения, стабильны при хранении при 40°С в течение 6 месяцев, что эквивалентно стабильности при хранении в естественных условиях 2 года. При более высоких значениях рН экстракты менее стабильны, а при рН более 7 быстро изменяется состав. Отхранившиеся 6 месяцев при 40°С образцы проверены по влиянию на иммунологические показатели у животных (аналогично примеру 2); полученные результаты приведены в таблице 8.
Из полученных данных видно, что образцы с рН≥7 перестали после хранения проявлять специфическую иммуномодуляторную активность.
Пример 6 (определение эффективных концентраций консервантов)
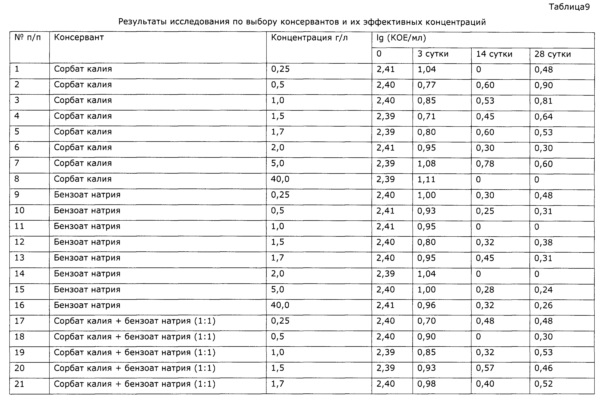
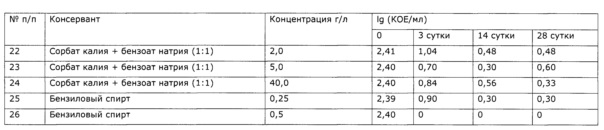
Определение эффективных концентраций консервантов проводят согласно ОФС.1.2.4.0011.15. В качестве среды культивирования используют стерилизованный экстракт солянки лиственничнолистной (Salsola laricifolia). Для его получения в трехгорлую колбу объемом 4 л, снабженную лопастной мешалкой, термометром и электродом для рН-метрии, загружают 1 л воды очищенной, при перемешивании добавляют 1 кг сорбита, затем подогревают до 80°С и загружают 300 г резанной сухой травы солянки лиственничнолистной (Salsola laricifolia); рН доводят до 4 добавлением аскорбиновой кислоты. В процессе экстракции значение рН незначительно увеличивается, по мере необходимости добавляют аскорбиновую кислоту, поддерживая значение рН 4,0±0,1; после 8 часов экстракции горячую суспензию фильтруют на фильтре с пористой стеклянной пластиной. Фильтрат в закрытой емкости стерилизуют γ-излучением согласно ОФС.1.1.0016.15 в ООО «Мегарад», стерильный экстракт используют для культивирования тест-микроорганизмов. В качестве последних использована Г(+) спорообразующая факультативно анаэробная палочка с высокой резистентностью к сорбатам, выделенная из приобретенного на рынке БАД-сиропа нефропотективного действия.
В стерильные флаконы помещали стерилизованный γ-излучением экстракт солянки лиственничнолистной с добавлением консервантов. В качестве консервантов использовали широко распространенные и безопасные сорбат калия, бензоат натрия и бензиловый спирт в концентрациях, указанных в таблице 7. К каждому образцу добавляли суспензию, содержащую выделенную тестовую микрофлору в количестве, необходимом для достижения концентрации клеток 102 КОЕ/мл. Фактическую исходную концентрацию микроорганизмов в исследуемых образцах определяли сразу после контаминации. Контаминированные образцы выдерживали в защищенном от света термостате при температуре 25,0°С в течение 28 суток. На 3, 14 и 28 сутки после инокуляции образцов определяли количество жизнеспособных микроорганизмов, делая высев глубинным способом в среду №1. Результаты испытаний представлены в таблице 9.
Из таблицы видно, что все используемые консерванты в выбранных концентрациях показали высокую эффективность. В течение первых трех дней показано снижение уровня контаминации образцов по сравнению с исходной концентрацией на значение Ig (КОЕ/мл) более чем на 1. В последующем уровень контаминации продолжал падать. В некоторых случаях наблюдалось незначительное увеличение уровня КОЕ, однако это увеличение не превышало 0,5 Ig КОЕ, что в соответствии с ОФС.1.2.4.0011.15 позволяет пренебречь таким незначительным ростом и заявлять, что роста микроорганизмов в образцах не наблюдается и консерванты показывают высокую эффективность в заявляемых концентрациях. Таким образом, консерванты эффективны в концентрациях 0,25-40,0 г/л в случае сорбатов (сорбат калия), 0,25-40,0 г/л в случае бензоатов (бензоат натрия) и 0,25-0,5 г/л в случае бензилового спирта.
Пример 7 (Разные стабилизаторы при экстракции)
В трехгорлую круглодонную колбу объемом 4 л, снабженную фторопластовой лопастной мешалкой, термометроми электродами для измерения рН, а также термостатируемой баней с триэтиленгликолем в качестве теплоносителя, вносят 1 кг воды очищенной и включают перемешивание. Воду нагревают до 80±5°С и порциями присыпают 1 кг сорбита, при растворении сорбита температура снижается. Раствор сорбита нагревают до 80°С и присыпают сначала 0,5 г сорбата калия, 300 г травы сухой резаной солянки лиственничнолистной (Salsola laricifolia). Затем небольшими порциями добавляют аскорбиновую кислоту до устойчивого значения рН 4±0,1; в процессе экстракции значение рН незначительно возрастает, при этом добавляют аскорбиновую кислоту. Периодически отбирают пробы и определяют содержание окискумаринов СФ-методом в пересчете на фраксетин; через 8,5 часов экстракции изменение концентрации оксикумаринов прекращается. Горячую суспензию фильтруют через фильтр с пористой стеклянной пластиной и остужают до комнатной температуры. Аналогично получают экстракты с использованием в качестве стабилизаторов янтарной кислоты, молочной кислоты, яблочной кислоты, уксусной кислоты, лимонной кислоты, винной кислоты, виноградной кислоты, глюконовой кислоты, фумаровой кислоты. Аналогично получают экстракты с теми же стабилизаторами в увеличенном количестве, обеспечивающем значение рН 3,0-3,2. Все полученные образцы анализируют на содержание сигнальных компонентов (оксикумаринов, флавоноидов, полисахаридов), а также определяют органолептические свойства (вкус, запах) и поедаемость разными видами животных (таблица 10). После этого полученные образцы хранят в термостате при 40±1°С в течение 6 месяцев (что соответствует 2 годам естественного хранения), после чего определяют содержание сигнальных компонентов и тестируют по органолептическим параметрам и поедаемости разными видами животных.
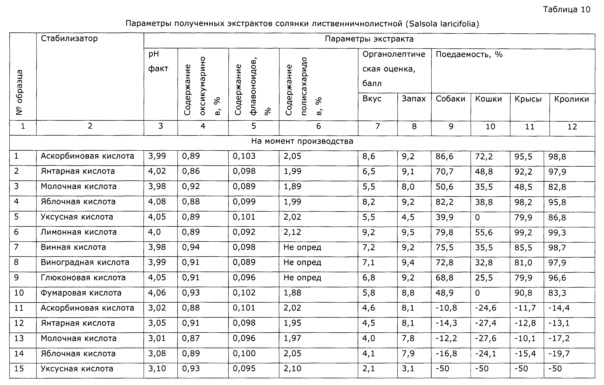
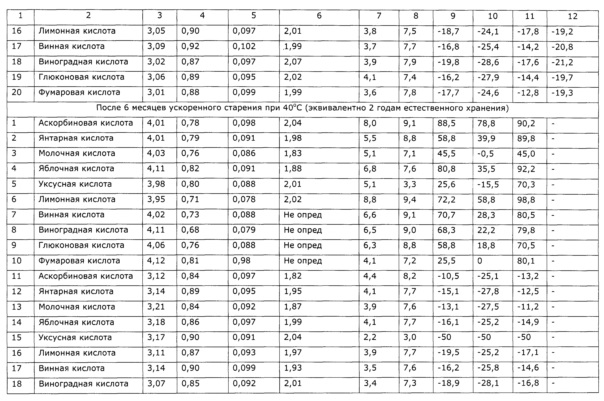

Результаты приведены в таблице 10, из них видно, что стабильность экстрактов не зависит достоверно от применяемого стабилизатора, однако органолептические параметры существенно зависят от стабилизатора. Наиболее высокие органолептические параметры и поедаемость обеспечили аскорбиновая и лимонная кислоты. Образцы с использованием в качестве стабилизатора карбоновых кислот с известной значимой биологической активностью (аскорбиновая, янтарная кислота) были изучены на влияние на уровень неспецифической резистентности к вирусу гриппа; в качестве сравнительного образца использован экстракт без добавок стабилизаторов. Результаты приведены в таблице 10, из которой видно отсутствие значимых влияний на биологическую активность экстрактов солянки лиственничнолистной используемых стабилизаторов.
Органолептическую оценку образцов проводили добровольцы (5 женщин, 5 мужчин), которые оценивали образец в интервале 0-10 баллов; баллы суммировались, вычислялось среднее значение.
Поедаемость образцов разными видами животных определяли следующим образом. К 10 г приемлемого для данного вида животных и привычного корма (отваренное куриное мясо для собак и кошек, зерно пшеницы для грызунов) добавляют 1 г образца. В контрольном опыте в качестве добавки используют 50%-ный раствор сорбита. Перед испытанием животное на 8-10 часов лишают корма, при свободном доступе к воде. При испытании животному в отдельном боксе предлагают испытуемый образец и контрольный, при этом емкости с кормом с добавками размещают на расстоянии 0,5 м друг от друга. Результат испытания оценивают следующим образом:
Полученные баллы суммируют и вычисляют среднее значение для 5-10 животных. В качестве испытуемых животных используют беспородных кошек, собак, крыс, кроликов.
Известно, что некоторые карбоновые кислоты - интермедиаты цикла Кребса или обладающие витаминной активностью, могут оказывать существенное влияние на иммунную систему животных. Для выявления влияния используемых стабилизаторов использовали тест, основанный на изучении неспецифической резистентности животных к вирусу гриппа. В опыте, проводимом аналогично описанной в примере 1 процедуре, использовали белых беспородных мышей массой 15-20 г. Были сформированы следующие экспериментальные группы:
1. Контрольная группа, получавшая 50%-ный раствор сорбита;
2. Опытная группа, получавшая экстракт солянки лиственничнолистной, стабилизированный аскорбиновой кислотой;
3. Опытная группа, получавшая экстракт солянки лиственничнолистной, стабилизированный янтарной кислотой;
4. Опытная группа, получавшая экстракт солянки лиственничнолистной, стабилизированный яблочной кислотой;
5. Опытная группа, получавшая экстракт солянки лиственничнолистной, стабилизированный фумаровой кислотой;
6. Опытная группа, получавшая нестабилизированный экстракт солянки лиственничнолистной.
Препараты вводили животным внутрижелудочно при помощи зонда в дозе 500 мг/кг 2 раза в день на протяжении 15 дней, на 16 день после начала опыта животных заражали интраназально патогенным штамом вируса гриппа А/Рr/8/34 (H0N1) в объеме 0,05 мл на мышь; летальную дозу вируса определяли в предварительном опыте путем титрования вируса на мышах с последующим вычислением ЛД50; результаты опыта оценивали на 5 день, регистрируя летальность мышей в контрольной и опытной группах. Аналогично опыту 1, вычисляли коэффициент защиты (КЗ) и индекс защиты (ИЗ). В данном опыте использовали увеличенную дозу экстракта, предполагая большую вероятность проявления эффектов биологически неинертных стабилизаторов.
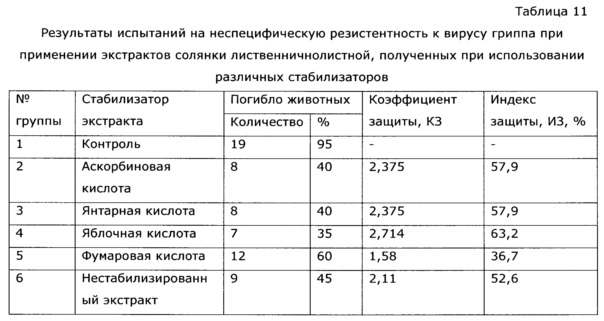
Из таблицы 11 видно, что эффективность как иммуномодулирующего средства стабилизированного различными карбоновыми кислотами и нестабилизированного экстракта практически идентична.
Пример 8 (стабилизаторы при внесении в готовый продукт)
В эмалированный реактор с якорной мешалкой, снабженный термодатчиком, с донным грибковым вентилем Dy 50, загружают из мерника 10 л воды очищенной. Циркуляцией теплоносителя через рубашку воду нагревают до 80°С, при этой температуре загружают 10 кг сорбита, при растворении сорбита температура сильно снижается. Раствор подогревают до 80°С, загружают 3 кг сухой резанной травы солянки лиственничнолистной (Salsola laricifolia) и при этой температуре ведут экстракцию 8 часов, после чего суспензию сливают в полимерную емкость и переносят на нутч-фильтр. После фильтрации горячего экстракта от шрота, фильтрат охлаждают до комнатной температуры, к нему добавляют 10 г сорбата калия и делят на образцы по 0,5 кг; каждый образец подкисляют фармацевтически приемлемой карбоновой кислотой: аскорбиновой, лимонной, янтарной, молочной, яблочной, уксусной, винной, виноградной, глюконовой и фумаровой кислотами до значения рН 4,0±0,1. Образцы анализируют и определяют органолептические свойства аналогично примеру 7 (результаты представлены в таблице 12); затем хранят при 40°С в шкафу-термостате 6 месяцев (эквивалентно 2 годам естественного хранения), после чего повторяют анализ и тестирование. Результаты опыта приведены в таблице 12, из них видно, что введение стабилизаторов после процесса экстракции не отличается от введения стабилизаторов в процессе экстракции.
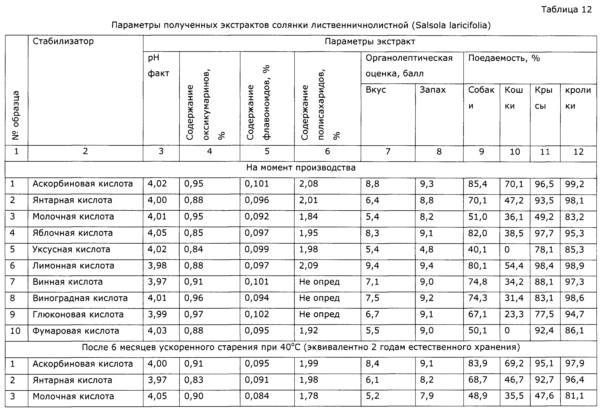
Пример 9 (стабилизация готового экстракта - разные значения рН)
Опыт проводят аналогично опыту 8; в полученный нестабилизированный экстракт, взятый в количестве 1000 мл каждый образец, добавляют цитратную смесь (см. пример 5) и аскорбиновую кислоту таким образом, что полученные образцы экстрактов имеют значение рН 8; 7; 6; 5; 4; 3,5; 3,0; 2,5. Образцы анализируют на содержание сигнальных компонентов тестируют по органолептическим параметрам и поедаемости животными аналогично примеру 7 (таблица 13); после 6 месяцев хранения при 40°С анализ и тестирование повторяют. Из результатов опыта (см. таблицу 14) видно, что экстракты при рН более 5 химически нестабильны, а образцы с рН менее 3,5 имеют низкие вкусовые качества и крайне низкую поедаемость животными, что объясняется резко выраженным кислым вкусом таких образцов и раздражением слизистых оболочек полости рта.
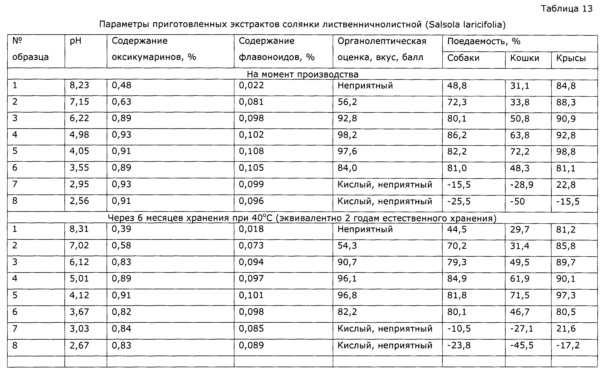
Пример 10 (стабилизация готового экстракта - влияние на микробиологическую стабильность)
В эмалированный реактор с якорной мешалкой, снабженный термодатчиком, с донным грибковым вентилем ДУ50, загружают из мерника 10 л воды очищенной. Циркуляцией теплоносителя через рубашку воду нагревают до 60°С, при этой температуре загружают 10 кг сорбита, после растворения сорбита и подъема температуры до 60°С при перемешивании в реактор загружают 3 кг сухой резанной травы солянки лиственничнолистной (Salsola laricifolia). Экстракцию ведут, периодически отбирая пробы, в которых определяют сумму оксикумаринов в пересчете на фраксетин СФ-методом. При прекращении роста концентрации оксикумаринов в экстракте, что происходит через 10,5 часов, суспензию сливают в полимерную емкость, фильтруют на нутч-фильтре. Получают 8,58 кг экстракта со следующими параметрами:
1. Описание: темно-коричневый мутноватый сироп с характерным приятным фруктовым запахом.
2. Суммарное содержание флавоноидов СФ-методом (алюминиевый комплекс) в пересчете на рутин 0,102%
3. Суммарное содержание оксикумаринов и гликозидов оксикумаринов СФ-методом в пересчете на фраксетин 0,97%
4. Содержание полисахаридов СФ-методом 2,05%
5. Микробиологическая чистота:
- общее число аэробных бактерий - 1,2*102 КОЕ (норма - не более 104 КОЕ)
- общее число грибов - менее 10 КОЕ (норма - не более 102 КОЕ)
- Salmonella - отсутствует
- Escherichia coli - отсутствует
- энтеробактерии - отсутствуют
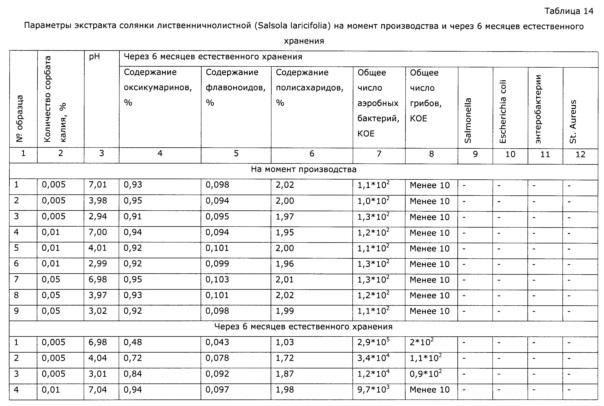
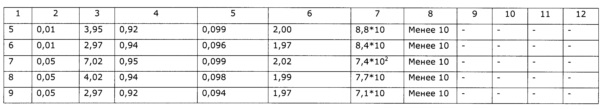
- St. Aureus – отсутствует.
Экстракт делят на образцы по 500 г с добавлением сорбата калия в качестве консерванта, в количествах, как указано в таблице 14, и аскорбиновой кислоты в качестве стабилизатора до достижения необходимого уровня рН. Образцы выдерживали при комнатной температуре в течение 6 месяцев и проверяли на содержание оксикумаринов СФ-методом. в пересчете на фраксетин, содержание флавоноидов по окрашиванию алюминиевого комплекса СФ-методом в пересчете на рутин, содержание полисахаридов СФ-методом и микробиологические показатели.
Как видно из таблицы 14, экстракт при рН более 5 нестабилен; при рН менее 3,5 неприменим по органолептическим свойствам.
Пример 11 (экстракция растворами сахаров)
В колбу объемом 3 л роторно-пленочного испарителя Buchi Rotovapor R215 помещают 300 г травы сухой резанной солянки лиственничнолистной (Salsola laricifolia), имеющей следующие параметры:
1. Описание - резанная трава с жесткой структурой, зеленовато-желтоватые серые фрагменты размерами 8-25 мм × 0,2-1,3 мм.
2. Влажность (высушиванием) 5,3%.
3. Зольность 7,9%.
4. Сумма оксикумаринов, СФ методом в пересчете на фраксетин 0,99%.
5. массовая доля дубильных веществ в пересчете на танин по индигосульфокислоте 3,53%.
6. Массовая доля полифенольных соединений 2,94%.
7. Микробиологическая чистота
Количество аэробных бактерий 8,2*102 КОЕ
Количество грибов 8,4*10 КОЕ
Esherichia coli - отсутствует
Pseudomonos spp - отсутствует
Salmonella - отсутствует
Staphylococcus - отсутствует
Enterobacteriaceae – отсутствует.
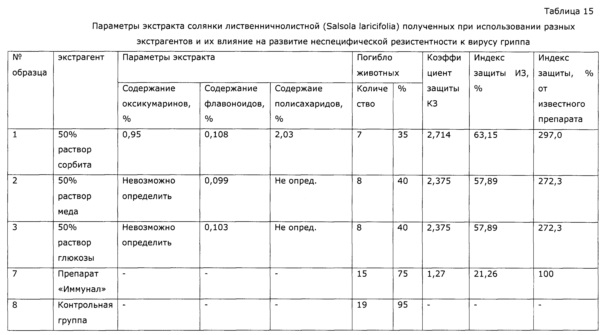
Экстрагент готовят следующим образом: мед (ГОСТ Р 54644-2011, производитель ООО «Медовая долина») анализируют на содержание воды методом К.-Фишера,считая остальное сахарами, готовят водный раствор с содержанием Сахаров 50% в количестве 500 г, в экстрагент добавляют 0,5 г сорбата калия и через воронку приливают к траве. Баню нагревают до 80°С; закрепляют колбу, устанавливают вращение 80 об/мин и ведут экстракцию в течение 4х часов. После этого горячую суспензию сливают на предварительно подогретый фильтр с пористой стеклянной пластиной, фильтруют под вакуумом 300 мм Hg, отжимают шрот под давлением 0,1 кг/см2, что обеспечивается давлением (под собственным весом) фторопластового штока (также прогретого до 80°С) на шрот в процессе фильтрации. Получают 751 г экстракта. Аналогично проводят экстракцию с использованием 50% раствора сорбита и 50% раствора глюкозы. Полученные экстракты анализируют аналогично предыдущим опытам, и исследуют влияние на неспецифическую резистентность к вирусу гриппа аналогично примеру 1. Результаты приведены в таблице 15, из них видно, что экстракты, полученные с использованием сорбитового раствора, глюкозного раствора и раствора меда, не различаются достоверно по иммуномодулирующим эффектам, при этом в экстрактах с использованием сахара не удается достоверно определить сигнальные компоненты применимым методом, а использование селективных ВЭЖХ-МС методов очень затратно и требует разработки самих методик.
Пример 12 (экстракция смешанным экстрагентом (эритрит, сорбит, ксилит); стабилизатор - две кислоты)
Для проведения процесса экстракции используют эмалированный перколятор с расчетным объемом 120 л, снабженный рубашкой для обогрева, термогильзой, фильтровальным полем и грибковым вентилем на нижнем спуске, и эмалированный реактор объемом 63 л, с якорной мешалкой, имеющий рубашку для обогрева, термогильзу с термодатчиком и нижний спуск с грибковым вентилем.
Для экстракции используют сухую резаную траву солянки лиственничнолистной (Salsola laricifolia), соответствующую монгольскому стандарту MNS-4403-05; параметры взятого на экстракцию материала следующие:
1. Описание - резаная трава с жесткой структурой, зеленовато-желтоватые серые фрагменты размерами 5÷30 мм × 0,2÷1,5 мм;
2. Запах - специфический, приятный;
3. Вкус - кисловатый;
4. Влажность (высушиванием) - 3,9%;
5. Примеси минеральные (нерастворимые в 10% соляной кислоте) - 0,5%;
6. Зольность 9,2%;
7. Сумма оксикумаринов, СФ-методом, в пересчете на фраксетин 2,92%;
8. Сумма флавоноидов, по окраске алюминиевого комплекса, СФ-методом, в пересчете на рутин 0,203%;
9. Массовая доля полифенолов 3,11%.
60 кг резанной сухой травы солянки лиственничнолистной (Salsola laricifolia) загружают в перколятор. В эмалированный реактор загружают 92,5 кг воды очищенной. Включают мешалку и циркуляцию теплоносителя в рубашке реактора, включают нагрев. При достижении 60°С в реакторе через люк загружают 35 кг эритрита, затем порциями 80 кг сорбита, после полного растворения догружают 32,5 кг ксилита, перемешивают до растворения и нагревают до 80°С. Горячий экстрагент передают в перколятор в количестве 100 кг, экстракцию ведут 8 часов при 90°С, после чего сливают экстракт в полимерную емкость через фильтрующее поле перколятора. Получают 21,88 кг экстракта. К оставшемуся в перколяторе шроту приливают 75 кг экстрагента и повторяют экстракцию в течение 12 часов, при сливе получают 62,77 кг сиропа-экстракта. К шроту загружают оставшиеся 75 кг эктсрагента, процесс экстракции ведут 16 часов. После слива получают 65,85 кг экстракта.
Все три экстракта объединяют в 200 л полимерной бочке, перемешивают штоком; добавляют 0,5 кг сорбата калия и снова перемешивают штоком до полного растворения гранул. После этого, продолжая перемешивание, добавляют 5 кг аскорбиновой кислоты, рН эктсракта после перемешивания 5,8. Небольшими порциями, перемешивая штоком, добавляют янтарную кислоту до устойчивого значения рН 4,0 - всего с этой целью загружается 6,32 кг янтарной кислоты. После загрузки всех компонентов получают 184,2 кг экстракта с следующими параметрами:
1. Описание - густой темно-бурый сироп с приятным фруктовым запахом, прозрачный;
2. Плотность 1,26 г/см3;
3. рН 4,1;
4. Суммарное содержание оксикумаринов СФ-методом, в пересчете на фраксетин 0,39%;
5. Суммарное содержание флавоноидов СФ-методом, по окраске алюминиевого комплекса, в пересчете на рутин 0,056%;
6. Микробиологическая чистота:
- количество аэробных бактерий 2,2*102 КОЕ;
- количество грибов менее 10 КОЕ.
После 6 месяцев хранения в естественных условиях параметры экстракта следующие:
1. Описание - густой прозрачный темно-бурый сиропа с приятным фруктовым запахом;
2. Плотность 1,22 г/см3;
3. рН 4,15;
4. Суммарное содержание оксикумаринов в пересчете на фраксетин (СФ-метод) 0,36%;
5. Суммарное содержание флавоноидов, по окраске алюминиевого комплекса, СФ-методом, в пересчете на рутин 0,052%;
6. Микробиологическая чистота:
- количество аэробных бактерий 1,4*102 КОЕ;
- количество грибов менее 10 КОЕ.
Изучение влияния полученного экстракта на антителообразование изучали методом локального гемолиза и в реакции гемагглютинации при иммунизации мышей эритроцитами барана. В опыте использовали белых беспородных мышей массой 15-20 г. Для определения изменения количества антителообразующих клеток (АОК) в селезенке особям опытной группы перорально вводили полученный экстракт в дозе 0,2 мл/кг одновременно с внутрибрюшинной иммунизацей их эритроцитами барана (2% взвесь) в дозе 0,5 мл/мышь. Особям контрольной группы полученный экстракт не применяли. Исследование изменения количества АОК проводили на 4-е сутки после иммунизации - селезенку извлекали и получали лимфоциты. Вокруг каждой антителообразующей клетки возникает зона гемолиза, которая на агаре видна в виде прозрачной точки. Индекс стимуляции (ИС) рассчитывали как отношение числа АОК опытной группы к АОК у особей контрольной группы:
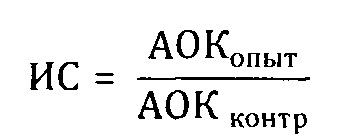
Результаты представлены в таблице 16, из которой видно, что введение экстракта приводит к активации трансформации В-лимфоцитов в АОК по сравнению с контролем, что выражалось в увеличении количества АОК в селезенке. Увеличение индекса стимуляции в 2,7 раза у особей опытной группы свидетельствует о стимулирующем действии экстракта на антителогенез и усиление гуморального иммунного ответа; увеличение содержания АОК предшественников В-лимфоцитов связано с активизацией функциональной активности Т-лимфоцитов.

Для определения изменения титров антител в сыворотке крови полученный экстракт в дозе 0,2 мл/кг вводили мышам опытной группы с одновременной внутрибруюшинной иммунизацией 2% взвесью эритроцитов барана. Контрольная группа экстракт не получала, а сразу подвергалась иммунизации. Реакция основана на способности агглютининов, содержащихся в сыворотке крови иммунизированных животных, агглютинировать эритроциты барана. Титры агглютининов в сыворотке крови животных и ИС подсчитывали на 7-е сутки после иммунизации. Результаты представлены в таблице 17, из которой видно, что на 7-й день после иммунизации у животных опытной группы титры агглютининов в сыворотке крови повысились до 7,4 (log2), в то время как у особей опытной группы уровень составил 1,9 (log2). Таким образом, однократное применение экстракта солянки лиственничнолистной сопровождается усилением иммунного ответа на тимусзависимый антиген, при этом отсутствует подавление Т-супрессорами активности В-лимфоцитов в отношении Т-зависимого антигена. Экстракт солянки лиственничнолистной оказывает стимулирующее воздействие на гуморальный иммунный ответ, что подтверждается увеличением индекса стимуляции до 3,89.

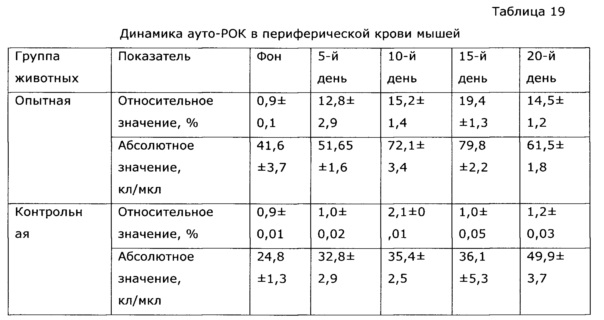
Также было проведено изучение действия экстракта солянки лиственничнолистной на клеточное звено иммунного ответа определением реакции гиперчувствительности замедленного типа (ГЗТ) и определением кинетики ауторозеткообразующих клеток (ауто-РОК).
При определении гиперчувствительности замедленного типа особям опытной группы вводили экстракт солянки лиственничнолистной в дозе 0,2 мл/кг с одновременной внутрибрюшинной иммунизацией 2% взвесью эритроцитов барана. На 5-е сутки вводили разрешающую дозу эритроцитов барана - 10% взвесь в объеме 0,02 мл в подушечки правых лап. В коллантеральную лапу в качестве контроля вводили физиологический раствор в таком же объеме. Особи контрольной группы подвергались аналогичной процедуре без применения экстракта солянки лиственничнолистной. Через 24 часа определяли индекс воспаления (ИВ) по следующей формуле:
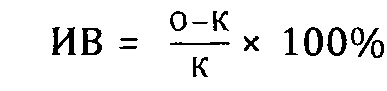 , где:
, где:
О - масса опытной лапы;
К - масса контрольной лапы.
Результаты представлены в таблице 18.

Из результатов видно, что применение экстракта вызывает индукцию ГЗТ, которая обусловлена инфильтрацией клетками воспалительного очага, а не сосудистой реакцией. Применение экстракта солянки лиственничнолистной вызывало сдвиг ИВ на 29,4%. Усиление ГЗТ указывает на способность экстракта стимулировать продукцию медиаторов клеточного ответа - лимфокинов.
При изучении динамики аутоиммунных розеткообразующих клеток обнаружено, что применение экстракта солянки лиственничнолистной кинетика ауто-РОК характеризовалась повышением как абсолютного, так и относительного количества розеткообразующих клеток. Максимальные значения показаний наблюдались на 10-15 сутки (см. таблицу 19).
Пример 13 (рост микроорганизмов в перколяторе при вынужденной остановке процесса)
Процесс проводят аналогично примеру 12. При первом сливе получают 22,86 кг экстракта (параметры см. таблицу 20). После загрузки II порции экстрагента процесс по внешним причинам останавливают и обогрев перколятора прекращают; через 14 дней включают обогрев, после прогрева перколятора и выдержки 6 часов экстракт сливают; при этом в перколяторе поднимается давление до 2,2 ата, слив сопровождается образованием пены, в конце сброс газа с неприятным запахом. Результаты анализа и тестирования представлены в таблице 20, из которой видно, что при вынужденной длительной задержке в процессе экстракции и при условии отсутствия в экстрагенте консервантов и стабилизаторов наблюдается рост микрофлоры.
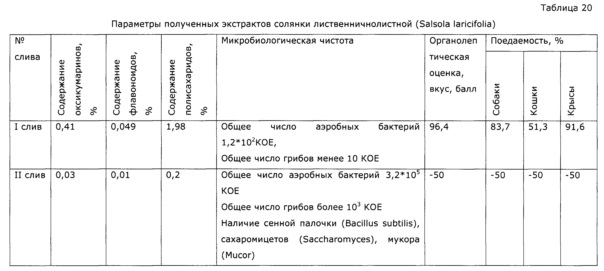
Пример 14 (смешанный стабилизатор, сравнение экономических показателей и активности с прототипом)
Для опыта используют траву солянки лиственничнолистной (Salsola laricifolia) со следующими параметрами:
1. Описание - резаная трава с жесткой структурой, зеленовато-желтоватые фрагменты размерами 4÷35×0,2÷1,6 мм;
2. Вкус - кисловатый, фруктовый;
3. Запах - специфический, приятный;
4. Влажность (высушиванием) 4,2%;
5. Зольность 7,6%;
6. Сумма оксикумаринов СФ-методом в пересчете на фраксетин 2,98%;
7. Сумма флавоноидов по окраске алюминиевого комплекса, СФ-методом, в пересчете на рутин 0,355%.
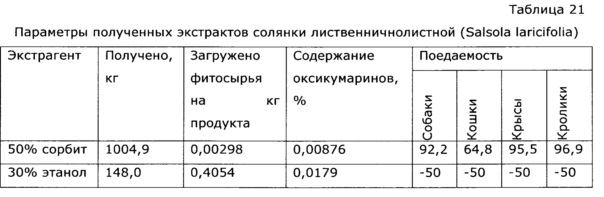
Аналогично примеру 12 в эмалированном реакторе объемом 63 л, снабженном якорной мешалкой, термогильзой, рубашкой для обогрева, готовят 50% раствор сорбита и нагревают до 80°С. В перколятор загружают 3 кг травы солянки лиственничнолистной (Salsola laricifolia) и ведут экстракцию многократно порциями по 100 л в течение 10 часов каждая процедура. В общей сложности процесс экстракции повторяют 10 раз, получаемый экстракт сливают в полимерную емкость объемом 1 м3, перемешивают при помощи циркуляционного насоса. Продолжая перемешивание, добавляют к суммарному экстракту 0,5 кг сорбата калия, 5 кг аскорбиновой кислоты и затем небольшими порциями лимонную кислоту, всего добавляют 2,4 кг лимонной кислоты. Всего получают 1004,9 кг экстракта со следующими параметрами:
1. Описание - раствор желтого цвета с приятным фруктовым запахом, приятного кислого вкуса;
2. рН 4,1;
3. Плотность 1,22 г/см3;
4. Содержание оксикумаринов в пересчете на фраксетин, СФ-методом 0,00876%.
На этой же схеме проводят экстракцию 30% раствором этанола согласно пат. MN2031. Для этого в перколятор с умеренным уплотнением загружают 60 кг сухой измельченной до частиц менее 0,5 мм травы солянки лиственничнолистной. Экстракцию ведут методом перколяции 30%-ным раствором этанола; при этом одна процедура эктсракции занимает 3 суток. В результате получают 156 л (ρ=0,952 г/см3), или 148 кг экстракта со следующими параметрами:
1. Плотность 0,952 г/см3;
2. Сумма оксикумаринов в пересчете на фраксетин СФ-методом 0,0112%;
3. Сухой остаток 1,1%.
Данные образцы тестируют на поедаемость разными видами животных и влиянию на неспецифическую резистентность к вирусу гриппа, аналогично примеру 1. Результаты приведены в таблице 21 и 22, из которых видно, что при сравнимой концентрации сигнальных компонентов сорбитовый экстракт заметно более активен как иммуномодулятор, при этом следует отметить, что в случае использования в качестве экстрагента водного раствора многоатомного спирта удельный расход фитосырья существенно ниже, чем при использовании раствора этанола, процесс более производителен и взрывобезопасен; к тому же в тесте «поедаемость» животные избегают образцов со спиртовым экстрактом.
Пример 15 (1,2-пропиленгликоль, 60°С)
В стеклянный реактор объемом 2000 мл помещают 1000 мл воды очищенной, 1000 г 1,2-пропиленгликоля, 10 г аскорбиновой кислоты и 5 г сорбата калия. Массу перемешивают и подогревают до 60°С. В горячий водно-пропиленгликолевый раствор загружают порциями резаную траву солянки лиственничнолистной, уплотняя по мере смачивания до общей загрузки 600 г. Экстракцию проводят при 60°С, отбирая каждый час пробу, в которой определяют спектрофотометрическим (СФ) методом содержание суммы оксикумаринов и гликозидов оксикумаринов в пересчете на фраксетин, до прекращения изменения их концентрации. Через 8 часов концентрация оксикумаринов перестает увеличиваться, процесс завершают. Экстракт самотеком выгружают из реактора на стеклянную воронку с пористой пластиной, фильтруют под вакуумом. Получают 1160 г темно-коричневого экстракта со следующими параметрами:
1. Описание. Темно-коричневый мутноватый относительно маловязкий сироп с характерным приятным фруктовым запахом, с небольшим осадком.
2. рН 4,2
3. Плотность 1,1 г/см3
4. Тяжелые металлы по ГФ XIII - менее 0,001%
5. Суммарное содержание флавоноидов СФ-методом (алюминиевый комплекс) в пересчете на рутин 0,14%
6. Суммарное содержание оксикумаринов и гликозидов оксикумаринов СФ методом в пересчете на фраксетин 0,92%
7. Содержание полисахаридов СФ методом 3,3%
8. Содержание аскорбиновой кислоты 0,77% (методом титрования)
9. Содержание сорбиновой кислоты 0,22% (методом ГЖХ)
10. Микробиологическая чистота:
- общее число аэробных бактерий - 1,1⋅102 КОЕ (норма - не более 104 КОЕ)
- общее число грибов - менее 10 КОЕ (норма - не более 102 КОЕ)
- Salmonella - отсутствует
- Escherichia coli - отсутствует
- энтеробактерии - отсутствуют
- St. Aureus – отсутствует.
После двух лет хранения образцов в естественных условиях, расфасованных в стеклянные бутылки по 100 мл, параметры экстракта следующие:
1. Описание. Темно-коричневый прозрачный относительно маловязкий сироп с характерным приятным фруктовым запахом, на дне флаконов тонкая темная пленка.
2. рН 4,3
3. Плотность 1,1 г/см3
4. Суммарное содержание флавоноидов СФ методом (алюминиевый комплекс) в пересчете на рутин 0,135%
5. Суммарное содержание оксикумаринов и гликозидов оксикумаринов СФ методом в пересчете на фраксетин 0,91%
6. Содержание полисахаридов СФ методом 3,29%
7. Содержание аскорбиновой кислоты 0,71% (методом титрования)
8. Содержание сорбиновой кислоты 0,18% (методом ГЖХ)
9. Микробиологическая чистота:
- общее число аэробных бактерий - менее 10 КОЕ
- общее число грибов - менее 10 КОЕ
- Salmonella - отсутствует
- энтеробактерии - отсутствуют
- St. Aureus – отсутствует.
Таким образом, полученный экстракт стабилен при хранении в естественных условиях в течение двух лет.
Пример 16 (экстракция 50% раствором сорбита при 90°С) В стеклянный реактор объемом 2000 мл помещают 600 г измельченной сухой травы солянки лиственничнолистной. Отдельно в стеклянном стакане при перемешивании и подогреве до 60-70°С (сорбит растворяется со значительным понижением температуры) растворяют 1 кг сорбита в 1 л воды. В горячий раствор сорбита вносят 5 г сорбата калия и 10 г аскорбиновой кислоты. Полученным раствором заливают траву в реакторе, массу подогревают при помощи термостата до 90°С и выдерживают при этой температуре в течение 6 часов, отбирая каждые полчаса пробы для определения содержания суммы оксикумаринов и гликозидов оксикумаринов. Через 4 часа концентрация оксикумаринов перестает увеличиваться. Экстракт сливают самотеком с реактора на стеклянную воронку с пористой пластиной, фильтруют под небольшим вакуумом. Получают 1726 г (1380 мл) экстракта со следующими параметрами:
1. Описание. Темный красно-бурый сироп с незначительным осадком, мутноватый, имеет характерный приятный фруктовый запах.
2. рН 3,9
3. Плотность 1,25 г/см3
4. Тяжелые металлы по ГФ XIII - менее 0,001%
5. Суммарное содержание флавоноидов спектрофотометрическим (СФ) методом (с алюминиевым комплексом) в пересчете на рутин 0,099%
6. Суммарное содержание оксикумаринов и гликозидов оксикумаринов СФ методом в пересчете на фраксетин 1,03%
7. Содержание оксикумаринов и гликозидов оксикумаринов (метод ВЭЖХ):
- фраксетин 0,44%
- фраксидин 0,023%
- изофраксидин 0,13%
- скополетин 0,08%
- фраксидин 8-о-β-D-глюкопиранозид 0,01%
- скополин 0,01%
- фраксин 0,06%
8. Содержание полисахаридов СФ методом 1,99%
9. Содержание аскорбиновой кислоты 0,91% (методом титрования)
10. Содержание сорбиновой кислоты 0,2% (методом ГЖХ)
11. Микробиологическая чистота:
- общее число аэробных бактерий - менее 10 КОЕ
- общее число грибов - менее 10 КОЕ
- Bacillus cereus - менее 10 КОЕ
- Salmonella - отсутствует
- Escherichia coli - отсутствует
12. Содержание ионов марганца 0,0001% (метод атомно-эмиссионной спектроскопии с индуктивно-связанной плазмой)
13. Содержание бора 0,0002% (метод атомно-эмиссионной спектроскопии с индуктивно-связанной плазмой)
14. Содержание флавоноидов (метод ВЭЖХ):
- рутин 0,026%
- кампферол 0,032%
- апигенин 0,009%.
После двух лет хранения образцов в естественных условиях параметры экстракта следующие:
1. Описание. Темный красно-бурый сироп, прозрачный, имеет характерный приятный фруктовый запах, на дне флаконов тонкая черная пленка - осадок.
2. рН 4,01
3. Плотность 1,25 г/см3
4. Суммарное содержание флавоноидов СФ методом (алюминиевый комплекс) в пересчете на рутин 0,095%
5. Суммарное содержание оксикумаринов и гликозидов оксикумаринов СФ методом в пересчете на фраксетин 1,025%
6. Содержание оксикумаринов и гликозидов оксикумаринов (метод ВЭЖХ):
- фраксетин 0,43%
- фраксидин 0,02%
- изофраксидин 0,13%
- скополетин 0,08%
- скополин 0,01%
- фраксин 0,06%
7. Содержание полисахаридов СФ методом 2,0%
8. Содержание аскорбиновой кислоты 0,82% (методом титрования)
9. Содержание сорбиновой кислоты 0,2% (методом ГЖХ)
10. Микробиологическая чистота:
- общее число аэробных бактерий - менее 10 КОЕ
- общее число грибов - менее 10 КОЕ
- Bacillus cereus - отсутствует
- Salmonella - отсутствует
- Escherichia coli – отсутствует.
Таким образом, полученный образец при хранении в течение двух лет практически не изменился по параметрам и остался пригоден для применения.
Пример 17 (1,2-пропиленгликоль 30%)
Опыт проводят аналогично примеру 16, но для приготовления экстрагента смешивают 300 г 1,2-пропиленгликоля, 5 г аскорбиновой кислоты и 2,5 г сорбата кальция, добавляют воду до 1 кг. Экстракцию проводят при 70°С, равновесная концентрация экстрактивных веществ в жидкой фазе достигается через 9,5 часов. Получают 715 г экстракта со следующими параметрами:
1. Описание. Темно-коричневый мутный сироп с характерным приятным фруктовым запахом, пенится, при стоянии образуется незначительный светлый осадок.
2. рН 4,2
3. Плотность 1,025 г/см3
4. Суммарное содержание флавоноидов СФ методом (по окраске алюминиевого комплекса) в пересчете на рутин 0,25%
5. Суммарное содержание оксикумаринов и гликозидов оксикумаринов СФ методом в пересчете на фраксетин 0,61%
6. Содержание полисахаридов СФ методом 2,88%
7. Микробиологическая чистота:
- общее число аэробных бактерий - 0,9⋅103 КОЕ (норма не более 104 КОЕ)
- общее число грибов - менее 1,8⋅10 КОЕ.
После двух лет хранения образца в естественных условиях в бутыли из темного стекла, параметры экстракта следующие:
1. Описание. Темный красно-коричневый прозрачный сироп с характерным приятным фруктовым запахом, с небольшим слоем светлого осадка на дне емкости.
2. рН 4,7
3. Плотность 1,05 г/см3
4. Суммарное содержание флавоноидов СФ методом (алюминиевый комплекс) в пересчете на рутин 0,16%
5. Суммарное содержание оксикумаринов и гликозидов оксикумаринов СФ методом в пересчете на фраксетин 0,33%
6. Содержание полисахаридов СФ методом 1,86%
7. Микробиологическая чистота:
- общее число аэробных бактерий - менее 10 КОЕ
- общее число грибов - менее 10 КОЕ.
Таким образом, использование экстрагента - 30% 1,2-пропиленгликоля в заявленных условиях позволяет получить экстракт требуемого качества и стабильный при хранении.
Пример 18 (сорбит + ксилит + эритрит, 80% раствор)
В стеклянный реактор объемом 2000 мл помещают 600 г резаной травы солянки лиственничнолистной. Отдельно в стеклянный термостойкий стакан, помещенный в баню с триэтиленгликолем и снабженный мешалкой, загружают 400 г воды очищенной. Включают мешалку и нагрев, при достижении температуры 90-95°С загружают 1 кг сорбита, 400 г ксилита и 200 г эритрита. Смесь перемешивают при нагреве до 100±5°С до полного растворения компонентов, добавляют 5 г сорбиновой кислоты и 15 г аскорбиновой кислоты. Горячий раствор осторожно сливают в реактор с резаной травой, помещенный в термостат с установленной температурой 90°С. Экстракцию проводят до прекращения роста концентрации суммы оксикумаринов в жидкой фазе, равновесное состояние устанавливается через 8 часов. Для проведения фильтрации стеклянную воронку с крупнопористой пластиной прогревают в сушильном шкафу при 100°С; в стеклянном стакане готовят 1 кг горячего раствора для промывки шрота, загружая 200 г очищенной воды, 100 г эритрита, 200 г ксилита и 500 г сорбита и подогревая смесь до 100°С.
Подогретую стеклянную воронку устанавливают на колбе Бунзена, в воронку быстро переносят содержимое реактора, фильтруют, реактор промывают приготовленным раствором, им же промывают уплотненный шрот и отжимают до прекращения стока экстракта. После фильтрации и охлаждения фильтрата до комнатной температуры получают 1899 г экстракта со следующими параметрами:
1. Описание - густой темно-коричневый прозрачный сироп, с приятным фруктовым запахом, с приятным кисло-сладким вкусом;
2. Плотность 1,26 г/см3
3. Вязкость 22850 сантипуаз;
4. рН 4,4 (рН 10% водного раствора 4,1);
5. Суммарное содержание флавоноидов СФ методом (по окраске алюминиевого комплекса) в пересчете на рутин 0,18%;
6. Суммарное содержание оксикумаринов и гликозидов оксикумаринов в пересчете на фраксетин 0,86%;
7. Содержание полисахаридов СФ-методом 2,77%;
8. Содержание аскорбиновой кислоты методом титрования 1,26%;
9. Микробиологическая чистота
- Общее число аэробных бактерий - менее 10 КОЕ;
- Общее число грибов - менее 10 КОЕ.
Образец расфасовывают в стеклянные бутылки темного стекла по 100 мл и хранят в естественных условиях в течение двух лет. После хранения параметры экстракта следующие:
1. Описание - густой темно-коричневый прозрачный сироп с приятным фруктовым запахом, с приятным кисловато-сладким вкусом. В отдельных флаконах на дне обнаруживаются единичные крупные кристаллы.
2. Плотность 1,26 г/см3;
3. Вязкость 21990 сантипуаз;
4. рН 4,5 (рН 10% водного раствора 4,2);
5. Суммарное содержание флавоноидов СФ методом (по окраске алюминиевого комплекса) в пересчете на рутин 0,17%;
6. Суммарное содержание оксикумаринов и гликозидов оксикумаринов в пересчете на фраксетин 0,82%;
7. Содержание полисахаридов СФ методом 2,78%;
8. Содержание аскорбиновой кислоты методом титрования 1,12%;
9. Микробиологическая чистота
- Общее число аэробных бактерий - менее 10 КОЕ;
- Общее число грибов - менее 10 КОЕ.
Таким образом, полученный экстракт при хранении в естественных условиях в течение двух лет стабилен. Выпавшие в отдельных флаконах единичные кристаллы ксилита не сказываются на потребительских свойствах сиропа.
Пример 19 (ксилит + 1,2-пропиленгликоль, стабилизаторы 0,1%, консерванты 0,01%)
В стеклянный реактор объемом 2000 мл, помещенный в термостат, загружают 600 г резаной травы солянки лиственничнолистной. В термостойкий стакан вносят 700 г ксилита, 700 г 1,2-пропиленгликоля, добавляют 2 г аскорбиновой кислоты и воду до 2 кг, смесь подогревают на водяной бане при перемешивании до полного растворения компонентов. Полученным раствором осторожно заливают траву в реакторе, массу подогревают до (80±5)°С и выдерживают при этой температуре, периодически определяя суммарное содержание оксикумаринов и гликозидов оксикумаринов, до прекращения роста их равновесной концентрации в жидкой фазе. Процесс экстракции в этих условиях занимает 8 часов. Массу вместе со шротом переносят на стеклянную воронку с крупнопористой фильтрующей пластиной и фильтруют под вакуумом, отжимая шрот до прекращения стока экстракта. Получают 1088 г экстракта. К экстракту, имеющему рН 4,6, добавляют 0,1 г сорбиновой кислоты и 0,1 г бензойной кислоты и перемешивают фторопластовым штоком. При этом рН понижается до 3,5 и экстракт немного светлеет. Параметры полученного экстракта следующие:
1. Описание. Темно-коричневый прозрачный сироп с характерным приятным фруктовым запахом.
2. рН 3,5
3. Плотность 1,22 г/см3
4. Суммарное содержание флавоноидов СФ методом (алюминиевый комплекс) в пересчете на рутин 0,22%
5. Суммарное содержание оксикумаринов и гликозидов оксикумаринов СФ методом в пересчете на фраксетин 0,59%
6. Содержание полисахаридов СФ методом 1,98%
7. Содержание аскорбиновой кислоты 0,11% (методом титрования)
8. Содержание сорбиновой кислоты 0,005% (методом ГЖХ)
9. Микробиологическая чистота:
- общее число аэробных бактерий - 5⋅102 КОЕ
- общее число грибов - 2,8⋅10 КОЕ.
Экстракт расфасовывают в стеклянные бутыли объемом по 100 мл и хранят в нормальных условиях два года. После хранения параметры экстракта следующие:
1. Описание. Темно-коричневый с красным оттенком сироп с характерным приятным фруктовым запахом, без осадка.
2. рН 3,8
3. Плотность 1,22 г/см3
4. Суммарное содержание флавоноидов СФ методом (алюминиевый комплекс) в пересчете на рутин 0,237%
5. Суммарное содержание оксикумаринов и гликозидов оксикумаринов СФ методом в пересчете на фраксетин 0,53%
6. Содержание полисахаридов СФ методом 1,95%
7. Содержание аскорбиновой кислоты 0,1% (методом титрования)
8. Микробиологическая чистота:
- общее число аэробных бактерий - 1,2⋅102 КОЕ
- общее число грибов -1,1⋅10 КОЕ.
Таким образом, содержание стабилизатора аскорбиновой кислоты 0,1% и консервантов сорбиновой и бензойной кислот 0,01% достаточно для стабилизации продукта.
Пример 20 (маннит, экстракт стабилен в течение трех лет)
В стеклянный реактор объемом 2000 мл помещают 600 г травы солянки лиственничнолистной. Отдельно в стеклянном стакане, снабженном мешалкой и водяной баней, растворяют при перемешивании и нагреве до (90-95)°С 1,2 кг маннита в 800 мл очищенной воды. В горячий раствор вносят 5 г сорбиновой кислоты, 5 г бензойной кислоты и 10 г аскорбиновой кислоты. Полученным горячим раствором заливают траву в реакторе. Реактор помещают в термостат с установленной температурой 90° и выдерживают до прекращения роста концентрации суммы оксикумаринов в жидкой фазе (4 часа). Массу быстро переносят на предварительно подогретую стеклянную воронку с крупнопористой пластиной и быстро фильтруют под вакуумом, избегая вспенивания фильтрата (что достигается регулированием уровня вакуума). Получают 1208 г (1210 мл) экстракта, который при охлаждении начинает кристаллизоваться. Экстракт выдерживают в течение суток, затем отфильтровывают выпавший осадок маннита (его используют в последующих опытах). Получают 585 г экстракта. Параметры полученного продукта следующие:
1. Описание. Темно-коричневый прозрачный сироп с характерным приятным фруктовым запахом, приятным кисловатым умеренно-сладким вкусом.
2. рН 4,1
3. Плотность 1,08 г/см3
4. Суммарное содержание флавоноидов СФ методом (алюминиевый комплекс) в пересчете на рутин 0,28%
5. Суммарное содержание оксикумаринов и гликозидов оксикумаринов СФ методом в пересчете на фраксетин 1,24%
6. Содержание оксикумаринов и гликозидов оксикумаринов (метод ВЭЖХ):
- фраксетин 0,538%
- фраксидин 0,0278%
- изофраксидин 0,162%
- скополетин 0,051%
- фраксидин 8-о-β-D-глюкопиранозид 0,018%
- скополин 0,016%
- фраксин 0,089%
7. Содержание полисахаридов СФ методом 3,8%
8. Содержание аскорбиновой кислоты 1,88% (методом титрования)
9. Микробиологическая чистота:
- общее число аэробных бактерий - 1,88⋅103 КОЕ (норма - не более 104)
- общее число грибов - 5,2⋅10 КОЕ.
Экстракт расфасовывают в стеклянные бутыли объемом 100 мл из темного стекла и хранят в естественных условиях два года. После хранения параметры экстракта следующие:
1. Описание. Темно-коричневый прозрачный сироп с характерным приятным фруктовым запахом, приятным кисловатым умеренно-сладким вкусом.
2. рН 4,2
3. Плотность 1,08 г/см3
4. Суммарное содержание флавоноидов СФ методом (алюминиевый комплекс) в пересчете на рутин 0,27%
5. Суммарное содержание оксикумаринов и гликозидов оксикумаринов СФ методом в пересчете на фраксетин 1,22%
6. Содержание полисахаридов СФ методом 3,7%
7. Содержание аскорбиновой кислоты 1,68% (методом титрования)
8. Микробиологическая чистота:
- общее число аэробных бактерий - менее 10 КОЕ
- общее число грибов - менее 10 КОЕ.
После хранения образцов в течение трех лет в естественных условиях параметры продукта следующие:
1. Описание. Темно-коричневый прозрачный сироп с характерным приятным фруктовым запахом, приятным кисловатым умеренно-сладким вкусом.
2. рН 4,2
3. Плотность 1,08 г/см3
4. Суммарное содержание флавоноидов СФ методом (алюминиевый комплекс) в пересчете на рутин 0,26%
5. Суммарное содержание оксикумаринов и гликозидов оксикумаринов СФ методом в пересчете на фраксетин 1,21%
6. Содержание полисахаридов СФ методом 3,68%
7. Содержание аскорбиновой кислоты 1,62% (методом титрования)
8. Микробиологическая чистота:
- общее число аэробных бактерий - менее 10 КОЕ
- общее число грибов - менее 10 КОЕ
9. Содержание в сиропе маннита 20,8% (метод ВЭЖХ с рефрактометрическим детектором).
Таким образом, продукт, полученный при экстракции травы солянки лиственничнолистной горячим насыщенным раствором маннита и последующим концентрированием вследствие кристаллизации избыточного полиола при охлаждении, стабилен при хранении в естественных условиях в течение 3 лет.
Пример 21 (инозитол 50%)
В стеклянный реактор объемом 2000 мл, помещенный в термостат с триэтиленгликолем, загружают 600 г резанной сухой травы солянки лиственничнолистной. Отдельно в стеклянном термостойком стакане, помещенном в баню и снабженном мешалкой, растворяют при перемешивании и нагреве до 100°С 1 кг инозитола (ЕР 7.0) в 1 кг воды очищенной. В горячий раствор вносят 10 г сорбиновой кислоты и 30 г аскорбиновой кислоты, перемешивают и сливают на траву в реактор. Экстракцию проводят при 90°С до прекращения роста концентрации суммы оксикумаринов и гликозидов оксикумаринов. Через 5 часов рост концентрации сигнальных компонентов прекращается. Сироп отфильтровывают от шрота при помощи стеклянного фильтра с крупнопористой пластиной. В результате опыта получают 1686 г экстракта со следующими параметрами:
1. Описание - темный красно-бурый умеренно вязкий сироп, с характерным приятным фруктовым запахом;
2. рН 3,6;
3. Плотность 1,19 г/см3;
4. Суммарное содержание флавоноидов СФ методом (по окраске алюминиевого комплекса) в пересчете на рутин 0,12%;
5. Суммарное содержание оксикумаринов и гликозидов оксикумаринов в пересчете на фраксетин 0,89%;
6. Содержание полисахаридов СФ методом 1,69%
7. Содержание аскорбиновой кислоты методом титрования 0,86%;
8. Микробиологическая чистота
- Общее число аэробных бактерий -1,8*102 КОЕ;
- Общее число грибов - 3,8*10 КОЕ.
После двух лет хранения образца в естественных условиях его параметры следующие:
1. Описание - темный красно-коричневый сироп с незначительным осадком с приятным фруктовым запахом;
2. рН 3,8;
3. Плотность 1,19 г/см3;
4. Суммарное содержание флавоноидов СФ методом (по окраске алюминиевого комплекса) в пересчете на рутин 0,11%;
5. Суммарное содержание оксикумаринов и гликозидов оксикумаринов в пересчете на фраксетин 0,86%;
6. Содержание полисахаридов СФ методом 1,66%;
7. Содержание аскорбиновой кислоты методом титрования 0,69%;
8. Микробиологическая чистота
- Общее число аэробных бактерий - менее 102 КОЕ;
- Общее число грибов - менее 10 КОЕ.
Таким образом, получаемый при использовании 50% водного раствора инозитола экстракт солянки листвиничнолистной стабилен при хранении в естественных условиях в течение двух лет. Использование обладающего витаминной и адаптогенной активностью многоатомного спирта инозитола может углубить клинический эффект препарата.
Пример 22 (глицерин 70%)
Опыт проводят аналогично примеру 15, но для приготовления экстрагента смешивают 1400 г сухого глицерина (хч), 22 г аскорбиновой кислоты, 10 г сорбата калия и 6 г бензоата натрия, добавляют 600 мл воды очищенной. Массу перемешивают и подогревают при помощи термостата до 90°С. Загружают порциями резаную траву солянки лиственничнолистной. Равновесная концентрация экстрактивных веществ в жидкой фазе достигается через 4 часа. Получают 1404 г (1180 мл) экстракта со следующими параметрами:
1. Описание. Мутный оранжево-коричневый сироп с характерным приятным фруктовым запахом.
2. рН 3,9
3. Плотность 1,19 г/см3
4. Тяжелые металлы по ГФ XIII - менее 0,001%
5. Суммарное содержание флавоноидов СФ методом (алюминиевый комплекс) в пересчете на рутин 0,16%
6. Суммарное содержание оксикумаринов и гликозидов оксикумаринов СФ методом в пересчете на фраксетин 0,68%
7. Содержание полисахаридов СФ методом 1,99%
8. Содержание аскорбиновой кислоты 1,17% (методом титрования)
9. Содержание сорбиновой кислоты 0,493% (методом ГЖХ)
10. Микробиологическая чистота:
- общее число аэробных бактерий - 1,5⋅102 КОЕ
- общее число грибов - 1,5⋅10 КОЕ
- Salmonella - отсутствует
- Escherichia coli - отсутствует
- энтеробактерии - отсутствуют
- St. Aureus – отсутствует.
Сироп расфасовывают в стеклянные бутыли по 1 л из темного стекла и хранят в естественных условиях два года. После хранения параметры экстракта следующие:
1. Описание. Прозрачный темно-коричневый экстракт с приятным запахом, на дне упаковки небольшое количество светлого осадка.
2. рН 4,2
3. Плотность 1,18 г/см3
4. Суммарное содержание флавоноидов СФ методом (алюминиевый комплекс) в пересчете на рутин 0,17%
5. Суммарное содержание оксикумаринов и гликозидов оксикумаринов СФ методом в пересчете на фраксетин 0,63%
6. Содержание полисахаридов СФ методом 1,91%
7. Содержание аскорбиновой кислоты 1,09% (методом титрования)
8. Содержание сорбиновой кислоты 0,46% (методом ГЖХ)
9. Микробиологическая чистота:
- общее число аэробных бактерий - 1,1⋅102 КОЕ
- общее число грибов - 2,2⋅10 КОЕ
- Escherichia coli - отсутствует
- Salmonella - отсутствует
- энтеробактерии - отсутствуют
- St. Aureus – отсутствует.
Таким образом, полученный экстракт при хранении в течение двух лет стабилен.
Пример 23 (Дульцит + глицерин, 50% раствор)
Экстракцию проводят аналогично опыту 21, но для приготовления экстрагента смешивают 1 кг воды очищенной, 240 г глицерина, 760 г дульцита, 4 г сорбиновой кислоты, 1 г бензоата кальция и 30 г аскорбиновой кислоты. Экстракцию проводят при 90°С, рост концентрации суммы оксикумаринов и гликозидов оксикумаринов прекращается через 9 часов после начала экстракции. Фильтрат выдерживают при естественных условиях в течение 5 суток, при этом часть дульцита выкристаллизовывается. Образовавшуюся суспензию фильтруют, получают 1210 г экстракта. Параметры продукта следующие:
1. Описание - прозрачный темно-бурый, не очень вязкий сироп, с характерным приятным фруктовым запахом, кисло-сладкого вкуса;
2. Плотность 1,08 г/см3;
3. рН 3,9;
4. Суммарное содержание флавоноидов СФ методом (по окраске алюминиевого комплекса) в пересчете на рутин 0,19%;
5. Суммарное содержание оксикумаринов и гликозидов оксикумаринов в пересчете на фраксетин 0,64%;
6. Содержание дубильных веществ в пересчете на танин 1,51%;
7. Содержание полифенольных соединений - 1,06%;
8. Содержание четвертичных аммонийных оснований (бетаинов) в пересчете на глицинбетаин - 0,0178%;
9. Содержание полисахаридов СФ методом 2,19%;
10. Содержание аскорбиновой кислоты методом титрования 1,24%;
11. Микробиологическая чистота
- Общее число аэробных бактерий -2,8*102 КОЕ;
- Общее число грибов - 5,2*10 КОЕ.
После двух лет хранения в естественных условиях экстракт имеет следующие параметры:
1. Описание - прозрачный темно-бурый умеренно вязкий сироп, с характерным приятным фруктовым запахом, приятным кисло-сладким вкусом;
2. Плотность 1,08 г/см3;
3. рН 4,1;
4. Суммарное содержание флавоноидов СФ методом (по окраске алюминиевого комплекса) в пересчете на рутин 0,175%;
5. Суммарное содержание оксикумаринов и гликозидов оксикумаринов в пересчете на фраксетин 0,625%;
6. Содержание дубильных веществ в пересчете на танин 1,49%;
7. Содержание полифенольных соединений 1,11%;
8. Содержание четвертичных аммонийных оснований (бетаинов) в пересчете на глицинбетаин 0,0112%;
9. Содержание полисахаридов СФ методом 2,17%
10. Содержание аскорбиновой кислоты методом титрования 0,98%;
11. Микробиологическая чистота
- Общее число аэробных бактерий - менее 10 КОЕ;
- Общее число грибов - менее 10 КОЕ.
Таким образом, полученный сироп стабилен при хранении в естественных условиях в течение двух лет.
Пример 24 (ксилит 50%)
Опыт проводят аналогично примеру 16, но при приготовлении экстрагента используют вместо сорбита ксилит в том же количестве. Получают 1330 мл экстракта, который после охлаждения до комнатной температуры и выдержки в течение суток частично кристаллизуется. Кристаллы отфильтровывают на фильтре с пористой стеклянной пластиной, отжимая до прекращения стекания экстракта. Получают 320 г очень крупных кристаллов, почти не содержащих экстрактивных веществ солянки лиственничнолистной и являющихся по результатам анализа ксилитом. В результате опыта получают 1380 г (1140 мл) экстракта. Параметры полученного продукта следующие:
1. Описание. Очень темный красно-бурый сироп, мутноватый, с приятным фруктовым запахом.
2. рН 4,1
3. Плотность 1,21 г/см3
4. Тяжелые металлы по ГФ XIII - менее 0,001%
5. Суммарное содержание флавоноидов СФ методом (алюминиевый комплекс) в пересчете на рутин 0,18%
6. Суммарное содержание оксикумаринов и гликозидов оксикумаринов СФ методом в пересчете на фраксетин 1,12%
7. Содержание оксикумаринов и гликозидов оксикумаринов (метод ВЭЖХ):
- фраксетин 0,482%
- фраксидин 0,0251%
- изофраксидин 0,144%
- скополетин 0,084%
- фраксидин 8-о-β-О-глюкопиранозид 0,0106%
- скополин 0,0115%
- фраксин 0,065%
8. Содержание полисахаридов СФ методом 2,2%
9. Содержание аскорбиновой кислоты 0,918% (методом титрования)
10. Содержание сорбиновой кислоты 0,22% (методом ГЖХ)
11. Содержание флавоноидов (метод ВЭЖХ):
- рутин 0,047%
- кампферол 0,059%
- апигенин 0,016%
15. Содержание ионов марганца 0,00012% (метод атомно-эмиссионной спектроскопии с индуктивно-связанной плазмой)
12. Содержание бора 0,00022% (метод атомно-эмиссионной спектроскопии с индуктивно-связанной плазмой)
13. Микробиологическая чистота:
- общее число аэробных бактерий - менее 10 КОЕ
- общее число грибов - менее 10 КОЕ
- Bacillus cereus - отсутствует
- Salmonella - отсутствует
- Escherichia coli – отсутствует.
После двух лет хранения образцов в естественных условиях параметры экстракта следующие:
1. Описание. Темный красно-бурый сироп, прозрачный, имеет характерный приятный запах (фруктовый), на дне флаконов тонкая черная пленка - осадок.
2. рН 4,2
3. Плотность 1,21 г/см3
4. Суммарное содержание флавоноидов СФ методом (алюминиевый комплекс) в пересчете на рутин 0,16%
5. Суммарное содержание оксикумаринов и гликозидов оксикумаринов СФ методом в пересчете на фраксетин 1,08%
6. Содержание полисахаридов СФ методом 2,2%
7. Содержание аскорбиновой кислоты 0,91% (методом титрования)
8. Содержание сорбиновой кислоты 0,21% (методом ГЖХ)
9. Микробиологическая чистота:
- общее число аэробных бактерий - менее 10 КОЕ
- общее число грибов - менее 10 КОЕ
- Bacillus cereus - отсутствует
- Salmonella - отсутствует
- Escherichia coli – отсутствует.
Таким образом, полученный образец стабилен при хранении в течение двух лет. Выкристаллизовавшийся при получении экстракта ксилит используется без дополнительной обработки в последующих опытах.
Пример 25 (эритрит, консерванты менее 0,01%)
Опыт проводят аналогично примеру 16, но в качестве многоатомного спирта при приготовлении экстрагента используют эритрит в том же количестве, а сорбата калия загружают 0,1 г. Получают 1439,9 г (1210 мл) экстракта. Параметры экстракта следующие:
1. Описание. Темно-коричневый с красным оттенком мутноватый пенящийся сироп с приятным характерным фруктовым запахом.
2. рН 4,2
3. Плотность 1,19 г/см3
4. Тяжелые металлы по ГФ XIII - менее 0,001%
5. Суммарное содержание флавоноидов СФ методом (алюминиевый комплекс) в пересчете на рутин 0,16%
6. Суммарное содержание оксикумаринов и гликозидов оксикумаринов СФ методом в пересчете на фраксетин 0,89%
7. Содержание полисахаридов СФ методом 2,8%
8. Содержание аскорбиновой кислоты 0,89% (методом титрования)
9. Содержание сорбиновой кислоты 0,005% (методом ГЖХ)
10. Микробиологическая чистота:
- общее число аэробных бактерий в 1 мл - 2⋅102 КОЕ
- общее число грибов в 1 мл - менее 10 КОЕ
- Bacillus cereus в 1 мл - отсутствует
- Salmonella в 10 мл - отсутствует
- Escherichia coli в 1 мл - отсутствует
- энтеробактерии в 1 мл - менее 10 (норма - не более 102)
- St. Aureus в 1 мл - отсутствует.
Экстракт расфасовывают в стеклянные бутыли темного стекла по 100 мл. После полугода хранения образцов в естественных условиях опыт прекращен из-за явной порчи образца. Его параметры следующие:
1. Описание. Мутный темно-коричневый прозрачный сироп с неприятным затхлым запахом, кислого вкуса.
2. рН 3,5
3. Суммарное содержание флавоноидов СФ методом (алюминиевый комплекс) в пересчете на рутин - не обнаруживаются;
4. Суммарное содержание оксикумаринов и гликозидов оксикумаринов СФ методом в пересчете на фраксетин 0,26%;
5. Содержание полисахаридов СФ методом 0,5%
6. Содержание аскорбиновой кислоты 0,15% (методом титрования)
7. Микробиологическая чистота:
- аэробные бактерии 105 КОЕ;
- грибы 5⋅102 КОЕ.
Таким образом, полученный эритритный экстракт солянки лиственничнолистной, содержащий консервантов менее 0,01%, не стабилен при хранении.
Пример 26 (Промышленное получение экстракта солянки лиственничнолистной)
Для процесса используют эмалированный перколятор с рабочим объемом 200 л, снабженный рубашкой для обогрева, термогильзой и грибковым вентилем на нижнем спуске, и эмалированный реактор с якорной мешалкой, имеющий рубашку для обогрева, термогильзу с термодатчиком и нижний спуск с грибковым вентилем.
Для экстракции используют резаную сухую траву солянки лиственничнолистной, соответствующую монгольскому стандарту MNS-4403-05. Параметры взятого на экстракцию материала следующие:
1. Описание - резаная трава с жесткой структурой, зеленовато-желтоватые серые фрагменты размерами 8-25 мм × 0,2-1,3 мм;
2. Запах - специфический, приятный;
3. Вкус - кисловатый;
4. Влажность (высушиванием) - 5,2%;
5. Примеси органических посторонних веществ - 0,16%;
6. Примеси минеральные (песок, порода) - 0,4% (примеси нерастворимые в 10% соляной кислоте);
7. Части, загнившие или поврежденные грибками - 0,22%;
8. Зольность - 8,4%;
9. Сумма оксикумаринов, СФ методом в пересчете на фраксетин 0,96%;
10. Вещества, экстрагируемые водой - 9,0%;
11. Массовая доля дубильных веществ в пересчете на танин по индигосульфокислоте 3,49%;
12. Массовая доля полифенольных соединений 2,83%;
13. Тяжелые металлы по ГФ XIII - менее 0,001%;
14. Микробиологическая чистота:
- аэробные бактерии 7*102 КОЕ;
- грибы 6*10 КОЕ;
- Escherichia coli - отсутствует;
- Pseudomonas spp - отсутствует;
- Salmonella - отсутствует;
- Staphylococcus - отсутствует;
- Enteobacteraceae - отсутствует.
55 кг резаной сухой травы солянки лиственничнолистной загружают в перколятор. В эмалированный реактор загружают 92,5 кг воды очищенной. Включают мешалку и циркуляцию теплоносителя в рубашке для нагрева. При достижении 30°С в массе через люк загружают 35 кг 1,2-пропиленгликоля (фармакопейного), затем порциями 80 кг сорбита. После полного растворения сорбита загружают 32,5 кг ксилита, затем стабилизаторы и консерванты - 7,31 кг аскорбиновой кислоты, 2,72 кг бензилового спирта, 0,47 кг сорбата калия. Все компоненты перемешивают при подогреве до 90°С и полного растворения.
100 кг экстрагента сливают через нижний спуск реактора и переносят в перколятор. Устанавливают температуру теплоносителя 85°С, началом экстракции считают момент достижения в массе температуры 80°С. Периодически из массы отбирают пробу и определяют содержание суммы оксикумаринов в пересчете на фраксетин. Концентрация сигнального компонента медленно увеличивается и через 8 часов перестает расти, что считают окончанием процесса. Горячий экстракт через фильтрующее поле сливают в приемную емкость, получают 25,47 кг экстракта со следующими параметрами:
1. Описание - густой темно-коричневый, почти черный сироп с характерным приятным запахом;
2. Плотность - 1,21 г/см3;
3. рН 4,2;
4. Суммарное содержание флавоноидов СФ методом (по окраске аллюминиевого комплекса) в пересчете на рутин - 0,189%;
5. Суммарное содержание оксикумаринов и гликозидов оксикумаринов СФ методом в пересчете на фраксетин - 0,633%;
6. Содержание дубильных веществ в пересчете на танин 1,44%;
7. Содержание полифенольных соединений 1,02%;
8. Содержание четвертичных аммонийных оснований (бетаинов) в пересчете на глицинбетаин 0,0162%;
9. Содержание полисахаридов СФ методом 2,62%;
10. Содержание аскорбиновой кислоты методом титрования 2,33%;
11. Содержание сорбиновой кислоты методом ГЖХ 0,17%;
12. Содержание бензилового спирта методом ГЖХ 1,06%;
13. Содержание 1,2-пропиленгликоля методом ГЖХ 13,8%;
14. Микробиологическая чистота:
- аэробные бактерии 9,9*102 КОЕ;
- грибы 9,3*10 КОЕ;
- Escherichia coli - отсутствует;
- Pseudomonas spp - отсутствует;
- Salmonella - отсутствует;
- Staphylococcus - отсутствует;
- Enteobacteraceae - отсутствует.
К оставшемуся в перколяторе влажному шроту загружают 75 кг экстрагента из реактора и повторяют процесс аналогично вышеизложенному. Прекращение роста концентрации сигнального компонента обнаруживается через 12 часов, что считают окончанием процесса экстракции. Экстракт аналогично описанному выше сливают, получают 59,70 кг сиропа со следующими параметрами:
1. Описание - густой темно-красный сироп с характерным приятным фруктовым запахом;
2. Плотность - 1,22 г/см3;
3. рН 3,9;
4. Суммарное содержание флаваноидов СФ методом (по окраске аллюминиевого комплекса) в пересчете на рутин - 0,172%;
5. Суммарное содержание оксикумаринов и гликозидов оксикумаринов СФ методом в пересчете на фраксетин - 0,575%;
6. Содержание дубильных веществ в пересчете на танин 1,32%;
7. Содержание полифенольных соединений 0,926%;
8. Содержание четвертичных аммонийных оснований (бетаинов) в пересчете на глицинбетаин 0,0259%;
9. Содержание полисахаридов СФ-методом 2,38%;
10. Содержание аскорбиновой кислоты методом титрования 2,91%;
11. Содержание сорбиновой кислоты методом ГЖХ 0,19%;
12. Содержание бензилового спирта методом ГЖХ 1,09%;
13. Содержание 1,2-пропиленгликоля методом ГЖХ 14,1%;
14. Микробиологическая чистота:
- аэробные бактерии 1,2*10 КОЕ;
- грибы 1,1*10 КОЕ;
К шроту снова загружают 75 кг экстрагента из реактора и повторяют экстракцию. Равновесная концентрация сигнального компонента достигается через 16 часов, после чего экстракт сливают. Получают 61,80 кг сиропа со следующими параметрами:
1. Описание - темно-красный сироп с характерным приятным фруктовым вкусом;
2. Плотность - 1,23 г/см3;
3. рН 3,8;
4. Суммарное содержание флавоноидов СФ методом (по окраске алюминиевого комплекса) в пересчете на рутин - 0,11%;
5. Суммарное содержание оксикумаринов и гликозидов оксикумаринов СФ методом в пересчете на фраксетин - 0,337%;
6. Содержание дубильных веществ в пересчете на танин - 0,857%;
7. Содержание полифенольных соединений 0,61%;
8. Содержание четвертичных аммонийных оснований (бетаинов) в пересчете на глицинбетаин 0,0096;
9. Содержание полисахаридов СФ-методом 1,56%;
10. Содержание аскорбиновой кислоты методом титрования 2,35%;
11. Содержание сорбиновой кислоты методом ГЖХ 0,175%;
12. Содержание бензилового спирта методом ГЖХ 1,05%;
13. Содержание 1,2-пропиленгликоля методом ГЖХ 13,75%;
14. Микробиологическая чистота:
- аэробные бактерии - менее 10 КОЕ;
- грибы - менее 10 КОЕ.
Таким образом, в результате экстракции получают 146,97 кг экстракта с суммой оксикумаринов в пересчете на фраксетин более 0,3% (0,337-0,633%), пригодного для получения медицинских препаратов, биологически активных добавок и препаратов ветеринарного назначения. После экстракции остается влажный шрот в количестве 158,03 кг, содержащий в среднем около 20% сорбита, около 9% ксилита, более 2% аскорбиновой кислоты и ряд других полезных для организма животных компонентов - антиоксиданты, полисахариды, витамины, что позволяет предполагать возможность его использования в качестве кормовой добавки в животноводстве.
Пример 27 (Стандартизация сиропов)
В эмалированный реактор с якорной мешалкой, снабженный рубашкой, термогильзой с термодатчиком, нижним спуском с грибковым вентилем, загружают 100 кг воды очищенной. При включенной мешалке и подаче нагретого теплоносителя в рубашку аппарата через люк порциями загружают 100 кг пищевого сорбита. После полного растворения и нагрева раствора до 80°С в реактор догружают 0,5 кг сорбата калия и 1,5 кг аскорбиновой кислоты. Раствор перемешивают до полного растворения компонентов, после чего сливают в полимерную емкость.
В реактор загружают продукты, полученные в опыте 26:
1. 25,47 кг сиропа с содержанием суммы оксикумаринов 0,633% в пересчете на фраксетин;
2. 59,70 кг сиропа с содержанием суммы оксикумаринов 0,575%;
3. 61,80 кг сиропа с содержанием суммы оксикумаринов 0,337%.
Затем в реактор загружают 90 кг раствора из полимерной емкости, перемешивают 30 минут при 60°С и сливают в полимерную тару. Получают 237 кг стандартизированного сиропа со следующими параметрами:
1. Описание - темный коричнево-бордовый прозрачный сироп с приятным фруктовым запахом;
2. Плотность - 1,23 г/см3;
3. рН 3,7;
4. Суммарное содержание флавоноидов СФ методом (по окраске алюминиевого комплекса) в пересчете на рутин - 0,092%;
5. Суммарное содержание оксикумаринов и гликозидов оксикумаринов СФ методом в пересчете на фраксетин 0,30%;
6. Содержание дубильных веществ в пересчете на танин 0,71%;
7. Содержание полифенольных соединений 0,502%;
8. Содержание четвертичных аммонийных соединений (бетаинов) в пересчете на глицинбетаин 0,0082%;
9. Содержание полисахаридов СФ-методом 1,18%;
10. Содержание аскорбиновой кислоты методом титрования 1,88%;
11. Микробиологическая чистота:
- количество аэробных бактерий 1,3*102 КОЕ;
- количество грибов 3,3*10 КОЕ.
Параметры образца после хранения в естественных условиях в полимерной таре в течение двух лет следующие:
1. Описание - темный коричнево-бардовый прозрачный сироп с приятным фруктовым запахом;
2. Плотность - 1,23 г/см3;
3. рН 3,8;
4. Суммарное содержание флавоноидов СФ методом (по окраске алюминиевого комплекса) в пересчете на рутин - 0,091%;
5. Суммарное содержание оксикумаринов и гликозидов оксикумаринов СФ-методом в пересчете на фраксетин 0,30%;
6. Содержание дубильных веществ в пересчете на танин 0,72%;
7. Содержание полифенольных соединений 0,50%;
8. Содержание четвертичных аммонийных соединений (бетаинов) в пересчете на глицинбетаин 0,0078%;
9. Содержание полисахаридов СФ-методом 1,19%;
10. Содержание аскорбиновой кислоты методом титрования 1,74%;
11. Микробиологическая чистота:
- количество аэробных бактерий менее 10 КОЕ;
- количество грибов менее 10 КОЕ.
Таким образом, удобный для практического использования (производство медицинских и ветеринарных препаратов, производство БАД) стандартизированный по сигнальным компонентам экстракт стабилен при хранении в естественных условиях в полимерной таре в течение двух лет. Аналогичным образом могут быть стандартизованы экстракты по примерам 15-25, что обеспечивает их практическое использование.
Пример 28 (Получение лекарственного препарата для медицинского использования)
В реакторе аналогично примеру 27 готовят 150 кг стабилизированного раствора сорбита (50%-ного), затем при включенной мешалке добавляют 30 кг стандартизированного экстракта (по примеру 27). Компоненты перемешивают в течение часа, сливают в полимерную бочку и передают на фасовку. Фасовку проводят в стеклянные бутылки темного стекла по 100 мл. Параметры продукта следующие:
1. Описание - красновато-коричневый сироп с приятным характерным фруктовым запахом, кисловато-сладкого вкуса;
2. Плотность - 1,23 г/см3;
3. рН 3,7;
4. Суммарное содержание оксикумаринов и гликозидов оксикумаринов СФ методом в пересчете на фраксетин 0,05%;
5. Содержание полисахаридов СФ методом 0,20%;
6. Содержание аскорбиновой кислоты методом титрования 0,78%;
7. Микробиологическая чистота:
- количество аэробных бактерий менее 10 КОЕ;
- количество грибов менее 10 КОЕ.
После хранения образцов в естественных условиях в течение двух лет их параметры следующие:
1. Описание - красновато-коричневый сироп, прозрачный, с приятным характерным запахом фруктов, кисловато-сладкого вкуса с привкусом фруктового компота;
2. Плотность - 1,23 г/см3;
3. рН 3,8;
4. Суммарное содержание оксикумаринов и гликозидов оксикумаринов СФ методом в пересчете на фраксетин 0,05%;
5. Содержание полисахаридов СФ методом 0,19%;
6. Содержание аскорбиновой кислоты методом титрования 0,73%;
7. Микробиологическая чистота:
- количество аэробных бактерий менее 10 КОЕ;
- количество грибов менее 10 КОЕ.
Таким образом, экстракт солянки лиственничнолистной для медицинского применения с содержанием сигнального компонента 0,05%, стабилен при хранении в естественных условиях в течение двух лет. Данный продукт использовали в исследованиях острой токсичности медицинского препарата, профилактики и лечения пневмонии (см. пример 41, 43, 44).
Пример 29 (Получение ветеринарного препарата)
В реактор загружают 187,9 кг воды очищенной, при включенной мешалке загружают 10 кг сорбита, 100 г аскорбиновой кислоты и 20 г сорбата калия, затем 2 кг экстракта по примеру 27. Массу перемешивают 30 минут и сливают в полимерную тару, затем передают на фасовку. Фасуют во флаконы по 100 мл из темной прозрачной пластмассы, на каждый флакон наклеивают этикетку. Параметры продукта:
1. Описание - раствор желтого цвета;
2. рН 4,8;
3. Плотность при 20°С 1,039 г/см3;
4. Содержание суммы оксикумаринов СФ методом в пересчете на фраксетин - 0,003%;
5. Содержание полисахаридов СФ методом 0,012%.
Данный продукт использован для ветеринарных клинических исследований (см. пример 42, 45-54).
Пример 30 (соотношение сухая трава - экстрагент 0,003:1)
В эмалированный реактор загружают 100 кг воды очищенной, включают мешалку, подачу теплоносителя в рубашку аппарата и ведут нагрев до 80°С; в процессе нагревания при 40-50°С загружают 10 кг ксилита, 200 г аскорбиновой кислоты, 20 г сорбата калия и 90 кг 1,2-пропиленгликоля, при 60°С загружают 0,6 кг травы солянки лиственничнолистной с содержанием суммы оксикумаринов в пересчете на фраксетин 0,99%. После достижения в массе температуры 80°С процесс экстракции ведут до установления постоянной концентрации сигнальных компонентов в жидкой фазе, через 2,5 часа концентрация сигнальных компонентов выходит на стабильный уровень - 0,0028%. Экстракцию на этом считают завершенной. Горячий экстракт фильтруют от шрота на друк-фильтре, охлаждают при перемешивании и расфасовывают в полимерные бутылки емкостью по 100 мл из темного пластика. Получают 1785 упаковок. Параметры продукта на момент фасовки следующие:
1. Описание - раствор желтого цвета с приятным фруктовым запахом;
2. рН 4,5;
3. Плотность при 20°С 1,12 г/см3;
4. Суммарное содержание оксикумаринов и гликозидов оксикумаринов СФ методом в пересчете на фраксетин 0,0028%;
5. Содержание полисахаридов СФ методом 0,0128%.
После двух лет хранения образцов в естественных условиях параметры сиропа следующие:
1. Описание - раствор желтого цвета с приятным фруктовым запахом;
2. рН 4,4;
3. Плотность - 1,13 г/см3;
4. Суммарное содержание оксикумаринов и гликозидов оксикумаринов СФ методом в пересчете на фраксетин 0,0029%;
5. Содержание полисахаридов СФ методом 0,013%.
Таким образом, продукт для ветеринарного применения, полученный прямой экстракцией, стабилен при хранении в нормальных условиях в течение двух лет. Однако энергозатраты при экстракции на единицу продукции на два порядка выше, чем при получении концентрированного экстракта с последующим разбавлением до необходимого уровня концентрации суммы оксикумаринов.
Пример 31 (по прототипу)
В н/ст реактор загружают 18,75 л этилового спирта с концентрацией 96,0%, и добавляют очищенную воду до 54,7 л.
Измельчают стебли и листья солянки лиственичнолистной (Salsola laricifolia) на режущей мельнице до частиц менее 0,5 мм. 12 кг измельченной травы загружают в мацерационный бак, и смачивают 12 л разбавленного спирта для набухания, выдерживают 4 часа. Набухшее сырье переносят в перколятор, догружают 16 л разбавленного спирта и настаивают при частом взбалтывании 3 суток. После этого медленно перколируют, после слива снова добавляют в перколятор 26 л разбавленного спирта и настаивают 3 суток, затем сливы с двух перколяций смешивают и выдерживают в прохладном месте 24 часа, затем фильтруют. Фильтрат анализируют, фасуют в бутыли темного стекла по 50 мл. В целом получают 30 л экстракта (600 флаконов по 50 мл) со следующими параметрами:
1. Сумма оксикумаринов СФ методом 0,0179%;
2. Содержание этанола 31,0%;
3. Сухой остаток 1,25%.
Данный продукт полученный в соответствии с MN2031 (монгольский патент) использован в сравнительных опытах (см. пример 43, 44).
Пример 32 (водный экстракт)
В стеклянный реактор, помещенный в баню термостата, помещают 2 л воды очищенной, 5 г аскорбиновой кислоты и 2,5 г сорбата калия. Включают термостат, нагревают баню и содержимое реактора до 90°С. В горячий экстрагент порциями, по мере наполнения, загружают в течение часа 600 г резаной травы солянки лиственничнолистной. Процесс экстракции проводят, периодически определяя содержание суммы оксикумаринов и гликозидов оксикумаринов; их концентрация медленно растет и через 24 часа останавливается на уровне 0,055%. Горячий экстракт сливают и фильтруют через стеклянный фильтр с крупнопористой пластиной. Получают 1180 г водного экстракта, после остывания имеющего следующие параметры:
1. Описание - темно-коричневый маловязкий экстракт кисловатого вкуса с приятным фруктовым запахом;
2. Плотность - 1,0 г/см3;
3. рН 4,4;
4. Суммарное содержание оксикумаринов и гликозидов оксикумаринов СФ методом в пересчете на фраксетин 0,055%;
5. Содержание отдельных оксикумаринов и гликозидов оксикумаринов методом ВЭЖХ:
- фраксидин 0,00047%;
- изофраксетин 0,00347%;
- скополетин 0,00121%;
- фраксетин 0,0184%;
- скополин 0,0070%;
- фраксин 0,00357%;
- фраксидин 8-о-β-D-глюкопиразонид 0,0007%;
6. Содержание полисахаридов СФ методом 1,92%;
7. Содержание аскорбиновой кислоты 0,24% (методом титрования);
8. Микробиологическая чистота:
- аэробные бактерии 8,2*103 КОЕ;
- грибы 9,1*10 КОЕ.
Через 3 месяца опыт прекращен из-за явной порчи образца.
Его параметры:
1. Описание - мутная жидкость темного цвета, кислого вкуса, с неприятным тухлым запахом, на поверхности слизистая пленка;
2. рН 3,8;
3. Суммарное содержание оксикумаринов СФ методом в пересчете на фраксетин - не обнаруживается;
4. Содержание аскорбиновой кислоты - не обнаруживается;
5. Микробиологическая чистота:
- аэробные бактерии - сплошной рост;
- грибы - сплошной рост.
Таким образом, водный экстракт солянки лиственничнолистной, несмотря на присутствие консервантов и стабилизаторов, не стабилен при хранении. При экстракции водой извлекаемые количества биологически активных компонентов существенно меньше, чем в условиях, предложенных согласно изобретению, что связано, по всей видимости, с сохранением структуры мембраны растительных клеток в чисто водной среде, что и препятствует экстракции.
Пример 33 (Получение биологически активной добавки для применения у человека)
В эмалированный реактор объемом 1 м3, снабженный якорной мешалкой, загружают при перемешивании 950 л воды очищенной, 45 кг стандартизованного экстракта (по примеру 27), 5 кг аскорбиновой кислоты, 500 г сорбата калия, 50,0 г сорбата кальция, 10 г бензоата натрия. Перемешивают, в течение часа, карбонизируют и фасуют в полиэтилентерифталатные емкости для пищевых продуктов из темного пластика объемом 0,5 л. Получают 2000 единиц упакованного продукта, с параметрами на момент фасовки:
1. Описание - желтый с коричневатым оттенком раствор с приятным запахом, кисло-сладкого вкуса
2. Плотность при 20°С 1,041 г/см3
3. рН 4,2
4. Суммарное содержание оксикумаринов и гликозидов оксикумаринов СФ-методом 0,0125%
5. Содержание полисахаридов СФ-методом 0,055%
6. Содержание аскорбиновой кислоты методом титрования 0,52%
7. Микробиологическая чистота
- Количество аэробных бактерий 110 КОЕ
- Количество грибов менее 10 КОЕ.
После хранения продукта в течение 3 лет параметры следующие:
1. Описание - желтый с коричневым оттенком раствор с приятным фруктовым запахом, кисло-сладкого вкуса, на дне упаковок обнаруживается тонкая темная пленка
2. Плотность при 20°С 1,039 г/см3
3. рН 4,3
4. Суммарное содержание оксикумаринов СФ методом 0,011%
5. Содержание полисахаридов СФ-методом 0,045%
6. Содержание аскорбиновой кислоты методом титрования 0,44%
7. Микробиологическая чистота
- Количество аэробных бактерий менее 100 КОЕ
- Количество грибов менее 10 КОЕ.
Пример 34 (получение ветеринарного препарата для продуктивных животных)
В эмалированный реактор объемом 0,5 м3, снабженный якорной мешалкой, через мерник загружают 395 л воды очищенной, при включенной мешалке через люк загружают 1 кг аскорбиновой кислоты, 20 г сорбата калия и 40 г бензоата натрия, затем из переносной емкости 4 кг экстракта по примеру 27. Массу перемешивают 30 минут и передают на фасовку. Фасуют в п/э канистры объемом 5 л, получают 80 канистр продукта со следующими параметрами на момент фасовки:
1. Описание - раствор желтого цвета с приятным запахом, кисловатого вкуса
2. рН 4,9
3. Плотность при 20°С 1,011 г/см3
4. Содержание оксикумаринов СФ методом в пересчете на фраксетин 0,003%
5. Содержание полисахаридов СФ методом 0,011%.
После 2 лет хранения продукта в указанной таре параметры продукта следующие:
1. Описание - раствор желтого цвета с характерным запахом, кисловатого вкуса, на дне канистр незначительная темная пленка
2. рН 4,9
3. Плотность при 20°С 1,010 г/см3
4. Содержание оксикумаринов СФ методом в пересчете на фраксетин 0,0028%
5. Содержание полисахаридов СФ методом 0,010%.
Таким образом, параметры продукта за 2 года хранения изменились незначительно и не вышли из рамок допустимого.
Пример 35 (получение экстракта при отсутствии консервантов и стабилизаторов в экстрагенте)
В 2 стеклянных реактора объемом каждый 2 л помещают по 500 г травы солянки лиственничнолистной. Отдельно в стеклянном стакане объемом 5 л, снабженным мешалкой и водяной баней, в 1,6 л очищенной воды, нагретой до 90°С, растворяют 2,4 кг маннита. Реакторы помещают в баню термостата, устанавливают температуру 90°С и заливают траву приготовленным экстрагентом. Процесс экстракции проводят до прекращения роста концентрации суммы оксикумаринов в жидкой фазе. Массу быстро переносят на обогреваемую воронку со стеклянной крупнопористой пластиной для фильтрования, и фильтруют под вакуумом, избегая вспенивания фильтрата. Получают 2,58 л фильтрата-экстракта, который делят на две порции по 1,29 л; в одну порцию добавляют 5 г сорбиновой кислоты, 5 г бензойной кислоты и 10 г аскорбиновой кислоты. Растворы выдерживают при комнатной температуре, затем отфильтровывают выпавшие кристаллы маннита. В результате опыта получают два образца экстракта:
С целевыми добавками получают 591 г экстракта со следующими параметрами:
1. Описание - темно-коричневый прозрачный сироп с характерным приятным фруктовым запахом, приятным кисловатым умеренно сладким вкусом;
2. рН 4,2;
3. плотность 1,08 г/см3;
4. Суммарное содержание флавоноидов СФ-методом (алюминиевый комплекс) в пересчете на рутин 0,31%;
5. Суммарное содержание оксикумаринов и гликозидов оксикумаринов СФ-методом в пересчете на фраксетин 1,18%;
6. Содержание полисахаридов СФ-методом 3,9%;
7. Содержание аскорбиновой кислоты 1,84% (метод титрования);
8. Микробиологическая чистота:
Общее число аэробных бактерий 1,56*102 КОЕ;
Общее число грибов 4,8*10 КОЕ.
Образец без целевых добавок, получают 584 г экстракта со следующими параметрами:
1. Описание - очень темно-коричневый сироп с характерным запахом сухофруктов, сладкого вкуса;
2. рН 6,1;
3. плотность 1,07 г/см3;
4. Суммарное содержание флавоноидов СФ-методом (алюминиевый комплекс) в пересчете на рутин 0,29%;
5. Суммарное содержание оксикумаринов и гликозидов окискумаринов СФ-методом в пересчете на фраксетин 1,09%;
6. Содержание полисахаридов СФ-методом 4,1%;
7. Содержание аскорбиновой кислоты (методом титрования) 0,15%;
8. Микробиологическая чистота:
Общее число аэробных бактерий 1,81*103 КОЕ;
Общее число грибов 8,3*10 КОЕ.
Далее ежедневно из обоих образцов отбирают пробы и определяют микробиологическую чистоту продуктов, а также значение рН и сигнального компонента - суммы оксикумаринов. Результаты представлены в таблице 23. Из результатов видно, что при отсутствии целевых добавок полученные экстракты нестабильны, и в них быстро размножаются микроорганизмы (Фиг. 7, 8).
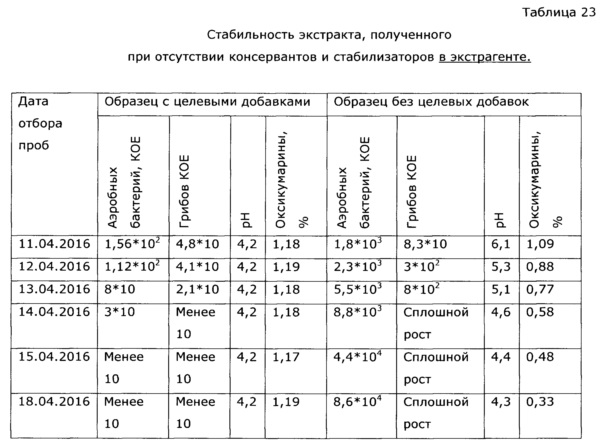
Тем не менее при использовании водно-маннитового экстрагента полученный экстракт стабилен как минимум сутки, что позволяет провести все необходимые технологические процедуры, в т.ч. ввести консерванты и стабилизаторы для получения лекарственного средства по п. 1; а также позволяет использовать по заявленному назначению без целевых добавок в домашних условиях, в условиях стационара и т.п., т.е. когда нет необходимости в расфасовке и длительном хранении лекарственного средства по п. 1.
Пример 36 (Промышленное получение экстракта без добавления стабилизаторов/консервантов в экстрагент)
Биологически активная добавка для человека
Процесс проводят на аппаратурной схеме, представленной на Фиг. 9. Для процесса используют эмалированный реактор Р1 для приготовления экстрагента с мешалкой и рубашкой, снабжен тензодатчиком; эмалированный перколятор Дф(П)2 с рабочим объемом 200 л, снабженный рубашкой для обогрева, фторопластовым ложным дном, термогильзой и грибковым вентилем на нижнем спуске; эмалированный реактор Р3 для сбора фильтрата-экстракта и введения целевых добавок с мешалкой, рубашкой, люком, грибковым вентилем на нижнем спуске и тензодатчиком; эмалированный реактор Р4 для усреднения и стандартизации полученного экстракта снабженный рубашкой, мешалкой и нижним грибковым вентилем; эмалированный мерник М5 для дозирования экстракта при приготовлении БАД; эмалированный реактор Р6 на расчетное давление 6 атм для приготовления БАД и карбонизирования, снабженный мешалкой, рубашкой, барботером для подачи углекислоты и нижним грибковым вентилем.
В качестве исходного сырья для экстракции используют сухую траву солянки лиственичнолистной (Salsola laricifolia), соответствующую монгольскому стандарту MNS-4403-05; параметры взятого сырья следующие:
1. Описание - резанная трава с жесткой структурой, зеленовато-желтоватые серые фрагменты размерами 8-25 мм × 0,2-1,3 мм.
2. Влажность (высушиванием) 5,3%.
3. Зольность 7,9%.
4. Сумма оксикумаринов, СФ методом в пересчете на фраксетин 1,99%.
5. массовая доля дубильных веществ в пересчете на танин по индигосульфокислоте 3,53%.
6. Массовая доля полифенольных соединений 2,94%.
7. Микробиологическая чистота
Количество аэробных бактерий 8,2*102 КОЕ
Количество грибов 8,4*10 КОЕ
Esherichia coli - отсутствует
Pseudomonos spp - отсутствует
Salmonella - отсутствует
Staphylococcus - отсутствует
Enterobacteriaceae – отсутствует.
60 кг резанной сухой травы солянки лиственничнолистной (насыпная плотность 0,367 г/см3) загружают в перколятор. В эмалированный реактор Р1 (2 м3) загружают 1000 кг воды очищенной, включают мешалку, подогревают воду до 80°С. Затем загружают 500 кг сорбита и перемешивают до полного растворения. После этого загружают 250 кг ксилита и 250 кг инозитола и перемешивают до полного растворения. Экстрагент хранят в Р1 при перемешивании и температуре 80±5°С.
100 кг экстрагента сливают через нижний спуск из реактора Р1 в перколятор Дф(П)2. Устанавливают температуру теплоносителя 85°С, началом экстракции считают момент достижения в фито-массе температуры 80°С. Периодически из массы отбирают пробу и определяют содержание суммы оксикумаринов в пересчете на фраксетин. Концентрация сигнального компонента медленно возрастает, через 8,5 часов перестает расти, что считают окончанием процесса. На реакторе P3 включают мешалку и горячий экстракт через фильтрующее поле Дф(П)2 сливают в реактор P3. Реактор P3 снабжен тензодатчиком, что позволяет определять вес слитого экстракта. При первой экстракции получают 22,8 кг экстракта. Через загрузочный люк в реактор P3 загружают 10 г сорбата калия, перемешивают, отбирают пробу для определения рН; значение рН 5,8. Порциями добавляют аскорбиновую кислоту до достижения значения рН 5,0, это достигается при добавке 16 г аскорбиновой кислоты. Содержание оксикумаринов в экстракте 0,688%, а флавоноидов в пересчете на рутин 0,178%. Экстракт из реактора P3 передают в реактор Р4 при работающей мешалке. В реакторе Р4 экстракт при перемешивании охлаждают до комнатной температуры.
В перколятор Дф(П)2 к влажному шроту порциями загружают 72 кг экстрагента из реактора Р1. Процесс экстракции проводят аналогично описанному при первой экстракции, равновесие устанавливается через 9,5 часов. Сливают 62,5 кг экстракта в реактор P3, к нему добавляют 28 г сорбата калия и аскорбиновую кислоту до значения рН 5,0. Экстракт из реактора P3 передают в реактор Р4 при работающей мешалке. В реакторе Р4 экстракт при перемешивании охлаждают до комнатной температуры.
Аналогичным образом проводят третью и последующие экстракции до полного расхода экстрагента (итоговое соотношение экстрагент : сухая трава = 1:0,03). В результате в реакторе Р4 получают 1940 кг сиропа-экстракта со следующими параметрами:
1. Описание - густой темно-бурый красноватый сироп с характерным приятным фруктовым запахом, сладко-кислого вкуса.
2. Плотность 1,21 г/см3
3. рН 5,0
4. Суммарное содержание флавоноидов в пересчете на рутин 0,0091%
5. суммарное содержание оксикумаринов и гликозидов оксикумаринов СФ методом в пересчете на фраксетин 0,027%
6. Микробиологическая чистота
Количество аэробных бактерий 1,5*102 КОЕ
Количество грибов менее 10 КОЕ.
Для приготовления пищевого продукта - биологически активной добавки, укрепляющей иммунитет и снижающей заболеваемость ОРЗ, в эмалированный реактор Р6 объемом 2 м3, снабженный якорной мешалкой и термогильзой, загружают при перемешивании 1981 л воды очищенной, 0,4 кг аскорбиновой кислоты, 0,01 кг лимонной кислоты, 0,5 кг сорбата калия, 0,1 кг сорбата кальция, 0,02 кг бензоата натрия.
При помощи мерника в реактор загружают 7,74 кг экстракта-сиропа (6,4 л), перемешивают 1 час, затем охлаждают до 5±1°С, карбонизируют подачей пищевой углекислоты через барботер. Полученный раствор фасуют в полиэтилентерифталатные емкости для пищевых продуктов из темного пластика объемом 0,5 л. Получают 3978 единиц упакованного продукта, с параметрами на момент фасовки:
1. Описание - желтый с коричневым оттенком раствор с приятным фруктовым запахом, кисло-сладкого, с «компотным» оттенком вкуса
2. Плотность при 20°С 1,002 г/см3
3. рН 4,2
4. Суммарное содержание оксикумаринов и гликозидов оксикумаринов СФ-методом 0,0001%
5. Содержание аскорбиновой кислоты 0,02% (методом титрования)
6. Микробиологическая чистота:
Количество аэробных бактерий 2*102 КОЕ
Количество грибов менее 10 КОЕ.
После хранения продукта в течение 2 лет параметры продукта следующие:
1. Описание - желтый с коричневато-красноватым оттенком раствор с приятным фруктовым запахом.
2. рН 4,3
3. Суммарное содержание оксикумаринов и гликозидов оксикумаринов СФ методом 0,00009%.
4. Содержание аскорбиновой кислоты 0,018% (методом титрования).
5. Микробиологическая чистота:
Количество аэробных бактерий менее 10 КОЕ
Количество грибов менее 10 КОЕ.
Биологически активная добавка на основе экстракта солянки лиственничнолистной обладает приятным вкусом, стабильна при хранении в течение 2 лет и предназначена для снижения заболеваемости ОРЗ в осенне-зимний период, диарей в летний период и других нозологии, связанных с функциональной недостаточностью иммунитета.
Пример 37 (экстрагент без целевых добавок, 30% ксилита)
Кормовая добавка для продуктивных животных, стабильный экстракт без целевых добавок.
Процесс проводят на аппаратурной схеме, описанной в примере 36.6 кг резанной травы солянки лиственничнолистной помещают в перколятор Дф(П)2. В реакторе Р1 готовят экстрагент растворением 600 кг ксилита в 1400 кг воды очищенной. Из реактора Р1 в перколятор Дф(П)2 загружают 100 кг экстрагента; экстракцию проводят при 80°С (температура в перколяторе) до достижения постоянного уровня сигнальных компонентов - оксикумаринов в пересчете на фраксетин, это происходит через 5,5 часов. Затем экстракт из перколятора Дф(П)2 сливают в реактор P3 и после измерения веса, объема и отбора пробы - в реактор Р4. При первой экстракции получают 85,8 кг экстракта с содержанием оксикумаринов 0,0733% и флавоноидов 0,0218%, с рН 5,8 и плотностью 1,109 г/см3. 1 кг данного экстракта отбирают в бутыль темного стекла, хранят в естественных условиях, отбирая пробы ежедневно, в которых определяют рН, содержание оксикумаринов в пересчете на фраксетин и флавоноидов в пересчете на рутин.
На следующую экстракцию берут экстратент из реактора Р1 в количестве, равном полученному экстракту, т.е. 85,8 кг; экстракцию проводят в тех же условиях. Через 7 часов уровень сигнальных компонентов перестает изменяться, что свидетельствует о завершении экстракции. Таким образом, экстракцию загруженной травы повторяют до исчерпания приготовленного экстрагента. Экстракты без введения целевых добавок сливают в реактор P3, а затем передают в реактор Р4, в котором циркуляцией хладоагента через рубашку поддерживается температура 5±1°С; слив экстрактов проводят при включенной мешалке. В процессе охлаждения из экстрактов кристаллизуется часть ксилита, суспензию перемешивают в указанных условиях до завершения процесса экстракции и полного расхода экстрагента. В общем итоге получают 1992 кг экстракта. В реактор Р4 загружают 1 кг бензойной кислоты, нагревают массу до комнатной температуры (при этом выпавший ксилит и загруженная бензойная кислота растворяются), после этого порциями добавляют в экстракт аскорбиновую кислоту до рН 4,9, всего для этого загружают 1,2 кг аскорбиновой кислоты. Полученный продукт фасуют в 5 л п/э канистры по 5 кг, получают 398 канистр.
Параметры продукта на момент фасовки:
1. Описание: коричневато-желтый сироп, с характерным фруктовым запахом, приятным кисло-сладким вкусом;
2. Плотность 1,108 г/см3 (при 20°С);
3. рН 4,9;
4. Содержание оксикумаринов и гликозидов оксикумаринов, в пересчете на фраксетин 0,00315%, спектрофотометрическим методом;
5. Содержание флавоноидов в пересчете на рутин спектрофотометрическим методом 0,00122%;
6. Содержание аскорбиновой кислоты методом титрования 0,063%;
7. Микробиологическая чистота:
Количество аэробных бактерий 5,8*102 КОЕ;
Количество грибов 2*10 КОЕ;
Escherichia coli в 1 г - не обнаружено;
Salmonella в 10 г - отсутствует;
Bacillus cereus - отсутствует.
После двух лет хранения в естественных условиях параметры продукта следующие:
1. Описание: коричневато-желтый сироп, с характерным фруктовым запахом, приятного кисло-сладкого вкуса;
2. Плотность 1,108 г/см3 (при 20°С);
3. рН 4,8;
4. Содержание оксикумаринов в пересчете на фраксетин, СФ-методом 0,00312%;
5. Содержание флавоноидов в пересчете на рутин, спектрофотометрическим методом 0,00121%;
6. Содержание аскорбиновой кислоты методом титрования 0,059%;
7. Микробиологическая чистота:
Количество аэробных бактерий 4,3*10 КОЕ;
Количество грибов 1,2*10 КОЕ.
Опытным путем установлено, что основным фактором риска нестабильности экстрактов солянки лиственничнолистной является рост аэробных, преимущественно спорообразующих бактерий, споры которых присутствуют в исходном фитосырье. При этом максимально обогащен спорами первый экстракт. Эта проблема решается введением консервантов в количестве 0,01-1,7 масс. % и стабилизатора до рН 5-3,5, т.е. до тех значений, при которых пищевые консерванты наиболее эффективны; однако, некоторые многоатомные спирты обладают собственной бактериостатической активностью, предотвращая рост микроорганизмов, хотя и не на очень продолжительный срок, но это позволяет провести все необходимые для получения готового лекарственного средства технологические процедуры. По указанным причинам стабильность экстракта в отсутствии целевых добавок проверена для наиболее обогащенного спорами первого экстракта со взятой загрузки фитосырья, полученные результаты приведены в таблице 24. Помимо содержания сигнальных компонентов фитоэкстракта, определяли также содержание щавелевой кислоты, как одного из основных метаболитов вегетирующих микроорганизмов и грибов (методом ГЖХ после метилирования диазометаном). Из полученных экспериментальных данных видно, что в отсутствии целевых добавок экстракт, полученный экстракцией 30% раствором ксилита, даже при комнатной температуре стабилен в течение двух недель.
Полученный продукт использован как кормовая добавка для повышения неспецифической резистентности животных в свиноводстве. Опыт проводили на двух группах свиноматок по 15 голов, отобранных по примерно одинаковому весу, без явной патологии. Супоросным маткам в опытной группе давали с водой раствор кормовой добавки в количестве 0,1 мл на 1 кг веса дважды в день; после опороса добавку не давали. Полученные результаты приведены в таблице 25.
Из опыта видно, что введение в рацион супоросным маткам иммуномодулирующей кормовой добавки на основе экстракта солянки лиственничнолистной существенно увеличивает неспецифическую резистентность как маток, так и поросят, что выражается в существенном возрастании и нормализации физиологических параметров животных.
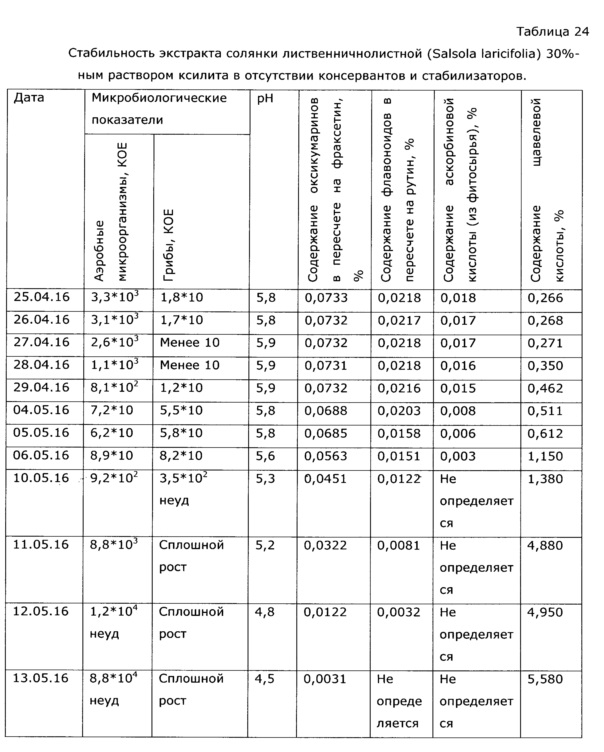

Пример 38 (стабильность экстракта, полученного без использования консервантов/стабилизаторов, в пределах заявленных рН, препарат для птицеводства)
Процесс проводили на аппаратурной схеме, описанной в примере 36.
Параметры взятой в опыт партии травы солянки лиственничнолистной следующие (Salsola laricifolia) (партия 011515):
1. Описание - резанная трава с жесткой структурой, зеленовато-желтоватые сырые фрагменты размером 5-30×0,1-0,5 мм;
2. Запах - специфичный, приятный;
3. Вкус - кисловатый, фруктовый;
4. Влажность (высушиванием) 6,1%;
5. Минеральные примеси (нерастворимые в 10% соляной кислоте) - 0,6%;
6. Части, загнившие или поврежденные грибками - не обнаружены;
7. Зольность 8,1%;
8. Сумма оксикумаринов, СФ-методом в пересчете на фраксетин 3,88%;
9. Сумма флавоноидов в пересчете на рутин - 1,3%;
10. Массовая доля дубильных веществ в пересчете на танин по индигосульфокислоте 5,68%;
11. Массовая доля полифенольных соединений 4,42%;
12. Тяжелые металлы по ГФХШ менее 0,001%;
13. Содержание мышьяка атомно-эмиссионным методом - не обнаружен;
14. Содержание кадмия атомно-эмиссионным методом 0,001 мг/кг;
15. Содержание свинца атомно-эмиссионным методом 0,004 мг/кг;
16. Содержание ртути атомно-эмиссионным методом - не обнаружено;
17. Содержание меди атомно-эмиссионным методом 0,8 мг/кг;
18. микробиологическая чистота:
Общее число аэробных бактерий 8,2*102 КОЕ;
Общее число грибов 5,8*10 КОЕ;
Escherichia coli - отсутствует;
Salmonella - отсутствует;
Staphylococcus - отсутствует;
Enterobacteriaceae - отсутствует.
60 кг резаной травы солянки лиственничнолистной (Salsola laricifolia) помещают в перколятор с уплотнением, экстрагент готовят смешением в реакторе Р1 160 кг 1,2-пропиленгликоля и 40 кг воды очищенной. Экстрагент нагревают до 80°С при перемешивании, сливают через нижний спуск половину (100 кг) и переносят в перколятор. Процесс проводят при 90°С до прекращения изменения концентрации сигнальных компонентов, это происходит через 3,5 часа. Экстракт сливают в реактор Р1, получают при первой экстракции 35,8 кг экстракта со следующими параметрами:
1. Описание - темно-коричневый сироп с характерным приятным запахом с небольшим осадком.
2. рН 6,2.
3. Плотность 1,09 г/см3.
4. Тяжелые металлы по ГФХIII менее 0,001%.
5. Суммарное содержание флавоноидов СФ-методом в пересчете на рутин 0,16%.
6. Суммарное содержание оксикумаринов и гликозидов оксикумаринов СФ-методом в пересчете на фраксетин 1,09%.
7. Содержание полисахаридов СФ-методом 1,9%.
8. Микробиологическая чистота:
Общее число аэробных бактерий 1,8*102 КОЕ. Общее число грибов менее 10 КОЕ. Из данного образца отбирают 5 образцов по 1 л для исследования стабильности экстракта при разных значениях рН.
К шроту приливают из реактора Р1 остаток экстрагента и повторяют экстракцию в тех же условиях, равновесие достигается через 6,5 часов; экстракт сливают и получают 84,5 кг; в реакторе P3 смешивают обе порции и получают 115,3 кг экстракта со следующими параметрами:
1. Описание - темно-коричневый сироп с характерным приятным запахом, с небольшим осадком.
2. рН 6,5.
3. Плотность 1,088 г/см3.
4. Тяжелые металлы по ГФ XIII менее 0,001%.
5. Суммарное содержание флавоноидов СФ-методом в пересчете на рутин 0,13%.
6. Суммарное содержание оксикумаринов и гликозидов оксикумаринов в пересчете на фраксетин 1,048%.
7. Содержание полисахаридов СФ-методом 1,95%.
В реактор Р4 загружают 1,5 м3 воды очищенной, при включенной мешалке из реактора P3 сливают 115,3 кг объединенного экстракта; реактор P3 дважды промывают 150 л воды очищенной, которую сливают в реактор Р4. При продолжающемся перемешивании в реактор загружают 0,2 кг сорбата калия, затем порциями аскорбиновую кислоту до достижения устойчивого значения рН 3,5; для этого требуется 61,3 кг фармакопейной аскорбиновой кислоты (с содержанием основного вещества в данной серии 99,5%). Затем водой очищенной доводят раствор до объема 2 м3, и фасуют в полимерные канистры объемом 20 л (100 единиц). Полученный продукт на момент выпуска имеет следующие параметры:
1. Описание - желтый раствор с явным фруктовым запахом, приятного кислого вкуса.
2. рН 3,5.
3. Плотность 1,017 г/см3
4. Тяжелые металлы по ГФ XIII менее 0,001%.
5. Суммарное содержание флавоноидов СФ-методом по окраске алюминиевого комплекса комплекса, в пересчете на рутин 0,0075%.
6. Суммарное содержание оксикумаринов и гликозидов оксикумаринов СФ-методом, в пересчете на фраксетин 0,0604%.
7. Содержание аскорбиновой кислоты методом титрования 3,07%.
8. Содержание полисахаридов СФ-методом 0,112%.
9. Микробиологическая чистота:
Общее число аэробных бактерий 1,2*102 КОЕ
Общее число грибов 1,5*10 КОЕ
Escherichia coli - отсутствует
Pseudomonas spp - отсутствует
Salmonella - отсутствует
Staphylococcus – отсутствует.
Опыт по влиянию препарата на показатели неспецифического иммунитета у цыплят-бройлеров проведен в виварии птицефабрики на цыплятах-бройлерах кросса «Кобб 500». В опыте использовали 2 группы цыплят по 35 голов - контрольная и опытная. Опытной группе ежедневно давали препарат с питьевой водой в дозе 1 мл/кг веса птицы, в контрольной группе - давали в том же количестве 3%-ный раствор аскорбиновой кислоты.
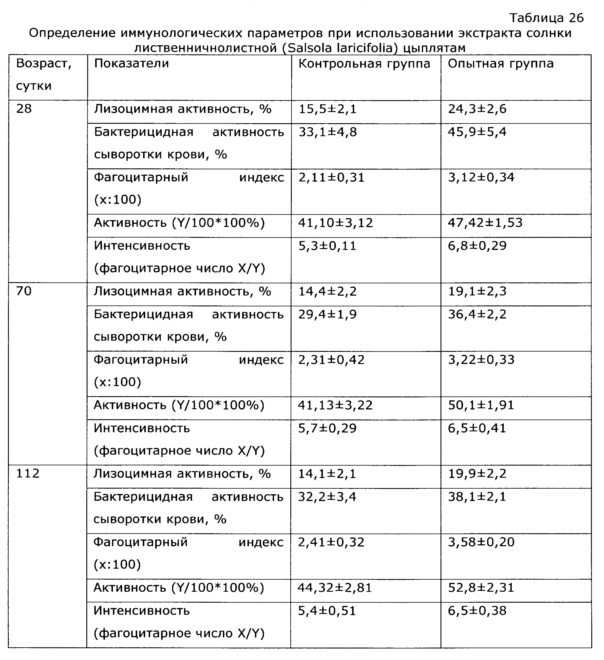
Оба раствора давали однократно ежедневно в течение 112 суток. В исследовании использованы методические рекомендации [Оценка качества кормов, органов, тканей, яиц и мяса птицы. Методическое руководство для зоотехнических лабораторий под общей редакцией академика РАСХН В.И. Фисинина и др. / Сергиев Посад. 2010. ВНИТИП. 120 С.], [Методика проведения исследований по технологии производства яиц и мяса птицы под общей редакцией Лукашенко B.C. и др. / Сергиев Посад. 2015. ВНИТИП. 104С.ISBN 978-5-980-20-154-8], [Корма, кормовые добавки, биологически активные вещества для сельскохозяйственной птицы Пономаренко Ю.А. и др. / М.: Типография Россельхозакадемии. 2009. 656С. ISBN 978-5-85941-323-2], [Болезни домашних и сельскохозяйственных птиц под редакцией Кэленка Б.У. и др. 10-е издание в 3-х томах / М.: Аквариум Принт. 2011. ISBN 978-5-4238-0080-2], результаты исследования приведены в таблицах 27 и 28.
Таким образом, препарат на основе экстракта солянки лиственничнолистной при выращивании бройлеров существенно повысил неспецифическую резистентность птицы, что выразилось в нормализации иммунологических показателей (таблицы 26 и 27) и сохранности поголовья, в условиях эксперимента увеличение сохранности составило 14,3% по сравнению с контролем.
Для изучения стабильности экстрактов в отсутствии специальных добавок (консервантов и стабилизаторов) и при введении добавок до разных значений рН используются отобранные пробы из первого экстракта (см. выше), т.к. опытным путем было обнаружено, что первые экстракты при проведении процесса экстракции содержат наибольшее количество спор микроорганизмов и, соответственно, риск недостаточной стабильности выше, по сравнению со вторыми и последующими экстрактами.
В качестве первого образца взяли экстракт без добавления целевых добавок, к следующим четырем образцам добавлен сорбат калия в количестве 0,1 г (образец 1 кг), при этом рН увеличилось до 6,8. В образцы 3, 4, 5 добавлена аскорбиновая кислота до рН соответственно 5,5, 3,5 и 3,0. Образцы поставлены на хранение в естественных условиях, пробы отбирали в первую неделю каждые сутки, затем 1 раз в неделю.
Образцы поставлены на хранение в естественных условиях, пробы отбирали в первую неделю каждые сутки, затем 1 раз в неделю. Результаты изменения параметров экстрактов приведены в таблице 28.
Из результатов опыта по исследованию стабильности экстракта солянки лиственничнолистной видно, что в отсутствии целевых добавок экстракт практически четыре недели пригоден для приготовления лекарственного средства. Введение сорбата калия без регулирующих рН стабилизаторов не предохраняет от роста микроорганизмов в условиях опыта, но по мере вызванного микроорганизмами снижения рН эффективность консерванта возрастает и становится достаточной. Экстракты с рН от 5,5 до 3,0 стабильны при хранении, однако, образец с рН 3,0 из-за крайне кислого вкуса малоприемлем при применении.
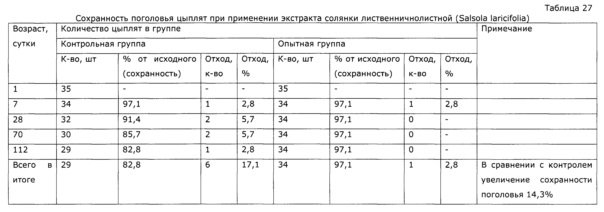
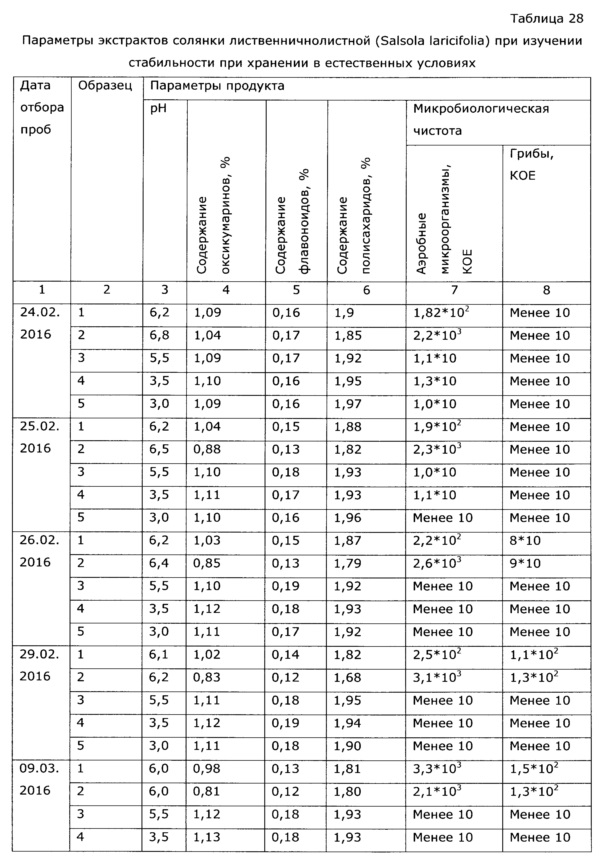
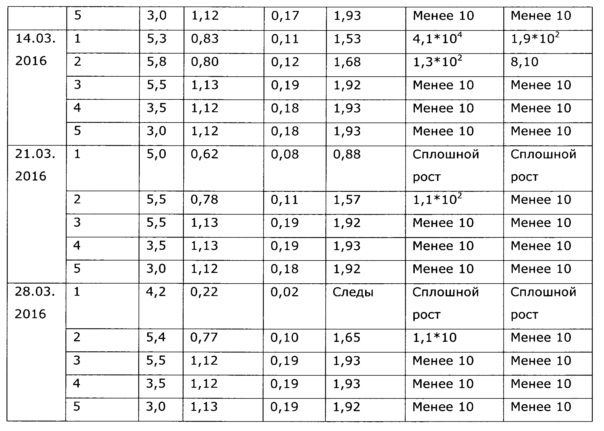
Пример 39 (влияние разбавителя на биологическую активность заявляемого ЛС)
В двухлитровый стакан, снабженный мешалкой, помещают 1 л воды очищенной, нагревают до 60°С и порциями загружают 500 г сорбита, после растворения 330 г ксилита и 330 г эритритола.
В двухлитровый стеклянный реактор, помещенный в термостат, загружают 600 г резанной травы солянки лиственничнолистной и заливают приготовленный экстрагент. Устанавливают температуру термостата 90°С, отсчет времени начала экстракции от достижения установленной температуры в термостате. С интервалом 30 минут отбирают пробы экстракта и определяют содержание оксикумаринов СФ-методом в пересчете на фраксетин. Равновесная концентрация устанавливается через 8,5 часов, после чего реактор достают, сливают экстракт. В результате опыта получают 1158 г экстракта с следующими параметрами:
1. Описание - густой темно-коричневый прозрачный сироп с приятным фруктовым запахом, сладкого вкуса;
2. Плотность 1,24 г/см3;
3. рН 6,6;
4. Суммарное содержание флавоноидов СФ-методом (по окраске алюминиевого комплекса) в пересчете на рутин 0,164%;
5. Суммарное содержание оксикумаринов и гликозидов оксикумаринов в пересчете на фраксетин 0,722%;
6. Содержание полисахаридов СФ-методом 3,02%.
Из полученного экстракта готовят образцы лекарственного средства следующим образом: взятую навеску сиропа при помощи магнитной мешалки растворяют в выбранном разбавителе (вода очищенная, 5% сорбитовый раствор или 50% сорбитовый раствор), добавляют консерванты, затем осторожным введением аскорбиновой кислоты доводят значение рН до 4,0±0,5 (при 20°С), после чего доводят соответствующим разбавителем до нужного веса.
Образец №1 - 0,6 г экстракта растворяют в 500 г воды очищенной, при перемешивании растворяют 1,5 г сорбата калия, 1,5 г бензоата натрия и добавлением кристаллической аскорбиновой кислоты доводят до рН=4,0±0,5; доводят водой очищенной до 600 г;
Образец №2 - готовят аналогично Образцу №1, но вместо воды очищенной используют 5% раствор сорбита;
Образец №3 - готовят аналогично Образцу №1, но вместо воды очищенной используют 50% раствор сорбита;
Образец №4 - 1,5 г экстракта 1,5 г растворяют в 500 г воды очищенной, при перемешивании растворяют 1,5 г сорбата калия, 1,5 г бензоата натрия и добавлением аскорбиновой кислоты доводят до рН=4,0±0,5; доводят водой очищенной до 600 г;
Образец №5 - готовят аналогично Образцу №4, но вместо воды очищенной используют 5% раствор сорбита;
Образец №6 - готовят аналогично образцу №4, но вместо воды очищенной используют 50% раствор сорбита;
Образец №7 - 300 г экстракта растворяют в воде очищенной, при перемешивании растворяют 1,5 г сорбата калия, 1,5 г бензоата натрия и доводят аскорбиновой кислотой до рН=4,0±0,5; доводят водой очищенной до 600 г;
Образец №8 - готовят аналогично Образцу №7, но вместо воды очищенной используют 5% раствор сорбита;
Образец №9 - готовят аналогично Образцу №7, но вместо воды очищенной используют 50% раствор сорбита;
Образец №10 - в 600 г экстракта при перемешивании растворяют 1,5 г сорбата калия, 1,5 г бензоата натрия и добавлением аскорбиновой кислоты доводят до рН=4,0±0,5.
Полученные образцы изучают на проявление фармакологической активности аналогично опыту 3. Препарат сравнения взят известный препарат «Иммунал капли для приема внутрь», который представляет собой спиртовой раствор сока травы эхинацеи пурпурной (Echinacea purpurea (L.) Moench)/
Материалы и методы
В эксперименте использовали мышей линии C57BL16, для воспроизведения патологического процесса использовали вирус гриппа A/PR/8/34 (H1N1), полученный из музея НИИ гриппа РАМН и адаптированный к мышам. Лечебное действие препаратов оценивали по интенсивности репродукции вируса в легких после интраназального заражения опытных и контрольных мышей под легким эфирным наркозом в дозе 0,01ЛД50 вирусом гриппа в объеме 0,05 мл на мышь. Препараты начинали вводить внутрижелудочно с 3-го дня после заражения в дозе 1300 мг/кг 2 раза в день на протяжении 10 дней. Контрольная группа мышей получала дистиллированную воду.
Всего было сформировано 12 экспериментальных групп (каждая группа по 25 животных):
1. Животные без лечения (контрольная группа);
2. Животные с лечением препаратом «Иммунал»;
3. Животные с лечением препаратом «Образец №1» (см. выше);
4. Животные с лечением препаратом «Образец №2» (см. выше);
5. Животные с лечением препаратом «Образец №3» (см. выше);
6. Животные с лечением препаратом «Образец №4» (см. выше);
7. Животные с лечением препаратом «Образец №5» (см. выше);
8. Животные с лечением препаратом «Образец №6» (см. выше);
9. Животные с лечением препаратом «Образец №7» (см. выше);
10. Животные с лечением препаратом «Образец №8» (см. выше);
11. Животные с лечением препаратом «Образец №9» (см. выше);
12. Животные с лечением препаратом «Образец №10» (см. выше).
Содержание вируса в легких определяли через 96 часов после заражения путем титрования 10% легочной суспензии в культуре хориоаллантоисной оболочки куриных эмбрионов (Ильенко В.И. «Методы испытаний и оценки противовирусной активности вируса гриппа. Методические указания», 35 с., СПб., 1977). Титр вируса определяли по Риду и Менчу и выражали в ед. ТИД50 (тканевые инфекционные дозы).
Степень поражения легких оценивали по наличию геморрагических очагов и выражали в процентах пораженных долей.
Животных умерщвляли на 14 день после заражения, легкие извлекали и использовали для биохимических и патоморфологических исследований. Определяли уровень перекисного окисления липидов, который оценивали по содержанию в гомогенате легочной ткани малонового альдегида. Оценку антиоксидантной активности ткани проводили на основании способности гомогената легочной ткани ингибировать окисление фосфолипидов яичного желтка, индуцированное двухвалентным железом.
Характер патологического процесса оценивали по макроскопическим и микроскопическим изменениям. Макроскопически оценивали частоту обнаружения очагов поражения легких. Микроскопически определяли интенсивность вирусного поражения респираторного эпителия, интенсивность токсических проявлений гриппа, а также активность и характер воспалительных клеточных реакций.
Для гистологических исследований легкие и надпочечники животных фиксировали в 10% растворе нейтрального формалина, обезвоживали в спиртах нарастающей концентрации и заливали в парафин; парафиновые срезы окрашивали гематоксилин-эозином и исследовали при помощи микроскопа.
Результаты исследования.
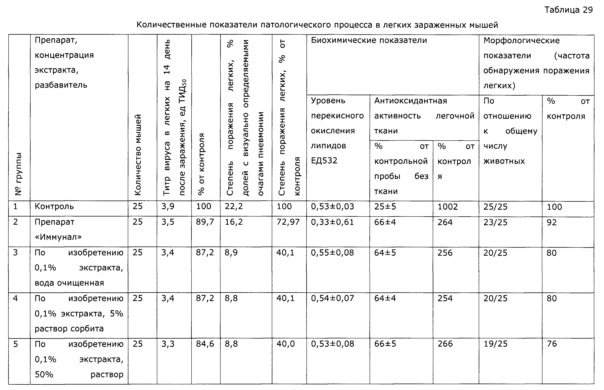
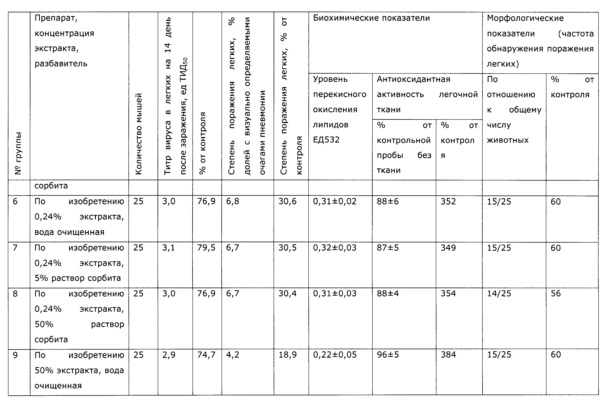
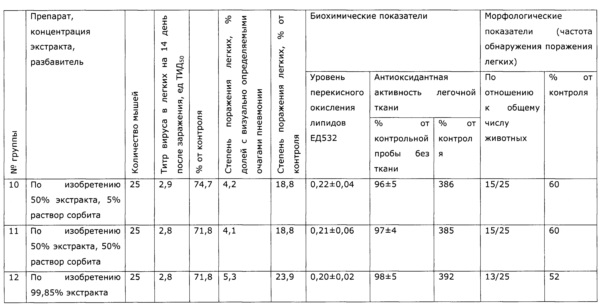
Исследуемые препараты в условиях опыта незначительно влияли на интенсивность размножения вируса гриппа в легких мышей опытных групп по сравнению с контрольной, однако некоторое дозозависимое (в зависимости от содержания экстракта в опытном препарате) снижение титра позволяет предположить прямое противовирусное действие. У животных, зараженных интраназально вирусом гриппа и не получавших лечение, в легких развилась типичная гриппозная бронхопневмония, через 3 суток после заражения признаки специфического поражения обнаружены как в трахеи и бронхах, так и в альвеолах. В толще эпителия мигрировали полиморфные лейкоциты, подвергающиеся там массовому распаду. Перибронхиальная соединительная ткань приобретала отечность и инфильтровывалась полинуклеарами. В итоге эти процессы приводили к интерстициальному отеку и спадению просвета альвеол, межальвеолярная соединительная ткань обильно инфильтровывалась свободноклеточными элементами. Применение препаратов на основе экстрактов солянки лиственничнолистной в 2-3 раза снижало уровень поражения легких по сравнению с контролем, при этом в случаях препаратов 6-12, соответствующих заявляемому составу, защитный эффект был относительно одинаков и существенно выше, чем в случае примера 43-45 (содержание экстракта меньше заявляемого), и в случае примера 42 (известный препарат «Иммунал»). Препараты на основе экстрактов солянки лиственничнолистной оказывали выраженное влияние на антиоксидантные системы легочной ткани, снижая уровень перекисного окисления и значительно, в разы увеличивая антиоксидантную активность ткани легких, что можно отнести к эффектам оксикумаринов, являющихся известными эффективными антиоксидантами. В отношении указанных эффектов обнаруживается явная дозозависимость.
Таким образом, препараты на основе экстракта солянки лиственничнолистной, при концентрации нативного экстракта от 0,24 до 99,85% (в последнем случае нативный экстракт с целевыми добавками, но без разбавления) показывают на модели гриппозной инфекции выраженный защитный и лечебный эффект. Снижение концентрации нативного экстракта в лекарственном средства ниже 0,24% (до 0,1%) существенно снижает лечебный эффект. Состав раствора-разбавителя не оказывает достоверного влияния на биологические эффекты лекарственного средства.
Пример 40 (Эффективность ЛС по изобретению в случае использования различных многоатомных спиртов для получения экстракта)
Эффективность лекарственных средств по изобретению, полученных методом экстракции травы солянки лиственничнолистной водными растворами многоатомных спиртов, в случае использования различных многоатомных спиртов, сравнивали по профилактической активности на модели гриппозной инфекции. В опыте использовал мышей линии C57B L/16, обладающих уменьшенным Т-клеточным иммунитетом и в силу этого высокочувствительных к вирусу гриппа. Всего было сформировано 8 экспериментальных групп животных, по 30 животных в группе. Для эксперимента использовали препараты с концентрацией экстрактов 99,89 масс. %.
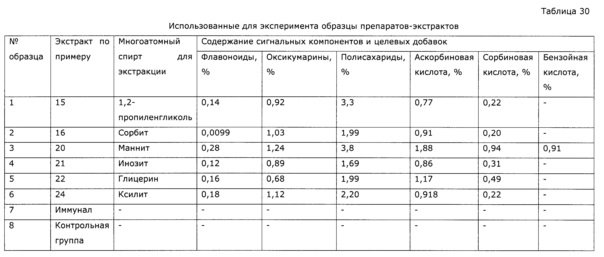
Препараты вводили мышам внутрижелудочно в дозе 1000 мг/кг 2 раза в день на протяжении 10 дней; контрольная группа получала аналогичное количество дистиллированной воды. На 11 день после начала введения препаратов мышей заражали интраназально под легким эфирным наркозом штамом вируса A/PR/8/34 (H0N1) в объеме 0,05 мл на мышь. Летальную дозу вируса определяли в предварительном опыте путем титрования вируса на мышах с последующим вычислением LD50. Результаты опыта оценивали на 6 день, регистрируя летальность мышей в контрольной и опытных группах. Оценку результатов испытания проводили на основании следующих показателей:
- сравнение процента погибших мышей в контрольной и опытных группах;
- определение индекса защиты испытуемого препарата
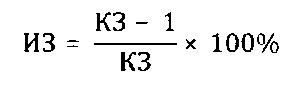
где коэффициент защиты вычислялся по формуле
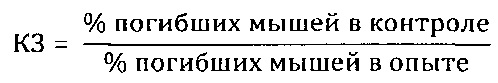
В контрольной группе вирус вызвал почти 90%-ную гибель животных. Введение препаратов существенно, в разы, снизило процент летальности мышей и увеличило индекс защиты. Все препараты на основе экстрактов солянки лиственничнолистной оказались близки по эффективности, эффект незначительно зависел от использованного при экстракции многоатомного спирта.
Таким образом, лекарственное средство по изобретению проявляет заявленную активность при использовании различных многоатомных спиртов для экстракции, при несущественной разнице в эффектах. Прослеживается корреляция между выраженностью биологического эффекта и содержанием в экстрактах сигнальных определяемых компонентов - оксикумаринов и полисахаридов.
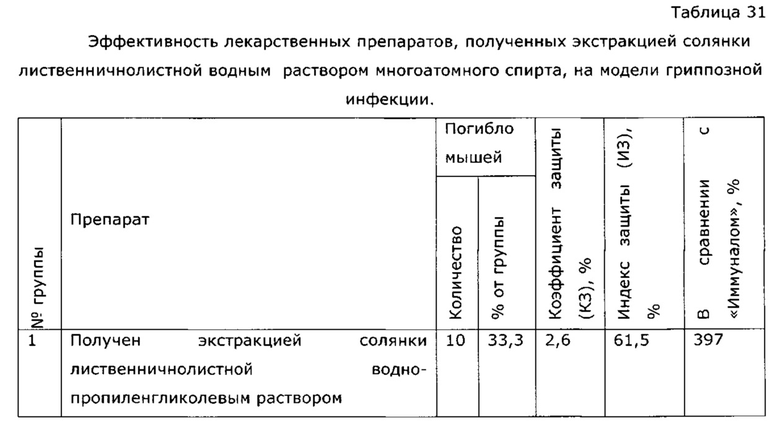
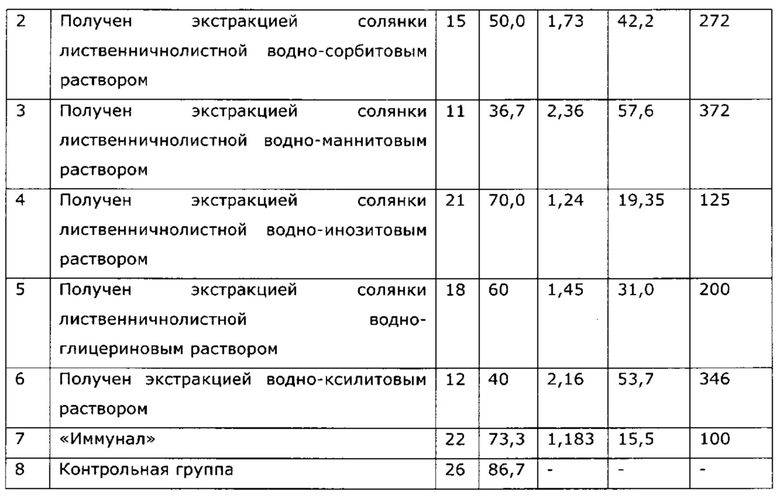
Пример 41 (Исследование острой токсичности медицинского препарата)
Материалы и методы
Определение показателей острой токсичности включало эксперименты на белых нелинейных крысах массой 160-180 г возраста 13-14 недель и белых мышах массой 18-20 г возраста 8-9 недель обоего пола. Крысы и мыши поступили из питомника РАМН «Рапполово» Ленинградской области.
Регистрируемые показатели: летальность, время гибели животных, симптоматика отравления, ежедневное наблюдение общего состояния и поведения, взвешивание, потребление корма и воды, вскрытие и макроскопическое описание погибавших и всех выживших животных в конце исследования (эвтаназия осуществлялась передозировкой эфира), оценка местно-раздражающего действия, определение массовых коэффициентов внутренних органов.
Препарат, полученный по примеру 28, вводили белым крысам и мышам обоего пола (по 6 животных одного пола) внутрижелудочно через атравматичный металлический зонд в возрастающих дозах по Литчфилду-Уилкоксону. Период последующего наблюдения составлял 14 суток.
Исследованный диапазон доз составил 5000, 10000 и 15000 мг/кг. Высокие дозы достигались повторными введениями препарата с интервалом 30 минут. Контрольные животные получали аналогичные объемы дистиллированной воды с интервалом 30 минут (максимальный объем растворителя).
Результаты исследования
Ни в одной из экспериментальных групп, ни у мышей, ни у крыс, гибели не отмечалось. Общее состояние и поведение животных соответствовало обычному.
В таблицах 32 и 33 приведены массовые коэффициенты внутренних органов мышей и крыс, усредненные по группам. Каких-либо достоверных различий между группами не выявлено.
Таким образом, по данным некропсии острое внутрижелудочное введение экспериментального препарата не вызвало макроскопических изменений внутренних органов, органов эндокринной системы и головного мозга подопытных белых мышей и крыс, а также не сопровождалось воспалительными изменениями или раздражением слизистых оболочек желудка и кишечника.
Результаты токсикометрии, данные некропсии позволили отнести экспериментальный препарат к V классу практически нетоксичных лекарственных веществ (Н. Hodge et al. Clinical Toxicology of Commercial Products. Acute Poisoning. Ed. IV, Baltimore, 1975, 427 p). Состояние животных после острого введения препарата свидетельствовало о хорошей переносимости и безвредности экспериментального средства в дозах, превышающих максимальные терапевтические (200 мг/кг, исходя из 14 г (11,4 мл) в сутки для человека средней массой 70 кг) в разы.
Кроме этого, результаты токсикометрии позволили отнести экспериментальный препарат к малоопасным веществам (IV класс опасности по ГОСТ 12.1.007-76).
Пример 42 (Исследование острой токсичности ветеринарного препарата)
Материалы и методы
В опыте по определению острой токсичности использовали белых мышей массой 18-20 г. Каждая группа состояла из 6-ти животных. Препарат, полученный по примеру 29, вводили в желудок через атравматичный металлический зонд в возрастающих дозах: 0,3; 0,4; 0,5; 0,6; 0,7 и 0,8 мл/мышь или 15; 20; 25; 30; 35 и 40 мл/кг. Введение препарата животным проводилось натощак, т.е. спустя не менее 4-х часов после кормления. В течение 14 дней за животными велось наблюдение, учитывалась клиническая картина интоксикации и смертность животных по дням.
Результаты исследования
Клиническая картина интоксикации животных, подвергавшихся воздействию препарата, не выражена. Животные опытной группы были активны, подвижны и по поведению не отличались от контрольных. Шерстный покров животных был гладким и опрятным, сукровичных выделений не наблюдали.
При проведении патологоанатомического вскрытия этих животных не было отмечено каких-либо признаков патологии внутренних органов. Желудок и кишечник были нормального наполнения и консистенции содержимого. Не было отмечено каких-либо геморрагических воспалений желудочно-кишечного тракта. Макроанатомических изменений печени, почек и селезенки выявлено не было.
В результате, препарат оказался практически не токсичен. Определить смертельные дозы (LD16, LD50 и LD84) не удалось. Максимально введенная доза составила 40 мл/кг (41,5 г/кг) живой массы (см. таблицу 34).
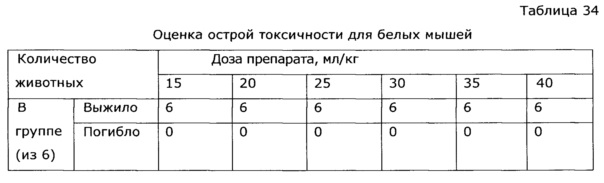
Полученные данные свидетельствуют о том, что экспериментальный препарат в условиях острого опыта при введении в желудок относится к IV классу токсичности (по ГОСТ 12.1.007-76).
Пример 43 (Изучение фармакологической активности)
Оценивали эффективность лекарственных препаратов, полученных по примеру 28 и по примеру 31 (прототип) при лечении гриппозной инфекции. Препаратом сравнения служил препарат «Иммунал капли для приема внутрь», который представляет собой спиртовый раствор сока травы эхинацеи пурпурной (Echinacea purpurea (L.) Moench).
Материалы и методы
В эксперименте использовали нелинейных белых мышей массой 25-30 г. Для воспроизведения патологического процесса использовали вирус гриппа A/PR/8/34 (HINI), полученный из музея НИИ гриппа РАМН и адаптированный к белым мышам.
Лечебное действие препаратов оценивали по интенсивности репродукции вируса в легких после интраназального заражения опытных и контрольных мышей под легким эфирным наркозом в дозе 0,01 ЛД50 (летальная доза) вирусом гриппа в объеме 0,05 мл на мышь. Препараты начинали вводить в/ж с 3-го дня после заражения в дозе 1300 мг/кг 2 раза в день на протяжении 10 дней. Контрольная группа мышей (без лечения) получала дистиллированную воду.
Всего было сформировано 4 экспериментальные группы (каждая группа включала по 20 животных):
1. Животные без лечения (контрольная группа).
2. Животные с заражением и лечением препаратом «Иммунал».
3. Животные с заражением и лечением препаратом, полученным по прототипу (пример 31).
4. Животные с заражением и лечением препаратом, полученным по изобретению (пример 28).
Содержание вируса в легких определяли через 96 ч после заражения путем титрования 10% легочной суспензии в культуре хорионаллантоидной оболочки куриных эмбрионов [Ильенко В.И. Методы испытаний и оценки противовирусной активности химических соединений в отношении вируса гриппа. Методические указания. 35 с., СПб., 1977 г.]. Титр вируса определяли по Риду и Менчу и выражали в Ig ТИД50 (тканевые инфекционные дозы).
Степень поражения легких оценивали по наличию геморрагических очагов и выражали в процентах пораженных долей.
Животных умерщвляли на 14 день после заражения, легкие извлекали и использовали для биохимических и патоморфологических исследований. Определяли уровень перекисного окисления липидов, который оценивали по содержанию в гомогенате легочной ткани малонового альдегида.
Оценку антиоксидантной активности ткани проводили на основании способности гомогената легочной ткани ингибировать окисление фосфолипидов яичного желтка, индуцированное двухвалентным железом.
Характер патологического процесса оценивали по макроскопическим и микроскопическим изменениям. Макроскопически оценивали частоту обнаружения очагов поражения легких. Микроскопически определяли интенсивность специфического вирусного поражения респираторного эпителия, интенсивность токсических проявлений гриппа, а также активность и характер воспалительных клеточных реакций.
Для гистологических исследований легкие и надпочечники животных фиксировали в 10% растворе нейтрального формалина, обезвоживали в спиртах нарастающей концентрации и заливали в парафин. Парафиновые срезы окрашивали гематоксилин-эозином и исследовали в световом микроскопе.
Достоверность полученных результатов оценивали с использованием критерия Стьюдента.
Результаты исследования
Исследуемые препараты практически не влияли на интенсивность размножения вируса гриппа в легких мышей опытных групп по сравнению с контрольной. Степень поражения легких на 14-е сутки после заражения, которую оценивали визуально по наличию очагов пневмонии, варьировала от 17% (контрольная группа) до 8.2% (опытная группа 4). Однако достоверных различий в инфекционных титрах вируса гриппа животных всех групп отмечено не было. Хотя имелась тенденция к снижению титра в группе 4, что позволяет предполагать наличие прямого противовирусного действия экспериментального препарата (см. таблицу 36).

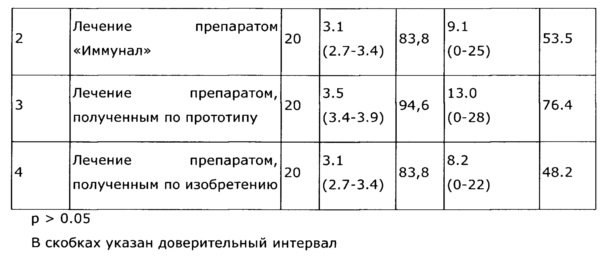
У животных, зараженных интраназально вирусом гриппа и не получавших лечения, в легких развивалась типичная гриппозная бронхопневмония. Через 3 суток после заражения признаки специфического поражения обнаружены как в трахее и бронхах, так и в альвеолярных отделах легких. Они заключались в деструктивных изменениях респираторного эпителия, сопровождающихся формированием в цитоплазме многочисленных базофильных и эозинофильных гриппозных включений. В толщу эпителия и просветы воздухоносных путей мигрировали полиморфноядерные лейкоциты, подвергающиеся там массовому распаду. Перибронхиальная соединительная ткань была отечной и инфильтрирована полинуклеарами. Патологический процесс в респираторных отделах приводил к интерстициальному отеку и спадению просвета альвеол, межальвеолярная соединительная ткань в таких местах была инфильтрирована свободноклеточными элементами.
Применение изучаемых для препарата по изобретению оказалась в 2 раза ниже, чем в контроле и существенно ниже, чем в случае известных препаратов. Интересно отметить, что уровень перекисного окисления липидов для всех экспериментальных групп различался мало, вместе с тем антиоксидантная активность легочной ткани в случае предлагаемого препарата оказалась в 2,5 раза выше, чем у животных контрольной группы, и значительно выше, чем у животных, получавших препараты сравнения (см. таблицу 36).
На 14 сутки у части выживших животных в легких формировались обширные очаги хронических поражений в виде стойкой гиперплазии и гипертрофии бронхиолярного эпителия, приводящей к закупориванию просветов бронхов гипертрофированными клетками и густым нейтрофильным экссудатом, инфильтрации стромы легких лимфоидномакрофагальными элементами и нейтрофилами, и метаплазия альвеолярного эпителия в виде аденоматозных разрастаний. Эти изменения типичны для поздних стадий гриппозной пневмонии, вызванной токсигенными штаммами вируса гриппа.
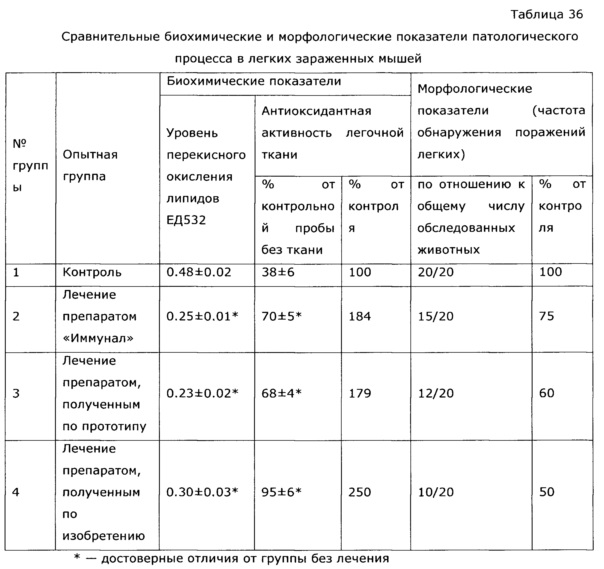
Интенсивность поражений легких оценивали по четырехбалльной системе: 1 - сегментарные поражения, 2 - долевые поражения, 3 - тотальные поражения легкого, 4 - тотальные поражения обоих легких. Аналогично оценивалась распространенность гиперплазии эпителия бронхов и альвеол.
Пероральное введение препаратов, начиная с острой фазы развития гриппозной инфекции (с 3 суток), оказывало благоприятное влияние на динамику патоморфологических процессов в бронхолегочной ткани зараженных животных (см. таблицу 37).
Гистологический анализ срезов легких показал, что в группах животных, которым вводили препараты, в очагах хронического поражения воздушность несколько возрастала за счет расправления ателектазов, расширения просветов бронхов и освобождения их от экссудата. Ранее метаплазированные участки респираторных отделов оказывались воздушными и были выстланы плоским эпителием. Воспалительная инфильтрация стромы в таких участках оказывалась незначительной.
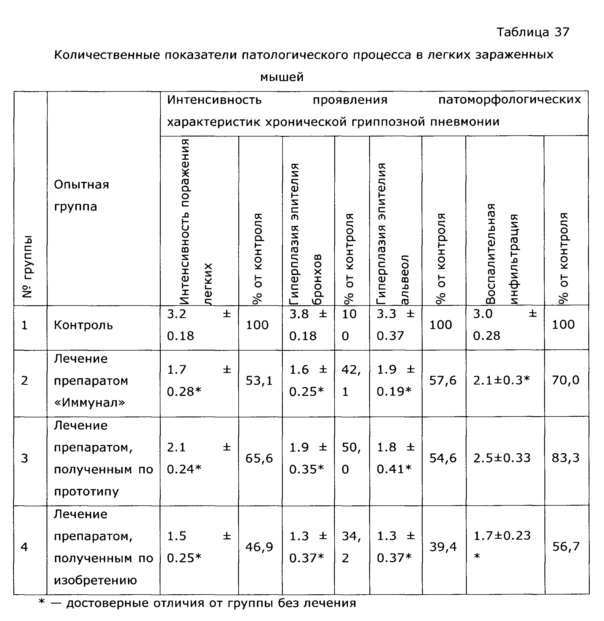
Для изучения возможного механизма лечебного действия препаратов для гистологических исследований использовали надпочечники животных.
В результате исследований было обнаружено достоверное увеличение размеров и вакуолизация клеток коры надпочечников экспериментальных животных, четко выделялись три зоны: подкапсульная клубочковая зона, представленная 3-4 рядами мелких клеток со светлой цитоплазмой и центрально расположенным ядром; пучковая зона, клетки которой были значительно крупнее и полиморфнее и содержали наряду с зернистым материалом небольшие вакуоли; сетчатая зона, расположенная на границе, с мозговым веществом надпочечника, представленная более мелкими клетками с зернистой цитоплазмой (см. таблицу 38).
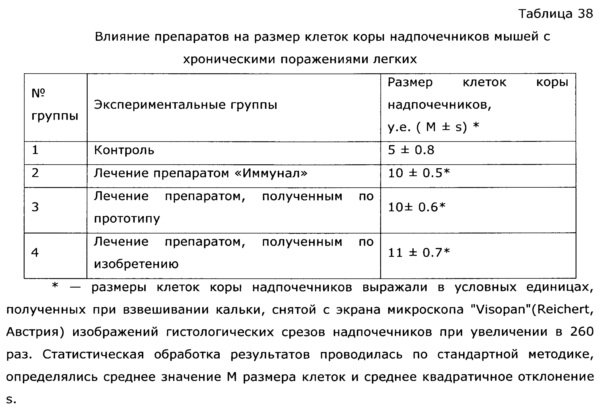
Выводы
Действие препаратов на развитие экспериментальной гриппозной инфекции при лечебной схеме оказывало защитный эффект, который проявлялся в существенном снижении интенсивности проявления патоморфологических характеристик хронической гриппозной пневмонии (интенсивность поражения легких, гиперплазия эпителия бронхов и альвеол, воспалительная инфильтрация). Лечебный эффект, вероятно, имеет неспецифический характер и отчасти опосредован гормональным влиянием глюкокортикостероидов, так как в ходе экспериментов установлено стимулирующее влияние препаратов на клетки коры надпочечников.
Проведенные исследования продемонстрировали эффективность препарата, полученного по примеру 28, в сравнении с прототипом (препаратом, полученным по примеру 31) и препаратом сравнения «Иммунал» в качестве иммуномодулятора при лечении вирусной инфекции, что позволяет рекомендовать его для профилактики возможных легочных осложнений при гриппе.
Пример 44 (Изучение профилактической активности)
Оценивали эффективность лекарственных препаратов, полученных по примеру 28 и по примеру 31 (прототип), для профилактики гриппозной инфекции. Препаратом сравнения служил препарат «Иммунал капли для приема внутрь».
Материалы и методы
В опыте использовали белых беспородных мышей массой 12-15 г. Всего было сформировано 4 экспериментальные группы (каждая группа включала по 20 животных):
1. Контрольная группа (животные без профилактики).
2. Опытная (животные, получавшие препарат «Иммунал»).
3. Опытная (животные, получавшие препарат, приготовленный по прототипу - примеру 31).
4. Опытная (животные, получавшие препарат, приготовленный по изобретению - примеру 28).
Препараты вводили мышам внутрижелудочно в дозе 1300 мг/кг 2 раза в день на протяжении 10 дней. Препарат сравнения вводили аналогично в той же дозе. Контрольная группа мышей получала дистиллированную воду. На 11 день после начала введения препаратов мышей заражали интраназально под легким эфирным наркозом патогенным для них штаммом вируса гриппа А/Pr/8/34 (H0N1) в объеме 0,05 мл на мышь. Летальную дозу вируса определяли в предварительном опыте путем титрования вируса на мышах с последующим вычислением ЛД50.
Результаты опыта оценивали на 5 день, регистрируя летальность мышей в контрольной и опытных группах.
Оценку результатов испытания проводили на основании следующих показателей:
- сравнения процента погибших мышей в контрольной и опытных группах;
- определения индекса защиты испытуемого препарата.
Для определения индекса защиты (ИЗ) вычисляли кратность или коэффициент защиты (КЗ) мышей препаратом.
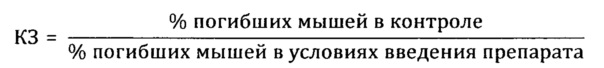
Расчет индекса защиты (ИЗ) осуществляли следующим образом:
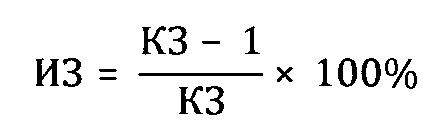
Результаты исследования
В контрольной группе вирус вызвал 80%-ную гибель мышей. Введение животным препаратов снизило процент летальности мышей и увеличило индекс защиты.
Экспериментальный препарат, полученный по примеру 28, оказался существенно эффективнее прототипа (препарата, полученного по примеру 31) и сопоставим по активности с препаратом сравнения «Иммунал» при профилактике вирусной инфекции (см. таблицу 39).
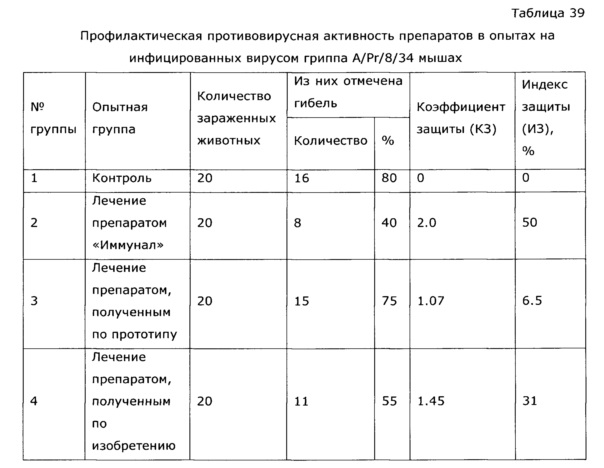
Пример 45 (Исследование накопления антителообразующих клеток у мышей - В-клеточное звено иммунной системы)
Материалы и методы
Оценивали влияние экспериментального препарата, полученного по примеру 29, на интегральные реакции гуморального иммунитета мышей - способность вырабатывать антителообразующие клетки (АОК) в ответ на введение тимусзависимого антигена - эритроцитов барана (ЭБ). Исследование проводили на мышах-гибридах (CBAxC57B1/6)F1 массой 19±0,4 грамм. В каждой группе было по 10 мышей. Всего было сформировано 2 группы:
1. Контрольная группа (животные, иммунизированные ЭБ, получавшие физраствор).
2. Опытная (животные, иммунизированные ЭБ, получавшие экспериментальный препарат).
Для определения количества АОК в селезенке мышам перорально вводили в терапевтической дозе (0,2 мл/кг) препарат одновременно с внутрибрюшинной иммунизацией их ЭБ в дозе 5⋅106 в объеме 0,5 мл/мышь, контрольным животным вводили физиологический раствор и также иммунизировали их ЭБ. Иммунизацию проводили однократно, экспериментальный препарат давали ежедневно в терапевтической дозе. На 4-е сутки извлекали селезенки, получали лимфоциты и проводили исследование методом локального гемолиза в геле агарозы, определяли количество АОК в селезенках. Число АОК считали в каждой пробе среди 200 лимфоцитов. Индекс стимуляции (ИС) определяли как отношение числа АОК в опыте к числу АОК в контроле. ИС 1,5 и выше - показатель стимуляции иммунитета, ниже 0,7 - иммунодепрессии.
Результаты

Увеличение числа продуцентов антител в селезенке мышей опытной группы свидетельствовало о стимулирующем действии экспериментального препарата на антителогенез. Введение препарата приводило к активизации трансформации В-лимфоцитов в АОК по сравнению с контролем, что выражалось в статистически достоверном увеличении количества АОК в селезенке. ИС увеличился в 2,5 раза, т.е. препарат усиливал гуморальный иммунный ответ у животных (см. таблицу 40). Увеличение содержания АОК опосредовано активизацией функциональной активности Т-лимфоцитов.
Пример 46 (Исследование титров антител в сыворотке крови мышей - В-клеточное звено иммунной системы)
Определяли изменение титров антител в сыворотке крови мышей при введении экспериментального препарата, полученного по примеру 29. Реакция основана на способности агглютининов, содержащихся в сыворотке крови иммунизированных животных, «склеивать» ЭБ. Известно, что вещества, обладающие стимулирующим эффектом, вызывают увеличение концентрации антител в сыворотке крови по сравнению с контролем.
Материалы и методы
Титры агглютининов определяли в микроварианте прямой реакции гемагглютинации. Исследование проводили на мышах-гибридах (CBAxC57B1/6)F1 массой 20±0,7 грамм. В каждой группе было по 10 мышей. Всего было сформировано 2 группы:
1. Контрольная группа (животные, иммунизированные ЭБ, получившие физраствор).
2. Опытная (животные, иммунизированные ЭБ, получившие экспериментальный препарат).
Для определения изменения титров агглютининов мышам вводили перорально испытуемый препарат в терапевтической дозе (0,2 мл/кг) одновременно с внутрибрюшинной иммунизацией их ЭБ в дозе 5-108 в объеме 0,5 мл/мышь, контрольным животным вводили физиологический раствор и также иммунизировали их ЭБ. При однократной иммунизации испытуемый препарат вводили ежедневно в течение всего периода наблюдения (7 дней). Ежедневно, начиная с 3-го дня после иммунизации, у мышей обеих групп из подключичной вены брали кровь для получения сыворотки и определения титра антиэритроцитарных антител.
Результаты

На 8-й день титры агглютининов в сыворотке крови мышей опытной группы повысились в 3,8 раза. Таким образом, экспериментальный препарат оказал стимулирующее воздействие на гуморальный иммунный ответ (см. таблицу 41).
Применение испытуемого препарата сопровождалось усилением иммунного ответа на тимусзависимый антиген (ЭБ). По-видимому, в данном случае отсутствовало подавление Т-суп рессора ми активности В-лимфоцитов. Гуморальная антителопродукция к тимусзависимому антигену (ЭБ) обусловлена кооперативным взаимодействием В-лимфоцитов и Т-хелперной популяцией иммунокомпетентных клеток (Петров Р.В., Чередеев А.И., 1974).
Пример 47 (Исследование количества ауторозеткообразующих клеток у мышей - Т-клеточный иммунитет)
К тестам по изучению действия иммуномодуляторов на Т-клеточное звено иммунного ответа относится определение изменения количества аутологичных розеткообразующих клеток (ауто-РОК).
Согласно данным Marian Е. et al. (1984) и Лескова В.П. (1984) ауто-РОК представляют собой посттимические клетки - предшественники Т-лимфоцитов, которые под влиянием сывороточного тимического фактора и интерлейкина-2 превращаются в зрелые клетки-хелперы и являются своеобразным резервом иммунной системы.
Материалы и методы
В исследовании использовали 50 мышей линии СВА массой 25-28 грамм. Было сформировано 2 группы (10 животных в контрольной группе, 40 в опытной):
1. Контрольная группа (иммунизированные животные, не получавшие экспериментальный препарат).
2. Опытная (иммунизированные животные, получавшие экспериментальный препарат).
Всех мышей однократно иммунизировали ЭБ в дозе 5-108 в объеме 0,3 мл/мышь. Животным опытной группы ежедневно перорально вводили испытуемый препарат, полученный по примеру 29, в терапевтической дозе (0,2 мл/кг), контрольные животные получали физраствор. Исследования проводили на 5, 10, 15 и 20 дни после дачи препарата. У умерщвленных животных извлекали селезенку, гомогенизировали, готовили суспензию клеток, обрабатывали ее 5%-ной суспензией ЭБ, определяли количество розеткообразующих клеток стандартными методами.
Результаты
На протяжении всего эксперимента наблюдалось статистически достоверное повышение как абсолютного, так и относительного количества розеткообразующих клеток в селезенках мышей опытной группы. Максимальных значений показатели достигли на 10-15-е сутки введения препарата - 18,3 и 17,4% (80,8 и 71,8 кл./мкл) соответственно, тогда как относительное и абсолютное количество ауто-РОК, зарегистрированных у животных в контроле, существенно не отличалось в течение всего опыта и составило 1,0-1,9% (30,5 и 36,3 кл./мкл). Число ауто-РОК на 10-ый день эксперимента в абсолютном выражении увеличилось более чем в 2 раза, а в относительном почти в 10 раз (см. таблицу 42).
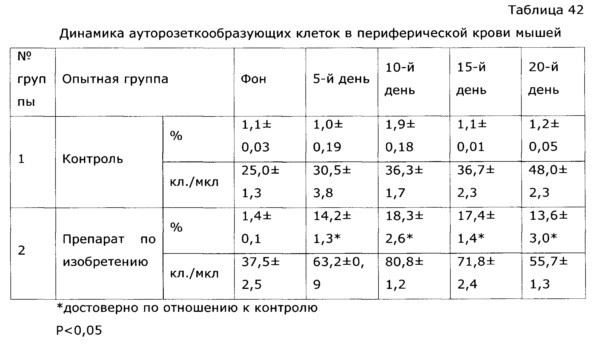
Пример 48 (Профилактика и лечение респираторных заболеваний собак)
На базе Балашихинской СББЖ в период с 10 марта по 30 июля 2010 года был испытан препарат, полученный по примеру 29, на собаках.
В весенний период наблюдаются респираторные заболевания новорожденных щенков. Летальный исход обычно составляет 15%.
Препарат применяли для профилактики и лечения респираторных заболеваний у щенков. Анализами было обнаружено наличие колибактерий, сальмонелл, протея.
С профилактической целью экспериментальный препарат давали 18 собакам два раза в сутки в течение 15-20 дней. Препарат вводили перорально по 1 мл на 5 кг массы животного. В случае наступления заболевания собакам вводили антибиотики и витамины. С 4-5 дня от начала медикаментозной терапии клинические признаки болезни исчезали, появлялась двигательная активность и аппетит. Все животные выздоровели. Летальных исходов не зафиксировано.
С лечебной целью экспериментальный препарат давали 19 щенкам, которые заболели диспепсией и бронхопневмонией на 3-5 день жизни. Клинические признаки заболевания выражались следующим: больные щенки лежали, состояние было угнетенное, затрудненное дыхание, повышение температуры тела, отказ от корма. Для лечения животным вводили антибиотики тетрациклинового ряда. Одновременно с этим давали экспериментальный препарат два раза в сутки в течение 25 дней. Признаки болезни исчезали к 4-5 дню от начала лечения. Применение препарата способствовало сокращению курса лечения в 2 раза. Но в этой группе было 2 павших щенка.
Применение препарата с профилактической и лечебной целью позволило повысить сохранность щенков.
Пример 49 (Лечение инфекционных заболеваний кошек)
На базе ФГУ Ступинской районной СББЖ с 20 июня по 30 августа 2010 года проведено испытание терапевтической эффективности лекарственного препарата, полученного по примеру 29, на кошках при лечении инфекционных заболеваний.
Эксперимент проводили на опытной группе из 13 кошек различных пород и возрастов с разными сроками заболевания герпесвирусной инфекцией. Диагноз ставился на основании эпизоотических, лабораторных и клинических данных. Экспериментальный препарат давали в дозе 1 мл на 5 кг массы животного два раза в день в течение 21 дня в комплексе с другими лекарственными средствами, традиционно применяемыми для лечения герпесвирусной инфекции: антибиотиками (ампициллин), сульфаниламидами (бисептол), антигистаминными препаратами (димедрол).
Контрольная группа из 9 кошек подверглась лечению антибиотиками, витаминами и другими средствами симптоматического лечения и восстановительной терапии.
Сроки наступления клинического выздоровления в опытной группе зависели от стадии заболевания. В начальной стадии (1-3 суток) препарат оказывал стойкий положительный эффект и болезнь клинически заканчивалась через 7-9 суток с последующим реабилитационным периодом. На более поздних стадиях заболевания болезнь затягивалась до 3 недель. Все животные выздоровели. Аллергических реакций и побочного действия на введение экспериментального препарата не отмечалось. В контрольной группе болезнь длилась от 2-6 недель. Выздоровление отмечалось не более чем у 30% кошек.
Таким образом, в комплексе со специфическими лекарственными средствами экспериментальный препарат проявил себя как хорошее средство лечения герпесвирусной инфекции кошек, что позволило повысить эффективность проводимой терапии и существенно сократить сроки выздоровления.
Пример 50 (Применение после хирургических операций)
На базе Бабушкинской участковой ветеринарной лечебницы в период с января по апрель 2010 года проводились клинические испытания препарата, полученного по примеру 29.
Препарат использовали после перенесенных хирургических операций на собаках и кошках. Под опытом находилось 12 собак и 17 кошек. Собакам после кастрации и кошкам после овариогистерэктомии давали экспериментальный препарат в течение 25-27 дней два раза в сутки в дозе 1 мл на 5 кг массы животного. Дополнительно не назначали никаких медикаментозных средств. У подопытных животных не наблюдалось в дальнейшем никаких осложнений.
Экспериментальный препарат был рекомендован в качестве профилактического средства, повышающего иммунную систему домашних животных.
Пример 51 (Применение после хирургических операций у кошек)
Проводили опыт на базе Воскресенской районной СББЖ с 5 июня по 25 августа 2010 года по испытанию терапевтической эффективности лекарственного препарата, полученного по примеру 29, на кошках после перенесенных хирургических операций.
Всего под опытом находилось 11 кошек разного возраста и породы. Экспериментальный препарат давали во время еды в дозе 1 мл на 5 кг массы животного два раза в день в течение 27 дней по показаниям. Опытные животные более легко переносили постоперационный период, были более активны по сравнению с контрольными животными, которые препарат не получали. Препарат хорошо переносился, побочного действия не проявлялось.
Таким образом, опытное лекарственное средство было рекомендовано в практику в постоперационный период у кошек.
Пример 52 (Применение при иммунодефицитных состояниях кошек)
На базе приюта для бездомных животных СГОБФ «Зоозащита плюс» Серпуховского района Московской области проведено испытание препарата, полученного по примеру 29, на 13 кошках разного пола, возраста и породной принадлежности с признаками иммунодефицитного состояния после химиотерапевтического лечения и антибиотикотерапии.
Животных со сходными клиническими признаками разделили на 2 группы. Первой группе (10 животных) вводили экспериментальный препарат в дозе 1 мл на 5 кг массы животного перорально два раза в день в течение 21-27 дней; вторая группа (3 животных) служила контролем и препарат не получала. Эффективность препарата оценивали на основании гематологических и биохимических показателей крови.
Применение экспериментального препарата способствовало эффективному лечению и нормализации гематологических и биохимических показателей крови.
Разработанный препарат явился хорошим средством лечения иммунодефицитного состояния после химиотерапевтического лечения и антибиотикотерапии кошек, что позволило повысить эффективность проводимой терапии и существенно сократить сроки выздоровления.
Пример 53 (Профилактика и лечение желудочно-кишечных заболеваний кошек)
На базе приюта СГОБФ «Зоозащита плюс» г. Серпухова Московской области в период с апреля по октябрь 2010 года проводились клинические испытания препарата, полученного по примеру 29. Испытания проводили с целью профилактики и лечения желудочно-кишечных заболеваний кошек (энтеритов).
С профилактической целью препарат вводили перорально 12 кошкам два раза в день по 1 мл на 5 кг массы животного в течение 21 дня. Клинические признаки после перенесения вирусных инфекций заканчивались через 15-19 дней полным выздоровлением.
С лечебной целью препарат применяли на 10 кошках после начала диареи в 20-дневном возрасте. Анамнез заболевания: у животных наблюдались симптомы диареи, они отказывались от корма, были угнетены. Экспериментальный препарат вводили перорально с первого дня проявления признаков заболевания в дозе 1 мл на 5 кг массы тела животного в течение 25 дней. Одновременно заболевшие кошки получали антибиотики согласно инструкции. На 3-й день от начала дачи препарата у кошек появилась двигательная активность, аппетит, признаки диареи остались незначительными.
Применение препарата с профилактической и лечебной целью способствовало отсутствию летальности и более быстрому восстановлению животных до физиологической нормы.
Пример 54 (Лечение желудочно-кишечных заболеваний собак)
Материалы и методы
Исследование проводили на собаках, поступивших в клинику с клиническими признаками патологии желудочно-кишечного тракта (ЖКТ) (диарея, неоформленный стул, метеоризм - т.е. с проявлениями клинико-лабораторного синдрома дисбактериоза). При назначении исследований животным проводили полное диагностическое обследование, включающее в себя лабораторные исследования: гематологические, копрологические, биохимические и инструментальные (рентгеновские и ультразвуковые исследования ЖКТ). Параллельно проводились иммунологические исследования и бактериологический анализ, который включал в себя подтирку выделенной микрофлоры к антибиотикам. Инфекционные заболевания исключали при помощи ИФА тестов компании ООО «Хема» и «ВетЭксперт».
Биохимические исследования проводили на биохимическом анализаторе «Mindray ВА-88А» с использованием диагностических систем фирмы «Ольвекс диагностикум». Ультразвуковую диагностику проводили на портативном ультразвуковом сканере марки «НТ1 PU-2200V» и «Mindray DP-6900» с использованием микроконвексных датчиков частотой 3,5-8 МГ. Рентгенологические исследования проводили на рентгеновском аппарате РУМ-20 и 12П6 (Россия) общепринятыми в рентгенологии методами.
Копрограмму и исследование на наличие яиц гельминтов и ооцист простейших, проводили по стандартным методам.
МТТ-тест проводили по следующей методике: выделенный лимфоидный пул (от пациентов) из цельной крови инкубировали по 500 мкл (2*108) в пробирках эппендорф при 37°С в течение 48 часов. Каждую пробирку с клеточными суспензиями по окончании инкубирования центрифугировали 10 мин при 1000 д.
Перерастворяли полученный осадок в 500 мкл раствора МТТ и инкубировали в течение часа. После инкубации клетки перерастворяли в 500 мкл ДМСО, отбирали по 200 мкл суспензии из каждой пробирки и помещали в лунки 96-луночного плоскодонного планшета. Показания оптической плотности считывали на планшетном ридере Multiscan Ascent Thermo (Scientific) (Bernas Т., Dobrucki J.W. 2000).
Лизосомально-катионовый тест проводили по общепринятому методу (Меньшиков В.В. 1999).
Фагоцитарную активность и фигоцитарное число определяли по методу (Пастер Е.У., Овод В.В., Позур В.К. 1989).
Определение субпопуляций лимфоцитов проводили методом розеткообразования по общепринятой методике (Петров И.В. и др. 1984).
Микробиологические исследования проводились по стандартным протоколам (Лабинская А.С. 1978).
Формирование групп проводили по сходным клиническим признакам и физиологическим показателям (см. таблицу 13). Было сформировано 2 группы: опытная и контрольная, по 5 особей обоего пола в каждой. Схема лечения контрольной группы включала следующее:
1. Диетическое дробное питание
2. Энтеродез или энтеросгель - внутрь
3. Очистительная клизма с энтеродезом
4. Физ. раствор или глюкоза 5% в/в
5. Гаммавит 0,5 мл на кг п/к
6. Лактобифадол, Ветом, Саинекс и т.д. (что есть в аптеке) - внутрь
7. Спазмолитики по показаниям
8. Кровеостанавливающие препараты по показаниям
9. Антибиотики при энтероколитах.
У опытной группы в схему лечения дополнительно включали препарат, полученный по примеру 30 (два раза в сутки во время кормления в дозе 1 мл на 5 кг массы в течение 27 дней).
У всех животных отмечался лейкоцитоз, показатели красной крови (эритроциты, гемоглобин и гематокрит) находились в пределах нормы (см. таблицу 44).
У животных была явно выражена гепатопатия и, по-видимому, воспалительные процессы тонкого отдела кишечника. На это указывало повышение активности таких ферментов как ALT и AST. Активация ферментов амилазы и липазы могла указывать на вовлеченность в данный процесс поджелудочной железы. А повышение активности щелочной фосфатазы указывало на то, что в воспалительный процесс была вовлечена и слизистая кишечника. Кроме того, повышение концентрации общего белка за счет глобулиновой фракции могло указывать, что воспалительный процесс в организме происходил с активацией условно патогенной микрофлоры (см. таблицу 45).

Копрологические исследования также показали нарушение функции поджелудочной железы и наличие воспалительных процессов, происходящих в кишечнике (см. таблицу 46).
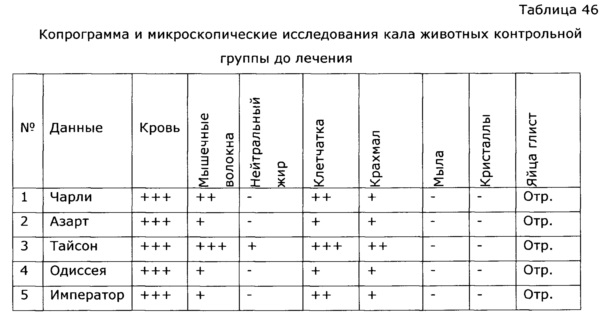
У заболевших животных было выявлено повышение пула В-лимфоцитов. Кроме того, наблюдалось смещение иммунорегуляторного индекса в сторону иммуносупрессии (см. таблицу 47)
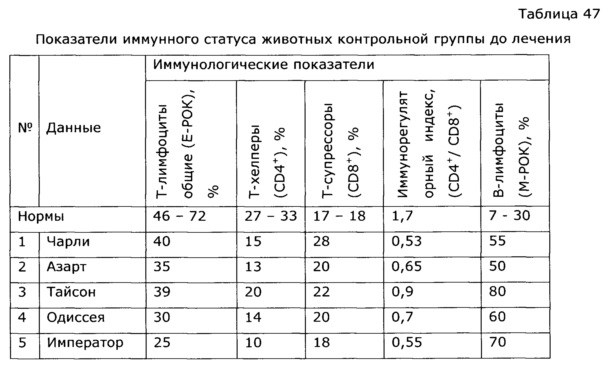

В период выздоровления у всех животных контрольной группы отмечалось постепенное восстановление показателей крови после оказания терапевтического воздействия (см. таблицу 48, 49).
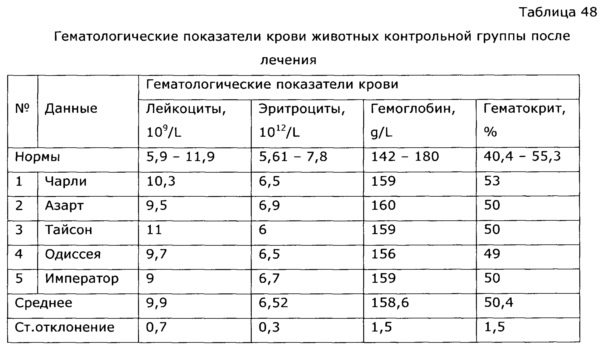
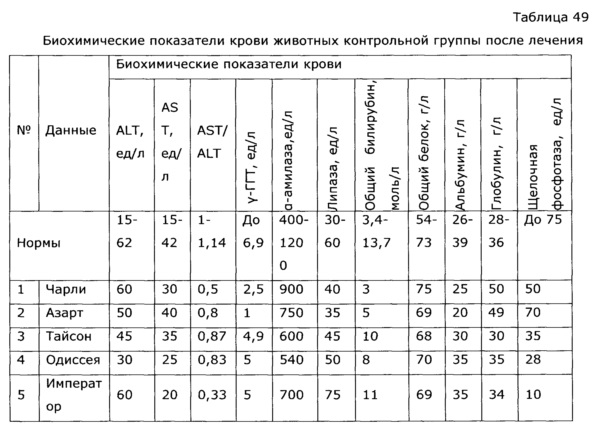
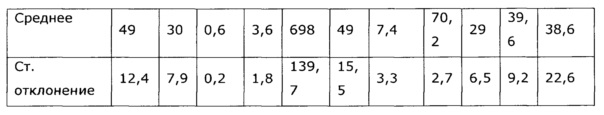
Положительная динамика также отмечалась и при проведении копрологических исследований (см. таблицу 50).
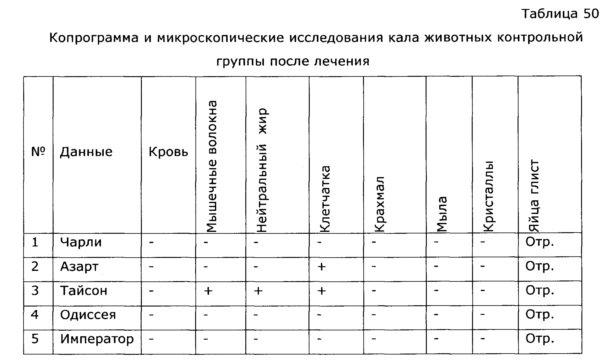
Иммунолгические исследования показали, что после лечения субпопуляции лимфоцитов в процентном отношении находились в пределах нормы, однако иммунорегуляторный индекс в среднем был ниже нормы, что указывало на преобладание в организме механизмов иммуносупрессии (см. таблицу 51).
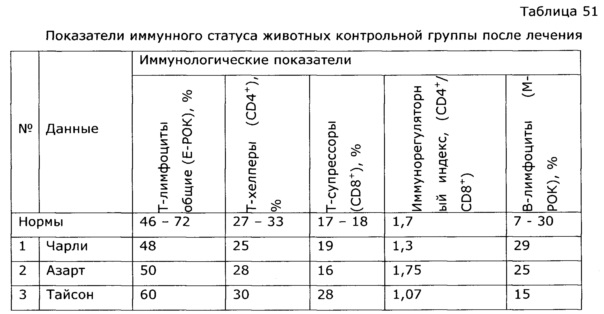
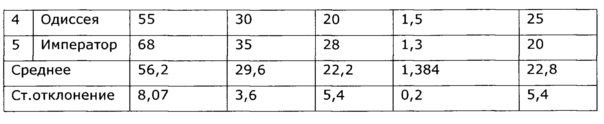
По мере проведения дальнейших реабилитационных процедур, отмечалось постепенное повышение неспецифических факторов иммунитета, таких как фагоцитарной активности, дыхательной активности, накопления катионного белка, что говорило о благоприятной динамике развития процесса выздоровления (см. таблицу 52).
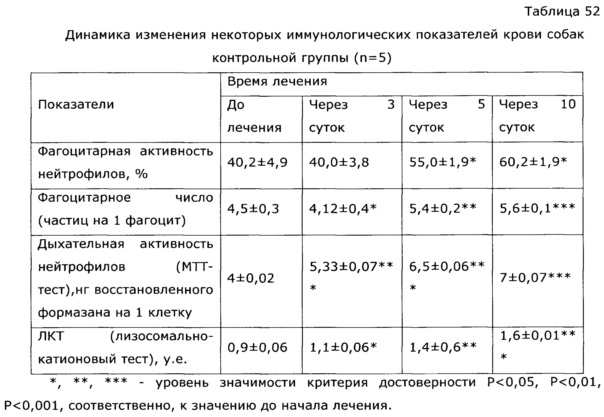
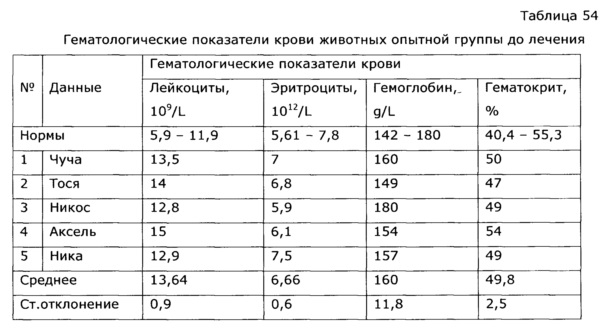
Аналогично животным контрольной группы у всех животных опытной группы отмечался лейкоцитоз, показатели красной крови (эритроциты, гемоглобин и гематокрит) находились в пределах нормы (см. таблицу 54).
У животных опытной группы биохимические показатели крови были сходны с таковыми животных контрольной группы, что свидетельствовало о гепатопатии и воспалительных процессах в тонком отделе кишечника (см. таблицу 55).
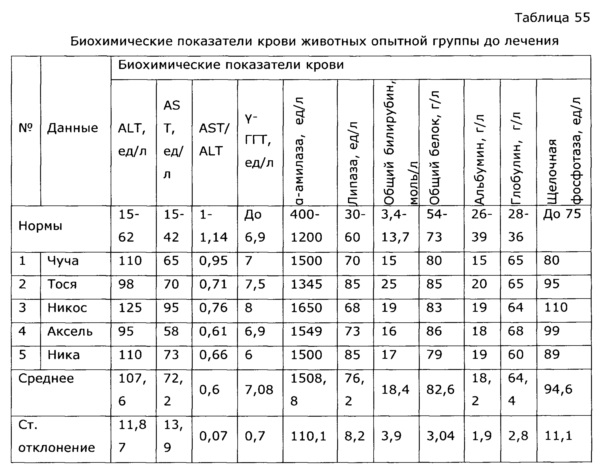
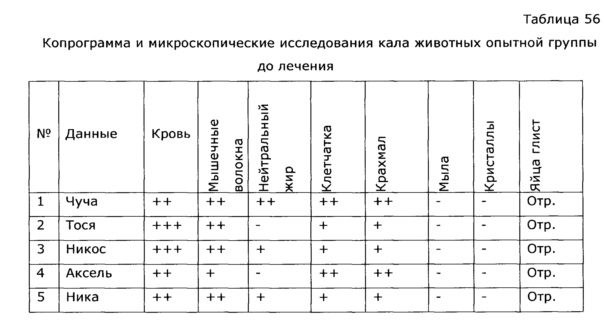
Копрологические исследования также показали нарушение функции поджелудочной железы и наличие воспалительных процессов, происходящих в кишечнике (см. таблицу 56).
У заболевших животных было выявлено повышение пула В-лимфоцитов, а также активация Т-хелперного и супрессорного звена иммунитета. Кроме того, наблюдалось смещение иммунорегуляторного индекса в сторону иммуносупрессии (см. таблицу 57).
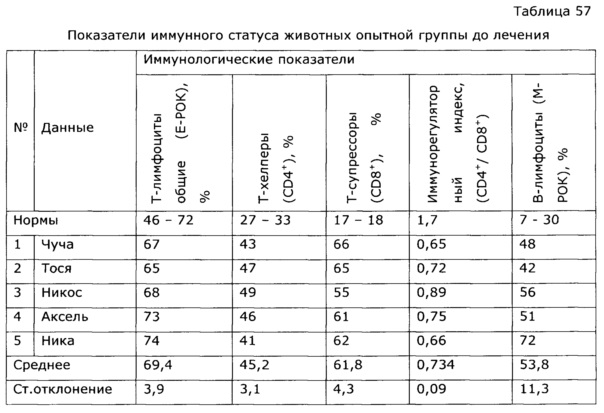
В период выздоровления у всех животных опытной группы отмечалось постепенное восстановление показателей крови после оказания терапевтического воздействия (см. таблицу 58, 59).
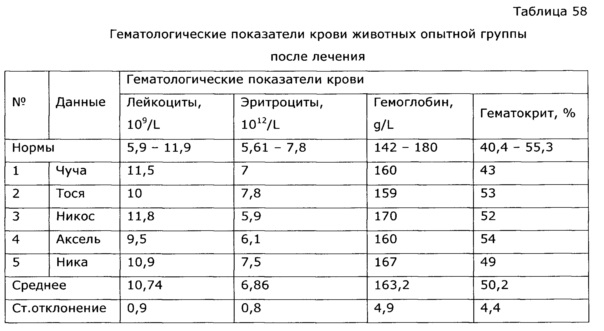
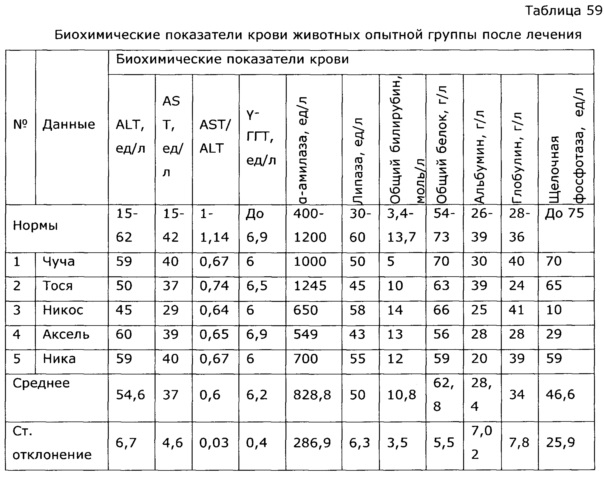
Положительная динамика также отмечалась и при проведении копрологических исследований (см. таблицу 60).

Иммунолгические исследования показали, что после лечения иммунорегуляторный индекс и субпопуляции лимфоцитов в процентном отношении находились в пределах нормы (см. таблицу 61). По мере проведения контрольного метода лечения отмечалось постепенное повышение неспецифических факторов иммунитета, таких как фагоцитарной активности, дыхательной активности, накопления катионного белка, что говорило о благоприятной динамике развития процесса выздоровления (см. таблицу 62).
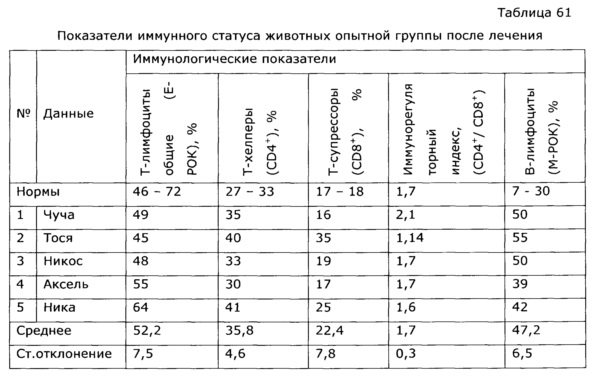
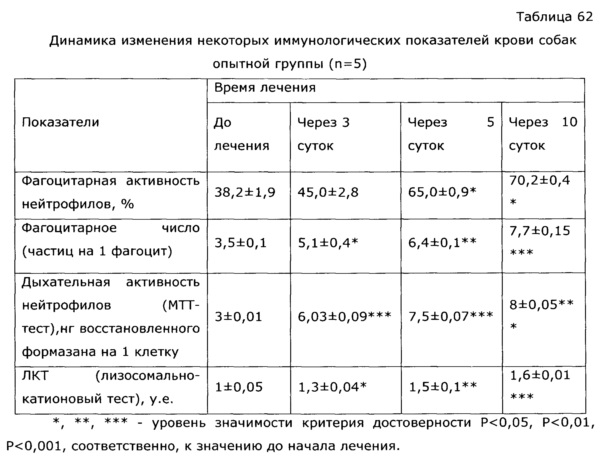
Картина биоценоза микрофлоры толстого отдела кишечника больных животных представлена в таблице 63.
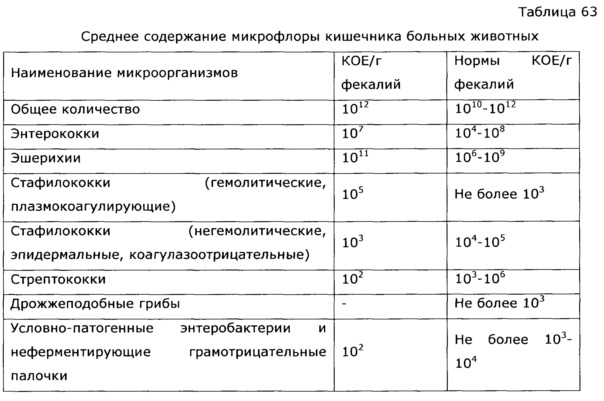
Для коррекции назначенного медикаментозного лечения выделенные штаммы кишечной палочки и стафилококка проверялись на чувствительность к антибиотикам (гемолитической и плазмокоагулирующей активностью) (см. таблицу 64).
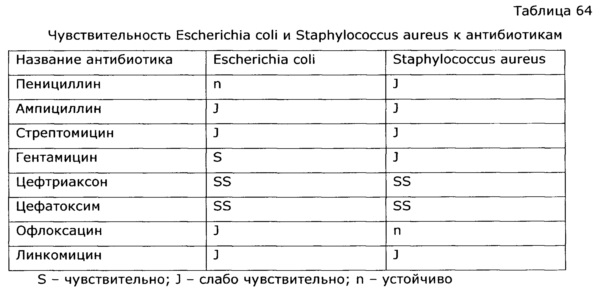
Выводы
Наблюдалось сокращение сроков лечения животных опытной группы. Животные контрольной группы лечились в среднем 10 дней, а опытной - 5-6, что связано с активацией иммунной системы. Нормализация иммунологических показателей крови в период выздоровления быстрее происходила в опытной группе, т.к. в контрольной отмечалась иммуносупрессия, выражавшаяся в сравнительно низком содержании Т-хелперных лимфоцитов и соответственно меньшем иммунорегуляторном индексе (см. таблицу 66).
При сравнении неспецифических факторов защиты у животных опытной группы отмечалась более интенсивная активация фагоцитирующего звена иммунитета по сравнению с контролем, что выражалось в увеличении показателей фагоцитарной активности на 10% и фагоцитирующего числа нейтрофилов в 1,4 раза на 10 сутки. Кроме того, у фагоцитирующих клеток опытной группы наблюдалось повышение дыхательной активности в 1,14 раза (см. таблицу 52, 62).
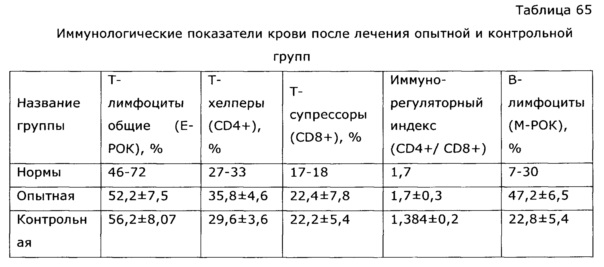
Таким образом, экспериментальный препарат в ходе клинических исследований показал себя как эффективный и безопасный лекарственный препарат иммуномодулирующего действия.
Пример 55 (исследование аллергизирующих свойств и местного раздражающего действия на слизистые оболочки)
Материалы и методы
Оценивали влияние экспериментального препарата, полученного по примеру 29 на интегральные модели аллергического ответа (конъюктивальная и внутрикожная проба, реакция дегрануляции тучных клеток) в ответ на применение препарата. Исследование проводили на морских свинках.
Конъюктивальные пробы на 12 день после внутрикожной сенсибилизации в дозе 0,2 мл/кг препаратом не отличались от аналогичных показателей у контрольных особей. Изменения сосудистого рисунка конъюктивы глаз через 15 минут и 24 часа были слабо выражены.
Аналогичные результаты были получены у животных, после 10 и 20 накожных аппликаций препарата в дозе 0,2 мл/кг. Кожный покров после 10 и 20 кратного нанесения препарата оставался без видимых изменений в течение всего срока наблюдения. Кожные реакции - цвет кожи (отсутствие гиперемии) и толщина кожной складки (отсутствие инфильтрации) после 10 и 20 кратных аппликаций не отличались от таковых у контрольных животных.
Нанесение препарата в ухо предварительно внутрикожно сенсибилизированным морским свинкам не вызывало кожных реакций гиперчувствительности немедленного и замедленного типа через 15 минут, 24, 48 и 72 часа.
Для тестирования сыворотки крови сенсибилизированных и контрольных морских свинок в реакции непрямой дегрануляции использовали тучные клетки, полученные из перитонеальной жидкости интактных белых крыс.

Процент дегранулированных тучных клеток у опытных животных незначительно отличался от аналогичного показателя контрольных особей и находился ниже 10%, что соответствует отрицательной оценке теста.
Для определения аллергизирующих реакций в крови препарат по примеру 29 вводили животным внутримышечно в дозе 0,2 мл/кг. Подсчет абсолютного количества эозинофилов в крови показал, что их количество у особей контрольной и опытной групп статистически достоверно не отличался (таблица 67).

Таким образом, на основании проведенных исследований показано, что внутримышечное введение препарата по примеру 29 в дозе 0,2 мл/кг не приводит к аллергизации организма животного.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛЕКАРСТВЕННОЕ СРЕДСТВО С НЕФРОПРОТЕКТОРНЫМ ДЕЙСТВИЕМ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2013 |
|
RU2535129C2 |
| СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА, ОБЛАДАЮЩЕГО ДИУРЕТИЧЕСКОЙ И ПРОТИВОВОСПАЛИТЕЛЬНОЙ АКТИВНОСТЬЮ | 2007 |
|
RU2342945C1 |
| СОСТАВ, ОБЛАДАЮЩИЙ ПРОТИВООПУХОЛЕВЫМ, ГЕПАТОПРОТЕКТОРНЫМ И ИММУНОСТИМУЛИРУЮЩИМ ДЕЙСТВИЕМ | 2002 |
|
RU2221586C1 |
| СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА, ОБЛАДАЮЩЕГО ГИПОТЕНЗИВНОЙ АКТИВНОСТЬЮ | 2000 |
|
RU2182487C2 |
| Средство, обладающее антигипоксическим и адаптогенным действием | 2021 |
|
RU2771555C1 |
| СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА, ОБЛАДАЮЩЕГО ЖЕЛЧЕГОННОЙ, ПРОТИВОСПАЛИТЕЛЬНОЙ АКТИВНОСТЯМИ | 2014 |
|
RU2557990C1 |
| СПОСОБ ПОЛУЧЕНИЯ РАСТИТЕЛЬНОГО СРЕДСТВА, ОБЛАДАЮЩЕГО ПРОТИВОВОСПАЛИТЕЛЬНЫМ ДЕЙСТВИЕМ | 2024 |
|
RU2827099C1 |
| СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА, ОБЛАДАЮЩЕГО ГИПОЛИПИДЕМИЧЕСКОЙ АКТИВНОСТЬЮ | 2000 |
|
RU2173161C1 |
| СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА, ОБЛАДАЮЩЕГО ГИПОГЛИКЕМИЧЕСКОЙ И ИММУНОМОДУЛИРУЮЩЕЙ АКТИВНОСТЬЮ | 2008 |
|
RU2356569C1 |
| Способ получения средства, обладающего желчегонной, противовоспалительной и антиоксидантной активностью | 2017 |
|
RU2665968C1 |
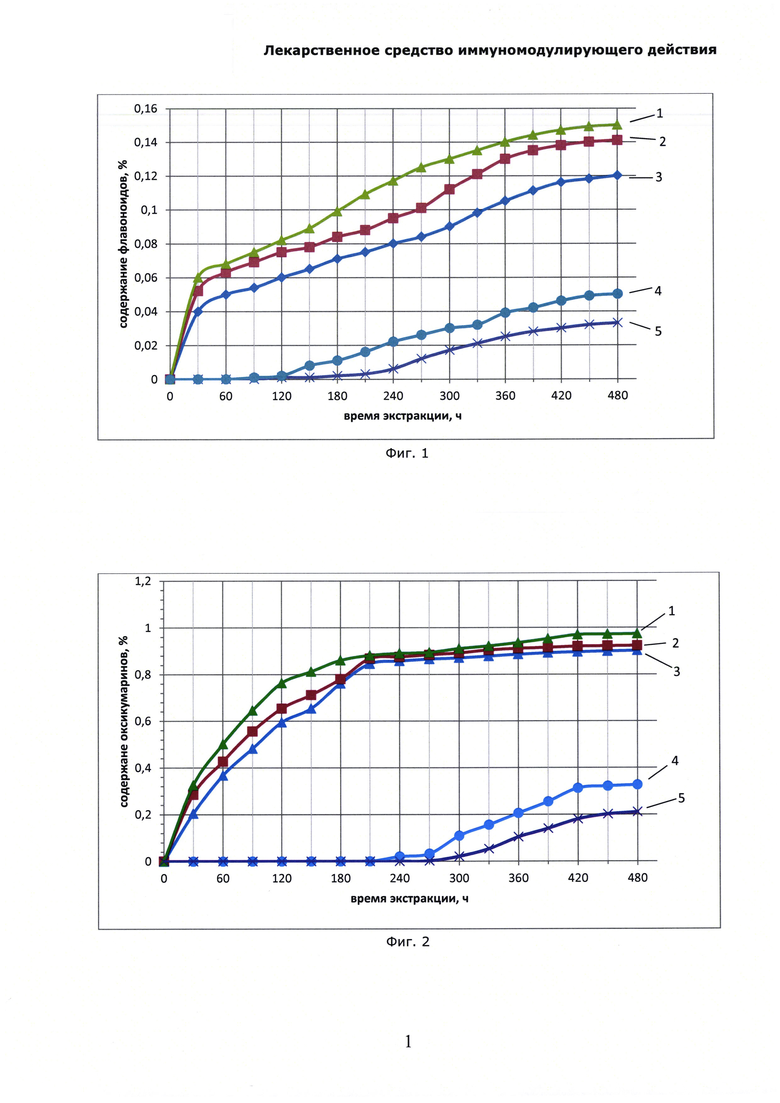
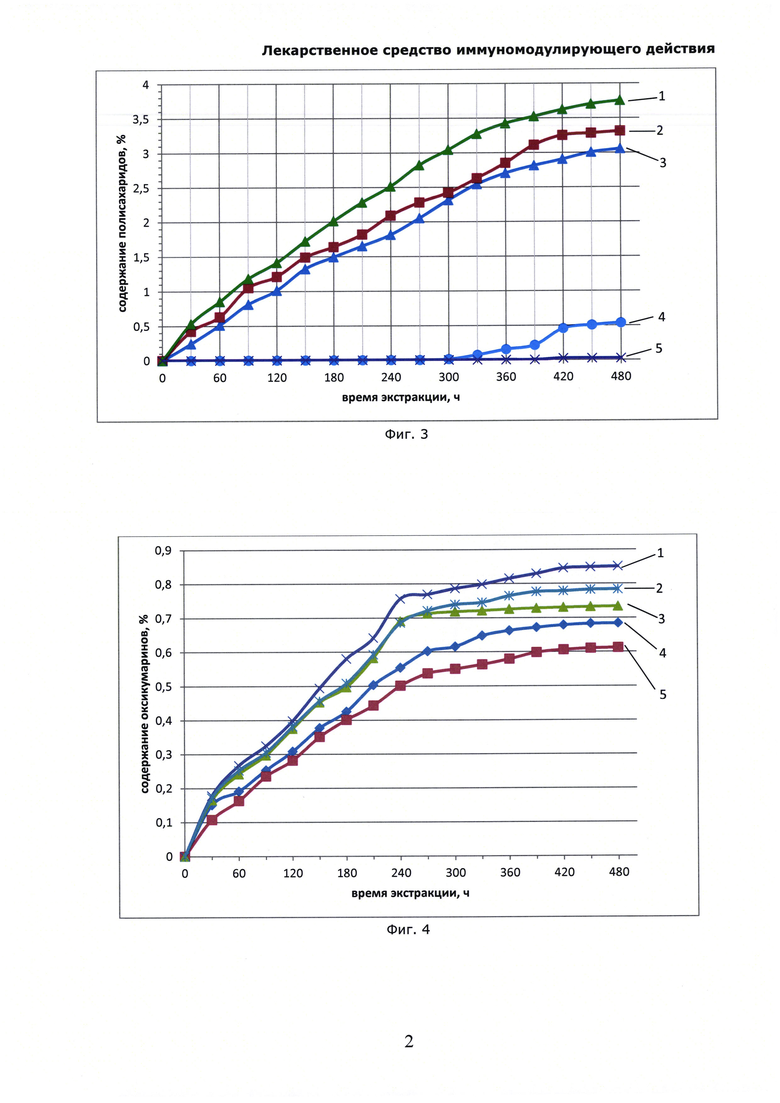
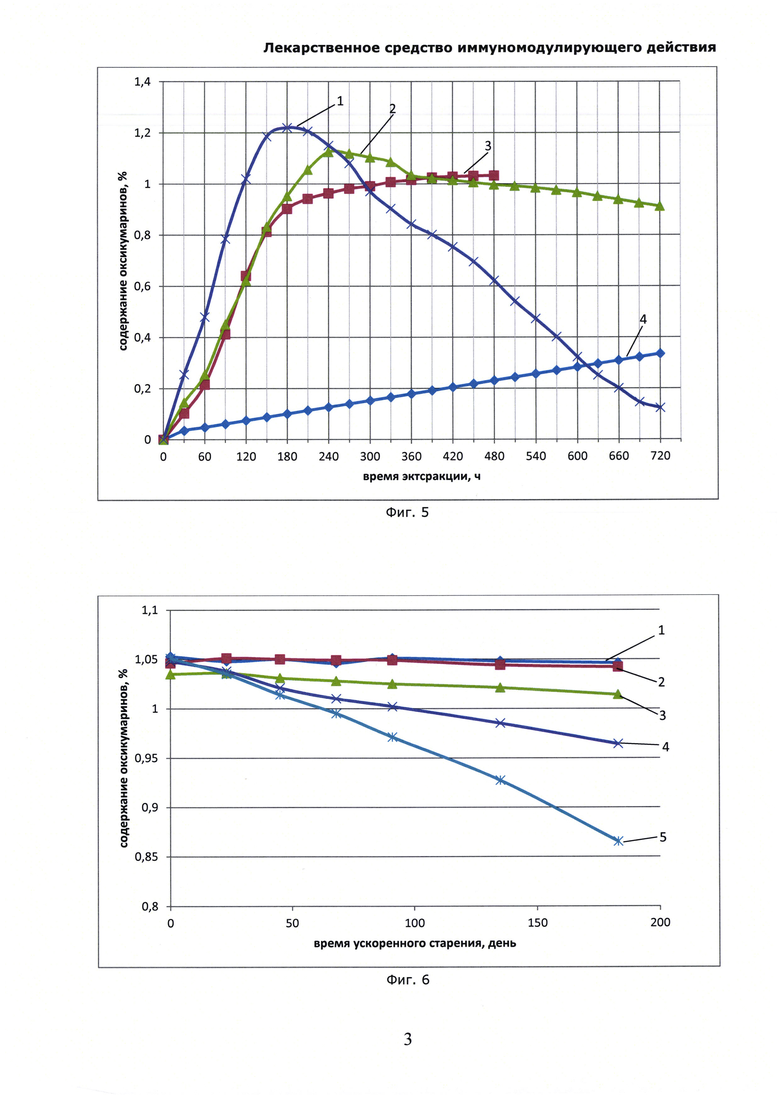
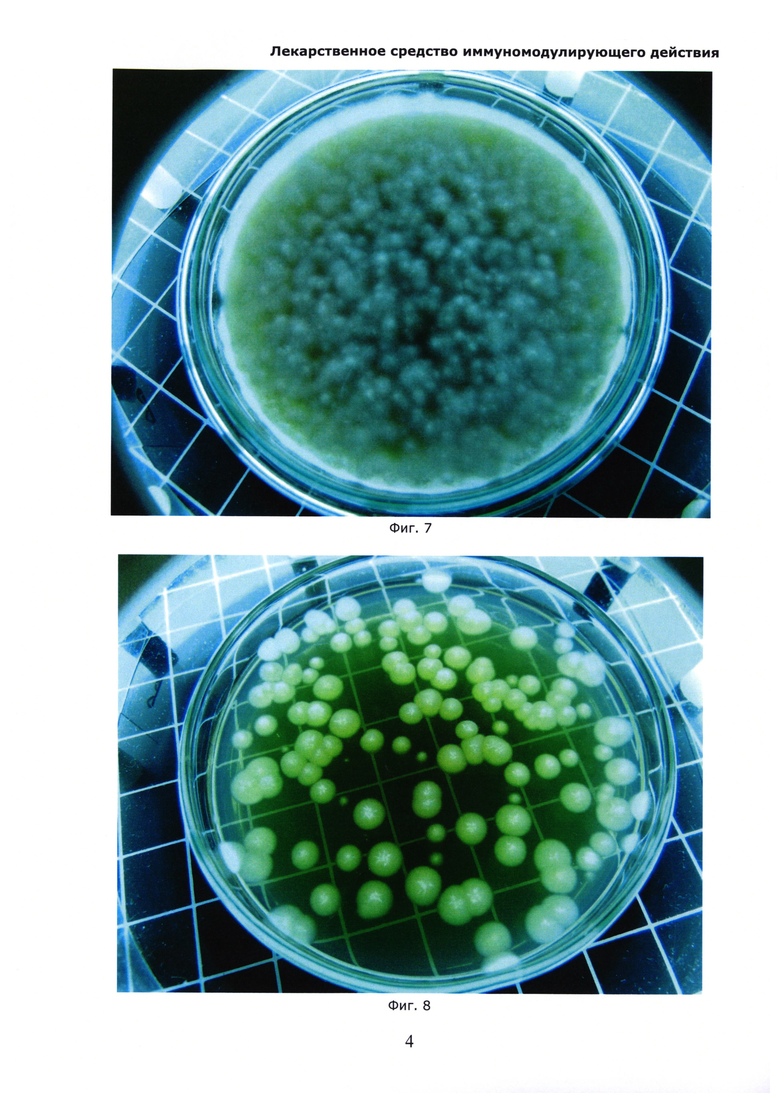
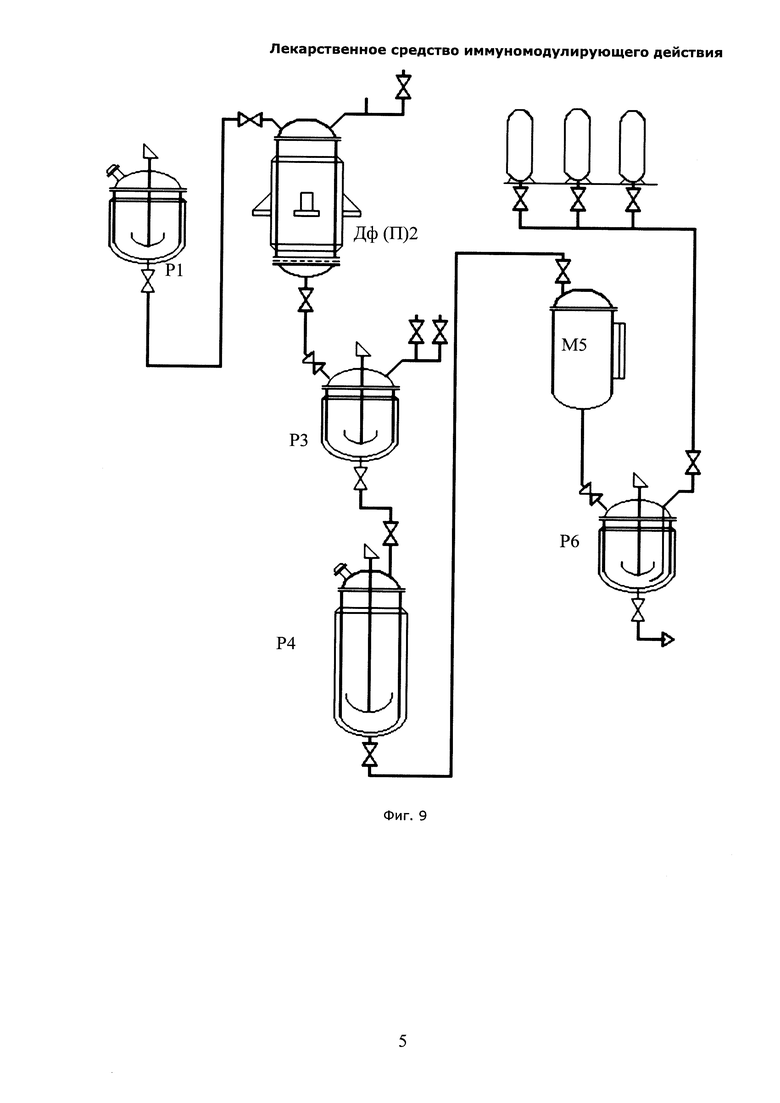
Изобретение относится к медицине, в частности к лекарственному средству, обладающему иммуномодулирующим и противовирусным действием. Лекарственное средство, обладающее иммуномодулирующим и противовирусным действием, представляющее собой экстракт травы солянки лиственничнолистной [Salsola laricifolia], полученный экстракцией сухой травы солянки лиственничнолистной [Salsola laricifolia] 30-80% водным раствором многоатомного спирта при 60-90°С; при этом используют соотношение экстрагент:сухая трава равное 1:(0,003-0,6) соответственно. Предлагаемое средство обладает выраженным иммуномодулирующим и противовирусным действием, эффективно повышает неспецифическую резистентность организма млекопитающих. 9 з.п. ф-лы, 9 ил., 67 табл., 55 пр.
1. Лекарственное средство с иммуномодулирующим и противовирусным действием, повышающее неспецифическую резистентность организма теплокровных животных к бактериальным и вирусным инфекциям, представляющее собой экстракт травы солянки лиственничнолистной [Salsola laricifolia], полученный экстракцией сухой травы солянки лиственничнолистной [Salsola laricifolia] 30-80% водным раствором многоатомного спирта при 60-90°C, при этом используют соотношение экстрагент:сухая трава, равное 1:(0,003-0,6) соответственно.
2. Лекарственное средство по п. 1, отличающееся тем, что в качестве многоатомного спирта используют 1,2-пропиленгликоль и/или глицерин, и/или эритритол, и/или ксилит, и/или сорбит, и/или маннит, и/или дульцит и/или инозит.
3. Лекарственное средство по п. 1, отличающееся тем, что при экстракции вводят стабилизаторы и консерванты, при этом стабилизаторы добавляют до достижения рН от 3,5 до 5,0, а консерванты в количестве 0,01-1,70 мас.%.
4. Лекарственное средство по п. 3, отличающееся тем, что в качестве стабилизаторов используют фармацевтически приемлемую карбоновую кислоту.
5. Лекарственное средство по п. 4, отличающееся тем, что в качестве фармацевтически приемлемой карбоновой кислоты используют аскорбиновую кислоту, и/или янтарную кислоту, и/или молочную кислоту, и/или яблочную кислоту, и/или уксусную кислоту, и/или лимонную кислоту, и/или винную кислоту, и/или виноградную кислоту, и/или глюконовую кислоту и/или фумаровую кислоту.
6. Лекарственное средство по п. 3, отличающееся тем, что в качестве консервантов используют бензойную кислоту или ее фармацевтически приемлемые соли в концентрации 0,01-0,5 мас.% и/или сорбиновую кислоту или ее фармацевтически приемлемые соли в концентрации 0,01-0,6 мас.% и/или бензиловый спирт в концентрации 0,014-0,6 мас.%.
7. Лекарственное средство по п. 1, отличающееся тем, что после экстракции вводят стабилизаторы и консерванты, при этом стабилизаторы добавляют до достижения рН от 3,5 до 5,0, а консерванты в количестве 0,01-1,70 мас.%.
8. Лекарственное средство по п. 7, отличающееся тем, что в качестве стабилизаторов используют фармацевтически приемлемую карбоновую кислоту.
9. Лекарственное средство по п. 8, отличающееся тем, что в качестве фармацевтически приемлемой карбоновой кислоты используют аскорбиновую кислоту, и/или янтарную кислоту, и/или молочную кислоту, и/или яблочную кислоту, и/или уксусную кислоту, и/или лимонную кислоту, и/или винную кислоту, и/или виноградную кислоту, и/или глюконовую кислоту, и/или фумаровую кислоту.
10. Лекарственное средство по п. 7, отличающееся тем, что в качестве консервантов используют бензойную кислоту или ее фармацевтически приемлемые соли в концентрации 0,01-0,5 мас.% и/или сорбиновую кислоту или ее фармацевтически приемлемые соли в концентрации 0,01-0,6 мас.% и/или бензиловый спирт в концентрации 0,014-0,6 мас.%.
| БАТСУХ ЦЭРЭНДОЛГОР и др | |||
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| БАТСУХ ЦЭРЭНДОЛГОР и др | |||
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| БИОЛОГИЧЕСКИ АКТИВНАЯ ДОБАВКА К ПИЩЕ, ОБЛАДАЮЩАЯ ГЕПАТОПРОТЕКТОРНЫМИ И ИММУНОСТИМУЛИРУЮЩИМИ СВОЙСТВАМИ | 2012 |
|
RU2516932C2 |
| RU 2203676 С2,) 10.05.2003 | |||
| WEN Z et all | |||
| Salsola laricifolia, another C3-C 4 intermediate species in tribe Salsoleae s.l | |||
| (Chenopodiaceae) //Photosynth Res., 2015 Jan, 123(1): 333-43. | |||
Авторы
Даты
2017-08-28—Публикация
2016-10-31—Подача