Область техники
Настоящее изобретение относится в целом к слитым белкам, и более конкретно - к слитым белкам для усиления опосредованных Т-клетками иммунных ответов.
Предшествующий уровень техники
Молекулярная биология обеспечила производство субъединичных вакцин, в которых иммуноген является фрагментом или субъединицей исходного белка или комплекса. Желательна разработка стабильной вакцины, которая могла бы вызвать ответы, опосредованные сенсибилизированными Т-клетками, и которая была бы достаточно гибкой для включения в нее последовательностей из многих штаммов инфекционных агентов.
Сущность изобретения
В одном из аспектов настоящее изобретение относится к слитому белку, содержащему:
(a) домен связывания с антигенпрезентирующей клеткой (АПК) или домен связывания с рецептором CD91, расположенный на N-конце слитого белка;
(b) домен трансдукции белка, расположенный на С-конце домена связывания с АПК или домена связывания с рецептором CD91, причем домен трансдукции белка выбран из группы, состоящей из:
(i) слитого полипептида, содержащего пептид, трансдуцирующий сигнал, сенсибилизирующий Т-клетки, линкер и транслокационный пептид, причем:
(1) пептид, трансдуцирующий сигнал, сенсибилизирующий Т-клетки, расположен на N-конце слитого полипептида;
(2) линкер содержит последовательность SEQ ID NO: 15, связывающую пептид, трансдуцирующий сигнал, сенсибилизирующий Т-клетки, и транслокационный пептид; и
(3) транслокационный пептид имеет длину от 34 до 112 аминокислотных остатков и содержит аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 3, 20 или 4;
(ii) пептида, трансдуцирующего сигнал, сенсибилизирующий Т-клетки; и
(iii) транслокационного пептида, длина которого равна 34-46 аминокислотным остаткам, содержащего аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 3 или 20; и
(с) антиген патогена, расположенный на С-конце домена трансдукции белка,
причем:
- пептид, трансдуцирующий сигнал, сенсибилизирующий Т-клетки, имеет длину от 28 до 53 аминокислотных остатков и содержит аминокислотную последовательность SEQ ID NO: 31, в которой Хаа8 соответствует I или L; Хаа10 соответствует V, F или А, Хаа11 Соответствует М или L, Хаа17 соответствует L или I; и
- домен связывания с антигенпрезентирующей клеткой (АПК) или домен связывания с рецептором CD91 не содержит аминокислотной последовательности домена I связывания экзотоксина A Pseudomonas (РЕ; от англ. Pseudomonas exotoxin), если домен трансдукции белка является транслокационным пептидом (biii).
В одном из вариантов осуществления настоящего изобретения домен связывания с АПК или домен связывания с рецептором CD91 является полипептидом, содержащим аминокислотную последовательность, которая по меньшей мере на 90% идентична последовательности, выбранной из группы, состоящей из последовательностей SEQ ID NO: 5, 9, 6, 7 и 8. Альтернативно, домен связывания с АПК выбран из группы, состоящей из домена III рецептор-ассоциированного белка-1 (RAP1; от англ.: receptor-associated protein-1), белка, ассоциированного с рецептором альфа-2-макроглобулина (А2М; от англ.: alpha-2-macroglobulin), белка Tat ВИЧ, белков теплового шока (HSPs; от англ.: heat shock proteins) и домена I связывания экзотоксина A Pseudomonas (РЕ).
В другом варианте осуществления настоящего изобретения слитый белок не содержит последовательности аминокислот домена I связывания экзотоксина А Pseudomonas (РЕ).
В другом варианте осуществления настоящего изобретения слитый белок содержит последовательность, обеспечивающую удержание в эндоплазматическом ретикулуме, расположенную на С-конце слитого белка.
В другом варианте осуществления настоящего изобретения последовательность, обеспечивающая удержание в эндоплазматическом ретикулуме, содержит последовательность аминокислот Lys-Asp-Glu-Leu (SEQ ID NO: 14). Последовательность, обеспечивающая удержание в эндоплазматическом ретикулуме, может содержать последовательность, выбранную из группы, состоящей из SEQ ID NO: 14 и с 16 по 19. Альтернативно, последовательность, обеспечивающая удержание в эндоплазматическом ретикулуме, может состоять из последовательности, выбранной из группы, состоящей из SEQ ID NO: с 16 по 19.
В другом варианте осуществления настоящего изобретения слитый белок не содержит последовательности, обеспечивающей удержание в эндоплазматическом ретикулуме, на его С-конце, если антиген содержит 10 или более эпитопов.
В другом варианте осуществления настоящего изобретения домен трансдукции белка является слитым полипептидом (bi).
В другом варианте осуществления настоящего изобретения домен трансдукции белка является пептидом, трансдуцирующим сигнал, сенсибилизирующий Т-клетки (bii).
В другом варианте осуществления настоящего изобретения слитый белок дополнительно содержит дополнительный линкер, расположенный между доменом трансдукции белка и антигеном, причем дополнительный линкер содержит последовательность SEQ ID NO: 15.
В другом варианте осуществления настоящего изобретения домен трансдукции белка является транслокационным пептидом (biii).
В другом варианте осуществления настоящего изобретения слитый белок дополнительно содержит дополнительный линкер, расположенный между доменом связывания АПК или доменом связывания рецептора CD91 и транслокационным пептидом, причем дополнительный линкер содержит последовательность SEQ ID NO: 15.
В другом варианте осуществления настоящего изобретения домен трансдукции белка содержит последовательность SEQ ID NO: 30.
В другом варианте осуществления настоящего изобретения домен связывания АПК содержит последовательность аминокислот, которая по меньшей мере на 95% идентична последовательности, выбранной из группы, состоящей из SEQ ID NO: 5, 9, 6, 7 и 8.
В другом варианте осуществления настоящего изобретения домен связывания АПК или домен связывания рецептора CD91 является полипептидом, содержащим последовательность аминокислот, выбранную из группы, состоящей из SEQ ID NO: 5, 9, 6, 7 и 8.
В другом варианте осуществления настоящего изобретения пептид, трансдуцирующий сигнал, сенсибилизирующий Т-клетки, содержит последовательность аминокислот, выбранную из группы, состоящей из SEQ ID NO: 1 и 2.
В другом варианте осуществления настоящего изобретения транслокационный пептид содержит последовательность аминокислот SEQ ID NO: 3.
В другом варианте осуществления настоящего изобретения транслокационный пептид имеет длину от 34 аминокислотных остатков до 61 аминокислотного остатка.
В другом варианте осуществления настоящего изобретения домен трансдукции белка, входящий в состав слитого белка, как указано выше, обладает следующими свойствами: (i) пептид, трансдуцирующий сигнал, сенсибилизирующий Т-клетки, содержит последовательность аминокислот SEQ ID NO: 1 или 2; и (и) транслокационный пептид содержит последовательность аминокислот, которая по меньшей мере на 95% идентична SEQ ID NO: 3.
Пептид, трансдуцирующий сигнал, сенсибилизирующий Т-клетки, обладает способность индуцировать появления антитела, которое распознает и связывается с последовательностью аминокислот K1(X)2E3(X)4(X)5Y6P7P8P9Y10 (SEQ ID NO: 32) рецептора CD28 Т-клеток, причем (X)2 соответствует I или L; (X)4 соответствует V, F или А, и (X)5 соответствует М или L.
В другом аспекте настоящее изобретение относится к слитому белку, состоящему из:
(a) домена связывания с антигенпрезентирующей клеткой (АПК) или домена связывания с рецептором CD91, расположенного на N-конце слитого белка;
(b) домена трансдукции белка, расположенного на С-конце домена связывания с АПК или домена связывания с рецептором CD91, причем домен трансдукции белка выбран из группы, состоящей из:
(i) слитого полипептида, содержащего пептид, трансдуцирующий сигнал, сенсибилизирующий Т-клетки, линкер и транслокационный пептид, причем:
(1) пептид, трансдуцирующий сигнал, сенсибилизирующий Т-клетки, расположен на N-конце слитого полипептида;
(2) линкер содержит последовательность SEQ ID NO: 15, связывающую пептид, трансдуцирующий сигнал, сенсибилизирующий Т-клетки, и транслокационный пептид; и
(3) транслокационный пептид имеет длину от 34 до 112 аминокислотных остатков и содержит аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 3, 20 или 4;
(ii) пептида, трансдуцирующего сигнал, сенсибилизирующий Т-клетки; и
(iii) транслокационного пептида, длина которого равна 34-46 аминокислотным остаткам, содержащего аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 3 или 20; и
(c) антигена патогена, расположенного на С-конце домена трансдукции белка,
причем:
- пептид, трансдуцирующий сигнал, сенсибилизирующий Т-клетки, имеет длину от 28 до 53 аминокислотных остатков и содержит аминокислотную последовательность SEQ ID NO: 31, в которой Хаа8 соответствует I или L; Хаа10 соответствует V, F или А, Хаа11 соответствует М или L, Хаа17 соответствует L или I; и
- домен связывания с антигенпрезентирующей клеткой (АПК) или домен связывания с рецептором CD91 не содержит аминокислотной последовательности домена I связывания экзотоксина A Pseudomonas (РЕ; от англ. Pseudomonas exotoxin), если домен трансдукции белка является транслокационным пептидом (biii).
Антигенпрезентирующая клетка (АПК) может быть выбрана из группы, состоящей из дендритных клеток, макрофагов, В-клеток и моноцитов.
В одном из вариантов осуществления настоящего изобретения клеточная мембрана АПК содержит рецептор CD91.
В другом аспекте настоящее изобретение относится к композиции вакцины, содержащей: (а) терапевтически эффективное количество слитого белка, описанного выше, и (b) адъювант.
Адъювант является либо агентом, обеспечивающим доставку антигена, либо иммуностимулятором. В одном из вариантов осуществления настоящего изобретения композиция вакцины содержит агент, обеспечивающий доставку антигена, и не содержит иммуностимулятора.
В еще одном аспекте изобретение относится к способу индуцирования усиленных антигенспецифических Т-клеточных ответов против патогена, включающему: введение композиции вакцины, содержащей терапевтически эффективное количество слитого белка, описанного выше, нуждающемуся в этом субъекту и индуцирование за счет этого усиленного антигенспецифического Т-клеточного ответа против патогена.
В еще одном аспекте изобретение относится к способу уничтожения болезненной клетки, которая презентирует антиген через молекулы класса I главного комплекса гистосовместимости (МНС; от англ.: major histocompatibily complex) на клеточной мембране болезненной клетки, включающему: введение композиции вакцины, содержащей терапевтически эффективное количество слитого белка, описанного выше, нуждающемуся в этом субъекту и уничтожение за счет этого болезненной клетки, которая презентирует антиген через молекулы класса I МНС на клеточной мембране болезненной клетки.
В одном из вариантов осуществления настоящего изобретения болезненная клетка является раковой клеткой.
В еще одном аспекте изобретение относится к способу профилактики или лечения инфекции, вызванной патогеном, и/или минимизации симптомов, вызванных инфекцией, включающему: введение композиции вакцины, содержащей терапевтически эффективное количество вышеуказанного слитого белка, нуждающемуся в этом субъекту и за счет этого профилактику или лечение инфекции, вызванной патогеном, и/или минимизацию симптомов, вызванных инфекцией. Изобретение также относится к слитому белку или композиции вакцины, описанным выше, для применения для индуцирования усиленных антигенспецифических Т-клеточных ответов против патогенов или для применения для уничтожения болезненной клетки, которая презентирует антиген через молекулы класса I МНС на клеточной мембране болезненной клетки, или для применения для профилактики или лечения инфекции, вызванной патогеном, и/или для минимизации симптомов, вызванных инфекцией.
Патоген может быть по меньшей мере одним патогеном, выбранным из группы, состоящей из вируса папилломы человека (HPV; от англ.: human papillomavirus), вируса репродуктивно-респираторного синдрома свиней (PRRSV; от англ.: porcine reproductive and respiratory syndrome virus), вируса иммунодефицита человека (ВИЧ-1), вируса гриппа, вируса болезни Денге, вируса гепатита С (HCV; от англ.: hepatitis С virus), вируса гепатита В (HBV; от англ.: hepatitis В virus) и цирковируса 2 свиней (PCV2; от англ.: porcine circovirus 2).
В одном из вариантов осуществления настоящего изобретения вышеописанный слитый белок предназначен для применения для усиления антигенспецифического цитотоксичего Т-клеточного ответа у нуждающегося в этом субъекта. Слитый белок также может быть предназначен для применения для усиления антигенспецифического CD4+ Т-клеточного ответа или для применения в качестве иммуногенного усилителя для индуцирования усиленного ответа в форме повышения титра антигенспецифического антитела у нуждающегося в этом субъекта.
Эти и другие аспекты станут очевидными из приведенного ниже описания предпочтительного варианта осуществления настоящего изобретения совместно с приведенными ниже графическими материалами, хотя возможны вариации и модификации настоящего изобретения без отклонения от сущности и объема новых идей раскрытия сущности изобретения.
Прилагаемые графические материалы иллюстрируют один или более вариантов осуществления настоящего изобретения и совместно с письменным описанием служат для разъяснения принципов настоящего изобретения. Насколько это возможно, на всех графических материалах использованы одинаковые ссылочные номера для обозначения одинаковых или сходных элементов настоящего изобретения.
Краткое описание графических материалов
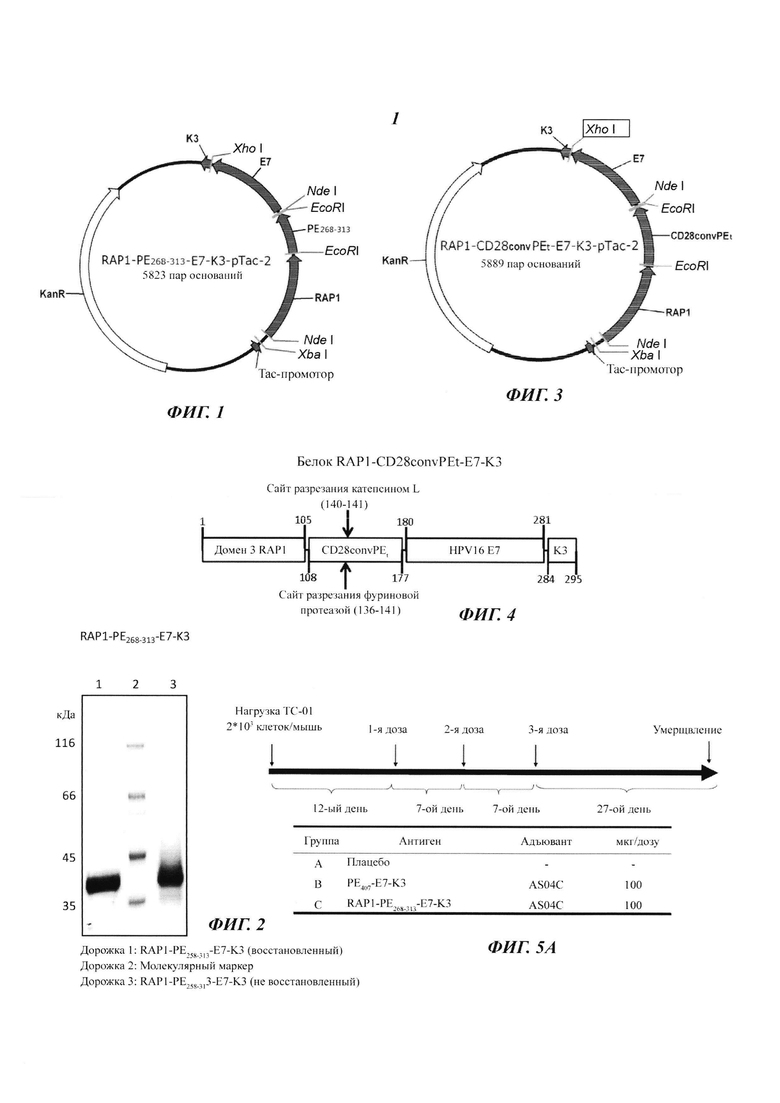
Фиг. 1 является картой вектора транскрипции.
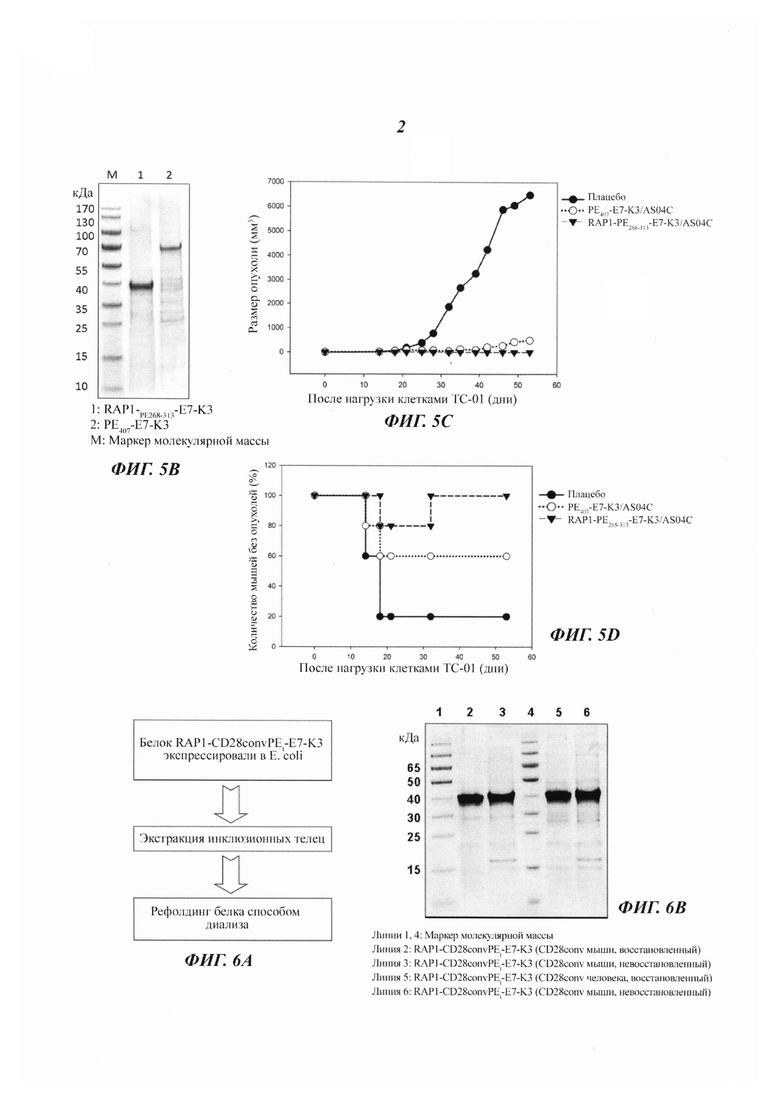
Фиг. 2 является фотографией, демонстрирующей результаты анализа слитых белков способом электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE; от англ.: sodium dodecylsulphate-polyacrylamide gel electrophoresis).
Фиг. 3 является картой вектора транскрипции.
Фиг. 4 является схематическим изображением, иллюстрирующим вариант осуществления настоящего изобретения.
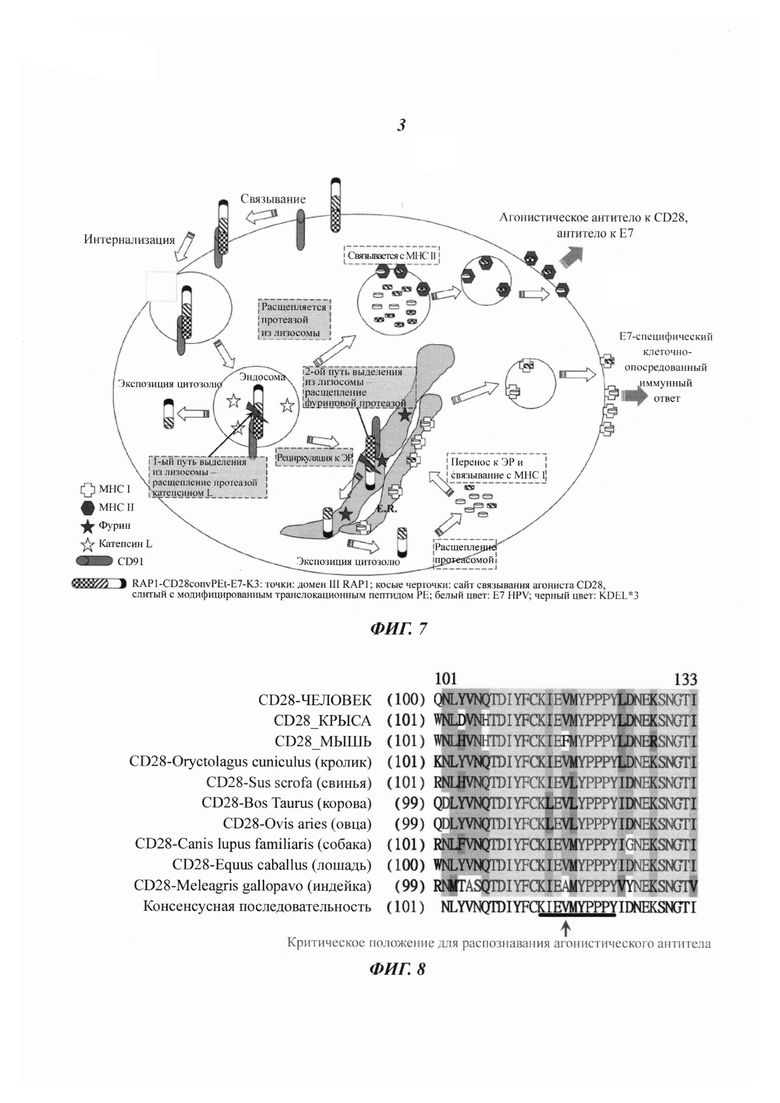
Фиг. 5А демонстрирует графики иммунизации.
Фиг. 5В является фотографией, демонстрирующей результаты анализа слитых белков способом SDS-PAGE.
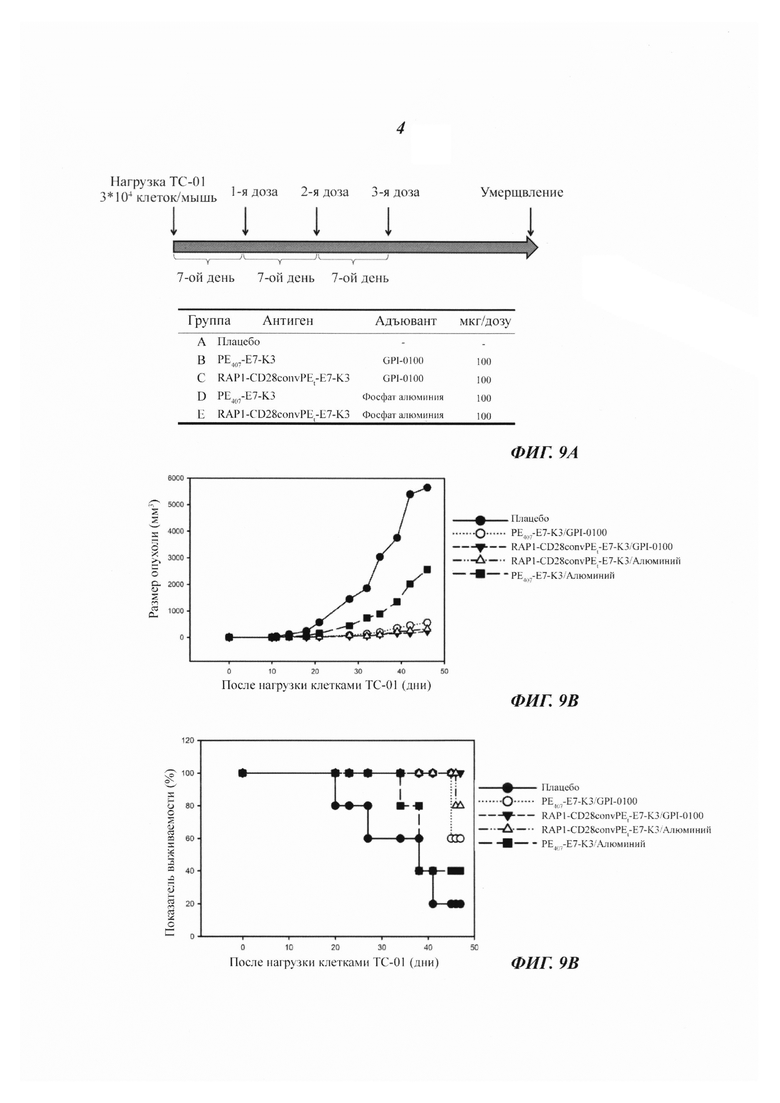
Фиг. 5С-5D являются графиками, изображающими кривые размеров опухолей и процент мышей, не имеющих опухолей, в группах животных, вакцинированных различными слитыми белками или плацебо, соответственно.
Фиг. 6 изображает технологическую схему (левая часть) получения слитых белков и фотографию (правая часть), демонстрирующую результаты анализа слитых белков способом SDS-PAGE.
Фиг. 7 является схематическим изображением, иллюстрирующим механизмы действия слитых белков, сенсибилизирующих Т-клетки.
Фиг. 8 демонстрирует линейные последовательности CD28 различных видов.
Фиг. 9А изображает графики иммунизации.
Фиг. 9В-9С демонстрируют кривые размеров опухолей и выживаемость, в группах животных, вакцинированных различными слитыми белками или плацебо, соответственно.
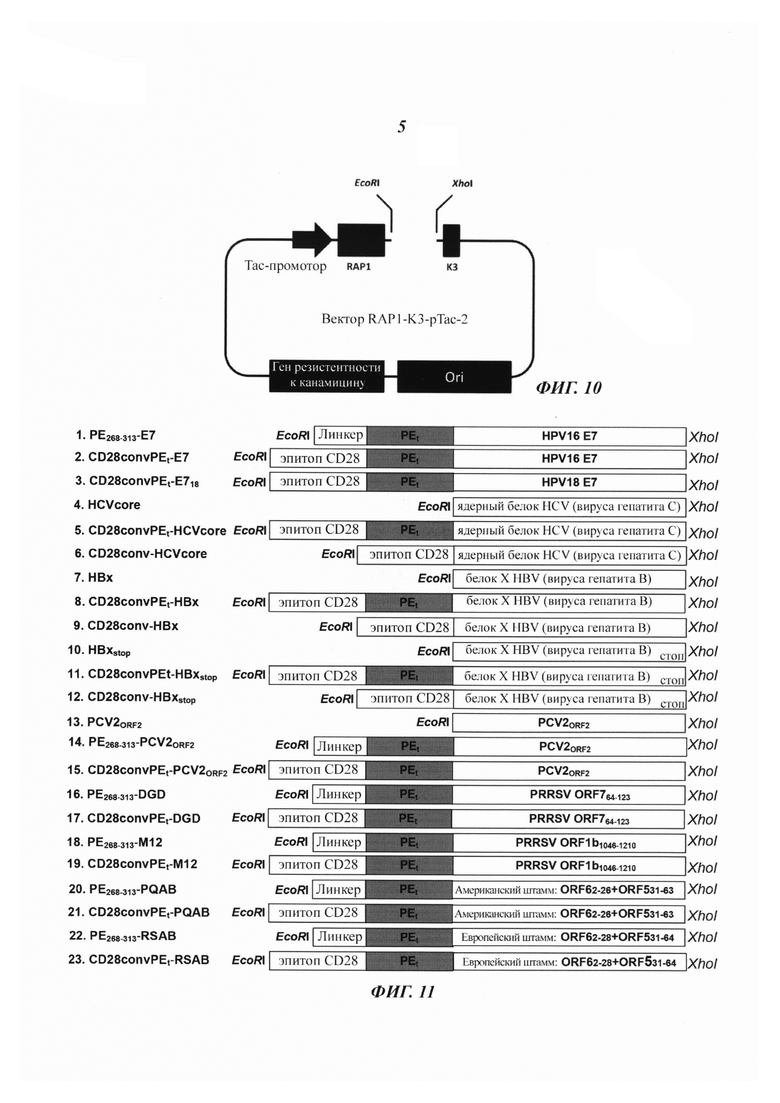
Фиг. 10 является схематическим изображением, демонстрирующим вектор, содержащий RAP1, используемый для получения плазмид, содержащих ДНК-вставку из патогеном.
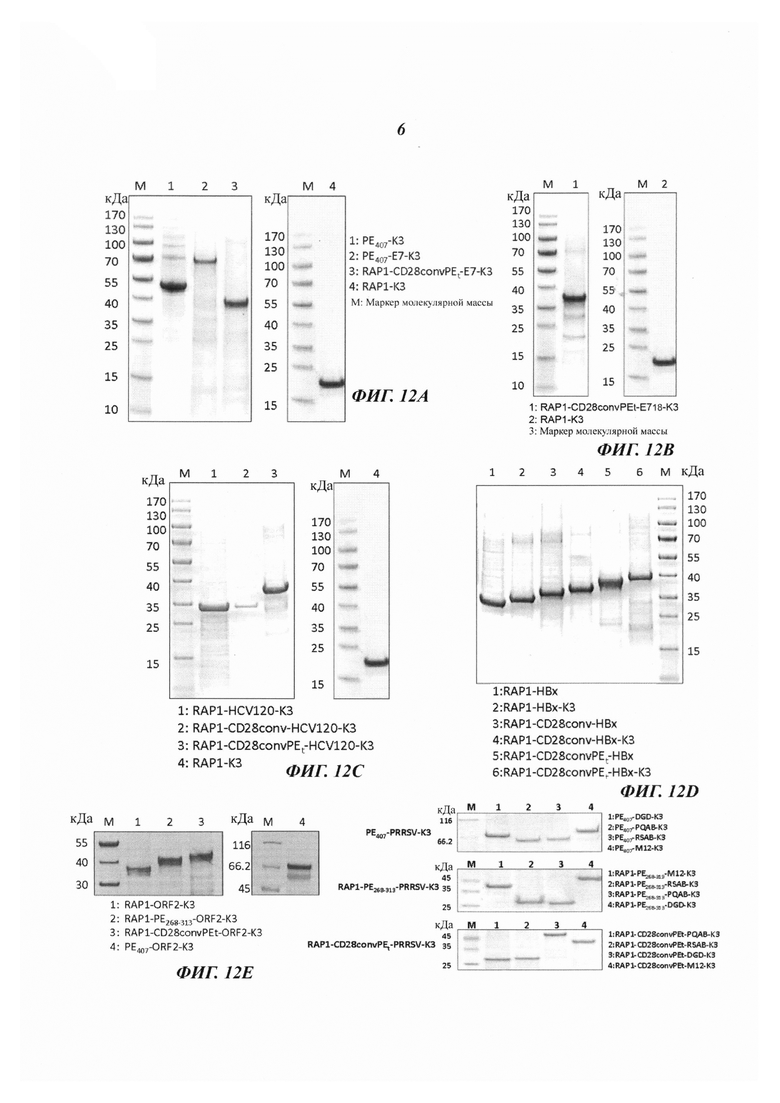
Фиг. 11 является схематическим изображением, иллюстрирующим конструкции слитых белков, содержащих антигены различных патогенов.
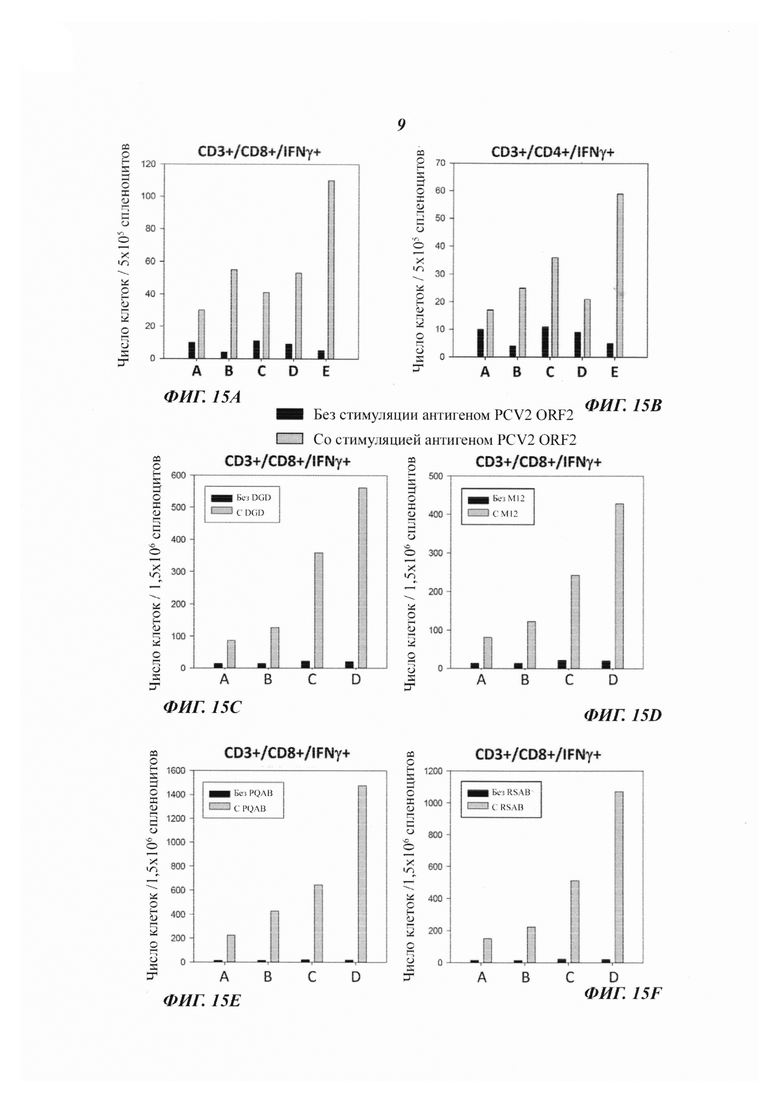
Фиг. 12А-12F являются фотографиями, демонстрирующими результаты анализа различных слитых белков способом SDS-PAGE.
Фиг. 13А-13В демонстрируют группы животных, вакцины и дозировки, использованные для иммунизации животных, а также графики иммунизации.
Фиг. 14А-14D являются таблицами, демонстрирующими результаты анализов ex vivo антигенспецифических иммунных ответов CD3+/CD4+ спленоцитов и CD3+/CD8+ спленоцитов из групп животных, показанных на Фиг. 13А, вакцинированных плацебо или слитым белком, содержащим антигены Е716, Е718, HCVcore или НВх.
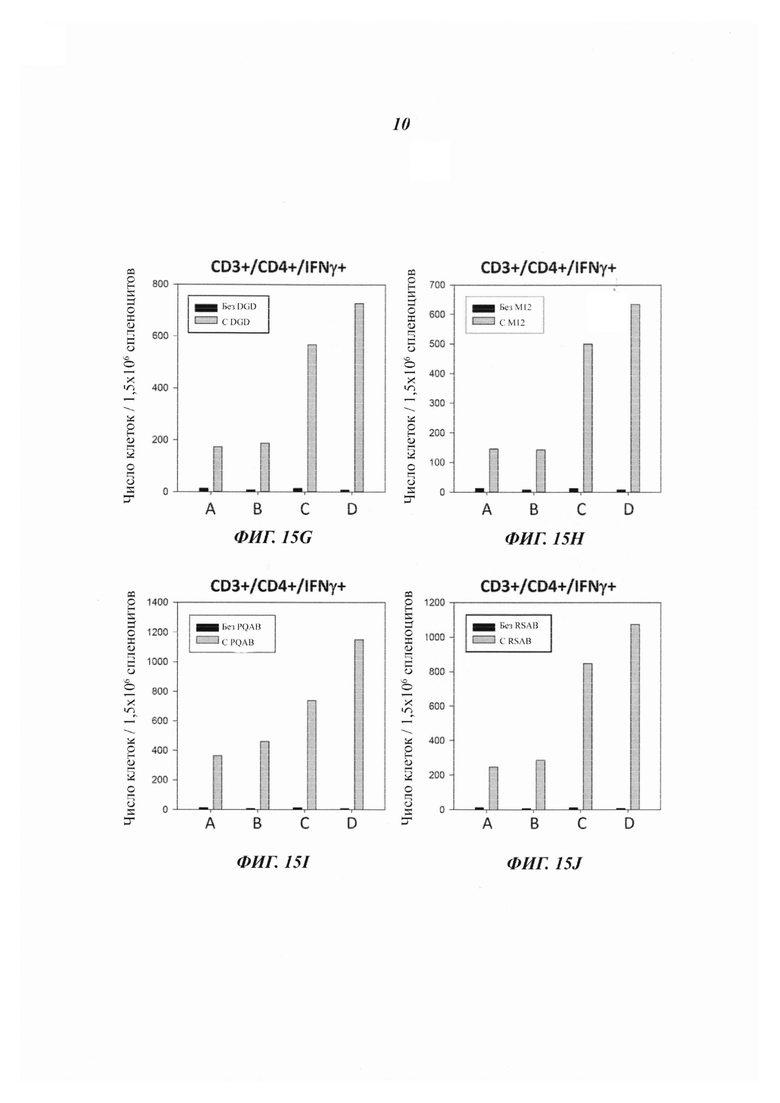
Фиг. 15А-15J демонстрирует количества IFNγ+ клеток в анализах ex vivo антигенспецифических иммунных ответов CD3+/CD8+ спленоцитов и CD3+/CD4+ спленоцитов из групп животных, показанных на Фиг. 13А, вакцинированных плацебо или слитым белком, содержащим антигены PCV2 (15А и 15В) или PRRSV (с 15С по 15J).
Сведения, подтверждающие возможность осуществления изобретения
Настоящее изобретение более конкретно описано в приведенных ниже примерах, которые являются исключительно иллюстративными, поскольку специалистам в данной области техники будут очевидными многочисленные модификации и вариации настоящего изобретения. Далее подробно описаны различные варианты осуществления настоящего изобретения. Что касается графических материалов, то одинаковые номера обозначают одинаковые компоненты на всех графических материалах. При использовании в описании и в приведенной ниже формуле настоящего изобретения значение артиклей «a», «an» и «the» включает множественное число, если контекст однозначно не указывает иное. Также при использовании в описании и в приведенной ниже формуле настоящего изобретения значение предлога «in» включает «в» и «на», если контекст однозначно не указывает иное. Более того, для удобства читателя в описании могут быть использованы заголовки и подзаголовки, которые не оказывают влияния на объем настоящего изобретения. Кроме того, некоторые термины, использованные в описании, более конкретно определены ниже.
Определения
Термины, использованные в данном описании, в целом имеют стандартные значения, используемые в данной области техники, в контексте настоящего изобретения и в конкретном контексте, в котором использован каждый термин. Некоторые термины, использованные для описания настоящего изобретения, обсуждены ниже или в других местах описания в качестве дополнительного руководства для практиков, касающегося описания настоящего изобретения. Для удобства некоторые термины могут быть выделены, например, с использованием курсивного шрифта и/или кавычек. Использование выделения не оказывает влияния на объем и смысл термина; объем и смысл термина остаются одинаковыми в одном и том же контексте, независимо от того, выделен термин или нет. Следует понимать, что одно и то же понятие может быть сформулировано более чем одним способом. Вследствие этого альтернативные языки и синонимы могут быть использованы для одного или более терминов, обсуждаемых в данной публикации, и им не может быть придано никакое особое значение, независимо от того, конкретизированы эти термины или обсуждены в данной публикации. Приведены синонимы некоторых терминов. Указание одного или более синонимов не исключает использования других синонимов. Использование примеров в любой части данного описания, включая примеры любых терминов, обсуждаемых в данной публикации, является исключительно иллюстративным и ни в коей мере не ограничивает объем и содержание изобретения или любого приведенного термина. Сходным образом, изобретение не ограничено различными вариантами его осуществления, приведенными в данном описании.
Если не указано иное, все технические и научные термины, использованные в данной публикации, имеют те значения, которые обычно используют специалисты в той области техники, к которой относится настоящее изобретение. В случае конфликта определяющее значение имеет настоящий документ, включая приведенные в нем определения.
При использовании в контексте настоящего изобретения термины «около», «порядка» или «примерно» обычно означают «в пределах 20 процентов», предпочтительно - «в пределах 10 процентов», и более предпочтительно - «в пределах 5 процентов» от указанного значения или диапазона. Численные значения, приведенные в данной публикации, являются примерными, так что, если в явном виде не указано иное, то можно подразумевать термины «около», «порядка» или «примерно».
Термин «антигенпрезентирующая клетка (АПК) или вспомогательная клетка (А-клетка)» относится к клетке, которая презентирует чужеродные антигены в комплексе с молекулами главного комплекса гистосовместимости (МНС; от англ.: major histocompatibility complex) на своей поверхности. Т-клетки могут распознавать эти комплексы с использованием рецепторов Т-клеток (TCR; от англ.: T-cell receptors). Эти клетки перерабатывают антигены и презентируют их Т-клеткам. Основными типами специализированных антигенпрезентирующих клеток являются дендритные клетки (DC; от англ.: dendritic cells), макрофаги, моноциты и некоторые В-клетки.
Термин «домен связывания с антигенпрезентирующей клеткой (АПК)» относится к домену, который может связываться с антигенпрезентирующей клеткой (АПК). Домен связывания с АПК может быть полипептидом, содержащим аминокислотную последовательность, которая по меньшей мере на 90% идентична последовательности, выбранной из группы, состоящей из последовательностей SEQ ID NO: 5, 6, 7, 8 и 9. Домен связывания с АПК является лигандом, который распознает рецептор АПК и связывается с ним.
Кластер дифференциации 91 (CD91) является белком, который образует рецептор в мембране клеток и участвует в рецептор-опосредованном эндоцитозе.
Термин «домен трансдукции белка» относится к полипептиду или слитому полипептиду, выполняющему функцию сенсибилизации Т-клеток и, за счет этого, усиления антигенспецифических Т-клеточных ответов и/или направления или ориентации (то есть нацеливания) антигена по пути презентации антигена, связанному с молекулами класса I главного комплекса гистосовместимости (МНС-1) (то есть, по пути, связанному с цитотоксическими Т-клетками).
Термин «сенсибилизация Т-клеток» в целом означает, что CD8+ и CD4+ Т-клетки сенсибилизируются, и в результате этого усиливаются ответы, опосредованные CD8+ (CTL) и CD4+ Т-клетками, на нагрузку антигеном. Антигенспецифический клеточно-опосредованный иммунный ответ измеряют посредством количественного определения продукции ангигенспецифического индуцированного γ-интерферона в ответ на антиген. Например, без сигнала сенсибилизации (то есть, без домена трансдукции белка) антиген сам по себе может индуцировать слабый клеточно-опосредованный иммунный ответ или вообще не индуцировать его, то есть индуцировать слабую продукцию антигенспецифического γ-интерферона CD8+ и CD4+ Т-клетками или вообще ее не индуцировать, тогда как в присутствии сигнала сенсибилизации (домена трансдукции белка) антиген может индуцировать усиленный клеточно-опосредованный иммунный ответ. Таким образом, функция сигнала сенсибилизации (домена трансдукции белка) состоит в сенсибилизации CD4+ и CD8+ Т-клеток организма-хозяина, так что, когда организм-хозяин впоследствии нагружается антигеном, антиген может индуцировать усиленный антигенспецифический клеточно-опосредованный иммунный ответ вследствие предварительной сенсибилизации CD4+ и CD8+ Т-клеток.
Домен трансдукции белка может быть пептидом и/или полипептидом, выбранным из группы, состоящей из:
(i) слитого полипептида, содержащего пептид, трансдуцирующий сигнал, сенсибилизирующий Т-клетки, линкер и транслокационный пептид, причем:
(1) пептид, трансдуцирующий сигнал, сенсибилизирующий Т-клетки, расположен на N-конце слитого полипептида;
(2) линкер содержит последовательность SEQ ID NO: 15, связывающую пептид, трансдуцирующий сигнал, сенсибилизирующий Т-клетки, и транслокационный пептид; и
(3) транслокационный пептид имеет длину от 34 до 112 аминокислотных остатков и содержит аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 3, 20 или 4;
(ii) пептида, трансдуцирующего сигнал, сенсибилизирующий Т-клетки; и
(iii) транслокационного пептида, длина которого равна 34-112 аминокислотным остаткам, содержащего аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 3, 20 или 4.
Домен трансдукции белка может быть «слитым полипептидом», причем слитый полипептид содержит пептид, трансдуцирующий сигнал, сенсибилизирующий Т-клетки, линкер и транслокационный пептид. Например, слитый полипептид может быть полипептидом «CD28convPEt».
Термин «CD28conv» относится к консервативной области CD28, которая является «пептидом, трансдуцирующим сигнал, сенсибилизирующий Т-клетки». Это эпитоп для индуцирования агонистического антитела к CD28.
Термин «PEt» или «центральная часть PEt» относится к центральной части транслокационного домена РЕ длиной 34 аминокислотных остатка.
Линкер находится между «CD28conv» и «PEt». Ориентация или расположение слитого полипептида «CD28convPEt» важна, поскольку область «CD28conv» (или пептид, трансдуцирующий сигнал, сенсибилизирующий Т-клетки) должна предшествовать PEt (или транслокационному пептиду), то есть PEt должен находиться на С-конце «CD28conv» для получения усиленных Т-клеточных ответов. «CD28convPEt» может повышать титр IgG (называемого CD28-специфическим агонистическим антителом), специфического в отношении CD28Conv, до гораздо более высокого уровня, чем слитый пептид PEtCD28conv с обратной ориентацией. CD28-специфическое агонистическое антитело может сенсибилизировать как CD4+, так и CD8+ Т-клетки. Слитый полипептид CD28convPEt правильной ориентации содержит линкер (RXRXKR) между доменами CD28conv и PEt. Линкер содержит сайт Lys-Arg (KR) разрезания протеазой (катепсином L), специфической в отношении антигенпрезентирующей клетки (АПК). Поэтому слитый белок RAP1-CD28convPEt-антиген-К3 может быть расщеплен на два фрагмента: RAP1-CD28conv и PEt-антиген-К3. Фрагмент RAP1-CD28conv может быть дальше расщеплен в лизосоме, и эпитоп CD28conv затем презентируется на поверхности АПК по пути МНС II, что в свою очередь вызывает гуморальный иммунный ответ, продуцирующий агонистическое антитело к CD28. Таким образом, агонистическое антитело к CD28 продуцируется В-клетками. Это агонистическое антиело к CD28 может связываться с CD28 на поверхности Т-клеток и преактивировать Т-клетки (CD4+ и CD8+ Т-клетки).
«Пептид, трансдуцирующий сигнал, сенсибилизирующий Т-клетки» имеет длину от 28 аминокислотных остатков до 53 аминокислотных остатков и содержит аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 31, в которой Хаа8 соответствует I или L; Хаа10 соответствует V, F или А, Хаа11 соответствует М или L, Хаа17 соответствует L или I.
Пептид, трансдуцирующий сигнал, сенсибилизирующий Т-клетки, содержит критическую область K1(I/L)2E3(V/F/A)4(M/L)5Y6P7P8P9Y10 (SEQ ID NO: 32), где (X)2 соответствует I или L; (X)4 соответствует V, F или А, (X)5 соответствует М или L.
В приведенных ниже примерах был использован пептид, трансдуцирующий сигнал, сенсибилизирующий Т-клетки (TDIYFCKIEFMYPPPYLDNEKSNGTIIH; SEQ ID NO: 31, где X8 соответствует I, X10 соответствует F, X11 соответствует М), который является специфическим для мышей.
Фиг. 7 является схематическим изображением, иллюстрирующим механизмы действия сенсибилизирующих Т-клетки слитых белков с использованием в качестве примера слитый белок RAP1-CD28convPEt-E7-K3. RAP1-CD28convPEt-E7-K3 содержит по направлению от N-конца к С-концу: (1) домен III полномерного RAP1 на N-конце, (2) CD28conv, (3) линкер, (4) модифицированный транслокационный пептид из экзотоксина A Pseudomonas, (5) полномерный белок Е7 HPV типа 16, и (6) тройную последовательность KDEL в качестве сигнала удержания в эндоплазматическом ретикулуме на С-конце. Белок HPV16 Е7 процессируется до эпитопов в клетках субъекта, иммунизированного слитым белком. RAP1-CD28convPEt-E7-K3 может вызывать лучший цитотоксический Т-клеточный (CTL; от англ.: cytotoxic T-lymphocyte) ответ, чем станжартные вакцины, которые содержат только антиген. Белок RAP1-CD28convPEt-E7-K3 предназначен улучшения захвата АПК-клетками (такими как дендритные клетки) и усиления процессинга HPV16E7 антигена по протеасомному пути и последующей презентации через комплексы с молекулами МНС I. Механизм действия иммунного CTL-ответа, специфического в отношении HPV16E7 белка, вызываемого вакциной RAP1-CD28convPEt-E7-K3, проиллюстрирован на Фиг. 7: (а) вакцина связывается с поверхностным рецептором (CD91) АПК (например, дендритной клетки) и интернализуется посредством эндоцитоза; (b1) RAP1-CD28convPEt-E7-K3 претерпевает протеолитический гидролиз за счет расщепления протеазой катепсином L на участке, расположенном перед транслокационным пептидом PEt; (b2) или рециркулируется в ЭР и подвергается протеолитическому гидролизу фуриновой протеазаой на участке, расположенном перед транслокационным пептидом PEt; (b3) тем временем RAP1-CD28conv расщепляется лизосомальной протеазой, и эпитопы CD28conv презентируются на поверхности клетки через МНС II и вызывают продукцию агонистических антител к CD28, которые могут преактивировать Т-клетки; (с) наиболее важной стадией является трансмембранная транслокация PEt-Е7-K3 в цитоплазматический компартмент из лизосомы транслокационным пептидом (PEt); (d) PEt-Е7-K3 подвергается расщеплению по протеасомному пути, затем эпитопы Е7 презентируются МНС I комплексом и вызывают опосредованный Е7-специфическими клетками иммунный ответ.
Фиг. 8 демонстрирует линейную последовательность консервативных областей CD28 различных видов животных и консенсусную последовательность. Подчеркнутая последовательность (KIEVMYPPPY; SEQ ID NO: 32, где X2 соответствует I, X4 соответствует V, X5 соответствует М) внутри консенсусной последовательности является критической областью для распознавания и связывания агонистических антител к CD28. Эта последовательность критической области может быть представлена как K1(I/L)2E3(V/F/A)4(M/L)5Y6P7P8P9Y10, в которой только четвертый аминокислотный остаток является видоспецифическим и должен соответствовать V у человека, крысы, свиньи, коровы, овцы, собаки и лошади, F - у мыши и V - у индейки. Последовательность критической области может быть представлена как K1(X)2E3(X)4(X)5Y6P7P8P9Y10 (SEQ ID NO: 32), где (X)2 соответствует I или L; (X)4 соответствует V, F или А, (X)5 соответствует М или L.
Транслокационный пептид РЕ может содержать аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 3 или 20. Например, аминокислотная последовательность транслокационого пептида РЕ может содержать аминокислоты с 280 по 313 (SEQ ID NO: 3), с 268 по 313 (SEQ ID NO: 20), с 253 по 313 или с 253 по 364 (SEQ ID NO: 4) РЕ. Это значит, что аминокислотная последовательность транслокационного пептида РЕ может содержать любую область домена II РЕ (аминокислоты с 253 по 364; SEQ ID NO: 4), если она содержит эссенциальный фрагмент с аминокислотами с 280 по 313 (SEQ ID NO: 3).
Антиген может быть белком, полипептидом или пептидом патогена, который ответственен за болезнь, вызываемую патогеном, или способен индуцировать иммунологический ответ в организме-хозяине, инфицированном патогеном, или опухолеассоциированным антигеном (ТАА; от англ.: tumor-associated antigen), который является полипептидом, специфически экспрессируемым в опухолевых клетках. Антиген может быть выбран из патогенов или раковых клеток, включающих, но не ограничивающихся этим, вирус папилломы человека (HPV; от англ.: human papilloma virus), вирус репродуктивного и респираторнаого синдрома свиней (PRRSV), вирус-1 иммунодефицита человека (HIV-1; от англ.: human immunodeficiency virus-1), вирус гриппа, вирус лихорадки Денге, вирус гепатита С (HCV; от англ.: hepatitis С virus), вирус гепатита В (HBV; от англ.: hepatitis В virus), цирковирус 2 свиней (PCV2), немелкоклеточный рак легкого, карциному молочной железы, меланому, лимфомы, карциному толстого кишечника, гепатоклеточную карциному и любые их комбинации. Например, для разработки вакцины были выбраны белок Е7 HPV (Е7), белок ядра HCV (HCV core), белок X HBV (НВх). Антиген может быть слитым антигеном, полученным посредством слияния двух или более антигенов, выбранных из одного или более белков патогенов. Например, он может быть слитым антигеном, состоящим из фрагментов PRRSV ORF6 и ORF5, или результатом слияния антигенных белков из патогенов PRRSV и PCV2.
Функция последовательности, обеспечивающей удержание в эндоплазматическом ретикулуме, состоит в том, чтобы способствовать транслокации антигена из эндоцитотического компартмента в ЭР и удержания его в просвете. Она содержит последовательность Lys Asp Glu Leu (KDEL) или RDEL. Последовательность, обеспечивающая удержание в ЭР, может содержать или по существу состоит или состоит из последовательности KKDLRDELKDEL (SEQ ID NO: 16), KKDELRDELKDEL (SEQ ID NO: 17), KKDELRVELKDEL (SEQ ID NO: 18).
Рецептор-ассоциированный белок (RAP1) с молекулярной массой, равной 39 кДа, является резидентным белком эндоплазматического ретикулума и молекулярным шапероном для белка, связанного с рецептором липопротеинов низкой плотности (LDL; от англ.: low density lipoprotein receptor). Он обладает высоким сродством связывания с CD91 (Kd~3 нМ) и состоит из трех функционально сходных доменов.
Изобретение относится к открытию индуцирования и усиления опосредованных Т-клетками иммунных ответов слитыми белками по настоящему изобретению. При использовании в качестве примера слитого белка RAP1-CD28convPEt-E7-K3 стратегия вакцины на основе RAP1-CD28convPEt-E7-K3 сфокусирована в первую очередь на стимулировании продукции и активации Т-клеток, которые способны распознавать клетки, инфицированные HPV16 и экспрессирующие целевой антиген Е7. За счет доставки антигена к дендритным клетками можно получить антигенспецифические CD8+ Т-клетки и CD4+ Т-клетки. CD4+ Т-клетки-хелперы 1 типа, в частности, способны эффективно стимулировать и усиливать иммунный ответ цитотоксических CD8+ Т-клеток. Совместно эти две ветви адаптивной иммунной системы обладают специфичностью и способность убивать клетки, инфицированные HPV16, или ассоциированные с HPV16 опухолевые клетки во многих участках организма, не вызывая значительного повреждения нормальных тканей.
Термин «субъект» относится к человеку или нечеловекообразному животному.
Термин «обработка» или «лечение» относится к введению эффективного количества слитого белка нуждающемуся в этом субъекту, имеющему рак или инфекционное заболевание или симптом или предрасположенность к такому заболеванию, с целью лечения, облегчения симптомов, помощи, устранения, улучшения состояния или профилактики заболевания, его симптомов или предрасположенности к нему. Такой субъект может быть выявлен профессиональным медиком на основании результатов любого подходящего диагностического метода.
Термин «эффективное количество» относится к количеству активного соединения, которое необходимо для оказания терапевтического эффекта на субъект, проходящий лечение. Эффективные дозы будут различными, как известно специалистам в данной области техники, в зависимости от пути введения, использования наполнителя и возможности совместного использования с другими терапевтическими процедурами.
Аббревиатуры: CD28 - кластер дифференциации 28.
Описание примеров осуществления изобретения
Далее приведены не ограничивающие объем настоящего изобретения характерные приборы, аппаратура, способы и связанные с ними результаты в соответствии с вариантами осуществления настоящего изобретения. Учтите, что в примерах для удобства читателя могут быть использованы заголовки и подзаголовки, которые никоим образом не ограничивают объем настоящего изобретения. Кроме того, в данной публикации предложены и раскрыты некоторые теории, однако, независимо от того, являются ли они верными или неверными, они никоим образом не должны ограничивать объем настоящего изобретения, поскольку изобретение осуществляют согласно настоящему изобретению безотносительно к какой-либо конкретной теории или схеме действия.
Пример 1
Конструкции векторов экспрессии
Фиг. 1 демонстрирует вектор экспрессии для слитого белка RAP1-РЕ268-313-Е7-K3, который содержит домен 3 RAP1 (SEQ ID NO: 5), минимальный эссенциальный транслокационный пептид (РЕ268-313; SEQ ID NO: 20), антиген Е7 и последовательность, обеспечивающую удержание в эндоплазматическом ретикулуме (K3, или сигнал KDEL; SEQ ID NO: 16, 17, 18 или 19). Минимальный эссенциальный транслокационный пептид (РЕ268-313; SEQ ID NO: 20) получен из области полипептидной последовательности (SEQ ID NO: 10) от аминокислоты 268 до аминокислоты 313.
Этот вектор экспрессии был сконструирован с использованием плазмиды RAP1-K3, изображенной на Фиг. 10. Плазмида RAP1-K3 (Фиг. 10), которая содержит слитый ген домена 3 RAP-1 и K3, была получена следующим образом: Фрагмент ДНК, кодирующий NdelRAP1-(EcoRl, Xhol)-K3Xho1, синтезировали способом ПЦР и лигировали в скелет плазмиды pUC18 с геном резистентности к канамицину с получением плазмиды RAP1-K3 (Фиг. 10). Для получения вектора экспрессии RAP1-РЕ268-313-Е7-K3 (Фиг. 1) фрагмент ДНК, кодирующий РЕ268-313-Е7, инсерцировали в плазмиду RAP1-K3 (Фиг. 10). С использованием сходных способов посредством ПЦР (Фиг. 11) генерировали фрагменты ДНК, кодирующие различные слитые пептиды, и инсерцировали, соответственно в плазмиду RAP1-K3 (Фиг. 10) с получением векторов экспрессии различных слитых белков (Фиг. с 12А по 12F). Фиг. 3 иллюстрирует вектор экспрессии слитого белка RAP1-CD28convPEt-E7-K3 (Фиг. 3).
Фрагмент CD28convPEt содержит сайты разрезания катепсином L м фуриновой протеазой. Фиг. 4 демонстрирует карту аминокислотной последовательности слитого белка RAP1-CD28convPEt-E7-K3 для иллюстрации важности фрагмента CD28convPEt. Две стрелки указывают на сайты разрезания катепсином L и фуриновой протеазой, соответственно. Эти два сайта разрезания не только служат линкерами для лигирования CD28conv и PEt-Е7, но и обеспечивают разрезание слитого белка для выделения фрагмента PEt-Е7-K3 в цитоплазму из лизосомы. Все остальные представляющие интерес антигены из различных патогенов могут заменять Е7 для слияния с CD28convPEt и слитый продукт затем можно инсерцировать в плазмиду из Фиг. 10 для получения различных векторов экспрессии для слитых белков, изображенных на Фиг. 11.
Последовательность РЕ268-313 имеет вид: pletftrhrqprgweqleqcgypvqrlvalylaarlswnqvdqvir (SEQ ID NO: 20). Вся последовательность CD28convPEt имеет вид: tdiyfckiefmypppyldneksngtiihrarykrgweqleqcgypvqrlvalvlaarlswnqvdqvirqs (SEQ ID NO: 30), причем подчеркнутая последовательность является линкерной последовательностью, содержащей сайты разрезания катепсином L и фуриновой протеазой.
Пример 2
Экспрессия белка
Клетки BL21 Е. coli, содержащие вектор экспрессии белка, культивировали в бульоне Лурия-Бертани, содержавшем 25 мкг/мл канамицина, при 37°С. Когда культура достигала ранней логарифмической фазы (А600=0,1), добавляли изопропил-1-тио-β-D-галактопиранозид (ИПТГ) до конечной концентрации от 0,5 мМ до 2 мМ для индукции. Клетки собирали через 4 часа после индукции ИПТГ и разрушали посредством обработки ультразвуком. Сверхэкспрессированные инклюзионные тельца, содержавшие белки, выделяли и солюбилизировали в 8М мочевине/NT-буфере (8 М мочевины, 50 мМ Трис, 50 мМ NaCl, pH 8,0).
Рефолдинг слитого белка RAP1-PE268-313-E7-K3 осуществляли способом диализа против 50-кратного объема TNZ-буфера (50 мМ Трис, 50 мМ NaCl и 0,01 мМ ZnCl2) при 4°С в течение ночи. Рефолдированные белки подвергали анализу способом электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE; от англ.: sodium dodecylsulphate-polyacrylamide gel electrophoresis) в восстановленных (с дитиотреитолом; +DTT) и невосстановленных (без дитиотреитола; -DTT) условиях (Фиг. 2). Результаты показали, что большинство рефолдированных белков были мономерами в невосстановленном состоянии, что свидетельствует о том, что слитые белки, содержавшие RAP1, легко подвергались рефолдингу и не агрегировали (Фиг. 2).
Фиг. 11 иллюстрирует перечень слитых белков, которые экспрессировали с использованием способа, сходного с описанным выше: (1) RAP1-PE268-313-E7-K3; (2) RAP1-CD28convPEt-E7-K3; (3) RAP1-CD28PEt-E718-K3; (4) RAP1-HCVcore-K3; (5) RAP1-CD28conv-HCVcore-K3; (6) RAP1-CD28convPEt-HCVcore-K3; (7) RAP1-HBx; (8) RAP1-HBX-K3; (9) RAP1-CD28conv-HBx; (10) RAP1-CD28conv-HBx-K3; (11) RAP1-CD28convPEt-HBx; (12) RAP1-CD28convPEt-HBx-K3; (13) RAP1-PCV2ORF2-K3; (14) RAP1-PE268-313-PCV2ORF2-K3; (15) RAP1-CD28convPEt-PCV2ORF2-K3; (16) RAP1-PE268-313-DGD-K3; (17) RAP1-PE268-313-M12-K3; (18) RAP1-PE268-313-PQAB-K3; (19) RAP1-PE268-313-RSAB-K3; (20) RAP1-CD28convPEt-DGD-K3; (21) RAP1-CD28convPEt-M12-K3; (22) RAP1-CD28convPEt-PQAB-K3; (23) RAP1-CD28convPEt-RSAB-K3. Эти слитые белки были подвергнуты рефолдингу с использованием способа, описанного выше. Результаты SDS-PAGE анализа показали, что все эти слитые белки были хорошо рефолдированы, и поэтому их использовали для приготовления вакцин (Фиг. с 12А по 12F).
Пример 3
Слитый белок RAP1-PE268-313-E7-K3 ингибирует рост опухолей, вызванных белком Е7 вируса папилломы человека (HPV) типа 16
Слитые белки РЕ407-Е7-K3 и RAP1-PE268-313-E7-K3 экспрессировали, как описано выше, и рефолдинг белка исследовали посредством SDS-PAGE анализа (Фиг. 5В). Мышей нагрузили 2×103 клеток ТС-01 (линия клеток легочного эпителия мыши, несущая ген Е7 HPV типа 16) посредством подкожной инъекция с целью индуцирования карциномы, вызванной HPV типа 16. Через двенадцать дней после нагрузки клетками ТС-01 мышей вакцинировали посредством подкожной инъекции плацебо (фосфатный буферный раствор + фосфат алюминия), РЕ407-Е7-K3 (200 мкг/дозу) или RAP1-PE268-313-E7-K3 (200 мкг/дозу) с AS04C (GlaxoSmithKline) в качестве адъюванта один раз в неделю в течение 3 недель (Фиг. 5А). AS04C, AS04C, который является адъювантом, стимулирующим цитотоксические Т-лимфоциты, содержит монофосфорил-липид A (MPL; от англ.: monophosphoryl-lipid А, иммуностимулятор) и фосфат алюминия (абсорбент белков для доставки антигенов). Термин «K3» относится к аминокислотной последовательности KDELKDELKDEL (SEQ ID NO: 19). В каждой группе регистрировали размеры опухолей и число животных, не имевших опухолей (Фиг. с 5С по 5D). Опухолевый рост существенно подавляли обе вакцины РЕ407-Е7-K3 и RAP1-PE268-313-E7-K3 с AS04C в качестве адъюванта. Однако в группе мышей, вакцинированных RAP1-PE268-313-E7-K3 число мышей, не имевших опухолей, было выше. Это показывает, что вакцина RAP1-PE268-313-E7-K3 была столь же эффективной или даже превосходила РЕ407-Е7-K3 в отношении подавления опухолевого роста, однако она была лучше в отношении увеличения процента животных, не имевших опухолей.
Пример 4
Слитый белок RAP1-CD28convPEt-E7-K3 ингибирует рост опухолей, вызванных белком Е7 вируса папилломы человека (HPV) типа 16 и увеличивает показатель выживаемости
Исследованы эффекты слитых белков РЕ407-Е7-K3 и RAP1-CD28convPEt-E7-K3 с иммуностимулятором или без иммуностимулятора на размеры опухолей и показатель выживаемости. Мышей нагрузили более высокой дозой клеток ТС-01 (3×104) посредством подкожной инъекции. Через семь дней после нагрузки мышей вакцинировали подкожно с использованием плацебо, РЕ407-Е7-K3 (100 мкг/дозу) или RAP1-CD28convPEt-E7-K3 (100 мкг/дозу) с иммуностимулятором GPI-0100 или абсорбентом белков фосфатом алюминия один раз в неделю в течение 3 недель (Фиг. 9А). GPI-0100 - это адъювант, стимулирующий Th1/CTL (иммуностимулятор). Регистрировали размеры опухолей и показатель выживаемости в каждой группе (Фиг. с 9В по 9С). В случае сочетания с адъювантом GPI-0100 обе вакцины РЕ407-Е7-K3 и RAP1-CD28convPEt-E7-K3 подавляли опухолевый рост. Неожиданно было обнаружено, что эффект RAP1-CD28convPEt-E7-K3, связанный с подавлением опухолевого роста, не зависел от адъюванта. При сочетании с абсорбентом фосфатом алюминия, а не с адъювантом GPI-0100, RAP1-CD28convPEt-E7-K3 все еще мог существенно подавлять опухолевый рост с такой же эффективностью, как и при сочетании с иммуностимулятором GPI-0100 (Фиг. 9В, незаполненные треугольники против заполненных перевернутых треугольников).
В противоположность этому эффективность РЕ407-Е7-K3 в отношении подавления опухолевого роста зависела от адъюванта. В сочетании с абсорбентом фосфатом алюминия РЕ407-Е7-K3 становился менее эффективным, чем в сочетании с иммуностимулятором GPI-0100 (Фиг. 9В, заполненные квадратики против незаполненных кружков).
С другой стороны, мыши, которым вводили комбинацию RAP1-CD28convPEt-Е7-K3 с иммуностимулятором GPI-0100 или абсорбентом фосфатом алюминия, имели лучший показатель выживаемости, чем в группах, вакцинированных РЕ407-Е7-K3 в комбинации с GPI-0100 или фосфатом алюминия (Фиг. 9С). Это показывает, что RAP1-CD28convPEt-E7-K3 может вызывать Th1/CTL иммунный ответ даже без иммуностимулятора GPI-0100. Результаты также показывают, что слитый белок RAP1-CD28convPEt-E7-K3 превосходил РЕ407-Е7-K3 в качестве вакцины для повышения показателя выживаемости животных.
Пример 5
Анализы иммуногенности
Была исследована иммуногенность различных вакцин. Коротко говоря, мышей разделили на следующие группы: HPV16 Е7, HPV 18 Е7, HCV core, HBV НВх, PCV2 ORF2 и PRRSV (Фиг. 13А). Каждую группу дополнительно разделили на подгруппы, и каждой подгруппе ввели либо плацебо, либо вакцину, разработанную так, что она была направлена против определенного антигена или определенных антигенов патогенов, посредством подкожной инъекции один раз в неделю в течение 3 недель (Фиг. 13В). За исключением вакцин, направленных против PRRSV, каждая вакцина состояла из одного слитого белка и абсорбента фосфата алюминия, причем один слитый белок содержал по меньшей мере один антиген патогена. Антиген был либо полномерным белком из патогена, либо неполномерным белком, который содержал по меньшей мере один эпитоп антигена патогена или был слитым пептидом, содержавшим два или более антигенов, в котором все антигены были выбраны из различных белков патогена.
График иммунизации, вакцины и дозы проиллюстрированы на Фиг. с 13А по 13В. Коротко говоря, мышей вакцинировали один раз в неделю в течение 3 недель вакцинами, перечисленными на Фиг. 13А. Всех мышей умертвили через 14 дней после последней иммунизации и извлекли у них селезенки. Выделили спленоциты и культивировали их в 6-луночном планшете (2×107 клеток/2 мл/лунку) с 10 мкг/мл соответствующих рекомбинантных антигенов патогенов для стимуляции спленоцитов в присутствии 1 мкг/мл реагента GolgiPlug (производства компании BD Pharmingen, Сан Диего, Калифорния) при 37°С в течение 16 часов.
Стимулированные спленоциты затем промыли буфером FACScan и окрасили маркеры клеточной поверхности CD8a, CD4 и CD3 конъюгированными с фикоэритрином моноклональными антителами крысы к рецепторам CD8a мыши, конъюгированными с AF700 моноклональными антителами крысы к рецепторам CD4 мыши и конъюгированными с AF647 моноклональными антителами крысы с рецепторам CD3 мыши. Затем клетки пермеабилизировали и зафиксировали с использованием набора Cytofix/Cytoperm согласно инструкциям производителя (компании BD Pharmingen). Внутриклеточный IFN-γ (интерферон-гамма; от англ.: interferon-gamma) окрасили конъюгированным с AF-488 антителом крысы к IFN-γ мыши для измерения иммунного ответа и концентраций цитокинов. Проточно-цитометрические анализы выполнили с использованием проточного цитометра Gallios с аналитическим программным обеспечением Kaluza (Beckman Coulter).
На иммуногенность были испытаны следующие вакцины против PRRSV: вакцины PE407-PRRSV-K3, RAP1-PE268-313-PRRSV-K3 или RAP1-CD28convPEt-PRRSV-K3. Каждая вакцина содержала смесь четырех различных слитых белков, и все слитые белки содержали различные антигены, которые были выбраны из группы, состоявшей из DGD, М12, PQAB и RSAB (Фиг. 13А). Вакцинацию мышей м стимуляцию спленоцитов выполнили с использованием способа, сходного с описанным выше. Коротко говоря, всех мышей умертвили через 7 дней после последней иммунизации и извлекли у них селезенки. Выделили спленоциты и культивировали их в 6-луночном планшете (2×107 клеток/2 мл/лунку) с 10 мкг/мл рекомбинантных антигенов DGD, М12, PQAB и RSAB по отдельности для стимуляции спленоцитов в присутствии 1 мкг/мл реагента GolgiPlug (производства компании BD Pharmingen, Сан Диего, Калифорния) при 37°С в течение 16 часов.
Аминокислотная последовательность «DGD» (SEQ ID NO: 26) является следующей:

 DGD представляет собой слитый антиген, состоящий из аминокислот с 64 по 123 белка ORF7 PRRSV ORF7 (жирный шрифт), линкера (подчеркнут) и аминокислот с 64 по 123 белка ORF7 (жирный шрифт).
DGD представляет собой слитый антиген, состоящий из аминокислот с 64 по 123 белка ORF7 PRRSV ORF7 (жирный шрифт), линкера (подчеркнут) и аминокислот с 64 по 123 белка ORF7 (жирный шрифт).
Термин «М12» относится к антигену, состоящему из аминокислот с 1046 по 1210 белка ORF1b PRRSV. Его аминокислотная последовательность (SEQ ID NO: 27) является следующей:

Аминокислотная последовательность «PQAB» (SEQ ID NO: 28) является следующей:
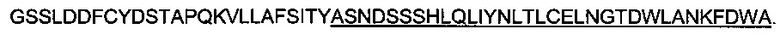
PQAB представляет собой слитый антиген, состоящий из аминокислот с 2 по 26 белка ORF6 американского штамма PRRSV и аминокислот с 31 по 63 (подчеркнуты) белка ORF5.
Аминокислотная последовательность RSAB имеет вид:
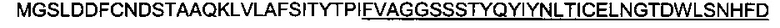
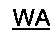 SEQ ID NO: 29). Термин «RSAB» относится к слитому антигену, состоящему из аминокислот с 2 по 28 белка ORF6 европейского штамма PRRSV и аминокислот с 31 по 64 белка ORF5 (подчеркнуты).
SEQ ID NO: 29). Термин «RSAB» относится к слитому антигену, состоящему из аминокислот с 2 по 28 белка ORF6 европейского штамма PRRSV и аминокислот с 31 по 64 белка ORF5 (подчеркнуты).
Пример 6
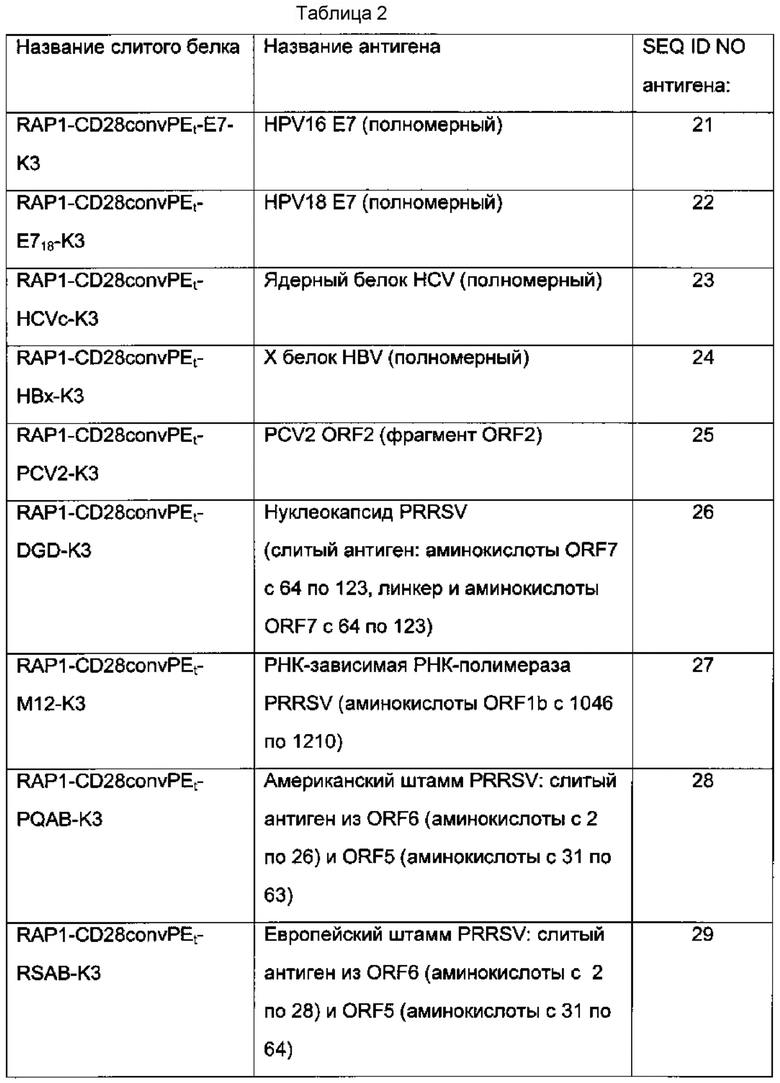
Фрагмент домена 3 RAP1 слитого белка RAP1-CD28convPEt-E7-K3 заменили на А2М минимум (SEQ ID NO: 6), HIV-Tat минимум (SEQ ID NO: 7) или HSPs минимум (SEQ ID NO: 8) для получения вакцин на основе слитых белков А2М-CD28convPEt-E7-K3, Tat-CD28convPEt-E7-K3 и HSP-CD28convPEt-E7-K3, соответственно. Активность в отношении угнетения ТС-1 опухолей и клеточно-опосредованные иммунные ответы, усиленные этими вакцинами, исследовали способами, сходными с описанными выше. В Таблице 1 указаны идентификационные номера последовательностей (SEQ ID NO) компонентов различных слитых белков. В Таблице 2 приведены слитые белки, испытанные на эффекты в отношении Т-клеточно-опосредованных иммунных ответов у животных, и последовательности антигенов.


В анализах иммуногенности антигенспецифические клеточно-опосредованные иммунные ответы, индуцированные различными вакцинами, были оценены посредством измерения числа CD3+/CD4+/IFNγ+ и CD3+/CD8+/IFNγ+ Т-клеток в спленоцитах. Результаты показали, что вакцина RAP1-CD28convPEt-антиген-K3 может вызывать сильные Т-клеточные ответы. Фиг. 14В демонстрирует, что число CD3+/CD4+/IFNγ+ Т-клеток и CD3+/CD8+/IFNγ+ Т-клеток, индуцированных CD28convPEt-E718-K3, было, соответственно, примерно в 50 раз и более чем в 9 раз больше, чем в случае RAP1-K3.
Вакцина RAP1-CD28convPEt-антиген-K3 превосходит вакцину на основе РЕ407-антиген-K3 в отношении индуцирования опосредованной Т-клетками иммуногенности. Например, Фиг. 14А иллюстрирует, что число CD3+/CD4+/IFNγ+ Т-клеток и число CD3+/CD8+/IFNγ+ Т-клеток, индуцированных CD28convPEt-E716-K3, было, соответственно, примерно в 5 раз и в 7 раз больше, чем в случае PE407-E716-K3. Это свидетельствует о том, что вакцина RAP1-CD28convPEt-E7-K3 обладала большей клеточно-опосредованной иммуногенностью, чем РЕ407-Е7-K3.
Слитого белка, содержащего домен III RAP1, сенсибилизирующий сигнал CD28conv без транслокационного пептида PEt, антиген и сигнал удержания в ЭР, достаточно для индуцирования сильных антигенспецифических опосредованных Т-клетками иммунных ответов, если выбранный антиген содержит десять или более десяти эпитопов. Фиг. 14С иллюстрирует Т-клеточные ответы, вызванные вакциной RAP1-CD28conv-HCVcore-K3, причем число CD3+/CD4+/IFNγ+ и число CD3+/CD8+/IFNγ+, соответственно, в 20 раз и 7,6 раз больше, чем в группе плацебо. Антиген HCVcore содержит 11 известных эпитопов МНС I.
Неожиданно оказалось, что сигнал удержания в ЭР не является обязательным для того, чтобы слитый белок по настоящему изобретению индуцировал сильную клеточно-опосредованную иммуногенность. Другими словами, и без последовательности, обеспечивающей удержание в ЭР, слитый белок по настоящему изобретению все еще может индуцировать сильные Т-клеточные ответы. Фиг. 14D иллюстрирует, что число CD3+/CD4+/IFNγ+ и число CD3+/CD8+/IFNγ+ Т-клеток, индуцированных RAP1-CD28convPEt-HBx (без сигнала K3 удержания в ЭР) были, соответственно, в 7 раз и в 74 раза больше, чем в группе плацебо.
В противоположность этому, в Патентах США 7378100 В2 и 7335361, показано, что сигнал K3 удержания в ЭР обязателен для того, чтобы слитые белки на основе РЕ (РЕ407-антиген-K3) вызывали Т-клеточные ответы.
Также было открыто, что слитый белок, содержащий домен III RAP1, транслокационный пептид PE218-313 (без сенсибилизирующего сигнала CD28conv), антиген и сигнал удержания в ЭР, превосходит слитый белок на основе РЕ, не содержащий домена III RAP1. Фиг. с 15С по 15J иллюстрируют, что вакцина RAP1-PE268-313-PRRSV-K3 индуцировала большие числа CD3+/CD4+/IFNγ+ и CD3+/CD8+/IFNγ+ Т-клеток, чем вакцина PE407-PRRSV-K3.
Приведенное выше описание характерных примеров осуществления настоящего изобретения представлено только с целью иллюстрации и описания и не является исчерпывающим и или ограничивающим изобретения точными описанными формами. В свете приведенных выше сведений возможны многочисленные модификации и вариации. Варианты и примеры осуществления настоящего изобретения выбраны и описаны для того, чтобы объяснить принципы настоящего изобретения и его практическое применение так, чтобы специалисты в данной области техники могли использовать настоящее изобретение и различные варианты его осуществления с различными модификациями, которые могут потребоваться для предполагаемого конкретного применения. Специалистам в той области техники, к которой относится настоящее изобретение, будут очевидными альтернативные варианты осуществления настоящего изобретения, не отклоняющиеся от его сущности и объема. Соответственно, объем настоящего изобретения определен прилагаемой формулой изобретения, а не приведенным выше описанием и характерными вариантами осуществления настоящего изобретения, описанными в данной публикации.
| название | год | авторы | номер документа |
|---|---|---|---|
| СЛИТЫЕ БЕЛКИ ДЛЯ ПРИМЕНЕНИЯ В КАЧЕСТВЕ ИММУНОГЕННЫХ УСИЛИВАЮЩИХ АГЕНТОВ ДЛЯ ИНДУЦИРОВАНИЯ АНТИГЕНСПЕЦИФИЧЕСКОГО Т-КЛЕТОЧНОГО ОТВЕТА | 2013 |
|
RU2619187C2 |
| ВАКЦИНЫ ПРОТИВ HPV | 2012 |
|
RU2644201C2 |
| СТАБИЛЬНЫЙ ВЕКТОР КОНСТИТУТИВНО ВЫСОКОЙ ЭКСПРЕССИИ ДЛЯ ПОЛУЧЕНИЯ ВАКЦИНЫ ПРОТИВ ВПЧ И ТРАНСФОРМИРОВАННЫЕ ЭТИМ ВЕКТОРОМ РЕКОМБИНАНТНЫЕ МОЛОЧНОКИСЛЫЕ БАКТЕРИИ | 2010 |
|
RU2492240C2 |
| КОНСТРУКЦИИ ГОМОДИМЕРНЫХ БЕЛКОВ | 2011 |
|
RU2624041C2 |
| Полиэпитопная противоопухолевая вакцинная конструкция, содержащая эпитопы опухоль-ассоциированных антигенов, фармацевтическая композиция и ее применение для стимуляции специфического противоопухолевого иммунного ответа | 2016 |
|
RU2684235C2 |
| СЛИТЫЕ БЕЛКИ С FC-ФРАГМЕНТОМ ИММУНОГЛОБУЛИНА ДЛЯ ПОВЫШЕНИЯ ИММУНОГЕННОСТИ БЕЛКОВЫХ И ПЕПТИДНЫХ АНТИГЕНОВ | 2000 |
|
RU2248214C2 |
| МОДИФИЦИРОВАННЫЙ БИОТИН-СВЯЗЫВАЮЩИЙ БЕЛОК, СЛИТЫЕ БЕЛКИ НА ЕГО ОСНОВЕ И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2632651C2 |
| ХИМЕРНЫЕ КОНСТРУКЦИИ АНТИТЕЛО/Т-КЛЕТОЧНЫЙ РЕЦЕПТОР И ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2767209C2 |
| СОЕДИНЕНИЯ И СПОСОБЫ ДЛЯ ЛЕЧЕНИЯ И ДИАГНОСТИКИ ХЛАМИДИЙНОЙ ИНФЕКЦИИ | 2001 |
|
RU2410394C2 |
| CPG АМФИФИЛЫ И ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2823677C2 |



























Изобретение относится к области биотехнологии, конкретно к слитым белкам для применения в качестве иммуногенного усиливающего агента для усиления антигенспецифических Т-клеточных ответов, и может быть использовано в медицине. Рекомбинантным путем получают слитый белок, который содержит: (а) домен связывания с антигенпрезентирующей клеткой (АПК) или домен связывания с рецептором CD91; (b) домен трансдукции белка; (с) антиген патогена, причем домен связывания с антигенпрезентирующей клеткой (АПК) или домен связывания с рецептором CD91 расположен на N-конце слитого белка, а антиген патогена расположен на С-конце домена трансдукции белка. Изобретение позволяет получить усиленный антигенспецифический Т-клеточный ответ против вирусного патогена и раковой клетки. 5 н. и 11 з.п. ф-лы, 15 ил., 2 табл., 6 пр.
1. Слитый белок для индуцирования усиленного антигенспецифического Т-клеточного ответа против вирусного патогена и раковой клетки, имеющий:
(a) домен связывания с антигенпрезентирующей клеткой (АПК) или домен связывания с рецептором CD91, выбранный из группы, состоящей из домена 3 рецептор-ассоциированного белка 1 (RAP1), белка, ассоциированного с рецептором альфа-2-макроглобулина (А2М), HIV-Tat, белков теплового шока (HSPs) и домена la связывания экзотоксина A Pseudomonas (РЕ), расположенный на N-конце слитого белка, где домен 3 RAP1, А2М, HIV-Tat, HSPs и домен la связывания экзотоксина А Pseudomonas (РЕ) имеют аминокислотные последовательности SEQ ID NO: 5, 6, 7, 8 и 9 соответственно;
(b) домен трансдукции белка, расположенный на С-конце домена связывания с АПК или домена связывания с рецептором CD91, где домен трансдукции белка представляет собой (i) слитый полипептид или (ii) пептид, трансдуцирующий сигнал, сенсибилизирующий Т-клетки, или (iii) транслокационный пептид, охарактеризованные как:
(i) слитый полипептид, имеющий:
(1) пептид, трансдуцирующий сигнал, сенсибилизирующий Т-клетки, имеющий аминокислотную последовательность SEQ ID NO: 31, 1 или 2, расположенный на N-конце слитого полипептида;
(2) транслокационный пептид, имеющий аминокислотную последовательность SEQ ID NO: 3, 20 или 4; и
(3) линкер, имеющий аминокислотную последовательность SEQ ID NO: 15, связывающий пептид, трансдуцирующий сигнал, сенсибилизирующий Т-клетки, и транслокационный пептид;
(ii) пептид, трансдуцирующий сигнал, сенсибилизирующий Т-клетки, имеющий аминокислотную последовательность SEQ ID NO: 31, 1 или 2; или
(iii) транслокационный пептид, имеющий аминокислотную последовательность SEQ ID NO: 3 или 20; и
(c) антиген вирусного патогена или раковой клетки, расположенный на С-конце домена трансдукции белка;
(d) необязательно последовательность, обеспечивающую удержание в эндоплазматическом ретикулуме, расположенную на С-конце слитого белка; и
(e) необязательно дополнительный линкер, имеющий аминокислотную последовательность SEQ ID NO: 15, расположенный между доменом трансдукции белка и антигеном, если домен трансдукции белка представляет собой пептид, трансдуцирующий сигнал, сенсибилизирующий Т-клетки, или расположенный между доменом связывания с АПК или домен связывания с рецептором CD91 и транслокационным пептидом, если домен трансдукции белка представляет собой транслокационный пептид;
причем домен связывания с АПК или домен связывания с рецептором CD91 не содержит аминокислотной последовательности домена I связывания экзотоксина А Pseudomonas (РЕ), если домен трансдукции белка является транслокационным пептидом.
2. Слитый белок по п. 1, где последовательность, обеспечивающая удержание в эндоплазматическом ретикулуме, расположенная на С-конце слитого белка, имеет аминокислотную последовательность SEQ ID NO: 16, 17, 18 или 19.
3. Слитый белок по п. 1, отличающийся тем, что последовательность, обеспечивающая удержание в эндоплазматическом ретикулуме, имеет аминокислотную последовательность Lys-Asp-Glu-Leu (SEQ ID NO: 14).
4. Слитый белок по п. 1, отличающийся тем, что он не содержит последовательности, обеспечивающей удержание в эндоплазматическом ретикулуме, на своем С-конце, если антиген имеет 10 или более эпитопов.
5. Слитый белок по п. 1, отличающийся тем, что домен трансдукции белка является слитым полипептидом.
6. Слитый белок по п. 1, отличающийся тем, что домен трансдукции белка является пептидом, трансдуцирующим сигнал, сенсибилизирующий Т-клетки.
7. Слитый белок по п. 6, который имеет дополнительный линкер с аминокислотной последовательностью SEQ ID NO: 15 между доменом трансдукции белка и антигеном.
8. Слитый белок по п. 1, отличающийся тем, что домен трансдукции белка является транслокационным пептидом.
9. Слитый белок по п. 8, который имеет дополнительный линкер, расположенный между доменом связывания АПК или доменом связывания рецептора CD91 и транслокационным пептидом.
10. Слитый белок по п. 1, отличающийся тем, что домен трансдукции белка имеет аминокислотную последовательность SEQ ID NO: 30.
11. Композиция вакцины для индуцирования усиленного антигенспецифического Т-клеточного ответа против вирусного патогена и раковой клетки, содержащая:
(a) терапевтически эффективное количество слитого белка по п. 1; и
(b) адъювант,
где антиген вирусного патогена представляет собой по меньшей мере один, выбранный из группы, состоящей из вируса папилломы человека (HPV), вируса репродуктивно-респираторного синдрома свиней (PRRSV), вируса иммунодефицита человека (ВИЧ-1), вируса гриппа, вируса болезни Денге, вируса гепатита С (HCV), вируса гепатита В (HBV) и цирковируса 2 свиней (PCV2).
12. Способ индуцирования усиленного антигенспецифического Т-клеточного ответа против вирусного патогена и раковой клетки, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества слитого белка по п. 1.
13. Способ уничтожения раковой клетки и клетки, презентирующей антиген вирусного патогена через молекулы класса 1 МНС на мембране клетки, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества слитого белка по п. 1.
14. Способ по п. 13, где антиген вирусного патогена представляет собой по меньшей мере один, выбранный из группы, состоящей из вируса папилломы человека (HPV), вируса репродуктивно-респираторного синдрома свиней (PRRSV), вируса иммунодефицита человека (ВИЧ-1), вируса гриппа, вируса болезни Денге, вируса гепатита С (HCV), вируса гепатита В (HBV) и цирковируса 2 свиней (PCV2).
15. Способ по п. 14, где клетка является раковой клеткой, презентирующей антиген, где указанный антиген представляет собой HPV16 Е7 или HPV18 Е7.
16. Способ профилактики, лечения инфекции или минимизации симптомов, вызванных вирусным патогенном и раковой клеткой, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества слитого белка по п. 1.
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Колосоуборка | 1923 |
|
SU2009A1 |
| WO 00/49041, 24.08.2000 | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| СОЕДИНЕНИЯ И СПОСОБЫ ДЛЯ ЛЕЧЕНИЯ И ДИАГНОСТИКИ ХЛАМИДИЙНОЙ ИНФЕКЦИИ | 2001 |
|
RU2410394C2 |
Авторы
Даты
2017-09-15—Публикация
2013-12-03—Подача