ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится в основном к обнаружению и лечению хламидийной инфекции. В частности, данное изобретение относится к полипептидам, содержащим антиген Chlamydia, и применению таких полипептидов для серодиагностики и лечения хламидийной инфекции.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Chlamydia являются внутриклеточными бактериальными патогенами, которые ответственны за большое разнообразие важных инфекций человека и животных. Chlamydia trachomatis является одной из наиболее обычных причин передающихся половым путем заболеваний и может приводить к воспалению тазовых органов (PID), ведущему к непроходимости маточных труб и бесплодию. Chlamydia trachomatis может также играть роль в мужском бесплодии. В 1990 году расходы на лечение PID в США оценивались в 4 миллиарда долларов. Трахома, вызываемая глазной инфекцией Chlamydia trachomatis, является основной причиной предотвращаемой слепоты во всем мире. Chlamydia pneumoniae является основной причиной острых инфекций дыхательных путей у человека и, как считается, играет роль в патогенезе атеросклероза и, в частности, ишемической болезни сердца. Было показано, что индивидуумы с высоким титром антител к Chlamydia pneumoniae имеют, по меньшей мере, вдвое большую вероятность заболевания ишемической болезнью сердца, чем сероотрицательные индивидуумы. Таким образом, хламидийные инфекции составляют существенную проблему здравоохранения как в США, так и во всем мире.
Хламидийная инфекция часто является бессимптомной. Например, к тому времени, когда женщина обращается к врачу по поводу PID, необратимое повреждение может уже произойти, приводя к бесплодию. Таким образом, в данной области остается потребность в усовершенствованных вакцинах и фармацевтических композициях для профилактики и лечения хламидийных инфекций. Данное изобретение удовлетворяет данную потребность и дополнительно обеспечивает другие связанные с данным преимущества.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к композициям и способам диагностики и терапии инфекции Chlamydia. В одном аспекте данное изобретение относится к полипептидам, содержащим иммуногенную часть антигена Chlamydia или вариант такого антигена. Определенные части и другие варианты являются иммуногенными, так что способность такого варианта взаимодействовать с антиген-специфическими антисыворотками по существу не уменьшается. В некоторых вариантах данный полипептид содержит аминокислотную последовательность, кодируемую полинуклеотидной последовательностью, выбранной из группы, состоящей из (а) последовательностей SEQ ID NO:358-361, 366-385, 406-430, 455-489, 515-517, 523-559 и 582-596; (b) комплементов указанных последовательностей и (с) последовательностей, которые гибридизуются с последовательностью (а) или (b) в умеренно жестких условиях - условиях высокой жесткости. В конкретных вариантах полипептиды данного изобретения содержат, по меньшей мере, часть белка Chlamydia, которая включает аминокислотную последовательность, выбранную из группы, состоящей из последовательностей, представленных в SEQ ID NO:362-365, 386-405, 431-454, 490-515, 518-522, 560-581 и 597-599, и их вариантов.
Далее, данное изобретение относится к полинуклеотидам, которые кодируют полипептид, описанный выше, или его часть (например, часть, кодирующую, по меньшей мере, 15 аминокислотных остатков белка Chlamydia), экспрессирующие векторы, содержащие такие полинуклеотиды, и клетки-хозяева, трансформированные или трансфицированные такими экспрессирующими векторами.
В родственном аспекте представлены также полинуклеотидные последовательности, кодирующие вышеуказанные полипептиды, рекомбинантные экспрессирующие векторы, содержащие одну или несколько из данных полинуклеотидных последовательностей, и клетки-хозяева, трансформированные или трансфицированные такими экспрессирующими векторами.
В другом аспекте данное изобретение относится к слитым белкам, содержащим полипептид данного изобретения или, альтернативно, полипептид данного изобретения и известный антиген Chlamydia, а также полинуклеотиды, кодирующие такие слитые белки, в комбинации с физиологически приемлемым носителем или иммуностимулятором для применения в качестве их фармацевтических композиций и вакцин.
Данное изобретение относится, кроме того, к фармацевтическим композициям, которые содержат: (а) антитело, как поликлональное, так и моноклональное, или его антигенсвязывающий фрагмент, который специфически связывается с белком Chlamydia; и (b) физиологически приемлемый носитель. В других аспектах данное изобретение относится к фармацевтическим композициям, которые содержат один или более из описываемых полипептидов Chlamydia, например полипептид, представленный в SEQ ID NO:362-365, 386-405, 431-454, 490-515, 518-522, 560-581 и 597-599, или полинуклеотидную молекулу, кодирующую такой полипептид, такую как полинуклеотид, представленный в SEQ ID NO:358-361, 366-385, 406-430, 455-489, 516-517, 523-559 и 582-596, и физиологически приемлемый носитель. Данное изобретение относится также к вакцинам для профилактических и терапевтических целей, содержащим один или несколько из описываемых полипептидов и иммуностимулятор вместе с вакцинами, содержащими одну или несколько полинуклеотидных последовательностей, кодирующих такие полипептиды, и иммуностимулятор.
Еще в одном аспекте представлены способы индукции защитного иммунитета у пациента, предусматривающие введение пациенту эффективного количества одной или нескольких из указанных выше фармацевтических композиций или вакцин.
В следующем аспекте представлены способы лечения инфекции Chlamydia у пациента, предусматривающие получение мононуклеарных клеток периферической крови (РВМС) от пациента, инкубирование данных РВМС с полипептидом данного изобретения (или полинуклеотидом, который кодирует такой полипептид), для получения инкубированных Т-клеток и введение инкубированных Т-клеток пациенту. Данное изобретение относится дополнительно к способам лечения инфекции Chlamydia, которые предусматривают инкубирование антигенпрезентирующих клеток с полипептидом данного изобретения (или полинуклеотидом, который кодирует такой полипептид), для получения инкубированных антигенпрезентирующих клеток и введение инкубированных антигенпрезентирующих клеток пациенту. Пролиферированные клетки могут быть, но не обязательно, клонированы перед введением пациенту. В некоторых вариантах антигенпрезентирующие клетки выбирают из группы, состоящей из дендритных клеток, макрофагов, моноцитов, В-клеток и фибробластов. Представлены также композиции для лечения инфекции Chlamydia, содержащие Т-клетки или антигенпрезентирующие клетки, которые были инкубированы с полипептидом или полинуклеотидом данного изобретения. В родственных аспектах представлены вакцины, которые содержат: (а) антигенпрезентирующую клетку, которая экспрессирует полипептид, описанный выше, и (b) иммуностимулятор.
Данное изобретение относится дополнительно, в других аспектах, к способам удаления инфицированных Chlamydia клеток из биологического образца, предусматривающим контактирование биологического образца с Т-клетками, которые специфически реагируют с белком Chlamydia, где стадию контактирования выполняют в условиях и в течение времени, достаточных для обеспечения удаления клеток, экспрессирующих данный белок, из образца.
В родственных аспектах представлены способы ингибирования развития инфекции Chlamydia у пациента, предусматривающие введение пациенту биологического образца, обработанного, как описано выше. В следующих аспектах данное изобретение относится к способам и диагностическим наборам для обнаружения инфекции Chlamydia у пациента. В одном варианте данный способ предусматривает: (а) контактирование биологического образца, по меньшей мере, с одним из полипептидов или слитых белков, описываемых здесь; и (b) определение в данном образце присутствия связывающих агентов, которые связываются с данным полипептидом или слитым белком, с обнаружением, таким образом, инфекции Chlamydia в данном биологическом образце. Подходящие биологические образцы включают цельную кровь, мокроту, сыворотку, плазму, слюну, цереброспинальную жидкость и мочу. В одном варианте диагностические наборы содержат один или несколько полипептидов или слитых белков, описываемых в комбинации с детектирующим реагентом. Еще в одном варианте диагностические наборы содержат либо моноклональное антитело, либо поликлональное антитело, которое связывается с полипептидом данного изобретения.
Данное изобретение относится также к способам обнаружения инфекции Chlamydia, предусматривающим: (а) получение биологического образца от пациента; (b) контактирование данного образца, по меньшей мере, с двумя олигонуклеотидными праймерами в полимеразной цепной реакции, причем, по меньшей мере, один из данных олигонуклеотидных праймеров является специфическим в отношении описываемой полинуклеотидной последовательности; и (с) определение в данном образце полинуклеотидной последовательности, которая амплифицируется в присутствии данных олигонуклеотидных праймеров. В одном варианте данный олигонуклеотидный праймер содержит, по меньшей мере, приблизительно 10 смежных нуклеотидов описываемой полинуклеотидной последовательности или последовательности, которая гибридизуется с ней.
В следующем аспекте данное изобретение относится к способу обнаружения инфекции Chlamydia у пациента, предусматривающему: (а) получение биологического образца от данного пациента; (b) контактирование данного образца с олигонуклеотидным зондом, специфическим для описываемой полинуклеотидной последовательности; и (с) определение в образце полинуклеотидной последовательности, которая гибридизуется с данным олигонуклеотидным зондом. В одном варианте данный олигонуклеотидный зонд содержит, по меньшей мере, приблизительно 15 смежных нуклеотидов описываемого полинуклеотида или последовательность, которая гибридизуется с ними.
Данные и другие аспекты данного изобретения станут очевидными при ссылке на следующее подробное описание. Все представленные ссылки тем самым включены в данное описание в виде ссылок во всей их полноте, как если бы каждая из них была включена индивидуально.
ИДЕНТИФИКАТОРЫ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID NO:1 является определенной последовательностью ДНК для клона 1-В1-66 C. trachomatis.
SEQ ID NO:2 является определенной последовательностью ДНК для клона 4-D7-28 C. trachomatis.
SEQ ID NO:3 является определенной последовательностью ДНК для клона 3-G3-10 C. trachomatis.
SEQ ID NO:4 является определенной последовательностью ДНК для клона 10-С10-31 C. trachomatis.
SEQ ID NO:5 является предсказанной аминокислотной последовательностью для 1-В1-66.
SEQ ID NO:6 является предсказанной аминокислотной последовательностью для 4-D7-28.
SEQ ID NO:7 является первой предсказанной аминокислотной последовательностью для 3-G3-10.
SEQ ID NO:8 является второй предсказанной аминокислотной последовательностью для 3-G3-10.
SEQ ID NO:9 является третьей предсказанной аминокислотной последовательностью для 3-G3-10.
SEQ ID NO:10 является четвертой предсказанной аминокислотной последовательностью для 3-G3-10.
SEQ ID NO:11 является пятой предсказанной аминокислотной последовательностью для 3-G3-10.
SEQ ID NO:12 является предсказанной аминокислотной последовательностью для 10-С10-31.
SEQ ID NO:13 является аминокислотной последовательностью синтетического пептида 1-В1-66/48-67.
SEQ ID NO:14 является аминокислотной последовательностью синтетического пептида 1-В1-66/58-77.
SEQ ID NO:15 является определенной последовательностью ДНК для клона 2С7-8 серовара LGV II C. trachomatis.
SEQ ID NO:16 является последовательностью ДНК предполагаемой открытой рамки считывания из района генома серовара D C. trachomatis, в котором картирован 2С7-8.
SEQ ID NO:17 является предсказанной аминокислотной последовательностью, кодируемой последовательностью ДНК SEQ ID NO:16.
SEQ ID NO:18 является аминокислотной последовательностью синтетического пептида CtC7.8-12.
SEQ ID NO:19 является аминокислотной последовательностью синтетического пептида CtC7.8-13.
SEQ ID NO:20 является предсказанной аминокислотной последовательностью, кодируемой второй предполагаемой открытой рамкой считывания из серовара D C. trachomatis.
SEQ ID NO:21 является определенной последовательностью ДНК для клона 4С9-18 из C. trachomatis LGV II.
SEQ ID NO:22 является определенной последовательностью ДНК, гомологичной липоамиддегидрогеназе из C. trachomatis LGV II.
SEQ ID NO:23 является определенной последовательностью ДНК, гомологичной гипотетическому белку из C. trachomatis LGV II.
SEQ ID NO:24 является определенной последовательностью ДНК, гомологичной убихинонметилтрансферазе из C. trachomatis LGV II.
SEQ ID NO:25 является определенной последовательностью ДНК для клона 4С9-18#2 BL21 pLysS из C. trachomatis LGV II.
SEQ ID NO:26 является предсказанной аминокислотной последовательностью для 4C9-18#2 из C. trachomatis LGV II.
SEQ ID NO:27 является определенной последовательностью ДНК для Ср-SWIB из штамма TWAR C. pneumoniaе.
SEQ ID NO:28 является предсказанной аминокислотной последовательностью для Ср-SWIB из штамма TWAR C. pneumoniaе.
SEQ ID NO:29 является определенной последовательностью ДНК для Ср-S13 (СТ509) из штамма TWAR C. pneumoniaе.
SEQ ID NO:30 является предсказанной аминокислотной последовательностью для Cp-S13 из штамма TWAR C. pneumoniaе.
SEQ ID NO:31 является аминокислотной последовательностью для 10-мерного консенсусного пептида из CtC7.8-12 и CtC7.8-13.
SEQ ID NO:32 является предсказанной аминокислотной последовательностью для клона 2С7-8 из C. trachomatis LGV II.
SEQ ID NO:33 является последовательностью ДНК, соответствующей нуклеотидам 597304-597145 генома серовара D C. trachomatis (NCBI, BLASTN-поиск), которая обнаруживает гомологию с клоном 2С7-8.
SEQ ID NO:34 является предсказанной аминокислотной последовательностью, кодируемой последовательностью SEQ ID NO:33.
SEQ ID NO:35 является последовательностью ДНК для С.p. SWIB Nde (5' праймера) из C. pneumoniaе.
SEQ ID NO:36 является последовательностью ДНК для С.p. SWIB EcoRI (3' праймера) из C. pneumoniaе.
SEQ ID NO:37 является последовательностью ДНК для С.p. S13 Nde (5' праймера) из C. pneumoniaе.
SEQ ID NO:38 является последовательностью ДНК для С.p. S13 EcoRI (3' праймера) из C. pneumoniaе.
SEQ ID NO:39 является аминокислотной последовательностью для пептида CtSwib 52-67 из C. trachomatis LGV II.
SEQ ID NO:40 является аминокислотной последовательностью для пептида CpSwib 53-68 из C. pneumoniaе.
SEQ ID NO:41 является аминокислотной последовательностью для пептида HuSwib 288-302 из домена SWI человека.
SEQ ID NO:42 является аминокислотной последовательностью для пептида CtSWI-T 822-837 из слитого белка топоизомераза-SWIB C. trachomatis.
SEQ ID NO:43 является аминокислотной последовательностью для пептида CpSWI-T 828-842 из слитого белка топоизомераза-SWIB C. pneumoniaе.
SEQ ID NO:44 является первой определенной последовательностью ДНК для клона 19783.3,jen.seq(1>509)CTL2#11-3' C. trachomatis LGV II, представляющей 3' конец.
SEQ ID NO:45 является второй определенной последовательностью ДНК для клона 19783.4,jen.seq(1>481)CTL2#11-5' C. trachomatis LGV II, представляющей 5' конец.
SEQ ID NO:46 является определенной последовательностью ДНК для клона 19784CTL2_12consensus.seq(1>427)CTL2#12 C. trachomatis LGV II.
SEQ ID NO:47 является определенной последовательностью ДНК для клона 19785.4,jen.seq(1>600)CTL2#16-5' C. trachomatis LGV II, представляющей 5' конец.
SEQ ID NO:48 является первой определенной последовательностью ДНК для клона 19786.3,jen.seq(1>600)CTL2#18-3' C. trachomatis LGV II, представляющей 3' конец.
SEQ ID NO:49 является второй определенной последовательностью ДНК для клона 19786.4,jen.seq(1>600)CTL2#18-5' C. trachomatis LGV II, представляющей 3' конец.
SEQ ID NO:50 является определенной последовательностью ДНК для клона 19788CTL2_21consensus.seq(1>406)CTL2#21 C. trachomatis LGV II.
SEQ ID NO:51 является определенной последовательностью ДНК для клона 19790CTL2_23consensus.seq(1>602)CTL2#23 C. trachomatis LGV II.
SEQ ID NO:52 является определенной последовательностью ДНК для клона 19791CTL2_24consensus.seq(1>145)CTL2#24 C. trachomatis LGV II.
SEQ ID NO:53 является определенной последовательностью ДНК для клона CTL2#4 C. trachomatis LGV II.
SEQ ID NO:54 является определенной последовательностью ДНК для клона CTL2#8b C. trachomatis LGV II.
SEQ ID NO:55 является определенной последовательностью ДНК для клона 15-G1-89 C. trachomatis LGV II, имеющей гомологию относительно гена липоамиддегидрогеназы СТ557.
SEQ ID NO:56 является определенной последовательностью ДНК для клона 14-H1-4 C. trachomatis LGV II, имеющей гомологию относительно гена тиол-специфического антиоксиданта СТ603.
SEQ ID NO:57 является определенной последовательностью ДНК для клона 12-G3-83 C. trachomatis LGV II имеющей гомологию относительно гипотетического белка СТ622.
SEQ ID NO:58 является определенной последовательностью ДНК для клона 12-B3-95 C. trachomatis LGV II, имеющей гомологию относительно гена липоамиддегидрогеназы СТ557.
SEQ ID NO:59 является определенной последовательностью ДНК для клона 11-Н4-28 C. trachomatis LGV II, имеющей гомологию относительно гена dnaK гена СТ396.
SEQ ID NO:60 является определенной последовательностью ДНК для клона 11-Н3-68 C. trachomatis LGV II, имеющей частичную гомологию относительно вирулентного белка PGP6-D и гена рибосомного белка L1 СТ318.
SEQ ID NO:61 является определенной последовательностью ДНК для клона 11-G1-34 C. trachomatis LGV II, имеющей частичную гомологию относительно гена малатдегидрогеназы СТ376 и гена гликогенгидролазы СТ042.
SEQ ID NO:62 является определенной последовательностью ДНК для клона 11-G10-46 C. trachomatis LGV II, имеющей гомологию относительно гипотетического белка СТ610.
SEQ ID NO:63 является определенной последовательностью ДНК для клона 11-С12-91 C. trachomatis LGV II, имеющей гомологию относительно гена СТ443 ОМР2.
SEQ ID NO:64 является определенной последовательностью ДНК для клона 11-А3-93 C. trachomatis LGV II, имеющей гомологию относительно гена СТ103 надсемейства HAD.
SEQ ID NO:65 является определенной аминокислотной последовательностью для клона 14-Н1-4 C. trachomatis LGV II, имеющей гомологию относительно гена тиол-специфического антиоксиданта СТ603.
SEQ ID NO:66 является определенной последовательностью ДНК для клона CtL2#9 C. trachomatis LGV II.
SEQ ID NO:67 является определенной последовательностью ДНК для клона CtL2#7 C. trachomatis LGV II.
SEQ ID NO:68 является определенной последовательностью ДНК для клона CtL2#6 C. trachomatis LGV II.
SEQ ID NO:69 является определенной последовательностью ДНК для клона CtL2#5 C. trachomatis LGV II.
SEQ ID NO:70 является определенной последовательностью ДНК для клона CtL2#2 C. trachomatis LGV II.
SEQ ID NO:71 является определенной последовательностью ДНК для клона CtL2#1 C. trachomatis LGV II.
SEQ ID NO:72 является первой определенной последовательностью ДНК для клона C. trachomatis LGV II 23509.2CtL2#3-5', представляющей 5' конец.
SEQ ID NO:73 является второй определенной последовательностью ДНК для клона C. trachomatis LGV II 23509.1CtL2#3-3', представляющей 3' конец.
SEQ ID NO:74 является первой определенной последовательностью ДНК для клона C. trachomatis LGV II 22121.2CtL2#10-5', представляющей 5' конец.
SEQ ID NO:75 является второй определенной последовательностью ДНК для клона C. trachomatis LGV II 22121.1CtL2#10-3', представляющей 3' конец.
SEQ ID NO:76 является определенной последовательностью ДНК для клона C. trachomatis LGV II 19787.6CtL2#19-5', представляющей 5' конец.
SEQ ID NO:77 является определенной последовательностью ДНК для клона C. pneumoniae LGV II CpS13-His.
SEQ ID NO:78 является определенной последовательностью ДНК для клона C. pneumoniae LGV II Cp_SWIB-His.
SEQ ID NO:79 является определенной последовательностью ДНК для клона C. trachomatis LGV II 23-G7-68, имеющей частичную гомологию относительно рибосомного белка L11, L10 и L1.
SEQ ID NO:80 является определенной последовательностью ДНК для клона C. trachomatis LGV II 22-F8-91, имеющей гомологию относительно гена pmpC.
SEQ ID NO:81 является определенной последовательностью ДНК для клона C. trachomatis LGV II 21-Е8-95, имеющей гомологию относительно генов СТ610-СТ613.
SEQ ID NO:82 является определенной последовательностью ДНК для клона C. trachomatis LGV II 19-F12-57, имеющей гомологию относительно генов СТ858 и recA.
SEQ ID NO:83 является определенной последовательностью ДНК для клона C. trachomatis LGV II 19-F12-53, имеющей гомологию относительно гена СТ445, кодирующего глутамил-тРНК-синтетазу.
SEQ ID NO:84 является определенной последовательностью ДНК для клона C. trachomatis LGV II 19-А5-54, имеющей гомологию относительно гена криптической плазмиды.
SEQ ID NO:85 является определенной последовательностью ДНК для клона C. trachomatis LGV II 17-Е11-72, имеющей частичную гомологию относительно генов ОррС_2 и pmpD.
SEQ ID NO:86 является определенной последовательностью ДНК для клона C. trachomatis LGV II 17-С1-77, имеющей частичную гомологию относительно открытых рамок считывания СТ857 и СТ858.
SEQ ID NO:87 является определенной последовательностью ДНК для клона C. trachomatis LGV II 15-Н2-76, имеющей частичную гомологию относительно генов pmpD и SycE и относительно ORF СТ089.
SEQ ID NO:88 является определенной последовательностью ДНК для клона C. trachomatis LGV II 15-А3-26, имеющей гомологию относительно ORF СТ858.
SEQ ID NO:89 является определенной аминокислотной последовательностью для клона C. pneumoniaе Cp_SWIB-His.
SEQ ID NO:90 является определенной аминокислотной последовательностью для клона C. trachomatis LGV II CtL2_LPDA_FL.
SEQ ID NO:91 является определенной аминокислотной последовательностью для клона C. pneumoniaе CpS13-His.
SEQ ID NO:92 является определенной аминокислотной последовательностью для клона C. trachomatis LGV II CtL2_TSA_FL.
SEQ ID NO:93 является аминокислотной последовательностью для пептида Ct-Swib 43-61 из C. trachomatis LGV II.
SEQ ID NO:94 является аминокислотной последовательностью для пептида Ct-Swib 48-67 из C. trachomatis LGV II.
SEQ ID NO:95 является аминокислотной последовательностью для пептида Ct-Swib 52-71 из C. trachomatis LGV II.
SEQ ID NO:96 является аминокислотной последовательностью для пептида Ct-Swib 58-77 из C. trachomatis LGV II.
SEQ ID NO:97 является аминокислотной последовательностью для пептида Ct-Swib 63-82 из C. trachomatis LGV II.
SEQ ID NO:98 является аминокислотной последовательностью для пептида Ct-Swib 51-66 из C. trachomatis LGV II.
SEQ ID NO:99 является аминокислотной последовательностью для пептида Cр-Swib 52-67 из C. pneumoniaе.
SEQ ID NO:100 является аминокислотной последовательностью для пептида Cр-Swib 37-51 из C. pneumoniaе.
SEQ ID NO:101 является аминокислотной последовательностью для пептида Cр-Swib 32-51 из C. pneumoniaе.
SEQ ID NO:102 является аминокислотной последовательностью для пептида Cр-Swib 37-56 из C. pneumoniaе.
SEQ ID NO:103 является аминокислотной последовательностью для пептида Ct-Swib 36-50 из C. trachomatis.
SEQ ID NO:104 является аминокислотной последовательностью для пептида Ct-S13 46-65 из C. trachomatis.
SEQ ID NO:105 является аминокислотной последовательностью для пептида Ct-S13 60-80 из C. trachomatis.
SEQ ID NO:106 является аминокислотной последовательностью для пептида Ct-S13 1-20 из C. trachomatis.
SEQ ID NO:107 является аминокислотной последовательностью для пептида Ct-S13 46-65 из C. trachomatis.
SEQ ID NO:108 является аминокислотной последовательностью для пептида Ct-S13 56-75 из C. trachomatis.
SEQ ID NO:109 является аминокислотной последовательностью для пептида Cp-S13 56-75 из C. pneumoniaе.
SEQ ID NO:110 является определенной последовательностью ДНК для клона 21-G12-60 C. trachomatis LGV II, содержащей частичные открытые рамки считывания для гипотетических белков СТ875, СТ229 и СТ228.
SEQ ID NO:111 является определенной последовательностью ДНК для клона 22-В3-53 C. trachomatis LGV II, имеющей гомологию относительно ORF GroEL СТ110.
SEQ ID NO:112 является определенной последовательностью ДНК для клона 22-А1-49 C. trachomatis LGV II, имеющей частичную гомологию относительно ORF СТ660 и СТ659.
SEQ ID NO:113 является определенной последовательностью ДНК для клона 17-Е2-9 C. trachomatis LGV II, имеющей частичную гомологию относительно ORF СТ611 и СТ610.
SEQ ID NO:114 является определенной последовательностью ДНК для клона 17-С10-31 C. trachomatis LGV II, имеющей частичную гомологию относительно ORF СТ858.
SEQ ID NO:115 является определенной последовательностью ДНК для клона 21-С7-8 C. trachomatis LGV II, имеющей гомологию относительно dnаK-подобного гена.
SEQ ID NO:116 является определенной последовательностью ДНК для клона 20-G3-45 C. trachomatis LGV II, содержащей часть гена pmpB СТ413.
SEQ ID NO:117 является определенной последовательностью ДНК для клона 18-С5-2 C. trachomatis LGV II, имеющей гомологию относительно ORF рибосомного белка S1.
SEQ ID NO:118 является определенной последовательностью ДНК для клона 17-С5-19 C. trachomatis LGV II, содержащей часть ORF для СТ431 и СТ430.
SEQ ID NO:119 является определенной последовательностью ДНК для клона 16-D4-22 C. trachomatis LGV II, содержащей частичные последовательности ORF3 и ORF4 плазмиды для роста в клетках млекопитающих.
SEQ ID NO:120 является определенной полноразмерной последовательностью ДНК для гена СТ529 Сар1 серовара LGV II C. trachomatis.
SEQ ID NO:121 является предсказанной полноразмерной аминокислотной последовательностью для гена Сар1 СТ529 серовара LGV II C. trachomatis.
SEQ ID NO:122 является определенной полноразмерной последовательностью ДНК для гена Сар1 СТ529 серовара Е C. trachomatis.
SEQ ID NO:123 является предсказанной полноразмерной аминокислотной последовательностью для гена Сар1 СТ529 серовара Е C. trachomatis.
SEQ ID NO:124 является определенной полноразмерной последовательностью ДНК для гена Сар1 СТ529 серовара 1А C. trachomatis.
SEQ ID NO:125 является предсказанной полноразмерной аминокислотной последовательностью для гена Сар1 СТ529 серовара 1А C. trachomatis.
SEQ ID NO:126 является определенной полноразмерной последовательностью ДНК для гена Сар1 СТ529 серовара G C. trachomatis.
SEQ ID NO:127 является предсказанной полноразмерной аминокислотной последовательностью для гена Сар1 СТ529 серовара G C. trachomatis.
SEQ ID NO:128 является определенной полноразмерной последовательностью ДНК для гена Сар1 СТ529 серовара F1 NII C. trachomatis.
SEQ ID NO:129 является предсказанной полноразмерной аминокислотной последовательностью для гена Сар1 СТ529 серовара F1 NII C. trachomatis.
SEQ ID NO:130 является определенной полноразмерной последовательностью ДНК для гена Сар1 СТ529 серовара L1 C. trachomatis.
SEQ ID NO:131 является предсказанной полноразмерной аминокислотной последовательностью для гена Сар1 СТ529 серовара L1 C. trachomatis.
SEQ ID NO:132 является определенной полноразмерной последовательностью ДНК для гена Сар1 СТ529 серовара L3 C. trachomatis.
SEQ ID NO:133 является предсказанной полноразмерной аминокислотной последовательностью для гена Сар1 СТ529 серовара L3 C. trachomatis.
SEQ ID NO:134 является определенной полноразмерной последовательностью ДНК для гена Сар1 СТ529 серовара Ва C. trachomatis.
SEQ ID NO:135 является предсказанной полноразмерной аминокислотной последовательностью для гена Сар1 СТ529 серовара Ва C. trachomatis.
SEQ ID NO:136 является определенной полноразмерной последовательностью ДНК для гена Сар1 СТ529 серовара MOPN C. trachomatis.
SEQ ID NO:137 является предсказанной полноразмерной аминокислотной последовательностью для гена Сар1 СТ529 серовара MOPN C. trachomatis.
SEQ ID NO:138 является определенной аминокислотной последовательностью для пептида #124-139 ORF Сар1 СТ529 серовара L2 C. trachomatis.
SEQ ID NO:139 является определенной аминокислотной последовательностью для пептида #132-147 ORF Сар1 СТ529 серовара L2 C. trachomatis.
SEQ ID NO:140 является определенной аминокислотной последовательностью для пептида #138-155 ORF Сар1 СТ529 серовара L2 C. trachomatis.
SEQ ID NO:141 является определенной аминокислотной последовательностью для пептида #146-163 ORF Сар1 СТ529 серовара L2 C. trachomatis.
SEQ ID NO:142 является определенной аминокислотной последовательностью для пептида #154-171 ORF Сар1 СТ529 серовара L2 C. trachomatis.
SEQ ID NO:143 является определенной аминокислотной последовательностью для пептида #162-178 ORF Сар1 СТ529 серовара L2 C. trachomatis.
SEQ ID NO:144 является определенной аминокислотной последовательностью для пептида #138-147 ORF Сар1 СТ529 серовара L2 C. trachomatis.
SEQ ID NO:145 является определенной аминокислотной последовательностью для пептида #139-147 ORF Сар1 СТ529 серовара L2 C. trachomatis.
SEQ ID NO:146 является определенной аминокислотной последовательностью для пептида #140-147 ORF Сар1 СТ529 серовара L2 C. trachomatis.
SEQ ID NO:147 является определенной аминокислотной последовательностью для пептида #138-146 ORF Сар1 СТ529 серовара L2 C. trachomatis.
SEQ ID NO:148 является определенной аминокислотной последовательностью для пептида #138-145 ORF Сар1 СТ529 серовара L2 C. trachomatis.
SEQ ID NO:149 является определенной аминокислотной последовательностью для пептида #F140>I ORF Сар1 СТ529 серовара L2 C. trachomatis.
SEQ ID NO:150 является определенной аминокислотной последовательностью для пептида ##S139>Ga ORF Сар1 СТ529 серовара L2 C. trachomatis.
SEQ ID NO:151 является определенной аминокислотной последовательностью для пептида ##S139>Gb ORF Сар1 СТ529 серовара L2 C. trachomatis.
SEQ ID NO:152 является определенной аминокислотной последовательностью для пептида #2 С7.8-6 ORF из 216 аминокислот серовара L2 C. trachomatis.
SEQ ID NO:153 является определенной аминокислотной последовательностью для пептида #2 C7.8-7 ORF из 216 аминокислот серовара L2 C. trachomatis.
SEQ ID NO:154 является определенной аминокислотной последовательностью для пептида #2 C7.8-8 ORF из 216 аминокислот серовара L2 C. trachomatis.
SEQ ID NO:155 является определенной аминокислотной последовательностью для пептида #2 C7.8-9 ORF из 216 аминокислот серовара L2 C. trachomatis.
SEQ ID NO:156 является определенной аминокислотной последовательностью для пептида #2 C7.8-10 ORF из 216 аминокислот серовара L2 C. trachomatis.
SEQ ID NO:157 является определенной аминокислотной последовательностью для пептида из 53 аминокислотных остатков ORF из 216 аминокислот в клоне 2С7.8 серовара L2 C. trachomatis.
SEQ ID NO:158 является определенной аминокислотной последовательностью для пептида из 52 аминокислотных остатков ORF СТ529 в клоне 2С7.8 серовара L2 C. trachomatis.
SEQ ID NO:159 является определенной последовательностью ДНК для 5'-(прямого) праймера для клонирования полноразмерного СТ529 серовара L2.
SEQ ID NO:160 является определенной последовательностью ДНК для 5'-(обратного) праймера для клонирования полноразмерного СТ529 серовара L2.
SEQ ID NO:161 является определенной последовательностью ДНК для 5'-(прямого) праймера для клонирования полноразмерного СТ529 для сероваров иных, чем L2 и МOPN.
SEQ ID NO:162 является определенной последовательностью ДНК для 5'-(обратного) праймера для клонирования полноразмерных сероваров СТ529 иных, чем L2 и MOPN.
SEQ ID NO:163 является определенной последовательностью ДНК для 5'-(прямого) праймера для клонирования полноразмерного серовара MOPN СТ529.
SEQ ID NO:164 является определенной последовательностью ДНК для 5'-(обратного) праймера для клонирования полноразмерного серовара MOPN СТ529.
SEQ ID NO:165 является определенной последовательностью ДНК для 5'-(прямого) праймера для pBIB-KS.
SEQ ID NO:166 является определенной последовательностью ДНК для 5'-(обратного) праймера для pBIB-KS.
SEQ ID NO:167 является определенной аминокислотной последовательностью для 9-мерного эпитопного пептида Сар1#139-147 из серовара L2.
SEQ ID NO:168 является определенной аминокислотной последовательностью для 9-мерного эпитопного пептида Сар1#139-147 из серовара D.
SEQ ID NO:169 является определенной полноразмерной последовательностью ДНК для гена pmpI (СТ874) C. trachomatis.
SEQ ID NO:170 является определенной полноразмерной последовательностью ДНК для гена pmpG C. trachomatis.
SEQ ID NO:171 является определенной полноразмерной последовательностью ДНК для гена pmpЕ C. trachomatis.
SEQ ID NO:172 является определенной полноразмерной последовательностью ДНК для гена pmpD C. trachomatis.
SEQ ID NO:173 является определенной полноразмерной последовательностью ДНК для гена pmpC C. trachomatis.
SEQ ID NO:174 является определенной полноразмерной последовательностью ДНК для гена pmpB C. trachomatis.
SEQ ID NO:175 является предсказанной полноразмерной аминокислотной последовательностью для гена pmpI C. trachomatis.
SEQ ID NO:176 является предсказанной полноразмерной аминокислотной последовательностью для гена pmpG C. trachomatis.
SEQ ID NO:177 является предсказанной полноразмерной аминокислотной последовательностью для гена pmpЕ C. trachomatis.
SEQ ID NO:178 является предсказанной полноразмерной аминокислотной последовательностью для гена pmpD C. trachomatis.
SEQ ID NO:179 является предсказанной полноразмерной аминокислотной последовательностью для гена pmpC C. trachomatis.
SEQ ID NO:180 является предсказанной полноразмерной аминокислотной последовательностью для гена pmpB C. trachomatis.
SEQ ID NO:181 является определенной последовательностью ДНК минус сигнальная последовательность для гена pmpI C. trachomatis.
SEQ ID NO:182 является впоследствии определенной полноразмерной последовательностью ДНК для гена pmpG C. trachomatis.
SEQ ID NO:183 является определенной последовательностью ДНК минус сигнальная последовательность для гена pmpE C. trachomatis.
SEQ ID NO:184 является первой определенной последовательностью ДНК, представляющей карбокси-конец для гена pmpD C. trachomatis.
SEQ ID NO:185 является второй определенной последовательностью ДНК, представляющей амино-конец минус сигнальная последовательность для гена pmpD C. trachomatis.
SEQ ID NO:186 является первой определенной последовательностью ДНК, представляющей карбокси-конец для гена pmpС C. trachomatis.
SEQ ID NO:187 является второй определенной последовательностью ДНК, представляющей амино-конец минус сигнальная последовательность для гена pmpС C. trachomatis.
SEQ ID NO:188 является определенной последовательностью ДНК, представляющей ген pmp серовара MOMPS C. pneumoniaе в слитой с Ra12 молекуле.
SEQ ID NO:189 является предсказанной аминокислотной последовательностью минус сигнальная последовательность для гена pmpI C. trachomatis.
SEQ ID NO:190 является предсказанной позже аминокислотной последовательностью для гена pmpG C. trachomatis
SEQ ID NO:191 является предсказанной аминокислотной последовательностью минус сигнальная последовательность для гена pmpE C. trachomatis.
SEQ ID NO:192 является первой предсказанной аминокислотной последовательностью, представляющей карбокси-конец гена pmpD C. trachomatis.
SEQ ID NO:193 является второй предсказанной аминокислотной последовательностью, представляющей амино-конец минус сигнальная последовательность гена pmpD C. trachomatis.
SEQ ID NO:194 является первой предсказанной аминокислотной последовательностью, представляющей карбокси-конец гена pmpС C. trachomatis.
SEQ ID NO:195 является второй предсказанной аминокислотной последовательностью, представляющей амино-конец гена pmpС C. trachomatis.
SEQ ID NO: 196 является предсказанной аминокислотной последовательностью, представляющей ген pmp серовара MOMPS C. pneumoniaе в слитой с Ra12 молекуле.
SEQ ID NO:197 является определенной последовательностью ДНК для 5' олигопраймера для клонирования гена pmpC C. trachomatis в вакцинном векторе SKB.
SEQ ID NO:198 является определенной последовательностью ДНК для 3' олигопраймера для клонирования гена pmpC C. trachomatis в вакцинном векторе SKB.
SEQ ID NO:199 является определенной последовательностью ДНК для встраивания последовательности для клонирования гена pmpC C. trachomatis в вакцинном векторе SKB.
SEQ ID NO:200 является определенной последовательностью ДНК для 5' олигопраймера для клонирования гена pmpD в вакцинном векторе SKB.
SEQ ID NO:201 является определенной последовательностью ДНК для 3' олигопраймера для клонирования гена pmpD C. trachomatis в вакцинном векторе SKB.
SEQ ID NO:202 является определенной последовательностью ДНК для встраивания последовательности для клонирования гена pmpD C. trachomatis в вакцинном векторе SKB.
SEQ ID NO:203 является определенной последовательностью ДНК для 5' олигопраймера для клонирования гена pmpЕ C. trachomatis в вакцинном векторе SKB.
SEQ ID NO:204 является определенной последовательностью ДНК для 3' олигопраймера для клонирования гена pmpЕ C. trachomatis в вакцинном векторе SKB.
SEQ ID NO:205 является определенной последовательностью ДНК для 5' олигопраймера для клонирования гена pmpG C. trachomatis в вакцинном векторе SKB.
SEQ ID NO:206 является определенной последовательностью ДНК для 3' олигопраймера для клонирования гена pmpG C. trachomatis в вакцинном векторе SKB.
SEQ ID NO:207 является определенной последовательностью ДНК для 5' олигопраймера для клонирования амино-концевой части гена pmpC C. trachomatis в векторе pET17b.
SEQ ID NO:208 является определенной последовательностью ДНК для 3' олигопраймера для клонирования амино-концевой части гена pmpC C. trachomatis в векторе pET17b.
SEQ ID NO:209 является определенной последовательностью ДНК для 5' олигопраймера для клонирования карбокси-концевой части гена pmpC C. trachomatis в векторе pET17b.
SEQ ID NO:210 является определенной последовательностью ДНК для 3' олигопраймера для клонирования карбокси-концевой части гена pmpC C. trachomatis в векторе pET17b.
SEQ ID NO:211 является определенной последовательностью ДНК для 5' олигопраймера для клонирования амино-концевой части гена pmpD C. trachomatis в векторе pET17b.
SEQ ID NO:212 является определенной последовательностью ДНК для 3' олигопраймера для клонирования амино-концевой части гена pmpD C. trachomatis в векторе pET17b.
SEQ ID NO:213 является определенной последовательностью ДНК для 5' олигопраймера для клонирования карбокси-концевой части гена pmpD C. trachomatis в векторе pET17b.
SEQ ID NO:214 является определенной последовательностью ДНК для 3' олигопраймера для клонирования карбокси-концевой части гена pmpD C. trachomatis в векторе pET17b.
SEQ ID NO:215 является определенной последовательностью ДНК для 5' олигопраймера для клонирования гена pmpЕ C. trachomatis в векторе pET17b.
SEQ ID NO:216 является определенной последовательностью ДНК для 3' олигопраймера для клонирования гена pmpЕ C. trachomatis в векторе pET17b.
SEQ ID NO:217 является определенной последовательностью ДНК для инсерционной последовательности для клонирования гена pmpE C. trachomatis в векторе pET17b.
SEQ ID NO:218 является аминокислотной последовательностью для инсерционной последовательности для клонирования гена pmpE C. trachomatis в векторе pET17b.
SEQ ID NO:219 является определенной последовательностью ДНК для 5' олигопраймера для клонирования гена pmpG C. trachomatis в векторе pET17b.
SEQ ID NO:220 является определенной последовательностью ДНК для 3' олигопраймера для клонирования гена pmpG C. trachomatis в векторе pET17b.
SEQ ID NO:221 является аминокислотной последовательностью для инсерционной последовательности для клонирования гена pmpG C. trachomatis в векторе pET17b.
SEQ ID NO:222 является определенной последовательностью ДНК для 5' олигопраймера для клонирования гена pmpI C. trachomatis в векторе pET17b.
SEQ ID NO:223 является определенной последовательностью ДНК для 3' олигопраймера для клонирования гена pmpI C. trachomatis в векторе pET17b.
SEQ ID NO:224 является определенной аминокислотной последовательностью для пептида 1-20 Swib C. pneumoniaе.
SEQ ID NO:225 является определенной аминокислотной последовательностью для пептида 6-25 Swib C. pneumoniaе.
SEQ ID NO:226 является определенной аминокислотной последовательностью для пептида 12-31 Swib C. pneumoniaе.
SEQ ID NO:227 является определенной аминокислотной последовательностью для пептида 17-36 Swib C. pneumoniaе.
SEQ ID NO:228 является определенной аминокислотной последовательностью для пептида 22-41 Swib C. pneumoniaе.
SEQ ID NO:229 является определенной аминокислотной последовательностью для пептида 27-46 Swib C. pneumoniaе.
SEQ ID NO:230 является определенной аминокислотной последовательностью для пептида 42-61 Swib C. pneumoniaе.
SEQ ID NO:231 является определенной аминокислотной последовательностью для пептида 46-65 Swib C. pneumoniaе.
SEQ ID NO:232 является определенной аминокислотной последовательностью для пептида 51-70 Swib C. pneumoniaе.
SEQ ID NO:233 является определенной аминокислотной последовательностью для пептида 56-75 Swib C. pneumoniaе.
SEQ ID NO:234 является определенной аминокислотной последовательностью для пептида 61-80 Swib C. pneumoniaе.
SEQ ID NO:235 является определенной аминокислотной последовательностью для пептида 66-87 Swib C. pneumoniaе.
SEQ ID NO:236 является определенной аминокислотной последовательностью для пептида 103-122 ОМСВ C. trachomatis.
SEQ ID NO:237 является определенной аминокислотной последовательностью для пептида 108-127 ОМСВ C. trachomatis.
SEQ ID NO:238 является определенной аминокислотной последовательностью для пептида 113-132 ОМСВ C. trachomatis.
SEQ ID NO:239 является определенной аминокислотной последовательностью для пептида 118-137 ОМСВ C. trachomatis.
SEQ ID NO:240 является определенной аминокислотной последовательностью для пептида 123-143 ОМСВ C. trachomatis.
SEQ ID NO:241 является определенной аминокислотной последовательностью для пептида 128-147 ОМСВ C. trachomatis.
SEQ ID NO:242 является определенной аминокислотной последовательностью для пептида 133-152 ОМСВ C. trachomatis.
SEQ ID NO:243 является определенной аминокислотной последовательностью для пептида 137-156 ОМСВ C. trachomatis.
SEQ ID NO:244 является определенной аминокислотной последовательностью для пептида 142-161 ОМСВ C. trachomatis.
SEQ ID NO:245 является определенной аминокислотной последовательностью для пептида 147-166 ОМСВ C. trachomatis.
SEQ ID NO:246 является определенной аминокислотной последовательностью для пептида 152-171 ОМСВ C. trachomatis.
SEQ ID NO:247 является определенной аминокислотной последовательностью для пептида 157-176 ОМСВ C. trachomatis.
SEQ ID NO:248 является определенной аминокислотной последовательностью для пептида 162-181 ОМСВ C. trachomatis.
SEQ ID NO:249 является определенной аминокислотной последовательностью для пептида 167-186 ОМСВ C. trachomatis.
SEQ ID NO:250 является определенной аминокислотной последовательностью для пептида 171-190 ОМСВ C. trachomatis.
SEQ ID NO:251 является определенной аминокислотной последовательностью для пептида 171-186 ОМСВ C. trachomatis.
SEQ ID NO:252 является определенной аминокислотной последовательностью для пептида 175-186 ОМСВ C. trachomatis.
SEQ ID NO:253 является определенной аминокислотной последовательностью для пептида 185-198 ОМСВ C. pneumoniaе.
SEQ ID NO:254 является определенной аминокислотной последовательностью для пептида 96-115 TSA C. trachomatis.
SEQ ID NO:255 является определенной аминокислотной последовательностью для пептида 101-120 TSA C. trachomatis.
SEQ ID NO:256 является определенной аминокислотной последовательностью для пептида 106-125 TSA C. trachomatis.
SEQ ID NO:257 является определенной аминокислотной последовательностью для пептида 111-130 TSA C. trachomatis.
SEQ ID NO:258 является определенной аминокислотной последовательностью для пептида 116-135 TSA C. trachomatis.
SEQ ID NO:259 является определенной аминокислотной последовательностью для пептида 121-140 TSA C. trachomatis.
SEQ ID NO:260 является определенной аминокислотной последовательностью для пептида 126-145 TSA C. trachomatis.
SEQ ID NO:261 является определенной аминокислотной последовательностью для пептида 131-150 TSA C. trachomatis.
SEQ ID NO:262 является определенной аминокислотной последовательностью для пептида 136-155 TSA C. trachomatis.
SEQ ID NO:263 является определенной полноразмерной последовательностью ДНК для гена СТ529/Сар1 серовара I C. trachomatis.
SEQ ID NO:264 является предсказанной полноразмерной аминокислотной последовательностью для гена СТ529/Сар1 серовара I C. trachomatis.
SEQ ID NO:265 является определенной полноразмерной последовательностью ДНК для гена СТ529/Сар1 серовара K C. trachomatis.
SEQ ID NO:266 является предсказанной полноразмерной аминокислотной последовательностью для гена СТ529/Сар1 серовара К C. trachomatis.
SEQ ID NO:267 является определенной последовательностью ДНК для клона 17-G4-36 C. trachomatis, имеющей гомологию относительно части ORF бета-субъединицы СТ315 ДНК-зависимой РНК-полимеразы в serD.
SEQ ID NO:268 является определенной последовательностью ДНК для частичной последовательности гена СТ016 C. trachomatis в клоне 2Е10.
SEQ ID NO:269 является определенной последовательностью ДНК для частичной последовательности гена тРНК-синтазы C. trachomatis в клоне 2Е10.
SEQ ID NO:270 является определенной последовательностью ДНК для частичной последовательности для гена clрX C. trachomatis в клоне 2Е10.
SEQ ID NO:271 является первой определенной последовательностью ДНК для клона CtL2gam-30 C. trachomatis, представляющей 5' конец.
SEQ ID NO:272 является второй определенной последовательностью ДНК для клона CtL2gam-30 C. trachomatis, представляющей 3' конец.
SEQ ID NO:273 является определенной последовательностью ДНК для клона CtL2gam-28 C. trachomatis.
SEQ ID NO:274 является определенной последовательностью ДНК для клона CtL2gam-27 C. trachomatis.
SEQ ID NO:275 является определенной последовательностью ДНК для клона CtL2gam-26 C. trachomatis.
SEQ ID NO:276 является определенной последовательностью ДНК для клона CtL2gam-24 C. trachomatis.
SEQ ID NO:277 является определенной последовательностью ДНК для клона CtL2gam-23 C. trachomatis.
SEQ ID NO:278 является определенной последовательностью ДНК для клона CtL2gam-21 C. trachomatis.
SEQ ID NO:279 является определенной последовательностью ДНК для клона CtL2gam-18 C. trachomatis.
SEQ ID NO:280 является определенной последовательностью ДНК для клона CtL2gam-17 C. trachomatis.
SEQ ID NO:281 является первой определенной последовательностью ДНК для клона CtL2gam-15 C. trachomatis, представляющей 5' конец.
SEQ ID NO:282 является второй определенной последовательностью ДНК для клона CtL2gam-15 C. trachomatis, представляющей 3' конец.
SEQ ID NO:283 является определенной последовательностью ДНК для клона CtL2gam-13 C. trachomatis.
SEQ ID NO:284 является определенной последовательностью ДНК для клона CtL2gam-10 C. trachomatis.
SEQ ID NO:285 является определенной последовательностью ДНК для клона CtL2gam-8 C. trachomatis.
SEQ ID NO:286 является первой определенной последовательностью ДНК для клона CtL2gam-6 C. trachomatis, представляющей 5' конец.
SEQ ID NO:287 является второй определенной последовательностью ДНК для клона CtL2gam-6 C. trachomatis, представляющей 3' конец.
SEQ ID NO:288 является определенной последовательностью ДНК для клона CtL2gam-5 C. trachomatis.
SEQ ID NO:289 является определенной последовательностью ДНК для клона CtL2gam-2 C. trachomatis.
SEQ ID NO:290 является определенной последовательностью ДНК для клона CtL2gam-1 C. trachomatis.
SEQ ID NO:291 является определенной полноразмерной последовательностью ДНК для гомолога C. pneumoniaе гена СТ529.
SEQ ID NO:292 является предсказанной полноразмерной аминокислотной последовательностью для гомолога C. pneumoniaе гена СТ529.
SEQ ID NO:293 является определенной последовательностью ДНК для инсерционной последовательности для клонирования гена pmpG C. trachomatis в вакцинном векторе SKB.
SEQ ID NO:294 является аминокислотной последовательностью открытой рамки считывания клона СТ603.
SEQ ID NO:295 является аминокислотной последовательностью первой открытой рамки считывания клона СТ875.
SEQ ID NO:296 является аминокислотной последовательностью второй открытой рамки считывания клона СТ875.
SEQ ID NO:297 является аминокислотной последовательностью первой открытой рамки считывания клона СТ858.
SEQ ID NO:298 является аминокислотной последовательностью второй открытой рамки считывания клона СТ858.
SEQ ID NO:299 является аминокислотной последовательностью открытой рамки считывания клона СТ622.
SEQ ID NO:300 является аминокислотной последовательностью открытой рамки считывания клона СТ610.
SEQ ID NO:301 является аминокислотной последовательностью открытой рамки считывания клона СТ396.
SEQ ID NO:302 является аминокислотной последовательностью открытой рамки считывания клона СТ318.
SEQ ID NO:304 является аминокислотной последовательностью для C. trachomatis, серовара L2 rCt529c1-125, имеющей модифицированную N-концевую последовательность (метка 6-His).
SEQ ID NO:305 является аминокислотной последовательностью для C. trachomatis, серовара L2 rCt529c1-125.
SEQ ID NO:306 является смысловым праймером, используемым в синтезе слитого белка PmpA(N-концевая часть).
SEQ ID NO:307 является антисмысловым праймером, используемым в синтезе слитого белка PmpA(N-концевая часть).
SEQ ID NO:308 является последовательностью ДНК, кодирующей слитый белок PmpA(N-концевая часть).
SEQ ID NO:309 является аминокислотной последовательностью слитого белка PmpA(N-концевая часть).
SEQ ID NO:310 является смысловым праймером, используемым в синтезе слитого белка PmpA(С-концевая часть).
SEQ ID NO:311 является антисмысловым праймером, используемым в синтезе слитого белка PmpA(С-концевая часть).
SEQ ID NO:312 является последовательностью ДНК, кодирующей слитый белок PmpA(С-концевая часть).
SEQ ID NO:313 является аминокислотной последовательностью слитого белка PmpA(С-концевая часть).
SEQ ID NO:314 является смысловым праймером, используемым в синтезе слитого белка PmpF(N-концевая часть).
SEQ ID NO:315 является антисмысловым праймером, используемым в синтезе слитого белка PmpF(N-концевая часть).
SEQ ID NO:316 является последовательностью ДНК, кодирующей слитый белок PmpF(N-концевая часть).
SEQ ID NO:317 является аминокислотной последовательностью слитого белка PmpF(N-концевая часть).
SEQ ID NO:318 является смысловым праймером, используемым в синтезе слитого белка PmpF(С-концевая часть).
SEQ ID NO:319 является антисмысловым праймером, используемым в синтезе слитого белка PmpF(С-концевая часть).
SEQ ID NO:320 является последовательностью ДНК, кодирующей слитый белок PmpF(С-концевая часть).
SEQ ID NO:321 является аминокислотной последовательностью слитого белка PmpF(С-концевая часть).
SEQ ID NO:322 является смысловым праймером, используемым в синтезе слитого белка РmpH(СТ412)(N-концевая часть).
SEQ ID NO:323 является антисмысловым праймером, используемым в синтезе слитого белка РmpH(N-концевая часть).
SEQ ID NO:324 является последовательностью ДНК, кодирующей слитый белок PmpH(N-концевая часть).
SEQ ID NO:325 является аминокислотной последовательностью слитого белка PmpH(N-концевая часть).
SEQ ID NO:326 является смысловым праймером, используемым в синтезе слитого белка РmpH(С-концевая часть).
SEQ ID NO:327 является антисмысловым праймером, используемым в синтезе слитого белка РmpH(С-концевая часть).
SEQ ID NO:328 является последовательностью ДНК, кодирующей слитый белок PmpH(С-концевая часть).
SEQ ID NO:329 является аминокислотной последовательностью слитого белка PmpH(С-концевая часть).
SEQ ID NO:330 является смысловым праймером, используемым в синтезе слитого белка РmpВ(1).
SEQ ID NO:331 является антисмысловым праймером, используемым в синтезе слитого белка РmpВ(1).
SEQ ID NO:332 является последовательностью ДНК, кодирующей слитый белок PmpВ(1).
SEQ ID NO:333 является аминокислотной последовательностью слитого белка PmpВ(1).
SEQ ID NO:334 является смысловым праймером, используемым в синтезе слитого белка РmpВ(2).
SEQ ID NO:335 является антисмысловым праймером, используемым в синтезе слитого белка РmpВ(2).
SEQ ID NO:336 является последовательностью ДНК, кодирующей слитый белок PmpВ(2).
SEQ ID NO:337 является аминокислотной последовательностью слитого белка PmpВ(2).
SEQ ID NO:338 является смысловым праймером, используемым в синтезе слитого белка РmpВ(3).
SEQ ID NO:339 является антисмысловым праймером, используемым в синтезе слитого белка РmpВ(3).
SEQ ID NO:340 является последовательностью ДНК, кодирующей слитый белок PmpВ(3).
SEQ ID NO:341 является аминокислотной последовательностью слитого белка PmpВ(3).
SEQ ID NO:342 является смысловым праймером, используемым в синтезе слитого белка РmpВ(4).
SEQ ID NO:343 является антисмысловым праймером, используемым в синтезе слитого белка РmpВ(4).
SEQ ID NO:344 является последовательностью ДНК, кодирующей слитый белок PmpВ(4).
SEQ ID NO:345 является аминокислотной последовательностью слитого белка PmpВ(4).
SEQ ID NO:346 является смысловым праймером, используемым в синтезе слитого белка РmpС(1).
SEQ ID NO:347 является антисмысловым праймером, используемым в синтезе слитого белка РmpС(1).
SEQ ID NO:348 является последовательностью ДНК, кодирующей слитый белок PmpС(1).
SEQ ID NO:349 является аминокислотной последовательностью слитого белка PmpС(1).
SEQ ID NO:350 является смысловым праймером, используемым в синтезе слитого белка РmpС(2).
SEQ ID NO:351 является антисмысловым праймером, используемым в синтезе слитого белка РmpС(2).
SEQ ID NO:352 является последовательностью ДНК, кодирующей слитый белок PmpС(2).
SEQ ID NO:353 является аминокислотной последовательностью слитого белка PmpС(2).
SEQ ID NO:354 является смысловым праймером, используемым в синтезе слитого белка РmpС(3).
SEQ ID NO:355 является антисмысловым праймером, используемым в синтезе слитого белка РmpС(3).
SEQ ID NO:356 является последовательностью ДНК, кодирующей слитый белок PmpС(3).
SEQ ID NO:357 является аминокислотной последовательностью слитого белка PmpС(3).
SEQ ID NO:358 является последовательностью ДНК белка оррА1, лишенного первого трансмембранного домена.
SEQ ID NO:359 является полноразмерной последовательностью ДНК СТ139.
SEQ ID NO:360 является полноразмерной последовательностью ДНК ORF-3.
SEQ ID NO:361 является полноразмерной последовательностью ДНК СТ611.
SEQ ID NO:362 является аминокислотной последовательностью оррА1 от аминокислоты 22.
SEQ ID NO:363 является аминокислотной последовательностью СТ139.
SEQ ID NO:364 является аминокислотной последовательностью ORF-3.
SEQ ID NO:365 является аминокислотной последовательностью СТ611.
SEQ ID NO:366 представляет последовательность ДНК для гомолога Chlamydia pneumoniaе, CPn0275, гена СТ190 Chlamydia trachomatis.
SEQ ID NO:367 представляет последовательность ДНК для гомолога Chlamydia pneumoniae, CPn0407, гена СТ103 Chlamydia trachomatis.
SEQ ID NO:368 представляет последовательность ДНК для гомолога Chlamydia pneumoniae, CPn0720, гена СТ659 Chlamydia trachomatis.
SEQ ID NO:369 представляет последовательность ДНК для гомолога Chlamydia pneumoniae, CPn0716, гена СТ660 Chlamydia trachomatis.
SEQ ID NO:370 представляет последовательность ДНК для гомолога Chlamydia pneumoniae, CPn0519, гена СТ430 Chlamydia trachomatis.
SEQ ID NO:371 представляет последовательность ДНК для гомолога Chlamydia pneumoniae, CPn0520, гена СТ431 Chlamydia trachomatis.
SEQ ID NO:372 представляет последовательность ДНК для гомолога Chlamydia pneumoniae, CPn0078, гена СТ318 Chlamydia trachomatis.
SEQ ID NO:373 представляет последовательность ДНК для гомолога Chlamydia pneumoniae, CPn0628, гена СТ509 Chlamydia trachomatis.
SEQ ID NO:374 представляет последовательность ДНК для гомолога Chlamydia pneumoniae, CPn0540, гена СТ414 Chlamydia trachomatis.
SEQ ID NO:375 представляет последовательность ДНК для гомолога Chlamydia pneumoniae, pmp20, гена СТ413 Chlamydia trachomatis.
SEQ ID NO:376 представляет последовательность ДНК для гомолога Chlamydia pneumoniae, CPn0081, гена СТ315 Chlamydia trachomatis.
SEQ ID NO:377 представляет последовательность ДНК для гомолога Chlamydia pneumoniae, CPn0761, гена СТ610 Chlamydia trachomatis.
SEQ ID NO:378 представляет последовательность ДНК для гомолога Chlamydia pneumoniae, CPn0557, гена СТ443 Chlamydia trachomatis.
SEQ ID NO:379 представляет последовательность ДНК для гомолога Chlamydia pneumoniae, CPn0833, гена СТ557 Chlamydia trachomatis.
SEQ ID NO:380 представляет последовательность ДНК для гомолога Chlamydia pneumoniae, CPn0134, гена СТ604 Chlamydia trachomatis.
SEQ ID NO:381 представляет последовательность ДНК для гомолога Chlamydia pneumoniae, CPn0388, гена СТ042 Chlamydia trachomatis.
SEQ ID NO:382 представляет последовательность ДНК для гомолога Chlamydia pneumoniae, CPn1028, гена СТ376 Chlamydia trachomatis.
SEQ ID NO:383 представляет последовательность ДНК для гомолога Chlamydia pneumoniae, CPn0875, гена СТ734 Chlamydia trachomatis.
SEQ ID NO:384 представляет последовательность ДНК для гомолога Chlamydia pneumoniae, CPn0908, гена СТ764 Chlamydia trachomatis.
SEQ ID NO:385 представляет последовательность ДНК для гомолога Chlamydia pneumoniae, CPn0728, гена СТ622 Chlamydia trachomatis.
SEQ ID NO:386 представляет аминокислотную последовательность для гомолога Chlamydia pneumoniae, CPn0275, гена СТ190 Chlamydia trachomatis.
SEQ ID NO:387 представляет аминокислотную последовательность для гомолога Chlamydia pneumoniae, CPn0407, гена СТ103 Chlamydia trachomatis.
SEQ ID NO:388 представляет аминокислотную последовательность для гомолога Chlamydia pneumoniae, CPn0720, гена СТ659 Chlamydia trachomatis.
SEQ ID NO:389 представляет аминокислотную последовательность для гомолога Chlamydia pneumoniae, CPn0716, гена СТ660 Chlamydia trachomatis.
SEQ ID NO:390 представляет аминокислотную последовательность для гомолога Chlamydia pneumoniae, CPn0519, гена СТ430 Chlamydia trachomatis.
SEQ ID NO:391 представляет аминокислотную последовательность для гомолога Chlamydia pneumoniae, CPn0520, гена СТ431 Chlamydia trachomatis.
SEQ ID NO:392 представляет аминокислотную последовательность для гомолога Chlamydia pneumoniae, CPn0078, гена СТ318 Chlamydia trachomatis.
SEQ ID NO:393 представляет аминокислотную последовательность для гомолога Chlamydia pneumoniae, CPn0628, гена СТ509 Chlamydia trachomatis.
SEQ ID NO:394 представляет аминокислотную последовательность для гомолога Chlamydia pneumoniae, CPn0540, гена СТ414 Chlamydia trachomatis.
SEQ ID NO:395 представляет аминокислотную последовательность для гомолога Chlamydia pneumoniae, pmp20, гена СТ413 Chlamydia trachomatis.
SEQ ID NO:396 представляет аминокислотную последовательность для гомолога Chlamydia pneumoniae, CPn0081, гена СТ315 Chlamydia trachomatis.
SEQ ID NO:397 представляет аминокислотную последовательность для гомолога Chlamydia pneumoniae, CPn0761, гена СТ610 Chlamydia trachomatis.
SEQ ID NO:398 представляет аминокислотную последовательность для гомолога Chlamydia pneumoniae, CPn0557, гена СТ443 Chlamydia trachomatis.
SEQ ID NO:399 представляет аминокислотную последовательность для гомолога Chlamydia pneumoniae, CPn0833, гена СТ557 Chlamydia trachomatis.
SEQ ID NO:400 представляет аминокислотную последовательность для гомолога Chlamydia pneumoniae, CPn0134, гена СТ604 Chlamydia trachomatis.
SEQ ID NO:401 представляет аминокислотную последовательность для гомолога Chlamydia pneumoniae, CPn0388, гена СТ042 Chlamydia trachomatis.
SEQ ID NO:402 представляет аминокислотную последовательность для гомолога Chlamydia pneumoniae, CPn1028, гена СТ376 Chlamydia trachomatis.
SEQ ID NO:403 представляет аминокислотную последовательность для гомолога Chlamydia pneumoniae, CPn0875, гена СТ734 Chlamydia trachomatis.
SEQ ID NO:404 представляет аминокислотную последовательность для гомолога Chlamydia pneumoniae, CPn0908, гена СТ764 Chlamydia trachomatis.
SEQ ID NO:405 представляет аминокислотную последовательность для гомолога Chlamydia pneumoniae, CPn0728, гена СТ622 Chlamydia trachomatis.
SEQ ID NO:406 представляет полноразмерную последовательность ДНК гена СТ287 серовара D Chlamydia trachomatis.
SEQ ID NO:407 представляет полноразмерную последовательность ДНК гена СТ858 серовара D Chlamydia trachomatis.
SEQ ID NO:408 представляет полноразмерную последовательность ДНК гена СТ764 серовара D Chlamydia trachomatis.
SEQ ID NO:409 представляет полноразмерную последовательность ДНК гена СТ734 серовара D Chlamydia trachomatis.
SEQ ID NO:410 представляет полноразмерную последовательность ДНК гена СТ660 серовара D Chlamydia trachomatis.
SEQ ID NO:411 представляет полноразмерную последовательность ДНК гена СТ659 серовара D Chlamydia trachomatis.
SEQ ID NO:412 представляет полноразмерную последовательность ДНК гена СТ622 серовара D Chlamydia trachomatis.
SEQ ID NO:413 представляет полноразмерную последовательность ДНК гена СТ610 серовара D Chlamydia trachomatis.
SEQ ID NO:414 представляет полноразмерную последовательность ДНК гена СТ604 серовара D Chlamydia trachomatis.
SEQ ID NO:415 представляет полноразмерную последовательность ДНК гена СТ557 серовара D Chlamydia trachomatis.
SEQ ID NO:416 представляет полноразмерную последовательность ДНК гена СТ509 серовара D Chlamydia trachomatis.
SEQ ID NO:417 представляет полноразмерную последовательность ДНК гена СТ443 серовара D Chlamydia trachomatis.
SEQ ID NO:418 представляет полноразмерную последовательность ДНК гена СТ431 серовара D Chlamydia trachomatis.
SEQ ID NO:419 представляет полноразмерную последовательность ДНК гена СТ430 серовара D Chlamydia trachomatis.
SEQ ID NO:420 представляет полноразмерную последовательность ДНК гена СТ414 серовара D Chlamydia trachomatis.
SEQ ID NO:421 представляет полноразмерную последовательность ДНК гена СТ413 серовара D Chlamydia trachomatis.
SEQ ID NO:422 представляет полноразмерную последовательность ДНК гена СТ396 серовара D Chlamydia trachomatis.
SEQ ID NO:423 представляет полноразмерную последовательность ДНК гена СТ376 серовара D Chlamydia trachomatis.
SEQ ID NO:424 представляет полноразмерную последовательность ДНК гена СТ318 серовара D Chlamydia trachomatis.
SEQ ID NO:425 представляет полноразмерную последовательность ДНК гена СТ315 серовара D Chlamydia trachomatis.
SEQ ID NO:426 представляет полноразмерную последовательность ДНК гена СТ104 серовара D Chlamydia trachomatis.
SEQ ID NO:427 представляет полноразмерную последовательность ДНК гена СТ103 серовара D Chlamydia trachomatis.
SEQ ID NO:428 представляет полноразмерную последовательность ДНК гена СТ102 серовара D Chlamydia trachomatis.
SEQ ID NO:429 представляет полноразмерную последовательность ДНК гена СТ098 серовара D Chlamydia trachomatis.
SEQ ID NO:430 представляет полноразмерную последовательность ДНК гена СТ042 серовара D Chlamydia trachomatis.
SEQ ID NO:431 представляет полноразмерную аминокислотную последовательность гена СТ858 серовара D Chlamydia trachomatis.
SEQ ID NO:432 представляет полноразмерную аминокислотную последовательность гена СТ764 серовара D Chlamydia trachomatis.
SEQ ID NO:433 представляет полноразмерную аминокислотную последовательность гена СТ734 серовара D Chlamydia trachomatis.
SEQ ID NO:434 представляет полноразмерную аминокислотную последовательность гена СТ660 серовара D Chlamydia trachomatis.
SEQ ID NO:435 представляет полноразмерную аминокислотную последовательность гена СТ659 серовара D Chlamydia trachomatis.
SEQ ID NO:436 представляет полноразмерную аминокислотную последовательность гена СТ622 серовара D Chlamydia trachomatis.
SEQ ID NO:437 представляет полноразмерную аминокислотную последовательность гена СТ610 серовара D Chlamydia trachomatis.
SEQ ID NO:438 представляет полноразмерную аминокислотную последовательность гена СТ604 серовара D Chlamydia trachomatis.
SEQ ID NO:439 представляет полноразмерную аминокислотную последовательность гена СТ557 серовара D Chlamydia trachomatis.
SEQ ID NO:440 представляет полноразмерную аминокислотную последовательность гена СТ509 серовара D Chlamydia trachomatis.
SEQ ID NO:441 представляет полноразмерную аминокислотную последовательность гена СТ443 серовара D Chlamydia trachomatis.
SEQ ID NO:442 представляет полноразмерную аминокислотную последовательность гена СТ431 серовара D Chlamydia trachomatis.
SEQ ID NO:443 представляет полноразмерную аминокислотную последовательность гена СТ430 серовара D Chlamydia trachomatis.
SEQ ID NO:444 представляет полноразмерную аминокислотную последовательность гена СТ414 серовара D Chlamydia trachomatis.
SEQ ID NO:445 представляет полноразмерную аминокислотную последовательность гена СТ413 серовара D Chlamydia trachomatis.
SEQ ID NO:446 представляет полноразмерную аминокислотную последовательность гена СТ396 серовара D Chlamydia trachomatis.
SEQ ID NO:447 представляет полноразмерную аминокислотную последовательность гена СТ376 серовара D Chlamydia trachomatis.
SEQ ID NO:448 представляет полноразмерную аминокислотную последовательность гена СТ318 серовара D Chlamydia trachomatis.
SEQ ID NO:449 представляет полноразмерную аминокислотную последовательность гена СТ315 серовара D Chlamydia trachomatis.
SEQ ID NO:450 представляет полноразмерную аминокислотную последовательность гена СТ104 серовара D Chlamydia trachomatis.
SEQ ID NO:451 представляет полноразмерную аминокислотную последовательность гена СТ103 серовара D Chlamydia trachomatis.
SEQ ID NO:452 представляет полноразмерную аминокислотную последовательность гена СТ102 серовара D Chlamydia trachomatis.
SEQ ID NO:453 представляет полноразмерную аминокислотную последовательность гена СТ098 серовара D Chlamydia trachomatis.
SEQ ID NO:454 представляет полноразмерную аминокислотную последовательность гена СТ042 серовара D Chlamydia trachomatis.
SEQ ID NO:455 соответствует последовательности ДНК CPn0894, которая является СР-гомологом СТ751 (amn), который был идентифицирован в клонах СТL2-1 и CТL2-5.
SEQ ID NO:456 соответствует последовательности ДНК CPn0074, которая является СР-гомологом СТ322 (tuf), который был идентифицирован в клоне СТL2-2.
SEQ ID NO:457 соответствует последовательности ДНК CPn0122, которая является СР-гомологом СТ032 (metG), который был идентифицирован в клонах СТL2gam2, CTL2-3(5') и CТL2-4.
SEQ ID NO:458 соответствует последовательности ДНК CPn0121, которая является СР-гомологом СТ031, который был идентифицирован в клоне СТL2-3(5')(3').
SEQ ID NO:459 соответствует последовательности ДНК CPn0120, которая является СР-гомологом СТ030 (gmK), который был идентифицирован в клонах СТL2-3(3') и CТL2-21.
SEQ ID NO:460 соответствует последовательности ДНК CPn0359, которая является СР-гомологом СТ064 (lepA), который был идентифицирован в клоне СТL2gam5.
SEQ ID NO:461 соответствует последовательности ДНК CPn0414, которая является СР-гомологом СТ265 (accA), который был идентифицирован в клоне СТL2-6.
SEQ ID NO:462 соответствует последовательности ДНК CPn0413, которая является СР-гомологом СТ264 (msbA), который был идентифицирован в клоне СТL2-6.
SEQ ID NO:463 соответствует последовательности ДНК CPn0394, которая является СР-гомологом СТ256, который был идентифицирован в клонах СТL2gam6(5') и CТL2-11(5').
SEQ ID NO:464 соответствует последовательности ДНК CPn0395, которая является СР-гомологом СТ257, который был идентифицирован в клонах СТL2gam6(5') и CТL2-11(5').
SEQ ID NO:465 соответствует последовательности ДНК CPn0487, которая является СР-гомологом СТ384, который был идентифицирован в клонах СТL2gam6(3') и CТL2-11(3').
SEQ ID NO:466 соответствует последовательности ДНК CPn0592, которая является СР-гомологом СТ473, который был идентифицирован в клоне СТL2-8b.
SEQ ID NO:467 соответствует последовательности ДНК CPn0593, которая является СР-гомологом СТ474, который был идентифицирован в клоне СТL2-8b.
SEQ ID NO:468 соответствует последовательности ДНК CPn0197, которая является СР-гомологом СТ139 (оррА1), который был идентифицирован в клоне СТL2-8b.
SEQ ID NO:469 соответствует последовательности ДНК CPn0363, которая является СР-гомологом СТ060 (flhA), который был идентифицирован в клоне СТL2-8b.
SEQ ID NO:470 соответствует последовательности ДНК CPn0301, которая является СР-гомологом СТ242, который был идентифицирован в клоне СТL2gam8.
SEQ ID NO:471 соответствует последовательности ДНК CPn0302, которая является СР-гомологом СТ243 (lpxD), который был идентифицирован в клоне СТL2gam8.
SEQ ID NO:472 соответствует последовательности ДНК CPn0324, которая является СР-гомологом СТ089 (lcrE), который был идентифицирован в клонах СТL2-9, CТL2gam1, CTL2gam17 и CTL2-19(5').
SEQ ID NO:473 соответствует последовательности ДНК CPn0761, которая является СР-гомологом СТ610, который был идентифицирован в клоне СТL2-10(5')(3').
SEQ ID NO:474 соответствует последовательности ДНК CPn0760, которая является СР-гомологом СТ611, который был идентифицирован в клоне СТL2-10(5').
SEQ ID NO:475 соответствует последовательности ДНК CPn0329, которая является СР-гомологом СТ154, который был идентифицирован в клонах СТL2gam10 и CТL2gam21.
SEQ ID NO:476 соответствует последовательности ДНК CPn0990, которая является СР-гомологом СТ833 (infC), который был идентифицирован в клоне СТL2-12.
SEQ ID NO:477 соответствует последовательности ДНК CPn0984, которая является СР-гомологом СТ827 (nrdA), который был идентифицирован в клонах СТL2-16(3') и CТL2gam15(3').
SEQ ID NO:478 соответствует последовательности ДНК CPn0985, которая является СР-гомологом СТ828 (nrdB), который был идентифицирован в клонах СТL2-16(3') и CТL2gam15(3').
SEQ ID NO:479 соответствует последовательности ДНК CPn0349, которая является СР-гомологом СТ067 (ytgA), который был идентифицирован в клонe СТL2gam18.
SEQ ID NO:480 соответствует последовательности ДНК CPn0325, которая является СР-гомологом СТ088 (sycE), который был идентифицирован в клонe СТL2-19(5').
SEQ ID NO:481 соответствует последовательности ДНК CPn0326, которая является СР-гомологом СТ087 (malQ), который был идентифицирован в клонe СТL2-19(5').
SEQ ID NO:482 соответствует последовательности ДНК CPn0793, которая является СР-гомологом СТ588 (rbsu), который был идентифицирован в клонe СТL2gam23.
SEQ ID NO:483 соответствует последовательности ДНК CPn0199, которая является СР-гомологом СТ199 (оррВ1), который был идентифицирован в клоне СТL2gam24.
SEQ ID NO:484 соответствует последовательности ДНК CPn0666, которая является СР-гомологом СТ545 (dnaE), который был идентифицирован в клоне СТL2-24.
SEQ ID NO:485 соответствует последовательности ДНК CPn0065, которая является СР-гомологом СТ288, который был идентифицирован в клоне СТL2gam27.
SEQ ID NO:486 соответствует последовательности ДНК CPn0444, которая является СР-гомологом СТ413 (pmpB), который был идентифицирован в клонe СТL2gam30(5')(3').
SEQ ID NO:487 соответствует последовательности ДНК CPn-ORF5, которая является СР-гомологом СТ-ORF3, который был идентифицирован в клонах СТL2gam15(5'), CTL2-16(5'), CTL2-18(5') и CTL2-23.
SEQ ID NO:488 соответствует последовательности ДНК CPn-ORF6, которая является СР-гомологом СТ-ORF4, который был идентифицирован в клоне СТL2-18(3').
SEQ ID NO:489 соответствует последовательности ДНК CPn-ORF7, которая является СР-гомологом СТ-ORF5, который был идентифицирован в клоне СТL2-18(3').
SEQ ID NO:490 соответствует аминокислотной последовательности CPn0894, которая является СР-гомологом СТ751 (amn), который был идентифицирован в клонах СТL2-1 и CТL2-5.
SEQ ID NO:491 соответствует аминокислотной последовательности CPn0074, которая является СР-гомологом СТ322 (tuf), который был идентифицирован в клоне СТL2-2.
SEQ ID NO:492 соответствует аминокислотной последовательности CPn0122, которая является СР-гомологом СТ032 (metG), который был идентифицирован в клонах СТL2gam2, CTL2-3(5') и CТL2-4.
SEQ ID NO:493 соответствует аминокислотной последовательности CPn0121, которая является СР-гомологом СТ031, который был идентифицирован в клоне СТL2-3(5')(3').
SEQ ID NO:494 соответствует аминокислотной последовательности CPn0120, которая является СР-гомологом СТ030 (gmK), который был идентифицирован в клонах СТL2-3(3') и CТL2-21.
SEQ ID NO:495 соответствует аминокислотной последовательности CPn0359, которая является СР-гомологом СТ064 (lepA), который был идентифицирован в клоне СТL2gam5.
SEQ ID NO:496 соответствует аминокислотной последовательности CPn0414, которая является СР-гомологом СТ265 (accA), который был идентифицирован в клоне СТL2-6.
SEQ ID NO:497 соответствует аминокислотной последовательности CPn0413, которая является СР-гомологом СТ264 (msbA), который был идентифицирован в клоне СТL2-6.
SEQ ID NO:498 соответствует аминокислотной последовательности CPn0394, которая является СР-гомологом СТ256, который был идентифицирован в клонах СТL2gam6(5') и CТL2-11(5').
SEQ ID NO:499 соответствует аминокислотной последовательности CPn0395, которая является СР-гомологом СТ257, который был идентифицирован в клонах СТL2gam6(5') и CТL2-11(5').
SEQ ID NO:500 соответствует аминокислотной последовательности CPn0487, которая является СР-гомологом СТ384, который был идентифицирован в клонах СТL2gam6(3') и CТL2-11(3').
SEQ ID NO:501 соответствует аминокислотной последовательности CPn0592, которая является СР-гомологом СТ473, который был идентифицирован в клоне СТL2-8b.
SEQ ID NO:502 соответствует аминокислотной последовательности CPn0593, которая является СР-гомологом СТ474, который был идентифицирован в клоне СТL2-8b.
SEQ ID NO:503 соответствует аминокислотной последовательности CPn0197, которая является СР-гомологом СТ139 (оррА1), который был идентифицирован в клоне СТL2-8b.
SEQ ID NO:504 соответствует аминокислотной последовательности CPn0363, которая является СР-гомологом СТ060 (flhA), который был идентифицирован в клоне СТL2-8b.
SEQ ID NO:505 соответствует аминокислотной последовательности CPn0301, которая является СР-гомологом СТ242, который был идентифицирован в клоне СТL2gam8.
SEQ ID NO:506 соответствует аминокислотной последовательности CPn0302, которая является СР-гомологом СТ243 (lpxD), который был идентифицирован в клоне СТL2gam8.
SEQ ID NO:507 соответствует аминокислотной последовательности CPn0324, которая является СР-гомологом СТ089 (lcrE), который был идентифицирован в клонах СТL2-9, CТL2gam1, CTL2gam17 и CTL2-19(5').
SEQ ID NO:508 соответствует аминокислотной последовательности CPn0761, которая является СР-гомологом СТ610, который был идентифицирован в клоне СТL2-10(5')(3').
SEQ ID NO:509 соответствует аминокислотной последовательности CPn0760, которая является СР-гомологом СТ611, который был идентифицирован в клоне СТL2-10(5').
SEQ ID NO:510 соответствует аминокислотной последовательности CPn0329, которая является СР-гомологом СТ154, который был идентифицирован в клонах СТL2gam10 и CТL2gam21.
SEQ ID NO:511 соответствует аминокислотной последовательности CPn0990, которая является СР-гомологом СТ833 (infC), который был идентифицирован в клоне СТL2-12.
SEQ ID NO:512 соответствует аминокислотной последовательности CPn-ORF5, которая является СР-гомологом СТ-ORF3, который был идентифицирован в клонах СТL2gam15(5'), CTL2-16(5'), CTL2-18(5') и CTL2-23.
SEQ ID NO:513 соответствует аминокислотной последовательности CPn0984, которая является СР-гомологом СТ827 (nrdA), который был идентифицирован в клонах СТL2-16(3') и CТL2gam15(3')
SEQ ID NO:514 соответствует аминокислотной последовательности CPn0985, которая является СР-гомологом СТ828 (nrdB), который был идентифицирован в клонах СТL2-16(3') и CТL2gam15(3').
SEQ ID NO:515 соответствует аминокислотной последовательности CPn0349, которая является СР-гомологом СТ067 (ytgA), который был идентифицирован в клонe СТL2gam18.
SEQ ID NO:516 соответствует аминокислотной последовательности CPn-ORF6, которая является СР-гомологом СТ-ORF4, который был идентифицирован в клоне СТL2-18(3').
SEQ ID NO:517 соответствует аминокислотной последовательности CP-ORF7, которая является СР-гомологом СТ-ORF5, который был идентифицирован в клоне СТL2-18(3').
SEQ ID NO:518 соответствует аминокислотной последовательности CPn0326, которая является СР-гомологом СТ087 (malQ), который был идентифицирован в клонe СТL2-19(5').
SEQ ID NO:519 соответствует аминокислотной последовательности CPn0325, которая является СР-гомологом СТ088 (sycE), который был идентифицирован в клонe СТL2-19(5').
SEQ ID NO:520 соответствует аминокислотной последовательности CPn0793, которая является СР-гомологом СТ588 (rbsu), который был идентифицирован в клонe СТL2gam23.
SEQ ID NO:521 соответствует аминокислотной последовательности CPn0199, которая является СР-гомологом СТ199 (оррВ1), который был идентифицирован в клоне СТL2gam24.
SEQ ID NO:522 соответствует аминокислотной последовательности CPn0666, которая является СР-гомологом СТ545 (dnaE), который был идентифицирован в клоне СТL2-24.
SEQ ID NO:523 соответствует последовательности ДНК CPn0065, которая является СР-гомологом СТ288, который был идентифицирован в клоне CTL2gam27.
SEQ ID NO:524 соответствует последовательности ДНК CPn0444, которая является СР-гомологом СТ413 (pmpB), который был идентифицирован в клоне CTL2gam30(5')(3').
SEQ ID NO:525 представляет полноразмерную последовательность ДНК серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ751 (amn), идентифицированной из клонов СТL2-1 и CTL2-5.
SEQ ID NO:526 представляет полноразмерную последовательность ДНК серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ322 (tuff), идентифицированной из клона СТL2-2.
SEQ ID NO:527 представляет полноразмерную последовательность ДНК серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ032 (metG), идентифицированной из клонов СТL2gam2, CTL2-3(5') и CTL2-4.
SEQ ID NO:528 представляет полноразмерную последовательность ДНК серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ031, идентифицированной из клона СТL2-3(5')(3').
SEQ ID NO:529 представляет полноразмерную последовательность ДНК серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ030 (gmK), идентифицированной из клонов СТL2-3(3') и CTL2-21.
SEQ ID NO:530 представляет полноразмерную последовательность ДНК серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ064 (lepA), идентифицированной из клона СТL2gam5.
SEQ ID NO:531 представляет полноразмерную последовательность ДНК серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ265 (accA), идентифицированной из клона СТL2-6.
SEQ ID NO:532 представляет полноразмерную последовательность ДНК серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ624 (msbA), идентифицированной из клона СТL2-6.
SEQ ID NO:533 представляет полноразмерную последовательность ДНК серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ256, идентифицированной из клонов СТL2gam6(5') и CTL2-11(5').
SEQ ID NO:534 представляет полноразмерную последовательность ДНК серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ257, идентифицированной из клонов СТL2gam6(5') и CTL2-11(5').
SEQ ID NO:535 представляет полноразмерную последовательность ДНК серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ384, идентифицированной из клонов СТL2gam6(3') и CTL2-11(3').
SEQ ID NO:536 представляет полноразмерную последовательность ДНК серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ473, идентифицированной из клона СТL2-8b.
SEQ ID NO:537 представляет полноразмерную последовательность ДНК серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ474, идентифицированной из клона СТL2-8b.
SEQ ID NO:538 представляет полноразмерную последовательность ДНК серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ139 (оррА1), идентифицированной из клона СТL2-8b.
SEQ ID NO:539 представляет полноразмерную последовательность ДНК серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ060 (flhA), идентифицированной из клона СТL2-8b.
SEQ ID NO:540 представляет полноразмерную последовательность ДНК серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ242, идентифицированной из клона СТL2gam8.
SEQ ID NO:541 представляет полноразмерную последовательность ДНК серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ243 (lpxD), идентифицированной из клона СТL2gam8.
SEQ ID NO:542 представляет полноразмерную последовательность ДНК серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ089, идентифицированной из клонов СТL2-9, CTL2gam1, CTL2gam17 и CTL2-19(5').
SEQ ID NO:543 представляет полноразмерную последовательность ДНК серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ610, идентифицированной из клона СТL2-10(5')(3').
SEQ ID NO:544 представляет полноразмерную последовательность ДНК серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ611, идентифицированной из клона СТL2-10(5').
SEQ ID NO:545 представляет полноразмерную последовательность ДНК серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ154, идентифицированной из клонов СТL2gam10 и CTL2gam21.
SEQ ID NO:546 представляет полноразмерную последовательность ДНК серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ833 (infC), идентифицированной из клона СТL2-12.
SEQ ID NO:547 представляет полноразмерную последовательность ДНК серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ827 (nrdA), идентифицированной из клонов СТL2-16(3') и CTL2gam15(3').
SEQ ID NO:548 представляет полноразмерную последовательность ДНК серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ828 (nrdB), идентифицированной из клонов СТL2-16(3') и CTL2gam15(3').
SEQ ID NO:549 представляет полноразмерную последовательность ДНК серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ067 (ytgA), идентифицированной из клона СТL2gam18.
SEQ ID NO:550 представляет полноразмерную последовательность ДНК серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ088 (sycE), идентифицированной из клона СТL2-19(5').
SEQ ID NO:551 представляет полноразмерную последовательность ДНК серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ087, идентифицированной из клона СТL2-19(5').
SEQ ID NO:552 представляет полноразмерную последовательность ДНК серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ588 (rsbu), идентифицированной из клона СТL2gam23.
SEQ ID NO:553 представляет полноразмерную последовательность ДНК серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ199 (оррВ1), идентифицированной из клона СТL2gam24.
SEQ ID NO:554 представляет полноразмерную последовательность ДНК серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ545 (dnaE), идентифицированной из клона СТL2-4.
SEQ ID NO:555 представляет полноразмерную последовательность ДНК серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ288, идентифицированной из клона СТL2gam27.
SEQ ID NO:556 представляет полноразмерную последовательность ДНК серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ413 (pmpB), идентифицированной из клона СТL2gam30(5')(3').
SEQ ID NO:557 представляет полноразмерную последовательность ДНК серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ-ORF3, идентифицированной из клонов СТL2gam15(5'), CTL2-16(5'), CTL2-18(5') и CTL2-23.
SEQ ID NO:558 представляет полноразмерную последовательность ДНК серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для рСТ-ORF4, идентифицированной из клона СТL2-18(3').
SEQ ID NO:559 представляет полноразмерную последовательность ДНК серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ-ORF5, идентифицированной из клона СТL2-18(3').
SEQ ID NO:560 представляет полноразмерную аминокислотную последовательность серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ751 (amn), идентифицированной из клонов СТL2-1 и CTL2-5.
SEQ ID NO:561 представляет полноразмерную аминокислотную последовательность серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ322 (tuff), идентифицированной из клона СТL2-2.
SEQ ID NO:562 представляет полноразмерную аминокислотную последовательность серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ032 (metG), идентифицированной из клонов СТL2gam2, CTL2-3(5') и CTL2-4.
SEQ ID NO:563 представляет полноразмерную аминокислотную последовательность серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ031, идентифицированной из клона СТL2-3(5')(3').
SEQ ID NO:564 представляет полноразмерную аминокислотную последовательность серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ030 (gmK), идентифицированной из клонов СТL2-3(3') и CTL2-21.
SEQ ID NO:565 представляет полноразмерную аминокислотную последовательность серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ064 (lepA), идентифицированной из клона СТL2gam5.
SEQ ID NO:566 представляет полноразмерную аминокислотную последовательность серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ265 (accA), идентифицированной из клона СТL2-6.
SEQ ID NO:567 представляет полноразмерную аминокислотную последовательность серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ624 (msbA), идентифицированной из клона СТL2-6.
SEQ ID NO:568 представляет полноразмерную аминокислотную последовательность серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ256, идентифицированной из клонов СТL2gam6(5') и CTL2-11(5').
SEQ ID NO:569 представляет полноразмерную аминокислотную последовательность серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ257, идентифицированной из клонов СТL2gam6(5') и CTL2-11(5').
SEQ ID NO:570 представляет полноразмерную аминокислотную последовательность серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ384, идентифицированной из клонов СТL2gam6(3') и CTL2-11(3').
SEQ ID NO:571 представляет полноразмерную аминокислотную последовательность серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ473, идентифицированной из клона СТL2-8b.
SEQ ID NO:572 представляет полноразмерную аминокислотную последовательность серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ474, идентифицированной из клона СТL2-8b.
SEQ ID NO:573 представляет полноразмерную аминокислотную последовательность серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ139 (оррА1), идентифицированной из клона СТL2-8b.
SEQ ID NO:574 представляет полноразмерную аминокислотную последовательность серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ060 (flhA), идентифицированной из клона СТL2-8b.
SEQ ID NO:575 представляет полноразмерную аминокислотную последовательность серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ242, идентифицированной из клона СТL2gam8.
SEQ ID NO:576 представляет полноразмерную аминокислотную последовательность серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ243 (lpxD), идентифицированной из клона СТL2gam8.
SEQ ID NO:577 представляет полноразмерную аминокислотную последовательность серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ089, идентифицированной из клонов СТL2-9, CTL2gam1, CTL2gam17 и CTL2-19(5').
SEQ ID NO:578 представляет полноразмерную аминокислотную последовательность серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ610, идентифицированной из клона СТL2-10(5')(3').
SEQ ID NO:579 представляет полноразмерную аминокислотную последовательность серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ611, идентифицированной из клона СТL2-10(5').
SEQ ID NO:580 представляет полноразмерную аминокислотную последовательность серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ154, идентифицированной из клонов СТL2gam10 и CTL2gam21.
SEQ ID NO:581 представляет полноразмерную аминокислотную последовательность серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ833 (infC), идентифицированной из клона СТL2-12.
SEQ ID NO:582 представляет полноразмерную аминокислотную последовательность серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ-ORF3, идентифицированной из клонов СТL2gam15(5'), CTL2-16(5'), CTL2-18(5') и CTL2-23.
SEQ ID NO:583 представляет полноразмерную аминокислотную последовательность серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ827 (nrdA), идентифицированной из клонов СТL2-16(3') и CTL2gam15(3').
SEQ ID NO:584 представляет полноразмерную аминокислотную последовательность серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ828 (nrdB), идентифицированной из клонов СТL2-16(3') и CTL2gam15(3').
SEQ ID NO:585 представляет полноразмерную аминокислотную последовательность серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ067 (ytgA), идентифицированной из клона СТL2gam18.
SEQ ID NO:586 представляет полноразмерную аминокислотную последовательность серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для рСТ-ORF4, идентифицированной из клона СТL2-18(3').
SEQ ID NO:587 представляет полноразмерную аминокислотную последовательность серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ-ORF5, идентифицированной из клона СТL2-18(3').
SEQ ID NO:588 представляет полноразмерную аминокислотную последовательность серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ087, идентифицированной из клона СТL2-19(5').
SEQ ID NO:589 представляет полноразмерную аминокислотную последовательность серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ088 (sycE), идентифицированной из клона СТL2-19(5').
SEQ ID NO:590 представляет полноразмерную аминокислотную последовательность серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ588 (rsbu), идентифицированной из клона СТL2gam23.
SEQ ID NO:591 представляет полноразмерную аминокислотную последовательность серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ199 (оррВ1), идентифицированной из клона СТL2gam24.
SEQ ID NO:592 представляет полноразмерную аминокислотную последовательность серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ545 (dnaE), идентифицированной из клона СТL2-4.
SEQ ID NO:593 представляет полноразмерную аминокислотную последовательность серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ288, идентифицированной из клона СТL2gam27.
SEQ ID NO:594 представляет полноразмерную аминокислотную последовательность серовара D C. trachomatis, гомологичную последовательности C. trachomatis LGV II для СТ413 (pmpB), идентифицированной из клона СТL2gam30(5')(3').
SEQ ID NO:595 представляет последовательность ДНК для гомолога Chlamydia pneumoniae, CPn0406, гена СТ102 Chlamydia trachomatis.
SEQ ID NO:596 представляет последовательность ДНК для гомолога Chlamydia pneumoniae, CPn0315, гена СТ098 Chlamydia trachomatis.
SEQ ID NO:597 представляет аминокислотную последовательность для гомолога Chlamydia pneumoniae, CPn0406, гена СТ102 Chlamydia trachomatis.
SEQ ID NO:598 представляет аминокислотную последовательность для гомолога Chlamydia pneumoniae, CPn0315, гена СТ098 Chlamydia trachomatis.
SEQ ID NO:599 представляет аминокислотную последовательность для белка СТ287 серовара D Chlamydia trachomatis.
ОПИСАНИЕ ФИГУР
Фиг. 1 иллюстрирует индукцию IFN-γ из Chlamydia-специфической линии Т-клеток, активированной клетками-мишенями, экспрессирующими клон 4С9-18#2.
Фиг. 2 иллюстрирует ретровирусные векторы pBIB-KS1,2,3, модифицированные таким образом, что они содержат сайт инициации трансляции Козака и стоп-кодоны.
Фиг. 3 показывает специфический лизис в тесте с высвобождением хрома клеток Р815, кратковременно обработанных пептидами Chlamydia CtC7.8-12 (SEQ ID NO:18) и CtC7.8-13 (SEQ ID NO:19).
Фиг. 4 показывает титры изотипов антител у мышей С57BI/6, иммунизированных белком SWIB C. trachomatis.
Фиг. 5 показывает Chlamydia-специфические пролиферативные ответные реакции Т-клеток в спленоцитах от мышей С3Н, иммунизированных белком SWIB C. trachomatis.
Фиг. 6 иллюстрирует 5' и 3' праймерные последовательности, сконструированные из C. pneumoniae, которые использовали для выделения генов SWIB и S13 из C. pneumoniae.
Фиг. 7А и 7В показывают индукцию IFN-γ из антихламидийной Т-клеточной линии человека (TCL-8), способной перекрестно реагировать с C. trachomatis и C. pneumoniae при активации происходящими из моноцитов дендритными клетками, экспрессирующими хламидийные белки.
Фиг. 8 показывает идентификацию Т-клеточных эпитопов в хламидийном рибосомном белке S13 линией Т-клеток TCL 8 EB/DC.
Фиг. 9А и В иллюстрируют пролиферативную ответную реакцию Т-клеток СР-21, генерированных против C. pneumoniae-инфицированных дендритных клеток, на рекомбинантный белок SWIB C. pneumoniae, но не на белок SWIB C. trachomatis.
Фиг. 10 показывает специфические для SWIB C. trachomatis пролиферативные ответные реакции линии первичных Т-клеток (ТСТ-10 ЕВ) от бессимптомного донора.
Фиг. 11 иллюстрирует идентификацию Т-клеточного эпитопа в SWIB C. trachomatis антиген-специфической линией Т-клеток (TCL-10 EB).
Фиг. 12 показывает C. trachomatis-специфические пролиферативные ответные реакции линий первичных Т-клеток, полученных от двух пациентов, против СТ-специфических антигенов СТ622, СТ875 и СТ ЕВ.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Как отмечалось выше, данное изобретение относится в общем к композициям и способам для диагностики и лечения хламидийной инфекции. В одном аспекте композиции данного изобретения включают полипептиды, которые содержат, по меньшей мере, одну иммуногенную часть антигена Chlamydia или его варианта.
В конкретных воплощениях данное изобретение описывает полипептиды, содержащие иммуногенную часть антигена Chlamydia, где антиген Chlamydia содержит аминокислотную последовательность, кодируемую описываемой полинуклеотидной молекулой, комплементами указанных нуклеотидных последовательностей и вариантами таких последовательностей.
Используемый в данном описании термин «полипептид» включает аминокислотные цепи любой длины, в том числе полноразмерные белки (т.е. антигены), в которых аминокислотные остатки связаны ковалентными пептидными связями. Таким образом, полипептид, содержащий иммуногенную часть одного из антигенов данного изобретения, может состоять целиком из данной иммуногенной части или может содержать дополнительные последовательности. Дополнительные последовательности могут быть получены из нативного антигена Chlamydia или могут быть гетерологичными, и такие последовательности могут быть (но необязательно) иммуногенными.
Используемый в данном описании термин «полинуклеотид (полинуклеотиды)» означает одноцепочечный или двухцепочечный полимер дезоксирибонуклеотидных или рибонуклеотидных оснований и включает ДНК- и соответствующие РНК-молекулы, в том числе гяРНК- и мРНК-молекулы, как смысловые, так и антисмысловые цепи, и подразумевает кДНК, геномную ДНК и рекомбинантную ДНК, а также полностью или частично синтезированные полинуклеотиды. Молекула гяРНК содержит интроны и соответствует молекуле ДНК обычно как один к одному. Молекула мРНК соответствует молекулам гяРНК и ДНК, из которых были вырезаны интроны. Полинуклеотид может состоять из полного гена или из любой его части. Функциональные антисмысловые полинуклеотиды могут содержать фрагмент соответствующего полинуклеотида, и, таким образом, определение «полинуклеотид» включает все такие функциональные антисмысловые фрагменты.
«Иммуногенная часть» антигена является частью, которая способна реагировать с сыворотками, полученными от инфицированного Chlamydia индивидуума (т.е. генерирует показание поглощения с сыворотками от инфицированных индивидуумов, которое является, по меньшей мере, на три стандартных отклонения выше поглощения, полученного с сыворотками от неинфицированных индивидуумов, в репрезентативном анализе ELISA, описанном в данном описании). Такие иммуногенные части обычно содержат, по меньшей мере, приблизительно 5 аминокислотных остатков, более предпочтительно, по меньшей мере, приблизительно 10 и наиболее предпочтительно, по меньшей мере, приблизительно 20 аминокислотных остатков. Способы получения и идентификации иммуногенных частей антигенов известной последовательности хорошо известны в данной области и включают способы, суммированные в Paul, Fundamental Immunology, 3rd ed., Raven Press, 1993, pp. 243-247 и цитированных в данной работе ссылках. Такие способы включают скрининг полипептидов на их способность реагировать с антиген-специфическими антителами, антисыворотками и/или Т-клеточными линиями или клонами. Применяемые в данном описании антисыворотки и антитела являются «антиген-специфическими», если они специфически связываются с антигеном (т.е. они реагируют с данным белком в ELISA или другом иммуноанализе и не реагируют определяемо с неродственными белками). Такие антисыворотки и антитела могут быть получены, как описано в данном описании и с использованием хорошо известных способов. Иммуногенная часть нативного белка Chlamydia является частью, которая реагирует с такими антисыворотками и/или Т-клетками на уровне, который не является по существу меньшим, чем реактивность полноразмерного полипептида (например, в ELISA и/или анализе реактивности с Т-клетками). Такие иммуногенные части могут реагировать в таких анализах на уровне, который является аналогичным или более высоким, чем реактивность полноразмерного полипептида. Такие скрининги могут быть обычно выполнены с использованием способов, хорошо известных среднему специалисту в данной области, таких как описанные в Harlow and Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory, 1988. Например, полипептид может быть иммобилизован на твердом носителе и приведен в контакт с сыворотками пациентов для связывания антител в данных сыворотках с иммобилизованным полипептидом. Затем несвязавшиеся сыворотки могут быть удалены и связанные антитела определены с использованием, например, 125I-меченого Белка А.
Примеры иммуногенных частей антигенов, рассматриваемые данным изобретением, включают, например, стимулирующие Т-клетки эпитопы, представленные в SEQ ID NO:9, 10, 18, 19, 31, 39, 93-96, 98, 100-102, 106, 108, 138-140, 158, 167, 168, 246, 247 и 254-256. Для обнаружения хламидийной инфекции у пациента обычно могут быть использованы полипептиды, содержащие, по меньшей мере, иммуногенную часть одного или нескольких антигенов Chlamydia, как описано в данном описании, отдельно или в комбинации.
Композиции и способы данного изобретения включают также варианты указанных выше полипептидных и полинуклеотидных молекул. Такие варианты включают, но не ограничиваются ими, встречающиеся в природе аллельные варианты последовательностей данного изобретения. В частности, варианты включают другие серовары Chlamydiae, такие как серовары D, E и F, а также несколько LGV-сероваров, которые имеют гомологию относительно описываемых полипептидных и полинуклеотидных молекул. Предпочтительно, гомологи-серовары обнаруживают 95-99%-ную гомологию относительно соответствующих описываемых полипептидных последовательностей.
Используемый в данном описании термин «вариант» полипептида означает полипептид, который отличается от указанного полипептида только консервативными заменами и/или модификациями, так что антигенные свойства данного полипептида сохраняются. В предпочтительном воплощении вариантные полипептиды отличаются от идентифицированной последовательности заменой, делецией или добавлением пяти или менее аминокислот. Такие варианты могут быть обычно идентифицированы модификацией одной из указанных выше полипептидных последовательностей и оценкой антигенных свойств модифицированного полипептида с использованием, например, репрезентативных методик, приведенных в данном описании. Другими словами, способность варианта реагировать с антиген-специфическими антисыворотками может быть усилена или остаться неизмененной, относительно нативного белка, или может быть понижена менее чем на 50%, и предпочтительно, менее чем на 20%, относительно нативного белка. Такие варианты могут быть обычно идентифицированы модификацией одной из приведенных выше полипептидных последовательностей и оценкой реактивности модифицированного полипептида с использованием антиген-специфических антител или антисывороток, как описано в данном описании. Предпочтительные варианты включают варианты, в которых были удалены одна или несколько частей, таких как N-концевая лидерная последовательность или трансмембранный домен. Другие предпочтительные варианты включают варианты, в которых небольшой белок (например, 1-30 аминокислот, предпочтительно 5-15 аминокислот) был удален из N- и/или С-конца зрелого белка.
Используемый в данном описании термин «консервативная замена» означает замену, в которой аминокислота заменяет другую аминокислоту, которая имеет аналогичные свойства, так что специалист в области пептидной химии может ожидать, что вторичная структура и гидропатическая природа данного полипептида будет по существу неизмененной. Аминокислотные замены могут быть обычно произведены на основе сходства полярности, заряда, растворимости, гидрофобности, гидрофильности и/или амфипатического характера остатков. Например, отрицательно заряженные аминокислоты включают аспарагиновую кислоту и глутаминовую кислоту; положительно заряженные аминокислоты включают лизин и аргинин; и аминокислоты с незаряженными головными полярными группами, имеющие аналогичные величины гидрофильности, включают лейцин, изолейцин и валин; глицин и аланин; аспарагин и глутамин; и серин, треонин, фенилаланин и тирозин. Другие группы аминокислот, которые могут представлять консервативные замены, включают: (1) ala, pro, gly, glu, asp, gln, asn, ser, thr; (2) cys, ser, tyr, thr; (3) val, ile, leu, met, ala, phe; (4) lys, arg, his; и (5) phe, tyr, trp, his. Вариант может также, или альтернативно, содержать неконсервативные замены. В предпочтительном воплощении вариантные полипептиды отличаются от нативной последовательности заменой, делецией или добавлением пяти или менее аминокислот. Варианты могут также (или альтернативно) быть модифицированы, например, делецией или добавлением аминокислот, которые имеют минимальное влияние на иммуногенность, вторичную структуру и гидропатичный характер полипептида. Варианты могут также, или альтернативно, содержать другие модификации, в том числе делецию или добавление аминокислот, которые имеют минимальное влияние на антигенные свойства, вторичную структуру и гидропатический характер полипептида. Например, полипептид может быть конъюгирован с сигнальной (или лидерной) последовательностью на N-конце белка, которая котрансляционно или посттрансляционно управляет транспортом данного белка. Полипептид может быть также конъюгирован с линкерной или другой последовательностью для легкости синтеза, очистки или идентификации данного полипептида (например, поли-His) или для усиления связывания данного полипептида с твердым носителем. Например, полипептид может быть конъюгирован с Fc-областью иммуноглобулина.
«Вариант» полинуклеотида является последовательностью, которая отличается от указанной нуклеотидной последовательности тем, что она имеет одну или несколько делеций, замен или добавлений, так что иммуногенность кодируемого полипептида не уменьшается в сравнении с нативным белком. Действие на иммуногенность кодируемого полипептида может обычно оцениваться, как описано в данном описании. Такие модификации могут быть легко введены с использованием стандартных способов мутагенеза, таких как олигонуклеотид-управляемый сайт-специфический мутагенез, например, описанный Adelman et al., (DNA, 2:183, 1983). Варианты нуклеотидов могут быть встречающимися в природе аллельными вариантами, как обсуждается ниже, или не встречающимися в природе вариантами. Полипептиды, представленные данным изобретением, включают варианты, которые кодируются полинуклеотидными последовательностями, являющимися существенно гомологичными одной или нескольким полинуклеотидным последовательностям, конкретно описываемым в данном описании. Используемый в данном описании термин «существенная гомология» относится к полинуклеотидным последовательностям, которые способны гибридизоваться в умеренно жестких условиях. Подходящие умеренно жесткие условия включают предварительную промывку в растворе 5х SSC, 0,5% ДСН, 1,0 мМ ЭДТА (рН 8,0); гибридизацию при 50°С-65°С, 5х SSC в течение ночи или, в случае перекрестно-видовой гомологии, при 45°С 0,5х SSC; с последующей промывкой дважды при 65°С в течение 20 минут каждым из 2х, 0,5х и 0,2х SSC, содержащим 0,1% ДСН. Такие гибридизующиеся полинуклеотидные последовательности также входят в объем данного изобретения, как и нуклеотидные последовательности, которые, вследствие вырожденности генетического кода, кодируют полипептид, который является таким же, что и полипептид данного изобретения.
Две нуклеотидные или полипептидные последовательности считаются «идентичными», если последовательность нуклеотидов или аминокислотных остатков в данных двух последовательностях является одной и той же при сопоставлении для максимального соответствия, как описано ниже. Сравнения между двумя последовательностями обычно проводят сравнением данных последовательностей на протяжении окна сравнения для идентификации и сравнения локальных областей сходства последовательностей. Используемый в данном описании термин «окно сравнения» означает сегмент, по меньшей мере, из 20 смежных положений, обычно 30-приблизительно 75, 40-приблизительно 59, в которых последовательность может сравниваться со ссылочной последовательностью с тем же самым числом смежных положений после того, как данные две последовательности оптимально выравнены.
Оптимальное сопоставление последовательностей для сравнения может быть проведено с использованием программы Megalign в программном обеспечении комплекта биоинформатики Lasergene (DNASTAR, Inc., Madison, WI) с использованием параметров по умолчанию. Данная программа объединяет несколько схем сопоставления, описанных в следующих ссылках: Dayhoff, M.O. (1978) A model of evolutionary change in proteins - Matrices for detecting distant relationships. In Dayhoff, M.O. (ed.) Atlas of Protein Sequence and Structure, National Biomedical Research Foundation, Washington DC Vol. 5, Suppl. 3, pp. 345-358; Hein J. (1990) Unified Approach to Alignment and Phylogenes pp. 626-646 Methods in Enzymology vol. 183, Academic Press, Inc., San Diego, CA; Higgins, D.G. and Sharp, P.M. (1989) Fast and sensitive multiple sequence alignments on a microcomputer CABIOS 5:151-153; Myers, E.W. and Muller W. (1988) Optimal alignments in linear space CABIOS 4:11-17; Robinson, E.D. (1971) Comb. Theor. 11:105; Santou, N. Nes, M. (1987) The neighbor joining method. A new method for reconstructing phylogenetic trees, Mol. Biol. Evol. 4:406-425; Sneath, P.H.A. and Sokal, R.R. (1973) Numerical Taxonomy - the Principles and Practice of Numerical Taxonomy, Freeman Press, San Francisco, CA; Wilbur, W.J. and Lipman, D.J. (1983) Rapid similarity searches of nucleic acid and protein data banks Proc. Natl. Acad. Sci. USA 80:726-730.
Альтернативно, оптимальное сопоставление последовательностей для сравнения может быть проведено локальным алгоритмом идентичности Smith and Waterman (1981) Add. APL Math 2:482, алгоритмом сопоставления идентичности Needleman and Wunsch (1970) J. Mol. Biol. 48:443, поиском на сходство согласно способам Pearson and Lipman (1988) Proc. Natl. Acad. Sci. (U.S.A.) 85:2444, компьютеризованными воплощениями данных алгоритмов (GAP, BESTFIT, BLAST, FASTA и TFASTA в пакете программного обеспечения Wisconsin Genetics Software Package, Genetics Computer Group (GCG), 575 Science Dr., Madison, WI) или при помощи обследования.
Иллюстративными примерами алгоритмов, которые пригодны для определения процентной идентичности последовательностей и сходства последовательностей, являются алгоритмы BLAST и BLAST 2.0, которые описаны Altschul et al. (1977) Nuc. Acids Res. 25:3389-3402 и Altschul et al., (1990) J. Mol. Biol. 215:403-410, соответственно. BLAST и BLAST 2.0 могут быть использованы, например, с описанными в данном описании параметрами для определения процентной идентичности последовательности для полипептидов и полинуклеотидов данного изобретения. Программное обеспечение для выполнения анализов BLAST является публично доступным через Национальный Центр Информации по Биотехнологии (http://www.ncbi.nlm.nih.gov/). В одном иллюстративном примере могут быть рассчитаны кумулятивные оценки с использованием, для нуклеотидных последовательностей, параметра М (балла «вознаграждения» за пару совпадающих остатков; всегда >0) и N (балла «штрафа» за несовпадающие остатки; всегда <0). Для аминокислотных последовательностей может быть использована матрица оценок для расчета кумулятивной оценки. Удлинения совпадений слов в каждом направлении приостанавливаются, когда: кумулятивная оценка снижается до нуля или ниже вследствие накопления одного или нескольких дающих негативную оценку сопоставлений остатков; или достигается конец любой последовательности. Параметры W, T и Х алгоритма BLAST определяют чувствительность и скорость сопоставления. Программа BLASTN (для нуклеотидных последовательностей) использует по умолчанию длину слова (W) 11 и ожидание (Е) 10 и сопоставления с оценочной матрицей BLOSUM62 (см. Henikoff and Henikoff (1989) Proc. Natl. Acad. Sci. USA 89:10915), (B) 50, ожидание (Е) 10, М=5, N=-4 и сравнение обеих цепей.
Предпочтительно «процент идентичности последовательности» определяют сравнением двух оптимально сопоставленных последовательностей на протяжении окна сравнения, по меньшей мере, из 20 положений, где часть полинуклеотидной или аминокислотной последовательности в окне сравнения может содержать добавления или делеции (т.е. гэпы) 20% или менее, обычно 5-15% или 10-12%, в сравнении со ссылочными последовательностями (которые не содержат добавлений или делеций), для оптимального выстраивания двух последовательностей. Процент рассчитывают определением числа положений, в которых идентичные основания нуклеиновых кислот или аминокислотные остатки встречаются в обеих последовательностях, что дает число совпадающих положений, делением числа совпадающих положений на общее число положений в ссылочной последовательности (т.е. размер окна) и умножением результатов на 100 с получением процента идентичности последовательности.
Таким образом, данное изобретение относится к полинуклеотидным и полипептидным последовательностям, имеющим существенную идентичность описываемых последовательностей, например последовательностей, имеющих, по меньшей мере, 50% или большую идентичность, предпочтительно, по меньшей мере, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% или более высокую идентичность последовательности в сравнении с полинуклеотидной или полипептидной последовательностью данного изобретения, с использованием описываемых способов (например, анализа BLAST с использованием стандартных параметров, как описано ниже). Специалисту в данной области будет очевидно, что данные величины могут быть подходящим образом скорректированы для определения соответствующей идентичности белков, кодируемых двумя полинуклеотидными последовательностями, с учетом вырожденности кодонов, сходства аминокислот, расположения рамок считывания и т.п.
В дополнительных воплощениях данное изобретение относится к выделенным полинуклеотидам или полипептидам, содержащим различные длины смежных отрезков последовательности, идентичных или комплементарных одной или нескольким описываемым последовательностям. Например, полинуклеотиды и полипептиды данного изобретения могут содержать, по меньшей мере, приблизительно 15, 20, 30, 40, 50, 75, 100, 150, 200, 300, 400, 500 или 1000 или более смежных нуклеотидов одной или большего числа описываемых последовательностей, а также все промежуточные длины между ними. Вполне понятно, что «промежуточные длины», в данном контексте, означают любую длину между приведенными величинами, например 16, 17, 18, 19 и т.д.; 21, 22, 23 и т.д.; 30, 31, 32 и т.д.; 50, 51, 52, 53 и т.д.; 100, 101, 102, 103 и т.д.; 150, 151, 152, 153 и т.д.; в том числе все целые числа 200-500; 500-1000 и т.п.
Полинуклеотиды данного изобретения или их фрагменты, независимо от длины самой кодирующей последовательности, могут быть объединены с другими ДНК-последовательностями, такими как промоторы, сигналы полиаденилирования, дополнительные сайты рестрикционных ферментов, сайты множественного клонирования, другие кодирующие сегменты и т.п., так что их полная длина может значительно варьироваться. Таким образом, подразумевается, что может быть использован фрагмент нуклеиновой кислоты почти любой длины, причем общая длина ограничивается легкостью получения и применения в предполагаемом протоколе рекомбинантных ДНК. Например, предполагается, что иллюстративные ДНК-сегменты с общими длинами около 10000, около 5000, около 3000, около 2000, около 1000, около 500, около 200, около 100, около 50 п.н. и т.д. (в том числе всеми промежуточными длинами) применимы во многих воплощениях данного изобретения.
В объем данного изобретения включены также аллели генов, кодирующих цитируемые в данном описании нуклеотидные последовательности. Используемый в данном описании термин «аллель» или «аллельная последовательность» означает альтернативную форму гена, которая может происходить, по меньшей мере, из одной мутации в последовательности нуклеиновой кислоты. Аллели могут приводить к измененным мРНК или полипептидам, структура и функция которых может быть или может не быть измененной. Любой конкретный ген может не иметь или иметь одну или много аллельных форм. Обычные мутационные изменения, которые приводят к появлению аллелей, обычно приписываются природным делециям, добавлениям или заменам нуклеотидов. Каждый из таких типов изменений может встречаться отдельно или в комбинации с другими, один раз или несколько раз в конкретной последовательности.
В характерных воплощениях данное изобретение описывает полипептиды, содержащие, по меньшей мере, иммуногенную часть антигена Chlamydia (или варианта такого антигена), которая содержит одну или несколько аминокислотных последовательностей, кодируемых (а) полинуклеотидной последовательностью, выбранной из группы, состоящей из последовательностей SEQ ID NO:358-361, 407-430, 525-559, 582-598; (b) комплементами таких ДНК-последовательностей или (с) ДНК-последовательностями, по существу гомологичными последовательности в (а) или (b). Как обсуждается в примерах ниже, несколько описываемых антигенов Chlamydia распознают Т-клеточную линию, которая распознает инфицированные как Chlamydia trachomatis, так и Chlamydia pneumoniae происходящие из моноцитов дендритные клетки, что указывает на то, что они могут представлять иммунореактивный эпитоп, общий для Chlamydia trachomatis и для Chlamydia pneumoniae. Таким образом, данные антигены могут быть использованы в вакцине как для инфекций C. trachomatis половых путей, так и для инфекций Chlamydia pneumoniae. Дополнительная характеристика таких антигенов Chlamydia из Chlamydia trachomatis и Chlamydia pneumoniae для определения степени перекрестной реактивности представлена в примере 6. Кроме того, пример 4 описывает кДНК-фрагменты (SEQ ID NO:15, 16 и 33), выделенные из C. trachomatis, которые кодируют белки (SEQ ID NO:17-19 и 32), способные стимулировать Chlamydia-специфическую мышиную CD8+ Т-клеточную линию.
Обычно антигены Chlamydia и кодирующие такие антигены полинуклеотидные последовательности могут быть получены с использованием любой из множества методик. Например, полинуклеотидные молекулы, кодирующие антигены Chlamydia, могут быть выделены из экспрессионной библиотеки геномной ДНК или кДНК Chlamydia при помощи скрининга Chlamydia-специфической Т-клеточной линии, как описано ниже, и секвенированы с использованием способов, хорошо известных специалистам в данной области. Дополнительно, полинуклеотид может быть идентифицирован, как описано более подробно ниже, при помощи скрининга микромассива кДНК для Chlamydia-ассоциированной экспрессии (т.е. экспрессии, которая, по меньшей мере, в два раза выше в инфицированных Chlamydia клетках, чем в контролях, как определено с использованием представленного в данном описании репрезентативного анализа). Такие скрининги могут быть выполнены с использованием микромассива Synteni (Palo Alto, CA) в соответствии с инструкциями изготовителя (и по существу, как описано Schena et al., Proc. Natl. Acad. Sci. USA 93:10614-10619, 1996 и Heller et al., Proc. Natl. Acad. Sci. USA 94:2150-2155, 1997). Альтернативно, полипептиды могут быть амплифицированы из кДНК, полученной из клеток, экспрессирующих описанные в данном описании белки. Такие полинуклеотиды могут быть амплифицированы посредством полимеразной цепной реакции (ПЦР). Для данного метода могут быть сконструированы последовательность-специфические праймеры на основе представленных в данном описании последовательностей, и они могут быть закуплены или синтезированы.
Антигены могут быть получены рекомбинантно, как описано ниже, встраиванием полинуклеотидной последовательности, которая кодирует данный антиген, в экспрессирующий вектор и экспрессией данного антигена в подходящем хозяине. Антигены могут оцениваться на желаемое свойство, например на способность реагировать с сыворотками, полученными от инфицированного Chlamydia индивидуума, как описано в данном описании, и могут быть секвенированы с использованием, например, традиционной методики Эдмана. См. Edman and Berg, Eur. J. Biochem. 80:116-132, 1967.
Полинуклеотидные последовательности, кодирующие антигены, могут быть также получены скринингом подходящей библиотеки кДНК или геномной ДНК Chlamydia на полинуклеотидные последовательности, которые гибридизуются с вырожденными олигонуклеотидами, полученными из частичных аминокислотных последовательностей выделенных антигенов. Вырожденные олигонуклеотидные последовательности для применения в таком скрининге могут быть сконструированы и синтезированы, и скрининг может быть проведен, как описано (например) Sambrook et al., Molecular Cloning. A Laboratory Manual, Cold Spring Harbor Laboratories, Cold Spring Harbor NY (и цитируемых там ссылках). Полимеразная цепная реакция (ПЦР) может быть также использована с применением указанных выше олигонуклеотидов в способах, хорошо известных в данной области, для выделения зонда нуклеиновой кислоты из библиотеки кДНК или геномной ДНК. Затем может быть проведен скрининг библиотеки с использованием выделенного зонда.
Амплифицированная часть может быть использована для выделения полноразмерного гена из подходящей библиотеки (например, библиотеки кДНК Chlamydia) с использованием хорошо известных способов. В таких способах библиотеку (кДНК или геномную) подвергают скринингу с использованием одного или нескольких полинуклеотидных зондов или праймеров, подходящих для амплификации. Предпочтительно, библиотека является отобранной по размеру, чтобы включать более крупные молекулы. Случайно праймированные библиотеки могут быть также предпочтительными для идентификации 5'-расположенных (против хода транскрипции) областей генов. Геномные библиотеки являются предпочтительными для получения интронов и удлинения 5'-последовательностей.
Для способов гибридизации частичная последовательность может быть меченой (например, ник-трансляцией или концевым мечением 32Р) с использованием хорошо известных способов. Затем бактериальную или бактериофаговую библиотеку подвергают скринингу посредством гибридизации фильтров, содержащих денатурированные бактериальные колонии (или газоны, содержащие фаговые бляшки), с меченым зондом (см. Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratories, Cold Spring Harbor, NY, 1989). Гибридизующиеся колонии или бляшки отбирают, размножают и выделяют ДНК для дальнейших анализов. кДНК-клоны можно анализировать для определения количества дополнительной последовательности, например, при помощи ПЦР с использованием праймера из данной частичной последовательности и праймера из вектора. Рестрикционные карты и частичные последовательности могут быть получены для идентификации одного из нескольких перекрывающихся клонов. Затем может быть определена полная последовательность с использованием стандартных способов, которые могут включать генерирование серии делеционных клонов. Полученные перекрывающиеся последовательности могут быть затем собраны в единую смежную последовательность. Полноразмерная кДНК-молекула может быть получена лигированием подходящих фрагментов с использованием хорошо известных способов.
Альтернативно, имеются многочисленные способы амплификации для получения полноразмерной кодирующей последовательности из частичной кДНК-последовательности. В таких способах амплификацию обычно выполняют посредством ПЦР. Любой из множества коммерчески доступных наборов может быть использован для выполнения стадии амплификации. Праймеры могут быть сконструированы с использованием способов, хорошо известных в данной области (см., например, Mullis et al., Cold Spring Harbor Symp. Quant. Biol. 51:263, 1987; Erlich ed., PCR Technology, Stockton Press, NY, 1989), и может быть также использовано программное обеспечение, хорошо известное в данной области. Праймеры предпочтительно имеют длину 22-30 нуклеотидов, имеют содержание GC, по меньшей мере, 50% и гибридизуются с последовательностью-мишенью при температурах около 68°С-72°С. Амплифицированная область может быть секвенирована, как описано выше, и перекрывающиеся последовательности могут быть собраны в непрерывную последовательность.
Одним из таких способов амплификации является инвертированная ПЦР (см. Triglia et al., Nucl. Acids Res. 16:8186, 1988), которая использует рестриктазы для генерирования фрагмента в известной области гена. Затем данный фрагмент циклизуется внутримолекулярным лигированием и используется в качестве матрицы для ПЦР с различными праймерами, полученными как известно в данной области. В альтернативном способе последовательности, соседние с частичной последовательностью, могут быть исправлены амплификацией с праймером к линкерной последовательности и праймером, специфическим для известной области. Амплифицированные последовательности обычно подвергают второму раунду амплификации с теми же самыми линкерным праймером и вторым праймером, специфическим для известной области. Вариация такой методики, которая использует два праймера, которые инициируют удлинение в противоположных направлениях от известной последовательности, описана в WO 96/38591. Дополнительные способы включают захватывающую ПЦР (Lagerstrom et al., PCR Methods Applic. 1:111-19, 1991) и пошаговую ПЦР (Parker et al., Nucl. Acids Res. 19:3055-60, 1991). Опосредованная транскрипцией амплификация, или ТМА, является другим способом, который может быть использован для амплификации ДНК, рРНК или мРНК, как описано в патенте РСТ/US91/03184. Данный автокаталитический и изотермический, не основанный на ПЦР способ использует два праймера и два фермента: РНК-полимеразу и обратную транскриптазу. Один праймер содержит промоторную последовательность для РНК-полимеразы. В первой амплификации данный промотор-праймер гибридизуется с рРНК-мишенью в заданном сайте. Обратная транскриптаза создает ДНК-копию данной рРНК-мишени удлинением от 3'-конца данного промотор-праймера. РНК в полученном комплексе деградируют и второй праймер связывают с ДНК-копией. Новая цепь ДНК синтезируется от конца данного праймера обратной транскриптазой с образованием двухцепочечной ДНК. РНК-полимераза распознает промоторную последовательность в данной ДНК-матрице и инициирует транскрипцию. Каждый из новосинтезированных РНК-репликонов повторно вступает в процесс ТМА и служит в качестве матрицы для нового раунда репликации, что приводит к экспоненциальному размножению РНК-ампликона. Другие способы с применением амплификации могут быть также использованы для получения полноразмерной кДНК-последовательности.
В некоторых случаях можно получить полноразмерную кДНК-последовательность анализом последовательностей, представленных в базе данных маркерных экспрессируемых последовательностей (EST), например, доступных из GenBank. Поиски на перекрывающиеся EST могут быть обычно выполнены с использованием хорошо известных программ (например, NCBI BLAST-поиск), и такие EST могут быть использованы для генерирования сплошной полноразмерной последовательности. Полноразмерные кДНК-последовательности могут быть также получены анализом геномных фрагментов.
Варианты полипептидов могут быть обычно получены любым способом, известным в данной области, в том числе химическим синтезом с использованием, например, твердофазного фосфорамидитного химического синтеза. Модификации в полинуклеотидной последовательности могут быть также введены с использованием стандартных способов мутагенеза, например олигонуклеотид-направляемого сайт-специфического мутагенеза (см. Adelman et al., DNA 2:183, 1983). Альтернативно, РНК-молекулы могут быть получены транскрипцией in vitro или in vivo ДНК-последовательностей, кодирующих белок Chlamydia или его часть, при условии, что данная ДНК включена в вектор с подходящим промотором РНК-полимеразы (таким как Т7 или SP6). Некоторые части могут быть использованы для получения кодируемого полипептида, как описано в данном описании. Кроме того, или альтернативно, часть может быть введена пациенту так, что кодируемый полипептид генерируется in vitro (например, трансфекцией антигенпрезентирующих клеток, таких как дендритные клетки, кДНК-конструкцией, кодирующей полипептид Chlamydia, и введением трансфицированных клеток пациенту).
Часть последовательности, комплементарной кодирующей последовательности (т.е. антисмысловой полинуклеотид) может быть также использована в качестве зонда или для модуляции экспрессии генов. кДНК-конструкции, которые могут транскрибироваться в антисмысловую РНК, могут быть также введены в клетки тканей для облегчения продуцирования антисмысловой РНК. Антисмысловой полинуклеотид может быть использован, как описано в данном описании, для ингибирования экспрессии хламидийного белка. Антисмысловая технология может быть также использована для регуляции экспрессии генов через образование тройного спирального комплекса, который ослабляет способность двойной спирали к открыванию, достаточному для связывания полимераз, факторов транскрипции или регуляторных молекул (см. Gee et al., In Huber and Carr, Molecular and Immunologic Approaches, Futura Publishing Co. (Mt. Kisco, NY; 1994)). Альтернативно, может быть сконструирована антисмысловая молекула для гибридизации с регуляторной областью гена (например, промотором, энхансером или сайтом инициации транскрипции) и блокирования транскрипции данного гена; или для блокирования трансляции посредством ингибирования связывания транскрипта с рибосомами.
Часть кодирующей последовательности или комплементарной последовательности может быть также сконструирована в виде зонда или праймера для определения экспрессии генов. Зонды могут быть помечены различными репортерными группами, такими как радионуклиды и ферменты, и имеют длину, по меньшей мере, 10 нуклеотидов, более предпочтительно, по меньшей мере, 20 нуклеотидов и еще более предпочтительно, по меньшей мере, 30 нуклеотидов. Праймеры, как отмечалось выше, имеют длину предпочтительно 22-30 нуклеотидов.
Любой полинуклеотид может быть дополнительно модифицирован для увеличения стабильности in vivo. Возможные модификации включают, но не ограничиваются ими, добавление фланкирующих последовательностей при 5' и/или 3'-концах; использование фосфоротиоатных или 2'-О-метильных, а не фосфодиэстеразных связей в скелете макромолекулы; и/или включение нетрадиционных оснований, таких как инозин, квеозин и вибутозин, а также ацетил-, метил-, тио- и другие модифицированные формы аденина, цитидина, гуанина, тимина и уридина.
Описываемые нуклеотидные последовательност могут быть соединены с различными другими нуклеотидными последовательностями с использованием установленных способов рекомбинантных ДНК. Например, полинуклеотид может быть клонирован в любой из разнообразных клонирующих векторов, в том числе в плазмиды, фагмиды, производные фага лямбда и космиды. Векторы, представляющие особенный интерес, включают экспрессирующие векторы, реплицирующиеся векторы, генерирующие зонды векторы и секвенирующие векторы. Обычно вектор будет содержать начало репликации, функциональное, по меньшей мере, в одном организме, подходящие сайты рестрикции эндонуклеазами и один или несколько селектируемых маркеров. Другие элементы будут зависеть от желаемого применения и будут очевидны среднему специалисту в данной области.
Синтетические полипептиды, имеющие менее чем приблизительно 100 аминокислот и обычно менее чем приблизительно 50 аминокислот, могут быть получены с использованием способов, хорошо известных в данной области. Например, такие полипептиды могут быть синтезированы с использованием любого из коммерчески доступных твердофазных методик, таких как твердофазный способ синтеза Меррифилда, где аминокислоты последовательно присоединяют к растущей аминокислотной цепи. См. Merrifield, J. Am. Chem. Soc. 85:2149-2146, 1963. Оборудование для автоматизированного синтеза полипептидов является коммерчески доступным от поставщиков, например Perkin Elmer/Applied BioSystems Division, Foster City, CA, и работа на нем может быть выполнена в соответствии с инструкциями изготовителя.
Как отмечалось выше, иммуногенные части антигенов Chlamydia могут быть получены и идентифицированы с использованием хорошо известных способов, таких как способы, суммированные в Paul, Fundamental Immunology, 3rd ed., Raven Press, 1993, pp. 243-247 и цитированных там ссылках. Такие способы включают скрининг частей полипептидов нативного антигена на иммуногенные свойства. Репрезентативные способы ELISA, описанные в данном описании, могут обычно использоваться в указанных скринингах. Иммуногенная часть полипептида является частью, которая в таких репрезентативных анализах генерирует сигнал, который является по существу одинаковым с сигналом, генерируемым полноразмерным антигеном. Другими словами, иммуногенная часть антигена Chlamydia генерирует, по меньшей мере, около 20% и предпочтительно около 100% сигнала, индуцируемого полноразмерным антигеном, в модельном ELISA, как описано в данном описании.
Части и другие варианты антигенов Chlamydia могут быть получены синтетическими или рекомбинантными способами. Варианты нативного антигена могут быть обычно получены с использованием стандартных способов мутагенеза, например олигонуклеотид-направляемого сайт-специфического мутагенеза. Участки полинуклеотидной последовательности могут быть также удалены с использованием стандартных способов для получения укороченных полипептидов.
Рекомбинантные полипептиды, содержащие части и/или варианты нативного антигена, могут быть легко получены из полинуклеотидной последовательности, кодирующей полипептид, с использованием различных способов, хорошо известных среднему специалисту в данной области. Например, супернатанты из подходящих систем хозяин-вектор, которые секретируют рекомбинантный белок в культуральную среду, могут быть сначала сконцентрированы при помощи коммерчески доступного фильтра. После концентрирования концентрат может быть нанесен на подходящий матрикс для очистки, например аффинный матрикс или ионообменную смолу. Наконец, одна или несколько стадий ВЭЖХ с обращенной фазой могут быть использованы для дополнительной очистки рекомбинантного белка.
Любой из разнообразия экспрессирующих векторов, известных среднему специалисту в данной области, может быть использован для экспрессии рекомбинантных полипептидов, как описано в данном описании. Экспрессия может быть достигнута в любой подходящей клетке-хозяине, которая была трансформирована или трансфицирована экспрессирующим вектором, содержащим полинуклеотидную молекулу, кодирующую рекомбинантный полипептид. Подходящие клетки-хозяева включают прокариоты, дрожжи и высшие эукариотические клетки. Предпочтительно, используемыми клетками-хозяевами являются E. coli, дрожжи или линия клеток млекопитающего, например COS или СНО. ДНК-последовательности, экспрессируемые таким образом, могут кодировать встречающиеся в природе антигены или другие их варианты.
Обычно, независимо от способа получения, описываемые полипептиды получают в выделенной, по существу чистой форме. Предпочтительно, полипептиды являются, по меньшей мере, приблизительно на 80% чистыми, более предпочтительно, по меньшей мере, приблизительно на 90% чистыми и наиболее предпочтительно, по меньшей мере, приблизительно на 99% чистыми.
В некоторых конкретных воплощениях полипептид может быть слитым белком, который содержит множественные описываемые полипептиды или который содержит, по меньшей мере, один описываемый полипептид и неродственную последовательность, например известный белок Chlamydia. Партнер слияния может, например, способствовать получению Т-хелперных эпитопов (иммунологический партнер слияния), предпочтительно Т-хелперных эпитопов, распознаваемых людьми, или он может способствовать экспрессии данного белка (энхансер экспрессии) с более высокими выходами, чем при применении нативного рекомбинантного белка. Некоторые предпочтительные партнеры слияния являются как иммунологическими, так и усиливающими экспрессию партнерами слияния. Другие партнеры слияния могут быть выбраны таким образом, что они увеличивают растворимость белка или позволяют данному белку быть направленным к желаемым внутриклеточным компартментам. Другие партнеры слияния включают аффинные метки, которые облегчают очистку данного белка. ДНК-последовательность, кодирующая слитый белок данного изобретения, может быть сконструирована с использованием известных способов рекомбинантных ДНК для сборки отдельных ДНК-последовательностей, кодирующих, например, первый и второй полипептиды, в подходящий экспрессирующий вектор. 3' конец ДНК-последовательности, кодирующей первый полипептид, лигируют, с пептидным линкером или без него, с 5'-концом ДНК-последовательности, кодирующей второй полипептид, таким образом, что рамка считывания данных последовательностей находится в фазе, позволяя трансляцию мРНК данных двух последовательностей в единый слитый белок, который сохраняет биологическую активность как первого, так и второго полипептидов.
Последовательность линкерного пептида может быть использована для разделения первого и второго полипептидов расстоянием, достаточным для гарантии того, что каждый полипептид укладывается в свою вторичную и третичную структуры. Такую пептидную линкерную последовательность включают в слитый белок с использованием стандартных способов, хорошо известных в данной области. Подходящие пептидные линкерные последовательности могут быть выбраны на основании следующих факторов: (1) их способности принимать гибкую удлиненную конформацию; (2) их неспособности принимать вторичную структуру, которая могла бы взаимодействовать с функциональными эпитопами на первом и втором полипептидах; и (3) отсутствии гидрофобных или заряженных остатков, которые могли бы реагировать с функциональными эпитопами полипептида. Предпочтительные пептидные линкерные последовательности содержат остатки Gly, Asn и Ser. Другие почти нейтральные аминокислоты, такие как Thr и Ala, могут быть также использованы в линкерной последовательности. Аминокислотные последовательности, которые могут быть успешно применимы в качестве линкеров, включают последовательности, описанные Maratea et al., Gene 40:39-46, 1985; Murphy et al., Proc. Natl. Acad. Sci. USA 83:8258-8562, 1986; в патенте США № 4935233 и патенте США № 4751180. Линкерная последовательность может иметь длину от 1 до приблизительно 50 аминокислот. В качестве альтернативы применению пептидной линкерной последовательности (если желательно) можно использовать области не-незаменимых N-концевых аминокислот (когда они присутствуют) на первом и втором полипептидах для разделения функциональных доменов и предотвращения стерического препятствия.
Лигированные ДНК-последовательности функционально связаны с подходящими регуляторными элементами транскрипции и трансляции. Регуляторные элементы, ответственные за экспрессию ДНК, расположены только 5' (слева) относительно ДНК-последовательности, кодирующей первые полипептиды. Подобным образом, стоп-кодоны, необходимые для окончания трансляции, и сигналы терминации транскрипции присутствуют только 3' (справа) относительно ДНК-последовательности, кодирующей второй полипептид.
Представлены также слитые белки, которые содержат полипептид данного изобретения вместе с неродственным иммуногенным белком. Предпочтительно, иммуногенный белок способен индуцировать ответную реакцию памяти. Примеры таких белков включают белки возбудителей столбняка, туберкулеза и гепатита (см., например, Stoute et al., New Engl. J. Med., 336:86-91, 1997).
В предпочтительных воплощениях иммунологический партнер слияния производят из белка D, поверхностного белка грамотрицательной бактерии Haemophilus influenza B (WO 91/18926). Предпочтительно, производное белка D содержит приблизительно первую треть данного белка (например, первые 100-110 N-концевых аминокислот), и производное белка D может быть липидировано. В некоторых предпочтительных воплощениях первые 109 остатков партнера слияния липопротеида D включены на N-конце для получения полипептида с дополнительными экзогенными Т-клеточными эпитопами и для увеличения уровня экспрессии в E. coli (действующего, следовательно, в качестве энхансера экспрессии). Липидный хвост обеспечивает оптимальную презентацию антигена антигенпрезентирующим клеткам. Другие партнеры слияния включают неструктурный белок из вируса гриппа, NS1 (гемаглютинин). Обычно используют 81 N-концевую аминокислоту, хотя могут быть использованы различные фрагменты, которые содержат Т-хелперные эпитопы.
В другом воплощении иммунологическим партнером слияния является белок, известный как LYTA, или его часть (предпочтительно С-концевая часть). LYTA получают из Streptococcus pneumoniae, который синтезирует N-ацетил-L-аланинамидазу, известную как амидаза LYTA (кодируемую геном LytA; Gene 43:265-292, 1986). LYTA является аутолизином, который специфически разрушает некоторые связи в скелете пептидогликанов. С-концевой домен белка LYTA является ответственным за аффинность в отношении холина или некоторых аналогов холина, таких как DEAE. Данное свойство было использовано для разработки экспрессирующих С-LYTA плазмид E. coli, применимых для экспрессии слитых белков. Была описана очистка гибридных белков, содержащих фрагмент С-LYTA на амино-конце (см. Biotechnology 10:795-798, 1992). В предпочтительном воплощении повторяющаяся часть LYTA может быть включена в слитый белок. Повторяющаяся часть обнаружена в С-концевой области, начинающейся при остатке 178. Особенно предпочтительная повторяющаяся часть включает в себя остатки 188-305.
В другом воплощении происходящий из Mycobacterium tuberculosis полинуклеотид Ra12 связан, по меньшей мере, с иммуногенной частью полинуклеотида данного изобретения. Композиции Ra12 и способы их применения в усилении экспрессии гетерологичных полинуклеотидных последовательностей описаны в заявке на патент США 60/158585, которая включена в данное описание в качестве ссылки во всей своей полноте. Короче, Ra12 представляет собой полинуклеотидную область, которая является подпоследовательностью нуклеиновой кислоты МТВ32А Mycobacterium tuberculosis. МТВ32А является сериновой протеазой с молекулярной массой 32 кД, кодируемой геном в вирулентных и авирулентных штаммах М. tuberculosis. Нуклеотидная последовательность и аминокислотная последовательность МТВ32А была описана (заявка на патент США 60/158585; см., также Skeiky et al., Infection and Immun. (1999) 67:3998-4007, включенные в данное описание в качестве ссылки). В одном воплощении полипептид Ra12, используемый в получении слитых полипептидов, содержит С-концевой фрагмент кодирующей последовательности МТВ32А, который является эффективным для усиления экспрессии и/или иммуногенности гетерологичных хламидийных антигенных полипептидов, с которыми он слит. В других воплощениях полипептид Ra12 соответствует С-концевому фрагменту приблизительно 14 кД МТВ32А, содержащему некоторые из аминокислотных остатков или все аминокислотные остатки 192-323 МТВ32А.
Рекомбинантные нуклеиновые кислоты, которые кодируют слитый полипептид, содержащий полипептид Ra12 и гетерологичный представляющий интерес полипептид Chlamydia, могут быть легко сконструированы общепринятыми способами генной инженерии. Рекомбинантные нуклеиновые кислоты конструируют таким образом, что последовательность полинуклеотида Ra12 предпочтительно находится 5' (слева) относительно выбранной гетерологичной полинуклеотидной последовательности Chlamydia. Может быть также удобным помещение полинуклеотидной последовательности Ra12 3' (справа) относительно выбранной гетерологичной представляющей интерес полинуклеотидной последовательности или встраивание гетерологичной полинуклеотидной последовательности в сайт внутри полинуклеотидной последовательности Ra12.
Кроме того, любой подходящий полинуклеотид, который кодирует Ra12 или его часть или другой вариант, может быть использован в конструировании рекомбинантных слитых полинуклеотидов, содержащих Ra12 и один или несколько описываемых полинуклеотидов Chlamydia. Предпочтительные полинуклеотиды Ra12 обычно содержат, по меньшей мере, приблизительно 15 последовательных нуклеотидов, по меньшей мере, приблизительно 30 нуклеотидов, по меньшей мере, приблизительно 60 нуклеотидов, по меньшей мере, приблизительно 100 нуклеотидов, по меньшей мере, приблизительно 200 нуклеотидов или, по меньшей мере, приблизительно 300 нуклеотидов, которые кодируют часть полипептида Ra12.
Полинуклеотиды Ra12 могут содержать нативную последовательность (т.е. эндогенную последовательность, которая кодирует полипептид Ra12 или его часть) или могут содержать вариант такой последовательности. Варианты полинуклеотида Ra12 могут содержать одну или несколько замен, добавлений, делеций и/или инсерций, так что биологическая активность кодируемого слитого полипептида не является по существу уменьшенной относительно слитого полипептида, содержащего нативный полипептид Ra12. Варианты предпочтительно проявляют, по меньшей мере, приблизительно 70% идентичность, более предпочтительно, по меньшей мере, приблизительно 80% идентичность и наиболее предпочтительно, по меньшей мере, приблизительно 90% идентичность относительно полинуклеотидной последовательности, кодирующей нативный полипептид Ra12 или его часть.
В другом аспекте данное изобретение относится к способам применения одного или нескольких описанных выше полипептидов или слитых белков (или полинуклеотидов, кодирующих такие полипептиды или слитые белки) для индукции защитного иммунитета против хламидийной инфекции у пациента. Используемый в данном описании термин «пациент» относится к любому теплокровному животному, преимущественно к человеку. Пациент может быть поражен заболеванием или он может не иметь обнаруживаемого заболевания и/или инфекции. Другими словами, защитный иммунитет может быть индуцирован для предупреждения или лечения хламидийной инфекции.
В данном аспекте молекула полипептида, слитого белка или полинуклеотида обычно присутствует в фармацевтической композиции или вакцине. Фармацевтические композиции могут содержать один или более полипептидов, каждый из которых может содержать одну или более из описанных выше последовательностей (или их вариантов) и физиологически приемлемый носитель. Вакцины могут содержать один или несколько из описанных выше полипептидов и иммуностимулятор, такой как адъювант или липосома (в которую включен данный полипептид). Такие фармацевтические композиции и вакцины могут также содержать другие антигены Chlamydia, либо включенные в комбинированный полипептид, либо присутствующие в отдельном полипептиде.
Альтернативно, вакцина может содержать полинуклеотиды, кодирующие один или несколько полипептидов или слитых белков, описанных выше, так что полипептид образуется in situ. В таких вакцинах полинуклеотиды могут присутствовать в любой из различных систем доставки, известных среднему специалисту в данной области, в том числе систем экспрессии нуклеиновых кислот, бактериальных и вирусных систем экспрессии. Подходящие системы экспрессии нуклеиновых кислот содержат необходимые полинуклеотидные последовательности для экспрессии у пациента (такие как подходящие промотор и сигнал терминации). Бактериальные системы доставки предусматривают введение бактерии (например, Bacillus-Calmette-Guerrin), которая экспрессирует иммуногенную часть полипептида на ее клеточной поверхности. В предпочтительном воплощении полинуклеотиды могут быть введены с использованием вирусной системы экспрессии (например, вируса коровьей оспы или другого поксвируса, ретровируса или аденовируса), которая может предусматривать применение непатогенного (дефектного) вируса. Способы включения полинуклеотидов в такие системы экспрессии хорошо известны среднему специалисту в данной области. Полинуклеотиды могут быть также введены в виде «голых» плазмидных векторов, как описано, например, Ulmer et al., Science 259:1745-1749, 1993 и в обзоре Cohen, Science 259:1691-1692, 1993. Способы включения ДНК в такие векторы хорошо известны среднему специалисту в данной области. Ретровирусный вектор может дополнительно переносить или включать ген для селектируемого маркера (для улучшения идентификации или отбора трансдуцированных клеток) и/или нацеливающую часть молекулы, например ген, который кодирует лиганд для рецептора на специфической клетке-мишени, для придания специфичности нацеливанию вектора. Нацеливание может быть также достигнуто использованием антитела способами, известными среднему специалисту в данной области.
Другие композиции для терапевтических целей включают коллоидальные диспергированные системы, такие как комплексы макромолекул, нанокапсулы, микросферы, гранулы и системы на основе липидов, в том числе эмульсии типа масло в воде, мицеллы, смешанные мицеллы и липосомы. Предпочтительной коллоидальной системой для использования в качестве носителя доставки in vitro и in vivo является липосома (т.е. искусственный мембранный пузырек, или везикула). Поглощение «голых» полинуклеотидов может быть увеличено включением данных полинуклеотидов в и/или на биодеградируемые гранулы, которые эффективно транспортируются в клетки. Получение и применение таких систем хорошо известно в данной области.
В родственном аспекте полинуклеотидная вакцина, описанная выше, может быть введена одновременно или последовательно с полипептидом данного изобретения или известным антигеном Chlamydia. Например, введение полинуклеотидов, кодирующих полипептид данного изобретения, либо в «голом» виде, либо в системе доставки, описанной выше, может сопровождаться введением антигена для усиления защитного иммунного эффекта данной вакцины.
Описываемые полипептиды и полинуклеотиды могут также использоваться в адоптивной иммунотерапии для лечения хламидийной инфекции. Адоптивная иммунотерапия может быть классифицирована в широком плане на активную и пассивную иммунотерапию. В активной иммунотерапии лечение основано на стимуляции in vivo эндогенной иммунной системы хозяина введением модифицирующих иммунный ответ агентов (например, вакцин, бактериальных адъювантов и/или цитокинов).
В пассивной иммунотерапии лечение включает доставку биологических агентов с установленной иммунореактивностью (таких как эффекторные клетки или антитела), которые могут прямо или опосредованно вызывать антихламидийные эффекты и не зависят обязательно от интактной иммунной системы хозяина. Примеры эффекторных клеток включают Т-лимфоциты (например, CD8+ цитотоксический Т-лимфоцит, CD4+ Т-хелпер), клетки-киллеры (например, натуральные клетки-киллеры, активируемые лимфокинами клетки-киллеры), В-клетки или антигенпрезентирующие клетки (такие как дендритные клетки и макрофаги), экспрессирующие описанные антигены. Описываемые полипептиды могут быть также использованы для генерирования антител или антиидиотипических антител (описанных в патенте США № 4918164) для пассивной иммунотерапии.
Предпочтительным способом обеспечения адекватных количеств Т-клеток для адоптивной иммунотерапии является выращивание иммунных Т-клеток in vitro. Условия культуры для размножения отдельных антиген-специфических Т-клеток до нескольких миллиардов клеток с сохранением распознавания антигена in vivo хорошо известны в данной области. Такие условия культуры in vitro обычно используют периодическую стимуляцию антигеном, часто в присутствии цитокинов, таких как IL-2, и неделящиеся клетки-фидеры. Как отмечалось выше, описываемые иммунореактивные полипептиды могут быть использованы для быстрого размножения антиген-специфических Т-клеточных культур для генерирования достаточного числа клеток для иммунотерапии. В частности, антигенпрезентирующие клетки, такие как дендритные клетки, макрофаги, моноциты, фибробласты или В-клетки, могут быть кратковременно обработаны иммунореактивными полипептидами, или полинуклеотидные последовательности могут быть введены в антигенпрезентирующие клетки с использованием стандартных способов, хорошо известных в данной области. Например, антигенпрезентирующие клетки могут быть трансфицированы или трансдуцированы полинуклеотидной последовательностью, причем указанная последовательность содержит промоторную область, подходящую для усиления экспрессии, и может быть экспрессирована в виде части рекомбинантного вируса или другой системы экспрессии. Несколько вирусных векторов могут быть использованы для трансдукции антигенпрезентирующей клетки, в том числе вирус оспы (поксвирус), вирус коровьей оспы и аденовирус; антигенпрезентирующие клетки могут быть также трансфицированы описываемыми полинуклеотидными последовательностями различными способами, включающими способ генной пушки, опосредованную липидами доставку, электропорацию, осмотический шок и механизмы доставки частиц, что приводит к эффективным и приемлемым уровням экспрессии, как может быть определено средним специалистом в данной области. Для того чтобы культивируемые Т-клетки были эффективными в терапии, культивируемые Т-клетки должны быть способны расти и широко распространяться и выживать в течение продолжительного времени in vivo. Исследования продемонстрировали, что культивируемые Т-клетки могут быть индуцированы для роста in vivo и выживания в течение продолжительного времени в значительных количествах с использованием периодической стимуляции антигеном, дополненным IL-2 (см., например, Cheever, M., et al., “Therapy With Cultured T Cells: Principles Revisited,” Immunological Reviews, 157:177, 1997).
Описываемые полипептиды могут быть также использованы для генерирования и/или выделения Chlamydia-реактивных Т-клеток, которые затем могут быть введены пациенту. В одном способе антиген-специфические Т-клеточные линии могут быть получены иммунизацией in vivo короткими пептидами, соответствующими иммуногенным частям описываемых полипептидов. Полученные антиген-специфические клоны CD8+ или CD4+ Т-клеток могут быть выделены у пациента, размножены с использованием стандартных способов культуры ткани и возвращены пациенту.
Альтернативно, пептиды, соответствующие иммуногенным частям данных полипептидов, могут быть использованы для генерирования Chlamydia-реактивных субпопуляций Т-клеток посредством селективной стимуляции in vitro и размножением аутологичных Т-клеток для получения антиген-специфических Т-клеток, которые могут быть затем перенесены пациенту, как описано, например, Chang et al., (Crit. Rev. Oncol. Hematol., 22(3), 213 (1996). Клетки иммунной системы, такие как Т-клетки, могут быть выделены из периферической крови пациента с использованием коммерчески доступной системы разделения клеток, такой как система Isolex™, доступная от Nexell Therapeutics, Inc. Irvine, CA. Отделенные клетки стимулируют одним или несколькими иммунореактивными полипептидами, содержащимися в носителе (векторе) доставки, таком как микросфера, для получения антиген-специфических Т-клеток. Затем популяцию антиген-специфических Т-клеток размножают с использованием стандартных способов и данные клетки вводят обратно пациенту.
В других воплощениях рецепторы Т-клеток и/или антител, специфических для описываемых полипептидов, могут быть клонированы, размножены и перенесены в другие векторы или эффекторные клетки для применения в адоптивной иммунотерапии. В частности, Т-клетки могут быть трансфицированы подходящими генами для экспрессии вариабельных доменов из Chlamydia-специфических моноклональных антител в виде внеклеточных элементов распознавания и присоединены к цепям передачи сигнала рецептора Т-клеток, что приводит к активации Т-клеток, специфическому лизису и высвобождению цитокинов. Это позволяет Т-клетке изменять ее специфичность независимым от МНС образом. См., например, Eshhar, Z., Cancer Immunol. Immunother, 45(3-4):131-6, 1997 и Hwu, P., et al., Cancer Res, 55(15):3369-73, 1995. Другое воплощение может включать трансфекцию специфических для антигена Chlamydia альфа- и бета-цепей рецептора Т-клеток в другие Т-клетки, как описано Cole, DJ, et al., Cancer Res, 55(4):748-52, 1995.
В дополнительном воплощении сингенные или аутологичные дендритные клетки могут быть кратковременно обработаны пептидами, соответствующими, по меньшей мере, иммуногенной части описываемого полипептида. Полученные антиген-специфические дендритные клетки могут быть либо перенесены пациенту, либо использованы для стимуляции Т-клеток для получения антиген-специфических Т-клеток, которые могут быть, в свою очередь, введены пациенту. Применение кратковременно обработанных пептидом дендритных клеток для генерирования антиген-специфических Т-клеток и последующее применение таких антиген-специфических Т-клеток для ликвидации заболевания на мышиной модели было продемонстрировано Cheever et al., Immunological Reviews, 157:177, 1997. Кроме того, векторы, экспрессирующие описанные полинуклеотиды, могут быть введены в стволовые клетки, взятые у пациента и клонально размноженные in vitro, для аутологичной трансплантации обратно тому же самому пациенту.
В некоторых аспектах описываемые полипептиды, полинуклеотиды, Т-клетки и/или связывающие агенты могут быть включены в фармацевтические композиции или иммуногенные композиции (т.е. вакцины). Альтернативно, фармацевтическая композиция может содержать антигенпрезентирующую клетку (например, дендритную клетку), трансфицированную полинуклеотидом Chlamydia, так что антигенпрезентирующая клетка экспрессирует полипептид Chlamydia. Фармацевтические композиции содержат одно или несколько таких соединений и физиологически приемлемый носитель. Вакцины могут содержать одно или несколько таких соединений и иммуностимулятор. Иммуностимулятором может быть любое вещество, которое усиливает или потенциирует иммунный ответ на экзогенный антиген. Примеры иммуностимуляторов включают адъюванты, биодеградируемые микросферы (например, полилактид-галактид) и липосомы (в которые включено данное соединение); см., например, Fullerton, патент США № 4235877. Приготовление вакцин описано в общем, например, M.F. Powell and M.J. Newman, eds., “Vaccine Design (the subunit and adjuvant approach),” Plenum Press (NY, 1995). Фармацевтические композиции и вакцины в рамках данного изобретения могут также содержать другие соединения, которые могут быть биологически активными или неактивными. Например, в композиции или вакцине могут присутствовать одна или несколько иммуногенных частей других антигенов Chlamydia либо в виде включенных в слитый белок частей, либо в виде отдельного соединения.
Фармацевтическая композиция или вакцина может содержать ДНК, кодирующую один или несколько описанных выше полипептидов, так что полипептид генерируется in situ. Как отмечалось выше, данная ДНК может присутствовать в любой из множества систем доставки, известных среднему специалисту в данной области, в том числе системах экспрессии нуклеиновых кислот, бактериальных и вирусных системах экспрессии. Многочисленные способы доставки генов хорошо известны в данной области, например, описанные Rolland, Crit. Rev. Therap. Drug Carrier Systems 15:143-198, 1998 и в цитируемых там ссылках. Подходящие системы экспрессии нуклеиновых кислот содержат необходимые ДНК-последовательности для экспрессии у пациента (такие как подходящий промотор и сигнал терминации). Бактериальные системы доставки предусматривают введение бактерии (такой как Bacillus-Calmette-Guerrin), которая экспрессирует иммуногенную часть полипептида на ее клеточной поверхности или секретирует такой эпитоп.
В предпочтительном воплощении ДНК может быть введена с использованием вирусной системы экспрессии (например, вируса коровьей оспы или другого поксвируса, ретровируса, аденовируса, бакуловируса, тогавируса, бактериофага и т.п.), которая может предусматривать применение непатогенного (дефектного), компетентного по репликации вируса.
Например, многие вирусные векторы доставки получают из вирусов семейства retroviridae. Данное семейство включает вирусы мышиного лейкоза, вирусы мышиной опухоли молочной железы, пенящие вирусы человека, вирус саркомы Рауса и вирусы иммунодефицита, в том числе человека, обезьян и кошачьих. Соображения по конструированию ретровирусных экспрессионных векторов обсуждаются Comstock et al. (1997).
Превосходные вирусные экспрессионные векторы на основе мышиного вируса лейкоза (MLV) были разработаны Kim et al. (1998). В создании MLV-векторов Kim et al. нашли, что вся последовательность gag, вместе с непосредственной областью слева, могла быть делетирована без значимого влияния на упаковку или экспрессию генов вируса. Кроме того, было обнаружено, что почти вся область U3 может быть заменена немедленно ранним промотором цитомегаловируса человека без повреждающих эффектов. Кроме того, MCR и внутренние сайты вхождения рибосом (IRES) могли быть добавлены без повреждающих эффектов. На основе своих наблюдений Kim et al. сконструировали ряд экспрессионных векторов на основе MLV, имеющих один или более из описанных выше признаков.
По мере все большего исследования пенящего вируса человека (HFV) открывали свойства HFV, которые являются благоприятными для его использования в качестве экспрессионного вектора. Такие свойства включают экспрессию pol сплайсингом и началом трансляции в определенном инициирующем кодоне. Другие аспекты экспрессионных векторов HFV рассматриваются Bodem et al. (1997).
Murakami et al. (1997) описывают векторы птичьего ретровируса на основе вируса саркомы Рауса (RSV), IR1 и IR2, для экспрессии гетерологичного гена на высоком уровне. В данных векторах IRES, происходящие от вируса энцефаломиокардита (EMCV), встраивали между геном env и гетерологичным геном. Вектор IR1 сохраняет акцепторный сайт сплайсинга, который присутствует справа от гена env, тогда как вектор IR2 не имеет данного сайта. Murakami et al. показали экспрессию высокого уровня нескольких гетерологичных генов такими векторами.
Недавно был получен ряд ретровирусных экспрессионных векторов на основе лентивируса. Kafri et al. (1997) показали пролонгированную экспрессию генов, доставленных непосредственно в печень и мышцу экспрессионным вектором на основе вируса иммунодефицита человека (ВИЧ). Одним из преимуществ данной системы является присущая ВИЧ способность трансдуцировать неделящиеся клетки. Поскольку данные вирусы Kafri et al. псевдотипируются с гликопротеином вируса G везикулярного стоматита (VSVG), они могут трансдуцировать широкий диапазон типов тканей и клеток.
Было разработано большое число экспрессионных векторов на основе аденовирусов, прежде всего вследствие преимуществ, предоставляемых такими векторами в применениях генотерапии. Аденовирусные экспрессионные векторы и способы применения таких векторов являются предметом ряда патентов США, в том числе патента США № 5698202, патента США № 5616326, патента США № 5585362 и патента США № 5518913, включенных в данное описание в качестве ссылки.
Дополнительные аденовирусные конструкции описаны Khatri et al. (1997) и Tomanin et al. (1997). Khatri et al. описывают новые экспрессионные векторы овечьего аденовируса и их способность инфицировать бычьи носовые раковины и клетки почек кролика, а также некоторые типы клеток человека, в том числе фибробласты легких и крайней плоти, а также линии клеток печени, предстательной железы, молочной железы, ободочной кишки и сетчатки. Tomanin et al. описывают аденовирусные экспрессионные векторы, содержащие ген РНК-полимеразы Т7. При введении в клетки, содержащие гетерологичный ген, функционально связанный с промотором Т7, данные векторы способны запускать экспрессию генов от промотора Т7. Предполагают, что такая система может быть полезной для клонирования и экспрессии генов, кодирующих цитотоксичные белки.
Поксвирусы широко используются для экспрессии гетерологичных генов в клетках млекопитающих. На протяжении многих лет данные векторы были усовершенствованы для создания возможности высокой экспрессии гетерологичного гена и упрощения интеграции множественных гетерологичных генов в единую молекулу. В попытках уменьшения цитопатических эффектов и увеличения безопасности мутант вируса коровьей оспы и другие поксвирусы, которые подвергаются абортивной инфекции в клетках млекопитающих, привлекали особое внимание (Oertli et al., 1997). Применение поксвирусов в качестве экспрессионных векторов рассматривается в обзоре Carroll and Moss (1997).
Тогавирусные экспрессионные векторы, которые включают альфавирусные экспрессионные векторы, были использованы для исследования структуры и функции белков и для целей получения белков. Привлекательными чертами тогавирусных экспрессионных векторов являются быстрая и эффективная экспрессия генов, широкий спектр хозяев и РНК-геномы (Huang, 1996). Также было показано, что рекомбинантные вакцины на основе альфавирусных экспрессионных векторов индуцируют сильный гуморальный и клеточный иммунный ответ с хорошими иммунологической памятью и защитными эффектами (Tubulekas et al., 1997). Альфавирусные экспрессионные векторы и их применение обсуждаются, например, Lundstrom (1997).
В одном исследовании Li and Garoff (1996) использовали экспрессионные векторы вируса лесов Семлики (SFV) для экспрессии ретровирусных генов и для получения ретровирусных частиц в клетках ВНК-21. Частицы, полученные таким способом, имели протеазную активность и активность обратной транскриптазы и были инфекционными. Кроме того, в исходном материале вируса не мог быть определен хелперный вирус. Таким образом, такая система имеет свойства, которые являются привлекательными для ее использования в протоколах генотерапии.
Бакуловирусные экспрессионные векторы традиционно использовали для экспрессии гетерологичных белков в клетках насекомых. Примеры белков включают рецепторы хемокинов млекопитающих (Wang et al., 1997), репортерные белки, такие как зеленый флуоресцентный белок (Wu et al., 1997), и FLAG-слитые белки (Wu et al., 1997; Koh et al., 1997). Недавний прогресс в технологии бакуловирусных экспрессионных векторов, в том числе их применение в вирионах в качестве представляющих векторов и экспрессия в клетках млекопитающих, обсуждается в обзоре Possee (1997). Другие обзоры по бакуловирусным экспрессионным векторам включают Jones and Morikawa (1996) и O'Reilly (1997).
Другие пригодные вирусные экспрессионные системы описаны, например, Fisher-Hoch et al., Proc. Natl. Acad. Sci. USA 86:317-321, 1989; Flexner et al., Ann. N.Y. Acad. Sci. 569:86-103, 1989; Flexner et al., Vaccine 8:17-21, 1990; в патентах США с номерами 4603112, 4769330 и 5017487; WO 89/01973; патенте США № 4777127; GB 2200651; ЕР 0345242; WO 91/02805; Berkner, Biotechniques 6:616-627, 1988; Risenfeld et al., Science 252:431-434, 1991; Kolls et al., Proc. Natl. Acad. Sci. USA 91:215-219, 1994; Kass-Eisler et al., Proc. Natl. Acad. Sci. USA 90:11498-11502, 1993; Guzman et al., Circulation 88:2838-2848, 1993 и Guzman et al., Cir. Res. 73:1202-1207, 1993. Способы включения ДНК в такие экспрессионные системы хорошо известны среднему специалисту в данной области. В других системах ДНК может быть введена в виде «голой» ДНК, как описано, например, Ulmer et al., в Science 259:1745-1749, 1993 и обсуждается Cohen, в Science 259:1691-1692, 1993. Поглощение «голой» ДНК может усиливаться нанесением данной ДНК в виде покрытия на биодеградируемые гранулы, которые эффективно транспортируются в клетки.
Должно быть понятно, что вакцина может содержать полинуклеотидный и/или полипептидный компонент, по желанию. Будет также понятно, что вакцина может содержать фармацевтически приемлемые соли представленных в данном описании полинуклеотидов и/или полипептидов. Такие соли могут быть получены из фармацевтически приемлемых нетоксичных оснований, в том числе органических оснований (например, соли первичного, вторичного и третичного аминов и основных аминокислот) и неорганических оснований (например, соли натрия, калия, лития, аммония, кальция и магния). Хотя в фармацевтических композициях данного изобретения может быть использован любой подходящий носитель, известный среднему специалисту в данной области, тип носителя будет варьироваться в зависимости от способа введения. Композиции данного изобретения могут быть приготовлены для любого подходящего способа введения, в том числе, например, локального, перорального, назального, внутривенного, внутричерепного, внутрибрюшинного, подкожного или внутримышечного введения. Для парентерального введения, например для подкожной инъекции, носитель предпочтительно содержит воду, солевой раствор, спирт, жир, воск или буфер. Для перорального введения может быть использован любой из названных выше носителей или твердый носитель, такой как маннит, лактоза, крахмал, стеарат магния, натрий-сахарин, тальк, целлюлоза, глюкоза, сахароза и карбонат магния. Биодеградируемые микросферы (например, полилактат-полигликолят) могут быть также использованы в качестве носителей для фармацевтических композиций данного изобретения. Подходящие биодеградируемые микросферы описаны, например, в патентах США №4897268 и 5075109.
Такие композиции могут также содержать буферы (например, нейтральный забуференный солевой раствор или забуференный фосфатом солевой раствор), углеводы (например, глюкозу, маннозу, сахарозу или декстраны), маннит, белки, полипептиды или аминокислоты, такие как глицин, антиоксиданты, бактериостатики, хелатообразователи, такие как ЭДТА или глутатион, адъюванты (например, гидроксид алюминия), растворенные вещества, которые делают композицию изотонической, гипотонической или слегка гипертонической относительно крови реципиента, суспендирующие агенты, загущающие агенты и/или консерванты. Альтернативно, композиции данного изобретения могут быть приготовлены в виде лиофилизата. Соединения могут быть также инкапсулированы в липосомах с использованием хорошо известной технологии.
Любой из многочисленных иммуностимуляторов может быть использован в вакцинах данного изобретения. Например, может быть включен адъювант. Большинство адъювантов содержат вещество, предназначенное для защиты антигена от быстрого катаболизма, такое как гидроксид алюминия или минеральное масло, и стимулятор иммунных ответов, такой как липид А, происходящие от Bortadella pertussis или Mycobacterium tuberculosis белки. Подходящие адъюванты являются коммерчески доступными, например, такие как неполный адъювант Фрейнда и полный адъювант Фрейнда (Difco Laboratories, Detroit, MI); адъювант 65 Merck (Merck and Company, Inc., Rahway, NJ); AS-2 (SmithKline Beecham, Philadelphia, PA); соли алюминия, такие как гель гидроксида алюминия (квасцы) или фосфат алюминия; соли кальция, железа или цинка; нерастворимая суспензия ацилированного тирозина; ацилированные сахара; катионно или анионно дериватизованные полисахариды; полифосфазены; биодеградируемые микросферы; монофосфориллипид А и квил А. Цитокины, такие как GM-CSF или интерлейкин-2, -7 или -12, могут быть также использованы в качестве адъювантов.
В представленных в данном описании вакцинах, при выбранных обстоятельствах, может быть сконструирована адъювантная композиция для индукции иммунного ответа преимущественно типа Th1 или типа Th2. Высокие уровни цитокинов Th1-типа (например, IFN-γ, TNFα, IL-2 и IL-12) имеют тенденцию поддерживать индукцию клеточно-опосредованных иммунных ответов на введенный антиген. В противоположность данному, высокие уровни цитокинов TH2-типа (например, IL-4, IL-5, IL-6 и IL-10) имеют тенденцию поддерживать индукцию гуморальных иммунных ответов. После применения представленной в данном описании вакцины пациент будет поддерживать иммунный ответ, который включает ответные реакции Th1-типа и Th2-типа. В предпочтительном воплощении, в котором ответная реакция является преимущественно реакцией Th1-типа, уровень цитокинов Th1-типа будет увеличиваться до более высокой степени, чем уровень цитокинов TH2-типа. Уровни таких цитокинов могут быть легко оценены с использованием стандартных анализов. Обзор семейств цитокинов дается Mosmann and Coffman, Ann. Rev. Immunol. 7:145-173, 1989.
Предпочтительные адъюванты для применения в индукции преимущественно ответные реакции Th1-типа включают, например, комбинацию монофосфориллипида А, предпочтительно 3-де-О-активированного монофосфориллипида А (3D-MPL), вместе с солью алюминия. MPL-адъюванты доступны от Corixa Corporation (Seattle, WA; см. патенты США № 4436727; 4877611; 4866034 и 4912094). CpG-содержащие олигонуклеотиды (в которых CpG-динуклеотид является неметилированным) также индуцируют преимущественно ответную реакцию Th1-типа. Такие олигонуклеотиды хорошо известны и описаны, например, в WO 96/02555 и WO 99/33488. Иммуностимуляторные ДНК-последовательности описаны также, например, Sato et al., Science 273:352, 1996. Другим предпочтительным адъювантом является сапонин, предпочтительно QS21 (Aquila Biopharmaceuticals Inc., Framingham, MA), который может быть использован отдельно или в комбинации с другими адъювантами. Например, усиленная система включает комбинацию монофосфориллипида А и производного сапонина, например комбинацию QS21 и 3D-MPL, описанную в WO 94/00153, или менее реактогенную композицию, где QS21 гасят холестерином, как описано в WO 96/33739. Другие предпочтительные композиции содержат эмульсию типа масло в воде и токоферол. В WO 95/17210 описана особенно эффективная адъювантная композиция, содержащая QS21, 2D-MPL и токоферол в эмульсии типа масло в воде.
Другие предпочтительные адъюванты включают Монтанид ISA 720 (Seppic, France), SAF (Chiron, California, United States), ISCOMS (CSL), MF-59 (Chiron), SBAS-серию адъювантов (например, SBAS-2 или SBAS-4, доступные от SmithKline Beecham, Rixensart, Belgium), Detox (Corixa Corporation; Seattle, WA), RC-529 (Corixa Corporation; Seattle, WA) и другие аминоалкилглюкозаминид-4-фосфаты (AGP), такие как описано в ожидающих рассмотрения заявках на патент США № 08/85826 и № 09/074720, которые включены в данное описание в качестве ссылки во всей своей полноте.
Любая представленная в данном описании вакцина может быть приготовлена с использованием хорошо известных способов, которые приводят к комбинации антигена, иммуностимулятора и подходящего носителя или наполнителя. Описываемые композиции могут быть введены в виде части композиции пролонгированного действия (т.е. такой композиции, как капсула, тампон или гель (состоящий, например, из полисахаридов), которая осуществляет медленное высвобождение соединения после ее введения). Такие композиции могут быть обычно приготовлены с использованием хорошо известной технологии (см., например, Coombes et al., Vaccine 14:1429-1438, 1996) и введены, например, перорально, ректально или подкожной имплантацией или имплантацией в желаемом участке-мишени. Композиции пролонгированного действия могут содержать полипептид, полинуклеотид или антитело, диспергированные в матриксе-носителе и/или содержащиеся в резервуаре, окруженном регулирующей скорость высвобождения мембраной.
Носители для использования в таких композициях являются биосовместимыми и могут быть также биодеградируемыми; предпочтительно такая композиция обеспечивает относительно постоянный уровень высвобождения активного компонента. Такие носители включают микрочастицы сополимера поли(лактид-гликолида), а также полиакрилата, латекса, крахмала, целлюлозы и декстрана. Другие носители для пролонгированного высвобождения включают супрамолекулярные биовекторы, которые содержат не являющийся жидкостью гидрофильный кор (например, перекрестно сшитый полисахарид или олигосахарид) и, необязательно, наружный слой, содержащий амфифильное соединение, такое как фосфолипид (см., например, патент США 5151254 и заявки РСТ WO 94/20078, WO 94/23701 и WO 06/06638). Количество активного соединения, содержащегося в композиции пролонгированного высвобождения, зависит от места имплантации, скорости и ожидаемой продолжительности высвобождения и характера состояния, подлежащего лечению или предупреждению.
Любой из различных носителей доставки может быть использован в фармацевтических композициях и вакцинах для облегчения получения антиген-специфического иммунного ответа, которая поражает инфицированные Chlamydia клетки. Носители доставки включают антигенпрезентирующие клетки (АПК), такие как дендритные клетки, макрофаги, В-клетки, моноциты и другие клетки, которые могут быть сконструированы таким образом, что они являются эффективными АПК. Такие клетки могут быть, но необязательно, генетически модифицированы для увеличения емкости для представления антигена, для улучшения активации и/или поддержания Т-клеточной реакции, для обладания анти-Chlamydia-эффектами per se и/или для иммунологической совместимости с получателем (т.е. для приобретения совместимого HLA-гаплотипа). АПК могут быть обычно выделены из любых различных биологических жидкостей и органов и могут быть аутологичными, аллогенными, сингенными или ксеногенными клетками.
Некоторые предпочтительные воплощения данного изобретения используют дендритные клетки или их предшественники в качестве антигенпрезентирующих клеток. Дендритные клетки являются высокоэффективными АПК (Banchereau and Steinman, Nature 392:245-251, 1998) и, как было показано, являются эффективными в качестве физиологического адъюванта для индукции профилактического или терапевтического иммунитета (см. Timmerman and Levy, Ann. Rev. Med. 50:507-529, 1999). Обычно дендритные клетки могут быть идентифицированы на основе их типичной формы (звездчатой in situ, с заметными цитоплазматическими выступами (дендритами), видимыми in vitro), их способности поглощать, процессировать и представлять антигены с высокой эффективностью и их способности активировать реакции «наивных» Т-клеток. Дендритные клетки могут быть, конечно, сконструированы для экспрессии специфических рецепторов или лигандов клеточной поверхности, которые обычно не обнаруживаются на дендритных клетках in vivo или ex vivo, и такие модифицированные дендритные клетки рассматриваются данным изобретением. В качестве альтернативы дендритным клеткам в вакцине могут быть использованы секретируемые пузырьки нагруженных антигеном дендритных клеток (называемые экзосомами) (см. Zitvogel et al., Nature Med. 4:594-600, 1998).
Дендритные клетки и клетки-предшественники могут быть получены из периферической крови, костного мозга, лимфатических узлов, селезенки, кожи, пуповинной крови или любой другой подходящей ткани или жидкости. Например, дендритные клетки могут быть дифференцированы ex vivo добавлением комбинации цитокинов, таких как GM-CSF, IL-4, IL-13 и/или TNFα, к культуре моноцитов, собранных из периферической крови. Альтернативно, CD34 позитивные клетки, собранные из периферической крови, пуповинной крови или костного мозга, могут быть дифференцированы в дендритные клетки добавлением к культуральной среде комбинаций GM-CSF, IL-3, TNFα, CD40-лиганда, LPS, flt3-лиганда и/или другого соединения (других соединений), которые индуцируют дифференцировку, созревание и пролиферацию дендритных клеток.
Дендритные клетки для удобства подразделяют на категории «незрелых» и «зрелых» клеток, что позволяет легко различать между двумя хорошо охарактеризованными фенотипами. Однако данная номенклатура не должна рассматриваться как исключающая все возможные промежуточные стадии дифференцировки. Незрелые дендритные клетки характеризуются как АПК с высокой емкостью для поглощения и процессинга антигенов, которая коррелирует с высокой экспрессией Fcγ-рецептора и рецептора маннозы. Зрелый фенотип обычно характеризуется более низкой экспрессией таких маркеров, но высокой экспрессией молекул клеточной поверхности, ответственных за активацию Т-клеток, таких как МНС класса I и класса II, молекулы адгезии (например, CD54 и CD11) и костимуляторных молекул (например, CD40, CD80, CD86 и 4-1ВВ).
АПК могут быть обычно трансфицированы полинуклеотидом, кодирующим белок Chlamydia (или его часть или другой вариант), так что хламидийный полипептид или его иммуногенная часть экспрессируется на клеточной поверхности. Такая трансфекция имеет место ex vivo, и затем композиция или вакцина, содержащая такие трансфицированные клетки, может быть использована для терапевтических целей, как описано в данном описании. Альтернативно, носитель доставки гена, который нацеливает дендритную или другую антигенпрезентирующую клетку, может быть введен пациенту, что приводит к трансфекции, которая имеет место in vivo. Например, трансфекция in vivo и ex vivo дендритных клеток может быть обычно выполнена с использованием любых способов, известных в данной области, например, описанных в WO 97/24447, или с использованием метода генной пушки, описанного Mahvi et al., Immunology and Cell Biology 75:456-460, 1997. Нагрузка антигеном дендритных клеток может быть достигнута инкубированием дендритных клеток или клеток-предшественников с полипептидом Chlamydia, ДНК («голой» или в плазмидном векторе) или РНК; или с экспрессирующими антиген рекомбинантной бактерией или вирусами (например, векторами вируса коровьей оспы, вируса оспы (дифтерита) птиц, аденовируса или лентивируса). Перед нагрузкой полипептид может быть ковалентно конъюгирован с иммунологическим партнером, который обеспечивает помощь Т-клеткам (например, молекулу-носитель). Альтернативно, дендритные клетки могут быть кратковременно обработаны неконъюгированным иммунологическим партнером, отдельно или в присутствии полипептида.
Пути и частота введения фармацевтических композиций и вакцин, а также доза будут варьироваться от индивидуума к индивидууму. Обычно фармацевтические композиции и вакцины могут быть введены инъекцией (например, внутрикожной, внутримышечной, внутривенной или подкожной), через нос (например, аспирацией) или перорально. 1-3 Дозы могут быть введены в течение 1-36-недельного периода времени. Предпочтительно вводят 3 дозы с интервалами 3-4 месяца, а затем могут периодически производиться бустер-вакцинации. Другие протоколы могут быть подходящими для отдельных пациентов. Подходящей дозой является количество полипептида или ДНК, которое при введении, описанном выше, способно вызывать иммунный ответ у иммунизированного пациента, достаточный для защиты пациента от хламидийной инфекции в течение, по меньшей мере, 1-2 лет. Обычно количество полипептида, присутствующего в дозе (или продуцируемого in situ ДНК, присутствующей в дозе), находится в диапазоне от приблизительно 1 пг до приблизительно 100 мг на кг массы хозяина, обычно от приблизительно 10 пг до приблизительно 1 мг и предпочтительно от приблизительно 100 пг до приблизительно 1 мкг. Подходящие размеры дозы будут варьироваться в зависимости от размера пациента, но обычно будут находиться в диапазоне от приблизительно 0,1 мл до приблизительно 5 мл.
Хотя любой подходящий носитель, известный среднему специалисту в данной области, может быть использован в фармацевтических композициях данного изобретения, тип носителя будет варьироваться в зависимости от способа введения. Для парентерального введения, например подкожной инъекции, носитель предпочтительно содержит воду, солевой раствор, спирт, жир, воск или буфер. Для перорального введения могут быть использованы любой из указанных выше носителей или твердый носитель, такой как маннит, лактоза, крахмал, стеарат магния, натрий-сахарин, тальк, целлюлоза, глюкоза, сахароза и карбонат магния. Биодеградируемые микросферы (например, полилактид-галактид) могут быть также использованы в качестве носителей для фармацевтических композиций данного изобретения. Подходящие биодеградируемые микросферы описаны, например, в патентах США №№ 4897268 и 5075109.
Обычно подходящая доза и схема лечения обеспечивает активное соединение (активные соединения) в количестве, достаточном для получения терапевтической и/или профилактической пользы. Такая ответная реакция может быть подвергнута мониторингу посредством установления улучшенного клинического результата у проходящих курс лечения пациентов в сравнении с не получающими лечения пациентами. Усиления предсуществующих иммунных ответов на хламидийный белок обычно коррелируют с улучшенным клиническим результатом. Такие иммунные ответы могут быть обычно оценены с использованием стандартных анализов пролиферации, цитотоксичности или цитокинов, которые могут выполняться с использованием проб, полученных от пациента до и после лечения.
В другом аспекте данное изобретение относится к способам применения описанных выше полипептидов для диагностики хламидийной инфекции. В данном аспекте представлены способы обнаружения хламидийной инфекции в биологическом образце с использованием одного или нескольких полипептидов, по отдельности или в комбинации. Для ясности, термин «полипептид» будет использоваться при описании конкретных воплощений диагностических способов данного изобретения. Однако специалисту в данной области должно быть ясно, что слитые белки данного изобретения также могут быть использованы в подобных способах.
Используемый в данном описании термин «биологический образец» означает содержащую антитело пробу, взятую у пациента. Предпочтительно пробой является цельная кровь, мокрота, сыворотка, плазма, слюна, цереброспинальная жидкость или моча. Более предпочтительно данной пробой является проба крови, сыворотки или плазмы, полученная от пациента. Полипептиды используют в анализе, как описано ниже, для определения присутствия или отсутствия антител к полипептиду (полипептидам) в пробе, относительно предварительно заданной предельной величины (величины «отсечения»). Присутствие таких антител указывает на прежнюю сенсибилизацию к антигенам Chlamydia, которая может свидетельствовать об инфекции Chlamydia.
В воплощениях, в которых используют более чем один полипептид, используемые полипептиды являются предпочтительно комплементарными (дополняющими) (т.е. один компонент-полипептид будет склонен к обнаружению инфекции в пробах, где данная инфекция не могла бы быть обнаружена другим компонентом-полипептидом). Комплементарные (дополняющие) полипептиды могут быть обычно идентифицированы с использованием каждого полипептида индивидуально для оценки проб сыворотки, полученных от ряда пациентов, о которых известно, что они инфицированы Chlamydia. После определения, какие пробы тестируются положительно (как описано ниже) каждым полипептидом, могут быть приготовлены комбинации двух или более полипептидов, которые способны определять инфекцию в большинстве или во всех тестируемых пробах.
Среднему специалисту в данной области известны различные форматы анализов для применения одного или нескольких полипептидов для обнаружения антител в пробе. См., например, руководство Harlow and Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory, 1988, включенное в данное описание в качестве ссылки. В предпочтительном воплощении анализ включает применение полипептида, иммобилизованного на твердом носителе, для связывания с антителом в пробе и удаления антитела из пробы. Затем связанное антитело может быть определено с использованием детектирующего реагента, который содержит репортерную группу. Подходящие детектирующие реагенты включают антитела, которые связываются с комплексом антитело/полипептид, и свободный полипептид, меченный репортерной группой (например, в полуконкурентном анализе). Альтернативно, может быть использован конкурентный анализ, в котором антитело, которое связывается с данным полипептидом, метят репортерной группой и дают ему связываться с иммобилизованным антигеном после инкубирования данного антигена с пробой. Степень, до которой компоненты пробы ингибируют связывание меченого антитела с полипептидом, является показателем реактивности данной пробы с иммобилизованным полипептидом.
Твердым носителем может быть любой твердый материал, известный среднему специалисту в данной области, к которому может быть присоединен данный антиген. Например, твердым носителем может быть тест-лунка в микротитрационном планшете или нитроцеллюлозная или другая подходящая мембрана. Альтернативно, данный носитель может быть гранулой или диском, например, из стекла, стекловолокна, латекса или пластического материала, такого как полистирол или поливинилхлорид. Носителем может также быть магнитная частица или оптоволоконный сенсор, такой как сенсоры, описанные, например, в патенте США № 5359681.
Полипептиды могут быть связаны с твердым носителем с использованием различных способов, известных среднему специалисту в данной области. В контексте данного изобретения термин «связанный» относится как к нековалентной связи, такой как адсорбция, так и ковалентному присоединению (которое может быть прямой связью между антигеном и функциональными группами на носителе или может быть связью посредством сшивающего агента). Предпочтительным является связывание путем адсорбции с использованием лунки микротитрационного планшета или мембраны. В таких случаях адсорбция может быть достигнута контактированием полипептида, в подходящем буфере, с твердым носителем в течение достаточного периода времени. Время контакта варьируется в зависимости от температуры, но обычно находится между приблизительно 1 часом и 1 днем. Обычно контактирование лунки пластикового микротитрационного планшета (например, из полистирола или поливинилхлорида) с количеством полипептида от приблизительно 10 нг до приблизительно 1 мкг и предпочтительно около 100 нг является достаточным для связывания адекватного количества антигена.
Ковалентное присоединение полипептида к твердому носителю может быть обычно достигнуто сначала взаимодействием носителя с бифункциональным реагентом, который будет реагировать как с носителем, так и с функциональной группой, такой как гидроксил или аминогруппа, на полипептиде. Например, полипептид может быть связан с носителями, имеющими подходящее полимерное покрытие, с использованием бензохинона или конденсацией альдегидной группы на носителе с амином или активным водородом на полипептиде (см., например, Pierce Immunotechnology Catalog and Handbook, 1991, A12-A13).
В некоторых воплощениях данный анализ является твердофазным иммуноферментным анализом (ELISA). Такой анализ может быть выполнен сначала контактированием полипептидного антигена, который был иммобилизован на твердом носителе, обычно лунке микротитрационного планшета, с пробой, так что антителам к данному полипептиду в пробе дают связываться с иммобилизованным полипептидом. Затем несвязанную пробу удаляют из иммобилизованного полипептида и дабавляли детектирующий реагент, способный связываться с иммобилизованным комплексом антитело/полипептид. Затем количество детектирующего реагента, которое остается связанным с твердым носителем, определяют с использованием способа, пригодного для данного конкретного детектирующего реагента.
Более конкретно, после иммобилизации полипептида на носителе, как описано выше, оставшиеся белоксвязывающие сайты на носителе обычно блокируют. Может быть использован любой подходящий блокирующий агент, известный среднему специалисту в данной области, например бычий сывороточный альбумин (БСА) или Твин 20™ (Sigma Chemical Co., St. Louis, MO). Затем иммобилизованный полипептид инкубируют с пробой и антителу дают связаться с антигеном. Проба может быть разведена подходящим разбавителем, таким как забуференный фосфатом солевой раствор (PBS) перед инкубированием. Обычно подходящим временем контакта (т.е. временем инкубирования) является период времени, который является достаточным для определения присутствия антитела в HGE-инфицированной пробе. Предпочтительно, данное время контакта является достаточным для достижения уровня связывания, которое составляет, по меньшей мере, 95% связывания, достигаемого при равновесии между связанным и несвязанным антителом. Среднему специалисту в данной области будет очевидно, что время, необходимое для достижения равновесия, может быть легко определено анализом уровня связывания, которое происходит на протяжении некоторого периода времени. При комнатной температуре обычно является достаточным период времени приблизительно 30 минут.
Затем несвязанная проба может быть удалена промыванием твердого носителя подходящим буфером, таким как PBS, содержащий 0,1% Твин 20™. Затем к твердому носителю может быть добавлен детектирующий реагент. Подходящим детектирующим реагентом является любое соединение, которое связывается с иммобилизованным комплексом антитело-полипептид и которое может быть определено любым из способов, известных в данной области. Предпочтительно, детектирующий реагент содержит связывающий агент (такой как, например, Белок А, Белок G, иммуноглобулин, лектин или свободный антиген), конъюгированный с репортерной группой. Предпочтительные репортерные группы включают ферменты (например, пероксидазу хрена), субстраты, кофакторы, ингибиторы, красители, радионуклиды, люминесцентные группы, флуоресцентные группы и биотин. Конъюгация связывающего агента с репортерной группой может быть достигнута с использованием стандартных способов, известных среднему специалисту в данной области. Обычные связывающие агенты могут быть приобретены уже в конъюгированном виде с различными репортерными группами из многих коммерческих источников (например, Zymed Laboratories, San Francisco, CA и Pierce, Rockford, IL).
Затем детектирующий реагент инкубируют с иммобилизованным комплексом антитело-полипептид в течение периода времени, достаточного для определения связанного антитела. Подходящий период времени может быть обычно определен из инструкций изготовителя или анализом уровня связывания, который происходит на протяжении некоторого периода времени. Затем несвязанный детектирующий реагент удаляют, а связанный детектирующий реагент определяют с использованием репортерной группы. Способ, применяемый для определения репортерной группы, зависит от характера данной репортерной группы. Для радиоактивных групп обычно пригодны сцинтилляционный счет или авторадиографические способы. Спектроскопические способы могут быть использованы для определения красителей, люминесцентных групп и флуоресцентных групп. Биотин может быть определен с использованием авидина, связанного с отличающейся репортерной группой (обычно с радиоактивной или флуоресцентной группой или с ферментом). Ферментные репортерные группы могут быть обычно определены добавлением субстрата (обычно в течение конкретного периода времени), с последующим спектроскопическим или иным анализом продуктов реакции.
Для определения присутствия или отсутствия антител против Chlamydia в пробе сигнал, определяемый из репортерной группы, которая остается связанной с твердым носителем, обычно сравнивают с сигналом, который соответствует заданной предельной величине. В одном предпочтительном воплощении предельной величиной является нормальный средний сигнал, полученный при инкубировании иммобилизованного антигена с пробами от неинфицированного пациента. Обычно пробу, генерирующую сигнал, который на три стандартных отклонения выше заранее определенной предельной величины, считают положительной в отношении инфекции Chlamydia. В другом предпочтительном воплощении предельную величину определяют с использованием кривой, называемой Receiver Operator Curve в соответствии со способом Sackett et al., Clinical Epidemiology: A Basic Science for Clinical Medicine, Little Brown and Co., 1985, pp. 106-107. Короче, в данном воплощении предельная величина может быть определена из графика пар истинноположительных уровней (т.е. чувствительности) и ложноположительных уровней (100%-специфичность), которые соответствуют каждой возможной предельной величине для результата диагностического теста. Предельная величина на данном графике, которая является самой близкой к верхнему левому углу (т.е. величина, которая включает в себя наибольшую площадь), является наиболее точной предельной величиной, и проба, генерирующая сигнал, который является более высоким, чем данная предельная величина, определенная таким способом, может считаться положительной. Альтернативно, предельная величина может быть сдвинута влево вдоль данного графика для минимизации ложноположительного уровня или вправо для минимизации ложноотрицательного уровня. Обычно пробу, генерирующую сигнал, который является более высоким, чем предельная величина, определенная таким способом, считают положительной в отношении хламидийной инфекции.
В родственном воплощении данный анализ выполняют в быстром проточном формате или тест-формате полоски (стрипа), где антиген иммобилизуют на мембране, такой как нитроцеллюлоза. В проточном тесте антитела в пробе связываются с иммобилизованным полипептидом при прохождении данной пробы через мембрану. Затем детектирующий реагент (например, Белок А-коллоидальное золото) связывается с комплексом антитело-полипептид при протекании раствора, содержащего детектирующий реагент, через данную мембрану. Затем определение связанного детектирующего реагента может быть выполнено, как описано выше. В тест-формате полоски (стрипа) один конец мембраны, с которой связан полипептид, погружают в раствор, содержащий пробу. Проба мигрирует вдоль мембраны через участок, содержащий детектирующий реагент, и в зону иммобилизованного полипептида. Концентрация детектирующего реагента в участке полипептида указывает присутствие антител против Chlamydia в данной пробе. Обычно концентрация детектирующего реагента на данном участке генерирует такую картину, как линия, которая может наблюдаться визуально. Отсутствие такой картины указывает на отрицательный результат. Обычно количество полипептида, иммобилизованного на мембране, выбирают таким образом, чтобы была генерирована визуально различимая картина, когда биологический образец содержит уровень антител, который был бы достаточным для генерирования положительного сигнала в ELISA, как обсуждалось выше. Предпочтительно, количество полипептида, иммобилизованного на мембране, находится в диапазоне от приблизительно 25 нг до приблизительно 1 мкг и более предпочтительно, от приблизительно 50 нг до приблизительно 500 нг. Такие тесты обычно проводят с очень малым количеством (например, одна капля) сыворотки или крови пациента.
Конечно, существуют многочисленные другие протоколы анализов, которые являются пригодными для применения с полипептидами данного изобретения. Приведенные выше описания являются только примерами. Одним примером альтернативного протокола анализа, который может быть успешно применен в таких способах, является Вестерн-блот, где белки, присутствующие в биологическом образце, разделяют на геле перед действием связывающего агента. Такие способы хорошо известны специалистам в данной области.
Данное изобретение относится также к агентам, таким как антитела и их антигенсвязывающие фрагменты, которые специфически связываются с хламидийным белком. При использовании в данном описании считется, что антитело или его антигенсвязывающий фрагмент «специфически связываются» с хламидийным белком, если они реагируют на определяемом уровне (например, в ELISA) с хламидийным белком и не реагируют определяемо с неродственными белками в аналогичных условиях. Используемый в данном описании термин «связывание» означает нековалентную связь между двумя отдельными молекулами, которая приводит к образованию комплекса. Способность связываться может оцениваться, например, определением константы связывания для образования комплекса. Константа связывания является величиной, получаемой при делении концентрации комплекса на произведение концентраций компонентов. Обычно считают, что два компонента «связываются», в контексте данного изобретения, когда константа связывания для образования комплекса превышает приблизительно 103 л/моль. Константа связывания может быть определена с использованием способов, хорошо известных в данной области.
Связывающие агенты могут обладать способностью различать пациентов с инфекцией Chlamydia и без инфекции Chlamydia, используя представленные в данном описании репрезентативные анализы. Другими словами, антитела или другие связывающие агенты, которые связываются с хламидийным белком, должны генерировать сигнал, указывающий на присутствие хламидийной инфекции, по меньшей мере, приблизительно у 20% пациентов с данным заболеванием, и должны генерировать отрицательный сигнал, указывающий на отсутствие данного заболевания, по меньшей мере, приблизительно у 90% индивидуумов без инфекции. Для определения, удовлетворяет ли связывающий агент данному требованию, биологические образцы (например, кровь, сыворотка, мокрота, моча и/или тканевые биопсии) могут быть подвергнуты анализу, как описано в данном описании, на присутствие полипептидов, которые связываются с данным агентом. Должно быть понятно, что анализу должно быть подвергнуто статистически значимое число проб с заболеванием и без заболевания. Каждый связывающий агент должен удовлетворять приведенным выше критериям; однако среднему специалисту в данной области будет очевидно, что связывающие агенты могут использоваться в комбинации для улучшения чувствительности.
Любой агент, который удовлетворяет приведенным выше требованиям, может быть связывающим агентом. Например, связывающим агентом может быть рибосома, с пептидным компонентом или без пептидного компонента, молекула РНК или полипептид. В предпочтительном воплощении связывающий агент является антителом или его антигенсвязывающим фрагментом. Антитела могут быть получены любым из различных способов, известных среднему специалисту в данной области. См., например, Harlow and Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory, 1988. Обычно антитела могут быть получены способами культуры клеток, включающими генерирование моноклональных антител, как описано в данном описании, или через трансфекцию генов антител в подходящие бактериальные клетки-хозяева или клетки-хозяева млекопитающих для продуцирования рекомбинантных антител. В одном способе иммуноген, содержащий данный полипептид, сначала инъецируют любому из широкого круга млекопитающих (например, мышей, крыс, кроликов, овец или коз). На данной стадии полипептиды данного изобретения могут служить в качестве иммуногена без модификации. Альтернативно, в частности для относительно коротких полипептидов, превосходящий иммунный ответ может быть индуцирован, если данный полипептид соединяют с белком-носителем, таким как бычий сывороточный альбумин или гемоцианин фиссуреллы. Иммуноген инъецируют животному-хозяину, предпочтительно в соответствии с заданной схемой применения, включающей одну или несколько бустер-иммунизаций, и у животных периодически берут кровь. Поликлональные антитела, специфические для данного полипептида, могут быть затем очищены из данных антисывороток, например, аффинной хроматографией с использованием данного полипептида, связанного с подходящим твердым носителем.
Моноклональные антитела, специфические для представляющего интерес антигенного полипептида, могут быть получены, например, с использованием способа Kohler and Milstein, Eur. J. Immunol. 6:511-519, 1976 и усовершенствований к нему. Короче, данные способы включают получение иммортализованных клеточных линий, способных продуцировать антитела, имеющие желаемую специфичность (т.е. реактивность с представляющим интерес полипептидом). Такие клеточные линии могут быть получены, например, из клеток селезенки, полученных от животного, иммунизированного, как описано выше. Затем клетки селезенки иммортализуют, например, слиянием с миеломными клетками в качестве партнера слияния, который предпочтительно является сингенным с иммунизированным животным. Могут быть использованы различные способы слияния. Например, клетки селезенки и клетки миеломы могут быть объединены с неионогенным детергентом в течение нескольких минут и затем высеяны при низкой плотности на селективную среду, которая поддерживает рост гибридных клеток, но не клеток миеломы. Предпочтительный селективный способ использует отбор с использованием НАТ (гипоксантин, аминоптерин, тимидин). После достаточного времени, обычно около 1-2 недель, наблюдают колонии гибридов. Одиночные колонии отбирают и их культуральные супернатанты тестируют на активность связывания против данного полипептида. Гибридомы, имеющие высокую реактивность и специфичность, являются предпочтительными.
Моноклональные антитела могут быть выделены из супернатантов растущих гибридомных колоний. Кроме того, могут быть использованы разнообразные способы для увеличения выхода, такие как инъекция гибридомной клеточной линии в брюшную полость подходящего позвоночного хозяина, например мыши. Затем моноклональные антитела могут быть собраны из асцитной жидкости или крови. Загрязнения могут быть удалены из данных антител общепринятыми способами, такими как хроматография, осаждение и экстракция. Полипептиды данного изобретения могут быть использованы в процессе очистки, например, на стадии аффинной хроматографии.
В некоторых воплощениях может быть предпочтительным использование антигенсвязывающих фрагментов антител. Такие фрагменты включают Fab-фрагменты, которые могут быть получены с использованием стандартных способов. Короче, иммуноглобулины могут быть очищены из сыворотки кролика аффинной хроматографией на колонке с гранулами с Белком А (Harlow and Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory, 1988) и расщеплены папаином с получением Fab- и Fc-фрагментов. Fab- и Fc-фрагменты могут быть разделены аффинной хроматографией на колонке с гранулами с Белком А.
Моноклональные антитела данного изобретения могут быть связаны с одним или несколькими терапевтическими агентами. Подходящие в данном отношении агенты включают радионуклиды, индукторы дифференцировки, лекарственные средства, токсины и их производные. Предпочтительные радионуклиды включают 90Y, 123I, 125I, 131I, 186Re, 188Re, 211At и 212Bi. Предпочтительные лекарственные средства включают метотрексат и аналоги пиримидина и пурина. Предпочтительные индукторы дифференцировки включают форболовые сложные эфиры и масляную кислоту. Предпочтительные токсины включают рицин, абрин, дифтерийный токсин, холерный токсин, гелонин, экзотоксин Pseudomonas, токсин Shigellа и антивирусный белок фитолакки американской.
Терапевтический агент может быть связан (например, ковалентной связью) с подходящим моноклональным антителом либо непосредственно, либо опосредованно (например, через линкерную группу). Прямая реакция между агентом и антителом возможна, когда каждый из компонентов имеет заместитель, способный реагировать с заместителем другого компонента. Например, нуклеофильная группа, такая как амино или сульфгидрильная группа, на одном, может быть способна реагировать с карбонилсодержащей группой, такой как ангидрид или галогенангидрид, или с алкильной группой, содержащей хорошо удаляемую (уходящую) группу (например, галогенид), на другом.
Альтернативно, может быть желательным связывание терапевтического агента и антитела через линкерную группу. Линкерная группа может функционировать в качестве спейсера для дистанцирования антитела от агента во избежание помех для связывающих способностей. Линкерная группа может также служить для увеличения химической реактивности заместителя на агенте или на антителе и, следовательно, для увеличения эффективности связывания. Увеличение химической реакционной способности может также облегчать использование агентов или функциональных групп на агентах, которое в противном случае не было бы возможным.
Специалистам в данной области будет очевидно, что в качестве линкерной группы могут быть использованы разнообразные бифункциональные или полифункциональные реагенты, как гомо-, так и гетерофункциональные (такие как описанные в каталоге Pierce Chemical Co., Rockford, IL). Связывание может быть выполнено, например, через аминогруппы, карбоксильные группы, сульфгидрильные группы или окисленные углеводные остатки. Имеются многочисленные ссылки, описывающие подобную методологию, например патент США № 4671958, выданный Rodwell et al.
Если терапевтический агент является более эффективным, когда он не содержит принадлежащую антителу часть иммуноконъюгатов данного изобретения, может быть желательным применение линкерной группы, которая является расщепляемой во время или после интернализации в клетку. Описан ряд различных расщепляемых линкерных групп. Механизмы внутриклеточного освобождения агента от таких линкерных групп включают расщепление восстановлением дисульфидной связи (например, патент США № 4489710, выданный Spitler), облучением фотолабильной связи (например, патент США № 4625014, выданный Sentler et al.), гидролизом дериватизованных аминокислотных боковых цепей (например, патент США № 4638045, выданный Kohn et al.), опосредованным сывороточным комплементом гидролизом (например, патент США № 4671958, выданный Rodwell et al.) и катализируемым кислотой гидролизом (например, патент США № 4569789, выданный Blattler et al.).
Может быть желательным связывание более чем одного агента с антителом. В одном воплощении с одной молекулой антитела связывают множественные молекулы агента. В другом воплощении с одним антителом может быть связан более чем один тип агента. Независимо от конкретного варианта, иммуноконъюгаты с более чем одним агентом могут быть связаны непосредственно с молекулой антитела или с линкерами, которые обеспечивают множественные сайты для присоединения. Альтернативно, может быть использован носитель.
Носитель может нести агенты различными путями, в том числе ковалентным связыванием либо непосредственно, либо через линкерную связь. Подходящие носители включают белки, такие как альбумины (например, патент США № 4507234, выданный Kato et al.), пептиды и полисахариды, такие как аминодекстран (например, патент США № 4699784, выданный Shih et al.). Носитель может также нести агент нековалентным связыванием или посредством инкапсулирования, например, в липосомном пузырьке (везикуле) (например, патенты США №№ 4429008 и 4873088). Носители, специфические в отношении радионуклидных агентов, включают малые радиогалогенированные молекулы и хелатирующие соединения. Например, в патенте США № 4735792 описаны репрезентативные радиогалогенированные малые молекулы и их синтез. Радионуклидный хелат может быть образован из хелатирующих соединений, которые включают соединения, содержащие атомы азота и серы в качестве донорных атомов для связывания радионуклида металла или оксида металла. Например, в патенте США № 4673562, выданном Davison et al., описаны репрезентативные хелатирующие соединения и их синтез.
Могут быть использованы различные способы введения для антител и иммуноконъюгатов. Обычно введение будет внутривенным, внутримышечным, подкожным или введением в сайт-специфические участки подходящими способами. Очевидно, что точная доза антитела/иммуноконъюгата будет варьироваться в зависимости от используемого антитела, плотности антигена и скорости клиренса антитела.
Антитела могут быть использованы в диагностических тестах для определения присутствия антигенов Chlamydia с использованием анализов, подобных описанным подробно выше, и других способов, хорошо известных специалистам в данной области, что обеспечивает способ обнаружения инфекции Chlamydia у пациента.
Диагностические реагенты данного изобретения могут также содержать ДНК-последовательности, кодирующие один или несколько указанных выше полипептидов, или одну или несколько их частей. Например, по меньшей мере, два олигонуклеотидных праймера могут применяться в анализе на основе полимеразной цепной реакции (ПЦР) для амплификации Chlamydia-специфической кДНК из биологического образца, где, по меньшей мере, один из данных олигонуклеотидных праймеров является специфическим для молекулы ДНК, кодирующей полипептид данного изобретения. Затем присутствие амплифицированной кДНК определяют с использованием способов, хорошо известных в данной области, таких как гель-электрофорез. Подобным образом, олигонуклеотидные зонды, специфические для молекулы ДНК, кодирующей полипептид данного изобретения, могут быть использованы в гибридизационном анализе для обнаружения присутствия полипептида данного изобретения в биологическом образце.
Используемый в данном описании термин «олигонуклеотидный праймер/зонд, специфический для молекулы ДНК» означает олигонуклеотидную последовательность, которая имеет, по меньшей мере, приблизительно 80%, предпочтительно, по меньшей мере, приблизительно 90% и более предпочтительно, по меньшей мере, приблизительно 95% идентичность относительно рассматриваемой молекулы ДНК. Олигонуклеотидные праймеры и/или зонды, которые могут быть с пользой применены в диагностических способах данного изобретения, предпочтительно имеют приблизительно 10-40 нуклеотидов. В предпочтительном воплощении данные олигонуклеотидные праймеры содержат, по меньшей мере, приблизительно 10 смежных нуклеотидов молекулы ДНК, кодирующей один из описываемых полипептидов. Предпочтительно, олигонуклеотидные зонды для применения в диагностических способах данного изобретения содержат, по меньшей мере, приблизительно 15 смежных олигонуклеотидов молекулы ДНК, кодирующей один из описываемых полипептидов. Способы как для анализов на основе ПЦР, так и гибридизационных анализов хорошо известны в данной области (см., например, Mullis et al., Ibid; Ehrlich, Ibid.). Таким образом, праймеры или зонды могут быть использованы для обнаружения Chlamydia-специфических последовательностей в биологических образцах. ДНК-зонды или праймеры, содержащие описываемые олигонуклеотидные последовательности, могут быть использованы отдельно или в комбинации друг с другом.
Нижеследующие примеры приведены в качестве иллюстрации, а не для ограничения данного изобретения.
ПРИМЕР 1
ВЫДЕЛЕНИЕ ДНК-ПОСЛЕДОВАТЕЛЬНОСТЕЙ, КОДИРУЮЩИХ АНТИГЕНЫ CHLAMIDIA
Антигены Chlamydia данного изобретения выделяли экспрессионным клонированием библиотеки геномной ДНК Chlamydia trachomatis LGV II по существу, как описано Sanderson et al., (J. Exp. Med., 1995, 182:1751-1757), и было показано, что они индуцируют пролиферацию РМВС и продуцирование IFN-γ в иммунореактивной Т-клеточной линии.
Chlamydia-специфическую Т-клеточную линию генерировали стимуляцией РВМС от нормального донора без истории хламидийной инфекции половых путей элементарными тельцами Chlamydia trachomatis LGV II. Было найдено, что данная Т-клеточная линия, названная TCL-8, распознавала инфицированные как Chlamydia trachomatis, так и Chlamydia pneumoniae полученные из моноцитов дендритные клетки.
Случайно фрагментированную геномную библиотеку Chlamydia trachomatis LGV II конструировали в Lambda ZAP (Stratagene, La Jolla, CA) и данную амплифицированную библиотеку высевали в 96-луночные микротитрационные планшеты при плотности 30 клонов на лунку. Бактерии индуцировали для экспрессии рекомбинантного белка в присутствии 2 мМ IPTG в течение 3 часов, затем осаждали и ресуспендировали в 200 мкл RPMI с 10% ФТС. 10 мкл индуцированной бактериальной суспензии переносили в 96-луночные планшеты, содержащие аутологичные происходящие из моноцитов дендритные клетки. После 2 часов инкубации дендритные клетки промывали для удаления свободной E. coli и добавляли Chlamydia-специфические Т-клетки. Положительные пулы E. coli идентифицировали определением продуцирования IFN-γ и пролиферации Т-клеток в ответ на данные пулы.
Были идентифицированы четыре положительных клона, которые разбивали с получением четырех чистых клонов (названных 1-В1-66, 4-D7-28, 3-G3-10 и 10-C10-31) с размерами инсертов 481 п.н., 183 п.н., 110 п.н. и 1400 п.н., соответственно. Определенные ДНК-последовательности для 1-В1-66, 4-D7-28, 3-G3-10 и 10-C10-31 представлены в SEQ ID NO:1-4, соответственно. Клон 1-В1-66 находится приблизительно в области 53690 генома C. trachomatis (база данных C. trachomatis NCBI). В клоне 1-В1-66 была идентифицирована открытая рамка считывания (ORF) (нуклеотиды 115-375), которая кодирует ранее идентифицированный белок 9 кДа (Stephens, et al., GenBank Accession No. AE001320), последовательность которого представлена в SEQ ID NO:5. Клон 4-D7-28 является меньшей областью той же самой ORF (аминокислоты 22-82 1-В1-66). Клон 3-G3-10 находится приблизительно в области 74559 генома C. trachomatis. Данный инсерт клонирован в антисмысловой ориентации относительно его ориентации в геноме. Клон 10-С10-31 содержит открытую рамку считывания, которая соответствует ранее опубликованной последовательности для рибосомного белка S13 из Chlamydia trachomatis (Gu, L. et al., J. Bacteriology, 177:2594-2601, 1995). Предсказанные белковые последовательности для 4-D7-28 и 10-С10-31 представлены в SEQ ID NO:6 и 12, соответственно. Предсказанные белковые последовательности для 3-G3-10 представлены в SEQ ID NO:7-11.
В родственной серии исследований с использованием скрининга дополнительную Т-клеточную линию использовали для скрининга библиотеки геномной ДНК Chlamydia trachomatis LGV II, описанной выше. Chlamydia-специфическую Т-клеточную линию (ТСТ-1) получали от пациента с хламидийной инфекцией половых путей стимуляцией РВМС пациента аутологичными происходящими из моноцитов дендритными клетками, инфицированными элементарными тельцами Chlamydia trachomatis LGV II. Один клон, 4С9-18 (SEQ ID NO:21), содержащий инсерт 1256 п.н., индуцировал специфический иммунный ответ, как измерено стандартными анализами пролиферации, из Chlamydia-специфической Т-клеточной линии ТСТ-1. Последующий анализ выявил, что данный клон содержит три известные последовательности: липоамиддегидрогеназы (GenBank Accession No, AE001326), представленной в SEQ ID NO:22; гипотетического белка СТ429 (GenBank Accession No, AE001316), представленной в SEQ ID NO:23; и части открытой рамки считывания убихинонметилтрансферазы СТ428 (GenBank Accession No, AE001316), представленной в SEQ ID NO:24.
В дальнейших исследованиях с использованием клона 4С9-18 (SEQ ID NO:21) полноразмерную аминокислотную последовательность для липоамиддегидрогеназы (SEQ ID NO:22) из C. trachomatis (LGV II) экспрессировали в клоне CtL2-LPDA-FL, представленном в SEQ ID NO:90.
Для дополнительной характеристики открытую рамку считывания, содержащую стимулирующий Т-клетки эпитоп (эпитопы), кДНК-фрагмент, содержащий нуклеотиды 1-695 клона 4С9-18 с кДНК-последовательностью, кодирующей 6х-гистидиновую метку на амино-конце, субклонировали в сайт NdeI/EcoRI вектора pET17b (Novagen, Madison, WI), обозначили как клон 4С9-18#2 BL21 pLysS (SEQ ID NO:25, причем соответствующая аминокислотная последовательность приведена в SEQ ID NO:26), и трансформировали в E. coli. Селективная индукция трансформированной E. coli 2 мМ IPTG в течение трех часов привела к экспрессии белка 26 кДа из клона 4С9-18#2 BL21 pLysS, как показано стандартным гель-электрофорезом в ДСН-ПААГ с окрашиванием Кумасси. Для определения иммуногенности белка, кодируемого клоном 4С9-18#2 BL21 pLysS, E. coli, экспрессирующую белок 26 кДа, титровали на 1 х 104 полученные из моноцитов дендритные клетки и инкубировали в течение двух часов. Культуры дендритных клеток промывали и добавляли 2,5 х 104 Т-клеток (ТСТ-1) и давали им инкубироваться в течение дополнительных 72 часов и в данной точке уровень IFN-γ в культуральном супернатанте определяли при помощи ELISA. Как показано на фиг. 1, было обнаружено, что Т-клеточная линия ТСТ-1 отвечает на индуцированные культуры, как измерено по IFN-γ, что указывает на Chlamydia-специфическую ответную реакцию Т-клеток против последовательности липоамиддегидрогеназы. Подобным образом было показано, что белок, кодируемый клоном 4С9-18#2 BL21 pLysS, стимулирует Т-клеточную линию ТСТ-1 посредством стандартных анализов пролиферации.
Последующие исследования для идентификации дополнительных антигенов Chlamydia trachomatis с использованием вышеописанного способа клонирования с экспрессией CD4+ Т-клеток дали дополнительные клоны. Chlamydia-специфические Т-клеточные линии ТСТ-1 и ТСТ-8, а также Т-клеточную линию ТСР-21 использовали для скрининга геномной библиотеки Chlamydia trachomatis LGV II. Т-клеточная линия ТСР-21 была получена от пациента, имеющего гуморальный иммунный ответ на Chlamydia pneumoniae. Клеточная линия ТСТ-1 идентифицировала 37 положительных пулов, клеточная линия ТСТ-3 идентифицировала 41 положительный пул и клеточная линия ТСР-21 идентифицировала 2 положительных пула. Следующие клоны получали из 10 таких положительных пулов. Клон 11-А3-93 (SEQ ID NO:64), идентифицированный клеточной линией ТСР-21, является геномным фрагментом 1339 п.н., имеющим гомологию относительно надсемейства HAD (CT103). Второй инсерт в том же самом клоне имеет гомологию с геном fab I (CT104), присутствующим на комплементарной цепи. Клон 11-С12-91 (SEQ ID NO:63), идентифицированный с использованием клеточной линии ТСР-21, имеет инсерт 269 п.н., который является частью гена ОМР2 (СТ443) и имеет гомологию с богатым цистеином белком наружной мембраны C. pneumoniae 60 кДа.
Клон 11-G10-46 (SEQ ID NO:62), идентифицированный с использованием клеточной линии ТСТ-3, содержит инсерт 688 п.н., который имеет гомологию относительно гипотетического белка СТ610. Клон 11-G1-34, (SEQ ID NO:61), идентифицированный с использованием клеточной линии ТСТ-3, имеет две частичные открытые рамки считывания (ORF) с размером инсерта 1215 п.н. Одна ORF имеет гомологию с геном малатдегидрогеназы (СТ376), а другая ORF имеет гомологию с геном гликогенгидролазы (СТ042). Клон 11-Н3-68, (SEQ ID NO:60), идентифицированный с использованием клеточной линии ТСТ-3, имеет две ORF с общим размером инсерта 1180 п.н. Одна частичная ORF кодирует кодируемый плазмидой белок вирулентности PGP6-D, тогда как вторая ORF является полной ORF для рибосомного гена L1 (CT318). Клон 11-Н4-28, (SEQ ID NO:59), идентифицированный с использованием клеточной линии ТСТ-3, имеет размер инсерта 552 п.н. и является частью ORF для гена dnaK (СТ396). Клон 12-В3-95, (SEQ ID NO:58), идентифицированный с использованием клеточной линии ТСТ-1, имеет размер инсерта 463 п.н. и является частью ORF для гена липоамиддегидрогеназы (СТ557). Клоны 15-G1-89 и 12-В3-95 являются идентичными (SEQ ID NO: 55 и 58, соответственно), идентифицированы с использованием клеточной линии ТСТ-1, имеют размер инсерта 463 п.н. и являются частью ORF для гена липоамиддегидрогеназы (СТ557). Клон 12-G3-83, (SEQ ID NO:57), идентифицированный с использованием клеточной линии ТСТ-1, имеет размер инсерта 1537 п.н. и имеет часть ORF для гипотетического белка СТ622.
Клон 23-G7-68, (SEQ ID NO:79), идентифицированный с использованием клеточной линии ТСТ-3, содержит инсерт 950 п.н. и содержит небольшую часть ORF рибосомного белка L11, всю ORF для рибосомного белка L1 и часть ORF для рибосомного белка L10. Кроме того, данный клон идентифицировал также линии пациента СТ4, СТ5, СТ11, СТ12 и СНН037. Клон 22-F8-91, идентифицированный с использованием клеточной линии ТСТ-1, содержит инсерт 395 п.н., который содержит часть ORF pmpC на комплементарной цепи данного клона. Клон 21-E8-95, (SEQ ID NO: 81), идентифицированный с использованием клеточной линии ТСТ-3, содержит инсерт 2085 п.н., который содержит часть ORF СТ613, полную ORF для СТ612, полную ORF для СТ611 и часть ORF для СТ610. Клон 19-F12-57, (SEQ ID NO:82), идентифицированный с использованием клеточной линии ТСТ-3, содержит инсерт 405 п.н., который содержит часть ORF СТ 858 и небольшую часть ORF recA. Клон 19-F12-52, (SEQ ID NO:83), идентифицированный с использованием клеточной линии ТСТ-3, содержит инсерт 379 п.н., который является частью ORF для СТ455 п.н., кодирующей глутамил-тРНК-синтетазу. Клон 19-А5-54, (SEQ ID NO:84), идентифицированный с использованием клеточной линии ТСТ-3, содержит инсерт 715 п.н., который является частью ORF3 (комплементарной цепи данного клона) криптической плазмиды. Клон 17-Е11-72, (SEQ ID NO:85), идентифицированный с использованием клеточной линии ТСТ-1, содержит инсерт 476 п.н., который является частью ORF для Орр_2 и pmpD. Область pmpD данного клона покрывается областью pmpD клона 15-Н2-76. Клон 17-С1-77, (SEQ ID NO:86), идентифицированный с использованием клеточных линий пациента СТ3, СТ1, СТ4 и СТ12, содержит инсерт 1551 п.н., который является частью ORF СТ857, а также частью ORF СТ858. Клон 15-Н2-76, (SEQ ID NO:87), идентифицированный с использованием клеточной линии ТСТ-1, содержит инсерт 3031 п.н., который содержит большую часть ORF pmpD, часть ORF СТ089, а также часть ORF для SycE. Клон 15-А3-26, (SEQ ID NO:88), содержит инсерт 976 п.н., который содержит часть ORF для СТ858. Клон 17-G4-36, (SEQ ID NO:267), идентифицированный с использованием клеточных линий пациента CL8, TCT-10, CT1, CT5, CT13 и СНН037, содержит инсерт 680 п.н., который находится в рамке считывания с β-gal в данной плазмиде и имеет гомологию относительно части ORF для бета-субъединицы ДНК-зависимой РНК-полимеразы (СТ315 в SerD).
Несколько из описанных выше клонов имеют гомологию относительно различных полиморфных мембранных белков. Геномная последовательность Chlamydia trachomatis содержит семейство из девяти генов полиморфных мембранных белков, называемых pmp. Такие гены обозначены pmpA, pmpB, pmpC, pmpD, pmpE, pmpF, pmpG, pmpH и pmpI. Считается, что белки, экспрессируемые из таких генов, имеют биологическое значение в генерировании защитного иммунного ответа на инфекцию Chlamydia. В частности, белки pmpC, pmpD, pmpE и pmpI содержат предсказуемые сигнальные пептиды, что предполагает, что они являются белками наружной мембраны и, следовательно, потенциальными иммунологическими мишенями.
На основе последовательности Chlamydia trachomatis LGV II были сконструированы пары праймеров для ПЦР-амплификации полноразмерных фрагментов pmpC, pmpD, pmpE, pmpF, pmpG, pmpH и pmpI. Полученные фрагменты субклонировали в ДНК-вакцинный вектор JA4304 или JAL, который является JA4304 с модифицированным линкером (SmithKline Beecham, London, England). Конкретно, PmpC субклонировали в вектор JAL с использованием 5' олиго GAT AGG CGC GCC GCA ATC ATG AAA TTT ATG TCA GCT ACT GCT G и 3' олиго CAG AAC GCG TTT AGA ATG TCA TAC GAG CAC CGC A, представленных в SEQ ID NO:197 и 198, соответственно. ПЦР-амплификацию данного гена в условиях, хорошо известных в данной области, и лигирование в сайты 5' ASCI/3' MluI вектора JAL завершали после инсерции короткой нуклеотидной последовательности GCAATC (SEQ ID NO:199) слева от ATG для создания Козак-подобной последовательности. Полученный экспрессирующий вектор содержал полноразмерный ген pmpC, содержащий 5325 нуклеотидов (SEQ ID NO:173), в том числе гипотетическую сигнальную последовательность, которая кодирует белок 187 кД (SEQ ID NO:179). Ген pmpD субклонировали в вакцинный вектор JA4304 после ПЦР-амплификации данного гена с использованием следующих олиго: 5' олиго TGC AAT CAT GAG TTC GCA GAA AGA TAT AAA AAG C (SEQ ID NO:200) и 3' олиго CAG AGC TAG CTT AAA AGA TCA ATC GCA ATC CAG TAT TC (SEQ ID NO:201). Данный ген лигировали в сайты 5'-затупленный HIII/3' MluI вакцинного вектора JA4304 с использованием стандартных способов, хорошо известных в данной области. СААТС (SEQ ID NO:202) инсертировали слева от ATG для создания Козак-подобной последовательности. Такой клон является уникальным вследствие того, что последний треонин сайта HindIII отсутствует вследствие процедуры затупления, как и последний глицин Козак-подобной последовательности. Инсерт, нуклеотидный фрагмент из 4593 нуклеотидов (SEQ ID NO:172) является полноразмерным геном для pmpD, содержащим гипотетическую сигнальную последовательность, которая кодирует белок 161 кД (SEQ ID NO: 178). PmpE субклонировали в вектор JA4304 с использованием 5' олиго TGC AAT CAT GAA AAA AGC GTT TTT CTT TTT C (SEQ ID NO:203) и 3' олиго CAG AAC GCG TCT AGA ATC GCA GAG CAA TTT C (SEQ ID NO: 204). После ПЦР-амплификации данный ген лигировали в сайты 5'-затупленный HindIII/3' MluI вакцинного вектора JA4304. Для облегчения этого короткую нуклеотидную последовательность, TGCAATC (SEQ ID NO:293) добавляли слева от инициирующего кодона для создания Козак-подобной последовательности и восстановления сайта HindIII. Данный инсерт является полноразмерным геном pmpE (SEQ ID NO:171), содержащим гипотетическую сигнальную последовательность. Ген pmpE кодирует белок 105 кД (SEQ ID NO:177). Ген pmpC ПЦР-амплифицировали с использованием 5' олиго GTG CAA TCA TGA TTC CTC AAG GAA TTT ACG (SEQ ID NO:205) и 3' олиго CAG AAC GCG TTT AGA ACC GGA CTT TAC TTC C (SEQ ID NO:206) и субклонировали в вектор JA4304. Аналогичные стратегии клонирования выполняли для генов pmpI и pmpK. Кроме того, конструировали пары праймеров для ПЦР-амплификации полноразмерных или перекрывающихся фрагментов генов pmp, которые затем субклонировали для экспрессии белков в вектор pET17b (Novagen, Madison, WI) и трансфицировали в E. coli BL21 pLysS для экспрессии и последующей очистки с использованием хроматографической методологии с использованием гистидина-никеля, предоставляемой Novagen. Несколько генов, кодирующих рекомбинантные белки, описанные ниже, не содержат нативной сигнальной последовательности для облегчения экспрессии белка. Экспрессию полноразмерного белка pmpC выполняли посредством экспрессии двух перекрывающихся фрагментов, представляющих амино- и карбокси-концы. Субклонирование амино-концевой части pmpC, которая не имеет сигнальной последовательности, (SEQ ID NO:187, с соответствующей аминокислотной последовательностью, приведенной в SEQ ID NO:195), использовало 5'- олиго- CAG ACA TAT GCA TCA CCA TCA CCA TCA CGA GGC GAG CTC GAT CCA AGA TC (SEQ ID NO:207) и 3' олиго CAG AGG TAC CTC AGA TAG CAC TCT CTC CTA TTA AAG TAG G (SEQ ID NO:208) в клонирующих сайтах 5' NdeI/3' KpnI данного вектора. Карбокси-концевую часть данного гена, карбокси-концевой фрагмент pmpC (SEQ ID NO:186 с соответствующей аминокислотной последовательностью, приведенной в SEQ ID NO:194), субклонировали в сайты клонирования 5' NheI/3' KpnI данного экспрессирующего вектора с использованием следующих праймеров: 5' олиго CAG AGC TAG CAT GCA TCA CCA TCA CCA TCA CGT TAA GAT TGA GAA CTT CTC TGG C (SEQ ID NO:209) и 3' олиго CAG AGG TAC CTT AGA ATG TCA TAC GAG CAC CGC AG (SEQ ID NO:210). Ген pmpD также экспрессировали в виде двух перекрывающихся белков. Амино-концевая часть pmpD, которая не имеет сигнальной последовательности, (SEQ ID NO:185, с соответствующей аминокислотной последовательностью, приведенной в SEQ ID NO:193), содержит инициирующий кодон pET17b и экспрессируется в виде белка 80 кД. Для целей экспрессии и очистки белка метка из шести гистидинов следует за инициирующим кодоном и является слитой при аминокислоте 28 (нуклеотиде 84) данного гена. Использовали следующие праймеры: 5' олиго CAG ACA TAT GCA TCA CCA TCA CCA TCA CGG GTT AGC (SEQ ID NO:211) и 3' олиго CAG AGG TAC CTC AGC TCC TCC AGC ACA CTC TCT TC (SEQ ID NO:212) для сплайсинга в клонирующие сайты 5' NdeI/3' KpnI данного вектора. Карбокси-концевую часть pmpD (SEQ ID NO:184) экспрессировали в виде белка 92 кД (SEQ ID NO:192). Для экспрессии и последующей очистки включали дополнительные метионин, аланин и серин, которые представляют инициирующий кодон и первые две аминокислоты из вектора pET17b. Метку из шести гистидинов справа от метионина, аланина и серина сливают при аминокислоте 691 (нуклеотиде 2073) данного гена. 5' олиго CAG AGC TAG CCA TCA CCA TCA CCA TCA CGG TGC TAT TTC TTG CTT ACG TGG (SEQ ID NO:213) и 3' олиго CAG AGG TAC TTn AAA AGA TCA ATC GCA ATC CAG TAT TCG (SEQ ID NO:214) использовали для субклонирования данного инсерта в клонирующие сайты 5' NheI/3' KpnI экспрессирующего вектора. Ген pmpE экспрессировали в виде белка 106 кД (SEQ ID NO:183, с соответствующей аминокислотной последовательностью, приведенной в SEQ ID NO:191). Инсерт pmpE также не содержит нативной сигнальной последовательности. ПЦР-амплификацию данного гена в условиях, хорошо известных в данной области, выполняли с использованием следующих олигопраймеров: 5' олиго CAG AGG ATC CAC ATC ACC ATC ACC ATC ACG GAC TAG CTA GAG AGG TCC (SEQ ID NO:215) и 3' олиго CAG AGA ATT CCT AGA ATC GCA GAG CAA TTT C (SEQ ID NO:216), и амплифицированный инсерт лигировали в сайт 5' BamHI/3' EcoRI JA4304. Короткую нуклеотидную последовательность, представленную в SEQ ID NO:217, инсертировали слева от инициирующего кодона для создания Козак-подобной последовательности и восстановления сайта HindIII. Экспрессированный белок содержит инициирующий кодон и справа 21 аминокислоту из экспрессирующего вектора pET17b, т.е. MASMTGGQQMGRDSSLVPSSDP (SEQ ID NO:218). Кроме того, шестигистидиновая метка включена слева от описанной выше последовательности и слита при аминокислоте 28 (нуклеотиде 84) данного гена, что элиминирует гипотетический сигнальный пептид. Последовательности, представленные в SEQ ID NO:183, с соответствующей аминокислотной последовательностью, представленной в SEQ ID NO:191, не включают такие дополнительные последовательности. Ген pmpG (SEQ ID NO:182, с соответствующей аминокислотной последовательностью, представленной в SEQ ID NO:190) ПЦР-амплифицировали в условиях, хорошо известных в данной области, с использованием следующих олигопраймеров: 5' олиго CAG AGG TAC CGC ATC ACC ATC ACC ATC ACA TGA TTC CTC AAG GAA TTT ACG (SEQ ID NO:219) и 3' олиго CAG AGC GGC CGC TTA GAA CCG GAC TTT ACT TCC (SEQ ID NO:220) и лигировали в клонирующий сайт экспрессирующего вектора 5'Kpn/3'NotI. Экспрессированный белок содержит дополнительную аминокислотную последовательность на амино-конце, а именно, MASMTGGQQNGRDSSLVPHHHHHH (SEQ ID NO:221), которая содержит инициирующий кодон и дополнительную последовательность из экспрессирующего вектора pET17b. Ген pmpI (SEQ ID NO:181 с соответствующей аминокислотной последовательностью, представленной в SEQ ID NO: 189) ПЦР-амплифицировали в условиях, хорошо известных в данной области, с использованием следующих олигопраймеров: 5' олиго CAG AGC TAG CCA TCA CCA TCA CCA TCA CCT CTT TGG CCA GGA TCC C (SEQ ID NO:222) и 3' олиго CAG AAC TAG TCT AGA ACC TGT AAG TGG TCC (SEQ ID NO:223) и лигировали в экспрессирующий вектор в клонирующем сайте 5' NheI/3' SpeI. Экспрессированный белок 95 кД содержит инициирующий кодон плюс дополнительные аланин и серин из вектора pET17b на амино-конце белка. Кроме того, шестигистидиновая метка слита при аминокислоте 21 данного гена, что элиминирует гипотетический сигнальный пептид.
Клон 14-Н1-4, (SEQ ID NO:56), идентифицированный с использованием клеточной линии ТСТ-3, содержит полную ORF для гена TSA, тиол-специфического антиоксиданта - СТ603 (ORF СТ603 является гомологом CPn0778 из C. pneumoniae). Открытую рамку считывания TSA в клоне 14-Н1-4 амплифицировали таким образом, что экспрессированный белок имел дополнительный метионин и 6х-гистидиновую метку (на амино-концевой стороне). Данный амплифицированный инсерт субклонировали в сайты Nde/EcoRI вектора pET17b. После индукции данного клона при помощи IPTG белок 22,6 кДа очищали Ni-NTA-агарозной аффинной хроматографией. Определенная аминокислотная последовательность для ORF из 195 аминокислот клона 14-Н1-4, кодирующего ген TSA, представлена в SEQ ID NO:65. Дополнительный анализ дал полноразмерный клон для гена TSA, названный СТL2-TSA-FL, с полноразмерной аминокислотной последовательностью, представленной в SEQ ID NO:92.
Дополнительные исследования дали 10 дополнительных клонов, идентифицированных Т-клеточными линиями ТСТ-1 и ТСТ-3, как описано выше. Клонами, идентифицированными линией ТСТ-1, являются: 16-D4-22, 17-C5-19, 18-C5-2, 20-G3-45 и 21-С7-66; клонами, идентифицированными клеточной линией ТСТ-3, являются: 17-С10-31, 17-Е2-9, 22-А1-49 и 22-В3-53. Клон 21-G12-60 распознавался как Т-клеточной линией ТСТ-1, так и клеточной линией ТСТ-3. Кроме того, идентифицировали клон 20-G3-45, специфический для pmpВ, против линий пациента СТ1 и СТ4. Клон 16-D4-22 (SEQ ID NO:119), идентифицированный с использованием клеточной линии ТСТ-1, содержит инсерт 953 п.н., который содержит два гена, части открытой рамки считывания 3 (ORF3) и ORF4 плазмиды C. trachomatis для роста в клетках млекопитающих. Клон 17-С5-19, (SEQ ID NO:118), содержит инсерт 951 п.н., который содержит часть ORF для DT431, кодирующий протеазу clP_1, и часть ORF для СТ430 (диаминопимелатэпимеразы). Клон 18-С5-2 (SEQ ID NO:117) является частью ORF для рибосомного белка S1 с инсертом 446 п.н., который идентифицировали с использованием клеточной линии ТСТ-1. Клон 20-G3-45 (SEQ ID NO:116), идентифицированный с использованием клеточной линии ТСТ-1, содержит инсерт 437 п.н., который является частью гена pmpВ (СТ413). Клон 21-С7-8 (SEQ ID NO:115), идентифицированный с использованием клеточной линии ТСТ-1, содержит инсерт 995 п.н., который кодирует часть dnaK-подобного белка. Инсерт данного клона не перекрывается с инсертом клона ТСТ-3 11-Н4-28 (SEQ ID NO:59), который, как было показано, является частью гена dnaK СТ396. Клон 17-С10-31 (SEQ ID NO:114), идентифицированный с использованием клеточной линии ТСТ-3, содержит инсерт 976 п.н. Данный клон содержит часть ORF для СТ858, содержащие протеазу IRBP и DHR-домены. Клон 17-Е2-9 (SEQ ID NO:113) содержит часть ORF для двух генов, СТ611 и СТ610, которые охватывают инсерт 1142 п.н. Клон 22-А1-49 (SEQ ID NO:112), идентифицированный с использованием клеточной линии ТСТ-3, также содержит два гена в инсерте 698 п.н. Часть ORF для СТ660 (ДНК-гираза {gyrA_2}) присутствует на верхней цепи, где в виде полной ORF для гипотетического белка СТ659 присутствует на комплементарной цепи. Клон 22-В3-53 (SEQ ID NO:111), идентифицированный с использованием клеточной линии ТСТ-1, имеет инсерт 267 п.н., который кодирует часть ORF для GroEL (СТ110). Клон 21-G12-60 (SEQ ID NO:110), идентифицированный с использованием обеих клеточных линий ТСТ-1 и ТСТ-3, содержит инсерт 1461 п.н., который содержит частичные ORF для гипотетических белков СТ875, СТ229 и СТ228.
Дополнительные антигены Chlamydia получали скринингом геномной экспрессионной библиотеки Chlamydia trachomatis (серовар LGV II) в векторе Lambda Screen-1 (Novagen, Madison, WI) сыворотками, смешанными от нескольких инфицированных Chlamydia индивидуумов с использованием хорошо известных в данной области способов. Следующие иммунореактивные клоны идентифицировали и секвенировали инсерты, содержащие гены Chlamydia: CTL2#1 (SEQ ID NO:71); CTL2#2 (SEQ ID NO:70); CTL2#3-5' (SEQ ID NO:72, первая определенная геномная последовательность, представляющая 5' конец); CTL2#3-3' (SEQ ID NO:73, вторая определенная геномная последовательность, представляющая 3' конец); CTL2#4 (SEQ ID NO:53); CTL2#5 (SEQ ID NO:69); CTL2#6 (SEQ ID NO:68); CTL2#7 (SEQ ID NO:67); CTL2#8b (SEQ ID NO:54); CTL2#9 (SEQ ID NO:66); CTL2#10-5' (SEQ ID NO:74, первая определенная геномная последовательность, представляющая 5' конец); CTL2#10-3' (SEQ ID NO:75, вторая определенная геномная последовательность, представляющая 3' конец); CTL2#11-5' (SEQ ID NO:45, первая определенная геномная последовательность, представляющая 5' конец); CTL2#11-3' (SEQ ID NO:44, вторая определенная геномная последовательность, представляющая 3' конец); CTL2#12 (SEQ ID NO:46); CTL2#16-5' (SEQ ID NO:47); CTL2#18-5' (SEQ ID NO:49, первая определенная геномная последовательность, представляющая 5' конец); CTL2#18-3' (SEQ ID NO:48, вторая определенная геномная последовательность, представляющая 3' конец); CTL2#19-5' (SEQ ID NO:76, определенная геномная последовательность, представляющая 5' конец); CTL2#21 (SEQ ID NO:50); CTL2#23 (SEQ ID NO:51) и CTL2#24 (SEQ ID NO:52).
Дополнительные антигены Chlamydia trachomatis идентифицировали серологическим экспрессионным клонированием. Данные исследования использовали сыворотки, смешанные от нескольких инфицированных Chlamydia пациентов, как описано выше, но, кроме IgG, использовали антитела IgА и IgМ в качестве вторичного антитела. Клоны, подвергнутые скринингу по данному способу, усиливали определение антигенов, распознаваемых ранним иммунным ответом на хламидийную инфекцию, который является мукозным гуморальным иммунным ответом. Следующие иммунореактивные клоны были охарактеризованы и инсерты, содержащие гены Chlamydia, были секвенированы: CTL2gam-1 (SEQ ID NO:290), CTL2gam-2 (SEQ ID NO:289), CTL2gam-5 (SEQ ID NO:288), CTL2gam-6-3' (SEQ ID NO:287, вторая определенная геномная последовательность, представляющая 3' конец), CTL2gam-6-5' (SEQ ID NO:286, первая определенная геномная последовательность, представляющая 5' конец), CTL2gam-8 (SEQ ID NO:285), CTL2gam-10 (SEQ ID NO:284), CTL2gam-13 (SEQ ID NO:283), CTL2gam-15-3' (SEQ ID NO:282, вторая определенная геномная последовательность, представляющая 3' конец), CTL2gam-15-5' (SEQ ID NO:281, первая определенная геномная последовательность, представляющая 5' конец), CTL2gam-17 (SEQ ID NO:280), CTL2gam-18 (SEQ ID NO:279), CTL2gam-21 (SEQ ID NO:278), CTL2gam-23 (SEQ ID NO:277), CTL2gam-24 (SEQ ID NO:276), CTL2gam-26 (SEQ ID NO:275), CTL2gam-27 (SEQ ID NO:274), CTL2gam-28 (SEQ ID NO:273), CTL2gam-30-3' (SEQ ID NO:272, вторая определенная геномная последовательность, представляющая 3' конец) и CTL2gam-30-5' (SEQ ID NO:271, первая определенная геномная последовательность, представляющая 5' конец).
ПРИМЕР 2
ИНДУКЦИЯ ПРОЛИФЕРАЦИИ Т-КЛЕТОК И ПРОДУЦИРОВАНИЯ ИНТЕРФЕРОНА-γ АНТИГЕНАМИ Chlamydia trachomatis
Способность рекомбинантных антигенов Chlamydia trachomatis индуцировать пролиферацию Т-клеток и продуцирование интерферона-γ определяли следующим образом.
Белки индуцировали IPTG и очищали аффинной хроматографией на Ni-NTA-агарозе (Webb et al., J. Immunology 157:5034-5041, 1996). Затем очищенные полипептиды подвергали скринингу на способность индуцировать пролиферацию Т-клеток в препаратах РВМС. РВМС от инфицированных C. trachomatis пациентов, а также от здоровых доноров, Т-клетки которых, как известно, пролиферируют в ответ на антигены Chlamydia, культивировали в среде, содержащей RPMI 1640, дополненной 10% смешанной сывороткой человека и 50 мкг/мл гентамицина. Очищенные полипептиды добавляли в двух повторностях в концентрациях 0,5-10 мкг/мл. После шести дней культивирования в 96-луночных круглодонных планшетах в объеме 200 мкл 50 мкл среды удаляли из каждой лунки для определения уровней IFN-γ, как описано ниже. Затем планшеты кратковременно обрабатывали 1 мкКи на лунку тритированного тимидина в течение дополнительных 18 часов, собирали и определяли поглощение трития с использованием газового сцинтилляционного счетчика. Фракции, которые приводят к пролиферации в обеих повторностях, в три раза более высокой, чем пролиферация, наблюдаемая в клетках, культивируемых только в среде, считают положительными.
IFN-γ измеряли с использованием твердофазного иммуноферментного анализа (ELISA). Планшеты ELISA покрывали мышиным моноклональным антителом против IFN-γ человека (PharMingen, San Diego, CA) в PBS в течение четырех часов при комнатной температуре. Затем лунки блокировали PBS, содержащим 5% (об./масса) обезжиренное сухое молоко, в течение 1 часа при комнатной температуре. Планшеты промывали шесть раз в PBS/0,2% ТВИН-20 и пробы, разведенные 1:2 в культуральной среде, в планшетах ELISA инкубировали в течение ночи при комнатной температуре. Планшеты вновь промывали и в каждую лунку добавляли поликлональную кроличью сыворотку против IFN-γ человека, разведенную 1:3000 в смеси PBS/10% нормальная козья сыворотка. Затем планшеты инкубировали в течение двух часов при комнатной температуре, промывали и дабавляли связанный с пероксидазой хрена антикроличий IgG (Sigma Chemical So., St. Louis, MO) при разведении 1:2000 в PBS/5% обезжиренное сухое молоко. После дополнительных двух часов инкубации при комнатной температуре планшеты промывали и дабавляли ТМВ-субстрат. Ответную реакцию останавливали после 20 минут 1N серной кислотой. Оптическую плотность определяли при 450 нм с использованием 570 нм в качестве ссылочной длины волны. Фракции, которые приводят в обеих повторностях к OD, в 2 раза большей, чем средняя OD для клеток, культивируемых только в среде, плюс 3 стандартных отклонения, считали положительными.
С использованием описанной выше методологии было обнаружено, что рекомбинантный белок 1В1-66 (SEQ ID NO:5), а также два синтетических пептида, соответствующих аминокислотным остаткам 48-67 (SEQ ID NO:13, называемый 1-В1-66/48-67) и 58-77 (SEQ ID NO:14, называемый 1В1-66/58-77), соответственно, SEQ ID NO:5, индуцируют пролиферативную ответную реакцию и продуцирование IFN-γ в Chlamydia-специфической Т-клеточной линии, используемой для скрининга геномной библиотеки C. trachomatis LGV II.
Дополнительные исследования идентифицировали C. trachomatis-специфический Т-клеточный эпитоп в рибосомном белке S13. С использованием стандартных способов картирования эпитопов, хорошо известных в данной области, идентифицировали два Т-клеточных эпитопа в рибосомном белке S13 (rS13) с Chlamydia-специфической Т-клеточной линией от донора CL8 (Т-клеточная линия TCL-8 EB/DC). Фиг. 8 иллюстрирует, что первый пептид, rS13 1-20 (SEQ ID NO:106) на 100% идентичен соответствующей последовательности C. pneumoniae, что объясняет перекрестную реактивность данной Т-клеточной линии с рекомбинантным rS13 C. trachomatis и C. pneumoniae. Ответная реакция на второй пептид rS13 56-75 (SEQ ID NO:108) является C. trachomatis-специфической, что свидетельствует о том, что rS13-ответная реакция у данного здорового бессимптомного донора индуцировалась действием C. trachomatis, но не C. pneumoniae или любой другой микробной инфекции.
Как описано в примере 1, клон 11-С12-91 (SEQ ID NO:63), идентифицированный с использованием клеточной линии ТСР-21, имеет инсерт 269 п.н., который является частью гена ОМР2 (СТ443) и имеет гомологию с богатым цистеином белком наружной мембраны 60 кДа C. pneumoniae, называемым ОМСВ. Для дополнительного определения реактивного эпитопа (эпитопов) картирование эпитопов выполняли с использованием серии перекрывающихся пептидов и описанного выше иммуноанализа. Короче, пролиферативные ответные реакции определяли стимулированием 2,5 х 104 Т-клеток ТСР-21 в присутствии 1 х 104 происходящих из моноцитов дендритных клеток либо неинфекционными элементарными тельцами, полученными из C. trachomatis и C. pneumoniae, либо пептидами, полученными из белковой последовательности белка ОМСВ C. trachomatis или C. pneumoniae (0,1 мкг/мл). Т-клетки ТСР-21 отвечали на эпитопы СТ-ОМСВ #167-186, СТ-ОМСВ #171-190, СТ-ОМСВ #171-186 и в меньшей степени на СТ-ОМСВ #175-186 (SEQ ID NO:249-252, соответственно). Примечательно, что Т-клеточная линия ТСР-21 давала также пролиферативную ответную реакцию на гомологичный пептид СР-ОМСВ #171-186 (SEQ ID NO:253) C. pneumoniae, которая была равной или большей, чем ответная реакция на пептиды C. trachomatis. Аминокислотные замены в положении 2 (т.е. Asp вместо Glu) и положении 4 (т.е. Cys вместо Ser) не изменяли пролиферативную ответную реакцию Т-клеток и, следовательно, показывали, что данный эпитоп является перекрестно-реактивным эпитопом между C. trachomatis и C. pneumoniae.
Для дополнительного определения описанного выше эпитопа, в экспериментах по картированию эпитопов использовали дополнительную линию Т-клеток, ТСТ-3. Иммуноанализы проводили, как описано выше, за исключением того, что испытывали только пептиды из C. trachomatis. Данные Т-клетки давали пролиферативную ответную реакцию на два пептида, СТ-ОМСВ #152-171 и СТ-ОМСВ #157-176 (SEQ ID NO:246 и 247, соответственно), определяя таким образом дополнительный иммуногенный эпитоп в богатом цистеином белке наружной мембраны C. trachomatis.
Клон 14-Н1-4 (SEQ ID NO:56, с соответствующей полноразмерной аминокислотной последовательностью, представленной в SEQ ID NO:92) идентифицировали с использованием клеточной линии ТСТ-3 в описанной выше системе экспрессионного клонирования CD4 Т-клеток, и было показано, что он содержит полную ORF для гена тиол-специфического антиоксиданта (СТ603), называемого TSA. Иммуноанализы картирования эпитопов выполняли, как описано выше, для дополнительного определения данного эпитопа. Т-клеточная линия ТСТ-3 проявляла сильную пролиферативную ответную реакцию на перекрывающиеся пептиды СТ-TSA #96-115, CT-TSA #101-120 и CT-TSA #106-125 (SEQ ID NO:254-256, соответственно), демонстрируя иммунореактивный эпитоп в гене тиол-специфического антиоксиданта C. trachomatis серовара LGV II.
ПРИМЕР 3
ПОЛУЧЕНИЕ СИНТЕТИЧЕСКИХ ПОЛИПЕПТИДОВ
Полипептиды могут быть синтезированы на пептидном синтезаторе Millipore 9050 с использованием FMOC-химии с активацией HPTU (О-бензотриазол-N,N,N',N'-тетраметилуронийгексафторфосфатом). Последовательность Gly-Cys-Gly может быть присоединена к амино-концу пептида для обеспечения способа конъюгации или мечения данного пептида. Отщепление пептидов от твердого носителя может быть проведено с использованием следующей отщепляющей смеси: трифторуксусная кислота:этандитиол:тиоанизол:вода:фенол (40:1:2:2:3). После расщепления в течение 2 часов пептиды могут быть осаждены в холодном метил-трет-бутиловом эфире. Затем осадки пептидов могут быть растворены в воде, содержащей 0,1% трифторуксусную кислоту (ТФУ), и лиофилизованы перед очисткой ВЭЖХ с обращенной фазой на С18-колонке. Для элюирования пептидов может быть использован градиент 0-60% ацетонитрила (содержащего 0,1% ТФУ) в воде (содержащей 0,1% ТФУ). После лиофилизации чистых фракций пептиды могут быть охарактеризованы с использованием электрораспылительной масс-спектрометрии и аминокислотного анализа.
ПРИМЕР 4
ВЫДЕЛЕНИЕ И ХАРАКТЕРИСТИКА ДНК-ПОСЛЕДОВАТЕЛЬНОСТЕЙ, КОДИРУЮЩИХ АНТИГЕНЫ Chlamydia, С ИСПОЛЬЗОВАНИЕМ РЕТРОВИРУСНЫХ ЭКСПРЕССИОННЫХ ВЕКТОРНЫХ СИСТЕМ И ПОСЛЕДУЮЩЕГО ИММУНОЛОГИЧЕСКОГО АНАЛИЗА
Геномную библиотеку Chlamydia trachomatis LGV II конструировали ограниченным расщеплением с использованием рестрикционных ферментов (рестриктаз) BamHI, BglII, BstYI и MboI. Фрагменты продукта рестрикционного расщепления затем лигировали в сайт BamHI ретровирусных векторов pBIB-KS1,2,3. Данный набор векторов модифицировали, чтобы они содержали сайт инициации трансляции Козака и стоп-кодоны для создания возможности экспрессии белков из коротких геномных ДНК-фрагментов, как показано на фиг. 2. Получали пулы ДНК из 80 клонов и трансфицировали в ретровирусную упаковочную линию Phoenix-Ampho, как описано Pear, W.S., Scott, M.L. and Nolan, G.P., в Generation of High Titre, Helper-free Retroviruses by Transient Transfection. Methods in Molecular Medicine: Gene Therapy Protocols, Humana Press, Totowa, NJ, pp. 41-57. Затем данную библиотеку Chlamydia в ретровирусной форме трансдуцировали в экспрессирующие Н2-Ld клетки Р815, которые затем использовали в качестве клеток-мишеней для стимуляции антиген-специфической Т-клеточной линии.
Chlamydia-специфическую мышиную Н2d-рестриктированную CD8+ Т-клеточную линию размножали в культуре повторяемыми раундами стимуляции облученными инфицированными C. trachomatis клетками J774 и облученными сингенными клетками селезенки, как описано Starnbach, M., в J. Immunol., 153:5183, 1994. Данную Chlamydia-специфическую линию Т-клеток использовали для скрининга описанной выше геномной библиотеки Chlamydia, экспрессируемой трансдуцированными ретровирусом клетками Р815. Положительные ДНК-пулы идентифицировали определением продуцирования IFN-γ с использованием анализа Elispot (см. Lalvani et al., J. Experimental Medicine 186:859-865, 1997).
С использованием анализов Elispot IFN-γ идентифицировали два положительных пула, названных 2С7 и 2Е10. Стабильные трансдуктанты клеток Р815 из пула 2С7 клонировали лимитирующим разведением и индивидуальные клоны отбирали на основе их способности индуцировать продуцирование IFN-γ из Chlamydia-специфической CTL-линии. В результате данного способа скрининга отбирали четыре положительных клона, названных 2С7-8, 2С7-9, 2С7-19 и 2С7-21. Подобным образом положительный пул 2Е10 подвергали дополнительному скринингу с получением дополнительного положительного клона, который содержит три инсерта. Данные три инсерта являются фрагментами генов СТ016, тРНК-синтазы и clpX (SEQ ID NO:268-270, соответственно).
Трансгенные ДНК из данных четырех положительных клонов 2С7 ПЦР-амплифицировали с использованием pBIB-KS-специфических праймеров для селективной амплификации ДНК-инсерта Chlamydia. Амплифицированные инсерты очищали из геля и секвенировали. Один иммунореактивный клон, 2С7-8 (SEQ ID NO:15, с предсказанной аминокислотной последовательностью, представленной в SEQ ID NO:32), является фрагментом 160 п.н. с гомологией относительно нуклеотидов 597304-597145 Chlamydia trachomatis, серовара D (NCBI, BLASTN-поиск; SEQ ID NO:33 с предсказанной аминокислотной последовательностью, представленной в SEQ ID NO:34). Последовательность клона 2С7-8 картируется в двух предположительных открытых рамках считывания из области высокой гомологии, описанных непосредственно выше, и, в частности, было показано, что одна из указанных предположительных открытых рамок считывания, состоящая из фрагмента из 298 аминокислот (SEQ ID NO:16, с предсказанной аминокислотной последовательностью, представленной в SEQ ID NO:17), проявляет иммунологическую активность.
Полноразмерное клонирование фрагмента из 298 аминокислот (называемого СТ529 и/или геном Сар1) из серовара L2 получали ПЦР-амплификацией с использованием 5'-ttttgaagcaggtaggtgaatatg (прямого) (SEQ ID NO:159) и 5'-ttaagaaatttaaaaaatccctta (обратного) (SEQ ID NO:160) праймеров с использованием геномной ДНК L2 C. trachomatis в качестве матрицы. Данный ПЦР-продукт гель-очищали, клонировали в pCRBlunt (Invitrogen, Carlsbad, CA) для секвенирования и затем субклонировали в сайт EcoRI pBIB-KМS, производное pBIB-KS, для экспрессии. Гомолог Chlamydia pneumoniae СТ529 представлен в SEQ ID NO:291 с соответствующей аминокислотной последовательностью, представленной в SEQ ID NO:292.
Полноразмерные ДНК, кодирующие различные серовары СТ529, амплифицировали при помощи ПЦР из бактериальных лизатов, содержащих 105 IFU, по существу, как описано (Denamur, E., C. Sayada, A. Souriau, J. Orfila, A. Rodolakis and J. Elion. 1991. J. Gen. Microbiol. 137:2525). Следующие серовары амплифицировали, как описано: Ва (SEQ ID NO:134, с соответствующей предсказанной аминокислотной последовательностью, представленной в SEQ ID NO:135); Е (BOUR) и Е (MTW447) (SEQ ID NO:122, с соответствующей предсказанной аминокислотной последовательностью, представленной в SEQ ID NO:123); F (NI1) (SEQ ID NO:128, с соответствующей предсказанной аминокислотной последовательностью, представленной в SEQ ID NO:129); G (SEQ ID NO:126, с соответствующей предсказанной аминокислотной последовательностью, представленной в SEQ ID NO:127); Ia (SEQ ID NO:124, с соответствующей предсказанной аминокислотной последовательностью, представленной в SEQ ID NO:125); L1 (SEQ ID NO:130, с соответствующей предсказанной аминокислотной последовательностью, представленной в SEQ ID NO:131); L3 (SEQ ID NO:132, с соответствующей предсказанной аминокислотной последовательностью, представленной в SEQ ID NO:133); I (SEQ ID NO:263, с соответствующей предсказанной аминокислотной последовательностью, представленной в SEQ ID NO:264); К (SEQ ID NO:265, с соответствующей предсказанной аминокислотной последовательностью, представленной в SEQ ID NO:266) и MoPn (SEQ ID NO:136, с соответствующей предсказанной аминокислотной последовательностью, представленной в SEQ ID NO:137). ПЦР-реакции проводили с набором Advantage Genomic PCR (Clontech, Palo Alto, CA) с использованием праймеров, специфических для ДНК серовара L2 (внешнего относительно ORF). Последовательности праймеров были 5'-ggtataatatсtctctaaattttg (прямой-SEQ ID NO:161) и 5'-agataaaaaaggctgtttc' (обратный-SEQ ID NO:162), за исключением MoPn, который требовал праймеров 5'-ttttgaagcaggtaggtgaatatg (прямой-SEQ ID NO:163) и 5'-tttacaataagaaaagctaagcactttgt (обратный-SEQ ID NO:164). ПЦР-амплифицированную ДНК очищали с использованием набора для очистки QIAquick PCR (Qiagen, Valencia, CA) и клонировали в pCR2.1 (Invitrogen, Carlsbad, CA) для секвенирования.
Секвенирование ДНК, полученной из ПЦР-амплифицированных инсертов иммунореактивных клонов, выполняли на автоматическом секвенаторе (ABI 377) с использованием pBIB-KS-специфического прямого праймера 5'-ccttacacagtcctgctgac (SEQ ID NO:165) и обратного праймера 3'-gtttccgggccctcacattg (SEQ ID NO:166). PCRBlunt-клонированную ДНК, кодирующую серовар L2 CТ529, и pCR2.1-клонированную ДНК, кодирующую серовар Ва СТ529, Е (BOUR), E (MTW447), F (NI1), G, Ia, K, L1, L3 и MoPn, секвенировали с использованием праймера промотора Т7 и универсальных прямого праймера М13 и обратного праймера М13.
Для определения, кодируют ли две предположительные открытые рамки считывания (SEQ ID NO:16 и 20) белок со связанной с ним иммунологической функцией, синтезировали перекрывающиеся пептиды (длиной 17-20 аминокислот), охватывающие длины данных двух открытых рамок считывания, как описано в примере 3. Стандартный анализ с высвобождением хрома использовали для определения процента специфического лизиса кратковременно обработанных пептидом Н2d-рестриктированных клеток-мишеней. В данном анализе аликвоты клеток Р815 (Н2d) метили при 37°С в течение одного часа 100 мкКи 51Cr в присутствии или в отсутствие 1 мкг/мл указанных пептидов. После инкубирования меченые клетки Р815 промывали для удаления избытка 51Cr и пептида и затем высевали в двух повторностях в микротитрационные планшеты при концентрации 1000 клеток на лунку. Эффекторные CTL (Chlamydia-специфические CD8 Т-клетки) добавляли в указанных соотношениях эффектор:мишень. После 4 часов инкубирования супернатанты собирали и измеряли с использованием гамма-счетчика высвобождение 51Cr в супернатант. Два перекрывающихся пептида из содержащей 298 аминокислот открытой рамки считывания действительно специфически стимулировали CTL-линию. Пептиды, представленные в SEQ ID NO:138-156, синтезировали, и они представляли трансляцию L2-гомолога открытой рамки считывания серовара D для СТ529 (гена Сар1) и открытой рамки считывания из 216 аминокислот. Как показано на фиг. 3, пептиды CtC7.8-12 (SEQ ID NO:18, также называемый Сар1#132-147, SEQ ID NO:139) и CtC7.8-13 (SEQ ID NO:19, также называемый Сар1#138-155, SEQ ID NO:140) были способны индуцировать 38-52% специфический лизис, соответственно, при соотношении эффектора к мишени 10:1. Примечательно, что перекрывание между двумя данными пептидами содержало предсказанный пептид связывания Н2d (Kd и Ld). Пептид из 10 аминокислот синтезировали таким образом, чтобы он соответствовал такой перекрывающейся последовательности (SEQ ID NO:31), и было обнаружено, что он генерировал сильный иммунный ответ анти-Chlamydia-CTL-линии согласно анализу Elispot. Интересно, что поиск в самой последней базе данных Genbank не выявил белков, описанных ранее, для данного гена. Таким образом, предположительная открытая рамка считывания, кодирующая клон 2С7-8 (SEQ ID NO:15), определяет ген, который охватывает антиген из Chlamydia, способный стимулировать антиген-специфические CD8+ Т-клетки рестриктированным по антигенам МНС-I образом, что демонстрирует, что данный антиген мог бы использоваться для разработки вакцины против Chlamydia.
Для подтверждения данных результатов и для дальнейшего картирования данного эпитопа, получали укороченные пептиды (SEQ ID NO:138-156) и испытывали их на распознавание Т-клетками в анализе IFN-γ с использованием ELISPOT. Укорочения либо Ser139 (Cap1#140-147, SEQ ID NO:146) или Leu147 (Cap1#138-146, SEQ ID NO:147) ликвидируют распознавание Т-клетками. Данные результаты указывают на то, что 9-мерный пептид Cap1#139-147 (SFIGGITYL, SEQ ID NO:145) является минимальным эпитопом, распознаваемым Chlamydia-специфическими Т-клетками.
Сопоставления последовательностей Сар1 (СТ529) из выбранных сероваров C. trachomatis (SEQ ID NO:121, 123, 125, 127, 129, 131, 133, 135, 137 и 139) показывают, что одно из аминокислотных различий обнаруживается в положении 2 данного предполагаемого эпитопа. Гомологичным пептидом серовара D является SIIGGITYL (SEQ ID NO:168). Сравнивали способность SFIGGITYL и SIIGGITYL нацеливать клетки для распознавания Chlamydia-специфическими Т-клетками. Серийные разведения каждого пептида инкубировали с клетками Р815 и испытывали на распознавание данными Т-клетками в анализе высвобождения 51Cr, как описано выше. Chlamydia-специфические Т-клетки распознают пептид серовара L2 при минимальной концентрации 1 нМ и пептид серовара D при минимальной концентрации 10 нМ.
Дополнительные исследования показали, что Сар1#139-147-специфический клон Т-клеток распознает инфицированные C. trachomatis клетки. Для подтверждения, что Сар1139-147 присутствует на поверхности инфицированных Chlamydia клеток, клетки Balb-3T3 (H-2d) инфицировали сероваром L2 C. trachomatis и испытывали для определения, распознаются ли данные клетки клоном CD8+ Т-клеток, специфическим для эпитопа Сар1#139-147 (SEQ ID NO:145). Клон Т-клеток, специфический для эпитопа Сар1#139-147, получали лимитирующим разведением Т-клеток линии 69. Данный клон Т-клеток специфически распознавал инфицированные Chlamydia клетки. В данных экспериментах клетками-мишенями были инфицированные C. trachomatis (положительный контроль) или неинфицированные клетки Balb/3T3, обнаруживающие 45%, 36% и 30% специфический лизис при отношениях эффектор:мишень 30:1, 10:1 и 3:1, соответственно; или покрытые эпитопом Сар1#139-147 (SEQ ID NO:145), или необработанные клетки Р815, обнаруживающие 83%, 75% и 58% специфический лизис при отношениях эффектор:мишень 30:1, 10:1 и 3:1, соответственно (отрицательные контроли, имеющие менее чем 5% лизис во всех случаях). Данные результаты предполагают, что данный эпитоп представляется во время инфекции.
Исследования in vivo показывают, что Сар1#139-147-эпитоп-специфические Т-клетки вступают в первичный контакт с антигеном (примируются) во время инфекции мышей C. trachomatis. Для определения, примирует ли инфицирование C. trachomatis Сар1#139-147-эпитоп-специфическую Т-клеточную ответную реакцию, мышей инфицировали внутрибрюшинно (i.p.) 108 IFU серовара L2 C. trachomatis. Спустя две недели после инфицирования мышей умерщвляли и клетки селезенки стимулировали облученными сингенными клетками селезенки, кратковременно обработанными пептидом эпитопа Сар1#139-147. Спустя 5 дней после стимуляции данные культуры использовали в стандартном анализе высвобождения 51Cr для определения, присутствуют ли Сар1#139-147-эпитоп-специфические Т-клетки в культуре. Конкретно, клетки селезенки от мышей, иммунизированных сероваром L2 C. trachomatis, или контрольной мыши, инъецированной PBS, после 5 дней культивирования с покрытыми Сар1#139-147-пептидом клетками селезенки и CD8+ Т-клетками, способными специфически распознавать эпитоп Сар1#139-147, давали 73%, 60% и 32% специфический лизис при отношениях эффектор:мишень 30:1, 10:1 и 3:1, соответственно. Контрольные мыши имели процент лизиса приблизительно 10% при отношении эффектор:мишень 30:1 и лизис стойко снижался с понижением Е:Т-отношений. Клетками-мишенями были покрытые пептидом Сар1#139-147 или необработанные Р815-клетки. Полученные данные предполагают, что Сар1#139-147-эпитоп-специфические Т-клетки примируются (вступают в первичный контакт с антигеном) во время инфицирования мышей C. trachomatis.
Локализация Ct529
Проводили исследования, демонстрирующие, что Ct529 (называемый в данном описании Сар-1) локализован в мембране включений инфицированных C. trachomatis клеток и не связан с элементарными тельцами или ретикулярными тельцами. Как описано выше, Сар-1 был идентифицирован в качестве продукта из Chlamydia, который стимулирует CD8+ CTL (цитотоксические Т-лимфоциты). Указанные CTL являются защитными в мышиной модели инфекции, что делает Сар-1 хорошим кандидатом для приготовления вакцины. Далее, поскольку указанные CTL являются МНС-I-рестриктированными, ген Сар-1 должен иметь доступ к цитозолю инфицированных клеток, что может быть уникальным признаком специфических продуктов хламидийных генов. Таким образом, определение клеточной локализации данных генных продуктов было бы полезным в характеристике Сар-1 в качестве вакцинного кандидата. Для обнаружения внутриклеточной локализации Сар-1 кроличьи поликлональные антитела, направленные против рекомбинантного полипептида, включающего 125 N-концевых аминокислот Сар-1 (SEQ ID NO:305, с аминокислотной последовательностью, включающей N-концевую 6-His-метку, представленную в SEQ ID NO:304), использовали для окрашивания клеток McCoy, инфицированных Chlamydia.
Кроличьи анти-Сар-1 поликлональные антитела получали гипериммунизацией кроликов рекомбинантным полипептидом rCt529c1-125 (SEQ ID NO:305), включающим N-концевую часть Сар-1. Рекомбинантный белок rCt529е1-125 получали из E. coli, трансформированной экспрессионной плазмидой рЕТ (описанной выше), содержащей нуклеотиды 1-375, кодирующие N-концевые 1-125 аминокислот Сар-1. Рекомбинантный белок очищали с использованием Ni-NTA при помощи способов, хорошо известных в данной области. Для положительной контрольной антисыворотки поликлональные антисыворотки, направленные против элементарных телец, получали иммунизацией кроликов очищенными элементарными тельцами C. trachomatis (Biodesign, Sacco, Maine). Неиммунные сыворотки, полученные от кроликов до иммунизации полипептидом Сар-1, использовали в качестве отрицательного контроля.
Иммуноцитохимию выполняли на монослоях клеток McCoy, выращенных на стеклянных покровных стеклах, инокулированных либо сероваром L2 C. trachomatis, либо штаммом 6ВС C. psitacci в концентрации 106 IFU (Образующих Включение Единиц) на мл. Спустя 2 часа среду отсасывали и заменяли свежей средой RP-10, дополненной циклогексимидом (1,0 мкг/мл). Инфицированные клетки инкубировали в 7% СО2 в течение 24 часов и фиксировали отсасыванием среды, промывкой клеток один раз PBS и фиксацией метанолом в течение 5 минут. Для окрашивания антигена фиксированные монослои клеток промывали PBS и инкубировали при 37°С в течение 2 часов 1:100-разведениями специфических или контрольных антисывороток. Клетки промывали PBS и инкубировали в течение 1 часа меченым флуоресцеин-изотиоцианатом (FITC) антикроличьим IgG (KPL, Gaithersburg) и окрашивали Evans blue (0,05%) в PBS. Флуоресценцию наблюдали с объективом 100Х (эпифлуоресцентный микроскоп Zeiss) и фотографировали (Nikon UFX-11A camera).
Результаты данного исследования показывают, что Сар-1 локализован в мембране включений инфицированных C. trachomatis клеток. Сар-1-специфическое антитело метило мембраны включений инфицированных C. trachomatis клеток, но не хламидийные элементарные тельца, содержащиеся в данных включениях или высвобождающиеся процессом фиксации. Напротив, антитело против элементарных телец явно метило бактериальные тельца не только во включениях, но и те, которые высвобождались процессом фиксации. Специфичность анти-Сар-1-антитела демонстрируется тем фактом, что оно не окрашивает инфицированные С. psittaci клетки. Специфичность Сар-1-мечения демонстрируется также отсутствием реактивности в неиммунных сыворотках. Данные результаты предполагают, что Сар-1 высвобождается из бактерий и становится связанным с хламидийной мембраной включений. Таким образом, Сар-1 является генным продуктом, который может быть использован для стимуляции CD8+ Т-клеток в разработке вакцины против инфекций, вызываемых Chlamydia.
Применимость гена Сар-1 в качестве потенциального CTL-антигена в вакцине против инфекции Chlamydia дополнительно иллюстрируется двумя дополнительными сериями исследований. Во-первых, было показано, что CTL, специфические для эпитопа МНС-I пептида Сар-1 СТ529 #138-147 C. trachomatis (SEQ ID NO:144), примируются до высокой частоты во время природной инфекции. Конкретно мышей Balb/C инокулировали 106 IFU C. trachomatis, серовара L2. Спустя 2 недели селезенки иссекали и количественно определяли число секретирующих IFN-γ клеток в ответ на кратковременно обработанные пептидом Сар-1 #138-147 антигенпрезентирующие клетки. В двух экспериментах число IFN-γ-секретирующих клеток в 105 спленоцитах составляло приблизительно 1% от всех CD8+ Т-клеток. Такая высокая частота встречаемости CD8+ CTL, отвечающих на эпитоп МНС-1 (Сар-1 СТ529 #138-147), предполагает, что Сар-1 является высокоиммуногенным в инфекциях.
Результаты второй серии исследований показали, что белок Сар-1 почти сразу же является доступным для цитозоля клетки-хозяина при инфекции. Это показано во временной кривой презентации пептида Сар-1 СТ529 #138-147. Короче, клетки 3Т3 инфицировали сероваром L2 C. trachomatis в течение различных периодов времени и затем тестировали на распознавание специфическими для Сар-1 СТ529 #138-147 цитотоксическими Т-лимфоцитами (CTL). Данные результаты показывают, что инфицированные C. trachomatis клетки 3Т3 становились мишенями для распознавания антиген-специфическими CTL спустя всего лишь 2 часа после инфекции. Данные результаты предполагают, что Сар-1 является ранним белком, синтезируемым в развитии элементарных телец C. trachomatis до ретикулярных телец. Иммунный ответ в виде CD8+ CTL, направленная против генного продукта, экспрессируемого в начале инфекции, может быть особенно эффективной в вакцине против инфекции Chlamydia.
ПРИМЕР 5
ГЕНЕРИРОВАНИЕ ОТВЕТНОЙ РЕАКЦИИ АНТИТЕЛ И Т-КЛЕТОЧНОЙ ОТВЕТНОЙ РЕАКЦИИ У МЫШЕЙ, ИММУНИЗИРОВАННЫХ АНТИГЕНАМИ Chlamydia
Исследования иммуногенности проводили для определения ответной реакции образования антител и ответной реакции CD8+ Т-клеток у мышей, иммунизированных либо очищенным SWIB, либо белками S13, приготовленными с адъювантом Montanide, или иммунизациями на основе ДНК экспрессирующими векторами pcDNA-3, содержащими ДНК-последовательности для SWIB или S13. SWIB называют также клоном 1-В1-66 (SEQ ID NO:1, с соответствующей аминокислотной последовательностью, представленной в SEQ ID NO:5), а рибосомный белок S13 называют также клоном 10-С10-31 (SEQ ID NO:4, с соответствующей аминокислотной последовательностью, представленной в SEQ ID NO:12). В первом эксперименте трех мышей C57BL/6 иммунизировали два раза и наблюдали образование антител и CD4+ Т-клеточные ответные реакции. Иммунизации ДНК были интрадермальными у основания хвоста, а иммунизации полипептидом выполняли подкожной инъекцией. Результаты стандартных анализов 3Н-включения клеток селезенки от иммунизированных мышей показывают сильную пролиферативную ответную реакцию в группе, иммунизированной очищенным рекомбинантным полипептидом SWIB (SEQ ID NO:5). Дополнительный анализ с использованием анализов индукции цитокинов, как описано выше, продемонстрировал, что группа, иммунизированная полипептидом SWIB, давала измеримые IFN-γ- и IL-4-ответные реакции. Последующие анализы выполняли на основе ELISA для определения ответной реакции преимущественного изотипа антител в экспериментальной группе, иммунизированной полипептидом SWIB. Фиг. 4 показывает, что иммунизированная SWIB группа давала гуморальную ответную ответную реакцию, которая была преимущественно ответной реакцией изотипа IgG1.
Во втором эксперименте мышей С3Н иммунизировали три раза 10 мкг очищенного белка SWIB (также называемого клоном 1-В1-66, SEQ ID NO:5), приготовленного либо в PBS, либо в адъюванте Montanide, с трехнедельными интервалами и определения проводили спустя две недели после третьей иммунизации. Титры антител, направленных против белка SWIB, определяли стандартными способами на основе ELISA, хорошо известными в данной области, и они показали, что белок SWIB, приготовленный с Montanide, индуцировал сильный гуморальный иммунный ответ. Т-клеточные пролиферативные ответные реакции определяли анализом на основе ХТТ (Scudiero, et al., Cancer Research, 1988, 48:4827). Как показано на фиг. 5, спленоциты от мышей, иммунизированных полипептидом SWIB плюс Мontanide, индуцировали антиген-специфическую пролиферативную ответную реакцию. Кроме того, способность спленоцитов от иммунизированных животных секретировать IFN-γ в ответ на растворимый рекомбинантный полипептид SWIB определяли с использованием описанного выше анализа индукции цитокинов. Спленоциты от всех животных в группе, иммунизированной полипептидом SWIB, приготовленным с Montanide, секретировали IFN-γ в ответ на обработку антигеном Chlamydia SWIB, демонстрируя Chlamydia-специфический иммунный ответ.
В следующем эксперименте мышей С3Н иммунизировали в трех разных временных точках у основания хвоста 10 мкг очищенного SWIB или белка S13 (C. trachomatis, белок SWIB, клон 1-В1-66, SEQ ID NO:5, и белок S13, клон 10-С10-31, SEQ ID NO:4), приготовленными с адъювантом SBAS2 (SmithKline Beecham, London, England). Титры антиген-специфических антител измеряли при помощи ELISA, и было показано, что оба полипептида индуцировали сильную IgG-ответную реакцию в диапазоне титров от 1 х 10-4 до 1 х 10-5. Компоненты IgG1 и IgG2а данной ответной реакции присутствовали в фактически равных количествах. Антиген-специфические Т-пролиферативные ответные реакции, определяемые стандартными анализами 3Н-включения на клетках селезенки, выделенных из иммунизированных мышей, были вполне эффективными для SWIB (на 50000 имп/мин выше отрицательного контроля) и даже еще более сильными для S13 (на 100000 имп/мин выше отрицательного контроля). Продуцирование IFN-γ анализировали стандартными способами ELISA из супернатанта пролиферирующей культуры. Повторная стимуляция in vitro данной культуры белком S13 индуцировала высокие уровни продуцирования IFN-γ, приблизительно 25 нг/мл против 2 нг/мл для отрицательного контроля. Повторная стимуляция белком SWIB также индуцировала IFN-γ, хотя и в меньшей степени.
В близком к данному эксперименте мышей С3Н иммунизировали в трех различных временных точках 10 мкг очищенного SWIB или белка S13 (C. trachomatis, белок SWIB, клон 1-В1-66, SEQ ID NO:5 и белок S13, клон 10-С10-31, SEQ ID NO:4), смешанных с 10 мкг холерного токсина. Мукозную иммунизацию выполняли инокуляцией через нос. Ответные реакции в виде антиген-специфических антител определяли стандартными способами ELISA. Антиген-специфические IgG-антитела присутствовали в крови SWIB-иммунизированных мышей с титрами в диапазоне от 1 х 10-3 до 1 х 10-4, но не определялись у иммунизированных S13 животных. Антиген-специфические Т-клеточные ответные реакции из выделенных спленоцитов, измеренные по продуцированию IFN-γ, давали результаты, аналогичные результатам, описанным непосредственно выше для системной иммунизации.
Исследование на животных проводили для определения иммуногенности эпитопа CTL серовара LGV II СТ529, определяемого 10-мерным консенсусным пептидом СТ529 (CSFIGGITYL - SEQ ID NO:31), который был идентифицирован как Н2-Kd-рестриктированный эпитоп CTL. Мышей BALB/c (3 мыши на группу) иммунизировали три раза 25 мкг пептида, комбинированного с различными адъювантами. Пептид вводили системно у основания хвоста либо в системе адъюванта SKB SBAS-2”, SBAS-7 (SmithKline, Beecham, London, England), или Montanide. Пептид вводили также через нос в смеси с 10 мкг холерного токсина (СТ). Необработанных мышей использовали в качестве контроля. Спустя четыре недели после 3-й иммунизации клетки селезенки рестимулировали LPS-бластами, кратковременно обработанными 10 мкг/мл 10-мерного консенсусного пептида СТ529 в трех различных отношениях эффектора к LPS-бластам: 6, 1,5 и 0,4 при 1х106 клетках/мл. После 2 рестимуляций эффекторные клетки тестировали на их способность лизировать кратковременно обработанные пептидом клетки Р815 с использованием стандартного анализа высвобождения хрома. Посторонний пептид из овальбумина куриного яйца использовали в качестве отрицательного контроля. Результаты демонстрируют, что значимый иммунный ответ быа индуцирован против 10-мерного консенсусного пептида СТ529 и что антиген-специфические Т-клетки, способные лизировать кратковременно обработанные пептидом мишени, были индуцированы в ответ на иммунизацию данным пептидом. Конкретно, антиген-специфические литические активности были обнаружены в группе с адъювантом SBAS-7 и группе с адъювантом СТ, тогда как Montanide и SBAS-2” не способствовали иммунизации эпитопом CTL.
ПРИМЕР 6
ЭКСПРЕССИЯ И ХАРАКТЕРИСТИКА ГЕНОВ CHLAMYDIA PNEUMONIAE
Линия Т-клеток человека, TCL-8, описанная в примере 1, распознает инфицированные Chlamydia trachomatis, а также инфицированные Chlamydia pneumoniae происходящие из моноцитов дендритные клетки, что позволяет предполагать, что Chlamydia trachomatis и Chlamydia pneumoniae могут кодировать перекрестно-реактивные эпитопы Т-клеток. Для выделения генов Chlamydia pneumoniae, гомологичных клону 1В1-66 Chlamydia trachomatis LGV II, также называемому SWIB (SEQ ID NO:1), и клону 10-С10-31, также называемому рибосомным белком S13 (SEQ ID NO:4), клетки HeLa 229 инфицировали штаммом C. pneumoniae TWAR (CDC/CWL-029). После трех дней инкубации инфицированные C. pneumoniae клетки HeLa собирали, промывали и ресуспендировали в 200 мкл воды и нагревали на кипящей водяной бане в течение 20 минут. Десять микролитров суспензии разрушенных клеток использовали в качестве матрицы в ПЦР.
Специфические праймеры C. pneumoniae конструировали для клонов 1В1-66 и 10-С10-31 таким образом, что 5' конец имел 6X-гистидиновую метку и встроенный сайт NdeI, а 3' конец имел стоп-кодон и включенный сайт BamHI (фиг. 6). ПЦР-продукты амплифицировали и секвенировали стандартными способами, хорошо известными в данной области. Специфические для C. pneumoniae ПЦР-продукты клонировали в экспрессирующий вектор рЕТ17В (Novagen, Madison, WI) и трансфицировали в E. coli BL21 pLysS для экспрессии и последующей очистки с использованием гистидин-никель-хроматографической методологии, предоставляемой Novagen. Таким образом были генерированы два белка из C. pneumoniae, белок 10-11 кДа, называемый CрSWIB (SEQ ID NO:27 и SEQ ID NO:78, имеющий 6х His-метку, с соответствующей аминокислотной последовательностью, представленной в SEQ ID NO:28, соответственно), и белок 15 кДа, называемый CpS13 (SEQ ID NO:29 и SEQ ID NO:77, имеющий 6х His-метку, с соответствующей аминокислотной последовательностью, представленной в SEQ ID NO:30 и 91, соответственно).
ПРИМЕР 7
ИНДУКЦИЯ ПРОЛИФЕРАЦИИ Т-КЛЕТОК И ПРОДУЦИРОВАНИЯ ИНТЕРФЕРОНА-γ АНТИГЕНАМИ Chlamydia pneumoniae
Способность рекомбинантных антигенов Chlamydia pneumoniae индуцировать пролиферацию Т-клеток и продуцирование интерферона-γ определяли следующим образом.
Белки индуцировали IPTG и очищали аффинной хроматографией на Ni-NTA-агарозе (Webb et al., J. Immunology 157:5034-5041, 1996). Затем очищенные полипептиды подвергали скринингу на способность индуцировать пролиферацию Т-клеток в препаратах РВМС. РВМС от инфицированных C. pneumoniae пациентов, а также от здоровых доноров, Т-клетки которых, как известно, пролиферируют в ответ на антигены Chlamydia, культивируют в среде, содержащей RPMI 1640, дополненную 10% смешанной сывороткой человека и 50 мкг/мл гентамицина. Очищенные полипептиды дабавляли в двух повторностях в концентрациях 0,5-10 мкг/мл. После шести дней культивирования в 96-луночных круглодонных планшетах в объеме 200 мкл 50 мкл среды удаляют из каждой лунки для определения уровней IFN-γ, как описано ниже. Затем планшеты кратковременно обрабатывали 1 мкКи на лунку тритированного тимидина в течение дополнительных 18 часов, собирали и определяли поглощение трития с использованием газового сцинтилляционного счетчика. Фракции, которые приводят к пролиферации в обеих повторностях в три раза более высокой, чем пролиферация, наблюдаемая в клетках, культивируемых только в среде, считают положительными.
IFN-γ измеряют с использованием твердофазного иммуноферментного анализа (ELISA). Планшеты ELISA покрывали мышиным моноклональным антителом против IFN-γ человека (PharMingen, San Diego, CA) в PBS в течение четырех часов при комнатной температуре. Затем лунки блокируют PBS, содержащим 5% (об./масса) обезжиренное сухое молоко, в течение 1 часа при комнатной температуре. Планшеты промывали шесть раз в PBS/0,2% ТВИН-20 и пробы, разведенные 1:2 в культуральной среде, в планшетах ELISA инкубируют в течение ночи при комнатной температуре. Планшеты вновь промывали и в каждую лунку дабавляли поликлональную кроличью сыворотку против IFN-γ человека, разведенную 1:3000 в смеси PBS/10% нормальная козья сыворотка. Затем планшеты инкубировали в течение двух часов при комнатной температуре, промывали и дабавляли связанный с пероксидазой хрена антикроличий IgG (Sigma Chemical So., St. Louis, MO) при разведении 1:2000 в смеси PBS/5% обезжиренное сухое молоко. После дополнительных двух часов инкубации при комнатной температуре планшеты промывали и дабавляли ТМВ-субстрат. Ответную реакцию останавливали после 20 минут 1N серной кислотой. Оптическую плотность определяют при 450 нм с использованием 570 нм в качестве ссылочной длины волны. Фракции, которые приводят в обеих повторностях к OD, в 2 раза большей, чем средняя OD для клеток, культивируемых только в среде, плюс 3 стандартных отклонения, считают положительными.
Линию анти-Chlamydia-Т-клеток человека (TCL-8), способную перекрестно реагировать с C. trachomatis и C. pneumoniae, использовали для определения, имели ли экспрессируемые белки, описанные в данном примере выше (т.е. СрSWIB, SEQ ID NO:27 и SEQ ID NO:78, имеющий 6х His-метку, с соответствующей аминокислотной последовательностью, представленной в SEQ ID NO:28, соответственно, и белок 15 кДа, называемый СрS13 SEQ ID NO:29, и SEQ ID NO:77, имеющий 6х His-метку, с соответствующей аминокислотной последовательностью, представленной в SEQ ID NO:30 и 91, соответственно), эпитопы Т-клеток, общие для C. trachomatis и C. pneumoniae. Короче, E. coli, экспрессирующую хламидийные белки, титровали на 1 х 104 происходящих из моноцитов дендритных клетках. Спустя 2 часа культуры дендритных клеток промывали и добавляли 2,5 х 104 Т-клеток (TCL-8) и давали им инкубироваться в течение дополнительных 72 часов. Затем количество IFN-γ в культуральном супернатанте определяли при помощи ELISA. Как показано на фиг. 7А и 7В, Т-клеточная линия ТCL-8 специфически распознавала рибосомный белок S13 как из C. trachomatis, так и C. pneumoniae, как продемонстрировано антиген-специфической индукцией IFN-γ, тогда как только белок SWIB из C. trachomatis распознавался данной Т-клеточной линией. Для подтверждения данных результатов Т-клеточный эпитоп SWIB C. trachomatis идентифицировали картированием эпитопа с использованием клеток-мишеней, кратковременно обработанных серией перекрывающихся пептидов и Т-клеточной линией TCL-8. Анализы включения 3Н-тимидина показали, что пептид, называемый C.t.SWIB 52-67, SEQ ID NO:39, давал самую сильную пролиферацию линии TCL-8. Гомологичные пептиды, соответствующие последовательности SWIB C. pneumoniae (SEQ ID NO:40), слиянию топоизомераза-SWIB C. pneumoniae (SEQ ID NO:43) и C. trachomatis (SEQ ID NO:42), а также домену SWI человека (SEQ ID NO:41), синтезировали и испытывали в описанном выше анализе. Т-клеточная линия TCL-8 распознавала только пептид C. trachomatis SEQ ID NO:39, но не соответствующий пептид C. pneumoniae (SEQ ID NO:40) или другие соответствующие пептиды, описанные выше (SEQ ID NO:41-43).
Линии Chlamydia-специфических Т-клеток генерировали от донора СР-21 с положительным титром сыворотки против C. pneumoniae стимуляцией РВМС донора инфицированными либо C. trachomatis, либо C. pneumoniae происходящими из моноцитов дендритными клетками, соответственно. Т-клетки, генерированные против C. pneumoniae, отвечали на рекомбинантный SWIB C. pneumoniae, но не на SWIB C. trachomatis, тогда как Т-клеточная линия, генерированная против C. trachomatis, не отвечала ни на SWIB C. trachomatis, ни на SWIB C. pneumoniae (см. фиг. 9). C. pneumoniae-SWIB-специфический иммунный ответ донора СР-21 подтверждает инфекцию C. pneumoniae и указывает на выявление C. pneumoniae-SWIB-специфических Т-клеток во время in vivo инфицирования C. pneumoniae.
Картирование эпитопа Т-клеточной реакции на C. pneumoniae-SWIB показало, что Ср-SWIB-специфические Т-клетки отвечают на перекрывающиеся пептиды Ср-SWIB 32-51 (SEQ ID NO:101) и Ср-SWIB 37-56 (SEQ ID NO:102), показывая эпитоп C. pneumoniae-SWIB-специфических Т-клеток Ср-SWIB 37-51 (SEQ ID NO:100).
В дополнительных экспериментах Т-клеточные линии генерировали от донора СР1, также C. pneumoniae-сероположительного донора, стимуляцией РВМС неинфекционными элементарными тельцами из C. trachomatis и C. pneumoniae, соответственно. В частности, пролиферативные ответные реакции определяли стимуляцией 2,5 х 104 Т-клеток в присутствии 1 х 104 происходящих из моноцитов дендритных клеток либо неинфекционными элементарными тельцами, полученными из C. trachomatis и C. pneumoniae, или рекомбинантным белком SWIB либо C. trachomatis, либо C. pneumoniae. Т-клеточная ответная реакция против SWIB была сходной с данными, полученными с Т-клеточными линиями из СР-21, в том смысле, что C. pneumoniae-SWIB, но не C. trachomatis-SWIB, индуцировал ответную реакцию Т-клеточной линии C. pneumoniae. Кроме того, C. trachomatis-Т-клеточная линия не пролиферировала в ответ на SWIB C. trachomatis или C. pneumoniae, хотя она пролиферировала в ответ на элементарные тельца как СТ, так и СР. Как описано в примере 1, клон 11-С12-91 (SEQ ID NO:63), идентифицированный с использованием клеточной линии ТСР-21, имеет инсерт 269, который является частью гена ОМР2 (СТ443) и имеет гомологию с цистеин-богатым мембранным белком 60 кДа C. pneumoniae, называемым ОМСВ. Для дополнительного определения реактивного эпитопа (эпитопов) проводили картирование эпитопов с использованием перекрывающихся пептидов и описанного выше иммуноанализа. Короче, пролиферативные ответные реакции определяли стимуляцией 2,5 х 104 Т-клеток ТСР-21 в присутствии 1 х 104 происходящих из моноцитов дендритных клеток либо неинфекционными элементарными тельцами, полученными из C. trachomatis и C. pneumoniae, либо пептидами, происходящими из белковой последовательности белка ОМСВ C. trachomatis или C. pneumoniae (0,1 мкг/мл). Т-клетки ТСР-21 отвечали на эпитопы СТ-ОМСВ #167-186, CT-OMCB #171-190, CT-OMCB #171-186 и в меньшей степени на CT-OMCB #175-186 (SEQ ID NO:249-252, соответственно). Примечательно, что Т-клеточная линия ТСР-21 давала также пролиферативную ответную реакцию на гомологичный пептид C. pneumoniae СР-ОМСВ #171-186 (SEQ ID NO:253), которая была равной ответной реакции на пептиды C. trachomatis или превышала ответную реакцию на пептиды C. trachomatis. Аминокислотные замены в положении 2 (т.е. Asp вместо Glu) и положении 4 (т.е. Cys вместо Ser) не изменяли пролиферативную ответную реакцию Т-клеток и, следовательно, данный эпитоп является перекрестно-реактивным эпитопом между C. trachomatis и C. pneumoniae.
ПРИМЕР 8
ИММУННЫЕ ОТВЕТЫ РВМС И Т-КЛЕТОЧНЫХ ЛИНИЙ ЧЕЛОВЕКА ПРОТИВ АНТИГЕНОВ Chlamydia
Приведенные примеры предполагают, что среди всей популяции, которая была инфицирована C. trachomatis и генерировала защитный иммунный ответ, подавляющий инфекцию C. trachomatis, имеется популяция здоровых доноров. Такие доноры оставались клинически бессимптомными и сероотрицательными в отношении C. trachomatis. Для характеристики иммунных ответов здоровых доноров против хламидийных антигенов, которые были идентифицированы CD4-экспрессионным клонированием, РВМС, полученные от 12 здоровых доноров, тестировали против панели рекомбинантных хламидийных антигенов, в том числе SWIB C. trachomatis, SWIB C. pneumoniae и S13 C. trachomatis и S13 C. pneumoniae. Результаты суммированы в таблице 1 ниже. Все доноры были сероотрицательными в отношении C. trachomatis, тогда как 6 из 12 имели положительный титр C. pneumoniae. С использованием индекса стимуляции >4 в качестве положительной реакции, 11/12 субъектов отвечали на элементарные тельца C. trachomatis и 12/12 отвечали на элементарные тельца C. pneumoniae. Один донор, AD104, отвечал на рекомбинантный белок S13 C. pneumoniae, но не рекомбинантный белок S13 C. trachomatis, демонстрируя C. pneumoniae-специфическую ответную реакцию. Три из 12 доноров имели C. trachomatis-SWIB-специфическую ответную реакцию, но не C. pneumoniae-SWIB-специфическую ответную реакцию, подтверждая инфекцию C. trachomatis. C. trachomatis-S13 и C. pneumoniae-S13 индуцировали ответную реакцию в 8/12 доноров, что предполагало хламидийную инфекцию. Полученные данные демонстрируют способность SWIB и S13 индуцировать Т-клеточную ответную реакцию в РВМС здоровых субъектов исследования.
Иммунный ответ здоровых субъектов исследования против Chlamydia
SI: Индекс стимуляции
+/-: SI ~ 4
+: SI > 4
++: SI 10-30
+++: SI > 30
В первой серии экспериментов линии Т-клеток получали от здорового индивидуума-женщины (СТ-10) (с историей воздействия C. trachomatis на половые органы) стимуляцией Т-клеток элементарными тельцами C. trachomatis LGV II, как описано выше. Хотя субъект исследования подвергался действию C. trachomatis, он не претерпевал сероконверсии (т.е. у нее не образовывались в сыворотке специфические антитела) и у него не развивались клинические симптомы, предполагающие, что у данного донора СТ-10 мог развиться защитный иммунный ответ против C. trachomatis. Как показано на фиг. 10, первичная Chlamydia-специфическая Т-клеточная линия, полученная от донора СТ-10, отвечала на рекомбинантный белок C. trachomatis-SWIB, но не на рекомбинантный белок C. pneumoniae-SWIB, что подтверждало действие C. trachomatis на донора CT-10. Картирование эпитопа данной Т-клеточной реакции относительно C. trachomatis-SWIB показало, что данный донор отвечал на тот же самый эпитоп Ct-SWIB 52-67 (SEQ ID NO:39), что и линия Т-клеток TCL-8, как показано на фиг. 11.
Дополнительные Т-клеточные линии генерировали для различных пациентов с C. Trachomatis, как описано выше. Суммирование клинического профиля пациентов и пролиферативных реакций на элементарные тельца и рекомбинантные белки C. trachomatis и C. pneumoniae приводится в таблице II следующим образом:
Пролиферативная реакция пациентов с C. trachomatis
рак половых органов
Cp 1:128
аномальн. пап.
Величины представляют собой результаты из стандартных анализов пролиферации. Пролиферативные ответные реакции определяли стимуляцией 3 х 105 РВМС соответствующими рекомбинантными антигенами или элементарными тельцами (ЕВ). Анализы проводили спустя 6 дней с кратковременной обработкой 3H-тимидином в течение последних 18 часов.
SI: Индекс стимуляции
+/-: SI ~ 4
+: SI > 4
++: SI 10-30
+++: SI > 30
С использованием панели бессимптомных (определенных, как описано выше) субъектов исследования и пациентов с C. trachomatis, как суммировано в таблицах I и II, проводили обширное исследование иммунных ответов РВМС, полученных от данных двух групп. Короче, РВМС от пациентов с C. pneumoniae, а также от здоровых доноров культивируют в среде, содержащей RPMI 1640, дополненную 10% смешанной сывороткой человека и 50 мкг/мл гентамицина. Очищенные полипептиды, панель рекомбинантных хламидийных антигенов, в том числе SWIB и S13 C. trachomatis и C. pneumoniae, а также lpdA и TSA C. trachomatis, дабавляли в двух повторностях в концентрациях 0,5-10 мкг/мл. После шести дней культивирования в 96-луночных круглодонных планшетах в объеме 200 мкл 50 мкл среды берут из каждой лунки для определения уровней IFN-γ, как описано ниже. Затем планшеты обрабатывали кратковременно 1 мкКи на лунку тритированного тимидина в течение дополнительных 18 часов, материал собирали и определяди поглощение трития с использованием газового сцинтилляционного счетчика. Фракции, которые приводят к пролиферации в обеих повторностях, в три раза большей, чем пролиферация, наблюдаемая в клетках, культивируемых только в среде, считаются положительными.
Пролиферативные ответные реакции на рекомбинантные антигены Chlamydiae показали, что большинство бессимптомных доноров и пациентов с инфекцией C. trachomatis распознавали антиген S13 C. trachomatis (8/12), и большинство пациентов с C. trachomatis распознавали антиген S13 C. pneumoniae (8/12), причем 4/12 бессимптомных доноров распознавали также антиген S13 C. pneumoniae. Также шесть из двенадцати пациентов с C. trachomatis и четыре из двенадцати бессимптомных доноров давали пролиферативную ответную реакцию на антиген lpdA C. trachomatis. Данные результаты демонстрируют, что антиген S13 C. trachomatis и C. pneumoniae, антиген SWIB C. trachomatis и антиген lpdA C. trachomatis распознаются бессимптомными донорами, что указывает на то, что данные антигены распознаются во время воздействия Chlamydia и против них индуцируется иммунный ответ. Это предполагает, что данные антигены играют роль в выработке защитного иммунитета в человеке-хозяине. Кроме того, антиген S13 C. trachomatis и C. pneumoniae распознается одинаково хорошо среди пациентов с C. trachomatis, что указывает, таким образом, на то, что могут существовать эпитопы, общие между C. trachomatis и C. pneumoniae в белке S13. Таблица III суммирует результаты данных исследований.
Серии исследований были начаты для определения клеточного иммунного ответа на краткосрочные линии Т-клеток, полученные от бессимптомных доноров и пациентов с инфекцией C. trachomatis. Клеточные иммунные ответы измеряли стандартными анализами пролиферации и измерением IFN-γ, как описано в примере 7. Конкретно, большинство антигенов были в форме отдельных клонов E. coli, экспрессирующих хламидийные антигены, хотя некоторые рекомбинантные белки также использовали в данных анализах. Отдельные клоны E. coli титровали на 1 х 104 происходящих из моноцитов дендритных клетках и после двух часов культуру промывали и добавляли 2,5 х 104 Т-клеток. Анализ с использованием рекомбинантных белков проводили, как описано выше. Пролиферацию определяли спустя четыре дня со стандартной кратковременной обработкой 3H-тимидином в течение последних 18 часов. Индукцию IFN-γ определяли в культуральных супернатантах, собранных после четырех дней, с использованием стандартных анализов ELISA, как описано выше. Данные результаты показывают, что все испытанные антигены C. trachomatis, за исключением SWIB C. trachomatis, индуцировали пролиферативную ответную реакцию одной или нескольких различных линий Т-клеток, полученных от пациентов с C. trachomatis. Кроме того, пролиферативные ответные реакции индуцировались в Т-клеточных линиях как от пациентов с C. trachomatis, так и от бессимптомных доноров в отношении следующих генов Chlamydia, СТ622, groEL, pmpD, CT610 и rS13.
Клон 12G3-83 также содержит последовательности для СТ734 и СТ764, наряду с СТ622, и, следовательно, такие последовательности генов могут также иметь иммунореактивные эпитопы. Подобным образом, клон 21G12-60 содержит последовательности для генов СТ229 и СТ228 гипотетических белков наряду с СТ875; и клон 15Н2-76 также содержит последовательности из СТ812 и СТ088, а также имеет гомологию относительно гена sycE. Клон 11Н3-61 содержит также последовательности, имеющие гомологию относительно вирулентного белка PGP6-D.
ПРИМЕР 9
ИССЛЕДОВАНИЯ ИММУНИТЕТА С ИСПОЛЬЗОВАНИЕМ АНТИГЕНОВ Chlamydia
1. SWIB
Исследования иммунитета проводили на мышах для определения, может ли иммунизация хламидийными антигенами влиять на болезни половых путей, происходящие от хламидийной инокуляции. Использовали две модели: модель интравагинальной инокуляции, которая использует изолят человека, содержащий штамм Chlamydia psittaci (MTW447), и модель внутриматочной инокуляции, которая использует изолят человека, идентифицированный как Chlamydia trachomatis, серовар F (штамм NI1). Оба штамма индуцируют воспаление в верхних половых путях, которое напоминает эндометрит и сальпингит, вызываемые Chlamydia trachomatis у женщин. В первом эксперименте мышей С3Н (4 мыши на группу) иммунизировали три раза 100 мкг экспрессирующего вектора pcDNA-3, содержащего ДНК SWIB C. trachomatis (SEQ ID NO:1, с соответствующей аминокислотной последовательностью, представленной в SEQ ID NO:5). Инокуляции выполняли инъекцией у основания хвоста для системной иммунизации. Спустя две недели после последней иммунизации животных обрабатывали прогестероном и инфицировали либо через вагину, либо инъекцией инокулята в матку. Спустя две недели после инфицирования мышей умерщвляли и делали срезы половых путей, окрашивали и обследовали на гистопатологию. Уровень воспаления оценивали (от + для очень слабого до +++++ для очень тяжелого). Оценки, даваемые каждому отдельному яйцеводу/яичнику, суммировали и делили на число обследованных органов для получения средней оценки воспаления для данной группы. В модели инокуляции матки иммунизированные отрицательным контролем животные, получавшие пустой вектор, показали стойкое воспаление со средней оценкой воспаления яйцевода/яичника 6,12, в противоположность 2,62 для иммунизированной ДНК группы. В модели вагинальной инокуляции и возрастающей инфекции иммунизированные отрицательным контролем мыши имели среднюю оценку воспаления яйцевода/яичника 8,37 против 5,00 для иммунизированной ДНК группы. Также, в последней модели, вакцинированные мыши не обнаруживали признаков закупорки маточных труб, хотя вакцинированные отрицательным контролем группы имели воспалительные клетки в просвете яйцевода.
Во втором эксперименте мышей С3Н (4 мыши на группу) иммунизировали три раза 50 мкг экспрессирующего вектора pcDNA-3, содержащего ДНК SWIB C. trachomatis (SEQ ID NO:1, с соответствующей аминокислотной последовательностью, представленной в SEQ ID NO:5), инкапсулированного в микросферах из сополимера полилактид-гликолид (PLG); иммунизации производили внутрибрюшинно. Спустя две недели после последней иммунизации животных обрабатывали прогестероном и инфицировали инокуляцией С. psittaci во влагалище. Спустя две недели после инфицирования мышей умерщвляли и делали срезы половых путей, окрашивали и обследовали на гистопатологию. Уровень воспаления оценивали, как описано выше. Оценки, даваемые каждому отдельному яйцеводу/яичнику, суммировали и делили на число обследованных органов для получения средней оценки воспаления для данной группы. Иммунизированные отрицательным контролем животные, получающие PLG-инкапсулированный пустой вектор, показали стойкое воспаление со средней оценкой воспаления яйцевода/яичника 7,28 против 5,71 для иммунизированной PLG-инкапсулированной ДНК группы. Воспаление в брюшной полости имело оценку 1,75 для вакцинированной группы против оценки 3,75 для контроля.
В третьем эксперименте мышей С3Н (4 мыши на группу) иммунизировали три раза 10 мкг очищенного рекомбинантного белка, либо SWIB (SEQ ID NO:1, с соответствующей аминокислотной последовательностью, представленной в SEQ ID NO:5), либо S13 (SEQ ID NO:4, с соответствующей аминокислотной последовательностью, представленной в SEQ ID NO:12), смешанного с холерным токсином (ХТ); иммунизацию производили интраназально при анестезии в объеме 20 мкл. Спустя две недели после последней иммунизации животных обрабатывали прогестероном и инфицировали либо вагинальной инокуляцией С. psittaci, либо инъекцией C. trachomatis, серовара F, в матку. Спустя две недели после инфицирования мышей умерщвляли и делали срезы половых путей, окрашивали и обследовали на гистопатологию. Степень воспаления оценивали, как описано выше. Оценки, даваемые каждому отдельному яйцеводу/яичнику, суммировали и делили на число обследованных органов для получения средней оценки воспаления для данной группы. В модели инокуляции матки иммунизированные отрицательным контролем животные, получающие только холерный токсин, показали среднюю оценку воспаления яичника/яйцевода 4,25 (анализировали только 2 мышей; 2 другие умерли) против 5,00 для иммунизированной S13 плюс холерным токсином группы, и 1,00 для варианта SWIB плюс холерный токсин. Необработанные инфицированные животные имели среднюю оценку воспаления яичника/яйцевода 7. На модели вагинальной инокуляции и возрастающей инфекции иммунизированные отрицательным контролем мыши имели среднюю оценку воспаления яичника/яйцевода 7,37 против 6,75 для иммунизированной S13 плюс холерным токсином группы и 5,37 для иммунизированной SWIB плюс холерным токсином группы. Необработанные инфицированные животные имели среднюю оценку воспаления яичника/яйцевода 8.
Три данных эксперимента, описанные выше, предполагают, что может быть получен SWIB-специфический иммунитет. Такой защитный эффект является более заметным на модели гомологичной инфекции, но все еще присутствует при гетерологичной инфекции C. psittaci.
2. СТ529/Сар1
СТ529/Сар1 идентифицировали ранее как продукт из Chlamydia, который стимулирует CD8+ CTL. В данном примере была сделана попытка подтвердить, что иммунизация Сар1 могла бы быть защитной (создавать иммунитет) на модели хламидийной инфекции животного.
Для получения рекомбинантного вируса коровьей оспы для доставки иммуногенного фрагмента Сар1, ДНК-фрагмент, содержащий модифицированную последовательность Козака и пары оснований 319-530 гена сар1 (СТ529), амплифицировали из геномной ДНК C. trachomatis L2 с использованием ПЦР™ и лигировали в pSC11ss (Earl PL, Koenig S, Moss B (1991) Biological and immunological properties of human immunodeficiency virus type 1 envelope glycoprotein: analysis of proteins with truncations and deletions expressed by recombinant vaccinia viruses. J Virol. 65:31-41). ДНК расщепляли SalI и StuI. Часть гена сар1, лигированная в pSC11ss, кодирует аминокислоты 107-176 белка Сар1, содержащие ранее идентифицированный эпитоп из аминокислот 139-147 CTL. Полученную плазмиду использовали для трансфекции клеток CV-1 (ATCC # CCL-70; Jensen FC et al., (1964) Infection of human and simian tissue cultures with Rous Sarcoma Virus. Proc. Natl. Acad. Sci. USA 52: 53-59), которые затем инфицировали вирусом коровьей оспы дикого типа. Гомологичная рекомбинация между вирусом дикого типа и плазмидной ДНК давала рекомбинантные вирусы коровьей оспы, которые отбирали на основе как экспрессии бета-галактозидазы, так и инактивации тимидинкиназы, как описано ранее (Ghakrabarti et al., Mol Cell Biol. 1985, 5(12):3403-9). Рекомбинантный вирус очищали из бляшек три раза и титровали после выращивания в клетках ТК-143В человека. Препараты вируса обрабатывали равным объемом 0,25 мг/мл трипсина в течение 30 минут при 37°С и разводили в PBS перед иммунизацией мышей. Группы по 5 мышей использовали для всех экспериментальных и контрольных групп. Данные, представленные ниже, являются репрезентативными из трех независимых экспериментов.
Группу мышей иммунизировали 106 рекомбинантных вирусов коровьей оспы внутрибрюшинно (i.p.) и давали им возможность прийти в себя в течение 3 недель. Группы отрицательного контроля иммунизировали либо одним буфером, либо вирусом коровьей оспы дикого типа. В качестве положительного контроля группу мышей инфицировали i.v. 106 IFU C. trachomatis. Предварительно было показано, что число организмов, введенных в группе положительного контроля, выводится в течение 2 недель. Спустя 3 недели животных в каждой группе заражали i.v. 106 IFU C. trachomatis. Спустя три дня после заражения мышей умерщвляли и определяли число IFU на селезенку.
Среднее число организмов, обнаруженных в селезенках животных, иммунизированных вирусом коровьей оспы, экспрессирующим Сар1 (7,1 х 104), было в 2,6 раза меньшим (р<0,001; анализ суммы рангов Уилкоксона), чем у животных в контрольных группах, иммунизированных либо буфером (1,8х105), либо вирусом коровьей оспы (1,9х105). Животные в группе положительного контроля имели в 77 раз меньше организмов (2,4х103) на селезенку, чем животные в группах отрицательного контроля (р<0,01; анализ суммы рангов Уилкоксона). Полученные данные демонстрируют, что иммунизация иммуногенным фрагментом Сар1 может дать статистически значимый уровень защиты (иммунитета) против инфекции C. trachomatis.
ПРИМЕР 10
СЛИТЫЕ БЕЛКИ Рmp/Ra12
Различные слитые конструкции Рmp/Ra12 получали сначала синтезом ПЦР-фрагментов гена Pmp с использованием праймеров, содержащих сайт рестрикции NotI. Затем каждый ПЦР-фрагмент лигировали в сайт рестрикции NotI рCRX1. Вектор pCRX1 содержит 6HisRa12-часть данного слитого белка. Ra12-часть данной слитой конструкции кодирует полипептид, соответствующий аминокислотным остаткам 192-323 МТВ32А Mycobacterium tuberculosis, как описано в патенте США 60/158585, описание которого включено в данное описание в качестве ссылки. Правильную ориентацию каждого инсерта определяли по распределению рестриктаз и его последовательность подтверждали. Множественные слитые конструкции конструировали для PmpA, PmpB, PmpC, PmpF и PmpH, как описано дополнительно ниже.
Слитые белки PmpA
PmpA является белком 107 кД, содержащим 982 аминокислоты, и был клонирован из серовара Е. Белок PmpA делили на 2 перекрывающихся фрагмента, (N-концевую) и (С-концевую) части PmpA.
PmpA(N-концевую часть) амплифицировали с использованием смыслового и антисмыслового праймеров:
GAGAGCGGCCGCTCATGTTTATAACAAAGGAACTTATG (SEQ ID NO: 306)
GAGAGCGGCCGCTTACTTAGGTGAGAAGAAGGGAGTTT.C (SEQ ID NO: 307)
соответственно. Полученная слитая конструкция имеет ДНК-последовательность, представленную в SEQ ID NO:308, кодирующую белок 66 кД (619 аминокислот), представляющий сегмент 1-473 аминокислот PmpA. Аминокислотная последовательность данного слитого белка представлена в SEQ ID NO:309.
PmpA(C-концевую часть) амплифицировали с использованием смыслового и антисмыслового праймеров:
GAGAGCGGCCGCTCCATTCTATTCATTTCTTTGATCCTG (SEQ ID NO: 310)
GAGAGCGGCCGCTTAGAAGCCAACATAGCCTCC (SEQ ID NO: 311)
соответственно. Полученная слитая конструкция имеет ДНК-последовательность, представленную в SEQ ID NO:312, кодирующую белок 74 кД (691 аминокислота), представляющий сегмент 438-982 аминокислот PmpA. Аминокислотная последовательность данного слитого белка представлена в SEQ ID NO:313.
Слитые белки PmpF
PmpF является белком 112 кД, содержащим 1034 аминокислот, и был клонирован из серовара Е. Белок PmpF делили на 2 перекрывающихся фрагмента, (N-концевую) и (С-концевую) части PmpF.
PmpF(N-концевую часть) амплифицировали с использованием смыслового и антисмыслового праймеров:
GAGAGCGGCCGCTCATGATTAAAAGAACTTCTCTATCC (SEQ ID NO: 314)
GAGAGCGGCCGCTTATAATTCTGCATCATCTTCTATGGC (SEQ ID NO: 315)
соответственно. Полученная слитая конструкция имеет ДНК-последовательность, представленную в SEQ ID NO:316, кодирующую белок 69 кД (646 аминокислот), представляющий сегмент 1-499 аминокислот PmpF. Аминокислотная последовательность данного слитого белка представлена в SEQ ID NO:317.
PmpF(C-концевую часть) амплифицировали с использованием смыслового и антисмыслового праймеров:
GAGAGCGGCCGCTCGACATACGAACTCTGATGGG (SEQ ID NO: 318)
GAGAGCGGCCGCTTAAAAGACCAGAGCTCCTCC (SEQ ID NO: 319)
соответственно. Полученная слитая конструкция имеет ДНК-последовательность, представленную в SEQ ID NO:320, кодирующую белок 77 кД (715 аминокислот), представляющий сегмент 466-1034 аминокислот PmpF. Аминокислотная последовательность данного слитого белка представлена в SEQ ID NO:321.
Слитые белки PmpH
PmpН является белком 108 кД, содержащим 1016 аминокислот, и был клонирован из серовара Е. Белок PmpН делили на 2 перекрывающихся фрагмента, (N-концевую) и (С-концевую) части PmpН.
PmpН(N-концевую часть) амплифицировали с использованием смыслового и антисмыслового праймеров:
GAGAGCGGCCGCTCATGCCTTTTTCTTTGAGATCTAC (SEQ ID NO: 322)
GAGAGCGGCCGCTTACACAGATCCATTACCGGACTG (SEQ ID NO: 323)
соответственно. Полученная слитая конструкция имеет ДНК-последовательность, представленную в SEQ ID NO:324, кодирующую белок 64 кД (631 аминокислота), представляющий сегмент 1-484 аминокислот PmpH. Аминокислотная последовательность данного слитого белка представлена в SEQ ID NO:325. Было обнаружено, что линия донора СНН037 была реактивной против данного белка.
PmpН(C-концевую часть) амплифицировали с использованием смыслового и антисмыслового праймеров:
GAGAGCGGCCGCTCGATCCTGTAGTACAAAATAATTCAGC (SEQ ID NO: 326)
GAGAGCGGCCGCTTAAAAGATTCTATTCAAGCC (SEQ ID NO: 327)
соответственно. Полученная слитая конструкция имеет ДНК-последовательность, представленную в SEQ ID NO:328, кодирующую белок 77 кД (715 аминокислот), представляющий сегмент 449-1016 аминокислот PmpH. Аминокислотная последовательность данного слитого белка представлена в SEQ ID NO:329. Было обнаружено, что линия пациента СТ12 была реактивной в отношении данного белка.
Слитые белки PmpB
PmpВ является белком 183 кД, содержащим 1750 аминокислот, и был клонирован из серовара Е. Белок PmpВ делили на 4 перекрывающихся фрагмента, PmpВ(1), (2), (3) и (4).
PmpВ(1) амплифицировали с использованием смыслового и антисмыслового праймеров:
GAGAGCGGCCGCTCATGAAATGGCTGTCAGCTACTGCG (SEQ ID NO: 330)
GAGAGCGGCCGCTTACTTAATGCGAATTTCTTCAAG (SEQ ID NO: 331)
соответственно. Полученная слитая конструкция имеет ДНК-последовательность, представленную в SEQ ID NO:332, и кодирует белок 53 кД (518 аминокислот), представляющий сегмент 1-372 аминокислоты PmpВ. Аминокислотная последовательность данного слитого белка представлена в SEQ ID NO:333.
PmpB(2) амплифицировали с использованием смыслового и антисмыслового праймеров:
GAGAGCGGCCGCTCGGTGACCTCTCAATTCAATCTTC (SEQ ID NO: 334)
GAGAGCGGCCGCTTAGTTCTCTGTTACAGATAAGGAGAC (SEQ ID NO: 335)
соответственно. Полученная слитая конструкция имеет ДНК-последовательность, представленную в SEQ ID NO:336, кодирующую белок 60 кД (585 аминокислот), представляющий сегмент 330-767 аминокислот PmpB. Аминокислотная последовательность данного слитого белка представлена в SEQ ID NO:337. Клеточные линии, полученные из линий пациента СТ1, СТ3, СТ4, отвечали на данный рекомбинантный белок pmpB.
PmpB(3) амплифицировали с использованием смыслового и антисмыслового праймеров:
GAGAGCGGCCGCTCGACCAACTGAATATCTCTGAGAAC (SEQ ID NO: 338)
GAGCGGCCGCTTAAGAGACTACGTGGAGTTCTG (SEQ ID NO: 339)
соответственно. Полученная слитая конструкция имеет ДНК-последовательность, представленную в SEQ ID NO:340, кодирующую белок 67 кД (654 аминокислоты), представляющий сегмент 732-1236 аминокислот PmpF. Аминокислотная последовательность данного слитого белка представлена в SEQ ID NO:341.
PmpВ(4) амплифицировали с использованием смыслового и антисмыслового праймеров:
GAGAGCGGCCGCTCGGAACTATTGTGTTCTCTTCTG (SEQ ID NO: 342)
GAGAGCGGCCGCTTAGAAGATCATGCGAGCACCGC (SEQ ID NO: 343)
соответственно. Полученная слитая конструкция имеет ДНК-последовательность, представленную в SEQ ID NO:344, кодирующую белок 76 кД (700 аминокислот), представляющий сегмент 1160-1750 аминокислот PmpВ. Аминокислотная последовательность данного слитого белка представлена в SEQ ID NO:345.
Слитые белки PmpC
PmpС является белком 187 кД, содержащим 1774 аминокислоты, и был клонирован из серовара Е. Белок PmpС делили на 3 перекрывающихся фрагмента, PmpС(1), (2) и (3).
PmpС(1) амплифицировали с использованием смыслового и антисмыслового праймеров:
GAGAGCGGCCGCTCATGAAATTTATGTCAGCTACTGC (SEQ ID NO: 346)
GAGAGCGGCCGCTTACCCTGTAATTCCAGTGATGGTC (SEQ ID NO: 347)
соответственно. Полученная слитая конструкция имеет ДНК-последовательность, представленную в SEQ ID NO:348, и кодирует белок 51 кД (487 аминокислот), представляющий сегмент 1-340 аминокислот PmpС. Аминокислотная последовательность данного слитого белка представлена в SEQ ID NO:349.
PmpС(2) амплифицировали с использованием смыслового и антисмыслового праймеров:
GAGAGCGGCCGCTCGATACACAAGTATCAGAATCACC (SEQ ID NO: 350)
GAGAGCGGCCGCTTAAGAGGACGATGAGACACTCTCG (SEQ ID NO: 351)
соответственно. Полученная слитая конструкция имеет ДНК-последовательность, представленную в SEQ ID NO:352, и кодирует белок 60 кД (583 аминокислоты), представляющий сегмент 305-741 аминокислот PmpС. Аминокислотная последовательность данного слитого белка представлена в SEQ ID NO:353.
PmpС(3) амплифицировали с использованием смыслового и антисмыслового праймеров:
GAGAGCGGCCGCTCGATCAATCTAACGAAAACACAGACG (SEQ ID NO: 354)
GAGAGCGGCCGCTTAGACCAAAGCTCCATCAGCAAC (SEQ ID NO: 355)
соответственно. Полученная слитая конструкция имеет ДНК-последовательность, представленную в SEQ ID NO:356, и кодирует белок 70 кД (683 аминокислоты), представляющий сегмент 714-1250 аминокислот PmpС. Аминокислотная последовательность данного слитого белка представлена в SEQ ID NO:357.
ПРИМЕР 11
ИММУНОГЕННОСТЬ СТ622
Chlamydia-специфические Т-клеточные линии получали от двух пациентов с инфекцией Chlamydia, и данные линии были названы СТ1 и СТ13. Данные Т-клеточные линии генерировали либо против происходящих из моноцитов дендритных клеток, инфицированных C. trachomatis (серовара Е) в течение 72 часов (СТ1-ERB), либо против элементарных телец (ЕВ) убитого серовара Е (СТ13-ЕЕВ). После генерирования данные линии испытывали против рекомбинантного Chlamydia-специфического белка, СТ622, в анализе пролиферации. Анализы пролиферации проводили стимуляцией 2,5х104 Т-клеток в присутствии 1х104 происходящих из моноцитов дендритных клеток либо рекомбинантными антигенами СТ (2 мкг/мл), либо ЕВ Chlamydia (1 мкг/мл). Тест-пробу инкубировали в течение 4 дней с кратковременной обработкой 3H-тимидином в течение последних 18 часов.
Клеточная линия СТ1-ERB продемонстрировала пролиферативные ответные реакции, значительно превышающие контроли только со средой при стимуляции СТ622, СТ875 и СТ ЕВ. Клеточная линия СТ13-ЕЕВ продемонстрировала пролиферативную ответную реакцию, значительно превышающую контроли со средой при стимуляции СТ622, СТ875 и СТ ЕВ (см. фиг. 12).
ПРИМЕР 12
КЛОНИРОВАНИЕ И ЭКСПРЕССИЯ ПОЛНОРАЗМЕРНЫХ ГЕНОВ СТ611, ORF3 И OppA1
Экспрессию рекомбинантных белков полных открытых рамок считывания проводили для клонов, содержащих гены СТ611, ORF3 и оррА1. Клонами, которые содержали представляющие интерес гены, были CtL2-8 (SEQ ID NO:285), который кодирует 4 ORF (СТ474, СТ473, CT060 и СТ139), CtL2-10 (SEQ ID NO:284), который кодирует ORF СТ610 и СТ611, и клоны 16CtL2-16 (SEQ ID NO:47), 17-D4-22 (SEQ ID NO:119) и 19-А5-54 (SEQ ID NO:84), которые все содержали последовательности, родственные ORF3. Последовательности в CtL2-10 (Ct-610) и CtL2-16 (ORF-3) были также независимо идентифицированы с использованием метода Т-клеточного экспрессионного клонирования. Клон CtL2-8 исследовали дополнительно, так как данный клон стимулировал пролиферативные ответные реакции и продуцирование IFN-γ двумя Т-клеточными линиями, генерированными против серовара Е.
Клонирование и экспрессия последовательностей клонов
Было обнаружено, что CtL2-10 кодирует две открытые рамки считывания (ORF), СТ610 и СТ611, и было обнаружено, что они организованы смежно друг с другом в данном геномном клоне. Полноразмерная ORF СТ610 (содержащая домен синтеза PQQ) была ранее экспрессирована, и было показано, что она стимулирует пролиферативные ответные реакции Т-клеточных линий, генерированных против Chlamydia. Для определения, распознается ли вторая ORF, СТ611, также Т-клетками, полноразмерную последовательность СТ611 ПЦР-амплифицировали и конструировали для экспрессии белка. Данная нуклеотидная последовательность описана в SEQ ID NO:361 с соответствующей аминокислотной последовательностью, описанной в SEQ ID NO:365.
Было обнаружено, что второй серологический клон, CtL2-8, содержит 4 ORF (СТ474, СТ473, СТ060 и СТ139). Перекрывающиеся пептиды к трем самым маленьким предсказанным ORF (СТ474, СТ473 и СТ060) не стимулировали пролиферативные ответные реакции Т-клеточных линий. Это предполагало, что иммуностимуляторный антиген находится в четвертой ORF, СТ139. ORF СТ139 содержит приблизительно 450 нуклеотидов. Полноразмерная нуклеотидная последовательность описана в SEQ ID NO:359, а полноразмерная аминокислотная последовательность описана в SEQ ID NO:363. Сравнение аминокислотных последовательностей из Genbank выявило, что она является олигопептидсвязывающим белком (оррА1), а также принадлежит к семейству пептид-АВС-транспортных белков. Данный белок имеет длину 462 аминокислоты с предсказанным размером 48,3 кДа и, по-видимому, содержит 2 трансмембранных области.
Для экспрессии полноразмерной последовательности оррА1 были сконструированы олигонуклеотиды, которые специфически амплифицируют последовательности, начинающиеся от аминокислотного остатка 22 (без первого трансмембранного домена); нуклеотидная последовательность для оррА1 описана в SEQ ID NO:358, а аминокислотная последовательность оррА1 описана в SEQ ID NO:362. Было показано, что данная нуклеотидная последовательность экспрессирует данный белок в E. coli.
Были достигнуты также полноразмерное клонирование и экспрессия рекомбинантного белка ORF-3. Нуклеотидная и аминокислотная последовательности описаны в SEQ ID NO:360 и 364, соответственно.
ПРИМЕР 13
РЕКОМБИНАНТНЫЕ ХЛАМИДИЙНЫЕ АНТИГЕНЫ, РАСПОЗНАВАЕМЫЕ Т-КЛЕТОЧНЫМИ ЛИНИЯМИ
Т-клеточные линии пациентов получали от следующих доноров: СТ1, СТ2, СТ3, СТ4, СТ5, СТ6, СТ7, СТ8, СТ9, СТ10, СТ11, СТ12, СТ13, СТ14, СТ15 и СТ16, некоторые из которых обсуждались выше. Суммирование их подробностей включено в таблицу V.
Dx был HPV
Cp 1:1024
Cps 1:256
Cp 1:256
Рак половых органов
Cp 1:1024
Cp 1:128
Аномал. пап-мазок
Cp 1:256
Вагин. выдел.
Ct IgM 1:320
Cp 1:64
контакт
РВМС собирали у второй серии доноров и Т-клеточные линии генерировали из их субпопуляции. Суммированные подробности для трех таких Т-клеточных линий приведены в таблице ниже.
Донор СНН011 является здоровым донором-женщиной 49 лет, сероотрицательным в отношении C. trachomatis. РВМС продуцировали более высокие количества IFN-γ в ответ на элементарные тельца C. trachomatis в сравнении с элементарными тельцами C. pneumoniae, что указывало на C. trachomatis-специфическую ответную реакцию. Донор СНН037 является здоровым донором-женщиной 22 лет, сероотрицательным в отношении C. trachomatis. РВМС продуцировали более высокие количества IFN-γ в ответ на элементарные тельца C. trachomatis в сравнении с элементарными тельцами C. pneumoniae, что указывало на C. trachomatis-специфическую ответную реакцию. Донор СНН042 является здоровым донором-женщиной 25 лет с IgG-титром 1:16 в отношении C. pneumoniae. РВМС продуцировали более высокие количества IFN-γ в ответ на элементарные тельца C. trachomatis в сравнении с элементарными тельцами C. pneumoniae, что указывало на C. trachomatis-специфическую ответную реакцию.
Рекомбинантные белки для нескольких генов Chlamydia trachomatis генерировали, как описано выше. Последовательности для МОМР получали из серовара F. Гены СТ875, СТ622, pmp-B-2, pmpA и СТ529 получали из серовара Е, а последовательности для генов gro-EL, SWIB, pmpD, pmpG, TSA, СТ610, pmpC, pmpE, S13, lpdA, pmpI и pmpH-C получали из LII.
Несколько линий пациентов и доноров, описанных выше, тестировали против рекомбинантных белков Chlamydia. Таблица VII суммирует результаты реакций Т-клеток на данные рекомбинантные белки Chlamydia.
Хотя данное изобретение было описано в некоторых деталях в качестве иллюстрации и примера с целью облегчения понимания, могут быть произведены изменения и модификации не выходя за рамки объема данного изобретения, которое ограничивается только объемом прилагаемой формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИММУНОГЕННАЯ КОМПОЗИЦИЯ НА ОСНОВЕ АНТИГЕНА Chlamydia trachomatis (ВАРИАНТЫ) И ЕЕ ИСПОЛЬЗОВАНИЕ | 2004 |
|
RU2352356C2 |
| ИММУНИЗАЦИЯ ПРОТИВ CHLAMYDIA TRACHOMATIS | 2002 |
|
RU2331435C2 |
| Вакцины против Chlamydia sp. | 2014 |
|
RU2723046C2 |
| ВЫДЕЛЕННЫЙ ОПУХОЛЕВЫЙ ПОЛИПЕПТИД ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ И КОДИРУЮЩИЙ ЕГО ПОЛИНУКЛЕОТИД | 1999 |
|
RU2234942C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ЛЕЧЕНИЯ И ДИАГНОСТИКИ РАКА ЛЕГКИХ | 2001 |
|
RU2311920C2 |
| Противохламидийная вакцина и способ ее получения | 2016 |
|
RU2676768C2 |
| СПОСОБ ОБНАРУЖЕНИЯ МИКРООРГАНИЗМОВ, ПРИНАДЛЕЖАЩИХ ВИДУ MYCOPLASMA PNEUMONIAE И/ИЛИ MYCOPLASMA GENITALIUM | 2010 |
|
RU2575075C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ТЕРАПИИ И ДИАГНОСТИКИ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2001 |
|
RU2344831C2 |
| МОДИФИЦИРОВАННЫЙ БИОТИН-СВЯЗЫВАЮЩИЙ БЕЛОК, СЛИТЫЕ БЕЛКИ НА ЕГО ОСНОВЕ И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2632651C2 |
| НАНОАНТИТЕЛА, СВЯЗЫВАЮЩИЕ АНТИГЕН Chlamydia trachomatis, СПОСОБ ПОДАВЛЕНИЯ ИНФЕКЦИИ, ВЫЗВАННОЙ Chlamydia trachomatis | 2012 |
|
RU2487724C1 |




















































































































































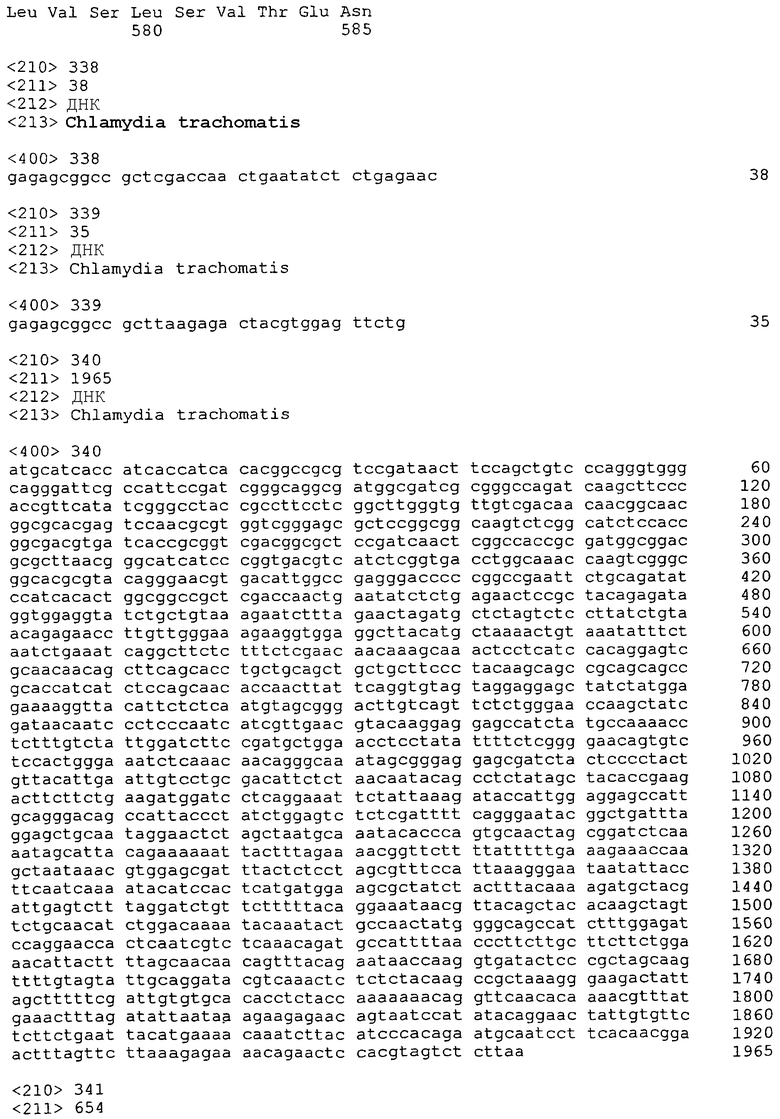




































































































































































































































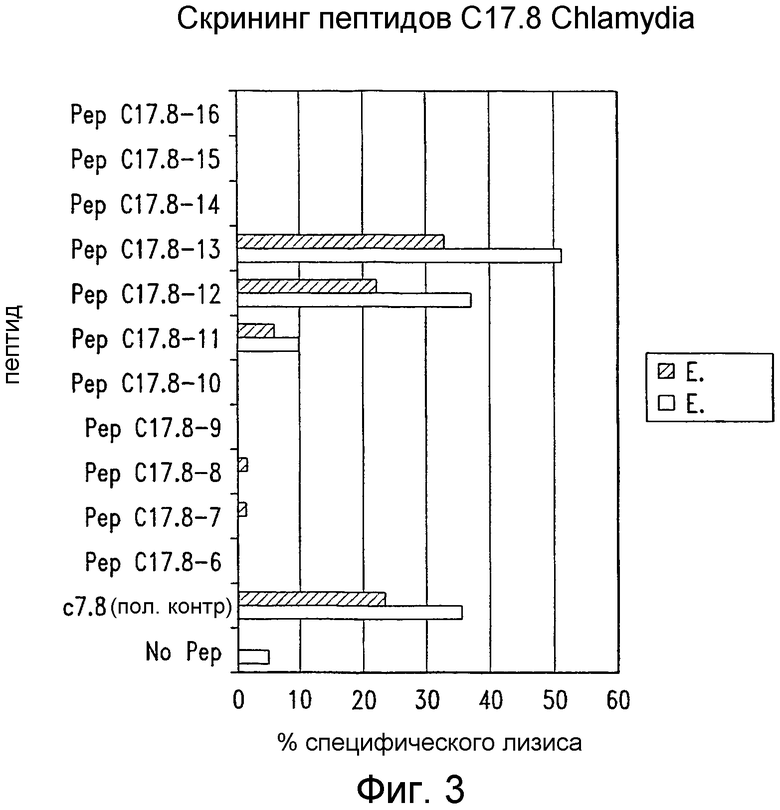





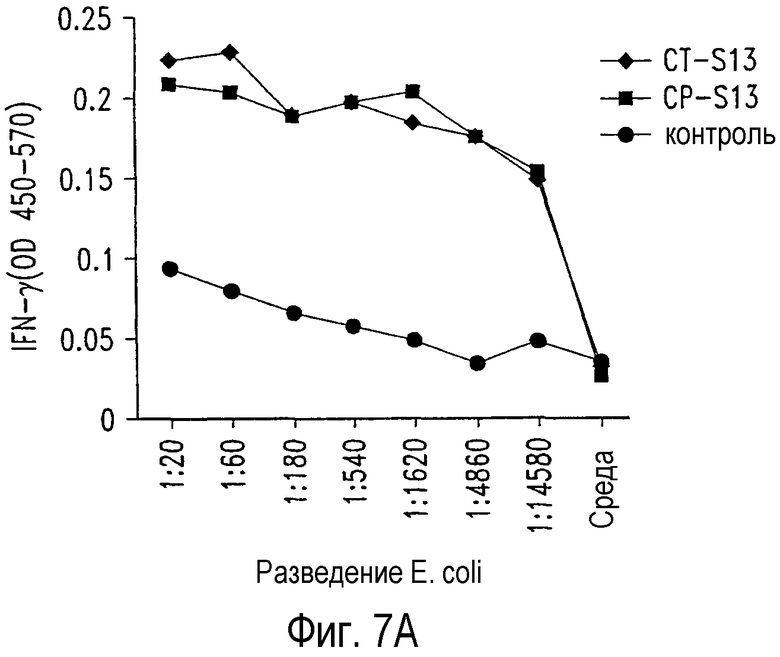
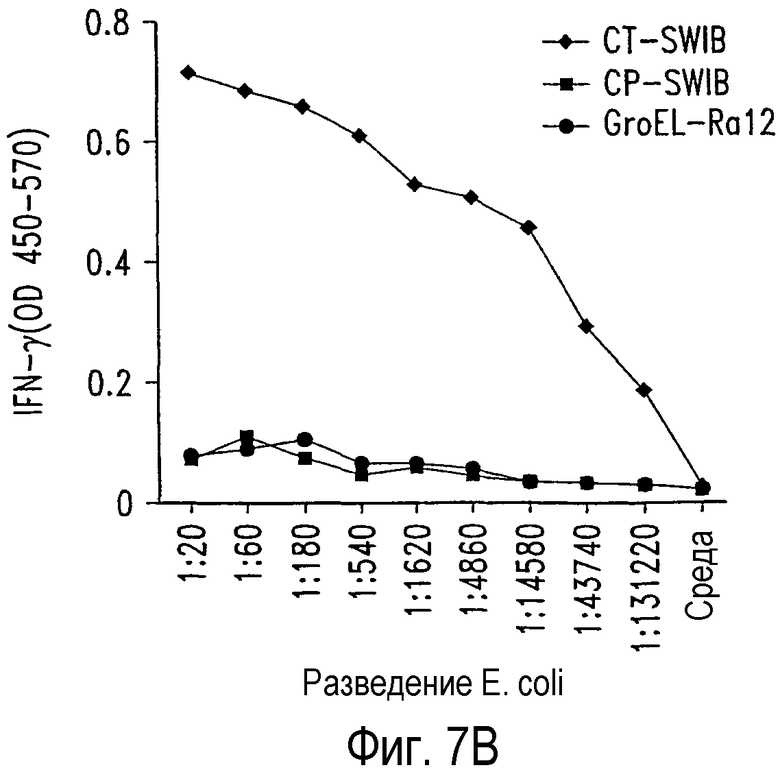

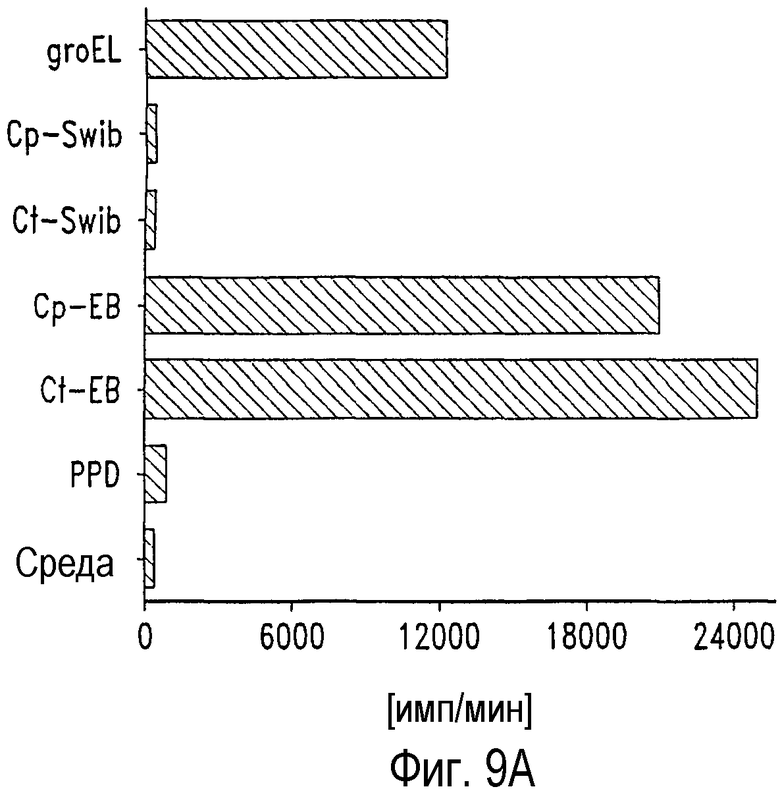
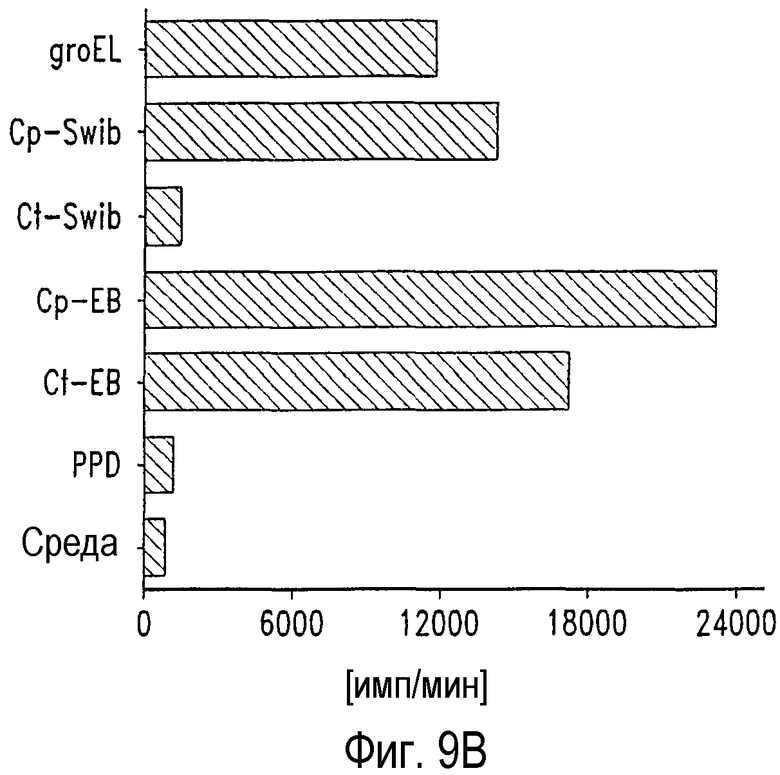



Описаны композиции на основе соединений для профилактики и лечения хламидийной инфекции. Соединения, входящие в состав одной из композиций, представляют собой полипептиды, которые содержат по меньшей мере иммуногенный фрагмент белка СТ858 или белка СТ089 Chlamydia trachomatis с определенной аминокислотной последовательностью, либо полинуклеотиды, кодирующие иммуногенные фрагменты указанных белков. Соединения, входящие в состав другой композиции, представляют собой слитые полипептиды, содержащие иммуногенный фрагмент белка СТ858 или СТ089 и партнер слияния, выбранный из иммунологических партнеров слияния, усилителей экспрессии, аффинных меток и неродственных известных белков Chlamydia trachomatis. Указанные композиции могут быть использованы для стимуляции специфического Т-клеточного ответа на Chlamydia trachomatis, для ингибирования развития инфекции и для лечения инфекции, вызванной Chlamydia trachomatis, обеспечивая высокий уровень иммунного ответа и терапевтического эффекта. 4 н. и 7 з.п. ф-лы, 7 табл., 16 ил.
1. Композиция для индукции иммунного ответа на Chlamydia trachomatis у животного, содержащая
первый компонент, выбранный из группы, состоящей из иммуностимуляторов, и второй компонент, выбранный из группы, состоящей из:
а) полипептида, содержащего по меньшей мере иммуногенный фрагмент белка СТ858 Chlamydia trachomatis, который имеет последовательность SEQ ID NO:431 или последовательность, имеющую по меньшей мере 90%-ную идентичность относительно последовательности, представленной в SEQ ID NO:431;
б) полипептида, содержащего по меньшей мере белок СТ089 Chlamydia trachomatis, который имеет последовательность SEQ ID NO:577 или последовательность, имеющую по меньшей мере 90%-ную идентичность относительно последовательности, представленной в SEQ ID NO:577;
в) полинуклеотида, кодирующего по меньшей мере иммуногенный фрагмент белка СТ858 Chlamydia trachomatis, который имеет последовательность SEQ ID NO:431 или последовательность, имеющую по меньшей мере 90%-ную идентичность относительно последовательности, представленной в SEQ ID NO:431;
г) полинуклеотида, кодирующего по меньшей мере белок СТ089 Chlamydia trachomatis, который имеет последовательность SEQ ID NO:577 или последовательность, имеющую по меньшей мере 90%-ную идентичность относительно последовательности, представленной в SEQ ID NO:577.
2. Композиция по п.1, где белок СТ858 Chlamydia trachomatis содержит последовательность SEQ ID NO:431 или последовательность, имеющую по меньшей мере 95%-ную идентичность относительно последовательности, представленной в SEQ ID NO:431.
3. Композиция по п.1, где белок СТ089 Chlamydia trachomatis содержит последовательность SEQ ID NO:577 или последовательность, имеющую по меньшей мере приблизительно 95%-ную идентичность относительно последовательности, представленной в SEQ ID NO:577.
4. Слитый полипептид, содержащий по меньшей мере белок СТ858 Chlamydia trachomatis, имеющий последовательность SEQ ID NO:431 или последовательность, имеющую по меньшей мере приблизительно 90%-ную идентичность относительно последовательности, представленной в SEQ ID NO:431, а также - партнер слияния, выбранный из иммунологических партнеров слияния, усилителей экспрессии, аффинных меток и неродственных известных белков Chlamydia trachomatis.
5. Слитый полипептид по п.4, где белок СТ858 Chlamydia trachomatis содержит последовательность SEQ ID NO:431 или последовательность, имеющую по меньшей мере или приблизительно 95%-ную идентичность относительно последовательности, представленной в SEQ ID NO:431.
6. Слитый полипептид, содержащий по меньшей мере иммуногенный фрагмент белка СТ089 Chlamydia trachomatis, имеющий последовательность SEQ ID NO:577 или последовательность, имеющую по меньшей мере приблизительно 90%-ную идентичность относительно последовательности, представленной в SEQ ID NO:577, а также - партнер слияния, выбранный из иммунологических партнеров слияния, усилителей экспрессии, аффинных меток и неродственных известных белков Chlamydia trachomatis.
7. Слитый полипептид по п.6, где белок СТ089 Chlamydia trachomatis содержит последовательность, имеющую приблизительно 95%-ную идентичность относительно последовательности, представленной в SEQ ID NO:577.
8. Композиция для индукции иммунного ответа на Chlamydia trachomatis у животного, содержащая иммуностимулятор и слитый полипептид по любому из пп.4-7.
9. Композиция по любому из пп.1-3 или 8 для использования в способе стимуляции специфического Т-клеточного ответа на Chlamydia trachomatis у животного, предусматривающем введение нуждающемуся в этом животному эффективного количества указанной композиции.
10. Композиция по любому из пп.1-3 или 8 для использования в способе ингибирования развития инфекции Chlamydia trachomatis у животного, предусматривающем введение нуждающемуся в этом животному эффективного количества указанной композиции.
11. Композиция по любому из пп.1-3 или 8 для использования в способе лечения инфекции Chlamydia trachomatis у пациента, предусматривающем введение нуждающемуся в этом животному эффективного количества указанной композиции.
| WO 9512411 А, 11.05.1995 | |||
| WO 9928475 А, 10.06.1999 | |||
| Ведущий механизм для врубовой машины | 1932 |
|
SU34483A1 |
| RU 9511866 A, 10.10.1998. | |||
Авторы
Даты
2011-01-27—Публикация
2001-07-20—Подача