ОБЛАСТЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Данное изобретение относится к области наночастиц, в частности, наночастиц, которые быстро проникают в слизь, такую как слизь в организме человека, а также способам их получения и применения.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Локализованная доставка терапевтических препаратов при помощи биоразлагаемых наночастиц часто обладает преимуществами по сравнению с системным введением лекарственных средств, в том числе, менее выраженными системными побочными эффектами и контролируемыми уровнями лекарственного средства в целевых участках. Однако контролируемая доставка лекарственного средства на поверхности слизистых оболочек была ограничена наличием защитного слоя слизи.
Слизь представляет собой вязкоупругий гель, покрывающий все открытые эпителиальные поверхности, не покрытые кожей, например, дыхательные пути, желудочно-кишечный тракт, носоглотку и женский репродуктивный тракт, а также поверхность глаз. Слизь эффективно улавливает обычные системы доставки лекарственных средств в виде частиц за счет стерических и/или адгезивных взаимодействий. В результате функционального цикла слизи эффективность большинства терапевтических препаратов, доставляемых локально на поверхности слизистых оболочек, ограничена, вследствие плохого удержания и распределения. Биоразлагаемые наночастицы, которые проникают глубоко в слизистый барьер, способны обеспечивать лучшее распределение, удержание и эффективность лекарственного средства на поверхности слизистых оболочек.
Плотное покрытие из низкомолекулярного полиэтиленгликоля (ПЭГ) позволяет наночастицам быстро проникать через очень вязкоупругие слизистые выделения в организме человека. Гидрофильное и биоинертное ПЭГ покрытие эффективно минимизирует адгезионные взаимодействия между наночастицами и составляющими слизи. Биоразлагаемые проникающие в слизь частицы (MPPs) были получены путем физической адсорбции определенных плюроников, таких как F127, на готовые мукоадгезивные наночастицы. Кроме того, MPPs были получены путем нанопреципитации с использованием диблок-сополимеров поли(себациновой кислоты) и ПЭГ.
Однако область применения биоразлагаемых MPP, полученных путем нанопреципитации, ограничена, поскольку для этого необходимо растворение лекарственного средства и полимера в смешивающихся с водой растворителях. Для множества гидрофобных лекарственных средств может быть выгодной локальная доставка с помощью MPP из-за серьезных системных побочных эффектов, однако их плохая растворимость в смешивающихся с водой органических растворителях ограничивает эффективную инкапсуляцию в MPP за счет нанопреципитации.
Другие классы новых разрабатываемых лекарственных средств, включая нуклеиновые кислоты, пептиды и белки, обладают огромным потенциалом для лечения заболеваний в местах скопления слизи. Однако эти гидрофильные лекарственные средства невозможно легко сформулировать в MPP путем нанопреципитации. Выпаривание эмульсионного растворителя широко используют для эффективной инкапсуляции как гидрофильных лекарственных средств (двойная эмульсия вода-в-масле-в-воде), так и гидрофобных лекарственных средств (простая эмульсия масло-в-воде), в биоразлагаемые наночастицы, однако полученные частицы являются мукоадгезивными при использовании общепринятого эмульгатора, поливинилового спирта (ПВС) (PVA).
Существует потребность в новых способах получения проникающих в слизь частиц, которые позволяют инкапсулировать широкий ассортимент лекарственных средств в наночастицы без снижения их способности проникать в слизь, как описано выше. Существует также потребность в препаратах, которые вводят путем инъекции. Установлено, что покрытия, аналогичные тем, которые улучшают проникновение в слизь, также уменьшают воспаление, вызываемое частицами лекарственного средства.
Таким образом, целью настоящего изобретения является предложение способов получения частиц, а также полученных частиц, позволяющих инкапсулировать широкий ассортимент лекарственных средств в биоразлагаемые наночастицы без снижения их способности проникать в слизь или без усиления воспаления, вызываемого частицами, как описано выше.
Другой целью настоящего изобретения является предложение частиц, таких как наночастицы и микрочастицы, с высокой нагрузкой лекарственных средств и плотным покрытием из изменяющего свойства поверхности материала для обеспечения эффективной доставки лекарственного средства различными способами введения.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Разработаны наночастицы, образованные путем эмульгирования одного или более полимерных заполнителей, одного или более изменяющих свойства поверхности материалов и одного или более низкомолекулярных эмульгаторов. Частицы получают путем растворения одного или более полимерных заполнителей в органическом растворителе, добавления раствора одного или более полимерных заполнителей в водный раствор или суспензию эмульгатора для образования эмульсии и последующего добавления эмульсии во второй раствор или суспензию эмульгатора для образования наночастиц. Полимерный заполнитель и эмульгатор могут быть раздельными, конъюгированными между собой или находиться в форме блок-сополимера, содержащего один или более блоков изменяющего свойства поверхности материала. В предпочтительном варианте осуществления изменяющий свойства поверхности материал представляет собой полиэтиленгликоль с молекулярной массой от примерно 1 кДа до примерно 10 кДа, предпочтительно от примерно 1 кДа до примерно 5 кДа, более предпочтительно примерно 5 кДа. В данном варианте осуществления плотность полиэтиленгликоля, измеренная методом 1H ЯМР, составляет от примерно 1 до примерно 100 цепей/нм2, предпочтительно от примерно 1 до примерно 50 цепей/нм2, более предпочтительно от примерно 5 до примерно 50 цепей/нм2, наиболее предпочтительно от примерно 5 до примерно 25 цепей/нм2.
Критичность молекулярной массы эмульгаторов продемонстрирована с помощью примеров. В предпочтительном варианте осуществления молекулярная масса одного или более эмульгаторов составляет менее чем 1500, 1300, 1200, 1000, 800, 600 или 500 а.е.м. Предпочтительные эмульгаторы включают натриевую соль холевой кислоты, диоктил сульфосукцинат натрия, гексадецилтриметиламмоний бромид, сапонин, твин® 20, твин® 80 и сложные эфиры сахаров. Изменяющие свойства поверхности материалы присутствуют в количестве, эффективном для того, чтобы сделать поверхностный заряд частиц нейтральным или практически нейтральным, когда один или более эмульгаторов несут заряд. Эмульгаторы обладают эмульгирующей способностью по меньшей мере примерно 50%, предпочтительно по меньшей мере 55, 60, 65, 70, 75, 80, 85, 90 или 95%.
Наночастицы особенно полезны для доставки терапевтических, профилактических, нутрицевтических или диагностических средств. Их можно вводить энтерально, парентерально или локально, предпочтительно на поверхность слизистой оболочки. В предпочтительном варианте осуществления частицы вводят внутривенной, подкожной, внутримышечной, внутрибрюшинной инъекцией или под конъюнктиву. В одном варианте осуществления частицы вводят в дыхательные пути, интраназально, интравагинально, ректально или буккально.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1a и 1b представлены траектории наночастиц PLA-ПЭГ и PCL-ПЭГ, содержащих CHA и ПВС, полученных методом эмульгирования. На фиг.1c и 1d приведены графики, демонстрирующие усредненные по множеству геометрические среднеквадратичные смещения (<MSD>/мкм2), как функцию от времени (временная шкала/с). На фиг. 1e и 1f приведены графики, демонстрирующие распределения логарифмов эффективных коэффициентов диффузии отдельных частиц (Dэфф) на временной шкале 1 с. На фиг.1g и 1h приведены графики, демонстрирующие расчетную фракцию частиц, способных проникать в физиологический слой слизи толщиной 30 мкм с течением времени. Данные представлены из трех независимых экспериментов с отслеживанием ≥120 наночастиц в каждом эксперименте. Планки погрешностей соответствуют S.E.M.
На фиг. 2a и 2b представлен эффект ММ ПЭГ на скорость перемещения MPP в шеечно-влагалищной слизи человека: Фиг.2a представляет собой график, демонстрирующий усредненное по множеству геометрическое среднеквадратичное смещение <MSD/мкм2> как функцию от временной шкалы/с. Фиг.2b представляет собой график, демонстрирующий распределения логарифмов эффективных коэффициентов диффузии отдельных частиц (Dэфф) на временной шкале 1 с. Частицы получали методом эмульгирования с использованием PLGA-ПЭГ (6 масс.% ПЭГ). Данные представлены из трех независимых экспериментов с отслеживанием ≥120 наночастиц в каждом эксперименте. Планки погрешностей соответствуют S.E.M.
На фиг. 3a приведен график, демонстрирующий усредненное по множеству геометрическое среднеквадратичное смещение <MSD/мкм2> как функцию от временной шкалы. На фиг. 3b приведен график, демонстрирующий распределения логарифмов эффективных коэффициентов диффузии отдельных частиц (Dэфф) на временной шкале 1 с. На фиг.3c приведен график, демонстрирующий расчетную фракцию частиц, по прогнозам, способных проникать в слой слизи толщиной 30 мкм с течением времени. Данные представлены из трех независимых экспериментов с отслеживанием ≥120 наночастиц в каждом эксперименте. Планки погрешностей соответствуют S.E.M.
Фиг. 4a-c представляют собой схемы, иллюстрирующие влияние поверхностного ПЭГ покрытия ([Г/Г*]) на проникновение наночастиц в слизь. Фиг. 4a-c демонстрируют получение PLGA-ПЭГ наночастиц с поверхностным ПЭГ покрытием при увеличении покрытия. По мере увеличения поверхностного ПЭГ покрытия, порядок расположения ПЭГ меняется с грибовидного (соседние цепи ПЭГ не перекрываются, [Г/Г*]<1, Фиг. 4a) на щеточное (соседние цепи ПЭГ перекрываются, 1<[Г/Г*]<3, Фиг. 4b) и на густое щеточное ([Г/Г*]>3, Фиг. 4c). При низком покрытии ПЭГ ([Г/Г*]<1, Фиг. 4a) волокна муцина прочно прикрепляются к ядру наночастицы. При среднем покрытии ПЭГ (1<[Г/Г*]<3, Фиг. 4b) волокна муцина все еще могут частично абсорбироваться на ядре наночастицы. При высоком ([Г/Г*]>3, Фиг. 4c) покрытии ПЭГ ядра наночастиц были полностью экранированы короной из биоинертного ПЭГ, что приводило к отсутствию абсорбции муцина на наночастицах. Фиг. 4c демонстрирует, что наночастицы с низким покрытием ПЭГ иммобилизуются в слизи, наночастицы со средним покрытием ПЭГ движутся с затруднением и даже иммобилизуются в слизи, а наночастицы с высоким и очень высоким покрытием ПЭГ способны быстро проникать в слизь.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
I. Определения
Используемый в настоящем документе термин «наночастица», в целом, относится к частице любой формы, имеющей диаметр от примерно 1 нм вплоть до, но, не включая, примерно 1 микрон, более предпочтительно от примерно 5 нм до примерно 500 нм, наиболее предпочтительно от примерно 5 нм до примерно 100 нм. Наночастицы, имеющие сферическую форму, как правило, называют «наносферы».
Используемый в настоящем документе термин «средний размер частиц», в целом, относится к статистическому среднему размеру частиц (диаметру) в популяции частиц. Диаметр практически сферической частицы можно называть физическим или гидродинамическим диаметром. Диаметр несферической частицы можно предпочтительно называть гидродинамическим диаметром. При использовании в настоящем документе, диаметр несферической частицы может означать наибольшее линейное расстояние между двумя точками на поверхности частицы. Средний размер частиц можно измерять с помощью методов, известных в данной области, таких как метод динамического рассеяния света.
Используемый в настоящем документе термин «средневзвешенный аэродинамический диаметр» (MMAD) относится к среднему аэродинамическому размеру множества частиц. «Аэродинамический диаметр» представляет собой диаметр единичной плотной сферы с той же скоростью оседания, как правило, в воздухе, что и у порошка, и, таким образом, является полезным способом охарактеризовать порошок в аэрозольном состоянии или другие диспергированные частицы, или препарат в виде частиц, в отношении его оседания. Аэродинамический диаметр охватывает форму, плотность частицы или корпускулы, а также физический размер частицы или корпускулы. MMAD можно экспериментально определять методами, известными в данной области, такими как метод каскадного импактора.
Используемый в настоящем документе термин «плотность утряски» относится к мере плотности порошка. Плотность утряски можно определять методом, описанным в «USP Bulk Density and Tapped Density», Фармакопейная конвенция США, Роквилл, Мэриленд, 10е приложение, 4950-4951, 1999. Особенности, которые могут способствовать низкой плотности утряски, включают неравномерную текстуру поверхности и пористую структуру.
Термины «монодисперсное» и «однородное распределение по размеру» используются в настоящем документе взаимозаменяемо и описывают множество наночастиц или микрочастиц, в котором частицы имеют одинаковый или почти одинаковый диаметр или аэродинамический диаметр. При использовании в настоящем документе, монодисперсное распределение означает распределение частиц, при котором 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95% или более распределения находится в пределах 5% от массового среднего диаметра или аэродинамического диаметра.
Используемый в настоящем документе термин «легочное введение» относится к введению фармацевтического препарата, содержащего активное средство, в легкие путем ингаляции. Используемый в настоящем документе термин «ингаляция» означает поступление воздуха в альвеолы. Воздух может поступать через рот или нос. Поступление воздуха может происходить путем самовведения препарата при вдыхании или путем введения через респиратор пациенту, пользующемуся респиратором.
Используемый в настоящем документе термин «фармацевтически приемлемый», относится к соединениям, материалам, композициям и/или лекарственным формам, которые с медицинской точки зрения подходят для использования в контакте с тканями человека и животных без чрезмерной токсичности, раздражения, аллергической реакции или других проблем или осложнений, с разумным соотношением польза/риск, в соответствии с руководящими принципами агентств, таких как Управление по контролю качества пищевых продуктов и лекарственных средств.
Используемые в настоящем документе термины «биосовместимый» и «биологически совместимый», в целом, относятся к материалам, которые, наряду с их любыми метаболитами или продуктами распада, как правило, являются нетоксичными для реципиента и не вызывают никаких существенных побочных эффектов у пациента. В общих чертах, биосовместимые материалы являются материалами, которые не вызывают существенные воспалительные или иммунные реакции при введении пациенту.
Используемый в настоящем документе термин «молекулярная масса», в целом, относится к относительной средней длине цепи блочного полимера, если не указано иначе. На практике, молекулярную массу можно оценивать или характеризовать с использованием различных методов, включая гельпроникающую хроматографию (ГПХ) (GPC) или капиллярную вискозиметрию. Определенную методом ГПХ молекулярную массу называют средневзвешенной молекулярной массой (Mw), в отличие от среднечисловой молекулярной массы (Mn). Метод капиллярной вискозиметрии позволяет оценивать молекулярную массу как характеристическую вязкость, определяемую в разбавленном растворе полимера с использованием определенного набора условий концентрации, температуры и растворителя.
Используемый в настоящем документе термин «гидрофильный» относится к свойству наличия сродства к воде. Например, гидрофильные полимеры (или гидрофильные полимерные сегменты) представляют собой полимеры (или полимерные сегменты), которые, прежде всего, растворимы в водных растворах и/или имеют тенденцию поглощать воду. Как правило, чем более гидрофильным является полимер, тем больше этот полимер имеет тенденцию растворяться, смешиваться или намокать в воде.
Используемый в настоящем документе термин «гидрофобный» относится к свойству отсутствия сродства, или даже отталкивания воды. Например, чем более гидрофобным является полимер (или полимерный сегмент), тем больше этот полимер (или полимерный сегмент) имеет тенденцию не растворяться, не смешиваться или не намокать в воде.
Используемый в настоящем документе термин «слизь» относится к вязкоупругому природному веществу, содержащему, главным образом, муциновые гликопротеины и другие материалы, которое защищает эпителиальную поверхность различных органов/тканей, включая дыхательную, носовую, шеечно-влагалищную, желудочно-кишечную, ректальную, зрительную и слуховую системы. Используемый в настоящем документе термин «мокрота» относится к очень вязкоупругим слизистым выделениям, состоящим из различных макромолекул, таких как ДНК, актины и другие продукты разрушения клеток, высвобождающихся из мертвых клеток, в дополнение к муциновым гликопротеинам. «Мокрота», как правило, присутствует в пораженных патогенами воздушных путях пациентов, страдающих от обструктивных заболеваний легких, включая, но не ограничиваясь ими, астму, COPD и КФ (CF). Используемые в настоящем документе термины «КФ слизь» и «КФ мокрота» относятся к слизи и мокроте, соответственно, от пациента, страдающего кистозным фиброзом.
Используемый в настоящем документе термин «разрушающее слизь средство» относится к веществу, которое увеличивает скорость клиренса слизи при введении пациенту. Разрушающие слизь средства известны в данной области. Смотри, например, Hanes, J. et al. «Gene Delivery to the Lung, in Pharmaceutical Inhalation Aerosol Technology», Marcel Dekker, Inc., New York: 489-539 (2003). Примеры разрушающих слизь средств включают N-ацетилцистеин (NAC), который расщепляет дисульфидные и сульфгидрильные связи, присутствующие в муцине. Другие разрушающие слизь средства включают полынь, бромелайн, папаин, клеродендрум, ацетилцистеин, бромгексин, карбоцистеин, эпразинон, месну, амброксол, собрерол, домиодол, денуфозол, летостеин, степронин, тиопронин, гелсолин, тимозин β4, нелтенексин, эрдостеин и различные ДНКзы, включая рчДНКазу.
Используемый в настоящем документе термин «устойчивая к КФ слизи/диффузионная частица» относится к частице, которая проявляет пониженную или низкую мукоадгезию в КФ слизи и которая, таким образом, проходит через КФ слизь с большей скоростью, чем другие частицы. Такие частицы могут быть охарактеризованы, как имеющие высокий коэффициент диффузии через КФ слизь. В некоторых вариантах осуществления устойчивая к КФ слизи/диффузионная частица обладает эффективным коэффициентом диффузии в КФ слизи более чем примерно 0,01 мкм2/с, более предпочтительно более чем примерно 0,5 мкм2/с, наиболее предпочтительно более чем примерно 1 мкм2/с. В предпочтительных вариантах осуществления популяция частиц может быть охарактеризована как «устойчивая к КФ слизи/диффузионная», если по меньшей мере 30%, более предпочтительно по меньшей мере 40%, наиболее предпочтительно по меньшей мере 50% популяции частиц диффундируют через слой КФ слизи толщиной 10 мкм в течение одного часа.
Используемый в настоящем документе термин «кистозный фиброз» (КФ) относится к наследственному генетическому заболеванию, возникающему в результате одной или более мутаций в гене, кодирующем кистозно-фиброзный трансмембранный регулятор проводимости (КФТР) (CFTR). У пациентов с кистозным фиброзом мутации в КФТР, эндогенно экспрессируемым в дыхательном эпителии, приводят к снижению секреции апикальных анионов, вызывая дисбаланс в транспорте ионов и жидкостей. Возникающее в результате снижение анионного транспорта способствует повышенному накоплению слизи в легких и сопутствующей микробной инфекции, которая в конечном итоге приводит к смерти пациентов с КФ. Помимо респираторного заболевания, пациенты с КФ, как правило, страдают от желудочно-кишечных проблем и недостаточности поджелудочной железы, которые, если их не лечить, приводят к смерти. Анализ последовательности гена КФТР в хромосомах больных КФ выявил различные вызывающие заболевания мутации. На сегодняшний день выявлено более 1000 вызывающих заболевание мутаций в гене КФ (http://www.genet.sickkids.on.ca/cftr/). Наиболее распространенной мутацией является делеция фенилаланина в положении 508 аминокислотной последовательности КФТР, и ее обычно называют ΔF508-КФТР. Эта мутация имеет место примерно в 70 процентах случаев кистозного фиброза и связана с тяжелой формой заболевания. Кистозным фиброзом страдает примерно один из каждых 2500 детей в Соединенных Штатах.
Используемый в настоящем документе термин «кистозно-фиброзный трансмембранный регулятор проводимости» (КФТР) относится к трансмембранному белку, играющему первостепенную роль в поддержании транспорта электролитов по всему телу, включая дыхательные и желудочно-кишечные ткани. КФТР состоит из примерно 1480 аминокислот, кодирующих белок, составленный из тандемного повтора трансмембранных доменов, каждый из которых содержит шесть трансмембранных спиралей, и нуклеотид-связывающего домена. Ген, кодирующий КФТР, был идентифицирован и секвенирован. Смотри Gregory, R. J. et al., Nature 347: 382-386 (1990); Rich, D. P. et al., Nature 347: 358-362 (1990) и Riordan, J. R. et al., Science 245: 1066-1073 (1989).
Используемый в настоящем документе термин «нуклеиновая кислота» относится к ДНК, РНК и молекулам нуклеиновых кислот, модифицированным с целью повышения стабильности для различных терапевтических задач. Одним из примеров является ген, кодирующий белок кистозно-фиброзный трансмембранный регулятор проводимости (КФТР) человека, его аналоги и варианты, которые могут экспрессироваться в организме людей, страдающих КФ, для коррекции, по меньшей мере частичной, некоторых симптомов, характерных для КФ. Сюда также относятся такие молекулы, как фрагменты ДНК, включающие области для внесения коррекций или модификаций в ген, например, ДНК, образующие тройные спирали, которые можно использовать для коррекции эндогенного гена КФ в генах по меньшей мере некоторых пациентов с КФ. Следует отметить, что этот термин не ограничен генами КФТР, но применим к каждому генетическому материалу, который можно использовать для лечения, диагностирования или исцеления заболевания.
Термины «парентеральное введение» и «введенный парентерально» являются признанными в данной области терминами и охватывают способы введения, отличные от энтерального и локального введения, такие как инъекции, и включают, но не ограничиваются ими, внутривенные, внутримышечные, интраплевральные, внутрисосудистые, интраперикардиальные, внутриартериальные, интратекальные, интракапсулярные, внутриглазничные, внутрисердечные, внутрикожные, внутрибрюшинные, транстрахеальные, подкожные, подэпидермисные, внутрисуставные, субкапсулярные, субарахноидальные, интраспинальные, подконъюнктивные и интрастернальные инъекции и инфузии.
Используемый в настоящем документе термин «сурфактант» относится к средству, которое снижает поверхностное натяжение жидкости.
Термин «терапевтическое средство» относится к средству, которое можно вводить для предотвращения или лечения заболевания или нарушения. Терапевтические средства могут представлять собой нуклеиновую кислоту, аналог нуклеиновой кислоты, малую молекулу, пептидомиметик, белок, пептид, углевод или сахар, липид или сурфактант, или их сочетание.
Термин «лечение» или предотвращение развития заболевания, нарушения или состояния у животного, которое может быть предрасположено к заболеванию, нарушению и/или состоянию, но пока еще не диагностировано как имеющее его; включает подавление заболевания, нарушения или состояния, например, препятствование его прогрессированию; и облегчение заболевания, нарушения или состояния, например, вызывание ремиссии заболевания, нарушения и/или состояния. Лечение заболевания или состояния включает ослабление по меньшей мере одного симптома конкретного заболевания или состояния, даже если не затронуты лежащие в основе патофизиологические процессы, например, лечение боли у субъекта путем введения анальгетика, даже если такой препарат не лечит причину боли.
Используемый в настоящем документе термин «нацеливающий фрагмент» относится к фрагменту, который задает направление к или от конкретного участка. Фрагмент может быть, например, белком, нуклеиновой кислотой, аналогом нуклеиновой кислоты, углеводом или малой молекулой. Фрагмент может быть, например, терапевтическим соединением, таким как малая молекула, или диагностическим фрагментом, таким как детектируемая метка. Конкретный участок может быть тканью, клетками конкретного типа или субклеточным компартментом. В одном варианте осуществления нацеливающий фрагмент задает направление активному фрагменту. Активный фрагмент может быть малой молекулой, белком, полимером или металлом. Активный фрагмент может быть полезен для терапевтических, профилактических или диагностических целей.
Термин «терапевтически эффективное количество» относится к количеству терапевтического средства, которое, при встраивании в и/или на частицы, описанные в настоящем документе, производит некоторый желаемый эффект при разумном соотношении польза/риск, применяемом к любому медицинскому лечению. Эффективное количество может варьироваться в зависимости от таких факторов, как заболевание или состояние, которое лечат, конкретные нацеленные конструкции, которые вводят, размер субъекта или степень тяжести заболевания или состояния. Рядовой специалист в данной области может эмпирически определять эффективное количество конкретного соединения без необходимости проведения излишних экспериментов.
Термины «встроенный» и «инкапсулированный» относятся к встраиванию, формулированию или иному включению активного средства в и/или на композицию, что делает возможным высвобождение, например, замедленное высвобождение, такого средства при желаемом применении. Термины предполагают любой способ, при помощи которого терапевтическое средство или другой материал встраивают в полимерную матрицу, включая, например: присоединение к мономеру такого полимера (за счет ковалентных, ионных или других связывающих взаимодействий), физическое смешивание, оборачивание средства в покрывающий слой полимера, встраивание в полимер, распределение по полимерной матрице, присоединение к поверхности полимерной матрицы (за счет ковалентных или других связывающих взаимодействий), инкапсуляцию внутри полимерной матрицы и так далее. Термин «совместное встраивание» или «совместная инкапсуляция» относится к встраиванию терапевтического средства или другого материала и по меньшей мере одного другого терапевтического средства или другого материала в конкретную композицию.
II. Проникающие в слизь наночастицы (MPP)
A. Полимерный заполнитель
Любое количество биосовместимых полимеров можно использовать для получения наночастиц. В одном варианте осуществления биосовместимый полимер(ы) является биоразлагаемым. В другом варианте осуществления частицы являются не биоразлагаемыми. В других вариантах осуществления частицы представляют собой смесь разлагаемых и не разлагаемых частиц.
Иллюстративные полимеры включают, но не ограничиваются ими, циклодекстрин-содержащие полимеры, в частности, катионные циклодекстрин-содержащие полимеры, такие как те, которые описаны в патенте США № 6509323,
полимеры, полученные из лактонов, такие как поли(капролактон) (PCL),
полигидроксикислоты и их сополимеры, такие как поли(молочная кислота) (PLA), поли(L-молочная кислота) (PLLA), поли(гликолевая кислота) (PGA), поли(молочная-со-гликолевая кислота) (PLGA), поли(L-молочная-со-гликолевая кислота) (PLLGA), поли(D,L-лактид) (PDLA), поли(D,L-лактид-со-капролактон), поли(D,L-лактид-co-капролактон-co-гликолид), поли(D,L-лактид-co-PEO-co-D,L-лактид), поли(D,L-лактид-co-PPO-co-D,L-лактид) и их смеси,
полиалкилцианоакрилат,
полиуретаны,
полиаминокислоты, такие как поли-L-лизин (PLL), поли(валериановая кислота) и поли-L-глутаминовая кислота,
гидроксипропилметакрилат (HPMA),
полиангидриды,
сложные полиэфиры,
сложные полиортоэфиры,
сложные поли(эфирамиды),
полиамиды,
поли(эфиры сложных эфиров),
поликарбонаты,
полиалкилены, такие как полиэтилен и полипропилен,
полиалкиленгликоли, такие как поли(этиленгликоль) (ПЭГ), полиалкиленоксиды (PEO),
полиалкилентерефталаты, такие как поли(этилентерефталат), этиленвинилацетатный полимер (EVA),
поливиниловые спирты (ПВС),
поливиниловые эфиры,
поливиниловые сложные эфиры, такие как поли(винилацетат),
поливинилгалогениды, такие как поли(винилхлорид) (PVC), поливинилпирролидон,
полисилоксаны,
полистирол (PS),
целлюлозы, включая дериватизированные целлюлозы, такие как алкилцеллюлозы, гидроксиалкилцеллюлозы, эфиры целлюлозы, сложные эфиры целлюлозы, нитроцеллюлозы, гидроксипропилцеллюлоза и карбоксиметилцеллюлоза,
полимеры акриловых кислот, такие как поли(метил(мет)акрилат) (PMMA), поли(этил(мет)акрилат), поли(бутил(мет)акрилат), поли(изобутил(мет)акрилат), поли(гексил(мет)акрилат), поли(изодецил(мет)акрилат), поли(лаурил(мет)акрилат), поли(фенил(мет)акрилат), поли(метилакрилат), поли(изопропилакрилат), поли(изобутилакрилат), поли(октадецилакрилат) (совместно называемые в настоящем документе «полиакриловыми кислотами»),
полидиоксанон и его сополимеры,
полигидроксиалканоаты,
полипропиленфумарат,
полиоксиметилен,
полоксамеры,
поли(масляную кислоту),
триметиленкарбонат и
полифосфазены.
Сополимеры вышеперечисленных полимеров, такие как случайные, блок или привитые сополимеры, или смеси полимеров, перечисленных выше, также можно использовать.
Функциональные группы на полимере могут быть блокированы с целью изменения свойств полимера и/или модификации (например, уменьшения или увеличения) реакционной способности функциональных групп. Например, карбоксильный конец полимеров, содержащих карбоновую кислоту, таких как лактид- и гликолид-содержащих полимеров, может, необязательно, быть блокирован, например, путем эстерификации, и гидроксильный конец может, необязательно, быть блокирован, например, путем этерификации или эстерификации.
Сополимеры ПЭГ или его производных с любым из полимеров, описанных выше, можно использовать для получения полимерных частиц. В некоторых вариантах осуществления ПЭГ или его производные могут быть расположены на внутренних положениях сополимера. Альтернативно, ПЭГ или его производные могут располагаться вблизи или на концевых положениях сополимера. Например, один или более из полимеров, описанных выше, могут заканчиваться блоком полиэтиленгликоля. В некоторых вариантах осуществления полимерный заполнитель представляет собой смесь пегилированного полимера и непегилированного полимера, при этом основные полимеры являются одинаковыми (например, PLGA и PLGA-ПЭГ) или разными (например, PLGA-ПЭГ и PLA). В некоторых вариантах осуществления микрочастицы или наночастицы получают в условиях, позволяющих областям из ПЭГ разделяться по фазам или иным образом размещаться на поверхности частиц. Расположенные на поверхности области ПЭГ могут самостоятельно выполнять функцию изменяющего поверхность средства или содержать его. В конкретных вариантах осуществления частицы получают из одного или более полимеров, заканчивающихся блоками полиэтиленгликоля в качестве материала, изменяющего свойства поверхности.
Средневзвешенная молекулярная масса может варьироваться для конкретного полимера, но, как правило, составляет от примерно 1000 Дальтон до 1000000 Дальтон, от 1000 Дальтон до 500000 Дальтон, от 1000 Дальтон до 250000 Дальтон, от 1000 Дальтон до 100000 Дальтон, от 5000 Дальтон до 100000 Дальтон, от 5000 Дальтон до 75000 Дальтон, от 5000 Дальтон до 50000 Дальтон или от 5000 Дальтон до 25000 Дальтон.
Примеры предпочтительных природных полимеров включают белки, такие как альбумин, коллаген, желатин и проламины, например, зеин, а также полисахариды, такие как альгинат.
В некоторых вариантах осуществления частицы можно использовать в качестве наночастиц - носителей генов. В данных вариантах осуществления частицы могут быть образованы из одного или более поликатионных полимеров, образующих комплекс с одной или более нуклеиновыми кислотами, которые заряжены отрицательно.
Катионный полимер может быть любым синтетическим или природным полимером, несущим по меньшей мере два положительных заряда на молекулу и имеющим достаточную плотность заряда и размер молекулы, чтобы связываться с нуклеиновой кислотой в физиологических условиях (то есть, условиях pH и содержания соли, встречающихся в организме или в клетках). В некоторых вариантах осуществления поликатионный полимер содержит один или более остатков амина.
Подходящие катионные полимеры включают, например, полиэтиленимин (PEI), полиаллиламин, поливиниламин, поливинилпиридин, аминоацетилированный поли(виниловый спирт), акриловые или метакриловые полимеры (например, поли(N,N-диметиламиноэтилметакрилат)), несущие один или более остатков амина, полиаминокислоты, такие как полиорнитин, полиаргинин и полилизин, протамин, катионные полисахариды, такие как хитозан, ДЭАЭ-целлюлоза и ДЭАЭ-декстран, и полиамидоаминовые дендримеры (катионные дендримеры), а также их сополимеры и смеси. В предпочтительных вариантах осуществления поликатионный полимер представляет собой PEI.
Катионные полимеры могут быть либо линейными, либо разветвленными, могут быть или гомополимерами, или сополимерами, и, в случае содержания аминокислот, могут иметь либо L, либо D конфигурацию, а также могут иметь любое сочетание этих признаков. Предпочтительно, молекула катионного полимера является достаточно гибкой, чтобы иметь возможность образовывать компактный комплекс с одной или более молекулами нуклеиновой кислоты.
В некоторых вариантах осуществления поликатионный полимер имеет молекулярную массу от примерно 5000 Дальтон до примерно 100000 Дальтон, более предпочтительно от примерно 5000 до примерно 50000 Дальтон, наиболее предпочтительно от примерно 10000 до примерно 35000 Дальтон.
B. Материалы, которые способствуют диффузии через слизь
Наночастицы предпочтительно покрыты или содержат один или более средств или материалов, изменяющих свойства поверхности. Используемый в настоящем документе термин «средства, изменяющие свойства поверхности» относится к средству или материалу, которые модифицируют одно или более свойств поверхности частиц, включая, но не ограничиваясь ими, гидрофильность (например, делают частицы более или менее гидрофильными), поверхностный заряд (например, делают поверхность нейтральной или почти нейтральной, или более отрицательной или положительной), и/или увеличивают транспорт в, или через жидкости и/или ткани организма, например, слизь. В некоторых вариантах осуществления материал, изменяющий свойства поверхности, оказывает прямой терапевтический эффект, например, уменьшает воспаление.
Примеры средств, изменяющих свойства поверхности, включают, но не ограничиваются ими, белки, в том числе анионные белки (например, альбумин), сурфактанты, сахара или производные сахаров (например, циклодекстрин), терапевтические средства и полимеры. Предпочтительные полимеры включают гепарин, полиэтиленгликоль («ПЭГ») и полоксомеры (блок-сополимеры полиэтиленоксида). Наиболее предпочтительным материалом является ПЭГ.
Примеры сурфактантов включают, но не ограничиваются ими, L-α-фосфатидилхолин (PC), 1,2-дипальмитоилфосфатидилхолин (DPPC), олеиновую кислоту, сорбитантриолеат, сорбитанмоноолеат, сорбитанмонолаурат, полиоксиэтилен (20) сорбитанмонолаурат, полиоксиэтилен (20) сорбитанмоноолеат, натуральный лецитин, олеилполиоксиэтилен (2) эфир, стеарилполиоксиэтилен (2) эфир, лаурилполиоксиэтилен (4) эфир, блок-сополимеры оксиэтилена и оксипропилена, синтетический лецитин, диэтиленгликольдиолеат, тетрагидрофурфурилолеат, этилолеат, изопропилмиристат, глицерилмоноолеат, глицерилмоностеарат, глицерилмонорицинолеат, цетиловый спирт, стеариловый спирт, полиэтиленгликоль 400, цетилпиридиния хлорид, бензалкония хлорид, оливковое масло, глицерилмонолаурат, кукурузное масло, хлопковое масло и подсолнечное масло, лецитин, олеиновую кислоту и сорбитантриолеат.
В одном варианте осуществления частицы покрыты или содержат полиэтиленгликоль (ПЭГ). ПЭГ можно наносить в качестве покрытия на поверхность частиц. Альтернативно, ПЭГ может находиться в форме блоков, связанных ковалентно (например, во внутренней части или на одном или обоих концах) с полимерным заполнителем, используемым для образования частиц. В конкретных вариантах осуществления частицы образованы из блок-сополимеров, содержащих ПЭГ. В более конкретных вариантах осуществления частицы получены из блок-сополимеров, содержащих ПЭГ, при этом ПЭГ ковалентно связан с концом основного полимера.
Репрезентативные значения молекулярной массы ПЭГ включают 300 Да, 600 Да, 1 кДа, 2 кДа, 3 кДа, 4 кДа, 6 кДа, 8 кДа, 10 кДа, 15 кДа, 20 кДа, 30 кДа, 50 кДа, 100 кДа, 200 кДа, 500 кДа, и 1 МДа, а также все значения в диапазоне от 300 Дальтон до 1 МДа. В предпочтительных вариантах осуществления ПЭГ имеет молекулярную массу примерно 5 кДа. ПЭГ с любой конкретной молекулярной массой может отличаться по другим характеристикам, таким как длина, плотность и ветвление.
i. Оценка поверхностной плотности
Поверхностная плотность поли(этиленгликоля) (ПЭГ) на наночастицах является ключевым параметром при определении их успешного применения in vivo. Контролируемая доставка лекарственных средств на поверхности слизистых оболочек является сложной задачей из-за наличия защитного слоя слизи, и проникающие в слизь частицы являются перспективными для улучшения распределения, удержания и эффективности лекарственных средств на поверхности слизистых оболочек. Плотное покрытие из ПЭГ на биоразлагаемых наночастицах может создать возможность для быстрого проникновения через слизь из-за значительно сниженного адгезионного взаимодействия между составляющими слизи и наночастицами. Однако по-прежнему остается неясным, как оптимально контролировать поверхностную плотность ПЭГ и получать биоразлагаемые, проникающие в слизь наночастицы, для применения in vivo.
Различные методы были использованы для оценки поверхностной плотности ПЭГ на наночастицах, включая те, которые позволяют непосредственно измерять изменения физико-химических свойств наночастиц, таких как поверхностный заряд и гидродинамический диаметр. Однако эти методы не могут предоставить количественную информацию о числе цепей ПЭГ на нм2 поверхности частицы.
Для того чтобы непосредственно количественно определять поверхностную плотность ПЭГ, использовали различные методы. Термогравиметрический анализ (TGA) можно использовать для расчета содержания ПЭГ, однако его применение ограничено неорганическими материалами и также требует использования относительно большого количества образцов.
Реакции красителей и реагентов (таких как флуоресцентные красители) с функциональным ПЭГ широко использовались для количественного определения ПЭГ. В этих методах непрореагировавшие молекулы ПЭГ с функциональными группами (такими как -SH, -NH2 и так далее) подсчитывали при помощи флуоресцентного анализа или колориметрического количественного определения после реакции с определенными реагентами, и поверхностную плотность ПЭГ получали путем вычитания доли непрореагировавшего ПЭГ в супернатанте. Однако эти методы имеют ограниченное применение для пегилированных поверхностей и функционального ПЭГ. Аналогичные методы, используемые для количественного определения поверхностной плотности ПЭГ на PRINT наночастицах путем измерения сигнала от непрореагировавшего меченого флуоресцеином ПЭГ в супернатанте, имеют ограниченное применение для модифицированной с помощью ПЭГ поверхности наночастиц. Таким образом, эти количественные анализы не подходят для определения плотности ПЭГ на биоразлагаемых наночастицах, полученных из содержащих ПЭГ блок-сополимеров, таких как широко используемые поли(молочная-co-гликолевая кислота)-поли(этиленгликоль) (PLGA-ПЭГ) и поли(молочная кислота)-поли(этиленгликоль) (PLA-ПЭГ).
Ядерный магнитный резонанс (ЯМР) можно использовать для оценки поверхностной плотности ПЭГ на ПЭГ-содержащих полимерных наночастицах, описанных в настоящем документе, как качественно, так и количественно (пик ПЭГ, как правило, наблюдается при ~3,65 ч./млн). При диспергировании наночастиц в растворителе для ЯМР D2O, только поверхностный ПЭГ, но не ПЭГ, находящийся в сердцевине, мог быть непосредственно обнаружен методом ЯМР. Таким образом, ЯМР обеспечивает возможность непосредственного измерения поверхностной плотности ПЭГ.
В некоторых вариантах осуществления поверхностную плотность ПЭГ можно контролировать, получая частицы из смеси пегилированных и не пегилированных частиц. Например, поверхностную плотность ПЭГ на PLGA наночастицах можно точно контролировать, получая частицы из смеси поли(молочная-co-гликолевая кислота) и поли(этиленгликоль) (PLGA-ПЭГ). Количественный 1H ядерный магнитный резонанс (ЯМР) можно использовать для измерения поверхностной плотности ПЭГ на наночастицах. Отслеживание множества частиц в человеческой слизи и изучение связывания с муцином и распределения в тканях влагалища мыши показало, что существует пороговая плотность ПЭГ, составляющая примерно 10-16 ПЭГ цепей/100 нм2, для эффективности PLGA-ПЭГ наночастиц при проникновении в слизь. Эта пороговая плотность может варьироваться в зависимости от различных факторов, включая полимерный заполнитель, используемый для получения частиц, размер частиц и/или молекулярную массу ПЭГ.
Плотность покрытия может варьироваться в зависимости от различных факторов, включая изменяющий свойства поверхности материал и состав частицы. В одном варианте осуществления плотность изменяющего свойства поверхности материала, такого как ПЭГ, измеренная методом 1H ЯМР, составляет по меньшей мере, 0,1, 0,2, 0,5, 0,8, 1, 2, 5, 8, 10, 15, 20, 25, 40, 50, 60, 75, 80, 90 или 100 цепей на нм2. Приведенный выше диапазон включает все значения от 0,1 до 100 единиц на нм2.
В конкретных вариантах осуществления плотность изменяющего свойства поверхности материала, такого как ПЭГ, составляет от примерно 1 до примерно 25 цепей/нм2, от примерно 1 до примерно 20 цепей/нм2, от примерно 5 до примерно 20 цепей/нм2, от примерно 5 до примерно 18 цепей/нм2, от примерно 5 до примерно 15 цепей/нм2, или от примерно 10 до примерно 15 цепей/нм2. Концентрация изменяющего свойства поверхности материала, такого как ПЭГ, также может варьироваться. В некоторых вариантах осуществления целевая концентрация изменяющего свойства поверхности материала, такого как ПЭГ, составляет по меньшей мере 0,5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25% или выше. Приведенный выше диапазон включает все значения от 0,5% до 25%. В другом варианте осуществления концентрация изменяющего свойства поверхности материала, такого как ПЭГ, в частице составляет по меньшей мере 0,5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25%. Приведенный выше диапазон включает все значения от 0,5% до 25%. В других вариантах осуществления содержание изменяющего свойства поверхности материала (например, ПЭГ) на поверхности частиц составляет по меньшей мере 0,5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25%. Приведенный выше диапазон включает все значения от 0,5% до 25%.
В конкретных вариантах осуществления плотность изменяющего свойства поверхности материала (например, ПЭГ) является такой, что изменяющий свойства поверхности материал (например, ПЭГ) принимает конфигурацию более объемной щетки.
В других вариантах осуществления масса изменяющего свойства поверхности фрагмента составляет по меньшей мере 1/10000, 1/7500, 1/5000, 1/4000, 1/3400, 1/2500, 1/2000, 1/1500, 1/1000, 1/750, 1/500, 1/250, 1/200, 1/150, 1/100, 1/75, 1/50, 1/25, 1/20, 1/5, 1/2 или 9/10 от массы частицы. Приведенный выше диапазон включает все значения от 1/10000 до 9/10.
C. Эмульгатор
Частицы, описанные в настоящем документе, содержат эмульгатор, в частности, низкомолекулярный эмульгатор. Эмульгатор включается в частицу в процессе образования частицы и, таким образом, является компонентом готовой частицы. Эмульгатор может быть инкапсулирован внутри частицы, быть диспергирован полностью или частично внутри полимерной матрицы (например, часть эмульгатора выступает за пределы полимерной матрицы) и/или связан (например, ковалентно или нековалентно) с поверхностью частицы.
Используемый в настоящем документе термин «низкомолекулярный», в целом, относится к эмульгатору, имеющему молекулярную массу менее 1500, 1400, 1300, 1200, 1100, 1000, 900, 800, 700, 600, 500, 400 или 300 а.е.м. В некоторых вариантах осуществления молекулярная масса составляет менее 1300 а.е.м. В некоторых вариантах осуществления молекулярная масса составляет от примерно 300 а.е.м. до примерно 1200 а.е.м.
Эмульгатор может быть положительно заряженным, отрицательно заряженным или нейтральным. Примеры отрицательно заряженных эмульгаторов включают, но не ограничиваются ими, натриевую соль холевой кислоты (CHA, ММ=430) и диоктил сульфосукцинат натрия (DSS, ММ=455). Примеры положительно заряженных эмульгаторов включают, но не ограничиваются ими, гексадецилтриметиламмоний бромид (CTAB, ММ=364). Примеры нейтральных эмульгаторов включают, но не ограничиваются ими, сапонин (ММ=1191), твин 20 (ММ=1225), твин 80 (ММ=1310) и сложный эфир сахара D1216 (лаурат сахарозы, SE, ММ=524).
Помимо обладания низкой молекулярной массой, эмульгатор должен быть способен соответствующим образом стабилизировать капли эмульсии в процессе образования частиц для предотвращения агрегации частиц. Эмульгирующую способность конкретного эмульгатора можно рассчитывать с использованием приведенного ниже уравнения и выражать в процентах.
Эмульгирующая способность = масса наночастиц/(масса наночастиц + масса агрегированных частиц) × 100%.
В некоторых вариантах осуществления эмульгирующая способность составляет по меньшей мере 50, 55, 60, 65, 70, 75, 80, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94 или 95%. Данный диапазон включает все значения от 50 до 95.
В дополнение к соответствующей стабилизации капель эмульсии для предотвращения образования агрегатов стабилизатор должен иметь достаточно небольшой размер, чтобы быть полностью экранированным на поверхности частицы короной из изменяющего свойства поверхности материала (например, ПЭГ) для обеспечения нейтрального или почти нейтрального поверхностного заряда. Перемещение заряженных частиц может быть затруднено из-за взаимодействия заряженных частиц с противоположно заряженными частицами in vivo. Например, способность частиц быстро проникать в слизь зависит, по меньшей мере частично, от поверхностного заряда частиц. Вследствие этого, эмульгатор(ы) должен иметь достаточно небольшой размер, чтобы заряд эмульгатора, если он имеет заряд (например, положительный или отрицательный), был экранирован короной изменяющего свойства поверхности материала (например, ПЭГ) таким образом, чтобы поверхностный заряд был равен нулю или практически равен нулю, например, от -10 до 10 эВ, от -5 до 5 эВ, от -3 до 3 эВ, от -2 до 2 эВ, или от -1 до 1 эВ.
D. Терапевтическое, профилактическое, нутрицевтическое и/или диагностическое средство
1. Терапевтические средства
В некоторых вариантах осуществления частицы содержат инкапсулированное в них, диспергированное в них и/или ковалентно или нековалентно связанное с поверхностью одно или более терапевтических средств. Терапевтическое средство может быть малой молекулой, белком, полисахаридом или сахаридом, молекулой нуклеиновой кислоты и/или липидом.
i. Низкомолекулярные терапевтические средства
Иллюстративные классы низкомолекулярных терапевтических средств включают, но не ограничиваются ими, анальгетики, противовоспалительные лекарственные средства, жаропонижающие, антидепрессанты, противоэпилептические препараты, антипсихотические средства, нейропротективные средства, антипролиферативные средства, такие как противораковое средство, антиинфекционные средства, такие как антибактериальные средства и противогрибковые средства, антигистаминные препараты, лекарственные средства против мигрени, антимускариновые препараты, транквилизаторы, седативные препараты, снотворные, антипсихотические препараты, бронходилятаторы, противоастматические лекарственные средства, сердечно-сосудистые лекарственные средства, кортикостероиды, дофаминергические препараты, электролиты, желудочно-кишечные лекарственные средства, миорелаксанты, питательные вещества, витамины, парасимпатомиметики, стимуляторы, анорексигенные препараты и препараты против нарколепсии.
ii. Нуклеиновые кислоты
В некоторых вариантах осуществления средство представляет собой одну или более из нуклеиновых кислот. Нуклеиновая кислота может изменять, корректировать или заменять эндогенную последовательность нуклеиновой кислоты. Нуклеиновую кислоту используют для лечения рака, для коррекции дефектов в генах при других легочных заболеваниях и метаболических заболеваниях, влияющих на легочную функцию, таких генах, как те, что используют для лечения болезни Паркинсона и БАС (ALS) в тех случаях, когда гены достигают мозга путем назального введения.
Генная терапия представляет собой метод коррекции дефектных генов, ответственных за развитие заболевания. Исследователи могут использовать один из нескольких подходов для коррекции дефектных генов:
- Нормальный ген можно вставлять в неспецифический участок в геноме для замены нефункционального гена. Такой подход является наиболее распространенным.
- Аномальный ген может быть заменен на нормальный ген путем гомологичной рекомбинации.
- Аномальный ген можно исправлять с помощью избирательной обратной мутации, которая возвращает ген в его нормальное функциональное состояние.
- Можно изменять регуляцию (состояние, в котором ген «включен» или «выключен») конкретного гена.
Нуклеиновая кислота может представлять собой ДНК, РНК, химически модифицированную нуклеиновую кислоту или их сочетание. Например, способы увеличения времени полураспада и устойчивости к ферментативному расщеплению нуклеиновой кислоты известны в данной области и могут включать одну или более модификаций или замен в нуклеиновых основаниях, сахарах или связях полинуклеотида. Нуклеиновую кислоту можно специально синтезировать так, чтобы она обладала свойствами, приспособленными для соответствия желаемому применению. Обычные модификации включают, но не ограничиваются ими, использование «закрытых» нуклеиновых кислот (LNA), «открытых» нуклеиновых кислот (UNA), морфолинов, пептид-нуклеиновых кислот (ПНК) (PNA), фосфоротиоатных связей, фосфоноацетатных связей, пропиновых аналогов, 2ʹ-O-метил-РНК, 5-Me-dC, 2ʹ-5ʹ-связанных фосфодиэфирных связей, химерных связей (смешанные фосфоротиоатные и фосфодиэфирные связи и модификации), конъюгации с липидом и пептидами, а также их сочетания.
В некоторых вариантах осуществления нуклеиновая кислота содержит модификации межнуклеотидных связей, например, фосфатные аналоги, имеющие ахиральные и незаряженные межсубъединичные связи (например, статья Sterchak, E. P. et al., Organic Chem., 52: 4202, (1987)), или незаряженные морфолино-содержащие полимеры, имеющие ахиральные межсубъединичные связи (смотри, например, патент США № 5034506). Некоторые аналоги межнуклеотидных связей включают морфолидат, ацеталь и полиамид-связанные гетероциклы. Другие модификации каркаса и связей включают, но не ограничиваются ими, фосфоротиоаты, пептидо-нуклеиновые кислоты, трицикло-ДНК, олигонуклеотиды-ловушки, рибозимы, шпигельмеры (содержащие L-нуклеиновые кислоты, аптамеры с высокой аффинностью связывания), или CpG олигомеры.
Фосфоротиоаты (или S-олигонуклеотиды) являются вариантом нормальной ДНК, в котором один из немостиковых атомов кислорода заменен атомом серы. Сульфуризация межнуклеотидной связи резко снижает действие эндо- и экзонуклеаз, включая 5ʹ-3ʹ и 3ʹ-5ʹ экзонуклеазу ДНК POL 1, нуклеазы S1 и P1, РНКазы, сывороточные нуклеазы и фосфодиэстеразу змеиного яда. Кроме того, возрастает потенциал для пересечения липидного бислоя. Благодаря этим важным усовершенствованиям, фосфоротиоаты нашли широкое применение в клеточной регуляции. Фосфоротиоаты получают двумя основными путями: путем воздействия раствором элементарной серы в дисульфиде углерода на водород фосфоната, или с помощью более нового метода сульфуризации фосфитных триэфиров либо тетраэтилтиурамдисульфидом (TETD), либо 3H-1,2-бензодитиол-3-он-1,1-диоксидом (BDTD).4 Последние методы позволяют избегать проблемы нерастворимости элементарной серы в большинстве органических растворителей и токсичности дисульфида углерода. Методы TETD и BDTD также позволяют получать фосфоротиоаты более высокой чистоты.
Пептидо-нуклеиновые кислоты (ПНК) представляют собой молекулы, в которых фосфатный каркас олигонуклеотидов заменен в полном объеме повторяющимися N-(2-аминоэтил)глициновыми единицами и фосфодиэфирные связи заменены пептидными связями. Различные гетероциклические основания связаны с каркасом метиленкарбонильными связями. В ПНК сохраняется расстояние между гетероциклическими основаниями как в олигонуклеотидах, однако они являются ахиральными и нейтрально заряженными молекулами. Пептидо-нуклеиновые кислоты, как правило, состоят из мономеров пептидо-нуклеиновых кислот. Гетероциклические основания могут быть любыми из стандартных оснований (урацил, тимин, цитозин, аденин и гуанин) или любыми из модифицированных гетероциклических оснований, описанных ниже. ПНК могут также иметь одну или более пептидных или аминокислотных вариаций и модификаций. Таким образом, каркасные составляющие в ПНК могут представлять собой пептидные связи, или альтернативно, они могут представлять собой непептидные связи. Примеры включают ацетильные кэпы, амино-спейсеры, такие как 8-амино-3,6-диоксаоктановая кислота (называемые в настоящем документе O-линкерами), и тому подобное. Методы химической сборки ПНК хорошо известны.
В некоторых вариантах осуществления нуклеиновая кислота содержит одно или более из химически модифицированных гетероциклических оснований, включая, но не ограничиваясь ими, инозин, 5-(1-пропинил)урацил (pU), 5-(1-пропинил)цитозин (pC), 5-метилцитозин, 8-оксоаденин, псевдоцитозин, псевдоизоцитозин, 5 и 2-амино-5-(2ʹ-дезокси-β-D-рибофуранoзил)пиридин(2-аминопиридин), а также различные пирроло- и пиразолoпиримидиновые производные, 4-ацетилцитозин, 8-гидрокси-N-6-метиладенозин, азиридинилцитозин, 5-(карбоксигидроксилметил)урацил, 5-бромурацил, 5-карбоксиметиламинометил-2-тиоурацил, 5-карбоксиметиламинометилурацил, дигидроурацил, N6-изопентениладенин, 1-метиладенин, 1-метилпсевдоурацил, 1-метилгуанин, 1-метилинозин, 2,2-диметилгуанин, 2-метиладенин, 2-метилгуанин, 3-метилцитозин, N6-метиладенин, 7-метилгуанин, 5-метиламинометилурацил, 5-метоксиаминометил-2-тиоурацил, бета-D-маннозилквеозин, 5ʹ-метоксикарбонилметилурацил, 5-метоксиурацил, 2-метилтио-N6-изопентениладенин, сложный метиловый эфир урацил-5-оксиуксусной кислоты, урацил-5-оксиуксусную кислоту, оксибутоксозин, псевдоурацил, квеозин, 2-тиоцитозин, 5-метил-2-тиоурацил, 2-тиоурацил, 4-тиоурацил, 5-метилурацил, сложный метиловый эфир N-урацил-5-оксиуксусной кислоты, 2,6-диаминопурин, а также 2ʹ-модифицированные аналоги, такие как, но не ограничиваясь ими, O-метил, амино- и фтор-модифицированные аналоги. Ингибирующие РНК, модифицированные при помощи 2ʹ-фтор(2ʹ-F)пиримидинов, судя по всему, обладают полезными свойствами in vitro. Более того, недавно в одной публикации было высказано предположение, что 2ʹ-F-модифицированные миРНК обладают повышенной активностью в культуре клеток по сравнению с содержащими 2ʹ-OH миРНК. 2ʹ-F-модифицированные миРНК являются функциональными у мышей, но они не обязательно обладают повышенной внутриклеточной активностью по сравнению с 2ʹ-OH миРНК.
В некоторых вариантах осуществления нуклеиновая кислота содержит одну или более модификаций сахарного фрагмента, включая, но не ограничиваясь ими, 2ʹ-O-аминоэтокси, 2ʹ-O-аммониоэтил (2ʹ-OAE), 2ʹ-O-метокси, 2ʹ-O-метил, 2-гуанидоэтил (2ʹ-OGE), 2ʹ-O,4ʹ-C-метилен (LNA), 2ʹ-O-(метоксиэтил) (2ʹ-OME) и 2ʹ-O-(N-(метил)ацетамидо) (2ʹ-OMA).
Методы генной терапии, как правило, основаны на введении в клетку молекулы нуклеиновой кислоты, которая изменяет генотип клетки. Введение молекулы нуклеиновой кислоты позволяет корректировать, заменять или иным образом изменять эндогенный ген посредством генетической рекомбинации. Методы могут включать введение целой замещающей копии дефектного гена, гетерологичного гена или низкомолекулярной нуклеиновой кислоты, такой как олигонуклеотид. Например, корректирующий ген можно вводить в неспецифический участок в геноме хозяина. Для такого подхода, как правило, необходимы системы доставки для введения замещающего гена в клетку, такие как полученные методами генетической инженерии вирусные векторы.
Методы конструирования экспрессионных векторов, содержащих генетические последовательности и соответствующие элементы контроля транскрипции и трансляции, хорошо известны в данной области. Такие методы включают методы рекомбинантной ДНК in vitro, методы синтеза и методы генетической рекомбинации in vivo. Экспрессионные векторы, как правило, содержат регуляторные последовательности, необходимые для трансляции и/или транскрипции введенных кодирующих последовательностей. Например, кодирующая последовательность предпочтительно функционально связана с промотором и/или энхансером для облегчения контроля экспрессии желаемого продукта гена. Промоторы, используемые в биотехнологии, бывают различных типов, в соответствии с желаемым типом контроля экспрессии гена. В целом, их можно разделять на конститутивные промоторы, тканеспецифичные или специфичные для стадии развития промоторы, индуцибельные промоторы и синтетические промоторы.
Вирусные векторы включают аденовирус, аденоассоциированный вирус, вирус герпеса, вирус осповакцины, вирус полиомиелита, вирус СПИДа, нейрональный трофический вирус, Синдбис и другие РНК-содержащие вирусы, включая вирусы на основе ВИЧ. Также полезными являются любые семейства вирусов, имеющих общие свойства с указанными вирусами, что делает их подходящими для использования в качестве векторов. Как правило, вирусные векторы содержат неструктурные ранние гены, структурные поздние гены, транскрипт РНК-полимеразы III, инвертированные концевые повторы, необходимые для репликации и инкапсидации, а также промоторы для контроля транскрипции и репликации вирусного генома. При конструировании векторов у вирусов, как правило, удаляют один или более из ранних генов, и ген или кассету ген/промотор вставляют в вирусный геном вместо удаленной вирусной ДНК.
Направленное воздействие на гены путем целевой рекомбинации, такой как гомологичная рекомбинация (HR), является другой стратегией для коррекции генов. Коррекция гена в целевом локусе может быть опосредована донорскими фрагментами ДНК, гомологичными целевому гену (Hu, et al., Mol. Biotech., 29: 197-210 (2005); Olsen, et al., J. Gene Med., 7: 1534-1544 (2005)). Один из способов целевой рекомбинации включает использование образующих триплекс олигонуклеотидов (TFO), которые связываются в виде третьих цепей с сайтами гомопурина/гомопиримидина в дуплексе ДНК специфическим для последовательности образом. Образующие триплекс олигонуклеотиды могут взаимодействовать с любыми двухцепочечными или одноцепочечными нуклеиновыми кислотами. Когда образующие триплекс молекулы взаимодействуют с целевой областью, образуется структура, называемая триплексом, в которой имеются три цепи ДНК, образующие комплекс, зависящий от спаривания оснований, как по принципу Уотсона-Крика, так и по принципу Хугстена. Образующие триплекс молекулы являются предпочтительными, поскольку они способны связывать целевые области с высокой аффинностью и специфичностью. Предпочтительно, если образующие триплекс молекулы связывают целевую молекулу с Кd менее чем 10-6, 10-8, 10-10 или 10-12.
Методы направленной генной терапии с использованием образующих триплекс олигонуклеотидов (TFOʹs) и пептид-нуклеиновых кислот (ПНК) описаны в опубликованной заявке на патент США № 2007/0219122, и их применение для лечения инфекционных заболеваний, таких как ВИЧ, описаны в опубликованной заявке на патент США № 2008/050920. Образующие триплекс молекулы также могут иметь присоединенные к концу пептид-нуклеиновые кислоты (tcPNA), например, те, которые описаны в опубликованной заявке на патент США № 2011/0262406. Высокостабильные триплексные структуры ПНК:ДНК:ПНК могут быть образованы в результате внедрения в дуплекс ДНК двух цепей ПНК. В этом комплексе как трехцепочечная часть ПНК/ДНК/ПНК, так и дуплексная часть ПНК/ДНК, обе производят смещение богатой пиримидинами тройной спирали, создавая измененную структуру, которая, как было показано, усиленно провоцирует путь нуклеотид-эксцизионной репарации и активирует сайт для рекомбинации с донорским олигонуклеотидом. Две цепи ПНК также могут быть связаны вместе, образуя молекулу бис-ПНК. Образующие триплекс молекулы полезны для индукции сайт-специфической гомологичной рекомбинации в клетках млекопитающих при использовании в сочетании с одним или более донорскими олигонуклеотидами, которые приводят к образованию скорректированной последовательности. Донорские олигонуклеотиды могут быть связаны с образующими триплекс молекулами или могут присутствовать отдельно от образующих триплекс молекул. Донорские олигонуклеотиды могут содержать по меньшей мере одну нуклеотидную мутацию, вставку или делецию относительно целевой дуплексной ДНК.
Образующие двойной дуплекс молекулы, такие как пара псевдокомплементарных олигонуклеотидов, также могут индуцировать рекомбинацию с донорским олигонуклеотидом на хромосомной сайте. Применение псевдокомплементарных олигонуклеотидов в направленной генной терапии описано в опубликованной заявке на патент США №2011/0262406. Псевдокомплементарные олигонуклеотиды представляют собой комплементарные олигонуклеотиды, которые содержат одну или более модификаций, так что они не узнают или не гибридизуются друг с другом, например, из-за пространственных затруднений, однако каждый способен узнавать и гибридизоваться с комплементарными цепями нуклеиновой кислоты в целевом сайте. В некоторых вариантах осуществления псевдокомплементарные олигонуклеотиды представляют собой псевдокомплементарные пептид-нуклеиновые кислоты (пкПНК) (pcPNA). Псевдокомплементарные олигонуклеотиды могут быть более эффективными и обеспечивать большую гибкость, чем методы индуцированной рекомбинации, такие как трехспиральные олигонуклеотиды и бис-пептид-нуклеиновые кислоты, для которых необходима полипуриновая последовательность в целевой двухцепочечной ДНК.
2. Диагностические средства
Иллюстративные диагностические материалы включают парамагнитные молекулы, флуоресцентные соединения, магнитные молекулы и радиоактивные изотопы. Подходящие диагностические средства включают, но не ограничиваются ими, средства для рентгеновской визуализации и контрастные вещества. Радиоактивные изотопы также можно использовать в качестве визуализирующих средств. Примеры других подходящих контрастных веществ включают газы или выделяющие газ соединения, которые являются рентгеноконтрастными. Наночастицы могут дополнительно содержать средства, полезные для определения локализации введенных частиц. Средства, полезные для этой цели, включают флуоресцентные маркеры, радиоактивные изотопы и контрастные вещества.
Для тех вариантов осуществления, в которых одно или более из терапевтических, профилактических и/или диагностических средств инкапсулированы в полимерную наночастицу и/или связаны с поверхностью наночастицы, процент нагрузки лекарственного средства составляет от примерно 1% до примерно 80%, от примерно 1% до примерно 50%, предпочтительно от примерно 1% до примерно 40% по массе, более предпочтительно от примерно 1% до примерно 20% по массе, наиболее предпочтительно от примерно 1% до примерно 10% по массе. Приведенные выше диапазоны включают все значения от 1% до 80%. Для тех вариантов осуществления, в которых средство связано с поверхностью частицы, процент нагрузки может быть выше, поскольку количество лекарственного средства не ограничено методами инкапсуляции. В некоторых вариантах осуществления средство, которое предстоит доставлять, может быть инкапсулировано в наночастицу и связано с поверхностью частицы. Нутрицевтики также могут быть включены. Ими могут быть витамины, добавки, такие как кальций или биотин, или натуральные ингредиенты, такие как растительные экстракты или фитогормоны.
E. Свойства частиц
1. Поверхностный заряд и размер частиц
Для облегчения их диффузии через слизь, наночастицы описанные в настоящем документе, как правило, имеют почти нейтральный поверхностный заряд. В некоторых вариантах осуществления наночастица имеет ξ-потенциал от примерно 10 мВ до примерно -10 мВ, предпочтительно от примерно 5 мВ до примерно -5 мВ, предпочтительно от примерно 3 мВ до примерно -3 мВ, более предпочтительно от примерно 2 мВ до примерно -2 мВ. Как обсуждалось выше, частицы, описанные в настоящем документе, содержат один или более низкомолекулярных эмульгаторов. Эмульгатор может быть нейтральным, в этом случае эмульгатор оказывает небольшое влияние или вовсе не оказывает влияния на поверхностный заряд частицы. Однако в некоторых случаях эмульгатор бывает положительно или отрицательно заряжен. В этих вариантах осуществления изменяющий свойства поверхности материал (например, ПЭГ) должен присутствовать в достаточной плотности, чтобы образовывать корону, которая экранирует положительно или отрицательно заряженный эмульгатор, создавая эффективно нейтральную поверхность.
Частицы, описанные в настоящем документе, называются наночастицами и, таким образом, как правило, имеют средний диаметр в диапазоне от 1 нм вплоть до, но, не включая, примерно 1 микрон, более предпочтительно от примерно 5 нм до примерно 500 нм, наиболее предпочтительно от примерно 5 нм до примерно 100 нм. В некоторых вариантах осуществления средний диаметр частиц составляет от примерно 100 нм до примерно 150 нм. Однако можно получать частицы, имеющие размеры в микронном диапазоне. Условия и/или материалы, используемые для получения частиц, можно изменять для изменения размера частиц.
В некоторых вариантах осуществления наночастицы сохраняют свой размер и ξ-потенциал после распыления или хранения в течение по меньшей мере 1 месяца, более предпочтительно по меньшей мере 2 месяцев, наиболее предпочтительно по меньшей мере 3 месяцев при 4°С.
2. Эффект эмульгатора на способность к перемещению
В некоторых вариантах осуществления частицы вводят, чтобы они проникали в слизь для доставки лекарственного средства к слизистой оболочке. Частицы, описанные в настоящем документе, содержат изменяющий свойства поверхности материал, который может облегчать перемещение через слизь. Например, содержащие ПЭГ блок-сополимеры могут самостоятельно собираться, образуя плотные, инертные для слизи ПЭГ покрытия на поверхности капель эмульсии, образованных при эмульгировании, но только при использовании эмульгаторов с низкой молекулярной массой (ММ) вместо общепринятых эмульгаторов с очень высокой молекулярной массой или высокой молекулярной массой, таких как ПВС. Эмульгаторы с низкой ММ создают, в среднем, в несколько тысяч раз большее среднеквадратичное смещение (<MSD>) наночастиц в CVM, на временной шкале 1 с, по сравнению с наночастицами, полученными с использованием эмульгаторов с высокой ММ.
Кроме того, частицы, описанные в настоящем документе, проникают в CVM с эффективными скоростями, которые менее чем в 10 раз ниже, чем у тех же частиц в воде. Например, также были оценены содержащие ПЭГ диблок-сополимеры, поли(молочная кислота)-b-ПЭГ5k (PLA-ПЭГ5k, Mn ~95 кДа) и поли(ε-капролактон)-b-ПЭГ5k (PCL-ПЭГ5k, Mn ~78 кДа). Наночастицы, полученные из этих двух полимеров и ПВС были иммобилизованы в CVM, тогда как быстрое проникновение в слизь наблюдали для наночастиц, полученных с использованием эмульгатора с низкой ММ, CHA, с эффективными коэффициентами диффузии, сходными с теми, которые были измерены для PLGA-ПЭГ5k наночастиц.
В некоторых вариантах осуществления частицы, описанные в настоящем документе (полученные с низкомолекулярным эмульгатором), демонстрировали скорости перемещения, по меньшей мере в 500, 1000, 1500, 2000, 2500, 3000, 3500, 4000, 4500, 5000, 5500, 6000, 7000, 8000, 9000 или 10000 раз большие, чем частицы, полученные с ПВС, и/или демонстрировали эффективные скорости, менее чем в 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4 или 3 раз ниже, чем у тех же частиц в воде.
В отсутствие ПЭГ PLGA/CHA наночастицы имели высокий анионный поверхностный заряд и были мукоадгезивными. Напротив, поверхностный заряд проникающих в слизь PLGA-ПЭГ5k/CHA наночастиц был близким к нейтральному, что предполагало образование плотного ПЭГ покрытия, которое маскировало отрицательный заряд PLGA и CHA. Концентрация эмульгаторов с низкой ММ не оказывала существенного влияния на поверхностный заряд и способность проникать в слизь наночастиц, вероятно потому, что корона ПЭГ полностью экранировала эти молекулы на поверхности частиц.
Кроме того, собственный заряд, связанный с эмульгатором (DSS и CHA заряжены отрицательно, CTAB заряжен положительно, сапонин, витамин-E TPGS, твин 20, твин 80 и SE заряжены нейтрально), имел слабое, или вовсе не имел влияния на поверхностный заряд и способность проникать в слизь, дополнительно свидетельствуя в пользу роли короны ПЭГ в экранировании этих молекул эмульгатора с низкой ММ на поверхности частицы.
Выбор эмульгатора также влиял на степень образования щеточной структуры ПЭГ во время процесса эмульгирования. Например, при том что как PLGA-ПЭГ5k/ПВС наночастицы, так и PLGA-ПЭГ5k/CHA наночастицы имеют почти нейтральные поверхностные заряды, только препараты с CHA способны проникать в слизь. ПВС и PEMA отличаются от других эмульгаторов, поскольку они содержат линейный гидрофобный каркас с гидрофильными боковыми группами. Возможно, что когда ПВС или PEMA стабилизирует поверхность раздела масло/вода, гидрофобный полимерный каркас может поливалентно прикрепляться к поверхности раздела масло/вода, где он находится в непосредственном контакте с выступающей щеткой ПЭГ. Таким образом, ПВС и PEMA могут нарушать архитектуру молекул ПЭГ на поверхности частицы, тем самым, делая частицы мукоадгезивными. В случае PLGA-ПЭГ5k/PEMA наночастиц, отрицательный поверхностный заряд (-42 мВ) предполагает разрушение ПЭГ покрытия, поскольку заряд, скорее всего, возникает от молекул PEMA, экспонированных на поверхности.
Однако не все эмульгаторы с низкой ММ подходят для получения MPP. Например, кремофор EL, твин 80, витамин-E TPGS, плюроник FI27 и F68 были неспособны полностью стабилизировать капли эмульсии в процессе получения частиц, что приводило к образованию в различной степени крупных агрегатов. Хотя фракции неагрегированных наночастиц, полученных таким образом, проникали в слизь, выход наночастиц составлял всего 30%. Таким образом, возможность получать MPP из содержащих ПЭГ блок-сополимеров методом эмульгирования критически зависит как от ММ, так и от эмульгирующей способности эмульгатора. Эмульгирующую способность эмульгаторов оценивали на основании процента неагрегированных PLGA-ПЭГ наночастиц, полученных в водной фазе, содержащей 1% эмульгатора. Эмульгаторы должны быть достаточно сильными, чтобы стабилизировать капли эмульсии, и в тоже время достаточно небольшими, чтобы полностью экранироваться на поверхности частицы короной из ПЭГ.
Все PLGA-ПЭГ/CHA наночастицы с широким диапазоном ММ ПЭГ (1, 2, 5 и 10 кДа), полученные методом эмульгирования, быстро проникали в слизь. Поверхностный заряд наночастиц был обратно пропорционален ММ ПЭГ и варьировался от -18 мВ (1 кДа) до -2,3 мВ (10 кДа). Поверхностная плотность ПЭГ [Г] (число молекул ПЭГ на 100 нм2), измеренная методом 1H ЯМР, уменьшается по мере увеличения ММ ПЭГ. Однако отношение [Г/Г*] поверхностной плотности ПЭГ к теоретической плотности ПЭГ, необходимой для образования щеточного ПЭГ покрытия [Г*], было больше 2, невзирая на ММ ПЭГ, что указывает на присутствие густого щеточного покрытия из ПЭГ на поверхности PLGA-ПЭГ(1-10 кДа)/CHA наночастиц. Образование густой ПЭГ щетки на поверхности частиц, по-видимому, необходимо для проникновения в слизь.
Было подтверждено, что как гидрофобные, так и гидрофильные лекарственные средства можно эффективно инкапсулировать в PLGA-ПЭГ MPP. Два модельных соединения: куркумин, гидрофобное лекарственное средство (ММ=368 Да), и БСА, гидрофильный белок (ММ=66 кДа), были инкапсулированы с использованием простой эмульсии м/в в PLGA-ПЭГ5k/CHA наночастицы и двойной эмульсии в/м/в в PLGA-ПЭГ5k/сапонин наночастицы, соответственно. Эффективность инкапсуляции как гидрофобного куркумина, так и гидрофильного БСА в MPP с использованием эмульгаторов с низкой ММ была аналогична той, которая достигается для обычных частиц (CP) при использовании метода эмульгирования с ПВС.
Нагруженные куркумином и БСА наночастицы быстро диффундировали в слизь со скоростями, лишь в 6 и 36 раз меньшими, чем в воде за τ=1 с, соответственно. С другой стороны, наночастицы, полученные с помощью ПВС, были иммобилизованы в CVM, со скоростями перемещения, более чем в 2000 раз меньшими, чем в воде. Ожидалось, что значительная фракция, вплоть до 40% и 30% для куркумин-MPP и БСА-MPP, соответственно, проникнет в слои слизи физиологической толщины за 60 мин, при этом предполагалось, что <1% покрытых ПВС наночастиц будут способны на это.
III. Фармацевтические композиции
Препараты, описанные в настоящем документе, содержат эффективное количество наночастиц в фармацевтическом носителе, подходящем для введения на поверхность слизистой оболочки. Препараты можно вводить парентерально (например, путем инъекции или инфузии), локально (например, в глаз), или легочным введением.
A. Легочные препараты
Фармацевтические препараты и способы легочного введения активных средств пациентам известны в данной области.
Дыхательные пути являются структурой, участвующей в газообмене между атмосферой и кровотоком. Дыхательные пути охватывают верхние дыхательные пути, включая ротоглотку и гортань, за которыми следуют нижние дыхательные пути, включающие трахею, далее разветвляющуюся на бронхи и бронхиолы. Верхние и нижние дыхательные пути называются проводящими дыхательными путями. Концевые бронхиолы затем делятся на дыхательные бронхиолы, которые затем подходят к конечной дыхательной зоне, альвеолам, или глубокой части легких, где происходит газообмен.
Препараты можно разделять на сухие порошковые препараты и жидкие препараты. Как сухие порошковые, так и жидкие препараты можно использовать для получения аэрозольных препаратов. Используемый в настоящем документе термин «аэрозоль» относится к любому препарату из мелко распыленных частиц, которые могут быть в растворе или суспензии, получаемому с использованием или без использования пропеллента.
I. Сухие порошковые препараты
Сухие порошковые препараты представляют собой тонко измельченные твердые препараты, содержащие носители в виде наночастиц, которые подходят для легочного введения. Сухие порошковые препараты включают, как минимум, один или более носителей в виде наночастиц, которые подходят для легочного введения. Такие сухие порошковые препараты можно вводить путем легочной ингаляции пациенту без использования какого-либо носителя, кроме воздуха или подходящего пропеллента.
В других вариантах осуществления сухие порошковые препараты содержат один или более носителей генов в виде наночастиц в сочетании с фармацевтически приемлемым носителем. В этих вариантах осуществления носители генов в виде наночастиц и фармацевтический носитель можно преобразовывать в нано- или микрочастицы для доставки в легкие.
Фармацевтический носитель может включать наполнитель или липид, или сурфактант. Природные сурфактанты, такие как дипальмитоилфосфатидилхолин (DPPC), являются наиболее предпочтительными. Синтетические и животного происхождения легочные сурфактанты включают:
Синтетические легочные сурфактанты
Экзосурф - смесь DPPC с гексадеканолом и тилоксаполом, добавленными в качестве усиливающих растекание добавок
Пумактант (искусственное расширяющее легкие соединение или ALEC) - смесь DPPC и PG
KL-4 - состоит из DPPC, пальмитоилолеоилфосфатидилглицерина и пальмитиновой кислоты, скомбинированных с синтетическим пептидом из 21 аминокислоты, который имитирует структурные характеристики SP-B.
Вентикут - DPPC, PG, пальмитиновая кислота и рекомбинантный SP-C
Сурфактанты животного происхождения
Альвеофакт - экстрагирован из промывной жидкости легких коровы
Куросурф - экстрагирован из материала, полученного из измельченных легких свиньи
Инфасурф - экстрагирован из промывной жидкости легких теленка
Сурванта - экстрагирован из измельченных легких коровы с добавлением DPPC, пальмитиновой кислоты и трипальмитина
Экзосурф, куросурф, инфасурф и сурванта являются сурфактантами, в настоящее время одобренными FDA для использования в США.
Фармацевтический носитель может также включать один или более стабилизаторов или диспергирующих средств. Фармацевтический носитель может также включать один или более регуляторов рН или буферов. Подходящие буферы включают органические соли, полученные из органических кислот и оснований, например, цитрат натрия или аскорбат натрия. Фармацевтический носитель может также включать одну или более солей, таких как хлорид натрия или хлорид калия.
Сухие порошковые препараты, как правило, получают путем смешивания одного или более носителей в виде наночастиц с одним или более из фармацевтически приемлемых носителей. Необязательно, в смесь можно включать дополнительные активные средства, как описано ниже. Смесь затем формуют в частицы, подходящие для легочного введения, с использованием методов, известных в данной области, таких как лиофилизация, сушка распылением, агломерация, покрытие распылением, коацервация, низкотемпературное литье, размалывание (например, воздушно-абразивное размалывание (размалывание на струйной мельнице), размалывание на шаровой мельнице), гомогенизация высокого давления и/или кристаллизация сверхкритической жидкости.
Подходящий метод получения частиц можно выбирать, исходя из желаемого размера частиц, распределения частиц по размерам и морфологии частиц, нужной для формулирования. В некоторых случаях метод получения частиц выбирают так, чтобы получить популяцию частиц с желаемым размером частиц и распределением частиц по размерам для легочного введения. Альтернативно, методом получения частиц можно получать популяцию частиц, из которой популяцию частиц с желаемым размером частиц и распределением частиц по размерам для легочного введения выделяют, например, просеиванием.
В данной области известно, что морфология частиц влияет на глубину проникновения частицы в легкое. Соответственно, сухие порошковые препараты преобразуют в частицы, имеющие подходящий средний массовый аэродинамический диаметр (MMAD), плотность утряски и шероховатость поверхности для обеспечения доставки одного или более активных средств в желаемую область(и) легкого. Например, предпочтительные морфологии частиц для доставки в глубокие легкие известны в данной области и описаны, например, в патенте США № 7052678, выданном Vanbever et al.
Частицы, имеющие средний массовый аэродинамический диаметр (MMAD) больше, чем примерно несколько микрон, как правило, не достигают легких; вместо этого они, как правило, сталкиваются с задней стенкой горла и проглатываются. Частицы, имеющие диаметры от примерно 3 до примерно 5 микрон, достаточно малы, чтобы достигать верхней и средней области легкого (проводящих дыхательных путей), однако могут быть слишком велики, чтобы достигать альвеол. Частицы меньшего размера (то есть, от примерно 0,5 до примерно 3 микрон) способны эффективно достигать области альвеол. Частицы, имеющие диаметры меньше, чем примерно 0,5 микрон, также могут откладываться в области альвеол за счет седиментации.
Точный диапазон размеров частиц, эффективный для обеспечения доставки в область альвеол, будет зависеть от нескольких факторов, включая плотность утряски доставляемых частиц. Вообще говоря, по мере снижения плотности утряски MMAD частиц, способных эффективно достигать области альвеол в легких, возрастает. Вследствие этого, в случае частиц с низкими значениями плотности утряски, частицы, имеющие диаметры от примерно 3 до примерно 5 микрон, от примерно 5 до примерно 7 микрон или от примерно 7 до примерно 9,5 микрон, могут быть эффективно доставлены в легкие. Предпочтительный аэродинамический диаметр для максимального осаждения в легких можно рассчитать. Смотри, например, патент США № 7052678, выданный Vanbever et al.
Микрочастицы не могут диффундировать через слизь, даже если их поверхность является устойчивой к слизи. Однако проникающие в слизь частицы могут быть инкапсулированы в микрочастицы для попадания в верхний отдел легких и последующего высвобождения наночастиц. В некоторых вариантах осуществления сухой порошковый препарат состоит из множества частиц, имеющих средний массовый аэродинамический диаметр от примерно 0,05 до примерно 10 микрон, более предпочтительно от примерно 0,05 микрон до примерно 7 микрон, наиболее предпочтительно от примерно 0,05 до примерно 5 микрон. В некоторых вариантах осуществления сухой порошковый препарат состоит из множества частиц, имеющих средний массовый аэродинамический диаметр от примерно 0,05 микрон до примерно 3 микрон, более предпочтительно от примерно 0,05 микрон до примерно 1 микрон, более предпочтительно от примерно 0,05 микрон до примерно 0,7 микрон. В некоторых вариантах осуществления сухой порошковый препарат состоит из множества частиц, имеющих средний массовый аэродинамический диаметр от примерно 3 до примерно 5 микрон. В некоторых вариантах осуществления сухой порошковый препарат состоит из множества частиц, имеющих средний массовый аэродинамический диаметр от примерно 5 до примерно 7 микрон. В некоторых вариантах осуществления сухой порошковый препарат состоит из множества частиц, имеющих средний массовый аэродинамический диаметр от примерно 7 до примерно 9,5 микрон.
В некоторых случаях может быть преимуществом доставка частиц с диаметром больше, чем примерно 3 микрон. Фагоцитоз частиц альвеолярными макрофагами резко уменьшается с увеличением диаметра частиц за пределы примерно 3 мкм. Kawaguchi, H., et al., Biomaterials 7: 61-66 (1986); Krenis, L. J. and Strauss, B., Proc. Soc. Exp. Med., 107: 748-750 (1961); и Rudt, S. and Muller, R.H., J. Contr. Rel, 22: 263-272 (1992). При введении частиц с аэродинамическим объемом более, чем 3 микрона, фагоцитарное поглощение альвеолярными макрофагами и клиренс из легких может быть сведен к минимуму.
В некоторых вариантах осуществления по меньшей мере примерно 80%, более предпочтительно по меньшей мере примерно 90%, наиболее предпочтительно по меньшей мере примерно 95% частиц в сухом порошковом препарате имеют аэродинамический диаметр меньше чем 10, 9, 8, 7, 6 или 5 микрон. В некоторых вариантах осуществления по меньшей мере примерно 80%, более предпочтительно по меньшей мере примерно 90%, наиболее предпочтительно по меньшей мере примерно 95% частиц в сухом порошковом препарате имеют аэродинамический диаметр больше чем примерно 0,03 микрон.
В некоторых вариантах осуществления по меньшей мере примерно 80%, более предпочтительно по меньшей мере примерно 90%, наиболее предпочтительно по меньшей мере примерно 95% частиц в сухом порошковом препарате имеют аэродинамический диаметр больше чем примерно 0,03 микрон и меньше чем примерно 10 микрон, более предпочтительно, больше чем примерно 0,03 микрон и меньше чем примерно 7 микрон, наиболее предпочтительно больше чем примерно 0,03 микрон и меньше чем примерно 5 микрон. В некоторых вариантах осуществления по меньшей мере примерно 80%, более предпочтительно по меньшей мере примерно 90%, наиболее предпочтительно по меньшей мере примерно 95% частиц в сухом порошковом препарате имеют аэродинамический диаметр больше чем примерно 0,03 микрон и меньше чем примерно 3 микрон. В некоторых вариантах осуществления, по меньшей мере примерно 80%, более предпочтительно по меньшей мере примерно 90%, наиболее предпочтительно по меньшей мере примерно 95% частиц в сухом порошковом препарате имеют аэродинамический диаметр больше чем примерно 0,03 микрон и меньше чем примерно 5 микрон. В некоторых вариантах осуществления по меньшей мере примерно 80%, более предпочтительно по меньшей мере примерно 90%, наиболее предпочтительно по меньшей мере примерно 95% частиц в сухом порошковом препарате имеют аэродинамический диаметр больше чем примерно 0,03 микрон и меньше чем примерно 7 микрон. В некоторых вариантах осуществления, по меньшей мере примерно 80%, более предпочтительно по меньшей мере примерно 90%, наиболее предпочтительно по меньшей мере примерно 95% частиц в сухом порошковом препарате имеют аэродинамический диаметр больше чем примерно 0,03 микрон и меньше чем примерно 9,5 микрон.
В некоторых вариантах осуществления частицы имеют плотность утряски меньше чем примерно 0,4 г/см3, более предпочтительно меньше чем примерно 0,25 г/см3, наиболее предпочтительно меньше чем примерно 0,1 г/см3. Особенности, которые могут способствовать низкой плотности утряски, включают неровную текстуру поверхности и пористую структуру.
В некоторых случаях частицы бывают сферической или яйцевидной формы. Частицы могут иметь гладкую или шероховатую текстуру поверхности. Частицы также могут быть покрыты полимером или другим подходящим материалом для контроля высвобождения одного или более активных средств в легких.
Сухие порошковые препараты можно вводить в виде сухого порошка с использованием подходящих способов, известных в данной области. Альтернативно, сухие порошковые препараты можно суспендировать в жидком препарате, как описано ниже, и вводить в легкие с использованием способов, известных в данной области для доставки жидких препаратов.
2. Жидкие препараты
Жидкие препараты содержат один или более носителей в виде наночастиц, суспендированных в жидком фармацевтическом носителе.
Подходящие жидкие носители включают, но не ограничиваются ими, дистиллированную воду, деионизированную воду, чистую или сверхчистую воду, солевой раствор, а также другие физиологически приемлемые водные растворы, содержащие соли и/или буферы, такие как фосфатно-солевой буфер (PBS), раствор Рингера и изотонический хлорид натрия, либо любой другой водный раствор, приемлемый для введения в организм животного или человека.
Предпочтительно, жидкие препараты являются изотоническими относительно физиологических жидкостей и имеют примерно такое же значение pH, например, в диапазоне от примерно pH 4,0 до примерно pH 7,4, более предпочтительно от примерно pH 6,0 до pH 7,0. Жидкий фармацевтический носитель может содержать один или более, физиологически совместимых буферов, таких как фосфатные буферы. Специалист в данной области может легко определять подходящий солевой состав и pH для водного раствора, предназначенного для легочного введения.
Жидкие препараты могут содержать одно или более суспендирующих средств, таких как производные целлюлозы, натрия альгинат, поливинилпирролидон, трагакантовая камедь или лецитин. Жидкие препараты могут также содержать один или более консервантов, таких как этил или н-пропил-п-гидроксибензоат.
В некоторых случаях жидкий препарат может содержать один или более растворителей, которые являются низкотоксичными органическими (то есть, неводными) остаточными растворителями 3 класса, такими как этанол, ацетон, этилацетат, тетрагидрофуран, этиловый эфир и пропанол. Эти растворители можно выбирать, исходя из их способности легко аэрозолизировать препарат. Любой такой растворитель, включенный в жидкий препарат, не должен отрицательно реагировать с одним или более активными средствами, присутствующими в жидком препарате. Растворитель должен быть достаточно летучим, чтобы допускать образование аэрозоля из раствора или суспензии. Дополнительные растворители или аэрозолизирующие средства, такие как фреон, спирт, гликоль, полигликоль или жирная кислота, при желании можно также включать в жидкий препарат для повышения летучести и/или изменения аэрозольного состояния раствора или суспензии.
Жидкие препараты могут также содержать незначительные количества полимеров, сурфактантов или других эксципиентов, хорошо известных специалистам в данной области. В данном контексте, «незначительные количества» означает, что отсутствуют эксципиенты, которые могут отрицательно влиять на поглощение одного или более активных средств в легких.
3. Аэрозольные препараты
Сухие порошковые и жидкие препараты, описанные выше, можно использовать для получения аэрозольных препаратов для легочного введения. Аэрозоли для доставки терапевтических средств в дыхательные пути известны в данной области. Используемый в настоящем документе термин «аэрозоль» относится к любому препарату тонкораспыленных твердых или жидких частиц, суспендированных в газе. В некоторых случаях газ может быть пропеллентом, однако это не является обязательным. Аэрозоли можно получать с использованием ряда стандартных методов, включая воздействие ультразвуком или высоким давлением.
Предпочтительно, сухой порошковый или жидкий препарат, описанный выше, формулируют в аэрозольные препараты с помощью одного или более пропеллентов. Подходящие пропелленты включают воздух, углеводороды, такие как пентан, изопентан, бутан, изобутан, пропан и этан, диоксид углерода, хлорфторуглероды, фторуглероды, а также их сочетания. Подходящие фторуглероды включают водород-содержащие 1-6 фторуглероды, такие как CHF2CHF2, CF3CH2F, CH2F2CH3 и CF3CHFCF3, а также фторированные эфиры, такие как CF3-O-CF3, CF2H-O-CHF2 и CF3-CF2-O-CF2-CH3. Подходящие фторуглероды также включают перфторуглероды, такие как перфторуглероды с 1-4 атомами углерода, включая CF3CF3, CF3CF2CF3 и CF3CF2CF2CF3.
Предпочтительно, пропелленты включают, но не ограничиваются ими, один или более гидрофторалканов (HFA). Подходящие HFA пропелленты включают, но не ограничиваются ими, 1,1,1,2,3,3-гептафтор-н-пропан (HFA 227), 1,1,1,2-тетрафторэтан (HFA 134), 1,1,1,2,3,3,3-гептафторпропан (пропеллент 227) или любую смесь этих пропеллентов.
Предпочтительно, один или более пропеллентов имеют достаточное давление пара, чтобы эффективно действовать в качестве пропеллентов. Предпочтительно, один или более пропеллентов выбирают так, чтобы плотность смеси соответствовала плотности частиц в аэрозольном препарате с целью минимизации оседания или расслаивания частиц в аэрозольном препарате. Пропеллент предпочтительно присутствует в количестве, достаточном для выталкивания различных выбранных доз аэрозольного препарата из аэрозольного баллончика.
4. Устройства для легочного введения
В некоторых случаях используют устройство для введения препаратов в легкие. Подходящие устройства включают, но не ограничиваются ими, ингаляторы сухого порошка, компрессорные дозирующие ингаляторы, небулайзеры и электрогидродинамические распыляющие устройства.
Ингаляцию можно производить через нос и/или рот пациента. Вводить препарат можно самостоятельно при вдыхании или путем введения через респиратор пациенту, пользующемуся респиратором.
Ингаляторы сухого порошка
Сухие порошковые препараты, описанные выше, можно вводить в легкие пациента при помощи ингалятора сухого порошка (DPI). В DPI устройствах, как правило, используется такой механизм, как быстрое расширение газа для создания внутри контейнера облака порошка, затем вдыхаемого пациентом.
В ингаляторе сухого порошка предназначенная для введения доза хранится в виде порошка, не находящегося под давлением, и при приведении в действие ингалятора частицы порошка вдыхаются субъектом. В некоторых случаях для диспергирования порошка можно использовать сжатый газ (то есть, пропеллент), как в компрессорных дозирующих ингаляторах (pMDI). В некоторых случаях DPI может приводиться в действие дыханием, это означает, что аэрозоль создается непосредственно в ответ на вдох. Как правило, ингаляторы сухого порошка вводят дозу менее чем несколько десятков миллиграмм за ингаляцию, чтобы не провоцировать кашель.
DPI устройства действуют с помощью различных механических средств для введения препаратов в легкие. В некоторых DPI устройствах лезвие дозирования или затвор скользит по сухому порошковому препарату, содержащемуся в резервуаре, отбирая препарат в воздуховод, из которого пациент может вдыхать порошок на одном дыхании. В других DPI устройствах сухой порошковый препарат упакован в готовую лекарственную форму, такую как блистер, капсула, таблетка или желатиновая капсула, которая прокалывается, ломается или иным образом открывается для высвобождения сухого порошкового препарата в воздуховод для последующей ингаляции. В других DPI устройствах сухой порошковый препарат высвобождается в камеру или капсулу, и используются механические или электрические мешалки для поддержания сухого порошкового препарата суспендированным в воздухе до того, как пациент вдохнет.
Сухие порошковые препараты можно упаковывать в различные формы, такие как рассыпчатый порошок, брикет или прессованная форма, для помещения в резервуар DPI.
Примеры подходящих DPI устройств для введения препаратов, описанных выше, включают ингалятор турбохалер® (Astrazeneca, Уилмингтон, Делавэр), ингалятор кликхалер® (Innovata, Руддингтон, Ноттингем, Великобритания), ингалятор дискус® (Glaxo, Гринфорд, Миддлсекс, Великобритания), изихалер® (Orion, Эспоо, Финляндия), ингалятор эксубера® (Pfizer, Нью-Йорк, Нью-Йорк), ингалятор кудоз® (Microdose, Монмут Джанкшен, Нью Джерси) и ингалятор спирос® (Dura, Сан-Диего, Калифорния).
Компрессорные дозирующие ингаляторы
Жидкие препараты, описанные выше, можно вводить в легкие пациента при помощи компрессорного дозирующего ингалятора (pMDI).
Компрессорные дозирующие ингаляторы (pMDI), как правило, включают по меньшей мере два компонента: камеру, в которой жидкий препарат содержится под давлением в сочетании с одним или более пропеллентами, и корпус, используемый для вмещения и приведение в действие камеры. Камера может содержать одну или несколько доз препарата. Камера может иметь клапан, как правило, дозирующий клапан, через который может подаваться содержимое камеры. Аэрозолизированное лекарственное средство поступает из pMDI при надавливании на камеру, чтобы загнать ее в корпус, при этом открывается клапан, и частицы лекарственного средства выходят из клапана через выходное отверстие корпуса. При выходе из камеры жидкий препарат распыляется, образуя аэрозоль.
В pMDI устройствах, как правило, используется один или более пропеллентов для повышения давления содержимого камеры и для выталкивания жидкого препарата из выходного отверстия корпуса с образованием аэрозоля. Можно использовать любые подходящие пропелленты, включая те, которые описаны выше. Пропеллент может принимать различные формы. Например, пропеллент может представлять собой сжатый газ или сжиженный газ. Хлорфторуглероды (CFC) когда-то широко использовались в качестве жидких пропеллентов, но в настоящее время запрещены. В настоящее время они заменены признанными гидрофторалкановыми (HFA) пропеллентами.
pMDI устройства поставляются на рынок многими компаниями, включая 3M Corporation, Aventis, Boehringer Ingelheim, Forest Laboratories, Glaxo-Wellcome, Schering Plough и Vectura. В некоторых случаях пациент вводит аэрозольный препарат, вручную выпуская аэрозолизированный препарат из pMDI на вдохе. Таким образом, аэрозолизированный препарат поступает в поток вдыхаемого воздуха и направляется в легкие.
В других случаях может быть использован активируемый дыханием триггер, такой как тот, который включен в ингалятор темпо® (MAP Pharmaceuticals, Маунтин-Вью, Калифорния), который реагирует на вдох и сразу же выпускает дозу препарата. Такие устройства, которые выпускают аэрозольный препарат, когда пользователь производит вдох, известны как активируемые дыханием компрессорные дозирующие ингаляторы (baMDI).
Небулайзеры
Жидкие препараты, описанные выше, также можно вводить при помощи небулайзера. Небулайзеры представляют собой жидкостные аэрозольные генераторы, которые превращают жидкий препарат, описанный выше, как правило, композицию на водной основе, в туман или облако мелких капель, предпочтительно имеющих средний массовый аэродинамический диаметр менее 5 микрон, которые могут вдыхаться в нижние дыхательные пути. Этот процесс называется распылением. Капли вносят одно или более активных средств в нос, верхние дыхательные пути или глубокие области легких при вдыхании аэрозольного облака. Небулайзеры любого типа можно использовать для введения препарата пациенту, включая, но не ограничиваясь ими, пневматические (струйные) небулайзеры и электромеханические небулайзеры.
В пневматических (струйных) небулайзерах используется подача сжатого газа в качестве движущей силы для распыления жидкого препарата. Сжатый газ доставляется через форсунку или диффузор для создания области низкого давления, которая втягивает окружающий жидкий препарат и рассекает его на тонкую пленку или нити. Пленка или нити являются неустойчивыми и распадаются на мелкие капли, которые переносятся потоком сжатого газа во вдыхаемый воздух. Дефлектор, находящийся на пути потока капель, отсеивает крупные капли и возвращает их в резервуар с жидкостью. Примеры пневматических небулайзеров включают, но не ограничиваются ими, PARI LC Plus®, PARI LC Sprint®, Devilbiss PulmoAide® и Respima® от компании Boehringer Ingelheim.
В электромеханических небулайзерах используется генерируемая при помощи электричества механическая сила для распыления жидких препаратов. Электромеханическая движущая сила может быть применена, например, для вибрации жидкого препарата на ультразвуковых частотах или для проталкивания объема жидкости через небольшие отверстия в тонкой пленке. Силы создают потоки тонких жидких пленок или нитей, которые разбиваются на мелкие капли с образованием медленно движущегося аэрозольного потока, который может направляться в поток вдыхаемого воздуха.
В некоторых случаях электромеханический небулайзер представляет собой ультразвуковой небулайзер, в котором жидкий препарат соприкасается с вибратором, осциллирующим с частотой в ультразвуковом диапазоне. Соприкосновение достигается за счет размещения жидкости в непосредственном контакте с вибратором, таким как пластина или кольцо в несущей чашке, или за счет размещения крупных капель на твердом вибрирующем распылителе (роге). Вибрации создают круговые стационарные пленки, которые разбиваются на капли по краям, распыляя жидкий препарат. Примеры ультразвуковых небулайзеров включают DuroMist®, Drive Medical Beetle Neb®, Octive Tech Densylogic® и John Bunn Nano-Sonic®.
В некоторых случаях электромеханический небулайзер представляет собой небулайзер с сеткой, в котором жидкий препарат пропускается через сетку или мембрану с мелкими отверстиями от 2 до 8 микрон в диаметре для создания тонких нитей, которые разбиваются на мелкие капли. В некоторых конструкциях жидкий препарат с силой пропускается через сетку за счет давления электромагнитного водителя поршня (например, небулайзер AERx®) или в результате помещения жидкости между пьезоэлектрически возбуждаемой вибрирующей пластиной и сеткой, что приводит к колебательному насосному действию (например, небулайзер EFlow®, AerovectRx® или TouchSpray®). В других случаях сетка вибрирует взад и вперед сквозь стационарную колонну жидкости, прокачивая ее через отверстия. Примеры таких небулайзеров включают AeroNeb Go®, AeroNeb Pro®, PARI EFlow®, Omron 22UE® и Aradigm AERx®.
Электрогидродинамические аэрозольные устройства
Жидкие препараты, описанные выше, можно также вводить при помощи электрогидродинамического (ЭГД) аэрозольного устройства. В ЭГД аэрозольных устройствах используется электрическая энергия
для аэрозолизации растворов или суспензий жидкого лекарственного средства. Примеры ЭГД аэрозольных устройств известны в данной области. Смотри, например, патент США № 4765539, выданный Noakes et al., и патент США № 4962885, выданный Coffee, R.A.
Электрохимические свойства препарата могут быть важными параметрами, которые следует оптимизировать при доставке жидкого препарата в легкие с помощью ЭГД аэрозольного устройства, и такую оптимизацию регулярно выполняют специалисты в данной области.
C. Парентеральные препараты
В некоторых вариантах осуществления наночастицы сформулированы для парентеральной доставки, такой как инъекция или инфузия, в форме раствора или суспензии. Препарат можно вводить любым способом, например, в кровоток или непосредственно в орган или ткань, которые предстоит лечить. В некоторых вариантах осуществления наночастицы сформулированы для парентеральной доставки в глаза.
Используемый в настоящем документе термин «парентеральное введение» означает введение любым способом, отличным от введения в пищеварительный тракт или неинвазивного локального или регионального способа введения. Например, парентеральное введение может включать введение препарата пациенту внутривенно, внутрикожно, внутрибрюшинно, интраплеврально, интратрахеально, внутримышечно, подкожно, под конъюнктиву инъекцией и инфузией.
Парентеральные препараты можно получать в виде водных композиций с использованием методов, известных в данной области. Как правило, такие композиции можно получать в виде инъекционных препаратов, например, растворов или суспензий; твердых форм, подходящих для использования в получении растворов или суспензий при добавлении восстанавливающей среды перед инъекцией; эмульсий, таких как эмульсии вода-в-масле (в/м), эмульсии масло-в-воде (м/в) и микроэмульсий из них, липосом или эмульсом.
Носитель может представлять собой растворитель или дисперсионную среду, содержащую, например, воду, этанол, один или более полиолов (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль), масла, такие как растительные масла (например, арахисовое масло, кукурузное масло, кунжутное масло и так далее), а также их сочетания. Надлежащую текучесть можно поддерживать, например, путем использования покрытия, такого как лецитин, путем поддержания требуемого размера частиц в случае дисперсии и/или путем использования сурфактантов. Во многих случаях будет предпочтительно включать изотонические средства, например, сахара или хлорид натрия.
Растворы и дисперсии активных соединений в виде свободной кислоты или основания, либо их фармакологически приемлемых солей, можно получать в воде или другом растворителе или дисперсионной среде, соответствующим образом смешанных с одним или более из фармацевтически приемлемых эксципиентов, включая, но, не ограничиваясь ими, сурфактанты, диспергирующие средства, эмульгаторы, модификаторы рН, а также их сочетания.
Подходящие сурфактанты могут быть анионными, катионными, амфотерными или неионными поверхностно-активными веществами. Подходящие анионные сурфактанты включают, но не ограничиваются ими, такие, которые содержат карбоксилатные, сульфонатные и сульфатные ионы. Примеры анионных сурфактантов включают длинноцепочечные алкилсульфонаты и алкиларилсульфонаты натрия, калия, аммония, такие как додецилбензолсульфонат натрия; диалкилсульфосукцинаты натрия, такие как додецилбензолсульфонат натрия; диалкилсульфосукцинаты натрия, такие как бис-(2-этилтиоксил)сульфосукцинат натрия; и алкилсульфаты, такие как лаурилсульфат натрия. Катионные сурфактанты включают, но не ограничиваются ими, четвертичные соединения аммония, такие как бензалкония хлорид, бензэтония хлорид, цетримония бромид, стеарилдиметилбензиламмония хлорид, полиоксиэтилен и кокосовый амин. Примеры неионных сурфактантов включают этиленгликоль моностеарат, пропиленгликоль миристат, глицерил моностеарат, глицерил стеарат, полиглицерил-4-олеат, сорбитан ацилат, сахарозы ацилат, ПЭГ-150 лаурат, ПЭГ-400 монолаурат, полиоксиэтилен монолаурат, полисорбаты, полиоксиэтилен октилфенилоый эфир, ПЭГ-1000 цетиловый эфир, полиоксиэтилен тридециловый эфир, полипропиленгликоль бутиловый эфир, полоксамер® 401, стеароил моноизопропаноламид и полиоксиэтилен амид гидрогенизированного жира. Примеры амфотерных сурфактантов включают натрий N-додецил-β-аланин, натрий N-лаурил-β-иминодипропионат, миристоамфоацетат, лаурил бетаин и лаурил сульфобетаин.
Препарат может содержать консервант для предотвращения роста микроорганизмов. Подходящие консерванты включают, но не ограничиваются ими, парабены, хлорбутанол, фенол, сорбиновую кислоту и тимеросал. Препарат может также содержать антиоксидант для предотвращения распада активного средства (средств).
Препарат, как правило, содержит буфер с pH 3-8 для парентерального введения после восстановления. Подходящие буферы включают, но не ограничиваются ими, фосфатные буферы, ацетатные буферы и цитратные буферы.
Водорастворимые полимеры часто используют в препаратах для парентерального введения. Подходящие водорастворимые полимеры включают, но не ограничиваются ими, поливинилпирролидон, декстран, карбоксиметилцеллюлозу и полиэтиленгликоль.
Стерильные инъекционные растворы можно получать путем включения активных соединений в необходимом количестве в соответствующий растворитель или дисперсионную среду с одним или более из эксципиентов, перечисленных выше, по мере необходимости, с последующей стерилизацией фильтрованием. Как правило, дисперсии получают путем введения различных стерилизованных активных ингредиентов в стерильный носитель, который содержит базовую дисперсионную среду и необходимые другие ингредиенты из тех, что перечислены выше. В случае стерильных порошков для приготовления стерильных инъекционных растворов, предпочтительными методами получения являются методы вакуумной сушки и сублимационной сушки, с помощью которых получают порошок активного ингредиента плюс любой дополнительный желаемый ингредиент из его ранее стерильно профильтрованного раствора. Порошки можно получать таким образом, чтобы частицы были пористыми, что может увеличивать растворение частиц. Методы получения пористых частиц хорошо известны в данной области.
Фармацевтические препараты для введения в глаза предпочтительно находятся в форме стерильного водного раствора или суспензии частиц, образованных из одного или более конъюгатов полимер-лекарственное средство. Приемлемые растворители включают, например, воду, раствор Рингера, фосфатно-солевой буфер (PBS) и изотонический раствор хлорида натрия. Препарат может также представлять собой стерильный раствор, суспензию или эмульсию в нетоксичном, парентерально приемлемом разбавителе или растворителе, таком как 1,3-бутандиол.
В некоторых случаях препарат распространяют или упаковывают в жидкой форме. Альтернативно, препараты для введения в глаза могут быть упакованы в твердой форме, полученной, например, путем лиофилизации подходящего жидкого препарата. Твердое вещество может быть восстановлено при помощи соответствующего носителя или разбавителя перед введением.
Растворы, суспензии или эмульсии для введения в глаза могут быть забуферены при помощи эффективного количества буфера, необходимого для поддержания значения pH, подходящего для введения в глаза. Подходящие буферы хорошо известны специалистам в данной области, и некоторыми примерами полезных буферов являются ацетатный, боратный, карбонатный, цитратный и фосфатный буферы.
Растворы, суспензии или эмульсии для введения в глаза могут также содержать одно или более веществ, регулирующих тоничность, для регулирования изотонического диапазона препарата. Подходящие вещества, регулирующие тоничность, хорошо известны в данной области, и некоторые примеры включают глицерин, маннит, сорбит, хлорид натрия и другие электролиты.
Растворы, суспензии или эмульсии для введения в глаза могут также содержать один или более консервантов для предотвращения бактериального загрязнения офтальмологических препаратов. Подходящие консерванты известны в данной области, и включают полигексаметиленбигуанидин (PHMB), бензалкония хлорид (BAK), стабилизированные оксихлор-комплексы (иначе известные как Purite®), фенилртути ацетат, хлорбутанол, сорбиновую кислоту, хлоргексидин, бензиловый спирт, парабены, тимеросал, а также их смеси.
Растворы, суспензии или эмульсии для введения в глаза могут также содержать один или более эксципиентов, известных в данной области, таких как диспергирующие средства, увлажняющие средства и суспендирующие средства.
D. Локальные препараты
В других вариантах осуществления наночастицы сформулированы для локального введения на слизистую оболочку. Подходящие лекарственные формы для локального введения включают кремы, притирания, мази, спреи, гели, лосьоны, эмульсии, жидкости и трансдермальные пластыри. Препарат может быть сформулирован для трансмукозального, трансэпителиального, трансэндотелиального или трансдермального введения. Композиции содержат один или более химических усилителей проникновения, средств для проникновения в мембрану, средств транспорта через мембрану, смягчителей, сурфактантов, стабилизаторов, а также их сочетания.
В некоторых вариантах осуществления наночастицы можно вводить в виде жидкого препарата, такого как раствор или суспензия, полутвердого препарата, такого как лосьон или мазь, или твердого препарата. В некоторых вариантах осуществления наночастицы сформулированы в виде жидкостей, включая растворы и суспензии, такие как глазные капли, или в виде полутвердого препарата, такого как мазь или лосьон для локального нанесения на слизистую оболочку, например, в глаза или вагинально, или ректально.
Препарат может содержать один или более эксципиентов, таких как смягчители, сурфактанты, эмульгаторы, усилители проникновения и тому подобное.
«Смягчители» представляют собой наносимые наружно средства, которые смягчают или успокаивают кожу, и которые, в целом, известны в данной области и перечислены в сборниках, таких как «Handbook of Pharmaceutical Excipients», 4е издание, Pharmaceutical Press, 2003. Сюда относятся, без ограничения, миндальное масло, касторовое масло, экстракт цератонии, цетостеариловый спирт, цетиловый спирт, цетиловые сложные эфиры воска, холестерин, хлопковое масло, циклометикон, этиленгликоль пальмитостеарат, глицерин, глицерин моностеарат, глицерил моноолеат, изопропил миристат, изопропил пальмитат, ланолин, лецитин, светлое минеральное масло, триглицериды средней цепи, минеральное масло и ланолиновые спирты, вазелин, вазелин и ланолиновые спирты, соевое масло, крахмал, стеариловый спирт, подсолнечное масло, ксилит, а также их сочетания. В одном варианте осуществления смягчителями являются этилгексилстеарат и этилгексилпальмитат.
«Сурфактанты» представляют собой поверхностно-активные вещества, которые снижают поверхностное натяжение и, тем самым, увеличивают эмульгирующие, пенообразующие, диспергирующие, распределяющие по поверхности и смачивающие свойства продукта. Подходящие неионные сурфактанты включают эмульгирующий воск, глицерил моноолеат, полиоксиэтилен алкиловые эфиры, полиоксиэтилен-производные касторового масла, полисорбат, сложные эфиры сорбитана, бензиловый спирт, бензилбензоат, циклодекстрины, глицерин моностеарат, полоксамер, повидон, а также их сочетания. В одном варианте осуществления неионный сурфактант представляет собой стеариловый спирт.
«Эмульгаторы» представляют собой поверхностно-активные вещества, которые способствуют образованию суспензии одной жидкости в другой и способствуют образованию стабильной смеси, или эмульсии, масла и воды. Общепринятыми эмульгаторами являются: металлические мыла, некоторые животные и растительные масла и различные полярные соединения. Подходящие эмульгаторы включают гуммиарабик, анионный эмульгирующий воск, стеарат кальция, карбомеры, цетостеариловый спирт, цетиловый спирт, холестерин, диэтаноламин, этиленгликоль пальмитостеарат, глицерин моностеарат, глицерил моноолеат, гидроксипропилцеллюлозу, гипромеллозу, ланолин, водный, ланолиновые спирты, лецитин, триглицериды средней цепи, метилцеллюлозу, минеральное масло и ланолиновые спирты, одноосновный фосфат натрия, моноэтаноламин, неионный эмульгирующий воск, олеиновую кислоту, полоксамер, полоксамеры, полиоксиэтилен алкиловые эфиры, полиоксиэтилен-производные касторового масла, сложные эфиры полиоксиэтилен сорбитана и жирных кислот, полиоксиэтилен стеараты, пропиленгликоль альгинат, самоэмульгирующийся глицерил моностеарат, цитрат натрия дегидрат, лаурилсульфат натрия, сложные эфиры сорбитана, стеариновую кислоту, подсолнечное масло, трагакант, триэтаноламин, ксантановую камедь, а также их сочетания. В одном варианте осуществления эмульгатор представляет собой глицерин стеарат.
Подходящие классы усилителей проникновения известны в данной области и включают, но не ограничиваются ими, жирные спирты, сложные эфиры жирных кислот, жирные кислоты, эфиры жирных спиртов, аминокислоты, фосфолипиды, лецитины, холат соли, ферменты, амины и амиды, комплексообразующие средства (липосомы, циклодекстрины, модифицированные целлюлозы и диимиды), макроциклы, такие как макроциклические лактоны, кетоны и ангидриды, и циклические мочевины, сурфактанты, N-метил-пирролидоны и их производные, ДМСО и родственные соединения, ионные соединения, азон и родственные соединения, а также растворители, такие как спирты, кетоны, амиды, полиолы (например, гликоли). Примеры этих классов соединений известны в данной области.
i. Лосьоны, кремы, гели, мази, эмульсии и пены
Используемый в настоящем документе термин «гидрофильный» относится к веществам, которые имеют сильно полярные группы, легко взаимодействующие с водой.
Термин «липофильный» относится к соединениям, имеющим сродство к липидам.
Термин «амфифильный» относится к молекуле, в которой объединены гидрофильные и липофильные (гидрофобные) свойства.
Используемый в настоящем документе термин «гидрофобный» относится к веществам, у которых отсутствует сродство к воде; проявляющим тенденцию отталкивать и не абсорбировать воду, а также не растворяться и не смешиваться с водой.
«Гель» представляет собой коллоид, в котором дисперсная фаза объединена с непрерывной фазой, образуя полутвердый материал, такой как желе.
«Масло» представляет собой композицию, содержащую по меньшей мере 95 масс.% липофильного вещества. Примеры липофильных веществ включают, но, не ограничиваются ими, природные и синтетические масла, жиры, жирные кислоты, лецитины, триглицериды, а также их сочетания.
Термин «непрерывная фаза» относится к жидкости, в которой твердые вещества суспендированы, или капли другой жидкости диспергированы, и ее иногда называют внешней фазой. Это также относится к жидкой фазе коллоида, внутри которой распределены твердые и жидкие частицы. Если непрерывная фаза представляет собой воду (или другой гидрофильный растворитель), водорастворимые или гидрофильные лекарственные средства будут растворяться в непрерывной фазе (в отличие от диспергирования). В многофазном препарате (например, эмульсии) дискретная фаза суспендирована или диспергирована в непрерывной фазе.
«Эмульсия» представляет собой композицию, содержащую смесь из несмешивающихся компонентов, равномерно смешанных вместе. В конкретных вариантах осуществления несмешивающиеся компоненты включают липофильный компонент и водный компонент. Эмульсия представляет собой препарат одной жидкости, распределенной в виде мелких глобул по всему объему второй жидкости. Дисперсная жидкость является дискретной фазой, а дисперсионная среда является непрерывной фазой. Если масло является дисперсной жидкостью и водный раствор является непрерывной фазой, это известно как эмульсия масло-в-воде, тогда как, если вода или водный раствор является дисперсной фазой и масло или маслянистая субстанция является непрерывной фазой, это известно как эмульсия вода-в-масле. Каждая из масляной фазы и водной фазы, или и та и другая, может содержать один или более сурфактантов, эмульгаторов, стабилизаторов эмульсии, буферов и других эксципиентов. Предпочтительные эксципиенты включают сурфактанты, особенно неионные сурфактанты; эмульгаторы, особенно эмульгирующие воски; и жидкие нелетучие неводные материалы, в частности, гликоли, такие как пропиленгликоль. Масляная фаза может содержать другие масляные фармацевтически одобренные эксципиенты. Например, такие материалы, как гидроксилированное касторовое масло или кунжутное масло, можно использовать в масляной фазе в качестве сурфактантов или эмульгаторов.
Эмульсия представляет собой препарат одной жидкости, распределенной в виде мелких глобул по всему объему второй жидкости. Дисперсная жидкость является дискретной фазой, а дисперсионная среда является непрерывной фазой. Если масло является дисперсной жидкостью и водный раствор является непрерывной фазой, это известно как эмульсия масло-в-воде, тогда как, если вода или водный раствор является дисперсной фазой и масло или маслянистая субстанция является непрерывной фазой, это известно как эмульсия вода-в-масле. Масляная фаза может состоять, по меньшей мере частично, из пропеллента, такого как HFA пропеллент. Каждая из масляной фазы и водной фазы, или и та и другая, может содержать один или более сурфактантов, эмульгаторов, стабилизаторов эмульсии, буферов и других эксципиентов. Предпочтительные эксципиенты включают сурфактанты, особенно неионные сурфактанты; эмульгаторы, особенно эмульгирующие воски; и жидкие нелетучие неводные материалы, в частности, гликоли, такие как пропиленгликоль. Масляная фаза может содержать другие масляные фармацевтически одобренные эксципиенты. Например, такие материалы, как гидроксилированное касторовое масло или кунжутное масло, можно использовать в масляной фазе в качестве сурфактантов или эмульгаторов.
Разновидностью эмульсий являются самоэмульгирующиеся системы. Эти системы доставки лекарственного средства, как правило, представляют собой капсулы (с твердой оболочкой или мягкой оболочкой), состоящие из лекарственного средства, диспергированного или растворенного в смеси сурфактанта(ов) и липофильных жидкостей, таких как масла или другие несмешивающиеся с водой жидкости. Когда капсула попадает в водное окружение и внешняя желатиновая оболочка растворяется, контакт между водной средой и содержимым капсулы мгновенно приводит к образованию очень маленьких капель эмульсии. Они, как правило, находятся в диапазоне размера мицелл или наночастиц. Не требуется никакой смешивающей силы для создания эмульсии, как это обычно имеет место в процессе формулирования эмульсии.
«Лосьон» представляет собой жидкий препарат низкой и средней вязкости. Лосьон может содержать тонкоизмельченные вещества, которые нерастворимы в дисперсионной среде, за счет использования суспендирующих средств и диспергирующих средств. Альтернативно, лосьоны могут иметь в качестве дисперсной фазы жидкие вещества, которые не смешиваются с растворителем и, как правило, диспергированы за счет эмульгаторов или других подходящих стабилизаторов. В одном варианте осуществления лосьон находится в форме эмульсии, имеющей вязкость от 100 до 1000 сантистоксов. Текучесть лосьонов допускает быстрое и равномерное нанесение на большую площадь поверхности. Лосьоны, как правило, предназначены для высыхания на коже, при этом на поверхности кожи остается тонкая пленка из их медицинских компонентов.
«Крем» представляет собой вязкую жидкость или полутвердую эмульсию типа либо «масло-в-воде», либо «вода-в-масле». Кремы могут содержать эмульгаторы и/или другие стабилизаторы. В одном варианте осуществления препарат находится в форме крема, имеющего вязкость более 1000 сантистоксов, как правило, в диапазоне 20000-50000 сантистоксов. Кремы часто являются более предпочтительными, чем мази, поскольку их легче наносить и легче удалять.
Разница между кремом и лосьоном заключается в вязкости, которая зависит от количества/использования различных масел и процентного содержания воды, используемой для получения препаратов. Кремы, как правило, более густые, чем лосьоны, могут иметь различные применения, и часто в них используют более разнообразные масла/жиры в зависимости от желаемого эффекта для кожи. В препарате крема процентное содержание водной основы составляет примерно 60-75%, а масляной основы составляет примерно 20-30% от общего количества, при этом остальные доли в процентах соответствуют эмульгатору, консервантам и добавкам, в общей сложности до 100%.
«Мазь» представляет собой полутвердый препарат, содержащий мазевую основу и, необязательно, один или более активных веществ. Примеры подходящих мазевых основ включают углеводородные основы (например, вазелин, белый вазелин, желтая мазь и минеральное масло); абсорбируемые основы (гидрофильный вазелин, безводный ланолин, ланолин и кольдкрем); смываемые водой основы (например, гидрофильная мазь) и водорастворимые основы (например, полиэтиленгликолевые мази). Пасты, как правило, отличаются от мазей тем, что они содержат больший процент твердых веществ. Пасты, как правило, лучше абсорбируются и являются менее жирными, чем мази, полученные из тех же компонентов.
«Гель» представляет собой полутвердую систему, содержащую дисперсии малых или больших молекул в жидком носителе, который становится полутвердым за счет действия загустителя или полимерного материала, растворенного или суспендированного в жидком носителе. Жидкость может включать липофильный компонент, водный компонент или оба. Некоторые эмульсии могут быть гелями или содержать гелевый компонент. Некоторые гели, однако, не являются эмульсиями, поскольку они не содержат гомогенизированную смесь несмешивающихся компонентов. Подходящие гелеобразующие вещества включают, но не ограничиваются ими, модифицированные целлюлозы, такие как гидроксипропилцеллюлоза и гидроксиэтилцеллюлоза; гомополимеры и сополимеры карбопола; а также их сочетания. Подходящие растворители в жидком носителе включают, но не ограничиваются ими, моноэтиловый эфир дигликоля; алкиленгликоли, такие как пропиленгликоль; диметилизосорбит; спирты, такие как изопропиловый спирт и этанол. Растворители, как правило, выбирают за их способность растворять лекарственное средство. Можно включать и другие добавки, которые улучшают ощущение на коже и/или смягчающие свойства препарата. Примеры таких добавок включают, но не ограничиваются ими, изопропилмиристат, этилацетат, C12-C15 алкилбензоаты, минеральное масло, сквалан, циклометикон, каприновые/каприловые триглицериды, а также их сочетания.
Пены состоят из эмульсии в сочетании с газообразным пропеллентом. Газообразный пропеллент состоит главным образом из гидрофторалканов (HFA). Подходящие пропелленты включают такие HFA, как 1,1,1,2-тетрафторэтан (HFA 134a) и 1,1,1,2,3,3,3-гептафторпропан (HFA 227), однако подходят также смеси и добавки этих и других HFA, которые в настоящее время одобрены или могут быть одобрены для медицинского применения. Пропелленты предпочтительно не являются углеводородными газами-пропеллентами, которые могут производить горючие или взрывоопасные пары во время распыления. Более того, композиции предпочтительно не содержат летучие спирты, которые могут производить горючие или взрывоопасные пары во время применения.
Буферы используют для контроля pH композиции. Предпочтительно, буферы поддерживают pH композиции от примерно pH 4 до примерно pH 7,5, более предпочтительно от примерно pH 4 до примерно pH 7, и наиболее предпочтительно от примерно pH 5 до примерно pH 7. В предпочтительном варианте осуществления буфер представляет собой триэтаноламин.
Консерванты можно использовать для предотвращения роста грибков и микроорганизмов. Подходящие противогрибковые и противомикробные средства включают, но не ограничиваются ими, бензойную кислоту, бутилпарабен, этилпарабен, метилпарабен, пропилпарабен, бензоат натрия, пропионат натрия, бензалкония хлорид, бензэтония хлорид, бензиловый спирт, цетилпиридиния хлорид, хлорбутанол, фенол, фенилэтиловый спирт и тимеросал.
В некоторых вариантах осуществления может быть желательным обеспечение непрерывной доставки одного или более аналогов носкапина пациенту, нуждающемуся в этом. Для локальных применений можно использовать повторное нанесение, или можно использовать пластырь для обеспечения непрерывного введения аналогов носкапина в течение продолжительного периода времени.
E. Энтеральные препараты
Подходящие пероральные лекарственные формы включают таблетки, капсулы, растворы, суспензии, сиропы и пастилки. Таблетки можно изготавливать с использованием методов прессования или формования, хорошо известных в данной области. Можно изготавливать желатиновые или не желатиновые капсулы с твердыми или мягкими оболочками капсул, в которых могут быть инкапсулированы жидкие, твердые и полутвердые заполняющие материалы, с использованием методов, хорошо известных в данной области.
Препараты можно получать с использованием одного или более фармацевтически приемлемых эксципиентов, включая разбавители, консерванты, связующие вещества, смазывающие средства, разрыхлители, способствующие набуханию вещества, наполнители, стабилизаторы, а также их сочетания.
Эксципиенты, включая пластификаторы, пигменты, красители, стабилизаторы и способствующие скольжению вещества, также можно использовать для получения композиций с покрытием для энтерального введения. Дозированные препараты с замедленным высвобождением можно получать, как описано в стандартных литературных источниках, таких как «Pharmaceutical dosage form tablets», под редакцией Liberman et. al. (New York, Marcel Dekker, Inc., 1989), «Remington - The science and practice of pharmacy», 20е издание, Lippincott Williams & Wilkins, Балтимор, Мэриленд, 2000, и «Pharmaceutical dosage forms and drug delivery systems», 6е издание, Ansel et al., (Media, PA: Williams and Wilkins, 1995). В этих литературных источниках можно найти информацию об эксципиентах, материалах, оборудовании и методах получения таблеток и капсул, а также лекарственных форм замедленного высвобождения в виде таблеток, капсул и гранул.
Наночастицы могут иметь покрытие, например, чтобы отсрочить высвобождение до того, как частицы пройдут через кислую среду желудка. Примеры подходящих материалов для покрытия включают, но не ограничиваются ими, полимеры целлюлозы, такие как ацетат фталат целлюлозы, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, гидроксипропилметилцеллюлозы фталат и гидроксипропилметилцеллюлозы ацетат сукцинат; поливинилацетат фталат, полимеры и сополимеры акриловой кислоты и метакриловые смолы, которые коммерчески доступны под торговым названием EUDRAGIT® (Roth Pharma, Вестерштеде, Германия), зеин, шеллак и полисахариды.
Разбавители, также называемые «наполнителями», как правило, необходимы для увеличения массы твердой лекарственной формы так, чтобы обеспечивать практичный размер для прессования таблеток или образования крупинок и гранул. Подходящие разбавители включают, но не ограничиваются ими, дикальция фосфат дигидрат, сульфат кальция, лактозу, сахарозу, маннит, сорбит, целлюлозу, микрокристаллическую целлюлозу, каолин, хлорид натрия, сухой крахмал, гидролизованные крахмалы, прежелатинизированный крахмал, диоксид силикона, оксид титана, алюмосиликат магния и порошковый сахар.
Связующие вещества используют для придания когезионных свойств препаратам в твердой лекарственной форме, и таким образом, обеспечить целостность таблетки или крупинки, или гранулы после образования лекарственных форм. Подходящие связующие материалы включают, но не ограничиваются ими, крахмал, прежелатинизированный крахмал, желатин, сахара (включая сахарозу, глюкозу, декстрозу, лактозу и сорбит), полиэтиленгликоль, воски, природные и синтетические камеди, такие как гуммиарабик, трагакант, натрия альгинат, целлюлозу, включая гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу, этилцеллюлозу, и вигум, а также синтетические полимеры, такие как сополимеры акриловой кислоты и метакриловой кислоты, сополимеры метакриловой кислоты, сополимеры метилметакрилата, сополимеры аминоалкилметакрилата, полиакриловая кислота/полиметакриловая кислота и поливинилпирролидон.
Смазывающие средства используют для облегчения производства таблеток. Примеры подходящих смазывающих средств включают, но не ограничиваются ими, стеарат магния, стеарат кальция, стеариновую кислоту, глицерин бегенат, полиэтиленгликоль, тальк и минеральное масло.
Дезинтегрирующие средства используются для облегчения дезинтеграции или «распада» лекарственной формы после введения и, как правило, включают, но не ограничиваются ими, крахмал, натрия крахмал гликолят, натрия карбоксиметилкрахмал, натрия карбоксиметилцеллюлозу, гидроксипропилцеллюлозу, прежелатинизированный крахмал, глины, целлюлозу, альгинин, камеди или сшитые полимеры, такие как поперечно-сшитый PVP (Polyplasdone® XL от компании GAP Chemical Corp).
Стабилизаторы используют для ингибирования или замедления реакций распада лекарственного средства, которые включают, в качестве примера, окислительные реакции. Подходящие стабилизаторы включают, но не ограничиваются ими, антиоксиданты, бутилированный гидрокситолуол (BHT); аскорбиновую кислоту, ее соли и сложные эфиры; витамин E, токоферол и его соли; сульфиты, такие как метабисульфит натрия; цистеин и его производные; лимонную кислоту; пропилгаллат и бутилированный гидроксианизол (BHA).
IV. Способы получения MPP
Методы получения наночастиц известны в данной области и включают, но не ограничиваются ими, выпаривание растворителя, удаление растворителя, сушку распылением, обращение фаз, низкотемпературное литье и нанопреципитацию. Подходящие способы формулирования частиц кратко описаны ниже. Фармацевтически приемлемые эксципиенты, включая модифицирующие pH средства, дезинтегрирующие средства, консерванты и антиоксиданты, необязательно, можно включать в частицы в процессе образования частиц. Как описано выше, одно или более из дополнительных активных средств также можно включать в наночастицы в процессе образования частиц.
1. Выпаривание растворителя
В данном методе полимерные компоненты наночастиц - носителей генов растворяют в летучем органическом растворителе, таком как метиленхлорид. Затем органический раствор, содержащий конъюгат полимер-лекарственное средство, суспендируют в водном растворе, содержащем поверхностно-активное вещество, такое как поли(виниловый спирт). Полученную эмульсию перемешивают до испарения большей части органического растворителя, при этом остаются твердые наночастицы. Полученные в результате наночастицы промывают водой и сушат в течение ночи в лиофилизаторе. Таким методом можно получать наночастицы с разными размерами и морфологией.
2. Удаление растворителя
В данном методе компоненты наночастиц - носителей генов диспергируют или растворяют в соответствующем растворителе. Эту смесь затем суспендируют путем перемешивания в органическом масле (таком как силиконовое масло) для получения эмульсии. Из эмульсии образуются твердые частицы, которые затем можно выделять из супернатанта.
3. Сушка распылением
В данном методе компоненты наночастиц - носителей генов диспергируют или растворяют в соответствующем растворителе. Раствор прокачивают через сопло микронизации с приводом от потока сжатого газа, и полученный аэрозоль суспендируют в циклоне нагретого воздуха, давая возможность растворителю испаряться из микрокапель, с образованием частиц.
4. Обращение фаз
В данном методе компоненты наночастиц - носителей генов диспергируют или растворяют в «хорошем» растворителе, и раствор выливают в сильный осадитель для полимерных компонентов наночастиц - носителей генов для спонтанного образования, при благоприятных условиях, наночастиц.
5. Низкотемпературное литье
Методы для литья наночастиц при очень низких температурах описаны в патенте США № 5019400, выданном Gombotz et al. В данном методе компоненты наночастиц - носителей генов диспергируют или растворяют в растворителе. Смесь затем распыляют в сосуд, содержащий жидкий осадитель при температуре ниже точки замерзания раствора, который замораживает компоненты наночастиц - носителей генов в виде крошечных капель. По мере того, как капли и осадитель для компонентов нагреваются, растворитель в каплях оттаивает и экстрагируется в осадитель, что делает наночастицы твердыми.
6. Нанопреципитация
В данном методе раствор, содержащий одну или более нуклеиновых кислот, добавляют по каплям к раствору, содержащему полимерные компоненты наночастиц - носителей генов. Поскольку нуклеиновые кислоты образуют комплексы с катионными полимерами, наночастицы осаждаются из раствора. Полученные наночастицы выделяют из раствора, например, фильтрованием или центрифугированием, промывают и высушивают в лиофилизаторе.
В конкретном варианте осуществления наночастицы получают с использованием метода эмульгирования. Как правило, частицы получают методом либо простой эмульсии м/в, либо двойной эмульсии в/м/в, как описано в статьях R.C. Mundargi et al., J. Control Release 125, 193 (2008), M. Li et al., Int. J. Pharm. 363, 26 (2008), C.E. Astete and C.M. Sabliov, J. Biomater. Sci. Polymer Ed. 17, 247 (2006) и R.A. Jain, Biomaterials, 21, 2475 (2000). В данном методе полимер растворяют в органическом растворителе, таком как дихлорметан, для получения масляной фазы. Масляную фазу добавляют к водному раствору эмульгатора, как правило, при воздействии на пробу ультразвуком в течение некоторого периода времени (например, 2 минут) для получения эмульсии. Эмульсию добавляют к другому большому объему эмульгатора при перемешивании на магнитной мешалке для испарения органического растворителя.
Наночастицы собирают центрифугированием (например, 20000 g в течение 25 минут) после фильтрования через мембранный фильтр с 1-мкм размером пор и тщательно промывают водой. Для получения наночастиц для флуоресцентной микроскопии определенное количество AF555-меченых полимеров смешивали перед процессом эмульгирования. В контрольном эксперименте с использованием метода нанопреципитации раствор PLGA45k-ПЭГ5k в ацетонитриле при концентрации 25 мг/мл медленно инъецировали в деионизированную воду при перемешивании на магнитной мешалке (700 об/мин). После полного удаления органического растворителя наночастицы собирали тем же методом, который описан выше.
Диаметр (нм), индекс полидисперсности (ИПД) (PDI) и поверхностный заряд (ξ потенциал, мВ) наночастиц определяли из трех повторных измерений методом динамического рассеяния света на приборе Zetasizer Nano ZS90 (Malvern Instruments, Саутборо, Массачусетс). Наночастицы диспергировали в 10 мМ растворе NaCl (pH 7). Морфологию наночастиц характеризовали при помощи просвечивающей электронной микроскопии (ПЭМ) (TEM) на приборе H7600 TEM (Hitachi, Япония).
V. Способы применения MPP
Данные, приведенные в настоящем документе, подчеркивают многочисленные потенциальные преимущества проникающих в слизь наночастиц, полученных методом эмульгирования, при применении для доставки лекарственных средств на слизистую оболочку. Во-первых, наиболее часто используемый эмульгатор ПВС может быть заменен эмульгаторами с низкой ММ для получения биоразлагаемых наночастиц с аналогичной инкапсуляцией лекарственного средства методом эмульгирования. Наночастицы отличаются высокой нагрузкой лекарственного средства, например, более 5% для гидрофобного лекарственного средства, такого как куркумин, и более 10% для биологических молекул. Изменяющий свойства поверхности материал (например, ПЭГ) может увеличивать доставку наночастиц к интересующему участку, поскольку он создает нейтральный или близкий к нейтральному поверхностный заряд, что может усиливать перемещение через жидкости и материалы in vivo.
Например, наночастицы, описанные в настоящем документе, быстро проникают через барьер человеческой слизи, тогда как покрытые ПВС наночастицы иммобилизуются. Таким образом, наиболее широко используемый метод промышленного производства частиц с контролируемым высвобождением можно использовать для производства MPP, применяемых для доставки лекарственного средства.
Во-вторых, ожидается, что MPP, полученные методом эмульгирования, смогут быстро проникать к поверхностям других слизистых оболочек, например, в глазах, в носу, в легких, в желудочно-кишечном тракте и так далее. CVM имеет сходный химический состав и реологические свойства с другими слизистыми жидкостями. Действительно, было обнаружено, что MPP, полученные методом эмульгирования, могут быстро проникать в нормальную слизь дыхательных путей, собранную во время хирургической операции, и мокроту, отхаркиваемую пациентами с кистозным фиброзом (КФ).
В-третьих, непростые в обращении гидрофильные лекарственные средства, включая белки, пептиды и нуклеиновые кислоты, могут быть инкапсулированы в наночастицы методом эмульгирования. Например, антигены вакцин (такие как овальбумин и анатоксин столбняка) могут быть сформулированы в биоразлагаемые наночастицы для вакцинации, например, в MPP для мукозальной вакцинации.
В-четвертых, гидрофобные лекарственные средства, которые с трудом растворяются в смешивающихся с водой органических растворителях, могут быть успешно сформулированы в биоразлагаемые наночастицы, такие как MPPs, методом эмульгирования. Можно ожидать улучшенную фармакокинетику и терапевтическую эффективность гидрофобных лекарственных средств, доставленных с помощью наночастиц, например, при доставке лекарственного средства на слизистую оболочку при помощи MPPs.
Настоящее изобретение станет более понятным со ссылкой на следующие неограничивающие примеры.
ПРИМЕРЫ
Материалы и методы
Натриевую соль холевой кислоты, твин® 20, твин® 80, гексадецилтриметиламмоний бромид (CTAB), диоктил сульфосукцинат натрия (DSS), полиоксил 35 гидрогенизированное касторовое масло (кремофор EL) и D-α-токоферол полиэтиленгликоль 1000 (витамин E-TPGS) приобретали у Sigma (Сент-Луис, Миссури).
Поли(виниловый спирт) (Mw=25 кДа с уровнем гидролиза 88% и 6 кДа с уровнем гидролиза 80%) и поли(этилен-малеиновый ангидрид, молярное отношение 1:1) с Mw ~400 кДа приобретали у PolySciences (Уоррингтон, Пенсильвания).
Сложный эфир сахара D1216 (SE) был любезно предоставлен компанией Mitsubishi-Kagaku Foods Co. (Токио, Япония).
Alexa Fluor 555 кадаверин приобретали у Invitrogen (Гранд-Айленд, Нью-Йорк).
Поли(молочную-co-гликолевую кислоту) (PLGA; LA:GA 50:50) с характеристической вязкостью 0,15-0,25 дл/г (ММ примерно 15 кДа) приобретали у Lakeshore Biomaterials (Бирмингем, Алабама). Сополимеры PLGA (LA:GA 50:50)-ПЭГ с ММ ПЭГ, равной 10, 5, 2 и 1 кДа, PLA-ПЭГ5k и PCL-ПЭГ5k были специально синтезированы в компании Jinan Daigang Biomaterial Co., Ltd, (Цзинань, Китай) и охарактеризованы методами ЯМР и гельпроникающей хроматографии (ГПХ). Использовали прибор Shimadzu, снабженный детектором показателя преломления, и две колонки Waters Styragel® HR4 и HRS. Анализ проводили при 35°C с использованием тетрагидрофурана (THF) в качестве элюента при скорости потока 0,5 мл/мин. ГПХ калибровали с использованием полистирольных стандартов (Sigma, Сент-Луис, Миссури).
Химический состав и молекулярную массу (ММ) блок-сополимера PLGA-ПЭГ характеризовали методом 1H ЯМР. Полимеры растворяли в CDCl3, и 1H ЯМР спектры регистрировали с использованием прибора Bruker 400 REM при 400 МГц. Спектры 1H ЯМР для сополимеров в CDCl3 приведены на фиг. 3. Пики CH (5,22 ч./млн) от единицы LA, CH2 (4,83 ч./млн) от единицы GA и CH2CH2 (3,65 ч./млн) от единицы этиленоксида были интегрированы, и I5,22, I4,83, I3,65 представляют собой интегральные интенсивности пиков при 5,22, 4,83 и 3,65 ч./млн, соответственно. Отношение LA:GA оценивали как I5,22:(I4,83/2).
ММ PLGA-ПЭГ оценивали следующим образом:
(I3,65/4)/(I4,83/2) = (ММПЭГ/44)/(ММGA/58)
(I3,65/4)/(I5,22/1) = (ММПЭГ/44)/(ММLA/72)
ММPLGA-ПЭГ = MМПЭГ + (ММGA+MМLA), где MМПЭГ составляет 1, 2, 5 и 10 кДа.
Аналогично, молекулярную массу PLA-ПЭГ и PCL-ПЭГ оценивали следующим образом:
(I3,65/4)/(I5,22/1) = (ММПЭГ/44)/(ММLA/72)
ММPLA-ПЭГ = ММПЭГ + MМLA;
(I3,65/4)/((I4,06 + I2,31)/4) = (ММПЭГ/44)/(ММCL/114)
ММPCL-ПЭГ = ММПЭГ + ММCL,
где ММПЭГ составляет 5 кДа, I4,06 и I2,31 представляют собой интегральные интенсивности пиков от PCL при 4,06 и 2,31 ч./млн, соответственно.
Характеристики различных ПЭГ-содержащих блок-сополимеров приведены в таблице 1.
[b] Содержание ПЭГ в блок-сополимерах определяли методом 1H ЯМР.
[c] Молекулярную массу PLGA-ПЭГ (Mn) определяли методом 1H ЯМР
путем сравнения интеграла при 5,22 ч./млн (-CH- в лактиде), 1,59 ч./млн (-CH3 на лактиде), 4,83 ч./млн (-CH2- в гликолиде) и 3,65 ч./млн (-CH2CH2- в ПЭГ), и принимая во внимание известную Mn ПЭГ. Для PCL-ПЭГ анализировали интегралы при 4,06 ч./млн (-O-CH2-) и 2,31 ч./млн (-CH2-CO-).
[d] Mn, Mw и индекс полидисперсности (ИПД) измеряли методом ГПХ.
[e] Наночастицы PLGA-ПЭГ 10 кДа получали путем смешивания PLGA 15 кДа с PLGA-ПЭГ 10 кДа (содержание ПЭГ 21,6%) с общим содержанием ПЭГ в наночастицах при 6 масс.%.
Общее содержание ПЭГ в наночастицах определяли методом 1H ЯМР с использованием прибора Bruker 400 REM при 400 МГц. Лиофилизированные наночастицы точно взвешивали и растворяли в CDCl3, содержащем 1 масс.% гексадейтеродиметилсульфоксида (TMS) в качестве внутреннего стандарта. Содержание ПЭГ определяли путем сравнения с калибровочной кривой для ПЭГ 5 кДа, полученной из спектров 1H ЯМР с использованием TMS в качестве внутреннего стандарта.
Отслеживание флуоресцентно меченых наночастиц в свежей человеческой шеечно-влагалищной слизи (CVM) выполняли, как опубликовано в 39-40. Вкратце, 0,6 мкл наночастиц в соответствующем разведении смешивали с 20 мкл слизи и инкубировали в течение 1 часа до микроскопического анализа. Движения снимали при временном разрешении в 66,7 мс с использованием телекамеры с кремниевым усилителем (VE-1000, Dage-MTI), установленной на инвертированном эпифлуоресцентном микроскопе, оборудованном 100x объективом для масляной иммерсии. Траектории n>150 частиц на эксперимент извлекали при помощи программы MetaMorph (Universal Imaging). Отслеженные движения (20 с) анализировали при помощи программы MetaMorph (Universal Imaging, Глендейл, Висконсин). Усредненное по времени среднеквадратичное смещение (MSD) и эффективный коэффициент диффузии для каждой частицы рассчитывали как функцию от временной шкалы. Для каждого условия проводили по три эксперимента. Для оценки значимости использовали односторонний критерий Стьюдента с разной дисперсией (P<0,05).
ИТК (ITC) эксперименты проводили при 25°C с использованием VP-ITC микрокалориметра (MicroCal Inc., США). Эксперименты проводили путем введения раствора 2 мг/мл муцина в деионизированной воде в 2-мл ячейку для образца, содержащую наночастицы с различной поверхностной плотностью ПЭГ в концентрации 1 мг/мл в воде при скорости перемешивания 481 об/мин. Проводили в общей сложности 28 инъекций с промежутком в сек и стандартной мощностью мккал/с. За первой инъекцией 2 мкл раствора муцина следовали 27 инъекций по 10 мкл раствора муцина. Изотермы связывания строили и анализировали с использованием программы Origin, где результаты ИТК измерений соответствовали одноцентровой модели связывания. Использовали стехиометрию для расчета количества связавшегося муцина на поверхности наночастицы, и представляли в виде мг муцина на м2.
Пример 1. Получение наночастиц
Материалы и методы
Биоразлагаемые наночастицы получали методом либо простой эмульсии м/в, либо двойной эмульсии в/м/в, как описано в статьях R.C. Mundargi et al., J. Control Release 125, 193 (2008), M. Li et al., Int. J. Pharm. 363, 26 (2008), C.E. Astete and C. M. Sabliov, J. Biomater. Sci. Polymer Ed. 17, 247 (2006) и R.A. Jain, Biomaterials, 21, 2475 (2000).
Наночастицы характеризовали с точки зрения размера, поверхностных свойств и нагрузки лекарственного средства (для наночастиц с инкапсулированным лекарственным средством). Смещения наночастиц отслеживали в свежей, неразбавленной человеческой CVM, отслеживая несколько частиц.
Наночастицы, полученные с различными количествами ПЭГ
Получали PLGA-ПЭГ наночастицы с разным целевым содержанием ПЭГ (0, 2, 3, 5, 8, 10 и 25 масс.%, обозначенные PLGA, PLGA-ПЭГ2%, PLGA-ПЭГ3%, PLGA-ПЭГ5%, PLGA-ПЭГ8%, PLGA-ПЭГ10% и PLGA-ПЭГ25%) методом эмульгирования. Молекулярную массу ПЭГ 5 кДа выбирали, поскольку при одинаковом содержании ПЭГ, 6 масс.%, все PLGA-ПЭГ наночастицы с ПЭГ в диапазоне от 1 кДа до 10 кДа могли быстро проникать в слизь. Целевое содержание ПЭГ регулировали путем изменения соотношения PLGA и PLGA-ПЭГ в процессе получения наночастиц. Размеры наночастиц контролировали в пределах 100 нм путем регулирования концентрации полимера и процедуры эмульгирования, и все наночастицы отличались монодисперсным диаметром с небольшим индексом полидисперсности (менее чем 0,1) при динамическом рассеянии света. Наночастицы имели сферическую форму, что определяли методом ПЭМ, и PLGA-ПЭГ25% наночастицы с максимальным целевым содержанием ПЭГ выглядели менее контрастными на границах частиц, что, возможно, являлось следствием высокого содержания отличающегося низкой электронной плотностью ПЭГ, расположенного на поверхности.
Результаты
В таблице 2 приведены характеристики частиц, полученных, как описано выше.
[b] Скорость перемещения также может быть отражена углом наклона α кривых зависимости дважды логарифмических значений MSD от времени (α=1 соответствует беспрепятственному броуновскому движению, тогда как меньшая величина α отражает возрастание препятствия для движения частиц.)
[c] Отношение усредненных по множеству коэффициентов диффузии в слизи (Dm) к таковым в воде (Dw) для наночастиц и значения эффективных коэффициентов диффузии рассчитывали по временной шкале 1 с. Данные представляют средние значения ± SD.
Увеличение целевого содержания ПЭГ приводило к значительному снижению поверхностного заряда наночастиц (таблица 2), и почти нейтральный поверхностный заряд (примерно 4 мВ) был достигнут, когда содержание ПЭГ достигло 8 масс.% и выше. Снижение поверхностного заряда отражает более широкий охват поверхности ПЭГ, поскольку плотное ПЭГ покрытие может эффективно экранировать поверхностный заряд наночастиц. Однако измерение поверхностного заряда (дзета-потенциала) не способно предоставить количественную информацию для оценки поверхностной плотности ПЭГ с точки зрения числа цепей ПЭГ на поверхности частицы. Кроме того, на измерение поверхностного заряда могут влиять заполняющие материалы и среда для измерений.
1H ЯМР использовали для непосредственного количественного определения поверхностной плотности ПЭГ на наночастицах. Как показано в таблице 3, поверхностное содержание ПЭГ на наночастицах возрастает с возрастанием целевого содержания ПЭГ. В таблице 3 приведена поверхностная плотность ПЭГ у наночастиц PLGA-ПЭГ с различным содержанием ПЭГ. Уровень поверхностного ПЭГ определяли методом 1H ЯМР в D2O относительно стандарта DSS (1 масс.%). Общее содержание ПЭГ в наночастицах измеряли методом 1H ЯМР в CDCl3 относительно стандарта TMS (1 масс.%). Н/п, не применимо.
[b] Плотность ПЭГ/полное покрытие поверхности [Г/Г*]. Полное грибовидное покрытие [Г*] означает число свободно расположенных молекул ПЭГ на 100 нм2 (значение <1 является признаком грибовидного покрытия с низкой плотностью ПЭГ, тогда как >1 соответствует покрытию щеточного типа; при этом значение >>1 соответствует покрытию густого щеточного типа с очень высокой плотностью ПЭГ). Данные (среднее ± SD) представляют средние значения из по меньшей мере трех различных серий образцов.
Пример 2: Наночастицы, полученные с различными эмульгаторами
Материалы и методы
Alexa Fluor 555 кадаверин (AF555) химически конъюгировали с полимерами. Наночастицы получали методом эмульгирования. Как правило, смесь (всего 50 мг) PLGA-ПЭГ5k и AF555-меченого PLGA-ПЭГ5k растворяли в 1 мл дихлорметана (ДХМ) (DCM). Масляную фазу выливали в 5 мл водного раствора, содержащего 1% эмульгатора, при обработке ультразвуком (VibraCell, Sonics & Materials Inc., Ньютаун, Коннектикут) при амплитуде 30% в течение 2 минут в ледяной бане для получения эмульсии масло-в-воде.
Эмульсию выливали в другую 40-мл водную фазу раствора эмульгатора при перемешивании на магнитной мешалке со скоростью 700 об/мин в течение по меньшей мере 3 часов, чтобы дать возможность растворителю испариться. Растворитель дополнительно выпаривали, помещая раствор в вакуумную камеру на 30 минут. Конечную суспензию наночастиц фильтровали через шприцевой фильтр с 1-мкм порами, центрифугировали при 20000 g в течение 25 минут и тщательно промывали водой.
Эмульгаторы, включая натриевую соль холевой кислоты (CHA), диоктил сульфосукцинат натрия (DSS), гексадецилтриметиламмоний бромид (CTAB), поливиниловый спирт (ПВС), поли(этилен-малеиновый ангидрид) (PEMA), сапонин, твин 20, твин 80 и сложный эфир сахара D1216 (SE), тестировали при концентрации 1% масс./об. Растворы CHA в концентрации 0,01%-0,5% масс./об. также обладали способностью к успешному образованию наночастиц. Растворы плюроника® FI27, F68 и других эмульгаторов с низкой ММ, таких как кремофор EL и витамин-E TPGS, также были протестированы, однако нестабильные эмульсии приводили к образованию крупных агрегированных частиц.
В таблице 4 приведены характеристики наночастиц, полученных с использованием PLGA-ПЭГ (Mn ~83 кДа) и PLGA (Mn ~15 кДа) и различных эмульгаторов (1% масс./об.).
Для оценки эффекта молекулярной массы полиэтиленгликоля (ММ ПЭГ) на способность проникать в слизь наночастиц, полученных методом эмульгирования, CHA выбрали в качестве репрезентативного сильного эмульгатора с низкой ММ. PLGA-ПЭГ наночастицы с различными ММ ПЭГ при содержании ПЭГ примерно 6 масс.%, получали в 0,5% растворе CHA. Для достижения общего содержания 6 масс.% ПЭГ у PLGA-ПЭГ10k наночастиц использовали смеси PLGA-ПЭГ10k (21,6 масс.%) и PLGA15k.
Результаты
Свойства наночастиц, полученных из ПЭГ с различными молекулярными массами (содержание ПЭГ ~6 масс.%), приведены в таблице 5.
[b] Отношение плотности ПЭГ к полному покрытию поверхности [Г/Г*]. Полное покрытие поверхности [Г*] соответствует теоретическому числу свободно расположенных молекул ПЭГ, необходимому для полного покрытия 100 нм2 поверхности. [Г/Г*]<1 является признаком грибовидного покрытия с низкой поверхностной плотностью ПЭГ, тогда как >1 соответствует покрытию щеточного типа с высокой поверхностной плотностью ПЭГ).
Свойства наночастиц, полученных при различных концентрациях CHA и PLGA-ПЭГ5k, содержащих 6 масс.% ПЭГ, приведены в таблице 6.
Пример 3: получение наночастиц с инкапсулированным лекарственным средством.
Материалы и методы
Куркумин был выбран в качестве модельного гидрофобного лекарственного средства, которое растворяли с полимером в ДХМ. Процедура была аналогична той, которую использовали для получения ненагруженных наночастиц. Полученные куркумин-наночастицы можно визуализировать в слизи, благодаря собственной флуоресценции куркумина.
БСА использовали в качестве модельного гидрофильного лекарственного средства, поскольку он является представителем высокомолекулярных биологических веществ. БСА-FITC и БСА (10% относительно БСА-FITC) растворяли в 0,2 мл 16% масс./об. водном растворе при 37°С. Этот раствор добавляли к 1 мл раствора 100 мг/мл PLGA-ПЭГ5k в ДХМ в процессе обработки пробы ультразвуком (амплитуда 30%, 1 мин с импульсом 1 с) в ледяной бане. Полученную первичную эмульсию в/м немедленно добавляли ко второй водной фазе (5 мл 1% раствора сапонина) при обработке ультразвуком (амплитуда 20% в течение 2 мин). Двойную эмульсию переносили в другие 40 мл 1% раствора сапонина с перемешиванием на магнитной мешалке в течение 3 часов. Наночастицы фильтровали через шприцевой фильтр с 1-мкм порами, промывали и собирали центрифугированием. Конъюгат БСА-FITC давал возможность отслеживать нагруженные БСА наночастицы в слизи.
Результаты
Целевая нагрузка лекарственного средства для наночастиц с куркумином и наночастиц с БСА составляла 9,1% и 16,7%, соответственно.
Пример 4. Оценка эмульгирующей способности
Материалы и методы
PLGA-ПЭГ5k (ММ примерно 83 кДа) использовали в качестве модельного полимера и растворяли в ДХМ при концентрации 50 мг/мл. 0,5 мл раствора PLGA-ПЭГ5k в ДХМ добавляли к 5 мл водной фазы, содержащей 1% (масс./об.) эмульгаторов, при обработке ультразвуком с амплитудой 30% для получения эмульсии с использованием того же метода, который описан выше. Полученную эмульсию добавляли к дополнительным 20 мл 1% раствора эмульгатора при перемешивании на магнитной мешалке со скоростью 700 об/мин в течение 3 часов. Эмульгирующую способность каждого эмульгатора оценивали по его способности предотвращать образование агрегированных частиц. Агрегированные частицы собирали центрифугированием при 500 g в течение 20 мин, и оставшиеся в супернатанте наночастицы собирали центрифугированием при 30000 g в течение 25 мин. Массовое отношение наночастиц к агрегированным частицам рассчитывали и использовали в качестве показателя для оценки эмульгирующей способности эмульгатора.
Диаметр и поверхностный заряд
Диаметр и ξ-потенциал (поверхностный заряд) наночастиц измеряли с использованием прибора Zetasizer Nano ZS90. Наночастицы ресуспендировали в 10 мМ растворе NaCl. Образцы для ПЭМ готовили, капая разбавленной суспензией наночастиц на сетку ПЭМ и оставляли высохнуть на воздухе. Морфологию частиц характеризовали при помощи просвечивающего электронного микроскопа H7600 (Hitachi, Япония).
Эффективность инкапсуляции
Эффективность инкапсуляции куркумина в наночастицы измеряли путем растворения лиофилизированных наночастиц в ДМСО и измерения оптической плотности при 430 нм с использованием планшетного ридера Biotek Synergy MX. Содержание лекарственного средства определяли, проводя сравнение с калибровочной кривой куркумина (диапазон концентраций 0-50 мкг/мл). Поглощение пустых наночастиц в ДМСО при той же концентрации полимера вычитали. Эффективность инкапсуляции БСА-FITC анализировали после расщепления щелочью. Проводили полный гидролиз известного количества лиофилизированных наночастиц в 1M гидроксиде натрия. Полученный раствор анализировали с использованием планшетного ридера Biotek Synergy MX при длине волны возбуждения 490 нм и длине волны излучения 525 нм. Готовили стандартные растворы, содержащие одинаковое количество полимера и возрастающие количества БСА-FITC, при тех же условиях обработки. Количество БСА в наночастицах определяли, проводя сравнение с калибровочной кривой БСА-FITC.
Нагрузку лекарственного средства (DL) и эффективность инкапсуляции (EE) вычисляли следующим образом:

Результаты
Результаты для различных эмульгаторов приведены в таблице 7.
[b] Эффективность инкапсуляции лекарственного средства (EE%) представляет отношение конечной нагрузки лекарственного средства к теоретической нагрузке лекарственного средства.
Количественное определение поверхностной плотности полиэтиленгликоля (ПЭГ)
Поверхностную плотность ПЭГ на наночастицах определяли методом 1H ЯМР с использованием прибора Bruker 400 REM при 400 МГц. Время релаксации устанавливали на уровне 10 с, и ZG на уровне 90°. Наночастицы с различным содержанием ПЭГ непосредственно готовили в 0,5% растворе CHA в D2O и суспендировали в D2O с 1 масс.% натриевой соли 3-(триметилсилил)-1-пропансульфоновой кислоты в качестве внутреннего стандарта для анализа 1H ЯМР.
Известную массу гомополимера ПЭГ 5 кДа (Sigma, Сент-Луис, Миссури) в D2O с 1% натриевой соли 3-(триметилсилил)-1-пропансульфоновой кислоты серийно разводили до различных концентраций для построения калибровочной кривой для сигнала ПЭГ в 1H ЯМР, и эту калибровочную кривую использовали для расчета поверхностного содержания ПЭГ на наночастицах.
0,2 мл раствора наночастиц в D2O лиофилизировали и взвешивали. Исходя из предположения, что все поверхностные цепи ПЭГ были полноразмерными молекулами ПЭГ 5 кДа, рассчитывали поверхностную плотность ПЭГ как число молекул ПЭГ на 100 нм2 площади поверхности наночастиц. Также проводили контрольные эксперименты 1H ЯМР с PLGA наночастицами, полученными тем же методом, и не наблюдали никаких поддающихся обнаружению пиков CHA для PLGA наночастиц. Плотность ПЭГ, [Г], представляет собой число молекул ПЭГ на поверхности наночастиц в расчете на 100 нм2. Ее можно рассчитать путем деления общего содержания ПЭГ (MПЭГ, в моль), определенного методом 1H ЯМР, на общую площадь поверхности всех наночастиц следующим образом:
где WNP представляет собой общую массу наночастиц, dNP представляет собой плотность наночастицы (плотность наночастиц считают равной плотности полимера, 1,21 г/мл для PLGA), и D представляет собой диметр частиц, измеренный методом динамического рассеяния света.
Полное грибовидное покрытие поверхности [Г*] представляет собой число свободно расположенных молекул ПЭГ, занимающих 100 нм2 площади поверхности частицы. Для определения [Г*] оценивали площадь поверхности, занятую одной цепью ПЭГ. При использовании статистического метода случайного блуждания, одна цепь ПЭГ занимает площадь на границе сферы диаметром ξ:
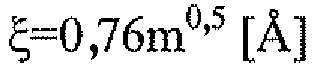
где m представляет собой молекулярную массу цепи ПЭГ. Площадь поверхности, занимаемую одной молекулой ПЭГ, можно определять из (ξ/2)2. Таким образом, ПЭГ 5 кДа имеет свободную сферическую молекулу с диаметром 5,4 нм и занимает площадь поверхности 22,7 нм2. Следовательно, число молекул ПЭГ для полного покрытия 100 нм2 площади поверхности, [Г*], составляет 4,4.
[Г/Г*] можно использовать в качестве показателя для измерения плотности ПЭГ на поверхности наночастиц, при этом значения меньше 1 указывают на низкую плотность ПЭГ, при которой молекулы ПЭГ находятся в грибовидной конформации; в то время как значения больше l указывают на высокую плотность ПЭГ, при которой молекулы ПЭГ находятся в щеточной конформации. Аналогично, [Г*] для ПЭГ 10 кДа, 2 кДа и 1 кДа составляет 2,2, 11 и 22, соответственно. Результаты приведены в таблице 2 выше.
В таблице 8 приведена поверхностная плотность ПЭГ PLGA-ПЭГ наночастиц с разным содержанием ПЭГ. Поверхностный уровень ПЭГ определяли методом 1H ЯМР в D2O относительно стандарта DSS (1 мас). Общее содержание ПЭГ в наночастицах измеряли методом 1H ЯМР в CDCl3 относительно стандарта TMS (1 масс.%). Н/п, не применимо.
[b] Плотность ПЭГ/полное покрытие поверхности [Г/Г*]. Полное грибовидное покрытие [Г*] означает число свободно расположенных молекул ПЭГ на 100 нм2 (<1 указывает на грибовидное покрытие с низкой плотностью ПЭГ, в то время как >1 представляет щеточный тип покрытия; при этом значение >>1 представляет плотный щеточный тип покрытия с очень высокой плотностью ПЭГ).
Данные (среднее ± SD) представляют средние значения из по меньшей мере трех различных серий образцов.
Поверхностную плотность ПЭГ ([Г], число цепей ПЭГ на 100 нм2) вычисляли и сравнивали с полным грибовидным покрытием поверхности ([Г*], числом свободно расположенных молекул ПЭГ на 100 нм2). Для PLGA-ПЭГ3% наночастиц было установлено поверхностное содержание ПЭГ 2,6 масс.% с плотностью 6,5 ПЭГ/100 нм2, соответствующее [Г]/[Г*] = 1,5, что представляет PLGA-ПЭГ3% со щеточной конформацией поверхностного покрытия ПЭГ. Очень густой щеточной конформации ПЭГ покрытия ([Г]/[Г*]>3) достигали при поверхностной плотности ПЭГ выше чем 10 ПЭГ/100 нм2 (PLGA-ПЭГ5%).
Растворяя лиофилизированные PLGA-ПЭГ наночастицы в растворителе для ЯМР CDCl3, общее содержание ПЭГ в наночастицах измеряли методом 1H ЯМР, и было установлено, что общее содержание ПЭГ в наночастицах (как поверхностного ПЭГ, так и ПЭГ, погруженного в сердцевину наночастиц) было очень близким к поверхностному содержанию ПЭГ, как показано в таблице 5. Почти все цепи ПЭГ в PLGA-ПЭГ наночастицах, полученных методом эмульгирования, были обнаружены на поверхности частиц. Метод эмульгирования включал испарение органического растворителя (дихлорметана) из капель эмульсии и последующее затвердевание полимерных ядер. Медленное испарение органического растворителя обеспечивает достаточно времени для гидрофильных цепей ПЭГ, чтобы диффундировать и собираться на поверхности наночастиц, что приводит к высокому коэффициенту извлечения ПЭГ на поверхность. Однако имеет место значительная потеря ПЭГ в процессе получения наночастиц методом эмульгирования, и коэффициент потери ПЭГ может составлять вплоть до 50% для PLGA-ПЭГ25% наночастиц.
Как и в предыдущих публикациях, потеря ПЭГ может быть отнесена на счет образования мицелл низкомолекулярной частью PLGA-ПЭГ в сополимере, которая имеет более высокое содержание ПЭГ и более высокую гидрофильность. Эта часть частиц очень мелкого размера, содержащих полимеры с более высоким содержанием ПЭГ, не может быть собрана после этапов центрифугирования и промывания, что может быть подтверждено увеличением средней молекулярной массы полимера после образования наночастиц по сравнению с исходным полимером, что определяют методом гельпроникающей хроматографии. PLGA-ПЭГ10% наночастицы (117 нм), полученные методом нанопреципитации (метод диффузии растворителя) в контрольном эксперименте, имели общее содержание ПЭГ 6,5 масс.% в наночастицах и только 89% цепей ПЭГ было обнаружено на поверхности (что соответствует 5,8 масс.% поверхностного содержания ПЭГ).
Пример 5. Отслеживание проникающих в слизь наночастиц
Материалы и методы
Собирали человеческую шеечно-влагалищную слизь (CVM). Вкратце, неразбавленные шеечно-влагалищные выделения от женщин с нормальной вагинальной микрофлорой получали с использованием устройства для самостоятельного сбора менструальных выделений, следуя протоколу, одобренному экспертным советом учреждения в университете Джонса Хопкинса. Устройство вводили во влагалище на 60 с, вынимали, помещали в 50-мл центрифужную пробирку и центрифугировали при 1000 об/мин в течение 2 мин для сбора выделений.
Проводили отслеживание флуоресцентно меченых наночастиц в свежей человеческой шеечно-влагалищной слизи (CVM). Вкратце, 0,6 мкл наночастиц в соответствующем разведении добавляли к 20 мкл слизи в специально созданном предметном стекле с лункой и инкубировали при комнатной температуре в течение 1 часа перед микроскопическим исследованием. Траектории наночастиц в CVM регистрировали путем отслеживания многих частиц (MPT). Движения за 20 с снимали при временном разрешении в 66,7 мс с использованием телекамеры с кремниевым усилителем (VE-1000, Dage-MTI), установленной на инвертированном эпифлуоресцентном микроскопе, оборудованном 100× объективом для масляной иммерсии (N.A., 1.3). Отслеженные движения (20 с) анализировали при помощи программы MetaMorph (Universal Imaging, Глендейл, Висконсин).
Усредненное по времени среднеквадратичное смещение (MSD) и эффективный коэффициент диффузии для каждой частицы рассчитывали как функцию от временной шкалы:
<Δr2(τ)> = [x(t+τ) - x(t)]2 + [y(t + τ) - y(t)]2
где x и y представляют координаты наночастиц как функцию от времени, и τ представляет собой запаздывание во времени.
Нагруженные куркумином наночастицы и нагруженные FITC-БСА наночастицы отслеживали в человеческой CVM таким же образом, используя флуоресценцию либо от инкапсулированного куркумина, либо от БСА-FITC. Проникновение частиц в слой слизи моделировали, используя второй закон Фика и коэффициенты диффузии, полученные из экспериментов с отслеживанием.
Результаты
Сравнение перемещений в человеческой CVM PLA-ПЭГ и PCL-ПЭГ наночастиц, содержащих CHA и ПВС, полученных методом эмульгирования, показано на фиг. 1a-h. На фиг. 1a и 1b представлены репрезентативные траектории PLA-ПЭГ и PCL-ПЭГ наночастиц, содержащих CHA и ПВС. На фиг. 1c и 1d приведены графики, демонстрирующие усредненные по множеству геометрические среднеквадратичные смещения (<MSD>) как функцию от временной шкалы. На фиг. 1e и 1f приведены графики, демонстрирующие распределения логарифмов эффективных коэффициентов диффузии отдельных частиц (Dэфф) на временной шкале 1с. На фиг. 1g и 1h приведены графики, демонстрирующие расчетную фракцию частиц, способных проникать в физиологический слой слизи толщиной 30 мкм с течением времени. Данные представлены из трех независимых экспериментов с отслеживанием ≥120 наночастиц в каждом эксперименте. Планки погрешностей соответствуют S.E.M. Эти данные демонстрируют иммобилизацию наночастиц, полученных с использованием ПВС, и быстрое проникновение в слизь наночастиц, полученных с использованием эмульгатора с низкой ММ, CHA, с эффективными коэффициентами диффузии, сходными с теми, которые измерены для PLGA-ПЭГ5k наночастиц.
Эффект молекулярной массы ПЭГ на скорость перемещения MPP в CVM приведен на фиг. 2a и 2b. На фиг. 2a и 2b представлен эффект ММ ПЭГ на скорость перемещения MPP в шеечно-влагалищной слизи человека: Фиг. 2a представляет собой график, демонстрирующий усредненное по множеству геометрическое среднеквадратичное смещение <MSD> как функцию от временной шкалы. Фиг. 2b представляет собой график, демонстрирующий распределения логарифмов эффективных коэффициентов диффузии отдельных частиц (Dэфф) на временной шкале 1 с. Частицы получали методом эмульгирования с использованием PLGA-ПЭГ (6 масс.% ПЭГ). Данные представлены из трех независимых экспериментов с отслеживанием ≥120 наночастиц в каждом эксперименте. Планки погрешностей соответствуют S.E.M. Все эти частицы быстро проникали в слизь (смотри также таблицу 5).
Поверхностный заряд наночастиц был обратно пропорционален ММ ПЭГ и варьировался от -18 мВ (1 кДа) до -2,3 мВ (10 кДа). Поверхностная плотность ПЭГ [Г] (число молекул ПЭГ на 100 нм2), измеренная методом 1H ЯМР, уменьшалась по мере возрастания ММ ПЭГ. Однако отношение [Г/Г*][11] поверхностной плотности ПЭГ к теоретической плотности ПЭГ, необходимой для образования щеточного покрытия ПЭГ [Г*], было более 2 (таблица 5), независимо от ММ ПЭГ, что указывало на наличие густого щеточного покрытия из ПЭГ на поверхности PLGA-ПЭГ(1-10 кДа)/CHA наночастиц.
На фиг. 3a-3c приведены скорости перемещения нагруженных куркумином и БСА MPP и обычных частиц (CP). На фиг. 3a приведен график, демонстрирующий усредненное по множеству геометрическое среднеквадратичное смещение <MSD> как функцию от временной шкалы. На фиг. 3b приведен график, демонстрирующий распределения логарифмов эффективных коэффициентов диффузии отдельных частиц (Dэфф) на временной шкале 1 с. На фиг. 3c приведен график, демонстрирующий расчетную фракцию частиц, по прогнозам, способных проникать в слой слизи толщиной 30 мкм с течением времени. Данные представлены из трех независимых экспериментов с отслеживанием ≥120 наночастиц в каждом эксперименте. Планки погрешностей соответствуют S.E.M. Нагруженные куркумином и БСА наночастицы быстро диффундировали в слизи со скоростями лишь в 6 и 36 раз ниже, чем в воде, при τ=1 с, соответственно (фиг. 3a). Напротив, наночастицы, полученные с ПВС, были иммобилизованы в CVM (фиг. 3b), со скоростями перемещения более чем в 2000 раз меньшими, чем в воде.
PLGA наночастицы без ПЭГ покрытия были полностью иммобилизованы в слизи с коэффициентами диффузии в 38000 раз более низкими, чем коэффициенты диффузии наночастиц того же размера в воде. Присутствие поверхностного покрытия из ПЭГ на наночастицах значительно улучшало их диффузию через очень вязкоупругую слизь, для PLGA-ПЭГ3% с поверхностной плотностью ПЭГ 6,5 ПЭГ/100 нм2 наблюдали повышенное значение Dw/Dm вплоть до 142. При дальнейшем увеличении поверхностной плотности ПЭГ вплоть до 10,4 ПЭГ/100 нм2 PLGA-ПЭГ5% наночастицы становились лишь в 17 раз более медленными, чем при их диффузии в воде. Более 90% наночастиц диффундировали, когда поверхностная плотность ПЭГ была выше чем 16,4 ПЭГ/100 нм2 (PLGA-ПЭГ8%). Дальнейшее увеличение поверхностной плотности ПЭГ, скорее всего, не позволит существенно повысить коэффициент диффузии частиц в слизи, поскольку поверхностная плотность 16,4 ПЭГ/100 нм2 уже позволяет эффективно защищать от связывания компонентов слизи. Примерно 50-70% наночастиц PLGA-ПЭГ8%, 10% и 25% были способны проникать в физиологический слой слизи толщиной 30 мкм в пределах 60 минут, что соответствует гораздо более высоким скоростям, чем у PLGA-ПЭГ5%, PLGA-ПЭГ3% (плотное покрытие), PLGA-ПЭГ2% (низкое покрытие) и PLGA (без покрытия).
Пример 6: Стабильность наночастиц в слизи.
Материалы и методы
Стабильность наночастиц в слизи за счет сведения к минимуму адгезивного взаимодействия между частицами и компонентами слизи является важным критерием для их применения в качестве проникающих в слизь носителей лекарственного средства in vivo. Изучали изменение размера наночастиц в присутствии муцина, в качестве признака связывания муцина, для определения стабильности наночастиц с различной поверхностной плотностью ПЭГ в присутствии муцина. Муцин, выделенный из бычьей подчелюстной железы, был выбран в качестве модельного муцина, поскольку муцин является основным компонентом слизи, и муцин из бычьей подчелюстной железы имеет сходство с человеческой CVM как по структуре, так и по физиологическим свойствам.
Наночастицы инкубировали с раствором муцина (10 мг/мл) и контролировали изменение размера частиц с течением времени.
Результаты
PLGA-ПЭГ наночастицы с поверхностной плотностью ПЭГ ≥16,4 ПЭГ/100 нм2 были стабильны в растворе муцина, сохраняя свой гидродинамический диаметр в течение всей 3-часовой инкубации, и при этих поверхностных плотностях ПЭГ покрытия ПЭГ были в конформации очень густой щетки ([Г]/[Г*]>3). Напротив, у PLGA-ПЭГ5% наночастиц с поверхностной плотностью 6,5 ПЭГ/100 нм2 наблюдали увеличение диаметра частиц примерно на 5% после инкубации с раствором муцина даже в течение лишь 5 минут, и поверхностная плотность ПЭГ на этих PLGA-ПЭГ5% наночастицах уже приводила к образованию щеточного ПЭГ покрытия ([Г]/[Г*]>1). Вследствие этого, одного только щеточного ПЭГ покрытия недостаточно для полной защиты от связывания муцина. Имело место прогрессивное увеличение размера частиц при снижении поверхностной плотности ПЭГ со щеточной конформации до грибовидной конформации. Без ПЭГ покрытия PLGA наночастицы демонстрировали резкое увеличение размера с 109±2 нм до 207±9 нм в течение 5 мин инкубации в муцине.
Фиг. 4a представляет собой схему, иллюстрирующую влияние поверхностного покрытия ПЭГ ([Г/Г*]) на проникновение наночастиц в слизь. На верхних панелях показан препарат PLGA-ПЭГ наночастиц с поверхностным покрытием ПЭГ при увеличении покрытия. По мере увеличения поверхностного покрытия ПЭГ порядок расположения ПЭГ меняется с грибовидного (соседние цепи ПЭГ не перекрываются, [Г/Г*]<1, Фиг. 4a), на щеточное (соседние цепи ПЭГ перекрываются, 1<[Г/Г*]<3, Фиг. 4b) и на густое щеточное ([Г/Г*]>3, Фиг. 4c). На средних панелях проиллюстрировано, каким образом ПЭГ покрытие определяет мукоадгезивное взаимодействие после попадания в слизь. При низком покрытии ПЭГ ([Г/Г*]<1) волокна муцина прочно прикрепляются к ядру наночастицы. При среднем покрытии ПЭГ (1<[Г/Г*]<3) волокна муцина все еще могут частично абсорбироваться на ядре наночастицы. При высоком ([Г/Г*]>3) покрытии ПЭГ ядра наночастиц были полностью экранированы короной из биоинертного ПЭГ, что приводило к отсутствию абсорбции муцина на наночастицах. На нижних панелях показано, что наночастицы с низким покрытием ПЭГ иммобилизованы в слизи, наночастицы со средним покрытием ПЭГ движутся с затруднением и даже иммобилизуются в слизи, а наночастицы с высоким и очень высоким покрытием ПЭГ способны быстро проникать в слизь.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ НА ОСНОВЕ НАНОЧАСТИЦ С УЛУЧШЕННЫМ ПРОНИКНОВЕНИЕМ ЧЕРЕЗ СЛИЗИСТЫЕ ОБОЛОЧКИ | 2013 |
|
RU2598627C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ УСТОЙЧИВОЙ ИММУНОТЕРАПИИ | 2014 |
|
RU2696876C2 |
| Способ изготовления микросфер, содержащих лекарственные вещества в качестве биологически активного действующего вещества, заключенные в матрицу полимера, с использованием получения микросфер методом двойной эмульсии | 2016 |
|
RU2635472C1 |
| СИСТЕМА ДОСТАВКИ ВЕЩЕСТВА БЕЛКОВОЙ ПРИРОДЫ В ВИДЕ НАНОЧАСТИЦ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2013 |
|
RU2566069C2 |
| ВНЕКЛЕТОЧНЫЕ ВЕЗИКУЛЫ ДЛЯ ИНГАЛЯЦИИ | 2019 |
|
RU2799315C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ РАССЕЯННОГО СКЛЕРОЗА И СВЯЗАННЫХ С НИМ ЗАБОЛЕВАНИЙ | 2013 |
|
RU2675322C2 |
| ПОЛИЛАКТИДНЫЕ НАНОЧАСТИЦЫ | 2007 |
|
RU2423104C2 |
| ПОЛИМЕРОСОДЕРЖАЩЕЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ОСНОВЕ ПРОТИВООПУХОЛЕВОГО ПРЕПАРАТА ЭТОПОЗИДА | 2015 |
|
RU2595859C1 |
| ПЭГ-ИЛИРОВАННЫЕ НАНОЧАСТИЦЫ | 2005 |
|
RU2400215C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЛИПИДНЫХ НАНОЧАСТИЦ ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННОГО СРЕДСТВА | 2012 |
|
RU2647476C2 |
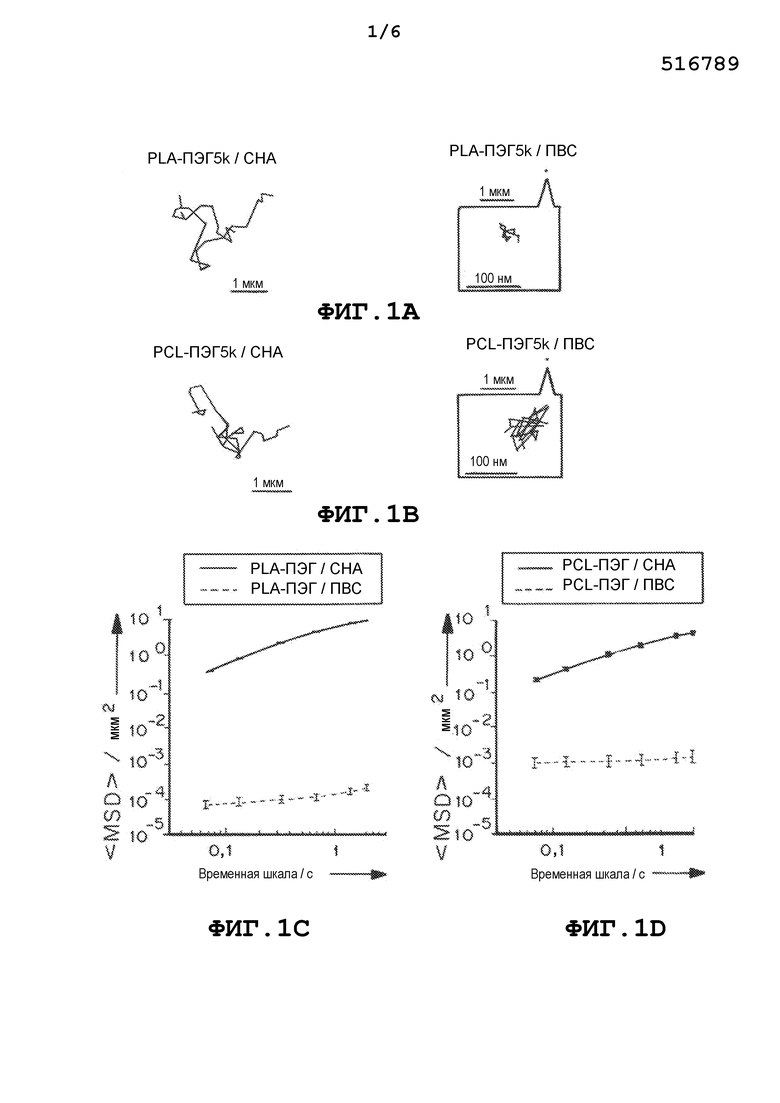
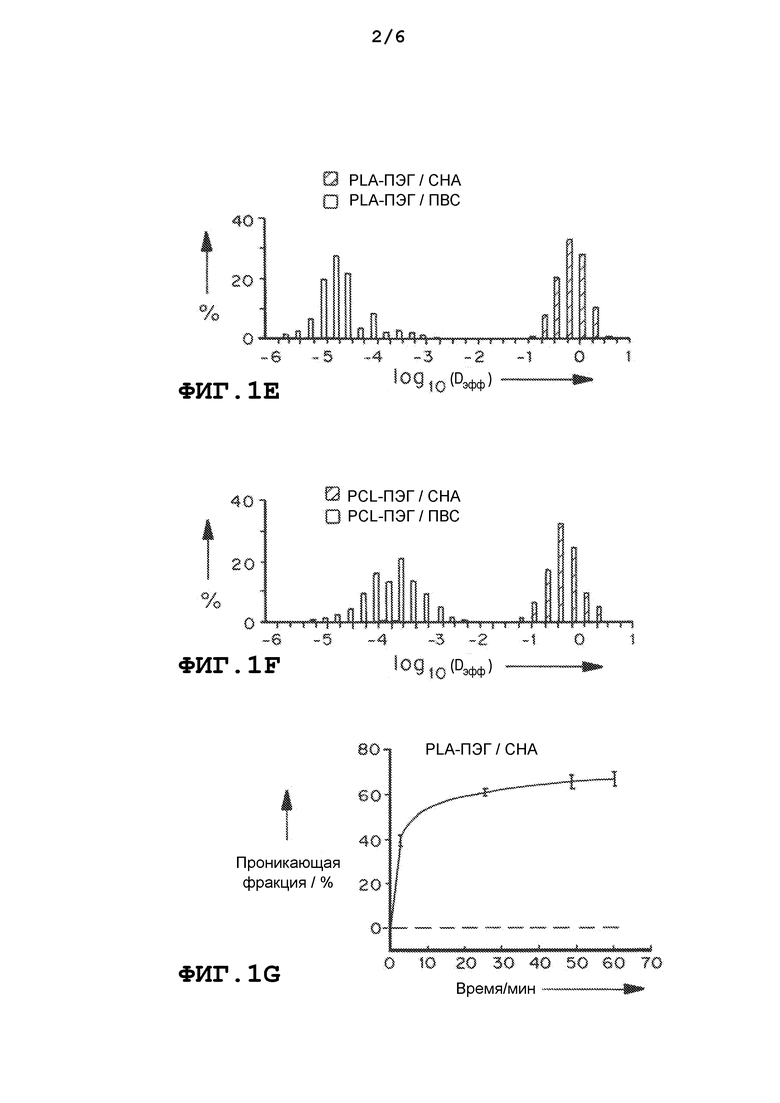
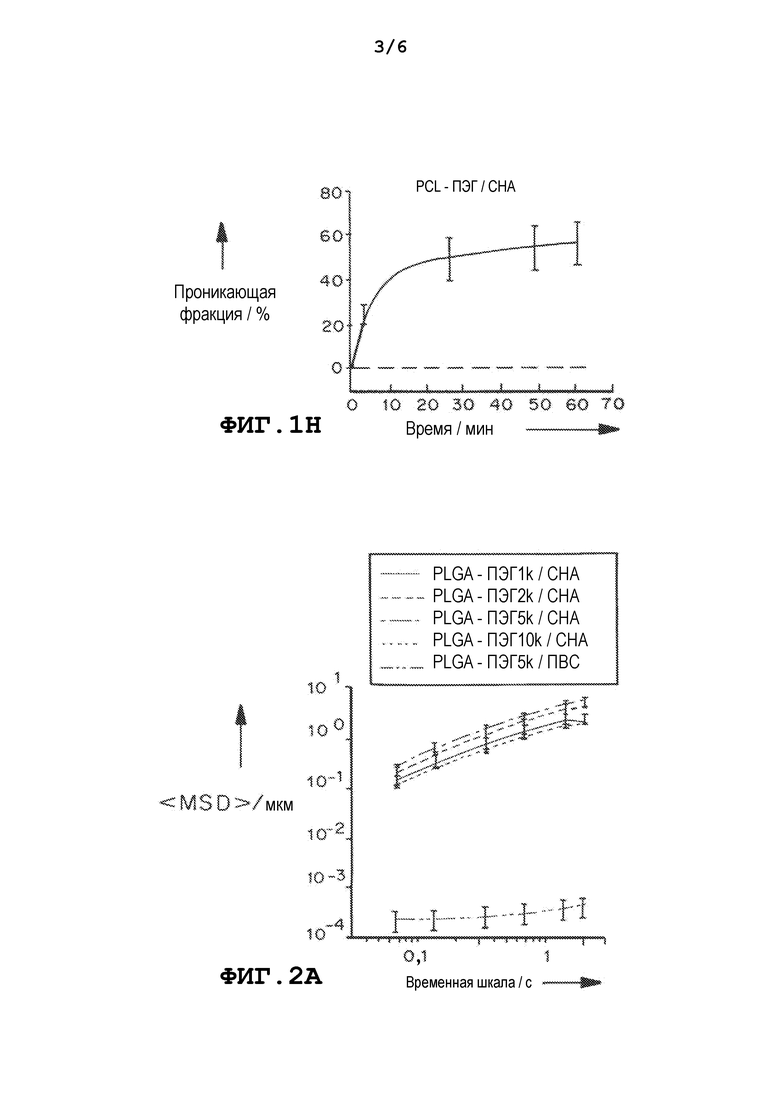
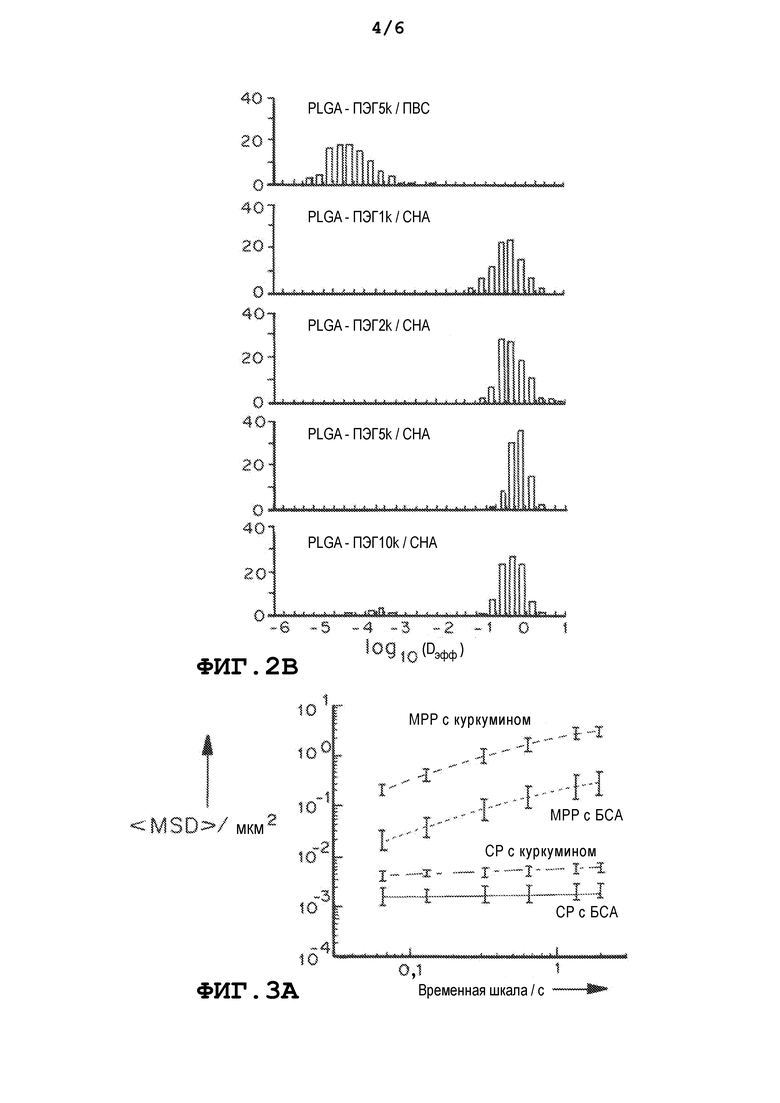
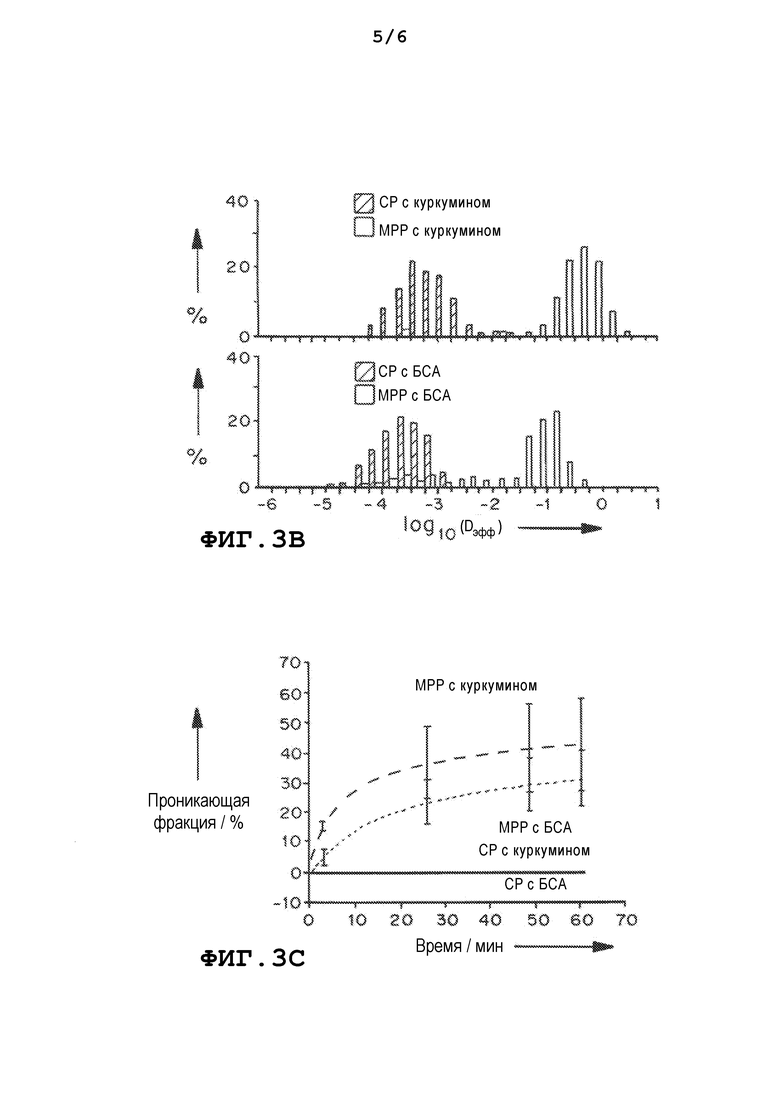
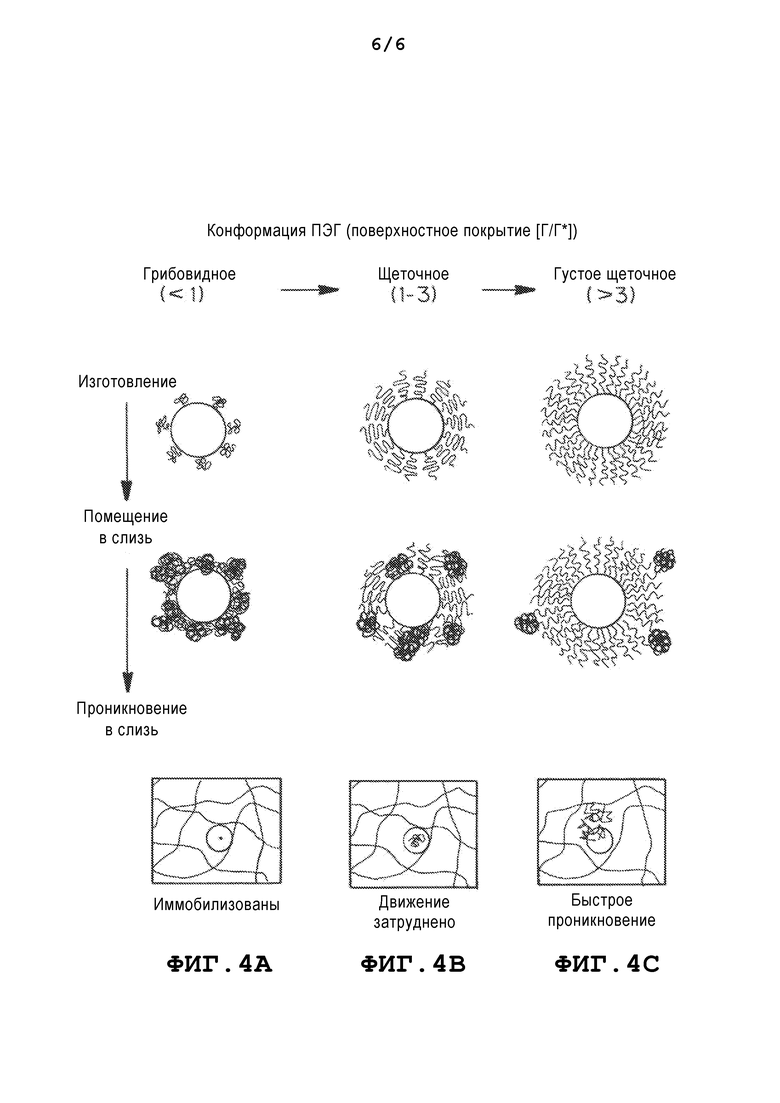
Группа изобретений относится к области медицины, а именно к наночастицам для введения одного или более терапевтических, профилактических и/или диагностических средств, которые получают эмульгированием раствора одного или более биосовместимых полимеров, формирующих ядро наночастиц, одного или более полиэтиленгликолей (ПЭГ), формирующих покрытие наночастиц, одного или более терапевтических, профилактических и/или диагностических средств и одного или более низкомолекулярных эмульгаторов в органическом растворителе при перемешивании в течение по меньшей мере трех часов для испарения органического растворителя и диффундирования и сбора цепей ПЭГ на поверхности наночастиц, при этом покрытие наночастиц характеризуется отношением [Г/Г*] больше 2, где Г – это поверхностная плотность ПЭГ, характеризующая число молекул ПЭГ на 100 нм2 поверхности наночастицы, а Г* – это полное покрытие поверхности наночастицы, характеризующее теоретическое число свободно расположенных молекул ПЭГ, необходимое для полного покрытия 100 нм2 поверхности наночастицы; а также к способу их получения и фармацевтической композиции, содержащей такие наночастицы. Группа изобретений обеспечивает улучшение способности наночастиц проникать через слизь, не сорбируя при этом муцин. 5 н. и 21 з.п. ф-лы, 16 ил., 8 табл., 6 пр.
1. Наночастицы для введения одного или более терапевтических, профилактических и/или диагностических средств, полученные эмульгированием раствора одного или более биосовместимых полимеров, формирующих ядро наночастиц, одного или более полиэтиленгликолей (ПЭГ), формирующих покрытие наночастиц, одного или более терапевтических, профилактических и/или диагностических средств и одного или более низкомолекулярных эмульгаторов в органическом растворителе при перемешивании в течение по меньшей мере трех часов для достаточного испарения органического растворителя и диффундирования и сбора цепей ПЭГ на поверхности наночастиц, при этом покрытие наночастиц характеризуется отношением [Г/Г*] больше 2, где Г – это поверхностная плотность ПЭГ, характеризующая число молекул ПЭГ на 100 нм2 поверхности наночастицы, а Г* – это полное покрытие поверхности наночастицы, характеризующее теоретическое число свободно расположенных молекул ПЭГ, необходимое для полного покрытия 100 нм2 поверхности наночастицы.
2. Наночастицы по п. 1, характеризующиеся тем, что покрытие наночастиц характеризуется отношением [Г/Г*] по меньшей мере 3.
3. Наночастицы по п. 1, характеризующиеся тем, что полимер, формирующий ядро наночастиц, является отличным от ПЭГ.
4. Наночастицы по п. 1, характеризующиеся тем, что ПЭГ ковалентно связан с полимером, формирующим ядро наночастицы.
5. Наночастицы по п. 3, характеризующиеся тем, что полимер, формирующий ядро наночастиц, представляет собой блок-сополимер, содержащий один или более блоков ПЭГ.
6. Наночастицы по п. 4, характеризующиеся тем, что полимер, формирующий ядро наночастиц, содержит один блок ПЭГ, ковалентно связанный на одном конце полимера, формирующего ядро наночастицы.
7. Наночастицы по п. 1, характеризующиеся тем, что полимер, формирующий ядро наночастиц, дополнительно содержит один или более полимеров, которые не связаны ковалентно с ПЭГ.
8. Наночастицы по п. 6, характеризующиеся тем, что один или более полимеров, не связанных ковалентно с ПЭГ, имеют тот же химический состав, что и один или более полимеров, формирующих ядро наночастицы.
9. Наночастицы по п. 1, характеризующиеся тем, что молекулярная масса ПЭГ составляет от примерно 1 кДа до примерно 10 кДа, предпочтительно от примерно 1 кДа до примерно 5 кДа, более предпочтительно примерно 5 кДа.
10. Наночастицы по п. 1, характеризующиеся тем, что плотность ПЭГ, измеренная методом 1Н ЯМР, составляет от примерно 1 до примерно 100 цепей/100 нм2, предпочтительно от примерно 1 до примерно 50 цепей/100 нм2, более предпочтительно от примерно 5 до примерно 50 цепей/100 нм2, наиболее предпочтительно от примерно 5 до примерно 25 цепей/100 нм2.
11. Наночастицы по п. 1, характеризующиеся тем, что молекулярная масса одного или более эмульгаторов составляет менее 1500, 1300, 1200, 1000, 800, 600 или 500 а.е.м.
12. Наночастицы по п. 11, характеризующиеся тем, что один или более из эмульгаторов являются нейтральными, положительно заряженными, отрицательно заряженными или их сочетаниями.
13. Наночастицы по п. 12, характеризующиеся тем, что один или более низкомолекулярных эмульгаторов выбраны из группы, состоящей из натриевой соли холевой кислоты, диоктил сульфосукцината натрия, гексадецилтриметиламмоний бромида, сапонина, твина® 20, твина® 80 и сложных эфиров сахаров.
14. Наночастицы по п. 12, характеризующиеся тем, что один или более ПЭГ присутствуют в количестве, эффективном для того, чтобы сделать поверхностный заряд наночастиц нейтральным или практически нейтральным, когда один или более эмульгаторов несут заряд.
15. Наночастицы по п. 1, характеризующиеся тем, что один или более эмульгатор обладает эмульгирующей способностью по меньшей мере примерно 50%, предпочтительно по меньшей мере 55, 60, 65, 70, 75, 80, 85, 90 или 95%.
16. Фармацевтическая композиция, содержащая наночастицы по любому из пп. 1-15 и один или более фармацевтически приемлемый носитель.
17. Способ введения одного или более терапевтических, профилактических и/или диагностических средств пациенту, нуждающемуся в этом, включающий введение эффективного количества наночастиц по любому из пп. 1-15.
18. Способ по п. 17, характеризующийся тем, что наночастицы вводят энтерально, парентерально или локально.
19. Способ по п. 17, характеризующийся тем, что наночастицы вводят парентерально.
20. Способ по п. 19, характеризующийся тем, что наночастицы вводят внутривенной, подкожной, внутримышечной или внутрибрюшинной инъекцией.
21. Способ по п. 19, характеризующийся тем, что наночастицы вводят под конъюнктиву.
22. Способ по п. 17, характеризующийся тем, что наночастицы вводят локально.
23. Способ по п. 22, характеризующийся тем, что наночастицы локально наносят на глаза или их отделы.
24. Способ по п. 22, характеризующийся тем, что наночастицы вводят в дыхательные пути, интраназально, интравагинально, ректально или буккально.
25. Способ получения наночастиц по любому из пп. 1-15, включающий растворение одного или более биосовместимых полимеров, формирующих ядро наночастиц, одного или более полиэтиленгликолей (ПЭГ), одного или более терапевтических, профилактических и/или диагностических средств в органическом растворителе с получением раствора, добавление указанного раствора к водному раствору или суспензии эмульгатора для получения эмульсии и добавление эмульсии ко второму раствору или суспензии эмульгатора при перемешивании в течение по меньшей мере трех часов для достаточного испарения органического растворителя и диффундирования и сбора цепей ПЭГ на поверхности наночастиц для образования наночастиц.
26. Наночастицы для введения одного или более терапевтических, профилактических и/или диагностических средств, полученные способом по п. 25.
| R | |||
| Gref et al | |||
| Stealth’ corona-core nanoparticles surface modified by polyethylene glycol (PEG): influences of the corona (PEG chain length and surface density) and of the core composition on phagocytic uptake and plasma protein adsorption / Colloids and Surfaces B: Biointerfaces, 2000, Vol.18, pages 301-313 | |||
| US 2008166414 A1, 10.07.2008 | |||
| Yan Sheng et al | |||
| In vitro macrophage uptake and in vivo biodistribution of PLA-;PEG nanoparticles loaded with hemoglobin as blood substitutes: effect of PEG content / J Mater Sci: Mater Med, 2009, Vol.20, pages 1881-1891. |
Авторы
Даты
2017-09-25—Публикация
2012-12-14—Подача