Область техники, к которой относится изобретение
Это изобретение касается синтетического соединения, Oxy133, имеющего структуру
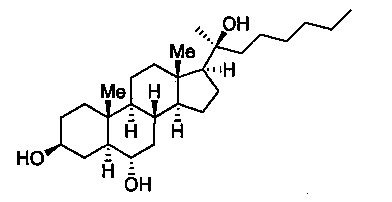
или биоактивной или фармацевтической композиции, содержащей Oxy133 и фармацевтически приемлемый носитель, а также способов использования соединения или его биоактивной или фармацевтической композиции для лечения целого ряда заболеваний, включая заболевание костей, ожирение, сердечнососудистые заболевания и неврологические нарушения.
Уровень техники
Для оказания содействия росту костей, включая сращение перелома и хирургическое лечение заболеваний позвоночника (1-4), в медицине обычно применяются биологические препараты. Для решения проблем, связанных с дегенеративным заболеванием межпозвоночных дисков и артритом, затрагивающим поясничный и шейный отдел позвоночника, хирургом-ортопедом и нейрохирургом зачастую осуществляется спондилодез. Исторически сложилось так, что аутокостный трансплантат, обычно взятый из гребня подвздошной кости пациента, используется для увеличения сращения между уровнями позвонков. Однако, частота осложнений в донорском участке, увеличение времени операции и повышение кровопотери, связанной с получением аутокостного трансплантата (5-7), обусловливают поиск безопасной и эффективной альтернативы.
Для содействия формированию спондилодеза у людей обычно используется рекомбинантный человеческий костный морфогенетический белок-2 (rhBMP-2). Его применение было утверждено в 2002 г. Управлением по надзору за качеством пищевых продуктов и лекарственных веществ США (FDA) для одноуровневого переднего поясничного межтелового спондилодеза (S). С тех пор применение rhBMP-2 значительно увеличилось, а также были расширены показания для его применения с целью включения заднего поясничного спондилодеза, а также шейного спондилодеза. Несмотря на эффективность rhBMP-2, последние сообщения подвергают сомнению его безопасность при использовании во время хирургической операции спондилодеза. Описанные в литературе осложнения включают образование серомы, припухлость мягких тканей, остеолизис позвоночника, эктопическое костеобразование, ретроградную эякуляцию и канцерогенность (9-12). Более того, при его использовании в шейном отделе позвоночника наблюдался отек дыхательных путей, что побудило FDA к выпуску уведомления от системы здравоохранения, содержащего предупреждение о его применении при операциях в шейном отделе позвоночника. В настоящее время не существует подходящей альтернативы, которая имела бы сходную эффективность, вызывая сращение без побочных действий rhBMP-2 (12).
Оксистеролы образуют большое семейство окисленных производных холестерина, присутствующих в кровообращении, а также тканях человека и животных. Было обнаружено, что оксистеролы входят в состав атеросклеротических повреждений и играют роль в различных физиологических процессах, таких как клеточная дифференцировка, воспаление, апоптоз и выработка стероидных гормонов. Некоторые из настоящих изобретателей ранее сообщали, что отдельные оксистеролы природного происхождения обладают устойчивыми остеогенными свойствами (13). Наиболее эффективный остеогенный природный оксистерол, 20(S)-гидроксихолестерол ("20S") (14), является и остеогенным и антилипогенным при применении к мультипотентным мезенхимальным клеткам, способным дифференцироваться в остеобласты и адипоциты. Ранее были осуществлены структурные модификации 20S с целью синтеза более эффективных аналогов 20S, включая Oxy34 и Oxy49, которые, как было показано, вызывают остеогенную и ингибируют липогенную дифференцировку стромальных клеток костного мозга (MSC) посредством активации сигнального пути Hedgehog (Hh) (15). В дополнение к этому Oxy34 и Oxy49 стимулируют спондилодез in vivo на крысиной модели заднелатерального спондилодеза (15). Предшествующие молекулы оксистерола обладают колеблющимися в широких пределах и непредсказуемыми свойствами. Сохраняется потребность в новых, улучшенных оксистеролах по сравнению с rhBMP-2 и предшествующими оксистеролами для обеспечения повышенной активности и эффективности, облегчения синтеза и более низкой стоимости производства. Новый оксистерол может сделать более обоснованным клинический выбор врача при лечении, например, переломов длинных трубчатых костей, болезней позвоночника и остеопороза.
Краткое описание фигур
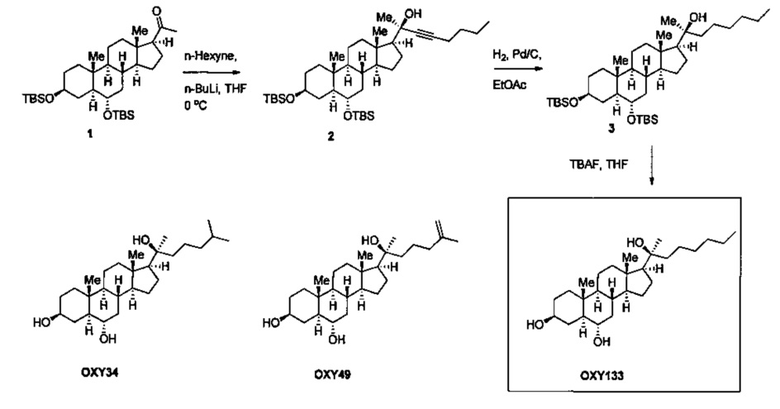
Фигура 1 показывает строение молекул остеогенных оксистеролов. Показано строение молекул 20(S)-гидроксихолестерола (20S), Oxy34, Oxy49 и Oxy133. Oxy34 отличается от 20S дополнительной ОН группой на С6, при этом двойная связь между С5 и С6 устраняется. Oxy49 имеет структуру, сходную с Oxy34, и включает двойную связь между С25 и С27. Oxy133 отличается от Oxy34 и 49 утратой С27 и увеличением длины боковой цепи на один атом углерода.
Фигура 2 показывает зависимое от дозы увеличение активности щелочной фосфатазы при воздействии оксистеролов. (Фиг. 2А) C3HT101/2 клетки или (фиг. 2В) М2-10 В4 клетки на этапе слияния обрабатывали разбавителем (контроль) или 0.125-10 мкм Oxy133. Для прямого сравнения с Oxy133 клетки C3H также обрабатывали Oxy34 и Oxy49 (фиг. 2А). Через 4 дня измеряли активность щелочной фосфатазы (ALP) в полных клеточных экстрактах. Результаты трех отдельных экспериментов приведены в виде среднего из трех определений +SD и нормированы по отношению к концентрации белка, (р<0.0001 для клеток, обработанных 0.25 мкМ или более высокими дозами всех оксистеролов по сравнению с контрольными клетками, обработанными разбавителем).
Фигура 3 показывает, что оху133 вызывает остеогенную дифференцировку. (Фиг. 3А) C3HT101/2 клетки на этапе слияния обрабатывали разбавителем (контроль) или 2.5 мкМ Oxy133 в остеогенной среде. Экспрессия остеогенных генов Runx2, ALP, BSP, OSX и OCN была измерена с помощью ПЦР в режиме реального времени через 48 часов, 4, 7 и 14 дней после обработки. Результаты типичного эксперимента представлены в виде среднего из трех определений ±SD (р<0.005 для контроля в сравнении с Oxy133 во всех временных точках ALP, BSP и OSX и через 4, 7 и 14 дней для Runx2 и OCN). (Фиг. 3В) C3H10T1/2 клетки обрабатывали разбавителем (контроль) или 2.5 мкМ Oxy133 в течение 3 недель. Для исследования внеклеточной минерализации проводили окрашивание по von Kossa, при этом минерализованный матрикс под световым микроскопом проявлялся в виде темного окрашивания (10Х). (Фиг. 3С) В параллельных культурах, описанных в (В), количественное определение минерализации осуществляли с помощью метода включения 45Са (р<0.005 для контроля против всех концентраций Oxy133). (Фиг. 3D) Первичные человеческие MSC обрабатывали в остеогенной среде разбавителем (контроль) или 5 мкМ Oxy133 в течение 4 недель. Экспрессия остеогенных генов OSX, BSP и OCN была измерена с помощью ПЦР в режиме реального времени. Результаты типичного эксперимента представлены в виде среднего из трех определений ±SD (р<0.05 для всех генов в контроле в сравнении с клетками, обработанными Oxy133). (Фиг. 3E) Первичные человеческие MSC обрабатывали в остеогенной среде с разбавителем (контроль) или 0.5, 1 и 5 мкМ Oxy133 в течение 5 недель. Для исследования внеклеточной минерализации проводили окрашивание по von Kossa, при этом минерализованный матрикс под световым микроскопом проявлялся в виде темного окрашивания (10Х).
Фигура 4 показывает роль сигнального пути Hedgehog в остеогенной дифференцировке, вызванной Oxy133. (Фиг. 4А) C3H10T1/2 клетки на этапе слияния обрабатывали в остеогенной среде разбавителем (контроль) или Oxy133 в присутствии или при отсутствии 4 мкМ циклопамина (Сус). Через 4 дня измеряли активность ALP и через 7 дней - экспрессию остеогенных генов ALP, BSP и OSX с помощью количественной ПЦР в режиме реального времени PCR (р<0.001 для контроля в сравнении с Oxy133, и для Oxy133 в сравнении с Oxy133+Сус в отношении активности ALP и экспрессии всех показанных генов). (Фиг. 4В) C3H10T1/2 клетки трансфицировали контрольной плазмидой (pGL3b) или плазмидой, содержащей 8X-Gli люциферазный репортер, и обрабатывали разбавителем (контроль) или Oxy133, причем люциферазную активность определяли через 48 часов. Результаты типичного эксперимента представлены в виде среднего из трех определений ±SD. (р<0.001 для контроля в сравнении с Oxy133 при 100 нМ, 250 нМ и 1 мкМ Oxy133). (Фиг. 4С) Количество YFP-Smo, захваченного 20S-гранулами, или контрольными гранулами сравнили в образцах, не содержащих конкурент или содержащих 50 мкМ свободного стерола-конкурента (20S, Oxy133 или Oxy16). Захваченный гранулами YFP-Smo измеряли методом вестерн-блоттинга (сверху) и наносили на график (внизу) относительно количества, захваченного в реакции связывания при отсутствии конкурента.
Фигура 5 показывает простые рентгенограммы масс сращения, образованных под воздействием ВМР2 и Oxy133. Показаны изображения (Faxitron) двух характерных животных из указанных групп через 8 недель после операции. Стрелки-указатели показывают отсутствие костеобразования; стрелки показывают костеобразование. Группа I (Контроль); пространство между поперечными отростками без костеобразования. Группа II (ВМР2); внедрение костной массы и билатеральное сращение между L4-L5. Группа III (Oxy133-20 мг); внедрение костной массы и билатеральное сращение между L4-L5. Группа IV (Oxy133-2 мг); внедрение костной массы и билатеральное сращение между L4-L5 у животных, показавших индукцию сращения с помощью Oxy133.
Фигура 6 показывает микро-СТ масс сращения, образованных под воздействием ВМР2 и Oxy133. Показаны микро-СТ двух характерных животных из указанных групп. Стрелки-указатели показывают отсутствие костеобразования; стрелки показывают костеобразование. Группа I (Контроль); пространство между поперечными отростками без костеобразования. Группа II (ВМР2); образование мостика из костной массы в пространстве между поперечными отростками и билатеральное сращение между L4-L5. Группа III (Oxy133-20 мг); образование мостика из костной массы в пространстве между поперечными отростками и билатеральное сращение между L4-L5. Группа IV (Oxy133-2 мг); образование мостика из костной массы в пространстве между поперечными отростками и билатеральное сращение между L4-L5 у животных, показавших индукцию сращения с помощью Oxy133. Группа V (Oxy133-0.2 мг); крайняя справа стрелка показывает небольшое количество костеобразования из L5 поперечного отростка.
Фигура 7 показывает гистологическое исследование эффекта Oxy133 на спондилодез. (Фиг. 7А) Показаны фронтальные гистологические срезы двух отдельных типичных животных из каждой группы (10Х). В группе I (Контроль) не наблюдается значительного костеобразования пространстве между поперечными отростками (стрелки-указатели). В группе II (ВМР2) происходит образование костного мостика L4-L5 (стрелки) с явным доказательством образования массы сращения трабекулярной и кортикальной кости. Образцы, полученные от группы III (Oxy133-20 мг) и группы IV (Oxy133-2 мг), демонстрируют значительное костеобразование в пространстве между поперечными отростками (стрелки) с трабекулярным и кортикальным костеобразованием, сравнимым с костеобразованием, индуцированным ВМР2. (Фиг. 7B) Фронтальные гистологические срезы, полученные от двух животных в каждой из групп группа II (ВМР2) и группа III (Oxy133-20 мг), показывают значительное образование адипоцитов в массе сращения у животных, обработанных ВМР2, и существенно меньшее количество адипоцитов в массе сращения у животных, обработанных оксистеролом (стрелки, увеличение 20Х).
Раскрытие изобретения
Изобретатели обнаружили остеогенный оксистерол, Oxy133, который вполне пригоден для целого ряда применений в клинической практике, и описали его способность оказывать содействие остеогенной дифференцировке in vitro и спондилодезу на крысиной модели in vivo. Среди большого количества синтезированных и исследованных аналогов оксистерола особенно эффективным и легким для синтеза неожиданно оказался Oxy133. Oxy133 вызывал значительную экспрессию остеогенных маркеров Runx2, osterix (OSX), щелочной фосфатазы (ALP), костного сиалопротеина (BSP) и остеокальцина (OCN) в фибробластах эмбриона мыши C3H10T1/2. Индуцированная Oxy133 активация 8X-Gli люциферазного репортера, его прямое связывание с Smoothened рецептором и ингибирование индуцированных Oxy133 остеогенных эффектов ингибитором пути Hedgehog (Hh), циклопамином, продемонстрировали роль пути Hh в опосредовании остеогенных ответов на Oxy133. В дополнение к этому, Oxy133 вызывал экспрессию OSX, BSP и OCN и стимулировал сильную минерализацию в первичных человеческих мезенхимальных стволовых клетках. In vivo, билатеральный спондилодез у животных, обработанных Oxy133 в месте сращения, наблюдался на рентгенограмме только через 4 недели и был подтвержден оценкой «вручную», микро-СТ и гистологическим исследованием через 8 недель, при одинаковой эффективности с костным морфогенетическим белком-2 (ВМР2). Однако, в отличие от ВМР2, Oxy133 не вызывал липогенез в массе сращения и приводил к образованию плотной костной ткани, о чем свидетельствует более высокое отношение BV/TV и меньшее трабекулярное отделение (trabecular separation). Таким образом, Oxy133 является пригодным для лечения состояний, которые могут получить пользу от локальной стимуляции костеобразования, включая, например, спондилодез, перелом кости, применение для костной регенерации/тканевой инженерии, увеличение плотности кости в челюсти для зубных имплантатов, остеопороз или тому подобное.
Изобретатели также продемонстрировали, что Oxy133 ингибирует липогенез плюрипотентных MSC клеток. Таким образом, Oxy133 является пригодным для лечения таких состояний, как, например, образование ксантом, локализованное скопление жировых «подушек» и ожирение.
Преимущества Oxy133 включают, например, более легкий синтез и сокращение времени до сращения по сравнению с другими остеогенными оксистеролами, исследованными изобретателями. Oxy133 является низкомолекулярным остеогенным оксистеролом, который может выступать в качестве члена следующего поколения костных анаболических терапевтических средств, а также в качестве средства, подходящего для лечения целого ряда других состояний, включая заболевания, которые могут получить пользу от стимулирования активности пути Hh.
Одним аспектом изобретения является соединение, называемое Oxy133 и имеющее формулу
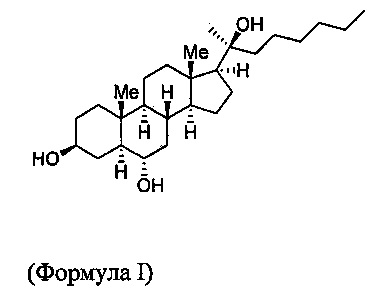
или его фармацевтически приемлемая соль или сольват.
Другим аспектом изобретения является биоактивная или фармацевтическая композиция, содержащая Oxy133 или его фармацевтически приемлемую соль или сольват и фармацевтически приемлемый носитель. Термины "биоактивная" композиция или "фармацевтическая" композиция используются в описании взаимозаменяемым образом. Оба термина относятся к композициям, которые могут вводиться субъектам, используются для нанесения на устройство или присутствуют в медицинском устройстве, которое вводится субъекту, или т.п. Эти биоактивные или фармацевтические композиции иногда в описании называются "фармацевтическими композициями или биоактивными композициями изобретения". Фраза "введение Oxy133" используется в описании в отношении введения этого соединения субъекту (например, контактирование субъекта с соединением). Следует понимать, что соединение, предназначенное для такого использования, в большинстве случаев может иметь форму фармацевтической композиции или биоактивной композиции, содержащей Oxy133.
Другим аспектом изобретения является способ индуцирования (стимулирования, активизации) ответа, опосредованного путем (Hh), в клетке или ткани, включающий контактирование клетки или ткани с эффективным количеством (например, терапевтически эффективным количеством) Oxy133. Клетка или ткань может быть клеткой или тканью в культуре in vitro или может принадлежать субъекту, такому как млекопитающее (например, человек). В вариантах осуществления изобретения ответ, опосредованный путем (Hh), представляет собой стимулирование остеобластической дифференцировки, остеоморфогенез, и/или остеопролиферацию; или ответ представляет собой стимулирование роста волос и/или образования хряща (например, способ лечения субъекта с алопецией или остеоартритом, соответственно, включающий введение субъекту эффективного количества биологически активной композиции изобретения); или ответ представляет собой стимулирование неоваскулогенеза, например, ангиогенеза, и таким образом увеличение доставки крови к ишемическим тканям (например, способ лечения субъекта с сердечнососудистым заболеванием, артериосклерозом, инфарктом миокарда, стенокардией, болезнью периферических сосудов и/или инсультом, включающий введение субъекту эффективного количества биологически активной композиции изобретения); или ответ представляет собой ингибирование дифференцировки адипоцитов, морфогенеза адипоцитов и/или пролиферации адипоцитов (например, способ лечения субъекта, у которого наблюдается образование ксантом, локализованное скопление жировых «подушек» и/или ожирение, включающий введение субъекту эффективного количества биологически активной композиции изобретения); или ответ представляет собой стимуляцию клеток-предшественников с целью прохождения нейрогенеза (дифференцировки нейронов) (например, способ лечения субъекта с неврологической болезнью). Hh-опосредованный ответ может включать регенерацию любого из целого ряда типов тканей для использования в регенеративной медицине.
Другим аспектом изобретения является способ лечения субъекта с заболеванием костей, остеопенией, остеопорозом или переломом кости, включающий введение субъекту эффективного количества биоактивной композиции или фармацевтической композиции, содержащей Oxy133. Биоактивная композиция или фармацевтическая композиция может вводиться субъекту в терапевтически эффективной дозе в эффективной лекарственной форме с подобранным интервалом, например, с целью увеличения костной массы, улучшения симптомов остеопороза, уменьшения, устранения, предотвращения или лечения атеросклеротических повреждений или тому подобного. Биоактивная композиция или фармацевтическая композиция может вводиться субъекту в терапевтически эффективной дозе в эффективной лекарственной форме с подобранным интервалом с целью улучшения симптомов остеопороза. В одном варианте осуществления субъект подвергается лечению с целью стимулирования костеобразования путем сбора мезенхимальных стволовых клеток млекопитающего (например, от субъекта или от подходящего млекопитающего, или из ткани или банка клеток), обработки мезенхимальных клеток млекопитающего Oxy133 с целью вызвать остеобластическую дифференцировку клеток и введения дифференцированных клеток субъекту.
В любом из способов изобретения Oxy133 может быть введен в клетку, ткань или орган с помощью местного введения. Например, Oxy133 может применяться местно в виде крема или тому подобного, или он может быть введен (впрыснут) непосредственно в клетку, ткань или орган, или он может быть помещен в подходящее медицинское устройство (например, имплантат).
Другим аспектом изобретения является набор, предназначенный для осуществления одного или более описанных здесь способов. Набор может содержать эффективное количество (например, терапевтически эффективное количество) Oxy133, необязательно в контейнере.
Другим аспектом изобретения является имплантат, предназначенный для использования в организме субъекта (например, животного, такого как человек), содержащий имеющий поверхность субстрат. Поверхность или внутренняя сторона имплантата содержит биоактивную композицию или фармацевтическую композицию, включающую Oxy133 в количестве, достаточном для того, чтобы вызвать костеобразование в окружающей костной ткани.
В некоторых случаях биоактивная композиция, способ, набор или медицинское устройство изобретения может содержать одно или более других подходящих терапевтических средств, например, таких как паратиреоидный гормон, фторид натрия, инсулиноподобный фактор роста I (ILGF-I), инсулиноподобный фактор роста II (ILGF-II), трансформирующий ростовой фактор бета (TGF-β), ингибитор цитохрома Р450, остеогенный простаноид, BMP 2, BMP 4, BMP 7 и/или BMP 14.
Oxy133 имеет структуру
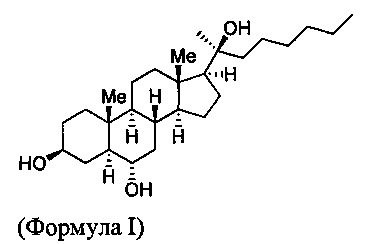
Химическое название данной структуры - (3S,5S,6S,8R,9S,10R,13S,14S,17S) 17-((S)-2-гидроксиоктан-2-ил)-10,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-3,6-диол.
Пример II описывает дизайн Oxy133 и метод синтеза данной молекулы.
В дополнение к соединению Oxy133 формулы I, другие варианты осуществления изобретения включают любые возможные отдельные стереоизомеры с любым из представленных формулой стереоцентров, включая диастереомеры, рацематы, энантиомеры и другие изомеры соединения. В некоторых вариантах осуществления изобретения "Oxy133" или "соединение, имеющее формулу I" или "Oxy133 или его фармацевтически приемлемая соль" может включать все полиморфы и сольваты соединения, например, образованные органическими растворителями, и гидраты. "Сольват" представляет собой комплекс или агрегат, образованный одной или более молекулами растворенного вещества, например, соединения или его фармацевтически приемлемой соли, и одной или более молекулами растворителя. Такие сольваты могут быть кристаллическими твердыми веществами, имеющими практически постоянное молярное отношение растворенного вещества и растворителя. Подходящие растворители известны специалистам в данной области техники, например, вода, этанол. Такие изомеры, полиморфы и сольваты можно получить с помощью известных в данной области методов, таких как региоспецифический и/или энантиоселективный синтез и разделение.
Пригодность для получения солей зависит от кислотности и основности соединения. Подходящие соли соединения включают, но не ограничиваются этим, соли присоединения кислоты, такие как соли, полученные при использовании хлористоводородной, бромистоводородной, йодистоводородной, хлорной, серной, азотной, фосфорной, уксусной, пропионовой, гликолевой, молочной, пировиноградной, малоновой, янтарной, малеиновой, фумаровой, яблочной, винной, лимонной, бензойной, угольной, коричной, миндальной, метансульфоновой, этансульфоновой, гидроксиэтансульфоновой, бензолсульфоновой, п-толуолсульфоновой, циклогексансульфаминовой, салициловой, п-аминосалициловой, 2-феноксибензойной и 2-ацетоксибензойной кислоты; соли, полученные при использовании сахарина; соли щелочных металлов, такие как соли натрия и калия; соли щелочно-земельных металлов, такие как соли кальция и магния; и соли, образованные с помощью органических или неорганических лигандов, таких как четвертичные аммониевые соли.
Дополнительные подходящие соли включают, но не ограничиваются этим, такие соли соединений, как ацетат, бензолсульфонат, бензоат, бикарбонат, бисульфат, битартрат, борат, бромид, эдетат кальция, камсилат, карбонат, хлорид, клавуланат, цитрат, дигидрохлорид, эдетат, эдизилат, эстолат, эзилат, фумарат, глюцептат, глюконат, глутамат, гликолиларсанилат, гексилрезорцинат, гидрабамин, гидробромид, гидрохлорид, гидроксинафтоат, иодид, изотионат, лактат, лактобионат, лаурат, манат, малеат, манделат, мезилат, метилбромид, метилнитрат, метилсульфат, мукат, напсилат, нитрат, N-метилглюкамин аммонийная соль, олеат, памоат (эмбонат), пальмитат, пантотенат, фосфат/дифосфат, полигалактуронат, салицилат, стеарат, сульфат, субацетат, сукцинат, таннат, тартрат, теоклат, тозилат, триетиодид и валерат.
Понятно, что ссылки в описании на "Oxy133" включают его фармацевтически приемлемые соли или сольваты.
В любых из способов, композиций или наборов изобретения, в частности при использовании для лечения субъекта, композиция изобретения необязательно может предоставляться в сочетании с одним или более другими подходящими терапевтическими средствами. Может использоваться любое подходящее для лечения конкретного заболевания терапевтическое средство. Такие подходящие средства или лекарственные препараты известны специалисту в данной области техники. Например, для лечения заболеваний костей общепринятые терапевтические средства могут использоваться в комбинации с композицией изобретения. Некоторые такие средства включают, например, паратиреоидный гормон, фторид натрия, инсулиноподобный фактор роста I (ILGF-I), инсулиноподобный фактор роста II (ILGF-II), трансформирующий ростовой фактор бета (TGF-β), ингибитор цитохрома Р450, остеогенный простаноид, BMP 2, BMP 4, BMP 7 и/или BMP 14. Для лечения сердечнососудистого заболевания или нарушения липидного обмена может использоваться статин или средство для лечения кровяного давления в комбинации с композицией изобретения.
Композиция или соединение изобретения может быть создано в виде фармацевтической композиции, содержащей композицию изобретения и фармацевтически приемлемый носитель. "Фармацевтически приемлемый носитель" подразумевает вещество, которое не является биологически или другим образом нежелательным, т.е., данное вещество может быть введено субъекту и не вызовет каких-либо нежелательных биологических эффектов или не будет взаимодействовать вредоносным образом с каким-либо из других компонентов фармацевтической композиции, в которой оно содержится. Разумеется, носитель выбирают так, чтобы свести к минимуму любого рода деградацию активного ингредиента и любые вредные побочные эффекты у субъекта, что хорошо известно специалисту в данной области техники. Обсуждение фармацевтически приемлемых носителей и других компонентов фармацевтических композиций, смотри, например, в Remington’s Pharmaceutical Sciences, 18th ed., Mack Publishing Company, 1990. Некоторые подходящие фармацевтические носители известны квалифицированным специалистам и включают, например, воду (включая стерильную и/или деионизированную воду), подходящие буферы (такие как PBS), физиологический раствор, среду для культуры клеток (такую как DMEM), искусственную спинномозговую жидкость, диметилсульфоксид (DMSO), этанол и тому подобное.
Специалисту понятно, что конкретный состав изобретения будет зависеть, по меньшей мере, частично, от конкретного используемого средства или комбинации используемых средств и выбранного способа введения. Соответственно, существует большое разнообразие подходящих составов композиций настоящего изобретения. Некоторые типичные составы обсуждаются ниже. Другие будут очевидны для квалифицированного специалиста. В общем, Oxy133 вводится локально или непосредственно в клетку, ткань или орган, нуждающийся в лечении. Также может использоваться системное введение, если при этом достигаются желательные результаты в ткани или органе, нуждающемся в лечении.
Составы или композиции, подходящие для перорального введения, могут иметь вид жидких растворов, например, эффективное количество Oxy149 может быть растворено в разбавителях, таких как вода, физиологический раствор или фруктовый сок; могут иметь вид капсул, саше или таблеток, содержащих заранее установленное количество активного ингредиента в виде твердого вещества, гранул или лиофилизированных клеток; могут иметь вид растворов или суспензий в водосодержащей жидкости; и могут иметь вид эмульсий масло-в-воде или вода-в-масле. Таблетированные формы могут включать одно или более из числа лактозы, маннитола, кукурузного крахмала, картофельного крахмала, микрокристаллической целлюлозы, гуммиарабика, желатина, коллоидного диоксида кремния, кросскармеллозы натрия, талька, стеарата магния, стеариновой кислоты и других эксципиентов, красящих веществ, разбавителей, буферных веществ, увлажняющих веществ, консервирующих веществ, вкусовых веществ и фармацевтически совместимых носителей. Кроме того, подходящие для пероральной доставки композиции могут заключаться в микросферы из синтетических или природных материалов, или могут использоваться другие способы для защиты средств настоящего изобретения от разрушения в желудочно-кишечном тракте.
Подходящие для парентерального введения композиции (например, внутривенного) включают водосодержащие и безводные, изотонические стерильные растворы для инъекций, которые могут содержать антиоксиданты, буферы, бактериостатические средства и растворенные вещества, приводящие композицию в изотоническое с кровью предполагаемого реципиента состояние, и водные и неводные стерильные суспензии, которые могут включать суспендирующие вещества, солюбилизаторы, загустители, стабилизирующие вещества и консервирующие вещества. Композиции могут помещаться в однодозовые и многодозовые контейнеры, такие как ампулы и флаконы, и могут храниться в высушенном сублимацией (т.е., лиофилизированном) состоянии, при этом для выполнения инъекции требуется только добавление стерильного жидкого носителя, например, воды, непосредственно перед применением. Растворы и суспензии для экстемпорального приготовления могут быть приготовлены из стерильных порошков, гранул или таблеток, описанных ранее.
Oxy133, отдельно или в комбинации с другими терапевтическими средствами, может входить в состав аэрозольных композиций, предназначенных для введения путем ингаляции. Эти аэрозольные составы могут быть помещены в находящиеся под давлением приемлемые пропелленты (распыляющие вещества), такие как дихлордифторметан, пропан, азот и т.п. Подходящие для местного введения композиции включают леденцы, содержащие активный ингредиент в ароматизирующем веществе, обычно сахарозе и гуммиарабике или трагакантовой камеди; пастилки, содержащие активный ингредиент в инертной основе, такой как желатин и глицерин, или сахароза и гуммиарабик; жидкости для полоскания рта, содержащие активный ингредиент в подходящем жидком носителе; или кремы, эмульсии, суспензии, растворы, гели, пасты, пены, смазки, спреи, суппозитории или тому подобное.
Другие подходящие композиции включают, например, гидрогели и полимеры, пригодные для регулируемого по времени высвобождения Oxy133, или наночастицы для доставки Oxy133 в низких дозах. Такие композиции хорошо известны специалистам в данной области техники.
Специалистам понятно, что подходящая или соответствующая композиция может быть выбрана, приспособлена или создана с учетом конкретного рассматриваемого применения. Кроме того, фармацевтические композиции настоящего изобретения могут быть приготовлены для введения с помощью целого ряда различных способов. Примеры локального или прямого введения включают, но не ограничиваются этим, внутрисуставное, внутричерепное, внутрикожное, внутрипеченочное, внутримышечное, внутриглазное, внутрибрюшинное, подоболочечное, внутривенное, подкожное, чрескожное введение или введение непосредственно в атеросклеротический участок кости, например, с помощью прямой инъекции, введение с помощью катетера или другого медицинского устройства, местное применение, направленное применение и/или введение путем имплантации устройства в артерию или другое место нужной ткани.
Oxy133 может быть заключен в состав или приспособлен для высвобождения хирургическим или медицинским устройством или имплантатом. В некоторых аспектах имплантат может быть покрыт или иным образом обработан Oxy133. Например, гидрогели или другие полимеры, такие как биосовместимые и/или биодеградируемые полимеры, могут использоваться для покрытия имплантата композициями настоящего изобретения (т.е. композиция может быть приспособлена для применения с помощью медицинского устройства с использованием гидрогеля или другого полимера). Полимеры и сополимеры, пригодные для нанесения средства на медицинское устройство, хорошо известны в данной области техники. Примеры имплантатов включают, но не ограничиваются этим, баллоны для ангиопластики, стенты, стенты с лекарственным покрытием, шовный материал, протезы, сосудистые катетеры, диализные катетеры, сосудистые трансплантаты, трансплантаты кости, искусственные клапаны сердца, электрокардиостимуляторы, имплантируемые кардиовертер-дефибрилляторы или IV иглы. Только в качестве примера, стент или стент-графт в большинстве случаев может включать участок стента из гибкого трубчатого материала, который обычно используется для укрепления или усиления слабого места во внутренних каналах организма, таких как кровеносный сосуд. Вставка стент-графта может осуществляться с помощью катетера. Размещение может облегчаться путем расширения с помощью баллона, например, во время или после процедуры баллонной ангиопластики, или альтернативно стент-графт может быть саморасправляющимся.
"Эффективное количество" Oxy133, при использовании в описании, относится к количеству, которое может вызывать, по меньшей мере, обнаружимый эффект. Использованный в описании термин "терапевтически эффективное количество" относится к количеству, которое может вызывать, по меньшей мере, обнаружимый терапевтический ответ у субъекта, подвергающегося лечению (например, улучшение одного или более симптомов) в течение целесообразного периода времени.
В вариантах осуществления изобретения Oxy133 может стимулировать или ингибировать терапевтический ответ, измеренный любым из целого ряда способов, примерно на 1%, 5%, 10%, 20%, 30%, 40%, 50% 150%, 200% или более по сравнению с контрольным необработанным образцом. Также включаются промежуточные значения этих пределов.
Дозировки Oxy133 могут содержаться в стандартных лекарственных формах, таких как таблетка или капсула. Использованный в описании термин "стандартная лекарственная форма" относится к физически раздельным единицам, подходящим в качестве однократных дозировок для субъектов (например, человека), при этом каждая единица содержит заранее установленное количество средства изобретения, отдельно или в комбинации с другими терапевтическими средствами, в количестве, достаточном для получения желательного эффекта, в сочетании с фармацевтически приемлемым разбавителем, носителем или средой.
Специалист в данной области может обычным путем определить подходящую дозу, режим и способ введения используемой композиции, имеющей определенный состав, для того, чтобы получить желательное эффективное количество или эффективную концентрацию средства у конкретного пациента. Специалист также может легко определить и использовать подходящий показатель "эффективной концентрации" соединений, например, Oxy133, полученный путем прямого или непрямого анализа соответствующего образца пациента (например, крови и/или тканей), в дополнение к анализу соответствующих клинических симптомов болезни, нарушения или состояния.
Точная доза Oxy133 или его композиции, которая вводится животному, например, человеку, в контексте настоящего изобретения будет варьировать в зависимости от вида, возраста, веса и общего состояния субъекта, тяжести или механизма нарушения, которое необходимо лечить, конкретного используемого средства или среды для лекарства, способа введения, применения дополнительной медикаментозной терапии и других факторов, обычно рассматриваемых лечащим врачом при установлении индивидуального режима и подходящего уровня дозировки для конкретного пациента, и тому подобного. Дозировка, используемая для получения желательной концентрации in vivo, будет определяться действенностью формы Oxy133, фармакодинамикой, связанной с Oxy133 у хозяина, наличием или отсутствием дополнительных средств, тяжестью болезненного состояния инфицированных индивидуумов, а также, в случае системного введения, весом тела и возрастом индивидуума. Величина дозировки также может определяться наличием каких-либо вредных побочных действий, которые могут сопутствовать конкретному используемому средству или его композиции. В общем, при наличии возможности, желательно удерживать вредные побочные действия на минимальном уровне.
Например, может быть введена доза в пределах примерно от 5 нг (нанограмм) до 1000 мг (миллиграмм), или примерно от 100 нг до 600 мг, или примерно от 1 мг до 500 мг, или примерно от 20 мг до 400 мг. Например, может быть выбрана доза для получения отношения по весу тела примерно от 0,0001 мг/кг до 1500 мг/кг, или примерно от 1 мг/кг до 1000 мг/кг, или примерно от 5 мг/кг до 150 мг/кг, или примерно от 20 мг/кг до 100 мг/кг. Например, единица дозирования может находиться в пределах примерно от 1 нг до 5000 мг, или примерно от 5 нг до 1000 мг, или примерно от 100 нг до 600 мг, или примерно от 1 мг до 500 мг, или примерно от 20 мг до 400 мг, или примерно от 40 мг до 200 мг Oxy133 или композиции, содержащей Oxy133. В одном варианте осуществления изобретения указанные выше количества Oxy133 (например, несколько грамм) вводятся локально, например, как в процедуре спондилодеза в качестве части матрицы.
Дозировка может вводиться один раз в день, два раза в день, четыре раза в день или более чем четыре раза в день, по необходимости для получения желательного терапевтического эффекта. Например, режим введения дозировки может быть выбран с целью получения концентрации соединения настоящего изобретения в сыворотке крови примерно от 0,01 до 1000 нМ, или от 0,1 до 750 нМ, или от 1 до 500 пМ, или от 20 до 500 нМ, или от 100 до 500 нМ, или от 200 до 400 нМ. Например, режим введения дозировки может быть выбран с целью получения средней концентрации в сыворотке крови при использовании половины максимальной дозы соединения настоящего изобретения в пределах примерно от 1 мкг/л (микрограмма на литр) до 2000 мкг/л, или от 2 мкг/л до 1000 мкг/л, или примерно от 5 мкг/л до 500 мкг/л, или примерно от 10 мкг/л до 400 мкг/л, или примерно от 20 мкг/л до 200 мкг/л, или примерно от 40 мкг/л до 100 мкг/л.
Некоторые варианты осуществления изобретения также могут включать лечение дополнительным средством, действующим независимо или синергетически с Oxy133, с целью получения терапевтических результатов. При проведении комбинированной терапии средство, отличное от Oxy133, может быть назначено в то же самое время, как и Oxy133, или дозирование может быть отсрочено по времени, по необходимости. Два (или более) лекарственных средств также могут быть объединены в композицию. Дозировки каждого из них могут быть меньше при использовании в комбинации, чем при использовании по отдельности. Подходящие дозировки могут быть определены квалифицированным специалистом с помощью стандартных параметров дозирования.
При использовании в описании формы единственного числа включают определяемые объекты во множественном числе, если контекст явно не указывает иное.
Использованный в описании термин "субъект" включает любое животное, демонстрирующее симптом состояния, которое можно лечить Oxy133. Подходящие субъекты (пациенты) включают лабораторных животных (таких как, мышь, крыса, кролик или морская свинка), сельскохозяйственных животных, домашних животных и домашних-питомцев (таких как, кошка, собака или лошадь). Также включаются приматы, не принадлежащие к человеческому роду, и человек. Типичные субъекты включают животных, демонстрирующих аномальные количества (не соответствующие норме) (более низкие количества, чем количества у "нормального" или "здорового" субъекта) одного или более показателей физиологической активности, которые активизированы сигнальным путем Hedgehog. Аномальная активность может регулироваться каким-либо из целого ряда механизмов, включая активацию активности Hedgehog. Аномальная активность может привести к патологическому состоянию.
Один вариант осуществления изобретения представляет собой набор, пригодный для применения раскрытых в описании способов или in vitro или in vivo. Такой набор включает Oxy133 или его биоактивную или фармацевтическую композицию и может содержать один или более других оксистеролов, например, таких, которые приводят к повышению активности, опосредованной Hh-путем, или другие подходящие терапевтические средства. Дополнительно набор включает инструкции, касающиеся осуществления данного способа. Дополнительные элементы набора изобретения включают подходящие буферы, фармацевтически приемлемые носители или тому подобное, контейнеры или упаковочные материалы. Реагенты набора могут содержаться в контейнерах, в которых реагенты являются стабильными, например, в лиофилизированной форме или в стабилизированных жидкостях. Реагенты также могут содержаться в форме для однократного применения, например, в одноразовой лекарственной форме. Подходящие для осуществления какого-либо из способов изобретения компоненты набора устанавливаются квалифицированным специалистом.
С помощью Oxy133, используя его в отдельности или в комбинации с другими терапевтическими средствами, можно лечить целый ряд состояний.
Например, как показано в примерах, Oxy133 приводит к увеличению активности пути hedgehog. Не желая быть связанными с каким-либо конкретным механизмом, предполагается, что это увеличение происходит вследствие прямого связывания Oxy133 с Smoothened-рецептором, ранним медиатором пути Hedgehog от внеклеточных к внутриклеточным компартментам.
Одно воздействие Oxy133 состоит в том, чтобы ориентировать плюрипотентные клетки на их линиеспецифическую дифференцировку в различные типы клеток, например, остеобласты. Например, как показано в примерах, мезенхимальные стволовые клетки, обработанные Oxy133, продемонстрировали индуцированную экспрессию маркеров дифференцировки остеобластов. Не желая быть связанными с каким-либо конкретным механизмом, мы предполагаем, что линиеспецифическая дифференцировка происходит в результате индукции сигнального пути Hedgehog в этих клетках. Однако обсуждаемые в описании способы лечения включаются в настоящее изобретение независимо от механизма, посредством которого действует Oxy133. Oxy133 подходит для лечения состояний, при которых будет полезна стимуляция костеобразования, остеобластическая дифференцировка, остеоморфогенез и/или остеопролиферация. К этим состояниям или способам лечения относятся, например, остеоиндуктивная терапия с целью стимулирования локализованного костеобразования при спондилодезе или остеопорозе, восстановление или заживление перелома кости, зубоврачебные процедуры, для которых повышенное костеобразование в челюсти является клинически полезным, восстановление черепно-лицевых дефектов костей, вызванных травмой, или врожденных дефектов, таких как расселина неба/губы, и ряд других мышечно-скелетных повреждений, при которых естественный рост кости нарушается, и которые известны квалифицированным практикам. Терапия может осуществляться с целью проведения лечения открытых переломов и переломов с риском несрастания, а также у субъектов с заболеваниями позвоночника, включая субъектов, нуждающихся в спондилодезе (например, переднем поясничном межтеловом спондилоде, заднем поясничном спондилодезе и шейном спондилодезе) или субъектов с дегенеративным заболеванием межпозвонковых дисков или артритом, затрагивающим поясничный или шейный отдел позвоночника. Кроме того, Oxy133 может использоваться для лечения остеопороза, в частности, в стареющей популяции, возникшего в результате повышенной резорбции кости остеокластами параллельно с пониженным костеобразованием остеобластами.
Конкретнее, могут осуществляться следующие типы лечения, связанного с костной системой:
1. Oxy133 используется в качестве остеогенного средства, локально доставляемого в организм для того, чтобы стимулировать локализованное костеобразование, используя матрицу, созданную на основе совместимой молекулы, такой как, но без ограничения, коллаген I, которая абсорбирует Oxy133, а затем помещается внутрь организма. Например, матрица, содержащая Oxy133, может быть размещена между поперечными отростками или в межпозвоночном диске, когда рекомендовано сращение двух или более позвонков, например, в спондилодезе, при псевдоартрозе и при несрастающихся переломах. В других вариантах осуществления матрица, содержащая Oxy133, располагается в отломке кости для того, чтобы стимулировать костеобразование и заживление перелома; помещается в костном дефекте, таком как дефект челюстно-лицевой кости или кости свода черепа, где рекомендована костная регенерация с помощью Oxy133; или располагается в нижней челюсти для того, чтобы стимулировать костеобразование, в качестве меры восстановления кости до зубоврачебных процедур, таких как установка зубных имплантатов.
2. Oxy133 используется в качестве остеогенного средства in vitro. Например, он вводится в остеопрогениторные клетки, например, мезенхимальные стволовые клетки, для того, чтобы стимулировать их остеогенную дифференцировку до применения таких клеток в ортопедических и других процедурах, как указано выше в 1), для стимуляции локализованного костеобразования.
3. Oxy133 используется in vitro для стимулирования сигнального пути Hedgehog в остеопрогениторных клетках, что приводит к остеогенной дифференцировке клеток in vitro или in vivo.
Другим действием Oxy133 является ингибирование дифференцировки адипоцитов, морфогенеза адипоцитов и/или пролиферации адипоцитов. К числу состояний, которые можно лечить в силу этого эффекта Oxy133, относятся, например, образование ксантом, локализованное скопление жировых «подушек» и ожирение.
Другие состояния, при которых можно получить пользу прямо или опосредованно от локального введения Oxy133, включают необходимость роста волос, нейрогенез, образование хряща и т.д. или сердечнососудистые заболевания, обусловленность которых связана со стимулированием активности пути Hedgehog, путем воздействия на клетки, ткани или органы, имеющие отношение к каждому показанию.
В настоящем документе и в следующих примерах все значения температуры представлены в градусах Цельсия без учета поправки; и, если не указано иное, все части и проценты являются весовыми.
ПРИМЕРЫ
Пример 1. Материалы и методы
Культура клеток и реактивы
Линию мультипонентных стромальных клеток костного мозга мыши (MSC), М2-10В4 (М2), и клеточную линию эмбриональных фибробластов C3H10T1/2 (C3H) купили в Американской коллекции типовых культур (Rockville, MD) и культивировали, как сообщалось ранее (14,15). Обработка с целью индукции остеогенной дифференцировки проводилась в среде RPMI для клеток М2 или в среде DMEM для клеток C3H с содержанием 5% эмбриональной бычьей сыворотки, 50 мкг/мл аскорбата и 3 мМ β-глицерофосфата (βGP) (среда для дифференцировки). Циклопамин был куплен у компании EMD Biosciences, Inc. (La Jolla, CA). Первичные мезенхимальные стволовые клетки человека (HMSC) купили у компании Lonza (Walkersville, MD), культивировали и пассировали в ростовой среде от компании StemCell Technologies (Vancouver, Canada) в соответствии с инструкциями производителя. Остеогенную дифференцировку HMSC вызывали обработкой клеток в среде DMEM с низким содержанием глюкозы, содержащей антибиотики и 10% инактивированной нагреванием FBS, 10-8 М дексаметазон, 10 мМ PGP и 0,2 мМ аскорбат.
Активность щелочной фосфатазы и окрашивание по Von Kossa
Анализ активности щелочной фосфатазы (ALP) на полных клеточных экстрактах (13,14) и окрашивание по von Kossa клеточных монослоев в отношении минерализации (16) проводили, как описано ранее.
Количественная ПЦР в реальном времени
Совокупную (тотальную) РНК экстрагировали с помощью выделения РНК реагентом Trizol от компании Ambion, Inc. (Austin, ТХ) в соответствии с инструкциями производителя. Была проведена реакция обратной транскрипции РНК (1 мкг) с использованием обратной транскриптазы от компании Bio-Rad (Hercules, СА) с получением одноцепочечной кДНК. Q-RT-PCR реакции были проведены с использованием систем детекции iQ SYBR Green Superrnix и iCycler RT-PCR (Bio-Rad). Были использованы последовательности праймеров для мышиных генов Gli-1, Patched 1 (Ptch1), изофермента щелочной фосфатазы (ALP) кости-печени-почки, сиалопротеина кости (BSP), Runx2, osterix (OSX), остеокальцина (OCN) и GAPDH, как описано ранее (14). Человеческие последовательности праймеров были следующие: GAPDH 5'-ССТ САА GAT CAT CAG САА TGC СТС СТ (SEQ ID NO: 1) и 3'-GGT CAT GAG ТСС ТТС САС GAT АСС АА (SEQ ID NO:2), BSP 5'- AGA AGA GGA GGA GGA AGA AGA GG (SEQ ID NO: 3) и 3’ - CAG TGT TGT AGC AGA AAG TGT GG (SEQ ID NO: 4), OSX 5’ - GCG GCA AGA GGT TCA CTC GTT CG (SEQ ID NO: 5) и 3’ - CAG GTC TGC GAA ACT TCT TAG AT (SEQ ID NO: 6); относительные уровни экспрессии вычисляли с помощью 2ДАСТ способа, как описано ранее (15).
Транзиентная трансфекция и Gli-зависимый анализ по гену-репортеру
Клетки при 70% слиянии в 24-луночных планшетах подвергались транзиентной трансфекции с помощью Gli-зависимой люциферазы светлячка и векторов люциферазы Renilla, как мы сообщали ранее (17,18). Реагент для трансфекции FuGENE 6 (Roche Applied Science, Indianapolis, IN) использовали в отношении 3:1 с водой без люциферазы, причем содержание общей ДНК на лунку не превышало 500 нг. Активность люциферазы оценивали, используя Dual Luciferase Reporter Assay System (Promega Corporation, Madison, WI) в соответствии с инструкциями производителя после обработки клеток в течение 48 часов.
Синтез и молекулярное исследование Oxy133
Материалы были получены из коммерческих источников и использовались без дополнительной очистки. Реакции, чувствительные к влаге и воздуху, проводили в атмосфере аргона, используя высушенную в сушильной печи стеклянную посуду и стандартные методы шприц/мембрана. Реакции регистрировали на силикагелевых пластинах для ТСХ при УФ излучении (254 нм) с последующей визуализацией окрашивающим раствором Hanessian. Колоночную хроматографию проводили на силикагеле 60.1Н ЯМР спектры измеряли в CDC13. Полученные результаты представлены далее в ppm по сравнению с внутренним стандартом (TMS, 0,0 ч/млн.): химический сдвиг (мультиплетность, интеграция, константа связывания в Гц). Пошаговое подробное описание протокола синтеза и характеристика промежуточных соединений и конечных продуктов предоставлены в разделе Дополнительный материал.
Анализ связывания Smoothened
Взаимодействие оксистерола с Smoothened (Smo) исследовали, как было описано ранее (19). Smo-/-:YFP-Smo клетки (20) лизировали в гипотоническом буфере SEAT (250 мМ сахароза, 1 мМ EDTA, 10 мМ уксусная кислота, 10 мМ триэтаноламин, 10 мг/мл леупептид-пепстатин-химостатин (LPC) ингибирующая протеазу смесь и SigmaFast протеазный коктейль, не содержащий EDTA). После удаления ядер центрифугированием (500×g, 5 мин), мембраны осаждали центрифугированием при 95000×g в течение 30 минут. Мембраны экстрагировали в буфере для экстракции с n-додецил-b-D-мальтопиранозидом (DDM) (50 мМ Tris рН 7,4, 500 мМ NaCl, 10% об/об глицерин, 0,1% вес/об DDM и SigmaFast протеазный коктейль, не содержащий EDTA) в течение 4 часов при 4°C с последующим удалением нерастворимого материала центрифугированием (100000×g, 30 мин). Этот мембранный экстракт инкубировали с 50 мкМ без содержания 20(S) или Oxy133 или Oxy16 (аналог оксистерола, которые не активирует Hh-сигнальный путь; Parhami et al. неопубликованные материалы) в течение одного часа при 4°C до добавления магнитных частиц, связанных с нат-20(S)-ином, или контрольных магнитных частиц (19). Проводили инкубирование реакции связывания в течение ночи при 4°C. Во всех экспериментах количество растворителя было тщательно уравнено в каждом образце. После промывки большим объемом белки, связанные на частицах, элюировали с восстанавливающим SDS-буфером для образцов. Наличие YFP-Smo в этих элюатах определяли с помощью метода количественного иммуноблоттинга с использованием анти-GFP антител (Novus, NB600-308, 1:5000) и получали изображение в инфракрасном свете (система формирования изображений Li-Cor Odyssey).
Животные
Тридцать восемь самцов крыс Lewis 8-недельного возраста были куплены у компании Charles River Laboratories (Wilmington, MA) и содержались в виварии Калифорнийского университета в Лос-Анжелесе (UCLA) в соответствии с инструкциями Департамента защиты исследований (Office of Protection of Research Subjects). Исследование было проведено в соответствии с протоколом, одобренным Комитетом по научным исследованиям на животных (ARC) Калифорнийского университета. Все животные подвергались эвтаназии с использованием стандартной CO2 камеры через 8 недель после процедуры сращения, их позвоночники извлекали и хранили в 40% этиловом спирте.
Хирургические процедуры
Для предварительной медикаментозной обработки мышей использовали бупренорфин с замедленным высвобождением за тридцать минут до хирургической процедуры, анестезию проводили введением 2% изофлурана в кислороде (1 л/мин). Участок хирургического вмешательства выбривали и дезинфицировали бетадином и 70% этанолом. Заднее-боковой межпоперечный спондилодез L4-L5 выполняли, как описано в предшествующих исследованиях (21,22). Тело позвонка L6 идентифицировали, используя гребень подвздошной кости в качестве ориентира. На коже делали 4-см продольный срединный разрез и подкожную ткань над L4-L5 опускали до пояснично-спинной фасции. Затем был сделан 2-см продольный парамедиальный разрез в околопозвоночных мышцах билатерально, чтобы раскрыть поперечные отростки L4-L5, которые были «ободраны» с помощью высокоскоростного бора. Затем участок хирургического вмешательства смачивали стерильным физиологическим раствором, билатерально размещали кусочки 5 мм×5 мм×13 мм коллагеновой губки (Helistat, Integra Life Sciences), содержащей диметилсульфоксид (DMSO-контроль), rhBMP-2, или Oxy133, при этом каждый имплантат перекрывал (соединял) поперечные отростки. Затем имплантаты покрывали вышележащими околопозвоночными мышцами и пояснично-спинной фасцией, кожу зашивали шовным материалом 4-0 Prolene (Ethicon, Inc., Somerville, NJ). Животным давали возможность передвигаться, есть и пить без ограничения сразу после хирургической процедуры.
Рентгенографический контроль
Задне-передние рентгеновские снимки поясничного отдела позвоночника каждого животного делали через 4, 6 и 8 недель после хирургической процедуры с помощью рентгенографической системы Faxitron LX60, оценка проводилась «вслепую» двумя независимыми экспертами с использованием следующей стандартной шкалы: 0 - нет сращения; 1 - одностороннее сращение; и 2 - полное двустороннее сращение. Баллы, полученные при обследовании, складывали вместе, и только счет в количестве 4 баллов считался полным сращением.
Оценка сращения вручную
Через 8 недель после хирургического вмешательства животные были подвергнуты эвтаназии, позвоночники были извлечены, а затем оценены «вслепую» двумя независимыми экспертами в отношении подвижности между уровнями. Регистрировалось несрастание, если имелась подвижность между суставными поверхностями или поперечными отростками на любой стороне. Полное сращение регистрировали, если не наблюдалась двусторонняя подвижность. Позвоночники отмечались как «сращенные» и «несросшиеся». Для учета полного сращения было необходимо единогласное согласие.
Компьютерная микротомография
Каждый извлеченный позвоночник исследовали с помощью высокочувствительной компьютерной микротомографии (микро-СТ) с использованием сканера SkyScan 1172 (SkyScan, Belgium) с вексельным изотропическим разрешением 20 мкм и энергией рентгеновского излучения 55 kVp и 181 мА для дополнительной оценки скорости сращения и регистрации массы сращения, как мы сообщали ранее (15). Было получено триста шестьдесят проекций в угловом диапазоне 180° с шагом 0,5 и временем экспозиции 220 мсек/срез. Пять кадров усредняли на каждом шаге поворота для получения лучшего отношения сигнал-помеха. Для уменьшения частоты рентгеновского луча использовали алюминиевый фильтр 0,5 мм, чтобы свести к минимуму увеличение жесткости излучения. Виртуальное изображение срезов реконструировали, используя конусообразное (cone-beam) преобразование версии программного обеспечения 2.6 на основе алгоритма Feldkamp (SkyScan). Такие настройки давали серийные поперечные изображения 1024×1024 пикселей. Переворот образца и 2D визуализацию проводили с помощью DataViewer (SkyScan). 3D визуализацию проводили, используя Dolphin Imaging, версия 11 (Dolphin Imaging & Management Solutions, Chatsworth, CA). Сращение определяли как двустороннее наличие соединяющей кости между L4 и L5 поперечными отростками. Два независимых квалифицированных эксперта оценивали, считаются ли восстановленные изображения объединенными (склеенными) или нет. Чтобы количественно определить плотность образованной кости в каждой массе сращения, вычисляли объем массы ткани (TV), объем трабекулярной кости (BY), отношение BV/TV, толщину трабекулярной кости и трабекулярное отделение. Для этого использовали программное обеспечение DataViewer с проведением измерений поперек 501 аксиальных срезов (20 мкм на срез, 10,02 мм длина) в каждой массе сращения, с центром на уровне межпозвонковых тел L4-5.
Гистология
После прохождения микро-СТ два характерных образца из каждой хирургической группы с целью декальцинирования (undecalcified) были подвергнуты обезвоживанию, очистке в ксилоле и погружению в метилметакрилат, как было описано ранее (15,23). Была сделана серия коронарных срезов толщиной 5 мкм, которые окрасили толуидином синим рН 6,4. Микрофотографии срезов были получены, как описано ранее, с использованием системы ScanScope XT System (Aperio Technologies, Inc., Vista, CA) при увеличении 10X, которые показаны на Фигуре 7А, и при увеличении 20Х показаны на Фигуре 7В (24).
Статистический анализ
Статистический анализ проводили, используя программу Stat View 5. Все значения р вычисляли с использованием ANOVA и тест Фишера на предполагаемое минимально значимое различие (PLSD). Значимым считалось различие р<0,05.
Пример II - Синтез и химическая характеристика Oxy133
Далее представлена химическая структура Oxy133:
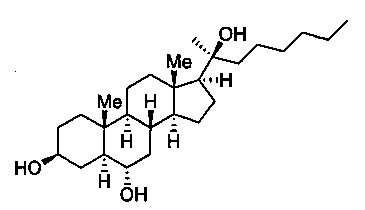
Материалы получали от коммерческих поставщиков и использовали без дополнительной очистки. Реакции, чувствительные к влаге и воздуху, проводили в атмосфере аргона, используя высушенную в сушильной печи стеклянную посуду и стандартные методы шприц/мембрана. Реакции регистрировали на силикагелевых пластинах для ТСХ при УФ излучении (254 нм) с последующей визуализацией окрашивающим раствором Hanessian. Колоночную хроматографию проводили на силикагеле 60. 1Н ЯМР спектры измеряли в CDCl3. Полученные результаты представлены далее в ppm по сравнению с внутренним стандартом (TMS, 0,0 ч/млн.): химический сдвиг (мультиплетность, интеграция, константа связывания в Гц). Далее следует пошаговое подробное описание протокола. Структуры Oxy34 и Oxy49, синтез которых мы представили ранее [Johnson et al. (2011), Journal of Cellular Biochemistry 112, 1673-1684], показаны для сравнения со структурой Oxy133.
1-((3S,5S,6S,8R,9S,10R,13S,14S,17S) 3,6-Бис((трет-бутилдиметилсилил)окси)-10,13-диметилгекса-декагидро-1H-циклопента[а]фенантрен-17-ил)этанон (1). Получали в соответствии с методом опубликованного патента (Parhami et al., WO 2009/07386, p. 52) 1H NMR (CDCl3, 400 MHz) δ: 3.47 (1H, dddd, J=11.0,11.0,4.8,4,8 Hz), 3.36 (1H, ddd, J=10.4, 10.4, 4.4 Hz), 2.53 (1H, d, J=8.8, 8.8 Hz), 2.20-2.14 (1H, m), 2.10 (3H, s), 2.01-1.97 (1H, m), 1.88-1.82 (1H, m), 1.73-0.89 (17H, m), 0.88 (18H, s), 0.79 (3H, s), 0.59 (3H, s), 0.043 (3H, s), 0.04 (3H, s), 0.03 (3H, s), 0.02 (3H, s). 13C ЯМР (CDCl3, 100 MHz) 5: 209.5, 72.2, 70.1, 63.7, 56.4, 53.7, 51.8, 44.2, 41.9, 38.9, 37.6, 36.3, 34.3, 33.2, 31.7, 31.5, 25.94, 25.92, 24.4, 22.7, 21.1, 18.3, 18.1, 13.5, 13.4, -4.1, -4.6, -4.7.
(R)-2-((3S,5S,6S,8R,9S,10R,13S,14S,17S) 3,6-Бис((трет-бутилдиметилсилил)оху)-10,13-диметил-гексадекагидро-1H-циклопента[а]фенантрен-17-ил)окт-3-ин-2-ол (2)
К охлажденному раствору (0°C) н-гексина (1,5 мл, 12 ммоль) в THF (6 мл) добавили 1,6 М раствор n-бутиллития в гексанах (3,75 мл). Полученный раствор перемешивали в течение 30 минут до добавления раствора соединения 1 (1,27 г, 2,2 ммоль) в THF (10 мл) через канюлю. Смесь нагревали до комнатной температуры в течение 3 часов и разбавили водой (40 мл), сырой продукт отделили с помощью экстракции этилацетатом (3×30 мл). Объединенные органические слои промыли рассолом и высушили над Na2SO4. После концентрирования получили маслянистый продукт, который очистили на силикагеле (градиент гексан: этилацетат) с получением 1,30 г соединения 2 (92%). 1Н ЯМР (CDCl3, 300 MHz) δ: 3.50 (1Н, ddd, J=15.9, 11.0, 4.8 Hz), 3.36 (1H, ddd, 7=10.6, 10.6, 4.3 Hz), 2.18 (1H, t, J=6.9 Hz), 2.10 (1H, m), 1.91-1.62 (4H, m), 1.53-1.31 (2H, m), 1.44 (3H, s), 1.31-0.93 (22H, m), 0.93 (3H, s), 0.92 (3H, m), 0.90 (18H, s), 0.88 (3H, s), 0.61 (1H, m), 0.04 (6H, s), 0.03 (6H, s). 13C ЯМР (CDCl3, 75 MHz) 8: 85.9, 83.9, 72.4, 71.4, 70.3, 60.5, 55.8, 53.8, 51.8, 43.5, 36.3, 33.7, 33.0, 30.7, 25.9, 22.0, 18.4, 18.3, 18.1, 13.6, 13.5, -4.7, -4.7.
(S)-2-((3S,5S,6S,8R,9S,10R,13S,14S,17S) 3,6-Бис((трет-бутилдиметилсилил)окси)-10,13-диметил-гексадекагадро-1H-циклопента[а]фенантрен-17-ил)октан-2-ол (3)
Соединение 2 (1,3 г, 2,0 ммоль) растворили в этилацетате (5 мл) и метаноле (5 мл) и добавили к раствору P6VC (10%, 0,1 г). Смесь повторно дегазировали в вакууме и затем подвергли воздействию газообразного водорода при атмосферном давлении (баллон). Через 18 час при комнатной температуре смесь разбавили этилацетатом (20 мл) и профильтровали через целит для удаления катализатора. Фильтрат промыли этилацетатом, объединенные фильтраты выпарили с получением 1,3 г восстановленного продукта 3, который использовали без дополнительной очистки. 1Н ЯМР (CDCl3, 300 MHz) δ: 3.50 (1Н, ddd, J=15.9, 11.0, 4.8 Hz), 3.36 (1Н, ddd, J=10.6, 10.6, 4.3 Hz), 2.1-1.95 (2H, m), 1.75-1.35 (10 H, m), 1.32-1.29 (10H, m), 1.24 (3H, s), 0.91-1.21 (10H, m), 0.89 (18H, s), 0.82 (3H, s), 0.79 (3H, s), 0.63 (1H, m), 0.04 (6H, s), 0.03 (6H, s) 13C NMR (CDCl3, 75 MHz) δ: 75.2, 72.3, 57.6, 56.4, 53.8, 51.8, 42.9, 37.6, 36.3, 33.7, 31.9, 30.0, 25.9, 22.6, 18.3, 18.1, 14.1, 13.8, 13.5, -4.6, -4.7.
(3S,5S,6S,8R,9S,10R,13S,14S,17S) 17-((S)-2-гидроксиоктан-2-ил)-10,13-диметилгексадекагидро-1H-пиклопента[а]фенантрен-3,6-диол (Oxy133)
1 М раствор TBAF в THF (8 мл, 8 ммоль, 4 экв.) непосредственно добавили к соединению 3 (1.3 г, 2.0 ммоль, 1.0 эквив.), полученный раствор разбавили THF (1 мл) и перемешивали при комнатной температуре в течение 72 час. Затем смесь разбавили водой (50 мл) и повторно экстрагировали этилацетатом (4×40 мл). Объединенные органические слои промыли рассолом, высушили над Na2SO4 и выпарили растворитель. Очистка сырого продукта с помощью хроматографии на силикагеле (гексан, этилацетат, градиент, затем 10% метанол в этилацетате) давала белое твердое вещество (0,6 г, 70%), которое гомогенизировали в водосодержащем ацетоне (ацетон, вода, 3:1) с получением 0,5 г чистого Oxy133. 1Н ЯМР (CDCl3, 300 MHz) δ: 3.50 (1Н, ddd, J=15.9, 11.0, 4.8 Hz), 3.36 (1Н, ddd, J=10.6, 10.6, 4.3 Hz), 2.19 (1H, m), 2.10-1.90 (3H, m), 1.85-1.60 (7H, m), 1.55-1.38 (7H, m), 1.25 (11H, m), 1.20-0.95 (4H, m), 0.90 (3H, m), 0.86 (3H, s), 0.80 (3H, s), 0.62 (1H, m). 13C ЯМР (CDCl3, 75 MHz) δ: 75.1, 71.1, 69.3, 57.5, 56.2, 53.6, 51.6, 44.0,42.8,41.4,40.1, 37.2, 36.2, 33.5, 32.1, 31.8, 30.9, 29.9, 26.3, 24.2, 23.6, 22.5, 22.2, 20.9, 14.0, 13.6, 13.3. MS: M+H=420,36. HRMS (ESI) m/z [M - 2 H2O H]+ вычислено для C27H44OH: 385,3470, найдено 385,3478.
Пример III - Результаты эксперимента; стимуляция остеогенеза костеобразования и спондилодез In Vivo
Oxy133 вызывает остеогенную дифференцировку стромальных клеток костного мозга, эмбриональных фибробластов и мезенхимальных стволовых клеток человека
Для достижения своей цели - создания молекулы, способной индуцировать остеогенную дифференцировку остеопрогениторных клеток, мы модифицировали молекулярную структуру наиболее эффективного остеогенного природного оксистерола, 20(S)-гидроксихолестерола (20S), исходя из наших представлений о зависимости активности лекарственного средства от структуры, наблюдаемой у более чем 100 ранее синтезированных аналогов. Ранее мы сообщали, что устойчивая остеогенная дифференцировка была достигнута при помощи двух структурных аналогов 20S, Oxy34 и Oxy49 (15). Эти молекулы были образованы добавлением а гидроксильной (ОН) группы к атому углерода 6 (С6) и в Oxy34 и в 49, и двойной связи между С25 и C27B Oxy49 (фигура 1) (15). В представленных в этом документе исследованиях мы сделали попытку дополнительно усовершенствовать эти две молекулы путем разработки более легкого способа синтеза и более эффективного аналога, подходящих для увеличения масштаба производства с целью проведения доклинических исследований на животных и клинических исследований на людях. Эта молекула может быть кандидатом, который будет использоваться для разработки терапевтического средства и его клинического применения с целью локального увеличения костеобразования для стимулирования спондилодеза и срастания переломов, и возможно даже в отношении всего организма в целом, адресуясь таким нарушениям, как остеопения и остеопороз. В результате исследований зависимости активности средства от структуры был синтезирован новый аналог, Oxy133, в соответствии с протоколом, описанным в примере II, который был проверен в отношении остеоиндуктивной активности. Oxy133 отличается от Oxy34 и 49 удалением С27 и увеличением длины боковой цепи на один атом углерода (фигура 1). Важно отметить, что получение Oxy133 в больших масштабах может быть более легким вследствие коммерческой доступности недорогих исходных материалов, что даст в результате значительно менее дорогой продукт по сравнению с Oxy34 и Oxy49. Кроме того, присоединение алкина, используемое при получении Oxy133, превосходит химию Гриньяра, использованную при синтезе Oxy34 и Oxy49, если говорить о выходе, чистоте продуктов (диастереоселективности) и возможности масштабирования.
По сравнению с другими структурными аналогами 20S Oxy133 обладает неожиданно улучшенной эффективностью при индукции активности щелочной фосфатазы (ALP), определенной с помощью анализа ферментативной активности ALP в клетках C3H и М2. Эта модель пригодна для исследования остеогенной активности, как сообщалось нами ранее в отношении других аналогов оксистерола (15). Зависимое от дозы увеличение активности ALP наблюдалось при использовании Oxy133 в низких микромолярных (мкМ) концентрациях (фигура 2А, В). Было найдено, что значение ЕС50 для Oxy133 составляет приблизительно 0,5 мкМ для C3H клеток (фигура 2А) и 0,44 мкМ для М2 клеток (фигура 2 В). Было обнаружено, что значение ЕС50 Oxy34 и Oxy49 для клеток C3H сходно со значением, которое было сообщено ранее для клеток М2, 0,8 и 0,9 мкМ, соответственно, и было значительно выше, чем значение ЕС50 Oxy133 (фигура 2А). Кроме того, Oxy133 в высоких дозах вызывал более высокий уровень ALP-активности, чем сходные дозы Oxy34 и Oxy49 на клетках C3H (фигура 2А). Посредством анализа экспрессии генов-маркеров остеогенной дифференцировки Runx2, Osterix (OSX), ALP, сиалопротеина кости (BSP) и остеокальцина (OCN) было установлено, что Oxy133 оказывает другие благоприятные действия при индукции остеогенной дифференцировки клеток. Обработка C3H клеток 2,5 мкМ Oxy133 вызывала увеличение экспрессии Runx2 в 2 и 3,2 раза через 4 и 7 дней после обработки, соответственно, при этом наблюдалось возвращение к исходным уровням через 14 дней (фигура 3А). Экспрессия OSX была значительно индуцирована (в 3 раза) через 2 дня и оставалась повышенной на всем протяжении эксперимента, достигая максимальной индукции в 4,5 раза (фигура 3А). Обработка C3H-клеток Oxy133 вызывала увеличение экспрессии ALP в 18 раз через 2 дня, экспрессия достигала максимума через 4 дня (120-кратное увеличение) и затем падала до 22-кратной через 7 и 14 дней, соответственно (фигура 3А). Максимальная индукция экспрессии BSP (в 9 раз) была обнаружена на 4 день и наблюдалась на всем протяжении эксперимента, несмотря на уменьшение продолжительности воздействия Oxy133 на клетки (фигура 3А). Обработка Oxy133 также вызывала экспрессию остеобласт-специфического гена, отсеокальцина, в 2,8 раза через 4 дня, которая достигала максимума (в 4,2 раза) через 14 дней после обработки (фигура 3А). Oxy133 индуцировал сильную минерализацию матрикса в культурах C3H клеток, как определено окрашиванием по вон Коссу (фигура 3В) и количественной 45Са оценкой внеклеточного матрикса через 21 день после обработки (фигура 3С). Эти результаты демонстрируют эффективность действия и потенциальную возможность Oxy133 в качестве остеоиндуктивного оксистерола.
Остеогенные эффекты Oxy133 были исследованы на первичных мезенхимальных стволовых клетках человека (MSC) путем определения размера экспрессии остеогенных генов через 1 неделю, 2 недели и 4 недели после обработки. Экспрессия ALP была высокой в необработанных клетках во всех временных точках и не изменялась при обработке Oxy133 (данные не показаны). Через 1 неделю наблюдалось значимое 2-кратное увеличение BSP экспрессии, которое дополнительно увеличивалось до 4-кратного через 2 и 4 недели (фигура 3D). Oxy133 также вызывал значимую индукцию OSX (в 3 раза) и OCN (в 2 раза) через 4 недели (фигура 3D). Кроме того, Oxy133 стимулировал сильную минерализацию внеклеточного матрикса в культурах первичных MSC человека, как показано окрашиванием по вон Коссу через 5 недель после обработки (фигура 3E).
Oxy133 вызывает остеогенную дифференцировку посредством активации сигнального пути Hedgehog
Предшествующие исследования продемонстрировали, что 20S и его структурные аналоги Oxy34 и Oxy49 вызывают остеогенную дифференцировку посредством активации сигнального пути Hedgehog (15). Однако молекулярный механизм остеогенной опосредованной оксистеролом активации сигнального пути Hh ранее не был известен. Учитывая его большую остеогенную активность, Oxy133 является средством, пригодным для установления молекулярного механизма, посредством которого достигается активация Hh пути и остеогенез при помощи полусинтетических оксистеролов. Для того, чтобы определить вызывает ли и как Oxy133 вызывает остеогенную дифференцировку через сигнальный путь Hh, был исследован эффект селективного ингибитора Hh-пути, циклопамина, на индуцированную Oxy133 активность ALP и экспрессию маркеров остеогенной дифференцировки ALP, BSP и OSX. Циклопамин полностью ингибировал Oxy133-индуцированную ALP активность и экспрессию остеогенных маркеров ALP, BSP и OSX на клетках C3H (фигура 4А), а также на клетках М2 (данные не приведены), подтверждая, что Oxy133 не действует через сигнальный путь Hh. Для дальнейшего анализа активации Hh-сигнального пути с помощью Oxy133 была исследована активация Gli-зависимого люциферазного репортера, трансфицированного в C3H клетки, с использованием описанных ранее методов (15, 17). Oxy133 вызывал зависимое от дозы увеличение активности Gli-зависимого репортера, достигая 5-кратной индукции при 100 нМ и 17-кратной индукции при 1 мкМ Oxy133 (фигура 4B).
Oxy133 активирует сигнальный путь Hedgehog посредством связывания с Smoothened рецептором
Как сообщалось ранее, 20S селективно активирует Hh-сигнальный путь путем связывания с рецептором Smo (19). Для того, чтобы установить, активирует ли Oxy133 сигнальный путь Hh посредством того же самого механизма, протестировали способность Oxy133 конкурировать за связывание YFP-меченого Smo (YFP-Smo) с 20S-аналогом, соединенным с магнитными частицами. Как сообщалось ранее, этот аналог, нат-20S-ин, содержит фрагмент алкина на изо-октиловой цепи, создавая возможность химически-опосредованного связывания с магнитными частицами (20S-частицы) (19). Используя эти частицы для анализа связывания стерола, было измерено количество YFP-Smo, оставшегося на частицах по сравнению с неконкурирующим образцом, с помощью вестерн-блоттинга. Соединения, которые связывают Smo в том же самом месте как 20S, конкурируют с 20S-частицами и уменьшают количество белка в элюате. Были проверены многие другие стеролы и в анализе Smo связывания и анализе сигнального пути Hh и во всех случаях связывание с Smo коррелировало с изменением активности Hh пути (19). И Oxy133 и 20S, положительный контроль, уменьшали количество YFP-Smo, захваченного на частицах, соединенных с 20S (фигура 4С). В важном контроле, структурно родственный аналог, Oxy16, который не мог активировать сигнальный путь Hh и остеогенез (Parhami et al. unpublished observations) не смог предотвратить взаимодействие между YFP-Smo и 20S-гранулами (фигура 4С). Это уменьшение количества YFP-Smo, захваченного 20S-частицами, в присутствии свободного Oxy133 подтверждает, что Oxy133 связывается в том же самом месте на Smo, как и 20S. Важно подчеркнуть, что этот анализ является полуколичественным и не может использоваться для получения Kd взаимодействия, в первую очередь потому, что не известна концентрация YFP-Smo в экстракте и количество 20S продуктивно иммобилизованного на частицах.
Oxy133 стимулирует костеобразование и спондилодез In Vivo
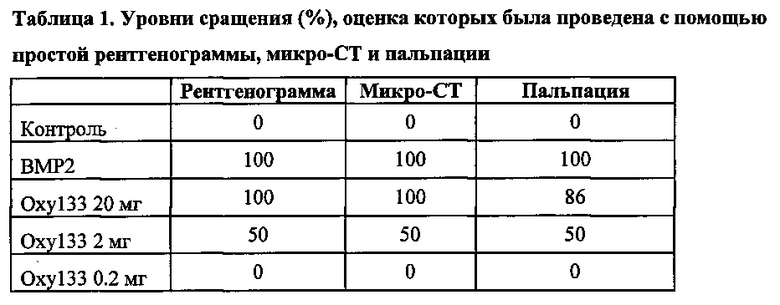
Крыс Lewis восьми-недельного возраста разделили на пять групп для обработки, различавшейся только по реактиву, содержащемуся в коллагеновой губке в участке хирургического вмешательства: группа 1 - контроль только с разбавителем (DMSO) (n=7), группа II - 5 мкг rhBMP-2 (n=8), группа III - 20 мг Oxy133 (n=7), группа IV - 2 мг Oxy133 (n=8) и группа V - 0,2 мг Oxy133 (n=8). Костеобразование и спондилодез оценивали в разные моменты времени после оперативного вмешательства с помощью рентгенографического анализа, а на момент умерщвления использовали оценку «вручную», компьютерную микротомографию и гистологический анализ. Уровни сращения на момент умерщвления представлены в таблице 1.
Рентгенографическое исследование
Первые серии рентгеновских снимков были сделаны через четыре недели после операции. На этот момент времени билатеральное сращение наблюдалось у 8/8 животных в ВМР2 группе, у 6/7 животных в группе Oxy133-20 мг, у 3/8 животных в Oxy133-2 мг группе, сращение не наблюдалось в контроле и группе Oxy133-0.2 мг. Одностороннее сращение наблюдалось у остальных обработанных Oxy133-20 мг животных и у трех животных, обработанных Oxy133-2 мг. Это противоречит предшествующим исследованиям с использованием Oxy34 и 49, в которых не наблюдалось сращения на момент времени 4 недели (15). Через шесть недель наблюдалось двустороннее сращение у всех животных в группе Oxy133-20 мг. Через восемь недель сращение было отмечено у всех животных в группах ВМР2 и Oxy133-20 мг и у 4/8 в группе Oxy133-2 мг (фигура 5). Масса сращения не наблюдалась в группах с DMSO или Oxy133-0.2 мг (данные не показаны) на окончательных рентгенограммах через 8 недель (фигура 5).
Оценка «вручную» и общая оценка костеобразования
После умерщвления извлекали спинной мозг каждого животного и проводили оценку «вручную», как было описано ранее (15,25-27). Результаты общей оценки и оценки «вручную» были сходны с данными рентгеновского исследования через 8 недель. Не наблюдалось одностороннего или двустороннего сращения в группах с DMSO или Oxy133-О.2 мг. Некоторое костеобразование отмечалось у двух животных в группе Oxy133-0.2 мг. Билатеральное сращение наблюдалось у всех животных в группе ВМР2 и у 6/7 животных в группе Oxy133-20 мг. Остальные животные в группе Oxy133-20 мг совершали движение односторонне, несмотря на значительную массу двустороннего сращения. У половины (4/8) животных в группе Oxy133-2 мг наблюдалось двустороннее сращение, подтвержденное пальпацией, в то время как у двух дополнительных животных имелось одностороннее сращение, и у двух животных не имелось доказательства сращения.
Компьютерная микротомография и гистологическая оценка
Оценка мостовидной трабекулярной кости с помощью микро-СТ анализа подтвердила результаты, полученные с помощью рентгенограмм, общего изучения и пальпации (фигура 6). Хотя некоторое костеобразование было видно у двух животных в группе Оху133-0.2 мг, не наблюдалось двусторонних сращений в этой группе или группе с DMSO. Двусторонняя мостовидная трабекулярная кость была видна у всех животных в группе ВМР2 и в группе Оху133-20 мг. Двустороннее сращение также наблюдалось у 4/8 животных в группе Оху133-2 мг, за исключением одностороннего сращения у двух дополнительных животных. Результаты микроструктурного анализа микро-СТ изображений показаны в таблице 2. Общий объем масс сращения ВМР2 был значительно больше, чем обоих образцов Оху133-2 мг и 20-мг. Однако, среднее отношение BV/TV Оху133-2 мг и 20-мг масс сращения было значительно больше, чем в группе ВМР2, показывая плотную костную ткань в массах. Трабекулярная толщина не различалась значительно между ВМР2 и любой из Оху133-2 мг или Оху133-20 мг. Трабекулярное разделение было значительно больше в массах сращения с ВМР2 по сравнению с Оху133-2 мг и Оху133-20 мг, также демонстрируя меньшую плотность кости в ВМР2 массах сращения.
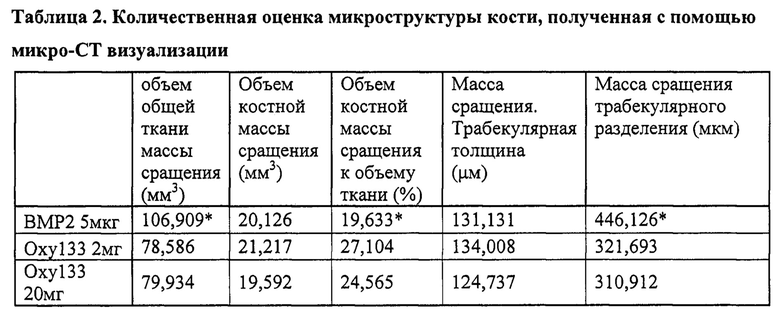
* показывает статистически значимое различие (p<0.01) общего объема ткани, отношение объема кости к объему ткани и трабекулярное разделение между ВМР2 и Оху133 20 мг и 2 мг. Не было обнаружено различий в объеме кости или трабекулярной толщине.
Затем было проведено гистологическое исследование двух характерных животных в DMSO-группе, ВМР2-группе, Oxy133-20 мг-группе и Oxy133-2 мг-группе.
Гистологическая оценка показала, что образование трабекулярной кости в массе сращения и непрерывную трубчатую кость, соединяющую поперечные отростки полностью сращенного поясничного позвонка у крыс, обработанных ВМР2, или дозой 2 мг или 20 мг Oxy133 (фигура 7А). Костеобразование не наблюдалось в образцах, полученных от контрольных крыс. Размер массы сращения был увеличен у крыс, обработанных ВМР2, по сравнению с 20 мг или 2 мг Oxy133. Однако визуальный осмотр гистологических образцов показал, что ВМР2 также вызывал повышенное образование адипоцитов в массе сращения, которое было значительно меньше в группах, обработанных Oxy133 (фигура 7B). В дополнение к этому, визуальный осмотр подтвердил, что образование трабекулярной кости было более сильным в группе Oxy133-20 мг по сравнению с группой ВМР2.
Пример IV - Ингибирование липогенеза
С помощью общеизвестных методов C3H10T1/2 остео-адипо-прогениторные клетки обработали PPAR-гамма активатором, троглитазоном ("Tro"), который, как сообщалось, вызывает образование адипоцитов. Через 2 недели липогенез в лунках, обработанных Tro, визуализировали Oil Red О окрашиванием и оценивали количество адипоцитов с помощью светового микроскопа. Было очевидно, что Oxy133 в дозе, вызывающей и остеогенную дифференцировку и Hh-сигнальный путь, полностью ингибировал образование адипоцитов. Ниже приводятся данные (как среднее число адипоцитов на поле зрения ≠SD):
Поле зрения ≠SD):
Контроль: 2,5≠2
Tro: 28≠4
Tro+Oxy133 (5 мкМ): 0,5≠1
Oxy133 (5 мкМ): 0,8≠1
р значение для контроля vs. Tro vs. Tro+Oxy133 при значимости <0,01
На основе предшествующего описания специалист в данной области техники может легко определить существенные характеристики изобретения, и без отступления от существа и объема настоящего изобретения может осуществить изменения и модификации изобретения, чтобы приспособить его к различным вариантам применения и условиям, чтобы использовать настоящее изобретение в полном размере. Предшествующие предпочтительные конкретные варианты осуществления следует рассматривать только как иллюстративные и не ограничивающие рамки изобретения, каким бы то ни было образом. Полное раскрытие всех заявок, патентов и публикаций, цитированных выше, включая предварительную заявку US 61/643,746, поданную 7 мая 2012, полностью включается в описание путем отсылки, в частности, что касается раскрытия, для которого они цитируются в данной заявке. Также полностью включаются в описание путем отсылки другие заявки, касающиеся оксистеролов, из лаборатории настоящих изобретателей, включая международные заявки по Договору о патентной кооперации (РСТ), опубликованные как WO/2008/115469, WO/2008/082520, WO/2007/098281, WO/2007/028101, WO/2006/110490, WO/2005/020928 и WO/2004/019884.
Ссылки
1. Johnson ЕЕ, Urist MR 2000 Human bone morphogenetic protein allografting for reconstruction of femoral nonunion. Clin Orthop Relat Res 371:61-74.
2. Mundy GR 2002 Directions of drug discovery in osteoporosis. Annu Rev Med 53:337-54.
3. Rodan GA, Martin TJ 2000 Therapeutic Approaches to Bone Diseases. Science 289:1508-14.
4. Yoon ST, Boden SD 2002 Osteoinductive molecules in orthopaedics: basic science and preclinical studies. Clin Orthop Relat Res 395:33-43.
5. Arrington ED, Smith WJ, Chambers HG, Bucknell AL, Davino NA 1996 Complications of iliac crest bone graft harvesting. Clin Orthop Relat Res 329:300-9.
6. Vaccaro AR, Chiba K, Heller JG, Patel TC, Thalgott JS, Traumees E, Fischgrund JS, Craig MR, Berta SC, Wang JC 2002 Bone grafting alternatives in spinal surgery. Spine J 2:206-15.
7. Rihn JA, Kirkpatrick K, Albert TJ 2010 Graft options in posterolateral and posterior interbody lumbar fusion. Spine 35:1629-39.
8. Mitka M 2011 Questions about spine fusion product prompt a new process for reviewing data. JAMA 306:1311-2.
9. Lewandrowski K-U, Nanson C, Calderon R 2007 Vertebral osteolysis after posterior interbody lumbar fusion with recombinant human bone morphogenetic protein 2: a report of five cases. Spine J 7:609-14.
10. Wong DA, Kumar A, Jatana S, Ghiselli G, Wong К 2008 Neurologic impairment from ectopic bone in the lumbar canal: a potential complication of off-label PLIF/TLIF use of bone morphogenetic protein-2 (BMP-2). Spine J 8:1011-8.
11. Smucker JD, Rhee JM, Singh K, Yoon ST, Heller JG 2006 Increased swelling complications associated with off-label usage of rhBMP-2 in the anterior cervical spine. Spine. 31:2813-9.
12. Carragee EJ, Hurwitz EL, Weiner BK 2011 A critical review of recombinant human bone morphogenetic protein-2 trials in spinal surgery: emerging safety concerns and lessons learned. Spine J 11:471-91.
13. Kha HT, Basseri B, Shouhed D, Richardson J, Tetradis S, Hahn TJ, Parhami F 2004 Oxysterols regulate differentiation of mesenchymal stem cells: pro-bone and anti-fat. J Bone Miner Res 19:830-40.
14. Kim W-K, Meliton V, Amantea CM, Hahn TJ, Parhami F 2007 20(S)-hydroxycholesterol inhibits PPARgamma expression and adipogenic differentiation of bone marrow stromal cells through a Hedgehog-dependent mechanism. J Bone Miner Res 22:1711-9.
15. Johnson JS, Meliton V, Kim WK, Lee K-B, Wang JC, Nguyen K, Yoo D, Jung ME, Atti E, Tetradis S, Pereira RC, Magyar C, Nargizyan T, Hahn TJ, Farouz F, Thies S, Parhami F 2011 Novel oxysterols have pro-osteogenic and anti-adipogenic effects in vitro and induce spinal fusion in vivo. J Cell Biochem 112:1673-84.
16. Parhami F, Morrow AD, Balucan J, Leitinger N, Watson AD, Tintut Y, Berliner JA, Demer LL 1997 Lipid oxidation products have opposite effects on calcifying vascular cell and bone cell differentiation. A possible explanation for the paradox of arterial calcification in osteoporotic patients. Arterioscler Thromb Vase Biol 17:680-7.
17. Dwyer JR, Sever N, Carlson M, Nelson SF, Beachy PA, Parhami F 2007 Oxysterols are novel activators of the Hedgehog signaling pathway in pluripotent mesenchymal cells. J Biol Chem 282:8959-68.
18. Kim W-K, Meliton V, Bourquard N, Hahn TJ, Parhami F 2010 Hedgehog signaling and osteogenic differentiation in multipotent bone marrow stromal cells are inhibited by oxidative stress. J Cell Biochem 111:1199-209.
19. Nachtergaele S, Mydock LK, Krishnan K, Rammohan J, Schlesinger PH, Covey DF, Rohatgi R 2012 Oxysterols are allosteric activators of the oncoprotein Smoothened. Nat Chem Biol 8:211-20.
20. Rohatgi R, Milenkovic L, Corcoran RB, Scott MP 2009 Hedgehog signal transduction by Smoothened: pharmacologic evidence for a 2-step activation process. Proc Natl Acad Sci USA 106:3196-201.
21. Alanay A, Chen C, Lee S, Murray SS, Brochmann EJ, Miyazaki M, Napoli A, Wang JC 2008 The adjunctive effect of a binding peptide on bone morphogenetic protein enhanced bone healing in a rodent model of spinal fusion. Spine 33:1709-13.
22. Miyazaki M, Sugiyama O, Tow B, Zou J, Morishita Y, Wei F, Napoli A, Sintuu C, Lieberman JR, Wang JC 2008 The effects of lentiviral gene therapy with bone morphogenetic protein-2-producing bone marrow cells on spinal fusion in rats. J Spinal Disord Tech 21:372-9.
23. Pereira RC, Stadmeyer LE, Smith DL, Rydziel S, Canalis E 2007 CCAAT/Enhancer-binding protein homologous protein (CHOP) decreases bone formation and causes osteopenia. Bone 40:619-26.
24. Magyar CE, Aghaloo TL, Atti E, Tetradis S 2008 Ostene, a new alkylene oxide copolymer bone hemostatic material, does not inhibit bone healing. Neurosurgery 63:373-378; discussion 378.
25. Sintuu С, Simon RJ, Miyazaki M, Morishita Y, Hymanson HJ, Taghavi C, Brochmann EJ, Murray SS, Wang JC 2011 Full-length spp24, but not its 18.5-kDa proteolytic fragment, inhibits bone-healing in a rodent model of spine fusion. J Bone Joint Surg Am 93:1022-32.
26. Miyazaki M, Morishita Y, He W, Ни M, Sintuu C, Hymanson HJ, Falakassa J, Tsumura H, Wang JC 2009 A porcine collagen-derived matrix as a carrier for recombinant human bone morphogenetic protein-2 enhances spinal fusion in rats. Spine J 9:22-30.
27. Zhu W, Rawlins В A, Boachie-Adjei O, Myers ER, Arimizu J, Choi E, Lieberman JR, Crystal RG, Hidaka С 2004 Combined bone morphogenetic protein-2 and -7 gene transfer enhances osteoblastic differentiation and спондилодез in a rodent model. J Bone Miner Res 19:2021-32.
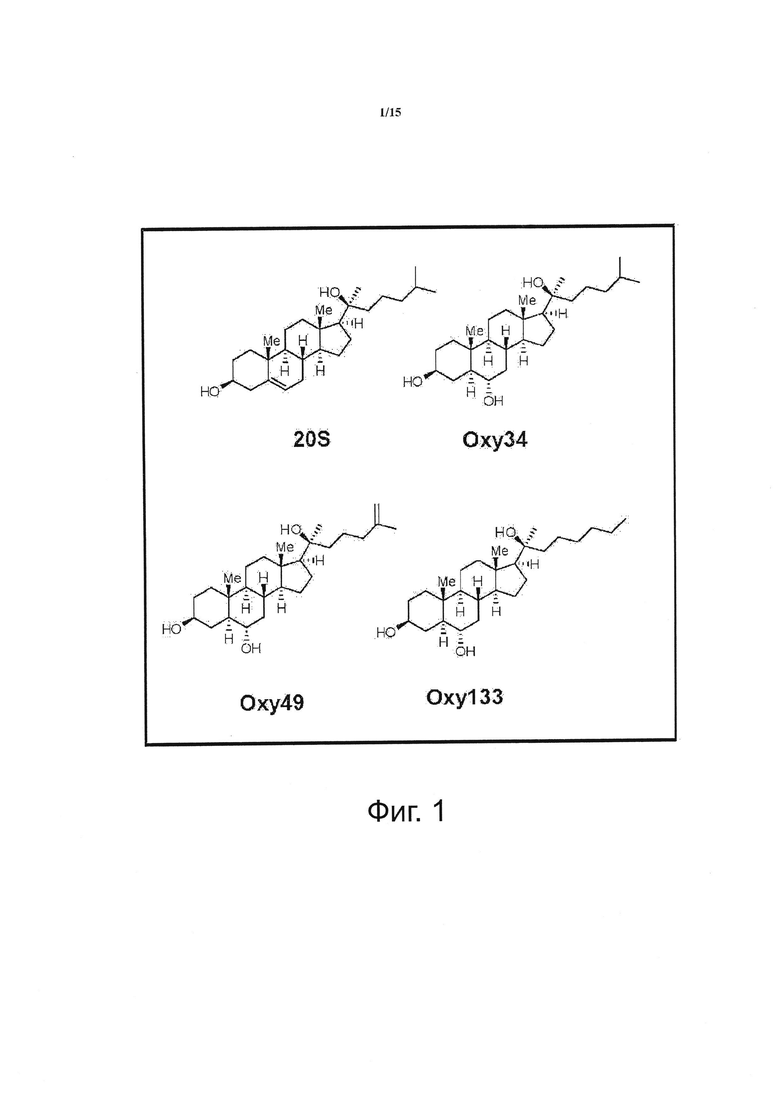
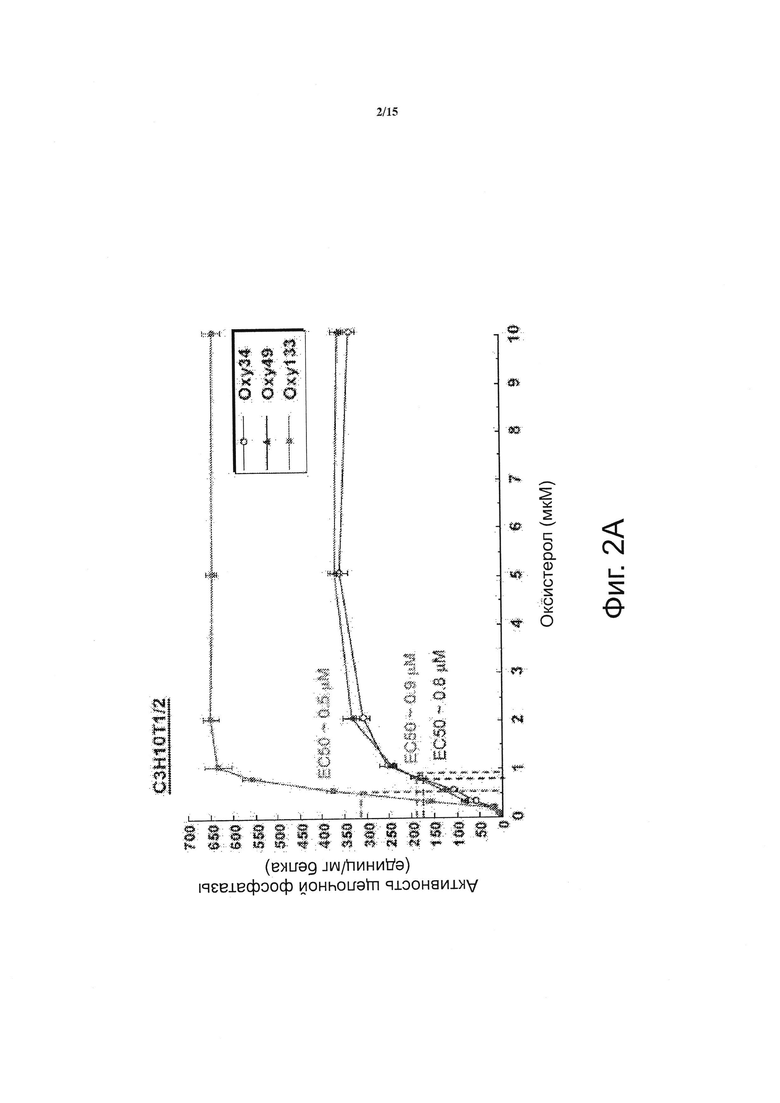
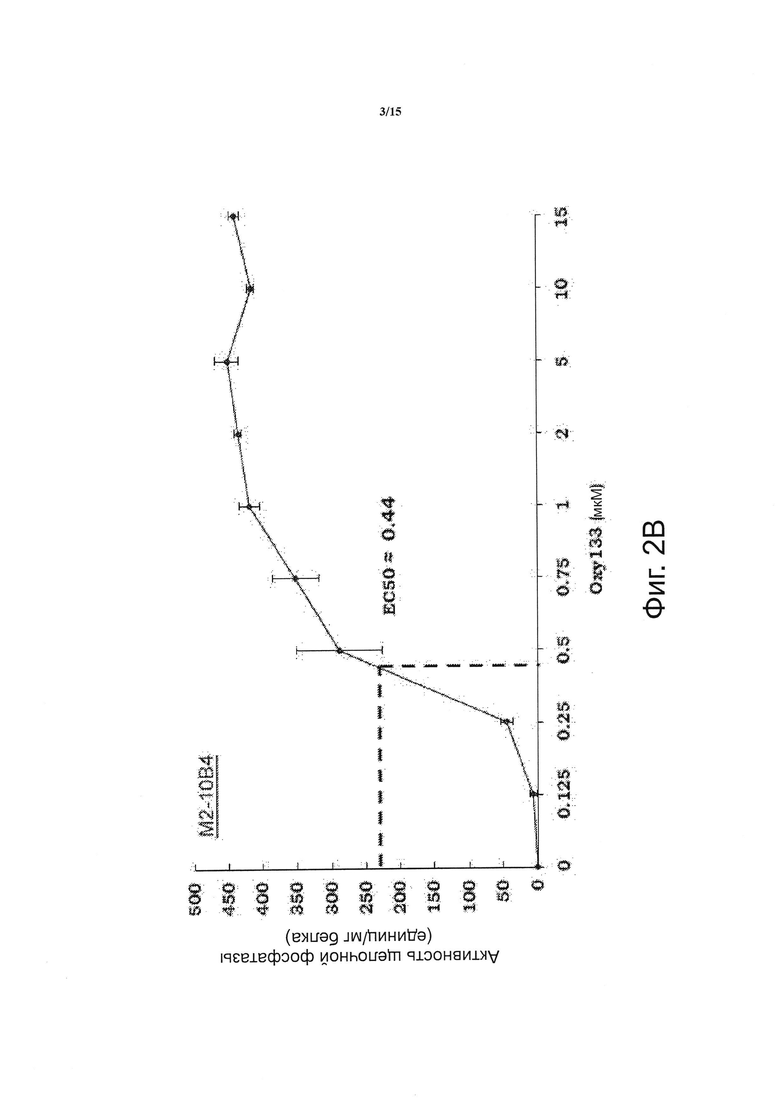
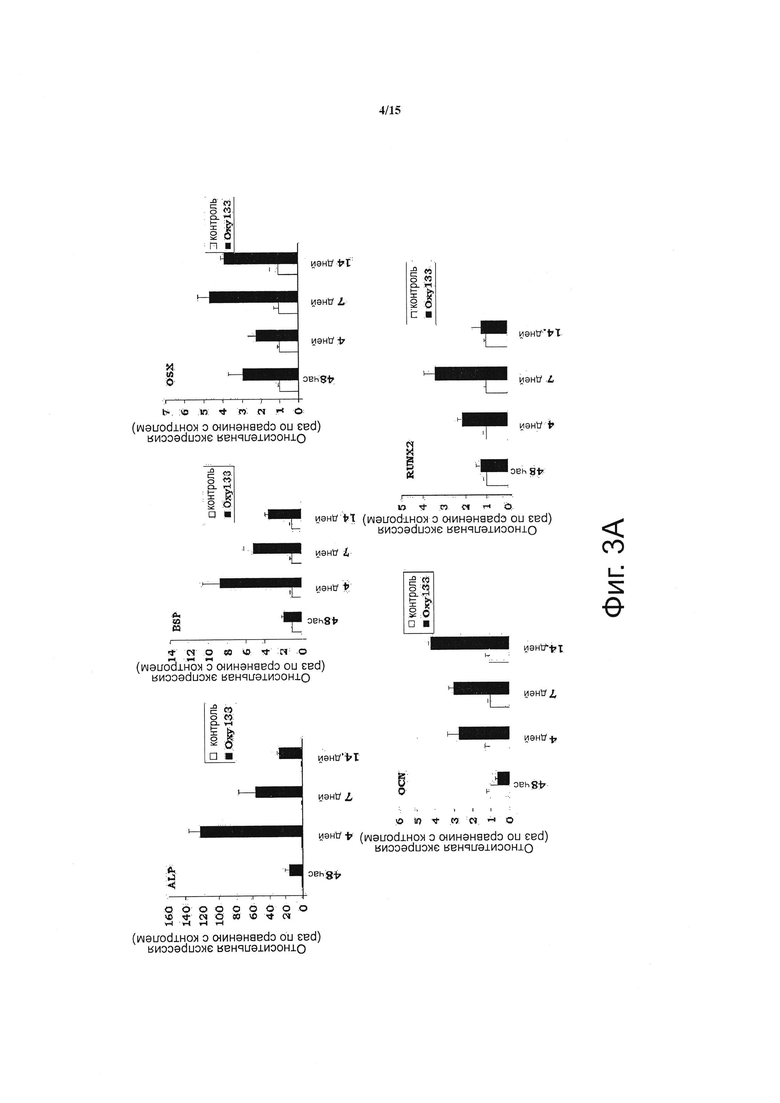
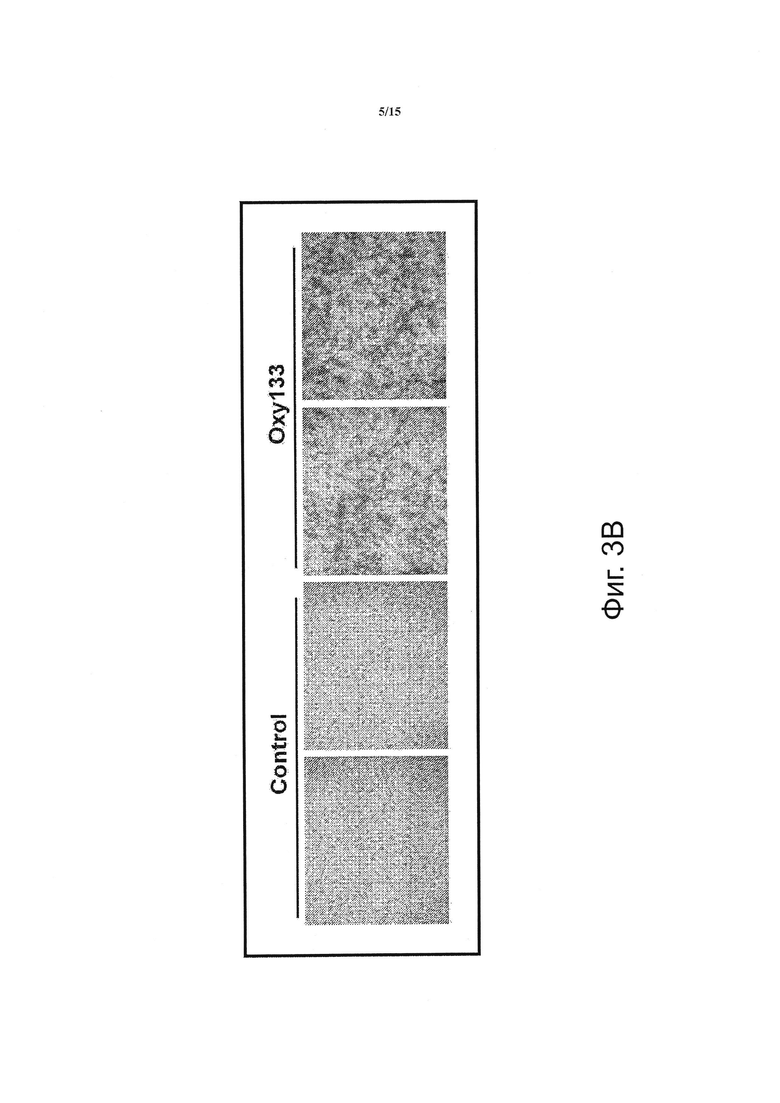
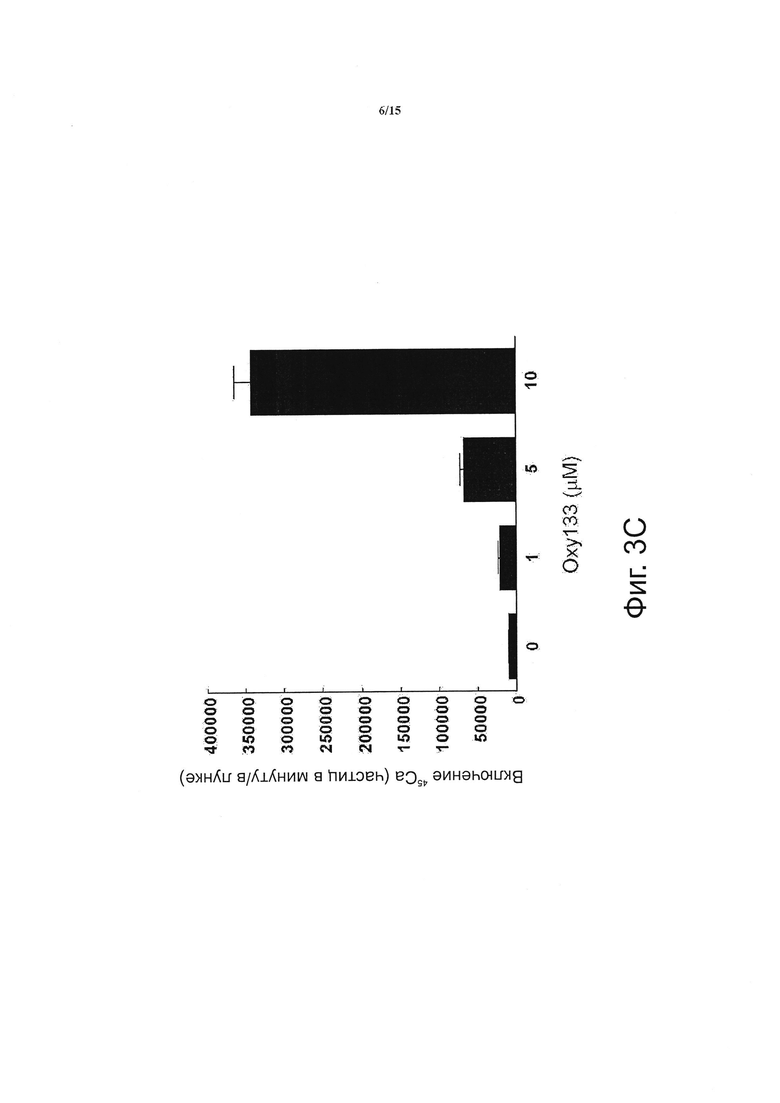
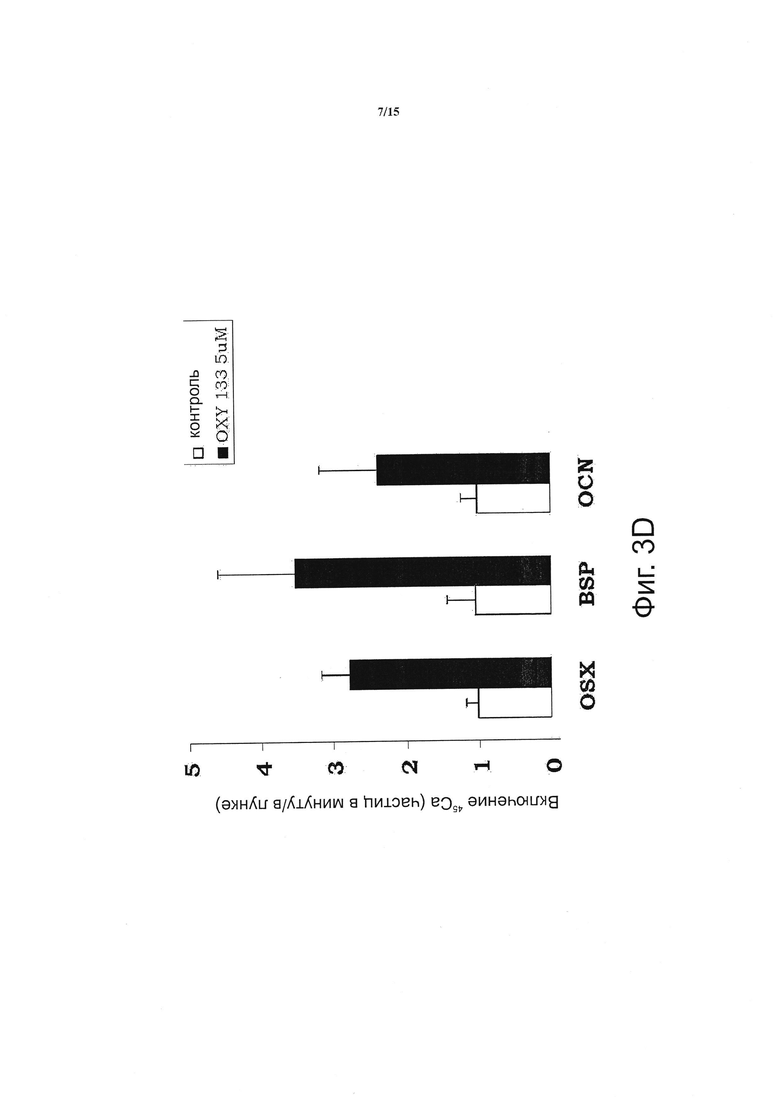


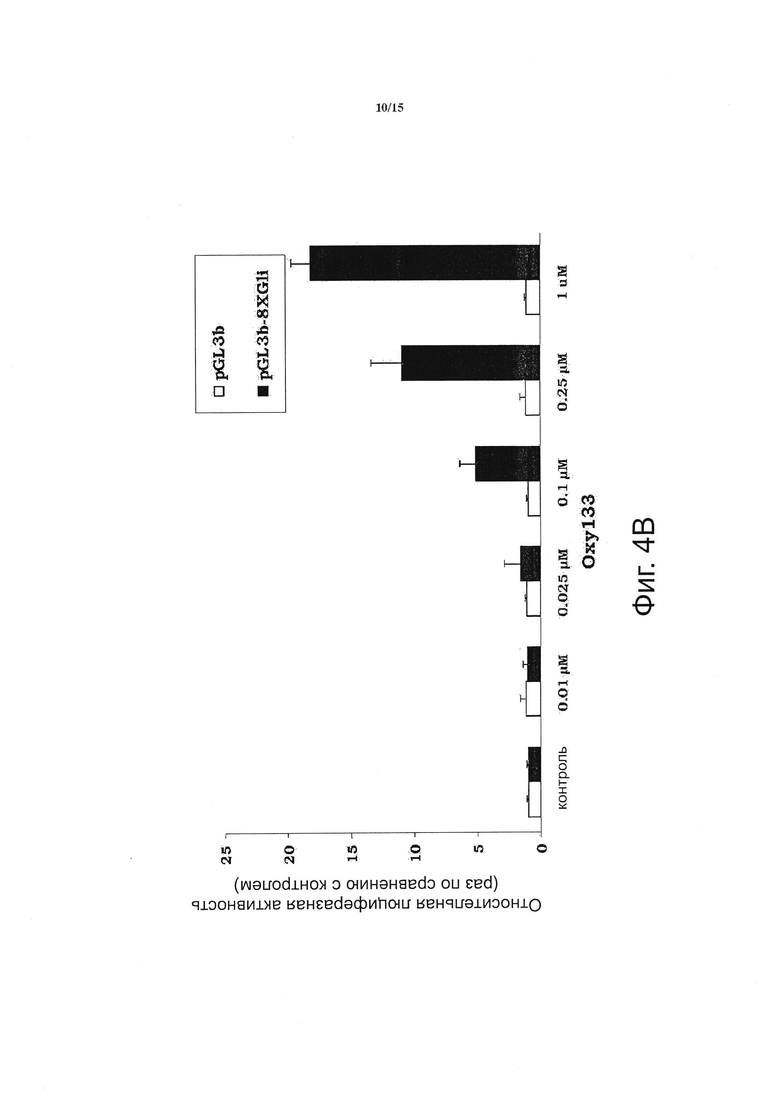
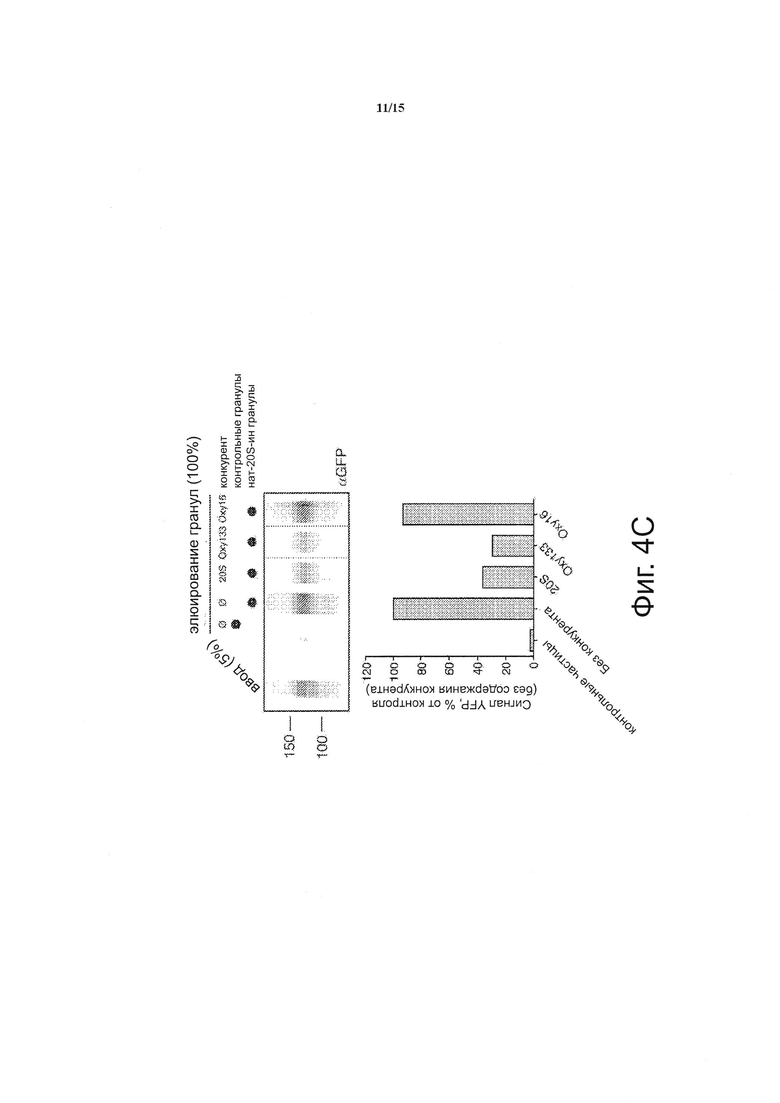
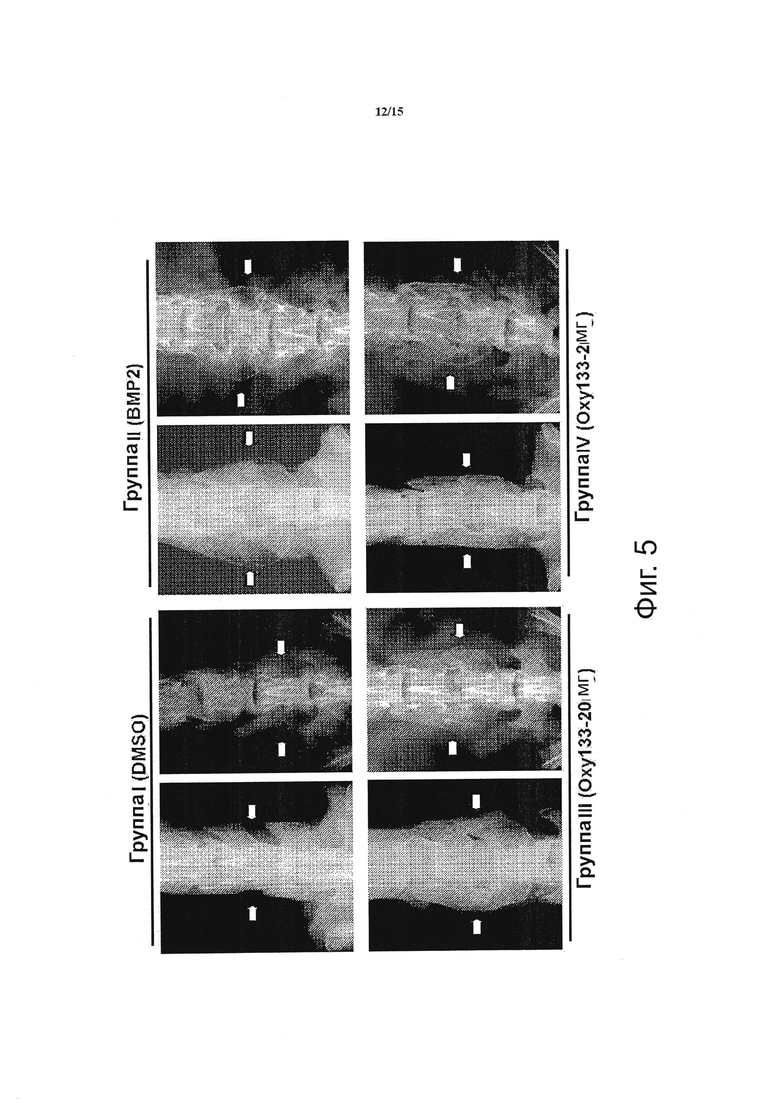
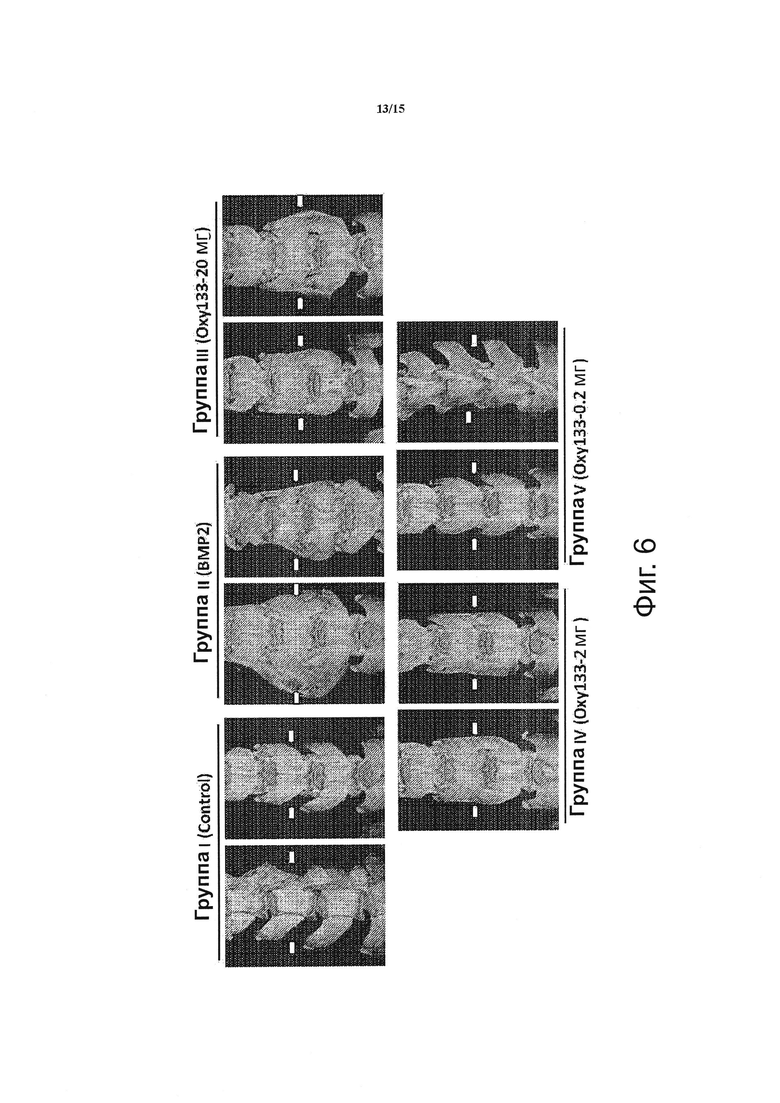

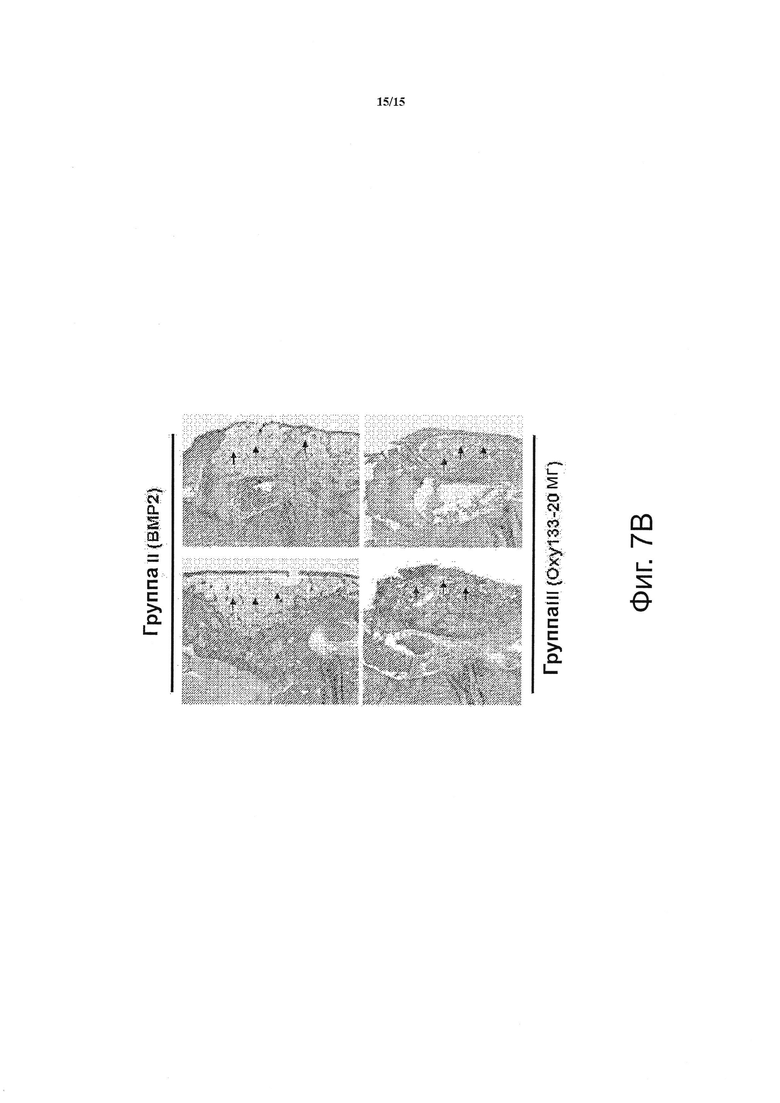
Изобретение относится к соединению Оху133, имеющему формулу I,
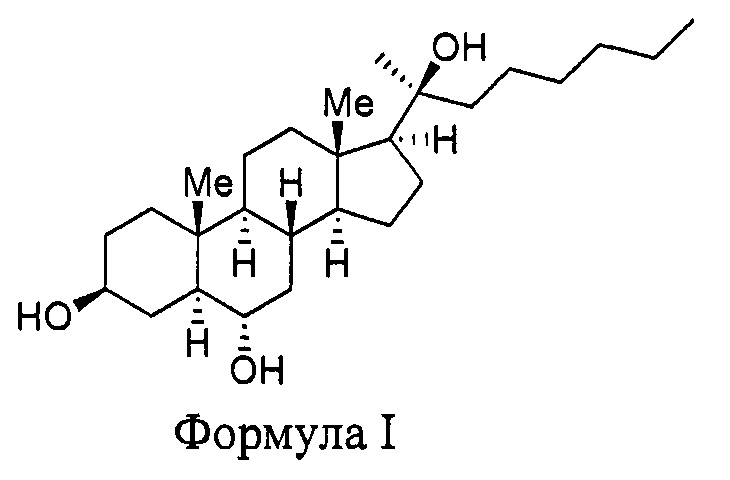 .
.
Изобретение также относится к биоактивной композиции, к способам лечения и к способу индукции остеобластической дифференцировки и/или ингибирования дифференцировки адипоцитов мезенхимальных стволовых клеток млекопитающих. Технический результат: получено новое соединение, которое применимо для лечения заболевания кости, для увеличения остеоморфогенеза и/или остеопролиферации, для стимулирования костеобразования, для индукции остеобластической дифференцировки и/или ингибирования дифференцировки адипоцитов мезенхимальных стволовых клеток. 6 н. и 2 з.п. ф-лы, 15 ил., 2 табл., 4 пр.
1. Соединение, Оху133, имеющее формулу I,
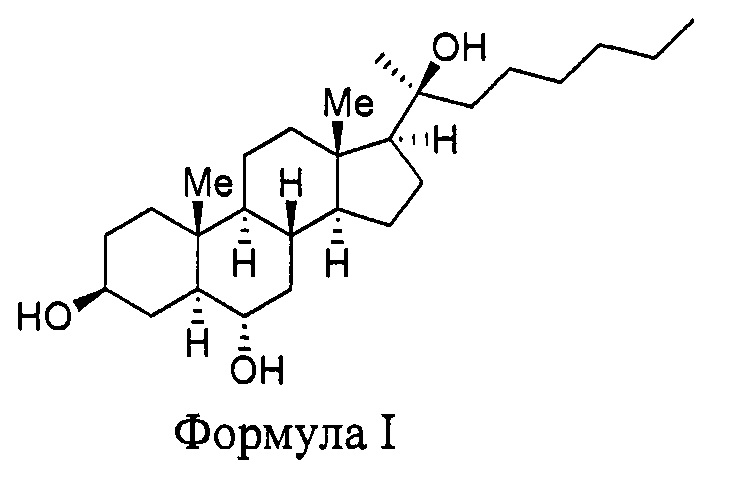
или его фармацевтически приемлемая соль.
2. Биоактивная композиция для лечения заболевания кости, для увеличения остеоморфогенеза и/или остеопролиферации, для стимулирования костеобразования, для индукции остеобластической дифференцировки и/или ингибирования дифференцировки адипоцитов мезенхимальных стволовых клеток, содержащая соединение Оху133 и фармацевтически приемлемый носитель.
3. Способ лечения субъекта, имеющего заболевание кости, остеопороз или перелом кости, включающий введение субъекту эффективного количества биоактивной композиции по п. 2.
4. Способ по п. 3, включающий введение субъекту биоактивной композиции в терапевтически эффективной дозе в эффективной лекарственной форме с подобранным интервалом с целью увеличения костной массы.
5. Способ по п. 3, включающий введение субъекту биоактивной композиции в терапевтически эффективной дозе в эффективной лекарственной форме с подобранным интервалом с целью улучшения симптомов остеопороза.
6. Способ лечения субъекта, нуждающегося в увеличении остеоморфогенеза и/или остеопролиферации, включающий введение субъекту эффективного количества композиции по п. 2.
7. Способ лечения субъекта, предназначенный для стимулирования костеобразования, включающий введение биоактивной композиции по п. 2 в эффективной лекарственной форме с подобранным интервалом с целью увеличения костной массы.
8. Способ индукции остеобластической дифференцировки и/или ингибирования дифференцировки адипоцитов мезенхимальных стволовых клеток млекопитающих, включающий контактирование клетки с эффективным количеством биоактивной композиции по п. 2, согласно которому мезенхимальная стволовая клетка млекопитающего является клеткой костномозговой стромы у субъекта.
| WO 2009073186 A1, 11.06.2009 | |||
| WO 2012024581 A2, 23.02.2012 | |||
| WO 2012024583 A2, 23.02.2012 | |||
| WO 2012024584 A2, 23.02.2012 | |||
| WO 2007098281 A2, 30.08.2007 | |||
| RU 2006103797 A, 27.07.2006. |
Авторы
Даты
2017-10-03—Публикация
2013-03-15—Подача