Изобретение относится к химической технологии кремнийорганических соединений, конкретно к способу получения алкокси(органо)дисилоксанов, которые могут найти применение в качестве мономеров при получении полиорганосилоксанов линейного, циклического, разветвленного, лестничного или кубического строения, а также для модификации полимеров и в качестве сшивающих агентов [G.В. Goodwin, М.Е. Kenney, Inorg. Chem., 1990, 29 (6), 1216-1220; L.С. Klein and A. Jitianu, Material Matters, 2012, 7 (2), 8-12].
Способ по изобретению позволяет получать алкокси(органо)дисилоксаны, содержащие различное количество алкоксигрупп, с высоким выходом и не требует применения органического растворителя и катализатора для образования целевых продуктов.
Известен способ получения симметричного тетра(трифторэтокси)дифенилдисилоксана взаимодействием трифтор-этилата цинка и фенилсилана (при мольном соотношении 3:1) в пентане при комнатной температуре. Наряду с низким выходом (38%) главным недостатком данного способа является необходимость использования дорогостоящего и пожароопасного фенилсилана и растворителя [V. Bette, А. Mortreux, D. Savoia, J.F. Carpentierc, Advanced Synthesis & Catalysis, 2005, 347 (2-3), 289-302].
Наиболее распространенным способом получения симметричных алкокси(органо)дисилоксанов является алкоголиз хлорсиланов, несмотря на то, что в этом случае целевые соединения образуются в результате побочных реакций [R. Nagel, С. Tamborski, Н.W. Post, J. Org. Chem., 1951, 16 (11), 1768-1771; С. Tamborski, H.W. Post, J. Org. Chem., 1952, 17 (10), 1400-1404]. Например, при кипячении винилтрихлорсилана с избытком соответствующего абсолютированного спирта в присутствии пиридина получают 1,3-дивинилтетраэтокси- и 1,3-дивинилтетрапентокси-дисилоксаны с выходами 20 и 18% [R. Nagel, С. Tamborski, Н.W. Post, J. Org. Chem., 1951, 16 (11), 1768-1771].
Известны способы получения симметричных алкокси(органо)дисилоксанов, основанные на модификации вышеуказанного способа, которые заключаются в получении недозамещенных органоалкоксисиланов с хлорным заместителем у кремния, дальнейшее взаимодействие последних с водным раствором гидроксида натрия приводит к образованию целевых продуктов [Н.J. Koetzsch, R. Buening, Patent Appl. GB 1218409 (A), 1971; R.C. Anderson, G.W. Cross, E.B. Burns, Patent Appl. GB 1008294 (A), 1965]. Например, кипячение винилтрихлорсилана с абсолютированным трет-бутанолом (при мольном соотношении 3:1) и пиридином в бензоле в течение 3-4 ч приводит к образованию винилтри-трет-бутоксисилана и винилди-трет-бутоксихлорсилана. Перемешивание последнего с раствором гидроксида натрия приводит к образованию целевого тетра-трет-бутоксидивинилдисилоксана [Н.J. Koetzsch, R. Buening, Patent Appl. GB 1218409 (A), 1971].
Известен способ получения симметричных алкокси(органо)дисилоксанов гидролизом алкокси(органо)хлорсиланов в присутствии акцептора хлористого водорода. Например, при добавлении воды, растворенной в тетрагидрофуране, к охлажденному до 0°C раствору метил-о,о1-дифеноксихлорсилана и пиридина в сухом эфире и последующем нагревании реакционной массы при 35°C получают 1,1,3,3-ди(о,о1-дифенокси)-1,3-диметилдисилоксан с выходом 32% [R.С. Anderson, G.W. Cross, Е.В. Burns, Patent Appl. GB 1008294 (A), 1965].
Общими недостатками известных способов получения симметричных алкокси(органо)дисилоксанов из хлорсодержащих алкокси(органо)силанов являются низкий выход целевых продуктов, образование солянокислых отходов и необходимость использования растворителей.
Описан способ получения симметричных алкокси(органо)дисилоксанов из алкоксиорганосиланов в присутствии катализаторов [А.Д. Кирилин, Л.О. Белова, В.Г. Лахтин, А.В. Лега, М.Ю. Петров, Е.А. Чернышев, Ж. общ. хим., 2005, 75 (9), 1474-1478; Z.X. Zhang, J. Нао, P. Xie, X. Zhang, C.C. Han, R.A. Zhang, Chemistry of Materials, 2008, 20 (4), 1322-1330].
Известен способ получения симметричных алкокси(органо)дисилоксанов из органотриалкоксисиланов частичным гидролизом органотриалкоксисилана в спирте в присутствии соляной кислоты [Z.X. Zhang, J. Нао, P. Xie, X. Zhang, C.C. Han, R.A. Zhang, Chemistry of Materials, 2008, 20 (4), 1322-1330]. Единственным примером использования этого способа является получение 1,3-дифенилтетраметоксидисилоксана из фенилтриметоксисилана, которое осуществляют следующим образом: к раствору 0,4 моль фенилтриметоксисилана в метаноле прибавляют по каплям смесь 0,15 моль воды и 0,3 мл 1 М раствора HCl в метаноле и перемешивают при 25°C в течение 24 ч. Дистилляцией реакционной массы выделяют целевой продукт (1,3-дифенилтетраметоксидисилоксан) с выходом 55%. Недостатками способа являются низкий выход продукта и необходимость использования кислотного катализатора и растворителя. Данный способ наиболее близок к заявляемому способу и может рассматриваться как прототип.
Задачей заявляемого изобретения является разработка эффективного способа получения симметричных алкокси(органо)дисилоксанов, обеспечивающего высокий выход целевого продукта и не требующего использования катализаторов и растворителей в процессе его образования.
Задача решается заявляемым способом получения симметричных алкокси(органо)дисилоксанов общей формулы [R1aR2b(AlkO)3-(a+b)Si]2O из алкоксисиланов общей формулы R1aR2bSi(OAlk)4-(a+b), где R1 обозначает CH3, C2H5, CH=CH2, C6H5; R2 обозначает CH3, C2H5; Alk обозначает C1-C3 алкил; а равно 0 или 1; b равно 0 или 1, включающим взаимодействие алкоксисилана с гидроксидом натрия и последующее действие диоксида углерода на образующийся продукт. Последнюю стадию проводят при температуре от 0 до 100°C, при этом диоксид углерода или барботируют через продукт взаимодействия алкоксисилана с гидроксидом натрия после отгонки образовавшегося спирта, или предварительно выделяют промежуточный силанолят натрия и проводят его взаимодействие с диоксидом углерода в автоклаве.
В общем виде синтез симметричных алкокси(органо)дисилоксанов может быть представлен следующей суммарной схемой:
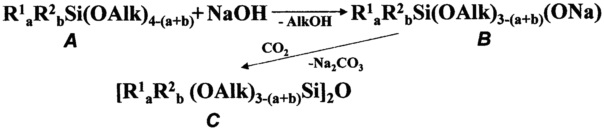
В отличие от прототипа, где используют частичный гидролиз органотриалкоксисилана в спирте в присутствии соляной кислоты, который характеризуется низкой избирательностью по алкокси-группам и сложностью контроля за количеством гидролизованных групп; что приводит к образованию более конденсированного продукта и уменьшению выхода целевого продукта, в заявляемом способе на первой стадии осуществляют реакцию алкоксисилана A с гидроксидом натрия, которая, как известно, происходит селективно с образованием силанолята натрия B [E.A. Rebrov, A.M. Muzafarov, Heteroatom Chemistry, 2006, 17 (6), 514-541]. Последующее взаимодействие силанолята натрия B с диоксидом углерода можно проводить либо барботированием диоксида углерода через раствор соединения B в избытке исходного алкоксисилана A после удаления спирта без выделения силанолята натрия B (реализация «one-pot» процесса), либо реакцией диоксида углерода с предварительно выделенным силанолятом натрия B в автоклаве. Оба варианта универсальны для алкоксисиланов с различным типом и количеством органических заместителей, причем выходы целевых симметричных алкокси(органо)дисилоксанов выше, чем в прототипе, и в отдельных случаях достигают 100% (см. таблицу).
Вероятный механизм взаимодействия силанолятов натрия B и диоксида углерода показан на схеме, приведенной ниже для органо(диэтокси)силанолята натрия:
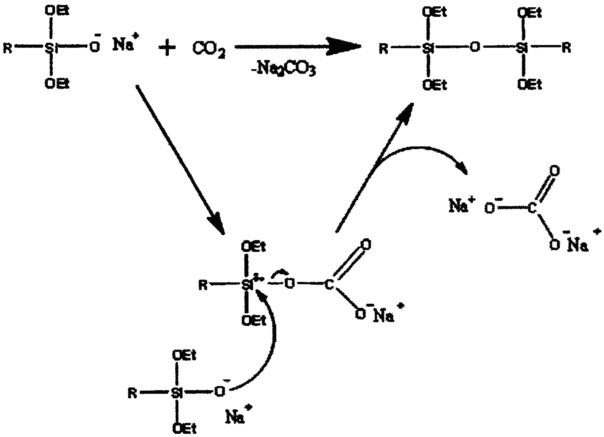
Можно предположить, что сначала происходит внедрение молекулы CO2 по связи SiO-Na с образованием промежуточного органо(диэтокси)силилоксикарбоната натрия, который, по-видимому, легко вступает в дальнейшее взаимодействие с непрореагировавшими молекулами органо(диэтокси)силанолята натрия с образованием симметричного алкокси(органо)дисилоксана и карбоната натрия [М.N. Temnikov, М.I. Buzin, N.V. Demchenko, G.V. Cherkaev, N.G. Vasilenko, A.M. Muzafarov, Mendeleev Commun., 2016, 26, 121-123; Y.V. Fedotova, E.V. Zhezlova, T.G. Mushtina, A.N. Kornev, T.A. Chesnokova, G.K. Fukin, L.N. Zakharov and G.A. Domrachev, Russ. Chem. Bull., 2003, 52, 414-420; H. Yildirimyan and G. Gattow, Zeitschrift  Anorg. und Allg. Chemie, 1980, 466, 188-194; H. Yildirimyan and G. Gattow, Zeitschrift
Anorg. und Allg. Chemie, 1980, 466, 188-194; H. Yildirimyan and G. Gattow, Zeitschrift  Anorg. und Allg. Chemie, 1984, 519, 204-212].
Anorg. und Allg. Chemie, 1984, 519, 204-212].
После проведения взаимодействия силанолята натрия B с диоксидом углерода образовавшуюся гетерогенную смесь разбавляют диэтиловым эфиром и отделяют осадок карбоната натрия трехкратным центрифугированием. После отгонки растворителя полученный продукт анализируют хроматографическими и спектроскопическими методами (ГЖХ, ГПХ, ИК и ЯМР).
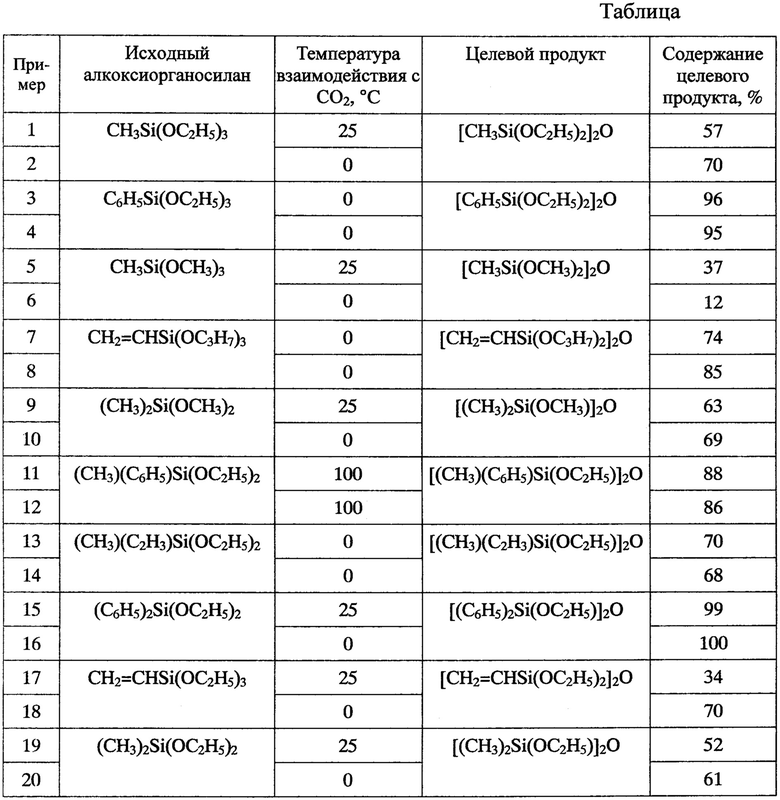
Заявляемым способом был получен ряд симметричных алкокси(органо)дисилоксанов с различными заместителями. Условия реакции с диоксидом углерода и содержание целевых соединений в полученных продуктах приведены в таблице.
Сравнение выходов симметричных этокси(органо)дисилоксанов с различным количеством C2H5O-групп (таблица) показывает, что электроотрицательные заместители у атома кремния повышают реакционную способность промежуточных алкокси(органо)силилоксикарбонатов натрия. Это приводит к их эффективному взаимодействию с алкокси(органо)силанолятами натрия B и более высокому выходу симметричных алкокси(органо)дисилоксанов C. При этом наиболее высокие выходы целевых продуктов наблюдаются в случае проведения взаимодействия силанолятов натрия B с диоксидом углерода при его барботировании в реакционную смесь.
Техническим результатом заявляемого изобретения является новый способ получения симметричных алкокси(органо)дисилоксанов, обеспечивающий увеличение выхода целевых продуктов и не требующий использования катализаторов и растворителей.
Заявляемый способ обладает следующими преимуществами:
- позволяет получать симметричные алкокси(органо)дисилоксаны с высоким выходом;
- допускает проведение двух стадий в одном реакторе без выделения промежуточного продукта (one-pot процесс);
- не требует применения катализаторов и растворителей для проведения реакций образования целевого продукта.
Изобретение иллюстрируется приведенными ниже примерами осуществления, результаты которых представлены в таблице.
Пример 1
Получение [CH3Si(OC2H5)2]2O (автоклав)
К 8 г (0,045 моль) метилтриэтоксисилана при температуре 5°C добавляют 0,6 г (0,015 моль) гидроксида натрия. Реакционную смесь перемешивают до полного растворения NaOH, после чего отгоняют выделившийся при реакции этанол при давлении 12 мбар. Полученный метилдиэтоксисиланолят натрия загружают в автоклав и закачивают в систему CO2 с расходом 20,0 мл/мин до достижения давления 150 атм. Перемешивают реакционную массу при комнатной температуре в течение 5 мин, затем сбрасывают давление. К образовавшейся гетерогенной смеси добавляют 50 мл сухого диэтилового эфира. Супернатант отделяют от осадка путем трехкратного центрифугирования при 9000 об/мин, затем эфир отгоняют. Содержание целевого диметилтетраэтоксидисилоксана в полученном продукте составляет 57%.
Пример 2
Получение [CH3Si(OC2H5)2]2O (барботирование CO2)
К 3,50 г (0,263 моль) NaOH добавляют 46,80 (0,875 моль) MeSi(OEt)3 и интенсивно перемешивают полученную смесь до полной гомогенизации при температуре 25°C. После этого образовавшийся в ходе реакции спирт удаляют отгонкой при остаточном давлении 12 мбар, реакционную смесь охлаждают до 0°C и барботируют CO2 в течение 1 ч с расходом 0,2 мл/мин при интенсивном перемешивании. После выпадения белого осадка реакционную смесь нагревают до комнатной температуры и добавляют к ней 50 мл сухого диэтилового эфира. Жидкую часть отделяют от осадка путем трехкратного центрифугирования при 9000 об/мин, затем растворитель отгоняют. Содержание целевого диметилтетраэтоксидисилоксана в продукте составляет 70%.
Примеры 3, 5, 7, 9, 11, 13, 15, 17, 19
Получение симметричных алкокси(органо)дисилоксанов в примерах 3, 5, 7, 9, 11, 13, 15, 17, 19 осуществляют по методике, аналогичной описанной в примере 1.
Примеры 4, 6, 8, 10, 12, 14, 16, 18, 20
Получение симметричных алкокси(органо)дисилоксанов в примерах 2, 4, 6, 8, 10, 12, 14, 16, 18, 20 осуществляют по методике, аналогичной описанной в примере 2.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИОРГАНОСИЛОКСАНОВ | 2014 |
|
RU2576311C1 |
| КОМПОЗИЦИЯ ОЛЕФИНФУНКЦИОНАЛИЗОВАННЫХ СИЛОКСАНОВЫХ ОЛИГОМЕРОВ, ОСНОВАННЫХ НА АЛКОКСИСИЛАНАХ | 2012 |
|
RU2613325C2 |
| КОМПОЗИЦИИ ОСНОВАННЫХ НА АЛКОКСИСИЛАНАХ ОЛЕФИНФУНКЦИОНАЛИЗОВАННЫХ СИЛОКСАНОВЫХ ОЛИГОМЕРОВ С НИЗКИМ СОДЕРЖАНИЕМ ХЛОРИДОВ | 2012 |
|
RU2612909C2 |
| НАТРИЙОКСИ(АМИНОПРОПИЛ)ДИАЛКОКСИСИЛАНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2014 |
|
RU2592061C2 |
| СПОСОБ ПОЛУЧЕНИЯ СИММЕТРИЧНЫХ МЕТИЛФЕНИЛДИСИЛОКСАНОВ И ГЕКСАФЕНИЛДИСИЛОКСАНА ДЕГИДРОКОНДЕНСАЦИЕЙ ТРИОРГАНОСИЛАНОВ | 2018 |
|
RU2687736C1 |
| СМЕСИ ОСНОВАННЫХ НА АЛКОКСИСИЛАНАХ ОЛЕФИНФУНКЦИОНАЛИЗОВАННЫХ СИЛОКСАНОВЫХ ОЛИГОМЕРОВ С ОСОБЕННО НИЗКИМ СОДЕРЖАНИЕМ ЛЕТУЧИХ ОРГАНИЧЕСКИХ КОМПОНЕНТОВ | 2012 |
|
RU2609209C2 |
| Наноразмерные фторсодержащие молекулярные силиказоли и способ их получения | 2014 |
|
RU2661894C2 |
| ПОЛИФУНКЦИОНАЛЬНЫЙ ОРГАНОСИЛАН, ПРИГОДНЫЙ ДЛЯ ИСПОЛЬЗОВАНИЯ В КАЧЕСТВЕ СВЯЗУЮЩЕГО АГЕНТА, И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2001 |
|
RU2272042C2 |
| КОМПОЗИЦИЯ АЛКОКСИСИЛАН/ОРГАНИЧЕСКИЙ ПОЛИМЕР ДЛЯ ИСПОЛЬЗОВАНИЯ В ПОЛУЧЕНИИ ИЗОЛИРУЮЩЕЙ ТОНКОЙ ПЛЕНКИ И ЕЕ ПРИМЕНЕНИЕ | 1998 |
|
RU2180671C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИОРГАНОСИЛОКСАНОВ НА ОСНОВЕ ОРГАНОАЛКОКСИСИЛАНОВ | 2009 |
|
RU2428438C2 |
Изобретение относится к способам получения алкокси(органо)дисилоксанов, которые могут найти применение в качестве мономеров для получения полиорганосилоксанов линейного, циклического, разветвленного, лестничного или кубического строения, а также в качестве модификаторов полимеров и сшивающих агентов. Предложен способ получения симметричных алкокси(органо)дисилоксанов общей формулы [R1aR2b(AlkO)3-(a+b)Si]2O из алкоксисиланов общей формулы R1aR2bSi(AlkO)4-(a+b), где R1 обозначает CH3, C2H5, CH=CH2, C6H5; R2 обозначает CH3, C2H5; Alk обозначает C1-C3 алкил; a равно 0 или 1; b равно 0 или 1, включающий последовательное взаимодействие указанного алкоксисилана с гидроксидом натрия и диоксидом углерода. Технический результат – предложенный способ обеспечивает повышение выхода целевых продуктов, не требует использования катализатора и растворителей, а также может быть проведен в одном реакторе без выделения промежуточного продукта. 3 з.п. ф-лы, 1 табл., 20 пр.
1. Способ получения симметричных алкокси(органо)дисилоксанов общей формулы [R1aR2b(AlkO)3-(a+b)Si]2O из алкоксисиланов общей формулы R1aR2bSi(AlkO)4-(a+b), где R1 обозначает СН3, С2Н5, СН=СН2, С6Н5; R2 обозначает СН3, С2Н5; Alk обозначает С1-С3 алкил; a равно 0 или 1; b равно 0 или 1, включающий взаимодействие алкоксисилана с гидроксидом натрия и последующую реакцию образующегося продукта с диоксидом углерода.
2. Способ по п. 1, отличающийся тем, что диоксид углерода барботируют через продукт взаимодействия алкоксисилана с гидроксидом натрия после отгонки спирта.
3. Способ получения по п. 1, отличающийся тем, что продукт взаимодействия алкоксисилана с гидроксидом натрия выделяют и проводят его взаимодействие с диоксидом углерода в автоклаве.
4. Способ по п. 1, отличающийся тем, что взаимодействие с диоксидом углерода проводят при температуре от 0 до 100°C.
| Zhong-Xing Zhang et al | |||
| A Well-Defined Ladder Polyphenylsilsesquioxane (Ph-LPSQ) Synthesized via a New Three-Step Approach: Mqnqmer Self-Organization - Liophilization - Surface-Confined Polycondensation | |||
| Chem | |||
| Mater., 2008, Vol.20, No.4, pp.1322-1330 | |||
| СПОСОБ ПОЛУЧЕНИЯ ВИНИЛДИСИЛОКСАНОВ | 1996 |
|
RU2100335C1 |
| А.Д.Кириллин и др | |||
| Использование хлорметилалкоксисиланов, силаэтанов и силаэтиленов в синтезе линейных и гетероциклических соединений | |||
| Журнал общей химии, 2005, т.75, вып.9, с.1474-1478 | |||
| Раскладочная гарнитура | 1980 |
|
SU1008294A1 |
| СПОСОБ ПОЛУЧЕНИЯ 1,3-ДИЭТЕНИЛ-1,1,3,3-ТЕТРАМЕТОКСИДИСИЛОКСАНА | 2003 |
|
RU2252940C1 |
Авторы
Даты
2017-10-05—Публикация
2016-12-13—Подача