Область техники, к которой относится изобретение
Изобретение относится к области медицины, а именно к внутренним болезням, и может быть использовано в гастроэнтерологии, терапии, хирургии и лучевой диагностике для диагностики варикозного расширения вен пищевода у пациентов с внепеченочной обструкцией воротной вены (ВПОВВ).
ВПОВВ - обструкция внепеченочной части воротной вены и/или ее ветвей с возможным вовлечением других вен портальной системы (de Franchis R.on behalf of VI Faculty Expanding consensus in portal hypertension report of the Baveno VI Consensus Workshop: Stratifying risk and individualizing care for portal hypertension // Journal of Hepatology. - 2015. - Vol. 63. - P. 743-752). Основной причиной ВПОВВ служит тромбоз воротной вены (ТВВ), который диагностируется с помощью визуальных методов исследования как наличие тромботических масс в просвете воротной вены или кавернозной трансформации воротной вены (EASL Clinical Practice Guidelines: Vascular diseases of the liver. J Hepatol. 2016 Jan; 64 (1): 179-202. doi: 10.1016/j.jhep.2015.07.040).
Около половины всех случаев ТВВ обусловлено циррозом печени и опухолями гепатобилиарной зоны, которые обычно рассматриваются как отдельные (специфические) ситуации. Большинство исследователей к ВПОВВ относят исключительно нецирротический / неопухолевый ТВВ, причинами которого служат системные факторы (врожденные и приобретенные тромбофилии) и локальные факторы: острые абдоминальные хирургические / воспалительные заболевания и операции на органах брюшной полости (Valla D.C.Vascular diseases of the liver. In: Feldman M, Friedman L.S., Brandt L.J., editors. Sleisenger and Fordtran's gastrointestinal and liver disease: pathophysiology, diagnosis, management. 10th ed. Philadelphia: Elsevier Saunders; 2016. p. 1393-1408).
Среди всех причин портальной гипертензии на долю ВПОВВ в западных странах приходится 5-10% всех случаев, в развивающихся странах до 40%. ВПОВВ обусловливает 20-30% кровотечений из варикозно расширенных вен (ВРВ) в Индии, 10-20% в Японии и 2-5% в западных странах (Wani Z.A., Bhat R.A., Bhadoria A.S., and Maiwall R. Extrahepatic Portal Vein Obstruction and Portal Vein Thrombosis in Special Situations: Need for a New Classification Saudi J Gastroenterol. 2015 May-Jun; 21(3): 129-138. doi: 10.4103/1319-3767.157550).
В Российской Федерации у взрослых среди причин осложненной портальной гипертензии на долю ВПОВВ приходится 11,3%-12,3% всех случаев (Шерцингер А.Г., Жигалова С.Б., Мусин Р.А., Демьянов А.И., Абдуллаев И.Ч. Осложнения после эндоскопических вмешательств у больных портальной гипертензией // Анналы хирургической гепатологии. 2007. Т. 12. №2. С. 16-21; Сапронова Н.Г., Ерошенко О.Л., Косовцев Е.В., Блинов И.М. Особенности диагностики и лечения внепеченочной портальной гипертензии // Фундаментальные исследования. 2013. №9-6. С. 1139-1145).
Основное следствие ВПОВВ - синдром портальной гипертензии, приводящий к формированию коллатерального кровотока с развитием варикозного расширения вен пищевода (ВРВП) и желудка (ВРВЖ) и кровотечениям из них. Другими клиническими проявлениями служат спленомегалия, гиперспленизм, асцит и печеночная энцефалопатия.
Кровотечение из ВРВ является самым тяжелым осложнением, требующим больших затрат на лечение. Поэтому выявление ВРВ у пациентов с ВПОВВ служит ключевой задачей диагностики, позволяющей своевременно начать лечение, направленное на профилактику кровотечения.
Уровень техники
Из уровня техники известен способ диагностики ВРВ с применением эндоскопии и видеоэндоскопии. При выполнении данных процедур пациенту через рот вводится гибкий оптический прибор эзофагогастроскоп или видеоэндоскоп, с помощью которого осматривается пищевод, желудок и двенадцатиперстная кишка. ВРВ диагностируют путем обнаружения во время осмотра в пищеводе и желудке стволов вен и их варикозного расширения, а также отдельных варикозных узлов в желудке и двенадцатиперстной кишке. Метод считается стандартом диагностики ВРВ (de Franchis R.on behalf of VI Faculty Expanding consensus in portal hypertension report of the Baveno VI Consensus Workshop: Stratifying risk and individualizing care for portal hypertension // Journal of Hepatology. - 2015. - Vol. 63. - P. 743-752). Недостатками данного метода служат: возможность проведения только в специальных условиях (эндоскопическое отделение или кабинет), инвазивность, необходимость применения местной анестезии или седации, наличие противопоказаний и осложнений, неприятные ощущения при выполнении исследования и после его завершения; высокая стоимость.
Известен еще один способ диагностики ВРВ - эндоскопическое ультразвуковое исследование (ЭндоУЗИ). Исследование выполняется с помощью специального эндоскопа, на конце которого имеется оптический прибор и миниатюрный ультразвуковой датчик. Для диагностики ВРВ пациенту через рот вводится аппарат для проведения ЭндоУЗИ. Ультразвук, отражаясь от внутренних органов, поступает обратно в датчик и дает возможность получить их изображение на экране монитора. ВРВ диагностируют по характерным признакам изображения тканей пищевода и желудка. (Shim J-J. Usefulness of Endoscopic Ultrasound in Esophagogastric Varices. Clin Endosc. 2012 Sep; 45(3): 324-327. doi: 10.5946/ce. 2012.45.3.324). Недостатками данного метода служат: возможность проведения только в специальных условиях (эндоскопическое отделение или кабинет), инвазивность, необходимость применения местной анестезии или седации, необходимость выполнения перед процедурой эндоскопии (метода, который сам по себе считается стандартом диагностики ВРВ), наличие противопоказаний и осложнений, неприятные ощущения при выполнении исследования и после его завершения; высокая стоимость.
Среди (относительно) неинвазивных методов диагностики ВРВ применяются: рентгеновское исследование пищевода, мультиспиральная компьютерная томографическая ангиография (МСКТ-ангиография), магнитно-резонансная ангиография (MP-ангиография). Все эти методы обычно проводятся при наличии противопоказаний к эндоскопии.
Рентгенография пищевода и желудка с контрастированием - исторически первый метод выявления ВРВП - проводится с применением рентгеновского аппарата. Пациенту дают выпить раствор сульфата бария, который заполняет пищевод, и производят осмотр с помощью рентгеновского аппарата. По характерному рисунку заполнения пищевода выявляют ВРВП (Wolf G. Die Erkennug von osophagus varizen im rontgenbilde. Fortsch Roentgenstr Nuklearmed Ergenzungsband. 1928. 37:890-3.; Sherlock S, Dooley J. Diseases of the Liver and Biliary System. 10th ed. Oxford, United Kingdom: Blackwell Science; 1997. 135-80). Недостатками данного метода служат: использование рентгеновского излучения, возможность проведения только в специальных условиях (рентгеновское отделение или кабинет), низкая чувствительность в диагностике ВРВП (около 50%); высокая стоимость.
МСКТ-ангиография - одна из разновидностей рентгеновского метода исследования. Проводится путем послойного сканирования с толщиной среза от 0,5 мм и последующей оценки полученных изображений. Для получения изображения сосудов во время процедуры внутривенно вводится окрашивающий йодсодержащий препарат (контраст). ВРВ диагностируют по характерным признакам изображения вен пищевода и желудка. Недостатками данного метода служат: использование рентгеновского излучения, возможность проведения только в специальных условиях (рентгеновское отделение, кабинет КТ), необходимость катетеризации периферической вены, наличие противопоказаний к самой процедуре и к введению контраста, более низкая чувствительность в обнаружении ВРВП, чем у эндокопического, видеоэндоскопического методов, отсутствие возможности выявлять ВРВП размером < 3 мм; длительность процедуры; высокая стоимость.
MP-ангиография - метод получения изображения сосудов при помощи магнитно-резонансного томографа, основанный на использовании явления ядерного магнитного резонанса. Для получения четкого изображения сосудов применяются контрастные вещества на основе парамагнетика. ВРВ диагностируют по характерным признакам изображения вен пищевода и желудка. (Lefkovitz Z., Cappell M.S., Kaplan M., Mitty H., Gerard P. Radiology in the diagnosis and therapy of gastrointestinal bleeding. Gastroenterol Clin North Am. 2000 Jun. 29(2): 489-512).
Основными недостатками метода служат: возможность проведения только в специальных условиях (отделение лучевой диагностики, кабинет MP томографии), необходимость катетеризации периферической вены, наличие противопоказаний к самой процедуре и к введению контрастного средства, дискомфорт от пребывания в аппарате (узкое пространство, шум), более низкая чувствительность в обнаружении ВРВП, чем у эндокопического, видеоэндоскопического методов, отсутствие возможности выявлять ВРВП размером < 3 мм; длительность процедуры; высокая стоимость.
Наиболее близким к заявляемому решению является неинвазивный способ диагностики ВРВП по показателям плотности печени, измеренным с помощью эластографических сканеров, которые анализируют локальные деформации при дозированной компрессии или вибрации. Выделяют несколько видов, в зависимости от способа создания деформаций и методов оценки результата: статическая эластография и динамическая: транзиентная эластография (ТЭ), акустическая импульсно-волновая эластография (ARFI - acoustic radiation force impulse), эластография с использованием оценки скорости сдвиговых волн (SWE - shear wave elastography). При ТЭ сдвиговые волны генерируются механическим способом, при ARFI и SWE - электронным.
В основе ТЭ лежит низкочастотная (частота 50 Герц) сдвиговая волна, которая создается расположенным в корпусе УЗ датчика механическим ударным устройством. Механический удар штифта датчика наносится через межреберье по правой доле печени, после чего с помощью ультразвукового М- и А- режима оценивается скорость продвижения сдвиговой волны через стандартный участок, протяженностью 4 см. На основании полученных показателей скорости рассчитывается эластичность в килопаскалях (кПа).
В ARFI для создания сдвиговых волн используют силу давления мощного импульса УЗ луча. Это давление приобретает максимальную величину в фокальной точке, которая и становится источником сдвиговых волн, распространяющихся от фокальной области в перпендикулярном направлении. Вслед за этим обычное УЗ сканирование отслеживает продвижение сдвиговой волны, определяя ее скорость в метрах в секунду и/или пересчитанный в кПа показатель эластичности. К недостаткам ARFI и SWE относят, в первую очередь, узкий интервал значений и небольшой объем накопленных к настоящему времени данных, необходимых для валидации методов.
Преимущества ТЭ: возможность проведения исследования во время «стандартного» УЗИ; неинвазивность; отсутствие необходимости использования: анестезии, седации, рентгеновского излучения, внутривенного введения контрастных препаратов; отсутствие неприятных ощущений при выполнении исследования и после его завершения; минимальное число противопоказаний; небольшое время для проведения процедуры; более низкая стоимость, чем у других исследований.
Сущность известного метода состоит в следующем: при ТЭ печени в определенном положении пациента и трансдуцера датчика (пациент находится лежа на спине, правая рука заведена за голову, тело максимально изогнуто влево, трансдуцер датчика устанавливается в 6-8 межреберьях по 1. medioclavicularis dextra в проекции правой доли печени на участке, свободном от сосудистых структур) выполняется 10 достоверных замеров, по результатам которых с помощью программы вычисляется результирующая величина эластичности печени (медиана), выраженная в кПа. Исследование считается достоверным, при числе валидных измерений > 60% и допустимом интерквартильном размахе (ИКР вычисляется как: третий квартиль минус первый квартиль) ≤ 25% медианы эластичности.
ТЭ печени используется в качестве метода диагностики ВРВП преимущественно у пациентов с циррозом печени вирусной HCV (hepatitis С virus - вирус гепатита С) этиологии (EASL-ALEH Clinical Practice Guidelines: Non-invasive tests for evaluation of liver disease severity and prognosis // Journal of Hepatology. - 2015. - Vol. 63 - P. 237-264). Для выявления ВРВП применяется точка разделения 21 кПа; специфичность метода составляет 90% (Shi K.Q., Fan Y.C., Pan Z.Z., Lin X.F., Liu W.Y., Chen Y.P., et al. Transient elastography: a meta-analysis of diagnostic accuracy in evaluation of portal hypertension in chronic liver disease. Liver Int 2013; 33: 62-71).
Следует отметить, что плотность печени у больных циррозом служит отражением выраженности первичного процесса в самой печени - фиброза / цирроза, вызывающего повышение сопротивления току крови в системе воротной вены и приводящего к развитию портальной гипертензии. Поэтому плотность печени используется для диагностики собственно цирроза: в качестве точки разделения применяется значение 12,5 кПа (соответствует F4 по METAVIR): показатели плотности печени выше этого значения с чувствительностью 87% специфичностью 91% указывают на наличие цирроза. (Castera L., Vergniol J., Foucher J., Le Bail В., Chanteloup E., Haaser M, et al. Prospective comparison of transient elastography, Fibrotest, APRI, and liver biopsy for the assessment of fibrosis in chronic hepatitis C. Gastroenterology 2005; 128: 343-350). У пациентов с ВПОВВ причина для развития портальной гипертензии локализована в самой воротной вене, первичное поражение печени отсутствует, значения плотности печени находятся ниже 12,5 кПа, следовательно, применение эластографии печени у этой категории больных для диагностики ВРВП нецелесообразно.
Заявляемый способ диагностики ВРВП у пациентов с ВПОВВ основан на эластографии селезенки с определением ее плотности.
Из уровня техники известен способ диагностики ВРВП у пациентов с циррозом печени HCV этиологии с применением эластографии селезенки. Точкой разделения служит значение 55 кПа. Показатели плотности селезенки > 55 кПа позволяют с чувствительностью 71% и специфичностью 95% диагностировать наличие ВРВП (Colecchia A., Montrone L., Scaioli Е., Bacchi-Reggiani М.L., Colli A., Casazza G., et al. Measurement of Spleen Stiffness to Evaluate Portal Hypertension and the Presence of Esophageal Varices in Patients With HCV-Related Cirrhosis // Gastroenterology. - 2012. - №143. - P. 646-654).
Отток крови от селезенки осуществляется по селезеночной вене в воротную вену. Поэтому повышение давления в системе воротной вены приводит к затруднению оттока крови от селезенки и повышению ее плотности. При этом плотность селезенки может повышаться как в результате затруднения тока крови через печень (например, при циррозе), так и вследствие препятствия току крови в самой воротной вене, что характерно для ВПОВВ.
К настоящему времени отсутствуют данные по использованию эластографии селезенки для диагностики ВРВП у больных ВПОВВ.
Раскрытие изобретения
Задачей изобретения является создание неинвазивного способа диагностики варикозного расширения вен пищевода у больных с внепеченочной обструкцией воротной вены с чувствительностью способа более 95% и его специфичностью более 62%.
Техническим результатом, на достижение которого направлено заявленное изобретение, является возможность ранней, неинвазивной, более точной диагностики ВРВП у больных с ВПОВВ при отсутствии цирроза, опухолей печени и иных заболеваний печени, сопровождающихся повышением ее плотности.
Поставленная задача решается тем, что способ диагностики ВРВП у пациентов с ВПОВВ характеризуется тем, что при отсутствии заболеваний печени, сопровождающихся повышением ее плотности, проводят эластографию селезенки, для чего у пациента в положении лежа на животе с максимально заведенной за голову левой рукой и максимальным изгибом туловища вправо, находят наиболее удаленную от левой почки область селезенки - между задней подмышечной и лопаточной линиями в 8-11 межреберьях и маркируют ее, в маркированной зоне устанавливают трансдуцер, измеряют плотность селезенки и при получении значения выше 34,4 кПа - точки разделения - устанавливают диагноз ВРВП.
Ниже представлено более подробное описание заявляемого способа.
Способ диагностики ВРВП включает исследование плотности селезенки. Исследование плотности селезенки проводят, например, на аппарате Fibroscan (Echosens, Франция).
Для проведения исследования плотности селезенки необходимо выполнение следующих условий:
I. Отсутствие противопоказаний:
1. Беременность
2. Наличие кардиовертер-дефибриллятора
3. Наличие повреждений кожи в зоне проведения измерения
II. Наличие согласия пациента на проведение процедуры
III. Соблюдение критериев для получения корректного результата:
1. Индекс массы тела (ИМТ)<30 кг/м (формула: вес, кг/рост, м2)
2. Отсутствие асцита
3. Отсутствие симптомов хронической сердечной недостаточности
4. Тощаковый статус (минимум 6 часов голодания)
5. Достаточный опыт оператора (>50 измерений)
6. Отсутствие холестаза (отсутствие желтухи, расширения желчных протоков по данным УЗИ)
7. Отсутствие очагового поражения печени в зоне измерения (определяется по данным УЗИ)
Исследования проводят в следующей последовательности.
I. Проводят УЗИ селезенки стандартным датчиком. Пациент находится на
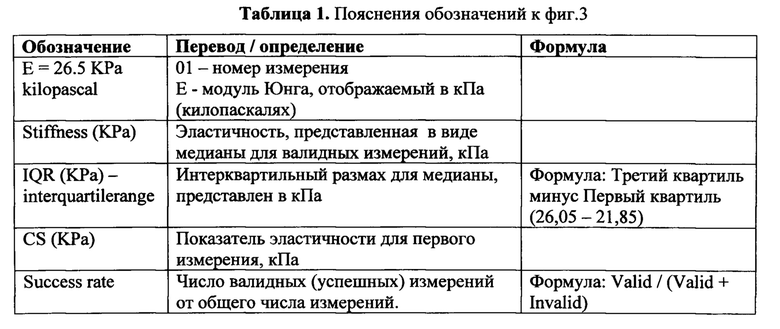
кушетке в положении лежа на животе с максимально заведенной за голову левой рукой. Находят наиболее удаленную от левой почки область селезенки и маркируют ее. Наиболее часто эта область локализована между левыми задней подмышечной и лопаточной линиями (l. axillaris posterior и l. scapularis sinistra) в 8-11 межреберьях (фиг. 1а).
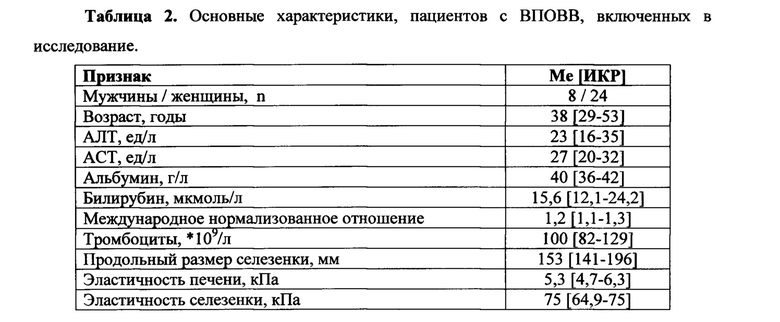
II. Проводят эластрографию селезенки. Положение пациента: лежа на животе с запрокинутой за голову левой рукой и максимальным изгибом туловища вправо. В маркированной зоне устанавливают трансдуцер. Проводят не менее 10 измерений (фиг. 1б). Полученные значения плотности выражаются в кПа. Диапазон измерения прибора 2,5-75 кПа. После проведения исследования распечатывают протокол исследования, в котором представлено общее число измерений, число и процент валидных измерений от общего числа измерений, последовательные значения плотности каждого из валидных измерений, медиана, ИКР (фиг. 2).
III. Определяют достоверность исследования. Исследование считается достоверным при количестве валидных измерений (Success rate) > 60% и ИКР ≥ 25% от медианы. Количество валидных измерений проверяют путем сравнения числа валидных измерений (Success rate) в протоколе исследования с требуемым > 60%. ИКР считается допустимым при сравнении IQR (КРа) с требуемым ≤ 25%. При количестве валидных измерений ≤ 60% и/или ИКР > 25% исследование считается не достоверным.
IV. В случае достоверности исследования сравнивают полученное значение плотности Stiffness с точкой разделения 34,4 кПа. Если значение плотности селезенки у пациента > 34,4 кПа, устанавливают диагноз ВРВП.
Краткое описание чертежей
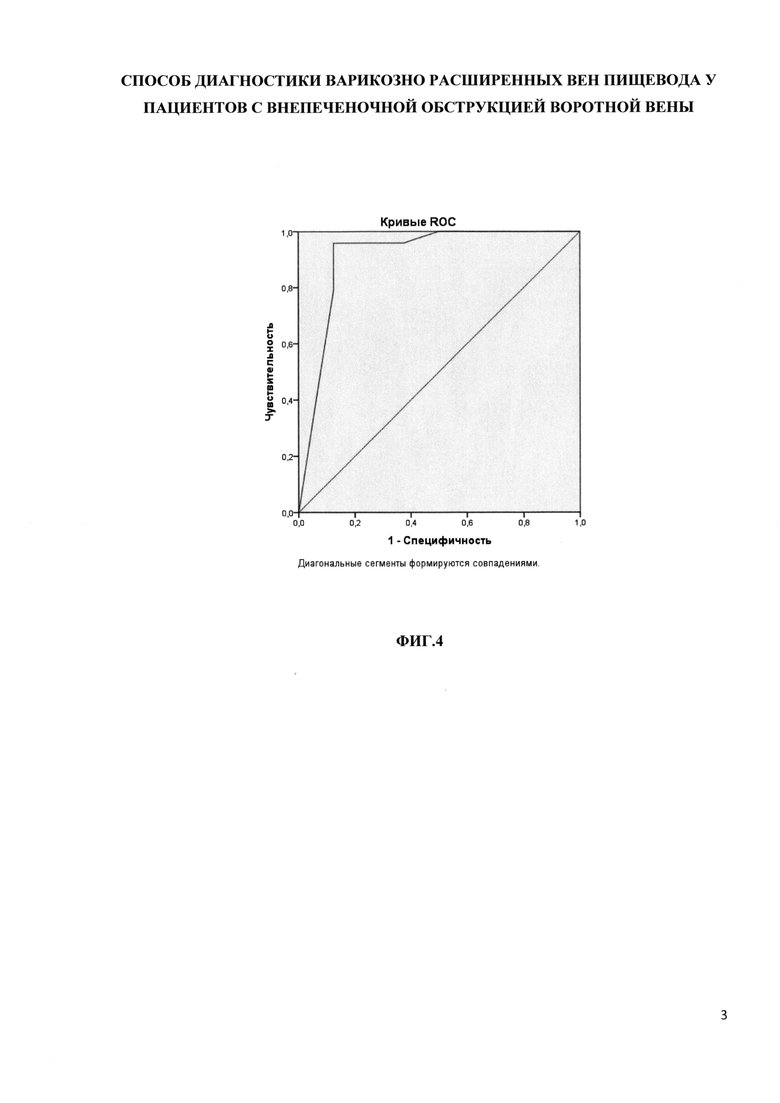
Изобретение поясняется чертежами, где на фиг. 1-2 представлено положение пациента и врача во время исследования. Позициями на фигурах обозначены: 1 - Левая рука пациента, максимально заведенная за голову, 2 - левая почка, 3 - селезенка, 4 - маркированная зона максимального удаления левой почки от селезенки, в которой будет выполняться эластография, 5 - трансдуцер для проведения эластографии. При этом на фиг. 1 показана схема нахождения с помощью УЗИ области для эластографии селезенки, на фиг. 2 - схема установки трансдуцера и проведения эластографии селезенки. На фиг. 3 представлен фрагмент протокола исследования эластографии селезенки. В таблице 1 представлены пояснения обозначений к фиг. 3. На фиг. 4 представлен график - ROC-анализ для эластичности селезенки в диагностике ВРВП.
Осуществление изобретения
Представленные примеры иллюстрируют способ диагностики ВРВП у больных с ВПОВВ с помощью исследования плотности селезенки.
ПРИМЕР №1
Пациентка К. 64 лет госпитализирована по поводу спленомегалии и двухростковой цитопении. В возрасте 60 лет перенесла острый флегмонозный холецистит. Выполнена лапароскопическая холецистэктомия. За год до госпитализации перенесла острый панкреатит, леченный консервативно. С этого времени отмечается спленомегалия и двухростковая цитопения. Обследование у гематолога не выявило первичной патологии системы крови, как причины цитопении. Исследования, направленные на выявление ВРВ пищевода и желудка, не проводились. Злоупотребление алкоголем, прием наркотических, гепатотоксических средств, перенесенную желтуху отрицает. Объективное исследование не выявило признаков заболевания печени; обнаружена спленомегалия. Печеночные функциональные тесты в пределах референсных значений. Лейкопения 2,8×109/л, тромбоцитопения 85×109/л. Скрининг-тесты на вирусные гепатиты, болезнь Вильсона-Коновалова, наследственный гемохроматоз, аутоиммунные заболевания печени отрицательные; показатели липидного обмена в пределах референсных значений. По данным МСКТ-ангиографии обнаружен тромбоз ствола и левой долевой ветви воротной вены, кавернозная трансформация воротной вены. Очаговых образований печени и панкреатобилиарной зоны не выявлено. Проведен поиск факторов риска ТВВ. Среди локальных факторов рассматривались: флегмонозный калькулезный холецистит, холецистэктомия, острый панкреатит. Исследование врожденных и приобретенных тромбофилий, включавшее уровень антитромбина III, протеинов С и S, гомоцистеина, тесты на антифосфолипидный синдром, однонуклеотидные полиморфизмы 16 генов, ассоциированных с системой гемостаза и мутацию в гене Jak-2, патологии не выявило.
Показатели плотности печени по данным эластографии составили 5,7 кПа. Таким образом, проведенное обследование позволило исключить цирроз и опухоли панкреатобилиарной системы как причину ТВВ. Установлен диагноз ВПОВВ - нецирротического / неопухолевого ТВВ.
Плотность селезенки по данным эластографии составила 40,3 кПа, ИКР 7,8 кПа. Валидных измерений 90%, ИКР < 25% от медианы; исследование достоверно. Полученный результат плотности селезенки больше точки разделения 34,4 кПа. С чувствительностью 95,8% и специфичностью 62,5% установлен диагноз ВРВП. Проведенная видеоэндоскопия подтвердила наличие ВРВП: начиная с верхней трети пищевода и дистальнее обнаружены ВРВ, размером от 4 до 5 мм. Назначено лечение бета-блокаторами с целью снижения риска кровотечения из ВРВП.
ПРИМЕР №2
Пациентка М. 73 лет. В возрасте 71 года перенесла острый панкреатит. В то же время диагностирован тромбоз воротной и селезеночной вен, спленомегалия. Печеночные функциональные тесты и показатели общего анализа крови в пределах референсных значений.
Перенесенную желтуху, злоупотребление алкоголем, прием гепатотоксических и наркотических средств отрицает. Показатели липидного обмена в пределах референсных значений. Скрининг тесты на вирусные гепатиты, болезнь Вильсона-Коновалова, наследственный гемохроматоз, аутоиммунные заболевания печени отрицательные. По данным МСКТ-ангиографии обнаружен тромбоз ствола воротной вены, кавернозная трансформация воротной вены. Очаговых образований печени и панкреатобилиарной зоны не выявлено.
Проведен поиск факторов риска ТВВ. Среди локальных факторов рассматривался острый панкреатит. Исследование врожденных и приобретенных тромбофилий, включавшее уровень антитромбина III, протеинов С и S, гомоцистеина, тесты на антифосфолипидный синдром, однонуклеотидные полиморфизмы 16 генов, ассоциированных с системой гемостаза, патологии не выявило. Обнаружена мутация в гене Jak-2. Проведено гематологическое обследование и установлен диагноз хронического миелопролиферативного заболевания, которое было системным фактором риска развития ТВВ.
Показатели плотности печени по данным эластографии составили 5,0 кПа. Таким образом, проведенное обследование позволило исключить цирроз и опухоли панкреатобилиарной системы как причину ТВВ. Установлен диагноз ВПОВВ - нецирротического / неопухолевого ТВВ.
Плотность селезенки по данным эластографии составила 75 кПа, ИКР 0. Валидных измерений - 100%, ИКР < 25% от медианы; исследование достоверно. Полученный результат плотности селезенки больше точки разделения 34,4 кПа. С чувствительностью 95,8% и специфичностью 62,5% установлен диагноз ВРВП. Проведенная видеоэндоскопия подтвердила наличие ВРВП: в просвете пищевода 3-4 ствола варикозных вен до 8 мм в диаметре. Признаков угрозы кровотечения не выявлено. Назначено лечение бета-блокаторами с целью снижения риска кровотечения из ВРВП.
Исследование: Способ диагностики варикозного расширения вен пищевода ВРВП у больных с ВПОВВ.
В исследование было включено 32 пациента с ВПОВВ, обусловленной нецирротическим / неопухолевым ТВВ. Диагноз ТВВ устанавливался по данным МСКТ-ангиографии согласно критериям последнего консенсуса по портальной гипертензии (Baveno VI): наличие тромба в просвете воротной вены, с возможным вовлечением других сегментов портальной венозной системы или обнаружение кавернозной трансформацией воротной вены с признаками портальной гипертензии (de Franchis R.on behalf of VI Faculty Expanding consensus in portal hypertension report of the Baveno VI Consensus Workshop: Stratifying risk and individualizing care for portal hypertension // Journal of Hepatology. - 2015. - Vol. 63. - P. 743-752).
Статистический анализ выполнялся с помощью статистических пакетов STATISTICA 10 (StatSoft. Inc., США) и IBMSPSS 21. За уровень статистической значимости принято значение р<0,05.
Распределение большинства количественных признаков отличалось от нормального (по критериям Шапиро-Уилка и Колмогорова-Смирнова). Количественные признаки представлены как Me [25-75% ИКР], где Me - медиана, 25-75% ИКР - первый и третий квартили. Для проверки статистических гипотез применялся U-критерий Манна-Уитни.
Результаты основных клинических, лабораторных и инструментальных методов обследования представлены в таблице 2. В исследование включено восемь мужчин и 24 женщины, медиана возраста составила 38 лет. Показатели печеночных функциональных тестов (АЛТ, ACT, альбумин, билирубин, протромбин, оцененный по международному нормализованному отношению) находились в пределах референсных значений или незначительно от них отклонялись. Отмечено увеличение продольного размера селезенки по данным УЗИ в сочетании с умеренной тромбоцитопенией, как проявлением гиперспленизма.
У всех пациентов в анамнезе отсутствовали факторы риска, а при объективном исследовании - признаки хронических заболеваний печени. Проведены исследования, исключившие опухоли печени и панкреатобилиарной системы, а также наиболее частые причины цирроза: вирусные гепатиты, алкогольную болезнь печени, неалкогольную жировую болезнь печени, аутоиммунные и холестатические заболевания, болезнь Вильсона-Коновалова, наследственный гемохроматоз.
Значения эластичности печени соответствовали степени выраженности фиброза F0-F1 по METAVIR, что позволяло исключить цирроз печени, как причину портальной гипертензии. Эластичность селезенки у всех пациентов была повышена: медиана составила 75 кПа.
Для оценки наличия ВРВП в качестве стандартного метода выполнена ЭГДС, по результатам которой ВРВП выявлено у 24 пациентов.
На следующем этапе анализа пациенты были разделены на две группы: с наличием ВРВП и без ВРВП по данным ЭГДС. Данные по группам представлены в таблице 3. При проведении сравнительного анализа определено, что группы не различаются по соотношению мужчин и женщин, возрасту, продольному размеру селезенки и уровню тромбоцитов. В группе пациентов с ВРВП эластичность селезенки была значительно выше (медиана 75 кПа), чем у пациентов без ВРВП (медиана 31,1 кПа), поэтому эластичность селезенки была включена в последующий ROC-анализ.
При проведении ROC-анализа для эластичности селезенки было получено максимальное значение площади под кривой AUROC 0,911 [95% ДИ 0,759-1,0) р=0,001. Использование индекса Йодена позволило идентифицировать точку разделения при максимальных значения чувствительности (95,8%) и специфичности (62,5%), этот показатель составил 34,4 кПа. На фиг. 4 представлен график - ROC-анализ для эластичности селезенки в диагностике ВРВП.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ ДАВЛЕНИЯ В ВОРОТНОЙ ВЕНЕ ПРИ ЦИРРОЗЕ ПЕЧЕНИ | 2024 |
|
RU2835773C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА КРОВОТЕЧЕНИЯ ИЗ ВАРИКОЗНО РАСШИРЕННЫХ ВЕН ПИЩЕВОДА У БОЛЬНЫХ ЦИРРОЗОМ ПЕЧЕНИ | 2010 |
|
RU2473914C2 |
| Способ прогнозирования риска кровотечения из варикозных вен желудка и пищевода после выполнения оперативного вмешательства в объеме трансъюгулярного внутрипеченочного портосистемного стент-шунтирования с селективной эмболизацией вен желудка | 2022 |
|
RU2804674C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ТАКТИКИ ЛЕЧЕНИЯ БОЛЬНЫХ С РИСКОМ КРОВОТЕЧЕНИЯ ИЗ ВАРИКОЗНО РАСШИРЕННЫХ ВЕН ПИЩЕВОДА И ИСПОЛЬЗОВАНИЯ ЭНДОСКОПИЧЕСКОГО ЛИГИРОВАНИЯ ДЛЯ ПРОФИЛАКТИКИ И ОСТАНОВКИ КРОВОТЕЧЕНИЯ ИЗ ВАРИКОЗНО РАСШИРЕННЫХ ВЕН ПИЩЕВОДА ПРИ ПОРТАЛЬНОЙ ГИПЕРТЕНЗИИ | 2016 |
|
RU2642965C2 |
| СПОСОБ ОЦЕНКИ РИСКА ТРАНСЮГУЛЯРНОГО ВНУТРИПЕЧЕНОЧНОГО ПОРТОСИСТЕМНОГО ШУНТИРУЮЩЕГО ХИРУРГИЧЕСКОГО ВМЕШАТЕЛЬСТВА У БОЛЬНЫХ С ПОРТАЛЬНОЙ ГИПЕРТЕНЗИЕЙ ЦИРРОТИЧЕСКОГО ГЕНЕЗА | 2011 |
|
RU2492479C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ РИСКА РАЗВИТИЯ ГИПЕРКОАГУЛЯЦИИ У БОЛЬНЫХ С ПОРТАЛЬНОЙ ГИПЕРТЕНЗИЕЙ ЦИРРОТИЧЕСКОГО ГЕНЕЗА ПОСЛЕ ПРОВЕДЕНИЯ ПОРТОСИСТЕМНОГО ШУНТИРОВАНИЯ | 2017 |
|
RU2665118C1 |
| Способ формирования эзофагогастроанастомоза у больных с портальной гипертензией | 2015 |
|
RU2607178C1 |
| Способ лечения больных циррозом печени, осложненным портальной гипертензией и гиперспленизмом | 2021 |
|
RU2783657C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ НЕБЛАГОПРИЯТНОГО ИСХОДА У БОЛЬНЫХ ЦИРРОЗОМ ПЕЧЕНИ ВИРУСНОЙ И АЛКОГОЛЬНОЙ ЭТИОЛОГИИ | 2008 |
|
RU2381748C1 |
| Способ оценки эффективности лечения болезни Гоше у детей | 2016 |
|
RU2629626C1 |

Изобретение относится к области медицины, а именно к внутренним болезням, и может быть использовано в гастроэнтерологии, терапии, хирургии и лучевой диагностике для диагностики варикозного расширения вен пищевода (ВРВП) у пациентов с внепеченочной обструкцией воротной вены. При отсутствии заболеваний печени, сопровождающихся повышением ее плотности, проводят эластографию селезенки. В положении пациента лежа на животе с максимально заведенной за голову левой рукой находят наиболее удаленную от левой почки область селезенки - между левой задней подмышечной и левой лопаточной линиями в 8-11 межреберьях. Маркируют ее. В маркированной зоне устанавливают трансдуцер. Измеряют плотность селезенки. При получении значения выше 34,4 кПа - точки разделения - устанавливают диагноз ВРВП. Способ обеспечивает раннюю, неинвазивную, точную диагностику ВРВП у пациентов с внепеченочной обструкцией воротной вены. 4 ил., 3 табл., 2 пр.
Способ диагностики варикозно расширенных вен пищевода (ВРВП) у пациентов с внепеченочной обструкцией воротной вены, характеризующийся тем, что при отсутствии заболеваний печени, сопровождающихся повышением ее плотности, проводят эластографию селезенки, для чего у пациента в положении лежа на животе с максимально заведенной за голову левой рукой находят наиболее удаленную от левой почки область селезенки - между левой задней подмышечной и левой лопаточной линиями в 8-11 межреберьях и маркируют ее, в маркированной зоне устанавливают трансдуцер, измеряют плотность селезенки и при получении значения выше 34,4 кПа - точки разделения - устанавливают диагноз ВРВП.
| Colecchia A | |||
| et al | |||
| Measurement of Spleen Stiffness to Evaluate Portal Hypertension and the Presence of Esophageal Varices in Patients With HCV-Related Cirrhosis // Gastroenterology | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Крутильная машина для веревок и проч. | 1922 |
|
SU143A1 |
| - P | |||
| СИГНАЛЬНОЕ УСТРОЙСТВО | 1923 |
|
SU646A1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА КРОВОТЕЧЕНИЯ ИЗ ВАРИКОЗНО-РАСШИРЕННЫХ ВЕН ЖЕЛУДКА | 2008 |
|
RU2398514C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СТЕПЕНИ РИСКА КРОВОТЕЧЕНИЯ ИЗ ВАРИКОЗНО РАСШИРЕННЫХ ВЕН ПИЩЕВОДА | 2003 |
|
RU2246893C1 |
| СПОСОБ ДИАГНОСТИКИ ФИБРОЗА ПАРЕНХИМЫ ПЕЧЕНИ У ДЕТЕЙ | 2013 |
|
RU2515155C1 |
| СПОСОБ ДИАГНОСТИКИ АЛКОГОЛЬНОЙ БОЛЕЗНИ ПЕЧЕНИ | 2011 |
|
RU2476154C1 |
| Lefkovitz Z | |||
| et al | |||
| Radiology in the diagnosis and therapy of gastrointestinal bleeding | |||
| Gastroenterol Clin North Am | |||
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
| Солесос | 1922 |
|
SU29A1 |
Авторы
Даты
2017-10-09—Публикация
2016-12-09—Подача